Изобретение относится к средствам на основе гуминовых кислот (ГК) из торфа, которые повышают продукцию оксида азота макрофагами для применения в медицине и ветеринарии и способам их получения.
Гуминовые вещества (ГВ) - основная органическая составляющая почвы, воды, а также твердых полезных ископаемых - каустобиолитов, образующихся при разложении растительных и животных остатков под действием микроорганизмов и абиотических факторов окружающей среды. Гумификация - второй по масштабности процесс превращения органических веществ после фотосинтеза, результатом которой является стохастическая, вероятностная смесь молекул, где ни одно из соединений не тождественно другому. Таким образом, гуминовые вещества - это сложная смесь природных соединений, не существующая в живых организмах. Соответственно, к ГВ сложно применить традиционный способ численного описания строения органических соединений - определить количество атомов, число и типы связей между ними. Поэтому химиками был предложен способ классификации на основе растворимости ГВ в щелочах и кислотах [1]. Между тем, с точки зрения химии будущего возможности ГВ безграничны, а области возможного применения, в том числе в медицине, чрезвычайно многосторонний.
В целом, несмотря на недостаточную изученность, ГК находят довольно широкое применение в различных отраслях деятельности человека: на производстве (нефте- и газодобыча, изготовление аккумуляторов и пр.), для ремедиации загрязненных производством экосистем, а также в сельском хозяйстве в качестве ветеринарных препаратов и компонентов органоминеральных удобрений [2]. Основной проблемой разработки и применения гуматов в фармакологии и медицине является трудности стандартизации и недостаточная изученность механизмов, определяющих их терапевтическую эффективность [3]. В настоящее время более или менее хорошо изучены физико-химические, биохимические свойства ГК для получения новых высокоэффективных пелоидопрепаратов, способствующих доступности и эффективности пелоидотерапии [4]. Известен сорбент «медицинский лигнин» или полифепан широко применяемый в клинической практике [5].
В эксперименте показано, что введение ГК животным снижает стрессороную нагрузку, в то же время, оказывают положительное влияние на функционирование печени [6]. У лабораторных животных, получавших с кормом ГК, в крови снижалась концентрация холестерина, липидов, глюкозы, увеличивалось содержание глобулинов, гемоглобина и количество эритроцитов [7]. Гуминовые кислоты обладают иммуностимулирующими свойствами, а также антивирусной активностью и не проявляют токсических эффектов в широкой линейке доз у экспериментальных животных при пероральном или накожном применении [8, 9]. Показано использование ГК (в окисленной форме) в качестве вспомогательной терапии у ВИЧ-инфицированных пациентов [10].
Гуминовые кислоты используются в составе средств, повышающих сопротивляемость организма к действию различных неблагоприятных факторов. Например, в Польше выпускается природный иммуномодулятор, включающий ГК, обладающий интерфероногенным эффектом и являющийся индуктором фактора некроза опухолей [11]. В литературе имеются сведения о положительных эффектах фенольных соединений торфа при лечения метаболических нарушений пищеварительной системы, при этом отмечается отсутствие побочных эффектов и полное выведение препарата из организма [12].
Описанное разнообразие биологических эффектов ГК на живые организмы нельзя свести к единому механизму. В целом, описание и применение ГК в качестве медицинских или ветеринарных препаратов, как субъектов стохастического происхождения, является сложной задачей, поскольку они не имеют привычного стехиометричного состава и регулярного строения, обладают гетерогенностью структурных элементов и поли дисперсностью [13]. Сложность с описанием данного класса препаратов усугубляется и тем, что ГК отличаются между собой по свойствам в зависимости не только от исходного сырья, но и от способа их извлечения - выщелачивающего реагента [14].
Предшествующий уровень техники.
Способы получения ГК, известные на сегодняшний день, в основном, базируются на кавитационном диспергировании каустобиолитов в водном растворе щелочей - водные растворы гидроксидов натрия и калия до полного выхода ГК с последующим получением гуматов и направлены на увеличение выхода масс % [15].
Известен способ выделения ГК [16], в котором природное сырье (богатые гумусовые почвы, черноземы с добавкой торфа и сапропеля) обрабатывают щелочным раствором в присутствии мочевины и комплексона в следующем соотношении по массе 1,0:1,0-1,5:0,1:2,5. В качестве комплексона используют этилендиаминтетрауксусную кислоту.
Известен способ выделения гуминовых веществ из торфа [17], в котором осуществляют очистку и измельчение влажного исходного сырья до 70%. Торф обрабатывают экстрагентом (NaOH рН 11-12) при перемешивании. Полученную торфоводяную массу подвергают активации за счет не менее чем одного измельчения, предпочтительно, на шнековом и/или ультразвуковом измельчителе, при которой происходит физико-химическое разложение торфа. В полученном после измельчения гуминовом продукте содержание гуматов в пересчете на сухое вещество составляет не менее 50%.
Известен способ получения органоминерального гуминового удобрения из жидкого гуматсодержащего продукта [18], содержащего 98 мас. % жидкого гуминового состава, гуминовые и фульвокислоты и усвояемые фосфор и калий. В качестве гуминового состава используют продукт обработки влажного сапропеля нагретым до 80°С водным раствором пирофосфата калия, содержащий 15,0-33,4 г/л гуминовых и 7,1-15,4 г/л фульвокислот.
Наиболее близким к предлагаемому, является способ получения водорастворимых гуматов [19], выбранный в качестве прототипа. Способ включает измельчение исходного сырья (торфа или угля), обработку экстрагентом (калиевая или натриевая щелочи или аммиачная вода, органические основания) при механическом перемешивании при нормальных условиях в течение 6-8 часов, разделение твердой и жидкой фаз (раствор в виде солей одновалентных катионов - гумата калия, натрия или аммония, соответственно) и высушивание последней. Установлено, что при использовании щелочи NaOH в концентрации от 0,03 М до 0,2 М происходит растворение гумуса и обеспечивается максимальный и стабильный выход конечного продукта в раствор. Оптимальной концентрацией растворов щелочей для выделения ГК из природного сырья авторы считают концентрацию 0,1 М, которая минимально необходима для замещения молекулы водорода всех функциональных групп на ионы щелочного металла в процессе реакции солеобразования растворимых в водном растворе ГК. Дальнейшее повышение концентрации щелочи более 0,2-0,3 М может привести к их химической деструкции.
Недостатками способов являются:
- нестабильность получаемого продукта и низкая воспроизводимость;
- использование для активации физико-химического разложения торфа агрессивных щелочных реагентов (рН 11-12) и измельчителей, что может способствовать искусственной гумификации и, наряду с высоким выходом, провоцирует химическую модификацию и препятствует получению нативных, близких к природным ГК;
- оснащение специальным оборудованием - шнековый или ультразвуковой измельчитель;
- использование высокой температуры (80°С), что способствует искусственной гумификации растительных остатков и разрушению нативной структуры ГК торфа с образованием новых веществ, в частности, полициклических ароматических углеводородов, относящихся к канцерогенам (3,4-бензфлуорантен, 10,11-бензфлуорантен, 3,4-бензпирен, 1,12-бензантрацен и др.), и препятствует для разработки на их основе медицинских и ветеринарных препаратов;
- большая часть имеющихся методов извлечения ГК и их солей из каустобиолитов нацелены на повышение продуктивности выхода гуминовых веществ, увеличения их растворимости и сохранения стабильности растворов, а также снижение затрат при производстве, связанных, возможно, с потерей некоторых биологических свойств.
Задачей предлагаемого изобретения является создание способа, позволяющего достигать получения химически чистых ГК при сохранении их нативной структуры и обладающих способностью стимулировать продукцию оксида азота перитонеальными макрофагами интактных мышей in vitro.
Новым техническим результатом изобретения является создание эффективной технологии переработки торфа, позволяющей получать именно такие водорастворимые гуминовые кислоты, которые обладают способностью активировать секреторные свойства макрофагов при упрощении технологического процесса производства, снижении трудоемкости и материалоемкости технологического процесса, и, соответственно, снижении себестоимости конечного продукта.
Для достижения нового технического результата в способе получения гуминовых кислот повышающих продукцию оксида азота макрофагами in vitro из торфа болот Томской области, включающем измельчение исходного сырья, обработку эстрагентом при механическом перемешивании в течение 8 часов, осаждение из раствора неорганической кислотой, разделение жидкой и твердой фаз и сушку последней, торф предварительно высушивают при комнатной температуре до воздушно-сухого состояния, измельчают, просеивают через сито с диаметром отверстий 3 мм, далее экстрагируют при помощи пирофосфата натрия концентрации 2,0-4,0 мас. % в массовом соотношении торф: экстрагент - 1:50-1:100 при постоянном перемешивании при температуре 25-27°С, затем экстракт гуминовых кислот обрабатывают хлороводородной кислотой до рН=1-2 и отделяют осадок выделившихся гуминовых кислот центрифугированием, затем отмывают от кислой до нейтральной рН=7 среды и высушивают при комнатной температуре.
Новым в предлагаемом изобретении является создание способа получения гуминовых кислот с использованием предварительно высушенного до воздушно-сухого состояния и просеянного торфа, применение низких концентраций экстрагентов, умеренного механического воздействия и комнатной температуры на этапе активации, а также исключение выхода ГК в виде солей - гуматов, обладающих биологической активностью, в частности, способностью стимулировать продукцию оксида азота, что позволяет рассматривать использование данного способа получения веществ для разработки на их основе медицинских препаратов, обладающих специфическими иммуномодулирующими свойствами.
Способ осуществляют следующим образом: навеску торфа подвергают высушиванию при комнатной температуре до воздушно-сухого состояния, измельчению в роторно-ножевой мельнице и просеиванию через сито с диаметром отверстий 3 мм, что позволяет обеспечить наиболее оптимальные условия физико-химического процесса взаимодействия частиц материала и раствора - эффективный массообмен, и, соответственно, полноту и ускорение экстракции. Затем торф обрабатывают раствором пирофосфата натрия (Na4P2O7) в концентрации 2,0-4,0 мас. % в массовом соотношении торф: экстрагент - 1:50-1:100 в течение 8 часов при постоянном перемешивании в реакторе Р-100 при температуре 25-27°С. Проведение экстракции торфа их такого уровня техники позволяет сохранить природный состав ГК без изменений, так как данный экстрагент в указанной концентрации исключает деструкцию молекул ГК и обеспечить извлечение ГК с максимально возможным выходом и минимально допустимыми потерями. Далее проводят отделение жидкой фазы (экстракта ГК) от твердой фазы (остатка торфа) с использованием системы вакуумной фильтрации (нутч-фильтр), что способствует ускорению процесса получения ГК. Полученный экстракт обрабатывают хлороводородной кислотой (НС1) до рН 1-2 для осаждения ГК из жидкой фазы, после чего отделяют выделившиеся в осадок ГК в поле центробежных сил центрифугированием, промывают осадок ГК очищенной водой рН 7 для освобождения полученных ГК от остатка кислоты и высушивают при комнатной температуре.
Способ получения ГК не вытекает для специалиста явным образом из уровня техники и предлагаемая совокупность признаков не обнаружена авторами в патентной и научно-медицинской литературе.
Для иллюстрации сущности изобретения приведены следующие примеры.
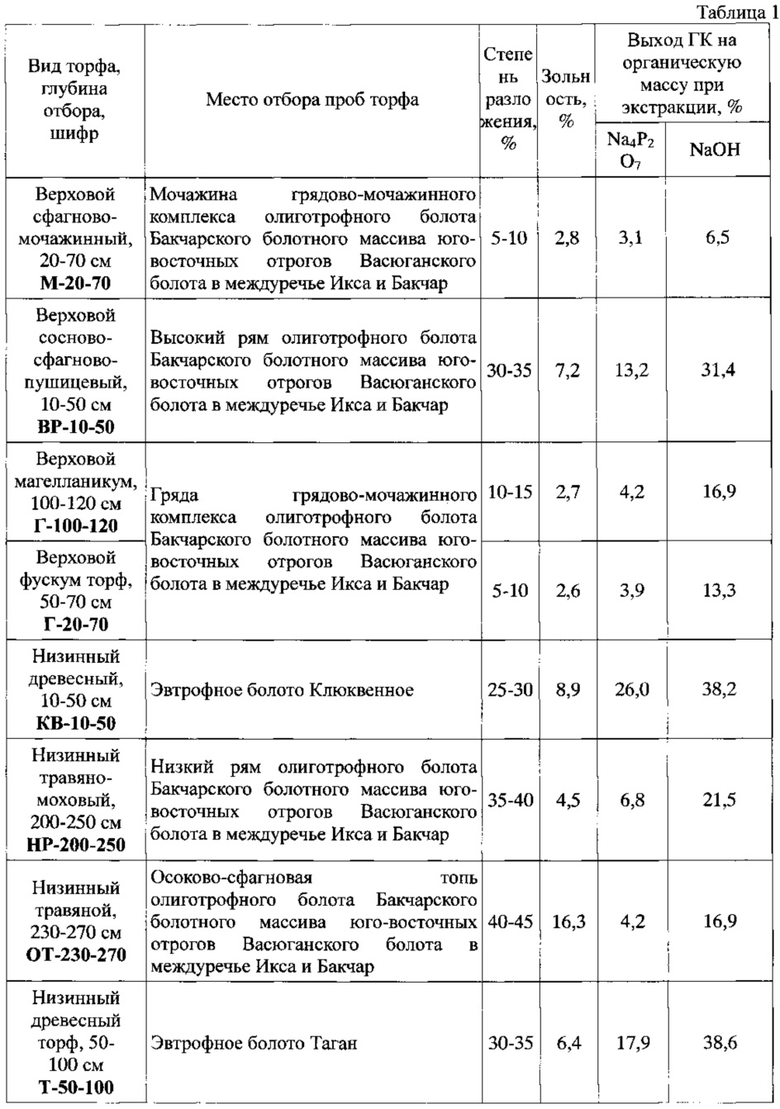
Пример 1. Восемь навесок торфа с различных болот (мест отбора образцов/проб) Томской области (таблица 1 приложения) высушивали при комнатной температуре до воздушно-сухого состояния, измельчали в роторно-ножевой мельнице и просеивали через сито с диаметром отверстий 3 мм, обрабатывали раствором пирофосфата натрия (концентрация 2,0-4,0 мас. %) в массовом соотношении торф: экстрагент - 1:50-1:100 в течение 8 часов при постоянном перемешивании в реакторе Р-100 при температуре 25-27°С, отделяли жидкую фазу (экстракт ГК) от осадка (остатка торфа) фильтрованием при помощи системы вакуумной фильтрации (нутч-фильтр), для осаждения ГК из экстракта, жидкую фазу обрабатывали хлороводородной кислотой до рН 1-2, выделившиеся ГК разделяли в поле центробежных сил (центрифугированием), отмывали водой очищенной до рН 7 и высушивали при комнатной температуре. Содержание ГК в торфе определяли гравиметрически.
Предлагаемый способ получения нативных химически чистых ГК из торфа болот Томской области, обладающих способностью повышать продукцию оксида азота перитонеальными макрофагами интактных мышей in vitro, позволяет извлекать ГК с выходом не менее 3,1% и не более 26,0% на органическую массу торфа.
Пример 2. Далее брали такие же восемь навесок торфа высушивали при комнатной температуре до воздушно-сухого состояния, измельчали в роторно-ножевой мельнице и просеивали через сито с диаметром отверстий 3 мм, обрабатывали раствором гидроксида натрия в концентрации 0,4 мас. % в массовом соотношении торф: экстрагент - 1:50-1:100 в течение 8 часов при постоянном перемешивании в реакторе Р-100 при температуре 25-27°С, отделяли жидкую фазу (экстракт ГК) от осадка (остатка торфа) фильтрованием при помощи системы вакуумной фильтрации (нутч-фильтр), для осаждения ГК из экстракта жидкую фазу обрабатывали хлороводородной кислотой до рН 1-2, выделившиеся ГК разделяли в поле центробежных сил (центрифугированием), отмывали водой очищенной до рН 7 и высушивали при комнатной температуре. Содержание ГК в торфе определяли гравиметрически.
Данный способ, отличающийся от предлагаемого в качестве изобретения способа в примере 1 только экстрагентом - гидроксидом натрия, позволяет извлекать из сухой массы исходного материала не менее 6,5% и не более 38,6 масс. % ГК, что значительно превышает показатель выхода гуминовых кислот при экстракции пирофосатом натрия: в пробе М-20-70 в 2 раза, ВР-10-50 - в 2,4 раза, Г-20-70 - в 3,4 раза, КВ-10-50 - в 1,5 раза, НР-200-250 - 3,2 раза, Т-50-100 - в 2,2 раза, в пробах ОТ-230-270 и Г-100-120 - в 4 раза (таблица 1 приложения).
Новое свойство полученных предлагаемым способом ГК стимулировать продукцию оксида азота макрофагами интактных мышей in vitro было обнаружено в результате экспериментальных исследований
Эксперименты по подтверждению биологической активности выделенных ГК проведены на линейных мышах C57BL/6 в возрасте 8-10 недель. Животные получены из отдела экспериментальных биологических моделей НИИФиРМ им. Е.Д. Гольдберга. Все процедуры (содержание, умерщвление) были проведены в соответствии с принципами Европейской конвенции о защите позвоночных животных (от 18 марта 1986 г.; Страсбург; ETS №123). Макрофаги (МФ) получали из суспензии перитонеальных клеток, для чего животных забивали дислокацией шейного отдела позвоночника, брюшную полость промывали ледяным изотоническим раствором хлорида натрия (ФР), клетки осаждали, ресуспендировали в культуральной среде и оценивали их жизнеспособность в тесте с 0,1% трипановым синим. Затем клетки помещали по 1,5-2,0×106/мл в пластиковые чашки Петри, культивировали 2 ч при 37°С (в атмосфере 5% СО2 и абсолютной влажности) в среде следующего состава: RPMI 1640 («Sigma») с добавлением 10% ЭТС («Нус1опе»), 20 мМ HEPES («Sigma»), 0,05 мМ 2-меркаптоэтанола («Sigma»), 50 мкг/мл гентамицина («Sigma»), 2 мМ L-глютамина («Sigma»), после чего собирали прилипшие к пластику клетки. Полученные после прилипания МФ (2,5-3,0×106 клеток/мл), помещали в плоскодонные 96-луночные планшеты и культивировали в указанных выше условиях 48 часов в присутствии выбранных концентраций ГК (наиболее эффективные концентрации действующих веществ были выявлены в предварительных экспериментах in vitro) или 1 мкг/мл ЛПС (серотип O111:В4, «Sigma»). Через 48 ч от начала культивирования в супернатантах оценивали продукцию оксида азота (NO) по содержанию нитритов при помощи реактива Грейса [20], который смешивали с эквивалентным объемом надосадка, абсорбцию замеряли с использованием многоканального спектрофотометра Titertek Multiskan® MCC («Labsystems», Финляндия) при длине волны 540 нм. Концентрацию нитритов определяли по калибровочной кривой, построенной с использованием стандартных растворов нитрита натрия.
Для определения примеси эндотоксина исследуемые образцы ГК инкубировали при тех же условиях с 50 мкг/мл полимиксином В («InvivoGen», США), вод эндотоксинами понимают бактериальные токсические вещества, которые являются структурными компонентами бактерий, например, структурные компоненты мембран грам-негативных бактерий -. липополисахариды (ЛПС) Сам по себе эндотоксин не является токсическим веществом, но его присутствие в препаратах, особенно для инъекционного введения, представляет собой огромную проблему, поскольку может приводить к активации системы иммунитета, а именно, усилению синтеза моноцитами и макрофагами целого ряда противовоспалительных медиаторов. Развитие этой каскадной противовоспалительной реакции, сопровождающейся повышением температуры и лихорадкой (эндотоксический шок), способное привести к летальному исходу принято обозначать термином пирогенность. Эндотоксин достаточно стабилен и сохраняется при высоких значениях температур и в широком диапазоне рН. Примеси эндотоксина достаточно часто обнаруживаются в образцах растительного происхождения как высших, так и низших растений. Отсутствие такой примеси в природной субстанции, при выявлении направленных фармакологических эффектов дает значительные преимущества для дальнейшей разработки на ее основе лекарственных препаратов различного назначения.
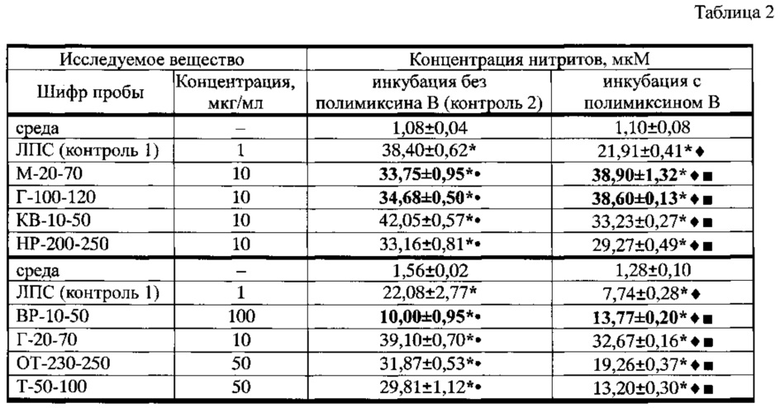
Пример 3. Биологическую активность ГК, выделенных предлагаемым в примере 1 способом из восьми различных видов торфа болот Томской области, оценивали по их NO-активирующему действию на перитонеальные макрофаги интактных мышей линии C57BL/6 in vitro (таблица 2). Инкубация макрофагов в присутствии образцов ГК приводила к усилению продукции оксида азота: проба М-20-70 (концентрация 10 мкг/мл) в 26 раз, проба Г-100-120 (10 мкг/мл) в 32 раза, проба КВ-10-50 (10 мкг/мл) в 39 раз, проба НР-200-250 (10 мкг/мл) в 30 раз, проба ВР-10-50 (100 мкг/мл) в 6,5 раз, проба Г-20-70 (10 мкг/мл) в 32 раза, проба ОТ-230-250 (50 мкг/мл) в 20 раз, проба Т-50-100 (50 мкг/мл) в 19 раз. При этом применение в качестве контроля стандартного активатора NO-продуцирующей активности макрофагов ЛПС увеличивало величину показателя в 35 или 14 раз в разных сериях экспериментов.
Культивирование ЛПС-стимулированных клеток в присутствии полимиксина В (контроль 1) приводило к снижению концентрации нитритов в супернатанте в 1,7 и 2,8 раза соответственно сериям эксперимента.
Добавление ингибитора к трем образцам ГК М-20-70, Г-100-120 и ВР-10-50 для того, чтобы исключить возможность NO-активирующего действия наличием эндотоксина, выявило отсутствие примеси эндотоксина, более того концентрация оксида азота была в 1,8 раза больше по сравнению с аналогичным показателем при инкубации МФ с ЛПС в присутствии полимиксина В.
При обработке ГК проб КВ-10-50, НР-200-250, Г-20-70, ОТ-230-250 и Т-50-100 полимиксином В концентрация продуцированного оксида азота несколько снижалась, однако значительно в 1,5, 1,3, 4, 2,5 и 1,7 раза, соответственно, превышала значения контроля 1 с полимиксином В.
Таким образом, ГК, выделенные при помощи пирофосфата натрия (пример 1), обладают значительным преимуществом при активации макрофагов, вызывая специфическое усиление ими продукции оксида азота, обусловленное исключительно особыми их свойствами.
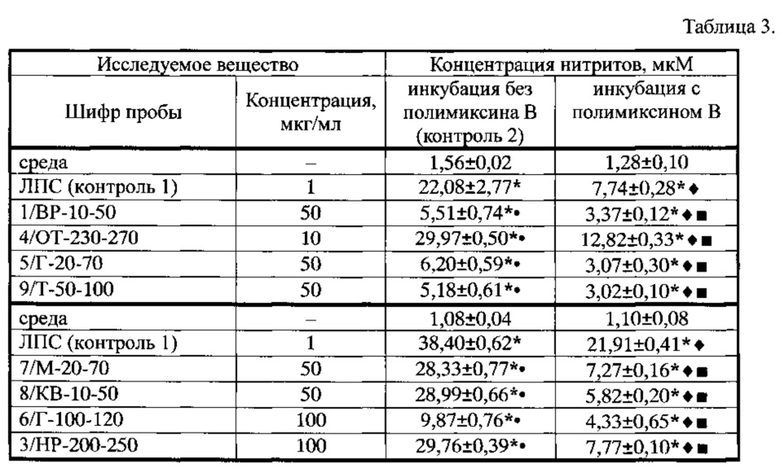
Пример 4. Инкубация макрофагов в присутствии ГК, выделенных предлагаемым в примере 2 способом из восьми различных видов торфа болот Томской области, выявила усиление продукции оксида азота: в пробе М-20-70 (концентрация 50 мкг/мл) в 26 раз, Г-100-120 (100 мкг/мл) в 9,1 раза, КВ-10-50 (50 мкг/мл) в 27 раз, НР-200-250 (100 мкг/мл) в 27,5 раз, ВР-10-50 (50 мкг/мл) в 3,5 раз, Г-20-70 (50 мкг/мл) в 4 раза, ОТ-230-270 (10 мкг/мл) в 19 раз, Т-50-100 (50 мкг/мл) в 3,3 раза (таблица 3).
Добавление полимиксина В в культуру клеток для того, чтобы исключить возможность NO-активирующего действия образцов наличием эндотоксина, полностью отменяло выявленное стимулирующее действие ГК, выделенных по способу из примера 3, концентрация оксида азота в супернатантах клеток снижалась в пробе М-20-70 в 3,9 раза, Г-100-120 в 2,3 раза, КВ-10-50 в 5 раз, НР-200-250 в 3,8 раза, ВР-10-50 в 1,6 раза, Г-20-70 в 2 раза, ОТ-230-270 в 2,3 раза, Т-50-100 в 1,7 раза, что было значительно в среднем 3-5 раз ниже показателя инкубации МФ с ЛПС в присутствии полимиксина В и, таким образом, указывает на наличие примеси эндотоксина в образцах ГК, выделенных при экстракции щелочью.
Таким образом, экспериментально установлено, что предложенный способ получения ГК при помощи пирофосфата натрия (пример 1) из торфа, позволяет получать ГК, сохраняющие нативную химическую структуру, свободные от примеси и обладающие значительным преимуществом при стимуляции NO-продуцирующих свойств макрофагов in vitro - вызывать специфическое усиление ими продукции оксида азота. ГК, полученные по способу в примере 3 при помощи гидроксида натрия, не обладают такими свойствами -их стимулирующая активность обусловлена наличием эндотоксина, хотя на выходе данный способ (пример 2) позволяет получать большее количество материала.
Выявленные свойства ГК стимулировать продукцию оксида азота, свидетельствующие об их способности классически активировать антигенпрезентирующие клетки и, соответственно, стимулировать развитие Th1-зависимого типа иммунного ответа, могут служить основой для разработки низкотоксичных и высокоэффективных средств растительного происхождения для коррекции системы иммунитета при хронических, вялотекущих инфекционно-воспалительных процессах в медицине и ветеринарии.
Источники информации
1. Перминова И.В. Гуминовые вещества - вызов химикам XXI века // Химия и жизнь.- 2008.- №1. - с. 50-55.
2. Материалы IV Всероссийской конференции «Гуминовые вещества в биосфере», Сыктывкар, Республика Коми, Россия, 6-10 октября 2014, Секция 5., с. 121-159.
3. Зыкова М.В., Белоусов М.В., Гурьев A.M., Ахмеджанов P.P., Юсубов М.С.Стандартизация гуминовых кислот низинного древесно-травяного вида торфа // Химико-фармацевтический журнал. - 2013. - Том 47. - №12. - С. 53-56.
4. Аввакумова Н.П., Орлов Е.В., Кривопалова М.А. Репаративное действие пелоидопрепаратов: сравнительные аспекты // Аллергология и иммунология. - 2006. - Т. 7. -С. 147-149.
5. Boerjan W., et al. Lignin biosinthesis // Annual Review of Plant Biology. - 2003. - Vol. 54. - P. 519-546.
6. Islam K.M.S., Schuhmacher A., Gropp J.M. Humic Acid Substances in Animal // Agriculture Pakistan Journal of Nutrition. - 2005. - №4. - V.3. - p. 126-134.
7. Maslinski C.W., Fogel A., Andrzejewski W. The influence of Tolpa Peat Preparation (TPP) on rat liver regeneration // Acta Pol Pharm. - 1993. - Vol. 50, №4-5. - P. 413-416.
8. Van Rensburg С.E.J., Malfeld S.С.K., Dekker J. Topical application of oxifulvic acid suppresses the cutaneous immune response in mice // Chemotherapy. - 2002. - Vol. 48. - P. 138-143.
9. Исматова P.P.В, Зиганшин А.У., Дмитрук С.E., Федько И.В. Низкая токсичность и противовоспалительная активность гуматов, выделенных из торфа и сапропеля Томской области // Казанский медицинский журнал. - 2006. - Том 87, №6. - С. 454-155.
10. Joone G.К., Dekker, С.Е.J. van Rensburg Investigation of the immunostimulatory properties of oxihumate // Z. Naturforsch. - 2003. - Vol. 58, №3-4. - P. 263-267.
11. Junek R., et al. Bimodal effect of humic acids on the US-induced TNF-alpha release from differentiated U937 cells // Phytomedicine. - 2009. - Vol. 16, №5. - P. 470-476.
12. Патент RU 2357741, 10.06.2009, A61K 35/10.
13. Лиштван И.И., Капуцкий Ф.Н., Янута Ю.Г. и др. Гуминовые кислоты торфа и препараты на их основе // Природопользование. 2004. Вып. 10. С. 114-119.
14. Михеев В.А., Москаленко Т.В., Данилов О.С.Фотометрический анализ молекулярной структуры гуминовых кислот, выделенных разными способами из торфа // Труды V Всероссийской конференции «Гуминовые вещества в биосфере». СПб., 2010. Ч.1. С. 161-166.
15. Ваксман С.А. Исследования по разложению органических веществ и образованию гумуса почв// Почвоведение. - 1936. - №1. - С. 145-146.
16. Патент RU 2118632, 10.09.1998, C05F 11/02.
17. Патент RU 2416591, 09.12.2009, C05F 11/02.
18. Патент RU 2220933, 26.06.2001, C05F 11/00.
19. Христева Л.А. Еще о функции гуминовых кислот в обмене веществ у высших растений // Гуминовые удобрения: Теория и практика их применения. Киев: Госсельхозиздат, 1962. Ч.2. С. 123-129.
20. Green L.C., Wagner D.A., Glogowski J. et al. Analysis of nitrate, nitrite and [15N] nitrite in biological fluids //Anal. Biochem. 1982. Vol. 126. P. 131-143.
Приложение
Таблица 1 Общая характеристика различных видов торфа Томской области при различных способах экстракции материала
Таблица 2 Влияние гуминовых кислот (экстракция при помощи пирофосфата натрия) на продукцию оксида азота перитонеальными макрофагами интактных мышей линии C57BL/6 (Х±m)
Примечание: * - различия показателя со средой достоверны, р<0,05;  - различия показателя по сравнению с инкубацией с ЛПС (контроль 1) без полимиксина В достоверны, р<0,05;
- различия показателя по сравнению с инкубацией с ЛПС (контроль 1) без полимиксина В достоверны, р<0,05;  - различия показателя по сравнению с инкубацией МФ с действующими веществами без полимиксина В (контроль 2) достоверны, р<0,05;
- различия показателя по сравнению с инкубацией МФ с действующими веществами без полимиксина В (контроль 2) достоверны, р<0,05;  -различия показателя по сравнению с инкубацией с ЛПС в присутствии полимиксина В достоверны, р<0,05. Концентрация полимиксина В - 50 мкг/мл, n=6.
-различия показателя по сравнению с инкубацией с ЛПС в присутствии полимиксина В достоверны, р<0,05. Концентрация полимиксина В - 50 мкг/мл, n=6.
Таблица 3. Влияние гуминовых кислот (экстракция при помощи гидроксида натрия) на продукцию оксида азота перитонеальными макрофагами интактных мышей линии C57BL/6 (Х±m)
Примечание: * - различия показателя со средой достоверны, р<0,05;  - различия показателя по сравнению с инкубацией с ЛПС (контроль 1) без полимиксина В достоверны, р<0,05;
- различия показателя по сравнению с инкубацией с ЛПС (контроль 1) без полимиксина В достоверны, р<0,05;  - различия показателя по сравнению с инкубацией МФ с действующими веществами без полимиксина В (контроль 2) достоверны, р<0,05;
- различия показателя по сравнению с инкубацией МФ с действующими веществами без полимиксина В (контроль 2) достоверны, р<0,05;  -различия показателя по сравнению с инкубацией с ЛПС в присутствии полимиксина В достоверны, р<0,05. Концентрация полимиксина В - 50 мкг/мл, n=6.
-различия показателя по сравнению с инкубацией с ЛПС в присутствии полимиксина В достоверны, р<0,05. Концентрация полимиксина В - 50 мкг/мл, n=6.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство, гуминовой природы, обладающее иммуномодулирующей активностью | 2019 |
|
RU2716504C1 |
| Средство гуминовой природы, обладающее иммуномодулирующей активностью | 2017 |
|
RU2662094C1 |
| СРЕДСТВО ГУМИНОВОЙ ПРИРОДЫ, УСИЛИВАЮЩЕЕ ФАГОЦИТИРУЮЩУЮ АКТИВНОСТЬ КЛЕТОК | 2023 |
|
RU2834961C1 |
| Средство гуминовой природы, обладающее иммуномодулирующим действием | 2022 |
|
RU2783772C1 |
| Средство гуминовой природы, обладающее противоаллергической активностью | 2020 |
|
RU2750098C1 |
| Средство на основе водорастворимых растительных полисахаридов, усиливающее секрецию оксида азота макрофагами in vitro | 2018 |
|
RU2735080C2 |
| СПОСОБ ПРОФИЛАКТИКИ ПОВРЕЖДЕНИЯ БИОЛОГИЧЕСКИХ МЕМБРАН | 2013 |
|
RU2549449C2 |
| СРЕДСТВО ГУМИНОВОЙ ПРИРОДЫ ДЛЯ ПОВЫШЕНИЯ ФИЗИЧЕСКОЙ РАБОТОСПОСОБНОСТИ И ВЫНОСЛИВОСТИ | 2019 |
|
RU2727692C1 |
| ИММУНОМОДУЛИРУЮЩЕЕ ГУМИНОВОЕ СРЕДСТВО | 2020 |
|
RU2756353C1 |
| Средство, обладающее иммуномодулирующей активностью | 2018 |
|
RU2697526C1 |
Изобретения относятся к медицине и ветеринарии. Способ получения гуминовых кислот, повышающих продукцию оксида азота макрофагами in vitro, из торфа болот Томской области включает измельчение исходного сырья, обработку экстрагентом при механическом перемешивании в течение 8 часов, осаждение из раствора неорганической кислотой, разделение жидкой и твердой фаз и сушку последней, причем торф предварительно высушивают при комнатной температуре до воздушно-сухого состояния, измельчают, просеивают через сито с диаметром отверстий 3 мм, далее экстрагируют при помощи пирофосфата натрия концентрации 2,0-4,0 мас. % в массовом соотношении торф : экстрагент - 1:50-1:100 при постоянном перемешивании при температуре 25-27°C; затем экстракт гуминовых кислот обрабатывают хлороводородной кислотой до pH 1-2,отделяют осадок выделившихся гуминовых кислот центрифугированием, затем отмывают от кислой до pH 7 среды и высушивают при комнатной температуре. Применение гуминовых кислот из торфа болот Томской области для повышения продукции оксида азота макрофагами in vitro. Изобретения позволяют создать эффективную технологию переработки торфа, позволяющую получать именно такие водорастворимые гуминовые кислоты, которые обладают способностью активировать секреторные свойства макрофагов. 2 н.п. ф-лы, 3 табл., 4 пр.
1. Способ получения гуминовых кислот, повышающих продукцию оксида азота макрофагами in vitro, из торфа болот Томской области, включающий измельчение исходного сырья, обработку экстрагентом при механическом перемешивании в течение 8 часов, осаждение из раствора неорганической кислотой, разделение жидкой и твердой фаз и сушку последней, отличающийся тем, что торф предварительно высушивают при комнатной температуре до воздушно-сухого состояния, измельчают, просеивают через сито с диаметром отверстий 3 мм, далее экстрагируют при помощи пирофосфата натрия концентрации 2,0-4,0 мас. % в массовом соотношении торф : экстрагент - 1:50-1:100 при постоянном перемешивании при температуре 25-27°C; затем экстракт гуминовых кислот обрабатывают хлороводородной кислотой до pH 1-2, отделяют осадок выделившихся гуминовых кислот центрифугированием, затем отмывают от кислой до pH 7 среды и высушивают при комнатной температуре.
2. Применение гуминовых кислот из торфа болот Томской области для повышения продукции оксида азота макрофагами in vitro.
| СПОСОБ ПОЛУЧЕНИЯ ОКСИГУМАТОВ ИЗ ТОРФА | 2007 |
|
RU2370478C2 |
| СПОСОБ КОМПОСТИРОВАНИЯ ОРГАНИЧЕСКИХ И ОРГАНОМИНЕРАЛЬНЫХ ВЕЩЕСТВ И ОТХОДОВ (ВАРИАНТЫ) | 2001 |
|
RU2212391C2 |
| CN 1232007 A, 20.10.1999. | |||
Авторы
Даты
2017-02-13—Публикация
2015-07-30—Подача