Изобретение относится к медицине, конкретно к фармакологии, и может быть использовано для таргетной стимуляции продукции оксида азота макрофагами при коррекции нарушений в иммунной системе при патологических состояниях, связанных с недостаточностью Th1-зависимого иммунного ответа (хронические, вялотекущие и рецидивирующие инфекционные, а также онкологические заболевания).
Многочисленными исследованиями доказано, что молекула оксида азота (NO) является универсальным трансмиттером, в развитии различных патологических процессов. NO играет важную роль в регуляции нервной, эндокринной и репродуктивной систем, вызывает расслабление гладких мышц сосудов, регламентирует апоптоз и пролиферацию клеток, участвует в защите от патогенов, развитии адаптивных иммунных реакций. Анти-генпрезентирующие клетки при контакте с антигеном ингибируют репликацию патогенов за счет высвобождения различных эффекторных молекул, включая NO, который регулирует функциональную активность, деление и гибель многих типов иммунных и воспалительных клеток, включая макрофаги, Т-лимфоциты, антигенпредставляющие клетки, тучные клетки, нейтрофилы и естественные киллерные клетки. [1, 2]. Такие функции макрофагов в системе иммунной защиты, как фагоцитоз микроорганизмов, микробицидная активность, индукция воспаления, традиционно ассоциируются с классически активированными макрофагами М1 типа, для которых характерна продукция ряда воспалительных цитокинов и активация индуцибельной NO-синтазы [3]. При этом растительные полисахариды (ПС) способны взаимодействовать с рядом рецепторов макрофагов, вызывая развитие воспалительных или противовоспалительных свойств и, как следствие, способствовать протеканию Th1 и Th2 типа иммунного ответа [4].
Род цветковых высших растений Saussurea DC (соссюреа - горькуша; сем. Asteraceae) насчитывает свыше 400 видов, широко распространенных в Евразии и Северной Америке [5]. Химический состав соссюрей мало изучен, несмотря на то, что они находят широкое применение в народной медицине в виде отваров при глаукоме, экземе, легочных, желудочно-кишечных заболеваниях, как кровоостанавливающее, противоревматическое средство и пр. [6]. Свежие листья обладают ранозаживляющим действием, особенно при гнойных ранах; эфирный экстракт из корней проявляет антибактериальную активность [7]. Из надземной части Saussurea salicifolia (L.) DC разработана технология таблеток «Саусифол», обладающих противолямблиозной и противоописторхозной активностью. [8]. Из травы Saussurea controversa DC. получены иммуномодуляторы с широким спектром биологической активности [9]. Получен патент, касающейся применения измельченной надземной части растения рода Saussurea или водного, или водно-спиртового, или сверхкритического флюидного экстракта в качестве средства, обладающего гепато-протекторной активностью [10]. Растения рода Соссюрея также входят в состав многокомпонентных травяных сборов, используемых для непрерывного лечения иммунной недостаточности (набор "Звезда Байкала") и для эндоэкологической коррекции [11, 12]. При этом в ходе оценки неспецифической токсичности установлено, что этанольные извлечения из соссюреи горькой относятся к IV классу опасности (малоопасные вещества) [13].
Известно, что в образцах растительного происхождения как высших, так и низших растений достаточно часто обнаруживаются примеси эндотоксина - липополисахарида (ЛПС), который являются структурными компонентами мембран грам-негативных бактерий [4]. Сам по себе эндотоксин не является токсическим веществом, но его наличие в препаратах, представляет собой серьезную проблему, т.к. может приводить к развитию каскадной прововоспалительной реакции, так называемому эндотоксическому шоку, вплоть до летального исхода. Эндотоксин стабилен в широком диапазоне рН и при высокой температуре. Отсутствие его примесей в природных субстанциях, при выявлении направленных фармакологических эффектов дает значительные преимущества для дальнейшей разработки на их основе лекарственных препаратов различного назначения.
Способы получения растительных ПС, известные на сегодняшний день, в основном, базируются на экстракции водой или другими растворителями (соляная кислота, формалин, этанол) при высокой температуре, осаждении ацетоном или оксалатом аммония и направлены на увеличение выхода масс %. К сожалению, обработка сырья при нагревании, хотя и приводит к повышению выхода целевого продукта, но не дает возможности получить нативные (с неизмененной структурой), в высокой степени очищенные от примеси белка и других сопутствующих веществ компоненты полисахаридной природы.
Известен способ получения суммы полисахаридов, обладающей противовоспалительной активностью [14], заключающийся в экстракции травы и шрота василька синего после выделения суммы флавоноидов исчерпывающей экстракцией 80%-ным водным ацетоном при соотношении сырье: экстрагент 1:1-6, горячей водой при соотношении сырье: экстрагент 1:15-20 соответственно в течение 40-50 мин с последующим упариванием, осаждением 96%-ным этиловым спиртом, фильтрованием и сушкой при температуре 70-75°С в сушильном шкафу. Недостатком этого способа является использование высокотемпературного высушивания полисахарида, что приводит к снижению качества целевого продукта.
Известен способ получения водорастворимых ПС из шрота травы фиалки душистой [15], где из исходного сырья 70%-ным этанолом удаляют полифенольные соединения, его затем дважды экстрагируют водой при нагревании до 95°С при соотношении сырье-экстрагент 1:10 в течение 30 минут. Экстракты объединяют, центрифугируют, упаривают. После этого ПС осаждают трехкратным количеством 96%-ного этилового спирта при комнатной температуре. Плотный осадок отфильтровывают, промывают 96%-ным этиловым спиртом и ацетоном, и затем сушат. Выход целевого продукта составляет до 10,5% от массы растительного сырья, но для его получения используется токсичный ацетон и высокая температура нагревания, что затрудняет очистку целевого продукта.
Известен способ получения ПС из донника желтого, позволяющий повышать их выход [16], при котором сырье экстрагируют 60%-ным этанолом на водяной бане при температуре 65-70°С в соотношении 1:3 по массе, высушивают и экстрагируют водой на кипящей водяной бане 1,5 часа, отжимают и добавляют полученную жидкость к экстракту. Растительное сырье заливают 1% раствором лимоннокислого или щавелевокислого аммония при температуре 75-80°С в соотношении 1:5 и проводят экстракцию для получения водонерастворимых ПС на кипящей водяной бане, экстракт сливают. Все полученные экстракты водорастворимых и водонерастворимых ПС собирают вместе, выпаривают, фильтруют, осаждают этанолом, центрифугируют, осадок высушивают, промывают спиртом, ацетоном, смесью спирта и эфира. Затем водный раствор ПС пропускают через ионообменные колонки с катионитом и анионитом и высушивают. Недостатком способа является получение неразделенной суммы водорастворимых и водонерастворимых полисахаридов.
Запатентован ряд способов выделения растительных полисахаридов при помощи ультразвука, в частности способ получения водорастворимых ПС из листьев подорожника большого [17], который предусматривает двукратное экстрагирование измельченного сырья водой в соотношении 1:20 сырье:экстрагент при обработке в ультразвуковой ванне с частотой 35 КГц в течение 20 мин при температуре 80°С, из полученного фильтрата ПС осаждают трехкратным количеством 95%-ного этанола при перемешивании и нагревании на водяной бане до 30°С в течение 5 минут, осадок фильтруют через предварительно высушенный беззольный бумажный фильтр под вакуумом при остаточном давлении 0,4-0,8 атм. Осадок на фильтре промывают последовательно 15 мл раствора 95%-ного этилового спирта в очищенной воде (3:1) в соотношении сырье:раствор 1:15 и 10 мл смеси этилацетата и 95%-ного этилового спирта (1:1) в соотношении сырье:раствор 1:10, затем сушат на воздухе и при температуре от 100-105°С до постоянной массы. Предложенный способ не предусматривают последующую очистку полисахаридов от белка и со-экстрагируемых веществ.
Задачей настоящего изобретения является получение нативных, высокоочищенных от белка и сопутствующих веществ водорастворимых полисахаридов из растений рода соссюрея (Saussurea DC), способных таргетно усиливать стимуляцию продукции нитритов антигенпрезентриующими клетками, а также расширение сырьевой базы за счет видовой принадлежности используемых растений.
Принципиально новым в предлагаемом изобретении является применение в качестве средства усиливающего секрецию универсального трансмиттера воспаления - оксида азота водорастворимых ПС, выделенных из надземной части соссюреи спорной (S. controversa D), соссюреи иволистной (S. salicifolia (L.) DC.) и соссюреи Фролова (S. frolovii Ldb). Новое свойство полученных водорастворимых ПС было обнаружено в результате экспериментальных исследований и для специалиста явным образом не вытекает из уровня техники, а описание этих свойств не обнаружено авторами в патентной и научно-медицинской литературе. Таким образом, предлагаемое техническое решение соответствует критериям изобретения, а именно - «новизна», «изобретательский уровень» и «промышленная применимость».
Надземную часть растений заготавливают в местах естественного произрастания в середине вегетационного периода (июнь-июль) и высушивают под навесом на открытом воздухе при температуре 25-35°С, в течение 10 дней до содержания влаги не более 9%. Выделение полисахаридов проводят по следующей методике: траву измельчают, просеивают через сита с диаметром пор 1-3 мм, обезжиривают и депигментируют хлороформом в аппарате Сокслета при температуре кипения, из сырья удаляют остатки хлороформа путем экспозиции в вытяжном шкафу, затем замачивают в этилацетате (1:15), настаивают 24 ч, фильтруют, операцию повторяют дважды и удаляют остатки этилацетата из сырья вышеуказанным способом. Далее сырье замачивают в 95% этаноле (1:20) и настаивают в течение 24 ч, далее фильтруют, операцию повторяют трижды, отжимают под прессом и высушивают до полного удаления этанола. Подготовленный растительный материал заливают водой очищенной 1:50, экстрагируют при температуре 25°С в течение 0,5 ч при перемешивании магнитной мешалкой, затем фильтруют через 4 слоя стерильной марли и бумажный фильтр. Экстракцию повторяют трижды, полученные извлечения объединяют и концентрируют на роторном испарителе при температуре 35°С.
Концентрат капельно прибавляют к 95% этанолу (1:4) при перемешивании на магнитной мешалке, затем отстаивают в течение 12 часов при комнатной температуре, полученный осадок отфильтровывают на воронке Бюхнера и промывают 95% этанолом до обесцвечивания фильтрата Выделенную сумму полисахаридов растворяют в воде 1:4 соединяют в соотношении 1:5 с раствором хлороформ-изоамилол (5:1), перемешивают на магнитной мешалке, в течение 0,5 ч, центрифугируют, водный слой содержащий полисахариды отбирают, операцию повторяют дважды. Очищенный раствор ПС переносят в полупроницаемую мембрану с диаметром пор 15 кДа, диализируют против воды очищенной в течение 30 ч, полученный диализат фильтруют через бумажный фильтр, лиофилизуют.
Осуществление заявляемого способа поясняется следующими примерами проведения технологического процесса.
Пример 1 конкретного выполнения технологического процесса.
45,0 г высушенной надземной части соссюреи спорной (S. controversa DC) с содержанием влаги 6,4%, измельчают и просеивают через сита с диаметром пор 1-3 мм, заворачивают в бумажную гильзу, помещают в аппарат Сокслета и проводят экстракцию хлороформом при температуре кипения до полного обесцвечивания хлороформа. Затем гильзу вынимают, сырье распределяют тонким слоем на поддоне и высушивают в вытяжном шкафу до полного удаления хлороформа. Сухое обезжиренное, депигментированное сырье помещают в колбу емкостью 1 литр, с притертым шлифом, заливают этилацетатом в соотношении 1:15, закрывают пробкой и настаивают 24 ч., затем фильтруют, операцию повторяют. Сырье отжимают под прессом, высушивают до полного удаления этилацетата. Далее сырье помещают в колбу емкостью 1 литр, с притертым шлифом, заливают 95% этанолом в соотношении 1:20, закрывают пробкой и настаивают 24 ч. затем фильтруют, операцию повторяют трижды. Сырье отжимают под прессом и высушивают до полного удаления этанола. Подготовленное, очищенное от липофильных и фенольных компонентов сырье в количестве 34,0 г помещают в плоскодонную коническую колбу со шлифом емкостью 2 литра, заливают водой очищенной в соотношении 1:50, устанавливают на магнитную мешалку и ведут экстракцию при температуре 25°С, в течение 0,5 ч. Экстракцию повторяют трижды, после третьей экстракции сырье отжимают, полученные водные извлечения фильтруют через 4 слоя стерильной марли и бумажный фильтр. Фильтраты объединяют и переносят в круглодонную колбу со шлифом и концентрируют на роторном испарителе при температуре 35°С до 250 мл. Концентрат переносят в делительную воронку, носик которой помещают в горловину конической плоскодонной колбы со 1000 мл 95% этанола. Полисахаридный комплекс осаждают путем капельного перемещения концентрата из воронки в колбу с этанолом при постоянном перемешивании на магнитной мешалке. После завершения осаждения, смесь отстаивают в течение 12 часов при комнатной температуре, полученный осадок отфильтровывают на воронке Бюхнера и промывают этанолом до обесцвечивания фильтрата. Осадок сушат, до полного удаления этанола. Затем производят очистку полисахаридов от белка. В колбу со шлифом емкостью 500 мл, помещают смесь хлороформа с изоамилолом (5:1) и устанавливают на магнитную мешалку. Сумму полисахаридов растворяют в воде очищенной в соотношении 1:4 и помещают в эту же колбу, при этом соотношение смесей водный раствор полисахаридов и хлороформ-изоамилол составляет 1:5. Колбу закрывают притертой пробкой и перемешивают на магнитной мешалке в течение 0,5 ч. Полученную суспензию центрифугируют со скоростью 2600 об/мин надосадочную жидкость отбирают. Операцию повторяют дважды. Надосадочную жидкость переносят в полупроницаемую мембрану и диализуют против воды очищенной в течение 30 ч. Диализат фильтруют через бумажный фильтр и лиофилизуют. Масса конечного продукта 0,8120 г, выход в пересчете на абсолютно сухое сырье - 1,93%.
Пример 2.
Отличается от примера 1 тем, что в качестве растительного сырья используется надземная часть соссюреи иволистной (S. salicifolia (L.) DC) и выход конечного продукта в пересчете на абсолютно сухое сырье составляет 1,44%.
Пример 3.
Отличается от примера 1 и 2 тем, что в качестве растительного сырья используется надземная часть соссюреи Фролова (S. frolovii Ldb.), а выход конечного продукта в пересчете на абсолютно сухое сырье составляет 1,17%.
Для определения белка в конечном продукте использовали колориметрический метод Лоури в вариации с предварительным осаждением белка - метод 2 В [18]. По результатам трех параллельных опытов для каждого образца подтверждено отсутствие белка.
Эксперименты по подтверждению биологической активности выделенных ПС проведены на линейных мышах C57BL/6 в возрасте 8-10 недель. Животные получены из отдела экспериментальных биологических моделей НИИФиРМ им. Е.Д. Гольдберга (сертификат качества животных 1 конвенциональной категории). Все процедуры (содержание, умерщвление) были проведены в соответствии с принципами Европейской конвенции о защите позвоночных животных (от 18 марта 1986 г.; Страсбург; ETS №123). Макрофаги (МФ) получали из суспензии перитонеальных клеток, для чего животных забивали дислокацией шейного отдела позвоночника, брюшную полость промывали ледяным изотоническим раствором хлорида натрия (ФР), клетки осаждали, ресуспендировали в культуральной среде и оценивали их жизнеспособность в тесте с 0,1% трипановым синим. Затем клетки помещали по 1,5-2,0×106/мл в пластиковые чашки Петри, культивировали 2 ч при 37°С (в атмосфере 5% CO2 и абсолютной влажности) в среде следующего состава: RPMI 1640 («Sigma») с добавлением 10% ЭТС («Hyclone»), 20 мМ HEPES («Sigma»), 0,05 мМ 2-меркаптоэтанола («Sigma»), 50 мкг/мл гентамицина («Sigma»), 2 мМ L-глютамина («Sigma»), после чего собирали прилипшие к пластику клетки. В экспериментах использовали суспензии, содержащие не менее 95% жизнеспособных клеток. Полученные после прилипания МФ (2,5-3,0×106 клеток/мл) помещали в плоскодонные 96-луночные планшеты и культивировали в указанных выше условиях 48 часов в присутствии выбранных концентраций ПС (наиболее эффективные концентрации действующих веществ были выявлены в предварительных экспериментах in vitro), мурамилдипептида (N-ацетилмурамил-L-аланил-D-изоглютамин, «Calbiochem», США) 30 мкг/мл или 0,1 мкг/мл ЛПС (серотип O111:В4, «Sigma»). Через 48 ч от начала культивирования в супернатантах оценивали содержанию нитритов при помощи реактива Грейса [19], который смешивали с эквивалентным объемом надосадка, абсорбцию замеряли с использованием многоканального спектрофотометра Titertek Multiskan® MCC («Labsystems», Финляндия) при длине волны 540 нм. Концентрацию нитритов определяли по калибровочной кривой, построенной с использованием стандартных растворов нитрита натрия. Для определения примеси эндотоксина исследуемые образцы ПС предварительно инкубировали при тех же условиях с 50 мкг/мл полимиксином В («InvivoGen», США).
Пример 4.
ПС, выделенные предлагаемыми в примерах 1, 2 и 3 способами, оказывали NO-активирующее действие на перитонеальные макрофаги интактных мышей линии C57BL/6 in vitro (таблица 1). Культивирование МФ с ПС приводило к значительному усилению продукции оксида азота в 8,7 (ПС соссюреи спорной), 4,9 (ПС соссюреи иволистной) и 8,5 раз (ПС соссюреи Фролова). При этом выявленное увеличение концентрации нитритов значительно в 5-8 раз превышало значения активирующего действия контрольного вещества - МДП а, в случае с ПС соссюреи Фролова, также было в 1,3 раза выше относительно ЛПС-стимулированного контроля.
Культивирование макрофагов в среде с полимиксином В (контроль 1) приводило к значительному снижению концентрации нитритов в супернатанте ЛПС-стимулированных клеток в 17,4 и 8,8 раза соответственно сериям эксперимента, а также к достоверному подавлению продукции оксида азота при активации МДП. При этом предварительная инкубация с полимиксином В полисахаридов соссюреи спорной, соссюреи иволистной и соссюреи Фролова не влияла на NO-стимулирующие свойства макрофагов. Значения показателя (концентрация оксида азота) не отличались как при инкубация без полимиксина В, так и в его присутствии.
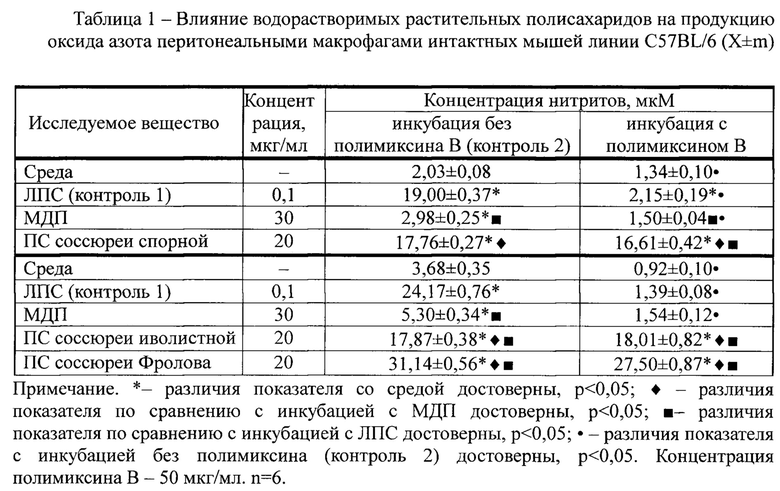
Таким образом, экспериментально установлено, что предложенный способ извлечения ПС из надземных частей соссюреи спорной, соссюреи иволистной и соссюреи Фролова позволяет получать свободные от примеси эндотоксина водорастворимые полисахариды, вызывающие специфическое усиление продукции оксида азота макрофагами in vitro. Выявленные свойства указывают на способность ПС классически активировать антигенпрезентирующие клетки, сами ПС могут быть использованы в качестве основы для разработки низкотоксичных и высокоэффективных средств растительного происхождения для коррекции системы иммунитета при хронических, вялотекущих инфекционно-воспалительных процессах в медицине и ветеринарии.
Список литературы
1. Ibiza, S. The role of nitric oxide in the regulation of adaptive immune responses / S. Ibiza, J.M. Serrador // Inmunologia Volume 27, Is. 3. 2008, P. 103-117.
2. Tripathi, P. The role of nitric oxide in inflammatory reactions / P. Tripathi, P. Tripathi, L. Kashyap, V. Singh // FEMS Immunology & Medical Microbiology, V. 51., Is. 3., 2007, P. 443-452.
3. Mantovani, A. Macrophage diversity and polarization: in vivo Veritas / A. Mantovani, // Blood. 2006. Vol. 108. №2. P. 408-409.
4. Schepetkin, I.A. Botanical polysaccharides: macrophage immunomodulation and therapeutic potential / Schepetkin I.A., Quinn М.Т // Int. Immunopharmacol. 2006. Vol. 6. P. 317-333.
5. Флора СССР / M. Л.: Изд-во АН СССР. - 1962. - Т. 27. - 757 с.
6. Телятьев, В.В. Полезные растения Центральной Сибири / В.В. Телятьев // Иркутск. - 1985. - 383 с.
7. Растительные ресурсы СССР: Цветковые растения, их химический состав, использование; Семейство Asteraceae. - Л.: Наука. - 1993. - 350 с.
8. Разработка психотропных и противопаразитарных лекарственных средств / Е.А. Краснов и др. // [и др.] // Актуальные проблемы фармакологии и поиска новых лекарственных препаратов: материалы науч. конф., посвящ. 15-летию НИИ фармакологии: Томск. - 1999. - с. 197-200.
9. Semenow, A.A. Natural immune-modulators from Siberian plants / A.A. Semenow // Int. Conf. Natur. Prod. and Physiol. Aktive Subst, Novosibirsk, Nov. 30 - Dec. 6, 1998. Book Ab-str. Novosibirsk, 1998. P. 11.
10. Патент RU 2464036 C1 МПК A61K 36/28 опубликован 20.10.2012 г.
11. Патент RU 2218168 C2 МПК A61K 35/78 опубликован 27.06.2003 г.
12. Патент RU 2297843 С2 МПК А61К 36/28 опубликован 27.04.2007 г.
13. Погодин, И.С. Фармакологическое изучение соссюреи горькой / И.С. Погодин, Е.А. Лукша // Омский научный вестник. 2012. №2(114). С. 49-52.
14. Патент RU 2063236, МПК А61К 35/76 опубликован 10.07.1996 г.
15. Патент RU 2232774 МПК С08В 37 А61К 35/78 опубликовано 20.07.2004 г.
16. Патент RU 2296132 МПК С08В 37 опубликовано 27.03.2007 г.
17. Патент RU 2530501 МПК С08В 37/00 опубликован 10.10.2014.
18. Государственная фармакопея РФ. XIII изд. - 2015. - Т.1. - ОФС.1.2.3.0012.15.
19. Analysis of nitrate, nitrite and [15N] nitrite in biological fluids / L.C. Green et al. // Anal. Biochem. - 1982. - V. 126. - P. 131-143.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО НА ОСНОВЕ ВОДОРАСТВОРИМЫХ РАСТИТЕЛЬНЫХ ПОЛИСАХАРИДОВ, ОБЛАДАЮЩЕЕ ПРОТИВОАЛЛЕРГИЧЕСКОЙ АКТИВНОСТЬЮ | 2023 |
|
RU2823873C1 |
| СРЕДСТВО НА ОСНОВЕ АРАБИНОГАЛАКТОУРОНАНОВ, ОБЛАДАЮЩЕЕ ИММУНОМОДУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2024 |
|
RU2836422C1 |
| СРЕДСТВО ДЛЯ СТИМУЛЯЦИИ РОСТА КЛЕТОК ГРАНУЛОЦИТАРНОГО И ЛИМФОИДНОГО РЯДА В КОСТНОМ МОЗГЕ И РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2017 |
|
RU2673537C2 |
| Средство, обладающее иммуномодулирующей активностью | 2018 |
|
RU2697526C1 |
| СПОСОБ ПОЛУЧЕНИЯ α(1,2)-L-рамно-α(1,4)-D-ГАЛАКТОПИРАНОЗИЛУРОНАНА ИЗ КОРНЕВИЩ Acorus calamus L. | 2014 |
|
RU2548768C1 |
| Средство, обладающее иммуномодулирующей активностью | 2019 |
|
RU2734420C1 |
| Средство, обладающее иммуномодулирующей активностью | 2017 |
|
RU2657819C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВОВОСПАЛИТЕЛЬНОЙ, МОЧЕГОННОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2542493C1 |
| СПОСОБ ВЫДЕЛЕНИЯ 3-ОКСО-8-ГИДРОКСИ-1,5,7А,4,8В(Н)-ГВАЙ-10(14),11(13)-ДИЕН-12,6-ОЛИДА | 2017 |
|
RU2665975C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ГЕПАТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2259208C2 |
Изобретение относится к фармацевтической промышленности, а именно к применению безбелковых водорастворимых полисахаридов в качестве средства для стимуляции продукции оксида азота макрофагами. Применение безбелковых водорастворимых полисахаридов, выделенных из надземной части соссюреи спорной (Saussurea controversa DC), соссюреи иволистной (Saussurea salicifolia (L.) DC) или соссюреи Фролова (Saussurea frolovii Ldb.), в качестве средства для стимуляции продукции оксида азота макрофагами, которые получают путем предварительного удаления липофильных и фенольных компонентов из растительного сырья, с последующим выделением и осаждением суммы полисахаридов, где растительный материал заливают водой очищенной 1:50, экстрагируют, отжимают, после третьей экстракции полученные водные извлечения фильтруют, фильтраты объединяют и концентрируют, далее полисахаридный комплекс осаждают этанолом, затем отстаивают, полученный осадок отфильтровывают и промывают этанолом до обесцвечивания фильтрата, осадок высушивают до полного удаления этанола, далее осуществляют очистку от белка и примеси эндотоксина. Вышеописанное применение эффективно в качестве средства для стимуляции продукции оксида азота макрофагами. 1 табл., 4 пр.
Применение безбелковых водорастворимых полисахаридов, выделенных из надземной части соссюреи спорной (Saussurea controversa DC), соссюреи иволистной (Saussurea salicifolia (L.) DC) или соссюреи Фролова (Saussurea frolovii Ldb.), в качестве средства для стимуляции продукции оксида азота макрофагами, полученных путем предварительного удаления липофильных и фенольных компонентов из растительного сырья, выделения и осаждения суммы полисахаридов, где растительный материал заливают водой очищенной 1:50, экстрагируют при температуре 25°С в течение 30 мин при перемешивании, сырье отжимают, экстракцию повторяют трижды, после третьей экстракции полученные водные извлечения фильтруют, фильтраты объединяют и концентрируют на роторном испарителе при температуре 35°С, далее полисахаридный комплекс осаждают этанолом 95%, затем отстаивают в течение 12 ч при комнатной температуре, полученный осадок отфильтровывают и промывают 95% этанолом до обесцвечивания фильтрата, осадок высушивают до полного удаления этанола, далее осуществляют очистку от белка и примеси эндотоксина.
| Андреева Е.Ю | |||
| и др | |||
| Содержание полисахаридов в наземной части | |||
| // Химия растительного сырья | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
| Schepetkin I.A | |||
| et al | |||
| Botanical polysaccharides: macrophage immunomodulation and therapeutic potential | |||
| // International immunopharmacology | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Приспособление для обрезывания караваев теста | 1921 |
|
SU317A1 |
| Шиповская А.И | |||
| Методы выделения и физико-химические | |||
Авторы
Даты
2020-10-28—Публикация
2018-12-24—Подача