Область техники, к которой относится изобретение
Настоящее изобретение касается нового применения производного вербенона для лечения дегенеративного заболевания мозга, и более конкретно - фармацевтической композиции для профилактики или лечения дегенеративного заболевания мозга, которая содержит производное вербенона или его соль, оказывающее влияние на ингибирование индуцированной эксайтотоксичностью гибель нейронов, ингибирование окислительного стресса и ингибирование миграции или инфильтрации внутрисосудистых воспалительных клеток (например, макрофагов и нейтрофилов) в пораженные участки мозга, и способа профилактики или лечения дегенеративных заболеваний мозга с применением указанной композиции.
Предшествующий уровень техники
Дегенеративные заболевания мозга представляют собой возрастные заболевания, вызванные дисфункцией нейронов, и интерес общества к дегенеративным заболеваниям мозга растет с быстрым увеличением доли пожилого населения. Дегенеративные заболевания мозга классифицируются по основным клиническим симптомам и поражаемым областям мозга и включают болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, рассеянный склероз и боковой амиотрофический склероз.
Известно, что дегенеративные заболевания мозга вызваны гибелью нейронов, что сильно влияет на передачу информации в центральной нервной системе, нарушения формирования или функционирования синапсов, осуществляющих передачу информации между нейронами, и на нарушения или ухудшение электрической активности нейронов, но до сих пор их радикальное лечение затруднено, и их причины все еще неясны.
В свете последних достижений клеточной и молекулярной биологии, активно изучаются причины дегенеративных заболеваний мозга и разработка терапевтических средств против дегенеративных заболеваний мозга. Исследования по разработке терапевтических средств против дегенеративных заболеваний мозга фокусировались главным образом на следующих направлениях: (1) стимуляция холинергической активности; (2) антагонизм в отношении рецепторов NMDA (N-метил-D-аспартат); (3) исследования в области молекулярной и клеточной биологии метаболизма β-амилоида или Тау-протеина, и разработка вакцины и терапевтических антител против β-амилоид-генерирующего протеина в качестве антигена; (4) индуцирование экспрессирования нейротрофического фактора; (5) разработка антиоксидантов, способных ингибировать протеин-индуцированное окислительное повреждение нейронов; и (6) разработка противовоспалительных лекарственных средств, способных ингибировать воспалительный ответ, вызванный избыточной инфильтрацией и активностью воспалительных клеток (Sonkusare et al., Pharmacological Research, 51(1), 1-17, 2005; Stanaione et al., Ann 1st Super Sanita, 47(1), 49-54, 2011; Halperin et al., Neurotherapeutics, 6(1), 128-140, 2009).
AChE ингибитор, представляющий собой холинэргический агент, подавляет разложение Ach (ацетилхолина) и, таким образом, восстанавливает работу холинэргических нейротрансмиттеров. В качестве таких AChE ингибиторов были одобрены FDA и в настоящий момент доступны на рынке таркриен, донепезил, ривастигмин и галантамин.
Сообщалось, что окислительный стресс является важной причиной дегенеративных заболеваний мозга и центральной нервной системы, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона (Jin DQ et al, Biochemical and Biophysical Research Communications, 331, 1264-1269, 2005; Lim CS et al, Biological and Pharmaceutical Bulletin, 29, 1212-1216, 2006).
Число пациентов с ишемическими сосудистыми заболеваниями (инфаркт миокарда, инсульт и тромбоз) в мире составляло 25 миллионов в 2007 году, и ожидается продолжение роста до 28 миллионов в 2017 году (DataMonitor, 2007). В большинстве стран ОЭСР ишемические сосудистые заболевания были лидирующей причиной смерти (226,6 человек на 100000 человек в 2004 году), а на втором месте был рак (165,6 человек). Инсульт подразделяется на геморрагический инсульт, характеризующийся повреждением тканей мозга, вызванным разрывом кровеносных сосудов мозга, и на ишемический инсульт, представляющий собой инфаркт головного мозга, вызванный блокадой кровотока в мозге. Инсульт представляет собой заболевание с очень высокой частотой встречаемости, которое каждый год вместе с раком занимает первое или второе место в качестве причины смерти в Корее (данные Корейского Государственного статистического бюро за 2002-2008 годы), и Корея занимает второе место среди стран ОЭСР по количеству смертей вследствие инсульта. Согласно отчету Американской организации по изучению сердечных заболеваний (AHA) за 2008 год, в мире ежегодно тратится 65,5 миллиардов долларов на лечение инсульта и ишемических сосудистых заболеваний, но размер рынка средств против инсульта составляет всего 1,3 миллиарда долларов. Так, предпринимались активные усилия по разработке терапевтических средств против ишемического инсульта, которые имеют потенциал рынка в 22 миллиарда долларов или больше, если какие-либо терапевтические средства с подтвержденной эффективностью выйдут на рынок в ближайшие несколько лет.
В Корее инсульт занимает первое место среди причин смерти, что выше, чем в высокоразвитых странах, включая США, Канаду, Австралию и т.п. Инсульт драматическим образом понижает качество жизни, нарушая моторные и сенсорные функции и вызывая нарушения функций высшего порядка, таких как память, обучаемость, вычисления и умозаключения, и причиняет сильные душевные и физические страдания пациентам и их семьям вплоть до момента смерти. За последние годы, в свете быстрого старения населения, количество инсультов и увеличение времени жизни после инсульта становятся большой социальной проблемой. Таким образом, необходима разработка терапевтических средств для уменьшения интенсивности симптомов и для лечения инсульта.
Несмотря на клиническую важность проблемы инсульта и большой размер рынка, как указано выше, разработка терапевтических средств против инсульта все еще находится на недостаточном уровне, и клинически одобренные терапевтические средства против инсульта включают только тканевой активатор плазминогена (t-PA). Инсульт вызывается разными причинами и включает в себя различные заболевания с разными этиологическими факторами, включая инфаркт мозга, кровоизлияние в мозг и субарахноидальное кровоизлияние и т.п. Кроме того, инсульт может быть вызван различными цереброваскулярными заболеваниями, включая артериосклероз, церебральную амилоидную ангиопатию и расслоение аорты, а также может быть вызван кардиогенной эмболией вследствие аритмии или заболевания коронарной артерии. Как описано выше, причины инсульта разнообразны, но с точки зрения клеточной биологии считается, что снижение притока крови и наступающая в результате гибель клеток имеет общий механизм. По этой причине понимание механизма ишемической гибели нейронов представляет собой ключевую технологию в разработке терапевтических стратегий профилактики, контроля и лечения инсульта.
В Корее и других странах многие исследовательские группы предпринимали усилия по предотвращению заболеваний мозга, изучая механизм гибели нейронов, как описано выше. На случай инсульта еще не разработано отдельного терапевтического средства, и многие лечащие врачи с неохотой применяют даже t-PA, единственное терапевтическое средство, применяющееся в клинике для растворения тромбов, образующихся в кровеносных сосудах мозга, из-за его побочных эффектов, таких как кровоизлияние в мозг. До настоящего момента многие исследовательские группы пытались разработать терапевтическое средство против инсульта на основе либо антагониста рецептора глютаминовой кислоты, являющейся возбуждающим нейротрансмиттером, либо антиоксиданта, но такие попытки проваливались из-за недостаточной эффективности или токсичности лекарственных средств.
Время, необходимое для доставки пациента с инсультом в отделение неотложной помощи после момента инсульта, обычно составляет несколько часов или больше. В промежуток времени от нескольких минут до нескольких часов после момента инсульта, нейроны в первую очередь поражаются вследствие возбуждающей нейротоксичности, являющейся следствием чрезмерного высвобождения глютаминовой кислоты, а во вторую очередь - вследствие воздействия избыточного количества кислородных и азотных радикалов, вырабатывающихся с течением времени. Через несколько десятков часов нейроны сильно и необратимо повреждены вследствие воспалительного ответа, и в этом случае клинически бессмысленно применять ингибитор возбуждающей нейротоксичности.
Как указано выше, инсульт является не заболеванием, вызываемым единственным фактором, а заболеванием, вызывающим повреждение мозга через различные пути и механизмы гибели клеток. В последние годы предпринимались попытки достижения синергетического терапевтического эффекта в отношении инсульта путем использования комбинации лекарственных средств с различными механизмами действия. Например, введение аспирина в комбинации с дипиридамолом показало благоприятный прогноз в случае инсульта, в сравнении с введением одного только аспирина (Chatuvedi S., Clin Therap, 30(7), 1196-205, 2008). Кроме того, комбинация 17β-эстрадиола и tPA удлиняет время терапевтического действия у пациентов с ишемическим инсультом, потому что 17β-эстрадиол уменьшает интенсивность кровоизлияния в мозг, вызываемого экспрессированием урокиназы, ММР2 и ММР9, в свою очередь вызываемого действием tPA (Liu R. et al., J Pharmacol Exp Ther, 332(3), 1006-12, 2010). Введение мемантина (являющегося антагонистом NMDA рецептора) в комбинации с кленбутеролом (являющимся агонистом бета-андреналин бета-2-рецептора) оказало синергетический эффект на подавление ишемического поражения мозга в модели перманентной очаговой ишемии). Кроме того, введение мемантина в комбинации с блокатором ионов кальция топираматом оказало синергетический эффект на подавление поражения мозга, индуцированного гипоксией, у новорожденных крысят (Culmsee С. et al., Stroke, 35(5), 1197-202, 2004). Однако такие исследования в основном направлены на уменьшение тяжести симптомов и не показывают синергетических эффектов в плане механизмов зашиты тканей мозга.
Для понимания ишемического повреждения тканей мозга, вызванных ишемией, и разработки лекарственного средства против такого повреждения тканей мозга, необходимо понимать механизм возникновения повреждения тканей мозга после ишемии. В целом, повреждение или гибель клеток мозга после ишемии могут быть вызваны различными факторами. Например, известно, что эксайтотоксичность, периинфарктная деполяризация, окислительный стресс и воспаление связаны с развитием ишемического повреждения мозга (Dirnagl et al., Trends Neurosci., 22, 391-397, 1999). Таким образом, важно понимать очень разнообразные временные профили (например, момент наступления и продолжительность) и надлежащим образом прерывать их патологические каскады.
Гибель нейронов вследствие эксайтотоксичности можно подавить с помощью антагониста глютаматного рецептора, и ионными рецепторами, на которые воздействует глютамат, являются рецепторы AMPA (α-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота), каината и NMDA (N-метил-D-аспартат). В частности, проводилось много исследований связи гибели клеток и активности NMDA рецептора (Standridge J.B., Clin. Ther., 26(5), 615-630, 2004). Однако, несмотря на предпринимавшиеся усилия, блокаторы NMDA рецептора не были успешны в клинических исследованиях, поскольку они показывали незначительную эффективность или обладали токсичностью. Блокатор NMDA рецептора МК-801 существенно уменьшал ишемическое повреждение мозга, но имел большой недостаток в виде маленького времени терапевтического действия. МК-801 показал нейрон-защитный эффект на крысах и карликовых песчанках только тогда, когда его вводили в течение 1 часа после наступления очаговой ишемии (Margaill et al., J Cereb Blood Flow Metab, 16, 107-113, 1996; Hatfield RH et al., Eur J Pharmacol, 216, 1-7, 1992). Кроме того, МК-801 замедлял наступление постишемической гибели нейронов, но не улучшал ни восстановление нейронов, ни финальное значение выживаемости спустя несколько недель после введения (Valtysson J. et al., Acta Neurochir (Wien), 129, 58-63, 1994; Von Lubitz DK et al., Eur J Pharmacol, 233, 95-100, 1993). Рецепторы возбуждающего нейромедиатора глютаминовой кислоты включают АМРА рецептор, вместе с NMDA рецептором. Антагонисты АМРА рецепторов не оказывали значительного защитного эффекта в отношении неврологического расстройства спустя 28 дней после МСАО (Colbourne F et al., Stroke, 30, 662-668, 1999). Короткое время терапевтического действия и отсутствие долговременного терапевтического эффекта у антагонистов NMDA или АМРА рецепторов подсказывает, что такие рецепторы имеют только временное значение в раннем ишемическом каскаде. Таким образом, предполагают, что другие патологические процессы, не подвергающиеся воздействию при таком лечении, обусловливают отсроченное ишемическое повреждение мозга.
Аналогично различным дегенеративным заболеваниям, окислительный стресс очень сильно влияет на гибель или потерю функции клеток при инсульте. Так, проводились активные исследования терапевтического эффекта антиоксидантов на ишемический инсульт (Salama М. et al., Co-Enzyme Q10 to Treat Neurological Disorders: Basic Mechanisms, Clinical Outcomes, and Future Research Direction. CNS Neurol Disord Drug Targets. 2013; Rodrigo R. et al., Oxidative Stress and Pathophysiology of Ischemic Stroke: Novel Therapeutic Opportunities. CNS Neurol Disord Drug Targets. 2013). В Японии эдаравон, имеющий антиоксидантный эффект в качестве основного механизма действия, выведен на рынок в качестве терапевтического средства против инсульта (Firuzi О et al., Curr Med Chem., 18(25), 3871-88, 2011; Yoshida H. et al., CNS Drug Rev., 12(1), 9-20.2006).
Через несколько часов после возбуждающей нейротоксичности вследствие ишемии в пораженной области мозга инициируется воспалительный ответ, который продолжается в течение периода от нескольких дней до нескольких недель, усугубляя поражение мозга. В последние годы активно предпринимались попытки лечения ишемического инсульта с применением противовоспалительных средств (Price CJ et al., J Neurol Neurosurg Psychiatry, 74, 1476-1484, 2003; Salama M, Co-Enzyme Q10 to Treat Neurological Disorders:Basic Mechanisms, Clinical Outcomes, and Future Research Direction. CNS Neurol Disord Drug Targets. 2013; Rodrigo R. et al., Oxidative Stress and Pathophysiology of Ischemic Stroke: Novel Therapeutic Opportunities. CNS Neurol Disord Drug Targets. 2013). Также недавно сообщалось, что воспалительные клетки, проникающие из кровеносных сосудов, играют большую роль в усугублении поражения мозга при ишемическом инсульте (Kang GH et al., J Neurol Sci., 15, 318(1-2), 25-30, 2012; Choi IYet al., Am J Pathol, 179(4), 2042-52, 2012; Choi YK et al., Free Radic Res., 44(8), 925-35, 2010; Choi IY et al., Free Radic Res., 44(5), 541-51, 2010; Lee JC et al., Glia, 50(2), 168-81, 2005). Кроме того, сообщалось, что противовоспалительный ответ, опосредуемый каннабиноидным В2 рецептором, ингибирует повреждения в ишемических тканях мозга (Choi IY et al., Am J Pathol, 182(3), 928-39, 2013).
Таким образом, предполагают, что разработка лекарственных средств, обладающих различной активностью в плане защиты клеток, является ключевой для всестороннего лечения инсульта. Для достижения этой цели, то есть для разработки плейотропного лекарственного средства, характеризующегося различными механизмами клеточной защиты, авторы настоящего изобретения разработали производное (1S)-(-)-вербенона. (1S)-(-)-вербенон представляет собой природный антиагрегационный феромон, генерируемый короедами из прекурсора, альфа-пинена, содержащегося в смоле деревьев, на которых обитают короеды. Сообщалось, что эфирные масла, содержащие (1S)-(-)-вербенон, обладают биологической активностью, такой как противомикробное действие или инсектицидное действие (Bernarde WA, Z Naturforsch С, 65, 588-93, 2010; Martinez-Velazquez М., J Med Entomol, 48, 822-827, 2011). Кроме того, в WO 2000/63159 описано, что вербеной ((1S, 5S)-4,6,6-триметилбицикло[3.3.3]гепт-3-ен-2-он) и его производные обладают противовоспалительным действием в дыхательных путях.
Однако в указанном выше патентном документе не описано и не предположено влияние производных вербенона на снижение смертности нейронов и уменьшение окислительного стресса, на подавление ишемического поражения мозга и подавление миграции воспалительных клеток.
Соответственно, авторы настоящего изобретения измерили NMDA-индуцированную эксайтотоксичность и смертность клеток в гипоксической-ишемической крысиной модели для оценки влияния производных вербенона на снижение смертности нейронов и уменьшение окислительного стресса, а также на подавление ишемического поражения мозга и воспалительного ответа, и экспериментально исследовали антиоксидантное действие производных вербенона. В результате авторы настоящего изобретения впервые обнаружили, что производные вербенона оказывают эффект на лечение дегенеративных заболеваний мозга. Конкретнее, авторы настоящего изобретения обнаружили, что производные вербенона по настоящему изобретению снижают смертность нейронов и уменьшают окислительный стресс, и оказывают прекрасный эффект на подавление ишемического поражения мозга и воспалительного ответа in vivo, тем самым совершив настоящее открытие.
Раскрытие изобретения
Целью настоящего изобретения является разработка нового применения производного вербенона для профилактики или лечения дегенеративного заболевания мозга.
Для достижения указанной цели в настоящем изобретении описана фармацевтическая композиция для профилактики или лечения дегенеративного заболевания мозга, композиция, содержащая в качестве действующего вещества производное вербенона, имеющее структуру формулы 1, или его фармацевтически приемлемую соль:
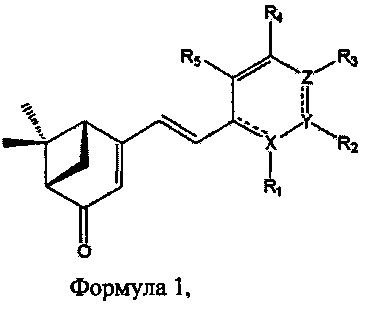
где R1, R2, R3, R4 и R5 каждый независимо представляют собой по меньшей мере один заместитель, выбранный из атома водорода, атома галогена, выбранного из F, Cl, Br и I, гидроксильной группы, С1-С3 алкильной группы, С1-С3 алкокси-группы, амино-группы, С1-С3 алкиламино-группы, С1-С3 алкилдиамино-группы, C5-C8 ароматического цикла, С5-С8 циклического кольца и C5-C8 гетероароматического цикла; X, Y и Z каждый независимо представляют собой атом углерода или по меньшей мере один гетероатом, выбранный из группы, состоящей из атомов N, OS; и
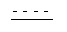 означает двойную связь или одинарную связь.
означает двойную связь или одинарную связь.
В настоящем изобретении, указанное производное вербенона может снижать смертность нейронов и окислительный стресс, подавлять ишемическое поражение мозга и подавлять миграцию воспалительных клеток.
В настоящем изобретении дегенеративное заболевание мозга может представлять собой инсульт, паралич, деменцию, болезнь Альцгеймера, болезнь Паркинсона или болезнь Хантингтона. Конкретно, оно может представлять собой инсульт, васкулярную деменцию или деменцию типа Альцгеймера. Более конкретно, оно может представлять собой инсульт, и еще более конкретно - ишемический инсульт.
В настоящем изобретении описанная композиция может дополнительно содержать подходящий носитель, вспомогательное вещество или разбавитель, обычно применяемые при приготовлении фармацевтических композиций.
В настоящем изобретении описанную композицию можно вводить в рецептуру или применять в комбинации с одним или больше лекарственными средствами, выбранными из группы, состоящей из блокаторов кальциевых каналов, антиоксидантов, антагонистов глютамата, антикоагулянтов, антигипертензивных лекарственных средств, антитромботических лекарственных средств, антигистаминных средств, противовоспалительных средств, противораковых средств и антибиотиков.
В настоящем изобретении также описано применение производного вербенона, имеющего структуру формулы 1, или его фармацевтически приемлемой соли для профилактики или лечения дегенеративного заболевания мозга.
В настоящем изобретении также описан способ профилактики или лечения дегенеративного заболевания мозга с применением производного вербенона, имеющего структуру формулы 1, или его фармацевтически приемлемой соли.
В настоящем изобретении также описан способ профилактики или лечения дегенеративного заболевания мозга, включающий введение пациенту производного вербенона, имеющего структуру формулы 1, или его фармацевтически приемлемой соли.
В настоящем изобретении также описан функциональный пищевой продукт для профилактики или смягчения симптомов дегенеративного заболевания мозга, содержащий в качестве действующего вещества производное вербенона, имеющее структуру формулы 1.
Краткое описание чертежей
На фиг. 1 показано влияние соединений по настоящему изобретению на защиту нейронов коры у крыс.
На фиг. 2 показано влияние соединений по настоящему изобретению на NMDA-индуцированную эксайтотоксичность.
На фиг. 3 показано влияние соединений по настоящему изобретению на ингибирование внутриклеточного окислительного стресса.
На фиг. 4 показано влияние соединений по настоящему изобретению на уменьшение ишемических повреждений, отека головного мозга, дефицита нейронов в in vivo модели очаговой церебральной ишемии.
На фиг. 5 показано влияние соединений по настоящему изобретению на повышение антиоксидантной активности в пораженных ишемией тканях мозга в in vivo модели очаговой церебральной ишемии.
На фиг. 6 показано влияние соединений по настоящему изобретению на ингибирование миграции и инфильтрации воспалительных клеток в пораженные ишемией ткани мозга в in vivo модели очаговой церебральной ишемии.
На фиг. 7 показано влияние соединений по настоящему изобретению на ингибирование экспрессии цитокинов в пораженных ишемией тканях мозга в in vivo модели очаговой церебральной ишемии.
На фиг. 8 показано влияние соединений по настоящему изобретению на подавление роста проницаемости гематоэнцефалического барьера вокруг пораженных ишемией тканей мозга в in vivo модели очаговой церебральной ишемии.
На фиг. 9 показано влияние соединений по настоящему изобретению на рост уровня долгосрочной выживаемости и неврологического восстановления у крыс с ишемическими повреждениями в in vivo моделях очаговой церебральной ишемии.
На фиг. 10 показано, что соединения по настоящему изобретению не обусловливают заметного роста площади гематомы, индуцированной аутологической кровью, в in vivo модели геморрагического инсульта.
Оптимальный способ практического осуществления настоящего изобретения
В одном аспекте настоящее изобретение касается нового применения производного вербенона, имеющего структуру формулы 1:
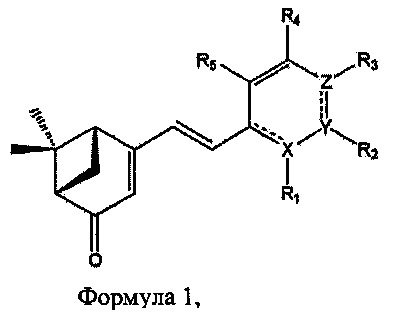
где R1, R2, R3, R4 и R5 каждый независимо представляют собой по меньшей мере один заместитель, выбранный из атома водорода, атома галогена, выбранного из F, Cl, Br и I, гидроксильной группы, С1-С3 алкильной группы, С1-С3 алкокси-группы, амино-группы, С1-С3 алкиламино-группы, С1-С3 алкилдиамино-группы, C5-C8 ароматического цикла, С5-С8 циклического кольца и С5-С8 гетероароматического цикла; X, Y и Z каждый независимо представляют собой атом углерода или по меньшей мере один гетероатом, выбранный из группы, состоящей из атомов N, О и S; и
 означает двойную связь или одинарную связь.
означает двойную связь или одинарную связь.
Среди соединений, отвечающих определению формулы I, предпочтительными являются соединения, в которых R1, R2, R3, R4 и R5 каждый независимо представляют собой по меньшей мере один заместитель, выбранный из атома водорода, атома галогена, выбранного из F, О, Br и I, гидроксильной группы, метальной группы, этильной группы, метокси-группы, этокси-группы, амино-груплы, C5-С6 ароматического цикла, C5-С6 циклического кольца и C5-С6 гетероароматического цикла, и еще более предпочтительно - по меньшей мере один заместитель, выбранный из атома водорода, атома галогена, выбранного из F, Cl, Br и I, гидроксильной группы, метальной группы, метокси-группы, фенильной группы, пиррольной группы и пиридиновой группы; и X, Y и Z каждый независимо представляют собой атом углерода или по меньшей мере один гетероатом, выбранный из группы, состоящей из атомов N, О и S, и более предпочтительно - по меньшей мере один атом, выбранный из группы, состоящей из атома углерода и атома N.
Наиболее предпочтительное соединение из группы соединений, отвечающих определению формулы I, выбрано из следующих соединений:
(1S,5R)-4-(4-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3а);
(1S,5R)-4-(4-гидрокси-2-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3b);
(1S,5R)-4-(3,4-дигидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3с);
(1S,5R)-4-(3-бром-4-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3d);
(1S,5R)-4-(4-гидрокси-2,6-диметоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3е);
(1S,5R)-4-(3,4-дигидрокси-5-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3f);
(1S,5R)-4-(3-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3g);
(1S,5R)-4-(2-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3h);
(1S,5R)-4-(2-гидрокси-4-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3i);
(1S,5R)-6,6-диметил-4-стирил-бицикло[3.1.1]гепт-3-ен-2-он (4а);
(1S,5R)-4-(4-фторстирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (4b);
(1S,5R)-4-(4-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (4с);
(1S,5R)-4-(2-(бифенил-4-ил)винил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (4d);
(1S,5R)-4-(4-(1Н-пиррол-1-ил)стирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (4е);
(1S,5R)-4-(3,4-диметоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (4f);
(1S,5R)-4-(3,5-диметоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (4g);
(1S,5R)-4-(2,5-диметоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (4h);
(1S,5R)-4-(5-бром-2-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (4i);
(1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-2-ил)винил)-бицикло[3.1.1]гепт-3-ен-2-он (5а);
(1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-3-ил)винил)-бицикло[3.1.1]гепт-3-ен-2-он (5b); и
(1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-4-ил)-винил)-бицикло[3.1.1]гепт-3-ен-2-он (5с).
Соединения по настоящему изобретению, представленные формулой I, могут быть получены в виде их фармацевтически приемлемых солей или сольватов, согласно общеупотребимым методам, известным в данной области техники.
Фармацевтически приемлемая соль предпочтительно представляет собой кислотно-аддитивную соль, сформированную с фармацевтически приемлемой свободной кислотой. Кислотно-аддитивную соль можно получить общеизвестным способом, например путем растворения соединения в избыточном количестве водного раствора кислоты с образованием соли и высаживания полученной соли с применением смешивающегося с водой органического растворителя, такого как метанол, этанол, ацетон или ацетонитрил. Альтернативно, кислотно-аддитивную соль можно получить нагреванием эквимольного количества соединения и кислоты в воде или спирте (например, в монометиловом эфире гликоля) и последующим высушиванием смеси упариванием или отфильтровыванием выпавшей в осадок соли.
В настоящем контексте свободная кислота может представлять собой неорганическую кислоту или органическую кислоту. Примеры неорганических кислот включают хлористоводородную кислоту, фосфорную кислоту, серную кислоту, азотную кислоту и оловянную кислоту, а примеры органических кислот включают метансульфокислоту, п-толуолсульфокислоту, уксусную кислоту, трифторуксусную кислоту, лимонную кислоту, малеиновую кислоту, янтарную кислоту, щавелевую кислоту, бензойную кислоту, винную кислоту, фумаровую кислоту, миндальную кислоту, пропионовую кислоту, молочную кислоту, гликолевую кислоту, глюконовую кислоту, галактуроновую кислоту, глютаминовую кислоту, глутаровую кислоту, глюкуроновую кислоту, аспарагиновую кислоту, аскорбиновую кислоту, угольную кислоту, ванилиновую кислоту и иодистоводородную кислоту.
Кроме того, можно получить фармацевтически приемлемые соли металлов с помощью основания. Соль щелочного металла или соль щелочноземельного металла можно получить, например, посредством растворения соединения в избыточном количестве раствора гидроксида щелочного металла или гидроксида щелочноземельного металла, отфильтровывания нерастворимой соли и последующей сушки фильтрата путем упаривания. В качестве солей металлов подходящими являются соли натрия, калия или кальция. Также можно получить соответствующие соли серебра путем реакции соли щелочного металла или соли щелочноземельного металла с подходящей солью серебра (например, нитратом серебра).
Если не указано иное, фармацевтически приемлемые соли соединений, имеющих структуру формулы 1, включают соли по кислотным или основным группам, которые могут присутствовать в соединениях формулы I. Например, фармацевтически приемлемые соли включают соли натрия, кальция и калия по гидроксильным группам, и другие фармацевтически приемлемые соли по амино-группе, включая гидробромид, сульфат, гидросульфат, фосфат, гидрофосфат, дигидрофосфат, ацетат, сукцинат, цитрат, тартрат, лактат, манделат, метансульфонат (мезилат) и пара-толуолсульфонат (тозилат). Указанные соли можно получать общеупотребимыми способами получения солей, известными в данной области техники.
Соединения формулы 1 можно получать известными в данной области методами синтеза, и их можно химически синтезировать способами, показанными на приведенных далее реакционных схемах, но не ограничиваясь только ими.
Реакционная схема 1
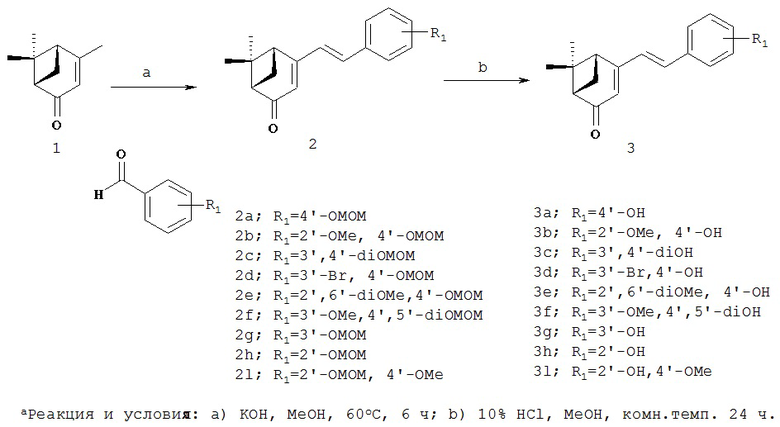
Коммерчески доступный (1S)-(-)-вербенон (1) можно конденсировать с бензальдегидными производными (2a-i), содержащими гидроксистирильную группу, в присутствии основания, и затем снять защиту кислотой, получая при этом различные производные вербенона (3а-i), имеющие алкокси- или бром-заместитель или фенольную функциональную группу.
Реакционная схема 2
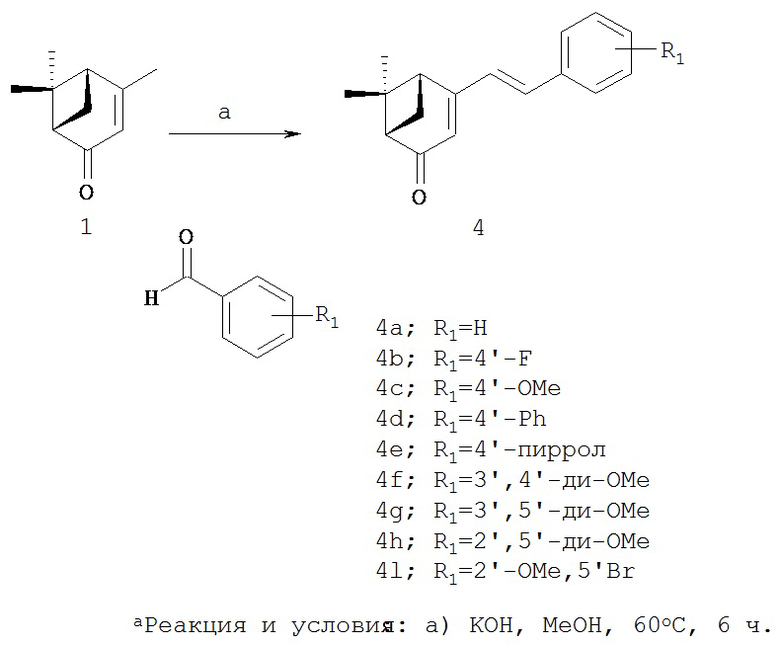
Реакционная схема 3
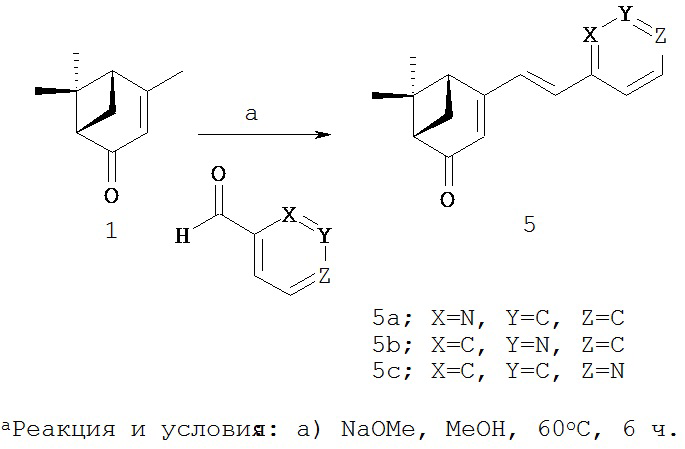
В другом методе синтеза указанных производных, коммерчески доступный (1S)-(-)-вербеной (1) можно ввести в процесс, аналогичный процессу на реакционной схеме 1, чтобы ввести стирильную группу в производные, имеющие различные функциональные группы, получая при этом различные производные вербенона (4a-i, 5а-с), содержащие ароматический цикл.
В настоящем изобретении были исследованы новые эффекты производных вербенона на лечение дегенеративного заболевания мозга. В результате было обнаружено, что производные вербенона ингибируют NMDA-индуцированную эксайтотоксичность и внутриклеточный окислительный стресс, повышают антиоксидантную активность, подавляют миграцию и инфильтрацию воспалительных клеток и подавляют экспрессирование цитокинов. Результаты данного исследования подробно описаны ниже в примерах.
В другом аспекте, настоящее изобретение касается применения производного вербенона, имеющего структуру формулы 1, или его фармацевтически приемлемой соли для профилактики или лечения дегенеративного заболевания мозга.
Кроме того, настоящее изобретение касается фармацевтической композиции для профилактики или лечения дегенеративного заболевания мозга, содержащей в качестве действующего вещества производное вербенона, имеющее структуру формулы 1, или его фармацевтически приемлемую соль, и способа профилактики или лечения дегенеративного заболевания мозга с применением производного вербенона, имеющего структуру формулы 1, или его фармацевтически приемлемой соли.
В одном варианте осуществления, настоящее изобретение касается способа профилактики или лечения дегенеративного заболевания мозга, включающего введение пациенту производного вербенона, имеющего структуру формулы 1, или его фармацевтически приемлемой соли. В данном случае введение можно проводить in vivo или in vitro.
В настоящем изобретении, дегенеративное заболевание мозга может быть выбрано из группы, состоящей из инсульта, паралича, деменции, болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, рассеянного склероза и амиотрофного бокового склероза. При использовании в настоящем тексте термин "дегенеративное заболевание мозга" означает любое заболевание, вызванное смертью нейронов, которые являются наиболее важными элементами передачи информации в центральной нервной системе, дефектами в формировании или работе синапсов, передающих информацию между нейронами, или нарушениями или снижением электрической активности нейронов.
В настоящем изобретении дегенеративное заболевание мозга предпочтительно представляет собой инсульт, и более предпочтительно - ишемический инсульт.
Фармацевтическая композиция по настоящему изобретению может вводиться различными путями, включая (но не ограничиваясь только ими) следующие способы введения: перорально, внутривенно, внутримышечно, внутриартериально, интрамедуллярно, интрадурально, в сердечную мышцу, чрезкожно, подкожно, интраперитонеально, назально, через желудочно-кишечный тракт, местно, сублингвально и ректально. Предпочтительно, фармацевтическая композиция по настоящему изобретению вводится перорально или парентерально. При использовании в настоящем тексте, термин "парентерально" включает подкожную, внутрикожную, внутривенную, внутримышечную, внутриартериальную, интрасиновиальную, внутригрудинную, подоболочечную, внутриочаговую и внутричерепную инъекцию или инфузию. Фармацевтическая композиция по настоящему изобретению может также вводиться в форме суппозиториев для ректального введения.
Фармацевтическая композиция по настоящему изобретению может вводиться перорально в любой приемлемой дозированной форме для перорального введения, включая (но не ограничиваясь только ими) капсулы, таблетки, водные суспензии и растворы. В случае таблеток для перорального введения, обычно применяемые носители включают лактозу и кукурузный крахмал. Обычно добавляют также любриканты, такие как стеарат магния. В случае перорального введения в форме капсул, подходящие разбавители включают лактозу и высушенный кукурузный крахмал. Когда перорально вводят водные суспензии, действующее вещество комбинируют с эмульгирующими и суспендирующими агентами. При необходимости можно добавлять определенные подсластители и/или ароматизаторы и/или красители.
Дозировка фармацевтической композиции по настоящему изобретению зависит от различных факторов, включая активность конкретного применяемого соединения, возраст, вес тела, общее состояние здоровья, пол, диету, время введения, способ введения, скорость выведения, используемые в комбинации лекарства и тяжесть заболевания, профилактика или лечение которого осуществляется. Фармацевтическая композиция по настоящему изобретению может иметь форму пилюль, покрытых сахаром таблеток, капсул, жидкости, геля, сиропа, взвеси или суспензии.
В настоящем изобретении фармацевтическую композицию можно вводить в рецептуру или использовать в комбинации с одним или более средствами, выбранными из группы, состоящей из блокаторов кальциевых каналов, антиоксидантов, антагонистов глютамата, антикоагулянтов, противогипертензивных средств, антитромботических средств, антигистаминных средств, противовоспалительных средств, противораковых средств и антибиотиков.
В другом, аспекте, настоящее изобретение касается способа профилактики или лечения дегенеративного заболевания мозга, включающего введение пациенту фармацевтической композиции для профилактики или лечения дегенеративного заболевания мозга, содержащей в качестве действующего вещества производное вербенона, имеющее структуру формулы 1, или его фармацевтически приемлемую соль.
Фармацевтическая композиция и способ профилактики или лечения по настоящему изобретению можно использовать с выгодой, поскольку в них применяется производное вербенона, полученное из природного вещества, имеющее отличную активность в плане подавления гибели нейронов и окислительного стресса и имеющее меньшую токсичность и меньше побочных эффектов.
В другом аспекте, настоящее изобретение касается функционального пищевого продукта или пищевой добавки, оказывающей эффект профилактики или лечения дегенеративного заболевания мозга и содержащей в качестве действующего вещества производное вербенона, имеющее структуру формулы 1, или его фармацевтически приемлемую соль.
Функциональный пищевой продукт, содержащий соединение по настоящему изобретению, можно использовать в разных областях применения, включая лекарственные средства, продукты питания или напитки, для профилактики воспаления. Примеры функционального пищевого продукта по настоящему изобретению включают различные виды продуктов, конфеты, шоколад, напитки, жевательные резинки, чаи, комплексы витамины, пищевые добавки и т.п., и он может применяться в форме порошков, гранул, таблеток, капсул или напитков.
Производное вербенона, содержащееся в качестве действующего вещества в функциональном пищевом продукте по настоящему изобретению, оказывает прекрасный эффект в виде защиты нейронов, подавления окислительного стресса и подавления экспрессирования цитокинов, что было ясно продемонстрировано результатами анализа биологического механизма, как описано ниже. Таким образом, квалифицированному специалисту в данной области будет очевидно, что применение производного вербенона в продуктах питания оказывает прекрасный эффект.
Фармацевтическую композицию, содержащую соединение по настоящему изобретению, можно вводить в рецептуру обычными способами. Например, она может иметь форму порошков, гранул, таблеток, капсул, суспензий, эмульсий, сиропов, аэрозолей и т.п. в случае перорального введения, средств для наружного применения, суппозиториев и стерильных растворов для инъекций. Носители, вспомогательные вещества и разбавители, которые могут входить в состав композиции по настоящему изобретению, включают лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, гуаровую камедь, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, стеарат магния и минеральное масло. Фармацевтическую композицию, содержащую соединение по настоящему изобретению, вводят в рецептуру с применением разбавителей или вспомогательных веществ, таких как наполнители, разбавители, связующие вещества, увлажняющие средства, разрыхлители или поверхностно-активные вещества, обычно использующихся для данной цели. Твердые составы для перорального введения включают таблетки, пилюли, порошки, гранулы, капсулы и т.д. Такие твердые составы готовят путем смешивания соединения по настоящему изобретению с по меньшей мере одним вспомогательным веществом, таким как хлопок, крахмал, карбонат кальция, сахароза, лактоза, желатин и т.д. Помимо простых вспомогательных веществ, можно также добавлять любриканты, такие как стеарат магния, тальк и т.д. Жидкие составы для перорального введения, такие как суспензии, растворы для перорального введения, эмульсии, сиропы и т.д., могут включать простые разбавители, например воду или жидкий парафин, а также различные вспомогательные вещества, например, увлажняющие средства, подсластители, ароматизаторы, консерванты и т.д. Составы для парентерального введения включают стерильные водные растворы, неводные растворы, суспензии, эмульсии, лиофилизующие средства, суппозитории и т.д. Неводные растворы и суспензии можно приготовить с помощью пропиленгликоля, полиэтиленгликоля, растительных масел, таких как оливковое масло, или инъецируемых сложных эфиров, таких как этилолеат. В качестве основы для суппозиториев можно использовать Witepsol, Macrogol, Tween 61, какао-масло, лавровое масло, глицерожелатин и т.д.
Предпочтительную дозировку соединения по настоящему изобретению можно подобрать в зависимости от разных факторов, включая состояние и вес пациента, тяжесть заболевания, тип лекарственного средства, способ и период введения, и ее может надлежащим образом определить квалифицированный специалист. Однако для достижения желаемого эффекта соединение по настоящему изобретению можно вводить в дневной дозировке от 0,01 мг/кг до 10 г/кг, и предпочтительно от 1 мг/кг до 1 г/кг. Соединение можно вводить в виде одной дозы в день или в виде нескольких доз в день. Дозировка никоим образом не ограничивает настоящее изобретение.
Кроме того, настоящее изобретение касается функционального пищевого продукта для профилактики или уменьшения симптомов дегенеративного заболевания мозга, содержащего в качестве действующего вещества производное вербенона, имеющее структуру формулы 1, или его фармацевтически приемлемую соль.
Функциональный пищевой продукт, содержащий соединение по настоящему изобретению, можно применять в различных областях, включая лекарственные средства, продукты питания и напитки для профилактики или уменьшения симптомов дегенеративного заболевания мозга. Примеры функционального пищевого продукта по настоящему изобретению включают различные продукты питания, напитки, жевательную резинку, чаи, витаминные комплексы, пищевые добавки и т.п., и его можно применять в форме порошков, гранул, таблеток, капсул или напитков.
Примеры продуктов питания, в которые можно добавлять соединение по настоящему изобретению, включают различные конфеты, напитки, жевательные резинки, чаи, витаминные комплексы, пищевые добавки и т.п.
Соединение по настоящему изобретению можно добавлять в продукты питания или напитки для профилактики или уменьшения симптомов дегенеративных заболеваний мозга. Что касается содержания соединения в пище или напитке, соединение по настоящему изобретению обычно добавляют в количестве 0,01-15 вес. %, из расчета на общий вес функционального пищевого продукта по настоящему изобретению, и соединение по настоящему изобретению можно добавлять в количестве 0,02-10 г, и предпочтительно 0,3-1 г, из расчета на 100 мл функционального пищевого напитка по настоящему изобретению.
При условии, что функциональный пищевой напиток по настоящему изобретению содержит указанное соединение в качестве обязательного компонента, нет специальных ограничений на другие компоненты композиции напитка, и данная композиция может дополнительно содержать одну или больше добавок, таких как различные ароматизаторы или натуральные углеводы, обычно используемые в напитках. Примеры натуральных углеводов для данной цели включают обычные сахара, такие как моносахариды, например, глюкоза, фруктоза и т.п.; дисахариды, например, мальтоза, сахароза и т.п.; и полисахариды, например, декстрин, циклодекстрин и т.п.; и сахароподобные спирты, такие как ксилит, сорбит, эритрит и т.п. В дополнение к перечисленному, в качестве ароматизаторов можно с успехом применять натуральные ароматизаторы (тауматин, соединение стевии (например, Ребаудиозид А, глицирризин и т.п.)) и синтетические ароматизаторы (сахарин, аспартам и т.п.). Содержание натуральных углеводов в композиции по настоящему изобретению составляет примерно 1-20 г, и предпочтительно около 5-12 г, из расчета на 100 мл композиции.
Кроме того, композиция по настоящему изобретению может дополнительно содержать различные питательные вещества, витамины, минеральные вещества (электролиты), приправы (искусственные приправы и натуральные приправы), красители и улучшители (сыр, шоколад и т.п.), пектиновые кислоты и их соли, альгиновую кислоту и ее соли, органические кислоты, защитный коллоид, загустители, регуляторы уровня рН, стабилизаторы, консерванты, глицерин, спирты, газирующие средства, применяющиеся в газированных напитках, и т.п. Кроме того, композиция по настоящему изобретению может дополнительно содержать мякоть фруктов для приготовления напитков на основе натуральных фруктовых соков, напитков на основе фруктовых соков и овощных напитков. Перечисленные добавки могут применяться независимо или в комбинации. Хотя содержание перечисленных добавок в композиции по настоящему изобретению не особенно важно для настоящего изобретения, обычно его устанавливают в диапазоне от 0 до 20 весовых частей на 100 весовых частей композиции по настоящему изобретению.
Композиция по настоящему изобретению содержит описанное соединение в количестве от 0,01 до 99 вес. % от общего веса композиции. Однако, композиция по настоящему изобретению не ограничивается данным критерием, и ее можно варьировать в зависимости от состояния пациента, типа заболевания и степени тяжести заболевания.
Композиция, содержащая соединение по настоящему изобретению, может дополнительно содержать подходящий носитель, вспомогательное вещество или разбавитель, обычно применяемые при приготовлении фармацевтической композиции.
Примеры
Далее настоящее изобретение будет описано более подробно на примерах. Однако квалифицированным специалистам в данной области будет очевидно, что приведенные примеры служат исключительно для иллюстративных целей и не ограничивают объем настоящего изобретения.
Пример 1. Получение производных вербенона
Реагенты и приборы
Химически чистые (1S)-(-)-вербенон, альдегиды, метилхлорметиловый эфир (МОМ-Cl), диизопропилэтиламин (DIPEA), гидроксид калия (КОН) и метоксид натрия (NaOCH3) приобретали в коммерческих источниках. Все покупные реагенты и растворители имели высокую степень чистоты и использовались напрямую, без дополнительной очистки, за исключением дихлорметана, который перегоняли над гидридом кальция. Если не указано иное, реакции проводили в стеклянной посуде, высушенной в пламени горелки в вакууме в атмосфере сухого азота. Тонкослойную хроматографию (ТСХ) проводили на пластинках Merck с силикагелем 60 F254, проявляющихся в УФ-свете, а колоночную хроматографию проводили на силикагеле (силикагель E. Merck, 70-230, 230-400 меш). Спектры 1Н-ЯМР и 13С-ЯМР регистрировали на приборе (Varian) на частоте 500 МГц, и значения химических сдвигов приводили в миллионных долях относительно тетраметилсилана (ТМС) в качестве внутреннего стандарта (CDCl3:d 7,26 м.д.), а значения констант спин-спинового взаимодействия измеряли в герцах (Гц). Мультиплетность обозначали следующими сокращениями: синглет (с), дублет (д), дублет дублетов (дд), дублет дублетов дублетов (ддд), триплет (т), триплет дублетов (тд), дублет триплетов (дт), квартет (кв), мультиплет (м) и уширенный (ушир) сигнал. Масс-спектры высокого разрешения (HRMS) записывали на приборе (Waters Q-TOF микро масс-спектрометр), а оптическое вращение регистрировали на приборе (JASCO поляриметр IP-2000) при 589 нм. Все соединения исследовали методом обращенно-фазной ВЭЖХ в описанных далее условиях, и уровень чистоты составлял >95%: Метод 1 (растворитель А: вода, растворитель В: ацетонитрил), скорость потока: 0,2 мл/мин: 90% В в течение 20 минут; метод 2 (растворитель А: вода, растворитель В: ацетонитрил), скорость потока: 1,0 мл/мин: от 40% до 100% В в течение 40 минут. Применявшуюся фетальную бычью сыворотку (FBS) покупали у компании (Hyclone, Logan, UT), а применявшуюся нейробазальную среду (NBM) и добавку В27 покупали у компании (Invitrogen, Carlsbad, СА). Все остальные химические реагенты приобретали у компании (Sigma-Aldrich, St. Louis, МО).
Пример 1-1. Получение (1S,5R)-4-(4-(метоксиметокси)стирил)-6,6-диметилбицикло [3.1.1]гепт-3-ен-2-она (соединение 2а)
Для получения диена из (1S)-(-)-вербенона посредством альдольной конденсации, (1S)-(-)-вербенон 1 (200 мг, 1,33 ммоль) и 4-(метоксиметокси)бензальдегид (332 мг, 2,00 ммоль) перемешивали в МеОН (7 мл) и добавляли КОН (149 мг, 2,66 ммоль). Реакционную смесь перемешивали при 60°C в течение 6 часов и охлаждали до комнатной температуры. В полученную смесь добавляли небольшое количество воды и оставляли при комнатной температуре на 24 часа. Затем полученную смесь упаривали при пониженном давлении, получая желтый продукт, который затем очищали колоночной хроматографией на силикагеле, получая (1S,5R)-4-(4-(метоксиметокси)стирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 2а) в виде желтого твердого вещества (353 мг, выход 89%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
т.пл. 88-90°C
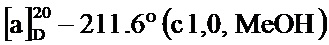
1Н-ЯМР (CDCl3, 500 МГц): d 7,45 (д, J=8,80 Гц, 2 Н), 7,04 (д, J=8,80 Гц, 2 Н), 6,81-6,92 (м, 2 Н), 5,90 (с, 1 Н), 5,20 (с, 2 Н), 3,48 (с, 3 Н), 3,03-3,17 (м, 1 Н), 2,91 (дт, J=9,48, 5,53 Гц, 1 Н), 2,72 (т, J=5,62 Гц, 1 Н), 2,12 (д, J=9,29 Гц, 1 Н), 1,58 (с, 3 Н), 1,01 (с, 3 H);
13С-ЯМР (CDCl3, 75 МГц); d 204,25, 164,57, 158,00, 134,51, 129,75, 128,73, 125,62, 121,83, 116,44, 94,171, 58,09, 56,09, 52,78, 43,59, 39,98, 26,72, 22,10.
HRMS: вычислено C17H18O2 (М-Н) 253,1229, получено 253,1221.
ВЭЖХ аналитика: (метод 1) 100,0% (tR=3,67 мин).
Пример 1-2. Получение (1S,5R)-4-(3-метокси-4,5-бис(метоксистирил)стирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 2f)
По методике, аналогичной методу получения соединения 2а, получали (1S,5R)-4-(3-метокси-4,5-бис(метоксиметокси)стирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 2f), имеющий приведенные ниже характеристики (выход: 90%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
1Н-ЯМР (CDCl3, 500 МГц); d 6,94 (д, J=1,96 Гц, 1Н), 6,84 (с, 2Н), 6,78 (д, J=1,71 Гц, 1Н), 5,92 (с, 1Н), 5,22 (с, 2Н), 5,15 (с, 2Н), 3,89 (с, 3H), 3,60 (с, 3H), 3,52 (с, 3H), 3,09 (т, J=5,75 Гц, 1Н), 2,90 (дт, J=9,48, 5,53 Гц, 1Н), 2,72 (тд, J=5,75,1,47 Гц, 1Н), 2,10 (д, J=9,29 Гц, 1Н), 1,57 (с, 3H), 1,00 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 203,92, 164,02, 153,63, 151,19, 136,64, 134,76, 132,10, 126,91, 122,43, 108,91, 104,88, 98,37, 95,33, 58,19, 57,11, 56,07, 52,70, 43,78, 39,93, 26,70, 22,11.
Пример 1-3. Получение (1S,5R)-4-(4-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 3а)
Для получения диена из (1S)-(-)-вербенона методом альдольной конденсации, прикапывали 10%-ный раствор HCl в перемешиваемый раствор соединения 2а (200 мг, 0,67 ммоль) в МеОН (3 мл) и оставляли реакционную смесь на ночь для завершения реакции. Затем в реакционную смесь добавляли насыщенный раствор NaHCO3, экстрагировали этилацетатом и сушили над безводным MgSO4. Полученный продукт очищали методом колоночной хроматографии, получая (1S,5R)-4-(4-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 3а) в виде желтого твердого вещества, имеющего приведенные ниже характеристики. Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах (162 мг, выход 95%).
т.пл. 88-90°C.
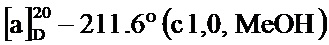
1H-ЯМР (CDCl3, 500 МГц); d 7,40 (д, J=8,56 Гц, 2 Н), 6,78-6,92 (м, 4 Н), 6,45 (ушир.с, 1 Н), 5,91 (с, 1 Н), 3,12 (т, J=5,75 Гц, 1 Н), 2,88-2,95 (м, 1 Н), 2,74 (т, J=5,62 Гц, 1 Н), 2,13 (д, J=9,29 Гц, 1 Н), 1,58 (с, 3 Н), 1,02 (с, 3 Н);
13С-ЯМР (CDCl3, 75 МГц); d 205,14, 165,56, 157,32, 135,24, 129,13, 128,51, 124,89, 121,29, 116,00, 58,10, 53,22, 43,86, 40,23, 26,79, 22,15;
HRMS вычислено C17H18O2 (М-Н) 253,1229, получено 253,1221;
ВЭЖХ аналитика: (метод 1) 100,0% (tR=3,67 мин).
Пример 1-4. Получение (1S,5R)-4-(4-гидрокси-2-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 3b)
По методике, аналогичной методу получения соединения 3а, получали (1S,5R)-4-(4-гидрокси-2-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3b) в виде желтого твердого вещества, имеющий приведенные ниже характеристики (выход: 97%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
т.пл. 78-80°C
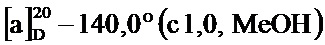
1Н-ЯМР (CDCl3, 500 МГц); d 7,45 (д, J=8,07 Гц, 1Н), 7,24 (д, J=16,63 Гц, 1Н), 6,88 (д, J=16,38 Гц, 1Н), 6,42-6,48 (м, 2Н), 5,88 (с, 1Н), 3,86 (с, 3H) 5,64 (ушир.с, 1Н), 3,16 (т, J=5,75 Гц, 1Н), 2,91 (дт, J=9,35, 5,59 Гц, 1Н), 2,72 (тд, J=5,60 Гц, 1Н), 2,12 (д, J=9,29 Гц, 1Н), 1,58 (с, 3H), 1,02 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 205,53, 166,76, 159,17, 158,94, 130,48, 128,48, 124,75, 120,62, 117,50, 108,19, 99,19, 58,10, 55,53, 53,25, 43,87, 40,33, 26,80, 22,16;
HRMS вычислено C18H20O3 (М+Н) 285,1491, получено 285,1480;
ВЭЖХ аналитика: (метод 1) 99,4% (tR=3,80 мин).
Пример 1-5. Получение (1S,5R)-4-(3,4-дигидроксистирил)-6,6-диметилцикло[3.1.1]гепт-3-ен-2-она (соединение 3с)
По методике, аналогичной методу получения соединения 3а, получали (1S,5R)-4-(3,4-дигидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3с) в виде желтого твердого вещества, имеющий приведенные ниже характеристики (выход: 84%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
т.пл. 68-70°C;
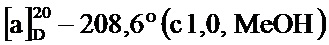
1Н-ЯМР (CDCl3, 500 МГц); d 7,13 (с, 1Н), 6,70-6,96 (м, 4Н), 5,92 (с, 1H), 3,12 (т, J=5,50 Гц, 1Н), 2,86-2,95 (м, 1Н), 2,71-2,81 (м, 1Н), 2,14 (д, J=9,54 Гц, 1Н), 1,58 (с, 3H), 1,00 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 206,39, 166,93, 146,23, 144,51, 136,47, 128,75, 124,62, 121,91, 120,72, 115,38, 113,17, 60,55, 58,04, 53,84, 44,01, 40,55, 26,78, 22,12;
HRMS вычислено C17H18O3 (M-H) 269,1178, получено 269,1169;
ВЭЖХ аналитика: (метод 1) 100% (tR=3,47 мин).
Пример 1-6. Получение (1S,5R)-4-(3-бром-4-гидроксистирил)-6,6-диметилдикло[3.1.1]гепт-3-ен-2-она (соединение 3d)
По методике, аналогичной методу получения соединения 3а, получали (1S,5R)-4-(3-бром-4-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 3d) в виде желтого твердого вещества, имеющий приведенные ниже характеристики (выход: 95%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
т.пл. 238-240°C;
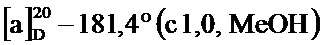
1H-ЯМР (CD3OD, 500 МГц); d 7,75 (д, J=2,20 Гц, 1Н),7.45 (дд, J=1,96, 8,56 Гц, 1Н), 7,02 (д, J=16,50 Гц, 1Н), 6,97 (д, J=16,50 Гц, 1Н), 6,92 (д, J=8,56 Гц, 1Н), 5,90 (с, 1Н), 3,24 (т, J=5,99 Гц, 1Н), 2,97 (тд, J=5,59, 9,35 Гц, 1Н), 2,62 (дт, J=1,50, 6,00 Гц, 1Н), 2,05 (д, J=9,54 Гц, 1Н), 1,60 (с, 3H), 0,98 (с, 3H);
13С-ЯМР (CD3OD, 75 МГц): d 203,02, 165,13, 155,42, 134,47, 132,29, 129,42, 128,79, 125,75, 121,59, 117,11, 110,36, 58,16, 52,33, 43,30, 26,83, 22,43;
HRMS вычислено C17H17BrO2 (M+Н) 333,0490, получено 333,0479;
ВЭЖХ аналитика: (метод 1) 98,9% (tR=3,91 мин).
Пример 1-7. Получение (1S,5R)-4-(4-гидрокси-2,6-диметоксистирил)-6,6-диметилцикло[3.1.1]гепт-3-ен-2-она (соединение 3е)
По методике, аналогичной методу получения соединения 3а, получали (1S,5R)-4-(4-гидрокси-2,6-диметоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 3е) в виде желтого твердого вещества, имеющий приведенные ниже характеристики (выход: 94%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
т.пл. 216-218°C;
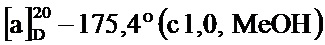
1Н-ЯМР (DMSO-d6, 500 МГц); d 7,28 (д, J=16,50 Гц, 1Н), 7,23 (д, J=16,50 Гц, 1Н), 6,12 (с, 2Н), 5,73 (с, 1Н), 3,80 (с, 6Н), 3,10 (т, J=5,38 Гц, 1Н), 2,89 (тд, J=5,50, 9,05 Гц, 1Н), 2,53 (т, J=5,50 Гц, 1Н), 1,93 (д, J=9,29 Гц, 1Н), 1,53 (с, 3H), 0,91 (с, 3H);
13С-ЯМР (DMSO-d6, 75 МГц); d 202,56, 166,66, 160,48, 160,27, 126,68, 126,11, 119,22, 104,67, 92,17, 57,50, 55,71, 55,67, 51,67, 42,59, 26,42, 21,96;
HRMS вычислено С19Н22О4 (М+Н) 315,1596, получено 315,1583;
ВЭЖХ аналитика: (метод 1) 99,3% (tR=3,70 мин).
Пример 1-8. Получение (1S,5R)-4-(3,4-дигидрокси-5-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 3f)
По методике, аналогичной методу получения соединения 3а, получали (1S,5R)-4-(3,4-дигидрокси-5-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3f) в виде желтого твердого вещества, имеющий приведенные ниже характеристики (выход: 92%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
т.пл. 168-170°C;
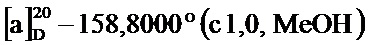
1Н-ЯМР (CDCl3, 500 МГц) d 6,78-6,82 (м, 3H), 6,64 (д, J=1,47 Гц, 1Н), 5,82-6,01 (м, 3H), 3,92 (с, 3H), 3,10 (т, J=5,62 Гц, 1Н), 2,91 (дт, J=9,35, 5,59 Гц, 1Н), 2,74 (тд, J=5,69, 1,59 Гц, 1Н), 2,12 (д, J=9,29 Гц, 1Н), 2,04 (с, 2Н), 1,58 (с, 3H), 1,01 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 204,92, 165,07, 147,23, 144,24, 135,54, 134,13, 128,07, 125,50, 121,62, 108,63, 58,08, 56,25, 53,12, 43,75, 40,1S, 26,78, 22,16;
HRMS вычислено C18H20O4 (M+Н) 301,1440, получено 301,1453;
ВЭЖХ аналитика: (метод 1) 100% (tR=3,46 мин).
Пример 1-9: Получение (1S,5R)-4-(3-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 3g)
По методике, аналогичной методу получения соединения 3а, получали (1S,5R)-4-(3-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 3g) в виде желтого твердого вещества, имеющий приведенные ниже характеристики (выход: 98%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
т.пл. 106-108°C;
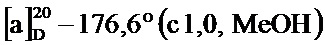
1H-ЯМР (CDCl3, 500 МГц); d 7,21-7,26 (м, 1Н), 7,01-7,05 (м, 2Н), 6,92 (д, J=16,50 Гц, 1Н), 6,88 (д, J=16,50 Гц, 1Н), 6,83-6,86 (м, 1Н), 6,46 (с, 1Н), 5,96 (с, 1Н), 3,11 (т, J=5,75 Гц, 1Н), 2,93 (тд, J=5,53, 9,48 Гц, 1Н), 2,77 (дт, J=1,59, 5,69 Гц, 1Н), 2,14 (д, J=9,29 Гц, 1Н), 1,59 (с, 3H), 1,01 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 205,19, 165,1S, 156,53, 137,42, 135,36, 130,03, 127,44, 122,37, 120,19, 116,68, 113,65, 58,17, 53,39, 43,89, 40,28, 26,77, 22,14;
HRMS вычислено C17H18O2 (М-Н) 253,1229, получено 253,1228;
ВЭЖХ аналитика: (метод 2) 99,3% (tR=3,73 мин).
Пример 1-10. Получение (1S,5R)-4-(2-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 3h)
По методике, аналогичной методу получения соединения 3а, получали (1S,5R)-4-(2-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 3h) в виде желтого твердого вещества, имеющий приведенные ниже характеристики (выход: 100%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
т.пл. 140-142°C;
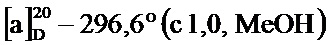
1H-ЯМР (CD3OD, 500 МГц); d 7,56 (дд, J=1,59, 7,70 Гц, 1Н), 7,42 (д, J=16,14 Гц, 1Н), 7,15 (дд, J=1,59, 15,53 Гц, 1Н), 7,13 (д, J=16,38 Гц, 1Н), 6,80-6,87 (м, 2Н), 5,89 (с, 1Н), 3,25 (т, J=5,87 Гц, 1Н), 2,99 (дт, J=5,53, 9,48 Гц, 1Н), 2,65(тд, J=1,71, 5,75 Гц, 1Н), 2,08 (д, J=9,29 Гц, 1Н), 1,61 (с, 3H), 1,01 (с, 3H);
13С-ЯМР (CD3OD, 75 МГц); d 207,46, 169,09, 157,56, 133,10, 131,67, 128,67, 127,63, 124,55, 122,03, 121,07, 117,05, 59,62, 54,52, 45,29, 41,45, 27,19, 22,58;
HRMS вычислено C17H18O2(M-Н) 253,1229, получено 253,1218;
ВЭЖХ аналитика: (метод 1) 99,4% (tR=3,80 мин).
Пример 1-11. Получение (1S,5R)-4-(2-гидрокси-4-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 3i)
По методике, аналогичной методу получения соединения 3а, получали (1S,5R)-(4-гидрокси-4-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 3i) в виде желтого геля, имеющий приведенные ниже характеристики (выход: 96%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
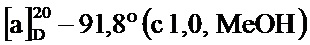
1H-ЯМР (CDCl3, 500 МГц); d 8,46 (ушир. с, 1Н), 7,37 (д, J=8,56 Гц, 1Н), 7,23 (д, J=16,50 Гц, 1Н), 7,17 (д, J=16,00 Гц, 1Н), 6,42-6,55 (м, 2Н), 6,04 (с, 1Н), 3,78 (с, 3H), 3,20 (т, J=5,38 Гц, 1Н), 2,88-2,98 (м, 1Н), 2,76 (т, J=5,14 Гц, 1Н), 2,17 (д, J=9,54 Гц, 1Н), 1,59 (с, 3H), 1,05 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 206,56, 167,94, 161,72, 156,99, 132,26, 130,09, 125,37, 119,93, 116,29, 106,90, 101,73, 57,96, 55,28, 53,74, 43,85, 40,60, 26,76, 22,13;
HRMS вычислено C18H20O3 (М+Н) 285,1491, получено 285,1494;
ВЭЖХ аналитика: (метод 1) 99,2% (tR=3,75 мин).
Пример 1-12. Получение (1S,5R)-6,6-диметил-4-стирилбицикло[3.1.1]гепт-3-ен-2-она (соединение 4а)
По методике, аналогичной методу получения соединения 2а, получали (1S,5R)-6,6-диметил-4-стирилбицикло[3.1.1]гепт-3-ен-2-он (соединение 4а) в виде желтого геля, имеющий приведенные ниже характеристики (выход: 92%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
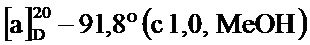
1H-ЯМР (CDCl3, 500 МГц); d 7,50(д, J=7,09 Гц, 2Н), 7,35-7,40 (м, 2Н), 7,33 (д, J=7,34 Гц, 1Н),6,97 (д, J=16,00 Гц, 1Н), 6,92 (д, J=16,00 Гц, 1Н), 5,94 (с, 1Н), 3,12 (тд, J=1,47, 5,87 Гц, 1Н), 2,93 (дт, J=5,62, 9,54 Гц, 1Н), 2,74 (тд, J=1,71, 5,75 Гц, 1Н), 2,13 (д, J=9,29 Гц, 1Н), 1,59 (с, 3H), 1,02 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 204,13, 164,23, 135,99, 134,96, 129,15, 128,88, 127,42, 127,35, 122,66, 58,23, 52,87, 43,76, 40,03, 26,78, 22,16;
HRMS вычислено C17H18O (М+Н) 239,1436, получено 239,1426;
ВЭЖХ аналитика: (метод 1) 95,0% (tR=4,82 мин).
Пример 1-13. Получение (1S,5R)-4-(4-фторстирил)-6,6-диметилцикло[3.1.1]гепт-3-ен-2-она (соединение 4b)
По методике, аналогичной методу получения соединения 2а, получали (1S,5R)-4-(4-фторстирил)-6,6-диметилцикло[3.1.1]гепт-3-ен-2-он (соединение 4b) в виде желтого геля, имеющий приведенные ниже характеристики (выход: 92%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
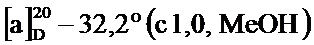
1H-ЯМР (CDCl3, 500 МГц); d 7,46-7,51 (м, 2Н), 7,04-7,09 (м, 2Н), 6,90 (д, J=17,00 Гц, 1Н), 6,86 (д, J=16,50 Гц, 1Н), 5,93 (с, 1H), 3,10 (тд, J=1,35, 5,81 Гц, 1H), 2,92 (дт, J=5,62, 9,29 Гц, 1Н), 2,74 (тд, J=1,71, 5,75 Гц, 1Н), 2,12 (д, J=9,29 Гц, 1Н), 1,59 (с, 3H), 1,02 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 204,04, 164,03, 162,13, 133,62, 132,21, 129,04, 127,15, 122,61, 116,02, 58,17, 52,83, 43,72, 39,99, 26,73, 22,12;
HRMS вычислено C17H17FO (М+Н) 257,1342, получено 257,1343;
ВЭЖХ аналитика: (метод 1) 90,6% (tR=4,52 мин).
Пример 1-14. Получение (1S,5R)-4-(4-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 4с)
По методике, аналогичной методу получения соединения 2а, получали (1S,5R)-4-(4-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 4с) в виде желтого твердого вещества, имеющий приведенные ниже характеристики (выход: 90%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
т.пл. 138-140°C;
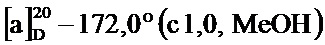
1Н-ЯМР (CDCl3, 500 МГц); d 7,46 (д, J=8,80 Гц, 2Н), 6,91 (д, J=9,05 Гц, 2Н), 6,90 (д, J=15,90 Гц, 1Н), 6,84 (д, J=16,50 Гц, 1Н), 5,90 (с, 1Н), 3,85 (с, 3H), 3,12 (тд, J=1,35, 5,81 Гц, 1Н), 2,92 (дт, J=5,53, 9,48 Гц, 1Н), 2,73 (тд, J=1,71, 5,75 Гц, 1Н), 2,13 (д, J=9,54 Гц, 1Н), 1,59 (с, 3H), 1,03 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 204,17, 164,63, 160,50, 134,64, 128,83, 128,78, 125,25, 121,66, 114,35, 58,17, 55,34, 52,74, 43,76, 39,99, 26,76, 22,15;
HRMS вычислено C18H20O2 (М+Н) 269,1542, получено 269,1549;
ВЭЖХ аналитика: (метод 1) 100% (tR=4,58 мин).
Пример 1-15. Получение (1S,5R)-4-(2-(бифенил-4-ил)винил)-6,6-диметилцикло[3.1.1]гепт-3-ен-2-она (соединение 4d)
По методике, аналогичной методу получения соединения 2а, получали (1S,5R)-4-(2-(бифенил-4-ил)винил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 4d) в виде желтого твердого вещества, имеющий приведенные ниже характеристики (выход: 92%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
т.пл. 148-150°C;
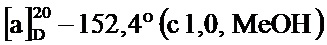
1Н-ЯМР (CDCl3, 500 МГц); d 7,55-7,65 (м, 6Н), 7,45 (т, J=7,58 Гц, 2Н), 7,34-7,39 (м, 1Н), 7,01 (д, J=16,50 Гц, 1Н), 6,96 (д, J=16,50 Гц, 1Н), 5,95 (с, 1Н), 3,14 (т, J=5,75 Гц, 1Н), 2,94 (дт, J=5,50, 9,54 Гц, 1Н), 2,75 (т, J=5,62 Гц, 1Н), 2,14 (д, J=9,29 Гц, 1Н), 1,60 (с, 3H), 1,03 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 204,12, 164,23, 141,86, 140,23, 134,99, 134,50, 128,87, 127,84, 127,69, 127,51, 127,38, 126,94, 122,65, 58,24, 52,86, 43,77, 40,02, 26,79, 22,18;
HRMS вычислено С23Н22О (М+Н) 315,1749, получено 315,1737;
ВЭЖХ аналитика: (метод 1) 100% (tR=6,35 мин).
Пример 1-16. Получение (1S,5R)-4-(4-(1Н-пиррол-1-ил)стирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 4е)
По методике, аналогичной методу получения соединения 2а, получали (1S,5R)-4-(4-(1Н-пиррол-1-ил)стирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 4е) в виде желтого твердого вещества, имеющий приведенные ниже характеристики (выход: 41%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
т.пл. 146-148°C;
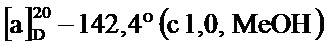
1H-ЯМР (CDCl3, 500 МГц); d 7,55 (д, J=8,56 Гц, 2Н), 7,39 (д, J=8,56 Гц, 2Н), 7,12 (т, J=2,20 Гц, 2Н), 6,95 (д, J=16,00 Гц, 1Н), 6,91 (д, J=16,00 Гц, 1Н), 6,36 (т, J=2,20 Гц, 2Н), 5,94 (с, 1Н), 3,12 (т, J=5,75 Гц, 1Н), 2,93 (тд, J=5,59, 9,35 Гц, 1Н), 2,74 (дт, J=1,71, 5,75 Гц, 1Н), 2,13 (д, J=9,29 Гц, 1Н), 1,59 (с, 3H), 1,03 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 203,97, 164,03, 140,92, 133,78, 133,21, 128,57, 127,14, 122,61, 120,25, 118,95, 110,94, 58,19, 25,79, 43,72, 39,97, 26,75, 22,14;
HRMS вычислено C21H21NO (М+Н) 304,1701, получено 304,1691;
ВЭЖХ аналитика: (метод 1) 94,7% (tR=5,10 мин).
Пример 1-17. Получение (1S,5R)-4-(3,4-диметоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 4f)
По методике, аналогичной методу получения соединения 2а, получали (1S,5R)-4-(3,4-диметоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 4f) в виде желтого геля, имеющий приведенные ниже характеристики (выход: 92%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
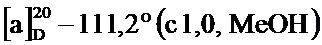
1H-ЯМР (CDCl3, 500 МГц); d 7,02-7,09 (м, 2Н), 6,89 (д, J=16,00 Гц, 1Н), 6,86 (д, J=7,00 Гц, 1Н), 6,83 (д, J=16,50 Гц, 1Н), 5,91 (с, 1Н), 3,93 (с, 3H), 3,91 (с, 3H), 3,11 (т, J=5,75 Гц, 1Н), 2,91 (дтд, J=1,47, 5,56, 9,41 Гц, 1Н), 2,72 (тт, J=1,74, 5,72 Гц, 1Н), 2,11 (д, J=9,29 Гц, 1Н), 1,58 (с, 3H), 1,02 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 204,03, 164,46, 150,28, 149,30, 134,89, 129,10, 125,42, 121,75, 111,24, 109,29, 58,19, 55,94, 52,69, 43,82, 39,96, 26,76, 22,15;
HRMS вычислено C19H22O3 (М+Н) 299,1647, получено 299,1657;
ВЭЖХ аналитика: (метод 2) 97,9% (tR=9,19 мин).
Пример 1-18. Получение (1S,5R)-4-(3,5-диметоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 4g)
По методике, аналогичной методу получения соединения 2а, получали (1S,5R)-4-(3,5-диметоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 4g) в виде желтого геля, имеющий приведенные ниже характеристики (выход: 90%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
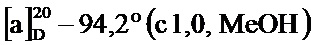
1Н-ЯМР (CDCl3, 500 МГц); d 6,93 (д, J=16,00 Гц, 1Н), 6,85 (д, J=16,00 Гц, 1Н), 6,65 (д, J=2,20 Гц, 2Н), 6,45 (т, J=2,20 Гц, 1Н), 5,94 (с, 1Н), 3,82 (с, 6Н), 3,10 (т, J=5,75 Гц, 1Н), 2,92 (дт, J=5,62, 9,54 Гц, 1H), 2,74 (тд, J=1,59, 5,69 Гц, 1H), 2,12 (д, J=9,29 Гц, 1H), 1,58 (с, 3H), 1,02 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 204,04, 163,03, 161,03, 137,88, 134,93, 127,83, 122,81, 105,32, 101,51, 58,19, 55,40, 52,82, 43,73, 39,99, 26,73, 22,12;
HRMS вычислено С19Н22О3 (М+Н) 299,1647, получено 299,1662;
ВЭЖХ аналитика: (метод 1) 100% (tR=4,58 мин).
Пример 1-19. Получение (1S,5R)-4-(2,5-диметоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 4h)
По методике, аналогичной методу получения соединения 2а, получали (1S,5R)-4-(2,5-диметоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 4h) в виде желтого геля, имеющий приведенные ниже характеристики (выход: 93%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
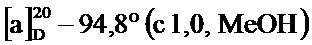
1H-ЯМР (CDCl3, 500 МГц); d 7,29 (д, J=16,38 Гц, 1Н), 7,11 (д, J=2,69 Гц, 1Н), 6,95 (д, J=16,14 Гц, 1Н), 6,81-6,88 (м, 2Н), 5,92 (с, 1Н), 3,84 (с, 3H), 3,81 (с, 3H), 3,16 (дт, J=1,50, 6,00 Гц, 1Н), 2,91 (тд, J=5,62, 9,29 Гц, 1Н), 2,72 (дт, J=1,71, 5,75 Гц, 1H), 2,11 (д, J=9,29 Гц, 1Н), 1,58 (с, 3H), 1,02 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 204,16, 164,83, 153,74, 152,04, 129,50, 127,74, 125,62, 122,37, 115,85, 112,34, 111,85, 58,24, 56,13, 52,76, 43,76, 40,03, 26,76, 22,15;
HRMS вычислено С19Н22О3 (М+Н) 299,1647, получено 299,1650;
ВЭЖХ аналитика: (метод 1) 96,4% (tR=4,69 мин).
Пример 1-20. Получение (1S,5R)-4-(5-бром-2-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-она (соединение 4i)
По методике, аналогичной методу получения соединения 2а, получали (1S,5R)-4-(5-бром-2-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (соединение 4i) в виде желтого геля, имеющий приведенные ниже характеристики (выход: 97%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
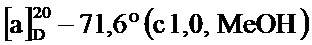
1H-ЯМР (CDCl3, 500 МГц); d 7,66 (с, 1Н), 7,36 (дд, J=2,45, 8,80 Гц, 1Н), 7,20 (д, J=16,38 Гц, 1Н), 6,95(д, J=16,14 Гц, 1Н), 6,77 (д, J=8,80 Гц, 1Н), 5,93 (с, 1Н), 3,87 (с, 3H), 3,12 (т, J=5,62 Гц, 1Н), 2,91 (дт, J=5,35, 9,60 Гц, 1Н), 2,73 (т, J=5,14 Гц, 1Н), 2,11 (д, J=9,29 Гц, 1Н), 1,58 (с, 3H), 1,01 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 203,97, 164,31, 156,40, 132,53, 129,53, 128,69, 128,09, 127,04, 122,89, 113,28, 112,75, 58,22, 55,77, 52,76, 43,71, 39,98, 26,73, 22,11;
HRMS вычислено C18H19BrO2 (M+H) 347,0647, получено 347,0651;
ВЭЖХ аналитика: (метод 1) 99,0% (tR=6,23 мин).
Пример 1-21. Получение (1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-2-ил)винил)бицикло[3.1.1]гепт-3-ен-2-она (соединение 5а)
Для получения диена из (1S)-(-)-вербенона методом альдольной конденсации, (1S)-(-)-вербенон 1 (200 мг, 1,33 ммоль) и 2-пиридинкарбоксальдегид (171 мг, 1,60 ммоль) перемешивали в МеОН (7 мл) и добавляли NaOCH3 (25 вес. % раствор в МеОН). Реакционную смесь перемешивали при 60°C в течение 6 часов и охлаждали до комнатной температуры. В смесь добавляли небольшое количество воды и оставляли при комнатной температуре на 24 часа. Затем смесь упаривали при пониженном давлении и очищали методом колоночной хроматографии, получая (1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-2-ил)винил)бицикло[3.1.1]гепт-3-ен-2-он (соединение 5а) в виде желтого сиропа, имеющий приведенные ниже характеристики (258 мг, выход 81%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
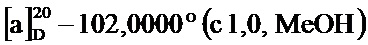
1Н-ЯМР (CDCl3, 500 МГц); d 8,60 (дд, J=4,77, 0,61 Гц, 1Н), 7,67 (тд, J=7,70, 1,71 Гц, 1Н), 7,45 (д, J=15,90 Гц, 1Н), 7,39 (д, J=7,83 Гц, 1Н), 7,19 (ддц, J=7,52, 4,83, 0,86 Гц, 1Н), 6,96 (д, J=15,89 Гц, 1Н), 6,02 (с, 1Н), 3,08-3,14 (м, 1Н), 2,87-2,95 (м, 1Н), 2,73 (тд, J=5,69, 1,59 Гц, 1Н), 2,11 (д, J=9,29 Гц, 1Н), 1,57 (с, 3H), 1,00 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 203,92, 163,51, 154,33, 149,96, 136,65, 133,90, 131,15, 124,29, 123,13, 58,27, 52,90, 43,86, 39,97, 26,71, 22,12;
HRMS вычислено C16H17NO (М+Н) 240,1388, получено 240,1392;
ВЭЖХ аналитика: (метод 1) 98,4% (tR=4,28 мин).
Пример 1-22. Получение (1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-3-ил)винил)бицикло[3.1.1]гепт-3-ен-2-она (соединение 5b)
По методике, аналогичной методу получения соединения 5а, (1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-3-ил)винил)бицикло[3.1.1]гепт-3-ен-2-он (соединение 5b) получали в виде желтого твердого вещества, имеющего приведенные ниже характеристики (выход: 77%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
т.пл. 102-104°C;
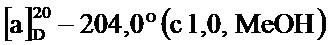
1H-ЯМР (CDCl3, 500 МГц); d 8,70 (д, J=1,96 Гц, 1Н), 8,54 (дд, J=1,22, 4,65 Гц, 1Н), 7,85 (тд, J=1,86, 8,01 Гц, 1Н), 7,31 (дд, J=4,77, 7,95 Гц, 1Н), 7,02 (д, J=16,00 Гц, 1Н), 6,91 (д, J=16,00 Гц, 1H), 5,97 (с, 1H), 3,12 (дт, J=1,10, 5,81 Гц, 1H), 2,94 (тд, J=5,62, 9,54 Гц, 1H), 2,76 (дт, J=1,71, 5,75 Гц, 1H), 2,13 (д, J=9,54 Гц, 1H), 1,60 (с, 3H), 1,03 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 203,72, 163,28, 149,82, 149,35, 133,12, 131,73, 130,98, 129,34, 123,61, 58,23, 52,84, 43,64, 39,96, 26,72, 22,13;
HRMS вычислено C16H17NO (М+Н) 240,1388, получено 240,1397;
ВЭЖХ аналитика: (метод 1) 98,7% (tR=3,89 мин).
Пример 1-23. Получение (1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-4-ил)винил)бицикло[3.1.1]гепт-3-ен-2-она (соединение 5с)
По методике, аналогичной методу получения соединения 5а, (1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-4-ил)винил)бицикло[3.1.1]гепт-3-ен-2-он (соединение 5с) получали в виде желтого геля, имеющего приведенные ниже характеристики (выход: 80%). Полученное вещество использовали в качестве образца в описанных ниже экспериментальных примерах.
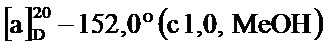
1Н-ЯМР (CDCl3, 500 МГц); d 8,62 (д, J=5,87 Гц, 2Н), 7,35 (д, J=5,87 Гц, 2Н), 7,13 (д, J=16,14 Гц, 1Н), 6,84 (д, J=16,14 Гц, 1Н), 6,01 (с, 1H), 3,10 (т, J=5,87 Гц, 1Н), 2,95 (тд, J=5,62, 9,54 Гц, 1Н), 2,77 (дт, J=1,59, 5,69 Гц, 1Н), 2,13 (д, J=9,54 Гц, 1Н), 1,60 (с, 3H), 1,02 (с, 3H);
13С-ЯМР (CDCl3, 75 МГц); d 203,57, 162,78, 150,42, 143,12, 131,89, 131,57, 124,62, 121,23, 58,24, 52,90, 43,68, 39,95, 26,70, 22,11;
HRMS вычислено C16H17NO (М+Н) 240,1338, получено 240,1378;
ВЭЖХ аналитика: (метод 1) 98,4% (tR=4,29 мин).
Пример 2. Эффекты производных вербенона на эксайтотоксичность, антиоксидантную активность и очаговую церебральную ишемию
Подготовка подопытных животных
SD крыс (260-270 г, самцы) покупали у Charles River Laboratories (Сеул, Корея) и перед экспериментом давали им акклиматизироваться в окружающей среде в условиях цикла 12 часов свет/12 часов темнота. Животные имели неограниченный доступ к питьевой воде, и эксперимент проводили в соответствии с принципами Руководства NIH по уходу и использованию лабораторных животных, а также Комитета Корейского Университета по уходу и использованию животных.
Статистический анализ
Данные выражали в виде средних значений ± S.E.M. (стандартная ошибка среднего значения), и статистический анализ проводили методом однофакторного дисперсионного анализа (ANOVA) и апостериорного критерия Бонферрони. Значение Р<0,05 рассматривали как статистически значимое. Перед ANOVA анализом определяли значение Р по критерию Левена для оценки равенства дисперсий двух выборок (Р>0,05). При необходимости, полученные данные дополнительно анализировали по критерию Краскела-Уоллиса и затем по критерию Манна-Уитни.
Пример 2-1. Эффект производных вербенона на эксайтотоксичностъ
Для оценки влияния образцов, полученных в описанных выше Примерах, на эксайтотоксичностъ, был проведен описанный далее эксперимент согласно литературной методике (Ju С. et al., BBRC, 431(3), 484-489, 2013).
(1) Культура кортикальных нейронов
Кортикальные нейроны (5×105 клеток/мл) выделяли из эмбрионов SD крыс (возраст 16-17 дней). Конкретно, разрезали кору головного мозга и отделяли клетки от ткани многократным растиранием пипеткой Пастера в буферном растворе (сбалансированный солевой раствор Хенкса, HBSS). Суспензию клеток (1,8×103 клеток/мм2) распределяли по планшету, заранее обработанным смесью поли-D-лизин (100 мг/мл)/ламинин (4 мг/мл). Клетки помещали в NBM среду с добавлением 10% FBS (эмбриональной бычьей сыворотки) и инкубировали в атмосфере 96% воздух/5% CO2 при 37°C. После 15-16 дней инкубирования проводили эксперимент.
(2) Реоксигенапия после OGD (депривапии кислорода и глюкозы)
Для индуцирования симптомов гипоксической ишемии in vitro, инкубированные клетки помещали в бескислородную камеру (парциальное давление кислорода <2 мм рт.ст.). Клетки инкубировали в не содержащей глюкозы среде DMEM (минимальная эссенциальная среда Игла, модифицированная по способу Дульбекко) при барботировании анаэробной газовой смеси (95% N2 и 5% CO2) в течение 30 минут для удаления остатков кислорода, и инкубировали при 37°C 90 минут для депривации кислорода. Через 90 минут раствор заменяли на не содержащую глюкозы среду DMEM (25 ммоль/л) для остановки OGD реакции и возвращали клетки в условия нормального снабжения кислородом. Контрольные клетки, не подвергавшиеся условиям OGD, инкубировали в содержащей глюкозу среде DMEM (25 ммоль/л) в атмосфере аэробной газовой смеси (95% воздух и 5% CO2). Клетки подвергались воздействию каждого Примера за 30 минут до и в течение всего периода OGD/реоксигенации.
(3) Оценка NMDA (N-метил-D-аспартат)индуцированной эксайтотоксичности
После инкубирования планшета в течение 15-18 дней, кортикальные нейроны подвергали воздействию NMDA (100 мМ) в растворе (не содержащий Mg2+ сбалансированный солевой раствор Эрла (EBSS), содержащий 1,8 мМ CaCl2 и 10 мМ глицин) в течение 10 минут. После воздействия клетки промывали MgSO4-содержащим раствором EBSS и инкубировали в 25 ммоль/л содержащей глюкозу среде DMEM в инкубаторе с 5% CO2 при 37°C. За 30 минут до обработки NMDA, клетки обрабатывали каждым образцом (10 мМ).
(4) Замер повреждений клеток или гибели клеток
Для замера повреждений клеток или гибели клеток измеряли количество LDH, высвобождаемого в среду, с помощью набора для определения жизнеспособности клеток (Sigma-Aldrich, St. Louis, МО). Жизнеспособность клеток выражали в процентах LDH относительно общего количества LDH в клетках, замеренного в родственных культурах, которые лизировали после эксперимента методом замораживания-оттаивания.
Эксайтотоксичность является важным фактором ишемия-индуцированной гибели нейронов, особенно при ранней ишемии головного мозга. OGD представляет собой экспериментальную модель, имитирующую внезапное прекращение снабжения кровью и затрат энергии при ишемии. Повреждения клеток индуцируются OGD, и повреждения клеточной мембраны и повреждения нейронов можно оценить путем измерения высвобождения в среду белка, такого как LDH. В результате было обнаружено, что соединения (3а, 3с и 3f) заметно снижают повреждение нейронов, по сравнению с МК801 (хорошо известный антагонист NMDA рецептора), и не продемонстрировали цитотоксичности (фиг. 1). Эксайтотоксичность, вызванная избыточным стимулированием NMDA рецептора, является важным фактором, влияющим на повреждение нейронов при OGD/R и на ишемическое повреждение головного мозга, источником которого является одновременная выработка свободных радикалов, приводящая к окислительному стрессу. Результаты эксперимента показали, что соединения (3а, 3с, 3f, 3i и 5а) по настоящему изобретению значительно уменьшали NMDA-индуцированное повреждение нейронов в культуре кортикальных нейронов, даже несмотря на то, что их активность была ниже, чем анти-эксайтотоксичная активность МК-801 (фиг. 2). Это позволяет предположить, что ингибирование NMDA-индуцированной нейронной эксайтотоксичности соединениями по настоящему изобретению вносит вклад в антиишемическую активность.
Пример 2-2. Антиоксидантная активность производных вербенона
Для исследования прямой антиоксидантной активности образцов, полученных в описанных выше Примерах, проводили описанный далее эксперимент согласно литературной методике (Ju с. et al., BBRC, 431(3), 484-489, 2013; Huang D. et al., J. Agric. Food Chem., 53, 1841-1856, 2005.)
(1) Измерение внутриклеточных концентраций (DCF флуоресценция) активных форм кислорода (ROS)
Для измерения способности образцов захватывать свободные радикалы, спустя 1 час после реоксигенации клетки окрашивали флюоресцентным зондом H2DCF-DA (2,7-дигидрохлорфлуоресцеин диацетат), широко применяющимся для измерения внутриклеточного окислительного стресса. Через 2 часа клетки промывали буферным раствором EBSS (содержащим 25 мМ глюкозы, 1,8 мМ CaCl2, 1,2 мМ MgSO4 и 2,5 мМ пробенецид (рН 7,4)), и замеряли DCF флуоресценцию на фотометре для микропланшетов SpectraMax GeminiEM; Ex=485 нм, Em=530 нм) или на флуоресцентном микроскопе (DM IL НС Fluo, Leica, Wetzlar, Германия), оснащенном цифровой фотокамерой (DFC420C, Leica, Wetzlar Германия). Интенсивность флуоресценции компенсировали автофлуоресценцией (т.е. флуоресценцией клеток, не окрашенных H2DCF-DA).
Результаты проведенного эксперимента показали, что соединения 3с и 3f уменьшали OGD-индуцированный внутриклеточный окислительный стресс (фиг. 3).
(2) Определение способности улавливать азотные радикалы (метод с реактивом DPPH)
Образцы смешивали с DPPH (2,2-ди(4-трет-октилфенил)-1-пикрилгидразил, 23,6 мкг/мл, в этаноле) и инкубировали в темноте при 37°C в течение 30 минут. Замеряли поглощение DPPH, уменьшенное каждым образцом, при 517 нм. Витамин С (Sigma-Aldrich, St. Louis, МО) использовали в качестве контрольного образца, и вычисляли показатель ингибирования DPPH (%) по следующему уравнению:
Уравнение 1
Улавливающая активность (%)=[Absмакс(Вит.С)-Absобр.]/[Absмакс(Вит.С)-Absмин(Вит.С)]×100.
(3) Измерение адсорбционной емкости по отношению к кислородным радикалам (ORAC)
Тест ORAC проводили по описанной в литературе методике (Huang, D. et al., J. Agric. Food Chem., 53, 1841-56, 2005).
Раствор AAPH (2,2'-азобис-(2-метилпропионамид)-дигидрохлорид, 60 мМ) и флуоресцеина (50 нМ) готовили в буферном растворе (75 мМ фосфатный буфер, рН 7,4) без образца или с образцом или со стандартом (тролокс). Каждый из образцов и стандарт суспендировали в растворе 7% RMCD (случайным образом метилированный бета-циклодекстрин) в 50%-ном ацетоне. RMCD применяли для улучшения растворимости жирорастворимых образцов. Каждый образец перемешивали с раствором флуоресцеина (66 нМ, 190 мкл), встряхивая в течение 5 секунд. После инкубирования при 37°C в течение 10 минут, быстро добавляли в каждый раствор ААРН (500 мМ, 30 мкл) и замеряли снижение флуоресценции на флуоресцентном планшет-ридере (Ех=485 нм, Em=530 нм; SpectraMax GeminiEM, Molecular Devices, Sunnyvale, CA) при 37°C через 5-минутные интервалы в течение 9 часов. Для количественной оценки активности улавливания пероксильных радикалов, вычисляли площадь под кривой (AUC) по приведенному далее уравнению 2, вычисляли неттоAUC по приведенному далее уравнению 3, и вычисляли значение ТЕ (тролокс-эквивалент антиоксидантной активности) для каждого образца по приведенному далее уравнению 4 по стандартной кривой неттоAUC, построенной относительно роста концентрации тролокса.
Уравнение 2
AUC=(0,5+f1/f0+f2/f0+f3/f0+…+fn-2/f0+fn-1/f0+fn/f0)×5,
где f0 это первое значение флуоресценции в момент времени 0 мин и в момент времени I.
Уравнение 3
неттоAUC=AUCобразец-AUCпустой.
Уравнение 4
ТЕ (тролокс-эквивалент) для каждого образца=[неттоAUCобразец при 25 мМ]/[нетто AUCтролокс при 25 мМ].
Антиоксидантную активность производных вербенона по настоящему изобретению измеряли с помощью двух разных химических реакций: (1) метод одноэлектронного переноса, представляющий собой метод с 2,2-ди(4-трет-октилфенил)-1-пикрилгидразилом [DPPH], в котором измеряется уменьшение количества DPPH, работающего в качестве генератора свободных радикалов и датчика окончания; и (2) метод переноса. атома водорода, который представляет собой метод измерения адсорбционной емкости по отношению к кислородным радикалам [ORAC], в котором анализируется кинетика конкурирующей реакции генератора пероксильных радикалов (ААРН; 2,2'-азобис-(2-метилпропионамид)-дигидрохлорид) с каждым образцом, выступающим в роли антиоксиданта, и окисляемым флуоресцентным образцом (флуоресцеин).
Результаты проведенного эксперимента показали, что в методе с DPPH большинство стирилпроизводных (3а-f и 3h-i), имеющих фенольную группу, показали сильную и прямую улавливающую активность в отношении превращения DPPH в органические безазотные радикалы (см. таблицу 1). Среди них, соединения 3с и 3f продемонстрировали улавливающую активность выше, чем у витамина С в той же концентрации. В методе с ORAC было показано, что соединение (4е), имеющее пиррольную группу, и соединения (3а-i), имеющее фенольную группу, все показали высокую способность улавливать пероксильные радикалы, в сравнении с тролоксом (см. Таблицы 1 и 2). Кроме того, было обнаружено, что введение гидроксильной группы в мета- и параположения фенильной группы усиливает способность каждого соединения улавливать свободные радикалы.
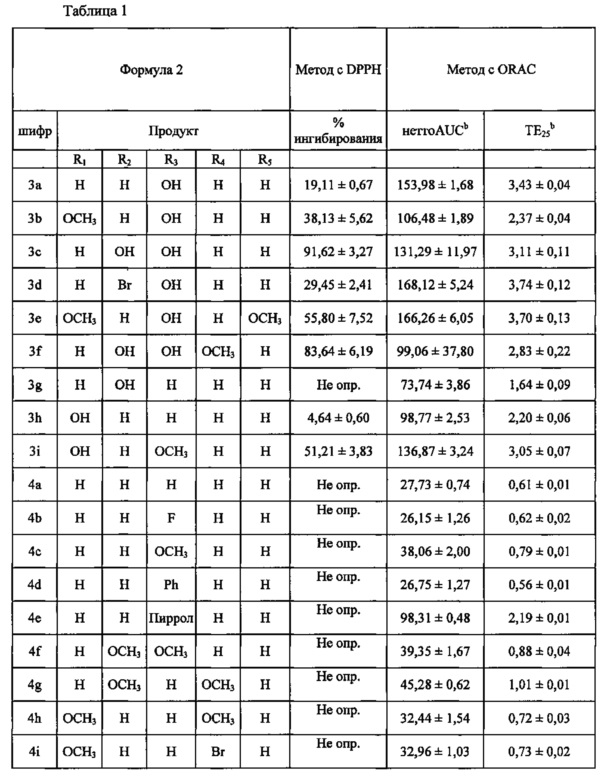
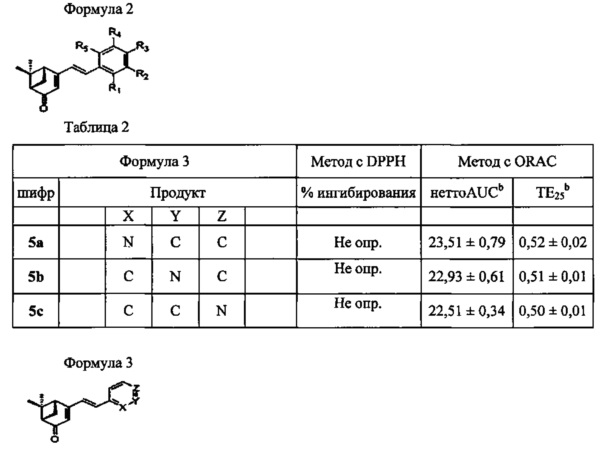
Пример 2-3. Эксперимент на модели очаговой церебральной ишемии
Для исследования влияния образцов, полученных в описанных выше Примерах, на очаговую церебральную ишемию был проведен описанный далее эксперимент по литературной методике (Belayev L. et al., Stroke, 27, 1616-1622, 1996; discussion 1623).
(1) Модель очаговой церебральной ишемии
Крыс усыпляли с помощью 3,0% изофлурана в смеси N2O и O2 (70:30 об/об) через маску для ингаляции и поддерживали на 2% изофлурана. На протяжении всего эксперимента осуществляли контроль температуры тела и поддерживали ее равной 37°C±0,3°C с использованием ректального термометра и электрогрелки, вплоть до полного восстановления животных от анестезии при хирургии. Очаговую церебральную ишемию вызывали с помощью правосторонней эндоваскулярной закупорки общей сонной артерии (МСАО). Вкратце, вводили хирургическую найлоновую мононить 3-0 (Ethicon Johnson & Johnson, Brussels, Бельгия) в правую наружную сонную артерию и продвигали на 17,5 мм во внутреннюю сонную артерию до закупорки входа в общую сонную артерию. Нить удаляли через 1,5 часа, давая животному восстановиться. Контрольным животным проводили те же хирургические операции, кроме МСАО. Физиологические параметры замеряли за 15 минут до процедуры МСАО и через 15 минут после реперфузии и отслеживали среднее давление крови в течение 5 минут с помощью датчика кровяного давления (MicroMed, Lousville, KY), и мониторили уровень глюкозы с помощью анализатора (Ciba Corning Diagnostics Corp., Medfield, MA). 5% образец (соединение 3f) растворяли в ДМСО, разбавляли 10% кремофора и стерильным физрастором, и вводили крысам интраперитонеально в течение 2 часов после вызывания МСАО (100 мг/кг).
(2) Измерение объема инфаркта
Крыс усыпляли с помощью 3,5% хлораль гидрата (5 мл/кг, интраперитонеальная инъекция) и обезглавливали. Коронарные срезы мозга (2 мм), полученные с применением матрикса (матрикс для мозга крыс, Ted Pella, Redding, СА) окрашивали 2% трифенилтетразолия хлоридом (Sigma-Aldrich, St. Louis, МО) при 37°C в течение 30 минут, фиксировали 4%-ным параформальдегидом (рН 7,4), и затем осуществляли криозащиту в фосфатном буфере, содержащем 30% сахарозы, при 4°C в течение 2 дней. Площадь поперечного сечения инфаркта между уровнями брегма +4 мм (передний) и -6 мм (задний) определяли с применением программного обеспечения для анализа (программа анализа изображений OPTIMAS5.1, BioScanInc. Edmonds, WA). Размер инфаркта мозга измеряли вручную, обводя границы площади инфаркта. Общий объем инфаркта (мм3) вычисляли по приведенному далее уравнению 5, как описано в документе (J Neurosci Methods (1998) 84:9-16; J Cereb Blood Flow Metab (1990) 10:290-293), и учитывали поправку на отек мозга. Отек мозга определяли по проценту увеличения площади ипсилатерального/контралатерального полушария, как показано в приведенном далее уравнении 6. Все измерения проводили по методике двойного слепого исследования.
Уравнение 5
Общий объем инфаркта (мм3)=ипсилатеральный объем (IVd), полученный прямым измерением×[(контралатеральный объем (Vc))/ипсилатеральный объем (VI)]
Уравнение 6
Объем отека) (%)=[(ипсилатеральный объем (VI)-контралатеральный объем (Vc))/контралатеральный объем (Vc)]×100.
После этого ткани замораживали, разрезали на 10- или 30-мкм коронарные срезы и хранили при -20°C.
(3) Оценка неврологических утрат
Неврологические утраты измеряли через 24 часа после ишемии и оценивали по 4-балльной шкале, как описано в литературе (0: отсутствие неврологических утрат, 1: лапа согнута; 2: согнутая лапа, пониженная устойчивость к приложенной сбоку силе, не вращается; 3: то же, что в 2), но вращается).
(4) Иммуногистологическое окрашивание тканей мозга
Срезы тканей мозга, приготовленные описанным выше способом, обрабатывали 5%-ным сыворотку-содержащим буфером при комнатной температуре в течение 1 часа для подавления неспецифического связывания антител. Первичные антитела, разбавленные до подходящих концентраций (МРО антитела и ED-1-антитела, каждые 1:100; нитротирозиновые антитела, 1:50; JL-1a, IL-1b, TNF-a антитела, каждые 1:100), добавляли в срезы тканей, которые после этого окрашивали в течение ночи при 4°C. Несвязанные первичные антитела удаляли промыванием, после чего срезы тканей окрашивали флуоресцентно-мечеными вторичными антителами при комнатной температуре в течение 1 часа. Несвязанные вторичные антитела удаляли промыванием, после чего окрашивали ядра красителем Hoechst 33258 в течение 20 минут, затем снова промывали. Срезы помещали на предметные стекла и анализировали через коночаговый флуоресцентный микроскоп (Zeiss LSM510; Zeiss, Oberkochen, Германия).
(5) Эксперимент по проницаемости гемато-энцефалического барьера
Краситель (краситель голубой Эванса, 2%) связывается с альбумином крови немедленно после внутривенной инъекции и превращается в высокомолекулярное вещество, неспособное проходить через нормальный гемато-энцефалический барьер, но в тканях мозга крыс с вызванной ишемией проницаемость голубого Эванса возрастает вследствие нарушений в гемато-энцефалическом барьере, и поэтому сила окрашивания голубым Эванса увеличивается. Сердце крыс с очаговой церебральной ишемией, вызванной как описано выше, обрызгивали 200 мл физиологического раствора. Ткань мозга отделяли, взвешивали и хранили в реагенте (трихлоруксусная кислота, 60%) при 4°C в течение 24 часов. Ткань измельчали и центрифугировали при 10000 об/мин 15 минут, после чего собирали надосадочный раствор. Поглощение голубого Эванса тканями мозга замеряли при 610 нм и вычисляли количество красителя на грамм ткани.
(6) Эксперимент по уровню долгосрочной выживаемости
Для крыс с очаговой церебральной ишемией, вызванной как описано выше, замеряли уровень выживаемости и нейрологических расстройств в течение 3 недель при тех же условиях, что и до операции.
(7) Животная модель эмболического ишемического инсульта
Крыс (вес: 270-300 г) усыпляли 3,0%-ным изофлураном в смеси 70% N2O/30% O2 (70:30 об/об) и поддерживали на 3% изофлуране. Вводили крысам ректальный термометр и поддерживали температуру тела крыс равной 37,0~37,9°C с помощью автоматической электрогрелки, соединенной с термометром. Делали разрез по средней линии горла, отделяли правую общую сонную артерию (ССА), правую внешнюю сонную артерию (ЕСА) и правую внутреннюю сонную артерию (ICA), и связывали внешнюю сонную артерию и общую сонную артерию. Внутреннюю сонную артерию временно пережимали изогнутым микрососудистым зажимом. Ответвления, начинающиеся от внешней сонной артерии и внутренней сонной артерии разрезали и вводили 35-мм эмбол во внутреннюю сонную артерию 100-мл шприцом Hamilton с помощью модифицированного РЕ-50 катетера (внешний диаметр: 0,58 мм; диаметр входа: 0,3 мм, для внутрисосудистых инъекций). Удаляли микрососудистый зажим, и осторожно продвигали катетер на 16-17 мм во внутреннюю сонную артерию и продвигали до точки, находящейся примерно в 2 мм от начала средней мозговой артерии. Эмбол катетера инъецировали во внутреннюю сонную артерию (10 мкл). Через 5 минут после инъекции эмбола, катетер удаляли. Перевязывали ответвление внутренней сонной артерии и зашивали место надреза, после чего крыс оставляли восстанавливаться от анестезии. Применяющийся в данном эксперименте эмбол получали быстрым инъецированием феморальной артериальной крови (брали у крыс-доноров) в РЕ-50 пробирку, после чего оставляли кровь при комнатной температуре на 2 часа и при 4°C на 22 часа для выработки тромба. Перед экспериментом пробирку вскрывали и переносили тромбы в модифицированный РЕ-50 катетер через РЕ-10 трубку с помощью 1-мл шприца с физиологическим растворов, оснащенным иглой 23G.
Результаты эксперимента показали, что в крысиной модели с вызванной преходящей ишемией пост-ишемическое лечение образцом 3f (50 мг/кг) (интраперитонеальная инъекция; вводилась дважды (через 2 часа и через 7 часов после инфаркта мозга)) значительно уменьшало ишемические повреждения, отек мозга и неврологические расстройства (фиг. 4). Кроме того, при измерении антиоксидантной активности в ткани методом иммуно-гистологического окрашивания нитротирозином в участках мозговой ткани, полученной от крыс, которым вводили образцы, было показано, что антиоксидантная активность в мозговой ткани у группы, которым вводили образцы, была значительно выше (фиг. 5).
Кроме того, при исследования инфильтрации воспалительных клеток в области инфаркта мозга и поврежденные области мозга методом иммунологического окрашивания, было обнаружено, что миграция нейтрофилов/моноцитов, окрашиваемых MPO антителами, и микроглии/макрофагов, окрашиваемых ED-1 антителами, была заметно подавлена (фиг. 6). Кроме того, было обнаружено, что уровень экспрессии цитокинов (таких как IL-1 альфа, IL-1 бета и TNF-альфа, которые играют важную роль в ишемическом поражении) в тканях был заметно снижен у группы, которым вводили образцы (фиг. 7). Более того, было обнаружено, что соединения по настоящему изобретению значительно уменьшают проницаемость гемато-энцефалического барьера, которая увеличивается при ишемическом поражении (фиг. 8). Также, при наблюдении влияния образцов (соединений) по настоящему изобретению на уровень долговременной выживаемости и.неврологического восстановления в течение 3 недель после введения образцов в крысиной модели с вызванной преходящей ишемией, было обнаружено, что уровень долговременной выживаемости и неврологического восстановления у крыс, которым вводили образцы, был значительно выше (фиг. 9). В случае ишемического инсульта часто наблюдается усиление кровотечения под действием лекарств (например, tPA), что может усилить клинические побочные эффекты (например, гибель или плохой прогноз) у пациентов. Однако образцы по настоящему изобретению не оказывали заметного влияния на масштаб повреждения мозга у животных моделей in vivo с эмболическим инсультом, вызванным аутологичной кровью, подтверждая низкую вероятность таких побочных эффектов вследствие воздействия образцов по настоящему изобретению (фиг. 10).
Далее в тексте будут описаны примеры составов, содержащих соединения по настоящему изобретению, но приведенные примеры составов служат исключительно в целях иллюстрации и не ограничивают каким-либо образом объем настоящего изобретения.

Перечисленные выше соединения смешивали друг с другом и засыпали в герметичное саше, получая состав в виде порошка.
Перечисленные выше соединения смешивали друг с другом и прессовали в таблетку обычным способом, получая состав в виде таблетки.

Согласно обычному способу приготовления капсул, перечисленные выше компоненты смешивали друг с другом и засыпали в желатиновую капсулу, получая состав в виде капсулы.

Согласно обычному способу приготовления растворов для инъекций, смесь перечисленных выше компонентов заполняли в каждую ампулу (2 мл).

Согласно обычному способу приготовления жидких составов, каждый из перечисленных выше компонентов растворяли в очищенной воде и добавляли лимонный ароматизатор. Затем добавляли в полученную смесь очищенную воду до общего объема 100 мл, и полученный раствор заливали в коричневую бутылку и стерилизовали, получая таким образом жидкий состав.

Содержание компонентов в смесях витаминов и минеральных веществ относительно приемлемы для функциональных пищевых продуктов, но их можно изменять на любые другие величины. В соответствии со стандартным способом приготовления функциональных пищевых продуктов, перечисленные выше компоненты смешивали, затем гранулировали, и полученные гранулы можно использовать для приготовления функциональных пищевых продуктов по стандартным методикам.

В соответствии со стандартным способом приготовления функциональных пищевых напитков, перечисленные выше компоненты смешивали, затем перемешивали и нагревали до 85°C в течение примерно 1 часа. Затем раствор фильтровали, заливали в 2-литровый стерилизованный контейнер, герметично закрывали, хранили в холодном месте и затем использовали для приготовления функциональных пищевых напитков по настоящему изобретению.
Приведенное выше соотношение компонентов в композиции относительно пригодно для предпочтительных напитков, но его можно изменять в соответствии с местными и этническими предпочтениями, такими как иерархия потребителей, страна проживания потребителей, предполагаемая область использования и т.п.
Хотя настоящее изобретение было подробно описано на конкретных примерах, квалифицированным специалистам в данной области будет понятно, что приведено описание только для предпочтительного варианта осуществления, и оно не ограничивает объем настоящего изобретения. Истинный объем настоящего изобретения определен в прилагаемой формуле изобретения и ее эквивалентах.
Промышленная применимость
Как описано выше, фармацевтическая композиция, содержащая в качестве действующего вещества производное вербенона, демонстрирует эффекты в защите нейронов, подавлении NMDA-индуцированной эксайтотоксичности, подавлении внутриклеточного окислительного стресса и подавлении миграции воспалительных клеток, по сравнению с обычно применяющимися фармацевтическими композициями. Так, она эффективна в лечении дегенеративных заболеваний мозга, в частности, ишемии головного мозга. Кроме того, ее можно использовать в функциональных пищевых продуктах.
| название | год | авторы | номер документа |
|---|---|---|---|
| Антиагрегационное и антиоксидантное средство | 2023 |
|
RU2808474C1 |
| Способ получения антиагрегационного и антиоксидантного средства | 2023 |
|
RU2819387C1 |
| Четвертичные аммониевые соединения на основе терпенов, обладающие противомикробной активностью | 2023 |
|
RU2818914C1 |
| СРЕДСТВА, ИНДУЦИРУЮЩИЕ АПОПТОЗ, ДЛЯ ЛЕЧЕНИЯ РАКА, ИММУННЫХ И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2568611C2 |
| Амиды, сочетающие адамантановый и монотерпеновый фрагменты, используемые в качестве ингибиторов ортопоксвирусов | 2019 |
|
RU2712135C1 |
| Хиральные монотерпеновые сульфинамиды | 2017 |
|
RU2646959C1 |
| Производные 7-гидроксикумарина, содержащие остатки монотерпеноидов, как ингибиторы репродукции респираторно-синцитиального вируса (РСВ) | 2022 |
|
RU2787352C1 |
| Способ получения хиральных монотерпеновых сульфинамидов | 2017 |
|
RU2650681C1 |
| НОВЫЕ АРИЛИРОВАННЫЕ КАМФЕНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2578715C2 |
| Новые азолы, содержащие монотерпеновые фрагменты, в качестве противогрибковых агентов широкого спектра действия | 2023 |
|
RU2806368C1 |
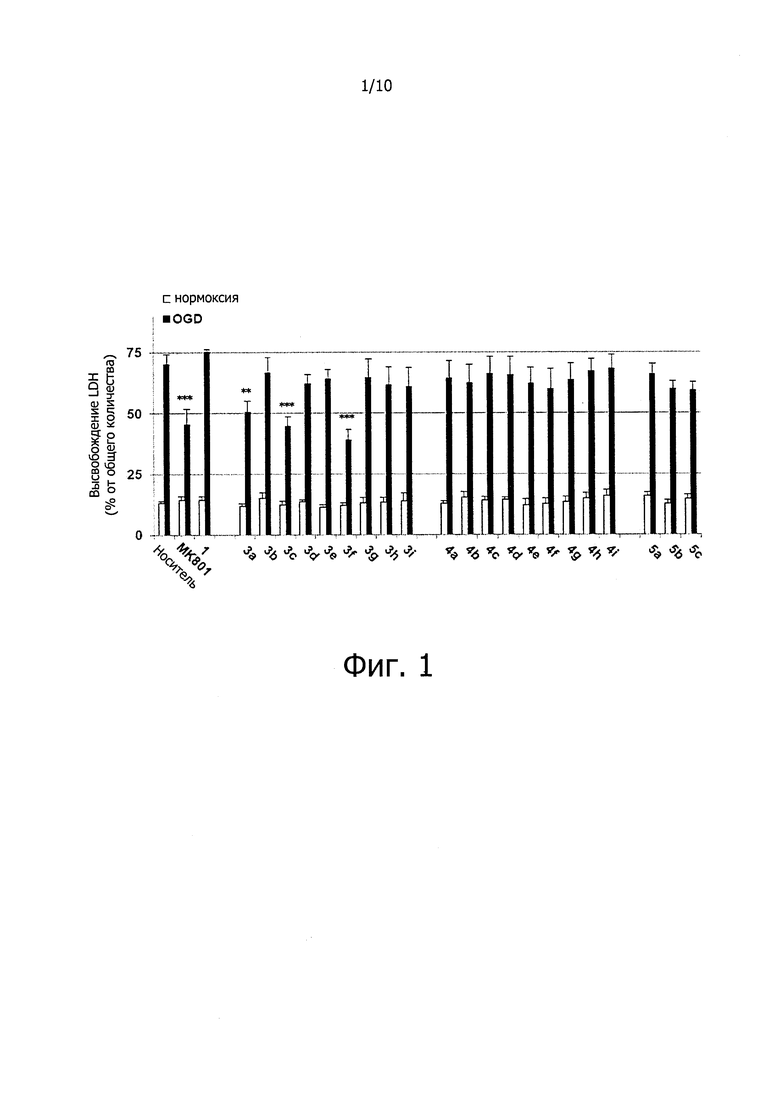
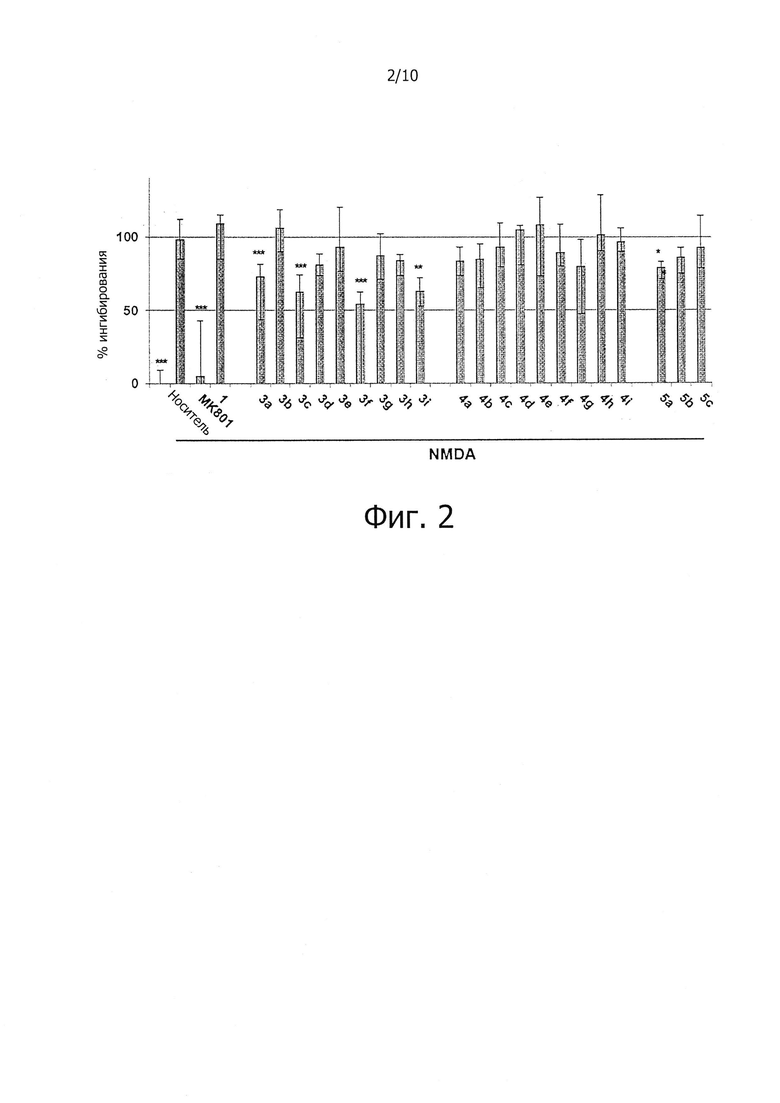
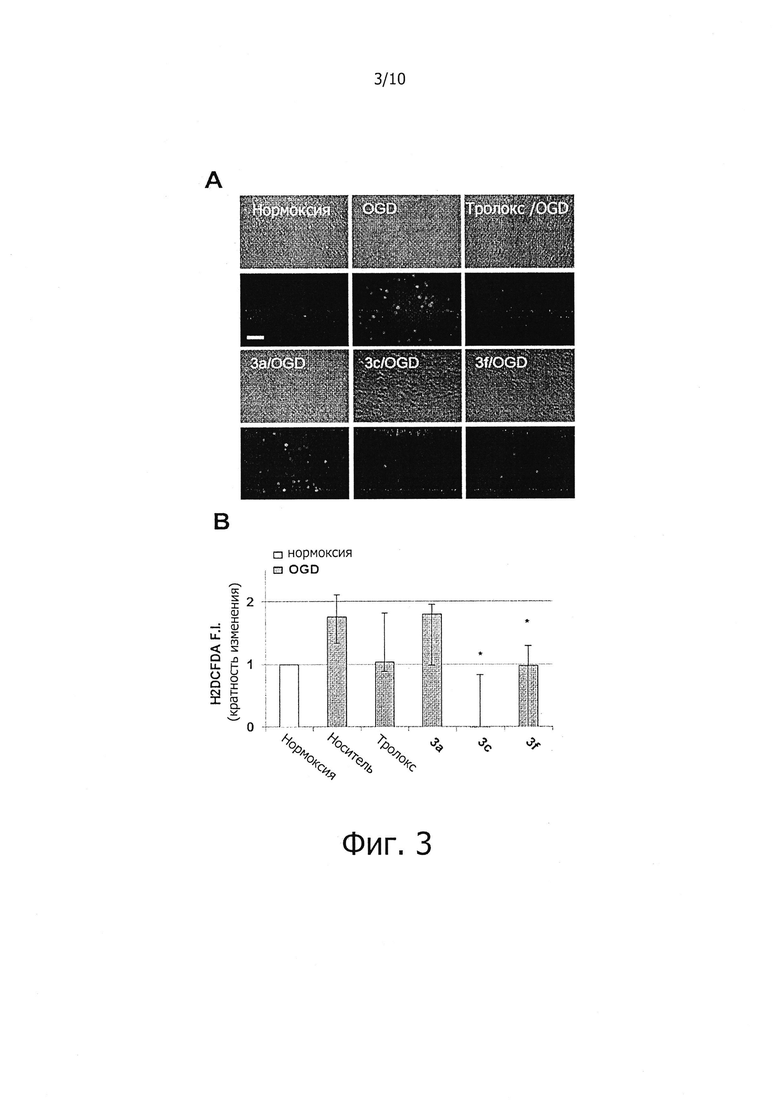
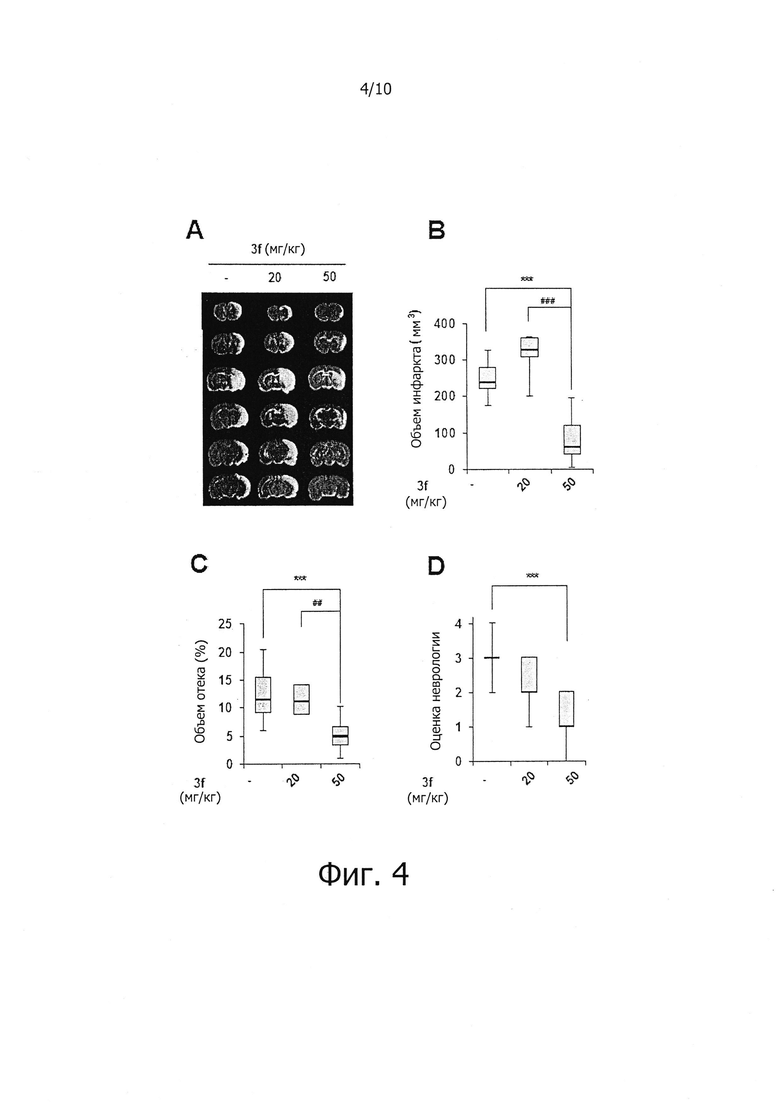
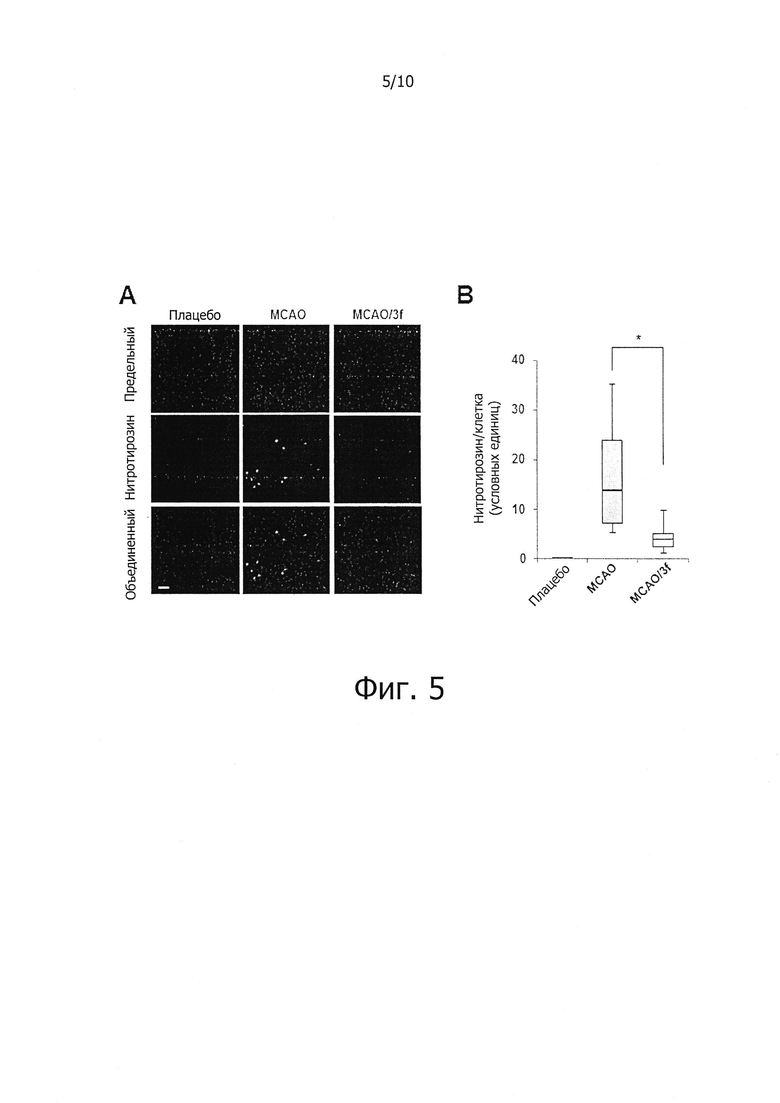
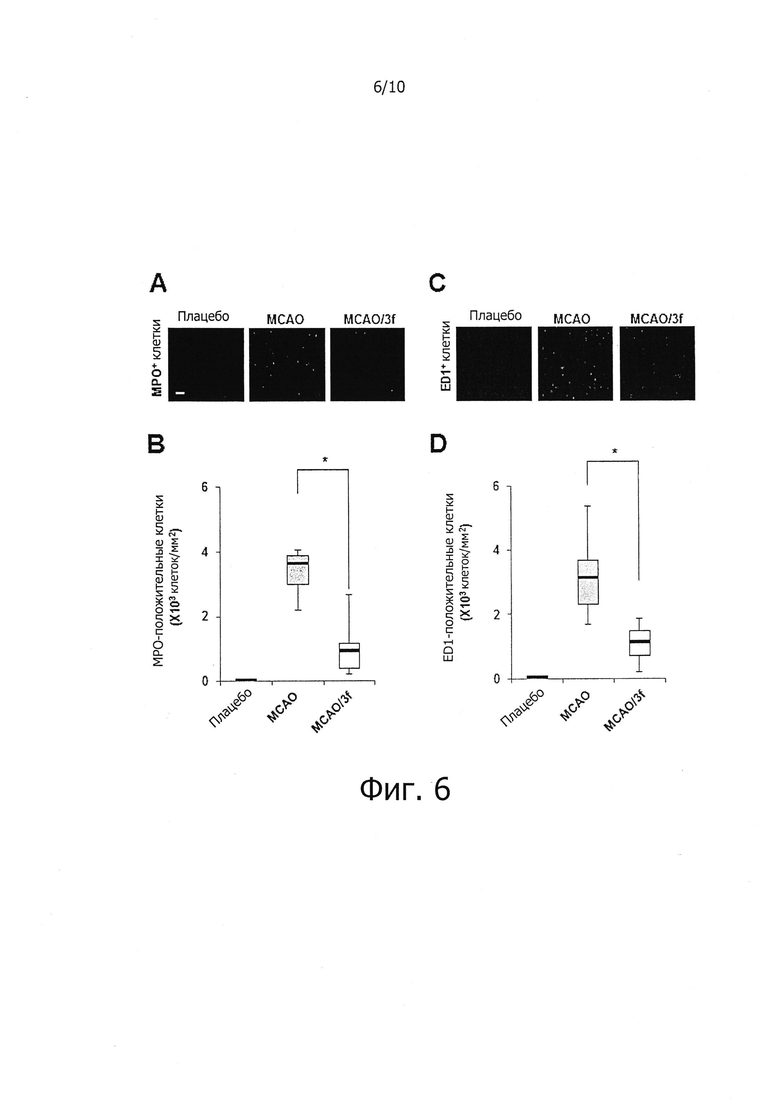
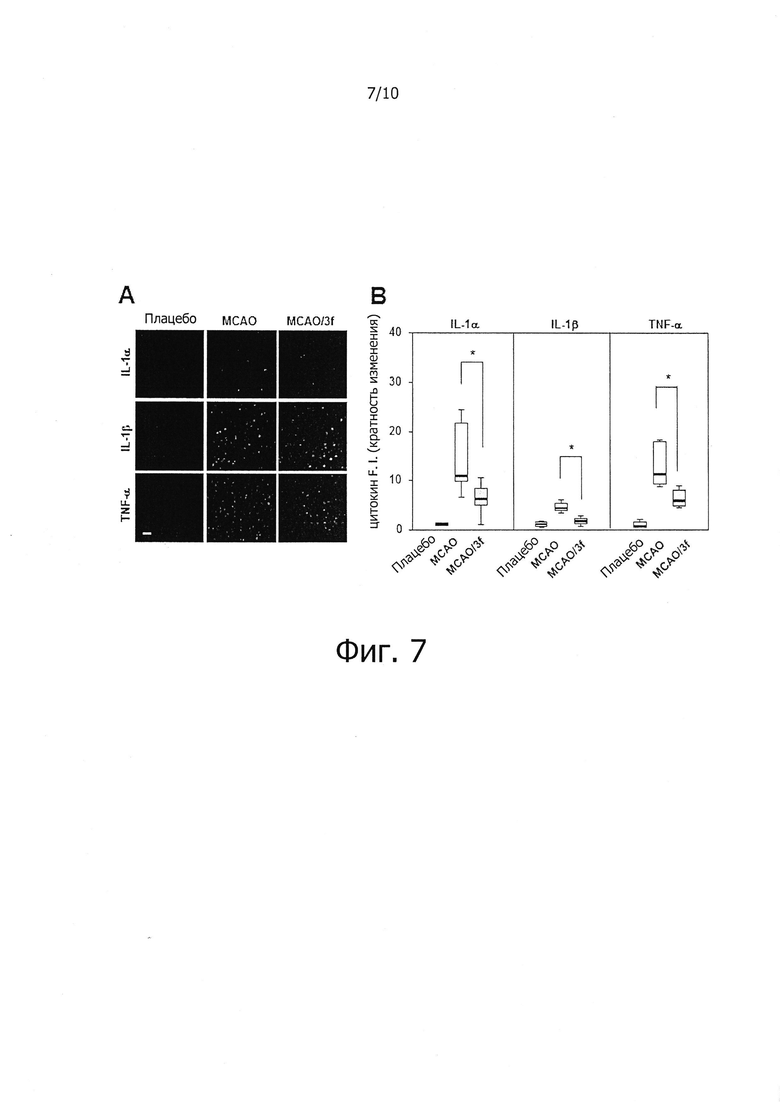
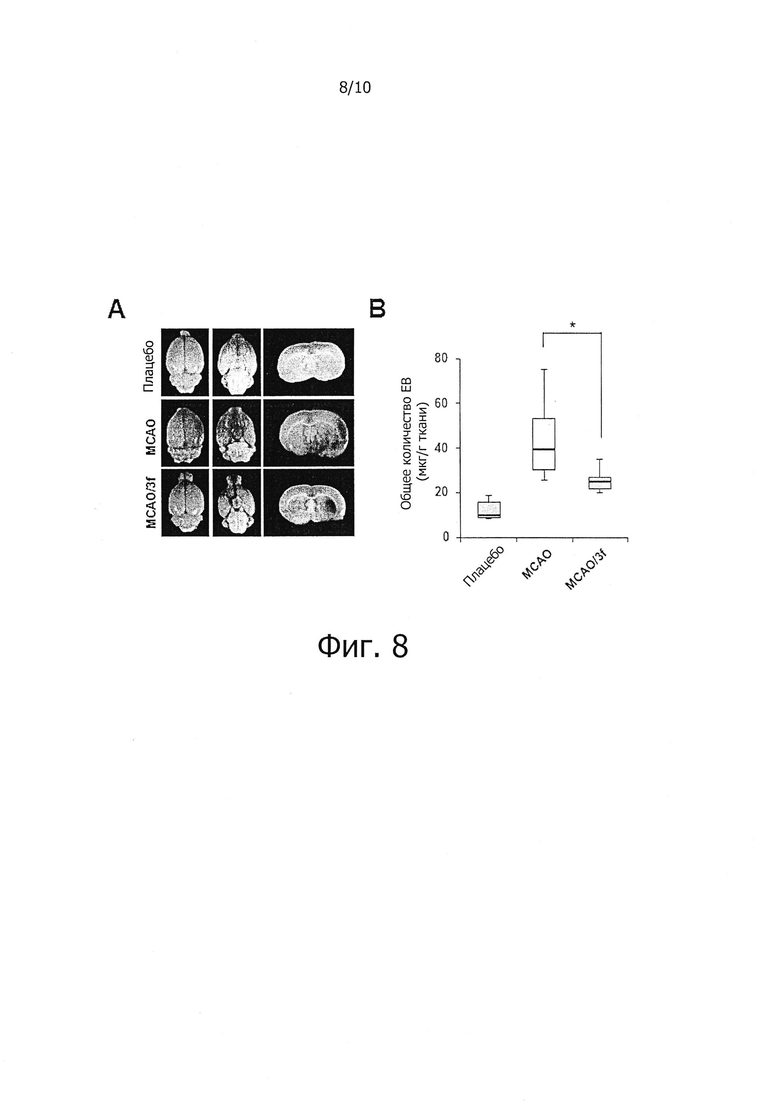
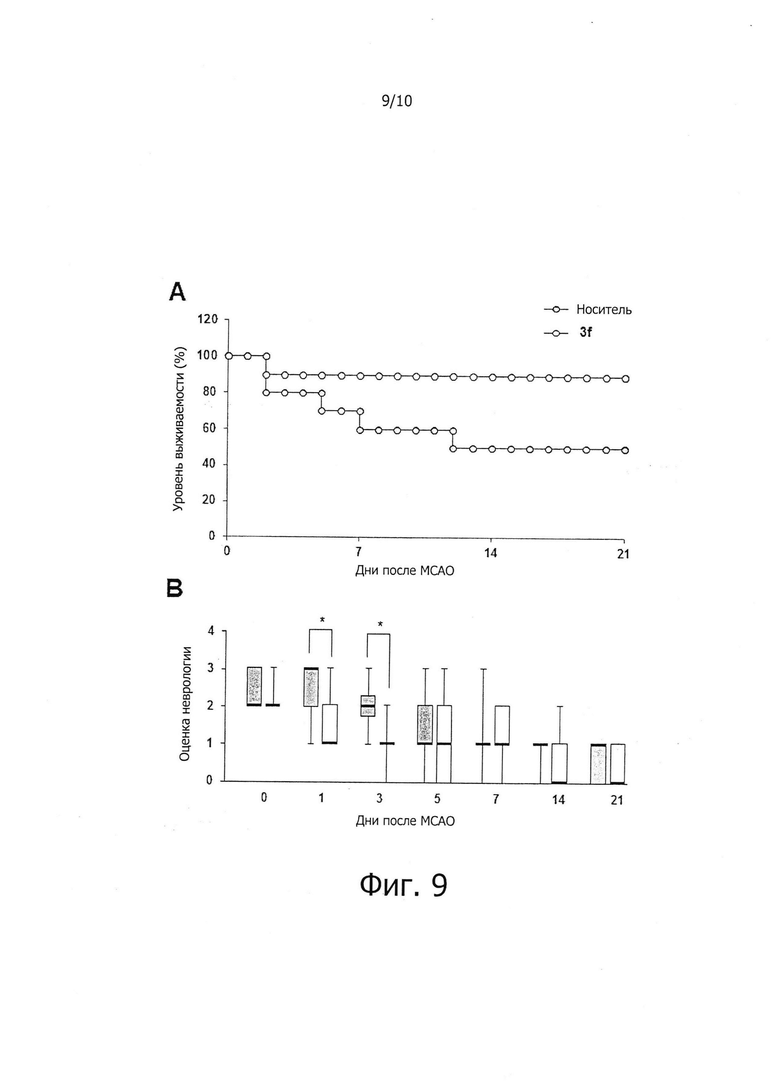
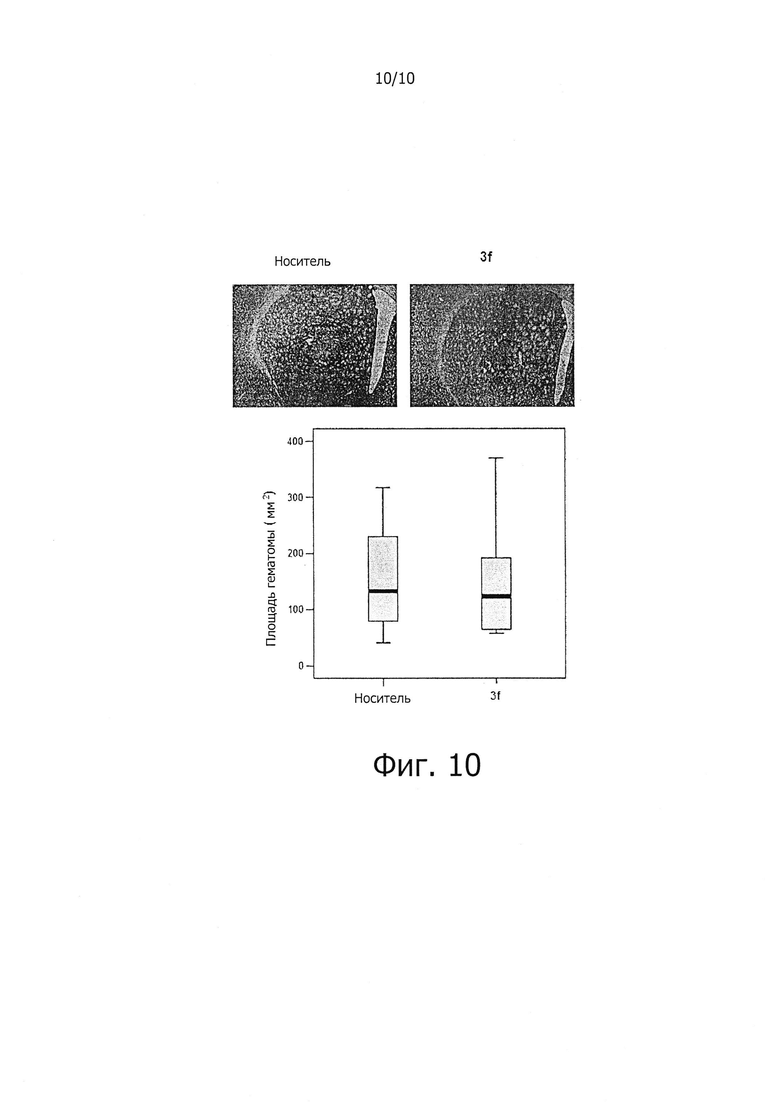
Настоящая группа изобретений относится к производным вербенола, к фармацевтической композиции для профилактики или лечения дегенеративного заболевания мозга, выбранного из инсульта, паралича, деменции, болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, рассеянного склероза и амиотрофного бокового склероза, которая содержит в качестве действующего вещества производное вербенола, а также к пищевой добавке с эффектом защиты нейронов, подавления окислительного стресса, подавления экспрессирования цитокинов, включающей производное вербенола, при чем указанное производное вербенола выбрано из группы, состоящей из: (1S,5R)-4-(4-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он; (1S,5R)-4-(3,4-дигидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он; (1S,5R)-4-(3,4-дигидрокси-5-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он; (1S,5R)-4-(2-гидрокси-4-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он; (1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-2-ил)винил)-бицикло[3.1.1]гепт-3-ен-2-он; и их фармацевтически приемлемых солей. 3 н. и 4 з.п. ф-лы, 10 ил., 2 табл., 2 пр.
1. Фармацевтическая композиция для профилактики или лечения дегенеративного заболевания мозга, выбранного из группы, состоящей из инсульта, паралича, деменции, болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, рассеянного склероза и амиотрофного бокового склероза,
которая содержит в качестве действующего вещества соединение, выбранное из группы, состоящей из:
(1S,5R)-4-(4-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3а);
(1S,5R)-4-(3,4-дигидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3с);
(1S,5R)-4-(3,4-дигидрокси-5-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3f);
(1S,5R)-4-(2-гидрокси-4-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3i);
(1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-2-ил)винил)-бицикло[3.1.1]гепт-3-ен-2-он (5а); и
их фармацевтически приемлемых солей.
2. Фармацевтическая композиция по п. 1, которая содержит (1S,5R)-4-(3,4-дигидрокси-5-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3f) или его фармацевтически приемлемую соль.
3. Фармацевтическая композиция по п. 1, в которой дегенеративное заболевание мозга представляет собой инсульт.
4. Пищевая добавка, имеющая эффекты в виде защиты нейронов, подавления окислительного стресса и подавления экспрессирования цитокинов, которая содержит соединение, выбранное из группы, состоящей из:
(1S,5R)-4-(4-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3а);
(1S,5R)-4-(3,4-дигидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3с);
(1S,5R)-4-(3,4-дигидрокси-5-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3f);
(1S,5R)-4-(2-гидрокси-4-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3i);
(1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-2-ил)винил)-бицикло[3.1.1]гепт-3-ен-2-он (5а); и
их фармацевтически приемлемых солей.
5. Пищевая добавка по п. 4, которая содержит (1S,5R)-4-(3,4-дигидрокси-5-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3f) или его фармацевтически приемлемую соль.
6. Соединение, выбранное из группы, состоящей из:
(1S,5R)-4-(4-гидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3а);
(1S,5R)-4-(3,4-дигидроксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3с);
(1S,5R)-4-(3,4-дигидрокси-5-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3f);
(1S,5R)-4-(2-гидрокси-4-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3i);
(1S,5R)-6,6-диметил-4-((Е)-2-(пиридин-2-ил)винил)-бицикло[3.1.1]гепт-3-ен-2-он (5а); и
их фармацевтически приемлемых солей.
7. Соединение по п. 6, которое представляет собой (1S,5R)-4-(3,4-дигидрокси-5-метоксистирил)-6,6-диметилбицикло[3.1.1]гепт-3-ен-2-он (3f) или его фармацевтически приемлемая соль.
| US 6649658 B1, 18.11.2003 | |||
| US 6214888 B1, 10.04.2001 | |||
| US 4036884 A, 19.07.1977 | |||
| WO 2011093742 A2, 04.08.2011. |
Авторы
Даты
2017-02-21—Публикация
2013-06-04—Подача