Изобретение относится к медицине и фармацевтике, а именно к лекарственным средствам, обладающим антивирусным действием против респираторно-синцитиального вируса (РСВ).
РСВ, принадлежащий к семейству Pneumoviridae, представляет собой оболочечный РНК-вирус, имеющий два основных серотипа A и B [1]. РСВ поражает дыхательные пути, вызывая ежегодные эпидемии в холодное время года. Несмотря на относительно невысокую изменчивость данного вируса, иммунитет к нему формируется нестойкий, вследствие чего возможно многократное инфицирование одного и того же человека в течение жизни. Обычно он вызывает простуду. Принципиально другая картина развития респираторно-синцитиальной инфекции наблюдается у пациентов в возрасте до 2 лет, особенно у недоношенных младенцев или детей с пороком сердца, а также пожилых людей [2-4]. Для этих возрастных категорий характерно поражение не только верхних, но и нижних дыхательных путей с развитием тяжелых бронхиолитов и пневмоний, вплоть до летального исхода. РСВ является наиболее частой причиной бронхита и пневмонии у детей в возрасте до одного года [5]. Предполагается, что количество детей, погибающих от этого заболевания, составляет до 200 тысяч ежегодно [6].
Вакцины от РСВ не существует, терапия респираторно-синцитиальной инфекции, как правило, симптоматическая. Практически единственным вариантом является лечение неспецифическим и малоэффективным противовирусным средством рибавирином [7, 8]. Кроме того, для профилактического применения используется моноклональное антитело Паливизумаб, но оно дорого, демонстрирует лишь умеренную эффективность в снижении частоты госпитализаций и не допущено к использованию в России. Таким образом, поиск низкомолекулярных препаратов против РСВ является важной задачей.
Поставленная задача решается применением в качестве противовирусных средств производных 7-гидроксикумарина общей формулы 1 и 2, включая их пространственные изомеры, в том числе оптически активные формы:
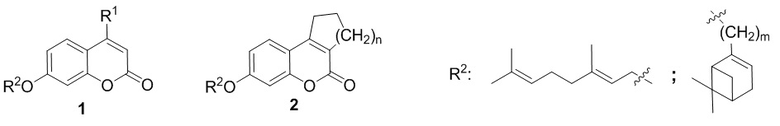
где R1 может быть Н или CH3, n=1 или 2, m может быть от 1 до 4.
Целевые соединения общей формулы 1 и 2 могут быть получены взаимодействием 7-гидроксикумарина и его производных общей формулы 3 или 4 с соответствующими галогенидами, например, бромидами, синтезированными из монотерпеноидов (Фиг. 1).
Синтез бромидов, содержащих остатки монотерпеноидов, может быть осуществлен исходя из соответствующих спиртов взаимодействием с бромирующими агентами, например, как показано на Фиг. 2.
Для получения других оптических изомеров можно использовать другие энантиомеры стартовых монотерпеноидов.
На первой стадии биологических экспериментов определяли 50% цитотоксическую дозу (CC50) каждого препарата в культуре клеток HEp2. Далее оценивали противовирусную активность каждого препарата и определяли 50% ингибирующую концентрацию (IC50), а также вычисляли химиотерапевтический индекс (SI) – отношение CC50 к IC50. Это соотношение отражает эффективность исследуемого соединения как противовирусного средства. Принято считать, что соединения, SI которых превышает 10, проявляют противовирусную активность. Полученные данные сравнивали с соответствующими показателями рибавирина.
Исследования биологической активности соединений 1 и 2 показали их высокую эффективность как ингибиторов репродукции РСВ (Таблица). Наиболее активные соединения 2в и 2д ингибируют репродукцию обоих серотипов РС вируса с IC50 в субмикромолярном диапазоне, в десятки раз превосходя по активности препарат сравнения рибавирин. В целом, значения активности против РС-вируса типа В не отличались от данных, полученных при использовании РС-вируса типа А, что свидетельствует об отсутствии типоспецифичности в противовирусной активности этих веществ.
Таблица. Результаты тестирования соединений общей формулы 1 и 2 в отношении РСВ A и B
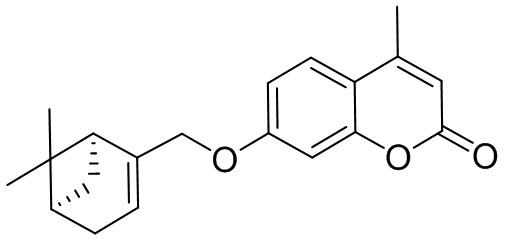
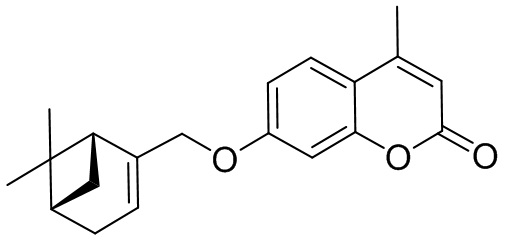
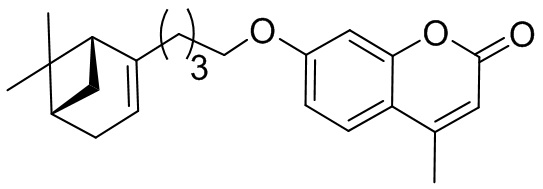
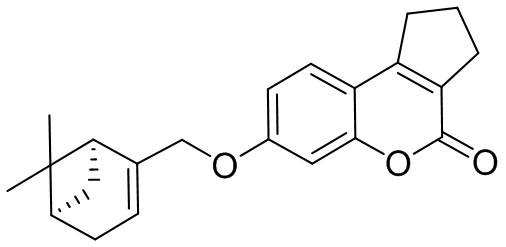
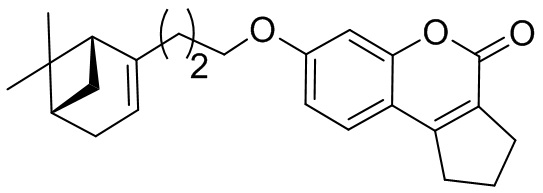
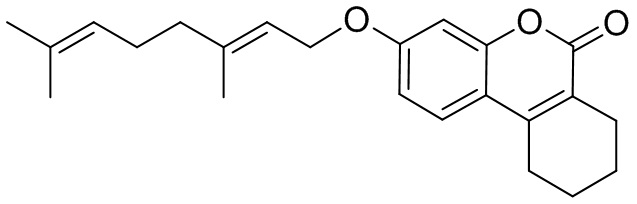
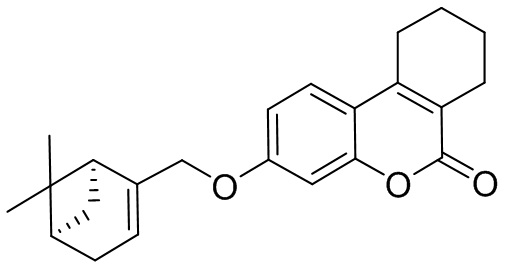
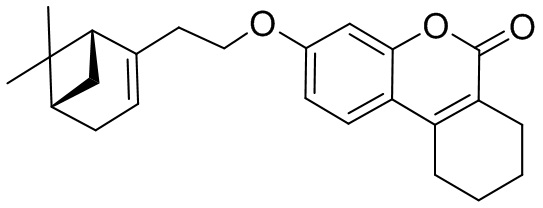
Изобретение иллюстрируется следующими примерами:
Пример 1. Общая методика синтеза соединений 1а, б, е и 2б, е
К 1.0 ммоль бромида 8, 9 или 10 в 5 мл диметилформамида прибавили 0.75 ммоль соединения 3 или 4 и 2.0 ммоль 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) и при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 15 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный – экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Продукт 1а, б, е или 2б, е выделили кристаллизацией из этанола или хроматографией на SiO2.
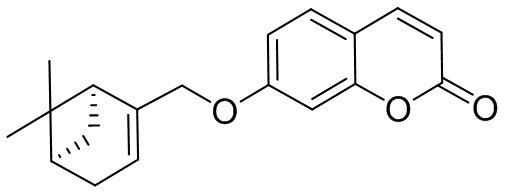
Пример 2. Синтез 7-(((1S,5R)-6,6-Диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-2H-хромен-2-она 1а.
Соединение 1а получили взаимодействием бромида 8 и кумарина 3а по методике, приведенной в примере 1. Продукт 1а выделили хроматографией на SiO2 , выход составил 53%.
Тпл 59°C. 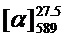 =+38.7 (c=0.46, EtOH). ЯМР 1Н и 13С соответствуют опубликованным [9].
=+38.7 (c=0.46, EtOH). ЯМР 1Н и 13С соответствуют опубликованным [9].
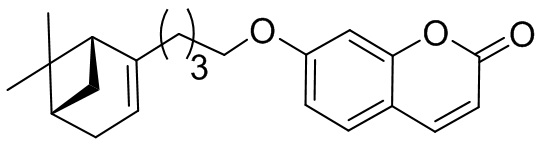
Пример 3. Синтез 7-(4-((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)бутокси)-2H-хромен-2-она 1б.
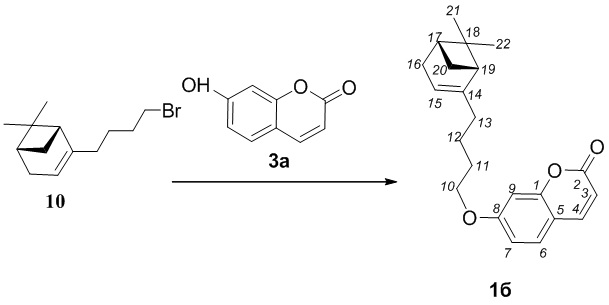
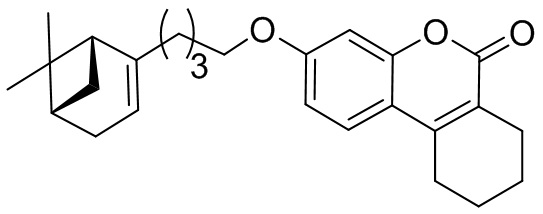
Соединение 1б получили взаимодействием бромида 10 и кумарина 3а по методике, приведенной в примере 1. Продукт 1б выделили хроматографией на SiO2, выход составил 80%.
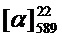 =-9.0 (c=1.78, CHCl3). Найдено: m/z=337.1793 ([M-1H]+ (C22H25O3)+. Вычислено: 337.1798). ЯМР 1Н (CDCl3, δH): 0.80 (с, 3H, 3H-C(22)); 1.11 (д, 1H, 2J=8.5, Hanti-C(20)); 1.24 (с, 3H, CH3-C(21)); 1.42-1.56 (м, 2H, 2H-C(12)); 1.74-1.81 (м, 2H, 2H-C(11)); 1.95-2.02 (м, 3H, 2H-C(13)), 1H-C(19)); 2.02-2.08 (м, 1H, H-C(17)); 2.15 (дм, 1H, 2J=17.4, H-C(16)); 2.22 (дм, 1H, 2J=17.4, H'-C(16)); 2.32 (ддд, 1H, 2J=8.5, J20sin,17=J20sin,19=5.6, Hsin-C(20)); 3.98 (т, 2H, J10,11 =6.5, 2H-C(10)); 5.16-5.20 (м, 1H, H-C(15)); 6.20 (д, 1H, J3,4=9.5, H-C(3)); 6.76 (д, 1H, J9,7=2.4, H-C(9)); 6.79 (дд, 1H, J7,6=8.6, J7.9=2.4, H-C(7)); 7.32 (д, 1H, J6.7=8.6, H-C(6)); 7.59 (д, 1H, J4,3=9.5, H-C(4)). ЯМР 13С (CDCl3, δC): 155.77 (с, C(1)); 161.07 (с, C(2)); 112.74 (д, C(3)); 143.26 (д, C(4)); 112.22 (с, C(5)); 128.53 (д, C(6)); 112.79 (д, C(7)); 162.26 (с, C(8)); 101.21 (д, C(9)); 68.38 (т, C(10)); 28.56 (т, C(11)); 23.32 (т, C(12)); 36.31 (т, C(13)); 147.68 (с, C(14)); 116.14 (д, C(15)); 31.12 (т, C(16)); 40.73 (д, C(17)); 37.78 (с, C(18)); 45.60 (д, C(19)); 31.52 (т, C(20)); 26.19 (к, C(21)); 21.05 (к, C(22)).
=-9.0 (c=1.78, CHCl3). Найдено: m/z=337.1793 ([M-1H]+ (C22H25O3)+. Вычислено: 337.1798). ЯМР 1Н (CDCl3, δH): 0.80 (с, 3H, 3H-C(22)); 1.11 (д, 1H, 2J=8.5, Hanti-C(20)); 1.24 (с, 3H, CH3-C(21)); 1.42-1.56 (м, 2H, 2H-C(12)); 1.74-1.81 (м, 2H, 2H-C(11)); 1.95-2.02 (м, 3H, 2H-C(13)), 1H-C(19)); 2.02-2.08 (м, 1H, H-C(17)); 2.15 (дм, 1H, 2J=17.4, H-C(16)); 2.22 (дм, 1H, 2J=17.4, H'-C(16)); 2.32 (ддд, 1H, 2J=8.5, J20sin,17=J20sin,19=5.6, Hsin-C(20)); 3.98 (т, 2H, J10,11 =6.5, 2H-C(10)); 5.16-5.20 (м, 1H, H-C(15)); 6.20 (д, 1H, J3,4=9.5, H-C(3)); 6.76 (д, 1H, J9,7=2.4, H-C(9)); 6.79 (дд, 1H, J7,6=8.6, J7.9=2.4, H-C(7)); 7.32 (д, 1H, J6.7=8.6, H-C(6)); 7.59 (д, 1H, J4,3=9.5, H-C(4)). ЯМР 13С (CDCl3, δC): 155.77 (с, C(1)); 161.07 (с, C(2)); 112.74 (д, C(3)); 143.26 (д, C(4)); 112.22 (с, C(5)); 128.53 (д, C(6)); 112.79 (д, C(7)); 162.26 (с, C(8)); 101.21 (д, C(9)); 68.38 (т, C(10)); 28.56 (т, C(11)); 23.32 (т, C(12)); 36.31 (т, C(13)); 147.68 (с, C(14)); 116.14 (д, C(15)); 31.12 (т, C(16)); 40.73 (д, C(17)); 37.78 (с, C(18)); 45.60 (д, C(19)); 31.52 (т, C(20)); 26.19 (к, C(21)); 21.05 (к, C(22)).
Пример 4. Синтез 7-(4-((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)бутокси)-4-метил-2H-хромен-2-она 1е.
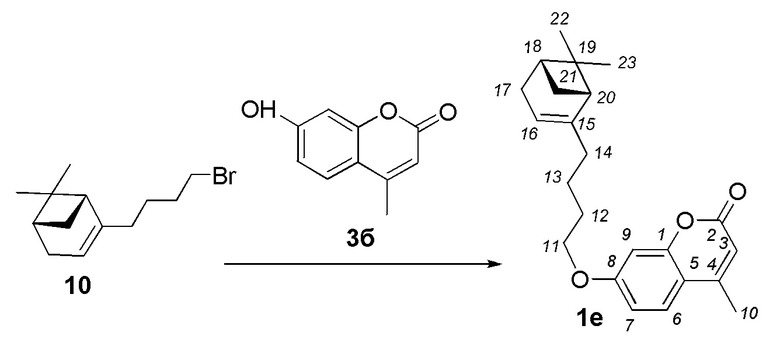
Соединение 1е получили взаимодействием бромида 10 и кумарина 3б по методике, приведенной в примере 1. Продукт 1е выделили кристаллизацией из этанола, выход составил 24%.
Тпл 77°C. 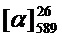 =-20.3 (c=0.60, CHCl3). Найдено: m/z=351.1954 ([M-1H]+ (C23H27O3)+. Вычислено: 351.1955). ЯМР 1Н (CDCl3, δH): 0.81 (с, 3H-C(23)); 1.11 (д, 1H, 2J=8.5, Hanti -C(21)); 1,24 (с, 3H-C(22)); 1.43-1.57 (м, 2H, 2H-C(13)); 1.74-1.82 (м, 2H, 2H-C(12)); 1.96-2.02 (м, 3H, 2H-C(14)), 1H-C(20)); 2.03-2.08 (м, 1H, H-C(18)); 2.16 (дм, 1H, 2J=17.5, H-C(17)); 2.23 (дм, 1H, 2J=17.5, H'-C(17)); 2.33 (ддд, 1H, 2J=8.5, J21s,18=J21s,20=5.6, Hsin-C(21)); 2.37 (д, 3H, J10,3=1,2, 3H-C(10)); 3.98 (т, 2H, J11,12=6.5, 2H-C(11)); 5.16-5.20 (м, 1H, H-C(16)); 6.10 (к, 1H, J3,10=1.2, H-C(3)); 6.77 (д, 1H, J9,7=2.5, H-C(9)); 6.82 (дд, 1H, J7,6=8.8, J7,9=2.5, H-C(7)); 7.45 (д, 1H, J6,7=8.8, H-C(6)). ЯМР 13С (CDCl3, δC): 155.14 (с, C(1)); 161.25 (с, C(2)); 111.65 (д, C(3)); 152.46 (с, C(4)); 113.24 (с, C(5)); 125.31 (д, C(6)); 112.53 (д, C(7)); 162.06 (с, C(8)); 101.18 (д, C(9)); 18.55 (к, C(10)); 68.33 (т, C(11)); 28.59 (т, C(12)); 23.33 (т, C(13); 36.35 (т, C(14)); 147.70 (с, C(15)); 116.13 (д, C(16)); 31.12 (т, C(17)); 40.70 (д, C(18)); 37.80 (с, C(19)); 45.55 (д, C(20)); 31.54 (т, C(21)); 26.20 (к, C(22)); 21.07 (к, C(23)).
=-20.3 (c=0.60, CHCl3). Найдено: m/z=351.1954 ([M-1H]+ (C23H27O3)+. Вычислено: 351.1955). ЯМР 1Н (CDCl3, δH): 0.81 (с, 3H-C(23)); 1.11 (д, 1H, 2J=8.5, Hanti -C(21)); 1,24 (с, 3H-C(22)); 1.43-1.57 (м, 2H, 2H-C(13)); 1.74-1.82 (м, 2H, 2H-C(12)); 1.96-2.02 (м, 3H, 2H-C(14)), 1H-C(20)); 2.03-2.08 (м, 1H, H-C(18)); 2.16 (дм, 1H, 2J=17.5, H-C(17)); 2.23 (дм, 1H, 2J=17.5, H'-C(17)); 2.33 (ддд, 1H, 2J=8.5, J21s,18=J21s,20=5.6, Hsin-C(21)); 2.37 (д, 3H, J10,3=1,2, 3H-C(10)); 3.98 (т, 2H, J11,12=6.5, 2H-C(11)); 5.16-5.20 (м, 1H, H-C(16)); 6.10 (к, 1H, J3,10=1.2, H-C(3)); 6.77 (д, 1H, J9,7=2.5, H-C(9)); 6.82 (дд, 1H, J7,6=8.8, J7,9=2.5, H-C(7)); 7.45 (д, 1H, J6,7=8.8, H-C(6)). ЯМР 13С (CDCl3, δC): 155.14 (с, C(1)); 161.25 (с, C(2)); 111.65 (д, C(3)); 152.46 (с, C(4)); 113.24 (с, C(5)); 125.31 (д, C(6)); 112.53 (д, C(7)); 162.06 (с, C(8)); 101.18 (д, C(9)); 18.55 (к, C(10)); 68.33 (т, C(11)); 28.59 (т, C(12)); 23.33 (т, C(13); 36.35 (т, C(14)); 147.70 (с, C(15)); 116.13 (д, C(16)); 31.12 (т, C(17)); 40.70 (д, C(18)); 37.80 (с, C(19)); 45.55 (д, C(20)); 31.54 (т, C(21)); 26.20 (к, C(22)); 21.07 (к, C(23)).
Пример 5. Синтез 7-(3-((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)пропокси)-2,3-дигидроциклопента[c]хромен-4(1H)-она 2б.
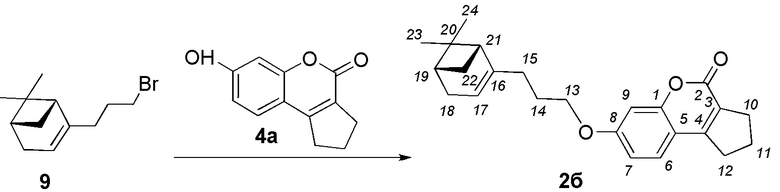
Соединение 2б получили взаимодействием бромида 9 и кумарина 4а по методике, приведенной в примере 1. Продукт 2б выделили кристаллизацией из этанола, выход составил 47%.
Тпл 68°C.  =-18.6 (c=0.88, CHCl3). Найдено: m/z=364.2038 ([M]+ (C24H28O3)+. Вычислено: 364.2033). ЯМР 1Н (CDCl3, δH): 0.81 (с, 3H-C(24)); 1.12 (д, 1H, 2J=8.5, Hanti-C(22)); 1.25 (с, 3H-C(23)); 1.77-1.90 (м, 2H, 2H-C(14)); 2.01 (ддд, 1 H, J21.19=J21,22sin5.6, J21,17=1.4, H-C(21)); 2.04-2.12 (м, 3H, 2H-C(15), 1H-C(19)); 2.13-2.19 (м, 3H, 2H-C(11), 1H-C(18)); 2.23 (дм, 1H, 2J=17.6, H'-C(18)); 2.34 (ддд, 1H, 2J=8.5, J22s,19=J22s,21=5.6, Hsin-C(22)); 2.83-2.88 (м, 2H, 2H-C(10)); 2.98-3.03 (м, 2H, 2H-C(12)); 3.96 (т, 2H, J13,14=6.5, 2H-C(13)); 5.19-5.23 (м, 1H, H-C(17)); 6.78-6.82 (м, 2H,H-C(7), H-C(9)); 7.27-7.32 (м, 1H, H-C(6)). ЯМР 13C (CDCl3, δC): 155.64 (с, C(1)); 160.46 (с, C(2)); 124.16 (с, C(3)); 156.28 (с, C(4)); 112.11 (с, C(5)); 125.38 (д, C(6)); 112.45 (д, C(7)); 161.43 (с, C(8)); 101.10 (д, C(9)); 30.20 (т, C(10)); 22.43 (т, C(11)); 31.90 (т, C(12)); 68.04 (т, C(13)); 26.50 (т, C(14)); 32.90 (т, C(15)); 146.99 (с, C(16)); 116.59 (д, C(17)); 31.12 (т, C(18)); 40.68 (д, C(19)); 37.81 (с, C(20)); 45.59 (д, C(21)); 31.56 (т, C(22)); 26.17 (к, C(23)); 21.05 (к, C(24)).
=-18.6 (c=0.88, CHCl3). Найдено: m/z=364.2038 ([M]+ (C24H28O3)+. Вычислено: 364.2033). ЯМР 1Н (CDCl3, δH): 0.81 (с, 3H-C(24)); 1.12 (д, 1H, 2J=8.5, Hanti-C(22)); 1.25 (с, 3H-C(23)); 1.77-1.90 (м, 2H, 2H-C(14)); 2.01 (ддд, 1 H, J21.19=J21,22sin5.6, J21,17=1.4, H-C(21)); 2.04-2.12 (м, 3H, 2H-C(15), 1H-C(19)); 2.13-2.19 (м, 3H, 2H-C(11), 1H-C(18)); 2.23 (дм, 1H, 2J=17.6, H'-C(18)); 2.34 (ддд, 1H, 2J=8.5, J22s,19=J22s,21=5.6, Hsin-C(22)); 2.83-2.88 (м, 2H, 2H-C(10)); 2.98-3.03 (м, 2H, 2H-C(12)); 3.96 (т, 2H, J13,14=6.5, 2H-C(13)); 5.19-5.23 (м, 1H, H-C(17)); 6.78-6.82 (м, 2H,H-C(7), H-C(9)); 7.27-7.32 (м, 1H, H-C(6)). ЯМР 13C (CDCl3, δC): 155.64 (с, C(1)); 160.46 (с, C(2)); 124.16 (с, C(3)); 156.28 (с, C(4)); 112.11 (с, C(5)); 125.38 (д, C(6)); 112.45 (д, C(7)); 161.43 (с, C(8)); 101.10 (д, C(9)); 30.20 (т, C(10)); 22.43 (т, C(11)); 31.90 (т, C(12)); 68.04 (т, C(13)); 26.50 (т, C(14)); 32.90 (т, C(15)); 146.99 (с, C(16)); 116.59 (д, C(17)); 31.12 (т, C(18)); 40.68 (д, C(19)); 37.81 (с, C(20)); 45.59 (д, C(21)); 31.56 (т, C(22)); 26.17 (к, C(23)); 21.05 (к, C(24)).
Пример 6. Синтез 3-(4-((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)бутокси)-7,8,9,10-тетрагидро-6H-бензо[c]хромен-6-она 2е.
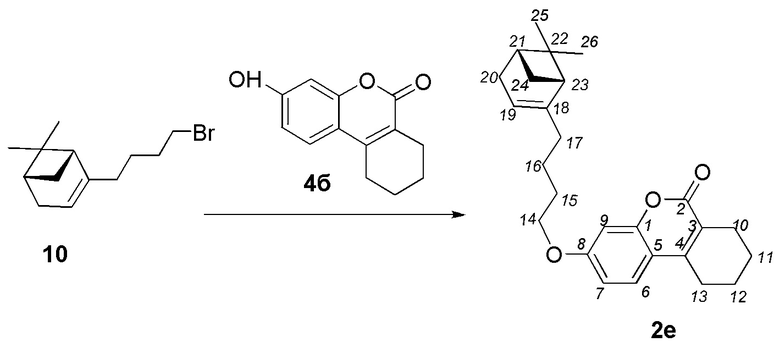
Соединение 2е получили взаимодействием бромида 10 и кумарина 4б по методике, приведенной в примере 1. Продукт 2е выделили кристаллизацией из этанола, выход составил 36%.
Тпл 69°C.  =-17.6 (c=0.90, CHCl3). Найдено: m/z=391.2265 ([M-1H]+ (C26H31O3)+. Вычислено: 391.2268). ЯМР 1Н (CDCl3, δH): 0.81 (с, 3H-C(26)); 1.11 (д, 1H, 2J=8.5, Hanti-C(24)); 1.24 (с, 3H-C(25)); 1.42-1.56 (м, 2H, 2H-C(16)); 1.73-1.86 (м, 6H, 2H-C(11), 2H-C(12), 2H-C(15)); 1.95-2.02 (м, 3H, 2H-C(17), H-C(23)); 2.02-2.08 (м, 1H, H-C(21)); 2.16 (дм, 1H, 2J=17.4, H-C(20)); 2.22 (дм, 1H, 2J=17.4, H'-C(20)); 2.33 (ддд, 1H, 2J=8.5, J24sin,21=J24sin,23=5.6, Hsin-C(24)); 2.49-2.55 (м, 2H, 2H-C(10));)); 2.68-2.75 (м, 2H, 2H-C(13)); 3.96 (т, 2H, J14,15=6.5, 2H-C(14)); 5.16-5.20 (м, 1H, H-C(19)); 6.75 (д, 1H, J9,7=2.5, H-C(9)); 6.79 (дд, 1H, J7,6= 8.8, J7,9=2.5, H-C(7)); 7.41 (д, 1H, J6,7=8.8, H-C(6)). ЯМР 13С (CDCl3, δC): 153.36 (с, C(1)); 162.10 (с, C(2)); 120.19 (с, C(3)); 147.19 (с, C(4)); 113.42 (с, C(5)); 123.89 (д, C(6)); 112.19 (д, C(7)); 160.82 (с, C(8)); 100.95 (д, C(9)); 23.68 (т, C(10)); 21.56 (т, C(11)); 21.25 (т, C(12)); 25.08 (т, C(13)); 68.20 (т, C(14)); 28.64 (т, C(15)); 23.35 (т, C(16)); 36.37(т, C(17)); 147.74 (с, C(18)); 116.09 (д, C(19)); 31.12 (т, C(20)); 40.70 (д, C(21)); 37.80 (с, C(22)); 45.55 (д, C(23)); 31.54 (т, C(24)); 26.20 (к, C(25)), 21.07 (к, C(26)).
=-17.6 (c=0.90, CHCl3). Найдено: m/z=391.2265 ([M-1H]+ (C26H31O3)+. Вычислено: 391.2268). ЯМР 1Н (CDCl3, δH): 0.81 (с, 3H-C(26)); 1.11 (д, 1H, 2J=8.5, Hanti-C(24)); 1.24 (с, 3H-C(25)); 1.42-1.56 (м, 2H, 2H-C(16)); 1.73-1.86 (м, 6H, 2H-C(11), 2H-C(12), 2H-C(15)); 1.95-2.02 (м, 3H, 2H-C(17), H-C(23)); 2.02-2.08 (м, 1H, H-C(21)); 2.16 (дм, 1H, 2J=17.4, H-C(20)); 2.22 (дм, 1H, 2J=17.4, H'-C(20)); 2.33 (ддд, 1H, 2J=8.5, J24sin,21=J24sin,23=5.6, Hsin-C(24)); 2.49-2.55 (м, 2H, 2H-C(10));)); 2.68-2.75 (м, 2H, 2H-C(13)); 3.96 (т, 2H, J14,15=6.5, 2H-C(14)); 5.16-5.20 (м, 1H, H-C(19)); 6.75 (д, 1H, J9,7=2.5, H-C(9)); 6.79 (дд, 1H, J7,6= 8.8, J7,9=2.5, H-C(7)); 7.41 (д, 1H, J6,7=8.8, H-C(6)). ЯМР 13С (CDCl3, δC): 153.36 (с, C(1)); 162.10 (с, C(2)); 120.19 (с, C(3)); 147.19 (с, C(4)); 113.42 (с, C(5)); 123.89 (д, C(6)); 112.19 (д, C(7)); 160.82 (с, C(8)); 100.95 (д, C(9)); 23.68 (т, C(10)); 21.56 (т, C(11)); 21.25 (т, C(12)); 25.08 (т, C(13)); 68.20 (т, C(14)); 28.64 (т, C(15)); 23.35 (т, C(16)); 36.37(т, C(17)); 147.74 (с, C(18)); 116.09 (д, C(19)); 31.12 (т, C(20)); 40.70 (д, C(21)); 37.80 (с, C(22)); 45.55 (д, C(23)); 31.54 (т, C(24)); 26.20 (к, C(25)), 21.07 (к, C(26)).
Пример 7. Общая методика синтеза соединений 1в-д и 2а,в-д.
К 0.50 ммоль соединения 3 или 4 в 5 мл этанола прибавили 0.75 ммоль K2CO3 и 0.75 ммоль бромида 5, 6, 7 или 8 при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Горячий раствор отфильтровали, фильтрат выдерживали при -10°С в течение 48 часов. Продукт 1в-д или 2а, в-д выделили кристаллизацией из этанола или хроматографией на SiO2.
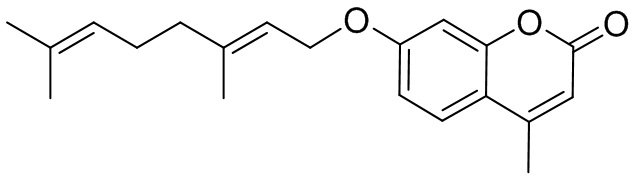
Пример 8. Синтез (E)-7-(3,7-диметилокта-2,6-диенилокси)-4-метил-2H-хромен-2-она 1в.
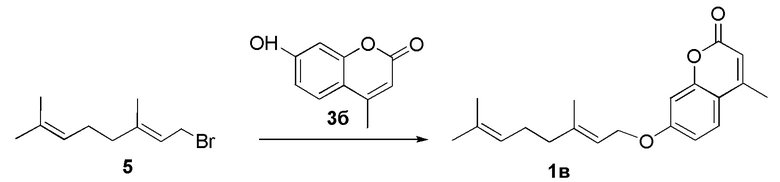
Соединение 1в получили взаимодействием бромида 5 и кумарина 3б по методике, приведенной в примере 7. Продукт 1в выделили хроматографией на SiO2, выход составил 47%.
Тпл=54°C. ЯМР 1Н и 13С соответствуют опубликованным [9].
Пример 9. Синтез 7-(((1S,5R)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-4-метил-2H-хромен-2-она 1г.
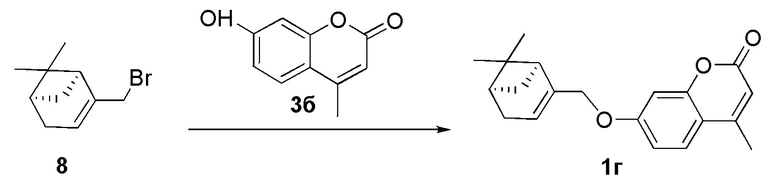
Соединение 1г получили взаимодействием бромида 8 и кумарина 3б по методике, приведенной в примере 7. Продукт 1г выделили хроматографией на SiO2, выход составил 30%.
Тпл=85°C. 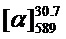 =+36 (c=0.8, EtOH). ЯМР 1Н и 13С соответствуют опубликованным [10].
=+36 (c=0.8, EtOH). ЯМР 1Н и 13С соответствуют опубликованным [10].
Пример 10. Синтез 7-(((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-4-метил-2H-хромен-2-она 1д.
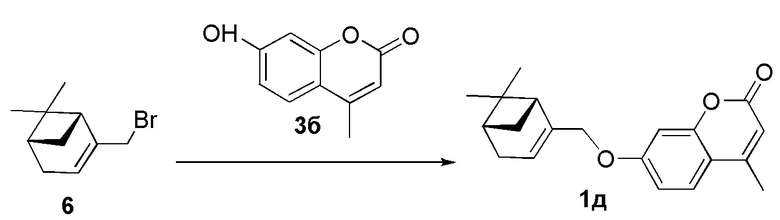
Соединение 1д получили взаимодействием бромида 6 и кумарина 3б по методике, приведенной в примере 7. Продукт 1д выделили хроматографией на SiO2, выход составил 54%.
Тпл=70°C. 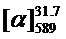 =-36 (c=0.8, EtOH). ЯМР 1Н и 13С соответствуют опубликованным [10].
=-36 (c=0.8, EtOH). ЯМР 1Н и 13С соответствуют опубликованным [10].
Пример 11. Синтез 7-(((1S,5R)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-2,3-дигидроциклопента[c]хромен-4(1H)-она 2а.
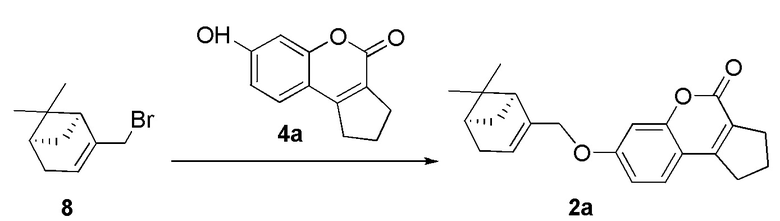
Соединение 2а получили взаимодействием бромида 8 и кумарина 4а по методике, приведенной в примере 7. Продукт 2а выделили кристаллизацией из этанола, выход составил 55%.
Тпл=140°C, 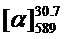 =+27.6 (c=0.65, EtOH). ЯМР 1Н и 13С соответствуют опубликованным [10].
=+27.6 (c=0.65, EtOH). ЯМР 1Н и 13С соответствуют опубликованным [10].
Пример 12. Синтез (E)-3-(3,7-диметилокта-2,6-диенокси)-7,8,9,10-тетрагидро-6H-бензо[c]хромен-6-она 2в.
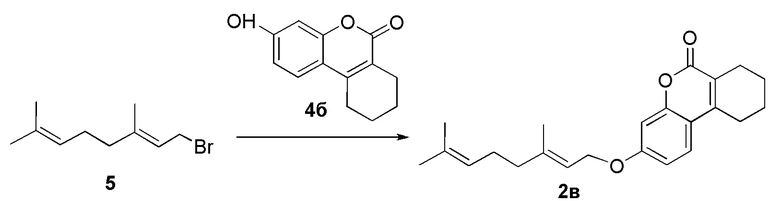
Соединение 2в получили взаимодействием бромида 5 и кумарина 4б по методике, приведенной в примере 7 . Продукт 2в выделили хроматографией на SiO2, выход составил 53%.
Тпл=62 °C. ЯМР 1Н и 13С соответствуют опубликованным [9].
Пример 13. Синтез 3-(((1S,5R)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-7,8,9,10-тетрагидро-6H-бензо[c]хромен-6-она 2г.
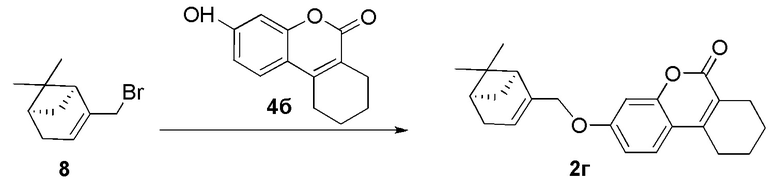
Соединение 2г получили взаимодействием бромида 8 и кумарина 4б по методике, приведенной в примере 7. Продукт 2г выделили кристаллизацией из этанола, выход составил 38%.
Тпл=105°C. 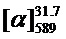 =+32.6 (c=0.65, EtOH). ЯМР 1Н и 13С соответствуют опубликованным [10].
=+32.6 (c=0.65, EtOH). ЯМР 1Н и 13С соответствуют опубликованным [10].
Пример 14. Синтез 3-(2-((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)этокси)-7,8,9,10-тетрагидро-6H-бензо[c]хромен-6-она 2д.
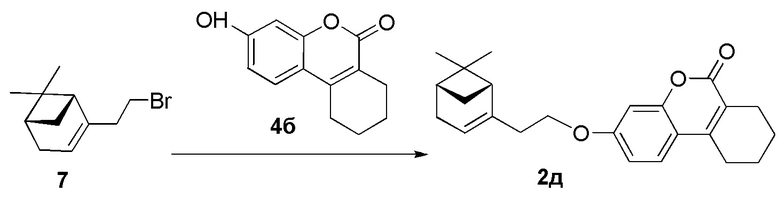
Соединение 2д получили взаимодействием бромида 7 и кумарина 4б по методике, приведенной в примере 7. Продукт 2д выделили кристаллизацией из этанола, выход составил 32%.
Тпл=120°C. 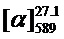 =-12.7 (c=0.55, EtOH). ЯМР 1Н и 13С соответствуют опубликованным [10].
=-12.7 (c=0.55, EtOH). ЯМР 1Н и 13С соответствуют опубликованным [10].
Пример 15. Изучение цитотоксичности соединений 1 и 2.
Препараты взвешивали в количестве 2 мг и растворяли в 100 мкл ДМСО. Далее доводили полученный раствор средой до концентрации 1000 мкг/мл, и готовили из него серию 2-кратных разведений.
Односуточную культуру клеток HEp2, выращенную на 96-луночных планшетах, концентрация клеток 3*105/лунку планшета, проверяли визуально в инвертированном микроскопе на целостность монослоя. В работу отбирали планшеты, где сомкнутость клеток составляла 60-80%. В планшет вносили разведения препаратов в соответствующей концентрации в объеме 100 мкл в каждую лунку в 2 повторах на каждую тестируемую концентрацию. Планшеты инкубировали 24 часа при температуре 37°С в присутствии 5% СО2.
Оценка жизнеспособности клеток велась при помощи микротетразолиевого теста (МТТ). МТТ-тест основан на восстановлении МТТ (желтый водорастворимый тетразолиевый краситель) под действием дегидрогеназ живых клеток с образованием голубых кристаллов формазана, количество которого измеряется спектрофотометрически. Раствор МТТ готовили на поддерживающей среде в концентрации 0.5 мг/мл. Далее вносили 0.1 мл раствора МТТ в каждую лунку. После 1.5 часа контакта МТТ при 37°С при концентрации СО2 5% с клетками лунки сбрасывали МТТ и заливали 0.1 мл этилового спирта 96%, после чего оптическую плотность в лунках измеряли на ридере Victor 2 1440 (Perkin Elmer, США) при длине волны 535 нм.
Основываясь на полученных данных, рассчитывали СС50, то есть дозу препарата в лунке, при которой погибает 50% клеток.
Полученные результаты приведены в таблице.
Пример 16. Изучение противовирусной активности соединений 1 и 2.
Для определения противовирусной активности в отношении респираторно-синцитиального вируса готовили серию 3-кратных разведений препаратов, начиная от 1/2 СС50, после чего наносили на культуру клеток НЕр-2 по 100 мкл на лунку в двойной концентрации и сразу же добавляли по 100 мкл вируса в серии 10-кратных разведений, после чего снова инкубировали в течение 1 часа при температуре 37°С и 5% СО2, далее вирус отмывали и снова наносили препараты в одинарной концентрации и инкубировали в течение 6 суток при температуре 37°С и 5% СО2.
Для проведения иммуноферментного анализа (cell-ELIZA) клеточную культуру фиксировали холодным 80%-ным ацетоном в течение 15 минут при -20°С, после чего ее промывали с помощью фосфатно-солевого буферного раствора с добавлением Tween 20 до 0.05 %. Далее на культуру наносили раствор первичных мышиных антител к белку F респираторно-синцитиального вируса, после чего инкубировали в течение 2 часов при комнатной температуре при непрерывном перемешивании.
Далее клетки снова промывали буфером и наносили вторичные антимышиные антитела, после чего снова инкубировали в течение 2 часов при непрерывном перемешивании. Далее антитела отмывали и наносили субстрат-хромогенную смесь с тетраметилбензидином. Через 5 минут реакцию останавливали с помощью 0.1М серной кислоты и оценивали оптическую плотность раствора при длине волны 450 нм. Лунки, в которых значение абсорбции превышало таковое в лунках с контролем клеток в два и более раза, считаются зараженными. Титр вируса считали по методу Рида и Менча.
Критерием оценки противовирусной активности является статистически значимое снижение титра вируса при применении препарата по сравнению с контролем.
Полученные результаты приведены в таблице.
Литература
1. Afonso, C.L.; Amarasinghe, G.K.; Banyai K, et al. Taxonomy of the order Mononegavirales: update 2016. Arch Virol. 2016, 161, 2351–2360.
2. Karron, R.A. Preventing respiratory syncytial virus (RSV) disease in children. Science, 2021, 372, 686-687.
3. Lozano, R.; Naghavi, M.; Foreman, K.; Lim, S.; Shibuya, K.; Aboyans, V.; et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012, 380, 2095-2128.
4. Falsey, A.R.; Hennessey, P.A.; Formica, M.A.; Cox, C.; Walsh, E.E. Respiratory syncytial virus infection in elderly and high-risk adults. N. Engl. J. Med. 2005, 352, 1749-1759.
5. Huang, H.; Chen, S.; Zhang, X.; Hong, L.; Zeng, Y.; Wu, B. Detection and clinical characteristics analysis of respiratory viruses in hospitalized children with acute respiratory tract infections by a GeXP-based multiplex-PCR assay. J Clin Lab Anal. 2020, 34, e23127.
6. Nair, H.; Nokes, D.J.; Gessner, B.D.; Dherani, M.; Madhi, S.A.; Singleton, R.J.; O'Brien, K.L.; Roca, A.; Wright, P.F.; Bruce, N.; Chandran, A.; Theodoratou, E.; Sutanto, A.; Sedyaningsih, E.R.; Ngama, M.; Munywoki, P.K.; Kartasasmita, C.; Simoes, E.A.; Rudan, I.; Weber, M.W.; Campbell, H. Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children: a systematic review and meta-analysis. Lancet 2010, 375, 1545–1555.
7. Wainwright, C. Acute viral bronchiolitis in children - a very common condition with few therapeutic options. Paediatr. Respir. Rev. 2010, 11, 39−45.
8. Empey, K.M.; Peebles, R.S., Jr.; Kolls, J.K. Pharmacologic advances in the treatment and prevention of respiratory syncytial virus. Clin. Infect. Dis. 2010, 50, 1258−1267.
9. Khomenko, T.M.; Zarubaev, V.V.; Orshanskaya, I.R.; Kadyrova, R.A.; Sannikova, V.A.; Korchagina, D.V.; Volcho, K.P.; Salakhutdinov, N.F. Anti-influenza activity of monoterpene-containing substituted coumarins. Bioorg. Med. Chem. Lett. 2017, 27, 2920–2925.
10. Khomenko, T.; Zakharenko, A.; Odarchenko, T.; Arabshahi, H.J.; Sannikova, V.; Zakharova, O.; Korchagina, D.; Reynisson, J.; Volcho, K.; Salakhutdinov, N.; Lavrik, O. New inhibitors of tyrosyl-DNA phosphodiesterase I (Tdp 1) combining 7-hydroxycoumarin and monoterpenoid moieties. Bioorg. Med. Chem. 2016, 24, 5573.
| название | год | авторы | номер документа |
|---|---|---|---|
| Производные 7-гидроксикумарина, соединенные с остатками монотерпенов через триазольный линкер, как ингибиторы репродукции респираторно-синцитиального вируса (РСВ) | 2024 |
|
RU2826560C1 |
| Средство для ингибирования фермента тирозил-ДНК-фосфодиэстеразы 1 человека на основе фенилкумаринов, сенсибилизирующее опухоли к действию противоопухолевых агентов | 2019 |
|
RU2724878C1 |
| СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ ФЕРМЕНТА ТИРОЗИЛ-ДНК-ФОСФОДИЭСТЕРАЗЫ 1 ЧЕЛОВЕКА | 2015 |
|
RU2612875C1 |
| 3-ЗАМЕЩЕННЫЕ 6-(МЕТОКСИКАРБОНИЛ)УМБЕЛЛИФЕРОНЫ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГРИППА A/Н1N1 | 2024 |
|
RU2838462C1 |
| Новые азолы, содержащие монотерпеновые фрагменты, в качестве противогрибковых агентов широкого спектра действия | 2023 |
|
RU2806368C1 |
| 2-(1,2,3-ТРИАЗОЛИЛ)ЗАМЕЩЕННЫЕ ЛИНЕЙНЫЕ ФУРОКУМАРИНЫ, ОБЛАДАЮЩИЕ АНТИВИРУСНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГРИППА A/Н1N1 | 2024 |
|
RU2841063C1 |
| Амиды, сочетающие адамантановый и монотерпеновый фрагменты, используемые в качестве ингибиторов ортопоксвирусов | 2019 |
|
RU2712135C1 |
| Четвертичные аммонийные соли диазаадамантанов, обладающие актопротекторной активностью | 2021 |
|
RU2760459C1 |
| Хиральные γ-кетосульфонильные производные пинановой структуры и способ их получения | 2021 |
|
RU2780452C1 |
| Хиральные трифторметилированные монотерпеновые тиоацетаты и тиолы на основе миртеналя | 2020 |
|
RU2743302C1 |
Изобретение относится к применению производных 7-гидроксикумарина общей формулы 1 и 2, включая их пространственные изомеры, в том числе оптически активные формы:
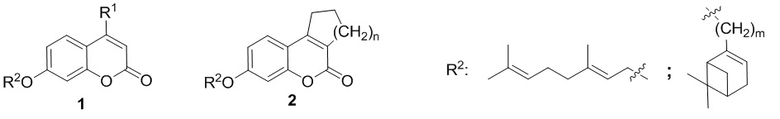
где R1 может быть Н или CH3, n=1 или 2, m может быть от 1 до 4, в качестве ингибиторов репродукции респираторно-синцитиального вируса. Технический результат: эффективное ингибирование репродукции респираторно-синцитиального вируса соединениями формулы 1 и 2. 2 ил., 1 табл., 16 пр.
Применение производных 7-гидроксикумарина общей формулы 1 и 2, включая их пространственные изомеры, в том числе оптически активные формы:
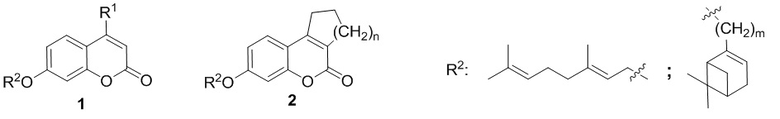
где R1 может быть Н или CH3, n=1 или 2, m может быть от 1 до 4, в качестве ингибиторов репродукции респираторно-синцитиального вируса.
| WO 2013068769 A1, 16.05.2013 | |||
| WO 2015069939 A1, 14.05.2015 | |||
| НОВЫЕ СОСТАВЫ 2-(ИМИДАЗОЛ-4-ИЛ)-ЭТАНАМИДА ПЕНТАНДИОВОЙ-1,5 КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ВИРУСНЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2745265C2 |
| T.M | |||
| Khomenko et al | |||
| "Anti-influenza activity of monoterpene-containing substituted coumarins", Bioorganic & Medicinal Chemistry Letters, 2017 vol.27, pp | |||
| Способ изготовления электрических нагревательных приборов | 1924 |
|
SU2920A1 |
| СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ ФЕРМЕНТА ТИРОЗИЛ-ДНК-ФОСФОДИЭСТЕРАЗЫ 1 ЧЕЛОВЕКА | 2015 |
|
RU2612875C1 |
Авторы
Даты
2023-01-09—Публикация
2022-03-21—Подача