Изобретение относится к области удовлетворения жизненных потребностей человека, может быть использовано в медицине и ветеринарии для лизиса (растворения) образовавшихся в кровеносных сосудах сгустков крови (далее по тексту тромбов), нарушающих нормальную циркуляцию (крови) и угрожающих жизни, предотвращения (профилактики) образования тромбов.
Известен препарат фибринолизин [1]. Недостатком [1] является происходящее при внутривенном введении препарата неконтролируемое резонансное усиление функции свертывающей системы, угрожающее образованием новых тромбов в кровеносных сосудах [2]. Кроме того, он часто вызывает весьма нежелательную аллергическую и пирогенную реакцию.
Известен препарат урокиназа [3]. Недостатком [3] являются многочисленные осложнения, выражающиеся в возникновении кровотечений, обусловленных повышением в крови продуктов деградации фибрина. Кроме того, при использовании урокиназы системно снижается концентрация фибриногена и других факторов свертывания. Недостатки [3] приводят к угрожающему для жизни живого организма нарушению коагуляционного звена системы гемостаза.
Известен тромболитический фармацевтический препарат стафилокиназа [4]. Недостатком [4] является то, что рассасывание тромба (сгустка крови), например, образовавшегося в кровеносном сосуде и нарушившего кровообращение, происходит весьма замедленно вследствие крайне медленной активации плазминогена под ее (стафилокиназы) воздействием [5]. Весьма замедленное лечебное действие препарата приводит к существенным нарушениям кровоснабжения живых тканей и органов, вплоть до их отмирания с угрозой жизни живого организма.
Известен препарат тканевый активатор плазминогена [6]. Недостатком [6] является быстрое выведение препарата из циркуляции в кровеносной системе. В связи с этим необходима длительная обработка пациента системным введением активатора, что стимулирует фибринолитическую систему, результатом чего являются опасные кровотечения из-за разрушения фибриногена, нарушающие жизнедеятельность органов, например головного мозга, и сопровождающиеся неврологической симптоматикой. Кроме того, наличие у больных сопутствующих сердечно-легочных заболеваний ограничивает область применения [6] из-за отрицательного влияния препарата так, что введение и увеличение его (препарата) дозы чревато непредсказуемыми тяжелыми геморрагическими осложнениями [7] с возникновением угрозы жизни живого организма.
Наиболее близким по существу заявляемого изобретения, прототипом, является тромболитический препарат стрептокиназа [8]. Недостатком прототипа является отсутствие специфического сродства к фибрину. Поэтому при индивидуальной потребности в высоких дозах, необходимых для достижения терапевтического эффекта, препарат превращает плазминоген в плазмин не только на тромбе, но и в циркуляции. С этим связаны его значительные побочные эффекты на состояние гемостаза, такие как разрушение фибриногена, истощение плазминогена и альфа-2-антиплазмина, выражающиеся в истощении свертывающей системы крови и возникающих вследствие этого неконтролируемых кровотечений. Другим недостатком стрептокиназы является ее (стрептокиназы) возможная нейтрализация при неконтролируемом наличии в организме антител к стрептококку [9].
Целью предлагаемого изобретения является повышение эффективности лизиса (растворения) тромба, ускорение процесса тромболизиса без побочных негативных явлений, профилактика образования тромбов в кровеносной системе организмов, повышение результативности и качества лечения.
Цели достигают тем, что применяют продукт жизнедеятельности рекомбинантного штамма Bacillus subtilis ТВ-06 [10] - глутамилэндопептидазу, вещество с тромболитическими и антикоагулянтными свойствами. Продукт жизнедеятельности штамма применяют для лизиса (растворения) образовавшихся тромбов (сгустков крови) в кровеносной системе организмов. Продукт жизнедеятельности штамма применяют для предупреждения образования тромбов (сгустков крови) в кровеносной системе организмов.
Заявляемое изобретение осуществляют, например, следующим путем.
1. Создают рекомбинантную глутамилэндопептидазу. Для этого:
1.1. Создают рекомбинантный штамм Bacillus subtilis ТВ-06.
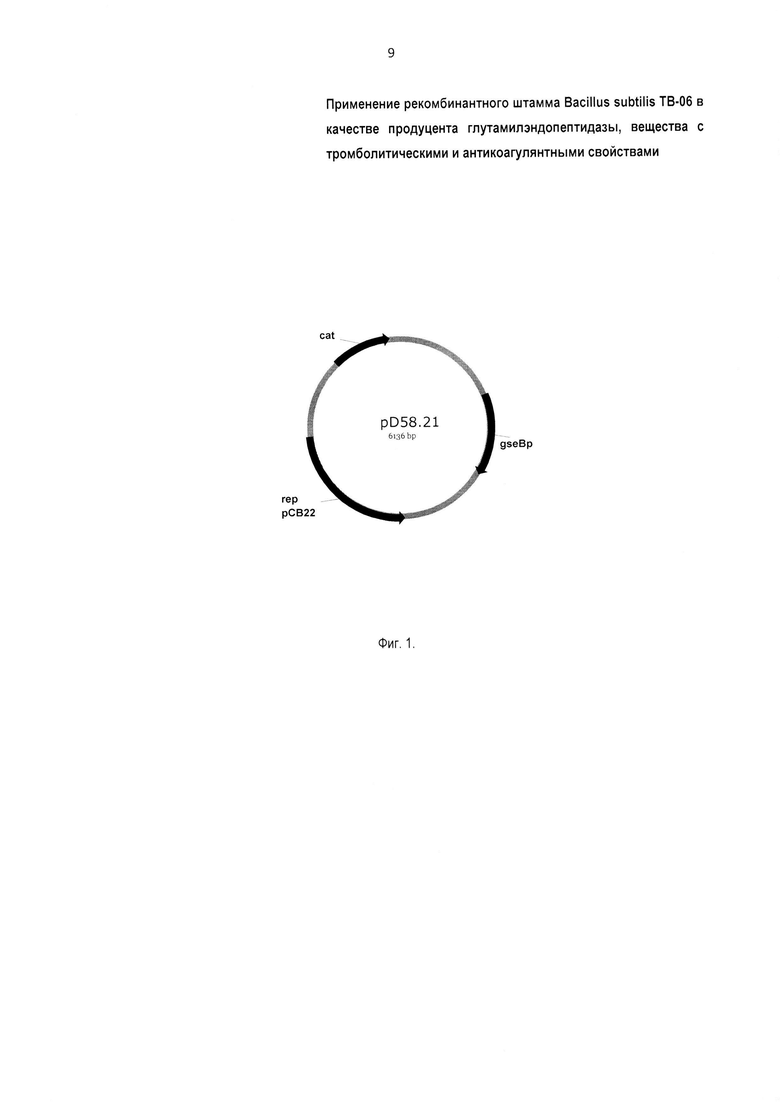
1.1.1. Известным способом [11] конструируют мультикопийную плазмиду Δ58.21 (Фиг. 1, где показана мультикопийная плазмида Δ58.21 с геном глутамилэндопептидазы Bacillus pumilus, в которой gseBp - ген глутамилэндопептидазы Bacillus pumilus; rep рСВ22 - ориджин репликации (точка начала удвоения ДНК) для бацилл; cat - ген устойчивости к хлорамфениколу), содержащую вставку, например, размером 2,6 тысяч пар азотистых оснований, с геном глутамилэндопептидазы Bacillus pumilus под контролем собственных регуляторных элементов. Регуляторный элемент [12] - это участок ДНК или РНК, регулирующий работу генов, находящихся на той же молекуле (ДНК или РНК). Выполняют трансформацию клеток Bacillus subtilis BG2036 плазмидной ДНК [13]. Для этого в штамм Bacillus subtilis BG2036 помещают полученную мультикопийную плазмиду Δ58.21 с геном глутамилэндопептидазы Bacillus pumilus (Фиг. 1). В результате трансформации получают рекомбинантный штамм Bacillus subtilis ТВ-06 [10].
1.1.2. Полученный рекомбинантный штамм Bacillus subtilis ТВ-06 культивируют в питательной среде, например, состава: пептон (1,70%); дрожжевой экстракт (0,50%); желатин (1,00%); CaCl2*2H2O (0,01%); MgSO4*7H2O (0,05%); NaCl (0,30%); MnSO4 (0,01%); NH4Cl (0,01%); Na2HPO4 (0,04%); остальное - вода дистиллированная, рН 8,5. В питательную среду для рекомбинантного штамма Bacillus subtilis ТВ-06 добавляют хлорамфеникол в концентрации 20 мкг/мл. Культивирование проводят при атмосферном давлении, на лабораторных качалках BIOSAN, при температуре от плюс 25 до плюс 35°С, с интенсивностью качания 200 об/мин.
1.2. Из культуральной жидкости рекомбинантного штамма Bacillus subtilis ТВ-06 выделяют и очищают заявляемый фермент глутамилэндопептидазу методом ионообменной хроматографии с использованием КМ-целлюлозы [14] и в системе FPLC на колонке Mono S [15]. Заявляемое вещество - полученный и очищенный фермент глутамилэндопептидазу упаковывают и хранят, например, при температуре не выше плюс 4°С, применяют по назначению, например в качестве тромболитического препарата. Неоднократная заморозка/разморозка вещества понижают активность препарата.
Далее согласно «Паспорту штамма микроорганизма» приведены основные характеристики и сведения о гарантированном неоднократном воспроизведении созданного рекомбинантного штамма Bacillus subtilis ТВ-06 [10]:
- Родовое и видовое название культуры: Bacillus subtilis, Семейство: Bacillaceae;
- Номер или наименование штамма: Bacillus subtilis ТВ-06;
- Область применения штамма: в биотехнологии как продуцент глутамилэндопептидазы, обладающей тромболитическими свойствами;
- Продукт, синтезируемый штаммом: внеклеточная сериновая протеиназа - глутамилэндопептидаза;
- Активность (продуктивность) штамма, другие производственные показатели: Активность глутамилэндопептидазы в культуральной жидкости составляет 0,1 мг/мл;
- Способ, условия и состав сред для длительного хранения штамма:
- длительное время хранения (до трех лет) - метод лиофилизации и замораживание культуры с 50% глицерином при минус 80°С. По мере необходимости хранимый штамм обновляют путем его культивирования;
- при хранении до года: 1,2 мл 0,7% агара с антибиотиком хлорамфениколом (20 мкг/мл) заливают в пробирки столбиком, посев делается уколом, после выращивания в течение суток при +37°С заливают сверху стерильным вазелиновым маслом (2 мл) и культуру хранят в темноте при комнатной температуре;
- Способ, условия и состав сред для размножения штамма: оптимальная температура роста +37°С. Среда: Лурия-Бертани (LB) (триптон - 1,0; дрожжевой экстракт - 0,5; NaCl - 0,5; рН 8,5) с антибиотиком хлорамфениколом в конечной концентрации 20 мкг/мл. Для создания твердой питательной среды дополнительно вносят 2% агар;
- Оптимальные условия и состав среды для ферментации: 1% глюкозы; 2% пептона; 0,05% MgSO4*7H2O; 0,01% CaCl2*2H2O; 0,01% MnSO4; 0,30% NaCl; 0,01% NH4Cl; 0,04% Na2HPO4; хлорамфеникол 20 мкг/мл; рН 8,5. Культивирование на вибростенде (2…3 с-1) при температуре 30+/-1°С. Соотношение среда в колбе:воздух равно 1:7,5.
2. Действие протеиназы на кровяные сгустки
Для определения тромболитических свойств протеиназы в чистую пробирку отбирают аликвоту (определенное количество) анализируемой крови, например - крыс. Кровь, например, в количестве 0,10 мл, смешивают с 0,05 мл раствора тромбина в концентрации 2,00 мг/мл в 0,14 М NaCl. Раствор выдерживают в течение 10 мин в водяном термостате при плюс 37°С и получают сгусток крови. Пробирку со сгустком крови закрывают ватной пробкой. Таким путем заготавливают несколько пробирок со сгустками крови.
К сгустку крови в отдельной пробирке добавляют (предварительно сняв ватную пробку) 0,50 мл раствора препарата заявляемого фермента - глутамилэндопептидазы в концентрации 0,10 мг/мл. Пробирку закрывают ватной пробкой. Сгусток с ферментом помещают в термостат, куда устанавливают контрольные пробирки со сгустками крови без фермента, но с добавкой NaCl в концентрации 0,14 М. Отмечают время полного лизиса (растворения) сгустков. Полноту лизиса определяют путем выливания содержимого пробирок с добавленным заявляемым ферментом и контрольных на бумажные фильтры. Полная, без остатков в виде сгустков крови, фильтрация содержимого пробирки через фильтр свидетельствует о полном лизисе сгустков. Наличие оставшихся на фильтре сгустков свидетельствует о неполноте растворения сгустков крови.
Вышеописанные действия с пробирками со сгустками крови выполняют поочередно, изменяя концентрацию заявляемого фермента, вливаемого в каждую отдельную пробирку со сгустком крови, доведя концентрацию фермента до 0,80 мг/мл.
Показано, что заявляемый фермент глутамилэндопептидаза в концентрации 0,2 и 0,4 мг/мл лизирует (растворяет) тромб за 16000 сек (266 мин) и 13000 сек (216 мин) соответственно. В этих же концентрациях прототип лизирует тромб за 18000 сек (300 мин) и 15200 сек (253 мин) соответственно, то есть за большее время (то есть, растворяя тромб действует медленнее).
Таким образом, доказано наличие у заявляемого фермента лизирующей (растворяющей) тромб способности, причем заявляемый фермент растворяет тромб быстрее прототипа, например - на 13% (1,126=18000 сек/16000сек) при концентрации фермента 0,2 мг/мл и на 17% (1,17=15200 сек/13000 сек) при концентрации фермента 0,4 мг/мл. Кроме того, полученные данные показывают, что исследуемая протеиназа (продуцируемая рекомбинантным штаммом Bacillus subtilis ТВ-06 глутамилэндопептидаза - вещество с тромболитическими и антикоагулянтными свойствами) обладает дозозависимой тромболитической активностью. При увеличении дозы глутамилэндопептидазы расщепление тромба происходит более интенсивно и эффективно. При этом не замечено влияния глутамилэндопептидазы на состояние свертывающей системы крови. При использовании глутамилэндопептидазы в качестве тромболитического средства сопровождающие применение препарата побочные явления, в том числе возникновение антител к бациллам, не наблюдается. При применении глутамилэндопептидазы в концентрации менее 0,6 мг/мл препарат нетоксичен для животных.
3. Антикоагулянтные свойства фермента
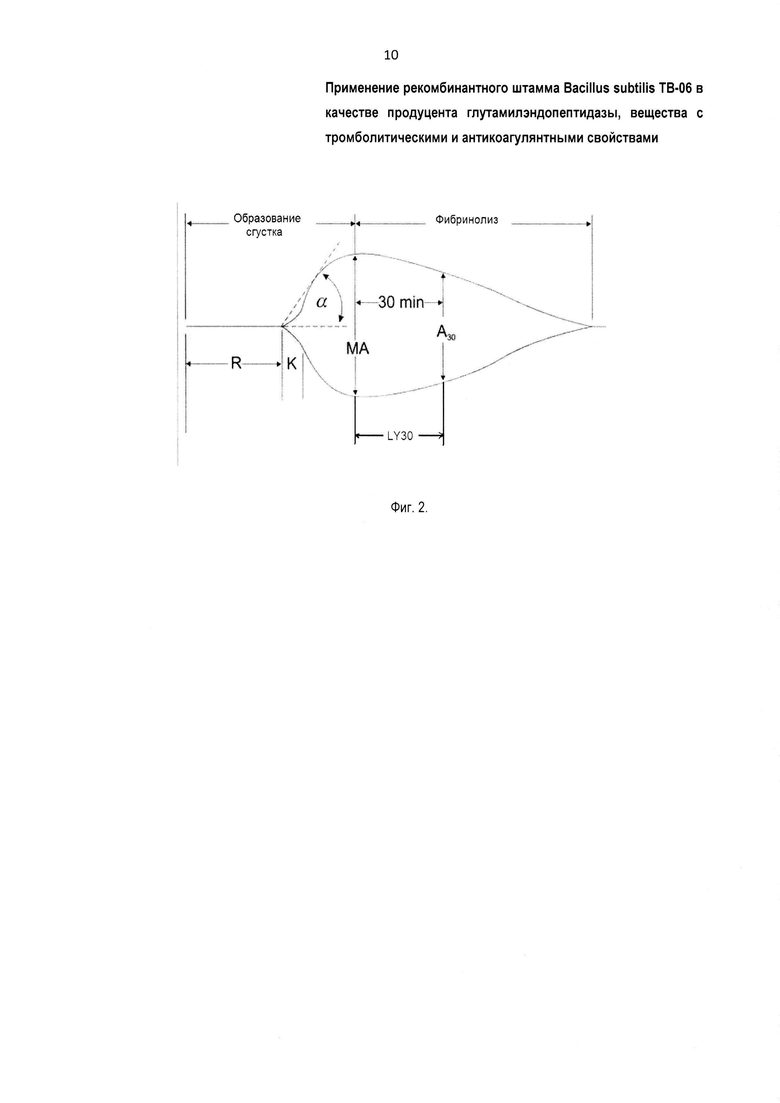
Способность заявляемого фермента предотвращать образование фибриновых сгустков, например, в профилактических целях исследуют с помощью тромбоэластографа (например, фирмы "Hellige", Австрия). Методика тромбоэластографии позволяет охарактеризовать весь процесс образования сгустка от момента выпадения первых нитей фибрина до стабилизации сгустка или его лизиса. Для этого в небольшую кювету помещают образец, кювету закрывают соприкасающейся с образцом крышечкой, подвешенной на тонкой чувствительной нити. Кювету заставляют совершать непрерывные попеременные вращательные движения по часовой и против часовой стрелки вокруг оси. Пока проба в кювете остается жидкой, вращение не передается на крышку. С момента, когда происходит образование первых нитей фибрина сгустка, начинается передача вращения с кюветы на крышку и, соответственно, на удерживающую крышку в подвешенном состоянии нить. С нити вращение регистрируется и для дальнейшей обработки передается на тромбоэластограф с самописцем. В зависимости от величины поступающего с прибора сигнала меняется амплитуда колебания пишущего пера самописца, рисующего картину, называемую тромбоэластограммой, Фиг. 2, где изображена обобщенная схема тромбоэластограммы при колебательном вращении кюветы. На Фиг. 2 показаны: по горизонтали - время, по вертикали - величина амплитуды колебаний крышки кюветы с пробой при колебательном вращении кюветы; R - время от момента постановки пробы до начала образования первых нитей фибрина (тромбообразования); K - время от начала образования первых нитей фибрина до достижения сгустком амплитуды 20 мм; α - угол касательной к кривой из точки начала времени образования сгустка; МА - максимальная амплитуда расхождения кривых на тромбоэластограмме; LY30 - процент, на который уменьшается величина (амплитуда) сгустка в течение 30 мин (min) после достижения MA; I - общий индекс коагуляции, 1=160×tg α. На картине (Фиг. 2) - тромбоэластограмме с некоторого момента наблюдается расхождение охватывающих картину кривых. Момент расхождения кривых соответствует началу образования фибриновых нитей и формированию сгустка. После завершения процесса формирования сгустка вращательные колебания кюветы в полной мере, без проскальзывания, передаются соприкасающейся с образцом крышке и далее в виде электрического сигнала - на тромбоэластограф с самописцем, а пишущее перо самописца рисует картину, где охватывающие кривые представляют прямую на Фиг. 2. В дальнейшем, например при растворении сгустка, перо самописца рисует картину, ограничиваемую сходящимися кривыми (Фиг. 2).
По тромбоэластограмме (Фиг. 2) выполняют расчет характеризующих процесс основных параметров: R - время от момента постановки пробы до начала образования первых нитей фибрина (тромбообразования); K - время от начала образования первых нитей фибрина до достижения сгустком амплитуды 20 мм; α - угол касательной к кривой из точки начала времени образования сгустка; МА - максимальная амплитуда расхождения кривых на тромбоэластограмме; LY30 - процент, на который уменьшается величина (амплитуда) сгустка в течение 30 мин (min) после достижения МА; I - общий индекс коагуляции. 1=160×tg α.
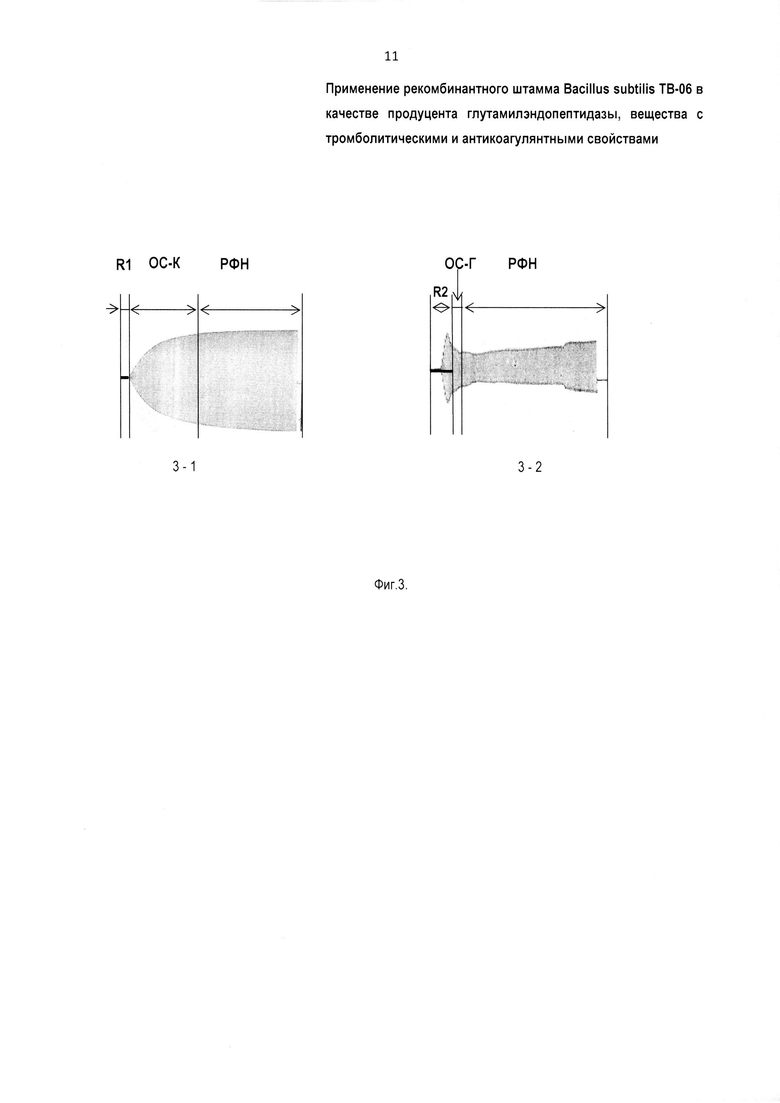
Для снятия тромбоэластограммы при применении глутамилэндопептидазы используют, например, плазму крови человека, титрованную цитратом натрия (3,8%) в соотношении 9:1. Аликвоту плазмы крови в пробирке, в количестве 0,20 мл, смешивают с 0,10 мл препарата заявляемого фермента (в концентрациях 0,20 и 0,40 мг/мл) и выдерживают в течение 10 мин при температуре плюс 22°С. Затем добавляют по 0,06 мл 1,3% раствора CaCl2, тем самым запускают коагуляционный каскад. В контрольные пробирки вместо белка добавляют 0,14 М NaCl. За процессом тромбообразования следят по кривой тромбоэластографа. При инкубации крови с заявляемым ферментом (глутамилэндопептидазой) сгусток не образуется. Это связано с тем, что добавленный к крови фермент разрушает компоненты гемостаза, в результате чего предотвращается образование сгустка. Полученные результаты подтверждают данные тромбоэластографии (Фиг. 3). На Фиг. 3 видно, что в пробе с глутамилэндопептидазой зона образования сгустка существенно (7-кратно) меньше, чем в контрольной пробе. Этот участок характеризует максимум динамических свойств соединения фибрина и тромбоцитов посредством факторов свертывания крови и отображает максимальную прочность сгустка. То есть в присутствии глутамилэндопептидазы сгусток крови не образуется.
На Фиг. 3 показаны тромбоэластограммы плазмы крови после инкубации ее с ферментом глутамилэндопептидаза: 3-1 - проба без фермента глутамилэндопептидаза (контроль), где ОС-К - Образование Сгустка в Контроле; 3-2 - проба с глутамилэндопептидазой, где ОС-Г - образование сгустка в присутствии Глутамилэндопептидазы; РФН - растворение фибриновых нитей; R - продолжительность времени от момента постановки пробы до начала образования первых нитей фибрина - тромбообразования, R1 - в контроле, R2 - с глутамилэндопептидазой, R1<R2.
В опытах с пробой без фермента (контроль) по истечении времени R1 начинается образование сгустка. По истечении времени ОС-К образование сгустка завершается и в дальнейшем масса крови остается в состоянии сгустка. Сгусток сохраняется во времени, то есть растворения фибриновых нитей не происходит. Это подтверждается тем, что на тромбоэластограмме (Фиг. 3-1) амплитуда вращательных колебательных движений крышки кюветы не уменьшается, вследствие того что движения кюветы (с пробой) крышке кюветы передаются без проскальзывания. В кровеносном сосуде такой сгусток был бы тромбом, нарушающим кровоток.
В опытах с пробой заявляемой глутамилэндопептидазы по истечении времени R2 также начинается образование сгустка, причем R1<R2. Затем по истечении времени ОС-Г образование сгустка прекращается. При этом ОС-К>ОС-Г. В дальнейшем начинается растворение фибриновых нитей, разрушение сгустка, массив сгустка крови разжижается, что на тромбоэластограмме (Фиг. 3-2) показывает уменьшение амплитуды колебательных движений крышки кюветы, соприкасающейся с образцом в кювете. То есть при наличии глутамилэндопептидазы в пробе начавшееся образование сгустка прекращается, образовавшийся сгусток разрушается. Это подтверждается тем, что на тромбоэластограмме (Фиг. 3-2) уменьшается амплитуда вращательных колебательных движений крышки кюветы, вследствие того что движения кюветы с пробой крышке кюветы передаются с проскальзыванием.
Таким образом, доказано, что в условиях in vitro глутамилэндопептидаза рекомбинантного штамма Bacillus subtilis ТВ-06 обладает антикоагулянтной активностью. То есть заявляемый фермент может быть основой медицинских препаратов для предотвращения тромбообразования, например для предотвращения закупорки кровеносных сосудов ног человека при тромбофлебите.
Как видно из приведенных данных, изобретение охватывает область создания и применения препаратов для ферментативного гидролиза образующих тромбы белков.
Проявленные и доказанные в опытах свойства предлагаемого изобретения показывают также его полезность для профилактики и/или лечения заболеваний людей в медицине и сельскохозяйственных животных в ветеринарии. Применение вещества с тромболитическими и антикоагулянтными свойствами, продуцентом которого является штамм Bacillus subtilis ТВ-06, способствует предупреждению тромбообразования в кровеносной системе, например, когда под влиянием внешних воздействий возникает или возрастает опасность образования тромбов. Возможность образования тромбов возрастает, например, при длительном пребывании на ногах работающего человека с нарушенной структурой кровеносных сосудов ног. В последующем образовавшиеся в венах тромбы могут сорваться, могут быть унесены кровотоком и занесены в сердце, что угрожает летальным исходом.
Уменьшение вероятности тромбообразования, профилактика тромбообразования путем применения продукта жизнедеятельности штамма Bacillus subtilis ТВ-06 или растворения образовавшегося тромба на ранних стадиях заболевания способствует предупреждению опасного заболевания или более раннему началу лечения, когда оно (лечение) наиболее эффективно, производится с меньшей затратой лечебных препаратов, труда и времени медицинских работников, с наименьшим ущербом для здоровья пациентов по сравнению с лечением болезней в поздней, запущенной стадии.
Предлагаемое изобретение удовлетворяет критериям новизны, так как при определении уровня техники не обнаружено средство, которому присущи признаки, идентичные (то есть совпадающие по исполняемой им функции и форме выполнения этих признаков) всем признакам, перечисленным в формуле изобретения, включая характеристику назначения.
Способ диагностики имеет изобретательский уровень, поскольку не выявлены технические решения, имеющие признаки, совпадающие с отличительными признаками данного изобретения, и не установлена известность влияния отличительных признаков на указанный технический результат.
Заявленное техническое решение можно реализовать в промышленном производстве лекарственных средств, в деятельности организаций здравоохранения, животноводства посредством использования известных стандартных технических устройств и оборудования. Это соответствует критерию «промышленная применимость», предъявляемому к изобретениям.
Источники информации
1. Патент RU №2458067, приоритеты: подача заявки: 17.05.2002; начало действия патента: 17.05.2002; публикация патента: 10.08.2012. Способ выделения плазминогена или плазмина в присутствии фибриногена из смеси // НУР Исраэль (IL), БАР Лилиана (IL), АЦАХИ Малкит (IL) / ОМРИКС БИОФАРМАСЬЮТИКАЛС С.А. (BE). Описание патента.
2. Barlow G.H. Report from the Subcommittee on Heparin. Thromb Haemost. 1979. - V. 41. - P. 625-627.
3. Патент RU №2259212, приоритеты: подача заявки: 15.03.2002; начало действия патента: 15.03.2002; публикация патента: 27.08.2005. Способ получения фармацевтически активных рекомбинантных белков // АРИНИ Акилле (СН), КОППОЛЕККИЯ Раффаэлла (СН), ПАГАНИ Франческа Паола (IT), ХЕРБСТ Детлев (СН), ТОНЬИНИ Антонио (СН) / СЕРБИОС-ФАРМА С.А. (СН). Описание патента.
4. Патент RU №2283863, приоритеты: подача заявки: 23.01.2001; начало действия патента: 23.01.2001; публикация патента: 20.09.2006. Рекомбинантное производное стафилокиназы, его получение и применение // СОНГ Хоуян (CN), СОНГ Ганг (CN) / ФУДАН ЮНИВЕРСИТИ (CN). Описание патента.
5. Марков В.А., Вышлов Е.В. Тромболитическая терапия при инфаркте миокарда. Томск.: STT, 2011. - С. 148.
6. Патент RU №2107727, приоритеты: подача заявки: 28.10.1988; публикация патента: 27.03.1998. Рекомбинантный тканевый активатор плазминогена и способ его получения // Ясуси Каваути (JP), Тосиюки Такемото (JP), Макото Такаяма (JP), Масами Екота (JP), Macao Като (JP), Кимио Катсута (JP), Хироси Гусима (JP) / Яманути Фармасьютикал Ко., Лтд. (JP)
7. Леонтьев С.Г., Чуриков Д.А. Стрептокиназа и тканевый активатор плазминогена в лечении массивной легочной эмболии. Что эффективнее? Флебология, 2001. - №13. - С. 24.
8. Патент RU №2127758, приоритеты: подача заявки: 03.04.1995; публикация патента: 20.03.1999. Способ получения рекомбинантной стрептокиназы // Хоуйан Сонг (CN) / Шангай Медикал Юниверсити (CN).
9. Buchalter М.В., Bourke J.P., Jennings К. The effect of thrombolytic therapy with anisoylated plasminogen streptokinase activator complex on the indicators of myocardial salvage. Drugs, 1987. - V. 33. - P. 209-215.
10. Справка о депонировании культуры Bacillus subtilis ТВ-06. Регистрационный номер ВКПМ: В-11978. Дата депонирования 10 декабря 2014 года.
11. Rebrikov D.V., Akimkina T.V., Shevelev А.В., Demiduyk I.V., Bushueva A.M., Kostrov S.V., Chestukhina G.G., Stepanov V.M. Molecular cloning and nucleotide sequence of Bacillus intermedius glutamylendopeptidase gene. J. Prot. Chem, 1999. - V. 18. - P. 21-26.
12. Wray G. A. The evolutionary significance of cis-regulatory mutations. Nature Reviews Genetics, 2007. - V. 8(3).-P. 206-216.
13. Yang M.Y., Ferrari E., Henner D. J. Cloning of the neutral protease gene of Bacillus subtilis and the use of the cloned gene to create an in vitro-derived deletion mutation. J. Bacteriol, 1984. - V. 160.-N. 1. - P. 15-21.
14. Фритц Дж., Гьертде Д., Поланд К. Ионная хроматография. М.: Мир, 1984. - С. 221.
15. Скоупс Р. Методы очистки белков. М.: Мир, 1985. - С. 358.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ РЕКОМБИНАНТНОГО ШТАММА BACILLUS SUBTILIS EO-11 ВКПМ В-11978 В КАЧЕСТВЕ ПРОДУЦЕНТА СУБТИЛИЗИНОПОДОБНОЙ ПРОТЕИНАЗЫ, ВЕЩЕСТВА С ТРОМБОЛИТИЧЕСКИМИ И АНТИКОАГУЛЯНТНЫМИ СВОЙСТВАМИ | 2015 |
|
RU2622006C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРА КОЛЛАГЕНАЗ С АНТИКОАГУЛЯНТНЫМ ДЕЙСТВИЕМ ИЗ ГЕПАТОПАНКРЕАСА КАМЧАТСКОГО КРАБА | 2009 |
|
RU2403284C1 |
| Способ иммобилизации фермента субтилизиноподобная протеиназа, продуцируемого штаммом бактерии рода Bacillus вида Bacillus sp. 7Р/3-19, на инструменте | 2017 |
|
RU2663128C1 |
| ИММОБИЛИЗИРОВАННЫЙ ПРОДУЦИРУЕМЫЙ БАКТЕРИЯМИ BACILLUS LICHENIFORMIS СУБТИЛИЗИН, ОБЛАДАЮЩИЙ ТРОМБОЛИТИЧЕСКИМ И АНТИКОАГУЛЯНТНЫМ СВОЙСТВАМИ | 2008 |
|
RU2416643C2 |
| СПОСОБ ПОЛУЧЕНИЯ АКТИВАТОРА ПЛАЗМИНОГЕНА | 2007 |
|
RU2346983C1 |
| Способ определения функционального фибриногена | 2017 |
|
RU2669796C1 |
| Способ выявления гепарина в крови | 2017 |
|
RU2662171C1 |
| СПОСОБ ОЦЕНКИ СОСТОЯНИЯ СВЕРТЫВАЮЩЕЙ СИСТЕМЫ КРОВИ У ПАЦИЕНТОВ, НАХОДЯЩИХСЯ В КРИТИЧЕСКОМ СОСТОЯНИИ | 2012 |
|
RU2517116C2 |
| Стабилизированная стрептокиназа,обладающая тромболитической активностью | 1979 |
|
SU822551A1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРЫХ ТРОМБОЗОВ ВЕН СЕТЧАТКИ | 2010 |
|
RU2416402C1 |
Изобретение относится к области медицины и ветеринарии. Предложено применение рекомбинантного штамма бактерий Bacillus subtilis ТВ-06 ВКПМ В-11978 в качестве продуцента глутамилэндопептидазы - вещества с тромболитическими и антикоагулянтными свойствами. Изобретение обеспечивает повышение эффективности лизиса (растворения) тромба, ускорение процесса тромболизиса без побочных негативных явлений, профилактику образования тромбов в кровеносной системе организмов и повышение результативности и качества лечения. 2 з.п. ф-лы, 3 ил.
1. Применение рекомбинантного штамма бактерий Bacillus subtilis ТВ-06 ВКПМ В-11978 в качестве продуцента глутамилэндопептидазы, вещества с тромболитическими и антикоагулянтными свойствами.
2. Применение штамма по п. 1 в качестве продуцента глутамилэндопептидазы, обеспечивающей лизис (растворение) образовавшихся тромбов (сгустков крови) в кровеносной системе организма.
3. Применение штамма по п. 1 в качестве продуцента глутамилэндопептидазы, обеспечивающей предупреждение (профилактику) образования тромбов в кровеносной системе организма.
| ДАНИЛОВА Ю.В | |||
| и др | |||
| Тромболитическая и фибринолитическая активность бактериальных протеаз | |||
| Клеточная трансплантология и тканевая инженерия | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| et al | |||
| Thrombolytic and fibrinolytic activity of bacterial proteases | |||
| Cellular Transplantation and Tissue Engineering | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| et al | |||
| Bacillus intermedius glutamyl endopeptidase | |||
| Molecular cloning and nucleotide sequence of the structural gene | |||
| J Protein Chem | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| и др | |||
| Сравнительная характеристика глутамилэндопептидазы Bacillus pumilus, секретируемой рекомбинантным штаммом Bacillus subtilis на разных фазах роста | |||
| Учен | |||
| зап | |||
| Казан | |||
| ун-та | |||
| Сер | |||
| Естеств | |||
| науки | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| - Т | |||
| Способ приготовления кирпичей для футеровки печей, служащих для получения сернистого натрия из серно-натриевой соли | 1921 |
|
SU154A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| - С | |||
| Устройство двукратного усилителя с катодными лампами | 1920 |
|
SU55A1 |
| Найдено из Интернет: URL: http://cyberleninka.ru/article/n/sravnitelnaya-harakteristika-glutamilendopeptidazy-bacillus-pumilus-sekretiruemoy-rekombinantnym-shtammom-bacillus-subtilis-naWO 9743910 A1, 27.11.1997. | |||
Авторы
Даты
2017-02-21—Публикация
2015-05-08—Подача