Изобретение относится к медицине, в частности к фармакологии и лекарственным средствам на основе ферментных препаратов, и может быть использовано для лечения и профилактики тромбозов, тромбофлебита, тромбоэмболии, тромбоэмболических осложнений и т.д. в комплексной терапии ишемической болезни сердца, ишемических инсультов мозга и других заболеваний, сопровождающихся явлениями тромбообразования, ишемии. Изобретение охватывает область создания и применения препаратов для ферментативного гидролиза белков, образующих тромб.
Известны средства, вызывающие лизис тромбов - тромболитики (http://hghltd.yandex.net/yandbtm?url=http%3A%2F%2Fhumbio.ru%2FHumbio2Fhar%2F0060c6e9.htm&text=%F2%F0%EE%EC%E1%EE%EB%E8%F2%E8%EA%E8%20%EF%EB%E0%E7%EC%E8%ED%EE%E3%E5%ED%20%EB%E8%E7%E8%F1%20%F2%F0%EE%EC%E1%E0). Одни тромболитики активируют тканевой плазминоген (алтеплаза, назаруплаза), другие оказывают непосредственные лизирующее действие на тромб (стрептокиназа, урокиназа). Применение тромболитиков может вызывать некоторые специфические осложнения. Так, у многих людей есть антистрептококковые антитела, которые реагируют со стрептокиназой, снижая ее активность и вызывая пирогенные реакции. Алтеплаза, назаруплаза и другие препараты, активирующие плазминоген, связанный с фибрином, всегда вызывают умеренный системный фибринолиз, что увеличивает риск развития кровотечения.
Известны средства, тормозящие свертывание крови - антикоагулянты (http://hghltd.yandex.net/yandbtm?url=http%3A%2F%2Fhumbio.ru%2Fhumbio%2Fhar%2F000753c2.htm&text=%E0%ED%F2%E8%EA%EE%E0%E3%F3%EB%FF%ED%F2%FB%20%EB%E5%EA%E0%F0%F1%F2%E2%E5%ED%ED%FB%E5%3A%20%EA%F0%E0%F2%EA%E8%E5%20%F1%E2%E5%E4%E5%ED%E8%FF; http://hghltd.yandex.net/yandbtm?url=http%3A%2F%2Fhumbio.ru%2Fhmbio%2Fhar%2F00075a46.htm&text=%E0%ED%F2%E8%EA%EE%E0%E3%F3%EB%FF%ED%F2%FB).
Антикоагулянты тормозят появление нитей фибрина, препятствуя тромбообразованию. Прямой антикоагулянт гепарин и непрямые антикоагулянты применяются при острых венозных тромбозах и тромбоэмболиях. Для применения гепарина имеется ряд противопоказаний, самыми важными из которых являются тяжелая артериальная гипертензия, цирроз печени, сопровождающийся варикозным расширением вен пищевода, почечная недостаточность (http://hghltd.yandex.net/yandbtm?url=http%3A%2F%2Fwww.rosmed.ru%2Fcatalog%2F67%2F2212.html&text=%E3%E5%EF%E0%F0%E8%ED%20%EE%F1%EB%EE%E6%ED%E5%ED%E8%FF%20%EF%F0%EE%F2%E8%E2%EE%EF%EE%EA%E0%E7%E0%ED%E8%FF). На фоне гепарин-индуцированной тромбоцитопении могут развиться некрозы кожи и артериальные тромбозы (<белые тромбы>), сопровождающиеся развитием гангрены, инфаркта миокарда, инсульта.
Антикоагулянты лишь препятствуют росту имеющихся тромбов и появлению новых, но не растворяют имеющиеся тромбы.
Известен патент РФ 2329053 на «Способ получения иммобилизованных физиологически активных веществ». Способ дает возможность получить полимерные производные антикоагулянтов крови с пониженной молекулярной массой. Осуществляют способ путем взаимодействия физиологически активного вещества (гепарина или гирудина) с сополимером N-акрилоилгидроксифталимида. Биологически активные вещества, полученные данным способом, обладают только антикоагулянтной активностью.
Известна фармацевтическая композиция, обладающая тромболитическими, противовоспалительными и цитопротективными свойствами (патент РФ 2213557, авторы: Артамонов А.В., Верещагин Е.И., Гришин О.В., Троицкий А.В.; опубл. 2003.10.10). Композиция содержит ферментный препарат, иммобилизированный с помощью ионизирующего излучения на полиэтиленоксиде и декстране, и буферную смесь. В качестве ферментного препарата она содержит протосубтилин марок Г3Х, Г10Х или Г20Х, который содержит комплекс нейтральных и щелочных протеаз, продуцируемых бактериями вида Bacillus subtilis. Композиция характеризуется следующим соотношением компонентов, мас.%: протосубтилин Г3Х, или Г10Х, или Г20Х - 0,5-5,0; полиэтиленоксид - 0,1-10,0; декстран - 1,0-10,0; буферная смесь - остальное.
Известен патент на изобретение US 7429377 «Therapeutic composition containing a plurality of immobilized proteases» авторов Артамонова A.B., Верещагина Е.И., Гришина О.В., Троицкого А.В. Водный раствор, содержащий множество активных протеаз и смесь водорастворимых полимеров, облучают ионизирующим излучением, в результате чего происходит одновременная иммобилизация протеаз на полиэтиленоксиде и декстране. Каждая из множества протеаз терапевтической композиции способна к селективной деградации тромбогенного белка. Протеазы микробиологического происхождения (протосубтилин) получены из Bacillus subtilis и включают субтилизины.
В обоих патентах (РФ 2213557, US 7429377) использованы два полимера для иммобилизации протеазы (полиэтиленоксид и декстран), что усложняет технологический процесс. Кроме того, технология получения иммобилизированного протосубтилина по данным патентам предусматривает включение буфера в исходную реакционная смесь, содержащую ферментный препарат и полимеры. Фармацевтические композиции по патентам РФ 2213557 и US 7429377 характеризуются низкой токсичностью (4-й класс - малоопасные вещества по ГОСТ 12.1.007-76). Указанная токсичность может быть уменьшена еще в большей степени использованием предлагаемого изобретения.
Раскрытие изобретения
Заявляемое изобретение представляет собой продуцируемый бактериями вида Bacillus licheniformis субтилизин, иммобилизированный на водорастворимом фармакологически приемлемом полимере и обладающий тромболитическим и/или антикоагулянтным свойствами.
Субтилизин по заявляемому изобретению иммобилизируют на водорастворимом фармакологически приемлемом полимере, в качестве которого может быть использован полиэтиленоксид (ПЭО) (син. полиэтиленгликоль), поливинилпирролидон, полиакриламид, декстран, плюроник и др.
Иммобилизацию продуцируемого бактериями Bacillus licheniformis субтилизина на фармакологически приемлемом полимере осуществляют путем воздействия ионизирующим излучением на водный раствор, содержащий указанный субтилизин и фармакологически приемлемый полимер. В качестве ионизирующего излучения используют гамма-излучение или поток ускоренных электронов, или ультрафиолетовое излучение.
Фармакологически приемлемый полимер используют, преимущественно, в концентрации, превышающей 10%, а реакционную смесь (полимер с субтилизином) перед облучением, предпочтительно, замораживают до температуры (-20)-(-140)°C для увеличения сохранности субтилизина от разрушения ионизирующим излучением.
Обладающий тромболитическим и/или антикоагулянтным эффектами продуцируемый Bacillus licheniformis иммобилизированный на фармакологически приемлемом полимере субтилизин может быть выбран из нижеуказанной группы, хотя последняя не ограничивает круг возможных вариантов заявляемого средства: алкалаза 2,4 Л ФГ, иммобилизированная на ПЭО; субтилизин Карлсберг, иммобилизированный на ПЭО; алкалаза 2,4 Л ФГ, иммобилизированная на поливинилпирролидоне; субтилизин Карлсберг, иммобилизированный на поливинилпирролидоне; алкалаза 2,4 Л ФГ, иммобилизированная на полиакриламиде; субтилизин Карлсберг, иммобилизированный на полиакриламиде; алкалаза 2,4 Л ФГ, иммобилизированная на плюронике; субтилизин Карлсберг, иммобилизированный на плюронике; алкалаза 2,4 Л ФГ, иммобилизированная на декстране; субтилизин Карлсберг, иммобилизированный на декстране.
Иммобилизированный продуцируемый Bacillus licheniformis субтилизин гидролизует белки тромбов, в частности фибрин, структурообразующий белок тромбов, оказывая тромболитическое действие. Его тромболитический эффект важен для коррекции патологических изменений в органах и тканях, возникших в результате тромбообразования и ишемии. Благодаря антикоагулянтному свойству предлагаемый препарат тормозит появление фибрина, препятствует тромбообразованию, способствует прекращению роста уже возникших тромбов, что важно для профилактики и лечения тромбоэмболических осложнений.
Предлагаемый иммобилизированный продуцируемый Bacillus liheniformis субтилизин может использоваться в жидкой или твердой форме (лиофилизированные порошки) в зависимости от того, в какой области планируется использование соединения - для приема внутрь, для парентерального применения, для наружного применения.
Заявляемое средство характеризуется следующими преимуществами по сравнению с известными из уровня техники средствами того же действия:
- оказывает непосредственное лизирующее действие на тромб, как, например, стрептокиназа. Но на стрептокиназу у многих людей есть антитела, которые снижают ее активность и вызывают пирогенные реакции. Предлагаемый препарат не обладает аллергогенным и иммунотоксическим действием, антитела на него не образуются, он не вызывает пирогенных реакций;
- вызывает растворение не только фибрина, но и клеточного детрита в тромбах;
- алтеплаза, назаруплаза и другие тромболитики, активирующие плазминоген, связанный с фибрином, всегда вызывают умеренный системный фибринолиз. Предлагаемый препарат лизирует фибрин, но не фибриноген, поэтому не вызывает кровотечения;
- по сравнению с гепарином, применение которого противопоказано при артериальной гипертензии, циррозе печени, сопровождающемся варикозным расширением вен пищевода, почечной недостаточности, предлагаемый препарат не имеет данных противопоказаний. На фоне гепарин-индуцированной тромбоцитопении могут развиться некрозы кожи и артериальные тромбозы (<белые тромбы>), сопровождающиеся развитием гангрены, инфаркта миокарда, инсульта. Предлагаемый препарат не вызывает таких побочных действий;
- в отличие от фармацевтических композиций по патентам РФ 2213557 и US 7429377, для получения которых в реакционную смесь вводится 4 компонента (ферментный препарат, два полимера - полиэтиленоксид и декстран, буфер), при получении предлагаемого средства в реакционную смесь вводится 2 компонента (ферментный препарат и полимер);
- по сравнению с фармацевтическими композициями, описанными в патентах РФ 2213557 и US 7429377, предлагаемый препарат характеризуется существенно меньшей токсичностью.
Получение иммобилизироеанного продуцируемого бактериями вида Bacillus licheniformis субтилизина. Подтверждение наличия у иммобилизироеанного субтилизина протеолитической активности
В качестве продуцируемого бактериями вида Bacillus liheniformis субтилизина (субтилизин - сериновая эндопептидаза; синонимы: Alcalase, Alcalase 0.6L, Alcalase 2.5L, ALK-enzyme, Alkaline mesentericopeptidase, Alkaline protease и др., ЕС-номер 3.4.21.62) использовали препарат алкалазы 2,4 Л ФГ. Алкалаза 2,4 Л ФГ (Alcalase 2,4 L FG) (http://fp.crc.ru/gosregfr/?pg=177&oper=s&rpp=25&type=min&pril=on&pdk=on&text=%EA%EE%EB%E8%F4%EE%F0%EC%FB, порядковый номер 4406; «Improvement of lipid and phospholipid recoveries from sardine (Sardina pilchardus) viscera using industrial proteases» /J.Dumay, C.Donnay-Moreno, Barnathan, P.Jaouen and J.P.Bergé/ Process Biochemistry, Vol.41, Issue 11, Nov. 2006, Pages 2327-2332, http.//dx.doi.org/10.1016/j.procbio.2006.04.005) - субтилизин, получаемый глубинной ферментацией бактерий вида Bacillus liheniformis. Основным ферментным компонентом алкалазы 2,4 Л ФГ является субтилизин Карлсберг (субтилизин Carlsberg, http://www.brenda-enzymes.org/php/result_flat.php4?ecno=3.4.21.62).
Тромболитическое и антикоагулянтное свойства заявляемого иммобилизированного продуцируемого бактериями Bacillus licheniformis субтилизина изучали параллельно со свойствами продуцируемого бактериями вида Bacillus subtilis очищенного иммобилизированного протосубтилина (протосубтилина Г20Х). Иммобилизированный протосубтилин Г20Х получали тем же описанным ниже способом, что и предлагаемое средство.
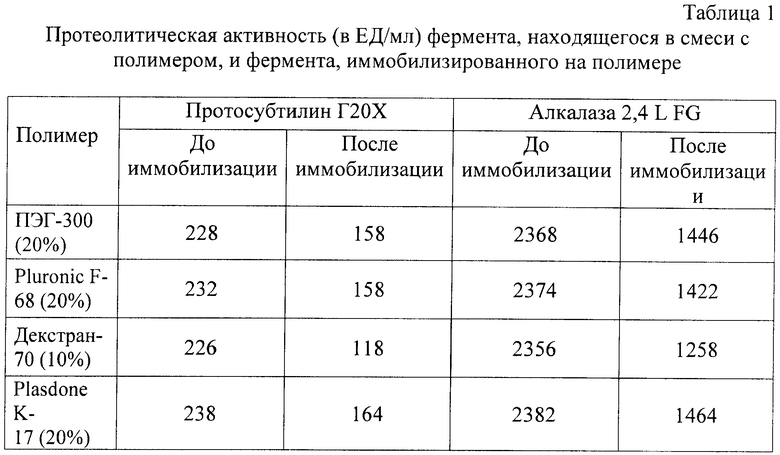
Готовили 2 серии проб. В первой серии по 5 мл концентрированной алкалазы 2,4 Л ФГ (производство «Novozymes А/S») добавляли в емкости, содержащие по 45 мл следующих растворов: 20%-й раствор полиэтиленоксида с молекулярной массой 300 Да, 20%-й раствор Pluronic F-68, 10%-й раствор декстрана с молекулярной массой 70 кДа, 20%-й раствор Plasdone К-17 (табл.1).
Во второй серии по 5 г протосубтилина Г20Х добавляли в емкости, содержащие по 45 мл таких же растворов (20%-й раствор полиэтиленоксида с молекулярной массой 300 Да, 20%-й раствор Pluronic F-68, 10%-й раствор декстрана с молекулярной массой 70 кДа, 20%-й раствор Plasdone К-17) (табл.1).
Измеряли протеолитическую активность ферментов в полученных смесях по гидролизу 1% раствора казеината натрия (табл.1).
После этого проводили иммобилизацию ферментов на полимерных носителях путем облучения растворов потоком ускоренных электронов в дозе 1,5 Мрад. Измеряли протеолитическую активность иммобилизированных ферментов по гидролизу 1% раствора казеината натрия. Результаты измерений представлены в табл.1. Как видно из данной таблицы, после иммобилизации на различных полимерах субтилизины сохраняют протеолитическую активность.
Сведения, подтверждающие антикоагулянтное и тромболитическое свойства продуцируемого бактериями вида Bacillus liheniformis иммобилизированного субтилизина
Алкалаза 2,4 Л ФГ и протосубтилин Г20Х были иммобилизированы на полиэтиленоксиде с молекулярной массой 1500 Да. Оба препарата были исследованы в пробах с активностью 5, 10, 20 и 40 ЕД/мл дистиллированной воды.
Для изучения антикоагулянтного и тромболитического свойств иммобилизованных субтилизинов использовали лиофилизированный фибрин-мономер, компонент набора «ТехФактор ХIII-тест» (производитель - ООО «Технология-Стандарт»), серия Б31122. Фибрин-мономер разводится в 1 мл 0,02% раствора уксусной кислоты. Приготовленный раствор содержит фибрин-мономер в концентрации 3,0 г/л и 15% мочевину. В экспериментах использовали трис-HCl буфер 0,1 М, pH 7,4 (производитель - ООО «Технология-Стандарт»), серия Б50112, а также термостат для исследования гемокоагуляции (ТПС).
Пример 1. Антикоагулянтное свойство иммобилизированных субтилизинов
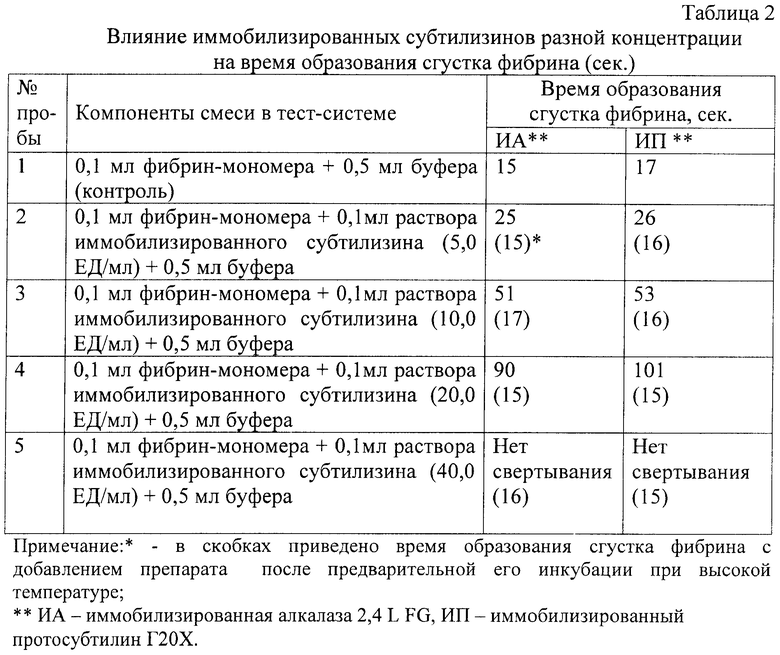
Антикоагулянтное действие препаратов исследовали по торможению полимеризации фибрин-мономера.
Для исключения влияния низкомолекулярных примесей, входящих в состав препаратов иммобилизованных субтилизинов, ферменты инактивировались прогреванием при температуре +100°С на водяной бане в течение 10 минут. Оценка антикоагулянтной активности проводилась в растворах как исходных препаратов, так и после их прогревания.
Изучали время образования сгустка фибрина в смеси фибрин-мономера, буфера и исследуемой концентрации препарата. Все исследования выполнялись при температуре 37°С.
Полученные результаты, приведенные в табл.2, подтверждают наличие антикоагулянтной активности у препаратов иммобилизированных субтилизинов. Это антикоагулянтное действие происходит вследствие дозозависимого торможения процессов полимеризации фибрина. Подтверждением присущего препаратам антикоагулянтного действия явилось исчезновение данного эффекта после инактивации иммобилизированных субтилизинов прогреванием при температуре +100°С.
Пример 2. Исследование тромболитического действия иммобилизированных субтилизинов
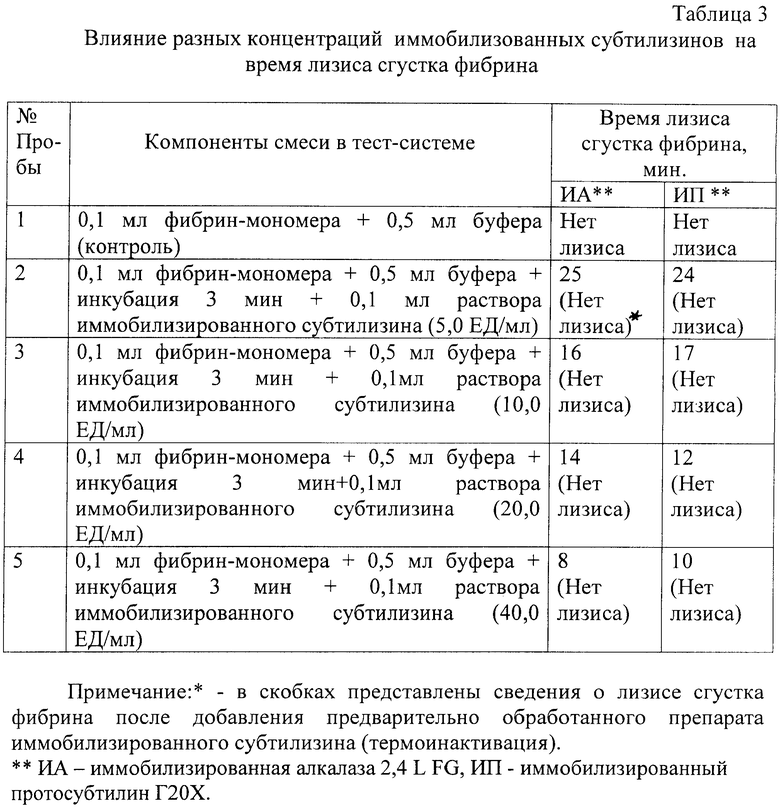
Изучалась способность препаратов иммобилизированных субтилизинов вызывать лизис сгустка фибрина, полученного из очищенного фибрин-мономера. Особенностью полученного таким способом фибрина является отсутствие в нем примесей других белков плазмы, в том числе плазминогена, его активаторов, а также стабилизирующего фибрин фактора ХIIIа.
Изучали время индуцирования препаратами иммобилизированных субтилизинов лизиса фибрина после формирования плотного сгустка из фибрин-мономера. Все исследования по растворению фибринового сгустка выполняли при температуре 37°С.
Полученные результаты, приведенные в табл.3, подтверждают наличие тромболитического действия препаратов иммобилизованных субтилизинов. С увеличением концентрации препарата в тестируемой смеси уменьшается время, необходимое для растворения сгустка фибрина в исследуемой тест-системе. Кроме того, эта фибринолитическая активность не выявляется после денатурации белков прогреванием на водяной бане при температуре +100°С.
Пример 3. Сравнительное изучение острой токсичности иммобилизированных субтилизинов
Исследования проведены в соответствии с методическими указаниями по изучению общетоксического действия фармакологических веществ («Руководство по экспериментальному /доклиническому/ изучению новых фармакологических веществ». М., 2000 г.; «Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ» / Под общей редакцией член-корр. РАМН, проф. Р.У.Хабриева. - 2-е изд., перераб. и доп. - М.: ОАО Издательство «Медицина», 2005. С.18-24).
Эксперименты поставлены на половозрелых неинбредных мышах и крысах. Содержание их осуществлялось в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных (Страсбург, 1986; Регламентирующий документ на содержание животных: «Лабораторные животные». - Москва, 2003).
Полученные при исследовании цифровые данные обрабатывали математически методом вариационной статистики с применением критерия Стьюдента и Вилкоксона-Манна-Уитни. Вычисляли среднее арифметическое значение исследуемого параметра (X) и его стандартную ошибку (±m).
3.1. Иммобилизированный продуцируемый бактериями Bacillus subtilis протосубтилин Г20Х. Данный препарат был получен способом, изложенным в патенте РФ 2213557.
В эксперименте использованы мыши, исходной массой 20-30 г (42 животных), и крысы (17 самцов и 17 самок), исходной массой 200-250 г.
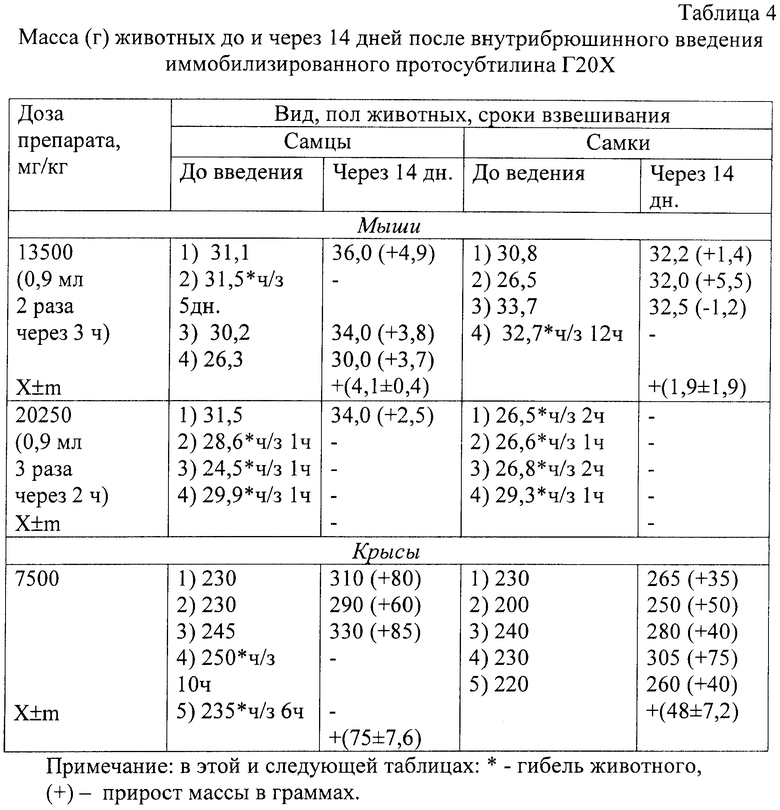
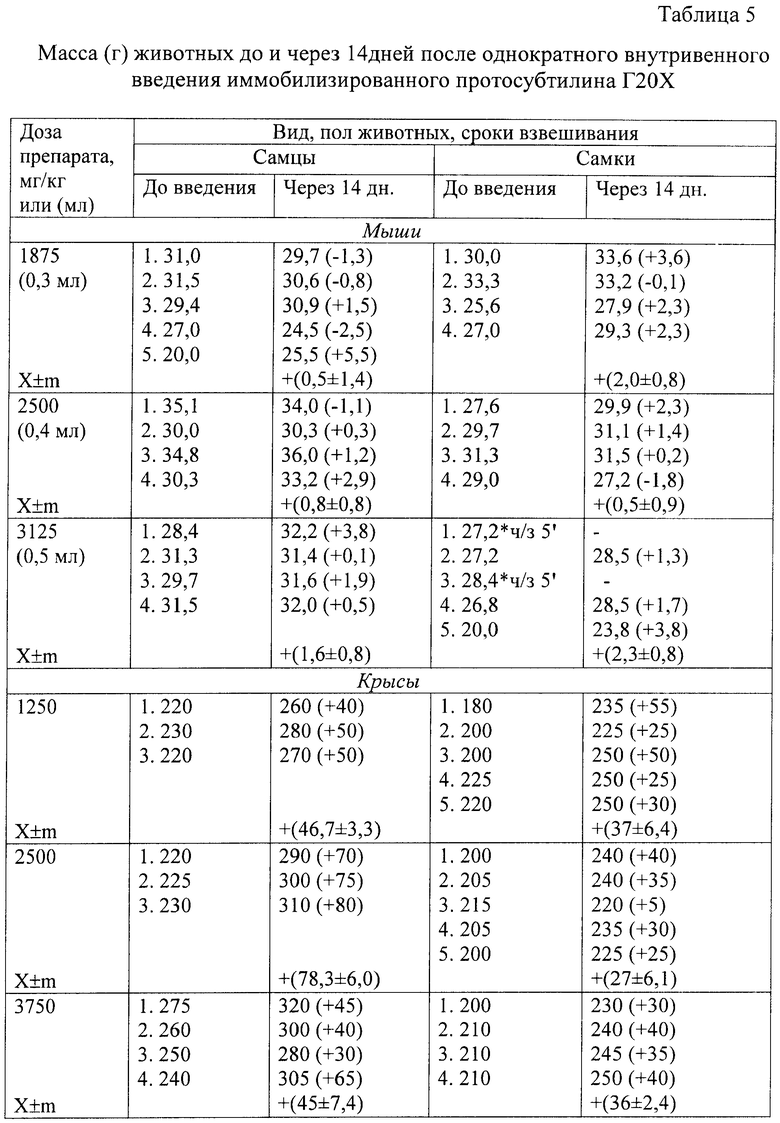
Перед введением (однократно внутривенно или внутрибрюшинно) содержимое одного флакона (200-240 ЕД или 1500 мг лекарственного средства) растворяли в физиологическом растворе до различной концентрации в разных разведениях. Наблюдение за животными осуществляли в течение 2-х недель. Следили за поведением, внешним видом, двигательной активностью, реакцией животных на внешние раздражители, общей массой (до и через 14 дней после введения) (табл.4 и 5).
Мышам (по 4-5 ♀ и ♂ на дозу) препарат (в 1 мл 20 ЕД, 150 мг лекарственного средства) вводили внутрибрюшинно в дозе 0,9 мл (18 ЕД или 135 мг/ на 20 г массы тела мыши, или 6750 мг/кг) двукратно через 3 ч (13500 мг/кг) и трехкратно через 2 ч (20250 мг/кг), а внутривенно препарат (в 1 мл 20 ЕД, 125 мг лекарственного средства) вводили в течение 10-20 с однократно - в дозах 0,3; 0,4 и 0,5 мл (6, 8, 10 ЕД или 37,5; 50,0 и 62,5 мг / на 20 г массы тела мыши или 1875, 2500 и 3125 мг/кг).
Крысам (по 3-5 ♀ и ♂ на дозу) препарат (в 1 мл 40 ЕД, 300 мг лекарственного средства) вводили внутрибрюшинно в дозе 7500 мг/кг (100 ЕД на 100 г общей массы крысы) в максимально допустимом объеме (5 мл); внутривенно препарат вводили в течение 10-20 с в дозе 1250, 2500, и 3750 мг/кг (20, 40 и 60 ЕД на 100 г общей массы крысы) в максимально допустимом объеме 2 мл.
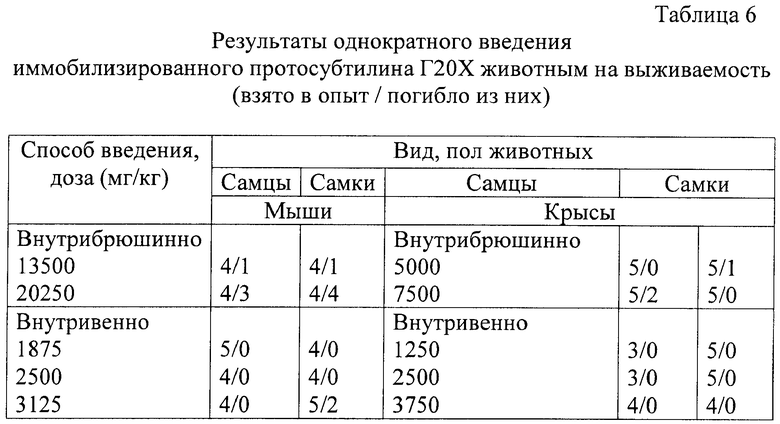
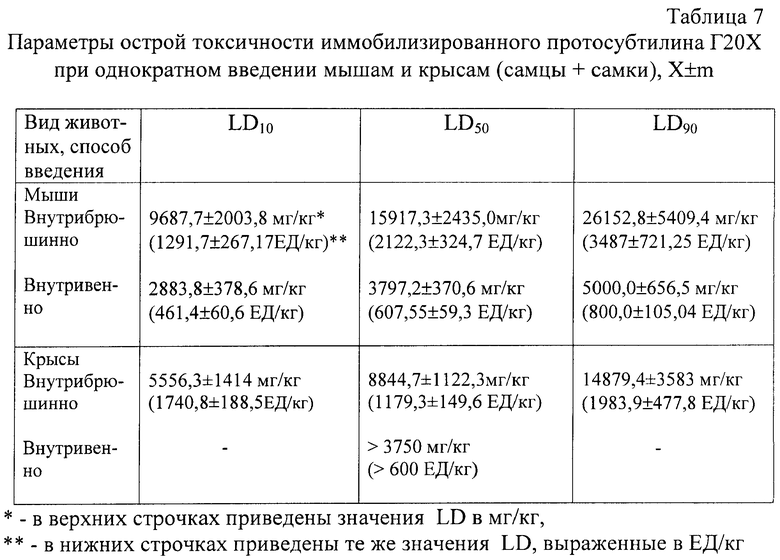
Результаты эксперимента позволили установить параметры острой токсичности иммобилизированного протосубтилина Г20Х для мышей и крыс (табл.6 и 7) при внутрибрюшинном и внутривенном его введении с использованием метода Литчфилда и Вилкоксона.
Таким образом, на основании анализа величин параметров острой токсичности иммобилизированный протосубтилин Г20Х можно отнести согласно ГОСТ 12.1.007-76 к 4-му классу (малоопасные вещества).
3.2. Иммобилизированный продуцируемый бактериями Bacillus liheniformis субтилизин
Активность изучаемого препарата составила 2500 ЕД на 2,91 мг белка. Растворенное средство имело активность 2500 ЕД/мл. Эксперименты поставлены на половозрелых белых конвенциональных нелинейных мышах (самцы и самки с исходной массой тела 20-25 г) и крысах (самцы и самки, исходная масса тела 200-400 г).
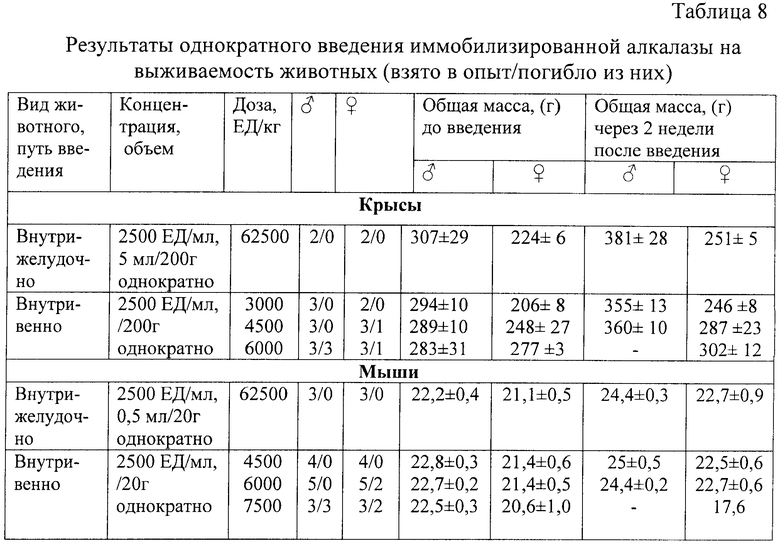
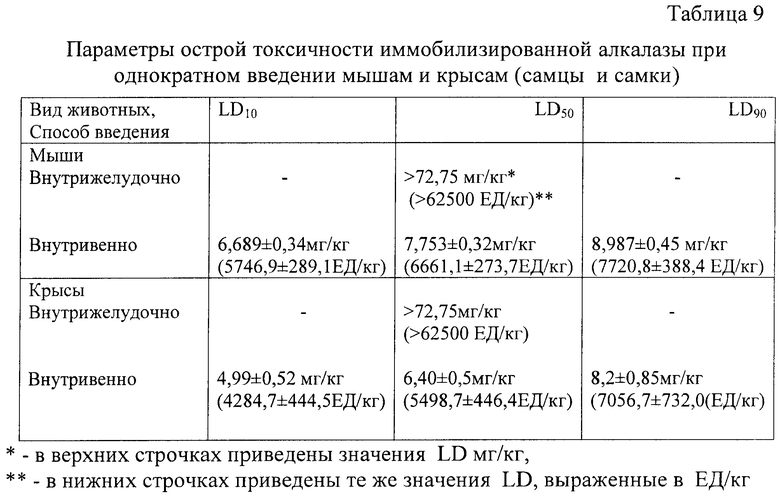
Иммобилизированную алкалазу вводили однократно крысам и мышам (самцам и самкам) внутрижелудочно и внутривенно в концентрации 2500 ЕД/мл в разных дозах утром до кормления (табл.8).
Длительность наблюдения за животными составляла 14 дней. В ходе эксперимента следили за поведением, внешним видом, двигательной активностью, реакцией животных на внешние раздражители, общей массой (табл.8).
Крысы
Внутрижелудочное введение
Введение препарата внутрижелудочно в максимально возможном для крыс объеме - 5,0 мл на 200 г массы крысы (что составило 62500 ЕД/кг) не вызвало никаких изменений в состоянии и поведении животных.
Внутривенное введение
Препарат вводили животным в хвостовую вену однократно в дозах 3000, 4500 и 6000 ЕД/кг.
Мыши
Внутрижелудочное введение
Введение препарата внутрижелудочно в максимально возможном для мышей объеме - 0,5 мл на 20 г массы мышей (что составило 62500 ЕД/кг) не вызвало никаких изменений в состоянии и поведении животных.
Внутривенное введение
Препарат вводили животным в хвостовую вену однократно в дозах 4500, 6000 и 7500 ЕД/кг. Введение иммобилизированной алкалазы в дозе 4500 ЕД/кг не вызвало каких-либо изменений в состоянии и поведении животных (табл.8). Введение алкалазы в дозах 6000 и 7500 ЕД/кг привело к гибели части мышей при симптомах, сходных с наблюдавшимися у крыс.
Внутрижелудочное введение препарата в максимально возможном (для данного пути введения) объеме не оказывает токсического влияния на организм мышей и крыс. Внутривенное введение алкалазы в больших дозах приводит к гибели экспериментальных животных.
По значениям LD, выраженным в мг/кг (табл.9), на основании ГОСТ 12.1.007-76 иммобилизированная алкалаза при внутривенном введении крысам и мышам (самцам, самкам) отнесена к первому классу опасности. Отнесение к классу опасности традиционно выполняется на основании указанного стандарта, хотя он распространяется только на вещества, воздействие которых на организм обусловлено количеством вещества, поступившего в организм и выраженного в единицах массы (мг/кг), воздействие же фермента связано с его активностью (ЕД/кг). Количество единиц активности, приходящееся на единицу массы фермента, сильно варьирует: в 1 мг иммобилизированного протосубтилина Г20Х содержится 0.1333-0,16 ЕД, в 1 мг иммобилизированной алкалазы 2,4 L FG - 859 ЕД. Классификацию опасности такого рода веществ ГОСТ 12.1.007-76 не содержит: в разделе «Информационные данные» говорится: «Стандарт не распространяется на вредные вещества, содержащие радиоактивные и биологические вещества (сложные биологические комплексы, …)». К биологическим веществам относятся и ферменты.
Для иммобилизированных протосубтилина и алкалазы терапевтическая доза введения составляет 10 ЕД/кг, 20 ЕД/кг, 30 ЕД/кг. Чтобы ввести наибольшую дозу из указанных (30 ЕД/кг), необходимо ввести 187,5 мг/кг иммобилизированного протосубтилина (30 ЕД/кг: 0,16 ЕД/мг = 187,5 мг/кг) или 0,035 мг/кг иммобилизированной алкалазы (30 ЕД/кг: 859 ЕД/мг = 0,035 мг/кг).
Пользуясь данными таблиц 7 и 9, посчитаем, во сколько раз при внутривенном введении исследуемых препаратов выраженные в мг/кг дозы ЛД10, ЛД50, ЛД90 для иммобилизированного протосубтилина больше соответствующих доз для иммобилизированной алкалазы у мышей и крыс. Получаем следующие значения: в 431 раз больше (по ЛД10 у мышей: 2883,8/6,689=431); в 489,8 раз (по ЛД50 у мышей: 3797,2/7,753=489,8); в 556,36 раз (по ЛД90 у мышей: 5000/8,987=556,36); в 585,9 раз (по ЛД50 у крыс: 3750/6,4=585,9). Возьмем наибольшее значение 585,9. Оно означает, что для оказания одинакового токсического воздействия на организм доза иммобилизированной алкалазы (в мг/кг массы организма) должна быть в 585,93 раз меньше дозы иммобилизированного протосубтилина. Реально же вводимая терапевтическая доза иммобилизированной алкалазы в мг/кг, соответствующая наибольшей из указанных выше терапевтических доз 30 ЕД/кг, в 5357 раз меньше (187,5 мг/кг/0,0355 мг/кг=5357), чем содержащая 30 ЕД доза иммобилизированного протосубтилина, который относится к малоопасным веществам.
Таким образом, иммобилизированная алкалаза в терапевтической дозе оказывает в 10 раз меньший токсический эффект, чем иммобилизированный протосубтилин, который, как уже указывалось, относится к малотоксичным веществам.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ иммобилизации фермента субтилизиноподобная протеиназа, продуцируемого штаммом бактерии рода Bacillus вида Bacillus sp. 7Р/3-19, на инструменте | 2017 |
|
RU2663128C1 |
| СПОСОБ ИММОБИЛИЗАЦИИ БИОЛОГИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА (БАВ) НА НОСИТЕЛЬ (ВАРИАНТЫ) И КОНЪЮГАТ БАВ-НОСИТЕЛЬ, ПОЛУЧЕННЫЙ ДАННЫМИ СПОСОБАМИ | 2008 |
|
RU2409669C9 |
| СПОСОБ ПРЕДОТВРАЩЕНИЯ ДЕСУЛЬФАТИРОВАНИЯ И ПОВЫШЕНИЯ БИОДОСТУПНОСТИ БИОЛОГИЧЕСКИ АКТИВНЫХ СУЛЬФАТИРОВАННЫХ ПОЛИСАХАРИДОВ ПРИ ИХ ПЕРОРАЛЬНОМ ПРИМЕНЕНИИ | 2009 |
|
RU2421230C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ТРОМБОЛИТИЧЕСКИМИ, ПРОТИВОВОСПАЛИТЕЛЬНЫМИ И ЦИТОПРОТЕКТИВНЫМИ СВОЙСТВАМИ | 2001 |
|
RU2213557C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИКОАГУЛЯНТНЫМИ И ГИПОХОЛЕСТЕРИНЕМИЧЕСКИМИ СВОЙСТВАМИ | 2007 |
|
RU2414907C2 |
| ПРИМЕНЕНИЕ РЕКОМБИНАНТНОГО ШТАММА BACILLUS SUBTILIS EO-11 ВКПМ В-11978 В КАЧЕСТВЕ ПРОДУЦЕНТА СУБТИЛИЗИНОПОДОБНОЙ ПРОТЕИНАЗЫ, ВЕЩЕСТВА С ТРОМБОЛИТИЧЕСКИМИ И АНТИКОАГУЛЯНТНЫМИ СВОЙСТВАМИ | 2015 |
|
RU2622006C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИКОАГУЛЯНТНЫМ ДЕЙСТВИЕМ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2302250C1 |
| ПРИМЕНЕНИЕ РЕКОМБИНАНТНОГО ШТАММА BACILLUS SUBTILIS ТВ-06 В КАЧЕСТВЕ ПРОДУЦЕНТА ГЛУТАМИЛЭНДОПЕПТИДАЗЫ, ВЕЩЕСТВА С ТРОМБОЛИТИЧЕСКИМИ И АНТИКОАГУЛЯНТНЫМИ СВОЙСТВАМИ | 2015 |
|
RU2611378C2 |
| СПОСОБ ПОВЫШЕНИЯ БИОДОСТУПНОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2006 |
|
RU2328309C1 |
| Применение икаритина для получения лекарственных средств | 2021 |
|
RU2806093C1 |
Изобретение относится к биотехнологии. Предложен иммобилизированный на водорастворимом фармакологически приемлемом полимере субтилизин, получаемый глубинной ферментацией бактерий вида Bacillus licheniformis. Иммобилизацию осуществляют путем воздействия ионизирующим излучением на водный раствор, содержащий субтилизин и фармакологически приемлемый полимер. Полимер выбирается из группы: полиэтиленоксид, поливинилпирролидон, полиакриламид, плюроник, декстран. Перед облучением реакционную смесь замораживают до (-20) - (-140)°С. Иммобилизированный субтилизин обладает антикоагулятным и тромболитическим свойствами и оказывает меньший токсический эффект. 3 з.п. ф-лы, 9 табл.
1. Иммобилизированный на водорастворимом фармакологически приемлемом полимере субтилизин, получаемый глубинной ферментацией бактерий вида Bacillus licheniformis, обладающий тромболитическим и/или антикоагулянтным свойствами, полученный путем воздействия ионизирующим излучением на водный раствор, содержащий субтилизин и фармакологически приемлемый полимер, выбранный из группы: полиэтиленоксид, поливинилпирролидон, полиакриламид, плюроник, декстран.
2. Иммобилизированный субтилизин по п.1, для получения которого в качестве ионизирующего излучения использовано γ-излучение, поток ускоренных электронов, ультрафиолетовое излучение.
3. Иммобилизированный субтилизин по п.1, для получения которого полимер использован преимущественно в концентрации, превышающей 10%, а реакционную смесь (водный раствор полимера с субтилизином) перед облучением замораживают до температуры (-20)-(-140)°С.
4. Иммобилизированный субтилизин по п.1, в котором продуцируемым бактериями вида Bacillus licheniformis субтилизином является алкалаза 2,4 LFG.
| US 7429377 A, 30.09.2008 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ТРОМБОЛИТИЧЕСКИМИ, ПРОТИВОВОСПАЛИТЕЛЬНЫМИ И ЦИТОПРОТЕКТИВНЫМИ СВОЙСТВАМИ | 2001 |
|
RU2213557C2 |
| US 5296223 A, 22.03.1994 | |||
| US 6410017 A, 25.06.2002 | |||
| БИОКАТАЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2002 |
|
RU2233327C2 |
| MIYAZAWA et al | |||
| Bacillus licheniformis protease-catalyzed peptide synthesis via the kinetically controlled approach using the carbamoylmethyl ester as an acyl donor in anhydrous acetonitrile | |||
| Letters in Peptide | |||
Авторы
Даты
2011-04-20—Публикация
2008-12-05—Подача