ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу лечения гиперфосфатемии у находящихся на гемодиализе пациентов, который включает введение агониста кальций-чувствительного рецептора (CaSR).
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Список последовательностей представлен в электронном виде с использованием EFS в виде текстового файла, созданного 8 июня 2012 и озаглавленного "632008021US00.txt" (87702 байт), содержание которого включено в настоящее описание в качестве ссылки во всей полноте.
УРОВЕНЬ ТЕХНИКИ
Фосфат (фосфор) играет важную роль в ряде биологических и клеточных процессов. Фосфат наряду с кальцием является основным компонентом скелетной системы, придавая костям прочность. Фосфат также является неотъемлемым компонентом нуклеиновых кислот и участвует в образовании фосфатных связей в молекуле АТФ, отвечающей за энергетический обмен в клетке. Фосфат выполняет роль буфера в костях, сыворотке и моче. Соответственно, физиологические уровни фосфата в крови подлежат тщательной регуляции посредством ряда органных систем организма.
Основная масса общего фосфата организма (85%) находится в кости в составе минерализованного внутриклеточного матрикса. Каждый день примерно 300 мг фосфата поступает в ткань кости и выходит из нее. Избыточные потери фосфата или невозможность пополнить его уровень в кости приводят к остеомаляции. Почки вместе с паратгормоном (PTH), который секретируется паращитовидной железой, играют важную роль в гомеостазе фосфата, регулируя его выведение из организма, а пищеварительный тракт и гормон витамин D играют другую важную роль в гомеостазе фосфата, регулируя его поглощение из потребляемой пищи.
Почки обеспечивают первичный путь выведения избыточного фосфора, абсорбированного из проглоченной пищи или высвобожденного из кости. Следовательно, у пациентов с хронической болезнью почек (CKD) наблюдается повышение уровня фосфора в сыворотке, обусловленное ухудшением функции почек, которое непосредственно стимулирует секрецию PTH паращитовидными железами, который, в свою очередь, может привести к дополнительному нарушению гомеостаза в результате высвобождения большего количества фосфора из кости. Поскольку почки с нарушенной функцией уже не способны регулировать нагрузку избытка фосфора, пациенты с CKD должны следить за своей диетой, чтобы уменьшить потребление фосфора. Повышение сывороточного уровня фосфора наблюдается на ранних стадиях развития CKD, а именно на стадии 3 и на стадии 4, и может постепенно ухудшаться по мере ухудшения функции почек. Пациенты с 5 стадией CKD (также называемой конечной стадией почечной болезни или ESRD), как правило, регулярно подвергаются диализу для удаления избытка токсинов и метаболитов, в том числе фосфора, и, кроме того, получают фосфат-связывающие средства, которые обеспечивают связывание поступающих с пищей фосфатов и, как следствие, предотвращают системную абсорбцию, снижая уровень фосфора в сыворотке до приемлемых значений. В США примерно 90% пациентов, находящихся на гемодиализе, получают продукты с регулируемым содержанием фосфата.
Повышенный уровень фосфора в сыворотке связан с развитием и прогрессированием гиперпаратиреоза, заболевания кости, такого как остеодистрофия, и минерализации мягких тканей, а также с повышенным риском смерти пациентов, находящихся на гемодиализе (Block et al., 1998, Am. J. Kidney Dis., 31:607-617; Block et al., 2000, Am. J. Kidney Dis., 35:1226-1237; Palmer et al., 2011, JAMA, 305:1119-1127). Тяжелая гиперфосфатемия (уровень фосфата в сыворотке >6,5 мг/дл (>2,10 ммоль/л)) непосредственно связана с повышенной общей смертностью и смертностью от сердечно-сосудистых нарушений пациентов, находящихся на гемодиализе (HD) (Palmer et al., 2011, JAMA, 305:1119-1127), и даже умеренная гиперфосфатемия (от 3,0 до 5,0 мг/дл) связана с повышенным риском сердечно-сосудистых нарушений у указанных пациентов. Существующие в настоящее время клинические руководства рекомендуют поддерживать уровень фосфата в нормальном диапазоне (от 3,0 до 5,0 мг/дл (от 0,97 до 1,61 ммоль/л)). Однако гиперфосфатемия со степенью от умеренной до тяжелой (уровень фосфата от 5,01 до 6,5 мг/дл (от 1,62 до 2,10 ммоль/л)) требует приведения в соответствие, поскольку она представляет собой независимый фактор риска смертности у пациентов, находящихся на HD, а монотерапия средствами, связывающими фосфат, не всегда уменьшает уровень сывороточного фосфора в достаточной степени.
Гиперфосфатемия также приводит к развитию вторичного гиперпаратиреоза (SHPT) и повышению уровня PTH в крови посредством (a) снижения уровня ионизированного кальция; (b) препятствования продукции 1,25(OH)2D3; и (c) прямого влияния на секрецию PTH. Указанные процессы приводят к интенсивному развитию болезни костей и других неблагоприятных последствий избыточного уровня PTH.
Существующие в настоящее время клинические руководства рекомендуют поддерживать уровень фосфата в нормальном диапазоне (от 3,0 до 5,0 мг/дл (от 0,97 до 1,61 ммоль/л)). Общепринято, что регуляция фосфора в сыворотке приводит к улучшению клинических результатов и повышению выживания пациентов, находящихся на гемодиализе. Способы снижения уровня фосфора в сыворотке включают диализ, ограничение фосфора в пищевых продуктах и пероральное введение средств, связывающих фосфат.
Уровень фосфата в сыворотке быстро уменьшается в течение первых 1-2 часов диализа и затем достигает плато, на протяжении которого уровень фосфата в сыворотке остается относительно постоянным. После диализа концентрация фосфора в сыворотке быстро увеличивается в течение нескольких первых часов и через 6-8 часов обычно достигает значения, примерно равного наблюдающемуся до диализа (Haas et al., 1991, Nephrol. Dial. Transplant., 2:108-113; Sugisaki et al., 1983 Trans. Am. Soc. Artif. Intern. Organs, 29:38-43). Данное явление называют "фосфатный рикошет". В некоторых случаях фосфатный рикошет дает уровни фосфата, превышающие исходные.
Регуляция фосфора у находящихся на диализе пациентов часто остается неудовлетворительной. Соответственно, продолжает существовать потребность в способах лечения гиперфосфатемии у пациентов, находящихся на гемодиализе. В частности, существует потребность в способах уменьшения фосфатного рикошета.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В одном аспекте изобретение предлагает способ лечения гиперфосфатемии у пациентов, находящихся на гемодиализе.
В другом аспекте изобретение предлагает способ уменьшения фосфатного рикошета у пациентов, находящихся на гемодиализе.
В другом аспекте способ лечения включает введение пациенту, находящемуся на диализе (таком как гемодиализ или перитонеальный диализ), соединения формулы X1-X2-X3-X4-X5-X6-X7, где X1 обозначает субъединицу, в состав которой входит тиол-содержащая группа; X5 обозначает катионную субъединицу; X6 обозначает не катионную субъединицу; X7 обозначает катионную субъединицу; и по меньшей мере два из X2, X3 и X4 независимо обозначают катионные субъединицы. Соединение вводят в течение примерно 5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 45 минут, 1 часа, 2 часов, 3 часов, 4 часов после гемодиализа, или в течение примерно 3 часов, 2 часов, 1 часа, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут, 5 минут до завершения сеанса гемодиализа, где введение позволяет эффективно поддерживать концентрацию фосфора в сыворотке после гемодиализа на более низком уровне, чем до гемодиализа, в течение периода, составляющего по меньшей мере примерно 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 24 часа, 48 часов, 72 часа после завершения диализа, или в течение периода времени, длящегося до следующего сеанса гемодиализа.
В одном варианте осуществления соединение вводят в течение периода, начинающегося примерно за 15 минут до завершения гемодиализа и заканчивающегося примерно через 3 часа после завершения гемодиализа, где указанное введение позволяет эффективно поддерживать концентрацию фосфора в сыворотке после гемодиализа на более низком уровне, чем до гемодиализа, в течение периода, составляющего по меньшей мере примерно 6 часов после завершения диализа.
В одном варианте осуществления агонист представляет собой Ac-c(C)arrrar-NH2 (SEQ ID NO:3).
В другом варианте осуществления агонист представляет собой фармацевтически приемлемую соль SEQ ID NO:3. В иллюстративном варианте осуществления агонист представляет собой хлористоводородную соль SEQ ID NO:3.
В одном варианте осуществления агонист вводят в течение примерно 1 часа после диализа или в течение примерно 30 минут после диализа. В предпочтительном варианте осуществления агонист вводят в процессе возвратной процедуры в конце диализа. В другом варианте осуществления агонист вводят в течение 5 часов до завершения диализа, ежедневно примерно за 1 час до завершения сеанса диализа. В одном варианте осуществления диализ представляет собой гемодиализ.
В другом варианте осуществления агонист вводят в процессе возвратной процедуры в конце диализа.
В других вариантах осуществления пациент с диагнозом конечная стадия почечной болезни или хроническая болезнь почек получает лечение, описанное в данном документе.
В других вариантах осуществления пациент получает лекарственное средство, связывающее фосфат, до и/или во время проведения описанного здесь лечения.
В следующих вариантах осуществления пациент страдает от хронической болезни почек, связанной с диабетом. В следующих вариантах осуществления пациент, страдающий от хронической болезни почек, связанной с гипертензией, находится на диализе и получает описанное здесь лечение. В других вариантах осуществления пациент находится на диализе по поводу вторичного гиперпаратиреоза или первичного гиперпаратиреоза и получает описанное здесь лечение.
В другом аспекте изобретение предлагает способ, включающий введение пациенту, находящемуся на гемодиализе, агониста кальций-чувствительного рецептора, где агонист вводят в течение примерно 5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 45 минут, 1 часа, 2 часов, 3 часов, 4 часов после завершения гемодиализа или в течение примерно 3 часов, 2 часов, 1 часа, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут, 5 минут до завершения гемодиализа, и где введение позволяет эффективно поддерживать концентрацию фосфора в сыворотке после гемодиализа на более низком уровне, чем до гемодиализа, в течение периода, составляющего по меньшей мере примерно 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 24 часа, 48 часов, 72 часа, или в течение периода времени, длящегося до начала следующего гемодиализа. В предпочтительном варианте осуществления агонист вводят в процессе возвратной процедуры в конце диализа.
В одном варианте осуществления данного аспекта агонист кальций-чувствительного рецептора отличается от соединения формулы X1-X2-X3-X4-X5-X6-X7, где X1 обозначает субъединицу, в состав которой входит тиол-содержащая группа; X5 обозначает катионную субъединицу; X6 обозначает некатионную субъединицу; X7 обозначает катионную субъединицу; и по меньшей мере два из X2, X3 и X4 независимо обозначают катионные субъединицы.
В одном варианте осуществления агонист кальций-чувствительного рецептора представляет собой миметик кальция. В других вариантах осуществления миметик кальция представляет собой цинакальцета гидрохлорид (C22H22F3N·HCl).
В следующем аспекте изобретение предлагает способ лечения гиперфосфатемии у пациента, по меньшей мере периодически находящегося на гемодиализе. Указанный способ включает введение пациенту эффективного количества агониста кальций-чувствительного рецептора (CaSR), где агонист вводят в течение примерно 18 часов после завершения гемодиализа, или менее чем примерно за 3 часа до завершения гемодиализа, и где введение позволяет эффективно поддерживать концентрацию фосфора в сыворотке после гемодиализа на более низком уровне, чем до гемодиализа, в течение периода, составляющего по меньшей мере примерно 6 часов.
В одном варианте осуществления агонист вводят менее чем за 30 минут до завершения диализа.
В одном варианте осуществления агонист представляет собой цинакальцета гидрохлорид. В другом варианте осуществления агонист представляет собой соединение формулы X1-X2-X3-X4-X5-X6-X7, где X1 обозначает субъединицу, в состав которой входит тиол-содержащая группа; X5 обозначает катионную субъединицу; X6 обозначает некатионную субъединицу; X7 обозначает катионную субъединицу; и по меньшей мере два из X2, X3 и X4 независимо обозначают катионную субъединицу.
В одном варианте осуществления агонист представляет собой Ac-c(C)arrrar-NH2 (SEQ ID NO:3) или его соль.
В других аспектах изобретение предлагает способ регуляции концентрации фосфора в сыворотке пациента, по меньшей мере периодически находящегося на гемодиализе. Указанный способ включает введение пациенту эффективного количества агониста кальций-чувствительного рецептора (CaSR), где агонист вводят в течение примерно 5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 45 минут, 1 часа, 2 часов, 3 часов, 4 часов после завершения гемодиализа, или менее чем примерно за 3 часа, 2 часа, 1 час, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут, 5 минут до завершения гемодиализа. В одном варианте осуществления введение позволяет эффективно поддерживать концентрацию фосфора в сыворотке после гемодиализа на более низком уровне, чем до гемодиализа, в течение периода, составляющего по меньшей мере примерно 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 24 часа, 48 часов, 72 часа, или в течение периода времени, длящегося до начала следующего сеанса гемодиализа. В предпочтительном варианте осуществления агонист вводят в процессе возвратной процедуры в конце диализа.
После перорального введения цинакальцета гидрохлорида Cmax достигается примерно через 2-6 часов. Соответственно, в другом варианте осуществления способ включает введение пациенту эффективного количества цинакальцета гидрохлорида, где цинакальцета гидрохлорид вводят в течение примерно 5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 45 минут, 1 часа, 2 часов, 3 часов, 4 часов после завершения гемодиализа, или менее чем примерно за 9 часов, 8 часов, 7 часов, 6 часов, 5 часов, 4 часа, 3 часа, 2 часа, 1 час, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут, 5 минут до завершения гемодиализа. В одном варианте осуществления введение позволяет эффективно поддерживать концентрацию фосфора в сыворотке после гемодиализа на более низком уровне, чем до гемодиализа, в течение периода, составляющего по меньшей мере примерно 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 24 часа, 48 часов, 72 часа, или в течение периода времени, длящегося до начала следующего сеанса гемодиализа.
В другом аспекте изобретение предлагает режим дозирования соединения, предназначенного для лечения гиперпаратиреоза у пациента, находящегося на гемодиализе. Режим дозирования включает введение пациенту агониста кальций-чувствительного рецептора, где агонист вводят в течение примерно 5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 45 минут, 1 часа, 2 часов, 3 часов, 4 часов после завершения гемодиализа, или менее чем примерно за 3 часа, 2 часа, 1 час, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут, 5 минут до завершения гемодиализа. В предпочтительном варианте осуществления агонист вводят в процессе возвратной процедуры в конце диализа. Указанный режим позволяет эффективно поддерживать концентрацию фосфора в сыворотке после гемодиализа на более низком уровне, чем до гемодиализа, в течение периода, составляющего по меньшей мере примерно 6 часов.
В другом аспекте изобретение предлагает способ лечения гиперфосфатемии у субъекта, находящегося на диализе, где субъект получает соединение-агонист CaSR, как описано в данном документе. Лечение обеспечивает эффективное снижение уровня фосфора в сыворотке после диализа по сравнению с сывороткой до диализа на протяжении периода между сеансами диализа, т.е. междиализного периода. В одном варианте осуществления на протяжении междиализного периода уровень фосфора в сыворотке после диализа снижен по сравнению с уровнем фосфора в сыворотке до диализа по меньшей мере примерно на 10%, 15%, 20% или 25%. Соединение-агонист CaSR вводят в соответствии с одним из описанных здесь способов лечения, например, до завершения сеанса диализа, или в течение примерно 5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 45 минут, 1 часа, 2 часов, 3 часов или 4 часов после сеанса диализа.
В вариантах осуществления одного из указанных здесь аспектов агонист CaSR может представлять собой соединение, содержащее последовательность carrrar (SEQ ID NO:2). В других вариантах осуществления агонист CaSR представляет собой конъюгат, содержащий пептид carrrar (SEQ ID NO:2), соединенный по N-концевому остатку с остатком Cys. В предпочтительном варианте осуществления конъюгат представляет собой Ac-c(C)arrrar-NH2 (SEQ ID NO:3).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 приведен график, демонстрирующий процентное изменение уровней интактного PTH в сыворотке после введения SEQ ID NO:3 или плацебо путем внутривенной инъекции сразу после диализа. Плацебо, закрашенные кружки; 5 мг SEQ ID NO:3, незакрашенные кружки; 10 мг SEQ ID NO:3, перевернутые незакрашенные треугольники; 20 мг SEQ ID NO:3, перевернутые закрашенные треугольники; 40 мг SEQ ID NO:3, закрашенные квадраты; 60 мг SEQ ID NO:3, незакрашенные квадраты.
На фиг. 2 приведен график, демонстрирующий процентное изменение уровня фосфора в сыворотке на протяжении междиализного периода (т.е. сразу после гемодиализа и в течение последующих ~72 часов, составляющих период между сеансами гемодиализа) после введения SEQ ID NO:3 или плацебо путем инъекции после диализа. Плацебо, закрашенные кружки; 5 мг SEQ ID NO:3, незакрашенные кружки; 10 мг SEQ ID NO:3, перевернутые незакрашенные треугольники; 20 мг SEQ ID NO:3, перевернутые закрашенные треугольники; 40 мг SEQ ID NO:3, закрашенные квадраты; 60 мг SEQ ID NO:3, незакрашенные квадраты.
На фиг. 3 приведен график, демонстрирующий среднее различие в уровне сывороточного фосфора (мг/дл) (активное соединение по сравнению с плацебо в каждой группе) в группах, получающих SEQ ID NO:3 в дозах 5 мг, 10 мг и 20 мг (измеренное на выходе их процедуры фазы 1).
Сущность настоящего изобретения можно легче понять с помощью приведенного ниже подробного описания предпочтительных вариантов осуществления и включенных в него примеров.
ПОДРОБНОЕ ОПИСАНИЕ
I. Определения
Если не указано иначе, определение терминов и описание методов, используемых в данной заявке, можно найти в любом из нескольких хорошо известных источников, таких как Sambrook, J., et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989); Goeddel, D., ed., Gene Expression Technology, Methods in Enzymology, 185, Academic Press, San Diego, CA (1991); "Guide to Protein Purification" in Deutshcer, M.P., ed., Methods in Enzymology, Academic Press, San Diego, CA (1989); Innis, et al., PGR Protocols: A Guide to Methods and Applications, Academic Press, San Diego, CA (1990); Freshney, R.I., Culture of Animal Cells: A Manual of Basic Technique, 2nd Ed., Alan Liss, Inc. New York, NY (1987); Murray, E.J., ed., Gene Transfer and Expression Protocols, pp. 109-128, The Humana Press Inc., Clifton, NJ and Lewin, B., Genes VI, Oxford University Press, New York (1997).
Если не указано иначе, в настоящем описании термины, находящиеся в единственном числе, включают отнесение к множественному числу. Например, термин модуляторный пептид относится к одному из нескольких модуляторных пептидов.
В настоящем описании термин "аминокислота" относится к природным и неприродным аминокислотам. Двадцать природных аминокислот (L-изомеры) обозначают с помощью трехбуквенного кода с префиксом "L-" (за исключением глицина, который является ахиральным), или с помощью однобуквенного кода в верхнем регистре: аланин ("L-Ala" или "A"), аргинин ("L-Arg" или "R"), аспарагин ("L-Asn" или "N"), аспарагиновая кислота ("L-Asp" или "D"), цистеин ("L-Cys" или "C"), глутамин ("L-Gln" или "Q"), глутаминовая кислота ("L-Glu" или "E"), глицин ("Gly" или "G"), гистидин ("L-His" или "H"), изолейцин ("L-Ile" или "I"), лейцин ("L-Leu" или "L"), лизин ("L-Lys" или "K"), метионин ("L-Met" или "M"), фенилаланин ("L-Phe" или "F"), пролин ("L-Pro" или "P"), серин ("L-Ser" или "S"), треонин ("L-Thr" или "T"), триптофан ("L-Trp" или "W"), тирозин ("L-Tyr" или "Y") и валин ("L-Val" или "V"). L-норлейцин и L-норвалин можно обозначать (NLeu) и (NVal), соответственно. Девятнадцать природных хиральных аминокислот имеют соответствующий D-изомер, который обозначают с помощью трехбуквенного кода с префиксом "D-", или с помощью однобуквенного кода в нижнем регистре: аланин ("D-Ala" или "a"), аргинин ("D-Arg" или "r"), аспарагин ("D-Asn" или "a"), аспарагиновая кислота ("D-Asp" или "d"), цистеин ("D-Cys" или "c"), глутамин ("D-Gln" или "q"), глутаминовая кислота ("D-Glu" или "e"), гистидин ("D-His" или "h"), изолейцин ("D-Ile" или "i"), лейцин ("D-Leu" или "l"), лизин ("D-Lys" или "k"), метионин ("D-Met" или "m"), фенилаланин ("D-Phe" или "f"), пролин ("D-Pro" или "p"), серин ("D-Ser" или "s"), треонин ("D-Thr" или "t"), триптофан ("D-Trp" или "w"), тирозин ("D-Tyr" или "y") и валин ("D-Val" или "v"). D-норлейцин и D-норвалин можно обозначать (dNLeu) и (dNVal), соответственно. Хотя термин "аминокислотный остаток" часто используется в применении к мономерной субъединице пептида, полипептида или белка, а термин "аминокислота" обычно используется для обозначения свободной молекулы, значения указанных терминов в данной области часто перекрываются и варьируют. Термины "аминокислота" и "аминокислотный остаток" используются как взаимозаменяемые и могут относиться к свободной молекуле или к мономерной субъединице пептида, полипептида или белка, в зависимости от контекста.
Термин "катионная аминокислота" относится к аминокислотному остатку, который несет суммарный положительный заряд при физиологическом значении pH (7,4), как в случае, например, аминокислотных остатков, боковая цепь или "R-группа" которых содержит в качестве функциональной группы амин или другую группу, способную акцептировать протон и приобретать положительный заряд при физиологическом значении pH, такую как гуанидиновый или имидазольный фрагмент. Катионные аминокислотные остатки включают аргинин, лизин, гистидин, 2,3-диаминопропионовую кислоту (Dap), 2,4-диаминомасляную кислоту (Dab), орнитин и гомоаргинин.
Термин "катионная субъединица" относится к субъединице, которая имеет суммарный положительный заряд при физиологическом значении pH (7,4).
В настоящем описании "консервативные аминокислотные замены" представляют собой замены, которые не приводят к существенному изменению активности или третичной структуры выбранного полипептида или белка. Такие замены обычно включают замену выбранного аминокислотного остатка другим аминокислотным остатком, имеющим похожие физико-химические свойства. Специалистам в данной области известно, что аминокислоты и аминокислотные остатки можно группировать в соответствии с их физико-химическими свойствами. Например, в данной области природные аминокислоты подразделяют на семейства, включающие аминокислотные остатки, которые содержат подобные боковые цепи, такие как основные боковые цепи (например, лизин, аргинин, гистидин), кислые боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин).
В настоящем описании термин "образование химических поперечных связей" относится к образованию ковалентных связей между двумя или более молекулами.
Считают, что пептид или пептидный фрагмент "получен из" исходного пептида или полипептида, если его аминокислотная последовательность идентична или гомологична последовательности исходного пептида или полипептида, состоящей по меньшей мере из пяти смежных аминокислотных остатков, более предпочтительно из восьми смежных аминокислотных остатков.
Описанные здесь соединения могут находиться в виде фармацевтически приемлемых солей. Фармацевтически приемлемые соли включают кислотно-аддитивные соли, такие как гидрохлорид, гидробромид, сульфурат, нитрат, фосфорат, ацетат, пропионат, гликолат, пируват, оксалат, малат, малонат, сукцинат, малеат, фумарат, тартарат, цитрат, бензоат, циннамат, манделат, метансульфонат, этансульфонат, п-толуолсульфонат, салицилат и т.п., и основно-аддитивные соли, такие как соли натрия, калия, кальция, магния, лития, алюминия, цинка, аммония, этилендиамина, аргинина, пиперазина и т.п.
Если не указано иначе, в настоящем описании термин "гиперпаратиреоз" относится к первичному, вторичному и третичному гиперпаратиреозу.
В настоящем описании "выделенный" или "очищенный" полипептид или его биологически активный фрагмент не содержит некоторых клеточных веществ, если его получают с помощью рекомбинантных методов ДНК, или химических предшественников или других химических веществ, если его получают путем химического синтеза. Выражение "практически не содержит клеточных веществ" относится к препаратам полипептидов, в которых полипептид отделен от некоторых компонентов клеток, в которых он продуцируется естественным или рекомбинантным способом. Если полипептид или его биологически активный фрагмент получают рекомбинантным способом, предпочтительно он также практически не содержит культуральной среды, т.е. объем культуральной среды составляет менее чем примерно 20%, более предпочтительно менее чем примерно 10% и наиболее предпочтительно менее чем примерно 5% от объема препарата полипептида. Выражение "практически не содержит химических предшественников или других химических веществ" относится к препаратам полипептидов, в которых полипептид отделен от химических предшественников или других химических веществ, участвующих в синтезе полипептида. В одном варианте осуществления выражение "практически не содержит химических предшественников или других химических веществ" относится к препаратам полипептида, которые содержат менее чем примерно 30% (по сухой массе) химических предшественников или других химических веществ, предпочтительно менее чем примерно 20% химических предшественников или других химических веществ, более предпочтительно менее чем примерно 15% химических предшественников или других химических веществ, еще более предпочтительно менее чем примерно 10% химических предшественников или других химических веществ и наиболее предпочтительно менее чем примерно 5% химических предшественников или других химических веществ. В предпочтительных вариантах осуществления выделенные полипептиды или их биологически активные фрагменты не содержат примесей других полипептидов из того же организма, из которого получают основной полипептид.
Термин "некатионная аминокислота" относится к аминокислотному остатку, который не несет заряд или несет суммарный отрицательный заряд при физиологическом значении pH (7,4), такому как, например, аминокислотный остаток, боковая цепь или "R-группа" которого является нейтральной (нейтральной полярной или нейтральной неполярной) или кислой. Некатионные аминокислоты включают остатки, R-группа которых представляет собой углеводородный алкильный или ароматический фрагмент (например, валин, аланин, лейцин, изолейцин, фенилаланин); нейтральную полярную R-группу (аспарагин, цистеин, глутамин, серин, треонин, триптофан, тирозин); или нейтральную неполярную группу (глицин, метионин, пролин, валин, изолейцин). Некатионные аминокислоты, содержащие кислую R-группу, включают аспарагиновую кислоту и глутаминовую кислоту.
Термин "полимер" обозначает линейную цепь, состоящую из двух или более идентичных или неидентичных субъединиц, соединенных ковалентными связями.
В настоящем описании термины "пептид" и "полипептид" относятся к любому полимеру, состоящему из цепи аминокислотных остатков, соединенных пептидными связями, независимо от его размера. Хотя термин "белок" часто используют для обозначения относительно крупных полипептидов, а термин "пептид" обычно используют для обозначения небольших полипептидов, значения указанных терминов в данной области могут перекрываться и варьировать. Таким образом, для простоты в настоящем описании используют термин "пептид", хотя в некоторых случаях для обозначения того же полимера можно использовать термин "полипептид". Если не указано иначе, последовательность пептида приводится в направлении от аминоконца к карбоксиконцу.
Термин "тиол-содержащая группа" или "тиол-содержащий фрагмент" в настоящем описании относится к функциональной группе, содержащей сероводородную связь (-SH) и способной взаимодействовать с другим тиолом в физиологических условиях с образованием дисульфидной связи. Тиол, способный образовывать дисульфидную связь с другим тиолом, называют здесь "реакционноспособный тиол". В предпочтительном варианте осуществления расстояние между тиол-содержащей группой и скелетом соединения составляет менее 6 атомов. В более предпочтительном варианте осуществления тиол-содержащая группа имеет структуру (-SH-CH2-CH2-C(O)-O-)-.
В настоящем описании термин "субъект" относится к человеку или к животному. Подобным образом, термин "пациент" может относиться как к человеку, так и к животному.
Термин "субъединица" относится к мономерному элементу, который соединяется более чем с одним другим мономерным элементом с образованием полимерного соединения, где субъединица представляет собой кратчайшую повторяющуюся группу элементов полимерного соединения. Типичными субъединицами являются аминокислоты, которые после соединения образуют полимерное соединение, называемое в данной области пептид, полипептид или белок.
В настоящем описании термин "терапевтически эффективное количество" относится к количеству, необходимому для достижения желательного терапевтического эффекта.
Если не указано иначе, все документы, упоминающиеся в данном описании, включены в него в качестве ссылки во всей полноте.
II. Способы лечения
В одном аспекте изобретение предлагает способ лечения гиперфосфатемии у субъекта, нуждающегося в таком лечении. В других аспектах изобретение предлагает способы модуляции, регуляции и/или уменьшения уровня фосфора в сыворотке пациента, находящегося на диализе. В других аспектах изобретение предлагает способы улучшения результатов лечения пациентов, по меньшей мере периодически находящихся на диализе. В другом аспекте изобретение предлагает способ уменьшения и/или ослабления фосфатного рикошета у субъекта, находящегося на диализе. Далее описываются указанные аспекты и варианты осуществления этих аспектов.
Как описано в примере 1, в подтверждение описанных здесь способов лечения проводят исследование, в котором субъекты с конечной стадией почечной болезни (ESRD), находящиеся на гемодиализе, получают миметик кальция. Пациенты, участвующие в данном исследовании, имеют диагноз вторичный гиперпаратиреоз (SHPT) и нуждаются в регулярных сеансах гемодиализа. Типичное средство, выбранное для данного исследования, представляет собой соединение-агонист кальций-чувствительного рецептора, имеющее описанную ниже формулу и последовательность, идентифицированную как SEQ ID NO:3. Соединение вводят пациентам, случайным образом распределенным в экспериментальные группы, путем внутривенной инъекции сразу после гемодиализа в дозах 5, 10, 20, 40 или 60 мг. В течение трех дней после введения соединения определяют концентрации интактного PTH и фосфора в крови. Результаты приведены на фиг. 1-2.
Как видно на фиг. 1, введение SEQ ID NO:3 после диализа приводит к быстрому уменьшению на 60-80% уровня интактного PTH в крови с последующим дозозависимым возвращением к исходному уровню в течение 48 часов. Наблюдается ассоциированное небольшое (10-16%) уменьшение уровня кальция в сыворотке. Как видно на фиг. 2, уровень сывороточного фосфора, который снижается в результате диализа, быстро растет в течение первых 8 часов, достигая плато, и затем, в течение остального междиализного периода, увеличивается более медленно. У субъектов, получающих плацебо (закрашенные кружки), средний уровень сывороточного фосфора быстро возрастает в течение первых ~36 часов после введения плацебо и затем приближается к плато на 84% выше исходного уровня при выписке. Неожиданно было обнаружено, что скорость возврата концентрации фосфора до уровня плато значительно изменяется после введения SEQ ID NO:3. Введение соединения-агониста в дозах, превышающих примерно 5 мг (незакрашенные кружки), приводит к значительному ослаблению или уменьшению возрастания уровня сывороточного фосфора после диализа. При выписке средний процент увеличения концентрации фосфора в сыворотке по сравнению с исходным уровнем у субъектов, получающих 20-60 мг агониста, идентифицированного как SEQ ID NO:3, варьирует от 23% до 60%, и по меньшей мере на ~24 процента ниже, чем у субъектов, получающих плацебо.
Полученные результаты демонстрируют, что после завершения сеанса гемодиализа концентрация фосфора в сыворотке быстро повышается в течение нескольких первых часов. То есть, уровень сывороточного фосфора рикошетирует после гемодиализа, возвращаясь в течение первых ~10 часов к значению, наблюдающемуся до диализа, и примерно через 18 часов после завершения диализа достигая плато, уровень которого примерно на 80% превышает исходный уровень, наблюдающийся после диализа. В таблице 1 приведены средние значения исходного (до лечения) уровня PTH и фосфора у субъектов с ESRD сразу (в течение 2 часов) после гемодиализа, но до введения ("перед дозированием") SEQ ID NO:3 или плацебо путем внутривенной инъекции. Уровень фосфора в сыворотке субъектов с ESRD, получающих плацебо, возрастает (рикошетирует) наиболее быстро в течение первых 3-10 часов после завершения диализа. Без связи с какой-либо теорией полагают, что 80-100% рикошета сывороточного фосфора после диализа являются следствием мобилизации фосфата из внутриклеточного пространства и/или из кости, или, возможно, стимуляции абсорбции фосфата в пищеварительном тракте, обусловленной или индуцированной удалением фосфата в процессе диализа.
Обнаружено, что в результате введения пациенту агониста CaSR в течение определенного периода времени по отношению к сеансу диализа рикошет фосфора может уменьшиться. Как показано на фиг. 2, внутривенное введение агониста CaSR (SEQ ID NO:3) в дозах, превышающих 5 мг, сильно снижает постдиализный рикошет уровня сывороточного фосфора. Введение агониста CaSR (например, SEQ ID NO:3) в дозе 10, 20, 40 или 60 мг непосредственно перед завершением диализа или вскоре после завершения диализа приводит лишь к небольшому увеличению уровня фосфора в течение первых 3-4 часов и к сильному снижению или притуплению увеличения уровня фосфора в сыворотке в течение 4-18 часов после диализа, так что в последующие 18-72 часа постдиализного периода наблюдается небольшое или среднее увеличение сывороточного фосфора, определяемое по проценту увеличения относительно постдиализного исходного уровня. Как ни удивительно, полученные результаты свидетельствуют о том, что введение пациенту с ESRD агониста CaSR или миметика кальция в течение первых 18 часов после диализа значительно ослабляет или уменьшает постдиализный рикошет концентрации сывороточного фосфора. Указанные данные демонстрируют, что большая часть рикошета сывороточного фосфора наблюдается в течение первых 8-10 часов после диализа, и неожиданно свидетельствуют о том, что существует окно длительностью 8-10 часов после диализа, в течение которого введение агониста CaSR пациенту с ESRD может приводить к значительному облегчению или притуплению рикошета сывороточного фосфора.
Соответственно, в первом аспекте пациент, находящийся на диализе, получает соединение-агонист CaSR в течение примерно 5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 45 минут, 1 часа, 2 часов, 3 часов, 4 часов после завершения сеанса диализа, или примерно за 3 часа, 2 часа, 1 час, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут, 5 минут до завершения сеанса диализа. В предпочтительном варианте осуществления соединение-агонист CaSR вводят в процессе возвратной процедуры в конце диализа. Как известно специалистам в данной области, диализ включает гемодиализ или перитонеальный диализ. Продолжительность сеанса гемодиализа обычно составляет 3-5 часов, и ссылка на "сеанс диализа" или "сеанс гемодиализа" в настоящем описании включает процедуру диализа длительностью TD, где TD может составлять 1 час или более, 2 часа или более, 2,5 часа или более, 3 часа или более, 3,5 часа или более, 4 часа или более, 4,5 часа или более, 5 часов или более, или, в альтернативных вариантах осуществления, 1-10 часов, или 2-8 часов, или 2-6 часов, или 3-5 часов. TD можно разделить на первую фазу и вторую фазу, где первая фаза соответствует первой половине суммарного временного диапазона TD, а вторая фаза соответствует второй половине суммарного временного диапазона TD. В одном варианте осуществления соединение-агонист вводят находящемуся на диализе пациенту во время второй фазы сеанса диализа продолжительностью TD. В другом варианте осуществления TD подразделяют на три или четыре равные части (трети и четверти), и соединение-агонист вводят находящемуся на диализе пациенту во время последней трети сеанса диализа продолжительностью TD, или во время последней четверти сеанса диализа продолжительностью TD. Например, в случае сеанса диализа с TD 3 часа, в одном варианте осуществления агонист вводят в течение последнего часа сеанса диализа, если TD подразделяют на трети, или в течение последних 45 минут сеанса диализа, если TD подразделяют на четверти. В предпочтительных вариантах осуществления агонист вводят за 30 минут, 20 минут, 15 минут, 10 минут, 5 минут или 1 минуту до завершения сеанса диализа продолжительностью TD.
В других вариантах осуществления агонист вводят находящемуся на диализе пациенту сразу после завершения сеанса диализа продолжительностью TD, или по меньшей мере в течение 18 часов, в течение 15 часов, в течение 10 часов, в течение 8 часов, в течение 5 часов, в течение 3 часов, в течение 2 часов, в течение 1 часа, в течение 30 минут, в течение 20 минут, в течение 10 минут или в течение 5 минут после завершения сеанса диализа продолжительностью TD. В одном варианте осуществления агонист CaSR вводят субъекту менее чем через 2 часа, менее чем через 3 часа, менее чем через 4 часа, менее чем через 5 часов, менее чем через 6 часов, менее чем через 7 часов, менее чем через 8 часов, менее чем через 9 часов, менее чем через 10 часов, менее чем через 18 часов или менее чем через 20 часов после завершения гемодиализа. В другом варианте осуществления соединение вводят субъекту через 30-60 минут, 1-2 часа, 2-3 часа, 3-5 часов, 5-8 часов, 8-10 часов, 10-15 часов, 15-18 часов после завершения диализа.
В предпочтительном варианте осуществления агонист CaSR вводят в конце диализа или сразу, как это станет практически возможным после окончания диализа. В некоторых вариантах осуществления агонист CaSR вводят в процессе диализа, или менее чем за 3 часа, менее чем за 2 часа, менее чем за 1 час, или менее чем за 30 минут до окончания диализа.
Как показано на фиг. 3, внутривенное введение агониста CaSR (SEQ ID NO:3) в дозах 10 мг, 20 мг или выше может значительно уменьшить постдиализное увеличение или постдиализный рикошет уровня сывороточного фосфора, и данное уменьшение можно преобразовать в среднее уменьшение сывороточного фосфата от 0,5 мг/дл до 1 мг/дл или более после однократного введения дозы. Предположительно указанные эффекты можно дополнительно усилить путем многократного введения агониста CaSR, где введение повторяют с каждым сеансом диализа (который в случае гемодиализа обычно проводят три раза в неделю), а лекарственное средство соответственно вводят в процессе или сразу после диализа, чтобы ослабить или затупить постдиализный рикошет сывороточного фосфора.
В одном варианте осуществления уровень фосфора в сыворотке пациента увеличивается менее чем на 10%, менее чем на 20%, менее чем на 30%, менее чем на 40%, менее чем на 50% или менее чем на 60% в течение первого часа после окончания диализа. В другом варианте осуществления уровень фосфора в сыворотке пациента увеличивается менее чем на 10%, менее чем на 20%, менее чем на 30%, менее чем на 40%, менее чем на 50% или менее чем на 60% в течение первых 2 часов после окончания диализа. В одном варианте осуществления уровень фосфора в сыворотке пациента увеличивается менее чем на 10%, менее чем на 20%, менее чем на 30%, менее чем на 40%, менее чем на 50% или менее чем на 60% в течение первых 3 часов после окончания диализа. В другом варианте осуществления уровень фосфора в сыворотке пациента увеличивается менее чем на 10%, менее чем на 20%, менее чем на 30%, менее чем на 40%, менее чем на 50% или менее чем на 60% в течение первых 4 часов после окончания диализа. В другом варианте осуществления уровень фосфора в сыворотке пациента увеличивается менее чем на 10%, менее чем на 20%, менее чем на 30%, менее чем на 40%, менее чем на 50% или менее чем на 60% в течение первых 5 часов после окончания диализа. В другом варианте осуществления уровень фосфора в сыворотке пациента увеличивается менее чем на 10%, менее чем на 20%, менее чем на 30%, менее чем на 40%, менее чем на 50% или менее чем на 60% в течение первых 6 часов после окончания диализа. В другом варианте осуществления уровень фосфора в сыворотке пациента увеличивается менее чем на 10%, менее чем на 20%, менее чем на 30%, менее чем на 40%, менее чем на 50% или менее чем на 60% в течение первых 7 часов после окончания диализа.
В одном варианте осуществления пациент находился или находится на гемодиализе, а уровень фосфора в сыворотке пациента увеличивается менее чем на 10%, менее чем на 20%, менее чем на 30%, менее чем на 40%, менее чем на 50% или менее чем на 60% в течение первых 3 часов или 6 часов после введения агониста CaSR. В другом варианте осуществления пациент находился или находится на гемодиализе, а уровень фосфора в сыворотке пациента увеличивается менее чем на 10%, менее чем на 20%, менее чем на 30%, менее чем на 40%, менее чем на 50% или менее чем на 60% в течение первых 4 часов или 6 часов после введения агониста CaSR. В другом варианте осуществления пациент находился или находится на гемодиализе, а уровень фосфора в сыворотке пациента увеличивается менее чем на 10%, менее чем на 20%, менее чем на 30%, менее чем на 40%, менее чем на 50% или менее чем на 60% в течение первых 5 часов после введения агониста CaSR. В другом варианте осуществления пациент находился или находится на гемодиализе, а уровень фосфора в сыворотке пациента увеличивается менее чем на 10%, менее чем на 20%, менее чем на 30%, менее чем на 40%, менее чем на 50% или менее чем на 60% в течение первых 6 часов после введения агониста CaSR. В другом варианте осуществления пациент находился или находится на гемодиализе, а уровень фосфора в сыворотке пациента увеличивается менее чем на 10%, менее чем на 20%, менее чем на 30%, менее чем на 40%, менее чем на 50% или менее чем на 60% в течение первых 7 часов после введения агониста CaSR.
В одном варианте осуществления доза вводимого пациенту агониста CaSR составляет от примерно 10 мг до примерно 20 мг, от примерно 10 мг до примерно 30 мг, от примерно 20 мг до примерно 30 мг, от примерно 20 мг до примерно 40 мг, от примерно 30 мг до примерно 50 мг, от примерно 40 мг до примерно 60 мг или от примерно 50 мг до примерно 80 мг. В другом варианте осуществления доза вводимого пациенту агониста CaSR составляет примерно 10 мг, примерно 20 мг, примерно 30 мг, примерно 40 мг, примерно 50 мг, примерно 60 мг, примерно 70 мг или примерно 80 мг.
В одном варианте осуществления доза вводимого пациенту агониста CaSR находится в диапазоне 10-20 мг, 10-30 мг, 20-30 мг, 20-40 мг, 30-50 мг или 40-60 мг. В другом варианте осуществления доза агониста CaSR, вводимого пациенту, находящемуся на гемодиализе, составляет менее 10 мг, менее 20 мг, менее 30 мг, менее 40 мг, менее 50 мг, менее 60 мг, менее 70 мг или менее 80 мг.
В одном варианте осуществления пациент получает фосфат-связывающее средство. Однако в другом варианте осуществления пациент не получает фосфат-связывающее средство.
В одном варианте осуществления традиционная процедура гемодиализа сама по себе является недостаточной для регуляции уровня фосфора в сыворотке пациента.
В одном варианте осуществления традиционная процедура гемодиализа, используемая совместно с введением фосфат-связывающих средств, является недостаточной для регуляции уровня фосфора в сыворотке пациента.
В одном варианте осуществления традиционная процедура гемодиализа, используемая совместно с диетическими ограничениями, является недостаточной для регуляции уровня фосфора в сыворотке пациента.
В одном варианте осуществления традиционная процедура гемодиализа, используемая совместно с введением фосфат-связывающих средств и диетическими ограничениями, является недостаточной для регуляции уровня фосфора в сыворотке пациента.
В одном варианте осуществления пациент также принимает витамин D или аналог витамина D.
Другие причины гиперфосфатемии включают повышенную нагрузку или абсорбцию экзогенного фосфора у недоношенных новорожденных, связанную с высоким содержанием фосфора в коровьем молоке, внутривенное добавление фосфора, быстрое окисление белого фосфора, PO34-содержащие клизмы или острое отравление фосфором. Гиперфосфатемия может возникать в результате повышенных эндогенных нагрузок, обусловленных синдромом лизиса опухоли, острым некрозом скелетных мышц, инфарктом кишечника, злокачественной гипертермией, тепловым ударом, кислотно-основными расстройствами, органическим ацидозом, лактоцидозом, кетоацидозом, респираторным ацидозом или хроническим респираторным алкалозом. Гиперфосфатемия может быть вызвана такими факторами, как пониженная экскреция в результате почечной недостаточности, гипопаратиреоз, псевдогипопаратиреоз, интоксикация витамином D, гормон роста, инсулин-подобный фактор роста-1, выброс глюкокортикоидов, дефицит Mg2+, опухолевый кальциноз, введение дифосфонатов или гипофосфатазия. Следует понимать, что раскрытые здесь способы введения можно использовать для лечения субъектов с диагностированной гиперфосфатемией, вызванной одним или несколькими из указанных выше факторов.
Описанные здесь способы можно использовать для лечения разных групп пациентов. Например, изобретение предлагает способ лечения находящихся на гемодиализе пациентов с сопутствующей гиперфосфатемией, способ лечения пациентов, у которых традиционная процедура гемодиализа сама по себе не позволяет в достаточной степени регулировать уровень фосфата в сыворотке. В альтернативном аспекте изобретение предлагает способ лечения находящихся на гемодиализе пациентов, принимающих диету с ограничением по фосфору. Изобретение также предлагает способ лечения находящихся на гемодиализе пациентов, которым вводят средства, связывающие фосфат, и/или которые принимают витамин D, и у которых наблюдается сопутствующее повышение уровня фосфора в сыворотке.
В любом из описанных здесь аспектов или вариантов осуществления предполагается, что один или несколько агонистов CaSR индивидуально исключаются или удаляются из сферы раскрытых здесь соединений, предназначенных для введения. В некоторых вариантах осуществления один или несколько пептидов, выбранных из группы, включающей SEQ ID NO:162-182, отдельно или в любом сочетании исключаются из заявляемых способов.
Например, в одном аспекте изобретение предлагает способ лечения находящегося на диализе пациента, страдающего, например, от SHPT, или CKD, или ESRD, где агонист CaSR вводят в течение примерно 18 часов после завершения диализа (предпочтительно гемодиализа), или в течение примерно 6 часов, 4 часов, 3 часов, 2 часов, 1 часа, 30 минут, 20 минут, 10 минут или 9, 8, 7, 6, 5, 4, 3, 2 или 1 минуты после завершения диализа (предпочтительно гемодиализа). В данном способе введение агониста CaSR позволяет эффективно поддерживать постдиализную концентрацию фосфора в сыворотке на более низком уровне, чем концентрация фосфора в сыворотке до диализа, в течение периода, составляющего по меньшей мере 6 часов, более предпочтительно в течение периода, составляющего 24 часа, еще более предпочтительно в течение периода, составляющего 36, 48, 60 или 72 часа. В одном варианте осуществления постдиализный уровень фосфора в сыворотке остается ниже уровня фосфора в сыворотке пациента до диализа в течение промежутка между сеансами диализа (также называемого междиализный период). В одном варианте осуществления данного способа агонист CaSR отличается от соединения формулы X1-X2-X3-X4-X5-X6-X7, где субъединицы X имеют указанные здесь значения.
В другом аспекте изобретение предлагает способ лечения гиперфосфатемии у субъекта, находящегося на диализе, где субъект получает соединение-агонист CaSR, как описано в данном документе. Указанный способ лечения позволяет эффективно поддерживать постдиализную концентрацию фосфора в сыворотке на более низком уровне, чем концентрация фосфора в сыворотке до диализа, в течение междиализного периода. В одном варианте осуществления в течение междиализного периода постдиализный уровень фосфора в сыворотке по меньшей мере примерно на 10% или 25% меньше, чем уровень фосфора в сыворотке до диализа. Соединение-агонист CaSR вводят в соответствии с одним из описанных здесь вариантов осуществления способа лечения, например, до завершения сеанса диализа, или в течение примерно 2, 4, 6, 10 или 18 часов после сеанса диализа.
III. Соединения-агонисты кальций-чувствительного рецептора и содержащие их композиции
Описанные здесь способы включают введение субъекту агониста CaSR. Такие агонисты описаны в патентах США № 6011068 и 6031003 и в публикациях патентов США № 2011/0028394 и 2009/0023652 (включенных в настоящее описание в качестве ссылки во всей полноте).
Неожиданно было обнаружено, что введение указанных соединений субъектам, страдающим от CKD и нуждающимся в диализе, приводит к подавлению или уменьшению накопления фосфора в сыворотке после диализа.
В одном варианте осуществления способ включает введение пациенту агониста CaSR. В одном варианте осуществления агонист CaSR представляет собой миметик кальция. В другом варианте осуществления агонист CaSR представляет собой аллостерический агонист. В другом варианте осуществления агонист CaSR представляет собой цинакальцета гидрохлорид. В другом варианте осуществления агонист CaSR представляет собой соединение, имеющее формулу:
X1-X2-X3-X4-X5-X6-X7
где X1 представляет собой субъединицу, в состав которой входит тиол-содержащая группа; X5 представляет собой катионную субъединицу; X6 представляет собой некатионную субъединицу; X7 представляет собой катионную субъединицу; и по меньшей мере два из X2, X3 и X4 независимо обозначают катионные субъединицы.
В одном варианте осуществления агонист CaSR представляет собой соединение, содержащее последовательность carrrar (SEQ ID NO:2). В другом варианте осуществления агонист CaSR представляет собой конъюгат, содержащий пептид carrrar (SEQ ID NO:2), конъюгированный по его N-концевому остатку с остатком Cys. В предпочтительном варианте осуществления конъюгат представляет собой Ac-c(C)arrrar-NH2 (SEQ ID NO:3). Хотя изобретение описывается со ссылкой на определенные предпочтительные варианты осуществления, такие как SEQ ID NO:3, для специалистов в данной области очевидно, что настоящее описание также применимо к другим агонистам CaSR, включающим соединения и конъюгаты, описанные в патентах США № 6011068 и 6031003 и в публикациях патентов США № 2011/0028394 и 2009/0023652 (включенных в настоящее описание в качестве ссылки во всей полноте). Подобным образом, хотя изобретение описывается со ссылкой на определенные предпочтительные варианты осуществления, такие как гемодиализ, для специалистов в данной области очевидно, что настоящее описание также применимо к другим формам диализа, таким как перитонеальный диализ, и к другим подходам, таким как ежедневный гемодиализ.
В одном варианте осуществления агонист CaSR вводят в составе композиции, содержащей соединение-агонист CaSR и фармацевтически приемлемый наполнитель. В некоторых вариантах осуществления наполнитель представляет собой буфер или физиологический раствор, так что вводимая пациенту композиция находится в виде раствора. В одном варианте осуществления соединение-агонист находится в виде лиофилизированного продукта, который используют для получения раствора или суспензии для введения в соответствии с описанными здесь способами. В одном варианте осуществления лиофилизированный продукт представляет собой солевую форму агониста, такую как цинакальцета гидрохлорид или гидрохлорид пептида формулы SEQ ID NO:3.
Пептидные соединения и взаимозависимость структура-активность
Синтезируют несколько соединений, чтобы тестировать их влияние на снижение уровня сывороточного фосфора и на гиперфосфатемию. Указанные соединения перечислены ниже в таблице 2. В таблице 1 и на всем протяжении описания остатки, обозначенные заглавными буквами, представляют собой L-аминокислоты, тогда как буквы нижнего регистра обозначают D-аминокислоты. "Ac" обозначает ацетильную кэпирующую группу, "NH2" обозначает амидную кэпирующую группу, "Ac-bAla" обозначает ацетилированный бета-аланин, "GSH" обозначает восстановленный глутатион, "GS" обозначает окисленный глутатион, "PEG" обозначает полиэтиленгликоль, "PEG2" и "PEG5" обозначают фрагменты полиэтиленгликоля массой 2 кДа и 5 кДа, соответственно, а "Mpa" обозначает меркаптопропионовую кислоту. Путем заключения в скобки обозначают группу или фрагмент, присоединенные к боковой цепи предшествующей субъединицы или предшествующего аминокислотного остатка.




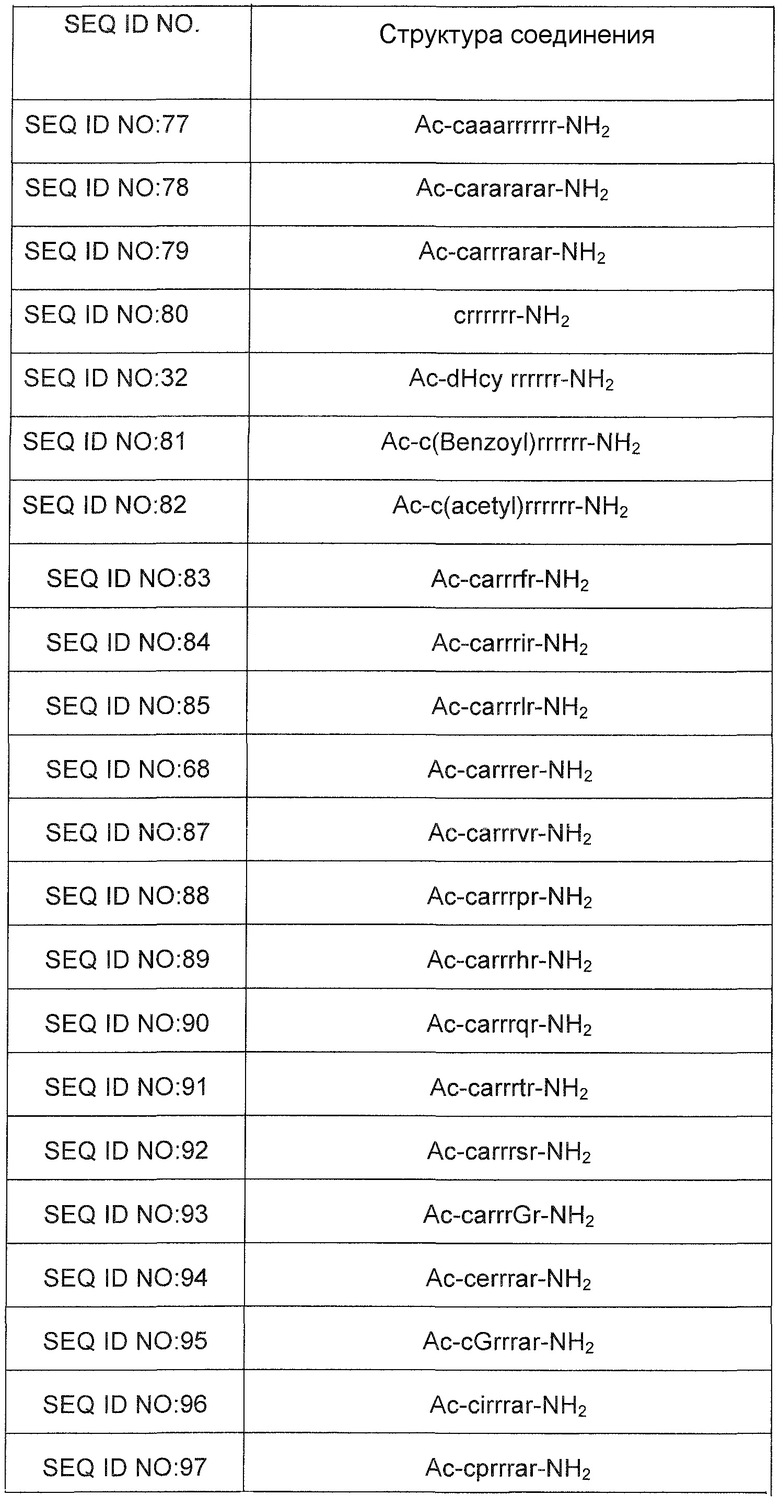

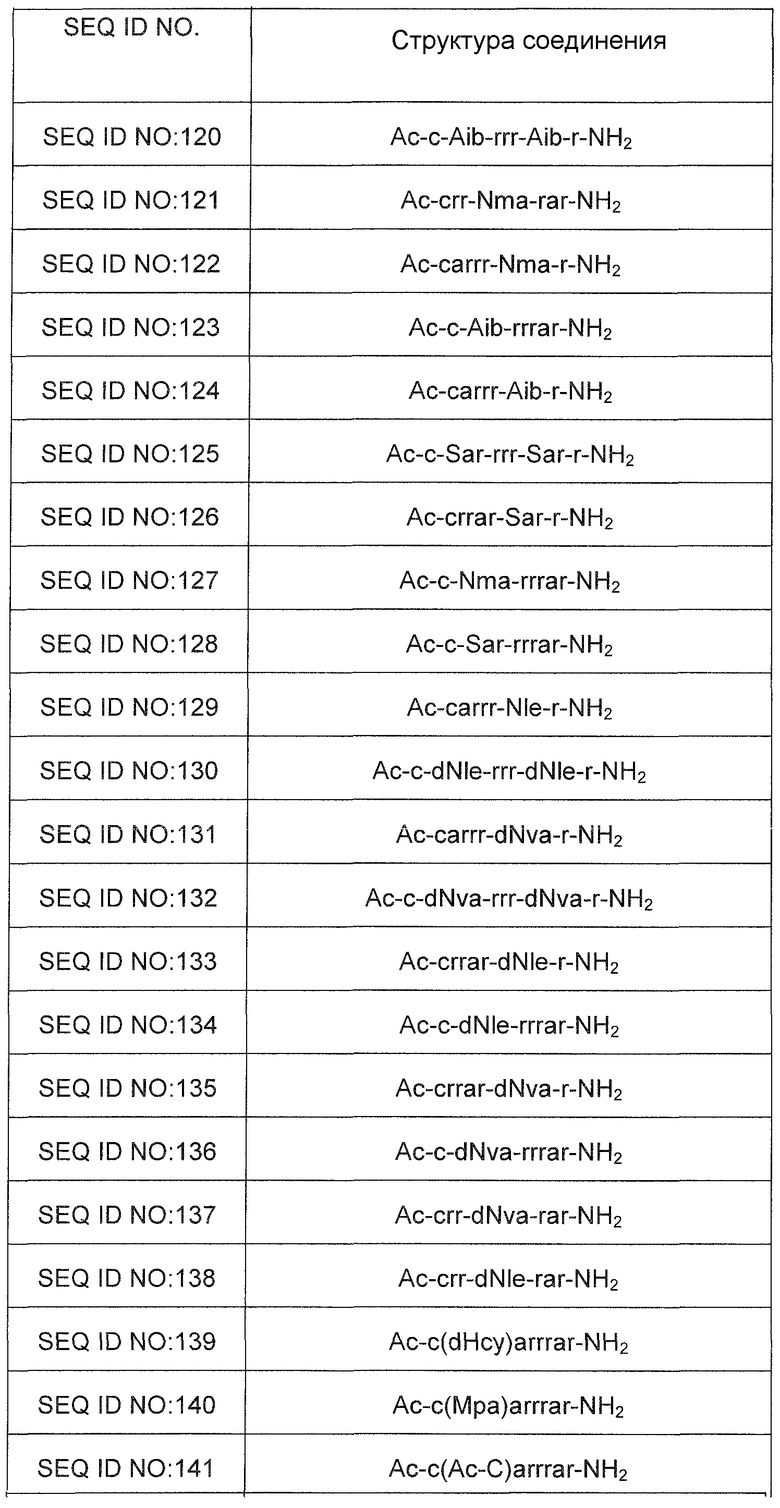
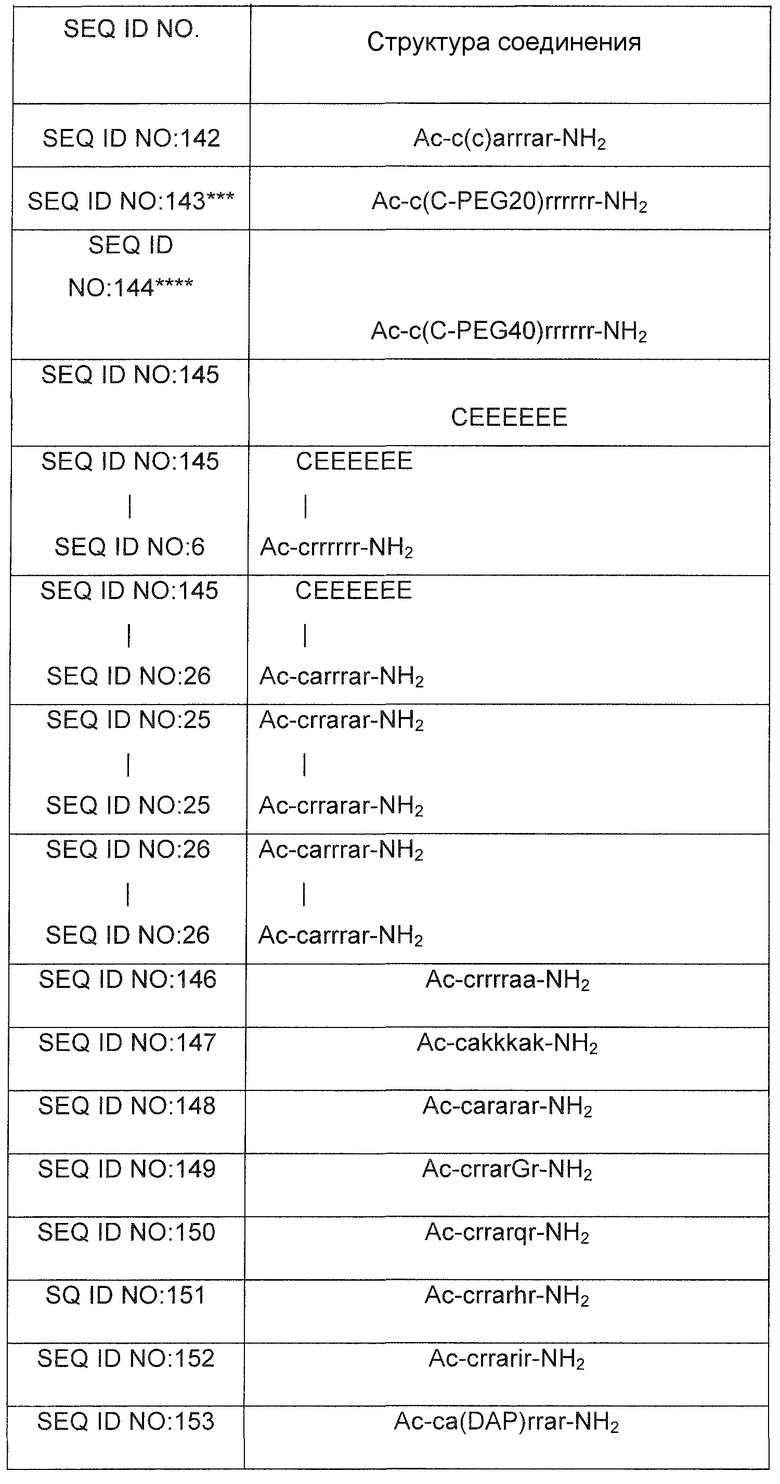
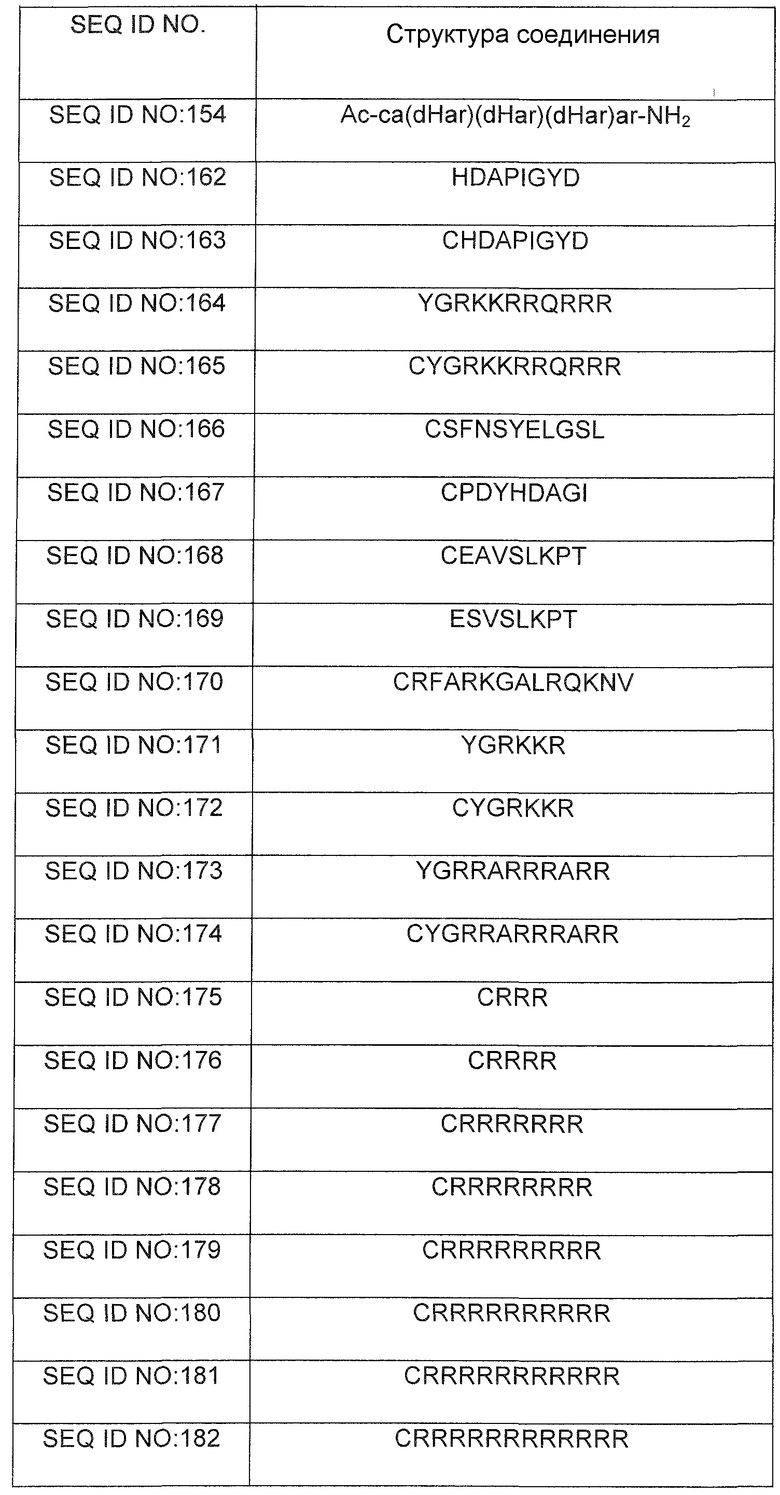
*Жирным шрифтом в скобках обозначают соответствующие тиол-содержащие конъюгированные группы. GS = окисленный глутатион; dHcy = D-гомоцистеин; Mpa = меркаптопропионовая кислота; PEG = полиэтиленгликоль.
Указанные соединения включают (i) Ac-crrrr-NH2 (SEQ ID NO:4), (ii) Ac-crrrrr-NH2 (SEQ ID NO:5), (iii) Ac-crrrrrr-NH2 (SEQ ID NO:6) и (iv) Ac-crrrrrrr-NH2 (SEQ ID NO:7). В предыдущих исследованиях получены результаты, свидетельствующие о том, что каждое из соединений, идентифицированных как SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6 и SEQ ID NO:7, вводимых животным моделям 1K1C путем в.в. инфузии в течение 30 минут, вызывает уменьшение уровня PTH в плазме, которое выражают в виде процента от уровня, наблюдающегося до введения соединения (исходный уровень). Все четыре соединения в дозе 3 мг/кг вызывают значительное уменьшение уровня PTH в плазме, однако различия в эффективности и длительности снижения уровня PTH позволяют сделать заключение о взаимосвязи суммарного положительного заряда и способности уменьшать уровень PTH. Например, соединение Ac-crrrrrr-NH2 (SEQ ID NO:6), содержащее шесть катионных субъединиц (аргинин), обладает повышенной эффективностью и продолжительностью действия по сравнению с соединениями Ac-crrrr-NH2 (SEQ ID NO:4) и Ac-crrrrr-NH2 (SEQ ID NO:5), содержащими четыре и пять катионных субъединиц (аргинин), соответственно. Неожиданно было обнаружено, что соединение Ac-crrrrrr-NH2 (SEQ ID NO:6), содержащее шесть катионных субъединиц (аргинин), обладает более высокой продолжительностью действия по сравнению с соединением Ac-crrrrrrr-NH2 (SEQ ID NO:7), содержащим семь катионных остатков (аргинин), и это позволило сделать вывод, что активность или эффективность соединений коррелирует не только с повышением катионного заряда соединения. То есть, соединение Ac-crrrrrrr-NH2 (SEQ ID NO:7), содержащее семь катионных субъединиц (остатков аргинина), вначале вызывает такое же уменьшение уровня PTH, как и соединения с меньшим числом катионных остатков, однако через 24 часа после введения его действие становится менее эффективным, чем действие Ac-crrrrrr-NH2 (SEQ ID NO:6) и Ac-crrrrr-NH2 (SEQ ID NO:5). Через 24 часа среднее уменьшение уровня PTH, вызванное двумя последними соединениями, составляет ~40% и 60%, соответственно. Следует отметить, что участвующие в данном исследовании соединения вводят в одинаковой дозе, измеряемой в мг/кг, однако вследствие различия в молекулярной массе количества молей вводимых соединений в действительности различаются. Следовательно, в пересчете на молярную основу Ac-crrrrrr-NH2 (SEQ ID NO:6) является значительно более активным, чем Ac-crrrr-NH2 (SEQ ID NO:4) и Ac-crrrrr-NH2 (SEQ ID NO:5).
Чтобы установить зависимость структура-активность для указанных соединений, проводят дополнительные исследования. Соединение Ac-crrrrrr-NH2 (SEQ ID NO:6) модифицируют путем последовательной замены остатка аргинина на остаток аланина в каждом из положений субъединиц X2-X7. Соединения характеризуют с помощью анализа человеческого кальций-чувствительного рецептора in vitro (CaSR), используя для измерения активности анализируемых соединений клетки HEK 293, экспрессирующие человеческий кальций-чувствительный рецептор.
Соединения Ac-crrrrrr-NH2 (SEQ ID NO:6), Ac-carrrrr-NH2 (SEQ ID NO:8) и Ac-crrarrr-NH2 (SEQ ID NO:10) являются достаточно активными, что подтверждает уменьшение содержания PTH до значения, находящегося ниже предела чувствительности, или практически до нуля, измеряемое in vivo после однократного в.в. введения нормальным крысам. Замена катионного остатка (аргинин) в положениях 2, 3, 4 или 7 Ac-crrrrrr-NH2 (SEQ ID NO:6) приводит примерно к двукратному снижению активности in vitro. Замена в положении 5 с получением соединения Ac-crrrarr-NH2 (SEQ ID NO:11) вызывает снижение активности in vitro в 5-10 раз, хотя соединение, вызывающее in vivo уменьшение AUC PTH на 45%, может быть достаточно активным для клинической терапии. Неожиданно было обнаружено, что замена катионного остатка аргинина в положении 6 на незаряженный остаток (аланин) в действительности приводит к увеличению активности. Полученные результаты демонстрируют, что катионные и незаряженные остатки в разных положениях не являются эквивалентными и что изменение структуры соединения приводит к изменению активности.
Чтобы дополнительно оценить влияние изменения структуры соединения на его активность, получают ряд аналогов Ac-crrrrrr-NH2 (SEQ ID NO:6), содержащих двойные аминокислотные замены, где два катионных остатка (аргинин) заменяют на незаряженные остатки (аланин) и затем анализируют активность полученных соединений. Неожиданно было обнаружено, что на активность соединений, проявляющуюся в уменьшении уровня PTH, может влиять положение зарядов и суммарный катионный заряд. Полученные данные позволяют предположить, что для проявления PTH-снижающей активности важно, чтобы в SEQ ID NO:6 катионные остатки присутствовали в положениях 5 и 7, но необязательно в положении 6.
Дополнительные исследования зависимости структура-активность проводят, используя in vitro анализ клеток HEK 293, которые экспрессируют человеческий кальций-чувствительный рецептор. Способность пептидов Ac-carrrar-NH2 (SEQ ID NO:26) и Ac-arrrar-NH2 (SEQ ID NO:29) активировать человеческий CaSR определяют путем измерения накопления монофосфата инозитола (IP1), который отражает продукцию IP3. Отсутствие N-концевого остатка D-цистеина в SEQ ID NO:29 значительно снижает способность соединения активировать CaSR по сравнению с SEQ ID NO:26. То есть, удаление N-концевого остатка цистеина значительно уменьшает активность соединения, поскольку пептиды Ac-carrrar-NH (SEQ ID NO:26) и Ac-arrrar-NH2 (SEQ ID NO:29) отличаются только присутствием или отсутствием N-концевого остатка D-цистеина.
Влияние введения тиол-содержащей группы (например, в некоторых вариантах осуществления, где соединение представляет собой пептид, по N-концевому остатку) в субъединицу X1 на активность соединения также исследуют in vivo. PTH-снижающую активность пептидов, идентифицированных как SEQ ID NO:26 (Ac-carrrar-NH2) и SEQ ID NO:29 (Ac-arrrar-NH2), анализируют in vivo. Доза 0,5 мг/кг пептида Ac-carrrar-NH2 (SEQ ID NO:26) снижает концентрацию PTH в крови до недектируемого уровня в течение промежутка времени, составляющего до 4 часов, после введения. И наоборот, пептид, в котором отсутствует тиол-содержащий N-концевой остаток, Ac-arrrar-NH2 (SEQ ID NO:29), не уменьшает концентрацию PTH даже при значительно более высокой дозе (т.е. 9 мг/кг).
Зависимость структура-активность с учетом тиол-содержащей группы, входящей в состав субъединицы X1 соединения, дополнительно исследуют путем получения соединений с различными субъединицами X1. Соединения тестируют in vivo на активность, связанную со снижением PTH у нормальных крыс. Полученные результаты демонстрируют, что тиол-содержащая субъединица может варьировать. Тестируют соединения, содержащие на N-концевом остатке D-цистеин (cys), D-пеницилламин (dPen), d-гомоцистеин (dHcy) и меркаптопропионовую кислоту (Mpa). Кроме того, с N-концевым тиол-содержащим остатком можно конъюгировать природную или неприродную аминокислоту, такую как бета-аланин. Полученные результаты демонстрируют, что катионные соединения, такие как Ac-crrrrrr-NH2 (SEQ ID NO:6), которые содержат разные тиол-содержащие группы в составе субъединицы X1, эффективно уменьшают уровень PTH in vivo. Замена N-концевого остатка цистеина на метионин, который не содержит тиольную группу, приводит к получению соединения с очень низкой PTH-снижающей активностью in vivo.
На основе описанных выше исследований можно сделать вывод, что соединения с непрерывной последовательностью субъединиц X1-X2-X3-X4-X5-X6-X7, где X1 представляет собой субъединицу, в состав которой входит тиол-содержащая группа, обладают способностью уменьшать уровень паращитовидного гормона. В одном варианте осуществления тиол-содержащая группа субъединицы X1 выбрана из группы, включающей тиол-содержащие аминокислотные остатки и органические тиол-содержащие фрагменты. В другом варианте осуществления тиол-содержащая группа способна взаимодействовать с другой тиольной группой при физиологических значениях pH и температуры. В некоторых вариантах осуществления, где тиол-содержащий остаток представляет собой аминокислотный остаток, субъединица X1 может быть выбрана из цистеина, глутатиона, меркаптопропионовой кислоты, н-ацетилированного цистеина и пэгилированного цистеина. В вариантах осуществления, где тиол-содержащая группа представляет собой субъединицу, отличную от аминокислотного остатка, такую как маленькая органическая молекула, в состав которой входит тиол-содержащая группа, субъединица X1 может представлять собой тиолалкильный или тиоацильный фрагмент, такой как 3-меркаптопропильный или 3-меркаптопропионильный остаток. В одном варианте осуществления тиол отличается от гомоцистеина.
Чтобы дополнительно оценить влияние свойств каждой субъединицы, входящей в состав соединения, на его терапевтическую активность, проводят очередные исследования зависимости структура-активность. На основе каркаса Ac-c(C)arrrar-NH2 (SEQ ID NO:3), обладающего способностью снижать уровень PTH, получают ряд соединений путем замены остатков L-аминокислот на остатки D-аминокислот. Соединения вводят субъектам и измеряют уровни PTH до введения и через 1, 2, 3 и 4 часа после введения.
Типичные соединения, приведенные в таблице 1, можно химически модифицировать как по N-концу, так и по C-концу, как указано обозначениями Ac и NH2. Последовательность из семи субъединиц carrrar (SEQ ID NO:3), где все субъединицы представляют собой D-аминокислотные остатки, модифицируют путем замены единовременно одной субъединицы на L-аминокислоту. Субъединица X1 представляет собой остаток D-Cys (или остаток L-Cys в SEQ ID NO:34), конъюгированный посредством дисульфидной связи с остатком L-Cys, что обозначают путем заключения в скобки (C). Предыдущие исследования показали, что на активность соединений влияет хиральность Arg и Ala. В одном варианте осуществления изобретение предлагает соединение с последовательностью X1-X2-X3-X4-X5-X6-X7, где по меньшей мере субъединицы, обозначенные X4 и X7, представляют собой остатки D-аминокислот. В другом варианте осуществления субъединицы, обозначенные X4, X5, X6 и X7, представляют собой остатки D-аминокислот. В предпочтительном варианте осуществления субъединицы, обозначенные X3, X4, X5, X6 и X7, представляют собой остатки D-аминокислот. В наиболее предпочтительных вариантах осуществления субъединицы, обозначенные X2, X3, X4, X5, X6 и X7, представляют собой остатки D-аминокислот, и все субъединицы, обозначенные X1, X2, X3, X4, X5, X6 и X7, представляют собой остатки D-аминокислот.
В других исследованиях также было обнаружено, что замена пептида, содержащего только L-аминокислоты, на пептид, содержащий только D-аминокислоты, не приводит к уменьшению активности пептидов in vitro; фактически пептиды, содержащие только D-аминокислоты, по всей видимости, увеличивают активность, связанную с активацией CaSR. Также было показано, что замена некоторых катионных остатков (аргинин), находящихся в определенных положениях по отношению к остатку цистеина, на незаряженные остатки (аланин) оказывает минимальное влияние на активность в отношении CaSR.
Чтобы дополнительно охарактеризовать взаимозависимость между структурой и активностью в отношении CaSR, тестируют ряд катионных пептидов с разным числом (от 4 до 8) остатков аргинина (все указанные пептиды содержат N-концевой цистеин) путем анализа клеток HEK-293 in vitro. Обнаружена непосредственная корреляция между числом катионных субъединиц и активностью соединения, где активность оценивают по способности активировать CaSR. Уменьшение числа катионных субъединиц (таких как аргинин) от 5 до 4 приводит к максимальному сдвигу активности (>10 раз), свидетельствуя о том, что может существовать точка перегиба кривой активности соединений с указанными суммарными зарядами, и что присутствие катионной субъединицы в положении X5 предпочтительно для проявления активности. Соответственно, изобретение предлагает соединения структуры X1-X2-X3-X4-X5-X6-X7, где X5 представляет собой катионную субъединицу. В некоторых вариантах осуществления X1 представляет собой субъединицу, содержащую тиольную группу, способную взаимодействовать с другой тиольной группой в физиологических условиях ("реакционноспособный тиол" представляет собой тиол, который взаимодействует с другим тиолом (например, цистеин может взаимодействовать с цистеином) в физиологических условиях, т.е. при pH 7,4 и температуре тела).
Неожиданно было обнаружено, что Ac-crrrrrr-NH2 (SEQ ID NO:6), содержащий шесть катионных остатков, по результатам анализа in vivo проявляет более высокую и более продолжительную активность, чем Ac-crrrrrrrr-NH2 (SEQ ID NO:41), содержащий восемь катионных остатков. Данные результаты находятся в противоречии с наблюдением, заключающимся в том, что SEQ ID NO:41 более эффективно активирует CaSR в указанном клеточном анализе in vitro. Без связи с какой-либо теорией авторы полагают, что превосходные характеристики Ac-crrrrrr-NH2 (SEQ ID NO:6) in vivo могут быть обусловлены более совершенными фармакокинетическими свойствами Ac-crrrrrr-NH2 (SEQ ID NO:6), поскольку Ac-crrrrrrrr-NH2 (SEQ ID NO:41) предположительно может поглощаться клетками благодаря его способности проникать в клетки и, следовательно, удаляется от активного фрагмента CaSR.
Чтобы дополнительно исследовать зависимость структура-активность для Ac-crrrrrr-NH2 (SEQ ID NO:6), некоторые катионные остатки (аргинин) заменяют на незаряженные остатки (аланин). Обнаружено, что замена катионных остатков (аргинин) в положениях субъединиц X2 и X4 приводит к получению соединения (SEQ ID NO:15), которое обладает гораздо более низкой активностью в отношении активации CaSR in vitro. И наоборот, замена катионных остатков (аргинин) в положениях субъединиц X2 и X6 приводит к получению соединения (SEQ ID NO:26), которое сохраняет основную долю активности Ac-crrrrrr-NH2 (SEQ ID NO:6). Полученные результаты позволяют предположить, что положение заряженных остатков в соединении вносит вклад в проявление активности, который в некоторых вариантах осуществления может превышать вклад суммарного положительного заряда пептида. Кроме того, катионные остатки (аргинин) в некоторых положениях, таких как положение субъединицы X5, вносят вклад несоразмерно активности.
Обнаружено, что присутствие N-концевого цистеина значительно увеличивает способность пептидов активировать CaSR. CaSR представляет собой 7-трансмембранный G-белок-сопряженный рецептор с большим внеклеточным доменом, который функционирует как гомодимерный рецептор. Во внеклеточном домене присутствует 18 остатков цистеина, и с помощью анализа полиморфизмов или мутационного анализа показано, что некоторые из них играют важную роль в проявлении активности рецептора. Следует особо отметить остатки цистеина 129 и 131 участка 2 петли внеклеточного домена. Полагают, что остатки цистеина 129 и 131 образуют межмолекулярный дисульфидный мостик между двумя мономерами рецепторного комплекса, который находится в замкнутой или ингибированной конфигурации. Мутация цистеина 129 активирует CaSR, как и ряд других мутаций, включающих полное удаление участка петли 2. Повышенная активность, обусловленная присутствием N-концевого остатка цистеина в описанных соединениях, может быть следствием специфического взаимодействия с одним или более остатками цистеина во внеклеточном домене CaSR.
Чтобы оценить влияние хиральности аминокислот на активность в отношении CaSR in vitro, получают ряд аналогов Ac-crrrrrr-NH2 (SEQ ID NO:6), содержащих замены на L-аминокислоты или ахиральные аминокислоты (глицин) в разных положениях, и тестируют их на активность в отношении CaSR. Тестируемые аналоги включают Ac-cGrrrGr-NH2 (SEQ ID NO:42), (ii) Ac-cArrrAr-NH2 (SEQ ID NO:43) и (iii) Ac-CaRrRaR-NH2 (SEQ ID NO:44). Все вышеуказанные аналоги обладают гораздо более низкой активностью, чем Ac-crrrrrr-NH2 (SEQ ID NO:6), причем разница в активности варьирует от 10 раз в случае SEQ ID NO:44 (наиболее активный из трех аналогов) до более 2000 раз в случае SEQ ID NO:43 (наименее активный из трех аналогов). Гораздо меньше (разница в ~3 раза) изменяется активность Ac-carrrar-NH2 (SEQ ID NO:26), в котором катионные остатки D-аминокислот (остатки D-аргинина) в положениях 2 и 6 SEQ ID NO:6 заменяют на незаряженные остатки D-аминокислот (остатки D-аргинина). Таким образом, неожиданно было обнаружено, что прерывание последовательности D-аминокислот Ac-crrrrrr-NH2 (SEQ ID NO:6) двумя или более остатками L-аминокислот приводит к значительному уменьшению активности. Неожиданным также является то, что активность соединения, в котором прерывающий остаток представляет собой остаток незаряженной ахиральной аминокислоты (остаток глицина), уменьшается более чем в 80 раз по сравнению с соединением, в котором прерывающий остаток представляет собой остаток незаряженной L-аминокислоты (остаток L-аланина).
Кроме того, неожиданным является то, что замена двух остатков незаряженных D-аминокислот (остатков D-аланина) в Ac-carrrar-NH2 (SEQ ID NO:26) на L-аналоги (SEQ ID NO:43) приводит к уменьшению активности более чем в 600 раз, хотя замена их на остатки незаряженных ахиральных аминокислот (остатки глицина) (SEQ ID NO:42) приводит к менее чем 8-кратному уменьшению активности; и что замена трех остатков катионных D-аминокислот (остатки D-аргинина) в Ac-carrrar-NH2 (SEQ ID NO:26) на L-аналоги (SEQ ID NO:44) обусловливает менее чем 4-кратную разницу в активности.
В другом исследовании зависимости структура-активность вклад некатионных аминокислот в проявление активности пептидов анализируют путем получения ряда пептидов, содержащих остатки разных D-аминокислот или глицина, или остатки стерически затрудненных неприродных аминокислот, замещенных по разным положениям, таких как пептид Ac-carrrar-NH2 (SEQ ID NO:26) и пептид Ac-crrarar-NH2 (SEQ ID NO:153). Указанные пептиды вводят в виде в.в. болюса нормальным крысам Sprague Dawley в дозе 0,5 мг/кг. Внутривенный (в.в.) болюс физиологического раствора используют в качестве контроля. Уровень PTH в плазме определяют до введения соединения и через 1, 2, 3 и 4 часа после введения. Результаты показывают, что 1) маленькие аминокислоты, такие как аланин, глицин или серин, предпочтительны в положении 6 пептида Ac-carrrar-NH2 (SEQ ID NO:26), 2) аланин в положении 2 пептида Ac-carrrar-NH2 (SEQ ID NO:26) гораздо больше подходит для замещения и может быть заменен на гидрофобные (например, D-Val, D-Leu), ароматические (например, D-Phe) или полярные (например, D-Ser, D-Gln) природные аминокислоты, а также на неприродные объемные гидрофобные аминокислоты (например, dNle, dNva), но не на кислые, и 3) остаток аланина в положении 4 пептида Ac-crrarar-NH2 (SEQ ID NO:25) также хорошо подходит для замещения и может быть заменен на природные аминокислоты большинства типов (а также неприродные объемные гидрофобные аминокислоты (например, dNle, dNva)), но не подходит для замены на аминокислоты, которые влияют на вторичную конформацию, такие как глицин или пролин, или на аминокислоты с кислой боковой цепью.
Активность ряда пептидов и конъюгатов тестируют по их влиянию на человеческий CaSR. Указанные исследования проводят путем измерения продукции IP1 в клетках HEK293, экспрессирующих человеческий CaSR. Результаты приведены ниже в таблице 3.
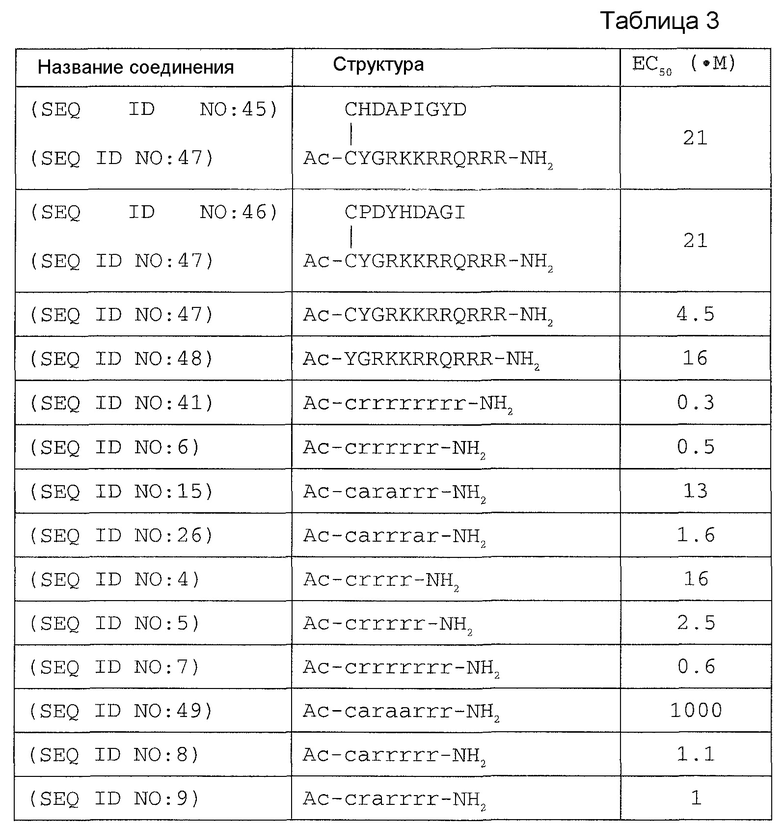
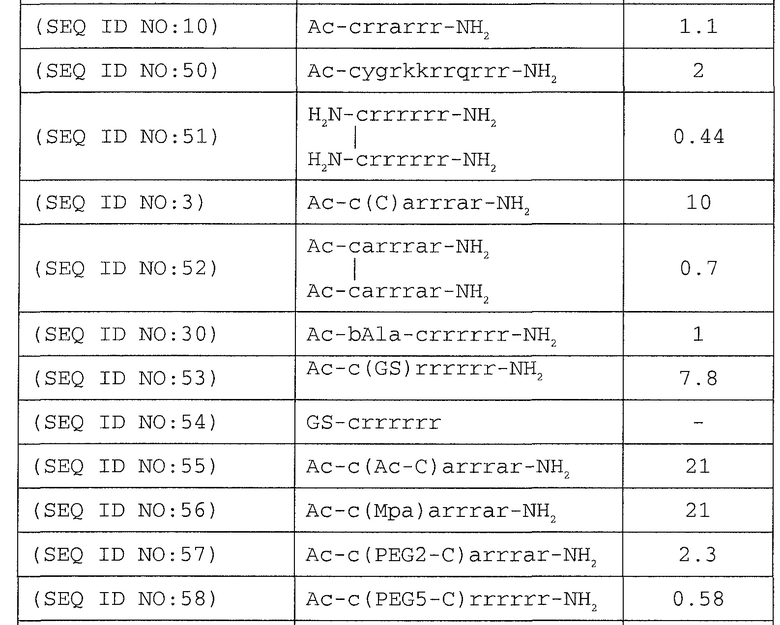
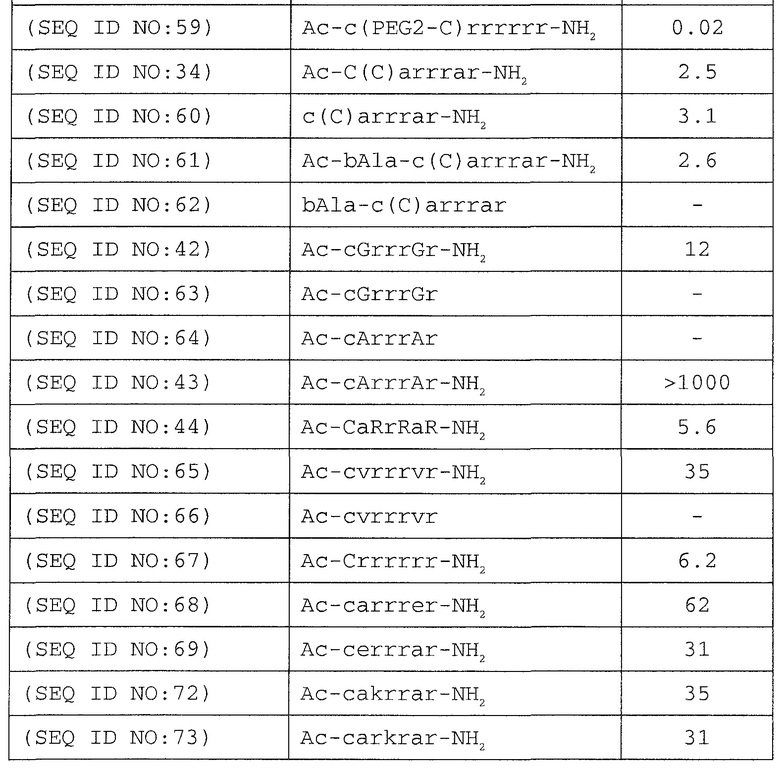
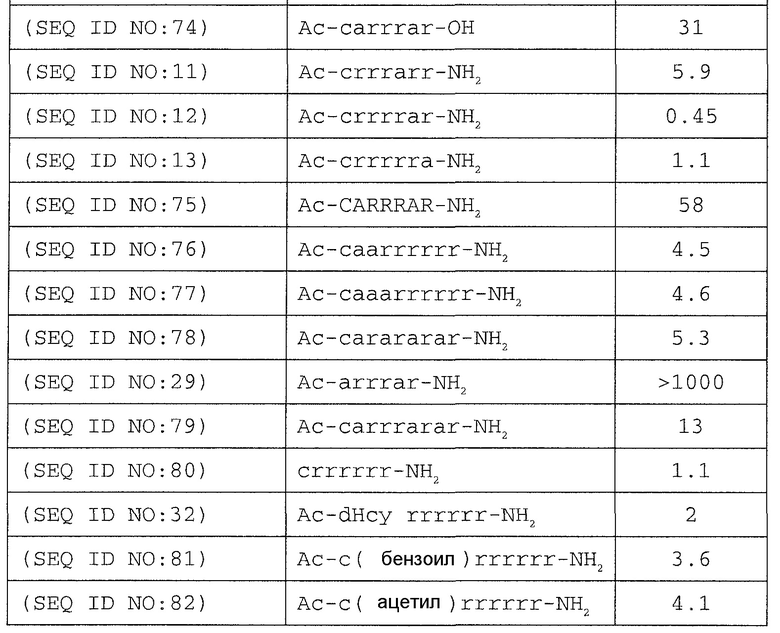
Раскрытые здесь соединения, как правило, содержат один или несколько тиольных фрагментов, предпочтительно один или несколько реакционноспособных тиольных фрагментов. Субъединицы, содержащие тиольную группу, включают отличные от аминокислот соединения, содержащие тиольную группу, и аминокислоты, содержащие тиольную группу. Тиольная группа тиол-содержащей субъединицы может находиться в конъюгированной форме (например, она может участвовать в образовании дисульфидной связи с конъюгирующей группой (партнером по конъюгации)) или в неконъюгированной форме (т.е. в виде восстановленного тиола). В предпочтительном варианте осуществления тиольная группа, находящаяся в неконъгированной форме или в конъюгированной форме, способна к образованию дисульфидной связи с тиол-содержащей группой. Тиол-содержащий остаток может находиться в любом положении пептидной цепи, в том числе на аминоконце, на карбоксиконце, или в любом другом положении. В предпочтительном варианте осуществления тиол-содержащий остаток или тиол-содержащая субъединица может находиться на аминоконце. В других вариантах осуществления тиол-содержащий остаток или тиол-содержащая субъединица может находиться на карбоксиконце или на протяжении всей пептидной последовательности.
Некоторые типичные примеры тиол-содержащих остатков включают, без ограничения, цистеин, меркаптопропионовую кислоту, гомоцистеин и пеницилламин. Если тиол-содержащий остаток содержит хиральный центр, он может находиться в L- или D-конфигурации. В предпочтительном варианте осуществления тиол-содержащий остаток представляет собой цистеин.
В некоторых вариантах осуществления поперечная связь между тиол-содержащей субъединицей в положении X1 соединения и тиол-содержащей конъюгирующей группой может расщепляться и/или она может участвовать в замене на другую тиол-содержащую конъюгирующую группу, такую как цистеин (например, путем восстановления дисульфидной связи), in vivo с образованием биологически активной формы соединения. В данном случае конъюгат можно использовать в качестве пролекарственной формы соединения. Конъюгирующую группу также можно использовать для изменения физико-химических, фармакокинетических и/или фармакодинамических свойств описанных соединений (например, для улучшения фармакокинетических параметров проводят конъюгирование с большим пэгилированным фрагментом посредством образования дисульфидной связи).
В некоторых вариантах осуществления соединение представляет собой пептид, содержащий аминокислотную последовательность (Xaa1)-(Xaa2)-(Xaa3)-(Xaa4)-(Xaa5)-(Xaa6)-(Xaa7) (SEQ ID NO:155), где (Xaa1) обозначает тиол-содержащий аминокислотный остаток, (Xaa2) обозначает некатионный аминокислотный остаток, (Xaa3) обозначает любой аминокислотный остаток, (Xaa4) обозначает любой аминокислотный остаток, (Xaa5) обозначает катионный аминокислотный остаток, (Xaa6) обозначает некатионный остаток, а (Xaa7) обозначает любой аминокислотный остаток. Пептид можно модифицировать по N-концу, по C-концу или по обоим концам. В предпочтительном варианте осуществления пептид модифицируют и по N-концу, и по C-концу путем ацетилирования и амидирования, соответственно.
В некоторых вариантах осуществления пептид содержит аминокислотную последовательность (D-Cys)-(Xaa2)-(Xaa3)-(Xaa4)-(Xaa5)-(Xaa6)-(Xaa7) (SEQ ID NO:156), где (Xaa2) обозначает некатионный аминокислотный остаток, (Xaa3) обозначает любой аминокислотный остаток, (Xaa4) обозначает любой аминокислотный остаток, (Xaa5) выбран из группы, включающей D-Arg, L-Arg, D-Lys и L-Lys, (Xaa6) обозначает некатионный остаток, а (Xaa7) обозначает любой аминокислотный остаток. Пептид может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления пептид содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу.
В некоторых вариантах осуществления пептид содержит аминокислотную последовательность (D-Cys)-(Xaa2)-(Xaa3)-(Xaa4)-(Xaa5)-(Xaa6)-(Xaa7) (SEQ ID NO:157), где (Xaa2), (Xaa3) и (Xaa4) независимо обозначают любые аминокислотные остатки (однако в предпочтительном варианте осуществления они независимо выбраны из группы, включающей D-Ala, D-Val, D-Leu, D-NorVal и D-NorLeu), (Xaa5) и (Xaa7) независимо обозначают любые катионные аминокислотные остатки (однако в предпочтительном варианте осуществления они независимо выбраны из группы, включающей D-Arg, L-Arg, D-Lys и L-Lys), (Xaa6) обозначает некатионный аминокислотный остаток (в предпочтительном варианте осуществления он выбран из группы, включающей D-Ala, D-Val, D-Leu, D-NorVal и D-NorLeu). Пептид может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления пептид содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу.
В некоторых вариантах осуществления пептид содержит аминокислотную последовательность (D-Cys)-(Xaa2)-(Xaa3)-(Xaa4)-(Xaa5)-(Xaa6)-(Xaa7) (SEQ ID NO:158), где (Xaa2) обозначает некатионный аминокислотный остаток, (Xaa3) обозначает любой аминокислотный остаток, (Xaa4) обозначает любой аминокислотный остаток, (Xaa5) выбран из группы, включающей D-Arg, L-Arg, D-Lys и L-Lys, (Xaa6) обозначает некатионный остаток, а (Xaa7) обозначает любой аминокислотный остаток. Пептид может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления пептид содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу.
В некоторых вариантах осуществления пептид содержит аминокислотную последовательность (D-Cys)-(D-Ala)-(Xaa3)-(Xaa4)-(D-Arg)-(D-Ala)-(Xaa7) (SEQ ID NO:159), где (Xaa3) обозначает любой катионный аминокислотный остаток, (Xaa4) обозначает любой катионный аминокислотный остаток и (Xaa7) обозначает любой катионный аминокислотный остаток. Пептид может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления пептид содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу.
В некоторых вариантах осуществления пептид содержит аминокислотную последовательность (D-Cys)-(Xaa2)-(Xaa3)-(D-Ala)-(D-Arg)-(D-Ala)-(Xaa7) (SEQ ID NO:160), где (Xaa2), (Xaa3) и (Xaa7) независимо обозначают любые катионные аминокислотные остатки. Пептид может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления пептид содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу.
Другой вариант осуществления относится к пептиду-миметику кальция, содержащему последовательность аминокислот, соединенных посредством пептидных связей, где последовательность содержит от 5 до 10 аминокислотных остатков, и где последовательность содержит аминоконец, карбоксиконец по меньшей мере один тиол-содержащий остаток и от 3 до 9 положительно заряженных остатков. В одном варианте осуществления, по меньшей мере, один тиол-содержащий остаток представляет собой остаток цистеина. В другом аспекте остаток цистеина находится на аминоконце пептида. В конкретном варианте осуществления остаток цистеина представляет собой остаток L-Cys, остаток D-Cys, или остаток L- или D-homoCys. В других вариантах осуществления аминокислотные остатки пептида представляют собой D-аминокислоты или L-аминокислоты.
В объем заявленных соединений также входят пептидомиметические молекулы, которые содержат примерно семь субъединиц, где по меньшей мере одна субъединица содержит тиольный фрагмент, предпочтительно реакционноспособный тиольный фрагмент, а другие субъединицы составляют совокупность некатионных субъединиц, и от 1 до 4 положительно заряженных субъединиц. Такие пептидомиметические молекулы могут содержать непептидные связи между двумя или более субъединицами. Разные признаки описанных выше соединений применимы в целом к пептидомиметической молекуле. Например, как описано выше, субъединицы, используемые для конструирования молекул, могут представлять собой природные аминокислоты, или остатки, содержащие неприродные боковые цепи, концы модулей могут необязательно содержать кэпирующие группы, как описано выше. Подобным образом аминокислотные остатки молекулы могут представлять собой L- или D-аминокислотные остатки. Кроме того, как описано выше, тиол-содержащие остатки могут находиться в восстановленном или окисленном виде и могут присоединяться к любым описанным выше тиол-содержащим фрагментам.
Разработано много пептидомиметических каркасов и способов их получения (Babine, R.E.; Bender, S.L., Chem. Rev., 97:1359, 1997; Hanessian, S.; et al., Tetrahedron, 53:12789, 1997; Fletcher, M.D.; Cambell, M.C., Chem. Rev., 98:763, 1998); Peptidomimetics Protocols; Kazmierski W.M., Ed.; Methods in Molecular Medicine Series, Vol. 23; Humana Press, Inc.; Totowa, N.J. (1999).
Конъюгаты
В некоторых вариантах осуществления соединение подвергают химической поперечной сшивке с тиол-содержащей конъюгирующей группой посредством образования дисульфидной связи между тиольной группой соединения и тиолом конъюгирующей группы. Тиол-содержащая конъюгирующая группа может представлять собой маленькую молекулу, такую как цистеин, или макромолекулу, такую как полипептид, содержащий остаток цистеина. Примеры подходящих тиол-содержащих конъюгирующих групп включают цистеин, глутатион, тиоалкил, фрагменты, такие как тиобензил, меркаптопропионовая кислота, N-ацетилированный цистеин, цистеамид, N-ацетилцистеамид, гомоцистеин, пеницилламин и поли(этиленгликоль) (ПЭГ)-модифицированные (называемые также "пэгилированные") тиолы, такие как пэгилированный цистеин, или удвоенное соединение (т.е. соединение, представляющее собой гомодимер, мономеры которого соединены дисульфидной связью). В предпочтительном варианте осуществления тиол-содержащая конъюгирующая группа представляет собой цистеин. В качестве тиол-содержащих конъюгирующих групп также можно использовать другие гомологи цистеина, сами по себе, или входящие в состав более крупных конъюгирующих групп. Подобным образом в качестве тиол-содержащих фрагментов можно использовать стереоизомеры цистеина, гомоцистеина и цистеамида. Конъюгирующие группы можно использовать для повышения химической стабильности и, следовательно, срока хранения фармацевтического продукта. В некоторых вариантах осуществления тиол-содержащая конъюгирующая группа и пептид представляют собой одинаковые молекулы (т.е. конъюгат представляет собой димер), и, как было неожиданно обнаружено, такие конъюгаты обладают более высокой химической стабильностью, чем конъюгаты, полученные с использованием гетерологичной конъюгирующей группы, такой как цистеин. Без связи с какой-либо теорией авторы полагают, что в том случае, когда тиол-содержащая конъюгирующая группа и пептид представляют собой одинаковые молекулы, любое диспропорционирование (например, перестановка конъюгирующей группы) воссоздает исходное димерное соединение. И наоборот, диспропорционирование соединения, содержащего гетерологичную конъюгирующую группу, такую как цистеин, может привести к образованию гомодимеров пептид плюс цистеин (таких как гомодимер цистеин-цистеин) и остаточного исходного соединения. Гомодимер пептида (т.е. конъюгирующая группа и пептид представляют собой одинаковые молекулы) может превращаться в цистеин-конъюгированную форму пептида in vivo вследствие высокой концентрации восстановленного цистеина в кровотоке.
Некоторые варианты осуществления относятся к дисульфидному конъюгату тиол-содержащей конъюгирующей группы с пептидом, имеющему аминокислотную последовательность (Xaa1)-(Xaa2)-(Xaa3)-(Xaa4)-(Xaa5)-(Xaa6)-(Xaa7) (SEQ ID NO:155), где (Xaa1) обозначает тиол-содержащий аминокислотный остаток, (Xaa2) обозначает некатионный аминокислотный остаток, (Xaa3) обозначает любой аминокислотный остаток, (Xaa4) обозначает любой аминокислотный остаток, (Xaa5) обозначает катионный аминокислотный остаток, (Xaa6) обозначает некатионный остаток, а (Xaa7) обозначает любой аминокислотный остаток. Пептид может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления пептид содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу. В предпочтительном варианте осуществления тиол-содержащая конъюгирующая группа выбрана из группы, включающей D-Cys, L-Cys, пептид, содержащий D-Cys, и пептид, содержащий L-Cys. Если тиол-содержащая конъюгирующая группа представляет собой аминокислоту или пептид, она может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления тиол-содержащая конъюгирующая группа содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу. В некоторых вариантах осуществления тиол-содержащая конъюгирующая группа представляет собой пептид, имеющий аминокислотную последовательность SEQ ID NO:155. В некоторых вариантах осуществления тиол-содержащая конъюгирующая группа и пептид представляют собой одинаковые молекулы (т.е. конъюгат представляет собой димер).
Некоторые варианты осуществления относятся к конъюгату тиол-содержащей конъюгирующей группы с пептидом, имеющему аминокислотную последовательность (D-Cys)-(Xaa2)-(Xaa3)-(Xaa4)-(Xaa5)-(Xaa6)-(Xaa7) (SEQ ID NO:156), где (Xaa2) обозначает некатионный аминокислотный остаток, (Xaa3) обозначает любой аминокислотный остаток, (Xaa4) обозначает любой аминокислотный остаток, (Xaa5) выбран из группы, включающей D-Arg, L-Arg, D-Lys и L-Lys, (Xaa6) обозначает некатионный остаток, а (Xaa7) обозначает любой аминокислотный остаток. Пептид может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления пептид содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу. В предпочтительном варианте осуществления тиол-содержащая конъюгирующая группа выбрана из группы, включающей D-Cys, L-Cys, пептид, содержащий D-Cys, и пептид, содержащий L-Cys. Если тиол-содержащая конъюгирующая группа представляет собой аминокислоту или пептид, она может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления тиол-содержащая конъюгирующая группа содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу. В некоторых вариантах осуществления тиол-содержащая конъюгирующая группа представляет собой пептид, имеющий аминокислотную последовательность SEQ ID NO:156. В некоторых вариантах осуществления тиол-содержащая конъюгирующая группа и пептид представляют собой одинаковые молекулы (т.е. конъюгат представляет собой димер).
Некоторые варианты осуществления относятся к конъюгату тиол-содержащей конъюгирующей группы с пептидом, имеющему аминокислотную последовательность (L-Cys)-(Xaa2)-(Xaa3)-(Xaa4)-(Xaa5)-(Xaa6)-(Xaa7) (SEQ ID NO:183), где (Xaa2) обозначает некатионный аминокислотный остаток, (Xaa3) обозначает любой аминокислотный остаток, (Xaa4) обозначает любой аминокислотный остаток, (Xaa5) выбран из группы, включающей D-Arg, L-Arg, D-Lys и L-Lys, (Xaa6) обозначает некатионный остаток, а (Xaa7) обозначает любой аминокислотный остаток. Пептид может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления пептид содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу. В предпочтительном варианте осуществления тиол-содержащая конъюгирующая группа выбрана из группы, включающей D-Cys, L-Cys, пептид, содержащий D-Cys, и пептид, содержащий L-Cys. Если тиол-содержащая конъюгирующая группа представляет собой аминокислоту или пептид, она может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления тиол-содержащая конъюгирующая группа содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу. В некоторых вариантах осуществления тиол-содержащая конъюгирующая группа представляет собой пептид, имеющий аминокислотную последовательность SEQ ID NO:183. В некоторых вариантах осуществления тиол-содержащая конъюгирующая группа и пептид представляют собой одинаковые молекулы (т.е. конъюгат представляет собой димер).
Некоторые варианты осуществления относятся к конъюгату тиол-содержащей конъюгирующей группы с пептидом, имеющему аминокислотную последовательность (D-Cys)-(D-Ala)-(Xaa3)-(Xaa4)-(D-Arg)-(D-Ala)-(Xaa7) (SEQ ID NO:161), где (Xaa3) обозначает любой аминокислотный остаток, (Xaa4) обозначает любой аминокислотный остаток и (Xaa7) обозначает любой аминокислотный остаток. Пептид может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления пептид содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу. В предпочтительном варианте осуществления тиол-содержащая конъюгирующая группа выбрана из группы, включающей D-Cys, L-Cys, пептид, содержащий D-Cys, и пептид, содержащий L-Cys. Если тиол-содержащая конъюгирующая группа представляет собой аминокислоту или пептид, она может содержать N-концевую кэпирующую группу, C-концевую кэпирующую группу, или и ту, и другую. В предпочтительном варианте осуществления тиол-содержащая конъюгирующая группа содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу. В некоторых вариантах осуществления тиол-содержащая конъюгирующая группа представляет собой пептид, имеющий аминокислотную последовательность SEQ ID NO:161. В некоторых вариантах осуществления тиол-содержащая конъюгирующая группа и пептид представляют собой одинаковые молекулы (т.е. конъюгат представляет собой димер).
Типичные соединения
В предпочтительном варианте осуществления тиол-содержащая конъюгирующая группа содержит как N-концевую кэпирующую группу, так и C-концевую кэпирующую группу. В некоторых вариантах осуществления тиол-содержащая конъюгирующая группа представляет собой пептид, имеющий аминокислотную последовательность SEQ ID NO:161. В некоторых вариантах осуществления тиол-содержащая конъюгирующая группа и пептид представляют собой одинаковые молекулы (т.е. конъюгат представляет собой димер).
В другом варианте осуществления соединения находятся в виде конъюгата, где тиол-содержащая субъединица в положении X1 связана посредством дисульфидной связи с остатком L-Cys. Указанные соединения имеют следующие структуры:

В соответствии с используемой здесь системой обозначений соединение, связанное с тиол-содержащим фрагментом субъединицы X1, заключают в скобки, например, в типичных конъюгатах соединение L-Cys, обозначенное (C), связано с тиол-содержащим фрагментом субъединицы X1: Ac-c(C)arrrar-NH2 (SEQ ID NO:3) и Ac-c(Ac-C)arrrar-NH2 (SEQ ID NO:141).
Описанные агонисты можно вводить в качестве фармацевтических средств людям и животным сами по себе, или в составе фармацевтической композиции, содержащей, например, от 0,1 до 99% (более предпочтительно от 10 до 30%) активного ингредиента в сочетании с фармацевтически приемлемым носителем. В других вариантах осуществления фармацевтическая композиция может содержать 0,2-25%, предпочтительно 0,5-5% или 0,5-2%, активного ингредиента. Указанные соединения можно вводить с целью лечения людям и другим животным посредством любого подходящего способа введения, такого как, например, пероральное введение, подкожная инъекция, подкожное депо, внутривенная инъекция, внутривенная или подкожная инфузия.
Указанные агонисты можно вводить с целью лечения людям и другим животным посредством любого подходящего способа введения.
Как указано выше, способы применения можно использовать сами по себе или в сочетании с другими средствами и/или методами. Такие другие средства и/или методы включают, без ограничения, контролирование содержания фосфора в пищевых продуктах, диализ, применение фосфат-связывающих средств (таких как гидроксид алюминия, карбонат кальция, ацетат кальция, соли магния, севеламера гидрохлорид, лантана карбонат, препараты многоядерного железа). При использовании конкретного сочетания способов лечения (средств и/или методов) для применения в сочетанном режиме следует учитывать совместимость желательных терапевтических средств и/или процедур и желательного терапевтического эффекта. Следует также отметить, что используемые способы лечения могут обеспечивать достижение желательного эффекта для одного и того же нарушения (например, соединение настоящего изобретения можно вводить одновременно с другим средством, используемым для лечения того же нарушения), или они могут обеспечивать достижение разных эффектов (например, подавление неблагоприятных эффектов). В настоящем описании другие терапевтические средства, которые обычно вводят для лечения или профилактики конкретного заболевания или состояния, известны как "подходящие при заболевании или состоянии, подлежащем лечению".
В одном варианте осуществления описанное соединение вводят в дозе, достаточной для уменьшения рикошета фосфора у пациента, находящегося на гемодиализе. В другом варианте осуществления дозу вводят после окончания диализа.
Сочетанное лечение настоящего изобретения, описанное в данном документе, можно осуществлять путем одновременного, последовательного или раздельного введения отдельных компонентов указанного лечения.
ПРИМЕРЫ
Нижеследующий пример предлагается для иллюстрации, но не для ограничения описанных здесь соединений и способов. Специалист в данной области может осуществить разные модификации, не отступая от истинной сущности и объема описанного здесь предмета.
Пример 1
Проводят начальную фазу 1 рандомизированного, двойного слепого, плацебо-контролируемого, однодозового, с увеличением дозы, перекрестного исследования в двух периодах, в котором участвуют пациенты с ESRD, находящиеся на гемодиализе и страдающие от SHPT. Отчасти исследование проводят для того, чтобы оценить безопасность, переносимость, фармакокинетику и фармакодинамику SEQ ID NO:3, вводимого внутривенно (в.в.) здоровым добровольцам мужского пола, и чтобы собрать информацию, необходимую для выбора дозы в указанном исследовании. Такое исследование, в котором участвуют субъекты, находящиеся на гемодиализе и страдающие от SHPT, называют фазой 1b.
Двадцать восемь пациентов, находящихся на гемодиализе, получают одну дозу SEQ ID NO:3 или плацебо. Группы, получающие дозу 5, 10 или 20 мг, исследуют по перекрестной схеме с 2 периодами, а в случае введения дозы 40 или 60 мг, субъектов случайным образом распределяют по группам, получающим SEQ ID NO:3 или плацебо, по 8 субъектов в группе.
Сразу после гемодиализа субъектов подвергают процедуре фазы 1 и наблюдают в течение 3 дней. Лабораторное тестирование исходного уровня проводят через 2 часа после гемодиализа. Введение SEQ ID NO:3 после диализа приводит к быстрому уменьшению на 60-80% уровней интактного PTH с последующим дозозависимым возвращением к исходному уровню в течение следующих 48 часов (фиг. 1). Наблюдается ассоциированное небольшое (10-16%) уменьшение уровня сывороточного кальция.
Уровень фосфора в сыворотке, уменьшенный в результате диализа, быстро возрастает в течение первых 8 часов до плато и затем увеличивается более медленно в течение остального междиализного периода (фиг. 2). У субъектов, получающих плацебо, средний уровень фосфора в сыворотке быстро увеличивается в течение первых ~36 часов после введения соединения, после чего концентрация фосфора достигает плато, находящегося на 84% выше исходного уровня, наблюдаемого при выписке (фиг. 2). Неожиданно было обнаружено, что скорость возвращения концентрации фосфора до уровня плато сильно изменяется после введения SEQ ID NO:3. Доза 5 мг оказывает минимальный эффект, однако более высокие дозы значительно снижают возрастание уровня сывороточного фосфора. При выписке средний процент увеличения уровня фосфора в сыворотке по сравнению с исходным уровнем у субъектов, получающих 20-60 мг SEQ ID NO:3, варьирует от 23% до 60% и является ниже, чем у пациентов, получающих плацебо, по меньшей мере примерно на 24 процента.
Пример 2
Процедуру фазы 2 проводят как двойное слепое, рандомизированное, плацебо-контролируемое исследование с применением нескольких возрастающих доз. Данное исследование представляет собой не сравнительное, 12-недельное исследование с открытой маркировкой и титрованием дозы, сопровождающееся 4-недельной фазой наблюдений, проводимой для изучения влияния SEQ ID NO:3 на лечение SHPT у находящихся на гемодиализе субъектов с хронической болезнью почек-минеральным и костным расстройством (CKD-MBD). Основной целью данного исследования является определение влияния SEQ ID NO:3, вводимого в.в. три раза в неделю, на лечение SHPT у находящихся на гемодиализе субъектов с CKD-MBD, количественной мерой которого является процент изменения уровня iPTH по сравнению с исходным уровнем в течение периода проявления эффекта. Другие цели также включают определение изменения по сравнению с исходными уровнями cCa (скорректированная концентрация кальция) и фосфора в сыворотке.
Начальная доза SEQ ID NO:3 составляет 5 мг. Дозу SEQ ID NO:3 титруют до заданного значения 150≤300 пг/мл. Влияние увеличения дозы SEQ ID NO:3 на субъектов анализируют в течение недели 5 и недели 9. Если у субъекта самое последнее значение концентрации cCa составляет ≥8,0 мг/дл и отсутствуют сопутствующие неблагоприятные события, исключающие повышение дозы, то дозу SEQ ID NO:3 выбирают следующим образом: если iPTH ≤300 пг/мл, дозу не меняют; если iPTH >300 пг/мл, то дозу увеличивают на 5 мг (т.е. от 5 мг до 10 мг) в течение недели 5, или увеличивают на 5 мг (т.е. если iPTH ≥300 пг/мл и ≤450 пг/мл) или 10 мг (iPTH >450 пг/мл) в течение недели 9.
Тридцать два субъекта (87%) полностью проходят 12-недельный период лечения. Пять субъектов (13/5%) выбывают до конца периода лечения. Из 32 субъектов, полностью прошедших 12-недельный период лечения, 30 субъектов принимают участие в дополнительном исследовании с открытой маркировкой, а два субъекта завершают 4-недельный период наблюдения.
Первичный результат представляет собой процентное изменение по сравнению с исходным уровнем концентрации iPTH в конце периода анализа эффективности. Исходный уровень iPTH определяют как среднее от трех значений уровня iPTH, полученных в течение 3 недель после введения первой дозы и до введения первой дозы SEQ ID NO:3. Период анализа эффективности начинается за 14 дней до и оканчивается через 3 дня после введения последней дозы SEQ ID NO:3. Вторичные результаты включают долю субъектов, у которых уменьшение iPTH по сравнению с исходным уровнем составляет ≥30%, и долю субъектов, у которых уровень iPTH составляет ≥300 пг/мл в течение периода анализа эффективности. Кроме того, определяют среднее изменение концентрации cCa и фосфора под действием SEQ ID NO:3.
Общий средний исходный уровень iPTH составляет 853,4 пг/мл. Среднее уменьшение концентрации iPTH в результате ведения SEQ ID NO:3 в конце периода лечения составляет 53% по сравнению с исходным уровнем (доверительный интервал 95% (-60,8, -46,3). В подгруппах с разным исходным уровнем iPTH получают похожие результаты (исходный уровень iPTH ≤700 пг/мл или >700 пг/мл) и это позволяет предположить, что ответ не зависит от значения исходного уровня iPTH.
График зависимости от времени демонстрирует, что введение SEQ ID NQ:3 вызывает прогрессирующее устойчивое уменьшение предиализного уровня iPTH в течение 12-недельного периода лечения. Во втором анализе показателей пациентов, ответивших на лечение, у 89% субъектов наблюдается уменьшение уровня iPTH, составляющее ≥30%; данный показатель лишь немного ниже у субъектов с тяжелой стадией заболевания (т.е. iPTH >700 пг/мл). Всего у 56% субъектов концентрация iPTH ≤300 пг/мл в конце периода лечения. Уровень сывороточного кальция корректируют по уровню альбумина ниже 4,0 г/дл с помощью следующего уравнения: скорректированная концентрация кальция (cCa) = (измеренная концентрация Ca в мг/дл) + [4-(концентрация альбумина в г/дл)]*0,8. Средний исходный уровень cCa составляет 10,1 мг/дл и уменьшается на 15% в конце периода лечения. Более выраженное уменьшение сывороточного cCa наблюдается у субъектов с тяжелой стадией заболевания.
Измерение уровня фосфора проводят до диализа в определенные протоколом дни анализа. Общий средний исходный уровень фосфора составляет 5,7 мг/дл, причем в подгруппе с более тяжелым исходным уровнем iPTH наблюдается более высокий исходный уровень фосфора. В конце периода анализа эффективности действия средний процент изменения уровня фосфора в сыворотке по сравнению с исходным уровнем составляет – 10,5%, причем более выраженное уменьшение наблюдается у субъектов с более тяжелой стадией заболевания (таблица 4).
В целом, за исключением одного среднего процентного изменения уровня фосфора в подгруппе с более низким значением iPTH, все анализы предварительно заданных первичных и вторичных результатов демонстрируют значительное уменьшение уровней iPTH, cCa и фосфора в обеих подгруппах.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРАПЕВТИЧЕСКИЕ АГЕНТЫ ДЛЯ СНИЖЕНИЯ УРОВНЕЙ ПАРАТИРЕОИДНОГО ГОРМОНА | 2010 |
|
RU2557654C2 |
| АНАЛОГИ ГЛЮКАГОНА, ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ РАСТВОРИМОСТЬЮ И СТАБИЛЬНОСТЬЮ В БУФЕРАХ С ФИЗИОЛОГИЧЕСКИМИ ЗНАЧЕНИЯМИ Ph | 2009 |
|
RU2560254C2 |
| ОСНОВАННЫЕ НА АМИДАХ ПРОЛЕКАРСТВА ПЕПТИДОВ ГЛЮКАГОНОВОГО НАДСЕМЕЙСТВА | 2009 |
|
RU2550696C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОНСТРУКЦИИ С ПОВЫШЕННОЙ АФФИННОСТЬЮ СВЯЗЫВАНИЯ С АЛЬБУМИНОМ | 2018 |
|
RU2753880C1 |
| АНАЛОГИ АЛЬФА- и ГАММА-MSH | 2013 |
|
RU2668791C2 |
| Линкерные звенья и содержащие их молекулярные конструкции | 2018 |
|
RU2752671C2 |
| ПЕПТИДЫ И ИХ ПРОИЗВОДНЫЕ, ВЗАИМОДЕЙСТВУЮЩИЕ С НИКОТИНОВЫМ АЦЕТИЛХОЛИНОВЫМ РЕЦЕПТОРОМ И ПРИГОДНЫЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КОСМЕТОЛОГИИ ПРОТИВ МИМИЧЕСКИХ И ВОЗРАСТНЫХ МОРЩИН | 2013 |
|
RU2524428C1 |
| АНАЛОГИ ГЛЮКАГОНА, ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ РАСТВОРИМОСТЬЮ В БУФЕРАХ С ФИЗИОЛОГИЧЕСКИМ ЗНАЧЕНИЕМ pH | 2008 |
|
RU2477286C2 |
| ПЕПТИДНЫЕ КОМПОЗИЦИИ | 2014 |
|
RU2725150C2 |
| МОДУЛЯЦИЯ АКТИВНОСТИ КОМПЛЕМЕНТА | 2015 |
|
RU2670988C2 |







































































































Изобретение относится к химико-фармацевтической промышленности и представляет собой способ лечения хронической болезни почек-минерального и костного расстройства (CKD-MBD) у пациента, находящегося на гемодиализе, где указанный способ включает введение пациенту композиции, содержащей соединение, включающее Ас-с(C)arrrar-NH2 (SEQ ID NO: 3), и фармацевтически приемлемый эксципиент, где композицию вводят как внутривенную инъекцию в течение периода, начинающегося примерно за 15 минут до завершения гемодиализа и заканчивающегося примерно через 3 часа после завершения гемодиализа, и где указанное введение позволяет эффективно поддерживать постгемодиализный уровень фосфора в сыворотке ниже уровня фосфора в сыворотке до гемодиализа в течение периода, составляющего по меньшей мере примерно 6 часов после диализа. Изобретение позволяет смягчить постдиализный рикошет уровней сывороточного фосфора. 6 з.п. ф-лы, 3 ил., 4 табл., 2 пр.
1. Способ лечения хронической болезни почек-минерального и костного расстройства (CKD-MBD) у пациента, находящегося на гемодиализе, включающий введение пациенту композиции, содержащей соединение, включающее Ас-с(C)arrrar-NH2 (SEQ ID NO: 3), и фармацевтически приемлемый эксципиент;
где композицию вводят как внутривенную инъекцию в течение периода, начинающегося примерно за 15 минут до завершения гемодиализа и заканчивающегося примерно через 3 часа после завершения гемодиализа, и где указанное введение позволяет эффективно поддерживать постгемодиализный уровень фосфора в сыворотке ниже уровня фосфора в сыворотке до гемодиализа в течение периода, составляющего по меньшей мере примерно 6 часов после диализа.
2. Способ по п. 1, где соединение включает фармацевтически приемлемую соль SEQ ID NO: 3.
3. Способ по п. 2, где соль представляет собой гидрохлорид.
4. Способ по любому из пп. 1-3, где композицию вводят в течение периода, начинающегося примерно за 15 минут до завершения гемодиализа и заканчивающегося примерно через 1 час после завершения гемодиализа.
5. Способ по любому из пп. 1-3, где композицию вводят в процессе возвратной процедуры в конце диализа.
6. Способ по любому из пп. 1-3, где пациент получает фосфат-связывающее средство.
7. Способ по любому из пп. 1-3, где указанное введение позволяет эффективно поддерживать постгемодиализный уровень фосфора в сыворотке ниже уровня фосфора в сыворотке до гемодиализа по меньшей мере примерно на 10% в течение междиализного периода.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| HIROAKI OGATA et al | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| NIGEL D | |||
| TOUSSAINT et al | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| ERIC B | |||
| GROSSMAN et al | |||
| The pharmacokinetics and hemodynamics of sildenafil citrate in male hemodialysis patients//Kidney International, Vol | |||
| Приспособление для соединения пучка кисти с трубкою или втулкою, служащей для прикрепления ручки | 1915 |
|
SU66A1 |
| ОРАЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ АБСОРБЦИИ ФОСФОРНЫХ СОЕДИНЕНИЙ | 2005 |
|
RU2392926C2 |
Авторы
Даты
2017-03-13—Публикация
2012-06-08—Подача