Область техники, к которой относится изобретение
Настоящее изобретение относится к пептидным аналогам природных или естественных меланокортинов, α-меланоцитстимулирующего гормона (α-MSH) и γ-меланоцитстимулирующего гормона (γ-MSH), или их вариантов, а также к их применению в лечении воспалительных и/или ишемических состояний.
Уровень техники изобретения
Каждый из природных пептидов, α-меланоцитстимулирующего гормона (α-MSH) и γ-меланоцитстимулирующего гормона (γ-MSH), известен как естественный агонист для рецепторов меланокортина (MCrs) 1 типа (MC1r), 3 типа (MC3r), 4 типа (MC4r) и 5 типа (MC5r). MCrs принадлежат к классу рецепторов, связанных с G-белками. Все подтипы рецепторов связаны со стимулирующим G-белком, это означает, что стимуляция рецепторов включает повышенную продукцию цАМФ. Адренокортикотропный гормон (ACTH) является естественным лигандом рецептора 2 типа (MC2r).
Рецепторы меланокортина 1 типа (MC1r) и/или 3 типа (MC3r) экспрессируются в иммунокомпетентных клетках, включая моноциты, макрофаги, нейтрофилы, T-клетки и дендритные клетки. Стимуляция MCr1 и/или MC3r связана с модуляцией воспалительного ответа, включая уменьшение продукции цитокинов и активацию механизмов, ведущих к устранению воспаления.
Избирательность MCr в отношении связывания различных пептидов MSH варьируется; α-MSH связывается с высокой аффинностью с MC1r и с несколько меньшей аффинностью с MC3r, MC4r и MCr5. Аффинность связывания γ-MSH в отношении MC1r и MC5r низкая, связывание с MC4r немного более сильное и еще более высокая аффинность имеет место в отношении MC3r (J. Med. Chem. 2005, 48, 1839-1848). Сообщалось, что MC2r связывает только ACTH, но не один из пептидов MSH. Следовательно, α-MSH может считаться агонистом всех MCr, в то время как γ-MSH проявляет избирательность в отношении MC3r.
Как гипоксические (ишемические), так и реперфузионные повреждения являются важными факторами в патофизиологии человека. Примеры тканевой гипоксии, которая предрасполагает к повреждениям во время реперфузии, включают циркуляторный шок, ишемию миокарда, инсульт, временную почечную ишемию, полостную операцию и трансплантацию органов. Поскольку заболевания вследствие ишемии являются чрезвычайно распространенными причинами заболеваемости и смертности, и поскольку трансплантацию органов используют все чаще, стратегии лечения, потенциально ограничивающие реперфузионные повреждения, крайне необходимы для улучшения общественного здравоохранения.
Лежащие в основе патофизиологические механизмы ишемических/реперфузионных повреждений являются сложными и включают не только классический воспалительный реперфузионный ответ с инфильтрацией нейтрофилов, но также и экспрессию генов цитокинов, включая фактор некроза опухоли-α (TNF-α), интерлейкин (IL)-1β, IL-6, IL-8, интерферон-γ и молекулу межклеточной адгезии-1 (ICAM-1), в реперфузированных тканях/органах. Более того, было высказано предположение, что локально продуцируемый TNF-α способствует постишемической дисфункции органов, как, например, в сердце после инфаркта, путем прямого подавления способности к сокращению и индукции апоптоза.
Вследствие комплексной природы ишемических/реперфузионных повреждений концепции простого противовоспалительного лечения доказали свою несостоятельность. Соответственно, большинство экспериментальных исследований указывают на то, что для защиты от реперфузионных повреждений необходимо одновременное взаимодействие с более чем одним из активированных путей.
Показано, что меланокортины обладают как противовоспалительными, антиоксидантными, так и антиапоптозными свойствами, а также стимулируют механизмы, ведущие к устранению воспаления, такие как способность макрофагов фагоцитировать апоптозные нейтрофилы. Лечение природными гормонами или их известными аналогами показало некоторые положительные эффекты в животных моделях ишемии/реперфузии и индуцированной воспалением органной недостаточности. Известные аналоги MSH содержат одну или две аминокислоты в D-конформации (D-стереоизомеры) и N-концевое добавление создающего структуру зонда (ССЗ), состоящего, например, из 6 линейных остатков лизина (Lys6).
Сущность изобретения
Настоящее изобретение относится к пептидным аналогам α-MSH и γ-MSH, содержащим аминокислотную последовательность α-MSH или γ-MSH человека, или их определенных вариантов в C-концевой части пептида и разветвленный аминокислотный зонд (РАЗ) в N-концевой части пептида. В настоящем документе они имеют общее название «аналоги α-MSH или γ-MSH».
В одном варианте осуществления пептиды по настоящему изобретению имеют одно или более улучшенных свойств, например, с точки зрения связывания и/или активации одного или более из рецепторов меланокортина, таких как MC1r и/или MC3r.
В некоторых вариантах осуществления аналоги MSH, предложенные в настоящем документе, имеют одно или более улучшенных свойств по сравнению с природным пептидом. Например, в некоторых вариантах осуществления аналоги MSH, предложенные в настоящем документе, отличаются более сильным связыванием с одним или более из рецепторов меланокортина, таких как MC1r и/или MC3r. В некоторых вариантах осуществления аналоги MSH, предложенные в настоящем документе, способны к улучшенной активации одного или более из рецепторов меланокортина, таких как MC1r и/или MC3r.
Таким образом, настоящее изобретение относится к определенным пептидам, содержащим модификацию в виде разветвленного аминокислотного зонда, или РАЗ, в N-концевой части пептида и содержащим всю или по меньшей мере часть аминокислотной последовательности α-MSH, γ-MSH или их вариантов.
Один из аспектов настоящего изобретения относится к пептидам, состоящим из 8-22 аминокислотных остатков, содержащим аминокислотную последовательность:
X-(ак1)n-Y-(ак2)m-Z,
где X содержит разветвленный аминокислотный зонд, имеющий первый остаток лизина (Lys1), выбранный из Lys и D-Lys, при этом указанный первый остаток лизина связан пептидной связью с (ак1)n,
указанный первый остаток лизина необязательно связан пептидными связями со вторым остатком лизина (Lys2), или со вторым и третьим остатком лизина (Lys3), с образованием линейной цепи в общей сложности из 2 или 3 остатков лизина, выбранных из Lys и D-Lys,
где боковая цепь(и) одного или более из каждого из указанных первого, второго и/или третьего остатков лизина модифицирована присоединением к ε-аминогруппе указанного одного или более из каждого из указанных остатков лизина молекулы, независимо выбранной из группы, состоящей из Lysq-Lys; (ак3)p-Lysq; Lysq-(ак3)p; [(ак3)-Lys]p и [Lys-(ак3)]p, где q представляет собой число, выбранное из 0, 1, 2 и 3; p представляет собой число, выбранное из 1, 2 и 3, и (ак3) представляет собой аминокислотный остаток, независимо выбранный из Arg, His, Gly и Ala,
при условии, что X состоит из 2-9 аминокислотных остатков,
где Y содержит аминокислотную последовательность, состоящую из 4 смежных аминокислотных остатков, выбранную из группы, состоящей из His-Phe-Arg-Trp (SEQ ID NO: 16); His-(D-Phe)-Arg-Trp; His-Phe-(D-Arg)-Trp; His-Phe-Arg-(D-Trp); His-(D-Phe)-Arg-(D-Trp); His-Nal-Arg-Trp и His-(D-Nal)-Arg-Trp; и
где Z содержит аминокислотную последовательность, состоящую из 2 или 3 смежных аминокислотных остатков, выбранную из группы, состоящей из Lys-Pro-Val; Lys-Pro-(D-Val); Arg-Phe-Gly; Arg-(D-Phe)-Gly; Arg-Phe и Arg-(D-Phe); и
где n представляет собой число, выбранное из 0, 1, 2, 3, 4 и 5, и (ак1) независимо может быть любым природным или неприродным аминокислотным остатком, и
где m равно 0 или 1, и (ак2) может быть любым природным или неприродным аминокислотным остатком.
В одном варианте осуществления (ак1)n представляет собой последовательность, состоящую из 4 или 5 смежных аминокислот (n=4 или 5) и выбранную из группы, состоящей из Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17), Ser-Tyr-Ser-Nle-Glu (SEQ ID NO: 18), Ser-Ser-Ile-Ile-Ser (SEQ ID NO: 19), Tyr-Val-Met-Gly (SEQ ID NO: 20) и Tyr-Val-Nle-Gly (SEQ ID NO: 21).
В одном варианте осуществления (ак2)m представляет собой 1 аминокислоту (m=1), выбранную из группы, состоящей из Gly и Asp.
Конкретные примеры аналогов α-MSH и аналогов γ-MSH по настоящему изобретению описаны далее в настоящем документе.
Аналоги α-MSH и γ-MSH по настоящему изобретению, содержащие разветвленный аминокислотный зонд, описанный в настоящем документе, в некоторых вариантах осуществления способны к связыванию и активации одного или обоих из рецепторов меланокортина MC1r и MC3r, в конкретном варианте осуществления являясь полными агонистами одного или обоих из рецепторов меланокортина MC1r и MC3r и/или имея повышенную аффинность связывания с одним или обоими из рецепторов меланокортина MC1r и MC3r.
Настоящее изобретение также охватывает фармацевтические композиции, содержащие аналоги α-MSH и γ-MSH по настоящему изобретению, а также аналоги α-MSH и γ-MSH по настоящему изобретению для применения в качестве лекарственного средства.
В одном варианте осуществления аналоги α-MSH и γ-MSH по настоящему изобретению подходят для применения в лечении ишемического и/или воспалительного состояния в ткани одного или более органов млекопитающего. В некоторых вариантах осуществления указанное лечение является профилактическим, облегчающим состояние или исцеляющим.
В некоторых вариантах осуществления указанное ишемическое состояние(я) обусловлено или вызвано одним или более первопричинными заболеваниями, такими как инсульт, травма, септический шок, системная гипотензия, остановка сердца вследствие сердечного приступа, сердечная аритмия, атероматозная болезнь с тромбозом, эмболия сердца или кровеносного сосуда из любого органа, спазм сосудов, аневризма аорты или аневризмы в других органах, коронарный стеноз, инфаркт миокарда, стенокардия, перикардит, миокардит, микседема или эндокардит.
Кроме того, в некоторых вариантах осуществления указанное ишемическое и/или воспалительное состояние связано с хирургической операцией, такой как полостная операция. В некоторых вариантах осуществления указанная хирургическая операция включает кардиоторакальную операцию, абдоминальную операцию, операцию на аорте и/или других крупных кровеносных сосудах, восстановление одного или более клапанов сердца, шунтирование коронарной артерии (CABG), операцию на корне аорты или ветви аорты, включая общие сонные артерии, и комбинированные операции на сердце, такие как замена клапана(ов) и CABG и/или операция на корне аорты.
Кроме того, в некоторых вариантах осуществления указанное ишемическое и/или воспалительное состояние связано с трансплантацией органов, например, трансплантацией цельных органов. В некоторых вариантах осуществления указанная трансплантация органов включает трансплантацию сердца, трансплантацию легких, трансплантацию сердечно-легочного комплекса, трансплантацию печени и трансплантацию почки.
В одном варианте осуществления указанное ишемическое и/или воспалительное состояние представляет собой послеоперационный синдром системного воспалительного ответа (SIRS) или послеоперационную дисфункцию органов, включая послеоперационную почечную недостаточность, такую как острое повреждение почек (AKI), нефротоксичность и/или хроническая почечная недостаточность (CRF).
В одном варианте осуществления указанное ишемическое и/или воспалительное состояние представляет собой реперфузионное повреждение.
Кроме того, в одном варианте осуществления указанное ишемическое и/или воспалительное состояние представляет собой воспалительное заболевание, включая, но не ограничиваясь ими, артропатию (поражение суставов), ревматоидный артрит (РА), подагру, воспалительные заболевания желудочно-кишечной системы и рассеянный склероз.
Описание чертежей
Фигура 1: Аффинность связывания в отношении MC1r человека аналога α-MSH № 1:
Ac-(Ac-Lys-Lys-)Lys-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-NH2 (Ac-(Ac-Lys-Lys-)Lys- SEQ ID NO: 2), α-MSH и Ac(Lys)6-α-MSH (смотри пример 1).
Фигура 2: Рецепторная эффективность в отношении MC1r человека соединений Ac(Lys)6-α-MSH, Ac(Lys)6-NDP-α-MSH и α-MSH (смотри пример 1).
Фигура 3: Рецепторная эффективность в отношении MC1r человека аналога α-MSH № 1:
Ac-(Ac-Lys-Lys-)Lys-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-NH2 (Ac-(Ac-Lys-Lys-)Lys- SEQ ID NO: 2), NDP-α-MSH и Ac(Lys)6-α-MSH (смотри пример 1).
Фигура 4: Аффинность связывания в отношении MC1r и MC3r человека аналога γ-MSH № 2: Ac-(Ac-Lys-Lys-)Lys-Tyr-Val-Met-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-Phe-Gly-NH2 (вариант D-Trp SEQ ID NO: 8) и NDP-α-MSH (смотри пример 2).
Фигура 5: Рецепторная эффективность в отношении MC1r и MC3r человека аналога γ-MSH № 2 (смотри пример 2).
Фигура 6: Рецепторная эффективность в отношении MC1r и MC3r человека аналога γ-MSH № 2 (смотри пример 2).
Фигура 7: Схематическое изображение разветвленного аминокислотного зонда (РАЗ) Ac-(Ac-Lys-Lys)Lys- (то есть, один вариант осуществления X в формуле X-(ак1)n-Y-(ак2)m-Z), демонстрирующее первый остаток лизина в X (Lys1), присоединенный к пептиду MSH посредством обычной пептидной связи, при этом указанный первый остаток лизина ацетилирован (COCH3) и указанный первый остаток лизина модифицирован присоединением к ε-аминогруппе указанного первого остатка лизина двух дополнительных остатков лизина, при этом один также является ацетилированным (внешний).
Подробное описание изобретения
Проопиомеланокортин (POMC) является полипептидом-предшественником, имеющим 241 аминокислотный остаток. POMC синтезируется из полипептида-предшественника длиной 285 аминокислот, препроопиомеланокортина (пре-POMC), путем удаления 44-аминокислотной сигнальной пептидной последовательности во время трансляции. POMC подвергается экстенсивному тканеспецифичному посттрансляционному процессингу путем расщепления субтилизин-подобными ферментами, известными как прогормон-конвертазы. Существует по меньшей мере восемь потенциальных сайтов расщепления в полипептиде-предшественнике и, в зависимости от типа ткани и доступных конвертаз, процессинг может приводить к образованию не менее десяти биологически активных пептидов, принимающих участие в различных клеточных функциях.
POMC может быть расщеплен ферментативно на следующие пептиды: N-концевой пептид проопиомеланокортина (NPP, или про-γ-MSH), γ-меланоцитстимулирующий гормон или γ-меланотропин (γ-MSH), адренокортикотропный гормон (ACTH) или кортикотропин, α-меланоцитстимулирующий гормон или α-меланотропин (α-MSH), кортикотропин-подобный промежуточный пептид (CLIP), β-липотропин (β-LPH), γ-липотропин (γ-LPH), β-меланоцитстимулирующий гормон или β-меланотропин (β-MSH), β-эндорфин и [мет]энкефалин.
Существуют три формы γ-MSH, а именно, γ1-MSH, γ2-MSH и γ3-MSH, которые различаются по структуре их C-концов. γ1-MSH и γ2-MSH могут отличаться только одной аминокислотой на C-конце.
Меланокортины включают ACTH и различные формы меланоцитстимулирующего гормона (MSH) (альфа, бета и гамма). Они проявляют свое действие путем связывания и активации рецепторов меланокортина MC1r-MC5r, каждый из которых имеет различные специфичности в отношении меланокортинов.
Природные или естественные меланоцитстимулирующие гормоны (α, γ1 и γ2 формы) имеют следующие аминокислотные последовательности:
P01189[138-150], проопиомеланокортин, Homo sapiens
ак модификация: амид валина (положение 150) = SEQ ID NO: 2
YVMGHFRWDRFG
P01189[77-88], проопиомеланокортин, Homo sapiens
ак модификации: амид фенилаланина (положение 88) = SEQ ID NO: 8
YVMGHFRWDRF
P01189[77-87], проопиомеланокортин, Homo sapiens
ак модификации: амид фенилаланина (положение 87) = SEQ ID NO: 12.
Аналоги меланоцитстимулирующего гормона (MSH)
Один из аспектов настоящего изобретения относится к пептидным аналогам α-MSH и γ-MSH. Пептиды содержат аминокислотную последовательность α-MSH или γ-MSH человека, или их определенных вариантов в C-концевой части пептида и разветвленный аминокислотный зонд (РАЗ) в N-концевой части пептида и имеют общее название «аналоги α-MSH или γ-MSH». В некоторых вариантах осуществления последовательность MSH и РАЗ ковалентно связаны друг с другом пептидной связью.
В некоторых вариантах осуществления пептиды, предложенные в настоящем документе, обладают определенными улучшенными свойствами, например, с точки зрения аффинности связывания и/или активации одного или обоих из рецепторов меланокортина MC1r и/или MC3r. Кроме того, в другом варианте осуществления пептиды, предложенные в настоящем документе, более стабильны, например, менее подвержены действию протеаз.
Таким образом, в одном аспекте настоящее изобретение относится к пептиду, состоящему из 8-22 аминокислотных остатков, который содержит аминокислотную последовательность:
X-(ак1)n-Y-(ак2)m-Z,
где X содержит или состоит из разветвленного аминокислотного зонда, имеющего первый остаток лизина, выбранный из Lys и D-Lys, при этом указанный первый остаток лизина связан пептидной связью с (ак1)n,
указанный первый остаток лизина необязательно связан пептидными связями со вторым остатком лизина или со вторым и третьим остатком лизина, с необязательным образованием линейной цепи в общей сложности из 2 или 3 остатков лизина, выбранных из Lys и D-Lys,
где боковая цепь(и) одного или более из каждого из указанных первого, второго и/или третьего остатков лизина модифицирована присоединением к ε-аминогруппе указанного одного или более из каждого из указанных остатков лизина молекулы, независимо выбранной из группы, состоящей из Lysq-Lys; (ак3)p-Lysq; Lysq-(ак3)p; [(ак3)-Lys]p и [Lys-(ак3)]p, где q представляет собой число, выбранное из 0, 1, 2 и 3; p представляет собой число, выбранное из 1, 2 и 3, и (ак3) представляет собой аминокислотный остаток, независимо выбранный из Arg, His, Gly и Ala,
при условии, что X состоит из 2-9 аминокислотных остатков,
где Y содержит аминокислотную последовательность, состоящую из 4 смежных аминокислотных остатков, выбранную из группы, состоящей из His-Phe-Arg-Trp (SEQ ID NO: 16); His-(D-Phe)-Arg-Trp; His-Phe-(D-Arg)-Trp; His-Phe-Arg-(D-Trp); His-(D-Phe)-Arg-(D-Trp); His-Nal-Arg-Trp и His-(D-Nal)-Arg-Trp; и
где Z содержит аминокислотную последовательность, состоящую из 2 или 3 смежных аминокислотных остатков, выбранную из группы, состоящей из Lys-Pro-Val; Lys-Pro-(D-Val); Arg-Phe-Gly; Arg-(D-Phe)-Gly; Arg-Phe и Arg-(D-Phe); и
где n представляет собой число, выбранное из 0, 1, 2, 3, 4 и 5, и (ак1) независимо может быть любым природным или неприродным аминокислотным остатком, и
где m равно 0 или 1, и (ак2) может быть любым природным или неприродным аминокислотным остатком.
«-» в формуле «X-(ак1)n-Y-(ак2)m-Z» означает пептидную связь.
Формулировка «указанный первый остаток лизина связан пептидной связью с (ак1)n» означает, что первый остаток лизина в РАЗ связан пептидной связью с самой N-концевой аминокислотой в (aa1)n.
Природная аминокислота представляет собой естественную аминокислоту, существующую в природе и естественным образом включаемую в полипептиды (протеиногенную). К ним относятся 20 генетически кодируемых аминокислот Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Tyr, Thr, Trp, Val, а также 2, которые включаются в белки с помощью уникальных механизмов синтеза: Sec (селеноцистеин, или U) и Pyl (пирролизин, O). Все они являются L-стереоизомерами.
Помимо 22 природных или стандартных аминокислот существует много других неприродных аминокислот (непротеиногенных или нестандартных). Они либо не встречаются в белках, либо не продуцируются напрямую и отдельно стандартным клеточным аппаратом. Нестандартные аминокислоты, как правило, образованы путем модификаций стандартных аминокислот, например, посттрансляционных модификаций. Примерами предпочтительных неприродных аминокислотных остатков по изобретению являются Nle (норлейцин), Nal (бета-2-нафтилаланин), D-Nal (бета-2-нафтил-D-аланин), D-Arg, D-Trp, D-Phe и D-Val.
Любые аминокислоты по настоящему изобретению могут находиться в L- или D-конфигурации. Если не указано конкретно, предпочтительно подразумевают L-изомерную форму.
Стандартные и/или нестандартные аминокислоты могут быть связаны пептидными связями (с образованием линейной пептидной цепи) или не пептидными связями (например, через различные боковые цепи аминокислот).
Термин «пептид» также охватывает посттрансляционные модификации, внесенные путем химических или катализируемых ферментами реакций, которые известны в данной области. Такие посттрансляционные модификации, при желании, можно вводить до разделения на части. Кроме того, функциональные эквиваленты могут содержать такие химические модификации, как убиквитинирование, мечение (например, радиоактивными изотопами, различными ферментами и так далее), пегилирование (дериватизация с помощью полиэтиленгликоля), либо вставка (или замена путем химического синтеза) аминокислот аминокислотами, например, орнитином, которые обычно не встречаются в человеческих белках.
Можно получать стерически подобные соединения, имитирующие ключевые части пептидной структуры, и такие соединения также можно использовать таким же образом, что и пептиды по изобретению. Это может быть достигнуто с помощью методов моделирования и химического проектирования, известных специалистам в данной области. Например, этерификацию и другие виды алкилирования можно использовать для модификации амино-конца, например, каркаса пептида из двух остатков аргинина, для имитации тетрапептидной структуры. Следует понимать, что все такие стерически подобные конструкции входят в объем настоящего изобретения.
Пептиды с N-концевым алкилированием и C-концевой этерификацией также включены в настоящее изобретение. Функциональные эквиваленты также включают гликозилированные и ковалентные или агрегированные конъюгаты, образованные теми же молекулами, включая димеры или несвязанные химические фрагменты. Такие функциональные эквиваленты получают путем связывания функциональных групп с группами, которые находятся во фрагменте, в том числе, на одном или обоих из N- и C-концов, методами, известными в данной области.
В некоторых вариантах осуществления пептиды по настоящему изобретению модифицированы путем N-концевого ацетилирования самой N-концевой аминокислоты пептида MSH или любых остатков, содержащихся в разветвленном X. В некоторых вариантах осуществления пептиды по настоящему изобретению модифицированы C-концевым амидированием. В одном варианте осуществления такая модификация повышает стабильность пептидов.
В одном варианте осуществления карбоксильный конец указанного пептида или аналога MSH, определенного выше в настоящем документе, представляет собой -C(=O)-B1, где B1 выбирают из OH, NH2, NHB2, N(B2)(B3), OB2 и B2, и где B2 и B3 независимо выбирают из необязательно замещенного C1-6-алкила, необязательно замещенного C2-6-алкенила, необязательно замещенного C6-10-арила, необязательно замещенного C7-16-аралкила и необязательно замещенного C7-16-алкиларила.
В конкретном варианте осуществления карбоксильный конец указанного пептида представляет собой -C(=O)-B1, где B1 представляет собой OH или NH2.
В одном варианте осуществления амино-конец указанного пептида представляет собой (Β4)ΗΝ-, (B4)(B5)N- или (B6)HN-, где B4 и B5 независимо выбирают из H, необязательно замещенного C1-6-алкила, необязательно замещенного C2-6-алкенила, необязательно замещенного C6-10-арила, необязательно замещенного C7-16-аралкила и необязательно замещенного C7-16-алкиларила; и B6 представляет собой B4-C(=O)-.
В другом варианте осуществления амино-конец указанного пептида представляет собой (B6)HN-, где B6 представляет собой B4-C(=O)- и B4 представляет собой CH3. В другом варианте осуществления амино-конец указанного пептида представляет собой (B4)HN-, где B4 представляет собой H.
Используемый в настоящем документе термин «необязательно замещенный» означает, что соответствующая группа может быть замещена один или несколько раз, например, от 1 до 5 раз, предпочтительно от 1 до 3 раз, наиболее предпочтительно 1-2 раза, одной или более группами, выбранными из C1-8-алкила, C1-8-алкокси, оксо (которая может быть представлена в таутомерной енольной форме), карбоксила, амино, гидрокси (которая при ее наличии в енольной системе может быть представлена в таутомерной кето-форме), нитро, циано, дигалоген-C1-8-алкила, тригалоген-C1-8-алкила и галогена. Как правило, вышеуказанные заместители могут подвергаться дальнейшему необязательному замещению.
Используемый в настоящем документе термин «C1-6-алкил» означает линейную или разветвленную насыщенную углеводородную цепь, при этом наиболее длинные цепи имеют от одного до шести атомов углерода, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил, гептил и октил. Разветвленная углеводородная цепь означает C1-6 алкил, замещенный на любом атоме углерода углеводородной цепью.
Используемый в настоящем документе термин «C2-6-алкенил» означает линейную или разветвленную углеводородную группу, имеющую от двух до шести атомов углерода и содержащую одну или более двойных связей. Иллюстративные примеры C2-6-алкенильных групп включают аллил, гомоаллил, винил, кротил, бутенил, пентенил и гексенил. Иллюстративные примеры C2-6-алкенильных групп с более чем одной двойной связью включают бутадиенильную, пентадиенильную, гексадиенильную и гексатриенильную группы, а также их разветвленные формы. Положение ненасыщенности (двойной связи) может быть в любом месте на протяжении углеродной цепи.
Используемый в настоящем документе термин «C3-8-циклоалкил» охватывает трех-, четырех-, пяти-, шести-, семи- и восьмичленные кольца, содержащие только атомы углерода, в то время как термин «гетероциклил» означает трех-, четырех-, пяти-, шести-, семи- и восьмичленные кольца, в которых атомы углерода совместно с 1-3 гетероатомами составляют указанное кольцо. Гетероатомы независимо выбирают из кислорода, серы и азота. C3-8-циклоалкильные и гетероциклические кольца могут необязательно содержать одну или более ненасыщенных связей.
Иллюстративными примерами C3-8-циклоалкила являются карбоциклы циклопропан, циклобутан, циклопентан, циклопентен, циклопентадиен, циклогексан, циклогексен, 1,3-циклогексадиен, 1,4-циклогексадиен, циклогептан, циклогептен, 1,2-циклогептадиен, 1,3-циклогептадиен, 1,4-циклогептадиен и 1,3,5-циклогептатриен.
Иллюстративными примерами гетероциклилов являются гетероциклы 2H-типиран, 3H-типиран, 4H-типиран, тетрагидротиопиран, 2H-пиран, 4H-пиран, тетрагидропиран, пиперидин, 1,2-дитиин, 1,2-дитиан, 1,3-дитиин, 1,3-дитиан, 1,4-дитиин, 1,4-дитиан, 1,2-диоксин, 1,2-диоксан, 1,3-диоксин, 1,3-диоксан, 1,4-диоксин, 1,4-диоксан, пиперазин, 1,2-оксатиин, 1,2-оксатиан, 4H-1,3-оксатиин, 1,3-оксатиан, 1,4-оксатиин, 1,4-оксатиан, 2H-1,2-тиазин, тетрагидро-1,2-тиазин, 2H-1,3-тиазин, 4H-1,3-тиазин, 5,6-дигидро-4H-тиазин, 4H-1,4-тиазин, тетрагидро-1,4-тиазин, 2H-1,2-оксазин, 4H-1,2-оксазин, 6H-1,2-оксазин, 2H-1,3-оксазин, 4H-1,3-оксазин, 4H-1,4-оксазин, малеимид, сукцинимид, имидазол, пиразол, пиррол, оксазол, фуразан, барбитуровая кислота, тиобарбитуровая кислота, диоксопиперазин, изоксазол, гидантоин, дигидроурацил, морфолин, триоксан, 4H-1,2,3-тритиин, 1,2,3-тритиан, 1,3,5-тритиан, гексагидро-1,3,5-триазин, тетрагидротиофен, тетрагидрофуран, пирролин, пирролидин, пирролидон, пирролидион, пиразолин, пиразолидин, имидазолин, имидазолидин, 1,2-диоксол, 1,2-диоксолан, 1,3-диоксол, 1,3-диоксолан, 3H-1,2-дитиол, 1,2-дитиолан, 1,3-дитиол, 1,3-дитиолан, изоксазолин, изоксазолидин, оксазолин, оксазолидин, тиазолин, тиозолидин, 3H-1,2-оксатиол, 1,2-оксатиолан, 5H-1,2-оксатиол, 1,3-оксатиол, 1,3-оксатиолан, 1,2,3-тритиол, 1,2,3-тритиолан, 1,2,4-тритиолан, 1,2,3-триоксол, 1,2,3-триоксолан, 1,2,4-триоксолан, 1,2,3-триазолин и 1,2,3-триазолидин. Связывание с гетероциклом может происходить в положении гетероатома или через атом углерода гетероцикла.
Используемый в настоящем документе термин «арил» означает карбоциклическое ароматическое кольцо или систему колец. Кроме того, термин «арил» включает системы конденсированных колец, в которых по меньшей мере два арильных кольца или по меньшей мере один арил и по меньшей мере один C3-8-циклоалкил, или по меньшей мере один арил и по меньшей мере один гетероциклил имеют по меньшей мере одну общую химическую связь. Иллюстративные примеры арильных колец включают необязательно замещенный фенил, нафталенил, фенантренил, антраценил, аценафтиленил, тетралинил, флуоренил, инденил, индолил, кумаранил, кумаринил, хроманил, изохроманил и азуленил. Предпочтительной арильной группой является фенил.
C7-16-аралкил означает C6-10-арил, замещенный C1-6-алкилом, и C7-16-алкиларил означает C1-6-алкил, замещенный C6-10-арилом.
Варианты осуществления Y
Как определено выше в настоящем документе, Y в формуле X-(ак1)n-Y-(ак2)m-Z представляет собой последовательность, состоящую из 4 аминокислотных остатков, выбранную из группы, состоящей из His-Phe-Arg-Trp (SEQ ID NO: 16), His-(D-Phe)-Arg-Trp, His-Phe-(D-Arg)-Trp, His-Phe-Arg-(D-Trp), His-(D-Phe)-Arg-(D-Trp), His-Nal-Arg-Trp и His-(D-Nal)-Arg-Trp.
Следовательно, Y может быть аминокислотной последовательностью, соответствующей природной части α- или γ-MSH, или их вариантов. Природной частью α-MSH в этом отношении будет His-Phe-Arg-Trp (SEQ ID NO: 16) и природной частью γ-MSH в этом отношении также будет His-Phe-Arg-Trp (SEQ ID NO: 16).
В одном конкретном варианте осуществления Y представляет собой His-Phe-Arg-Trp (SEQ ID NO: 16). В другом конкретном варианте осуществления Y представляет собой His-(D-Phe)-Arg-Trp. В еще одном конкретном варианте осуществления Y представляет собой His-Phe-(D-Arg)-Trp. В другом варианте осуществления Y представляет собой His-Phe-Arg-(D-Trp). В другом варианте осуществления Y представляет собой His-(D-Phe)-Arg-(D-Trp). В другом варианте осуществления Y представляет собой His-Nal-Arg-Trp. В другом варианте осуществления Y представляет собой His-(D-Nal)-Arg-Trp.
Варианты осуществления Z
Как определено выше в настоящем документе, Z в формуле X-(ак1)n-Y-(ак2)m-Z представляет собой последовательность, состоящую из 2 или 3 смежных аминокислотных остатков, выбранную из группы, состоящей из Lys-Pro-Val, Lys-Pro-(D-Val), Arg-Phe-Gly, Arg-(D-Phe)-Gly, Arg-Phe и Arg-(D-Phe).
Следовательно, Z может быть аминокислотной последовательностью, соответствующей природной части α- или γ-MSH, или их вариантов. Природной частью α-MSH в этом отношении будет Lys-Pro-Val и природной частью γ-MSH в этом отношении будет Arg-Phe-Gly (γ1-MSH) или Arg-Phe (γ2-MSH).
В одном конкретном варианте осуществления Z представляет собой Lys-Pro-Val или Lys-Pro-(D-Val). В другом конкретном варианте осуществления Z представляет собой Arg-Phe-Gly или Arg-(D-Phe)-Gly. В еще одном конкретном варианте осуществления Z представляет собой Arg-Phe или Arg-(D-Phe).
В конкретном варианте осуществления самая карбокси-концевая аминокислота может быть амидирована (-NH2; -CONH2). Таким образом, в одном варианте осуществления Val или (D-Val) представляет собой амид валина. В другом варианте осуществления Phe или (D-Phe) представляет собой амид фенилаланина. В другом варианте осуществления Gly представляет собой амид глицина.
Варианты осуществления (ак1)n
Как определено выше в настоящем документе, (ак1)n в формуле X-(ак1)n-Y-(ак2)m-Z представляет собой последовательность, состоящую из 0-5 аминокислот (n=0, 1, 2, 3, 4 или 5). Следовательно, (ак1)n может состоять из 0 аминокислот или состоять из 1-2, например, 2-3, например, 3-4, например, 4-5 смежных аминокислотных остатков.
В конкретном варианте осуществления (ак1)n представляет собой последовательность, состоящую из 4 или 5 смежных аминокислот (n=4 или 5).
В конкретном варианте осуществления (ак1)n может быть аминокислотной последовательностью, соответствующей природной части α- или γ-MSH, или их вариантов. Природной частью α-MSH в этом отношении будет Ac-Ser-Tyr-Ser-Met-Glu (Ac-SEQ ID NO: 17) и природной частью γ-MSH в этом отношении будет Tyr-Val-Met-Gly (SEQ ID NO: 20).
В конкретном варианте осуществления (ак1)n выбирают из группы, состоящей из Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17), Ser-Tyr-Ser-Nle-Glu (SEQ ID NO: 18), Ser-Ser-Ile-Ile-Ser (SEQ ID NO: 19), Tyr-Val-Met-Gly (SEQ ID NO: 20) и Tyr-Val-Nle-Gly (SEQ ID NO: 21).
В конкретном варианте осуществления применительно к аналогам α-MSH (ак1)n выбирают из группы, состоящей из Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17), Ser-Tyr-Ser-Nle-Glu (SEQ ID NO: 18) и Ser-Ser-Ile-Ile-Ser (SEQ ID NO: 19); или группы, состоящей из Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17) и Ser-Tyr-Ser-Nle-Glu (SEQ ID NO: 18). В одном конкретном варианте осуществления (ак1)n представляет собой Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17).
В конкретном варианте осуществления применительно к аналогам γ-MSH (ак1)n выбирают из группы, состоящей из Tyr-Val-Met-Gly (SEQ ID NO: 20) и Tyr-Val-Nle-Gly (SEQ ID NO: 21). В одном конкретном варианте осуществления (ак1)n представляет собой Tyr-Val-Met-Gly (SEQ ID NO: 20).
Варианты осуществления (ак2)m
Как определено выше в настоящем документе, (ак2)m в формуле X-(ак1)n-Y-(ак2)m-Z представляет собой аминокислотный остаток из 0 или 1 аминокислоты (m=0 или 1). В одном варианте осуществления (ак2)m состоит из 1 аминокислоты (m=1).
В одном варианте осуществления (ак2)m представляет собой аминокислоту, соответствующую природной части α- или γ-MSH, или их вариантов. Природной частью α-MSH в этом отношении будет Gly и природной частью γ-MSH в этом отношении будет Asp.
Следовательно, в одном варианте осуществления (ак2)m выбирают из группы, состоящей из Gly и Asp. В одном конкретном варианте осуществления (ак2)m представляет собой Gly. В другом конкретном варианте осуществления (ак2)m представляет собой Asp.
В одном варианте осуществления (ак1)n выбирают из группы, состоящей из Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17), Ac-Ser-Tyr-Ser-Met-Glu (Ac-SEQ ID NO: 17), Ser-Tyr-Ser-Nle-Glu (SEQ ID NO: 18), Ac-Ser-Tyr-Ser-Nle-Glu (Ac-SEQ ID NO: 18), Ser-Ser-Ile-Ile-Ser (SEQ ID NO: 19) и Ac-Ser-Ser-Ile-Ile-Ser (Ac-SEQ ID NO: 19), и (ак2)m представляет собой Gly.
В другом варианте осуществления (ак1)n выбирают из группы, состоящей из Tyr-Val-Met-Gly (SEQ ID NO: 20), Ac-Tyr-Val-Met-Gly (Ac-SEQ ID NO: 20), Tyr-Val-Nle-Gly (SEQ ID NO: 21) и Ac-Tyr-Val-Nle-Gly (Ac-SEQ ID NO: 21), и (ак2)m представляет собой Asp.
Варианты осуществления X
Как определено выше в настоящем документе, X в формуле X-(ак1)n-Y-(ак2)m-Z соответствует разветвленному аминокислотному зонду (РАЗ), присоединенному или связанному с N-концом α- или γ-MSH, или их вариантов, при этом указанные α- или γ-MSH, или их варианты определены в настоящем документе как: -(ак1)n-Y-(ак2)m-Z).
В одном варианте осуществления X соединен или связан с самой N-концевой аминокислотой последовательности -(ак1)n- пептидной связью с первым остатком лизина, выбранным из Lys и D-Lys. Таким образом, первой аминокислотой X, связанной с -(ак1)n-, в одном варианте осуществления является остаток лизина. Указанный первый остаток лизина в одном варианте осуществления является ацетилированным (Ac-Lys). В одном варианте осуществления первый остаток лизина может быть обозначен Lys1.
В некоторых вариантах осуществления самой N-концевой аминокислотой в последовательности -(ак1)n- является Ser или Tyr. Ser является самой N-концевой аминокислотой в природном α-MSH, и Tyr является самой N-концевой аминокислотой в природном γ-MSH. Следовательно, в некоторых вариантах осуществления первый остаток лизина в X связан пептидной связью либо с Ser, либо с Tyr. N-концевой Ser в природном α-MSH является ацетилированным, причем ацетилирование отсутствует, когда РАЗ или X, описанный в настоящем документе, добавляют для получения заявленных аналогов.
X всегда содержит первый остаток лизина. Первый остаток лизина в одном варианте осуществления может быть обозначен Lys1. В одном варианте осуществления указанный первый остаток лизина дополнительно связан пептидной связью со вторым остатком лизина, с образованием линейной цепи в общей сложности из 2 остатков лизина, выбранных из Lys и D-Lys. В одном варианте осуществления один или оба из каждого из указанных первого и второго остатков лизина являются ацетилированными (Ac-Lys). Второй остаток лизина в одном варианте осуществления может быть обозначен Lys2.
В одном варианте осуществления указанный первый остаток лизина дополнительно связан пептидными связями со вторым и третьим остатками лизина, с образованием линейной цепи в общей сложности из 3 остатков лизина, выбранных из Lys и D-Lys. В одном варианте осуществления один, два или три из каждого из указанных первого, второго и третьего остатков лизина являются ацетилированными (Ac-Lys). Третий остаток лизина в одном варианте осуществления может быть обозначен Lys3.
В одном варианте осуществления первый, первый и второй и/или первый, второй и третий остатки лизина в X называют лизиновым каркасом X (Lys1, Lys1-2, Lys1-3).
В одном варианте осуществления первый остаток лизина или второй остаток лизина, или третий остаток лизина, или первый и второй остатки лизина, или первый и третий остатки лизина, или второй и третий остатки лизина, или первый, второй и третий остатки лизина лизинового каркаса X являются ацетилированными (Ac-Lys).
Следовательно, в одном варианте осуществления X содержит первый остаток лизина, выбранный из Lys и D-Lys, связанный пептидной связью с (ак1)n (то есть лизиновый каркас X состоит из 1 остатка лизина). В одном варианте осуществления указанный первый остаток лизина может быть ацетилирован (COCH3).
В другом варианте осуществления X содержит первый и второй остатки лизина, выбранные из Lys и D-Lys, связанные пептидными связями, с образованием линейной цепи в общей сложности из 2 остатков лизина (то есть лизиновый каркас X состоит из 2 остатков лизина).
В другом варианте осуществления X содержит первый, второй и третий остатки лизина, выбранные из Lys и D-Lys, связанные пептидными связями, с образованием линейной цепи в общей сложности из 3 остатков лизина (то есть лизиновый каркас X состоит из 3 остатков лизина). В этой ситуации понятно, что второй и третий остатки лизина могут быть оба присоединены к аминогруппе или оба присоединены к карбоксильной группе первого остатка лизина; или второй остаток лизина может быть присоединен к его аминогруппе и третий остаток лизина присоединен к его карбоксильной группе.
Необходимо, чтобы боковая цепь(и) одного или более из каждого из указанных первого, второго и/или третьего остатков лизина была модифицирована присоединением к ε-аминогруппе указанного одного или более из каждого из указанных остатков лизина дополнительной молекулы. Присоединение молекулы к ε-аминогруппе одного или более из каждого из указанных остатков лизина лизинового каркаса X делает X разветвленным, то есть, разветвленным аминокислотным зондом (РАЗ).
В одном варианте осуществления один остаток лизина лизинового каркаса X модифицирован присоединением молекулы к ε-аминогруппе. Указанный один остаток лизина лизинового каркаса X в одном варианте осуществления представляет собой Lys1, Lys2 или Lys3.
В другом варианте осуществления два остатка лизина лизинового каркаса X модифицированы присоединением молекулы к ε-аминогруппам указанных двух остатков лизина. Указанные два остатка лизина лизинового каркаса X в одном варианте осуществления представляют собой Lys1 и Lys2, Lys1 и Lys3 или Lys2 и Lys3.
В другом варианте осуществления три остатка лизина лизинового каркаса X модифицированы присоединением молекулы к ε-аминогруппам указанных трех остатков лизина. Указанные три остатка лизина лизинового каркаса X в одном варианте осуществления представляют собой Lys1, Lys2 и Lys3.
Следовательно, каждый из первого остатка лизина или второго остатка лизина, или третьего остатка лизина, или первого и второго остатков лизина, или первого и третьего остатков лизина, или второго и третьего остатков лизина, или первого, второго и третьего остатков лизина лизинового каркаса X может быть модифицирован соответственно.
X в одном варианте осуществления состоит в общей сложности из 2-9 аминокислотных остатков. Таким образом, общее число аминокислот, составляющих разветвленный аминокислотный зонд (РАЗ), в одном варианте осуществления равно 2-9; это число включает 1, 2 или 3 остатка лизина, составляющие лизиновый каркас X.
В одном варианте осуществления X содержит разветвленный аминокислотный зонд, состоящий из 2-3 аминокислотных остатков, например, 3-4 аминокислотных остатков, например, состоящий из 4-5 аминокислотных остатков, например, состоящий из 5-6 аминокислотных остатков, например, состоящий из 6-7 аминокислотных остатков, например, состоящий из 7-8 аминокислотных остатков, например, состоящий из 8-9 аминокислотных остатков.
В одном варианте осуществления молекулу, присоединяемую к ε-аминогруппе(ам) одного или более из остатков лизина X, независимо выбирают из группы, состоящей из Lysq-Lys; (ак3)p-Lysq; Lysq-(ак3)p; [(ак3)-Lys]p и [Lys-(ак3)]P, где q представляет собой число, выбранное из 0, 1, 2 и 3; p представляет собой число, выбранное из 1, 2 и 3, и (ак3) представляет собой аминокислотный остаток, независимо выбранный из Arg, His, Gly и Ala.
Следовательно, в одном варианте осуществления каждый из первого остатка лизина или второго остатка лизина, или третьего остатка лизина, или первого и второго остатков лизина, или первого и третьего остатков лизина, или второго и третьего остатков лизина, или первого, второго и третьего остатков лизина X модифицирован присоединением к ε-аминогруппе(ам) молекулы, независимо выбранной из группы, состоящей из Lysq-Lys; (ак3)p-Lysq; Lysq-(ак3)p; [(ак3)-Lys]p и [Lys-(ак3)]p, где q представляет собой число, выбранное из 0, 1, 2 и 3; p представляет собой число, выбранное из 1, 2 и 3, и (ак3) представляет собой аминокислотный остаток, независимо выбранный из Arg, His, Gly и Ala.
В конкретном варианте осуществления (ак3) представляет собой аминокислотный остаток, независимо выбранный из Gly и Ala. В следующем варианте осуществления (ак3) представляет собой Gly.
В одном варианте осуществления молекулы, присоединяемые к ε-аминогруппе(ам), дополнительно ацетилированы. Следовательно, в одном варианте осуществления молекулы независимо выбирают из группы, состоящей из Ac-Lysq-Lys; Ac-(ак3)p-Lysq; Ac-Lysq-(ак3)p; Ac-[(ак3)-Lys]p и Ac-[Lys-(ак3)]p, и/или Lysq-Lys; (ак3)p-Lysq; Lysq-(ак3)p; [(ак3)-Lys]p и [Lys(ак3)]p.
В конкретном варианте осуществления молекула, присоединяемая к ε-аминогруппам одного или более остатков лизина, представляет собой Lysq-Lys, где q представляет собой число, выбранное из 0, 1, 2 и 3.
Следовательно, в одном варианте осуществления X содержит разветвленный аминокислотный зонд, состоящий из 2-9 остатков лизина, выбранных из Lys и D-Lys.
В одном варианте осуществления X содержит максимум 1, 2, 3 или 4 аминокислоты, выбранные из Arg, His, Gly и Ala (ак3), оставшиеся аминокислоты X выбирают из Lys и D-Lys. В одном варианте осуществления X содержит максимум 1 аминокислоту, выбранную из Arg, His, Gly и Ala (ак3). В другом варианте осуществления X содержит максимум 2 аминокислоты, выбранные из Arg, His, Gly и Ala (ак3). В другом варианте осуществления X содержит максимум 1 остаток Arg и/или содержит максимум 1 остаток His, и/или содержит максимум 1 остаток Gly, и/или содержит максимум 1 остаток Ala.
В конкретном варианте осуществления молекулу, присоединяемую к ε-аминогруппе(ам) одного или более остатков лизина лизинового каркаса X, выбирают из группы, состоящей из

Каждый из вышеуказанных остатков Lys, Gly, Ala, His и Arg может находиться в L- или D-конформации.
В конкретном варианте осуществления X содержит разветвленный аминокислотный зонд, состоящий из первого остатка лизина, выбранного из Lys и D-Lys, причем указанный первый остаток лизина необязательно ацетилирован, при этом указанный первый остаток лизина модифицирован присоединением к ε-аминогруппе указанного первого остатка лизина молекулы, выбранной из группы, состоящей из

Каждый из вышеуказанных остатков Lys, Gly, Ala, His и Arg может находиться в L- или D-конформации.
В одном варианте осуществления X содержит или состоит из последовательности: Ac-(Ac-Lys-Lys)Lys1- (идентично Ac-(Ac-Lys-Lys)Lys-), где Lys1 представляет собой первый остаток лизина, связанный пептидной связью с самым N-концевым аминокислотным остатком пептида MSH, являющийся ацетилированным, и (Ac-Lys-Lys) представляет собой молекулу, присоединенную к ε-аминогруппе указанного первого остатка лизина Lys1. Фигура 7 иллюстрирует эту последовательность/структуру.
В одном варианте осуществления X содержит или состоит из последовательности, выбранной из группы, состоящей из
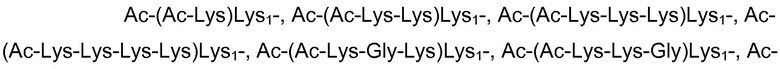
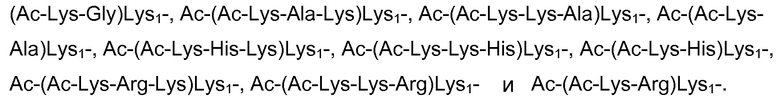
Более конкретно, в одном варианте осуществления X содержит или состоит из последовательности, выбранной из группы, состоящей из
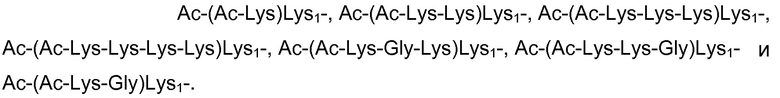
В конкретном варианте осуществления X содержит разветвленный аминокислотный зонд, состоящий из первого и второго остатков лизина, выбранных из Lys и D-Lys, причем указанные первый и второй остатки лизина необязательно ацетилированы, при этом каждый из указанных первого и/или второго остатков лизина модифицирован присоединением к ε-аминогруппе указанных первого и/или второго остатков лизина молекулы, выбранной из группы, состоящей из

Каждый из вышеуказанных остатков Lys, Gly, Ala, His и Arg может находиться в L- или D-конформации.
В одном варианте осуществления X содержит или состоит из последовательности: Ac-(Ac-Lys)Lys2-Lys1-, где Lys1 представляет собой первый остаток лизина, связанный пептидной связью с самым N-концевым аминокислотным остатком пептида MSH, являющийся ацетилированным, Lys2 представляет собой второй остаток лизина, связанный с Lys1 пептидной связью, и (Ac-Lys-Lys) представляет собой молекулу, присоединенную к ε-аминогруппе указанного первого остатка лизина Lys1. В данном варианте осуществления молекулы Ac-Lys2-(Ac-Lys)Lys1- молекула (Ac-Lys) присоединена к ε-аминогруппе указанного второго остатка лизина Lys2.
В одном варианте осуществления X содержит или состоит из последовательности, выбранной из группы, состоящей из

Более конкретно, в одном варианте осуществления X содержит или состоит из последовательности, выбранной из группы, состоящей из

В конкретном варианте осуществления X содержит разветвленный аминокислотный зонд, состоящий из первого, второго и третьего остатков лизина, выбранных из Lys и D-Lys, причем первый, второй и/или третий остатки лизина необязательно ацетилированы, при этом каждый их указанных первого, второго и/или третьего остатков лизина модифицирован присоединением к ε-аминогруппе указанных первого, второго и/или третьего остатков лизина молекулы, выбранной из группы, состоящей из

Каждый из вышеуказанных остатков Lys, Gly, Ala, His и Arg может находиться в L- или D-конформации.
В одном варианте осуществления X содержит или состоит из последовательности, выбранной из группы, состоящей из

В конкретном варианте осуществления X содержит или состоит из последовательности, выбранной из группы, состоящей из

В конкретном варианте осуществления X содержит разветвленный аминокислотный зонд, состоящий из первого и второго остатков лизина, выбранных из Lys и D-Lys, причем один или оба из первого и второго остатков лизина модифицированы присоединением к ε-аминогруппе указанных первого и/или второго остатков лизина одного остатка лизина, выбранного из Lys и D-Lys.
В конкретном варианте осуществления X содержит разветвленный аминокислотный зонд, состоящий из первого и второго остатков лизина, выбранных из Lys и D-Lys, причем один, либо первый, либо второй остаток лизина модифицирован присоединением к ε-аминогруппе указанного первого или второго остатка лизина одного остатка лизина, выбранного из Lys и D-Lys.
Длина
В одном варианте осуществления настоящее изобретение относится к пептиду, состоящему из 8-22 аминокислотных остатков, содержащему аминокислотную последовательность, определенную выше в настоящем документе. В конкретном варианте осуществления указанный пептид состоит из 8-9 аминокислот, например, 9-10 аминокислотных остатков, например, 10-11 аминокислотных остатков, например, 11-12 аминокислотных остатков, например, 12-13 аминокислотных остатков, например, 13-14 аминокислотных остатков, например, 14-15 аминокислотных остатков, например, 15-16 аминокислотных остатков, например, 16-17 аминокислотных остатков, например, 17-18 аминокислотных остатков, например, 18-19 аминокислотных остатков, например, 19-20 аминокислотных остатков, например, 20-21 аминокислотных остатков, например, 21-22 аминокислотных остатков, содержащих аминокислотную последовательность, определенную выше в настоящем документе.
В одном конкретном варианте осуществления пептид по настоящему изобретению состоит из 14-22 аминокислотных остатков. В другом конкретном варианте осуществления пептид по настоящему изобретению состоит из 8-18 аминокислотных остатков. В другом конкретном варианте осуществления пептид по настоящему изобретению состоит из 14-18 аминокислотных остатков, например, 14-16 аминокислотных остатков.
Пептид, состоящий, например, из 8-22 аминокислотных остатков, означает пептид, состоящий в общей сложности из 8-22 аминокислотных остатков. Это, однако, не исключает того, что пептид дополнительно модифицирован любым способом, известным квалифицированному специалисту, связан с другими молекулами, содержится в более крупном комплексе, посттрансляционно модифицирован и так далее.
Примеры конкретных пептидов по изобретению
Пептид по настоящему изобретению в одном конкретном варианте осуществления может состоять из аминокислотной последовательности X-(ак1)n-Y-(ак2)m-Z, где (ак1)n представляет собой Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17), Ser-Tyr-Ser-Nle-Glu (SEQ ID NO: 18) или Ser-Ser-Ile-Ile-Ser (SEQ ID NO: 19); Y представляет собой His-Phe-Arg-Trp (SEQ ID NO: 16), His-(D-Phe)-Arg-Trp или His-Phe-Arg-(D-Trp); (ак2)m представляет собой Gly и Z представляет собой Lys-Pro-Val.
В частности, в одном варианте осуществления (ак1)n представляет собой Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17), Y представляет собой His-Phe-Arg-Trp (SEQ ID NO: 16), (ак2)m представляет собой Gly и Z представляет собой Lys-Pro-Val. Это соответствует природному пептиду α-MSH, модифицированному фрагментом X, описанным в настоящем документе.
Следовательно, в соответствии с настоящим изобретением пептид может представлять собой аналог α-MSH, состоящий из последовательности, выбранной из группы, состоящей из:

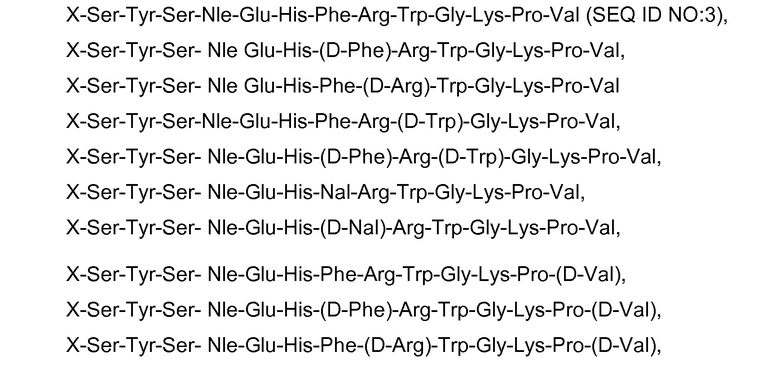

где X представляет собой разветвленный аминокислотный зонд, описанный выше в настоящем документе.
В одном варианте осуществления самый карбокси-концевой остаток Val или (D-Val) представляет собой амид валина.
Кроме того, пептид по настоящему изобретению в одном конкретном варианте осуществления может состоять из аминокислотной последовательности X-(ак1)n-Y-(ак2)m-Z, где (ак1)n представляет собой Tyr-Val-Met-Gly (SEQ ID NO: 20) или Tyr-Val-Nle-Gly (SEQ ID NO: 21); Y представляет собой His-Phe-Arg-Trp (SEQ ID NO: 16); His-(D-Phe)-Arg-Trp; His-Phe-(D-Arg)-Trp; His-Phe-Arg-(D-Trp); His-(D-Phe)-Arg-(D-Trp); His-Nal-Arg-Trp или His-(D-Nal)-Arg-Trp; (ак2)m представляет собой Asp и Z выбирают из группы, состоящей из Arg-Phe-Gly; Arg-(D-Phe)-Gly; Arg-Phe и Arg-(D-Phe).
В частности, в одном варианте осуществления (ак1)n представляет собой Tyr-Val-Met-Gly (SEQ ID NO: 20), Y представляет собой His-Phe-Arg-Trp (SEQ ID NO: 16), (ак2)m представляет собой Asp и Z выбирают из группы, состоящей из Arg-Phe-Gly и Arg-Phe. Это соответствует природному пептиду γ-MSH (1 или 2 типа), модифицированному фрагментом X, описанным в настоящем документе.
В соответствии с настоящим изобретением пептид может представлять собой аналог γ1-MSH, состоящий из последовательности, выбранной из группы, состоящей из:


где X представляет собой разветвленный аминокислотный зонд, описанный выше в настоящем документе.
В одном варианте осуществления самый карбокси-концевой остаток Gly представляет собой амид глицина.
В соответствии с настоящим изобретением пептид может представлять собой аналог γ2-MSH, состоящий из последовательности, выбранной из группы, состоящей из:


где X представляет собой разветвленный аминокислотный зонд, описанный выше в настоящем документе.
В одном варианте осуществления самый карбокси-концевой остаток Phe или (D-Phe) представляет собой амид фенилаланина.
Активность
Термин «агонист» в контексте настоящего изобретения относится к веществу или пептиду, описанному в настоящем документе, способному связываться, или в некоторых вариантах осуществления способному связываться по меньшей мере до некоторой степени, и/или активировать рецептор, или в некоторых вариантах осуществления активировать рецептор по меньшей мере до некоторой степени. Агонист рецептора MC1r (агонист MC1r), таким образом, способен связываться и/или активировать рецептор MC1r. В настоящем документе термины «агонист MC1r» и «агонист рецептора MC1r» используются взаимозаменяемо.
Агонист может быть агонистом рецепторов нескольких разных типов, и таким образом, быть способным связываться и/или активировать рецепторы нескольких разных типов. Указанный агонист может также быть избирательным агонистом, который связывает и активирует рецептор только одного типа. Термин «антагонист» в контексте настоящего изобретения относится к веществу, способному ингибировать действие агониста рецептора.
Полные агонисты связывают (обладают аффинностью в отношении) и активируют рецептор, проявляя полную эффективность в отношении этого рецептора. «Частичные агонисты» в контексте настоящего изобретения представляют собой пептиды, способные связывать и активировать указанный рецептор, однако проявляющие лишь частичную эффективность в отношении рецептора, по сравнению с полным агонистом. Частичные агонисты могут действовать как антагонисты, когда конкурируют с полным агонистом за связывание с рецептором и приводят в конечном итоге с уменьшению активации рецептора по сравнению с эффектами или активацией, наблюдаемой в случае одного только полного агониста.
«Избирательные агонисты» в контексте настоящего изобретения представляют собой соединения, которые являются избирательными, и таким образом, преимущественно связывают и активируют рецепторы одного типа. Таким образом, избирательный агонист рецептора MC1r является избирательным для рецептора MC1r.
В одном варианте осуществления пептиды по настоящему изобретению способны к связыванию и активации до некоторой степени одного или нескольких рецепторов меланокортина и могут иметь разные аффинности связывания и/или разные эффективности активации рецепторов для разных рецепторов MC, при этом термин «аффинность» относится к числу и величине межмолекулярных сил между пептидным лигандом и его рецептором, а также времени нахождения лиганда в сайте связывания его рецептора; и термин «эффективность активации рецепторов» относится к способности пептидного лиганда вызывать биологический ответ при связывании с целевым рецептором, а также количественной величине этого ответа. В некоторых вариантах осуществления такие различия в аффинности и эффективности активации рецепторов определяют путем изучения связывания/активации рецепторов, которое является обычным в данной области, например, путем получения значений EC50 и Emax для стимуляции при связывании лиганда в клетках, экспрессирующих упомянутые в настоящем документе рецепторы MC одного или нескольких типов, или на тканях, экспрессирующих рецепторы MC разных типов. Высокая аффинность означает, что более низкая концентрация соединения требуется для достижения связывания 50% рецепторов, по сравнению с пептидами, которые имеют более низкую аффинность; высокая эффективность активации рецепторов означает, что более низкая концентрация пептида требуется для достижения 50% ответа активации рецепторов (низкое значение EC50), по сравнению с пептидами, которые имеют более низкую аффинность и/или эффективность активации рецепторов (более высокое значение EC50).
В одном варианте осуществления настоящего изобретения пептиды, которые являются комбинированными агонистами двух или более рецепторов MC, имеют разные аффинности и/или эффективности активации рецепторов для двух или более рецепторов, выбранных из MC1r, MC2r, MC3r, MC4r и MC5r.
Эффективность активации рецепторов для пептидных агонистов по настоящему изобретению можно также измерять в величинах p(A50), что является общепринятым способом определения эффективности активации рецепторов для агониста.
В одном конкретном варианте осуществления пептиды по настоящему изобретению способны к связыванию и активации по меньшей мере рецептора меланокортина MC1r. В следующем варианте осуществления указанный пептид является полным агонистом рецептора меланокортина MC1r.
В следующем варианте осуществления указанный пептид дополнительно способен к связыванию и активации рецептора меланокортина MC3r. Следовательно, в одном варианте осуществления пептид по настоящему изобретению способен к связыванию и активации рецепторов меланокортина MC1r и/или MC3r. В другом варианте осуществления пептид по настоящему изобретению способен к связыванию и активации рецепторов меланокортина MC1r и MC3r.
Способ получения
Пептиды по настоящему изобретению можно получать любыми подходящими методами, известными в данной области. Таким образом, в некоторых вариантах осуществления α- и γ-MSH (природные или варианты/аналоги, описанные в настоящем документе), а также фрагмент X получают стандартными методами получения пептидов, такими как жидкофазный или твердофазный пептидный синтез (SPPS), например твердофазный синтез методом Меррифилда.
В одном варианте осуществления пептиды по изобретению получают методом твердофазного синтеза, сначала получая фармакологически активную пептидную последовательность (α- или γ-MSH; природных или вариантов, описанных в настоящем документе) с использованием хорошо известных стандартных методик создания защиты, соединения и снятия защиты, затем последовательно присоединяя разветвленную аминокислотную последовательность фрагмента X к активному пептиду тем же методом, что и при конструировании активного пептида, и наконец, отщепляя законченный пептид от носителя. Данная стратегия приводит к получению пептида, в котором фрагмент X ковалентно связан с фармакологически активным пептидом на N-концевом атоме азота пептида.
В одном варианте осуществления альфа-атом азота на последней аминокислоте в разветвленной аминокислотной последовательности блокируют ацетилом, используя стандартные методики ацилирования, до или после связывания разветвленной аминокислотной последовательности с активным пептидом.
Реакционно-способные фрагменты на N- и C-концах, которые способствуют связыванию аминокислот во время синтеза, а также реакционно-способные функциональные группы боковых цепей, могут взаимодействовать со свободными концами или другими группами боковых цепей во время синтеза и удлинения пептида и отрицательно влиять на выход и чистоту продукта. Поэтому разработаны химические группы, которые связываются со специфическими функциональными группами аминокислот и блокируют, или защищают, функциональные группы от неспецифических реакций. Очищенные отдельные аминокислоты взаимодействуют с этими защитными группами до начала синтеза, а затем они избирательно удаляются во время определенных стадий пептидного синтеза. Примерами N-концевых защитных групп являются t-Boc и Fmoc, обычно используемые в твердофазном пептидном синтезе. C-концевые защитные группы в основном используют в жидкофазном синтезе. Поскольку снятие защиты на N-конце происходит постоянно в процессе пептидного синтеза, были созданы схемы создания защиты, в которых различные типы защитных групп боковых цепей (бензил, Bzl, или трет-бутил, tBu) подобраны либо для Boc, либо для Fmoc, соответственно, для оптимизации снятия защиты.
В конкретном варианте осуществления изобретения при получении разветвленного аминокислотного зонда, например, Ac(Ac-Lys-Lys)Lys-, защитной группой для Lys является Mtt, защищенная с ее помощью аминокислота коммерчески доступна (Fmoc-Lys(Mtt)-OH; N-α-Fmoc-N-ε-4-метилтритил-L-лизин, CAS# 167393-62-6). Lys(Mtt) позволяет блокировать Lys ацетилом, так как эта группа не отщепляется в условиях, в которых отщепляется Fmoc, и может быть удалена без отщепления других защитных групп боковой цепи.
В некоторых вариантах осуществления способ получения оптимизирован с помощью рутинных методов в данной области, которые могут повышать выход и/или качество полученного таким образом синтетического пептида. Например, использование дипептидов псевдоролина (оксазолидина) в Fmoc SPPS серин- и треонин-содержащих пептидов может приводить к повышению качества и выхода сырых продуктов и может помогать избегать ненужного повторного синтеза неудачных последовательностей. Эти дипептиды просты в использовании: просто заменяют остаток серина или треонина вместе с предшествующим аминокислотным остатком в пептидной последовательности соответствующим псевдопролиновым дипептидом. Естественная последовательность восстанавливается при расщеплении и снятии защиты.
В одном варианте осуществления каждую из фармакологически активной пептидной последовательности (α или γ-MSH; природных или вариантов, описанных в настоящем документе) и последовательности фрагмента X (или его частей) получают отдельно, например, жидкофазным синтезом, твердофазным синтезом, рекомбинантными методами или ферментативным синтезом, с последующим связыванием (по меньшей мере) двух последовательностей хорошо известными методами конденсации сегментов с использованием либо жидкофазных, либо твердофазных методов, либо их сочетания.
В одном варианте осуществления α- или γ-MSH, описанные в настоящем документе, получают методами рекомбинантной ДНК и фрагмент X получают методом твердофазного или жидкофазного синтеза. Конъюгирование α- или γ-MSH и фрагмента X в одном варианте осуществления проводят с использованием химического лигирования. Эта методика позволяет собирать полностью незащищенные пептидные сегменты высокоспецифичным образом. В другом варианте осуществления конъюгирование осуществляют путем катализируемого протеазой образования пептидной связи, что является высокоспецифичным методом соединения полностью незащищенных пептидных сегментов с помощью пептидной связи.
В одном варианте осуществления C-концевую аминокислоту фрагмента X или C-концевую аминокислоту α- или γ-MSH присоединяют к твердому материалу подложки с помощью обычного линкера, такого как 2,4-диметокси-4'-гидроксибензофенон, 4-(4-гидроксиметил-3-метоксифенокси)масляная кислота, 4-гидроксиметилбензойная кислота, 4-гидроксиметилфеноксиуксусная кислота, 3-(4-гидроксиметилфенокси)пропионовая кислота или п-{(R,S)-α-[1-(9H-флуорен-9-ил)метоксиформамидо]-2,4-диметоксибензил}феноксиуксусная кислота (линкер из смолы Ринка).
Примерами подходящих твердых материалов подложки (SSM) являются, например, функционализированные смолы, такие как полистирол, полиакриламид, полидиметилакриламид, полиэтиленгликоль, целлюлоза, полиэтилен, полиэтиленгликоль, привитый на полистирол, латекс, парамагнитные микрочастицы Dynabeads и так далее.
Полученные пептиды по изобретению в некоторых вариантах осуществления отщепляют от твердого материала подложки с помощью кислоты, такой как трифторуксусная кислота, трифторметансульфоновая кислота, бромистоводородная, хлористоводородная, фтористоводородная кислота и так далее, необязательно в сочетании с фенолом, тиоанизолом и так далее, либо пептидный конъюгат по изобретению в других вариантах осуществления отщепляют от твердого материала подложки с помощью основания, такого как аммиак, гидразин, алкоксид, такой как этоксид натрия, гидроксид, такой как гидроксид натрия, и так далее.
В других вариантах осуществления пептиды по изобретению можно получать или производить рекомбинантными методами. Так, в одном аспекте настоящего изобретения пептид продуцируется клетками-хозяевами, содержащими первую последовательность нуклеиновой кислоты, кодирующую пептид, функционально связанную со второй нуклеиновой кислотой, способной направлять экспрессию в указанных клетках-хозяевах. В некоторых вариантах осуществления вторая последовательность нуклеиновой кислоты содержит или даже состоит из промотора, который будет направлять экспрессию интересующего белка в указанных клетках. Специалист легко сможет определить полезные последовательности второй нуклеиновой кислоты (например, векторы и плазмиды) для использования в конкретной клетке-хозяине.
Способ получения рекомбинантного пептида, как правило, включает этапы: подготовки клетки-хозяина; создания экспрессионного генного конструкта, содержащего первую нуклеиновую кислоту, кодирующую пептид, функционально связанную со второй нуклеиновой кислотой, способной направлять экспрессию указанного интересующего белка в клетке-хозяине; трансформирования клетки-хозяина конструктом и культивирования клетки-хозяина, в результате чего осуществляется экспрессия пептида. В одном варианте осуществления изобретения рекомбинантно продуцируемый пептид выделяется клетками-хозяевами. Клетка-хозяин включает любую подходящую клетку-хозяина, известную в данной области, включая прокариотические клетки, дрожжевые клетки, клетки насекомых и клетки млекопитающих.
В одном варианте осуществления рекомбинантный пептид, полученный таким образом, выделяют общепринятым способом. Специалист будет в состоянии определить подходящие этапы выделения белка для очистки пептида.
Лекарственное средство/Способы лечения
Один из аспектов относится к аналогам α-MSH и γ-MSH по настоящему изобретению, предназначенным для применения в качестве лекарственного средства.
В другом аспекте настоящее изобретение относится к способам лечения, предотвращения или облегчения ишемического и/или воспалительного состояния в ткани одного или более органов, как упомянуто в настоящем документе. Такие способы по настоящему изобретению в одном варианте осуществления включают один или более этапов введения или высвобождения в организме индивидуума, который нуждается в этом, эффективного количества пептида по настоящему изобретению или фармацевтической композиции, содержащей один или более таких пептидов. В одном варианте осуществления такие этапы введения или высвобождения по настоящему изобретению выполняют одновременно, последовательно или раздельно.
Ишемию определяют как уменьшение/остановку потока крови к одному или более органам, что приводит к снижению доставки и/или утилизации кислорода в тканях. Ишемия вызывает множественные реакции в тканях, включая накопление нейтрофилов, другие воспалительные ответы и гибель клеток. Ишемия вовлечена в различные заболевания, ассоциирована с полостными операциями и, кроме того, является вторичной при других тяжелых заболеваниях.
Описанный в настоящем документе «нуждающийся индивидуум» в одном варианте осуществления является индивидуумом, который получает пользу от введения пептида или фармацевтической композиции по настоящему изобретению. В одном варианте осуществления такой индивидуум страдает от ишемического и/или воспалительного состояния в ткани одного или более органов, или имеет риск развития такого состояния. В одном варианте осуществления индивидуум является любым человеком, мужчиной или женщиной, ребенком, человеком средних лет или пожилым человеком. В одном варианте осуществления заболевание, которое предстоит лечить или предотвращать у индивидуума, связано с возрастом индивидуума, общим состоянием здоровья индивидуума, препаратами, используемыми для лечения индивидуума, а также с тем, имеет или не имеет индивидуум в анамнезе заболевания или нарушения, которые могли вызвать или вызвали ишемические и/или воспалительные состояния у индивидуума.
Используемые в настоящем документе термины «терапия» и «лечение» означают систему мер и уход за пациентом с целью борьбы с состоянием, заболеванием или нарушением. Термин охватывает полный спектр методов лечения для конкретного состояния, от которого страдает пациент, например, введение пептида или композиции с целью: облегчения или ослабления симптомов или осложнений; замедления прогрессирования состояния, частичного купирования клинических проявлений заболевания или нарушения; излечения или устранения состояния, заболевания или нарушения и/или предотвращения или снижения риска развития состояния, заболевания или нарушения; при этом термины «предотвращение» или «профилактика» означают систему мер и уход за пациентом с целью препятствования развитию состояния, заболевания или нарушения и подразумевают введение активных соединений для предотвращения или снижения риска возникновения симптомов или осложнений. Пациент, подлежащий лечению, предпочтительно является млекопитающим, в частности, человеком. Однако лечение животных, таких как мыши, крысы, собаки, кошки, коровы, лошади, овцы и свиньи, также входит в объем настоящего изобретения. Пациенты, подлежащие лечению в соответствии с настоящим изобретением, могут быть людьми разного возраста, например, взрослыми, детьми, детьми в возрасте до 16 лет, детьми в возрасте 6-16 лет, детьми в возрасте 2-16 лет, детьми в возрасте от 2 месяцев до 6 лет или детьми в возрасте от 2 месяцев до 5 лет.
Упомянутые пептиды представляют собой аналоги α-MSH и γ-MSH по настоящему изобретению и подробно описаны выше в настоящем документе.
Таким образом, в одном варианте осуществления изобретение относится к пептиду по настоящему изобретению для применения в лечении ишемического и/или воспалительного состояния в ткани одного или более органов млекопитающего. В одном варианте осуществления указанное лечение является профилактическим, облегчающим состояние или исцеляющим. В одном варианте осуществления указанное млекопитающее является человеком (Homo sapiens).
В некоторых вариантах осуществления изобретение также относится к способу лечения ишемического и/или воспалительного состояния в ткани одного или более органов, включающему этап введения терапевтически эффективного количества пептида по настоящему изобретению индивидууму, который нуждается в этом.
В конкретном варианте осуществления изобретение также относится к использованию пептида по настоящему изобретению для производства лекарственного средства для лечения ишемического и/или воспалительного состояния в ткани одного или более органов млекопитающего.
В случае ссылки на ткань одного или более органов, указанный орган в одном варианте осуществления выбирают из группы, состоящей из почки, печени, головного мозга, сердца, мышц, костного мозга, кожи, скелета, легких, дыхательных путей, селезенки, экзокринных желез, мочевого пузыря, желез внутренней секреции, репродуктивных органов, включая фаллопиевы трубы, глаза, уха, сосудистой системы, желудочно-кишечного тракта, включая тонкий кишечник, толстую кишку, прямую кишку, анальный канал, а также предстательной железы.
В одном варианте осуществления ишемическое и/или воспалительное состояние в ткани одного или более органов является острым, подострым или хроническим состоянием.
В одном варианте осуществления ишемическое и/или воспалительное состояние в ткани одного или более органов является ишемическим состоянием. В другом варианте осуществления ишемическое и/или воспалительное состояние в ткани одного или более органов является воспалительным состоянием.
В следующем варианте осуществления ишемическое состояние в ткани одного или более органов представляет собой вторичную ишемию.
Вторичная ишемия представляет собой ишемию, которая вызвана первопричинным состоянием, таким образом, ишемия, как правило, является вторичной, например, при инсульте, травме, септическом шоке, системной гипотензии, остановке сердца вследствие сердечного приступа, сердечной аритмии, атероматозной болезни с тромбозом, эмболии сердца или кровеносного сосуда из любого органа, спазме сосудов, аневризме аорты или аневризмах в других органах, коронарном стенозе, инфаркте миокарда, стенокардии, перикардите, миокардите, микседеме или эндокардите.
В одном варианте осуществления аневризма аорты является аневризмой грудного отдела, брюшного отдела или расслаивающей аневризмой аорты. В одном варианте осуществления системная гипотензия является гипотензией вследствие заболевания сердца, гипотензией вследствие системного заболевания, включая инфекцию или аллергические реакции, или гипотензией, вызванной одним или более токсическими соединениями или ядом(ами), или лекарственным средством(ами).
В одном варианте осуществления указанное ишемическое и/или воспалительное состояние в ткани одного или более органов возникает вследствие (или является результатом) состояния, выбранного из инсульта, травмы, септического шока, системной гипотензии, остановки сердца вследствие сердечного приступа, сердечной аритмии, атероматозной болезни с тромбозом, эмболии сердца или кровеносного сосуда из любого органа, спазма сосудов, аневризмы аорты или аневризмы в других органах, коронарного стеноза, инфаркта миокарда, стенокардии, перикардита, миокардита, микседемы или эндокардита.
В одном варианте осуществления указанное ишемическое состояние представляет собой ишемию миокарда.
В одном варианте осуществления указанное ишемическое и/или воспалительное состояние в ткани одного или более органов возникает вследствие сердечной аритмии. В одном варианте осуществления указанная сердечная аритмия является первичным заболеванием или вторичным по отношению к другому состоянию у индивидуума, включая острые инфекции, в частности, те, которые затрагивают легкие, легочную эмболию, гипотензию, шок, кислородное голодание и анемию.
Сердечные аритмии включают желудочковую или наджелудочковую тахиаритмии, атриовентрикулярную блокаду, болезнь синусного узла, синдром Вольфа-Паркинсона-Уайта, болезнь Ленегра, болезнь Лева, а также любой синдром, включающий аномальное миокардиальное соединение между атриумом и желудочком.
В одном варианте осуществления вторичную ишемию также можно наблюдать в связи с рядом других заболеваний и состояний, включая, но не ограничиваясь ими, сахарный диабет, гиперлипидемию, облитерирующий тромбангиит, синдром Такаясу, височный артериит, слизисто-кожный лимфоузелковый синдром (болезнь Кавасаки), сифилис сердечно-сосудистой системы, заболевания соединительной ткани, такие как болезнь Рейно, циркуляторную венозную гангрену, травму кровеносных сосудов, включая ятрогенные травмы, например, вследствие катетеризации, состояния с повышенным уровнем натощак ЛПНП-холестерина, триглицеридов и/или ЛПВП-холестерина, забрюшинный фиброз, ревматические заболевания, системную красную волчанку, узелковый полиартериит, склеродермию, полимиозит, дерматомиозит, ревматоидный артрит, нейромиопатические заболевания, такие как прогрессирующая мышечная дистрофия Дюшенна, атаксия Фридрейха и миотоническая дистрофия, анафилаксию, сывороточную болезнь, гемолитическую анемию, аллергию и аллергический агранулематоз. В одном варианте осуществления пептиды по настоящему изобретению также полезны для лечения или предотвращения указанных состояний.
Самые разные инфекции могут оказывать влияние на ткани и нарушать нормальную функцию, приводя к ухудшению функционирования, что в одном варианте осуществления лечат введением эффективной дозы пептида по изобретению. В одном варианте осуществления инфекции включают инфекции, вызванные простейшими, вирусами, бактериями и грибками, и включают такие заболевания как СПИД, бактериальная септицемия, системные грибковые инфекции, риккетсиозные заболевания, синдром токсического шока, инфекционный мононуклеоз, хламидиоз, вызванный Chlamydia thrachomatis, хламидиоз, вызванный Chlamydia psittaci, цитомегаловирусная инфекция, инфекции Campylobacter, Salmonella, грипп, полиомиелит, токсоплазмоз, лихорадка Ласса, желтая лихорадка, билхарциоз, болезни, вызванные колиподобными бактериями, энтерококками, простейшими, клебсиеллой, псевдомонадами, золотистым стафилококком, эпидермальным стафилококком, Candida albicans, туберкулез, паротит, инфекционный мононуклеоз, гепатит и болезнь, вызванная вирусом Коксэки.
В одном варианте осуществления состояние, которое подлежит лечению, вызвано раком или предраковым заболеванием, оказывающим влияние на орган, например, на дыхательную систему, включая легкие, бронхиолы, верхние дыхательные пути, и/или на сердце, и/или на почки, и/или на желудочно-кишечную систему, включая острый лейкоз, хронический миелоцитарный лейкоз, хронический лимфоцитарный лейкоз, болезнь Ходжкина, лимфосаркому, миелому, метастазирующую карциному любого происхождения. В одном варианте осуществления пептиды по изобретению используют для лечения или предотвращения указанных состояний.
В одном варианте осуществления ишемическое и/или воспалительное состояние в ткани одного или более органов вызвано физической травмой, в том числе электромагнитным излучением.
Хирургическая операция и трансплантация
Обширные оперативные вмешательства, включая кардиоторакальную операцию, абдоминальную операцию, операции на аорте и других крупных кровеносных сосудах, а также трансплантация органов, например, легких или сердца, или трансплантация сердечно-легочного комплекса, трансплантация печени или трансплантация почек, индуцируют системный воспалительный ответ (SIR; или синдром системного воспалительного ответа SIRS) и ассоциированы с послеоперационной дисфункцией органов, включая развитие почечной недостаточности.
Почечная недостаточность является последствием SIR и уменьшения потока крови, возникающего в процессе хирургического вмешательства. Результатом является послеоперационное острое поражение почек (AKI), которое в большинстве случаев переходит в хроническую почечную недостаточность. На данный момент не существует эффективного метода лечения для предотвращения развития почечной недостаточности. Послеоперационная почечная недостаточность может быть определена как снижение более чем на 25% скорости клубочковой фильтрации (GFR), имеющее место через 3 месяца после хирургического вмешательства.
Большая операция на сердце, такая как восстановление одного или более клапанов сердца, шунтирование коронарной артерии (CABG), операция на корне аорты или ветви аорты, включая общие сонные артерии, или комбинированные операции на сердце, такие как замена клапана(ов) и CABG и/или операция на корне аорты, связана с развитием почечной недостаточности, которая, в случае ее развития, связана с возрастанием заболеваемости и смертности.
В одном варианте осуществления лечение аналогом α-MSH или γ-MSH по настоящему изобретению уменьшает степень почечной недостаточности. В одном варианте осуществления это достигается за счет уменьшения снижения GFR после операции; за счет уменьшения степени послеоперационного возрастания концентрации в сыворотке креатинина или цистатина С, или более экстренного увеличения выделения с мочой маркеров AKI NGAL, IL18 или KIM-1; и/или за счет уменьшения степени послеоперационного SIR (например, путем снижения уровня циркулирующего IL-6 и других провоспалительных маркеров).
Трансплантация легких (LTX) является последним методом лечения, к которому прибегают на конечной стадии заболевания легких. Основными проблемами, связанными с LTX, являются нехватка доноров, острое и хроническое отторжение трансплантированных легких и побочные эффекты иммуносупрессивной терапии, включая развитие хронической почечной недостаточности (CRF).
Хотя с помощью новых иммуносупрессивных лекарственных средств достигнут значительный прогресс в лечении острого отторжения, приводящий к сокращению числа случаев острого отторжения в течение первого года, сокращению потери органов, уменьшению побочных эффектов, уменьшению инфекций и менее инвазивным методам мониторинга, контроль хронического отторжения не удалось намного улучшить, и время полужизни, определяемое тем, сколько лет смогут прожить 50% пациентов, лишь незначительно увеличилось в последние 2 десятилетия, достигнув примерно 7 лет.
Преобладающими побочными эффектами иммуносупрессивного лечения являются 2 основные проблемы: нефротоксичность и посттрансплантационные лимфопролиферативные заболевания (PTLD), причем последние можно рассматривать как последствие той степени иммуносупрессии, которая необходима, чтобы избежать хронического отторжения органа - «слишком много» отдаляет перспективу отторжения, но приводит к инфекциям и PTLD, в то время как «слишком мало» создает для пациентов повышенный риск отторжения трансплантата. Нефротоксичность и развитие CRF, несмотря на обширные исследования в течение последних 30 лет, по-прежнему является серьезной проблемой. Через пять лет после LTX ни у кого из пациентов не сохраняется нормальная почечная функция, и 20% выживших в течение длительного времени в конечном итоге нуждаются также и в трансплантации почек.
Лечение ингибитором кальцинейрина (такролимус, циклоспорин A) является краеугольным камнем в стратегии иммуносупрессивной терапии для успешной трансплантации цельных органов. Ограничивающим фактором в использовании ингибиторов кальцинейрина является острая и хроническая необратимая нефротоксичность. Последние данные показывают, что почечная функция (измеренная как уменьшение GFR) снижается на 40% в течение первых 14 дней после LTX и что это снижение является необратимым.
Трансплантация сердца (HTX) является последним методом лечения, к которому прибегают на конечной стадии сердечной недостаточности. Как и в случае LTX, основными проблемами, связанными с HTX, являются нехватка доноров, острое и хроническое отторжение трансплантированного сердца и побочные эффекты иммуносупрессивной терапии, включая развитие CRF. Как и в случае LTX, число пациентов с сохраненной почечной функцией с течением времени становится ограниченным, или их не остается, и как и в случае LTX, значительное снижение почечной функции наблюдается уже через две-четыре недели после трансплантации.
Этот драматический эффект на почечную функцию, наблюдаемый после LTX и HTX, вероятно, вызван не только самим ингибитором кальцинейрина, но является конечным результатом хирургической и анестезиологической травмы в сочетании с ишемией органа и побочными эффектами антибиотиков, противовирусных, противогрибковых и иммуносупрессивных лекарственных средств. Следовательно, в одном варианте осуществления фармакологическое вмешательство путем применения аналогов α-MSH и γ-MSH по настоящему изобретению будет уменьшать степень почечной недостаточности, ассоциированной с трансплантацией органов, такой как LTX и HTX.
Таким образом, хирургическая операция, как подробно описано выше в настоящем документе, включая трансплантацию органов, может являться причиной вторичной ишемии.
Соответственно, в одном варианте осуществления изобретение относится к пептиду по настоящему изобретению для применения в лечении ишемического и/или воспалительного состояния в ткани одного или более органов млекопитающего, при этом указанное ишемическое и/или воспалительное состояние ассоциировано с хирургической операцией. В одном варианте осуществления указанная хирургическая операция является полостной операцией или обширным оперативным вмешательством.
В одном варианте осуществления указанную хирургическую операцию выбирают из группы, состоящей из кардиоторакальной операции, абдоминальной операции, операции на аорте и других крупных кровеносных сосудах, восстановления одного или более клапанов сердца, шунтирования коронарной артерии (CABG), операции на корне аорты или ветви аорты, включая общие сонные артерии, и комбинированных операций на сердце, таких как замена клапана(ов) и CABG и/или операция на корне аорты.
В одном варианте осуществления указанная хирургическая операция включает хирургическое введение трансплантатов, устройств, имплантатов, протезов или других биомедицинских соединений или устройств, вводимых в организм путем хирургических операций.
В одном варианте осуществления указанная полостная операция включает трансплантацию органа. Следовательно, в одном варианте осуществления изобретение относится к пептиду по настоящему изобретению для применения в лечении ишемического и/или воспалительного состояния в ткани одного или более органов млекопитающего, при этом указанное ишемическое и/или воспалительное состояние ассоциировано с трансплантацией органа. В одном варианте осуществления указанная трансплантация органа является трансплантацией цельного органа.
В одном варианте осуществления указанная трансплантация цельного органа является трансплантацией сердца, трансплантацией легких, трансплантацией сердечно-легочного комплекса, трансплантацией печени или почечной (ренальной) трансплантацией.
В другом варианте осуществления изобретение относится к пептиду по настоящему изобретению для применения в лечении послеоперационного синдрома системного воспалительного ответа (SIRS), послеоперационной дисфункции органов и/или послеоперационной почечной недостаточности, такой как острое поражение почек (AKI), нефротоксичность и/или хроническая почечная недостаточность (CRF).
В одном варианте осуществления изобретение относится к пептиду по настоящему изобретению, применяемому для уменьшения степени почечной недостаточности, ассоциированной с полостной операцией, в одном варианте осуществления - с трансплантацией органа.
Реперфузионное повреждение представляет собой поражение ткани, возникающее, когда в ткани возобновляется кровоснабжение после периода ишемии или недостатка кислорода. Отсутствие кислорода и питательных веществ из крови во время периода ишемии создает условия, в которых восстановление кровообращения приводит к воспалению и окислительному повреждению в результате индукции окислительного стресса вместо восстановления нормальной функции.
Реперфузионные повреждения могут возникать в связи с операциями, такими как обширные оперативные вмешательства, включая трансплантации органов. Это является главной проблемой при проведении трансплантаций печени, а также при операциях на сердце.
В конкретном варианте осуществления указанное ишемическое и/или воспалительное состояние в ткани одного или более органов ассоциировано с реперфузионным повреждением. Таким образом, в одном варианте осуществления настоящее изобретение относится к пептиду по настоящему изобретению для применения в лечении ишемического и/или воспалительного состояния в ткани одного или более органов млекопитающего, при этом указанное ишемическое и/или воспалительное состояние ассоциировано с реперфузионным повреждением.
В некоторых вариантах осуществления пептиды или композиции по настоящему изобретению следует вводить до и/или во время хирургической операции и/или трансплантации органа.
Токсины и лекарственные средства
В одном варианте осуществления ишемическое и/или воспалительное состояние в ткани одного или более органов, описанное в настоящем документе, вызвано функциональной недостаточностью клеток, тканей или органов, индуцированной токсином или лекарственным средством.
Следовательно, в одном варианте осуществления изобретение относится к пептиду по настоящему изобретению для применения в лечении ишемического и/или воспалительного состояния в ткани одного или более органов млекопитающего, при этом указанное ишемическое и/или воспалительное состояние вызвано (или индуцировано) функциональной недостаточностью клеток, тканей или органов, индуцированной токсином или лекарственным средством.
Указанное лекарственное средство включает, но не ограничивается ими, противораковые химиотерапевтические средства, включая цисплатин, карбоплатин, дакарбазин, прокарбазин, алтретамин, семустин, ломустин, кармустин, бусульфан, тиотепу, мелфалан, циклофосфамид, хлорамбуцил, мехлорэтамин, азацитидин, кладрибин, цитарабин, флударабин, фторурацил, меркаптопурин, метотрексат, тиогуанин, аллопуринол, блеомицин, дактиномицин, даунорубицин, доцетаксел, доксорубицин (адриамицин), этопозид, идарубицин, иринотекан, митомицин, паклитаксел, пликамицин, топотекан, винбластин, винкристин, винорелбин, амсакрин, аспарагиназу, гидроксимочевину, митотан, митоксантрон; антибиотики, такие как аминогликозиды, включая стрептомицин, неомицин, канамицин, амикацин, гентамицин, тобрамицин, сизомицин и нетилмицин; иммунодепрессанты, такие как циклоспорин; трициклические антидепрессанты, соли лития, производные прениламина и фенотизина.
Воспалительные состояния
Воспаление является локализованной защитной реакцией организма против патогенов и травм. Иммунные клетки и растворимые факторы принимают участие в этом процессе для нейтрализации наносящего вред агента и инициации заживления тканей для восстановления гомеостаза. Утрата регуляции этих механизмов может препятствовать окончательному разрешению воспалительного процесса, приводя к хроническому воспалению. Хроническое воспаление является крайне актуальной проблемой современной медицины, поскольку оно вносит вклад в патогенез наиболее распространенных заболеваний в промышленно развитых странах, включая атеросклероз, острую и хроническую сердечную недостаточность, рак, диабет и заболевания, связанные с ожирением. Последние результаты изучения эндогенных противовоспалительных путей выявили ряд природных противовоспалительных и способствующих устранению воспаления молекул и путей, подходящих для фармакологического вмешательства, что позволило бы разрабатывать лекарственные средства, которые имитируют естественный ход разрешения воспаления. В число этих природных противовоспалительных и способствующих устранению воспаления путей входит система меланокортинов.
Противовоспалительные эффекты меланокортинов проявляются за счет ингибирования медиаторов воспаления и за счет ингибирования миграции воспалительных клеток. Меланокортины оказывают свое действие в различных клетках, включая моноциты, макрофаги, подтипы T-клеток, эндотелиальные клетки и эпителиальные клетки.
Большинство типов клеток, восприимчивых к противовоспалительному действию меланокортинов, экспрессируют MCr1, например, моноциты, макрофаги, нейтрофилы, тучные клетки, фибробласты, дендритные клетки, астроциты и микроглия. Как человеческие, так и мышиные макрофаги экспрессируют MCr3, и появляется все больше информации, свидетельствующей о том, что MC3r опосредует противовоспалительные эффекты in vitro и in vivo в моделях как острого, так и более устойчивого/хронического воспаления.
Следовательно, в одном варианте осуществления противовоспалительное вмешательство, направленное на систему меланокортинов, принесет больше пользы при использовании в качестве мишеней как MC1r, так и MC3r.
Заболевания суставов, такие как ревматоидный артрит (РА) и подагра, характеризуются приступами с обострениями, при РА обострения (часто описываемые как вспышки), как правило, возникают на фоне хронических симптомов и развиваются, несмотря на интенсивное фармакологическое лечение. Аналогичную картину можно наблюдать при подагре, с той основной разницей, что у большинства пациентов с подагрой симптомы между обострениями отсутствуют. При обоих состояниях значительная инфильтрация нейтрофилов в синовиальную мембрану и суставную жидкость является основным патологическим признаком обострений. Наиболее важные вовлеченные провоспалительные эффекторы включают IL-1β, TNF-α, IL-6, IL-8 и COX-2. Разрешение обострений во избежание развития или усугубления хронического воспаления включает активацию макрофагов для фагоцитоза апоптических нейтрофилов.
Рецепторы меланокортина 1 и 3 типов экспрессируются в синовиальной ткани как животных, так и человека, и судя по всему, экспрессия MC3r повышена у пациентов с RA в активной форме.
Следовательно, в одном варианте осуществления было бы привлекательным использование лечения аналогами α-MSH или γ-MSH по настоящему изобретению при заболевании суставов, не в последнюю очередь для того, чтобы снижать степень тяжести осложнений при существующем заболевании, поскольку вспышки при ревматоидном артрите имеют серьезные клинические последствия. Однако не только заболевания суставов связаны с обострением симптомов. Нейродегенеративные заболевания, такие как рассеянный склероз, отличаются вспышкоподобными обострениями, в случае которых лечение аналогом α-MSH или γ-MSH по настоящему изобретению в одном варианте осуществления могло бы уменьшить симптомы и в конечном итоге, как и в случае заболевания суставов, уменьшить общее ухудшение функционального состояния пациентов.
Таким образом, в одном варианте осуществления изобретение относится к пептиду по настоящему изобретению для применения в лечении воспалительного состояния в ткани одного или более органов млекопитающего, при этом указанное ишемическое и/или воспалительное состояние представляет собой воспалительное заболевание.
В одном варианте осуществления указанное воспалительное заболевание представляет собой артрит. В одном варианте осуществления указанное воспалительное заболевание выбирают из группы, состоящей из артропатии (заболевания суставов), артрита (включая заболевания, ассоциированные с артритом), остеоартрита, ревматоидного артрита; спондилоартропатии (например, анкилозирующего спондилита), реактивного артрита (включая артрит после ревматической атаки), пурпуры Геноха-Шенлейна, болезни Рейтера, ювенильного хронического артрита, включая болезнь Стилла, ювенильного ревматоидного артрита, ювенильного анкилозирующего спондилита, псориаза, остеоартрита, остеоартрита вследствие разболтанности суставов, врожденной дисплазии, эпифизеолиза бедренной кости, болезни Пертеса, внутрисуставных переломов, менискэктомии, ожирения, рецидивирующего вывиха, навязчивых действий, отложений кристаллов, а также заболеваний и метаболических аномалий хрящей, включая пирофосфатную артропатию, охроноз, гемохроматоз, аваскулярный некроз, включая серповидноклеточную анемию, терапию кортикоидами или другими лекарственными средствами, кессонную болезнь, септический или инфекционный артрит (включая туберкулезный артрит, менингококковый артрит, гонококковый артрит, сальмонеллезный артрит), инфекционный эндокардит, вирусный артрит, рецидивирующий гемартроз и все виды болезней отложения солей, таких как подагра, пирофосфатная артропатия и острый кальцинирующий периартрит.
В одном варианте осуществления указанное воспалительное заболевание представляет собой заболевание соединительной ткани, в одном варианте осуществления выбранное из группы, состоящей из системной красной волчанки, полимиозита/дерматомиозита, системной склеродермии, смешанного заболевания соединительной ткани, саркоидоза и первичного синдрома Шегрена, включая сухой кератоконъюнктивит, ревматическую полимиалгию и другие типы васкулита, болезни отложения кристаллов (включая подагру), пирофосфатной артропатии и острого кальцинирующего периартрита.
В одном варианте осуществления указанное воспалительное заболевание представляет собой ревматизм мягких тканей, включая бурсит, тендовагинит или перитендинит, энтезит, сдавление нерва, периартрит или капсулит, напряжение мышц и дисфункцию мышц.
В одном варианте осуществления указанное воспалительное заболевание выбирают из группы, состоящей из васкулита, включая васкулит вследствие ревматоидного артрита, инфекционный васкулит вследствие бактериальных инфекций, в том числе болезней, вызываемых спирохетами, таких как болезнь Лайма, сифилис, риккетсиозных и микобактериальных инфекций, грибковых, вирусных или протозойных инфекций, неинфекционный васкулит вследствие гиперчувствительности и лейкоцитокластический васкулит, включая сывороточную болезнь и пурпуру Геноха-Шенлейна, лекарственный васкулит, идиопатическую смешанную криоглобулинемию, гипокомплементемию, васкулит, ассоциированный с другими видами злокачественных новообразований, неинфекционный васкулит, включая синдром/болезнь Такаясу, гигантоклеточный артериит (височный артериит и ревматическую полимиалгию), болезнь Бюргера, узелковый полиартериит, микроскопический полиартрит, гранулематоз Вегенера, синдром Черджа-Стросс, а также васкулит вследствие заболеваний соединительной ткани, включая системную красную волчанку, полимиозит/дерматомиозит, системную склеродермию, смешанное заболевание соединительной ткани, саркоидоз и первичный синдром Шегрена.
В одном варианте осуществления указанное воспалительное заболевание представляет собой воспалительные заболевания желудочно-кишечной системы. Указанные воспалительные заболевания желудочно-кишечной системы могут быть выбраны из группы, состоящей из воспалительного заболевания кишечника, целиакии, глютензависимой энтеропатии, эозинофильного гастроэнтерита, лимфангиэктазии кишечника, воспалительного заболевания кишечника (включая болезнь Крона и язвенный колит), дивертикулита толстой кишки, радиационного энтерита, синдрома раздраженной кишки, болезни Уиппла, стоматита всех видов, заболеваний слюнных желез (таких как саркоидоз, обструкция слюнных протоков и синдром Шегрена), воспаления пищевода (например, вследствие гастроэзофагеального рефлюкса или кандидоза, герпесвирусной и цитомегаловирусной инфекции), воспалительных заболеваний желудка (включая острый и хронический гастрит, инфекцию Helicobacter pylori и болезнь Менетрие), а также воспаления тонкого кишечника.
В одном варианте осуществления указанное воспалительное заболевание представляет собой нейродегенеративное заболевание, такое как нейродегенеративное заболевание с воспалительным компонентом, например, рассеянный склероз (MS).
В одном варианте осуществления указанное воспалительное заболевание выбирают из группы, состоящей из дерматита, пемфигуса, буллезного пемфигоида, доброкачественного пемфигоида слизистой оболочки, герпетиформного дерматита, тропических афт, системного амилоидоза, первичного биллиарного цирроза, синдрома Гудпасчера, всех видов заболеваний отложения солей, таких как подагра, пирофосфатная артропатия и острый кальцинирующий периартрит, панкреатита, септического дисцита, туберкулеза, злокачественных новообразований (таких как метастазы, миелома и другие), опухолей позвоночника, анкилозирующего спондилита, острого пролапса диска, хронического заболевания диска/остеоартрита, остеопороза и остеомаляции, болезни Паджета, гиперпаратиреоза, нефрогенной остеодистрофии, спондилолистеза, врожденной аномалии - стеноза позвоночного канала и фибромиалгии.
В одном варианте осуществления указанное воспалительное заболевание выбирают из группы, состоящей из заболеваний верхних и нижних дыхательных путей, таких как хронические обструктивные заболевания легких (COPD), аллергическая и неаллергическая астма, аллергический ринит, аллергический и неаллергический конъюнктивит, аллергический и неаллергический дерматит и воспаление легких.
Второстепенные активные ингредиенты
В некоторых вариантах осуществления пептиды по настоящему изобретению объединены с, или содержат один или более второстепенных активных ингредиентов, которые представляют собой другие терапевтические соединения или их фармацевтически приемлемые производные.
Таким образом, в одном варианте осуществления способы лечения по настоящему изобретению дополнительно включают один или более этапов введения одного или более второстепенных активных ингредиентов, либо одновременно, либо последовательно, и в любых подходящих соотношениях. В одном варианте осуществления такие второстепенные активные ингредиенты выбирают, например, из соединений, используемых для лечения или предотвращения ишемического и/или воспалительного состояния в ткани одного или более органов, либо симптомов и осложнений, ассоциированных с ишемическим и/или воспалительным состоянием в ткани одного или более органов.
В одном варианте осуществления способы лечения по настоящему изобретению включают этап, на котором фармацевтическую композицию или пептид, описанные в настоящем документе, вводят одновременно, последовательно или раздельно в сочетании с одним или более второстепенными активными ингредиентами.
Набор компонентов
В одном варианте осуществления настоящее изобретение относится к набору компонентов. В одном варианте осуществления набор компонентов по настоящему изобретению содержит один или более из пептидов или композиций, описанных в настоящем документе, предназначенных для лечения, предотвращения или облегчения ишемического и/или воспалительного состояния в ткани одного или более органов. В одном варианте осуществления наборы по настоящему изобретению делают возможным одновременное, последовательное или раздельное введение пептидов или второстепенных активных ингредиентов, описанных в настоящем документе.
В одном варианте осуществления настоящего изобретения набор компонентов содержит один или более второстепенных активных ингредиентов, описанных в настоящем документе.
Введение и дозировка
В соответствии с настоящим изобретением, композицию, содержащую аналог MSH, описанный в настоящем документе, в одном варианте осуществления вводят индивидуумам, которые нуждаются в лечении, в фармацевтически эффективных дозах или в терапевтически эффективном количестве.
В одном варианте осуществления терапевтически эффективное количество пептида по настоящему изобретению представляет собой количество, достаточное для излечения, предотвращения, снижения риска развития, облегчения или частичного подавления клинических проявлений конкретного заболевания или нарушения и его осложнений. Количество, являющееся эффективным для конкретной терапевтической цели, будет зависеть от степени тяжести и типа нарушения, а также от массы тела и общего состояния здоровья субъекта. Количество, достаточное для достижения этой цели, называют «терапевтически эффективным количеством».
В одном варианте осуществления настоящего изобретения композицию вводят в дозах от 1 мкг/сутки до 100 мг/сутки; например, от 1 мкг/сутки до 10 мкг/сутки, например, от 10 мкг/сутки до 100 мкг/сутки, например, от 100 мкг/сутки до 250 мкг/сутки, например, от 250 мкг/сутки до 500 мкг/сутки, например, от 500 мкг/сутки до 750 мкг/сутки, например, от 750 мкг/сутки до 1 мг/сутки, например, от 1 мг/сутки до 2 мг/сутки, например, от 2 мг/сутки до 5 мг/сутки, или например, от 5 мг/сутки до 10 мг/сутки, например, от 10 мг/сутки до 20 мг/сутки, например, от 20 мг/сутки до 30 мг/сутки, например, от 30 мг/сутки до 40 мг/сутки, например, от 40 мг/сутки до 50 мг/сутки, например, от 50 мг/сутки до 75 мг/сутки, или например, от 75 мг/сутки до 100 мг/сутки.
В одном варианте осуществления настоящего изобретения вводят одну дозу композиции, и она может содержать от 1 мкг/кг массы тела до 100 мг/кг массы тела; например, 1-10 мкг/кг массы тела, например, 10-100 мкг/сутки, например, 100-250 мкг/кг массы тела, например, 250-500 мкг/кг массы тела, например, 500-750 мкг/кг массы тела, например, от 750 мкг/кг массы тела до 1 мг/кг массы тела, например, от 1 мг/кг массы тела до 2 мг/кг массы тела, например, 2-5 мг/кг массы тела, например, 5-10 мг/кг массы тела, например, 10-20 мг/кг массы тела, например, 20-30 мг/кг массы тела, например, 30-40 мг/кг массы тела, например, 40-50 мг/кг массы тела, например, 50-75 мг/кг массы тела или, например, 75-100 мг/кг массы тела.
В одном варианте осуществления дозу по настоящему изобретению вводят один или несколько раз в сутки, например, от 1 до 6 раз в сутки, например, от 1 до 5 раз в сутки, например, от 1 до 4 раз в сутки, например, от 1 до 3 раз в сутки, например, от 1 до 2 раз в сутки, например, от 2 до 4 раз в сутки, например, от 2 до 3 раз в сутки. В одном варианте осуществления композицию, содержащую пептид по изобретению, вводят предоперационно (до операции или хирургического вмешательства) и/или интраоперационно (во время операции или хирургического вмешательства).
Пути введения
Следует иметь в виду, что предпочтительный путь введения будет зависеть от общего состояния и возраста субъекта, которого предстоит лечить, природы состояния, подлежащего лечению, локализации ткани, подлежащей лечению, в организме и выбранного активного ингредиента.
В одном варианте осуществления настоящего изобретения путь введения позволяет пептиду пересекать гематоэнцефалический барьер.
Системное лечение
В одном варианте осуществления путь введения позволяет вводить пептид в кровоток, чтобы он в конечном итоге достиг участков, где желательно оказываемое им действие.
В одном варианте осуществления путями введения являются любые подходящие пути введения, такие как энтеральный путь (включая пероральный, ректальный, назальный, легочный, трансбуккальный, подъязычный, чрескожный, интрацистернальный и внутрибрюшинный пути введения) и/или парентеральный путь (включая подкожный, внутримышечный, интратекальный, внутривенный и внутрикожный пути введения).
Подходящие лекарственные формы для такого введения можно получать общепринятыми методами.
Парентеральное введение
Парентеральное введение представляет собой любой путь введения, не являющийся пероральным/энтеральным путем, в результате чего лекарственное средство не подвергается пресистемному метаболизму в печени. Соответственно, парентеральное введение включает любые инъекции и инфузии, например, болюсную инъекцию или непрерывную инфузию, например, внутривенное введение, внутримышечное введение или подкожное введение. Кроме того, парентеральное введение включает ингаляции и местное введение.
Соответственно, в одном варианте осуществления пептид или композицию вводят местно для пересечения ими какой-либо слизистой оболочки у животного, которому должно быть введено вещество или пептид, например, в носу, во влагалище, в глазу, во рту, в половых путях, легких, желудочно-кишечном тракте или прямой кишке, например, слизистой оболочки носа или рта, и, соответственно, парентеральное введение может также включать трансбуккальное, подъязычное, носовое, ректальное, вагинальное и внутрибрюшинное введение, а также легочное и бронхиальное введение путем ингаляции или инстилляции. В некоторых вариантах осуществления пептид вводят местно для его прохождения через кожу.
В одном варианте осуществления используют внутривенную, подкожную и внутримышечную формы парентерального введения.
Локальное лечение
В одном варианте осуществления пептид или композицию по изобретению используют для локального лечения, то есть вводят непосредственно в зону(ы) его действия. Соответственно, пептид можно наносить непосредственно на кожу или слизистую оболочку, или пептид можно инъецировать в зону его действия, например, в пораженную ткань или в концевой участок артерии, ведущей непосредственно к пораженной ткани.
Фармацевтические препараты
В одном варианте осуществления пептиды по настоящему изобретению или их фармацевтически приемлемые производные вводят отдельно или в сочетании с фармацевтически приемлемыми носителями или эксципиентами, либо в одной, либо в нескольких дозах. Фармацевтические композиции или соединения по изобретению можно формулировать с фармацевтически приемлемыми носителями или разбавителями, а также любыми другими известными адъювантами и эксципиентами в соответствии с общепринятыми методами, такими как те, которые описаны в Remington: The Science и Practice of Pharmacy, 20th Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA, 2000.
В контексте настоящего изобретения термин «фармацевтически приемлемое производное» включает фармацевтически приемлемые соли, то есть соли, которые не наносят вред пациенту. Такие соли включают фармацевтически приемлемые основно-аддитивные или кислотно-аддитивные соли, а также фармацевтически приемлемые соли металлов, соли аммония и алкилированные соли аммония. Кроме того, фармацевтически приемлемое производное включает сложные эфиры и пролекарства, или другие предшественники соединения, которые могут быть биологически метаболизированы в активное соединение, или кристаллические формы соединения.
Фармацевтическая композиция или фармацевтически приемлемая композиция может быть специально сформулирована для введения любым подходящим путем введения, таким как энтеральный путь, пероральный, ректальный, назальный, легочный, трансбуккальный, подъязычный, чрескожный, интрацистернальный, внутрибрюшинный и парентеральный (включая подкожный, внутримышечный, интратекальный, внутривенный и внутрикожный) пути введения.
В одном из вариантов осуществления настоящего изобретения фармацевтические композиции или соединения по настоящему изобретению сформулированы для пересечения гематоэнцефалического барьера.
Фармацевтические композиции для перорального введения включают твердые лекарственные формы, такие как твердые или мягкие капсулы, таблетки, лепешки, драже, пилюли, пастилки, порошки и гранулы. Когда это целесообразно, их можно изготавливать с покрытием, таким как энтеросолюбильное покрытие, или их можно формулировать так, чтобы обеспечить контролируемое высвобождение активного ингредиента, например, замедленное или пролонгированное высвобождение, с использованием методов, хорошо известных в данной области. В одной и той же твердой лекарственной форме два активных ингредиента можно объединять таким образом, чтобы обеспечить контролируемое высвобождение одного активного ингредиента и немедленное высвобождение другого активного ингредиента.
Жидкие лекарственные формы для перорального введения включают растворы, эмульсии, водные или масляные суспензии, сиропы и эликсиры.
Фармацевтические композиции для парентерального введения включают стерильные водные и неводные инъекционные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления в стерильных инъекционных растворах или дисперсиях перед использованием. Инъекционные препараты замедленного всасывания также считаются входящими в объем настоящего изобретения.
Другие подходящие лекарственные формы включают суппозитории, спреи, мази, кремы/лосьоны, гели, ингаляторы, кожные пластыри, имплантаты и так далее.
В одном варианте осуществления соединение или пептид для применения по настоящему изобретению, как правило, используют в форме свободного вещества или в форме фармацевтически приемлемого производного, такого как его фармацевтически приемлемый сложный эфир или соль. Примерами последних являются: кислотно-аддитивная соль соединения, имеющего функциональность свободного основания, и основно-аддитивная соль соединения, имеющего функциональность свободной кислоты. Термин «фармацевтически приемлемая соль» означает нетоксичную соль соединения, используемого по настоящему изобретению, такие соли, как правило, получают в результате реакции свободного основания с подходящей органической или неорганической кислотой, или в результате реакции кислоты с подходящим органическим или неорганическим основанием. Если соединение, используемое по настоящему изобретению, имеет функциональность свободного основания, такие соли получают общепринятым методом, обрабатывая раствор или суспензию соединения химическим эквивалентом фармацевтически приемлемой кислоты. Если соединение, используемое по настоящему изобретению, имеет функциональность свободной кислоты, такие соли получают общепринятым методом, обрабатывая раствор или суспензию соединения химическим эквивалентом фармацевтически приемлемого основания. Физиологически приемлемые соли соединения с гидроксильной группой включают анионную форму соединения в сочетании с подходящим катионом, таким как ион натрия или аммония. Другие соли, которые не являются фармацевтически приемлемыми, могут быть полезны для получения соединения по изобретению, и они составляют дополнительный аспект изобретения.
Фармацевтически приемлемые кислотно-аддитивные соли включают, но не ограничиваются ими, гидрохлоридные, гидробромидные, гидроиодидные, нитратные, сульфатные, бисульфатные, фосфатные, кислые фосфатные, изоникотинaтные, ацетатные, лактатные, салицилатные, цитратные, тартратные, пантотенатные, битартратные, аскорбатные, сукцинатные, малеатные, гентизинатные, фумаратные, глюконатные, глюкаронатные, сахаратные, форматные, бензоатные, глутаматные, метансульфонатные, этансульфонатные, бензолсульфонатные, п-толуолсульфонатные и памоатные (то есть, 1,1'-метилен-бис-(2-гидрокси-3-нафтоатные)) соли.
В одном варианте осуществления настоящего изобретения пептиды по настоящему изобретению находятся в кристаллических формах, например, совместно кристаллизованных формах или кристаллических формах гидратов.
Термин «пролекарство» относится к пептидам, которые быстро преобразуются in vivo, с образованием основного соединения приведенных выше формул, например, путем гидролиза в крови или путем метаболизма в клетках, таких как, например, клетки базальных ганглиев. Подробное обсуждение приведено в публикациях T. Higuchi and V. Stella, «Pro-drugs as Novel Delivery Systems», Vol. 14 of the A.C.S. Symposium Series, и в Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, обе из которых включены в настоящий документ посредством ссылки. Примеры пролекарств включают фармацевтически приемлемые нетоксичные сложные эфиры соединений по настоящему изобретению. Сложные эфиры соединений по настоящему изобретению можно получать общепринятыми методами: «March's Advanced Organic Chemistry, 5th Edition» M. B. Smith & J. March, John Wiley & Sons, 2001.
В одном варианте осуществления для парентерального введения используют растворы пептидов, применяемых по настоящему изобретению, в стерильном водном растворе, в водном пропиленгликоле или в кунжутном или арахисовом масле. Водные растворы должны быть соответствующим образом забуферены, когда это целесообразно, и жидкий разбавитель сделан изотоническим, например, с помощью соответствующего солевого раствора или глюкозы. Водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Все используемые стерильные водные среды легко могут быть получены стандартными методами, известными специалистам в данной области.
Подходящие фармацевтические носители включают инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Примерами твердых носителей являются лактоза, магнезия, сахароза, циклодекстрин, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния, стеариновая кислота и низшие алкильные эфиры целлюлозы. Примерами жидких носителей являются сироп, арахисовое масло, оливковое масло, фосфолипиды, жирные кислоты, амины жирных кислот, полиоксиэтилен и вода. Кроме того, носитель или разбавитель может включать любой материал замедленного высвобождения, известный в данной области, такой как глицерилмоностеарат или глицерилдистеарат, самостоятельно или в смеси с воском. Фармацевтические композиции, полученные путем объединения соединений, применяемых по настоящему изобретению, и фармацевтически приемлемых носителей, затем могут быть легко введены в различных лекарственных формах, подходящих для описанных путей введения. Препараты могут быть для удобства предоставлены в стандартной лекарственной форме с помощью методов, известных в области фармацевтики.
Препараты по настоящему изобретению, подходящие для перорального введения, могут быть предоставлены в виде дискретных единиц, таких как капсулы или таблетки, каждая из которых содержит заданное количество активного ингредиента и может содержать подходящий эксципиент.
Кроме того, перорально принимаемые препараты могут быть в форме порошка или гранул, раствора или суспензии в водной или неводной жидкости, или в форме эмульсии типа масло-в-воде или вода-в-масле.
Композиции, предназначенные для перорального приема, можно получать любым известным методом, и такие композиции могут содержать одно или более средств, выбранных из группы, состоящей из подсластителей, ароматизаторов, красителей и консервантов, для придания фармацевтическим препаратам приятного внешнего вида и вкуса. Таблетки могут содержать активный ингредиент(ы) в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, подходящими для производства таблеток. Такие эксципиенты могут, например, представлять собой: инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие средства, например, кукурузный крахмал или альгиновую кислоту; связующие вещества, например, крахмал, желатин или гуммиарабик; а также смазывающие средства, например, стеарат магния, стеариновую кислоту или тальк. Таблетки могут не иметь покрытия или иметь покрытие, нанесенное при помощи известных методов, для отсрочки дезинтеграции и абсорбции в желудочно-кишечном тракте и обеспечения, таким образом, пролонгированного действия на протяжении более длительного периода времени. Например, можно использовать такой материал для замедленного высвобождения, как глицерилмоностеарат или глицерилдистеарат. Они также могут быть покрыты при помощи методов, описанных в патентах США № 4356108, 4166452 и 4265874, содержание которых включено в настоящий документ посредством ссылки, с получением осмотических терапевтических таблеток для контролируемого высвобождения.
Препараты для перорального использования можно также предоставлять в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, либо мягких желатиновых капсул, в которых активный ингредиент смешан с водной или масляной средой, например, арахисовым маслом, вазелиновым маслом или оливковым маслом. Водные суспензии могут содержать соединение, применяемое по настоящему изобретению, в смеси с эксципиентами, подходящими для производства водных суспензий. Такими эксципиентами являются суспендирующие средства, например, натрий-карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и гуммиарабик; диспергирующие или увлажняющие средства, которые могут представлять собой природные фосфатиды, такие как лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например, полиоксиэтиленстеарат, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и гексита, например, полиоксиэтилен сорбит моноолеат, или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и ангидридов гексита, например, моноолеат полиэтиленсорбитана. Водные суспензии могут также содержать один или более красителей, один или более ароматизаторов и один или более подсластителей, таких как сахароза или сахарин.
Масляные суспензии можно формулировать путем суспендирования активного ингредиента в растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как вазелиновое масло. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт. Подсластители, такие, как указанные выше, и ароматизаторы можно добавлять для придания пероральному препарату приятного вкуса. Эти композиции могут сохраняться дольше за счет добавления антиоксиданта, такого как аскорбиновая кислота.
Диспергируемые порошки и гранулы, подходящие для получения водной суспензии при добавлении воды, содержат активное соединение в смеси с диспергирующим или увлажняющим средством, суспендирующим средством и одним или более консервантами. Подходящие диспергирующие или увлажняющие средства и суспендирующие средства представлены теми, которые уже упоминались выше. Дополнительные эксципиенты, например, подсластители, ароматизаторы и красители, также могут присутствовать.
Фармацевтические композиции, содержащие пептиды, применяемые по настоящему изобретению, могут также находиться в форме эмульсии типа масло-в-воде. Масляная фаза может представлять собой растительное масло, например, оливковое масло или арахисовое масло, или минеральное масло, например, вазелиновое масло, либо их смесь. Подходящими эмульгаторами могут быть природные камеди, например, гуммиарабик или трагакантовая камедь, природные фосфатиды, например, соевый лецитин, а также сложные эфиры или неполные сложные эфиры, полученные из жирных кислот и ангидридов гексита, например, сорбитан моноолеат, и продукты конденсации указанных неполных сложных эфиров с этиленоксидом, например, моноолеат полиоксиэтиленсорбитана. Эмульсии могут также содержать подсластители и ароматизаторы.
Сиропы и эликсиры могут быть сформулированы с подсластителями, например, глицерином, пропиленгликолем, сорбитом или сахарозой. Такие препараты, кроме того, могут содержать смягчающее средство, консервант и ароматизатор, а также краситель. Фармацевтические композиции могут находиться в виде стерильной инъекционной водной или маслянистой суспензии. Такая суспензия может быть сформулирована известными методами с использованием подходящих диспергирующих или увлажняющих средств, а также суспендирующих средств, описанных выше. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, раствор в 1,3-бутандиоле. В число приемлемых сред и растворителей, которые можно использовать, входят вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используют в качестве растворителя или суспендирующей среды. Для этой цели можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, также находят применение в изготовлении инъекционных препаратов.
Композиции могут также находиться в форме суппозиториев для ректального введения соединений по изобретению. Такие композиции можно получать путем смешивания соединения с подходящим не раздражающим эксципиентом, который является твердым при обычных температурах, но жидким при ректальной температуре, и, таким образом, будет плавиться в прямой кишке, высвобождая лекарственное средство. Такие материалы включают, например, масло какао и полиэтиленгликоли.
Пептиды по настоящему изобретению можно также вводить в форме липосомных систем доставки, таких как мелкие однослойные везикулы, крупные однослойные везикулы и многослойные везикулы. Липосомы могут быть образованы из различных фосфолипидов, таких как, но не ограничиваясь ими, холестерин, стеариламин или фосфатидилхолины.
Кроме того, некоторые пептиды по настоящему изобретению могут образовывать сольваты с водой или обычными органическими растворителями. Такие сольваты также включены в объем изобретения.
Таким образом, следующий вариант осуществления относится к фармацевтической композиции, содержащей пептид, применяемый по настоящему изобретению, или его фармацевтически приемлемую соль, сольват или пролекарство, и один или более фармацевтически приемлемых носителей, эксципиентов или разбавителей.
ПРИЛОЖЕНИЕ - Примеры последовательностей аналогов MSH
Аналоги α-MSH

C-концевой валин может быть амидирован (NH2).

C-концевой валин может быть амидирован (NH2).

C-концевой валин может быть амидирован (NH2).

C-концевой валин может быть амидирован (NH2).

C-концевой валин может быть амидирован (NH2).

C-концевой валин может быть амидирован (NH2).

C-концевой валин может быть амидирован (NH2).

C-концевой валин может быть амидирован (NH2).


C-концевой валин может быть амидирован (NH2).


C-концевой валин может быть амидирован (NH2).

C-концевой валин может быть амидирован (NH2).


C-концевой валин может быть амидирован (NH2).

C-концевой валин может быть амидирован (NH2).

C-концевой валин может быть амидирован (NH2).
Аналоги γ-MSH


[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).

[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).

[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).


[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).


[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).

[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).
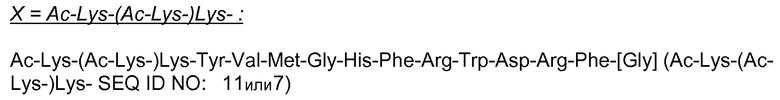

[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).

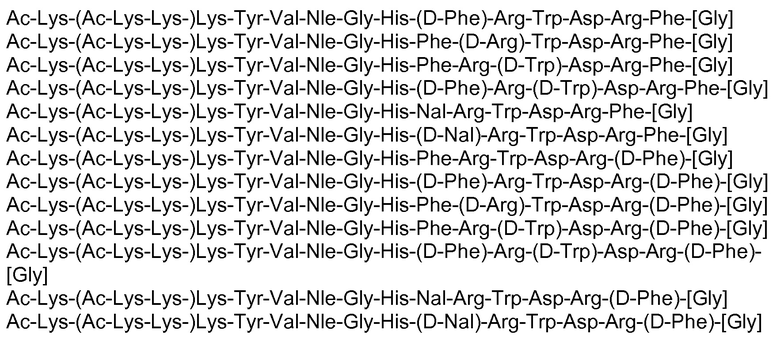
[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).


[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).

[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).

[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).


[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).

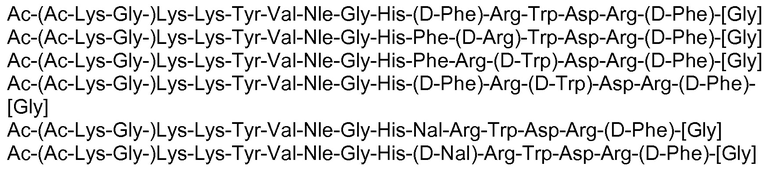
[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).

[Gly] является необязательной аминокислотой в последовательности (может присутствовать или отсутствовать); C-концевой Phe или Gly может быть амидирован (NH2).
Примеры
Потенциальные возможности и эффективность заявленного настоящего изобретения можно определять при помощи различных фармакологических методов. Настоящее изобретение дополнительно проиллюстрировано с помощью следующих примеров, которые никоим образом не должны ограничивать объем заявленного изобретения.
Далее способы тестирования пептидов по изобретению описаны в общих чертах. Результаты для протестированных пептидов представлены в приведенных ниже примерах. Целью использования данных методов являлось тестирование пептидов по изобретению на аффинность связывания рецептора в отношении MC1r человека и эффективность в отношении MC1r и MCr3 человека.
Иммуномодулирующие эффекты меланокортинов опосредованы стимуляцией MC1r и/или MC3r на иммунокомпетентных клетках в тканях, органах и плазме. MC1r и/или MC3r экспрессируются в иммунокомпетентных клетках, включая моноциты, макрофаги, нейтрофилы, T-клетки и дендритные клетки. Стимуляция MCr1 и/или MC3r связана с затуханием продукции цитокинов и активацией механизмов, ведущих к устранению воспаления. Аффинность связывания и рецепторная эффективность (альтернативой экспрессии является активность) конкретного меланокортина в совокупности, в некоторых вариантах осуществления, составляют общую эффективность конкретного соединения. Степень аффинности связывания конкретного соединения в отношении MCr определяют как способность к вытеснению радиоактивно меченного полного агониста, имеющего высокую аффинность связывания с рецептором, в данном случае, к вытеснению 125I-NDP-α-MSH с MCr1. Аффинность связывания выражают через константу ингибирования IC50, определяемую как концентрация конкретного соединения, которая вызывает 50% вытеснение радиоактивно меченых соединений (чем меньше IC50, тем выше аффинность связывания). Рецепторную эффективность определяют как способность стимулировать продукцию цАМФ в сравнении с полным агонистом, таким как α-MSH или NDP-α-MSH. Так же, относительно максимальной эффективности (Emax) константу эффективности EC50 определяют как концентрацию агониста, при которой достигается 1/2 максимального ответа (чем меньше EC50, тем выше эффективность).
Тестируемые соединения в примерах включают:
1) α-MSH (Ac-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-NH2) (Ac-SEQ ID NO: 2);
2) NDP-α-MSH (Ac-Ser-Tyr-Ser-Nle-Glu-His-(D-Phe)-Arg-Trp-Gly-Lys-Pro-Val-NH2);
3) Ac(Lys)6-α-MSH (Ac(Lys)6-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-NH2) (Ac(Lys)6- SEQ ID NO: 2); и
4) Ac(Lys)6-NDP-α-MSH (Ac(Lys)6-Ser-Tyr-Ser-Nle-Glu-His-(D-Phe)-Arg-Trp-Gly-Lys-Pro-Val-NH2).
5) аналог α-MSH № 1: Ac-(Ac-Lys-Lys-)Lys-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-NH2 (Ac-(Ac-Lys-Lys-)Lys- SEQ ID NO: 2).
6) аналог γ-MSH № 2: Ac-(Ac-Lys-Lys-)Lys-Tyr-Val-Met-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-Phe-Gly-NH2.
Дизайн эксперимента
Тест 1) Аффинность связывания в отношении MC1r человека
Аффинность связывания в отношении MC1r человека тестировали с использованием анализа связывания радиоактивного лиганда с мембранной фракцией клеток CRO, стабильно экспрессирующих MC1r человека.
Конкурентное связывание проводили в лунках 96-луночного планшета (Master Block, Greiner, 786201), содержащих буфер для связывания, мембранные экстракты с MC1r человека, [125I](Lys11)(Nle4-D-Phe7)-α-MSH и тестируемое соединение в возрастающих концентрациях. Образцы инкубировали в конечном объеме 0,1 мл в течение 60 мин при 25°C и затем фильтровали через фильтры. Фильтры промывали шесть раз по 0,5 мл ледяного буфера для промывки и добавляли 50 мкл Microscint 20 (Packard) в каждую лунку. Планшеты инкубировали 15 мин на орбитальном шейкере и затем просчитывали на гамма-счетчике TopCount в течение 1 мин/лунку.
Данные представлены в виде средних значений. Константу ингибирования определяли методом наилучшей подгонки после логарифмического преобразования с использованием программы GraphPad (версия 6.0). Различия считались достоверными при уровне вероятности (p), равном 0,05.
Тест 2) Рецепторная эффективность в отношении MC1r и MC3r человека
Клетки CHO-K1, экспрессирующие либо MC1r, либо MC3r, выращенные в среде без антибиотиков, отделяли осторожным промыванием PBS-ЭДТА (5 мМ ЭДТА), собирали центрифугированием и ресуспендировали в буфере для анализа (KRH: 5 мМ KCl, 1,25 мМ MgSO4, 124 мМ NaCl, 25 мМ HEPES, 13,3 мМ глюкоза, 1,25 мМ KH2PO4, 1,45 мМ CaCl2, 0,5 г/л БСА).
12 мкл клеток смешивали с 12 мкл тестируемого соединения в возрастающих концентрациях в 96-луночных планшетах и затем инкубировали в течение 30 мин при комнатной температуре. Продукцию цАМФ определяли после добавления лизирующего буфера и инкубации в течение 1 часа конкурентным иммуноанализом с использованием меченных криптатом анти-цАМФ и D2-меченого цАМФ (набор HTRF от компании CisBio) с процентными значениями дельта F, рассчитанными в соответствии с инструкциями производителя. Анализы для построения кривых «доза-ответ» проводили параллельно для тестируемых соединений и эталонных соединений.
Технология HTRF представляет собой анализ титрования, основанный на конкуренции между меченным цАМФ (экзогенным) и цАМФ, продуцируемым клеткой после активации MCr. Динамический диапазон анализа охватывал 3-4 кратные значения, это означает, что линейный диапазон (позволяющий преобразовывать первичные данные в нМ цАМФ) находился в этих пределах. Интервал между верхним и нижним участками кривой был высоким (примерно 100), это означает, что при преобразовании в нМ цАМФ аналитический интервал для цАМФ простирается от 1 нМ (базовый) до примерно 30 нМ (Emax). Все эксперименты проводили в присутствии неизбирательного ингибитора фосфодиэстеразы IBMX (конечная концентрация 1 мМ).
Данные представлены в виде средних значений. Константу ингибирования определяли методом наилучшей подгонки после логарифмического преобразования с использованием программы GraphPad (версия 6.0). Различия считались достоверными при уровне вероятности (p), равном 0,05.
Тест 3) Рецепторная эффективность в отношении MC1r человека
Альтернативно, рецепторную эффективность в отношении MCR1 тестировали на стабильно трансфицированных клетках HEK, экспрессирующих MC1r человека. Клетки выращивали в модифицированной по способу Дульбекко среде Игла 1885 с добавлением 10% эмбриональной телячьей сыворотки, 2 мМ глутамина и 0,01 мг/мл гентамицина. Экспрессионные плазмиды, содержащие кДНК, кодирующие рецепторы дикого типа или мутантные рецепторы, были экспрессированы после трансфекции методом кальций-фосфатной преципитации. Клетки хранили в замороженном состоянии до проведения экспериментов, в которых клетки выращивали в среде RPMI 1640 с добавлением 2 мМ L-глутамина, бикарбоната натрия, добавленного до содержания 1,5 г/литр, 4,5 г/литр глюкозы, 10 мМ HEPES, 1,0 мМ пирувата натрия и 10% эмбриональной бычьей сыворотки.
Клетки (2,5×105 клеток на лунку) инкубировали в течение 15 мин при 37°C в 1 мл свежеприготовленного буфера для связывания с добавлением 5×10-4 M неспецифического ингибитора фосфодиэстеразы 3-изобутил-1-метилксантина (IBMX), 40 мкг/мл бацитрацина и тестируемого соединения в различных концентрациях. После инкубации клетки помещали на лед, среду удаляли и клетки лизировали. Измерение цАМФ в образцах проводили с использованием коммерческого набора для иммуноферментного анализа цАМФ от компании Cayman Chemicals (каталожный № 581001). Все концентрации цАМФ выражали относительно общего количества клеток в отдельных образцах.
Пример 1
Тестируемое соединение представляет собой аналог α-MSH № 1:
Ac-(Ac-Lys-Lys-)Lys-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-NH2 (Ac-(Ac-Lys-Lys-)Lys- SEQ ID NO: 2).
Таким образом, X (или разветвленный аминокислотный зонд РАЗ) в данном аналоге представляет собой Ac-(Ac-Lys-Lys-)Lys (смотри, например, фигуру 7), который связан с N-концевым Ser природного α-MSH Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-NH2, амидированного на С-конце.
Аналог № 1 тестировали, как указано:
Тест 1: Изучали аналог α-MSH № 1, α-MSH и Ac(Lys)6-α-MSH. Аналог α-MSH № 1 и Ac(Lys)6-α-MSH тестировали в диапазоне концентраций от 10-6 до 10-13 M (n=2-4 для каждой концентрации); α-MSH тестировали в диапазоне концентраций от 10-6 до 10-11 M (n=2 для каждой концентрации).
Результаты приведены на фигуре 1. Значение IC50 для аналога α-MSH № 1 по расчетам составило 6,45×10-11, и значение IC50 для эталонного α-MSH по расчетам составило 4,095×10-10. Убедительных данных для Ac(Lys)6-α-MSH получить не удалось.
Тест 3: Соединения Ac(Lys)6-α-MSH, Ac(Lys)6-NDP-α-MSH и α-MSH тестировали в диапазоне доз от 10-11 до 10-6 M (n=5-6 для каждой концентрации).
Результаты приведены на фигуре 2. Была рассчитана максимальная эффективность EMax (максимальная эффективность, выраженная в виде процента от α-MSH):
Ac(Lys)6-α-MSH Emax: 72±5% от α-MSH, p<0,05;
Ac-(Lys)6-NDP-MSH: Emax: 62±8% от α-MSH, p<0,05.
Кроме того, были рассчитаны значения EC50:
α-MSH: 1,74×10-9 M
Ac(Lys)6-α-MSH: 2,12×10-9 M
Ac(Lys)6-NDP-α-MSH: 1,35×10-9 M.
Тест 2: аналог α-MSH № 1, NDP-α-MSH (Ac-Ser-Tyr-Ser-Nle-Glu-His-(D-Phe)-Arg-Trp-Gly-Lys-Pro-Val-NH2) и Ac(Lys)6-α-MSH тестировали в отношении MC1r человека. Как известно из литературы, NDP-α-MSH является высокоэффективным полным агонистом для MC1r с величиной EC50, согласно сообщениям, ~10 раз меньшей, чем в случае α-MSH.
Аналог α-MSH № 1 и Ac(Lys)6-α-MSH тестировали в диапазоне концентраций от 10-6 до 10-11 M (n=2 для каждой концентрации); NDP-α-MSH тестировали в диапазоне концентраций от 10-6 до 10-13 M (n=2 для каждой концентрации).
Результаты приведены на фигуре 3. Максимальная эффективность (Emax) как для аналога α-MSH № 1, NDP-α-MSH, так и для Ac(Lys)6-α-MSH составляла ~3 нМ. Величина EC50 составляла 2,0×10-10 и 4,7×10-11 M для аналога α-MSH № 1 и NDP-α-MSH, соответственно.
Пример 2
Тестируемое соединение представляет собой аналог γ-MSH № 2:
Ac-(Ac-Lys-Lys-)Lys-Tyr-Val-Met-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-Phe-Gly-NH2.
Таким образом, X (или разветвленный аминокислотный зонд РАЗ) в данном соединении представляет собой Ac-(Ac-Lys-Lys-)Lys (смотри, например, фигуру 7), который связан с N-концевым Tyr в γ-MSH Tyr-Val-Met-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-Phe-Gly-NH2, амидированном на С-конце и с Trp в D-конформации.
Аналог № 2 тестировали, как указано:
Тест 1: Изучали аналог γ-MSH № 2 и NDP-α-MSH. Как известно из литературы, NDP-α-MSH является высокоэффективным агонистом для MC1r с величиной IC50, согласно сообщениям, ~10 раз меньшей, чем в случае α-MSH. Аналог γ-MSH № 2 тестировали в диапазоне концентраций от 10-8 до 10-13 M (n=2 для каждой концентрации); NDP-α-MSH тестировали в диапазоне концентраций от 10-6 до 10-12 M (n=3-4 для каждой концентрации).
Результаты приведены на фигуре 4. В целом, известно, что γ-MSH имеет слабую аффинность связывания в отношении MC1r человека. Величина IC50 для аналога γ-MSH № 2 по расчетам составляла 6,06×10-10, и величина IC50 для NDP-α-MSH по расчетам составляла 5,53×10-10; таким образом, аффинность связывания аналога γ-MSH № 2 сравнима с таковой у суперэффективного NDP-α-MSH.
Тест 2: аналог γ-MSH № 2 и NDP-α-MSH тестировали на агонистическую активность в отношении MC1r и MC3r человека. Из литературы известно, что NDP-α-MSH является высокоэффективным полным агонистом как для MC1r, так и для MC3r, и превосходит природный α-MSH как в случае MC1r, так и в случае MC3r человека (~10 раз более высокая активность в отношении обоих рецепторов). NDP-α-MSH также более чем в 100 раз более активен, чем γ-MSH, в отношении MC1r и MC3r человека.
Для обоих рецепторов аналог γ-MSH № 2 тестировали в диапазоне концентраций от 10-6 до 10-11 M (n=2 для каждой концентрации) и NDP-α-MSH тестировали в диапазоне концентраций от 10-6 до 3×10-13 M (n=2 для каждой концентрации).
Результаты приведены на фигурах 5 и 6:
В случае аналога γ-MSH № 2 в отношении MC1r человека; Emax ~10 нМ и EC50 составляет 1,52×10-10. В случае NDP-α-MSH в отношении MC1r человека Emax ~3 нМ и EC50 составляет 5,5×10-11 (смотри фигуру 5).
В случае аналога γ-MSH № 2 в отношении MC3r человека; Emax ~1 нМ и EC50 составляет 5,65×10-11 M. В случае NDP-α-MSH в отношении MC3r человека Emax ~10 нМ и EC50 составляет 2,80×10-10 M (смотри фигуру 6).
Пример 3
Синтез пептидов примеров 1 и 2:
аналог α-MSH № 1:
Ac-(Ac-Lys-Lys-)Lys-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-NH2 (Ac-(Ac-Lys-Lys-)Lys- SEQ ID NO: 2).
аналог γ-MSH № 2:
Ac-(Ac-Lys-Lys-)Lys-Tyr-Val-Met-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-Phe-Gly-NH2.
Пептиды получали, используя химические методы синтеза с Fmoc (9-флуоренилметилоксикарбонил). Пептиды получали с использованием полистирольной смолы, функционализированной соответствующим линкером, и затем пептиды производили при помощи пептидного синтезатора Intavis. Добавляли 4-кратный избыток аминокислот по отношению к смоле, и либо HATU (O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат), либо HCTU (2-(6-хлор-1H-бензотриазол-1-ил)-1,1,3,3-тетраметиламинийгексафторфосфат) использовали в 3,95-кратном избытке для получения активного сложного эфира. Наряду с 8-кратным избытком DIPEA (Ν,Ν-диизопропилэтиламин) в виде основания, эти реагенты катализировали присоединение следующей аминокислоты. После связывания аминокислоты (каждый цикл включал двойной цикл связывания для гарантии эффективного связывания) смолу подвергали воздействию 20% уксусного ангидрида для завершения («установки заглушки») любых пептидных цепей, в которые не добавляли следующую аминокислоту.
Аминокислоты растворяли в NMP (N-метил-2-пирролидон) или DMF (диметилформамид) для промывания. Пиперидин использовали для удаления Fmoc-группы в конце каждого цикла связывания, что позволяло присоединять следующую аминокислоту.
Аналог α-MSH № 1 получали с остатком Lys(Mtt) на конце; пептид ацетилировали, удаляли Mtt, добавляли Lys, добавляли Lys и затем вновь ацетилировали.
В случае аналога γ-MSH № 2 добавление одного или более псевдопролиновых (оксазолидиновых) дипептидов в процессе синтеза серин- и/или треонин-содержащих пептидов приводило к повышению качества пептида и увеличению выхода полноразмерного сырого пептида. В этом случае пептид доводили до MEHF, добавляли псевдопролиновый дипептид (Fmoc-YS), следующую аминокислоту «Ser» присоединяли 3 раза, чтобы убедиться, что процесс завершен, и пептид заканчивали вручную путем добавления Lys(Mtt), ацетилирования и затем завершения, как указано выше.
В каждом случае пептиды высушивали с использованием MeOH (3X), DCM (3X), расщепляли с помощью 92% ТФУ, 2% воды, 2% триизопропилсилана, 2% тиоанизола и 2% этандитиола в течение 3-4 часов при комнатной температуре. Пептиды осаждали холодным диэтиловым эфиром, центрифугировали (2000 об/мин) и осадки промывали 2X холодным эфиром. После высушивания пептиды солюбилизировали в воде, содержащей 0,1% ТФУ (буфер A), и подвергали ОФ-ВЭЖХ на колонках C18 (буфер B=95% ацетонитрил/0,1% ТФУ).
Чистоту определяли методом аналитической ВЭЖХ и теоретические моноизотопные молекулярные массы подтверждали методом МС. Целостность последовательностей подтверждали секвенированием с использованием тандемной масс-спектрометрии с CID.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДНЫЕ АНАЛОГИ АЛЬФА-МЕЛАНОЦИТСТИМУЛИРУЮЩЕГО ГОРМОНА | 2009 |
|
RU2496786C2 |
| АНТИТЕЛА, НАЦЕЛИВАЮЩИЕСЯ НА КОСТНУЮ ТКАНЬ | 2018 |
|
RU2801206C2 |
| ПРОЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ С ВЫСОКОЙ СТЕПЕНЬЮ ПРОНИКНОВЕНИЯ НА ОСНОВЕ ПЕПТИДОВ И РОДСТВЕННЫХ ПЕПТИДАМ СОЕДИНЕНИЙ | 2010 |
|
RU2627065C2 |
| НАПРАВЛЕННАЯ РЕГЕНЕРАЦИЯ ПЕРЕЛОМАННОЙ КОСТИ ПОСРЕДСТВОМ СТИМУЛЯЦИИ РЕЦЕПТОРА ПАРАТИРЕОИДНОГО ГОРМОНА | 2017 |
|
RU2785401C2 |
| ПЕПТИДНЫЕ КОМПОЗИЦИИ | 2014 |
|
RU2725150C2 |
| Модифицированные аналоги GIP пептида | 2019 |
|
RU2817673C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ ADAM9, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2783619C2 |
| НОВАЯ ИЗОФОРМА ТРИПСИНА И ЕЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2814729C2 |
| ПЕПТИДНЫЕ ИНГИБИТОРЫ РЕЦЕПТОРА ИНТЕРЛЕЙКИНА-23 ДЛЯ ПЕРОРАЛЬНОГО ПРИЕМА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА | 2015 |
|
RU2736637C2 |
| КОНСТРУКЦИИ, ИМЕЮЩИЕ SIRP-АЛЬФА ДОМЕН ИЛИ ЕГО ВАРИАНТ | 2016 |
|
RU2740672C2 |






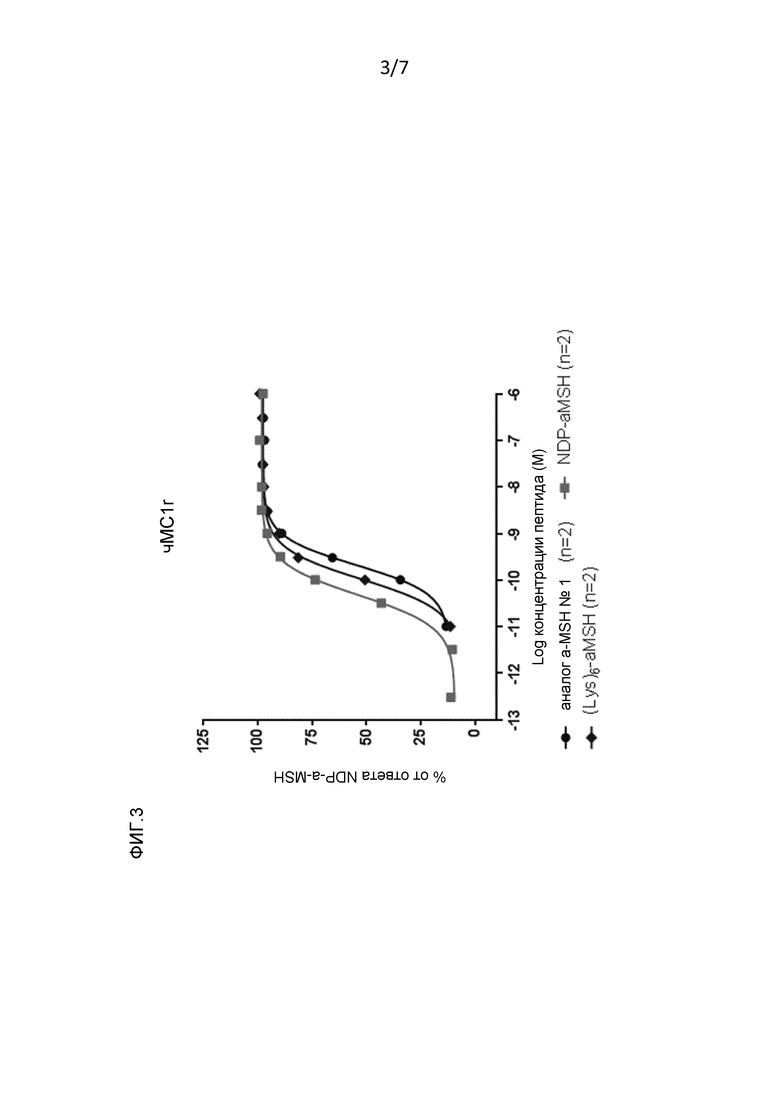
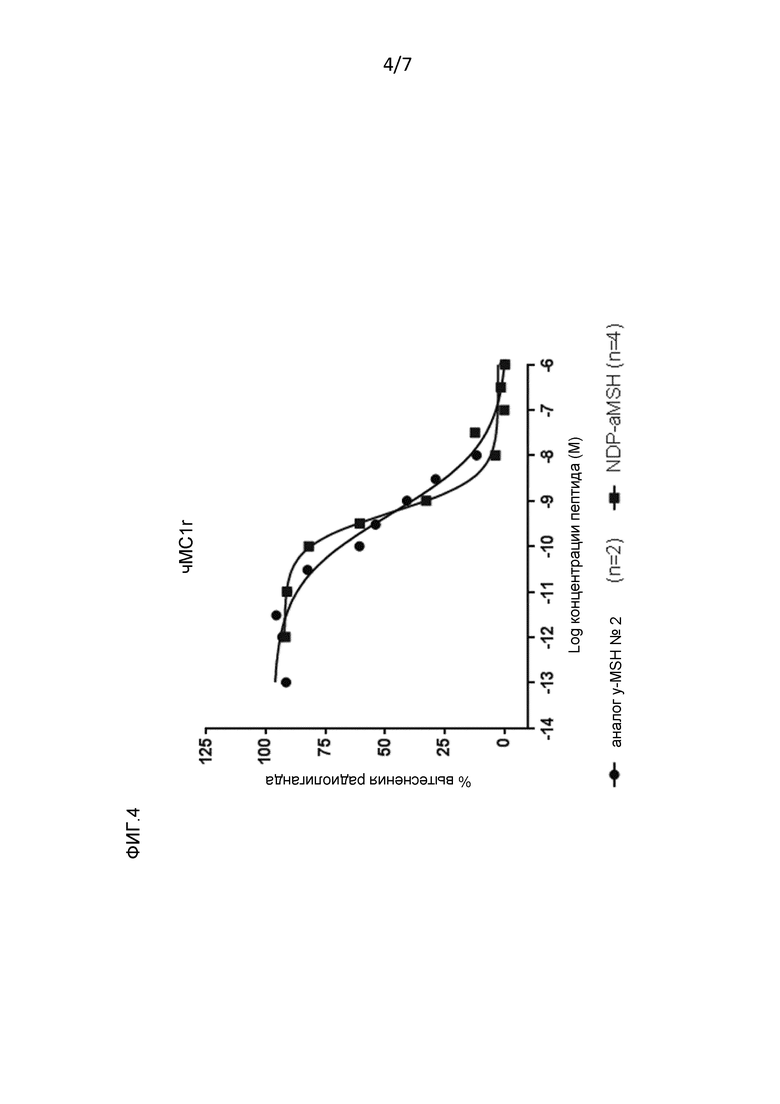
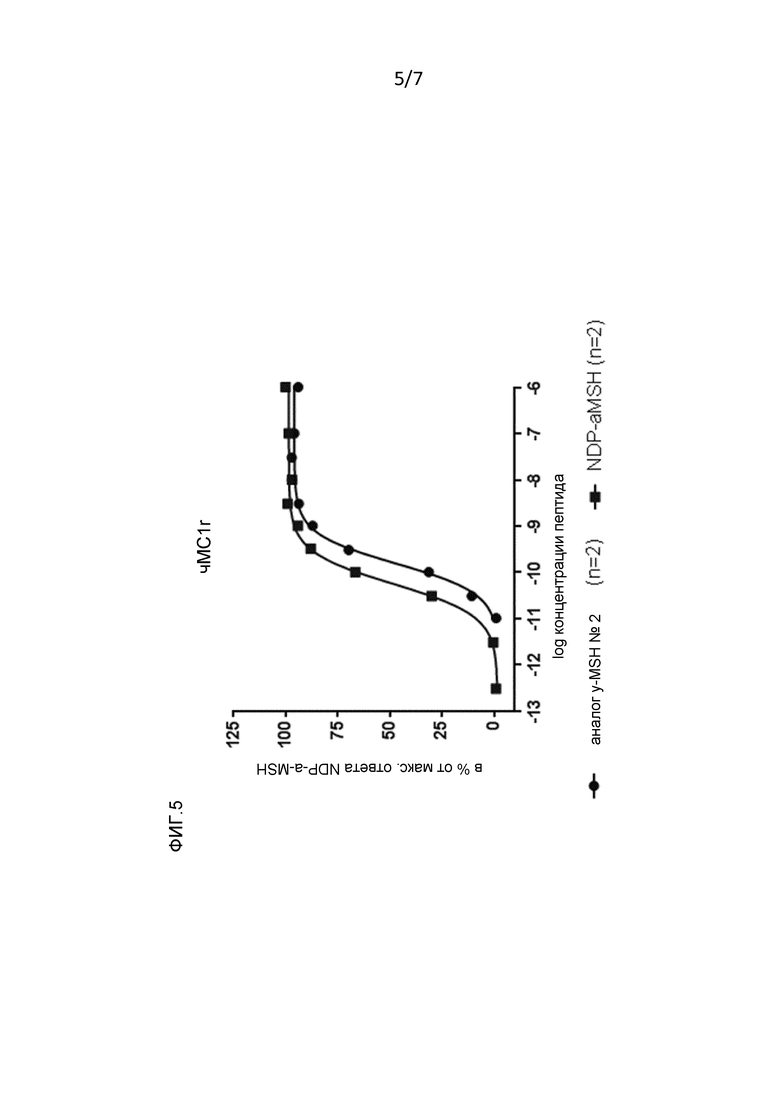
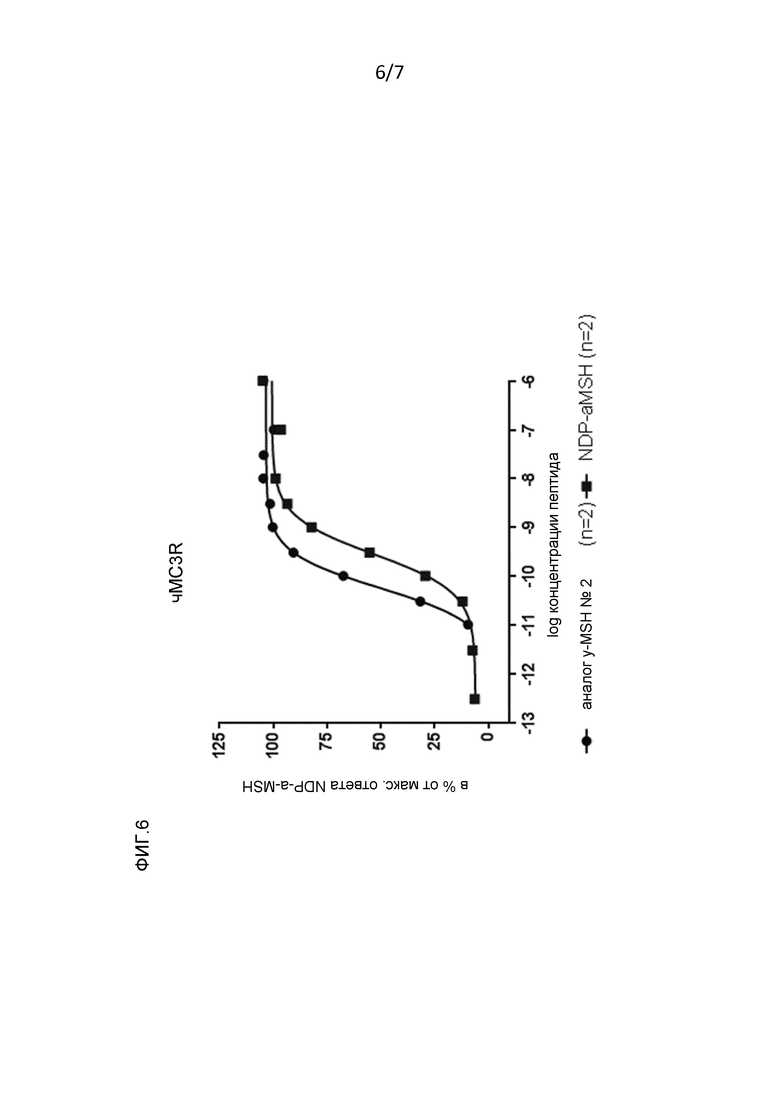
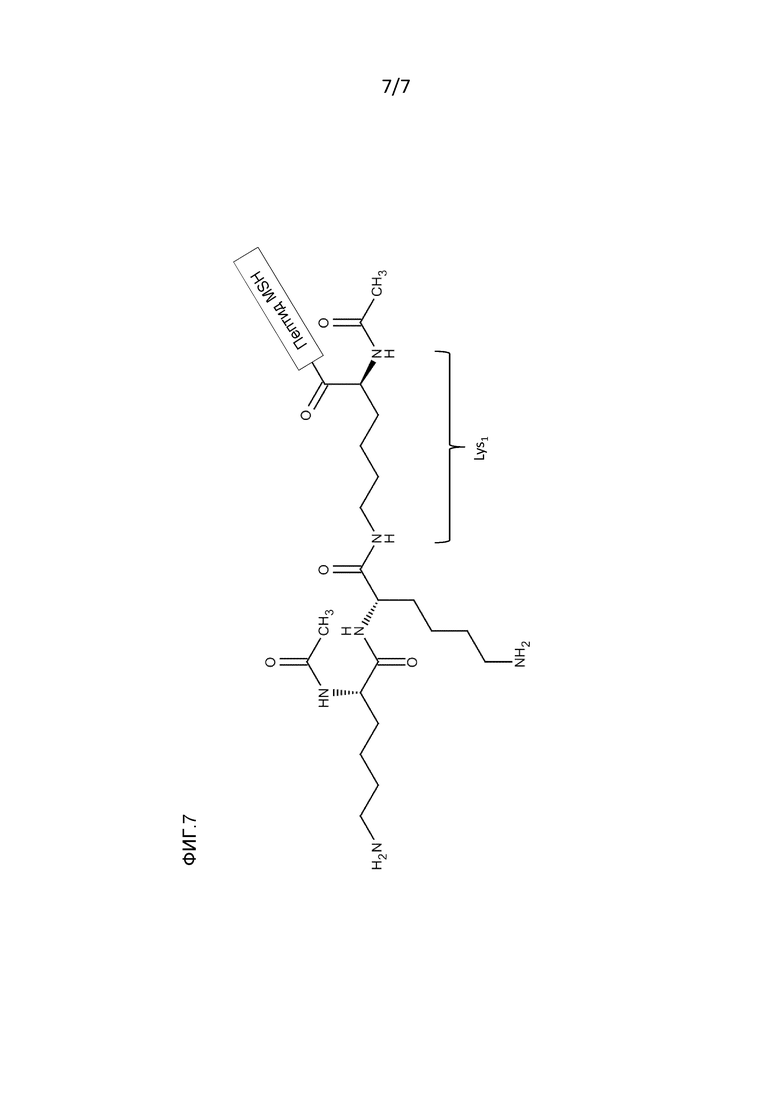
Изобретение относится к области биотехнологии, конкретно к пептидным аналогам α-MSH и γ-MSH, чтоможет быть использовано в медицине. Пептидные аналоги содержат аминокислотную последовательность человеческого α-MSH или γ-MSH, или их вариантов, и имеют разветвленный аминокислотный зонд в N-концевой части пептида, используются в фармацевтических композициях для связывания и активации рецепторов меланокортина MC1r и/или MC3r. Изобретение позволяет осуществлять эффективную терапию ишемического и/или воспалительного состояния. 3 н. и 17 з.п. ф-лы, 7 ил., 3 пр.
1. Пептид, состоящий из 8-22 аминокислотных остатков, содержащий аминокислотную последовательность:
Х-(ак1)n-Y-(ак2)m-Z,
где X содержит разветвленный аминокислотный зонд, имеющий первый остаток лизина (Lys1), выбранный из Lys и D-Lys, при этом указанный первый остаток лизина связан пептидной связью с (ак1)n,
указанный первый остаток лизина необязательно связан пептидными связями со вторым остатком лизина (Lys2), или со вторым и третьим остатком лизина (Lys3), с образованием линейной цепи в общей сложности из 2 или 3 остатков лизина, выбранных из Lys и D-Lys,
где боковая цепь(и) одного или более из каждого из указанных первого, второго и/или третьего остатков лизина модифицирована присоединением к ε-аминогруппе указанного одного или более из каждого из указанных остатков лизина молекулы, независимо выбранной из группы, состоящей из Lysq-Lys; (ак3)p-Lysq; Lysq-(ак3)p; [(ак3)-Lys]p и [Lys-(ак3)]p, где q представляет собой число, выбранное из 0, 1, 2 и 3; р представляет собой число, выбранное из 1, 2 и 3, и (ак3) представляет собой аминокислотный остаток, независимо выбранный из Arg, His, Gly и Ala,
при условии, что X состоит из 2-9 аминокислотных остатков,
где Y содержит аминокислотную последовательность, состоящую из 4 смежных аминокислотных остатков, выбранную из группы, состоящей из His-Phe-Arg-Trp (SEQ ID NO: 16); His-(D-Phe)-Arg-Trp; His-Phe-(D-Arg)-Trp; His-Phe-Arg-(D-Trp); His-(D-Phe)-Arg-(D-Trp); His-Nal-Arg-Trp и His-(D-Nal)-Arg-Trp; и
где Z содержит аминокислотную последовательность, состоящую из 2 или 3 смежных аминокислотных остатков, выбранную из группы, состоящей из Lys-Pro-Val; Lys-Pro-(D-Val); Arg-Phe-Gly; Arg-(D-Phe)-Gly; Arg-Phe и Arg-(D-Phe); и
где n представляет собой число, выбранное из 0, 1, 2, 3, 4 и 5, и (ак1) независимо может быть любым природным или неприродным аминокислотным остатком, и
где m равно 0 или 1, и (ак2) может быть любым природным или неприродным аминокислотным остатком, и
где указанный пептид способен к связыванию с и/или активации рецептора(ов) меланокортина MC1r и/или MC3r.
2. Пептид по п. 1, в котором X содержит разветвленный аминокислотный зонд, состоящий из 2-3 аминокислотных остатков, например, из 3-4 аминокислотных остатков, например, состоящий из 4-5 аминокислотных остатков, например, состоящий из 5-6 аминокислотных остатков, например, состоящий из 6-7 аминокислотных остатков, например, состоящий из 7-8 аминокислотных остатков, например, состоящий из 8-9 аминокислотных остатков.
3. Пептид по п. 1, в котором X содержит первый (Lys1) и второй (Lys2) остатки лизина, выбранные из Lys и D-Lys, связанные пептидными связями, с образованием линейной цепи в общей сложности из 2 остатков лизина; или в котором X содержит первый (Lys1), второй (Lys2) и третий (Lys3) остатки лизина, выбранные из Lys и D-Lys, связанные пептидными связями, с образованием линейной цепи в общей сложности из 3 остатков лизина.
4. Пептид по п. 3, в котором каждый из первого остатка лизина или второго остатка лизина, или третьего остатка лизина, или первого и второго остатков лизина, или первого и третьего остатков лизина, или второго и третьего остатков лизина, или первого, второго и третьего остатков лизина в X является ацетилированным (Ac-Lys).
5. Пептид по п. 1, в котором молекулы, присоединяемые к ε-аминогруппе(ам), независимо выбирают из группы, состоящей из Lysq-Lys и Ac-Lysq-Lys, где q представляет собой число, выбранное из 0, 1, 2 и 3.
6. Пептид по п. 1, в котором (ак3) представляет собой аминокислотный остаток, независимо выбранный из Gly и Ala.
7. Пептид по п. 1, в котором молекулу, присоединяемую к ε-аминогруппе(ам) первого, второго и/или третьего остатков лизина в X выбирают из группы, состоящей из Lys, Ac-Lys, Lys-Lys, Ac-Lys-Lys, Lys-Lys-Lys, Ac-Lys-Lys-Lys, Lys-Lys-Lys-Lys (SEQ ID NO: 22), Ac-Lys-Lys-Lys-Lys (Ac-SEQ ID NO: 22), Lys-Gly-Lys, Ac-Lys-Gly-Lys, Lys-Lys-Gly, Ac-Lys-Lys-Gly, Lys-Gly, Ac-Lys-Gly, Lys-Ala-Lys, Ac-Lys-Ala-Lys, Lys-Lys-Ala, Ac-Lys-Lys-Ala, Lys-Ala, Ac-Lys-Ala, Lys-His-Lys, Ac-Lys-His-Lys, Lys-Lys-His, Ac-Lys-Lys-His, Lys-His, Ac-Lys-His, Lys-Arg-Lys, Ac-Lys-Arg-Lys, Lys-Lys-Arg, Ac-Lys-Lys-Arg, Lys-Arg и Ac-Lys-Arg, где каждый из остатков Lys, Gly, Ala, His и Arg может находиться в L- или D-конформации.
8. Пептид по п. 1, в котором X содержит или состоит из последовательности, выбранной из группы, состоящей из Ac-Lys3-Lys2-(Ac-Lys)Lys1-, Ac-Lys3-(Ac-Lys)Lys2-Lys1-, Ac-(Ac-Lys)Lys3-Lys2-Lys1-, Ac-Lys3-(Ac-Lys)Lys2-(Ac-Lys)Lys1-, Ac-(Ac-Lys)Lys3-(Ac-Lys)Lys2-Lys1- и Ac-(Ac-Lys)Lys3-Lys2-(Ac-Lys)Lys1-.
9. Пептид по п. 1, отличающийся тем, что карбоксильный конец указанного пептида представляет собой -С(=O)-В1, где В1 представляет собой ОН или NH2.
10. Пептид по п. 1, в котором (ак1)n выбирают из группы, состоящей из Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17), Ser-Tyr-Ser-Nle-Glu (SEQ ID NO: 18), Ser-Ser-Ile-Ile-Ser (SEQ ID NO: 19), Tyr-Val-Met-Gly (SEQ ID NO: 20) и Tyr-Val-Nle-Gly (SEQ ID NO: 21); или в котором (ак1)n представляет собой Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17), Ser-Tyr-Ser-Nle-Glu (SEQ ID NO: 18) или Ser-Ser-Ile-Ile-Ser (SEQ ID NO: 19); или в котором (ак1)n представляет собой Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17) или Ser-Tyr-Ser-Nle-Glu (SEQ ID NO: 18); или в котором (ак1)n представляет собой Ser-Ser-Ile-Ile-Ser (SEQ ID NO: 19); или в котором (ак1)n представляет собой Tyr-Val-Met-Gly (SEQ ID NO: 20) или Tyr-Val-Nle-Gly (SEQ ID NO: 21).
11. Пептид по п. 1, в котором (ак1)n представляет собой Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17), Ser-Tyr-Ser-Nle-Glu (SEQ ID NO: 18) или Ser-Ser-Ile-Ile-Ser (SEQ ID NO: 19) и (ак2)m представляет собой Gly; или в котором (ак1)n представляет собой Tyr-Val-Met-Gly (SEQ ID NO: 20) или Tyr-Val-Nle-Gly (SEQ ID NO: 21) и (ак2)m представляет собой Asp; или в котором Y выбирают из группы, состоящей из His-Phe-Arg-Trp (SEQ ID NO: 16), His-(D-Phe)-Arg-Trp, His-Phe-(D-Arg)-Trp, His-Phe-Arg-(D-Trp) и His-(D-Phe)-Arg-(D-Trp); или в котором Y представляет собой His-Nal-Arg-Trp или His-(D-Nal)-Arg-Trp.
12. Пептид по п. 1, в котором Z представляет собой Lys-Pro-Val или Lys-Pro-(D-Val); или в котором Z представляет собой Arg-Phe-Gly или Arg-(D-Phe)-Gly; или в котором Z представляет собой Arg-Phe или Arg-(D-Phe).
13. Пептид по п. 1, в котором (ак1)n представляет собой Ser-Tyr-Ser-Met-Glu (SEQ ID NO: 17), Ser-Tyr-Ser-Nle-Glu (SEQ ID NO: 18) или Ser-Ser-Ile-Ile-Ser (SEQ ID NO: 19); Y представляет собой His-Phe-Arg-Trp (SEQ ID NO: 16); His-(D-Phe)-Arg-Trp; His-Phe-(D-Arg)-Trp; His-Phe-Arg-(D-Trp); His-(D-Phe)-Arg-(D-Trp); His-Nal-Arg-Trp или His-(D-Nal)-Arg-Trp; (ак2)m представляет собой Gly и Z представляет собой Lys-Pro-Val или Lys-Pro-(D-Val).
14. Пептид по п. 1, состоящий из последовательности, выбранной из группы, состоящей из
X-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val (SEQ ID NO: 1).
X-Ser-Tyr-Ser-Met-Glu-His-(D-Phe)-Arg-Trp-Gly-Lys-Pro-Val,
X-Ser-Tyr-Ser-Met-Glu-His-Phe-(D-Arg)-Trp-Gly-Lys-Pro-Val
X-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-(D-Trp)-Gly-Lys-Pro-Val,
X-Ser-Tyr-Ser-Met-Glu-His-(D-Phe)-Arg-(D-Trp)-Gly-Lys-Pro-Val,
X-Ser-Tyr-Ser-Met-Glu-His-Nal-Arg-Trp-Gly-Lys-Pro-Val,
X-Ser-Tyr-Ser-Met-Glu-His-(D-Nal)-Arg-Trp-Gly-Lys-Pro-Val,
X-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-(D-Val),
X-Ser-Tyr-Ser-Met-Glu-His-(D-Phe)-Arg-Trp-Gly-Lys-Pro-(D-Val),
X-Ser-Tyr-Ser-Met-Glu-His-Phe-(D-Arg)-Trp-Gly-Lys-Pro-(D-Val),
X-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-(D-Trp)-Gly-Lys-Pro-(D-Val),
X-Ser-Tyr-Ser-Met-Glu-His-(D-Phe)-Arg-(D-Trp)-Gly-Lys-Pro-(D-Val),
X-Ser-Tyr-Ser-Met-Glu-His-Nal-Arg-Trp-Gly-Lys-Pro-(D-Val),
Х-Ser-Tyr-Ser-Met-Glu-His-(D-Nal)-Arg-Trp-Gly-Lys-Pro-(D-Val),
X-Ser-Tyr-Ser-Nle-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val (SEQ ID NO: 3),
X-Ser-Tyr-Ser-Nle-Glu-His-(D-Phe)-Arg-Trp-Gly-Lys-Pro-Val,
X-Ser-Tyr-Ser-Nle-Glu-His-Phe-(D-Arg)-Trp-Gly-Lys-Pro-Val
X-Ser-Tyr-Ser-Nle-Glu-His-Phe-Arg-(D-Trp)-Gly-Lys-Pro-Val,
X-Ser-Tyr-Ser-Nle-Glu-His-(D-Phe)-Arg-(D-Trp)-Gly-Lys-Pro-Val,
X-Ser-Tyr-Ser-Nle-Glu-His-Nal-Arg-Trp-Gly-Lys-Pro-Val,
X-Ser-Tyr-Ser-Nle-Glu-His-(D-Nal)-Arg-Trp-Gly-Lys-Pro-Val,
X-Ser-Tyr-Ser-Nle-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-(D-Val),
X-Ser-Tyr-Ser-Nle-Glu-His-(D-Phe)-Arg-Trp-Gly-Lys-Pro-(D-Val),
X-Ser-Tyr-Ser-Nle-Glu-His-Phe-(D-Arg)-Trp-Gly-Lys-Pro-(D-Val),
X-Ser-Tyr-Ser-Nle-Glu-His-Phe-Arg-(D-Trp)-Gly-Lys-Pro-(D-Val),
X-Ser-Tyr-Ser-Nle-Glu-His-(D-Phe)-Arg-(D-Trp)-Gly-Lys-Pro-(D-Val),
X-Ser-Tyr-Ser-Nle-Glu-His-Nal-Arg-Trp-Gly-Lys-Pro-(D-Val),
X-Ser-Tyr-Ser-Nle-Glu-His-(D-Nal)-Arg-Trp-Gly-Lys-Pro-(D-Val),
X-Ser-Ser-Ile-Ile-Ser-His-Phe-Arg-Trp-Gly-Lys-Pro-Val (SEQ ID NO: 5),
X-Ser-Ser-Ile-Ile-Ser-His-(D-Phe)-Arg-Trp-Gly-Lys-Pro-Val,
X-Ser-Ser-Ile-Ile-Ser-His-Phe-(D-Arg)-Trp-Gly-Lys-Pro-Val
X-Ser-Ser-Ile-Ile-Ser-His-Phe-Arg-(D-Trp)-Gly-Lys-Pro-Val,
X-Ser-Ser-Ile-Ile-Ser-His-(D-Phe)-Arg-(D-Trp)-Gly-Lys-Pro-Val,
X-Ser-Ser-Ile-Ile-Ser-His-Nal-Arg-Trp-Gly-Lys-Pro-Val,
X-Ser-Ser-Ile-Ile-Ser-His-(D-Nal)-Arg-Trp-Gly-Lys-Pro-Val,
X-Ser-Ser-Ile-Ile-Ser-His-Phe-Arg-Trp-Gly-Lys-Pro-(D-Val),
X-Ser-Ser-Ile-Ile-Ser-His-(D-Phe)-Arg-Trp-Gly-Lys-Pro-(D-Val),
X-Ser-Ser-Ile-Ile-Ser-His-Phe-(D-Arg)-Trp-Gly-Lys-Pro-(D-Val),
X-Ser-Ser-Ile-Ile-Ser-His-Phe-Arg-(D-Trp)-Gly-Lys-Pro-(D-Val),
X-Ser-Ser-Ile-Ile-Ser-His-(D-Phe)-Arg-(D-Trp)-Gly-Lys-Pro-(D-Val),
X-Ser-Ser-Ile-Ile-Ser-His-Nal-Arg-Trp-Gly-Lys-Pro-(D-Val), и
X-Ser-Ser-Ile-Ile-Ser-His-(D-Nal)-Arg-Trp-Gly-Lys-Pro-(D-Val),
где X представляет собой разветвленный аминокислотный зонд.
15. Пептид по п. 1, состоящий из последовательности, выбранной из группы, состоящей из
X-Tyr-Val-Met-Gly-His-Phe-Arg-Trp-Asp-Arg-Phe-Gly (SEQ ID NO: 7),
X-Tyr-Val-Met-Gly-His-(D-Phe)-Arg-Trp-Asp-Arg-Phe-Gly,
X-Tyr-Val-Met-Gly-His-Phe-(D-Arg)-Trp-Asp-Arg-Phe-Gly,
X-Tyr-Val-Met-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-Phe-Gly,
X-Tyr-Val-Met-Gly-His-(D-Phe)-Arg-(D-Trp)-Asp-Arg-Phe-Gly,
X-Tyr-Val-Met-Gly-His-Nal-Arg-Trp-Asp-Arg-Phe-Gly,
X-Tyr-Val-Met-Gly-His-(D-Nal)-Arg-Trp-Asp-Arg-Phe-Gly,
X-Tyr-Val-Met-Gly-His-Phe-Arg-Trp-Asp-Arg-(D-Phe)-Gly,
X-Tyr-Val-Met-Gly-His-(D-Phe)-Arg-Trp-Asp-Arg-(D-Phe)-Gly,
X-Tyr-Val-Met-Gly-His-Phe-(D-Arg)-Trp-Asp-Arg-(D-Phe)-Gly,
X-Tyr-Val-Met-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-(D-Phe)-Gly,
X-Tyr-Val-Met-Gly-His-(D-Phe)-Arg-(D-Trp)-Asp-Arg-(D-Phe)-Gly,
X-Tyr-Val-Met-Gly-His-Nal-Arg-Trp-Asp-Arg-(D-Phe)-Gly,
X-Tyr-Val-Met-Gly-His-(D-Nal)-Arg-Trp-Asp-Arg-(D-Phe)-Gly,
X-Tyr-Val-Nle-Gly-His-Phe-Arg-Trp-Asp-Arg-Phe-Gly (SEQ ID NO: 9).
X-Tyr-Val-Nle-Gly-His-(D-Phe)-Arg-Trp-Asp-Arg-Phe-Gly,
X-Tyr-Val-Nle-Gly-His-Phe-(D-Arg)-Trp-Asp-Arg-Phe-Gly,
X-Tyr-Val-Nle-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-Phe-Gly,
X-Tyr-Val-Nle-Gly-His-(D-Phe)-Arg-(D-Trp)-Asp-Arg-Phe-Gly,
X-Tyr-Val-Nle-Gly-His-Nal-Arg-Trp-Asp-Arg-Phe-Gly,
X-Tyr-Val-Nle-Gly-His-(D-Nal)-Arg-Trp-Asp-Arg-Phe-Gly,
X-Tyr-Val-Nle-Gly-His-Phe-Arg-Trp-Asp-Arg-(D-Phe)-Gly,
X-Tyr-Val-Nle-Gly-His-(D-Phe)-Arg-Trp-Asp-Arg-(D-Phe)-Gly,
X-Tyr-Val-Nle-Gly-His-Phe-(D-Arg)-Trp-Asp-Arg-(D-Phe)-Gly,
X-Tyr-Val-Nle-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-(D-Phe)-Gly,
X-Tyr-Val-Nle-Gly-His-(D-Phe)-Arg-(D-Trp)-Asp-Arg-(D-Phe)-Gly,
X-Tyr-Val-Nle-Gly-His-Nal-Arg-Trp-Asp-Arg-(D-Phe)-Gly, и
X-Tyr-Val-Nle-Gly-His-(D-Nal)-Arg-Trp-Asp-Arg-(D-Phe)-Gly,
где X представляет собой разветвленный аминокислотный зонд.
16. Пептид по п. 1, состоящий из последовательности, выбранной из группы, состоящей из
X-Tyr-Val-Met-Gly-His-Phe-Arg-Trp-Asp-Arg-Phe (SEQ ID NO: 11),
X-Tyr-Val-Met-Gly-His-(D-Phe)-Arg-Trp-Asp-Arg-Phe,
X-Tyr-Val-Met-Gly-His-Phe-(D-Arg)-Trp-Asp-Arg-Phe,
X-Tyr-Val-Met-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-Phe,
X-Tyr-Val-Met-Gly-His-(D-Phe)-Arg-(D-Trp)-Asp-Arg-Phe,
X-Tyr-Val-Met-Gly-His-Nal-Arg-Trp-Asp-Arg-Phe,
X-Tyr-Val-Met-Gly-His-(D-Nal)-Arg-Trp-Asp-Arg-Phe,
X-Tyr-Val-Met-Gly-His-Phe-Arg-Trp-Asp-Arg-(D-Phe),
X-Tyr-Val-Met-Gly-His-(D-Phe)-Arg-Trp-Asp-Arg-(D-Phe),
X-Tyr-Val-Met-Gly-His-Phe-(D-Arg)-Trp-Asp-Arg-(D-Phe),
X-Tyr-Val-Met-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-(D-Phe),
X-Tyr-Val-Met-Gly-His-(D-Phe)-Arg-(D-Trp)-Asp-Arg-(D-Phe),
X-Tyr-Val-Met-Gly-His-Nal-Arg-Trp-Asp-Arg-(D-Phe),
X-Tyr-Val-Met-Gly-His-(D-Nal)-Arg-Trp-Asp-Arg-(D-Phe),
X-Tyr-Val-Nle-Gly-His-Phe-Arg-Trp-Asp-Arg-Phe (SEQ ID NO: 13),
X-Tyr-Val-Nle-Gly-His-(D-Phe)-Arg-Trp-Asp-Arg-Phe,
X-Tyr-Val-Nle-Gly-His-Phe-(D-Arg)-Trp-Asp-Arg-Phe,
X-Tyr-Val-Nle-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-Phe,
X-Tyr-Val-Nle-Gly-His-(D-Phe)-Arg-(D-Trp)-Asp-Arg-Phe,
X-Tyr-Val-Nle-Gly-His-Nal-Arg-Trp-Asp-Arg-Phe,
X-Tyr-Val-Nle-Gly-His-(D-Nal)-Arg-Trp-Asp-Arg-Phe,
X-Tyr-Val-Nle-Gly-His-Phe-Arg-Trp-Asp-Arg-(D-Phe),
X-Tyr-Val-Nle-Gly-His-(D-Phe)-Arg-Trp-Asp-Arg-(D-Phe),
X-Tyr-Val-Nle-Gly-His-Phe-(D-Arg)-Trp-Asp-Arg-(D-Phe),
X-Tyr-Val-Nle-Gly-His-Phe-Arg-(D-Trp)-Asp-Arg-(D-Phe),
X-Tyr-Val-Nle-Gly-His-(D-Phe)-Arg-(D-Trp)-Asp-Arg-(D-Phe),
X-Tyr-Val-Nle-Gly-His-Nal-Arg-Trp-Asp-Arg-(D-Phe), и
X-Tyr-Val-Nle-Gly-His-(D-Nal)-Arg-Trp-Asp-Arg-(D-Phe),
где X представляет собой разветвленный аминокислотный зонд.
17. Пептид по п. 1, состоящий из 14-22 аминокислотных остатков, или состоящий из 8-18 аминокислотных остатков, или состоящий из 14-18 аминокислотных остатков.
18. Фармацевтическая композиция, содержащая пептид по п. 1 в эффективном количестве, который способен к связыванию с и/или активации рецептора(ов) меланокортина MC1r и/или MC3r.
19. Применение пептида по п. 1 для лечения ишемического и/или воспалительного состояния.
20. Применение пептида по п. 19, где ишемическое и/или воспалительное состояние локализовано в ткани одного или более органов млекопитающего, где указанный орган выбирают из группы, состоящей из почки, печени, головного мозга, сердца, мышц, костного мозга, кожи, скелета, легких, дыхательных путей, селезенки, экзокринных желез, мочевого пузыря, желез внутренней секреции, репродуктивных органов, включая фаллопиевы трубы, глаза, уха, сосудистой системы, желудочно-кишечного тракта, включая тонкий кишечник, толстую кишку, прямую кишку, анальный канал, и предстательной железы.
| WO 2007022774 A1, 01.03.2007 | |||
| HOLDER J.R., HASKELL-LUEVANO C., Melanocortin ligands: 30 years of structure-activity relationship (SAR) studies, Med | |||
| Res | |||
| Rev., 2004, v.24, is.3, p:325-356 | |||
| ЛИГАНДЫ РЕЦЕПТОРОВ МЕЛАНОКОРТИНОВ | 2006 |
|
RU2380372C2 |
Авторы
Даты
2018-10-02—Публикация
2013-10-21—Подача