Отсылки к родственным заявкам
[0001] По настоящей заявке испрашивается приоритет на основании даты подачи предварительной заявки США с регистрационным номером 61/475,788, от 15 апреля 2011 г., которая включена в настоящий документ путем указания ссылки.
ПРЕДПОСЫЛКА ИЗОБРЕТЕНИЯ
Область изобретения
[0002] Настоящее изобретение относится к соединениям и способам ингибирования индоламин-2,3-диоксигеназы; также изобретение относится к способу лечения заболеваний и расстройств, вызванных индоламин-2,3-диоксигеназой.
Краткое описание известного уровня техники
[0003] Триптофан (Trp) является незаменимой аминокислотой, необходимой для биосинтеза белков, ниацина и нейромедиатора 5-гидрокситриптамина (серотонин). Фермент индоламин-2,3-диоксигеназа (также известный как ИНДО или ИДО) катализирует первую и лимитирующую скорость стадии разложения L-триптофана до N-формил-кинуренина. В клетках человека стимуляция ИФН-y вызывает активацию ИДО, что приводит к уменьшению уровня Trp, а, следовательно, и остановку роста Trp-зависимых внутриклеточных патогенов, таких как Toxoplasma gondii и Chlamydia trachomatis. Активность ИДО также оказывает антипролиферативный эффект на различные опухолевые клетки, а индукция ИДО наблюдалась в условиях in vivo при отторжении аллогенных опухолей, что указывает на возможную роль этого фермента в процессе отторжения опухоли.
[0004] Было обнаружено, что клетки HeLa, культивируемые одновременно с лимфоцитами периферической крови (ЛПК), приобретают иммуноингибирующий фенотип через повышающую регуляцию активности ИДО. Предполагалось, что уменьшение пролиферации ЛПК при обработке интерлейкином-2 (IL-2) происходит в результате выброса ИДО опухолевыми клетками в ответ на IFN-y секрецию ЛПК. Данный эффект устранялся при обработке 1-метил-триптофаном (1-МТ) - специфическим ингибитором ИДО. Предполагается, что активность ИДО в опухолевых клетках может нарушать противоопухолевый отклик (Logan, et al., 2002, Immunology, 105: 478-87).
[0005] Некоторые данные позволяют сделать вывод, что ИДО участвует в индукции иммунной толерантности. Исследования протекания беременности у млекопитающих, устойчивости опухолей, хронических инфекций и аутоиммунных заболеваний показали, что клетки, экспрессирующие ИДО, могут подавлять отклики Т-клеток и усиливать толерантность. Ускоренный катаболизм Trp наблюдался при заболеваниях и расстройствах, связанных с иммунной активацией клеток, например, при инфекциях, злокачественных опухолях, аутоиммунных заболеваниях и СПИДе, а также во время беременности. Сделано предположение о том, что ИДО постоянно образуется при ВИЧ-инфекции, а затем ее выброс увеличивается в результате оппортунистических инфекций, а также о том, что хроническая потеря Trp запускает механизмы, ответственные за развитие кахексии, деменции, диареи и, возможно, подавления иммунитета у больных СПИДом (Brown, et al., 1991, Adv. Exp. Med. Biol., 294: 425-35). Для подтверждения данного предположения в проведенных недавно исследованиях было показано, что ингибирование ИДО может повышать уровни специфических к вирусу Т-клеток и, одновременно, уменьшать количество инфицированных вирусом макрофагов в модели ВИЧ на мышах (Portula et al., 2005, Blood, 106:2382-90).
[0006] Предполагается, что ИДО играет определенную роль в иммуносупрессивных процессах, которые предотвращают внутриутробное отторжение плода. Более 40 лет назад было обнаружено, что во время беременности млекопитающих генетически разнородный зародыш выживает, несмотря на предположения, которые можно было бы сделать на основании законов иммунологии трансплантации тканей (Medawar, 1953, Symp. Soc. Exp. Biol. 7: 320-38). Анатомическое разделение матери и плода и антигенная незрелость плода не могут полностью объяснить выживание аллотрансплантата плода. В последнее время внимание уделяется иммунологической толерантности матери. Поскольку ИДО экспрессируется синцитиотрофобластами человека и системная концентрация триптофана при беременности уменьшается, была выдвинута гипотеза, что экспрессия ИДО в области взаимодействия мать-плод необходима для предотвращения иммунологического отторжения аллотрансплантатов плода. Для проверки данной гипотезы беременные мыши (вынашивающие сингенные или аллогенные плоды) подвергались обработке 1-МТ, в результате чего наблюдалось быстрое, индуцированное Т-клетками отторжение всех аллогенных зародышей. Таким образом, оказывается, что, катаболизируя триптофан, зародыш млекопитающего подавляет активность Т-клеток и защищает себя от отторжения, а блокирование катаболизма триптофана во время беременности у мышей позволяет Т-клеткам матери вызывать отторжение аллотрансплантата плода (Munn, et al., 1998, Science 281: 1191-3).
[0007] Еще одно подтверждение механизма иммунной устойчивости опухоли, основанного на разложении триптофана ИДО, получено из наблюдения, указывающего на то, что большинство человеческих опухолей конститутивно экспрессируют ИДО и что экспрессия ИДО иммуногенными опухолевыми клетками мышей предотвращает их отторжение у предварительно иммунизированных мышей. Данный эффект сопровождается отсутствием накопления специфических Т-клеток в опухоли и может быть частично скомпенсирован системным воздействием на мышей ингибитором ИДО при отсутствии заметной токсичности. Таким образом, высказано предположение, что эффективность терапевтической вакцинации онкологических больных может быть улучшена путем одновременного введения ингибитора ИДО (Uyttenhove et al., 2003, Nature Med., 9: 1269-74). Кроме того, было показано, что ингибитор ИДО 1-МТ может вступать в синергистическое действие с химиотерапевтическими агентами в плане уменьшения роста опухоли у мышей, указывая на то, что ингибирование ИДО также может повышать противоопухолевую активность обычных режимов цитотоксической терапии (Muller et al., 2005, Nature Med., 11: 312-9).
[0008] Одним из механизмов, способствующих иммунологической невосприимчивости к опухоли, может быть воздействие толерогенных АПК хозяина. Также был описан подтип экспрессирующих ИДО антигенпредставляющих клеток (АПК) человека, которые также коэкспрессировали CD123 (IL3RA) и CCR6 и ингибировали пролиферацию Т-клеток. И зрелые, и незрелые CD123-положительные дендритные клетки подавляли активность Т-клеток, и подобное супрессорное действие ИДО блокировалось действием 1-МТ (Munn, et al., 2002, Science 297: 1867-70). Кроме того, было показано, что дренирующие опухоль лимфатические узлы мышей (ДОЛУ) содержат подтип плазмоцитоидных дендритных клеток (пДК), которые конститутивно экспрессируют иммуноподавляющие уровни ИДО. Несмотря на то, что in vitro эти пДК содержат только 0,5% клеток лимфатических узлов, они мощно подавляют реакцию Т-клеток на антигены, продуцируемые самими же пДК, а также доминирующим образом подавляют отклики Т-клеток на другие антигены, поставляемые АПК. В популяции пДК большая часть функциональной опосредованной ИДО супрессорной активности была обусловлена новым подтипом пДК, коэкспрессирующих маркер клеток линии В CD19. Следовательно, сделано предположение, что опосредованное ИДО подавление пДК в ДОЛУ создает локальную микросреду, которая мощно подавляет противоопухолевые отклики Т-клеток (Munn, et al., 2004, J. Clin. Invest., 114 (2): 280-90).
[0009] ИДО разрушает индольный остаток триптофана, серотонина и мелатонина и инициирует производство нейроактивных и иммунорегуляторных метаболитов, известных под названием кинуренинов. Локально снижая содержание триптофана и увеличивая уровень проапоптотических кинуренинов, экспрессирующие ИДО дендритные клетки (ДК) могут оказывать значительное влияние на пролиферацию и выживание Т-клеток. Индукция ИДО в ДК могла бы иметь схожий механизм уменьшения толерантности, обусловленного регуляторными Т-клетками. Поскольку ожидается, что подобные толерогенные отклики могут возникать при различных физиопатологических состояниях, метаболизм триптофана и производство кинуренина могут играть важную роль в совместной работе иммунной и нервной систем (Grohmann, et al., 2003, Trends Immunol., 24: 242-8).
[0010] Низкомолекулярные блокаторы ИДО разрабатываются для лечения или профилактики связанных с ИДО заболеваний, которые уже упоминались выше. Например, в публикации РСТ WO 99/29310 сообщается о методиках изменения опосредованного Т-клетками иммунитета, в том числе изменения локальных внеклеточных концентраций триптофана и его метаболитов при использовании ингибиторов ИДО, например, таких как 1-метил-DL-триптофан, р-(3-бензофуранил)-DL-аланин, р-[3-бензо-(b)-тиенил]-DL-аланин и 6-нитро-L-триптофан (Munn, 1999). Сообщаемая в WO 03/087347, а также опубликованная в Европейском патенте 1501918 информация касается методов получения антигенпредставляющих клеток с целью увеличения или снижения толерантности Т-клеток (Munn, 2003). Соединения, обладающие ингибирующей индоламин-2,3-диоксигеназу (ИДО) активностью, кроме того, описаны в WO 2004/094409, а патентная заявка США №2004/0234623 относится к способам лечения пациентов, больных раком или имеющих инфекции, путем использования ингибитора индоламина-2,3-диоксигеназы в сочетании с другими видами терапии.
[0011] Ввиду того, что экспериментальные данные указывают на роль ИДО в иммуносупрессии, развитии толерантности и (или) отторжения опухоли при хронических инфекциях, ВИЧ-инфекции, СПИДе (в том числе при его проявлениях, таких как кахексия, деменция и диарея), аутоиммунных заболеваниях или расстройствах (таких как ревматоидный артрит), а также в развитии иммунологической толерантности и профилактике отторжения плода в матке, желательным представляется разработка терапевтических агентов, действие которых направлено на подавление разложения триптофана путем подавления активности ИДО. Ингибиторы ИДО могут использоваться для активации Т-клеток, а, следовательно, и повышения активации Т-клеток в случае их подавления при беременности, присутствии злокачественных опухолей или вирусов, таких как ВИЧ. Использование ингибирования ИДО также может представлять собой важную стратегию лечения пациентов с неврологическими или психоневрологическими заболеваниями или расстройствами, например, депрессией. Описанные в настоящем документе соединения, композиции и методы помогают удовлетворить существующую в настоящее время потребность в модуляторах ИДО.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0012] В одном аспекте изобретение охватывает соединения, имеющие формулу (I),
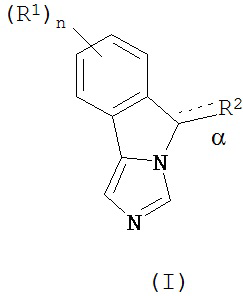
пояснения в отношении R1, R2, n и α представлены в данном документе.
[0013] В другом аспекте изобретение охватывает соединения, имеющие формулу (II),
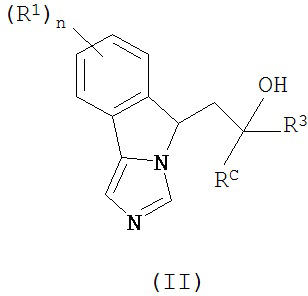
пояснения в отношении R1, R3, RC и n представлены в данном документе.
[0014] В другом аспекте представлены фармацевтические композиции, содержащие в составе фармацевтически приемлемое вспомогательное вещество, растворитель или носитель и соединение, имеющее формулу (I) или (II).
[0015] В другом аспекте представлены методы для (а) модулирования активности индоламин-2,3-диоксигеназы путем изменения оптимального содержания соединения формулы (I) или (II) или фармацевтической композиции, содержащей соединение формулы (I) или (II); (b) воздействия на опосредованную индоламин-2,3-диоксигеназой (ИДО) иммуносупрессию у нуждающихся в этом пациентов, предусматривающего введение оптимального для ингибирования индоламин-2,3-диоксигеназы количества соединения формулы (I) или (II) или фармацевтической композиции, содержащей соединение формулы (I) или (II); (с) лечения клинического состояния в результате ингибирования ферментативной активности индоламин-2,3-диоксигеназы, предусматривающего введение оптимального для ингибирования индоламин-2,3-диоксигеназы количества соединения формулы (I) или (II) или фармацевтической композиции, содержащей соединение формулы (I) или (II); (d) повышения эффективности противоракового лечения, предусматривающего введение противоопухолевого агента и соединения формулы (I) или (II) или фармацевтической композиции, содержащей соединение формулы (I) или (II); (е) лечения связанной с раком специфической для опухоли иммуносупрессии, предусматривающего введение оптимального для ингибирования индоламин-2,3-диоксигеназы количества соединения формулы (I) или (II) или фармацевтической композиции, содержащей соединение формулы (I) или (II); и (f) лечения иммуносупрессии, опосредованной инфекционными заболеваниями, например инфекции ВИЧ-1, предусматривающего введение оптимального для ингибирования индоламин-2,3-диоксигеназы количества соединения формулы (I) или (II) или фармацевтической композиции, содержащей соединение формулы (I) или (II).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0016] На Рисунке 1 представлена абсолютная конфигурация диастереоизомера HBr соли соединения 1417, подтвержденная результатами рентгеноструктурной кристаллографии.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0017] В одном аспекте изобретение относится к применению соединений формулы (I),
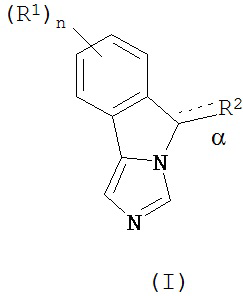
или их фармацевтически приемлемым солям, где
связь α является одиночной или двойной связью;
n - 0, 1, 2, 3 или 4;
каждый из R1 независимым образом представляет собой галоген, циан, нитро,
C1-6алкил,
C1-6галоалкил, -OR, -N(R)2, -SR, -C(O)OR, -C(O)N(R)2, -C(O)R, -S(O)R, -S(O)OR, -S(O)N(R)2, -S(O)2R, -S(O)2OR, -S(O)2N(R)2, -OC(O)R, -OC(O)OR, -OC(O)N(R)2, -N(R)C(O)R, -N(R)C(O)OR, или -N(R)C(O)N(R)2;
R2 представляет собой -C1-4алкил-RA или -C2-4алкенил-R3, когда связь α является одиночной связью; a
R2 представляет собой =C(H)RA, когда связь а является двойной связью;
где
RA представляет собой -CN, -C(O)R3, -C(O)OR3, -C(O)N(R3)(RC), -C(ORB)(R3)(RC), -C(NHRB)(R3)(RC), или -C(=N-ORC)R3, где
RB RB представляет собой водород, C1-6алкил, C1-6галоалкил, -C1-6алкил-RB1, -C(O)R3, или -S(O)2R3, -C(O)(CH2)1-4COOR, -C(O)CH(NH2)(RD), -S(O)2OR3, -S(O)2N(R3)2, -CH2-OP(O)2(OR)2, или -P(O)(OR3)2, где
RB1 представляет собой циан, нитро, C1-6алкил, C1-6галоалкил, -OR, -N(R)2, -SR, -C(O)OR, -C(O)N(R)2, -C(O)R, -S(O)R, -S(O)OR, -S(O)N(R)2, -S(O)2R, -S(O)2OR, -S(O)2N(R)2, -OC(O)R, -OC(O)OR, -OC(O)N(R)2, -N(R)C(O)R, -N(R)C(O)OR, или -N(R)C(O)N(R)2;
RD представляет собой водород, метил, -СН(СН3)2, СН2СН(СН3)2, -СН(СН3)(СН2СН3), бензил, 4-гидроксибензила, -CH2(3-indolyl), -CH2SH, -CH2CH2SCH3, -СН2ОН, -СН(СН3)ОН, -(CH2)4-NH2, -(CH2)3-N(H)C(=NH)NH2, -CH2(4-imidazolyl), -CH2COOH, -CH2CH2COOH, -CH2CONH2, -CH2CH2CONH2;
каждый из R3 независимым образом представляет собой водород, C1-6алкил, C1-6галоалкил, арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил, арилС1-6алкил-, гетероарил С1-6алкил-, С3-8циклоалкилС1-6алкил-, С3-8циклоалкенилС1-6алкил- или (3-10-членный гетероциклил)С1-6алкил-, где
алкил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил, С3-8циклоалкилС1-6алкил-, С3-8циклоалкенилС1-6алкил- и (3-10-членный гетероциклил)С1-6алкил- необязательным и независимым образом замещены одной группой =R32 или необязательным и независимым образом замещены одной, двумя, тремя или четырьмя группами R31;
арил, гетероарил, арилС1-6алкил- и гетероарилС1-6алкил- группы, каждая из которых необязательным и независимым образом замещена одной, двумя, тремя или четырьмя группами R31;
где
каждый из R31 независимым образом представляет собой галоген, циан, нитро, C1-6алкил, -C1-6алкил-R33, C1-6галоалкил, -OR, -N(R)2, -SR, -C(O)OR, -C(O)N(R)2, -C(O)R,- -S(O)R, -S(O)OR, -S(O)N(R)2, -S(O)2R, -S(O)2OR, -S(O)2N(R)2, -OC(O)R, -OC(O)OR, -OC(O)N(R)2, -N(R)C(O)R, -N(R)C(O)OR, -N(R)C(O)N(R)2, где
R33 представляет собой циан, -OR, -N(R)2, -SR, -C(O)OR, -C(O)N(R)2, -C(O)R, -S(O)R, -S(O)OR, -S(O)N(R)2, -S(O)2R, -S(O)2OR, -S(O)2N(R)2, -OC(O)R, -OC(O)OR, -OC(O)N(R)2, -N(R)C(O)R, -N(R)C(O)OR, или -N(R)C(O)N(R)2;
R32 представляет собой =O, =S, =N(R), =N(OR), =C(R34)2, =(spiro-С3-8циклоалкил), или =(спиро-(3-10-членный гетероциклил)), где
каждый из R34 независимым образом представляет собой водород, галоген, C1-6алкил, C1-6галоалкил, С3-8циклоалкил или 3-10-членный гетероциклил;
или оба R34, соединенные через общий атом, образуют моноциклический С3-8циклоалкил или моноциклический 3-8-членный гетероциклил;
RC представляет собой водород или C1-6алкил;
и
каждый из R независимым образом представляет собой водород или R10, где
R10 - это C1-6алкил, C1-6галоалкил, арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил, арилС1-6алкил, гетероарилС1-6алкил-, С3-8циклоалкилС1-6алкил-, С3-8циклоалкенилС1-6алкил- или (3-10-членный гетероциклил)С1-6алкил-, каждый из R10 необязательно замещен одной, двумя, тремя или четырьмя группами, которые независимым образом представляют собой галоген, циан, нитро, C1-6алкил, C1-6галоалкил, -OR11, -N(R11)2, -SR11, -C(O)OR11, -C(O)N(R11)2, -C(O)R11, -S(O)R11, -S(O)OR11, -S(O)N(R11)2, -S(O)2R11, -S(O)2OR11, -S(O)2N(R11)2, -OC(O)R11, -OC(O)OR11, -OC(O)N(R11)2, -N(R11)C(O)R11, -N(R11)C(O)OR11, -N(R11)C(O)N(R11)2, где каждый из R11 независимым образом представляет собой водород или C1-6алкил.
[0018] В одной модификации, соединения формулы (I) далее включают соединения, где
RB является дополнительной группой -C(O)N(H)R3 или -С(O)(СН2)1-4(NR)COOR;
R3 является дополнительной группой (гетероарил)-(3-10-членный гетероциклил)-,
R31 является дополнительной группой -C(O)N(OH)R, -C(N=R11)R или -C(N=R11)N(R11)R;
R34 является дополнительным цианом или -C1-6алкил-OR; и (или)
R10 представляет собой дополнительный необязательно замещенный -N(R11)S(O)2R11 или -С(О)-(3-10-членный гетероциклил);
такие соединения упоминаются как соединения формулы (I').
[0019] Изобретение также охватывает подтипы формулы (I) и формулы (I'), в которых заместители подобраны как любая возможная комбинация одного или более следующих элементов: структурная формула (I), n, R1, R2, R3, RA, RB и RC, согласно описанию, представленному в настоящем документе, но не ограничиваясь ими, например:
[0020] Структурная формула I является одной из формул (Ia)-(Ih):
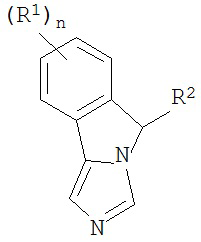
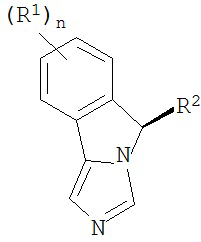
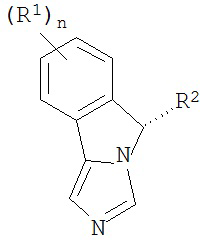
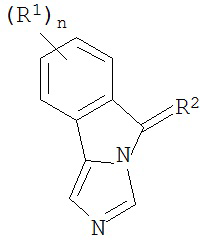
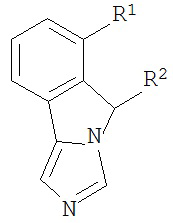
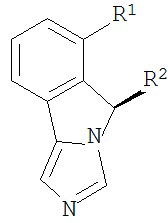
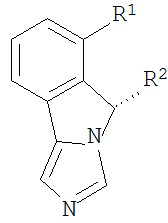
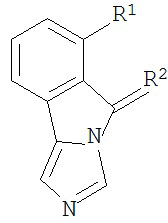
[0021] n и R1 выбирают из одной из следующих групп (1a)-(1u):
(1a) n - 1, 2, 3 или 4, а каждый из R1 соответствует формуле (I).
(1b) n - 0, 1, 2 или 3, а каждый из R1 соответствует формуле (I).
(1c) n - 0, 1 или 2, а каждый из R1 соответствует формуле (I).
(1d) n - 0, 1 или 2, а каждый из R1 независимым образом представляет собой галоген, -OR, -N(R)2 или -SR.
(1e) n - 0, 1 или 2, а каждый из R1 независимым образом представляет собой галоген, -OR0, -N(R0)2 или -SR0, где в свою очередь каждый из R0 независимым образом представляет собой водород или С1-6алкил.
(1f) n - 0, 1 или 2, а каждый из R1 независимым образом представляет собой фтор, хлор, гидрокси или метокси-группу.
(1g) n - 0, 1 или 2, а каждый из R1 независимым образом представляет собой галоген.
(1h) n - 0, 1 или 2, а каждый из R1 независимым образом представляет собой фтор или хлор.
(1i) n - 0 или 1, a R1 соответствует формуле (I).
(1j) n - 0 или 1, а каждый из R1 представляет собой галоген, -OR, -N(R)2 или -SR.
(1k) n - 0 или 1, a R1 представляет собой галоген, -OR0, -N(R0)2 или -SR0; где в свою очередь каждый из R0 независимым образом представляет собой водород или С1-6алкил.
(1l) n - 0 или 1, a R1 представляет собой фтор, хлор, гидрокси или метокси-группу.
(1m) n - 0 или 1, a R1 представляет собой галоген.
(1n) n - 0 или 1, a R1 представляет собой фтор или хлор.
(1o) n - 1, a R1 соответствует формуле (I).
(1p) n - 1, a R1 представляет собой галоген, -OR, -N(R)2 или -SR;
(1q) n - 1, a R1 представляет собой галоген, -OR0, -N(R0)2 или -SR0; где в свою очередь каждый из R0 независимым образом представляет собой водород или C1-6алкил.
(1r) n - 1, a R1 представляет собой фтор, хлор, гидрокси или метокси-группу.
(1s) n - 1, a R1 представляет собой галоген.
(1t) n - 1, a R1 представляет собой фтор или хлор.
(1u) n - 0.
[0022] R2 выбирают из одной из следующих групп (2а)-(2l):
(2а) R2 представляет собой -С1-4алкил-RA.
(2b) R2 представляет собой -С1-2алкил-RA.
(2с) R2 представляет собой -C(H)=C(H)R3.
(2d) R2 представляет собой -C(H)=C(H)R30, где R30 является фенилом, необязательно замещенным одной, двумя, тремя или четырьмя группами R31.
(2е) R2 представляет собой -C(H)=C(H)R30, где R30 является фенилом, необязательно замещенным одной или двумя группами R31.
(2f) R2 представляет собой -CH2-RA, -CH2CH2-RA, -C(H)(CH3)CH2-RA, или -C(H)=C(H)R3.
(2g) R2 представляет собой -CH2-RA, -CH2CH2-RA, или -C(H)(CH3)CH2-RA.
(2h) R2 представляет собой -CH2-RA, -CH2CH2-RA, или -C(H)=C(H)R3.
(2i) R2 представляет собой -CH2-RA.
(2j) R2 представляет собой -CH2CH2-RA.
(2k) R2 представляет собой -C(H)(CH3)CH2-RA.
(2l) R2 представляет собой -CH2-RA, -CH2CH2-RA, или -C(H)=C(H)R3.
[0023] RA выбирают из одной из следующих групп (3а)-(3n):
(3а) RA представляет собой -CN, -C(O)OR3, или -C(O)N(R3)(RC).
(3b) RA представляет собой -C(O)R3 или -C(ORB)(R3)(RC).
(3с) RA представляет собой -C(NHRB)(R3)(RC), или -C(=N-ORC)R3.
(3d) RA является -C(NHRB)(R3)(RC), где RB представляет собой водород, C1-6алкил или -С(O)С1-6алкил.
(3е) RA представляет собой-C(NH2)(R3)(RC).
(3f) RA представляет собой -C(O)OR3.
(3g) RA представляет собой -C(O)N(R3)(RC).
(3h) RA представляет собой -C(O)R3.
(3i) RA представляет собой -C(ORB)(R3)(RC).
(3j) RA представляет собой -C(OH)(R3)(RC).
(3k) RA представляет собой -CH(OH)(R3).
(3l) RA представляет собой -CN, -C(O)R3, -C(O)OR3, -C(O)N(R3)(RC), -C(ORB)(R3)(RC), -C(NHRB)(R3)(RC), или -C(=N-ORC)R3.
(3m) RA представляет собой -C(O)R3 или -C(ORB)(R3)(RC), где RB представляет собой водород, a RC - водород или C1-6алкил.
(3n) RA является -C(ORB)(R3)(RC), где RB представляет собой водород, a RC - водород или C1-6алкил.
[0024] RB выбирают из одной из следующих групп (4а)-(4k):
(4а) RB представляет собой водород, C1-6алкил, C1-6галоалкил, -C1-6алкил-RB1, -C(O)(CH2)1-4COORB2, -C(O)C(NH2)RD, -P(O3)(RB2)2, -CH2-OP(O)2(OR)2, где RD представляет собой боковую цепь естественных альфа-аминокислот, -C(O)R3, или -S(O)2R3, где RB1 представляет собой циан, нитро, С1-6алкил, C1-6галоалкил, -ORB2, -N(RB2)2, -SRB2, -C(O)ORB2, -C(O)N(RB2)2, -C(O)RB2, -S(O)RB2, -S(O)ORB2, -S(O)N(RB2)2, -S(O)2RB2, -S(O)2ORB2, -S(O)2N(RB2)2, -OC(O)RB2, -OC(O)ORB2, -OC(O)N(RB2)2, -N(RB2)C(O)RB2, -N(RB2)C(O)ORB2, или -N(RB2)C(O)N(RB2)2, где каждый из RB2 независимым образом представляет собой водород или C1-6алкил.
(4b) RB представляет собой водород, С1-6алкил, C1-6галоалкил, -C1-6алкил-RB1, -C(O)R3, или -S(O)2R3, где RB1 представляет собой циан, нитро, C1-6алкил, C1-6галоалкил, -ORB2, -N(RB2)2, -SRB2, -C(O)ORB2, -C(O)N(RB2)2, -C(O)RB2, -S(O)RB2, -S(O)ORB2, -S(O)N(RB2)2, -S(O)2RB2, -S(O)2ORB2, -S(O)2N(RB2)2, -OC(O)RB2, -OC(O)ORB2, -OC(O)N(RB2)2, -N(RB2)C(O)RB2, -N(RB2)C(O)ORB2, или -N(RB2)C(O)N(RB2)2, где каждый из RB2 независимым образом представляет собой водород или C1-6алкил.
(4с) RB представляет собой водород, C1-6алкил, С1-6галоалкил, или -C1-6алкил-RB1, где RB1 представляет собой циан, нитро, C1-6алкил, C1-6галоалкил, -ORB2, -N(RB2)2, -SRB2, -C(O)ORB2, -C(O)N(RB2)2, -C(O)RB2, -S(O)RB2, -S(O)ORB2, -S(O)N(RB2)2, -S(O)2RB2, -S(O)2ORB2, -S(O)2N(RB2)2, -OC(O)RB2, -OC(O)ORB2, -OC(O)N(RB2)2, -N(RB2)C(O)RB2, -N(RB2)C(O)ORB2, или -N(RB2)C(O)N(RB2)2, где каждый из RB2 независимым образом представляет собой водород или C1-6алкил.
(4d) RB представляет собой водород, C1-6алкил, C1-6галоалкил или -C1-6алкил-RB1, где RB1 - это циан, -C(O)ORB2, -C(O)N(RB2)2, -C(O)RB2, -S(O)2RB2, -S(O)2ORB2 или -S(O)2N(RB2)2, где каждый из RB2 независимым образом представляет собой водород или C1-6алкил.
(4е) RB представляет собой -C1-6алкил-RB1, где RB1 - это циан, -C(O)ORB2, -C(O)N(RB2)2, -C(O)RB2, -S(O)2RB2, -S(O)2ORB2 или -S(O)2N(RB2)2, где каждый из RB2 независимым образом представляет собой водород или C1-6алкил.
(4f) RB представляет собой водород, С1-6алкил, C1-6галоалкил, -C1-6алкил-RB1, -C(O)RB2 или -S(O)2RB2, где RB1 - это -C(O)ORB3, -C(O)N(RB3)2, -S(O)2ORB3 или -S(O)2N(R3)2, RB2 - это C1-6алкил; a RB3 представляет собой водород или C1-6алкил.
(4g) RB представляет собой водород, C1-6алкил или C1-6галоалкил.
(4h) RB представляет собой водород или C1-6алкил;
(4i) RB представляет собой водород.
(4j) RB представляет собой С1-6алкил.
(4k) RB представляет собой водород, -C(O)RB2, -C(O)(CH2)1-4COORB2, -C(O)C(NH2)RD, -P(O)(ORB2)2, -CH2-OP(O)2(OR)2, -S(O)2RB2, -C(O)N(RB2)2, -S(O)2ORB2, -S(O)2N(R3)2, где RB2 - это водород или C1-6алкил.
[0025] RC выбирают из одной из следующих групп (5а)-(5g):
(5а) RC представляет собой водород или С1-6алкил.
(5b) RC представляет собой водород или C1-6алкил.
(5с) RC представляет собой водород или метил.
(5d) RC представляет собой водород.
(5е) RC представляет собой C1-6алкил.
(5f) RC представляет собой C1-4алкил.
(5g) RC представляет собой метил.
[0026] R3 выбирают из одной из следующих групп (6а)-(6z):
(6а) R3 представляет собой водород, С1-6алкил, арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил или С3-8циклоалкилС1-6алкил-, в котором C1-6алкил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил и С3-8циклоалкилС1-6алкил- необязательным образом замещены одной группой =R32 и одной или двумя группами R31; а арильная и гетероарильная группы необязательным образом замещены одной или двумя группами R31.
(6b) R3 представляет собой арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил или С3-8циклоалкилС1-6алкил-, в котором С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил и С3-8циклоалкилС1-6алкил- необязательным и независимым образом замещены одной группой =R32 и каждый необязательным и независимым образом замещен одной или двумя группами R31; а арильная и гетероарильная группы необязательным образом замещены одной или двумя группами R3l.
(6с) R3 представляет собой фенил, пяти- или шестичленный гетероарил, моноциклический С5-8циклоалкил, моноциклический С5-8циклоалкенил, пятнили шестичленный моноциклический гетероциклил или (моноциклический С5-8циклоалкил)С1-6алкил-, в котором С5-8циклоалкил, С5-8циклоалкенил, 5-6-членный гетероциклил и С5-8циклоалкилС1-6алкил- необязательным и независимым образом замещены одной группой =R32 и каждый необязательным и независимым образом замещен одной или двумя группами R31; а фенильная и гетероарильная группы необязательным образом замещены одной или двумя группами R31.
(6d) R3 представляет собой фенил или пяти- или шестичленный гетероарил, каждый из которых необязательным образом замещен одной или двумя группами R31.
(6e) R3 представляет собой моноциклический С5-8циклоалкил, моноциклический С5-8циклоалкенил, пяти- или шестичленный моноциклический гетероциклил или (моноциклический С5-8циклоалкил)C1-6алкил-, каждый из которых необязательным образом замещен одной группой =R32 и одной или двумя группами R31.
(6f) R3 представляет собой 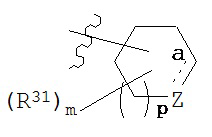 , где связь а является одиночной или двойной связью; m - 0, 1 или 2; р - 0 или 1; в которой
, где связь а является одиночной или двойной связью; m - 0, 1 или 2; р - 0 или 1; в которой
если связь а является одиночной связью, то Z представляет собой -C(R36)2-, -C(=R32)-, -N(R35)- или -О-, где каждый из R36 независимым образом является водородом или R31;
R35 - это водород, С1-6алкил, -C(O)R, -S(O)2R, -C(O)OR, -C(O)N(R)2, -S(O)2OR или -S(O)2N(R)2;
а если связь а является двойной связью, то Z представляет собой -C(R36)= или -N=.
(6g) R3 представляет собой 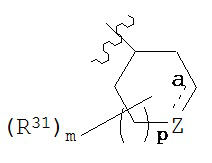 , где связь а является одиночной или двойной связью; m - 0, 1 или 2; р - 0 или 1; в которой
, где связь а является одиночной или двойной связью; m - 0, 1 или 2; р - 0 или 1; в которой
если связь а является одиночной связью, то Z представляет собой -C(R36)2-, -C(=R32)-, -N(R35)- или -О-, где каждый из R36 независимым образом является водородом или R31; и
R35 - это водород, С1-6алкил, -C(O)R, -S(O)2R, -C(O)OR, -C(O)N(R)2, -S(O)2OR или -S(O)2N(R)2;
а если связь а является двойной связью, то Z представляет собой -C(R36)= или -N=.
(6h) Как группа (6g), в которой если связь а является одиночной связью, то Z представляет собой -C(R36)2- или -C(=R32)-; а если связь а является двойной связью, то Z является -C(R36)= или -N=.
(6i) Как группа (6g), в которой m - 0; если связь а является одиночной связью, то Z представляет собой -C(R36)2- или -C(=R32)-; а если связь а является двойной связью, то Z является -C(R36)= или -N=.
(6j) Как группа (6g), в которой связь а является одиночной связью; a Z представляет собой -C(R36)2- или -C(=R32)-.
(6k) Как группа (6g), в которой связь а является одиночной связью; a Z представляет собой -C(R36)2-.
(6l) Как группа (6g), в которой связь а является одиночной связью; a Z представляет собой -C(=R32)-.
(6m) Как группа (6g), в которой m - 0; связь а является одиночной связью; a Z представляет собой -C(R36)2- или -C(=R32)-.
(6n) Как группа (6g), в которой m - 0; связь а является одиночной связью; a Z представляет собой -C(R36)2-.
(6о) Как группа (6g), в которой m - 0; связь а является одиночной связью; a Z представляет собой -C(=R32)-.
(6р) Как группа (6g), в которой связь а является одиночной связью; a Z представляет собой -C(R36)2- или -C(=R32)-, в котором каждый из R36 независимым образом является водородом, галогеном, С1-6алкилом, -C1-6алкил-ОН, С1-6галоалкилом или -ОН, а
R32 - это =O, =C(R34)2, =(спиро-С3-8циклоалкил) или =(спиро-(3-8 членный гетероциклил)), в котором каждый из R34 независимым образом является водородом, галогеном, C1-6алкилом, С1-6галоалкилом, С3-8циклоалкилом или 3-8 членным гетероциклом.
(6q) Как группа (6g), в которой m - 0; связь а является одиночной связью; a Z представляет собой -C(R36)2- или -C(=R32)-, в котором каждый из R36 независимым образом является водородом, галогеном, C1-6алкилом, -C1-6алкил-ОН, C1-6галоалкилом или -ОН, а
R32 - это =O, =C(R34)2, =(спиро-С3-8циклоалкил) или =(спиро-(3-8 членный гетероциклил)), в котором каждый из R34 независимым образом является водородом, галогеном, C1-6алкилом, С1-6галоалкилом, С3-8циклоалкилом или 3-8 членным гетероциклом.
(6r) Как группа (6g), в которой связь а является одиночной связью; a Z представляет собой -N(R35)- или -О-.
(6s) R3 - это водород, C1-6алкил, арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил или С3-8циклоалкилС1-6алкил, где
C1-6алкил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил и С3-8циклоалкилС1-6алкил необязательным образом замещены одной группой =R32 и одной или двумя группами R31,
арильная и гетероарильные группы необязательным образом замещены одной или двумя группами R31; где
каждый из R31 независимым образом представляет собой галоген, циан, нитро, C1-6алкил, -С1-6алкил-R33, С1-6галоалкил, -OR, -N(R)2, -SR, -C(O)OR, -C(O)N(R)2, -C(O)R, -S(O)R, -S(O)OR, -S(O)N(R)2, -S(O)2R, -S(O)2OR, -S(O)2N(R)2, -OC(O)R, -OC(O)OR, -OC(O)N(R)2, -N(R)C(O)R, -N(R)C(O)OR, -N(R)C(O)N(R)2, в котором R33 - это -OR, -N(R)2 или -SR; a
R32 - это оксо, =C(R34)2, =(спиро-С3-8циклоалкил) или =(спиро-(3-10-членный гетероциклил)), в котором каждый из R34 независимым образом представляет собой водород, галоген, С1-6алкил или С3-8циклоалкил.
(6t) R3 - это водород, C1-6алкил, арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил или С3-8циклоалкилС1-6алкил-, где
C1-6алкил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил и С3-8циклоалкилС1-6алкил- необязательным и независимым образом замещен одной группой =R32 и каждый из них необязательным и независимым образом замещен одной или двумя группами R31;
а арильная и гетероарильные группы необязательным образом замещены одной или двумя группами R31;
в которой
каждый из R31 независимым образом представляет собой галоген, циан, нитро, C1-6алкил, -C1-6алкил-R33, C1-6галоалкил, -OR, -N(R)2, -SR, -C(O)OR, -C(O)N(R)2, -C(O)R, -S(O)R, -S(O)OR, -S(O)N(R)2, -S(O)2R, -S(O)2OR, -S(O)2N(R)2, -OC(O)R, -OC(O)OR, -OC(O)N(R)2, -N(R)C(O)R, -N(R)C(O)OR, -N(R)C(O)N(R)2, где R33 - это -OR, -N(R)2 или -SR;
a
R32 - это оксо, =C(R34)2, =(спиро-С3-8циклоалкил) или =(спиро-(3-10-членный гетероциклил)), в котором каждый из R34 независимым образом представляет собой водород, галоген, C1-6алкил или С3-8циклоалкил.
(6u) R3 представляет собой арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил или 3-10-членный гетероциклил, в котором С3-8циклоалкил, С3-8циклоалкенил и 3-10-членный гетероциклил необязательным образом замещены одной группой =R32 и одной, двумя, тремя или четырьмя группами R31; а
арильная и гетероарильная группы необязательным образом замещены одной, двумя, тремя или четырьмя группами R31.
(6v) RC представляет собой фенил, циклопентил, циклогексил, циклогексенил, фуранил, тетрагидропиранил, пиперидинил, имидазолил, тиазолил, каждый из которых необязательным образом замещен одной, двумя, тремя или четырьмя группами R31, в которой циклопентил, циклогексил, циклогексенил и пиперидинил-группы необязательным образом замещены одной группой =R32.
(6w) R3 представляет собой фенил, циклопентил, циклогексил, циклогекс-1-ен-1-ил, циклогекс-3-ен-1-ил, фуран-2-ил, фуран-3-ил, тетрагидропиран-3-ил, тетрагидропиран-4-ил, пиперидин-3-ил, пиперидин-4-ил, имидазол-2-ил, имидазол-4-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, каждый из которых необязательным образом замещен одной или двумя группами R31, в которой циклопентил, циклогексил, циклогексенил и пиперидинил-группы необязательным образом замещены одной группой =R32.
(6х) Любая из групп (6а)-(6w), где каждый из R независимым образом представляет собой водород, С1-6алкил, C1-6галоалкил, арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил, арилС1-6алкил, гетероарилС1-6алкил-, С3-8циклоалкилС1-6алкил-, С3-8циклоалкенилС1-6алкил- или (3-10-членный гетероциклил)С1-6алкил-.
(6y) Любая из групп (6а)-(6w), где каждый из R независимым образом представляет собой водород, С1-6алкил, C1-6галоалкил, фенил, 5- или 6-членный гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-8 членный гетероциклил, бензил, (5- или 6-членный гетероарил)С1-6алкил-, С3-8циклоалкилС1-6алкил-, С3-8циклоалкенилС1-6алкил- или (3-8 членный гетероциклил)С1-6алкил-.
(6z) Любая из групп (6а)-(6w), где каждый из R независимым образом представляет собой водород или C1-6алкил.
[0027] Отдельные модификации данного аспекта изобретения охватывают соединения любой из формул (I), (I') и (Ia)-(Id), каждая из которых описана в одной из строк, где каждая запись является номером группы, описанной выше (напр., (1s) относится к n - 1, а каждый R1 - это галоген), одиночная черта «-» говорит о том, что переменное значение указано как для формулы (I) или (I') или указано в соответствии с одним из применимых изменяемых определений (Ia)-(6z) [напр., если RC указано с одиночной чертой, оно может быть описано или в соответствии с информацией для формулы (I) или (I'), или с помощью любого из определений (5a)-(5g)]:
[0028] В другом аспекте изобретение относится к соединению формулы (II),
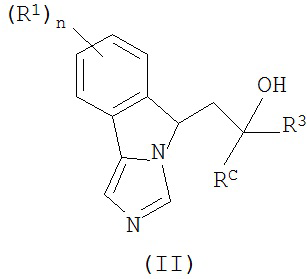
или его фармацевтически приемлемым солям, где
n - 0 или 1;
каждый из R1 независимым образом представляет собой галоген, -OR, -N(R)2 или -SR;
каждый из R3 независимым образом представляет собой водород, C1-6алкил, арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил или С3-8циклоалкилС1-6алкил-, в которой
С1-6алкил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил и С3-8циклоалкилС1-6алкил- необязательным и независимым образом замещены одной группой =R32 и каждый из них необязательным и независимым образом замещен одной или двумя группами R31;
арильная и гетероарильные группы необязательным образом замещены одной или двумя группами R31; где
каждый из R31 независимым образом представляет собой галоген, циан, нитро, C1-6алкил, -C1-6алкил-R33, C1-6галоалкил, -OR, -N(R)2, -SR, -C(O)OR, -C(O)N(R)2, -C(O)R, -S(O)R, -S(O)OR, -S(O)N(R)2, -S(O)2R, -S(O)2OR, -S(O)2N(R)2, -OC(O)R, -OC(O)OR, -OC(O)N(R)2, -N(R)C(O)R, -N(R)C(O)OR, -N(R)C(O)N(R)2, в котором R33 = это -OR, -N(R)2 или -SR;
R32 - это оксо, =C(R34)2, =(спиро-С3-8циклоалкил) или =(спиро-(3-10-членный гетероциклил)), в котором каждый из R34 независимым образом представляет собой водород, галоген, C1-6алкил или С3-8циклоалкил; а
RC представляет собой водород или C1-6алкил; а
каждый R независимым образом - водород или R10, в которой
R10 представляет С1-6алкил, С1-6галоалкил, арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил, арилС1-6алкил, гетероарилС1-6алкил-, С3-8 циклоалкилС1-6алкил-, С3-8циклоалкенилС1-6алкил- или (3-10-членный гетероциклил)С1-6алкил-, каждый из R10 необязательным образом замещен одной, двумя, тремя или четырьмя группами, каждая из которых независимым образом представляет собой галоген, циан, нитро, C1-6алкил,
C1-6галоалкил, -OR11, -N(R11)2, -SR11, -C(O)OR11, -C(O)N(R11)2, -C(O)R11, -S(O)R11, -S(O)OR11, -S(O)N(R11)2, -S(O)2R11, -S(O)2OR11, -S(O)2N(R11)2, -OC(O)R11, -OC(O)OR11, -OC(O)N(R11)2, -N(R11)C(O)R11, -N(R11)C(O)OR11, -N(R11)C(O)N(R11)2, в которых каждый из R11 независимым образом может являться водородом или C1-6алкилом.
[0029] В одной модификации, соединения формулы (II) далее включают соединения, где
R3 является дополнительной группой (гетероарил)-(3-10-членный гетероциклил)-;
R31 является дополнительной группой -C(O)N(OH)R, -C(N=R11)R или -C(N=R11)N(R11)R;
R34 является дополнительным цианом или -C1-6алкил-OR; и (или)
R10 представляет собой дополнительный необязательно замещенный -N(R11)S(O)2R11 или -С(О)-(3-10-членный гетероциклил);
такие соединения упоминаются как соединения формулы (II').
[0030] Изобретение также охватывает подтипы формулы (II) или (IV), в которых заместители подобраны как любая возможная комбинация одного или более следующих элементов: структурная формула (II), n, R1, R3 и RC, согласно описанию, представленному в настоящем документе, но не ограничиваясь ими, например:
[0031] Структурная формула II является одной из формул (IIa)-(IId):
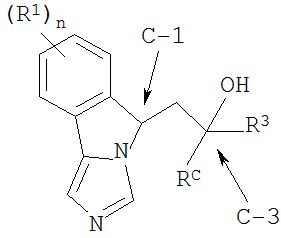
[0032] (IIa): в которой стереоизомерная конфигурация углерода-1 (С-1) и углерода-3 (С-3) формулы (II) соответственно указана как (R, R).
[0033] (IIb): в которой стереоизомерная конфигурация углерода-1 и углерода-3 формулы (II) соответственно указана как (R, S).
[0034] (IIc): в которой стереоизомерная конфигурация углерода-1 и углерода-3 формулы (II) соответственно указана как (S, R).
[0035] (IId): в которой стереоизомерная конфигурация углерода-1 и углерода-3 формулы (II) соответственно указана как (S, S).
[0036] Структурная формула II является одной из формул (IIe)-(IIh):
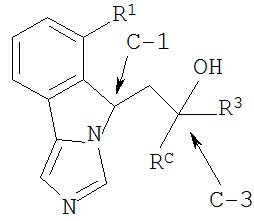
[0037] (IIe): которой стереоизомерная конфигурация углерода-1 (С-1) и углерода-3 (С-3) формулы (II) соответственно указана как (R, R).
[0038] (IIf): в которой стереоизомерная конфигурация углерода-1 и углерода-3 формулы (II) соответственно указана как (R, S).
[0039] (IIg): в которой стереоизомерная конфигурация углерода-1 и углерода-3 формулы (II) соответственно указана как (S, R).
[0040] (IIh): в которой стереоизомерная конфигурация углерода-1 и углерода-3 формулы (II) соответственно указана как (S, S).
[0041] n и R1 выбирают из одной из следующих групп (7а)-(7i):
(7а) n - 0 или 1, а каждый из R1 представляет собой галоген, -OR0, -N(R0)2 или -SR0; где в свою очередь каждый из R0 независимым образом представляет собой водород или C1-6алкил.
(7b) n - 0 или 1, а каждый из R1 представляет собой фтор, хлор, гидрокси- или метокси-группу.
(7с) n - 0 или 1, а каждый R1 представляет собой галоген.
(7d) n - 0 или 1, а каждый R1 представляет собой фтор или хлор.
(7е) n - 1, a R1 представляет собой галоген, -OR0, -N(R0)2 или -SR0; где в свою очередь каждый из R0 независимым образом представляет собой водород или C1-6алкил.
(1v) n - 1, a R1 представляет собой фтор, хлор, гидрокси или метокси-группу.
(7f) n - 1, a R1 представляет собой галоген.
(7g) n - 1, a R1 представляет собой фтор или хлор.
(7h) n-0.
[0042] RC выбирают из одной из следующих групп (8а)-(8g):
(8а) RC представляет собой водород или С1-4алкил.
(8b) RC представляет собой водород или С1-2алкил.
(8с) RC представляет собой водород или метил.
(5h) RC представляет собой водород.
(5i) RC представляет собой C1-6алкил.
(5j) RC представляет собой С1-4алкил.
(8d) RC представляет собой метил.
[0043] R3 выбирают из одной из следующих групп (9а)-(9х):
(9а) R3 представляет собой арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил или С3-8циклоалкилС1-6алкил-, в котором С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил и С3-8циклоалкилС1-6 алкил- необязательным и независимым образом замещены одной группой =R32 и каждый необязательным и независимым образом замещен одной или двумя группами R31; а арильная и гетероарильная группы необязательным образом замещены одной или двумя группами R31.
(9b) R3 представляет собой фенил, пяти- или шестичленный гетероарил, моноциклический С5-8циклоалкил, моноциклический С5-8циклоалкенил, пятнили шестичленный моноциклический гетероциклил или (моноциклический С5-8циклоалкил)C1-6 алкил-, в котором С3-8циклоалкил, С3-8циклоалкенил, 5-6-членный гетероциклил и С3-8циклоалкилС1-6алкил- необязательным и независимым образом замещены одной группой =R32 и каждый необязательным и независимым образом замещен одной или двумя группами R31; а фенильная и гетероарильная группы необязательным образом замещены одной или двумя группами R31.
(9с) R3 представляет собой фенил или пяти- или шестичленный гетероарил, каждый из которых необязательным образом замещен одной или двумя группами R31.
(9d) R3 представляет собой моноциклический С3-8циклоалкил, моноциклический С5-8циклоалкенил, пяти- или шестичленный моноциклический гетероциклил или (моноциклический С5-8циклоалкил)C1-6алкил-, каждый из которых необязательным образом замещен одной группой =R32 и одной или двумя группами R31.
(9е) RC представляет собой  , где связь а является одиночной или двойной связью; m - 0, 1 или 2; р - 0 или 1; в которой
, где связь а является одиночной или двойной связью; m - 0, 1 или 2; р - 0 или 1; в которой
если связь а является одиночной связью, то Z представляет собой -C(R36)2-, -C(=R32)-, -N(R35)- или -О-, где каждый из R36 независимым образом является водородом или R31; а
R35 - это водород, С1-6алкил, -C(O)R, -S(O)2R, -C(O)OR, -C(O)N(R)2, -S(O)2OR или -S(O)2N(R)2;
а если связь а является двойной связью, то Z представляет собой -C(R36)= или -N=.
(9f) R3 представляет собой  , где связь а является одиночной или двойной связью; m - 0, 1 или 2;
, где связь а является одиночной или двойной связью; m - 0, 1 или 2;
р - 0 или 1; в которой
если связь а является одиночной связью, то Z представляет собой -C(R36)2-, -C(=R32)-, -N(R35)- или -О-, где каждый из R36 независимым образом является водородом или R31; и
R35 - это водород, С1-6алкил, -C(O)R, -S(O)2R, -C(O)OR, -C(O)N(R)2, -S(O)2OR или -S(O)2N(R)2;
а если связь а является двойной связью, то Z представляет собой -C(R36)= или -N=.
(9g) Как группа (9f), в которой если связь а является одиночной связью, то Z представляет собой -C(R36)2- или -C(=R32)-; а если связь а является двойной связью, то Z является -C(R36)= или -N=.
(9h) Как группа (9f), в которой m - 0; если связь а является одиночной связью, то Z представляет собой -C(R36)2- или -C(=R32)-; а если связь а является двойной связью, то Z является -C(R36)= или -N=
(9i) Как группа (9f), в которой связь а является одиночной связью; a Z представляет собой -C(R36)2- или -C(=R32)-.
(9j) Как группа (9f), в которой связь а является одиночной связью; a Z представляет собой -C(R36)2-.
(9k) Как группа (9f), в которой связь а является одиночной связью; a Z представляет собой -C(=R32)-.
(9l) Как группа (9f), в которой m - 0; связь а является одиночной связью; a Z представляет собой -C(R36)2- или -C(=R32)-
(9m) Как группа (9f), в которой m - 0; связь а является одиночной связью; a Z представляет собой -C(R36)2-.
(9n) Как группа (9f), в которой m - 0; связь а является одиночной связью; a Z представляет собой -C(=R32)-.
(9о) Как группа (9f), в которой связь а является одиночной связью; a Z представляет собой -C(R36)2- или -C(=R32)-, в котором каждый из R36 независимым образом является водородом, галогеном, C1-6алкилом, -C1-6алкил-ОН, С1-6галоалкилом или -ОН, а
R32 - это =O, =C(R34)2, =(спиро-С3-8циклоалкил) или =(спиро-(3-8 членный гетероциклил)), в котором каждый из R34 независимым образом является водородом, галогеном, C1-6алкилом, C1-6галоалкилом, С3-8циклоалкилом или 3-8-членным гетероциклом.
(9р) Как группа (9f), в которой m - 0; связь а является одиночной связью; a Z представляет собой -C(R36)2- или -C(=R32)-, в котором каждый из R36 независимым образом является водородом, галогеном, C1-6алкилом, -C1-6алкил-ОН, C1-6галоалкилом или -ОН, где
R32 - это =O, =C(R34)2, =(спиро-С3-8циклоалкил) или =(спиро-(3-8 членный гетероциклил)), в котором каждый из R34 независимым образом является водородом, галогеном, С1-6алкилом, C1-6галоалкилом, С3-8циклоалкилом или 3-8 членным гетероциклом.
(9q) Как группа (9f), в которой связь а является одиночной связью; a Z представляет собой -N(R35)- или -О-.
(9r) R3 представляет собой водород, C1-6алкил, арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил или С3-8циклоалкилС1-6алкил, где
C1-6алкил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил и С3-8циклоалкилС1-6алкил необязательным образом замещены одной группой =R32 и одной или двумя группами R31;
арильная и гетероарильные группы необязательным образом замещены одной или двумя группами R31; где
каждый из R31 независимым образом представляет собой галоген, циан, нитро, C1-6алкил, -C1-6алкил-R33, С1-6галоалкил, -OR, -N(R)2, -SR, -C(O)OR, -C(O)N(R)2, -C(O)R, -S(O)R, -S(O)OR, -S(O)N(R)2, -S(O)2R, -S(O)2OR, -S(O)2N(R)2, -OC(O)R, -OC(O)OR, -OC(O)N(R)2, -N(R)C(O)R, -N(R)C(O)OR, -N(R)C(O)N(R)2, в котором R33 - это -OR, -N(R)2 или -SR; a
R32 - это оксо, =C(R34)2, =(спиро-С3-8циклоалкил) или =(спиро-(3-10-членный гетероциклил)), в котором каждый из R34 независимым образом представляет собой водород, галоген, C1-6алкил или С3-8циклоалкил.
(9s) R3 представляет собой арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил или 3-10-членный гетероциклил, в котором С3-8циклоалкил, С3-8циклоалкенил и 3-10-членный гетероциклил необязательным образом замещены одной группой =R32 и одной, двумя, тремя или четырьмя группами R31; а
арильная и гетероарильная группы необязательным образом замещены одной, двумя, тремя или четырьмя группами R31.
(9t) R3 представляет собой фенил, циклопентил, циклогексил, циклогексенил, фуранил, тетрагидропиранил, пиперидинил, имидазолил, тиазолил, каждый из которых необязательным образом замещен одной, двумя, тремя или четырьмя группами R31, в которой циклопентил, циклогексил, циклогексенил и пиперидинил-группы необязательным образом замещены одной группой =R32.
(9u) R3 представляет собой фенил, циклопентил, циклогексил, циклогекс-1-ен-1-ил, циклогекс-3-ен-1-ил, фуран-2-ил, фуран-3-ил, тетрагидропиран-3-ил, тетрагидропиран-4-ил, пиперидин-3-ил, пиперидин-4-ил, имидазол-2-ил, имидазол-4-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, каждый из которых необязательным образом замещен одной или двумя группами R31, в которой циклопентил, циклогексил, циклогексенил и пиперидинил-группы необязательным образом замещены одной группой =R32.
(9v) Любая из групп (9а)-(9u), где каждый из R независимым образом представляет собой водород, C1-6алкил, С1-6галоалкил, арил, гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-10-членный гетероциклил, арилС1-6алкил, гетероарил С1-6алкил-, С3-8циклоалкилС1-6алкил-, С3-8циклоалкенилС1-6алкил- или (3-10-членный гетероциклил)C1-6алкил-.
(9w) Любая из групп (9а)-(9u), где каждый из R независимым образом представляет собой водород, C1-6алкил, C1-6галоалкил, фенил, 5- или 6-членный гетероарил, С3-8циклоалкил, С3-8циклоалкенил, 3-8 членный гетероциклил, бензил, (5- или 6-членный гетероарил)С1-6алкил-, С3-8 циклоалкилС1-6алкил-, С3-8циклоалкенилС1-6алкил- или (3-8 членный гетероциклил)C1-6алкил-.
(9х) Любая из групп (9а)-(9u), где каждый из R независимым образом представляет собой водород или C1-6алкил.
[0044] Отдельные модификации данного аспекта изобретения охватывают соединения любой из формул (II), (II') и (IIa)-(IId), каждая из которых описана в одной из строк, где каждая запись является номером группы, описанной выше, а одиночная черта «-» говорит о том, что переменное значение указано как для формулы (II) или (II') или указано в соответствии с одним из применимых изменяемых определений (7a)-(9t) [напр., если RС указано с одиночной чертой, оно может быть описано или в соответствии с информацией для формулы (II) или (II'), или с помощью любого из определений (8a)-(8g)]:
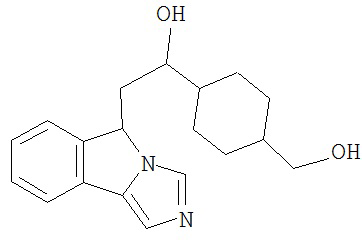
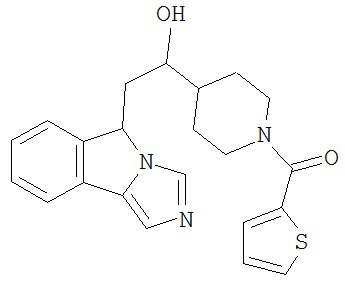
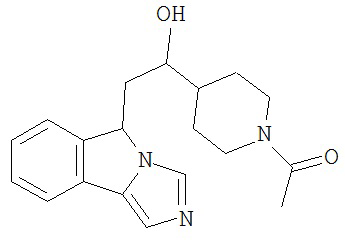
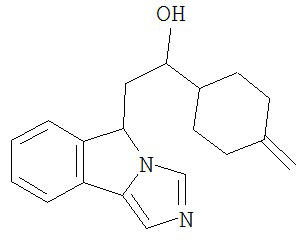
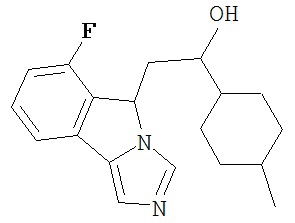
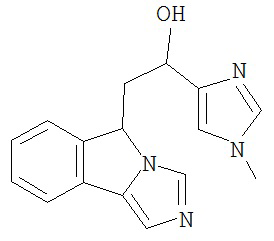
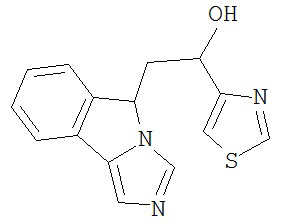
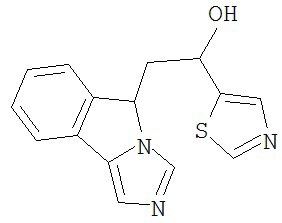
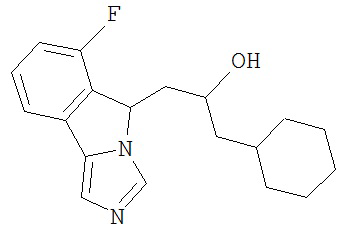
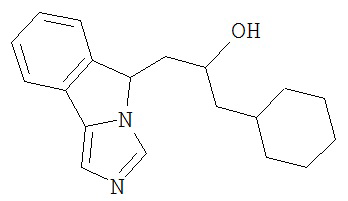
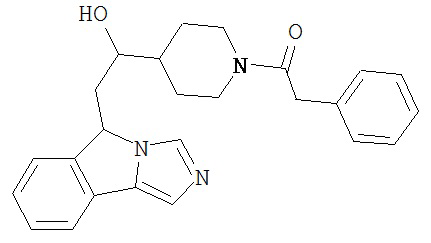
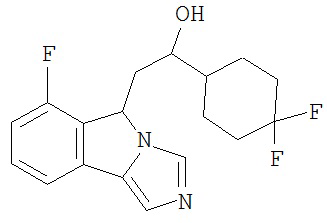
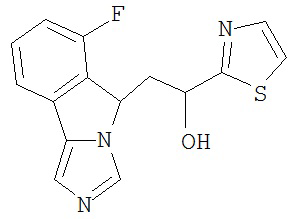
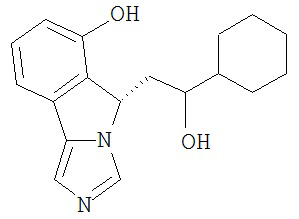
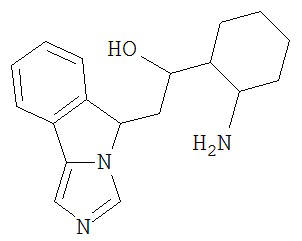
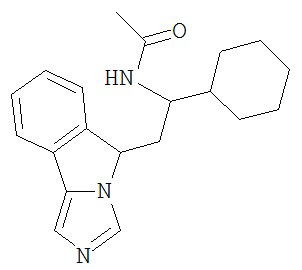
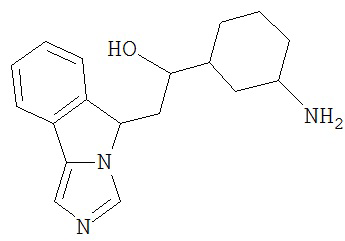
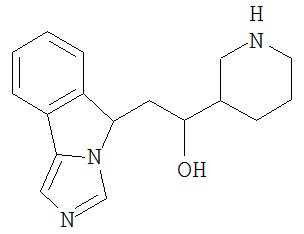
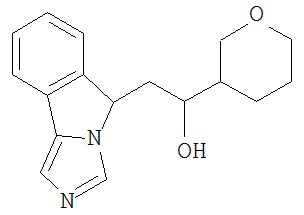
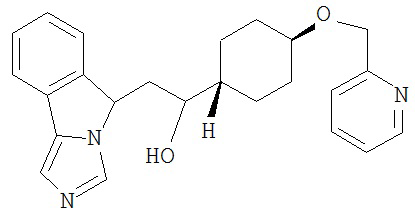
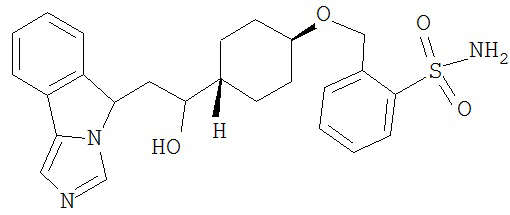
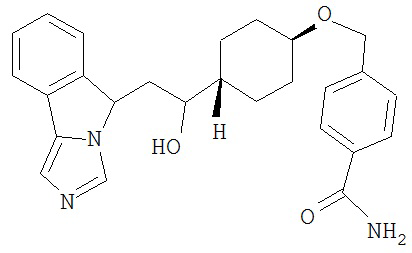
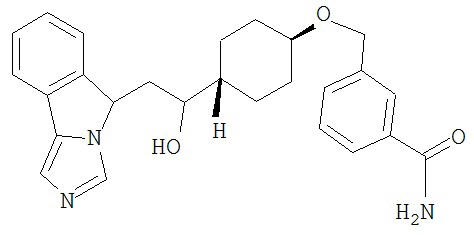
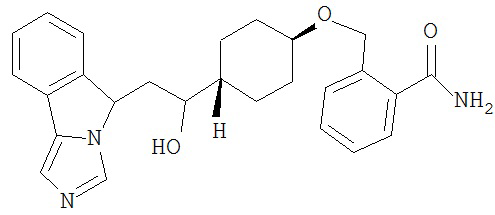
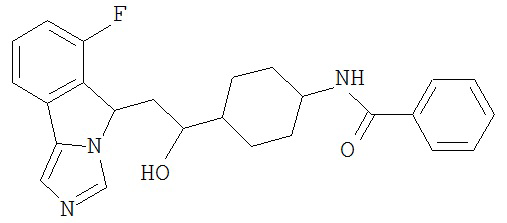
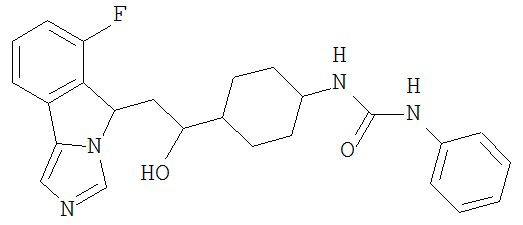
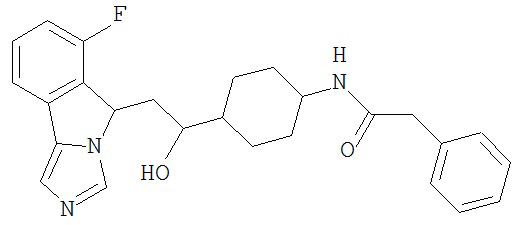
[0045] В другом аспекте настоящее изобретение охватывает следующие соединения
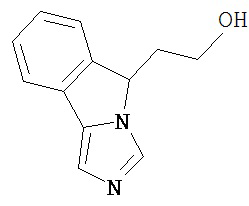
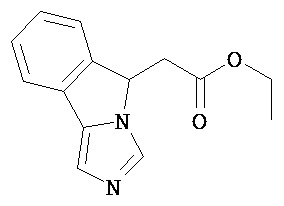
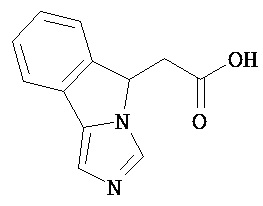
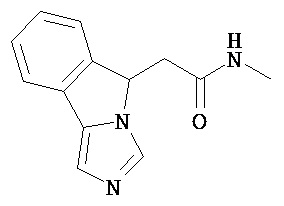
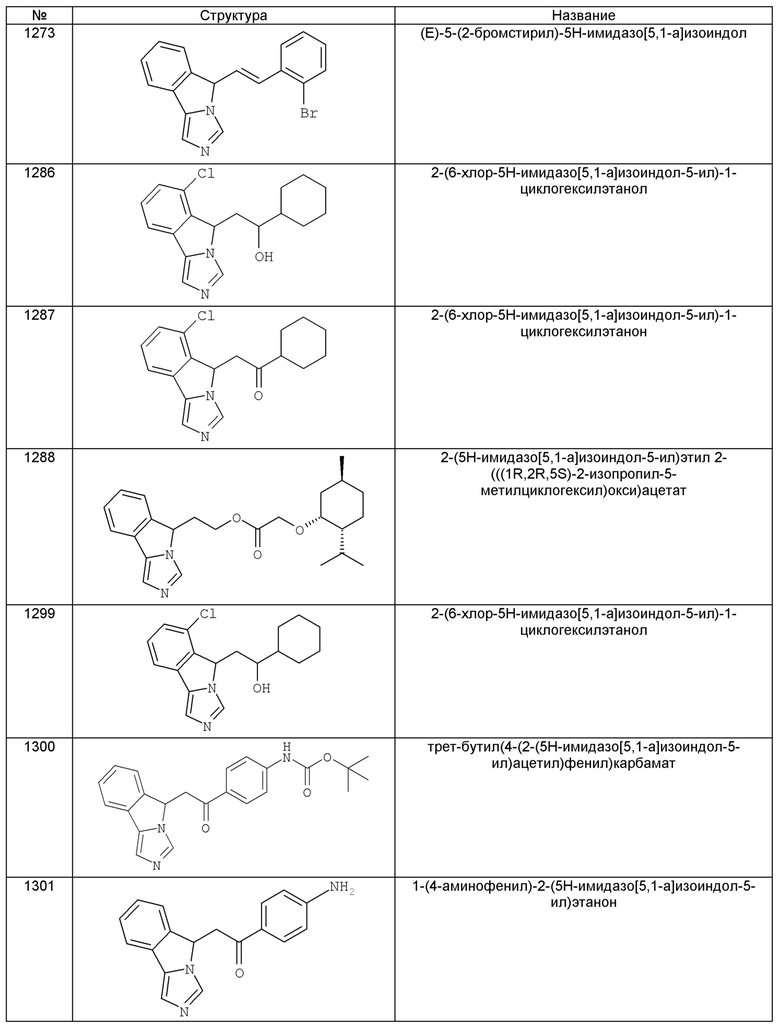
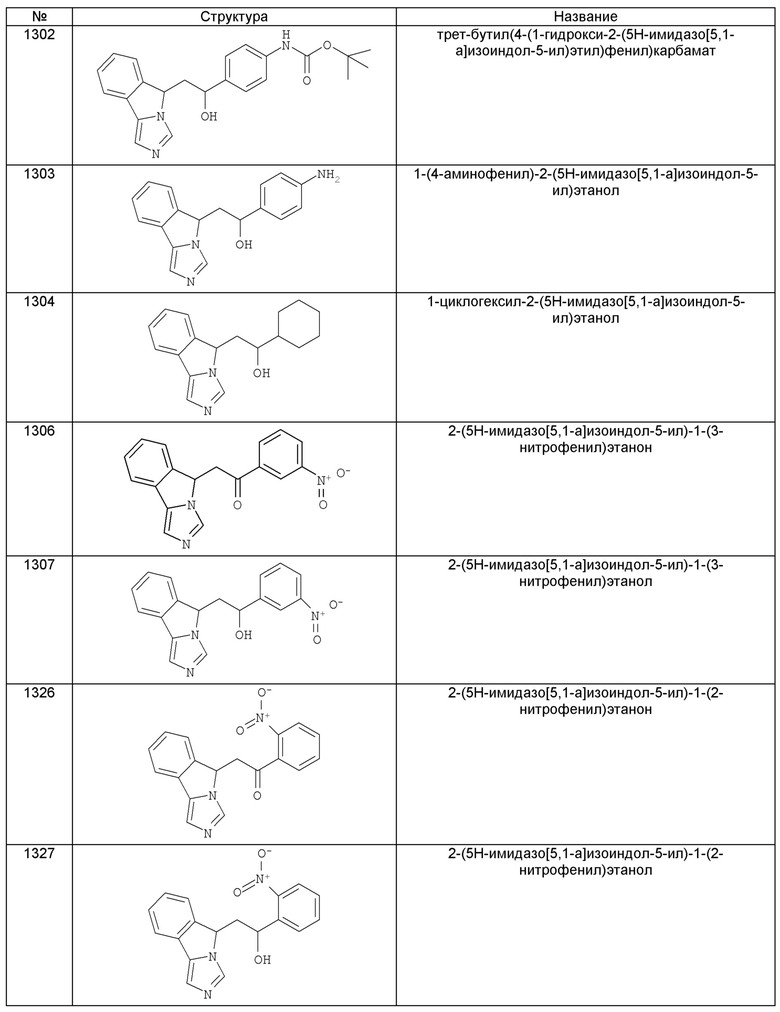
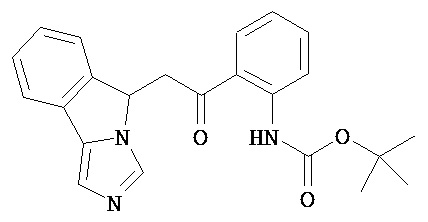
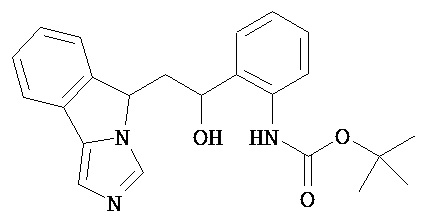
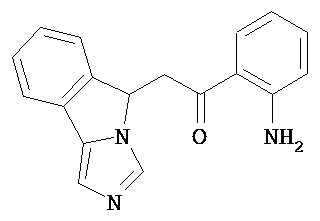
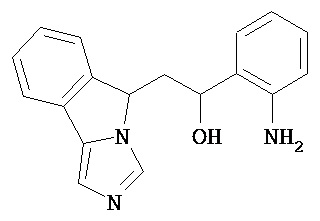
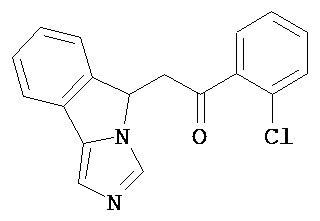
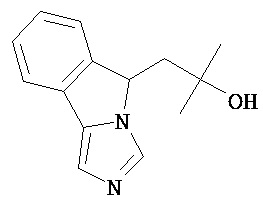
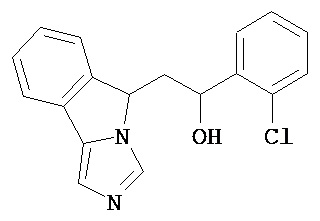
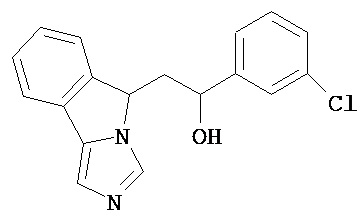
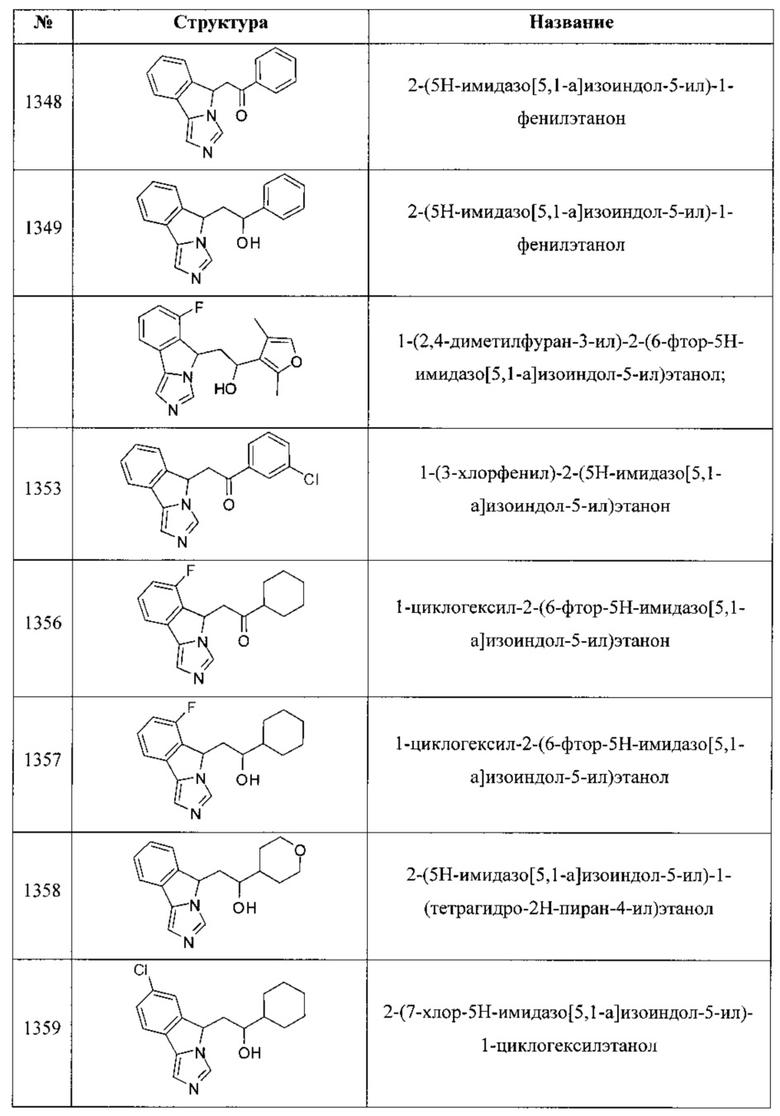
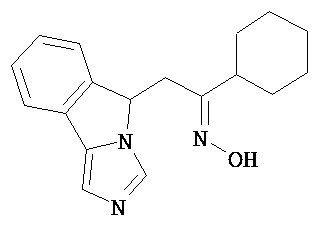
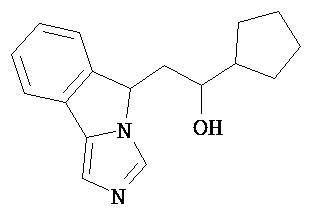
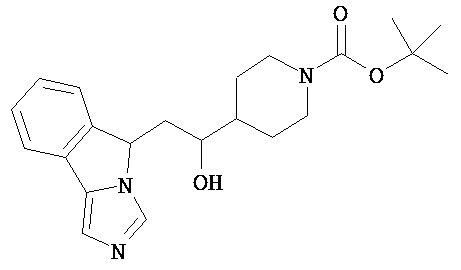
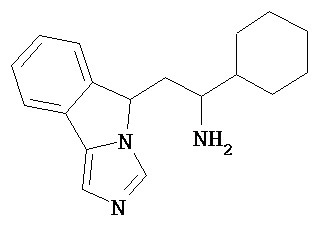
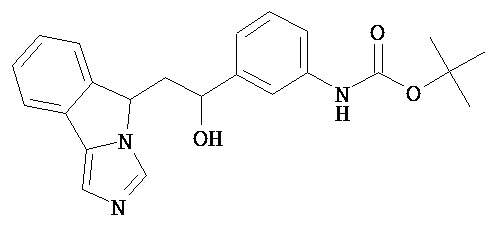
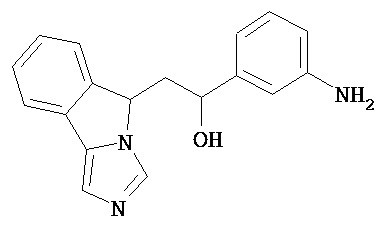
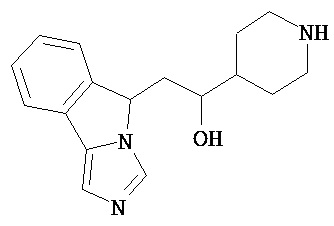
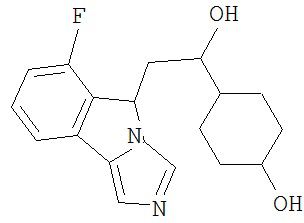
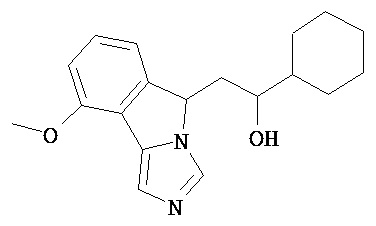
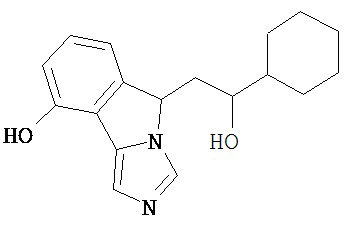
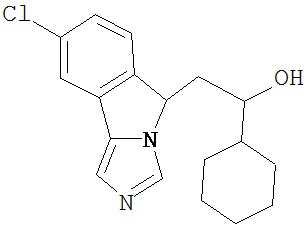
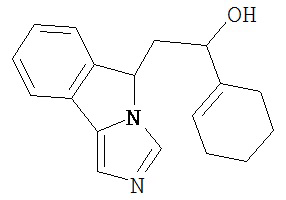
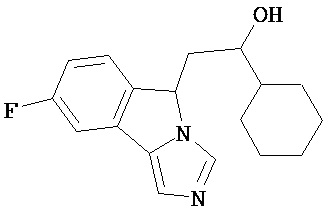
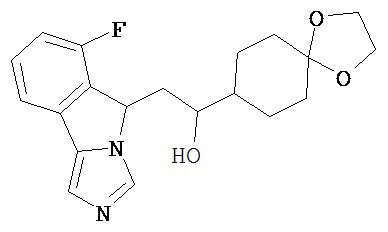
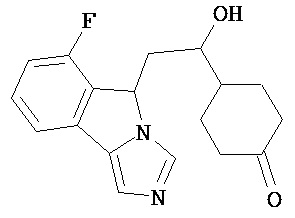
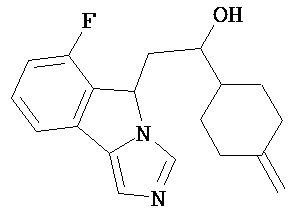
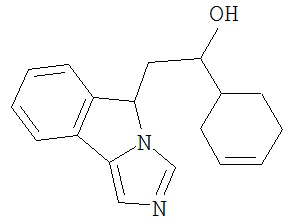
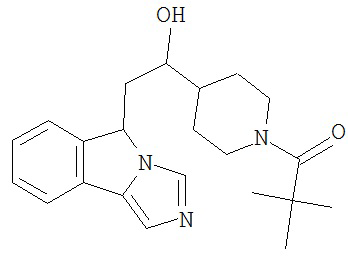
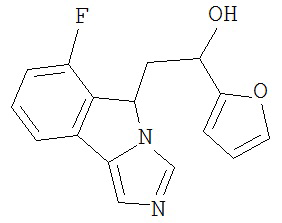
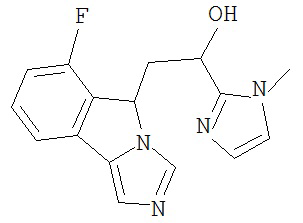
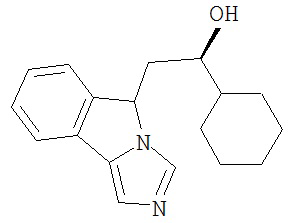
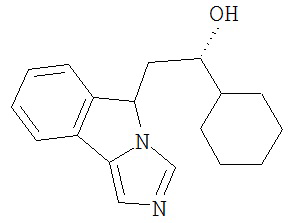
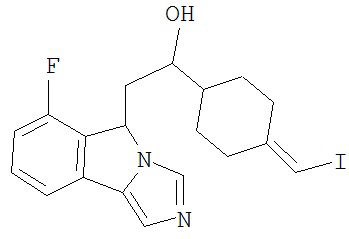
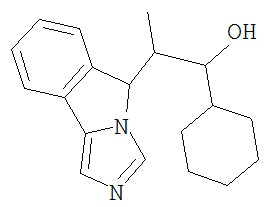
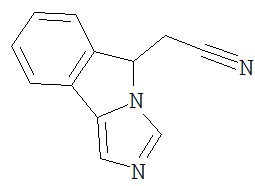
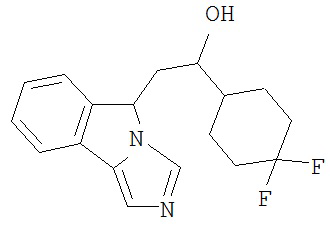
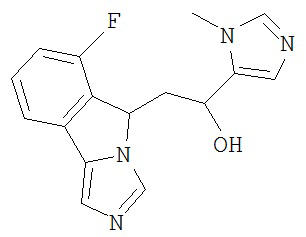
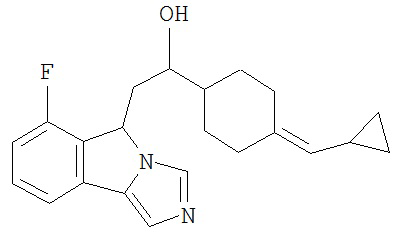
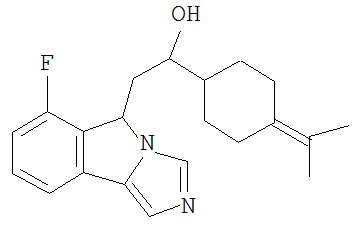
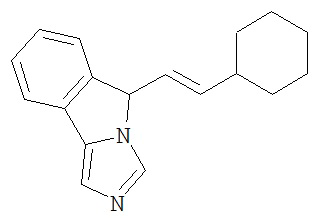
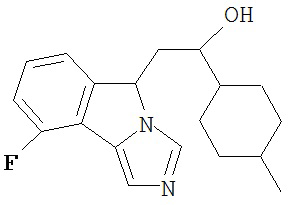
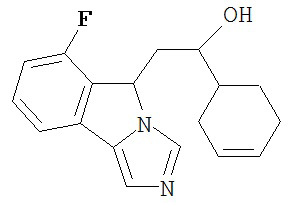
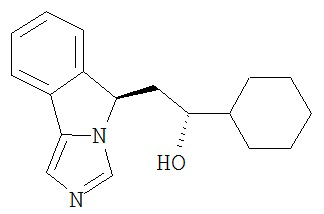
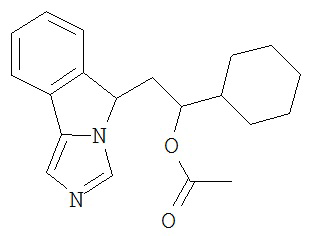
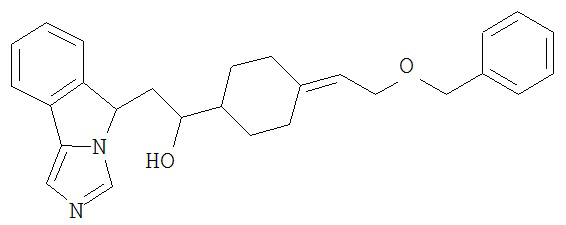
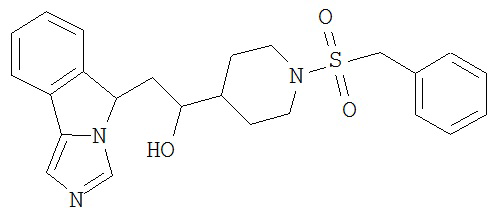
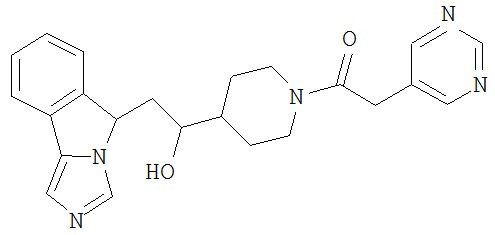
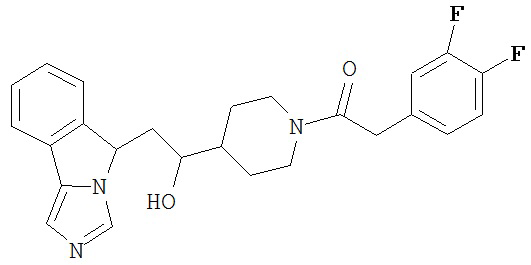
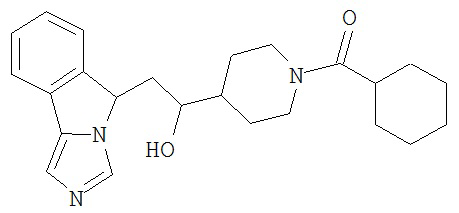
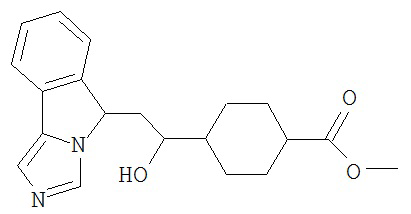
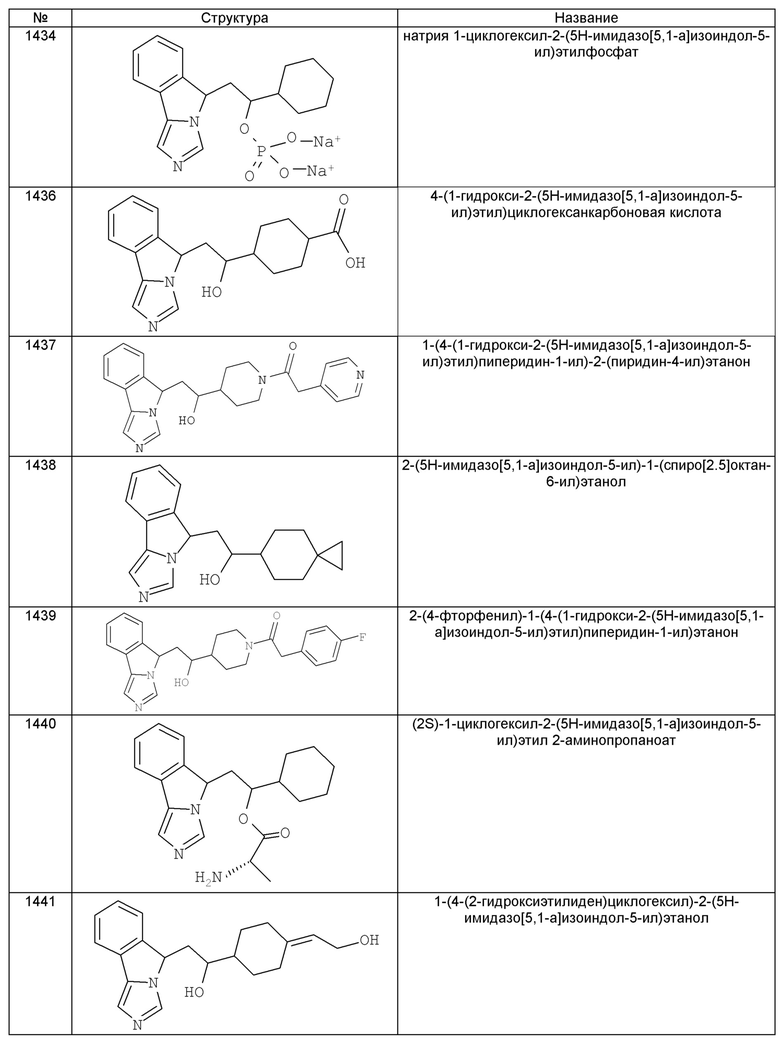
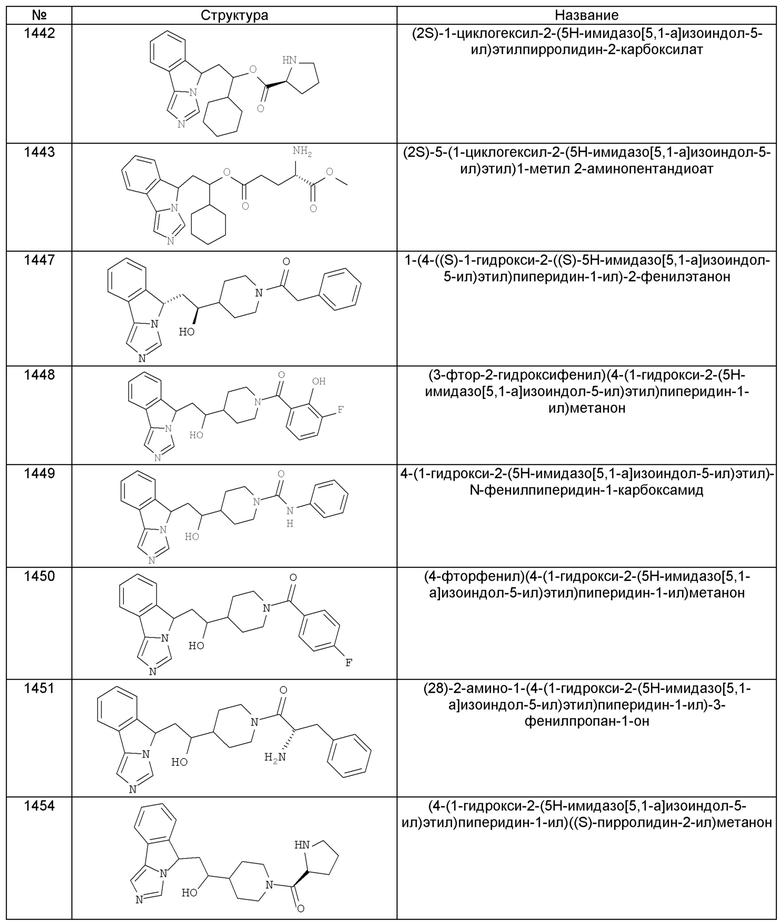
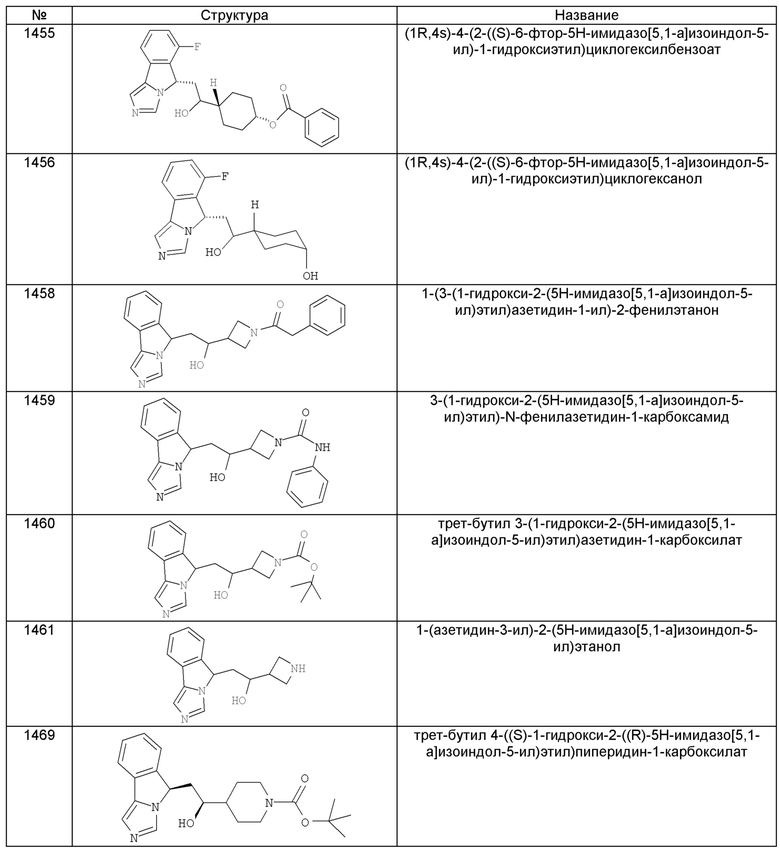
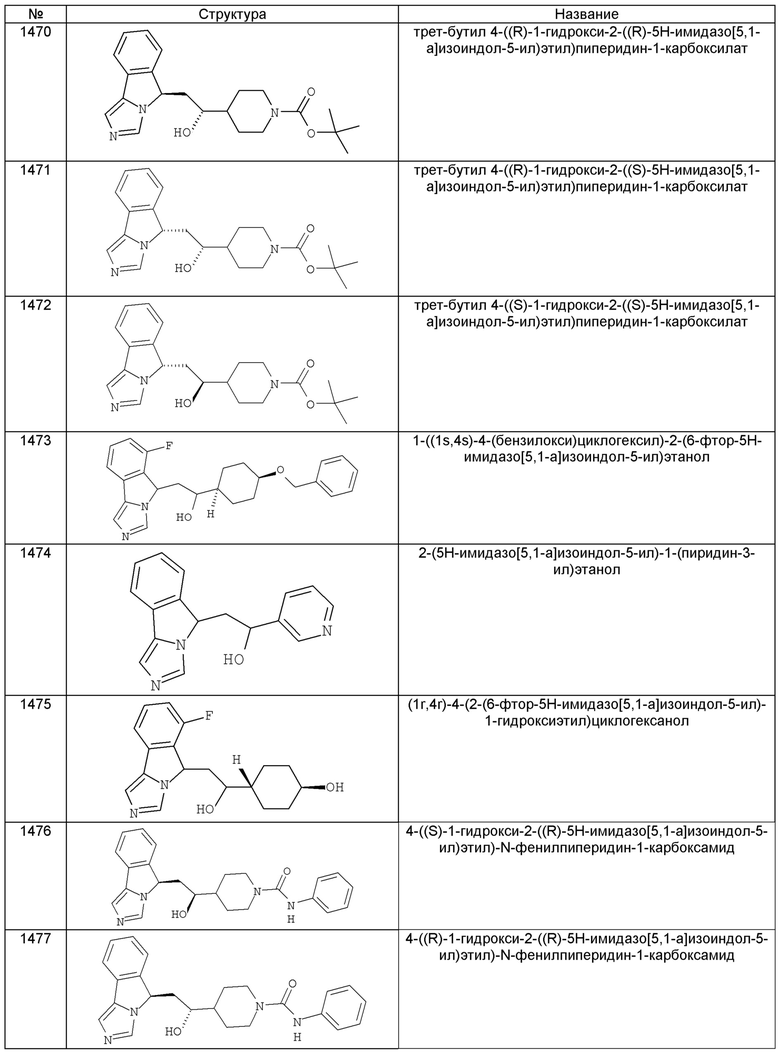
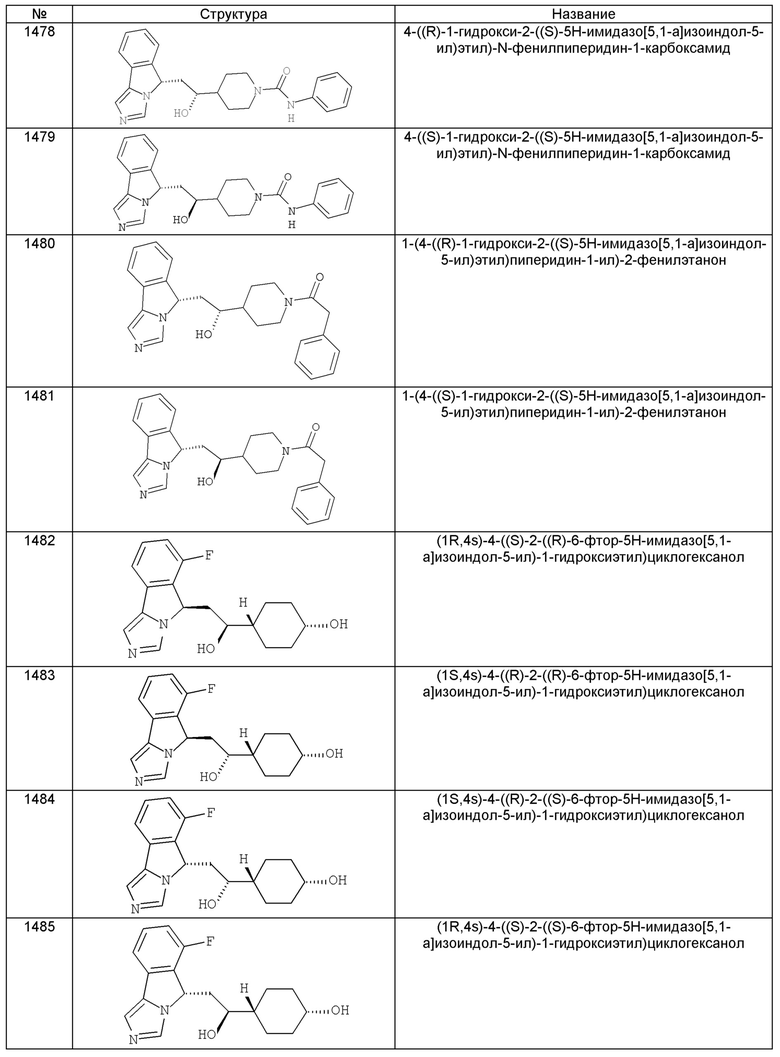
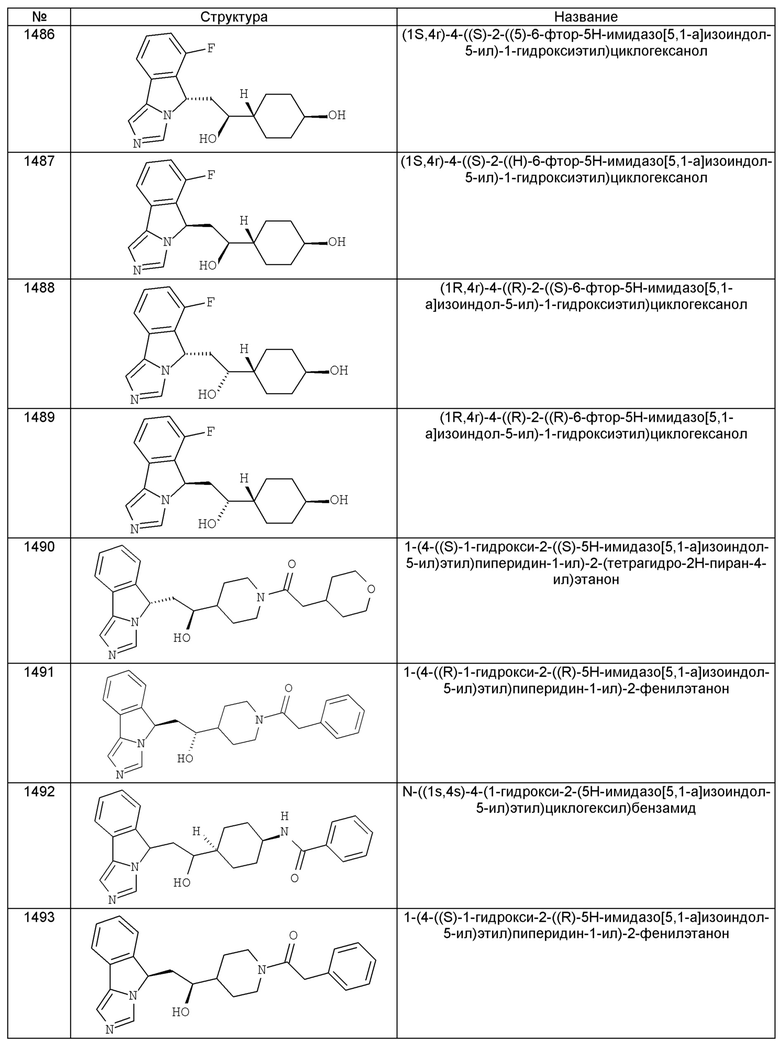
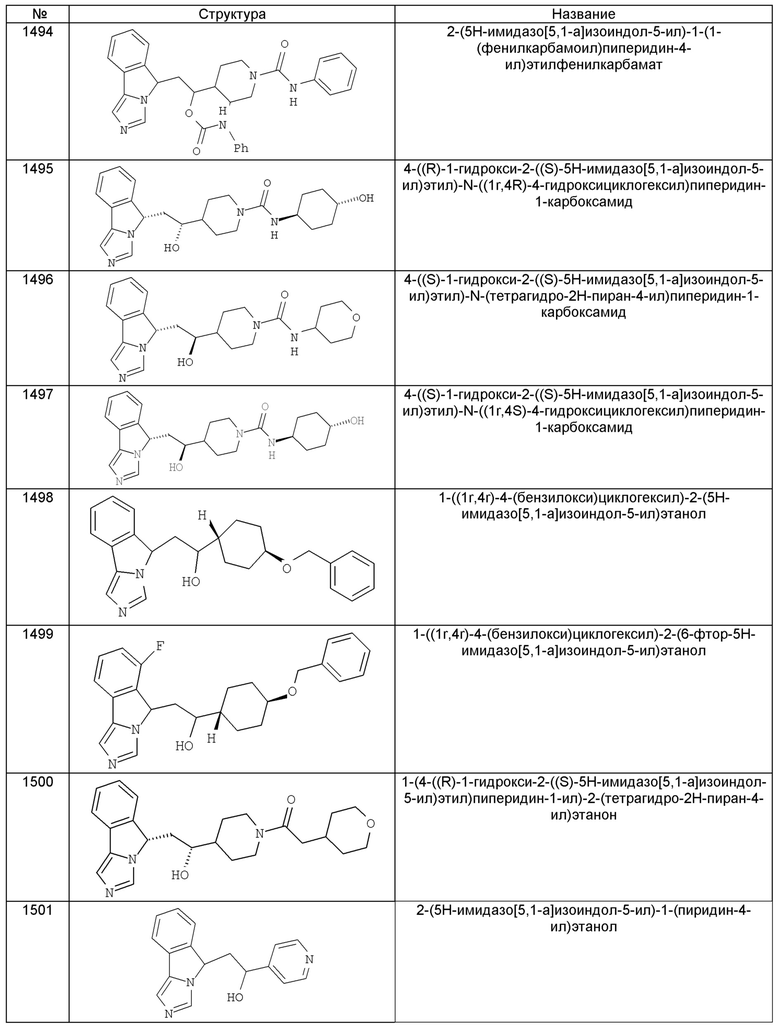
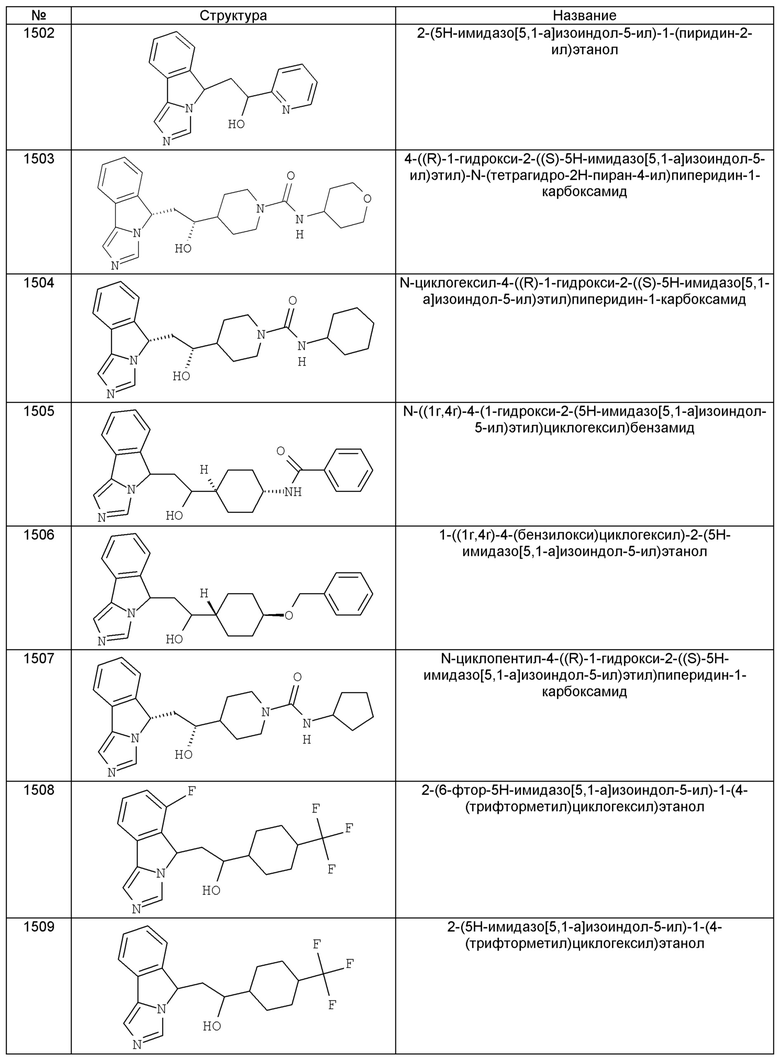
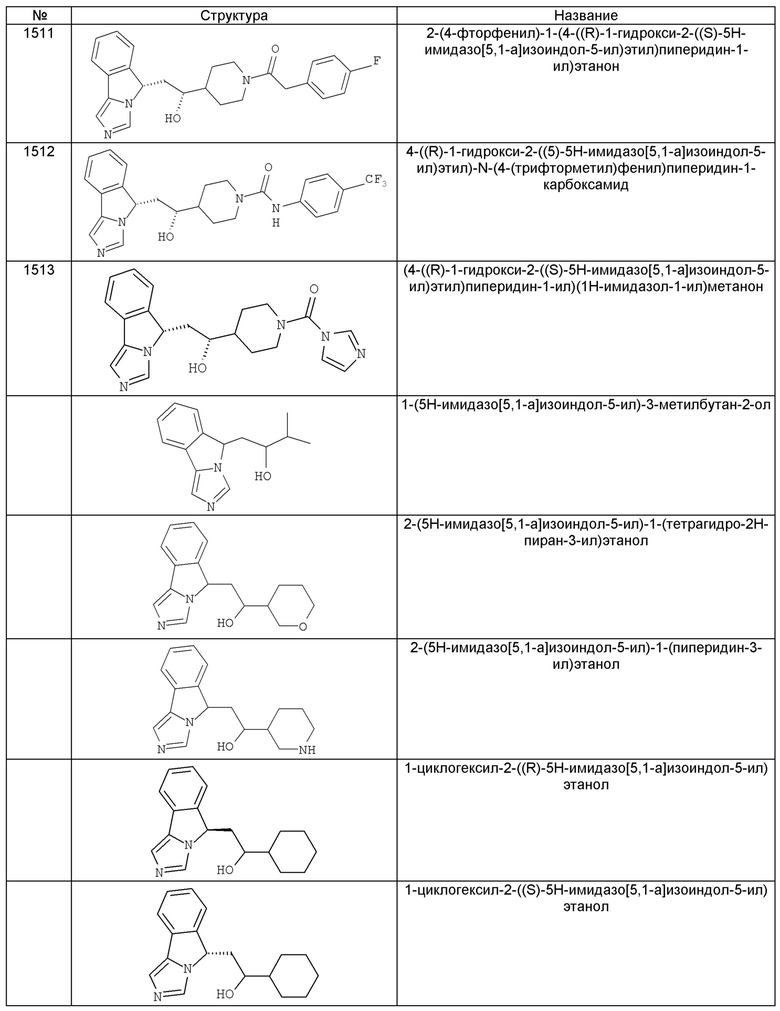
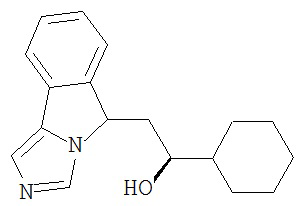
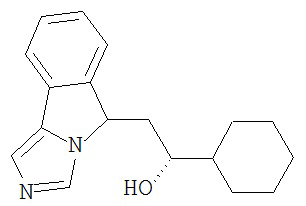
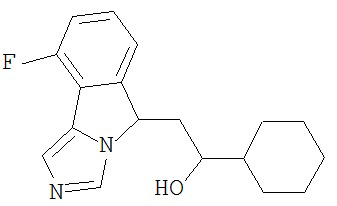
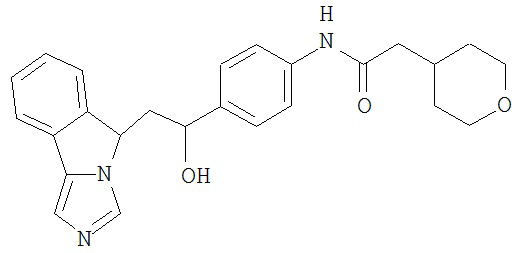
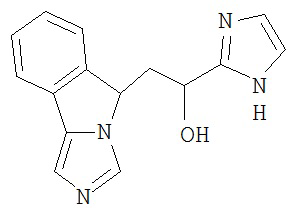
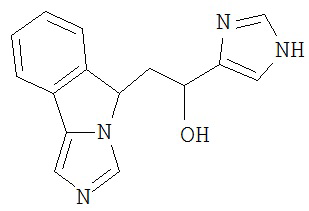
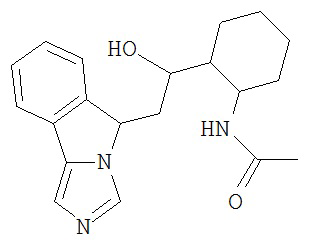
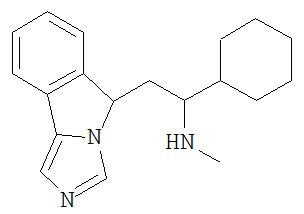
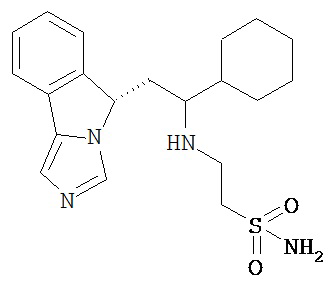
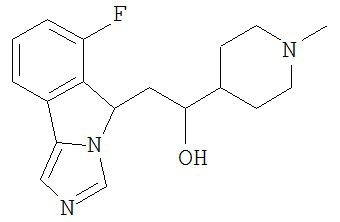
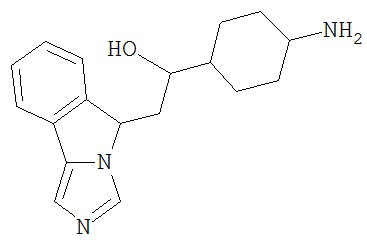
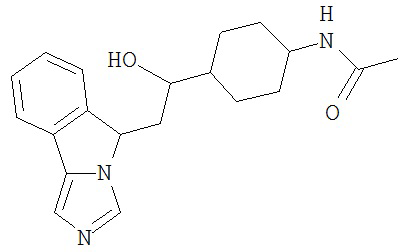
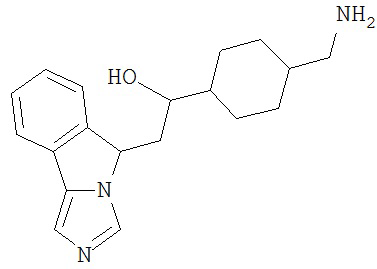
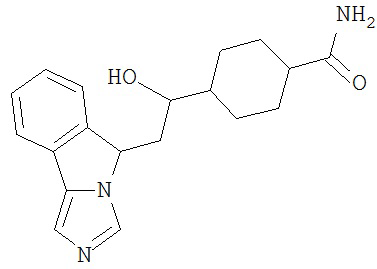
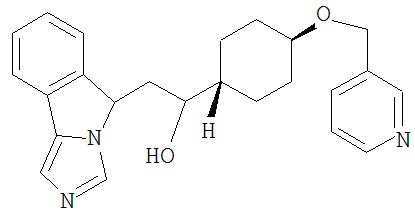
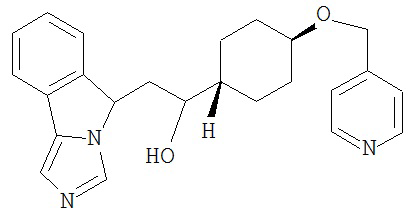
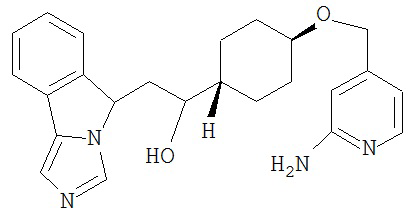
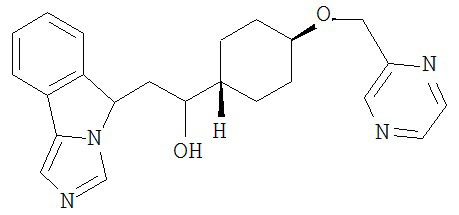
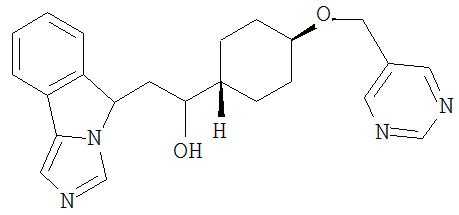
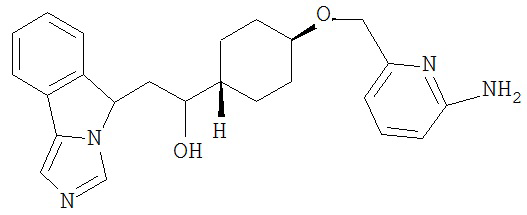
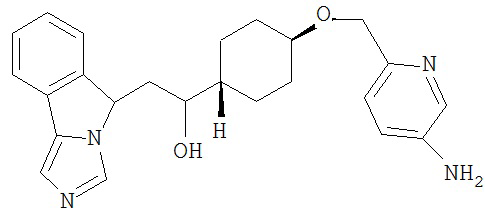
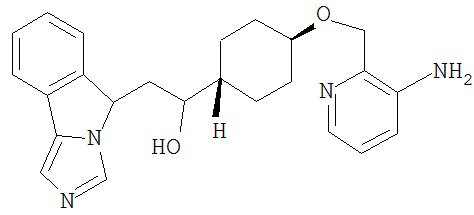
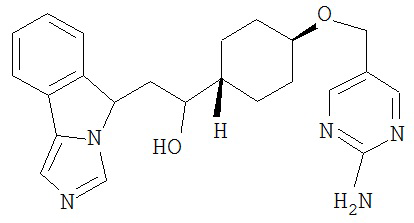
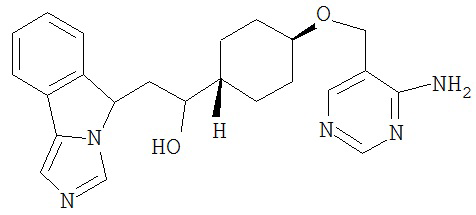
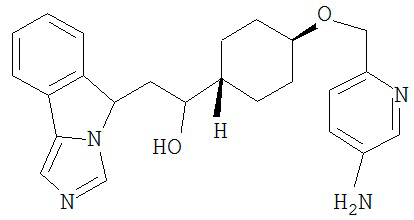
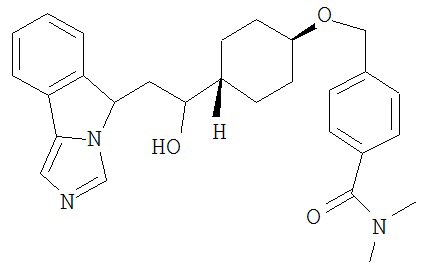
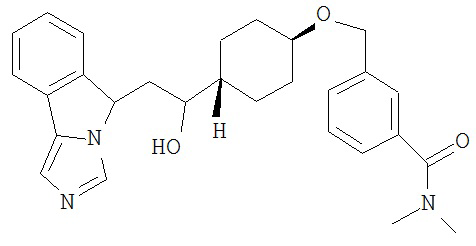
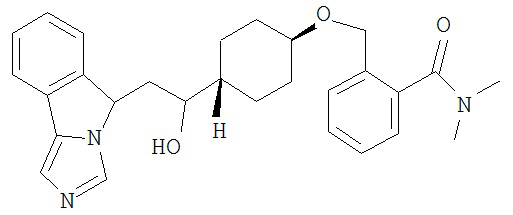
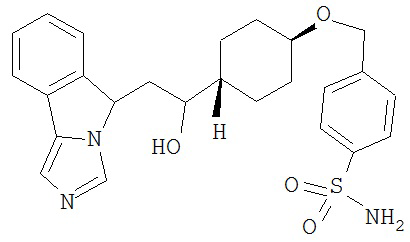
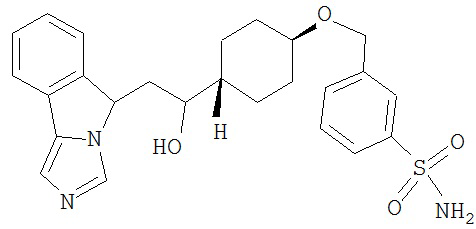
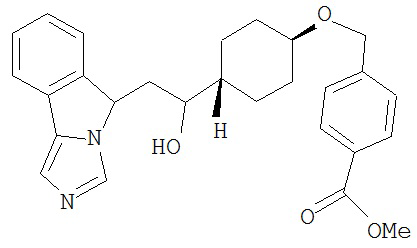
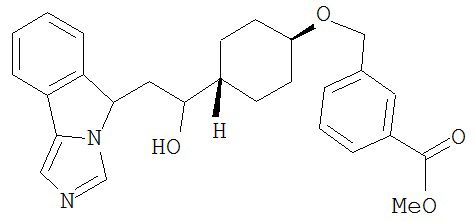
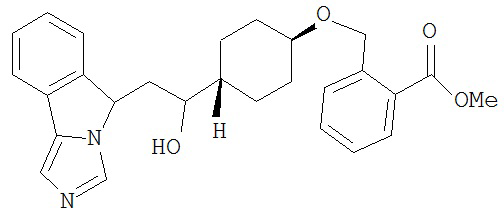
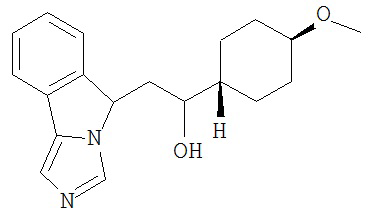
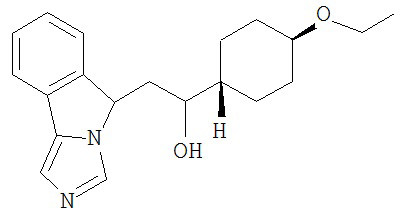
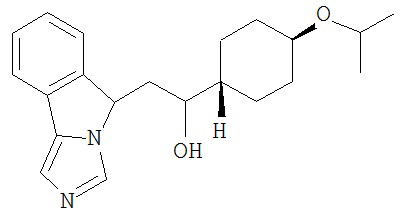
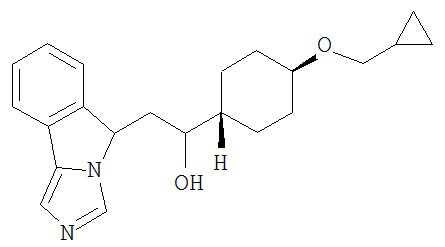
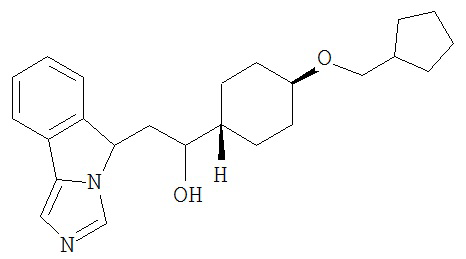
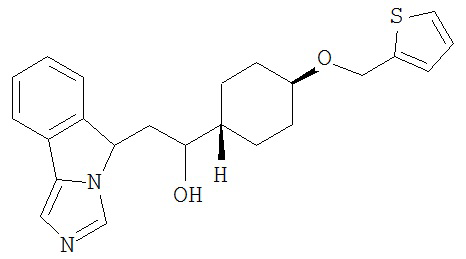
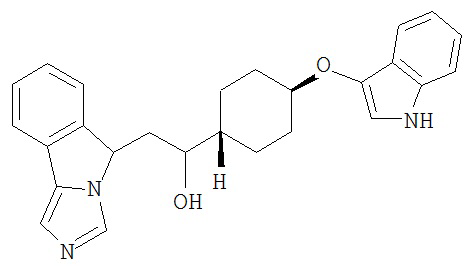
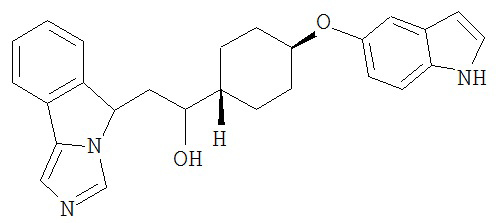
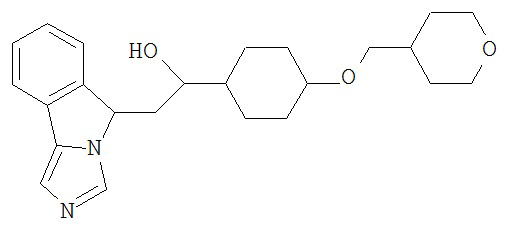
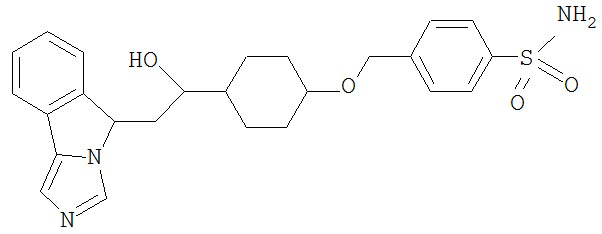
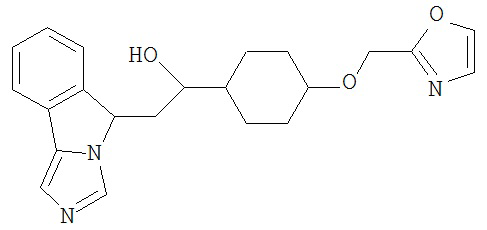
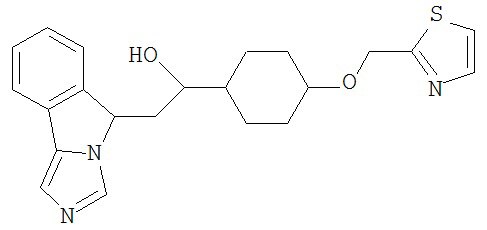
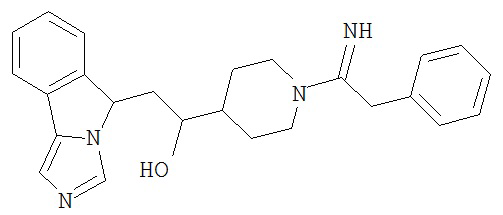
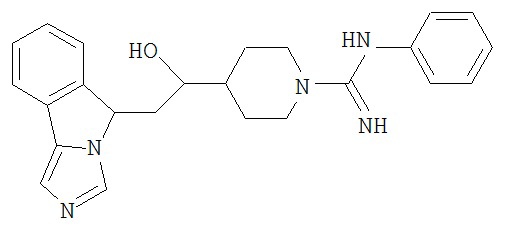
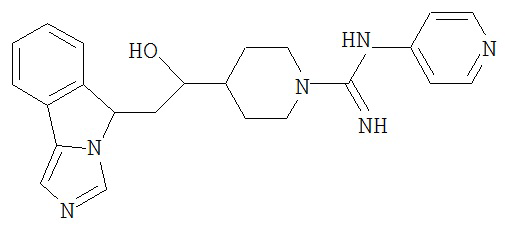
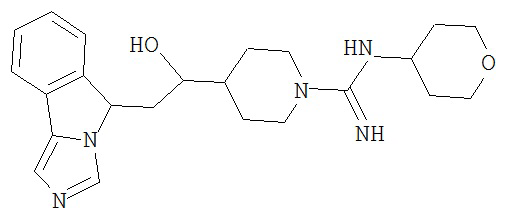
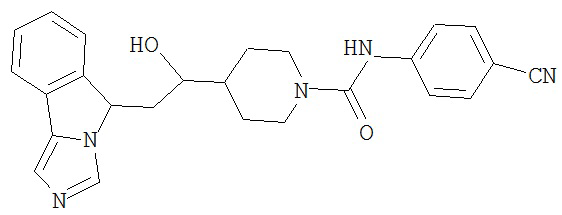
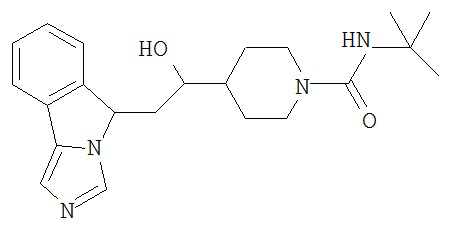
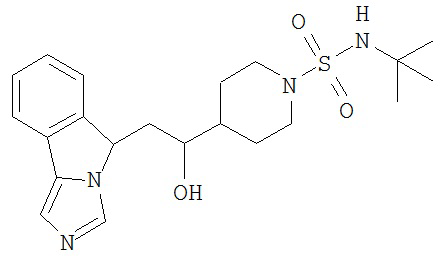
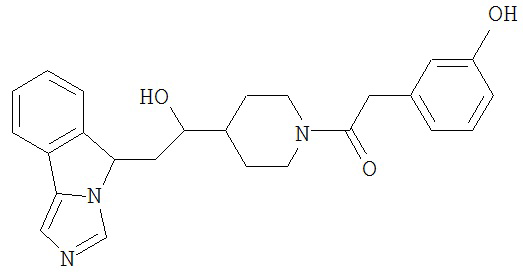
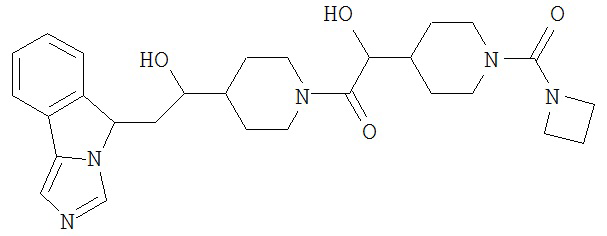
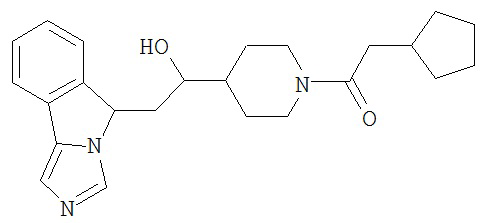
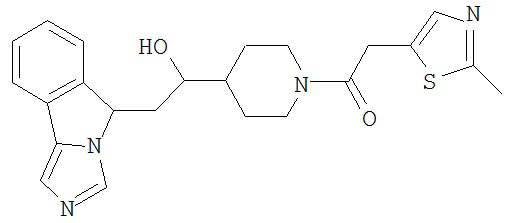

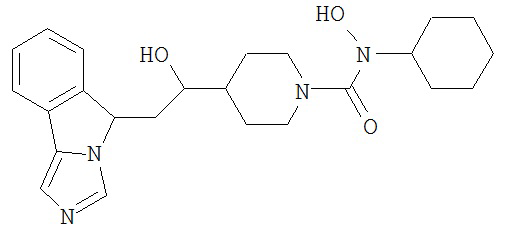
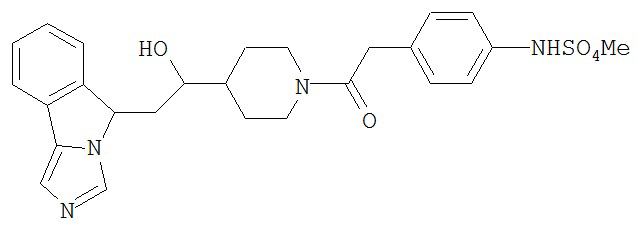
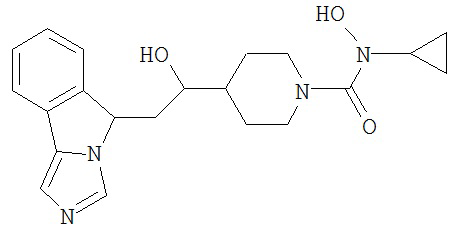
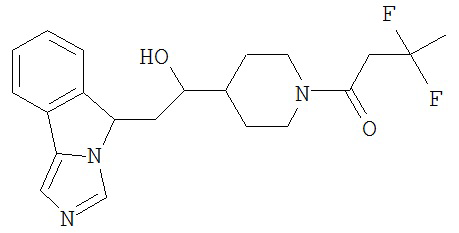
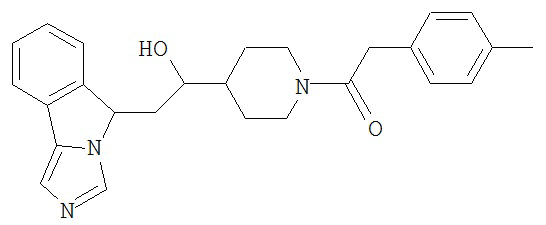
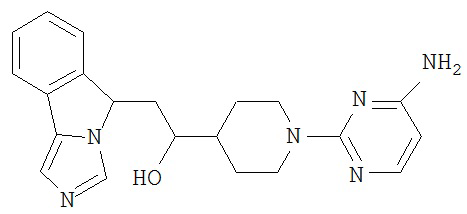
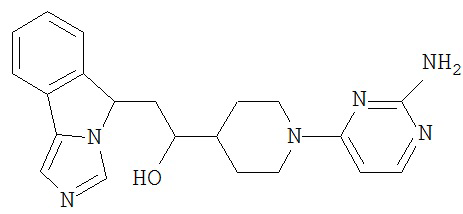
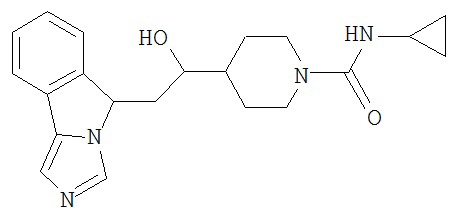
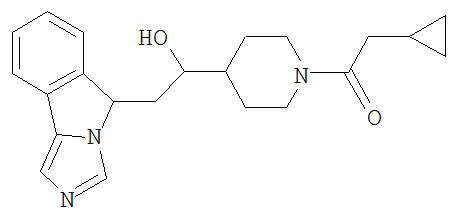
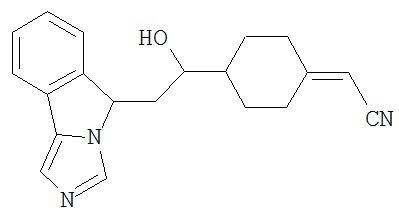
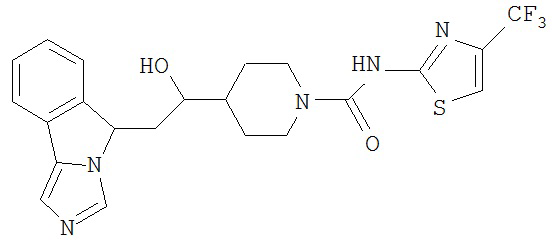
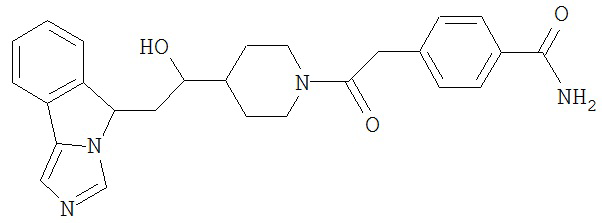
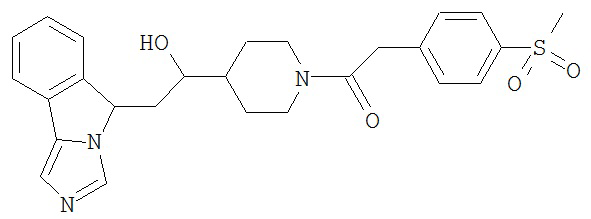
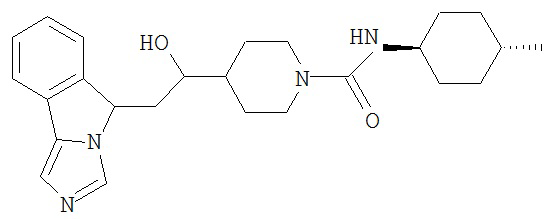
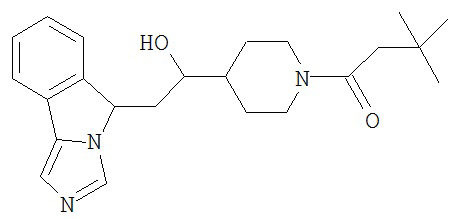
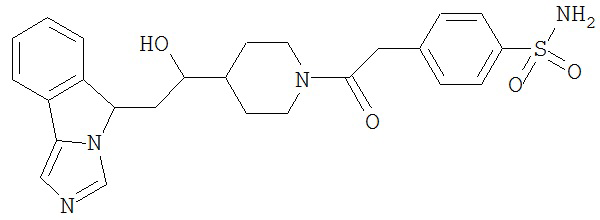
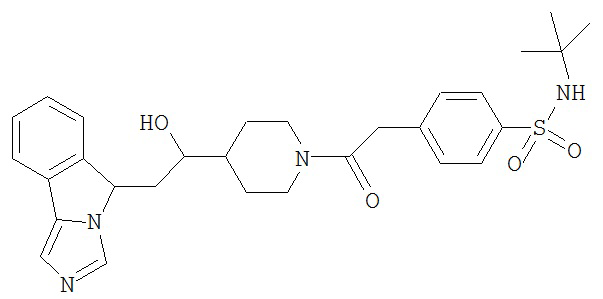
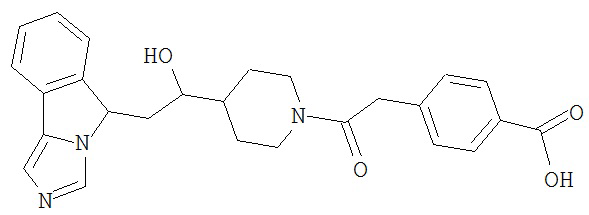
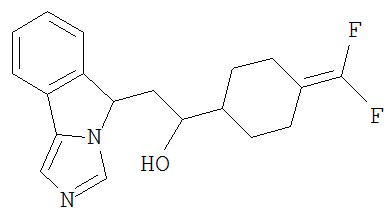
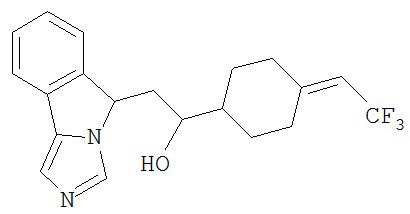
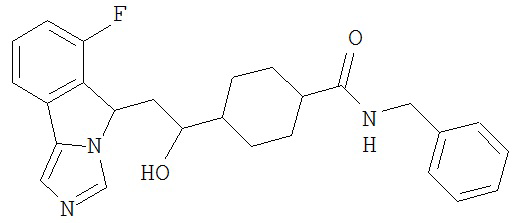
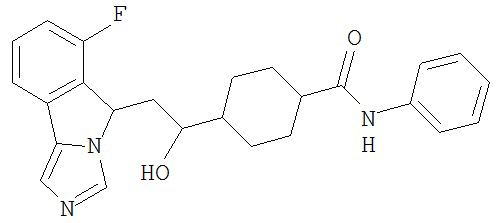
[0046] В другом аспекте настоящее изобретение предоставляет соединения и фармацевтические композиции, содержащие соединения согласно любому из представленных выше аспектов изобретения или любой его модификации, в том числе в комбинации с фармацевтически приемлемым вспомогательным веществом, растворителем или носителем.
[0047] В другом аспекте, изобретение предоставляет методы лечения опосредованной индоламин-2,3-диоксигеназой (ИДО) иммуносупрессии у нуждающихся в этом пациентов, предусматривающие введение эффективного в плане ингибирования индоламин-2,3-диоксигеназы количества соединения или фармацевтической композиции, согласно любому из представленных выше аспектов изобретения или любой его модификации.
[0048] В одном варианте иммуносупрессия вызвана инфекционным заболеванием или раком.
[0049] В другом варианте иммуносупрессия вызвана инфекционным заболеванием, а инфекционное заболевание является вирусной инфекцией, вызываемой вирусом из группы, включающей вирус гепатита С (ВГС), вирус папилломы человека (ВПЧ), цитомегаловирус (ЦМВ), вирус Эпштейна-Барр (ВЭБ), вирус полиомиелита, вирус ветряной оспы, вирус коксаки, вирус иммунодефицита человека (ВИЧ).
[0050] В другом варианте под иммуносупрессией подразумевается иммуносупрессия, вызванная инфекцией ВИЧ-1.
[0051] В другом варианте иммуносупрессия вызвана раком.
[0052] В одном варианте под иммуносупрессией подразумевается опухоль-специфическая иммуносупрессия, вызванная раком.
[0053] В другом варианте иммуносупрессия вызвана раком, который может представлять собой рак толстой кишки, поджелудочной железы, молочной железы, простаты, легких, мозга, яичников, шейки матки, семенников, почек, головы или шеи, а также лимфому, лейкемию или меланому.
[0054] В другом аспекте настоящее изобретение относится к использованию соединений, описанных в любом из указанных выше аспектов (или любой его модификации), с целью получения лекарственного препарата для лечения клинических состояний, при которых ингибирование ферментативной активности индоламин-2,3 диоксигеназы может оказывать благотворное влияние. Клинические состояния, рассматриваемые в данном аспекте, включают все описанные в данном документе состояния.
[0055] В другом аспекте настоящее изобретение относится к использованию соединений, описанных в любом из указанных выше аспектов (или любой его модификации), с целью получения лекарственного препарата для стимуляции пролиферации Т-клеток или восстановления иммунологического статуса при анергии или иммуносупрессия.
[0056] В одном варианте анергия или иммуносупрессия вызвана экспрессией фермента индоламин-2,3-диоксигеназы.
[0057] В другом аспекте настоящее изобретение относится к использованию соединений, описанных в любом из указанных выше аспектов (или в любом из его вариантов), с целью получения лекарственного препарата для лечения иммуносупрессии, вызванной раком, инфекционными заболеваниями или вирусными инфекциями.
[0058] В одном варианте настоящее изобретение относится к использованию соединений, описанных в любом из указанных выше аспектов (или в любом из его вариантов), с целью получения лекарственного препарата для лечения опухоль-специфичной иммуносупрессии, вызванной раком. В большинстве случаев рассматриваемые типы рака - это рак толстой кишки, поджелудочной железы, молочной железы, простаты, легких, мозга, яичников, шейки матки, семенников, почек, головы или шеи, лимфома, лейкемия, меланома и т.п.
[0059] В другом варианте настоящее изобретение относится к использованию соединений, описанных в любом из указанных выше аспектов (или в любом из его вариантов), с целью получения лекарственного препарата для лечения инфекционных заболеваний, когда инфекционное заболевание представляет собой вирусную инфекцию, вызываемую вирусом из группы, включающей вирус гепатита С (ВГС), вирус папилломы человека (ВПЧ), цитомегаловирус (ЦМВ), вирус Эпштейна-Барр (ВЭБ), вирус полиомиелита, вирус ветряной оспы, вирус коксаки, вирус иммунодефицита человека (ВИЧ).
Определения
[0060] Термины, используемые в настоящем документе, могут сопровождаться одиночной «-» или двойной «=» чертой, которые указываются до или после термина и обозначают тип связи между определенным заместителем и основной группой; одиночная черта обозначает одиночную связь, двойная черта - двойную связь или пару одиночных связей в случае спиро-заместителя. При отсутствии одиночной иди двойной черты следует считать, что между заместителем и основной группой образуется одиночная связь; кроме того, заместители должны читаться «слева направо» кроме случаев, когда наличие черты указывает на другой порядок чтения. Например, С1-С6алкоксикарбонилокси и -ОС(O)С1-С6алкил обозначают одну и ту же функциональную группу; аналогичным образом, арилалкил, арилалкил- и - алкиларил также обозначают одну функциональную группу.
[0061] Кроме того, некоторые термины, применяемые в настоящем документе, могут использоваться в виде моно- и бивалентно связанных радикалов, что должно быть понятно для специалистов в данной области науки, с указанием вида связи между двумя другими группами. Например, алкил-группа может быть и моновалентным и бивалентным радикалом, причем в последнем случае специалистам в данной области науки должно быть понятно, что дополнительный атом водорода удален из моновалентного алкил-радикала с целью получения соответствующего бивалентного остатка.
[0062] Термин «алкенил», используемый в настоящем документе, обозначает линейную или разветвленную углеводородную цепь, содержащую от 2 до 10 атомов углерода, если не указано иное, и содержащую по меньшей мере одну углерод-углеродную двойную связь. Типичные примеры алкенилов включают, но не ограничиваются перечисленным, этенил, 2-пропенил, 2-метил-2-пропенил, 3-бутенил, 4-пентенил, 5-гексенил, 2-гептенил, 2-метил-1-гептенил, 3-деценил и 3,7-диметилокта-2,6-диенил.
[0063] Термин «алкокси», используемый в настоящем документе, обозначает алкильную группу, согласно представленному в настоящем документе определению, присоединенную к остатку молекулы через атом кислорода. Типичные примеры алкокси-групп включают, но не ограничиваются перечисленным, метокси, этокси, пропокси, 2-пропокси, бутокси, трет-бутокси, пентилокси и гексилокси-группы.
[0064] Термин «алкил», используемый в настоящем документе, обозначает линейную или разветвленную углеводородную цепь, содержащую от 1 до 10 атомов углерода, если не указано иное. Типичные примеры алкенилов включают, но не ограничиваются перечисленным, метил, этил, n-пропил, изо-пропил, n-бутил, втор-бутил, изобутил, трет-бутил, n-пентил, изопентил, неопентил, n-гексил, 3-метилгексил, 2,2-диметилпентил, 2,3-диметилпентил, n-гептил, n-октил, n-нонил и n-децил. Если группа «алкил» представляет собой группу, связывающую два других остатка, она также может быть прямой или разветвленной цепью; примеры включают, но не ограничиваются
перечисленным, -СН2-, -СН2СН2-, -СН2СН2СНС(СН3)-, -СН2СН(СН2СН3)СН2-.
[0065] Термин «арил», используемый в настоящем документе, обозначает фенил (т.е. моноциклический арил), ароматическую бициклическую кольцевую систему, содержащую, по меньшей мере, одно фенильное кольцо или бициклическое ароматическое кольцо, содержащее в ароматической бициклической кольцевой системе только атомы углерода. Примерами бициклического арила могут быть азуленил, нафтил или фенил, сконденсированный в моноциклический циклоалкил, моноциклический циклоалкенил или моноциклический гетероциклил. Бициклический арил присоединен к остатку основной молекулы через любой атом углерода, содержащийся в фениле бициклической системы, или любой атом углерода в кольце нафтила или азуленила. Конденсированный моноциклический циклоалкил или моноциклический гетероциклил бициклического арила могут быть необязательно замещены одной или двумя оксо- и (или) тиа-группами. Типичные примеры арилов включают, но не ограничиваются перечисленным, азуленил, нафтил, дигидроинден-1-ил, дигидроинден-2-ил, дигидроинден-3-ил, дигидроинден-4-ил, 2,3-дигидроиндол-4-ил, 2,3-дигидроиндол-5-ил, 2,3-дигидроиндол-6-ил, 2,3-дигидроиндол-7-ил, инден-1-ил, инден-2-ил, инден-3-ил, инден-4-ил, дигидронафталин-2-ил, дигидронафталин-3-ил, дигидронафталин-4-ил, дигидронафталин-1-ил, 5,6,7,8-тетрагидронафталин-1-ил, 5,6,7,8-тетрагидронафталин-2-ил, 2,3-дигидробензофуран-4-ил, 2,3-дигидробензофуран-5-ил, 2,3-дигидробензофуран-6-ил, 2,3-дигидробензофуран-7-ил, бензо[d][1,3]диоксол-4-ил, бензо[d][1,3]диоксол-5-ил, 2Н-хромен-2-он-5-ил, 2Н-хромен-2-он-6-ил, 2Н-хромен-2-он-7-ил, 2Н-хромен-2-он-8-ил, изоиндолин-1,3-дион-4-ил, изоиндолин-1,3-дион-5-ил, инден-1-он-4-ил, инден-1-он-5-ил, инден-1-он-6-ил, инден-1-он-7-ил, 2,3-дигидробензо[b][1,4]диоксан-5-ил, 2,3-дигидробензо[b][1,4]диоксан-6-ил, 2Н-бензо[b][1,4]оксазин3(4Н)-он-5-ил, 2Н-бензо[b][1,4]оксазин3(4Н)-6-ил, 2Н-бензо[b][1,4]оксазин3(4Н)-он-7-ил, 2Н-бензо[b][1,4]оксазин3(4Н)-он-8-ил, бензо[d]оксазин-2(3H)-он-5-ил, бензо[d]оксазин-2(3H)-он-6-ил, бензо[d]оксазин-2(3H)-он-7-ил, бензо[d]оксазин-2(3H)-он-8-ил, хиназолин-4(3H)-он-5-ил, хиназолин-4(3H)-он-6-ил, хиназолин-4(3H)-он-7-ил, хиназолин-4(3H)-он-8-ил, хиноксалин-2(1Н)-он-5-ил, хиноксалин-2(1Н)-он-6-ил, хиноксалин-2(1Н)-он-7-ил, хиноксалин-2(1Н)-он-8-ил, бензо[d]тиазол-2(3H)-он-4-ил, бензо[d]тиазол-2(3H)-он-5-ил, бензо[d]тиазол-2(3H)-он-6-ил и бензо[d]тиазол-2(3H)-он-7-ил. В некоторых вариантах бициклический арил представляет собой (i) нафтилов или (ii) фенильных колец, сконденсированных в 5 или 6-членный моноциклический циклоалкил, 5-6-членный моноциклический циклоалкенил или 5-6- членный моноциклический гетероциклил, где конденсированный циклоалкил, циклоалкенил и гетероциклил могут необязательно быть замещены одной или двумя оксо- или тиа-группами, выбранными независимым образом.
[0066] Термины «арилалкил», «-алкиларил» и «арилалкил-», используемые в настоящем документе, обозначают уже описанную выше группу арил, присоединенную к остатку молекулы через группу описанную группу алкил. Типичные примеры арилалкилов включают, но не ограничиваются перечисленным, бензил, 2-фенилэтил, 3-фенилпропил и 2-нафт-2-илэтил.
[0067] Термины «циан» и «нитрил», используемые в настоящем документе, обозначают группу -CN.
[0068] Термин «циклоалкил», используемый в настоящем документе, обозначает моноциклическую или бициклическую циклоалькильную кольцевую систему. Моноциклические кольцевые системы - это циклические углеводородные группы, содержащие от 3 до 8 атомов углерода; такие группы могут быть насыщенными или ненасыщенными, но при этом не являются ароматическими. В некоторых вариантах циклоалкильные группы являются полностью насыщенными. Типичные примеры моноциклических циклоалкилов включают циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил и циклооктил. Бициклические циклоалкильные кольцевые системы представляют собой мостиковые моноциклические кольца или конденсированные бициклические кольца. Мостиковые моноциклические кольца содержат моноциклическое циклоалкильное кольцо, в котором два, не являющихся соседними, атома углерода связаны алкиленовым мостиком из одного-трех дополнительных атомов углерода (т.е. соединяющая группа представляет собой группу вида -(CH2)W-, где w принимает значения 1, 2 или 3). Типичные примеры бициклических кольцевых систем включают, но не ограничиваются перечисленным, бицикло [3.1.1] гептан, бицикло[2.2.1]гептан, бицикло[2.2.2]октан, бицикло[3.2.2]нонан, бицикло[3.3.1]нонан и бицикло[4.2.1]нонан. Конденсированные бициклические циклоалкильные кольцевые системы содержат моноциклическое циклоалкильное кольцо, сконденсированное по выбору с фенилом, моноциклическим циклоалкилом, моноциклическим циклоалкенилом, моноциклическим гетероциклилом или моноциклическим гетероарилом. Мостиковый или конденсированный бициклический циклоалкил присоединяется к остатку основной молекулы через любой атом углерода, содержащийся в кольце моноциклического циклоалкила. Циклоалкильные группы могут необязательно быть замещены одной или двумя оксо- или тиа-группами, выбранными независимым образом. В некоторых вариантах конденсированный бициклический циклоалкил представляет собой 5- или 6-членное моноциклическое циклоалкильное кольцо, сконденсированное по выбору с фенилом, 5- или 6-членным моноциклическим циклоалкилом, 5- или 6-членным моноциклическим циклоалкенилом, 5- или 6-членным моноциклическим гетероциклилом или 5-6-членный моноциклическим гетероарилом, конденсированный бициклический циклоалкил может необязательно быть замещен одной или двумя оксо- или тиа-группами, выбранными независимым образом.
[0069] Термин «циклоалкенил», используемый в настоящем документе, обозначает моноциклическую или бициклическую циклоалкенильную кольцевую систему. Моноциклические кольцевые системы - это циклические углеводородные группы, содержащие от 3 до 8 атомов углерода; такие группы являются ненасыщенными (т.е. содержат в кольце, по меньшей мере, одну углерод-углеродную двойную связь), но не являются ароматическими. Типичные примеры моноциклических кольцевых систем включают циклопентенил и циклогексенил. Бициклические циклоалкенильные кольца представляют собой мостиковые моноциклические кольца или конденсированные бициклические кольца. Мостиковые моноциклические кольца содержат моноциклическое циклоалкенильное кольцо, в котором два, не являющихся соседними, атома углерода связаны алкиленовым мостиком из одного-трех дополнительных атомов углерода (т.е. соединяющая группа представляет собой группу вида -(CH2)W-, где w принимает значения 1, 2 или 3). Типичные примеры бициклических циклоалкенилов включают, но не ограничиваются перечисленным, норборненил и бицикло[2.2.2]окт-2-енил. Бициклические циклоалкенильные кольцевые системы содержат моноциклическое циклоалкенильное кольцо, сконденсированное по выбору с фенилом, моноциклическим циклоалкилом, моноциклическим циклоалкенилом, моноциклическим гетероциклилом или моноциклическим гетероарилом. Мостиковый или конденсированный бициклический циклоалкил присоединяется к остатку основной молекулы через любой атом углерода, содержащийся в кольце моноциклического циклоалкенила. Циклоалкенильные группы могут необязательно быть замещены одной или двумя оксо- или тиа-группами, выбранными независимым образом.
[0070] Термин «гало» или «галоген», используемый в настоящем документе, обозначает группы -Cl, -Br, -I или -F.
[0071] Термин «галоалкил», используемый в настоящем документе, обозначает по крайней мере один галоген, согласно представленному здесь определению, присоединенный к остатку основной молекулы через группу алкил, согласно представленному здесь определению. Типичные примеры галоалкилов включают, но не ограничиваются перечисленным, хлорметил, 2-фторэтил, трифторметил, пентафторэтил и 2-хлор-3-фторпентил.
[0072] Термин «гетероарил», используемый в настоящем документе, обозначает моноциклический гетероарил или бициклическую кольцевую систему, содержащую по меньшей мере одно гетероароматическое кольцо. Моноциклический гетероарил может представлять собой 5- или 6-членное кольцо. 5-членное кольцо содержит две двойные связи и один, два, три или четыре атома азота и необязательным образом один атом кислорода или серы. 6-членное кольцо содержит три двойные связи и один, два, три или четыре атома азота. 5- или 6-членный гетероарил присоединен к остатку основной молекулы через любой атом углерода или любой атом азота гетероарила. Типичные примеры моноциклического гетероарила включают, но не ограничиваются перечисленным, фурил, имидазолил, изоксазолил, изотиазолил, оксадиазолил, оксазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, пиразолил, пирролил, тетразолил, тиадиазолил, тиазолил, тиенил, триазолил и триазинил. Бициклический гетероарил состоит из моноциклического гетероарила, сконденсированного по выбору с фенилом, моноциклическим циклоалкилом, моноциклическим циклоалкенилом, моноциклическим гетероциклилом или моноциклическим гетероарилом. Конденсированная циклоалкильная или гетероциклильная часть бициклической гетероарильной группы могут необязательно быть замещены одной или двумя оксо- или тиа-группами, выбранными независимым образом. Если бициклический гетероарил содержит конденсированное циклоалкильное, циклоалкенильное или гетероциклильное кольцо, тогда бициклическая гетероарильная группа присоединена к остатку основной молекулы через любой атом углерода или атом азота моноциклического гетероарильного фрагмента бициклической кольцевой системы. Если бициклический гетероарил представляет собой моноциклический гетероарил, сконденсированный с фенильным кольцом или моноциклическим гетероарилом, тогда бициклическая гетероарильная группа присоединена к остатку основной молекулы через любой атом углерода или атом азота бициклической кольцевой системы. Типичные примеры бициклических гетероарилов включают, но не ограничиваются перечисленным, бензимидазолил, бензофуранил, бензотиенил, бензоксадиазолил и бензоксатиадиазолил, бензотиазолил, циннолинил, 5,6-дигидрохинолин-2-ил, 5,6-дигидроизохинолин-1-ил, фуропиридинил, индазолил, индолил, изохинолинил, нафтиридинил, хинолинил, пуринил, 5,6,7,8-тетрагидрохинолин-2-ил, 5,6,7,8-тетрагидрохинолин-3-ил, 5,6,7,8-тетрагидрохинолин-4-ил, 5,6,7,8 тетрагидроизохинолин-1-ил, тиенопиридинил, 4,5,6,7-тетрагидробензо[с][1,2,5]оксадиазолил и 6,7-дигидробензо[с][1,2,5]оксадиазол-4(5Н)-онил. В некоторых вариантах конденсированный бициклический гетероарил представляет собой 5- или 6-членное моноциклическое гетероарильное кольцо, сконденсированное по выбору с фенилом, 5- или 6-членным моноциклическим циклоалкилом, 5- или 6-членным моноциклическим циклоалкенилом, 5- или 6-членным моноциклическим гетероциклилом или 5-6-членным моноциклическим гетероарилом, в котором конденсированный циклоалкил, циклоалкенил и гетероциклил необязательно могут быть замещены одной или двумя оксо- или тиа-группами, выбранными независимым образом.
[0073] Термин «гетероарилалкил» и «-алкилгетероарил», используемый в настоящем документе, обозначает гетероарил, согласно представленному здесь определению, присоединенный к остатку основной молекулы через группу алкил, согласно представленному здесь определению. Типичные примеры гетероарилалкилов включают, но не ограничиваются перечисленным, фур-3-илметил, 1Н-имидазол-2-илметил, 1Н-имидазол-4-илметил, 1-(пиридин-4-ил)этил, пиридин-3-илметил, пиридин-4-илметил, пиримидин-5-илметил, 2-(пиримидин-2-ил)пропил, тиен-2-илметил и тиен-3-илметил.
[0074] Термин «гетероциклил», используемый в настоящем документе, обозначает моноциклический гетероцикл или бициклический гетероцикл. Моноциклический гетероцикл представляет собой 3, 4, 5, 6 или 7-членное кольцо, содержащее по меньшей мере один гетероатом, независимо выбранный из группы, включающей О, N и S, при этом кольцо может быть насыщенным или ненасыщенным, но не является ароматическим. 3 или 4-членное кольцо содержит 1 гетероатом, выбранный из группы, включающей О, N и S. 5-членное кольцо может содержать ноль или одну двойную связь и один, два или три гетероатома, выбранных из группы, включающей О, N и S. 6- или 7-членное кольцо содержит ноль, одну или две двойные связи и один, два или три гетероатома, выбранных из группы, включающей О, N и S. Моноциклический гетероцикл присоединен к остатку основной молекулы через любой атом углерода или азота, содержащийся в моноциклическом гетероцикле. Типичные примеры моноциклического тетероцикла, включают, но не ограничиваются перечисленным, азетидинил, азепанил, азиридинил, диазепанил, 1,3-диоксанил, 1,3-диоксоланил, 1,3-дитиоланил, 1,3-дитианил, имидазолинил, имидазолидинил, изотиазолинил, изотиазолидинил, изоксазолинил, изоксазолидинил, морфолинил, оксадиазолинил, оксадиазолидинил, оксазолинил, оксазолидинил, пиперазинил, пиперидинил, пиранил, пиразолинил, пиразолидинил, пирролинил, пирролидинил, тетрагидрофуранил, тетрагидротиенил, тиадиазолинил, тиадиазолидинил, тиазолинил, тиазолидинил, тиоморфолинил, 1,1-диоксидтиоморфолинил (тиоморфолина сульфон), тиопиранил и тритианил. Бициклический гетероцикл представляет собой моноциклический гетероцикл, сконденсированный по выбору с фенилом, моноциклическим циклоалкилом, моноциклическим циклоалкенилом, моноциклическим гетероциклилом или моноциклическим гетероарилом. Бициклический гетероцикл присоединен к остатку основной молекулы через любой атом углерода или азота, содержащийся в моноциклическом гетероцикле фрагменте бициклической кольцевой системы. Типичные примеры бициклических гетероциклилов включают, но не ограничиваются перечисленным, 2,3-дигидробензофуран-2-ил, 2,3-дигидробензофуран-3-ил, индолин-1-ил, индолин-2-ил, индолин-3-ил, 2,3-дигидробензотиен-2-ил, декагидрохинолинил, декагидроизохинолинил, октагидро-1Н-индолил и октагидробензофуранил. Гетероциклилы необязательно могут быть замещены одной или двумя оксо- или тиа-группами, выбранными независимым образом. В некоторых вариантах бициклический гетероциклил представляет собой 5- или 6-членное моноциклическое гетероциклильное кольцо, сконденсированное по выбору с фенилом, 5- или 6-членным моноциклическим циклоалкилом, 5- или 6-членным моноциклическим циклоалкенилом, 5- или 6-членным моноциклическим гетероциклилом или 5- или 6-членным моноциклическим гетероарилом, в котором бициклический гетероциклил необязательно может быть замещен одной или двумя оксо- или тиа-группами, выбранными независимым образом.
[0075] Термин «гидрокси», используемый в настоящем документе, обозначает группу -ОН.
[0076] Термин «нитро», используемый в настоящем документе, обозначает группу -NO2.
[0077] Термин «оксо», используемый в настоящем документе, обозначает группу =O.
[0078] Термин «насыщенный», используемый в настоящем документе, обозначает химическую структуру, которая не содержит каких-либо двойных углерод-углеродных связей. Примерами насыщенной циклоалкильной группы, согласно представленному здесь определению, являются циклогексил, циклопропил и т.п.
[0079] Термин «спиро», используемый в настоящем документе, обозначает циклический фрагмент, содержащий замещенный атом и две доступные для замещения позиции на этом же атоме. Например, такой остаток как
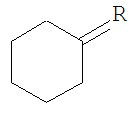 , где R - это спиро-циклоалкил =, имеет структуру
, где R - это спиро-циклоалкил =, имеет структуру 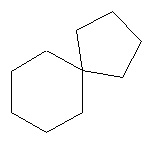 , в которой спиро-циклопентильная группа - это группа R, присоединенная к главному циклогексильному кольцу двумя одиночными связями. Аналогичным образом, если R - это спиро-гетероциклил, соединение имеет структуру
, в которой спиро-циклопентильная группа - это группа R, присоединенная к главному циклогексильному кольцу двумя одиночными связями. Аналогичным образом, если R - это спиро-гетероциклил, соединение имеет структуру 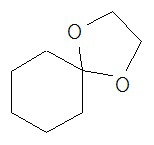 , и спиро-1,3-диоксоанильное кольцо - это группа R, присоединенная к главному циклогексильному кольцу двумя одиночными связями.
, и спиро-1,3-диоксоанильное кольцо - это группа R, присоединенная к главному циклогексильному кольцу двумя одиночными связями.
[0080] Термин «тиа», используемый в настоящем документе, обозначает группу =S.
[0081] Термин «ненасыщенный», используемый в настоящем документе, обозначает химическую структуру, которая содержит по меньшей мере одну двойную углерод-углеродную связь, но не является ароматической. Примерами ненасыщенной циклоалкильной группы, согласно представленному здесь определению, являются циклогексенил, циклопентенил, циклогексадиенил и т.п.
[0082] Используемый в настоящем документе термин «клетка» обозначает клетку, находящуюся в условиях in vitro, ex vivo или in vivo. В некоторых вариантах клетка в условиях ex vivo может быть частью образца ткани, извлеченного из организма, например, млекопитающего. В некоторых вариантах клетка в условиях in vitro может представлять собой клетку в культуре клеток. В некоторых вариантах клетка в условиях in vivo представляет собой клетку, живущую в организме, например, млекопитающего.
[0083] Используемый в настоящем документе термин «контактирование» обозначает сближение указанных фрагментов в системе in vitro или системе in vivo. Например, «контактирование» фермента ИДО с соединением предусматривает введение описанного в настоящем документе соединения индивиду или пациенту, например, человеку, имеющему ИДО, а также, например, введение соединения в образец, содержащий клеточный или очищенный препарат, содержащий фермент ИДО.
[0084] Используемый в настоящем документе термин «индивид» или «пациент», применяемый в качестве синонима, обозначает любое животное, включая млекопитающих, предпочтительно мышей, крыс и других грызунов, кроликов, собак, кошек, свиней, крупного рогатого скота, овец, лошадей или приматов, а в большинстве случаев - человека.
[0085] Используемое в настоящем документе выражение «терапевтически эффективное количество» обозначает количество активного соединения или фармацевтического агента, вызывающее биологический или клинический отклик, достигаемый в ткани, системе, животном, индивиде или человеке исследователем, ветеринаром, врачом или другим клиницистом.
[0086] В некоторых вариантах терапевтически эффективное количество может представлять собой количество, оптимальное для (1) профилактики заболевания, например, профилактики заболевания, состояния или расстройства у индивида, который может быть предрасположен к развитию заболевания, состояния или расстройства, но еще не перенес или не демонстрирует патологию или симптоматику заболевания;
[0087] (2) подавления заболевания, например, подавления заболевания, состояния или расстройства у индивида, который испытывает или демонстрирует патологию или симптоматику заболевания, состояния или расстройства, или
[0088] (3) облегчения заболевания, например, облегчения заболевания, состояния или расстройства у индивида, который испытывает или демонстрирует патологию или симптоматику заболевания, состояния или расстройства (т.е. обратив патологию и (или) симптоматику), например, уменьшение степени тяжести заболевания.
[0089] Используемые в настоящем документе термины «лечение» и «терапия» обозначают (i) облегчение определенного болезненного состояния, например, уменьшение интенсивности симптомов заболевания, состояния или расстройства у индивида, который испытывает или демонстрирует патологию или симптоматику заболевания, состояния или расстройства (например, обращение или улучшение патологии и (или) симптоматики), например, уменьшение степени тяжести заболевания или (ii) достижение определенного биологического эффекта (например, изменение содержания ИДО или ингибирование разложения триптофана).
[0090] Проявление улучшения болезненного состояния, в основе которого лежит опосредованная ИДО иммуносупрессия, может потребовать сопутствующего или последовательного введения дополнительных терапевтических агентов, например, противоопухолевых агентов в случае рака или антиретровирусных препаратов в случае вирусных заболеваний. Например, введение ингибиторов ИДО для лечения рака не всегда вызывает прямой противоопухолевый эффект при их использовании в качестве монотерапии. Однако в сочетании с химиотерапевтическими препаратами (противоопухолевыми) наблюдаемый противоопухолевый эффект является более значительным, чем сумма эффектов, достигаемых в случае введения каждого препарата по отдельности.
[0091] Используемые в настоящем документе термины «каталитическая зона», каталитический участок», «активный участок» в собирательном значении обозначают участок фермента, содержащий остатки аминокислот, отвечающих за связывание субстрата (заряд, гидрофобность, стерическое несоответствие), и остатки каталитических аминокислот, действующих в качестве доноров протонов или акцепторов или отвечающих за связывание кофактора; данный участок фермента участвует в катализе химической реакции.
[0092] Используемое в настоящем документе выражение «фармацевтически приемлемая соль» обозначает фармацевтически приемлемые кислотные и щелочные аддитивные соли и сольваты. Такие фармацевтически приемлемые соли включают соли кислот, например, хлористоводородной, фосфорной, бромистоводородной, серной, сульфиновой, муравьиной, толуолсульфоновой, метансульфоновой, азотной, бензойной, лимонной, винной, малеиновой, йодистоводородной, алкановой, например, уксусной, НООС-(СН2)n-СООН, где n может составлять 0-4 и т.п. Нетоксичные фармацевтические щелочные аддитивные соли включают соли оснований, например, натрия, калия, кальция, аммония и т.п. Специалисты в данной области науки смогут исследовать разнообразные нетоксичные фармацевтически приемлемые аддитивные соли.
Способы применения
[0093] Соединения и фармацевтические композиции, описанные в настоящем документе, могут модулировать активность фермента индоламин-2,3-диоксигеназы (ИДО). Термин «модулировать» обозначает способность уменьшать активность фермента или рецептора. Таким образом, описанные в настоящем документе соединения могут использоваться для модуляции активности ИДО путем контактирования фермента с одним или более из рассматриваемых соединений или композиций. В некоторых вариантах описанные в настоящем документе соединения могут действовать как ингибиторы ИДО. В других вариантах описанные в настоящем документе соединения могут использоваться для модуляции активности ИДО в клетке или у индивида, нуждающегося в модуляции активности фермента, путем введения модулирующего (например, ингибирующего) количества описанного соединения.
[0094] Кроме того, предложены способы ингибирования разложения триптофана и предотвращения образования N-формилкинуренина в системе, содержащей клетки, экспрессирующие ИДО, например, в ткани, живом организме или культуре клеток. В некоторых вариантах способы изменения (например, увеличения) внеклеточных уровней триптофана у млекопитающих включают введение эффективного количества соединения или фармацевтической композиции, описанных в данном документе. Методы измерения уровня триптофана и разложения триптофана являются обычными методами, используемыми в данной области.
[0095] Кроме того, предложены способы подавления иммуносупрессии, например, опосредованной ИДО иммуносупрессии у пациента, путем введения пациенту эффективного количества соединения или композиции, описанной в данном документе. Опосредованная ИДО иммуносупрессия может быть связана, например, с присутствием рака, роста опухоли, метастазов, инфекционных заболеваний (например, вирусных инфекций), репликации вируса и др.
[0096] Кроме того, предложены способы лечения у пациента опухоль-специфической иммуносупрессии, вызванной раком, путем введения пациенту эффективного количества соединения или композиции, описанной в данном документе. Примерами вызванной раком опухоль-специфической иммуносупрессии, которую можно лечить с помощью описанных здесь способов, являются иммуносупрессия, вызванная раком толстой кишки, поджелудочной железы, молочной железы, простаты, легких, мозга, яичников, шейки матки, семенников, почек, головы или шеи, а также лимфомой, лейкемией, меланомой и т.п.
[0097] Например, пациент, проходящий или завершивший курс химиотерапии и (или) лучевой терапии болезненных состояний, таких как рак, может получить пользу в результате введения ему терапевтически эффективного количества соединения или композиции, описанных в настоящем документе, с целью подавления иммуносупрессии в результате болезненного состояния и (или) его лечения.
[0098] Кроме того, предложены способы лечения у пациента иммуносупрессии, вызванной инфекционным заболеванием, например, инфекцией ВИЧ-1, путем введения ему эффективного количества соединения или композиции, описанных в настоящем документе.
[0099] Примером опосредованной ИДО иммуносупрессией, связанной с вирусной инфекцией, является иммуносупрессия в результате инфекции, вызываемой вирусом из группы, включающей вирус гепатита С (ВГС), вирус папилломы человека (ВПЧ), цитомегаловирус (ЦМВ), вирус Эпштейна-Барр (ВЭБ), вирус полиомиелита, вирус ветряной оспы, вирус коксаки, вирус иммунодефицита человека (ВИЧ).
[00100] Кроме того, предложены способы лечения заболеваний, связанных с активностью или экспрессией, в том числе аномальной активностью и (или) повышенной экспрессией, ИДО у индивида (например, у пациента) путем введения индивиду, нуждающемуся в подобном лечении, терапевтически эффективного количества или дозы описанного в настоящем документе соединения или его фармацевтической композиции. Примером подобного заболевания может быть любое заболевание, расстройство или состояние, непосредственно или косвенно связанное с экспрессией или активностью фермента ИДО, например, повышенной его экспрессией или аномальной активностью. Опосредованные ИДО заболевания также могут включать любые заболевания, расстройства или состояния, которые можно предотвратить, вылечить или уменьшить степень их тяжести в результате модуляции активности фермента.
[00101] Примерами опосредованных ИДО заболеваний могут быть рак, вирусные инфекции, такие как ВИЧ-инфекция, депрессия, нейродегенеративные расстройства, например, болезнь Альцгеймера и болезнь Хантингтона, травма, возрастная катаракта или трансплантация органов (например, отторжение трансплантата органа) и аутоиммунные заболевания, в том числе астма, ревматоидный артрит, рассеянный склероз, воспалительное заболевание кишечника, псориаз и системная эритематозная волчанка. Примерами типов рака, которые можно лечить с помощью описанных в настоящем документе способов, являются рак толстой кишки, поджелудочной железы, молочной железы, простаты, легких, мозга, яичников, шейки матки, семенников, почек, головы и шеи, лимфома, лейкоз, меланома и т.п.
Комбинационная терапия
[00102] Один или несколько применяемых для терапии дополнительных лекарственных препаратов, например, противовирусные препараты, химиотерапевтические препараты или другие противораковые средства, усилители иммунитета, иммунодепрессанты, лучевая терапия, противоопухолевые и противовирусные вакцины, терапия цитокинами (например, IL2, GM-CSF и др.) и (или) ингибиторы тирозинкиназы, могут быть использованы в комбинации с соединениями и фармацевтическими композициями, описанными в настоящем документе, для лечения опосредованных ИДО заболеваний, расстройств или состояний (согласно определению выше), или для повышения эффективности лечения заболевания или состояния, например, рака. Препараты могут использоваться в комбинации с представленными в рамках настоящего изобретения соединениями в рамках одной лекарственной формы или могут вводиться одновременно или последовательно в виде отдельных лекарственных форм.
[00103] Предполагается, что использование терапевтических агентов, которые представляют собой стандарт лечения конкретного типа рака или инфекционного заболевания, будет более эффективным в сочетании с ингибиторами ИДО, предлагаемыми в рамках настоящего изобретения. Например, в случае опухолей, более предпочтительно, чтобы опухоль была чувствительной к цитотоксическим эффектам химиотерапевтического агента с целью стимуляции высвобождение антигенов, которые, в конечном счете, опосредуют иммунный оклик, который будет усиливаться при добавлении ингибиторов ИДО в рамках комбинированного лечения. Специалист в данной области должен знать, каким образом выбирать химиотерапевтический препарат, основываясь на его клинических свойствах и известной чувствительности каждой опухоли к различным противоопухолевым агентам.
[0100] Подходящие противовирусные агенты, рассматриваемые для применения в комбинации с соединениями, описанными в настоящем документе, включают нуклеозидные и нуклеотидные ингибиторы обратной транскриптазы (НИОТ), ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ), ингибиторы протеазы и другие противовирусные препараты.
[0101] Примерами подходящих НИОТ являются зидовудин (AZT); диданозин (ddI); зальцитабин (ddC); ставудин (d4T); ламивудин (3ТС); абакавир (1592U89); адефовира дипивоксил [бис(РОМ)-РМЕА]; лобукавир (BMS-180194); ВСН-10652; эмитрицитабин [(-)-FTC]; бета-L-FD4 (также называемый бета-L-D4C и бета L-2',3'-диклеокси-5-фтор-цитиден); DAPD ((-)-бета-D-2,6,-диамин-пурина диоксолан) и лоденозин (FddA). Примерами подходящих ННИОТ являются невирапин (BI-RG-587); делавирадин (ВНАР, U-90152); эфавиренц (DMP-266); PNU-142721; AG-1549; МКС-442 (1-(этокси-метил)-5-(1-метилэтил)-6-(фенилметил)-(2,4(1Н,3Н)-пиримид-i-недион) и (+)-каланолид A (NSC-675451) и В. Примерами подходящих ингибиторов протеазы являются саквинавир (Ro 31-8959); ритонавир (АВТ-538); индинавир (МК-639); нелфинавир (AG-1343); ампренавир (141W94); лазинавир (BMS-234475); DMP-450; BMS-2322623; АВТ-378 и AG-1549 Другие противовирусные агенты включают гидроксимочевину, рибавирин, IL-2, IL-12, пентафузид и проект Yissum №11607.
[0102] Подходящие химиотерапевтические или другие противораковые агенты включают, например, алкилирующие агенты (в том числе, но не ограничиваясь перечисленным, азотистый иприт, производные этиленимина, алкилсульфонаты, нитрозомочевины и триазены), такие как азотистый иприт, хлорметин, циклофосфамид (Цитоксан™), ифосфамид, мелфалан, хлорамбуцил, пипоброман, триэтилен-меламин, триэтилентиофосфорамин, бусульфан, кармустин, ломустин, стрептозоцин, дакарбазин и темозоломид.
[0103] Подходящие химиотерапевтические или другие противораковые агенты включают, например, антиметаболиты (в том числе, но не ограничиваясь перечисленным, антагонисты фолиевой кислоты, аналоги пиримидина, аналоги пурина и ингибиторы аденозиндеаминазы), такие как метотрексат, 5-фторурацил, флоксуридин, цитарабин, 6-меркаптопурин, 6-тиогуанин, флударабина фосфат, пентостатин и гемцитабин.
[0104] Подходящие химиотерапевтические или другие противораковые агенты, кроме того, включают некоторые природные вещества и их производные (например, алкалоиды барвинка, противоопухолевые антибиотики, ферменты, лимфокины и эпиподофиллотоксины), такие как винбластин, винкристин, виндезин, блеомицин, дактиномицин, даунорубицин, доксорубицин, эпирубицин, идарубицин, ара-С, паклитаксел (Таксол™), доцетаксел, митрамицин, деоксико-формицин, митомицин-С, L-аспарагиназа, интерфероны (в частности, IFN), этопозид и тенипозид.
[0105] Другие цитотоксические агенты включают навелбен, СРТ-11, анастразол, летразол, капецитабин, релоксафин, циклофосфамид, ифозамид и дролоксафин.
[0106] Кроме того, подходящими препаратами являются цитотоксические агенты, такие как эпидофиллотоксин; противоопухолевый фермент; ингибитор топоизомеразы; прокарбазин; митоксантрон; координационные комплексы платины, такие как цисплатин и карбоплатин; модификаторы биологического отклика; ингибиторы роста; противогормональные лекарственные препараты; лейковорин; тегафур и гематопоэтические факторы роста.
[0107] Другие противораковые препараты включают препараты на основе антител, например, трастузумаб (Герцептин), антитела к костимулирующим молекулам, такие как CTLA-4,4-1B и PD-1, или антитела к цитокинам (IL-10, TGF-β и др.).
[0108] Другие противораковые препараты также включают средства, блокирующие иммунную миграцию клеток, например, такие как антагонисты хемокиновых рецепторов, в том числе CCR2, CCR4 и CCR6.
[0109] Другие противораковые препараты также включают средства, усиливающие иммунную систему, такие как вспомогательные лекарственные средства или адоптивный перенос Т-клеток.
[0110] Противораковые вакцины содержат дендритные клетки, синтетические пептиды, ДНК и рекомбинантные вирусы.
[0111] Безопасные и эффективные методы введения большинства из этих химиотерапевтических агентов известны специалистам в данной области науки. Кроме того, способы их введения описаны в стандартной литературе. Например, введение многих химиотерапевтических средств описано в «Настольном пособии для врачей» (PDR, например, издание 1996 года, «Медикал Экономикс Компани», Монтвэйл, Нью-Джерси), которое включено в настоящий документ в качестве ссылки на основной документ в полном объеме.
Фармацевтические композиции и лекарственные формы
[0112] Фармацевтические композиции, описанные в настоящем документе, обычно содержат комбинацию описанного здесь соединения и фармацевтически приемлемого носителя, разбавителя или вспомогательного вещества. Такие композиции практически содержат фармацевтически неприемлемых компонентов, т.е. содержат фармацевтически неприемлемые компоненты в количествах ниже пределов, допустимых нормативными требованиями США на момент подачи настоящей заявки. В некоторых вариантах данного аспекта, если соединение растворяют или суспендируют в воде, композиция также необязательно будет содержать дополнительный фармацевтически приемлемый носитель, растворитель или наполнитель. В других вариантах фармацевтические композиции, описанные в настоящем документе, представляют собой твердые фармацевтические композиции (например, таблетки, капсулы и др.).
[0113] Эти композиции могут быть получены хорошо известным в области фармацевтики методом и могут быть введены в организм различными способами, в зависимости от того, какой тип лечения - местное или системное - желателен в каждом конкретном случае, а также в зависимости от размера площади, подлежащей обработке. Введение может быть местным (в том числе офтальмологическое и нанесение на слизистые оболочки, включая интраназальный, вагинальный и ректальный типы введения), пульмональным (например, ингаляции или инсуффляции порошков или аэрозолей, в том числе распылителей; интратрахеальный, интраназальный, трансдермальный и эпидермальный типы введения), окулярным или парентеральным. Способы введения препарата в область глаза могут включать местное нанесение (глазные капли), субконъюнктивальные, периокулярные или интравитреальные инъекции или введение с помощью баллонного катетера, а также офтальмологические вставки, помещаемые в конъюнктивальный мешок хирургическим методом. Парентеральный способ введения включает внутривенные, внутриартериальные, подкожные, внутрибрюшинные или внутримышечные инъекции или инфузии, а также интракраниальное, например, интратекальное или интравентрикулярное, введение. Парентеральное введение может осуществляться в форме болюсной инъекции или инфузии, проводимой, например, с помощью насоса для непрерывной перфузии. Фармацевтические композиции и лекарственные формы для местного применения могут включать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Необходимым или желательным может оказаться использование обычных фармацевтических носителей, водных, порошковых или масляных основ, загустителей и т.п.
[0114] Кроме того, фармацевтические композиции могут содержать в качестве активного ингредиента одно или более описанных выше соединений в комбинации с одним или несколькими фармацевтически приемлемыми носителями. При изготовлении композиций, описанных в настоящем документе, активный ингредиент обычно смешивают со вспомогательным веществом, разбавляют вспомогательным веществом или заключают в носитель, например, в виде капсул, саше, бумаги или другого контейнера. Если вспомогательное вещество используется в качестве разбавителя, он может представлять собой твердый, полутвердый или жидкий материал, который будет действовать как матрикс, носитель или среда для активного ингредиента. Таким образом, описанные композиции могут применяться в форме таблеток, пилюль, порошков, пастилок, саше, облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (как твердое вещество или в жидкой среде), мазей, содержащих, например, до 10% по массе активного соединения, мягких и твердых желатиновых капсул, суппозиториев, стерильных инъекционных растворов и стерильных упакованных порошков.
[0115] При приготовлении лекарственной формы перед смешиванием с другими ингредиентами активное соединение может быть измельчено для обеспечения соответствующего размера его частиц. Если активное соединение в целом является нерастворимым, его можно измельчить до частиц размером менее 200 меш. Если активное соединение в целом является растворимым, размер частиц можно регулировать путем измельчения с целью обеспечения их равномерного распределения в лекарственной форме, например, придать размер около 40 меш.
[0116] Примерами некоторых подходящих вспомогательных веществ являются лактоза, декстроза, сахароза, сорбит, маннит, крахмалы, гуммиарабик, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическая целлюлоза, поливинилпиролидон, целлюлоза, вода, сироп и метилцеллюлоза. Лекарственные формы могут дополнительно содержать смазывающие агенты, такие как тальк, стеарат магния и минеральное масло; смачивающие агенты; эмульгирующие и суспендирующие агенты; консерванты, такие как метил- и пропилгидроксибензоаты; подсластители и ароматизаторы. Описанные в настоящем документе композиции могут быть сформулированы таким образом, который будет обеспечивать быстрое, пролонгированное или замедленное высвобождение активного ингредиента после их введения пациенту с использованием процедур, используемых в данной области науки.
[0117] Композиции могут быть изготовлены в виде дозированной лекарственной формы, при этом каждая дозированная единица будет содержать от 5 до 100 мг активного ингредиента, а чаще всего от 10 до 30 мг. Термин «дозированная лекарственная форма» обозначает физически дискретные единицы, подходящие для использования в качестве разовых доз для человека и других млекопитающих, причем каждая единица содержит определенное заранее количество активного материала, рассчитанное на получение желаемого терапевтического эффекта, в сочетании с подходящим фармацевтическим наполнителем.
[0118] Активное соединение может обладать эффективностью в широком диапазоне доз и, как правило, вводится в организм в фармацевтически эффективном количестве. Однако следует понимать, что количество фактически принимаемого соединения, как правило, будет определяться лечащим врачом в зависимости от соответствующих обстоятельств, включая состояние, подлежащее лечению, выбранный способ введения, конкретное вводимое соединение, возраст, массу тела и реакцию конкретного пациента, степень тяжести симптомов пациента и т.п.
[0119] Для получения твердых композиций, таких как таблетки, основной активный ингредиент смешивают с фармацевтическим вспомогательным веществом с образованием твердой предварительной формуляции, содержащей однородную смесь соединения, описанного в настоящем документе. Если расценивать данные предварительные формуляции как однородные, предполагается, что активный ингредиент обычно равномерно распределен по всей композиции, поэтому композицию легко можно разделить на одинаково эффективные дозированные единицы, например, таблетки, пилюли и капсулы. Данная твердая предварительная формуляция, таким образом, разделяется на стандартные дозированные единицы описанного выше типа, содержащие, например, от 0,1 до 500 мг активного ингредиента, являющегося соединением, описанным в настоящем документе.
[0120] Таблетки или пилюли могут быть покрыты оболочкой или обработаны иным образом для получения лекарственной формы, обладающей преимуществом в виде пролонгированного действия. Например, таблетка или пилюля может состоять из внутреннего и внешнего дозирующего компонентов, причем последний находится в форме оболочки, покрывающей первый компонент. Два компонента могут быть разделены энтеросолюбильным слоем, который предназначен для предотвращения разрушения внутреннего компонента в желудке и позволяет ему попадать в двенадцатиперстную кишку в неповрежденном виде или задерживает выход активного вещества. Для создания таких энтеросолюбильных слоев или покрытий могут быть использованы различные материалы, в том числе ряд полимерных кислот и смесей полимерных кислот с такими материалами, как шеллак, цетиловый спирт и ацетат целлюлозы.
[0121] Жидкие формы, в которых соединения и композиции могут быть введены в организм перорально или в виде инъекции, включают водные растворы, соответствующим образом ароматизированные сиропы, водные или масляные суспензии, ароматизированные эмульсии с пищевыми маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и другие подобные лекарственные формы.
[0122] Лекарственные формы для ингаляции или инсуффляции включают растворы и суспензии в фармацевтически приемлемых водных или органических растворителях или их смесях, а также порошки. Жидкие или твердые композиции могут содержать подходящие фармацевтически приемлемые вспомогательные вещества, в соответствии с описанием выше. В некоторых вариантах лекарственные формы вводят перорально или назально через дыхательные пути с целью достижения местного или системного эффекта. Лекарственные формы можно распылять при использовании инертных газов. Распыляемые растворы можно вдыхать непосредственно из распылительного устройства, или распылительное устройство может быть присоединено к дыхательной маске для лица или устройству для искусственной вентиляции с перемежающимся положительным давлением. Лекарственные формы в виде раствора, суспензии или порошка могут вводиться перорально или назально из устройств, которые позволяют вводить препарат соответствующим образом.
[0123] Количество вводимого пациенту соединения или композиции будет варьироваться в зависимости от вводимого материала, цели введения (профилактика или лечение), состояния пациента, способа введения и тому подобное. В терапевтических целях композиции могут вводиться пациенту, уже имеющему заболевание, в количестве, достаточном для лечения или, по крайней мере, частичной остановки симптомов заболевания и его осложнений. Величина эффективной дозы будет зависеть от типа болезненного состояния, подлежащего лечению, а также от мнения лечащего врача, принимаемого исходя из таких факторов, как тяжесть заболевания, возраст, масса тела, общее состояние пациента и т.п.
[0124] Композиции, вводимые пациенту, могут использоваться в форме описанных выше лекарственных форм. Данные лекарственные формы могут быть простерилизованы методами обычной стерилизации или могут быть подвергнуты стерильной фильтрации. Водные растворы могут быть упакованы для использования в уже готовом виде или могут быть подвергнуты лиофилизации, причем перед введением лиофилизированный препарат должен быть соединен со стерильным водным носителем. значение рН полученного препарата, как правило, должно составлять от 3 до 11, более предпочтительным значением является 5-9, а наиболее предпочтительным - от 7 до 8. Следует понимать, что использование некоторых из указанных выше вспомогательных веществ, носителей или стабилизаторов будет приводить к образованию фармацевтических солей.
[0125] Терапевтические дозы соединений могут меняться в зависимости, например, от конкретного типа лечения, способа введения соединения, здоровья и состояния пациента, а также от мнения лечащего врача. Доля или концентрация в фармацевтической композиции соединения, описанного в настоящем документе, может варьировать в зависимости от ряда факторов, в том числе дозировки, химических характеристик (например, гидрофобности) и способа введения. Например, соединения, описанные в настоящем документе, могут быть предложены для применения в форме водного физиологического буферного раствора для парентерального введения, содержащего примерно от 0,1 до 10% масс/объем, соединения. Некоторые обычные диапазоны доз варьируют примерно от 1 мкг/кг до 1 г/кг массы тела в сутки. В некоторых вариантах изобретения используются дозы в диапазоне около от 0,01 до 100 мг/кг массы тела в сутки. Дозировка может зависеть от таких факторов, как тип и степень прогрессирования заболевания или расстройства, общего состояния здоровья конкретного пациента, относительной биологической эффективности выбранного соединения, состава лекарственной формы и способа введения. Эффективные дозы могут быть экстраполированы из кривых доза-отклик, полученных в условиях in vitro или в моделях на животных.
[0126] Описанные в настоящем документе соединения могут быть также сформулированы в комбинации с одним или более дополнительным активным ингредиентом, в том числе фармацевтическим агентом, например, противовирусным агентом, вакциной, антителами, усилителями иммунитета, подавителями иммунитета, противовоспалительными агентами и т.п.
Меченые соединения и методы количественного определения
[0127] Другой аспект относится к производным описанных в настоящем документе соединений, меченых флуоресцентным красителем, спиновой меткой, тяжелым металлом или радиоактивной меткой, которые были бы полезны не только в плане построения изображений, а также и при проведении количественного определения, как в условиях in vitro, так и in vivo, с целью выявления локализации и оценки содержания фермента ИДО в образцах ткани, в том числе человека, а также для идентификации лигандов фермента ИДО путем ингибирования связывания меченого соединения. Соответственно, также предложены методики проведения количественного определения фермента ИДО с использованием таких меченых соединений.
[0128] Кроме того, предложены меченые изотопами соединения, соответствующие соединениям, описанным в настоящем документе. «Меченое изотопом» или «радиомеченое» соединение представляет собой описанное в настоящем документе соединение, в котором один или более атомов заменены или замещены атомом с атомной массой или массовым числом, отличающимся от атомной массы или массового числа, обычно встречающихся в природе (т.е. образующихся в естественных условиях). Подходящие радионуклиды включают, но не ограничиваются перечисленным, 2Н (также обозначаемый как D для дейтерия), 3H (также обозначаемый как Т для трития), 11С, 13С, 14С, 13N, 15N, 15O, 17O, 18O, 18F, 35S, 36Cl, 82Br, 75Br, 76Br, 77Br, 123I, 124I, 125I и 131I. Радионуклид, включаемый в радиомеченое соединение, будет выбираться в зависимости от конкретной цели применения радиомеченого соединения. Например, для маркировки фермента ИДО in vitro и конкурентного количественного определения более полезными представляются соединения, содержащие 3Н, 14С, 82Br, 125I, 131I, 35S или. Для наглядности, как правило, наиболее полезными являются 11С, 18F, 125I, 123I, l24I, 131I, 75Br, 76Br или 77Br.
[0129] Следует понимать, что «радиомеченое» или «меченое» соединение представляет собой соединение, которое включает по меньшей мере один радионуклид. В некоторых вариантах радионуклид выбирают из группы, включающей 3Н, 14С, 125I, 35S и 82Br.
[0130] Синтетические способы введения радиоизотопов в органические соединения применимы для соединений, описанных в настоящем документе, и хорошо известны в данной области науки.
[0131] Радиомеченое соединение, описанное в настоящем документе, может быть использовано в скрининговом исследовании с целью идентификации/оценки соединений. В общих чертах, новое синтезированное или идентифицированное соединение (т.е. исследуемое соединение) может быть подвергнуто оценке в плане его способности ингибировать связывание радиомеченого соединения, описанного в настоящем документе, с ферментом ИДО. Соответственно, способность исследуемого соединения конкурировать с радиомеченым соединением за связывание с ферментом ИДО напрямую зависит от его сродства к связыванию.
Наборы
[0132] Кроме того, изобретение охватывает фармацевтические наборы, которые, например, будут полезны при лечении или профилактике связанных с ИДО заболеваний или расстройств, ожирения, сахарного диабета и других заболеваний, упомянутых в настоящем документе; данные наборы включают один или несколько контейнеров с фармацевтической композицией, содержащей терапевтически эффективное количество соединения, описанного в настоящем документе. Такие наборы также могут, при необходимости, включать один или более различных обычных фармацевтических компонентов набора, например, контейнеры с одним или несколькими фармацевтически приемлемыми носителями, дополнительные контейнеры и т.д., назначение которых должно быть очевидно для специалистов в данной области науки. В состав комплекта также могут входить инструкции по применению либо в виде вкладыша, либо в виде этикетки, с указанием количества компонентов для введения, указаний по введению и (или) указаний по смешиванию компонентов.
[0133] Следующие примеры представлены для наглядности и не предназначены для ограничения каким-либо образом применения изобретения. Специалисты в данной области должны легко распознавать различные некритические параметры, которые могут быть изменены или модифицированы с получением, в целом, таких же результатов. Подтверждено, что представленные ниже соединения являются ингибиторами ИДО при их исследовании одной или более методик количественного определения, описанных в настоящем документе.
Примеры
Все реагенты и растворители были приобретены из коммерческих источников. Все коммерческие реагенты и растворители использовались в полученном виде без дополнительной очистки. Реакции контролировали с помощью аналитической тонкослойной хроматографии (ТСХ) с использованием силикагелевых пластин 0,25 мм ЕМ Science (60F-254). Обработанные ТСХ пластины подвергали визуализации с помощью коротковолнового УФ-освещения (254 нм) или при погружении в раствор перманганата калия с последующим нагреванием на горячей пластине. Флеш-хроматографию проводили с использованием силикагеля Selecto Scientific с размером частиц 32-63 мкм. Все реакции проводили в стеклянной посуде, высушенной в пламени или сушильной печи, в атмосфере азота. Все реакционные смеси перемешивали магнитной мешалкой при комнатной температуре, если не указано иное. 1Н ЯМР-спектры были получены с помощью Bruker DRX400, Varian VXR400 или VXR300. 1Н ЯМР-спектры представлены при использовании в качестве единиц измерения «частей на миллион» (δ) относительно ТМС (0.0), ДМСО-d6 (2.50) или CD3OD (4.80) в качестве внутренних стандартов. Все 1Н ЯМР-спектры сняты в CDCl3, если не указано иное. Следующие исходные вещества получают в соответствии с описанными в литературе способами: (E)-этил 3-(2-йодфенил)акрилат (Synth. Comm. 2007, 37, 2989-2994), 2-хлор-6-йодбензальдегид (J. Agric. Food Chem. 2008, 56, 5247-5253), 2-йод-3-метоксибензальдегид (Chem. - Eur. J., 2004, 10, 5233-5242), диметил-(2-(циклогекс-1-ен-1-ил)-2-оксоэтил)фосфонат (Phosphorus, Sulfur Silicon Relat. Elem., 1999, 755, 67-80), диметил-(2-циклогексил-2-оксо)этилфосфонат (Patent: US 5807892 A1, 1998), этил-1,4-диоксаспиро[4.5]декан-8-карбоксилат (Patent: US 2008/306084 A1 2008), (транс)-этил-4-((трет-бутилдиметилсилил)окси)циклогексанкарбоксилат (Patent: US 2006/25383 A1 2006), этил-спиро[2.5]октан-6-карбоксилат (Bioorg. Med. Chem. Lett. 2008, 18, 5280-5284), этил 4-(циклопропилметилен)циклогексанкарбоксилат (Patent: US 4584013 A1 1986).
[0134] Упомянутым выше соединениям с целью использования в настоящем патенте присвоены идентификационные номера соединений 86-91 и 113-115 соответственно. (4.80) используется в качестве внутреннего стандарта. Все спектры сняты в CDCl3, если не указано иное.
[0135] Различные методы, используемые в настоящем патенте для синтеза промежуточных соединений, представлены ниже на Схеме 1. Катализируемое палладием перекрестное связывание Сузуки 4-йод-1-тритил-1H-имидазола с фенилборной кислотой приводит к получению 2-(1-тритил-1H-имидазол-4-ил)бензальдегидов. Полученные 2-(1-тритил-1H-имидазол-4-ил)бензальдегиды подвергают альдольной конденсации или реакции Хорнера-Вадсворта с получением интермедиата А. В качестве альтернативы синтез интермедиата А может быть проведен с помощью реакции 2-йодбензальдегидов с замещенными метилкетонами в присутствии основания с получением 3-(2-йодфенил)проп-2-ен-1-онов. Перекрестное связывание Негиши полученных 3-(2-йодфенил)проп-2-ен-1-онов с 4-йод-1-тритил-1H-имидазолом также приводит к получению интермедиата А. Удаление у интермедиата А защитной тритил-группы приводит к получению 2-(5H-имидазо[5,1-а]изоиндол-5-ил)этанона В, который может быть восстановлен до 2-(5H-имидазо[5,1-а]изоиндол-5-ил)этанола С (Схема 2).
Схема 1. Синтез (E)-3-(2-(1-тритил-1H-имидазол-4-ил)фенил)проп-2-ен-1-онов (интермедиат А)
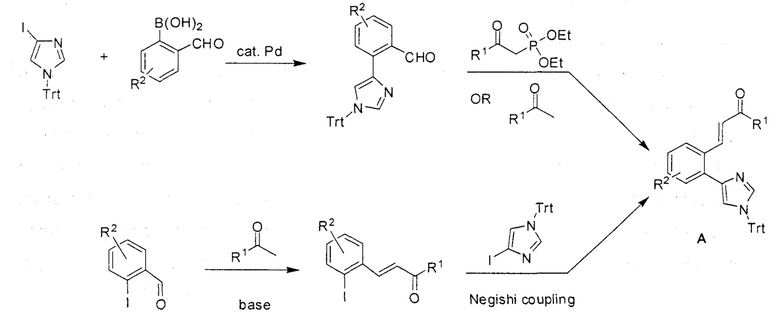
Схема 2. Синтез 2-(5H-имидазо[5,1-а]изоиндол-5-ил)этанонов и их соответствующих 2-(5H-имидазо[5,1-а]изоиндол-5-ил)этанолов
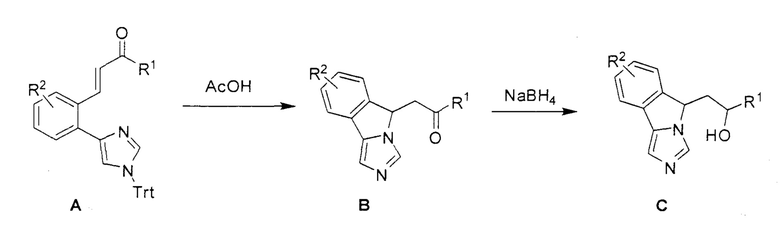
Пример 1 Общая схема синтеза 3-(2-йодфенил)проп-2-ен-1-оновальдольной конденсацией
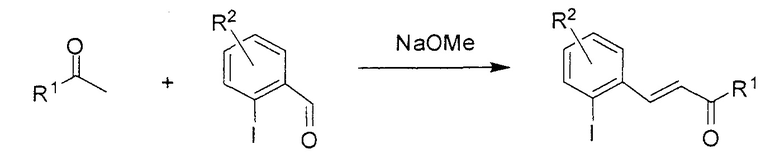
[0136] К раствору соответствующего доступного в продаже бензальдегида или соединения 87 (4,31 ммоль) в безводном МеОН (15 мл) при комнатной температуре добавляли NaOMe (4,31 ммоль, 0,5 М в МеОН) и оставляли получившийся желтый раствор для перемешивания в течение 5 минут. Соответствующий кетон (4,31 ммоль) по каплям добавляли в форме раствора в МеОН (3 мл). После перемешивания в течение ночи, растворитель удаляли при пониженном давлении, а неочищенный остаток разбавляли насыщенным раствором NH4Cl (20 мл). Водный слой удаляли с помощью CH2Cl2 (3×20 мл), объединенные органические экстракты подвергали высушиванию (MgSO4), а растворитель отгоняли при пониженном давлении с получением неочищенного остатка. Неочищенный продукт подвергали очистке кремнийдиоксидной флеш-хроматографией с получением следующих соединений.
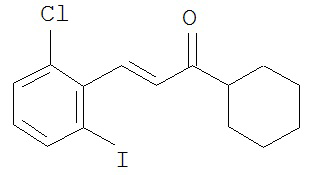
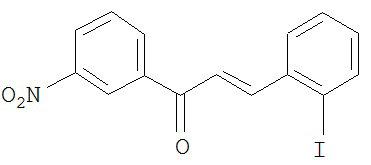
Пример 2 Общая схема синтеза 2-(5H-имидазо[5,1-а]изоиндол-5-ил)этанонов катализируемым палладием перекрестным связыванием Негиши арилйодидов 1 и 2 с 4-йод-1-тритил-1H-имидазолом.
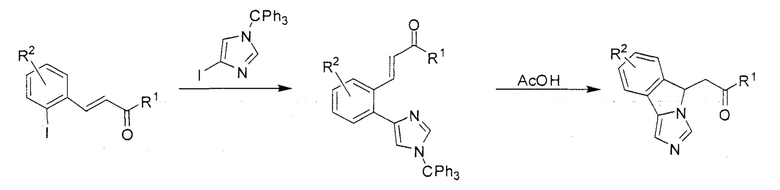
[0137] К перемешанному раствору 4-йод-1-тритил-1H-имидазола (218 мг, 0,5 ммоль) в безводном ТГФ (4 мл) при комнатной температуре по каплям добавляли EtMgBr (1,0 М в ТГФ, 0,5 ммоль, 0,5 мл) в атмосфере N2. Получившийся раствор оставляли для перемешивания в течение 90 минут и добавляли безводный ZnCl2 (0,5 ммоль, 68,2 мг). Получившуюся белую суспензию оставляли для перемешивания в течение 90 минут, затем добавляли раствор соответствующего арилйодида 1, 2 или 86 (0,5 ммоль) в ТГФ (1 мл), после чего сразу же добавляли Pd(PPh3)4 (56 мг, 0,05 ммоль). Реакционную смесь оставляли для перемешивания при 70°С в течение 12 ч в атмосфере N2. После охлаждения до комнатной температуры раствор разбавляли CH2Cl2 (20 мл) и промывали органический слой ЭДТА (водный) буфером (рН=9) (2×5 мл) и соляным раствором. Органический слой подвергали сушке (Na2SO4) и концентрировали при пониженном давлении. Неочищенный остаток использовали в следующей стадии без дополнительной очистки. К раствору неочищенного имидазола из предыдущей стадии добавляли уксусную кислоту (1,0 мл) и МеОН (4,0 мл). Раствор перемешивали при 90°С в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры, а ее рН доводили до ~10 насыщенным раствором К2СО3 (водный). Водную фазу экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали водой, соляным раствором и подвергали сушке. Растворитель удаляли под вакуумом с получением неочищенного остатка, который затем подвергали очистке колоночной флеш-хроматографией на селикагеле с получением следующих соединений.
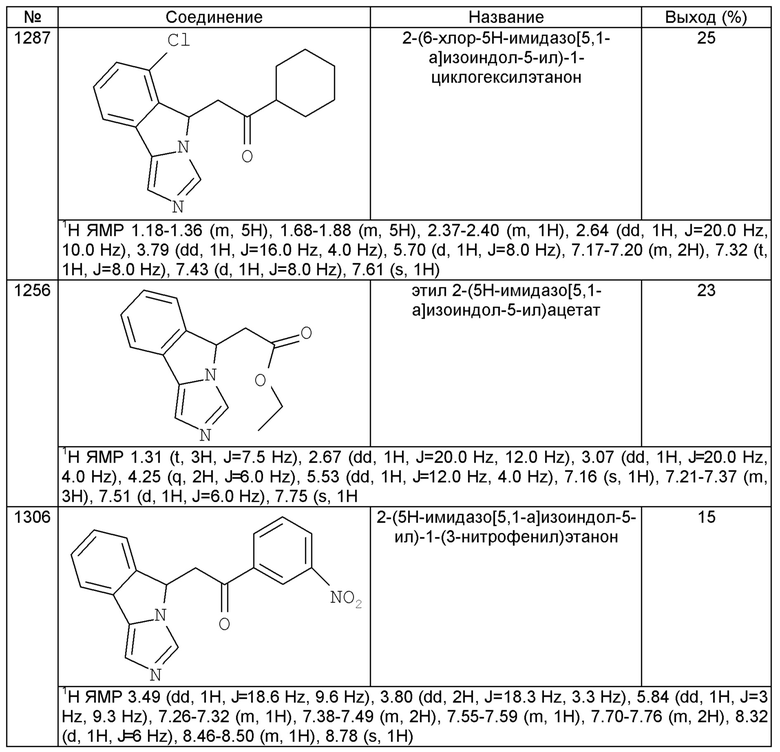
Пример 3 Перекрестное связывание Сузуки 4-йод-1-тритил-1H-имидазола с фенилборными кислотами
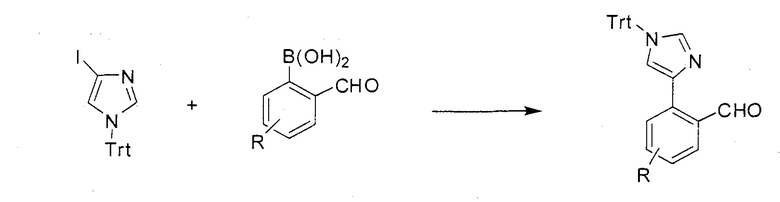
[0138] Суспензию 4-йод-1-тритил-1H-имидазола (6,88 ммоль), соответствующего производного 2-формилборной кислоты (10,31 ммоль) и К3РО4 (20,63 ммоль) в N,N-диметилформамиде (30 мл) и воде (6 мл) продували азотом в течение 5 минут, после чего добавляли Pd(PPh3)4, полученную смесь продували азотом еще 5 минут. Реакционную смесь перемешивали при 90°С в течение 16 ч в атмосфере N2. Раствор оставляли для охлаждения и фильтровали через слой целита. Смесь разбавляли водой (50 мл) и EtOAc (25 мл). Органический слой отбирали, а водный слой экстрагировали EtOAc (2×25 мл). Объединенные органические экстракты промывали водой (2×25 мл), соляным раствором и подвергали сушке (Na2SO4). Раствор подвергали фильтрации, а растворитель удаляли под вакуумом с получением неочищенного остатка, который затем подвергали очистке колоночной флеш-хроматографией на силикагеле с получением следующих соединений.
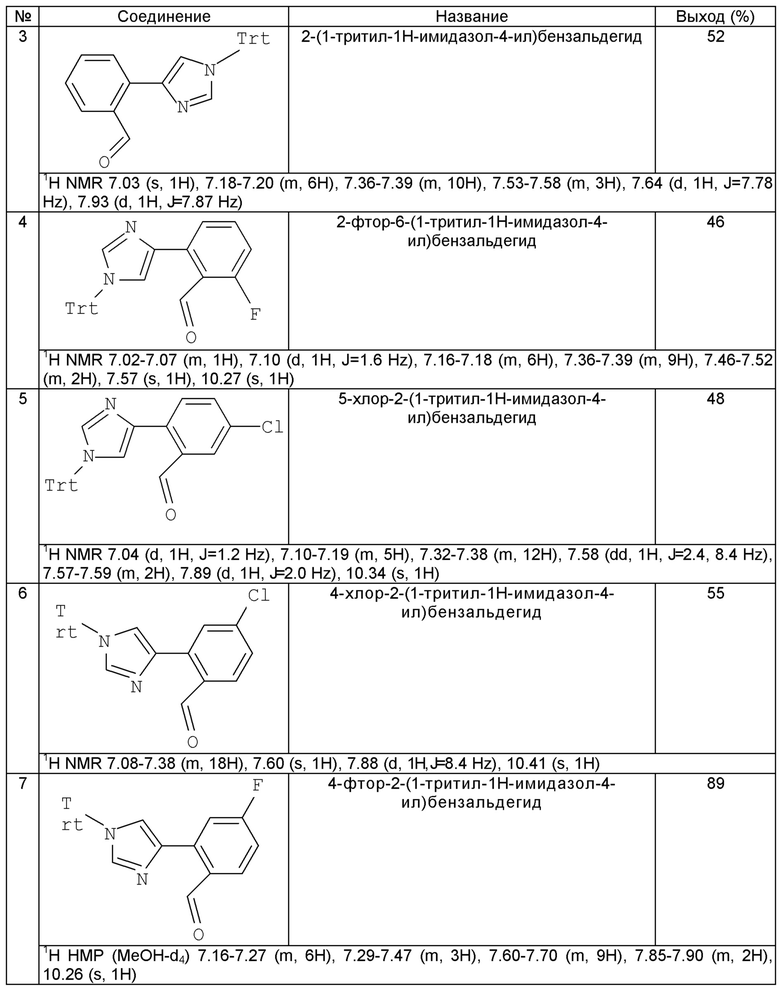
Пример 4 3-метокси-2-(1-тритил-1H-имидазол-4-ил)бензальдегид
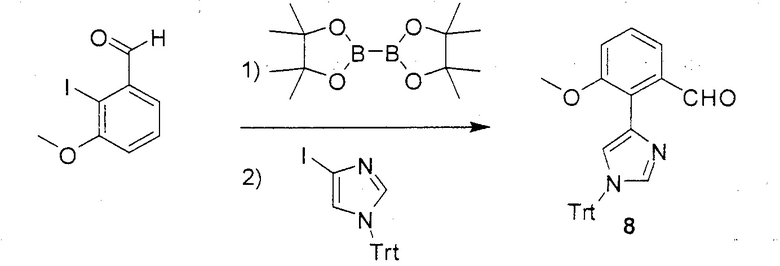
[0139] Суспензию 88 (667 мг, 2,55 ммоль), бис(пинаколато)дибора (711 мг, 2,88 ммоль), КОАс (749 мг, 7,64 ммоль), Pd(OAc)2 (17 мг, 76 мкмоль) в ДМФ (10 мл) перемешивали при 80°С в течение 16 ч. Смесь фильтровали через слой целита, а фильтрат помещали в воду. Водный слой экстрагировали EtOАс (2×30 мл). Объединенные органические экстракты промывали водой (2×10 мл), соляным раствором, сушили и концентрировали. Неочищенный продукт далее использовался без последующей очистки. Суспензию 4-йод-1-тритил-1H-имидазола (400 мг, 0,917 ммоль), 3-метокси-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензальдегида (288 мг, 1,10 ммоль), K2CO3 (444 мг, 3,21 ммоль), комплекса Pd(dppf)Cl2⋅CH2Cl2 (150 мг, 0,18 ммоль) в ДМСО (10 мл) нагревали при 80°С в течение 20 ч. Раствор фильтровали через целит, а фильтрат помещали в воду. Водный слой экстрагировали этилацетатом (2×20 мл). Объединенные органические слои промывали водой (2×10 мл), соляным раствором, сушили и концентрировали. Неочищенный остаток очищали с помощью колоночной флеш-хроматографии с получением соединения 8 в виде белого твердого вещества (78 мг, 19%). 1H ЯМР: 3.75 (s, 3H), 7.08 (d, 1Н, J=8.0 Hz), 7.20-7.25 (m, 7Н), 7.30-7.36 (m, 10Н), 7.52 (s, 1H), 7.55 (d, 1H, J=4.0 Hz), 10.31 (s, 1H).
Пример 5 Общая схема синтеза 2-(5H-имидазо[5,1-а]изоиндол-5-ил)этанона альдольной конденсацией 2-(1-тритил-1H-имидазол-4-ил)бензальдегидов с метилкетонами, с последующей циклизацией
[0140] К раствору соответствующего альдегида 3-8 (0,97 ммоль) и кетона (0,97 ммоль) в безводном ТГФ (5 мл) при комнатной температуре добавляли NaOEt (1,25 ммоль, 21 масс % раствор в EtOH), полученный желтый раствор оставляли для перемешивания в течение 3 ч при комнатной температуре. Растворитель отгоняли, неочищенный остаток разбавляли насыщенным NH4Cl (10 мл), а водный слой экстрагировали дихлорметаном (3×20 мл). Объединенные органические экстракты промывали соляным раствором, сушили Na2SO4, а растворитель выпаривали при пониженном давлении, получая при этом неочищенный продукт. К неочищенному имидазолу из предыдущей стадии добавляли уксусную кислоту (1,0 мл) и МеОН (4,0 мл). Раствор перемешивали при 90°С в течение 3-10 ч. Реакционную смесь оставляли для охлаждения до комнатной температуры, а ее рН доводили до ~10 насыщенным раствором К2СО3 (водный). Водную фазу экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали водой, соляным раствором и подвергали сушке. Растворитель удаляли под вакуумом с получением неочищенного остатка, который затем подвергали очистке колоночной флеш-хроматографией на силикагеле с получением следующих соединений.
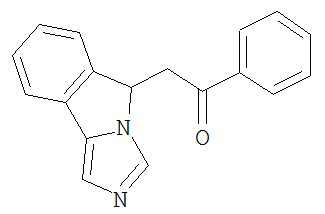
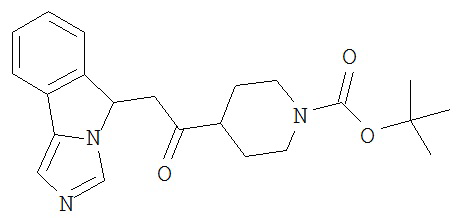
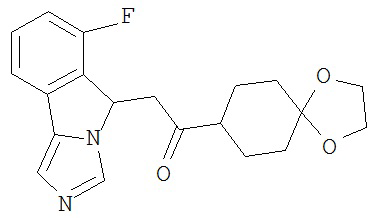
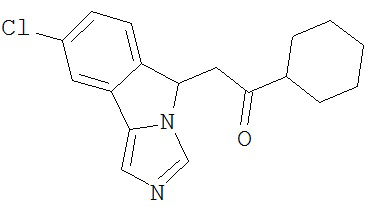
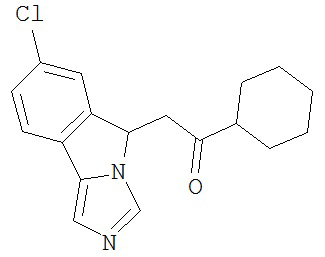
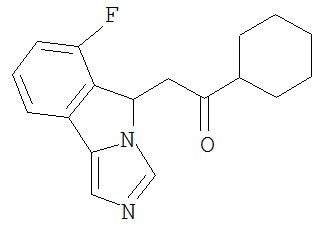
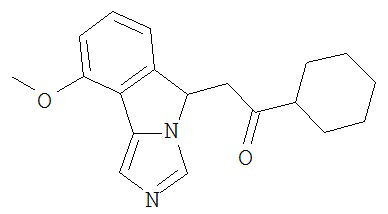
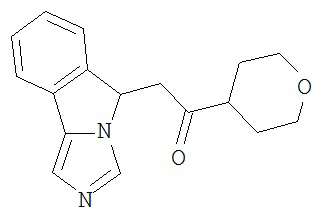
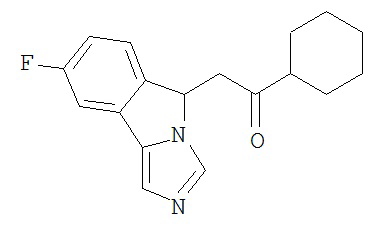
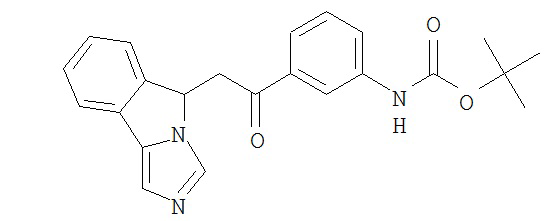
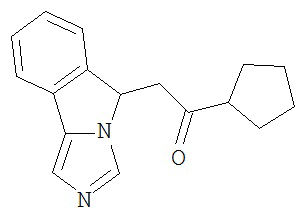
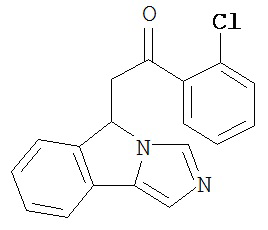
Пример 6 Этил-4-метиленциклогексанкарбоксилат
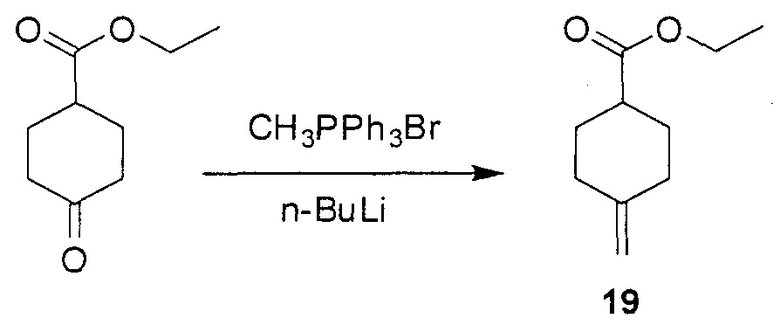
[0141] К суспензии метилтрифенилфосфония бромида (1,57 г, 4,41 ммоль) в ТГФ (9 мл) при -10°С по каплям добавляли n-BuLi (2,5 М в гексанах, 1,65 мл, 4,11 ммоль) и оставляли раствор для перемешивания в течение 1 ч. Добавляли этил-4-оксоциклогексанкарбоксилат (0,47 мл, 2,94 ммоль) и оставляли смесь на 3 ч для нагревания до комнатной температуры. Добавляли ацетон (3 мл) и удаляли Пример 6 Этил-4-метиленциклогексанкарбоксилат растворитель при пониженном давлении. Остаток суспендировали в дихлорметане и этиловом эфире (1:1), фильтровали и концентрировали. Неочищенный остаток очищали с помощью флеш-хроматографии с получением соединения 19 в форме прозрачного масла (419 мг, 85%). 1Н ЯМР: 1.25 (t, 3Н), 1.50-1.70 (m, 2Н), 1.90-2.16 (m, 4Н), 2.30-2.50 (m, 3Н), 4.12 (q, 2Н), 4.65 (s, 2Н).
Пример 7 Этил-4-(йодметилен)циклогексанкарбоксилат
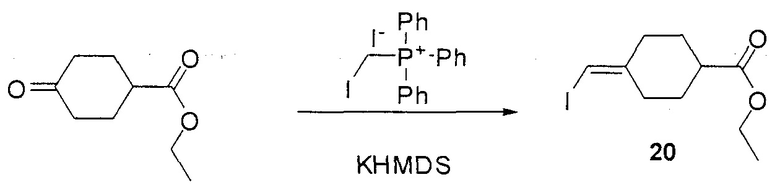
[0142] К суспензии йодметилтрифенилфосфония йодида (1,95 г, 3,67 ммоль) в ТГФ (10 мл) при -23°С медленно добавляли раствор калия гексаметилдисилазана (20% в толуоле, 7,34 мл, 3,67 ммоль), получившийся раствор оставляли для перемешивания в течение 15 минут. Добавляли этил-4-оксоциклогексанкарбоксилат (500 мг, 2,94 ммоль). Раствор снимали с ледяной бани и оставляли для перемешивания при комнатной температуре на протяжении 2 дней. Реакционную смесь разбавляли водой (20 мл) и экстрагировали эфиром (3×20 мл). Объединенные органические слои сушили безводным MgSO4 и концентрировали с получением неочищенного продукта. Неочищенный остаток очищали с помощью колоночной хроматографии с получением соединения 20 в форме светло-розового масла (207 мг, 24%). 1Н ЯМР: 1.21-1.52 (m, 2Н), 1.93-2.13 (m, 4Н), 2.30-2.50 (m, 4Н), 2.49-2.70 (m, 4Н), 4.12 (q, 2Н), 4.60 (s, 1Н)
Пример 8 Этил-4-(пропан-2-илиден)циклогексанкарбоксилат
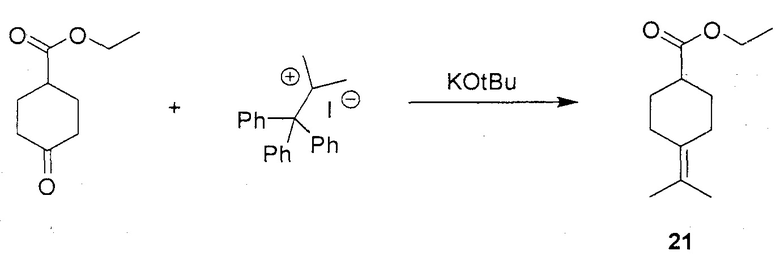
[0143] К суспензии изопропилтрифенилфосфония йодида (3,81 г, 8,81 ммоль) в безводном ГТФ (20 мл) при 0°С добавляли раствор t-BuOK (1,19 г, 10.,8 ммоль) в ТГФ (15 мл). Реакционную смесь оставляли для нагревания при комнатной температуре и перемешивали в течение 1 ч. Получившуюся смесь охлаждали до 0°С и добавляли 4-оксо-циклогексанкарбоновой кислоты этиловый эфир (1,0 г, 5,88 ммоль) в течение 5 минут. Раствор оставляли для медленного нагревания до комнатной температуры и перемешивали в течение 2 ч. Затем раствор перемешивали при 50°С в течение ночи. Растворитель отгоняли при пониженном давлении, а получившийся неочищенный остаток разделяли между CH2Cl2 (50 мл) и насыщенным раствором NH4Cl (30 мл). Органический слой отбирали, а водный слой экстрагировали CH2Cl2 (2×30 мл). Органический слой промывали соляным раствором, сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта. Неочищенный остаток очищали с помощью колоночной хроматографии с получением соединения 21 в форме прозрачного масла (280 мг, 24%). 1Н ЯМР: 1.24 (t, 3Н, J=6.0 Hz), 1.43-1.50 (m, 2Н), 1.63 (s, 6Н), 1.74-1.83 (m, 2Н), 1.92-1.98 (m, 2Н), 2.39-2.47 (m, 1H), 2.58-2.69 (m, 2H).
Пример 9 Этил-4-(циклопропилметилен)циклогексанкарбоксилат
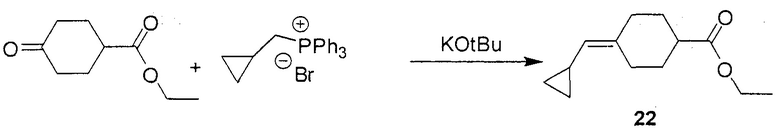
[0144] К суспензии циклопропилметилтрифенилфосфония йодида (3,5 г, 8,81 ммоль) в безводном ГТФ (20 мл) при 0°С добавляли раствор t-BuOK (1,19 г, 10,58 ммоль) в ТГФ (15 мл). Реакционную смесь оставляли для нагревания при комнатной температуре и перемешивали в течение 1 ч. Получавшуюся смесь охлаждали до 0°С и добавляли 4-оксо-циклогексанкарбоновой кислоты этиловый эфир (1,0 г, 5,88 ммоль) в течение 5 минут. Раствор оставляли для медленного нагревания до комнатной температуры и перемешивали в течение 2 ч. Затем раствор перемешивали при 50°С в течение ночи. Растворитель отгоняли при пониженном давлении, а получившийся неочищенный остаток разделяли между CH2Cl2 (50 мл) и насыщенным раствором NH4Cl (30 мл). Органический слой отбирали, а водный слой экстрагировали CH2Cl2 (2×30 мл). Органический слой промывали соляным раствором, сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта. Неочищенный остаток очищали с помощью колоночной хроматографии с получением соединения 22 в форме бесцветного масла (800 мг, 65%). 1Н ЯМР: CDCl3 0.22-0.26 (m, 2Н), 0.62-0.68 (m, 2Н), 1.22 (t, 3Н, J=7.2 Hz), 1.39-1.47 (m, 3Н), 1.75-2.04 (m, 4Н), 2.14-2.20 (m, 1H), 2.37-2.46 (m, 1H), 2.67-2.75 (m, 1H), 4.10 (q, 2H, J=7.2 Hz), 4.49 (d, 1H, J=9.3 Hz).
Пример 10 Этил-4-(тритилокси)циклогексанкарбоксилат
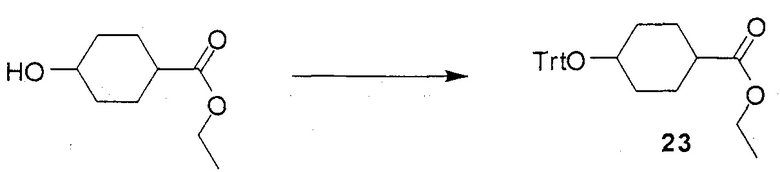
[0145] К раствору трифенилметилхлорида (0,97 г, 3,48 ммоль) в дихлорметане (10 мл) добавляли DBU (0,61 мл, 4,06 ммоль) и этил-4-гидроксициклогексанкарбоксилат (500 мг, 2,90 ммоль) и нагревали полученную смесь в сосуде с обратным холодильником в течение 24 ч. Реакционную смесь охлаждали и добавляли к ней холодную воду (40 мл). Органический слой отбирали, а водный слой экстрагировали дихлорметаном (2×30 мл). Объединенные органические слои подвергали сушке (Na2SO4) и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью колоночной флеш-хроматографии с получением соединения 23 в форме бесцветного масла (714 мг, 59%). 1Н ЯМР: (смесь цис- и транс-изомеров (1:1.4)) 1.06 (t, 2Н, J=12.4 Hz), 1.16-1.26 (m, 14Н), 1.32-1.35 (m, 2H), 1.54-1.58 (m, 2H), 1.76-1.79 (m, 3H),1.95-2.04 (m, 2H), 2.11-2.22 (m, 2H), 3.35-3.41 (m, 1.4H), 3.72-3.76 (m, 1H), 4.04 (q, 2.8H, J=7.2 Hz), 4.14 (q, 2H, J=6.8 Hz), 7.22-7.27 (m, 24H, объединилась с CHCl3), 7.49-7.51 (m, 13H).
Пример 11 Метил-цис-4-аминоциклогексанкарбоксилата гидрохлорид
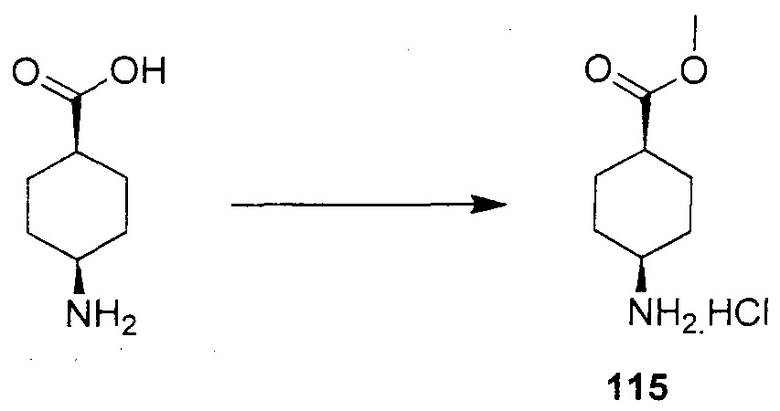
Раствор цис-4-аминоциклогексанкарбоновой кислоты (1,04 г, 7,26 ммоль) в 10 мл метанола охлаждали до 0°С и добавляли тионилхлорид (1,58 мл, 21,79 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 18 ч. Реакционный раствор концентрировали, а остаток промывали этиловым эфиром с получением соединения 115 в форме бесцветных кристаллов (1,3 г, 92%). 1Н ЯМР (CD3OD): 1.73-1.77 (m, 4Н), 1.92-1.96 (m, 2Н), 2.16-2.73 (m, 2Н), 2.70-2.73 (m, 1H), 3.19-3.24 (m, 1Н), 3.74 (s, 3Н).
Пример 12 Метил-цис-4-бензамидоциклогексанкарбоксилат
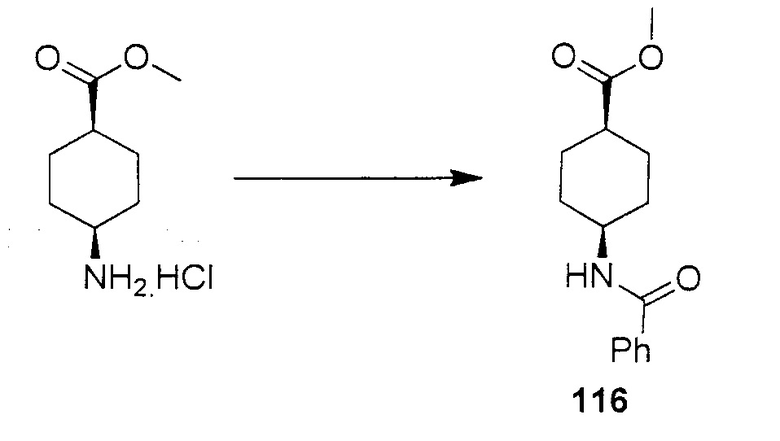
[0146] К суспензии метил-цис-4-аминоциклогексанкарбоксилата гидрохлорида (0,63 г, 3,26 ммоль) в CH2Cl2 (10 мл) при 0°С добавляли диизопропилэтиламин (1,71 мл, 9,79 ммоль) и подвергали ее смешиванию в течение 10 минут. По каплям добавляли бензоилхлорид (0,45 мл, 3,92 ммоль), а получившийся прозрачный раствор нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь разбавляли водой (15 мл) и CH2Cl2 (15 мл), отбирали органический слой, а водный слой экстрагировали CH2Cl2 (2×25 мл). Объединенные органические экстракты сушили Na2SO4 и концентрировали при пониженном давлении с получением 116 в форме прозрачного геля (850 мг, 100%). 1Н ЯМР: 1.70-1.73 (m, 2Н), 1.76-1.90 (m, 4Н), 1.95-2.06 (m, 2Н), 2.55-2.61 (m, 1Н), 3.72 (s, 3Н), 4.14-4.20 (m, 1H), 6.14 (d, 1Н, J=6.0 Hz), 7.43-7.47 (m, 2Н), 7.49-7.51 (m, 1Н), 7.76-7.78 (m, 2Н).
Пример 13 Метил-транс-4-аминоциклогексанкарбоксилата гидрохлорид
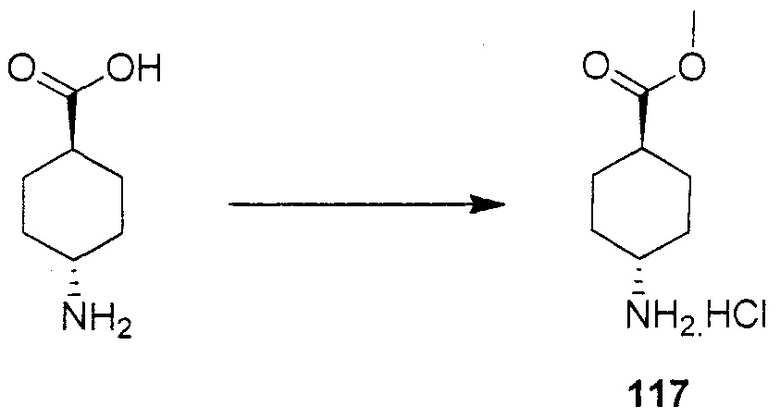
Раствор транс-4-аминоциклогексанкарбоновой кислоты (1,24, 8,66 ммоль) в 12 мл метанола охлаждали до 0°С и добавляли тионилхлорид (1,89 мл, 25,98 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 18 ч. Реакционный раствор концентрировали, а остаток промывали этиловым эфиром с получением соединения 117 в форме бесцветных кристаллов (1,61 г, 95%). 1Н ЯМР (CD3OD): 1.43-1.61 (m, 4Н), 2.11-2.15 (m, 4Н), 2.39 (dt, 1Н, J=2.8, 11.8 Hz), 3.12 (dt, 1Н, J=3.2, 8.0 Hz), 3.70 (s, 3H).
Пример 14 Метил-транс-4-бензамидоциклогексанкарбоксилат
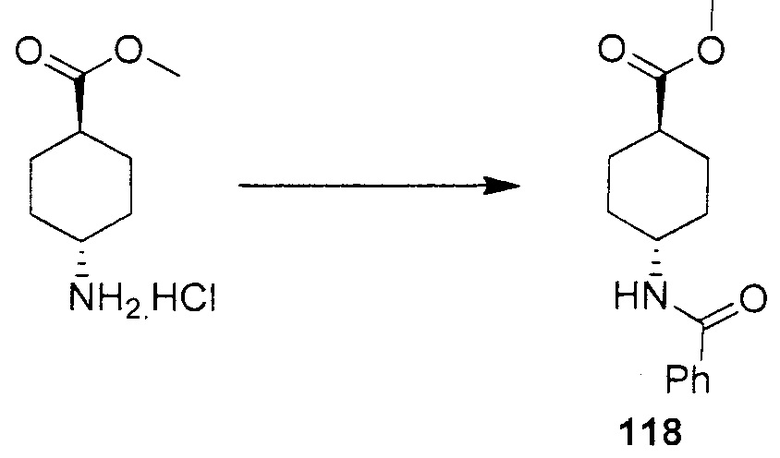
[0147] К суспензии метил-транс-4-аминоциклогексанкарбоксилата гидрохлорида, 9,79 ммоль) и подвергали ее смешиванию в течение 10 минут. По каплям добавляли бензоилхлорид (0,45 мл, 3,92 ммоль), а получившийся прозрачный раствор нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь разбавляли водой (15 мл) и CH2Cl2 (15 мл), отбирали органический слой, а водный слой экстрагировали CH2Cl2 (2×25 мл). Объединенные органические экстракты сушили Na2SO4 и концентрировали при пониженном давлении с получением соединения 118 в форме белого твердого вещества (200 мг, 24%). 1H ЯМР (CD3OD): 1.46 (q, 2Н, J=11.5 Hz), 1.60 (q, 2Н, J=12.0 Hz), 2.09 (d, 4H, J=11.2 Hz), 2.37 (t, 1H, J=12.0 Hz), 3.71 (s, 3H), 3.90 (t, 1H, J=11.4 Hz), 7.46-7.57 (m, 3H), 7.83 (d, 2H, J=7.1 Hz).
Пример 15 1-трет-бутил 3-метилазетидин-1,3-дикарбоксилат
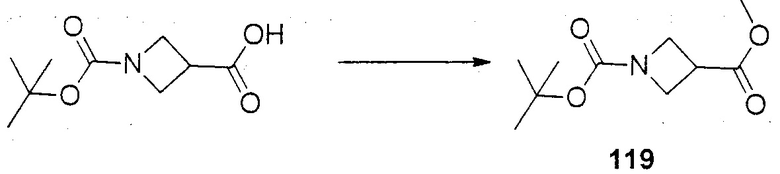
[0148] 1-(t-бутоксикарбонил)азетидин-3-карбоновую кислоту (2,03 г, 10,09 ммоль) растворяли в МеОН (10 мл) и DCM (10 мл), а затем охлаждали до 0°С. Затем по каплям в течение 5 минут добавляли 2М раствор триметилсилилдиазометана в эфире (7,57 мл, 15,1 ммоль). Раствор перемешивали в течение 10 минут при 0°С, а затем нагревали до комнатной температуры в течение 30 минут. Для удаления летучих веществ раствор концентрировали при пониженном давлении с получением неочищенного соединения 119, которое затем использовалось в следующей стадии синтеза без дополнительной очистки. 1Н ЯМР: 1.44 (s, 9Н), 3.35 (m, 1Н), 3.75 (s, 3Н), 4.10 (d, 4Н, J=7.6 Hz).
Пример 16 Метил-цис-4-гидроксициклогексанкарбоксилат
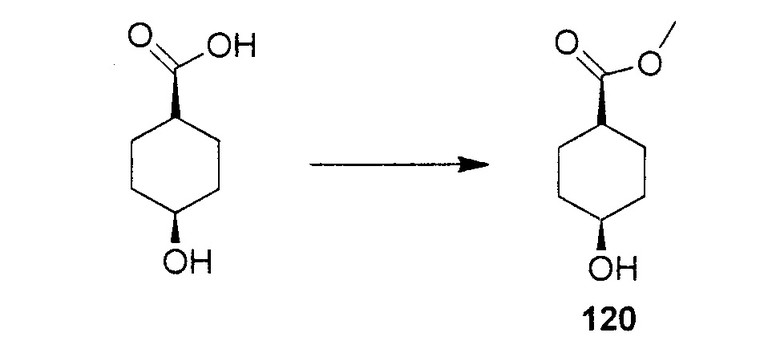
[0149] К раствору цис-4-гидроксициклогексанкарбоновой кислоты (5,0 г, 34,7 ммоль) в обезвоженном МеОН (40 мл) при комнатной температуре добавляли концентрированную H2SO4 (0,2 мл, 3,47 ммоль) и полученный раствор перемешивали при 65°С в течение 16 ч. Растворитель отгоняли, неочищенный остаток растворяли в EtOAc (40 мл) и промывали полученный раствор насыщенным раствором NaHCO3 (25 мл). Органический слой отбирали, а водный слой экстрагировали EtOAc (2×20 мл). Объединенные органические экстракты подвергали сушке Na2SO4 и концентрировали при пониженном давлении с получением соединения 120 (4,90 г, 89%). 1H ЯМР: 1.62-2.01 (m, 8Н), 2.34-2.38 (m, 1Н), 3.64 (s, 3Н), 3.82-3.88 (m, 1Н).
Пример 17 Метил-цис-4-(бензилокси)циклогексанкарбоксилат
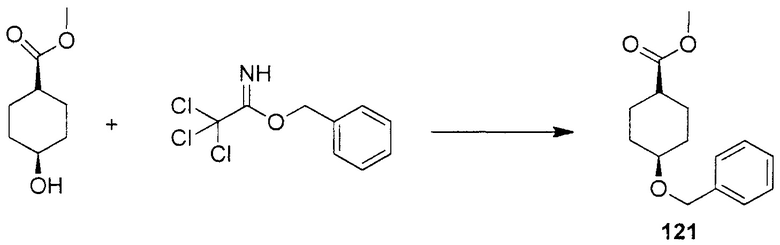
К раствору метил-цис-4-гидроксициклогексанкарбоксилата (4,80 г, 30,3 ммоль) в смеси гексан/CHCl3 2:1 (60 мл) добавляли бензилтрихлорацетамид (9,19 г, 36,4 ммоль) и трифторметансульфоновую кислоты (683 мг, 4,55 ммоль) при 23°С. Реакционную смесь перемешивали в течение 18 ч и разбавляли EtOAc (300 мл). Смесь промывали насыщенным водным раствором NaHCO3, водой и соляным раствором. Органический слой подвергали сушке безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью колоночной хроматографии на силикагеле с получением соединения 121 (4,60 г, 18,5 ммоль). 1Н ЯМР: 1.55-1.98 (m, 8Н), 2.36-2.41 (s, 1H), 3.56-3.66 (, 1Н), 3.67 (s, 3Н), 4.51 (s, 2Н), 7.28-7.35 (m, 5Н).
Пример 18 Общая схема реакции метилпиперидин-4-карбоксилата гидрохлорида с хлорангидридами
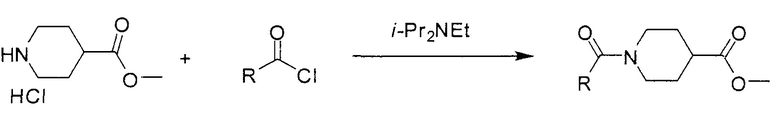
[0150] К суспензии метилпиперидин-4-карбоксилата гидрохлорида (5,6 ммоль) в CH2Cl2 (20 мл) при 0°С добавляли диизопропилэтиламин (16,7 ммоль) и перемешивали ее в течение 10 минут. По каплям добавляли соответствующий хлорангидрид (8,4 ммоль) и оставляли раствор для нагревания при комнатной температуре и перемешивания в течение ночи. Реакционную смесь разбавляли водой (15 мл) и CH2Cl2 (15 мл). Органический слой отбирали, а водный слой экстрагировали CH2Cl2 (2×20 мл). Объединенные органические экстракты подвергали сушке (Na2SO4) и концентрировали при пониженном давлении с получением следующих соединений.
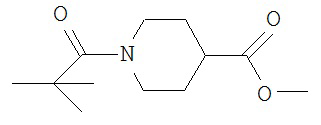
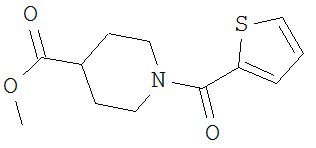
Пример 19 Метил-2-бром-3-фторбензоат
[0151] К суспензии 2-бром-3-фторбензойной кислоты (300 мг, 1,37 ммоль) в метаноле (10 мл) при комнатной температуре добавляли SOCl2 (0,11 мл, 1,51 ммоль), полученную смесь подвергали смешиванию при комнатной температуре в течение 18 ч. Растворитель отгоняли при пониженном давлении. Неочищенный остаток подщелачивали путем добавления насыщенного водного раствора NaHCO3, а водный слой экстрагировали EtOAc (3×25 мл). Объединенные органические слои подвергали сушке Na2SO4, фильтровали и концентрировали. Полученный неочищенный продукт использовали в следующей стадии без дополнительной очистки.
Пример 20 Метил-3-фтор-2-(1-тритил-1H-имидазол-4-ил)бензоат
[0152] К перемешанному раствору 4-йод-1-тритил-1H-имидазола (436 мг, 1,0 ммоль) в безводном ТГФ (6 мл) добавляли EtMgBr (3,0 М в ТГФ, 1,20 ммоль, 0,40 мл) в атмосфере N2. Получившийся раствор оставляли для перемешивания в течение 90 минут и добавляли ZnCl2 (0,5 М в ТГФ, 2,40 мл, 1,20 ммоль). Получившуюся белую суспензию оставляли для перемешивания в течение 90 минут, после чего добавляли раствор метил-2-бром-3-фторбензоата (280 мг, 1,20 ммоль) в ТГФ (1 мл), с последующим незамедлительным добавлением Pd(PPh3)4 (58 мг, 0,05 ммоль). Реакционную смесь оставляли для перемешивания при 90°С в течение 18 ч в атмосфере N2. После охлаждения до комнатной температуры раствор разбавляли CH2Cl2 (20 мл), органический слой промывали ЭДТА (водный) буфером (рН=9) (2×5 мл) и соляным раствором. Органический слой подвергали сушке (Na2SO4) и концентрировали при пониженном давлении. Неочищенный остаток очищали метолом колоночной флеш-хроматографии с получением желаемого продукта в форме желтого масла (190 мг, 41%). 1H ЯМР: 3.93 (s, 3Н), 7.12-7.59 (m, 18Н), 7.56 (s, 1H), 7.73-7.75 (m, 1Н).
Пример 21 3-фтор-2-(1-тритил-1H-имидазол-4-ил)бензальдегид
[0153] К раствору метил-3-фтор-2-(1-тритил-1H-имидазол-4-ил)бензоата (62 мг, 0,134 ммоль) в толуоле (4 мл) при -78°С добавляли по каплям раствор DIBAH (1 М, 0,161 мл, 0,161 ммоль). Перемешивание продолжали на протяжении 10 минут. При такой температуре добавляли безводный метанол. Смесь помещали в насыщенный водный раствор NH4Cl (5 мл) и разбавляли EtOAc (15 мл), тщательно встряхивая в течение 3 минут, добавляли соляной раствор (5 мл), опять встряхивали, разделяли фазы и сушили органический слой Na2SO4, затем фильтровали и выпаривали с получением желаемого альдегида, который затем использовался без дополнительной очистки.
Пример 22 Общая схема синтеза диметил-(2-оксо)фосфонатов
[0154] К перемешанному раствору диметил-метилфосфоната (3,14 г, 25,3 ммоль) в 20 мл безводного тетрагидрофурана при -78°С по каплям добавляли раствор n-бутил лития (10,13 мл, 25,3 ммоль, 2,5 М в гексанах) в атмосфере N2, затем смесь перемешивали в течение 30 минут. К данной реакционной смеси по каплям добавляли раствор соответствующего доступного в продаже метилового или этилового эфира или соединения 19-26, 91 или 115-121 (12,7 ммоль) в виде раствора в ТГФ (5 мл). После перемешивания в течение 30 минут, реакционную смесь оставляли для нагревания до 0°С и перемешивали в течение 1 ч. Растворитель отгоняли, а неочищенный остаток разбавляли насыщенным раствором NH4Cl (10 мл) и 10 мл воды. Смесь экстрагировали этилацетатом (2×40 мл). Объединенные слои этилацетата промывали водой (1×20 мл), соляным раствором (1×20 мл) и повергали сушке безводным натрия сульфатом. Раствор фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищали колоночной хроматографией с получением следующих соединений.
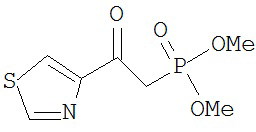
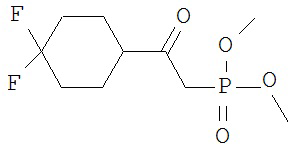
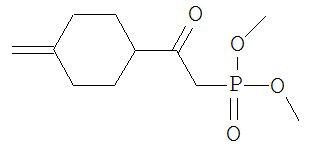
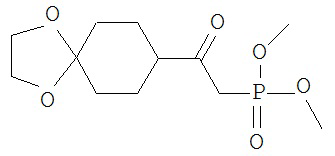
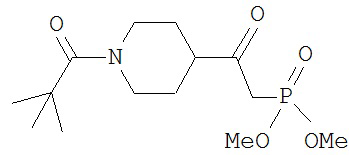
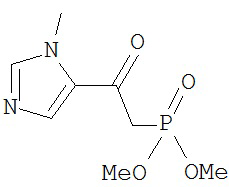
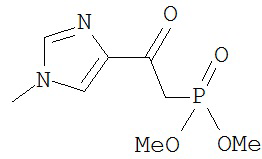
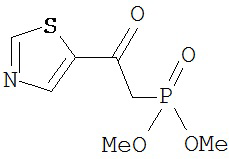
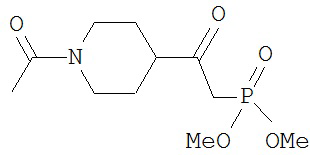
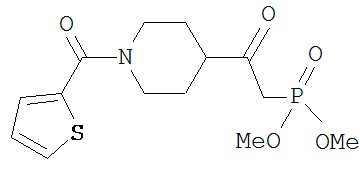
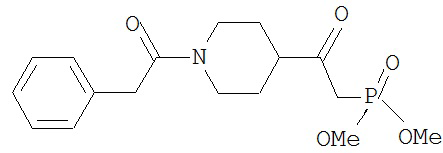
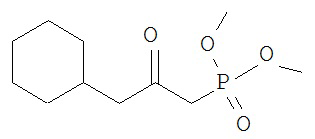
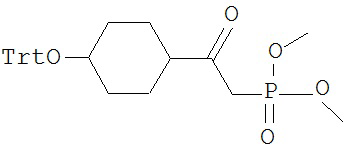
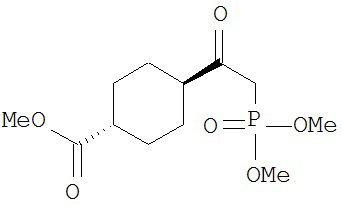
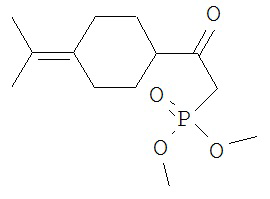
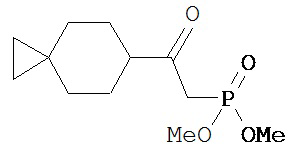
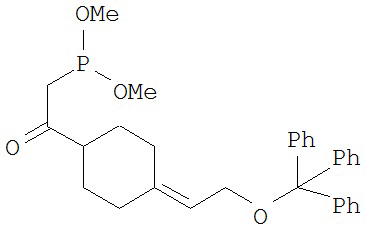
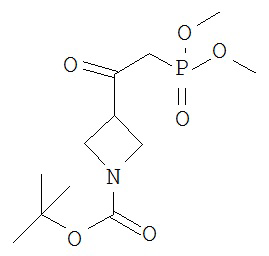
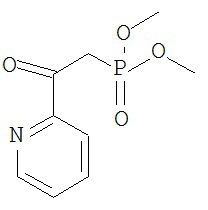
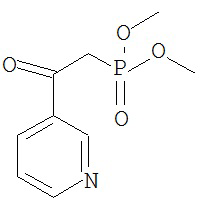
Пример 23 Общая схема синтеза 2-(5H-имидазо[5,1-a]изоиндол-5-ил)этанонов реакцией Хорнера-Вадсворта-Эммонса с последующей циклизацией.
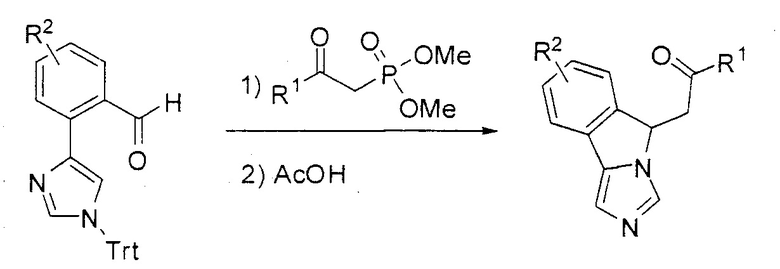
[0155] К суспензии 95% NaH (17,4 мг, 0,7 ммоль) в ТГФ (3 мл) при 0°С добавляли соответствующий фосфонатный реагент 27-46, 89, 90 или 122-135 (0,75 ммоль) в виде. раствора в ТГФ (2 мл) и перемешивали полученную смесь в течение 40 минут. Соответствующий 2-(1-тритил-1H-имидазол-4-ил)бензальдегид добавляли по каплям в виде раствора в ТГФ (3 мл) в течение 3 минут. Оставляли реакционную смесь для нагревания до комнатной температуры и перемешивали в течение ночи. Растворитель удаляли при пониженном давлении, а неочищенный остаток разбавляли насыщенным раствором NH4Cl (10 мл) и водой (10 мл). Водный слой экстрагировали CH2Cl2 (2×20 мл), а объединенные органические фракции промывали соляным раствором (15 мл), сушили Na2SO4 и концентрировали при пониженном давлении с получением неочищенного продукта. К неочищенному остатку добавляли АсОН (1 мл) и МеОН (3 мл) и перемешивали раствор при 90°С в течение 2 ч. После охлаждения до комнатной температуры растворитель отгоняли, а неочищенный остаток подвергали смешиванию со смесью насыщенного раствора К2СО3 (5 мл) и EtOAc (5 мл). Органический слой отделяли, а водный слой экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали водой, соляным раствором и подвергали сушке (Na2SO4), растворитель выпаривали при пониженном давлении. Неочищенный остаток очищали с помощью колоночной флеш-хроматографии на силикагеле, с получением следующих соединений.
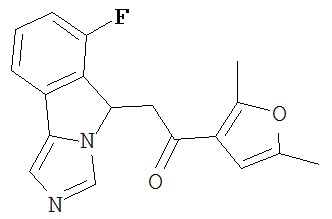
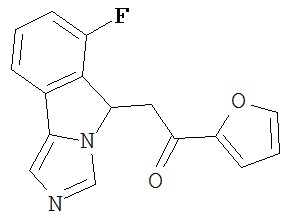
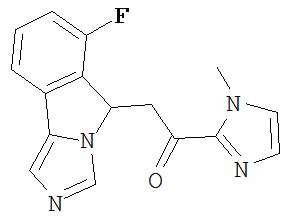
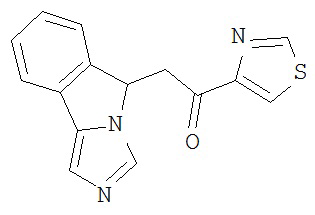
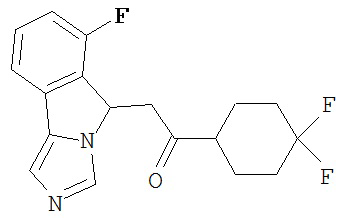
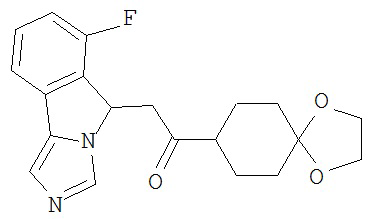
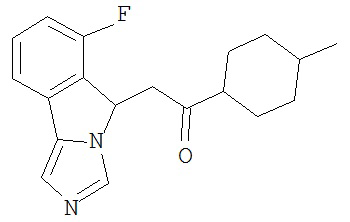
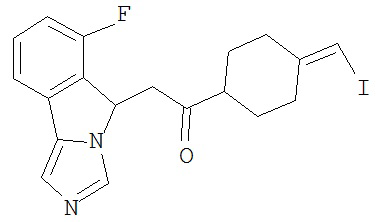
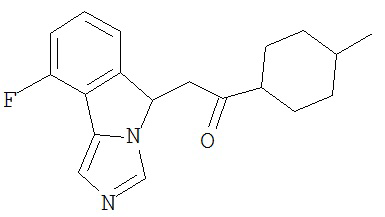
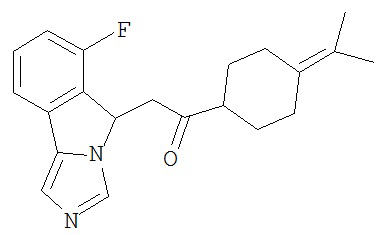
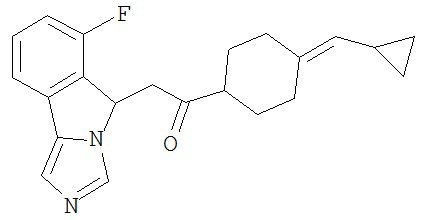
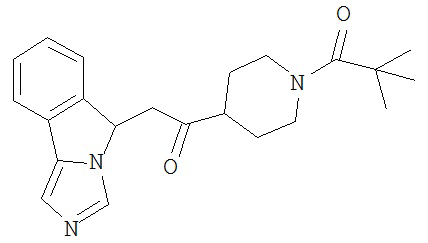
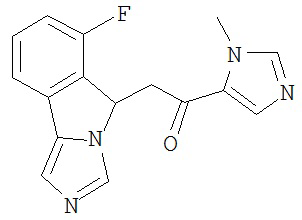
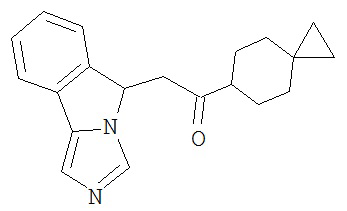
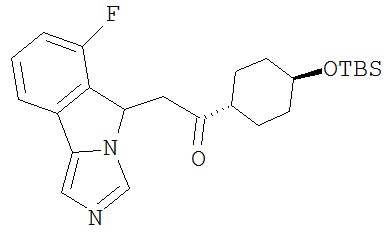
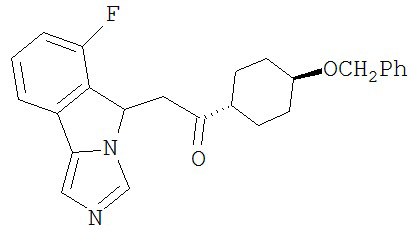
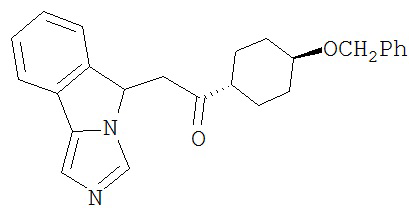
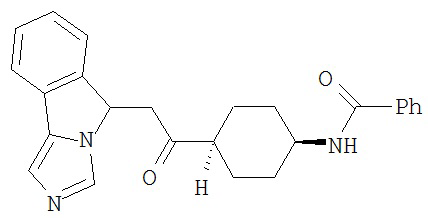
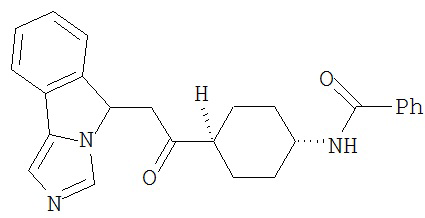
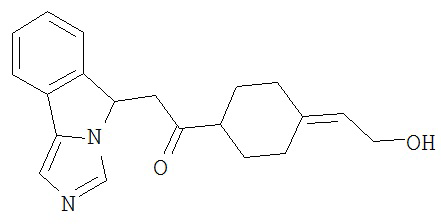
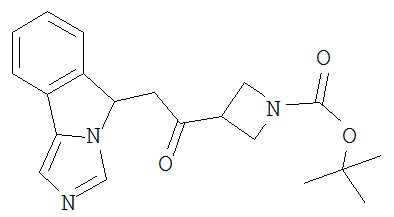
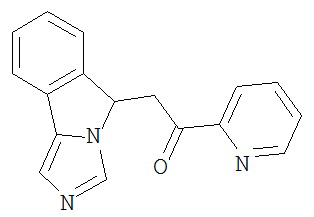
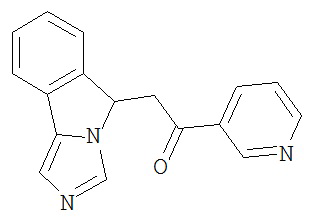
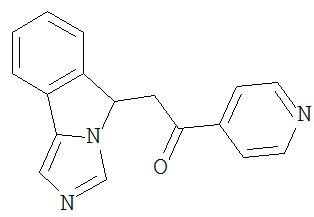
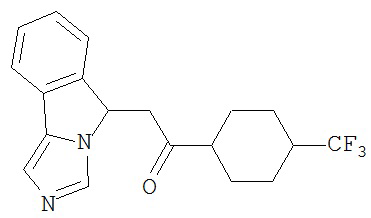
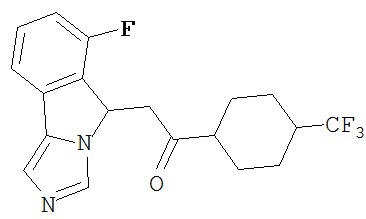
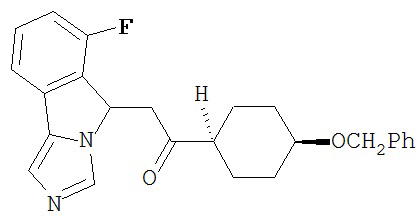
Пример 24 1-(циклогекс-3-енил)-2-(6-фтор-5H-имидазо[5,1-a]изоиндол-5-ил)этанон
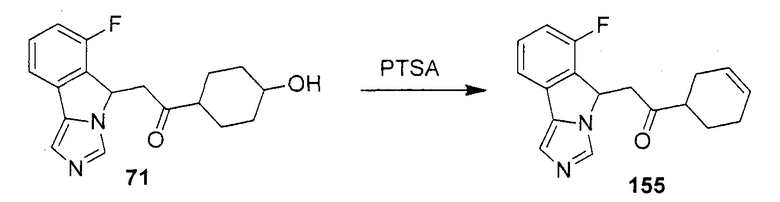
[0156] 71 (270 мг, 0,86 ммоль) растворяли в бензоле (7 мл) и добавляли р-толуолсульфоновую кислоту (444 мг, 2,58 ммоль). Реакционную смесь нагревали до 100°С в течение 48 ч и концентрировали. Остаток подщелачивали водным раствором карбоната калия (5 мл). Водный раствор экстрагировали этилацетатом (2×20 мл). Объединенные органические слои промывали водой, соляным раствором, сушили Na2SO4, фильтровали и концентрировали. Остаток очищали колоночной флеш-хроматографией с получением соединения 155 в форме желтого геля (218 мг, 86%). 1H ЯМР: 1.35-1.71 (m, 1H), 1.88-2.40 (m, 5Н), 2.62-2.67 (m, 1Н), 2.74-2.87 (m, 1H), 3.47-3.58 (m, 1Н), 5.66-5.75 (m, 3Н), 6.91 (t, 1H, J=8.9 Hz), 7.15 (s, 1Н), 7.26-7.35 (m, 2H), 7.62 (d, 1H, J=9.8 Hz).
Пример 25 Общая схема восстановления 2-(5H-имидазо[5,1-a]изоиндол-5-ил)этанонов до 2-(5H-имидазо[5,1-a]изоиндол-5-ил)этанолов.
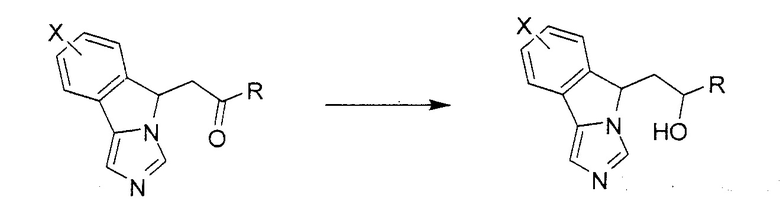
[0157] К раствору соответствующего кетона (9-18, 47-72, 136-153, 155, 1256, 1287, 1300, 1306, 1326, 1328, 1334, 1348 или 1353) (0,25 ммоль) в МеОН (2 мл) при 0°С, добавляли NaBH4 (0,75 ммоль) и оставляли раствор для перемешивания в течение 1 ч. Растворитель удаляли при пониженном давлении и добавляли к неочищенному остатку 2М HCl (2 мл). Раствор оставляли для перемешивания в течение 10 минут и подщелачивали насыщенным раствором К2СО3. The водный слой экстрагировали CH2Cl2 (3×5 мл). Объединенные органические слои промывали соляным раствором, сушили (MgSO4) и концентрировали при пониженном давлении с получением неочищенного остатка. Неочищенный остаток очищали колоночной хроматографией с использованием градиента 1-10% MeOH:DCM с получением следующих соединений.
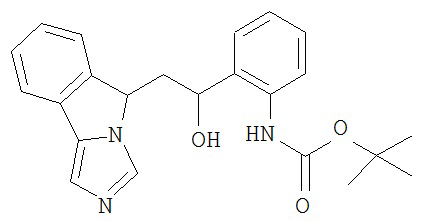
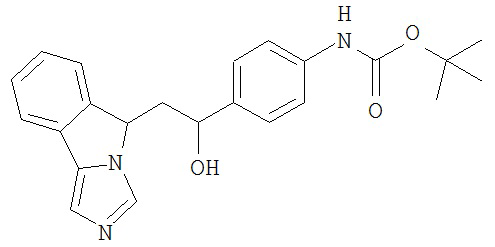
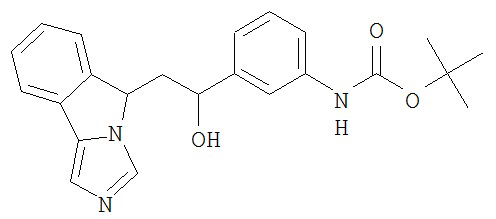
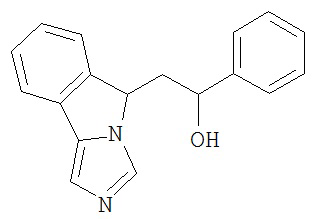
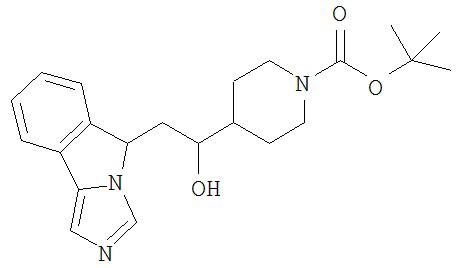
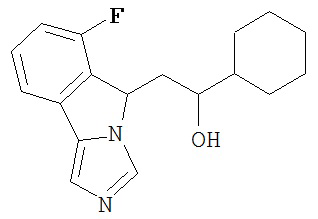
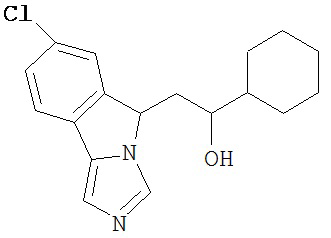
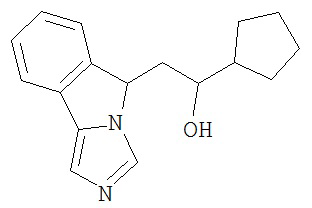
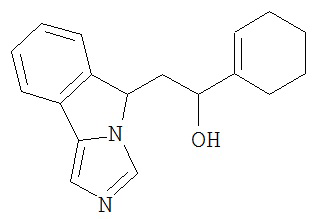
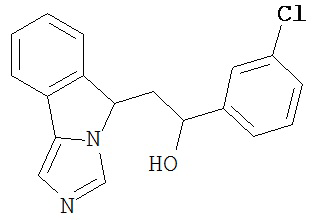
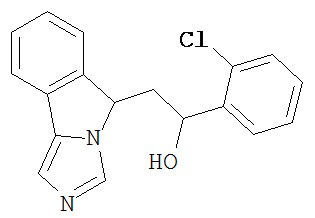
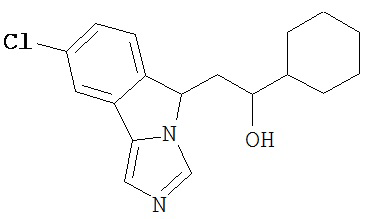
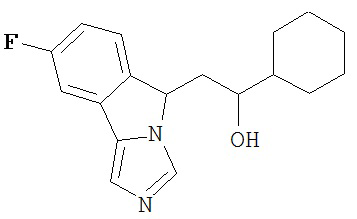
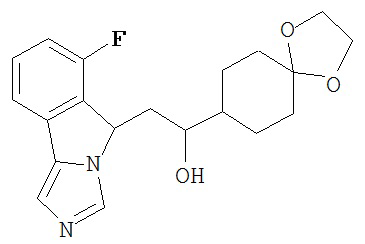
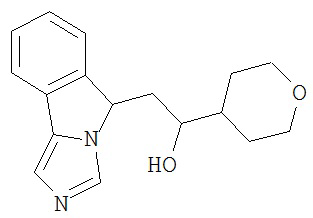
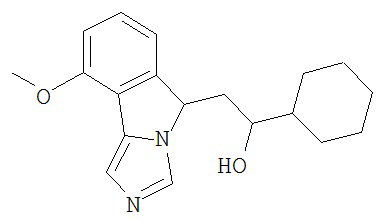
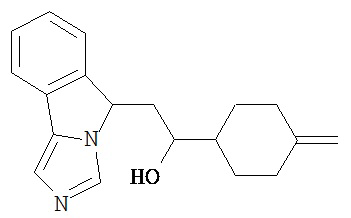
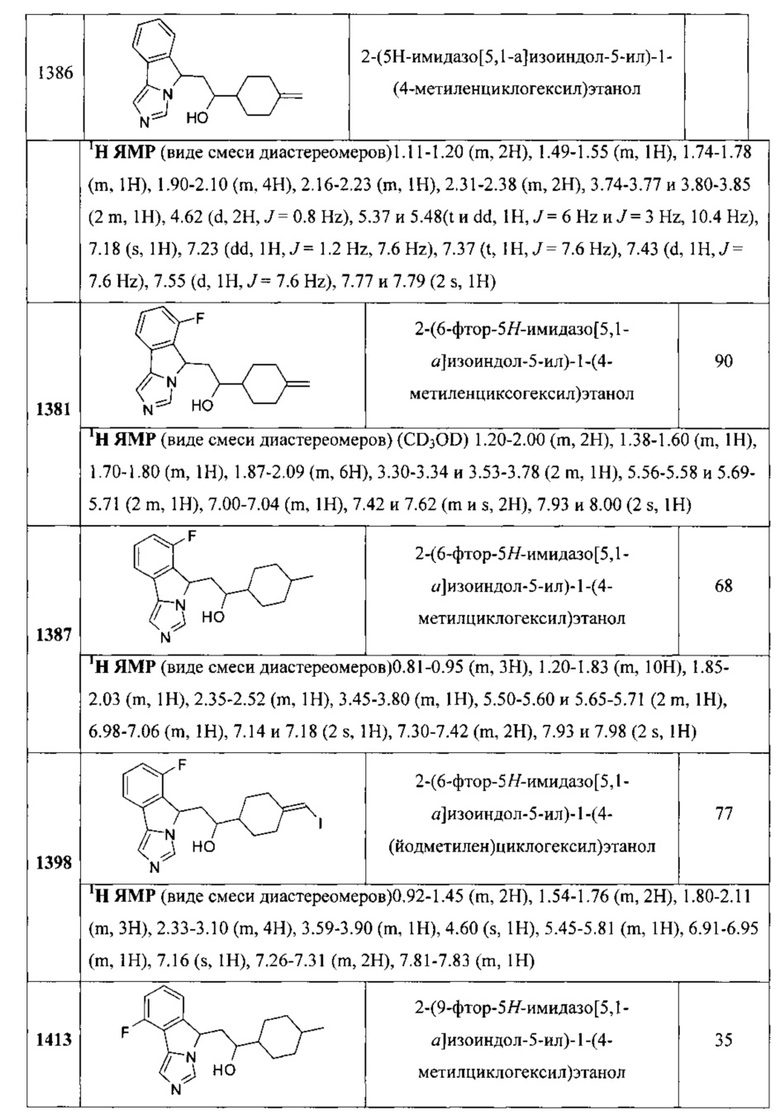
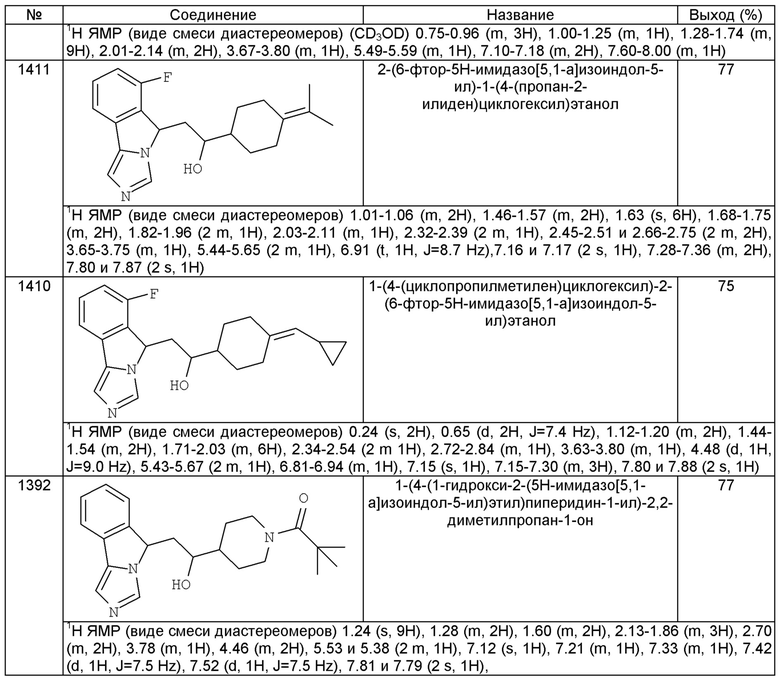
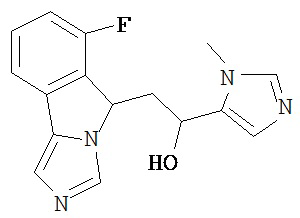
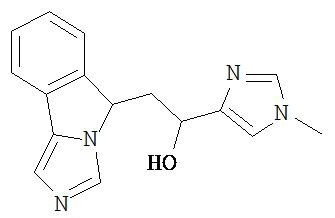
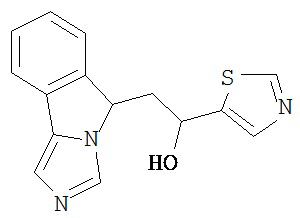
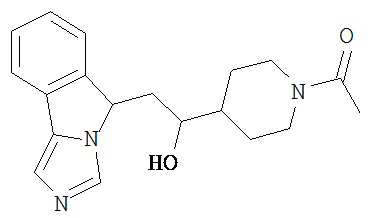
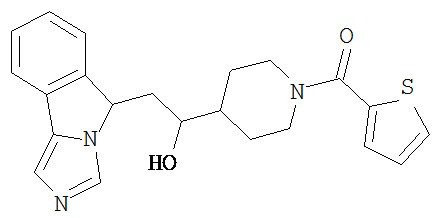
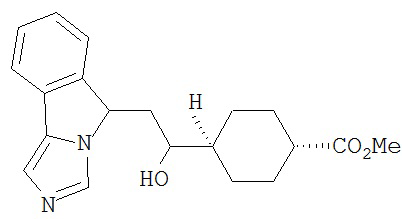
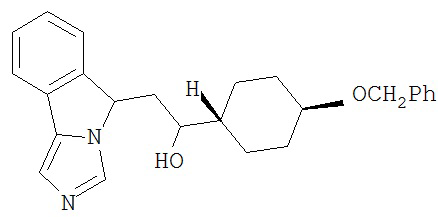
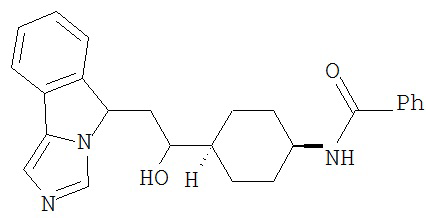
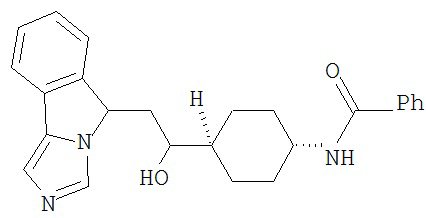
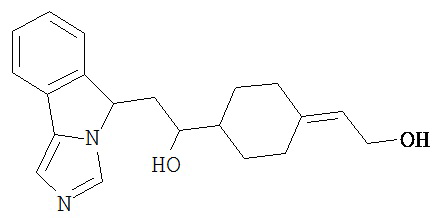
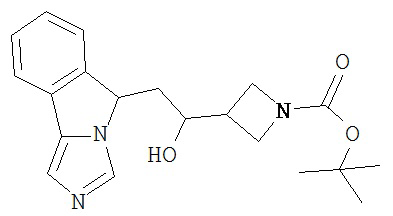
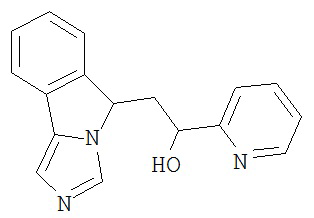
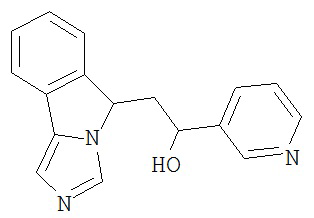
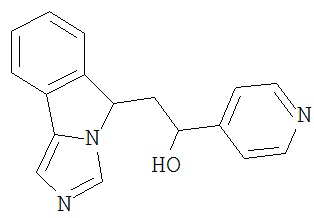
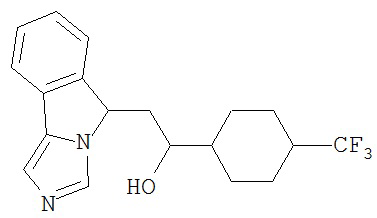
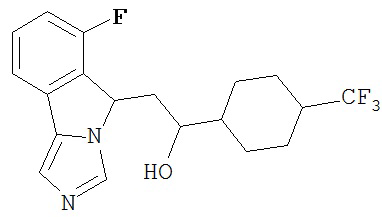
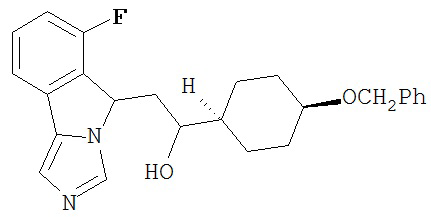
Пример 26 Получение 1469-1472
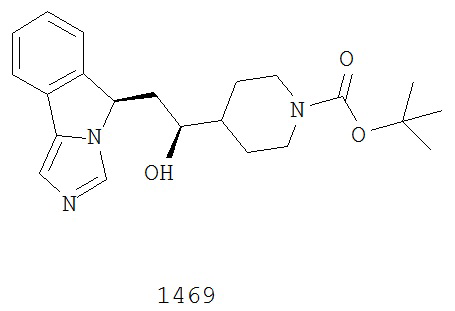
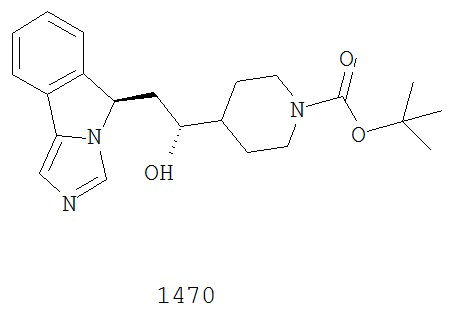
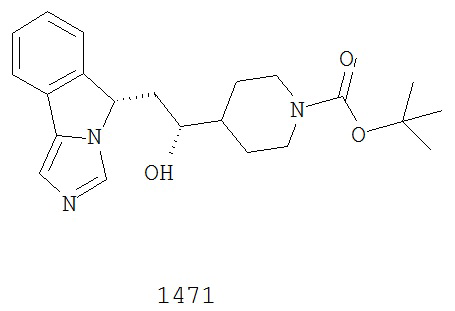
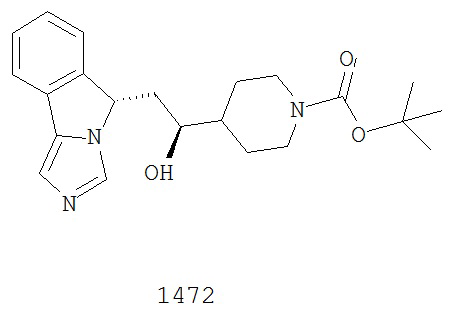
Чистые диастереоизомеры получали из рацемической смеси соединения 1363 с помощью подготовительной хиральной сверхкритической хроматографии (SFC) с использованием колонки AD-H (Regis Technologies, Inc.) в смеси метанол: СО2 (24:76).
Пример 27 Общая схема удаления защитной группы Boc
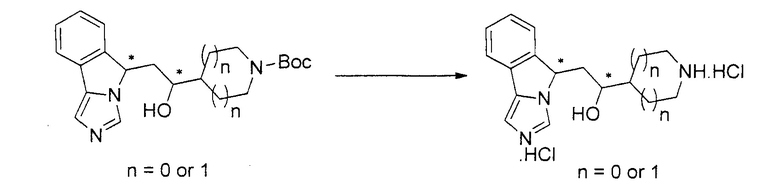
К раствору соответствующего Вос-защищенного амина 1363, 1469, 1470, 1471, 1472 или 1460 (1,13 ммоль) в дихлорметане (10 мл) добавляли трифторуксусную кислоту (33,8 ммоль). Получившийся раствор подвергали смешиванию при комнатной температуре в течение 2 ч и концентрировали. Неочищенный остаток растворяли в метаноле (4 мл) и добавляли хлороводород (4М в диоксане) (3,39 ммоль). Смесь концентрировали и подвергали сушке под вакуумом с получением желаемого продукта в форме дигидрохлоридной соли, которая использовалась в следующей стадии синтеза без предварительной очистки.
Пример 28 Общая схема синтеза 1423, 1424,1425, 1437, 1439, 1448, 1450, 1458, 1480, 1481, 1490, 1493, 1500 и 1511 с помощью связывания с HATU.
Во флакон, содержащий соответствующую соль амина, полученную в Примере 27 (0,25 ммоль) в ДМФ (4 мл), добавляли соответствующую карбоновую кислоту (0,26 ммоль), DIPEA (1,5 ммоль) и HATU (0,28 ммоль). Реакционную смесь подвергали смешиванию при комнатной температуре в течение 18 ч и помещали в воду (10 мл), водный слой экстрагировали дихлорметаном (2×20 мл). Объединенные органические слои промывали водой (2×10 мл), сушили Na2SO4 и концентрировали. Неочищенный продукт очищали колоночной флеш-хроматографией с получением соединений 1423, 1424, 1425, 1437, 1439, 1448, 1450, 1458, 1480, 1481, 1490, 1493 или 1500.
Пример 29 Общая схема синтеза 1449, 1459, 1476, 1477, 1478 и 1479.
Во флакон, содержащий соответствующую соль амина, полученную в Примере 19 (0,25 ммоль) в дихлорметане (4 мл), добавляли DIPEA (1,0 ммоль) и фенилизоцианат (0,25 ммоль). Реакционную смесь подвергали смешиванию при комнатной температуре в течение 30 минут и концентрировали. Остаток растворяли в дихлорметане (30 мл) и промывали водой (3×10 мл). Органический слой подвергали сушке Na2SO4 и концентрировали. Неочищенный продукт очищали колоночной флеш-хроматографией с получением мочевин 1449, 1459, 1476, 1477, 1478 и 1479.
Пример 30 Общая схема синтеза 1495, 1496, 1497, 1503, 1504, 1507, 1512.
К раствору соответствующего амина (0,3 ммоль) в CH2Cl2 (3 мл) добавляли карбонилдиимидазол (0,35 ммоль) и этилдиизопропиламин (2,0 ммоль) при 0°С в атмосфере N2 и перемешивали смесь в течение 1 ч. Добавляли соответствующую соль амина, полученную в Примере 19 (0,25 ммоль), и оставляли смесь для перемешивания в течение ночи. Раствор порционно промывали водой в делительной воронке и отбирали органические слои. Водный слой экстрагировали дихлорметаном (3×10 мл), объединенные органические фракции подвергали сушке (Na2SO4). Неочищенный остаток очищали колоночной флеш-хроматографией с получением соединений 1495, 1496, 1497, 1503, 1504 или 1507.
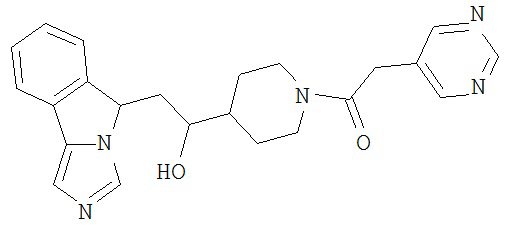
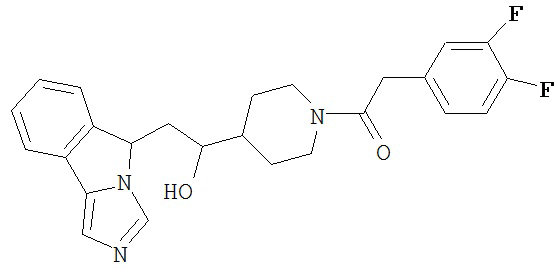
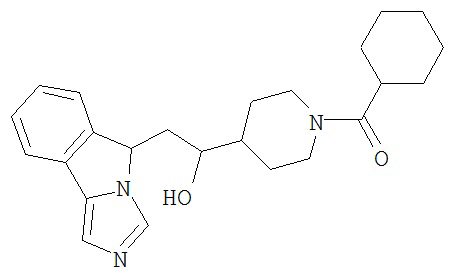
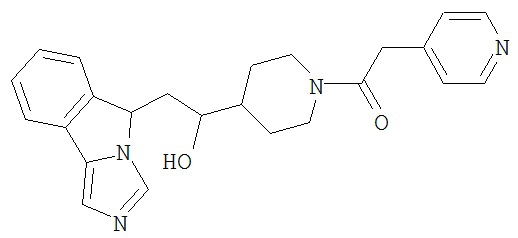
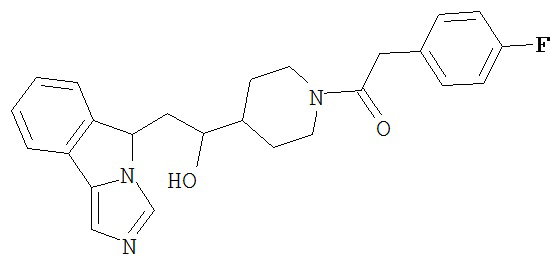
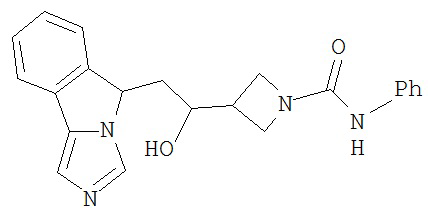
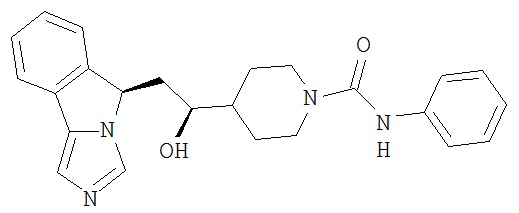
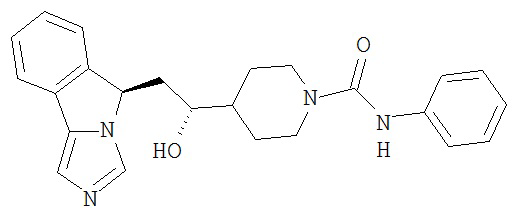
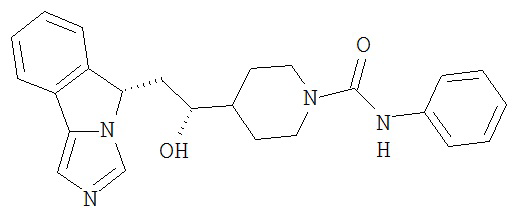
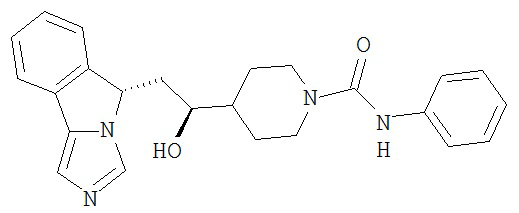
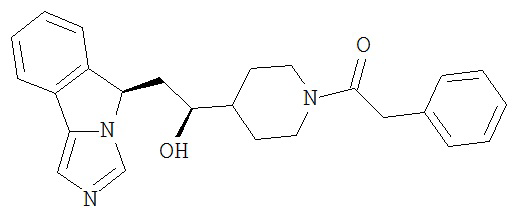
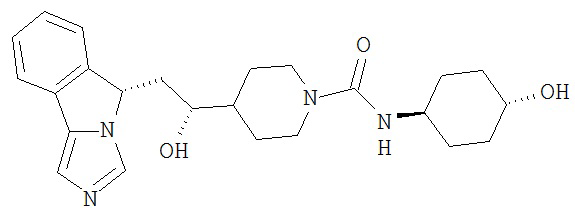
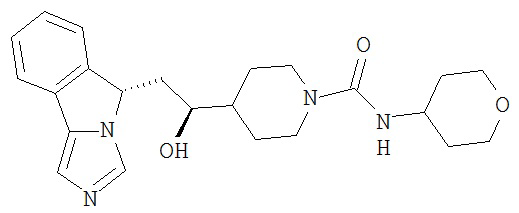
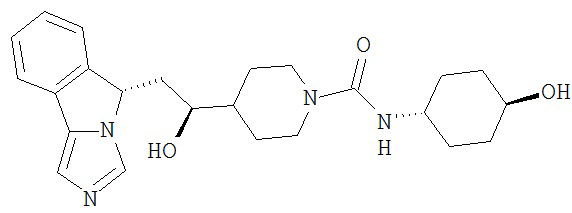
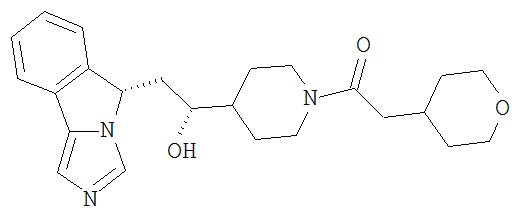
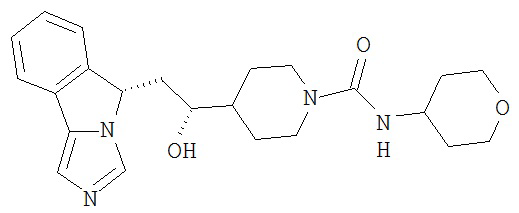
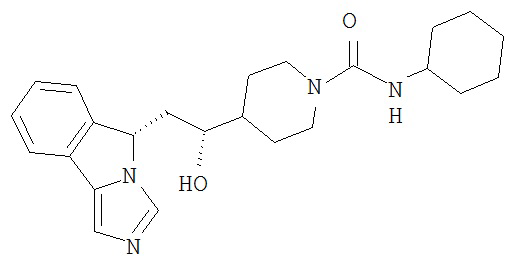
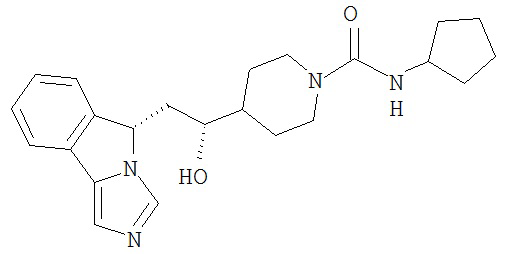
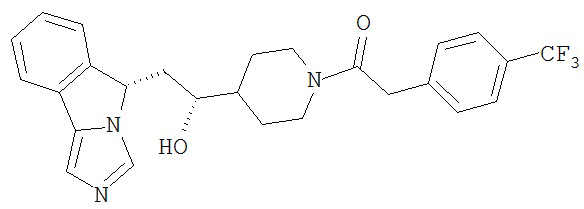
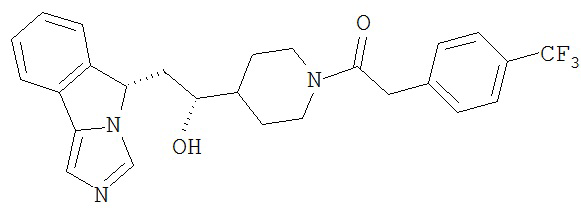
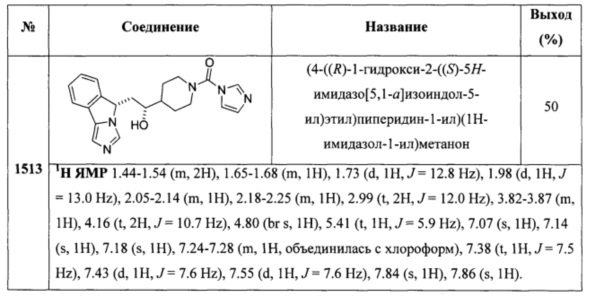
Пример 31 1-(1-(бензилсульфонил)пиперидин-4-ил)-2-(5H-имидазо[5,1-а]изоиндол-5-ил)этанол
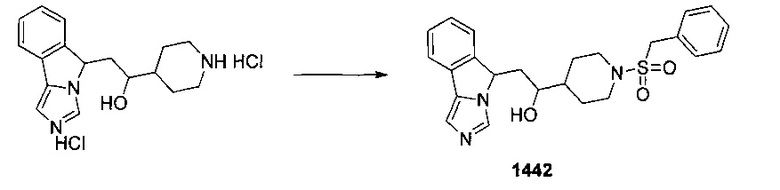
Во флакон, содержащий 2-(5H-имидазо[5,1-а]изоиндол-5-ил)-1-(пиперидин-4-ил)этанола дигидрохлорид (0,12 г, 0,34 ммоль) в CH2Cl2 (3 мл) добавляли этилдиизопропиламин (0,35 мл, 2,0 ммоль) и бензилсульфонилхлорид (67 мг, 0,35 ммоль). Реакционную смесь подвергали смешиванию при комнатной температуре в течение 18 ч и концентрировали. Остаток растворяли в дихлорметане (30 мл) и промывали водой (3×10 мл). Органический слой подвергали сушке Na2SO4 и концентрировали. Неочищенный продукт очищали колоночной флеш-хроматографией с получением соединения 1422 в форме белого твердого вещества (85 мг, 58%). 1Н ЯМР (виде смеси диастереомеров) 1.21-1.29 (m, 2Н), 1.34-1.36 (m, 1Н), 1.57-1.60 (m, 1H), 1.79-1.90 (m, 2Н), 2.03-2.10 (m, 1Н), 2.52-2.66 (m, 2Н), 3.55-3.63 (m, 2Н), 3.67-3.71 (m, 1H), 4.38 (s, 2Н), 5.03 и 5.14 (2d, 1H, J=6.0 Hz, ОН), 5.39 (t, 1H, J=6.8 Hz), 7.13 и 7.16 (2 s, 1H), 7.29 (t, 1H, J=7.2 Hz), 7.37-7.42 (m, 6H), 7.60 (dd, 2H, J=7.8, 14.2 Hz), 7.92 и 7.95 (2 s, 1H).
Пример 32 2-(5H-имидазо[5,1-a]изоиндол-5-ил)уксусная кислота
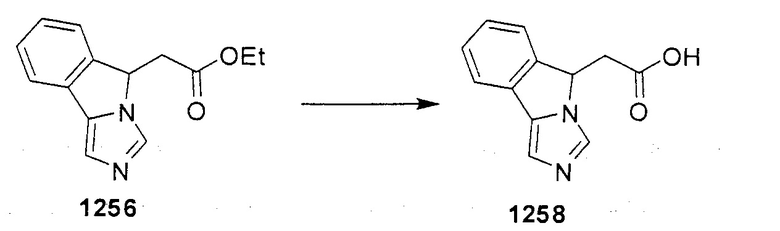
[0158] К раствору соединения 1256 (0,41 ммоль) в тетрагидрофуране (2 мл) при комнатной температуре добавляли LiOH⋅H2O (0,45 ммоль) и воду (0,5 мл). Раствор подвергали смешиванию в течение ночи. Растворитель отгоняли, а неочищенный остаток растворяли в метаноле (1,5 мл), затем добавляли этилацетат (2,5 мл), осажденное белое твердое вещество фильтровали, промывали этилацетатом и подвергали сушке при пониженном давлении с получением соединения 1258 (68 мг, 75%). 1H ЯМР: 2.10 (dd, 1Н, J=18.0 Hz, 9.0 Hz), 2.66 (dd, 1H, J=15.0 Hz, 3.0 Hz), 5.43-5.47 (m, 1H), 7.05 (s, 1H), 7.20 (t, 1H, J=9.0 Hz), 7.32 (t, 1H, J=9.0 Hz), 7.50-7.54 (m, 2H), 7.90 (s, 1H).
Пример 33 2-(5H-имидазо[5,1-a]изоиндол-5-ил)этанол
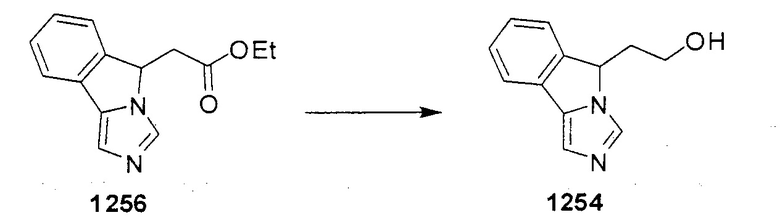
[0159] К раствору соединения 1256 (3,51 ммоль) в смеси 1:2 ТГФ:EtOH (24 мл) при комнатной температуре добавляли NaBH4 (12,28 ммоль) и LiCl (12,28 ммоль). После перемешивания в течение ночи растворители отгоняли, а неочищенный остаток разбавляли насыщенным раствором NH4Cl (20 мл). Водный слой экстрагировали CH2Cl2 (3×40 мл). Объединенные органические экстракты подвергали сушке MgSO4, а растворитель отгоняли при пониженном давлении с получением неочищенного остатка. Неочищенный продукт подвергали очистке кремнийдиоксидной флеш-хроматографией с получением соединения 1254 (638 мг, 91%). lH ЯМР: 2.04-2.08 (m, 1Н), 2.36-2.40 (m, 1Н), 3.84 (t, 2Н, J=6.3 Hz), 5.37-5.41 (m, 1H), 7.17 (s, 1Н), 7.25-7.28 (m, 1Н), 7.35 (d, 1Н, J=6.90 Hz), 7.38 (d, 1H, J=7.2 Hz), 7.54 (d, 1H, J=7.5 Hz), 7.76 (s, 1H).
Пример 34 2-(5H-имидазо[5,1-a]изоиндол-5-ил)-N-метилацетамид
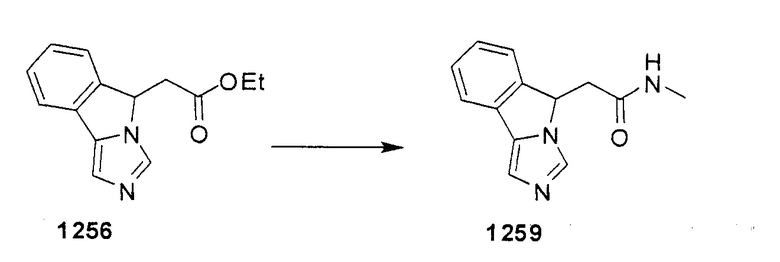
[0160] К раствору соединения 1256 (0,124 ммоль) в тетрагидрофуране (1,5 мл) при комнатной температуре добавляли раствор метиламина (1,24 ммоль, 0,62 мл, 2М в ТГФ) и перемешивали при 60°С в течение ночи. После охлаждения до комнатной температуры растворитель отгоняли при пониженном давлении, а неочищенный остаток очищали с помощью колоночной хроматографии с получением соединения 1259 (21 мг, 75%). 1Н ЯМР: 2.43 (dd, 1Н, J=20.0 Hz, 12.8 Hz), 2.91 (d, 3H, J=4.8 Hz), 2.94 (dd, 1H, J=20.0 Hz, 6.0 Hz) 5.69 (dd, 1H, J=12.8 Hz, 5.60 Hz), 5.81 (br s, 1H), 7.13 (s, 1H), 7.22-7.26 (m, 1H), 7.33 (d, 1H, J=8.4 Hz), 7.38 (d, 1H, J=7.2 Hz), 7.53 (d, 1H, J=7.80 Hz), 7.67 (s, 1H).
Пример 35 2-(5H-имидазо[5,1-a]изоиндол-5-ил)ацетальдегид
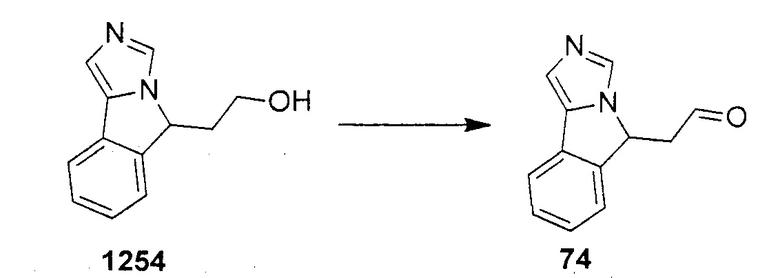
[0161] К раствору соединения 1254 (0,5 ммоль) в дихлорметане (5 мл) при 0°С добавляли пиридиния хлорхромат (0,6 ммоль) и оставляли раствор для нагревания до комнатной температуры. После перемешивания в течение 4 ч растворитель отгоняли при пониженном давлении, а неочищенный остаток очищали с помощью колоночной хроматографии с получением соединения 74 (63 мг, 64%). 1Н ЯМР: 2.99 (dd, 1Н, J=7.5 Hz, 6.0 Hz), 3.28 (dd, 1Н, J=12.0 Hz), 5.61-5.65 (m, 1H), 7.18 (s, 1H), 7.26-7.30 (m, 1H), 7.32 (d, 1H, J=6.0 Hz), 7.39 (t, 1H, J=6.0 Hz), 7.55 (d, 1H, J=6.0 Hz), 7.68 (s, 1H), 9.80 (s, 1H).
Пример 36 (Е)-5-(2-бромстирил)-5H-имидазо[5,1-a]изоиндол
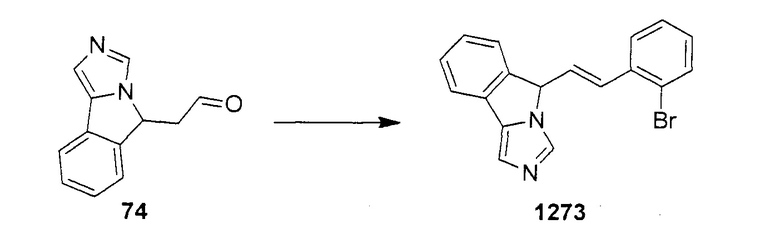
[0162] К раствору соединения 74 (1.21 ммоль) в тетрагидрофуране (4 мл) при -20°С по каплям добавляли iPrMgCl⋅LiCl (1,21 ммоль, 1,3 М в ТГФ). После перемешивания в течение 1 ч при -20°С добавляли 2-(5H-имидазо[5,1-a]изоиндол-5-ил)ацетальдегид в виде раствора в тетрагидрофуране (2 мл) и оставляли реакционную смесь для нагревания до -10°С. После перемешивания в течение 2 ч при -10°С реакцию гасили добавлением насыщенного раствора NH4Cl (2 мл) и воды (2 мл). Водный слой экстрагировали EtOAc (3×15 мл). Объединенные органические экстракты подвергали сушке Na2SO4 и концентрировали при пониженном давлении с получением неочищенного остатка. Хроматографическая очистка неочищенного остатка с использованием смеси EtOAc:MeOH (98:2) приводила к образованию соединения 1273 (42 мг, 21%). 1Н ЯМР 5.77 (d, 1Н, J=6.0 Hz), 6.26 (dd, 1Н, J=15.0 Hz, Hz, 6.0 Hz), 6.97 (d, 1H, J=15.0 Hz), 7.13-7.17 (m, 2H), 7.26-7.33 (m, 2H), 7.47-7.65 (m, 5H).
Пример 37 2-(5H-имидазо[5,1-a]изоиндол-5-ил)этил 2-(((1R,2R,5S)-2-изопропил-5-метилциклогексил)окси)ацетат
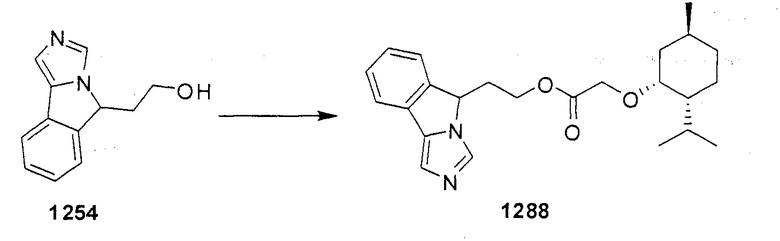
[0163] К раствору соединения 1254 (110 мг, 0,55 ммоль) в CH2Cl2 при 0°С добавляли диизопропилэтиламин (110 мг, 0,824 ммоль). Смесь оставляли для перемешивания в течение 5 минут и добавляли 2-(((1S,2S,5R)-2-изопропил-5-метилциклогексил)окси)ацетилхлорид (129 мг, 0,55 ммоль). Раствор оставляли для нагревания до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь разбавляли водой (10 мл) и отбирали органический слой. Водный слой экстрагировали CH2Cl2 (3×15 мл). Объединенные органические экстракты подвергали сушке (MgSO4) и концентрировали при пониженном давлении с получением неочищенного продукта. Неочищенный остаток очищали флеш-хроматографией с получением соединения 1288 (200 мг, 92%). 1Н ЯМР: 0.77 (d, 3Н, J=3.0 Hz), 0.75-1.25 (m, 7Н) 1.23-1.31 (m, 2Н), 1.54-1.72 (m, 3Н), 1.98-2.03 (m, 1Н), 2.20-2.28 (m, 2H), 2.50-2.54 (m, 1H), 3.09-3.14 (m, 1H), 3.97-4.15 (m, 2H), 4.27 (t, 2H, J=4.5 Hz), 5.26-5.31 (m, 1H), 7.19 (s, 1H), 7.26-7.30 (m, 1H), 7.35 (d, 1H, J=6.0 Hz), 7.39 (d, 1H, J=6.0 Hz), 7.55 (d, 1H, J=6.0 Hz), 7.75 (s, 1H).
Пример 38 1-циклогексил-2-(5H-имидазо[5,1-a]изоиндол-5-ил)этанамин и (E)-5-(2-циклогексилвинил)-5H-имидазо[5,1-a]изоиндол
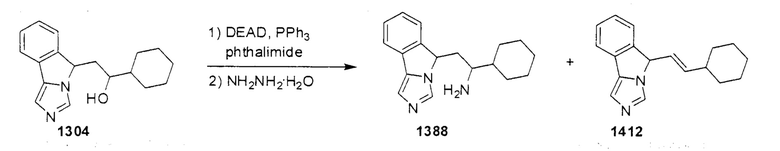
[0164] К раствору трифенилфосфина (255 мг, 0,97 ммоль) в ТГФ (10 мл) при 0°С добавляли фталимид (143 мг, 0,97 ммоль) и соединение 1304 (250 мг, 0,885 ммоль), после чего по каплям производили добавление DEAD (0,44 мл, 0,97 ммоль). Реакционную смесь оставляли для нагревания до комнатной температуры и перемешивали в течение ночи. Растворитель отгоняли при пониженном давлении, разбавляли CH2Cl2 (30 мл) и промывали 10% водным раствором NaOH (2×15 мл), водой и соляным раствором. Органический слой подвергали сушке (Na2SO4), растворитель выпаривали при пониженном давлении с получением почти белого твердого вещества. Твердое вещество растворяли в EtOH (5 мл) и добавляли гидразина моногидрат (0,09 мл, 1,77 ммоль). Смесь нагревали при 80°С в течение ночи. Раствор охлаждали до комнатной температуры, а растворитель отгоняли при пониженном давлении. Неочищенный остаток разбавляли CH2Cl2 (20 мл) и промывали органическую фазу водой (10 мл). Органический слой подвергали сушке (Na2SO4), растворитель выпаривали при пониженном давлении с получением неочищенного остатка, который затем подвергали очистке колоночной хроматографией с получением соединения 1388 в форме белого твердого вещества (50 мг, 14%) и удалением побочного продукта 1412 (30 мг). 1388 1Н ЯМР: 0.97-1.24 (m, 7Н), 1.62-1.71 (m, 6Н), 2.0 (m, 1Н), 2.89 (m, 1Н), 5.34 (dd, 1Н, J=8.4 Hz, 15.6 Hz), 5.38 и 5.49 (2 m, 1Н), 7.15 (s, 1Н), 7.24 (m, 1H), 7.31-7.52 (m, 3Н), 7.77 и 7.81 (2 s, 1Н). 1412 1Н ЯМР: 1.11-1.28 (m, 5Н), 1.55-1.75 (m, 5Н), 2.01-2.11 (m, 1Н), 5.47 (d, 1H, J=8.0 Hz), 6.01 (dd, 1H, J=6.8 Hz, 15.0 Hz), 7.18 (s, 1H), 7.26 (m, 2H), 7.36 (m, 1H), 7.52 (d, 1H, J=7.6 Hz), 7.64 (s, 1H).
Пример 39 4-(2-(6-фтор-5H-имидазо[5,1-a]изоиндол-5-ил)-1-гидроксиэтил)циклогексанон
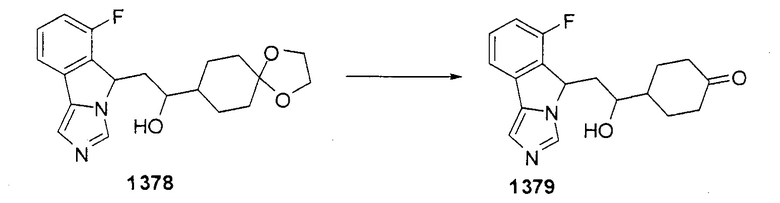
[0165] К раствору соединения 1378 (186 мг, 0,52 ммоль) в ТГФ (5 мл) добавляли 2М HCl (5 мл) и перемешивали раствор при комнатной температуре в течение ночи. Растворитель удаляли под вакуумом, а оставшийся раствор подщелачивали 2М водным раствором NaOH (6 мл) до рН>8,0. Водный раствор экстрагировали дихлорметаном (2×50 мл), объединенные органические слои сушили (Na2SO4) и концентрировали под вакуумом с получением соединения 1379 в виде твердого белого вещества (155 мг, 95%).
1Н ЯМР: (CD3OD) 1.23-2.51 (m, 11H), 3.53-3.77 (m, 2Н), 5.60-5.75 (m, 1Н), 7.03-7.08 (m, 1Н), 7.26-7.27 (m, 1Н), 7.43-7.44 (m, 1H), 8.13 и 8.21 (2 s, 1H).
Пример 40 1-(4-(гидроксиметил)циклогексил)-2-(5H-имидазо[5,1-a]изоиндол-5-ил)этанол (1383)
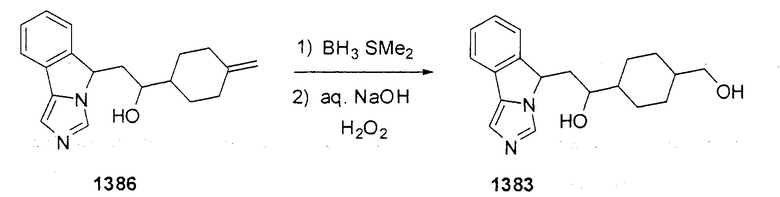
[0166] К раствору соединения 1386 (121 мг, 0,41 ммоль) в обезвоженном ТГФ (10 мл) при 0°С добавляли ВН3⋅SMe2 (0,05 мл, 0,53 ммоль). Реакционную смесь оставляли для нагревания до комнатной температуры и перемешивали в течение ночи в атмосфере N2. Раствор разбавляли водой (10 мл) и охлаждали до 0°С. Последовательно добавляли 3М NaOH (0,55 мл, 1,64 ммоль) и 30% (м/м) раствор пероксида водорода (0,19 мл, 1,64 ммоль). Реакционную смесь оставляли для перемешивания в течение ночи при комнатной температуре. Водный слой экстрагировали CH2Cl2 (3×40 мл). Объединенные органические слои сушили (Na2SO4) и концентрировали при пониженном давлении. Неочищенный остаток очищали колоночной флеш-хроматографией с получением соединения 1383 в виде твердого белого вещества (45 мг, 35%). 1Н ЯМР MeOH-d4: 1.20-1.78 (m, 11H), 2.02-2.22 (m, 2Н), 3.46-3.51 (m, 2Н), 3.78-3.88 (m, 2Н), 5.38-5.44 (m, 1Н), 7.12 и 7.14 (2 s, 1H), 7.27-7.46 (m, 2Н), 7.52-7.61 (m, 2Н), 7.92 и 7.95 (2 s, 1H).
Пример 41 1-(5H-имидазо[5,1-a]изоиндол-5-ил)-2-метилпропан-2-ол
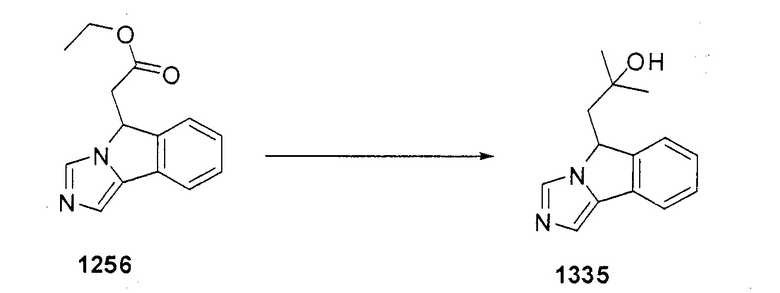
[0167] К перемешанному раствору соединения 1256 (48 мг, 0,20 ммоль) в ТГФ при 0°С по каплям добавляли 1,0 М раствор MeMgBr в ТГФ (0,4 мл). Получившийся раствор оставляли для перемешивания при комнатной температуре в течение 2 ч. Реакцию гасили осторожным добавлением к реакционной смеси метанола. Неочищенный остаток концентрировали, абсорбировали в силикагеле и очищали колоночной хроматографией с получением соединения 1335 (24 мг, 52%). 1Н ЯМР 1.43 (s, 3Н), 1.49 (s, 3Н), 2.05-2.30 (m, 2Н), 5.30-5.35 (m, 1Н), 7.14 (s, 1Н), 7.20-7.40 (m, 3Н), 7.52 (d, 1H, J=9.6 Hz), 8.02 (s, 1Н).
Пример 42 4-(2-(6-фтор-5H-имидазо[5,1-a]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол
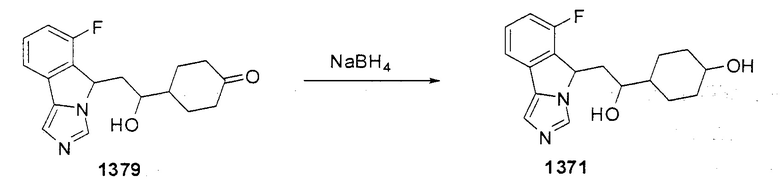
[0168] К смеси соединения 1379 (38 мг, 0,12 ммоль) в безводном МеОН при 0°С добавляли NaBH4 (0.36 ммоль) и оставляли раствор для перемешивания в течение 2 ч при комнатной температуре. Растворитель отгоняли при пониженном давлении, а остаток разделяли между CH2Cl2 (15 мл) и насыщенным раствором NH4Cl (5 мл). Объединенные органические слои отбирали, а водный слой экстрагировали CH2Cl2 (2×10 мл). Органический слой промывали соляным раствором, сушили (Na2SO4) и выпаривали растворитель. Неочищенный остаток очищали с помощью колоночной хроматографии (25% МеОН в EtOAc) с получением соединения 1371 (29 мг, 76%). 1Н ЯМР MeOH-d4 (смесь диастереоизомеров): 1.00-1.40 (m, 5Н), 1.40-2.10 (m, 5Н), 2.37-2.47 (m, 1H), 3.39-3.57 (m, 2Н), 5.54 и 5.72 (2 m, 1Н), 6.98-7.06 (m, 1H), 7.15-7.18 (m, 1H), 7.37-7.42 (m, 2Н), 7.93-7.99 (m, 1Н).
Пример 43 1-циклогексил-2-(5H-имидазо[5,1-a]изоиндол-5-ил)этанона оксим
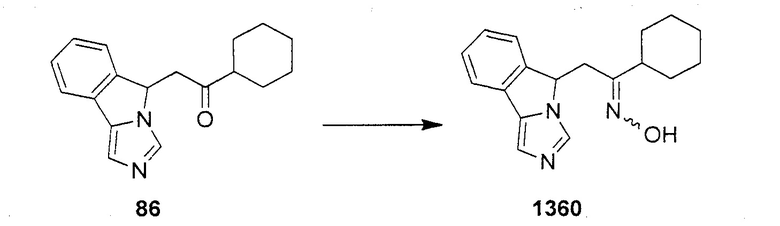
[0169] К раствору соединения 86 (160 мг, 0.57 ммоль) в EtOH (3 мл) при комнатной температуре добавляли 50% водного раствора NH2OH (1,71 ммоль) и перемешивали раствор при 50°С в течение ночи. После охлаждения до комнатной температуры растворитель удаляли при пониженном давлении, а неочищенный остаток очищали колоночной флеш-хроматографией с получением соединения 1360 (120 мг, 71%). 1Н ЯМР 0.99-1.15 (m, 5H), 1.45-1.72 (m, 6Н), 2.43 и 2.58 (2 m, 1Н), 2.70 и 2.91 (m, 1Н), 4.69 (m, 1Н), 7.23-7.29 (m, 3Н), 7.40 и 7.46 (2 m, 1H), 7.53 и 7.58 (2 m, 1Н), 7.75 и 7.76 (2 s, 1Н), 10.34 и 10.41 (2 s, 1Н).
Пример 44 1-циклогексил-2-(5H-имидазо[5,1-a]изоиндол-5-ил)этанамин
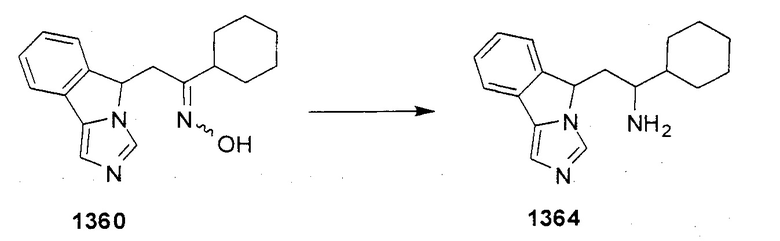
[0170] К раствору соединения 1360 (100 мг, 0,34 ммоль) в смеси 1:1 EtOH/АсОН (4 мл) добавляли порошковый цинк (67 мг, 1,0 ммоль) и подвергали смешиванию в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении, а смесь суспендировали в 1:1 МеОН/ДХМ (10 мл) и фильтровали. Фильтрат отбирали и концентрировали при пониженном давлении. Неочищенный остаток очищали ионообменной хроматографией с использованием воды и NH4OH в качестве элюента с получением соединения 1364 (25 мг, 26%). 1Н ЯМР (виде смеси диастереомеров) 0.89-1.75 (m, 11H), 2.24 и 2.42 (2 m, 1Н), 2.62 (m, 1Н), 4.52 (m, 1Н), 7.09 (t, 1H, J=9.2 Hz), 7.29 (m, 2Н), 7.38 (m, 1H), 7.47 (m, 1Н), 7.60 (d, 1Н, J=9.2 Hz).
Пример 45 Общая схема удаления защитной группы ВОС с замещенных анилинов и аминов
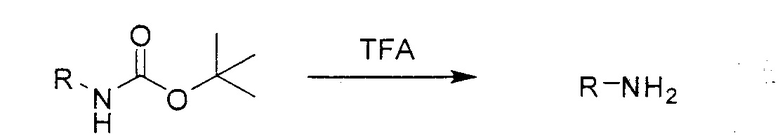
[0171] К раствору соединений 17,1300, 1328 или 1363 (66,0 мкмоль) в дихлорметане (2 мл) добавляли трифторуксусную кислоту (0,2 мл, 2,66 ммоль) и подвергали смешиванию при комнатной температуре в течение 2 ч. Растворители отгоняли при пониженном давлении, а раствор подщелачивали насыщенным раствором NaHCO3. Водный слой экстрагировали EtOAc (3×15 мл). Объединенные органические слои промывали водой, соляным раствором и сушили (Na2SO4). Раствор фильтровали, а растворитель удаляли при пониженном давлении. Неочищенный остаток очищали колоночной хроматографией с получением следующих соединений.
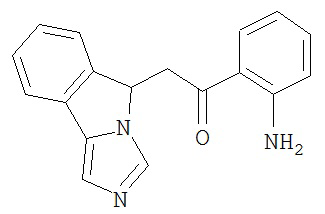
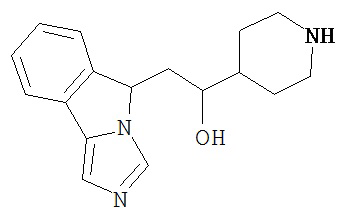
Пример 46 5-(2-циклогексил-2-гидроксиэтил)-5H-имидазо[5,1-a]изоиндол-9-ол
[0172] К раствору соединения 1372 (28 мг, 0,09 ммоль) в ДХМ (3 мл) при 0°С по каплям добавляли BBr3 (1M в ДХМ, 0,27 мл, 0,27 ммоль) и оставляли смесь для перемешивания при 0°С в течение 2 ч. Добавляли насыщенный водный раствор NaHCO3, а водный слой экстрагировали ДХМ (2×10 мл). Объединенные органические слои сушили (Na2SO4) и концентрировали при пониженном давлении. Остаток очищали колоночной флеш-хроматографией с получением соединения 1373 (15 мг, 56%). 1H ЯМР MeOH-d4: (виде смеси диастереомеров) 1.04-1.12 (m, 1Н), 1.15-1.33 (m, 4Н), 1.62-1.86 (m, 5Н), 2.00-2.07 (m, 1Н), 3.55 и 3.70 (2 m, 1Н), 5.38 и 5.44 (2 m, 1Н), 6.80 и 6.81 (2 d, 1H, J=8.0 Hz), 6.90 и 6.99 (2 d, 1H, J=7.6 Hz), 7.03 и 7.05 (2 s, 1H), 7.12-7.16 (m, 1H), 7.93 и 7.99 (2 s, 1H).
Схема 3. Энантиоселективный синтез (S)-1-циклогексил-2-((S)-5H-имидазо[5,1-a]изоиндол-5-ил)этанола (1417) и (R)-1-циклогексил-2-((S)-5H-имидазо[5,1-a]изоиндол-5-ил)этанола (1418)
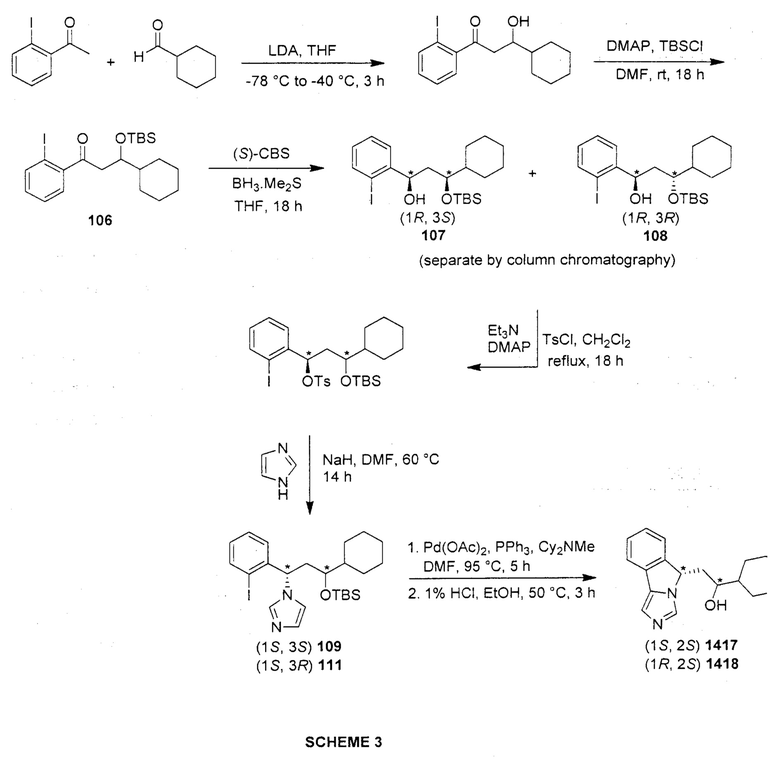
Пример 47 3-циклогексил-3-гидрокси-1-(2-йодфенил)пропан-1-он
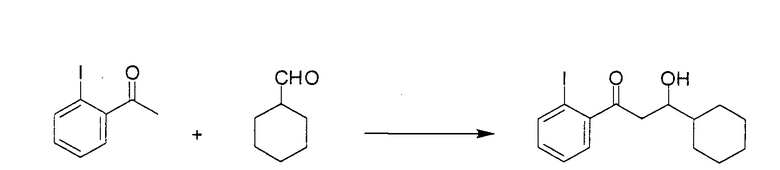
[0173] К раствору диизопропиламина (1,6 мл, 11,1 ммоль) в ТГФ (38 мл) при 0°С добавляли n-BuLi (4,1 мл, 10,2 ммоль) в атмосфере N2. По прошествии 30 минут раствор охлаждали до -30°С, по каплям добавляли к смеси раствор 1-(2-йодфенил)этанона (2,27 г, 9,23 ммоль) в ТГФ (6 мл) и перемешивали в течение 45 минут при -30°С. Смесь охлаждали до -78°С и по каплям добавляли циклогексилкарбоксиальдегид (1,2 мл, 9,69 ммоль), оставляли смесь для нагревания до -40°С в течение 2 ч. Реакцию гасили добавлением насыщенного водного раствора NH4Cl. Водный слой экстрагировали EtOAc (2×50 мл). Объединенные органические слои промывали соляным раствором, сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной флеш-хроматографией с получением соединения в виде желтого масла (2,56 г, 78%). 1Н ЯМР: 1.02-1.27 (m, 4Н), 1.41-1.49 (m, 1Н), 1.66-1.76 (m, 4Н), 1.89 (d, 1Н, J=12.4 Hz), 2.88 (d, 1Н, J=3.2 Hz), 2.98 (dd, 1H, J=9.2 Hz, 17.2 Hz), 3.13 (dd, 1H, J=2.0 Hz, 17.2 Hz), 3.99-4.01 (m, 1H), 7.11-7.15 (m, 1H), 7.42 (d, 2H, J=4.4 Hz), 7.93 (d, 1H, J=8.0 Hz).
Пример 48 3-(трет-бутилдиметилсилилокси)-3-циклогексил-1-(2-йодфенил)пропан-1-он
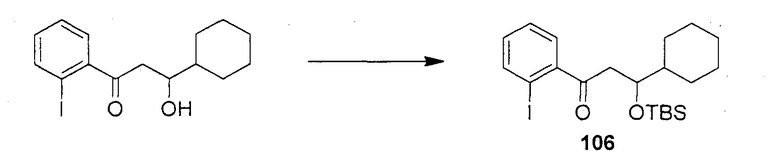
[0174] К раствору 3-циклогексил-3-гидрокси-1-(2-йодфенил)пропан-1-она (2,56 г, 7,15 ммоль) и DMAP (1,05 г, 8,58 ммоль) в ДМФ (40 мл) добавляли TBSCl (1,62, 10,7). Реакционную смесь подвергали смешиванию при комнатной температуре в течение 18 ч и помещали в воду (40 мл). Водный слой экстрагировали EtOAc (2×50 мл), объединенные органические слои промывали водой (2×20 мл), соляным раствором (10 мл), сушили (Na2SO4), фильтровали и концентрировали. Неочищенный остаток очищали колоночной флеш-хроматографией с получением соединения 106 в виде прозрачного масла (3,15 г, 93%). 1H ЯМР: 0.01 (s, 3Н), 0.08 (s, 3Н), 0.86 (s, 9Н), 1.12-1.24 (m, 6Н), 1.43-1.52 (dt, 1Н, J=3.6 Hz, 15.2 Hz), 1.65-1.76 (m, 4Н), 2.91 (dd, m, J=6.8 Hz, 22.0 Hz), 3.1 (dd, 1H, J=9.4 Hz, 22.0 Hz), 4.19-4.24 (m, 1H), 7.11 (dt, 1H, J=2.4 Hz, 10.0 Hz), 7.40 (t, 1H, J=9.6 Hz), 7.48 (dd, 1H, J=2.4 Hz, 10.4 Hz), 7.92 (d, 1H, J=10.4 Hz).
Пример 49 (1R,3R)-3-(трет-бутилдиметилсилилокси)-3-циклогексил-1-(2-йодфенил)пропан-1-ол и (1R,3S)-3-(трет-бутилдиметилсилилокси)-3-циклогексил-1-(2-йодфенил)пропан-1-ол
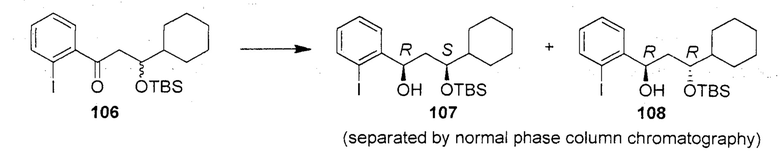
[0175] Смесь соединения 106 (3,15 г, 6,67 ммоль), BH3⋅SMe2 (0,63 мл, 6,67 ммоль) и S-2-метил-CBS-оксазаборолидина (370 мг, 1,33 ммоль) в ТГФ (50 мл) перемешивали при комнатной температуре в течение 16 ч. Добавляли водный 6 М раствор HCl (4 мл) и перемешивали смесь в течение 5 минут. Смесь помещали в воду (20 мл), а водный слой экстрагировали EtOAc (2×40 мл). Объединенные органические слои промывали соляным раствором (20 мл), сушили (Na2SO4) фильтровали и концентрировали. Остаток очищали колоночной флеш-хроматографией (градиент 3-6% EtOAc/гексаны). Таким образом проводили разделение диастереоизомеров 107 и 108. Стереохимия была подтверждена явным разделением соединений 107 и 108 на обычной аналитической силикагелевой пластине для ТСХ при ее сравнении с ТСХ-хроматограммой, полученной для образца соединения 108 с установленной подлинностью. Образец соединения 108 с установленной подлинностью готовили независимым образом при использовании энантиоселективной альдольной реакции согласно описанию, представленному на Схеме 4. 1H ЯМР: (1R,3S): 0.15 (s, 3Н), 0.18 (s, 3Н), 0.87 (s, 9Н), 1.08-1.27 (m, 5Н), 1.52-1.68 (m, 4Н), 1.75-1.89 (m, 4Н), 4.02-4.10 (m, 1Н), 4.91 (d, 1H, J=9.6 Hz), 6.95 (t, 1H, J=6.8 Hz), 7.37 (t, 1H, J=7.4 Hz), 7.61 (d, 1H, J=6.8 Hz), 7.78 (d, 1H, J=7.2 Hz). 1H ЯМР: (1R,3R): 0.12 (s, 3H), 0.16 (s, 3H), 0.88-0.93 (m, 2H), 0.97 (s, 9H), 1.12-1.17 (m, 1H), 1.27-1.31 (m, 2H), 1.57-1.79 (m, 5H), 1.91-2.07 (m, 3H), 3.70-3.72 (m, 1H), 4.19 (s, 1H), 5.20 (d, 1H, J=10.4 Hz), 6.94 (t, 1H, J=6.8 Hz), 7.38 (t, 1H, J=7.4 Hz), 7.60 (d, 1H, J=7.2 Hz), 7.77 (d, 1H, J=12 Hz).
Пример 50 (1R,3S)-3-(трет-бутилдиметилсилилокси)-3-циклогексил-1-(2-йодфенил)пропил 4-метилбензолсульфонат
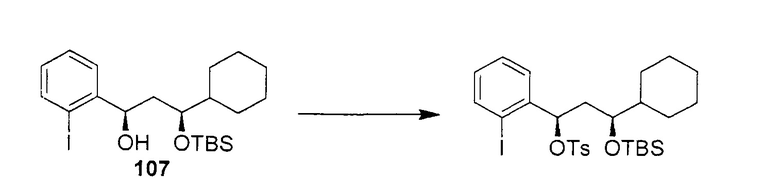
[0176] К раствору соединения 107 или 108 (300 мг, 0,63 ммоль) в дихлорметане (5 мл) добавляли триэтиламин (0,18 мл, 1,26 ммоль) и DMAP (85 мг, 0,70 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 минут и добавляли р-толуолсульфонила хлорид (145 мг, 0,76 ммоль). Реакционную смесь нагревали в сосуде с обратным холодильником в течение 18 ч. Растворитель удаляли при пониженном давлении. Остаток растворяли в EtOAc (30 мл), органический слой промывали водой (10 мл), насыщенным водным раствором NaHCO3 (15 мл) и соляным раствором. Органический слой подвергали сушке (Na2SO4), фильтровали и концентрировали. Полученное соединение использовалось в следующей стадии синтеза без предварительной очистки.
Пример 51 (1R,3R)-3-(трет-бутилдиметилсилилокси)-3-циклогексил-1-(2-йодфенил)пропил 4-метилбензолсульфонат

((1S,3S)-3-(трет-бутилдиметилсилилокси)-3-циклогексил-1-(2-йодфенил)пропил-4-метилбензолсульфонат синтезировали в соответствии с описанной выше методикой. Полученное соединение использовалось в следующей стадии синтеза без предварительной очистки.
Пример 52 1-((1S,3S)-3-(трет-бутилдиметилсилилокси)-3-циклогексил-1-(2-йодфенил)пропил)-1H-имидазол
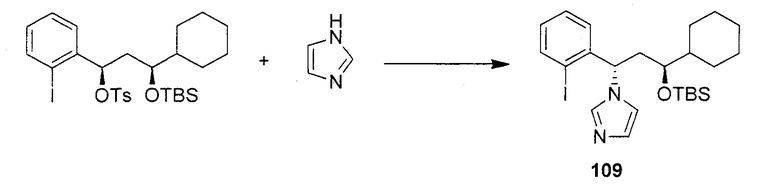
[0177] К суспензии NaH (55 мг, 2,17 ммоль) в обезвоженном ДМФ (4 мл) добавляли имидазол (148 мг, 2,17 ммоль). Раствор перемешивали в течение 2 ч и добавляли раствор (1R,3S)-3-(трет-бутилдиметилсилилокси)-3-циклогексил-1-(2-йодфенил)пропил-4-метилбензолсульфоната (341 мг, 0,54 ммоль) в ДМФ (2 мл). Реакционную смесь нагревали при 60°С в течение 14 ч. Затем помещали реакционную смесь в воду (10 мл) и экстрагировали водный слой EtOAc (2×20 мл). Объединенные органические слои промывали водой (2×10 мл), соляным раствором (10 мл), сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной флеш-хроматографией с получением соединения 109 в виде прозрачного геля (130 мг, 46%). 1Н ЯМР: (1S, 3S) 0.03 (s, 3Н), 0.05 (s, 3Н), 0.97 (s, 9Н), 1.11-1.31 (m, 5Н), 1.53-1.59 (m, 2Н), 1.68-1.79 (m, 4Н), 2.20-2.23 (m, 2Н), 3.59-3.62 (m, 1Н), 5.75-5.79 (m, 1Н), 7.01-7.13 (m, 3Н), 7.17 (s, 1Н), 7.34-7.37 (m, 1Н), 7.73 (s, 1Н), 7.93 (d, 1H, J=7.8 Hz).
Пример 53 1-((1S,3R)-3-(трет-бутилдиметилсилилокси)-3-циклогексил-1-(2-йодфенил)пропил)-1H-имидазол (78)
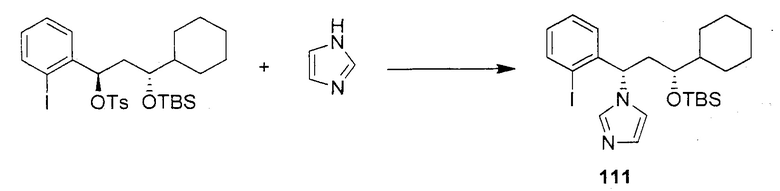
[0178] Соединение 111 получали способом, описанным выше для соединения 109. Соединение 111 выделяли в виде прозрачного геля (42% через две стадии). 1Н ЯМР: (1S,3R) 0.05 (s, 3Н), 0.07 (s, 3Н), 0.97 (s, 9Н), 1.12-1.29 (m, 5Н), 1.47-1.50 (m, 1Н), 1.69-1.77 (m, 3Н), 1.82-1.85 (m, 2H), 2.20-2.28 (m, 1H), 2.39-2.47 (m, 1H), 3.56-3.60 (m, 1H), 5.63 (t, 1H, J=7.4 Hz), 6.97-6.98 (m, 1H), 7.04-7.11 (m, 2H), 7.31-7.34 (m, 2H), 7.45 (dt, 1H, J=1.0 Hz, 7.6 Hz), 7.64 (s, 1H), 7.96 (dd, 1H, J=1.2 Hz, 8.0 Hz).
Пример 54 (S)-5-((S)-2-(трет-бутилдиметилсилилокси)-2-циклогексилэтил)-5H-имидазо[5,1-a]изоиндол
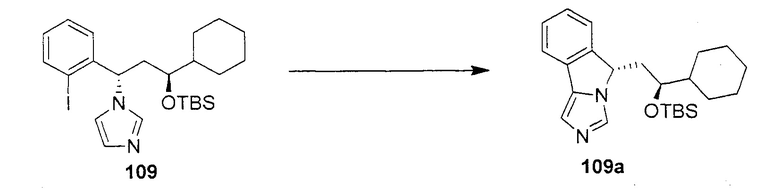
[0179] Во флакон, содержащий соединение 109 (65 мг, 0,12 ммоль) добавляли дициклогексилметиламин (0,04 мл, 0,19 ммоль), PPh3 (13 мг, 0,05 ммоль) и ДМФ (4 мл). Смесь дегазировали в течение 10 минут и добавляли Pd(OAc)2 (6 мг, 25 мкмоль). Полученную смесь нагревали при 95°С в течение 5 ч. После охлаждения до комнатной температуры смесь разбавляли этилацетатом (15 мл) и пропускали через слой целита. Фильтр промывали этилацетатом. Органический слой промывали водой (3×10 мл), соляным раствором (10 мл), сушили (Na2SO4), фильтровали и концентрировали. Неочищенный остаток использовали в следующей стадии синтеза без очистки.
Пример 55 (S)-5-((R)-2-((трет-бутилдиметилсилил)окси)-2-циклогексилэтил)-5Н-имидазо[5,1-a]изоиндол
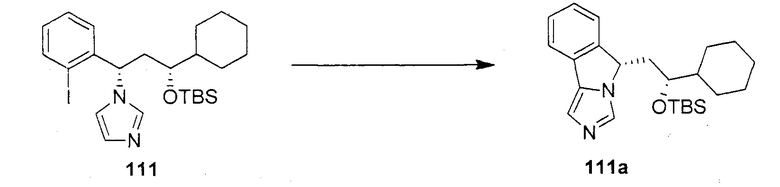
[0180] Соединение 111а получали описанным выше способом. Неочищенный остаток использовали в следующей стадии синтеза без очистки.
Пример 56 (S)-1-циклогексил-2-((S)-5H-имидазо[5,1-a]изоиндол-5-ил)этанол (1417)
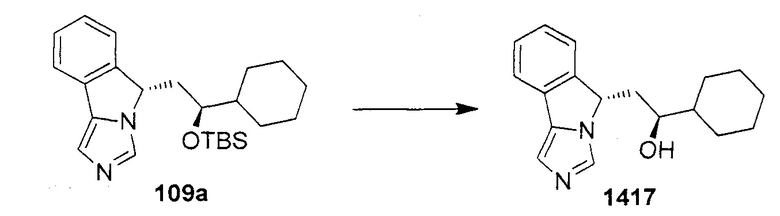
[0181] Во флакон, содержащий неочищенное соединение 109а (60 мг, 0,15 ммоль) добавляли 1%-ный раствор HCl в этаноле (2 мл). Реакционную смесь нагревали при 50°С в течение 3 ч и помещали в насыщенный водный раствор NaHCO3 (5 мл). Водный слой экстрагировали дихлорметаном (2×15 мл). Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной флеш-хроматографией с получением соединения 1417 в виде твердого белого вещества (17 мг, 47% через 2 стадии). 1Н ЯМР: (1S, 2S) 1.02-1.28 (m, 5Н), 1.40-1.42 (m, 1H), 1.67-1.83 (m, 4Н), 1.91 (d, 1H, J=12.4 Hz), 2.22-2.30 (m, 1Н), 2.82 (br s, 1Н), 3.80-3.83 (m, 1Н), 5.52 (dd, 1H, J=3.0 Hz, 10.8 Hz), 7.20 (s, 1H), 7.25-7.29 (m, 1H), 7.36-7.40 (m, 2H), 7.56 (d, 1H, J=7.6 Hz), 7.84 (s, 1H). Абсолютная конфигурация данного диастереоизомера была подтверждена рентгеновской кристаллографией кристаллов соли HBr: 1417 (Рисунок 1).
[0182]
Пример 57 (R)-1-циклогексил-2-((S)-5H-имидазо[5,1-a]изоиндол-5-ил)этанол (1418)
[0183] Соединение 1418 получали способом, описанным выше для соединения 111а. 1418 выделяли в виде бесцветного твердого вещества (42% через 2 стадии). 1Н ЯМР: (1S, 2R) 0.97-1.26 (m, 5Н), 1.32-1.39 (m, 1H), 1.63-1.67 (m, 2H), 1.71-1.80 (m, 3Н), 2.00-2.06 (m, 1H), 2.10-2.18 (m, 1H), 2.55 (br s, 1H), 3.70-3.74 (m, 1H), 5.35 (t, 1H, J=7.6 Hz), 7.14 (s, 1H), 7.19-7.23 (m, 1H), 7.34 (t, 1H, J=7.6 Hz), 7.42 (d, 1H, J=7.4 Hz), 7.52 (d, 1H, J=7.4 Hz), 7.78 (s, 1H).
Пример 58 (транс)-1-гидрокси-2-(5H-имидазо[5,1-a]изоиндол-5-ил)этил) циклогексанкарбоновая кислота (1436)
[0184] К раствору 1426 (268 мг, 0,79 ммоль) в смеси ТГФ: вода 3:1 (4 мл) добавляли лития гидроксида моногидрат (99 мг, 2,36 ммоль). Раствор оставляли для перемешивания в течение 18 ч. ТГФ удаляли при пониженном давлении, а раствор нейтрализовали до рН=5 1М HCl. Раствор концентрировали при пониженном давлении и к полученному остатку добавляли 20% МеОН/ДХМ. Остаток фильтровали через слой силикагеля, который затем подвергали элюированию 200 мл 20% МеОН/ДХМ. Раствор концентрировали с получением NLG-1436 в виде светло-желтого твердого вещества в количестве 193 мг (75%). 1Н ЯМР (DMSO-d6): 0.83-0.85 (m, 1H), 1.05-1.25 (m, 4Н), 1.41-1.45 (m, 2Н), 1.85-1.88 (m, 3Н), 2.03-2.21 (m, 2Н), 3.61-3.64 (m, 1H), 5.35-5.42 (m, 1H), 7.11 и 7.13 (2 s, 1H), 7.27 (t, 1H, J=7.0 Hz), 7.37 (t, 1H, J=7.4 Hz), 7.49 и 7.56 (2 d, 1H, J=7.5 Hz), 7.59 (d, 1H, J=7.5 Hz), 7.88 и 7.92 (2 s, 1H), 11.98 (br s, 1H).
Пример 59 1-((транс)-4-(гидроксиметил)циклогексил)-2-(5H-имидазо[5,1-a]изоиндол-5-ил)этанол (NLG-1430)
[0185] К раствору соединения 1426 (100 мг, 0,30 ммоль) в смеси ТГФ: EtOH (3 мл, соотношение 1:2) при комнатной температуре добавляли NaBH4 (48,1 мг, 1,27 ммоль) и LiCl (53,9 мг, 1,27 ммоль). Реакционную смесь подвергали смешиванию в течение ночи. Растворители удаляли при пониженном давлении, а неочищенный остаток разбавляли насыщенным раствором NH4Cl (20 мл). Продукт экстрагировали EtOAc (3×10 мл). Объединенные органические экстракты подвергали сушке Na2SO4 и проводили удаление растворителей при пониженном давлении. Неочищенный продукт очищали кремнийдиоксидной флеш-хроматографией с получением соединения 1430 (78 мг, 85%). 1H ЯМР (виде смеси диастереомеров) 0.94-1.13 (m, 4Н), 1.14-2.18 (m, 10Н), 3.45 (d, J=6.3 Hz, 2Н), 3.73-3.78 (m, 1H), 5.30-5.38 (m, 1Н), 7.17 (s, 1Н), 7.22-7.27 (m объединилась с CHCl3, 1Н), 7.33-7.44 (m, 2Н), 7.54 (d, J=7.6 Hz, 1H), 7.83 (d, J=10.4 Hz, 1H).
Пример 60 (транс)-1-гидрокси-2-(5Н-имидазо[5,1-a]изоиндол-5-ил)этил)-N-(2-метилсульфонамидо)этил)циклогексанкарбоксамид (1432)
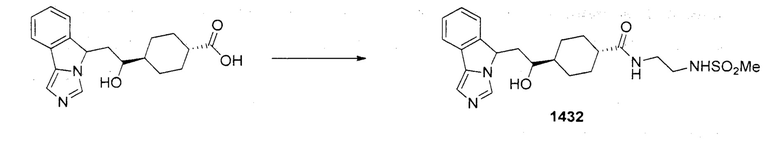
[0186] Во флакон, содержащий N-(2-аминоэтил)метансульфонамида дигидрохлорид (56,4 мг, 0,27 ммоль) в ДМФ (4 мл) добавляли соединение 1436 (83 мг, 0,25 ммоль), DIPEA (197 мг, 1,53 ммоль) и HATU (106 мг, 0,28 ммоль). Реакционную смесь подвергали смешиванию при комнатной температуре в течение 18 ч и концентрировали. Остаток очищали колоночной хроматографией с использованием силикагеля и градиента гексаны/EtOAc 10%->60%. Соединение выделяли в виде светло-желтого твердого вещества в количестве 72 мг (64%). 1Н ЯМР: (CD3OD) 1.04-1.14 (m, 2Н), 1.38-1.46 (m, 3Н), 1.73-1.96 (m, 4Н), 2.11-217 (m, 2Н), 2.32-2.38 (m, 1Н), 2.93 и 2.97 (2 s, 3Н), 3.15 (t, 1.7Н, J=6.4 Hz), 3.29-3.31 (m overlap with, 1H), 3.54-3.58 и 3.78-3.80 (2 m, 1H), 5.57-5.66 (t и dd, 1H, J=6.3 и J=2.6, 9.2 H), 7.33-7.47 (m, 3H), 7.52 и 7.60 (2 d, 1H, J=7.6 Hz), 7.68-7.71 (m, 0.8 H), 7.91 (s, 0.4 H), 8.21 (dd, 0.6 H, J=1.1, 8.4 Hz), 8.44 (s, 0.4 H), 8.53-8.57 (m, 1H).
Пример 61 (цис)-4-(2-(6-фтор-5Н-имидазо[5,1-a]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол
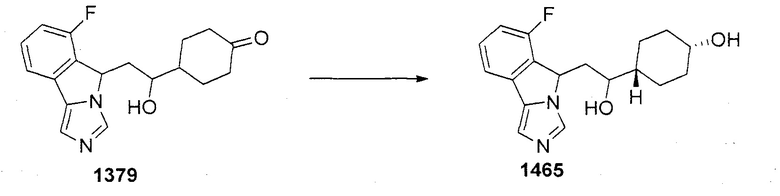
[0187] К раствору соединения NLG-1379 (60 мг, (0,19 ммоль) в обезвоженном ТГФ (5 мл) при -78°С в атмосфере азота добавляли раствор лития трисамилборгидрида (1,0 М в ТГФ) (0,38 мл, 0,38 ммоль). Получившуюся смесь подвергали интенсивному перемешиванию в течение 3 ч при температуре -78°С, а затем оставляли для нагревания до комнатной температуры (1 ч). Реакцию гасили смесью 1:1 H2O/EtOH (4 мл). Смесь подкисляли 6 N HCl, а затем подщелачивали насыщенным раствором К2СО3. Водный слой экстрагировали дихлорметаном (5×15 мл). Объединенные органические слои подвергали сушке Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного остатка. Остаток очищали колоночной хроматографией с получением соединения 1465 в количестве 35 мг (58%). виде смеси диастереомеров 1Н ЯМР: 1.45-2.15 (m, 10Н), 2.35-2.51 (m, 1Н), 3.66-3.79 (2 m, 1Н), 4.03 (br s, 1Н), 5.48 (t, 1H, J=5.1 Hz, isomer), 5.67 (dd, 1H, J=10.6, 2.8 Hz), 6.91-6.95 (m, 1H), 7.19 (d, 1H, J=5.4 Hz), 7.25-7.39 (m, 2H), 7.88 (2, s, 1H).
[0188] Смеси четырех диастереоизомеров (1465) разделяли помощью подготовительной хиральной сверхкритической хроматографии (SFC) с получением чистых диастереоизомеров 1482-1485. SFC осуществляли на колонке RegisPack 5 в смеси изопропанол/CO2: 0,2%DEA.
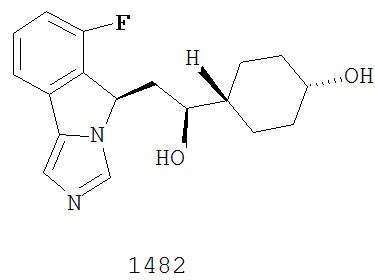
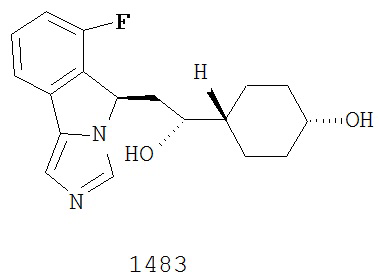
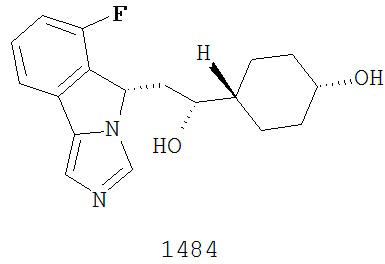
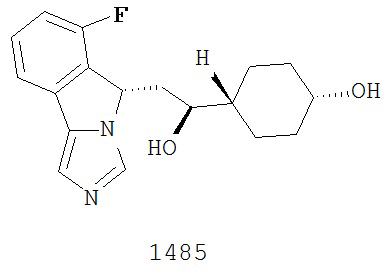
1482 и 1484 1Н ЯМР (CD3OD) δ 1.16 (d, J=6.1 Hz, 1H), 1.23 (d, J=17.8 Hz, 2H), 1.28 (s, 1H), 1.37-1.65 (m, 6H), 1.73 (s, 2H), 1.90-2.14 (m, 1H), 2.48 (d, J=15.2 Hz, 1H), 3.55 (s, 1H), 3.90 (s, 1H), 5.58 (s, 1H), 6.91-7.08 (m, 1H), 7.16 (s, 1H), 7.41 (s, 2H), 7.96 (d, J=28.8 Hz, 1H).
1483 и 1485 1Н ЯМР: (CD3OD) δ 1.15 (d, J=6A Hz, 1H), 1.26 (d, J=24.4 Hz, 2H) 1.41-1.79 (m, 8H) 2.35-2.50 (m, 1H), 3.65 (d, J=7.8 Hz, 1H), 3.90 (s, 1H), 5.69 (dd, J=10.1, 2.4 Hz, 1H), 6.93-7.08 (m, 1H), 7.18 (s, 1H), 7.41 (dd, J=5.2, 3.5 Hz, 2H), 7.94 (s, 1H).
Пример 62 2-(6-фтор-5Н-имидазо[5,1-a]изоиндол-5-ил)-1-((транс)-4-гидроксициклогексил)этанон
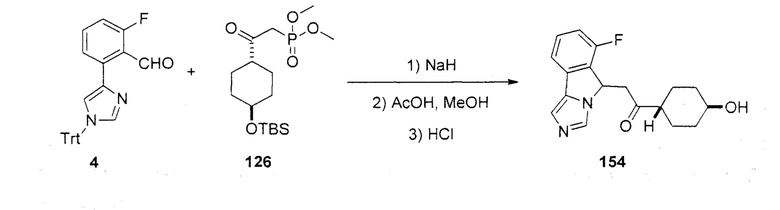
[0189] К суспензии NaH (1,11 г, 46,2 ммоль) в ТГФ (150 мл) при -10°С по каплям добавляли раствор соединения 126 (18,5 г, 50,8 ммоль) в ТГФ (75 мл) и перемешивали смесь в течение 45 минут при 0°С. Альдегид 4 (20,0 г, 46,4 ммоль) по каплям добавляли в виде раствора в ТГФ (120 мл) в течение 15 минут. После перемешивания в течение 1 ч при 0°С реакционную смесь оставляли для нагревания до комнатной температуры и подвергали смешиванию в течение ночи. Растворитель отгоняли при пониженном давлении, а неочищенный остаток разбавляли насыщенным раствором NH4Cl (80 мл), водой (100 мл) и EtOAc (100 мл). Раствор разделяли на фракции в делительной воронке и отбирали органический слой. Водный слой экстрагировали EtOAc (3×150 мл), объединенные органические фракции промывали соляным раствором и сушили Na2SO4. Раствор фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта. Неочищенный остаток подвергали смешиванию со смесью уксусной кислоты (20 мл) и МеОН (170 мл) при 90°С в течение 1,5 ч. После охлаждения до 50°С реакционную смесь обрабатывали 6N HCl (20 мл) и перемешивали в течение 30 минут. После охлаждения до комнатной температуры растворитель отгоняли и добавляли к остатку насыщенный раствор NaHCO3 (200 мл), а затем CH2Cl2 (200 мл). Слои разделяли, водный слой экстрагировали CH2Cl2 (2×100 мл). Объединенные органические слои подвергали сушке Na2SO4 и выпаривали растворитель при пониженном давлении с получением неочищенного продукта, который очищали кремнийдиоксидной колоночной флеш-хроматографией с получением соединения 154 (13,8 г, 95%).
Пример 63 (транс)-4-(2-(6-фтор-5Н-имидазо[5,1-a]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол (1475)
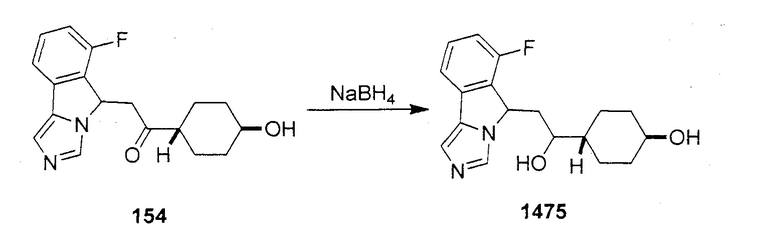
[0190] К раствору соединения 154 (13,8 г, 43,9 ммоль) в МеОН (150 мл) при температуре от -10 до 0°С малыми порциями добавляли NaBH4 (4,98 г, 131,71 ммоль) и оставляли для перемешивания в течение 4 ч. Растворитель отгоняли при пониженном давлении, разбавляли смесь добавлением насыщенного раствора NH4Cl (200 мл) и дихлорметана (200 мл) и перемешивали ее в течение 25 минут. Органический слой отделяли, а водный слой экстрагировали 5%-ным раствором 2,2,2-трифторэтанола в CH2Cl2 (5×75 мл). Объединенные органические экстракты промывали соляным раствором, сушили (MgSO4) и концентрировали при пониженном давлении с получением неочищенного остатка. Очистка методом колоночной хроматографии приводила к получению соединения 1475 в виде твердого белого вещества (13,24 г, 95%). 1H ЯМР (виде смеси диастереомеров): 1.07-2.52 (m, 11H), 3.48-3.68 (2 m, 2Н), 5.45 (t, 1H, J=6.0 Hz), 5.65 (dd, 1H, J=9.0, 3.0 Hz), 6.89-6.96 (m, 1H), 7.16 (s, 1H), 7.29-7.38 (m, 2H), 7.80 и 7.88 (2 s, 1H).
[0191] Смеси четырех диастереоизомеров разделяли помощью подготовительной хиральной сверхкритической хроматографии с получением чистых диастереоизомеров 1486-1489. Разделение смеси методом SFC осуществлялось при первом прохождении через колонку AD-H (Regis Technologies, Inc.) и позволяло получить соединения 1487, 1486+1488 и 1489. Пик, соответствующий смеси 1486+1488, разделяли методом SFC на колонке Whelk-O1 (Regis Technologies, Inc.). Все разделения осуществлялись в смеси изопропанол: CO2 (10:90)+DEA 0,1%.
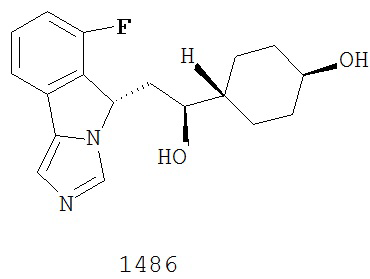
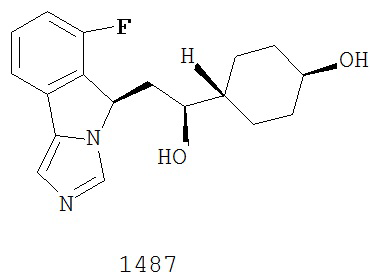
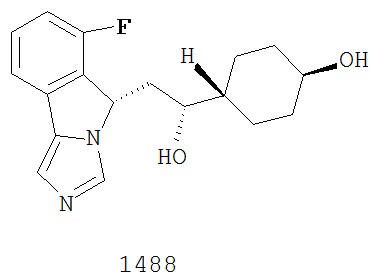
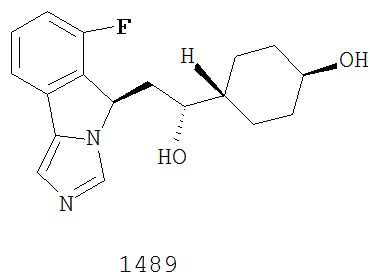
NLG-1486 и NLG-1489 1Н ЯМР: 1.03-1.26 (m, 6Н), 1.43-1.47 (m, 2Н), 1.93-1.96 (m, 2Н), 2.45-2.50 (m, 3Н), 3.48 (s, 1Н), 3.61 (s, 1Н), 5.62 (d, J=8.9 Hz, 1Н), 6.91 (t, J=8.6 Hz, 1H), 7.12 (s, 1H), 7.26-7.30 (m объединилась с CHCl3, 2H), 7.79 (s, 1H).
NLG-1487 и NLG-1488 1H ЯМР: 0.95-1.33 (m, 6H), 1.61-1.64 (m, 1H), 1.79-1.82 (m, 1H), 1.91-2.04 (m, 4H), 2.28 (d, J=14.4 Hz, 1H), 3.42-3.45 (m, 1H), 3.62 (s, 1H), 5.37 (t, J=4.9 Hz, 1H), 6.88 (t, J=8.9 Hz), 7.05 (s, 1H), 7.24-7.31 (m объединилась с CHCl3, 2H), 7.84 (s, 1Н).
[0192] Синтез пролекарств 1304
Пример 64 Натрия 1-циклогексил-2-(5Н-имидазо[5,1-a]изоиндол-5-ил)этилфосфат (1434)
[0193] К раствору соединения 1304 (150 мг, 0,53 ммоль) и пиридина (85,7 мкл, 1,1 ммоль) в дихлорметане (4 мл) при 0°С добавляли POCl3 (99,3 мкл, 1,06 ммоль) и оставляли его для нагревания до комнатной температуры. После перемешивания в течение ночи реакцию гасили насыщенным раствором NaHCO3 (5 мл) и перемешивали смесь в течение 15 минут. Растворители выпаривали при пониженном давлении, получившийся твердый остаток промывали ТГФ (2×15 мл). Растворитель удаляли при пониженном давлении с получением неочищенного остатка. Остаток растворяли в ДХМ (5 мл) и пропускали через слой Na2SO4 для удаления воды. Растворитель выпаривали при пониженном давлении с получением соединения 1434.
(33%). 1Н ЯМР (виде смеси диастереомеров): (CD3OD) 1.15-1.41 (m, 6Н), 1.59-1.82 (m, 5Н), 1.98-2.04 (m, 1Н), 2.56-2.86 (2 m, 1H), 3.57-3.58 и 4.08-4.11 (2 m, 1H), 5.29-5.54 (2 m, 1H), 7.11 и 7.16 (2 s, 1H), 7.25-7.47 (m, 3H), 7.53-7.60 (m, 1H), 7.83 и 7.95 (2 s, 1H).
Пример 65 1-циклогексил-2-(5H-имидазо[5,1-a]изоиндол-5-ил)этилацетат
[0194] Раствор соединения 1304 (80 мг, 0,28 ммоль) и 4-диметиламинопиридина (1,04 мг, 8,5 мкмоль) в пиридине (3 мл) обрабатывали уксусным ангидридом (32 мкл, 0,34 ммоль) при комнатной температуре и подвергали реакционную смесь смешиванию в течение ночи. Раствор концентрировали под вакуумом, полученный остаток растворяли в дихлорметане (10 мл), последовательно промывали водой (3×10 мл) и сушили Na2SO4. Раствор концентрировали, а неочищенный остаток очищали колоночной флеш-хроматографией с получением желаемого продукта в виде желтого геля (75 мг, 82%). 1Н ЯМР (смесь диастереоизомеров): 0.76-1.25 (m, 5Н), 1.30-1.75 (m, 6Н), 1.78-2.20 (m, 4Н), 2.26-2.40 (m, 1Н), 4.96-5.12 (m, 2Н), 7.17-7.39 (m, 4Н), 7.51-7.53 (m, 1Н), 7.71 и 8.00 (2 s, 1H).
Пример 66 4-(1-циклогексил-2-(5H-имидазо[5,1-a]изоиндол-5-ил)этокси)-4-оксобутановая кислота (1428)
[0195] Раствор соединения 1304 (48 мг, 0,17 ммоль) и 4-диметиламинопиридина (0,83 мг, 6,8 мкмоль) в дихлорметане (3 мл) обрабатывали янтарным ангидридом (19 мг, 0,19 ммоль) и DIPEA (33 мкл, 0,19 ммоль) при комнатной температуре и подвергали реакционную смесь смешиванию в течение ночи. Раствор помещали в насыщенный раствор NH4Cl (10 мл) и экстрагировали дихлорметаном (3×10 мл). Объединенные органические слои подвергали сушке Na2SO4 и концентрировали. Неочищенный продукт выкристаллизовывали в смеси этанол/хлороформ (1:4) с получением соединения 1428 в виде белого твердого вещества (62 мг, 95%). 1Н ЯМР (виде смеси диастереомеров): 0.93-1.65 (m, 11H), 1.90-2.32 (m, 1Н), 2.50-2.90 (m, 3Н), 2.92-3.05 (m, 1H), 3.57 и 3.73 (m, 1Н), 5.20-5.22 (m, 1Н), 5.29-5.33 (m, 1Н), 6.41-6.78 (m, 1H), 7.16-8.00 (m, 5Н), 12.20-12.80 (br s, 1H).
Пример 67 1-циклогексил-2-(5H-имидазо[5,1-a]изоиндол-5-ил)этилбензоат (1431)
Раствор соединения 1304 (76 мг, 0,27 ммоль) и 4-диметиламинопиридина (1.0 мг, 8,1 мкмоль) в пиридине (3 мл) обрабатывали бензангидридом (73 мг, 0,32 ммоль) при комнатной температуре и подвергали реакционную смесь смешиванию в течение ночи. Раствор концентрировали под вакуумом, полученный остаток растворяли в дихлорметане (10 мл), последовательно промывали насыщенным раствором NaHCO3 (10 мл), водой (10 мл) и сушили Na2SO4. Раствор концентрировали, а неочищенный остаток очищали колоночной флеш-хроматографией с получением соединения 1431 (25 мг, 23%). 1H ЯМР (виде смеси диастереомеров): 0.88-1.25 (m, 7Н), 1.62-1.90 (m, 4Н), 2.15-2.25 (m, 1Н), 2.49-2.58 (m, 1Н), 5.19-5.21 (m, 1Н), 5.34-5.37 (m, 1Н), 7.16-7.28 (m, 4Н), 7.40-7.64 (m, 4Н), 7.80 (s, 1H), 8.00-8.02 (d, J=6.3 Hz, 1Н), 8.12-8.14 (d, J=5.7 Hz, 1H).
Пример 68 1-циклогексил-2-(5H-имидазо[5,1-a]изоиндол-5-ил)этил-фенилкарбамат (1427)
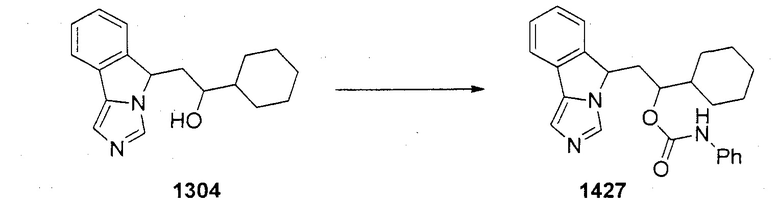
[0196] К раствору соединения 1304 (40 мг, 0,14 ммоль) в ТГФ (5 мл) добавляли триэтиламин (43 мкл, 0,31 ммоль), а затем фенилизоцианат (17 мкл, 0,16 ммоль). Реакционную смесь подвергали смешиванию при комнатной температуре в течение 18 ч и концентрировали. Неочищенный продукт очищали колоночной флеш-хроматографией (4:1 EtOAc:МеОН) с получением соединения 1427 в виде бесцветного геля (19 мг, 34%). 1Н ЯМР (виде смеси диастереомеров): 1.02-1.04 (m, 5Н), 1.56-1.70 (m, 6Н), 2.10-2.14 (m, 1H), 2.31-2.40 (m, 1Н), 5.02-5.10 (m, 1H), 5.18-5.24 (m, 1H), 7.04-7.08 (m, 1Н), 7.18-7.35 (m, 6Н), 7.39-7.41 (m, 2Н), 7.50 (d, J=4 Hz, 1Н), 7.65 (d, J=8 Hz, 1H), 7.74 (s, 1H).
[0197]
Пример 69 Общая схема синтеза пролекарств 1304
Во флакон, содержащий соединений 1304 (0,5 ммоль) в дихлорметане (5 мл), добавляли соответствующую карбоновую кислоту (1,1 ммоль), диизопропилэтиламин (3,0 ммоль) и HATU (1,3 ммоль). Реакционную смесь подвергали смешиванию при комнатной температуре в течение 48 ч и помещали в насыщенный водный раствор NaHCO3 (10 мл) и экстрагировали водный слой дихлорметаном (2×20 мл). Объединенные органические слои подвергали сушке Na2SO4 и концентрировали. Неочищенный продукт растворяли в дихлорметане (6 мл) и добавляли ТФК (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и концентрировали. Остаток растворяли в воде и добавляли твердый К2СО3 до тех пор, пока рН раствора не становился щелочным. Водный раствор экстрагировали дихлорметаном (2×20 мл). Объединенные органические слои подвергали сушке Na2SO4, фильтровали и концентрировали с получением соединений 1433, 1440, 1442 и 1443.
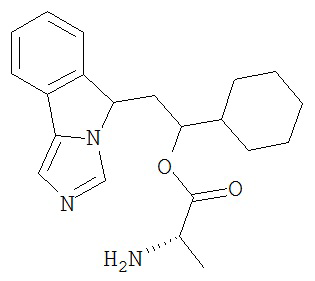
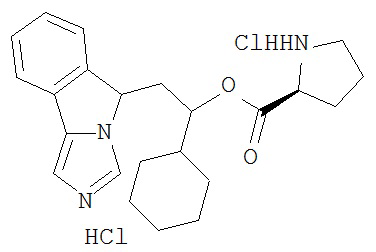
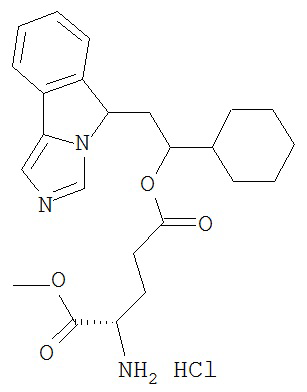
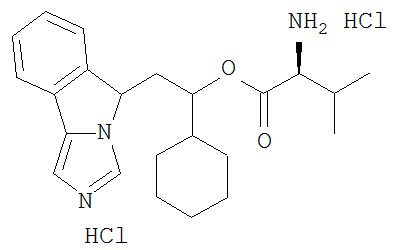
Биологический пример 1 Клонирование, экспрессия и очистка человеческого белка ИДО
[0198] Экспрессионные векторы для человеческого белка индоламин-2,3-диоксигеназы (ИДО) получали путем амплификации фрагмента 1219 пары нуклеотидных оснований последовательности, присутствующей в векторе кДНК phIDO6His с праймерами 5'-ggagcatgctaATGGCACACGCTATGGAAAAC-3' и 5'-gagagatctACCTTCCTTCAAAAGGGATTTC-3' и клонирования фрагмента пары нуклеотидных оснований SphI-BglII 1213 в pQE70 (Qiagen) для создания вектора pQE70-hIDO. Эта структура добавляет 2 дополнительные аминокислоты и маркер 6-гистидин к С-терминальному концу натурального человеческого белка ИДО, сохраняя нетронутыми натуральный инициирующий кодон и N-конец аминокислотной последовательности. Амплифицированный аллель человеческого белка ИДО демонстрирует два вида полиморфизма по отношению к последовательности, внесенной в файл доступа Р14902 базы данных SwissProt. Данные виды полиморфизма приводят к замене аминокислот P110S и E119G.
[0199] Плазмиду pQE70-hIDO трансформировали в клетки M15 (pREP4) (Qiagen) и полученные клоны отбирали и помещали на чашки Петри с агаром Луриа-Бертани (ЛБ) с добавлением карбенициллина в концентрации 50 мкг/мл и канамицина в концентрации 30 мкг/мл. Экспрессия белка проводилась путем выращивания в течение ночи культуры клона M15pREP4/pQE70-hIDO в 100 мл ЛБ с добавлением карбенициллина в концентрации 100 мкг/мл, канамицина в концентрации 50 мкг/мл и L-триптофана - 50 мкг/мл (среда ЛБККТ). 40 мл данной культуры инокулировали 750 мл ЛБККТ и выращивали в течение 4 ч при температуре 37°С. Полученную культуру разводили в соотношении 1:10 в среде ЛБККТ и выращивали еще в течение 2 ч при температуре 37°С до тех пор, пока значение OD600 не превышало 0,8. В этот момент культуры инокулировали гемином до 7 мкМ и L-триптофаном в концентрации до 75: мкг/мл и инкубировали при температуре 37°С в течение 2 ч. Индукцию экспрессии протеина проводили путем добавления в культуры ИПТГ до 1 мМ, ПМСФ до 200 мкМ, ЭДТА до 1 мМ и L-триптофана в концентрации до 50 мкг/мл. Инкубацию продолжали еще в течение 16 ч при температуре 25°С. Клетки собирали центрифугированием и клеточные конгломераты промывали фосфатно-солевым буферным раствором (PBS) с добавлением 200 мкМ ПМСФ и 1 мМ ЭДТА и хранили при температуре -80°С до проведения очистки протеинов.
[0200] Объем культуры, эквивалентный 16 л, подвергался обработке в рамках одной серии очистки. Конгломераты клеток оттаивали, повторно суспендировали в 50 мМ растворе калий-фосфатного буфера, рН 7,0, 200 мкМ ПМСФ, 1 мМ ЭДТА, 1 мг/мл лизоцима на 10 мл на литр бактериальной культуры и инкубировали в течение 30 минут на льду. После чего клетки подвергались лизису путем обработки ультразвуком. Лизаты клеток центрифугировали 20 минут при 20000 об/мин и надосадочную жидкость фильтровали через фильтр с размером пор 0,45 мкм. Отфильтрованную надосадочную жидкость помещали в фосфоцеллюлозную колонку объемом 60 мл, уравновешенную 50 мМ раствором калий-фосфатного буфера с рН 6,5 (КФБ) при скорости 1-3 мл/мин. Колонку промывали 3 объемами 50 мМ раствора КФБ, 3 объемами 100 мМ раствора КФБ и белок элюировали линейным градиентом 15 объемов КФБ 100-500 мМ. Фракции собирали и проводили количественное определение активности ИДО, измеряя образование кинуренина. Для этой цели смешивали 50 мкл каждой фракции с 100 мкл реакционной смеси, чтобы получить конечную концентрацию 50 мМ КФБ, 20 мМ аскорбиновой кислоты, 200 мкг/мл каталазы, 20 мкМ метиленового синего и 400 мкМ L-триптофана. Фракции, продемонстрировавшие активность ИДО, загружали в очистительную колонку Ni-NTA (объемом 15 мл). Данную колонку аффинной очистки промывали 10 объемами 250 мМ КФБ, 150 мМ NaCl, 50 мМ имидазола, рН 8 и белок элюировали линейным градиентом 10 объемов буфера, содержащего 250 мМ КФБ, 150 мМ NaCl и 50-250 мМ имидазола. Собранные фракции подвергали количественному определению с помощью ферментного анализа ИДО, описанного выше, и положительные фракции объединяли и концентрировали ультрафильтрацией и диализовали против буфера, содержащего 250 мМ КФБ, 50% глицерина. В ходе данного процесса получают ~ 8-10 мг чистого белка (>98%) с удельной активностью 170 мкмоль/ч/мг.
Биологический пример 2 Исследование соединений, ингибирующих ИДО, методом ферментного анализа ИДО
[0201] Значения IC50 для каждого соединения определяли путем исследования активности ИДО в смеси, содержащей 50 мМ раствор калий-фосфатного буфера с рН 6,5, 70 нМ очищенного человеческого белка ИДО, 200 мкМ L-триптофана, 20 мМ аскорбата, 20 мкМ метиленового синего, 0,1% ДМСО. Первоначально ингибиторы разводили в ДМСО 100 мМ, затем в 50 мМ растворе фосфата калия, добавляли к реакционной смеси с конечной концентрацией, варьирующей от 1 мМ до 5HM, и предварительно инкубировали с ферментом в течение 5 минут при температуре 25°С. Реакцию инициировали, добавляя L-триптофан до 200 мкМ. Инкубировали в течение 15 минут при температуре 37°С. Реакцию останавливали, добавляя 0,5 объема 30% трихлоруксусной кислоты, инкубировали в течение 30 минут при температуре 60°С для гидролиза N-формилкинуренина до кинуренина. Реакционную смесь центрифугировали при 3400 об/мин в течение 5 минут для удаления осажденного белка и надосадочную жидкость подвергали взаимодействию с 2% (м/о) раствором р-диметиламинобензальдегида в уксусной кислоте. Реакционную смесь инкубировали в течение 10 минут при температуре 25°С и считывали показания спектрофотометра при длине волны 480 нм. Контрольные образцы, не содержащие ингибитора ИДО или не содержащие фермента ИДО или содержащие стандартные ингибиторы 1-метилтриптофан (200 мкМ) и менадион (1,2 мкМ), использовались в качестве контроля для установки параметров для нелинейных регрессий, необходимых для определения IC50 для каждого соединения. Построение нелинейных регрессий и определение величины IC50 проводилось с использованием программного обеспечение GraphPad Prism 4. В данном анализе соединения с IC50 менее 500 мкМ считались активными ингибиторами.
Биологический пример 3 Определение ингибирующей активности ИДО и токсичности в клеточном анализе ИДО/кинуренин
[0202] Клетки 293-T-Rex™ (Invitrogen) конститутивно экспрессируют репрессорный белок, связывающий оператор tet, и содержатся в условиях DMEM, 10% FBS, IX пенициллин + стрептомицин, 2 мМ L-глутамина, 5 мкг/мл бластицидина при температуре 37°С с концентрацией СО2 атмосферном воздухе 5% и, как правило, разделяются до момента конфлюентности. Клетки подготавливали, разделяя культуру в соотношении 1/10, удаляя среду аспирацией, промывая IX PBS, инкубируя с 0,25% среды трипсин/ЭДТА, до тех пор, пока клетки не отделялись, распределяясь на свежей питательной среде, и покрывали ими свежую питательную среду в разведении 1/10. Для длительной криоконсервации клетки отделяют от чашки Петри, в соответствии с описанной выше процедурой, собирают центрифугируя, ресуспендируют в среде для замораживания (питательная среда, 10% ДМСО), хранят во флаконах для криоконсервации объемом 1,8 мл (~ 2-5×106 клеток на флакон) в емкости для хранения с парами жидкого азота.
[0203] Линии клеток 293-T-Rex™, экспрессирующие ИД01, получали путем стабильной трансфекции плазмиды PcDNA-tetO-ИДО, экспрессирущей человеческий или мышиный ИДО, под контролем доксициклин-индуцируемого промотора CMV-tet. Трансфицированные клетки отбирали и помещали в среду DBZ (DMEM, 10% FBS, IX пенициллин + стрептомицин, 2 мМ L-глутамина, бластицидин в концентрации 5 мкг/мл и зеоцин в концентрации 25 мкг/мл) при температуре 37°С в атмосферном воздухе, содержащем 5% СО2. Отдельные клоны выделяли из этих популяций путем клонирования методом серийных разведений. Проводили анализ клонов на активность ИДО, и клоны, продемонстрировавшие максимальный уровень активности ИДО, индуцируемой доксициклином, использовались для последующих клеточных анализов ИДО.
[0204] Для проведения клеточного анализа активности ИДО отбирали клетки ИДО-293-T-Rex, ресуспендировали в средах DBZ до концентрации 106 клеток/мл и помещали в лунки 96-луночных планшетов, покрытых поли-D-лизином, в концентрации 100000 клеток на лунку. К клеткам добавляли 100 мкл нейтральной среды (среда DBZ, 200 мкМ L-триптофана) или индукционной среды (нейтральная среда с добавлением 5 мкМ доксициклина) и инкубировали в течение 28 ч при температуре 37°С. По истечении периода индукции ИДО, среду удаляют и заменяют индукционной или нейтральной средой, содержащей различные концентрации каждого ингибитора (от 1 мМ до 0,5 нM). Клетки, инкубировавшиеся в нейтральной среде, служат в качестве отрицательного контроля анализа. Клетки, инкубировавшиеся в индукционной среде и не содержащие ингибитора, служат в качестве положительного контроля анализа. Инкубация проводится в течение 16 ч при температуре 37°С в инкубаторе для клеточных культур. 200 мкл среды переносят на 96-луночные полипропиленовые планшеты с U-образным дном, содержащие 25 мкл 30% ТХУ, инкубируют в течение 30 минут при температуре 60°С и центрифугируют при 3400 об/мин в течение 5 минут. 150 мкл прозрачной надосадочной жидкости помещают в лунки 96-луночного полипропиленового планшета, содержащие 50 мкл 4% масс/объем раствора р-диметиламинобензальдегида в уксусной кислоте, инкубируют в течение 10 минут. Концентрацию кинуренина определяют путем измерения оптической плотности при длине волны 480 нм.
[0205] Для измерения токсичности каждого соединения после 16 ч инкубации с клетками определяли жизнеспособность клеток с помощью анализа с WST-1 (Roche) в соответствии с инструкциями производителя. Краткое описание: после инкубации с каждым соединением среду аспирировали и заменяли 100 мл реагента WST-1 и инкубировали в течение 30 минут при температуре 37°С. Поглощение при длине волны 540 нм коррелирует с количеством жизнеспособных клеток. Определение IC50 (анализ кинуренина) или LD50 (анализ с WST-1) проводится с помощью нелинейного регрессионного анализа с использованием программного обеспечения GraphPad Prism
Биологический пример 4 Ингибирование ИДО-опосредованной супрессии пролиферации Т-клеток с помощью ингибиторов ИДО.
[0206] Моноциты человека отбирали из периферических мононуклеарных клеток с помощью лейкоафереза и культивировали в течение ночи в концентрации 106 клеток/лунка на 96-луночном планшете в среде RPMI 1640 с добавлением 10% фетальной телячьей сыворотки и 2 мМ L-глутамина. Прилипавшие клетки сохраняли и культивировали в течение 7 дней с 200 нг/мл IL-4, 100 нг/мл гранулоцитарно-моноцитарный колониестимулирующим фактором (ГМ-КСФ). Клетки доводили до созревания в течение 2 дней цитокиновым коктейлем, содержащим TNF-α, IL-1β, IL-6, и еще в течение 2 дней с PGE2, чтобы вызвать созревание дендритных клеток. В конце созревания свободно прилипавшие клетки отделяли путем осторожной аспирации и помещали на 96-луночные планшеты с V-образным дном в концентрации 5000 клеток/лунка. Эти клетки представляли собой >80% ИДО+ дендритные клетки. Человеческие аллогенные Т-клетки (3×105), полученные от здоровых доноров, ресуспендировали в среде RPMI 1640 с добавлением 100-200 Ед/мл IL-2 и 100 нг/мл антител анти-CD3 и добавляли в лунки. Серийные разведения соединений ИДО, растворенные в феноловом красном RPMI, добавляли до получения конечной концентрации ИДOi от 500 до 1 мкМ. После инкубации в течение 2-4 дней, пролиферацию Т-клеток оценивали с помощью BrdU-инкорпорационного анализа после пульсового мечения смесью для мечения BrdU (Roche Molecular Biochemicals) в течение ночи. По окончании пульсового мечения, клетки фиксировали и инкубировали с антителами анти- BrdU-POD в концентрации 100 мкл/лунка, следуя инструкциям производителя. Показания для планшетов считывали на планшет-ридере.
[0207] В качестве альтернативы исследование ингибиторов ИДО на мышиной модели ИДО-опосредованной супрессии пролиферации Т-клеток in vitro проводится с помощью следующей процедуры. Мышам С57bl6 инокулируют в правый бок клетки опухоли B78H1-GMCSF в концентрации 1×106. Спустя 10-12 дней собирают дренирующие опухоль лимфатические узлы, и клетки помечают анти-CD11c и анти-В220 моноклональными антителами. Клетки сортируют с помощью высокоскоростной сортировки флуоресцентно-активированных клеток. CD11c + /В220 + плазмацитоидные дендритные клетки собирают и помещают в концентрации 2000 клеток/лунка на 96-луночные планшеты с V-образным дном. Спленоциты получают от трансгенных мышей ВМ3 (на фоне СВА) и обогащают с помощью нейлоновой ваты. Т-клетки ВМ3 (105 клеток/лунка) добавляют в каждую лунку в 200 мкл RPMI, 10% FCS, 50 мкМ β-меркаптоэтанола. В качестве альтернативы Т-клетки получают из селезенки трансгенных мышей OT-I и добавляют к культуре в комбинации с OVA-пептидом. Ингибиторы ИДО добавляют в растворенном в среде RPMI виде в конечных концентрациях, варьирующих в диапазоне от 1 мМ до 10 нМ. После 3 дней стимуляции клетки подвергают пульсовому мечению в 16 часов БДУ или 3Н-тимидином. Клетки собирают, фиксируют и тестируют на включение БДУ, следуя инструкциям производителя комплекта для маркирования БДУ (Roche Diagnostics). Если для оценки пролиферации Т-клеток используется 3Н-тимидин, то клетки собирают и проводят подсчет числа распадов в минуту в сцинтилляционном счетчике, следуя широко известной в данной области процедуре. Контрольные CD11c + клетки, взятые из контралатерального лимфатического узла, или CD11c+/В220- клетки (ИДО- популяция) из TDLN используют в качестве положительного контроля для оценки пролиферации
Биологический пример 5 Фармакологическое значение
[0208] В следующей далее таблице приводятся фармакологические значения для соединений, исследование которых проводилось в соответствии с одним или несколькими из предыдущих примеров, включая
[0209] IC50 ИДО человека: это концентрация соединения, при которой, используя рекомбинантный человеческий ИДО, наблюдается 50% ферментной активности при проведении анализа в условиях, описанных в одном из примеров
[0210] Значения IC50 приведены в диапазонах: А: <1 мкМ, В: 1-10 мкМ, С: 10-100 мкМ; D: >100 мкМ.
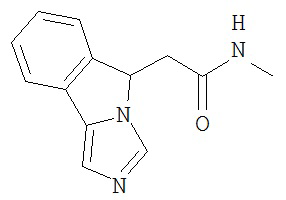
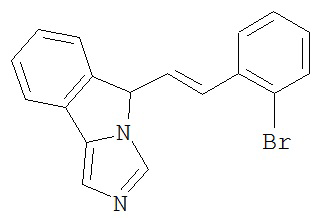
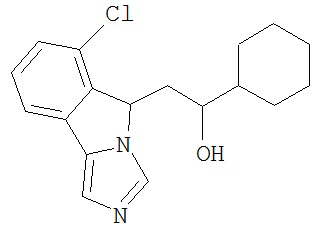
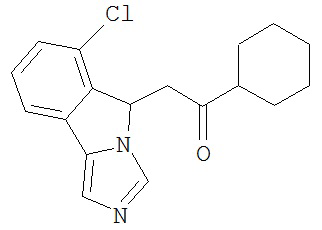
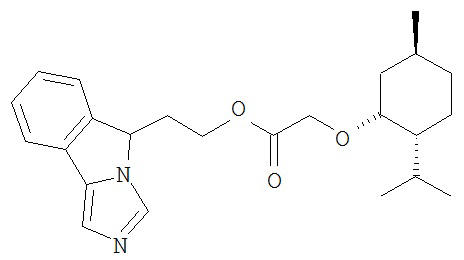
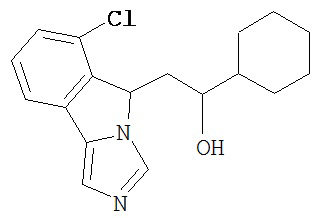
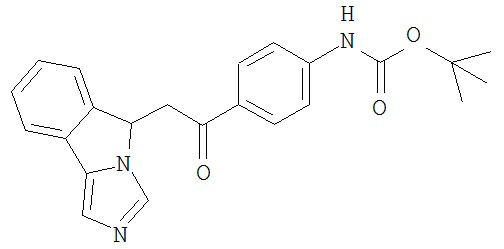
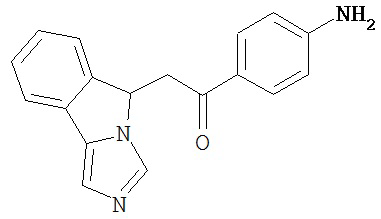
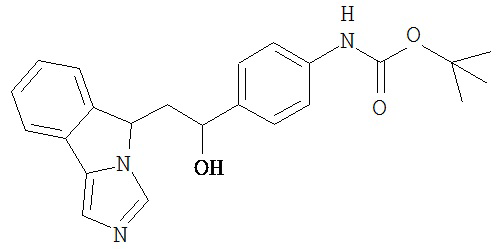
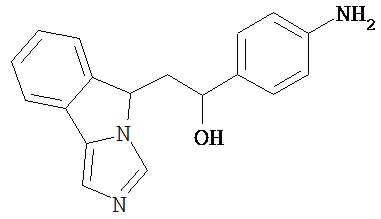
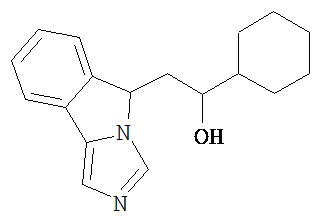
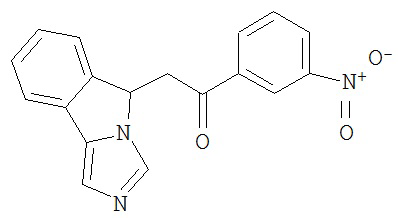
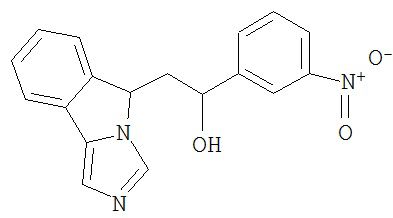
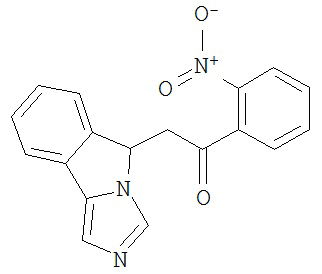
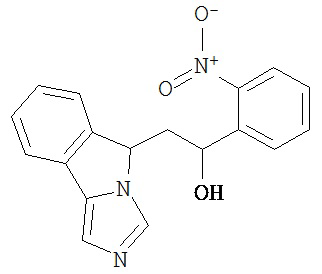
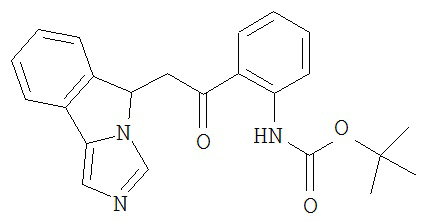
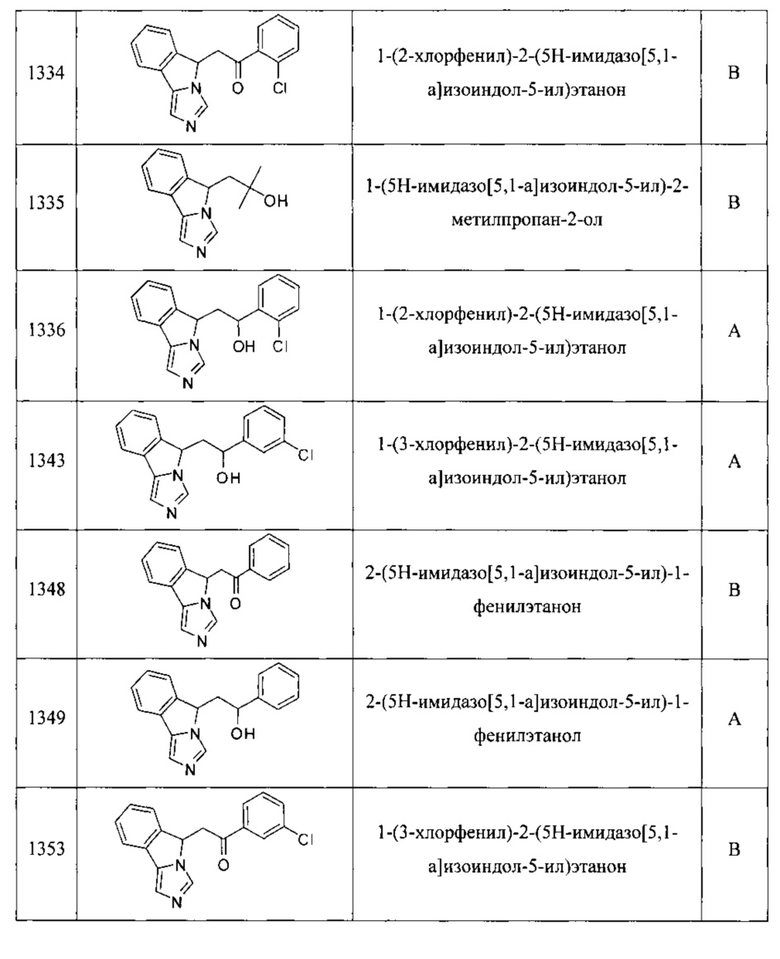
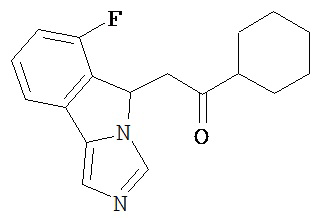
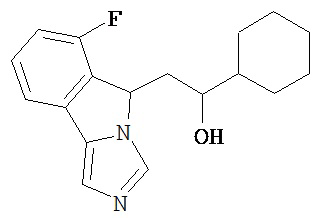
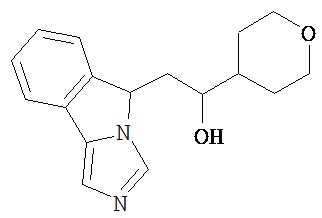
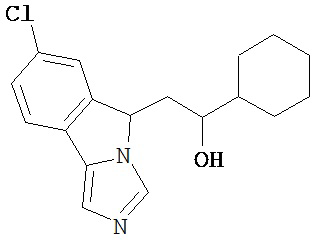
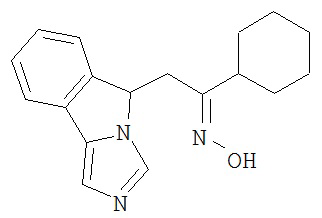
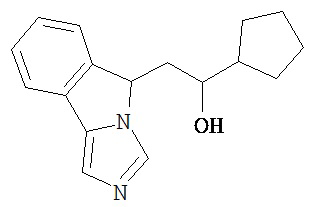
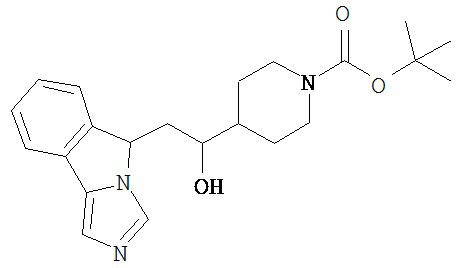
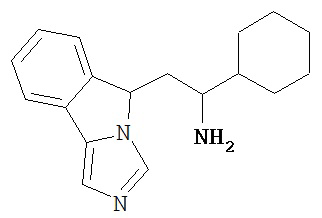
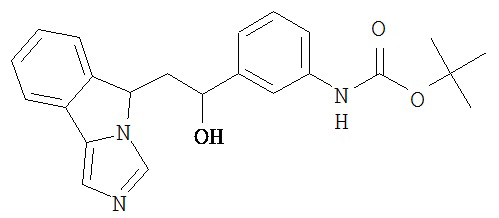
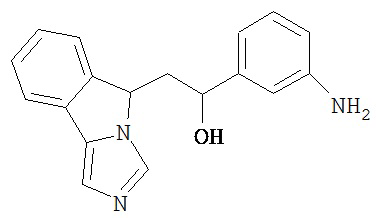
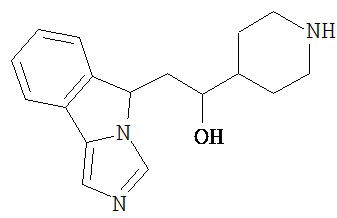
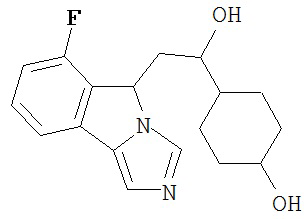
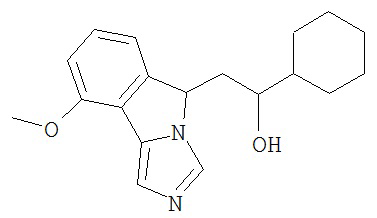
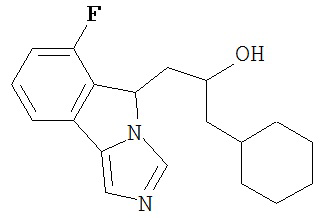
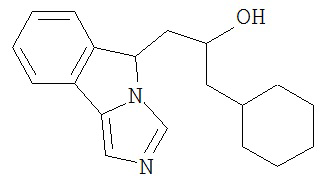
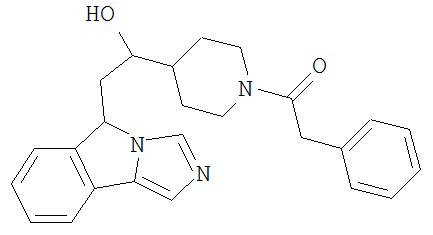
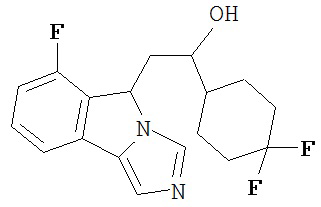
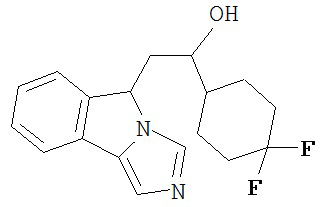
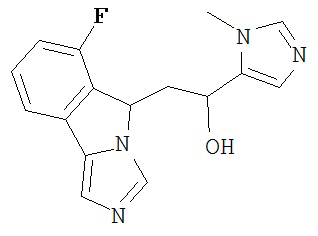
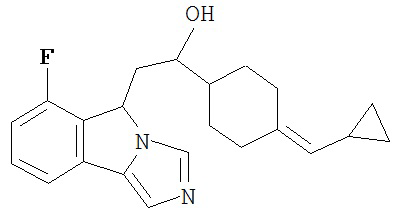
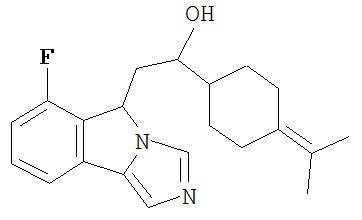
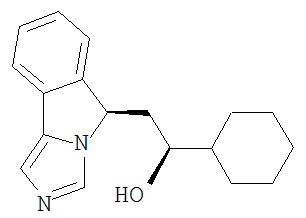
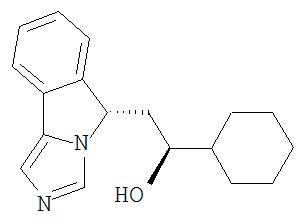
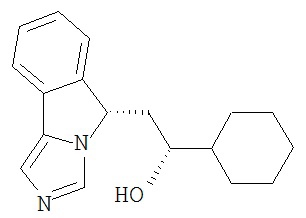
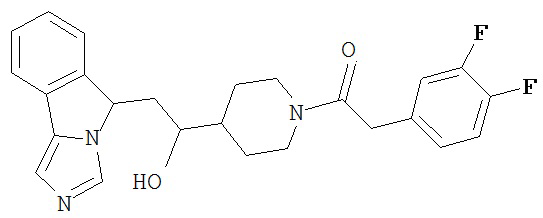
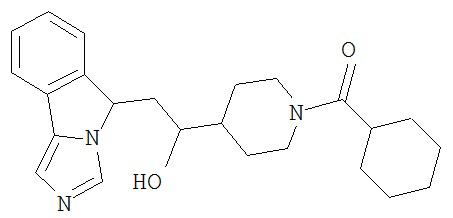
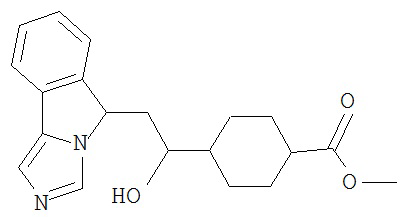
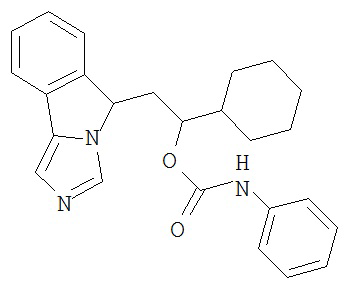
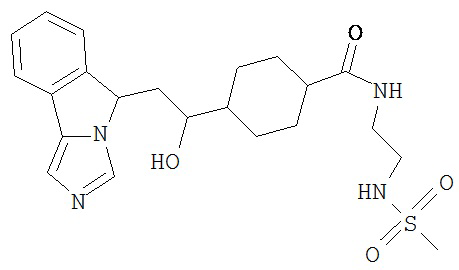
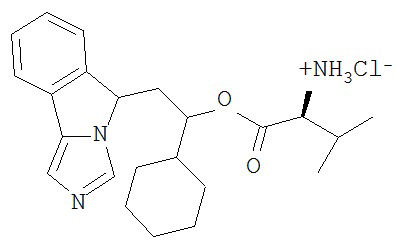
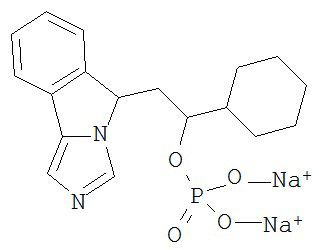
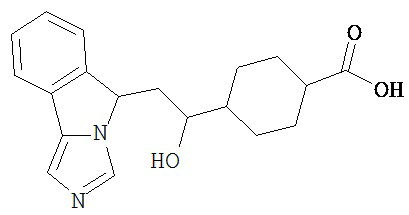
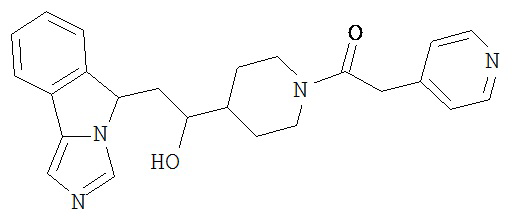
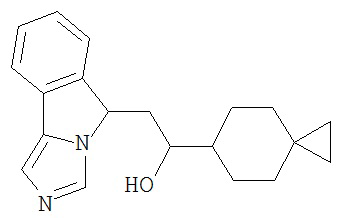
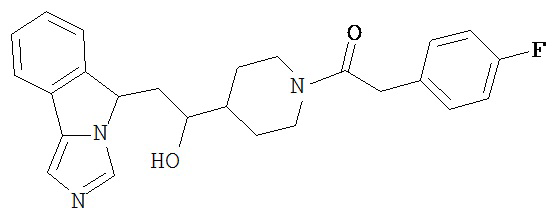
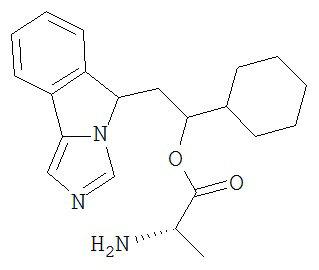
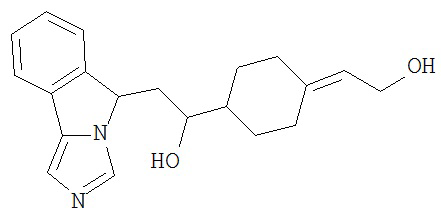
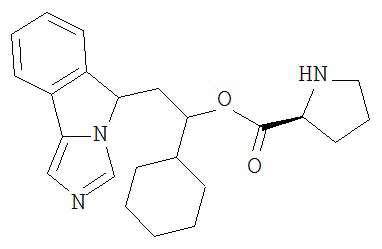
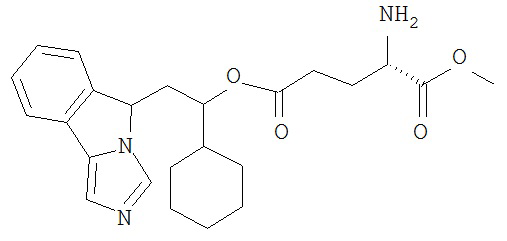
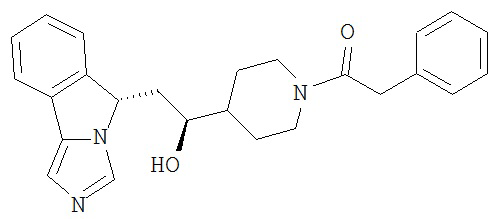
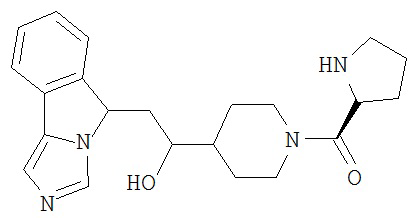
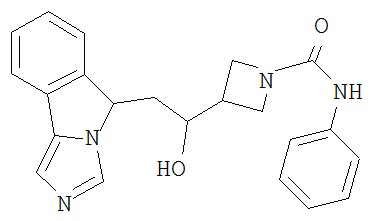
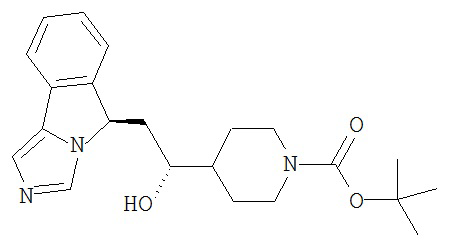
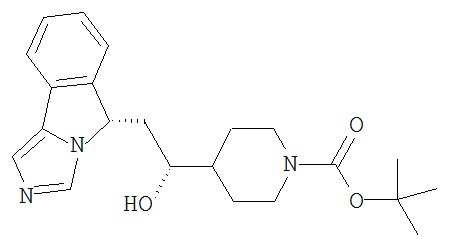
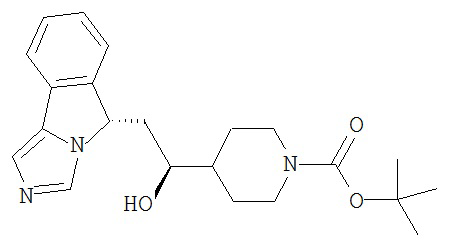
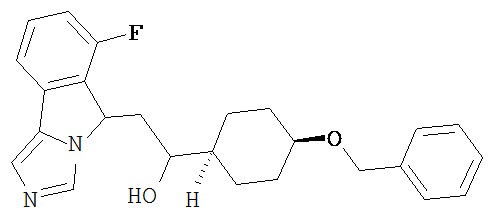
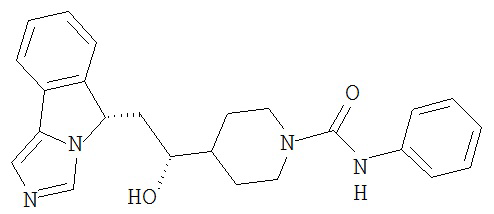
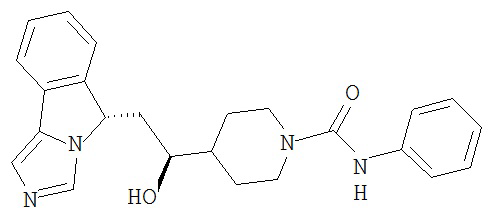
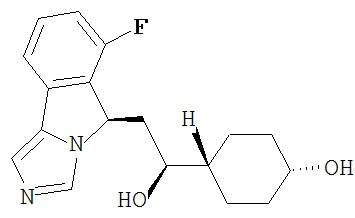
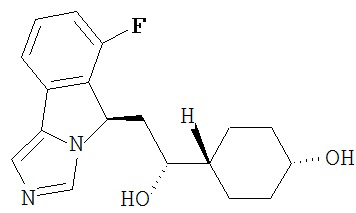
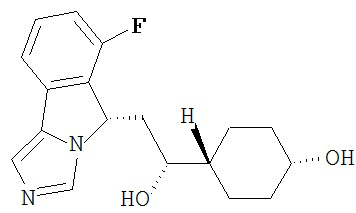
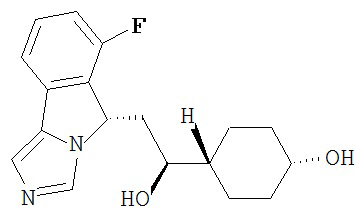
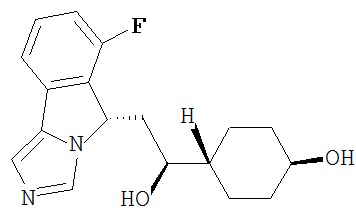
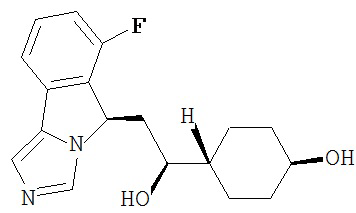
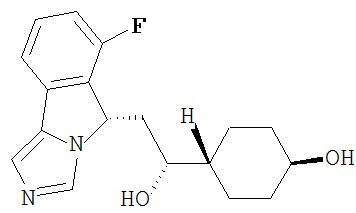
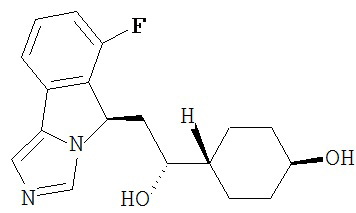
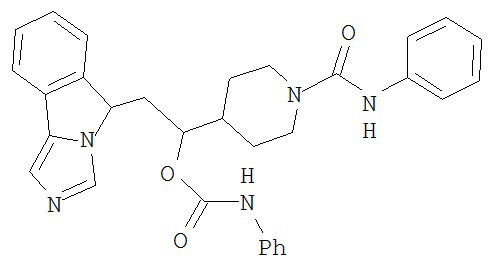
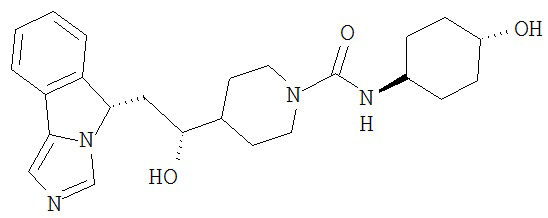
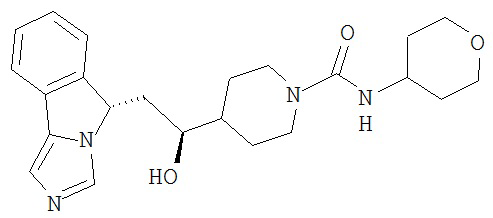
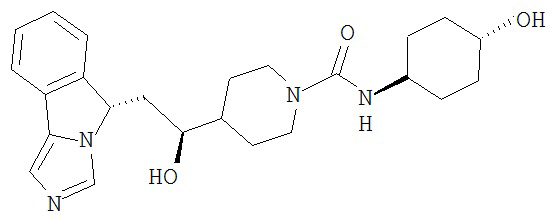
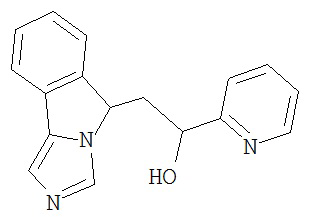
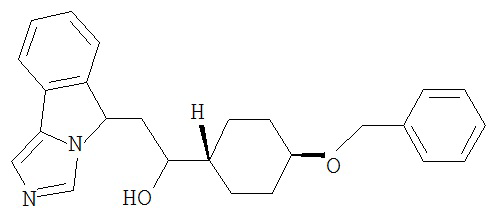
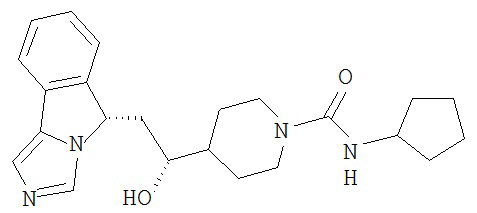
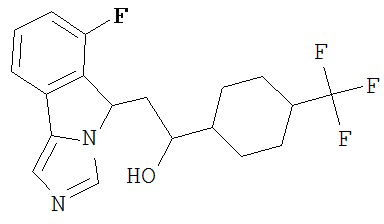
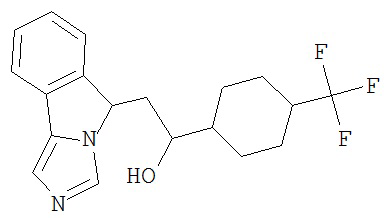
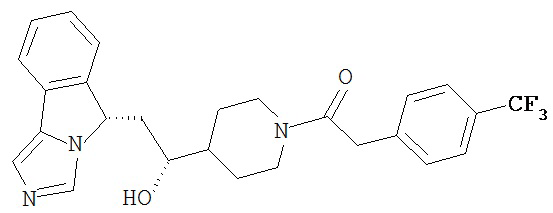
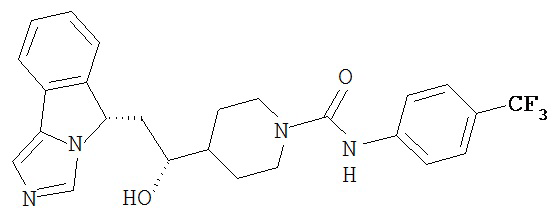
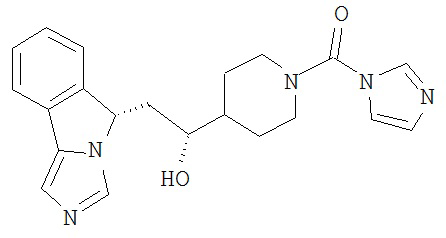
Биологический пример 6 In Vivo исследование ингибиторов ИДО на предмет проявления противоопухолевой активности в сочетании с химиотерапевтическими агентами
[0211] Демонстрируемая in vivo противоопухолевая эффективность может быть проверена с использованием модифицированных протоколов опухолевых аллотрансплантатов. Например, в литературе было описано, что ингибирование ИДО может оказывать синергичное с цитотоксической химиотерапией действие у иммунокомпетентных мышей. Ввиду различной восприимчивости различных линий опухолевых клеток к химиотерапевтическим препаратам и к опосредованному имунитетом отторжению, каждый ингибитор ИДО проверяется отдельно и в комбинации с 2 разными химиотерапевтическими препаратами в рамках 4 различных моделей опухолей животных, представленных 4 различными линиями опухолевых клеток мышей, отобранных из тканей различного происхождения (колоректальная карцинома, карцинома мочевого пузыря, молочной железы и легких), которые имплантировали подкожно сингенной линии мышей. Данные линии клеток были выбраны на основании их известной чувствительности к химиотерапевтическим препаратам, частичном отклике к ингибиторам ИДО, используемым в качестве монотерапии, предполагаемой модели экспрессии ИДО в соответствии с происхождением ткани, а также их способности вызывать иммунную реакцию.
[0212] В случае каждой модели опухоли животных испытание проводится в отдельных группах мышей с использованием двух различных химиотерапевтических препаратов в соответствии со следующим протоколом: 1] опухоль LLC (карцинома легкого): циклофосфамид и паклитаксел; 2] опухоль ЕМТ6: циклофосфамид и паклитаксел; 3] опухоль СТ26: циклофосфамид и доксорубицин; и 4] опухоль МВ49: циклофосфамид и гемцитабин.
[0213] Химиотерапевтические препараты используются в указанных дозах. Максимальная переносимая доза для указанных ниже химиотерапевтических агентов у мышей зависит от лекарственной формы, концентрации, частоты введения, способа введения и количества доз. Химиотерапевтические лекарственные средства вводят в сочетании с препаратом, являющимся ингибитором ИДО: 1] паклитаксел: 20 мг/кг/сутки интраперитонеально, каждые 4 дня, 4 раза (q4d×4) (в Cremophor); 2] доксорубицин: 5 мг/кг один раз неделю в течение 3 недель (q7d×3); 3] циклофосфамид (СТХ): 100 мг/кг интраперитонеально, каждые 4 дня, 4 раза (q4d×4); 4] гемцитабин: 80 мг/кг каждые 4 дня, 4 раза, интраперитонеально (q4d×4).
[0214] В день 1 все животные получают подкожные инъекции живых опухолевых клеток в формирующих опухоли дозах (~ 50000-1000000 клеток), суспендированных в 0,1 мл PBS или физиологического раствора. Подкожная инъекция образует локализованную опухоль, позволяющую осуществлять мониторинг роста опухолей во времени.
[0215] Для имитации эффекта препаратов-ингибиторов ИДО в виде лекарственных форм, введение препаратов-ингибиторов ИДО начинают на 5-8 день после инокуляции опухоли. Доза, способ введения, частота введения варьирует в зависимости от токсичности и фармакокинетического профиля каждого из препаратов. Продолжительность лечения составляет 2 недели. Наиболее предпочтительно, чтобы лекарственное средство вводилось непрерывно через желудочный зонд или растворялось в питьевой воде. В качестве альтернативы возможна хирургическая имплантация под кожу гранул замедленного высвобождения или осмотических насосов, содержащих по 100 мг каждого из препаратов. Лекарственное средство-ингибитор ИДО вводят в максимально переносимой дозе или в концентрации, соответствующей LD50.
[0216] Пример противоопухолевой активности представлен на Рисунках 1-2 (для соединения №1357) и Рисунках 3-4 (для соединения №1304). В данном испытании сингенным мышам С57В16 в день 0 подкожно вводили 200000 мышиных опухолевых клеток LLC. Каждая испытуемая группа включала 10 мышей. На 7 день уже после формирования опухоли и начала экспрессии ИДО в плазмоцитоидных дендритных клеток лимфатических узлов в опухоли, группе из 10 мышей хирургически имплантировали (подкожно, на противоположной по отношению к опухоли стороне тела) осмотические насосы, содержащие по 200 мкл раствора соединений 1357 или 1304 в Cremaphor:EtOH:физраствор (10:10:80) с концентрацией 30 мг/мл. Эти насосы выпускают по 1 мкл раствора в час на протяжении 8 дней, что позволяет добиться постоянной концентрации соединения в плазме ~ 0,5-3 мкмоль. С 15 по 24 день введение соединения производят в форме двух ПК суточных доза по 1 мг каждая. На Рисунках 3-4 мышам дополнительно вводили циклофосфамид в дозе 100 мг/кг интраперитонеально в дни 9, 13 и 15 после инокуляции опухоли либо в виде монотерапии, либо в комбинации с соединением 1304. Результаты данных испытаний указывают на то, что соединения 1357 и 1304 оказывают значительный противоопухолевый эффект при их использовании либо в форме монотерапии, либо при введении в комбинации с химиотерапевтическими препаратами. Наблюдаемый терапевтический эффект проявляется в снижении темпов роста опухоли, что оказывает влияние на среднюю продолжительность жизни и общую выживаемость.
[0217] На Рисунке 1 показан средний объем опухоли с течением времени для двух групп из 10 мышей. Контрольную группу обрабатывали носителем, в то время как испытуемой группе имплантировали осмотические насосы с соединением 1357, согласно описанной выше процедуре. Значения для объема опухоли вводили в уравнение экспоненциального роста и сравнивали полученные параметры с помощью программного обеспечения GraphPad. Полученные данные свидетельствуют о статистически значимых различий между двумя кривыми (р<0,0001).
[0218] На рисунке 2 показан график выживаемости для группы мышей, описанной на Рисунке 1. Значение лог-рангового критерия указывает на статистически значимое различие в средней продолжительности жизни по сравнению с группой, в которой животные получали соединение 1357 в форме монотерапии.
[0219] На Рисунке 3 показан средний объем опухоли во времени для четырех групп из 10 мышей. Контрольную группу обрабатывали носителем, в то время как в остальных группах мышам проводилась химиотерапия циклофосфамидом, имплантация осмотических насосов с соединением 1304 или комбинированная терапия циклофосфамидом и соединением 1304. Результаты указывают на то, что данная опухоль является очень чувствительной к воздействию соединения 1304 либо в форме монотерапии, либо в комбинации с химиотерапией.
[0220] На Рисунке 4 показан график выживаемости для группы мышей, описанной на Рисунке 3. Значение лог-рангового критерия указывает на статистически значимое различие в средней продолжительности жизни по сравнению с группами, в которых животные получали соединение 1357 либо в форме монотерапии, либо в комбинации с циклофосфамидом. Продолжительность жизни, наблюдаемая в группе лечения соединением 1304, исключительно высока: через 60 дней у 70-80% мышей опухоль отсутствовала.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ИМИДАЗОИЗОИНДОЛА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2717577C2 |
| ИЗОИНДОЛИНОНОВЫЕ ИНГИБИТОРЫ ВЗАИМОДЕЙСТВИЯ MDM2-P53, ОБЛАДАЮЩИЕ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2794333C1 |
| ПИРРОЛОПИРАЗИНОВЫЕ ИНГИБИТОРЫ КИНАЗЫ | 2012 |
|
RU2673064C2 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ИММУНОСУПРЕССИИ, ОПОСРЕДУЕМОЙ МЕТАБОЛИЗИРОВАНИЕМ ТРИПТОФАНА | 2014 |
|
RU2667509C2 |
| НОВОЕ ИМИДАЗООКСАЗИНОВОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ | 2012 |
|
RU2578608C2 |
| ХИМИЧЕСКИЕ СОЕДИНЕНИЯ 637: ПИРИДОПИРИМИДИНДИОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2008 |
|
RU2479584C2 |
| ИМИДАЗОПИРАЗИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ТИРОЗИНКИНАЗ | 2004 |
|
RU2405784C2 |
| ИЗОИНДОЛИНОНОВЫЕ ИНГИБИТОРЫ ВЗАИМОДЕЙСТВИЯ MDM2-P53, ОБЛАДАЮЩИЕ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2797295C1 |
| ИМИДАЗОПИРАЗИНЫ | 2012 |
|
RU2600327C2 |
| ПОЛИЦИКЛИЧЕСКИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНО-СИНЦИТИАЛЬНЫХ ВИРУСНЫХ ИНФЕКЦИЙ | 2004 |
|
RU2422444C2 |
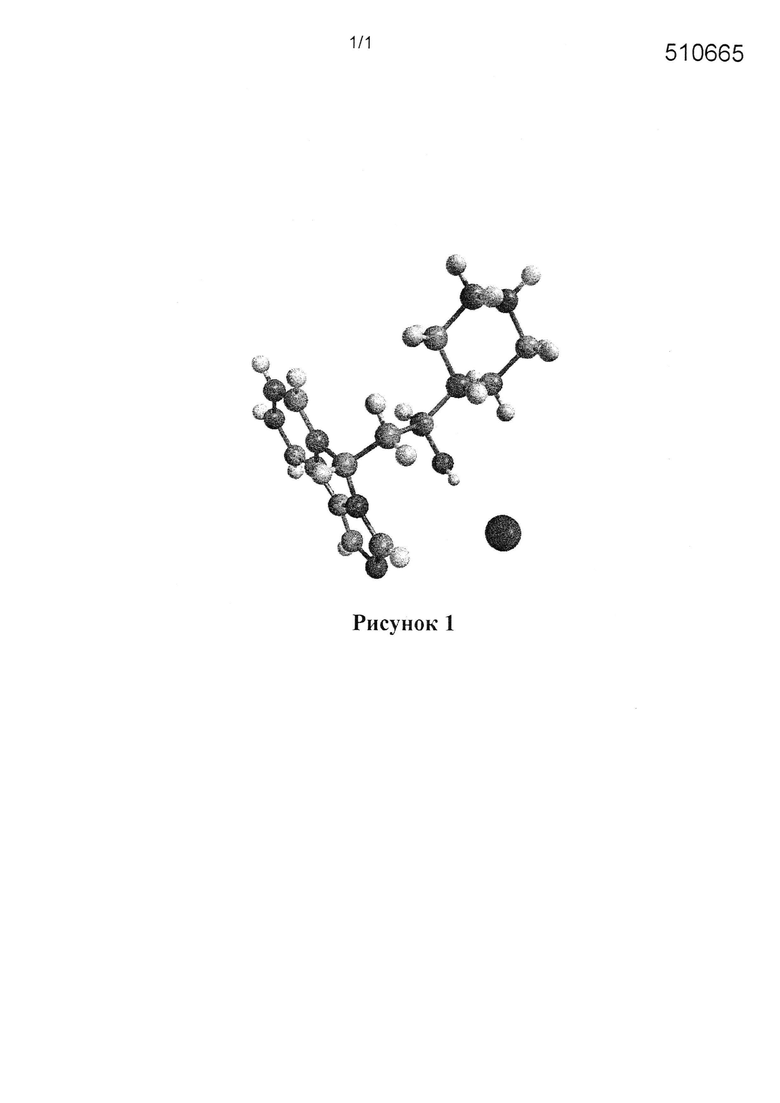
Изобретение относится к области органической химии, а именно к производным имидазо[5,1-а]изоиндола указанной ниже структуры, или к его стереоизомеру или фармацевтически приемлемой соли, где связь α является одиночной или двойной; n = 0 или 1; R1: галоген или -OR; R2: -С1-4алкил-RA или -С2-4алкенил-R3, если связь α является одиночной; и R2: =C(H)RA, если связь α является двойной; в котором RA: -CN, -C(O)R3, -C(O)OR3, -C(O)N(R3)(RC), -C(ORB)(R3)(RC), -C(NHRB)(R3)(RC), или -C(=N-ORC)R3, где RB: водород, -C(O)R3, -C(O)N(H)R3, -C(O)(CH2)2COOR, -C(O)(CH2)1-4(NR)COOR, -C(O)CH(NH2)(RD), или -P(O)(OR3)2; где RD: метил или -СН(СН3)2; R3: водород, C1-6алкил, фенил, имидазолил, фуранил, тиазолил, пиридинил, С5-6циклоалкил, С3-8циклоалкенил, пиперидинил, пирролидинил, тетрагидропиранил, азетидинил или С6циклоалкилС1алкил-, где каждый алкил, циклоалкил, пиперидинил, пирролидинил, тетрагидропиранил и азетидинил необязательно и независимо замещен одной группой =R32 и необязательно и независимо замещен одной или двумя группами R31; каждый фенил, имидазолил, фуранил, тиазолил и пиридинил необязательно замещен одной или двумя группами R31; где R31: галоген, нитро, C1-6алкил, -C1-6алкил-R33, C1-6галоалкил, -OR, -N(R)2, -C(O)OR, -C(O)N(R)2, -C(O)R, -S(O)2R, -OC(O)R, -N(R)C(O)R или -N(R)C(O)OR, где R33: -OR; R32: =O, =C(R34)2, =(спиро-С3-8циклоалкил), или =(спиродиоксаланил), где R34: водород, галоген, C1-6алкил или -С1алкил-OR; RC: водород или C1-6алкил; и R: водород или R10, где R10: C1-6алкил, фенил, тиофенил, С5-6циклоалкил, пирролидинил, тетрагидропиранил, фенилС1-6алкил, гетероарилС1-2алкил- (где гетероарильная группа представляет собой пиридин, пиримидин или имидазол) или тетрагидропиранС1алкил, где каждый из алкила, фенила, циклоалкила и фенилС1-2алкила необязательно замещен одной или двумя группами, которые независимо представляют собой галоген, C1-6алкил, С1галоалкил, -OR11, -N(R11)2 или -N(R11)S(O)2R11, где R11: водород или C1-6алкил. Также изобретение относится к конкретным соединениям, фармацевтической композиции на основе заявленного производного имидазо[5,1-а]изоиндола и способу лечения опосредованной индоламин-2,3-диоксигеназой (ИДО) иммуносупрессии. Технический результат: получены новые производные имидазо[5,1-а]изоиндола, обладающие полезными биологическими свойствами. 10 н. и 32 з.п. ф-лы, 1 ил., 75 пр.
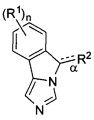
1. Соединение формулы,
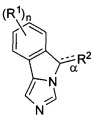
или его стереоизомер или фармацевтически приемлемая соль, где
связь α является одиночной или двойной;
n принимает значения 0 или 1;
каждый R1 независимо представляет собой галоген или -OR;
R2 представляет собой -С1-4алкил-RA или -С2-4алкенил-R3, если связь α является одиночной; и
R2 представляет собой =C(H)RA, если связь α является двойной;
в котором
RA представляет собой -CN, -C(O)R3, -C(O)OR3, -C(O)N(R3)(RC), -C(ORB)(R3)(RC), -C(NHRB)(R3)(RC), или -C(=N-ORC)R3, где
RB представляет собой водород, -C(O)R3, -C(O)N(H)R3, -C(O)(CH2)2COOR, -C(O)(CH2)1-4(NR)COOR, -C(O)CH(NH2)(RD), или -P(O)(OR3)2; где
RD представляет собой метил или -СН(СН3)2;
каждый из R3 независимо представляет собой водород, C1-6алкил, фенил, имидазолил, фуранил, тиазолил, пиридинил, С5-6циклоалкил, С3-8циклоалкенил, пиперидинил, пирролидинил, тетрагидропиранил, азетидинил или С6циклоалкилС1алкил-, где
каждый алкил, циклоалкил, пиперидинил, пирролидинил, тетрагидропиранил и азетидинил необязательно и независимо замещен одной группой =R32 и необязательно и независимо замещен одной или двумя группами R31;
каждый фенил, имидазолил, фуранил, тиазолил и пиридинил необязательно замещен одной или двумя группами R31;
где
каждый из R31 независимо представляет собой галоген, нитро, C1-6алкил, -C1-6алкил-R33, C1-6галоалкил, -OR, -N(R)2, -C(O)OR, -C(O)N(R)2, -C(O)R, -S(O)2R, -OC(O)R, -N(R)C(O)R или -N(R)C(O)OR, где
R33 представляет собой -OR;
R32 представляет собой =O, =C(R34)2, =(спиро -С3-8циклоалкил), или =(спиродиоксаланил), где
каждый из R34 независимо представляет собой водород, галоген, C1-6алкил или -С1алкил-OR;
RC представляет собой водород или C1-6алкил;
и
каждый из R независимо представляет собой водород или R10, где
R10 представляет собой C1-6алкил, фенил, тиофенил, С5-6циклоалкил, пирролидинил, тетрагидропиранил, фенилС1-6алкил, гетероарилС1-2алкил- (где гетероарильная группа представляет собой пиридин, пиримидин или имидазол) или тетрагидропиранС1алкил, где каждый из алкила, фенила, циклоалкила и фенилС1-2алкила необязательно замещен одной или двумя группами, которые независимо представляют собой галоген, C1-6алкил, С1галоалкил, -OR11, -N(R11)2 или -N(R11)S(O)2R11, где каждый из R11 независимо представляет собой водород или C1-6алкил.
2. Соединение по п.1, где связь α является одиночной.
3. Соединение по п.1 или 2, где R2 представляет собой -С1-4алкил-RA.
4. Соединение по п.1 или 2, где R2 представляет собой -CH2-RA, -CH2CH2-RA, -C(H)(CH3)CH2-RA или -C(H)=C(H)R3.
5. Соединение по п.1 или 2, где R2 представляет собой -CH2-RA.
6. Соединение по п.1, где RA представляет собой -C(O)R3 или -C(ORB)(R3)(RC).
7. Соединение по п.1, где RA представляет собой -C(NHRB)(R3)(RC) или -C(=N-ORC)R3.
8. Соединение по п.1, где RA представляет собой -C(NHRB)(R3)(RC), a RB - водород, или -С(O)С1-6алкил.
9. Соединение по п.1, где RA представляет собой -C(NH2)(R3)(RC).
10. Соединение по п.1, где RA представляет собой -C(O)R3.
11. Соединение по п.1, где RA представляет собой -C(ORB)(R3)(RC).
12. Соединение по п.1, где RA представляет собой -CH(OH)(R3).
13. Соединение по п.1, где R3 представляет собой водород, C1-6алкил, фенил, имидазолил, фуранил, тиазолил, пиридинил, C5-6циклоалкил, С3-8циклоалкенил, пиперидинил, пирролидинил, тетрагидропиранил или азетидинил,
в котором каждый алкил, циклоалкил, пиперидинил, пирролидинил, тетрагидропиранил и азетидинил необязательно замещен одной группой =R32 и каждый необязательно и независимо замещен или одной или двумя группами R31; и каждый фенил, имидазолил, фуранил, тиазолил и пиридинил необязательно замещен одной или двумя группами R31.
14. Соединение по п.1, где R3 представляет собой фенил, имидазолил, фуранил, тиазолил, пиридинил, C5-6циклоалкил, С3-8циклоалкенил, пиперидинил, пирролидинил, тетрагидропиранил, азетидинил или С6циклоалкилС1алкил-, в котором
каждый циклоалкил, пиперидинил, пирролидинил, тетрагидропиранил, азетидинил необязательно и независимо замещен одной группой =R32 и каждый необязательно и независимо замещен одной или двумя группами R31; и
каждый фенил, имидазолил, фуранил, тиазолил и пиридинил необязательно замещен одной или двумя группами R31.
15. Соединение по п.1, где R3 представляет собой фенил, имидазолил, фуранил, тиазолил, пиридинил, моноциклический С5-6циклоалкил, моноциклический С5-8циклоалкенил, пиперидинил, пирролидинил, тетрагидропиранил или азетидинил, где
каждый циклоалкил, пиперидинил, пирролидинил, тетрагидропиранил и азетидинил необязательно и независимо замещен одной группой =R32, и каждый необязательно и независимо замещен одной или двумя группами R31; и
каждый фенил, имидазолил, фуранил, тиазолил и пиридинил необязательно замещен одной или двумя группами R31.
16. Соединение по п.1, где R3 представляет собой фенил, имидазолил, фуранил, тиазолил или пиридинил, каждый из которых необязательно замещен одной или двумя группами R31.
17. Соединение по п.1, где R3 представляет собой моноциклический С5-6циклоалкил, пиперидинил, пирролидинил, тетрагидропиранил или азетидинил, каждый из которых необязательно замещен одной группой =R32 и одной или двумя группами R31.
18. Соединение по п.1, где R3 представляет собой 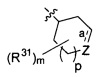 , где связь а является одиночной или двойной;
, где связь а является одиночной или двойной;
m - 0 или 1;
p - 0 или 1;
если связь а является одиночной, то Z представляет собой -C(R36)2-, -C(=R32)-, -N(R35)-или -О-, где
R35 представляет собой водород, C1-6алкил, -C(O)R, -S(O)2R, -C(O)OR или -C(O)N(R)2;
если связь а является двойной, то Z представляет собой -C(R36)=; и
каждый из R36 независимо представляет собой водород или R31,
при условии, что R3 не представляет собой тетрагидрофуран.
19. Соединение по п.18, где если связь а является одиночной, то Z представляет собой -C(R36)2- или -C(=R32)-; а если связь а является двойной, то Z представляет собой -C(R33)=.
20. Соединение по п.18, где связь а является одиночной и Z представляет собой -C(R36)2- или -C(=R32)-.
21. Соединение по п.18, где связь а является одиночной и Z представляет собой -N(R35)- или -О-.
22. Соединение по п.2, где
n - 0 или 1;
каждый из R1 независимым образом представляет собой галоген или -OR;
R2 представляет собой -CH2-RA, -CH2CH2-RA или -C(H)=C(H)R3;
в котором
RA представляет собой -C(O)R3 или -C(ORB)(R3)(RC), где
RB представляет собой водород;
каждый из R3 независимо представляет собой водород, C1-6алкил, фенил, имидазолил, фуранил, тиазолил, пиридинил, С5-6циклоалкил, С3-8циклоалкенил, пиперидинил, пирролидинил, тетрагидропиранил, азетидинил или С6циклоалкилС1алкил-,
в котором
каждый алкил, циклоалкил, пиперидинил, пирролидинил, тетрагидропиранил и азетидинил необязательно и независимо замещен одной группой =R32, и каждый необязательно и независимо замещен одной или двумя группами R31;
каждый фенил, имидазолил, фуранил, тиазолил и пиридинил необязательно замещен одной или двумя группами R31;
где
каждый из R31 независимо представляет собой галоген, нитро, C1-6алкил, -C1-6алкил-R33, С1галоалкил, -OR, -N(R)2, -C(O)OR, -C(O)N(R)2, -C(O)R, -S(O)2R, -OC(O)R, -N(R)C(O)R или -N(R)C(O)OR, где R33 представляет собой -OR;
R32 представляет собой оксо, =C(R34)2, =(спиро-С3циклоалкил) или =(спиродиоксаланил), где
каждый из R34 независимым образом представляет собой водород, галоген или C1-6алкил; и
RC представляет собой водород или C1-6алкил.
23. Соединение по п.22 формулы
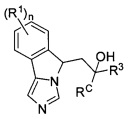 .
.
24. Соединение по п.23, где
R3 представляет собой фенил, имидазолил, фуранил, тиазолил, пиридинил, С5-6циклоалкил, пиперидинил, пирролидинил, тетрагидропиранил или азетидинил, в котором
каждый циклоалкил, пиперидинил, пирролидинил, тетрагидропиранил и азетидинил необязательно замещен одной группой =R32 и одной или двумя группами R31; и
каждый фенил, имидазолил, фуранил, тиазолил и пиридинил необязательно замещен одной или двумя группами R31.
25. Соединение по п.24 формулы,
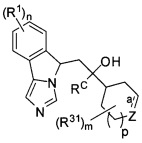 ,
,
где
связь а является одиночной или двойной;
m - 0 или 1;
p - 0 или 1;
если связь а является одиночной, то Z представляет собой -C(R36)2-, -C(=R32)-, -N(R35)- или -О-, где R35 представляет собой водород, C1-6алкил, -C(O)R, -S(O)2R, -C(O)OR или -C(O)N(R)2; и
если связь а является двойной, то Z представляет собой -C(R36)=; и
каждый из R36 независимым образом представляет собой водород или R31, при условии, что R3 не представляет собой тетрагидрофуран.
26. Соединение по п.1 формулы,
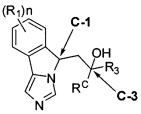
где стереоизмерическая конфигурация углерода-1 (С-1) и углерода-3 (С-3) соответственно представляет собой (R,R).
27. Соединение по п.1 формулы,
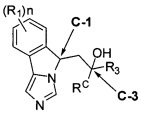
где стереоизмерическая конфигурация углерода-1 и углерода-3 соответственно представляет собой (R,S).
28. Соединение по п.1 формулы,
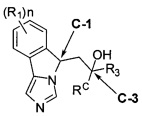
где стереоизмерическая конфигурация углерода-1 и углерода-3 соответственно представляет собой (S,R).
29. Соединение по п.1 формулы,
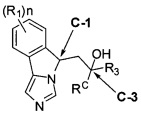
где стереоизмерическая конфигурация углерода-1 и углерода-3 соответственно представляет собой (S,S).
30. Соединение по п.1 формулы,
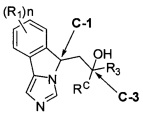
где стереоизмерическая конфигурация углерода-1 и углерода-3 соответственно представляет собой (S,R) или (S,S) и где R3 представляет собой циклогексил, необязательно замещенный R31, представляющим собой OR.
31. Соединение по п.1 формулы,
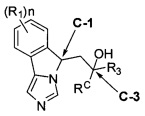
где стереоизмерическая конфигурация углерода-1 и углерода-3 соответственно представляет собой (S,R) или (S,S), R3 представляет собой пиперидин, необязательно замещенный R31, представляющим собой -C(O)R или -C(O)(NHR).
32. Соединение по п.1, представляющее собой
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
этил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)ацетат;
(Е)-5-(2-бромстирил)-5Н-имидазо[5,1-а]изоиндол;
2-(6-хлор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-циклогексилэтанол;
2-(6-хлор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-циклогексилэтанон;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил2-(((1R,2R,5S)-2-изопропил-5-метилциклогексил)окси)ацетат;
трет-бутил (4-(2-(5Н-имидазо[5,1-а]изоиндол-5-ил)ацетил)фенил)карбамат;
1-(4-аминофенил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанон;
трет-бутил (4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)фенил)карбамат;
1-(4-аминофенил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(3-нитрофенил)этанон;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(3-нитрофенил)этанол;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(2-нитрофенил)этанон;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(2-нитрофенил)этанол;
трет-бутил (2-(2-(5Н-имидазо[5,1-а]изоиндол-5-ил)ацетил)фенил)карбамат;
трет-бутил (2-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)фенил)карбамат;
1-(2-аминофенил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанон;
1-(2-аминофенил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
1-(2-хлорфенил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанон;
1-(5Н-имидазо[5,1-а]изоиндол-5-ил)-2-метилпропан-2-ол;
1-(2-хлорфенил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
1-(3-хлорфенил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-фенилэтанон;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-фенилэтанол;
1-(2,5-диметилфуран-3-ил)-2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
1-(3-хлорфенил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанон;
1-циклогексил-2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)этанон;
1-циклогексил-2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(тетрагидро-2Н-пиран-4-ил)этанол;
2-(7-хлор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-циклогексилэтанол;
(Z)-1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанона оксим;
1-циклопентил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
трет-бутил 4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-карбоксилат;
1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанамин;
трет-бутил (3-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)фенил)карбамат;
1-(3-аминофенил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
4-(2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол;
1-циклогексил-2-(9-метокси-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
5-(2-циклогексил-2-гидроксиэтил)-5Н-имидазо[5,1-а]изоиндол-9-ол;
2-(8-хлор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-циклогексилэтанол;
1-(циклогекс-1-ен-1-ил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
1-циклогексил-2-(8-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(1,4-диоксаспиро[4.5]декан-8-
ил)этанол;
4-(2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексанон;
2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(4-метиленциклогексил)этанол;
1-(циклогекс-3-ен-1-ил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
1-(4-(гидроксиметил)циклогексил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)(тиофен-2-ил)метанон;
1-(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)этанон;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(4-метиленциклогексил)этанол;
2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(4-метилциклогексил)этанол;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(тиазол-4-ил)этанол;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(тиазол-5-ил)этанол;
1-(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)-2,2-диметилпропан-1-он;
2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(фуран-2-ил)этанол;
(1S)-1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
(1R)-1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(4-(йодметилен)циклогексил)этанол;
1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)пропан-1-ол;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)ацетонитрил;
1-циклогексил-3-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пропан-2-ол;
1-циклогексил-3-(5Н-имидазо[5,1-а]изоиндол-5-ил)пропан-2-ол;
1-(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)-2-фенилэтанон;
1-(4,4-дифторциклогексил)-2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
1-(4,4-дифторциклогексил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(1-метил-1Н-имидазол-5-ил)этанол;
1-(4-(циклопропилметилен)циклогексил)-2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(4-(пропан-2-илиден)циклогексил)этанол;
(Е)-5-(2-циклогексилвинил)-5Н-имидазо[5,1-а]изоиндол;
2-(9-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(4-метилциклогексил)этанол;
1-(циклогекс-3-ен-1-ил)-2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
(S)-1-циклогексил-2-((R)-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
(R)-1-циклогексил-2-((R)-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
(R)-1-циклогексил-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-илиден)этанол;
1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этилацетат;
1-(4-(2-(бензилокси)этилиден)циклогексил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
1-(1-(бензилсульфонил)пиперидин-4-ил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
1-(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)-2-(пиримидин-5-ил)этанон;
2-(3,4-дифторфенил)-1-(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)этанон;
циклогексил(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)метанон;
метил 4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)циклогексанкарбоксилат;
1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил фенилкарбамат;
4-(1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этокси)-4-оксобутановая кислота;
4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)циклогексанол;
1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этилбензоат;
4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-N-(2-(метилсульфонамид)этил)циклогексанкарбоксамид;
(2S)-1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил-2-амино-3-метилбутаноат;
1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этила дигидрофосфат;
4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)циклогексанкарбоновая кислота;
1-(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)-2-(пиридин-4-ил)этанон;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(спиро[2.5]октан-6-ил)этанол;
2-(4-фторфенил)-1-(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)этанон;
(2S)-1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил 2-аминопропаноат;
1-(4-(2-гидроксиэтилиден)циклогексил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
(2S)-1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этилпирролидин-2-карбоксилат;
(2S)-5-(1-циклогексил-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-1-метил 2-аминопентандиоат;
(3-фтор-2-гидроксифенил)(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)метанон;
4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-N-фенилпиперидин-1-карбоксамид;
(4-фторфенил)(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)метанон;
(2S)-2-амино-1-(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)-3-фенилпропан-1-он;
(4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)((S)-пирролидин-2-ил)метанон;
(1R,4s)-4-(2-((S)-6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексил бензоат;
(1R,4s)-4-(2-((S)-6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол;
1-(3-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)азетидин-1-ил)-2-фенилэтанон;
3-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-N-фенилазетидин-1-карбоксамид;
трет-бутил 3-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)азетидин-1-карбоксилат
1-(азетидин-3-ил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
трет-бутил 4-((S)-1-гидрокси-2-((R)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-карбоксилат;
трет-бутил 4-((R)-1-гидрокси-2-((R)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-карбоксилат;
трет-бутил 4-((R)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-карбоксилат;
трет-бутил 4-((S)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-карбоксилат;
1-((1s,4s)-4-(бензилокси)циклогексил)-2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(пиридин-3-ил)этанол;
(1r,4r)-4-(2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол;
4-((S)-1-гидрокси-2-((R)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-N-фенилпиперидин-1-карбоксамид;
4-((R)-1-гидрокси-2-((R)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-N-фенилпиперидин-1-карбоксамид;
4-((S)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-N-фенилпиперидин-1-карбоксамид;
(1R,4s)-4-((S)-2-((R)-6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол;
(1S,4s)-4-((R)-2-((R)-6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол;
(1S,4s)-4-((R)-2-((S)-6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол;
(1R,4s)-4-((S)-2-((S)-6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол;
(1S,4r)-4-((S)-2-((S)-6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол;
(1S,4r)-4-((S)-2-((R)-6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол;
(1R,4r)-4-((R)-2-((R)-6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол;
1-(4-((S)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)-2-(тетрагидро-2Н-пиран-4-ил)этанон;
1-(4-((R)-1-гидрокси-2-((R)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)-2-фенилэтанон;
N-((1s,4s)-4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-
ил)этил)циклогексил)бензамид;
1-(4-((S)-1-гидрокси-2-((R)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)-2-фенилэтанон;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(1-(фенилкарбамоил)пиперидин-4-ил)этилфенилкарбамат;
4-((R)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-N-((1r,4R)-4-гидроксициклогексил)пиперидин-1-карбоксамид;
4-((S)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-N-(тетрагидро-2Н-пиран-4-ил)пиперидин-1-карбоксамид;
4-((S)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-N-((1r,4S)-4-гидроксициклогексил)пиперидин-1-карбоксамид;
1-((1r,4r)-4-(бензилокси)циклогексил)-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
1-((1r,4r)-4-(бензилокси)циклогексил)-2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол;
1-(4-((R)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)-2-(тетрагидро-2Н-пиран-4-ил)этанон;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(пиридин-4-ил)этанол;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(пиридин-2-ил)этанол;
4-((R)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-N-(тетрагидро-2Н-пиран-4-ил)пиперидин-1-карбоксамид;
N-циклогексил-4-((R)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-карбоксамид;
N-((1r,4r)-4-(1-гидрокси-2-(5Н-имидазо[5,1-а]изоиндол-5-ил)этил)циклогексил)бензамид;
N-циклопентил-4-((R)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-карбоксамид;
2-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(4-(трифторметил)циклогексил)этанол;
2-(5Н-имидазо[5,1-а]изоиндол-5-ил)-1-(4-(трифторметил)циклогексил)этанол;
1-(4-((R)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-ил)-2-(4-(трифторметил)фенил)этанон;
4-((R)-1-гидрокси-2-((S)-5H-имидазо[5,1-а]изоиндол-5-ил)этил)-N-(4-(трифторметил)фенил)пиперидин-1-карбоксамид;
(4-((R)-1-гидрокси-2-((S)-5H-имидазо[5,1-а]изоиндол-5-ил)этил)пиперидин-1-
ил)(1Н-имидазол-1-ил)метанон;
или его фармацевтически приемлемую соль.
33. Соединение, представляющее собой 4-((R)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-N-фенилпиперидин-1-карбоксамид или его фармацевтически приемлемая соль.
34. Соединение, представляющее собой 1-4-((R)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-пиперидин-1-ил)-2-фенилэтанон или его фармацевтически приемлемая соль.
35. Соединение, представляющее собой 1-(4-((S)-1-гидрокси-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этил)-пиперидин-1-ил)-2-фенилэтанон или его фармацевтически приемлемая соль.
36. Соединение, представляющее собой (S)-1-циклогексил-2-((S)-5Н-имидазо[5,1-а]изоиндол-5-ил)этанол или его фармацевтически приемлемая соль.
37. Соединение, представляющее собой (1R,4r)-4-((R)-2-((S)-6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-1-гидроксиэтил)циклогексанол или его фармацевтически приемлемая соль.
38. Фармацевтическая композиция для ингибирования индоламин-2,3-диоксигеназой (ИДО) иммуносупрессии, содержащая из соединений по пп.1-37 и фармацевтически приемлемый наполнитель, растворитель или носитель.
39. Способ лечения опосредованной индоламин-2,3-диоксигеназой (ИДО) иммуносупрессии у нуждающихся в этом пациентов, предусматривающий введение эффективного количества соединения по пп.1-37 или фармацевтической композиции по п.38.
40. Способ по п.39, когда иммуносупрессия вызвана вирусом иммунодефицита человека (ВИЧ).
41. Способ по п.39, когда иммуносупрессия вызвана раком.
42. Способ ингибирования опосредованной индоламин-2,3-диоксигеназой (ИДО) иммуносупрессии в клетке, включающий контактирование клетки с соединением по любому из пп.1-37 или фармацевтической композицией по п.38.
| WO 2009132238 A3, 29.10.2009 | |||
| EA 200702455 A1, 28.04.2008. |
Авторы
Даты
2017-03-17—Публикация
2012-04-12—Подача