Настоящее изобретение относится к применению новых производных пирролопиразина, которые представляют собой ингибиторы JAK (janus kinase - янус-киназа) и SYK (spleen tyrosine kinase - тирозинкиназа селезенки), избирательно ингибируют JAK3 и полезны для лечения аутоиммунных и воспалительных заболеваний. Данная заявка является родственной заявкам США с серийными №№13/110062 (подана 18 мая 2011 года), 13/11005 (подана 18 мая 2011 года), 13/040310 (подана 4 марта 2011 года), 13/039433 (подана 3 марта 2011 года), 12/378837 (подана 20 февраля 2009 года), 12/378869 (подана 20 февраля 2009 года), 12/378971 (подана 20 февраля 2009 года), 12/378977 (подана 20 февраля 2009 года) и 12/378978 (подана 20 февраля 2009 года), описания которых включены в данную заявку посредством ссылки.
JAK (янус-киназы) представляют собой семейство цитоплазматических протеинтирозинкиназ, включающее JAK1, JAK2, JAK3 и TYK2 (non-receptor tyrosine-protein kinase 2 - нерецепторная тирозинкиназа 2). Каждая из JAK предпочтительно связывается с внутрицитоплазматической частью отдельных цитокиновых рецепторов (Annu. Rev. Immunol. 16 (1998), pp. 293-322).
Передача сигнала с участием JAK/STAT (signal transducers and activators of transcription - передатчики сигнала и активаторы транскрипции) вовлечена в опосредование многих аномальных иммунных ответов, таких как аллергические реакции, астма, аутоиммунные заболевания, такие как отторжение трансплантата (аллотрансплантата), ревматоидный артрит, боковой амиотрофический склероз и рассеянный склероз, а также в солидные и гематологические злокачественные опухоли, такие как лейкоз и лимфомы.
По результатам исследований на животных высказано предположение, что JAK3 не только играет критическую роль в созревании B- и T-лимфоцитов, но и то, что для поддержания функционирования T-клеток постоянно необходимо присутствие JAK3. Модулирование иммунной активности с участием этого нового механизма может оказаться полезным в лечении T-клеточных пролиферативных расстройств, таких как отторжение трансплантата и аутоиммунные заболевания.
Ингибиторы JAK3 полезны в терапии в качестве иммуносупрессивных агентов для органных трансплантатов, ксенотрансплантации, волчанки, рассеянного склероза, ревматоидного артрита, псориаза, диабета I типа и осложнений диабета, рака, астмы, атопического дерматита, аутоиммунных
расстройств щитовидной железы, язвенного колита, болезни Крона, болезни Альцгеймера, лейкоза и других показаний, при которых будет желательна иммуносупрессия.
SYK (тирозинкиназа селезенки) представляет собой нерецепторную тирозинкиназу, присутствие которой существенно для активации B-клеток с участием передачи сигнала посредством BCR (B-cell receptor - B-клеточный рецептор). SYK активируется после связывания с фосфорилированным BCR и таким образом инициирует ранние события передачи сигнала после активации BCR. Мыши, дефицитные по SYK, демонстрируют раннее блокирование развития B-клеток (Cheng et al. Nature, 378: 303, 1995; Turner et al. Nature, 378: 298, 1995). Поэтому ингибирование ферментативной активности SYK в клетках предлагается использовать в качестве лечения аутоиммунного заболевания путем его воздействия на продуцирование аутоантител.
SYK вовлечена в аллергические расстройства, включая астму (обзор приведен в Wong et al. Expert Opin. Investig. Drugs, 13: 743, 2004). Ввиду этого, низкомолекулярные ингибиторы SYK будут полезны для лечения воспалительных заболеваний, индуцированных аллергическими реакциями, включая астму.
Принимая во внимание многочисленные состояния, в отношении которых будет полезно лечение, включающее модулирование JAK- и/или SYK-опосредованных путей, сразу видно, что новые соединения, которые модулируют JAK- и/или SYK-пути, и способы применения этих соединений должны обеспечить существенную терапевтическую пользу большому количеству пациентов. Согласно данному изобретению предложены новые производные пирролопиразина для применения в лечении состояний, при которых осуществляется направленное воздействие на JAK- и/или SYK-пути или ингибирование киназ JAK или SYK, в частности, JAK3, являющиеся терапевтически полезными для лечения аутоиммунных и воспалительных заболеваний.
Новые производные пирролопиразина, предложенные в данном описании, избирательно ингибируют JAK3- и/или SYK-пути и полезны для лечения аутоиммунных и воспалительных заболеваний. Например, соединения по изобретению могут ингибировать JAK3 и SYK. Кроме того, соединения по изобретению могут ингибировать JAK3 и JAK2, причем предпочтительные соединения селективны в отношении JAK3 из этих киназ JAK, и представляют собой новые производные пирролопиразина, полезные для лечения аутоиммунных и воспалительных заболеваний. Аналогично, соединения по
изобретению могут ингибировать JAK3 и JAK1, причем предпочтительные соединения селективны в отношении JAK3 из этих киназ JAK, и представляют собой новые производные пирролопиразина, полезные для лечения аутоиммунных и воспалительных заболеваний. В частности, бициклическая гетероарильная боковая цепь пирролопиразинового ядра соединения формулы I, обозначенная как переменная величина Q, неожиданно придает этим молекулам повышенную селективность в отношении JAK3 из JAK-киназ и/или SYK. В комбинации с амидо-связанными боковыми цепями (C-(=O)NRR') пирролопиразинового ядра, которая неожиданно придает соединениям формулы I большую эффективность по сравнению с пирролопиразиновыми соединениями с боковыми цепями, отличающимися от амидо-содержащих боковых цепей в том же положении на пирролопиразиновом ядре, оба соединения формулы I неожиданно оказывают эффективное и избирательное действие в отношении JAK3 из JAK-киназ и/или SYK.
Согласно данной заявке предложено соединение формулы I
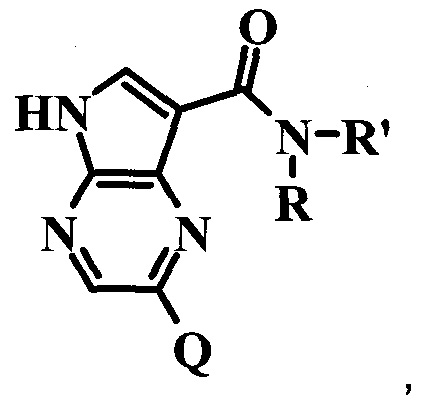
где:
R представляет собой H;
R' представляет собой низший алкокси или  ;
;
или R и R' вместе образуют гетероциклоалкил, возможно замещенный группой -CN;
R1 представляет собой H или R1a;
R1a представляет собой низший алкил, циклоалкил, низший алкокси, гидрокси-(низший алкил) или низший галогеналкил;
R1' представляет собой H или низший алкил;
или R1a и R1' вместе образуют гетероциклоалкил, циклоалкил, индан-1-ил, фенил или гетероарил, возможно замещенный одним или более R1ʺ;
каждый R1ʺ независимо представляет собой гидрокси, амино, оксо, низший алкил, -C(=O)NH2, -CN, низший галогеналкил, бензил, циано-(низший алкил) или -NHC(=O)OC(CH3)3;
R2 представляет собой H, гидрокси, -CN, -C(=O)NH2, -C(=O)OH, -C(=O)OC(CH3)3, R2a или R2b;
R2a представляет собой низший алкил, фенил, фенил-(низший алкил), циклоалкил, гетероарил, гетероциклоалкил, гетероциклоалкил-(низший алкил), гетероарил-(низший алкил), фенил-(низший алкокси), низший алкокси, возможно замещенный одним или более R2a';
каждый R2a' независимо представляет собой гидрокси, -CN, амино, (низший алкил)-сульфониламино, низший алкокси, атом галогена, низший алкил, циано-(низший алкил), низший галогеналкил, (низший алкил)-сульфонил, оксо, галоген-(низший алкокси), циклоалкил, -C(=O)OCH3;
R2b представляет собой -C(=O)R3 или -CH2C(=O)R3;
R3 представляет собой гетероциклоалкил, возможно замещенный одним или более R3';
каждый R3' независимо представляет собой -CN, атом галогена, низший алкил или (низший алкил)-сульфонил;
Q представляет собой 5,6-бициклическую гетероарильную кольцевую систему, 6,6-бициклическую гетероарильную кольцевую систему, 5,5-бициклическую гетероарильную кольцевую систему, 6,5-бициклическую гетероарильную кольцевую систему или 5,7-бициклическую гетероарильную кольцевую систему, возможно замещенную одним или более Qa или Qb;
каждый Qa' независимо представляет собой атом галогена, -CN, гидрокси или -(CH2)nC(=O)Qa';
каждый Qa' независимо представляет собой гидрокси, амино или гетероциклоалкил, где гетероциклоалкил возможно замещен одним или более Qaʺ;
каждый Qaʺ независимо представляет собой низший алкил или низший галогеналкил;
n равно 1, 2 или 3;
каждый Qb независимо представляет собой низший алкил, циклоалкил, низший алкокси, фенокси, (низший алкил)-сульфонил, гетероциклоалкил, гетероциклоалкил-(низший алкил) или гетероарил-(низший алкил), возможно замещенный одним или более Qb'; и
каждый Qb' независимо представляет собой гидрокси, атом галогена, -CN, амино, гетероцикпоалкил, низший алкил, бензил или (низший алкил)-сульфонил;
или его фармацевтически приемлемая соль.
Определения
Фраза "объект" (в единственном или множественном числе), использованная в данном описании, относится к одному или более чем одному такому объекту; например, соединение относится к одному или более соединениям или по меньшей мере к одному соединению. Как таковые, термины "какой-либо", "один или более" и "по меньшей мере один/одна/одно" могут использоваться в данном описании взаимозаменяемо.
Использованные в этом описании термины "содержат(ит)" и "содержащий", независимо от того, применяются ли они в переходной фразе или в описании изобретения, следует интерпретировать как имеющие неограничивающее значение. То есть, эти термины следует интерпретировать как синомимы фразам "имеющий по меньшей мере" или "включающий по меньшей мере". При использовании в контексте способа, термин "включающий" означает, что данный способ включает по меньшей мере перечисленные стадии, но может включать дополнительные стадии. При использовании в контексте соединения или композиции, термин "содержащий" означает, что соединение или композиция включает по меньшей мере перечисленные признаки или компоненты, но также может включать дополнительные признаки или компоненты.
Как использовано в данном описании, если конкретно не указано иное, слово "или" используется во "включающем" смысле термина "и/или", а не в "исключающем" смысле термина "или/или".
Термин "независимо" используется в данном описании для указания на то, что переменная величина в каждом случае применяется безотносительно присутствия или отсутствия переменной величины, имеющей то же самое или другое определение для одного и того же соединения. Таким образом, в том соединении, в котором Rʺ появляется дважды и определяется как "независимо атом углерода или азота", оба Rʺ могут представлять собой атом углерода, оба Rʺ могут представлять собой атом азота или один Rʺ может представлять собой атом углерода, а другой представлять собой атом азота.
Если какая-либо переменная величина (например, X, X' или Q) присутствует более чем один раз в какой-либо группировке или формуле, изображающей и описывающей соединения, примененные или заявленные в настоящем изобретении, ее определение для каждого случая не зависит от ее определения в каждом другом случае. Кроме того, комбинации заместителей и/или переменных допустимы только в том случае, если такие соединения являются стабильными соединениями.
Символ "*" на конце связи или символ " " проведенный поперек связи, каждый означает место присоединения функциональной группы или
" проведенный поперек связи, каждый означает место присоединения функциональной группы или
другой химической группировки к остальной части молекулы, частью которой она является. Так, например:
Связь, проведенная к кольцевой системе (в отличие от присоединения в отдельной вершине), указывает на то, что это может быть связь с любым из подходящих атомов в кольце.
Термин "возможный" или "возможно", использованный в данном описании, означает, что описываемое впоследствии событие или обстоятельство может иметь место, но происходит не обязательно, и что данное описание включает случаи, когда это событие или обстоятельство происходит, и случаи, в которых это не так. Например, "возможно замещенный" означает, что возможно замещенная группировка может содержать атом водорода или заместитель.
Фраза "вместе образуют бициклическую кольцевую систему", использованная в данном описании, означает присоединение с образованием бициклической кольцевой системы, где каждое кольцо может быть образовано либо из 4-7 атомов углерода, либо 4-7 атомов углерода и гетероатомов, и может быть насыщенным или ненасыщенным.
Термин "примерно" используется в данном описании для обозначения таких понятий, как приблизительно, в области, ориентировочно или около. В том случае, когда термин "примерно" используется вместе с численным диапазоном, корректировка этого диапазона осуществляется путем расширения границ выше и ниже указанных численных значений. В общем случае, термин "примерно" используется в данном описании для корректировки численного значения выше и ниже указанной величины на величину дисперсии, равную 20%.
Определения, изложенные в данном описании, могут быть дополнены с образованием химически релевантных комбинаций, таких как "гетероалкиларил", "галогеналкилгетероарил", "арилалкилгетероциклил", "алкилкарбонил", "алкоксиалкил", "циклоалкилалкил" и им подобное. В том случае, когда термин "алкил" используется в качестве окончания после другого термина, как в "фенилалкиле" или "гидроксиалкиле", подразумевается, что он относится к алкильной группе, определенной выше, которая замещена одним-двумя заместителями, выбранными из другой, конкретно обозначенной группы. Так, например, "фенилалкил" относится к алкильной группе, имеющей от одного до двух фенильных заместителей, и поэтому включает бензил, фенилэтил и бифенил. "Алкиламиноалкил" представляет собой алкильную группу, имеющую
от одного до двух заместителей алкиламино. "Гидроксиалкил" включает 2-гидроксиэтил, 2-гидроксипропил, 1-(гидроксиметил)-2-метилпропил, 2-гидроксибутил, 2,3-дигидроксибутил, 2-(гидроксиметил), 3-гидроксипропил и так далее. Соответственно, использованный в данном описании термин "гидроксиалкил", применяется для определения подгруппы гетероалкильных групп, определенных ниже. Термин "-(ар)алкил" относится или к незамещенному алкилу, или к аралкильной группе. Термин (гетеро)арил или (гет)арил относится или к арильной, или гетероарильной группе.
Соединения формулы I могут демонстрировать таутомерию. Таутомерные соединения могут существовать в виде двух или более взаимопревращаемых разновидностей. Прототропные таутомеры являются результатом миграции ковалентно связанного атома водорода между двумя атомами. Как правило, таутомеры существуют в равновесии, и попытки выделить индивидуальные таутомеры обычно дают смесь, химические и физические свойства которой соответствуют смеси соединений. Положение равновесия зависит от химических особенностей строения молекулы. Например, у многих алифатических альдегидов и кетонов, таких как ацетальдегид, преобладает кето-форма, при этом у фенолов преобладает енольная форма. Обычные прототропные таутомеры включают таутомерную пару кето/енол  , таутомерию амид/имидокислота
, таутомерию амид/имидокислота  и таутомеры амидина
и таутомеры амидина  . Двое последних, в частности, обычно встречаются в гетероарильных и гетероциклических кольцах, и настоящее изобретение охватывает все таутомерные формы соединений.
. Двое последних, в частности, обычно встречаются в гетероарильных и гетероциклических кольцах, и настоящее изобретение охватывает все таутомерные формы соединений.
Технические и научные термины, использованные в данном описании, имеют значение, обычно понимаемое специалистом в области техники, к которой настоящее изобретение относится, если не указано иное. В этом описании дается ссылка на различные методологии и вещества, известные специалистам в данной области. Стандартные справочники, в которых изложены основные принципы фармакологии, включают Goodman and Gilman's, The Pharmacological Basis of Therapeutics, 10th Ed., McGraw Hill Companies Inc., New York (2001). При осуществлении настоящего изобретения могут быть использованы любые подходящие вещества и/или способы, известные специалистам. Однако описываются предпочтительные вещества и способы. Вещества, реагенты и им подобное, на которые дается ссылка в следующих далее описании и примерах, получают из коммерческих источников, если не указано иное.
Термин "ацил", использованный в данном описании, означает группу формулы -C(=O)R, где R представляет собой водород или низший алкил,
определенный в данном описании. Термин "алкилкарбонил", использованный в данном описании, означает группу формулы C(=O)R, где R представляет собой алкил, определенный в данном описании. Термин C1-6ацил относится к группе -C(=O)R, содержащей 1-6 атомов углерода. Термин "арилкарбонил", использованный в данном описании, означает группу формулы C(=O)R, где R представляет собой арильную группу; термин "бензоил", использованный в данном описании, означает "арилкарбонильную" группу, где R представляет собой фенил.
Термин "алкил", использованный в данном описании, означает неразветвленный или разветвленный насыщенный моновалентный углеводородный остаток, содержащий 1-10 атомов углерода. Термин "низший алкил" означает прямой или разветвленный углеводородный остаток, содержащий 1-6 атомов углерода. "C1-10алкил" использованный в данном описании, относится к алкилу, состоящему из 1-10 атомов углерода. Примеры алкильных групп включают, но не ограничиваются этим, низшие алкильные группы, которые включают метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил или пентил, изопентил, неопентил, гексил, гептил и октил, и являются возможно полностью или частично дейтерированными.
В том случае, когда термин "алкил" используется в качестве окончания после другого термина, как в "фенилалкиле" или "гидроксиалкиле", подразумевается, что он относится к алкильной группе, определенной выше, которая замещена одним-двумя заместителями, выбранными из другой конкретно обозначенной группы. Так, например, "фенилалкил" означает радикал R'Rʺ-, где R' представляет собой фенильный радикал, а Rʺ представляет собой алкильный радикал, определенный в данном описании, при этом понимается, что местом присоединения фенилалкильной группировки будет алкильный радикал. Примеры арилалкильных радикалов включают, но не ограничиваются этим, бензил, фенилэтил, 3-фенилпропил. Термины "арилалкил", "арилалкил" или "аралкил" интерпретируются аналогично за исключением того, что R' представляет собой арильный радикал. Термины "гетероарил-алкил" или "гетероарилалкил" интерпретируются аналогично за исключением того, что R' возможно представляет собой арильный или гетероарильный радикал.
Термин "галогеналкил", использованный в данном описании, означает неразветвленную или разветвленную алкильную группу, которая определена выше, где 1, 2, 3 или более атомов водорода заменены на атом(ы) галогена. Термин "низший галогеналкил" означает прямой или разветвленный углеводородный остаток, содержащий 1-6 атомов углерода, где 1, 2, 3 или более
атомов водорода заменены на атом(ы) галогена. Примерами являются 1-фторметил, 1-хлорметил, 1-бромметил, 1-иодметил, дифторметил, трифторметил, трихлорметил, трибромметил, трииодметил, 1-фторэтил, 1-хлорэтил, 1-бромэтил, 1-иодэтил, 2-фторэтил, 2-хлорэтил, 2-бромэтил, 2-иодэтил, 2,2-дихлорэтил, 3-бромпропил или 2,2,2-трифторэтил.
Термин "алкилен", использованный в данном описании, означает двухвалентный насыщенный линейный углеводородный радикал из 1-10 атомов углерода (например, (CH2)n) или разветвленный насыщенный двухвалентный углеводородный радикал из 2-10 атомов углерода (например, -CHMe- или -CH2CH(i-Pr)CH2-), если не указано иное. За исключением случая метилена, свободные валентности алкиленовой группы не присоединены к одному и тому же атому. Примеры алкиленовых радикалов включают, но не ограничиваются этим, метилен, этилен, пропилен, 2-метил-пропилен, 1,1-диметил-этилен, бутилен, 2-этилбутилен.
Термин "алкокси", использованный в данном описании, означает группу -O-алкильную группу, где алкил является таким, как определено выше, как например, метокси, этокси, н-пропилокси, изопропилокси, н-бутилокси, изобутилокси, трет-бутилокси, пентилокси, гексилокси, включая их изомеры. "Низший алкокси", использованный в данном описании, означает алкоксигруппу с группой "низший алкил", которая определена ранее и является возможно полностью или частично дейтерированной.
Термин "гидроксиалкил", использованный в данном описании, означает алкильный радикал, определенный в данном описании, где от одного до трех атомов водорода у разных атомов углерода заменены на гидроксильные группы.
Термин "циклоалкил", использованный в данном описании, относится к насыщенному карбоциклическому кольцу, содержащему 3-8 атомов углерода, т.е. циклопропилу, циклобутилу, циклопентилу, циклогексилу, циклогептилу или циклооктилу. "С3-7циклоалкил", использованный в данном описании, относится к циклоалкилу, содержащему 3-7 атомов углерода в карбоциклическом кольце.
Термин "циклоалкенил" относится к частично ненасыщенному карбоциклическому кольцу, содержащему 5-7 атомов углерода, если не указано иное, и имеющему углерод-углеродную двойную связь в пределах кольца. Например, C5-6циклоалкенил относится к циклоалкенильной группе, имеющей от 5 до 6 атомов-членов кольца. В некоторых воплощениях циклоалкенильные группы имеют одну углерод-углеродную двойную связь в пределах кольца. В других воплощениях циклоалкенильные группы имеют более чем одну углерод-углеродную двойную связь в пределах кольца. Однако, циклоалкенильные кольца
не являются ароматическими. Циклоалкенильные группы возможно могут быть замещены одним или более чем одним заместителем. Примеры циклоалкенила включают, но не ограничиваются этим, циклопентенил и циклогексенил.
Термин "галоген" или "атом галогена", использованный в данном описании, означает фтор, хлор, бром или йод.
Термин "амино", использованный в данном описании, охватывает -NR2, где каждая группа R независимо представляет собой H или низший алкил, где низший алкил является таким, как определено в данном описании. Примеры аминогрупп включают диметиламино, метиламине и NH2.
Использованный в данном описании термин "арил" означает моноциклическую или бициклическую (также обозначаемую как "биарил") замещенную или незамещенную карбоциклическую ароматическую группу. Примерами арильных групп являются фенил, нафтил и им подобное.
Термин "гетероарил", использованный в данном описании, означает моноциклический, бициклический или трициклический радикал из 5-18 кольцевых атомов, имеющий по меньшей мере одно ароматическое кольцо, содержащее от четырех до восьми атомов на одно кольцо, включая один или более чем один гетероатом N, O или S, причем остальные кольцевые атомы представляют собой углерод, при этом понимается, что местом присоединения гетероарильного радикала будет ароматическое кольцо. Как хорошо известно специалистам в данной области, гетероарильные кольца проявляют ароматический характер в меньшей степени, чем их состоящие полностью из атомов углерода аналоги. Так, для задач данного изобретения необходимо, чтобы гетероарильная группа проявляла ароматический характер только в некоторой степени. Примеры гетероарильных группировок включают моноциклические ароматические гетероциклы, имеющие 5-6 кольцевых атомов и 1-3 гетероатома, в том числе, но не ограничиваясь этим, пиридинил, пиримидинил, пиразинил, пирролил, пиразолил, имидазолил, индолил, оксазол, изоксазол, тиазол, изотиазол, триазолин, триазолил, тиофенил, фуранил, тиадиазол и оксадиаксолин, который возможно может быть замещен одним или более, предпочтительно одним или двумя заместителями, выбранными из гидрокси, циано, алкила, алкокси, тио, низшего галогеналкокси, алкилтио, атома галогена, галогеналкила, алкилсульфинила, алкилсульфонила, амино, алкиламино, диалкиламино, аминоалкила, алкиламиноалкила и диалкиламиноалкила, нитро, алкоксикарбонила, карбамоила, алкилкарбамоила, диалкилкарбамоила, арилкарбамоила, алкилкарбониламино и арилкарбониламино. Примеры бициклических группировок включают, но не ограничиваются этим, хинолинил,
индазолил, изохинолинил, бензофурил, бензотиофенил, бензоксазол, бензизоксазол, бензотиазол, пирролопиридинил, пирролопиразинил и бензизотиазол.
Термин "5,6-бициклическая гетероарильная кольцевая система", использованный в данном описании, означает частично насыщенную или ненасыщенную 5,6-бициклическую кольцевую систему, содержащую по меньшей мере один гетероатом N, O или S, причем остальные кольцевые атомы представляют собой атом углерода, при этом понимается, что место присоединения гетероарильной кольцевой системы будет находиться на 5-членном кольце. Примеры включают, но не ограничиваются этим: 1H-индазол-3-ил, 4,5,6,7-тетрагидро-1H-индазол-3-ил, 1H-индол-3-ил, 5,6,7,8-тетрагидро-имидазо[1,5-a]пиридин-1-ил, имидазо[1,5-a]пиридин-1-ил, индазол-1-ил, 1H-пиразоло[3,4-b]пиридин-3-ил, 1H-пиразоло[4,3-b]пиридин-3-ил, имидазо[1,2-a]пиридин-3-ил, 2-окси-4,5,6,7-тетрагидро-1H-индазол-3-ил и бензоимидазол-1-ил, каждый из которых возможно может быть замещен.
Термин "6,6-бициклическая гетероарильная кольцевая система", использованный в данном описании, означает частично насыщенную или ненасыщенную 6,6-бициклическую кольцевую систему, содержащую по меньшей мере один гетероатом N, O или S, причем остальные кольцевые атомы представляют собой атом углерода, при этом понимается, что место присоединения гетероарильной кольцевой системы будет находиться на 6-членном кольце, содержащем по меньшей мере один гетероатом N, O или S. Примеры включают, но не ограничиваются этим: изохинолин-1-ил и изохинолин-8-ил, каждый из которых возможно может быть замещен.
Термин "5,5-бициклическая гетероарильная кольцевая система", использованный в данном описании, означает частично насыщенную или ненасыщенную бициклическую кольцевую систему, содержащую по меньшей мере один гетероатом N, O или S, причем остальные кольцевые атомы представляют собой атом углерода, при этом понимается, что место присоединения гетероарильной кольцевой системы будет находиться на 5-членном кольце, содержащем по меньшей мере один гетероатом N, O или S. Примеры включают, но не ограничиваются этим: 1H-тиено[3,2-c]пиразол-3-ил, 1,4,5,6-тетрагидро-циклопентапиразол-3-ил и 5,6-дигидро-4H-циклопентапиразол-1-ил, каждый из которых возможно может быть замещен.
Термин "5,7-бициклическая гетероарильная кольцевая система", использованный в данном описании, означает частично насыщенную или ненасыщенную бициклическую кольцевую систему, содержащую по меньшей
мере один гетероатом N, O или S, причем остальные кольцевые атомы представляют собой атом углерода, при этом понимается, что место присоединения гетероарильной кольцевой системы будет находиться на 5-членном кольце, содержащем по меньшей мере один гетероатом N, O или S. Примеры включают, но не ограничиваются этим: 1,4,5,6,7,8-гексагидро-циклогептапиразол-3-ил, каждый из которых возможно может быть замещен.
Термин "6,5-бициклическая гетероарильная кольцевая система", использованный в данном описании, означает частично насыщенную или ненасыщенную 6,5-бициклическую кольцевую систему, содержащую по меньшей мере один гетероатом N, O или S, причем остальные кольцевые атомы представляют собой атом углерода, при этом понимается, что место присоединения гетероарильной кольцевой системы будет находиться на 6-членном кольце, которое возможно содержит один или более гетероатомов N, O или S. Примеры включают, но не ограничиваются этим: 1H-индол-7-ил, 1H-пирроло[2,3-c]пиридин-7-ил, 1H-индазол-4-ил и 1H-индазол-7-ил, каждый из которых возможно может быть замещен.
Термин "гетероциклоалкил", "гетероциклил" или "гетероцикл", использованный в данном описании, означает моновалентный насыщенный циклический радикал, состоящий из одного или более колец, предпочтительно одного-двух колец или трех колец, содержащих три-восемь атомов на одно кольцо, включая один или более кольцевых атомов углерода и один или более кольцевых гетероатомов (выбранных из N, O или S(=O)0-2), при этом присоединение может происходить либо через атом углерода, либо гетероатом, и который возможно может быть независимо замещен одним или более, предпочтительно одним, или двумя, или тремя заместителями, выбранными из гидрокси, оксо, циано, низшего алкила, низшего алкокси, низшего галогеналкокси, алкилтио, атома галогена, галогеналкила, гидроксиалкила, нитро, алкоксикарбонила, амино, алкиламино, алкилсульфонила, арилсульфонила, алкиламиносульфонила, ариламиносульфонила, алкилсульфониламино, арилсульфониламино, алкиламинокарбонила, ариламинокарбонила, алкилкарбониламино, арилкарбониламино, если не указано иное. Примеры гетероциклических радикалов включают, но не ограничиваются этим, азетидинил, пирролидинил, гексагидроазепинил, оксетанил, тетрагидрофуранил, тетрагидротиофенил, оксазолидинил, тиазолидинил, изоксазолидинил, пирролидинил, морфолинил, пиперазинил, пиперидинил, изоиндолинил, дигидроизохинолинил, тетрагидропиранил, тетрагидрокарбонил, имидазолинил, тиоморфолинил, хинуклидинил и имидазолинил.
Фраза "отторжение органных трансплантатов" относится к острому отторжению аллотрансплантатов или ксенотрансплантатов и хроническому отторжению аллотрансплантатов или ксенотрансплантатов при установке трансплантатов на сосудистой ножке (vascularized transplants) и/или не являющихся таковыми (например, костный мозг, клетки панкреатических островков).
Термин "эксципиент", использованный в данном описании, относится к соединению, которое полезно при изготовлении фармацевтической композиции, как правило является безопасным, нетоксичным и не является нежелательным ни в биологическом, ни в каком-либо ином отношении, и включает эксципиенты, приемлемые для применения в ветеринарии, а также для использования в производстве фармацевтических продуктов для людей. Соединения по данному изобретению можно вводить в том виде, как они есть, но обычно их вводят в смеси с одним или более подходящими фармацевтическими эксципиентами, разбавителями или носителями, выбранными с учетом предполагаемого пути введения и общепринятой фармацевтической практикой.
Термин "фармацевтически приемлемый" означает то, что полезно при изготовлении фармацевтической композиции, то есть, как правило является безопасным, нетоксичным и не является нежелательным ни в биологическом, ни в каком-либо ином отношении, и включает в себя то, что приемлемо для использования в производстве фармацевтических продуктов для ветеринарии, а также для людей.
"Фармацевтически приемлемая солевая" форма активного ингредиента также может изначально придавать желаемые фармакокинетические свойства активному ингредиенту, которые отсутствовали в несолевой форме, и даже может положительно влиять на фармакодинамику активного ингредиента применительно к его терапевтической активности в организме. Фраза "фармацевтически приемлемая соль" соединения означает соль, которая является фармацевтически приемлемой и которая обладает желаемой фармакологической активностью исходного соединения. Такие соли включают: (1) соли присоединения кислоты, образованные с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и им подобные; или образованные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная
кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этан-дисульфоновая кислота, 2-гидрокси-этансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурил-серная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и им подобные; или (2) соли, образованные в том случае, когда кислотный протон, присутствующий в исходном соединении, либо заменен на ион металла, например, ион щелочного металла, ион щелочноземельного металла или ион алюминия; либо образует координационную связь с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и им подобные.
Ингибиторы JAK3 и/или SYK
Согласно данной заявке предложено соединение формулы I
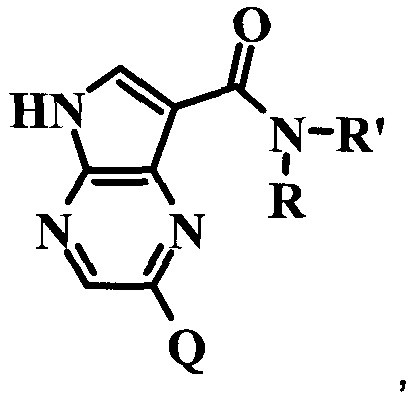
где:
R представляет собой H;
R' представляет собой низший алкокси или  ;
;
или R и R' вместе образуют гетероциклоалкил, возможно замещенный группой -CN;
R1 представляет собой H или R1a;
R1a представляет собой низший алкил, циклоалкил, низший алкокси, гидрокси-(низший алкил) или низший галогеналкил;
R1' представляет собой H или низший алкил;
или R1a и R1' вместе образуют гетероциклоалкил, циклоалкил, индан-1-ил, фенил или гетероарил, возможно замещенный одним или более R1ʺ;
каждый R1ʺ независимо представляет собой гидрокси, амино, оксо, низший алкил, -C(=O)NH2, -CN, низший галогеналкил, бензил, циано-(низший алкил) или -NHC(=O)OC(CH3)3;
R2 представляет собой H, гидрокси, -CN, -C(=O)NH2, -C(=O)OH, -C(=O)OC(CH3)3, R2a или R2b;
R2a представляет собой низший алкил, фенил, фенил-низший алкил), циклоалкил, гетероарил, гетероциклоалкил, гетероциклоалкил-(низший алкил), гетероарил-(низший алкил), фенил-(низший алкокси), низший алкокси, возможно замещенный одним или более R2a';
каждый R2a' независимо представляет собой гидрокси, -CN, амино, (низший алкил)-сульфониламино, низший алкокси, атом галогена, низший алкил, циано-(низший алкил), низший галогеналкил, (низший алкил)-сульфонил, оксо, галоген-(низший алкокси), циклоалкил, -C(=O)OCH3;
R2b представляет собой -C(=O)R3 или -CH2C(=O)R3;
R3 представляет собой гетероциклоалкил, возможно замещенный одним или более R3';
каждый R3' независимо представляет собой -CN, атом галогена, низший алкил или (низший алкил)-сульфонил;
Q представляет собой 5,6-бициклическую гетероарильную кольцевую систему, 6,6-бициклическую гетероарильную кольцевую систему, 5,5-бициклическую гетероарильную кольцевую систему, 6,5-бициклическую гетероарильную кольцевую систему или 5,7-бициклическую гетероарильную кольцевую систему, возможно замещенную одним или более Qa или Qb;
каждый Qa независимо представляет собой атом галогена, -CN, гидрокси или -(CH2)nC(=O)Qa';
каждый Qa' независимо представляет собой гидрокси, амино или гетероциклоалкил, где гетероциклоалкил возможно замещен одним или более Qaʺ;
каждый Qaʺ независимо представляет собой низший алкил или низший галогеналкил;
n равно 1, 2 или 3;
каждый Qb независимо представляет собой низший алкил, циклоалкил, низший алкокси, фенокси, (низший алкил)-сульфонил, гетероциклоалкил, гетероциклоалкил-(низший алкил) или гетероарил-(низший алкил), возможно замещенный одним или более Qb'; и
каждый Qb' независимо представляет собой гидрокси, атом галогена, -CN, амино, гетероциклоалкил, низший алкил, бензил или (низший алкил)-сульфонил;
или его фармацевтически приемлемая соль.
Согласно данной заявке предложено соединение формулы I, где R представляет собой H.
Согласно данной заявке предложено соединение формулы I, где R' представляет собой  .
.
Согласно данной заявке предложено соединение формулы I, где R представляет собой H, и R' представляет собой  .
.
Согласно данной заявке предложено соединение формулы I, где R1' представляет собой H или низший алкил.
Согласно данной заявке предложено соединение формулы I, где R1' представляет собой H или низший алкил, R представляет собой H, и R' представляет собой  .
.
Согласно данной заявке предложено соединение формулы I, где R1 представляет собой низший алкил.
Согласно данной заявке предложено соединение формулы I, где R1 представляет собой низший алкил, R1' представляет собой H или низший алкил, R представляет собой H, и R' представляет собой 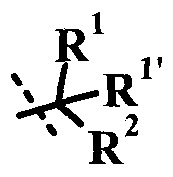 .
.
Согласно данной заявке предложено соединение формулы I, где оба R1 и R1' представляют собой H.
Согласно данной заявке предложено соединение формулы I, где R представляет собой H, R' представляет собой 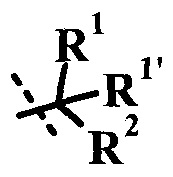 , и оба R1 и R1' представляют собой H.
, и оба R1 и R1' представляют собой H.
Согласно данной заявке предложено соединение формулы I, где R2 представляет собой -C(=O)R3.
Согласно данной заявке предложено соединение формулы I, где R2 представляет собой -C(=O)R3, R1 представляет собой низший алкил, R1' представляет собой H или низший алкил, R представляет собой H, и R' представляет собой 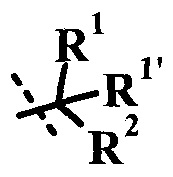 .
.
Согласно данной заявке предложено соединение формулы I, где R2 представляет собой низший алкил, возможно замещенный одним или более R2a'.
Согласно данной заявке предложено соединение формулы I, где R2 представляет собой низший алкил, возможно замещенный одним или более R2a', R1 представляет собой низший алкил, R1' представляет собой H или низший алкил, R представляет собой H, и R' представляет собой 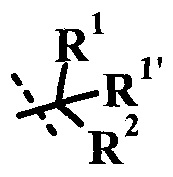 .
.
Согласно данной заявке предложено соединение формулы I, где Q представляет собой 5,6-бициклическую гетероарильную кольцевую систему, возможно замещенную одним или более Qa или Qb.
Согласно данной заявке предложено соединение формулы I, где Q представляет собой 5,6-бициклическую гетероарильную кольцевую систему, возможно замещенную одним или более Qa или Qb, R2 представляет собой низший алкил, возможно замещенный одним или более R2a', R1 представляет собой низший алкил, R1' представляет собой H или низший алкил, R представляет собой H, и R' представляет собой  .
.
Согласно данной заявке предложено соединение формулы I, где Q представляет собой индазол-3-ил, возможно замещенный одним или более Qa или Qb.
Согласно данной заявке предложено соединение формулы I, где Qa представляет собой атом галогена или низший алкил.
Согласно данной заявке предложено соединение формулы I, где Q представляет собой индазол-3-ил, возможно замещенный одним или более Qa или Qb, и Qa представляет собой атом галогена или низший алкил.
Согласно данной заявке предложено соединение формулы I, где Qb представляет собой низший алкил.
Согласно данной заявке предложено соединение формулы I, где Q представляет собой индазол-3-ил, возможно замещенный одним или более Qa
или Qb, и Qa представляет собой атом галогена или низший алкил, a Qb представляет собой низший алкил.
Согласно данной заявке предложено соединение формулы I, где R1a и R1' вместе образуют гетероциклоалкил или циклоалкил, возможно замещенный одним или более R1ʺ.
Согласно данной заявке предложено соединение формулы I, где R1a и R1' вместе образуют гетероциклоалкил или циклоалкил, возможно замещенный одним или более R1ʺ, Q представляет собой индазол-3-ил, возможно замещенный одним или более Qa или Qb, и Qa представляет собой атом галогена или низший алкил, a Qb представляет собой низший алкил.
Согласно данной заявке предложено соединение формулы I, где R1ʺ представляет собой амино или -CN.
Согласно данной заявке предложено соединение формулы I, где R1ʺ представляет собой амино или -CN, R1a и R1' вместе образуют гетероциклоалкил или циклоалкил, возможно замещенный одним или более R1ʺ, Q представляет собой индазол-3-ил, возможно замещенный одним или более Qa или Qb, и Qa представляет собой атом галогена или низший алкил, а Qb представляет собой низший алкил.
Согласно данной заявке предложено соединение формулы I, где R2 представляет собой низший алкил.
Согласно данной заявке предложено соединение формулы I, где R2 представляет собой низший алкил, R1ʺ представляет собой амино или -CN, R1a и R1' вместе образуют гетероциклоалкил или циклоалкил, возможно замещенный одним или более R1ʺ, Q представляет собой индазол-3-ил, возможно замещенный одним или более Qa или Qb, и Qa представляет собой атом галогена или низший алкил, a Qb представляет собой низший алкил.
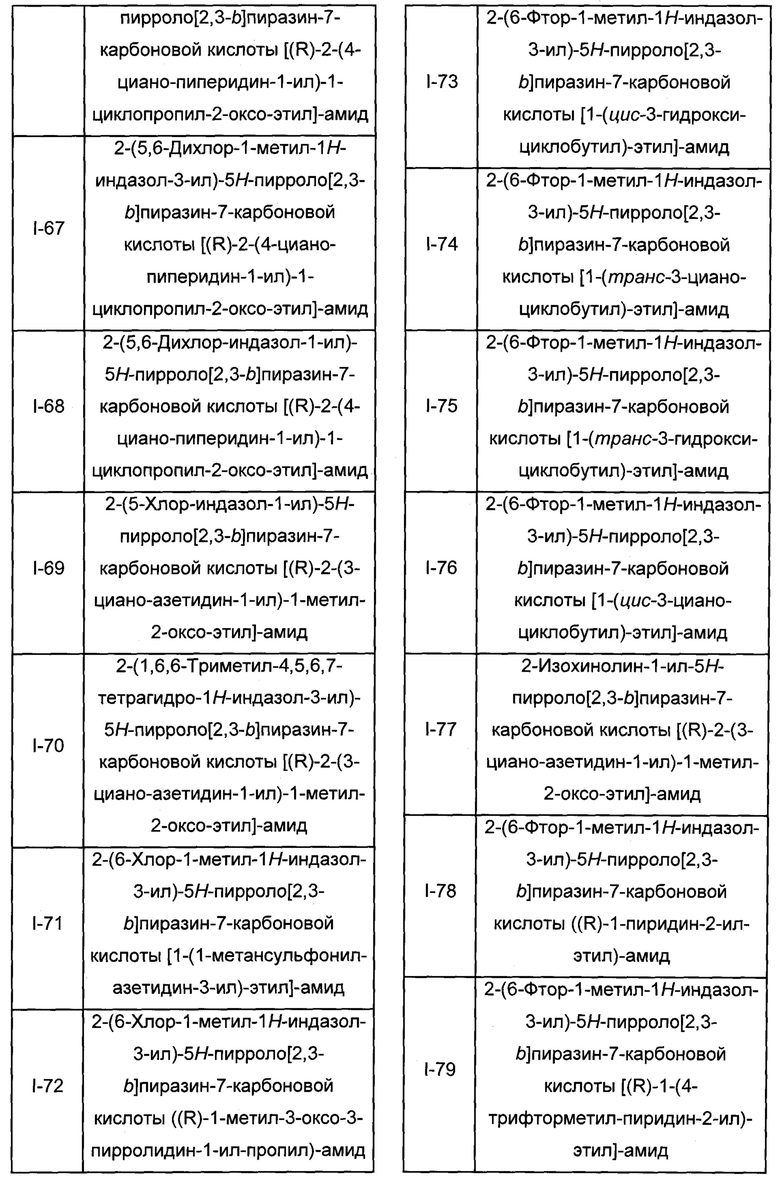
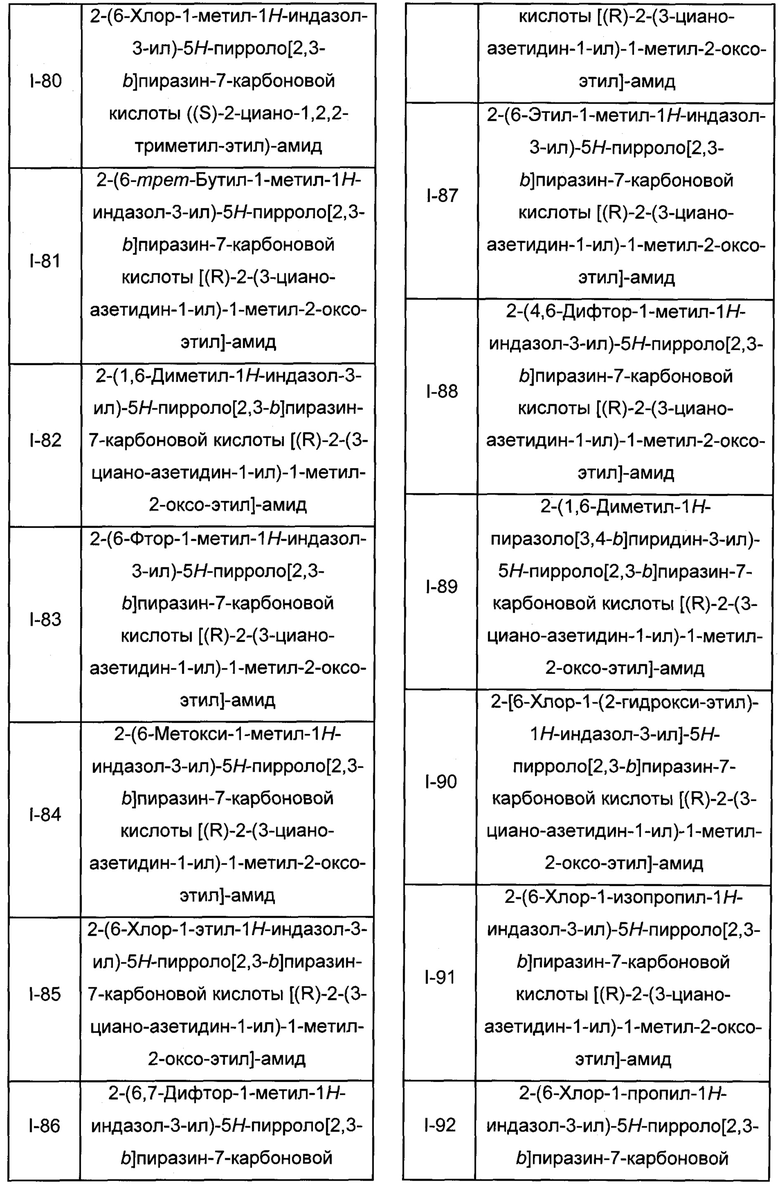
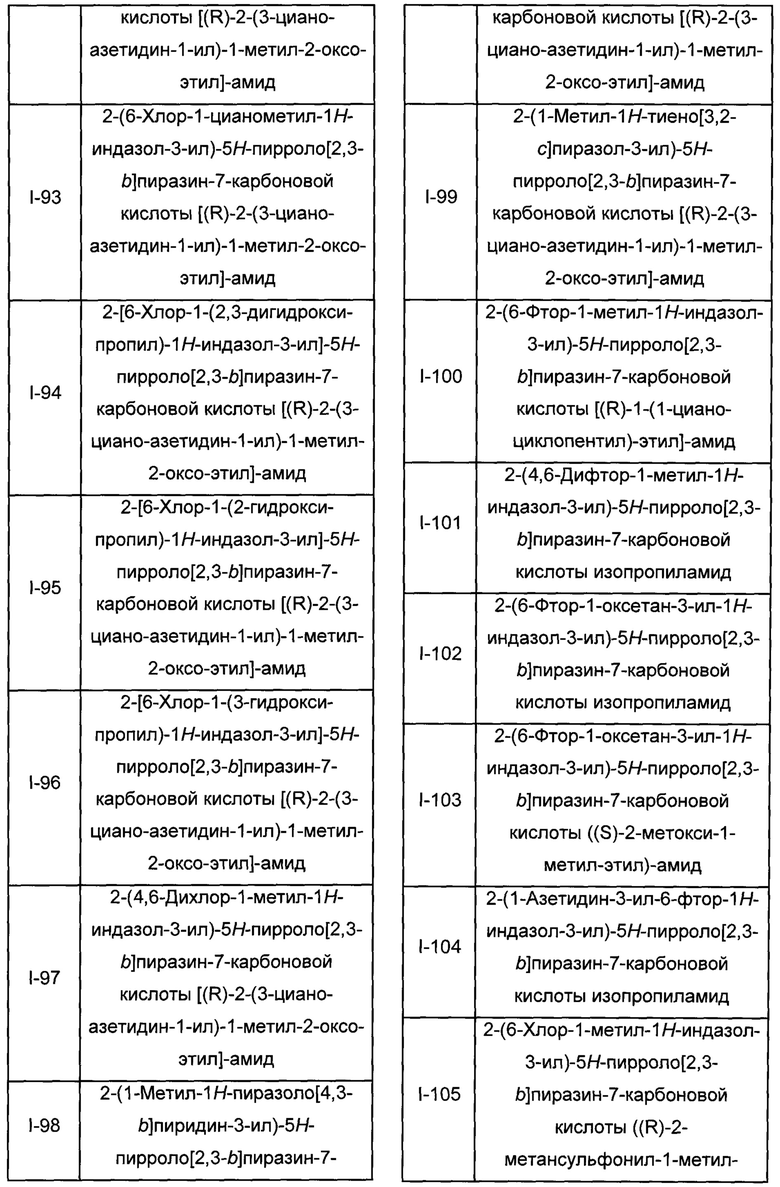
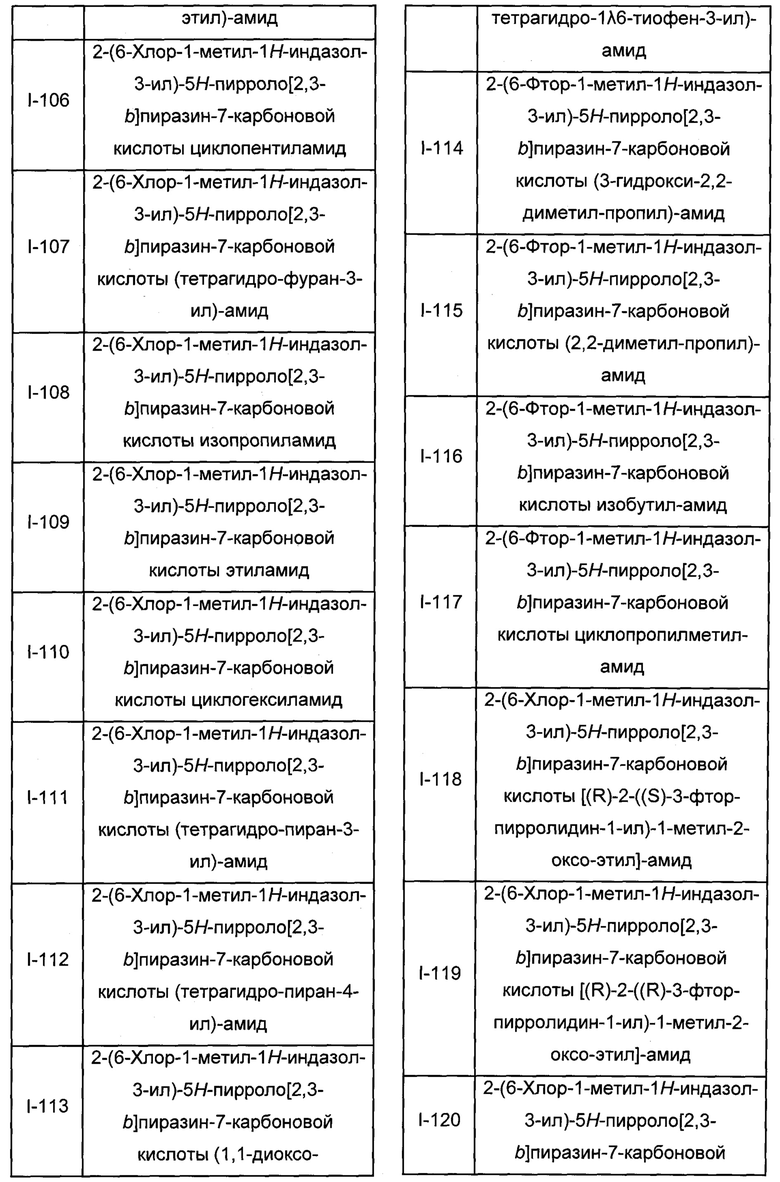
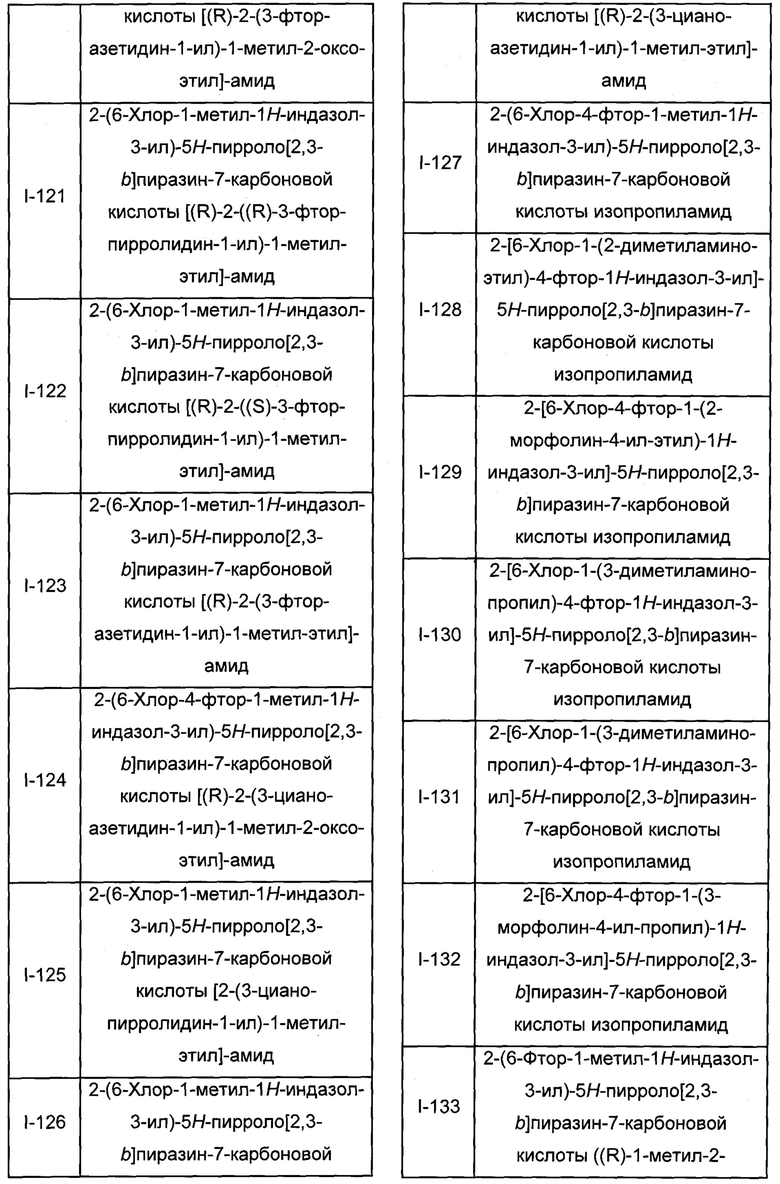
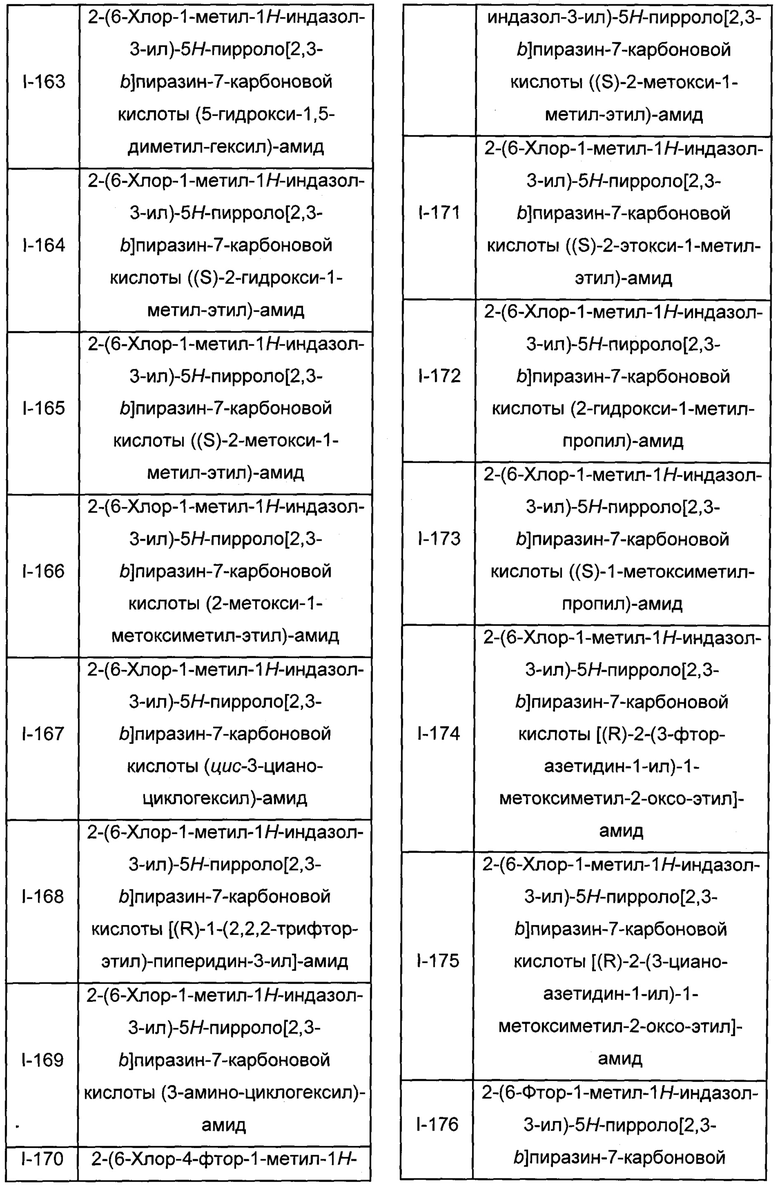
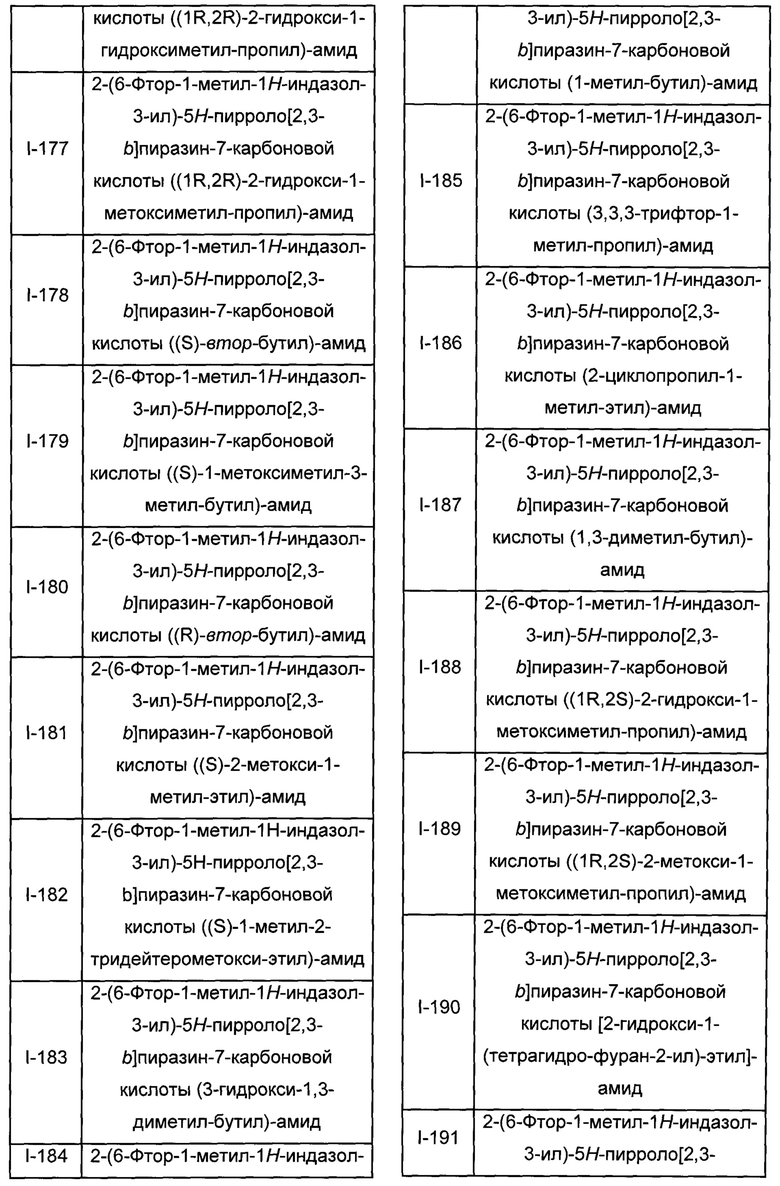
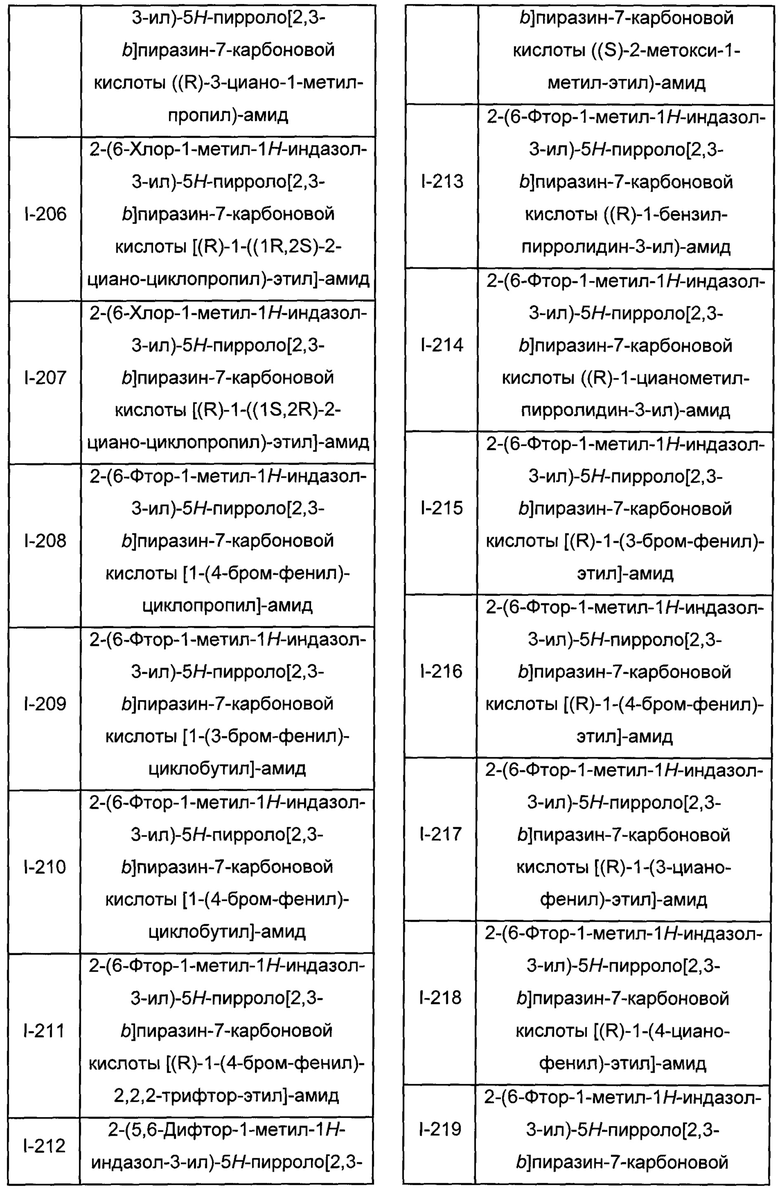
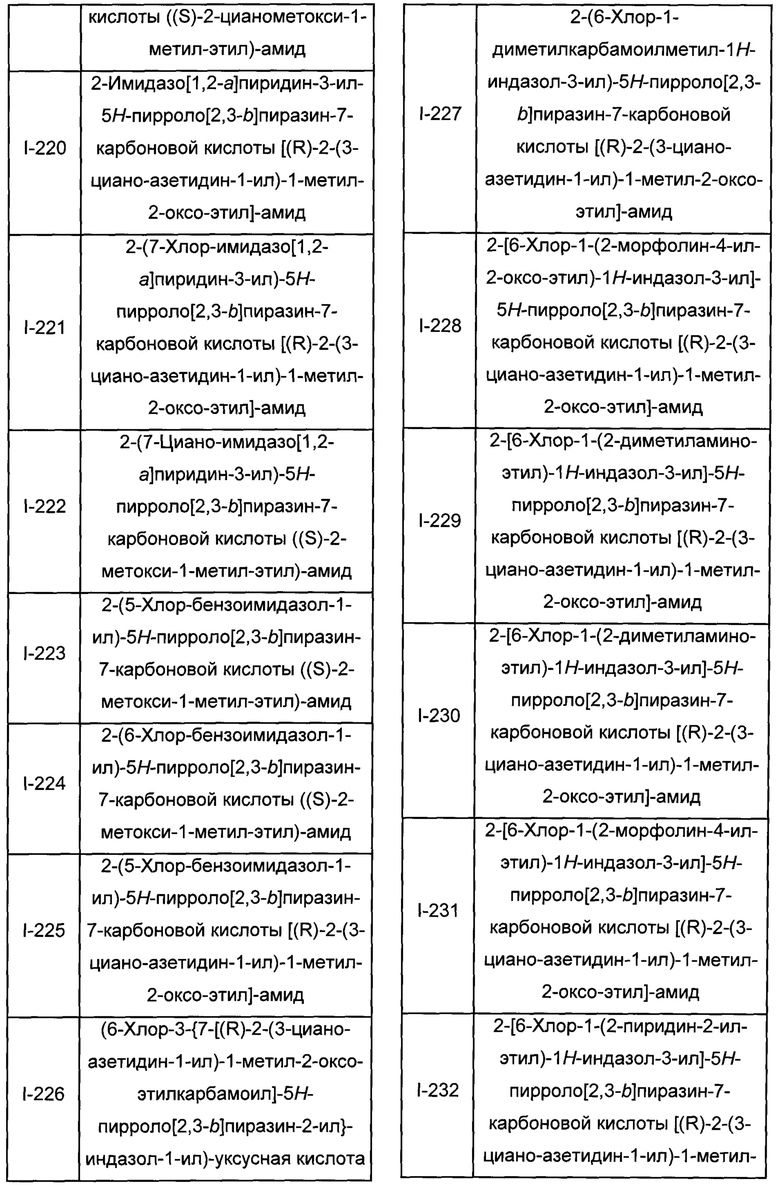
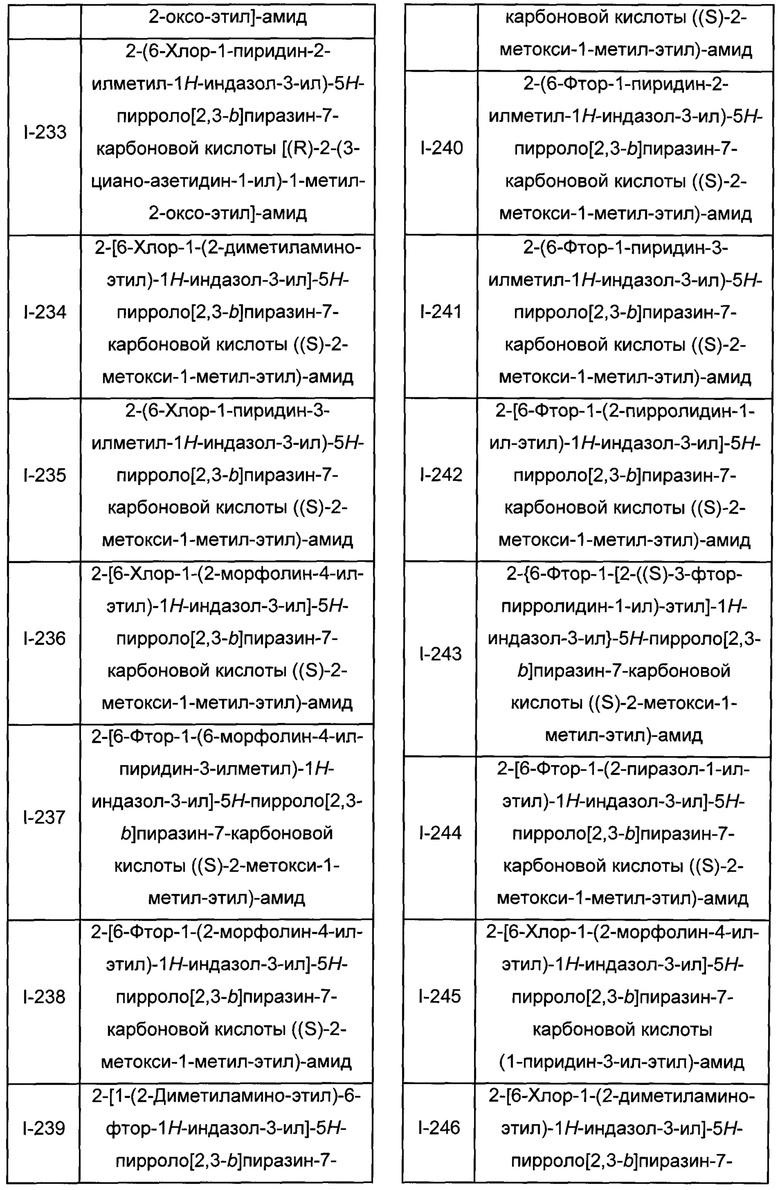
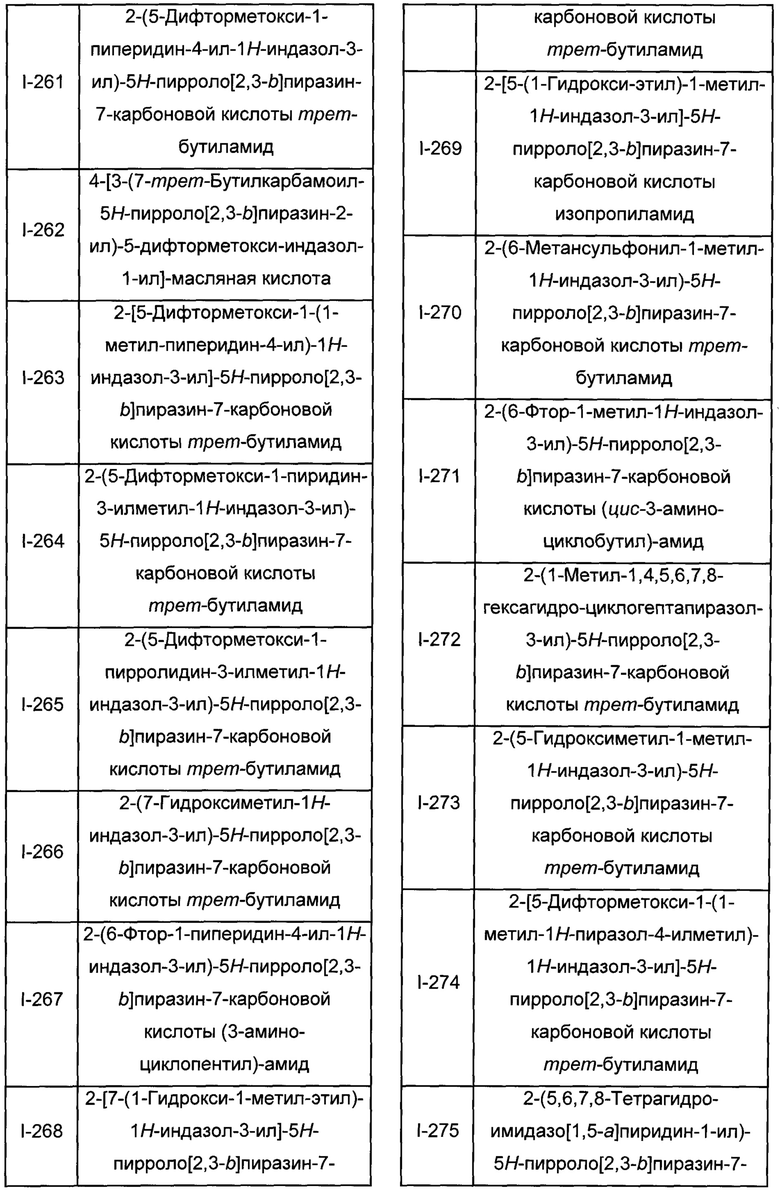
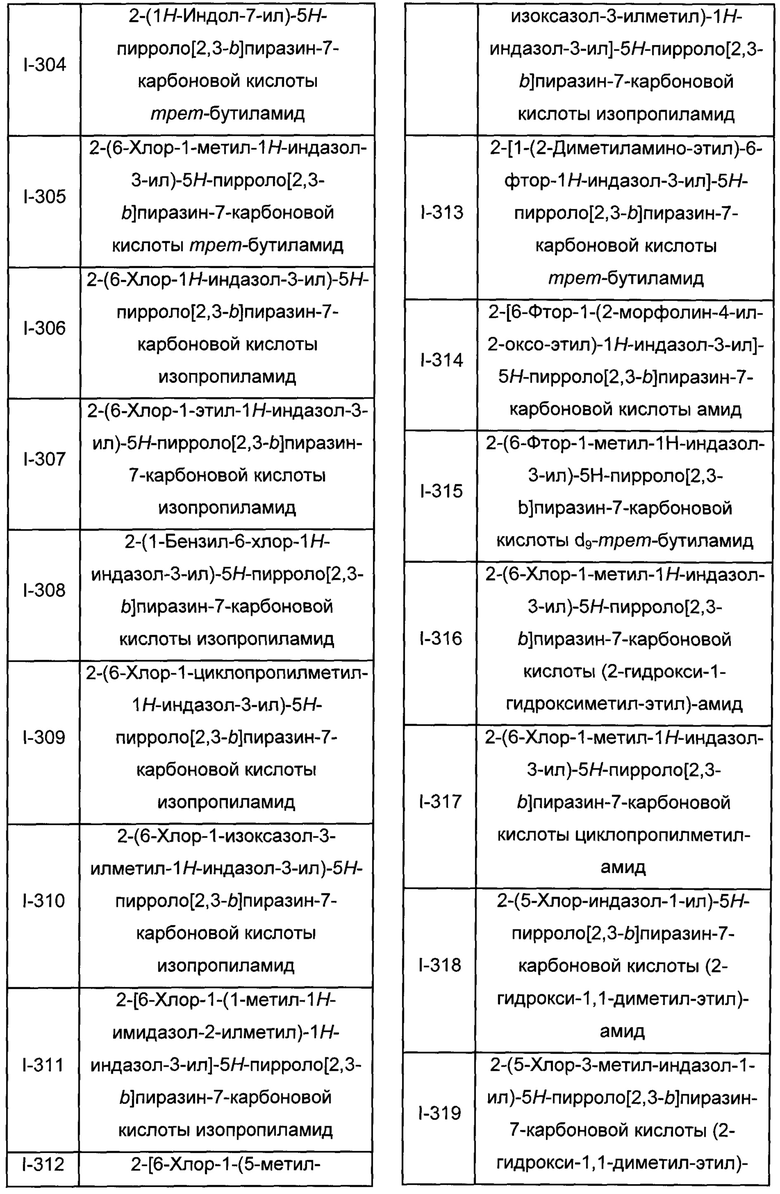
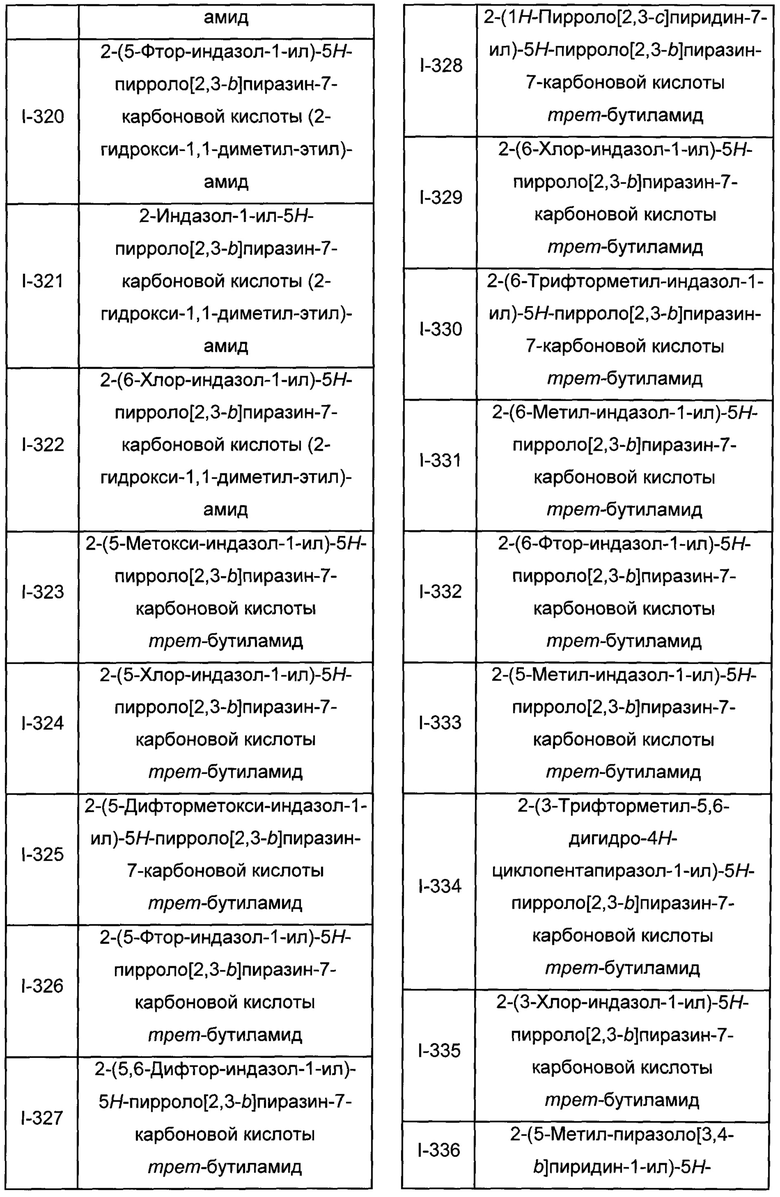
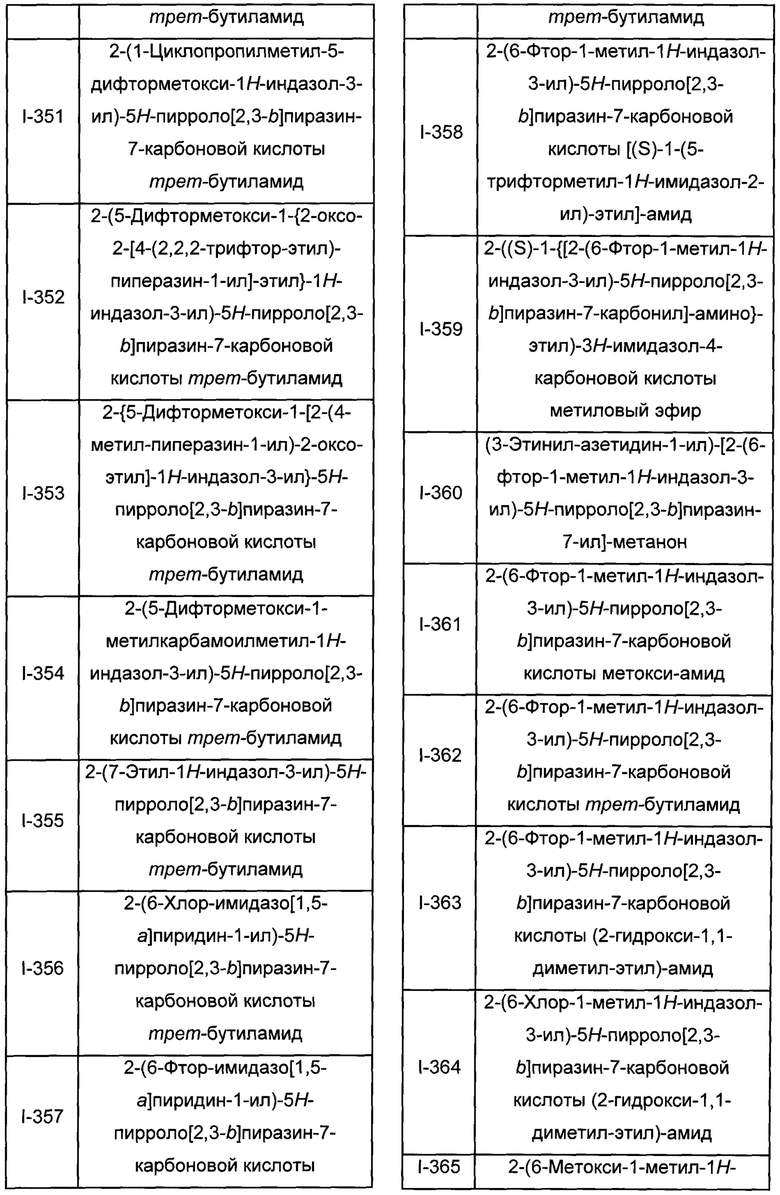
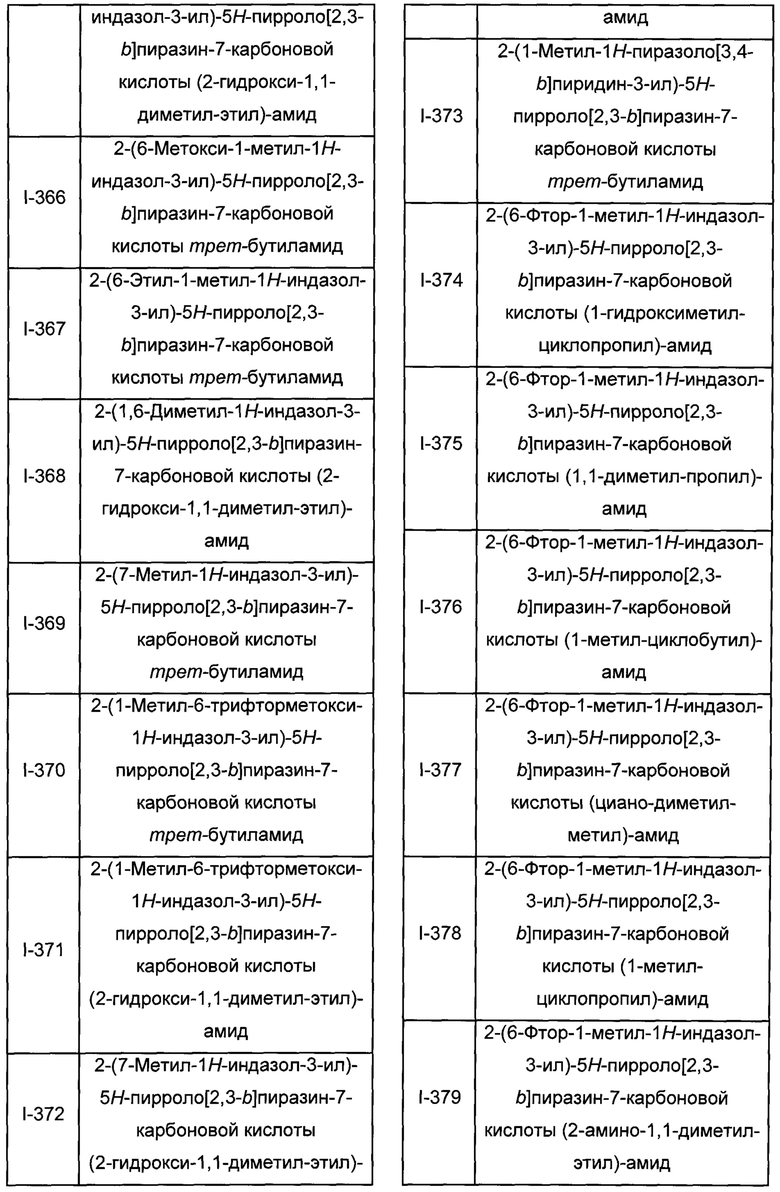
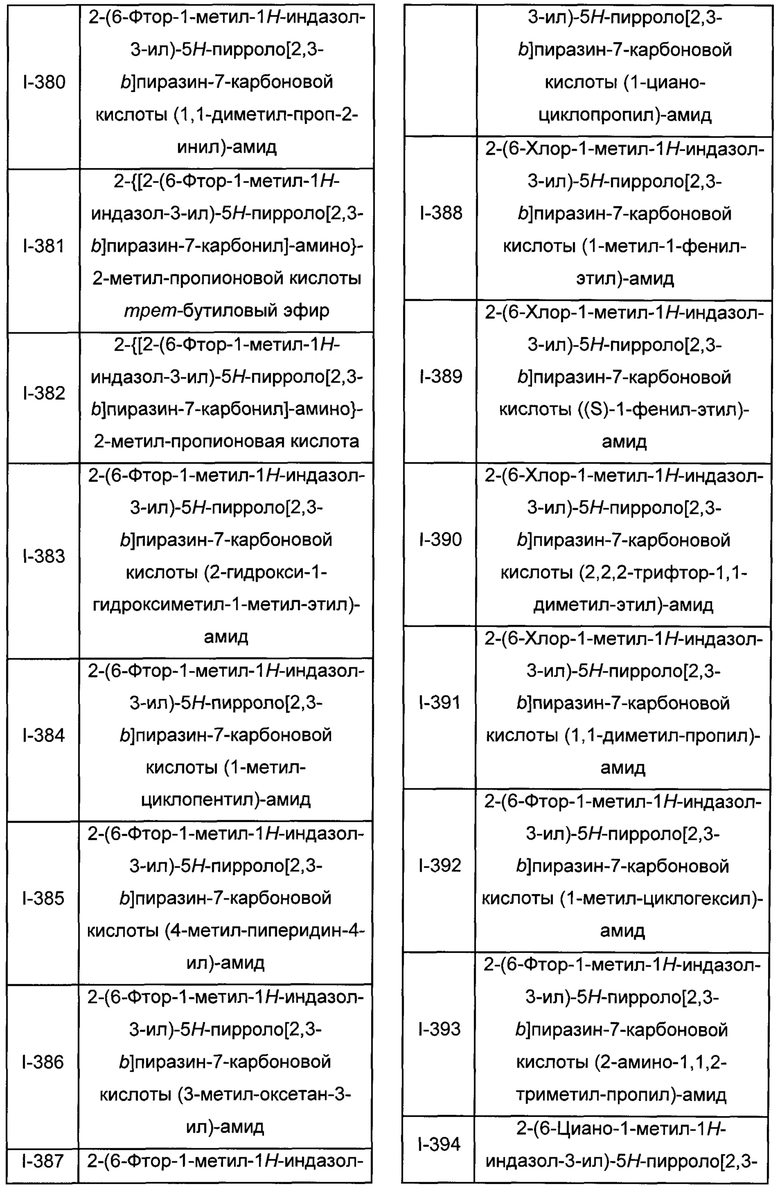
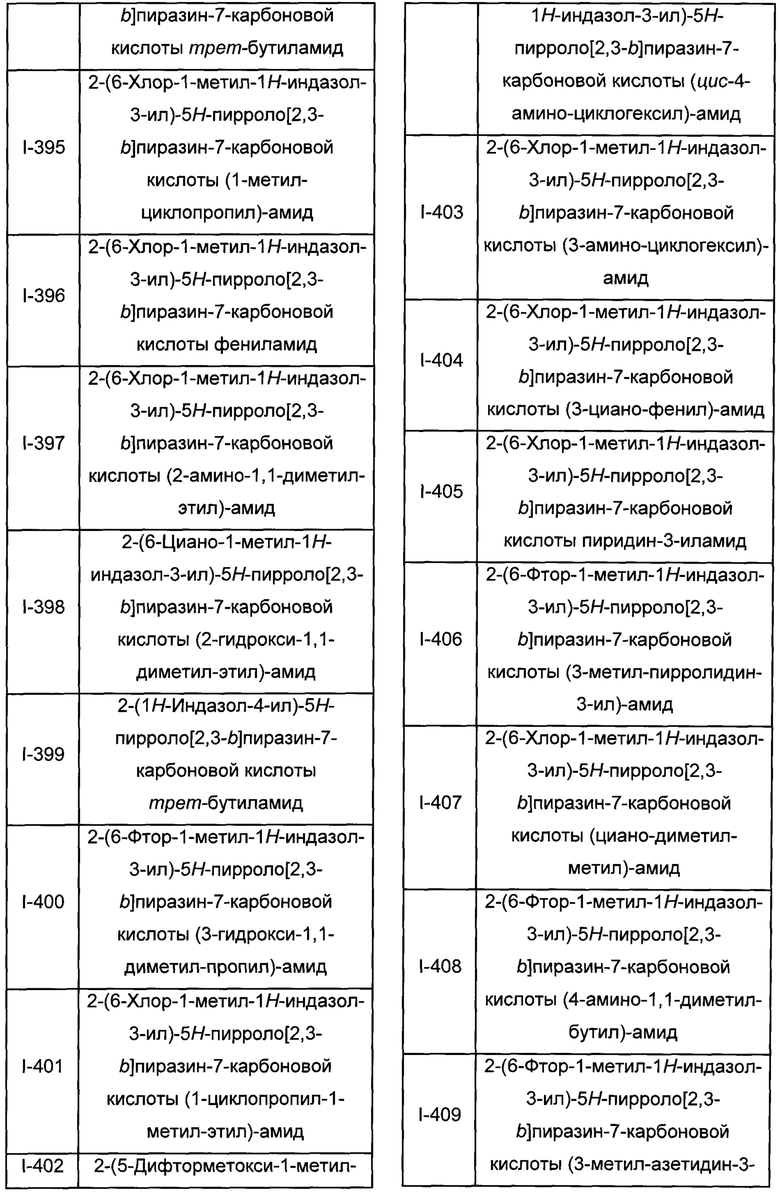
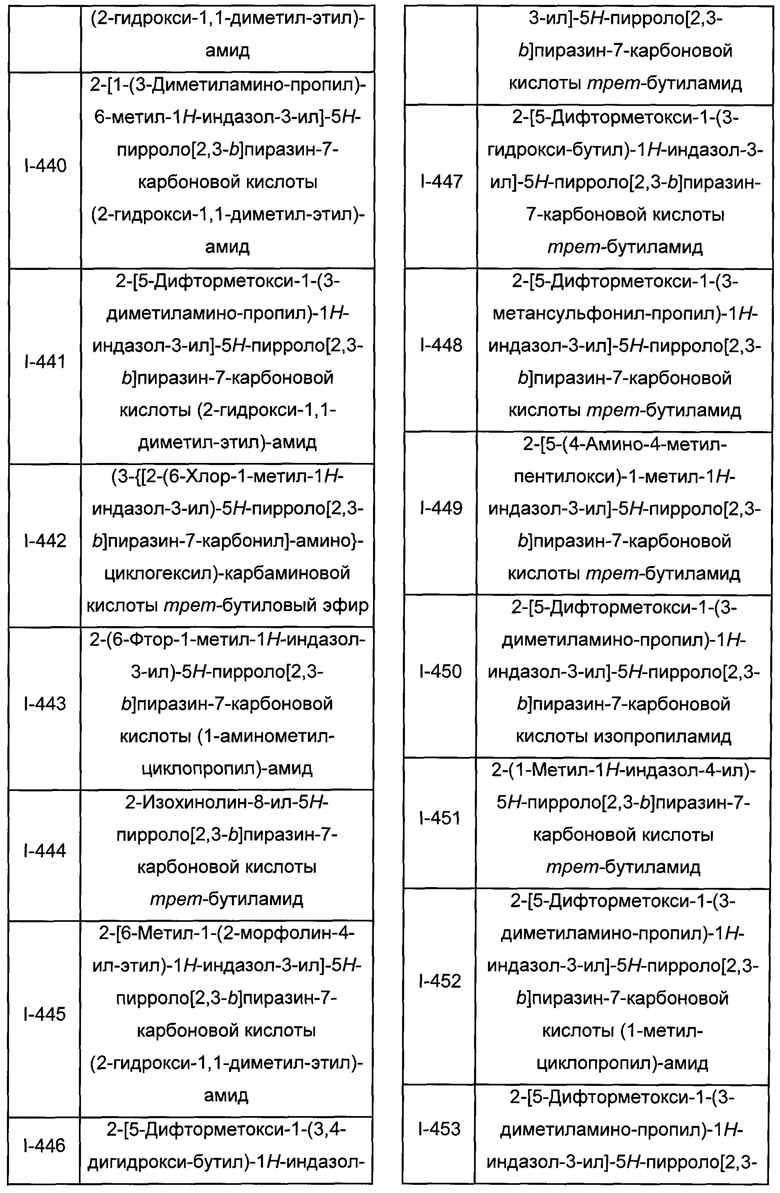
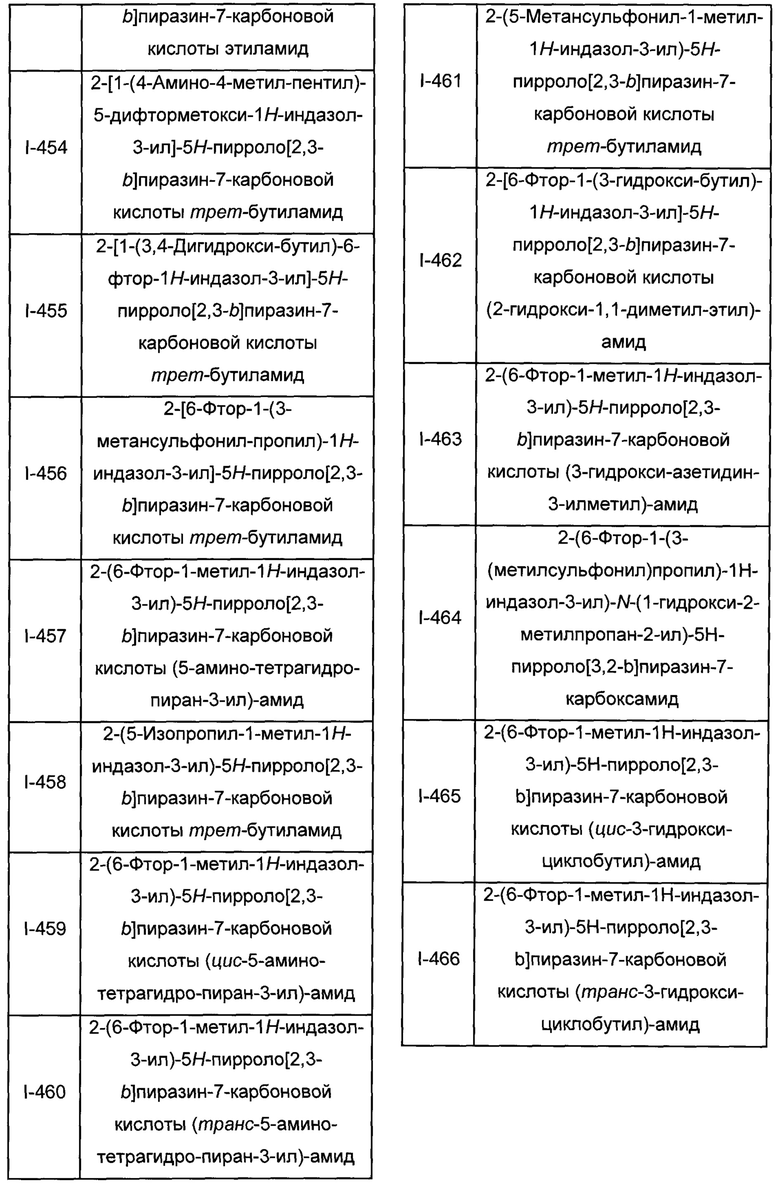
Согласно данной заявке предложено соединение, выбранное из соединений, приведенных в Таблице I.
Согласно данной заявке предложен способ лечения воспалительного или аутоиммунного состояния, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен указанный выше способ, дополнительно включающий введение дополнительного терапевтического агента, выбранного из химиотерапевтического или антипролиферативного агента, противовоспалительного агента, иммуномодулирующего или иммуносупрессивного агента, нейротрофического фактора, агента для лечения
сердечно-сосудистого заболевания, агента для лечения диабета или агента для лечения иммунодефицитных состояний.
Согласно данной заявке предложен способ лечения ревматоидного артрита, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен способ лечения астмы, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен способ лечения воспалительного состояния, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен способ ингибирования T-клеточного пролиферативного расстройства, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен указанный выше способ, где пролиферативное расстройство представляет собой рак.
Согласно данной заявке предложен способ лечения B-клеточного пролиферативного расстройства, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен способ лечения иммунного расстройства, включая волчанку, рассеянный склероз, ревматоидный артрит, псориаз, диабет 1 типа, осложнения в результате применения органных трансплантатов, ксенотрансплантацию, диабет, рак, астму, атопический дерматит, аутоиммунные расстройства щитовидной железы, язвенный колит, болезнь Крона, болезнь Альцгеймера и лейкоз, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен способ предупреждения или лечения всех форм отторжения органных трансплантатов, включая острое отторжение аллотрансплантатов или ксенотрансплантатов и хроническое отторжение аллотрансплантатов или ксенотрансплантатов, трансплантатов на сосудистой ножке или не являющихся таковыми, включающий введение пациенту, нуждающемуся в этом, соединения формулы I.
Согласно данной заявке предложен способ ингибирования активности JAK3, включающий введение соединения формулы I, где соединение
демонстрирует IC50 на уровне 50 микромолярной концентрации или меньше в биохимическом анализе активности JAK3 in vitro.
Согласно данной заявке предложен указанный выше способ, где соединение демонстрирует IC50 на уровне 100 наномолярной концентрации или меньше в биохимическом анализе активности JAK3 in vitro.
Согласно данной заявке предложен указанный выше способ, где соединение демонстрирует IC50 на уровне 10 наномолярной концентрации или меньше в биохимическом анализе активности JAK3 in vitro.
Способ ингибирования активности SYK, включающий введение соединения формулы I, где соединение демонстрирует IC50 на уровне 50 микромолярной концентрации или меньше в биохимическом анализе активности SYK in vitro.
Согласно данной заявке предложен указанный выше способ, где соединение демонстрирует IC50 на уровне 100 наномолярной концентрации или меньше в биохимическом анализе активности SYK in vitro.
Согласно данной заявке предложен указанный выше способ, где соединение демонстрирует IC50 на уровне 10 наномолярной концентрации или меньше в биохимическом анализе активности SYK in vitro.
Согласно данной заявке предложен способ лечения воспалительного состояния, включающий совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества противовоспалительного соединения в комбинации с соединением формулы I.
Согласно данной заявке предложен способ лечения иммунного расстройства, включающий совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения-иммуносупрессанта в комбинации с соединением формулы I.
Согласно данной заявке предложена фармацевтическая композиция, содержащая соединение формулы I в смеси по меньшей мере с одним фармацевтически приемлемым носителем, эксципиентом или разбавителем.
Согласно данной заявке предложена указанная выше композиция, дополнительно содержащий дополнительный терапевтический агент, выбранный из химиотерапевтического или антипролиферативного агента, противовоспалительного агента, иммуномодулирующего или иммуносупрессивного агента, нейротрофического фактора, агента для лечения сердечно-сосудистого заболевания, агента для лечения диабета и агента для лечения иммунодефицитных состояний.
Согласно данной заявке предложен способ получения соединения формулы I.
Согласно данной заявке предложено применение соединения формулы I в изготовлении лекарственного средства для лечения воспалительного нарушения.
Согласно данной заявке предложено применение соединения формулы I в изготовлении лекарственного средства для лечения аутоиммунного расстройства.
Согласно данной заявке предложено применение соединения по любому из п.п. 1-15 в изготовлении лекарственного средства для лечения артрита или астмы.
Согласно данной заявке предложено изобретение, как оно изложено в данном описании ранее.
Соединения
В следующей далее таблице приведены примеры репрезентативных соединений, охваченных настоящим изобретением и включенных в объем изобретения. Эти примеры и подготовительные примеры, которые приведены ниже, дают возможность специалистам в данной области более четко понимать и применять на практике настоящее изобретение. Их не следует рассматривать как ограничивающие объем данного изобретения, а только как иллюстрирующие и характеризующие его.
В общем случае, использованная в этой заявке номенклатура основывается на компьютеризированной системе института Бейльштейна AUTONOM™, v. 4.0, для создания систематической номенклатуры IUPAC (International Union of Pure and Applied Chemistry - Международный союз по теоретической и прикладной химии). Если есть несоответствие между изображенной структурой и названием, приданным этой структуре, то изображенную структуру следует считать более весомой. К тому же, если стереохимия структуры или части структуры не указана, например, жирными или пунктирными линиями, то эту структуру или часть структуры следует интерпретировать как охватывающую все ее стереоизомеры.
В ТАБЛИЦЕ I приведены типичные примеры соединений формулы I.
ТАБЛИЦА I.











Синтез
Общие схемы
Схема 1
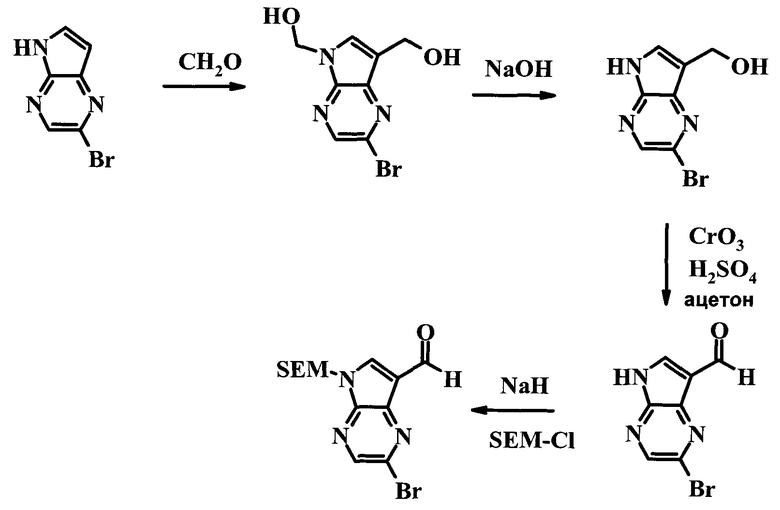
Схема 2
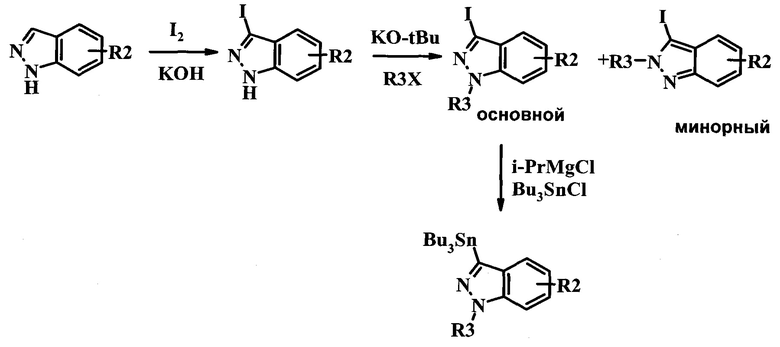
Схема 3
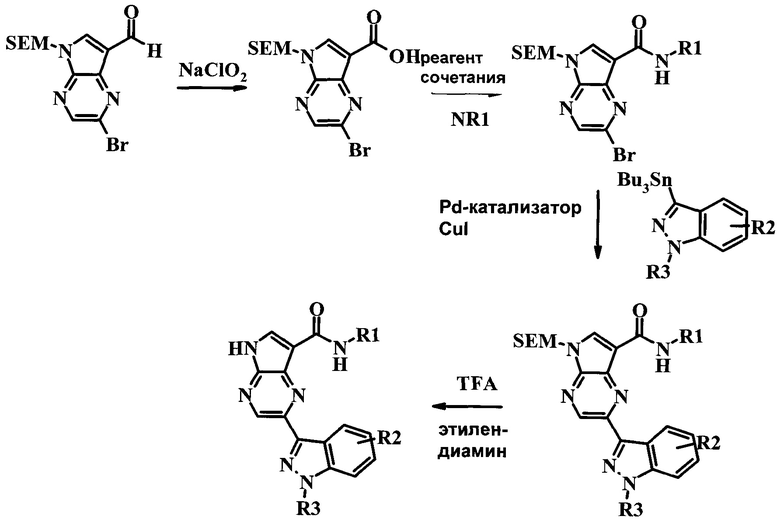
Схема 4
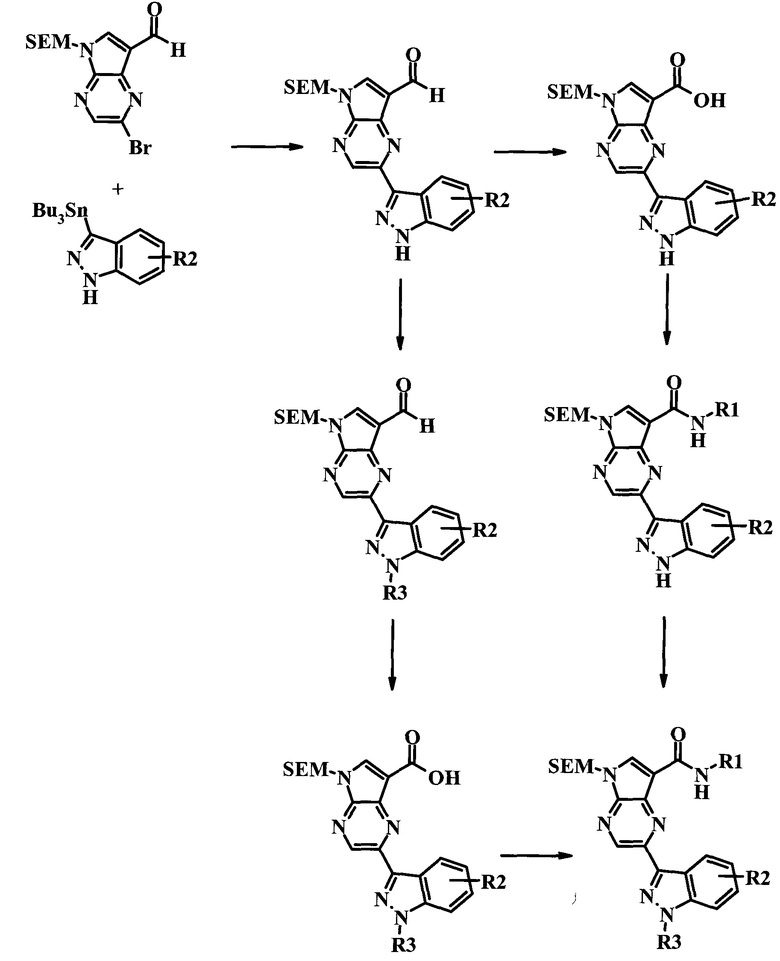
Методика 1
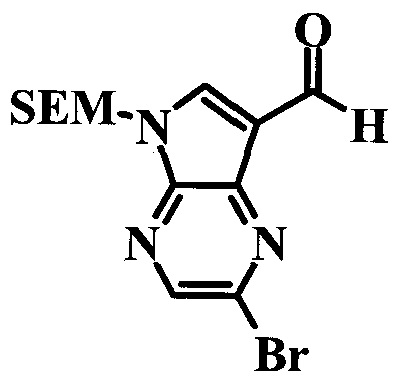
2-Бром-5-(2-триметилсиланил-этоксиметил)-5h-пирроло[2,3-b]пиразин-7-карбальдегид
Способ A
Стадия 1
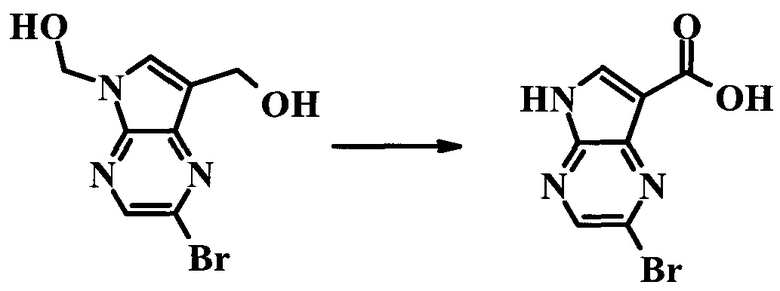
(2-Бром-7-гидроксиметил-пирроло[2,3-b]пиразин-5-ил)-метанол
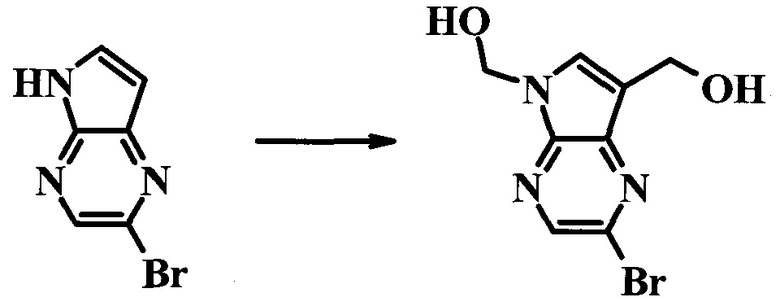
К частичной суспензии (partial suspension) 2-бром-5H-пирроло[2,3-b]пиразина (5,0 г; 25,2 ммоль) в 1,4-диоксане (100 мл) добавляли 2,0 М водный NaOH (25 мл; 50,0 ммоль) и 37%-ный водный формальдегид (19 мл; 252 ммоль). Темную гомогенную реакционную смесь перемешивали при комнатной температуре в течение ночи. Органические слои упаривали при пониженном давлении. Водный слой нейтрализовали, используя 1,0 М HCl, и экстрагировали EtOAc (2×). Объединенные органические экстракты концентрировали, получая 2,6 г оранжевого твердого вещества. При стоянии образовывался вязкий коричневый осадок в водном слое. Осадок собирали фильтрованием и сушили. Коричневое тввердое вещество экстрагировали горячей смесью 10% MeOH/EtOAc (3×200 мл). Экстракты объединяли и упаривали, получая дополнительно 3,05 г оранжевого твердого вещества. Общий выход составлял 5,65 г (87%) (2-бром-7-гидроксиметил-пирроло[2,3-b]пиразин-5-ил)-метанола. 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 8.43 (s, 1H), 7.96 (s, 1H), 6.71 (t, J=7,3 Гц, 1H), 5.59 (d, J=7,6 Гц, 2H), 5.10 (t, J=5,3 Гц, 1H), 4.66 (d, J=5,6 Гц, 2H).
Стадия 2
(2-Бром-5H-пирроло[2,3-b]пиразин-7-ил)-метанол
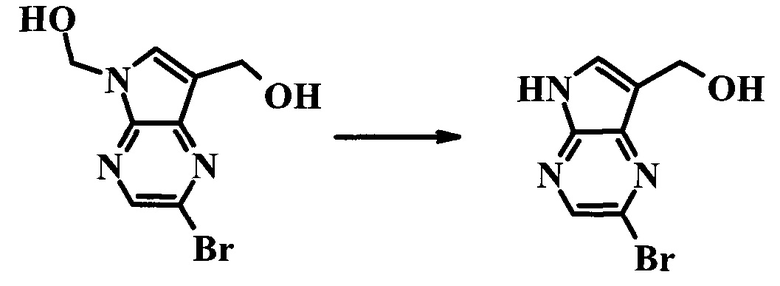
К суспензии (2-бром-7-гидроксиметил-пирроло[2,3-b]пиразин-5-ил)-метанола (5,65 г; 21,9 ммоль) в THF (150 мл) добавляли раствор 2,0 М водного NaOH (33 мл; 66 ммоль). Гомогенную реакционную смесь перемешивали в течение ночи, затем органические слои удаляли при пониженном давлении. Величину pH водного остатка подводили до 4, используя 1,0 М водный HCl. Полученный осадок собирали посредством фильтрования и промывали H2O, получая 3,68 г желтого твердого вещества. Фильтрат экстрагировали EtOAc (2×) и органические экстракты концентрировали при пониженном давлении, получая дополнительно 0,92 г желтого твердого вещества. Общий выход составлял 4,60 г (92%) (2-бром-5H-пирроло[2,3-b]пиразин-7-ил)-метанола. 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.19 (br. s., 1H), 8.33 (s, 1H), 7.85 (s, 1H), 4.96 (t, J=5,3 Гц, 1H), 4.62 (d, J=4,9 Гц, 2H).
Стадия 3
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
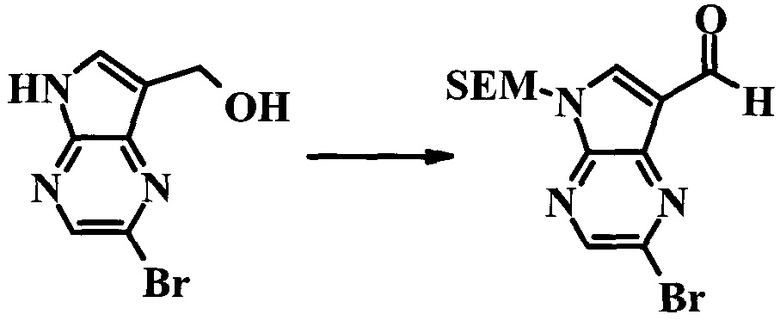
Получали концентрированный раствор реагента Джонса (2,67 М), осторожно добавляя концентрированную H2SO4 (2,3 мл) к CrO3 (2,67 г), затем разбавляя 10 мл N2O. К частичной суспензии (2-бром-5H-пирроло[2,3-b]пиразин-7-ил)-метанола (4,6 г; 20,1 ммоль) в ацетоне (300 мл) медленно добавляли реагент Джонса (9 мл; 24,0 ммоль). В процессе добавления исходное вещество постепенно растворялось, и образовывался вязкий зеленый осадок. Реакционную смесь перемешивали в течение 15 мин, затем гасили, используя i-PrOH (2 мл), и фильтровали через целит, промывая ацетоном. Фильтрат концентрировали, получая 4,76 г 2-бром-5H-пирроло[2,3-b]пиразин-7-карбальдегида в виде желто-оранжевого твердого вещества, которое использовали без дополнительной очистки. К раствору этого твердого вещества в DMF (50 мл) при 0°C добавляли NaH (60%-ный в минеральном масле; 1,2 г; 30,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем снова охлаждали до 0°C и медленно добавляли 2-(триметилсилил)этоксиметилхлорид (4,3 мл; 24,1 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч, затем гасили H2O и экстрагировали EtOAc (3×).
Объединенные органические экстракты промывали H2O (3×) и рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на SiO2 (от 20% до 30% EtOAc/гексаны), получая 3,82 г (53%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида в виде желтого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 10.37 (s, 1H), 8.50 (s, 1H), 8.33 (s, 1H), 5.73 (s, 2H), 3.53-3.70 (m, 2H), 0.90-1.05 (m, 2H), 0.00 (s, 9H).
Способ B
Стадия 1
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин

В сухой круглодонной колбе растворяли 2-бром-5H-пирроло[2,3-b]пиразин (5,0 г; 25,2 ммоль) в DMF (50 мл). Реакционную смесь охлаждали до 0°C и добавляли гидрид натрия (60%-ную дисперсию в минеральном масле; 1,22 г; 30,6 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 15 мин, затем снова охлаждали до 0°C и медленно добавляли SEM-Cl (триметилсилилэтил-хлорид) (5,4 мл; 30,4 ммоль). По завершении добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч. Реакционную смесь гасили 50 мл воды и экстрагировали 150 мл диэтилового эфира (2×). Объединенные органические слои дважды промывали 30 мл воды и один раз 30 мл рассола, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на примерно 20 г SiO2 и хроматографировали через 200 г SiO2, используя EtOAc/гексаны (градиент: 0-15% EtOAc). Все содержащие продукт фракции объединяли и концентрировали, получая 6,61 г (80%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразина в виде бледно-желтого масла, которое постепенно отвердевало. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.38 (s, 1H), 7.70 (d, J=3,8 Гц, 1H), 6.76 (d, J=3,8 Гц, 1H), 5.68 (s, 2H), 3.50-3.65 (m, 2H), 0.88-1.03 (m, 2H), 0.00 (s, 9H).
Стадия 2
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
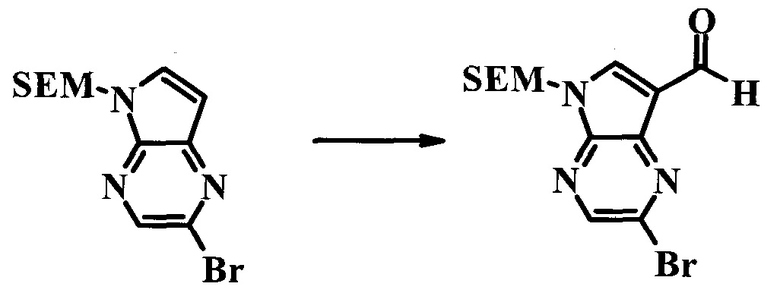
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин (6,58 г; 20,0 ммоль) в хлороформе (стабилизированном пентеном, 120 мл) и добавляли хлорид хлорметилендиметил-иминия (10,3 г; 80,2 ммоль). Реакционную смесь перемешивали при температуре дефлегмации в течение 8 ч пока реакционную смесь барботировали устойчивой струей газообразного азота. Темно-коричневый раствор охлаждали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь осторожно гасили, используя примерно 100 мл насыщенного раствора NaHCO3 (осторожно: экзотермическая реакция) и затем дважды экстрагировали 200 мл диэтилового эфира. Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на примерно 20 г SiO2 и хроматографировали через 200 г SiO2, используя смесь EtOAc/гексаны (градиент: 0-25% EtOAc). Все содержащие продукт фракции объединяли и концентрировали, получая 5,92 г (83%) смеси (приблизит. 3:1) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида и 2-хлор-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида в виде желтого твердого вещества. Бромид: 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 10.37 (s, 1Н), 8.50 (s, 1H), 8.33 (s, 1H), 5.73 (s, 2H), 3.56-3.67 (m, 2H), 0.91-1.02 (m, 2H), 0.00 (s, 9H); хлорид: 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 10.36 (s, 1H), 8.41 (s, 1H), 8.35 (s, 1H), 5.74 (s, 2H), 3.56-3.67 (m, 2H), 0.91-1.02 (m, 2H), 0.00 (s, 9H).
Методика 2
2-Бром-5-(2-триметилсиланилэтоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
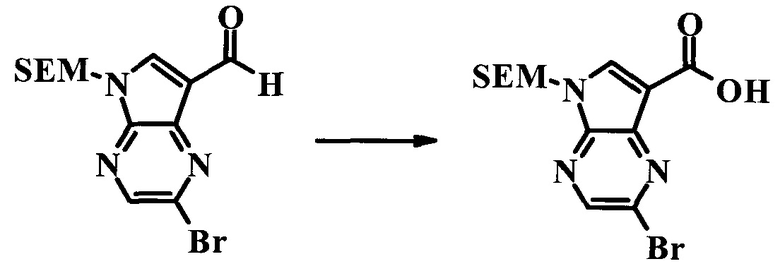
В колбе растворяли в диоксане (120 мл) и H2O (30 мл) 2-бром-5-(2-триметилсиланилэтоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (3,11 г;
8,74 ммоль) и смесь охлаждали при 0°C. Добавляли сульфаминовую кислоту (5,09 г; 52,4 ммоль), затем раствор хлорита натрия (1,28 г; 11,4 ммоль) и дигидрофосфата калия (14,3 г; 104,9 ммоль) в H2O (75 мл) через капельную воронку в течение 15 мин. Смесь оставляли нагреваться до комнатной температуры в течение 2 ч. Полученное желтое твердое вещество отфильтровывали, промывали H2O и гексаном и сушили. Затем фильтрат экстрагировали EtOAc и объединенные органические экстракты промывали рассолом, сушили над MgSO4 и концентрировали, получая дополнительный продукт. Суммарно получали 3,71 г 2-бром-5-(2-триметилсиланилэтоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты в виде желтого твердого вещества. 1H ЯМР (CDCl3, 400 МГц): δ (млн-1) 8.52 (s, 1Н), 8.42 (s, 1H), 5.73 (s, 2H), 3.56-3.65 (m, 2H), 0.90-1.02 (m, 2H), 0.00 (s, 9H).
Методика 3
2-Бром-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты метиловый эфир
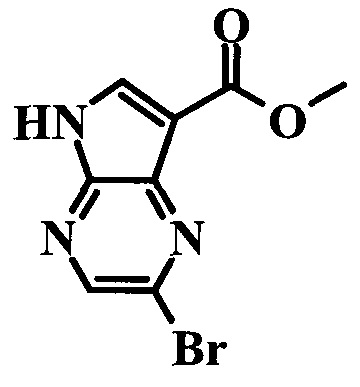
Стадия 1
2-Бром-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
К перемешиваемому раствору (2-бром-7-гидроксиметил-пирроло[2,3-b]пиразин-5-ил)-метанола (0,525 г; 2,03 ммоль) в 200 мл ацетона при 40°C добавляли раствор CrO3 (0,832 г; 8,32 ммоль) и H2SO4 (1,32 г; 13,4 ммоль) в воде (3 мл). Затем реакционную смесь перемешивали при 40°C в течение 16 часов, затем фильтровали через целит. Фильтрат упаривали при 40°C при пониженном давлении, получая 2-бром-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (0,527 г) в виде беловатого твердого вещества. LCMS: (M+H)+=264; 1H ЯМР (300 МГц, DMSO-d6): δ 13.04 (s, 1H), 8.53 (s, 1H), 8.45 (s, 1H), 5.63 (s, 1H).
Стадия 2
2-Бром-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты метиловый эфир
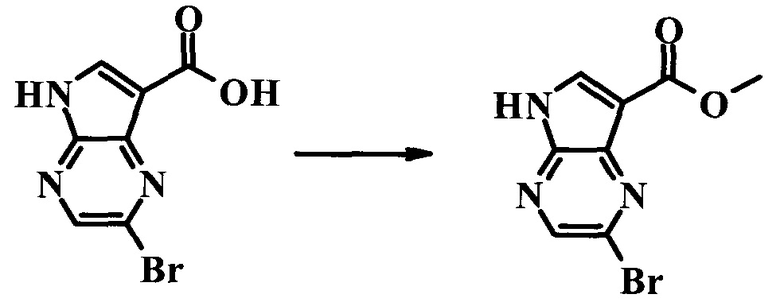
К перемешиваемому раствору 2-бром-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (0,527 г; 2,18 ммоль) в 50 мл метанола медленно при комнатной температуре добавляли H2SO4 (1,5 мл). Реакционную смесь перемешивали при температуре дефлегмации в течение 16 ч. Растворитель выпаривали при 40°C и пониженном давлении, затем остаток суспендировали в 5 мл воды и обрабатывали твердым NaHCO3 до pH 7. Раствор экстрагировали этилацетатом (90 мл), затем органические экстракты промывали водой (20 мл), рассолом (20 мл) и сушили над безводным сульфатом натрия. Сушильный агент удаляли фильтрованием и растворитель выпаривали при 40°C при пониженном давлении, получая неочищенный продукт, который очищали колоночной хроматографией (силикагель, 200-300 меш, с элюированием смесью петролейного эфира и этилацетата (1:1, об./об.), получая 2-бром-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты метиловый эфир (0,24 г; 43%) в виде белого твердого вещества. LCMS: (M+H)+=278; 1H ЯМР (300 МГц, DMSO-d6): δ 8.62 (s, 1H), 8.48 (s, 1H), 3.91 (s, 3H).
Фармацевтические композиции и введение
Соединения по настоящему изобретению могут быть изготовлены в разнообразных лекарственных формах для перорального введения и носителях. Пероральное введение может быть осуществлено в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Соединения по настоящему изобретению эффективны при введении другими способами введения, включая непрерывное (с использованием внутривенной капельницы) местное, парентеральное, внутримышечное, внутривенное, подкожное, трансдермальное (при котором может быть включен усиливающий проницаемость агент), трансбуккальное, назальное введение, введение посредством ингаляции и суппозиториев, среди других способов введения. Предпочтительным способом введения обычно является пероральный с использованием удобного режима введения один раз в сутки, который можно регулировать в соответствии с тяжестью заболевания и реакцией пациента на активный ингредиент.
Соединение или соединения по настоящему изобретению, а также их фармацевтически приемлемые соли, вместе с одним или более чем одним традиционным эксципиентом, носителем или разбавителем могут быть представлены в форме фармацевтических композиций и стандартных лекарственных форм. Фармацевтические композиции и стандартные лекарственные формы могут содержать традиционные ингредиенты в обычных пропорциях с добавлением или без добавления дополнительных активных соединений или действующих начал, и такие стандартные лекарственные формы могут содержать любое подходящее эффективное количество активного ингредиента в соответствии с предполагаемым диапазоном суточных дозировок, который будет использован. Фармацевтические композиции могут быть использованы в виде твердых веществ, таких как таблетки или заполненные капсулы, полутвердых веществ, порошков, композиций с непрерывным высвобождением или жидкостей, таких как растворы, суспензии, эмульсии, эликсиры или заполненные капсулы для перорального применения; или в форме суппозиториев для ректального или вагинального введения; или в форме стерильных инъекционных растворов для парентерального применения. Типичный препарат будет содержать от примерно 5% до примерно 95% активного соединения или соединений (масс./масс.). Подразумевается, что термин "препарат" или "лекарственная форма" включает в себя как твердые, так и жидкие композиции активного соединения, и специалисту в данной области техники будет очевидно, что активный ингредиент может находиться в разных препаратах в зависимости от целевого органа или ткани, желаемой дозы и фармакокинетических параметров.
Препараты в твердой форме включают порошки, таблетки, пилюли, капсулы, облатки, суппозитории и диспергируемые гранулы. Твердым носителем может быть одно или более веществ, которые также могут действовать в качестве разбавителей, корригенов, солюбилизаторов, смазывающих веществ, суспендирующих агентов, связующих веществ, консервантов, разрыхлителей для таблеток или инкапсулирующего материала. Носитель в порошках обычно является тонкоизмельченным твердым веществом, которое представляет собой смесь вместе с тонкоизмельченным активным компонентом. Активный компонент в таблетках обычно смешан в подходящих пропорциях с носителем, обладающим необходимой связывающей способностью, и скомпактизован до желаемых формы и размера. Подходящие носители включают, но не ограничиваются этим, карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлозу, натриевую соль
карбоксиметилцеллюлозы, легкоплавкий воск, масло какао и им подобное. Препараты в твердой форме могут содержать помимо активного компонента красители, корригенты, стабилизаторы, буферы, искусственные и природные подсластители, диспергирующие вещества, загустители, солюбилизирующие агенты и им подобное.
Композиции в жидкой форме, также подходящие для перорального введения, включают композицию в жидкой форме в жидкой форме, в том числе эмульсии, сиропы, эликсиры, водные растворы, водные суспензии. Они включают препараты в твердой форме, предназначенные для преобразования их в препараты в жидкой форме незадолго до применения. Эмульсии могут быть приготовлены в растворах, например, в водно-пропиленгликолиевых растворах, или могут содержать такие эмульгирующие агенты, как лецитин, моноолеат сорбитана или аравийская камедь. Водные растворы могут быть приготовлены путем растворения активного компонента в воде и добавления подходящих красителей, корригентов, стабилизаторов и загустителей. Водные суспензии могут быть приготовлены путем диспергирования тонкоизмельченного активного компонента в воде с вязким веществом, таким как природные или синтетические камеди, смолы, метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и другие хорошо известные суспендирующие агенты.
На основе соединений по настоящему изобретению могут быть изготовлены композиции для парентерального введения (например, путем инъекции, например болюс-инъекции или непрерывной инфузии), которые могут быть представлены в стандартной лекарственной форме в ампулах, предварительно заполненных шприцах, капельницах небольшого объема или в контейнерах для многократного введения с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных разбавителях, например, растворы в водном полиэтиленгликоле. Примеры масляных или неводных носителей, разбавителей, растворителей или наполнителей включают пропиленгликоль, полиэтиленгликоль, растительные масла (например, оливковое масло) и инъекционные органические сложные эфиры (например, этилолеат) и могут содержать такие входящие в состав композиции агенты, как консерванты, увлажняющие, эмульгирующие или суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в порошковой форме, полученной в результате выделения стерильного твердого вещества в асептических условиях или в результате лиофилизации из раствора,
для повторного разведения подходящим разбавителем, например стерильной апирогенной водой, перед применением.
На основе соединений по настоящему изобретению могут быть изготовлены композиции для местного введения в эпидермис в виде мазей, кремов или лосьонов или в виде трансдермального пластыря. Мази и кремы могут быть изготовлены, например, с использованием водной или масляной основы с добавлением подходящих загущающих и/или желатинизирующих агентов. Лосьоны могут быть изготовлены с использованием водной или масляной основы и в общем случае также будут содержать один или более эмульгирующих агентов, стабилизирующих агентов, диспергирующих агентов, суспендирующих агентов, загустителей или красителей. Композиции, подходящие для местного введения в ротовую полость, включают пастилки для рассасывания, содержащие активные агенты в корригентной основе, обычно сахарозе и аравийской или трагакантовой камеди; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь; и жидкости для полоскания рта, содержащие активный ингредиент в подходящем жидком носителе.
На основе соединений по настоящему изобретению могут быть изготовлены композиции для введения в виде суппозиториев. Сначала расплавляют легкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, и в нем гомогенно диспергируют активный компонент, например, путем перемешивания. Расплавленную гомогенную смесь затем выливают в формы удобного размера, оставляли охлаждаться и отвердеть.
На основе соединений по настоящему изобретению могут быть изготовлены композиции для вагинального введения. Пессарии, тампоны, кремы, гели, пасты, пенки или спреи содержат помимо активного ингредиента такие носители, которые известны в данной области как приемлемые.
На основе соединений по настоящему изобретению могут быть изготовлены композиции для назального введения. Растворы или суспензии вводят непосредственно в носовую полость традиционными способами, например, с использованием капельницы, пипетки или спрея. Композиции могут быть представлены в лекарственной форме для однократного или многократного приема. В последнем случае с использованием капельницы или пипетки этого можно достичь путем введения пациентом соответствующего, предварительно определенного объема раствора или суспензии. В случае спрея этого можно достичь, например, посредством дозирующего мелкодисперсно распыляющего насоса.
На основе соединений по настоящему изобретению могут быть изготовлены композиции для аэрозольного способа введения, в частности в респираторный тракт, и в том числе для интраназального введения. Как правило, частицы, содержащие данное соединение будут иметь размер, соответствующий мелким частицам, например порядка пяти (5) микронов или меньше. Такого размера частиц можно добиться средствами, известными в данной области техники, например путем микронизации. Активный ингредиент представлен в находящейся под давлением упаковке вместе с подходящим пропеллентом, таким как хлорфторуглерод (CFC), например, дихлордифторметан, трихлорфторметан или дихлортетрафторэтан, либо диоксид углерода или другой подходящий газ. Удобно, если аэрозоль также может содержать поверхностно-активное вещество, такое как лецитин. Дозу лекарственного средства можно контролировать посредством дозирующего клапана. Альтернативно, активные ингредиенты могут быть представлены в форме сухого порошка, например порошковой смеси соединения в подходящей порошковой основе, такой как лактоза, крахмал, производные крахмала, например, в гидроксипропилметил-целлюлозе и поливинилпирролидине (PVP). Порошковый носитель будет образовывать гель в носовой полости. Порошковая композиция может быть представлена в стандартной лекарственной форме, например в капсулах или картриджах из, например желатина, или блистерных упаковках, из которых находящийся там порошок может быть введен посредством ингалятора.
При желании композиции могут быть изготовлены с энтеросолюбильными покрытиями, адаптированными для введения активного ингредиента посредством непрерывного или регулируемого высвобождения. Например, на основе соединений по настоящему изобретению могут быть изготовлены устройства для трансдермальной или подкожной доставки лекарственных средств. Такие системы доставки имеют преимущество в случае непрерывного высвобождения необходимого соединения и тогда, когда соблюдение больным режима и схемы лечения является принципиальным. Соединения в трансдермальных системах доставки часто нанесены на приклеиваемую к коже твердую подложку. Представляющее интерес соединение также может быть в комбинации с усилителем проницаемости, например, азоном (1-додецилазациклогептан-2-оном). Системы доставки с непрерывным высвобождением вводят подкожно в субдермальный слой путем хирургической манипуляции или инъекции. В подкожных имплантатах соединение заключено в липидорастворимую оболочку, например, из силиконового каучука или биоразлагаемого полимера, например, полимолочной кислоты.
Подходящие композиции вместе с фармацевтическими носителями, разбавителями и эксципиентами описаны в Remington: The Science and Practice of Pharmacy, 1995, под редакцией E.W. Martin, Mack Publishing Company, 19-e издание, Easton, Pennsylvania. Репрезентативные фармацевтические композиции, содержащие соединение по настоящему изобретению, описаны ниже.
Благодаря разъяснениям, изложенным в этом описании, опытный специалист в области разработки композиций может модифицировать состав композиций с получением большого числа композиций для конкретного пути введения без изменения композиций по настоящему изобретению в сторону нестабильности или снижения их терапевтической активности.
Модификацию соединений по настоящему изобретению, например, с целью увеличения их растворимости в воде или другом разбавителе, можно легко осуществить путем несущественных модификаций (солевого состава, этерификации и т.д.), которые очевидны среднему специалисту в данной области техники. Среднему специалисту в данной области также очевидно, как можно модифицировать путь введения и режим введения конкретного соединения, чтобы регулировать фармакокинетику соединений по настоящему изобретению для получения пациентом максимального полезного эффекта.
Термин "терапевтически эффективное количество", использованный в данном описании, означает количество, необходимое для ослабления симптомов заболевания у индивидуума. В каждом конкретном случае доза будет подведена с учетом индивидуальных требований. Такую дозировку можно варьировать в широких пределах в зависимости от многочисленных факторов, таких как тяжесть подлежащего лечению заболевания, возраст и общее состояние здоровья пациента, другие лекарственные средства, которыми лечат пациента, путь и форма введения, а также предпочтения и опыт лечащего врача. Суточная дозировка для перорального введения в монотерапии и/или в комбинированной терапии должна составлять соответственно от примерно 0,01 до примерно 1000 мг/кг массы тела в сутки. Предпочтительная суточная дозировка составляет от примерно 0,1 до примерно 500 мг/кг массы тела, более предпочтительная от 0,1 до примерно 100 мг/кг массы тела и наиболее предпочтительная от 1,0 и примерно 10 мг/кг масса тела в сутки. Таким образом, диапазон дозировок для введения субъекту массой 70 кг будет составлять от примерно 7 мг до 0,7 г в сутки. Суточную дозу можно вводить в виде одной дозировки или в виде разделенных дозировок, обычно от 1 до 5 дозировок в сутки. Как правило, лечение начинают с более мелких дозировок, которые меньше оптимальной дозы
соединения. Затем дозировку увеличивают небольшими приращениями для достижения оптимального эффекта у индивидуального пациента. Средний специалист в лечении заболеваний, изложенных в данном описании, будет способен, без излишнего экспериментирования и руководствуясь персональными знаниями, личным опытом и описанием этой заявки, определить терапевтически эффективное количество соединений по настоящему изобретению, необходимое для данного заболевания.
Фармацевтические препараты предпочтительно находятся в стандартных лекарственных формах. Препарат в такой форме подразделен на стандартные дозы, содержащие соответствующие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, при этом такая упаковка содержит дискретные количества препарата, как например упакованные таблетки, капсулы и порошки во флаконах или ампулах. Кроме того, стандартная лекарственная форма может представлять собой только одну капсулу, таблетку, облатку или пастилку, или это может быть соответствующее количество любой из них в упакованной форме.
Показания и способ лечения
Согласно данной заявке предложен способ лечения воспалительного или аутоиммунного состояния, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен указанный выше способ, дополнительно включающий введение дополнительного терапевтического агента, выбранного из химиотерапевтического или антипролиферативного агента, противовоспалительного агента, иммуномодулирующего или иммуносупрессивного агента, нейротрофического фактора, агента для лечения сердечно-сосудистого заболевания, агента для лечения диабета или агента для лечения иммунодефицитных состояний.
Согласно данной заявке предложен способ лечения ревматоидного артрита, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен способ лечения астмы, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен способ лечения воспалительного состояния, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен способ ингибирования T-клеточного пролиферативного расстройства, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен указанный выше способ, где пролиферативное расстройство представляет собой рак.
Согласно данной заявке предложен способ лечения B-клеточного пролиферативного расстройства, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен способ лечения иммунного расстройства, включая волчанку, рассеянный склероз, ревматоидный артрит, псориаз, диабет 1 типа, осложнения в результате применения органных трансплантатов, ксенотрансплантацию, диабет, рак, астму, атопический дерматит, аутоиммунные расстройства щитовидной железы, язвенный колит, болезнь Крона, болезнь Альцгеймера и лейкоз, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I.
Согласно данной заявке предложен способ предупреждения или лечения всех форм отторжения органных трансплантатов, включая острое отторжение аллотрансплантатов или ксенотрансплантатов и хроническое отторжение аллотрансплантатов или ксенотрансплантатов, трансплантатов на сосудистой ножке или не являющихся таковыми, включающий введение пациенту, нуждающемуся в этом, соединения формулы I.
Согласно данной заявке предложен способ ингибирования активности JAK3, включающий введение соединения формулы I, где соединение демонстрирует IC50 на уровне 50 микромолярной концентрации или меньше в биохимическом анализе активности JAK3 in vitro.
Согласно данной заявке предложен указанный выше способ, где соединение демонстрирует IC50 на уровне 100 наномолярной концентрации или меньше в биохимическом анализе активности JAK3 in vitro.
Согласно данной заявке предложен указанный выше способ, где соединение демонстрирует IC50 на уровне 10 наномолярной концентрации или меньше в биохимическом анализе активности JAK3 in vitro.
Способ ингибирования активности SYK, включающий введение соединения формулы I, где соединение демонстрирует IC50 на уровне 50
микромолярной концентрации или меньше в биохимическом анализе активности SYK in vitro.
Согласно данной заявке предложен указанный выше способ, где соединение демонстрирует IC50 на уровне 100 наномолярной концентрации или меньше в биохимическом анализе активности SYK in vitro.
Согласно данной заявке предложен указанный выше способ, где соединение демонстрирует IC50 на уровне 10 наномолярной концентрации или меньше в биохимическом анализе активности SYK in vitro.
Согласно данной заявке предложен способ лечения воспалительного состояния, включающий совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества противовоспалительного соединения в комбинации с соединением формулы I.
Согласно данной заявке предложен способ лечения иммунного расстройства, включающий совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения-иммуносупрессанта в комбинации с соединением формулы I.
ПРИМЕРЫ
Следующие далее примеры иллюстрируют получение и биологическую оценку соединений, включенных в объем изобретения. В общем случае, использованная в этой разделе номенклатура основывается на AUTONOM™, v. 4.0, как указано выше, или, альтернативно, основывается на ChemDraw. Эти примеры и подготовительные примеры, которые приведены ниже, дают возможность специалистам в данной области более четко понимать и применять на практике настоящее изобретение. Их не следует рассматривать как ограничивающие объем данного изобретения, а только как иллюстрирующие и характеризующие его.
Сокращения
Обычно используемые сокращения включают следующее: ацетил (Ac), азо-бис-изобутирилнитрил (AIBN), атмосферы (атм.), 9-борабицикло[3.3.1]нонан (9-BBN или BBN), трет-бутоксикарбонил (Boc), ди-трет-бутилпирокарбонат или boc-ангидрид (BOC2O), бензил (Bn), бутил (Bu), регистрационный номер в химической реферативной службе (chemical abstracts registration number, CASRN), бензилоксикарбонил (CBZ или Z), карбонилдиимидазол (CDI), 1,4-диазабицикло[2.2.2]октан (DABCO), трифторид диэтиламиносеры (DAST), дибензилиденацетон (dba), 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), N,N'-дициклогексилкарбодиимид (DCC),
1,2-дихлорэтан (DCE), дихлорметан (DCM), диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат (DIAD), диизобутилалюминийгидрид (DIBAL или DIBAL-H), диизопропилэтиламин (DIPEA), N,N-диметилацетамид (DMA), 4-N,N-диметиламинопиридин (DMAP), N,N-диметилформамид (DMF), диметилсульфоксид (DMSO), 1,1'-бис-(дифенилфосфино)этан (dppe), 1,1'-бис-(дифенилфосфино)ферроцен (dppf), 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDC), этил (Et), этилацетат (EtOAc), этанол (EtOH), 2-этокси-2H-хинолин-1-карбоновой кислоты сложный этиловый эфир (EEDQ), диэтиловый эфир (Et2O), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), уксусная кислота (HOAc), 1-N-гидроксибензотриазол (HOBt), жидкостная хроматография высокого давления (HPLC), изопропанол (IPA), гексаметилдисилазан лития (LiHMDS), метанол (MeOH), точка плавления (т.пл.), MeSO2 (мезил или Ms), метил (Me), ацетонитрил (MeCN), м-хлорпероксибензойная кислота (МСРВА), масс-спектр (MS), простой метил-трет-бутиловый эфир (МТВЕ), N-бромсукцинимид (NBS), N-карбоксиангидрид (NCA), N-хлорсукцинимид (NCS), N-метилморфолин (NMM), N-метилпирролидон (NMP), хлорхромат пиридиния (PCC), дихромат пиридиния (PDC), фенил (Ph), пропил (Pr), изопропил (i-Pr), фунты на квадратный дюйм (ф/кв. дюйм), пиридин (pyr), комнатная температура (кг или КТ), трет-бутилдиметилсилил или трет-BuMe2Si (TBDMS), триэтиламин (TEA или Et3N), 2,2,6,6-тетраметилпиперидин-1-оксил (TEMPO), трифлат или CF3SO2 (Tf), трифторуксусная кислота (TFA), O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (TBTU), тонкослойная хроматография (TLC), тетрагидрофуран (THF), триметилсилил или Me3Si (TMS), п-толуолсульфоновой кислоты моногидрат (TsOH или п-TsOH), 4-Me-CeH4SO2 или тозил (Ts), N-уретан-N-карбоксиангидрид (UNCA). Традиционная номенклатура включает префиксы нормальный (н-), изо (i-), вторичный (втор-), третичный (трет-) и нео-, имеющие свое общепринятое значение при использовании вместе с алкильной группировкой. (J. Rigaudy and D.P. Klesney, Nomenclature in Organic Chemistry, IUPAC, 1979, Pergamon Press, Oxford.).
Подготовительные примеры
Пример 1
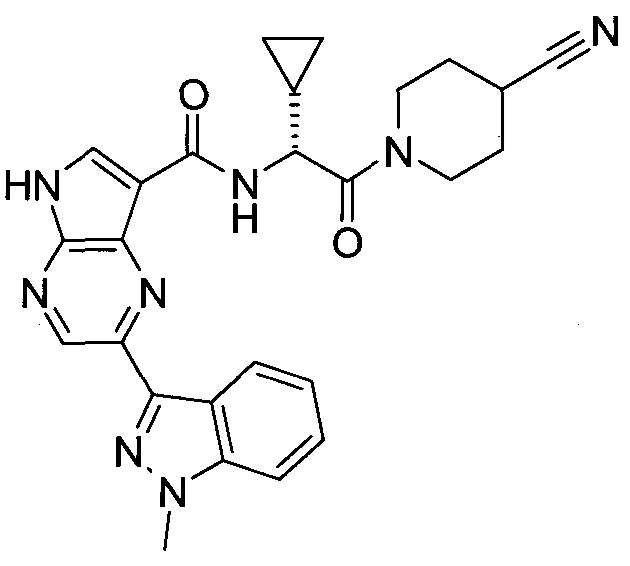
2-(1-Метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
Стадия 1
3-Иод-1H-индазол

В круглодонной колбе емкостью 50 мл растворяли индазол (0,80 г; 6,8 ммоль) в DMF (14 мл). Добавляли йод (3,4 г; 13,5 ммоль), затем гидроксид калия (1,47 г; 26,2 ммоль). Темную реакционную смесь перемешивали при комнатной температуре в течение 1,25 ч, затем гасили 10%-ным водн. NaHSO3 и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 1,65 г (95%) 3-иод-1H-индазола в виде светло-желтого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 10.56 (br. s, 1H), 7.47-7.57 (m, 3H), 7.23-7.30 (m, 1H).
Стадия 2
3-Иод-1-метил-1H-индазол

В круглодонной колбе емкостью 50 мл растворяли 3-иод-1H-индазол (1,0 г; 3,9 ммоль) в THF (12 мл) и раствор охлаждали до 0°C. Добавляли трет-бутилат калия (612 мг; 5,45 ммоль) и реакционную смесь перемешивали при 0°C в течение 1,25 ч. По каплям добавляли метилиодид (0,29 мл; 4,64 ммоль), затем ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле с использованием смеси EtOAc/гексаны
(градиент 0-10% EtOAc), получая 863 мг (86%) 3-иод-1-метил-1H-индазола в виде желтого масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.42-7.53 (m, 2H), 7.33-7.40 (m, 1H), 7.22 (ddd, J=8,0; 6,9; 0,9 Гц, 1H), 4.11 (s, 3H).
Стадия 3
1-Метил-3-трибутилстаннанил-1H-индазол

3-Иод-1-метил-1H-индазол (0,15 г; 0,58 ммоль) растворяли в THF (3 мл) и раствор охлаждали до -16°C, используя баню со смесью NaCl/лед. По каплям добавляли хлорид изопропилмагния (2,0 М в THF; 0,32 мл; 0,64 ммоль) и реакционную смесь перемешивали при -16°C в течение 15 мин. Медленно добавляли трибутилхлорстаннан (0,18 мл; 0,66 ммоль) и реакционную смесь оставляли нагреваться до комнатной температуры в течение 1,5 ч. Реакционную смесь гасили насыщенным раствором NH4Cl и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле с использованием смеси EtOAc/гексаны (0,5% триэтиламина, градиент 0-5% EtOAc), получая 224 мг (92%) 1-метил-3-трибутилстаннанил-1H-индазола в виде бесцветного масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.70 (d, J=8,3 Гц, 1H), 7.32-7.45 (m, 2H), 7.11 (ddd, J=8,0; 6,3; 1,5 Гц, 1H), 1.52-1.69 (m, 6H), 1.19-1.44 (m, 12H), 0.83-0.95 (m, 9H).
Стадия 4
[(R)-2-(4-Цианопиперидин-1-ил)-1-циклопропил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир
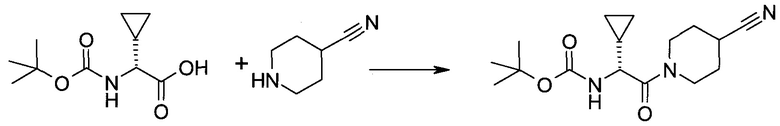
В круглодонной колбе растворяли Boc-D-циклопропилглицин (1,80 г; 8,36 ммоль) и пиперидин-4-карбонитрил (1,2 г; 10,9 ммоль) в DMF (30 мл). Добавляли HATU (3,5 г; 9,2 ммоль) и N,N-диизопропилэтиламин (2,3 мл; 13,2 ммоль) и желтый раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и
концентрировали, получая 2,72 г (95%) [(R)-2-(4-цианопиперидин-1-ил)-1-циклопропил-2-оксо-этил]-карбаминовой кислоты трет-бутилового эфира в виде светло-желтого масла, которое использовали без дополнительной очистки.
Стадия 5
1-((R)-2-Амино-2-циклопропил-ацетил)-пиперидин-4-карбонитрила трифторацетат
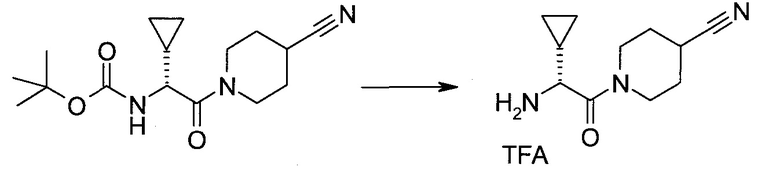
В круглодонной колбе растворяли [(R)-2-(4-цианопиперидин-1-ил)-1-циклопропил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир (2,71 г; 7,93 ммоль) в дихлорметане (50 мл). Раствор охлаждали до 0°C и медленно добавляли трифторуксусную кислоту (18 мл; 234 ммоль). По завершении добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали, получая 1-((R)-2-амино-2-циклопропил-ацетил)-пиперидин-4-карбонитрила трифторацетат в виде желтого масла, которое использовали без дополнительной очистки.
Стадия 6
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
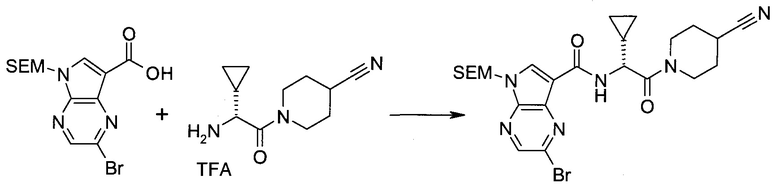
В круглодонной колбе растворяли 1-((R)-2-амино-2-циклопропил-ацетил)-пиперидин-4-карбонитрила трифторацетат (5,19 г; 7,27 ммоль) в DMF (25 мл) и добавляли N,N-диизопропилэтиламин (8,5 мл; 48,7 ммоль). Затем добавляли 2-бром-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (2,20 г; 5,91 ммоль) (приблизит. 2:1 Br:Cl) и HATU (2,47 г; 6,5 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз
рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-80% EtOAc), получая 3,0 г беловатой пены. После хроматографии SFC (supercritical fluid chromatography - сверхкритическая жидкостная хроматография) (колонка Chiralpak IA-H (2×25), 40%-ный MeOH) получали 1,71 г (52%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида в виде белой пены и 779 мг (26%) 2-хлор-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида в виде беловатой пены.
Стадия 7
2-(1-Метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
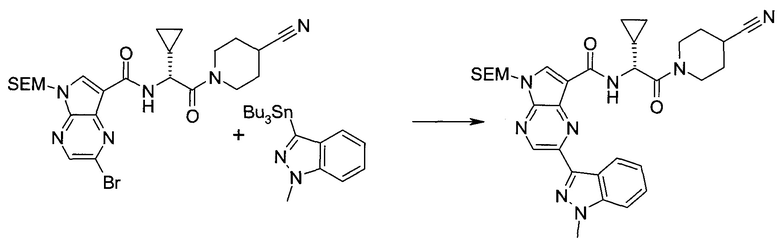
В сухой круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид (0,12 г; 0,21 ммоль) и 1-метил-3-трибутилстаннанил-1H-индазол (117 мг; 0,28 ммоль) в DMF (2 мл). Реакционный сосуд вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенилфосфин)палладий(0) (13 мг; 0,011 ммоль) и иодид меди(1) (9 мг; 0,047 ммоль). Реакционную смесь перемешивали при 80°C в течение 1,5 ч, затем охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле с использованием смеси MeOH/CH2Cl2 (0,5% NH4OH) (градиент 0-3% MeOH), получая 161 мг 2-(1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-
5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида в виде желтого масла.
Стадия 8
2-(1-Метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
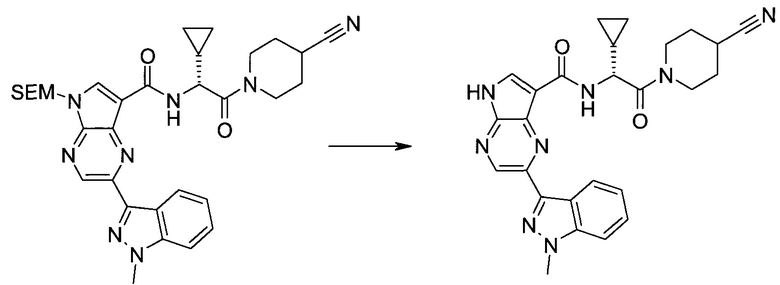
В круглодонной колбе растворяли 2-(1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид (0,158 г; 0,193 ммоль) в дихлорметане (1 мл) и добавляли трифторуксусную кислоту (0,6 мл; 7,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток снова растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,8 мл; 11,7 ммоль). Раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле с использованием смеси MeOH/CH2Cl2 (0,5% NH4OH) (градиент 0-4% MeOH), после чего растирали с этилацетатом, получая 31 мг (32%) 2-(1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида в виде светло-желтого порошка. MS: (M+H)+=483; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.89 (br. s., 1H), 9.17 (s, 1H), 8.79 (d, J=7,9 Гц, 1H), 8.65 (d, J=8,3 Гц, 1H), 8.45 (d, J=9,4 Гц, 1H), 7.75 (d, J=8,3 Гц, 1H), 7.50 (t, J=7,6 Гц, 1H), 7.13-7.33 (m, 1H), 4.88 (t, J=7,9 Гц, 1H), 4.19 (s, 3H), 3.68-4.05 (m,2H), 3.34-3.66 (m,2H), 3.14 (br. s., 1H), 1.47-2.07 (m, 4H), 1.34 (br. s., 1H), 0.37-0.65 (m, 4H).
Пример 2
2-(б-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
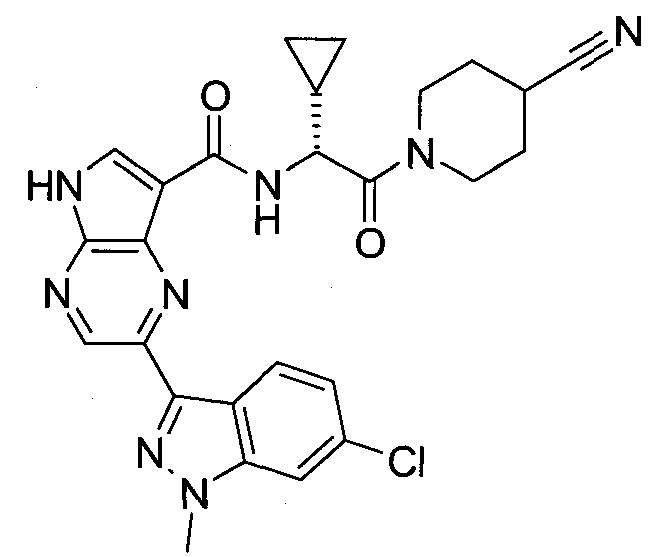
Получали в соответствии с методикой, приведенной в примере 1, заменяя 6-хлор-1H-индазол на индазол на стадии 1. MS: (M+H)+=517; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.93 (s, 1H), 9.15 (s, 1H), 8.83 (dd, J=8,5; 2,8 Гц, 1H), 8.59 (d, J=8,3 Гц, 1H), 8.46 (d, J=7,9 Гц, 1H), 7.97 (d, J=1,5 Гц, 1H), 7.23 (t, J=7,0 Гц, 1H), 4.86-4.99 (m, 1H), 4.17 (s, 3H), 3.67-4.04 (m, 2H), 3.06-3.67 (m, 3H), 1.49-2.08 (m, 4H), 1.31 (br. s., 1H), 0.28-0.61 (m, 4H).
Пример 3
2-(5-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
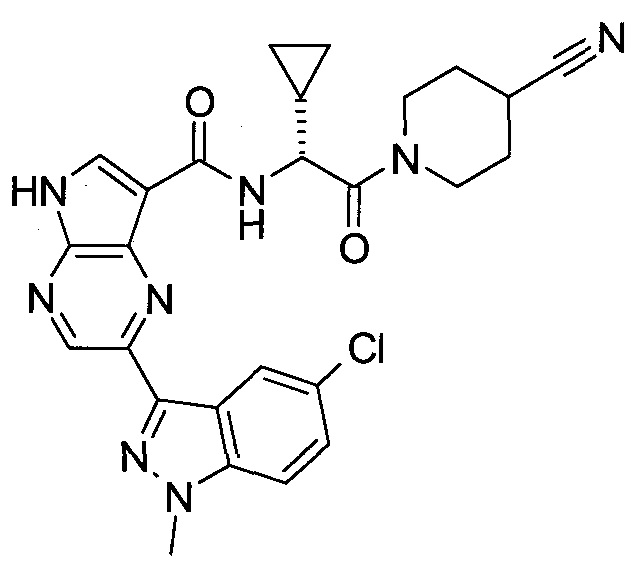
Получали в соответствии с методикой, приведенной в примере 1, заменяя 5-хлор-1H-индазол на индазол на стадии 1. MS: (M+H)+=517; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.91 (s, 1H), 9.16 (s, 1H), 8.70 (br. s., 2H), 8.46 (d, J=9,4 Гц, 1H), 7.83 (d, J=8,9 Гц, 1H), 7.51 (dd, J=8,9; 1,5 Гц, 1H), 4.88 (t, J=7,7 Гц, 1H), 4.20 (s, 3H), 3.07-3.98 (m, 5H), 1.33-2.12 (m, 5H), 0.38-0.65 (m, 4H).
Пример 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
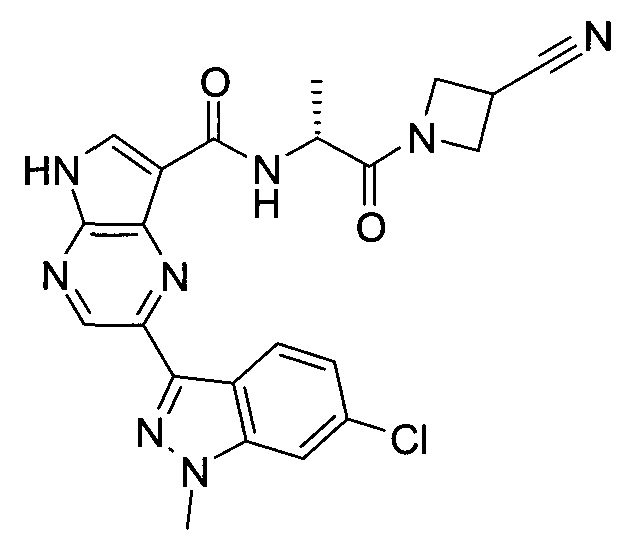
Стадия 1
6-Хлор-3-иод-1H-индазол
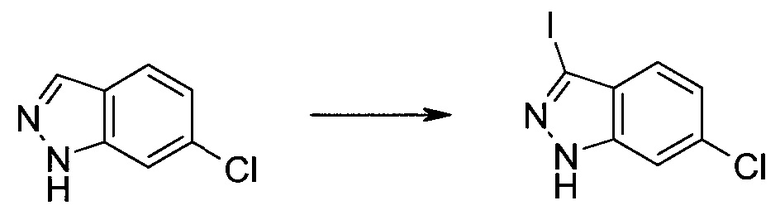
В круглодонной колбе растворяли 6-хлор-1H-индазол (90 мг; 0,59 ммоль) в DMF (1,4 мл). Добавляли йод (300 мг; 1,18 ммоль), затем гидроксид калия (128 мг; 2,28 ммоль). Темную реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем гасили 10%-ным водн. NaHSO3 и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 169 мг (98%) 6-хлор-3-иод-1H-индазола в виде оранжевого твердого вещества.
Стадия 2
6-Хлор-3-иод-1-метил-1H-индазол
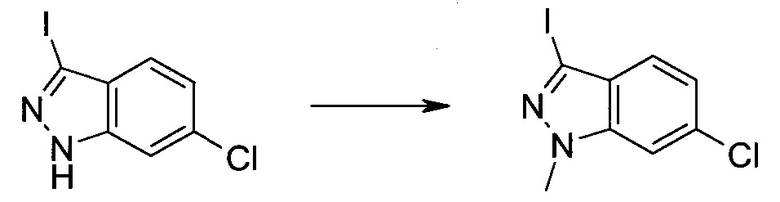
В круглодонной колбе растворяли 6-хлор-3-иод-1H-индазол (167 мг; 0,57 ммоль) в THF (2 мл) и раствор охлаждали до 0°C. Добавляли трет-бутилат калия (90 мг; 0,80 ммоль) и реакционную смесь перемешивали при 0°C в течение 1,25 ч. По каплям добавляли метилиодид (0,045 мл; 0,72 ммоль), затем ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили водой и экстрагировали EtOAc (2x). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле с использованием смеси EtOAc/гексаны (градиент
0-5% EtOAc), получая 110 мг (63%) 6-хлор-3-иод-1-метил-1H-индазола в виде желтого твердого вещества.
Стадия 3
6-Хлор-1-метил-3-трибутилстаннанил-1H-индазол
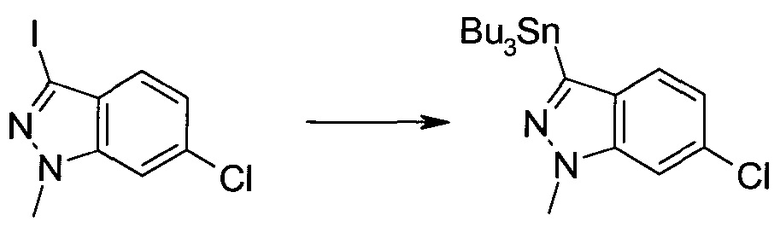
6-Хлор-3-иод-1-метил-1H-индазол (108 мг; 0,35 ммоль) растворяли в THF (2 мл) и раствор охлаждали до -16°C, используя баню со смесью NaCl/лед. По каплям добавляли хлорид изопропилмагния (2,0 М в THF; 0,20 мл; 0,40 ммоль) и реакционную смесь перемешивали при -16°C в течение 15 мин. Медленно добавляли трибутилхлорстаннан (0,11 мл; 0,40 ммоль) и реакционную смесь оставляли нагреваться до комнатной температуры в течение 1,5 ч. Реакционную смесь гасили насыщенным раствором NH4Cl и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 6-хлор-1-метил-3-трибутилстаннанил-1H-индазол в виде коричневого масла, которое использовали без дополнительной очистки.
Стадия 4
[(R)-2-(3-Цианоазетидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир
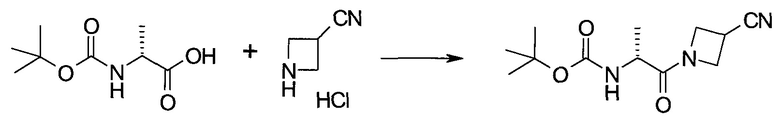
В круглодонной колбе объединяли Boc-D-аланин (500 мг; 2,64 ммоль), азетидин-3-карбонитрила гидрохлорид (376 мг; 3,17 ммоль), НОВТ (445 мг; 2,91 ммоль) и HATU (1,11 г; 2,91 ммоль). Затем добавляли DMF (5 мл), после чего N,N-диизопропилэтиламин (1,38 мл; 7,93 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем гасили водой и экстрагировали EtOAc (3×). Объединенные органические экстракты промывали водой (3×), сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на SiO2 (50%-100% EtOAc/гексаны), получая 493 мг (74%) [(R)-2-(3-цианоазетидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутилового эфира в виде белого твердого вещества.
Стадия 5
1-((R)-2-Амино-пропионил)-азетидин-3-карбонитрила трифторацетат
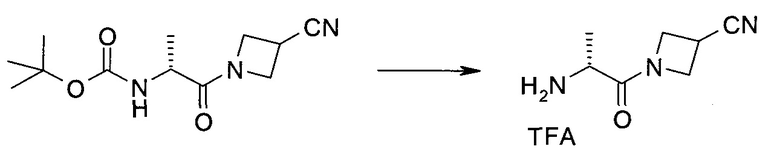
К раствору [(R)-2-(3-цианоазетидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутилового эфира (860 мг; 3,4 ммоль) в CH2Cl2 (20 мл) добавляли трифторуксусную кислоту (4,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали, получая 1-((R)-2-амино-пропионил)-азетидин-3-карбонитрила трифторацетат в виде бледно-желтого масла, которое использовали без дополнительной очистки.
Стадия 6
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
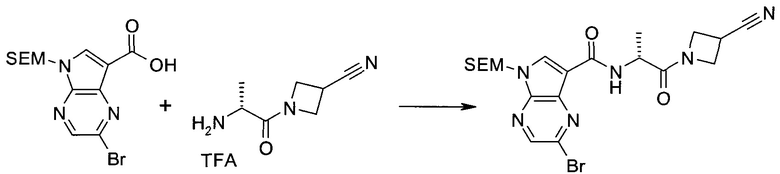
В круглодонной колбе объединяли 2-бром-5-((2-(триметилсилил)этокси)-метил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (1,05 г; 2,82 ммоль) (приблизит. 3:1 Br:Cl), 1-((R)-2-амино-пропионил)-азетидин-3-карбонитрила трифторацетат (900 мг; 3,37 ммоль) и HATU (1,18 г; 3,1 ммоль). Затем добавляли DMF (10 мл), после чего N,N-диизопропилэтиламин (1,48 мл; 8,46 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (3×). Объединенные органические экстракты промывали водой (3×), сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на SiO2 (30%-100% EtOAc/гексаны), получая 1,19 г (83%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде белого пенообразного твердого вещества (приблизит, смесь 3:1 Br- и Cl-содержащих соединений).
Стадия 7
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
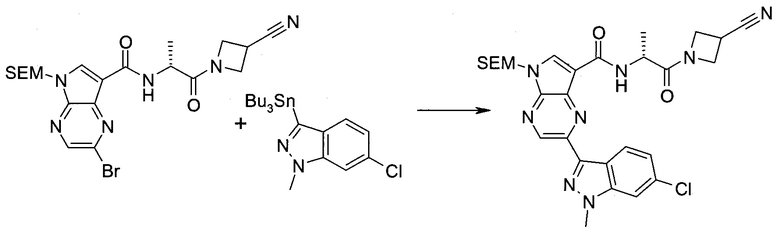
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (0,135 г; 0,27 ммоль) и 6-хлор-1-метил-3-трибутилстаннил-1H-индазол (неочищенный со стадии 3; 342 мг; 0,38 ммоль) в DMF (2,4 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенилфосфин)палладий(0) (16 мг; 0,014 ммоль) и иодид меди(I) (11 мг; 0,058 ммоль). Реакционную смесь перемешивали при 90°C в масляной бане в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на силикагеле и очищали хроматографией с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-2,5% MeOH), получая 157 мг (90%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-желтого твердого вещества.
Стадия 8
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
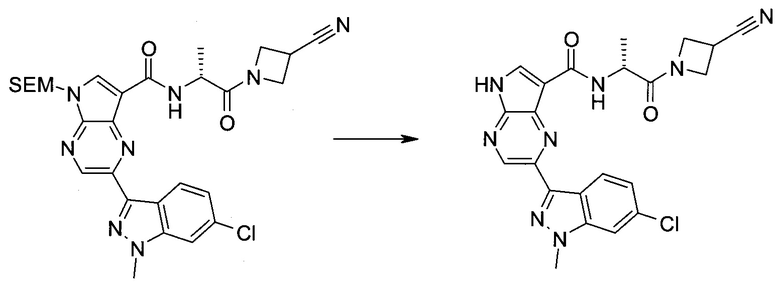
В круглодонной колбе растворяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (154 мг;
0,23 ммоль) в дихлорметане (1,2 мл) и добавляли трифторуксусную кислоту (0,72 мл; 9,35 ммоль). Оранжевую реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток снова растворяли в дихлорметане (1,2 мл) и добавляли этилендиамин (1,0 мл; 14,8 ммоль). Раствор перемешивали при комнатной температуре в течение 1,5 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывая водой (горячей), этилацетатом и дихлорметаном, затем сушили под высоким вакуумом, получая 37 мг (33%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде белого порошка. MS: (M+H)+=463; 1H ЯМР (DMSO-d6 , 300 МГц): δ (млн-1) 12.70 (br. s., 1H), 9.15 (s, 1H), 8.73 (d, J=8,7 Гц, 1H), 8.47 (t, J=7,4 Гц, 2H), 7.98 (s, 1H), 7.27 (d, J=8,7 Гц, 1H), 4.47-4.84 (m, 3H), 4.18 (s, 3H), 4.02-4.32 (m, 2H), 3.86 (br. s., 1H), 1.42 (d, J=4,5 Гц, 3H).
Пример 5
2-(5-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
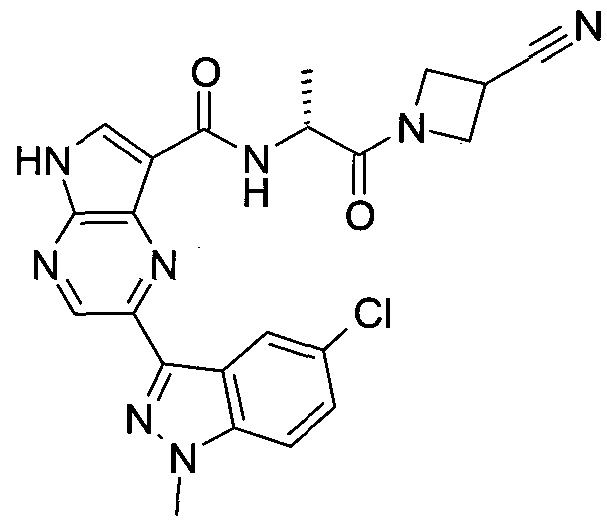
Получали в соответствии с методикой, приведенной в примере 4, заменяя 5-хлор-1H-индазол на 6-хлор-1H-индазол на стадии 1. MS: (M+H)+=463; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 11.73 (br. s., 1H), 9.13 (s, 1H), 8.36-8.59 (m, 3H), 7.83 (d, J=9,1 Гц, 1H), 7.52 (d, J=8,7 Гц, 1H), 4.45-4.77 (m, 3H), 4.20 (s, 3H), 3.95-4.34 (m, 2H), 3.74-3.92 (m, 1H), 1.50 (t, J=6,0 Гц, 3H).
Пример 6
2-(5,6-Дихлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
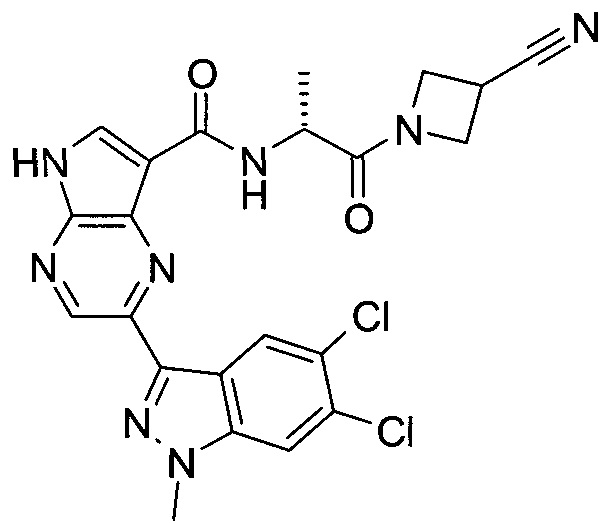
Получали в соответствии с методикой, приведенной в примере 5, заменяя 5,6-дихлор-1H-индазол на 6-хлор-1H-индазол на стадии 1. MS: (M+H)+=497; 1H ЯМР (DMSO-d6 , 300 МГц): δ (млн-1) 12.82 (br. s, 1H), 9.11 (s, 1H), 8.71 (s, 1H), 8.47 (t, J=8,3 Гц, 2H), 8.24 (s, 1H), 4.47-4.79 (m, 3H), 4.18 (s, 3H), 3.97-4.27 (m, 2H), 3.77-3.93 (m, 1H), 1.48 (t, J=6,4 Гц, 3H).
Пример 7
2-(1-Метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
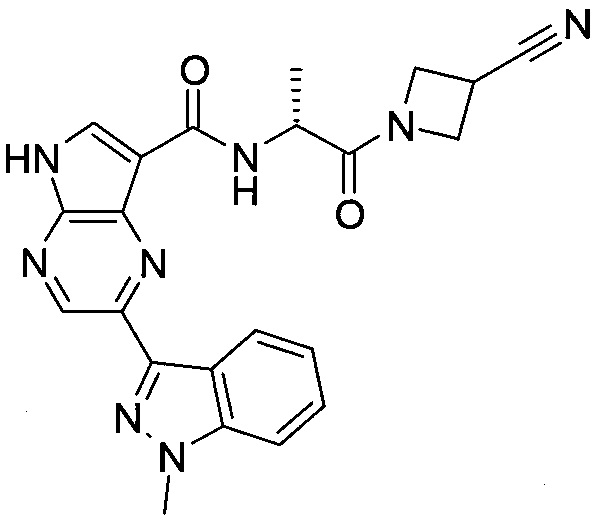
Получали в соответствии с методикой, приведенной в примере 5, заменяя индазол на 6-хлор-1H-индазол на стадии 1. MS: (M+H)+=429; 1H ЯМР (DMSO-d6 , 300 МГц): δ (млн-1) 12.80 (br. s., 1H), 9.16 (s, 1H), 8.69 (d, J=7,9 Гц, 1H),8.51 (d,J=7,9 Гц, 1H), 8.47 (d, J=8,7 Гц, 1H), 7.76 (d, J=8,7 Гц, 1H), 7.52 (t, J=7,6 Гц, 1H), 7.23-7.38 (m, 1H), 4.49-4.80 (m, 3H), 4.14-4.28 (m, 1H), 4.14-4.28 (m, 1H), 4.21 (s, 3H), 4.03-4.13 (m, 1H), 3.75-3.95 (m, 1H), 1.43 (dd, J=6,6; 4,3 Гц, 3H).
Пример 8
2-(5-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-амид
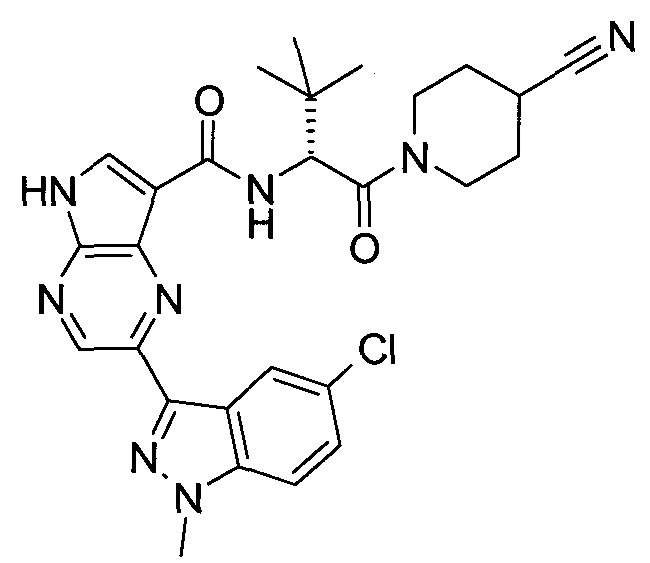
Стадия 1
[(R)-1-(4-Циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-карбаминовой кислоты трет-бутиловый эфир
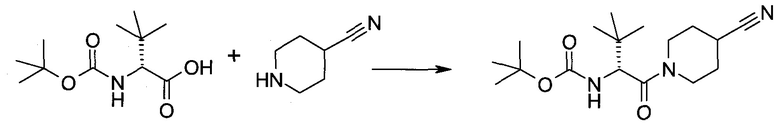
В круглодонную колбу загружали Boc-D-трет-лейцин (2,5 г; 10,8 ммоль), НОВТ (4,2 г; 24,9 ммоль), EDC (4,77 г; 24,9 ммоль) и пиперидин-4-карбонитрил (2,98 г; 27,0 ммоль). Затем добавляли DMF (50 мл), после чего N,N-диизопропилэтиламин (10,7 мл; 61,6 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили 10%-ной лимонной кислотой и экстрагировали EtOAc (2×). Объединенные органические слои дважды промывали 10%-ной лимонной кислотой, дважды насыщ. LiCl и один раз рассолом, затем сушили над MgSO4, фильтровали и концентрировали, получая 3,4 г (97%) [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-карбаминовой кислоты трет-бутилового эфира в виде бежевого пенообразного твердого вещества.
Стадия 2
1-((R)-2-Амино-3,3-диметил-бутирил)-пиперидин-4-карбонитрила трифторацетат
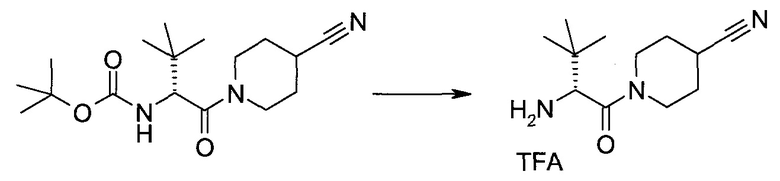
К раствору [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-карбаминовой кислоты трет-бутилового эфира (3,4 г; 10,5 ммоль) в CH2Cl2 (60 мл) добавляли трифторуксусную кислоту (20 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем
концентрировали, получая 1-((R)-2-амино-3,3-диметил-бутирил)-пиперидин-4-карбонитрила трифторацетат в виде светло-коричневого масла, которое использовали без дополнительной очистки.
Стадия 3
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-амид
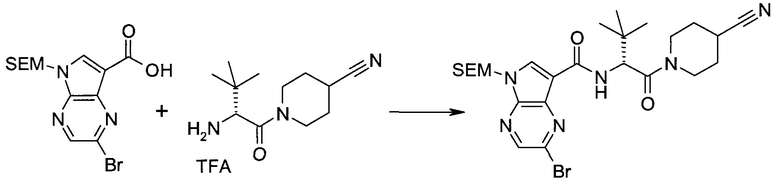
В колбе объединяли 2-бром-5-(2-триметилсиланилэтоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (1,6 г; 4,3 ммоль), 1-((R)-2-амино-3,3-диметил-бутирил)-пиперидин-4-карбонитрила трифторацетат (неочищенный со стадии 2), EDC (1,89 г; 9,9 ммоль) и HOBt (1,67 г; 9,9 ммоль). Добавляли DMF (40 мл), затем i-Pr2NEt (5,2 мл; 30,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение в течение ночи и затем концентрировали. Остаток переносили в EtOAc и 10%-ую лимонную кислоту и органический слой промывали 10%-ной лимонной кислотой, насыщ. NaHCO3, насыщ. LiCl и рассолом, сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле (40%-100% EtOAc/гексаны), получая 1,46 г (59%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-амида в виде бежевого пенообразного твердого вещества.
Стадия 4
2-(5-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-амид
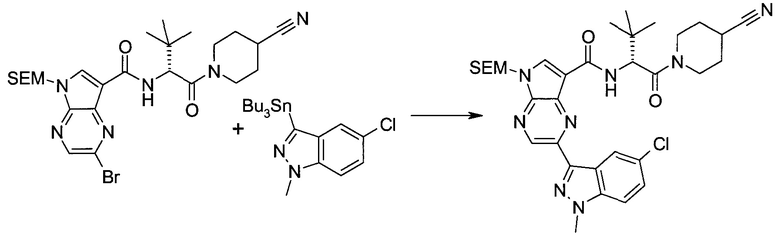
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-амид (150 мг; 0,26 ммоль) и 5-хлор-1-метил-3-трибутилстаннанил-1H-индазол (372 мг; 0,45 ммоль) в DMF (2,4 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенил-фосфин)палладий(0) (15 мг; 0,013 ммоль) и иодид меди(I) (10 мг; 0,053 ммоль). Реакционную смесь перемешивали при 90°C в масляной бане в течение 3,5 ч, затем охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-2% MeOH), получая 137 мг (80%) 2-(5-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-амида в виде желтого масла.
Стадия 5
2-(5-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-амид
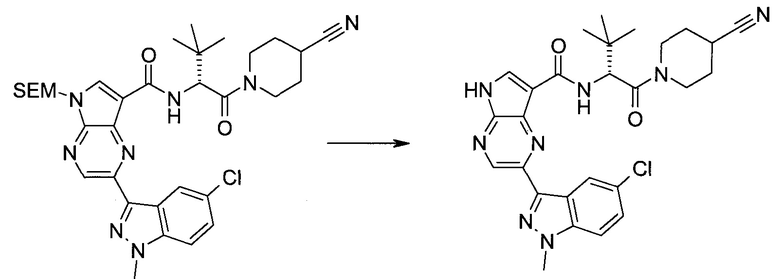
В круглодонной колбе растворяли 2-(5-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-амид (0,158 г; 0,193 ммоль) в дихлорметане (1 мл) и добавляли трифторуксусную кислоту (0,6 мл; 7,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток снова растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,8 мл; 11,7 ммоль). Раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и
концентрировали. Остаток очищали хроматографией на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-100% EtOAc), получая 26 мг (24%) 2-(5-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-амида в виде беловатого твердого вещества. MS: (M+H)+=533; 1H ЯМР (DMSO-d6 , 300 МГц): δ (млн-1) 12.92 (br. s., 1H), 9.09 (s, 1H), 8.73 (d, J=6,8 Гц, 1H), 8.61 (t, J=8,1 Гц, 1H), 8.46 (d, J=9,1 Гц, 1H), 7.80 (d, J=9,1 Гц, 1H), 7.50 (d, J=9,1 Гц, 1H), 5.20 (d, J=9,4 Гц, 1H), 4.19 (s, 3H), 3.97-4.12 (m, 1H), 3.35-3.91 (m, 2H), 3.01-3.23 (m, 2H), 1.39-2.07 (m, 4H), 1.04 (d, J=6,4 Гц, 9H).
Пример 9
2-(6-Циклопропил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
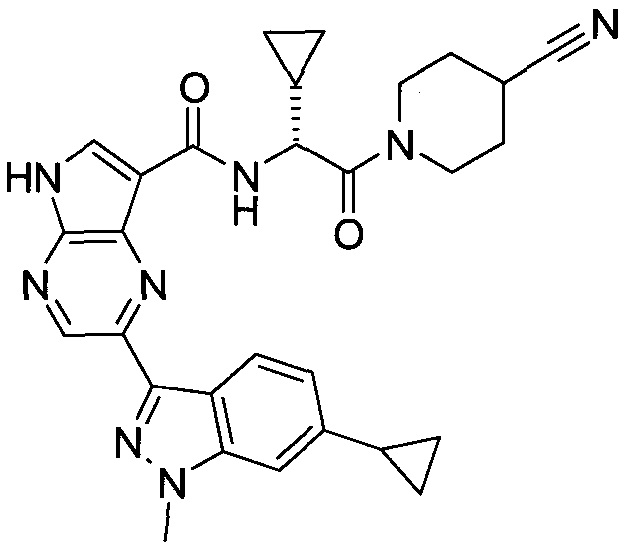
Стадия 1 6-Бром-1-(2-триметилсиланил-этоксиметил)-1H-индазол

В круглодонной колбе растворяли 6-бром-1H-индазол (0,70 г; 3,55 ммоль) в DMF (7,5 мл). Реакционную смесь охлаждали до 0°C и добавляли гидрид натрия (60%-ную дисперсию в минеральном масле; 172 мг; 4,3 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 30 мин, затем снова охлаждали до 0°C и медленно добавляли SEM-Cl (0,76 мл; 4,28 ммоль). По завершении добавления ледяную баню удаляли и реакционную смесь нагревали до комнатной температуры. Через 1,5 ч реакцию гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны
(градиент 0-10% EtOAc), получая 802 мг (69%) 6-бром-1-(2-триметилсиланил-этоксиметил)-1H-индазола в виде светло-желтого масла.
Стадия 2
6-Циклопропил-1-(2-триметилсиланил-этоксиметил)-1H-индазол
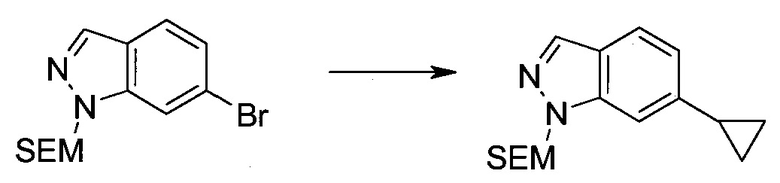
В круглодонную колбу загружали 6-бром-1-(2-триметилсиланил-этоксиметил)-1H-индазол (0,80 г; 2,44 ммоль), циклопропилбороновую кислоту (377 мг; 4,39 ммоль), ацетат палладия(II) (28 мг; 0,125 ммоль), фосфат калия трехосновный (1,04 г; 4,88 ммоль), толуол (9 мл) и воду (0,9 мл). Реакционную смесь перемешивали при 100°C в масляной бане в течение ночи, затем охлаждали до комнатной температуры, гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-5% EtOAc), получая 670 мг (90%) 6-циклопропил-1-(2-триметилсиланил-этоксиметил)-1H-индазола в виде светло-желтого масла.
Стадия 3
6-Циклопропил-1H-индазол
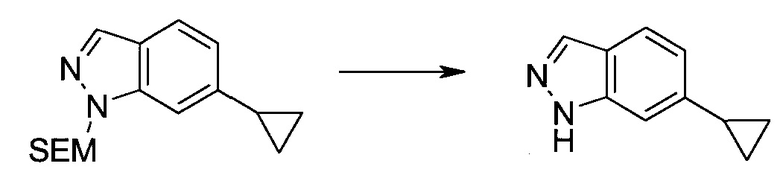
В круглодонной колбе растворяли 6-циклопропил-1-(2-триметилсиланил-этокси метил)-1H-индазол (668 мг; 2,2 ммоль) в дихлорметане (12 мл) и добавляли трифторуксусную кислоту (6,5 мл; 84,4 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение 2,25 ч, затем концентрировали. Остаток снова растворяли в дихлорметане (12 мл) и добавляли этилендиамин (9,0 мл; 133 ммоль). Раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-25% EtOAc), получая 317 мг (91%) 6-циклопропил-1H-индазола в виде светло-желтого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.99-8.08
(m, 1H), 7.59-7.70 (m, 1H), 7.16-7.25 (m, 1H), 6.88-7.01 (m, 1H), 1.94-2.14 (m, 1H), 0.96-1.11 (m, 2H), 0.71-0.84 (m, 2H).
Стадия 4
2-(6-Циклопропил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
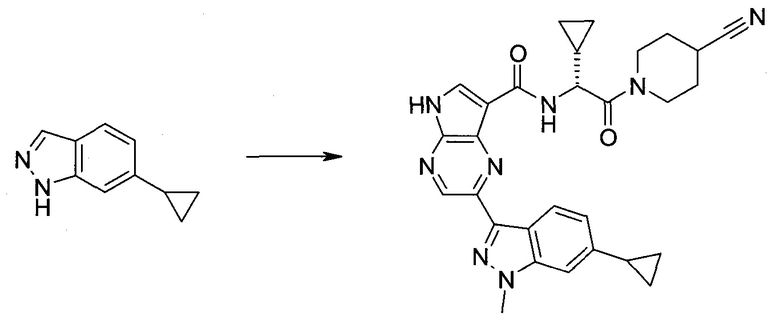
Получали в соответствии с методикой, приведенной в примере 1, заменяя 6-циклопропил-1H-индазол на индазол на стадии 1. MS: (M+H)+=523; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.88 (br. s, 1H), 9.15 (s, 1H), 8.63 (t, J=8,7 Гц, 2H), 8.44 (d, J=9,4 Гц, 1H), 7.37 (s, 1H), 7.04 (br. s., 1H), 4.74-4.95 (m, 1H), 4.14 (s, 3H), 3.35-4.06 (m, 4H), 3.17 (br. s., 1H), 2.13 (br. s., 1H), 1.51-2.05 (m, 4H), 1.35 (br. s., 1H), 1.04 (d, J=6,8 Гц, 2H), 0.83 (d, J=3,4 Гц, 2H), 0.34-0.65 (m, 4H).
Пример 10
2-(1-Метил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
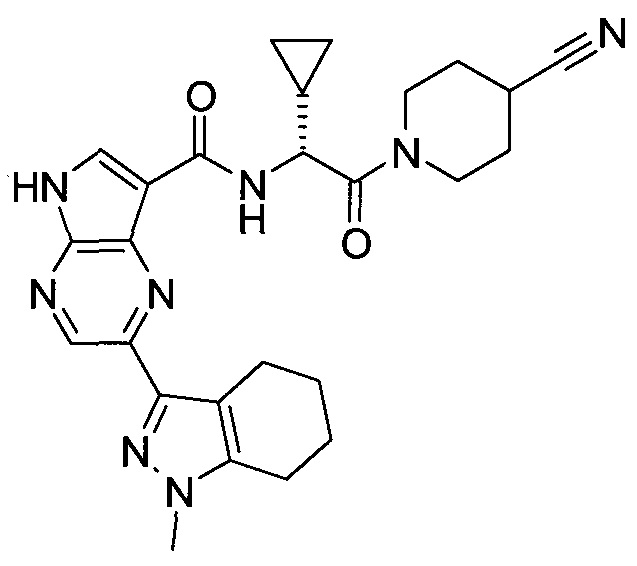
Получали в соответствии с методикой, приведенной в примере 1, заменяя 4,5,6,7-тетрагидро-1H-индазол на индазол на стадии 1. MS: (M+H)+=487; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 12.76 (s, 1H), 8.93 (s, 1H), 8.58 (d, J=8,1 Гц, 1H), 8.36 (d, J=15,2 Гц, 1H), 4.66 (t, J=8,1 Гц, 1H), 3.78 (s, 3H), 3.34-4.04 (m, 4H), 2.84-3.18 (m, 3H), 2.60-2.70 (m, 2H), 1.44-1.97 (m, 8H), 1.17-1.31 (m, 1H), 0.29-0.66 (m, 4H).
Пример 11
2-(5-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амид
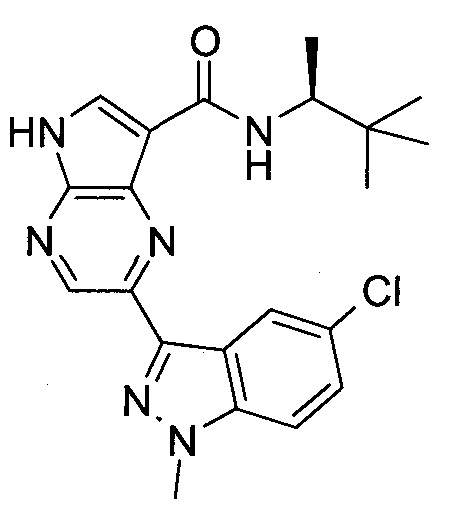
Стадия 1
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амид
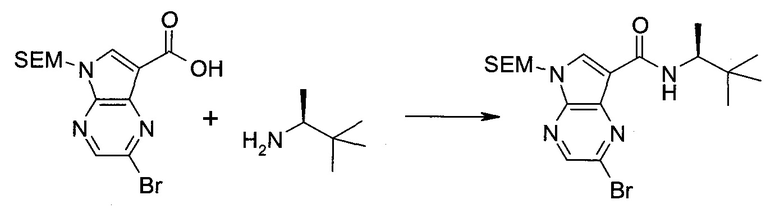
В круглодонную колбу загружали 2-бром-5-(2-триметилсиланилэтокси-метил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (150 мг; 0,40 ммоль), HOBT (68 мг; 0,44 ммоль) и EDC (85 мг; 0,44 ммоль). Добавляли DMF (1,8 мл), затем (S)-3,3-диметилбутан-2-амин (0,10 мл; 0,73 ммоль) и N,N-диизопропилэтиламин (0,11 мл; 0,63 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-20% EtOAc), получая 97 мг (50%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амида в виде светло-коричневого масла.
Стадия 2
2-(5-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амид
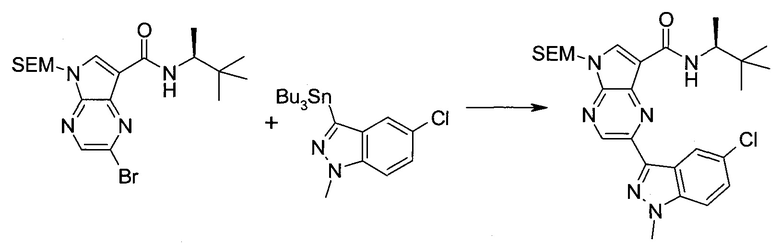
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амид (94 мг; 0,21 ммоль) и 6-хлор-1-метил-3-трибутилстаннил-1H-индазол (367 мг; 0,40 ммоль) в DMF (1,9 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенилфосфин)палладий(0) (12 мг; 0,010 ммоль) и иодид меди(I) (8 мг; 0,042 ммоль). Реакционную смесь перемешивали при 90°C в масляной бане в течение 3,5 ч, затем охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-40% EtOAc), получая 92 мг (82%) 2-(5-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амида в виде беловатого твердого вещества.
Стадия 3
2-(5-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амид
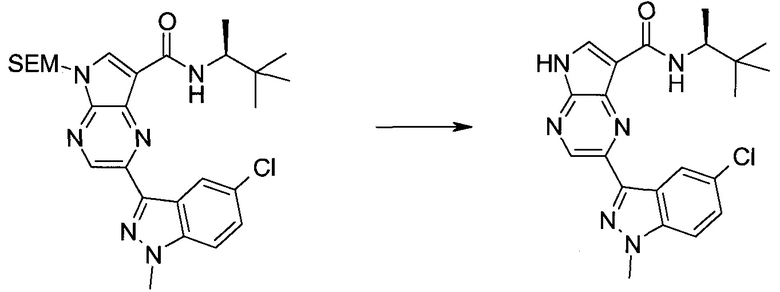
В круглодонной колбе растворяли 2-(5-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((3)-1,2,2-триметил-пропил)-амид (90 мг; 0,17 ммоль) в дихлорметане (0,8 мл) и добавляли трифторуксусную кислоту (0,5 мл; 6,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем
концентрировали. Остаток снова растворяли в дихлорметане (0,8 мл) и добавляли этилендиамин (0,7 мл; 9,9 ммоль). Раствор перемешивали при комнатной температуре в течение 1,5 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом, затем сушили под высоким вакуумом, получая 60 мг (83%) 2-(5-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амида в виде светло-желтого порошка. MS: (M+H)+=411; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.43 (br. s., 1H), 9.08 (s, 1H), 8.45 (s, 1H), 8.33 (s, 1H), 8.00 (d, J=10,2 Гц, 1H), 7.85 (d, J=8,9 Гц, 1H), 7.55 (dd, J=8,9; 1,5 Гц, 1H), 4.20 (s, 3H), 4.06-4.28 (m, 1H), 1.33 (d, J=6,8 Гц, 3H), 0.92 (s, 9H).
Пример 12
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1,2-диметил-пропил)-амид
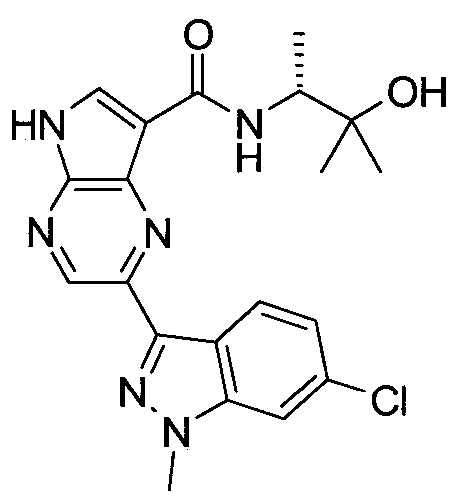
Стадия 1
((R)-2-Гидрокси-1,2-диметил-пропил)-карбаминовой кислоты трет-бутиловый эфир
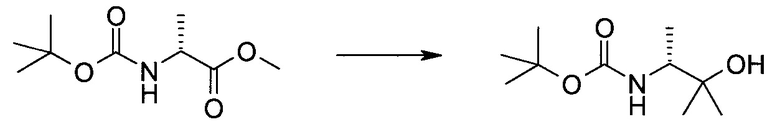
К раствору метилового эфира Boc-D-аланина (5,00 г; 24,6 ммоль) в THF (100 мл) при 0°C медленно добавляли бромид метилмагния (3,0 М в Et2O; 28,7 мл; 86,1 ммоль). Полученную белую суспензию перемешивали при 0°C в течение 1 ч, затем при комнатной температуре в течение 2 ч. Реакционную смесь гасили насыщенным водным NH4Cl, разбавляли H2O и экстрагировали EtOAc. Объединенные органические экстракты промывали рассолом, сушили над MgSO4 и концентрировали, получая 4,93 г (99%) ((R)-2-гидрокси-1,2-диметил-пропил)-карбаминовой кислоты трет-бутилового эфира в виде бесцветного вязкого масла.
Стадия 2
(R)-3-Амино-2-метил-бутан-2-ола гидрохлорид
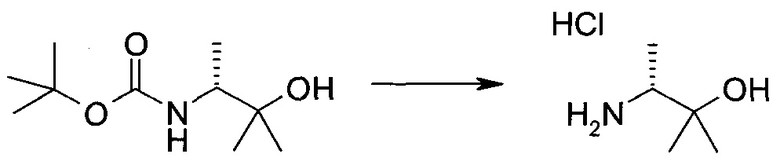
((R)-2-Гидрокси-1,2-диметил-пропил)-карбаминовой кислоты трет-бутиловый эфир (4,93 г; 24,2 ммоль) растворяли в 1,0 М HCl (150 мл) и перемешивали при 50°C в течение 4 ч. После концентрирования получали 4,01 г (R)-3-амино-2-метил-бутан-2-ола гидрохлорида в виде бледно-коричневого твердого вещества, которое использовали без дополнительной очистки.
Стадия 3
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1,2-диметил-пропил)-амид
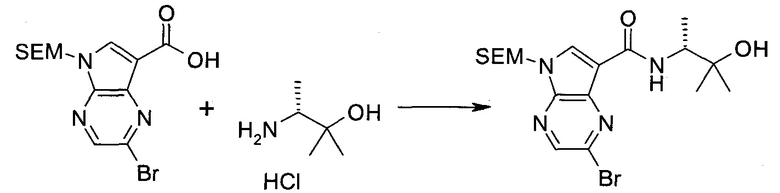
В колбе объединяли 2-бром-5-(2-триметилсиланилэтоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (3,25 г; 8,74 ммоль), (R)-3-амино-2-метил-бутан-2-ола гидрохлорид (3,05 г; 21,9 ммоль), EDC (3,85 г; 20,1 ммоль) и HOBt (2,72 г; 20,1 ммоль). Затем добавляли DMF (50 мл), после чего i-Pr2NEt (4,87 мл; 28,0 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали при пониженном давлении. Остаток очищали хроматографией на SiO2 (20-100% EtOAc/гексан), получая 2,40 г (60%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1,2-диметил-пропил)-амида в виде желтого твердого вещества.
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1,2-диметил-пропил)-амид
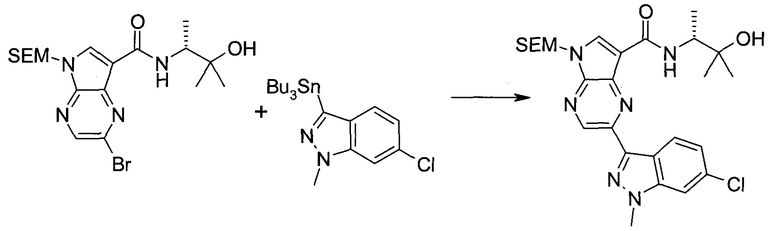
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1,2-диметил-пропил)-амид (120 мг; 0,26 ммоль) и 6-хлор-1-метил-3-трибутилстаннил-1H-индазол (319 мг; 0,42 ммоль) в DMF (2,5 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенилфосфин)палладий(0) (16 мг; 0,014 ммоль) и иодид меди(1) (10 мг; 0,053 ммоль). Реакционную смесь перемешивали при 90°C в масляной бане в течение ночи, затем охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-2% MeOH), получая 122 мг (86%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1,2-диметил-пропил)-амида в виде беловатого твердого вещества.
Стадия 5
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1,2-диметил-пропил)-амид
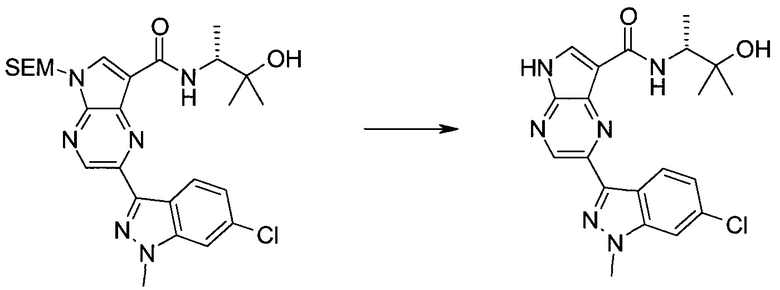
В круглодонной колбе растворяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1,2-диметил-пропил)-амид (121 мг; 0,22 ммоль) в дихлорметане (1 мл) и добавляли трифторуксусную кислоту (0,7 мл; 9,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали. Остаток снова растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,9 мл; 13,3 ммоль). Раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом, затем сушили под высоким вакуумом, получая 53 мг (58%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты
((R)-2-гидрокси-1,2-диметил-пропил)-амида в виде беловатого порошка. MS: (M+H)+=413; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.83 (br. s., 1H), 9.14 (s, 1H), 8.75 (d, J=8,7 Гц, 1H), 8.42 (s, 1H), 8.16 (d, J=9,4 Гц, 1H), 7.95 (d, J=1,1 Гц, 1H), 7.36 (dd, J=8,7; 1,1 Гц, 1H), 4.78 (s, 1H), 4.17 (s, 3H), 4.03-4.16 (m, 1H), 1.22-1.28 (m, 6H), 1.16 (s, 3H).
Пример 13
2-(1,5,5-Триметил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
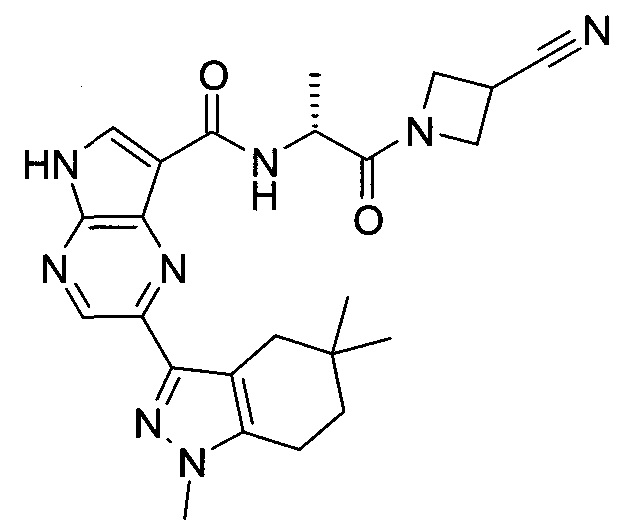
Стадия 1
2-[1-Гидрокси-мет-(Z)-илиден]-4,4-диметил-циклогексанон
В сухую круглодонную колбу загружали гидрид натрия (60%-ную дисперсию в минеральном масле; 475 мг; 11,9 ммоль) и диэтиловый эфир (24 мл). Реакционную смесь охлаждали до 0°C и по каплям добавляли этанол (0,06 мл; 1,03 ммоль). Суспензию перемешивали при 0°C в течение 20 мин, затем по каплям в течение 15 мин добавляли раствор 4,4-диметилцикло-гексанона (1,50 г; 11,9 ммоль) и этилформиата (1,45 мл; 17,8 ммоль) в диэтиловом эфире (3 мл). Желтый раствор перемешивали при 0°C в течение 3 ч, затем оставляли медленно нагреваться до комнатной температуры в течение ночи. Добавляли этанол (0,24 мл) и смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и экстрагировали диэтиловым эфиром. Водный слой подкисляли 6 M HCl до pH 2, затем экстрагировали диэтиловым эфиром (2×). Объединенные органические слои промывали рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 1,30 г (71%) 2-[1-гидрокси-мет-(2)-илиден]-4,4-диметил-циклогексанона в виде бледно-коричневого масла, которое использовали без дополнительной очистки. 1H ЯМР (CDCl3,
300 МГц): δ (млн-1) 14.40 (br. s., 1H), 8.58 (s, 1H), 2.39 (t, J=6,8 Гц, 2H), 2.13 (s, 2H), 1.48 (t, J=6,8 Гц, 2H), 1.00 (s, 6H).
Стадия 2
5,5-Диметил-4,5,6,7-тетрагидро-1H-индазол

В круглодонной колбе емкостью 100 мл растворяли 2-[1-гидрокси-мет-(Z)-илиден]-4,4-диметил-циклогексанон (1,30 г; 8,43 ммоль) в метаноле (8,5 мл). Очень медленно добавляли гидразин (0,27 мл; 8,43 ммоль), что приводило к экзотермической реакции. Реакционную смесь перемешивали при комнатной температуре в течение 50 мин, затем концентрировали. Остаток растирали с петролейным эфиром, получая 1,05 г (83%) 5,5-диметил-4,5,6,7-тетрагидро-1H-индазола в виде светло-коричневого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.28 (s, 1H), 2.67 (t, J=6,6 Гц, 2H), 2.32 (s, 2H), 1.60 (t, J=6,6 Гц, 2H), 0.99 (s, 6H).
Стадия 3
3-Иод-5,5-диметил-4,5,6,7-тетрагидро-1H-индазол

В круглодонной колбе растворяли 5,5-диметил-4,5,6,7-тетрагидро-1H-индазол (0,50 г; 3,33 ммоль) в DMF (7 мл). Добавляли йод (1,69 г; 6,66 ммоль), затем гидроксид калия (723 мг; 12,9 ммоль). Темную реакционную смесь перемешивали при комнатной температуре в течение 1,25 ч. Добавляли дополнительное количество йода (1,69 г; 6,66 ммоль) и гидроксида калия (723 мг; 12,9 ммоль) и темно-коричневую реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч. Реакцию гасили 10%-ным водным раствором NaHSO3 и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси EtOAc/гексаны (градиент 0-20% EtOAc), получая 645 мг (70%) 3-иод-5,5-диметил-4,5,6,7-тетрагидро-1H-индазола в виде белого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 2.66 (t, J=6,6 Гц, 2H), 2.14 (s, 2H), 1.59 (t, J=6,4 Гц, 2H), 1.01 (s, 6H).
Стадия 4
3-Иод-1,5,5-триметил-4,5,6,7-тетрагидро-1H-индазол
В круглодонной колбе растворяли 3-иод-5,5-диметил-4,5,6,7-тетрагидро-1H-индазол (642 мг; 2,33 ммоль) в THF (8,5 мл). Раствор охлаждали до 0°C и добавляли трет-бутилат калия (365 мг; 3,26 ммоль). Реакционную смесь перемешивали при 0°C в течение 40 мин, затем по каплям добавляли метилиодид (0,18 мл; 2,88 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1,5 ч, затем гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-15% EtOAc), получая 497 мг (74%) 3-иод-1,5,5-триметил-4,5,6,7-тетрагидро-1H-индазола в виде белого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 3.76 (s, 3H), 2.53 (t, J=6,4 Гц, 2H), 2.11 (s, 2H), 1.58 (t, J=6,6 Гц, 2H), 0.99 (s, 6H).
Стадия 5
1,5,5-Триметил-3-трибутилстаннанил-4,5,6,7-тетрагидро-1H-индазол
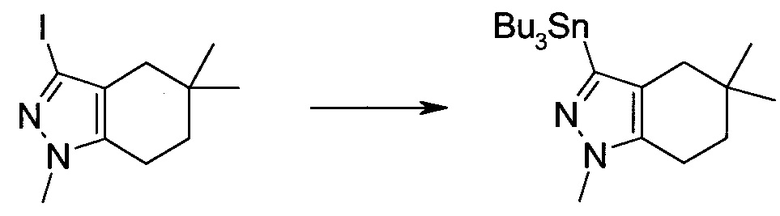
В круглодонной колбе растворяли 3-иод-1,5,5-триметил-4,5,6,7-тетрагидро-1H-индазол (140 мг; 0,48 ммоль) в THF (3 мл). Бесцветный раствор охлаждали до -16°C (баня со смесью NaCl/лед) и по каплям добавляли хлорид изопропилмагния (2,0 М в THF; 0,27 мл; 0,54 ммоль). Реакционную смесь перемешивали при -16°C в течение 20 мин, затем медленно добавляли трибутилхлорстаннан (0,15 мл; 0,55 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры в течение 1,5 ч, затем гасили насыщенным NH4Cl, разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 1,5,5-триметил-3-трибутил-станнанил-4,5,6,7-тетрагидро-1H-индазол в виде бесцветного масла, которое использовали без дополнительной очистки.
Стадия 6
5-(2-Триметилсиланил-этоксиметил)-2-(1,5,5-триметил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
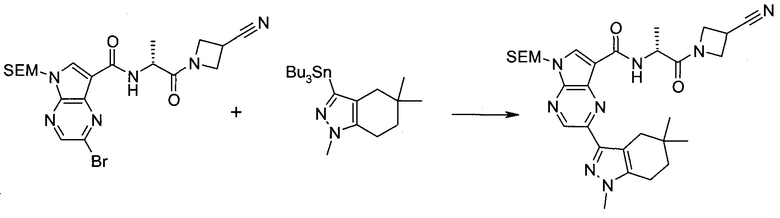
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (130 мг; 0,26 ммоль) и 1,5,5-триметил-3-(трибутилстаннил)-4,5,6,7-тетрагидро-1H-индазол (375 мг; 0,41 ммоль) в DMF (2,4 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенилфосфин)палладий(0) (15 мг; 0,013 ммоль) и иодид меди(I) (10 мг; 0,053 ммоль). Реакционную смесь перемешивали при 90°C в масляной бане в течение 2,5 ч, затем охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-5% MeOH), получая 113 мг (75%) 5-(2-триметилсиланил-этоксиметил)-2-(1,5,5-триметил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-желтой пены.
Стадия 7
2-(1,5,5-Триметил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
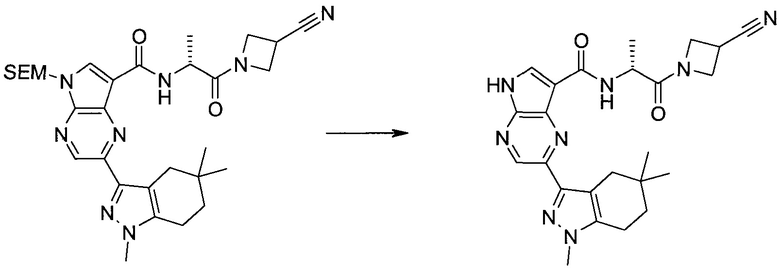
В круглодонной колбе растворяли 5-(2-триметилсиланил-этоксиметил)-2-(1,5,5-триметил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (112 мг; 0,19 ммоль) в дихлорметане (0,9 мл) и добавляли трифторуксусную кислоту (0,6 мл; 7,5 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали. Остаток снова растворяли в дихлорметане (0,9 мл) и добавляли этилендиамин (0,8 мл; 11,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 47 мг (51%) 2-(1,5,5-триметил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде белого порошка. MS: (M+H)+=461; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.61 (br. s., 1H),8.94(s, 1H), 8.27-8.41 (m, 2H), 4.43-4.80 (m, 3H), 3.94-4.24 (m, 2H), 3.80 (s, 3H), 3.72-3.91 (m, 1H), 2.89 (d, J=15,9 Гц, 1H), 2.59-2.71 (m, 3H), 1.59 (t, J=6,2 Гц, 2H), 1.40 (dd, J=6,8; 3,0 Гц, 3H), 1.00 (s, 6H).
Пример 14
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3,3-дифтор-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
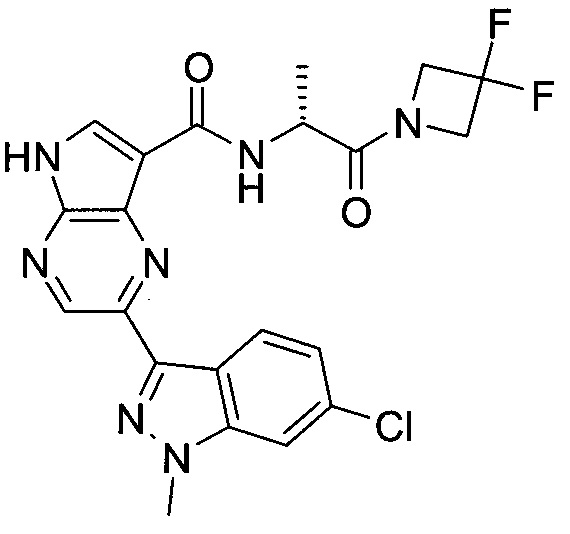
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
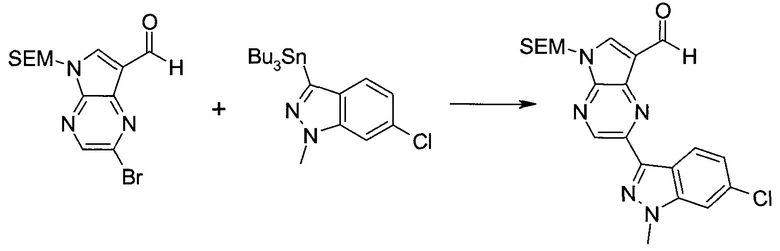
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (400 мг; 1,12 ммоль) и 6-хлор-1-метил-3-трибутилстаннил-1H-индазол (1,11 г; 1,7 ммоль) в DMF (10 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трисренил-фосфин)палладий(0) (65 мг; 0,056 ммоль) и иодид меди(I) (43 мг; 0,23 ммоль). Реакционную смесь перемешивали при 80°C в масляной бане в течение ночи, затем охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси EtOAc/гексаны (градиент 0-30% EtOAc), получая 416 мг (84%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида в виде желтого твердого вещества.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
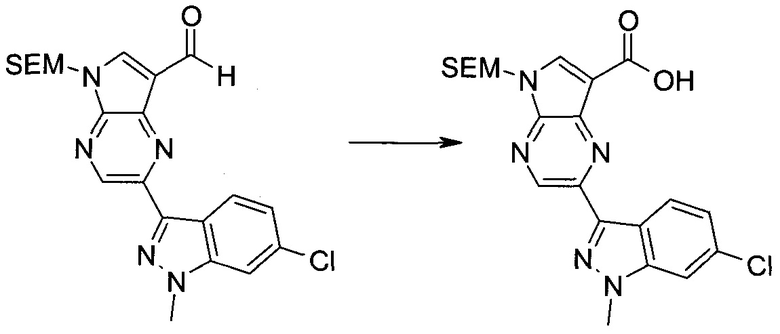
В круглодонной колбе суспендировали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (412 мг; 0,93 ммоль) в 1,4-диоксане (15 мл) и воде (Змл). Суспензию охлаждали до 0°C и добавляли сульфаминовую кислоту (543 мг; 5,59 ммоль). Затем через капельную воронку в течение примерно 20 мин
добавляли раствор хлорита натрия (80%-ного; 137 мг; 1,21 ммоль) и дигидрофосфата калия (1,52 г; 11,2 ммоль) в воде (9 мл). По завершении добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Добавляли THF (15 мл) и реакционную 5 смесь перемешивали при комнатной температуре в течение еще 3 ч. Реакционную смесь разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток растирали со смесью этилацетат/гексаны, получая 358 мг (84%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты в виде светло-желтого порошка.
Стадия 3
[(R)-2-(3,3-Дифтор-азетидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир
В круглодонную колбу загружали Boc-D-аланин (400 мг; 2,11 ммоль), 3,3-дифторазетидина гидрохлорид (383 мг; 2,96 ммоль), HOBT (356 мг; 2,33 ммоль) и EDC (446 мг; 2,33 ммоль). Добавляли DMF (9 мл), затем N,N-диизопропилэтиламин (1,0 мл; 5,73 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 48 ч, затем гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 509 мг (91%) [(R)-2-(3,3-дифтор-азетидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутилового эфира в виде светло-желтого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 5.14 (d, J=7,2 Гц, 1H), 4.59-4.80 (m, 1H), 4.17-4.55 (m, 4H), 1.45 (s, 9H), 1.32 (d, J=7,2 Гц, 3H).
Стадия 4
(R)-2-Амино-1-(3,3-дифтор-азетидин-1-ил)-пропан-1-он
Во флакон для микроволнового реактора емкостью 5 мл загружали [(R)-2-(3,3-дифтор-азетидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир (170 мг; 0,64 ммоль) и 2,2,2-трифторэтанол (2,4 мл; 32,9 ммоль).
Содержимое флакона промывали сильной струей аргона, флакон герметично закрывали и нагревали при 150°C в условиях облучения микроволнами в течение 3 ч. Реакционную смесь концентрировали, получая 102 мг (97%) (R)-2-амино-1-(3,3-дифтор-азетидин-1-ил)-пропан-1-она в виде коричневого масла, которое использовали без дополнительной очистки.
Стадия 5
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3,3-дифтор-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
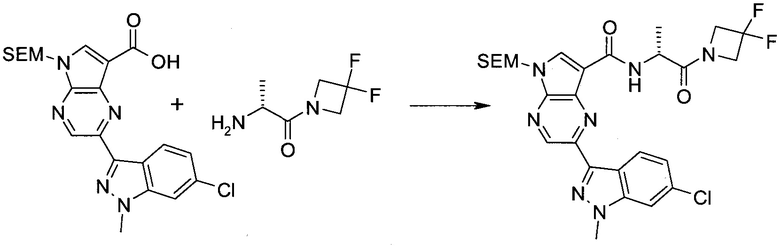
В круглодонную колбу загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (110 мг; 0,24 ммоль), (R)-2-амино-1-(3,3-дифтор-азетидин-1-ил)-пропан-1-он (98 мг; 0,60 ммоль), HOBT (41 мг; 0,27 ммоль) и EDC (51 мг; 0,27 ммоль). Добавляли DMF (1,1 мл), затем N,N-диизопропилэтиламин (0,10 мл; 0,57 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 48 часов, затем гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-50% EtOAc), получая 89 мг (61%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3,3-дифтор-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-желтого твердого вещества.
Стадия 6
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3,3-дифтор-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
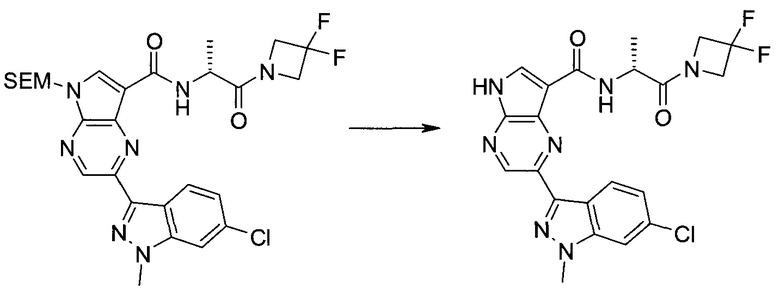
В круглодонной колбе растворяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3,3-дифтор-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (88 мг; 0,146 ммоль) в дихлорметане (0,7 мл) и добавляли трифторуксусную кислоту (0,45 мл; 5,84 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,7 мл) и добавляли этилендиамин (0,6 мл; 8,74 ммоль). Раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 45 мг (62%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3,3-дифтор-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-желтого порошка. MS: (M+H)+=474; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 10.55-11.71 (b. s, 1H), 9.13 (s, 1H), 8.71 (d, J=8,7 Гц, 1H), 8.40-8.54 (m, 2H), 7.97 (d, J=1,5 Гц, 1H), 7.26 (dd, J=8,7; 1,5 Гц, 1H), 4.67-4.99 (m, 3H), 4.38 (t, J=12,7 Гц, 2H), 4.17 (s, 3H), 1.44 (d, J=6,8 Гц, 3H).
Пример 15
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метансульфонил-пиперидин-3-ил)-амид
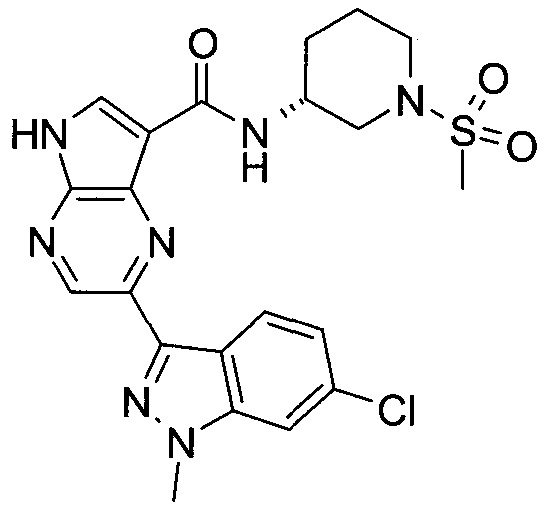
Стадия 1
(R)-3-{[2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-пиперидин-1-карбоновой кислоты трет-бутиловый эфир
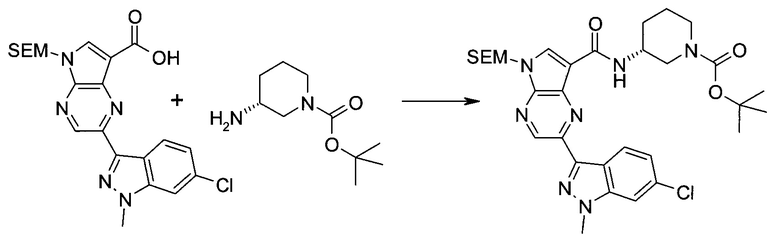
В круглодонную колбу загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (120 мг; 0,26 ммоль), (R)-трет-бутил-3-аминопиперидин-1-карбоксилат (80 мг; 0,40 ммоль), HOBT (45 мг; 0,29 ммоль) и EDC (56 мг; 0,29 ммоль). Добавляли DMF (1,2 мл), затем N,N-диизопропилэтиламин (0,10 мл; 0,57 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 48 ч, затем гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-50% EtOAc), получая 139 мг (83%) (R)-3-{[2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-пиперидин-1-карбоновой кислоты трет-бутилового эфира в виде светло-желтого твердого вещества.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (R)-пиперидин-3-иламид
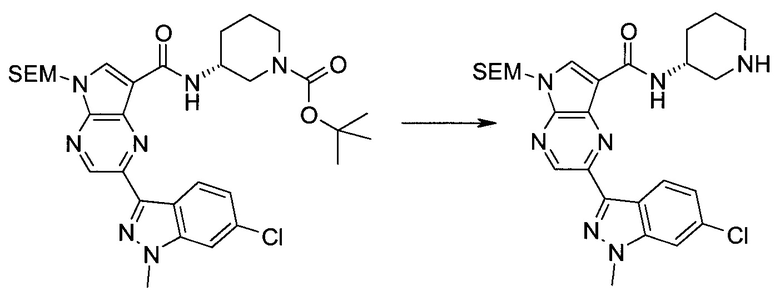
В круглодонной колбе суспендировали (R)-3-{[2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-
карбонил]-амино}-пиперидин-1-карбоновой кислоты трет-бутиловый эфир (138 мг; 0,22 ммоль) в метаноле (2 мл). Реакционную смесь охлаждали до 0°C и по каплям добавляли ацетилхлорид (0,30 мл; 4,22 ммоль) в течение 10 мин. Полученную ярко-желтую суспензию перемешивали при комнатной температуре в течение 50 мин. Добавляли THF (1 мл) и метанол (1 мл) и перемешивание продолжали в течение 1 ч при комнатной температуре, затем растворитель выпаривали при комнатной температуре. Остаток суспендировали в дихлорметане и промывали насыщенным раствором Na2CO3. Водный слой экстрагировали дихлорметаном. Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали, получая 105 мг (90%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (R)-пиперидин-3-иламида в виде светло-желтого твердого вещества.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метансульфонил-пиперидин-3-ил)-амид
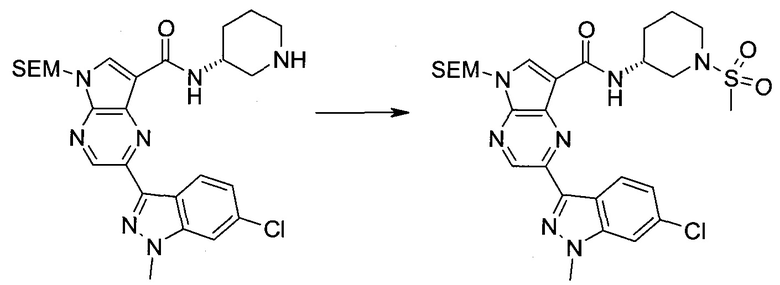
К раствору 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (R)-пиперидин-3-иламида (104 мг; 0,19 ммоль) в дихлорметане (1,5 мл) при 0°C добавляли триэтиламин (0,04 мл; 0,29 ммоль), затем метансульфонилхлорид (0,02 мл; 0,26 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали дихлорметаном (2×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-4% MeOH), затем растирали с этилацетатом, получая 106 мг (89%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метансульфонил-пиперидин-3-ил)-амида в виде светло-желтого твердого вещества.
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метансульфонил-пиперидин-3-ил)-амид
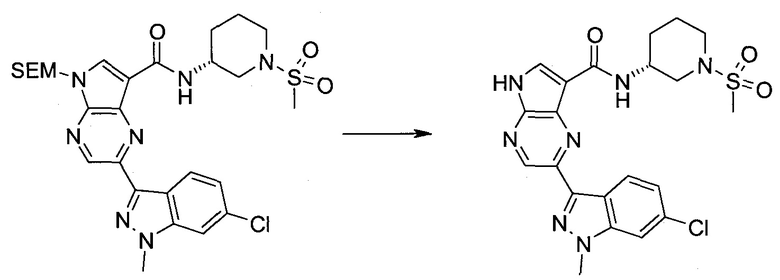
В круглодонной колбе растворяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метансульфонил-пиперидин-3-ил)-амид (103 мг; 0,167 ммоль) в дихлорметане (0,8 мл) и добавляли трифторуксусную кислоту (0,5 мл; 6,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,8 мл) и добавляли этилендиамин (0,67 мл; 9,92 ммоль). Полученную светло-желтую суспензию перемешивали при комнатной температуре в течение 45 мин, затем гасили водой и разбавляли этилацетатом. Суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 54 мг (63%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метансульфонил-пиперидин-3-ил)-амида в виде светло-желтого порошка. MS: (M+H)+=488; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 9.06 (s, 1H), 8.47 (s, 1H), 8.41 (d, J=8,7 Гц, 1H), 8.13 (d, J=7,6 Гц, 1H), 8.00 (s, 1H), 7.36 (d, J=8,7 Гц, 1H), 4.17 (s, 3H), 4.06-4.15 (m, 1H), 3.66-3.75 (m, 1H), 3.34-3.41 (m, 1H), 2.89-2.99 (m, 1H), 2.86 (s, 3H), 2.80 (d, J=10,6 Гц, 1H), 2.11 (br. s., 1H), 1.87 (br. s., 1H), 1.51-1.74 (m, 2H).
Пример 16
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-циклопропил-этил)-амид
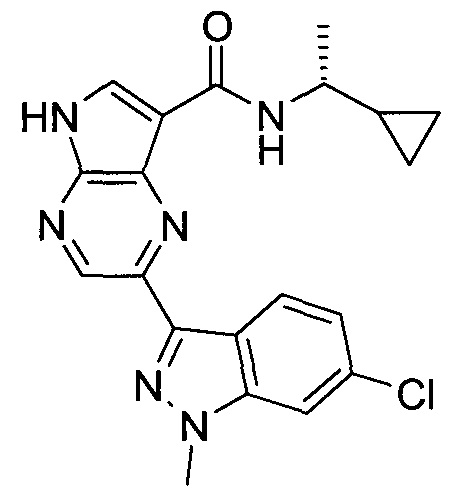
Получали в соответствии с методикой, приведенной в примере 14, стадии 5-6, заменяя (R)-1-циклопропилэтиламин на (R)-2-амино-1-(3,3-дифтор-азетидин-1-ил)-пропан-1-он на стадии 5. MS: (M+H)+=395; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 10.64 (br. s, 1H),9.10(s, 1H), 8.48 (d, J=8,7 Гц, 1H), 8.42 (s, 1H), 8.16 (d,J=8,4 Гц, 1H), 8.01 (s, 1H), 7.28 (dd, J=8,4; 0,9 Гц, 1H), 4.18 (s, 4H), 3.52-3.74 (m, 1H), 1.35 (d, J=6,8 Гц, 3H), 0.95-1.14 (m, 1H), 0.24-0.64 (m, 4H).
Пример 17
2-(6-Циклопропил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
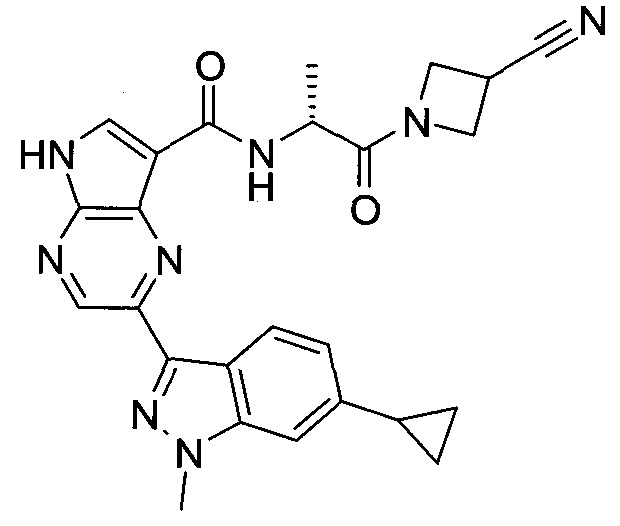
Получали в соответствии с методикой, приведенной в примере 4, заменяя 6-циклопропил-1H-индазол на 6-хлор-1H-индазол на стадии 1. MS: (M+H)+=469; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.88 (br. s., 1H), 9.14 (s, 1H), 8.42-8.59 (m, 3H), 7.40 (s, 1H), 7.06 (dd, J=7,9, 3,8 Гц, 1H), 4.48-4.81 (m, 3H), 4.14 (s, 3H), 4.01-4.29 (m, 2H), 3.77-3.92 (m, 1H), 2.06-2.21 (m, 1H), 1.44 (dd, J=6,2; 4,3 Гц, 3H), 0.95-1.10 (m, 2H), 0.77-0.88 (m, 2H).
Пример 18
2-(1-Метил-6-трифторметил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
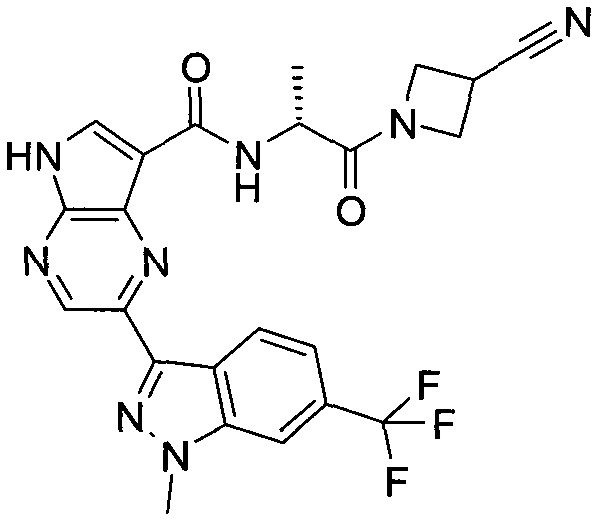
Получали в соответствии с методикой, приведенной в примере 4, заменяя 6-трифторметил-1H-индазол на 6-хлор-1H-индазол на стадии 1. MS: (M+H)+=497; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.93 (br. s., 1H), 9.16 (s, 1H), 8.93 (d, J=8,3 Гц, 1H), 8.48 (t, J=7,6 Гц, 2H), 8.29 (s, 1H), 7.50 (dd, J=8,1; 4,0 Гц, 1H), 4.49-4.85
(m, 3H), 4.28 (s, 3H), 4.17-4.40 (m, 1H), 4.03-4.17 (m, 1H), 3.78-3.96 (m, 1H), 1.36-1.48 (m, 3H).
Пример 19
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-амид
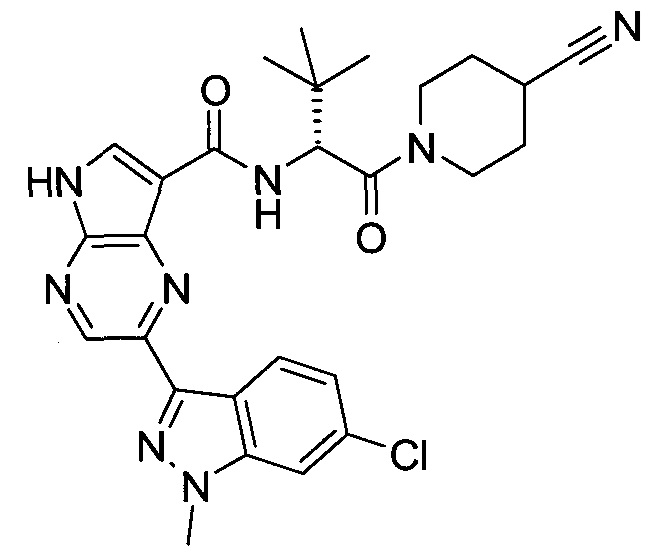
Получали в соответствии с методикой, приведенной в примере 14, стадии 5-6, заменяя 1-((R)-2-амино-3,3-диметил-бутирил)-пиперидин-4-карбонитрила трифторацетат на (R)-2-амино-1-(3,3-дифтор-азетидин-1-ил)-пропан-1-он на стадии 5. MS: (M+H)+=533; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.94 (br. s., 1H), 9.16 (s, 1H), 9.02 (dd, J=8,5; 6,2 Гц, 1H), 8.60 (dd, J=9,6; 5,5 Гц, 1H), 8.47 (d, J=5,7 Гц, 1H), 7.95 (s, 1H), 7.12-7.28 (m, 1H), 5.30 (d, J=9,8 Гц, 1H), 4.17 (s, 3H), 3.40-4.10 (m,4H), 3.05-3.26 (m, 1H), 1.44-2.10 (m, 4H), 1.02 (d, J=6,0 Гц, 9H).
Пример 20
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-циано-азетидин-1-карбонил)-пропил]-амид
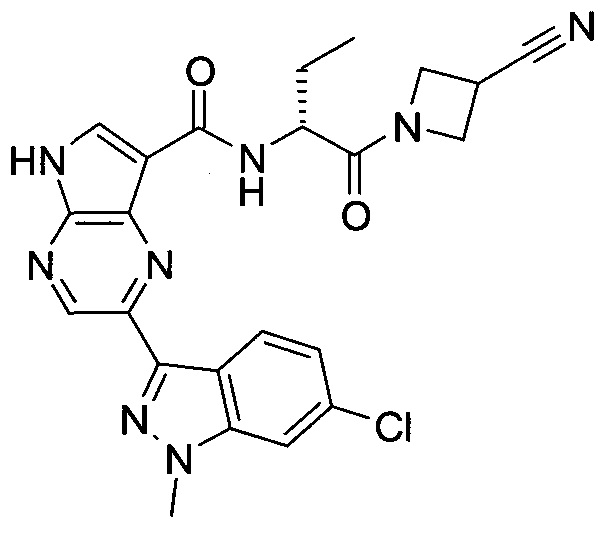
Стадия 1
[(R)-1-(3-Циано-азетидин-1-карбонил)-пропил]-карбаминовой кислоты трет-бутиловый эфир
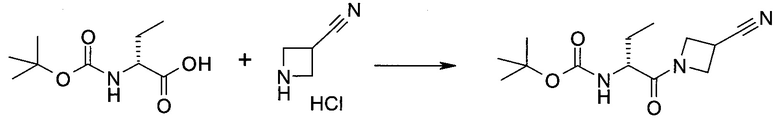
В круглодонной колбе растворяли Boc-D-2-аминомасляную кислоту (400 мг; 1,97 ммоль) и азетидин-3-карбонитрила гидрохлорид (373 мг; 3,15 ммоль) в DMF (9 мл). Добавляли N,N-диизопропилэтиламин (1,0 мл; 5,73 ммоль), затем HATU (823 мг; 2,16 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 48 часов, затем гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 410 мг (70%) [(R)-1-(3-циано-азетидин-1-карбонил)-пропил]-карбаминовой кислоты трет-бутилового эфира в виде беловатого твердого вещества.
Стадия 2
1-((R)-2-Амино-бутирил)-азетидин-3-карбонитрила трифторацетат
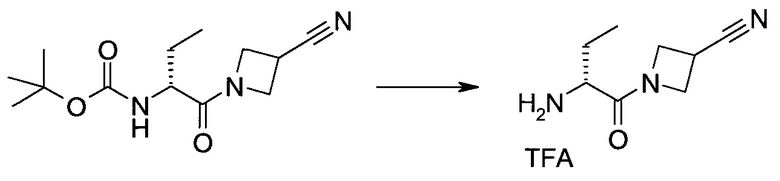
К раствору [(R)-1-(3-циано-азетидин-1-карбонил)-пропил]-карбаминовой кислоты трет-бутилового эфира (200 мг; 0,67 ммоль) в дихлорметане (4 мл) добавляли трифторуксусную кислоту (1,8 мл; 23,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали, получая 1-((R)-2-амино-бутирил)-азетидин-3-карбонитрила трифторацетат в виде светло-желтого масла, которое использовали без дополнительной очистки.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-циано-азетидин-1-карбонил)-пропил]-амид
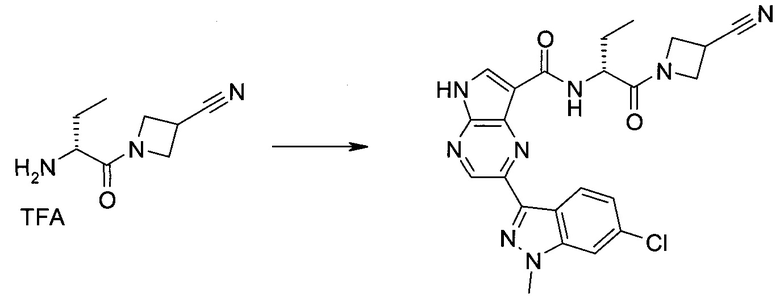
Получали в соответствии с методикой, приведенной в примере 14, стадии 5-6, заменяя 1-((R)-2-амино-бутирил)-азетидин-3-карбонитрила трифторацетат на (R)-2-амино-1-(3,3-дифтор-азетидин-1-ил)-пропан-1-он на стадии 5. MS: (M+H)+=477; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.73 (s, 1H), 9.15 (s, 1H), 8.73 (d, J=8,7 Гц, 1H), 8.40-8.55 (m, 2H), 7.99 (s, 1H), 7.24 (d, J=8,3 Гц, 1H), 4.48-4.79 (m, 3H), 4.18 (s, 3H), 3.99-4.33 (m, 2H), 3.75-3.96 (m, 1H), 1.62-1.97 (m, 2H), 0.83-1.02 (m, 3H).
Пример 21
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
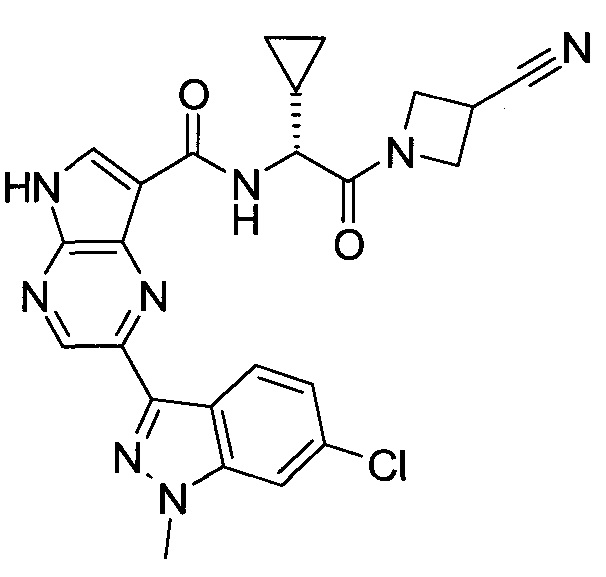
Стадия 1
[(R)-2-(3-Циано-азетидин-1-ил)-1-циклопропил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир
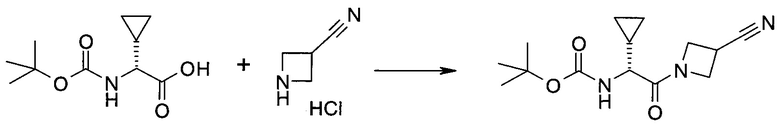
В круглодонной колбе растворяли Boc-D-циклопропилглицин (500 мг; 2,32 ммоль) и азетидин-3-карбонитрила гидрохлорид (441 мг; 3,72 ммоль) в DMF (10 мл). Добавляли N,N-диизопропилэтиламин (1,2 мл; 6,87 ммоль), затем HATU (972 мг; 2,56 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток растирали с петролейным эфиром, получая 384 мг (59%) [(R)-2-(3-циано-азетидин-1-ил)-1-циклопропил-2-оксо-этил]-карбаминовой кислоты трет-бутилового эфира в виде беловатого твердого вещества.
Стадия 2
1-((R)-2-Амино-2-циклопропил-ацетил)-азетидин-3-карбонитрила трифторацетат
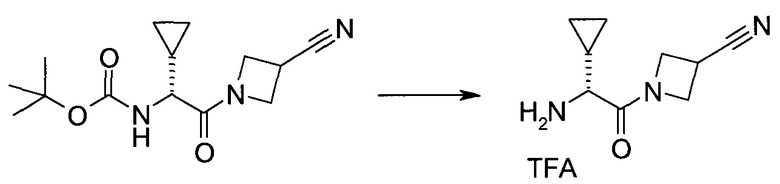
К раствору [(R)-2-(3-циано-азетидин-1-ил)-1-циклопропил-2-оксо-этил]-карбаминовой кислоты трет-бутилового эфира (190 мг; 0,69 ммоль) в дихлорметане (4 мл) добавляли трифторуксусную кислоту (1,8 мл; 23,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали, получая 1-((R)-2-амино-2-циклопропил-ацетил)-азетидин-3-карбонитрила трифторацетат в виде светло-желтого масла, которое использовали без дополнительной очистки.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
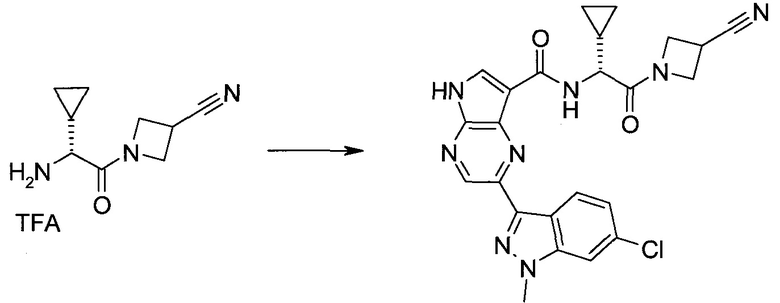
Получали в соответствии с методикой, приведенной в примере 14, стадии 5-6, заменяя 1-((R)-2-амино-2-циклопропил-ацетил)-азетидин-3-карбонитрила трифторацетат на (R)-2-амино-1-(3,3-дифтор-азетидин-1-ил)-пропан-1-он на стадии 5. MS: (M+H)+=489; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 12.92 (br. s, 1H), 9.15 (s, 1H), 8.72 (dd, J=8,6; 3,5 Гц, 1H), 8.43-8.56 (m, 2H), 7.98 (s, 1H), 7.24 (t, J=7,1 Гц, 1H), 4.44-4.76 (m, 2H), 4.17 (s, 3H), 4.01-4.36 (m, 3H), 3.81-3.93 (m, 1H), 1.24-1.38 (m, 1H), 0.36-0.65 (m, 4H).
Пример 22
2-(6-Циано-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
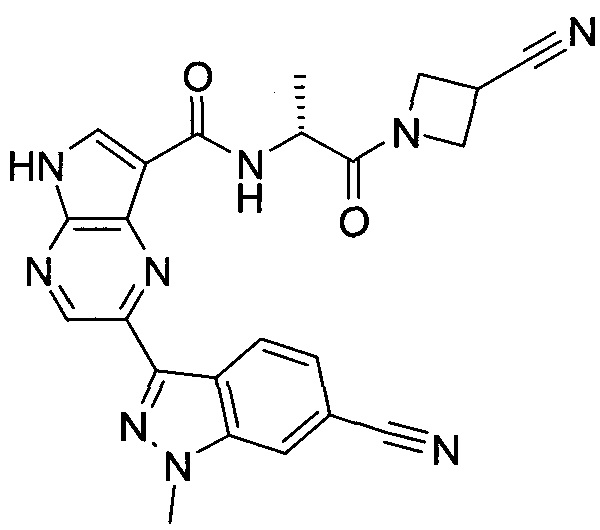
Получали в соответствии с методикой, приведенной в примере 4, заменяя 6-циано-1H-индазол на 6-хлор-1H-индазол на стадии 1. MS: (M+H)+=454; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 12.93 (br. s., 1H), 9.15 (s, 1H), 8.89 (d, J=8,1 Гц, 1H), 8.39-8.55 (m, 3H), 7.49-7.59 (m, 1H), 4.50-4.83 (m, 3H), 4.25 (s, 3H), 4.20-4.28 (m, 1H), 4.07-4.18 (m, 1H), 3.79-3.93 (m, 1H), 1.41 (t, J=6,8 Гц, 3H).
Пример 23
2-(6-Хлор-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
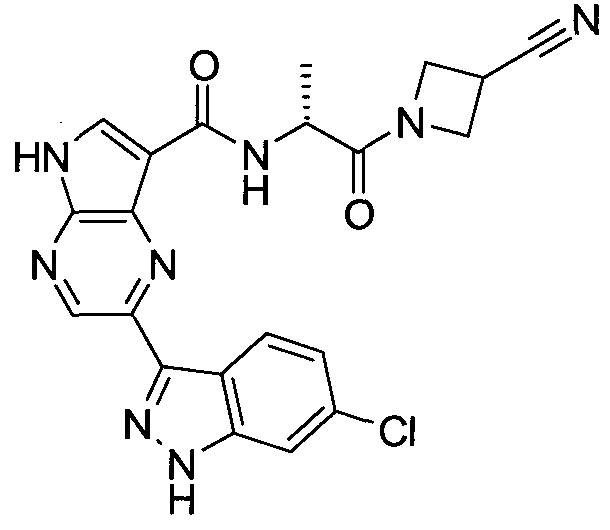
Стадия 1
6-Хлор-3-трибутилстаннанил-1H-индазол
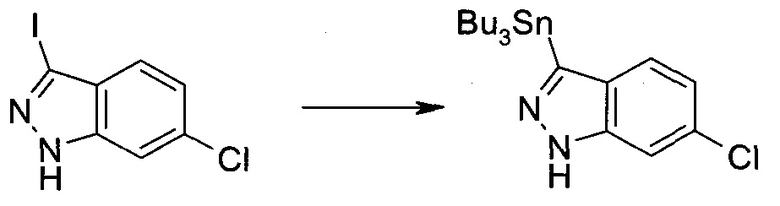
В круглодонной колбе растворяли 6-хлор-3-иод-1H-индазол (250 мг; 0,85 ммоль) в THF (5 мл) и добавляли гидрид натрия (60%-ную дисперсию в минеральном масле; 41 мг; 1,03 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин, затем охлаждали до -16°C (баня со смесью NaCl/лед) и по каплям добавляли хлорид изопропилмагния (2,0 М в THF; 0,52 мл; 1,04 ммоль). Реакционную смесь перемешивали при -16°C в течение 30 мин, затем добавляли дополнительное количество хлорида изопропилмагния (2,0 М в THF; 0,14 мл; 0,28 ммоль). Реакционную смесь перемешивали при -16°C в течение 10 мин, затем медленно добавляли трибутилхлорстаннан (0,28 мл;
1,03 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры в течение 2,5 ч, затем гасили насыщенным раствором NH4Cl и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали, концентрировали, получая 6-хлор-3-трибутилстаннанил-1H-индазол в виде желтого масла, которое использовали без дополнительной очистки.
Стадия 2
2-(6-Хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
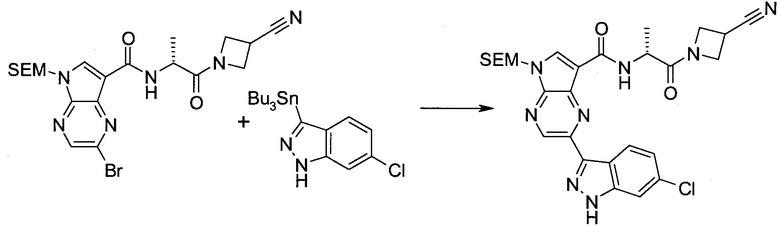
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (190 мг; 0,37 ммоль) и 6-хлор-3-трибутилстаннил-1H-индазол (неочищенный со стадии 1; 619 мг; 0,70 ммоль) в DMF (3,4 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенилфосфин)палладий(0) (22 мг; 0,019 ммоль) и иодид меди(I) (15 мг; 0,079 ммоль). Реакционную смесь перемешивали при 90°C в масляной бане в течение 3 ч, затем охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-3% MeOH), затем растирали со смесью диэтиловый эфир/этилацетат, получая 159 мг (73%) 2-(6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-коричневого порошка.
Стадия 3
2-(6-Хлор-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
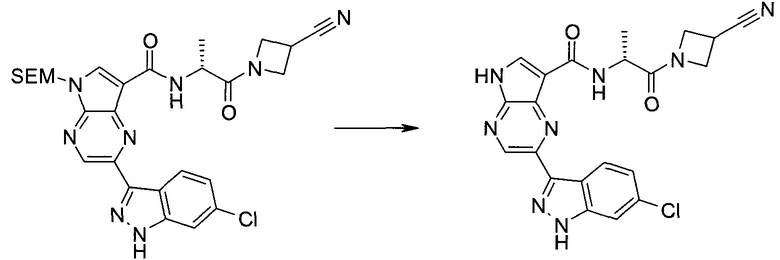
В круглодонной колбе растворяли 2-(6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (65 мг; 0,112 ммоль) в дихлорметане (0,6 мл) и добавляли трифторуксусную кислоту (0,35 мл; 4,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток снова растворяли в дихлорметане (0,6 мл) и добавляли этилендиамин (0,46 мл; 6,8 ммоль). Раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 30 мг (59%) 2-(6-хлор-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-желтого порошка. MS: (M+H)+=449.
1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 13.35-13.88 (m, 1H), 12.77 (s, 1H), 9.20 (s, 1H), 8.73 (dd, J=8,7; 2,9 Гц, 1H), 8.48 (d, J=8,0 Гц, 2H), 7.74 (d, J=1,5 Гц, 1H), 7.22-7.28 (m, 1H), 4.71-4.78 (m, 1H), 4.64-4.70 (m, 1H), 4.60 (d, J=7,8 Гц, 1H), 4.51-4.57 (m, 1H), 4.23 (td, J=9,5; 3,4 Гц, 1H), 4.06-4.15 (m, 1H), 3.80-3.93 (m, 1H), 1.41 (t, J=6,5 Гц, 3H).
Пример 24
2-[6-Хлор-1-(2-метокси-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
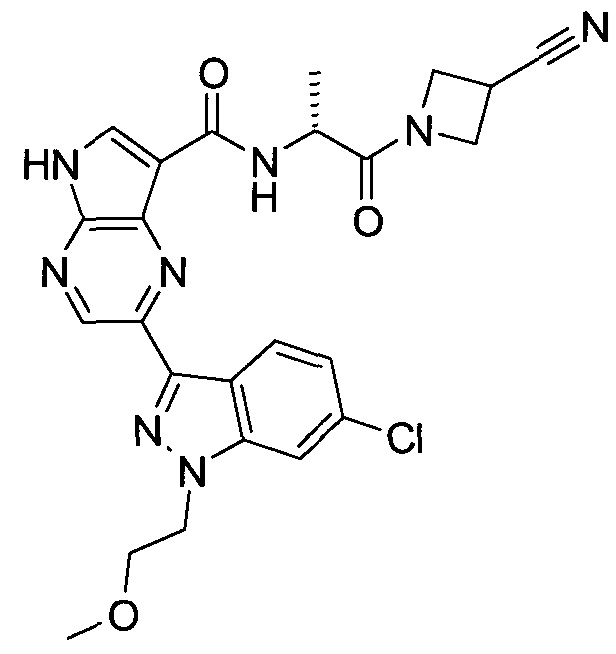
Стадия 1
2-[6-Хлор-1-(2-метокси-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
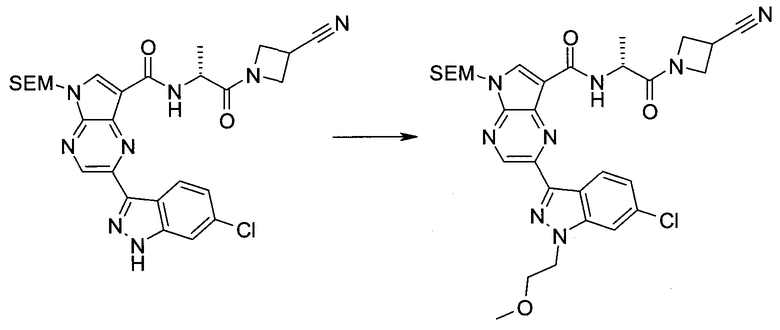
В круглодонной колбе растворяли 2-(6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (90 мг; 0,155 ммоль) в DMF (1 мл). Реакционную смесь охлаждали до 0°C и добавляли гидрид натрия (60%-ную дисперсию в минеральном масле; 8 мг; 0,20 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин, затем добавляли 1-бром-2-метоксиэтан (22 мкл, 0,23 ммоль). Реакционную смесь перемешивали при 0°C в течение 3 ч и затем при комнатной температуре в течение ночи. Реакционную смесь гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2/0,5 NH4OH (градиент 0-3% MeOH), получая 51 мг (52%) 2-[6-хлор-1-(2-метокси-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде желтой пены.
Стадия 2
2-[6-Хлор-1-(2-метокси-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
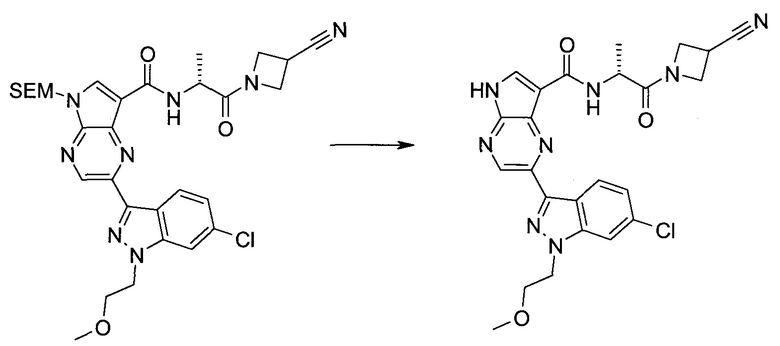
В круглодонной колбе растворяли 2-[6-хлор-1-(2-метокси-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (50 мг; 0,079 ммоль) в дихлорметане (0,5 мл) и добавляли трифторуксусную кислоту (0,25 мл; 3,24 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,5 мл) и добавляли этилендиамин (0,32 мл; 4,74 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 19 мг (48%) 2-[6-хлор-1-(2-метокси-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-желтого порошка. MS: (M+H)+=507; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 12.88 (br. s., 1H), 9.16 (s, 1H), 8.72 (dd, J=8,6; 3,0 Гц, 1H), 8.49 (dd, J=8,6; 4,8 Гц, 2H), 8.00 (s, 1H), 7.23-7.30 (m, 1H), 4.52-4.79 (m, 5H), 4.19-4.28 (m, 1H), 4.08-4.16 (m, 1H), 3.85 (t, J=5,3 Гц, 3H), 3.24 (s, 3H), 1.41 (t, J=6,6 Гц, 3H).
Пример 25
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-фенилэтил)-амид
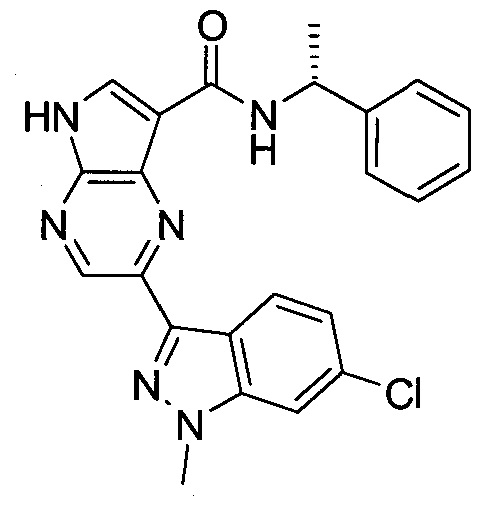
Получали в соответствии с методикой, приведенной в примере 14, стадии 5-6, заменяя (R)-1-фенилэтиламин на (R)-2-амино-1-(3,3-дифтор-азетидин-1-ил)-пропан-1-он на стадии 5. MS: (M+H)+=431; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.73 (br. s., 1H),9.11 (s, 1H), 8.42-8.53 (m, 2H), 8.28 (d, J=8,7 Гц, 1H), 7.99 (d, J=1,1 Гц, 1H), 7.46 (d, J=7,6 Гц, 2H), 7.34 (t, J=7,4 Гц, 2H), 7.17-7.29 (m, 1H), 7.08 (dd, J=8,7; 1,5 Гц, 1H), 5.34 (quin, J=7,2 Гц, 1H), 4.17 (s, 3H), 1.64 (d, J=7,2 Гц, 3H).
Пример 26
2-(1-Метил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
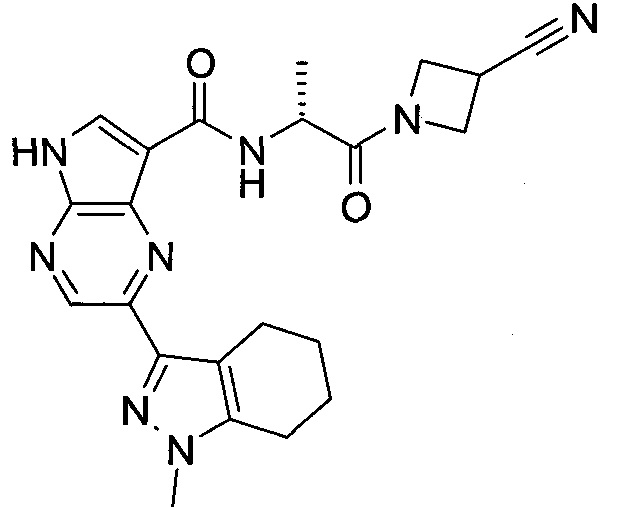
Получали в соответствии с методикой, приведенной в примере 4, заменяя 4,5,6,7-тетрагидро-1H-индазол на 6-хлор-1H-индазол на стадии 1. MS: (M+H)+=433; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.64 (br. s., 1H), 8.93 (s, 1H), 8.36 (d, J=9,8 Гц, 2H), 4.57-4.73 (m, 2H), 4.43-4.57 (m, 1H), 4.08-4.20 (m, 1H), 3.95-4.06 (m, 1H), 3.79-3.89 (m, 1H), 3.77 (s, 3H), 2.93-3.07 (m, 1H), 2.86 (d, J=18,5 Гц, 1H), 2.58-2.68 (m, 2H), 1.76 (dd, J=13,6; 6,0 Гц, 4H), 1.33 (dd, J=6,8; 3,8 Гц, 3H).
Пример 27
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-метил-2-(2-окса-6-аза-спиро[3.3]гепт-6-ил)-2-оксо-этил]-амид
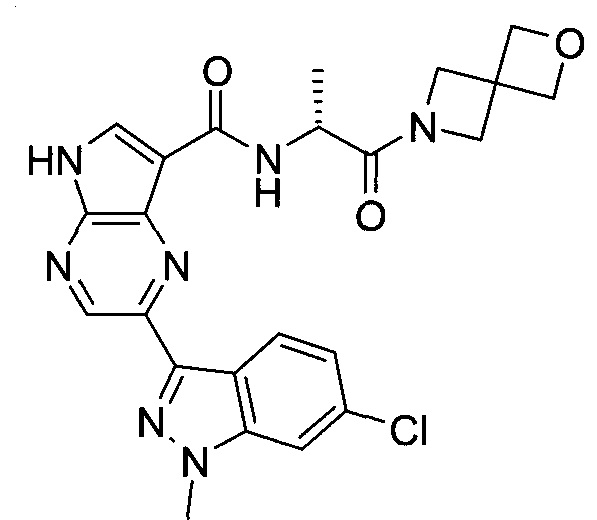
Получали в соответствии с методикой, приведенной в примере 14, стадии 3-6, заменяя 2-окса-6-аза-спиро[3.3]гептана оксалат на 3,3-дифторазетидина
гидрохлорид на стадии 3. MS: (M+H)+=480; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.83 (br. s., 1H),9.14(s, 1H), 8.78 (d, J=8,7 Гц, 1H), 8.40-8.49 (m, 2H), 7.96 (d, J=1,5 Гц, 1H), 7.24 (dd, J=8,7; 1,5 Гц, 1H), 4.59-4.82 (m, 5H), 4.40-4.56 (m, 2H), 4.16 (s, 3H), 4.11 (s, 2H), 1.37 (d, J=6,8 Гц, 3H).
Пример 28
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-2-морфолин-4-ил-2-оксо-этил)-амид
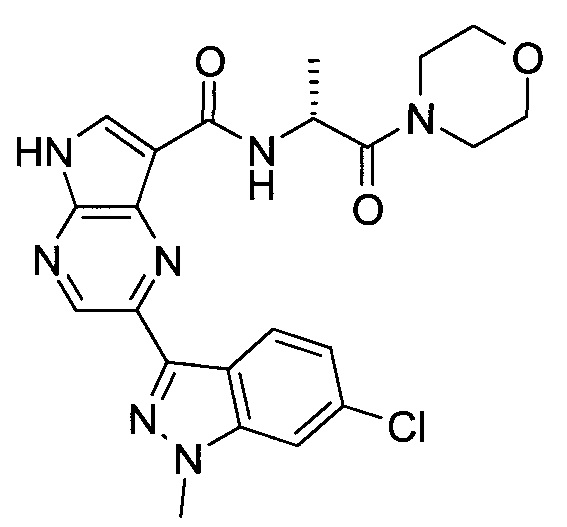
Получали в соответствии с методикой, приведенной в примере 14, стадии 3-6, заменяя морфолин на 3,3-дифторазетидина гидрохлорид на стадии 3. MS: (M+H)+=468; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.47 (br. s, 1H), 9.16 (s, 1H), 8.88 (d, J=8,7 Гц, 1H), 8.62 (d, J=8,3 Гц, 1H), 8.47 (s, 1H), 7.97 (d, J=1,5 Гц, 1H), 7.26 (dd, J=8,7; 1,5 Гц, 1H), 5.23 (quin, J=7,1 Гц, 1H), 4.18 (s, 3H), 3.47-3.73 (m, 8H), 1.42 (d, J=6,8 Гц, 3H).
Пример 29
2-(6-Хлор-1-метил-1H-индол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
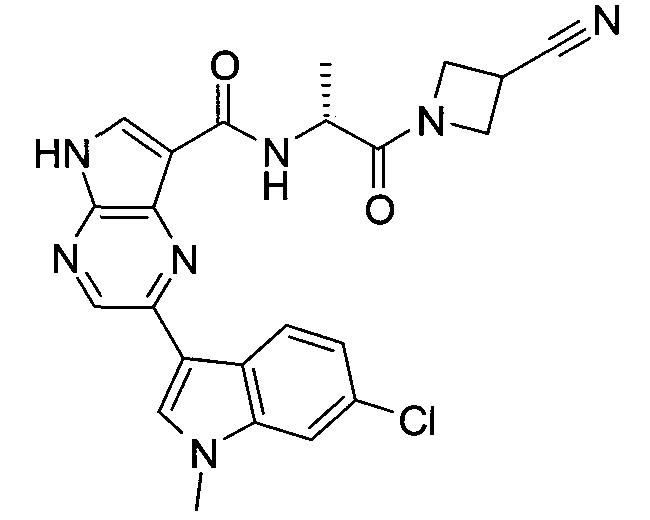
Стадия 1
2-(6-Хлор-1H-индол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
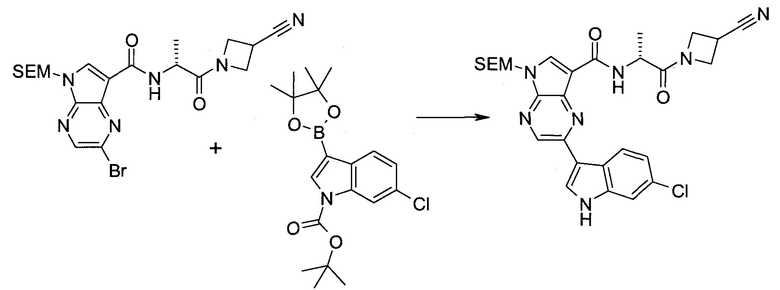
Во флакон загружали 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (158 мг; 0,31 ммоль), трет-бутил-6-хлор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол-1-карбоксилат (176 мг; 0,47 ммоль) и тетракис(трифенилфосфин)палладий(0) (18,0 мг; 0,016 ммоль). Флакон вакуумировали и заполняли аргоном, затем добавляли 1,2-диметоксиэтан (1,8 мл) и водный 2 М карбонат натрия (0,47 мл; 0,940 ммоль). Флакон герметично закрывали и реакционную смесь перемешивали при 90°C в масляной бане в течение ночи. Реакционную смесь охлаждали до комнатной температуры, гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-3% MeOH), получая 93 мг (52%) 2-(6-хлор-1H-индол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-зеленой пены. Также выделяли минорное количество неочищенного 6-хлор-3-[7-[(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этилкарбамоил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-2-ил]-индол-1-карбоновой кислоты трет-бутилового эфира в виде светло-коричневого твердого вещества.
Стадия 2
2-(6-Хлор-1-метил-1H-индол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
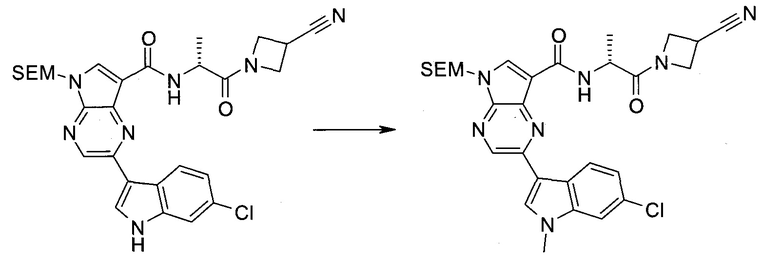
В круглодонной колбе растворяли 2-(6-хлор-1H-индол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (90 мг; 0,156 ммоль) в DMF (1 мл). Реакционную смесь охлаждали до 0°C и добавляли гидрид натрия (60%-ную дисперсию в минеральном масле; 8 мг; 0,20 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин, затем добавляли метилиодид (10 мкл, 0,16 ммоль). Реакционную смесь перемешивали при 0°C в течение 1,5 ч, затем гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-2% MeOH), получая 56 мг (61%) 2-(6-хлор-1-метил-1H-индол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде желтой пены.
Стадия 3
2-(6-Хлор-1-метил-1H-индол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
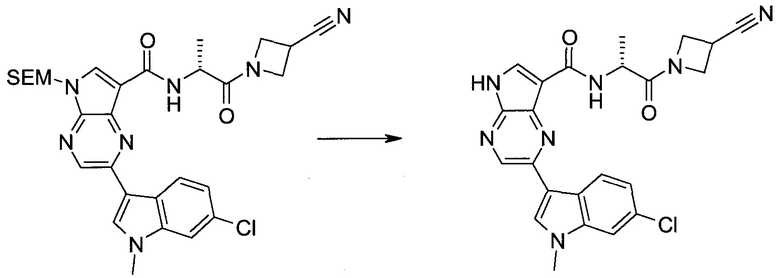
В круглодонной колбе растворяли 2-(6-хлор-1-метил-1H-индол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (54 мг; 0,091 ммоль) в дихлорметане (0,5 мл) и добавляли трифторуксусную кислоту (0,28 мл;
3,63 ммоль). Темно-красный раствор перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток снова растворяли в дихлорметане (0,5 мл) и добавляли этилендиамин (0,37 мл; 5,48 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 28 мг (63%) 2-(6-хлор-1-метил-1H-индол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде желтого порошка. MS: (M+H)+=462; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.62 (br. s., 1H), 8.88 (s, 1H), 8.61 (d, J=7,6 Гц, 1H), 8.55 (d, J=8,7 Гц, 1H), 8.27-8.39 (m, 2H), 7.70 (d, J=1,5 Гц, 1H), 7.17 (dd, J=8,5; 2,5 Гц, 1H), 4.46-4.77 (m, 3H), 4.14-4.27 (m,1H), 4.01-4.12 (m, 1H), 3.88 (s, 3H), 3.83 (br. s., 1H), 1.40 (dd, J=6,8; 4,2 Гц, 3H).
Пример 30
2-(6-Хлор-5-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
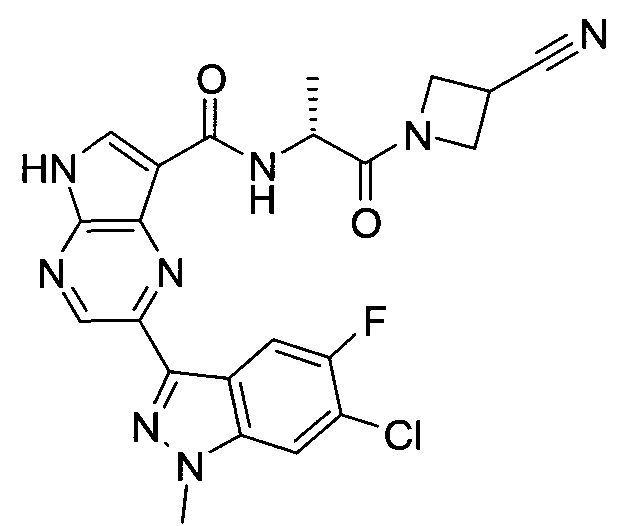
Получали в соответствии с методикой, приведенной в примере 4, заменяя 6-хлор-5-фтор-1H-индазол на 6-хлор-1H-индазол на стадии 1. MS: (M+H)+=481; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.87 (br. s., 1H), 9.13 (s, 1H), 8.49 (d, J=7,9 Гц, 2H), 8.44 (d, J=7,6 Гц, 1H), 8.21 (d, J=6,0 Гц, 1H), 4.48-4.77 (m, 3H), 4.20 (s,3H), 4.13-4.28 (m, 1H), 4.07 (dt, J=9,7; 5,1 Гц, 1H), 3.79-3.93 (m, 1H), 1.45 (t,J=6,2 Гц, 3H).
Пример 31
2-(6-Метил-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
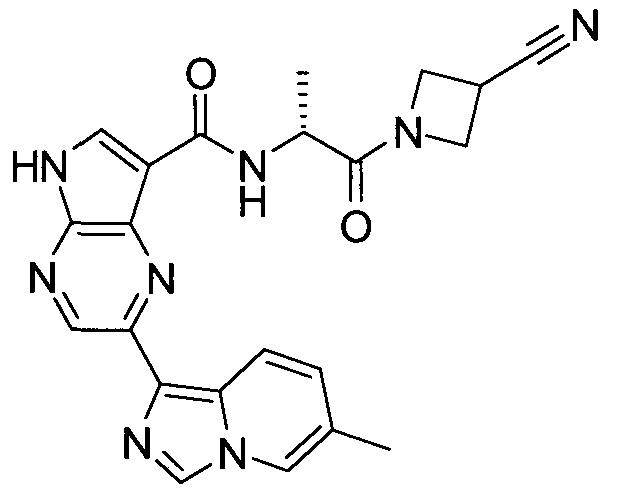
Стадия 1
(5-Метил-пиридин-2-ил)-метиламин
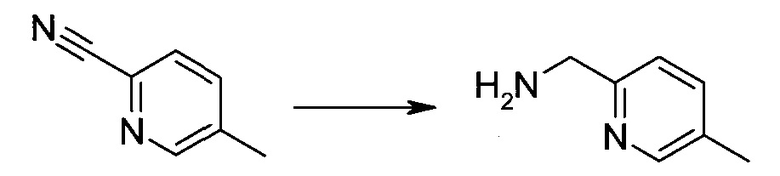
В сухой круглодонной колбе растворяли 5-метил-пиридин-2-карбонитрил (1,0 г; 8,46 ммоль) в THF (45 мл). Раствор охлаждали до 0°C и по каплям в течение 20 мин добавляли алюмогидрид лития (1,0 М в THF; 25 мл; 25,0 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин, затем осторожно добавляли сульфат натрия декагидрат. Когда выделение газа прекращалось, ледяную баню удаляли, добавляли сульфат натрия и смесь интенсивно перемешивали в течение 30 мин при комнатной температуре. Суспензию фильтровали через целит и промывали этилацетатом, дихлорметаном и метанолом. Фильтрат концентрировали, получая (5-метил-пиридин-2-ил)-метиламин в виде коричневого твердого вещества, которое использовали без дополнительной очистки.
Стадия 2
N-(5-Метил-пиридин-2-илметил)-формамид
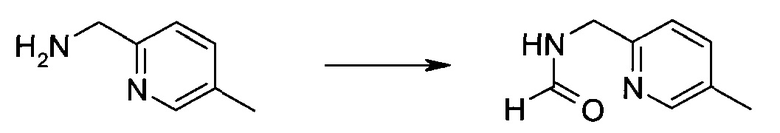
В круглодонной колбе растворяли (5-метил-пиридин-2-ил)-метиламин (неочищенный со стадии 1) в 88%-ной муравьиной кислоте (6,0 мл; 156 ммоль). Темно-коричневый раствор перемешивали при температуре дефлегмации в масляной бане в течение ночи. Реакционную смесь охлаждали до 0°C и pH осторожно подводили до 8 добавлением 25%-ного водного гидроксида аммония. Смесь разбавляли водой и водный слой экстрагировали дихлорметаном (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали, получая N-(5-метил-пиридин-2-илметил)-формамида в виде темно-коричневого масла и использовали без дополнительной очистки.
Стадия 3
6-Метил-имидазо[1,5-a]пиридин
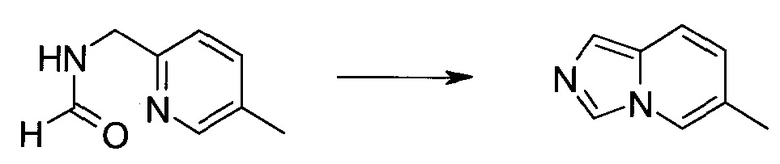
В круглодонной колбе растворяли N-(5-метил-пиридин-2-илметил)-формамид (неочищенный со стадии 2) в толуоле (30 мл) и добавляли оксихлорид фосфора (1,2 мл; 12,9 ммоль). Реакционную смесь перемешивали при 100°C в масляной бане в течение ночи, затем охлаждали до 0°C и осторожно гасили, используя лед. Добавляли 25%-ный водный гидроксид аммония до pH примерно 9. Смесь разбавляли водой и экстрагировали дихлорметаном (2×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси EtOAc/гексаны (градиент 0-80% EtOAc), получая 386 мг (41%, 3 стадии) 6-метил-имидазо[1,5-a]пиридина в виде светло-коричневого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.09 (s, 1H), 7.74 (s, 1H), 7.32-7.43 (m, 2H), 6.60 (dd, J=9,4; 1,1 Гц, 1H), 2.25 (d, J=1,1 Гц, 3H).
Стадия 4
1-Иод-6-метил-имидазо[1,5-a]пиридин
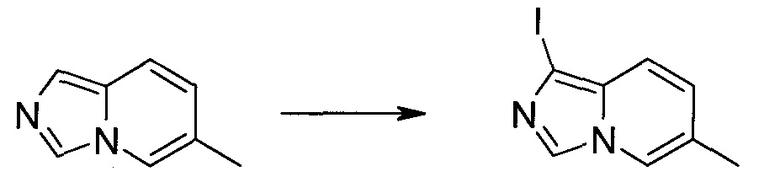
В круглодонной колбе суспендировали бикарбонат натрия (215 мг; 2,56 ммоль) в воде (0,6 мл) и этаноле (1,2 мл). Добавляли 6-метил-имидазо[1,5-a]пиридин (90 мг; 0,68 ммоль), затем йод (242 мг; 0,95 ммоль). Темно-коричневую суспензию перемешивали при комнатной температуре в течение ночи, затем гасили 10%-ным раствором Na2S2O3 и экстрагировали EtOAc (2×). Органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-30% EtOAc), получая 99 мг (56%) 1-иод-6-метил-имидазо[1,5-a]пиридина в виде светло-коричневого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.11 (s, 1H), 7.73 (s, 1H), 7.24 (d, J=9,4 Гц, 1H), 6.67 (d, J=9,1 Гц, 1H), 2.27 (s, 3H).
Стадия 5
6-Метил-1-трибутилстаннанил-имидазо[1,5-a]пиридин
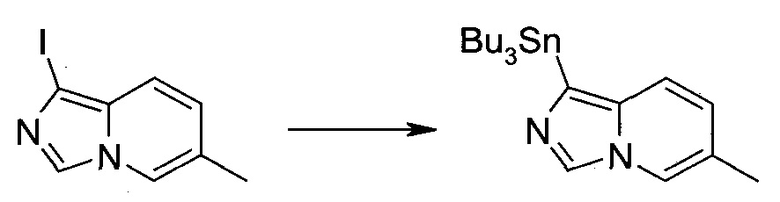
В круглодонной колбе растворяли 1-иод-6-метил-имидазо[1,5-a]пиридин (97 мг; 0,38 ммоль) в THF (3 мл). Раствор охлаждали до -16°C (баня со смесью NaCl/лед) и по каплям добавляли хлорид изопропилмагния (2,0 М раствор в THF; 0,23 мл; 0,46 ммоль). Реакционную смесь перемешивали при -16°C в течение 20 мин, затем медленно добавляли трибутилхлорстаннан (0,12 мл; 0,44 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 2 ч, затем гасили насыщенным водным NH4Cl и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 6-метил-1-трибутилстаннанил-имидазо[1,5-a]пиридин в виде коричневого масла, которое использовали без дополнительной очистки.
Стадия 6
2-(6-Метил-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
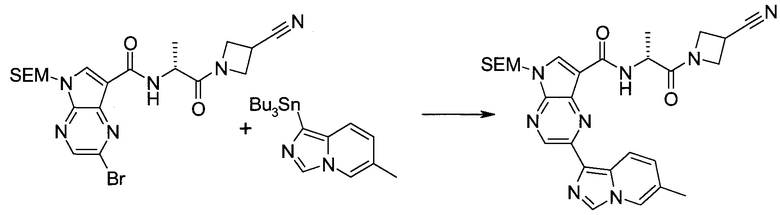
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (100 мг; 0,20 ммоль) и 6-метил-1-трибутилстаннил-имидазо[1,5-a]пиридин (неочищенный со стадии 5; 307 мг; 0,36 ммоль) в DMF (1,8 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенилфосфин)палладий(0) (12 мг; 0,010 ммоль) и иодид меди(I) (8 мг; 0,042 ммоль). Реакционную смесь перемешивали при 90°C в масляной бане в течение ночи, затем охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси
MeOH/CH2Cl2/0,5% NH4OH (градиент 0-3% MeOH), получая 98 мг (89%) 2-(6-метил-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде желтого масла.
Стадия 7
2-(6-Метил-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
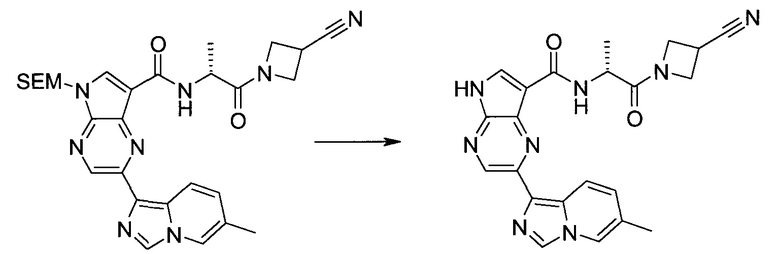
В круглодонной колбе растворяли 2-(6-метил-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (92 мг; 0,165 ммоль) в дихлорметане (0,8 мл) и) добавляли трифторуксусную кислотау (0,5 мл; 6,6 ммоль. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,8 мл) и добавляли этилендиамин (0,67 мл; 9,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 48 мг (65%) 2-(6-метил-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде желтого порошка. MS: (M+H)+=429; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.40 (br. s, 1H), 9.11 (s, 1H), 8.39-8.61 (m, 3H), 8.34 (d, J=7,2 Гц, 1H), 8.28 (s, 1H), 6.79-7.05 (m, 1H), 4.41-4.86 (m, 3H), 4.15-4.33 (m, 1H), 3.99-4.15 (m, 1H), 3.71-3.94 (m, 1H), 2.26 (s, 3H), 1.40 (d, J=4,9 Гц, 3H).
Пример 32
2-(6-Фтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
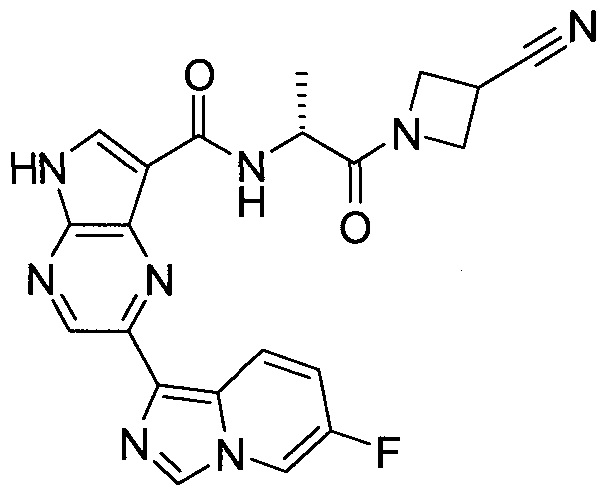
Стадия 1
(5-Фтор-пиридин-2-ил)-метиламин
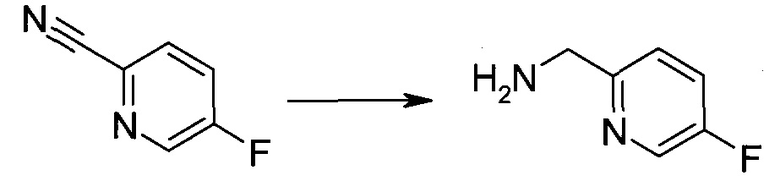
В сосуде Парра для работы под давлением растворяли 2-циано-5-фторпиридин (2,0 г; 16,4 ммоль) в этаноле (60 мл). Добавляли палладий на угле (10%-ный Pd (влажный); 574 мг; 5,39 ммоль), затем конц. HCl (4,6 мл; 56,0 ммоль). Сосуд помещали в автоклав Парра для гидрирования и встряхивали в течение 3,5 ч в атмосфере водорода (45 ф/кв. дюйм (310 кПа)). Реакционную смесь фильтровали через целит и промывали метанолом. Фильтрат концентрировали до светло-желтого твердого вещества. Это твердое вещество переносили в дихлорметан, охлаждали до 0°C и подщелачивали насыщенным водным NaHCO3. Водный слой экстрагировали дихлорметаном (3×) и объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали, получая 558 мг (27%) (5-фтор-пиридин-2-ил)-метиламина в виде желтого масла, которое использовали без дополнительной очистки.
Стадия 2
N-(5-Фтор-пиридин-2-илметил)-формамид

В круглодонной колбе растворяли (5-фтор-пиридин-2-ил)метиламин (557 мг; 4,42 ммоль) в 88%-ной муравьиной кислоте (3,6 мл; 82,6 ммоль). Коричневый раствор перемешивали при температуре дефлегмации в масляной бане в течение ночи. Реакционную смесь охлаждали до 0°C и pH осторожно подводили до 9 добавлением 25%-ного водного гидроксида аммония. Смесь разбавляли водой и водный слой экстрагировали дихлорметаном (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и
концентрировали, получая 614 мг (90%) N-(5-фтор-пиридин-2-илметил)-формамида в виде коричневого масла, которое использовали без дополнительной очистки.
Стадия 3
6-Фтор-имидазо[1,5-a]пиридин
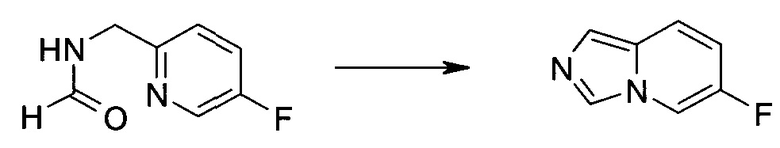
В круглодонной колбе растворяли N-(5-фтор-пиридин-2-илметил)-формамид (612 мг; 3,97 ммоль) в толуоле (16 мл) и добавляли оксихлорид фосфора (0,68 мл; 7,3 ммоль). Реакционную смесь перемешивали при 100°C в масляной бане в течение 4 ч, затем охлаждали до 0°C и осторожно гасили, используя лед. Добавляли 25%-ный водный гидроксид аммония до pH примерно 9. Смесь разбавляли водой и экстрагировали дихлорметаном (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали, получая 517 мг (96%) 6-фтор-имидазо[1,5-a]пиридина в виде светло-коричневого масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.16 (s, 1H), 7.84-7.94 (m, 1H), 7.50 (s, 1H), 7.46 (dd, J=9,8; 5,3 Гц, 1H), 6.69 (ddd, J=9,8; 7,7; 2,1 Гц, 1H).
Стадия 4
2-(6-Фтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
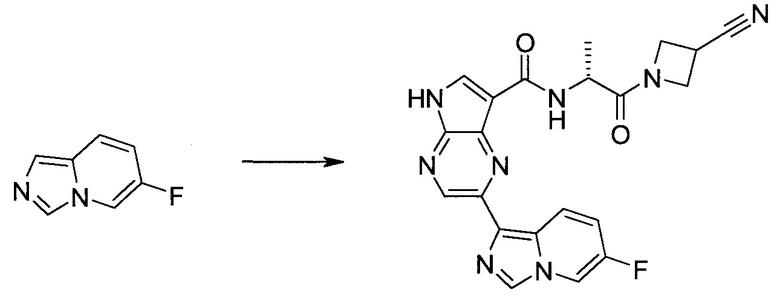
Получали в соответствии с методикой, приведенной в примере 31, стадии 4-7, заменяя 6-фтор-имидазо[1,5-a]пиридин на 6-метил-имидазо[1,5-a]пиридин на стадии 4. MS: (M+H)+=433; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.76 (br. s., 1H), 9.14 (s, 1H), 8.62-8.80 (m, 2H), 8.53 (s, 1H), 8.31-8.47 (m, 2H), 7.00-7.15 (m, 1H), 4.44-4.83 (m, 3H), 4.25 (q, J=9,2 Гц, 1H), 4.05-4.18 (m, 1H), 3.77-3.94 (m, 1H), 1.40 (t, J=5,7 Гц, 3H).
Пример 33
2-(6,8-Дифтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
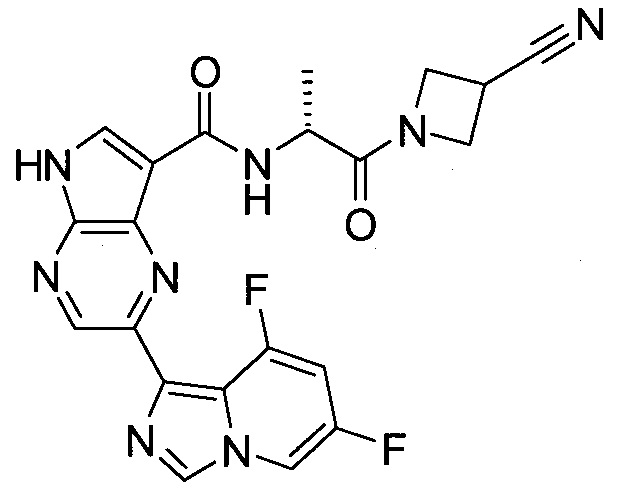
Стадия 1
(3,5-Дифтор-пиридин-2-ил)-метиламин
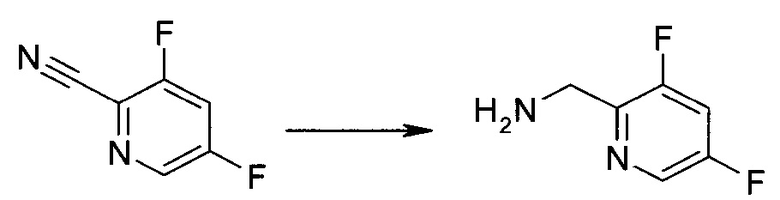
В сосуде Парра для работы под давлением растворяли 2-циано-3,5-дифторпиридин (1,0 г; 7,14 ммоль) в этаноле (30 мл). Добавляли палладий на угле (10%-ный Pd (влажный); 250 мг; 2,35 ммоль), затем конц. HCl (2,0 мл; 24,4 ммоль). Сосуд помещали в автоклав Парра для гидрирования и встряхивали в течение 3,5 ч в атмосфере водорода (45 ф/кв. дюйм (310 кПа)). Реакционную смесь фильтровали через целит и промывали метанолом. Фильтрат концентрировали до светло-желтого твердого вещества. Это твердое вещество переносили в дихлорметан, охлаждали до 0°C и подщелачивали насыщенным водным NaHCO3. Водный слой экстрагировали дихлорметаном (3×) и объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали, получая 662 мг (64%) (3,5-дифтор-пиридин-2-ил)-метиламина в виде светло-желтого масла, которое использовали без дополнительной очистки.
Стадия 2
N-(3,5-Дифтор-пиридин-2-илметил)-формамид
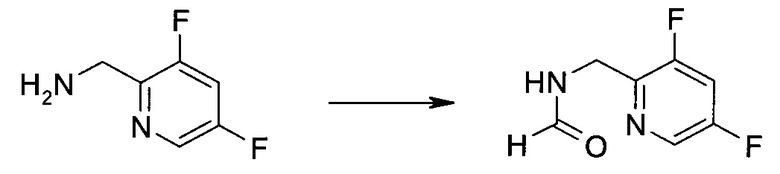
В круглодонной колбе растворяли (3,5-дифтор-пиридин-2-ил)метиламин (660 мг; 4,58 ммоль) в 88%-ной муравьиной кислоте (3,6 мл; 82,6 ммоль). Коричневый раствор перемешивали при температуре дефлегмации в масляной бане в течение ночи. Реакционную смесь охлаждали до 0°C и pH осторожно
подводили до 8 добавлением 25%-ного водного гидроксида аммония. Смесь разбавляли водой и водный слой экстрагировали дихлорметаном (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. ЯМР показал приблизительно 50%-ное соотношение исходного вещества и продукта. Эту смесь обрабатывали в идентичных реакционных условиях. После обработки выделяли 657 мг коричневого масла, для которого посредством ЯМР определяли, что соотношение N-(3,5-дифтор-пиридин-2-илметил)-формамида и исходного вещества составляло приблизительно 3:1. Этот продукт использовали без дополнительной очистки.
Стадия 3
6,8-Дифтор-имидазо[1,5-a]пиридин

В круглодонной колбе растворяли N-(3,5-дифтор-пиридин-2-илметил)-формамид (неочищенный со стадии 2) в толуоле (14 мл) и добавляли оксихлорид фосфора (0,65 мл; 7,0 ммоль). Реакционную смесь перемешивали при 100°C в масляной бане в течение 3,5 ч, затем охлаждали до 0°C и осторожно гасили, используя лед. Добавляли 25%-ный водный гидроксид аммония до pH примерно 9. Смесь разбавляли водой и экстрагировали дихлорметаном (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси EtOAc/гексаны (градиент 0-60% EtOAc), получая 319 мг (45%, за 2 стадии) 6,8-дифтор-имидазо[1,5-a]пиридина в виде желтого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.36 (d, J=3,0 Гц, 1H), 7.84 (d, J=3,4 Гц, 1H), 7.65 (s, 1H), 6.39-6.57 (m, 1H).
Стадия 4
2-(6,8-Дифтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
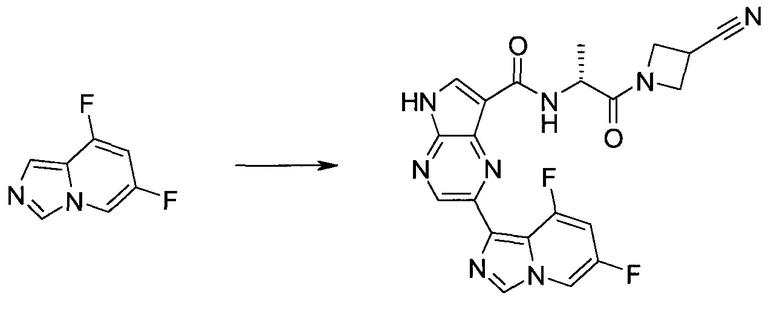
Получали в соответствии с методикой, приведенной в примере 31, стадии 4-7, заменяя 6,8-дифтор-имидазо[1,5-a]пиридин на 6-метил-имидазо[1,5-a]пиридин на стадии 4. MS: (M+H)+=451; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.39 (br. s., 1H), 9.03 (s, 1H), 8.70 (d, J=2,3 Гц, 1H), 8.63 (dd, J=4,2; 1,5 Гц, 1H), 8.54 (d, J=7,2 Гц, 1H), 8.41 (d, J=11,0 Гц, 1H), 7.21 (t, J=10,2 Гц, 1H), 4.40-4.74 (m, 3H), 4.08-4.24 (m, 1H), 3.95-4.07 (m, 1H), 3.74-3.90 (m, 1H), 1.31-1.44 (m, 3H).
Пример 34
2-(6-Фтор-3-метил-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
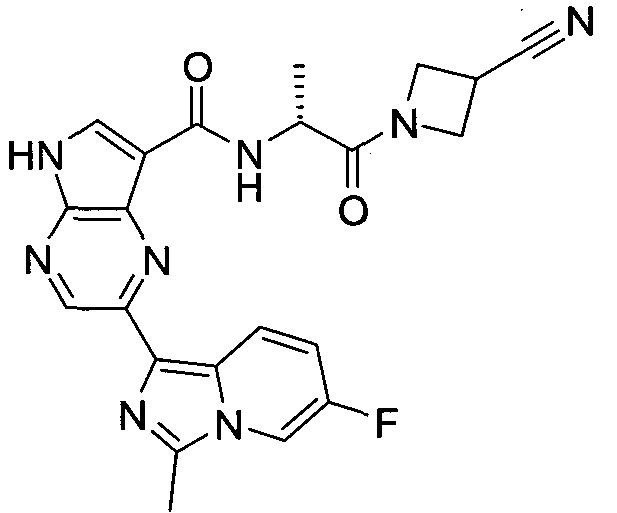
Стадия 1
(5-Фтор-пиридин-2-ил)-метиламина дигидрохлорид
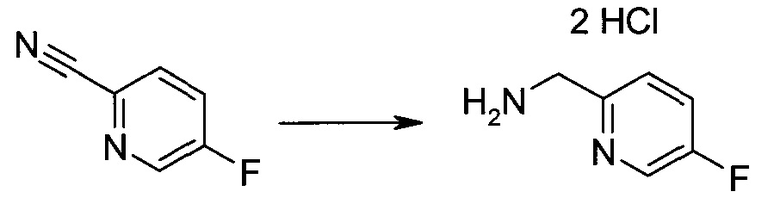
В сосуде Парра для работы под давлением растворяли 2-циано-5-фторпиридин (1,0 г; 8,2 ммоль) в этаноле (30 мл). Добавляли палладий на угле (10%-ный Pd (влажный); 290 мг; 2,73 ммоль), затем конц. HCl (2,3 мл; 28,0 ммоль). Сосуд помещали в автоклав Парра для гидрирования и встряхивали в течение 4 ч в атмосфере водорода (45 ф/кв. дюйм (310 кПа)). Реакционную смесь фильтровали через целит и промывали метанолом. Фильтрат концентрировали, получая 1,61 г (99%) (5-фтор-пиридин-2-ил)-метиламина дигидрохлорида в виде светло-желтого твердого вещества, которое использовали без дополнительной очистки.
Стадия 2
N-(5-Фтор-пиридин-2-илметил)-ацетамид
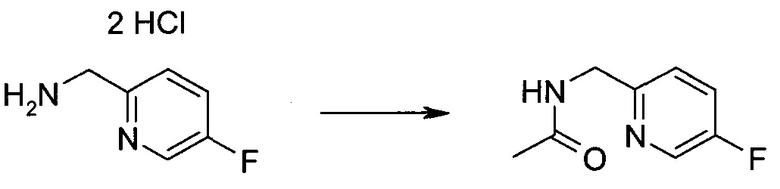
В круглодонной колбе суспендировали (5-фторпиридин-2-ил)метиламина дигидрохлорид (800 мг; 4,0 ммоль) в THF (15 мл). Суспензию охлаждали до 0°C и добавляли триэтиламин (1,75 мл; 12,6 ммоль), затем по каплям добавляли ацетилхлорид (0,30 мл; 4,22 ммоль). По завершении добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакцию гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 654 мг (97%) N-(5-фтор-пиридин-2-илметил)-ацетамида в виде светло-коричневого масла, которое использовали без дополнительной очистки.
Стадия 3
6-Фтор-3-метил-имидазо[1,5-a]пиридин
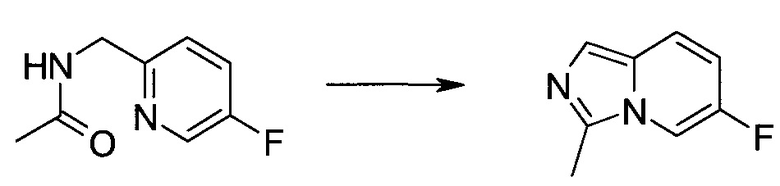
В круглодонной колбе растворяли N-(5-фтор-пиридин-2-илметил)-ацетамид (653 мг; 3,88 ммоль) в толуоле (19 мл) и добавляли оксихлорид фосфора (0,66 мл; 7,1 ммоль). Реакционную смесь перемешивали при 100°C в масляной бане в течение ночи, затем охлаждали до 0°C и осторожно гасили, используя лед. Добавляли 25%-ный водный гидроксид аммония до pH примерно 9. Смесь разбавляли водой и экстрагировали дихлорметаном (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-70% EtOAc), получая 255 мг (44%) 6-фтор-3-метил-имидазо[1,5-a]пиридина в виде желтого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.61 (d, J=5,3 Гц, 1H), 7.38-7.50 (m, 2H), 6.67 (ddd, J=9,7; 7,6; 1,9 Гц, 1H), 2.66 (s, 3H).
Стадия 4
2-(6-Фтор-3-метил-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
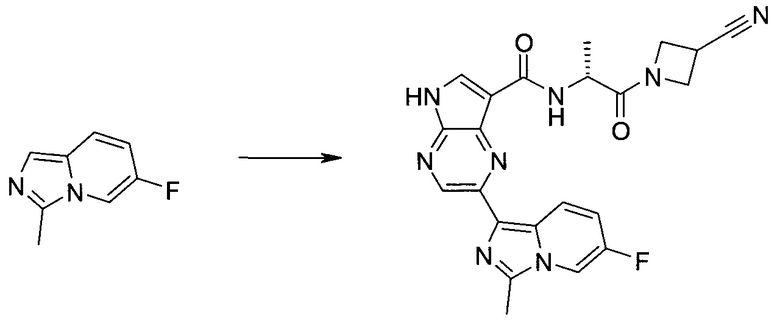
Получали в соответствии с методикой, приведенной в примере 31, стадии 4-7, заменяя 6-фтор-3-метил-имидазо[1,5-a]пиридин на 6-метил-имидазо[1,5-a]пиридин на стадии 4. MS: (M+H)+=447; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.53 (br. s., 1H), 9.09 (s, 1H), 8.61-8.76 (m, 1H), 8.28-8.54 (m, 3H), 7.01 (br. s., 1H), 4.45-4.81 (m, 3H), 4.19-4.32 (m, 1H), 4.14 (br. s., 1H), 3.87 (br. s., 1H), 2.67 (s, 3H), 1.39(br. s.,3H).
Пример 35
2-(6-Фтор-3-гидроксиметил-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
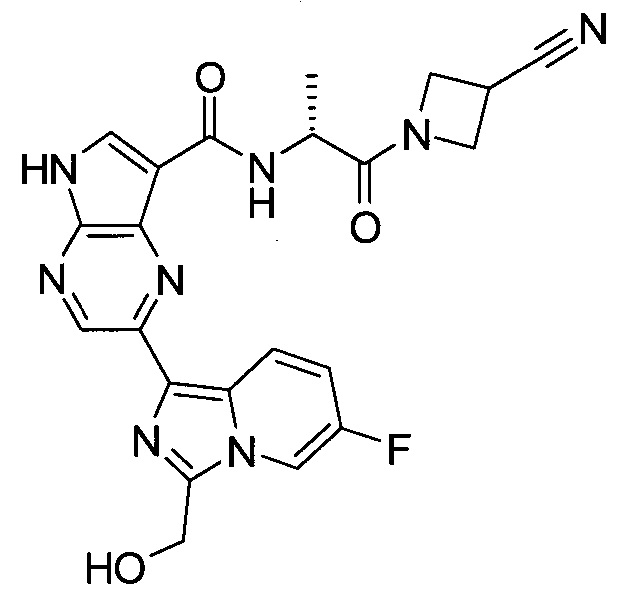
Стадия 1
N-(5-Фтор-пиридин-2-илметил)-оксаминовой кислоты метиловый эфир
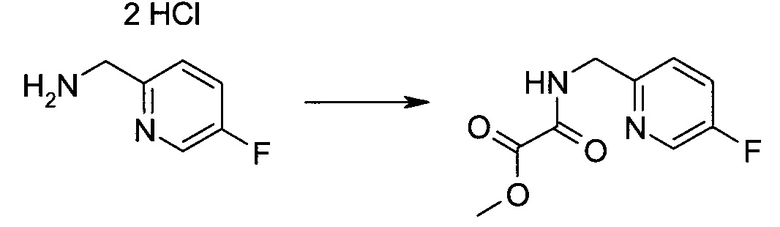
В круглодонной колбе суспендировали (5-фторпиридин-2-ил)метиламина дигидрохлорид (800 мг; 4,0 ммоль) в THF (15 мл). Суспензию охлаждали до 0°C и добавляли триэтиламин (1,75 мл; 12,6 ммоль), затем по каплям добавляли метилоксалилхлорид (0,40 мл; 4,18 ммоль). По завершении добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в
течение 2,5 ч. Реакцию гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая N-(5-фтор-пиридин-2-илметил)-оксаминовой кислоты метиловый эфир в виде светло-коричневого масла, которое использовали без дополнительной очистки.
Стадия 2
6-Фтор-имидазо[1,5-a]пиридин-3-карбоновой кислоты метиловый эфир
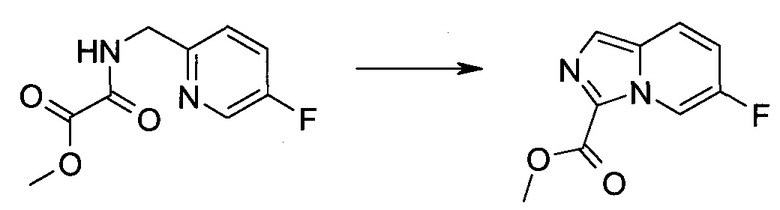
В круглодонной колбе растворяли N-(5-фтор-пиридин-2-илметил)-оксаминовой кислоты метиловый эфир (неочищенный со стадии 1) в толуоле (8 мл) и добавляли оксихлорид фосфора (1,5 мл; 16,1 ммоль). Реакционную смесь перемешивали при 105°C в масляной бане в течение ночи, затем охлаждали до 0°C и осторожно гасили, используя лед. Добавляли 25%-ный водный гидроксид аммония до pH примерно 9. Смесь разбавляли водой и экстрагировали дихлорметаном (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси EtOAc/гексаны (градиент 0-50% EtOAc), получая 230 мг (31%, за 2 стадии) 6-фтор-имидазо[1,5-a]пиридин-3-карбоновой кислоты метилового эфира в виде светло-коричневого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 9.33 (dd, J=5,1; 1,3 Гц, 1H), 7.75 (s, 1H), 7.69 (dd, J=9,8; 5,3 Гц, 1H), 7.09 (ddd, J=9,7; 7,5; 2,1 Гц, 1H), 4.06 (s, 3H).
Стадия 3
(6-Фтор-имидазо[1,5-a]пиридин-3-ил)-метанол
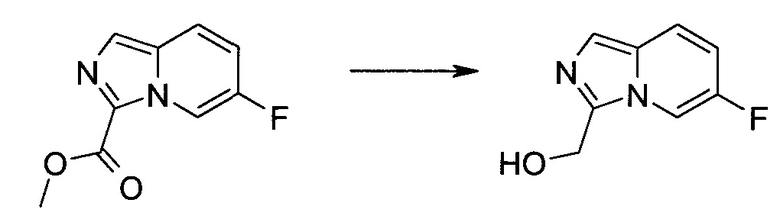
В круглодонной колбе растворяли 6-фтор-имидазо[1,5-a]пиридин-3-карбоновой кислоты метиловый эфир (223 мг; 1,15 ммоль) в THF (7 мл). Раствор охлаждали до 0°C и по каплям добавляли алюмогидрид лития (1,0 М в THF; 1,4 мл; 1,4 ммоль). Реакционную смесь перемешивали при 0°C в течение 1,5 ч, затем осторожно добавляли сульфат натрия декагидрат. Когда выделение газа
прекращалось, ледяную баню удаляли, добавляли сульфат натрия и смесь интенсивно перемешивали в течение 30 мин при комнатной температуре. Суспензию фильтровали через целит и промывали этилацетатом и метанолом. Фильтрат концентрировали, получая 225 мг (6-фтор-имидазо[1,5-a]пиридин-3-ил)-метанола в виде коричневого твердого вещества, которое использовали без дополнительной очистки.
Стадия 4
(6-Фтор-1-иод-имидазо[1,5-a]пиридин-3-ил)-метанол
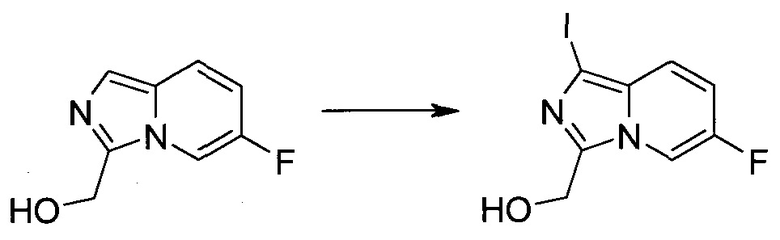
В круглодонной колбе растворяли (6-фтор-имидазо[1,5-a]пиридин-3-ил)-метанол (225 мг; 1,15 ммоль) в этаноле (2 мл) и воде (1 мл). Добавляли бикарбонат натрия (341 мг; 4,06 ммоль), затем йод (383 мг; 1,51 ммоль). Темно-коричневую суспензию перемешивали при комнатной температуре в течение 3 ч, затем гасили 10%-ным раствором Na2S2O3 и экстрагировали EtOAc (2×). Органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси EtOAc/гексаны (градиент 0-40% EtOAc), получая 157 мг (50%, 2 стадии) (6-фтор-1-иод-имидазо[1,5-a]пиридин-3-ил)-метанола в виде светло-желтого твердого вещества.
Стадия 5
(6-Фтор-1-трибутилстаннанил-имидазо[1,5-a]пиридин-3-ил)-метанол
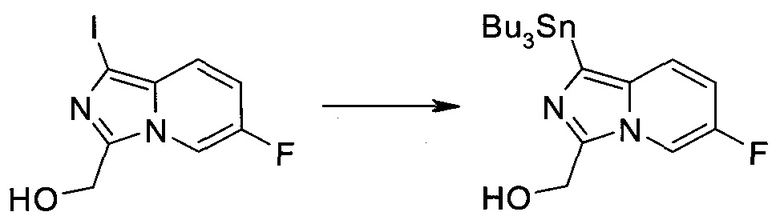
В круглодонной колбе растворяли (6-фтор-1-иод-имидазо[1,5-a]пиридин-3-ил)-метанол (156 мг; 0,53 ммоль) в THF (4 мл). Добавляли гидрид натрия (60%-ную дисперсию в минеральном масле; 26 мг; 0,65 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 10 мин. Реакционную смесь охлаждали до -16°C (баня со смесью NaCl/лед) и по каплям добавляли хлорид изопропилмагния (2,0 М в THF; 0,32 мл; 0,64 ммоль). Реакционную смесь перемешивали при -16°C в течение 25 мин, затем медленно добавляли трибутилхлорстаннан (0,17 мл; 0,63 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1,5 ч, затем
гасили насыщенным водным NH4Cl и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая (6-фтор-1-трибутилстаннанил-имидазо[1,5-a]пиридин-3-ил)-метанол в виде коричневого полутвердого вещества, которое использовали без дополнительной очистки.
Стадия 6
2-(6-Фтор-3-гидроксиметил-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
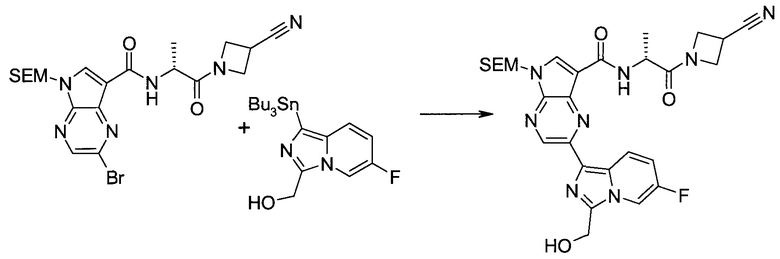
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (100 мг; 0,20 ммоль) и (6-фтор-1-трибутилстаннанил-имидазо[1,5-a]пиридин-3-ил)-метанол (неочищенный со стадии 5) в DMF (2 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенилфосфин)палладий(0) (12 мг; 0,010 ммоль) и иодид меди(I) (8 мг; 0,042 ммоль). Реакционную смесь перемешивали при 90°C в масляной бане в течение 3 ч, затем охлаждали до комнатной температуры, гасили водой и экстрагировали дихлорметаном (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-3% MeOH), получая 83 мг (71%) 2-(6-фтор-3-гидроксиметил-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-коричневого твердого вещества.
Стадия 7
2-(6-Фтор-3-гидроксиметил-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
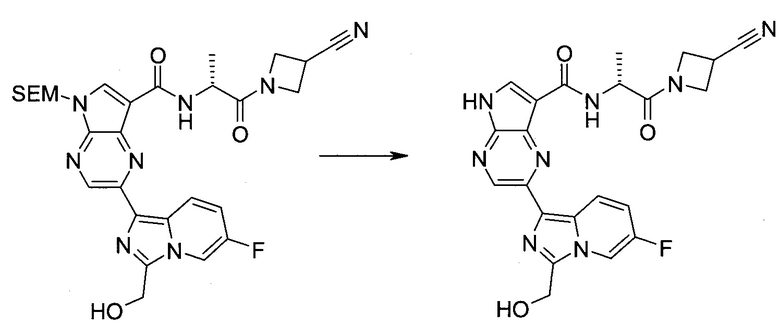
В круглодонной колбе растворяли 2-(6-фтор-3-гидроксиметил-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (82 мг; 0,138 ммоль) в дихлорметане (0,7 мл) и добавляли трифторуксусную кислоту (0,43 мл; 5,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,7 мл) и добавляли этилендиамин (0,56 мл; 8,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли дихлорметаном. Полученный осадок отфильтровывали, промывая водой и дихлорметаном, затем сушили под высоким вакуумом, получая 46 мг (68%) 2-(6-фтор-3-гидроксиметил-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде желтого порошка. MS: (M+H)+=463; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.30 (br. s, 1H), 9.12 (s, 1H), 8.79 (dd, J=9,6; 3,2 Гц, 1H), 8.55 (d, J=4,9 Гц, 1H), 8.44 (d, J=7,9 Гц, 1H), 8.40 (d, J=5,7 Гц, 1H), 7.07-7.17 (m, 1H), 5.61 (t, J=5,7 Гц, 1H), 4.94 (d, J=5,3 Гц, 2H), 4.50-4.81 (m, 3H), 4.20-4.32 (m, 1H), 4.14 (dt, J=10,3; 5,2 Гц, 1H), 3.81-3.93 (m, 1H), 1.40 (t, J=6,0 Гц, 3H).
Пример 36
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,3R)-3-циано-циклопентил)-амид
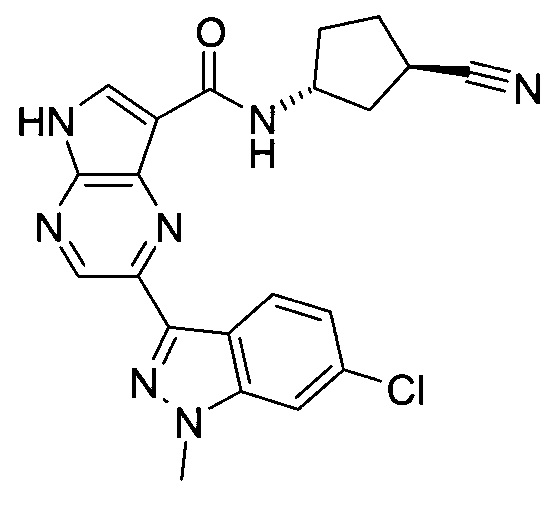
Стадия 1
((1R,3R)-3-Карбамоил-циклопентил)-карбаминовой кислоты трет-бутиловый эфир
В круглодонной колбе суспендировали в DMF (6 мл) (1R,3R)-N-Boc-1-аминоциклопентан-3-карбоновую кислоту (300 мг; 1,31 ммоль) и хлорид аммония (210 мг; 3,93 ммоль). Добавляли HATU (547 мг; 1,44 ммоль) и N,N-диизопропилэтиламин (0,80 мл; 4,58 ммоль) и желтую суспензию перемешивали при комнатной температуре в течение 72 ч. Реакционную смесь гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 97 мг (33%) ((1R,3R)-3-карбамоил-циклопентил)-карбаминовой кислоты трет-бутилового эфира в виде белого твердого вещества.
Стадия 2
((1R,3R)-3-Циано-циклопентил)-карбаминовой кислоты трет-бутиловый эфир
В круглодонной колбе суспендировали в THF (2,5 мл) ((1R,3R)-3-карбамоил-циклопентил)-карбаминовой кислоты трет-бутиловый эфир (96 мг; 0,42 ммоль). Реакционную смесь охлаждали до 0°C и добавляли триэтиламин (0,28 мл; 2,01 ммоль), затем трифторуксусный ангидрид (0,095 мл; 0,67 ммоль). Гомогенную реакционную смесь перемешивали при 0°C в течение 1,5 ч, затем гасили водой и экстрагировали дихлорметаном (2×). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали, получая ((1R,3R)-3-циано-циклопентил)-карбаминовой кислоты трет-бутиловый эфир в виде беловатого воскообразного твердого вещества, которое содержало некоторое количество триэтиламина трифторацетата в качестве основной примеси. Это вещество использовали без дополнительной очистки.
Стадия 3
(1R,3R)-3-Амино-циклопентанкарбонитрила трифторацетат
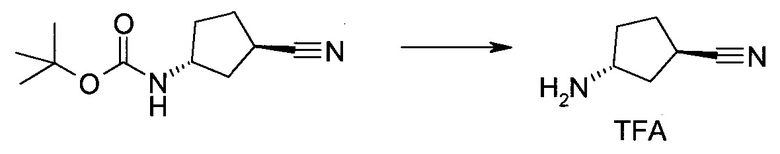
В круглодонной колбе растворяли ((1R,3R)-3-циано-циклопентил)-карбаминовой кислоты трет-бутиловый эфир (неочищенный со стадии 2) в дихлорметане (2,5 мл). Раствор охлаждали до 0°C и медленно добавляли трифторуксусную кислоту (1,1 мл; 14,3 ммоль). По завершении добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали, получая (1R,3R)-3-амино-циклопентанкарбонитрила трифторацетат в виде светло-коричневого масла, которое использовали без дополнительной очистки.
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,3R)-3-циано-циклопентил)-амид
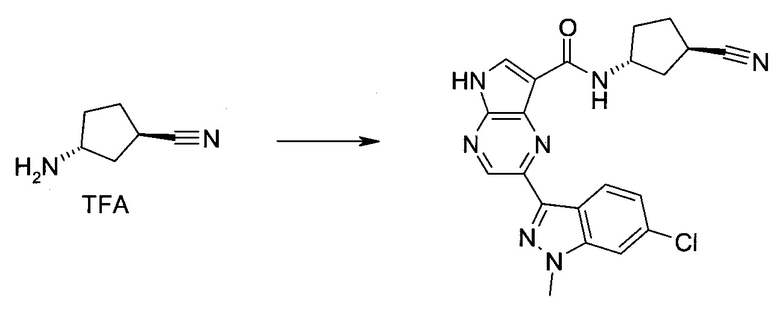
Получали в соответствии с методикой, приведенной в примере 14, стадии 5-6, заменяя (1R,3R)-3-амино-циклопентанкарбонитрила трифторацетат на (R)-2-амино-1-(3,3-дифтор-азетидин-1-ил)-пропан-1-он на стадии 5. MS: (M+H)+=420; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.48 (br. s, 1H), 9.08 (s, 1H), 8.44 (s, 1H), 8.42 (d, J=8,7 Гц, 1H), 8.13 (d, J=6,8 Гц, 1H),8.00(s, 1H), 7.35 (dd, J=8,7; 1,5 Гц, 1H), 4.44-4.58 (m, 1H), 4.17 (s, 3H), 3.22-3.29 (m, 1H), 2.19-2.39 (m, 3H), 1.99-2.12 (m, 1H), 1.81-1.97 (m, 1H), 1.62-1.76 (m, 1H).
Пример 37
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-амино-циклопентил)-амид
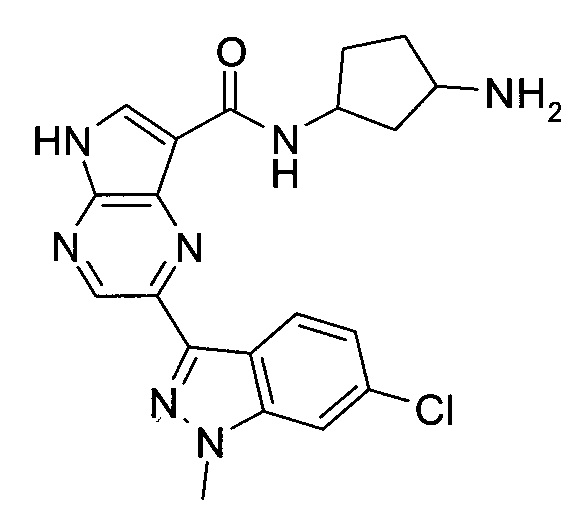
Стадия 1
(3-{[2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-циклопентил)-карбаминовой кислоты трет-бутиловый эфир
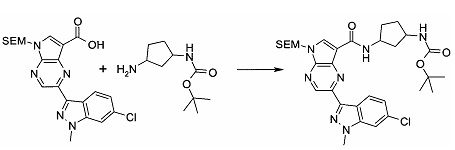
В круглодонную колбу загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (300 мг; 0,66 ммоль) и гидрохлорид (3-аминоциклопентил)-карбаминовой кислоты трет-бутилового эфира (233 мг; 0,98 ммоль). Добавляли DMF (3 мл), затем HATU (274 мг; 0,72 ммоль) и N,N-диизопропилэтиламин (0,30 мл; 1,72 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли дополнительное количество DMF (2 мл) и светло-желтую суспензию перемешивали при комнатной температуре в течение ночи. Добавляли воду и полученную суспензию фильтровали, промывали водой и петролейным эфиром и сушили под высоким вакуумом, получая 413 мг (99%) (3-{[2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-циклопентил)-карбаминовой кислоты трет-бутилового эфира в виде беловатого порошка. С использованием ЯМР-анализа определяли, что выделенный продукт представлял собой единичный диастереомер с неизвестной относительной стереохимией.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-амино-циклопентил)-амид
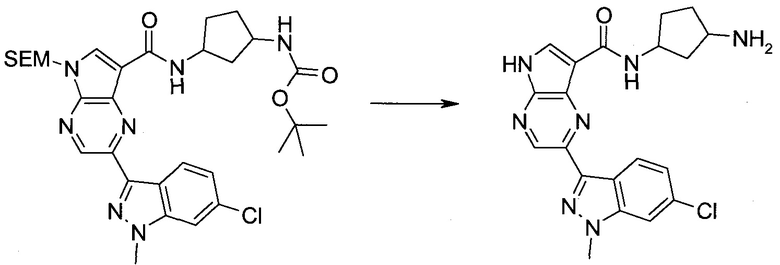
В круглодонной колбе растворяли (3-{[2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-циклопентил)-карбаминовой кислоты трет-бутиловый эфир (80 мг; 0,125 ммоль) в дихлорметане (0,7 мл) и добавляли трифторуксусную кислоту (0,4 мл; 5,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3,5 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,7 мл) и добавляли этилендиамин (0,5 мл; 7,5 ммоль). Раствор перемешивали при комнатной температуре в течение 2 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 40 мг (74%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-амино-циклопентил)-амида в виде беловатого порошка. MS: (M+H)+=410; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 9.07 (s, 1H), 8.55 (d, J=8,7 Гц, 1H),8.40(s, 1H), 8.24 (d, J=7,6 Гц, 1H), 7.99 (s, 1H), 7.40 (d, J=9,1 Гц, 1H), 5.54 (br. s, 2H), 4.34-4.45 (m, 1H), 4.17 (s, 3H), 3.36-3.44 (m, 1H), 2.25-2.37 (m, 1H), 2.03-2.16 (m, 1H), 1.71-1.88 (m, 2H), 1.51-1.62 (m, 1H), 1.32-1.43 (m, 1H). С использованием ЯМР-анализа определяли, что выделенный продукт представлял собой единичный диастереомер с неизвестной относительной стереохимией.
Пример 38
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-метансульфониламино-циклопентил)-амид
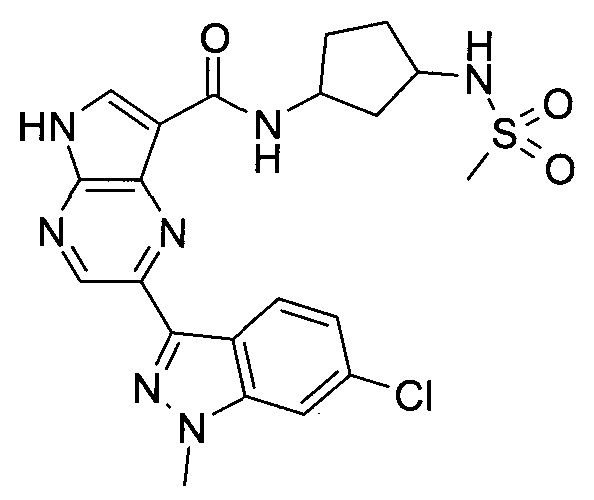
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-амино-циклопентил)-амида гидрохлорид
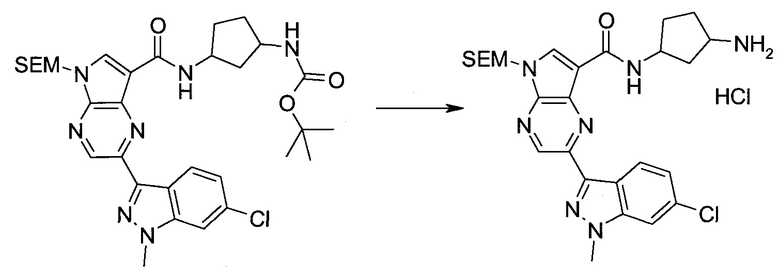
В круглодонной колбе суспендировали (3-{[2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-циклопентил)-карбаминовой кислоты трет-бутиловый эфир (150 мг; 0,23 ммоль) в метаноле (2 мл). Реакционную смесь охлаждали до 0°C и по каплям добавляли ацетилхлорид (0,33 мл; 4,64 ммоль). Ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч. Растворитель выпаривали при комнатной температуре и остаток сушили под высоким вакуумом, получая 147 мг (98%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-амино-циклопентил)-амида гидрохлорида в виде светло-желтого твердого вещества.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-метансульфониламино-циклопентил)-амид
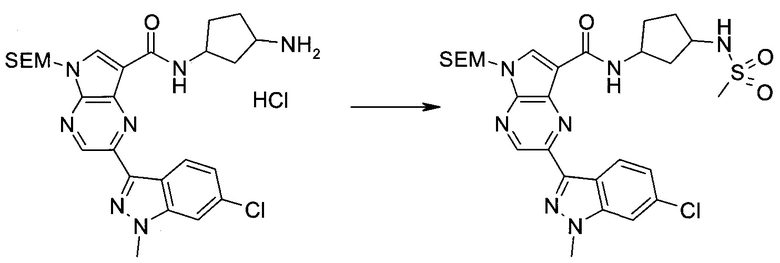
В круглодонной колбе суспендировали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-амино-циклопентил)-амида гидрохлорид (145 мг; 0,23 ммоль) в дихлорметане (2,5 мл). Суспензию охлаждали до 0°C и добавляли триэтиламин (0,10 мл; 0,72 ммоль), затем метансульфонилхлорид (0,02 мл; 0,26 ммоль).
Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали дихлорметаном (2×). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-5% MeOH), получая 111 мг (79%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-метансульфониламино-циклопентил)-амида в виде светло-желтого твердого вещества.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-метансульфониламино-циклопентил)-амид
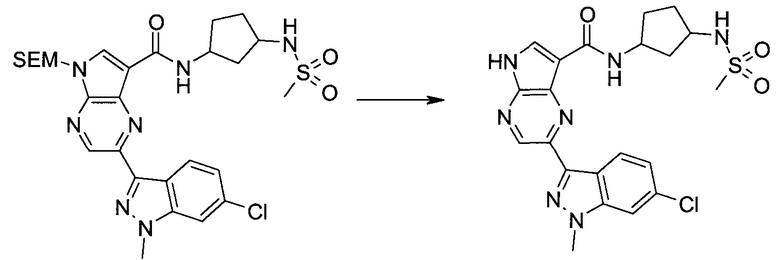
В круглодонной колбе растворяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-метансульфониламино-циклопентил)-амид (109 мг; 0,176 ммоль) в дихлорметане (0,9 мл) и добавляли трифторуксусную кислоту (0,54 мл; 7,0 ммоль). Оранжевый раствор перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,9 мл) и добавляли этилендиамин (0,7 мл; 10,5 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 1,5 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 76 мг (88%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-метансульфониламино-циклопентил)-амида в виде беловатого порошка. MS: (M+H)+=488; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.30 (br. s, 1H), 9.11 (s, 1H), 8.42-8.52 (m, 2H), 8.17 (d, J=7,2 Гц, 1H), 8.02 (s, 1H), 7.41 (dd, J=8,7; 1,5 Гц, 1H), 7.31 (d, J=7,2 Гц, 1H), 4.27-4.40 (m, 1H), 4.18 (s, 3H), 3.67-3.82 (m, 1H), 2.92 (s, 3H), 2.53-2.63 (m, 1H), 1.97-2.20 (m, 2H), 1.65-1.81 (m, 2H), 1.55 (dt, J=12,3; 9,0 Гц, 1H).
Пример 39
2-(3-Хлор-6-фтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
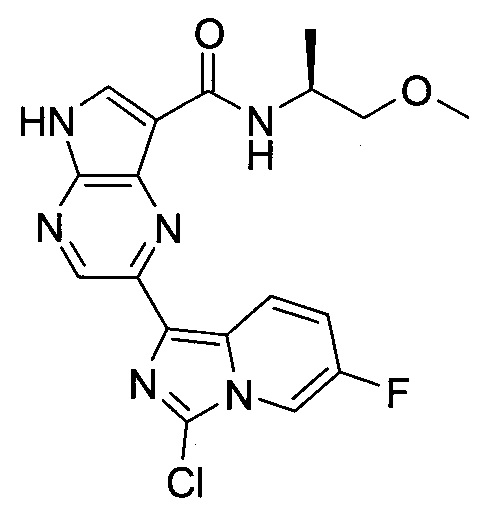
Стадия 1
2-(6-Фтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
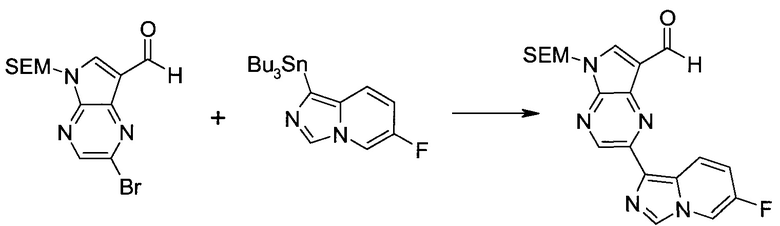
В круглодонной колбе растворяли 6-фтор-1-трибутилстаннил-имидазо[1,5-a]пиридин (577 мг; 0,81 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (210 мг; 0,59 ммоль) в DMF (5 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенил-фосфин)палладий(0) (33 мг; 0,029 ммоль) и иодид меди(I) (22 мг; 0,12 ммоль). Реакционную смесь перемешивали при 80°C в масляной бане в течение 4 ч, затем охлаждали до комнатной температуры. Добавляли воду и полученную суспензию фильтровали. Осадок на фильтре промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 256 мг (95%) 2-(6-фтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида в виде желтого порошка.
Стадия 2
2-(3-Хлор-6-фтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
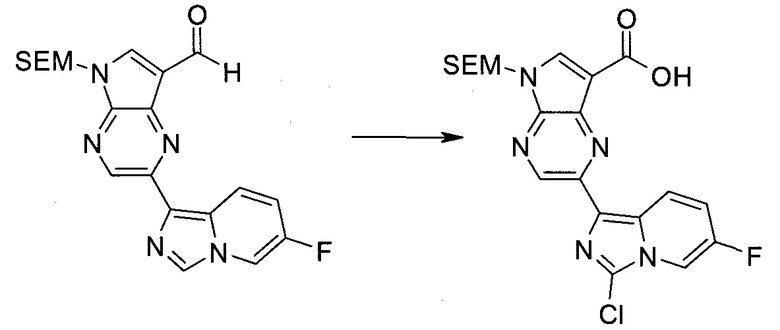
В круглодонной колбе суспендировали 2-(6-фтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (254 мг; 0,55 ммоль) в THF (10 мл) и воде (2 мл). Суспензию охлаждали до 0°C и добавляли сульфаминовую кислоту (324 мг; 3,33 ммоль). Затем по каплям в течение 10 мин добавляли раствор хлорита натрия (80%; 88 мг; 0,78 ммоль) и дигидрофосфата калия (907 мг; 6,67 ммоль) в воде (6 мл). По завершении добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток растирали с гексанами, получая 184 мг 2-(3-хлор-6-фтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты в виде светло-зеленого порошка, который использовали без дополнительной очистки.
Стадия 3
2-(3-Хлор-6-фтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
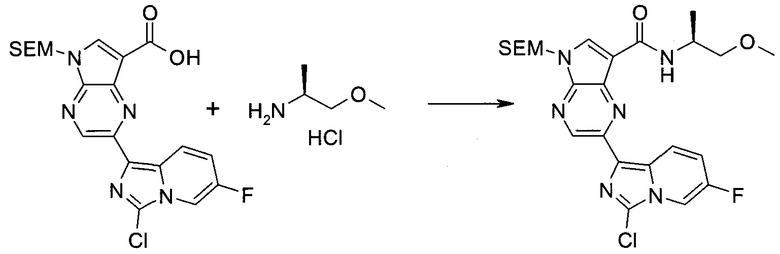
В круглодонную колбу загружали 2-(3-хлор-6-фтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (90 мг; 0,16 ммоль) и (S)-1-метоксипропан-2-амина гидрохлорид (40 мг; 0,32 ммоль). Добавляли DMF (1 мл), затем N,N-диизопропилэтиламин (0,1 мл; 0,57 ммоль) и HATU (71 мг; 0,19 ммоль).
Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем добавляли воду. Полученную суспензию фильтровали, промывая водой и петролейным эфиром. Коричневый порошок хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-2% MeOH), получая 37 мг (44%) 2-(3-хлор-6-фтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде желтого твердого вещества.
Стадия 4
2-(3-Хлор-6-фтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
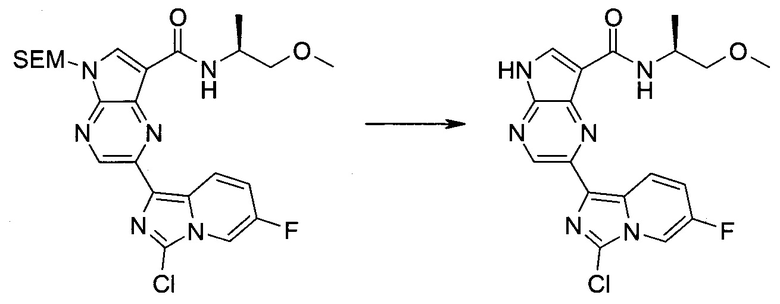
В круглодонной колбе растворяли 2-(3-хлор-6-фтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (36 мг; 0,068 ммоль) в дихлорметане (0,4 мл) и добавляли трифторуксусную кислоту (0,22 мл; 2,86 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,4 мл) и добавляли этилендиамин (0,3 мл; 4,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 21 мг (77%) 2-(3-хлор-6-фтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде желтого порошка. MS: (M+H)+=403; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.01 (br. s, 1H), 9.03 (s, 1H), 8.58 (d, J=3,8 Гц, 1H), 8.49 (dd, J=10,0; 5,5 Гц, 1H), 8.40 (s, 1H), 8.10 (d, J=8,3 Гц, 1H), 7.18-7.29 (m, 1H), 4.39 (d, J=7,9 Гц, 1H), 3.50 (qd, J=9,9; 4,3 Гц, 2H), 3.30 (s, 3H), 1.31 (d, J=6,8 Гц, 3H).
Пример 40
2-(6,8-Дифтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
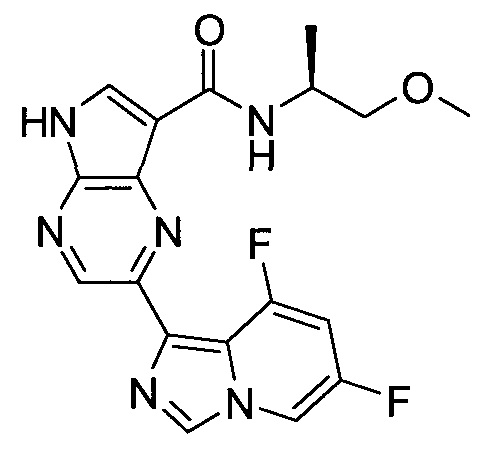
Стадия 1
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
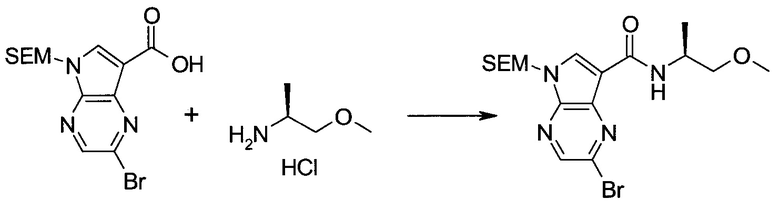
В круглодонной колбе объединяли 2-бром-5-((2-(триметилсилил)этокси)-метил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (120 мг; 0,32 ммоль) и (S)-1-метоксипропан-2-амина гидрохлорид (61 мг; 0,49 ммоль). Добавляли DMF (1,5 мл), затем N,N-диизопропилэтиламин (0,15 мл; 0,86 ммоль) и HATU (135 мг; 0,36 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем добавляли воду. Полученную суспензию фильтровали, осадок на фильтре промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 129 мг (90%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде беловатого порошка.
Стадия 2
2-(6,8-Дифтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
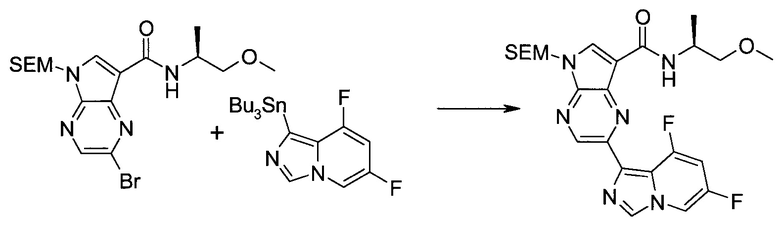
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-
метил-этил)-амид (125 мг; 0,28 ммоль) и 6,8-дифтор-1-трибутилстаннил-имидазо[1,5-a]пиридин (458 мг; 0,62 ммоль) в DMF (2,5 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенилсросфин)палладий(0) (17 мг; 0,015 ммоль) и иодид меди(I) (11 мг; 0,058 ммоль). Реакционную смесь перемешивали при 90°C в масляной бане в течение 1,5 ч, затем охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток дважды хроматографировали через силикагель с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-3% MeOH), получая 136 мг (89%) 2-(6,8-дифтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде желтого твердого вещества.
Стадия 3
2-(6,8-Дифтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
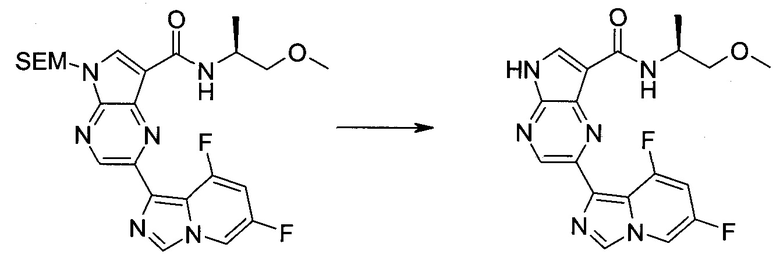
В круглодонной колбе растворяли 2-(6,8-дифтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (134 мг; 0,25 ммоль) в дихлорметане (1,2 мл) и добавляли трифторуксусную кислоту (0,75 мл; 9,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (1,2 мл) и добавляли этилендиамин (1,0 мл; 14,8 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 74 мг (78%) 2-(6,8-дифтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде желтого порошка. MS: (M+H)+=387; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.14 (br. s., 1H), 9.03 (s, 1H), 8.70 (d, J=1,9 Гц, 1H), 8.63 (dd, J=4,2; 1,9 Гц, 1H), 8.37 (s, 1H), 8.29 (d, J=8,3 Гц, 1H),
7.24-7.36 (m, 1H), 4.32 (dt, J=13,2; 6,6 Гц, 1H), 3.42-3.51 (m, 1H), 3.35-3.41 (m, 1H), 3.25 (s, 3H), 1.24 (d, J=6,8 Гц, 3H).
Пример 41
2-(6-Фтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
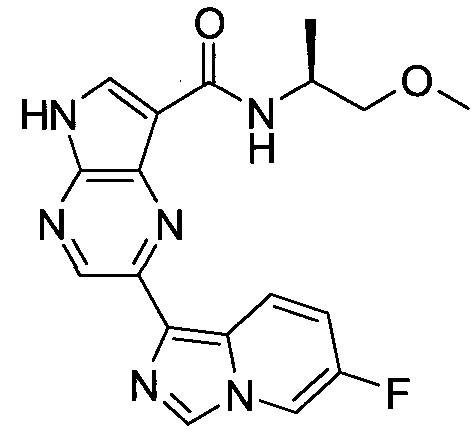
Получали в соответствии с методикой, приведенной в примере 40, стадии 2-3, заменяя 6-фтор-1-трибутилстаннил-имидазо[1,5-a]пиридин на 6,8-дифтор-1-трибутилстаннил-имидазо[1,5-a]пиридин на стадии 2. MS: (M+H)+=369; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.15 (br. s., 1H), 9.11 (s, 1H), 8.68-8.75 (m, 1H), 8.54 (s, 1H), 8.44 (dd, J=9,8; 5,7 Гц, 1H), 8.35 (s, 1H), 8.16 (d, J=8,7 Гц, 1H), 7.08-7.18 (m, 1H), 4.39 (d, J=7,2 Гц, 1H), 3.49 (qd, J=9,8; 4,5 Гц, 2H), 3.30 (s, 3H), 1.31 (d, J=6,8 Гц, 3H).
Пример 42
2-(6-Фтор-3-метансульфонил-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
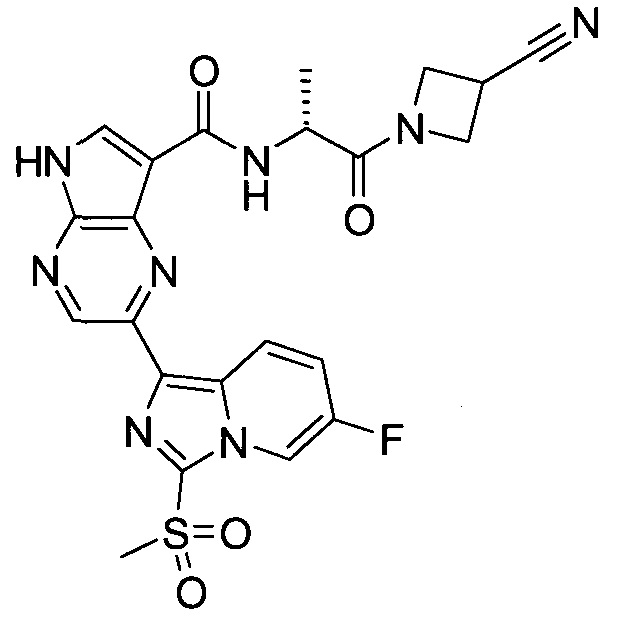
Стадия 1
6-Фтор-2H-имидазо[1,5-a]пиридин-3-тион
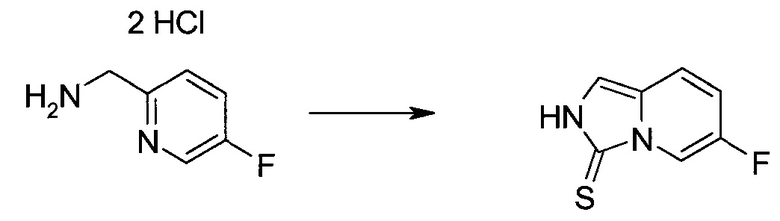
В круглодонной колбе суспендировали (5-фторпиридин-2-ил)метиламина дигидрохлорид (600 мг; 3,0 ммоль) в метаноле (16 мл). Добавляли триэтиламин (1,4 мл; 10,0 ммоль), затем сероуглерод (1,4 мл; 23,2 ммоль). Реакционную смесь перемешивали при температуре дефлегмации (температура масляной бани 75°C) в течение ночи, затем охлаждали до комнатной температуры и далее концентрировали. Остаток распределяли между дихлорметаном и водой. Водный слой экстрагировали дихлорметаном, затем органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси EtOAc/гексаны (градиент 0-60% EtOAc), получая 169 мг (33%) 6-фтор-2H-имидазо[1,5-a]пиридин-3-тиона в виде оранжевого твердого вещества. 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 13.47 (br. s., 1H), 8.04 (dd, J=4,9; 1,1 Гц, 1H), 7.43-7.56 (m, 2H), 6.88 (ddd, J=10,0; 7,9; 2,1 Гц, 1H).
Стадия 2
6-Фтор-3-метилсульфанил-имидазо[1,5-a]пиридин
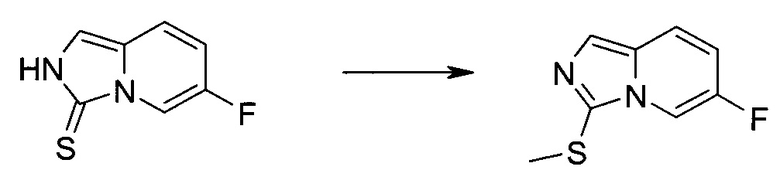
В круглодонной колбе суспендировали 6-фтор-2Н-имидазо[1,5-a]пиридин-3-тион (158 мг; 0,94 ммоль) в метаноле (1 мл) и по каплям добавляли метилат натрия (0,5 М в MeOH; 2,0 мл; 1,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин, затем по каплям добавляли метилиодид (0,07 мл; 1,12 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток распределяли между дихлорметаном и водой. Водный слой экстрагировали дихлорметаном, затем органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали, получая 179 мг 6-фтор-3-метилсульфанил-имидазо[1,5-a]пиридина в виде коричневого масла, которое использовали без дополнительной очистки. 1H ЯМР (CDCl3, 400 МГц): δ (млн-1) 7.98-8.05 (m, 1H), 7.58 (s, 1H), 7.45 (dd, J=9,3; 4,8 Гц, 1H), 6.73 (ddd, J=9,6; 7,6; 2,0 Гц, 1H), 2.56 (s, 3H).
Стадия 3
6-Фтор-1-иод-3-метилсульфанил-имидазо[1,5-a]пиридин

В круглодонной колбе растворяли 6-фтор-3-метилсульфанил-имидазо[1,5-a]пиридин (178 мг; 0,88 ммоль) в этаноле (1,6 мл). Добавляли воду (0,8 мл), бикарбонат натрия (278 мг; 3Д31 ммоль) и йод (312 мг; 1Д23 ммоль). Темно-коричневую суспензию перемешивали при комнатной температуре в течение ночи, затем гасили 10%-ным водным Na2S2O3 и экстрагировали EtOAc (2×). Объединенные органические слои промывали 10%-ным водным Na2S2O3, водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси EtOAc/гексаны (градиент 0-10% EtOAc), получая 110 мг (41%) 6-фтор-1-иод-3-метилсульфанил-имидазо[1,5-a]пиридина в виде коричневого твердого вещества.
Стадия 4
6-Фтор-3-метилсульфанил-1-трибутилстаннанил-имидазо[1,5-a]пиридин
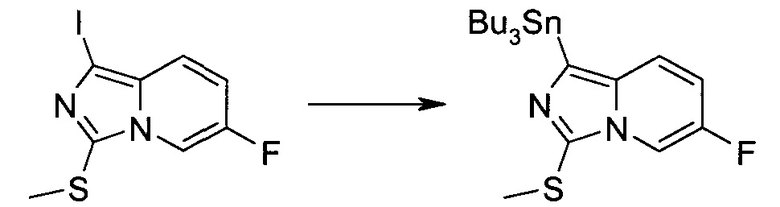
В круглодонной колбе растворяли 6-фтор-1-иод-3-метилсульфанил-имидазо[1,5-a]пиридин (109 мг; 0,35 ммоль) в THF (3 мл). Светло-коричневый раствор охлаждали до -16°C (баня со смесью NaCl/лед) и по каплям добавляли хлорид изопропилмагния (2,0 М в THF; 0,21 мл; 0,42 ммоль). Реакционную смесь перемешивали при -16°C в течение 20 мин, затем медленно добавляли трибутилхлорстаннан (0,11 мл; 0,40 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 2 ч, затем гасили насыщенным водным NH4Cl и экстрагировали этилацетатом (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 6-фтор-3-метилсульфанил-1-трибутилстаннанил-имидазо[1,5-a]пиридин в виде коричневого масла, которое использовали без дополнительной очистки.
Стадия 5
2-(6-Фтор-3-метилсульфанил-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
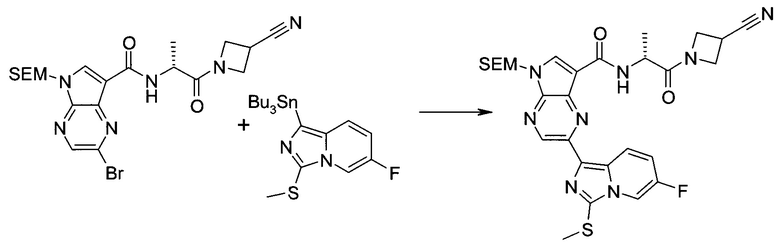
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (100 мг; 0,20 ммоль) и 6-фтор-3-метилсульфанил-1-трибутилстаннанил-имидазо[1,5-a]пиридин (неочищенный со стадии 4) в DMF (2 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенилфоссрин)палладий(0) (12 мг; 0,010 ммоль) и иодид меди(I) (8 мг; 0,042 ммоль). Реакционную смесь перемешивали при 80°C в масляной бане в течение ночи, затем охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-2,5% MeOH), получая 109 мг (82%) 2-(6-фтор-3-метилсульфанил-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде коричневого масла.
Стадия 6
2-(6-Фтор-3-метансульфонил-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
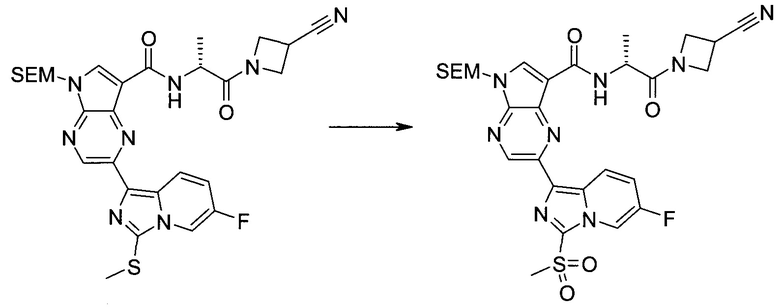
В круглодонной колбе растворяли 2-(6-фтор-3-метилсульфанил-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (105 мг; 0,155 ммоль) в дихлорметане (4 мл). Раствор охлаждали до 0°C и добавляли м-СРВА (75%; 79 мг; 0,343 ммоль). Ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли дополнительное количество м-СРВА (75%; 36 мг; 0,155 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли раствор 10%-ного водного Na2S2O3 (3 мл) и двухфазную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Органический слой промывали насыщенным водным NaHCO3. Водный слой экстрагировали дихлорметаном (2×). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-2,5% MeOH), получая 25 мг (25%) 2-(6-фтор-3-метансульфонил-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-коричневого масла.
Стадия 7
2-(6-Фтор-3-метансульфонил-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
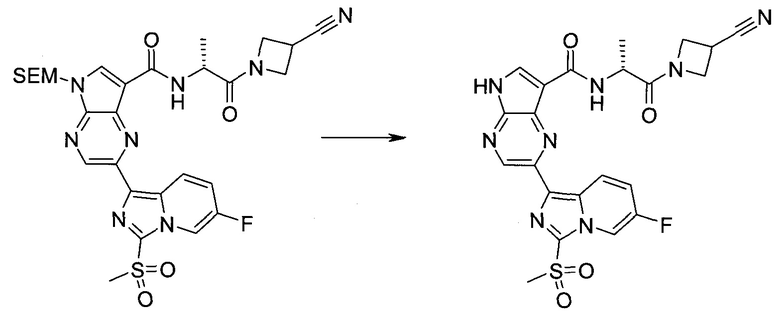
В круглодонной колбе растворяли 2-(6-фтор-3-метансульфонил-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (0,024 г; 37,5 мкмоль; 1,00 экв.) в дихлорметане (0,3 мл) и добавляли трифторуксусную кислоту (0,12 мл; 1,6 ммоль). Реакционную смесь
перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали. Остаток снова растворяли в смеси дихлорметан/метанол/гидроксид аммония (60:10:1) (3,5 мл). Раствор перемешивали при комнатной температуре в течение ночи, затем концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-7% MeOH), получая 6 мг (30%) 2-(6-фтор-3-метансульфонил-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде желтого твердого вещества. MS: (M+H)+=511; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.92 (br. s., 1H), 9.17 (s, 1H), 9.01-9.10 (m, 1H), 8.95 (d, J=3,0 Гц, 1H), 8.47-8.53 (m, 1H), 8.42 (d, J=7,6 Гц, 1H), 7.43-7.53 (m, 1H), 4.51-4.80 (m, 3H), 4.27 (q, J=9,6 Гц, 1H), 4.11-4.21 (m, 1H), 3.81-3.94 (m, 1H), 3.57 (s, 3H), 1.40 (t, J=6,4 Гц, 3H).
Пример 43
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-циано-азетидин-1-карбонил)-2,2-диметил-пропил]-амид
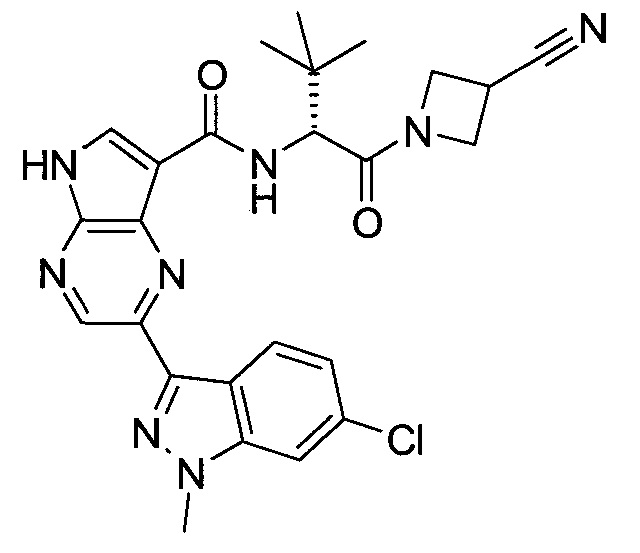
Стадия 1
[(R)-1-(3-Циано-азетидин-1-карбонил)-2,2-диметил-пропил]-карбаминовой кислоты трет-бутиловый эфир
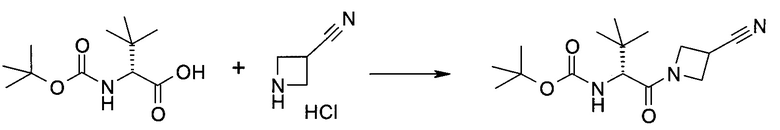
В круглодонную колбу загружали Boc-D-трет-лейцин (300 мг; 1,3 ммоль) и азетидин-3-карбонитрила гидрохлорид (231 мг; 1,95 ммоль). Добавляли DMF (6 мл), затем N,N-диизопропилэтиламин (0,68 мл; 3,9 ммоль) и HATU (543 мг; 1,43 ммоль). Светло-желтый раствор перемешивали при комнатной температуре в течение 48 часов, затем гасили водой и экстрагировали диэтиловым эфиром
(2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 458 мг [(R)-1-(3-циано-азетидин-1-карбонил)-2,2-диметил-пропил]-карбаминовой кислоты трет-бутилового эфира в виде светло-желтого масла.
Стадия 2
1-((R)-2-Амино-3,3-диметил-бутирил)-азетидин-3-карбонитрила трифторацетат
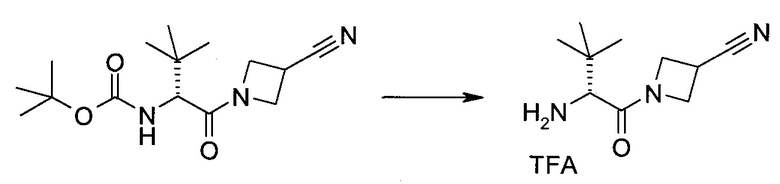
К раствору [(R)-1-(3-циано-азетидин-1-карбонил)-2,2-диметил-пропил]-карбаминовой кислоты трет-бутилового эфира (180 мг; 0,49 ммоль) в дихлорметане (3 мл) при 0°C добавляли трифторуксусную кислоту (1,2 мл; 15,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали, получая 1-((R)-2-амино-3,3-диметил-бутирил)-азетидин-3-карбонитрила трифторацетат в виде светло-желтого масла, которое использовали без дополнительной очистки.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-циано-азетидин-1-карбонил)-2,2-диметил-пропил]-амид
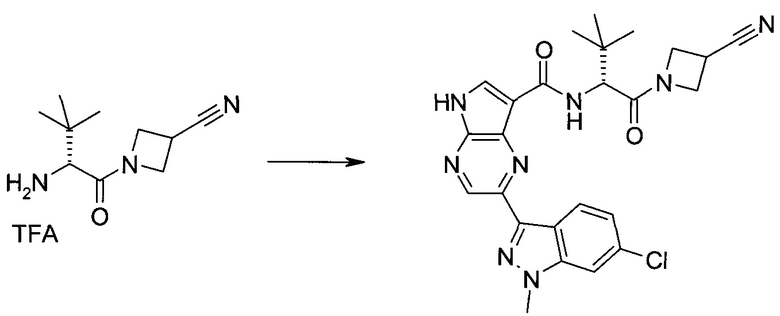
Получали в соответствии с методикой, приведенной в примере 14, стадии 5-6, заменяя 1-((R)-2-амино-3,3-диметил-бутирил)-азетидин-3-карбонитрила трифторацетат на (R)-2-амино-1-(3,3-дифтор-азетидин-1-ил)-пропан-1-он на стадии 5. MS: (M+H)+=505; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.92 (br. s, 1H), 9.15 (s, 1H), 8.90 (dd, J=8,5; 5,9 Гц, 1H), 8.54 (d, J=9,8 Гц, 1H), 8.49 (d, J=7,6
Гц, 1H), 7.94 (s, 1H),7.21 (d, J=8,7 Гц, 1H), 4.57-4.70 (m, 2H), 4.52 (m, 1H),4.17 (s, 3H), 4.07-4.31 (m, 2H), 3.76-3.95 (m, 1H), 1.01 (d, J=4,2 Гц, 9H).
Пример 44
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-фтор-1,2-диметил-пропил)-амид
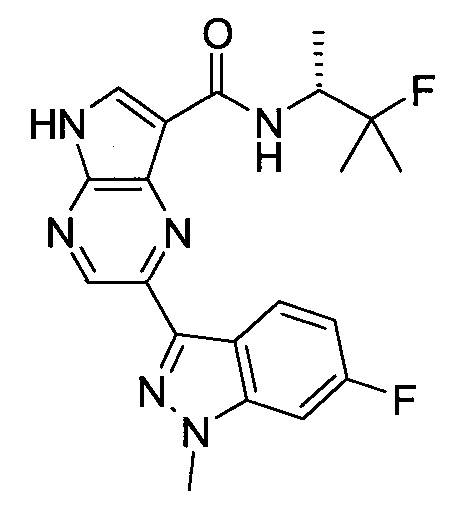
Стадия 1
((R)-2-Гидрокси-1,2-диметил-пропил)-карбаминовой кислоты трет-бутиловый эфир

К раствору метилового эфира Boc-D-аланина (5,00 г; 24,6 ммоль) в THF (100 мл) при 0°C медленно добавляли бромид метилмагния (3,0 М в Et2O; 28,7 мл; 86,1 ммоль). Полученную белую суспензию перемешивали при 0°C в течение 1 ч, затем при комнатной температуре в течение 2 ч. Реакционную смесь гасили насыщенным водным NH4Cl, разбавляли H2O и экстрагировали EtOAc. Объединенные органические экстракты промывали рассолом, сушили над MgSO4 и концентрировали, получая 4,93 г (99%) ((R)-2-гидрокси-1,2-диметил-пропил)-карбаминовой кислоты трет-бутилового эфира в виде бесцветного вязкого масла.
Стадия 2
((R)-2-Фтор-1,2-диметил-пропил)-карбаминовой кислоты трет-бутиловый эфир
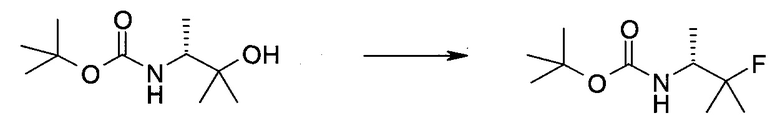
В сухой круглодонной колбе растворяли ((R)-2-гидрокси-1,2-диметил-пропил)-карбаминовой кислоты трет-бутиловый эфир (534 мг; 2,36 ммоль) в дихлорметане (22 мл). Раствор охлаждали до -76°C и по каплям добавляли DAST (0,34 мл; 2,57 ммоль). Реакционную смесь перемешивали при -76°C в течение
1,5 ч, затем гасили насыщенным водным NaHCO3 (5 мл), нагревали до комнатной температуры и экстрагировали дихлорметаном (2×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали, получая 534 мг ((R)-2-фтор-1,2-диметил-пропил)-карбаминовой кислоты трет-бутилового эфира в виде желтого масла, которое использовали без дополнительной очистки.
Стадия 3
(R)-2-Фтор-1,2-диметил-пропиламина гидрохлорид
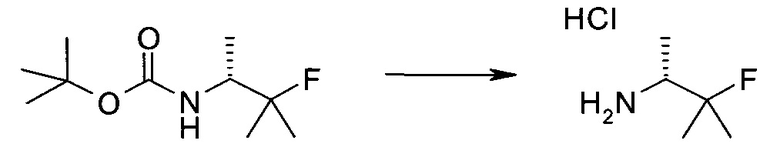
((R)-2-Фтор-1,2-диметил-пропил)-карбаминовой кислоты трет-бутиловый эфир (140 мг; 0,61 ммоль) растворяли в 1,0 М HCl растворе в MeOH (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали, получая (R)-2-фтор-1,2-диметил-пропиламина гидрохлорид в виде светло-коричневого масла, которое использовали без дополнительной очистки.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-фтор-1,2-диметил-пропил)-амид
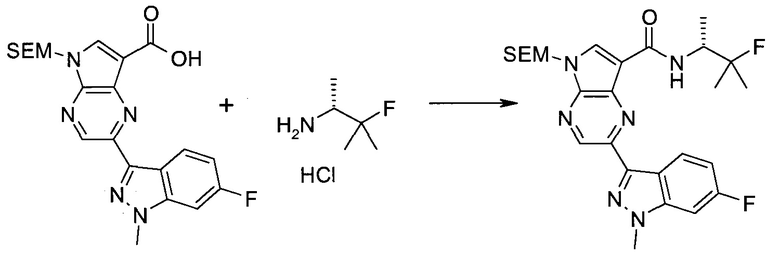
В круглодонную колбу емкостью 10 мл загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (120 мг; 0,27 ммоль) и (R)-2-фтор-1,2-диметил-пропиламина гидрохлорид (неочищенный со стадии 3; 155 мг; 0,55 ммоль). Добавляли DMF (1,2 мл), затем N,N-диизопропилэтиламин (0,20 мл; 1,15 ммоль) и HATU (114 мг; 0,30 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли воду и полученную суспензию фильтровали. Осадок на фильтре промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 95 мг (66%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-
триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-фтор-1,2-диметил-пропил)-амида в виде светло-коричневого порошка.
Стадия 5
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-фтор-1,2-диметил-пропил)-амид
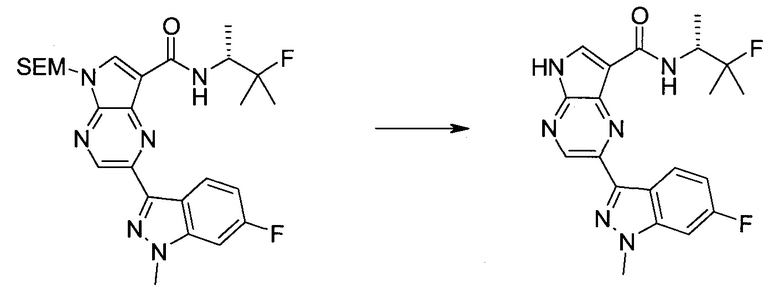
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-фтор-1,2-диметил-пропил)-амид (93 мг; 0,176 ммоль) в дихлорметане (0,9 мл) и добавляли трифторуксусную кислоту (0,54 мл; 7,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,9 мл) и добавляли этилендиамин (0,7 мл; 10,5 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и экстрагировали дихлорметаном (2×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-6% MeOH), затем растирали с этилацетатом, получая 34 мг (46%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-фтор-1,2-диметил-пропил)-амида в виде светло-желтого порошка. MS: (M+H)+=399; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.90 (br. s., 1H), 9.12 (s, 1H), 8.45-8.54 (m, 2H), 8.25 (d, J=9,8 Гц, 1H), 7.68 (dd, J=9,8; 2,3 Гц, 1H), 7.09 (td, J=9,1; 2,3 Гц, 1H), 4.30-4.48 (m, 1H), 4.15 (s, 3H), 1.29-1.52 (m, 9H).
Пример 45
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амид
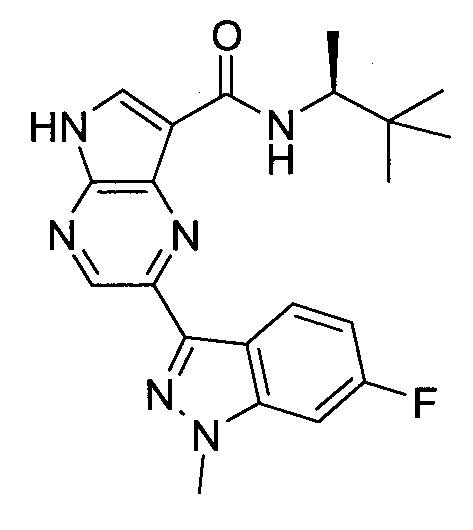
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амид
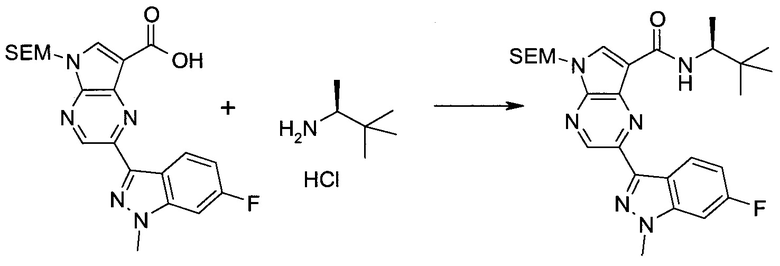
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (120 мг; 0,27 ммоль) в DMF (1,2 мл). Добавляли (S)-3,3-диметилбутан-2-амин (0,25 мл; 1,84 ммоль), затем HATU (114 мг; 0,30 ммоль) и желтый раствор перемешивали при комнатной температуре в течение ночи. Добавляли воду и полученную суспензию фильтровали. Осадок на фильтре промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 104 мг (73%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амида в виде светло-желтого порошка.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амид
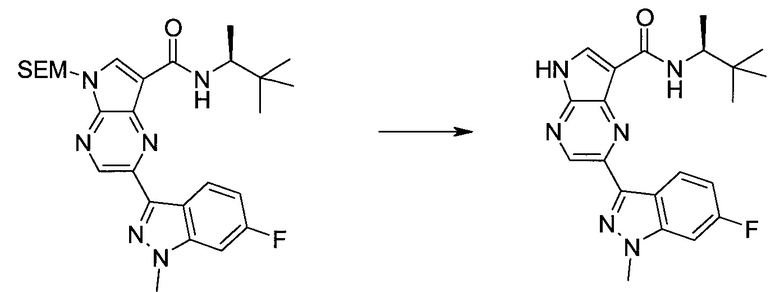
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амид (102 мг; 0,194 ммоль) в дихлорметане (0,9 мл) и добавляли трифторуксусную кислоту (0,6 мл; 7,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,9 мл) и добавляли и этилендиамин (0,8 мл; 11,7 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 52 мг (64%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амида в виде светло-желтого порошка. MS: (M+H)+=395; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.38 (br. s., 1H), 9.08 (s, 1H), 8.44 (s, 1H), 8.40 (dd, J=9,1; 5,3 Гц, 1H), 8.03 (d, J=9,8 Гц, 1H), 7.69 (dd, J=9,8; 1,9 Гц, 1H), 7.20 (td, J=9,1; 2,3 Гц, 1H), 4.15 (s, 3H), 4.09-4.19 (m, 1H), 1.26 (d, J=6,8 Гц, 3H), 0.93 (s, 9H).
Пример 46
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-гидрокси-циклопентил)-амид
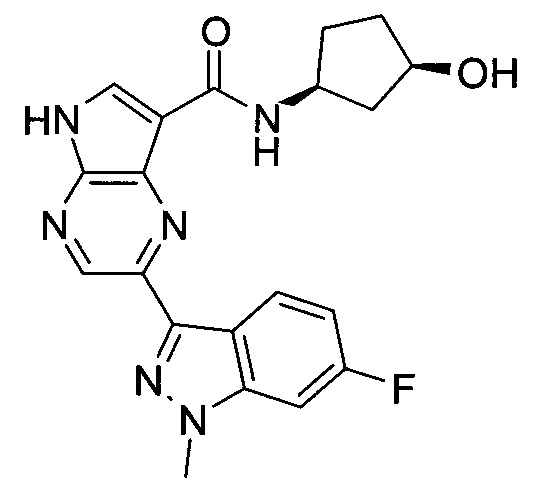
Стадия 1
(цис-3-Гидрокси-циклопентил)-карбаминовой кислоты трет-бутиловый эфир и (транс-3-гидрокси-циклопентил)-карбаминовой кислоты трет-бутиловый эфир
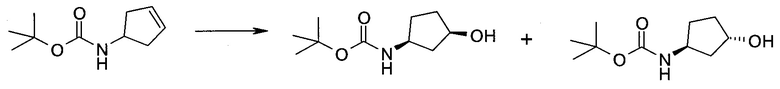
В сухой круглодонной колбе растворяли N-1-Boc-амино-3-циклопентен (1,0 г; 5,46 ммоль) в THF (7 мл). Раствор охлаждали до 0°C и по каплям добавляли боран-тетрагидрофурановый комплекс (1,0 М в THF; 6,0 мл; 6,0 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, затем нагревали до комнатной температуры в течение ночи. Смесь снова охлаждали до 0°C и добавляли воду (2 мл). Затем по каплям добавляли 10%-ный водный гидроксид натрия (8 мл; 20,0 ммоль), после чего по каплям добавляли перекись водорода (30%-ный раствор в воде; 5,0 мл; 49 ммоль). По завершении добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь экстрагировали этилацетатом (2×). Объединенные органические слои промывали рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-60% EtOAc), получая 330 мг (30%) (цис-3-гидрокси-циклопентил)-карбаминовой кислоты трет-бутилового эфира в виде бесцветного масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 5.12 (br. s., 1H), 4.39 (m, 1H), 4.03 (br. s., 1H), 1.95-2.17 (m, 2H), 1.78 (d, J=2,6 Гц, 3H), 1.64 (d, J=12,5 Гц, 1H), 1.44 (s, 9H).
Также выделяли 99 мг (9%) (транс-3-гидрокси-циклопентил)-карбаминовой кислоты трет-бутилового эфира в виде белого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 4.35-4.51 (m, 2H), 4.15 (br. s, 1H), 2.15-2.30 (m, 1H), 1.98-2.10 (m, 2H), 1.45 (s, 9H), 1.34-1.72 (m, 3H).
Стадия 2
цис-3-Амино-циклопентанола трифторацетат
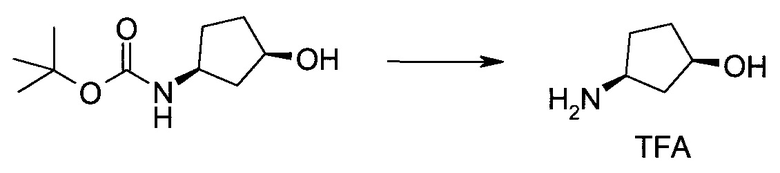
В круглодонной колбе растворяли (цис-3-гидрокси-циклопентил)-карбаминовой кислоты трет-бутиловый эфир (320 мг; 1,59 ммоль) в дихлорметане (10 мл) и медленно добавляли трифторуксусную кислоту (3,6 мл; 46,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали, получая цис-3-амино-циклопентанола трифторацетат в виде светло-желтого масла, которое использовали без дополнительной очистки.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-гидрокси-циклопентил)-амид
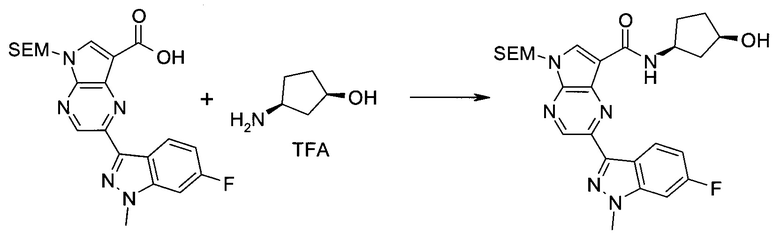
В круглодонной колбе растворяли цис-3-амино-циклопентанола трифторацетат (неочищенный со стадии 2) в DMF (1,2 мл) и добавляли N,N-диизопропилэтиламин (0,40 мл; 2,3 ммоль). Затем добавляли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (120 мг; 0,27 ммоль) и HATU (114 мг; 0,30 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем концентрировали. Остаток абсорбировали на силикагеле и хроматографировали с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-4% MeOH), получая 50 мг (35%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-гидрокси-циклопентил)-амида в виде светло-желтого твердого вещества.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-гидрокси-циклопентил)-амид
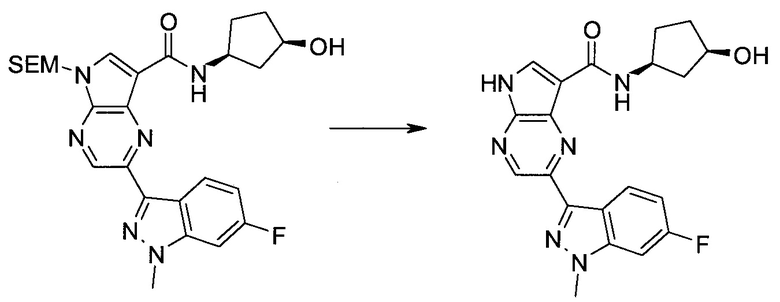
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-гидрокси-циклопентил)-амид (49 мг; 0,093 ммоль) в дихлорметане
(0,5 мл) и добавляли трифторуксусную кислоту (0,3 мл; 3,8 ммоль). Оранжевую реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,5 мл) и добавляли этилендиамин (0,4 мл; 5,7 ммоль). Светло-желтый раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученный осадок отфильтровывали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 29 мг (75%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-гидрокси-циклопентил)-амида в виде беловатого порошка. MS: (M+H)+=395; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.42 (br. s, 1H), 9.11 (s, 1H), 8.59 (dd, J=9,1; 5,3 Гц, 1H), 8.42 (s, 1H), 8.20 (d, J=8,3 Гц, 1H), 7.68 (dd, J=9,6; 2,1 Гц, 1H), 7.24 (td, J=9,2; 2,1 Гц, 1H), 4.78 (br. s., 1H), 4.36-4.52 (m, 1H), 4.22 (br. s., 1H), 4.15 (s, 3H), 2.30 (ddd, J=13,7; 8,2; 5,7 Гц, 1H), 2.04-2.19 (m, 1H), 1.67-1.86 (m, 3H), 1.49-1.63 (m, 1H).
Пример 47
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-гидрокси-циклопентил)-амид
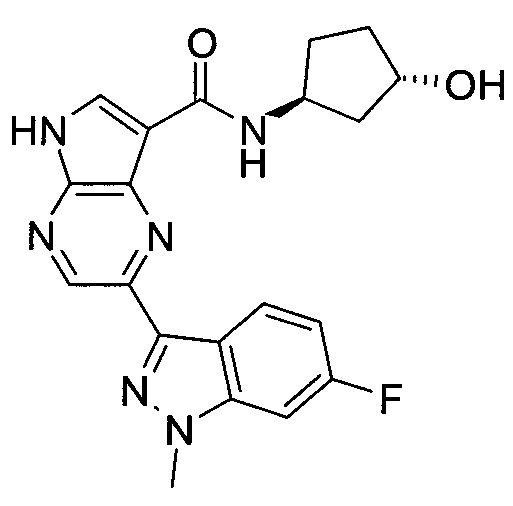
Получали в соответствии с методикой, приведенной в примере 46, но заменяя (транс-3-гидрокси-циклопентил)-карбаминовой кислоты трет-бутиловый эфир на (цис-3-гидрокси-циклопентил)-карбаминовой кислоты трет-бутиловый эфир на стадии 2. MS: (M+H)+=395. 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.26 (br. s., 1H), 9.06 (s, 1H), 8.36-8.47 (m, 2H), 8.09 (d, J=7,6 Гц, 1H), 7.69 (d, J=9,8 Гц, 1H), 7.06-7.22 (m, 1H), 4.49-4.71 (m, 2H), 4.30 (br. s., 1H), 4.13 (s, 3H), 2.17-2.32 (m, 1H), 1.92-2.10 (m, 2H), 1.65-1.77 (m, 1H), 1.43-1.62 (m, 2H).
Пример 48
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амид
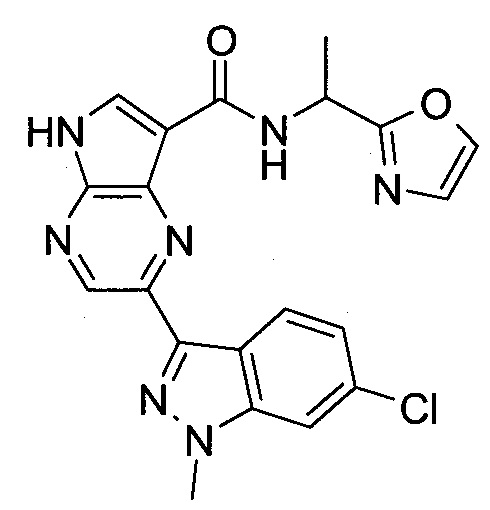
Стадия 1
2-Метил-пропан-2-сульфиновой кислоты 1-оксазол-2-ил-мет-(E)-илиденамид
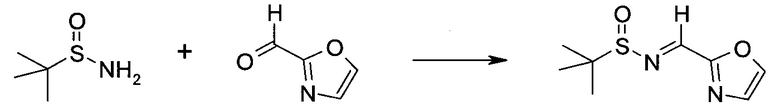
В круглодонной колбе растворяли оксазол-2-карбальдегид (300 мг; 3,09 ммоль) в THF (7 мл) и добавляли 2-метилпропан-2-сульфинамид (450 мг; 3,71 ммоль) и этилат титана(IV) (1,3 мл; 6,18 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем медленно гасили, по каплям добавляя рассол (2 мл), что приводило к образованию вязкого желтого осадка. Реакционную смесь разбавляли этилацетатом и интенсивно перемешивали при комнатной температуре в течение 10 мин. Суспензию фильтровали через целит и промывали этилацетатом. Фильтрат концентрировали и остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-30% EtOAc), получая 419 мг (68%) 2-Метил-пропан-2-сульфиновой кислоты 1-оксазол-2-ил-мет-(E)-илиденамида в виде светло-желтого твердого вещества.
Стадия 2
2-Метил-пропан-2-сульфиновой кислоты (1-оксазол-2-ил-этил)-амид

В круглодонной колбе растворяли 2-Метил-пропан-2-сульфиновой кислоты 1-оксазол-2-ил-мет-(E)-илиденамид (414 мг; 2,07 ммоль) в дихлорметане (7 мл). Реакционную смесь охлаждали до 0°C и по каплям добавляли бромид метилмагния (3,0 М в диэтиловом эфире; 0,76 мл; 2,28 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, затем гасили насыщенным водным NH4Cl и экстрагировали этилацетатом (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия,
фильтровали и концентрировали, получая 453 мг (96%) 2-метил-пропан-2-сульфиновой кислоты (1-оксазол-2-ил-этил)-амида в виде желтого масла.
Стадия 3
1-Оксазол-2-ил-этиламина дигидрохлорид
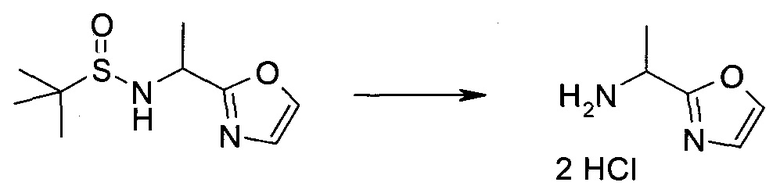
В круглодонной колбе растворяли в метаноле (3,5 мл) 2-метил-пропан-2-сульфиновой кислоты (1-оксазол-2-ил-этил)-амид (449 мг; 1,97 ммоль) и по каплям добавляли хлористый водород (4,0 М в 1,4-диоксане; 1,0 мл; 4,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 мин, затем концентрировали, получая 417 мг 1-оксазол-2-ил-этиламина дигидрохлорида в виде оранжевого воскообразного твердого вещества, которое использовали без дополнительной очистки.
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амид
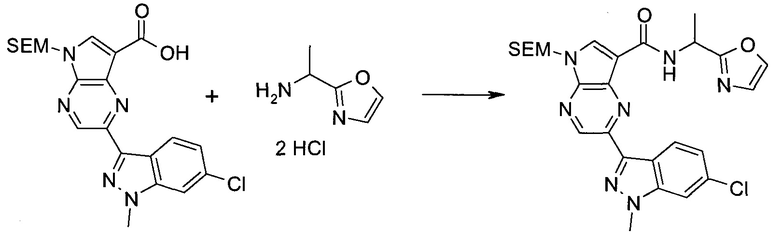
В круглодонную колбу загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (100 мг; 0,22 ммоль) и 1-оксазол-2-ил-этиламина дигидрохлорид (91 мг; 0,39 ммоль). Добавляли DMF (1 мл), затем N,N-диизопропилэтиламин (0,25 мл; 1,43 ммоль) и HATU (92 мг; 0,24 ммоль). Светло-желтый раствор перемешивали при комнатной температуре в течение 48 часов. Добавляли воду и полученную суспензию фильтровали. Твердое вещество промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 108 мг (90%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амида в виде беловатого порошка.
Стадия 5
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амид
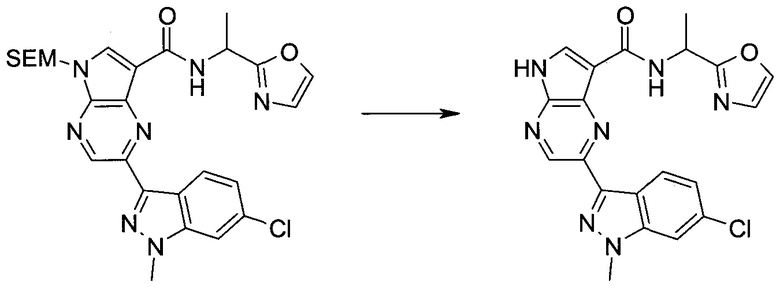
В круглодонной колбе растворяли в дихлорметане (0,9 мл) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амид (106 мг; 0,192 ммоль) и добавляли трифторуксусную кислоту (0,6 мл; 7,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,9 мл) и добавляли и этилендиамин (0,8 мл; 11,7 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 66 мг (82%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амида в виде беловатого порошка. MS: (M+H)+=422; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.91 (br. s., 1H), 9.13 (s, 1H), 8.66 (d, J=8,3 Гц, 1H), 8.51 (s, 1H), 8.46 (d, J=8,3 Гц, 1H), 8.11 (s, 1H), 8.00 (s, 1H), 7.23 (s, 1H), 7.15-7.21 (m, 1H), 5.47-5.61 (m, 1H), 4.18 (s, 3H), 1.66 (d, J=7,2 Гц, 3H).
Пример 49
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амид
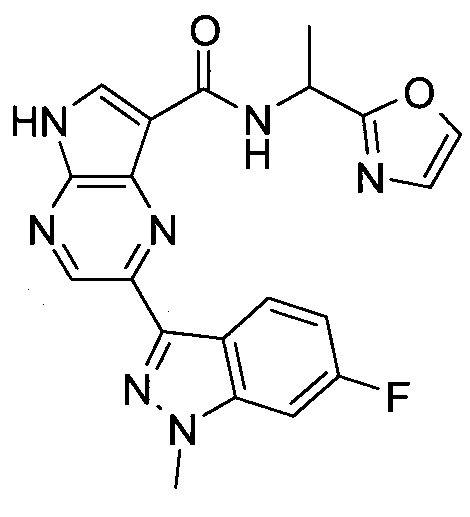
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амид
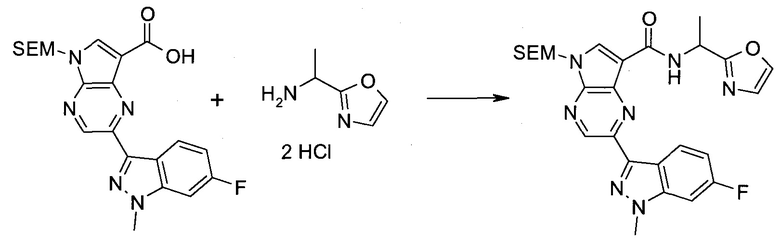
В круглодонную колбу загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (210 мг; 0,48 ммоль) и 1-оксазол-2-ил-этиламина дигидрохлорид (198 мг; 0,86 ммоль). добавляли DMF (2,2 мл), затем N,N-диизопропилэтиламин (0,55 мл; 3,15 ммоль) и HATU (199 мг; 0,52 ммоль). Светло-желтый раствор перемешивали при комнатной температуре в течение ночи. Добавляли воду и полученную суспензию фильтровали. Твердое вещество промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 248 мг (97%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амида в виде светло-желтого порошка.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амид
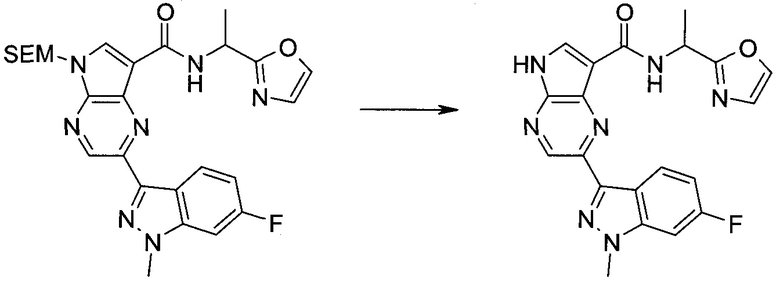
В круглодонной колбе растворяли в дихлорметане (0,6 мл) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амид (64 мг; 0,12 ммоль) и добавляли трифторуксусную кислоту (0,4 мл; 5,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,6 мл) и добавляли этилендиамин (0,5 мл; 7,3 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом
и сушили под высоким вакуумом, получая 33 мг (65%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амида в виде светло-желтого порошка, MS: (M+H)+=406; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.93 (br. s., 1H), 9.13 (s, 1H), 8.66 (d, J=8,7 Гц, 1H), 8.51 (s, 1H), 8.47 (dd, J=8,9; 5,5 Гц, 1H), 8.11 (s, 1H), 7.69 (dd, J=9,8; 2,3 Гц, 1H), 7.25 (s, 1H), 7.07 (td,J=9,2; 2,1 Гц, 1H), 5.48-5.61 (m, 1H),4.15(s, 3H), 1.67 (d, J=7,2 Гц, 3H).
Пример 50
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид
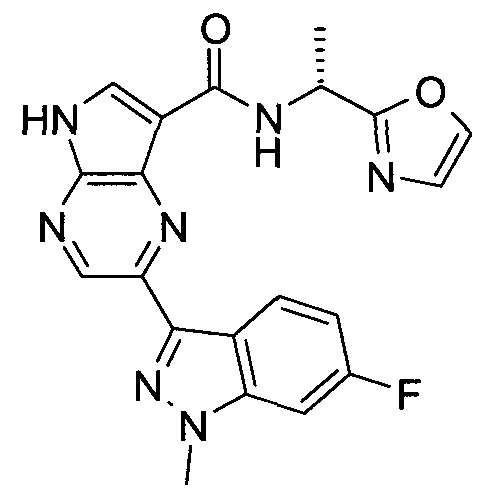
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид и 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-оксазол-2-ил-этил)-амид
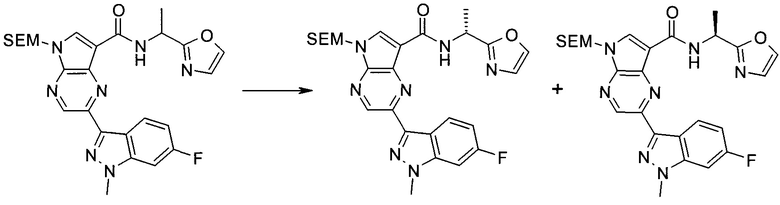
Рацемический образец 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амида (182 мг; 0,34 ммоль) подвергали хиральной SFC-хроматографии. Разделения энантиомеров достигали на колонке WHELK-01 R,R, используя смесь 30% EtOH/CO2 в качестве элюента. Получали 76 мг (42%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амида в виде светло-желтого твердого вещества и 72 мг (40%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-
карбоновой кислоты ((S)-1-оксазол-2-ил-этил)-амида в виде светло-желтого твердого вещества.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид
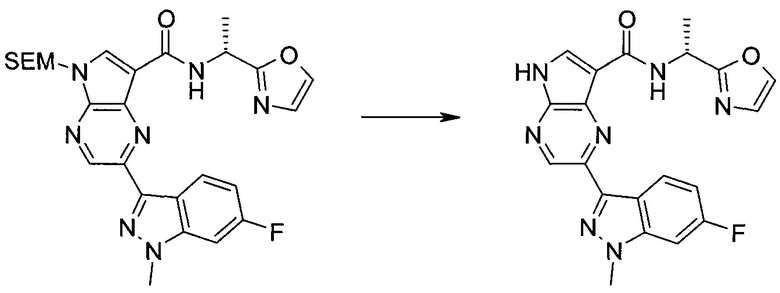
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид (75 мг; 0,14 ммоль) в дихлорметане (0,7 мл) и добавляли трифторуксусную кислоту (0,45 мл; 5,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,7 мл) и добавляли этилендиамин (0,6 мл; 8,4 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 23 мг (39%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амида в виде светло-желтого порошка. MS: (M+H)+=406; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.95 (br. s., 1H), 9.13 (s, 1H), 8.66 (d, J=8,7 Гц, 1H), 8.51 (s, 1H), 8.47 (dd, J=9,1; 5,3 Гц, 1H), 8.11 (s, 1H), 7.69 (dd, J=9,6; 2,1 Гц, 1H), 7.24 (s, 1H), 7.02-7.11 (m, 1H), 5.48-5.60 (m, 1H), 4.15 (s, 3H), 1.66 (d, J=7,2 Гц, 3H).
Пример 51
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-оксазол-2-ил-этил)-амид
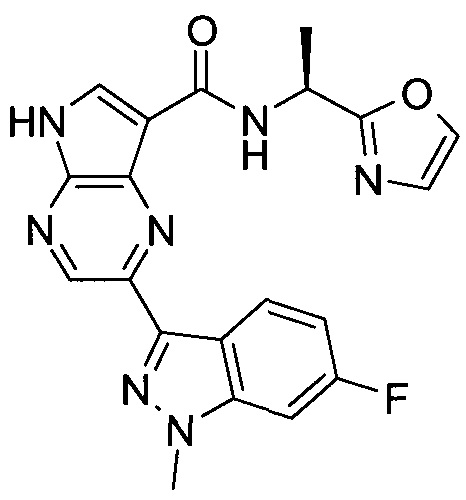
Получали согласно примеру 50, заменяя 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-оксазол-2-ил-этил)-амид на 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид на стадии 2. MS: (M+H)+=406; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.93 (br. s., 1H), 9.12 (s, 1H), 8.64 (d, J=8,7 Гц, 1H), 8.50 (s, 1H), 8.46 (dd, J=9,1; 5,3 Гц, 1H), 8.10 (s, 1H), 7.68 (dd, J=9,8; 2,3 Гц, 1H), 7.23 (s, 1H), 7.05 (td, J=9,1; 2,3 Гц, 1H), 5.53 (quin, J=7,5 Гц, 1H), 4.14 (s, 3H), 1.65 (d, J=7,2 Гц, 3H).
Пример 52
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-4-ил-этил)-амид
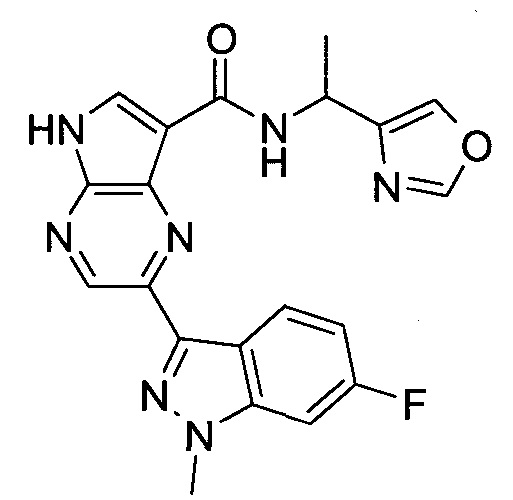
Стадия 1
2-Метил-пропан-2-сульфиновой кислоты 1-оксазол-4-ил-мет-(У)-илиденамид
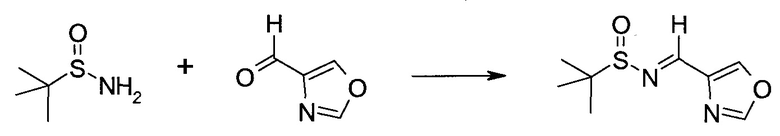
В круглодонной колбе растворяли оксазол-4-карбальдегид (300 мг; 3,09 ммоль) в THF (7 мл) и добавляли 2-метилпропан-2-сульфинамид (450 мг; 3,71 ммоль) и этилат титана(IV) (1,3 мл; 6,18 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем медленно гасили, по каплям добавляя рассол (2 мл), что приводило к образованию вязкого
светло-желтого осадка. Реакционную смесь разбавляли этилацетатом и интенсивно перемешивали при комнатной температуре в течение 30 мин. Суспензию фильтровали через целит и промывали этилацетатом. Фильтрат концентрировали и остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-40% EtOAc), получая 552 мг (89%) 2-метил-пропан-2-сульфиновой кислоты 1-оксазол-4-ил-мет-(E)-илиденамида в виде белого твердого вещества.
Стадия 2
2-метил-пропан-2-сульфиновой кислоты (1-оксазол-4-ил-этил)-амид

В круглодонной колбе растворяли 2-метил-пропан-2-сульфиновой кислоты 1-оксазол-4-ил-мет-(E)-илиденамид (548 мг; 2,74 ммоль) в дихлорметане (9 мл). Реакционную смесь охлаждали до 0°C и по каплям добавляли бромид метилмагния (3,0 М в диэтиловом эфире; 1,0 мл; 3,0 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, затем гасили насыщенным водным NH4Cl и экстрагировали этилацетатом (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 588 мг 2-метил-пропан-2-сульфиновой кислоты (1-оксазол-4-ил-этил)-амида в виде светло-желтого масла.
Стадия 3
1-Оксазол-4-ил-этиламина дигидрохлорид
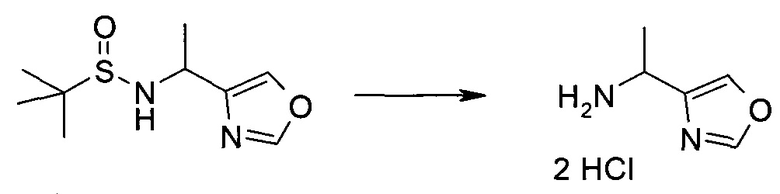
В круглодонной колбе растворяли 2-метил-пропан-2-сульфиновой кислоты (1-оксазол-4-ил-этил)-амид (585 мг; 2,57 ммоль) в метаноле (4,5 мл) и по каплям добавляли хлористый водород (4,0 М в 1,4-диоксане; 1,3 мл; 5,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 мин, затем концентрировали, получая 1-оксазол-4-ил-этиламина дигидрохлорид в виде вязкого оранжевого масла, которое использовали без дополнительной очистки.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-4-ил-этил)-амид
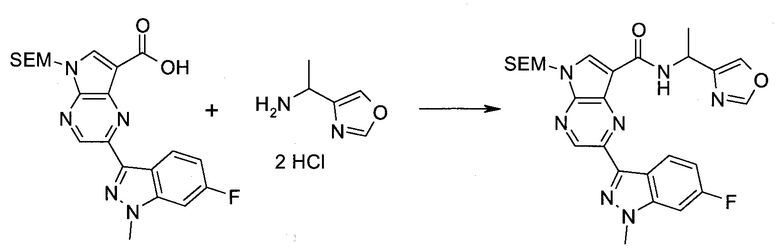
В круглодонную колбу загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (100 мг; 0,23 ммоль) и 1-оксазол-2-ил-этиламина дигидрохлорид (неочищенный со стадии 3; 90 мг; 0,41 ммоль). Добавляли DMF (1,1 мл), затем N,N-диизопропилэтиламин (0,26 мл; 1,49 ммоль) и HATU (95 мг; 0,25 ммоль). Светло-желтый раствор перемешивали при комнатной температуре в течение 48 часов. Добавляли воду и полученную суспензию фильтровали. Твердое вещество промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 113 мг (93%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-4-ил-этил)-амида в виде беловатого порошка.
Стадия 5
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-4-ил-этил)-амид
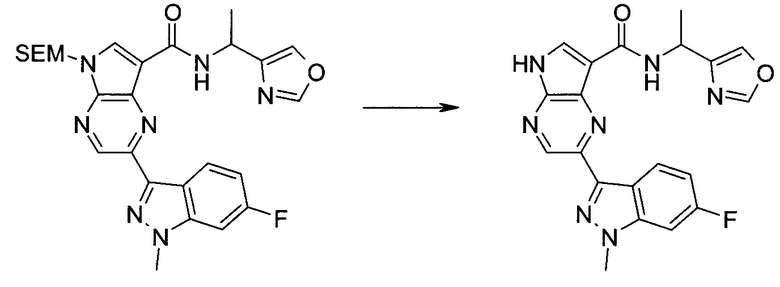
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-4-ил-этил)-амид (110 мг; 0,205 ммоль) в дихлорметане (1 мл) и добавляли трифторуксусную кислоту (0,63 мл; 8,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,83 мл; 12,3 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и
этилацетатом и сушили под высоким вакуумом, получая 58 мг (70%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-4-ил-этил)-амида в виде светло-желтого порошка. MS: (M+H)+=406; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.83 (br. s., 1H), 9.12 (s, 1H), 8.42-8.51 (m, 2H), 8.32-8.42 (m, 2H), 8.20 (s, 1H), 7.68 (dd, J=9,8; 1,9 Гц, 1H), 7.04 (td, J=9,3; 1,9 Гц, 1H), 5.28-5.46 (m, 1H), 4.14 (s, 3H), 1.58 (d, J=6,8 Гц, 3H).
Пример 53
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-изоксазол-3-ил-этил)-амид
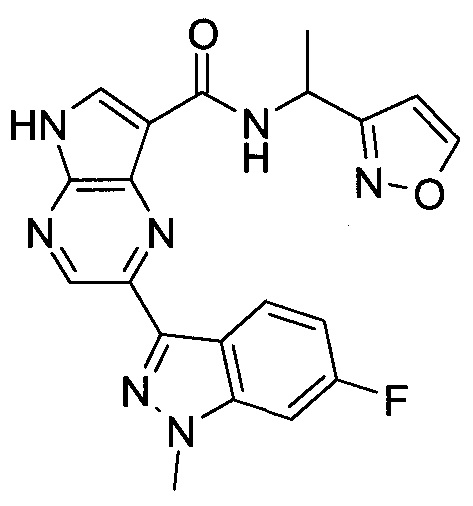
Стадия 1
2-Метил-пропан-2-сульфиновой кислоты 1-изоксазол-3-ил-мет-(E)-илиденамид
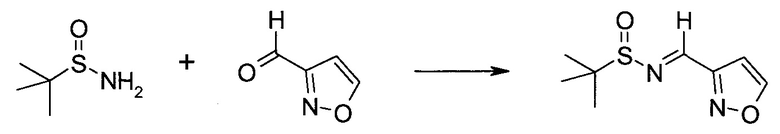
В круглодонной колбе растворяли изоксазол-3-карбальдегид (300 мг; 3,09 ммоль) в THF (7 мл) и добавляли 2-метилпропан-2-сульфинамид (450 мг; 3,71 ммоль) и этилат титана(IV) (1,3 мл; 6,18 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем медленно гасили, по каплям добавляя рассол (2 мл), что приводило к образованию вязкого желтого осадка. Реакционную смесь разбавляли этилацетатом и интенсивно перемешивали при комнатной температуре в течение 10 мин. Суспензию фильтровали через целит и промывали этилацетатом. Фильтрат концентрировали и остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-20% EtOAc), получая 585 мг (95%) 2-Метил-пропан-2-сульфиновой кислоты 1-изоксазол-3-ил-мет-(E)-илиденамида в виде бесцветного масла.
Стадия 2
2-Метил-пропан-2-сульфиновой кислоты (1-изоксазол-3-ил-этил)-амид
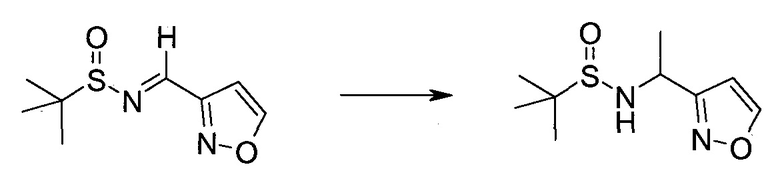
В круглодонной колбе растворяли 2-метил-пропан-2-сульфиновой кислоты 1-изоксазол-3-ил-мет-(E)-илиденамид (584 мг; 2,92 ммоль) в дихлорметане (10 мл). Реакционную смесь охлаждали до 0°C и по каплям добавляли бромид метилмагния (3,0 М в диэтиловом эфире; 1,1 мл; 3,3 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 ч, затем гасили насыщенным водным NH4Cl и экстрагировали этилацетатом (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 655 мг 2-метил-пропан-2-сульфиновой кислоты (1-изоксазол-3-ил-этил)-амида в виде бесцветного масла.
Стадия 3
1-Изоксазол-3-ил-этиламина гидрохлорид
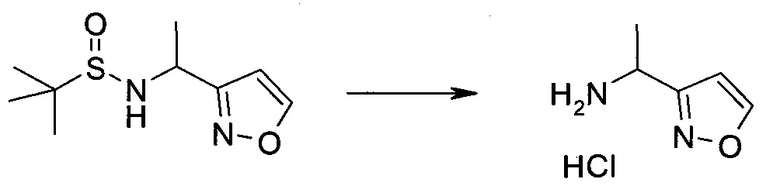
В круглодонной колбе растворяли 2-метил-пропан-2-сульфиновой кислоты (1-изоксазол-3-ил-этил)-амид (652 мг; 2,71 ммоль) в метаноле (5 мл) и по каплям добавляли хлористый водород (4,0 М в 1,4-диоксане; 1,4 мл; 5,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 мин, затем концентрировали, получая 1-изоксазол-3-ил-этиламина гидрохлорид в виде беловатого твердого вещества, которое использовали без дополнительной очистки.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-изоксазол-3-ил-этил)-амид
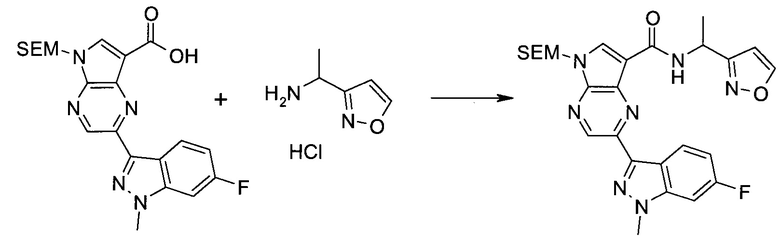
В круглодонную колбу загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту
(100 мг; 0,23 ммоль) и 1-изоксазол-3-ил-этиламина гидрохлорид (неочищенный со стадии 3; 81 мг; 0,41 ммоль). Добавляли DMF (1,1 мл), затем N,N-диизопропил-этиламин (0,26 мл; 1,49 ммоль) и HATU (95 мг; 0,25 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 48 часов. Добавляли воду и полученную суспензию фильтровали. Твердое вещество промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 115 мг (95%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-изоксазол-3-ил-этил)-амида в виде беловатого порошка.
Стадия 5
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-изоксазол-3-ил-этил)-амид
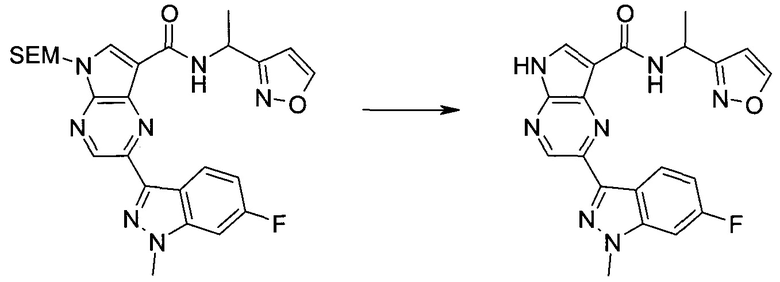
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-изоксазол-3-ил-этил)-амид (113 мг; 0,211 ммоль) в дихлорметане (1,1 мл) и добавляли трифторуксусную кислоту (0,65 мл; 8,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (1,1 мл) и добавляли этилендиамин (0,86 мл; 12,7 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 46 мг (54%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-изоксазол-3-ил-этил)-амида в виде светло-желтого порошка. MS: (M+H)+=406; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.89 (br. s., 1H), 9.12 (s, 1H), 8.91 (d, J=1,5 Гц, 1H), 8.58 (d, J=8,7 Гц, 1H), 8.50 (s, 1H), 8.44 (dd, J=8,9; 5,5 Гц, 1H), 7.68 (dd, J=9,6; 2,1 Гц, 1H), 7.02 (td, J=9,1; 1,9 Гц, 1H), 6.68 (d, J=1,5 Гц, 1H), 5.53 (quin, J=7,2 Гц, 1H), 4.15 (s, 3H), 1.65 (d, J=6,8 Гц, 3H).
Пример 54
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(5-метил-изоксазол-3-ил)-этил]-амид
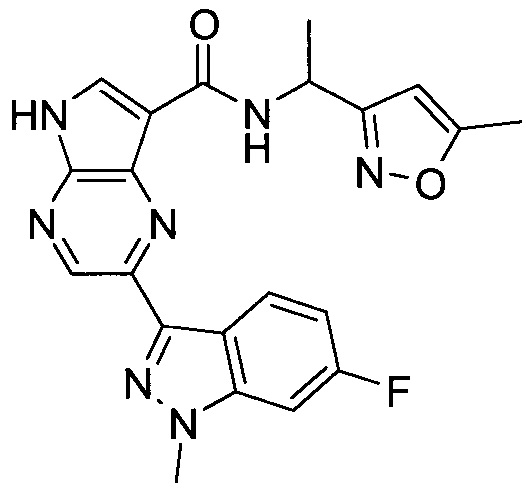
Получали в соответствии с методикой, приведенной в примере 53, заменяя 5-метил-изоксазол-3-карбальдегид на изоксазол-3-карбальдегид на стадии 1. MS: (M+H)+=420.
1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.86 (br. s., 1H), 9.12 (s, 1H), 8.55 (d, J=8,3 Гц, 1H), 8.50 (s, 1H), 8.45 (dd, J=8,9; 5,5 Гц, 1H), 7.68 (dd, J=9,8; 2,3 Гц, 1H), 7.04 (td, J=9,2; 2,1 Гц, 1H), 6.31 (s, 1H), 5.38-5.50 (m, 1H), 4.15 (s, 3H), 2.37 (s, 3H), 1.62 (d, J=7,2 Гц, 3H).
Пример 55
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-изоксазол-5-ил-этил)-амид
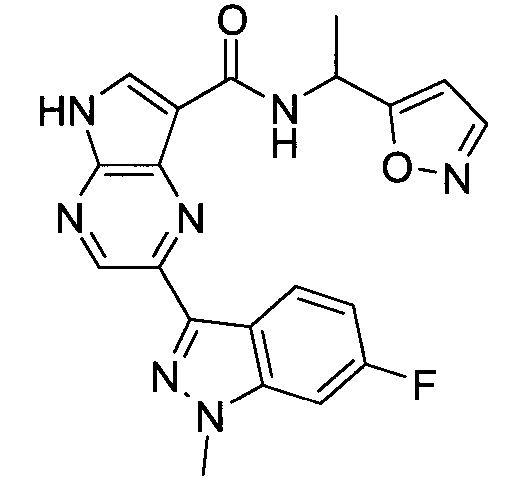
Стадия 1
Изоксазол-5-ил-метанол

В круглодонной колбе растворяли изоксазол-5-карбоновую кислоту (1,0 г; 8,84 ммоль) в THF (35 мл). Раствор охлаждали до 0°C и добавляли триэтиламин (1,4 мл; 10,0 ммоль), затем этилхлорформиат (0,94 мл; 9,8 ммоль). По мере добавления последнего образовывался вязкий осадок. Суспензию перемешивали при 0°C в течение 15 мин, затем порциями через пипетку добавляли раствор боргидрида натрия (1,00 г; 26,5 ммоль) в воде (14 мл). Наблюдалось бурное
выделение газа. Реакционную смесь перемешивали при 0°C в течение 1 ч, затем разбавляли водой и насыщенным водным NH4Cl и экстрагировали дихлорметаном (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-50% EtOAc), получая 513 мг (59%) изоксазол-5-ил-метанола в виде бесцветного масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.23 (d, J=1,9 Гц, 1H), 6.26-6.30 (m, 1H), 4.82 (s, 2H), 2.13 (br. s., 1H).
Стадия 2
Изоксазол-5-карбальдегид

В круглодонной колбе изоксазол-5-ил-метанол (511 мг; 5,16 ммоль) растворяли в дихлорметане (30 мл). Добавляли периодинан Десса-Мартина (2,3 г; 5,41 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч. Реакцию гасили 50 мл раствора 10%-ного водного Na2S2O3 и насыщенного водного NaHCO3 в соотношении 1:1 и затем экстрагировали дихлорметаном (2×). Органические слои промывали насыщенным водным NaHCO3, водой и рассолом. Водные слои вновь экстрагировали дихлорметаном. Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-40% EtOAc), получая 226 мг (45%) изоксазол-5-карбальдегида в виде бесцветного масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 10.05 (s, 1H), 8.44 (d, J=1,9 Гц, 1H), 7.02 (d, J=1,9 Гц, 1H).
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-изоксазол-5-ил-этил)-амид
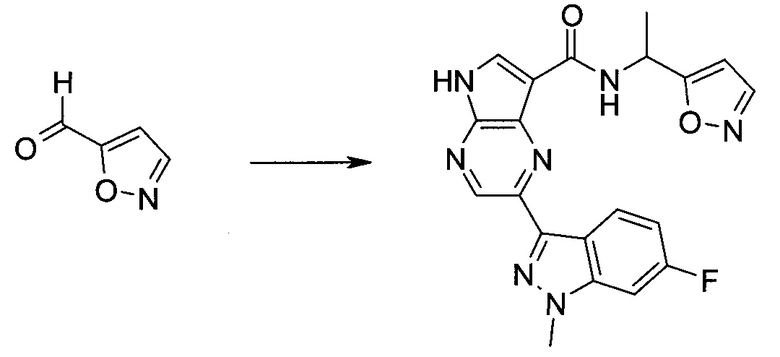
Получали в соответствии с методикой, приведенной в примере 53, заменяя изоксазол-5-карбальдегид на изоксазол-3-карбальдегид на стадии 1. MS: (M+H)+=406.
1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.94 (br. s., 1H), 9.12 (s, 1H), 8.49-8.62 (m, 3H), 8.34 (dd, J=8,9; 5,5 Гц, 1H), 7.69 (dd, J=9,8; 1,9 Гц, 1H), 7.12 (td, J=9,2; 2,1 Гц, 1H), 6.56 (d, J=1,9 Гц, 1H), 5.62 (quin, J=7,5 Гц, 1H), 4.15 (s, 3H), 1.67 (d, J=7,2 Гц, 3H).
Пример 56
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-пропил)-амид
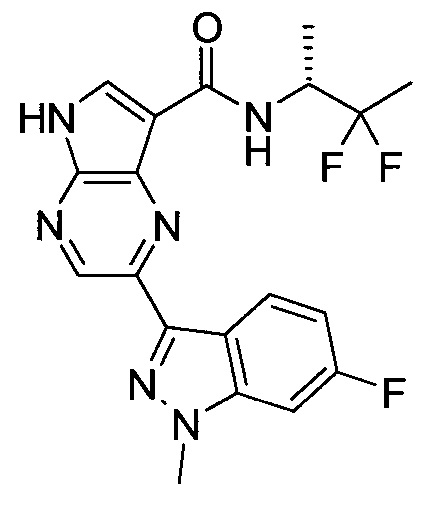
Стадия 1
[(R)-1-(Метокси-метил-карбамоил)-этил]-карбаминовой кислоты трет-бутиловый эфир
В круглодонную колбу загружали Boc-D-аланин (1,0 г; 5,29 ммоль) и N,O-диметилгидроксиламина гидрохлорид (670 мг; 6,87 ммоль). Добавляли DMF (12 мл), затем N,N-диизопропилэтиламин (2,4 мл; 13,7 ммоль) и HATU (2,21 г; 5,81 ммоль). Желтую суспензию перемешивали при комнатной температуре в течение 48 часов. Реакционную смесь гасили водой и петролейным эфиром добавляли. Полученную суспензию фильтровали, промывали водой и петролейным эфиром и сушили под высоким вакуумом, получая 1,05 г (85%) [(R)-1-(метокси-метил-карбамоил)-этил]-карбаминовой кислоты трет-бутилового эфира в виде белого порошка.
Стадия 2
((R)-1-Метил-2-оксо-пропил)-карбаминовой кислоты трет-бутиловый эфир
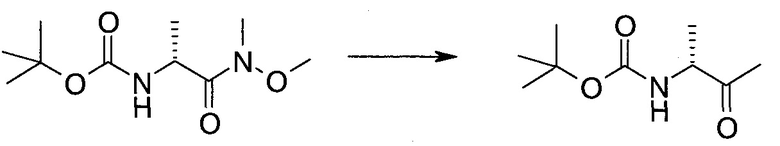
В круглодонной колбе растворяли [(R)-1-(метокси-метил-карбамоил)-этил]-карбаминовой кислоты трет-бутиловый эфир (3,00 г; 12,9 ммоль) в THF (100 мл). Раствор охлаждали до -16°C (баня со смесью NaCl/лед) и по каплям в течение 20 мин добавляли бромид метилмагния (3,0 М в диэтиловом эфире; 12,0 мл; 36,0 ммоль). После добавления реакционную смесь оставляли медленно нагреваться до комнатной температуры в течение ночи. Реакционную смесь охлаждали до 0°C, гасили насыщенным водным NH4Cl и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-20% EtOAc), получая 2,21 г (91%) ((R)-1-метил-2-оксо-пропил)-карбаминовой кислоты трет-бутилового эфира в виде белого твердого вещества.
Стадия 3
((R)-2,2-Дифтор-1-метил-пропил)-карбаминовой кислоты трет-бутиловый эфир
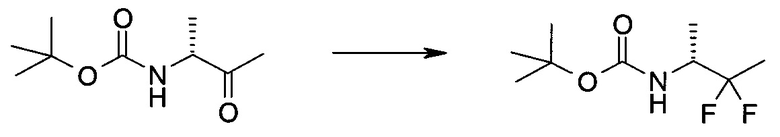
В круглодонной колбе растворяли ((R)-1-метил-2-оксо-пропил)-карбаминовой кислоты трет-бутиловый эфир (300 мг; 1,6 ммоль) в дихлорметане (15 мл). По каплям при комнатной температуре добавляли DAST (0,64 мл; 4,84 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи, затем при температуре дефлегмации в течение 7 ч. Реакционную смесь охлаждали до комнатной температуры, гасили 15 мл насыщенного водного NaHCO3 и затем экстрагировали дихлорметаном (2×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-5% EtOAc), получая 152 мг (45%) ((R)-2,2-дифтор-1-метил-пропил)-карбаминовой кислоты трет-бутилового эфира в виде светло-желтого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 4.59 (br. s., 1H), 3.90-4.08 (m, 1H), 1.62 (t, J=18,9 Гц, 3H), 1.46 (s, 9H), 1.23 (d, J=6,8 Гц, 3H).
Стадия 4
(R)-2,2-Дифтор-1-метил-пропиламина трифторацетат
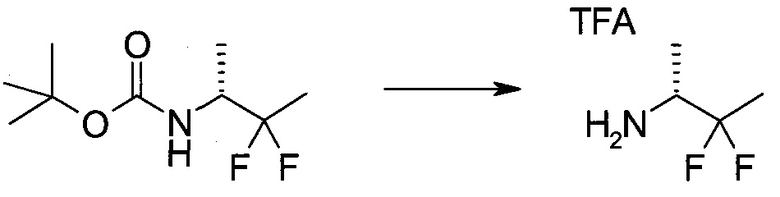
В круглодонной колбе растворяли ((R)-2,2-дифтор-1-метил-пропил)-карбаминовой кислоты трет-бутиловый эфир (148 мг; 0,71 ммоль) в дихлорметане (3 мл) и медленно добавляли трифторуксусную кислоту (1,6 мл; 20,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч, затем концентрировали, получая (R)-2,2-дифтор-1-метил-пропиламина трифторацетат в виде светло-коричневого масла, которое использовали без дополнительной очистки.
Стадия 5
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-пропил)-амид
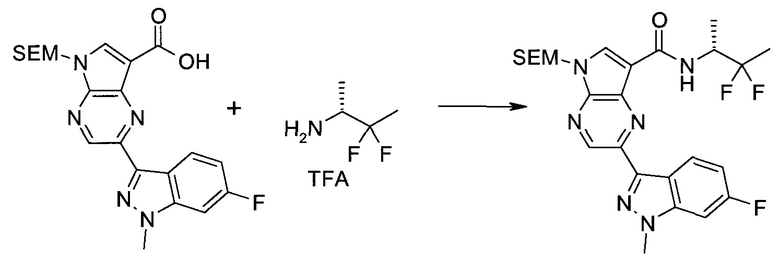
В круглодонной колбе растворяли (R)-2,2-дифтор-1-метил-пропиламина трифторацетат (неочищенный со стадии 4) в DMF (1,2 мл) и добавляли N,N-диизопропилэтиламин (0,5 мл; 2,86 ммоль). Затем добавляли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (110 мг; 0,25 ммоль), после чего HATU (104 мг; 0,27 ммоль). Желтый раствор перемешивали при комнатной температуре в течение ночи. Добавляли воду и суспензию фильтровали. Осадок на фильтре промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 108 мг (81%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-пропил)-амида в виде беловатого порошка.
Стадия 6
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-пропил)-амид
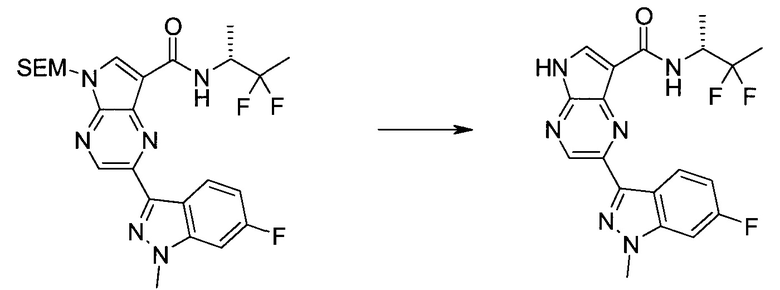
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-пропил)-амид (105 мг; 197 ммоль) в дихлорметане (1 мл) и добавляли трифторуксусную кислоту (0,6 мл; 7,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,8 мл; 11,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 48 мг (61%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-пропил)-амида в виде беловатого порошка. MS: (M+H)+=403; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.85 (br. s., 1H), 9.12 (s, 1H), 8.51 (s, 1H), 8.45 (dd, J=8,9; 5,5 Гц, 1H), 8.32 (d, J=9,8 Гц, 1H), 7.69 (dd, J=9,8; 2,3 Гц, 1H), 7.10 (td, J=9,1; 1,9 Гц, 1H), 4.56-4.80 (m, 1H), 4.15 (s, 3H), 1.72 (t, J=19,3 Гц, 3H), 1.37(d,J=6,8rn,3H).
Пример 57
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-цианометил-циклопентил)-амид
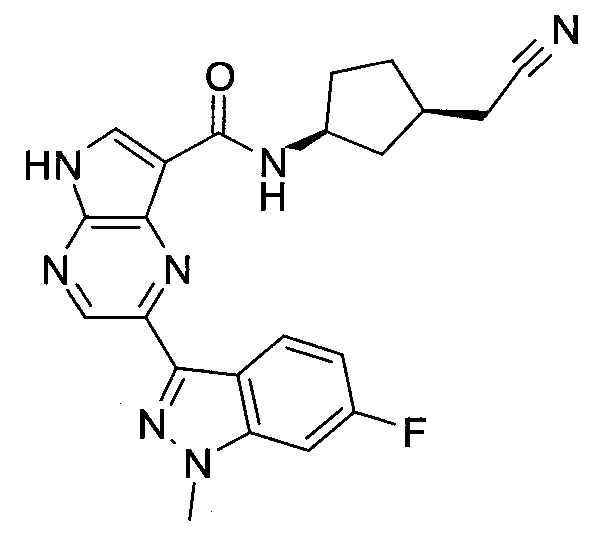
Стадия 1
3-Оксо-2-аза-бицикпо[2.2.1]гепт-5-ен-2-карбоновой кислоты трет-бутиловый эфир
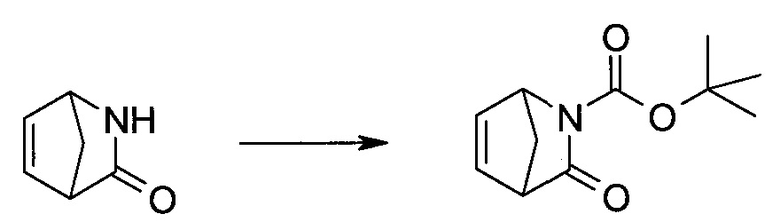
В круглодонной колбе суспендировали 2-азабицикло[2.2.1]гепт-5-ен-3-он (1,0 г; 9,16 ммоль) в THF (10 мл) и добавляли триэтиламин (1,9 мл; 13,6 ммоль), ди-трет-бутилдикарбонат (2,4 г; 11,0 ммоль) и 4-диметиламинопиридин (112 мг; 0,92 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали этилацетатом (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-30% EtOAc), получая 1,79 г (93%) 3-оксо-2-аза-бицикло[2.2.1]гепт-5-ен-2-карбоновой кислоты трет-бутилового эфира в виде светло-желтого твердого вещества.
Стадия 2
3-Оксо-2-аза-бицикло[2.2.1]гептан-2-карбоновой кислоты трет-бутиловый эфир
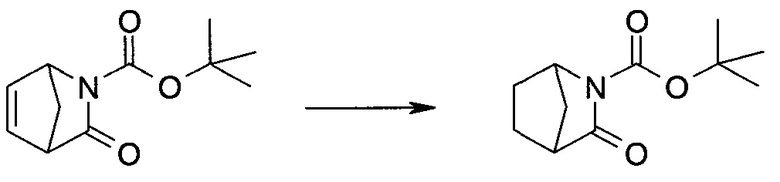
В сосуде Парра для работы под давлением растворяли 3-оксо-2-аза-бицикло[2.2.1]гепт-5-ен-2-карбоновой кислоты трет-бутиловый эфир (1,77 г; 8,46 ммоль) в метаноле (12 мл) и осторожно добавляли 10%-ный палладий на угле (влажный; 170 мг; 0,16 ммоль). Сосуд помещали в автоклав Парра для гидрирования и встряхивали под давлением водорода 40 ф/кв. дюйм (276 кПа) в течение 2 ч. Реакционную смесь фильтровали через целит и промывали смесью метанол/этилацетат.Фильтрат концентрировали, получая 1,88 г 3-оксо-2-аза-бицикло[2.2.1]гептан-2-карбоновой кислоты трет-бутилового эфира в виде светло-серого масла, которое использовали без дополнительной очистки.
Стадия 3
(цис-3-Гидроксиметил-циклопентил)-карбаминовой кислоты трет-бутиловый эфир
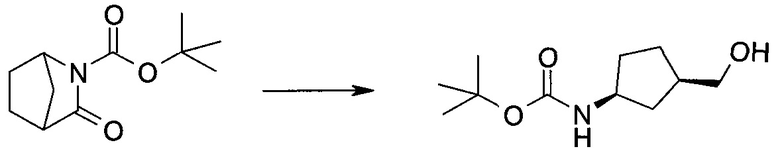
В круглодонной колбе растворяли 3-оксо-2-аза-бицикло[2.2.1]гептан-2-карбоновой кислоты трет-бутиловый эфир (неочищенный со стадии 2; 1,87 г) в THF (20 мл) и воде (2 мл). Реакционную смесь охлаждали до 0°C и добавляли боргидрид натрия (301 мг; 7,97 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин, затем добавляли вторую порцию боргидрида натрия (301 мг; 7,97 ммоль). Реакционную смесь перемешивали при 0°C в течение 7,5 ч, затем добавляли третью порцию боргидрида натрия (602 мг; 15,94 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем добавляли четвертую порцию боргидрида натрия (602 мг; 15,94 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем охлаждали до 0°C и осторожно гасили с использованием 1 М HCl. Когда выделение газа прекращалось (pH было приблизительно равно 6), смесь экстрагировали дихлорметаном (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-60% EtOAc), получая 1,73 г (95%, 2 стадии) (цис-3-гидроксиметил-циклопентил)-карбаминовой кислоты трет-бутилового эфира в виде беловатого твердого вещества.
Стадия 4
Метансульфоновой кислоты (цис)-3-трет-бутоксикарбониламино-циклопентилметиловый эфир
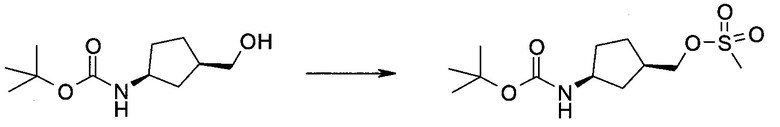
В круглодонной колбе растворяли (цис-3-гидроксиметил-циклопентил)-карбаминовой кислоты трет-бутиловый эфир (500 мг; 2,21 ммоль) в дихлорметане (5 мл). Раствор охлаждали до 0°C и добавляли триэтиламин (0,40 мл; 2,87 ммоль), затем метансульфонилхлорид (0,20 мл; 2,57 ммоль). Реакционную смесь перемешивали при 0°C в течение 45 мин, затем гасили водой и экстрагировали дихлорметаном (2×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали, получая 780 мг метансульфоновой кислоты (цис)-3-трет-бутоксикарбониламино-циклопентил-метилового эфира в виде бледно-желтого масла, которое использовали без дополнительной очистки.
Стадия 5
(цис-3-Цианометил-цикпопентил)-карбаминовой кислоты трет-бутиловый эфир
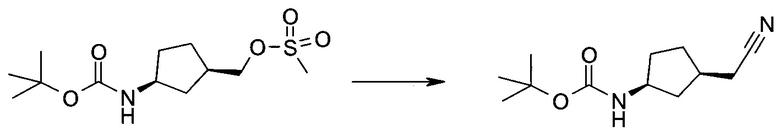
В круглодонной колбе растворяли метансульфоновой кислоты (цис)-3-трет-бутоксикарбониламино-циклопентилметиловый эфир (неочищенный со стадии 4; 779 мг) в DMF (5 мл). Добавляли цианид калия (277 мг; 4,25 ммоль) и реакционную смесь перемешивали при 80°C в течение ночи. Добавляли цианид натрия (104 мг; 2,12 ммоль) и реакционную смесь перемешивали при 80°C в течение 48 часов. Реакционную смесь охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-30% EtOAc), получая 190 мг (38%, 2 стадии) (цис-3-цианометил-циклопентил)-карбаминовой кислоты трет-бутилового эфира в виде светло-желтого масла.
Стадия 6
(цис-3-Амино-циклопентил)-ацетонитрила трифторацетат
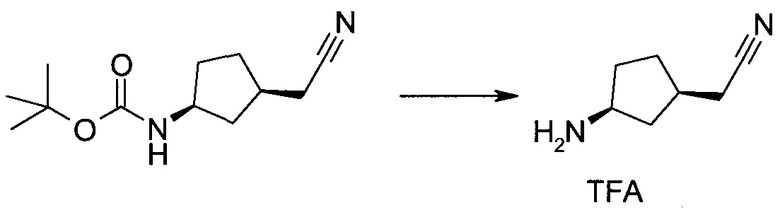
В круглодонной колбе растворяли (цис-3-цианометил-циклопентил)-карбаминовой кислоты трет-бутиловый эфир (188 мг; 0,84 ммоль) в дихлорметане (5 мл) и медленно добавляли трифторуксусную кислоту (2,0 мл; 26,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали, получая (цис-3-амино-циклопентил)-ацетонитрила трифторацетат в виде желтого масла, которое использовали без дополнительной очистки.
Стадия 7
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-цианометил-циклопентил)-амид
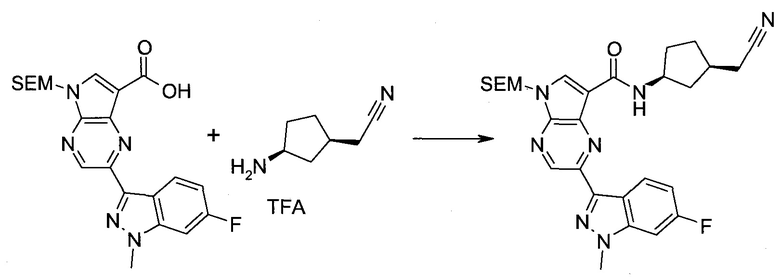
В круглодонной колбе растворяли (цис-3-амино-циклопентил)-ацетонитрила трифторацетат (неочищенный со стадии 6) в DMF (1,3 мл) и добавляли N,N-диизопропилэтиламин (0,65 мл; 3,72 ммоль). Затем добавляли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (110 мг; 0,25 ммоль) и HATU (104 мг; 0,27 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 48 часов. Добавляли воду и петролейный эфир и полученную суспензию фильтровали. Осадок на фильтре промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 128 мг (94%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-цианометил-циклопентил)-амида в виде беловатого порошка.
Стадия 8
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-цианометил-циклопентил)-амид
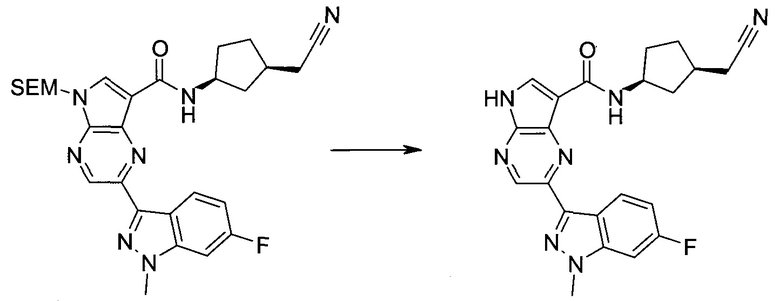
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-цианометил-циклопентил)-амид (126 мг; 0,23 ммоль) в дихлорметане (1,2 мл) и добавляли трифторуксусную кислоту (0,7 мл; 9,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (1,2 мл) и добавляли этилендиамин (0,93 мл; 13,8 ммоль). Желтый раствор перемешивали
при комнатной температуре в течение 1,25 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 75 мг (74%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-цианометил-циклопентил)-амида в виде светло-желтого порошка. MS: (M+H)+=418; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.61 (br. s., 1H), 9.09 (s, 1H), 8.40-8.49 (m, 2H), 8.18 (d, J=7,2 Гц, 1H), 7.69 (dd, J=9,8; 2,3 Гц, 1H), 7.24 (td, J=9,2; 2,1 Гц, 1H), 4.29-4.45 (m, 1H), 4.15 (s, 3H), 2.66 (d, J=6,4 Гц, 2H), 2.34-2.43 (m, 1H), 2.23-2.34 (m, 1H), 2.11-2.23 (m, 1H), 1.85-2.00 (m, 1H), 1.46-1.74 (m, 2H), 1.28-1.41 (m, 1H).
Пример 58
2-(6-Фтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид
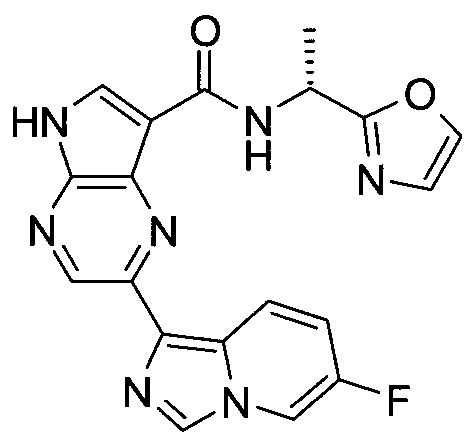
Стадия 1
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амид
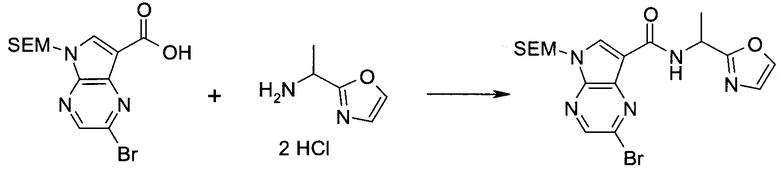
В круглодонную колбу загружали 2-бром-5-((2-(триметилсилил)этокси)-метил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (300 мг; 0,81 ммоль) и 1-оксазол-2-ил-этиламина дигидрохлорид (244 мг; 1,0 ммоль). Добавляли DMF (4 мл), затем N,N-диизопропилэтиламин (0,9 мл; 5,15 ммоль) и HATU (337 мг; 0,89 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и разбавляли петролейным эфиром. Полученную суспензию фильтровали. Осадок на фильтре промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 268 мг (71%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амида в виде беловатого порошка.
Стадия 2
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-оксазол-2-ил-этил)-амид
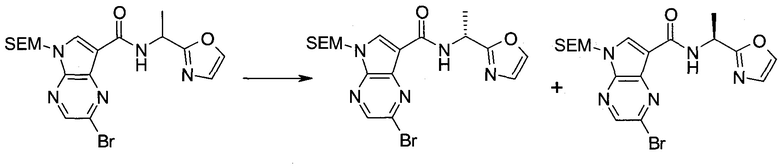
Рацемический образец 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амида (268 мг) подвергали SFC-хроматографии. Разделения энантиомеров достигали на колонке DAICEL OD, 3×25, используя смесь 20% MeOH/CO2 в качестве элюента. Получали 152 мг (57%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амида в виде беловатого порошка и 85 мг (32%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-оксазол-2-ил-этил)-амида в виде беловатого порошка.
Стадия 3
2-(6-Фтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид
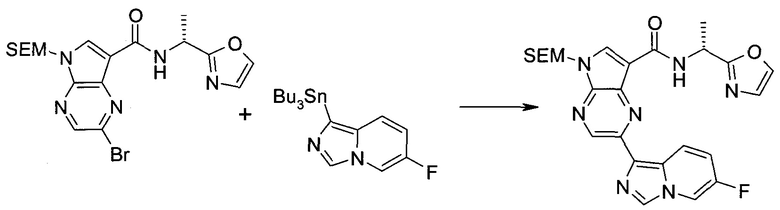
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид (148 мг; 0,32 ммоль) и 6-фтор-1-трибутилстаннил-имидазо[1,5-a]пиридин (380 мг; 0,45 ммоль) в DMF (3 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенилфосфин)палладий(0) (19 мг; 0,016 ммоль) и иодид меди(I) (13 мг; 0,068 ммоль). Реакционную смесь перемешивали при 80°C в масляной бане в течение ночи, затем охлаждали до
комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали через силикагель с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-2% MeOH), получая 109 мг (66%) 2-(6-фтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амида в виде желтого твердого вещества.
Стадия 4
2-(6-Фтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид
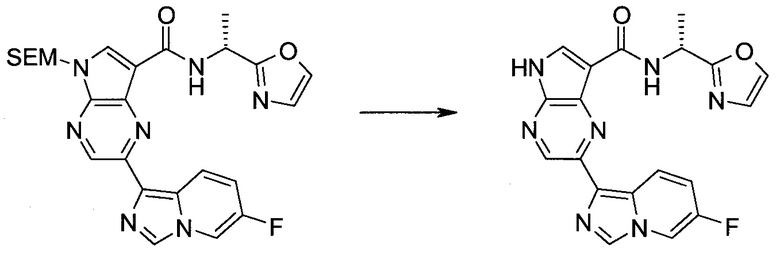
В круглодонной колбе растворяли 2-(6-фтор-имидазо[1,5-a]пиридин-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид (107 мг; 0,205 ммоль) в дихлорметане (1,1 мл) и добавляли трифторуксусную кислоту (0,64 мл; 8,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (1,1 мл) и добавляли этилендиамин (0,84 мл; 12,4 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 76 мг (90%) 2-(6-фтор-имидазо[1,5-a]пиридин-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амида в виде желтого порошка. MS: (M+Na)+=414; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.76 (br. s., 1H), 9.12 (s, 1H), 8.70 (dd, J=4,7; 2,1 Гц, 1H), 8.60 (d, J=8,7 Гц, 1H), 8.54 (s, 1H), 8.36-8.46 (m, 2H), 8.11 (s, 1H), 7.25 (s, 1H), 7.04 (ddd, J=9,9; 7,8; 1,9 Гц, 1H), 5.45-5.60 (m, 1H), 1.65 (d, J=6,8 Гц, 3H).
Пример 59
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-фтор-азетидин-1-карбонил)-бутил]-амид
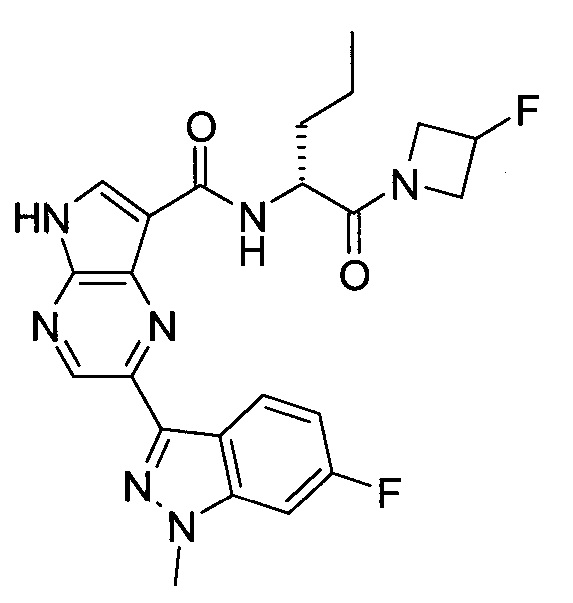
Стадия 1
[(R)-1-(3-Фтор-азетидин-1-карбонил)-бутил]-карбаминовой кислоты трет-бутиловый эфир
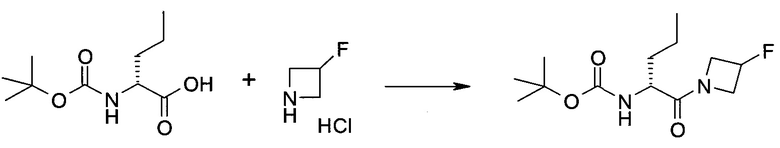
В круглодонную колбу загружали Boc-D-норвалин (300 мг; 1,38 ммоль) и 3-фторазетидина гидрохлорид (216 мг; 1,93 ммоль). Добавляли DMF (6 мл), затем N,N-диизопропилэтиламин (0,65 мл; 3,72 ммоль) и HATU (578 мг; 1,52 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение 48 часов, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 417 мг [(R)-1-(3-фтор-азетидин-1-карбонил)-бутил]-карбаминовой кислоты трет-бутилового эфира в виде светло-желтого твердого вещества.
Стадия 2
(R)-2-Амино-1-(3-фтор-азетидин-1-ил)-пентан-1-она трифторацетат
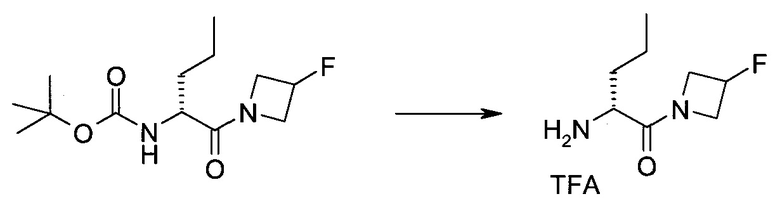
В круглодонной колбе растворяли [(R)-1-(3-фтор-азетидин-1-карбонил)-бутил]-карбаминовой кислоты трет-бутиловый эфир (200 мг; 0,66 ммоль) в дихлорметане (4 мл) и медленно добавляли трифторуксусную кислоту (1,6 мл; 20,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали, получая (R)-2-амино-1-(3-фтор-азетидин-1-
ил)-пентан-1-она трифторацетат в виде бледно-коричневого масла, которое использовали без дополнительной очистки.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-фтор-азетидин-1-карбонил)-бутил]-амид
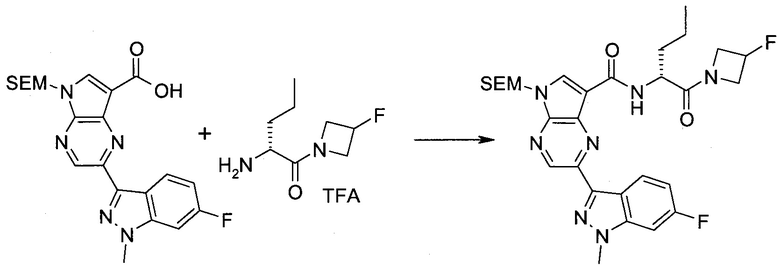
В круглодонной колбе растворяли (R)-2-амино-1-(3-фтор-азетидин-1-ил)-пентан-1-она трифторацетат (неочищенный со стадии 2) в DMF (1,5 мл) и добавляли N,N-диизопропилэтиламин (0,60 мл; 3,44 ммоль). Затем добавляли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (110 мг; 0,25 ммоль) и HATU (104 мг; 0,27 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и разбавляли петролейным эфиром. Полученную суспензию фильтровали. Осадок на фильтре промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 128 мг (86%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-фтор-азетидин-1-карбонил)-бутил]-амида в виде беловатого порошка.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-фтор-азетидин-1-карбонил)-бутил]-амид
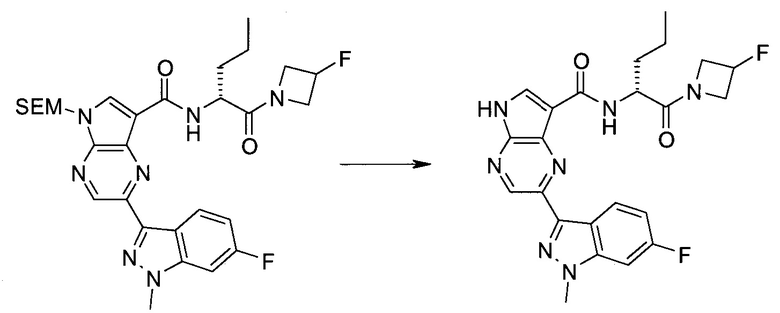
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-фтор-азетидин-1-карбонил)-бутил]-амид (126 мг; 0,21 ммоль) в дихлорметане (1,1 мл) и добавляли трифторуксусную кислоту (0,65 мл; 8,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали. Остаток растворяли в дихлорметане (1,1 мл) и добавляли этилендиамин (0,85 мл; 12,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 49 мг (50%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-фтор-азетидин-1-карбонил)-бутил]-амида в виде беловатого порошка. MS: (M+H)+=468; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.84 (br. s, 1H), 9.15(s, 1H), 8.74 (dt, J=9,3; 4,6 Гц, 1H), 8.41-8.52 (m, 2H), 7.68 (d, J=7,9 Гц, 1H), 7.02-7.17 (m, 1H), 5.29-5.61 (m, 1H), 4.18-4.84 (m, 4H), 4.16 (s, 3H), 3.87-4.09 (m, 1H), 1.62-1.91 (m, 2H), 1.41 (d, J=7,2 Гц, 2H), 0.82-0.97 (m, 3H).
Пример 60
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4,5-дигидро-оксазол-2-ил)-этил]-амид
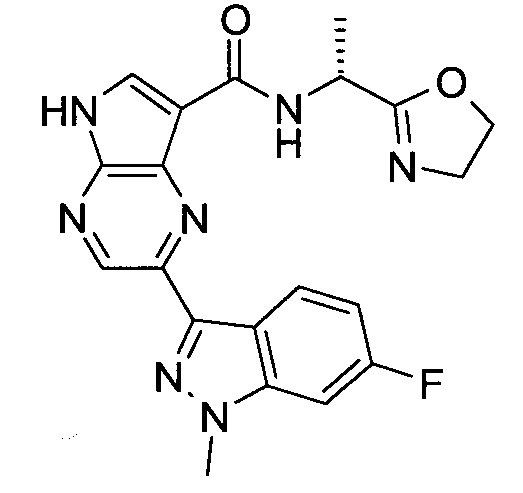
Стадия 1
[(R)-1-(2-Гидрокси-этилкарбамоил)-этил]-карбаминовой кислоты трет-бутиловый эфир
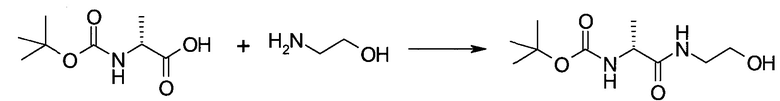
В круглодонной колбе растворяли Boc-D-аланин (1,0 г; 5,29 ммоль в THF (40 мл) и добавляли 1,1'-карбонилдиимидазол (1,03 г; 6,34 ммоль). Реакционную смесь перемешивали при 60°C в течение 45 мин, затем охлаждали до комнатной температуры и добавляли этаноламин (3,2 мл; 52,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили,
используя 1 М водный HCl (15 мл), и экстрагировали дихлорметаном. Органический слой промывали 1 М водным HCl, водой и рассолом. Водные слои вновь экстрагировали дихлорметаном (2×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали, получая 1,11 г (90%) [(R)-1-(2-гидрокси-этилкарбамоил)-этил]-карбаминовой кислоты трет-бутилового эфира в виде бесцветного масла.
Стадия 2
(R)-2-Амино-N-(2-гидрокси-этил)-пропионамида трифторацетат
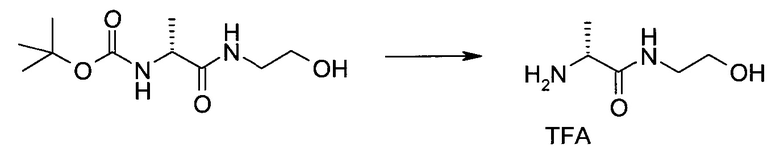
В круглодонной колбе растворяли [(R)-1-(2-гидрокси-этилкарбамоил)-этил]-карбаминовой кислоты трет-бутиловый эфир (180 мг; 0,78 ммоль) в дихлорметане (5 мл) и медленно добавляли трифторуксусную кислоту (1,8 мл; 23,4 ммоль). Бледно-желтую реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали, получая (R)-2-амино-N-(2-гидрокси-этил)-пропионамида трифторацетат в виде светло-желтого масла, которое использовали без дополнительной очистки.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2-гидрокси-этилкарбамоил)-этил]-амид
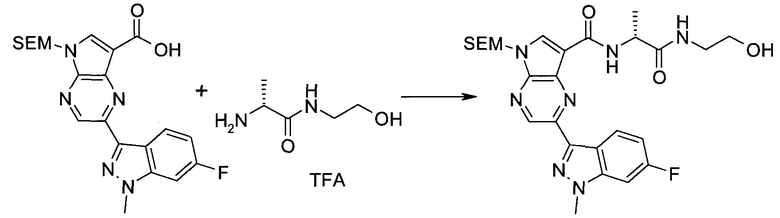
В круглодонной колбе растворяли (R)-2-амино-N-(2-гидрокси-этил)-пропионамида трифторацетат (неочищенный со стадии 2) в DMF (2 мл) и добавляли N,N-диизопропилэтиламин (0,70 мл; 4,0 ммоль). Затем добавляли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло-[2,3-b]пиразин-7-карбоновую кислоту (170 мг; 0,39 ммоль), после чего HATU (161 мг; 0,42 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и разбавляли
петролейным эфиром. Полученную суспензию фильтровали. Осадок на фильтре промывали водой и петролейным эфиром, затем сушили под высоким вакуумом. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-100% EtOAc) и MeOH/EtOAc (градиент 0-10% MeOH), получая 127 мг (59%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2-гидрокси-этилкарбамоил)-этил]-амида в виде беловатого твердого вещества.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4,5-дигидро-оксазол-2-ил)-этил]-амид
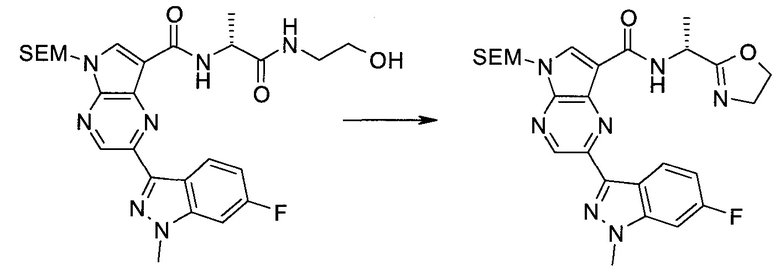
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2-гидрокси-этилкарбамоил)-этил]-амид (126 мг; 0,23 ммоль) в дихлорметане (2,2 мл). Раствор охлаждали до -76°C и добавляли DAST (45 мкл; 0,34 ммоль). Бледно-желтую реакционную смесь перемешивали при -76°C в течение 6 ч, затем добавляли безводный карбонат калия (64 мг; 0,46 ммоль) в виде одной порции. Реакционную смесь оставляли нагреваться до комнатной температуры, гасили насыщенным водным NaHCO3 и экстрагировали дихлорметаном (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-90% EtOAc), получая 86 мг (71%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4,5-дигидро-оксазол-2-ил)-этил]-амида в виде светло-желтого твердого вещества.
Стадия 5
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4,5-дигидро-оксазол-2-ил)-этил]-амид
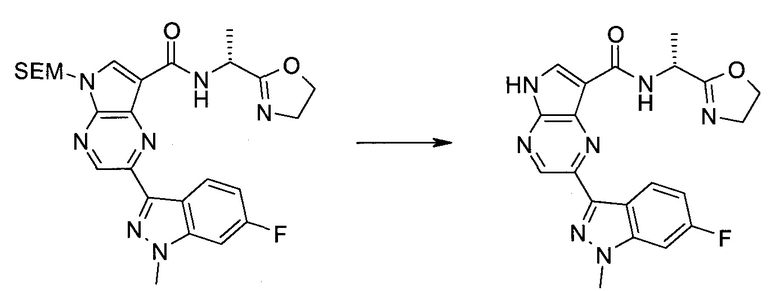
В небольшом флаконе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4,5-дигидро-оксазол-2-ил)-этил]-амид (85 мг; 0,16 ммоль) в тетрабутиламмонийфториде (1,0 М в THF; 1,6 мл; 1,6 ммоль). Желтую реакционную смесь перемешивали при 60°C в течение ночи, затем охлаждали до комнатной температуры, гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-5% MeOH), получая 27 мг (40%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4,5-дигидро-оксазол-2-ил)-этил]-амида в виде беловатого твердого вещества. MS: (M+Na)+=430; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.93 (br. s., 1H), 9.14 (s, 1H), 8.69 (dd, J=9,1; 5,3 Гц, 1H), 8.57 (d, J=8,3 Гц, 1H), 8.49 (s, 1H), 7.69 (dd, J=9,8; 1,9 Гц, 1H), 7.14 (td, J=9,1; 2,3 Гц, 1H), 4.97 (quin, J=7,5 Гц, 1H), 4.27-4.39 (m, 2H), 4.16 (s, 3H), 3.79 (td, J=9,3; 4,3 Гц, 2H), 1.50 (d, J=7,2 Гц, 3H).
Пример 61
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-3-фенил-пропил)-амид
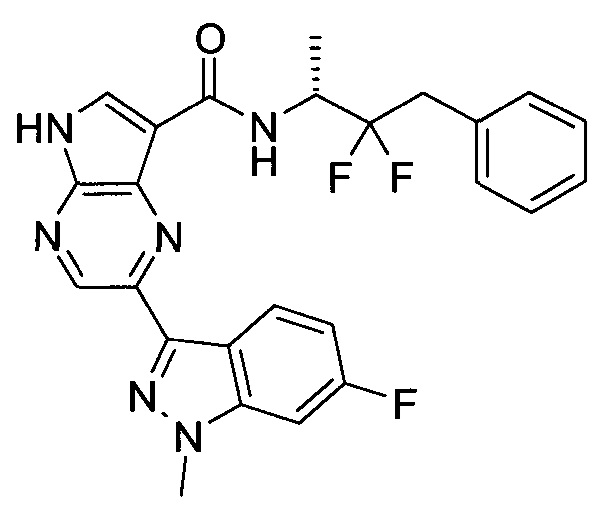
Стадия 1
((R)-1-Метил-2-оксо-3-фенил-пропил)-карбаминовой кислоты трет-бутиловый эфир
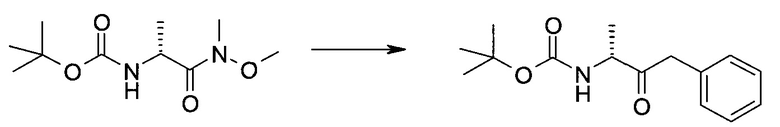
В круглодонной колбе растворяли [(R)-1-(метокси-метил-карбамоил)-этил]-карбаминовой кислоты трет-бутиловый эфир (300 мг; 1,29 ммоль) в THF (8 мл). Раствор охлаждали до -16°C (баня со смесью NaCl/лед) и по каплям добавляли хлорид бензилмагния (1,0 М в диэтиловом эфире; 3,8 мл; 3,8 ммоль). После добавления реакционную смесь оставляли медленно нагреваться до комнатной температуры и перемешивали в течение 5,5 ч. Реакционную смесь гасили насыщенным водным NH4Cl и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-20% EtOAc), получая 353 мг (99%) ((R)-1-метил-2-оксо-3-фенил-пропил)-карбаминовой кислоты трет-бутилового эфира в виде бесцветного масла.
Стадия 2
((R)-2,2-Дифтор-1-метил-3-фенил-пропил)-карбаминовой кислоты трет-бутиловый эфир
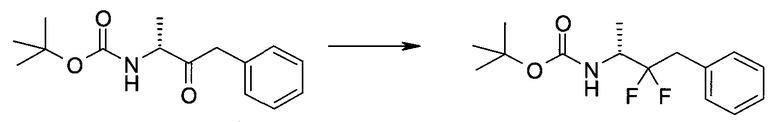
В сухой круглодонной колбе растворяли ((R)-1-метил-2-оксо-3-фенил-пропил)-карбаминовой кислоты трет-бутиловый эфир (171 мг; 0,65 ммоль) в дихлорметане (0,3 мл). По каплям при комнатной температуре добавляли DAST (0,26 мл; 1,97 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли дихлорметаном и медленно гасили с использованием 5 мл насыщенного водного NaHCO3. Водный слой экстрагировали дихлорметаном (2×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-5% EtOAc), получая 95 мг (51%) ((R)-2,2-дифтор-1-метил-3-фенил-пропил)-карбаминовой кислоты трет-бутилового эфира в виде светло-желтого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.23-7.39 (m, 5H), 4.57-4.72 (m, 1H), 3.93-4.14 (m, 1H), 3.12-3.28 (m, 2H), 1.47 (s, 9H), 1.24 (dd, J=6,8; 1,1 Гц, 3H).
Стадия 3
(R)-2,2-Дифтор-1-метил-3-фенил-пропиламина трифторацетат
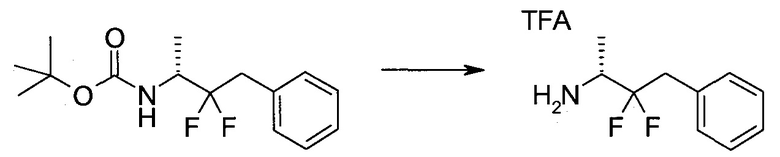
В круглодонной колбе растворяли ((R)-2,2-дифтор-1-метил-3-фенил-пропил)-карбаминовой кислоты трет-бутиловый эфир (92 мг; 0,32 ммоль) в дихлорметане (2 мл) и медленно добавляли трифторуксусную кислоту (0,75 мл; 9,73 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали, получая (R)-2,2-дифтор-1-метил-3-фенил-пропиламина трифторацетат в виде светло-коричневого масла, которое использовали без дополнительной очистки
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-3-фенил-пропил)-амид
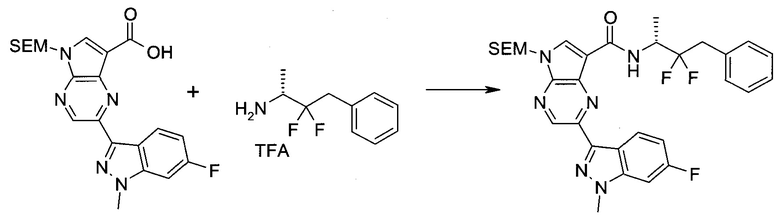
В круглодонной колбе растворяли (R)-2,2-дифтор-1-метил-3-фенил-пропиламина трифторацетат (неочищенный со стадии 3) в DMF (1,1 мл) и добавляли N,N-диизопропилэтиламин (0,25 мл; 1,43 ммоль). Затем добавляли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло-[2,3-b]пиразин-7-карбоновую кислоту (100 мг; 23 ммоль), после чего HATU (95 мг; 0,25 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток растирали с петролейным эфиром, получая 136 мг (94%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-3-фенил-пропил)-амида в виде беловатого порошка.
Стадия 5
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-3-фенил-пропил)-амид
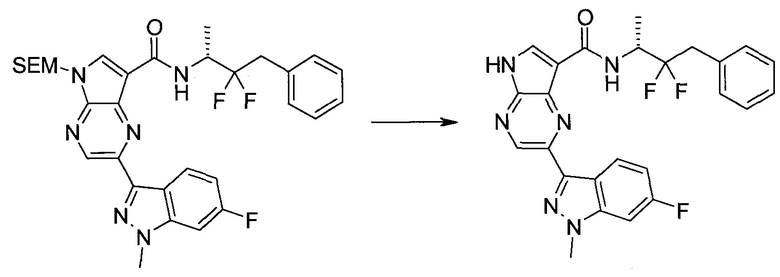
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-3-фенил-пропил)-амид (133 мг; 0,21 ммоль в дихлорметане (1,1 мл) и добавляли трифторуксусную кислоту (0,64 мл; 8,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (1,1 мл) и добавляли этилендиамин (0,84 мл; 12,4 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток растирали со смесью 5% EtOAc/диэтиловый эфир, получая 73 мг (70%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-3-фенил-пропил)-амида в виде светло-желтого порошка. MS: (M+Na)+=501; 1H ЯМР (DMSO-d6, 400 МГц): 5 (млн-1) 12.94 (br. s., 1H), 9.12 (s, 1H), 8.52 (s, 1H), 8.47 (dd, J=8,9; 5,4 Гц, 1H), 8.36 (d, J=9,8 Гц, 1H), 7.68 (dd, J=9,8; 2,0 Гц, 1H), 7.23-7.35 (m, 5H), 7.02 (td, J=9,0; 2,3 Гц, 1H), 4.60-4.78 (m, 1H), 4.15 (s, 3H), 3.33-3.45 (m, 2H), 1.41 (d, J=7,0 Гц, 3H).
Пример 62
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-цианометил-оксазол-2-ил)-этил]-амид
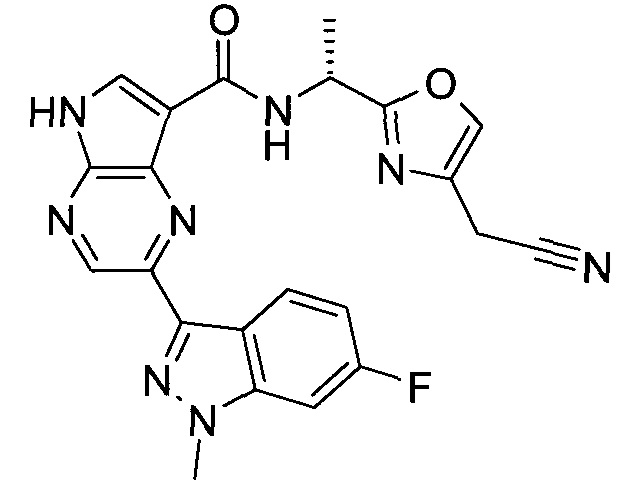
Стадия 1
2-((R)-2-трет-Бутоксикарбониламино-пропиониламино)-3-гидрокси-пропионовой кислоты метиловый эфир
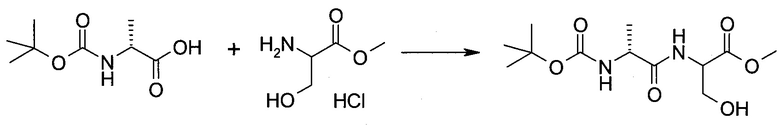
В круглодонную колбу загружали Boc-D-аланин (600 мг; 3,17 ммоль) и добавляли гидрохлорид метилового эфира DL-серина (691 мг; 4,44 ммоль). Добавляли DMF (12 мл), затем N,N-диизопропилэтиламин (1,5 мл; 8,6 ммоль) и HATU (1,33 г; 3,49 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение 48 часов, затем гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 422 мг (41%) 2-((R)-2-трет-бутоксикарбониламино-пропиониламино)-3-гидрокси-пропионовой кислоты метилового эфира в виде бесцветного масла.
Стадия 2
2-((R)-1-трет-Бутоксикарбониламино-этил)-4,5-дигидро-оксазол-4-карбоновой кислоты метиловый эфир
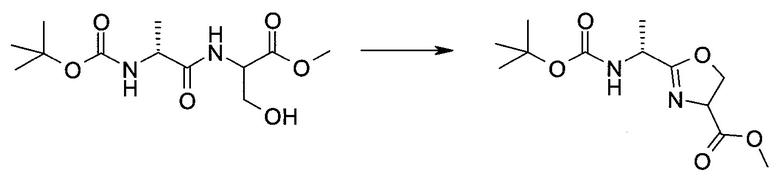
В круглодонной колбе растворяли 2-((R)-2-трет-бутоксикарбониламино-пропиониламино)-3-гидрокси-пропионовой кислоты метиловый эфир (419 мг; 1,3 ммоль) в дихлорметане (11 мл). Раствор охлаждали до -76°C и по каплям добавляли DAST (0,20 мл; 1,51 ммоль). Светло-желтый раствор перемешивали при -76°C в течение 2 ч, затем добавляли безводный карбонат калия (269 мг; 1,95 ммоль) в виде одной порции. Реакционную смесь оставляли нагреваться до комнатной температуры, гасили с использованием 10 мл насыщенного водного NaHCO3 и экстрагировали дихлорметаном (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали, получая 339 мг (91%) 2-((R)-1-трет-бутоксикарбониламино-этил)-4,5-дигидро-оксазол-4-карбоновой кислоты метилового эфира в виде коричневого масла.
Стадия 3
2-((R)-1-трет-Бутоксикарбониламино-этил)-оксазол-4-карбоновой кислоты метиловый эфир
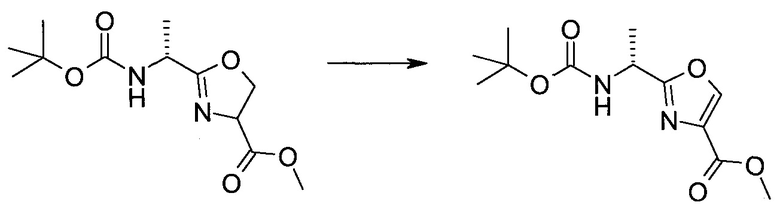
В круглодонной колбе растворяли 2-((R)-1-трет-бутоксикарбониламино-этил)-4,5-дигидро-оксазол-4-карбоновой кислоты метиловый эфир (337 мг; 1,18 ммоль) в дихлорметане (11 мл). Раствор охлаждали до -16°C (баня со смесью NaCl/лед) и добавляли DBU (0,35 мл; 2,32 ммоль). Через 5 мин добавляли бромтрихлорметан (0,13 мл; 1,33 ммоль), реакционную смесь оставляли медленно нагреваться до комнатной температуры и перемешивали в течение 4 суток. Реакцию гасили 0,1 М водным HCl и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-30% EtOAc), получая 152 мг (48%) 2-((R)-1-трет-бутоксикарбонил-амино-этил)-оксазол-4-карбоновой кислоты метилового эфира в виде беловатого твердого вещества.
Стадия 4
[(R)-1-(4-Гидроксиметил-оксазол-2-ил)-этил]-карбаминовой кислоты трет-бутиловый эфир
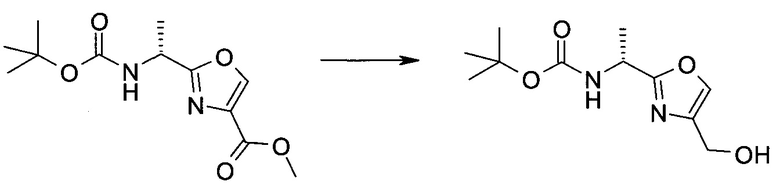
В круглодонной колбе растворяли 2-((R)-1-трет-бутоксикарбониламино-этил)-оксазол-4-карбоновой кислоты метиловый эфир (151 мг; 0,56 ммоль) в THF (4 мл). Бледно-желтый раствор охлаждали до 0°C и по каплям добавляли алюмогидрид лития (1,0 М в THF; 0,60 мл; 0,60 ммоль). Реакционную смесь перемешивали при 0°C в течение 1,5 ч, затем осторожно добавляли декагидрат сульфата натрия. Когда выделение газа прекращалось, ледяную баню удаляли, добавляли сульфат натрия и смесь интенсивно перемешивали в течение 30 мин при комнатной температуре. Суспензию фильтровали через целит и промывали смесью этилацетат/метанол. Фильтрат концентрировали, получая 140 мг (93%)
[(R)-1-(4-гидроксиметил-оксазол-2-ил)-этил]-карбаминовой кислоты трет-бутилового эфира в виде желтого масла, которое использовали без дополнительной очистки.
Стадия 5
[2-((R)-1-Амино-этил)-оксазол-4-ил]-метанола трифторацетат
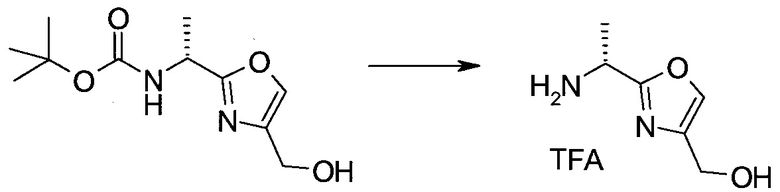
В круглодонной колбе растворяли [(R)-1-(4-гидроксиметил-оксазол-2-ил)-этил]-карбаминовой кислоты трет-бутиловый эфир (137 мг; 0,51 ммоль) в дихлорметане (3 мл) и медленно добавляли трифторуксусную кислоту (1,2 мл; 15,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч, затем концентрировали, получая [2-((R)-1-амино-этил)-оксазол-4-ил]-метанола трифторацетат в виде коричневого масла, которое использовали без дополнительной очистки.
Стадия 6
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-гидроксиметил-оксазол-2-ил)-этил]-амид
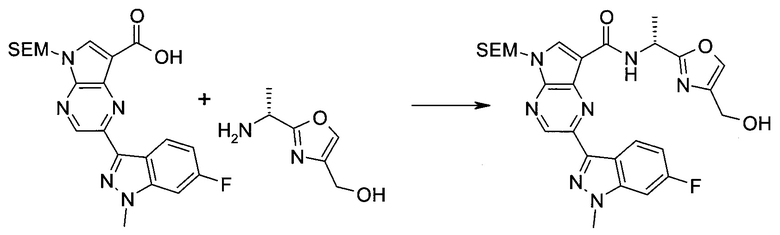
В круглодонной колбе растворяли [2-((R)-1-амино-этил)-оксазол-4-ил]-метанола трифторацетат (неочищенный со стадии 5) в DMF (1,5 мл) и добавляли N,N-диизопропилэтиламин (0,70 мл; 4,0 ммоль). Затем добавляли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (140 мг; 0,32 ммоль), после чего HATU (133 мг; 0,35 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием
смеси EtOAc/гексаны (градиент 0-100% EtOAc), получая 118 мг (66%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-гидроксиметил-оксазол-2-ил)-этил]-амида в виде светло-коричневой пены.
Стадия 7
Метансульфоновой кислоты 2-((R)-1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-оксазол-4-илметиловый эфир
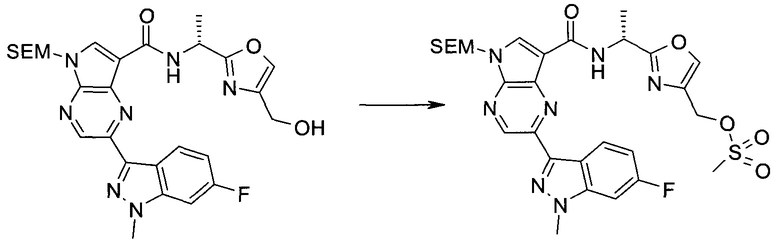
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-гидроксиметил-оксазол-2-ил)-этил]-амид (115 мг; 0,20 ммоль) в дихлорметане (1 мл). Раствор охлаждали до 0°C и добавляли триэтиламин (0,04 мл; 0,29 ммоль) и метансульфонилхлорид (19 мкл; 0,24 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 ч, затем гасили водой и экстрагировали дихлорметаном (2×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали, получая 147 мг метансульфоновой кислоты 2-((R)-1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-оксазол-4-илметилового эфира в виде желтой пены, которую использовали без дополнительной очистки.
Стадия 8
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-цианометил-оксазол-2-ил)-этил]-амид
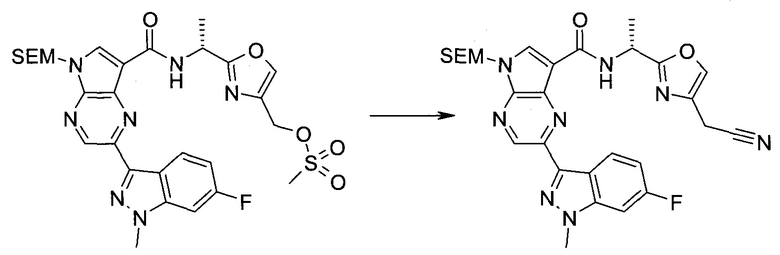
В круглодонной колбе растворяли метансульфоновой кислоты 2-((R)-1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-оксазол-4-илметиловый эфир (146 мг; 0,18 ммоль) в DMF (0,5 мл). Добавляли цианид натрия (27 мг; 0,55 ммоль) и реакционную смесь перемешивали при 80°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-60% EtOAc), получая 37 мг (36%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-цианометил-оксазол-2-ил)-этил]-амида в виде желтого твердого вещества.
Стадия 9
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-цианометил-оксазол-2-ил)-этил]-амид
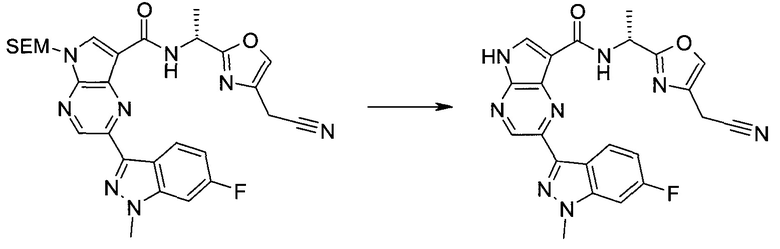
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-цианометил-оксазол-2-ил)-этил]-амид (36 мг; 0,063 ммоль) в дихлорметане (0,4 мл) и добавляли трифторуксусную кислоту (0,20 мл; 2,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,4 мл) и добавляли этилендиамин (0,26 мл; 3,8 ммоль). Желтый раствор
перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 18 мг (65%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-цианометил-оксазол-2-ил)-этил]-амида в виде беловатого порошка. MS: (M+Na)+=467; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 12.93 (br. s., 1H), 9.12 (s, 1H), 8.66 (d, J=8,3 Гц, 1H), 8.50 (s, 1H), 8.46 (dd, J=8,9; 5,4 Гц, 1H), 8.06 (t, J=1,0 Гц, 1H), 7.69 (dd, J=9,7; 2,1 Гц, 1H), 7.12 (td, J=9,0; 2,3 Гц, 1H), 5.44-5.56 (m, 1H), 4.15 (s, 3H), 3.92 (d, J=1,3 Гц, 2H), 1.68 (d, J=7,0 Гц, 3H).
Пример 63
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(S)-1-(тетрагидро-фуран-2-ил)-этил]-амид
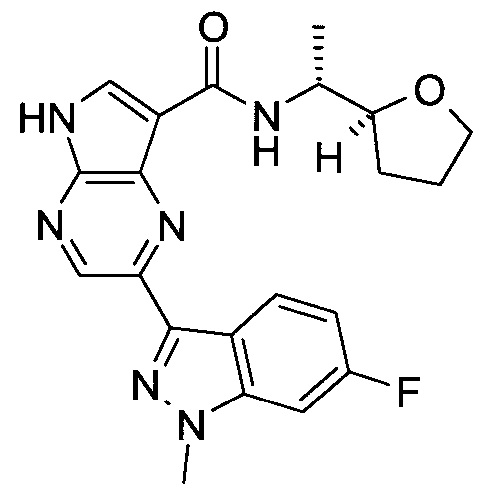
Стадия 1
(S)-2-Метил-пропан-2-сульфиновой кислоты 1-фуран-2-ил-мет-(E)-илиденамид
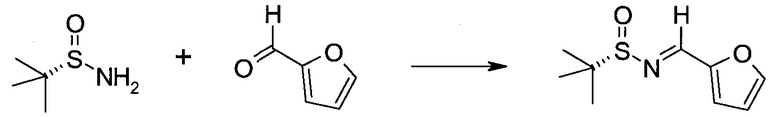
В круглодонной колбе растворяли фуран-2-карбальдегид (800 мг; 8,33 ммоль) в THF (20 мл) и добавляли (S)-2-метилпропан-2-сульфинамид (1,21 г; 10,0 ммоль) и этилат титана(IV) (3,5 мл; 16,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч, затем медленно гасили, по каплям добавляя рассол (5 мл), что приводило к образованию вязкого осадка. Реакционную смесь разбавляли этилацетатом и интенсивно перемешивали при комнатной температуре в течение 15 мин. Суспензию фильтровали через целит и промывали этилацетатом. Фильтрат концентрировали и остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-25% EtOAc), получая 1,48 г
(89%) (S)-2-метил-пропан-2-сульфиновой кислоты 1-фуран-2-ил-мет-(E)-илиденамида в виде светло-желтого масла.
Стадия 2
(S)-2-Метил-пропан-2-сульфиновой кислоты ((R)-1-фуран-2-ил-этил)-амид

В круглодонной колбе растворяли (S)-2-метил-пропан-2-сульфиновой кислоты 1-фуран-2-ил-мет-(E)-илиденамид (500 мг; 2,51 ммоль) в дихлорметане (10 мл). Раствор охлаждали до -76°C и по каплям добавляли бромид метилмагния (3,0 М в диэтиловом эфире; 1,0 мл; 3,00 ммоль). Реакционную смесь перемешивали при -76°C в течение 1,5 ч и затем оставляли нагреваться до комнатной температуры в течение 1,5 ч. Реакционную смесь снова охлаждали до -76°C и по каплям добавляли вторую порцию бромида метилмагния (3,0 М в диэтиловом эфире; 1,0 мл; 3,00 ммоль). Реакционную смесь перемешивали при -76°C в течение 1 ч и затем оставляли нагреваться до комнатной температуры в течение 3 ч. Реакционную смесь снова охлаждали до -76°C и по каплям добавляли третью порцию бромида метилмагния (3,0 М в диэтиловом эфире; 0,5 мл; 1,5 ммоль). Реакционную смесь оставляли медленно нагреваться до комнатной температуры в течение ночи, затем гасили насыщенным водным NH4Cl и экстрагировали этилацетатом (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 515 мг (91%) желтого твердого вещества. ЯМР-анализ показал наличие смеси 9:1 (80% de) диастереомеров, при этом основной был определен как (S)-2-метил-пропан-2-сульфиновой кислоты ((R)-1-фуран-2-ил-этил)-амид на основе сопоставления с литературными данными.
Стадия 3
(R)-1-Фуран-2-ил-этиламина гидрохлорид
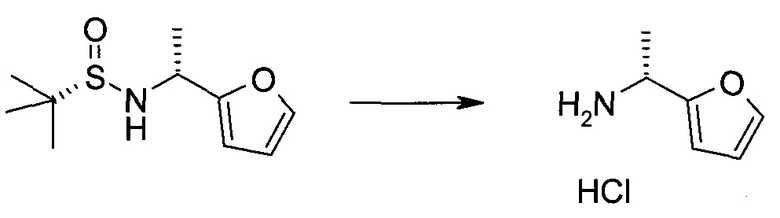
В круглодонной колбе растворяли (S)-2-метил-пропан-2-сульфиновой кислоты ((R)-1-фуран-2-ил-этил)-амид (514 мг; 2,27 ммоль) в метаноле 4 мл) и по каплям добавляли хлористый водород (4,0 М в 1,4-диоксане; 1,2 мл; 4,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 мин,
затем концентрировали, получая 416 мг (R)-1-фуран-2-ил-этиламина гидрохлорида в виде темно-коричневого воскообразного твердого вещества, которое использовали без дополнительной очистки.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-фуран-2-ил-этил)-амид
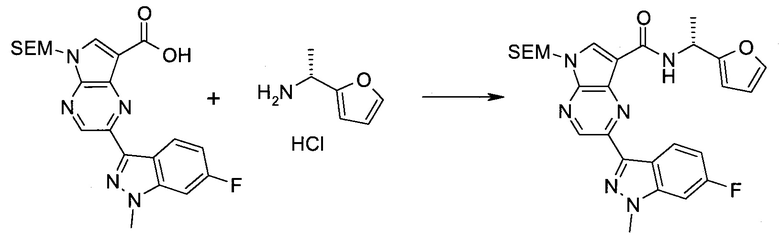
В круглодонную колбу загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (300 мг; 0,68 ммоль) и (R)-1-фуран-2-ил-этиламина гидрохлорид (416 мг; 1,55 ммоль). Добавляли DMF (3,5 мл), затем N,N-диизопропилэтиламин (0,85 мл; 4,87 ммоль) и HATU (284 мг; 0,75 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем добавляли воду и петролейный эфир. Полученную суспензию фильтровали. Осадок на фильтре промывали водой и петролейным эфиром, затем сушили под высоким вакуумом, получая 338 мг (88%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-фуран-2-ил-этил)-амида в виде светло-коричневого порошка.
Стадия 5
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(тетрагидро-фуран-2-ил)-этил]-амид
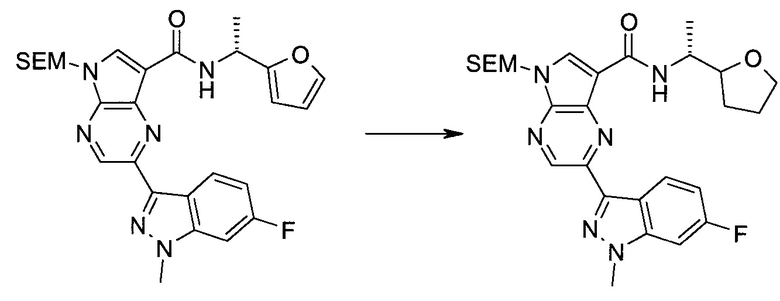
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой
кислоты ((R)-1-фуран-2-ил-этил)-амид (370 мг; 0,66 ммоль) в метаноле (6 мл) и этилацетате (2 мл).
Колбу промывали сильной струей аргона, затем добавляли 20%-ный гидроксид палладия на угле (50% воды; 100 мг; 0,71 ммоль). Реакционную смесь перемешивали в атмосфере водорода (баллон) при комнатной температуре в течение 48 часов, затем фильтровали через целит и промывали смесью дихлорметан/этилацетат. Фильтрат концентрировали и остаток хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2/0,5% NH4OH (градиент 0-2,5% MeOH), получая 300 мг (86%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(тетрагидро-фуран-2-ил)-этил]-амида в виде светло-желтого твердого вещества.
Стадия 6
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(S)-1-(тетрагидро-фуран-2-ил)-этил]-амид и 2-(б-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(R)-1-(тетрагидро-фуран-2-ил)-этил]-амид
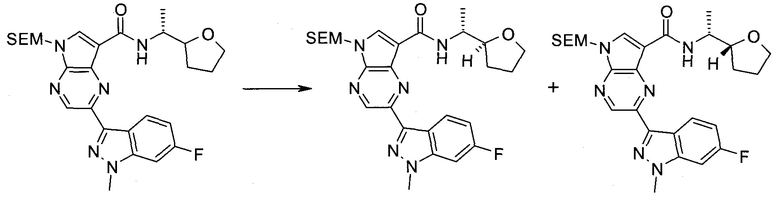
Образец 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(тетрагидро-фуран-2-ил)-этил]-амида (300 мг; 0,56 ммоль) подвергали хиральной SFC-хроматографии. Разделения энантиомеров достигали на колонке WHELK-01 R,R, 3×25, используя смесь 45% MeOH/CO2 (с добавлением 0,2% триэтиламина) в качестве элюента. Получали 163 мг (54%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(S)-1-(тетрагидро-фуран-2-ил)-этил]-амида в виде беловатого твердого вещества и 38 мг (13%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(R)-1-(тетрагидро-фуран-2-ил)-этил]-амида в виде беловатого порошка.
Стадия 7
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(S)-1-(тетрагидро-фуран-2-ил)-этил]-амид
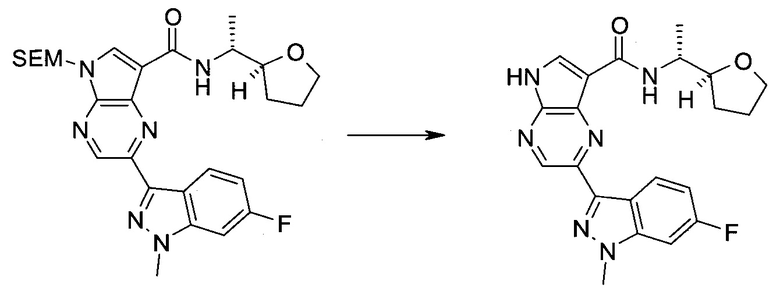
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(S)-1-(тетрагидро-фуран-2-ил)-этил]-амид (152 мг; 0,28 ммоль) в дихлорметане (1,4 мл) и добавляли трифторуксусную кислоту (0,87 мл; 11,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (1,4 мл) и добавляли этилендиамин (1,2 мл; 17,8 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 46 мг (40%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(S)-1-(тетрагидро-фуран-2-ил)-этил]-амида в виде беловатого порошка. MS: (M+Na)+=431; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.09 (br. s., 1H), 9.13 (s, 1H), 8.64 (dd, J=8,7; 5,3 Гц, 1H), 8.44 (s, 1H), 8.22 (d, J=9,4 Гц, 1H), 7.67 (d, J=8,3 Гц, 1H), 7.10 (t, J=8,1 Гц, 1H), 4.32 (br. s., 1H), 4.15 (s, 3H), 3.96 (d, J=3,0 Гц, 1H), 3.52-3.68 (m, 2H), 1.86-2.00 (m, 1H), 1.52-1.84 (m, 3H), 1.33(d,J=6,8 Гц, 3H).
Пример 64
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(R)-1-(тетрагидро-фуран-2-ил)-этил]-амид
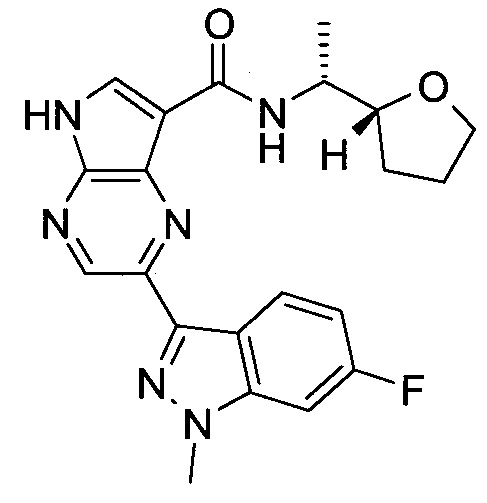
Получали согласно примеру 63, стадия 7, заменяя 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(R)-1-(тетрагидро-фуран-2-ил)-этил]-амид на 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(S)-1-(тетрагидро-фуран-2-ил)-этил]-амид. MS:(M+Na)+=431; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 9.12 (s, 1H), 8.56 (dd, J=8,7; 5,3 Гц, 1H), 8.44 (s, 1H), 8.24 (d, J=9,1 Гц, 1H), 7.69 (dd, J=9,8; 2,3 Гц, 1H), 7.14 (td, J=9,1; 2,3 Гц, 1H), 4.26 (dd, J=13,4; 7,0 Гц, 1H), 4.15 (s, 3H), 3.79-4.00 (m, 2H), 3.69 (q, J=7,3 Гц, 1H), 1.65-2.02 (m, 4H), 1.26 (d, J=6,4 Гц, 3H).
Пример 65
2-(5-Гидрокси-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
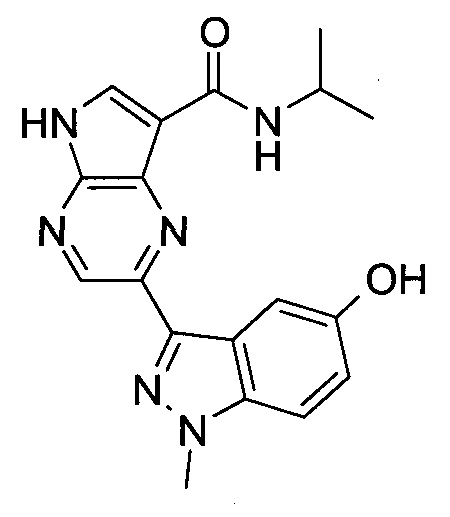
Стадия 1
5-(трет-Бутил-диметил-силанилокси)-1H-индазол
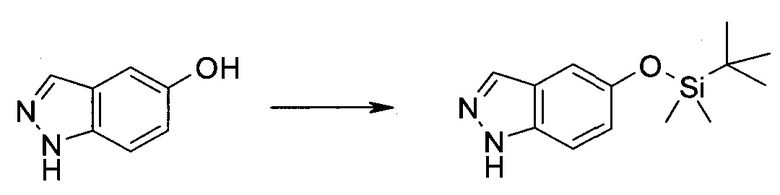
В круглодонной колбе растворяли 5-гидрокси-1H-индазол (700 мг; 5,22 ммоль) в DMF (15 мл) и добавляли TBDMS-Cl (865 мг; 5,74 ммоль) и имидазол (426 мг; 6,26 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-30% EtOAc), получая 1,21 г (93%) 5-(трет-бутил-диметил-силанилокси)-1H-индазола в виде беловатого твердого вещества.
Стадия 2
5-(трет-Бутил-диметил-силанилокси)-3-иод-1H-индазол
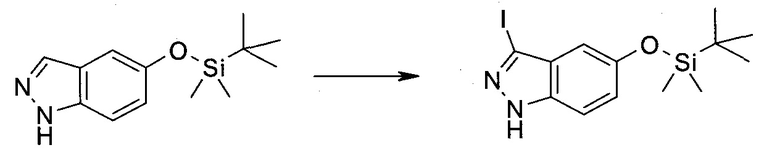
В круглодонной колбе растворяли 5-(трет-бутил-диметил-силанилокси)-1H-индазол (1,20 г; 4,83 ммоль) в DMF (12 мл). Добавляли йод (2,45 г; 9,66 ммоль), затем карбонат калия (2,58 г; 18,7 ммоль). Темную суспензию перемешивали при комнатной температуре в течение 3 ч, затем гасили 10%-ным водным NaHSO3 и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои промывали 10%-ным водным NaHSO3, три раза водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 1,65 г (91%) 5-(трет-бутил-диметил-силанилокси)-3-иод-1H-индазола в виде темно-коричневой пены.
Стадия 3
5-(трет-Бутил-диметил-силанилокси)-3-иод-1-метил-1H-индазол
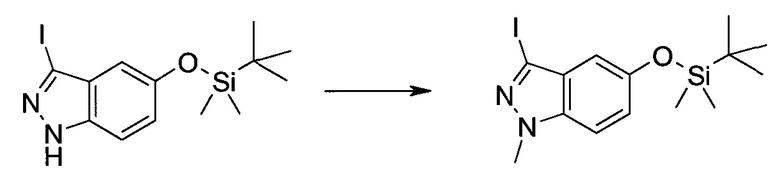
В круглодонной колбе растворяли 5-(трет-бутил-диметил-силанилокси)-3-иод-1H-индазол (1,65 г; 4,41 ммоль) в THF (16 мл). Раствор охлаждали до 0°C и добавляли трет-бутилат калия (697 мг; 6,22 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин, затем по каплям добавляли метилиодид (0,38 мл; 6,08 ммоль). По завершении добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 4,5 ч. Реакцию гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-10% EtOAc), получая 770 мг (45%) 5-(трет-бутил-диметил-силанилокси)-3-иод-1-метил-1H-индазола в виде светло-желтого твердого вещества.
Стадия 4
5-(трет-Бутил-диметил-силанилокси)-1-метил-3-трибутилстаннанил-1H-индазол
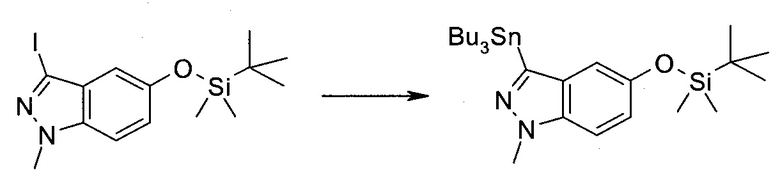
В круглодонной колбе растворяли 5-(трет-бутил-диметил-силанилокси)-3-иод-1-метил-1H-индазол (140 мг; 0,36 ммоль) в THF (2 мл). Раствор охлаждали до -16°C (баня со смесью NaCl/лед) и по каплям добавляли хлорид изопропилмагния (2,0 М в THF; 0,22 мл; 0,44 ммоль). Реакционную смесь перемешивали при -16°C в течение 20 мин, затем медленно добавляли трибутилхлорстаннан (0,11 мл; 0,41 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры в течение 1,5 ч, затем гасили насыщенным водным NH4Cl и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 5-(трет-бутил-диметил-силанилокси)-1-метил-3-трибутилстаннанил-1H-индазол в виде светло-желтого масла, которое использовали без дополнительной очистки.
Стадия 5
2-[5-(трет-Бутил-диметил-силанилокси)-1-метил-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
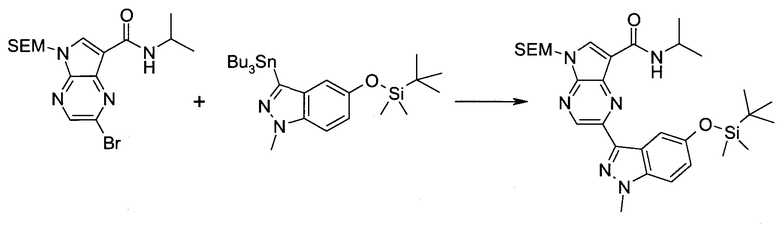
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид (100 мг; 0,24 ммоль) и 5-(трет-бутил-диметил-силанилокси)-1-метил-3-трибутил-станнанил-1H-индазол (неочищенный со стадии 4) в DMF (2 мл). Колбу вакуумировали и заполняли аргоном, затем добавляли тетракис(трифенил-фосфин)палладий(0) (14 мг; 0,012 ммоль) и иодид меди(I) (10 мг; 0,053 ммоль). Реакционную смесь перемешивали при 80°C в течение 2 ч, затем охлаждали до комнатной температуры, гасили водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и
концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-30% EtOAc), получая 104 мг (72%) 2-[5-(трет-бутил-диметил-силанилокси)-1-метил-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида в виде светло-желтого твердого вещества.
Стадия 6
2-[5-(трет-Бутил-диметил-силанилокси)-1-метил-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
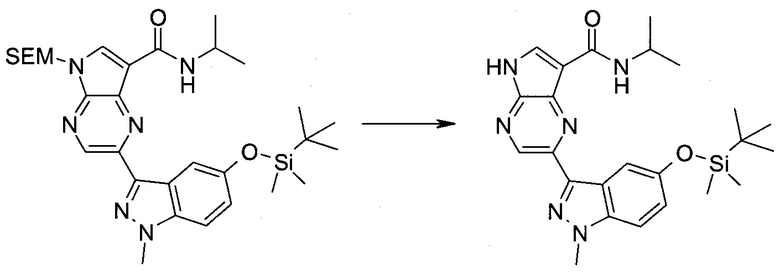
В круглодонной колбе растворяли 2-[5-(трет-бутил-диметил-силанилокси)-1-метил-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид (100 мг; 0,168 ммоль) в дихлорметане (0,8 мл) и добавляли трифторуксусную кислоту (0,52 мл; 6,75 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,8 мл) и добавляли этилендиамин (0,68 мл; 10,1 ммоль). Желтый раствор перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток растирали с этилацетатом, получая 55 мг (70%) 2-[5-(трет-бутил-диметил-силанилокси)-1-метил-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида в виде желтого порошка.
Стадия 7
2-(5-Гидрокси-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
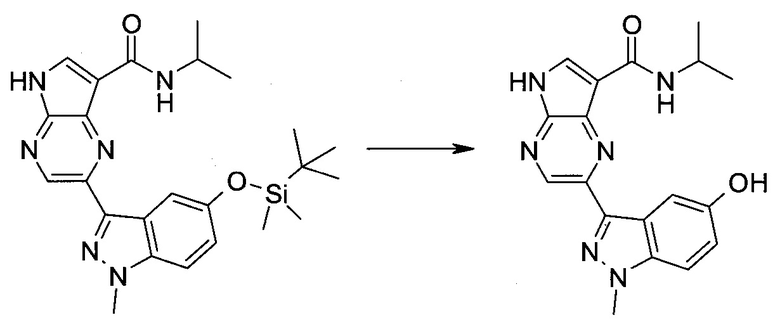
В круглодонной колбе суспендировали 2-[5-(трет-бутил-диметил-силанилокси)-1-метил-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид (50 мг; 0,108 ммоль) в THF (1,2 мл) и добавляли фторид тетрабутиламмония (1,0 М в THF; 0,11 мл; 110 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали, твердое вещество промывали горячей водой и этилацетатом, затем сушили под высоким вакуумом, получая 33 мг (83%) 2-(5-гидрокси-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида в виде желтого порошка. MS: (M+Na)+=373; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.77 (br. s., 1H), 9.25 (s, 1H), 9.06 (s, 1H), 8.38 (s, 1H), 8.16 (d, J=7,6 Гц, 1H), 7.73 (d, J=1,9 Гц, 1H), 7.60 (d, J=9,1 Гц, 1H), 7.10 (dd, J=9,1; 2,3 Гц, 1H), 4.23 (dq, J=13,6; 6,7 Гц, 1H),4.13 (s, 3H), 1.35 (d, J=6,8 Гц, 6H).
Пример 66
2-(5-Хлор-индазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-цикпопропил-2-оксо-этил]-амид
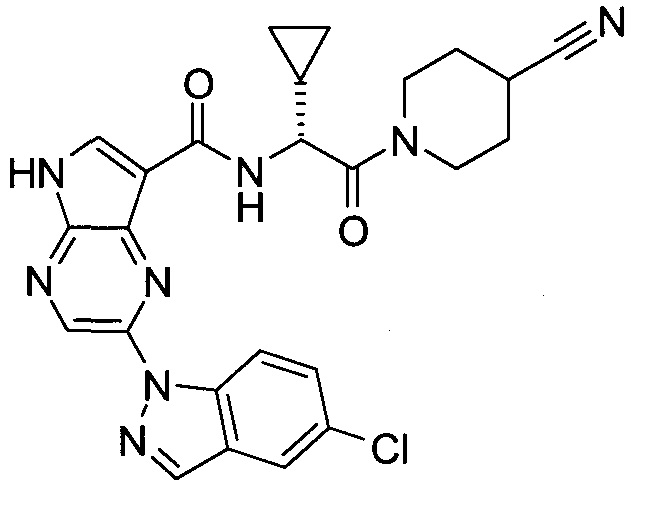
Стадия 1
2-(5-Хлор-индазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
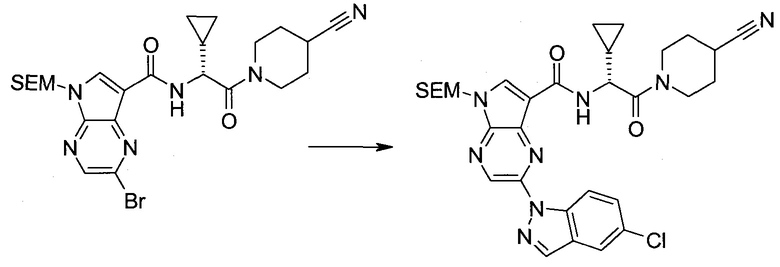
Во флакон емкостью 5 мл для микроволнового реактора загружали 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид (252 мг; 0,45 ммоль), иодид натрия (112 мг; 0,75 ммоль) и иодид меди(I) (8 мг; 0,04 ммоль). Флакон вакуумировали, заполняли аргоном, затем добавляли толуол (0,4 мл) и транс-N,N'-диметилциклогексан-1,2-диамин (0,015 мл; 0,095 ммоль) с помощью шприца. Флакон герметично закрывали и реакционную смесь перемешивали при 110°C в масляной бане в течение 22 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли 5-хлор-1H-индазол (57 мг; 0,37 ммоль) и фосфат калия трехосновный (167 мг; 0,79 ммоль). Флакон снова вакуумировали, заполняли аргоном, герметично закрывали и перемешивали при 110°C в масляной бане в течение 19 ч. Реакционную смесь охлаждали до комнатной температуры, фильтровали через целит и промывали этилацетатом. Фильтрат концентрировали и остаток очищали хроматографией на силикагеле с использованием смеси MeOH/CH2Cl2 (0,5% NH4OH) (градиент 0-2,5% MeOH), получая 53 мг (22%) 2-(5-хлор-индазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида в виде желтого масла и 76 мг (33%) 2-иод-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида в виде светло-коричневого твердого вещества.
Стадия 2
2-(5-Хлор-индазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-цикпопропил-2-оксо-этил]-амид
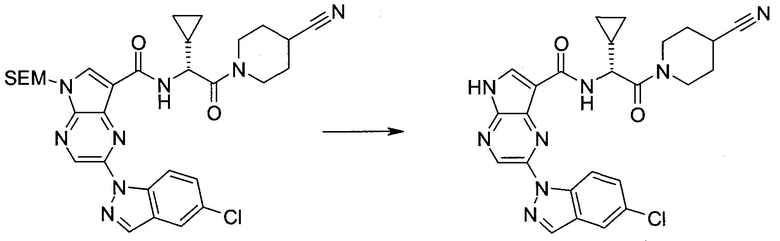
В круглодонной колбе растворяли 2-(5-хлор-индазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид (51 мг; 0,08 ммоль) в дихлорметане (0,5 мл) и добавляли трифторуксусную кислоту (0,25 мл; 3,24 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,5 мл) и добавляли этилендиамин (0,33 мл; 4,89 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч, затем гасили водой и экстрагировали EtOAc (2×30 мл). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-100% EtOAc), затем растирали со смесью EtOAc/гексаны (1:1), получая 22 мг (52%) 2-(5-хлор-индазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида в виде желтого твердого вещества. MS: (M+H)+=503; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 13.01 (br. s., 1H), 9.10 (s, 1H), 8.94 (dd, J=8,9; 5,1 Гц, 1H), 8.54 (d, J=0,8 Гц, 1H), 8.51 (d, J=6,8 Гц, 1H), 8.29 (d, J=8,3 Гц, 1H), 8.07 (d, J=1,9 Гц, 1H), 7.56 (t, J=6,6 Гц, 1H), 4.92-5.02 (m, 1H), 3.70-4.06 (m, 2H), 3.09-3.68 (m, 3H), 1.50-2.08 (m, 4H), 1.20-1.39 (m, 1H), 0.31-0.61 (m, 4H).
Пример 67
2-(5,6-Дихлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
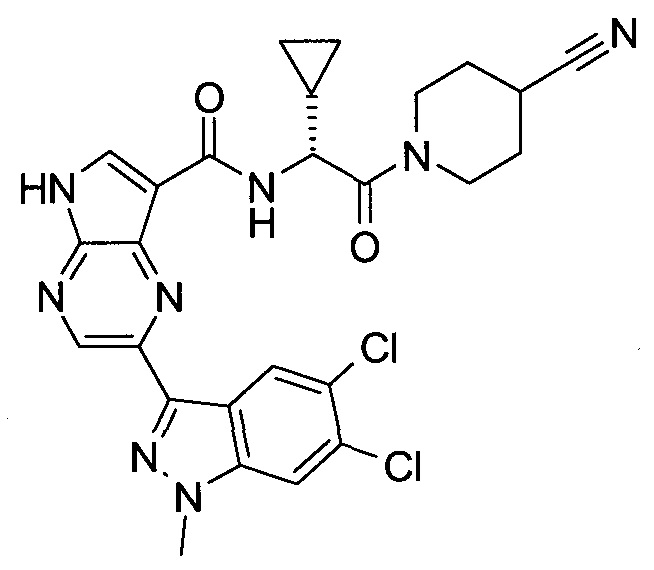
Стадия 1
4,5-Дихлор-2-метиланилин
К частичной суспензии 1,2-дихлор-4-метил-5-нитробензола (2,0 г; 9,71 ммоль) в MeOH (25 мл), воде (25 мл) и THF (10 мл) добавляли NH4Cl (5,19 г; 97,1 ммоль), затем порошок железа (2,71 г; 48,5 ммоль). Гетерогенную реакционную смесь нагревали при 100°C в течение 3 ч, затем охлаждали до комнатной температуры и фильтровали через воронку Бюхнера, промывая MeOH. Фильтрат разбавляли водой и насыщенным водным NaHCO3, затем экстрагировали CH2Cl2 (3×). Объединенные органические экстракты сушили над MgSO4 и концентрировали, получая 1,69 г (99%) 4,5-дихлор-2-метиланилина в виде белого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.10 (s, 1H), 6.75 (s, 1H), 3.74 (br. s., 2H), 2.12 (s, 3H).
Стадия 2
5,6-Дихлор-1H-индазол

К раствору 4,5-дихлор-2-метиланилина (1,69 г; 9,6 ммоль) в CHCl3 (25 мл) при 0°C медленно добавляли уксусный ангидрид (2,09 мл; 22,1 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Постепенно образовывался вязкий белый осадок. Добавляли ацетат калия (283 мг; 2,88 ммоль), затем медленно добавляли изоамилнитрит (2,78 мл; 20,6 ммоль). Реакционную смесь нагревали при температуре дефлегмации в течение ночи. Гомогенную темно-оранжевую реакционную смесь охлаждали до комнатной температуры и концентрировали. Добавляли воду (10 мл) и смесь снова концентрировали до оранжевого твердого вещества. Это твердое вещество
суспендировали в конц. HCl (15 мл) и нагревали при 60°C в течение 2 ч, затем охлаждали до 0°C и нейтрализовали 50%-ным NaOH. Экстрагировали с помощью EtOAc, сушили над MgSO4 и концентрировали до оранжевого твердого вещества. Это твердое вещество растворяли в THF/MeOH (1:1, 25 мл) и добавляли 10%-ный NaOH (3 мл). Темно-бордовую реакционную смесь перемешивали при комнатной температуре в течение 5 мин, затем нейтрализовали, используя 1,0 М HCl, и разбавляли водой. Смесь экстрагировали EtOAc (2×), затем сушили над MgSO4 и концентрировали. Остаток абсорбировали на силикагель и очищали хроматографией с использованием 30%-50% EtOAc/гексаны, получая 1,50 г (84%) 5,6-дихлор-1H-индазола в виде светло-оранжевого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.04 (s, 1H), 7.89 (s, 1H), 7.68 (s, 1H).
Стадия 3
5,6-Дихлор-3-иод-1H-индазол

К раствору 5,6-дихлор-1H-индазола (0,50 г; 2,67 ммоль) в DMF (8 мл) при комнатной температуре добавляли порошкообразный гидроксид калия (450 мг; 8,02 ммоль) и йод (1,02 г; 4,01 ммоль). Темно-бордовую реакционную смесь перемешивали при комнатной температуре в течение 45 мин, затем гасили 10%-ным водным Na2S2O3 и разбавляли водой. Смесь экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой (3×), сушили над MgSO4 и концентрировали, получая 827 мг (99%) 5,6-дихлор-3-иод-1H-индазола в виде бледно-желтого твердого вещества. 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 13.79 (s, 1H), 7.94 (s, 1H), 7.72 (s, 1H).
Стадия 4
5,6-Дихлор-3-иод-1-метил-1H-индазол
К раствору 5,6-дихлор-3-иод-1H-индазола (820 мг; 2,62 ммоль) в THF (8 мл) при 0°C добавляли KOtBu (412 мг; 3,67 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин, затем добавляли иодметан (0,23 мл; 3,67 ммоль). Перемешивали при 0°C в течение 30 мин, затем нагревали до комнатной температуры и перемешивали в течение 1,5 ч. Реакцию гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты сушили над
MgSO4 и концентрировали. Неочищенный остаток абсорбировали на силикагеле и очищали хроматографией с использованием 20%-30% EtOAc/гексаны, получая 585 мг (68%) 5,6-дихлор-3-иод-1-метил-1H-индазола в виде светло-желтого твердого вещества. 1H ЯМР (CDCl3, 400 МГц): δ (млн-1) 7.61 (s, 1H), 7.56 (s, 1H), 4.09 (s, 3H). Также отмечали присутствие минорного региоизомера 5,6-дихлор-3-иод-2-метил-1H-индазола, но его не выделяли.
Стадия 5
5,6-Дихлор-1-метил-3-трибутилстаннанил-1H-индазол
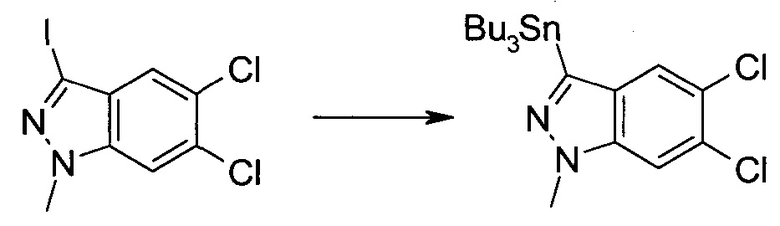
К раствору 5,6-дихлор-3-иод-1-метил-1H-индазола (150 мг; 0,44 ммоль) в THF (3 мл) при -10°C (лед/ацетон) медленно добавляли хлорид изопропилмагния (2,0 М в THF; 0,26 мл; 0,52 ммоль). Ярко-желтую гетерогенную реакционную смесь перемешивали при -10°C в течение 15 мин, затем по каплям добавляли трибутилхлорстаннан (0,14 мл; 0,52 ммоль). Перемешивание продолжали при -10°C в течение 30 мин, затем при комнатной температуре в течение 1 ч. Реакционную смесь гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты сушили над MgSO4 и концентрировали, получая 5,6-дихлор-1-метил-3-трибутилстаннанил-1H-индазол в виде бледно-желтого масла, которое использовали на следующей стадии без дополнительной очистки.
Стадия 6
2-(5,6-Дихлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
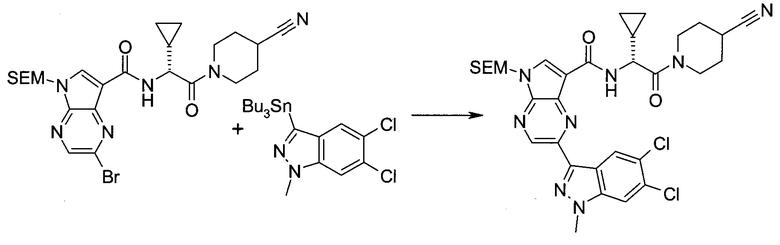
К раствору 5,6-дихлор-1-метил-3-трибутилстаннил-1H-индазола (неочищенного со стадии 5; 218 мг; 0,44 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-
пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида (125 мг; 0,22 ммоль) в DMF (2 мл) добавляли Pd(PPh3)4 (12,9 мг; 0,011 ммоль) и иодид меди(I) (8 мг; 0,044 ммоль). Желтую реакционную смесь нагревали при 90°C в течение 1,5 ч, затем охлаждали до комнатной температуры, гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой (3×) и рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток очищали хроматографией на силикагеле с использованием 50%-100% EtOAc/гексаны, получая 130 мг (86%) 2-(5,6-дихлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида в виде бледно-желтого пенообразного твердого вещества.
Стадия 7
2-(5,6-Дихлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
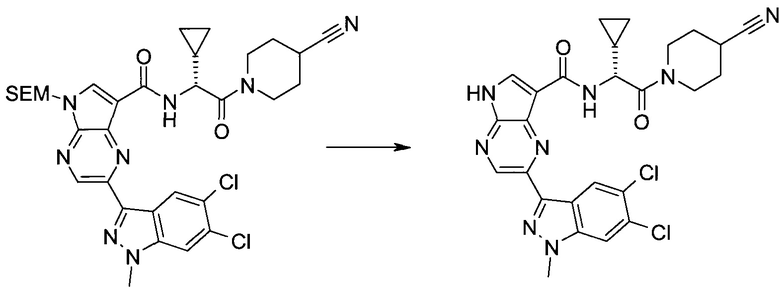
К раствору 2-(5,6-дихлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида (130 мг; 0,19 ммоль) в CH2Cl2 (4 мл) добавляли TFA (2,0 мл; 26,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (4 мл) и добавляли этилендиамин (0,4 мл; 5,92 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, затем гасили водой и экстрагировали CH2Cl2 (3×). Объединенные органические экстракты концентрировали. Остаток очищали хроматографией на силикагеле с использваонием смеси от 0% до 4% MeOH/CH2Cl2 (0,5% NH4OH) затем растирали с Et2O, получая белое твердое вещество. Это твердое вещество далее очищали перекристаллизацией из MeOH/EtOAc, получая 22 мг 2-(5,6-дихлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида в виде белого твердого
вещества. MS: (M+Na)+=573; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.92 (br. s, 1H), 9.14 (s, 1H), 8.88 (s, 1H), 8.69 (d, J=8,7 Гц, 1H), 8.46 (d, J=8,7 Гц, 1H), 8.24 (s, 1H), 4.93 (t, J=7,4 Гц, 1H), 4.18 (s, 3H), 3.45-3.94 (m, 3H), 3.15 (d, J=4,9 Гц, 2H), 1.35-1.91 (m, 5H), 0.51 (br. s., 4H).
Пример 68
2-(5,6-Дихлориндазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
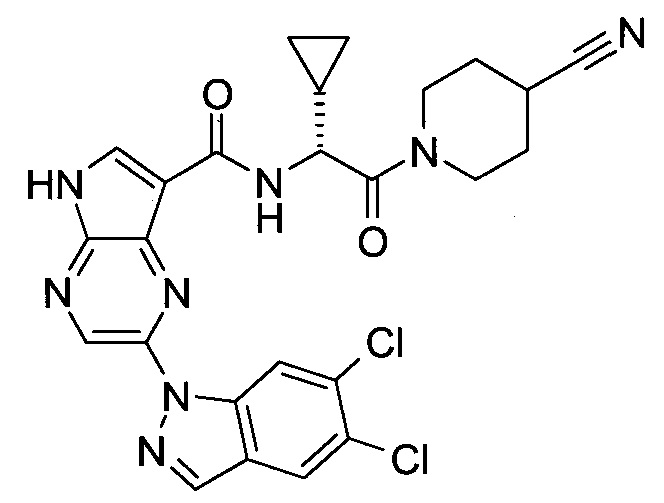
Стадия 1
2-Иод-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
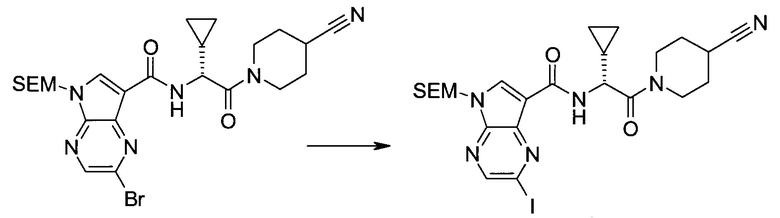
Во флакон емкостью 5 мл для микроволнового реактора помещали иодид меди(I) (5 мг; 0,027 ммоль), иодид натрия (120 мг; 0,80 ммоль), 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид (150 мг; 0,27 ммоль), 1,4-диоксан (1 мл) и транс-N,N'-диметилциклогексан-1,2-диамин (8 мг; 0,054 ммоль). Флакон продували струей азота, затем герметично закрывали и нагревали в масляной бане при 110°C в течение 20 ч. Реакционную смесь охлаждали до комнатной температуры и гасили насыщ. водным NH4OH (3 мл), затем разбавляли водой и экстрагировали CH2Cl2. Органические экстракты сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 50%-80% EtOAc/гексаны, получая 130 мг (80%) 2-иод-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой
кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида в виде оранжевого пенообразного твердого вещества.
Стадия 2
2-(5,6-Дихлор-индазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
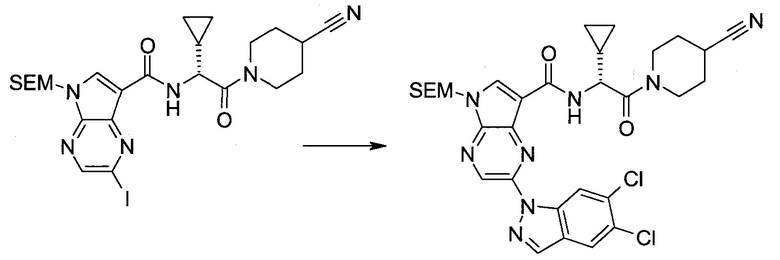
Во флакон емкостью 5 мл для микроволнового реактора помещали иодид меди(I) (6 мг; 0,033 ммоль), K3PO4 (146 мг; 0,69 ммоль), 5,6-дихлор-1H-индазол (74 мг; 0,39 ммоль), 2-иод-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид (200 мг; 0,33 ммоль), толуол (1,2 мл) и транс-N,N'-диметилциклогексан-1,2-диамин (9 мг; 0,066 ммоль). Флакон продували струей азота, затем герметично закрывали и нагревали в масляной бане при 110°C в течение 48 часов. Реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc, затем фильтровали через воронку Бюхнера, промывая EtOAc. Фильтрат концентрировали и полученный остаток очищали хроматографией на силикагеле с использованием 0%-2% MeOH/CH2Cl2 (0,5% NH4OH), получая 215 мг (98%) 2-(5,6-дихлор-индазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида в виде светло-желтой пены.
Стадия 3
2-(5,6-Дихлор-индазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид
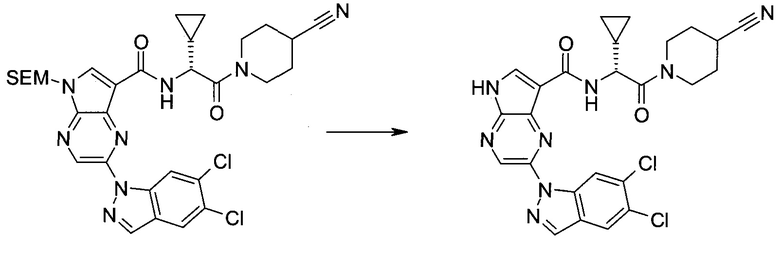
К раствору 2-(5,6-дихлор-индазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида (220 мг; 0,33 ммоль) в CH2Cl2 (4 мл) добавляли TFA (2,0 мл; 26,0 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (4 мл) и добавляли этилендиамин (0,4 мл; 5,92 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, затем гасили водой и экстрагировали CH2Cl2 (3×). Объединенные органические экстракты концентрировали и остаток очищали хроматографией на силикагеле с использованием 0%-5% MeOH/CH2Cl2 (0,5% NH4OH), затем растирали с Et2O, получая 95 мг (54%) 2-(5,6-дихлор-индазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амида в виде светло-желтого твердого вещества. MS: (M+Na)+=559; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.91 (br. s., 1H), 8.91 (s, 1H), 8.79 (s, 1H), 8.44 (s, 1H), 8.41 (d, J=7,9 Гц, 1H), 8.29 (d, J=7,9 Гц, 1H), 8.18 (s, 1H), 4.77 (t, J=7,6 Гц, 1H), 3.59-3.86 (m, 2H), 3.32-3.46 (m, 1H), 2.95-3.05 (m, 2H), 1.45-1.92 (m, 4H), 1.24 (br. s., 1H), 0.32-0.48 (m, 4H).
Пример 69
2-(5-Хлориндазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
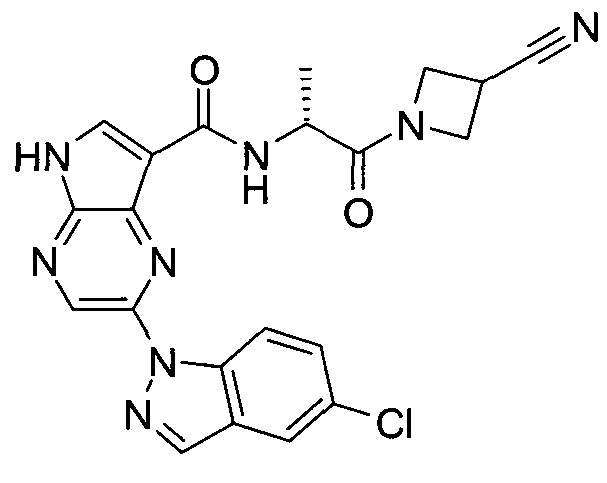
Стадия 1
2-Иод-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
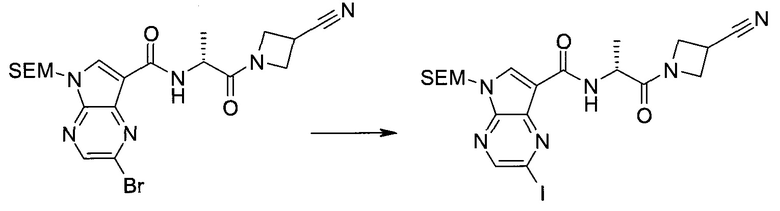
Во флакон емкостью 5 мл для микроволнового реактора помещали иодид меди(I) (6 мг; 0,03 ммоль), иодид натрия (133 мг; 0,89 ммоль), 2-бром-5-(2-
триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (150 мг; 0,30 ммоль), 1,4-диоксан (1 мл) и транс-N,N'-диметилциклогексан-1,2-диамин (9 мг; 0,06 ммоль). Флакон продували струей азота, затем герметично закрывали и нагревали в масляной бане при 110°C в течение 48 часов. Реакционную смесь охлаждали до комнатной температуры и гасили насыщ. водным NH4OH (3 мл), затем разбавляли водой и экстрагировали CH2Cl2. Органические экстракты сушили над MgSO4 и концентрировали, получая 2-иод-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид в виде темно-бордового масла, которое использовали без дополнительной очистки.
Стадия 2
2-(5-Хлор-индазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
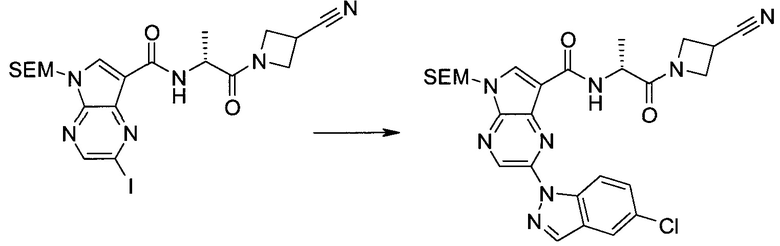
Во флакон емкостью 5 мл для микроволнового реактора помещали иодид меди(I) (6 мг; 0,033 ммоль), R3PO4 (132 мг; 0,62 ммоль), 5-хлор-1H-индазол (54 мг; 0,36 ммоль), 2-иод-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (164 мг; 0,30 ммоль), толуол (1,2 мл) и транс-N,N'-диметилциклогексан-1,2-диамин (9 мг; 0,066 ммоль). Флакон продували струей азота, затем герметично закрывали и нагревали в масляной бане при 110°C в течение 24 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc, затем фильтровали через воронку Бюхнера, промывая EtOAc. Фильтрат концентрировали и полученный остаток очищали хроматографией на силикагеле с использованием 50%-80% EtOAc/гексаны, получая 100 мг (58%) 2-(5-хлор-индазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-желтой пены.
Стадия 3
2-(5-Хлориндазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
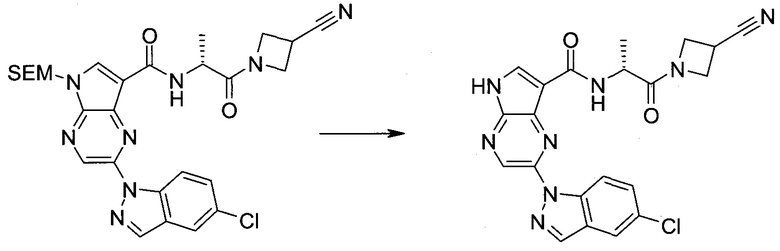
К раствору 2-(5-хлор-индазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (100 мг; 0,17 ммоль) в CH2Cl2 (4 мл) добавляли TFA (2,0 мл; 26,0 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (4 мл) и добавляли этилендиамин (0,4 мл; 5,92 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, затем гасили водой и экстрагировали CH2Cl2 (3×). Объединенные органические экстракты концентрировали и остаток растирали с EtOAc, получая 45 мг (58%) 2-(5-хлориндазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-желтого твердого вещества. MS: (M+Na)+=471; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.88 (s, 1H), 8.95 (s, 1H), 8.72 (dd, J=9,1; 4,5 Гц, 1H), 8.36-8.43 (m, 2H), 7.99-8.07 (m, 1H), 7.94 (d, J=1,9 Гц, 1H), 7.41-7.52 (m, 1H), 4.36-4.66 (m, 3H), 4.06-4.18 (m, 1H), 3.94-4.04 (m, 1H), 3.66-3.81 (m, 1H), 1.26 (t, J=6,0 Гц, 3H).
Пример 70
2-(1,6,6-Триметил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
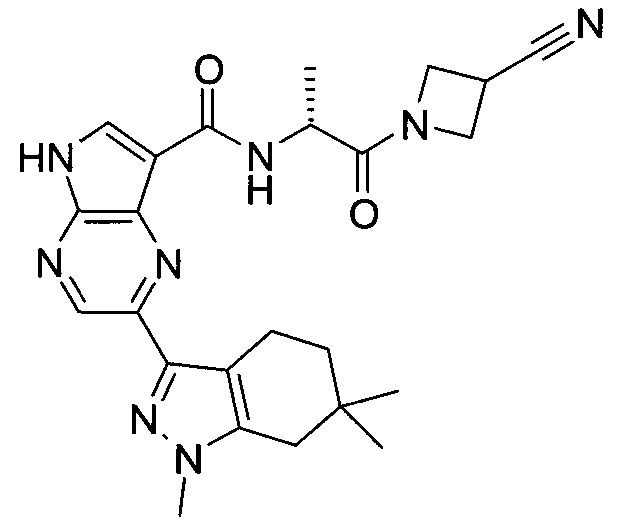
Стадия 1
2-[1-Гидрокси-мет-(Z)-илиден]-5,5-диметил-циклогексанон
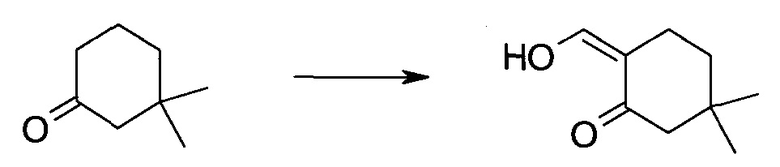
К суспензии гидрида натрия (60%-ной дисперсии в минеральном масле, 475 мг; 11,9 ммоль) в диэтиловом эфире (25 мл) при 0°C по каплям добавляли этанол (0,06 мл; 1,03 ммоль). Серую суспензию перемешивали при 0°C в течение 20 мин. По каплям в течение 10 мин добавляли раствор 3,3-диметилцикло-гексанона (1,50 г; 11,9 ммоль) и этилформиата (1,45 мл; 17,8 ммоль) в диэтиловом эфире (3 мл). Желтую гетерогенную реакционную смесь перемешивали при 0°C в течение 1 ч, затем нагревали до комнатной температуры и перемешивали в течение 2 ч. Добавляли этанол (1 мл) и смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой (25 мл). Слои разделяли и водную фазу промывали диэтиловым эфиром. Водный слой подкисляли, используя 1 М HCl, до pH 2 и затем экстрагировали диэтиловым эфиром (2×). Объединенные органические слои сушили над MgSO4 и концентрировали, получая 1,64 г (90%) 2-[1-гидрокси-мет-(Z)-илиден]-5,5-диметил-циклогексанона в виде светло-желтого масла. 1H ЯМР (CDCl3, 400 МГц): δ (млн-1) 14.38 (br. s., 1H), 8.79 (s, 1H), 2.34-2.47 (m, 2H), 2.16 (s, 2H), 1.42-1.53 (m, 2H), 1.00 (s, 6H).
Стадия 2
6,6-Диметил-4,5,6,7-тетрагидро-1H-индазол

К раствору 2-[1-гидрокси-мет-(Z)-илиден]-5,5-диметил-циклогексанона (1,64 г; 10,6 ммоль) в MeOH (10 мл) по каплям добавляли гидразин (0,33 мл; 10,6 ммоль). Экзотермическую реакцию контролировали путем периодического использования ледяной бани. Желтую реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем концентрировали. Остаток растворяли в CH2Cl2 и промывали водой. Органический слой сушили над MgSO4 и концентрировали, получая 1,53 г (96%) 6,6-диметил-4,5,6,7-тетрагидро-1H-индазола в виде желтого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.32 (s, 1H), 2.55 (t, J=6,4 Гц, 2H), 2.44 (s, 2H), 1.53 (t, J=6,4 Гц, 2H), 1.01 (s, 6H).
Стадия 3
3-Иод-6,6-диметил-4,5,6,7-тетрагидро-1H-индазол
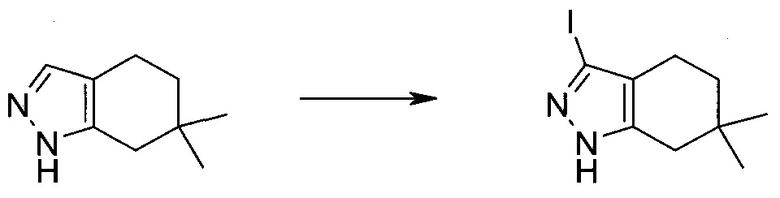
К раствору 6,6-диметил-4,5,6,7-тетрагидро-1H-индазола (0,50 г; 3,33 ммоль) в DMF (8 мл) при комнатной температуре добавляли порошкообразный гидроксид калия (560 мг; 10,0 ммоль) и йод (1,69 г; 6,66 ммоль). Темно-бордовую реакционную смесь перемешивали при комнатной температуре в течение 45 мин, затем гасили 10%-ным водным Na2S2O3, разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой (3×), сушили над MgSO4 и концентрировали, получая 920 мг (99%) 3-иод-6,6-диметил-4,5,6,7-тетрагидро-1H-индазола в виде светло-желтого воскообразного твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 2.44 (s, 2H), 2.35 (t, J=6,4 Гц, 2H), 1.55 (t, J=6,4 Гц, 2H), 1.01 (s, 6H).
Стадия 4
3-Иод-1,6,6-триметил-4,5,6,7-тетрагидро-1H-индазол и 3-иод-2,6,6-триметил-4,5,6,7-тетрагидро-2Н-индазол
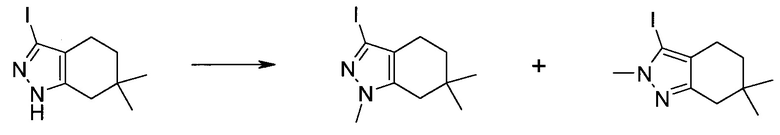
К раствору 3-иод-6,6-диметил-4,5,6,7-тетрагидро-1H-индазола (919 мг; 3,33 ммоль) в THF (8 мл) при 0°C добавляли KOtBu (523 мг; 4,66 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин, затем добавляли иодметан (0,29 мл; 4,66 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин, затем нагревали до комнатной температуры и перемешивали в течение 1,5 ч. Реакцию гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты сушили над MgSO4 и концентрировали. Остаток абсорбировали на SiO2 и очищали хроматографией с использованием 10%-20% EtOAc/гексаны, получая 523 мг (54%) 3-иод-1,6,6-триметил-4,5,6,7-тетрагидро-1H-индазола в виде бесцветного масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 3.72 (s, 3H), 2.33 (t, J=6,4 Гц, 2H), 2.29 (s, 2H), 1.51 (t, J=6,4 Гц, 2H), 1.02 (s, 6H). Также выделяли 160 мг(17%) 3-иод-2,6,6-триметил-4,5,6,7-тетрагидро-2Н-индазола в виде белого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 3.87 (s, 3H), 2.41 (s, 2Н), 2.36 (t, J=6,6 Гц, 2H), 1.54 (t, J=6,6 Гц, 2H), 1.00 (s, 6H).
Стадия 5
1,6,6-Триметил-3-трибутилстаннанил-4,5,6,7-тетрагидро-1H-индазол
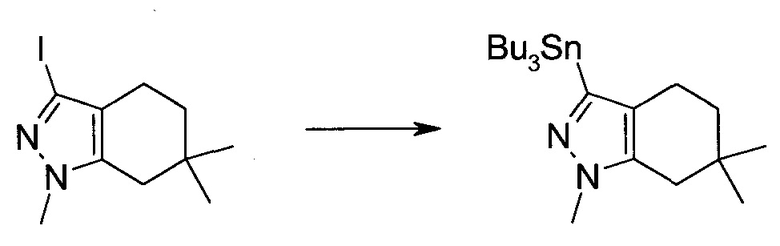
К раствору 3-иод-1,6,6-триметил-4,5,6,7-тетрагидро-1H-индазола (0,150 г; 0,49 ммоль) в THF (3 мл) при 0°C медленно добавляли хлорид изопропилмагния (2,0 М в THF) (0,30 мл; 0,59 ммоль). Реакционную смесь перемешивали при 0°C в течение 20 мин, затем по каплям добавляли трибутилхлорстаннан (0,16 мл; 0,59 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин, затем нагревали до комнатной температуры и перемешивали в течение 1 ч. Реакцию гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 0%-10% EtOAc/гексаны (0,5% Et3N), получая 116 мг (52%) 1,6,6-триметил-3-трибутилстаннанил-4,5,6,7-тетрагидро-1H-индазола в виде бесцветного масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 3.74 (s, 3H), 2.49 (t, J=6,4 Гц, 2H), 2.30 (s, 2H), 1.45-1.61 (m, 8H), 1.25-1.41 (m,6H), 1.04-1.13(m,6H), 1.01 (s, 6H), 0.89 (t, J=7,2 Гц, 9H).
Стадия 6
5-(2-Триметилсиланил-этоксиметил)-2-(1,6,6-триметил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
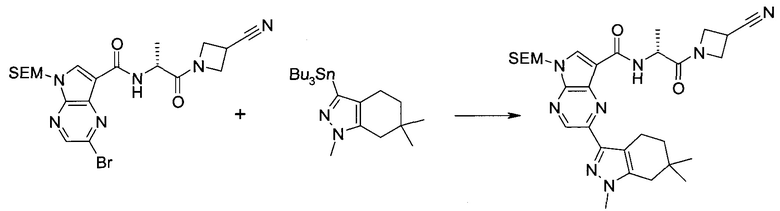
К раствору 1,6,6-триметил-3-трибутилстаннил-4,5,6,7-тетрагидро-1H-индазола (110 мг; 0,24 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (95 мг; 0,19 ммоль) в DMF (2 мл) добавляли Pd(PPh3)4 (11 мг; 0,01 ммоль) и иодид меди(I) (7 мг; 0,037 ммоль). Реакционную смесь нагревали при 90°C в течение 2 ч, затем охлаждали до комнатной температуры и перемешивали в течение ночи. Реакцию гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой (3×) и рассолом, затем сушили над MgSO4 и концентрировали. Неочищенное коричневое масло
очищали хроматографией на силикагеле с использованием 0%-3% MeOH/CH2Cl2, получая 43 мг (38%) 5-(2-триметилсиланил-этоксиметил)-2-(1,6,6-триметил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде бледно-оранжевой пены.
Стадия 7
2-(1,6,6-Триметил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
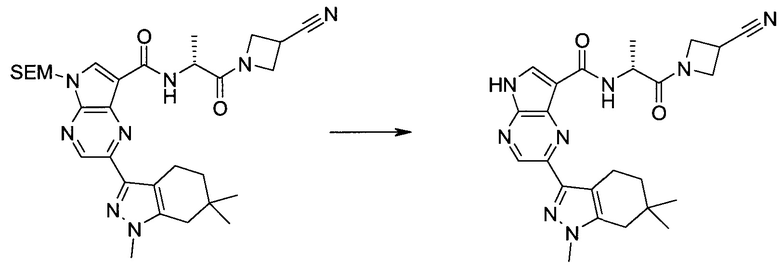
К раствору 5-(2-триметилсиланил-этоксиметил)-2-(1,6,6-триметил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (40 мг; 0,068 ммоль) в CH2Cl2 (3 мл) добавляли TFA (1,5 мл; 19,5 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (3 мл) и добавляли этилендиамин (0,3 мл; 4,44 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, затем гасили водой и экстрагировали CH2Cl2 (3×). Объединенные органические экстракты концентрировали до желтого маслянистого твердого вещества. После растирания с EtOAc/Et2O получали 17 мг (55%) 2-(1,6,6-триметил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде беловатого твердого вещества. MS (M+H)+=461; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 8.94 (d, J=2,0 Гц, 1H), 8.34-8.44 (m, 2H), 4.46-4.74 (m, 3H), 4.10-4.21 (m, 1H), 4.02 (dd, J=9,9; 6,4 Гц, 1H), 3.78-3.86 (m, 1H), 3.77 (s, 3H), 2.98-3.08 (m, 1H), 2.85-2.94 (m, 1H), 2.45 (s, 2H), 1.52 (t, J=6,4 Гц, 2H), 1.29-1.39 (m, 3H), 1.03 (s, 6H).
Пример 71
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метансульфонил-азетидин-3-ил)-этил]-амид
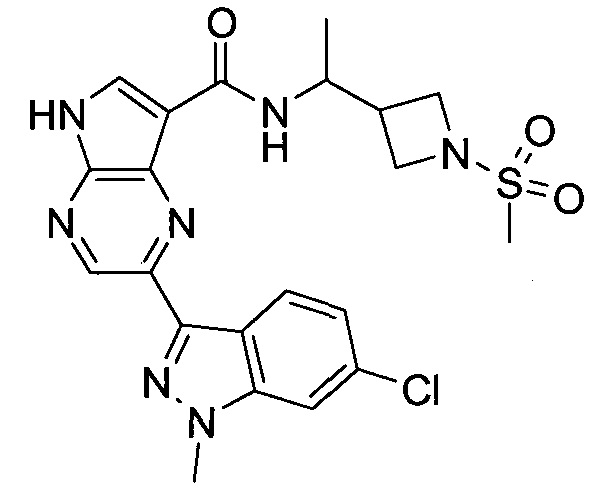
Стадия 1
3-{[(E)-2-Метил-пропан-2-сульфинилимино]-метил}-азетидин-1-карбоновой кислоты трет-бутиловый эфир
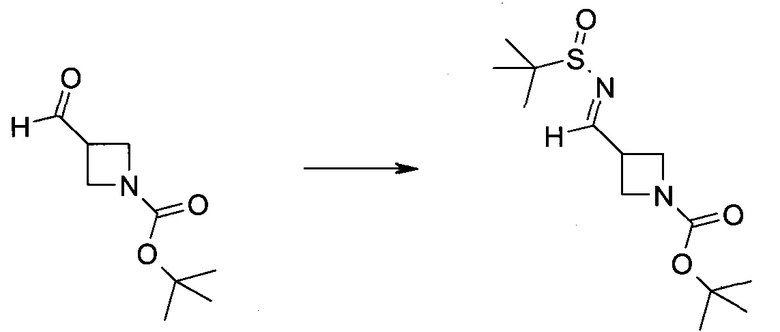
К раствору 3-формил-азетидин-1-карбоновой кислоты трет-бутилового эфира (1,0 г; 5,4 ммоль) и 2-метилпропан-2-сульфинамида (654 мг; 5,4 ммоль) в безводном CH2Cl2 (10 мл) добавляли безводный CuSO4 (1,9 г; 11,9 ммоль). Гетерогенную реакционную смесь перемешивали при комнатной температуре в течение ночи, затем фильтровали через целит, промывая CH2Cl2. Фильтрат концентрировали, полученный остаток абсорбировали на SiO2 и очищали колоночной хроматографией с использованием 20%-40% EtOAc/гексаны, получая 1,26 г (81%) 3-{[(E)-2-метил-пропан-2-сульфинилимино]-метил}-азетидин-1-карбоновой кислоты трет-бутилового эфира в виде белого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.20 (d, J=4,5 Гц, 1H), 4.14-4.23 (m, 2H), 4.00-4.13 (m, 2H), 3.53-3.65 (m, 1H), 1.45 (s, 9H), 1.21 (s, 9H).
Стадия 2
3-[1-(2-Метил-пропан-2-сульфиниламино)-этил]-азетидин-1-карбоновой кислоты трет-бутиловый эфир
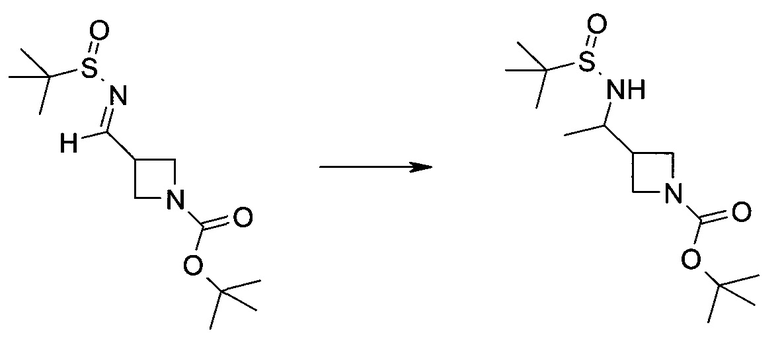
К раствору 3-{[(E)-2-метил-пропан-2-сульфинилимино]-метил}-азетидин-1 -карбоновой кислоты трет-бутилового эфира (0,25 г; 0,87 ммоль) в CH2Cl2 (4 мл) при 0°C по каплям добавляли бромид метилмагния (3,0 М в Et2O; 0,35 мл; 1,04 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, затем гасили насыщенным водным NH4Cl, разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические экстракты сушили над MgSO4 и концентрировали, получая 273 мг 3-[1-(2-метил-пропан-2-сульфиниламино)-этил]-азетидин-1-карбоновой кислоты трет-бутилового эфира в виде беловатого пенообразного твердого вещества, которое использовали без дополнительной очистки.
Стадия 3
3-(1-Амино-этил)-азетидин-1 -карбоновой кислоты трет-бутиловый эфир
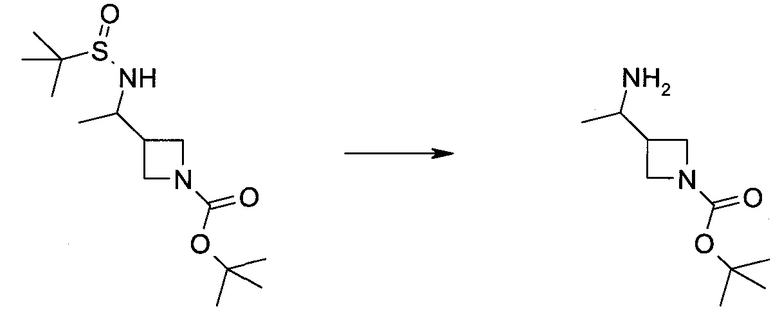
К раствору 3-[1-(2-метил-пропан-2-сульфиниламино)-этил]-азетидин-1-карбоновой кислоты трет-бутилового эфира (неочищенного со стадии 2; 264 мг; 0,87 ммоль) в MeOH при 0°C по каплям добавляли 4,0 М HCl в диоксане (0,28 мл; 1,13 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, затем гасили насыщенным водным NaHCO3, разбавляли водой и экстрагировали CH2Cl2 (3×). Объединенные органические экстракты, сушили над MgSO4 и концентрировали, получая 3-(1-амино-этил)-азетидин-1-карбоновой кислоты трет-бутиловый эфир в виде вязкого бесцветного масла, которое использовали без дополнительной очистки.
Стадия 4
3-(1-{[2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-азетидин-1-карбоновой кислоты трет-бутиловый эфир
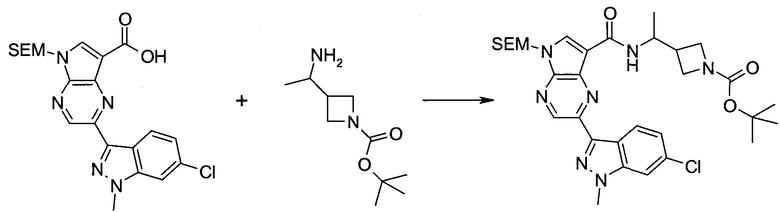
К раствору 3-(1-амино-этил)-азетидин-1-карбоновой кислоты трет-бутилового эфира (неочищенного со стадии 3; 63 мг; 0,31 ммоль) в DMF (2 мл) добавляли N,N-диизопропилэтиламин (69 мкл; 0,39 ммоль), 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (120 мг; 0,26 ммоль) и HATU (110 мг; 0,29 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (3×). Объединенные органические экстракты промывали водой (3×) и рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 30%-60% EtOAc/гексаны, получая 158 мг (94%) 3-(1-{[2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-азетидин-1-карбоновой кислоты трет-бутилового эфира в виде белой пены. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 9.23 (s, 1H), 8.36 (t, J=4,3 Гц, 2H), 8.18 (d, J=9,1 Гц, 1H), 7.52 (s, 1H), 7.24-7.29 (m, 1H), 5.73 (s, 2H), 4.57-4.68 (m, 1H), 4.18 (s, 3H), 3.87-4.08 (m, 3H), 3.79 (dd, J=8,7; 6,0 Гц, 1H), 3.55-3.65 (m, 2Н), 2.73 (br. s., 1H), 1.39 (s, 9H), 1.36 (d, J=6,8 Гц, 6H), 0.89-1.01 (m, 2H), - 0.03 (s, 9H).
Стадия 5
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-азетидин-3-ил-этил)-амида гидрохлорид
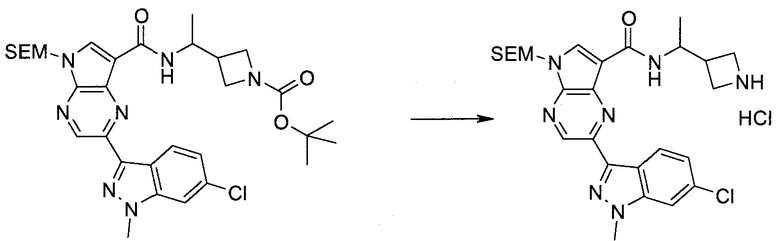
К раствору 3-(1-{[2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-азетидин-1-карбоновой кислоты трет-бутилового эфира (150 мг; 0,23 ммоль) в MeOH (4 мл) при 0°C по каплям в течение 5 мин добавляли ацетилхлорид (0,33 мл; 4,69 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, за это время постепенно образовывался вязкий осадок. Растворитель выпаривали при комнатной температуре и остаток сушили под высоким вакуумом, получая 145 мг 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-азетидин-3-ил-этил)-амида гидрохлорида в виде желтого твердого вещества.
Стадия 6
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метансульфонил-азетидин-3-ил)-этил]-амид
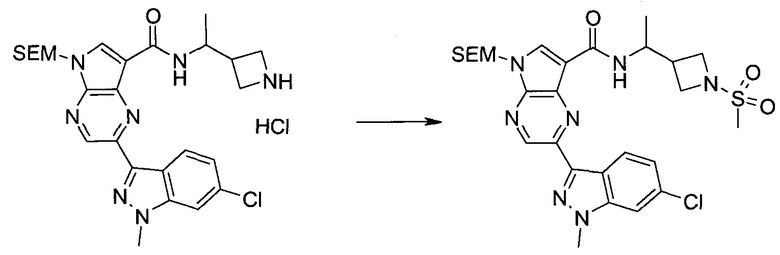
К суспензии 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-азетидин-3-ил-этил)-амида гидрохлорида (65 мг; 0,11 ммоль) в CH2Cl2 (2 мл) при 0°C добавляли триэтиламин (47 мкл; 0,33 ммоль), после чего метансульфонилхлорид (10 мкл; 0,12 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин, затем при комнатной температуре в течение 1 ч. Реакцию гасили водой и экстрагировали CH2Cl2. Объединенные органические экстракты сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 0%-5% MeOH/CH2Cl2 (0,5% NH4OH), получая 35 мг (50%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метансульфонил-азетидин-3-ил)-этил]-амида в виде бледно-желтого твердого вещества.
Стадия 7
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метансульфонил-азетидин-3-ил)-этил]-амид
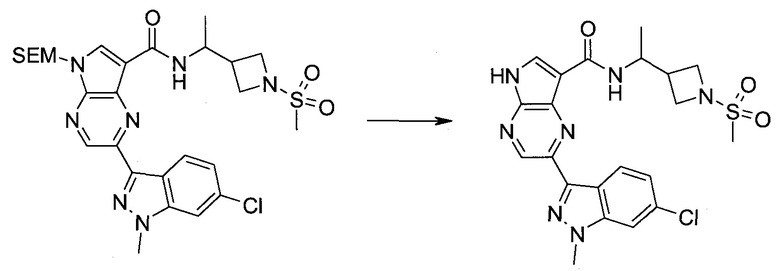
К раствору 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метансульфонил-азетидин-3-ил)-этил]-амида (30 мг; 0,049 ммоль) в CH2Cl2 (2 мл) добавляли TFA (0,3 мл; 3,89 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (2 мл) и добавляли этилендиамин (0,3 мл; 4,49 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и экстрагировали смесью MeOH/CH2Cl2 (1:9). Органический слой промывали водой и водный слой повторно экстрагировали CH2Cl2. Объединенные органические экстракты концентрировали и остаток растирали с MeOH/EtOAc/Et2O, получая 15 мг (63%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метансульфонил-азетидин-3-ил)-этил]-амида в виде бледно-желтого твердого вещества. MS (M+H)+=488; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 9.05 (br. s., 1H), 8.86 (s, 1H), 8.63 (s, 1H), 8.41 (d, J=8,7 Гц, 1H), 7.92 (s, 1H), 7.26 (d, J=8,7 Гц, 1H), 4.35-4.45 (m, 1H), 4.22-4.33 (m, 1H), 4.12 (s, 3H), 4.04-4.10 (m, 1H), 3.62-3.74 (m, 1H), 3.45-3.58 (m, 1H), 3.25 (s, 3H), 2.57-268 (m, 1H), 1.38 (d, J=6,8 Гц, 3H).
Пример 72
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-3-оксо-3-пирролидин-1-ил-пропил)-амид
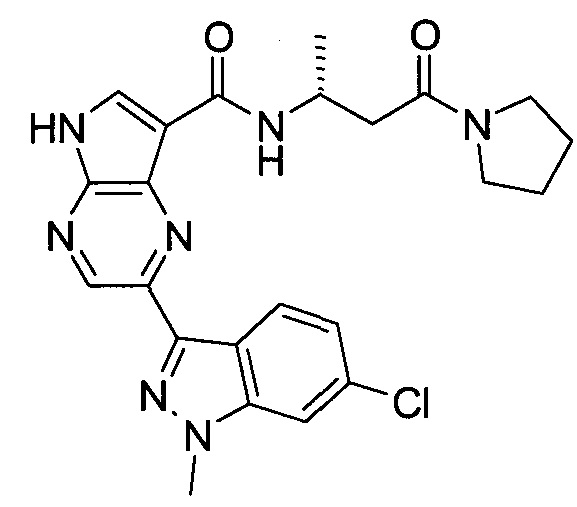
Стадия 1
((R)-1-Метил-3-оксо-3-пирролидин-1-ил-пропил)-карбаминовой кислоты трет-бутиловый эфир
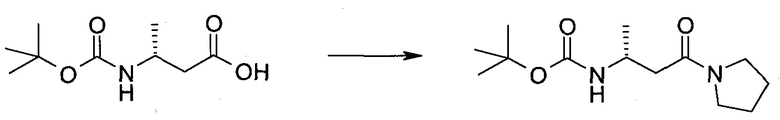
К раствору (R)-3-трет-бутоксикарбониламино-масляной кислоты (150 мг; 0,74 ммоль) и HATU (309 мг; 0,81 ммоль) в DMF (2 мл) добавляли пирролидин (0,19 мл; 2,21 ммоль). Полученную желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой (3×) и рассолом, затем сушили над MgSO4 и концентрировали, получая ((R)-1-метил-3-оксо-3-пирролидин-1-ил-пропил)-карбаминовой кислоты трет-бутилового эфира в виде бесцветного масла, которое использовали без дополнительной очистки.
Стадия 2
(R)-3-Амино-1-пирролидин-1-ил-бутан-1-она трифторацетат
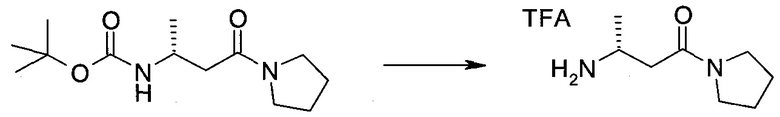
К раствору ((R)-1-метил-3-оксо-3-пирролидин-1-ил-пропил)-карбаминовой кислоты трет-бутилового эфира (неочищенного со стадии 1; 189 мг; 0,74 ммоль) в CH2Cl2 (5 мл) добавляли трифторуксусную кислоту (2,0 мл; 27,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали, получая (R)-3-амино-1-пирролидин-1-ил-бутан-1-она трифторацетат в виде бледно-желтого масла, которое использовали без дополнительной очистки.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-3-оксо-3-пирролидин-1-ил-пропил)-амид
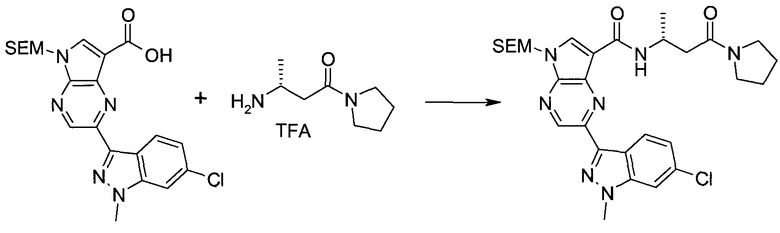
К раствору (R)-3-амино-1-пирролидин-1-ил-бутан-1-она трифторацетата (неочищенного со стадии 2; 118 мг; 0,44 ммоль) в DMF (2 мл) добавляли N,N-диизопропилэтиламин (0,19 мл; 1,09 ммоль), 2-(6-хлор-1-метил-1H-индазол-3-ил)-
5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (100 мг; 0,22 ммоль) и HATU (91 мг; 0,24 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (3×). Объединенные органические экстракты промывали водой (3×) и рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 50%-100% EtOAc/гексаны, получая 125 мг (96%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-3-оксо-3-пирролидин-1-ил-пропил)-амида в виде белого твердого вещества.
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-3-оксо-3-пирролидин-1-ил-пропил)-амид
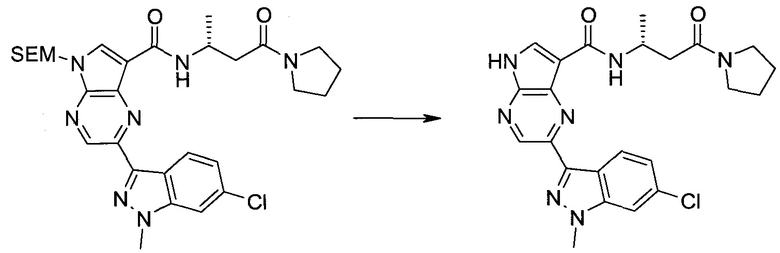
К раствору 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-3-оксо-3-пирролидин-1-ил-пропил)-амида (125 мг; 0,21 ммоль) в CH2Cl2 (2 мл) добавляли TFA (0,5 мл; 6,49 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (2 мл) и добавляли этилендиамин (0,4 мл; 6,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой. Полученный осадок собирали фильтрованием и промывали водой и EtOAc. Твердое вещество растворяли в смеси 10% MeOH/CH2Cl2 и промывали водой. Водный слой повторно экстрагировали Ch^Cb. Объединенные органические экстракты сушили над MgSO4 и концентрировали, получая 64 мг (66%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-3-оксо-3-пирролидин-1-ил-пропил)-амида в виде беловатого твердого вещества. MS: (M+H)+=466; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 9.07 (s, 1H), 8.57 (d, J=8,7 Гц, 1H), 8.41 (s, 1H), 8.26 (d, J=7,9 Гц, 1H), 7.97 (d, J=1,1 Гц, 1H), 7.28 (dd, J=8,7; 1,5 Гц, 1H), 4.36-4.54 (m, 1H), 4.16 (s, 3H), 3.40
(t, J=6,6 Гц, 2H), 3.10-3.25 (m, 2H), 2.52-2.76 (m, 2H), 1.61-1.90 (m, 4H), 1.38 (d, J=6,8 Гц, 3H).
Пример 73
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-гидрокси-циклобутил)-этил]-амид
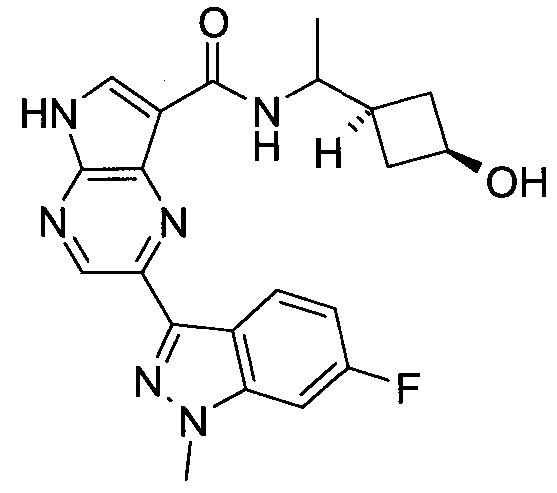
Стадия 1
цис-3-Гидрокси-циклобутанкарбонитрил

3-Оксоциклобутанкарбонитрил получали согласно Elend D., Fengas D., Fray J.M. Synthetic Communications, 2005, 35, 657. К раствору 3-оксоциклобутан-карбонитрила (600 мг; 6,31 ммоль) в MeOH (25 мл) при 0°C медленно добавляли боргидрид натрия (263 мг; 6,94 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, затем гасили водой и рассолом и экстрагировали EtOAc (3×). Объединенные органические экстракты сушили над MgSO4 и концентрировали, получая 500 мг (82%) цис-3-гидрокси-циклобутанкарбонитрила в виде бесцветного масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 4.26 (quin, J=7,5 Гц, 1H), 2.70-2.82 (m, 2H), 2.50-2.66 (m, 1H), 2.26-2.41 (m, 2H), 2.09 (br. s., 1H).
Стадия 2
цис-3-(трет-Бутилдиметилсиланилокси)-циклобутанкарбонитрил
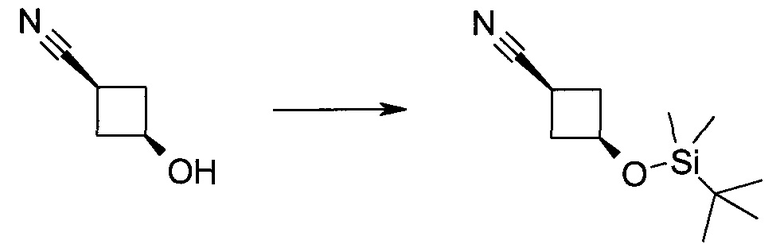
К раствору цис-3-гидрокси-циклобутанкарбонитрила (500 мг; 5,15 ммоль в DMF (3 мл) при комнатной температуре добавляли имидазол (876 мг; 12,9 ммоль), затем TBDMS-Cl (854 мг; 5,66 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и
экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой (3×), сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 0%-10% EtOAc/гексаны, получая 890 мг (82%) цис-3-(трет-бутилдиметилсиланилокси)-циклобутанкарбонитрила в виде бесцветного масла. 1H ЯМР (CDCl3, 400 МГц): δ (млн-1) 4.10-4.19 (m, 1H), 2.57-2.67 (m, 2Н), 2.43-2.54 (m, 1H), 2.22-2.34 (m, 2H), 0.84 (s, 9H), 0.00 (s, 6H).
Стадия 3
цис-3-(трет-Бутилдиметилсиланилокси)-циклобутанкарбальдегид
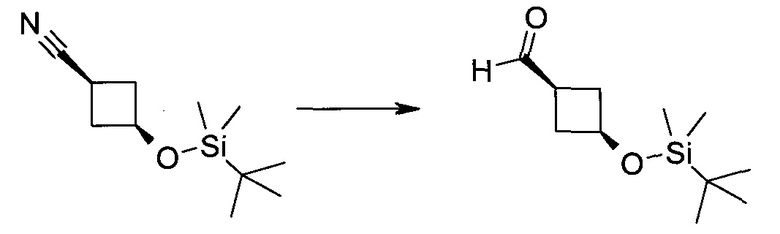
К раствору цис-3-(трет-бутилдиметилсилилокси)циклобутанкарбонитрила (0,89 г; 4,21 ммоль в CH2Cl2 (25 мл) при -70°C медленно добавляли DIBAL-H (1,05 мл; 5,89 ммоль). Реакционную смесь перемешивали в течение 2,5 ч, за это время температура постепенно повышалась до 0°C. Мутную реакционную смесь гасили MeOH (1 мл), затем разбавляли CH2Cl2 (20 мл) и добавляли насыщенный водный Na+K+-тартрат (25 мл). Двухфазную смесь интенсивно перемешивали при комнатной температуре в течение 1 ч. Слои разделяли и водную фазу экстрагировали CH2Cl2 (2×). Объединенные органические экстракты, сушили над MgSO4 и концентрировали, получая цис-3-(трет-бутилдиметилсиланилокси)-циклобутанкарбальдегид в виде бесцветного масла, которое использовали без дополнительной очистки.
Стадия 4
2-Метил-пропан-2-сульфиновой кислоты 1-[цис-3-(трет-бутилдиметил-силанилокси)-циклобутил]-мет-(E)-илиденамид
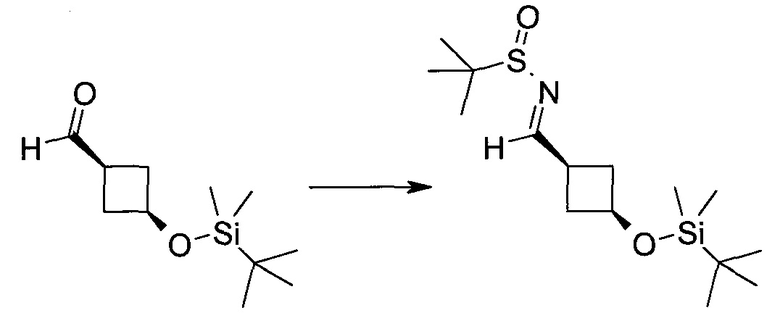
К раствору цис-3-(трет-бутилдиметилсиланилокси)-циклобутан-карбальдегида (неочищенного со стадии 3; 900 мг; 4,2 ммоль) и 2-метилпропан-2-сульфинамида (509 мг; 4,2 ммоль) в безводном CH2Cl2 (10 мл) добавляли
безводный CuSO4 (1,47 г; 9,24 ммоль). Гетерогенную реакционную смесь перемешивали при комнатной температуре в течение ночи, затем фильтровали через целит, промывая CH2Cl2. Фильтрат абсорбировали на SiO2 и очищали посредством хроматографии с использованием 0%-20% EtOAc/гексаны, получая 642 мг (48%) 2-метил-пропан-2-сульфиновой кислоты 1-[цис-3-(трет-бутил-диметилсиланилокси)-циклобутил]-мет-(E)-илиденамида в виде бесцветного масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.04 (d, J=5,3 Гц, 1H), 4.25 (quin, J=7,4 Гц, 1H), 2.73-2.88 (m, 1H), 2.46-2.59 (m, 2H), 2.06-2.18 (m, 2H), 1.19 (s, 9H), 0.89 (s, 9Р), 0.05 (s, 6H).
Стадия 5
2-метил-пропан-2-сульфиновой кислоты {1-[цис-3-(трет-бутил-диметил-силанилокси)-циклобутил]-этил}-амид
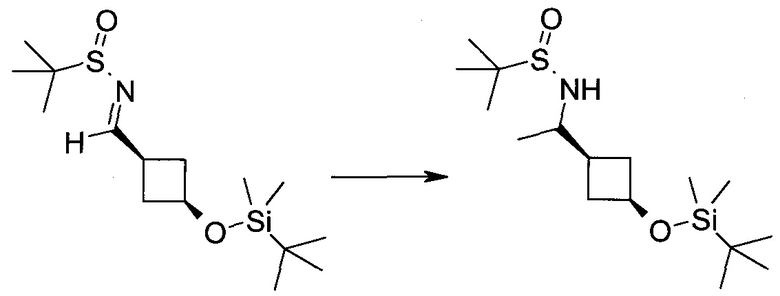
К раствору 2-метил-пропан-2-сульфиновой кислоты 1-[цис-3-(трет-бутилдиметилсиланилокси)-циклобутил]-мет-(E)-илиденамида (640 мг; 2,02 ммоль) в CH2Cl2 (10 мл) при 0°C медленно добавляли бромид метилмагния (3,0 М в Et2O; 1,14 мл; 3,43 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, затем гасили насыщенным водным NH4Cl, разбавляли водой и экстрагировали EtOAc (3×). Объединенные органические экстракты сушили над MgSO4 и концентрировали, получая 685 мг 2-метил-пропан-2-сульфиновой кислоты {1-[цис-3-(трет-бутил-диметил-силанилокси)-циклобутил]-этил}-амида в виде беловатого воскообразного твердого вещества, которое использовали без дополнительной очистки. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 4.05-4.18 (m, 1H), 3.16-3.31 (m, 1H), 2.85 (d, J=7,2 Гц, 1H), 2.21-2.44 (m, 2H), 1.59-1.76 (m, 3H), 1.20 (s, 9H), 1.18 (d, J=6,0 Гц, 3H), 0.88 (s, 9H), 0.03 (s, 6H).
Стадия 6
цис-3-(1-Аминоэтил)-циклобутанола гидрохлорид
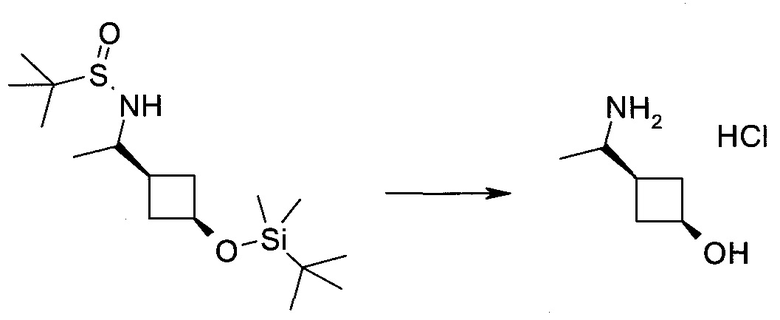
К раствору 2-метил-пропан-2-сульфиновой кислоты {1-[цис-3-(трет-бутил-диметил-силанилокси)-циклобутил]-этил}-амида (200 мг; 0,60 ммоль) в MeOH (3 мл) добавляли хлористый водород (4,0 М в 1,4-диоксане; 0,30 мл; 1,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 мин, затем концентрировали, получая цис-3-(1-аминоэтил)-циклобутанола гидрохлорид в виде беловатого полутвердого вещества, которое использовали без дополнительной очистки. 1H ЯМР (МЕТАНОЛ-d4, 300 МГц): δ (млн-1) 4.09 (quind, J=7,5; 3,8 Гц, 1H), 3.17 (dt, J=6,0; 3,0 Гц, 1H), 2.36-2.56 (m, 2H), 1.78-1.96 (m, 1H), 1.59-1.77 (m, 2H), 1.22 (dd, J=6,8; 3,8 Гц, 3H).
Стадия 7
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-гидрокси-циклобутил)-этил]-амид
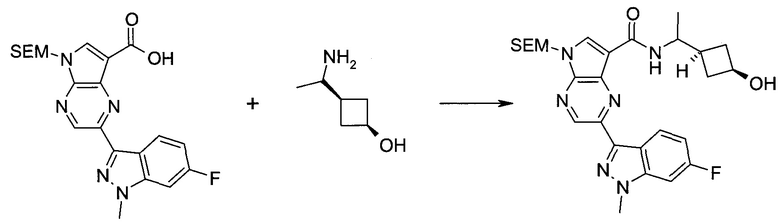
К раствору цис-3-(1-аминоэтил)-циклобутанола гидрохлорида (неочищенного со стадии 6; 91 мг; 0,60 ммоль) в DMF (2 мл) добавляли N,N-диизопропилэтиламин (0,24 мл; 1,36 ммоль), 2-(6-сртор-1-метил-1H-и ндазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (120 мг; 0,27 ммоль) и HATU (114 мг; 0,30 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (3×). Объединенные органические экстракты промывали водой (3×) и рассолом, затем сушили над MgSO4 и концентрировали до бледно-желтого твердого вещества. После растирания с использованием EtOAc/Et2O получали 108 мг (74%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-
триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоть [1-(цис-3-гидрокси-циклобутил)-этил]-амида в виде белого твердого вещества.
Стадия 8
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-гидрокси-циклобутил)-этил]-амид
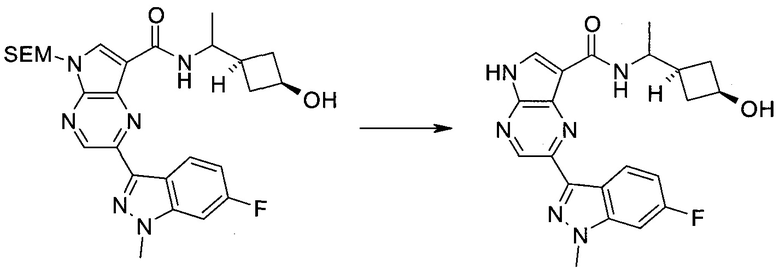
К раствору 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-гидрокси-циклобутил)-этил]-амида (60 мг; 0,11 ммоль) в CH2Cl2 (2 мл) добавляли TFA (1 мл; 13,0 ммоль). Яркую желто-оранжевую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (2 мл) и добавляли этилендиамин (0,4 мл; 6,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли CH2Cl2. Образовывался мелкодисперсный осадок, который собирали посредством фильтрования. Это твердое вещество переносили в MeOH/CH2Cl2 (200 мл) и снова проводили фильтрование, промывая MeOH/CH2Cl2. Фильтрат концентрировали и растирали с EtOAc/MeOH, получая 28 мг (62%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-гидрокси-циклобутил)-этил]-амида в виде светло-желтого твердого вещества. MS: (M+H)+=409; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 9.08 (s, 1H), 8.37-8.48 (m, 2H), 7.96 (d, J=8,7 Гц, 1H), 7.70 (dd, J=9,8; 1,9 Гц, 1H), 7.18 (td, J=9,1; 2,3 Гц, 1H), 4.92 (br. s., 1H), 4.14 (s, 3H), 4.04-4.13 (m, 1H), 3.87 (br. s, 1H), 2.14-2.34 (m, 2H), 1.78-1.93 (m, 1H), 1.58 (quin, J=9,8 Гц, 2H), 1.19 (d, J=6,8 Гц, 3H).
Пример 74
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-цианоциклобутил)-этил]-амид
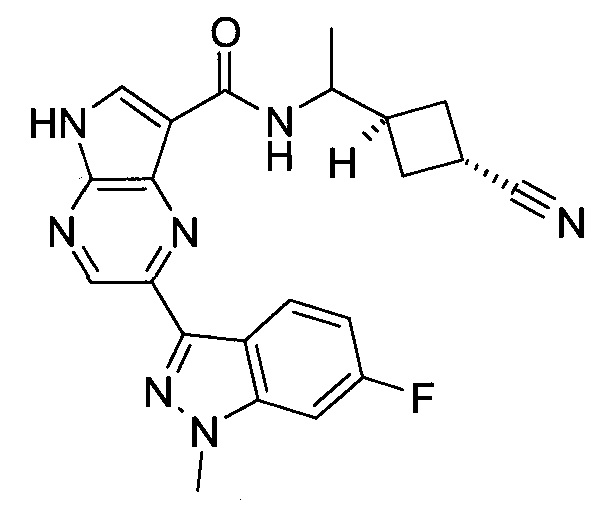
Стадия 1
Метансульфоновой кислоты цис-3-(1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-циклобутиловый эфир
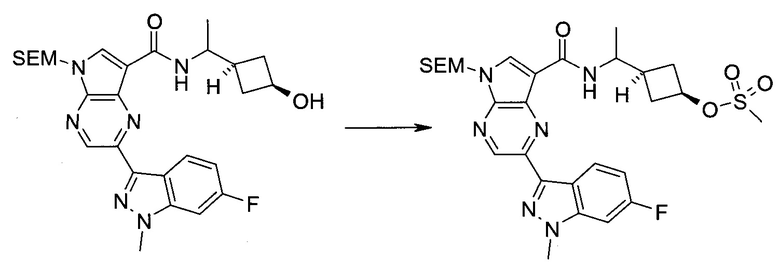
К частичной суспензии 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-гидрокси-циклобутил)-этил]-амида (100 мг; 0,19 ммоль) в CH2Cl2 (3 мл) при 0°C добавляли триэтиламин (39 мкл, 0,28 ммоль), затем метансульфонилхлорид (16 мкл, 0,21 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, затем гасили водой и экстрагировали CH2Cl2. Органические экстракты сушили над MgSO4 и концентрировали, получая метансульфоновой кислоты цис-3-(1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-циклобутилового эфира в виде беловатой пены, которую использовали без дополнительной очистки.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-циано-циклобутил)-этил]-амид
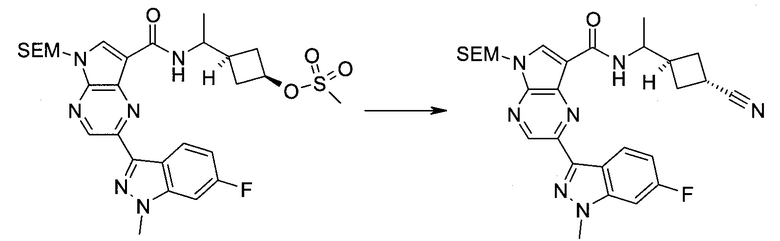
К раствору метансульфоновой кислоты цис-3-(1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-циклобутилового эфира (неочищенного со стадии 1, 114 мг; 0,19 ммоль) в DMSO (1,5 мл) при комнатной температуре добавляли цианид калия (48 мг; 0,74 ммоль). Реакционную смесь нагревали при 60°C в течение 2,5 ч. Добавляли 18-краун-6 (10 мг; 0,04 ммоль) и нагревание продолжали при 80°C в течение 2 ч, затем при 100°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, гасили водой и экстрагировали EtOAc (3×). Объединенные органические экстракты промывали водой (3×) и рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали посредством хроматографии с использованием 30%-50% EtOAc/гексаны, получая 46 мг (45%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-циано-цикпобутил)-этил]-амида в виде желтой пены.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-цианоциклобутил)-этил]-амид
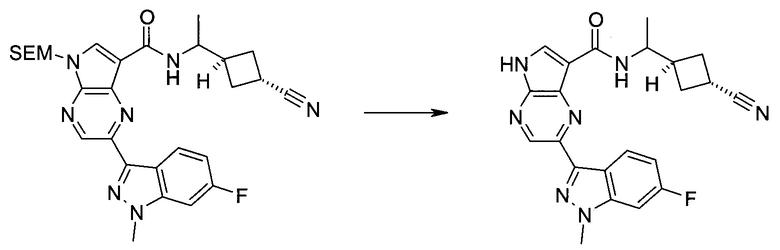
К раствору 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-циано-циклобутил)-этил]-амида (44 мг; 0,08 ммоль) в CH2Cl2 (2 мл) добавляли TFA (1 мл; 13,0 ммоль). Светлую желто-оранжевую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (2 мл) и добавляли этилендиамин (0,4 мл; 6,0 ммоль).
Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и экстрагировали смесью 5% MeOH/CH2Cl2 (2×). Объединенные органические экстракты концентрировали и остаток растирали с EtOAc, получая 19 мг (57%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-цианоциклобутил)-этил]-амида в виде светло-желтого твердого вещества. MS: (M+H)+=418; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 9.08 (s, 1H), 8.43 (s, 1H), 8.40 (dd, J=8,9; 5,5 Гц, 1H), 7.96 (d, J=9,1 Гц, 1H), 7.70 (dd, J=9,8; 2,3 Гц, 1H), 7.29 (td, J=9,1; 1,9 Гц, 1H), 4.19-4.31 (m, 1H), 4.14 (s, 3H), 2.64-2.77 (m, 2H), 2.34-2.45 (m, 1H), 2.22-2.33 (m, 3H), 1.18 (d, J=6,4 Гц, 3H).
Пример 75
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-гидрокси-циклобутил)-этил]-амид
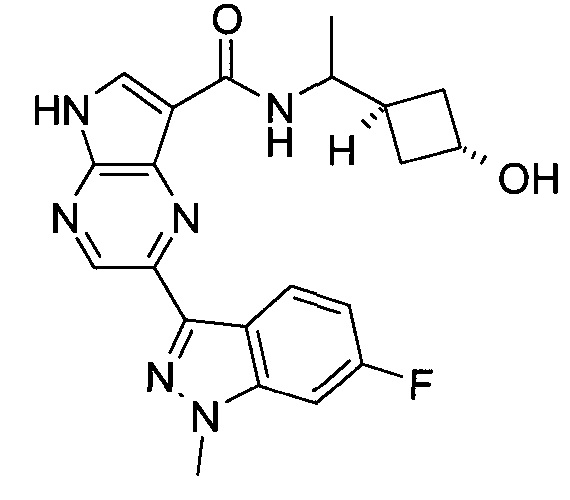
Стадия 1
4-Нитробензойной кислоты транс-3-(1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-циклобутиловый эфир
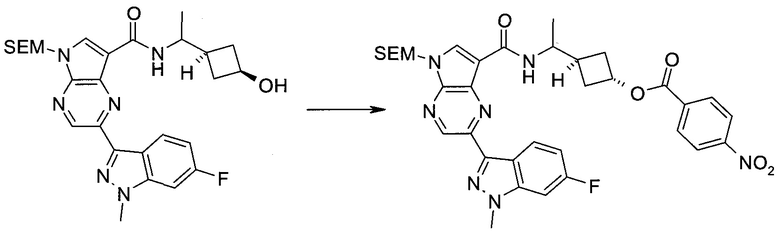
К раствору 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-гидрокси-циклобутил)-этил]-амида (200 мг; 0,37 ммоль) в THF (4 мл) добавляли 4-нитробензойную кислоту (124 мг; 0,74 ммоль) и трифенилфосфин (204 мг; 0,78 ммоль). Затем реакционную смесь охлаждали до 0°C и по каплям добавляли диэтилазодикарбоксилат (123 мкл, 0,78 ммоль). Реакционную смесь
перемешивали при комнатной температуре в течение ночи, затем разбавляли CH2Cl2 (25 мл) и промывали 1,0 М водным NaOH. Водную фазу повторно экстрагировали CH2Cl2, затем объединенные органические экстракты сушили над MgSO4 и концентрировали. Остаток абсорбировали на SiO2 и очищали посредством хроматографии с использованием 20%-80% EtOAc/гексаны, получая 250 мг (98%) 4-нитробензойной кислоты транс-3-(1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-циклобутилового эфира в виде белого твердого вещества.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-гидрокси-циклобутил)-этил]-амид
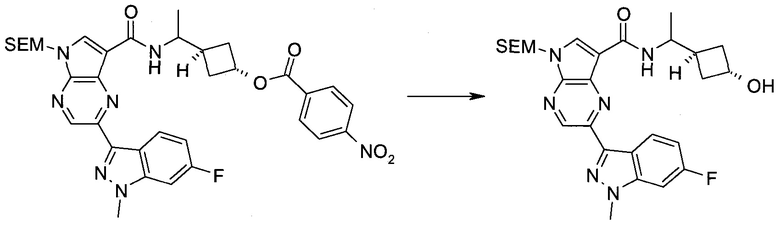
К суспензии 4-нитробензойной кислоты транс-3-(1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-циклобутилового эфира (250 мг; 0,36 ммоль) в THF (12 мл) добавляли 10%-ный водный гидроксид натрия (0,44 мл; 1,09 ммоль), воду (1 мл) и MeOH (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем разбавляли водой и экстрагировали CH2Cl2 (3×). Объединенные органические экстракты, сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 30%-80% EtOAc/гексаны, получая 140 мг (72%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-гидрокси-циклобутил)-этил]-амида в виде беловатого твердого вещества.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-гидрокси-циклобутил)-этил]-амид
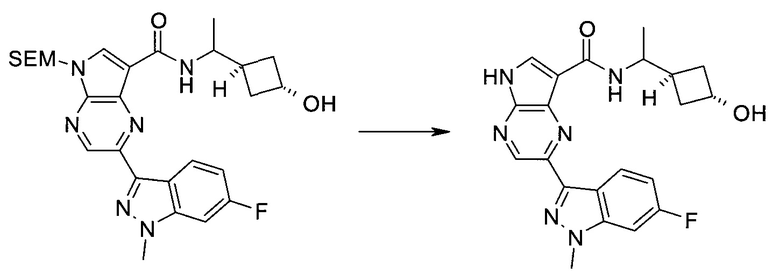
К раствору 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-гидрокси-циклобутил)-этил]-амида (50 мг; 0,09 ммоль) в CH2Cl2 (2 мл) добавляли TFA (1 мл; 13,0 ммоль). Яркую желто-оранжевую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (2 мл) и добавляли этилендиамин (0,4 мл; 6,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и экстрагировали смесью 5% MeOH/CH2Cl2 (2×). Объединенные органические экстракты концентрировали и растирали с EtOAc, получая 19 мг (50%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-гидрокси-циклобутил)-этил]-амида в виде светло-желтого твердого вещества. MS: (M+H)+=409; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 9.09 (s, 1H), 8.42 (s, 1H), 8.39 (dd, J=8,7; 5,3 Гц, 1H), 7.94 (d, J=8,7 Гц, 1H), 7.71 (dd, J=9,6; 2,1 Гц, 1H), 7.26 (td, J=9,1; 1,9 Гц, 1H), 4.96 (br. s., 1H), 4.14 (s, 3H), 4.07-4.26 (m, 2H), 2.23-2.41 (m, 1H), 1.98-2.19 (m, 3H), 1.84-1.98 (m, 1H), 1.20 (d, J=6,4 Гц, 3H).
Пример 76
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-цианоциклобутил)-этил]-амид
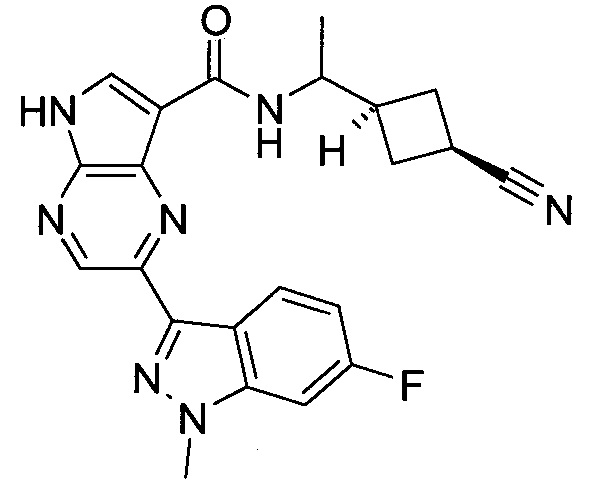
Стадия 1
Метансульфоновой кислоты транс-3-(1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-циклобутиловый эфир
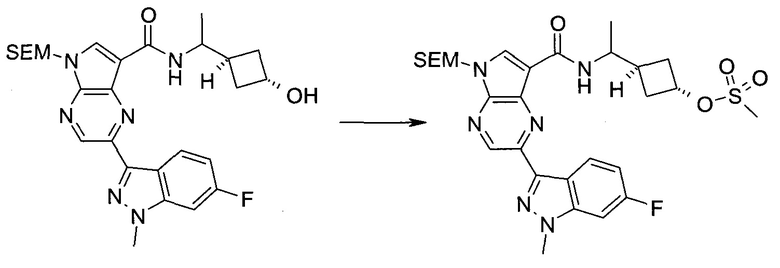
К частичной суспензии 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-гидрокси-циклобутил)-этил]-амида (85 мг; 0,16 ммоль) в CH2Cl2 (3 мл) при 0°C добавляли триэтиламин (33 мкл, 0,24 ммоль), после чего метансульфонилхлорид (14 мкл, 0,18 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, затем гасили водой и экстрагировали CH2Cl2. Органические экстракты сушили над MgSO4 и концентрировали, получая метансульфоновой кислоты транс-3-(1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-цикпобутилового эфира в виде беловатой пены, который использовали без дополнительной очистки.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-циано-циклобутил)-этил]-амид
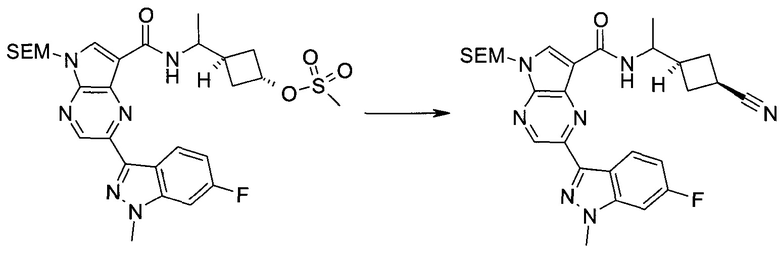
К раствору метансульфоновой кислоты транс-3-(1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-циклобутилового эфира (неочищенного со стадии 1, 97 мг; 0,16 ммоль) в DMSO (1,5 мл) при комнатной температуре добавляли цианид калия (41 мг; 0,63 ммоль) и 18-краун-6 (8 мг; 0,03 ммоль). Реакционную смесь нагревали при 100°C в течение ночи, затем охлаждали до комнатной температуры, гасили водой и экстрагировали EtOAc (3×). Объединенные органические экстракты промывали водой (3×) и рассолом, затем сушили над
MgSO4 и концентрировали. Остаток очищали посредством хроматографии с использованием 20%-50% EtOAc/гексаны, получая 34 мг (40%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-циано-циклобутил)-этил]-амида в виде желтой пены.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-цианоциклобутил)-этил]-амид
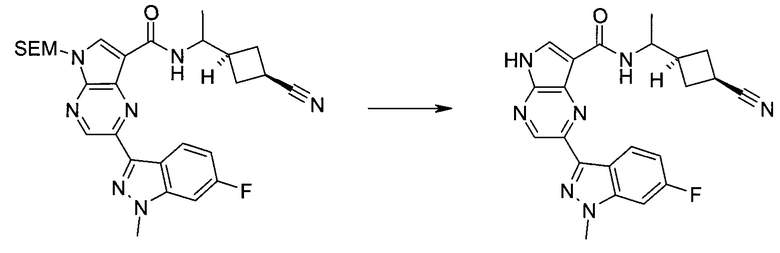
К раствору 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-циано-циклобутил)-этил]-амида (34 мг; 0,06 ммоль) в CH2Cl2 (2 мл) добавляли TFA (1 мл; 13,0 ммоль). Светлую желто-оранжевую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (2 мл) и добавляли этилендиамин (0,4 мл; 6,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем непосредственно концентрированную смесь очищали хроматографией на силикагеле с использованием смесей от 50%-100% EtOAc/гексаны до 5% MeOH/EtOAc, получая 15 мг (58%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-цианоциклобутил)-этил]-амида в виде белого твердого вещества. MS: (M+H)+=418; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.86 (br. s., 1H), 9.08 (s, 1H), 8.44 (s, 1H), 8.40 (dd, J=9,1; 5,3 Гц, 1H), 7.98 (d, J=8,7 Гц, 1H), 7.70 (dd, J=9,8; 1,9 Гц, 1H), 7.25 (td, J=9,0; 2,1 Гц, 1H), 4.17-4.28 (m, 1H), 4.14 (s, 3H), 3.20 (t, J=8,7 Гц, 1H), 2.30-2.46 (m, 3H), 2.04-2.20 (m, 2H), 1.18 (d, J=6,8 Гц, 3H).
Пример 77
2-Изохинолин-1-ил-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
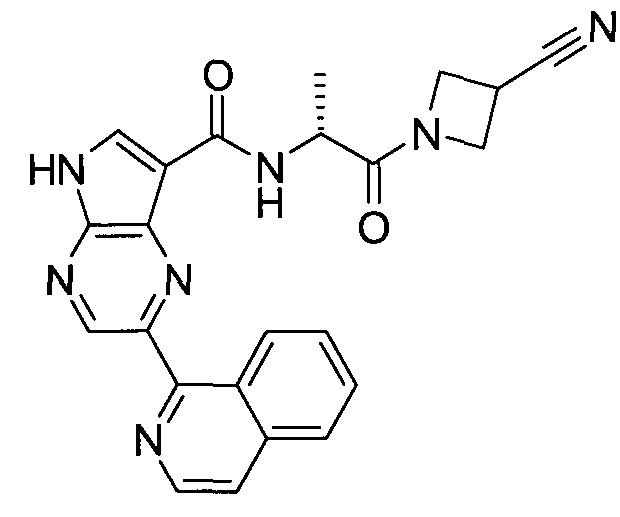
Стадия 1
2-Изохинолин-1-ил-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
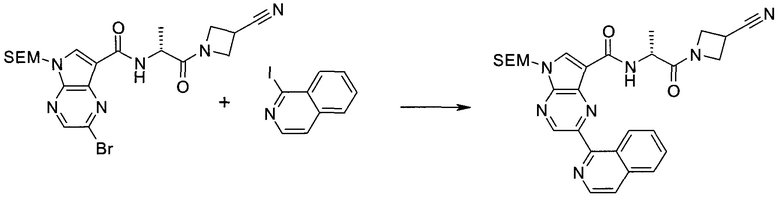
К раствору гексаметилдиолова (ditin - 5p) (90 мг; 0,28 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (100 мг; 0,20 ммоль) в толуоле (2 мл) добавляли Pd(Ph3P)4 (23 мг; 0,02 ммоль). Струей газообразного азота осторожно барботировали реакционную смесь в течение 15 мин, затем ее нагревали до 95°C.Через 1,5 ч добавляли 1-иодизохинолин (50 мг; 0,20 ммоль) и Pd(Ph3P)4 (23 мг; 0,02 ммоль) в виде твердых веществ одной порцией. Нагревание продолжали при 95°C в течение 1,5 ч и добавляли дополнительное количество 1-иодизохинолина (25 мг; 0,10 ммоль), DMF (0,5 мл) и иодида меди(I) (5 мг). Реакционную смесь нагревали при 95°C в течение ночи. Еще раз добавляли 1-иодхинолин (25 мг; 0,10 ммоль) и Pd(Ph3P)4 (23 мг; 0,02 ммоль) и нагревание продолжали в течение 8 ч. Реакционную смесь охлаждали до комнатной температуры, гасили водой и экстрагировали EtOAc (3×). Объединенные органические экстракты промывали водой (3×) и рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 30%-80% EtOAc/гексаны, получая 52 мг (48%) 2-изохинолин-1-ил-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде желтой пены.
Стадия 2
2-Изохинолин-1-ил-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
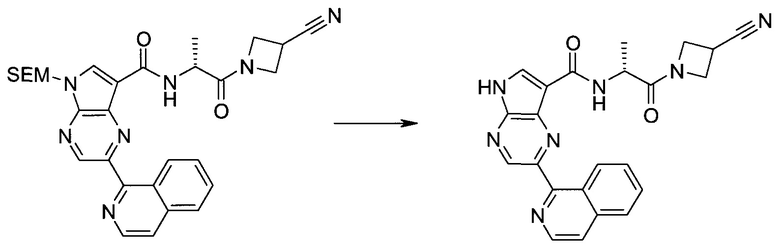
К раствору 2-изохинолин-1-ил-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (52 мг; 0,094 ммоль) в CH2Cl2 (2 мл) добавляли TFA (1 мл; 13,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (2 мл) и добавляли этилендиамин (0,4 мл; 6,0 ммоль). Реакционную смесь перемешивали в течение 1 ч, затем гасили водой и экстрагировали CH2Cl2. Объединенные органические экстракты концентрировали и остаток очищали хроматографией на силикагеле с использованием 0%-5% MeOH/CH2Cl2 (0,5% NH4OH), получая 17 мг (43%) 2-изохинолин-1-ил-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде беловатого твердого вещества. MS (M+H)+=426; т.пл. = 180-185°C; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 13.02 (br. s, 1H), 9.09 (s, 1H), 8.91 (d, J=8,7 Гц, 1H), 8.68 (d, J=5,7 Гц, 1H), 8.55 (d, J=9,1 Гц, 1H), 8.44 (d, J=7,6 Гц, 1H), 8.09 (d, J=7,9 Гц, 1H), 7.98 (d, J=5,7 Гц, 1H), 7.84 (t, J=7,6 Гц, 1H), 7.66-7.77 (m, 1H), 4.40-4.70 (m, 3H), 4.12 (q,J=9,7 Гц, 1H), 3.93-4.04 (m, 1H), 3.74-3.88 (m, 1H), 1.22 (t, J=6,6 Гц, 3H).
Пример 78
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-пиридин-2-ил-этил)-амида гидрохлорид
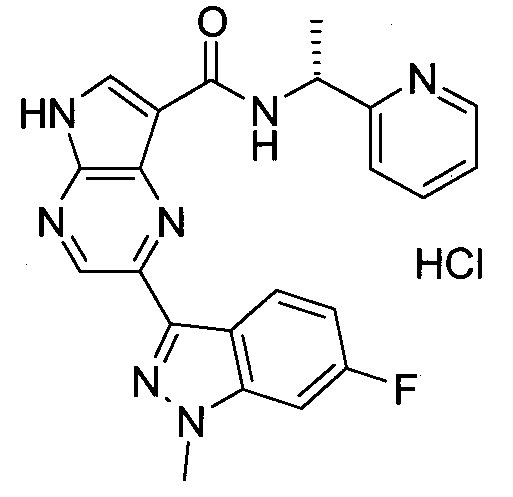
Стадия 1
(R)-2-Метил-пропан-2-сульфиновой кислоты ((R)-1-пиридин-2-ил-этил)-амид
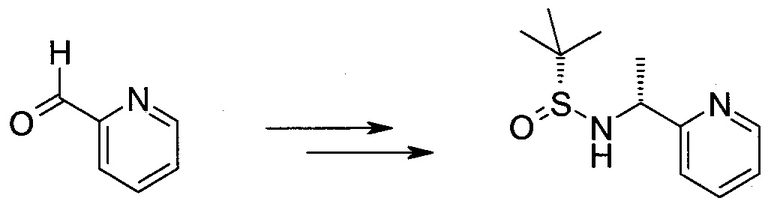
Указанное в заголовке соединение получали из пиридин-2-карбоксальдегида в соответствии с методикой, описанной в Kuduk, et al. Tempahedron Lett., 2004, 45, 6641. Продукт получали в виде смеси 10:1 с предпочтительным содержанием RSR-диастереомер по оценкам посредством ЯМР, что согласуется с литературными данными. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.55 (d, J=4,9 Гц, 1H), 7.66 (td, J=7,6; 1,7 Гц, 1H), 7.29 (d, J=7,6 Гц, 1H), 7.18 (dd, J=7,6; 4,9 Гц, 1H), 4.83 (d, J=4,9 Гц, 1H), 4.53-4.66 (m, 1H), 1.51 (d, J=6,8 Гц, 3H), 1.26 (s, 9H).
Стадия 2
(R)-1-Пиридин-2-ил-этиламина дигидрохлорид
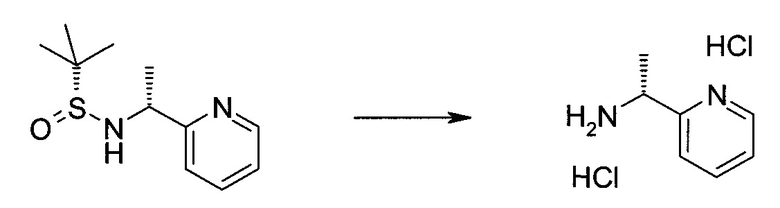
К раствору (R)-2-метил-пропан-2-сульфиновой кислоты ((R)-1-пиридин-2-ил-этил)-амида (1,10 г; 4,86 ммоль) в MeOH (12 мл) добавляли 4,0 М хлористый водород в диоксане (3,04 мл; 12,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем концентрировали и сушили под высоким вакуумом, получая 1,0 г (R)-1-пиридин-2-ил-этиламина дигидрохлорида в виде светло-желтого твердого вещества. 1H ЯМР (МЕТАНОЛ-d4, 300 МГц): δ (млн-1) 8.80 (t, J=3,8 Гц, 1H), 8.32 (tdd, J=7,9; 4,5, 1,7 Гц, 1H), 7.88 (dd, J=7,9; 4,5 Гц, 1H), 7.72-7.83 (m, 1H), 4.78 (qd, J=6,9; 4,5 Гц, 1H), 1.73 (dd, J=6,9; 4,5 Гц, 3H). Предположительно 82% ее с учетом соотношения 10:1, определенного (dr от англ. determined) для исходного вещества.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-пиридин-2-ил-этил)-амид
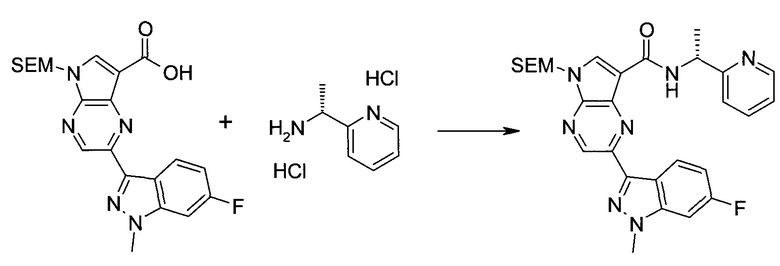
К раствору (R)-1-пиридин-2-ил-этиламина дигидрохлорида (66 мг; 0,34 ммоль) в DMF (2 мл) добавляли N,N-диизопропилэтиламин (0,20 мл; 1,13 ммоль), 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (100 мг; 0,23 ммоль) и HATU (95 мг; 0,25 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (3×). Объединенные органические экстракты промывали водой (3×) и рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 50%-100% EtOAc/гексаны, получая 117 мг (95%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-пиридин-2-ил-этил)-амида в виде белого твердого вещества.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-пиридин-2-ил-этил)-амида гидрохлорид
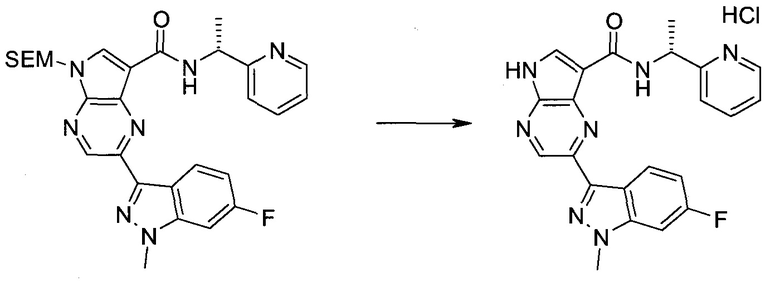
К раствору 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-пиридин-2-ил-этил)-амида (117 мг; 0,21 ммоль) в CH2Cl2 (2 мл) добавляли TFA (1 мл; 13,0 ммоль). Яркую желто-оранжевую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (2 мл) и добавляли этилендиамин (0,5 мл; 7,50 ммоль). Реакционную смесь перемешивали в течение 1 ч, затем непосредственно хроматографировали с использованием смеси от 50%-100% EtOAc/гексаны до 5%
MeOH/EtOAc. Выделенное таким образом белое твердое вещество растирали с EtOAc, затем суспендировали в CH2Cl2 и MeOH (1:1, 6 мл). Добавляли 1,0 М HCl в MeOH (2 экв.), что приводило к полному растворению. Раствор концентрировали и сушили под высоким вакуумом, получая 67 мг (69%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-пиридин-2-ил-этил)-амида гидрохлорида в виде светло-желтого твердого вещества. MS (M+H)+=416; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.93 (d, J=2,6 Гц, 1H), 9.13 (s, 1H), 8.83 (d, J=7,6 Гц, 1H), 8.73 (dd, J=8,9; 5,5 Гц, 1H), 8.59 (d, J=4,9 Гц, 1H), 8.44 (d, J=3,0 Гц, 1H), 8.07 (br. s., 1H), 7.76 (d, J=7,9 Гц, 1H), 7.68 (dd, J=9,6; 2,1 Гц, 1H), 7.53 (br. s., 1H), 7.05 (td, J=9,1; 1,9 Гц, 1H), 5.44 (quin, J=7,0 Гц, 1H), 4.15 (s, 3H), 1.67 (d, J=6,8 Гц, 3H).
Пример 79
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-трифторметил-пиридин-2-ил)-этил]-амид
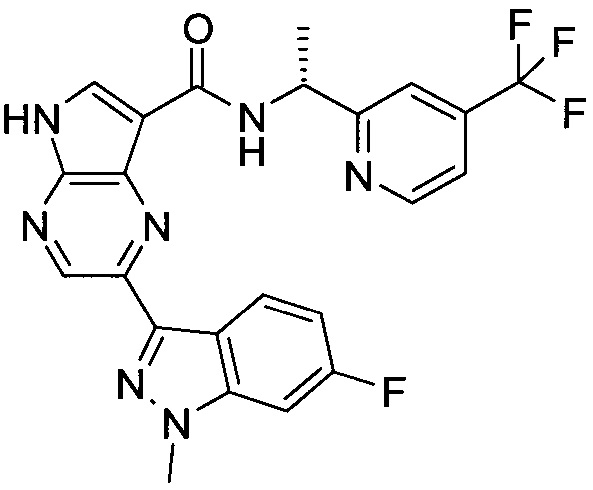
Стадия 1
(4-Трифторметил-пиридин-2-ил)-метанол

К раствору 4-трифторметил-пиридин-2-карбоновой кислоты (500 мг; 2,62 ммоль) в THF (20 мл) при 0°С добавляли триэтиламин (0,40 мл; 2,88 ммоль), затем этилхлорформиат (0,28 мл; 2,88 ммоль). Образовывался вязкий белый осадок. Реакционную смесь перемешивали при 0°С в течение 15 мин, затем медленно через пипетку добавляли раствор боргидрида натрия (297 мг; 7,85 ммоль) в воде (5 мл). Наблюдалось бурное выделение газа, и все твердые вещества растворялись. Реакционную смесь перемешивали при 0°С в течение 10 мин, затем нагревали до комнатной температуры и перемешивали в течение 1 ч. Реакционную смесь разбавляли водой и экстрагировали CH2Cl2 (3×). Объединенные органические экстракты сушили над MgSO4 и концентрировали. Остаток очищали хроматографией с использованием 20%-50% EtOAc/гексаны,
получая 296 мг (64%) (4-трифторметил-пиридин-2-ил)-метанола в виде бесцветного масла, которое застывало при температуре чуть ниже комнатной. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.76 (d, J=4,9 Гц, 1H), 7.55 (s, 1H), 7.45 (d, J=4,9 Гц, 1H), 4.87 (s, 2H).
Стадия 2
4-Трифторметил-пиридин-2-карбальдегид
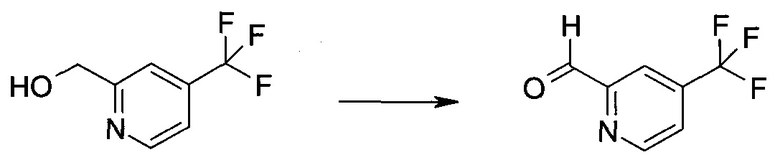
К раствору (4-трифторметил-пиридин-2-ил)-метанола (290 мг; 1,64 ммоль) в CH2Cl2 (15 мл) при комнатной температуре добавляли периодинан Десса-Мартина (764 мг; 1,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили насыщенным водным NaHCO3 (10 мл) и 10%-ным водным Na2S2O3 (10 мл). Двухфазную смесь разбавляли CH2Cl2 и интенсивно перемешивали в течение 10 мин. Слои разделяли и водный слой экстрагировали CH2Cl2. Объединенные органические экстракты сушили над MgSO4 и концентрировали, получая 300 мг 4-трифторметил-пиридин-2-карбальдегида в виде бледно-желтого масла, которое использовали без дополнительной очистки. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 10.15 (s, 1H), 9.00 (d, J=5,3 Гц, 1H), 8.19 (s, 1H), 7.77 (dd, J=5,3; 1,3 Гц, 1H).
Стадия 3
(R)-2-Метил-пропан-2-сульфиновой кислоты 1-(4-трифторметил-пиридин-2-ил)-мет-(E)-илиденамид
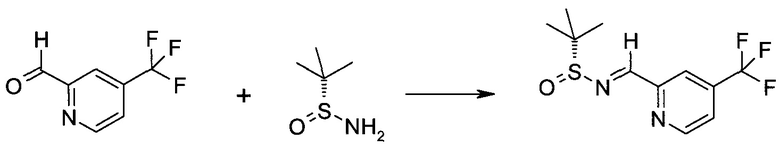
К раствору 4-трифторметил-пиридин-2-карбальдегида (287 мг; 1,64 ммоль) и (R)-2-метилпропан-2-сульфинамида (209 мг; 1,72 ммоль) в CH2Cl2 (10 мл) добавляли безводный сульфат меди(II) (576 мг; 3,61 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем фильтровали через воронку Бюхнера, промывая CH2Cl2. Фильтрат концентрировали, остаток абсорбировали на SiO2 и очищали хроматографией с использованием 20%-40% EtOAc/гексаны, получая 340 мг (75%) (R)-2-метил-пропан-2-сульфиновой кислоты 1-(4-трифторметил-пиридин-2-ил)-мет-(E)-илиденамида в виде бледно-желтого масла.
Стадия 4
(R)-2-Метил-пропан-2-сульфиновой кислоты [(R)-1-(4-трифторметил-пиридин-2-ил)-этил]-амид
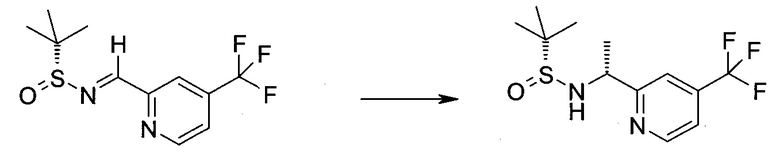
К раствору (R)-2-метил-пропан-2-сульфиновой кислоты 1-(4-трифторметил-пиридин-2-ил)-мет-(E)-илиденамида (0,34 г; 1,22 ммоль) в THF (5 мл) при -78°С медленно добавляли бромид метилмагния (3,0 М в Et2O) (0,73 мл; 2,2 ммоль). Реакционную смесь перемешивали при -78°С в течение 30 мин, затем гасили в охлажденном виде насыщенным водным NH4Cl. Смесь нагревали до комнатной температуры, разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические экстракты сушили над MgSO4 и концентрировали. ЯМР-анализ показал наличие смеси диастереомеров в соотношении приблизит. 8:1. Остаток очищали хроматографией с использованием 50%-100% EtOAc/гексаны, получая 225 мг (63%) (R)-2-метил-пропан-2-сульфиновой кислоты [(R)-1-(4-трифторметил-пиридин-2-ил)-этил]-амида в виде бесцветного масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.75 (d, J=5,3 Гц, 1H), 7.51 (s, 1H), 7.42 (d, J=5,3 Гц, 1H), 4.77 (d, J=4,9 Гц, 1H), 4.67 (quin, J=6,3 Гц, 1H), 1.55 (d, J=6,8 Гц, 3H), 1.27 (s, 9H). Полученный единственный диастереомер оценивали как RSR на основе предшествующей литературы (Kuduk, et. al. Tempahedron Lett. 2004, 45, 6641).
Стадия 5
(R)-1-(4-Трифторметил-пиридин-2-ил)-этиламина дигидрохлорид
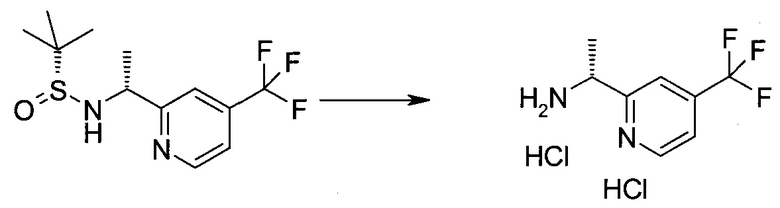
К раствору (R)-2-метил-пропан-2-сульфиновой кислоты [(R)-1-(4-трифторметил-пиридин-2-ил)-этил]-амида (225 мг; 0,76 ммоль) в MeOH (4 мл) добавляли 4,0 М хлористый водород в диоксане (0,48 мл; 1,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем концентрировали и сушили под высоким вакуумом, получая 225 мг (R)-1-(4-трифторметил-пиридин-2-ил)-этиламина дигидрохлорида в виде вязкого бесцветного масла, которое использовали без дополнительной очистки.
Стадия б
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-трифторметил-пиридин-2-ил)-этил]-амид
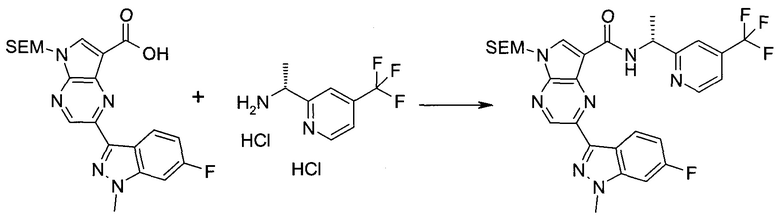
К раствору (R)-1-(4-трифторметил-пиридин-2-ил)-этиламина дигидрохлорида (89 мг; 0,34 ммоль) в DMF (2 мл) добавляли N,N-диизопропилэтил-амин (0,20 мл; 1,13 ммоль), 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметил-силанил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (100 мг; 0,23 ммоль) и HATU (95 мг; 0,25 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (3×). Объединенные органические экстракты промывали водой (3×) и рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 50%-100% EtOAc/гексаны, получая 122 мг (88%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-трифторметил-пиридин-2-ил)-этил]-амида в виде белого твердого вещества.
Стадия 7
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-трифторметил-пиридин-2-ил)-этил]-амид
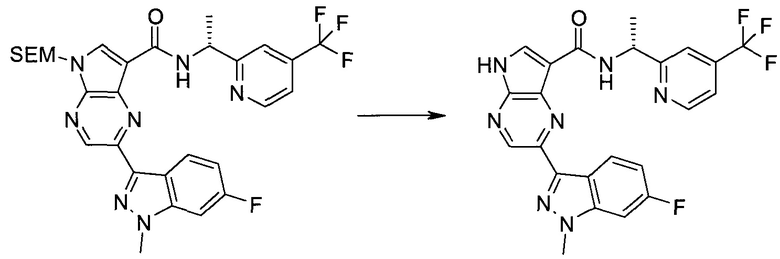
К раствору 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-трифторметил-пиридин-2-ил)-этил]-амида (122 мг; 0,20 ммоль) в CH2Cl2 (3 мл)
добавляли TFA (1 мл; 13,0 ммоль). Яркую желто-оранжевую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (3 мл) и добавляли этилендиамин (0,5 мл; 7,50 ммоль). Реакционную смесь перемешивали в течение 1 ч, затем гасили водой и экстрагировали смесью 5% MeOH/CH2Cl2 (2×). Объединенные органические экстракты концентрировали и растирали с MeOH/CH2Cl2, получая 65 мг (68%) 2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-трифторметил-пиридин-2-ил)-этил]-амида в виде беловатого твердого вещества. MS: (M+Na)+=506; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.79 (br. s., 1H), 9.12 (s, 1H), 8.86 (d, J=7,9 Гц, 1H), 8.71-8.81 (m, 2H), 8.43 (s, 1H), 7.91 (s, 1H), 7.60-7.73 (m, 2H), 7.03 (td, J=9,2; 2,1 Гц, 1H), 5.55 (quin, J=7,3 Гц, 1H), 4.15 (s, 3H), 1.64 (d, J=6,8 Гц, 3H).
Пример 80
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-циано-1,2,2-триметил-этил)-амид
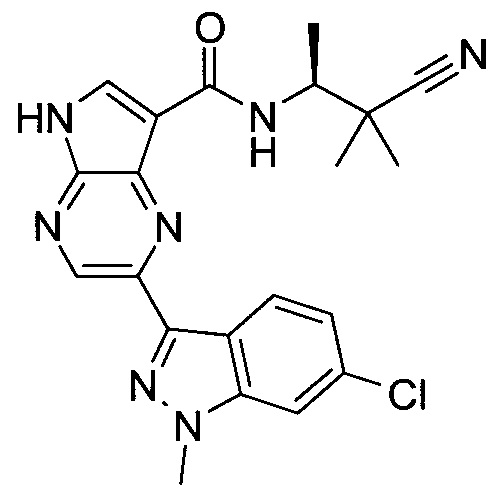
Стадия 1
(R)-2-Метил-пропан-2-сульфиновой кислоты (E)-этилиденамид
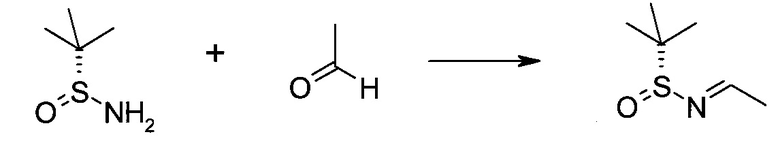
В колбе растворяли (R)-2-метил-пропан-2-сульфиновой кислоты амид (4,00 г; 33,0 ммоль) в CH2Cl2 (14,0 мл). Добавляли ацетальдегид (16,7 мл; 297 ммоль), MgSO4 (11,9 г; 99,0 ммоль) и пиридинийтозилат (415 мг; 1,65 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, фильтровали и концентрировали, получая 5,21 г (R)-2-метил-пропан-2-сульфиновой кислоты (E)-этилиденамида в виде желтого масла, которое использовали без дополнительной очистки.
Стадия 2
(R)-2-Метил-пропан-2-сульфиновой кислоты ((S)-2-циано-1,2,2-триметил-этил)-амид
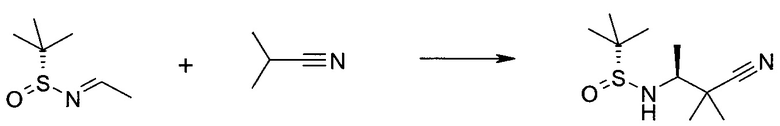
В колбе растворяли изобутиронитрил (6,39 г; 92,4 ммоль) в диэтиловом эфире (190 мл) и охлаждали при -78°С.Добавляли NaHMDS (1,0 M в THF; 99,0 мл; 99,0 ммоль) и смесь перемешивали в течение 30 мин при -78°С. Медленно добавляли раствор (R)-2-метил-пропан-2-сульфиновой кислоты (E)-этилиденамида (неочищенного со стадии 1; 5,21 г; 33,0 ммоль) в THF (50,0 мл). Смесь перемешивали при -78°С в течение 2 ч, затем оставляли нагреваться до комнатной температуры в течение ночи. Реакционную смесь гасили насыщенным водным хлоридом аммония и экстрагировали EtOAc. Объединенные органические экстракты промывали рассолом, сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на SiO2 (20-100% EtOAc/гексан), получая 2,93 г (41%) (R)-2-метил-пропан-2-сульфиновой кислоты ((S)-2-циано-1,2,2-триметил-этил)-амида в виде светло-желтого масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 3.28 (dq, J=8,7; 6,4 Гц, 1H), 3.08 (d, J=8,7 Гц, 1H), 1.45 (d, J=6,4 Гц, 3H), 1.39 (s, 3H), 1.34 (s, 3H), 1.26 (s, 9H).
Стадия 3
(S)-3-Амино-2,2-диметил-бутиронитрила гидрохлорид

(R)-2-Метил-пропан-2-сульфиновой кислоты (2-циано-1,2,2-триметил-этил)-амид (2,93 г; 13,6 ммоль) растворяли в MeOH и добавляли HCl (4,0 М в 1,4-диоксане; 6,8 мл; 27,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем концентрировали, получая 1,90 г (94%) (S)-3-амино-2,2-диметил-бутиронитрила гидрохлорида в виде белого твердого вещества, которое использовали без дополнительной очистки.
Стадия 4
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-циано-1,2,2-триметил-этил)-амид
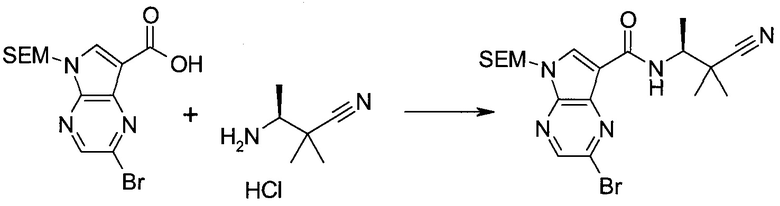
В колбе объединяли 2-бром-5-(2-триметилсиланилэтоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (1,10 г; 2,95 ммоль), (3)-3-амино-2,2-диметил-бутиронитрила гидрохлорид (439 мг; 2,95 ммоль), EDC (1,3 г; 6,8 ммоль) и HOBt (1,15 г; 6,8 ммоль). Добавляли DMF (27 мл), затем i-Pr2NEt (3,6 мл; 20,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем гасили водой и экстрагировали EtOAc. Органические экстракты промывали 10%-ной лимонной кислотой, насыщ. NaHCO3, насыщ. LiCl и насыщ. NaCl, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на SiO2 (50-100% EtOAc/гексан), получая 1,32 г (96%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-циано-1,2,2-триметил-этил)-амида в виде беловатого порошка.
Стадия 5
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-циано-1,2,2-триметил-этил)-амид
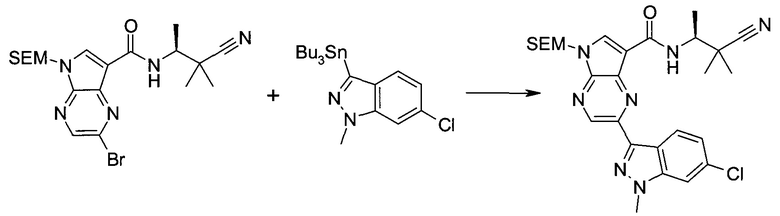
К раствору 6-трет-бутил-1-метил-3-трибутилстаннил-1H-индазола (222 мг; 0,49 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-циано-1,2,2-триметил-этил)-амида (110 мг; 0,24 ммоль) в DMF (1,5 мл) добавляли Pd(PPh3)4 (14 мг; 0,012 ммоль) и иодид меди(I) (9 мг; 0,05 ммоль). Желтую реакционную смесь продували аргоном, затем нагревали при 80°С в течение 2 ч, после чего охлаждали до комнатной температуры, гасили насыщ. NH4Cl и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток очищали хроматографией на силикагеле с использованием 20%-50% EtOAc/гептан, получая 120 мг (92%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-циано-1,2,2-триметил-этил)-амида в виде белого порошка.
Стадия 6
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-циано-1,2,2-триметил-этил)-амид
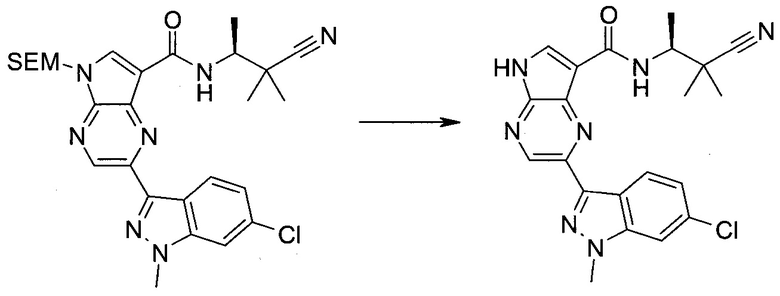
К раствору 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-циано-1,2,2-триметил-этил)-амида (120 мг; 0,22 ммоль) в CH2Cl2 (2 мл) добавляли TFA (0,75 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток снова растворяли в смеси 10:90:0,5 MeOH/CH2Cl2/NH4OH (3 мл) и перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток переносили в смесь 10% MeOH/CH2Cl2 и добавляли воду. Полученный осадок собирали посредством фильтрования, затем растирали с EtOAc, получая 77 мг (84%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-циано-1,2,2-триметил-этил)-амида в виде светло-желтого порошка. MS: (M+H)+=422; т.пл. = 322-328°С; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 12.78 (s, 1H), 8.99 (s, 1H), 8.38 (s, 1H), 8.34 (d, J=9,1 Гц, 1H), 8.01 (d, J=9,6 Гц, 1H), 7.86 (d, J=1,5 Гц, 1H), 7.19 (dd, J=8,6; 1,5 Гц, 1H), 4.20-4.34 (m, 1H), 4.04 (s, 3H), 1.31 (d, J=6,6 Гц, 3H), 1.28 (s, 3H), 1.25 (s, 3H).
Пример 81
2-(6-трет-Бутил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
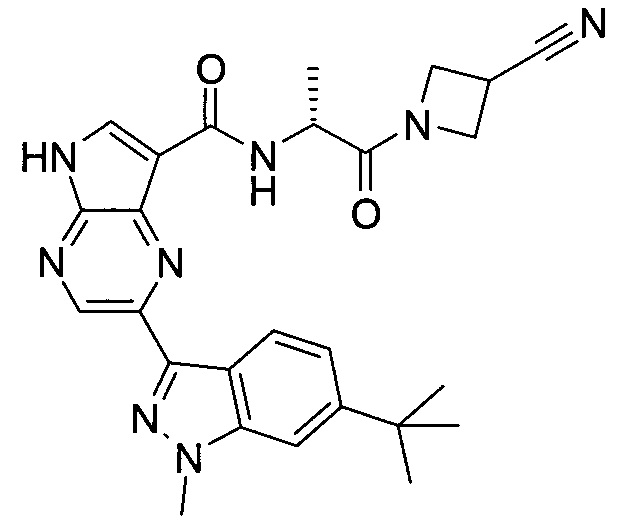
Стадия 1
5-трет-Бутил-2-метиланилин

К раствору 4-трет-бутил-1-метил-2-нитробензола (3,58 г; 18,5 ммоль) в MeOH (80 мл) добавляли 10%-ный Pd на угле (влажный; 358 мг). Реакционную смесь перемешивали в атмосфере водорода (баллон) в течение 4 ч, затем фильтровали через целит, промывая EtOAc. Фильтрат концентрировали, получая 2,48 г (82%) 5-трет-бутил-2-метиланилина в виде коричневого масла, которое использовали без дополнительной очистки.
Стадия 2
6-трет-Бутил-1H-индазол

К раствору 5-трет-бутил-2-метиланилина (2,48 г; 15,2 ммоль) в CHCl3 (40 мл) при 0°С медленно добавляли уксусный ангидрид (3,3 мл; 34,9 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Добавляли ацетат калия (446 мг; 4,55 ммоль), затем медленно добавляли изоамилнитрит (4,4 мл; 32,6 ммоль). Реакционную смесь нагревали при температуре дефлегмации в течение ночи. Реакционную смесь охлаждали до комнатной температуры и концентрировали. Остаток растворяли в EtOAc и промывали водой, насыщ. NaHCO3 и рассолом, затем сушили над MgSO4 и концентрировали. Остаток растворяли в THF/MeOH (1:1, 40 мл) и добавляли 10%-ный NaOH (4,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин, затем нейтрализовали, используя 1,0 М HCl, разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 20%-50% EtOAc/гептан, получая 1,02 г (39%) 6-трет-бутил-1H-индазола в виде беловатого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.03 (s, 1H), 7.70 (d, J=8,7 Гц, 1H), 7.48 (s, 1H), 7.29 (dd, J=8,7; 1,5 Гц, 1H), 1.40 (s, 9H).
Стадия 3
6-трет-Бутил-3-иод-1H-индазол
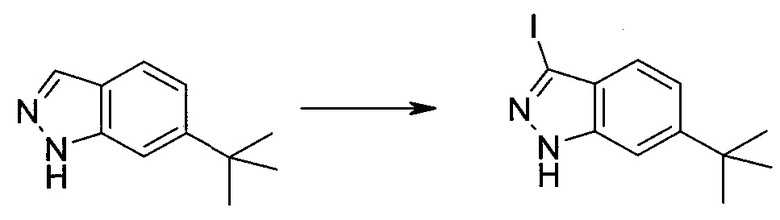
К раствору 6-трет-бутил-1H-индазола (1,02 г; 5,84 ммоль) в DMF (20 мл) при комнатной температуре добавляли гидроксид калия (983 мг; 17,5 ммоль) и йод (2,22 г; 8,76 ммоль). Темно-бордовую реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили 10%-ным водным Ма2320з и разбавляли водой. Смесь экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой, насыщ. LiCl и насыщ. NaCl, затем сушили над MgSO4 и концентрировали, получая 1,92 г 6-трет-бутил-3-иод-1H-индазола в виде светло-коричневого твердого вещества.
Стадия 4
6-трет-Бутил-3-иод-1-метил-1H-индазол

К раствору 6-трет-бутил -3-иод-1H-индазола (820 мг; 2,73 ммоль) в THF (8 мл) при 0°С добавляли KOtBu (429 мг; 3,82 ммоль). Реакционную смесь перемешивали при 0°С в течение 30 мин, затем добавляли иодметан (0,24 мл; 3,82 ммоль). Перемешивали при 0°С в течение 30 мин, затем нагревали до комнатной температуры и перемешивали в течение 1,5 ч. Реакцию гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток очищали хроматографией на силикагеле с использованием 10%-50% EtOAc/гептан, получая 592 мг (69%) 6-трет-бутил-3-иод-1-метил-1H-индазола в виде белого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.37-7.43 (m, 1H), 7.31 (d, J=9,8 Гц, 2H), 4.10 (s, 3H), 1.41 (s, 9H). Минорный региоизомер 6-трет-бутил-3-иод-2-метил-1H-индазол также отмечали, но не выделяли.
Стадия 5
6-трет-Бутил-1-метил-3-трибутилстаннанил-1H-индазол
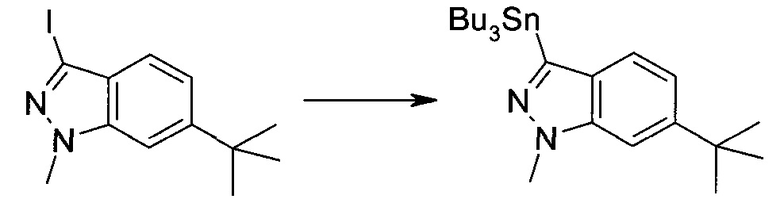
К раствору 6-трет-бутил-3-иод-1-метил-1H-индазола (150 мг; 0,45 ммоль) в THF (3 мл) при 0°С медленно добавляли хлорид изопропилмагния (2,0 М в THF; 0,27 мл; 0,54 ммоль). Ярко-желтую гетерогенную реакционную смесь перемешивали при 0°С в течение 1 ч, затем по каплям добавляли трибутилхлорстаннан (0,15 мл; 0,54 ммоль). Перемешивание продолжали при 0°С в течение 20 мин, затем при комнатной температуре в течение 3 ч. Реакционную смесь гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали рассолом, затем сушили над MgSO4 и концентрировали, получая 6-трет-бутил-1-метил-3-трибутилстаннанил-1H-индазол в виде вязкого желтого масла, которое использовали на следующей стадии без дополнительной очистки.
Стадия 6
2-(6-трет-Бутил-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
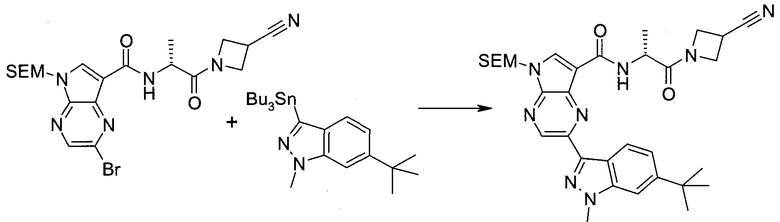
К раствору 6-трет-бутил-1-метил-3-трибутилстаннил-1H-индазола (неочищенного со стадии 5; 217 мг; 0,45 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (125 мг; 0,25 ммоль) в DMF (1,5 мл) добавляли Pd(PPh3)4 (14 мг; 0,012 ммоль) и иодид меди(I) (9 мг; 0,05 ммоль). Желтую реакционную смесь продували аргоном, затем нагревали при 80°С в течение 1,5 ч, далее охлаждали до комнатной температуры, гасили насыщ. NH4Cl и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток очищали хроматографией на силикагеле с использованием 50%-100% EtOAc/гептан, получая 129 мг (85%) 2-(6-трет-бутил-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде белого твердого вещества.
Стадия 7
2-(6-трет-Бутил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
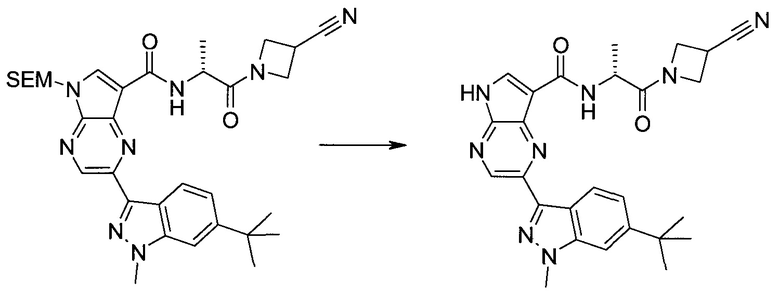
К раствору 2-(6-трет-бутил-1-метил-1H-индазол-3-ил)-5-(2-триметил-силанил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (129 мг; 0,21 ммоль) в CH2Cl2 (2 мл) добавляли TFA (0,75 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, затем концентрировали. Остаток снова растворяли в смеси 10:90:0,5 MeOH/CH2Cl2/NH4OH (3 мл) и перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали и остаток очищали хроматографией на силикагеле с использованием 0%-5% MeOH/EtOAc, получая 74 мг (73%) 2-(6-трет-бутил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-желтого порошка. MS: (M+H)+=485; т.пл. = 180-195°С; 1H ЯМР (CDCl3, 400 МГц): δ (млн-1) 10.08-10.28 (m, 1H), 9.02-9.14 (m, 1H), 8.65 (d, J=7,1 Гц, 1H), 8.46 (d, J=8,6 Гц, 1H), 7.99-8.13 (m, 1H), 7.40-7.49 (m, 1H), 7.36 (s, 1H), 4.86-5.08 (m, 1H), 4.23-4.76 (m, 4H), 4.11 (s, 3H), 3.52-3.59 (m, 1H), 1.55-1.71 (m, 3H), 1.48 (s, 9H).
Пример 82
2-(1,6-Диметил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
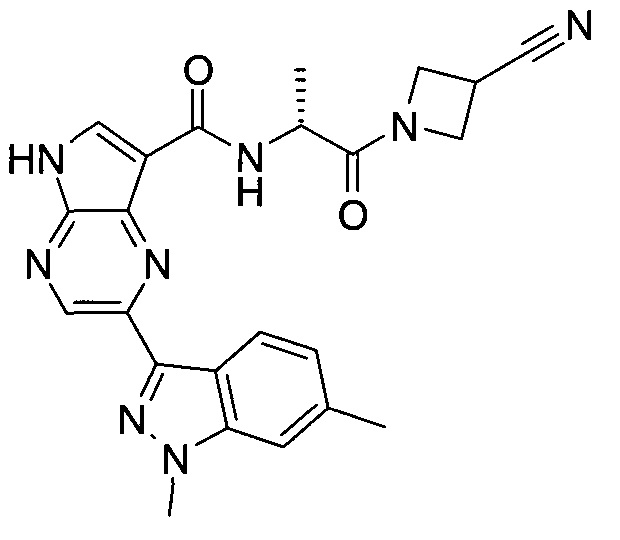
Получали в соответствии с методикой, приведенной в примере 81, стадии 3-7, заменяя 6-метил-1H-индазол на 6-трет-бутил-1H-индазол на стадии 3. MS:
(M+H)+=443; т.пл. = 260-275°С; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 9.23 (s, 1H), 8.63 (d,J=8,1 Гц, 1H), 8.59 (d,J=8,1 Гц, 1H), 8.54 (d, J=11,6 Гц, 1H), 7.63 (s, 1H), 7.17-7.27 (m, 1H), 4.59-4.89 (m, 3H), 4.26-4.35 (m, 1H), 4.23 (s, 3H), 4.17 (dd, J=9,6; 6,1 Гц, 1H), 3.91-3.97 (m, 1H), 1.52 (t, J=6,3 Гц, 3H).
Пример 83
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
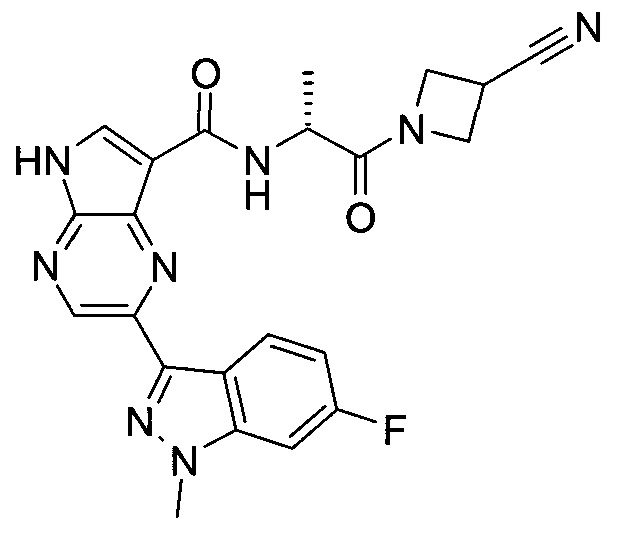
Получали в соответствии с методикой, приведенной в примере 81, стадии 3-7, заменяя 6-фтор-1H-индазол на 6-трет-бутил-1H-индазол на стадии 3. MS: (M+H)+=447; т.пл. = 270-277°С; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 12.91 (br. s., 1H), 9.15 (s, 1H), 8.71-8.80 (m, 1H), 8.42-8.52 (m, 2H), 7.68 (dd, J=9,9; 2,3 Гц, 1H), 7.13 (d, J=2,0 Гц, 1H), 4.50-4.80 (m, 3H), 4.19-4.29 (m, 1H), 4.16 (s, 3H), 4.11 (dd, J=9,9; 6,3 Гц, 1H), 3.82-3.93 (m, 1H), 1.42 (t, J=6,6 Гц, 3H).
Пример 84
2-(6-Метокси-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
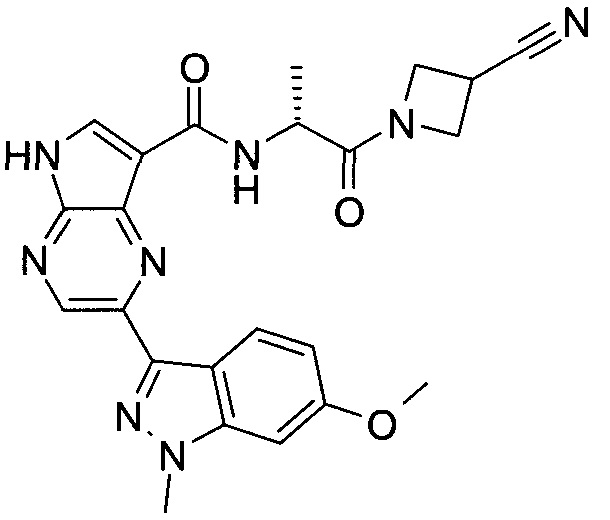
Получали в соответствии с методикой, приведенной в примере 81, стадии 3-7, заменяя 6-метокси-1H-индазол на 6-трет-бутил-1H-индазол на стадии 3. MS: (M+Na)+=481; т.пл. = 220-240°С; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 12.88 (br. s., 1H), 9.13 (s, 1H), 8.53 (d, J=9,1 Гц, 1H), 8.43-8.51 (m, 2H), 7.22 (d, J=2,0 Гц, 1H), 6.88 (dd, J=8,8; 2,8 Гц, 1H), 4.50-4.78 (m, 3H), 4.22 (td, J=9,5; 5,3 Гц, 1H), 4.14 (s, 3H), 4.05-4.12 (m, 1H), 3.91 (s, 3H), 3.81-3.90 (m, 1H), 1.42 (t, J=6,3 Гц, 3H).
Пример 85
2-(6-Хлор-1-этил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
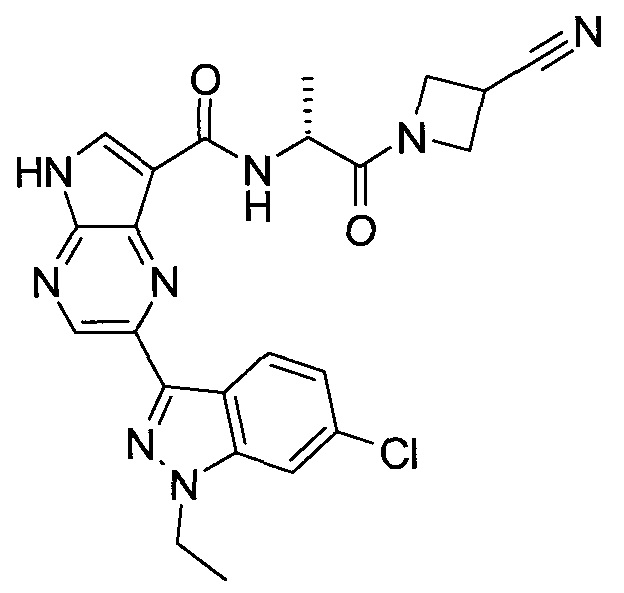
Стадия 1
6-Хлор-1-этил-3-иод-1H-индазол
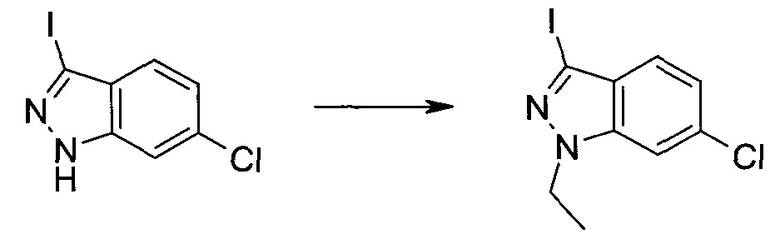
К раствору 6-хлор-3-иод-1H-индазола (913 мг; 3,28 ммоль) в THF (12 мл) при 0°С добавляли KOtBu (429 мг; 3,82 ммоль). Реакционную смесь перемешивали при 0°С в течение 30 мин, затем добавляли иодэтан (0,37 мл; 4,6 ммоль). Перемешивали при 0°С в течение 30 мин, затем нагревали до комнатной температуры и перемешивали в течение 48 часов. Реакцию гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток очищали хроматографией на силикагеле с использованием 10%-50% EtOAc/гептан, получая 622 мг (62%) 6-хлор-1-этил-3-иод-1H-индазола в виде белого порошка. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.37-7.43 (m, 2H), 7.17 (dd, J=8,7; 1,1 Гц, 1H),4.41 (q, J=7,2 Гц, 2H), 1.51 (t, J=7,2 Гц, 3H). Также выделяли 174 мг (17%) 6-хлор-2-этил-3-иод-2H-индазола в виде более полярного минорного региоизомера. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.66-7.70 (m, 1H), 7.35 (d, J=9,1 Гц, 1H), 7.04-7.12 (m, 1H), 4.56 (q, J=7,2 Гц, 2H), 1.58 (t, J=7,2 Гц, 3H).
Стадия 2
6-Хлор-1-этил-3-трибутилстаннанил-1H-индазол
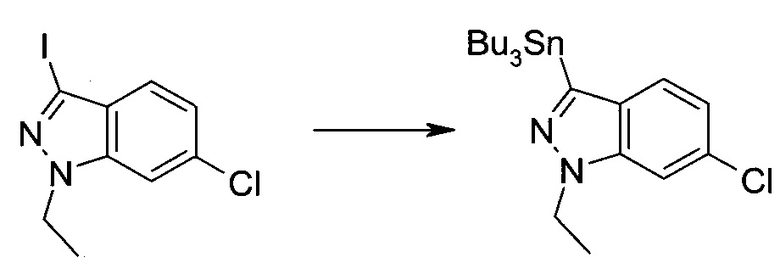
К раствору 6-хлор-1-этил-3-иод-1H-индазола (150 мг; 0,47 ммоль) в THF (3 мл) при 0°С медленно добавляли хлорид изопропилмагния (2,0 М в THF; 0,28 мл; 0,56 ммоль). Ярко-желтую гетерогенную реакционную смесь перемешивали при 0°С в течение 20 мин, затем по каплям добавляли трибутилхлорстаннан (0,15 мл; 0,56 ммоль). Перемешивание продолжали при 0°С в течение 20 мин, затем при комнатной температуре в течение 2 ч. Реакционную смесь гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали рассолом, затем сушили над MgSO4 и концентрировали. Точно такую же реакцию повторяли еще раз в таком же масштабе. Остатки с этих двух прогонов объединяли и очищали хроматографией на силикагеле с использованием 10%-50% EtOAc/гептан (0,5% Et3N), получая 128 мг (29%) 6-хлор-1-этил-3-трибутилстаннанил-1H-индазола в виде бесцветного масла.
Стадия 3
2-(6-Хлор-1-этил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
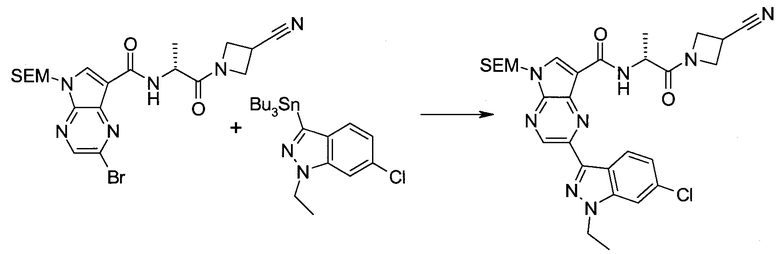
К раствору 6-хлор-1-этил-3-трибутилстаннил-1H-индазол (125 мг; 0,27 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (125 мг; 0,25 ммоль) в DMF (1,5 мл) добавляли Pd(PPh3)4 (14 мг; 0,012 ммоль) и иодид меди(I) (9 мг; 0,05 ммоль). Желтую реакционную смесь продували аргоном, затем нагревали при 80°С в течение 0,5 ч, после чего охлаждали до комнатной температуры, гасили насыщ. NH4Cl и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток
очищали хроматографией на силикагеле с использованием 50%-100% EtOAc/гептан, получая 156 мг 2-(6-хлор-1-этил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде вязкого бесцветного масла.
Стадия 4
2-(6-Хлор-1-этил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
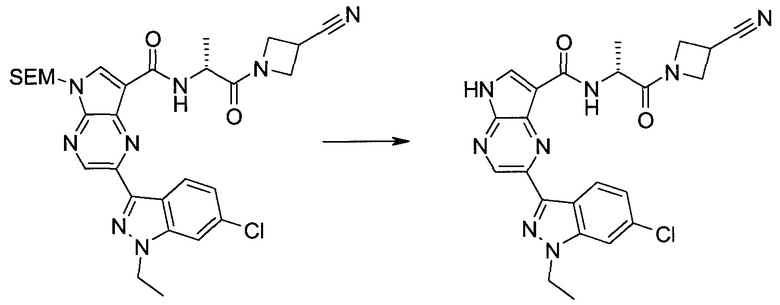
К раствору 2-(6-хлор-1-этил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (150 мг; 0,25 ммоль) в CH2Cl2 (2 мл) добавляли TFA (0,75 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч, затем концентрировали. Остаток снова растворяли в смеси 10:90:0,5 MeOH/CH2Cl2/NH4OH (3 мл) и перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали и остаток очищали хроматографией на силикагеле с использованием 0%-5% MeOH/EtOAc, затем растирали с использованием MeOH, получая 88 мг (75%) 2-(6-хлор-1-этил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде белого порошка. MS: (M+Na)+=499; т.пл. = 248-255°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.92 (br. s., 1H), 9.14 (s, 1H), 8.71 (d, J=8,7 Гц, 1H), 8.47 (dd, J=7,6; 3,4 Гц, 2H), 8.02 (s, 1H), 7.25 (d, J=8,7 Гц, 1H), 4.48-4.79 (m, 5H), 4.04-4.28 (m, 2H), 3.77-3.92 (m, 1H), 1.47 (t, J=7,2 Гц, 3H), 1.39 (dd, J=6,8; 4,5 Гц, 3H).
Пример 86
2-(6,7-Дифтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
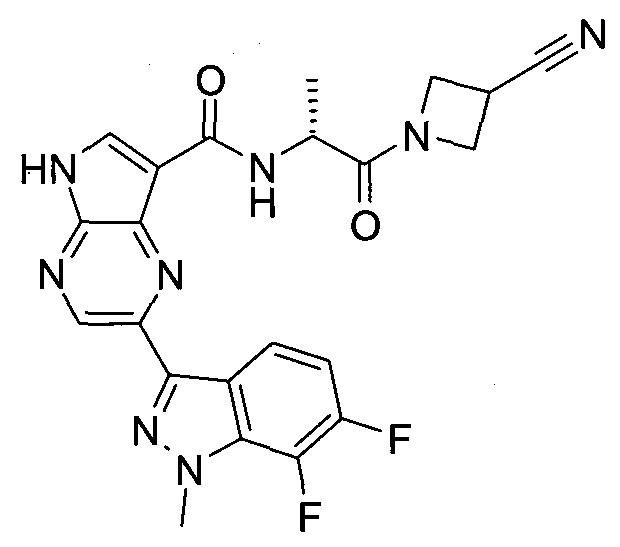
Стадия 1
6,7-Дифтор-1H-индазол

Во флаконе для микроволнового реактора растворяли 2,3,4-трифторбензальдегид (1,5 г; 9,4 ммоль) в 1,4-диоксане (6 мл) и добавляли гидразин (6 мл; 191 ммоль). Флакон герметично закрывали и нагревали облучением микроволнами при 150°С в течение 30 мин. Реакцию гасили водой и экстрагировали EtOAc. Органический слой промывали рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 20%-50% EtOAc/гептан, получая 664 мг (46%) 6,7-дифтор-1H-индазола в виде светло-коричневого порошка. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.10 (d, J=3,4 Гц, 1H), 7.47 (dd, J=8,9; 4,0 Гц, 1H), 7.05 (ddd, J=10,6; 8,9; 6,6 Гц, 1H).
Стадия 2
2-(6,7-Дифтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
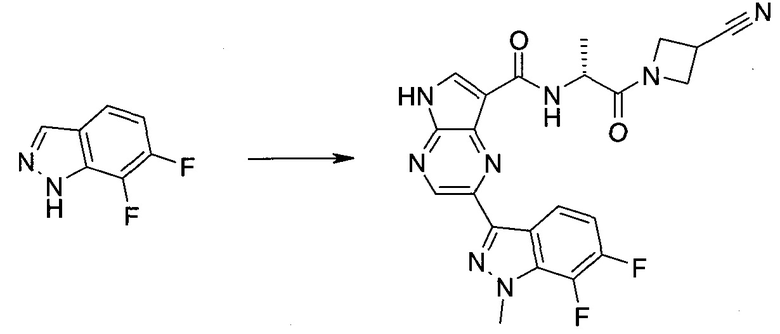
Получали в соответствии с методикой, приведенной в примере 81, стадии 3-7, заменяя 6,7-дифтор-1H-индазол на 6-трет-бутил-1H-индазол на стадии 3. MS: (M+Na)+=487; т.пл. = 240-250°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.92
(s, 1H), 9.11 (s, 1H), 8.53 (dd, J=9,1; 4,2 Гц, 1H), 8.48 (d, J=6,8 Гц, 1H), 8.38 (d, J=7,6 Гц, 1H), 7.18-7.33 (m, 1H), 4.48-4.78 (m, 3H), 4.28 (s, 3H), 4.16-4.26 (m, 1H), 4.05-4.14 (m, 1H), 3.84 (dd, J=9,3; 5,1 Гц, 1H), 1.38 (t, J=5,9 Гц, 3H).
Пример 87
2-(6-Этил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
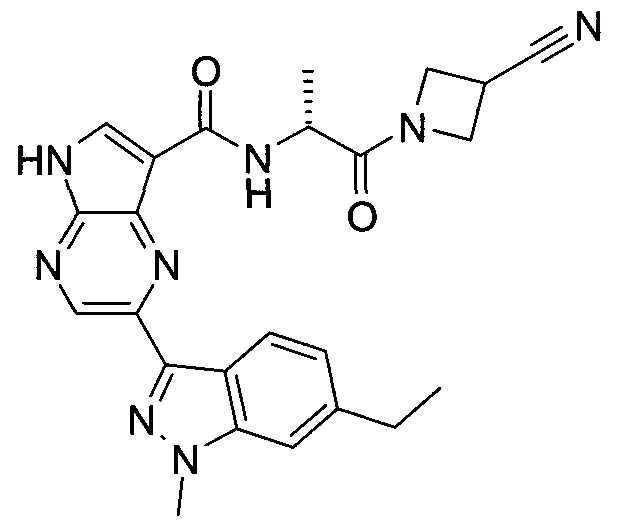
Стадия 1
6-Винил-1H-индазол
К суспензии 6-бром-1H-индазола (600 мг; 3,05 ммоль) в толуоле (18 мл) и 1,2-диметоксиэтане (6 мл) добавляли трибутил(винил)олово (1,33 мл; 4,57 ммоль) и PdCl2(PPh3)2 (214 мг; 0,31 ммоль). Реакционную смесь продували аргоном, затем нагревали при температуре дефлегмации в течение 3 ч. Добавляли дополнительное количество трибутил(винил)олова (0,66 мл; 2,28 ммоль) и PdCl2(PPh3)2 (107 мг; 0,15 ммоль) и нагревание продолжали в течение 1 ч. Проводили аналогичную реакцию с дополнительной партией 6-бром-1H-индазола (200 мг; 1,02 ммоль) и эти две неочищенные партии объединяли. Реакционные смеси разбавляли этилацетатом, промывали водой и рассолом, сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 5%-50% EtOAc/гептан, получая 350 мг (60%) 6-винил-1H-индазола в виде желтого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.07 (s, 1H), 7.72 (d, J=8,3 Гц, 1H), 7.48 (s, 1H), 7.35 (d, J=8,3 Гц, 1H), 6.85 (dd, J=17.4, 11,0 Гц, 1H), 5.86 (d, J=17,4 Гц, 1H), 5.35 (d, J=11,0 Гц, 1H).
Стадия 2
6-Этил-1H-индазол
К раствору 6-винил-1H-индазола (350 мг; 2,42 ммоль) в MeOH (24 мл) добавляли 10%-ный Pd на угле (влажный; 443 мг). Реакционную смесь перемешивали в атмосфере водорода (баллон) в течение 2,5 ч, затем фильтровали через целит, промывая EtOAc. Фильтрат концентрировали, получая 305 мг (86%) 6-этил-1H-индазола в виде белого полутвердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.04 (s, 1H), 7.67 (d, J=8,3 Гц, 1H), 7.32 (s, 1H), 7.06 (d, J=8,3 Гц, 1H), 2.80 (q, J=7,6 Гц, 2H), 1.31 (t, J=7,6 Гц, 3H).
Стадия 3
2-(6-Этил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
Получали в соответствии с методикой, приведенной в примере 81, стадии 3-7, заменяя 6-этил-1H-индазол на 6-трет-бутил-1H-индазол на стадии 3. MS: (M+Na)+=479; т.пл. = 185-190°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.87 (br. s., 1H), 9.13 (s, 1H), 8.50-8.58 (m, 2H), 8.41-8.49 (m, 2H), 7.54 (s, 1H), 7.15 (dd, J=8,3; 3,0 Гц, 1H), 4.63-4.80 (m, 2H), 4.44-4.63 (m, 2H), 4.00-4.28 (m, 4H), 3.74-3.94 (m, 1H), 2.80 (q, J=7,6 Гц, 2H), 1.43 (dd, J=6,8; 4,2 Гц, 3H), 1.29 (t, J=7,6 Гц, 3H).
Пример 88
2-(4,6-Дифтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
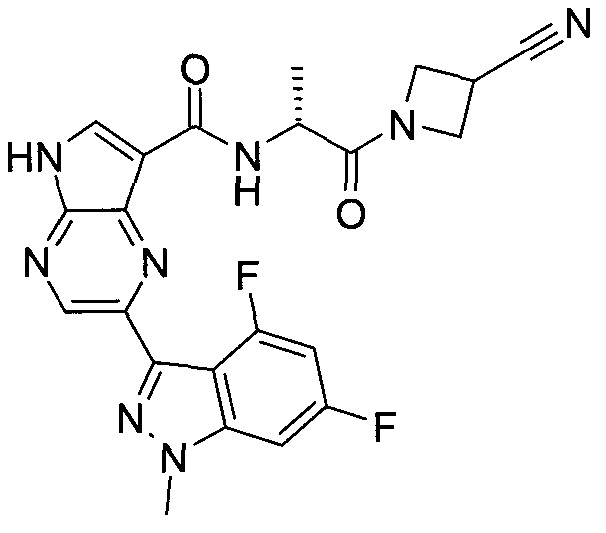
Стадия 1
4,6-Дифтор-1H-индазол
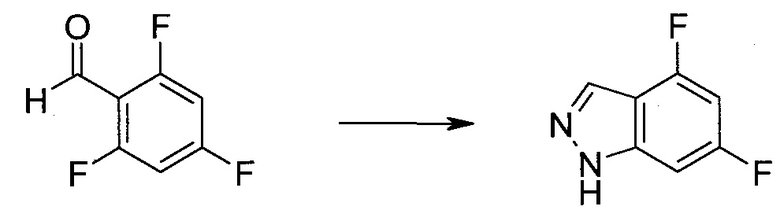
К раствору 2,4,6-трифторбензальдегида (0,80 г; 5,0 ммоль) в 1,2-диметоксиэтане (10 мл) добавляли карбонат калия (1,04 г; 7,5 ммоль) и O-метил-гидроксиламина гидрохлорид (438 мг; 5,25 ммоль). Реакционную смесь нагревали при 50°С в течение 5 ч, затем охлаждали до комнатной температуры и фильтровали, промывая дихлорметаном. Фильтрат концентрировали. Остаток растворяли в 1,2-диметоксиэтане (10 мл) и добавляли гидразин (0,17 мл; 5,5 ммоль). Реакционную смесь нагревали при 100°С в течение 1,5 ч. Добавляли дополнительное количество гидразина (0,17 мл; 5,5 ммоль) и нагревание продолжали в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры, выливали в воду и экстрагировали этилацетатом. Органический слой промывали насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 20%-50% EtOAc/гептан, получая 358 мг (47%) 4,6-дифтор-1H-индазола в виде светло-желтого твердого вещества. 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 13.47 (br. s., 1H), 8.19 (s, 1H), 7.22 (d, J=9,1 Гц, 1H), 6.96 (td, J=10,0; 1,9 Гц, 1H).
Стадия 2
2-(4,6-Дифтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
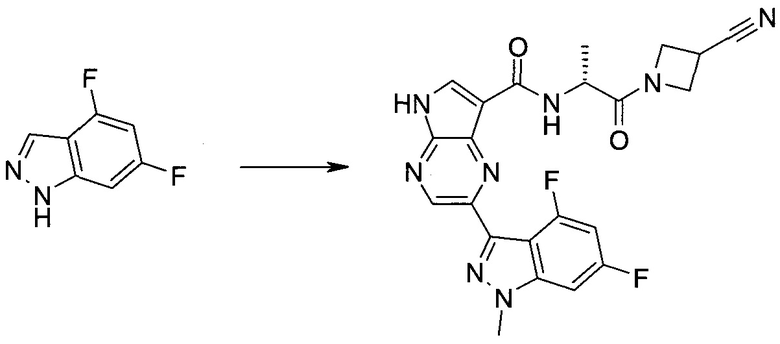
Получали в соответствии с методикой, приведенной в примере 81, стадии 3-7, заменяя 4,6-дифтор-1H-индазол на 6-трет-бутил-1H-индазол на стадии 3. MS: (M+Na)+=487; т.пл. = 235-265°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.94 (br. s., 1H), 8.99 (s, 1H), 8.54 (d, J=7,2 Гц, 1H), 8.47 (dd, J=10,8; 3,2 Гц, 1H), 7.55-7.63 (m, 1H), 7.09 (t, J=10,2 Гц, 1H), 4.40-4.68 (m, 3H), 4.15 (s, 3H), 4.08-4.17 (m, 1H), 3.93-4.03 (m, 1H), 3.73-3.86 (m, 1H), 1.35 (t, J=5,7 Гц, 3H).
Пример 89
2-(1,6-Диметил-1H-пиразоло[3,4-b]пиридин-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
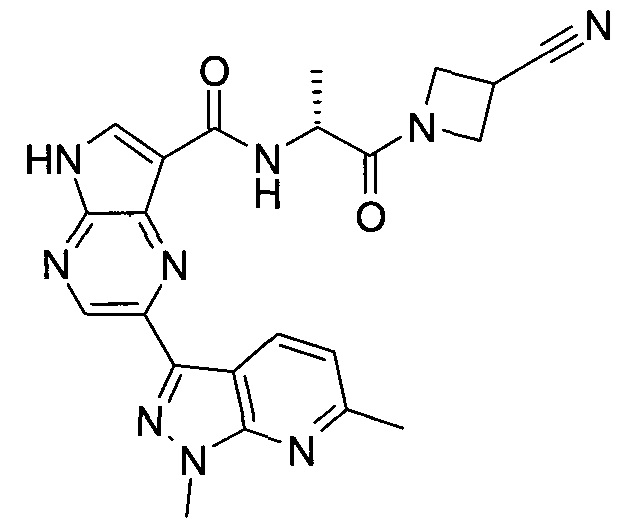
Стадия 1
2-Хлор-6-метилпиридин-3-карбальдегид
К раствору 2-хлор-6-метилникотинонитрила (2,0 г; 13,1 ммоль) в дихлорметане (40 мл) при -78°С по каплям добавляли DIBAL-H (2,92 мл; 16,4 ммоль). Реакционную смесь перемешивали при -78°С в течение 5 мин, затем оставляли нагреваться до комнатной температуры и перемешивали в течение 6 ч. Реакция осторожно гасили, используя 1 н. HCl (40 мл), и смесь нагревали при температуре дефлегмации в течение 30 мин. После охлаждения реакционную смесь подщелачивали водным 10%-ным NaOH и экстрагировали EtOAc (3×). Объединенные органические экстракты промывали рассолом, затем сушили над MgSO4 и концентрировали, получая 1,98 г (97%) 2-хлор-6-метилпиридин-3-карбальдегида в виде светло-желтого твердого вещества.
Стадия 2
6-Метил-1H-пиразоло[3,4-b]пиридин

Во флаконе для микроволнового реактора растворяли 2-хлор-6-метилпиридин-3-карбальдегид (1,98 г; 12,7 ммоль) в 1,4-диоксане (12 мл) и добавляли гидразин (6,0 мл; 191 ммоль). Флакон герметично закрывали и нагревали облучением микроволнами при 150°С в течение 1 ч. Реакцию гасили водой и экстрагировали EtOAc. Органический слой промывали рассолом, затем
сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 50%-100% EtOAc/гептан, получая 863 мг (41%) 6-метил-1H-пиразоло[3,4-b]пиридина в виде светло-желтого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.06 (s, 1H), 8.03 (d, J=8,3 Гц, 1H), 7.07 (d, J=8,3 Гц, 1H), 2.79 (8, 3H).
Стадия 3
2-(1,6-Диметил-1H-пиразоло[3,4-b]пиридин-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
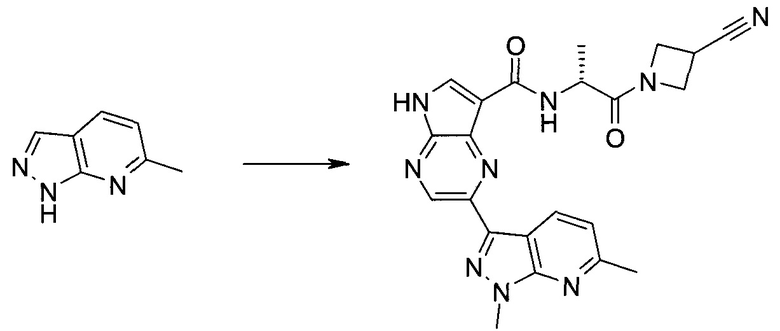
Получали в соответствии с методикой, приведенной в примере 81, стадии 3-7, заменяя 6-метил-1H-пиразоло[3,4-b]пиридин на 6-трет-бутил-1H-индазол на стадии 3. MS: (M+Na)+=466; т.пл. = 275-285°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.92 (br. s., 1H), 9.14 (s, 1H), 8.98 (d, J=8,3 Гц, 1H), 8.47 (d, J=6,4 Гц, 2H), 7.22 (dd, J=8,3; 3,4 Гц, 1H), 4.46-4.80 (m, 3H), 4.17-4.30 (m, 1H), 4.13 (s, 3H), 4.07-4.15 (m, 1H), 3.77-3.93 (m, 1H), 2.66 (s, 3H), 1.31-1.48 (m, 3H).
Пример 90
2-[6-Хлор-1-(2-гидрокси-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
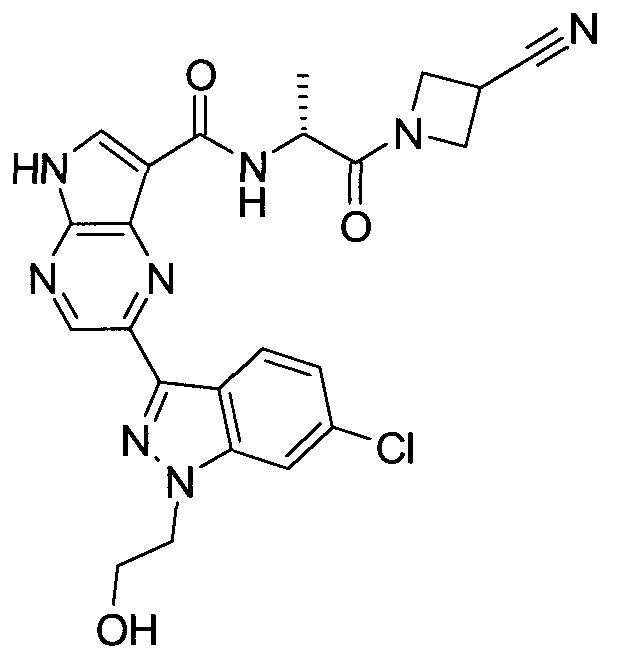
Стадия 1
2-{6-Хлор-1-[2-(тетрагидро-пиран-2-илокси)-этил]-1H-индазол-3-ил}-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
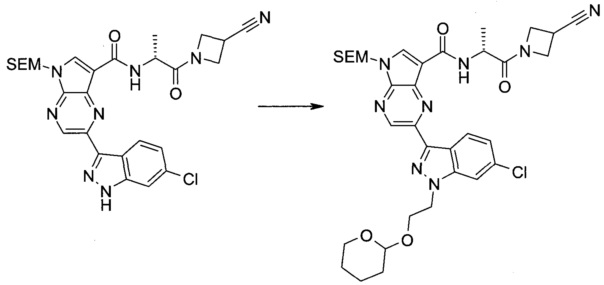
В круглодонной колбе растворяли 2-(6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (см. пример 23; 120 мг; 0,21 ммоль) в DMF (1,3 мл). Реакционную смесь охлаждали до 0°С и добавляли гидрид натрия (60%-ную дисперсию в минеральном масле; 10 мг; 0,25 ммоль). Реакционную смесь перемешивали при 0°С в течение 30 мин, затем добавляли 2-(2-бромэтокси)тетрагидро-2H-пиран (47 мкл; 0,31 ммоль). Реакционную смесь перемешивали при 0°С в течение 1 ч и затем при комнатной температуре в течение 4 ч. Реакционную смесь гасили водой и экстрагировали этилацетатом (2×). Объединенные органические слои промывали водой, насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Остаток хроматографировали на силикагеле с использованием 50%-100% EtOAc/гептан, получая 138 мг (94%) 2-{6-хлор-1-[2-(тетрагидро-пиран-2-илокси)-этил]-1H-индазол-3-ил}-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде вязкого желтого масла.
Стадия 2
2-[6-Хлор-1-(2-гидрокси-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
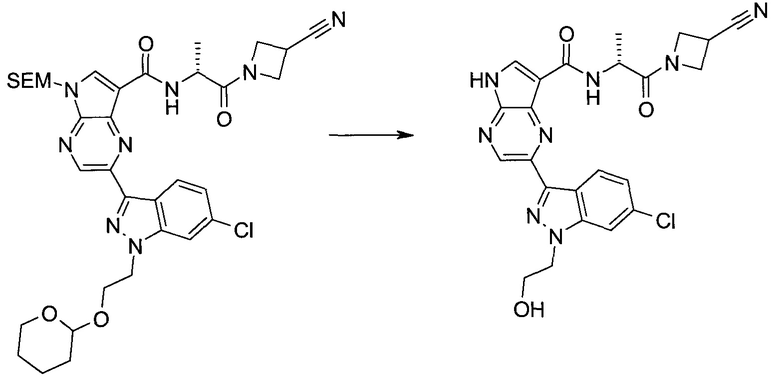
К раствору 2-{6-хлор-1-[2-(тетрагидро-пиран-2-илокси)-этил]-1H-индазол-3-ил}-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (138 мг; 0,20 ммоль) в CH2Cl2 (2 мл) добавляли TFA (0,75 мл). Реакционную смесь перемешивали при комнатной температуре в течение 6 ч, затем концентрировали. Остаток снова растворяли в смеси 10:90:0,5 MeOH/CH2Cl2/NH4OH (3 мл) и перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали и остаток очищали хроматографией на силикагеле с использованием 0%-10% MeOH/CH2Cl2, получая 63 мг (65%) 2-[6-хлор-1-(2-гидрокси-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде белого твердого вещества. MS: (M+Na)+=515; т.пл. = 225-250°C; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.92 (br. s., 1H), 9.14 (s, 1H), 8.69 (d, J=8,7 Гц, 1H), 8.47 (d, J=7,2 Гц, 2H), 7.95 (d, J=1,5 Гц, 1H), 7.24 (d, J=8,7 Гц, 1H), 4.92 (t, J=5,5 Гц, 1H), 4.49-4.78 (m, 5H), 4.17-4.27 (m, 1H), 4.05-4.15 (m, 1H), 3.83-3.93 (m, 3H), 1.39 (dd, J=6,6; 4,7 Гц, 3H).
Пример 91
2-(6-Хлор-1-изопропил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
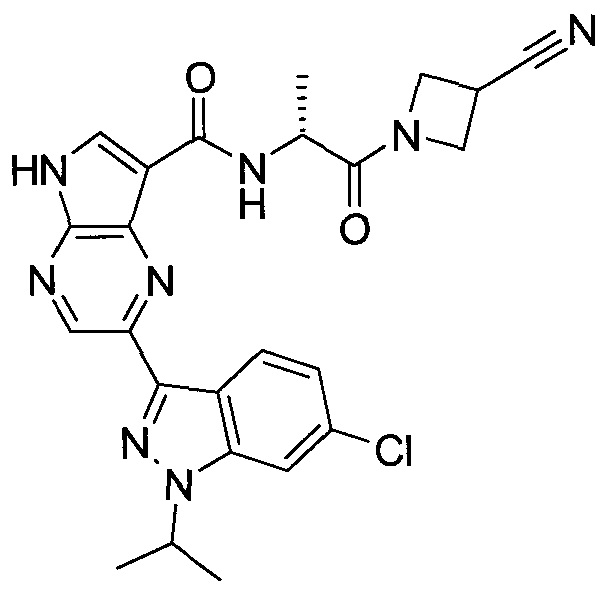
Получали в соответствии с методикой, приведенной в примере 90, заменяя 2-бромпропан на 2-(2-бромэтокси)тетрагидро-2H-пиран на стадии 1. MS: (M+H)+=491; т.пл. = 204-208°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.91 (br. s., 1H), 9.16 (s, 1H), 8.70 (d, J=8,3 Гц, 1H), 8.47 (dd, J=7,6; 2,6 Гц, 2H), 8.03 (d, J=1,1 Гц, 1H), 7.19-7.29 (m, 1H), 5.14 (quin, J=6,6 Гц, 1H), 4.46-4.79 (m, 3H), 4.15-4.27 (m, 1H), 4.03-4.14 (m, 1H), 3.78-3.92 (m, 1H), 1.56 (dd, J=6,6; 3,0 Гц, 6H), 1.39 (dd, J=6,6; 4,7 Гц, 3H).
Пример 92
2-[6-Хлор-1-пропил-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
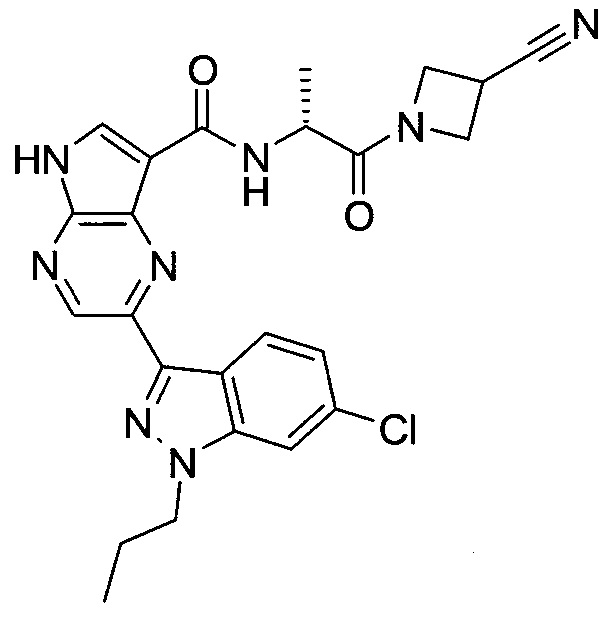
Стадия 1
2-(1-Аллил-6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
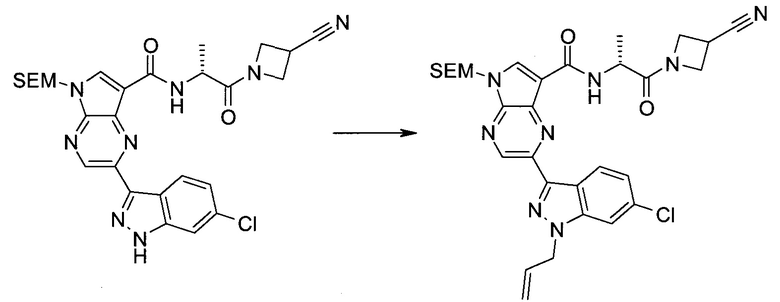
В круглодонной колбе растворяли 2-(6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (см. пример 23; 396 мг; 0,68 ммоль) в DMF (4,5 мл). Реакционную смесь охлаждали до 0°С и добавляли гидрид натрия (60%-ную дисперсию в минеральном масле; 33 мг; 0,83 ммоль). Реакционную смесь перемешивали при 0°С в течение 20 мин, затем добавляли
аллилбромид (65 мкл; 0,75 ммоль). Реакционную смесь перемешивали при 0°С в течение 20 мин и затем при комнатной температуре в течение 1 ч. Реакционную смесь гасили водой и экстрагировали этилацетатом (2×). Объединенные органические слои промывали водой, насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Остаток хроматографировали на силикагеле с использованием 50%-100% EtOAc/гептан, получая 388 мг (92%) 2-(1-аллил-6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде светло-желтой пены.
Стадия 2
2-(6-Хлор-1-пропил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
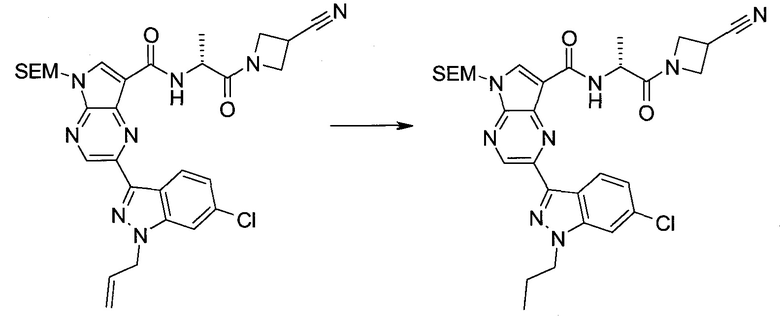
К раствору 2-(1-аллил-6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (50 мг; 0,08 ммоль) в MeOH (6 мл) добавляли 10%-ный Pd на угле (влажный; 17 мг). Реакционную смесь перемешивали в атмосфере водорода (баллон) в течение 1,5 ч, затем фильтровали через целит, промывая EtOAc. Фильтрат концентрировали и остаток очищали хроматографией на силикагеле с использованием 50%-100% EtOAc/гептан, получая 38 мг (76%) 2-(6-хлор-1-пропил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде вязкого бесцветного масла.
Стадия 3
2-[6-Хлор-1-пропил-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
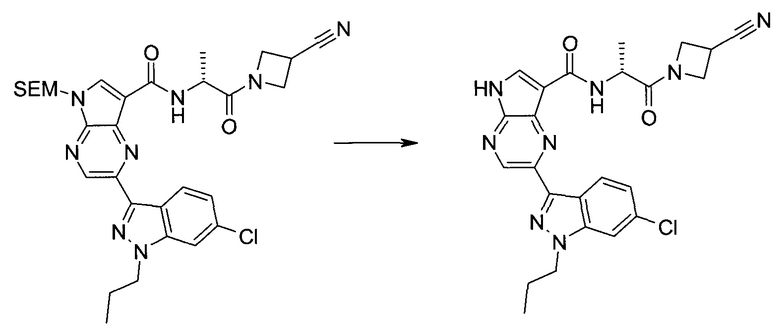
К раствору 2-(6-хлор-1-пропил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (38 мг; 0,06 ммоль) в CH2Cl2 (1,5 мл) добавляли TFA (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в смеси 10:90:0,5 MeOH/CH2Cl2/NH4OH (3 мл) и перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали и остаток очищали хроматографией на силикагеле с использованием 0%-10% MeOH/CH2Cl2, получая 10 мг (32%) 2-[6-хлор-1-пропил-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде белого твердого вещества. MS: (M+Na)+=513; т.пл. = 219-221°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.93 (s, 1H), 9.13 (s, 1H), 8.71 (d,J=9,1 Гц, 1H), 8.46 (dd, J=7,6; 2,6 Гц, 2H), 8.03 (s, 1H), 7.25 (d, J=9,1 Гц, 1H), 4.43-4.78 (m, 5H), 4.16-4.27 (m, 1H), 4.05-4.13(m, 1H), 3.78-3.91 (m, 1H), 1.86-1.96 (m, 2H), 1.39 (dd, J=6,6; 4,3 Гц, 3H), 0.89 (t, J=7,4 Гц, 3H).
Пример 93
2-(6-Хлор-1-цианометил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
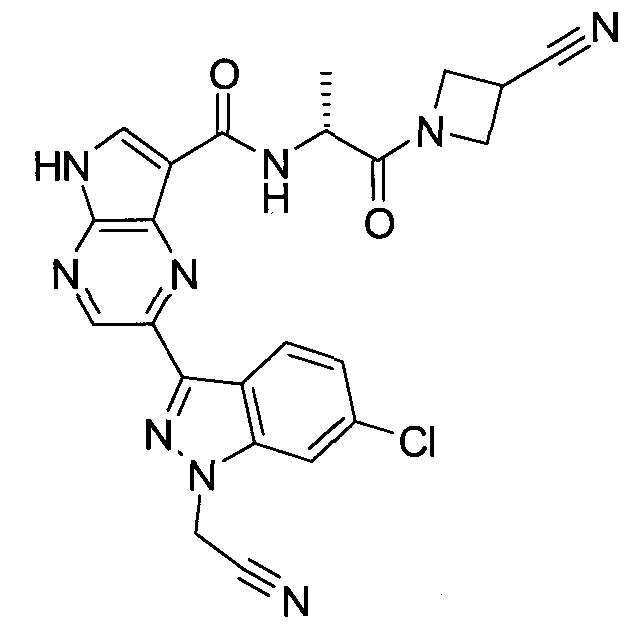
Получали в соответствии с методикой, приведенной в примере 90, заменяя 2-иодацетонитрил на 2-(2-бромэтокси)тетрагидро-2H-пиран на стадии 1.
MS: (M+Na)+=510; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 13.00 (br. s., 1H), 9.14 (s, 1H), 8.79 (dd, J=8,7; 2,3 Гц, 1H), 8.52 (d, J=6,4 Гц, 1H), 8.42 (d, J=7,9 Гц, 1H), 8.15 (s, 1H), 7.36 (d, J=9,1 Гц, 1H), 5.94 (s, 2H), 4.48-4.78 (m, 3H), 4.17-4.28 (m, 1H), 4.06-4.15 (m, 1H), 3.80-3.89 (m, 1H), 1.33-1.44 (m, 3H).
Пример 94
2-[6-Хлор-1-(2,3-дигидрокси-пропил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
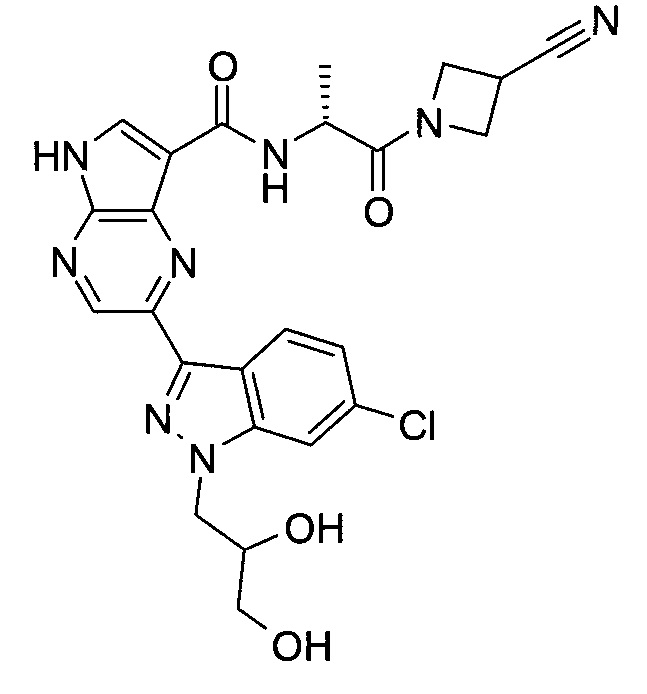
Стадия 1
Метансульфоновой кислоты 2,2-диметил-[1,3]диоксолан-4-илметиловый эфир
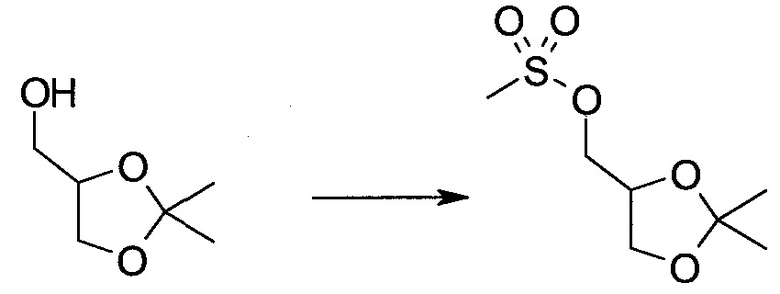
К раствору (2,2-диметил-[1,3]диоксолан-4-ил)-метанола (1,25 г; 9,46 ммоль) и триэтиламина (9,2 мл; 66,2 ммоль) в дихлорметане (60 мл) при 0°С медленно добавляли метансульфонилхлорид (2,2 мл; 28,4 ммоль). Реакционную смесь перемешивали при 0°С в течение 2 ч, затем гасили водой и водный слой экстрагировали дихлорметаном. Объединенные органические экстракты промывали 10%-ной лимонной кислотой, насыщ. NaHCO3 и рассолом, затем сушили над MgSO4 и концентрировали, получая метансульфоновой кислоты 2,2-диметил-[1,3]диоксолан-4-илметиловый эфир в виде светло-коричневого масла, которое использовали без дополнительной очистки.
Стадия 2
2-[6-Хлор-1-(2,2-диметил-[1,3]диоксолан-4-илметил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
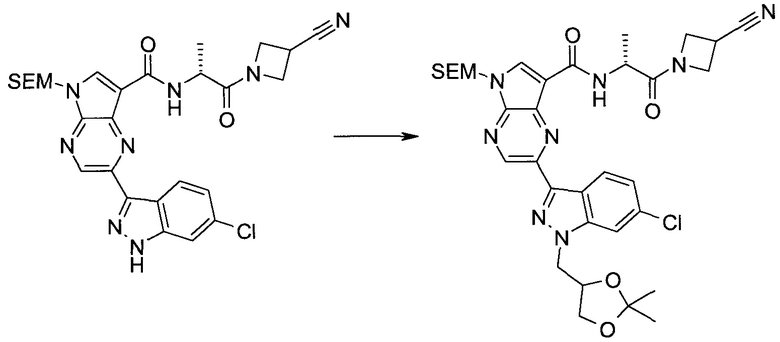
В круглодонной колбе растворяли 2-(6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (см. пример 23; 120 мг; 0,21 ммоль) в DMF (1,3 мл). Реакционную смесь охлаждали до 0°С и добавляли гидрид натрия (60%-ную дисперсию в минеральном масле; 12 мг; 0,31 ммоль). Реакционную смесь перемешивали при 0°С в течение 30 мин, затем добавляли раствор метансульфоновой кислоты 2,2-диметил-[1,3]диоксолан-4-илметилового эфира (131 мг; 0,62 ммоль) в DMF (0,5 мл). Реакционную смесь перемешивали при 0°С в течение 1 ч и затем при комнатной температуре в течение 48 часов. Реакционную смесь гасили водой и экстрагировали этилацетатом (2×). Объединенные органические слои промывали водой, насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали, получая 2-[6-хлор-1-(2,2-диметил-[1,3]диоксолан-4-илметил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид в виде светло-коричневого вязкого масла, которое использовали без дополнительной очистки.
Стадия 3
2-[6-Хлор-1-(2,3-дигидрокси-пропил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
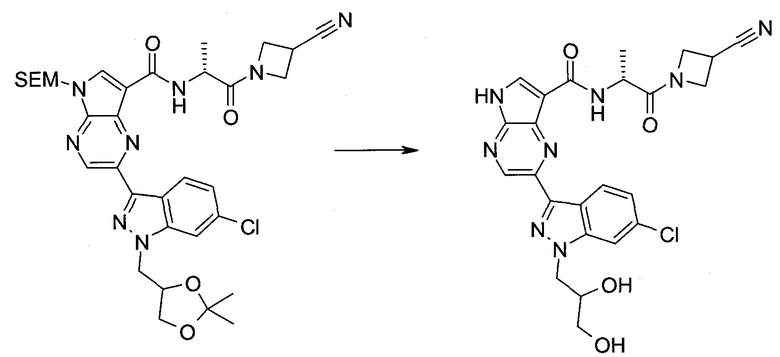
К раствору 2-[6-хлор-1-(2,2-диметил-[1,3]диоксолан-4-илметил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (неочищенного со стадии 2) в CH2Cl2 (3 мл) добавляли TFA (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 48 часов, затем концентрировали. Остаток снова растворяли в смеси 10:90:0,5 MeOH/CH2Cl2/NH4OH (3 мл) и перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали и остаток очищали хроматографией на силикагеле с использованием 0%-10% MeOH/CH2Cl2, получая 22 мг (20%, 2 стадии) 2-[6-хлор-1-(2,3-дигидрокси-пропил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде белого твердого вещества. MS: (M+Na)+=545; т.пл. = 165-180°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 9.14 (s, 1H), 8.69 (d, J=8,7 Гц, 1H), 8.47 (d, J=7,6 Гц, 2H), 7.91 (s, 1H), 7.23 (d, J=6,8 Гц, 1H), 5.15 (d, J=5,3 Гц, 1H), 5.03 (dd, J=5,3; 3,0 Гц, 1H), 4.84 (t, J=5,5 Гц, 1H), 4.35-4.80 (m, 5H), 4.18-4.26 (m, 1H), 3.93-4.15 (m, 2H), 3.79-3.90 (m, 1H), 3.34-3.49 (m, 2H), 1.33-1.45 (m, 3H).
Пример 95
2-[6-Хлор-1-(2-гидрокси-пропил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
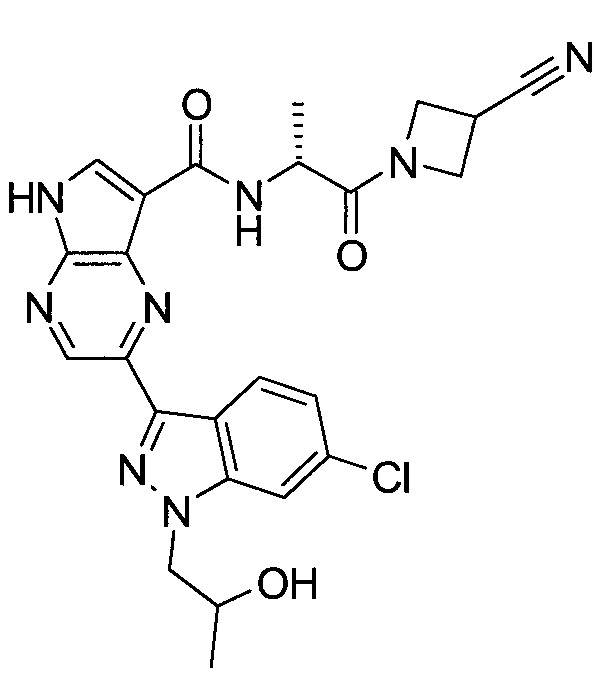
Стадия 1
2-(2-Бром-1-метил-этокси)-тетрагидро-2H-пиран
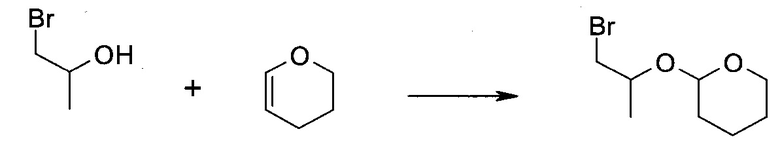
К раствору 1-бромпропан-2-ола (1,25 г; 9,0 ммоль) и 3,4-дигидро-2H-пирана (2,04 мл; 22,5 ммоль) в дихлорметане (50 мл) при 0°С добавляли п-толуол-сульфоновой кислоты моногидрат (85 мг; 0,45 ммоль). Реакционную смесь перемешивали при 0°С в течение 15 мин, затем нагревали до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь разбавляли EtOAc и промывали водой, насыщ. NaHCO3 и рассолом, затем сушили над MgSO4 и концентрировали, получая 2-(2-бром-1-метил-этокси)-тетрагидро-2H-пиран в виде светло-коричневого масла, которое использовали без дополнительной очистки.
Стадия 2
2-[6-Хлор-1-(2-гидрокси-пропил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
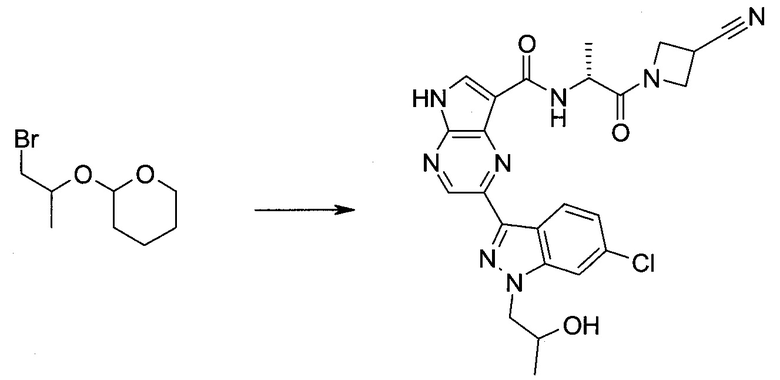
Получали в соответствии с методикой, приведенной в примере 90, заменяя 2-(2-бром-1-метил-этокси)-тетрагидро-2H-пиран на 2-(2-бромэтокси)тетрагидро-2H-пиран на стадии 1. MS: (M+Na)+=529; т.пл. = 160-165°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.91 (br. s., 1H), 9.13 (s, 1H), 8.69 (d, J=8,7 Гц, 1H), 8.47 (d, J=7,6 Гц, 2H), 7.95 (s, 1H), 7.17-7.27 (m, 1H), 4.93 (dd, J=5,1; 2,8 Гц, 1H), 4.49-4.78 (m, 3H), 4.42 (d, J=6,0 Гц, 2H), 4.06-4.27 (m, 3H), 3.80-3.87 (m, 1H), 1.39 (dd, J=6,6; 4,7 Гц, 3H), 1.11-1.21 (m, 3H).
Пример 96
2-[6-Хлор-1-(3-гидрокси-пропил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
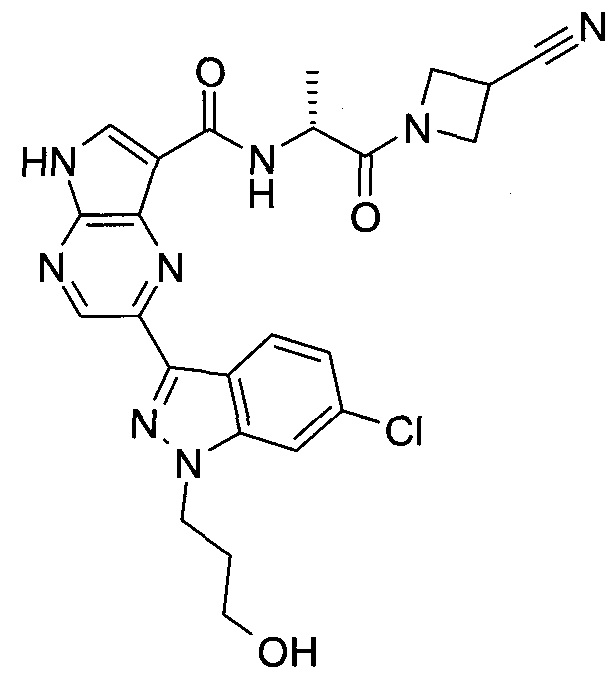
Стадия 1
2-(3-Бромпропокси)-тетрагидро-2H-пиран
К раствору 3-бромпропан-1-ола (1,25 г; 9,0 ммоль) и 3,4-дигидро-2H-пирана (2,04 мл; 22,5 ммоль) в дихлорметане (50 мл) при 0°С добавляли п-толуол-сульфоновой кислоты моногидрат (85 мг; 0,45 ммоль). Реакционную смесь перемешивали при 0°С в течение 15 мин, затем нагревали до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь разбавляли EtOAc и промывали водой, насыщ. NaHCO3 и рассолом, затем сушили над MgSO4 и концентрировали, получая 2-(3-бромпропокси)-тетрагидро-2H-пиран в виде светло-коричневого масла, которое использовали без дополнительной очистки.
Стадия 2
2-[6-Хлор-1-(3-гидрокси-пропил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
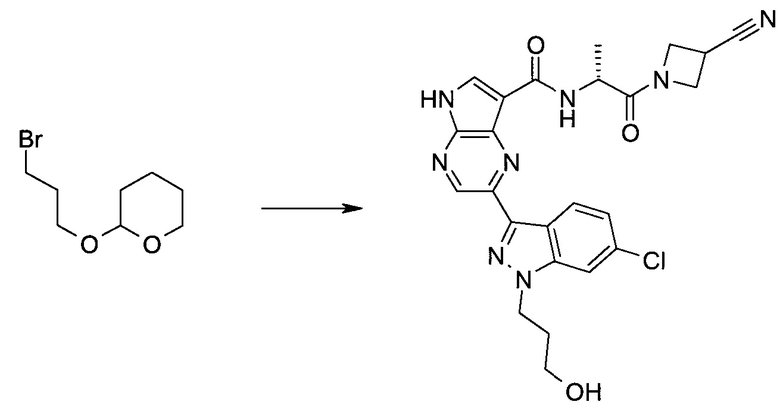
Получали в соответствии с методикой, приведенной в примере 90, заменяя 2-(3-бромпропокси)-тетрагидро-2H-пиран на 2-(2-бромэтокси)тетрагидро-2H-пиран на стадии 1. MS: (M+Na)+=529; т.пл. = 240-250°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.92 (br. s., 1H), 9.14 (s, 1H), 8.71 (d, J=9,1 Гц, 1H), 8.47 (dd, J=7,4; 4,0 Гц, 2H), 7.96 (d, J=1,5 Гц, 1H), 7.20-7.30 (m, 1H), 4.49-4.79 (m, 6H), 4.17-4.28 (m, 1H), 4.04-4.14 (m, 1H), 3.78-3.89 (m, 1H), 3.44 (q, J=5,9 Гц, 2H), 2.05 (t, J=6,6 Гц, 2H), 1.39 (dd, J=6,8; 4,5 Гц, 3H).
Пример 97
2-(4,6-Дихлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
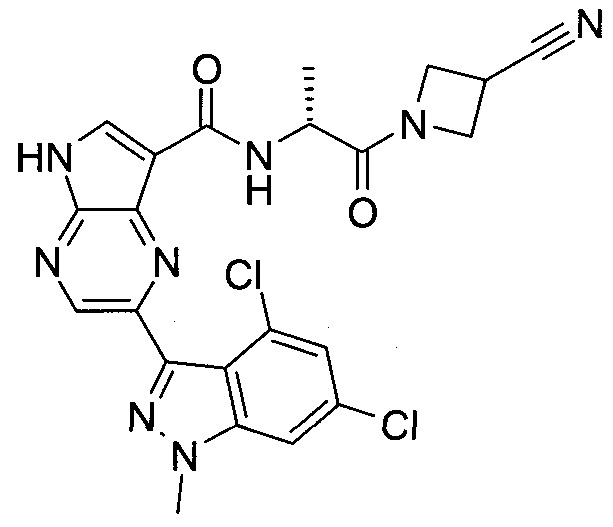
Стадия 1
2,4,6-Трихлорбензальдегид
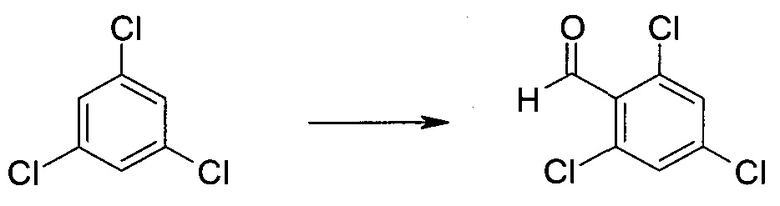
2,4,6-Трихлорбензальдегид получали в соответствии с методикой, приведенной в Synthesis, 2008, 279. К раствору 1,3,5-трихлорбензола (10,0 г;
55,1 ммоль) в THF (200 мл) при -78°С медленно в течение 20 мин добавляли н-BuLi (1,6 М в гексанах; 34,4 мл; 55,1 ммоль). Реакционную смесь перемешивали при -78°С в течение 30 мин, затем по каплям добавляли DMF (7,5 мл; 96,4 ммоль). Реакционную смесь перемешивали при -78°С в течение еще 1,5 ч, затем гасили, используя 3 н. HCl (200 мл), и нагревали до комнатной температуры. Смесь экстрагировали EtOAc.Органический слой промывали насыщ. NaHCO3 и рассолом, затем сушили над MgSO4 и концентрировали, получая 10,7 г (93%) 2,4,6-трихлорбензальдегида в виде белого твердого вещества.
Стадия 2
4,6-Дихлор-1H-индазол
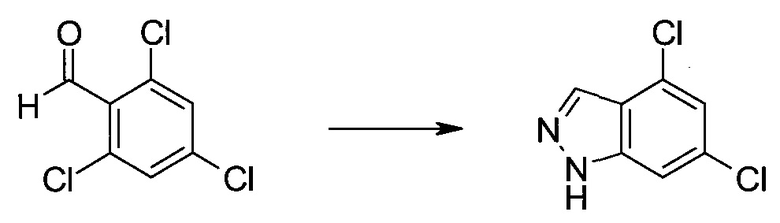
Во флаконе для микроволнового реактора растворяли 2,4,6-трихлорбензальдегид (4,0 г; 19,1 ммоль) в 1,4-диоксане (8 мл) и добавляли гидразин (7,2 мл; 229 ммоль). Флакон герметично закрывали и нагревали облучением микроволнами при 160°С в течение 30 мин. Реакцию гасили водой и экстрагировали EtOAc. Органический слой промывали рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 50%-100% EtOAc/гептан, получая 1,38 г (38%) 4,6-дихлор-1H-индазола в виде белого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.14 (s, 1H), 7.44 (s, 1H), 7.20 (d, J=1,5 Гц, 15H).
Стадия 3
2-(4,6-Дихлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
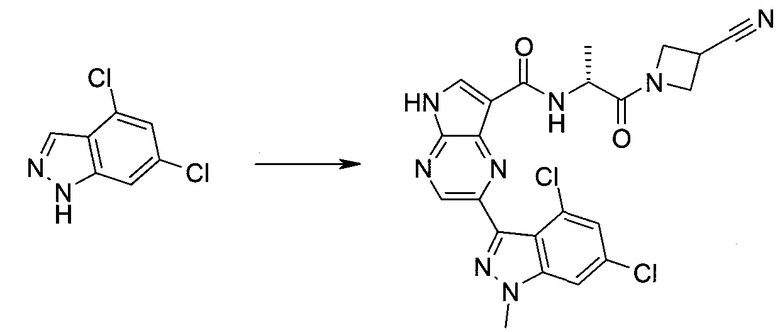
Получали в соответствии с методикой, приведенной в примере 81, стадии 3-7, заменяя 4,6-дихлор-1H-индазол на 6-трет-бутил-1H-индазол на стадии 3. MS: (M+Na)+=519; т.пл. = 196-200°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 8.75
(s, 1H), 8.45-8.56 (m, 2H), 8.03 (s, 1H), 7.42 (s, 1H), 4.38-4.66 (m, 3H), 4.17 (s, 3H), 3.91-4.14 (m, 2H), 3.73-3.86 (m, 1H), 1.23-1.32 (m, 3H).
Пример 98
2-(1-Метил-1H-пиразоло[4,3-b]пиридин-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
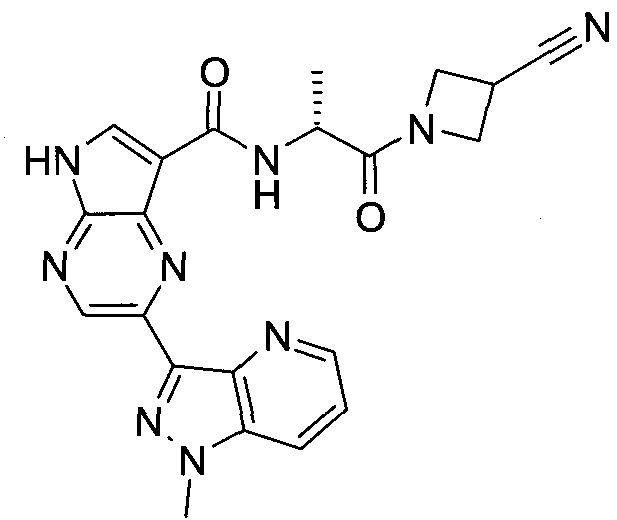
Стадия 1
1-Пиразоло[4,3-b]пиридин-1-ил-этанон

К раствору 3-амино-2-метилпиридина (1,0 г; 9,25 ммоль) в CHCl3 (24 мл) при 0°С медленно добавляли уксусный ангидрид (2,0 мл; 21,3 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Добавляли ацетат калия (272 мг; 2,77 ммоль), затем медленно добавляли изоамилнитрит (2,7 мл; 19,9 ммоль). Реакционную смесь нагревали при температуре дефлегмации в течение ночи. Реакционную смесь охлаждали до комнатной температуры и концентрировали. Остаток растворяли в EtOAc и промывали водой, насыщ. NaHCO3 и рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 20%-100% EtOAc/гептан, получая 973 мг (65%) 1-пиразоло[4,3-b]пиридин-1-ил-этанона в виде светло-желтого твердого вещества.
Стадия 2
1H-Пиразоло[4,3-b]пиридин

Пиразоло[4,3-b]пиридин-1-ил-этанон (973 мг; 6,04 ммоль) растворяли в THF/MeOH (1:1, 16 мл) и добавляли 10%-ный NaOH (1,8 мл). Реакционную смесь
перемешивали при комнатной температуре в течение 30 мин, затем нейтрализовали, используя 1,0 М HCl, разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали рассолом, затем сушили над MgSO4 и концентрировали, получая 687 мг (96%) 1H-пиразоло[4,3-b]пиридина в виде светло-желтого твердого вещества. 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 13.29 (br. s., 1H), 8.50 (d, J=4,5 Гц, 1H), 8.27 (s, 1H), 8.00 (d, J=8,7 Гц, 1H), 7.34 (dd, J=8,7; 4,5 Гц, 1H).
Стадия 3
2-(1-Метил-1H-пиразоло[4,3-b]пиридин-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
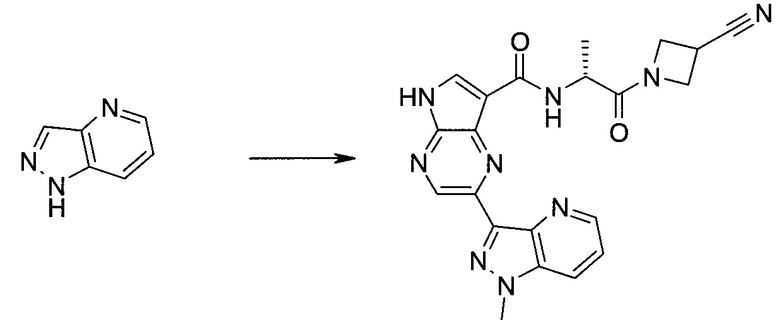
Получали в соответствии с методикой, приведенной в примере 81, стадии 3-7, заменяя 1H-пиразоло[4,3-b]пиридин на 6-трет-бутил-1H-индазол на стадии 3. MS: (M+H)+=430; т.пл. = 194-198°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.86 (br. s., 1H),9.32(s, 1H), 9.05 (t, J=7,9 Гц, 1H), 8.68 (d, J=4,2 Гц, 1H), 8.44 (d, J=12,1 Гц, 1H), 8.27 (d, J=8,3 Гц, 1H), 7.52 (dd, J=8,7; 4,2 Гц, 1H), 4.40-4.79 (m, 3H), 4.21 (s, 3H), 3.98-4.05 (m, 2H), 3.74-3.84 (m, 1H), 1.49 (d, J=6,8 Гц, 3H).
Пример 99
2-(1-Метил-1H-тиено[3,2-c]пиразол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
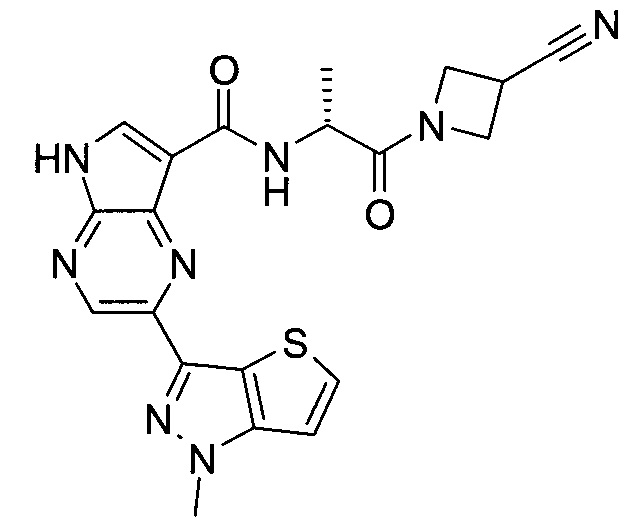
Стадия 1
N-Бензгидрилиден-N'-[1-(3-бром-тиосрен-2-ил)-мет-(E)-илиден]-гидразин
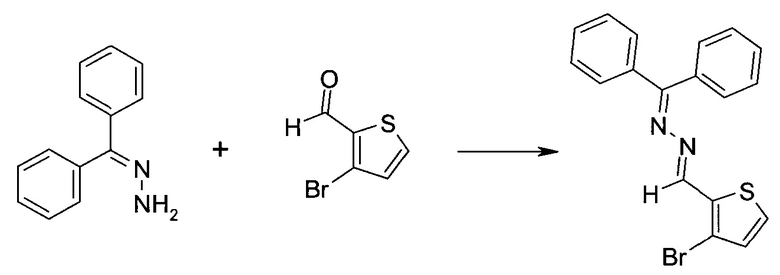
К раствору 3-бромтиофен-2-карбальдегида (5,57 г; 29,2 ммоль) в EtOH (90 мл) добавляли (дифенилметилен)гидразин (6,3 г; 32,1 ммоль). Реакционную смесь нагревали при 65°С в течение 4 ч, затем концентрировали. Остаток очищали хроматографией на силикагеле с использованием 10%-20% EtOAc/гептан, получая 11 г N-бензгидрилиден-N'-[1-(3-бром-тиофен-2-ил)-мет-(E)-илиден]-гидразина в виде вязкого желтого масла.
Стадия 2
N-Бензгидрилиден-N'-[2-(бензгидрилиден-гидразонометил)-тиофен-3-ил]-гидразин
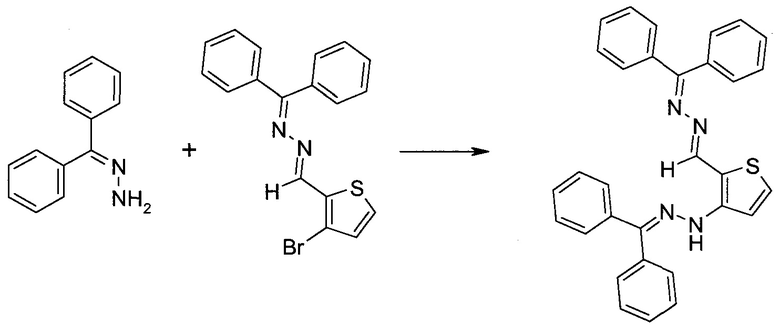
К раствору N-бензгидрилиден-N'-[1-(3-бром-тиофен-2-ил)-мет-(E)-илиден]-гидразина (10,8 г; 29,2 ммоль) в толуоле (200 мл) добавляли (дифенилметилен)-гидразин (6,9 г; 35,1 ммоль), карбонат цезия (16,2 г; 49,7 ммоль), Pd(OAc)2 (1,31 г; 5,85 моль) и 1,1'-бис(дифенилфосфино)ферроцен (2,43 г; 4,4 ммоль). Реакционную смесь нагревали при 100°С в течение 8,5 ч, затем охлаждали до комнатной температуры, разбавляли EtOAc и фильтровали через целит, промывая EtOAc. Фильтрат концентрировали и остаток очищали хроматографией на силикагеле с использованием 10%-20% EtOAc/гептан, получая 12,8 г N-бензгидрилиден-N'-[2-(бензгидрилиден-гидразонометил)-тиофен-3-ил]-гидразин в виде вязкого коричневого масла.
Стадия 3
1H-Тиено[3,2-c]пиразол
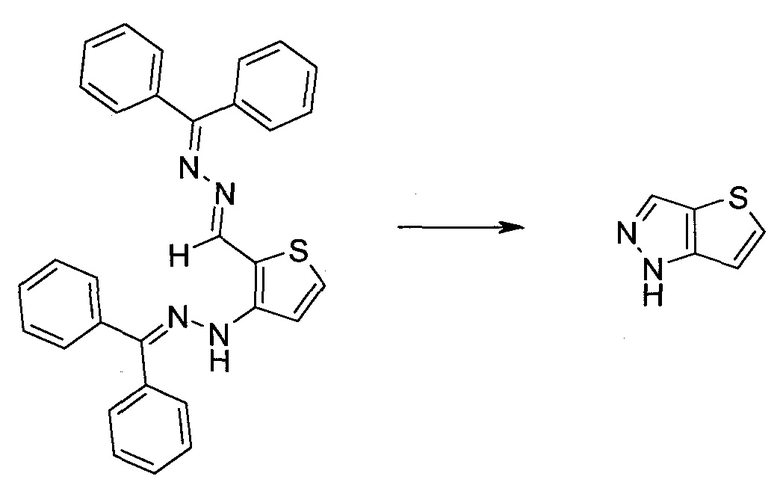
К раствору N-бензгидрилиден-N'-[2-(бензгидрилиден-гидразонометил)-тиофен-3-ил]-гидразина (12,8 г; 26,4 ммоль) в EtOH (300 мл) добавляли конц. HCl (150 мл). Темно-красную реакционную смесь перемешивали при 85°С в течение 1 ч, затем охлаждали до комнатной температуры, разбавляли водой и нейтрализовали, используя Na2COs. Смесь экстрагировали EtOAc. Органический слой промывали рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 20%-100% EtOAc/гептан, получая 2,0 г (60%) 1H-тиено[3,2-c]пиразола в виде коричневого твердого вещества. По-видимому, ЯМР демонстрирует наличие смеси 1H- и 2H-таутомеров: для основного 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 13.00 (br. s., 1H), 7.74 (s, 1H), 7.60 (d, J=5,3 Гц, 1H), 7.09 (d, J=5,3 Гц, 1H); для минорного 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 13.32 (s, 1H), 8.02 (s, 1H), 7.56 (d, J=4,9 Гц, 1H), 7.13 (d, J=4,9 Гц, 1H).
Стадия 4
3-Иод-1H-тиено[3,2-c]пиразол

К раствору 1H-тиено[3,2-c]пиразола (1,0 г; 8,05 ммоль) в DMF (65 мл) при комнатной температуре добавляли гидроксид калия (1,36 г; 24,2 ммоль) и йод (3,07 г; 12,1 ммоль). Темно-бордовую реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем гасили 10%-ным водным Na2S2O3 и разбавляли водой. Смесь экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой, насыщ. LiCl и насыщ. NaCl, затем сушили над MgSO4 и концентрировали, получая 2,0 г (99%) 3-иод-1H-тиено[3,2-c]пиразола в виде светло-коричневого твердого вещества. 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 13.38 (br. s., 1H), 7.68 (d, J=5,3 Гц, 1H), 7.21 (d, J=5,3 Гц, 1H).
Стадия 5
3-Иод-1-метил-1H-тиено[3,2-c]пиразол
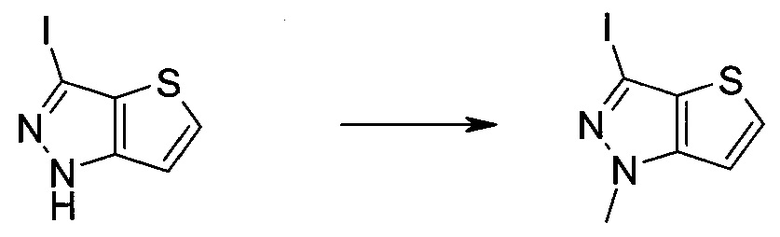
К раствору 3-иод-1H-тиено[3,2-c]пиразола (500 мг; 2,0 ммоль) в THF (7 мл) при 0°С добавляли KOtBu (314 мг; 2,8 ммоль). Реакционную смесь перемешивали при 0°С в течение 30 мин, затем добавляли иодметан (0,17 мл; 2,8 ммоль). Перемешивали при 0°С в течение 30 мин, затем нагревали до комнатной температуры и перемешивали в течение 1,5 ч. Реакцию гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток очищали хроматографией на силикагеле с использованием 20%-50% EtOAc/гептан, получая 292 мг (55%) 3-иод-1-метил-1H-тиено[3,2-c]пиразола в виде светло-коричневого вязкого масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.41 (d, J=5,3 Гц, 1H), 6.97 (d, J=5,3 Гц, 1H), 4.05 (s, 3H). Также выделяли 141 мг (27%) 3-иод-2-метил-2H-тиено[3,2-c]пиразола в виде беловатого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.36 (d, J=5,3 Гц, 1H), 7.16 (d, J=5,3 Гц, 1H), 4.13 (s, 3H).
Стадия 6
1-Метил-3-трибутилстаннанил-1H-тиено[3,2-c]пиразол
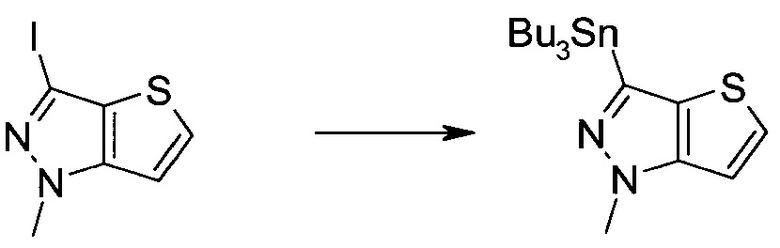
К раствору 3-иод-1-метил-1H-тиено[3,2-c]пиразола (290 мг; 1,10 ммоль) в THF (6 мл) при -15°С медленно добавляли хлорид изопропилмагния (2,0 М в THF; 0,66 мл; 1,32 ммоль). Ярко-желтую гетерогенную реакционную смесь перемешивали при -15°С в течение 20 мин, затем по каплям добавляли трибутилхлорстаннан (0,36 мл; 1,32 ммоль). Перемешивание продолжали при -15°С в течение 20 мин, затем при комнатной температуре в течение 2 ч. Реакционную смесь гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 10%-20% EtOAc/гептан (0,5% Et3N), получая 298 мг (63%) 1-метил-3-трибутилстаннанил-1H-тиено[3,2-c]пиразола в виде бледно-желтого
масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.36 (d, J=5,3 Гц, 1H), 6.90 (d, J=5,3 Гц, 1H), 4.06 (s, 3H), 1.54-1.67 (m, 6H), 1.36 (dq, J=14,7; 7,3 Гц, 6H), 1.13-1.22 (m, 6H), 0.90 (t, J=7,3 Гц, 9H).
Стадия 7
2-(1-Метил-1H-тиено[3,2-c]пиразол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
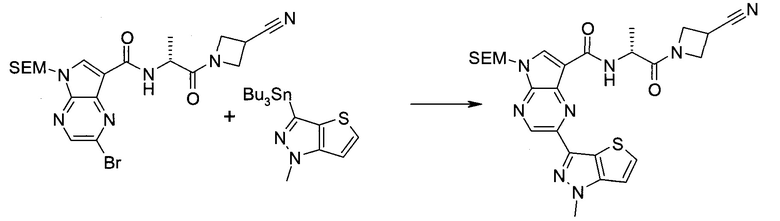
К раствору 1-метил-3-трибутилстаннанил-1H-тиено[3,2-c]пиразола (111 мг; 0,26 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (120 мг; 0,24 ммоль) в DMF (1,2 мл) добавляли Pd(PPh3)4 (14 мг; 0,012 ммоль) и иодид меди(I) (9 мг; 0,05 ммоль). Желтую реакционную смесь продували аргоном, затем нагревали при 80°С в течение 1,5 ч, далее охлаждали до комнатной температуры, гасили насыщ. NH4Cl и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток очищали хроматографией на силикагеле с использованием 50%-100% EtOAc/гептан, получая 131 мг (98%) 2-(1-метил-1H-тиено[3,2-c]пиразол-3-ил)-5-(2-триметил-силанил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде беловатого твердого вещества.
Стадия 8
2-(1-Метил-1H-тиено[3,2-c]пиразол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
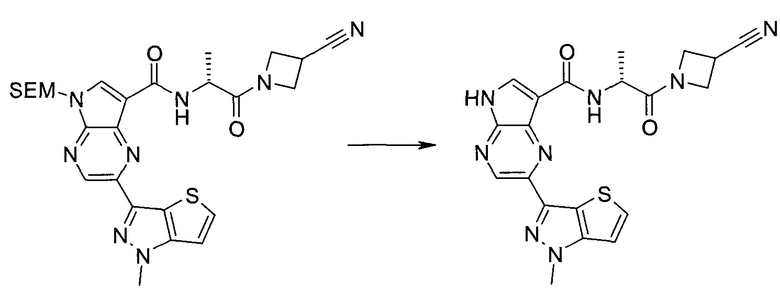
К раствору 2-(1-метил-1H-тиено[3,2-c]пиразол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида (131 мг; 0,23 ммоль) в CH2Cl2 (2 мл) добавляли TFA (0,75 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч, затем концентрировали. Остаток снова растворяли в смеси 10:90:0,5 MeOH/CH2Cl2/NH4OH (3 мл) и перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали и остаток очищали хроматографией на силикагеле с использованием 0%-10% MeOH/CH2Cl2, получая 83 мг (83%) 2-(1-метил-1H-тиено[3,2-c]пиразол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде белого твердого вещества. MS (M+Na)+=457; т.пл. = 310-320°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.93 (br. s., 1H), 9.07 (s, 1H), 8.46 (d, J=11,0 Гц, 1H), 8.19 (d, J=7,9 Гц, 1H), 7.82 (d, J=5,3 Гц, 1H), 7.32 (d, J=5,3 Гц, 1H), 4.42-4.77 (m, 3H), 4.13-4.21 (m, 1H), 4.12 (s, 3H), 3.97-4.08 (m, 1H), 3.76-3.89 (m, 1H), 1.51 (dd, J=6,8; 2,6 Гц, 3H).
Пример 100
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(1-циано-циклопентил)-этил]-амид
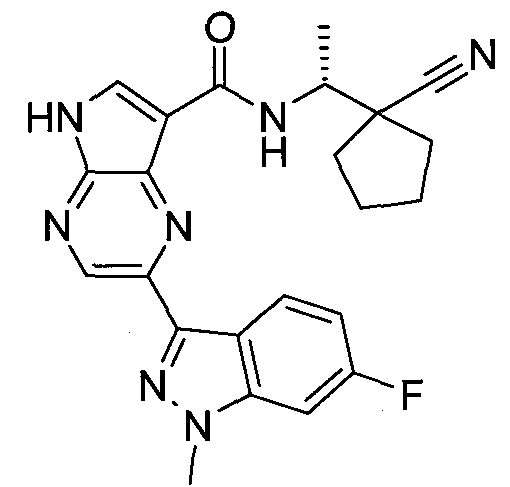
Стадия 1
(S)-2-Метил-пропан-2-сульфиновой кислоты (E)-этилиденамид
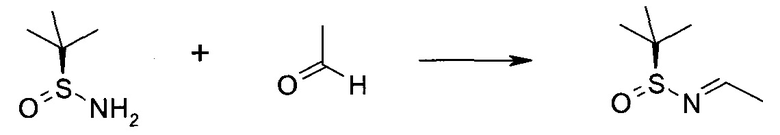
В колбе растворяли (S)-2-метил-пропан-2-сульфиновой кислоты амид (1,50 г; 12,4 ммоль) в CH2Cl2 (6 мл). Добавляли ацетальдегид (6,25 мл; 111 ммоль), MgSO4 (4,47 г; 37,1 ммоль) и пиридинийтозилат (156 мг; 0,62 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, фильтровали и концентрировали, получая (S)-2-метил-пропан-2-сульфиновой кислоты (E)-этилиденамид в виде бледно-красного масла, которое использовали без дополнительной очистки.
Стадия 2
(S)-2-Метил-пропан-2-сульфиновой кислоты [(R)-1-(1-циано-циклопентил)-этил]-амид
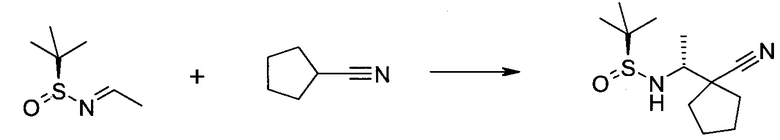
В колбе растворяли циклопентанкарбонитрил (3,53 г; 37,1 ммоль) в THF (40 мл) и охлаждали при -78°С. Добавляли LiHMDS (1,0 M в THF; 41 мл; 41 ммоль) и смесь перемешивали в течение 30 мин при -78°С.Медленно добавляли раствор (S)-2-метил-пропан-2-сульфиновой кислоты (E)-этилиденамида (неочищенного со стадии 1; 1,82 г; 12,4 ммоль) в THF (10 мл). Смесь перемешивали при -78°С в течение 2 ч, затем оставляли нагреваться до комнатной температуры в течение ночи. Реакционную смесь гасили насыщенным водным хлоридом аммония и экстрагировали EtOAc.Объединенные органические экстракты промывали рассолом, сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на SiO2 (50-100% EtOAc/гептан), получая 1,96 г (65%) (S)-2-метил-пропан-2-сульфиновой кислоты [(R)-1-(1-циано-циклопентил)-этил]-амида в виде белого твердого вещества.
Стадия 3
1-((R)-1-Амино-этил)-циклопентанкарбонитрила гидрохлорид

(S)-2-Метил-пропан-2-сульфиновой кислоты [(R)-1-(1-циано-циклопентил)-этил]-амид (1,96 г; 8,07 ммоль) растворяли в MeOH (16 мл) и добавляли HCl (4,0 М в 1,4-диоксане; 4,0 мл; 16,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем концентрировали, получая 1-
((R)-1-амино-этил)-циклопентанкарбонитрила гидрохлорид в виде беловатого твердого вещества, которое использовали без дополнительной очистки.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(1-циано-циклопентил)-этил]-амид
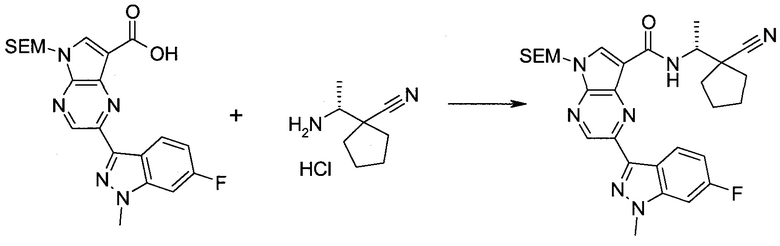
В колбе объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметил-силанил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (120 мг; 0,27 ммоль), 1-((R)-1-амино-этил)-циклопентанкарбонитрила гидрохлорид (48 мг; 0,27 ммоль), EDC (120 мг; 0,63 ммоль) и HOBt (106 г; 0,63 ммоль). Добавляли DMF (3 мл), затем i-Pr2NEt (0,28 мл; 1,63 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем гасили водой и экстрагировали EtOAc. Органические экстракты промывали 10%-ной лимонной кислотой, насыщ. NaHCO3, насыщ. LiCl и насыщ. NaCl, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на SiO2 (20-100% EtOAc/гептан), получая 140 мг (92%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(1-циано-циклопентил)-этил]-амида в виде белого твердого вещества.
Стадия 5
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(1-циано-циклопентил)-этил]-амид
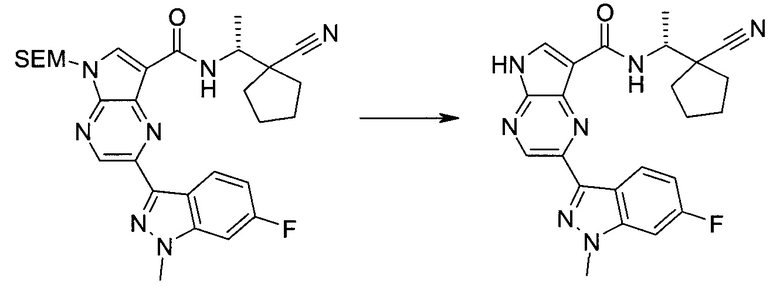
К раствору 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(1-циано-
циклопентил)-этил]-амида (140 мг; 0,25 ммоль) в CH2Cl2 (2 мл) добавляли TFA (0,75 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, затем концентрировали. Остаток снова растворяли в смеси 10:90:0,5 MeOH/CH2Cl2/NH4OH (3 мл) и перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток очищали хроматографией на силикагеле с использованием 0%-5% MeOH/EtOAc, получая 92 мг (86%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(1-циано-циклопентил)-этил]-амида в виде светло-желтого порошка. MS (M+Na)+=454; т.пл. = 300-315°С; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.96 (br. s., 1H), 9.11 (s, 1H), 8.51-8.56 (m, 1H), 8.50 (s, 1H), 8.19 (d, J=9,1 Гц, 1H), 7.67 (dd, J=9,8; 1,9 Гц, 1H), 7.15 (td, J=9,1; 2,3 Гц, 1H), 4.34-4.50 (m, 1H), 4.14 (s, 3H), 1.92-2.14 (m, 3H), 1.63-1.90 (m, 5H), 1.46 (d, J=6,8 Гц, 3H).
Пример 101
2-(4,6-Дифтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
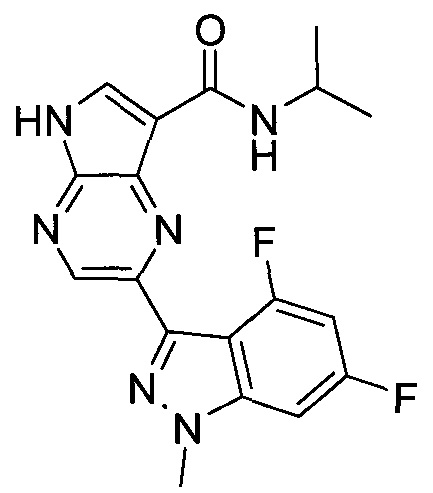
Стадия 1
4,6-Дифтор-3-иод-1H-индазол

К раствору 4,6-дифтор-1H-индазола (1,16 г; 7,53 ммоль) в DMF (60 мл) при комнатной температуре добавляли гидроксид калия (1,27 г; 22,6 ммоль) и йод (2,87 г; 11,3 ммоль). Темно-бордовую реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем гасили 10%-ным водным Na2S20s и разбавляли водой. Смесь экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой, насыщ. LiCl и насыщ. NaCl, затем сушили над MgSO4 и концентрировали, получая 2,18 г 4,6-дифтор-3-иод-1H-индазола в виде светло-коричневого твердого вещества.
Стадия 2
4,6-Дифтор-3-трибутилстаннанил-1H-индазол
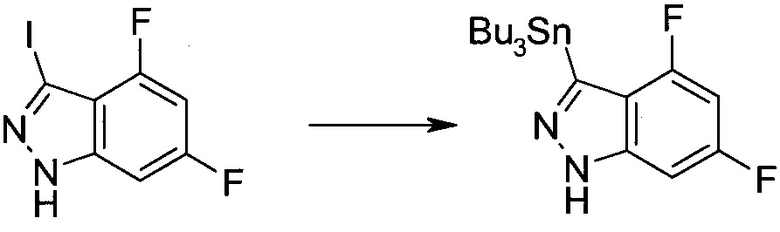
К раствору 4,6-дифтор-3-иод-1H-индазола (2,11 г; 7,53 ммоль) в THF (45 мл) при 0°С медленно добавляли гидрид натрия (60%-ный в минеральном масле; 362 мг; 9,04 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин, затем охлаждали до -10°С и добавляли хлорид изопропилмагния (2,0 М в THF; 4;52 мл; 9,04 ммоль). Реакционную смесь перемешивали при -10°С в течение 30 мин, затем по каплям добавляли трибутилхлорстаннан (2,66 мл; 9,8 ммоль). Перемешивание продолжали при -10°С в течение 20 мин, затем при комнатной температуре в течение 3 ч. Реакционную смесь гасили насыщенным водным NH4Cl, затем разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 10%-20% EtOAc/гептан (0,5% Et3N), получая 1,94 г (58%) 4,6-дифтор-3-трибутилстаннанил-1H-индазола в виде бледно-желтого вязкого масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.03 (dd, J=8,9; 2,1 Гц, 1H), 6.60 (td, J=9,8; 2,1 Гц, 1H), 1.51-1.64 (m, 6H), 1.29-1.42 (m, 6H), 1.20-1.29 (m, 6H), 0.88 (t, J=7,4 Гц, 9H).
Стадия 3
2-(4,6-Дифтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
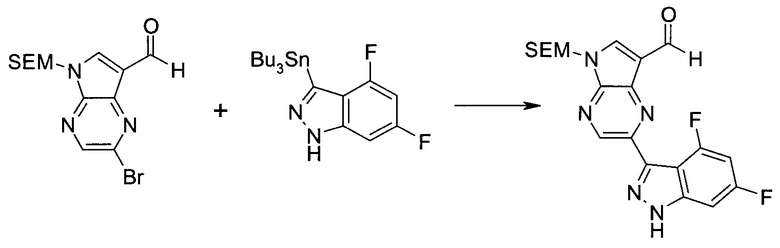
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (1,56 г; 4,38 ммоль) и 4,6-дифтор-3-трибутилстаннанил-1H-индазол (1,94 г; 4,38 ммоль) в DMF (40 мл) и добавляли тетракис(трифенилфосфин)палладий(0) (253 мг; 0,22 ммоль) и иодид меди(I) (167 мг; 0,88 ммоль). Реакционную смесь продували аргоном, перемешивали при комнатной температуре в течение 4 ч, затем нагревали при 80°С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры,
гасили насыщ. NH4Cl и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток очищали хроматографией на силикагеле с использованием 50%-100% EtOAc/гептан, получая 1,89 г 2-(4,6-дифтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида в виде коричневого твердого вещества.
Стадия 4
2-(4,6-Дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
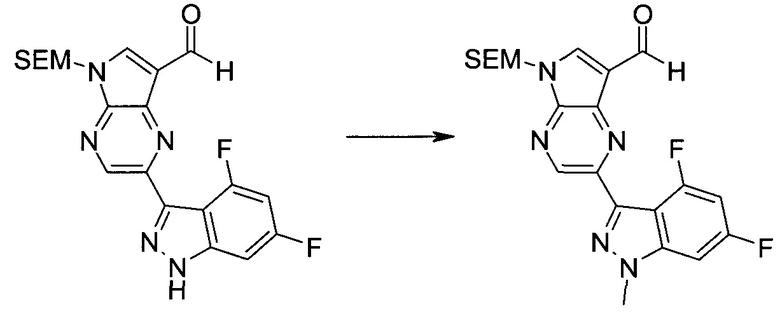
К раствору 2-(4,6-дифтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида (890 мг; 2,1 ммоль) в DMF (9 мл) при 0°С добавляли гидрид натрия (60%-ный в минеральном масле; 279 мг; 2,49 ммоль). Реакционную смесь перемешивали при 0°С в течение 10 мин, затем медленно добавляли иодметан (0,18 мл; 2,9 ммоль). Смесь перемешивали при 0°С в течение 30 мин, затем при комнатной температуре в течение 30 мин. Реакцию гасили насыщ. NH4Cl, разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток очищали хроматографией на силикагеле с использованием 20%-100% EtOAc/гептан, получая 226 мг (22%) 2-(4,6-дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида в виде желтого твердого вещества.
Стадия 5
2-(4,6-Дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
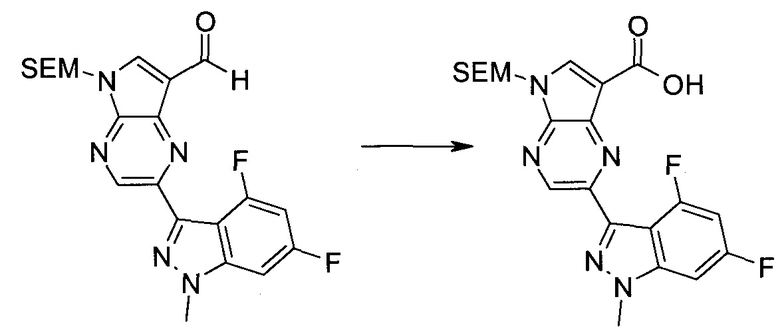
К раствору 2-(4,6-дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида (226 мг; 0,51 ммоль) в 1,4-диоксане (15 мл) и воде (3 мл) при 0°С добавляли сульфаминовую кислоту (297 мг; 3,06 ммоль). Затем через капельную воронку в течение примерно 15 мин добавляли раствор хлорита натрия (80%-ного; 75 мг; 0,66 ммоль) и дигидрофосфата калия (834 мг; 6,13 ммоль) в воде (12 мл). По завершении добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь разбавляли водой и экстрагировали EtOAc (3×). Объединенные органические слои промывали рассолом, затем сушили над MgSO4 и концентрировали, получая 230 мг (98%) 2-(4,6-дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты в виде светло-желтого порошка.
Стадия 6
2-(4,6-Дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
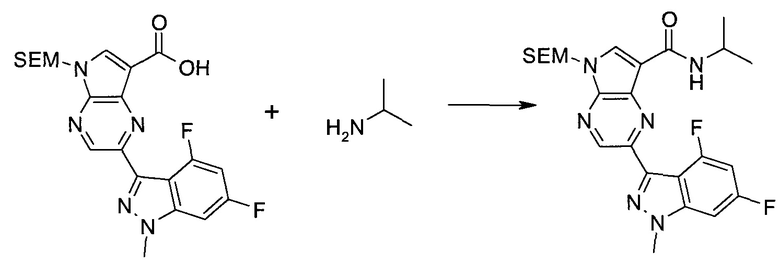
К раствору 2-(4,6-дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (75 мг; 0,16 ммоль), HOBt (63 мг; 0,38 ммоль) и EDC (72 мг; 0,38 ммоль) в DMF добавляли изопропиламин (84 мкл; 0,98 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч, затем дополнительно добавляли HOBt, EDC и изопропиламин. Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем добавляли диизопропилэтиламин
(170 мкл; 0,98 ммоль). Реакционную смесь перемешивали в течение 1 ч, затем гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали 10%-ной лимонной кислотой, насыщ. NaHCO3, насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Остаток хроматографировали на силикагеле с использованием 20%-100% EtOAc/гептан, получая 30 мг (37%) 2-(4,6-дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида в виде белого твердого вещества.
Стадия 7
2-(4,6-Дифтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
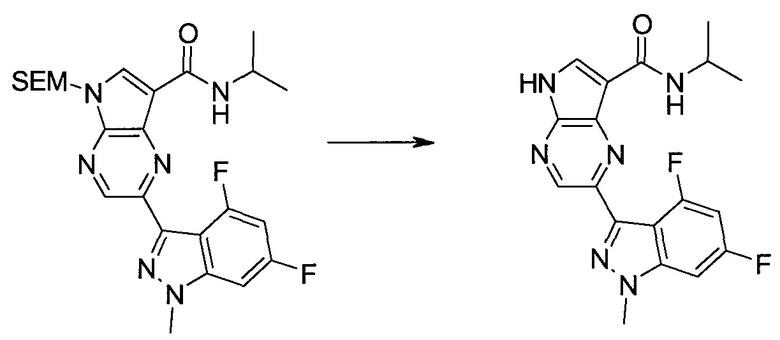
К раствору 2-(4,6-дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида (30 мг; 0,06 ммоль) в CH2Cl2(1,5 мл) добавляли TFA (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, затем концентрировали. Остаток снова растворяли в смеси 10:90:0,5 MeOH/CH2Cl2/NH4OH (3 мл) и перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток очищали хроматографией на силикагеле с использованием 0%-5% MeOH/EtOAc, получая 18 мг (82%) 2-(4,6-дифтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида в виде светло-желтого порошка. MS (M+Na)+=393; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.83 (s, 1H), 8.99 (s, 1H), 8.40 (s, 1H), 8.27 (d, J=7,9 Гц, 1H), 7.59 (dd, J=9,1; 1,9 Гц, 1H), 7.12-7.23 (m, 1H), 4.16-4.27 (m, 1H), 4.14 (s, 3H), 1.22 (d, J=6,4 Гц, 6H).
Пример 102
2-(6-Фтор-1-оксетан-3-ил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
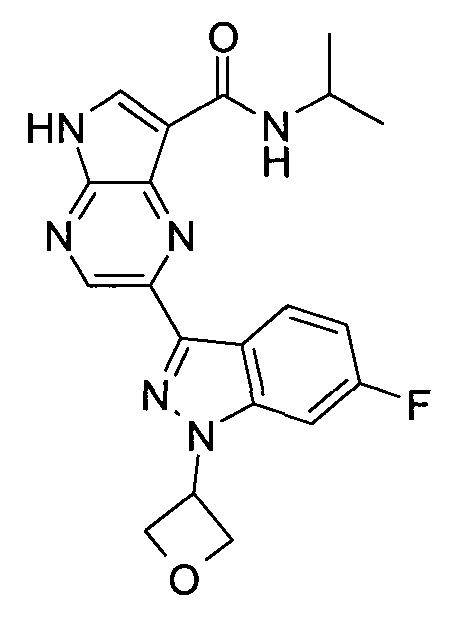
Стадия 1
6-Фтор-3-иод-1H-индазол
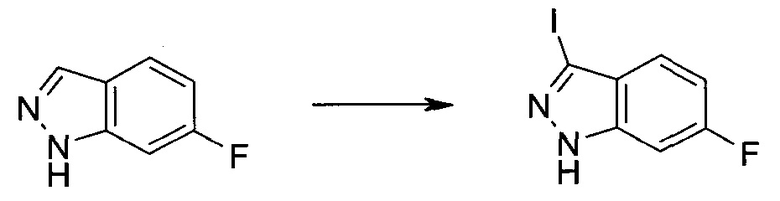
К раствору 6-фтор-1H-индазола (5,50 г; 40,4 ммоль) в DMF (150 мл) при комнатной температуре добавляли гидроксид калия (6,8 г; 121 ммоль) и йод (15,4 г; 60,6 ммоль). Темно-бордовую реакционную смесь перемешивали при комнатной температуре в течение 8 ч, затем гасили 10%-ным водным Na2S20s и разбавляли водой. Смесь экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой, насыщ. LiCl и насыщ. NaCl, затем сушили над MgSO4 и концентрировали, получая 8,6 г (81%) 6-фтор-3-иод-1H-индазола в виде светло-желтого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.48 (dd, J=8,9; 5,1 Гц, 1H), 7.20 (dd, J=8,9; 2,1 Гц, 1H), 7.02 (td, J=9,1; 2,1 Гц, 1H)
Стадия 2
6-Фтор-3-трибутилстаннанил-1H-индазол
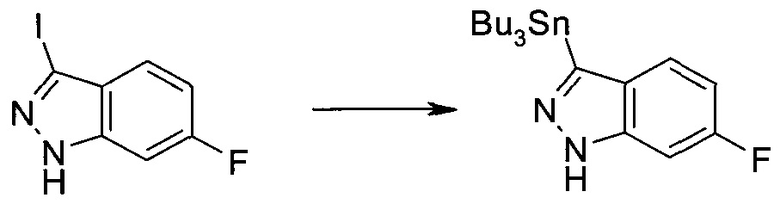
К раствору 6-фтор-3-иод-1H-индазола (8,6 г; 32,8 ммоль) в THF (200 мл) при 0°С медленно добавляли порциями гидрид натрия (60%-ный в минеральном масле; 1,58 г; 39,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин, затем охлаждали до -10°С и добавляли хлорид изопропилмагния (2,0 М в THF; 19,7 мл; 39,4 ммоль). Реакционную смесь перемешивали при -10°С в течение 30 мин, затем добавляли дополнительное количество хлорида изопропилмагния (2,0 М в THF; 8,2 мл; 16,4 ммоль). Реакционную смесь перемешивали при -10°С в течение 30 мин, затем медленно
добавляли трибутилхлорстаннан (11,6 мл; 42,7 ммоль). Перемешивание продолжали при -10°С в течение 20 мин, затем при комнатной температуре в течение 3 ч. Реакционную смесь гасили насыщенным водным NH4Cl, затем разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием 10%-20% EtOAc/гептан (0,5% Et3N), получая 6,53 г (47%) 6-фтор-3-трибутилстаннанил-1H-индазола в виде светло-коричневого вязкого масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 7.65 (dd, J=8,7; 5,3 Гц, 1H), 7.20 (dd, J=9,3; 2,1 Гц, 1H), 6.92 (td, J=9,0; 2,1 Гц, 1H), 1.53-1.67 (m, 6H), 1.28-1.43 (m, 6H), 1.20-1.28 (m, 6H), 0.89 (t, J=7,4 Гц, 9H).
Стадия 3
2-(6-Фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
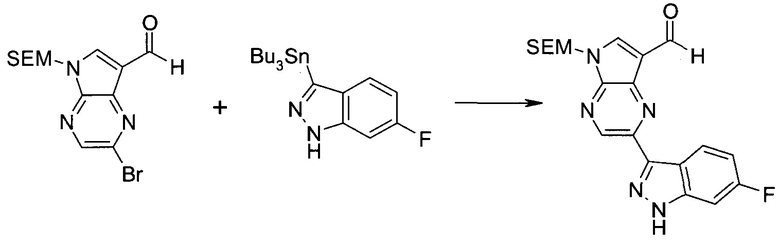
В круглодонной колбе растворяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (5,47 г; 15,4 ммоль) и 6-фтор-3-трибутилстаннанил-14-индазол (6,53 г; 15,4 ммоль) в DMF (140 мл) и добавляли тетракис(трифенилфосфин)палладий(0) (888 мг; 0,76 ммоль) и иодид меди(I) (585 мг; 3,07 ммоль). Реакционную смесь продували аргоном, затем нагревали при 80°С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, гасили насыщ. NH4Cl и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток перекристаллизовывали из EtOAc, получая 3,74 г белого твердого вещества. Маточную жидкость очищали хроматографией на силикагеле с использованием 50%-100% EtOAc/гептан, получая дополнительно 1,75 г белого твердого вещества. Общий выход составлял 5,49 г (87%) 2-(6-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 10.49 (s, 1H), 9.34 (s, 1H), 8.83 (dd, J=9,1; 5,3 Гц, 1H), 8.32 (s,
1H), 7.08-7.25 (m, 2H), 5.77 (s, 2H), 3.55-3.71 (m, 2H), 0.87-1.03 (m, 2H), -0.03 (s, 9H).
Стадия 4
2-(6-Фтор-1-оксетан-3-ил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
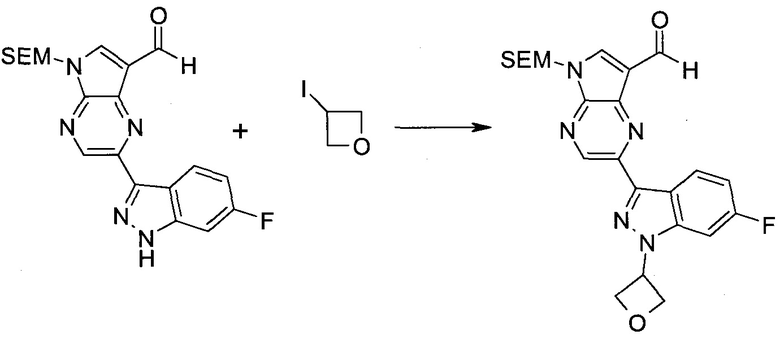
Во флаконе для микроволнового реактора растворяли 2-(6-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (300 мг; 0,73 ммоль) в DMF (5 мл) и добавляли карбонат цезия (714 мг; 2,19 ммоль) и 3-иодоксетан (200 мг; 1,08 ммоль). Флакон герметично закрывали и нагревали при 100°C облучением микроволнами в течение 2 ч. Реакционную смесь охлаждали, гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток очищали хроматографией на силикагеле с использованием 20%-100% EtOAc/гептан, получая 295 мг (86%) 2-(6-фтор-1-оксетан-3-ил-1H-индазол-3-ил)-5-(2-триметил-силанил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида в виде белого твердого вещества. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 10.48 (s, 1H), 9.40 (s, 1H), 8.86 (dd, J=9,1; 5,3 Гц, 1H), 8.31 (s, 1H), 7.11-7.25 (m, 2H), 5.72-5.86 (m, 3H), 5.41 (t, J=6,6 Гц, 2H), 5.20 (t, J=7,4 Гц, 2H), 3.56-3.70 (m, 2H), 0.85-1.06 (m, 2H), -0.02 (s, 9H).
Стадия 5
2-(6-Фтор-1-оксетан-3-ил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
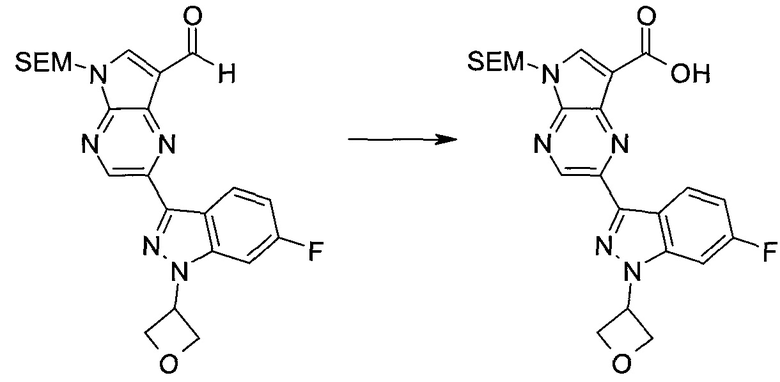
К раствору 2-(6-фтор-1-оксетан-3-ил-1H-индазол-3-ил)-5-(2-триметил-силанил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида (293 мг; 0,63 ммоль) в 1,4-диоксане (20 мл) и воде (4 мл) при 0°C добавляли сульфаминовую кислоту (365 мг; 3,76 ммоль). Затем в течение примерно 15 мин добавляли раствор хлорита натрия (80%-ного; 92 мг; 0,82 ммоль) и дигидрофосфата калия (1,02 г; 7,52 ммоль) в воде (16 мл). По завершении добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли THF (20 мл) и перемешивание продолжали в течение 2 ч. Реакционную смесь разбавляли водой и экстрагировали EtOAc (3×). Объединенные органические слои промывали рассолом, затем сушили над MgSO4 и концентрировали, получая 340 мг 2-(6-фтор-1-оксетан-3-ил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты в виде беловатого порошка.
Стадия 6
2-(6-Фтор-1-оксетан-3-ил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
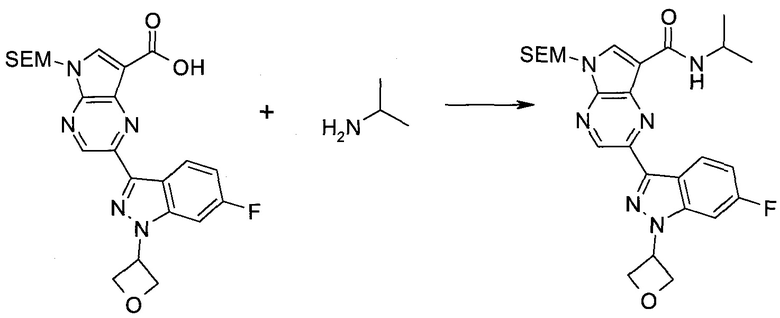
К раствору 2-(4,6-дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (115 мг; 0,23 ммоль), HOBt (92 мг; 0,55 ммоль) и EDC (105 мг; 0,55 ммоль) в DMF (3 мл) добавляли изопропиламин (41 мкл; 0,48 ммоль) и N,N-
диизопропилэтиламин (0,17 мл; 0,95 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали 10%-ной лимонной кислотой, насыщ. NaHCO3, насыщ. LiCl и рассолом, затем сушили над MgSO4 и концентрировали. Остаток хроматографировали на силикагеле с использованием 20%-100% EtOAc/гептан, получая 98 мг (78%) 2-(6-фтор-1-оксетан-3-ил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида в виде белого твердого вещества.
Стадия 7
2-(6-Фтор-1-оксетан-3-ил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
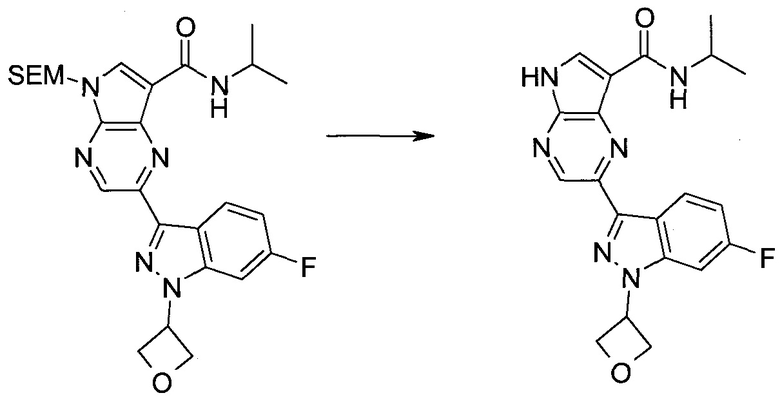
К раствору 2-(6-фтор-1-оксетан-3-ил-1H-индазол-3-ил)-5-(2-триметил-силанил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида (98 мг; 0,18 ммоль) в CH2Cl2 (1,5 мл) добавляли TFA (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в смеси 10:90:0,5 MeOH/CH2Cl2/NH4OH (3 мл) и перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток распределяли между водой и смесью 10% MeOH/CH2Cl2. Водный слой экстрагировали смесью 10% MeOH/CH2Cl2 (3×). Объединенные органические экстракты концентрировали и остаток очищали хроматографией на силикагеле с использованием 0%-5% MeOH/CH2Cl2 (0,5% MH4OH), получая 30 мг (41%) 2-(6-фтор-1-оксетан-3-ил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида в виде белого твердого вещества. MS (M+Na)+=417; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 12.87 (br. s., 1H), 9.20 (s, 1H), 8.45-8.51 (m, 1H), 8.44 (s, 1H), 8.04 (d, J=7,6 Гц, 1H), 7.73 (dd, J=9,8; 1,9 Гц, 1H), 7.22 (td, J=9,1; 1,9 Гц, 1H), 6.13 (quin, J=7,0 Гц, 1H), 5.11-5.20 (m, 2H), 4.99-5.10 (m, 2H), 4.21 (dq, J=13,5; 6,4 Гц, 1H), 1.30 (d,J=6,4 Гц, 6H).
Пример 103
2-(6-Фтор-1-оксетан-3-ил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
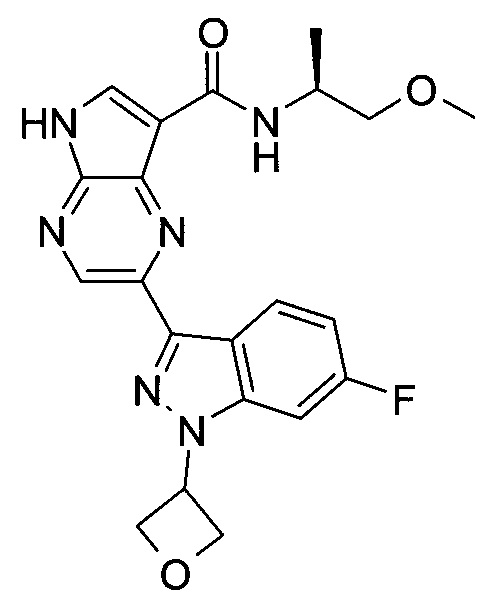
Получали в соответствии с методикой, приведенной в примере 102, стадии 6-7, заменяя (S)-1-метоксипропан-2-амина гидрохлорид на изопропиламин на стадии 6. MS: (M+Na)+=447; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 12.87 (br. s., 1H), 9.25 (s, 1H), 8.56 (dd, J=9,0; 5,2 Гц, 1H), 8.47 (s, 1H), 8.21 (d, J=8,3 Гц, 1H), 7.74 (dd, J=9,7; 2,1 Гц, 1H), 7.20 (td, J=9,0; 2,1 Гц, 1H), 6.09-6.22 (m, 1H), 5.18 (q, J=6,1 Гц, 2H), 5.03-5.11 (m, 2H), 4.34-4.44 (m, 1H), 3.40-3.57 (m, 2H), 3.31 (s, 3H), 1.32 (d, J=6,8 Гц, 3H).
Пример 104
2-(1-Азетидин-3-ил-6-фтор-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
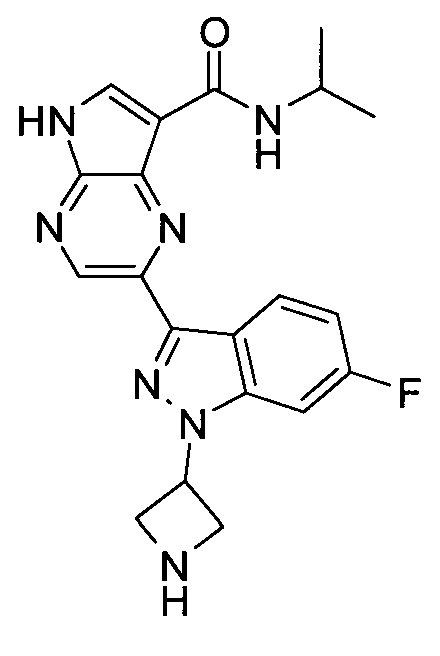
Стадия 1
2-[1-(1-Бензгидрил-азетидин-3-ил)-6-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
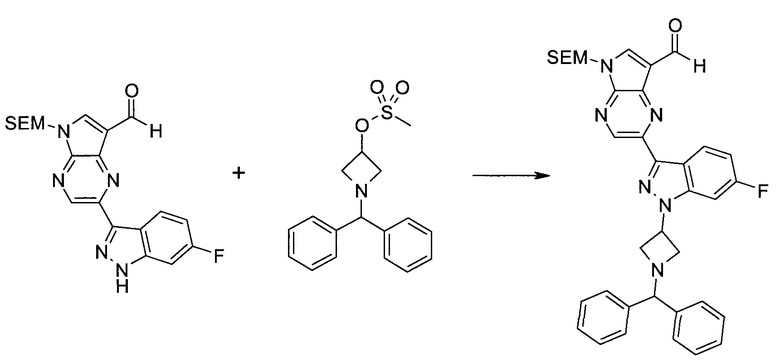
Во флаконе для микроволнового реактора растворяли 2-(6-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (300 мг; 0,73 ммоль) в DMF (6 мл) и добавляли карбонат цезия (713 мг; 2,19 ммоль) и метансульфоновой кислоты 1-бензгидрил-азетидин-3-иловый эфир (347 мг; 1,09 ммоль). Флакон герметично закрывали и нагревали в микроволновом реакторе при 100°C в течение 3 ч. Реакционную смесь охлаждали, гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой и рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток очищали хроматографией на силикагеле с использованием 20%-30% EtOAc/гексаны, получая 176 мг (38%) 2-[1-(1-бензгидрил-азетидин-3-ил)-6-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида в виде оранжевой пены.
Стадия 2
2-[1-(1-Бензгидрил-азетидин-3-ил)-6-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
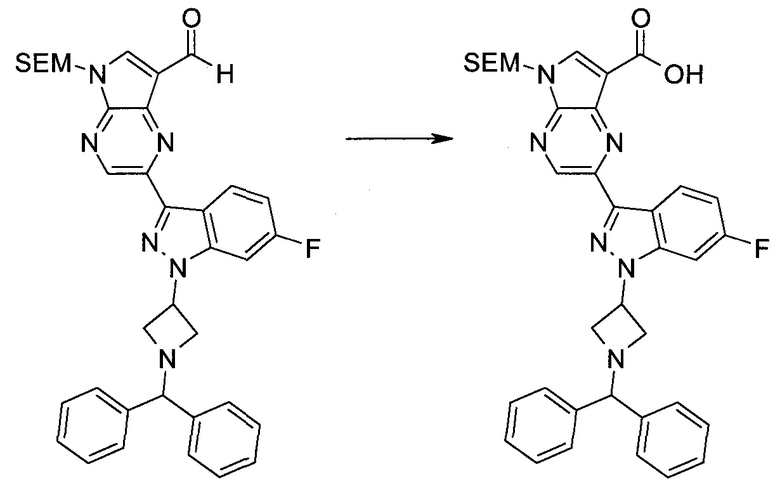
К раствору 2-[1-(1-бензгидрил-азетидин-3-ил)-6-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида (170 мг; 0,27 ммоль) в 1,4-диоксане (10 мл) и воде (2 мл) при 0°C добавляли сульфаминовую кислоту (157 мг; 1,61 ммоль). Затем по каплям в течение 5 мин добавляли раствор NaClO2 (43 мг; 0,37 ммоль) и KH2PO4 (439 мг; 3,22 ммоль) в воде (4 мл). Ледяную баню удаляли и желтую мутную реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические слои сушили над MgSO4 и концентрировали. Остаток растирали с петролейным эфиром, получая 45 мг (26%) 2-[1-(1-бензгидрил-азетидин-3-ил)-6-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты в виде светло-желтого твердого вещества.
Стадия 3
2-[1-(1-Бензгидрил-азетидин-3-ил)-6-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
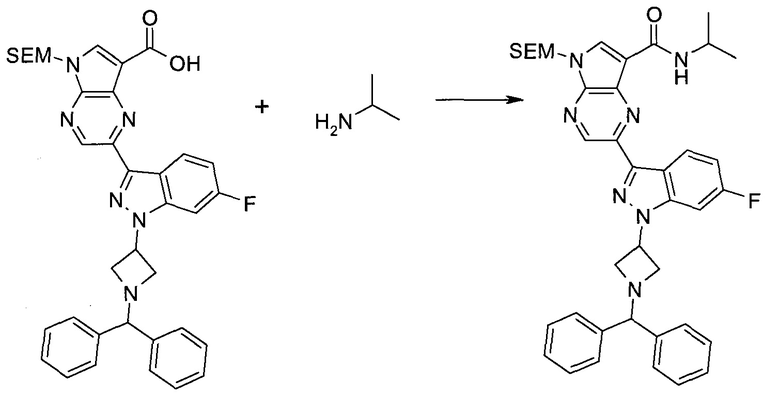
К раствору 2-[1-(1-бензгидрил-азетидин-3-ил)-6-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (130 мг; 0,20 ммоль) в DMF (2 мл) добавляли HATU (84 мг; 0,22 ммоль) и изопропиламин (86 мкл; 1,00 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой (3×) и рассолом, затем сушили над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с использованием смеси 50% EtOAc/гексаны, получая 74 мг (54%) 2-[1-(1-бензгидрил-азетидин-3-ил)-6-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида в виде беловатого пенообразного твердого вещества.
Стадия 4
2-(1-Азетидин-3-ил-6-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
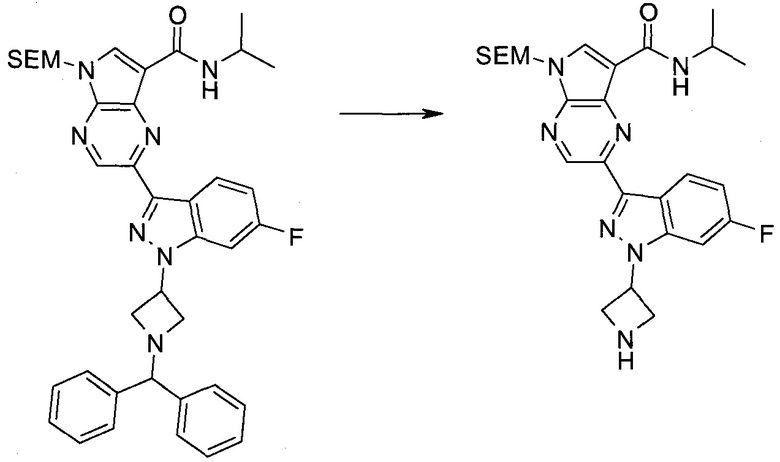
В круглодонной колбе растворяли формиат аммония (135 мг; 2,15 ммоль) в MeOH (1,5 мл). Этот раствор добавляли к раствору 2-[1-(1-бензгидрил-азетидин-3-ил)-6-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида (74 мг; 0,107 ммоль) в THF (1,5 мл), что приводило к образованию белого осадка. Эту суспензию переносили через пипетку в пробирку для работы под давлением, содержащую 10%-ный палладий на угле (влажный; 23 мг) в MeOH (1 мл). Пробирку герметично закрывали и нагревали при 50°C в течение 4 ч, затем охлаждали до комнатной температуры в течение ночи. Смесь фильтровали через целит, промывая CH2Cl2. Фильтрат концентрировали, остаток абсорбировали на SiO2 и хроматографировали с использованием 0%-10% MeOH/CH2Cl2 (0,5% NH4OH), получая 38 мг (68%) 2-(1-азетидин-3-ил-6-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида в виде бледно-желтого пенообразного твердого вещества.
Стадия 5
2-(1-Азетидин-3-ил-6-фтор-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
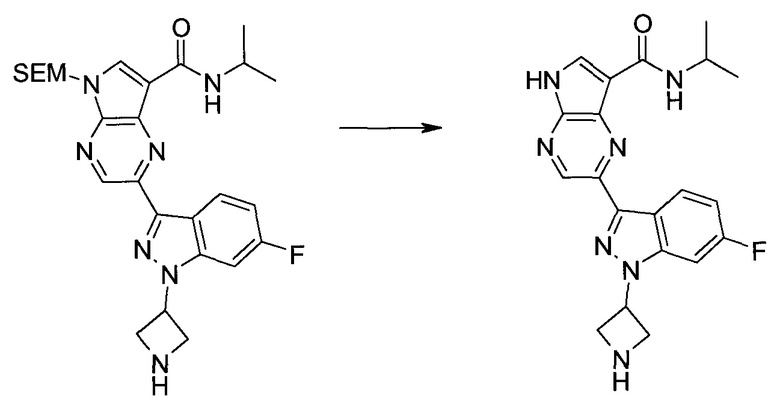
К раствору 2-(1-азетидин-3-ил-6-фтор-1H-индазол-3-ил)-5-(2-триметил-силанил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида (36 мг; 0,69 ммоль) в CH2Cl2 (1 мл) добавляли TFA (0,5 мл; 6,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали. Остаток снова растворяли в CH2Cl2 (1 мл) и добавляли этилендиамин (0,2 мл; 3,00 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и экстрагировали смесью 5% MeOH/CH2Cl2 (3×). Объединенные органические слои сушили над MgSO4 и концентрировали. Остаток растирали с EtOAc, получая 17 мг (63%) 2-(1-азетидин-3-ил-6-фтор-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида в виде бледно-желтого порошка. MS: (M+H)+=394; 1H ЯМР (DMSO-d6, 300 МГц): δ (млн-1) 9.14 (s, 1H), 8.40-8.50 (m, 2H), 8.04 (d, J=7,6 Гц, 1H), 7.78-7.86 (m, 1H), 7.13-7.24 (m, 1H), 5.65-5.76 (m, 1H), 4.12-4.28 (m, 3H), 3.86 (t, J=7,9 Гц, 2H), 1.30 (d, J=6,4 Гц, 3H).
Пример 105
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метансульфонил-1-метил-этил)-амид
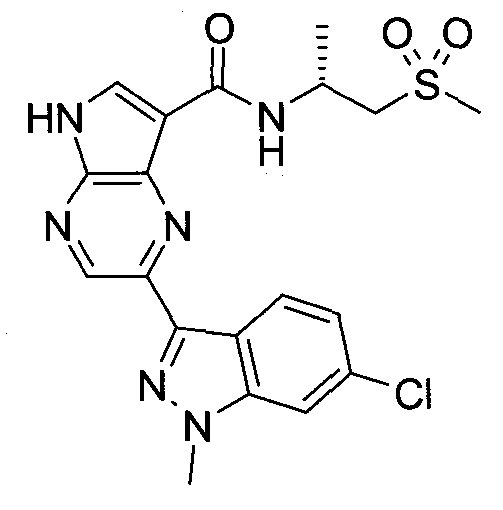
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метансульфонил-1-метил-этил)-амид
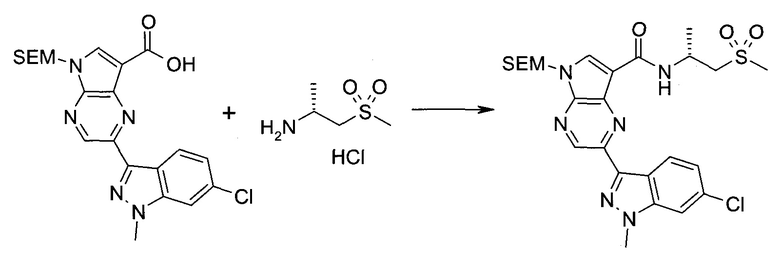
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (80 мг; 0,175 ммоль), O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (84 мг; 0,26 ммоль) и N,N-диизопропилэтиламин (0,076 мл; 0,44 ммоль) растворяли в ацетонитриле (1,75 мл). Добавляли (R)-1-(метилсульфонил)пропан-2-амина гидрохлорид (36 мг; 0,21 ммоль) и смесь перемешивали при комнатной температуре в течение 3 ч. Добавляли воду и этилацетат, слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия, сушили над сульфатом натрия и концентрировали. Остаток очищали хроматографией на силикагеле (этилацетат/гексаны), получая 65 мг (64%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метансульфонил-1-метил-этил)-амида. (M+H)+=578.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метансульфонил-1-метил-этил)-амид
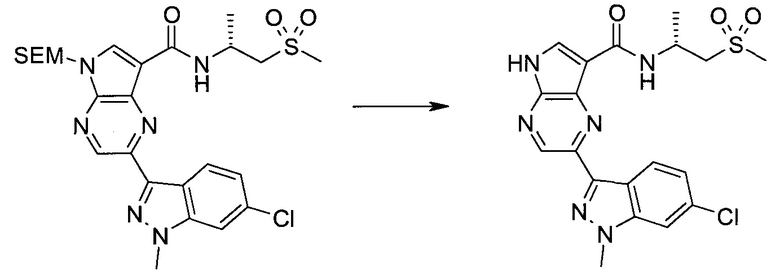
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метансульфонил-1-метил-этил)-амид (65 мг; 0,113 ммоль) растворяли в дихлорметане (0,8 мл) и затем перемешивали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,4 мл) и ледяную баню удаляли. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем охлаждали в ледяной бане. Добавляли раствор бикарбоната натрия и смесь три раза экстрагировали
этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток растворяли в абсолютном этаноле (7 мл) и добавляли ацетат натрия (185 мг; 2,25 ммоль). Смесь перемешивали в течение 20 ч при 60°C. Реакционную смесь охлаждали и добавляли воду и этилацетат. Водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия, сушили над сульфатом натрия и упаривали до получения остатка. После очистки хроматографией на силикагеле (метанол/дихлорметан) получали 18,6 мг (37%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метансульфонил-1-метил-этил)-амида. MS: (M+H)+=447; т.пл. = 287-290°C. 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 12.91 (s, 1H) 9.10 (s, 1H) 8.54 (d, J=8,7 Гц, 1H) 8.47 (s, 1H) 8.26 (d, J=7,9 Гц, 1H) 7.97-8.02 (m, 1H) 7.35 (dd, J=8,7; 1,5 Гц, 1H) 4.60-4.72 (m, 1H) 4.18 (s, 3H) 3.45-3.63 (m, 2H) 3.06 (s, 3H) 1.52 (d, J=6,8 Гц, 3H).
Пример 106
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты циклопентиламид
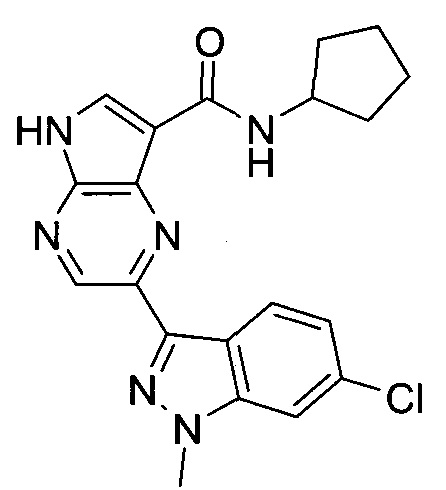
Получали в соответствии с методикой, приведенной в примере 105, заменяя циклопентиламин на (R)-1-(метилсульфонил)пропан-2-амина гидрохлорид на стадии 1. MS: (M+H)+=395; т.пл. = 341-343°C. 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 12.81-12.89 (m, 1H) 9.07 (s, 1H) 8.42 (d, J=3,0 Гц, 1H) 8.39 (d, J=8,7 Гц, 1H) 8.05-8.13 (m, 1H) 8.00 (d, J=1,5 Гц, 1H) 7.24 (dd, J=8,7; 1,5 Гц, 1H) 4.30-4.43 (m, 1H) 4.16 (s, 3H) 2.00-2.15 (m, 2H) 1.50-1.83 (m, 6H).
Пример 107
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (тетрагидрофуран-3-ил)-амид
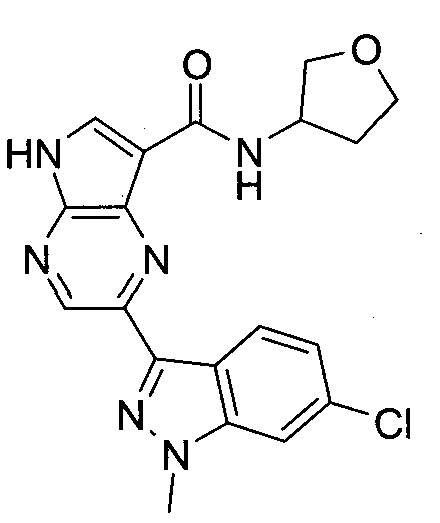
Получали в соответствии с методикой, приведенной в примере 105, заменяя тетрагидрофуран-3-иламина гидрохлорид на (R)-1-(метилсульфонил)пропан-2-амина гидрохлорид на стадии 1. MS: (M+Na)+=419; т.пл. = 345-347°C. 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 12.89 (br. s., 1H) 9.10 (s, 1H) 8.44 (d, J=8,7 Гц, 1H) 8.46 (d, J=3,4 Гц, 1H) 8.29 (d, J=7,6 Гц, 1H) 7.99 (s, 1H) 7.27 (dd, J=8,7; 1,5 Гц, 1H) 4.62-4.74 (m, 1H) 4.16 (s, 3H) 3.74-4.00 (m, 4H) 2.27-2.41 (m, 1H) 1.88-2.01 (m, 1H).
Пример 108
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
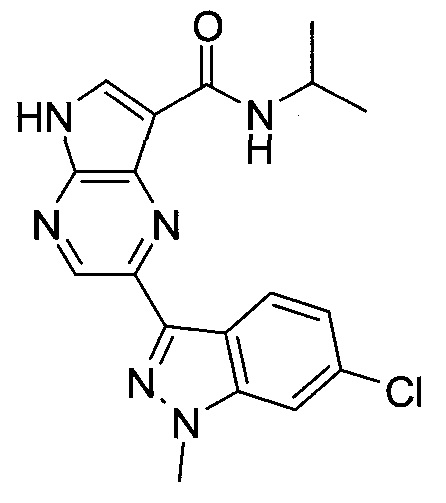
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
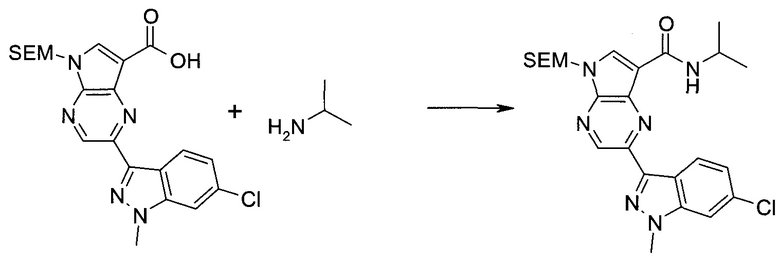
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (80 мг; 0,175 ммоль), O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (84 мг;
0,26 ммоль) и N,N-диизопропилэтиламин (0,076 мл; 0,44 ммоль) растворяли в ацетонитриле (1,75 мл). Добавляли изопропиламин (0,018 мл; 0,21 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и этилацетат, слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия, сушили над сульфатом натрия и концентрировали. Остаток очищали хроматографией на силикагеле (этилацетат/гексаны), получая 45 мг (52%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида. (M+H)+=500.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
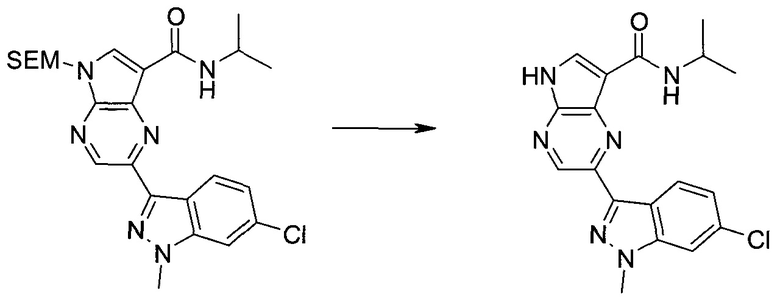
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид (45 мг; 0,09 ммоль) растворяли в дихлорметане (0,9 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,3 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3,5 ч. Реакционную смесь упаривали и остаток растворяли в дихлорметане (2 мл). Добавляли этилендиамин (0,36 мл; 5,4 ммоль) и смесь перемешивали при комнатной температуре в течение 18 ч. К этой смеси добавляли воду и затем этилацетат. Полученный осадок отфильтровывали, промывали водой и сушили под высоким вакуумом, получая 21 мг (81%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида. (M+Na)+=391; т.пл. = 356-362°C. 1H ЯМР (400 МГц, DMSO-d6) δ млн-1 12.79-12.90 (m, 1H), 9.09 (s, 1H), 8.44 (d, J=9,1 Гц, 1H), 8.42 (s, 1H), 8.02 (d, J=7,6 Гц, 1H), 8.00 (d, J=1,5 Гц, 1H), 7.30 (dd,J=8,8; 1,8 Гц, 1H), 4.19-4.27 (m, 1H), 4.17 (s, 3H), 1.32 (d, J=6,6 Гц, 6H).
Пример 109
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты этиламид
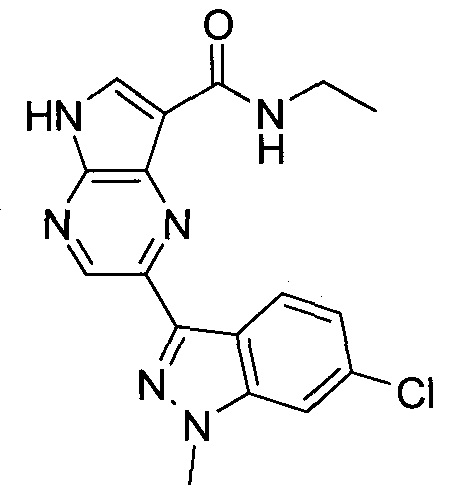
Получали в соответствии с методикой, приведенной в примере 108, заменяя этиламин на изопропиламин на стадии 1. MS: (M+Na)+=377; т.пл. = 373-377°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.79-12.88 (m, 1H), 9.09 (s, 1H), 8.42 (s, 1H), 8.43 (d, J=8,6 Гц, 1H), 8.07-8.14 (m, 1H), 7.99 (d, J=1,5 Гц, 1H), 7.32 (dd, J=8,6; 1,5 Гц, 1H), 4.17 (s, 3H), 3.44-3.54 (m, 2H), 1.31 (t, J=7,3 Гц, 3H).
Пример 110
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты циклогексиламид
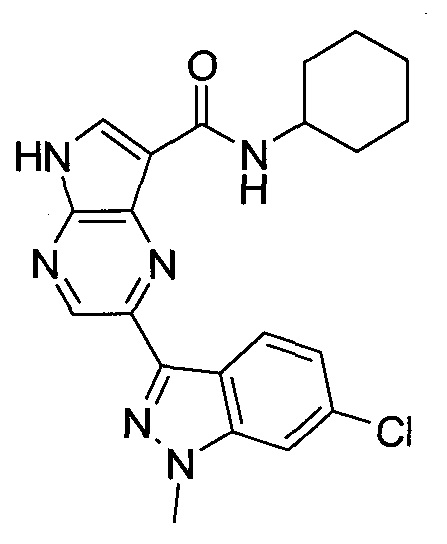
Получали в соответствии с методикой, приведенной в примере 108, заменяя циклогексиламин на изопропиламин на стадии 1. MS: (M+H)+=409; т.пл. = 321-323°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.81-12.89 (m, 1H), 9.08 (s, 1H), 8.41 (d, J=8,3 Гц, 1H), 8.43 (s, 1H), 8.06 (d, J=7,9 Гц, 1H), 8.00 (d, J=1,5 Гц, 1H), 7.27 (dd, J=8,7; 1,5 Гц, 1H), 4.17 (s, 3H), 3.84-3.98 (m, 1H), 1.99-2.09 (m, 2H), 1.74-1.84 (m, 2H), 1.59-1.70 (m, 1H), 1.20-1.49 (m, 5H).
Пример 111
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (тетрагидро-пиран-3-ил)-амид
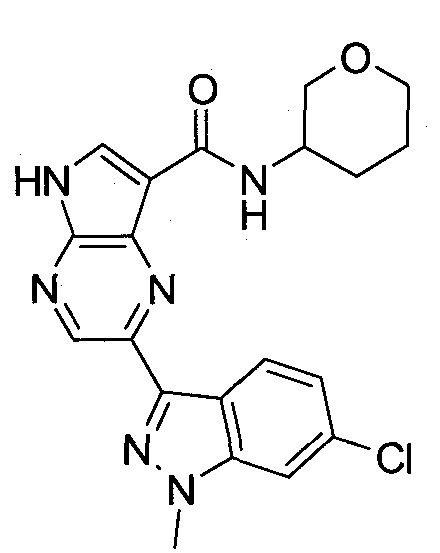
Получали в соответствии с методикой, приведенной в примере 108, заменяя тетрагидро-2H-пиран-3-иламина гидрохлорид на изопропиламин на стадии 1. MS: (M+Na)+=433; т.пл. = 339-342°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.91-13.01 (m, 1H), 9.11 (s, 1H), 8.52 (d, J=8,3 Гц, 1H), 8.45 (d, J=3,0 Гц, 1H), 8.19(d,J=7,9 Гц, 1H), 7.97-8.01 (m, 1H), 7.26 (dd, J=8,7; 1,5 Гц, 1H), 4.17 (s, 3H), 4.04-4.22 (m, 1H), 3.85-3.95 (m, 1H), 3.56-3.72 (m, 2H), 3.47-3.56 (m, 1H), 1.68-1.85 (m,2H), 1.49-1.65 (m, 2H).
Пример 112
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (тетрагидро-пиран-4-ил)-амид
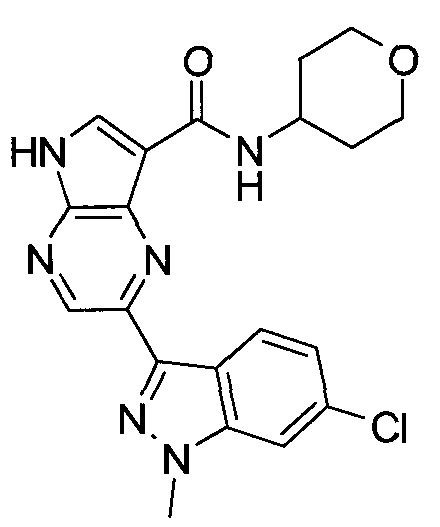
Получали в соответствии с методикой, приведенной в примере 108, заменяя тетрагидро-2H-пиран-4-иламина гидрохлорид на изопропиламин на стадии 1. MS: (M+Na)+=433; т.пл. = 355-358°C.1H ЯМР (300 МГц, DMSO-d6) δ: 12.85-12.93 (m, 1H), 9.09 (s, 1H), 8.43 (d, J=8,3 Гц, 1H), 8.46 (s, 1H), 8.11 (d, J=7,6 Гц, 1H), 8.01 (s, 1H), 7.26-7.33 (m, 1H), 4.07-4.23 (m, 4H), 3.90-4.00 (m, 2H), 3.42-3.55 (m, 2H), 1.97-2.08 (m, 2H), 1.51-1.68 (m, 2H).
Пример 113
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1,1-диоксо-тетрагидро-тиофен-3-ил)-амид
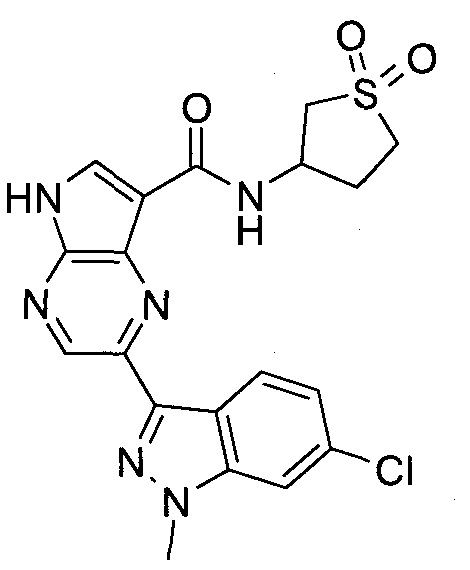
Получали в соответствии с методикой, приведенной в примере 108, заменяя 1,1-диоксо-тетрагидро-тиосрен-3-иламин (полученный как в WO 2008033562 A2) на изопропиламин на стадии 1. MS: (M+Na)+=467; т.пл. = 383-385°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.11 (s, 1H), 8.50 (d, J=9,8 Гц, 1H), 8.49 (s, 1H), 8.36 (d, J=7,2 Гц, 1H), 7.97-8.02 (m, 1H), 7.34-7.41 (m, 1H), 4.77-4.93 (m, 1H), 4.17 (s, 3H), 3.59-3.70 (m, 1H), 3.40-3.51 (m, 2H), 3.11-3.23 (m, 1H), 2.61-2.75 (m, 1H), 2.20-2.37 (m, 1H).
Пример 114
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-2,2-диметил-пропил)-амид
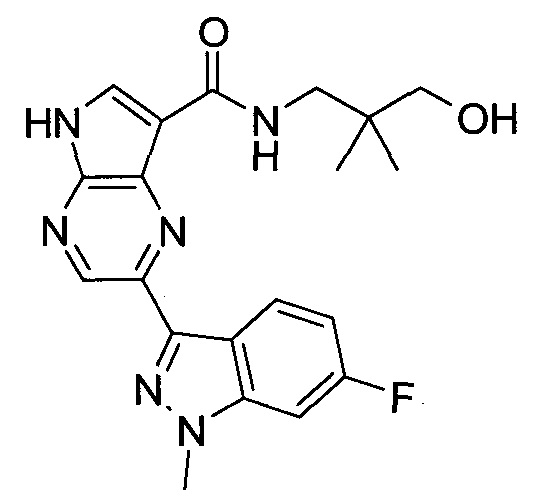
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-2,2-диметил-пропил)-амид
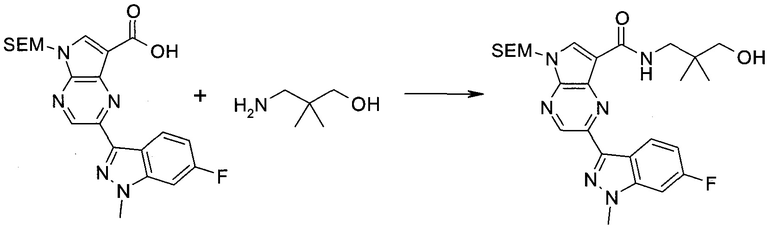
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (80 мг; 0,18 ммоль), O-бензо-
триазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (87 мг; 0,27 ммоль) и N,N-диизопропилэтиламин (0,16 мл; 0,91 ммоль) растворяли в ацетонитриле (1,8 мл). Добавляли 3-амино-2,2-диметилпропан-1-ол (22 мг; 0,22 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и этилацетат, слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия, сушили над сульфатом натрия и концентрировали. Остаток очищали хроматографией на силикагеле (этилацетат/гексаны), получая 85 мг (89%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-2,2-диметил-пропил)-амида. (M+Na)+=549.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-2,2-диметил-пропил)-амид
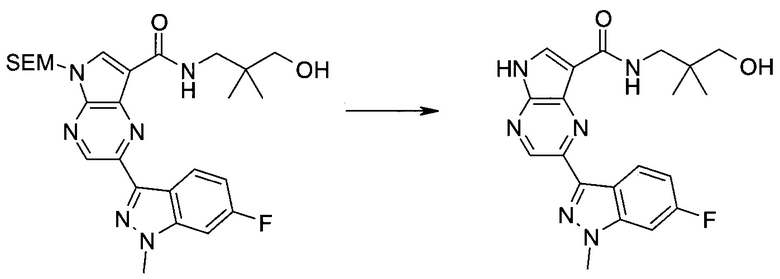
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-2,2-диметил-пропил)-амид (82 мг; 0,156 ммоль) суспендировали в дихлорметане (1,1 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,5 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3,5 ч. Реакционную смесь упаривали и остаток растворяли в дихлорметане (1,6 мл). Добавляли этилендиамин (0,63 мл; 9,3 ммоль) и смесь перемешивали при комнатной температуре в течение 18 ч. Затем к этой смеси добавляли воду и этилацетат, слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия, сушили над сульфатом натрия и концентрировали. Остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 39 мг (63%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-2,2-диметил-пропил)-амида в виде беловатого твердого вещества. (М+Na)+=419; т.пл. = 291-293°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.10 (s, 1H), 8.45 (s, 1H), 8.41-8.49 (m, 1H), 8.19-8.27 (m,
1H), 7.67 (dd, J=9,8; 2,3 Гц, 1H), 7.14-7.23 (m, 1H), 4.63-4.72 (m, 1H), 4.14 (s, 3H), 3.37-3.43 (m, 2H), 3.16-3.24 (m, 2H), 0.90 (s, 6H).
Пример 115
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2,2-диметил-пропил)-амид
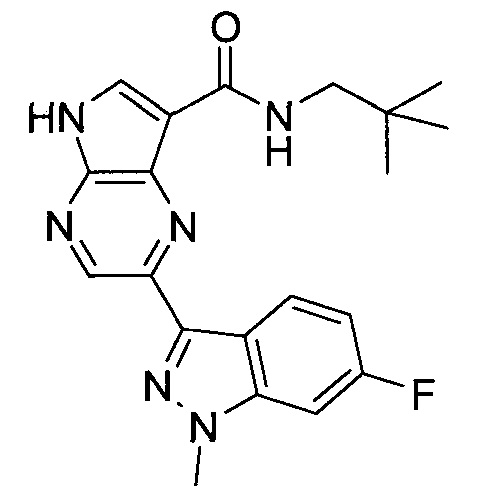
Получали в соответствии с методикой, приведенной в примере 114, заменяя 2,2-диметилпропиламин на 3-амино-2,2-диметилпропан-1-ол на стадии 1. MS: (M+Na)+=403; т.пл. = 294-295°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.81-12.93 (m, 1H), 9.09 (s, 1H), 8.44 (s, 1H), 8.41 (dd, J=8,9; 5,5 Гц, 1H), 8.21-8.29 (m, 1H), 7.67 (dd, J=9,8; 2,3 Гц, 1H), 7.12-7.22 (m, 1H), 4.14 (s, 3H), 3.33-3.38 (m, 2H), 0.95 (s, 9H).
Пример 116
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изобутил-амид
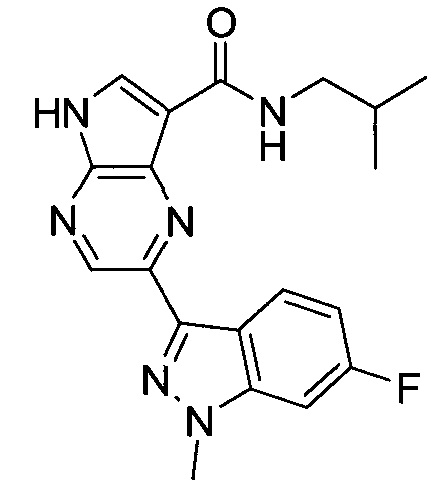
Получали в соответствии с методикой, приведенной в примере 114, заменяя изобутиламин на 3-амино-2,2-диметилпропан-1-ол на стадии 1. MS: (M+H)+=367; т.пл. = 285-287°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.79-12.89 (m, 1H), 9.09 (s, 1H), 8.42 (dd, J=9,1; 5,3 Гц, 1H), 8.43 (s, 1H), 8.18-8.28 (m, 1H), 7.68 (dd, J=9,6; 2,1 Гц, 1H), 7.13-7.23 (m, 1H), 4.14 (s, 3H), 3.34-3.37 (m, 2H), 1.91 (s, 1H), 0.98 (d, J=6,8 Гц, 6H).
Пример 117
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты циклопропилметил-амид
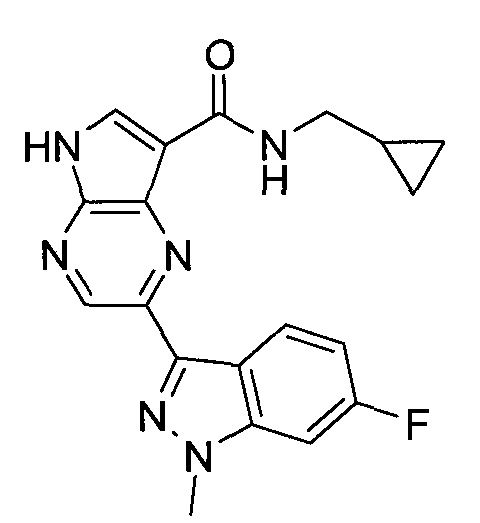
Получали в соответствии с методикой, приведенной в примере 114, заменяя циклопропилметиламин на 3-амино-2,2-диметилпропан-1-ол на стадии 1. MS: (M+Na)+=387; т.пл. = 319-322°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.80-12.88 (m, 1H), 9.09-9.12 (m, 1H), 8.48 (dd, J=8,9; 5,5 Гц, 1H), 8.43 (s, 1H), 8.17-8.25 (m, 1H), 7.68 (dd, J=9,8; 2,3 Гц, 1H), 7.13-7.23 (m, 1H), 4.15 (s, 3H), 3.34-3.39 (m, 2H), 1.08-1.22 (m, 1H), 0.52-0.60 (m, 2H), 0.29-0.36 (m, 2H).
Пример 118
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((3)-3-фтор-пирролидин-1-ил)-1-метил-2-оксо-этил]-амид
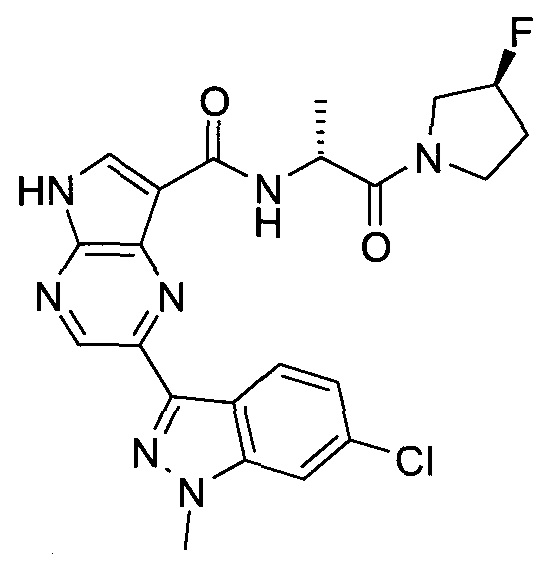
Стадия 1
[(R)-2-((S)-3-Фтор-пирролидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир
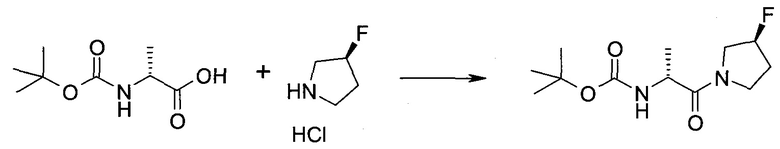
(R)-2-трет-Бутоксикарбониламино-пропионовую кислоту (1,0 г; 5,3 ммоль), 1-(3-(диметиламино)-пропил)-3-этилкарбодиимид (2,33 г; 12,2 ммоль) и гидроксибензотриазол (1,64 г; 12,2 ммоль) растворяли в DMF (50 мл). Добавляли (S)-3-фторпирролидина гидрохлорид (1,66 г; 13,2 ммоль) и N,N-диизопропил-этиламин (2,95 мл; 16,9 ммоль) и смесь перемешивали при
комнатной температуре в течение 16 ч. Добавляли этилацетат и раствор три раза промывали 10%-ным раствором лимонной кислоты. Органический слой промывали раствором бикарбоната натрия и затем повторно экстрагировали этилацетатом четыре раза. Затем объединенные органические слои далее промывали раствором хлорида лития, раствором хлорида натрия и сушили над сульфатом магния. После концентрирования раствора получали 1,3 г (94%) [(R)-2-((S)-3-фтор-пирролидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутилового эфира.
Стадия 2
(R)-2-Амино-1-((S)-3-фтор-пирролидин-1-ил)-пропан-1-она трифторацетат
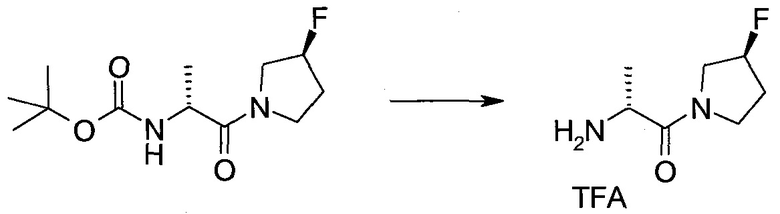
[(R)-2-((S)-3-Фтор-пирролидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир (43 мг; 0,127 ммоль) растворяли в дихлорметане (1,6 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,8 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем упаривали и сушили под высоким вакуумом, получая (R)-2-амино-1-((S)-3-фтор-пирролидин-1-ил)-пропан-1-она трифторацетат, который использовали без дополнительной очистки.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((S)-3-фтор-пирролидин-1-ил)-1-метил-2-оксо-этил]-амид
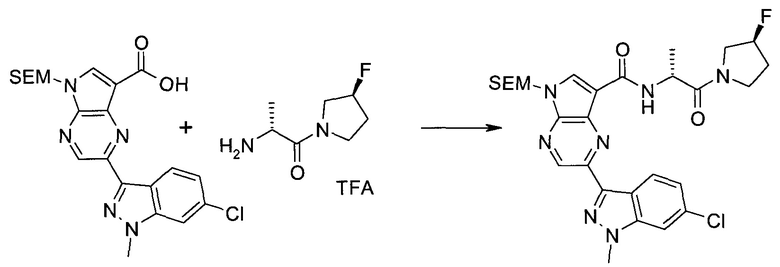
(R)-2-Амино-1-((S)-3-фтор-пирролидин-1-ил)-пропан-1-она трифторацетат (неочищенный со стадии 2) растворяли в ацетонитриле (4 мл), куда затем добавляли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (60 мг;
0,13 ммоль), O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (63 мг; 0,197 ммоль) и N,N-диизопропилэтиламин (0,092 мл; 0,52 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и затем добавляли воду и этилацетат. Слои разделяли и водный слой еще раз экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (этилацетат/гексаны), получая 55 мг (70%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((S)-3-фтор-пирролидин-1-ил)-1-метил-2-оксо-этил]-амида. 1H ЯМР (300 МГц, CDCl3) δ: 9.29 (s, 1H), 8.88-8.93 (m, 1H), 8.85 (d, J=8,1 Гц, 1H), 8.32 (s, 1H), 7.43-7.46 (m, 1H), 7.35-7.39 (m, 1H), 5.70-5.74 (m, 2H), 5.21-5.26 (m, 1H), 4.15 (s, 3H), 3.61-4.00 (m, 5H), 3.54-3.61 (m, 2H), 2.06-2.46 (m, 2H), 1.59 (d, J=6,6 Гц, 3H), 0.90-0.97 (m, 2H), -0.05 (s, 9H).
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((S)-3-фтор-пирролидин-1-ил)-1-метил-2-оксо-этил]-амид
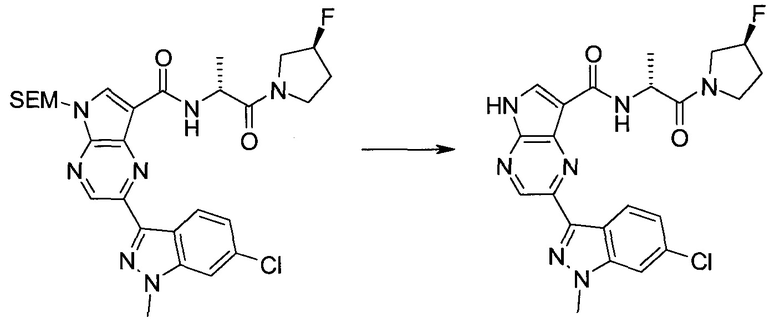
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((S)-3-фтор-пирролидин-1-ил)-1-метил-2-оксо-этил]-амид (54 мг; 0,09 ммоль) растворяли в дихлорметане (0,9 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,45 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч. Реакционную смесь упаривали и остаток суспендировали в дихлорметане (0,9 мл). Добавляли этилендиамин (0,36 мл; 5,4 ммоль) и смесь перемешивали в течение 18 ч. Затем к этой смеси добавляли воду и этилацетат .Полученный осадок отфильтровывали, промывали водой и сушили под высоким вакуумом, получая 24 мг (58%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((S)-3-фтор-
пирролидин-1-ил)-1-метил-2-оксо-этил]-амида. MS: (M+H)+=470; т.пл. = 269-271°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.16 (s, 1H), 8.81-8.91 (m, 1H), 8.53-8.62 (m, 1H), 8.47 (d, J=2,0 Гц, 1H), 7.97 (s, 1H), 7.25-7.33 (m, 1H), 5.27-5.52 (m, 1H), 4.95-5.11 (m, 1H), 4.18 (s, 3H), 3.96-4.12 (m, 1H), 3.73-3.92 (m, 1H), 3.61-3.72 (m, 1H), 2.08-2.35 (m, 1H), 1.38-1.48 (m, 3H).
Пример119
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((R)-3-фтор-пирролидин-1-ил)-1-метил-2-оксо-этил]-амид
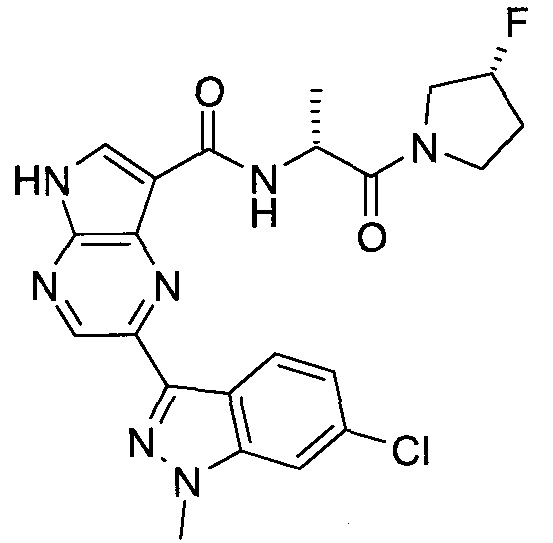
Получали в соответствии с методикой, приведенной в примере 118, заменяя (R)-3-фтор-пирролидина гидрохлорид на (S)-3-фторпирролидина гидрохлорид на стадии 1. MS: (M+H)+=470; т.пл. = 272-274°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.85-12.95 (m, 1H), 9.15 (s, 1H), 8.80-8.87 (m, 1H), 8.55 (d, J=8,6 Гц, 1H), 8.46 (d, J=2,5 Гц, 1H), 7.97 (d, J=1,5 Гц, 1H), 7.24-7.32 (m, 1H), 5.26-5.53 (m, 1H), 4.92-5.09 (m, 1H), 4.18 (s, 3H), 3.67-3.95 (m, 2H), 3.36-3.62 (m, 2H), 2.09-2.34 (m, 2H), 1.40-1.47 (m, 3H).
Пример 120
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-фтор-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
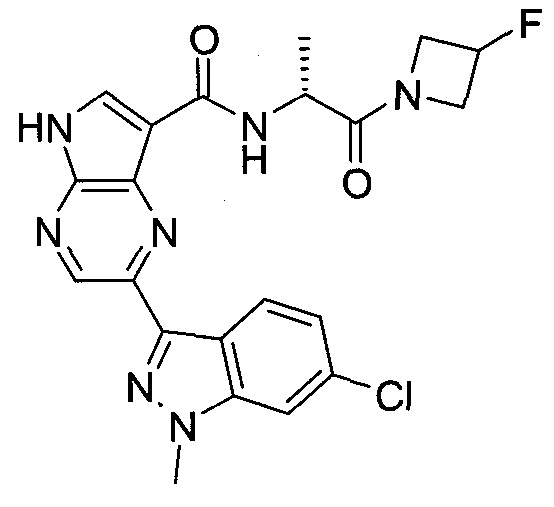
Получали в соответствии с методикой, приведенной в примере 118, заменяя 3-фтор-азетидина гидрохлорид на (S)-3-фторпирролидина гидрохлорид на стадии 1. MS: (M+H)+=456; т.пл. = 257-260°C. 1H ЯМР (300 МГц, DMSO-d6) δ:
9.14 (s, 1H), 8.70-8.81 (m, 1H), 8.48 (br. s., 1H), 8.42-8.53 (m, 1H), 7.97 (s, 1H), 7.22-7.31 (m, 1H), 5.30-5.59 (m, 1H), 4.20-4.85 (m, 4H), 4.17 (s, 3H), 3.90-4.10 (m, 1H), 1.36-1.48 (m, 3H).
Пример 121
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((R)-3-фтор-пирролидин-1-ил)-1-метил-этил]-амид
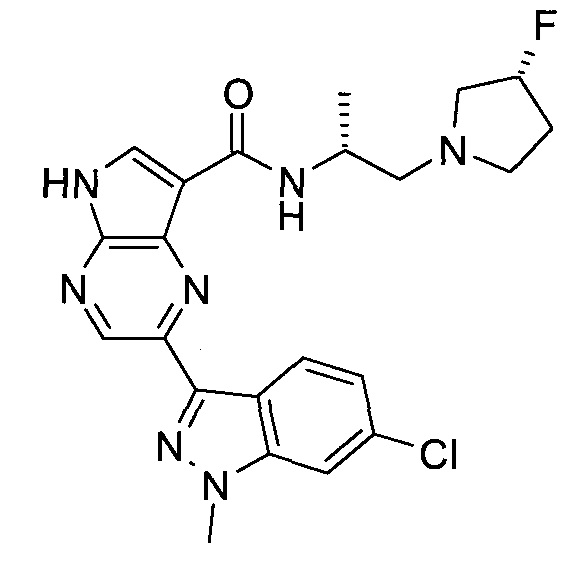
Стадия 1
[(R)-2-((R)-3-Фтор-пирролидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир
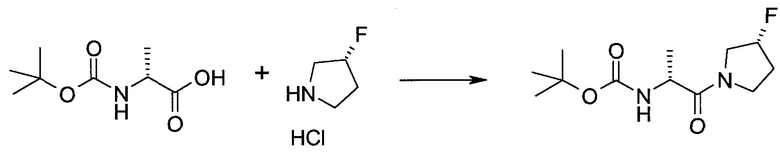
Стадия 1
(R)-трет-Бутоксикарбониламино-пропионовую кислоту (1,0 г; 5,3 ммоль), 1-(3-(диметиламино)-пропил)-3-этилкарбодиимид (2,33 г; 12,2 ммоль) и гидроксибензотриазол (1,64 г; 12,2 ммоль) растворяли в DMF (50 мл). Добавляли (R)-3-фторпирролидина гидрохлорид (1,66 г; 13,2 ммоль) и N,N-диизопропил-этиламин (2,95 мл; 16,9 ммоль) и смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли этилацетат и раствор три раза промывали 10%-ным раствором лимонной кислоты. Органический слой промывали раствором бикарбоната натрия и затем повторно экстрагировали этилацетатом четыре раза. Затем объединенные органические слои далее промывали раствором хлорида лития, раствором хлорида натрия и сушили над сульфатом магния. После концентрирования раствора получали 1,3 г (94%) [(R)-2-((R)-3-фтор-пирролидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутилового эфира.
Стадия 2
[(R)-2-((R)-3-Фтор-пирролидин-1-ил)-1-метил-этил]-карбаминовой кислоты трет-бутиловый эфир
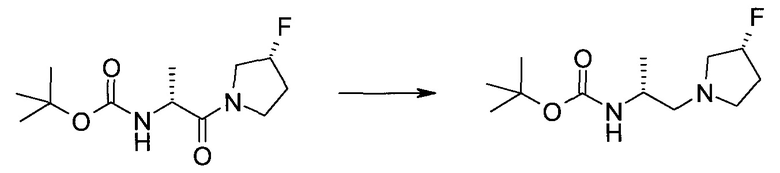
[(R)-2-((R)-3-Фтор-пирролидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир (50 мг; 0,19 ммоль) растворяли в диэтиловом эфире (0,8 мл) и перемешивали в бане с ледяной водой. По каплям добавляли алюмогидрид лития (1,0 М в диэтиловом эфире; 0,38 мл; 0,38 ммоль). Реакционную смесь перемешивали при 0°C и мониторинг реакции проводили посредством TLC. После того, как делали вывод о полном завершении реакции, добавляли воду (15 мкл), затем 10%-ный раствор гидроксида натрия (23 мкл) и после этого воду (45 мкл). Реакционную смесь нагревали до комнатной температуры, затем фильтровали. Фильтрат упаривали, получая 47 мг (99%) [(R)-2-((R)-3-фтор-пирролидин-1-ил)-1-метил-этил]-карбаминовой кислоты трет-бутилового эфира.
Стадия 3
(R)-2-((R)-3-Фтор-пирролидин-1-ил)-1-метил-этиламина бистрифторацетат
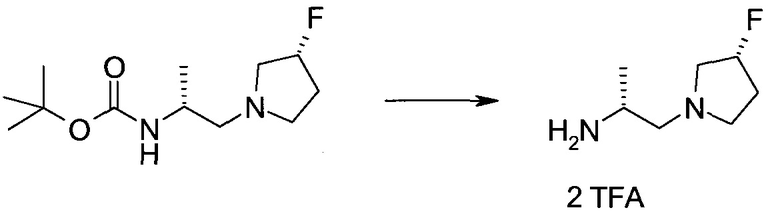
[(R)-2-((R)-3-Фтор-пирролидин-1-ил)-1-метил-этил]-карбаминовой кислоты трет-бутиловый эфир (48 мг; 0,185 ммоль) растворяли в дихлорметане (1,2 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,74 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем упаривали, получая (R)-2-((R)-3-фтор-пирролидин-1-ил)-1-метил-этиламина бистрифторацетат, который использовали без дополнительной очистки.
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((R)-3-фтор-пирролидин-1-ил)-1-метил-этил]-амид
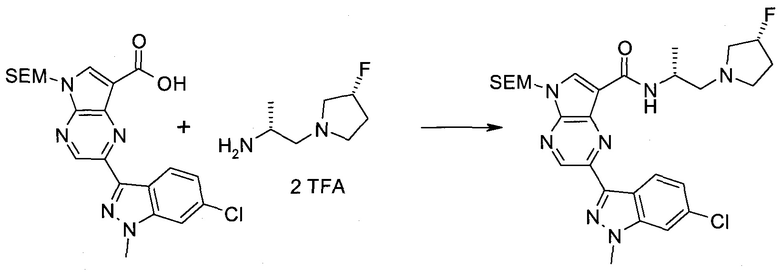
(R)-2-((R)-3-Фтор-пирролидин-1-ил)-1-метил-этиламина бистрифторацетат (неочищенный со стадии 3) растворяли в ацетонитриле (4 мл), куда затем добавляли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (65 мг; 0,14 ммоль), 0-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (68 мг; 0,21 ммоль) и N,N-диизопропилэтиламин (0,12 мл; 0,71 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и затем добавляли воду и этилацетат. Слои разделяли и водный слой еще раз экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 65 мг (78%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((R)-3-фтор-пирролидин-1-ил)-1-метил-этил]-амида. (M+H)+=586.
Стадия 5
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((R)-3-фтор-пирролидин-1-ил)-1-метил-этил]-амид
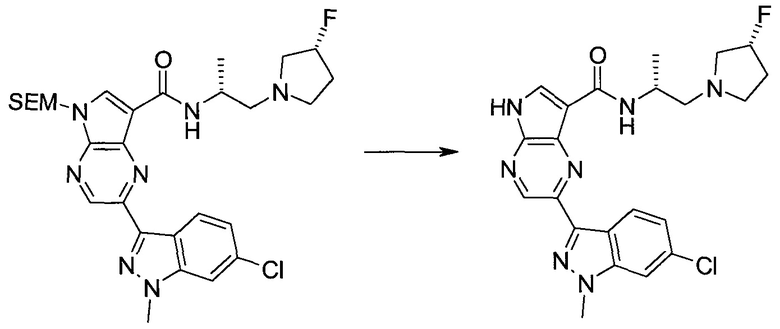
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((R)-3-фтор-пирролидин-1-ил)-1-метил-этил]-амид (65 мг; 0,11 ммоль) растворяли в дихлорметане (0,7 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту
(0,4 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь упаривали и остаток суспендировали в дихлорметане (1,1 мл). Добавляли этилендиамин (0,45 мл; 6,65 ммоль) и смесь перемешивали в течение 18 ч. Затем к этой смеси добавляли воду и этилацетат. Слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 33 мг (65%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((R)-3-фтор-пирролидин-1-ил)-1-метил-этил]-амида. MS: (M+H)+=456; т.пл. = 233-234°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.81-12.93 (m, 1H), 9.10 (s, 1H), 8.44 (s, 1H), 8.38-8.46 (m, 1H), 8.07 (d, J=8,3 Гц, 1H), 7.99-8.03 (m, 1H), 7.28-7.36 (m, 1H), 4.97-5.24 (m, 1H), 4.20-4.33 (m, 1H), 4.17 (s, 3H), 2.54-2.90 (m, 1H), 2.54-2.90 (m, 4H), 2.32-2.44 (m, 1H), 1.66-2.13 (m, 2H), 1.32 (d, J=6,4 Гц, 3H).
Пример 122
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((S)-3-фтор-пирролидин-1-ил)-1-метил-этил]-амид
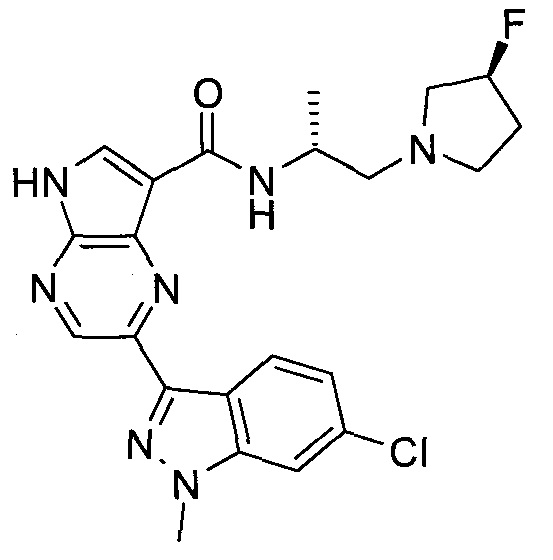
Получали в соответствии с методикой, приведенной в примере 121, заменяя (S)-3-фторпирролидина гидрохлорид на (R)-3-фторпирролидина гидрохлорид на стадии 1. MS: (M+H)+=456; т.пл. = 251-253°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.81-12.94 (m, 1H), 9.09 (s, 1H), 8.43 (s, 1H), 8.43 (d, J=8,7 Гц, 1H), 8.04-8.11 (m, 1H), 8.01 (d, J=1,1 Гц, 1H), 7.32 (dd, J=8,7; 1,5 Гц, 1H), 4.96-5.23 (m, 1H), 4.20-4.34 (m, 1H), 4.17 (s, 3H), 2.58-2.93 (m, 5H), 2.37-2.47 (m, 1H), 1.65-2.12 (m, 2H), 1.33 (d, J=6,4 Гц, 3H).
Пример 123
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-фтор-азетидин-1-ил)-1-метил-этил]-амид
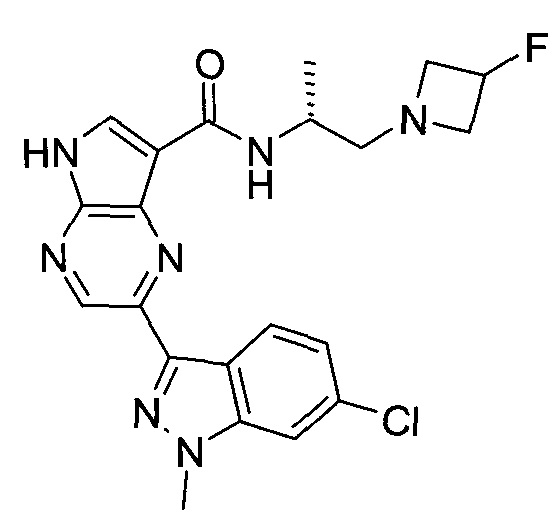
Получали в соответствии с методикой, приведенной в примере 121, заменяя 3-фтор-азетидина гидрохлорид на (R)-3-фторпирролидина гидрохлорид на стадии 1. MS: (M+H)+=442; т.пл. = 182-185°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.76-12.96 (m, 1H), 9.11 (s, 1H), 8.44 (s, 1H), 8.38-8.49 (m, 1H), 8.05 (d, J=8,3 Гц, 1H), 8.02 (d, J=1,5 Гц, 1H), 7.29-7.35 (m, 1H), 4.88-5.18 (m, 1H), 4.18 (s, 3H), 4.08-4.22 (m, 1H), 3.48-3.73 (m, 2H), 3.04-3.29 (m, 2H), 2.62-2.85 (m, 2H), 1.29 (d, J=6,8 Гц, 3H).
Пример 124
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
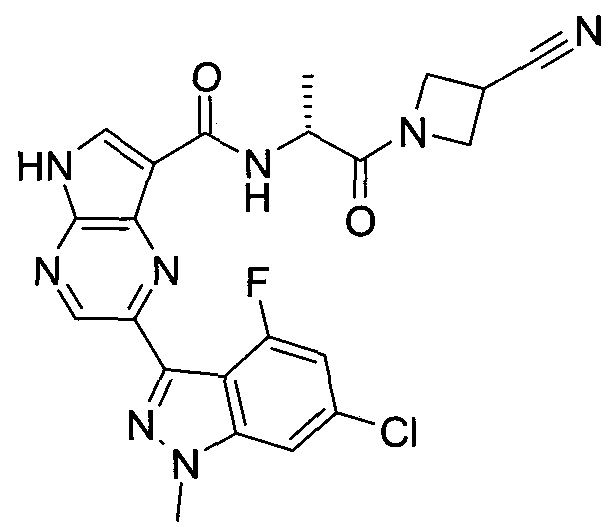
Стадия 1
6-Хлор-4-фтор-1H-индазол

4-Хлор-2,6-дифтор-бензальдегид (15 г; 85 ммоль) растворяли в 1,2-диметоксиэтане 170 мл). Затем добавляли O-метил-гидроксиламина гидрохлорид (7,1 г; 85 ммоль) и карбонат калия (12,9 г; 93,5 ммоль) и смесь перемешивали при 35°C в течение 24 ч. Реакционную смесь фильтровали, промывали дихлорметаном, упаривали и снова растворяли в DMF (170 мл). Добавляли гидразин (2,9 мл 93,5 ммоль) и реакционную смесь перемешивали при 100°C в течение 1 ч. После охлаждения добавляли воду и этилацетат. Слои разделяли и
водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали водой и раствором хлорида натрия, затем сушили над сульфатом натрия. Растворитель выпаривали, получая твердое вещество, которое очищали хроматографией на силикагеле (диэтиловый эфир/гексаны), получая 7 г (49%) 6-хлор-4-фтор-1H-индазола. (M+H)+=171.
Стадия 2
6-Хлор-4-фтор-3-иод-1H-индазол
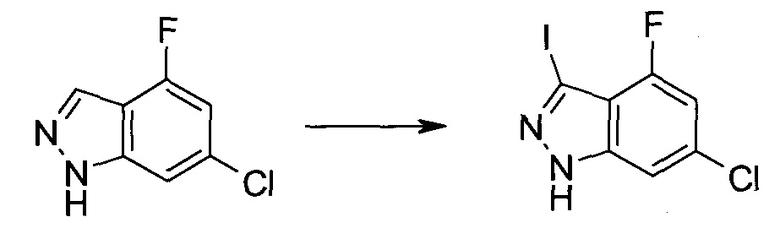
6-Хлор-4-фтор-1H-индазол (7,6 г; 44,6 ммоль) растворяли в DMF (110 мл). Добавляли йод (22,6 г; 89,1 ммоль), затем гидроксид калия (9,5 г; 169 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч. Добавляли воду, 1 М раствор тиосульфата натрия и диэтиловый эфир. Слои разделяли и водный слой еще раз экстрагировали эфиром. Органические слои промывали водой и раствором хлорида натрия и затем сушили над сульфатом натрия. После выпаривания растворителя получали 11,16 г (85%) 6-Хлор-4-фтор-3-иод-1H-индазола в виде светло-коричневого твердого вещества (M-H)-=295.
Стадия 3
6-Хлор-4-фтор-3-трибутилстаннанил-1H-индазол

6-Хлор-4-фтор-3-иод-1H-индазол (10,1 г; 34,1 ммоль) растворяли в THF (170 мл). Содержимое реакционной колбы перемешивали в водяной бане и добавляли гидрид натрия (60%-ную дисперсию; 1,64 г; 40,9 ммоль). Смесь перемешивали в течение 15 мин, затем охлаждали до -15°C в бане со смесью лед/соль. По каплям добавляли хлорид изопропилмагния (2,0 М в THF; 20,6 мл; 41,2 ммоль). Через 40 мин медленно добавляли хлорид трибутилолова (11,6 мл; 42,6 ммоль) и реакционную смесь оставляли нагреваться до комнатной температуры. После еще 2 ч перемешивания добавляли раствор хлорида аммония и этилацетата. Слои разделяли и водный слой еще раз экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После выпаривания растворителя
получали 6-хлор-4-фтор-3-трибутилстаннанил-1H-индазола в виде масла, которое непосредственно использовали на следующей стадии.
Стадия 4
2-(6-Хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
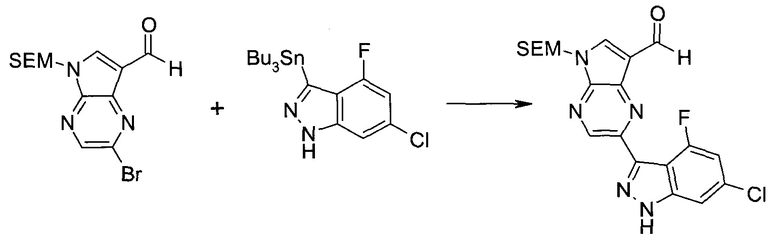
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (7,6 г; 18,6 ммоль) и 6-хлор-4-фтор-3-трибутилстаннанил-1H-индазол (неочищенный со стадии 3) растворяли в DMF (180 мл) и продували Ar(газ.). Добавляли тетракис(трифенилфосфин)палладий (1,07 г; 0,93 ммоль) и затем иодид меди (707 мг; 3,71 ммоль), колбу закрывали пробкой и содержимое перемешивали при 90°C в масляной бане в течение 20 ч. Реакционную смесь охлаждали и добавляли воду, этилацетат и раствор бикарбоната натрия. Слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали водой и раствором хлорида натрия, затем сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан) с последующим растиранием со смесью диэтиловый эфир/гексаны, получая 3,9 г (47%) 2-(6-хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида. (M+H)+=446.
Стадия 5
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
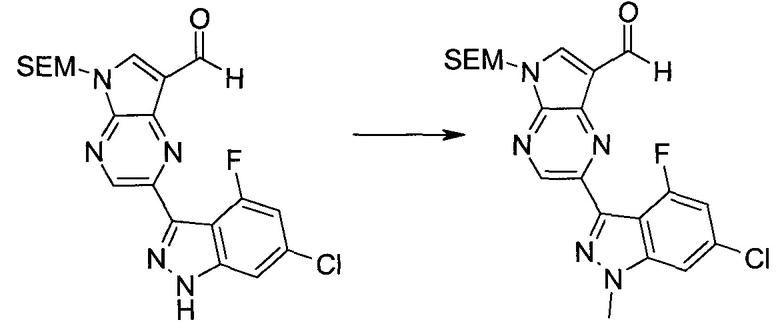
2-(6-Хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (0,5 г; 1,12 ммоль) растворяли в DMF
(5,6 мл) и охлаждали в ледяной бане. Осторожно добавляли гидрид натрия (60%-ную дисперсию; 67 мг; 1,68 ммоль). Смесь перемешивали в течение 10 мин, затем добавляли иодметан (84 мкл; 1,35 ммоль) и реакционную смесь нагревали до комнатной температуры и перемешивали в течение 18 ч. К реакционной смеси добавляли воду и этилацетат. Слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали водой и раствором хлорида натрия и сушили над сульфатом натрия. После упаривания сохранившийся остаток очищали хроматографией на силикагеле (этилацетат/дихлорметан), получая 257 мг (50%) 2-(6-хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида. (M+H)+=460.
Стадия 6
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
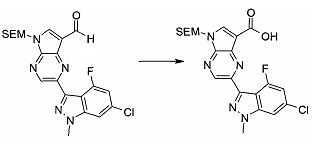
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (255 мг; 0,55 ммоль) растворяли в THF (8,3 мл) и воде (2,8 мл). Добавляли сульфаминовую кислоту (517 мг; 5,3 ммоль). Реакционную колбу охлаждали в бане с ледяной водой и медленно добавляли раствор хлорита натрия (104 мг; 1,15 ммоль) и фосфата калия моноосновного (1,45 г; 10,6 ммоль) в воде (8 мл). Через 1 ч реакционную смесь выливали в этилацетат и воду. Слои разделяли и водный слой еще раз экстрагировали этилацетатом. Объединенные органические слои промывали водой и раствором хлорида натрия и сушили над сульфатом натрия. После выпаривания растворителя получали 270 мг 2-(6-хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этокси метил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты в виде светло-желтого твердого вещества. (M+H)+=476.
Стадия 7
1-((R)-2-Амино-пропионил)-азетидин-3-карбонитрила трифторацетат
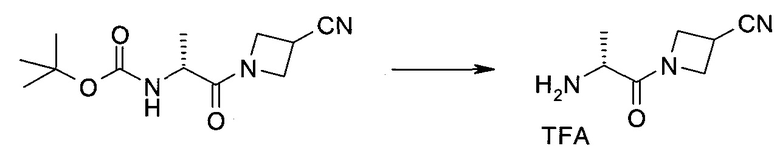
[(R)-2-(3-Цианоазетидин-1-ил)-1-метил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир (47 мг; 0,185 ммоль) растворяли в дихлорметане (1 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,5 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем упаривали и сушили под высоким вакуумом, получая 1-((R)-2-амино-пропионил)-азетидин-3-карбонитрила трифторацетат, который использовали без дополнительной очистки.
Стадия 8
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
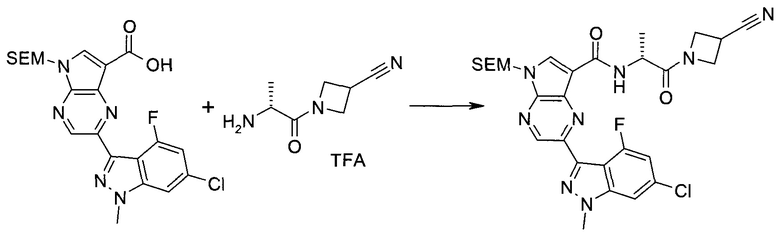
1-((R)-2-Амино-пропионил)-азетидин-3-карбонитрила трифторацетат (неочищенный со стадии 7) растворяли в ацетонитриле (2 мл), куда затем добавляли 2-(6-хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (80 мг; 0,168 ммоль), O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (81 мг; 0,252 ммоль) и N,N-диизопропилэтиламин (0,15 мл; 0,84 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и затем добавляли воду и этилацетат. Слои разделяли и водный слой еще раз экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 84 мг (82%) 2-(6-хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида. (M+Na)+=633.
Стадия 9
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
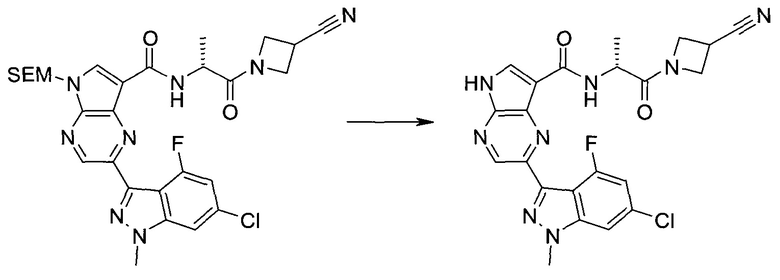
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (84 мг; 0,137 ммоль) суспендировали в дихлорметане (2 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,9 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем упаривали. Остаток растворяли в дихлорметане (1,4 мл) и добавляли этилендиамин (0,55 мл; 8,25 ммоль). Реакционную смесь перемешивали в течение 8 ч. Добавляли воду, получая мутную смесь, которую восемь раз экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. Сушильный агент отфильтровывали, промывали смесью 10% метанол/дихлорметан и упаривали до получения остатка. Его объединяли с твердым веществом, которое появлялось в водном слое. Объединенное вещество очищали хроматографией на силикагеле (метанол/дихлорметан), получая 32 мг (48%) 2-(6-хлор-4-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида. (M+H)+=481; т.пл. = 267-268°C. 1H ЯМР (300 МГц, DMSO-d6 δ: 9.00 (s, 1H), 8.54 (d, J=7,2 Гц, 1H), 8.49 (d,J=10,6 Гц, 1H), 7.86-7.90 (m, 1H), 7.18 (d, J=10,2 Гц, 1H), 4.42-4.69 (m, 3H), 4.18 (s, 3H), 4.07-4.17 (m, 1H), 3.95-4.05 (m, 1H), 3.76-3.87 (m, 1H), 1.32-1.41 (m, 3H).
Пример 125
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-(3-циано-пирролидин-1-ил)-1-метил-этил]-амид
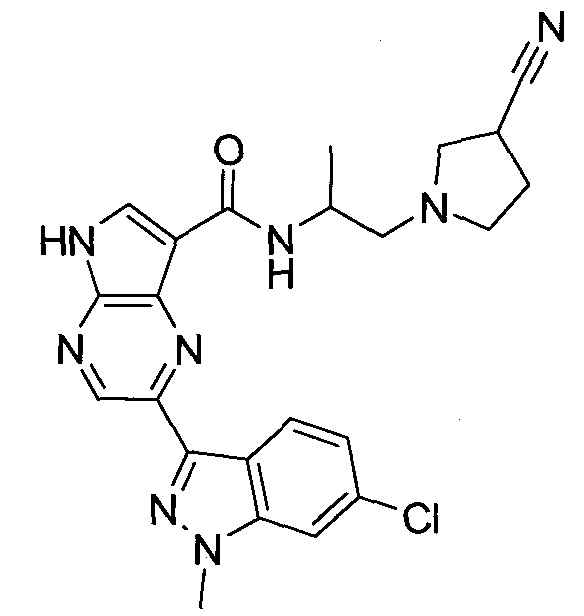
Стадия 1
[2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-ил]-(2-метил-азиридин-1-ил)-метанон
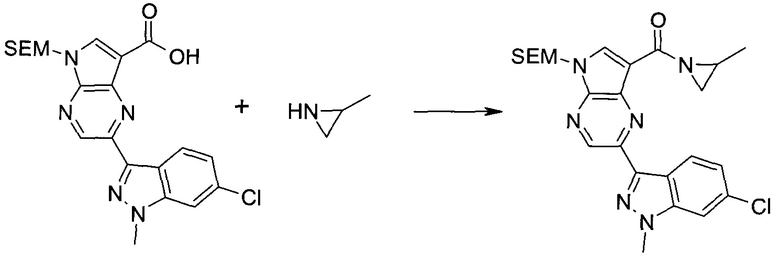
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[3,2-Ь]пиразин-7-карбоновую кислоту (100 мг; 0,218 ммоль) суспендировали в дихлорметане (2,2 мл). Добавляли 4-диметиламинопиридин (5,3 мг; 0,044 ммоль), N,N-диизопропилэтиламин (76 мкл; 0,44 ммоль) и затем 1-(3-(диметиламино)-пропил)-3-этилкарбодиимид (84 мг; 0,44 ммоль). Раствор перемешивали в течение 5 мин, затем охлаждали в ледяной бане. Добавляли 2-метилазиридин (23 мкл; 0,33 ммоль) и реакционную смесь нагревали до комнатной температуры. Перемешивание продолжали до установления посредством TLC факта завершения реакции, затем добавляли воду, разбавленную HCl и этилацетат. Водный слой еще раз экстрагировали этилацетатом и объединенные органические слои промывали раствором бикарбоната натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (этилацетат/гексаны), получая 70 мг (64%) [2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-ил]-(2-метил-азиридин-1-ил)-метанона. 1H ЯМР (300 МГц, CDCl3) δ млн-1 9.23 (s, 1H) 8.76 (d, J=8,7 Гц, 1H) 8.33 (s, 1H) 7.44 (s, 1H) 7.24 (d, J=8,7 Гц, 1H) 5.73 (s, 2H) 4.14 (s, 3H) 3.56-3.65 (m, 6H) 2.80-2.91 (m, 1H) 2.59 (d, J=6,0 Гц, 1H) 2.33 (d, J=3,8 Гц, 1H) 1.41 (d, J=5,3 Гц, 3H) 0.89-0.99 (m, 2H) -0.05 (s, 9H).
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-(3-циано-пирролидин-1-ил)-1-метил-этил]-амид
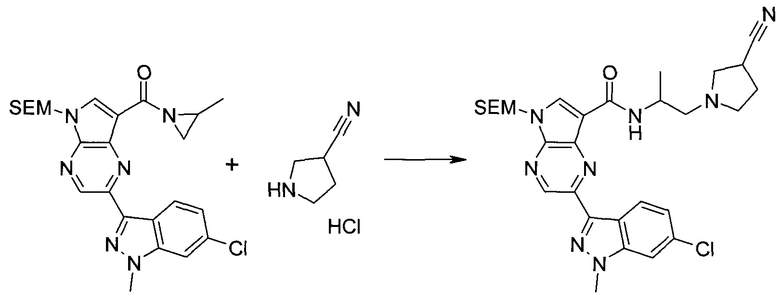
[2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-ил]-(2-метил-азиридин-1-ил)-метанон (70 мг; 0,14 ммоль) растворяли в смеси 1:1 THF : ацетонитрил (1,5 мл). Добавляли 3-цианопирролидина гидрохлорид (28 мг; 0,21 ммоль) и N,N-диизопропилэтиламин (37 мкл; 0,21 ммоль) и реакционную смесь нагревали в микроволновом реакторе при 120°C в течение 2 ч. Дополнительно добавляли по 0,5 экв. 3-цианопирролидина гидрохлорида и N,N-диизопропилэтиламина и нагревание повторяли еще дважды. Затем к охлажденному раствору добавляли воду и этилацетат. Водный слой еще дважды экстрагировали этилацетатом, объединенные органические экстракты промывали раствором хлорида натрия и сушили над сульфатом натрия. После выпаривания растворителя неочищенный остаток очищали хроматограсрией на силикагеле (этилацетат/дихлорметан), получая 21 мг (25%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-(3-циано-пирролидин-1-ил)-1-метил-этил]-амида. (M+H)+=593.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-(3-циано-пирролидин-1-ил)-1-метил-этил]-амид
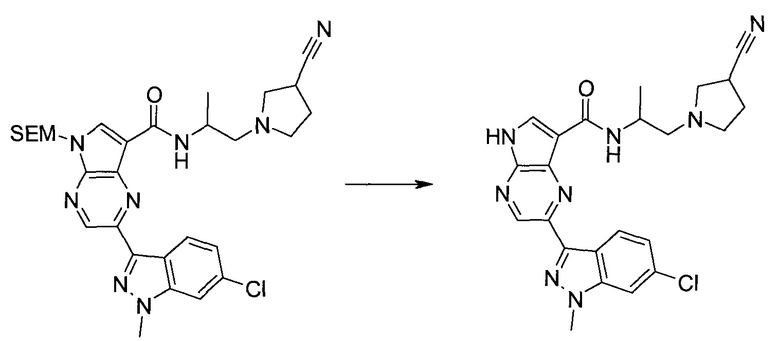
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-(3-циано-пирролидин-1-ил)-1-метил-этил]-амид (37 мг; 0,062 ммоль) растворяли в дихлорметане (0,8 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,4 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь упаривали и остаток растворяли в дихлорметане (1,2 мл). Добавляли этилендиамин (0,25 мл; 3,7 ммоль) и смесь перемешивали в течение 18 ч. Затем к этой смеси добавляли воду и этилацетат. Слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 15 мг (52%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-(3-циано-пирролидин-1-ил)-1-метил-этил]-амида. MS: (M+H)+=463; т.пл. = 206-209°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.83-12.94 (m, 1H), 9.10 (s, 1H), 8.38-8.51 (m, 2H), 8.04-8.13 (m, 1H), 7.99-8.04 (m, 1H), 7.30-7.39 (m, 1H), 4.20-4.36 (m, 1H), 4.18 (s, 3H), 3.07-3.22 (m, 1H), 2.53-2.88 (m, 5H), 1.99-2.15 (m, 1H), 1.74-1.92 (m, 1H), 1.33 (d, J=6,4 Гц, 3H).
Пример 126
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-этил]-амид
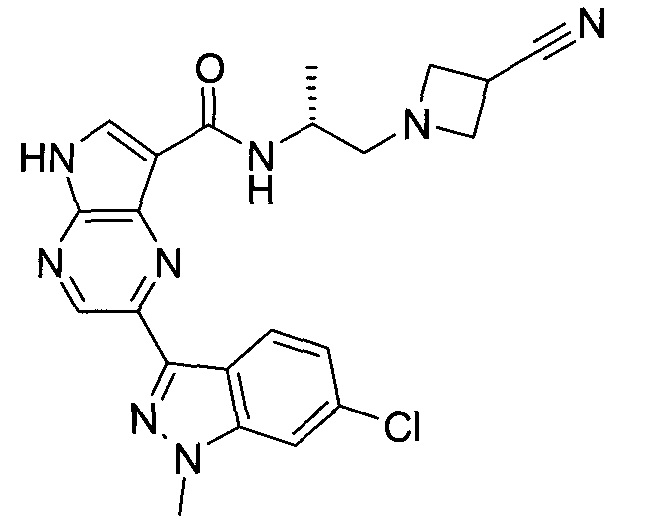
Стадия 1
(R)-2-Метил-1-(4-нитро-бензолсульфонил)-азиридин
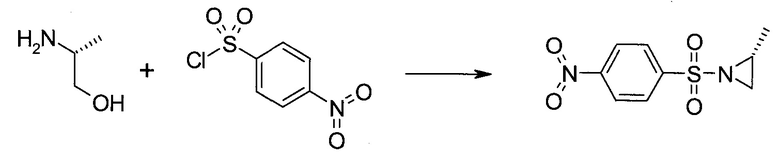
4-Нитробензол-1-сульфонилхлорид (6,9 г; 31 ммоль) растворяли в ацетонитриле (8 мл) и перемешивали в ледяной бане. Медленно добавляли раствор (R)-2-аминопропан-1-ола (1 г; 13,3 ммоль) в пиридине (5 мл) и реакционную смесь перемешивали в течение 2 ч. Добавляли этилацетат (25 мл) и воду (10 мл) и реакционную смесь перемешивали в течение 10 мин. Слои разделяли и органический слой дважды промывали 1 М раствором лимонной кислоты и один раз водой. Органический слой охлаждали до 10°C и добавляли 7 мл воды, затем по каплям добавляли N,N-диизопропилэтиламин (3,7 мл; 21,3 ммоль). После перемешивания в течение 1 ч слои разделяли и водный слой экстрагировали этилацетатом. Объединенные органические экстракты дважды промывали 1 М раствором лимонной кислоты и дважды водой. Затем добавляли изопропанол (70 мл) и растворители медленно выпаривали, главным образом изопропанол. После кристаллизации из изопропанола получали (R)-2-метил-1-(4-нитро-бензолсульфонил)-азиридин (2,2 г; 69%). 1H ЯМР (300 МГц, CDCl3) δ: 8.40 (d, J=9,1 Гц, 2H), 8.16 (d, J=9,1 Гц, 2H), 2.92-3.04 (m, 1H), 2.74 (d, J=7,2 Гц, 1H), 2.13 (d, J=4,5 Гц, 1H), 1.30 (d, J=5,7 Гц, 3H).
Стадия 2
N-[(R)-2-(3-Циано-азетидин-1-ил)-1-метил-этил]-4-нитро-бензолсульфонамид
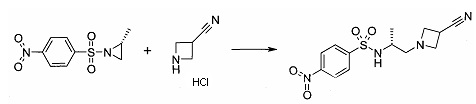
(R)-2-Метил-1-(4-нитро-бензолсульфонил)-азиридин (0,2 г; 0,83 ммоль) растворяли в THF (1 мл). Добавляли 3-цианоазетидина гидрохлорид (117 мг; 0,99 ммоль) и N,N-диизопропилэтиламин (0,2 мл; 1,16 ммоль) и реакционную смесь перемешивали в течение 64 ч. Затем добавляли воду и этилацетат. Водный слой еще дважды экстрагировали этилацетатом, объединенные органические экстракты промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на
силикагеле (этилацетат/гексаны), получая 133 мг (49%) N-[(R)-2-(3-циано-азетидин-1-ил)-1-метил-этил]-4-нитро-бензолсульфонамида. (M+H)+=325.
Стадия 3
N-[(R)-2-(3-Циано-азетидин-1-ил)-1-метил-этил]-4-нитро-бензолсульфонамид
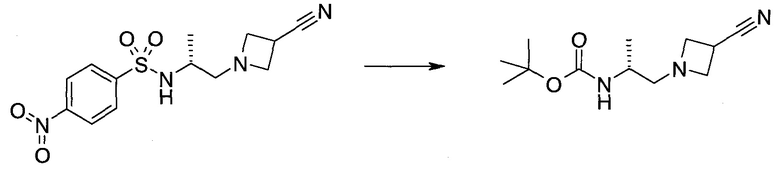
N-[(R)-2-(3-Циано-азетидин-1-ил)-1-метил-этил]-4-нитро-бензолсульфонамид (133 мг; 0,41 ммоль) растворяли в DMF (2 мл). Добавляли ди-трет-бутилдикарбонат (98 мг; 0,45 ммоль) и 4-диметиламинопиридин (55 мг; 0,45 ммоль) и реакционную смесь перемешивали в течение 6 ч. Затем добавляли тиофенол (63 мкл; 0,615 ммоль) и карбонат калия (170 мг; 1,23 ммоль) и реакционную смесь оставляли стоять в течение 16 ч при 0°C. Затем добавляли воду, раствор гидроксида натрия и этилацетат. Водный слой еще раз экстрагировали этилацетатом и объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (этилацетат/гексаны), получая 75 мг (76%) [(R)-2-(3-циано-азетидин-1-ил)-1-метил-этил]-карбаминовой кислоты трет-бутилового эфира. (M+H)+=240.
Стадия 4
1-((R)-2-Амино-пропил)-азетидин-3-карбонитрила бистрифторацетат
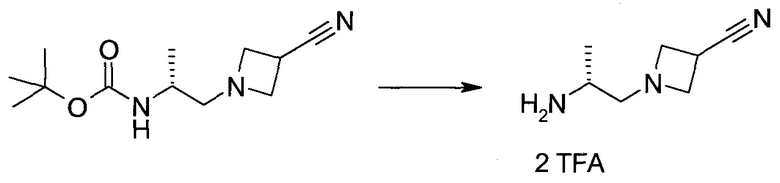
[(R)-2-(3-Циано-азетидин-1-ил)-1-метил-этил]-карбаминовой кислоты трет-бутиловый эфир (35 мг; 0,146 ммоль) растворяли в дихлорметане (1 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,45 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем упаривали и сушили под высоким вакуумом, получая 1-((R)-2-амино-пропил)-азетидин-3-карбонитрила бистрифторацетат, который использовали без дополнительной очистки.
Стадия 5
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-этил]-амид
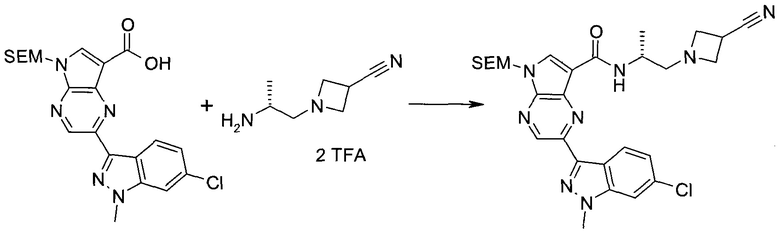
1-((R)-2-Амино-пропил)-азетидин-3-карбонитрила бистрифторацетат (неочищенный со стадии 4) растворяли в ацетонитриле (1,5 мл), куда затем добавляли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (60 мг; 0,132 ммоль), O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (70 мг; 0,22 ммоль) и N,N-диизопропилэтиламин (0,13 мл; 0,73 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и затем добавляли воду и этилацетат. Слои разделяли и водный слой еще раз экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 58 мг (64%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-этил]-амида. (M+H)+=579.
Стадия 6
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-этил]-амид
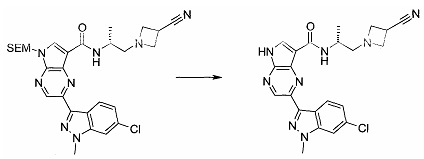
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-
метил-этил]-амид (58 мг; 0,10 ммоль) растворяли в дихлорметане (1,4 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,6 мл) и реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь упаривали и остаток растворяли в дихлорметане (1 мл). Добавляли этилендиамин (0,40 мл; 6,0 ммоль) и смесь перемешивали в течение 18 ч. Затем к этой смеси добавляли воду и этилацетат. Слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 29 мг (64%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-этил]-амида. MS: (M+H)+=449; т.пл. = 235-238°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.10 (s, 1H), 8.44 (d, J=8,7 Гц, 1H), 8.43 (s, 1H), 8.01 (d, J=1,5 Гц, 1H), 8.02 (d, J=8,3 Гц, 1H), 7.34 (dd, J=8,7; 1,5 Гц, 1H), 4.18 (s, 3H), 4.04-4.16 (m, 1H), 3.36-3.53 (m, 4H), 3.28 (d, J=7,9 Гц, 1H), 2.60-2.68 (m, 2H), 1.28 (d, J=6,8 Гц, 3H).
Пример 127
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
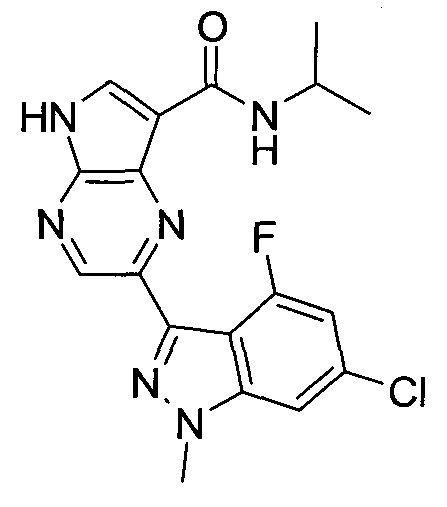
Стадия 1
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
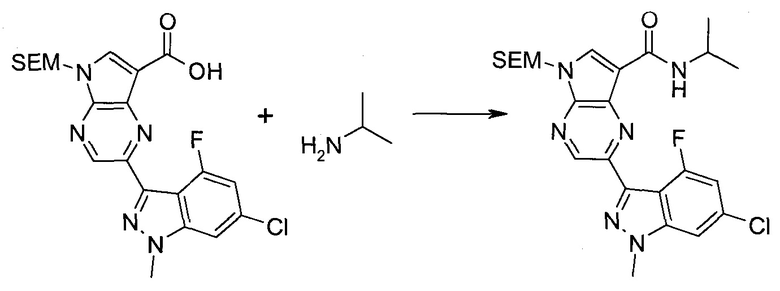
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (59 мг; 0,124 ммоль), O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (60 мг; 0,186 ммоль), N,N-диизопропилэтиламин (0,11 мл; 0,62 ммоль) и изопропиламин (11 мкл; 0,124 ммоль) совместно добавляли в ацетонитрил (1,3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем добавляли воду и этилацетат.Слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (этилацетат/гексаны), получая 46 мг (72%) 2-(6-хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида. (M+H)+=517.
Стадия 2
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
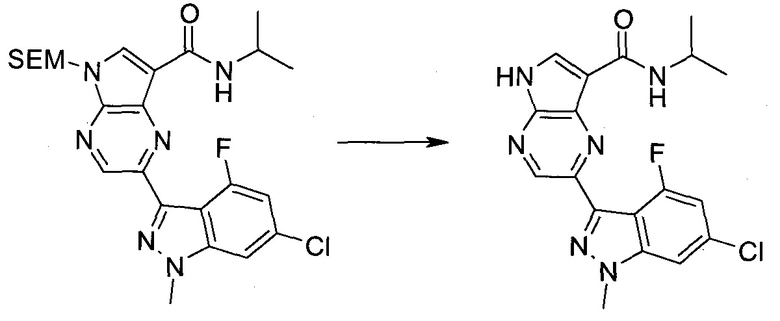
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид (46 мг; 0,09 ммоль) растворяли в дихлорметане (1,2 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,6 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь упаривали и остаток растворяли в дихлорметане (1 мл). Добавляли этилендиамин (0,36 мл; 5,3 ммоль) и смесь перемешивали в течение 18 ч. Затем к этой смеси добавляли воду и этилацетат. Полученный осадок отфильтровывали, промывали водой, диэтиловым эфиром и этилацетатом и отставляли в сторону. Органический фильтрат отделяли, промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток объединяли с осадком, собранным выше. Твердые вещества сушили под высоким вакуумом, получая 34 мг (98%) 2-(6-хлор-4-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида. MS: (M+H)+=387;
т.пл. = 347-349°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.01 (s, 1H), 8.42 (s, 1H), 8.22-8.33 (m, 1H), 7.88 (s, 1H), 7.20-7.32 (m, 1H), 4.13-4.30 (m, 1H), 4.18 (s, 3H), 1.24 (d, J=6,4 Гц, 6Н).
Пример 128
2-[6-Хлор-1-(2-диметиламино-этил)-4-фтор-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида гидрохлорид
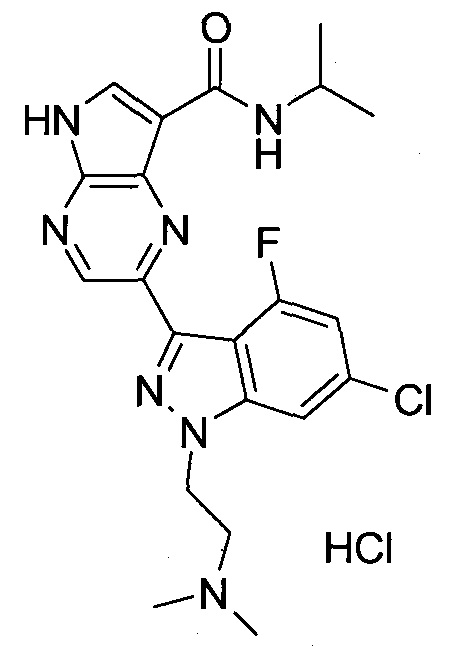
Стадия 1
2-[6-Хлор-1-(2-диметиламино-этил)-4-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
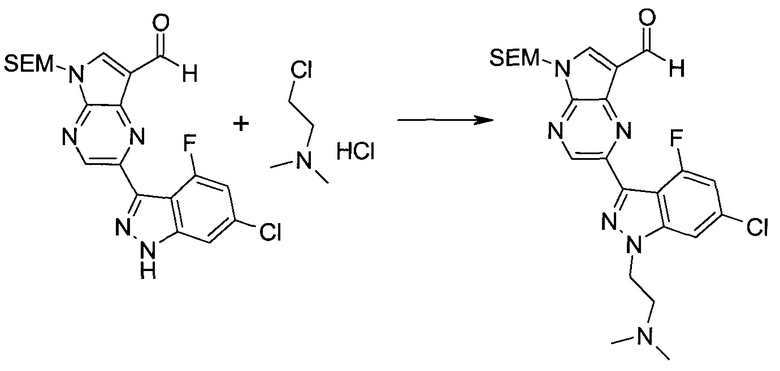
2-(6-Хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (100 мг; 0,22 ммоль) растворяли в DMF (0,5 мл) и охлаждали в ледяной бане. Осторожно добавляли гидрид натрия (60%-ную дисперсию; 22 мг; 0,56 ммоль). Смесь перемешивали в течение 10 мин, затем добавляли диметиламиноэтилхлорида гидрохлорид (36 мг; 0,25 ммоль) и иодид калия (4 мг; 0,022 ммоль) и реакционную смесь нагревали до комнатной температуры, затем перемешивали при 50°C в течение ночи. После охлаждения до комнатной температуры к реакционной смеси добавляли воду и этилацетат. Слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали водой и раствором хлорида натрия
и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 46 мг (40%) 2-[6-хлор-1-(2-диметиламино-этил)-4-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида. (M+H)+=517.
Стадия 2
2-[6-Хлор-1-(2-диметиламино-этил)-4-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
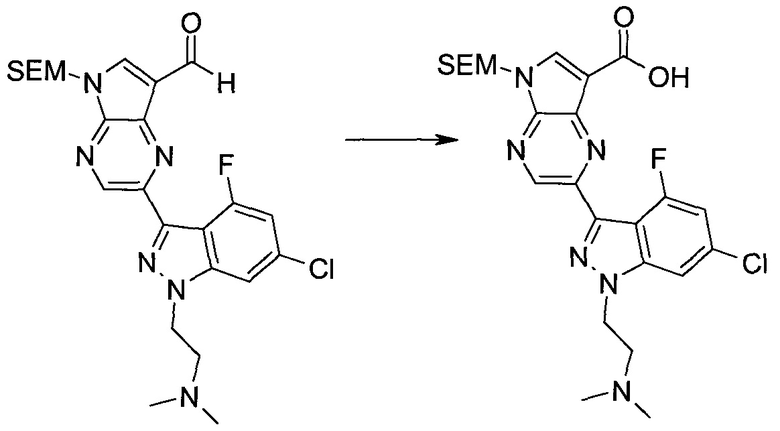
2-[6-Хлор-1-(2-диметиламино-этил)-4-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (46 мг; 0,09 ммоль) растворяли в THF (1,3 мл) и воде (0,4 мл) и добавляли сульфаминовую кислоту (83 мг; 0,85 ммоль). Медленно добавляли раствор хлорита натрия (17 мг; 0,185 ммоль) и фосфата калия моноосновного (232 мг; 1,7 ммоль) в воде (1,4 мл). Через 1 ч реакционную смесь выливали в этилацетат и воду. Значение pH подводили до 6, слои разделяли и водный слой пять раз экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом натрия и концентрировали, получая 53 мг 2-[6-хлор-1-(2-диметиламино-этил)-4-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты.
Стадия 3
2-[6-Хлор-1-(2-диметиламино-этил)-4-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
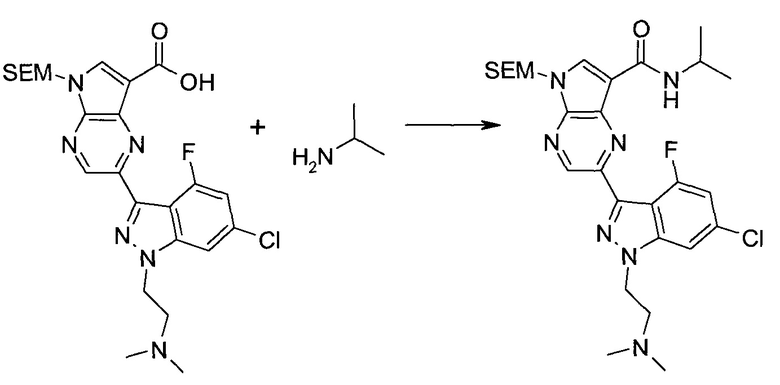
2-[6-Хлор-1-(2-диметиламино-этил)-4-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (50 мг; 0,094 ммоль), O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (45 мг; 0,14 ммоль), N,N-диизопропилэтиламин (0,08 мл; 0,47 ммоль) и изопропиламин (10 мкл; 0,11 ммоль) совместно добавляли в ацетонитрил (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем добавляли воду и этилацетат. Слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 35 мг (65%) 2-[6-хлор-1-(2-диметиламино-этил)-4-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида.
Стадия 4
2-[6-Хлор-1-(2-диметиламино-этил)-4-фтор-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида гидрохлорид
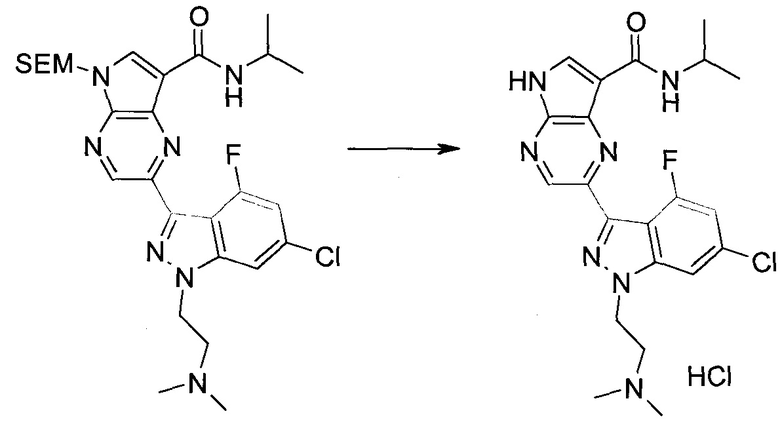
2-[6-Хлор-1-(2-диметиламино-этил)-4-фтор-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид (35 мг; 0,06 ммоль) растворяли в дихлорметане (1,6 мл) и
охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,8 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь упаривали и остаток растворяли в дихлорметане (1 мл). Добавляли этилендиамин (0,25 мл; 3,7 ммоль) и смесь перемешивали в течение 18 ч. Затем к этой смеси добавляли воду и этилацетат. Слои разделяли и водный слой три раза экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия, сушили над сульфатом натрия и упаривали. Остаток очищали хроматографией на силикагеле (метанол/дихлорметан). Выделенный таким образом продукт растворяли в метаноле/дихлорметан и обрабатывали 4 экв. 4 М HCl в 1,4-диоксане. После выпаривания растворителя получали твердое вещество, которое сушили под высоким вакуумом, получая 18 мг (62%) 2-[6-хлор-1-(2-диметиламино-этил)-4-фтор-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида гидрохлорида. MS: (M+H)+=444; т.пл. = 281-283°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 10.17-10.33 (m, 1H), 9.08 (s, 1H), 8.44 (d, J=3,0 Гц, 1H), 8.26 (d, J=7,9 Гц, 1H), 8.03-8.08 (m, 1H), 7.34 (d, J=10,6 Гц, 1H), 4.94-5.05 (m, 2H), 4.14-4.30 (m, 1H), 3.66-3.77 (m, 2H), 2.89 (d, J=4,5 Гц, 6H), 1.24 (d, J=6,8 Гц, 6H).
Пример 129
2-[6-Хлор-4-фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида гидрохлорид
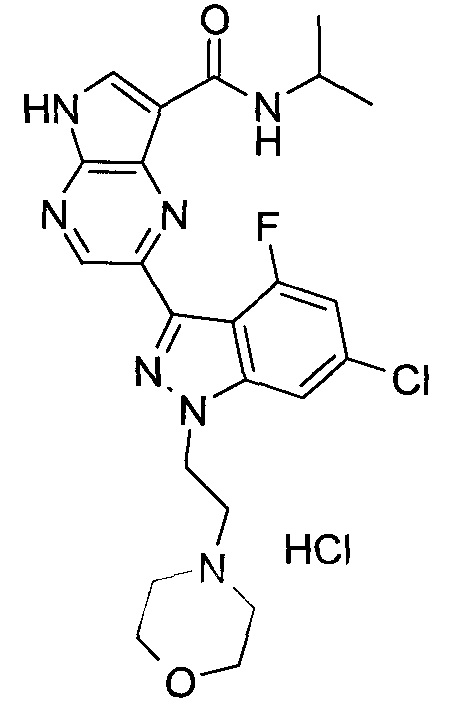
Стадия 1
2-(6-Хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
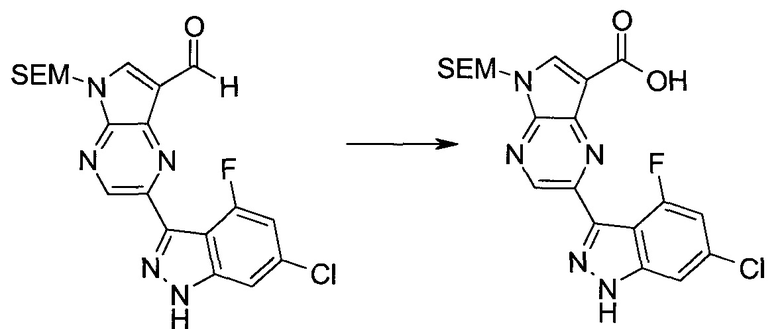
2-(6-Хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (139 мг; 0,31 ммоль) растворяли в THF (4,7 мл) и воде (1,6 мл) и добавляли сульфаминовую кислоту (291 мг; 3,0 ммоль). Медленно добавляли раствор хлорита натрия (17 мг; 0,185 ммоль) и фосфата калия моноосновного (232 мг; 1,7 ммоль) в воде (1,4 мл). Через 1 ч реакционную смесь выливали в этилацетат и воду. Слои разделяли и водный слой еще раз экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом натрия и концентрировали, получая 136 мг 2-(6-хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту.
Стадия 2
2-(6-Хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
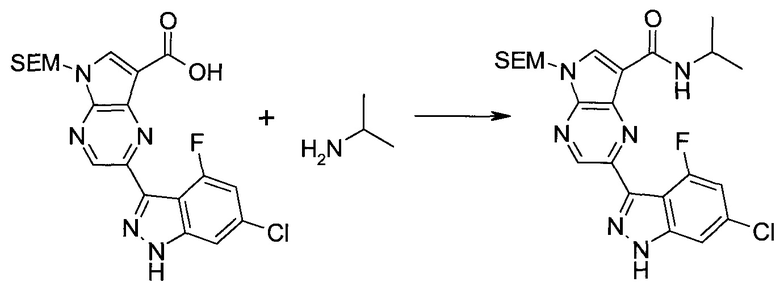
2-(6-Хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (140 мг; 0,30 ммоль), O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (146 мг, 0,46 ммоль), N,N-диизопропилэтиламин (0,27 мл; 1,52 ммоль) и изопропиламин (31 мкл; 0,36 ммоль) совместно добавляли в ацетонитрил (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем добавляли воду и этилацетат. Слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан),
получая 77 мг (51%) 2-(6-хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида.
Стадия 3
2-[6-Хлор-4-фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
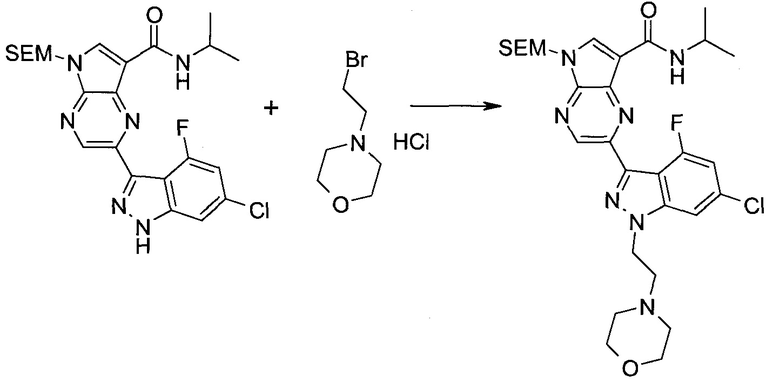
2-(6-Хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид (77 мг; 0,15 ммоль) растворяли в DMF (2,5 мл) и охлаждали в ледяной бане. Осторожно добавляли гидрид натрия (60%-ную дисперсию; 8 мг; 0,20 ммоль). Смесь перемешивали в течение 15 мин, затем добавляли дополнительное количество гидрида натрия (60%-ной дисперсии; 10 мг; 0,25 ммоль) и 4-(2-бромэтил)морфолина гидрохлорида (42 мг; 0,18 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. К реакционной смеси добавляли воду, раствор бикарбоната натрия и этилацетат. Слои разделяли и водный слой три раза экстрагировали этилацетатом. Объединенные органические слои промывали водой и раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 66 мг (70%) 2-[6-хлор-4-фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида.
Стадия 4
2-[6-Хлор-4-фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида гидрохлорид
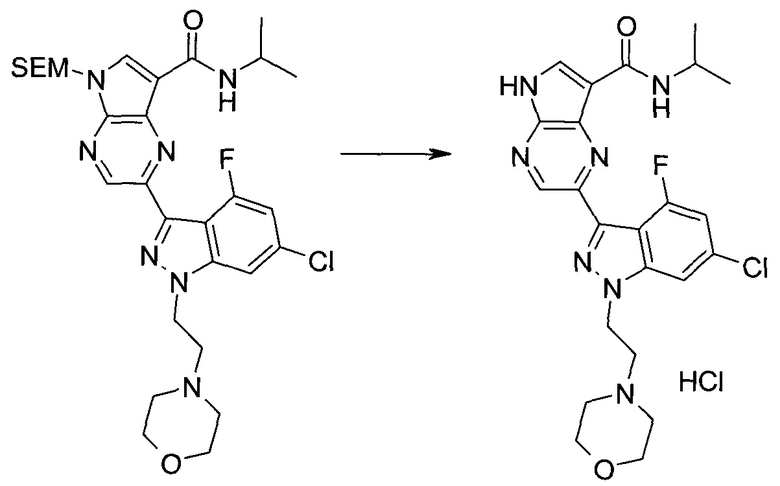
2-[6-Хлор-4-фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид (66 мг; 0,107 ммоль) растворяли в дихлорметане (1,4 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,7 мл) и реакционную смесь перемешивали при комнатной Температуре в течение 2 ч. Реакционную смесь упаривали и остаток растворяли в дихлорметане (1 мл). Добавляли этилендиамин (0,43 мл; 6,4 ммоль) и смесь перемешивали в течение 18 ч. Затем к этой смеси добавляли воду и этилацетат. Слои разделяли и водный слой три раза экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия, сушили над сульфатом натрия и упаривали. Остаток очищали хроматографией на силикагеле (метанол/дихлорметан). Выделенный таким образом продукт растворяли в метаноле/дихлорметан и обрабатывали 2 экв. 4 М HCl в 1,4-диоксане. После выпаривания растворителей получали твердое вещество, которое сушили под высоким вакуумом, получая 40 мг (72%) 2-[6-хлор-4-фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида гидрохлорида. MS: (M+H)+=486; т.пл. = 190-195°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.86-12.98 (m, 1H), 10.92-11.17 (m, 1H), 9.06 (s, 1H), 8.45 (d, J=3,0 Гц, 1H), 8.26 (d, J=7,9 Гц, 1H), 8.05 (s, 1H), 7.35 (d, J=10,6 Гц, 1H), 5.05 (br. s., 2H), 4.14-4.30 (m, 1H), 3.93-4.09 (m, 2H), 3.68-3.85 (m, 4H), 3.54-3.64 (m, 2H), 3.11-3.30 (m, 2H), 1.24 (d,J=6,4 Гц, 6H).
Пример 130
2-[6-Хлор-1-(3-диметиламино-пропил)-4-фтор-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
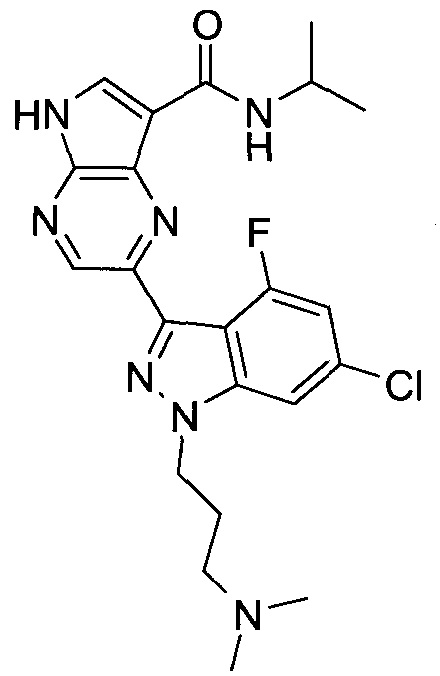
Получали в соответствии с методикой, приведенной в примере 128, заменяя диметиламинопропилхлорида гидрохлорид на диметиламиноэтилхлорида гидрохлорид на стадии 1. Образования соли конечного продукта на стадии 4 не проводили. MS: (M+H)+=458; т.пл. = 249-255°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.04 (s, 1H), 8.43 (s, 1H), 8.27 (d, J=7,9 Гц, 1H), 7.93 (s, 1H), 7.28 (d, J=10,6 Гц, 1H), 4.59 (s, 2H), 4.18-4.30 (m, 1H), 2.56-2.66 (m, 2H), 2.39 (br. s., 6H), 2.12-2.16 (m, 2H), 1.24 (d, J=6,8 Гц, 6H).
Пример 131
2-[6-Хлор-1-(3-диметиламино-пропил)-4-фтор-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида гидрохлорид
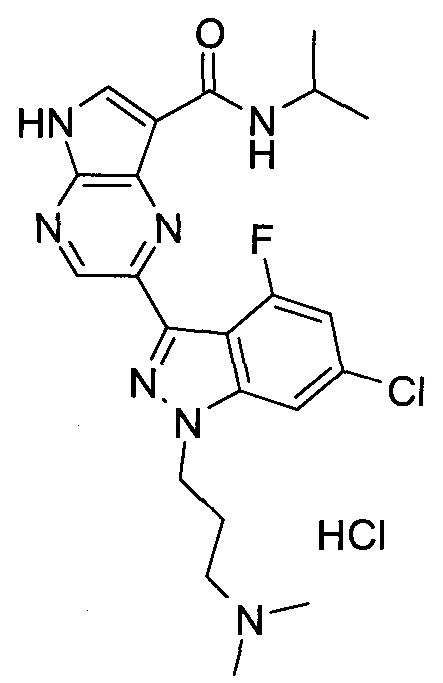
Получали в соответствии с методикой, приведенной в примере 128, заменяя диметиламинопропилхлорида гидрохлорид на диметиламиноэтилхлорида гидрохлорид на стадии 1. MS: (M+H)+=458; т.пл. = 304-305°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.84-12.93 (m, 1H), 10.12-10.30 (m, 1H), 9.05 (s, 1H), 8.44 (d, J=3,0 Гц, 1H), 8.22-8.31 (m, 1H), 7.96-8.02 (m, 1H), 7.30 (d, J=9,8 Гц, 1H), 4.59-4.71 (m, 2H), 4.13-4.31 (m, 1H), 3.09-3.23 (m, 2H), 2.75 (d, J=4,9 Гц, 6H), 2.24-2.41 (m, 2H), 1.24 (d, J=6,8 Гц, 6H).
Пример 132
2-[6-Хлор-4-фтор-1-(3-морфолин-4-ил-пропил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламида гидрохлорид
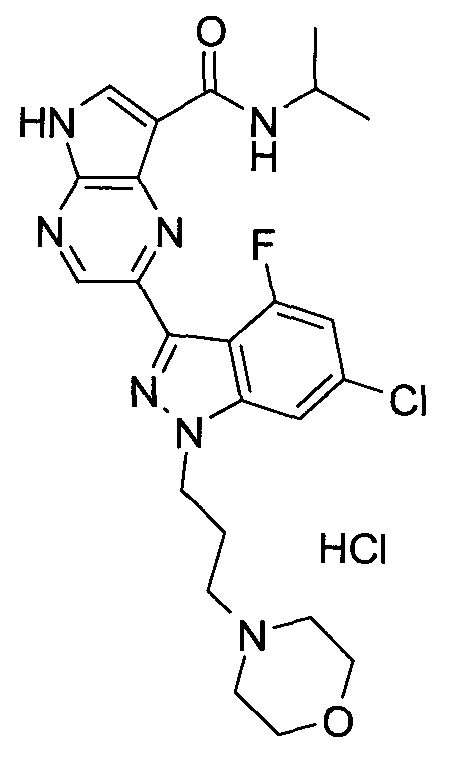
Получали в соответствии с методикой, приведенной в примере 128, заменяя 4-(3-хлорпропил)морфолин на диметиламиноэтилхлорида гидрохлорид на стадии 1. MS: (M+H)+=500; т.пл. = 282-285°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.86-12.92 (m, 1H), 10.72-10.88 (m, 1H), 9.06 (s, 1H), 8.43 (d, J=3,0 Гц, 1H), 8.27 (d, J=7,9 Гц, 1H), 7.96-8.01 (m, 1H), 7.30 (d, J=10,6 Гц, 1H), 4.61-4.72 (m, 2H), 4.13-4.30 (m, 1H), 3.88-3.99 (m, 2H), 3.68-3.83 (m, 2H), 3.41-3.46 (m, 2H), 3.15-3.27 (m, 2H), 2.96-3.13 (m, 2H), 2.31-2.45 (m, 2H), 1.24 (d, J=6,8 Гц, 6H).
Пример 133
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-2-пиразол-1-ил-этил)-амид
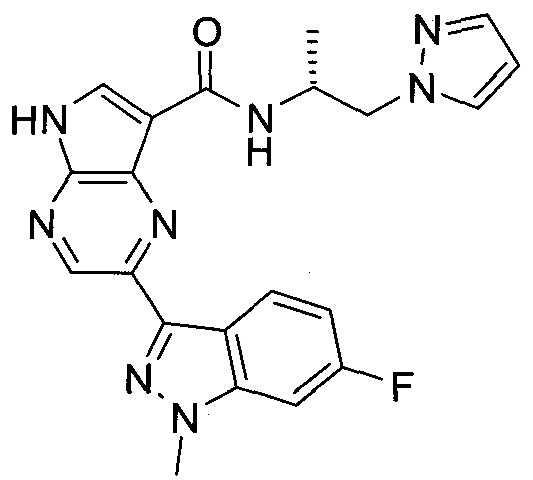
Стадия 1
((R)-2-Гидрокси-1-метил-этил)-карбаминовой кислоты трет-бутиловый эфир
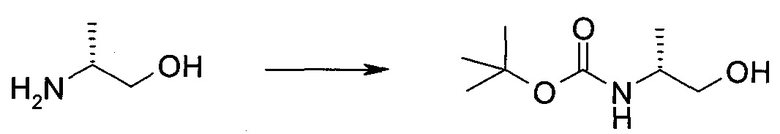
R-(-)-2-Аминопропан-1-ол (2,0 г; 26,6 ммоль) растворяли в дихлорметане (133 мл) и порциями добавляли ди-трет-бутилдикарбонат (11,6 г; 53,3 ммоль).
Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли воду и водный слой один раз экстрагировали дихлорметаном. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 4,0 г (85%) ((R)-2-гидрокси-1-метил-этил)-карбаминовой кислоты трет-бутилового эфира. (M+Na)+=198.
Стадия 2
Метансульфоновой кислоты (R)-2-трет-бутоксикарбониламино-пропиловый эфир

((R)-2-Гидрокси-1-метил-этил)-карбаминовой кислоты трет-бутиловый эфир (0,5 г; 2,85 ммоль) растворяли в дихлорметане (14 мл) и перемешивали в ледяной бане. Медленно добавляли N,N-диизопропилэтиламин (0,75 мл; 4,28 ммоль) и затем метансульфонилхлорид (0,27 мл; 3,4 ммоль) и реакционную смесь нагревали до комнатной температуры в течение 16 ч. К реакционной смеси добавляли раствор хлорида аммония и дважды экстрагировали этилацетатом. Объединенные органические экстракты промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания получали 0,73 г метансульфоновой кислоты (R)-2-трет-бутоксикарбониламино-пропилового эфира в виде белого воскообразного твердого вещества. 1H ЯМР (CDCl3) δ: 4.51-4.68 (m, 1H), 4.19-4.28 (m, 1H), 4.11-4.18 (m, 1H), 3.90-4.04 (m, 1H), 3.03 (s, 3H), 1.24 (d, J=6,8 Гц, 3H).
Стадия 3
((R)-1-Метил-2-пиразол-1-ил-этил)-карбаминовой кислоты трет-бутиловый эфир

1H-Пиразол (70 мг; 1,03 ммоль) растворяли в DMF (5 мл) и охлаждали в ледяной бане. Добавляли гидрид натрия (60%-ную дисперсию в минеральном масле; 41 мг; 1,03 ммоль) и реакционную смесь перемешивали в течение 15 мин. Затем добавляли метансульфоновой кислоты (R)-2-трет-бутоксикарбонил-амино-пропиловый эфир (200 мг; 0,79 ммоль) и смесь перемешивали при 50°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и
добавляли воду и этилацетат. Водный слой еще дважды экстрагировали этилацетатом, объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 129 мг (72%) ((R)-1-метил-2-пиразол-1-ил-этил)-карбаминовой кислоты трет-бутилового эфира. (M+H)+=226.
Стадия 4
(R)-1-Метил-2-пиразол-1-ил-этиламина трифторацетат
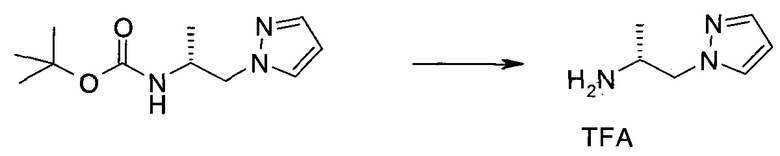
((R)-1-Метил-2-пиразол-1-ил-этил)-карбаминовой кислоты трет-бутиловый эфир (49 мг; 0,22 ммоль) растворяли в дихлорметане (2,4 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (1,2 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем упаривали и сушили под высоким вакуумом, получая (R)-1-метил-2-пиразол-1-ил-этиламина трифторацетат, который использовали без дополнительной очистки.
Стадия 5
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-2-пиразол-1-ил-этил)-амид
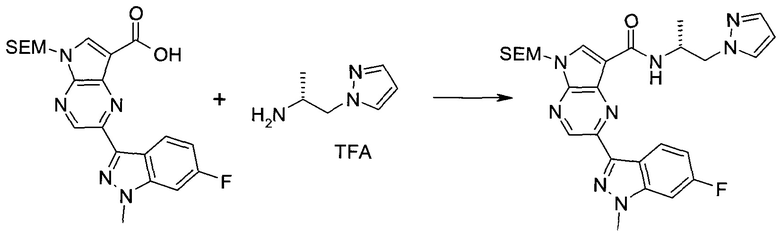
(R)-1-Метил-2-пиразол-1-ил-этиламина трифторацетат (неочищенный со стадии 4) растворяли в ацетонитриле (1,8 мл), куда затем добавляли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (80 мг; 0,18 ммоль), О-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (87 мг; 0,27 ммоль) и N,N-диизопропилэтиламин (0,16 мл; 0,91 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и затем добавляли воду и этилацетат. Слои разделяли и водный слой три раза экстрагировали этилацетатом.
Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 89 мг (81%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-2-пиразол-1-ил-этил)-амида.
Стадия 6
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-2-пиразол-1-ил-этил)-амид
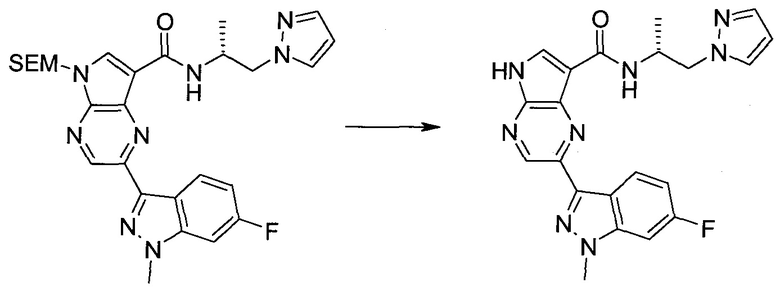
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-2-пиразол-1-ил-этил)-амид (86 мг; 0,16 ммоль) растворяли в дихлорметане (2,2 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (1 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь упаривали и остаток растворяли в дихлорметане (1 мл). Добавляли этилендиамин (0,63 мл; 9,4 ммоль) и смесь перемешивали в течение 18 ч. Затем к этой смеси добавляли воду и этилацетат. Полученный осадок отфильтровывали, промывали водой и диэтиловым эфиром и сушили под высоким вакуумом, получая 37 мг (57%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-2-пиразол-1-ил-этил)-амида. MS: (M+Na)+=441; т.пл. = 252-253°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.08 (s, 1H), 8.46 (s, 1H), 8.21-8.33 (m, 1H), 8.12 (d, J=7,9 Гц, 1H), 7.63-7.75 (m, 2H), 7.31-7.40 (m, 1H), 6.97-7.10 (m, 1H), 6.12-6.23 (m, 1H), 4.46-4.63 (m, 1H), 4.32-4.44 (m, 2H), 4.14 (s, 3H), 1.23 (d, J=6,4 Гц, 3H).
Пример 134
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-имидазол-1-ил-1-метил-этил)-амид
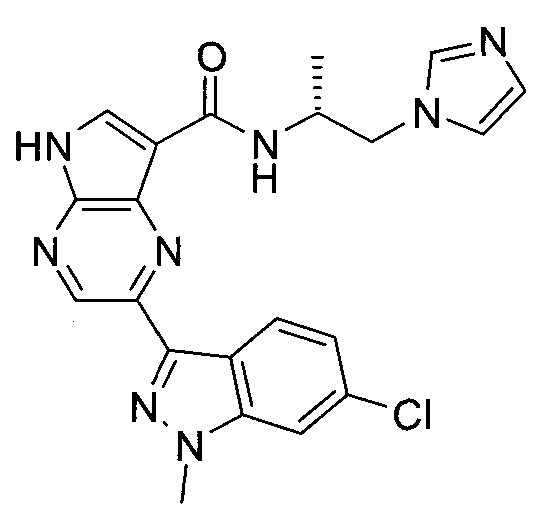
Получали в соответствии с методикой, приведенной в примере 133, заменяя 1H-имидазол на 1H-пиразол на стадии 3 и заменяя 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[3,2-b]пиразин-7-карбоновую кислоту на 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту на стадии 5. MS: (M+H)+=435; т.пл. = 276-279°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.76-13.03 (m, 1H), 9.08 (s, 1H), 8.47 (s, 1H), 8.01-8.14 (m, 2H), 7.98 (br. s, 1H), 7.62 (br. s., 1H), 7.18-7.27 (m, 1H), 7.15 (br. s., 1H), 6.82 (s, 1H), 4.36-4.50 (m, 1H), 4.16 (br. s., 3H), 4.09-4.36 (m, 2H), 1.26 (d, J=6,4 Гц, 3H).
Пример 135
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-пропил)-амид
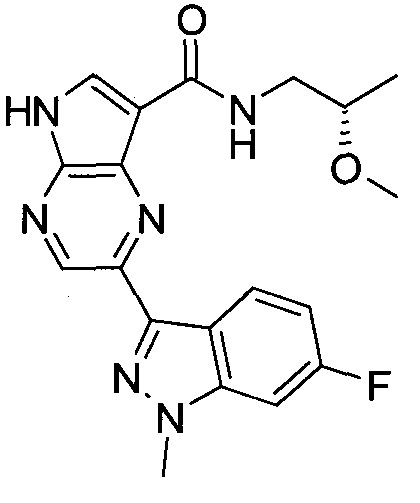
Стадия 1
((S)-2-Гидрокси-пропил)-карбаминовой кислоты трет-бутиловый эфир
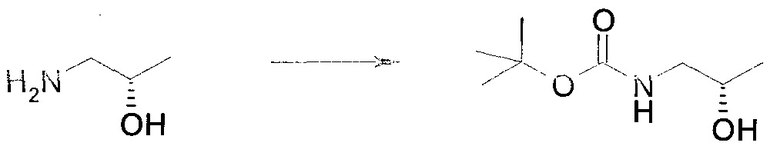
(S)-1-Аминопропан-2-ол (1,0 г; 13,3 ммоль) растворяли в дихлорметане (67 мл) и порциями добавляли ди-трет-бутилдикарбонат (5,8 г; 26,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли раствор хлорида аммония и воду и водный слой дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания
остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 2,35 г (99%) ((S)-2-гидрокси-пропил)-карбаминовой кислоты трет-бутилового эфира.
Стадия 2
((S)-2-Метокси-пропил)-карбаминовой кислоты трет-бутиловый эфир
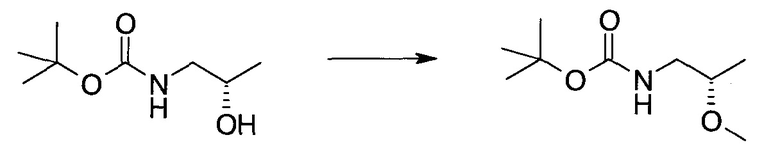
((S)-2-Гидрокси-пропил)-карбаминовой кислоты трет-бутиловый эфир (0,25 г; 1,43 ммоль) растворяли в ацетонитриле (14 мл) и добавляли иодметан (1,78 мл; 28,5 ммоль) и затем оксид серебра (0,53 г; 2,28 ммоль; полученный как в Org. Syn. Coll. Vol.VII, p. 386). Реакционную колбу покрывали, чтобы защитить от света, и реакционную смесь нагревали при температуре дефлегмации в течение 24 ч. Добавляли дополнительное количество иодметана (1,8 мл) и оксида серебра (0,26 г) и нагревание продолжали до полного завершения реакции, что устанавливали посредством стандартной обращенно-фазовой LC в сочетании с MS. Реакционную смесь фильтровали через диатомовую землю, промывая этилацетатом. После упаривания остаток очищали хроматографией на силикагеле (этилацетат/гексаны), получая 85 мг (32%) ((S)-2-метокси-пропил)-карбаминовой кислоты трет-бутилового эфира. (M+Na)+=212.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-пропил)-амид
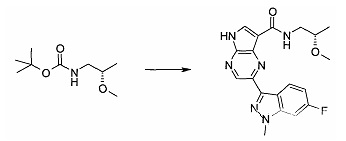
Получали в соответствии с методикой, приведенной в примере 133, стадии 4-6, заменяя ((S)-2-метокси-пропил)-карбаминовой кислоты трет-бутиловый эфир на ((R)-1-метил-2-пиразол-1-ил-этил)-карбаминовой кислоты трет-бутиловый эфир на стадии 4. MS: (M+H)+=383; т.пл. = 269-271°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.81-12.92 (m, 1H), 9.12 (s, 1H), 8.55 (dd, J=9,1; 5,3 Гц, 1H), 8.45 (s, 1H), 8.24-8.33 (m, 1H), 7.67 (dd, J=9,8; 2,3 Гц, 1H), 7.13 (ddd, J=9,1;
2,3 Гц, 1H), 4.15 (s, 3H), 3.65-3.75 (m, 1H), 3.40-3.60 (m, 2H), 3.26 (s, 3H), 1.17 (d, J=6,0 Гц, 3H).
Пример 136
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-циано-2-метил-этил)-амид
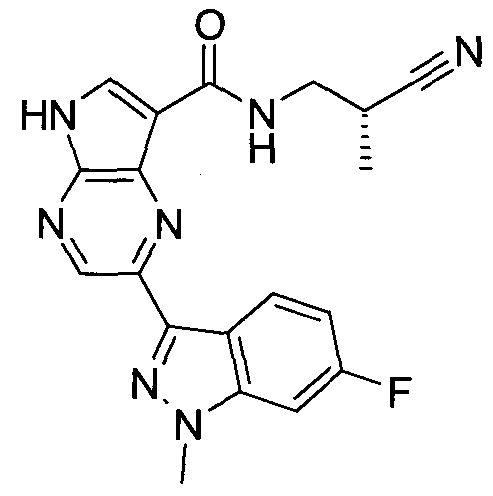
Стадия 1
((R)-2-Карбамоил-пропил)-карбаминовой кислоты трет-бутиловый эфир

(R)-3-(трет-Бутоксикарбониламино)-2-метилпропановую кислоту (465 мг; 2,3 ммоль) растворяли в дихлорметане (11 мл). Добавляли 4-диметиламино-пиридин (280 мг; 2,3 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимид (877 мг; 4,58 ммоль), затем N-гидроксисукцинимид (290 мг; 2,52 ммоль). Через 4 ч перемешивания при комнатной температуре медленно добавляли концентрированный гидроксид аммония (1,6 мл). Реакционную смесь перемешивали в течение еще 20 мин, затем добавляли водный HCl и этилацетат и водный слой шесть раз экстрагировали этилацетатом. Объединенные органические слои промывали раствором бикарбоната натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле, получая 335 мг (72%) ((R)-2-карбамоил-пропил)-карбаминовой кислоты трет-бутилового эфира. (M+Na)+=225.
Стадия 2
((R)-2-Циано-2-метил-этил)-карбаминовой кислоты трет-бутиловый эфир
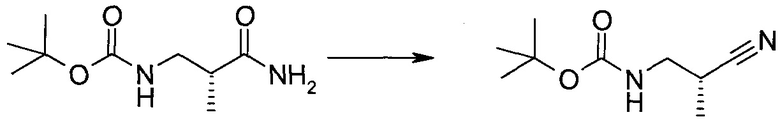
((R)-2-Карбамоил-пропил)-карбаминовой кислоты трет-бутиловый эфир (50 мг; 0,247 ммоль) растворяли в THF (1,4 мл). По каплям добавляли пиридин (40 мкл; 0,49 ммоль) и затем трифторуксусный ангидрид (42 мкл; 0,30 ммоль).
Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем добавляли дополнительное количество пиридина (40 мкл; 0,49 ммоль) и трифторуксусного ангидрида (42 мкл; 0,30 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, затем добавляли воду, раствор карбоната натрия и этилацетат. Водный слой три раза экстрагировали этилацетатом. Объединенные органические слои промывали водой и раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 40 мг (87%) ((R)-2-циано-2-метил-этил)-карбаминовой кислоты трет-бутилового эфира. (M+Na)+=207.
Стадия 3
(R)-3-Амино-2-метил-пропионитрила трифторацетат

((R)-2-Циано-2-метил-этил)-карбаминовой кислоты трет-бутиловый эфир (42 мг; 0,23 ммоль) растворяли в дихлорметане (1,2 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,7 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем упаривали и сушили под высоким вакуумом, получая (R)-3-амино-2-метил-пропионитрила трифторацетат, который использовали без дополнительной очистки.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-циано-2-метил-этил)-амид
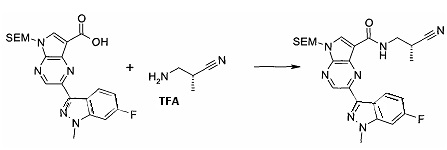
(R)-3-Амино-2-метил-пропионитрила трифторацетат (неочищенный со стадии 3) растворяли в ацетонитриле (2,8 мл), куда затем добавляли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (80 мг; 0,18 ммоль), O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (70 мг; 0,22 ммоль) и N,N-диизопропилэтиламин (0,11 мл; 0,63 ммоль). Реакционную смесь перемешивали
при комнатной температуре в течение 18 ч. Добавляли дополнительное количество O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторбората (50 мг; 0,16 ммоль) и N,N-диизопропилэтиламина (0,11 мл; 0,63 ммоль) и перемешивание продолжали в течение 24 ч. Добавляли воду и этилацетат. Слои разделяли и водный слой дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 33 мг (36%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-циано-2-метил-этил)-амида. (M+Na)+=530.
Стадия 5
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-2-пиразол-1-ил-этил)-амид
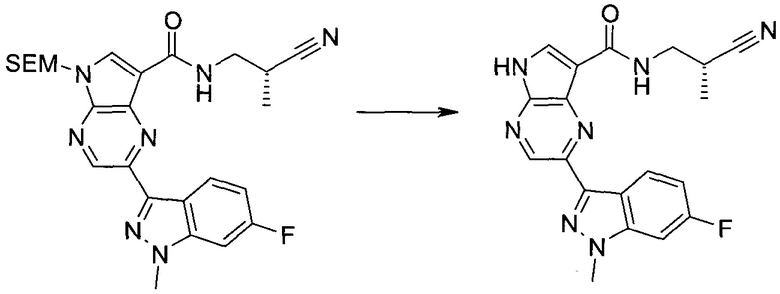
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-циано-2-метил-этил)-амид (32 мг; 0,06 ммоль) растворяли в дихлорметане (1,6 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,8 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч. Реакционную смесь упаривали и остаток растворяли в дихлорметане (1 мл). Добавляли этилендиамин (0,26 мл; 3,8 ммоль) и смесь перемешивали в течение 18 ч. Затем к этой смеси добавляли воду и этилацетат. Слои разделяли и водный слой дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия, сушили над сульфатом натрия и упаривали. Остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 5 мг (20%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-циано-2-метил-этил)-амида. MS: (M+Na)+=400. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.80-12.98 (m, 1H), 9.11 (s, 1H), 8.50 (s, 1H), 8.44-8.56 (m, 2H), 7.67 (dd, J=9,8; 2,3 Гц, 1H), 7.20 (ddd, J=9,3; 1,9 Гц, 1H), 4.15 (s, 3H), 3.64-3.76 (m, 2H), 3.18-3.27 (m, 1H), 1.34 (d, J=6,8 Гц, 3H).
Пример 137
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-карбамоил-пропил)-амид
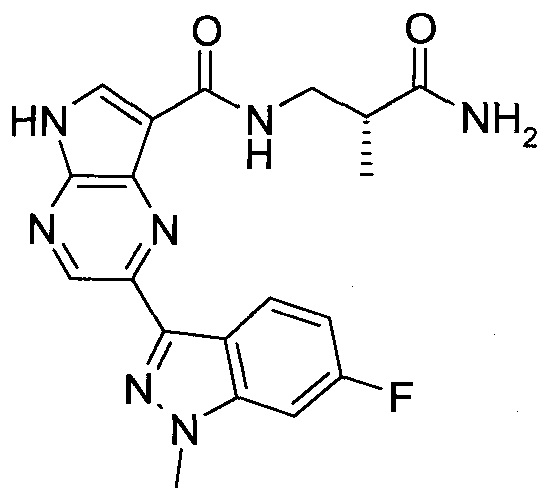
Выделяли as an дополнительный продукт (3 мг; 12%) from Пример 136, стадия 5. MS: (M+Na)+=418. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.11 (s, 1H), 8.49-8.60 (m, 1H), 8.44 (s, 1H), 8.22-8.30 (m, 1H), 7.65 (dd, J=9,8; 2,3 Гц, 1H), 7.40 (s, 1H), 7.30 (ddd, J=9,3; 2,3 Гц, 1H), 6.84 (s, 1H), 4.15 (s, 3H), 3.39-3.67 (m, 2H), 2.62-2.74 (m, 1H), 1.13 (d, J=6,8 Гц, 3H).
Пример 138
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (S)-N-(тетрагидро-пиран-3-ил)-амид
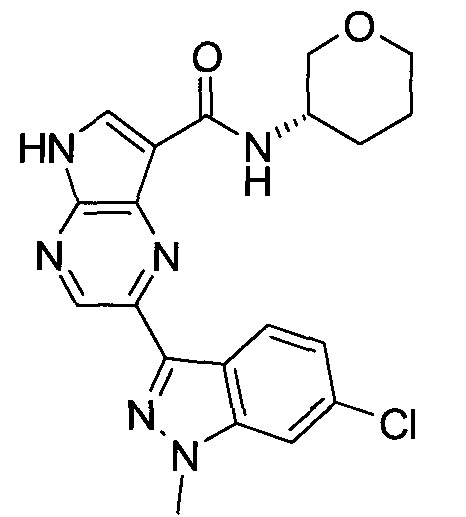
Стадия 1
(S)-2-трет-Бутоксикарбониламино-пентандиовой кислоты диэтиловый эфир
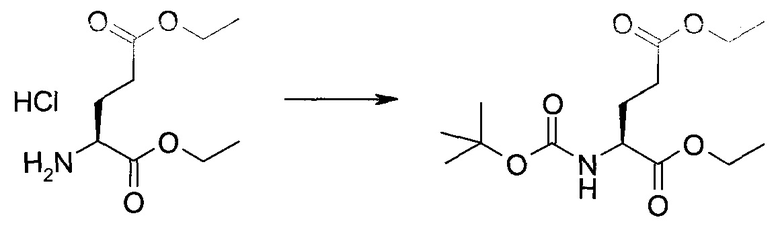
(S)-1,5-Диэтокси-1,5-диоксопентан-2-амина гидрохлорид (1,0 г; 4,17 ммоль) растворяли в дихлорметане (10 мл) и охлаждали в ледяной бане. Добавляли триэтиламин (0,58 мл; 4,17 ммоль), затем ди-трет-бутилдикарбонат (1,09 г; 5,0 ммоль) и смесь нагревали до комнатной температуры в течение 16 ч.
Добавляли воду и этилацетат и водный слой еще раз экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (этилацетат/гексаны), получая 1,11 г (87%) (S)-2-трет-бутоксикарбониламино-пентандиовой кислоты диэтилового эфира. (M+Na)+=326.
Стадия 2
((S)-4-Гидрокси-1-гидроксиметил-бутил)-карбаминовой кислоты трет-бутиловый эфир
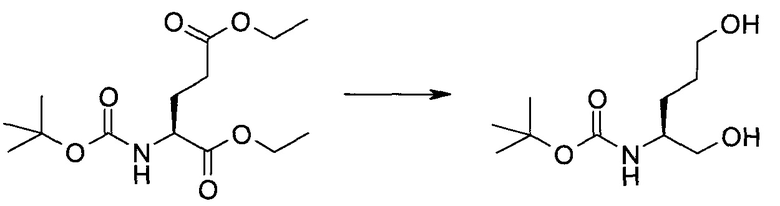
Боргидрид лития (2,0 М в THF; 4; 12 мл; 8,24 ммоль) охлаждали в ледяной бане и по каплям добавляли раствор (S)-2-трет-бутоксикарбониламино-пентандиовой кислоты диэтилового эфира (0,5 г; 1,65 ммоль) в THF (5,5 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 16 ч. К реакционной смеси очень медленно добавляли метанол. С некоторым отставанием по времени, после того, когда бурное выделение газа ослабевало, добавляли воду и этилацетат. Водный слой пять раз экстрагировали этилацетатом и объединенные органические слои промывали раствором хлорида натрия и сушили над сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 0,3 г (83%) ((S)-4-гидрокси-1-гидроксиметил-бутил)-карбаминовой кислоты трет-бутилового эфира. (M+Na)+=242.
Стадия 3
(S)-(Тетрагидро-пиран-3-ил)-карбаминовой кислоты трет-бутиловый эфир
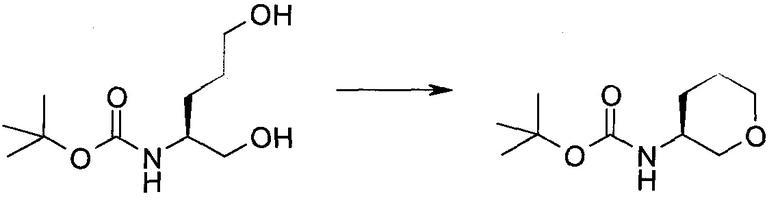
((S)-4-Гидрокси-1-гидроксиметил-бутил)-карбаминовой кислоты трет-бутиловый эфир (100 мг; 0,46 ммоль) растворяли в теплом бензоле (1,5 мл). Добавляли цианометилентрибутилфосфоран (165 мг; 0,68 ммоль) и реакционный сосуд герметично закрывали и содержимое перемешивали при 100°C в течение 24 ч. Реакционную смесь охлаждали, упаривали и очищали хроматографией на
силикагеле (этилацетат/гексаны), получая 64 мг (69%) (S)-(тетрагидро-пиран-3-ил)-карбаминовой кислоты трет-бутилового эфира. (M+Na)+=224.
Стадия 4
(S)-(Тетрагидро-пиран-3-ил)амина трифторацетат
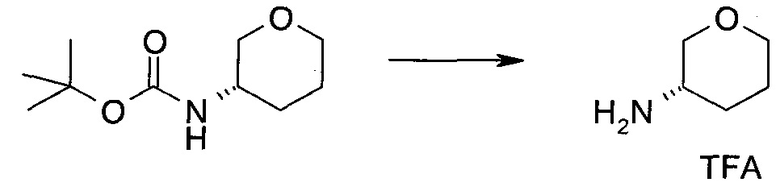
(S)-(Тетрагидро-пиран-3-ил)-карбаминовой кислоты трет-бутил о вы и эфир (42 мг; 0,21 ммоль) растворяли в дихлорметане (2,2 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (1,2 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем упаривали и сушили под высоким вакуумом, получая (S)-(тетрагидро-пиран-3-ил)амина трифторацетат, который использовали без дополнительной очистки.
Стадия 5
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (S)-N-(тетрагидро-пиран-3-ил)-амид
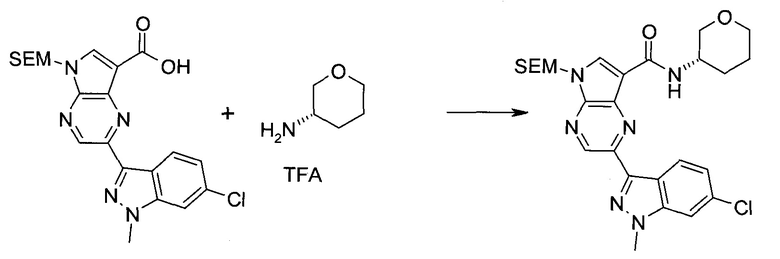
(S)-(Тетрагидро-пиран-3-ил)амина трифторацетат (неочищенный со стадии 4) растворяли в ацетонитриле (1,8 мл), куда затем добавляли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (80 мг; 0,175 ммоль), O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат (84 мг; 0,26 мн/юль) и N,N-диизопропилэтиламин (0,15 мл; 0,87 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли дополнительное количество O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторбората (50 мг; 0,16 ммоль) и N,N-диизопропилэтиламина (0,11 мл; 0,63 ммоль) и перемешивание продолжали в течение 24 ч. Добавляли воду и этилацетат. Слои разделяли и водный слой дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия и сушили над
сульфатом натрия. После упаривания остаток очищали хроматографией на силикагеле (этилацетат/гексаны), получая 55 мг (58%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (S)-N-(тетрагидро-пиран-3-ил)-амида. (M+Na)+=563.
Стадия 6
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (S)-N-(тетрагидро-пиран-3-ил)-амид
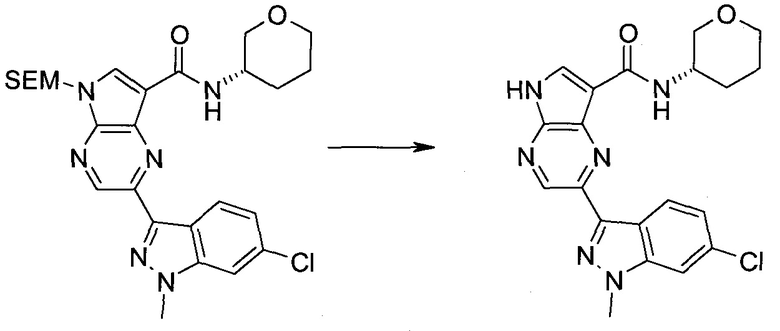
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (б)-М-(тетрагидро-пиран-3-ил)-амид (55 мг; 0,10 ммоль) растворяли в дихлорметане (1,2 мл) и охлаждали в ледяной бане. Медленно добавляли трифторуксусную кислоту (0,6 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь упаривали и остаток растворяли в дихлорметане (1 мл). Добавляли этилендиамин (0,41 мл; 6,1 ммоль) и смесь перемешивали в течение 18 ч. Затем к этой смеси добавляли воду и этилацетат. Слои разделяли и водный слой дважды экстрагировали этилацетатом. Объединенные органические слои промывали раствором хлорида натрия, сушили над сульфатом натрия и упаривали. Остаток очищали хроматографией на силикагеле (метанол/дихлорметан), получая 30 мг (71%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (S)-N-(тетрагидро-пиран-3-ил)-амида. MS: (M+H)+=411; т.пл. = 320-323°C. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.10 (s, 1H), 8.50 (d, J=8,7 Гц, 1H), 8.44 (s, 1H), 8.16 (d, J=7,6 Гц, 1H), 7.96 (d, J=1,9 Гц, 1H), 7.24 (dd, J=8,5; 1,7 Гц, 1H), 4.16 (s, 3H), 4.04-4.14 (m, 1H), 3.86-3.94 (m, 1H), 3.62-3.73 (m, 2H), 3.46-3.55 (m, 1H), 1.93-2.08 (m, 1H), 1.69-1.89 (m, 2H), 1.50-1.68 (m, 1H).
Пример 139
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (R)-N-(тетрагидро-пиран-3-ил)-амид
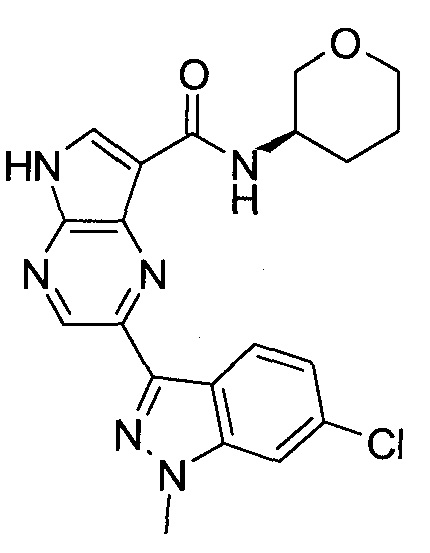
Стадия 1
(R)-2-трет-Бутоксикарбониламино-пентандиовой кислоты диметиловый эфир
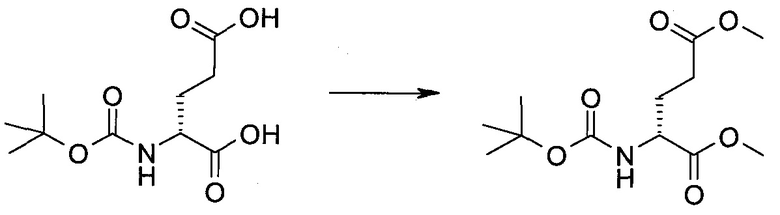
(R)-2-трет-Бутилоксикарбониламино)пентандиовую кислоту (1,0 г; 4,04 ммоль) растворяли в толуоле (31,5 мл) и метаноле (9 мл). Раствор перемешивали в ледяной бане и медленно добавляли TMS-диазометан (2,0 М в диэтиловом эфире; 16,2 мл; 32,4 ммоль). Реакционную смесь нагревали до комнатной температуры с перемешиванием в течение 16 ч. Реакционную смесь упаривали и очищали хроматографией на силикагеле (этилацетат/гексаны), получая 0,95 г (85%) (R)-2-трет-бутоксикарбониламино-пентандиовой кислоты диметилового эфира. (M+Na)+=298.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (R)-N-(тетрагидро-пиран-3-ил)-амид
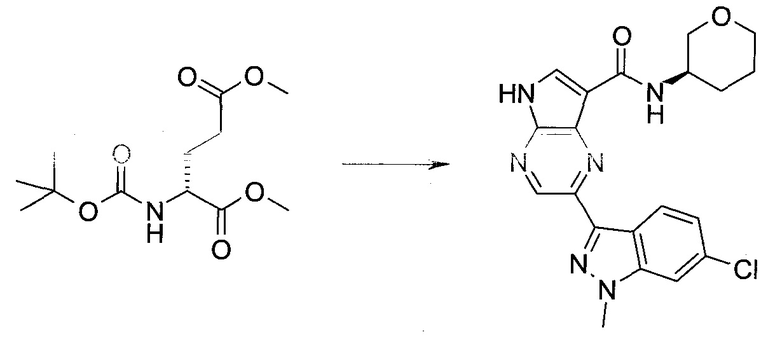
Получали в соответствии с методикой, приведенной в примере 138, стадии 2-6, заменяя (R)-2-трет-бутоксикарбониламино-пентандиовой кислоты диметиловый эфир на (S)-2-трет-бутоксикарбониламино-пентандиовой кислоты диэтиловый эфир на стадии 2. MS: (M+H)+=411; т.пл. = 316-318°C. 1H ЯМР
(300 МГц, DMSO-d6) δ: 9.11 (s, 1H), 8.52 (d, J=8,7 Гц, 1H), 8.46 (s, 1H), 8.18 (d, J=7,9 Гц, 1H), 7.98 (d, J=1,5 Гц, 1H), 7.26 (dd, J=8,7; 1,5 Гц, 1H), 4.17 (s, 3H), 4.01-4.15 (m, 1H), 3.86-3.95 (m, 1H), 3.56-3.74 (m, 2H), 3.44-3.56 (m, 1H), 1.94-2.09 (m, 1H), 1.70-1.90 (m, 2H), 1.51-1.65 (m, 1H).
Пример 140
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-циклопропил-этил)-амид
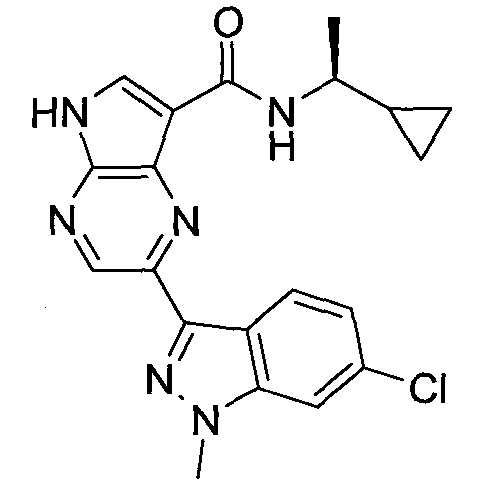
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-циклопропил-этил)-амид
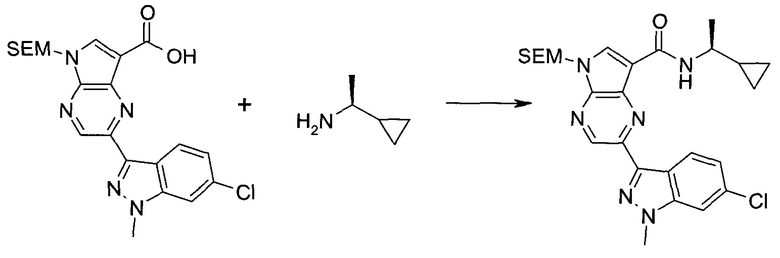
Раствор (S)-1-циклопропилэтанамина (32 мг; 0,373 ммоль), 3 мл дихлорметана, 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (77 мг; 0,169 ммоль), 4-диметиламинопиридина (21 мг; 0,169 ммоль) и N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорида (71 мг; 0,371 ммоль) перемешивали в течении 18 ч, зачем концентрировали до получения беловатого твердого вещества. Это твердое вещество распределяли между 10 мл этилацетата и 10 мл 10%-ного раствора лимонной кислоты. Органический слой последовательно промывали 10 мл воды, 10 мл 10%-ного раствора NaOH, 10 мл воды и 10 мл насыщ. водн. раствора NaCl; сушили над Na2SO4, фильтровали и концентрировали до получения 70 мг (80%) неочищенного 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-
карбоновой кислоты ((S)-1-циклопропил-этил)-амида, который использовали без дополнительной очистки. MS: (M+Na)+=547.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-циклопропил-этил)-амид
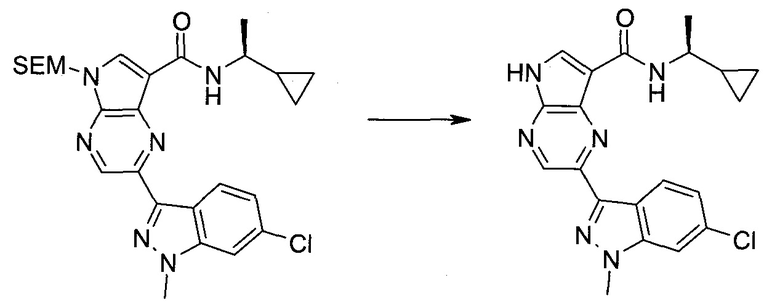
Раствор неочищенного 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-циклопропил-этил)-амида (70 мг; 0,134 ммоль), 2 мл дихлорметана и 2 мл трифторуксусной кислоты перемешивали в течение 1 ч, затем концентрировали до получения желтого твердого вещества. Это твердое вещество растворяли в 2 мл дихлорметана и 1 мл этилендиамина и желтый раствор перемешивали в течение 30 мин. Добавляли воду (20 мл). Полученный осадок выделяли фильтрованием через воронку Бюхнера, хорошо промывая водой, затем дихлорметаном, и сушили на воздухе, затем в вакууме, получая 33 мг (56%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3b]пиразин-7-карбоновой кислоты ((S)-1-циклопропил-этил)-амида в виде бледно-желтого твердого вещества. MS: (M+Na)+=417; 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 9.10 (s, 1H), 8.46 (d, J=8,69 Гц, 1H), 8.42 (s, 1H), 8.14 (d, J=7,93 Гц, 1H), 8.00 (d, J=1,51 Гц, 1H), 7.27 (dd, J=8,50; 1,70 Гц, 1H), 4.17 (s,3H), 3.55-3.70 (m, 1H), 1.34 (d, J=6,80 Гц, 3H), 1.00-1.16 (m, 1H), 0.56 (td, J=8,31; 3,40 Гц, 1H), 0.42-0.50 (m, 1H), 0.26-0.41 (m, 2H).
Пример 141
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-циклопропил-этил)-амид
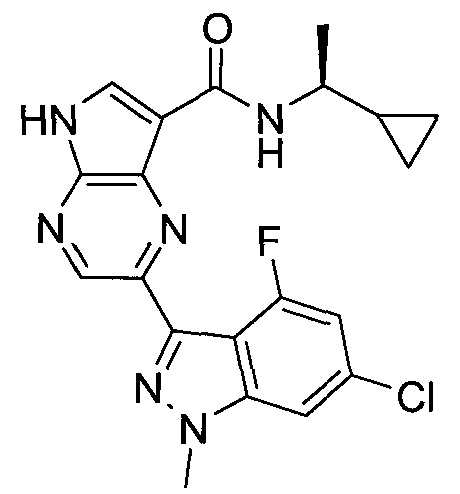
Получали в соответствии с методикой, приведенной в примере 140, заменяя 2-(6-хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту на 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту на стадии 1. MS: (M-H)-=411; 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 12.84 (br. s, 1H), 9.01 (s, 1H), 8.41 (s, 1H), 8.37 (d, J=7,93 Гц, 1H), 7.87 (s, 1H), 7.26 (d, J=10,95 Гц, 1H), 4.17 (s, 3H), 3.57-3.70 (m, 1H), 1.21-1.32 (m, 3H), 0.94-1.08 (m, 1H), 0.18-0.52 (m, 4H).
Пример 142
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-циано-1-метил-этил)-амид
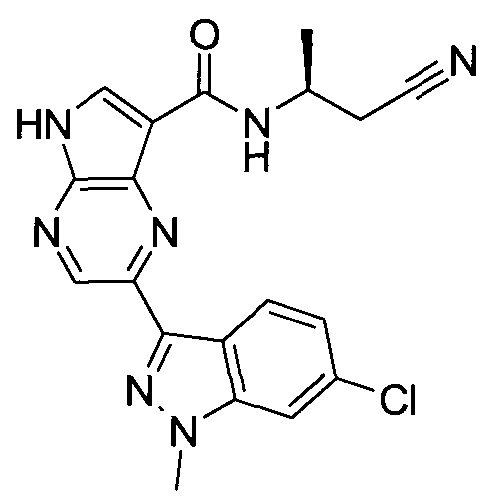
Получали в соответствии с методикой, приведенной в примере 140, заменяя (S)-3-аминобутаннитрил на (S)-1-циклопропилэтанамин на стадии 1. MS: (M-H)-=392; 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 12.92 (br. s., 1H), 9.09 (s, 1H), 8.47-8.54 (m, 2H), 8.21 (d, J=7,55 Гц, 1H), 7.99 (s, 1H), 7.27-7.34 (m, 1H), 4.33-4.45 (m, 1H), 4.17 (s, 3H), 2.96 (qd, J=16,62; 5,29 Гц, 2H), 1.44 (d, J=6,80 Гц, 3H).
Пример 143
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-амино-этил)-амида трифторацетат
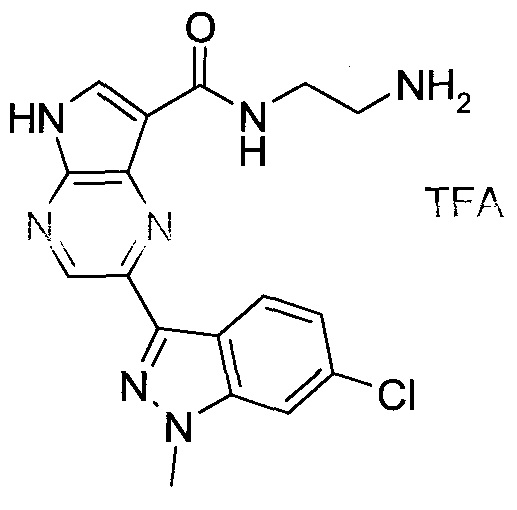
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1H-имидазол-2-ил)-амид
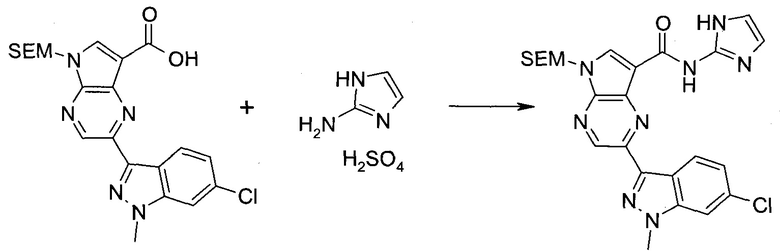
Раствор 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (205 мг; 0,447 ммоль), 1 мл N,N-диметилформамида и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (208 мг; 0,548 ммоль) перемешивали в течение 10 мин. К этому раствору добавляли свежеизмельченный сульфат 2-аминоимидазола (62 мг; 0,468 ммоль) и диизопропилэтиламин (0,39 мл; 2,2 ммоль). Колбу нагревали до 70°C и мутный желтый раствор перемешивали в течение 18,5 ч, за это время образовывался белый осадок. Смесь оставляли охлаждаться, затем обрабатывали 20 мл воды. Осадок выделяли фильтрованием через воронку Бюхнера, хорошо промывая водой, и сушили на воздухе, затем в вакууме, получая 177 мг неочищенного (1H-имидазол-2-ил)-амида 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты в виде бледно-желтого твердого вещества. MS: (M+H)+=523.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-амино-этил)-амида трифторацетат
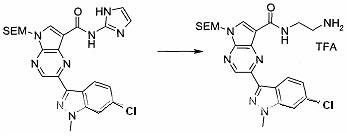
Раствор неочищенного (1H-имидазол-2-ил)-амида 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты со стадии 1 (175 мг; 0,334 ммоль) в 2 мл дихлорметана и 2 мл трифторуксусной кислоты перемешивали в течение 1 ч, затем концентрировали до получения оранжевого масла. К этому маслу добавляли 5 мл дихлорметана и 1 мл этилендиамина. Желтую суспензию перемешивали в
течение 30 мин. Добавляли воду (20 мл) и осадок выделяли фильтрованием через воронку Бюхнера, хорошо промывая водой и дихлорметаном, и сушили на воздухе, затем в вакууме, получая 109 мг рыжевато-коричневого твердого вещества. Твердое вещество растирали в 15 мл кипящего метанола, смесь оставляли охлаждаться до комнатной температуры и твердое вещество выделяли фильтрованием через воронку Бюхнера, хорошо промывая метанолом, и сушили на воздухе, получая 53 мг рыжевато-коричневого твердого вещества. Твердое вещество обрабатывали 2 мл метанола и 1 мл 1,0 М HCl в метанольном растворе. Твердое вещество осаждали, используя 10 мл диэтилового эфира, выделяли фильтрованием через воронку Бюхнера и сушили на воздухе, затем в вакууме, получая 45 мг оранжевого твердого вещества. После окончательной очистки обращенно-фазовой высокоэффективной жидкостной хроматографией (колонка C-18, 2×10 см, с элюированием при скорости 25 мл/мин в линейном градиенте (A) 0,05% TFA/вода - (B) 0,05% TFA/ацетонитрил) получали два продукта в виде трифторацетатных солей: 7 мг (4%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1H-имидазол-2-ил)-амида трифторацетата в виде бледно-желтого твердого вещества (второй пик, MS: (M+H)+=393; 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 13.24 (br. s., 1H), 11.33 (br. s., 1H), 9.19 (s, 1H), 8.70-8.79 (m, 2H), 8.00 (s, 1H), 7.29 (d, J=8,69 Гц, 1H), 7.11 (br. s., 2H), 4.18 (s, 3H)) и 0,016 г (10%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-амино-этил)-амида трифторацетата в виде белого твердого вещества (первый пик, MS: (M+H)+=370; 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 12.92 (br. s., 1H), 9.10 (s, 1H), 8.44-8.51 (m, 2H), 8.33 (t, J=5,67 Гц, 1H), 8.00 (s, 1H), 7.85 (br. s., 3H), 7.38 (d, J=8,69 Гц, 1H), 4.17 (s, 3H), 3.70 (q, J=6,04 Гц, 2H), 3.02-3.16 (m, 2H)).
Пример 144
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-4-гидрокси-циклогексил)-амид
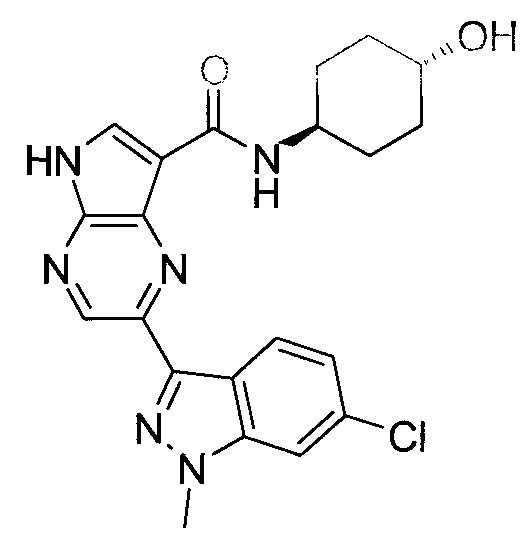
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-4-гидрокси-циклогексил)амид
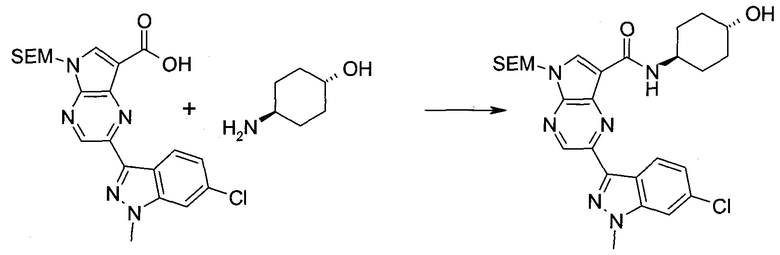
В круглодонной колбе емкостью 100 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбонову. кислоту (0,150 г; 0,295 ммоль), EDC (61 мг; 0,32 ммоль), DIEA (52 мкл; 0,295 ммоль) в дихлорметане (3 мл), получая желтый раствор. Перемешивали в течение 30 мин, затем добавляли транс-4-аминоциклогексанол (48 мг; 0,42 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч, затем разбавляли дихлорметаном и промывали водой. Органический слой сушили над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 0%-5% MeOH в DCM) и перекристаллизовывали из этилацетата, получая 60 мг 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-4-гидрокси-циклогексил)амида в виде белого твердого вещества. MS: [M+H]+=555.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-4-гидрокси-циклогексил)-амид
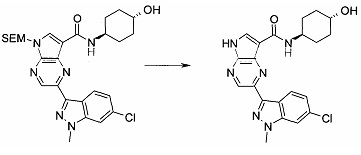
В круглодонной колбе емкостью 25 мл растворяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-4-гидрокси-циклогексил)амид (60 мг; 0,108 ммоль) в
дихлорметане (3 мл). Добавляли трифторуксусную кислоту (0,2 мл; 2,6 ммоль) и оранжевую реакционную смесь перемешивали при комнатной температуре в течение 15 ч. Добавляли дополнительное количество трифторуксусной кислоты (0,7 мл) и реакционную смесь перемешивали в течение еще 5 ч. Затем реакционную смесь концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (3 мл) и добавляли этилендиамин (0,20 мл; 2,96 ммоль). Светло-желтую реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество последовательно промывали водой, дихлорметаном, этилацетатом и гексанами, получая 28 мг (60%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-4-гидрокси-циклогексил)амида в виде светло-желтого твердого вещества. MS: [M+H]+=525; 1H ЯМР (300 МГц, DMSO-d6) δ: 9.08 (s, 2H), 8.40 (s, 1H), 8.43 (d, J=1,0 Гц, 1H), 8.02 (d, J=1,0 Гц, 1H), 8.01 (s, 1H), 7.28 (dd, J=8,6; 2,0 Гц, 1H), 4.45-4.76 (m, 1H), 4.17 (s, 3H), 3.70-3.96 (m, 1H), 3.43-3.59 (m, 1H), 2.07 (d, J=11,1 Гц, 2H), 1.92 (d, J=10,6 Гц, 2H), 1.18-1.55 (m, 4H).
Пример 145
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-4-амино-циклогексил)-амид
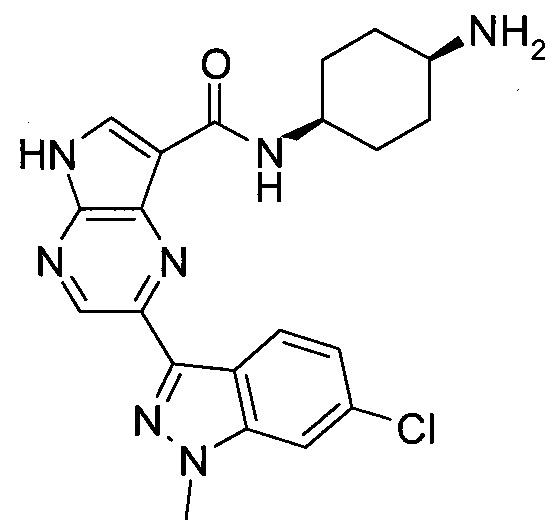
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-4-амино-циклогексил)амид
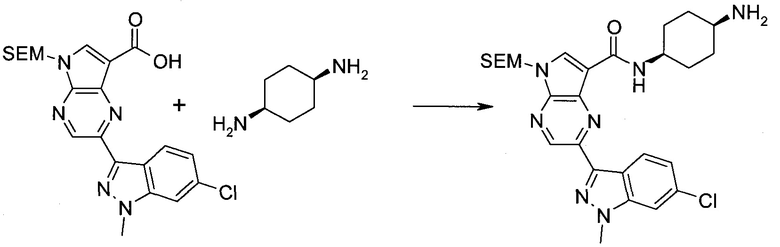
В сцинтилляционном флаконе емкостью 20 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (0,10 г; 0,22 ммоль), 2-(1H-бензо[d][1,2,3]триазол-1-ил)-1,1,3,3-тетраметилизоурония гексафторфосфат (91 мг; 0,24 ммоль), 1H-бензо[d][1,2,3]триазол-1-ол (33 мг; 0,240 ммоль) и N,N-диизопропилэтиламин (38 мкл; 0,22 ммоль) в DMF (4 мл), получая светло-желтый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 45 мин. В круглодонной колбе емкостью 20 мл растворяли цис-циклогексан-1,4-диамин (249 мг; 2,18 ммоль) в 0,4 мл DMF, получая бесцветный раствор. К этому раствору амина по каплям добавляли реакционную смесь с карбоновой кислотой. Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь разбавляли EtOAc (примерно 50 мл) и промывали насыщ. NaHCO3 (3×25 мл) и H2O (3×25 мл). Органический слой сушили над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на SiO2 с использованием 0%-10% MeOH в DCM, содержащем 0,1% NH4OH, получая 86 мг 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-4-амино-циклогексил)амида в виде белого твердого вещества. MS: [M+H]+=554.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-4-амино-циклогексил)-амид
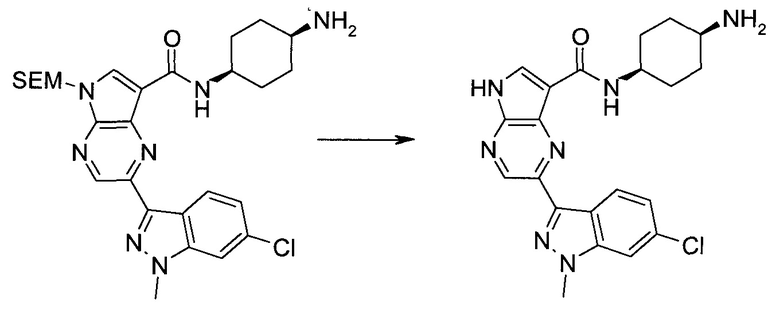
В круглодонной колбе емкостью 25 мл растворяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-4-амино-циклогексил)амид (85 мг; 0,153 ммоль) в дихлорметане (8 мл). Добавляли трифторуксусную кислоту (2,5 мл; 32,4 ммоль) и оранжевую реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Затем реакционную смесь концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (8 мл) и добавляли этилендиамин (1 мл; 14,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество последовательно промывали водой, дихлорметаном, этилацетатом и гексанами, получая 61 мг (93%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-4-амино-циклогексил)-амида в виде светло-желтого твердого вещества. MS: [M+H]+=424; 1H ЯМР (300 МГц, DMSO-d6) δ: 9.05 (d, J=1,0 Гц, 1H), 8.47 (d, J=9,1 Гц, 1H), 8.42 (d, J=1,0 Гц, 1H), 8.08 (d, J=7,1 Гц, 1H), 7.98 (s, 1H), 7.40 (d, J=9,1 Гц, 1H), 4.17 (d, J=1,0 Гц, 3H), 4.00 (br. s., 1H), 2.96 (br. s., 1H), 1.87-2.02 (m, 2H), 1.66-1.76 (m, 2H), 1.55-1.66 (m, 2H), 1.44-1.54 (m, 2H).
Пример 146
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-4-амино-циклогексил)-амид
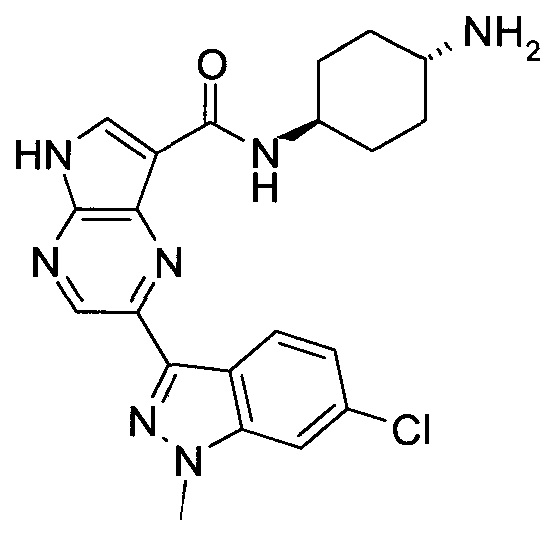
Получали в соответствии с методикой, приведенной в примере 2, заменяя транс-циклогексан-1,4-диамин на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде беловатого твердого вещества (33 мг; 68%); MS: [M+H]+=424; 1H ЯМР (300 МГц, DMSO-d6) δ: 9.04 (d, J=1,5 Гц, 1H), 8.44 (dd, J=8,6; 1,0 Гц, 1H), 8.41 (d, J=1,5 Гц, 1H), 8.03 (d, J=8,1 Гц, 1H), 8.00 (s, 1H), 7.26 (d, J=8,6 Гц, 1H), 4.17 (d, J=1,5 Гц, 3H), 3.83 (br. s., 1H), 2.64-2.76 (m, 1H), 2.08 (d, J=10,1 Гц, 2H), 1.88 (d, J=12,1 Гц, 2H), 1.33-1.43 (m, 2H), 1.18-1.30 (m, 2H).
Пример 147
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-оксо-циклогексил)-амид
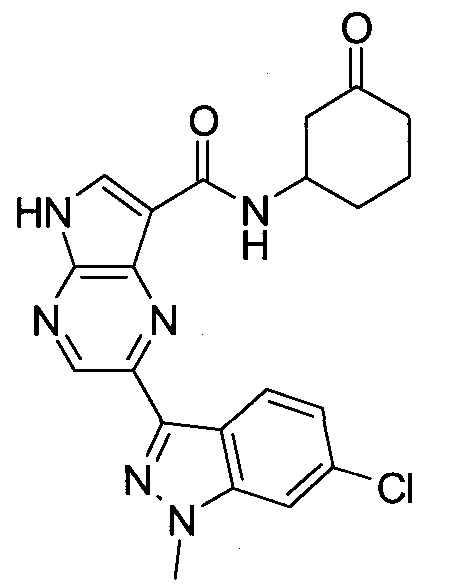
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-циклогексил)амид
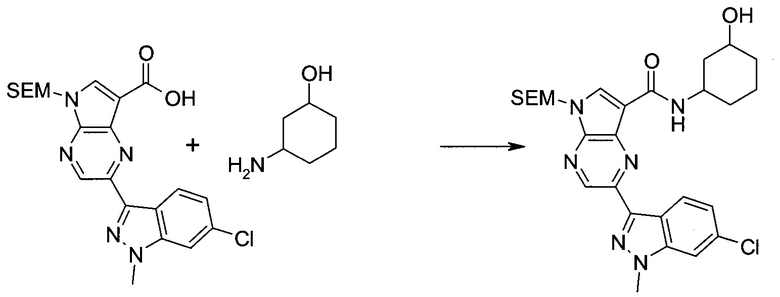
В круглодонную колбу емкостью 25 мл загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (0,10 г; 0,22 ммоль), 3-аминоциклогексанол (смесь цис- и транс-изомеров) (45 мг; 0,39 ммоль), HBTU (0,10 г; 0,26 ммоль) и HOBT (0,03 г; 0,26 ммоль). Затем добавляли DMF (1,0 мл), после чего N,N-диизопропилэтиламин (0,07 мл; 0,26 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (30 мл). Органический слой один раз промывали насыщенным NaHCO3 и водой. Объединенные водные слои повторно экстрагировали EtOAc (25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на SiO2 с использвоанием смеси EtOAc/гексаны (градиент: 0-100% EtOAc), получая 106 мг 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-циклогексил)амида в виде беловатой пены. MS: [M+H]+=556.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-циклогексил)-амид
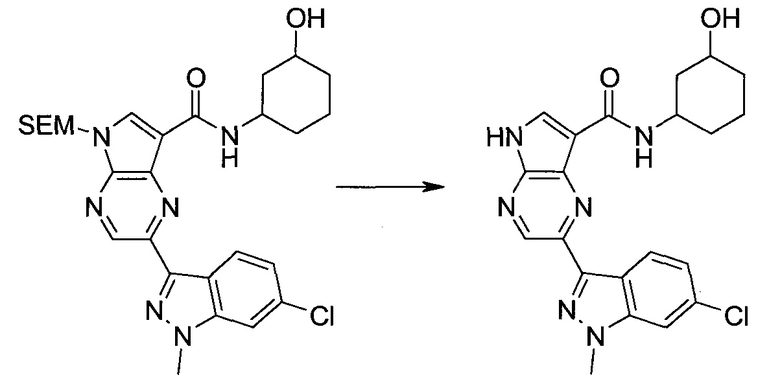
В круглодонной колбе емкостью 25 мл растворяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-циклогексил)амид (106 мг; 0,19 ммоль) в дихлорметане (3 мл). Добавляли трифторуксусную кислоту (0,2 мл; 2,6 ммоль) и оранжевую реакционную смесь перемешивали при комнатной температуре в течение 15 ч. Добавляли дополнительное количество трифторуксусной кислоты (0,7 мл) и реакционную смесь перемешивали в течение еще 5 ч. Затем реакционную смесь концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (3 мл) и добавляли этилендиамин (0,20 мл; 2,96 ммоль). Светло-желтую реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество последовательно промывали водой, дихлорметаном, этилацетатом и гексанами, получая 74 мг (91%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-циклогексил)-амида в виде белого твердого вещества и 2:1 смесь цис- и транс-изомеров (не определенных). MS: [M+Na] 447.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-оксо-циклогексил)-амид
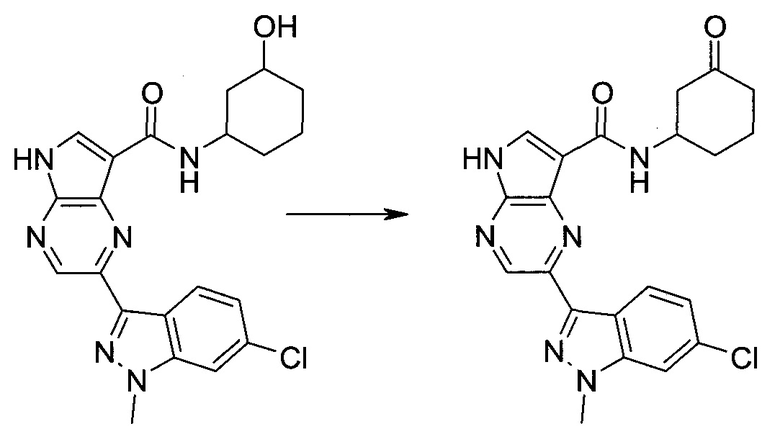
В круглодонную колбу емкостью 25 мл загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-циклогексил)амид (22 мг; 0,052 ммоль) и дихлорметан (5 мл). К реакционной смеси добавляли в виде одной порции периодинан Десса-Мартина (34,0 мг; 0,08 ммоль). Реакционную смесь помещали в атмосферу Ar и перемешивали в течение 2 ч при комнатной температуре. Добавляли DMF (1,5 мл) и реакционную смесь перемешивали в течение еще 18 ч. Реакционную смесь разбавляли до 100 мл, используя EtOAc, и промывали насыщ. NaHCO3 (3×20 мл). Неочищенный белый осадок отфильтровывали и сохраняли. Органический слой сушили над Na2SO4 и концентрировали в вакууме, получая неочищенное твердое вещество. Объединенные неочищенные твердые вещества растирали с EtOAc (1×20 мл), затем очищали хроматографией на SiO2 с использованием смеси MeOH/дихлорметан (градиент: 0%-5% MeOH), получая 6 мг (27%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-оксо-циклогексил)-амида в виде белого твердого вещества. MS: [M+H]+=423, 1H ЯМР (300 МГц, DMSO-d6) δ: 12.89 (br. s., 1H), 9.09 (s, 1H), 8.47 (s, 1H), 8.42 (d, J=8,7 Гц, 1H), 8.16 (d, J=7,6 Гц, 1H), 8.01 (d, J=1,5 Гц, 1H), 7.39 (dd, J=8,7; 1,9 Гц, 1H), 4.23-4.41 (m, 1H), 4.18 (s, 3H), 2.69-2.78 (m, 1H), 2.58 (d, J=10,2 Гц, 1H), 2.42 (dd, J=11,1; 5,9 Гц, 1H), 2.17-2.34 (m, 2H), 1.96-2.08 (m, 1H), 1.80-1.93 (m, 1H), 1.65-1.80 (m, 1H).
Примеры 148 и 149
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-гидрокси-циклогексил)-амид и 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-гидрокси-циклогексил)-амид
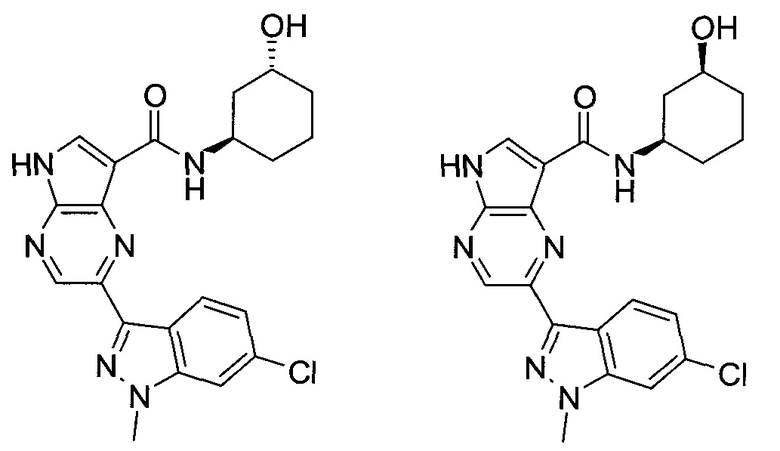
Образец 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-циклогексил)-амида (пример 147, стадия 2) очищали хроматографией на SiO2 с использованием смеси MeOH/дихлорметан (градиент: 0%-10% MeOH, содержащего 0,1% NH4OH), получая 8 мг 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-гидрокси-циклогексил)-амида: 1H ЯМР (300 МГц, DMSO-d6) δ: 12.85 (br s, 1H), 9.08 (s, 1H), 8.48 (d, J=8,7 Гц, 1H), 8.42 (s, 1H), 8.09 (d, J=7,9 Гц, 1H), 8.01 (d, J=1,1 Гц, 1H), 7.31 (dd, J=8,5; 1,3 Гц, 1H), 4.79 (br. s., 1H), 4.17 (s, 3H), 3.84-4.02 (m, 1H), 3.49-3.61 (m, 1H), 2.28 (app d, J=10,6 Гц, 1H), 2.03 (app d, J=12,8 Гц, 1H), 1.88 (app d, J=10,6 Гц, 1H), 1.77 (app d, J=13,2 Гц, 1H), 1.06-1.43 (m, 4H); и 3 мг 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-гидрокси-циклогексил)-амида: 1H ЯМР (300 МГц, DMSO-d6) δ: 12.85 (br s, 1H), 9.10 (s, 1H), 8.46 (d, J=8,7 Гц, 1H), 8.40 (d, J=7,9 Гц, 1H), 8.02 (s, 1H), 8.01 (d, J=8,3 Гц, 1H), 7.30 (dd, J=9,1; 1,3 Гц, 1H), 4.57 (br d, J=3,8 Гц, 1H), 4.26-4.43 (m, 1H), 4.18 (s, 3H), 3.96-4.05 (m, 1H), 1.92 (app d, J=11,7 Гц, 1H), 1.77 (app d, J=13,2 Гц, 1H), 1.65 (app d, J=12,8 Гц, 1H), 1.49-1.58 (m, 1H), 1.10-1.43 (m, 4H).
Пример 150
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-фенил-этил)-амид
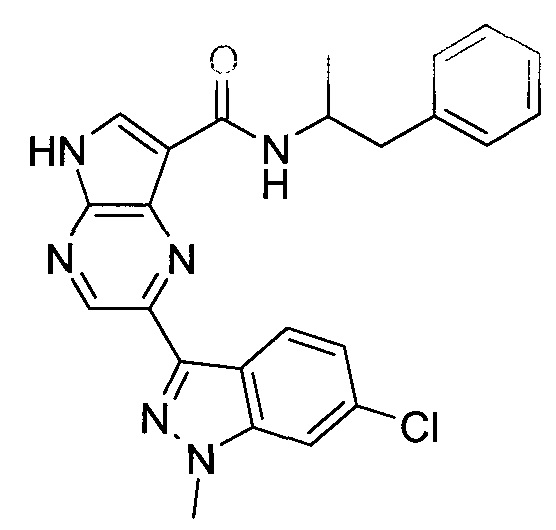
Получали в соответствии с методикой, приведенной в примере 145, заменяя d,l-амфетамина сульфат на цис-циклогексан-1,4-диамин на стадии 1.
Конечное соединение выделяли в виде светло-желтого твердого вещества (31 мг; 67%); MS: [M+Na]+=467; 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 12.83 (br. s., 1H), 9.09 (s, 1H),8.44(s, 1H), 8.16 (d, J=8,7 Гц, 1H), 8.09 (d, J=8,3 Гц, 1H), 7.99 (d, J=1,5 Гц, 1H), 7.04-7.31 (m, 6H), 4.41 (dt, J=13,8; 6,7 Гц, 1H), 4.17 (s, 3H), 2.84-3.05 (m, 2H), 1.27 (d, J=6,4 Гц, 3H).
Пример 151
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,3S)-3-гидрокси-циклопентил)-амид
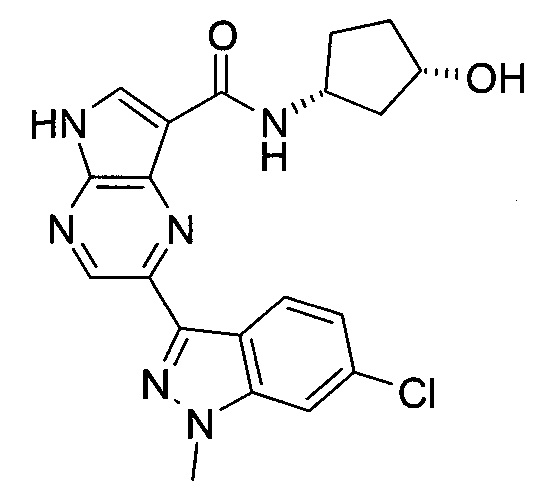
Получали в соответствии с методикой, приведенной в примере 145, заменяя (1S,3R)-3-аминоциклопентанол на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде светло-желтого твердого вещества (26 мг; 97%); MS: [M+Na]+=432; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.61 (br. s., 1H), 9.12 (s, 1H), 8.57 (d, J=8,7 Гц, 1H), 8.42 (s, 1H), 8.19 (d, J=8,3 Гц, 1H), 7.99 (s, 1H), 7.37 (dd, J=8,5; 1,3 Гц, 3H), 4.80 (d, J=2,6 Гц, 1H), 4.44 (sxt, J=7,5 Гц, 1H), 4.20-4.26 (m, 1H), 4.17 (s, 3H), 2.30 (ddd, J=13,7; 8,2; 5,7 Гц, 1H), 2.07-2.18 (m, 1H), 1.69-1.86 (m, 3H), 1.51-1.62 (m, 1H).
Пример 152
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-метокси-1-метил-этил)-амид
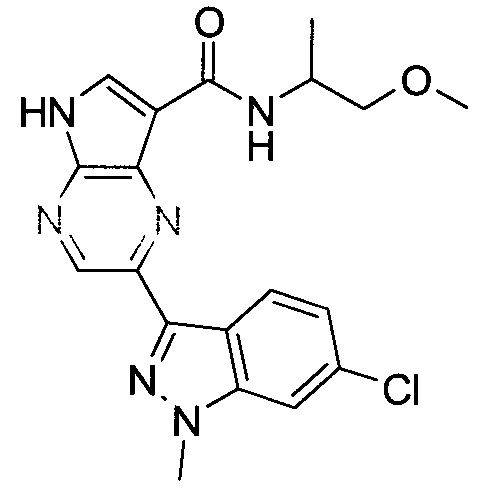
Получали в соответствии с методикой, приведенной в примере 145, заменяя 1-метоксипропан-2-амин на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде светло-желтого твердого вещества (28 мг; 69%); MS: [M+H]+=399; 1H ЯМР (300 МГц, DMSO-d6) δ: 9.11 (s, 1H), 8.53 (d, J=8,7
Гц, 1H), 8.44 (s, 1H), 8.20 (d, J=8,7 Гц, 1H), 8.01 (d, J=1,5 Гц, 1H), 7.28 (dd, J=8,7; 1,5 Гц, 1H), 4.30-4.47 (m, 1H), 4.18 (s, 3H), 3.50 (qd, J=9,6; 4,5 Гц, 2H), 3.27 (s, 3H), 1.31 (d, J=6,8 Гц, 3H).
Пример 153
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-метил-циклогексил)-амид
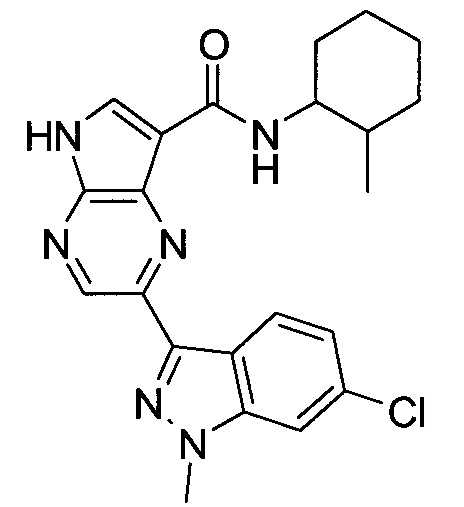
Получали в соответствии с методикой, приведенной в примере 145, заменяя 2-метилциклогексиламин на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде светло-желтого твердого вещества в смеси диастереомеров 2:3 (39 мг; 58%); MS: [M+H]+=423; 1H ЯМР (300 МГц, DMSO-d6) δ: 9.08 (s, 1H), 9.01 (s, 1H), 8.42 (s, 1H), 8.43 (d, J=8,7 Гц, 1H), 8.39 (s, 1H), 8.35 (d, J=8,7 Гц, 1H), 8.07 (s, 1H), 8.03 (d, J=8,7 Гц, 1H), 8.02 (d, J=8,9 Гц, 1H), 7.99 (s, 1H), 7.26 (d, J=8,3 Гц, 1H), 7.25 (d, J=8,3 Гц, 1H), 4.25 (br. s., 2H), 4.17 (s, 6H), 1.06-2.12 (m, 18H), 0.98 (d, J=6,4 Гц, 3H), 0.90 (d, J=6,8 Гц, 3H)).
Пример 154
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(тетрагидро-фуран-2-ил)-этил]-амид
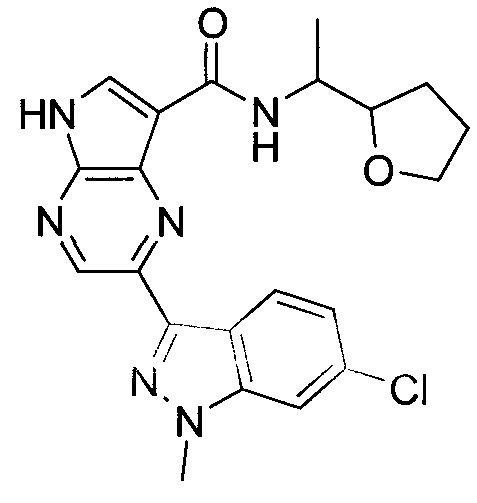
Получали в соответствии с методикой, приведенной в примере 145, заменяя 1-(тетрагидрофуран-2-ил)этиламин на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде беловатого твердого вещества и смеси изомеров (36 мг; 71%) MS: [M+H]+=425; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.81 (br. s., 2H), 9.15 (s, 1H), 9.12 (s, 1H), 8.64 (d, J=8,7 Гц, 1H), 8.54 (d, J=8,7 Гц, 1H), 8.45 (s, 2H), 8.23 (d, J=9,4 Гц, 2H), 8.00 (d, J=1,5 Гц, 2H), 7.27 (dd, J=8,7;
1,5 Гц, 1H), 7.25 (dd, J=8,7; 1,5 Гц, 1H), 4.18-4.41 (m, 2H), 4.18 (s, 6H), 3.91-4.02 (m, 1H), 3.85 (q, J=6,9 Гц, 1H), 3.65-3.75 (m, 1H), 3.53-3.66 (m, 1H), 3.36 (s, 2H), 1.52-2.05 (m, 8H), 1.34 (d, J=6,8 Гц, 3H), 1.26 (d, J=6,8 Гц, 3H).
Пример 155
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-карбамоил-циклогексил)-амид
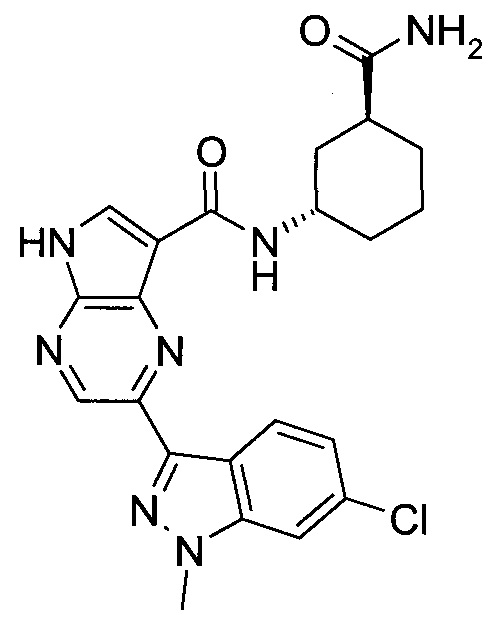
Получали в соответствии с методикой, приведенной в примере 145, заменяя транс-3-аминоциклогексанкарбоксамида гидрохлорид на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде беловатого твердого вещества (4,5 мг; 29%); MS: [M+Na]+=474; 1H ЯМР (DMSO-d6) δ: 12.85 (br. s., 1H), 9.05 (s, 1H), 8.46 (s, 1H), 8.41 (d, J=8,7 Гц, 1H), 8.12 (d, J=7,6 Гц, 1H), 8.00 (d, J=1,5 Гц, 1H), 7.27 (dd, J=8,7; 1,5 Гц, 1H), 7.16 (br. s., 1H), 6.69 (br. s., 1H), 4.27-4.39 (m, 1H), 4.18 (s, 3H), 2.39-2.52 (m, 1H), 1.43-1.95 (m, 8H).
Пример 156
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-циано-цикпогексил)-амид
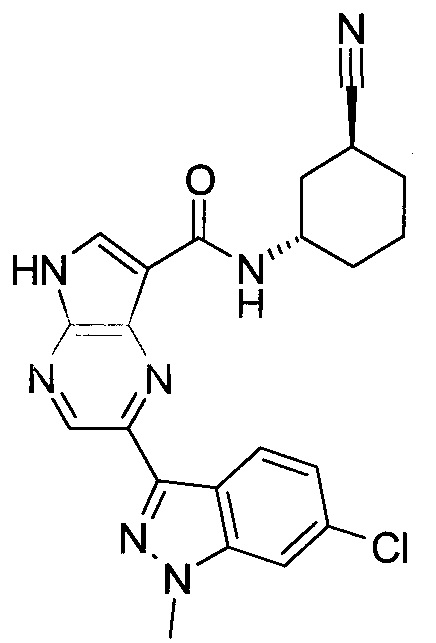
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-карбамоил-циклогексил)-амид
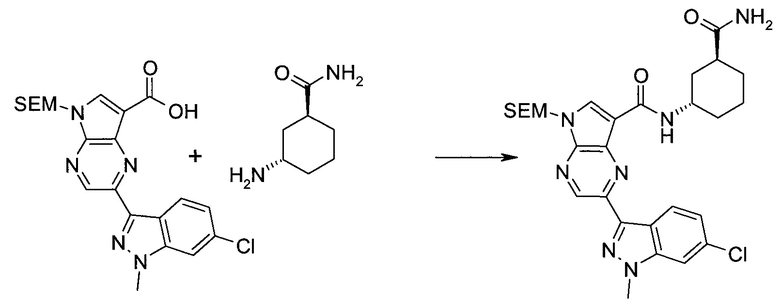
В круглодонную колбу емкостью 25 мл загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (0,15 г; 0,33 ммоль), транс-3-аминоциклогексан-карбоксамида гидрохлорид (88 мг; 0,49 ммоль), HBTU (155 мг; 0,41 ммоль) и HOBT (49 мг; 0,41 ммоль). Затем добавляли DMF (1,0 мл), после чего N,N-диизопропилэтиламин (0,17 мл; 0,97 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (30 мл). Органический слой один раз промывали насыщенным NaHCO3 и водой. Объединенные водные слои повторно экстрагировали EtOAc (25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гексаны (градиент: 0-100% EtOAc), получая 119 мг (62%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-карбамоил-циклогексил)-амида в виде белого твердого вещества. MS: [M+Na]+=604.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-циано-циклогексил)-амид
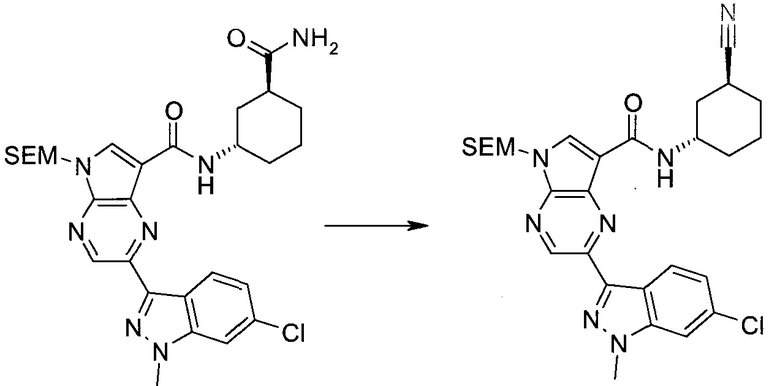
В колбе грушевидной формы емкостью 25 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-карбамоил-циклогексил)-амид (72 мг; 0,124 ммоль) в пиридине (412 мкл), получая беловатый раствор. Реакционную смесь охлаждали при 0°C и по каплям добавляли трифторуксусный ангидрид (0,71 М в пиридине; 26 мкл; 0,18 ммоль). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 30 мин и затем концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гексаны (градиент: 0-50% EtOAc), получая 27 мг (39%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-циано-циклогексил)-амида в виде белого твердого вещества. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.14 (s, 1H), 8.66 (s, 1H), 8.40 (d, J=8,7 Гц, 1H), 8.06 (d, J=7,9 Гц, 1H), 8.01 (d, J=1,0 Гц, 1H), 7.38 (dd, J=8,7; 1,0 Гц, 1H), 5.73 (s, 2H), 4.18 (s, 3H), 4.09-4.28 (m, 1H), 3.59 (t, J=7,9 Гц, 2H), 3.41-3.60 (br. s., 1H), 2.24 (app. d, J=12,5 Гц, 1H), 2.07 (app. d, J=12,1 Гц, 1H), 1.59-1.91 (m, 5H), 1.39-1.59 (m, 1H), 0.86 (t, J=7,9 Гц, 2H), -0.08 (s, 9H).+
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-циано-циклогексил)-амид
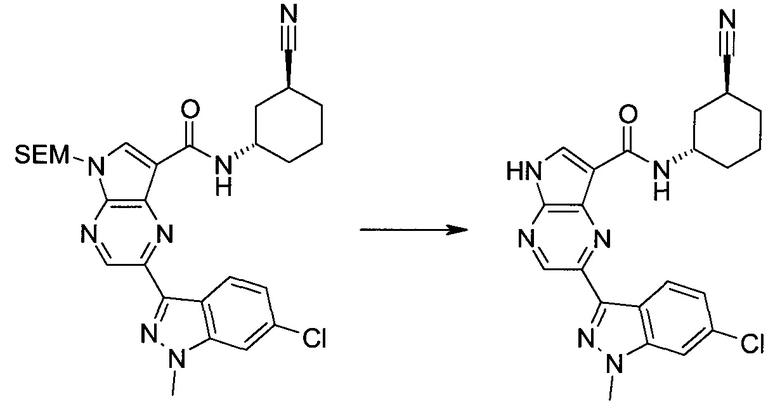
В круглодонной колбе емкостью 25 мл растворяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-циано-циклогексил)-амид (48 мг; 0,085 ммоль) в дихлорметане (3 мл). Добавляли трифторуксусную кислоту (1,2 мл; 15,6 ммоль) и оранжевую реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Затем реакционную смесь концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (3 мл) и добавляли этилендиамин (0,50 мл; 7,4 ммоль). Светло-желтую реакционную смесь перемешивали при комнатной температуре в течение
18 ч. Реакционную смесь концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество последовательно промывали водой, этилацетатом и гексанами, получая 35 мг (95%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-циано-циклогексил)-амида в виде беловатого твердого вещества. MS: [M+Na]+=474; 1H ЯМР (DMSO-d6) δ: 12.79 (br. s., 1H), 9.08 (s, 1H), 8.46 (s, 1H), 8.40 (d, J=8,7 Гц, 1H), 8.08 (d, J=7,9 Гц, 1H), 8.00 (d, J=0,8 Гц, 1H), 7.37 (dd, J=8,5; 1,1 Гц, 1H), 4.17 (s, 3H), 4.01-4.31 (m, 1H), 3.30-3.49 (m, 1H), 2.24 (d, J=13,2 Гц, 1H), 2.07 (d, J=12,1 Гц, 1H), 1.59-1.94 (m, 5H), 1.36-1.59 (m, 1H).
Пример 157
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (R)-индан-1-иламид
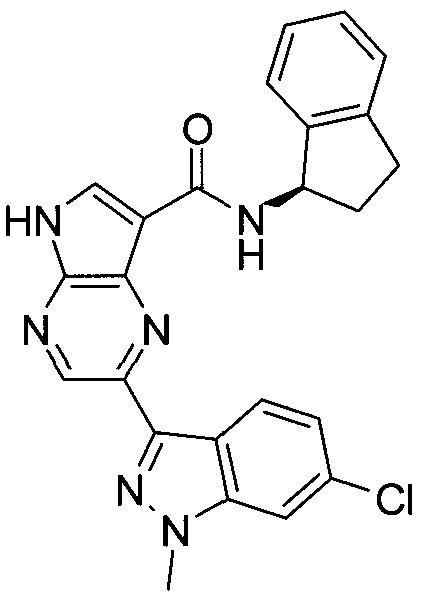
Получали в соответствии с методикой, приведенной в примере 145, заменяя (R)-2,3-дигидро-1H-инден-1-амин на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде беловатого твердого вещества (15 мг; 21%); MS: [M+Na]+=475; 1H ЯМР (DMSO-d6) δ: 12.91 (br. s., 1H), 9.09 (s, 1H), 8.52-8.55 (m, 1H), 8.50 (d, J=8,7 Гц, 1H), 7.91 (d, J=1,0 Гц, 1H), 7.83 (d, J=8,7 Гц, 1H), 7.41 (t, J=9,1 Гц, 1H), 7.32 (t, J=7,2 Гц, 2H), 7.22 (t, J=7,6 Гц, 1H), 6.51 (dd, J=8,7; 1,5 Гц, 1H), 5.73 (q, J=7,8 Гц, 1H), 4.14-4.20 (m, 1H), 4.12 (s, 3H), 3.01-3.16 (m, 1H), 2.86-3.01 (m, 1H), 2.59-2.77 (m, 1H), 1.79-2.02 (m, 1H).
Пример 158
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-4-гидрокси-циклогексил)-амид
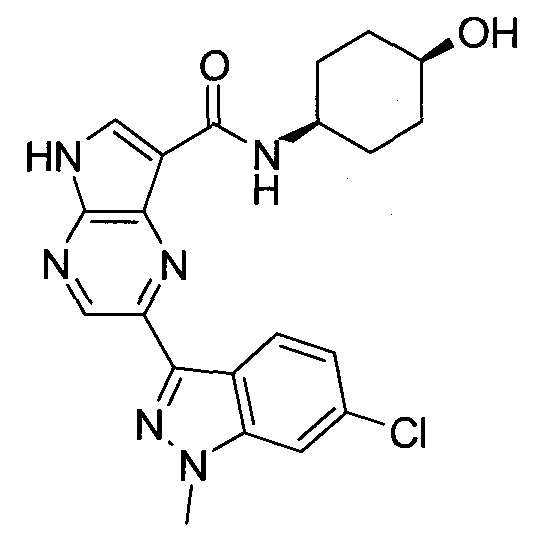
Получали в соответствии с методикой, приведенной в примере 145, заменяя цис-4-аминоциклогексанола гидрохлорид на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде светло-желтого твердого вещества (47 мг; 91%); MS: [M+Na]+=447; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.35 (br. s., 1H), 9.11 (s, 1H), 8.47 (d, J=8,7 Гц, 1H), 8.43 (s, 1H), 8.14 (d, J=7,9 Гц, 1H), 8.00 (d, J=1,5 Гц, 1H), 7.42 (dd, J=8,7; 1,5 Гц, 1H), 4.58 (br. s., 1H), 4.18 (s, 3H), 3.88-4.09 (m, 1H), 3.81 (br. s., 1H), 1.53-1.93 (m, 8H).
Пример 159
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метокси-1-метил-этил)-амид
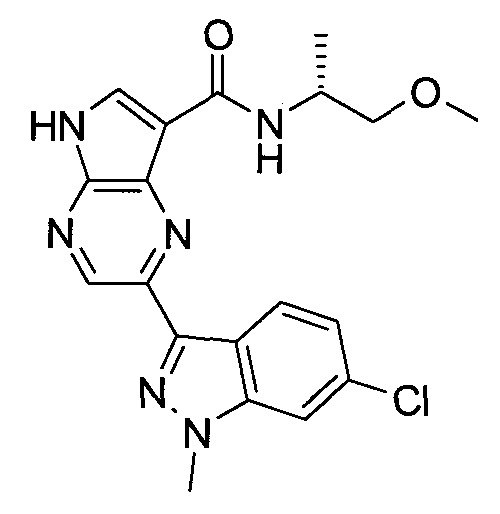
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1-метил-этил)-амид
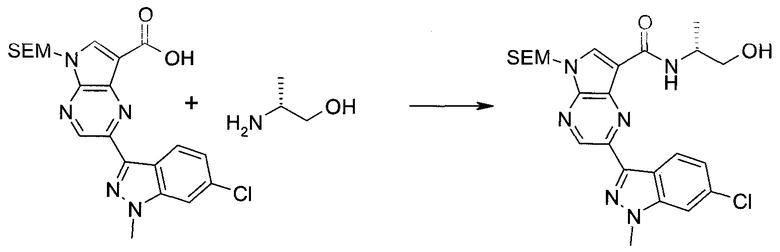
В круглодонную колбу емкостью 25 мл загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-
карбоновую кислоту (0,15 г; 0,33 ммоль), (R)-2-аминопропан-1-ол (49 мг; 0,66 ммоль), HBTU (155 мг; 0,41 ммоль) и HOBT (58 мг; 0,49 ммоль). Затем добавляли DMF (1,1 мл), после чего N,N-диизопропилэтиламин (0,17 мл; 0,97 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (30 мл). Органический слой один раз промывали насыщенным NaHCO3 и водой. Объединенные водные слои повторно экстрагировали EtOAc (25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гексаны (градиент: 0-60% EtOAc), получая 110 мг (65%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1-метил-этил)-амида в виде беловатого твердого вещества. MS: [M+H]+=515.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метокси-1-метил-этил)-амид
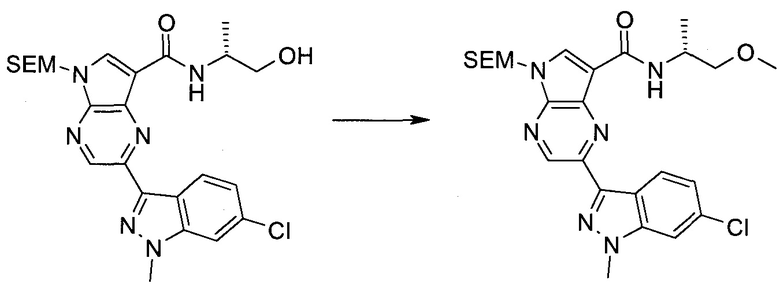
В круглодонной колбе емкостью 25 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1-метил-этил)-амид (70 мг; 0,136 ммоль), оксид серебра (51 мг; 0,22 ммоль) и метилиодид (100 мкл; 1,6 ммоль) в MeCN, получая черную суспензию. Круглодонную колбу обертывали фольгой для исключения попадания света. Систему помещали в песочную баню и нагревали до 40°C с перемешиванием. Такую температуру поддерживали в течение 2 суток. После охлаждения реакционную смесь фильтровали через набивку целита. Фильтрат концентрировали. Неочищенное вещество очищали хроматографией на SiO2 с использованием смеси EtOAc/гексаны (градиент: 0%-40% EtOAc), получая 32 мг (45%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метокси-1-метил-этил)-амида в виде беловатого твердого вещества. [M+Na]+=551.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метокси-1-метил-этил)-амид
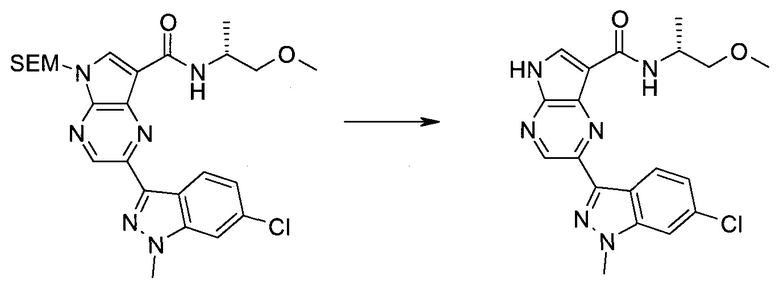
В герметично закрываемой круглодонной колбе емкостью 25 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метокси-1-метил-этил)-амид (32 мг; 0,061 ммоль) и TFA (0,9 мл; 11,7 ммоль) в дихлорметане (3 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре до полного израсходования исходного вещества (2,5 ч). Затем реакционную смесь концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (3 мл) и добавляли этилендиамин (300 мкл; 4,44 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (1:1 дихлорметан/гептан), получая 14 мг (59%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метокси-1-метил-этил)-амида в виде беловатого твердого вещества. MS: [M+H]+=399; 1H ЯМР (300 МГц, DMSO-d6) δ: 9.11 (s, 1H), 8.53 (d, J=8,6 Гц, 1H), 8.44 (s, 1H), 8.20 (d, J=8,6 Гц, 1H), 8.01 (d, J=1,5 Гц, 1H), 7.28 (dd, J=8,6; 2,0 Гц, 1H), 4.30-4.46 (m, 1H), 4.18 (s, 3H), 3.53 (dd, J=9,6; 5,1 Гц, 1H), 3.47 (dd, J=9,6; 4,5 Гц, 1H), 3.27 (s, 3H), 1.31 (d, J=6,6 Гц, 3H).
Пример 160
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2,2,2-трифтор-1-метил-этил)-амид
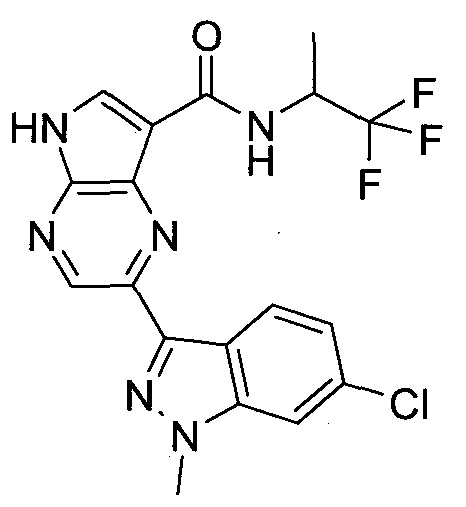
Получали в соответствии с методикой, приведенной в примере 145, заменяя 1,1,1-трифторпропан-2-амин на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде светло-желтого твердого вещества (25 мг; 68%); MS: [M+H]+=423; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.76 (br. s., 1H), 9.13 (s, 1H), 8.57 (s, 1H), 8.42 (d, J=8,7 Гц, 1H), 8.43 (d, J=9,4 Гц, 1H), 8.02 (d, J=1,5 Гц, 1H), 7.26 (dd, J=8,7; 1,9 Гц, 1H), 4.96-5.15 (m, 1H), 4.18 (s, 3H), 1.49 (d, J=7,2 Гц, 3H).
Пример 161
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-гидроксиметил-пропил)-амид
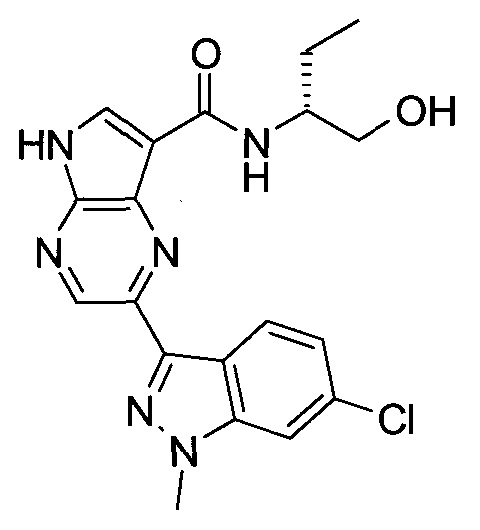
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-гидроксиметил-пропил)-амид
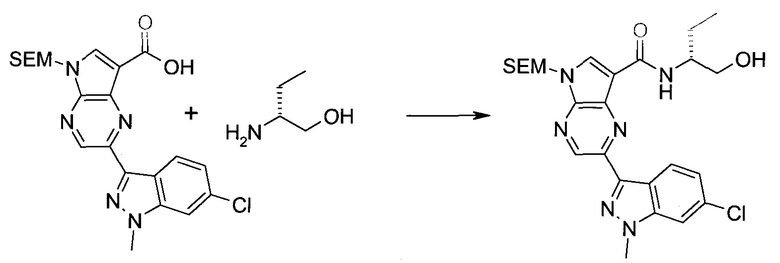
В круглодонную колбу емкостью 25 мл загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-
карбоновую кислоту (0,10 г; 0,22 ммоль), (R)-2-аминобутан-1-ол (65 мг; 0,73 ммоль), HBTU (108 мг; 0,28 ммоль) и HOBT (44 мг; 0,28 ммоль). Затем добавляли DMF (1 мл), после чего N,N-диизопропилэтиламин (0,11 мл; 0,66 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (30 мл). Органический слой один раз промывали насыщенным МаНСОз и водой. Объединенные водные слои повторно экстрагировали EtOAc (25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гексаны (градиент: 0-50% EtOAc), получая 70 мг (61%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-гидроксиметил-пропил)-амида в виде беловатого твердого вещества.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-гидроксиметил-пропил)-амид
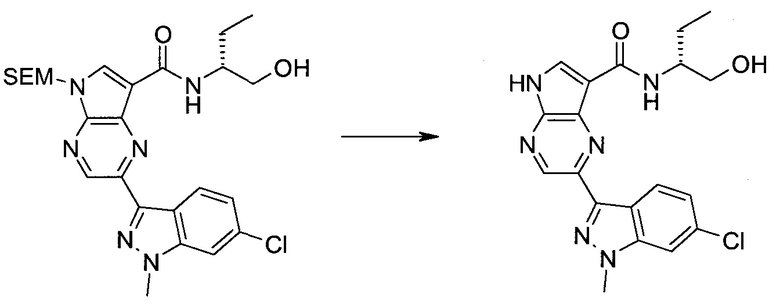
В герметично закрываемой круглодонной колбе емкостью 25 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1 -гидроксиметил-пропил)-амид (34 мг; 0,064 ммоль) и TFA (0,6 мл; 7,8 ммоль) в дихлорметане (2 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч. Затем реакционную смесь концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (2 мл) и добавляли этилендиамин (420 мкл; 6,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (1:1 дихлорметан/гептан), получая 8 мг (30%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-
гидроксиметил-пропил)-амида в виде желтого твердого вещества. MS: [M+H]+=399; 1H ЯМР (DMSO-d6) δ: 12.74 (br. s., 1H), 9.13 (s, 1H), 8.64 (d, J=8,7 Гц, 1H), 8.43 (s, 1H), 8.18 (d, J=9,1 Гц, 1H), 7.98 (d, J=1,1 Гц, 1H), 7.20-7.38 (m, 1H), 5.04 (t, J=5,1 Гц, 1H), 4.17 (s, 3H), 3.98-4.13 (m, 1H), 3.50-3.70 (m, 2H), 1.55-1.85 (m, 2H), 0.94 (t, J=7,4 Гц, 3H).
Пример 162
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метоксиметил-пропил)-амид
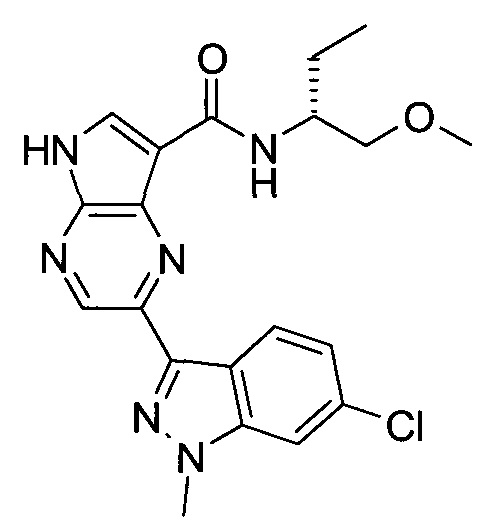
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метоксиметил-пропил)-амид
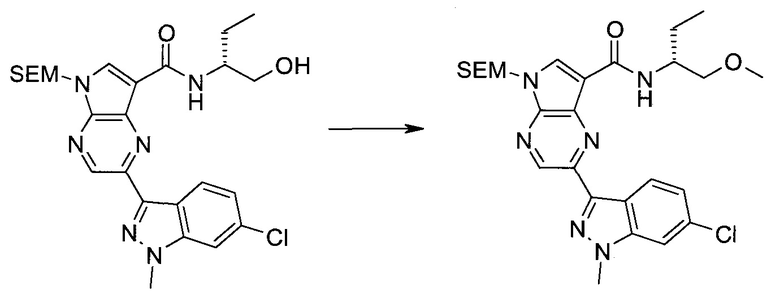
В реакционной пробирке емкостью 25 мл объединяли NaH (60%-ный в минеральном масле; 20 мг; 0,50 ммоль) с DMF (0,2 мл), получая серую суспензию. Реакционную смесь помещали в атмосферу аргона добавляли и раствор 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-гидроксиметил-пропил)-амида (161 мг; 0,30 ммоль) в DMF (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем добавляли иодметан (23 мкл; 0,37 ммоль). Реакционную смесь оставляли перемешиваться в течение 18 ч, затем гасили водным раствором хлорида аммония (5 мл) и экстрагировали EtOAc (3×10 мл). Объединенные органические слои промывали рассолом, сушили над
Na2SO4 и концентрировали. Неочищенное вещество очищали хроматографией на SiO2 с использованием смеси EtOAc/гексаны (градиент: 0%-40% EtOAc), получая 25 мг (15%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3b]пиразин-7-карбоновой кислоты ((R)-1-метоксиметил-пропил)-амида в виде беловатого твердого вещества. 1H ЯМР (DMSO-d6) δ: 9.18 (s, 1H), 8.65 (s, 1H), 8.50 (d, J=8,7 Гц, 1H), 8.15 (d, J=9,4 Гц, 1H), 8.02 (d, J=1,5 Гц, 1H), 7.26 (dd, J=8,5; 1,7 Гц, 1H), 5.74 (s, 2H), 4.19 (s, 3H), 4.14-4.30 (m, 1H), 3.60 (t, J=7,9 Гц, 2H), 3.54-3.63 (m, 1H), 3.49 (dd, J=9,4; 4,2 Гц, 1H), 3.27 (s, 3H), 1.78 (dq, J=13,6; 6,9 Гц, 1H), 1.66 (dq, J=14,5; 7,0 Гц, 1H), 0.96 (t, J=7,4 Гц, 3H), 0.86 (t, J=7,9 Гц, 2H), -0.08 (s, 9H).
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метоксиметил-пропил)-амид
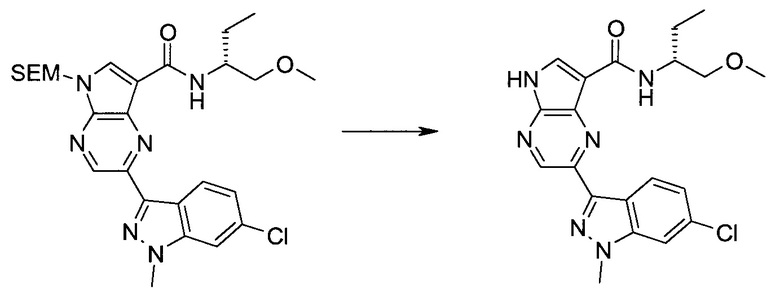
В герметично закрываемой круглодонной колбе емкостью 25 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метоксиметил-пропил)-амид (40 мг; 0,074 ммоль) и TFA (0,9 мл; 11,7 ммоль) в дихлорметане (3 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч. Затем реакционную смесь концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (3 мл) и добавляли этилендиамин (500 мкл; 7,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (11:1:1, горячая смесь гептан/дихлорметан/EtOAc), получая 21 мг (69%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метоксиметил-пропил)-амида в виде беловатого твердого вещества. MS: [M+H]+=413; 1H ЯМР (DMSO-d6) δ: 12.84 (br. s., 1H), 9.12 (s, 1H), 8.51 (d, J=8,7 Гц, 1H), 8.45 (s, 1H), 8.17 (d, J=9,1 Гц, 1H), 8.01 (d, J=1,5
Гц, 1H), 7.25 (dd, J=8,7; 1,5 Гц, 1H), 4.16-4.27 (m, 1H), 4.18 (s, 3H), 3.57 (dd, J=9,6; 4,3 Гц, 1H), 3.47 (dd, J=9,6; 4,3 Гц, 1H), 3.27 (s, 3H), 1.71-1.89 (m, 1H), 1.47-1.71 (m, 1H), 0.96 (t, J=7,4 Гц, 3H).
Пример 163
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (5-гидрокси-1,5-диметил-гексил)-амид
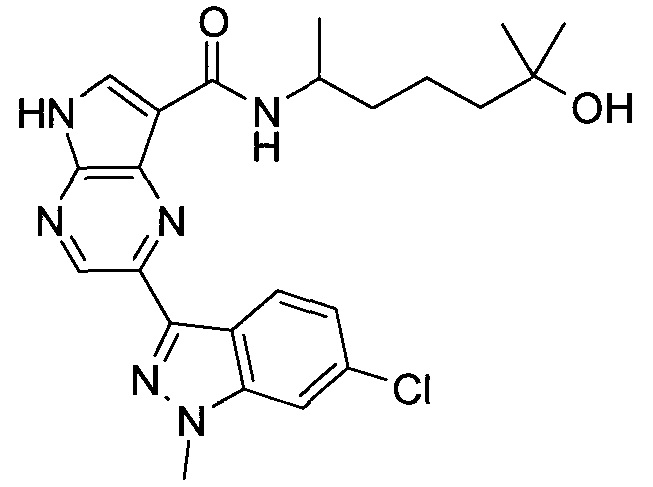
Получали в соответствии с методикой, приведенной в примере 145, заменяя 6-амино-2-метилгептан-2-ола гидрохлорид на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде белого твердого вещества (23 мг; 35%); [M+Na]+=477; 1H ЯМР (DMSO-d6) δ: 12.84 (br. s., 1H), 9.10 (s, 1H), 8.34-8.48 (m, 2H), 8.02 (t, J=4,2 Гц, 2H), 7.31 (dd, J=8,5; 1,3 Гц, 1H), 4.18 (s, 3H), 4.07-4.16 (m, 1H), 1.32-1.70 (m, 6H), 1.29 (d, J=6,8 Гц, 3H), 0.96 (d, J=2,3 Гц, 6H).
Пример 164
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амид
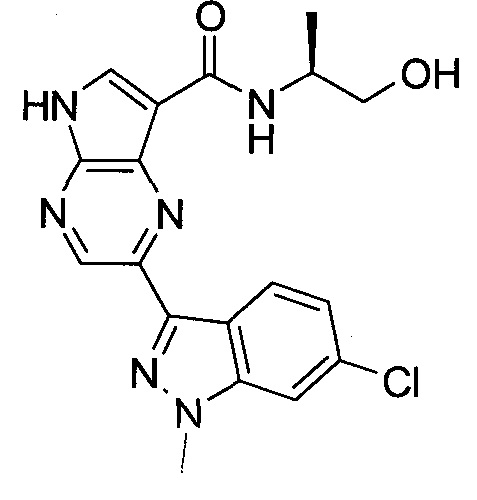
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амид
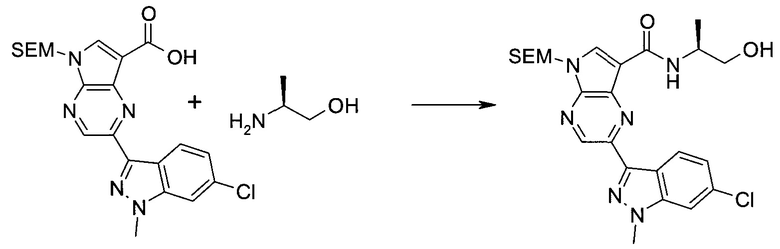
В круглодонную колбу емкостью 25 мл загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (0,20 г; 0,44 ммоль), (S)-2-аминопропан-1-ол (0,10 мл; 1,31 ммоль), HBTU (331 мг; 0,87 ммоль) и HOBT (134 мг; 0,87 ммоль). Затем добавляли DMF (1 мл), после чего N,N-диизопропилэтиламин (0,31 мл; 1,75 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (30 мл). Органический слой один раз промывали насыщенным NaHCO3 и водой. Объединенные водные слои повторно экстрагировали EtOAc (25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гексаны (градиент: 0-100% EtOAc), получая 149 мг(66%)2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амида в виде белого твердого вещества.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амид
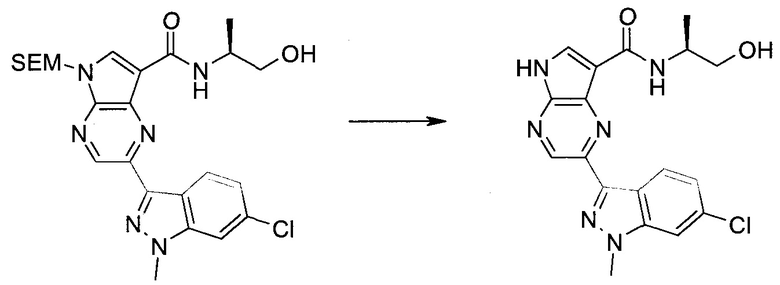
В герметично закрываемой круглодонной колбе емкостью 25 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амид (41 мг; 0,080 ммоль) и TFA (0,6 мл; 7,8 ммоль) в дихлорметане (2 мл), получая оранжевый раствор. Реакционную смесь перемешивали при
комнатной температуре до полного израсходования исходного вещества (2,5 ч). Затем реакционную смесь концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (2 мл) и добавляли этилендиамин (400 мкл; 5,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (9:1 дихлорметан/MeOH), получая 11 мг (36%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амида в виде беловатого твердого вещества. MS: [M+H]+=385; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.84 (br. s., 1H), 9.13 (s, 1H), 8.66 (d, J=8,7 Гц, 1H), 8.43 (s, 1H), 8.21 (d, J=8,3 Гц, 1H), 7.91-8.04 (m, 1H), 7.32 (dd, J=8,7; 1,5 Гц, 1H), 5.09 (t, J=5,1 Гц, 1H), 4.18 (s, 3H), 4.08-4.33 (m, 1H), 3.58 (t, J=4,7 Гц, 2H), 1.28 (d, J=6,8 Гц, 3H).
Пример 165
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
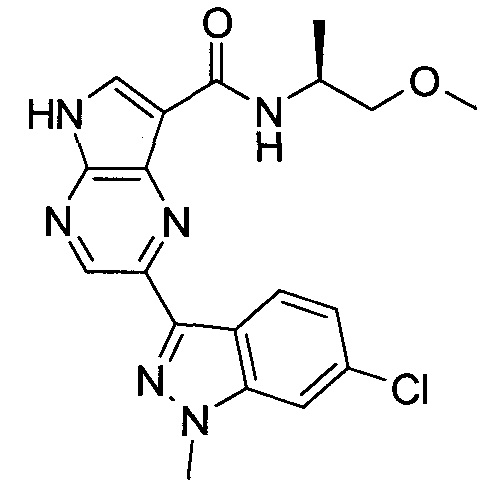
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
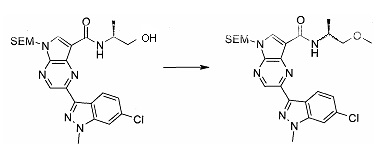
В круглодонной колбе емкостью 10 мл растворяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-
карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амид (44 мг; 0,085 ммоль) в THF (0,85 мл), получая бесцветный раствор. Реакционную смесь охлаждали в ледяной бане. К охлажденному раствору добавляли последовательно измельченный KOH (64 мг; 1,14 ммоль), каталитическое количество 18-краун-6 и иодметан (9 мкл; 0,147 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, после чего ледяную баню удаляли. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем разбавляли дихлорметаном (10 мл) и промывали водным хлоридом аммония (10 мл), водой (10 мл) и насыщенным бикарбонатом натрия (10 мл). Органический слой сушили над Na2SO4 и концентрировали. Неочищенное вещество очищали хроматографией на SiO2 с использованием смеси EtOAc/гептан (градиент: 0%-100% EtOAc), получая 22 мг (49%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((3)-2-метокси-1-метил-этил)-амида в виде белого твердого вещества. MS:
[M+Na]+=551.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
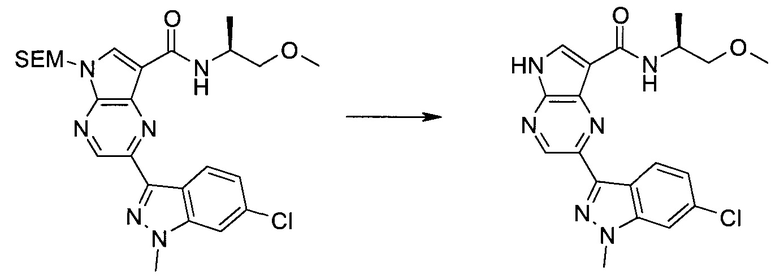
В герметично закрываемой круглодонной колбе емкостью 25 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (32 мг; 0,061 ммоль) и TFA (1,2 мл; 15,6 ммоль) в дихлорметане (4 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре до полного израсходования исходного вещества (2,5 ч). Затем реакционную смесь концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (2 мл) и добавляли этилендиамин (300 мкл; 4,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное
твердое вещество очищали растиранием (9:1 дихлорметан/гептан), получая 22 мг (93%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде беловатого твердого вещества. MS: [M+H]+=399; 1H ЯМР (DMSO-d6) δ: 12.72 (br. s., 1H), 9.11 (s, 1H), 8.53 (d, J=8,7 Гц, 1H), 8.44 (s, 1H), 8.20 (d, J=8,7 Гц, 1H), 8.01 (d, J=1,9 Гц, 1H), 7.28 (dd, J=8,7; 1,9 Гц, 1H), 4.30-4.45 (m, 1H), 4.18 (s, 3H), 3.50 (qd, J=9,6; 4,7 Гц, 2H), 3.27 (s, 3H), 1.31 (d, J=6,8 Гц, 3H).
Пример 166
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-метокси-1-метоксиметил-этил)-амид
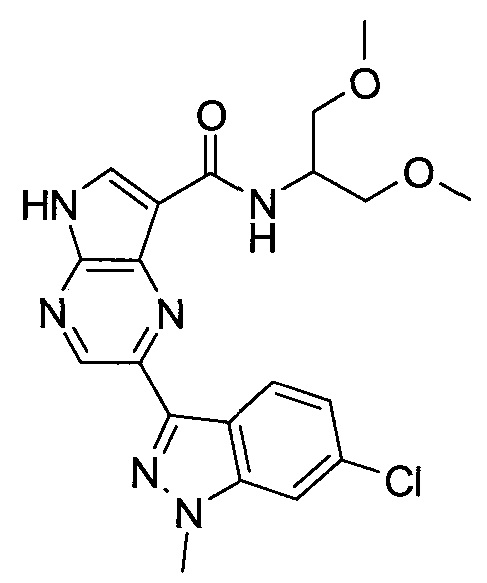
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1-гидроксиметил-этил)-амид
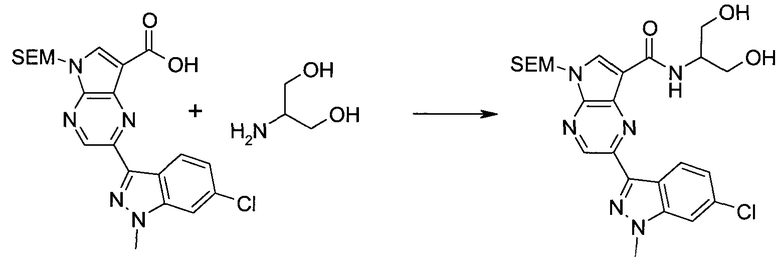
В круглодонную колбу емкостью 25 мл загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (0,20 г; 0,44 ммоль), 2-аминопропан-1,3-диол (119 мг; 1,31 ммоль), HBTU (331 мг; 0,87 ммоль) и HOBT (134 мг; 0,87 ммоль). Затем добавляли DMF (1 мл), после чего N,N-диизопропилэтиламин (0,31 мл; 1,75 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (30 мл). Органический слой один раз промывали насыщенным NaHCO3 и водой.
Объединенные водные слои повторно экстрагировали EtOAc (25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гексаны (градиент: 0-100% EtOAc), получая 157 мг (68%)2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1-гидроксиметил-этил)-амида в виде белого твердого вещества. MS: [M+Na]+=552.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-метокси-1-метоксиметил-этил)-амид
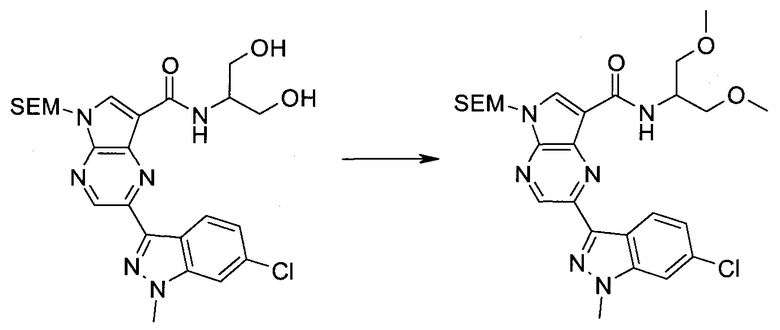
В круглодонной колбе емкостью 10 мл растворяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1-гидроксиметил-этил)-амид (60 мг; 0,113 ммоль) в THF (2,5 мл). Реакционную смесь охлаждали в ледяной бане и добавляли последовательно измельченный КОН (76 мг; 1,35 ммоль), 18-краун-6 (15 мг; 0,057 ммоль) и иодметан (18 мкл; 0,28 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, после чего ледяную баню удаляли. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем разбавляли дихлорметаном (10 мл) и промывали водой (10 мл) и насыщенным бикарбонатом натрия (10 мл). Органический слой сушили над Na2SO4 и концентрировали. Неочищенное вещество очищали хроматографией на SiO2 с использованием смеси EtOAc/гептан (градиент: 0%-100% EtOAc), получая 53 мг (84%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-метокси-1-метоксиметил-этил)-амида в виде белого твердого вещества. MS: [M+H]+=559.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-метокси-1-метоксиметил-этил)-амид
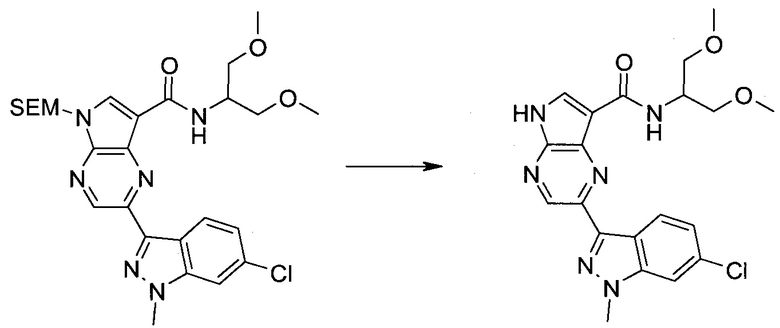
В герметично закрываемой круг-поденной колбе емкостью 25 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-метокси-1-метоксиметил-этил)-амид (40 мг; 0,071 ммоль) и TFA (0,6 мл; 7,8 ммоль) в дихлорметане (2 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре до полного израсходования исходного вещества (2,5 ч). Затем реакционную смесь концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (2 мл) и добавляли этилендиамин (400 мкл; 5,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (гексаны/дихлорметан/EtOAc), получая 19 мг (62%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-метокси-1-метоксиметил-этил)-амида в виде беловатого твердого вещества. MS: [M+H]+=429; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.88 (br. s., 1H), 9.13 (s, 1H), 8.55 (d, J=8,7 Гц, 1H), 8.46 (s, 1H), 8.30 (d, J=9,1 Гц, 1H), 8.01 (s, 1H), 7.25 (dd, J=8,7; 1,1 Гц, 1H), 4.33-4.67 (m, 1H), 4.18 (s, 3H), 3.61 (dd, J=9,8; 5,3 Гц, 2H), 3.56 (dd, J=9,4; 5,3 Гц, 1H), 3.27 (s, 3H).
Пример 167
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-циано-циклогексил)-амид
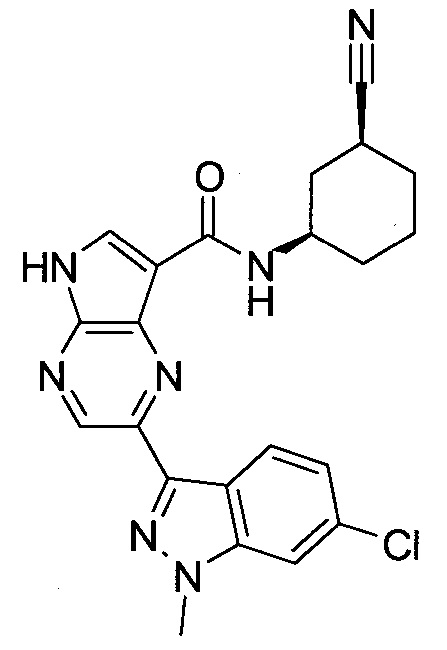
Стадия 1
(цис-3-Карбамоил-циклогексил)-карбаминовой кислоты трет-бутиловый эфир
В круглодонной колбе емкостью 100 мл суспендировали цис-3-(трет-бутоксикарбониламино)-циклогексанкарбоновую кислоту (2,26 г; 9,29 ммоль) в THF (15 мл). Суспензию охлаждали до -10°C в бане со смесью ацетон-сухой лед. К охлажденной суспензии медленно добавляли TEA (2,6 мл; 18,7 ммоль) и после него этилхлорформиат (1,03 мл; 10,7 ммоль) с поддержанием температуры. После добавления охлаждающую баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь охлаждали до -10°C и медленно добавляли NH4OH (2,17 мл; 55,7 ммоль). После перемешивания при комнатной температуре в течение 18 ч осадок собирали фильтрованием. Осадок промывали водой и сушили в вакууме при 50°C, получая 1,67 г (74%) (цис-3-карбамоил-циклогексил)-карбаминовой кислоты трет-бутилового эфира в виде белого твердого вещества. 1H ЯМР (300 МГц, DMSO-d6) δ: 7.19 (br. s., 1H), 6.76 (d, J=7,9 Гц, 1H), 6.65 (br. s., 1H), 3.04-3.30 (m, 1H), 1.98-2.21 (m, 1H), 1.50-1.84 (m, 4H), 1.37 (s, 9H), 0.90 1.29 (m, 4H)
Стадия 2
цис-(3-Циано-циклогексил)-карбаминовой кислоты трет-бутиловый эфир
В круглодонной колбе емкостью 25 мл суспендировали (цис-3-карбамоил-циклогексил)-карбаминовой кислоты трет-бутиловый эфир (1,00 г; 4,13 ммоль) в
дихлорметане (7 мл). Суспензию охлаждали до -10°C в бане со смесью ацетон-сухой лед. К охлажденной суспензии медленно добавляли триэтиламин (1,15 мл; 8,25 ммоль) и поел него TFAA (0,62 мл; 4,39 ммоль) с поддержанием температуры. Реакционную смесь перемешивали при этой температуре в течение 3 ч и затем разбавляли водой и дихлорметаном. Органический слой промывали водой, сушили над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 0%-60% EtOAc в гептане), получая 0,803 г (87%) цис-(3-циано-циклогексил)-карбаминовой кислоты трет-бутилового эфира в виде белого кристаллического вещества. 1H ЯМР (300 МГц, DMSO-d6) δ: 6.86 (d, J=7,9 Гц, 1H), 3.09-3.30 (m, 1H), 2.77 (tt, J=12,0; 3,3 Гц, 1H), 2.04 (d, J=12,1 Гц, 1H), 1.90 (d, J=9,1 Гц, 1H), 1.61-1.80 (m, 2H), 1.37 (s, 9H), 1.21-1.35 (m, 3H), 0.98-1.20 (m, 1H).
Стадия 3
цис-3-Амино-циклогексанкарбонитрила трифторацетат
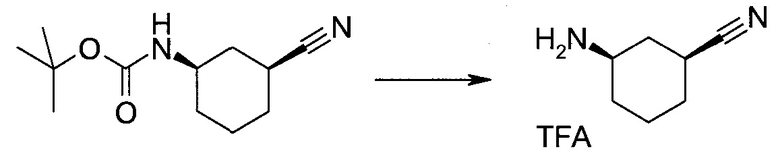
В круглодонной колбе емкостью 25 мл объединяли цис-(3-циано-циклогексил)-карбаминовой кислоты трет-бутиловый эфир (212 мг; 0,945 ммоль) с дихлорметаном (3 мл), получая бесцветный раствор. Добавляли трифторуксусную кислоту (0,9 мл; 11,7 ммоль), получая желтый раствор, который перемешивали при комнатной температуре в течение 1,5 ч. Затем реакционную смесь концентрировали при пониженном давлении. Остаток азеотропно отгоняли с толуолом, получая 321 мг цис-3-амино-циклогексанкарбонитрила трифторацетат в виде неочищенного твердого вещества, которое передавали на следующую стадию без очистки. 1H ЯМР (300 МГц, DMSO-d6) δ: 7.96 (br. s., 3H), 2.93-3.14 (m, 1H), 2.87 (tt, J=12,2; 3,5 Гц, 1H), 2.22 (d, J=12,1 Гц, 1H), 1.96 (d, J=10,2 Гц, 1H), 1.87 (d, J=11,3 Гц, 1H), 1.68-1.81 (m, 1H), 1.49 (q, J=12,1 Гц, 1H), 1.18-1.41 (m, 3H).
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-циано-циклогексил)-амид
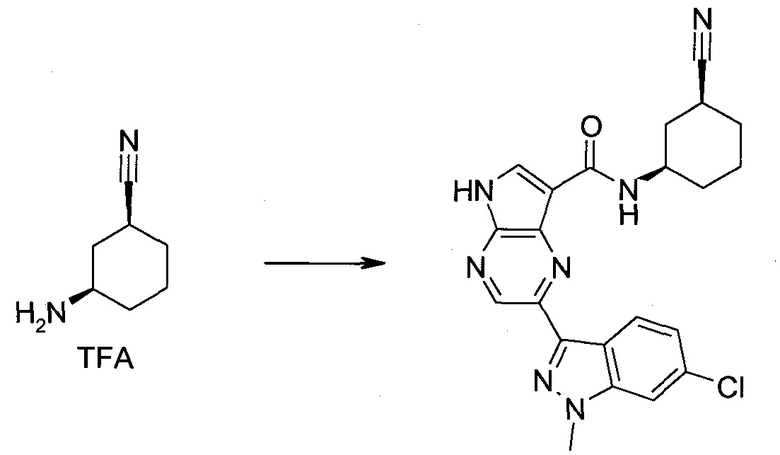
Получали в соответствии с методикой, приведенной в примере 2, заменяя цис-3-аминоциклогексанкарбонитрила трифторацетат на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде беловатого твердого вещества (37 мг; 74%); MS: [M+H]+=434; 1H ЯМР (DMSO-d6) δ: 12.87 (br. s., 1H), 9.10 (s, 1H), 8.46 (s, 1H), 8.44 (d, J=8,7 Гц, 1H), 8.08 (d, J=7,6 Гц, 1H), 8.01 (d, J=1,5 Гц, 1H), 7.34 (dd, J=8,5; 1,7 Гц, 1H), 4.18 (s, 3H), 3.82-4.05 (m, 1H), 2.91-3.08 (m, 1H), 1.94-2.16 (m, 2H), 1.77-1.92 (m, J=7,2; 4,2 Гц, 1H), 1.29-1.73 (m, 5H).
Пример 168
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2,2,2-трифтор-этил)-пиперидин-3-ил]-амида гидрохлорид
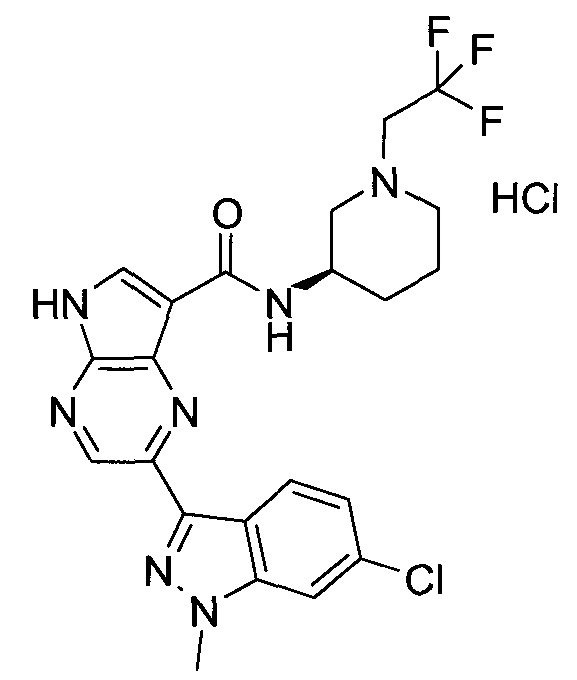
Стадия 1
[(R)-1-(2,2,2-Трифтор-этил)-пиперидин-3-ил]-карбаминовой кислоты трет-бутиловый эфир
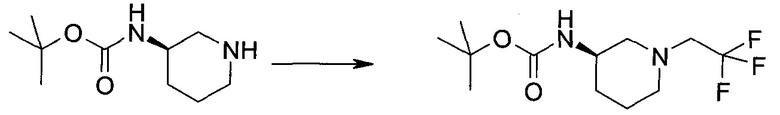
В круглодонной колбе емкостью 25 мл объединяли (R)-пиперидин-3-ил-карбаминовой кислоты трет-бутиловый эфир (1,00 г; 4,99 ммоль) и DIPEA
(0,96 мл; 5,49 ммоль) в дихлорметане (20 мл). Реакционную смесь помещали в атмосферу аргона и охлаждали в ледяной бане. По каплям добавляли раствор 1,1,1-трифтор-2-(трифторметилсульфонил)этана (1,19 г; 5,49 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры. После перемешивания в течение 18 ч реакционную смесь разбавляли дихлорметаном и последовательно промывали водой, насыщенным бикарбонатом и рассолом. Органический слой сушили над Na2S04 и концентрировали. Неочищенное вещество очищали флэш-хроматографией (силикагель, 24 г; 0%-70% EtOAc в гептане), получая 1,20 г (85%) [(R)-1-(2,2,2-трифтор-этил)-пиперидин-3-ил]-карбаминовой кислоты трет-бутилового эфира в виде белого кристаллического вещества. 1H ЯМР (300 МГц, CDCl3) δ: 4.97 (br. s., 1H), 3.75 (br. s., 1H), 2.98 (q, J=9,4 Гц, 2H), 2.82 (app d, J=11,7 Гц, 1H), 2.64-2.76 (m, 1H), 2.46-2.64 (m, 2H), 1.66-1.81 (m, 1H), 1.60 (m, 3H), 1.45 (s, 9H).
Стадия 2
(R)-1-(2,2,2-трифторэтил)пиперидин-3-амина дигидрохлорид
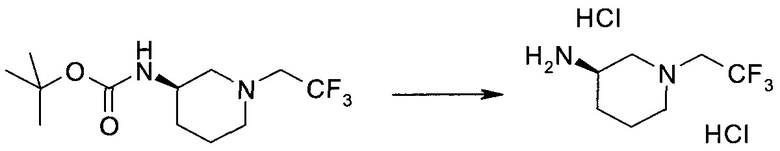
В круглодонной колбе емкостью 250 мл объединяли [(R)-1-(2,2,2-трифтор-этил)-пиперидин-3-ил]-карбаминовой кислоты трет-бутиловый эфир (1,20 г; 4,25 ммоль) с MeOH (100 мл), получая бесцветную суспензию. Реакционную смесь помещали в атмосферу азота и охлаждали в ледяной бане. Медленно добавляли ацетилхлорид (6,04 мл; 85,0 ммоль). Реакционную смесь перемешивали при 5°C в течение еще 10 мин, затем нагревали до комнатной температуры. После перемешивания при комнатной температуре в течение 17 ч реакционную смесь концентрировали досуха, получая 1,10 г (количественный выход) (R)-1-(2,2,2-трифторэтил)пиперидин-3-амина дигидрохлорида в виде светло-желтого твердого вещества. 1H ЯМР (300 МГц, DMSO-d6) δ: 8.27 (br. s., 3H), 3.39 (q, J=10,2 Гц, 2H), 3.15-3.27 (m, 1H), 3.10 (dd, J=11,3; 3,0 Гц, 1H), 2.83 (app d, J=11,7 Гц, 1H), 2.56 (d, J=10,2 Гц, 1H), 2.45 (d, J=9,8 Гц, 1H), 1.83-2.04 (m, 1H), 1.62-1.83 (m, 1H), 1.45-1.62 (m, 1H), 1.25-1.45 (m, 1H).
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2,2,2-трифтор-этил)-пиперидин-3-ил]-амида гидрохлорид
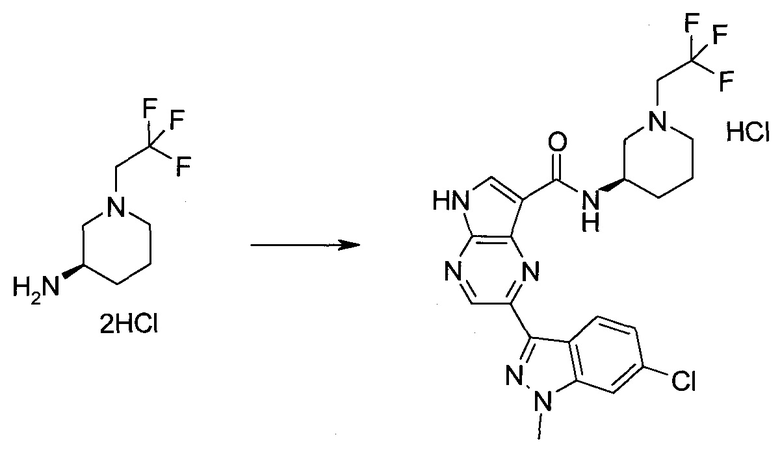
Получали в соответствии с методикой, приведенной в примере 2, заменяя (R)-1-(2,2,2-трифторэтил)пиперидин-3-амина дигидрохлорид на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение обрабатывали HCl (4,0 М в 1,4-диоксане), получая соль в виде оранжевого твердого вещества (32 мг; 46%); MS: [M+H]+=492; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.92 (d, J=2,6 Гц, 1H), 9.09 (s, 1H), 8.46 (d, J=3,0 Гц, 1H), 8.43 (d, J=8,7 Гц, 1H), 8.21 (br. s., 1H), 8.11 (d, J=8,3 Гц, 1H), 8.02 (s, 1H), 7.32 (dd, J=8,7; 1,1 Гц, 1H), 4.09-4.25 (m, 1H), 4.09-4.25 (m, 3H), 3.30-3.52 (m, 1H), 3.25 (br. d, J=9,8 Гц, 1H), 3.02-3.11 (m, 1H), 2.88-3.01 (m, 1H), 1.96-2.07 (m, 1H), 1.78-1.91 (m, 1H), 1.57-1.75 (m, 1H), 1.36-1.56 (m, 1H).
Пример 169
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-амино-циклогексил)-амида гидрохлорид
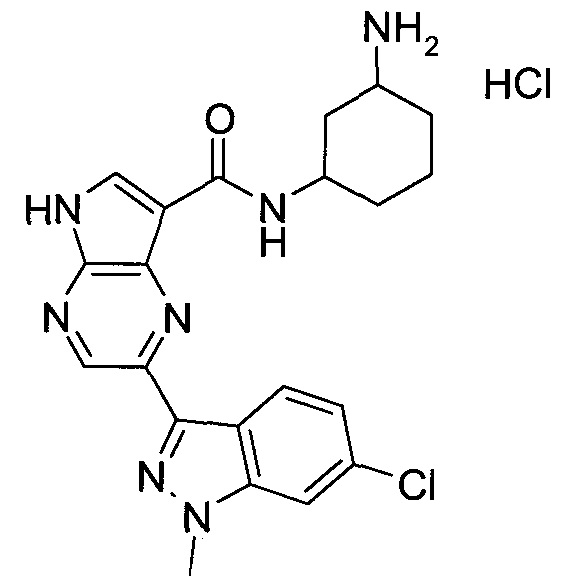
Получали в соответствии с методикой, приведенной в примере 145, заменяя циклогексан-1,3-диамин на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение обрабатывали HCl (4,0 М в 1,4-диоксане), получая соль в виде желтого твердого вещества (смесь диастереомеров) (34 мг; 56%); MS: [M+H]+=424; 1H ЯМР (DMSO-d6) δ: 12.92 (d, J=3,0 Гц, 1H), 9.12 (s, 1H), 8.48 (s, 1H), 8.42 (d, J=8,7 Гц, 1H), 8.11 (d, J=7,9 Гц, 1H), 8.03 (d, J=1,1 Гц, 1H), 7.46 (dd, J=8,7; 1,1 Гц, 1H), 4.18 (s, 3H), 3.96-4.12 (m, 1H), 3.19-3.30 (m, 1H), 1.18-2.14 (m, 8H).
Пример 170
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
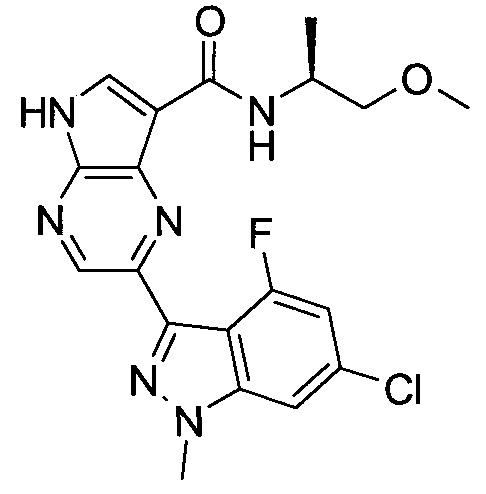
Стадия 1
2-(6-Хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
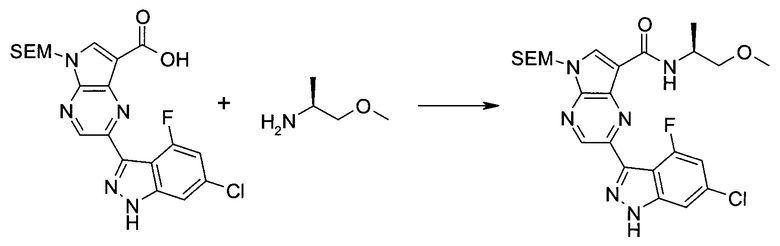
В круглодонную колбу емкостью 25 мл загружали 2-(6-хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (0,39 г; 0,84 ммоль), (S)-1-метоксипропан-2-амина гидрохлорид (253 мг; 2,0 ммоль), HBTU (457 мг; 1,27 ммоль) и HOBT (125 мг; 0,93 ммоль). Затем добавляли DMF (2 мл), после чего N,N-диизопропилэтиламин (0,59 мл; 3,38 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (30 мл). Органический слой один раз промывали насыщенным NaHCO3 и водой. Объединенные водные слои повторно экстрагировали EtOAc (25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гептан (градиент; 0-100% EtOAc), получая 401 мг (89%) 2-(6-хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде светло-желтого твердого вещества. MS: [M+H]+=533.
Стадия 2
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
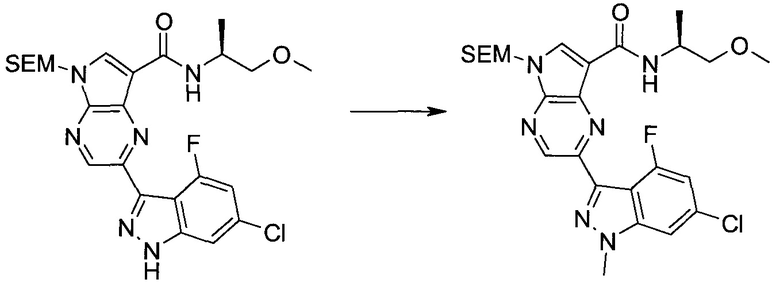
В круглодонную колбу емкостью 50 мл загружали 2-(6-хлор-4-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (120 мг; 0,225 ммоль) и DMF (0,45 мл), получая светло-желтый раствор. Реакционную смесь помещали в атмосферу аргона и охлаждали в бане при 0°C. Добавляли NaH (60%-ный в минеральном масле; 23 мг; 0,575 ммоль). Реакционную смесь перемешивали при 0°C в течение 10 мин и при комнатной температуре в течение 10 мин, затем возвращали в охлаждающую баню и добавляли иодметан (21 мкл; 0,34 ммоль). Реакционную смесь перемешивали при 0°C в течение 10 мин, затем баню удаляли и перемешивание продолжали при комнатной температуре в течение еще 18 ч. Реакцию гасили водой и осадок собирали фильтрованием. Неочищенное вещество очищали хроматографией на SiO2 с использованием смеси EtOAc/гептан (градиент: 0-100% EtOAc), получая 41 мг (33%) 2-(6-хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде беловатого твердого вещества. MS: [M+H]+=547.
Стадия 3
2-(6-Хлор-4-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
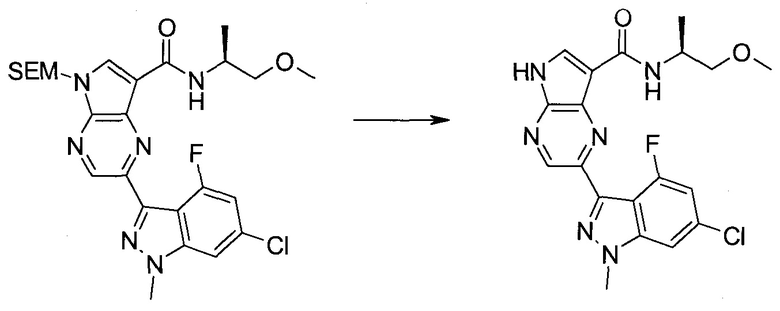
В круглодонной колбе емкостью 25 мл объединяли 2-(6-хлор-4-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (40 мг; 0,073 ммоль) и TFA (0,60 мл; 7,8 ммоль) в дихлорметане (2 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (2 мл) и добавляли этилендиамин (0,40 мл; 5,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (дихлорметан/гептан), получая 17 мг (55%) 2-(6-хлор-4-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде беловатого твердого вещества. MS: [M+H]+=417; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.68 (br. s., 1H), 9.00 (s, 1H), 8.44 (s, 1H), 8.32 (d, J=8,7 Гц, 1H), 7.89 (d, J=1,5 Гц, 1H), 7.27 (dd, J=10,6; 1,5 Гц, 1H), 4.31 (dt, J=13,5; 7,0 Гц, 1H), 4.19 (s, 3H), 3.45 (dd, J=9,3; 5,8 Гц, 3H), 3.36 (dd, J=9,8; 5,3 Гц, 1H), 3.20 (s, 3H), 1.22 (d, J=6,8 Гц, 3H).
Пример 171
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-этокси-1-метил-этил)-амид
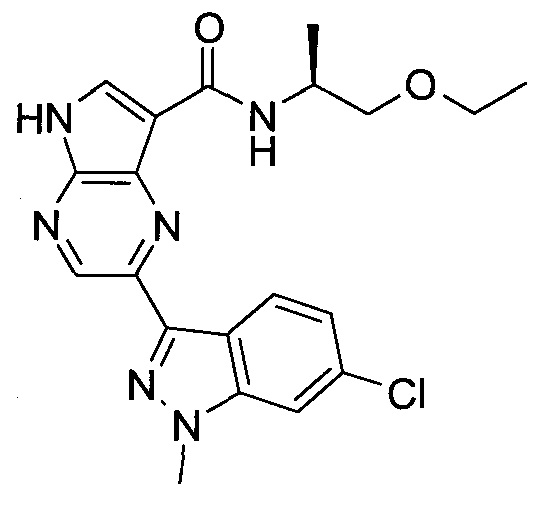
Получали в соответствии с методикой, приведенной в примере 145, заменяя (S)-1-этоксипропан-2-амина гидрохлорид на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде белого твердого вещества (35 мг; 68%); MS: [M+H]+=413; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.49-13.15 (m, 1H), 9.11 (s, 1H), 8.41-8.48 (m, 1H), 8.41-8.56 (m, 2H), 8.21 (d, J=8,3 Гц, 1H), 8.00 (d, J=1,5 Гц, 1H), 7.28 (dd, J=8,7; 1,5 Гц, 1H), 4.27-4.45 (m, 1H), 4.18 (s, 3H), 3.56 (dd, J=9,4; 4,5 Гц, 1H), 3.48 (dd, J=9,2; 4,5 Гц, 1H), 3.45 (q, J=7,2 Гц, 2H), 1.33 (d, J=6,8 Гц, 3H), 0.97 (t, J=7,0 Гц, 3H).
Пример 172
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1-метил-пропил)-амид
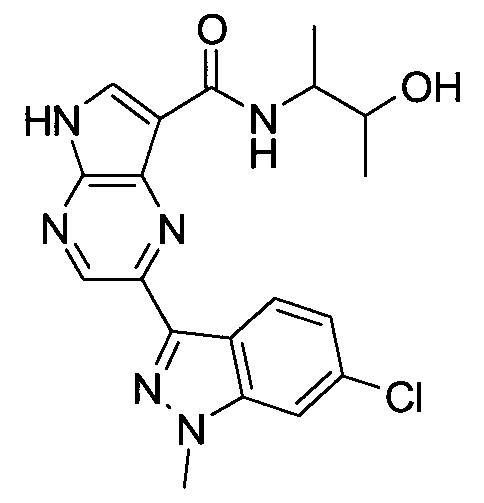
Получали в соответствии с методикой, приведенной в примере 145, заменяя 3-аминобутан-2-ол на цис-циклогексан-1,4-диамин на стадии 1. Конечное соединение выделяли в виде беловатого твердого вещества (смесь диастереомеров) (22 мг; 73%); [M+H]+=399; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.76 (br. s., 1H), 9.15 (s, 1H), 8.78 (d, J=8,7 Гц, 1H), 8.42 (s, 1H), 8.12 (d, J=9,4 Гц, 1H), 7.96 (s, 1H), 7.33 (dd, J=8,7; 1,5 Гц, 1H), 5.18 (d, J=4,2 Гц, 1H), 4.17 (s, 3H), 4.12-4.22 (m, 1H), 3.77-3.89 (m, 1H), 1.27 (d, J=6,8 Гц, 3H), 1.11 (d, J=6,4 Гц, 3H).
Пример 173
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метоксиметил-пропил)-амид
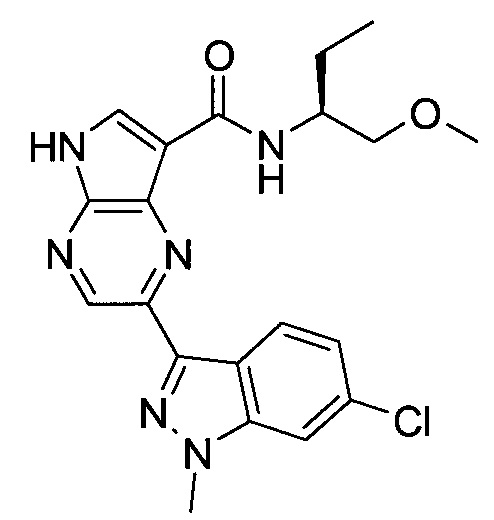
Получали в соответствии с методикой, приведенной в примере 166, заменяя (S)-2-аминобутан-1-ол на 2-аминопропан-1,3-диол на стадии 1. Конечное соединение выделяли в виде беловатого твердого вещества (20 мг; 70%); MS: [M+H]+=413; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.85 (br. s., 1H), 9.12 (s, 1H), 8.50 (d, J=8,7 Гц, 1H), 8.44 (s, 1H), 8.17 (d, J=9,1 Гц, 1H), 8.00 (d, J=1,5 Гц, 1H), 7.25 (dd, J=8,7; 1,5 Гц, 1H), 4.15-4.20 (m, 3H), 4.10-4.32 (m, 1H), 3.57 (dd, J=9,5; 4,2 Гц, 1H), 3.47 (dd, J=9,7; 4,3 Гц, 1H), 3.27 (s, 3H), 1.50-1.92 (m, 2H), 0.96 (t, J=7,4 Гц, 3H).
Пример 174
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-фтор-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амид
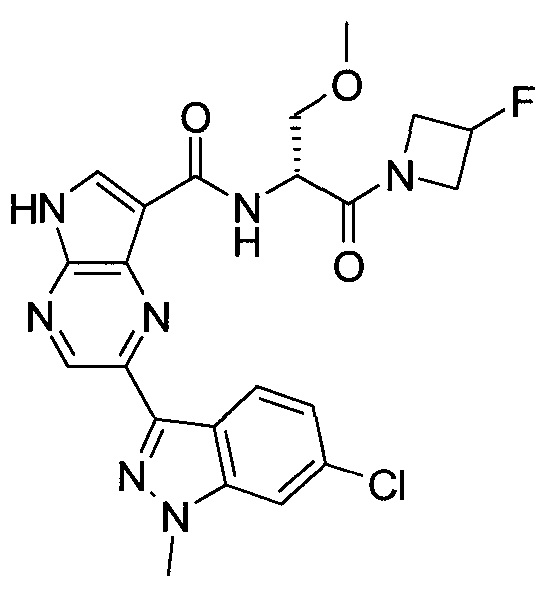
Стадия 1
[(R)-2-(3-Фтор-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир
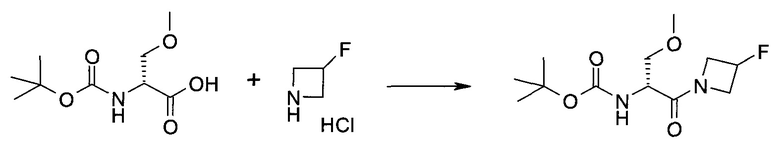
В круглодонную колбу емкостью 25 мл загружали (R)-2-трет-бутоксикарбониламино-3-метокси-пропионовую кислоту (0,40 г; 1,82 ммоль), 3-фторазетидина гидрохлорид (204 мг; 1,82 ммоль), HBTU (989 мг; 2,74 ммоль) и HOBt (375 мг; 2,74 ммоль). Затем добавляли DMF (3,6 мл), после чего N,N-диизопропилэтиламин (1,27 мл; 7,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (30 мл). Органический слой один раз промывали насыщенным NaHCO3 и водой. Объединенные водные слои повторно экстрагировали EtOAc (25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гептан (градиент: 0-50% EtOAc), получая 267 мг (53%) [(R)-2-(3-фтор-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-карбаминовой кислоты трет-бутилового эфира в виде белого твердого вещества.
Стадия 2
(R)-2-Амино-1-(3-фтор-азетидин-1-ил)-3-метокси-пропан-1-она трифторацетат
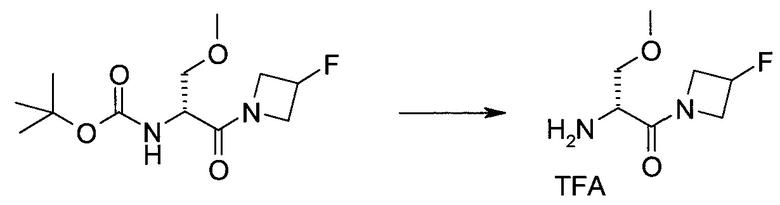
В круглодонной колбе емкостью 25 мл растворяли [(R)-2-(3-фтор-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир (265 мг; 0,96 ммоль) в дихлорметане (5 мл). Реакционную смесь охлаждали до 0°C и медленно добавляли трифторуксусную кислоту (1,5 мл; 19,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали, получая (R)-2-амино-1-(3-фтор-азетидин-1-ил)-3-метокси-пропан-1-она трифторацетат в виде бесцветного вязкого масла, которое использовали без дополнительной очистки.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-фтор-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амид
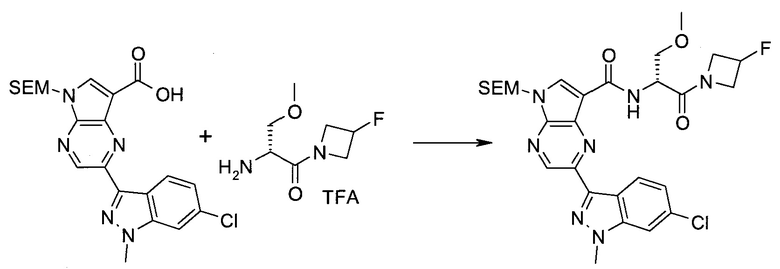
В круглодонную колбу емкостью 10 мл загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (75 мг; 0,16 ммоль), (R)-2-амино-1-(3-фтор-азетидин-1-ил)-3-метокси-пропан-1-она трифторацетат (63 мг; 0,21 ммоль) и HATU (63 мг; 0,21 ммоль). Затем добавляли ацетонитрил (1 мл), после чего N,N-диизопропилэтиламин (0,55 мл; 3,15 ммоль). Светло-желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой. Смесь экстрагировали дихлорметаном. Органические слои объединяли, сушили над Na2SO4 и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гептаны (градиент: 5-90% EtOAc), получая 47 мг (47%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-фтор-азетидин-1-ил)-1-
метоксиметил-2-оксо-этил]-амида в виде беловатого твердого вещества. MS: [M+H]+=616.
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-фтор-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амид
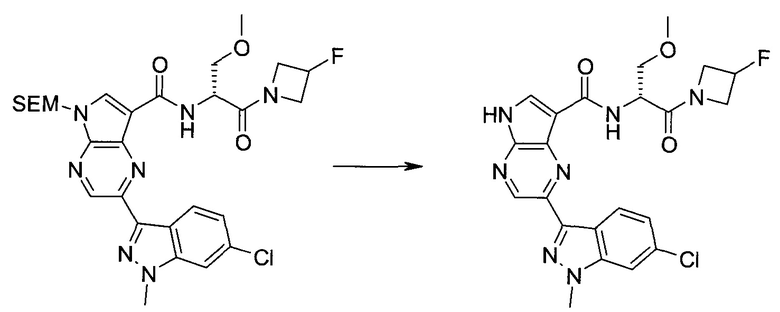
В круглодонной колбе емкостью 25 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-фтор-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амид (47 мг; 0,076 ммоль) и TFA (1,2 мл; 15,6 ммоль) в дихлорметане (4 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (4 мл) и добавляли этилендиамин (0,36 мл; 5,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (дихлорметан/гептан), получая 24 мг (64%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-фтор-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амида в виде беловатого твердого вещества. MS: [M+H]+=486; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.85 (br. s., 1H), 9.16 (s, 1H), 8.76 (dd, J=8,7; 5,3 Гц, 1H), 8.55 (d, J=8,3 Гц, 1H), 8.49 (s, 1H), 7.97 (d, J=1,5 Гц, 1H), 7.24 (d, J=9,1 Гц, 1H), 5.23-5.58 (m, 1H), 4.97 (dt, J=8,1; 5,8 Гц, 1H), 4.56-4.82 (m, 1H), 4.21-4.56 (m, 2H), 4.18 (s, 3H), 3.87-4.10 (m, 1H), 3.68 (qd, J=9,8; 5,7 Гц, 2H), 3.28 (app. d, J=3,4 Гц, 3H).
Пример 175
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амид
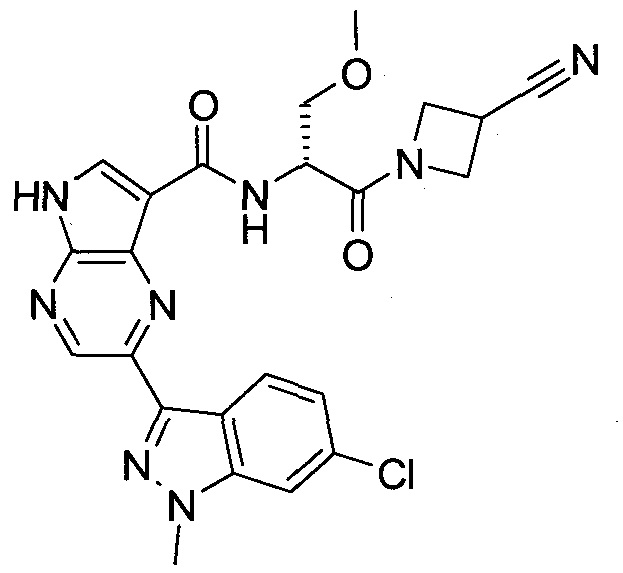
Стадия 1
[(R)-2-(3-Циано-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир
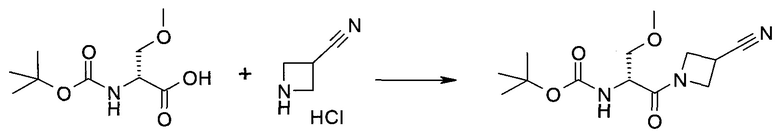
В круглодонную колбу емкостью 25 мл загружали (R)-2-трет-бутоксикарбониламино-3-метокси-пропионовую кислоту (0,475 г; 2,17 ммоль), азетидин-3-карбонитрила гидрохлорид (314 мг; 2,65 ммоль) и HATU (832 мг; 2,19 ммоль). Затем добавляли DMF (3,6 мл), после чего N,N-диизопропилэтиламин (1,5 мл; 8,67 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (30 мл). Органический слой один раз промывали насыщенным NaHCO3 и водой. Объединенные водные слои повторно экстрагировали EtOAc (25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гептан (градиент: 0-100% EtOAc), получая 288 мг (47%) [(R)-2-(3-циано-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-карбаминовой кислоты трет-бутилового эфира в виде вязкого бесцветного масла.
Стадия 2
1-((R)-2-Амино-3-метокси-пропионил)-азетидин-3-карбонитрила трифторацетат
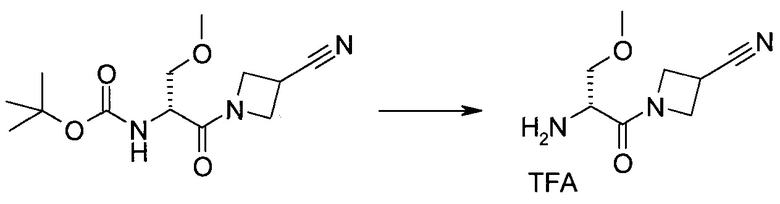
В круглодонной колбе емкостью 25 мл растворяли [(R)-2-(3-циано-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-карбаминовой кислоты трет-бутиловый эфир (286 мг; 1,00 ммоль) в дихлорметане (4 мл). Реакционную смесь охлаждали до 0°C и медленно добавляли трифторуксусную кислоту (1,2 мл; 15,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали, получая 1-((R)-2-амино-3-метокси-пропионил)-азетидин-3-карбонитрила трифторацетат в виде бесцветного вязкого масла, которое использовали без дополнительной очистки.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амид
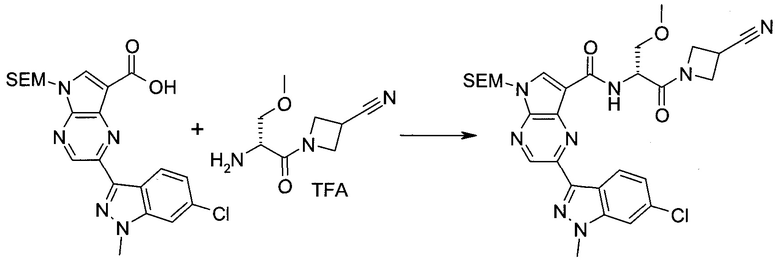
В круглодонную колбу емкостью 10 мл загружали 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (50 мг; 0,11 ммоль), 1-((R)-2-амино-3-метокси-пропионил)-азетидин-3-карбонитрила трифторацетат (42 мг; 0,14 ммоль) и HATU (42 мг; 0,11 ммоль). Затем добавляли ацетонитрил (1 мл), после чего N,N-диизопропилэтиламин (0,19 мл; 1,1 ммоль). Светло-желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой. Смесь экстрагировали дихлорметаном. Органические слои объединяли, сушили над N32S04 и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гептаны (градиент: 5-90% EtOAc), получая 44 мг (63%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амида в виде беловатого твердого вещества. MS: [M+H]+=623.
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амид
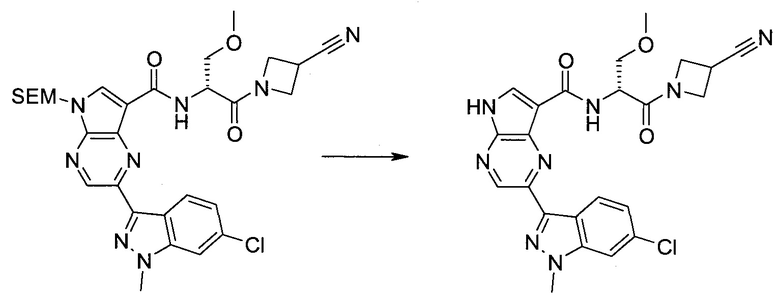
В круглодонной колбе емкостью 25 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амид (44 мг; 0,071 ммоль) и TFA (1,8 мл; 23,4 ммоль) в дихлорметане (6 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (4 мл) и добавляли этилендиамин (0,30 мл; 4,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (с горячей смесью дихлорметан/гептан), получая 21 мг (59%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амида в виде белого твердого вещества. MS: [M+H]+=492; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.72 (br. s, 1H), 9.16 (s, 1H), 8.74 (d, J=8,7 Гц, 1H), 8.55 (d, J=8,3 Гц, 1H), 8.50 (d, J=4,9 Гц, 1H), 7.97 (d, J=1,5 Гц, 1H), 7.23 (d, J=8,7 Гц, 1H), 4.86-5.04 (m, 1H), 4.46-4.73 (m, 2H), 4.17-4.19 (m, 1H), 4.16-4.28 (m, 4H), 4.04-4.16 (m, 1H), 3.77-3.93 (m, 1H), 3.72 (dd, J=9,5; 4,9 Гц, 1H), 3.59-3.68 (m, 1H), 3.27 (app d, J=4,9 Гц, 3H).
Пример 176
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1-метил-пропил)-амид
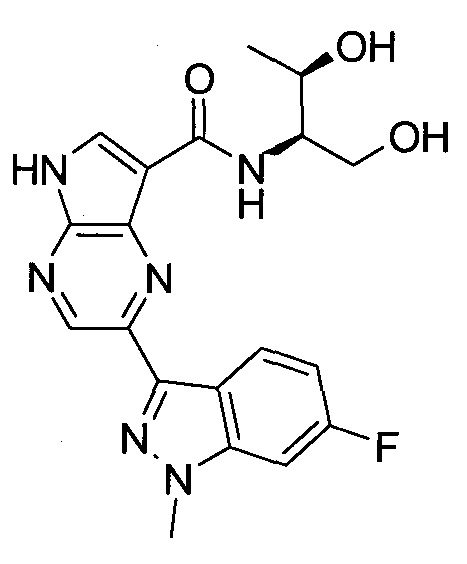
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-гидроксиметил-пропил)-амид
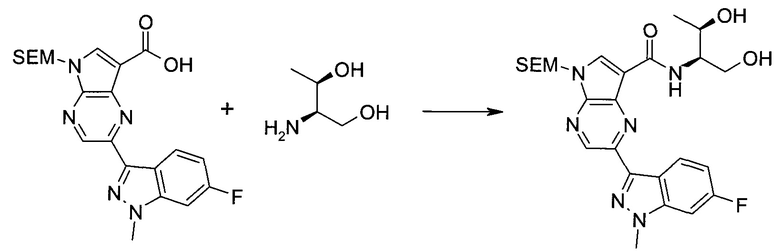
В круглодонную колбу емкостью 25 мл загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (100 мг; 0,226 ммоль), (2R,3R)-2-аминобутан-1,3-диол (25 мг; 0,24 ммоль) и HATU (90 мг; 0,24 ммоль). Затем добавляли ацетонитрил (2 мл), после чего N,N-диизопропилэтиламин (0,10 мл; 0,57 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой. Смесь экстрагировали этилацетатом (3×). Органические слои объединяли, сушили над Na2SO4 и концентрировали. Остаток очищали растиранием со смесью 1:1 гептан/дихлорметан, получая 115 мг (96%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-гидроксиметил-пропил)-амида в виде белого твердого вещества. MS: [M+H]+=529.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-гидроксиметил-пропил)-амид
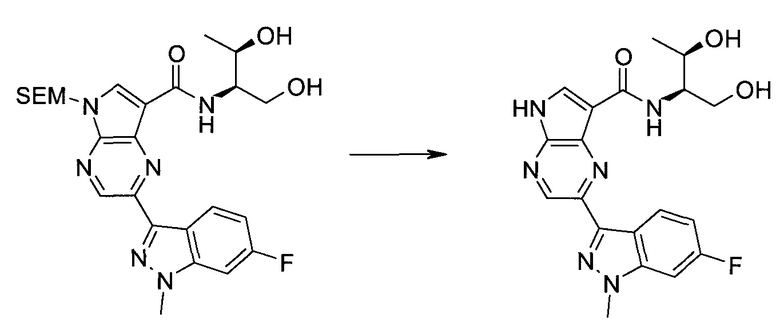
В круглодонной колбе емкостью 10 мл объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-гидроксиметил-пропил)-амид (30 мг; 0,057 ммоль) и TFA (0,3 мл; 3,9 ммоль) в дихлорметане (1 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,10 мл; 1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (с горячей смесью дихлорметан/гептан), получая 9 мг (40%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-гидроксиметил-пропил)-амида в виде светло-желтого твердого вещества. MS: [M+H]+=399; 1H ЯМР (DMSO-d6) δ: 12.61 (br. s., 1H), 9.16 (s, 1H), 8.83 (dd, J=8,9; 5,5 Гц, 1H), 8.44 (s, 1H), 8.15 (d, J=9,4 Гц, 1H), 7.64 (dd, J=9,8; 1,9 Гц, 1H), 7.15 (td, J=9,3; 1,9 Гц, 1H), 5.07 (d, J=4,2 Гц, 1H), 4.85 (t, J=4,9 Гц, 1H), 4.15 (s, 3H), 3.98-4.24 (m, 2H), 3.54-3.71 (m, 2H), 1.13 (d, J=6,0 Гц, 3H).
Пример 177
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-метоксиметил-пропил)-амид
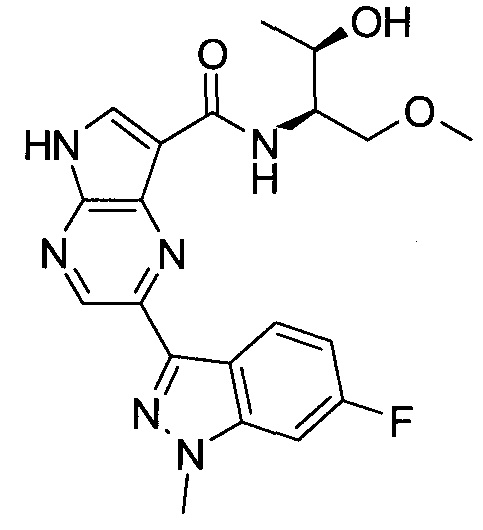
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-метоксиметил-пропил)-амид
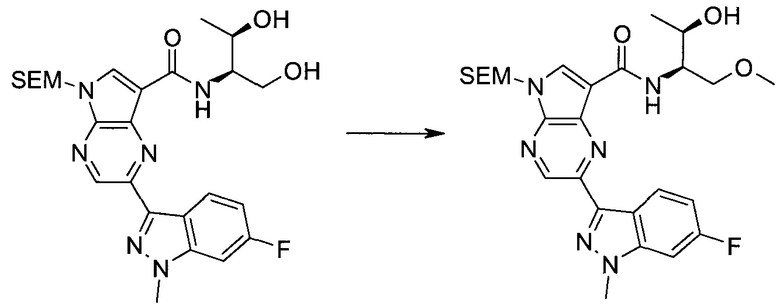
В круглодонной колбе емкостью 10 мл растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-гидроксиметил-пропил)-амид (81 мг; 0,152 ммоль) в THF (1,5 мл), получая бесцветный раствор. Реакционную смесь охлаждали в ледяной бане и добавляли последовательно измельченный KOH (86 мг; 1,52 ммоль), 18-краун-6 (40 мг; 0,152 ммоль) и иодметан (10 мкл; 0,152 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, после чего ледяную баню удаляли. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем разбавляли дихлорметаном (10 мл) и промывали водным хлоридом аммония (10 мл), водой (10 мл) и насыщенным бикарбонатом натрия (10 мл). Органический слой сушили над Na2SO4 и концентрировали. Неочищенное вещество очищали хроматографией на SiO2 с использованием смеси EtOAc/гептан (градиент: 0%-60% EtOAc), получая 30 мг (36%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-метоксиметил-пропил)-амида в виде беловатого твердого вещества. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.22 (s, 1H), 8.78 (dd, J=8,9; 5,5 Гц, 1H), 8.66 (s, 1H), 8.14 (d, J=9,4 Гц, 1H), 7.67 (dd, J=9,8; 2,3 Гц, 1H), 7.17 (td, J=9,2; 2,1 Гц, 1H), 5.75 (s, 2H), 5.21 (d, J=4,2 Гц, 1H), 4.22-4.34 (m, 1H), 4.17 (s, 3H), 3.97-4.12 (m, 1H), 3.61 (app t, J=8,2 Гц, 3H), 3.52 (dd, J=9,8; 6,4 Гц, 1H), 3.28 (s, 3H), 1.14 (d, J=6,4 Гц, 3H), 0.87 (t, J=7,9 Гц, 2H), -0.07 (s, 9H).
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-метоксиметил-пропил)-амид
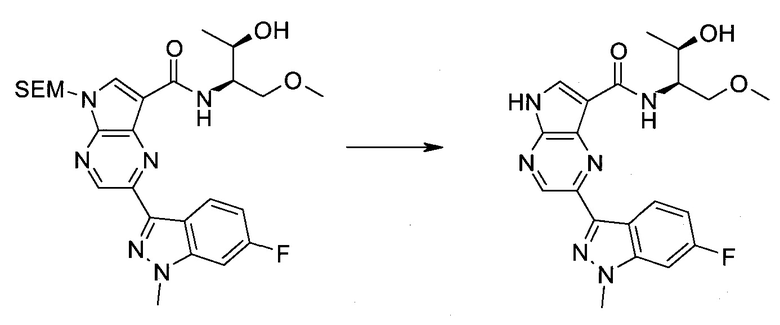
В круглодонной колбе емкостью 10 мл объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-метоксиметил-пропил)-амид (30 мг; 0,055 ммоль) и TFA (0,3 мл; 3,9 ммоль) в дихлорметане (1 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,26 мл; 3,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (с горячей смесью дихлорметан/гептан), получая 11 мг (47%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-метоксиметил-пропил)-амида в виде светло-желтого твердого вещества. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.85 (br. s., 1H), 9.16 (s, 1H), 8.78 (dd, J=8,9; 5,5 Гц, 1H), 8.43 (s, 1H), 8.15 (d, J=9,4 Гц, 1H), 7.65 (dd, J=9,6; 2,1 Гц, 1H), 7.15 (td, J=9,2; 2,5 Гц, 1H), 5.17 (d, J=4,2 Гц, 1H), 4.20-4.33 (m, 1H), 4.15 (s, 3H), 3.98-4.09 (m, 1H), 3.59 (dd, J=9,8; 6,8 Гц, 1H), 3.50 (dd, J=9,4;6,4 Гц, 1H), 3.27 (s, 3H), 1.13 (d, J=6,4 Гц, 3H).
Пример 178
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-втор-бутил)-амид
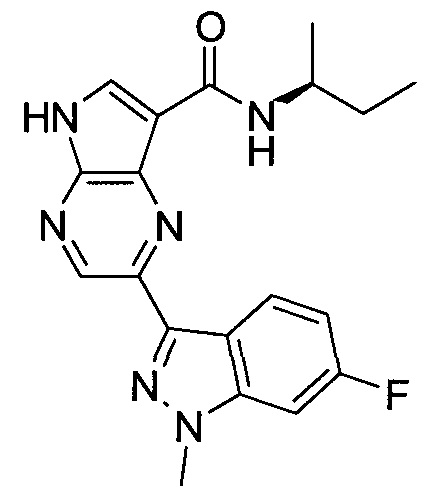
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-втор-бутил)-амид
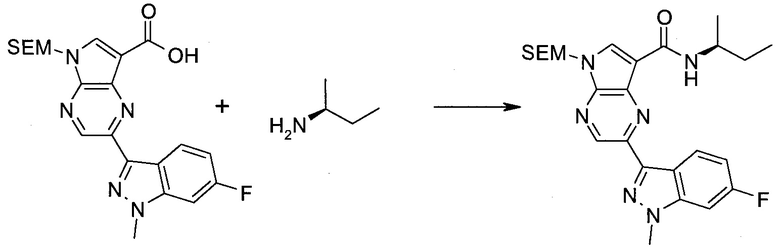
В круглодонную колбу емкостью 25 мл загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (50 мг; 0,11 ммоль), (S)-бутан-2-амин (9 мг; 0,12 ммоль) и HATU (45 мг; 0,12 ммоль). Затем добавляли ацетонитрил (1 мл), после чего N,N-диизопропилэтиламин (0,09 мл; 0,55 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой. Смесь экстрагировали этилацетатом (3×). Органические слои объединяли, сушили над Na2SO4 и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гептаны (градиент: 0-50% EtOAc), получая 40 мг (71%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-втор-бутил)-амида в виде белого твердого вещества. [M+Na]+=519.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-втор-бутил)-амид
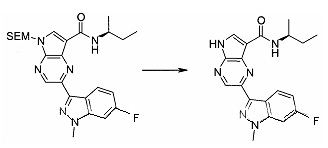
В круглодонной колбе емкостью 10 мл объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-бтор-бутил)-амид (40 мг; 0,080 ммоль) и TFA (0,9 мл; 11,7 ммоль) в дихлорметане (3 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали при пониженном давлении. Полученное неочищенное твердое
вещество растворяли в дихлорметане (3 мл) и добавляли этилендиамин (0,38 мл; 5,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (с горячей смесью дихлорметан/гептан), получая 19 мг (67%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-втор-бутил)-амида в виде беловатого твердого вещества. [M+H]+=367; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.77 (br. s., 1H), 9.09 (s, 1H), 8.43 (s, 1H), 8.43 (dd, J=9,1; 5,5 Гц, 1H), 8.00 (d, J=8,7 Гц, 1H), 7.70 (dd, J=9,8; 1,9 Гц, 1H), 7.19 (td, J=9,1; 2,3 Гц, 1H), 4.15 (s, 3H), 4.03-4.14 (m, 1H), 1.57-1.73 (m, 2H), 1.28 (d, J=6,4 Гц, 3H).
Пример 179
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метоксиметил-3-метил-бутил)-амид
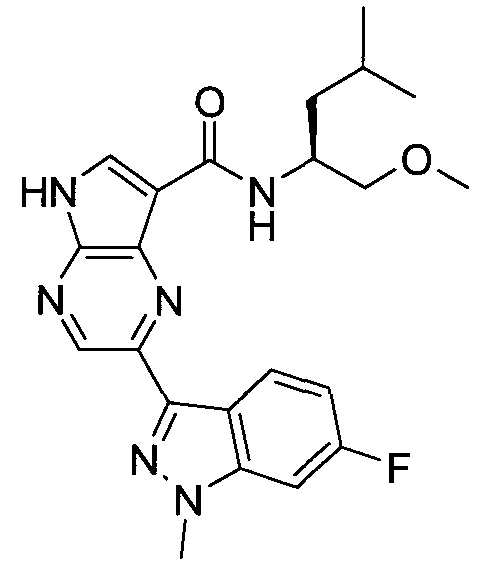
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-гидроксиметил-3-метил-бутил)-амид
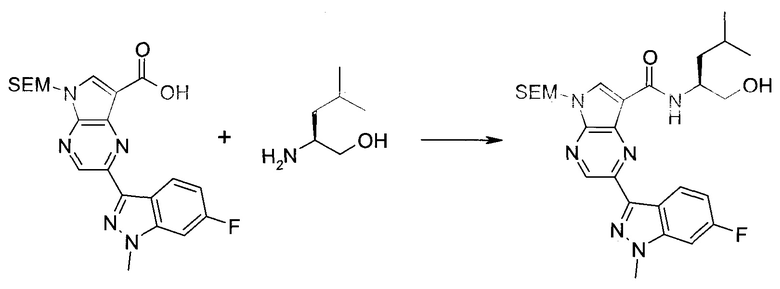
В круглодонную колбу емкостью 25 мл загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (100 мг; 0,226 ммоль), (S)-2-амино-4-метилпентан-1-ол
(28 мг; 0,24 ммоль) и HATU (90 мг; 0,24 ммоль). Затем добавляли ацетонитрил (2 мл), после чего N,N-диизопропилэтиламин (0,13 мл; 0,77 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой. Смесь экстрагировали этилацетатом (3×). Органические слои объединяли, сушили над Na2SO4 и концентрировали, получая 73 мг (59%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-гидроксиметил-3-метил-бутил)-амида в виде белого твердого вещества. MS: [M+H]+=541.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метоксиметил-3-метил-бутил)-амид
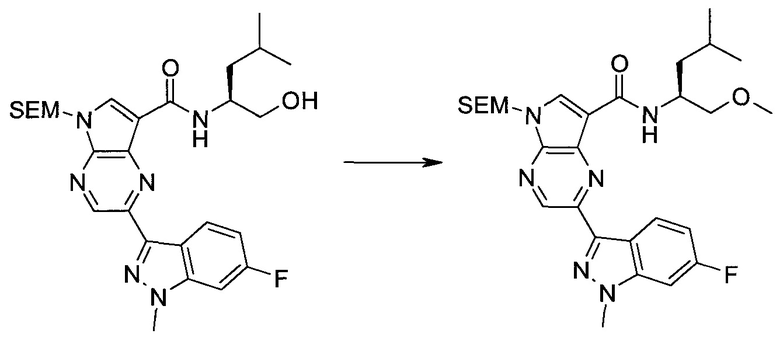
В круглодонной колбе емкостью 10 мл растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-гидроксиметил-3-метил-бутил)-амид (73 мг; 0,135 ммоль) в THF (1,4 мл), получая бесцветный раствор. Реакционную смесь охлаждали в ледяной бане и добавляли последовательно измельченный KOH (76 мг; 1,35 ммоль), 18-краун-6 (36 мг; 0,135 ммоль) и иодметан (9 мкл; 0,135 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, после чего ледяную баню удаляли. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем разбавляли дихлорметаном (10 мл) и промывали водным хлоридом аммония (10 мл), водой (10 мл) и насыщенным бикарбонатом натрия (10 мл). Органический слой сушили над Na2SO4 и концентрировали. Неочищенное вещество очищали хроматографией на SiO2 с использованием смеси EtOAc/гептан (градиент: 0%-70% EtOAc), получая 38 мг (50%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метоксиметил-3-метил-бутил)-амида в виде беловатого твердого вещества. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.18 (s, 1H), 8.64 (s, 1H), 8.52 (dd, J=9,1; 5,3 Гц, 1H), 8.15 (d, J=9,4 Гц, 1H),
7.72 (dd, J=9,6; 2,1 Гц, 1H), 7.13 (td, J=9,1; 1,9 Гц, 1H), 5.73 (s, 2H), 4.41 (td, J=9,0; 5,1 Гц, 1H), 4.17 (s, 3H), 3.60 (t, J=7,9 Гц, 2H), 3.44-3.55 (m, 2H), 3.27 (s, 3H), 1.48-1.72 (m, 3H), 0.91 (d, J=6,0 Гц, 3H), 0.86 (d, J=6,0 Гц, 3H), 0.85 (t, J=7,6 Гц, 2H), -0.08 (s, 9H).
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метоксиметил-3-метил-бутил)-амид
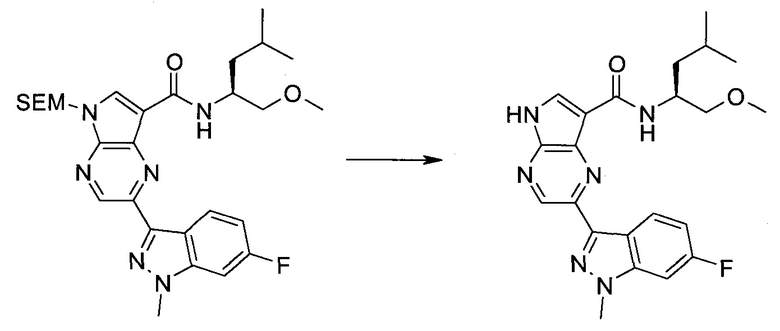
В круглодонной колбе емкостью 10 мл объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метоксиметил-3-метил-бутил)-амид (35 мг; 0,063 ммоль) и TFA (0,6 мл; 7,8 ммоль) в дихлорметане (2 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,32 мл; 4,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (с горячей смесью дихлорметан/гептан), получая 16 мг (60%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метоксиметил-3-метил-бутил)-амида в виде белого твердого вещества. MS: [M+H]+=425, 1H ЯМР (300 МГц, DMSO-d6) δ: 12.87 (s, 1H), 9.13 (s, 1H), 8.53 (dd, J=8,7; 5,3 Гц, 1H), 8.44 (s, 1H), 8.17 (d, J=9,4 Гц, 1H), 7.71 (dd, J=9,8; 2,3 Гц, 1H), 7.11 (td, J=9,1; 2,3 Гц, 1H), 4.41 (td, J=9,1; 4,9 Гц, 1H), 4.16 (s, 3H), 3.52 (dd, J=9,4; 4,2 Гц, 1H), 3.46 (dd, J=9,4; 4,2 Гц, 1H), 3.27 (s, 3H), 1.48-1.75 (m, 3H), 0.91 (d, J=6,4 Гц, 3H), 0.86 (d, J=6,0 Гц, 3H).
Пример 180
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-втор-бутил)-амид
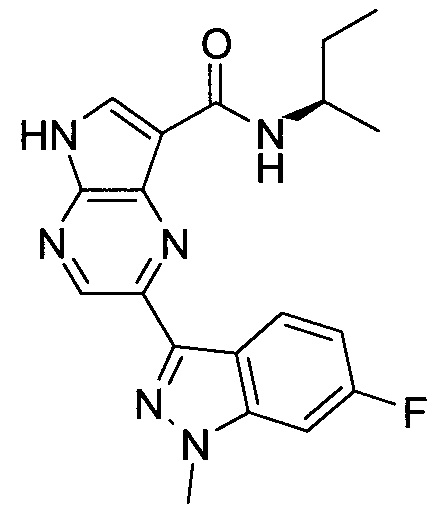
Получали в соответствии с методикой, приведенной в примере 178, заменяя (R)-бутан-2-амин на (S)-бутан-2-амин на стадии 1. Конечное соединение выделяли в виде беловатого твердого вещества (17 мг; 82%); [M+H]+=367; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.76 (br. s., 1H), 9.10 (s, 1H), 8.43 (s, 1H), 8.43 (dd, J=8,7; 5,4 Гц, 2H), 8.01 (d, J=8,7 Гц, 1H), 7.71 (dd, J=9,8; 2,3 Гц, 1H), 7.19 (td, J=9,1; 1,9 Гц, 1H), 4.15 (s, 3H), 4.02-4.14 (m, 1H), 1.56-1.75 (m, 2H), 1.28 (d, J=6,8 Гц, 3H), 0.96 (t, J=7,6 Гц, 3H).
Пример 181
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
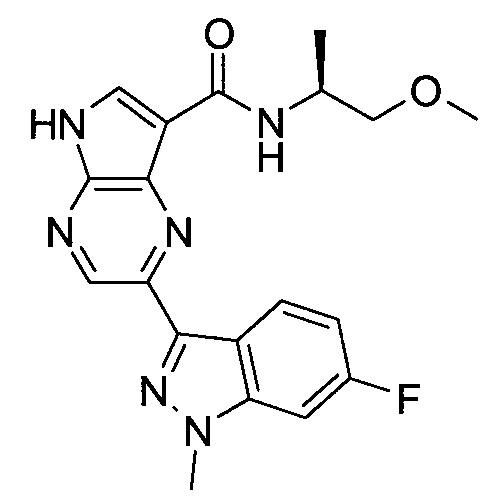
Получали в соответствии с методикой, приведенной в примере 178, заменяя (S)-1-метоксипропан-2-амина гидрохлорид на (S)-бутан-2-амин на стадии 1. Конечное соединение выделяли в виде беловатого твердого вещества, 27 мг (73%); MS: [M+Na]+=405; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.85 (br. s., 1H), 9.12 (s, 1H), 8.54 (dd, J=9,1; 5,3 Гц, 1H), 8.44 (s, 1H), 8.21 (d, J=8,3 Гц, 1H), 7.70 (dd, J=9,8; 2,3 Гц, 1H), 7.16 (td, J=9,1; 2,3 Гц, 1H), 4.30-4.47 (m, 1H), 4.15 (s, 3H), 3.50 (qd, J=9,3; 4,5 Гц, 2H), 3.28 (s, 3H), 1.31 (d, J=6,4 Гц, 3H).
Пример 182
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метил-2-тридейтерометокси-этил)-амид
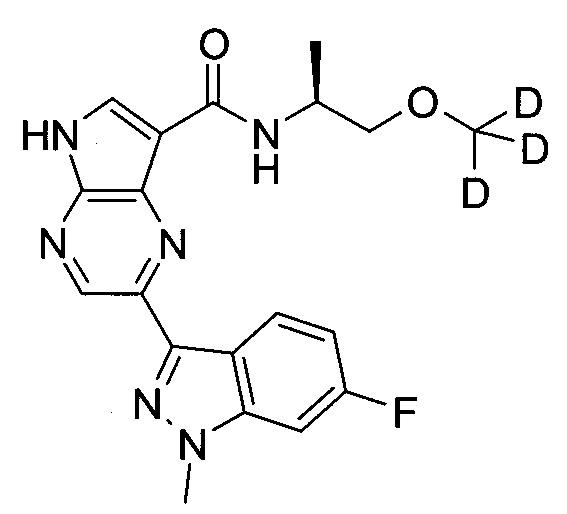
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амид
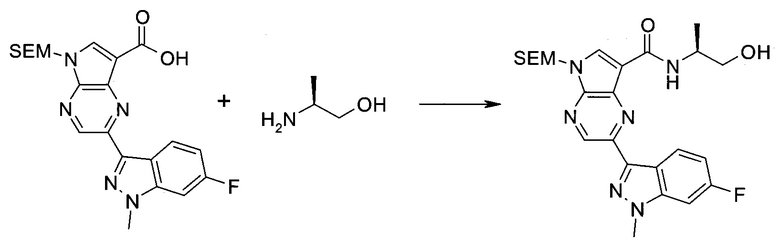
В круглодонную колбу емкостью 25 мл загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (115 мг; 0,26 ммоль), (S)-2-аминопропан-1-ол (0,21 мкл; 0,27 ммоль) и HATU (104 мг; 0,27 ммоль). Затем добавляли ацетонитрил (2 мл), после чего N,N-диизопропилэтиламин (0,2 мл; 1,12 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали EtOAc (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали, получая 76 мг (57%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амида в виде белого твердого вещества.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метил-2-тридейтерометокси-этил)-амид
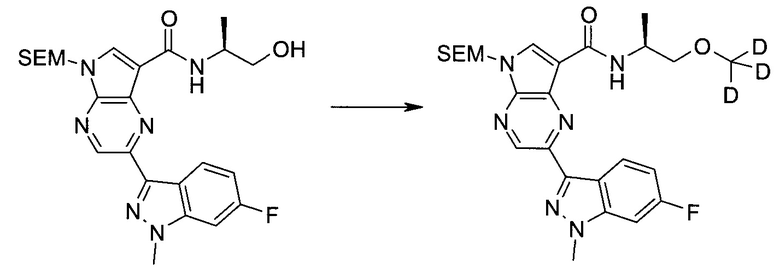
В круглодонной колбе емкостью 10 мл растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амид (70 мг; 0,14 ммоль) в THF (1,4 мл), получая бесцветный раствор. Реакционную смесь охлаждали в ледяной бане и добавляли последовательно измельченный KOH (91 мг; 1,62 ммоль), 18-краун-6 (44 мг; 0,166 ммоль) и иодтридейтерометан (9 мкл; 0,147 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, после чего ледяную баню удаляли. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем разбавляли дихлорметаном (10 мл) и промывали водным хлоридом аммония (10 мл), водой (10 мл) и насыщенным бикарбонатом натрия (10 мл). Органический слой сушили над Na2SO4 и концентрировали. Неочищенное вещество очищали хроматографией на SiO2 с использованием смеси EtOAc/гептан (градиент: 5%-60% EtOAc), получая 38 мг (53%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метил-2-тридейтерометокси-этил)-амида в виде белого твердого вещества. MS: [M+Na]+=538.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метил-2-тридейтерометокси-этил)-амид
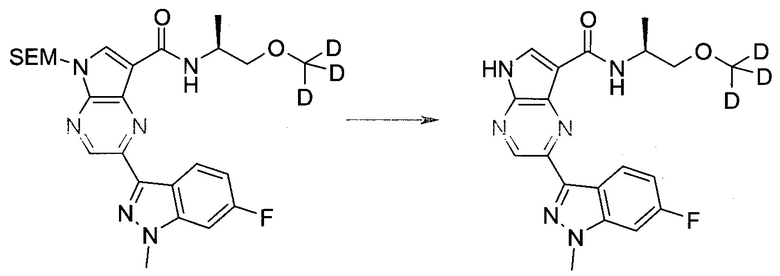
В круглодонной колбе емкостью 10 мл объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метил-2-тридейтерометокси-этил)-амид (38 мг; 0,074 ммоль) и TFA (0,5 мл; 6,5 ммоль) в дихлорметане (1,5 мл), получая
оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,10 мл; 1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (дихлорметан/гептан), получая 27 мг (96%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метил-2-тридейтерометокси-этил)-амида в виде беловатого твердого вещества. MS: [M+H]+=386; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.85 (br. s., 1H), 9.11 (s, 1H), 8.54 (dd, J=8,9; 5,5 Гц, 1H), 8.44 (s, 1H), 8.21 (d, J=8,3 Гц, 1H), 7.70 (dd, J=9,8; 2,3 Гц, 1H), 7.15 (td, J=9,1; 2,3 Гц, 1H), 4.25-4.45 (m, 1H), 4.15 (s, 3H), 3.49 (qd, J=9,3; 4,5 Гц, 2H), 1.31 (d, J=6,8 Гц, 3H).
Пример 183
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-1,3-диметил-бутил)-амид
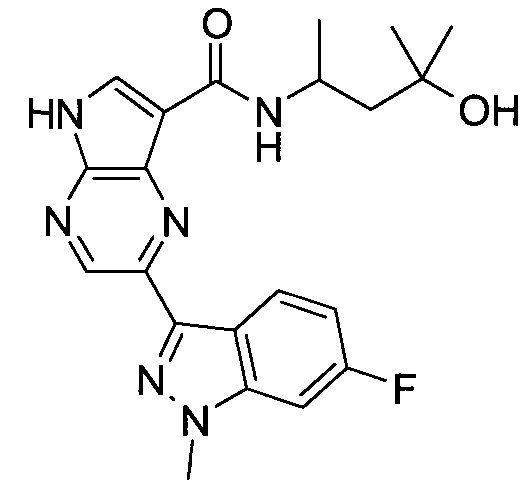
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-1,3-диметил-бутил)-амид
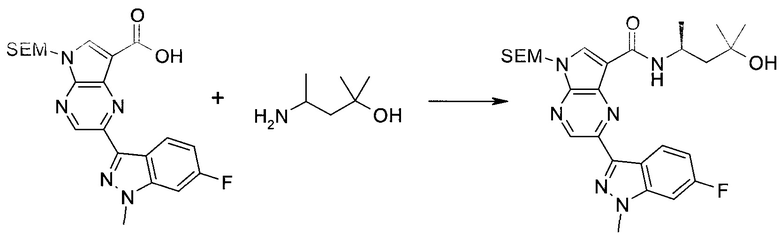
В круглодонную колбу емкостью 25 мл загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-
карбоновую кислоту (98 мг; 0,22 ммоль), 4-амино-2-метилпентан-2-ол (полученный согласно US 2003/0171584 A1) (27 мг; 0,23 ммоль) и HATU (89 мг; 0,23 ммоль). Затем добавляли ацетонитрил (2 мл), после чего N,N-диизопропилэтиламин (0,2 мл; 1,12 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем разбавляли EtOAc и промывали водой (3×). Органический слой объединяли, сушили над Na2SO4 и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гептаны (градиент: 5-90% EtOAc), получая 75 мг (63%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-1,3-диметил-бутил)-амида в виде беловатого твердого вещества. MS: [M+H]+=541.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-1,3-диметил-бутил)-амид
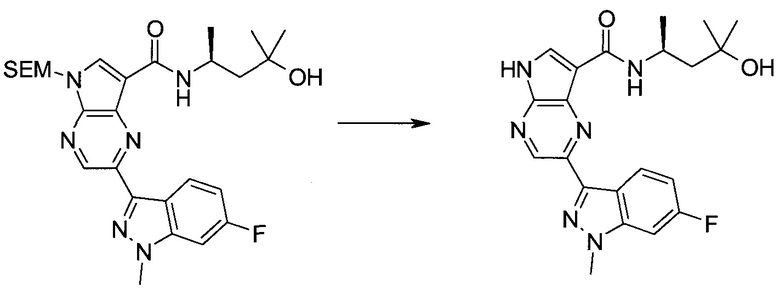
В круглодонной колбе емкостью 125 мл объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-1,3-диметил-бутил)-амид (25 мг; 0,046 ммоль), фторид цезия (70 мг; 0,46 ммоль) и 18-краун-6 (12 мг; 0,046 ммоль) в ацетонитриле, получая беловатое суспензия. Реакционную смесь перемешивали при температуре дефлегмации в течение 72 ч. Добавляли большой избыток CsF и 18-краун-6 и реакционную смесь нагревали в течение еще 24 ч. Реакционную смесь разбавляли этилацетатом и промывали водой. Органический слой сушили над Na2SO4 и концентрировали. Неочищенное вещество суспендировали в воде и собирали фильтрованием, затем растирали со смесью 1:2 дихлорметан/гептан, получая 4 мг (21%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-1,3-диметил-бутил)-амида в виде желтого твердого вещества. MS: [M+Na]+=433, 1H ЯМР (300 МГц, DMSO-d6) δ: 12.83 (br. s., 1H), 9.10 (s, 1H), 8.57 (dd, J=8,9; 5,5 Гц, 1H), 8.41 (d, J=2,3 Гц, 1H), 8.15 (d, J=8,3 Гц, 1H), 7.71 (dd, J=9,8; 1,9 Гц, 1H), 7.20 (td, J=9,1; 2,3 Гц, 1H),
4.35 (s, 1H), 4.29-4.43 (m, 1H), 4.16 (s, 3H), 1.83 (dd, J=14,4; 7,9 Гц, 1H), 1.73 (dd, J=16,6; 4,9 Гц, 1H), 1.31 (d, J=6,4 Гц, 3H), 1.15 (s, 3H), 1.12 (s, 3H).
Пример 184
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-бутил)-амид
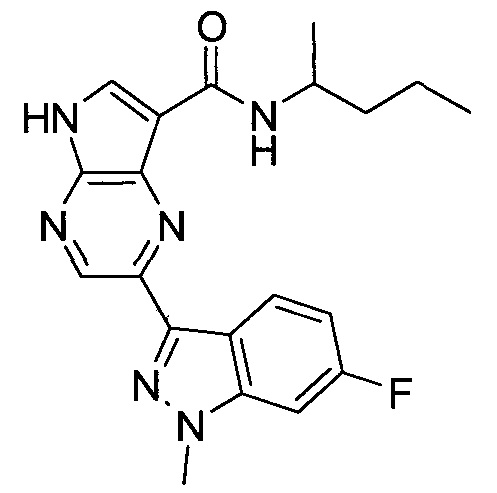
Получали в соответствии с методикой, приведенной в примере 178, заменяя 1-метил-бутиламин на (S)-бутан-2-амин на стадии 1. Конечное соединение выделяли в виде светло-желтого твердого вещества (25 мг; 96%); MS: [M+H]+=403; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.83 (br. s., 1H), 9.10 (s, 1H), 8.42 (s, 1H), 8.43 (dd, J=8,9; 5,3 Гц, 1H), 8.00 (d, J=8,7 Гц, 1H), 7.71 (dd, J=9,8; 1,9 Гц, 1H), 7.18 (td, J=9,1; 2,3 Гц, 1H), 4.15 (s, 3H), 4.18 (quin, J=6,8 Гц, 1H), 1.55-1.67 (m, 2H), 1.36-1.48 (m, 2H), 1.28 (d, J=6,4 Гц, 3H), 0.89 (t, J=7,4 Гц, 3H).
Пример 185
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3,3,3-трифтор-1-метил-пропил)-амид
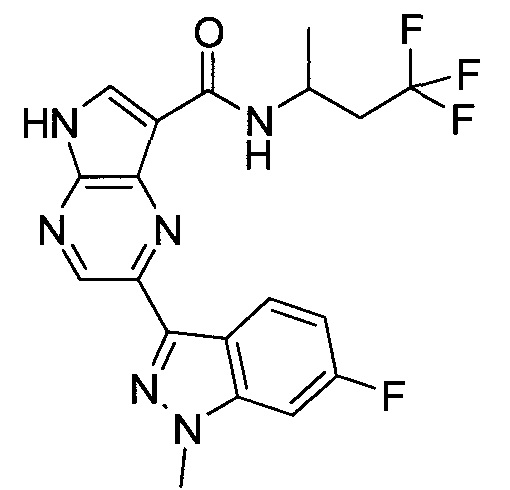
Стадия 1
3,3,3-Трифтор-1-метил-пропиламина гидрохлорид
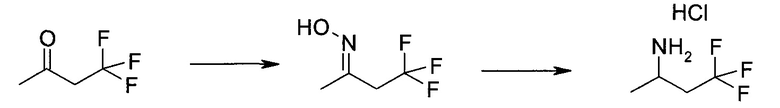
Соль этого амина получали в соответствии с методикой, приведенной в Gassen K.-R; Kirmse W. Chem. Ber., 1986, 119, 2233-2248.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3,3,3-трифтор-1-метил-пропил)-амид
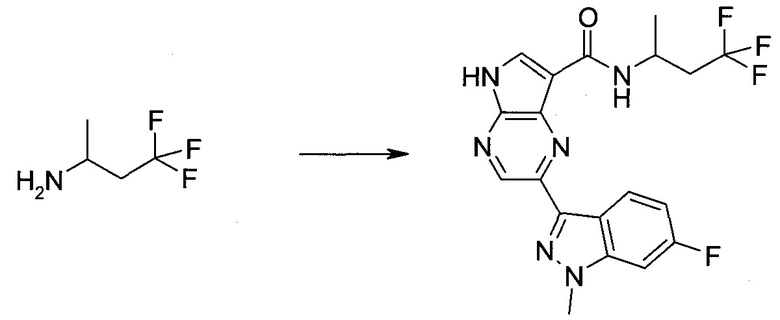
Получали в соответствии с методикой, приведенной в примере 178, заменяя 3,3,3-трифтор-1-метил-пропиламина гидрохлорид на (S)-бутан-2-амин на стадии 1. Конечное соединение выделяли в виде беловатого твердого вещества (16 мг; 38%); MS: [M+H]+=421; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.83 (br. s., 1H), 9.10 (s, 1H), 8.45-8.46 (m, 1H), 8.48 (dd, J=9,0; 5,3 Гц, 1H), 8.17 (d, J=8,3 Гц, 1H), 7.70 (dd, J=9,8; 2,3 Гц, 1H), 7.18 (td, J=9,1; 2,3 Гц, 1H), 4.42-4.59 (m, 1H), 4.15 (s, 3H), 2.70-2.78 (m, 1H), 2.62-2.70 (m, 1H), 1.43 (d, J=6,8 Гц, 3H).
Пример 186
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-циклопропил-1-метил-этил)-амид
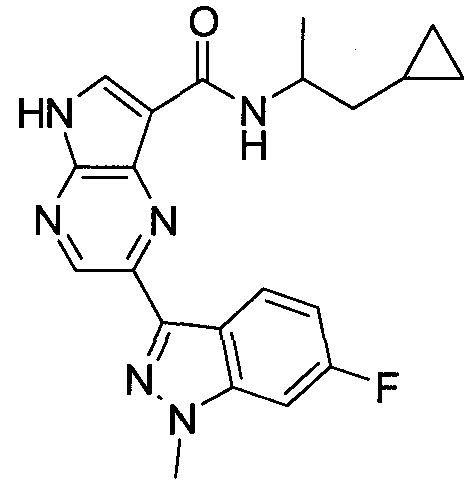
Стадия 1
2-Метил-пропан-2-сульфиновой кислоты [2-циклопропил-1-метил-эт-(E)-илиден]-амид
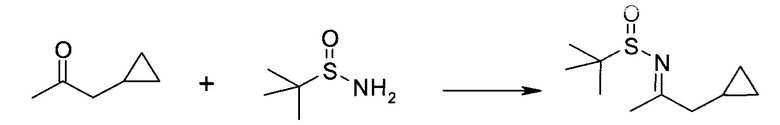
В круглодонную колбу емкостью 25 мл в атмосфере аргона загружали Ti(OEt)4 (технически чистый; 0,37 мл; 1,4 ммоль) и 1-циклопропилпропан-2-он (79,0 мг; 0,81 ммоль) в THF (1,45 мл). Затем добавляли 2-метилпропан-2-сульфинамид (88,7 мг; 0,73 ммоль) и реакционную смесь нагревали до температуры дефлегмации в течение ночи. После охлаждения до комнатной
температуры реакционную смесь выливали в рассол (1,7 мл) при быстром перемешивании. Полученную суспензию фильтровали через набивку целита Фильтрат концентрировали при пониженном давлении, получая неочищенный 2-метил-пропан-2-сульфиновой кислоты [2-циклопропил-1-метил-эт-(E)-илиден]-амид, который передавали непосредственно на следующую стадию без очистки.
Стадия 2
2-Метил-пропан-2-сульфиновой кислоты (2-циклопропил-1-метил-этил)-амид
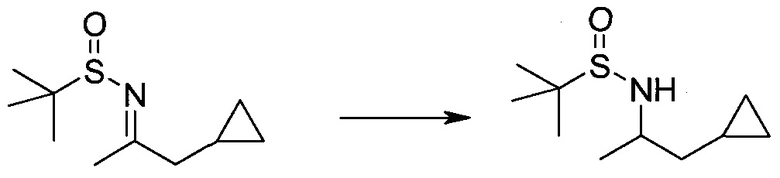
В круглодонную колбу емкостью 25 мл в атмосфере аргона загружали 2-метил-пропан-2-сульфиновой кислоты [2-циклопропил-1-метил-эт-(E)-илиден]-амид (120 мг; 0,596 ммоль) и дихлорметан (2 мл). Реакционную смесь охлаждали в бане при -78°C.Медленно по каплям добавляли DIBAL-H (0,80 мл; 0,800 ммоль). Реакционную смесь оставляли перемешиваться в течение 45 мин, после чего охлаждающую баню удаляли. Реакционную смесь перемешивали в течение 15 мин при комнатной температуре, после чего реакционную смесь возвращали в охлаждающую баню. Реакцию гасили MeOH (0,08 мл; 1,98 ммоль). Реакционную смесь разбавляли дихлорметаном (8 мл) и 1,0 М водным раствором Na+K+-тартрата (5 мл). После перемешивания при комнатной температуре в течение ночи смесь экстрагировали дихлорметаном. Органический слой концентрировали, получая 50 мг 2-Метил-пропан-2-сульфиновой кислоты (2-циклопропил-1-метил-этил)-амида, который непосредственно использовали на следующей стадии без очистки.
Стадия 3
2-циклопропил-1-метил-этиламина гидрохлорид
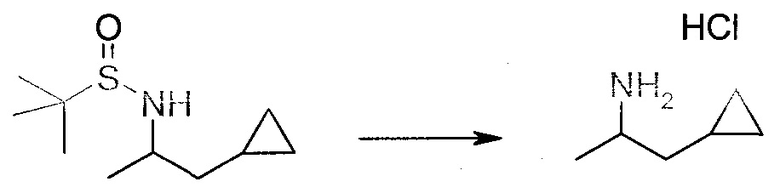
В охлажденную (5°C) круглодонную колбу емкостью 50 мл, содержащую MeOH (10 мл), медленно добавляли ацетилхлорид (0,10 мл; 1,41 ммоль). Раствор оставляли перемешиваться в течение 30 мин. Свежеполученную HCl в MeOH переносили в круглодонную колбу, содержащую 2-метил-пропан-2-сульфиновой кислоты (2-циклопропил-1-метил-этил)-амид (50 мг; 0,25 ммоль). После перемешивания в течение 30 мин при комнатной температуре реакционную
смесь концентрировали, получая 2-циклопропил-1-метил-этиламина гидрохлорид, который использовали без дополнительной очистки. MS: [M+H]+=100.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-циклопропил-1-метил-этил)-амид
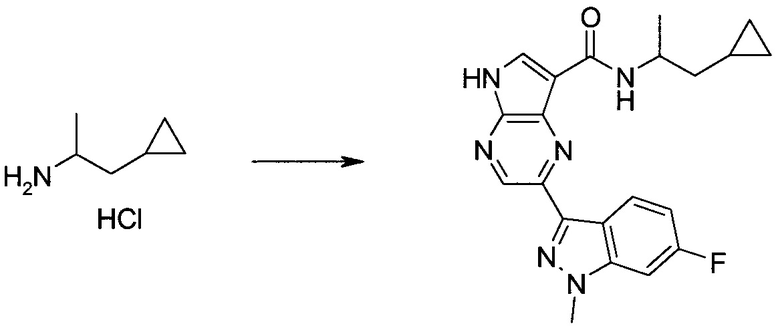
Получали в соответствии с методикой, приведенной в примере 178, заменяя 2-циклопропил-1-метил-этиламина гидрохлорид на (S)-бутан-2-амин на стадии 1. Конечное соединение выделяли в виде светло-желтых игольчатых веществ (9 мг; 28%); MS: [M+H]+=393; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.70 (br. s, 1H), 9.10 (s, 1H), 8.46 (dd, J=9,1; 5,3 Гц, 1H), 8.42 (s, 1H), 7.17 (td, J=9,1; 2,3 Гц, 1H), 4.17-4.31 (m, 1H), 4.15 (s, 3H), 1.63 (dt, J=13,7; 6,8 Гц, 1H), 1.47 (dt, J=13,7; 6,6 Гц, 1H), 1.35 (d, J=6,8 Гц, 3H), 0.72-0.93 (m, 1H), 0.32-0.43 (m, 2H), 0.08 (app. t, J=5,3 Гц, 2H).
Пример 187
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1,3-диметил-бутил)-амид
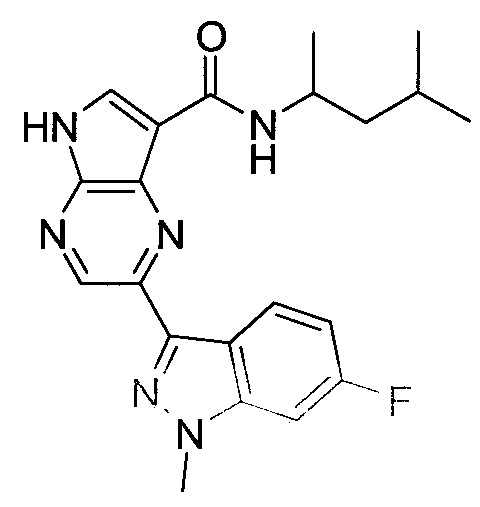
Получали в соответствии с методикой, приведенной в примере 178, заменяя 1,3-диметил-бутиламин на (S)-бутан-2-амин на стадии 1. Конечное соединение выделяли в виде светло-желтых игольчатых веществ (24 мг; 76%); MS: [M+Na]+=417; 1H ЯМР (DMSO-d6) δ: 12.83 (br. s., 1H), 9.09 (s, 1H), 8.42 (s, 1H), 8.41 (dd, J=8,9; 5,7 Гц, 1H), 7.98 (d, J=8,7 Гц, 1H), 7.70 (dd, J=9,8; 2,3 Гц, 1H), 7.16 (td, J=9,1; 2,3 Гц, 1H), 4.18-4.34 (m, 1H), 4.15 (s, 3H), 1.64-1.78 (m, 1H), 1.51-
1.65 (m, 1H), 1.38-1.51 (m, 1H), 1.27 (d, J=6,4 Гц, 3H), 0.92 (d, J=6,4 Гц, 3H), 0.87 (d, J=6,4 Гц, 3H).
Пример 188
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-гидрокси-1-метоксиметил-пропил)-амид
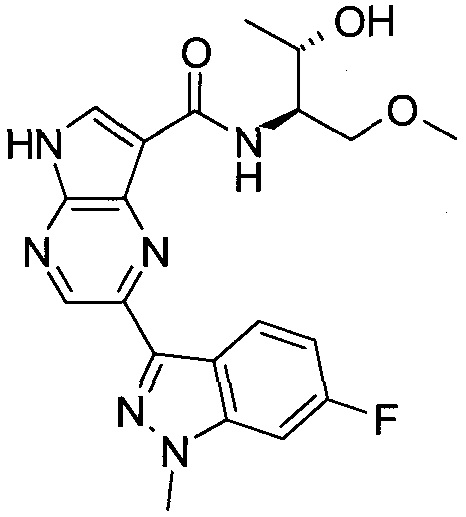
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-гидрокси-1-гидроксиметил-пропил)-амид
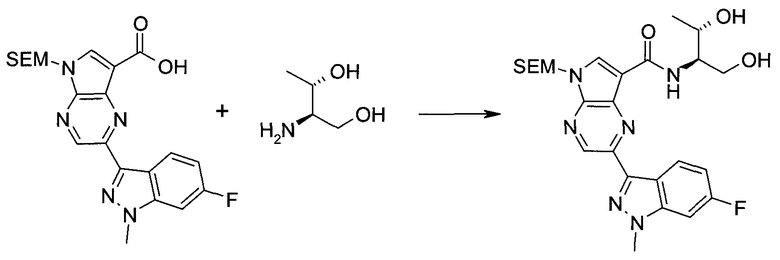
В круглодонную колбу емкостью 25 мл загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (102 мг; 0,23 ммоль), (2R,3S)-2-аминобутан-1,3-диол (34 мг; 0,32 ммоль) и HATU (97 мг; 0,25 ммоль). Затем добавляли ацетонитрил (6 мл), после чего N,N-диизопропилэтиламин (0,25 мл; 1,43 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой. Смесь экстрагировали этилацетатом (3×). Органические слои объединяли, сушили над Na2SO4 и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гептаны (градиент: 5-100% EtOAc), получая 100 мг (82%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-гидрокси-1-гидроксиметил-пропил)-амида в виде белого твердого вещества. MS: [M+Na]+=551.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-гидрокси-1-метоксиметил-пропил)-амид и 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-метокси-1-метоксиметил-пропил)-амид
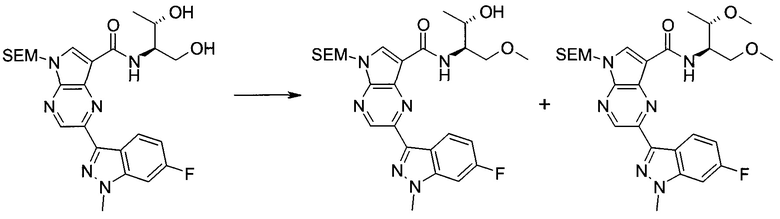
В пробирке для работы под давлением объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-гидрокси-1-гидроксиметил-пропил)-амид (93 мг; 0,176 ммоль), оксид серебра (83 мг; 0,36 ммоль) и метилиодид (200 мкл; 3,2 ммоль) в ацетонитриле, получая черную суспензию. Пробирку обертывали фольгой для исключения попадания света. Систему помещали в песочную банюи нагревали до 40°C с перемешиванием. Такую температуру поддерживали в течение 21 ч. После охлаждения реакционную смесь фильтровали через набивку целита. Фильтрат концентрировали. Неочищенное вещество очищали хроматографией на SiO2 с использованием смеси EtOAc/гексаны (градиент: 15%-90% EtOAc), получая 45 мг (47%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-гидрокси-1-метоксиметил-пропил)-амида в виде светло-желтого твердого вещества ([M+H]+=543) и 20 мг (20%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-метокси-1-метоксиметил-пропил)-амида в виде белого твердого вещества ([M+H]+=557).
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-гидрокси-1-метоксиметил-пропил)-амид
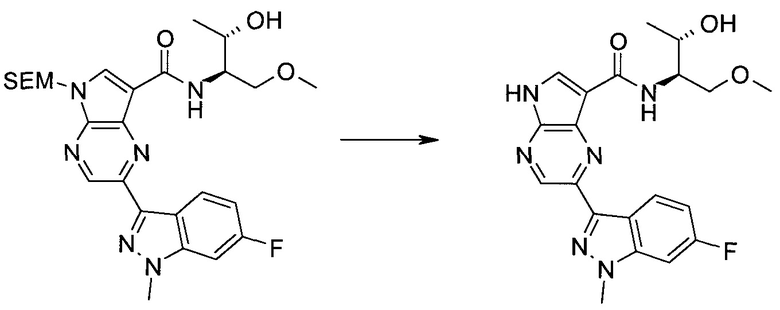
В круглодонной колбе емкостью 10 мл объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-гидрокси-1-метоксиметил-пропил)-амид (44 мг; 0,081 ммоль) и TFA (0,3 мл; 3,9 ммоль) в дихлорметане (1 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,15 мл; 2,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (с горячей смесью дихлорметан/гептан), получая 15 мг (46%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-гидрокси-1-метоксиметил-пропил)-амида в виде беловатого твердого вещества. MS: [M+H]+=413; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.83 (br. s, 1H), 9.14 (s, 1H), 8.62 (dd, J=8,8; 5,3 Гц, 1H), 8.44 (s, 1H), 8.30 (d, J=9,6 Гц, 1H), 7.68 (dd, J=9,6; 1,8 Гц, 1H), 7.13 (td, J=9,1; 2,0 Гц, 1H), 4.94 (d, J=5,6 Гц, 1H), 4.17-4.23 (m, 1H), 4.15 (s, 3H), 3.85-3.96 (m, 1H), 3.75 (dd, J=9,6; 5,6 Гц, 1H), 3.57 (dd, J=9,6; 3,5 Гц, 1H), 3.25 (s, 3H), 1.17 (d, J=6,1 Гц, 3H).
Пример 189
2-(б-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-гидрокси-1-метоксиметил-пропил)-амид
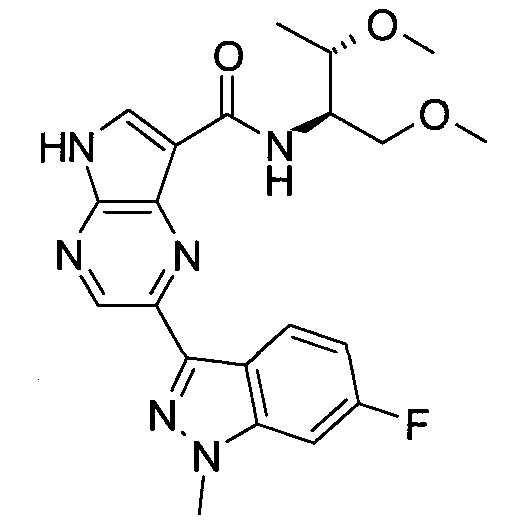
Получали в соответствии с методикой, приведенной в примере 188, стадия 3, заменяя 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-метокси-1-метоксиметил-пропил)-амид на 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-гидрокси-1-метоксиметил-пропил)-амид. Конечное соединение выделяли в виде белого твердого вещества (11 мг; 81%); MS: [M+H]+=427; 1H ЯМР (DMSO-d6) δ: 12.87 (br. s., 1H), 9.14 (s, 1H), 8.58 (dd, J=8,8; 5,3 Гц, 1H), 8.45 (s, 1H), 8.33 (d, J=9,6 Гц, 1H), 7.69 (dd, J=9,6; 2,0 Гц, 1H), 7.10 (td, J=9,0; 2,3 Гц, 1H), 4.38 (dq, J=9,7; 5,0 Гц, 1H), 4.16 (s, 3H), 3.69 (dd, J=10,1; 5,6 Гц, 1H), 3.56-3.60 (m, 1H), 3.56 (dd, J=10,1; 4,0 Гц, 1H), 3.28 (s, 3H), 3.25 (s, 3H), 1.17(d, J=6,1 Гц, 3H).
Пример 190
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-гидрокси-1-(тетрагидро-фуран-2-ил)-этил]-амид
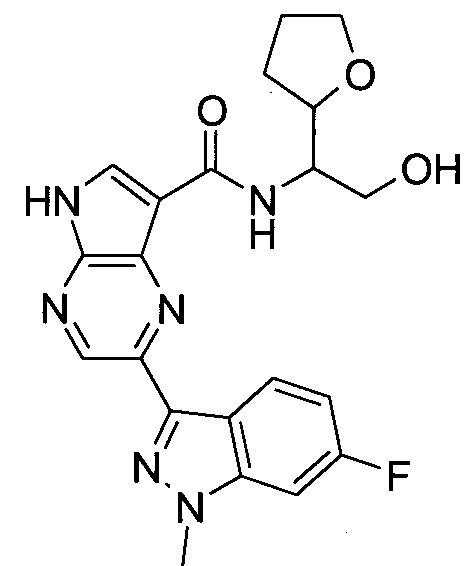
Получали в соответствии с методикой, приведенной в примере 178, заменяя 2-амино-2-(тетрагидрофуран-2-ил)этанол на (S)-бутан-2-амин на стадии 1. Конечное соединение выделяли в виде беловатого твердого вещества (смесь диастереомеров) (10 мг; 59%); MS: [M+H]+=425; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.87 (br. s., 2H), 9.14 (s, 2H), 8.71 (dd, J=9,0; 5,5 Гц, 1H), 8.70 (dd, J=9,1; 5,2 Гц, 1H), 8.45 (s, 2H), 8.35 (t, J=9,1 Гц, 2H), 7.67 (dd, J=9,8; 1,9 Гц, 2H), 7.16 (tt, J=9,1; 2,1 Гц, 2H), 5.16 (t, J=4,2 Гц, 1H), 5.13 (t, J=4,9 Гц, 1H), 4.15 (s, 6H), 4.10-4.27 (m, 2H), 3.88 (t, J=7,9 Гц, 1H), 3.75 (t, J=8,3 Гц, 1H), 3.45-3.76 (m, 10H), 2.58-2.69 (m, 2H), 2.01-2.13 (m, 1H), 1.85-1.97 (m, 1H), 1.63-1.78 (m, 2H).
Пример 191
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-метокси-1-(тетрагидро-фуран-2-ил)-этил]-амид
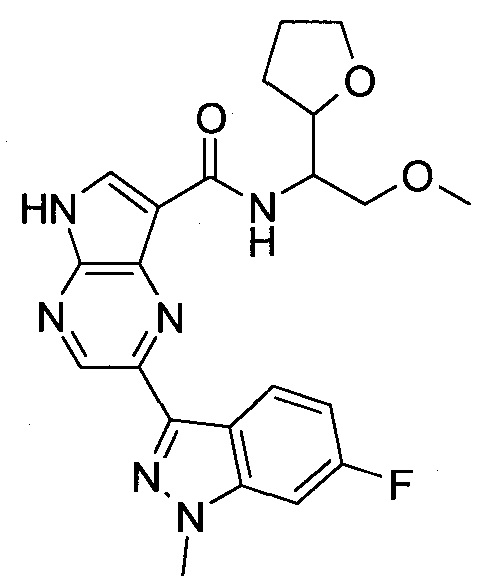
Получали в соответствии с методикой, приведенной в примере 179, заменяя 2-амино-2-(тетрагидрофуран-2-ил)этанол на (S)-2-амино-4-метилпентан-1-ол на стадии 1. Конечное соединение выделяли в виде беловатого твердого вещества (смесь 1:1 диастереомеров) (12 мг; 53%); MS: [M+Na]+=461; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.88 (br. s., 2H), 9.13 (s, 2H), 8.56 (dd, J=9,1; 5,3 Гц, 2H), 8.46 (s, 2H), 8.33 (t, J=9,3 Гц, 2H), 7.70 (dd, J=9,8; 2,3 Гц, 2H), 7.15 (tt, J=9,0; 2,3 Гц, 2H), 4.26-4.41 (m, 2H), 4.16 (s, 6H), 3.86 (t, J=7,9 Гц, 1H), 3.76 (t, J=8,1 Гц, 1H), 3.43-3.74 (m, 10H), 3.27 (s, 3H), 3.26 (s, 3H), 2.56-2.67 (m, 2H), 1.99-2.11 (m, 1H), 1.86-1.98 (m, 1H), 1.64-1.82 (m, 2H).
Пример 192
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-3-метансульфонил-1-метоксиметил-пропил)-амид
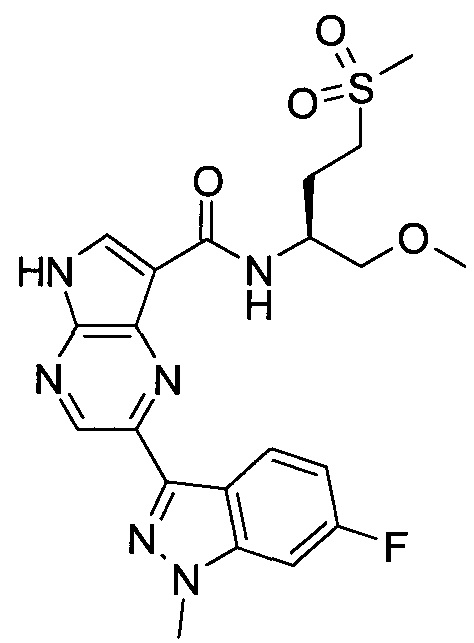
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-гидроксиметил-3-метилсульфанил-пропил)-амид
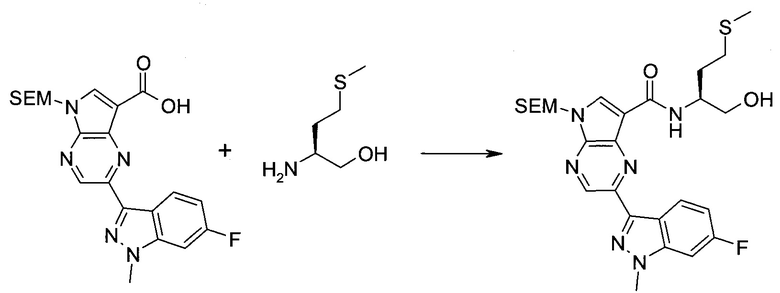
В круглодонную колбу емкостью 25 мл загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этокси метил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (100 мг; 0,23 ммоль), (S)-2-амино-4-(метилтио)бутан-1-ол (32 мг; 0,24 ммоль) и HATU (90 мг; 0,24 ммоль). Затем добавляли ацетонитрил (4 мл), после чего N,N-диизопропилэтиламин (0,19 мл; 1,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой. Смесь экстрагировали этилацетатом (3×). Органические слои объединяли, сушили над Na2SO4 и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси EtOAc/гептаны (градиент: 5-50% EtOAc), получая 105 мг (83%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-гидроксиметил-3-метилсульфанил-пропил)-амида в виде беловатой пены. MS: [M+H]+=559.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-гидроксиметил-3-метансульфонил-пропил)-амид
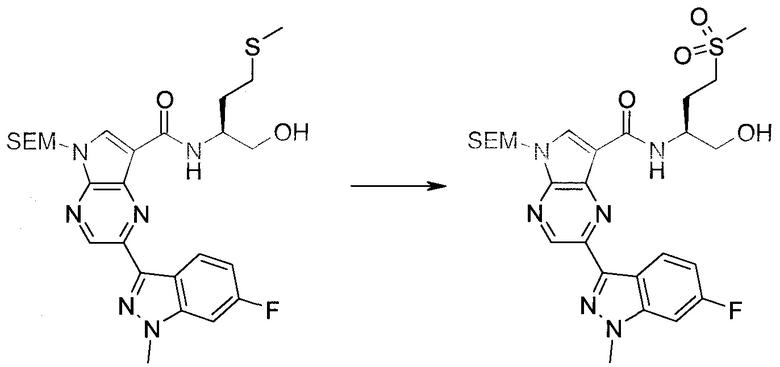
В круглодонной колбе емкостью 25 мл объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-гидроксиметил-3-метилсульфанил-пропил)-амид
(105 мг; 0,188 ммоль) в дихлорметане (2 мл), получая беловатый раствор. Раствор охлаждали до 5°C, используя ледяную баню. Медленно добавляли раствор м-СРВА (87 мг; 0,388 ммоль) в дихлорметане (2 мл). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 1 ч, после чего добавляли 20 капель MeOH. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 18 ч, затем разбавляли дихлорметаном и промывали насыщенным раствором бикарбоната натрия (2×15 мл). Органический слой сушили над Na2SO4 и концентрировали, получая 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-гидроксиметил-3-метансульсронил-пропил)-амид, который использовали без дополнительной очистки.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метоксиметил-3-метансульфонил-пропил)-амид
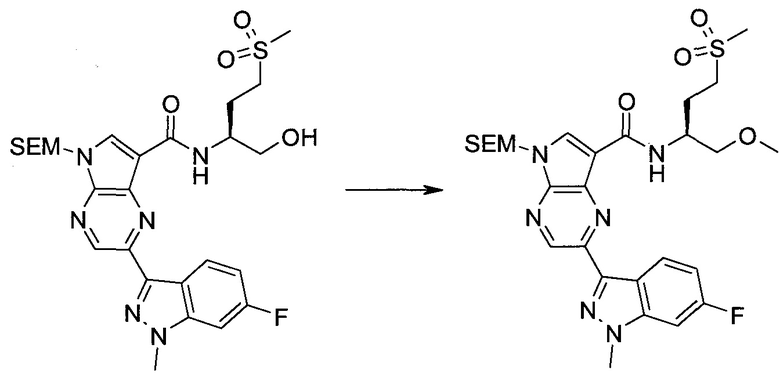
В круглодонной колбе емкостью 10 мл растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-гидроксиметил-3-метансульфонил-пропил)-амид (102 мг; 0,173 ммоль) в THF (1,9 мл), получая бесцветный раствор. Реакционную смесь охлаждали в ледяной бане и добавляли последовательно измельченный KOH (97 мг; 1,73 ммоль), 18-краун-6 (46 мг; 0,173 ммоль) и иодметан (11 мкл; 0,173 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, после чего ледяную баню удаляли. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем разбавляли дихлорметаном (10 мл) и промывали водным хлоридом аммония (10 мл), водой (10 мл) и насыщенным бикарбонатом натрия (10 мл). Органический слой сушили над Na2SO4 и концентрировали. Неочищенное вещество очищали хроматографией на SiO2 с использованием смеси EtOAc/гептан (градиент: 0%-60% EtOAc), получая 30 мг
(29%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метоксиметил-3-метансульфонил-пропил)-амида в виде беловатого твердого вещества. MS: [M+Na]+=627.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-3-метансульфонил-1-метоксиметил-пропил)-амид
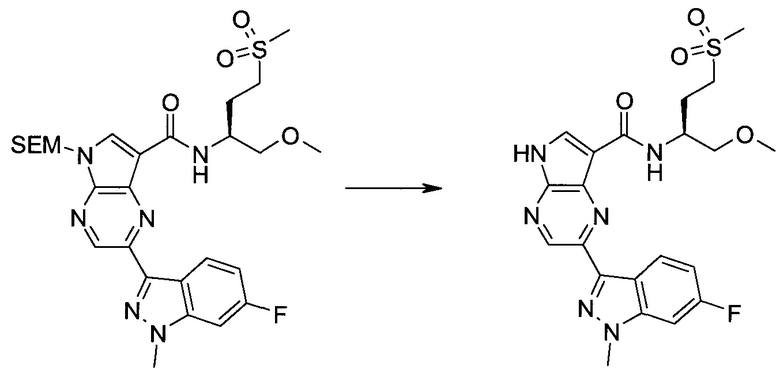
В круглодонной колбе емкостью 10 мл объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метоксиметил-3-метансульфонил-пропил)-амид (35 мг; 0,058 ммоль) и TFA (0,5 мл; 6,5 ммоль) в дихлорметане (1,5 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,19 мл; 2,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (дихлорметан/гептан), получая 12 мг (44%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-3-метансульфонил-1-метоксиметил-пропил)-амида в виде светло-желтого твердого вещества. MS: [M+Na]+=497; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.87 (br. s., 1H), 9.12 (s, 1H), 8.54 (dd, J=8,7; 5,3 Гц, 1H), 8.47 (s, 1H), 8.28 (d, J=9,1 Гц, 1H), 7.69 (dd, J=9,8; 2,3 Гц, 1H), 7.19 (td, J=9,1; 2,3 Гц, 1H), 4.35-4.55 (m, 1H), 4.15 (s, 3H), 3.60 (dd, J=9,8; 4,2 Гц, 1H), 3.51 (dd, J=9,4; 4,2 Гц, 1H), 3.26 (s, 3H), 3.20-3.28 (m, 2H), 2.97 (s, 3H), 2.02-2.23 (m, 2H).
Пример 193
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-дифторметокси-1-метил-этил)-амид
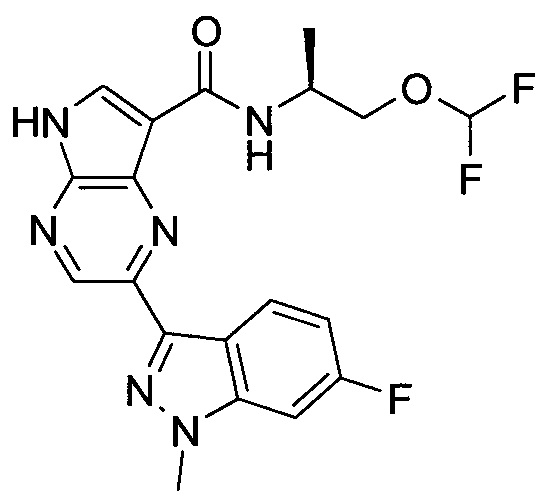
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-дифторметокси-1-метил-этил)-амид
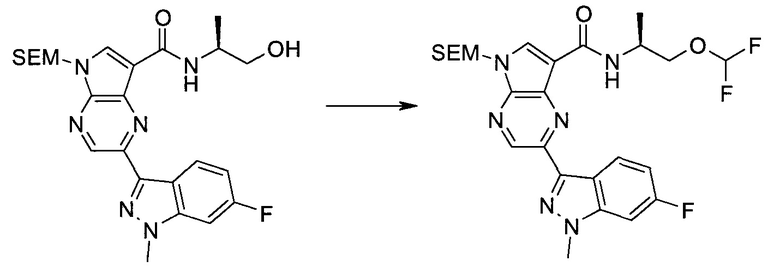
В пробирке емкостью 25 мл для работы под давлением объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амид (60 мг; 0,12 ммоль) и иодид меди(1) (14 мг; 0,070 ммоль) с ацетонитрилом (3 мл), получая светло-желтую суспензию. Смесь дегазировали (was degassed - 36+6p) и помещали в атмосферу аргона. Реакционную смесь нагревали до 50°C в песочной бане. Медленно по каплям добавляли 2,2-дифтор-2-(фторсульфонил)уксусную кислоту (12 мкл; 0,112 ммоль), получая светло-желтый раствор. Реакционную смесь перемешивали в течение еще 5 мин. Реакцию гасили водой и экстрагировали этилацетатом. Объединенные органические экстракты последовательно промывали водой, насыщенным бикарбонатом натрия и рассолом, затем сушили над Na2SO4 и концентрировали. Неочищенное вещество очищали флэш-хроматографией на силикагеле (градиент: от 0% до 50% EtOAc в гексанах), получая 12 мг (18%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-дифторметокси-1-метил-этил)-амида в виде белого твердого вещества. MS: [M+H]+=549.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-дифторметокси-1-метил-этил)-амид
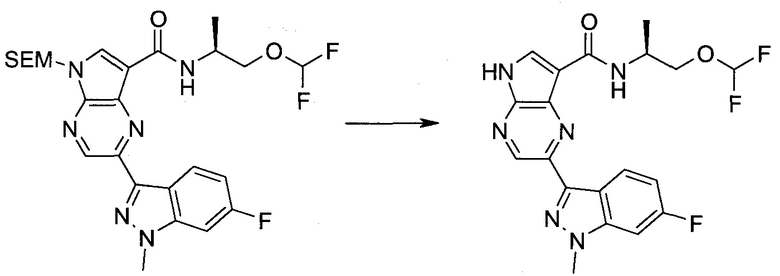
В круглодонной колбе емкостью 10 мл объединяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-дифторметокси-1-метил-этил)-амид (10 мг; 0,018 ммоль) и TFA (0,5 мл; 6,5 ммоль) в дихлорметане (1,5 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (1 мл) и добавляли этилендиамин (30 мкл; 0,46 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (дихлорметан), получая 2 мг (32%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-дифторметокси-1-метил-этил)-амида в виде беловатого твердого вещества. MS: [M+H]+=419; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.86 (br. s., 1H), 9.11 (s, 1H), 8.47 (s, 1H), 8.49 (dd, J=9,1; 5,3 Гц, 1H), 8.19 (d, J=8,3 Гц, 1H), 7.70 (dd, J=9,8; 2,3 Гц, 1H), 7.15 (td, J=9,2; 2,1 Гц, 1H), 6.70 (t, J=75,2 Гц, 1H), 4.36-4.54 (m, 1H), 4.16 (s, 3H), 4.00 (d, J=4,5 Гц, 2H), 1.37 (d, J=6,8 Гц, 3H).
Пример 194
2-(5-Циклопропил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
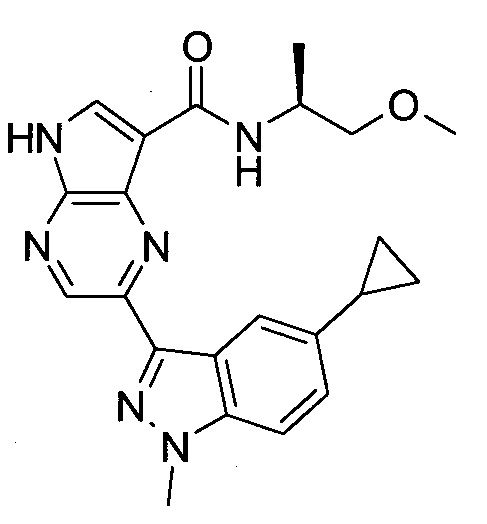
Стадия 1
5-Циклопропил-1-(2-триметилсиланил-этоксиметил)-1H-индазол
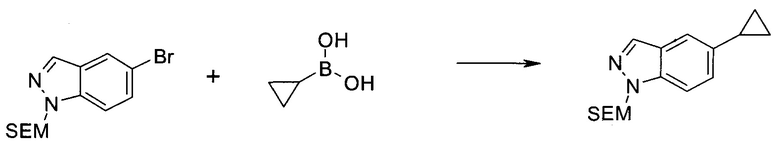
В 2-горлую круглодонную колбу емкостью 250 мл загружали 5-бром-1-((2-(триметилсилил)этокси)метил)-1H-индазол (2,5 г; 7,64 ммоль), циклопропилбороновую кислоту (1,18 г; 13,7 ммоль), ацетат палладия(II) (85,7 мг; 0,38 ммоль), трициклогексилфосфин (214 мг; 0,764 ммоль), фосфат калия трехосновный (3,24 г; 15,3 ммоль), толуол (40 мл) и воду (4 мл). Реакционную смесь перемешивали при 100°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем разбавляли EtOAc (100 мл) и водой (20 мл). Смесь экстрагировали EtOAc (100 мл). Органические слои промывали водой (20 мл) и рассолом (20 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали. Остаток абсорбировали на SiO2 и очищали хроматографией на SiO2 с использованием смеси EtOAc/CH2Cl2 (градиент: 0-10% EtOAc), получая 1,7 г (77%) 5-циклопропил-1-(2-триметилсиланил-этоксиметил)-1H-индазола в виде светло-желтого масла. 1H ЯМР (300 МГц, CDCl3) δ: 7.93 (s, 1H), 7.48 (d, J=8,7 Гц, 1H), 7.44 (s, 1H), 7.19 (dd, J=8,5; 1,7 Гц, 1H), 3.53 (app t, J=8,3 Гц, 2H), 1.93-2.12 (m, 1H), 0.92-1.04 (m, 2H), 0.88 (app t, J=8,3 Гц, 2H), 0.64-0.78 (m, 2H), -0.07 (s, 9H).
Стадия 2
5-Циклопропил-1H-индазол
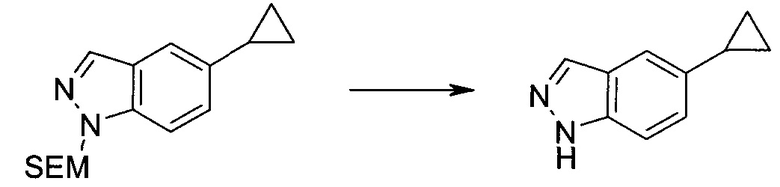
В круглодонной колбе емкостью 1 л растворяли 5-циклопропил-1-(2-триметилсиланил-этоксиметил)-1H-индазол (1,7 г; 5,89 ммоль) в растворе
дихлорметана (292 мл) и трифторуксусной кислоты (194 мл). После перемешивания при комнатной температуре в течение ночи реакционную смесь концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане и добавляли этилендиамин (24,2 мл; 5,89 ммоль). После перемешивания при комнатной температуре в течение ночи реакционную смесь выливали в воду (50 мл) и экстрагировали EtOAc (2×100 мл). Органические слои сушили над MgSO4 и концентрировали при пониженном давлении, получая 1 г 5-циклопропил-1H-индазола, который использовали без дополнительной очистки. MS: [M+H]+=299.
Стадия 3
5-Циклопропил-1-метил-3-трибутилстаннанил-1H-индазол
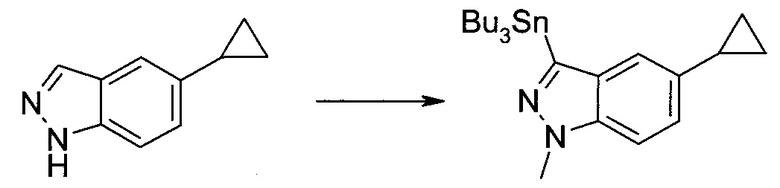
Получали в соответствии с методикой, приведенной в примере 1, стадии 1-3, заменяя 5-циклопропил-1H-индазол на индазол на стадии 1.
Стадия 4
2-(5-Цикпопропил-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
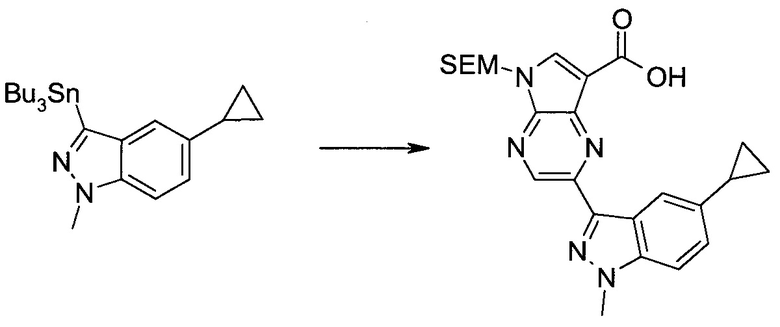
Получали в соответствии с методикой, приведенной в примере 14, стадии 1-2, заменяя 5-Циклопропил-1-метил-3-трибутилстаннанил-1H-индазол на 6-хлор-1-метил-3-трибутилстаннанил-1H-индазол на стадии 1. 1H ЯМР (300 МГц, DMSO-d6) δ: 9.10 (s, 1H), 8.69 (s, 1H), 8.62 (s, 1H), 7.61 (d, J=9,1 Гц, 1H), 7.34 (dd, J=8,7; 1,9 Гц, 1H), 5.72 (s, 2H), 4.14 (s, 3H), 3.60 (t, J=8,2 Гц, 2H), 2.01-2.15 (m, 1H), 0.94-1.03 (m, 2H), 0.85 (t, J=8,3 Гц, 2H), 0.78-0.85 (m, 2H), -0.09 (s, 9H).
Стадия 5
2-(5-Циклопропил-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
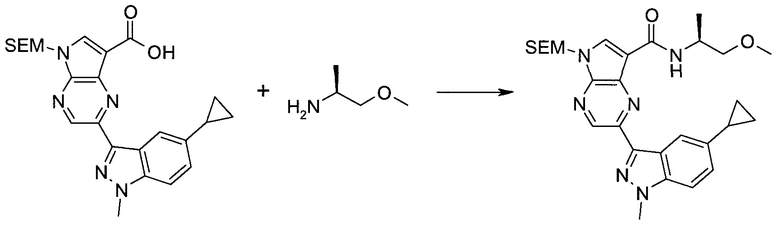
В круглодонную колбу емкостью 25 мл загружали 2-(5-циклопропил-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (70 мг; 0,15 ммоль), (S)-1-метоксипропан-2-амина гидрохлорид (21 мг; 0,16 ммоль) и HATU (63 мг; 0,16 ммоль). Затем добавляли ацетонитрил (2 мл), после чего N,N-диизопропилэтиламин (0,08 мл; 0,45 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой. Смесь экстрагировали этилацетатом (3×). Органические слои объединяли, сушили над Na2SO4 и концентрировали. Неочищенное вещество очищали флэш-хроматографией на силикагеле (градиент: 15% to 100% EtOAc в гептане), получая 34 мг (42%) 2-(5-циклопропил-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде белого твердого вещества. MS: [M+H]+=535.
Стадия 6
2-(5-Циклопропил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
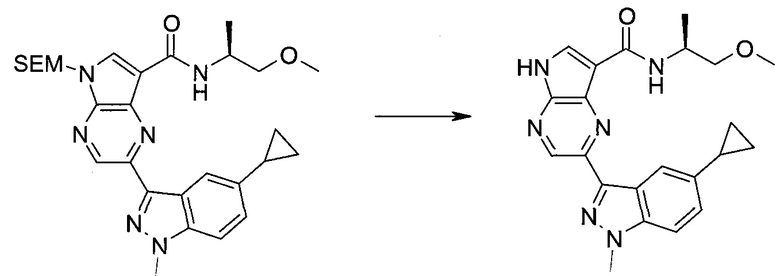
В круглодонной колбе емкостью 10 мл объединяли 2-(5-циклопропил-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (34 мг; 0,065 ммоль) и TFA (0,5 мл; 6,5 ммоль) в дихлорметане (1,5 мл), получая оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч, затем концентрировали при пониженном давлении. Полученное неочищенное твердое вещество растворяли в дихлорметане (1,5 мл)
и добавляли этилендиамин (0,11 мл; 1,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали и остаток осаждали водой. Суспензию перемешивали в течение 1 ч и неочищенное твердое вещество собирали фильтрованием. Неочищенное твердое вещество очищали растиранием (дихлорметан/гептан), получая 10 мг (38%) 2-(5-циклопропил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде беловатого твердого вещества. MS: [M+H]+=405; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.79 (br. s., 1H), 9.09 (s, 1H), 8.42 (s, 1H), 8.30 (s, 1H), 8.26 (d, J=8,3 Гц, 1H), 7.66 (d, J=8,7 Гц, 1H), 7.10 (dd, J=8,7; 1,5 Гц, 1H), 4.28-4.43 (m, 1H), 4.15 (s, 3H), 3.53 (dd, J=9,1; 4,5 Гц, 1H), 3.45 (dd, J=9,1; 4,9 Гц, 1H), 3.20 (s, 3H), 2.18-2.25 (m, 1H), 1.35 (d, J=6,8 Гц, 3H), 0.94-1.02 (m, 2H), 0.76 (td, J=5,3; 4,2 Гц, 2H).
Пример 195
2-(5-Циклопропил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид
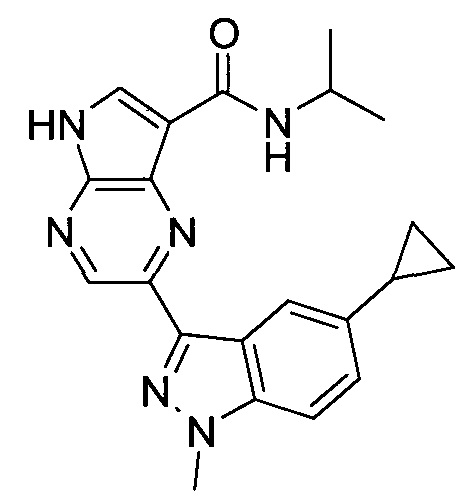
Получали в соответствии с методикой, приведенной в примере 194, стадии 5-6, заменяя изопропиламин на (S)-1-метоксипропан-2-амина гидрохлорид на стадии 5. Конечное соединение выделяли в виде беловатого твердого вещества (18 мг; 62%); MS: [M+H]+=375; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.72 (br. s., 1H), 9.06 (s, 1H), 8.41 (s, 1H), 8.26 (s, 1H), 8.13 (d, J=7,9 Гц, 1H), 7.67 (d, J=8,7 Гц, 1H), 7.15 (dd, J=8,7; 1,5 Гц, 1H), 4.24 (dq, J=13,9; 6,8 Гц, 1H), 4.15 (s, 3H), 2.12 (app. quin, J=4,9 Гц, 1H), 1.34 (s, 3H), 1.32 (s, 3H), 0.93-1.02 (m, 2H), 0.70-80 (m, 2H).
Пример 196
2-(5-Циклопропил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид
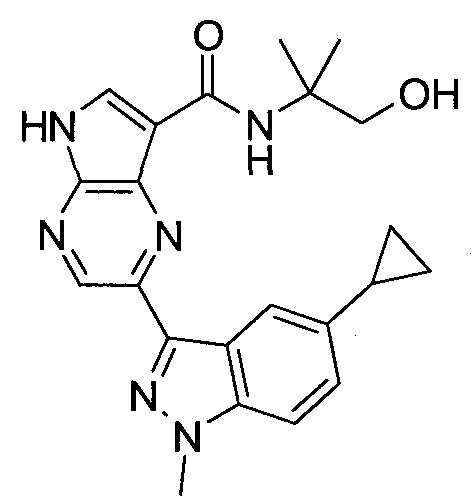
Получали в соответствии с методикой, приведенной в примере 194, стадии 5-6, заменяя 2-амино-2-метилпропан-1-ол на (S)-1-метоксипропан-2-амина гидрохлорид на стадии 5. Конечное соединение выделяли в виде беловатого твердого вещества (25 мг; 55%); MS: [M+H]+=405; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.70 (br. s., 1H), 9.03 (s, 1H), 8.37 (s, 1H), 8.29 (s, 1H), 8.02 (s, 1H), 7.64 (d, J=8,7 Гц, 1H), 7.11 (dd, J=8,7; 1,5 Гц, 1H), 5.00 (t, J=5,7 Гц, 1H), 4.14 (s, 3H), 3.65 (d, J=5,3 Гц, 2H), 2.18 (app. quin, J=4,9 Гц, 1H), 1.44 (s, 6H), 0.92-1.00 (m, 2H), 0.69-0.76 (m, 2H).
Пример 197
2-(5-Циклопропил-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид
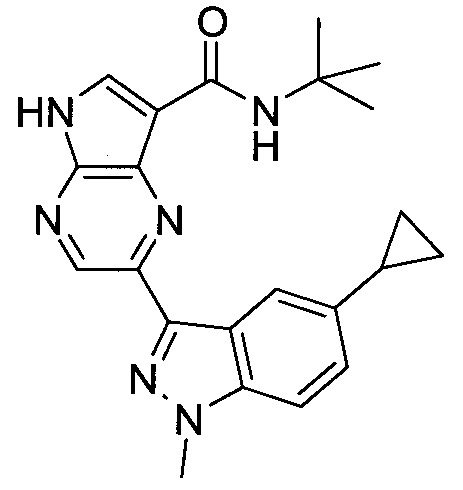
Получали в соответствии с методикой, приведенной в примере 194, стадии 5-6, заменяя трет-бутиламин на (S)-1-метоксипропан-2-амина гидрохлорид на стадии 5. Конечное соединение выделяли в виде беловатого твердого вещества (25 мг; 79%); MS: [M+H]+=389; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.17 (br. s., 1H), 9.01 (s, 1H), 8.36 (s, 1H), 8.24 (s, 1H), 8.06 (s, 1H), 7.65 (d, J=8,7 Гц, 1H), 7.14 (dd, J=8,7; 1,5 Гц, 1H), 4.14 (s, 3H), 2.10 (s, 1H), 1.51 (s, 9H), 0.88-1.08 (m, 2H), 0.65-0.80 (m, 2H).
Пример 198
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(1R,2R)-1-(3-фтор-азетидин-1-карбонил)-2-гидрокси-пропил]-амид
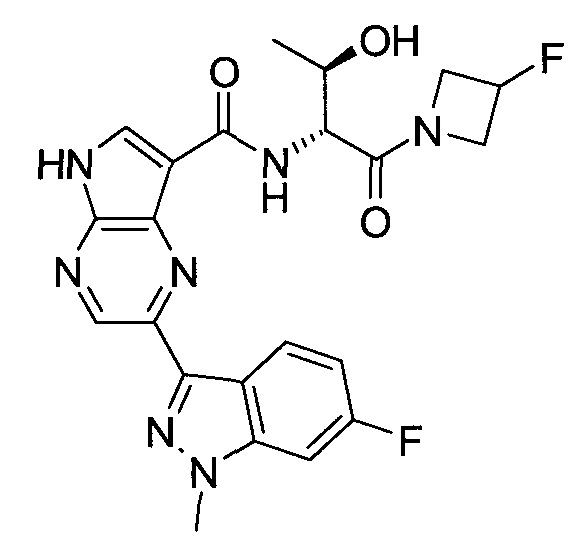
Стадия 1
[(1R,2R)-1-(3-фтор-азетидин-1-карбонил)-2-гидрокси-пропил]-карбаминовой кислоты 9H-флуорен-9-илметиловый эфир
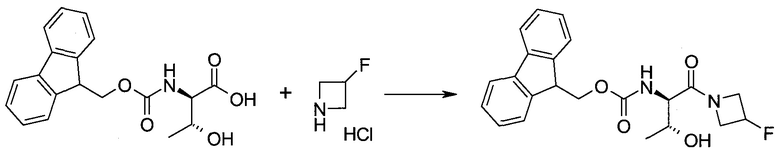
В круглодонную колбу емкостью 25 мл загружали (2R,3R)-2-(((9H-флуорен-9-ил)метокси)карбониламино)-3-гидроксибутановую кислоту (184 мг; 0,54 ммоль), 3-фторазетидина гидрохлорид (66 мг; 0,59 ммоль) и HATU (242 мг; 0,64 ммоль). Затем добавляли ацетонитрил (1,1 мл), после чего N,N-диизопропилэтиламин (0,20 мл; 1,1 ммоль) и N-метилморфолин (0,05 мл; 0,45 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали. Неочищенное твердое вещество очищали хроматографией на SiO2 с использованием смеси EtOAc/гептан (градиент: 10-80% EtOAc), получая 112 мг (52%) [(1R,2R)-1-(3-фтор-азетидин-1-карбонил)-2-гидрокси-пропил]-карбаминовой кислоты 9H-флуорен-9-илметилового эфира в виде белого твердого вещества. MS: [M+H]+=399.
Стадия 2
(2R,3R)-2-Амино-1-(3-фтор-азетидин-1-ил)-3-гидрокси-бутан-1-он
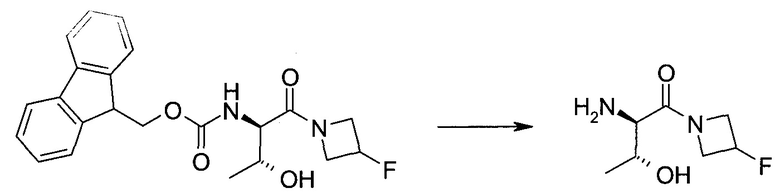
В круглодонной колбе емкостью 25 мл объединяли [(1R,2R)-1-(3-фтор-азетидин-1-карбонил)-2-гидрокси-пропил]-карбаминовой кислоты 9H-флуорен-9-илметиловый эфир (112 мг; 0,28 ммоль) и диэтиламин (0,29 мл; 2,81 ммоль) в ацетонитриле (6 мл), получая белую суспензию. Реакционную смесь
перемешивали при комнатной температуре в течение 2,5 ч и затем концентрировали досуха, получая (2R,3R)-2-амино-1-(3-фтор-азетидин-1-ил)-3-гидрокси-бутан-1-он, который использовали без дополнительной очистки.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(1R,2R)-1-(3-фтор-азетидин-1-карбонил)-2-гидрокси-пропил]-амид
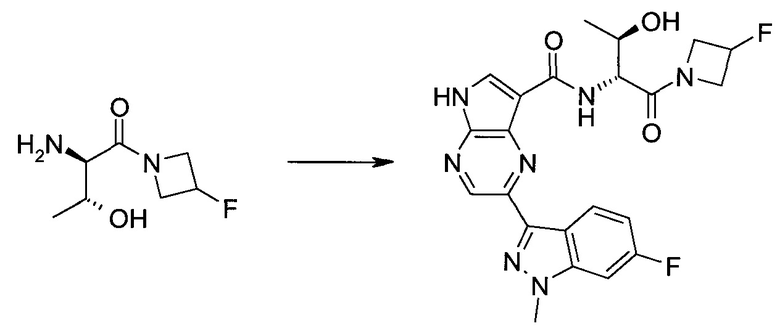
Получали в соответствии с методикой, приведенной в примере 178, заменяя (2R,3R)-2-амино-1-(3-фтор-азетидин-1-ил)-3-гидрокси-бутан-1-он на(S)-бутан-2-амин на стадии 1. Конечное соединение выделяли в виде белого твердого вещества (31 мг; 63%), MS: [M+H]+=470; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.58 (br. s, 1H), 9.14 (s, 1H), 8.65-8.98 (m, 1H), 8.47 (s, 1H), 8.48 (d, J=13,2 Гц, 1H), 7.65 (dd, J=9,6; 2,1 Гц, 1H), 7.10 (tt, J=9,0; 2,5 Гц, 1H), 5.43 (d, J=56,3 Гц, 1H), 5.19 (br. s., 1H), 4.69-4.77 (m, 1H), 4.64 (t, J=8,3 Гц, 1H), 4.32-4.52 (m, 1H), 4.18-4.32 (m, 1H), 4.14 (s, 3H), 3.98 (br. s., 2H), 1.16 (d, J=6,0 Гц, 3H).
Пример 199
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метил-1H-имидазол-2-ил)-этил]-амид
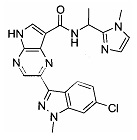
Стадия 1
2-Метил-пропан-2-сульфиновой кислоты 1-(1-метил-1H-имидазол-2-ил)-мет-(E)-илиденамид
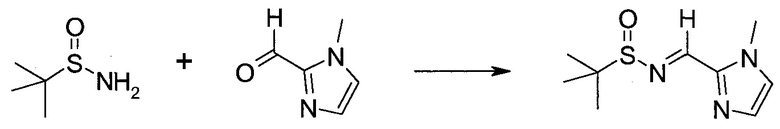
Во флаконе емкостью 25 мл объединяли сульфат меди (1,96 г; 12,3 ммоль), 1-метил-1H-имидазол-2-карбальдегид (450 мг; 4,09 ммоль) и 2-метилпропан-2-сульфинамид (594 мг; 4,9 ммоль) в дихлорметане (2 мл), получая светло-голубую суспензию. Реакционную смесь перемешивали при 25°C в течение 15 ч, затем фильтровали через целит. Реакционную смесь снова фильтровали через силикагель, элюируя этилацетатом. Неочищенную реакционную смесь концентрировали в вакууме, получая 670 мг (76%) 2-метил-пропан-2-сульфиновой кислоты 1-(1-метил-1H-имидазол-2-ил)-мет-(E)-илиденамида в виде масла. 1H ЯМР (300 МГц, CDCl3): δ 8.62 (s, 1H), 7.27 (bs, 1H), 7.08 (bs, 1H), 4.02 (s, 1H), 1.26 (s, 9H).
Стадия 2
2-Метил-пропан-2-сульфиновой кислоты [1-(1-метил-1H-имидазол-2-ил)-этил]-амид

В круглодонной колбе емкостью 250 мл объединяли 2-метил-пропан-2-сульфиновой кислоты 1-(1-метил-1H-имидазол-2-ил)-мет-(E)-илиденамид (670 мг; 3,14 ммоль) с THF, получая бесцветный раствор. Добавляли бромид метилмагния в эфире (3,0 М; 5,24 мл; 15,7 ммоль) при 0°C. Реакционную смесь перемешивали при 0°C в течение 2 ч. Реакционную смесь разбавляли насыщ. водн. NH4Cl. Водный слой повторно экстрагировали дихлорметаном (2×100 мл). Водный слой повторно экстрагировали EtOAc (1×125 мл). Неочищенную реакционную смесь концентрировали в вакууме, получая 700 мг (92%) 2-метил-пропан-2-сульфиновой кислоты [1-(1-метил-1H-имидазол-2-ил)-этил]-амида в виде единственного диастереомера. 1H ЯМР (300 МГц, DMSO-d6): δ 6.98 (bs, 1H), 6.82 (bs, 1H), 4.61 (q, 1H, J=6 Гц), 4.10 (bs, 1H), 1.61 (d, 1H, J=6 Гц), 1.29 (s, 9H).
Стадия 3
1-(1-Метил-1H-имидазол-2-ил)-этиламина дигидрохлорид
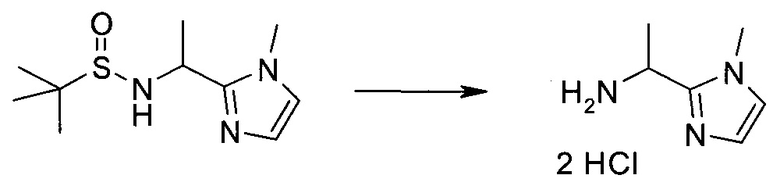
В круглодонной колбе емкостью 250 мл объединяли 2-метил-пропан-2-сульфиновой кислоты [1-(1-метил-1H-имидазол-2-ил)-этил]-амид (700 мг; 3,05 ммоль) с метанолом при 0°C, получая бесцветный раствор. Добавляли хлористый водород (4,0 М в 1,4-диоксане; 10 мл; 40,0 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 ч, затем концентрировали в вакууме, получая 1-(1-метил-1H-имидазол-2-ил)-этиламина дигидрохлорид. 1H ЯМР (300 МГц, DMSO-d6): δ 9.28 (bs, 1H), 7.67 (bs, 2H), 4.92 (bs, 1H), 3.93 (bd, 1H), 1.67 (bd, 3H).
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метил-1H-имидазол-2-ил)-этил]-амид
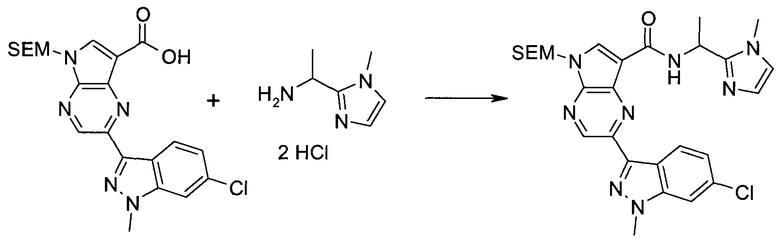
В сцинтилляционном флаконе емкостью 20 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (400 мг; 0,87 ммоль), 1-(1-метил-1H-имидазол-2-ил)-этиламина дигидрохлорид (219 мг; 1,75 ммоль), HBTU (431 мг; 1,14 ммоль), HOBt (153 мг; 1,14 ммоль) и DIPEA (0,31 мл; 1,75 ммоль) в DMF (6 мл), получая светло-желтый раствор. После перемешивания при комнатной температуре в течение ночи реакционную смесь разбавляли EtOAc (50 мл) и промывали насыщ. NaHCO3 (3×25 мл) и H2O (3×25 мл). Органический слой сушили над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 4 г; 0%-10% MeOH в DCM, содержащем 0,1% NH4OH), получая 300 мг (61%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метил-1H-имидазол-2-ил)-этил]-амида. MS: (M+H)+=566.
Стадия 5
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метил-1H-имидазол-2-ил)-этил]-амид
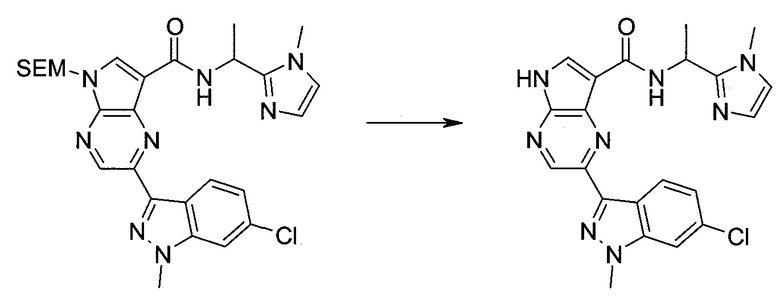
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метил-1H-имидазол-2-ил)-этил]-амид (300 мг; 0,531 моль) растворяли в растворе смеси 4:6 TFA:DCM (142 мл). После перемешивания при комнатной температуре в течение ночи летучие вещества удаляли при пониженном давлении. Затем неочищенное вещество растворяли в дихлорметане и обрабатывали этилендиамином (319 мг; 5,31 ммоль). После перемешивания при комнатной температуре в течение ночи осадок собирали фильтрованием, получая 100 мг (43%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метил-1H-имидазол-2-ил)-этил]-амида в виде желтого твердого вещества. MS: (M+H)+=435; 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 9.12 (s, 1H), 8.50-8.63 (m, 2H), 8.49-8.50 (m, 1H), 7.96 (d, J=1,51 Гц, 1H), 7.29 (dd, J=8,69; 1,51 Гц, 1H), 7.09 (s, 1H), 6.85 (s, 1H), 5.40-5.68 (m, 1H), 4.15 (s, 3H), 3.63-3.77 (m, 3H), 1.61 (d, J=6,80 Гц, 3H).
Пример 200
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1-метил-этил)-амид
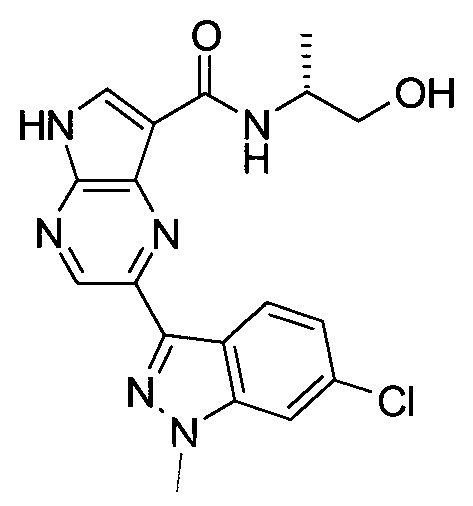
Стадия 1
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1-метил-этил)-амид
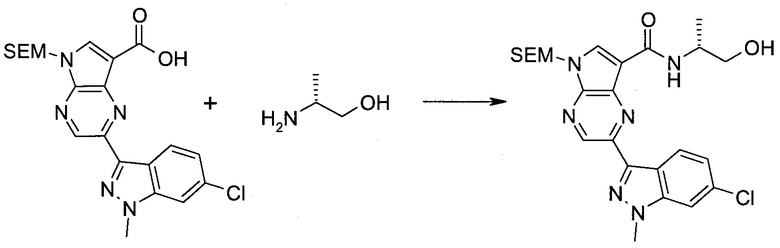
В сцинтилляционном флаконе емкостью 20 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (400 мг; 0,87 ммоль), D-аланинол (131 мг; 1,75 ммоль), HBTU (431 мг; 1,14 ммоль), HOBt (153 мг; 1,14 ммоль) и DIPEA (0,31 мл; 1,75 ммоль) в DMF (6 мл), получая светло-желтый раствор. После перемешивания при комнатной температуре в течение ночи реакционную смесь разбавляли EtOAc (50 мл) и промывали насыщ. NaHCO3 (3×25 мл) и H2O (3×25 мл). Органический слой сушили над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 4 г; 0%-10% MeOH в DCM, содержащем 0,1% NH4OH), получая 250 мг (56%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1-метил-этил)-амида в виде беловатого твердого вещества. MS: (M+H)+=516.
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1-метил-этил)-амид
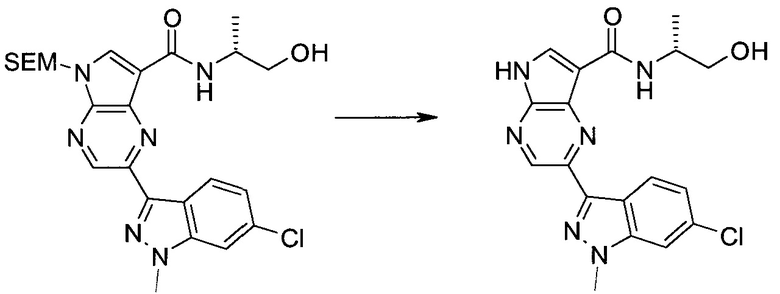
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1-метил-этил)-амид (35 мг; 0,068 моль) растворяли в растворе смеси 4:6 TFA:DCM (10 мл). После перемешивания при комнатной температуре в течение ночи летучие вещества удаляли при пониженном давлении. Затем неочищенное вещество растворяли в дихлорметане и обрабатывали этилендиамином (41 мг; 0,68 ммоль). После перемешивания при комнатной температуре в течение ночи
осадок собирали фильтрованием, получая 15 мг (57%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1-метил-этил)-амида в виде желтого твердого вещества. MS: (M+H)+=385; 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 8.97 (d, J=2,64 Гц, 1H), 8.66 (d, J=8,69 Гц, 1H), 8.36 (s, 1H), 8.15 (d, J=7,93 Гц, 1H), 7.92 (s, 1H), 7.26 (d, J=8,31 Гц, 1H), 3.96-4.39 (m, 3H), 3.31-3.68 (m, 1H), 1.25 (d, J=6,80 Гц, 3H).
Пример 201
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-2-гидрокси-1-метил-пропил)-амид
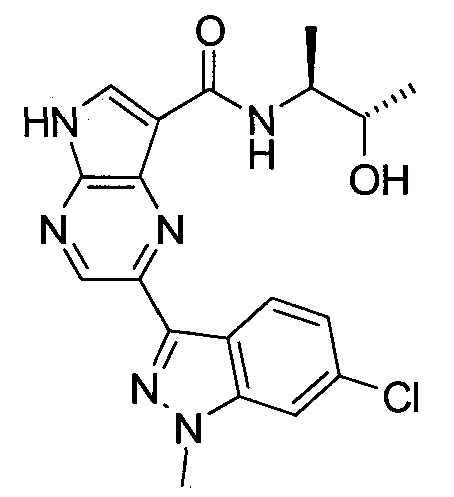
Стадия 1
транс-3-Амино-бутан-2-ол
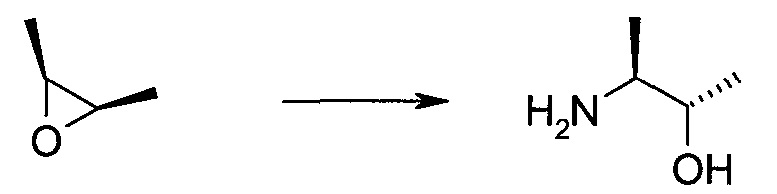
Во флакон емкостью 20 мл для микроволнового реактора добавляли аммиак (7,87 г; 10 мл; 462 ммоль), цис-2,3-диметилоксиран (1,0 г; 13,9 ммоль) и изопропиловый спирт (3 мл). Флакон закрывали и нагревали в микроволновом реакторе при 160°C в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель выпаривали, получая 1,24 г транс-3-амино-бутан-2-ола в виде бесцветного масла. 1H ЯМР (300 МГц, d6-DMSO): δ 4.36 (bs, 1H), 3.19 (q, 1H, J=12 Гц), 2.48 (m, 1H), 1.39 (bs, 2H), 0.97 (m, 3H), 0.86 (m, 3H).
Стадия 2
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-2-гидрокси-1-метил-пропил)-амид
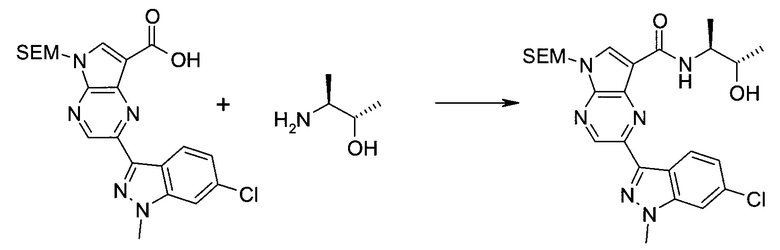
В сцинтилляционном флаконе емкостью 20 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (120 мг; 0,26 ммоль), транс-3-аминобутан-2-ол (47 мг; 0,524 ммоль), HBTU (129 мг; 0,341 ммоль), HOBt (46 мг; 0,341 ммоль) и DIPEA (169 мг; 1,31 ммоль) в DMF (1,8 мл), получая светло-желтый раствор. После перемешивания при комнатной температуре в течение ночи реакционную смесь разбавляли EtOAc (50 мл) и промывали насыщ. NaHCO3 (3×25 мл) и H2O (3×25 мл). Органический слой сушили над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 4 г; 0%-10% MeOH в DCM, содержащем 0,1% NH4OH), получая 127 мг (91%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-2-гидрокси-1-метил-пропил)-амида в виде беловатого твердого вещества. MS: (M+H)+=530.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-2-гидрокси-1-метил-пропил)-амид
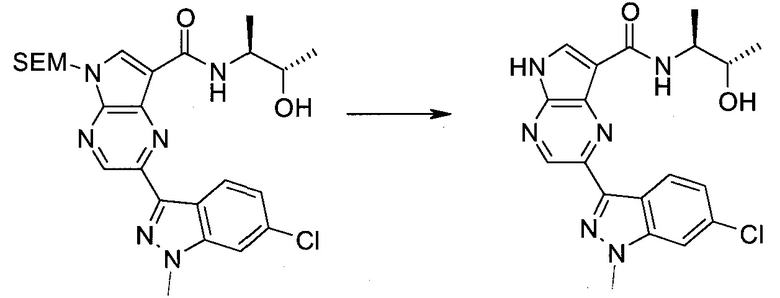
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-2-гидрокси-1-метил-пропил)-амид (120 мг; 0,227 моль) растворяли в растворе смеси 4:6 TFA:DCM (34 мл). После перемешивания при комнатной температуре в течение ночи летучие вещества удаляли при пониженном давлении. Затем неочищенное вещество растворяли в дихлорметане и обрабатывали этилендиамином (136 мг; 2,27 ммоль). После перемешивания при комнатной температуре в течение ночи
добавляли воду и полученный осадок собирали фильтрованием, получая 77 мг (85%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-2-гидрокси-1-метил-пропил)-амида в виде желтого твердого вещества. MS: (M+H)+=399. 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 12.65 (br. s., 1H), 9.13 (s, 1H), 8.76 (d, J=8,69 Гц, 1H), 8.40 (s, 1H), 8.10 (d, J=9,06 Гц, 1H), 7.94 (s, 5H), 7.32 (d, J=8,69 Гц, 1H), 5.16 (br. s., 1H), 4.01-4.30 (m, 4H), 3.81 (br. s., 1H), 1.26 (d, J=6,80 Гц, 3H), 1.09 (d, J=6,04 Гц, 3H).
Пример 202
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-фенокси-этил)-амид
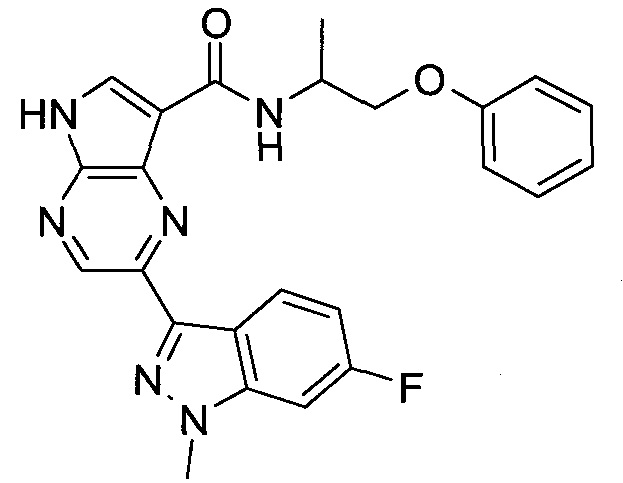
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-фенокси-этил)-амид
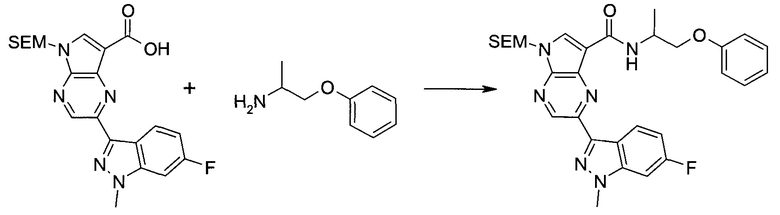
В круглодонной колбе емкостью 100 мл объединяли HBTU (78 мг; 0,21 ммоль), основание Хюнига (0,14 мл; 0,79 ммоль) и 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]-пиразин-7-карбоновую кислоту (70 мг; 0,16 ммоль) в DMF (3 мл), получая светло-желтый раствор. Добавляли 1-феноксипропан-2-амин (48 мг; 0,32 ммоль) и реакционную смесь перемешивали при 25°C в течение 16 ч. Реакционную смесь разбавляли EtOAc.Реакционную смесь выливали в 50 мл насыщ. NaHCO3 и экстрагировали EtOAc (2×50 мл). Органические слои объединяли и промывали водой (2×50 мл), затем сушили над MgSO4 и концентрировали в вакууме, получая 81 мг (89%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-
этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-фенокси-этил)-амида в виде белого твердого вещества. MS: (M+H)+=575.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-фенокси-этил)-амид
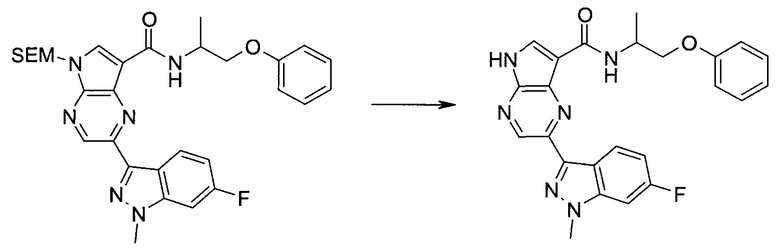
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-фенокси-этил)-амид (80 мг; 0,139 моль) растворяли в растворе смеси 4:6 TFA:DCM (6,5 мл). После перемешивания при комнатной температуре в течение ночи летучие вещества удаляли при пониженном давлении. Затем неочищенное вещество растворяли в дихлорметане и обрабатывали этилендиамином (837 мг; 13,9 ммоль). После перемешивания при комнатной температуре в течение ночи добавляли воду и полученный осадок собирали фильтрованием, получая 35 мг (57%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-фенокси-этил)-амида в виде желтого твердого вещества. MS: (M+H)+=445; 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 12.56 (s, 1H), 9.09 (s, 1H), 8.37-8.61 (m, 2H), 8.30 (d, J=7,93 Гц, 1H), 7.67 (d, J=7,93 Гц, 1H), 7.11-7.36 (m, 2H), 6.76-7.07 (m, 4H), 4.54 (br. s., 1H), 3.98-4.27 (m, 5H), 1.18-1.62 (m, 3H).
Пример 203
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-гидрокси-1-метил-2-(тетрагидро-пиран-4-ил)-этил]-амид (диастереомер A)
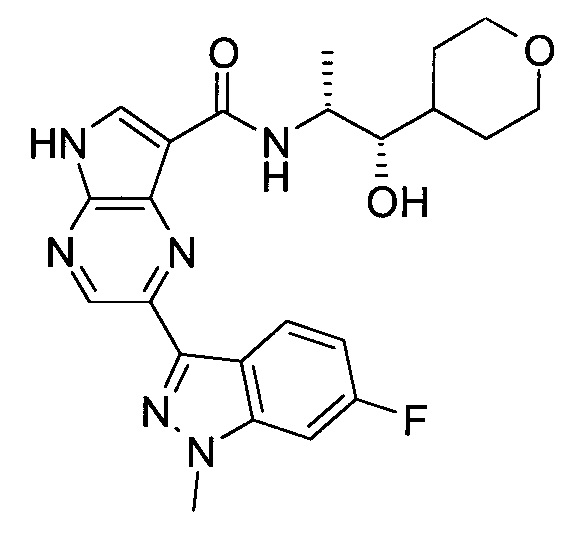
Стадия 1
2-Нитро-1-(тетрагидро-пиран-4-ил)-пропан-1-ол
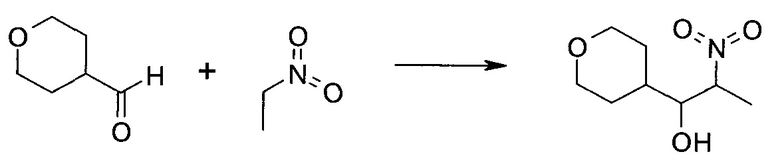
В круглодонной колбе емкостью 100 мл объединяли нитроэтан (1,42 мл; 26,3 ммоль) и тетрагидро-2H-пиран-4-карбальдегид (1,0 г; 8,76 ммоль) в THF (5 мл) и трет-бутаноле, получая бесцветный раствор. Добавляли трет-бутилат калия (197 мг; 1,75 ммоль) при комнатной температуре. Через 30 мин выдерживания при комнатной температуре реакционную смесь разбавляли EtOAc и водой. Органическую фазу отделяли, сушили и упаривали, получая 1,3 г (79%) неочищенного 2-нитро-1-(тетрагидро-пиран-4-ил)-пропан-1-ола в виде бесцветного масла. 1H ЯМР (300 МГц, CDCl3) δ млн-1 4.74 (quin, J=6,61 Гц, 1H), 4.61 (qd, J=6,80; 3,02 Гц, 1H), 3.91-4.10 (m, 7H), 3.60 (t, J=5,48 Гц, 1H), 3.28-3.54 (m, 3H), 2.20-2.28 (m, 3H), 1.89-2.00 (m, 4H), 1.11-1.74 (m, 16H).
Стадия 2
2-Амино-1-(тетрагидро-пиран-4-ил)-пропан-1-ол
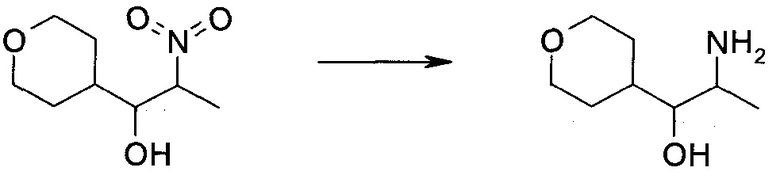
2-Нитро-1-(тетрагидро-пиран-4-ил)-пропан-1-ол (1,3 г; 6,87 ммоль) растворяли в этаноле (55 мл) и обрабатывали палладием на угле (0,2 г) при давлении водорода 1 атм. После перемешивания при комнатной температуре в течение ночи палладий отфильтровывали и растворитель удаляли при пониженном давлении, получая 1,0 г (91%) 2-амино-1-(тетрагидро-пиран-4-ил)-пропан-1-ола. MS: (M+H)+=160.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-гидрокси-1-метил-2-(тетрагидро-пиран-4-ил)-этил]-амид (диастереомер A и диастереомер B)
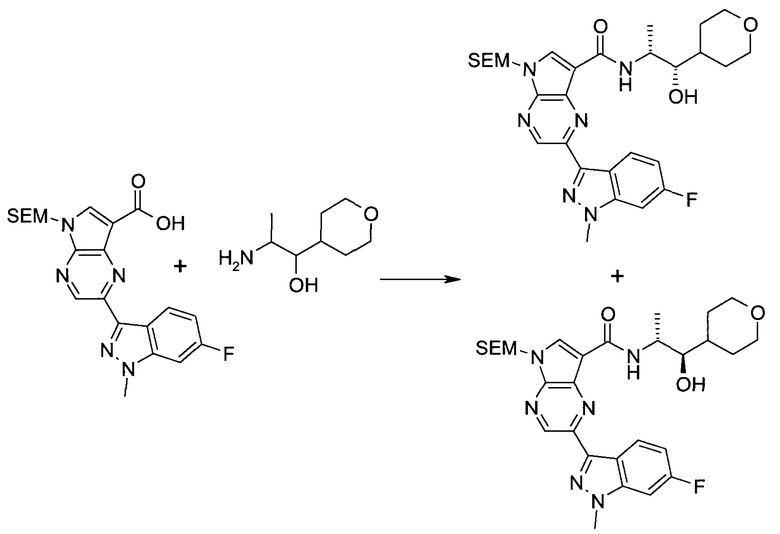
В круглодонной колбе емкостью 100 мл объединяли HBTU (112 мг; 0,29 ммоль), основание Хюнига (0,20 мл; 1,13 ммоль) и 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (100 мг; 0,23 ммоль) в DMF (3,0 мл), получая светло-желтый раствор. Добавляли 2-амино-1-(тетрагидро-2H-пиран-4-ил)пропан-1-ол (72 мг; 0,45 ммоль) и реакционную смесь перемешивали при 25°C в течение 16 ч. Реакционную смесь разбавляли EtOAc. Реакционную смесь выливали в 50 мл насыщ. NaHCO3 и экстрагировали EtOAc (2×50 мл). Органические слои объединяли и промывали H2O (2×50 мл), затем сушили над MgSO4 и концентрировали в вакууме, получая неочищенное вещество. Продукт очищали флэш-хроматографией (силикагель, 80 г; 20%-50% EtOAc в гексанах), получая 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-гидрокси-1-метил-2-(тетрагидро-пиран-4-ил)-этил]-амид в виде двух отдельных диастереомеров (произвольно определенных). Диастереомер A (30 мг; 22%) в виде белого порошка: 1H ЯМР (300 МГц, CDCl3) δ млн-1 9.20 (m, 1H), 8.68 (dd, J=8,69; 5,29 Гц, 1H), 8.41 (d, J=9,44 Гц, 1H), 8.27 (s, 1H), 6.96-7.13 (m, 2H), 5.70 (s, 2H), 4.54-4.67 (m, 1H), 4.06-4.20 (m, 4H), 3.87-4.04 (m, 2H), 3.56-3.65 (m, 2H), 3.42 (d, J=6,80 Гц, 1H), 3.21-3.39 (m, 2H), 2.53 (d, J=4,15 Гц, 1H), 1.85 (d, J=12,84 Гц, 2H), 1.76 (ddd, J=11,52; 7,93; 3,97 Гц, 1H), 1.33-1.56 (m, 5H), 0.75-1.04 (m, 2H), -0.05 (s, 9H). Диастереомер B (70 мг; 53%) в виде белого порошка: 1H ЯМР (300 МГц, CDCl3) δ млн-1 9.21 (s, 1H), 8.42-8.61 (m, 2H), 8.27 (s, 1H), 6.96-7.15 (m, 2H), 5.51-5.76 (m, 2H), 4.40-4.64 (m,
1H), 3.93-4.24 (m, 3H), 3.62-3.83 (m, 2H), 3.50-3.62 (m, 2H), 3.26-3.50 (m, 2H), 2.70 (d, J=5.29 Гц, 1H), 1.92-2.10 (m, 2H), 1.14-1.84 (m, 5H), 0.67-1.07 (m, 2H), -0.33-0.16 (m, 9H).
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-гидрокси-1-метил-2-(тетрагидро-пиран-4-ил)-этил]-амид (диастереомер A)
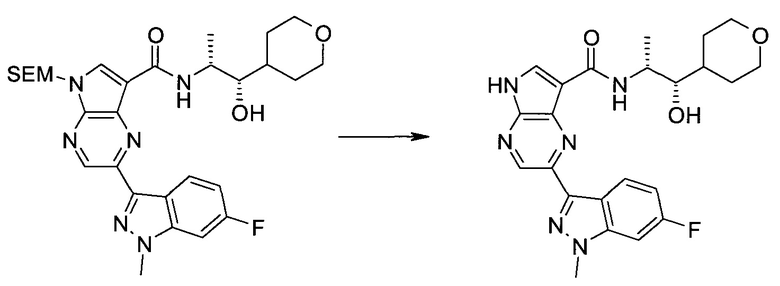
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-гидрокси-1-метил-2-(тетрагидро-пиран-4-ил)-этил]-амид, диастереомер A (26 мг; 0,034 ммоль) растворяли в растворе смеси 4:6 TFA:DCM (5,7 мл). После перемешивания при комнатной температуре в течение ночи летучие вещества удаляли при пониженном давлении. Затем неочищенное вещество растворяли в дихлорметане и обрабатывали этилендиамином (206 мг; 3,43 ммоль). После перемешивания при комнатной температуре в течение ночи добавляли воду и полученный осадок собирали фильтрованием, получая 13 мг (83%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-гидрокси-1-метил-2-(тетрагидро-пиран-4-ил)-этил]-амида (диастереомера A) в виде беловатого твердого вещества. MS: (M+H)+=453. 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 12.79 (br. s., 1H), 9.15 (s, 1H), 8.85 (dd, J=8,88; 5,48 Гц, 1H), 8.40 (s, 1H), 8.13 (d, J=9,44 Гц, 1H), 7.56-7.78 (m, 1H), 7.11-7.37 (m, 1H), 5.49 (d, J=5,67 Гц, 1H), 4.34-4.53 (m, 1H), 4.13 (s, 3H), 3.80 (d, J=10,58 Гц, 2H), 3.18-3.28 (m, 1H), 3.11 (t, J=11,14 Гц, 2H), 1.66-1.89 (m, 2H), 1.42-1.66 (m, 1H), 1.10-1.36 (m, 5H).
Пример 204
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-гидрокси-1-метил-2-(тетрагидро-пиран-4-ил)-этил]-амид (диастереомер B)
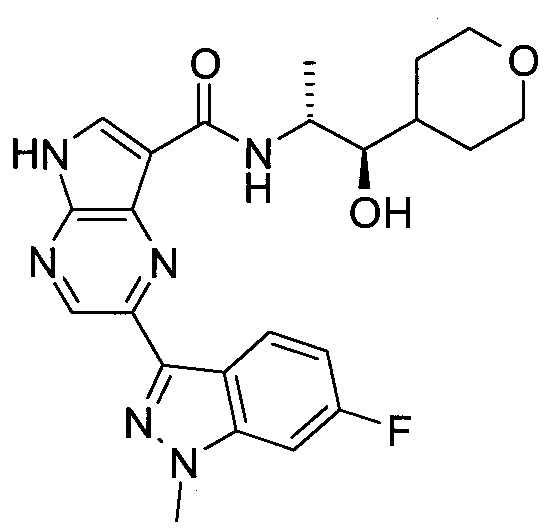
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-гидрокси-1-метил-2-(тетрагидро-пиран-4-ил)-этил]-амид, диастереомер B, (70 мг; 0,120 ммоль) растворяли в растворе смеси 4:6 TFA:DCM (5,7 мл). После перемешивания при комнатной температуре в течение ночи летучие вещества удаляли при пониженном давлении. Затем неочищенное вещество растворяли в дихлорметане и обрабатывали этилендиамином (722 мг; 12 ммоль). После перемешивания при комнатной температуре в течение ночи добавляли воду и полученный осадок собирали фильтрованием, получая 30 мг (55%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-гидрокси-1-метил-2-(тетрагидро-пиран-4-ил)-этил]-амида (диастереомера B) в виде беловатого твердого вещества. MS: (M+H)+=453. 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 12.73 (br. s., 1H), 8.99-9.30 (m, 1H), 8.70 (dd, J=9,06; 5,29 Гц, 1H), 8.22-8.48 (m, 1H), 7.65 (dd, J=9,82; 1,89 Гц, 2H), 6.94-7.22 (m, 1H), 4.97 (d, J=6,80 Гц, 1H), 4.35 (m, 1H), 4.2 (s, 1H), 3.71 (m, 2H), 1.87 (d, J=13,60 Гц, 1H), 1.43-1.77 (m, 2H), 0.97-1.43 (m, 5H).
Пример 205
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-3-циано-1-метил-пропил)-амид
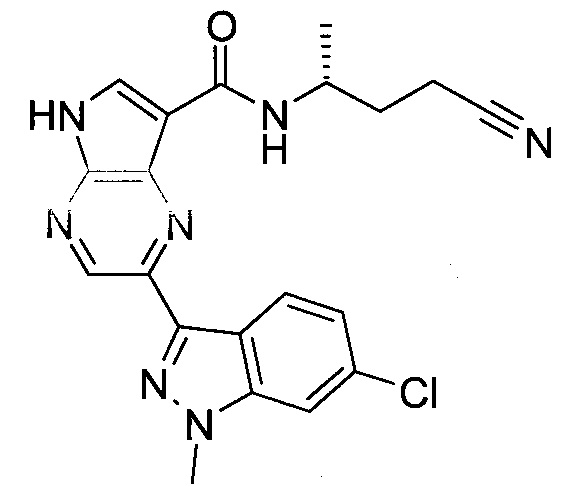
Стадия 1
((R)-3-Циано-1-метил-аллил)-карбаминовой кислоты трет-бутиловый эфир
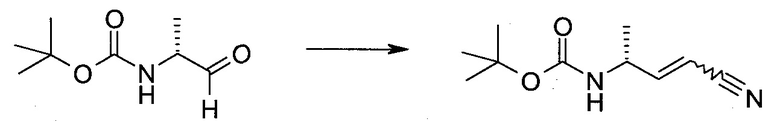
В сцинтилляционном флаконе емкостью 20 мл смешивали ((R)-1-метил-2-оксо-этил)-карбаминовой кислоты трет-бутиловый эфир (2,5 г; 14,4 ммоль) и (трифенилфосфоранилиден)ацетонитрил (6,52 г; 21,7 ммоль) в дихлорметане (20 мл) и перемешивали при комнатной температуре в течение 16 ч. Растворитель выпаривали, получая неочищенное вещество, которое очищали колоночной хроматографией (силикагель, градиент н-гексаны/этилацетат), получая 1,8 г (63%) ((R)-3-циано-1-метил-аллил)-карбаминовой кислоты трет-бутилового эфира с диастереоселективностью 3:1 (E:Z) в виде бесцветного масла. 1H ЯМР (300 МГц, CDCl3) δ млн-1 6.38-6.79 (m, 1H), 5.47 (dd, J=16,24; 1,89 Гц, 1H), 4.48 (bs, 1H), 4.47 (bs, 1H), 1.45 (s, 1H), 1.28 (d, J=7,18 Гц, 9H).
Стадия 2
((R)-3-Циано-1-метил-пропил)-карбаминовой кислоты трет-бутиловый эфир
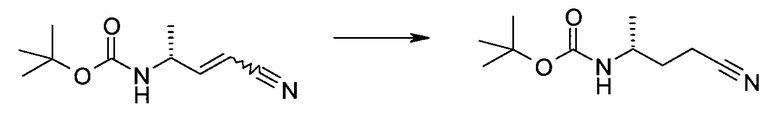
В круглодонной колбе емкостью 250 мл объединяли палладий на угле (150 мг) и смесь олефинов с соотношением E:Z, равным 3:1, т.е. ((R)-3-циано-1-метил-аллил)-карбаминовой кислоты трет-бутилового эфира (375 мг; 1,91 ммоль) в этаноле, получая черную суспензию. Реакционную смесь перемешивали при 25°C в течение 16 ч в атмосфере водорода с использованием баллона. Реакционную смесь фильтровали через целит. Неочищенную реакционную смесь концентрировали в вакууме, получая 250 мг (66%) ((R)-3-циано-1-метил-пропил)-карбаминовой кислоты трет-бутилового эфира в виде бесцветного масла, которое использовали без дополнительной очистки. 1H ЯМР (300 МГц, CDCl3) δ млн-1 4.30-4.65 (m, 1H), 3.52-3.81 (m, 1H), 2.28 (m, 1H), 2.72 (m, 1H), 1.58-1.97 (m, 1H), 1.04-1.24 (m, 3H).
Стадия 3
(R)-4-Аминопентаннитрилатрифторацетат
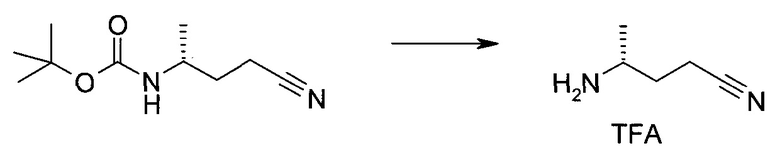
В круглодонной колбе емкостью 100 мл объединяли ((R)-3-циано-1-метил-пропил)-карбаминовой кислоты трет-бутиловый эфир (158 мг; 0,80 ммоль) c TFA (2 мл) и дихлорметаном (8 мл), получая бесцветный раствор. Реакционную смесь перемешивали при 25°C в течение 15 ч. Растворитель выпаривали, получая 53 мг (68%) (R)-4-аминопентаннитрила трифторацетата, который использовали на следующей стадии без дополнительной очистки.
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-3-циано-1-метил-пропил)-амид
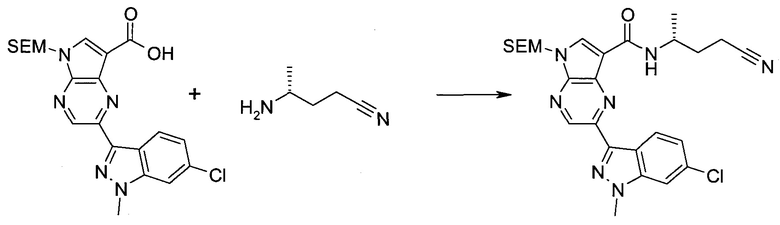
В сцинтилляционном флаконе емкостью 20 мл объединяли 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (120 мг; 0,26 ммоль), (R)-4-аминопентаннитрила трифторацетат (51 мг; 0,524 ммоль), HBTU (129 мг; 0,341 ммоль), HOBt (46 мг; 0,341 ммоль) и DIPEA (169 мг; 1,31 ммоль) в DMF (1,8 мл), получая светло-желтый раствор. После перемешивания при комнатной температуре в течение ночи реакционную смесь разбавляли EtOAc (50 мл) и промывали насыщ. NaHCO3 (3×25 мл) и H2O (3×25 мл). Органический слой сушили над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 4 г; 0%-10% MeOH в DCM, содержащем 0,1% NKtOH), получая 99 мг (70%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-3-циано-1-метил-пропил)-амида в виде беловатого твердого вещества. MS: (M+H)+=539.
Стадия 5
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-3-циано-1-метил-пропил)-амид
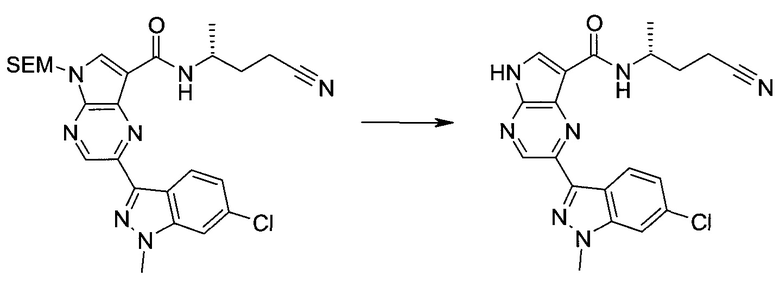
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-3-циано-1-метил-пропил)-амид (120 мг; 0,223 ммоль) растворяли в растворе смеси 4:6 TFA:DCM (57 мл). После перемешивания при комнатной температуре в течение ночи летучие вещества удаляли при пониженном давлении. Затем неочищенное вещество растворяли в дихлорметане и обрабатывали этилендиамином (134 мг; 2,23 ммоль). После перемешивания при комнатной температуре в течение ночи добавляли воду и полученный осадок собирали фильтрованием, получая 45 мг (49%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-3-циано-1-метил-пропил)-амида в виде желтого твердого вещества. MS: (M+H)+=408. 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 12.81 (br. s., 1H), 8.88-9.14 (m, 1H), 8.35-8.51 (m, 1H), 7.93-8.10 (m, 2H), 7.35 (dd, J=8,69; 1,89 Гц, 1H), 4.08-4.36 (m, 4H), 2.61 (t, J=7,36 Гц, 2H), 1.76-2.02 (m, 2H), 1.32 (d, J=6,80 Гц, 3H).
Пример 206
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2-циано-циклопропил)-этил]-амид (диастереомер A)
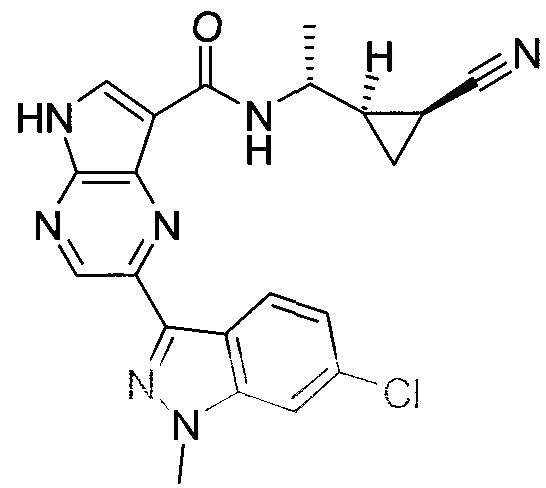
Стадия 1
[(R)-1-(2-Циано-циклопропил)-этил]-карбаминовой кислоты трет-бутиловый эфир (диастереомер A и диастереомер B)
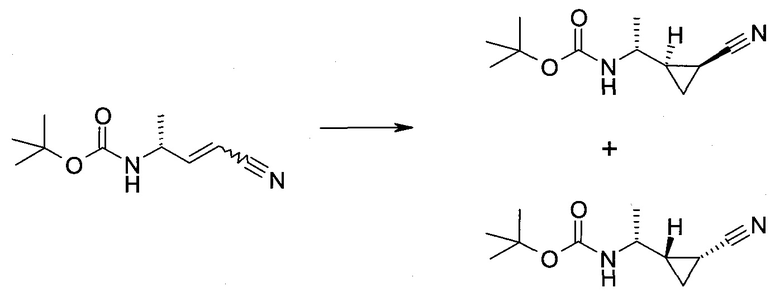
Добавляли DMSO к триметилсульфонийиодиду (1,79 г; 8,15 ммоль) и гидриду натрия (60%-ному в минеральном масле; 326 мг; 8,15 ммоль) при 0°C. Затем добавляли смесь E:Z (3:1) ((R)-3-циано-1-метил-аллил)-карбаминовой кислоты трет-бутилового эфира (0,4 г; 2,04 ммоль) в DMSO. Реакционную смесь оставляли нагреваться до комнатной температуры в течение ночи. Реакционную смесь перемешивали при комнатной температуре в течение 2 суток, затем разбавляли водой и этилацетатом. Органические слои сушили над MgSO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 80 г; 20%-50% EtOAc в гексанах), получая [(R)-1-(2-циано-циклопропил)-этил]-карбаминовой кислоты трет-бутиловый эфир в виде двух отдельных диастереомеров (произвольно определенных). Диастереомер A (250 мг; 58%) в виде бесцветного масла; MS: (M+H)+=211. Диастереомер B (130 мг; 30%) в виде белого порошка; M+Na)+=233.
Стадия 2
2-((R)-1-Амино-этил)-циклопропанкарбонитрила трифторацетат (диастереомер A)
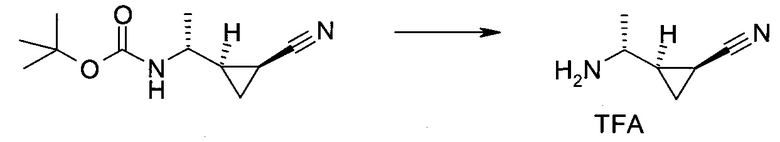
В круглодонной колбе емкостью 100 мл растворяли [(R)-1-(2-циано-циклопропил)-этил]-карбаминовой кислоты трет-бутиловый эфир, диастереомер A, (250 мг; 1,19 ммоль) в TFA (2 мл) и дихлорметане (8 мл). Реакционную смесь перемешивали при 25°C в течение 15 ч и летучие вещества удаляли при пониженном давлении, получая 2-((R)-1-амино-этил)-циклопропанкарбонитрила трифторацетат (диастереомер A), который использовали на следующей стадии без дополнительной очистки.
Стадия 3
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2-циано-циклопропил)-этил]-амид (диастереомер A)
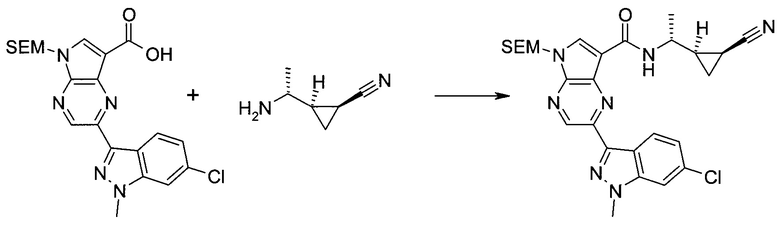
2-((R)-1-Амино-этил)-циклопропанкарбонитрила трифторацетат, диастереомер A, (неочищенный со стадии 2) обрабатывали 1-гидрокси-бензотриазолом (153 мг; 1,14 ммоль), 2-(1H-бензо[d][1,2,3]триазол-1-ил)-1,1,3,3-тетраметилизоурония гексафторфосфатом(V) (662 мг; 1,75 ммоль), DIPEA (0,76 мл; 4,37 ммоль), 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислотой (400 мг; 0,87 ммоль) и DMF (6,0 мл), получая светло-желтый раствор. После перемешивания при комнатной температуре в течение ночи реакционную смесь разбавляли этилацетатом и водой. Органические слои сушили над MgSO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 40 г; градиент: EtOAc в гептане), получая 210 мг (44%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2-циано-циклопропил)-этил]-амида (диастереомера A) в виде бесцветного масла. MS: (M+H)+=551.
Стадия 4
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2-циано-циклопропил)-этил]-амид (диастереомер A)
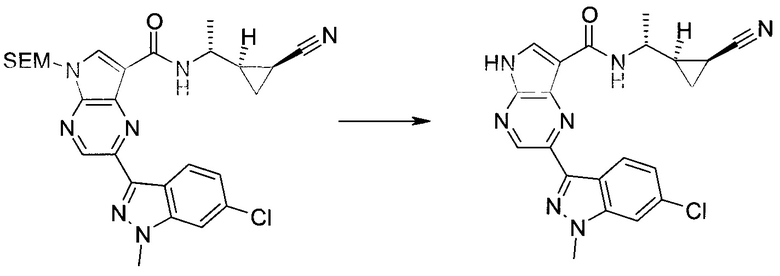
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2-циано-циклопропил)-этил]-амид, диастереомер A, (210 мг; 0,382 ммоль) растворяли в растворе смеси
4:6 TFA:DCM (57 мл). После перемешивания при комнатной температуре в течение ночи летучие вещества удаляли при пониженном давлении. Затем неочищенное вещество растворяли в дихлорметане и обрабатывали этилендиамином (229 мг; 3,82 ммоль). После перемешивания при комнатной температуре в течение ночи добавляли воду и полученный осадок собирали фильтрованием, получая 140 мг (87%) 2-(6-хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2-циано-циклопропил)-этил]-амида (диастереомера A) в виде светло-желтого твердого вещества. MS: (M+H)+=420. 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 9.70 (bs, 1H) 9.08 (s, 4H), 8.32-8.58 (m, 2H), 8.13 (dd, J=12,27; 8,12 Гц, 1H), 7.98 (s, 1H), 7.24-7.44 (m, 1H), 4.16 (s, 3H), 3.80 (d, J=5,29 Гц, 1H), 1.61-1.96 (m, 2H), 1.40 (m, 3H), 0.98-1.30 (m, 2H).
Пример 207.
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2-циано-циклопропил)-этил]-амид (диастереомер B)
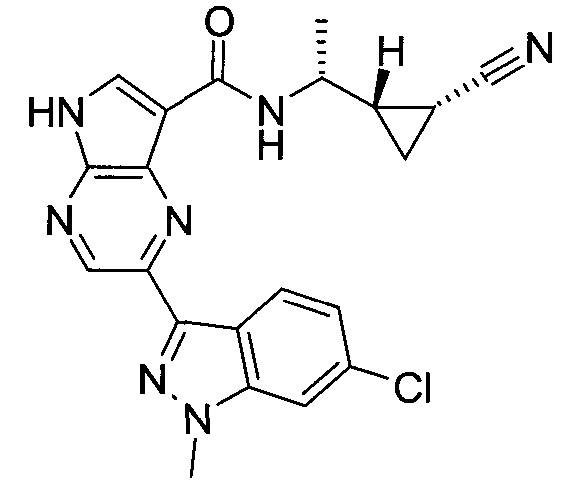
Получали в соответствии с методикой, приведенной в примере 206, стадии 2-4, заменяя [(R)-1-(2-циано-циклопропил)-этил]-карбаминовой кислоты трет-бутиловый эфир, диастереомер B, на [(R)-1-(2-циано-циклопропил)-этил]-карбаминовой кислоты трет-бутиловый эфир, диастереомер A, на стадии 2. Продукт выделяли в виде светло-желтого твердого вещества. MS: (M+H)+=420 (M+H)+. 1H ЯМР (300 МГц, DMSO-d6) δ млн-1 9.10 (s, 1H), 8.40-8.52 (m, 2H), 8.32 (d, J=7,93 Гц, 1H), 7.99 (s, 1H), 7.35 (d, J=8,69 Гц, 1H), 4.06-4.22 (m, 3H), 3.80 (d, J=9,82 Гц, 1H), 1.92-2,10 (m, 1H), 1.56-1.73 (m, 1H), 1.49 (d, J=6,80 Гц, 3H), 0.94-1.35 (m, 2H).
Пример 208
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(4-бром-фенил)-циклопропил]-амид
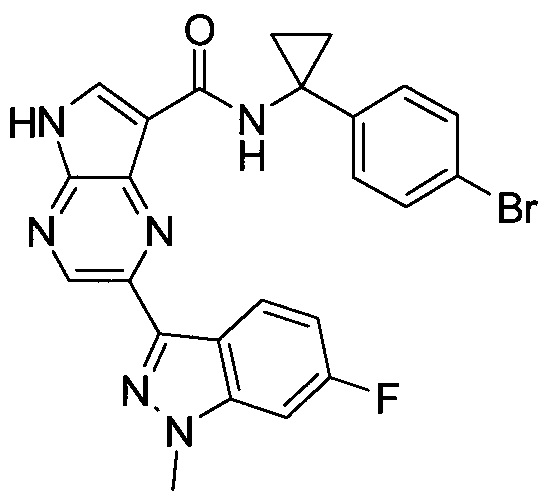
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(4-бром-фенил)-циклопропил]-амид
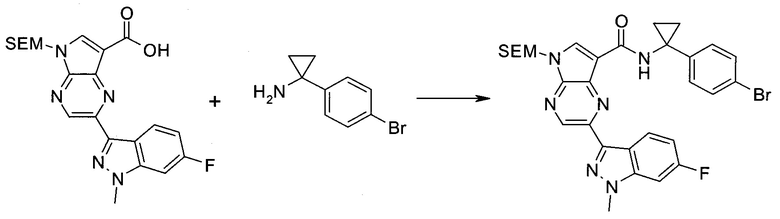
К перемешиваемой суспензии 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (150 мг; 0,34 ммоль) в DMF (5 мл) при комнатной температуре в атмосфере азота добавляли HATU (258 мг; 0,68 ммоль) и 1-(4-бром-фенил)-циклопропанамин (108 мг; 0,51 ммоль), затем DIPEA (0,24 мл; 1,36 ммоль). Полученный светло-желтый раствор перемешивали в течение 15 ч, после чего TLC-анализ (гекс.:EA, 1:1, Rf=0,5) показал наличие нового пятна. Затем реакционную смесь разбавляли водой и органическое соединение экстрагировали в EtOAc (3×25 мл). Объединенные экстракты промывали раствором рассола и затем сушили над безводным MgSO4. После фильтрования для удаления сушильного агента и концентрирования фильтрата получали неочищенный продукт, который очищали колоночной хроматографией ISCO (40 г), элюируя смесью EtOAc в гексанах (0-60%) в течение 10 минут. Желаемые фракции объединяли и растворитель удаляли под вакуумом, получая 197 мг (91%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(4-бром-фенил)-циклопропил]-амида в виде беловатого твердого вещества.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(4-бром-фенил)-циклопропил]-амид
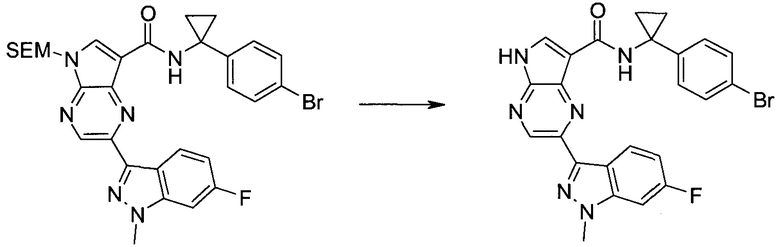
К перемешиваемому раствору 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(4-бром-фенил)-циклопропил]-амида (50 мг; 0,078 ммоль) в THF (3 мл) добавляли раствор TBAF (1,0 М в THF; 1,18 мл; 1,18 ммоль) при комнатной температуре. Полученный светло-коричневый раствор нагревали до 85°C и перемешивали в течение 3 ч, после чего TLC-анализ (EA, Rf=0,3) показал отсутствие исходного вещества. Затем реакционную смесь охлаждали до комнатной температуры и добавляли 3 мл ацетона и 9 мл насыщенного раствора бикарбоната натрия и полученную суспензию перемешивали в течение 1 ч. Реакционную суспензию разбавляли водой и органическое соединение экстрагировали в EtOAc (3×25 мл), объединенные экстракты промывали раствором рассола и сушили над MgSO4. После фильтрования от сушильного агента и удаления растворителя под вакуумом получали неочищенное твердое вещество, которое растворяли в ацетонитриле с нагреванием. Полученный зеленоватый раствор хранили в холодильнике в течение 15 ч и твердые вещества собирали фильтрованием и промывали ацетонитрилом. После сушки на воздухе выделяли 25 мг (63%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(4-бром-фенил)-циклопропил]-амида в виде беловатого твердого вещества. LC-MS (M+H)+=507; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.91 (s, 1H), 9.11 (s, 1H), 8.99 (s, 1H), 8.52 (s, 1H), 8.39-8.51 (m, 1H), 7.68 (dd, J=9,7; 1,9 Гц, 1H), 7.47 (d, J=8,5 Гц, 2H), 7.27 (d, J=8,5 Гц, 2H), 7.14 (td, J=9,0; 2,0 Гц, 1H), 4.14 (s, 3H), 1.44 (s, 4H).
Пример 209
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(3-бром-фенил)-циклобутил]-амид
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(3-бром-фенил)-циклобутил]-амид
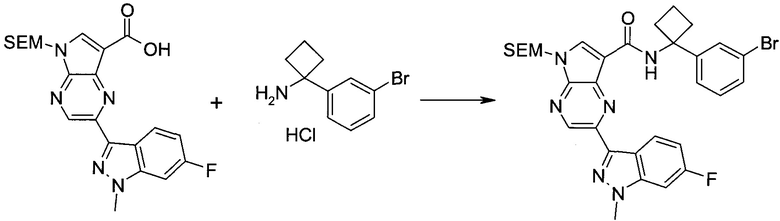
К перемешиваемой суспензии 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (200 мг; 0,45 ммоль) в DMF (5 мл) при комнатной температуре в атмосфере азота добавляли HATU (344 мг; 0,91 ммоль) и 1-(3-бром-фенил)-циклобутанамина гидрохлорид (178 мг; 0,68 ммоль), затем DIPEA (0,40 мл; 2,26 ммоль). Полученный светло-желтый раствор перемешивали в течение 15 ч, после чего TLC-анализ (гекс.:EA, 1:1, Rf=0,5) показал наличие нового пятна. Затем реакционную смесь разбавляли водой и органическое соединение экстрагировали в EtOAc (3×25 мл). Объединенные экстракты промывали раствором рассола и затем сушили над безводным MgSO4. После фильтрования для удаления сушильного агента и концентрирования фильтрата получали неочищенный продукт, который очищали колоночной хроматографией ISCO (40 г), элюируя смесью EtOAc в гексанах (0-60%) в течение 10 минут. Желаемые фракции объединяли и растворитель удаляли под вакуумом, получая 234 мг (80%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(3-бром-фенил)-циклобутил]-амида в виде светло-коричневого твердого вещества.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(3-бром-фенил)-циклобутил]-амид
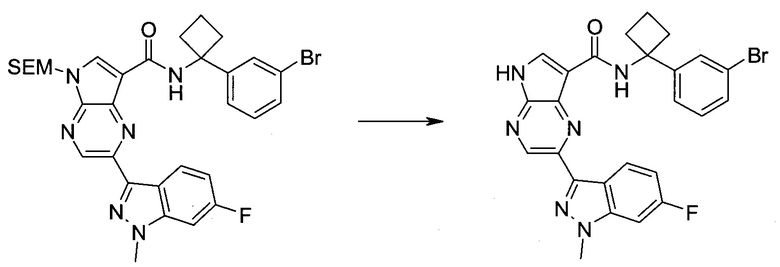
К светло-коричневому раствору 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(3-бром-фенил)-циклобутил]-амида (50 мг; 0,077 ммоль) в дихлорметане (3 мл) при комнатной температуре в атмосфере азота добавляли избыток TFA (1,2 мл; 15,4 ммоль). Полученный светло-коричневый раствор перемешивали в течение 4 ч, после чего TLC-анализ (EA, Rf=0.35) показал отсутствие исходного вещества. Затем растворитель удаляли под вакуумом и остаток азеотропно отгоняли с толуолом, получая светло-коричневое твердое вещество. Затем это твердое вещество обрабатывали взятым в избытке триэтиламином (1,07 мл; 7,7 ммоль) в метаноле (3 мл) при комнатной температуре в атмосфере азота. Полученную суспензию перемешивали в течение 15 ч и затем растворитель удаляли под вакуумом. Остаток растирали с ацетонитрилом, твердые вещества собирали фильтрованием и промывали ацетонитрилом. После сушки на воздухе выделяли 15 мг (38%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(3-бром-фенил)-циклобутил]-амида в виде светло-желтого твердого вещества. LC-MS (M+H)+=519; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.80 (br. s., 1H), 9.10 (s, 1H), 8.77 (s, 1H), 8.55 (dd, J=8,8; 5,5 Гц, 1H), 8.36 (s, 1H), 7.64-7.80 (m, 2H), 7.57 (d, J=7,8 Гц, 1H), 7.41 (d, J=7,8 Гц, 1H), 7.23-7.35 (m, 1H), 7.15 (t, J=8,2 Гц, 1H), 4.15 (s, 3H), 2.56-2.81 (m, 4H), 2.19 (d, J=8,5 Гц, 1H), 1.96 (d, J=8,3 Гц, 1H).
Пример 210
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(4-бром-фенил)-циклобутил]-амид
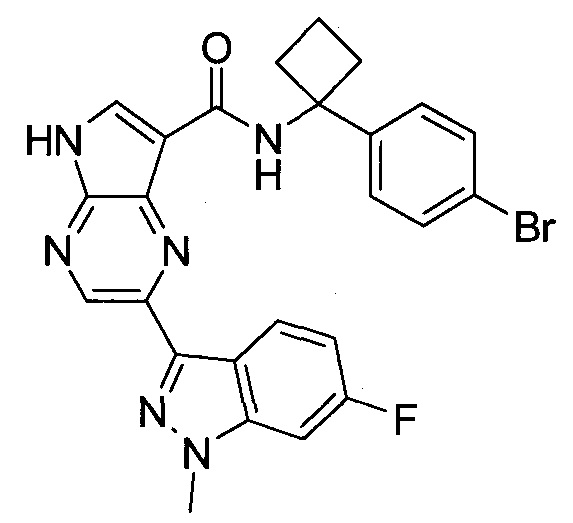
Получали в соответствии с методикой, приведенной в примере 209, заменяя 1-(4-бром-фенил)-циклобутанамина гидрохлорид на 1-(3-бром-фенил)-циклобутанамина гидрохлорид на стадии 1. LC-MS (M+H)+=519; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.87 (br. s., 1H), 9.10 (s, 1H), 8.76 (s, 1H), 8.48 (dd, J=8,5; 5,3 Гц, 1H), 8.35 (s, 1H), 7.69 (d, J=9,3 Гц, 1H), 7.52 (s, 4H), 7.13 (t, J=8,5 Гц, 1H), 4.15 (s, 3H), 2.68 (t, J=7,4 Гц, 4H), 2.17 (d, J=7,8 Гц, 1H), 1.85-2.03 (m, 1H).
Пример 211
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-бром-фенил)-2,2,2-трифтор-этил]-амид
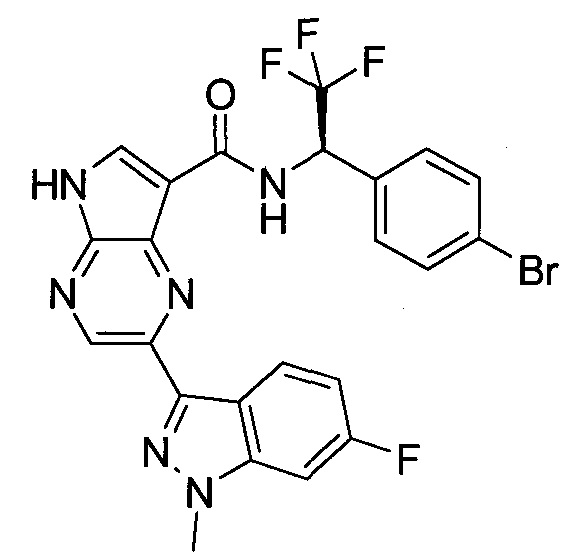
Получали в соответствии с методикой, приведенной в примере 209, заменяя (R)-1-(4-бром-фенил)-2,2,2-трифторэтанамин на 1-(3-бром-фенил)-циклобутанамина гидрохлорид на стадии 1. LC-MS (M+H)+=547; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.87 (br. s., 1H), 8.81-9.13 (m, 2H), 8.47 (s, 1H), 8.21-8.36 (m, 1H), 7.34-7.69 (m, 4H), 6.88 (t, J=8,4 Гц, 1H), 6.08-6.27 (m, 1H), 5.63 (s, 1H), 4.03 (s, 3H).
Пример 212
2-(5,6-Дифтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
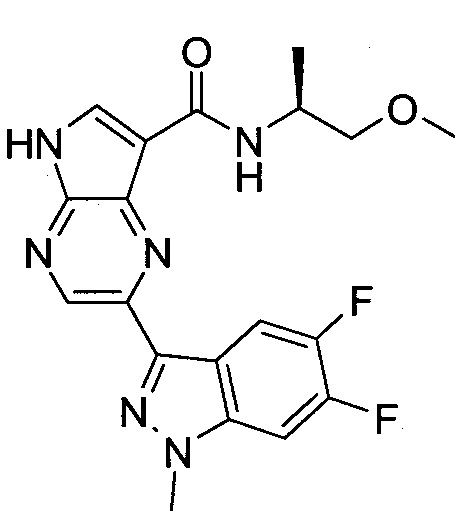
Стадия 1
3-Бром-5,6-дифтор-1-метил-1H-индазол
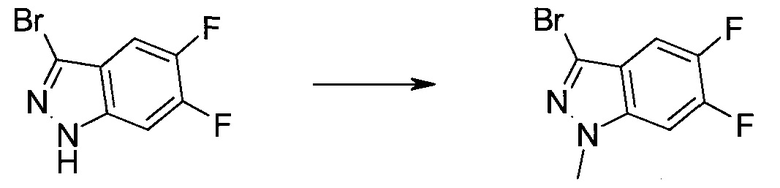
К светло-коричневой суспензии 3-бром-5,6-дифтор-1H-индазола (1,0 г; 4,29 ммоль) и карбоната калия (4,15 г; 30,0 ммоль) в N-метилпирролидине (20 мл) добавляли иодметан (0,81 мл; 12,9 ммоль) при комнатной температуре. Полученный темно-коричневый раствор перемешивали в течение 15 ч при комнатной температуре в атмосфере азота, после чего TLC (2:1, гекс.:EA, Rf=0,6 для основного и 0,4 для минорного) показала наличие желаемого соединения. Реакционную смесь разбавляли водой (примерно 100 мл), органическое соединение экстрагировали этилацетатом (3×50 мл) и объединенные экстракты промывали рассолом раствор. После сушки над MgSO4 фильтрат концентрировали до получения неочищенного светло-коричневого твердого вещества, которое очищали хроматографией на колонке ISCO (80 г) с элюированием гексанами (1 мин), 0-15% EA в гексанах (2 мин), 15-40% EA в гексанах (15 мин), получая 746 мг (70%) 3-бром-5,6-дифтор-1-метил-1H-индазола в виде белого твердого вещества и 186 мг (18%) 3-бром-5,6-дифтор-2-метил-2H-индазола в виде светло-желтого твердого вещества.
Стадия 2
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
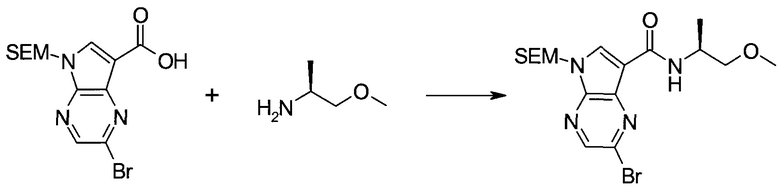
К смеси 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2,0 г; 5,37 ммоль), (S)-1-метоксипропан-2-амина (718 мг; 8,06 ммоль) и HATU (4,09 г; 10,7 ммоль) добавляли DMF (20 мл) и DIPEA (3,75 мл; 21,5 ммоль) при комнатной температуре в атмосфере азота. Полученный раствор перемешивали в течение 15 ч при комнатной температуре, после чего LCMS-анализ и TLC-система (1:1, гекс.:EA, Rf=0,4) показали наличие желаемого соединения. Реакционную смесь разбавляли водой (примерно 100 мл), органическое соединение экстрагировали этилацетатом (3×50 мл) и объединенные экстракты промывали раствором рассола. После сушки над MgSO4 фильтрат концентрировали до получения неочищенного светло-коричневого твердого вещества (примерно 4,1 г), которое очищали хроматографией на колонке ISCO (120 г) с элюированием гексанами (1 мин), 0-30% EA в гексанах (2 мин), 30-60% EA в гексанах (15 мин), получая 1,9 г (80%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде белого твердого вещества.
Стадия 3
2-(5,6-Дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
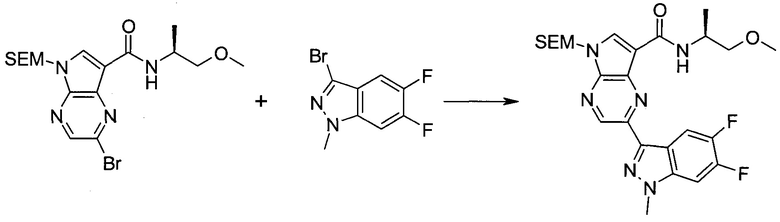
К бесцветному раствору 3-бром-5,6-дифтор-1-метил-1H-индазола (247 мг; 1,00 ммоль) в THF (3 мл; перегнанном) при -5°C (лед/ацетон) по каплям добавляли раствор хлорида изопропилмагния (2,0 М в THF; 0,715 мл; 1,43 ммоль) в течение 3-5 мин. Полученный очень светло-желтый раствор перемешивали в течение 2 ч при 0°C, после чего TLC-анализ (гекс.:EA, 2:1, Rf=0,5 для нового пятна, Rf=0,65 для SM (starting material - исходное вещество) гидролизованной аликвоты показал наличие более полярного пятна, но исходное вещество также присутствовало. Прозрачный светло-желтый раствор оставляли медленно нагреваться до комнатной температуры. За это время образовывалась желтая суспензия, которую перемешивали в течение еще 3 ч до полного завершения
реакции. Затем к этой желтой суспензии при комнатной температуре добавляли раствор хлорида цинка (273 мг; 2,0 ммоль) (безводный ZnCl2 нагревали, используя струйный сушильный аппарат, для расплавления под высоким вакуумом и затем охлаждали до комнатной температуры, после чего растворяли в THF) в THF (3 мл). Полученную светло-желтую суспензию перемешивали в течение 10 мин.
В отдельную одногорлую круглодонную колбу емкостью 25 мл загружали бис-(дибензилидинацетон)-палладий (29 мг; 0,050 ммоль) и три-орто-толилфосфин (61 мг; 0,20 ммоль) и колбу продували газообразным азотом. Добавляли THF (1 мл) и полученную светло-коричневую суспензию перемешивали в течение 5 мин, после чего добавляли раствор 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида (111 мг; 0,25 ммоль) в THF (2 мл) при комнатной температуре в атмосфере азота. Затем к этой смеси добавляли полученную выше желтую цинк-содержащую суспензию. В процессе добавления раствор приобретал светло-коричневую окраску, затем его нагревали до 60°C и перемешивали в течение 15 ч, после чего TLC-анализ (гекс.:EA, 1:1, Rf=0,5 и 0,55 для SM) гидролизованной реакционной смеси показал наличие нового пятна. Реакционную смесь охлаждали до комнатной температуры и разбавляли насыщенным раствором хлорида аммония и EtOAc. Эти два слоя разделяли и водный слой экстрагировали EtOAc. Объединенные органические экстракты промывали раствором рассола и сушили над безводным MgSO4. После фильтрования для удаления сушильного агента и концентрирования фильтрата получали неочищенный продукт, который очищали хроматографией, используя колонку ISCO (40 г) и элюируя гексанами (1 мин), 0-25% EA в гексанах (2 мин), 25-60% EA в гексанах (10 мин), 60-100% EA в гексанах (2 мин) и чистым EA (5 мин). Желаемые фракции объединяли и растворитель удаляли под вакуумом, получая 57 мг (43%) 2-(5,6-дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде светло-коричневого твердого вещества.
Стадия 4
2-(5,6-Дифтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
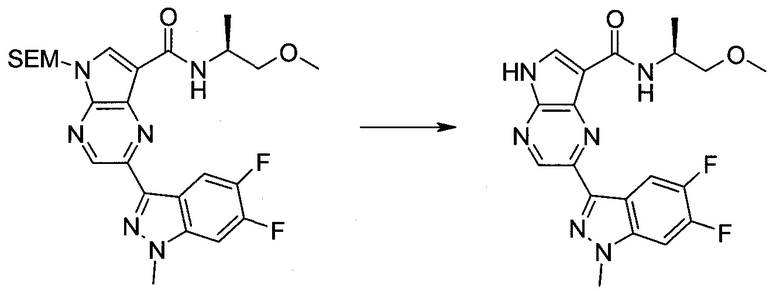
К перемешиваемому раствору 2-(5,6-дифтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((3)-2-метокси-1-метил-этил)-амида (52 мг; 0,098 ммоль) в THF (3 мл) добавляли раствор TBAF (1,0 М в THF; 1,96 мл; 1,96 ммоль) при комнатной температуре. Полученный светло-коричневый раствор нагревали до 85°C и перемешивали в течение 3 ч, после чего TLC-анализ (EA, Rf=0,3) показал отсутствие исходного вещества. Затем реакционную смесь охлаждали до комнатной температуры и добавляли 3 мл ацетона и 9 мл насыщенного раствора бикарбоната натрия и полученную суспензию перемешивали в течение 2 ч. Реакционную суспензию разбавляли водой и органическое соединение экстрагировали в EtOAc (3×), объединенные экстракты промывали водой и раствором рассола, затем сушили над MgSO4. После фильтрования от сушильного агента и удаления растворителя под вакуумом получали неочищенный продукт, который растворяли в горячем ацетонитриле. Добавляли EtOAc и раствор хранили в холодильнике в течение 15 ч. Полученное твердое вещество собирали фильтрованием, промывали ацетонитрилом и сушили на воздухе, получая 15 мг беловатого твердого вещества. Маточную жидкость очищали хроматографией на колонке ISCO (40 г) с элюированием дихлорметаном (1 мин), смесью 0-100% (10% метанола в дихлорметане) в дихлорметане (5 мин) и 10%-ным метанолом в дихлорметане (5 мин), получая еще 10 мг светло-желтого твердого вещества. В общем выделяли 25 мг (64%) 2-(5,6-дифтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида. LC-MS (M+H)+=401; т.пл. = 295-297°C; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.87 (br. s., 1H), 9.09 (s, 1H), 8.44 (s, 1H), 8.34 (dd,J=10,2; 7,9 Гц, 1H), 8.12 (d, J=8,5 Гц, 1H), 8.00 (dd, J=10,7; 6,7 Гц, 1H), 4.27-4.48 (m, 1H), 4.16 (s, 3H), 3.42-3.57 (m, 2H), 3.32 (br. s., 3H), 1.33 (d, J=6,8 Гц, 3H).
Пример 213
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-бензил-пирролидин-3-ил)-амид
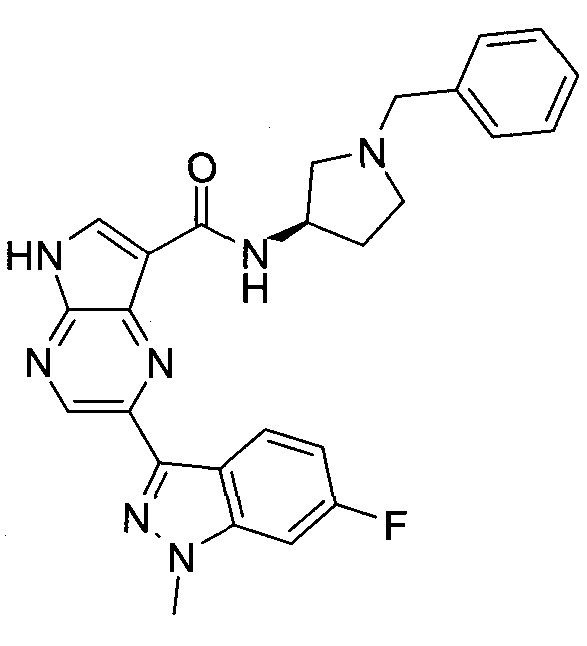
Стадия 1
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-бензил-пирролидин-3-ил)-амид
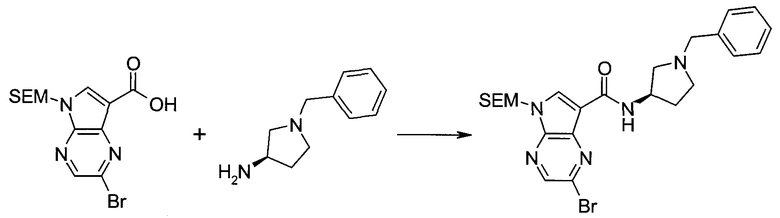
В круглодонной колбе емкостью 100 мл объединяли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (1,0 г; 2,69 ммоль) с дихлорметаном (3 мл), получая желтый раствор. Добавляли (R)-1-бензилпирролидин-3-амин (710 мг; 4,03 ммоль) и затем DIEA (1,88 мл; 10,7 ммоль). К прозрачному раствору добавляли HATU (2,04 г; 5,37 ммоль) и к этой смеси добавляли DMF (4 мл). Реакционную смесь перемешивали в атмосфере азота в течение ночи, затем концентрировали и распределяли между водой (100 мл) и EtOAc (100 мл). Водный слой промывали EtOAc (50 мл), затем объединенные органические слои промывали рассолом, сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт растворяли в EtOAc, наносили на силикагель и очищали флэш-хроматографией (120 г Silicycle) с использованием от 0% до 100% EtOAc в гексанах. Соответствующие фракции объединяли и концентрировали, получая 1,38 г (97%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-бензил-пирролидин-3-ил)-амида в виде прозрачного вязкого полутвердого вещества с легким красно-коричневым оттенком. LC-MS (M+H)+=530.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-бензил-пирролидин-3-ил)-амид
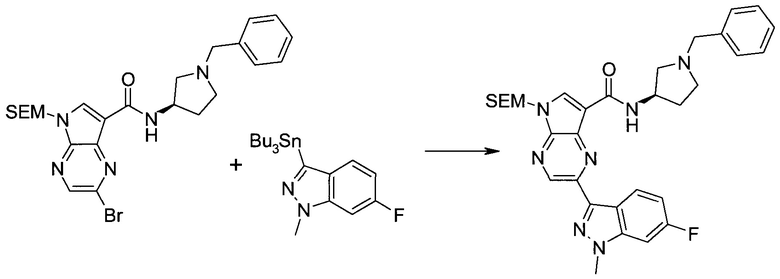
Во флакон емкостью 40 мл, содержащий 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-бензил-пирролидин-3-ил)-амид (1,32 г; 2,49 ммоль), добавляли раствор 6-фтор-1-метил-3-трибутилстаннил-1H-индазола (1,20 г; 2,73 ммоль) в DMF (25 мл). Флакон заполняли азотом и добавляли тетракис(трифенилфосфин)палладий(0) (159 мг; 0,14 ммоль) и иодид меди(I) (107 мг; 0,56 ммоль). Флакон снова заполняли азотом, затем герметично закрывали и реакционную смесь перемешивали в термоблоке при 80°C в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры разбавляли смесью EtOAc/гексаны (100/30 мл) и промывали водой (100 мл). Водный слой экстрагировали смесью EtOAc/гексаны (100/30 мл). Объединенные органические слои промывали рассолом, затем сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали флэш-хроматографией (120 г Analogix) с использованием 20%-100% EtOAc в гексанах. Соответствующие фракции объединяли и концентрировали, получая 1,02 г (62%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-бензил-пирролидин-3-ил)-амида в виде светло-желтого твердого вещества. LC-MS (M+H)+=600.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-бензил-пирролидин-3-ил)-амид
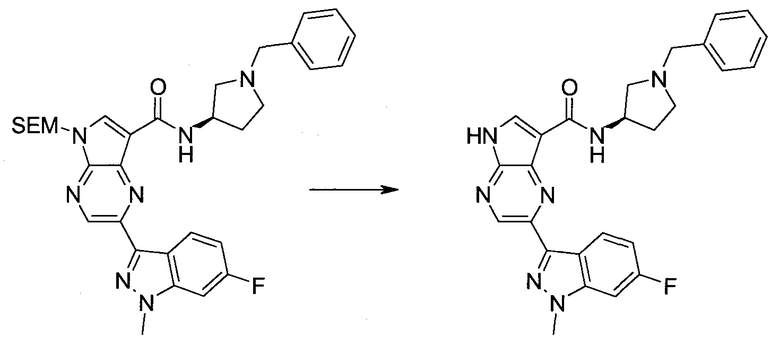
Во флакон емкостью 20 мл, содержащий 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-бензил-пирролидин-3-ил)-амид (51 мг; 0,085 ммоль), растворенный в THF (1 мл), добавляли TBAF (1,0 М в THF; 1,0 мл; 1,0 ммоль). Флакон заполняли азотом, затем герметично закрывали и помещали в термоблок при 80°C на 3 ч. Реакционную смесь охлаждали до комнатной температуры, гасили ацетоном (2 мл) и насыщ. NaHCO3 (20 мл). Смесь перемешивали в течение 1 ч, затем экстрагировали EtOAc и органические экстракты промывали рассолом. Водный слой снова экстрагировали EtOAc и органические экстракты промывали рассолом. Органические экстракты объединяли, сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт растворяли в MeOH и EtOAc, наносили на целит и очищали флэш-хроматографией (4 г Silicycle) с использованием от 0%-10% MeOH в дихлорметане до 10% MeOH в EtOAc. Соответствующие фракции объединяли и концентрировали. Твердое вещество растирали с дихлорметаном, Et2O и гексанами, получая 11 мг (29%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-бензил-пирролидин-3-ил)-амида в виде белого твердого вещества. LC-MS (M+H)+=470; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.87 (br. s., 1H), 9.10 (s, 1H), 8.34-8.54 (m, 3H), 7.68 (dd, J=9,8; 1,8 Гц, 1H), 7.11-7.26 (m, 5H), 6.97 (td, J=9,1; 1,9 Гц, 1H), 4.60 (br. s., 1H), 4.16 (s, 3H), 3.61 (s, 2H), 2.82-2.97 (m, 1H), 2.58-2.75 (m, 2H), 2.29-2.44 (m, 2H), 1.75 (br. s., 1H).
Пример 214
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-цианометил-пирролидин-3-ил)-амид
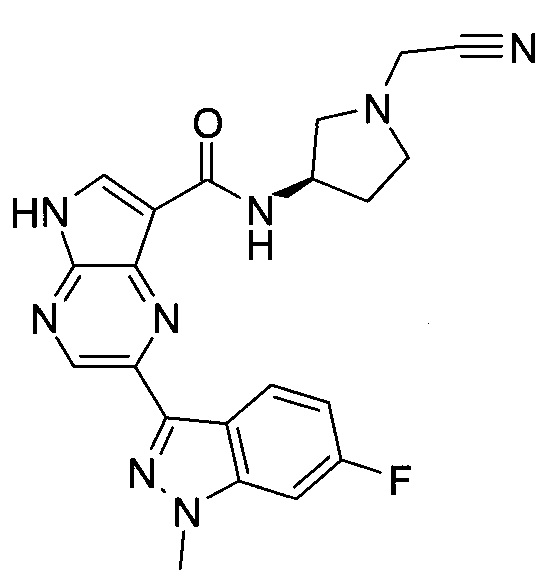
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (R)-пирролидин-3-иламид
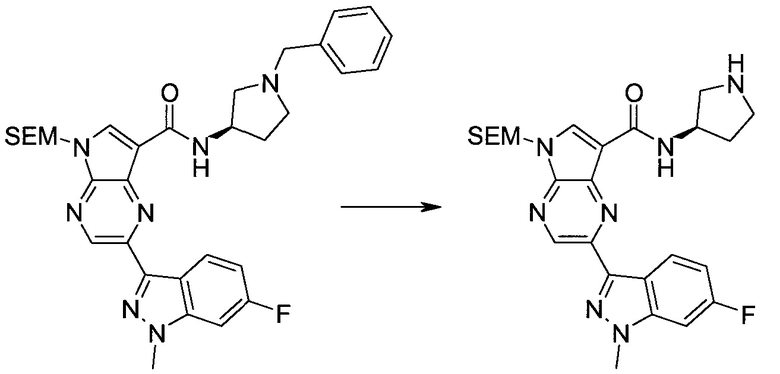
В круглодонную колбу емкостью 100 мл, содержащую 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-бензил-пирролидин-3-ил)-амид (530 мг; 0,88 ммоль) и "протонную губку" (proton sponge) (132 мг; 0,62 ммоль), добавляли 1,2-дихлорэтан (20 мл). Прозрачный раствор перемешивали в атмосфере азота и охлаждали в ледяной бане в течение 10 мин. К нему добавляли 1-хлорэтилхлорформиат (0,19 мл; 1,77 ммоль). Реакционную смесь перемешивали в ледяной бане в течение 5 мин, баню удаляли и реакционную смесь нагревали до комнатной температуры в течение 20 мин. Реакционную смесь помещали в масляную баню и нагревали при 85°C в течение 4 ч, затем оставляли охлаждаться до комнатной температуры в течение ночи и концентрировали. Остаток суспендировали в метаноле (20 мл) и нагревали при температуре дефлегмации в течение 3 ч, затем извлекали из нагревательного устройства и оставляли охлаждаться до комнатной температуры. В процессе охлаждения некоторое количество продукта выпадало в осадок, и его отфильтровывали и промывали метанолом. Остальной продукт извлекали из маточной жидкости. Жидкость концентрировали, суспендировали в этилацетате и промывали водным бикарбонатом натрия. Водный раствор с твердыми веществами четыре раза
экстрагировали дихлорметаном. Органические слои объединяли и промывали рассолом (100 мл), сушили над сульфатом магния, фильтровали, концентрировали и сушили из смеси этилацетата и гексанов. Неочищенный продукт суспендировали в кипящем этилацетате (20 мл), охлаждали, фильтровали и промывали этилацетатом и гексанами, получая 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-Ь]пиразин-7-карбоновой кислоты (R)-пирролидин-3-иламид в виде белого твердого вещества. Это вещество объединяли с продуктом, выпавшим в осадок из реакционной смеси, и использовали без дополнительной очистки. LC-MS: (M+H)+=510.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-цианометил-пирролидин-3-ил)-амид
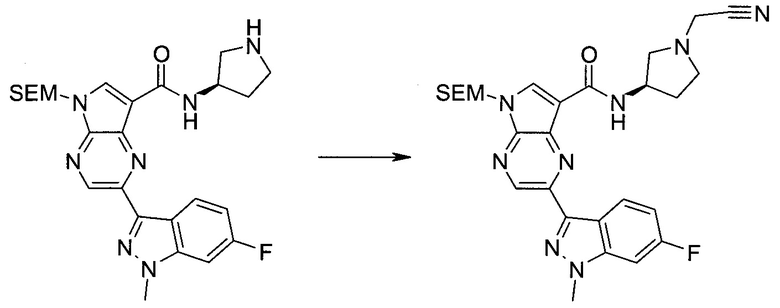
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (R)-пирролидин-3-иламид со стадии 1 растворяли в дихлорметане с добавлением триэтиламина и бром-ацетонитрила. Реакционную смесь концентрировали и сушили из смесей дихлорметана и гексанов. Неочищенный продукт растворяли в смеси дихлорметана, тетрагидрофурана и метанола, наносили на силикагель и очищали флэш-хроматографией (4 г Silicycle) с использованием 0%-10% MeOH в дихлорметане (0,5% Et3N). Соответствующие фракции объединяли и концентрировали. Полученное твердое вещество растирали с Et2O и гексанами. Твердое вещество отбрасывали, а маточную жидкость концентрировали, получая 220 мг (45%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-цианометил-пирролидин-3-ил)-амида в виде белого твердого вещества (выход 45%). LC-MS (M+H)+=549.
Стадия 3
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-цианометил-пирролидин-3-ил)-амид
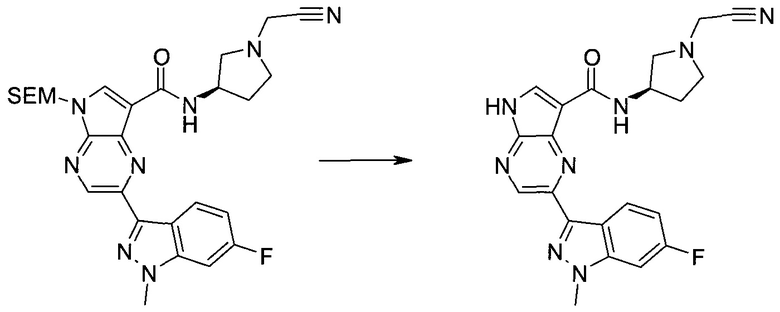
В круглодонную колбу емкостью 100 мл, содержащую 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-цианометил-пирролидин-3-ил)-амид (216 мг; 0,394 ммоль), суспендированный в THF (5 мл), добавляли TBAF (1,0 М в THF; 5,0 мл; 5,0 ммоль). Флакон заполняли азотом, затем герметично закрывали и нагревали в масляной бане при 85°C в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры, гасили ацетоном (5 мл) и насыщ. NaHCO3 (10 мл). Смесь перемешивали в течение 1 ч, затем разбавляли водой и экстрагировали EtOAc. Добавляли рассол и водный слой дважды экстрагировали EtOAc. Объединенные органические экстракты промывали водой и рассолом, затем сушили над MgSO4, фильтровали и концентрировали. Неочищенное твердое вещество растирали с Et2O, EtOAc и гексанами, получая 54 мг (33%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-цианометил-пирролидин-3-ил)-амида в виде белого твердого вещества. LC-MS (M+H)+=419; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.87 (br. s., 1H), 9.10 (s, 1H), 8.39-8.52 (m, 2H), 8.31 (d, J=7,8 Гц, 1H), 7.63-7.73 (m, 1H), 7.18-7.31 (m, 1H), 4.64 (br. s., 1H), 4.14 (s, 3H), 3.81-4.05 (m, 2H), 2.97 (td, J=8,6; 4,6 Гц, 1H), 2.86 (dd, J=9,2; 6,7 Гц, 1H), 2.72 (dd, J=9,3; 3,5 Гц, 1H), 2.52-2.62 (m, 1H), 2.36-2.45 (m, 1H), 1.70-1.85 (m, 1H).
Пример 215
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-бром-фенил)-этил]-амид
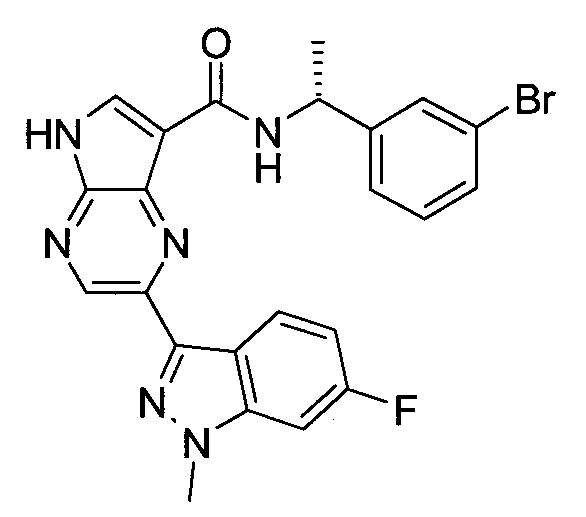
Получали в соответствии с методикой, приведенной в примере 208, заменяя (R)-1-(3-бромфенил)этанамин на 1-(4-бром-фенил)-циклопропанамин на стадии 1. LC-MS (M+H)+=493/495; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.91 (br. s., 1H), 9.11 (s, 1H), 8.31-8.59 (m, 3H), 7.60-7.75 (m, 2H), 7.46 (t, J=6,5 Гц, 2H), 7.24-7.37 (m, 1H), 7.03 (td, J=9,0; 2,0 Гц, 1H), 5.30 (quin, J=7,0 Гц, 1H), 4.15 (s, 3H), 1.64 (d, J=7,0 Гц, 3H).
Пример 216
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-бром-фенил)-этил]-амид
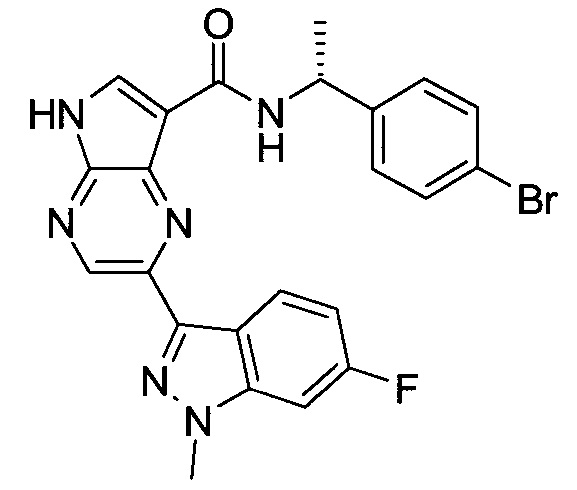
Получали в соответствии с методикой, приведенной в примере 208, заменяя (R)-1-(4-бромфенил)этанамин на 1-(4-бром-фенил)-циклопропанамин на стадии 1. LC-MS (M+H)+=493/495; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.90 (br. s., 1H), 9.10 (s, 1H), 8.41-8.54 (m, 2H), 8.28 (dd, J=8,9; 5,4 Гц, 1H), 7.68 (dd, J=9,8; 2,0 Гц, 1H), 7.53 (d, J=8,5 Гц, 2H), 7.42 (d, J=8,3 Гц, 2H), 6.98 (td, J=9,1; 2,1 Гц, 1H), 5.28 (quin, J=7,0 Гц, 1H), 4.14 (s, 3H), 1.62 (d, J=6,8 Гц, 3H).
Пример 217
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-циано-фенил)-этил]-амид
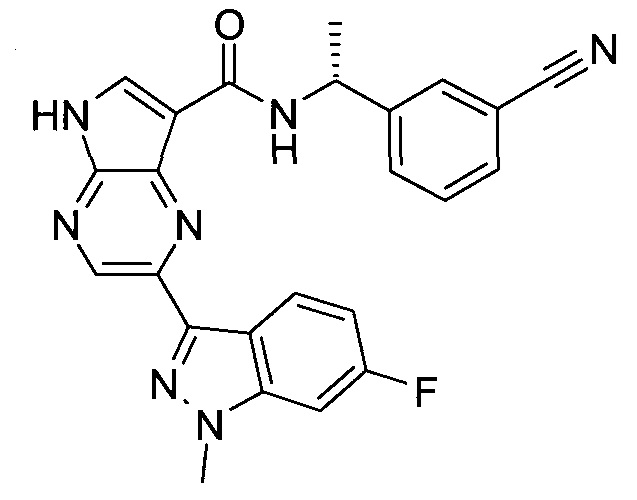
Получали в соответствии с методикой, приведенной в примере 208, заменяя (R)-1-(3-цианофенил)этанамин на 1-(4-бром-фенил)-циклопропанамин на стадии 1. LC-MS (M+H)+=440; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.91 (br. s., 1H), 9.11 (s, 1H), 8.54 (d, J=7,3 Гц, 1H), 8.35-8.49 (m, 2H), 7.94 (s, 1H), 7.80 (d, J=7,8 Гц, 1H), 7.65-7.76 (m, 2H), 7.48-7.61 (m, 1H), 7.05 (t, J=8,0 Гц, 1H), 5.32 (t, J=6,9 Гц, 1H), 4.15 (s, 3H), 1.66 (d, J=7,0 Гц, 3H).
Пример 218
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-фенил)-этил]-амид
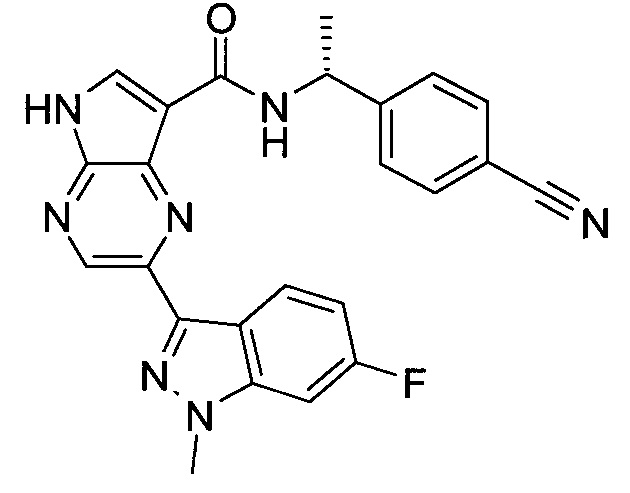
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-фенил)-этил]-амид
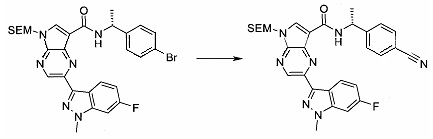
Во флакон емкостью 20 мл для микроволнового реактора добавляли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-бром-фенил)-этил]-амид
(62 мг; 0,10 ммоль), цианид меди(I) (18 мг; 0,20 ммоль) и N-метил-пирролидинон (6 мл) (квалификации "для HPLC", высушенный с использованием 4Ǻ порошкообразных молекулярных сит). Полученный раствор продували азотом, затем флакон герметично закрывали и нагревали в масляной бане при 200°C. Через 2,5 ч реакционную смесь оставляли охлаждаться до комнатной температуры в течение 17 ч. Реакционную смесь распределяли в двух флаконах и содержимое каждого независимо подвергали нагреванию в микроволновом реакторе при 200-230°C в течение 2,5 ч. Реакционные смеси объединяли, разбавляли водой (50 мл) и два раза экстрагировали этилацетатом (50 мл) (для очистки фаз добавляли 5 мл рассола). Органические слои промывали рассолом (25 мл), объединяли, сушили над сульфатом магния, фильтровали и далее сушили в токе азота. Неочищенное коричневое твердое вещество очищали флэш-хроматографией (4 г Silicycle) с использованием 0%-60% EtOAc в гексанах. Соответствующие фракции объединяли и сушили из смеси дихлорметана и гексанов, получая 32 мг (56%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-фенил)-этил]-амида в виде светло-желтого твердого вещества.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-фенил)-этил]-амид
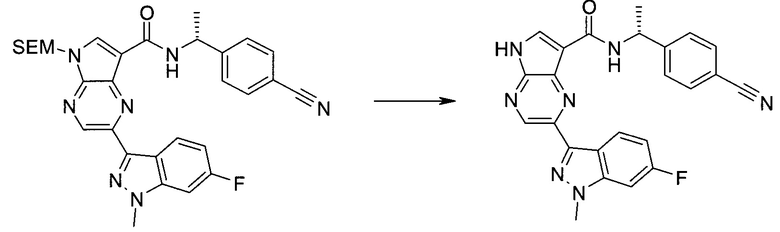
В круглодонную колбу, содержащую 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-фенил)-этил]-амид (32 мг; 0,056 ммоль), растворенный в THF (1 мл), добавляли TBAF (1,0 М в THF; 1,0 мл; 1,0 ммоль). Колбу заполняли азотом, затем герметично закрывали и помещали в масляную баню при 85°C на 2 ч. Реакционную смесь охлаждали до комнатной температуры, гасили ацетоном (2 мл) и насыщ. NaHCO3 (4 мл). Смесь перемешивали в течение 1 ч, затем разбавляли водой и экстрагировали EtOAc. Добавляли рассол и водный слой дважды экстрагировали EtOAc. Объединенные органические экстракты промывали водой и рассолом, затем сушили над MgSO4, фильтровали и
концентрировали. Неочищенное твердое вещество очищали флэш-хроматографией (4 г Silicycle), используя 0%-7,5% MeOH в дихлорметане. Соответствующие фракции объединяли и концентрировали, получая 4 мг (19%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-фенил)-этил]-амида в виде белого твердого вещества. LC-MS (M+H)+=440; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.97 (br. s., 1H), 9.17 (s, 1H), 8.33-8.69 (m, 3H), 7.85 (d, J=8,3 Гц, 2H), 7.64-7.78 (m, 3H), 7.08 (d, J=2,0 Гц, 1H), 5.39 (br. s., 1H), 4.20 (s, 3H), 1.70 (d, J=7,0 Гц, 3H).
Пример 219
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-цианометокси-1-метил-этил)-амид
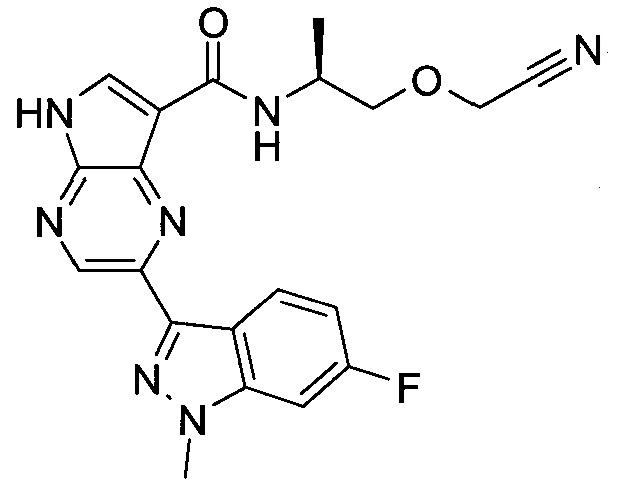
Стадия 1
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-цианометокси-1-метил-этил)-амид
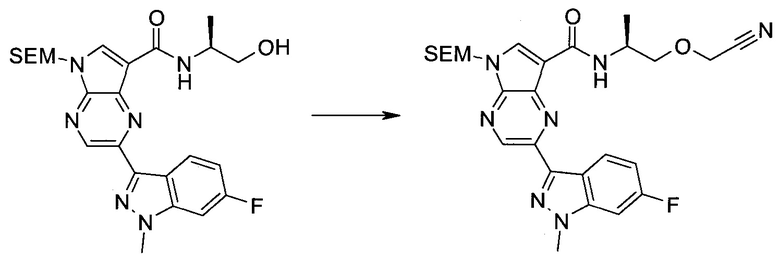
В трехгорлую колбу емкостью 100 мл, содержащую 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (S)-2-гидрокси-1-метил-этил)-амид (176 мг; 0,35 ммоль), добавляли THF (4 мл) в атмосфере азота и смесь охлаждали в ледяной бане. К этой смеси по каплям добавляли бис(триметилсилил)амид лития (1,0 М в THF; 1,06 мл; 1,06 ммоль), в результате получая прозрачный красный раствор. Через 30 мин реакционную смесь извлекали из ледяной бани и оставляли нагреваться до комнатной температуры в течение 1 ч. По каплям добавляли 2-бромацето-
нитрил (0,10 мл; 1,44 ммоль), что приводило к тому, что реакционная смесь становилась темно-коричневой/зеленой. Через 3 ч добавляли дополнительное количество 2-бромацетонитрила (0,10 мл; 1,44 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 суток. Реакционную смесь разбавляли водой и три раза экстрагировали этилацетатом (добавляли рассол для очистки эмульсии). Органические слои промывали рассолом, объединяли, сушили над сульфатом магния, фильтровали и концентрировали до получения коричневого полутвердого вещества. Неочищенное вещество очищали флэш-хроматографией (12 г Analogix) с использованием 0%-75% этилацетата в гексанах. Соответствующие фракции объединяли и концентрировали, получая 57 мг (30%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-цианометокси-1-метил-этил)-амида в виде желтого твердого вещества.
Стадия 2
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-цианометокси-1-метил-этил)-амид
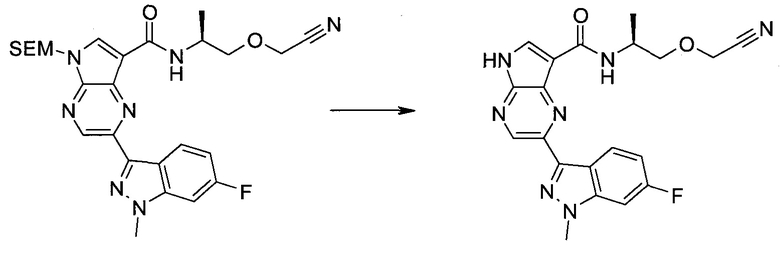
В круглодонную колбу, содержащую 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-цианометокси-1-метил-этил)-амид (55 мг; 0,102 ммоль), растворенный в THF (1 мл), добавляли TBAF (1,0 М в THF; 1,0 мл; 1,0 ммоль). Колбу заполняли азотом, затем герметично закрывали и помещали в масляную баню при 85°C в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры, гасили ацетоном (2 мл) и насыщ. NaHCO3 (4 мл). Смесь перемешивали в течение 1 ч, затем разбавляли водой и дважды экстрагировали EtOAc. Объединенные органические экстракты промывали водой и рассолом, затем сушили над MgSO4, фильтровали и концентрировали. Неочищенное твердое вещество очищали флэш-хроматографией (4 г Silicycle) с использованием 0%-10% MeOH в дихлорметане. Соответствующие фракции объединяли и концентрировали. Твердое вещество растирали с Et2O, получая 7 мг (16%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-
карбоновой кислоты ((S)-2-цианометокси-1-метил-этил)-амида в виде светло-коричневого твердого вещества. LC-MS (M+H)+=408; 1H ЯМР (300 МГц, DMSO-d6) δ: 12.95 (br. s., 1H), 9.17 (s, 1H), 8.47-8.62 (m, 2H), 8.26 (d, J=8,5 Гц, 1H), 7.76 (dd, J=9,8; 2,0 Гц, 1H), 7.25 (td, J=9,0; 2,3 Гц, 1H), 4.57 (s, 2H), 4.43-4.53 (m, 1H), 4.21 (s, 3H), 3.66-3.85 (m, 2H), 1.40 (d, J=6,8 Гц, 3H).
Пример 220
2-Имидазо[1,2-a]пиридин-3-ил-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
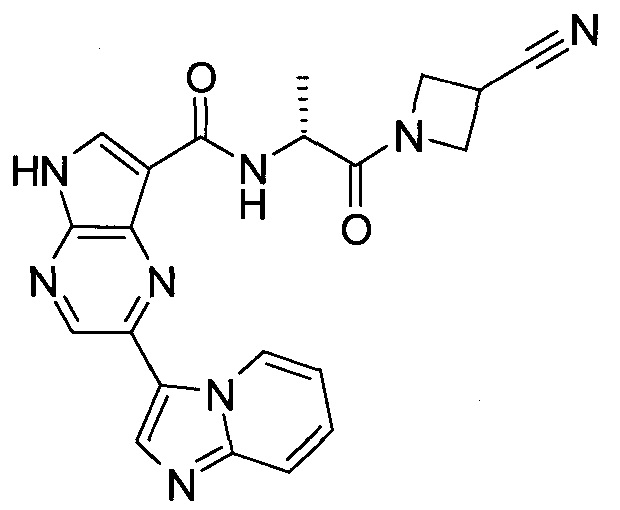
Стадия 1
3-Иодимидазо[1,2-a]пиридин
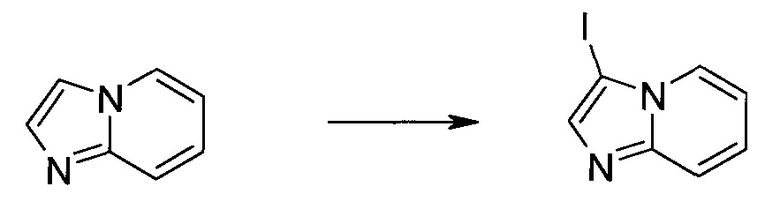
В трехгорлой колбе емкостью 1 л обрабатывали бутиллитием (14,6 мл; 36,4 ммоль) при -50°C имидазо[1,2-a]пиридин (4,1 г; 34,7 ммоль) в THF. Медленно добавляли N-иодсукцинимид (8,59 г; 38,2 ммоль) в 50 мл THF и смесь отставляли, чтобы температура поднялась до 0°C. Ее разбавляли водой и гексаном. Органический слой промывали смесью 10% рассола/вода (2×), сушили (MgSO4) и упаривали, получая твердое вещество. Это твердое вещество растворяли в THF/DCM и очищали флэш-хроматографией (80-100% этилацетат/гексан), получая желаемый изомер 3-иодимидазо[1,2-a]пиридина. 1H ЯМР (300 МГц, DMSO-d6) δ: 8.32 (m, 1H), 7.72 (s, 1H), 7.62 (m, 1H), 7.34 (m, 1H), 7.06 (t, 1H).
Стадия 2
3-Трибутилстаннанил-имидазо[1,2-a]пиридин
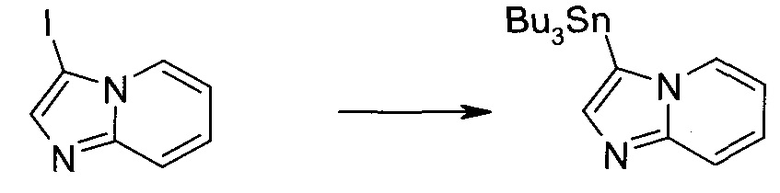
В трехгорлой колбе емкостью 100 мл растворяли 3-иодимидазо[1,2-a]пиридин (0,9 г; 3,69 ммоль) в 50 мл THF при -5°C, используя баню со смесью
ацетон/лед. Добавляли с помощью шприца хлорид изопропилмагния (1,3 М; 2,84 мл; 3,69 ммоль) и образовывалась светло-белая суспензия. Через 0,5 ч добавляли трибутилхлорстаннан (1,15 г; 0,95 мкл; 3,69 ммоль). Все это перемешивали при 20°C в течение 1,5 ч. Реакционную смесь разбавляли гексаном (100 мл), гасили насыщенным раствором хлорида аммония и органические слои промывали 50%-ным рассолом в воде. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали, получая 3-трибутилстаннанил-имидазо[1,2-a]пиридин в виде масла. 1H ЯМР (300 МГц, CDCl3) δ 8.03 (d, 1H) 7.61 (d, 1H) 7.59 (s, 1H) 7.17 (m, 1H) 6.72 (m, 1H) 0.9-1.55 (m, 27).
Стадия 3
2-Имидазо[1,2-a]пиридин-3-ил-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
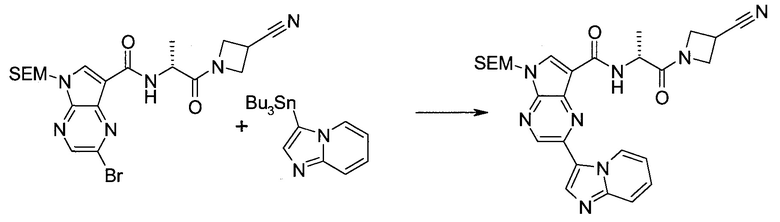
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]амид (110 мг; 0,22 ммоль) объединяли с 3-трибутилстаннанил-имидазо[1,2-a]пиридином (159 мг; 0,39 ммоль) в DMF, который был барботирован азотом в течение 10 мин. Туда добавляли тетракис(трифенилфосфин)-палладий(0) (25 мг; 0,022 ммоль) и смесь нагревали до 70-80°C в течение 3 ч. Весь растворитель удаляли путем упаривания под высоким вакуумом и продукт очищали хромэтографией на силикагеле, получая 2-имидазо[1,2-a]пиридин-3-ил-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид. LCMS: (M+H)+=544.
Стадия 4
2-Имидазо[1,2-a]пиридин-3-ил-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
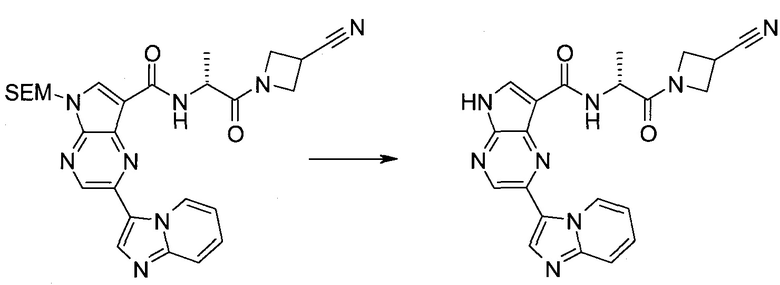
С 2-имидазо[1,2-a]пиридин-3-ил-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида удаляли защиту, используя описанную двухстадийную методику (TFA, затем водный раствор основания), после чего хроматографировали, получая 2-имидазо[1,2-a]пиридин-3-ил-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид. (ES+): 414. 1H ЯМР (300 МГц, DMSO-d) δ: 12.9 (m, 1H), 9.86 (m, 1H), 9.11 (s, 1H), 8.57 (s, 1H), 8.42 (d, 1H), 8.34 (d, 1H), 7.78 (d, 1H), 7.47 (t, 1H), 7.19 (m, 1H), 4.65 (m, 1H), 4.13 (m, 2H), 3.89 (m, 2H), 3.78 (m, 1H), 1.39 (d, 3H).
Пример 221
2-(7-Хлор-имидазо[1,2-a]пиридин-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
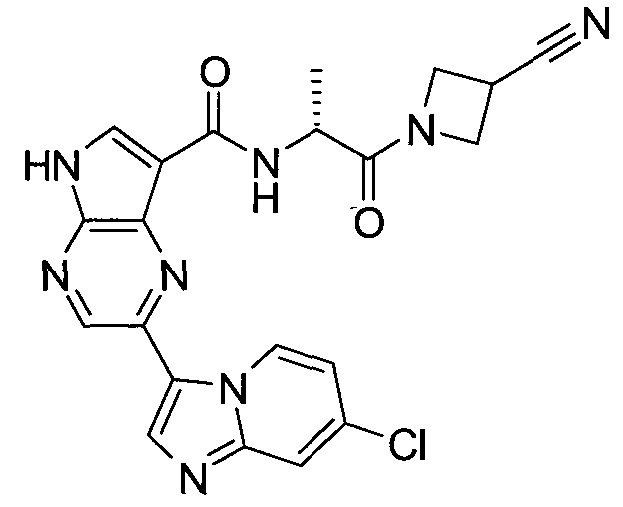
Получали в соответствии с методикой, приведенной в примере 220, заменяя 7-хлор-имидазо[1,2-a]пиридин на имидазо[1,2-a]пиридин на стадии 1. LCMS: (M+H)+=448.
Пример 222
2-(7-Циано-имидазо[1,2-a]пиридин-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
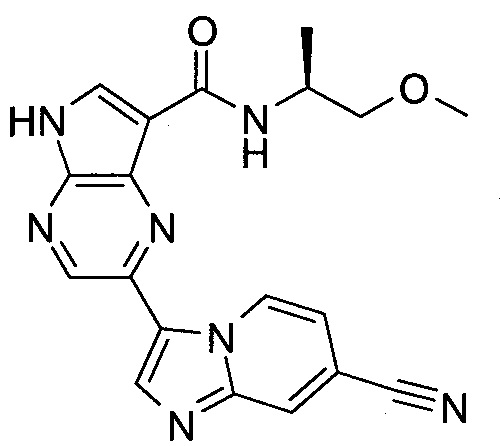
Стадия 1
3-Иод-имидазо[1,2-a]пиридин-7-карбонитрил
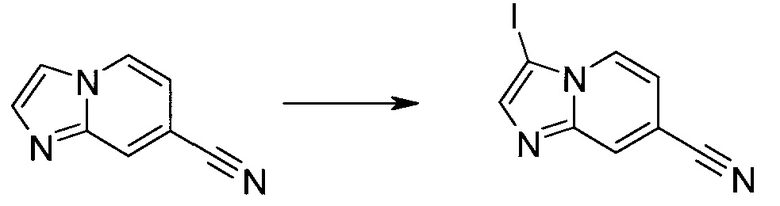
В круглодонной колбе емкостью 50 мл объединяли имидазо[1,2-a]пиридин-7-карбонитрил (1,1 г; 7,68 ммоль) и М-иодсукцинимид (2,07 г; 9,22 ммоль) в DMF (50 мл), получая бесцветный раствор. Реакционную смесь хранили при 20°C и перемешивали в течение 2 ч. Реакционную смесь разбавляли этилацетатом (150 мл), THF (50 мл) и 300 мл 5%-ого тиосульфата натрия и хорошо встряхивали. Водный слой повторно экстрагировали этилацетатом (1×100 мл). Органические слои объединяли, промывали водой, рассолом, сушили (MgSO4) и упаривали. Неочищенное вещество очищали флэш-хроматографией (силикагель, 60%-80% этилацетат/гексаны), получая 3-иод-имидазо[1,2-a]пиридин-7-карбонитрил. 1H ЯМР (300 МГц, DMSO-d6) δ: 8.52 (d, 1H), 8.44 (d, 1H), 8.04 (d, 1H), 7.36 (dd, 1H).
Стадия 2
2-(7-Циано-имидазо[1,2-a]пиридин-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
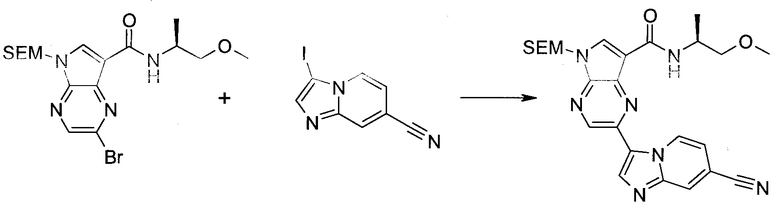
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (100 мг; 0,196 ммоль) и гексаметилолово (72 мг; 0,22 ммоль) объединяли в барботированном азотом растворе толуола (5 мл). Добавляли тетракис(трифенилфосфин)палладий(0)
(19,5 мг; 0,17 ммоль) и раствор нагревали до 95°C в течение 2 ч. Реакционную смесь охлаждали и добавляли 3-иод-имидазо[1,2-a]пиридин-7-карбонитрил (54 мг; 0,2 ммоль) с дополнительным количеством тетракис(трифенилфосфин)-палладия(0) (20 мг; 0,02 ммоль). Смесь нагревали при 100°C в течение 14 ч, охлаждали и непосредственно очищали хроматографией на силикагеле, получая 2-(7-циано-имидазо[1,2-a]пиридин-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид.
Стадия 3
2-(7-Циано-имидазо[1,2-a]пиридин-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
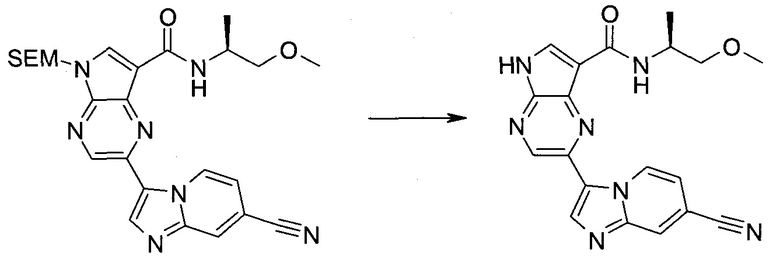
После проведения стандартного удаления защиты с использованием описанной двухстадийной методики (TFA, затем водный раствор основания) получали твердое вещество, которое очищали хроматографией, получая 2-(7-циано-имидазо[1,2-a]пиридин-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид. LCMS: (M+H)+=376. 1H ЯМР (300 МГц, DMSO-d6) δ: 12.9 (m, 1H), 9.68 (m, 1H), 9.10 (s, 1H), 8.75 (s, 1H), 8.56 (m, 1H), 8.45 (s, 1H), 7.96 (d, 1H), 7.36 (m, 1H), 4.35 (m, 1H), 3.48-3.52 (m, 2H), 3.27 (s, 3H), 1.29 (d, 3H).
Пример 223
2-(5-Хлор-бензоимидазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
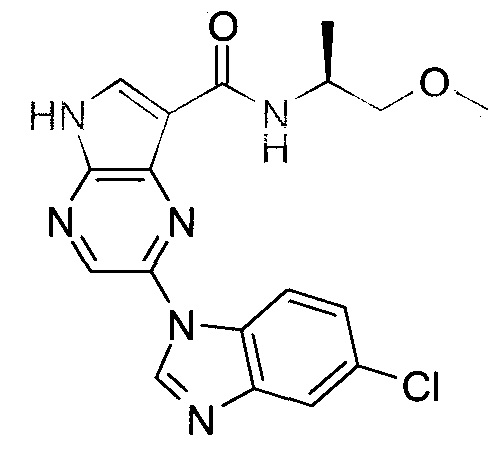
Стадия 1
2-(5-Хлор-бензоимидазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин и 2-(6-хлор-бензоимидазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин
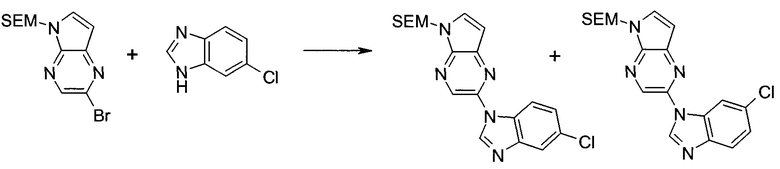
В трехгорлой колбе емкостью 75 мл объединяли гидрид натрия (60%-ную дисперсию; 134 мг; 3,35 ммоль) и 6-хлор-1H-бензо[d]имидазол (511 мг; 3,35 ммоль) в NMP (15 мл), получая светло-коричневый раствор. Добавляли 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин (1,0 г; 3,05 ммоль). Реакционную смесь нагревали до 135°C и перемешивали в течение 15 ч. Реакционную смесь охлаждали, выливали в смесь 50% вода/рассол и экстрагировали в смеси 50% этилацетат/гексан. Неочищенное вещество очищали флэш-хроматографией (силикагель, 40%-50% этилацетата в гексанах), получая два региоизомера: 2-(5-хлор-бензоимидазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин: 1H ЯМР (300 МГц, DMSO-d6) δ: 9.15 (s, 1H), 9.02 (s, 1H), 8.38 (m, 1H), 8.31 (m, 1H), 7.90 (d, 1H), 7.48 (m, 1H), 6.99 (d, 1H), 5.75 (s, 2H), 3.66 (t, 2H), 0.94 (t, 2H), 0.02 (s, 9H); и 2-(6-хлор-бензоимидазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин: 1H ЯМР (300 МГц, DMSO-d6) δ: 9.16 (s, 1H), 9.02 (s, 1H), 8.36 (m, 1H), 8.34 (m, 1H), 7.96 (d, 1H), 7.48 (m, 1H), 6.94 (d, 1H), 5.75 (s, 2H), 3.66 (t, 2H), 0.94 (t, 2H), 0.02 (s, 9H).
Стадия 2
2-(5-Хлор-бензоимидазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
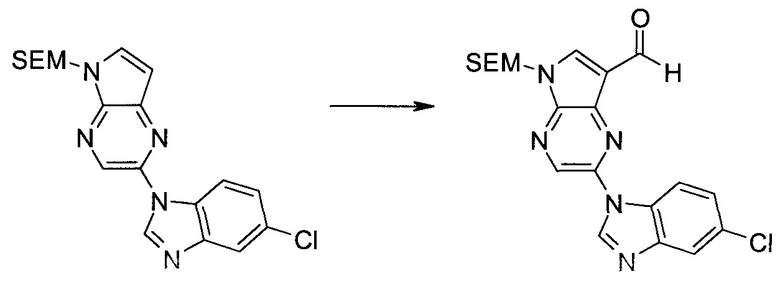
Раствор DMF при 5°C обрабатывали трихлоридом фосфора (483 мг; 3,2 ммоль) в течение 0,5 ч. Добавляли 2-(5-хлор-бензоимидазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин (210 мг; 0,52 ммоль) и смесь перемешивали при 65-70°C в течение 7 ч. Реакционную смесь охлаждали и гасили, используя NaHCO3 (водн.), затем экстрагировали в этилацетат (2×). Органические экстракты промывали водой и рассолом, затем сушили (MgSO4). После очистки флэш-хроматографией получали 2-(5-хлор-бензоимидазол-1-ил)-
5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид. LCMS: (M+H)+=428.
Стадия 3
2-(5-Хлор-бензоимидазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
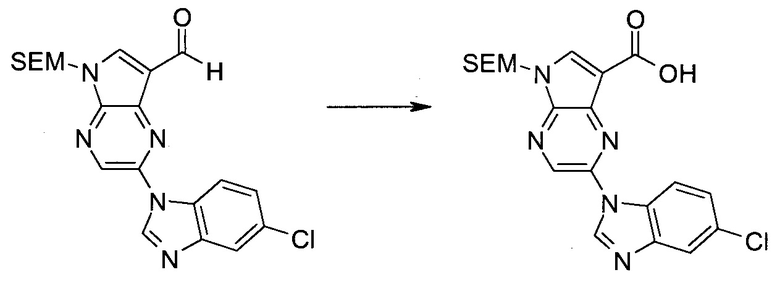
В круглодонной колбе емкостью 50 мл объединяли сульфаминовую кислоту (187 мг; 1,54 ммоль) и 2-(5-хлор-бензоимидазол-1-ил)-5-(2-триметил-силанил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (110 мг; 0,26 ммоль) в диоксане (6 мл), получая беловатую суспензию. Реакционную смесь охлаждали до 5°C и по каплям с помощью шприца в течение 5 мин добавляли раствор хлорита натрия (30,2 мг; 0,33 ммоль) и дигидрофосфата калия (35,0 мг; 0,26 ммоль) в воде (2 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Реакционную смесь разбавляли EtOAc (25 мл) и промывали смесью 50% рассол/вода. Водный слой повторно экстрагировали EtOAc (15 мл). Органические слои объединяли, промывали рассолом и сушили (MgSO4). После выпаривания растворителя получали 90 мг (79%) 2-(5-хлор-бензоимидазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты в виде твердого вещества. (M+H)+=444.
Стадия 4
2-(5-Хлор-2-бензоимидазол-1-ил)-5-(триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
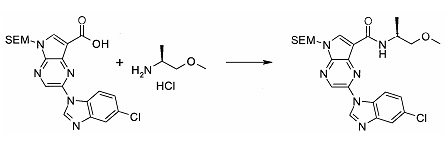
В колбе грушевидной формы емкостью 5 мл объединяли 2-(5-хлор-бензоимидазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (40 мг; 0,09 ммоль, (S)-1-метоксипропан-2-амина
гидрохлорид (12,0 мг; 0,135 ммоль) и HATU (51 мг; 0,135 ммоль) с DMF (3 мл) и N,N-диизопропилэтиламином (0,22 мл; 1,26 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, затем концентрировали. Остаток разбавляли водой и экстрагировали EtOAc (2×). Органические слои сушили над MgSO4 и концентрировали, получая 2-(5-хлор-2-бензоимидазол-1-ил)-5-(триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид.
Стадия 5
2-(5-Хлор-бензоимидазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
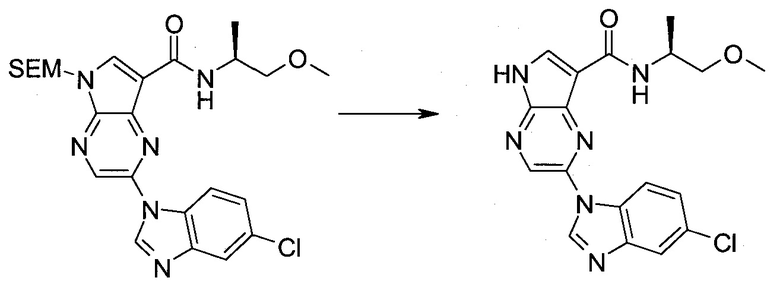
2-(5-Хлор-2-бензоимидазол-1-ил)-5-(триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (40 мг; 0,078 ммоль) растворяли в дихлорметане (2 мл) при комнатной температуре и добавляли 1,5 мл TFA. Реакционную смесь перемешивали в течение 4 ч, затем весь растворитель выпаривали и остаток сушили под высоким вакуумом. Неочищенное вещество растворяли в метаноле и обрабатывали 0,5 мл триэтиламина. Реакционную смесь перемешивали в течение 14 ч. Растворитель выпаривали и остаток суспендировали в смеси 10% THF/EtOAc (20 мл), разбавляли смесью 50% этилацетат/гексаны (25 мл), промывали водой и рассолом, сушили и упаривали. Остаток растирали с эфиром и фильтровали, получая 22 мг (73%) 2-(5-хлор-бензоимидазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде белого твердого вещества. MS: (M+H)+=385, 1H ЯМР (300 МГц, DMSO-d6) δ: 13.1 (s, 1H), 9,11 (s, 1H), 9.01 (s, 1H), 8.58 (m, 1H), 8.29 (d, 1H), 7.95-8.01 (m, 2H), 7.47 (d, 1H), 4.28 (m, 1H), 3.48 (m, 2H), 3.28 (s, 3H), 1.23 (d, 3H).
Пример 224
2-(6-Хлор-бензоимидазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
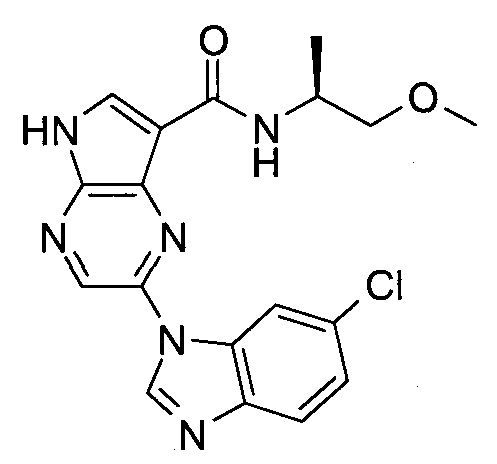
Получали в соответствии с методикой, приведенной в примере 223, стадии 2-5, заменяя 2-(6-хлор-бензоимидазол-1-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин на 2-(5-хлор-бензоимидазол-1-ил)-5-(2-триметил-силанил-этоксиметил)-5H-пирроло[2,3-b]пиразин на стадии 2. MS: (M+H)+=385. 1H ЯМР (300 МГц, DMSO-d6) δ: 10.5 (s, 1H), 8.66 (s, 1H), 8.49 (s, 1H), 8.39 (m, 1H), 8.06 (d, 1H), 7.89 (m, 1H), 7.76 (d, 1H), 7.34 (d, 1H), 4.44 (m, 1H), 3.50 (m, 2H), 3.28 (s, 3H), 1.31 (d, 3H).
Пример 225
2-(5-Хлор-бензоимидазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
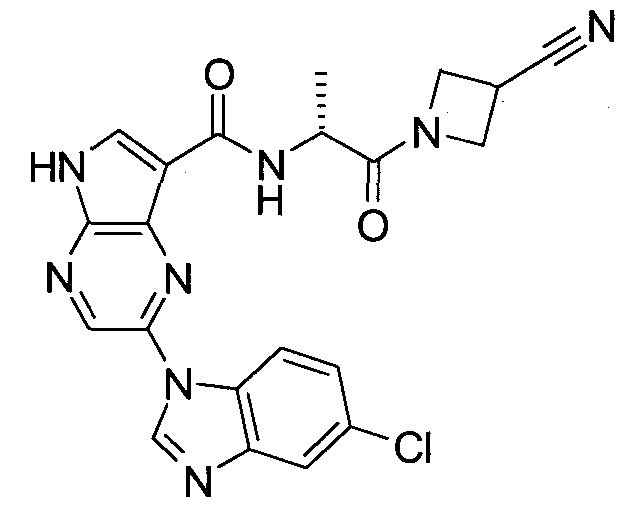
Получали в соответствии с методикой, приведенной в примере 223, стадии 4-5, заменяя 1-((R)-2-амино-пропионил)-азетидин-3-карбонитрила трифторацетат на (S)-1-метоксипропан-2-амина гидрохлорид на стадии 4. MS: (M+H)+=449. 1H ЯМР (300 МГц, DMSO-d6) δ: 13.1 (s, 1H), 9.16 (s, 1H), 9.03 (s, 1H), 8.59 (d, 1H), 8.42 (d, 1H), 7.29 (d, 1H), 7.91 (s, 1H), 7.42 (d, 1H), 4.48-4.71 (m, 3H), 4.20 (m, 1H), 4.09 (m, 1H), 3.83 (m, 1H), 1.33 (d, 3H).
Пример 226
(6-Хлор-3-{7-[(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этилкарбамоил]-5H-пирроло[2,3-b]пиразин-2-ил}-индазол-1-ил)-уксусная кислота
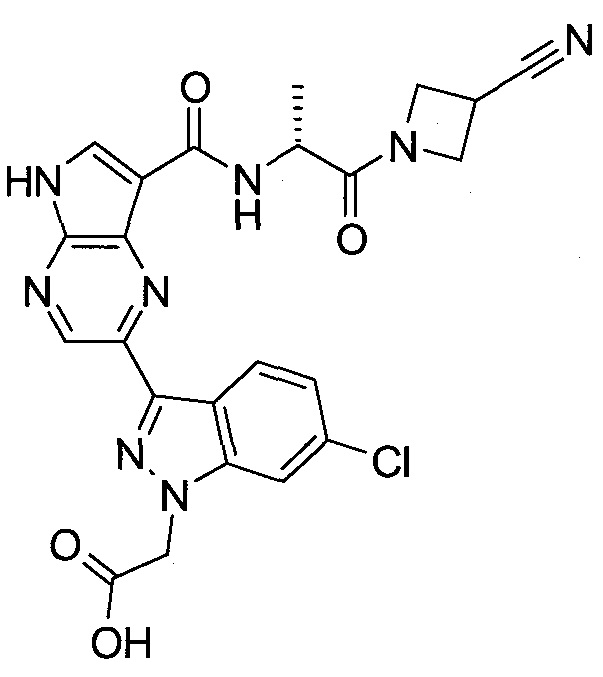
Стадия 1
{6-Хлор-3-[7-[(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этилкарбамоил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-2-ил]-индазол-1-ил}-уксусной кислоты трет-бутиловый эфир
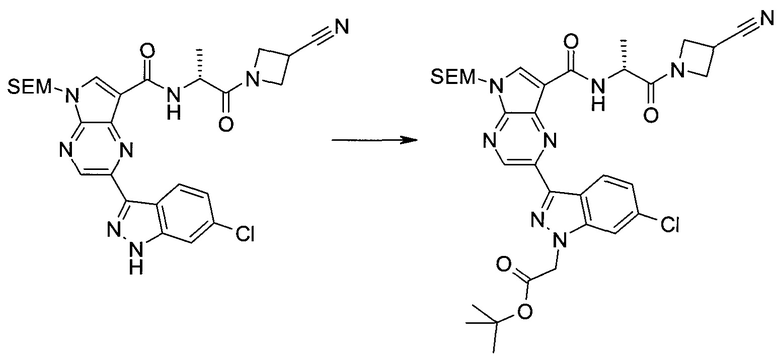
В колбе грушевидной формы емкостью 20 мл объединяли 2-(6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (80 мг; 0,14 ммоль) с THF (3 мл), получая светло-желтый раствор. Его охлаждали до 0°C и добавляли трет-бутилат калия (19 мг; 0,17 ммоль). Все это перемешивали при 0°C в течение 30 мин, по каплям добавляли трет-бутил-2-бромацетат (22 мкл; 0,14 ммоль) и реакционную смесь перемешивали при 0°C в течение 1 ч. Реакционную смесь разбавляли водным NH4Cl и водой, затем экстрагировали Et2O (2×30 мл). Объединенные органические экстракты промывали водой и рассолом, затем сушили над MgSO4 и концентрировали. Неочищенный остаток очищали хроматографией на SiO2 (5%-80% EtOAc/CH2Cl2), получая 35 мг (37%) {6-хлор-3-[7-[(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этилкарбамоил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-2-ил]-индазол-1-ил}-уксусной кислоты трет-бутилового эфира в виде пенообразного твердого вещества. MS: (M+H)+=694.
Стадия 2
(6-Хлор-3-{7-[(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этилкарбамоил]-5H-пирроло[2,3-b]пиразин-2-ил}-индазол-1-ил)-уксусная кислота
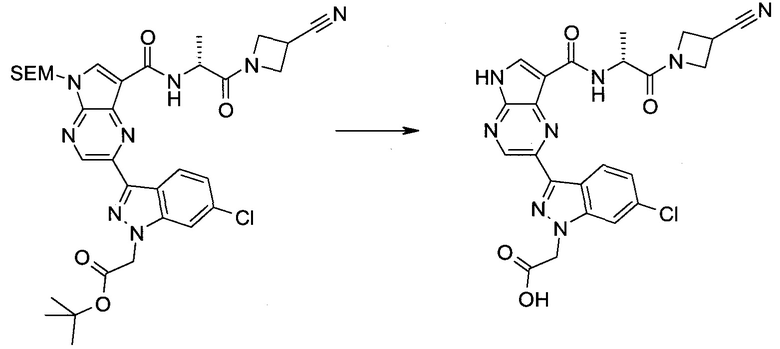
В колбе грушевидной формы емкостью 5 мл объединяли {6-хлор-3-[7-[(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этилкарбамоил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-2-ил]-индазол-1-ил}-уксусной кислоты трет-бутиловый эфир (30 мг; 0,043 ммоль) с CH2Cl2 (1 мл), получая светло-желтый раствор. Добавляли TFA (0,10 мл; 1,3 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Неочищенную реакционную смесь концентрировали в вакууме и снова растворяли в CH2Cl2. По каплям добавляли этилендиамин (88 мкл; 1,3 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Неочищенную реакционную смесь концентрировали в вакууме. Остаток растворяли в воде и раствор лиофилизировали в течение ночи. Желтое воскообразное твердое вещество суспендировали в воде и фильтровали, промывая водой, затем сушили под высоким вакуумом, получая 8 мг (32%) (6-хлор-3-{7-[(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этилкарбамоил]-5H-пирроло[2,3-b]пиразин-2-ил}-индазол-1-ил)-уксусной кислоты в виде желтого твердого вещества. MS: (M+H)+=507.
Пример 227
2-(6-Хлор-1-диметилкарбамоилметил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
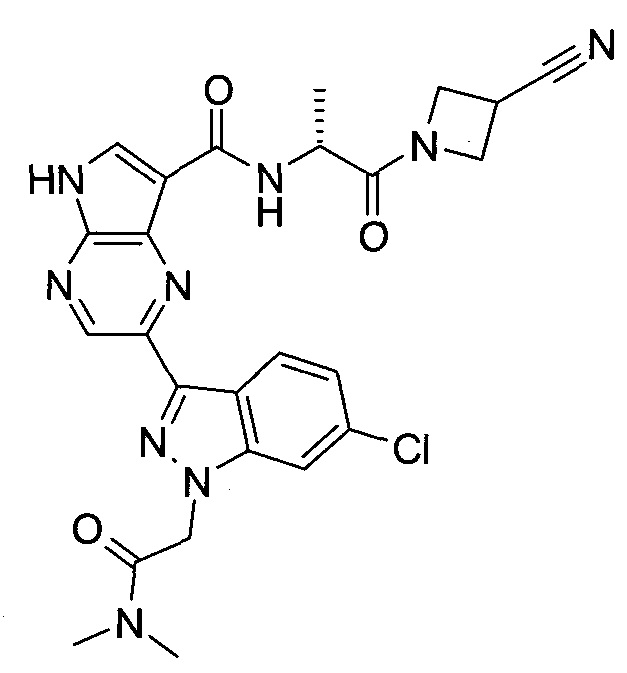
Получали в соответствии с методикой, приведенной в примере 226, заменяя 2-хлор-N,N-диметилацетамид на трет-бутил-2-бромацетат на стадии 1. MS: (M+H)+=534; 1H ЯМР (DMSO-d6) δ: 9.05-9.13 (m, 1H), 8.73 (dd, J=8,6; 4,3 Гц, 1H), 8.42-8.53 (m, 2H), 7.90 (s, 1H), 7.12-7.37 (m, 1H), 5.58 (s, 2H), 4.46-4.83 (m, 3H), 4.18-4.31 (m, 1H), 4.06-4.16 (m, 1H), 3.86 (d, J=5,9 Гц, 1H), 3.15 (s, 3H), 2.88 (s, 3H), 1.41 (t, J=6,2 Гц, 3H).
Пример 228
2-[6-Хлор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
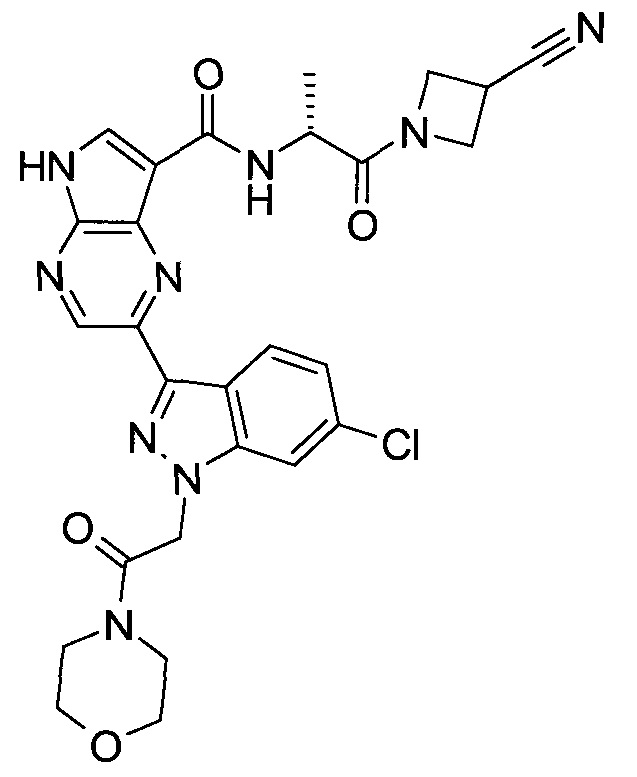
Получали в соответствии с методикой, приведенной в примере 226, заменяя 2-хлор-1-морфолиноэтанон на трет-бутил-2-бромацетат на стадии 1. MS: (M+H)+=577; 1H ЯМР (DMSO-d6) δ: 9.20 (s, 1H), 8.83 (dd, J=8,6; 3,9 Гц, 1H), 8.55-8.65 (m, 2H), 8.02 (s, 2H), 7.37 (d, J=7,0 Гц, 1H), 5.73 (s, 2H), 4.55-4.92 (m, 3H), 4.28-4.39 (m, 1H), 4.15-4.25 (m, 1H), 3.82 (br. s., 1H), 3.71 (br. s., 4H), 3.54 (d, J=4,3 Гц, 4H), 1.90 (s, 3H).
Пример 229
2-[6-Хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
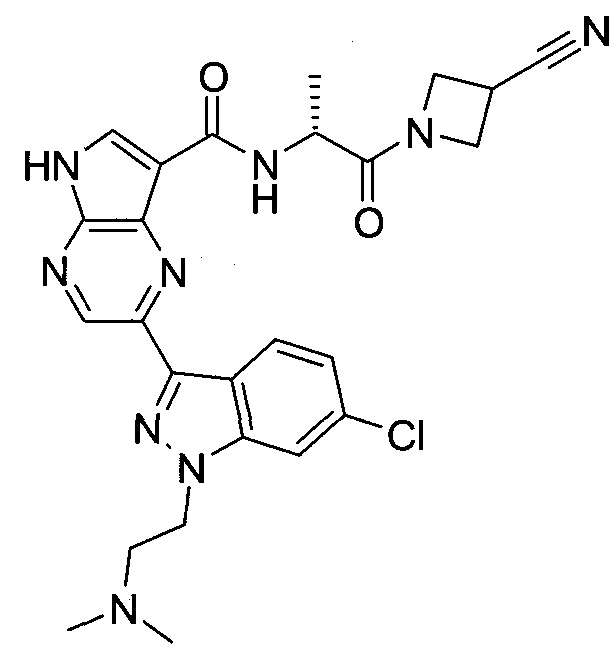
Стадия 1
2-[6-Хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
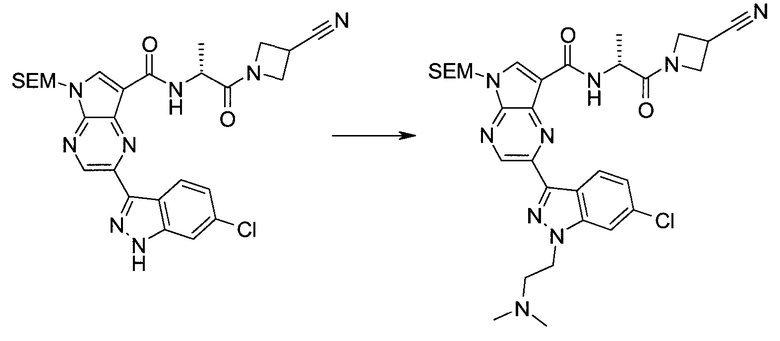
В колбе грушевидной формы емкостью 10 мл объединяли 2-(6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (280 мг; 0,48 ммоль) с DMF (8 мл) при 0°C, получая желтый раствор. Добавляли гидрид натрия (60%-ный в минеральном масле; 70 мг; 1,74 ммоль) и реакционную смесь перемешивали при 0°C в течение 10 мин. Добавляли диметиламиноэтилбромида гидробромид (169 мг; 0,73 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 мин, затем оставляли нагреваться до комнатной температуры и перемешивали в течение 2 ч. Реакцию гасили 5 мл рассола и 10 мл воды, затем экстрагировали EtOAc (2×). Объединенные органические экстракты промывали водой и рассолом, затем сушили и очищали хроматографией на SiO2 (0%-10% MeOH/CH2Cl2), получая 135 мг (43%) 2-[6-хлор-
1-(2-диметиламино-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде пенообразного твердого вещества. MS: (M+H)+=651.
Стадия 2
2-[6-Хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
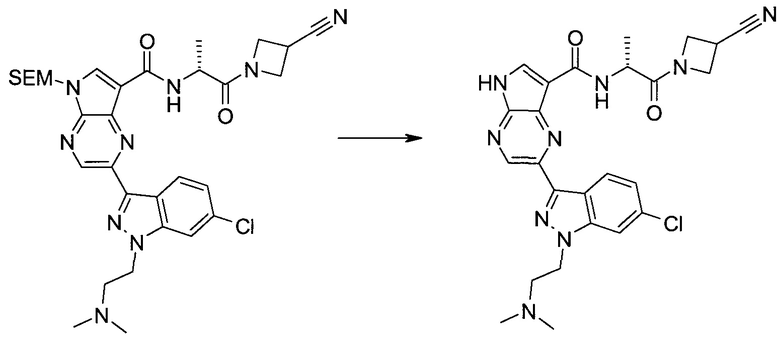
В колбе грушевидной формы емкостью 10 мл объединяли 2-[6-хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид (130 мг; 0,20 ммоль) с CH2Cl2 (1 мл), получая желтый раствор. Добавляли TFA (0,24 мл; 3,2 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Неочищенную реакционную смесь концентрировали в вакууме и снова растворяли в CH2Cl2. По каплям добавляли этилендиамин (0,33 мл; 5,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 20 мин. Неочищенную реакционную смесь концентрировали в вакууме. Остаток суспендировали в холодной воде и фильтровали, промывая водой, затем сушили под высоким вакуумом, получая 70 мг (64%) 2-[6-хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида в виде желтого твердого вещества. MS: (M+H)+=520; 1H ЯМР (DMSO-d6) δ: 9.14 (s, 1H), 8.70 (d, J=7,0 Гц, 1H), 8.36-8.63 (m, 2H), 8.03 (s, 1H), 7.25 (d, J=6,6 Гц, 1H), 4.48-4.82 (m, 5H), 4.16-4.34 (m, 1H), 4.01-4.15 (m, 1H), 3.86 (d,J=5,1 Гц, 1H), 3.33 (br. s., 1H), 2.80 (t, J=6,1 Гц, 2H), 2.20 (s, 6H), 1.40 (t, J=6,4 Гц, 3H).
Пример 230
2-[6-Хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида гидрохлорид
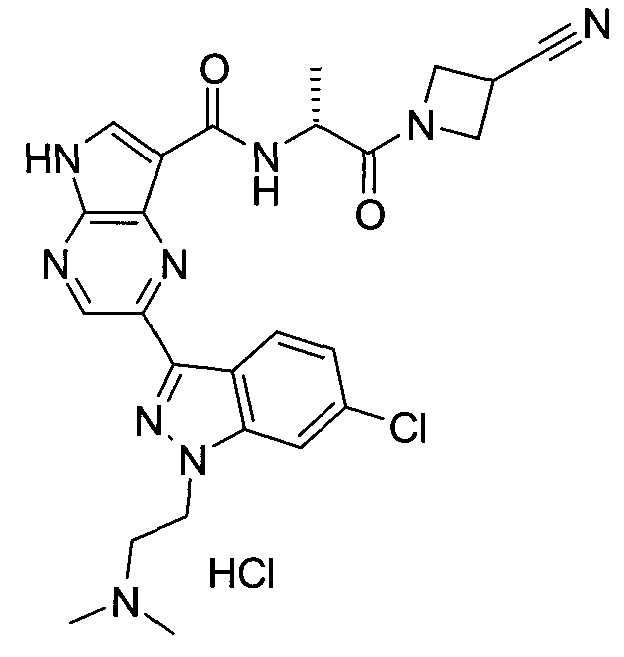
В колбе грушевидной формы емкостью 10 мл объединяли 2-[6-хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида гидрохлорид (40 мг; 0,077 ммоль) с HCl (4 н. в диоксане) (0,2 мл; 0,80 ммоль), получая суспензию. Добавляли воду и получали желтую пастообразную суспензию. Добавляли Et20, смесь перемешивали и органический слой декантировали. Это повторяли 5 раз (5×8 мл). Желтое твердое вещество фильтровали, промывали Et2O и сушили под высоким вакуумом, получая 35 мг (85%) 2-[6-хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амида гидрохлорида в виде желтого твердого вещества. MS: (M+H)+=520; 1H ЯМР (DMSO-d6) δ: 13.03 (br. s., 1H), 10.22 (br. s, 1H), 9.20 (s, 1H), 8.76 (d, J=8,6 Гц, 1H), 8.44-8.54 (m, 2H), 8.15 (s, 1H), 7.29-7.35 (m, 1H), 4.96-5.02 (m, 2H), 4.99 (t, J=6,1 Гц, 2H), 4.64-4.79 (m, 1H), 4.52-4.62 (m, 1H), 4.07-4.26 (m, 2H), 3.72 (d, J=5,9 Гц, 2H), 2.89 (d, J=4,7 Гц, 6H), 1.40 (t, J=6,8 Гц, 3H).
Пример 231
2-[6-Хлор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
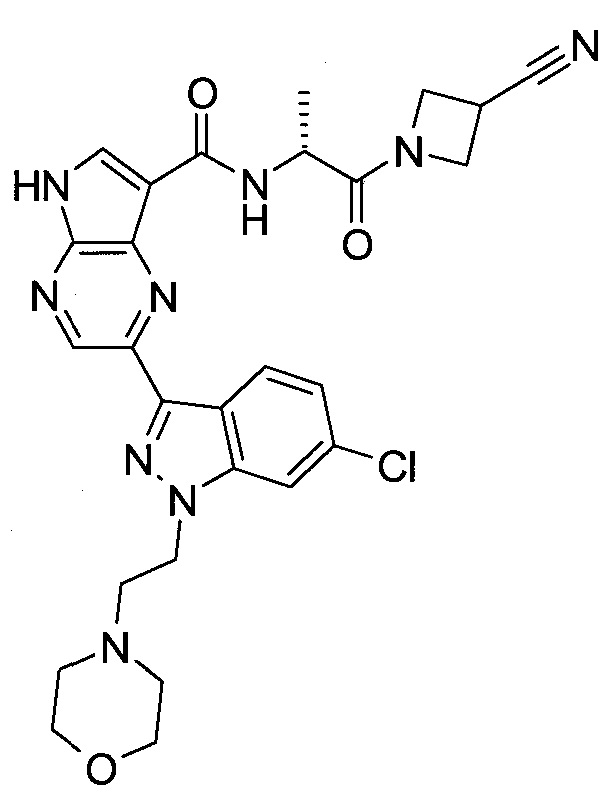
Получали в соответствии с методикой, приведенной в примере 229, заменяя 4-(2-бромэтил)морфолин на диметиламиноэтилбромида гидробромид на стадии 1. MS: (M+H)+=563; 1H ЯМР (DMSO-d6) δ: 9.15 (s, 1H), 8.70 (d, J=8,0 Гц, 1H), 8.42-8.50 (m, 2H), 8.05 (s, 1H), 7.25 (d, J=8,0 Гц, 1H), 4.45-4.80 (m, 5H), 4.20-4.28 (m, 1H), 4.05-4.12 (br. s., 1H), 3.80-3.90(m, 1H), 3.45-3.52 (m, 4H), 3.26-3.32 (m, 4H), 2.80-2.88 (m, 2H), 1.40 (t, J=6,4 Гц, 3H).
Пример 232
2-[6-Хлор-1-(2-пиридин-2-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
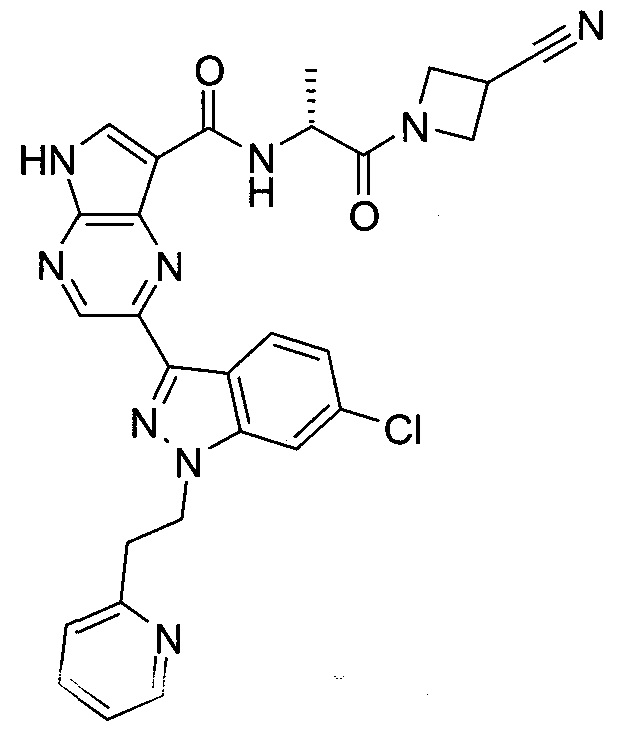
Получали в соответствии с методикой, приведенной в примере 229, заменяя 2-(2-бромэтил)пиридина гидробромид на диметиламиноэтилбромида гидробромид на стадии 1. MS: (M+H)+=555; 1H ЯМР (DMSO-d6) δ: 9.11 (s, 1H), 8.68 (d, J=6,8 Гц, 1H), 8.41-8.54 (m, 3H), 7.81 (s, 1H), 7.64 (t, J=7,2 Гц, 1H), 7.16-7.31 (m, 3H), 4.92 (t, J=6,4 Гц, 2H), 4.49-4.81 (m, 3H), 4.23 (br. s., 1H), 4.10 (br. s., 1H), 3.86 (br. s., 1H), 3.39 (t, J=6,7 Гц, 2H), 1.33-1.47 (m, 3H).
Пример 233
2-(6-Хлор-1-пиридин-2-илметил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид
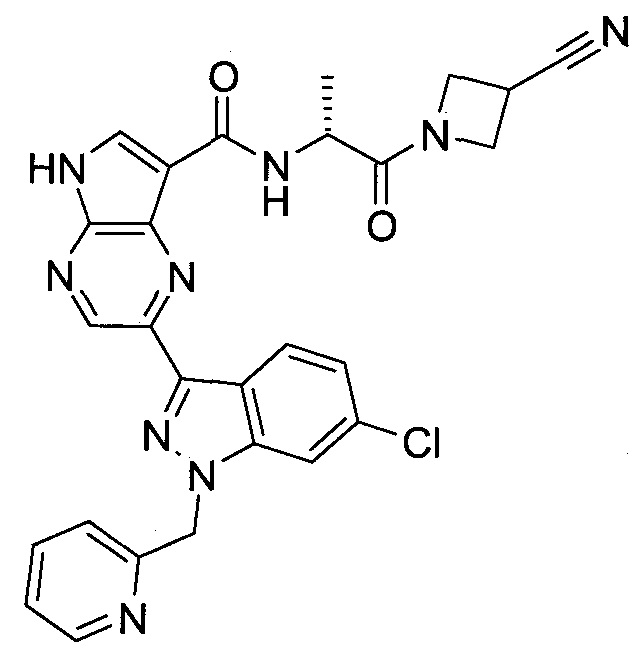
Получали в соответствии с методикой, приведенной в примере 229, заменяя 2-(хлорметил)пиридина гидрохлорид на диметиламиноэтилбромида гидробромид на стадии 1. MS: (M+H)+=540; 1H ЯМР (DMSO-d6) δ: 9.10 (s, 1H), 8.75 (d, J=7,0 Гц, 1H), 8.35-8.57 (m, 3H), 8.01 (s, 1H), 7.78 (t, J=7,4 Гц, 1H), 7.16-7.37 (m, 3H), 5.92 (s, 2H), 4.48-4.82 (m, 3H), 4.04-4.29 (m, 2H), 3.86 (br. s., 1H), 1.34-1.47 (m, 3H).
Пример 234
2-[6-Хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
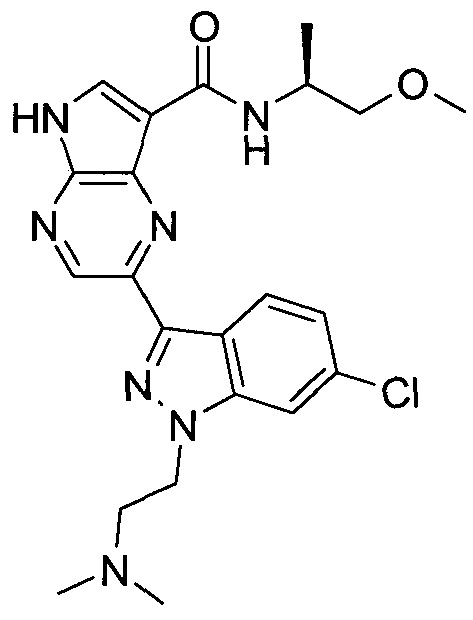
Стадия 1
2-(6-Хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
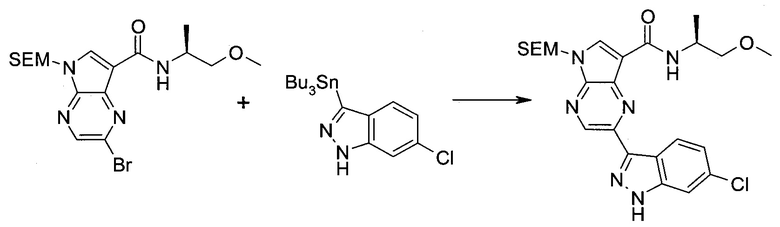
6-Хлор-3-трибутилстаннил-1H-индазол (1,04 г; 2,35 ммоль), иодид меди(I) (17 мг; 0,09 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (400 мг; 0,90 ммоль) объединяли в DMF (6 мл), получая желтый раствор. Смесь дегазировали путем барботирования азота в течение 10 мин, затем добавляли тетракис(трифенилфосфин)палладий(0) (52 мг; 0,045 ммоль) и реакционную смесь перемешивали в атмосфере азота при 90°C в течение 15 ч. Реакционную смесь охлаждали, разбавляли диэтиловым эфиром (60 мл) и промывали водой и рассолом. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле (0-10% метанола в дихлорметане, содержащем 0,5% гидроксида аммония), получая 300 мг (65%) 2-(6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде пенообразного твердого вещества. MS:(M+H)+=516.
Стадия 2
2-[6-Хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
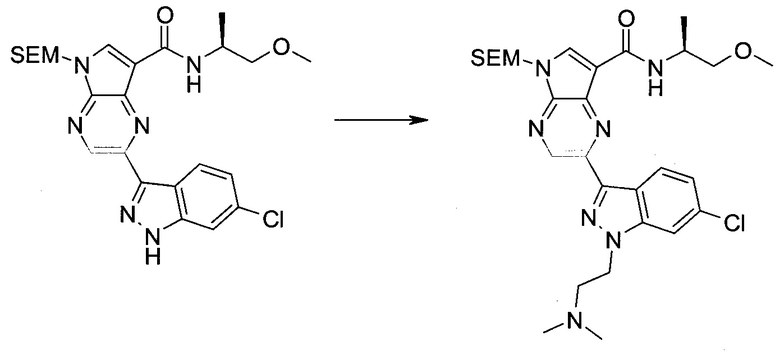
2-(6-Хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (80 мг; 0,16 ммоль) объединяли с DMF (8 мл) при 0°C, получая желтый раствор.
Добавляли гидрид натрия (60%-ный в минеральном масле; 19 мг; 0,47 ммоль) и реакционную смесь перемешивали при 0°C в течение 10 мин. Добавляли диметиламиноэтилбромида гидробромид (54 мг; 0,23 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 мин, затем оставляли нагреваться до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь гасили 5 мл рассола и 10 мл воды, затем экстрагировали этилацетатом (2×30 мл). Объединенные органические слои промывали водой и рассолом, затем сушили и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле (0-10% метанола в дихлорметане), получая 50 мг (55%) 2-[6-хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5-(2-триметил-силанил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде пенообразного твердого вещества. MS: (M+H)+=587.
Стадия 3
2-[6-Хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
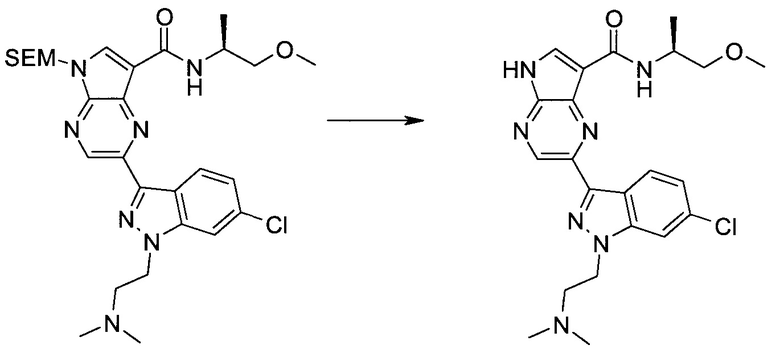
2-[6-Хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (50 мг; 0,085 ммоль) объединяли в дихлорметане (1 мл) и добавляли трифторуксусную кислоту (0,19 мл; 2,56 ммоль). После перемешивания в течение 2 ч реакционную смесь концентрировали в вакууме и остаток растворяли в дихлорметане (1 мл). Добавляли этилендиамин (0,17 мл; 2,56 ммоль). После перемешивания в течение 20 мин реакционную смесь концентрировали в вакууме. Остаток растирали с водой (2 мл). Осадок отфильтровывали, промывали водой и сушили, получая 30 мг (73%) 2-[6-хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде желтого твердого вещества. MS: (M+H)+=456; 1H ЯМР (DMSO-d6) δ; 9.11 (s, 1H),
8.51 (d, J=8,5 Гц, 1H), 8.44 (s, 1H), 8.45 (s, 1H), 8.20 (d, J=8,0 Гц, 1H), 8.06 (s, 1H), 7.26 (d, J=8,3 Гц, 1H), 4.62 (br. s., 2H), 4.38 (br. s., 1H), 3.50 (dd, J=16,1; 4,0 Гц, 2H), 3.28 (s, 3H), 2.81 (br. s., 2H), 2.21 (s, 6H), 1.31 (d, J=6,5 Гц, 3H).
Пример 235
2-(6-Хлор-1-пиридин-3-илметил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
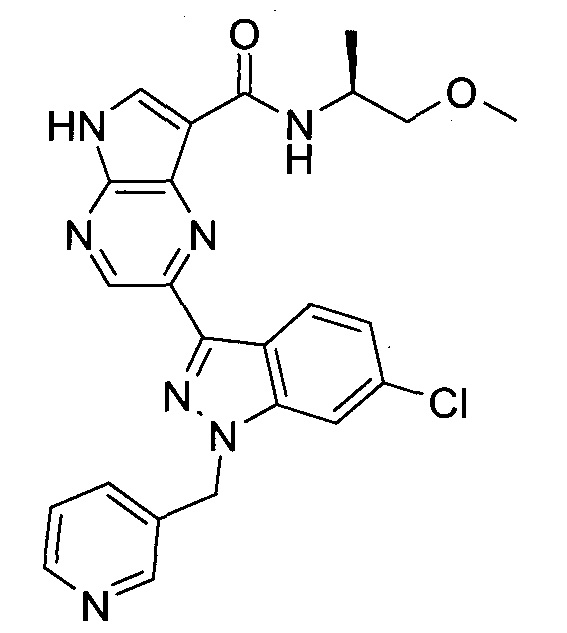
Получали в соответствии с методикой, приведенной в примере 234, стадии 2-3, заменяя 3-(хлорметил)пиридина гидрохлорид на диметиламиноэтилбромида гидробромид на стадии 2. MS: (M+H)+=476; 1H ЯМР (DMSO-d6) δ: 9.22 (s, 1H), 8.77 (br. s., 1H), 8.48-8.69 (m, 3H), 8.21-8.34 (m, 2H), 7.84 (d, J=7,3 Гц, 1H), 7.32-7.54 (m, 3H), 5.94 (br. s., 2H), 4.46 (br. s., 1H), 3.57 (dd, J=15,4; 3,9 Гц, 2H), 3.35 (s, 3H), 1.39 (d, J=6,3 Гц, 3H).
Пример 236
2-[6-Хлор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
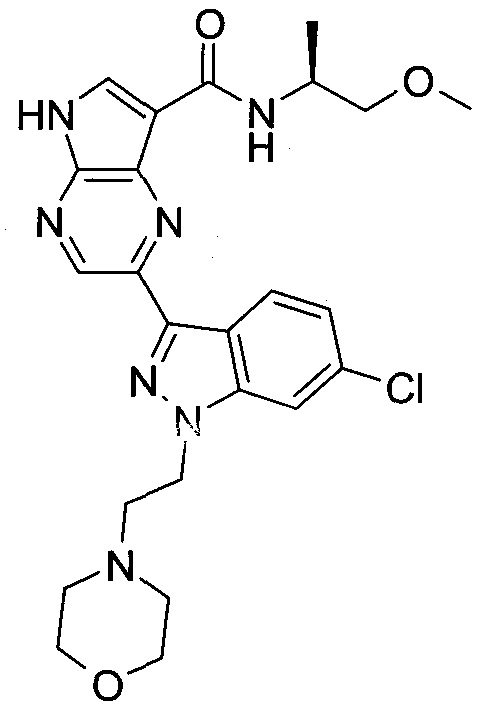
Получали в соответствии с методикой, приведенной в примере 234, стадии 2-3, заменяя 4-(2-бромэтил)морфолина гидрохлорид на диметиламиноэтилбромида гидробромид на стадии 2. MS: (M+H)+=498; 1H ЯМР (DMSO-d6) δ: 9.12 (s, 1H), 8.51 (d, J=8,5 Гц, 1H), 8.45 (s, 1H), 8.20 (d, J=8,0 Гц, 1H), 8.06 (br. s., 2H),
7.27 (d, J=8,0 Гц, 1H), 4.66 (br. s, 2H), 4.38 (br. s., 1H), 3.51 (br. s., 7H), 3.21-3.38 (m, 5H), 2.85 (br. s., 2H), 1.32 (d, J=6,3 Гц, 3H).
Пример 237
2-[6-Фтор-1-(6-морфолин-4-ил-пиридин-3-илметил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
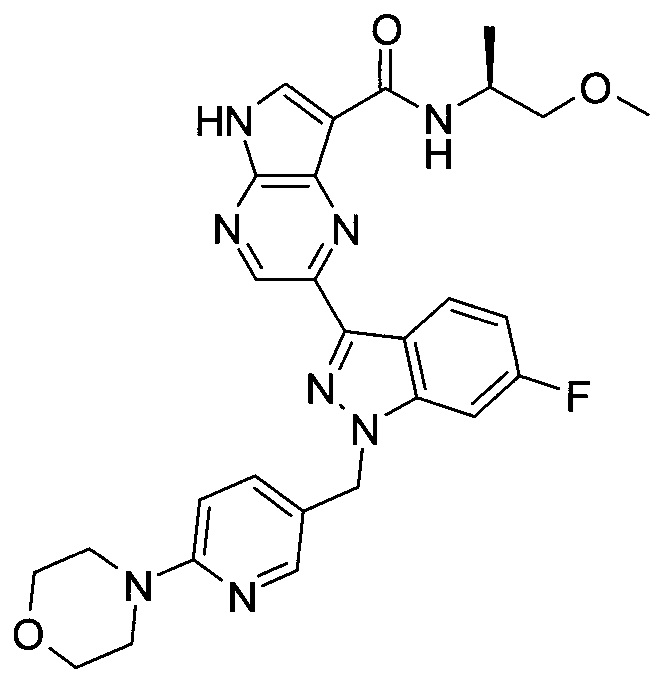
Стадия 1
2-(6-Фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
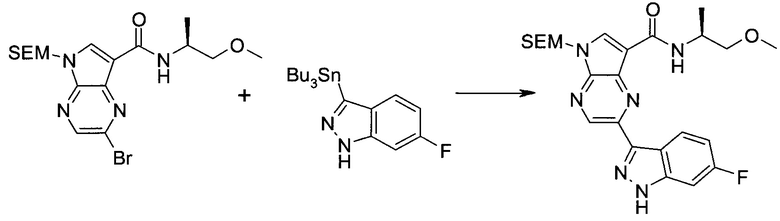
6-Фтор-3-трибутилстаннил-1H-индазол (1,10 г; 2,59 ммоль), иодид меди(I) (24 мг; 0,13 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (560 мг; 1,26 ммоль) объединяли с DMF (6 мл), получая желтый раствор. Смесь дегазировали путем барботирования азота в течение 10 мин, затем добавляли тетракис(трифенилфосфин)палладий(0) (73 мг; 0,06 ммоль) и реакционную смесь перемешивали в атмосфере азота при 80°C в течение 2 ч. Реакционную смесь охлаждали, разбавляли диэтиловым эфиром (60 мл) и промывали водой и рассолом. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле (0-10% метанола в дихлорметане с 0,5% гидроксида аммония), получая 580 мг (92%) 2-(6-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-
этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде беловатого твердого вещества. MS: (M+H)+=499.
Стадия 2
2-[6-Фтор-1-(6-морфолин-4-ил-пиридин-3-илметил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
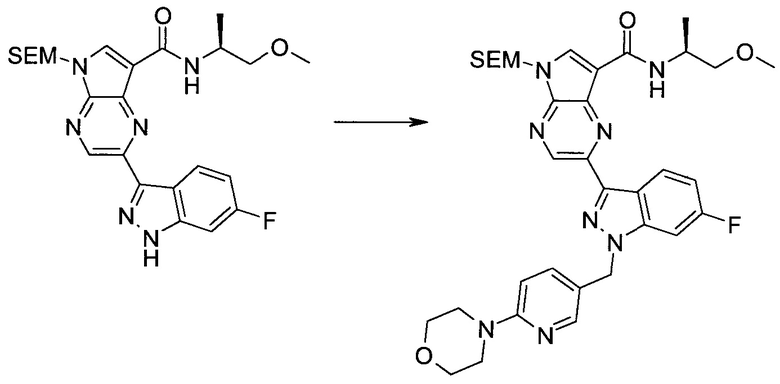
2-(6-Фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (80 мг; 0,16 ммоль) объединяли с DMF (8 мл) при 0°C, получая желтый раствор. Добавляли гидрид натрия (60%-ный в минеральном масле; 19 мг; 0,48 ммоль) и реакционную смесь перемешивали при 0°C в течение 10 мин. Добавляли 4-(5-(хлорметил)пиридин-2-ил)морфолина гидрохлорид (60 мг; 0,24 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 мин, затем нагревали до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь гасили 5 мл рассола и 10 мл воды и экстрагировали этилацетатом (2×30 мл). Объединенные органические слои промывали водой и рассолом, затем сушили и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле (0-10% метанола в дихлорметане), получая 58 мг (53%) 2-[6-фтор-1-(6-морфолин-4-ил-пиридин-3-илметил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде пенообразного твердого вещества. MS: (M+H)+=675.
Стадия 3
2-[6-Фтор-1-(6-морфолин-4-ил-пиридин-3-илметил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
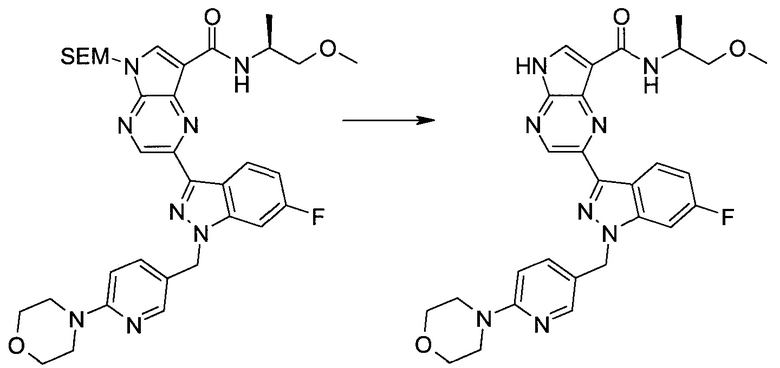
2-[6-Фтор-1-(6-морфолин-4-ил-пиридин-3-илметил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид (50 мг; 0,074 ммоль) объединяли в дихлорметане (1 мл) и добавляли трифторуксусную кислоту (0,17 мл; 2,22 ммоль). После перемешивания в течение 2 ч реакционную смесь концентрировали в вакууме. Остаток растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,15 мл; 2,22 ммоль). Через 20 мин реакционную смесь концентрировали в вакууме и остаток растирали с водой (2 мл). Осадок отфильтровывали, промывали водой и сушили, получая 33 мг (77%) 2-[6-фтор-1-(6-морфолин-4-ил-пиридин-3-илметил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амида в виде светло-желтого твердого вещества. MS: (M+H)+=545; 1H ЯМР (DMSO-d6) δ: 9.14 (s, 1H), 8.52-8.60 (m, 1H), 8.45 (s, 1H), 8.31 (br. s., 1H), 8.19 (d, J=8,3 Гц, 1H), 7.89 (d, J=9,5 Гц, 1H), 7.63 (d, J=8,3 Гц, 1H), 7.16 (t, J=9,0 Гц, 1H), 6.79 (d, J=8,3 Гц, 1H), 5.63 (br. s., 2H), 4.37 (br. s., 1H), 3.65 (br. s., 4H), 3.44-3.57 (m, 2H), 3.39 (br. s., 4H), 3.27 (s, 3H), 1.30 (d, J=6,3 Гц, 3H).
Пример 238
2-[6-Фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
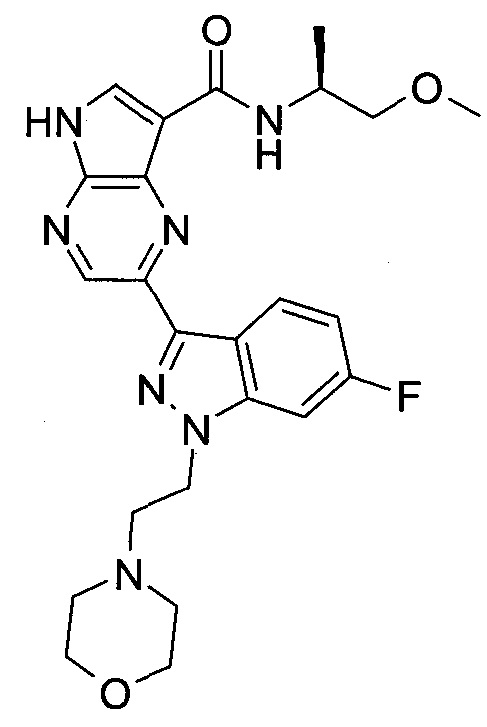
Получали в соответствии с методикой, приведенной в примере 237, стадии 2-3, заменяя 4-(2-бромэтил)морфолина гидрохлорид на 4-(5-(хлорметил)пиридин-2-ил)морфолина гидрохлорид на стадии 2. MS: (M+H)+=482; 1H ЯМР (DMSO-d6) δ: 9.12 (s, 1H), 8.53 (dd, J=8,7; 5,4 Гц, 1H), 8.44 (s, 1H), 8.21 (d, J=8,5 Гц, 1H), 7.76 (d, J=9,8 Гц, 1H), 7.15 (t, J=8,2 Гц, 1H), 4.62 (t, J=6,3 Гц, 2H), 4.38 (br. s., 1H), 3.41-3.62 (m, 7H), 3.30 (d, J=18,3 Гц, 6H), 2.85 (t, J=6,3 Гц, 2H), 1.31 (d, J=6,8 Гц, 3H).
Пример 239
2-[1-(2-Диметиламино-этил)-6-фтор-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
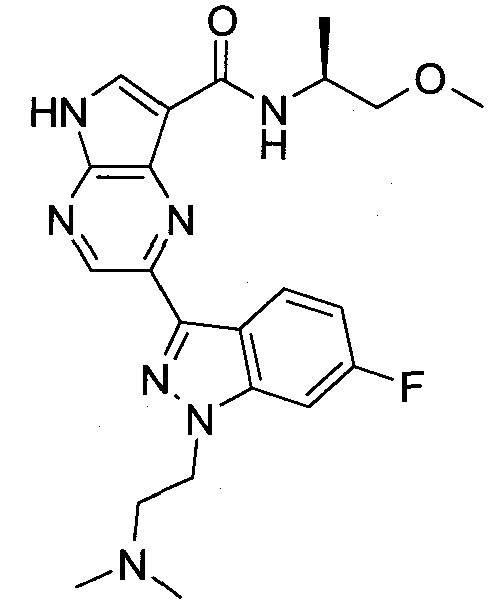
Получали в соответствии с методикой, приведенной в примере 237, стадии 2-3, заменяя диметиламиноэтилбромида гидробромид на 4-(5-(хлорметил)-пиридин-2-ил)морфолина гидрохлорид на стадии 2. MS: (M+H)+=440; 1H ЯМР (DMSO-d6) δ: 9.11 (s, 1H), 8.52 (dd, J=8,5; 5,3 Гц, 1H), 8.44 (s, 1H), 8.21 (d, J=8,3 Гц, 1H), 7.76 (d, J=9,3 Гц, 1H), 7.14 (t, J=8,4 Гц, 1H), 4.59 (t, J=6,0 Гц, 2H), 4.38 (br. s., 1H), 3.42-3.61 (m, 2H), 3.28 (s, 3H), 2.80 (t, J=6,1 Гц, 2H), 2.20 (s., 6Н), 1.31 (d, J=6,5 Гц, 3H).
Пример 240
2-(6-Фтор-1-пиридин-2-илметил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
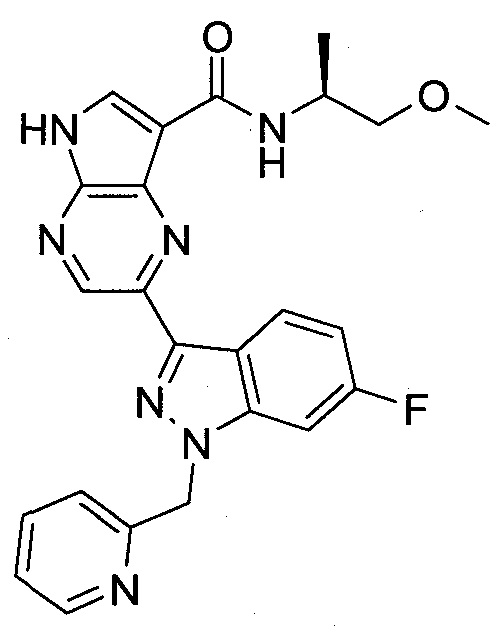
Получали в соответствии с методикой, приведенной в примере 237, стадии 2-3, заменяя 2-(хлорметил)пиридина гидрохлорид на 4-(5-(хлорметил)пиридин-2-ил)морфолина гидрохлорид на стадии 2. MS: (M+H)+=460; 1H ЯМР (DMSO-d6) δ: 9.08 (s, 1H), 8.48-8.63 (m, 2H), 8.45 (s, 1H), 8.20 (d, J=8,5 Гц, 1H), 7.69-7.78 (m, 2H), 7.29-7.39 (m, 1H), 7.15-7.26 (m, 2H), 5.89 (s, 2H), 4.38 (br. s., 1H), 3.42-3.59 (m, 2H), 3.28 (s, 3H), 1.31 (d, J=6,8 Гц, 3H).
Пример 241
2-(6-Фтор-1-пиридин-3-илметил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
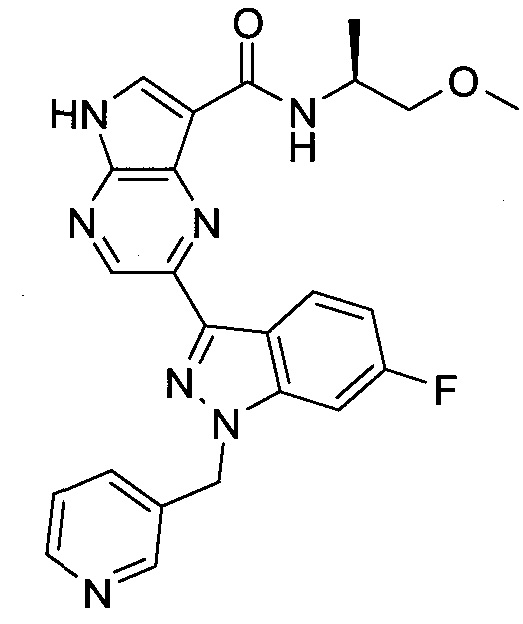
Получали в соответствии с методикой, приведенной в примере 237, стадии 2-3, заменяя 3-(хлорметил)пиридина гидрохлорид на 4-(5-(хлорметил)пиридин-2-ил)морфолина гидрохлорид на стадии 2. MS: (M+H)+=460; 1H ЯМР (DMSO-d6) δ: 9.13 (s, 1H), 8.69 (s, 1H), 8.40-8.61 (m, 3H), 8.18 (d, J=8,5 Гц, 1H), 7.88 (d, J=8,8 Гц, 1H), 7.77 (d, J=7,8 Гц, 1H), 7.32-7.45 (m, 1H), 7.18 (t, J=8,2 Гц, 1H), 5.82 (s, 2H), 4.37 (br. s., 1H), 3.49 (dd, J=14.1; 4,5 Гц, 2H), 3.27 (s, 3H), 1.30 (d, J=6,8 Гц, 3H).
Пример 242
2-[6-Фтор-1-(2-пирролидин-1-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
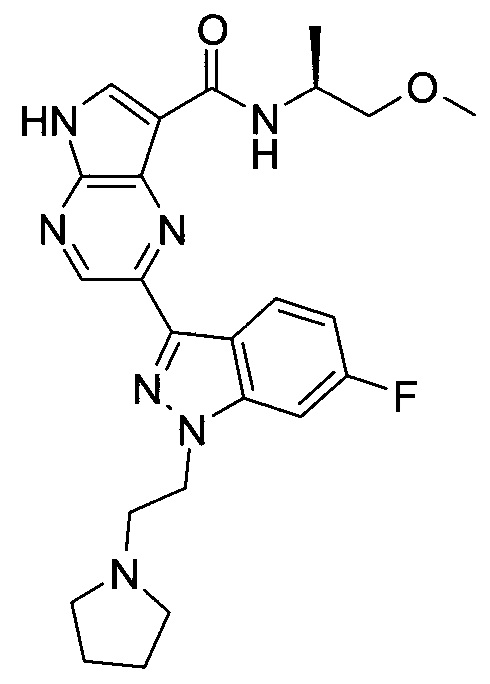
Получали в соответствии с методикой, приведенной в примере 237, стадии 2-3, заменяя 1-(2-бромэтил)пирролидин на 4-(5-(хлорметил)пиридин-2-ил)морфолина гидрохлорид на стадии 2. MS: (M+H)+=466; 1H ЯМР (DMSO-d6) δ: 9.12 (s, 1H), 8.53 (br. s., 1H), 8.43 (s, 1H), 8.20 (d, J=8,0 Гц, 1H), 7.74 (d, J=9,5 Гц, 1H), 7.03-7.22 (m, 1H), 4.61 (br. s., 2H), 3.43-3.57 (m, 2H), 3.29 (m, 8H), 2.98 (br. s., 2H), 1.64 (br. s., 4H), 1.31 (d, J=6,5 Гц, 3H).
Пример 243
2-{6-Фтор-1-[2-((S)-3-фтор-пирролидин-1-ил)-этил]-1H-индазол-3-ил}-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
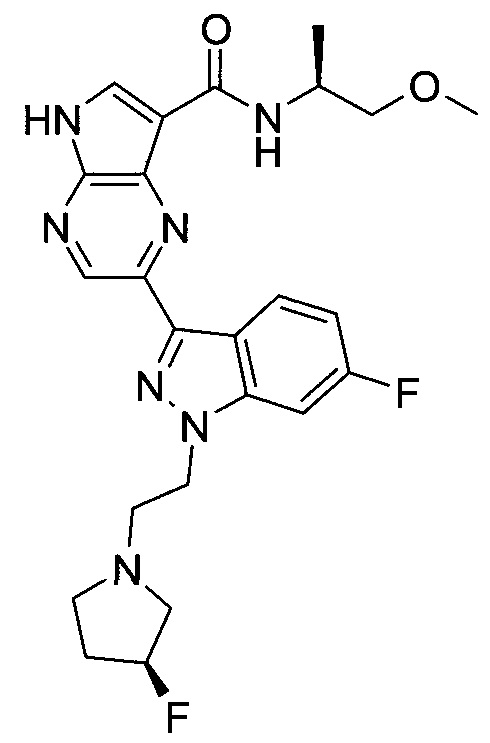
Получали в соответствии с методикой, приведенной в примере 237, стадии 2-3, заменяя (S)-1-(2-хлорэтил)-3-фторпирролидин на 4-(5-(хлорметил)пиридин-2-ил)морфолина гидрохлорид на стадии 2. MS: (M+H)+=484; 1H ЯМР (DMSO-d6) δ: 9.12 (s, 1H), 8.53 (dd, J=8,8; 5,3 Гц, 1H), 8.43 (s, 1H), 8.20 (d, J=8,3 Гц, 1H), 7.76 (d, J=9,0 Гц, 1H), 7.15 (t, J=8,7 Гц, 1H), 5.23 (br. s., 1H), 5.09 (br. s., 1H), 4.62 (t, J=6,3 Гц, 2H), 4.38 (br. s., 1H), 3.40-3.59 (m, 2H), 3.23-3.32 (s, 3H), 2.79-3.10 (m, 4H), 2.57-2.75 (m, 1H), 2.32-2.47 (m, 1H), 2.05 (m, 1H), 1.31 (d, J=6,8 Гц, 3H).
Пример 244
2-[6-Фтор-1-(2-пиразол-1-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид
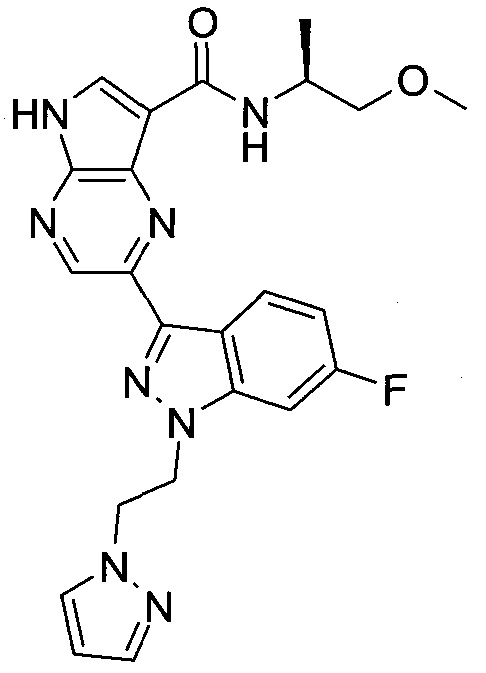
Получали в соответствии с методикой, приведенной в примере 237, стадии 2-3, заменяя 1-(2-бромэтил)-1H-пиразол на 4-(5-(хлорметил)пиридин-2-ил)морфолина гидрохлорид на стадии 2. MS: (M+H)+=463; 1H ЯМР (DMSO-d6) δ: 12.84 (br. s., 1H), 9.11 (s, 1H), 8.37-8.58 (m, 2H), 8.17 (d, J=8,3 Гц, 1H), 7.49 (d, J=2,0 Гц, 1H), 7.39 (s, 1H), 7.22-7.31 (m, 1H), 6.97-7.17 (m, 1H),6.08(s, 1H),4.91 (t,J=5,5 Гц, 2H), 4.62-4.74 (m, 2H), 4.37 (br. s., 1H), 3.49 (dt, J=17,9; 4,7 Гц, 2H), 3.27 (s, 3H), 1.30 (d, J=6,8 Гц, 3H).
Пример 245
2-[6-Хлор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид
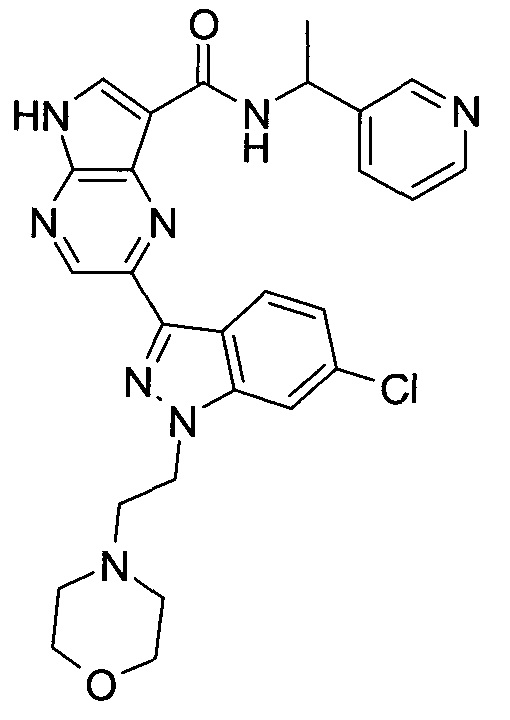
Стадия 1
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид
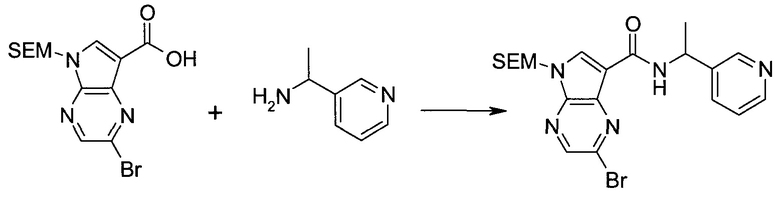
2-Бром-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (300 мг; 0,81 ммоль), 1-(пиридин-3-ил)этанамин (148 мг; 1,21 ммоль) и DIPEA (0,42 мл; 2,42 ммоль) объединяли в DMF (5 мл), получая желтый раствор. Затем добавляли HATU (306 мг; 0,81 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь разбавляли рассолом и экстрагировали этилацетатом (2×30 мл). Объединенные органические слои промывали водой и рассолом, затем сушили над MgSO4, фильтровали и концентрировали в вакууме, получая 350 мг (91%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амида в виде желтого масла. MS: (M+H)+=477.
Стадия 2
2-(6-Хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид
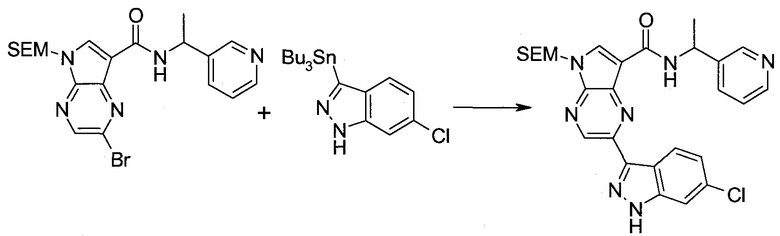
6-Хлор-3-трибутилстаннил-1H-индазол (584 мг; 1,32 ммоль), иодид меди(I) (14 мг; 0,074 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид (350 мг; 0,74 ммоль) объединяли в DMF (6 мл), получая желтый раствор. Смесь дегазировали, используя азот, в течение 10 мин, затем добавляли тетракис(трифенилфосфин)палладий(0) (42 мг; 0,037 ммоль) и реакционную смесь перемешивали в атмосфере азота при 90°C в течение 15 ч. Реакционную смесь охлаждали, разбавляли эфиром (60 мл) и промывали водой и рассолом. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (0-3% метанола в дихлорметане с 0,5% гидроксида аммония), получая 203 мг (48%)
2-(6-хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амида в виде пенообразного твердого вещества. MS: (M+H)+=549.
Стадия 3
2-[6-Хлор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид
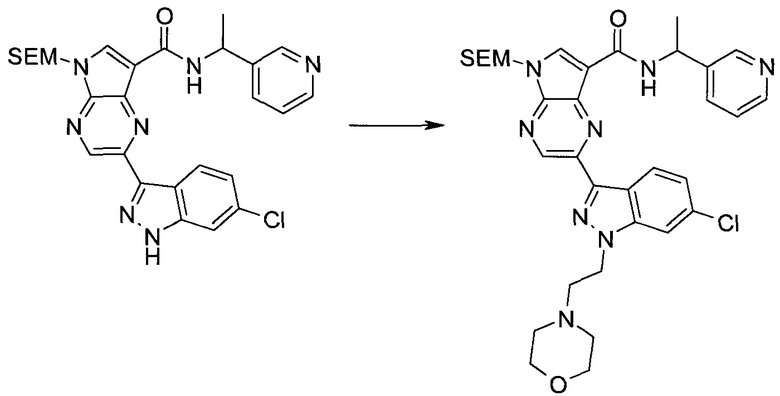
2-(6-Хлор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид (100 мг; 0,18 ммоль) объединяли с DMF (2 мл) при 0°C, получая желтый раствор. Добавляли гидрид натрия (60%-ный в минеральном масле; 22 мг; 0,55 ммоль) и реакционную смесь перемешивали при 0°C в течение 10 мин. Добавляли 4-(2-бромэтил)морфолина гидрохлорид (63 мг; 0,27 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 мин, затем нагревали до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь гасили 5 мл рассола и 10 мл воды и экстрагировали этилацетатом (2×30 мл). Объединенные органические слои промывали водой и рассолом, затем сушили с использованием MgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле (0-10% метанола в дихлорметане), получая 40 мг (33%) 2-[6-хлор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амида в виде пенообразного твердого вещества. MS: (M+H)+=662.
Стадия 4
2-[6-Хлор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид
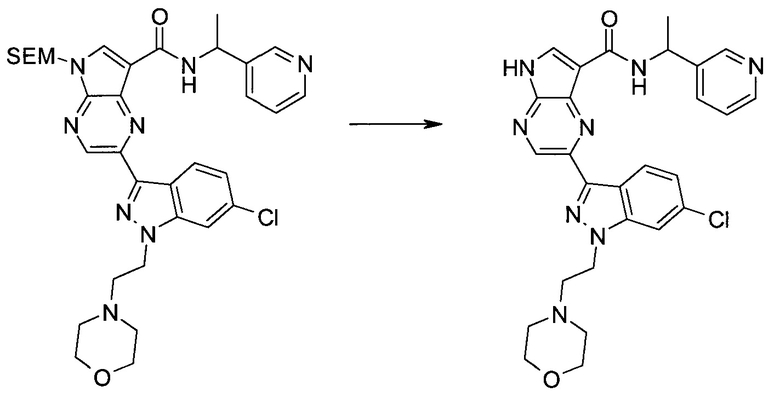
2-[6-Хлор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид (50 мг; 0,076 ммоль) объединяли с дихлорметаном (1 мл) и добавляли трифторуксусную кислоту (0,17 мл; 2,27 ммоль). После перемешивания в течение 2 ч реакционную смесь концентрировали в вакууме. Остаток растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,15 мл; 2,27 ммоль). Реакционную смесь перемешивали в течение 20 мин, затем концентрировали в вакууме и остаток растирали с водой (2 мл). Осадок отфильтровывали, промывали водой и сушили, получая 29 мг (68%) 2-[6-хлор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амида в виде желтого твердого вещества. MS: (M+H)+=531; 1H ЯМР (DMSO-d6) δ: 9.11 (s, 1H), 8.71 (br. s, 1H), 8.43-8.58 (m, 3H), 8.29-8.38 (m, 1H), 8.05 (s, 1H), 7.86 (d, J=7,3 Гц, 1H), 7.36 (br. s., 1H), 7.15 (d, J=8,3 Гц, 1H), 5.35 (t, J=6,9 Гц, 1H), 4.65 (br. s., 2H), 3.50 (br. s., 4H), 3.33 (br. s., 4H), 2.84 (br. s., 2H), 1.68 (d, J=6,3 Гц, 3H).
Пример 246
2-[6-Хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид
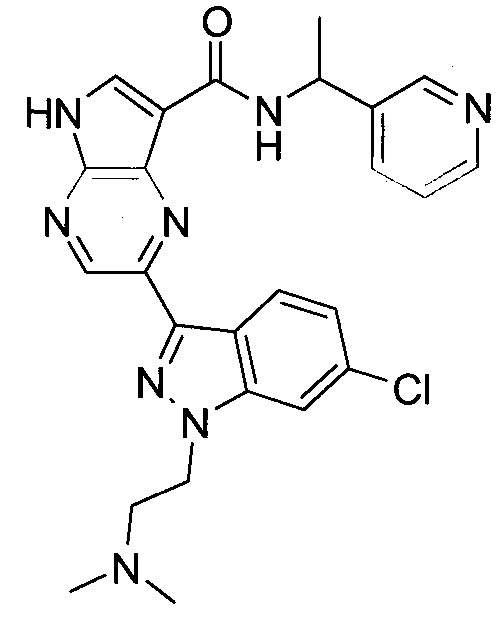
Получали в соответствии с методикой, приведенной в примере 245, стадии 3-4, заменяя 2-бром-N,N-диметилэтанамина гидробромид на 4-(2-бромэтил)морфолина гидрохлорид на стадии 3. MS: (M+H)+=489; 1H ЯМР (DMSO-d6) δ: 9.11 (s, 1H), 8.71 (br. s, 1H), 8.43-8.55 (m, 3H), 8.31 (d, J=8,5 Гц, 1H), 8.04 (s, 1H), 7.85 (d, J=7,5 Гц, 1H), 7.33-7.39 (m, 1H), 7.15 (d, J=8,5 Гц, 1H), 5.34 (t, J=6,8 Гц, 1H), 4.61 (br. s., 2H), 2.72-2.84 (m, 2H), 2.20 (s, 6H), 1.68 (d, J=6,5 Гц, 3H).
Пример 247
2-(6-Хлор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид
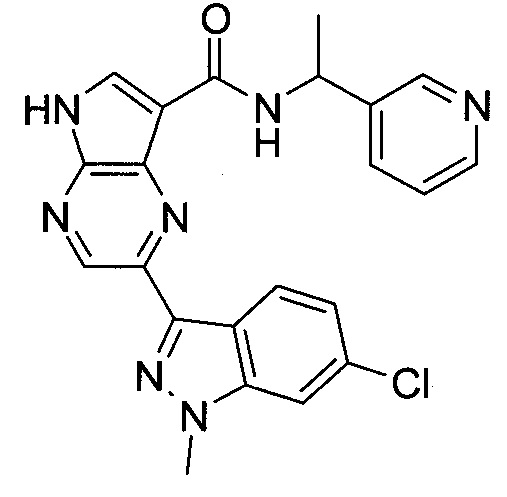
Получали в соответствии с методикой, приведенной в примере 245, стадии 3-4, заменяя иодметан на 4-(2-бромэтил)морфолина гидрохлорид на стадии 3. MS:(M+H)+=431.
Пример 248
2-[6-Фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амид
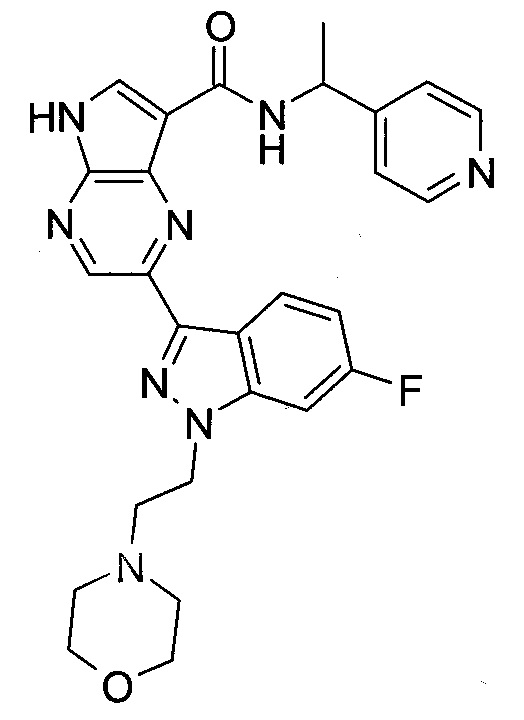
Стадия 1
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амид
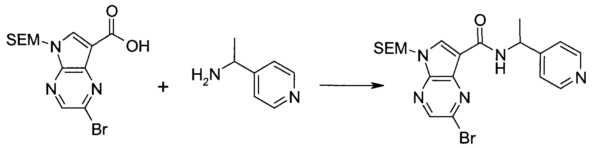
2-Бром-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (320 мг; 0,86 ммоль), 1-(пиридин-4-ил)этанамин (105 мг; 0,86 ммоль) и DIPEA (449 мг; 2,58 ммоль) объединяли в DMF (5 мл), получая желтый раствор. Добавляли HATU (327 мг; 0,86 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли рассолом и экстрагировали этилацетатом (3×20 мл). Объединенные органические слои промывали водой и рассолом, затем сушили с использованием MgSO4, фильтровали и концентрировали в вакууме, получая 380 мг (93%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амида в виде красного масла. MS: (M+H)+=477.
Стадия 2
2-(6-Фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амид
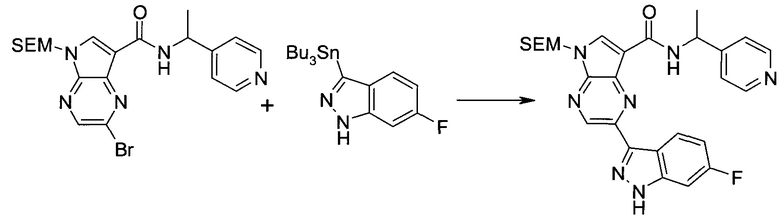
6-Фтор-3-трибутилстаннил-1H-индазол (0,48 г; 1,13 ммоль), иодид меди(I) (16 мг; 0,084 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амид (400 мг; 0,84 ммоль) объединяли в DMF (6 мл), получая желтый раствор. Смесь дегазировали в течение 10 мин, затем добавляли тетракис(трифенилфосфин)-палладий(0) (45 мг; 0,039 ммоль). Реакционную смесь перемешивали в атмосфере азота при 90°C в течение 15 ч. Реакционную смесь охлаждали, разбавляли эфиром (60 мл) и промывали водой и рассолом. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (0-3% метанола в дихлорметане с 0,5% гидроксида аммония), получая 390 мг (87%) 2-(6-фтор-1H-
индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амида в виде желтого твердого вещества. MS: (M+H)+=532.
Стадия 3
2-[6-Фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амид
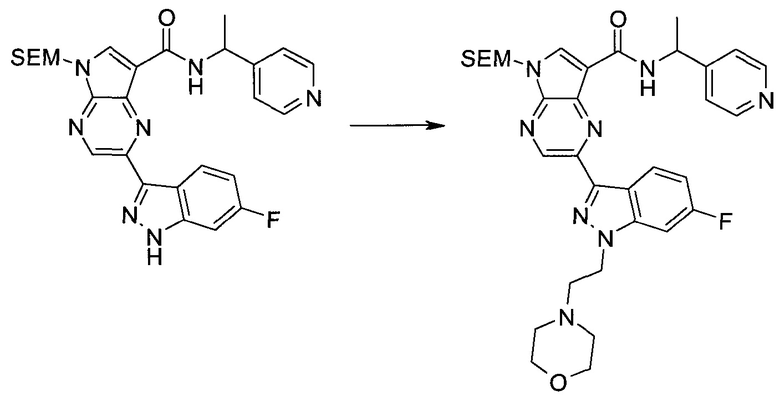
2-(6-Фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амид (100 мг; 0,19 ммоль) объединяли с DMF (2 мл) при 0°C, получая желтый раствор. Добавляли гидрид натрия (60%-ный в минеральном масле; 23 мг; 0,56 ммоль) и реакционную смесь перемешивали при 0°C в течение 10 мин. Добавляли 4-(2-бромэтил)морфолина гидрохлорид (55 мг; 0,28 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 мин, затем нагревали до комнатной температуры. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре, затем гасили 5 мл рассола и 10 мл воды и экстрагировали этилацетатом (2×30 мл). Объединенные органические слои промывали водой и рассолом, затем сушили с использованием MgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле (0-10% метанола в дихлорметане), получая 70 мг (58%) 2-[6-фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амида в виде пенообразного твердого вещества. MS: (M+H)+=645.
Стадия 4
2-[6-Фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амид
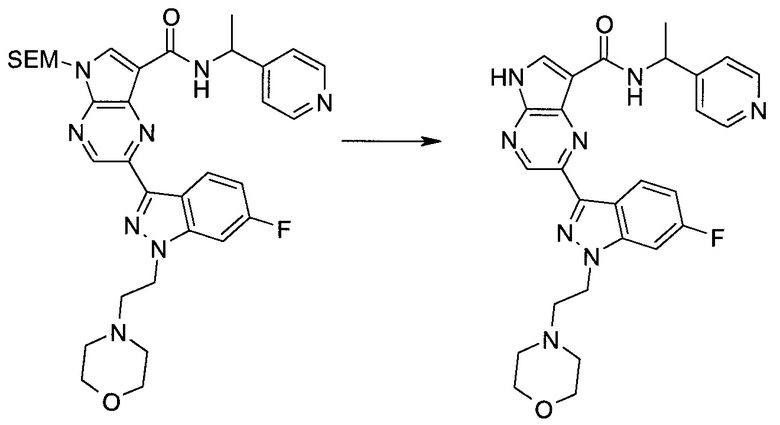
2-[6-Фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амид (70 мг; 0,11 ммоль) объединяли в дихлорметане (1 мл), затем добавляли трифторуксусную кислоту (0,24 мл; 3,26 ммоль). После перемешивания в течение 2 ч реакционную смесь концентрировали в вакууме. Остаток растворяли в дихлорметане (1 мл) и добавляли этилендиамин (0,22 мл; 3,26 ммоль). Реакционную смесь перемешивали в течение 20 мин, затем концентрировали в вакууме. Остаток разбавляли водой, затем экстрагировали CH2Cl2 (2×20 мл). Объединенные органические слои сушили с использованием MgSO4, фильтровали и концентрировали в вакууме, получая 26 мг (44%) 2-[6-фтор-1-(2-морфолин-4-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амида в виде желтого твердого вещества. MS: (M+H)+=515; 1H ЯМР (DMSO-d6) δ: 9.13 (s, 1H), 8.44-8.62 (m, 4H), 8.35 (dd, J=8,9; 5,4 Гц, 1H), 7.73 (dd, J=10,0; 2,0 Гц, 1H), 7.45 (d, J=6,0 Гц, 2H), 6.98 (d, J=2,0 Гц, 1H), 5.29 (t, J=7,2 Гц, 1H), 4.62 (t, J=6,4 Гц, 2H), 3.42-3.59 (m, 4H), 3.30 (m, 4H), 2.85 (t, J=6,4 Гц, 2H), 1.65 (d, J=7,0 Гц, 3H).
Пример 249
2-[6-Фтор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амид
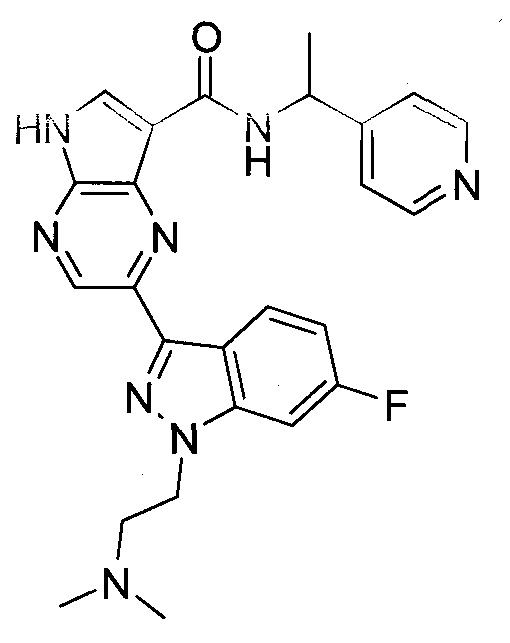
Получали в соответствии с методикой, приведенной в примере 248, стадии 3-4, заменяя 2-бром-N,N-диметилэтанамина гидробромид на 4-(2-бромэтил)-морфолина гидрохлорид на стадии 3. MS: (M+H)+=473; 1H ЯМР (DMSO-d6) δ: 9.12 (s, 1H), 8.42-8.63 (m, 4H), 8.35 (dd, J=8,8; 5,3 Гц, 1H), 7.70-7.81 (m, 1H), 7.45 (d, J=5,8 Гц, 2H), 6.98 (d, J=1,8 Гц, 1H), 5.29 (t, J=7,2 Гц, 1H), 4.58 (t, J=6,4 Гц, 2H), 2.81 (t, J=6,4 Гц, 2H), 2.21 (s, 6H), 1.65 (d, J=7,0 Гц, 3H).
Пример 250
2-[6-Фтор-1-(2-пирролидин-1-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амид
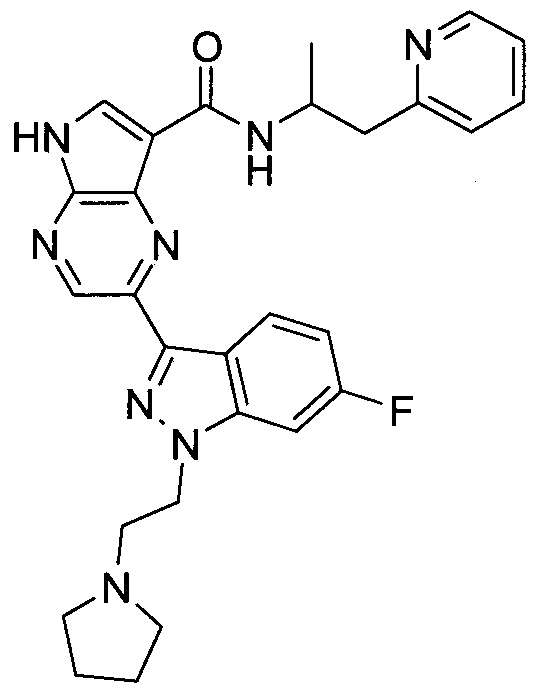
Стадия 1
2-Бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амид
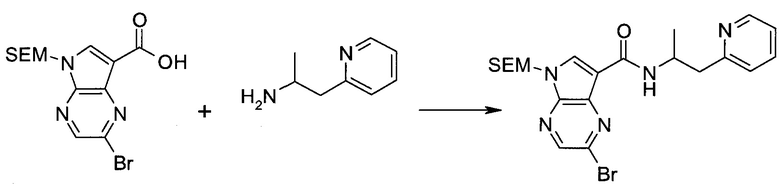
2-Бром-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (300 мг; 0,81 ммоль), 1-(пиридин-2-ил)пропан-2-амин (165 мг; 1,21 ммоль) и DIPEA (312 мг; 2,42 ммоль) объединяли в DMF (5 мл), получая желтый раствор. Добавляли HATU (306 мг; 0,81 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли рассолом и экстрагировали этилацетатом (2×30 мл). Объединенные органические слои промывали водой и рассолом, затем сушили с использованием MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (0-5% метанола в дихлорметане), получая 360 мг (86%) 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-
пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амида в виде желтого масла. MS: (M+H)+=491.
Стадия 2
2-(6-Фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амид
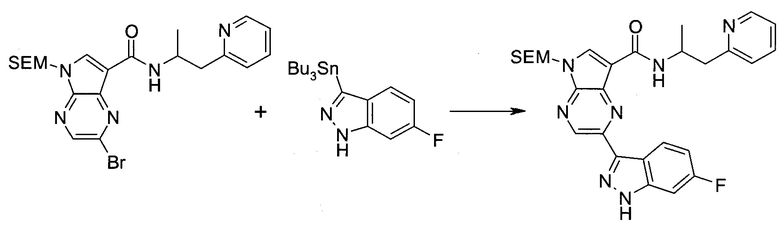
6-Фтор-3-трибутилстаннил-1H-индазол (0,20 г; 0,47 ммоль), иодид меди(I) (12 мг; 0,06 ммоль) и 2-бром-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амид (200 мг; 0,41 ммоль) объединяли в DMF (6 мл), получая желтый раствор. Смесь дегазировали, используя азот, в течение 10 мин, затем добавляли тетракис(трифенилфосфин)палладий(0) (23 мг; 0,02 ммоль). Реакционную смесь перемешивали при 90°C в атмосфере азота в течение 15 ч. Реакционную смесь охлаждали, разбавляли эфиром (60 мл) и промывали водой и рассолом. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (0-3% метанола в дихлорметане с 0,5% гидроксида аммония), получая 136 мг (61%) 2-(6-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амида в виде пенообразного твердого вещества. MS: (M+H)+=546.
Стадия 3
2-[6-Фтор-1-(2-пирролидин-1-ил-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амид
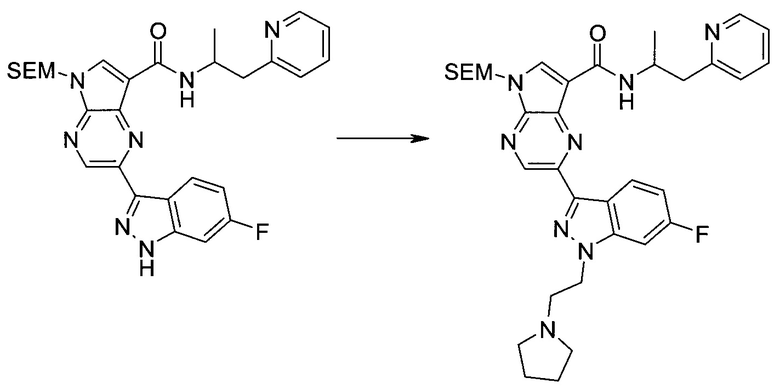
2-(6-Фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амид (70 мг; 0,13 ммоль) объединяли с DMF (2 мл) при 0°C, получая желтый раствор. Добавляли гидрид натрия (60%-ный в минеральном масле; 14 мг; 0,385 ммоль) и реакционную смесь перемешивали при 0°C в течение 10 мин. Добавляли 1-(2-бромэтил)пирролидина гидрохлорид (41 мг; 0,19 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 мин, затем нагревали до комнатной температуры. Реакционную смесь перемешивали в течение 2 ч, затем гасили 5 мл рассола и 10 мл воды и экстрагировали этилацетатом (2×30 мл). Объединенные органические слои промывали водой и рассолом, затем сушили с использованием MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (0-10% метанола в дихлорметане), получая 75 мг (91%) 2-[6-фтор-1-(2-пирролидин-1-ил-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амида в виде пенообразного твердого вещества. MS: (M+H)+=643.
Стадия 4
2-[6-Фтор-1-(2-пирролидин-1-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амид
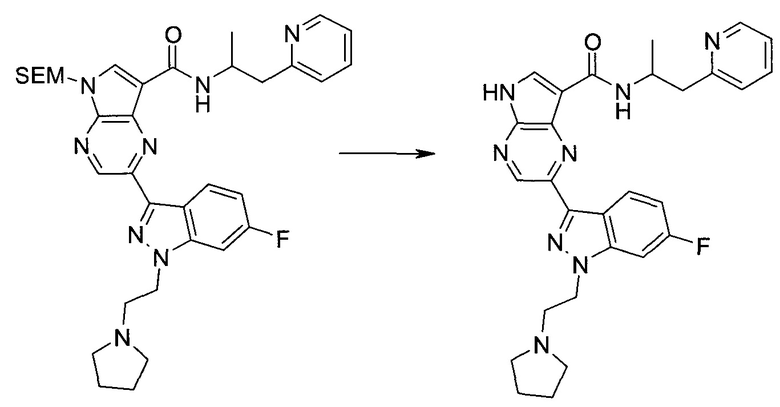
2-[6-Фтор-1-(2-пирролидин-1-ил-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амид (75 мг; 0,117 ммоль) объединяли с дихлорметаном (1 мл), затем добавляли трифторуксусную кислоту (0,26 мл; 3,50 ммоль). После перемешивания в течение 2 ч реакционную смесь концентрировали в вакууме. Остаток растворяли в дихлорметане (1 мл), добавляли этилендиамин (0,23 мл; 3,50 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 20 мин. Реакционную смесь концентрировали в вакууме и остаток растирали с водой (2 мл). Осадок отфильтровывали, промывали водой и сушили, получая 26 мг (41%) 2-[6-фтор-1-(2-пирролидин-1-ил-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амида (26 мг; 41%) в виде желтого твердого вещества. MS: (M+H)+=513; 1H ЯМР (DMSO-d6) δ: 9.07 (s, 1H), 8.32-8.44 (m, 2H), 8.22 (d, J=8,3 Гц, 1H), 7.73 (d, J=9,8 Гц, 1H), 7.50-7.66 (m, 2H), 7.27 (d, J=7,8 Гц, 1H), 7.03-7.16 (m, 2H), 4.53-4.67 (m, 4H), 4.46 (s, 1H), 3.02-3.25 (m, 2H), 2.98 (t, J=6,5 Гц, 3H), 1.64 (br. s., 5H), 1.29 (d, J=6,5 Гц, 3H).
Пример 251
2-[6-Фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид
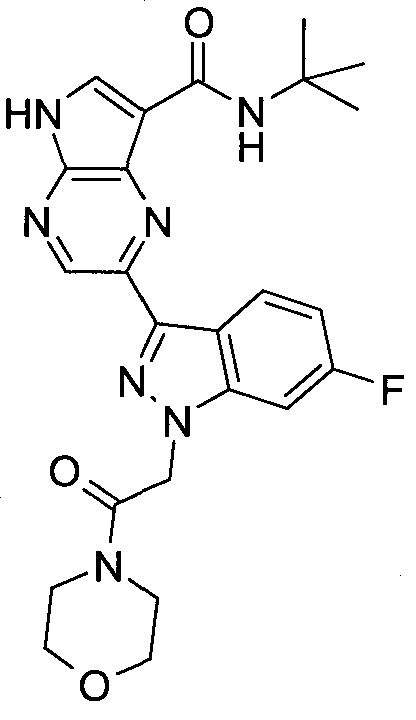
Стадия 1
2-[6-Фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид
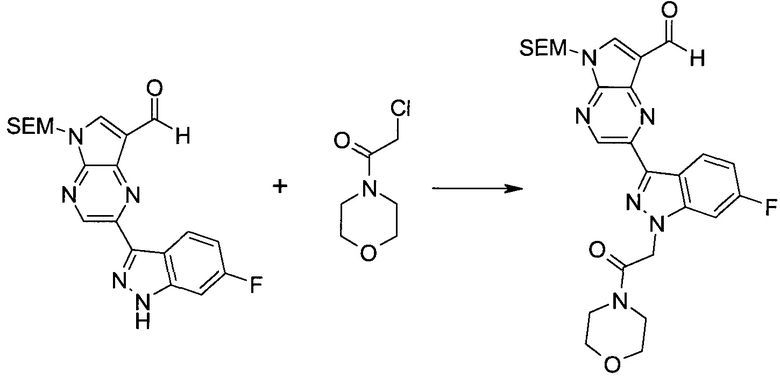
Во флакон емкостью 5 мл для микроволнового реактора загружали 2-(6-фтор-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (300 мг; 0,73 ммоль), 4-(2-хлорацетил)морфолин (0,19 мл; 1,46 ммоль), карбонат цезия (713 мг; 2,19 ммоль) и DMF (3,3 мл). Флакон промывали сильной струей аргона, герметично закрывали и нагревали в микроволновом реакторе при 100°C в течение 2 ч. Реакционную смесь гасили водой и экстрагировали диэтиловым эфиром (2×). Органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-70% EtOAc), получая 268 мг (68%) 2-[6-фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегида в виде желтого порошка.
Стадия 2
2-[6-Фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновая кислота
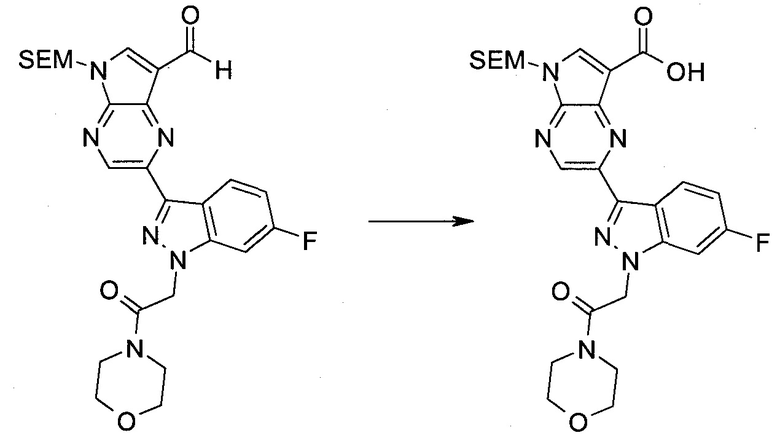
В круглодонной колбе емкостью 50 мл растворяли 2-[6-фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-
этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбальдегид (265 мг; 0,49 ммоль) в THF (10 мл) и воде (2 мл). Желтый раствор охлаждали до 0°C и добавляли сульфаминовую кислоту (287 мг; 2,95 ммоль). Затем по каплям через пипетку добавляли раствор хлорита натрия (80%-ного; 76 мг; 0,67 ммоль) и дигидрофосфата калия (803 мг; 5,9 ммоль) в воде (6 мл). По завершении добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток растирали со смесью гексаны/этилацетат, получая 259 мг (95%) 2-[6-фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты в виде светло-желтого порошка.
Стадия 3
2-[6-Фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид
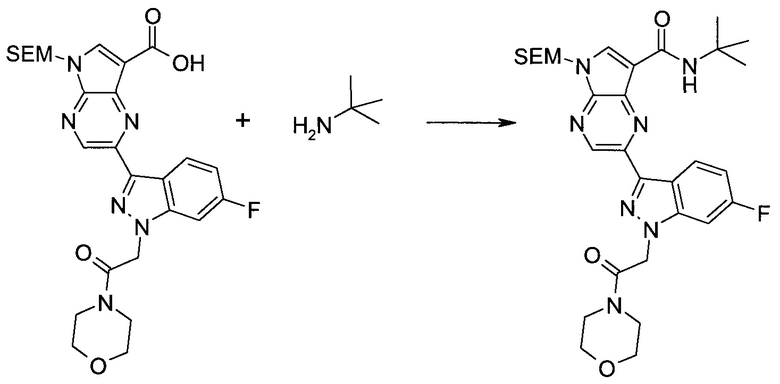
В круглодонной колбе емкостью 15 мл суспендировали 2-[6-фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (110 мг; 0,20 ммоль) в THF (3 мл) и добавляли 1,1'-карбонилдиимидазол (39 мг; 0,24 ммоль). Светло-желтую суспензию перемешивали при 60°C в течение 45 мин, за это время все твердые вещества растворялись. Реакционную смесь охлаждали до комнатной температуры, добавляли трет-бутиламин (0,20 мл; 1,9 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент: 0-80% EtOAc), получая 84 мг (70%) 2-[6-фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламида в виде беловатого твердого вещества.
Стадия 4
2-[6-Фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид
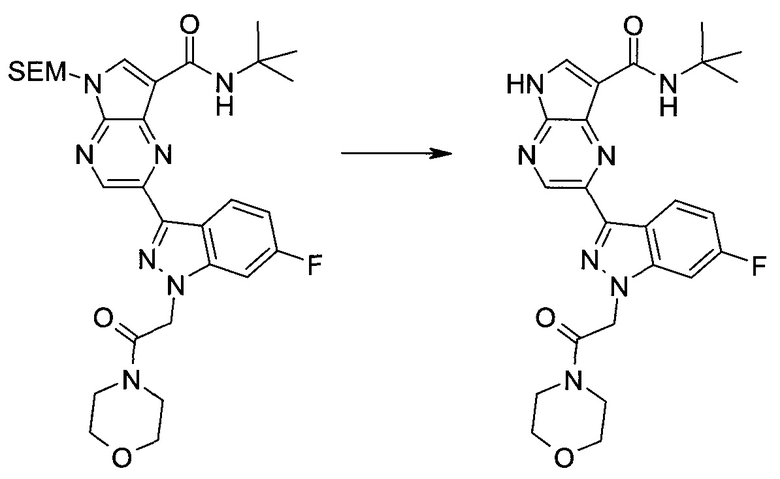
В круглодонной колбе растворяли 2-[6-фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид (81 мг; 0,13 ммоль) в дихлорметане (0,7 мл) и добавляли трифторуксусную кислоту (0,41 мл; 5,32 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане (0,7 мл) и добавляли этилендиамин (0,54 мл; 8,00 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем гасили водой и разбавляли этилацетатом. Полученную суспензию фильтровали и промывали горячей водой и этилацетатом и сушили под высоким вакуумом, получая 38 мг (60%) 2-[6-фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламида в виде беловатого порошка. MS: (M+Na)+=502; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 12.81 (br. s., 1H), 9.04 (s, 1H), 8.49 (dd, J=8,8; 5,3 Гц, 1H), 8.40 (s, 1H),7.95(s, 1H), 7.62 (dd, J=10,0; 2,1 Гц, 1H), 7.16 (td, J=9,1; 2,3 Гц, 1H), 5.60 (s, 2H), 3.69-3.77 (m, 2H), 3.57-3.67 (m, 4H), 3.42-3.50 (m, 2H), 1.53 (s, 9H).
Пример 252
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксетан-3-ил-этил)-амид
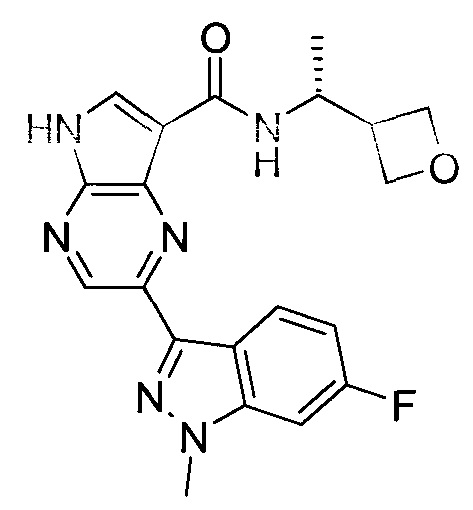
Стадия 1
Оксетан-3-карбальдегид
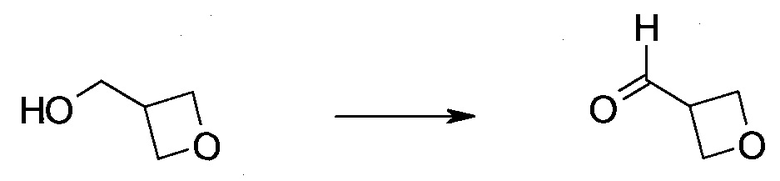
В круглодонной колбе емкостью 50 мл растворяли оксетан-3-илметанол (330 мг; 3,75 ммоль) в дихлорметане (16 мл). Добавляли пиридинийхлорхромат (888 мг; 4,12 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Темно-коричневую суспензию фильтровали через целит и промывали дихлорметаном. Фильтрат концентрировали при комнатной температуре, получая оксетан-3-карбальдегид в виде темно-коричневого масла, которое использовали без дополнительной очистки.
Стадия 2
(S)-2-Метил-пропан-2-сульфиновой кислоты 1-оксетан-3-ил-мет-(E)-илиденамид
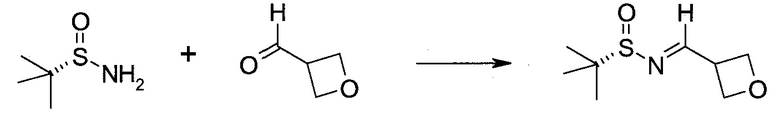
В круглодонной колбе растворяли оксетан-3-карбальдегид (452 мг; 3,15 ммоль) в дихлорметане (18 мл) и добавляли (S)-2-метилпропан-2-сульфинамид (435 мг; 3,59 ммоль) и безводный сульфат меди(II) (1,11 г; 6,93 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 48 часов, затем фильтровали через стеклянный микроволокнистый фильтр, промывая дихлорметаном. Фильтрат концентрировали и остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент: 0-30% EtOAc), получая 173 мг (29%) (S)-2-метил-пропан-2-сульфиновой кислоты 1-оксетан-3-ил-мет-(E)-илиденамида в виде бесцветного масла. 1H ЯМР (CDCl3, 300 МГц): δ (млн-1) 8.28 (d, J=4,9 Гц, 1H), 4.74-5.00 (m, 4H), 4.00-4.19 (m, 1H), 1.23 (s, 9H).
Стадия 3
(S)-2-Метил-пропан-2-сульфиновой кислоты ((R)-1-оксетан-3-ил-этил)-амид
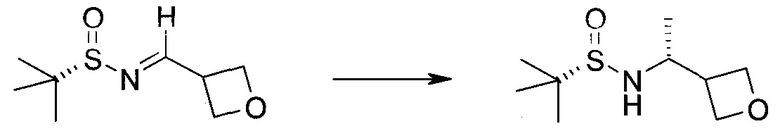
В круглодонной колбе растворяли (S)-2-метил-пропан-2-сульфиновой кислоты 1-оксетан-3-ил-мет-(E)-илиденамид (172 мг; 0,91 ммоль) в дихлорметане (3,6 мл). Бесцветный раствор охлаждали до -76°C и по каплям добавляли бромид метилмагния (3,0 М в диэтиловом эфире; 0,91 мл; 2,73 ммоль). Реакционную
смесь перемешивали при -76°C в течение 3 ч и затем оставляли медленно нагреваться до комнатной температуры в течение ночи. Реакцию гасили насыщенным раствором NH4Cl, затем экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали, получая 143 мг (77%) (S)-2-метил-пропан-2-сульфиновой кислоты ((R)-1-оксетан-3-ил-этил)-амида в виде светло-желтого масла, которое использовали без дополнительной очистки.
Стадия 3
(R)-1-Оксетан-3-ил-этиламин

В круглодонной колбе растворяли (S)-2-метил-пропан-2-сульфиновой кислоты ((R)-1-оксетан-3-ил-этил)-амид (142 мг; 0,69 ммоль) в метаноле (3 мл). Бледно-желтый раствор охлаждали до 0°C и по каплям добавляли хлористый водород (4,0 М в 1,4-диоксане; 0,24 мл; 0,96 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 ч, затем гасили насыщенным водным NaHCO3 и экстрагировали дихлорметаном (2×). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали, получая (R)-1-оксетан-3-ил-этиламин в виде светло-желтого масла, которое использовали без дополнительной очистки.
Стадия 4
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксетан-3-ил-этил)-амид
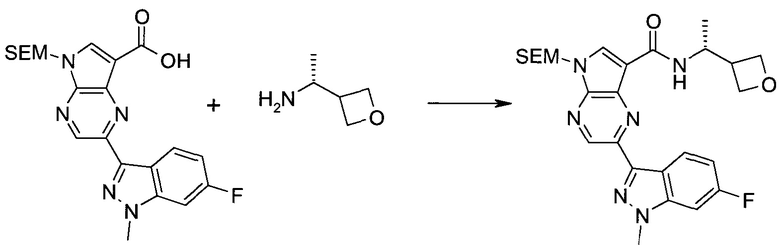
В круглодонную колбу загружали 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту (100 мг; 0,23 ммоль) и (R)-1-оксетан-3-ил-этиламин (120 мг; 0,59 ммоль). Добавляли DMF (1 мл), затем N,N-диизопропилэтиламин (0,16 мл; 0,92 ммоль) и HATU (95 мг; 0,25 ммоль). Желтую реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали
диэтиловым эфиром (2×). Объединенные органические слои дважды промывали водой и один раз рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент: 0-60% EtOAc), получая 31 мг (26%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксетан-3-ил-этил)-амида в виде беловатого твердого вещества.
Стадия 5
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксетан-3-ил-этил)-амид
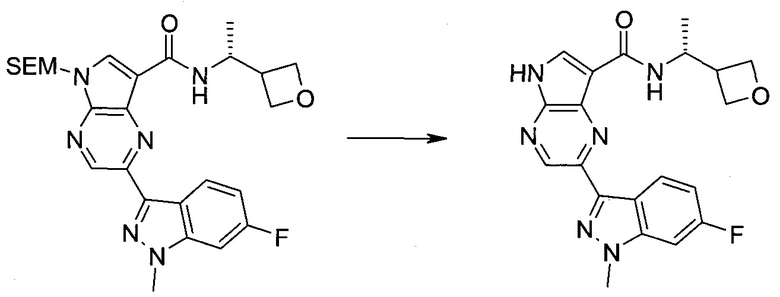
В круглодонной колбе растворяли 2-(6-фтор-1-метил-1H-индазол-3-ил)-5-(2-триметилсиланил-этоксиметил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксетан-3-ил-этил)-амид (29 мг; 0,055 ммоль) во фториде тетрабутиламмония (1,0 М в THF; 0,56 мл; 0,56 ммоль). Светло-коричневую реакционную смесь перемешивали при 70°C в течение 4 ч, затем охлаждали до комнатной температуры, гасили водой и экстрагировали EtOAc (2×). Объединенные органические слои промывали водой и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси MeOH/CH2Cl2 (0,5% NH4OH) (градиент: 0-5% MeOH), получая 14 мг (64%) 2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксетан-3-ил-этил)-амида в виде светло-желтого твердого вещества. Посредством хиральной HPLC определяли, что оптическая чистота составляла 60% ее. MS: (M+Na)+=417; 1H ЯМР (DMSO-d6, 400 МГц): δ (млн-1) 12.87 (br. s, 1H), 9.10 (s, 1H), 8.46 (s, 1H), 8.42 (dd, J=8,8; 5,3 Гц, 1H), 8.07 (d, J=8,6 Гц, 1H), 7.71 (dd, J=9,9; 1,8 Гц, 1H), 7.25 (td, J=9,1; 2,0 Гц, 1H), 4.69 (dd, J=7,6; 6,1 Гц, 1H), 4.53-4.65 (m, 2H), 4.50 (t, J=6,1 Гц, 1H), 4.42 (t, J=6,3 Гц, 1H), 4.16 (s, 3H), 3.10-3.23 (m, 1H), 1.24 (d, J=6,6 Гц, 3H).
Пример 253
2-(6-Фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(S)-1-(3-трифторметокси-фенил)-этил]-амид
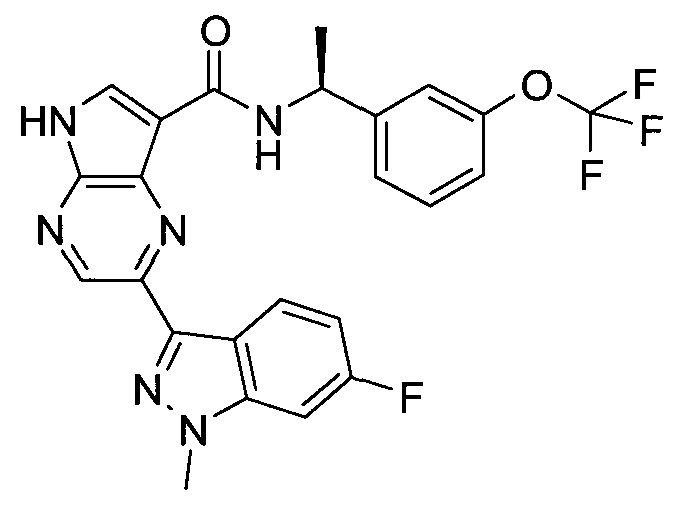
Стадия 1
(S)-2-Метил-пропан-2-сульфиновой кислоты 1-(3-трифторметокси-фенил)-мет-(E)-илиденамид
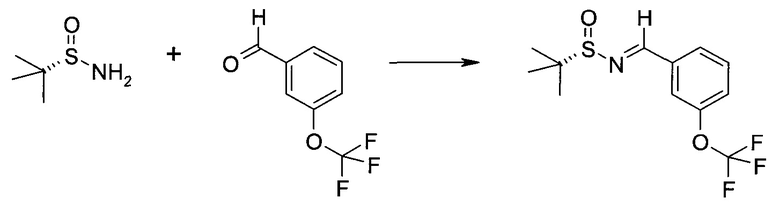
В круглодонной колбе емкостью 50 мл растворяли 3-(трифторметокси)-бензальдегид (400 мг; 2,1 ммоль) в дихлорметане (12 мл) и добавляли (S)-2-метилпропан-2-сульфинамид (281 мг; 2,31 ммоль) и безводный сульфат меди(II) (739 мг; 4,63 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем фильтровали через стеклянный микроволокнистый фильтр, промывая дихлорметаном. Фильтрат концентрировали и остаток хроматографировали на силикагеле с использованием смеси EtOAc/гексаны (градиент 0-20% EtOAc), получая 430 мг (70%) (S)-2-метил-пропан-2-сульфиновой кислоты 1-(3-трифторметокси-фенил)-мет-(E)-илиденамида в виде светло-желтого масла.
Стадия 2
(S)-2-Метил-пропан-2-сульфиновой кислоты [(R)-1-(3-трифторметокси-фенил)-этил]-амид и (S)-2-метил-пропан-2-сульфиновой кислоты [(S)-1-(3-трифторметокси-фенил)-этил]-амид
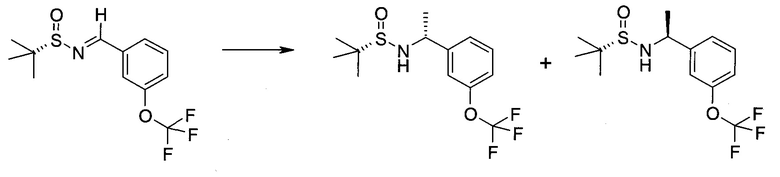
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРРОЛО[2,3-В]ПИРАЗИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ SYK | 2013 |
|
RU2656853C2 |
| СОЕДИНЕНИЯ ПИРИДАЗИНАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ТИРОЗИНКИНАЗЫ СЕЛЕЗЕНКИ (SYK) | 2013 |
|
RU2627661C2 |
| ПРОИЗВОДНЫЕ 6-КАРБОНИТРИЛ ДИПИРИДОПИРРОЛЫ И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ РАКА | 2010 |
|
RU2575635C2 |
| АЗОТСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРА КАЛЛИКРЕИНА ПЛАЗМЫ | 2014 |
|
RU2712621C2 |
| АЗАИНДОЛЫ | 2002 |
|
RU2326880C2 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИММУНОЛОГИЧЕСКИХ И ОНКОЛОГИЧЕСКИХ СОСТОЯНИЙ | 2009 |
|
RU2545023C9 |
| Имидазопирролопиразиновые производные, полезные для лечения заболеваний, вызванных аномальной активностью протеинкиназ Jak1, Jak3 или Syk | 2010 |
|
RU2711869C2 |
| Спироконденсированные пирролидиновые производные в качестве ингибиторов деубиквитилирующих ферментов (DUB) | 2017 |
|
RU2730552C2 |
| ИМИДАЗОПИРРОЛОПИРАЗИНОВЫЕ ПРОИЗВОДНЫЕ, ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ АНОМАЛЬНОЙ АКТИВНОСТЬЮ ПРОТЕИНКИНАЗ Jak1, Jak3 ИЛИ Syk | 2010 |
|
RU2570416C2 |
| ПЕРВИЧНЫЕ КАРБОКСАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ BТK | 2014 |
|
RU2708395C2 |
Изобретение относится к соединению формулы I
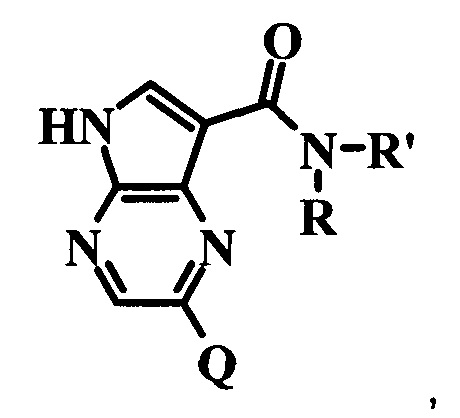
где R представляет собой Н; R' представляет собой C1-6 алкокси или 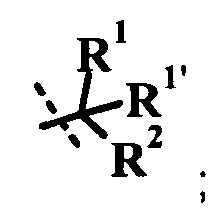 или R и R' вместе образуют 4-членный гетероциклоалкил, содержащий один атом азота в качестве кольцевого гетероатома, возможно замещенный группой -CN; R1 представляет собой Н или R1a; R1a представляет собой C1-6 алкил, С3-8 циклоалкил, C1-6 алкокси, гидрокси-C1-6 алкил или галоген-C1-6 алкил; R1 представляет собой Н или C1-6 алкил; или R1a и R1' вместе образуют 4-6-членный гетероциклоалкил, содержащий один кольцевой гетероатом, выбранный из N, О и S(=O)2, С3-8 циклоалкил, индан-1-ил или фенил, возможно замещенный одним или более R1"; каждый R1" независимо представляет собой гидрокси, амино, оксо, C1-6 алкил, -C(=O)NH2, -CN, галоген-C1-6 алкил, бензил, циано-C1-6 алкил или -NHC(=O)OC(CH3)3; R2 представляет собой Н, гидрокси, -CN, -С(=O)ОН, -С(=O)ОС(СН3)3, R2a или R2b; R2a представляет собой C1-6 алкил, фенил, фенил-C1-6 алкил, С3-8 циклоалкил, гетероарил, гетероциклоалкил, гетероциклоалкил-C1-6 алкил, гетероарил-C1-6 алкил, фенил-C1-6 алкокси, C1-6 алкокси, возможно замещенный одним или более R2a', где гетероарил выбран из оксазолила, изоксазолила, 4,5-дигидро-оксазолила, пиридинила, имидазолила и пиразолила, и где гетероциклоалкил выбран из тетрагидрофуранила, азетидинила, оксетанила, пирролидинила и тетрагидропиранила; каждый R2a' независимо представляет собой гидрокси, -CN, амино, C1-6 алкил-сульфониламино, C1-6 алкокси, атом галогена, C1-6 алкил, циано-C1-6 алкил, галоген-C1-6 алкил, C1-6 алкил-сульфонил, галоген-C1-6 алкокси, С3-8 циклоалкил; R2b представляет собой -C(=O)R3 или -CH2C(=O)R3; R3 представляет собой гетероциклоалкил, выбранный из пиперидинила, азетидинила, 2-окса-6-аза-спиро[3.3]гептила, морфолинила и пирролидинила, возможно замещенный одним или более R3'; каждый R3' независимо представляет собой -CN, атом галогена или C1-6 алкил; Q представляет собой 1Н-индазол-3-ил, 4,5,6,7-тетрагидро-1Н-индазол-3-ил, 1Н-индол-3-ил, 5,6,7,8-тетрагидроимидазо[1,5-а]пиридин-1-ил, имидазо[1,5-a] пиридин-1-ил, индазол-1-ил, 1Н-пиразоло[3,4-b]пиридин-3-ил, 1Н-пиразоло[4,3-b] пиридин-3-ил, имидазо[1,2-а]пиридин-3-ил, 2-окси-4,5,6,7-тетрагидро-1Н-индазол-3-ил, бензоимидазол-1-ил, изохинолин-1-ил, изохинолин-8-ил, 1Н-тиено[3,2-с]пиразол-3-ил, 1,4,5,6-тетрагидро-циклопентапиразол-3-ил, 5,6-дигидро-4Н-циклопентапиразол-1-ил, 1,4,5,6,7,8-гексагидро-циклогептапиразол-3-ил, 1Н-индол-7-ил, 1Н-пирроло[2,3-с]пиридин-7-ил, 1Н-индазол-4-ил или 1Н-индазол-7-ил, возможно замещенный одним или более Qa или Qb; каждый Qa независимо представляет собой атом галогена, гидрокси или -(CH2)nC(=O)Qa'; каждый Qa' независимо представляет собой гидрокси, амино или гетероциклоалкил, где гетероциклоалкил выбран из морфолинила и пиперазинила и возможно замещен одним или более Qa"; каждый Qa" независимо представляет собой алкил или галоген-С1-6 алкил; m равно 1, 2 или 3; каждый Qb независимо представляет собой алкил, С3-8 циклоалкил, C1-6 алкокси, фенокси, алкил-сульфонил, гетероциклоалкил, гетероциклоалкил-C1-6 алкил или гетероарил-C1-6 алкил, возможно замещенный одним или более Qb', где гетероциклоалкил выбран из оксетанила, азетидинила, пиперидинила, пирролидинила, морфолинила и [1,3]диоксанила, и где гетероарил выбран из пиридинила, пиразолила, изоксазолила и имидазолила; и каждый Qb' независимо представляет собой гидрокси, атом галогена, -CN, амино, морфолинил, C1-6 алкил, бензил или C1-6 алкил-сульфонил; или его фармацевтически приемлемой соли, которое ингибирует янус-киназу (JAK) и тирозинкиназу селезенки (SYK) и полезно для лечения аутоиммунных и воспалительных заболеваний. 5 н. и 12 з.п. ф-лы, 2 табл., 466 пр.
или R и R' вместе образуют 4-членный гетероциклоалкил, содержащий один атом азота в качестве кольцевого гетероатома, возможно замещенный группой -CN; R1 представляет собой Н или R1a; R1a представляет собой C1-6 алкил, С3-8 циклоалкил, C1-6 алкокси, гидрокси-C1-6 алкил или галоген-C1-6 алкил; R1 представляет собой Н или C1-6 алкил; или R1a и R1' вместе образуют 4-6-членный гетероциклоалкил, содержащий один кольцевой гетероатом, выбранный из N, О и S(=O)2, С3-8 циклоалкил, индан-1-ил или фенил, возможно замещенный одним или более R1"; каждый R1" независимо представляет собой гидрокси, амино, оксо, C1-6 алкил, -C(=O)NH2, -CN, галоген-C1-6 алкил, бензил, циано-C1-6 алкил или -NHC(=O)OC(CH3)3; R2 представляет собой Н, гидрокси, -CN, -С(=O)ОН, -С(=O)ОС(СН3)3, R2a или R2b; R2a представляет собой C1-6 алкил, фенил, фенил-C1-6 алкил, С3-8 циклоалкил, гетероарил, гетероциклоалкил, гетероциклоалкил-C1-6 алкил, гетероарил-C1-6 алкил, фенил-C1-6 алкокси, C1-6 алкокси, возможно замещенный одним или более R2a', где гетероарил выбран из оксазолила, изоксазолила, 4,5-дигидро-оксазолила, пиридинила, имидазолила и пиразолила, и где гетероциклоалкил выбран из тетрагидрофуранила, азетидинила, оксетанила, пирролидинила и тетрагидропиранила; каждый R2a' независимо представляет собой гидрокси, -CN, амино, C1-6 алкил-сульфониламино, C1-6 алкокси, атом галогена, C1-6 алкил, циано-C1-6 алкил, галоген-C1-6 алкил, C1-6 алкил-сульфонил, галоген-C1-6 алкокси, С3-8 циклоалкил; R2b представляет собой -C(=O)R3 или -CH2C(=O)R3; R3 представляет собой гетероциклоалкил, выбранный из пиперидинила, азетидинила, 2-окса-6-аза-спиро[3.3]гептила, морфолинила и пирролидинила, возможно замещенный одним или более R3'; каждый R3' независимо представляет собой -CN, атом галогена или C1-6 алкил; Q представляет собой 1Н-индазол-3-ил, 4,5,6,7-тетрагидро-1Н-индазол-3-ил, 1Н-индол-3-ил, 5,6,7,8-тетрагидроимидазо[1,5-а]пиридин-1-ил, имидазо[1,5-a] пиридин-1-ил, индазол-1-ил, 1Н-пиразоло[3,4-b]пиридин-3-ил, 1Н-пиразоло[4,3-b] пиридин-3-ил, имидазо[1,2-а]пиридин-3-ил, 2-окси-4,5,6,7-тетрагидро-1Н-индазол-3-ил, бензоимидазол-1-ил, изохинолин-1-ил, изохинолин-8-ил, 1Н-тиено[3,2-с]пиразол-3-ил, 1,4,5,6-тетрагидро-циклопентапиразол-3-ил, 5,6-дигидро-4Н-циклопентапиразол-1-ил, 1,4,5,6,7,8-гексагидро-циклогептапиразол-3-ил, 1Н-индол-7-ил, 1Н-пирроло[2,3-с]пиридин-7-ил, 1Н-индазол-4-ил или 1Н-индазол-7-ил, возможно замещенный одним или более Qa или Qb; каждый Qa независимо представляет собой атом галогена, гидрокси или -(CH2)nC(=O)Qa'; каждый Qa' независимо представляет собой гидрокси, амино или гетероциклоалкил, где гетероциклоалкил выбран из морфолинила и пиперазинила и возможно замещен одним или более Qa"; каждый Qa" независимо представляет собой алкил или галоген-С1-6 алкил; m равно 1, 2 или 3; каждый Qb независимо представляет собой алкил, С3-8 циклоалкил, C1-6 алкокси, фенокси, алкил-сульфонил, гетероциклоалкил, гетероциклоалкил-C1-6 алкил или гетероарил-C1-6 алкил, возможно замещенный одним или более Qb', где гетероциклоалкил выбран из оксетанила, азетидинила, пиперидинила, пирролидинила, морфолинила и [1,3]диоксанила, и где гетероарил выбран из пиридинила, пиразолила, изоксазолила и имидазолила; и каждый Qb' независимо представляет собой гидрокси, атом галогена, -CN, амино, морфолинил, C1-6 алкил, бензил или C1-6 алкил-сульфонил; или его фармацевтически приемлемой соли, которое ингибирует янус-киназу (JAK) и тирозинкиназу селезенки (SYK) и полезно для лечения аутоиммунных и воспалительных заболеваний. 5 н. и 12 з.п. ф-лы, 2 табл., 466 пр.
1. Соединение формулы I
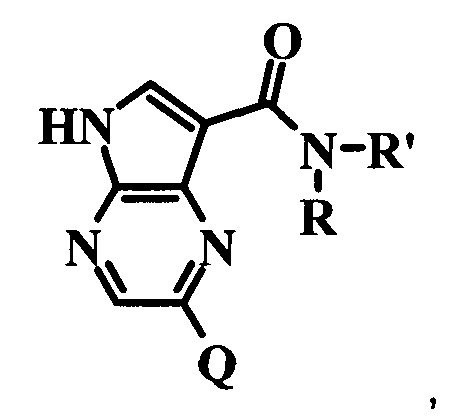
где
R представляет собой Н;
R' представляет собой C1-6 алкокси или 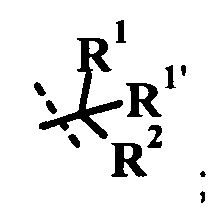
или R и R' вместе образуют 4-членный гетероциклоалкил, содержащий один атом азота в качестве кольцевого гетероатома, возможно замещенный группой -CN;
R1 представляет собой Н или R1a;
R1a представляет собой C1-6 алкил, С3-8 циклоалкил, C1-6 алкокси, гидрокси-C1-6 алкил или галоген-C1-6 алкил;
R1 представляет собой Н или C1-6 алкил;
или R1a и R1' вместе образуют 4-6-членный гетероциклоалкил, содержащий один кольцевой гетероатом, выбранный из N, О и S(=O)2, С3-8 циклоалкил, индан-1-ил или фенил, возможно замещенный одним или более R1";
каждый R1" независимо представляет собой гидрокси, амино, оксо, C1-6 алкил, -C(=O)NH2, -CN, галоген-C1-6 алкил, бензил, циано-C1-6 алкил или -NHC(=O)OC(CH3)3;
R2 представляет собой Н, гидрокси, -CN, -С(=O)ОН, -С(=O)ОС(СН3)3, R2a или R2b;
R2a представляет собой C1-6 алкил, фенил, фенил-C1-6 алкил, С3-8 циклоалкил, гетероарил, гетероциклоалкил, гетероциклоалкил-C1-6 алкил, гетероарил-C1-6 алкил, фенил-C1-6 алкокси, C1-6 алкокси, возможно замещенный одним или более R2a', где гетероарил выбран из оксазолила, изоксазолила, 4,5-дигидро-оксазолила, пиридинила, имидазолила и пиразолила, и где гетероциклоалкил выбран из тетрагидрофуранила, азетидинила, оксетанила, пирролидинила и тетрагидропиранила;
каждый R2a' независимо представляет собой гидрокси, -CN, амино, C1-6 алкил-сульфониламино, C1-6 алкокси, атом галогена, C1-6 алкил, циано-C1-6 алкил, галоген-C1-6 алкил, C1-6 алкил-сульфонил, галоген-C1-6 алкокси, С3-8 циклоалкил;
R2b представляет собой -C(=O)R3 или -CH2C(=O)R3;
R3 представляет собой гетероциклоалкил, выбранный из пиперидинила, азетидинила, 2-окса-6-аза-спиро[3.3]гептила, морфолинила и пирролидинила, возможно замещенный одним или более R3';
каждый R3' независимо представляет собой -CN, атом галогена или C1-6 алкил;
Q представляет собой 1Н-индазол-3-ил, 4,5,6,7-тетрагидро-1Н-индазол-3-ил, 1Н-индол-3-ил, 5,6,7,8-тетрагидроимидазо[1,5-а]пиридин-1-ил, имидазо[1,5-a] пиридин-1-ил, индазол-1-ил, 1Н-пиразоло[3,4-b]пиридин-3-ил, 1Н-пиразоло[4,3-b] пиридин-3-ил, имидазо[1,2-а]пиридин-3-ил, 2-окси-4,5,6,7-тетрагидро-1Н-индазол-3-ил, бензоимидазол-1-ил, изохинолин-1-ил, изохинолин-8-ил, 1Н-тиено[3,2-с]пиразол-3-ил, 1,4,5,6-тетрагидро-циклопентапиразол-3-ил, 5,6-дигидро-4Н-циклопентапиразол-1-ил, 1,4,5,6,7,8-гексагидро-циклогептапиразол-3-ил, 1Н-индол-7-ил, 1Н-пирроло[2,3-с]пиридин-7-ил, 1Н-индазол-4-ил или 1Н-индазол-7-ил, возможно замещенный одним или более Qa или Qb;
каждый Qa независимо представляет собой атом галогена, гидрокси или -(CH2)nC(=O)Qa';
каждый Qa' независимо представляет собой гидрокси, амино или гетероциклоалкил, где гетероциклоалкил выбран из морфолинила и пиперазинила и возможно замещен одним или более Qa";
каждый Qa" независимо представляет собой С1-6 алкил или галоген-С1-6 алкил;
n равно 1, 2 или 3;
каждый Qb независимо представляет собой С1-6 алкил, С3-8 циклоалкил, C1-6 алкокси, фенокси, С1-6 алкил-сульфонил, гетероциклоалкил, гетероциклоалкил-C1-6 алкил или гетероарил-C1-6 алкил, возможно замещенный одним или более Qb', где гетероциклоалкил выбран из оксетанила, азетидинила, пиперидинила, пирролидинила, морфолинила и [1,3]диоксанила, и где гетероарил выбран из пиридинила, пиразолила, изоксазолила и имидазолила; и
каждый Qb' независимо представляет собой гидрокси, атом галогена, -CN, амино, морфолинил, C1-6 алкил, бензил или C1-6 алкил-сульфонил;
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, где R представляет собой Н, и R' представляет собой 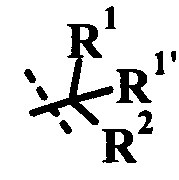 .
.
3. Соединение по п. 1, где R1 представляет собой C1-6 алкил.
4. Соединение по п. 1, где оба R1 и R1' представляют собой Н.
5. Соединение по п. 1, где R2 представляет собой -C(=O)R3.
6. Соединение по п. 1, где R2 представляет собой C1-6 алкил, возможно замещенный одним или более R2a'.
7. Соединение по п. 1, где Q представляет собой 1Н-индазол-3-ил, возможно замещенный одним или более Qa или Qb.
8. Соединение по пп. 1 или 7, где Qa представляет собой атом галогена.
9. Соединение по пп. 1 или 7, где Qb представляет собой C1-6 алкил.
10. Соединение по пп. 1 или 7, где R1a и R1' вместе образуют 4-6-членный гетероциклоалкил, содержащий один кольцевой гетероатом, выбранный из N, О и S(=O)2, или С3-8 циклоалкил, возможно замещенный одним или более R1".
11. Соединение по пп. 1 или 7, где R1" представляет собой амино или -CN.
12. Соединение по п. 1 или 7, где R2 представляет собой C1-6 алкил.
13. Соединение, выбранное из следующих соединений:
2-(1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид,
2-(5-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(5-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(5,6-дихлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(5-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-амид,
2-(6-циклопропил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид,
2-(1-метил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид,
2-(5-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1,2-диметил-пропил)-амид,
2-(1,5,5-триметил-4,5,6,7-тетрагидро-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3,3-дифтор-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метансульфонил-пиперидин-3-ил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-циклопропил-этил)-амид,
2-(6-циклопропил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(1-метил-6-трифторметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-пиперидин-1-карбонил)-2,2-диметил-пропил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-циано-азетидин-1-карбонил)-пропил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-циклопропил-2-оксо-этил]-амид,
2-(6-циано-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-[6-хлор-1-(2-метокси-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-фенил-этил)-амид,
2-(1-метил-4,5,6,7-тетрагидро-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-метил-2-(2-окса-6-аза-спиро[3.3]гепт-6-ил)-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-2-морфолин-4-ил-2-оксо-этил)-амид,
2-(6-хлор-1-метил-1Н-индол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-5-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-метил-имидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-фтор-имидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6,8-дифтор-имидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-фтор-3-метил-имидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-фтор-3-гидроксиметил-имидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,3R)-3-циано-циклопентил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-амино-циклопентил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-метансульфониламино-циклопентил)-амид,
2-(3-хлор-6-фтор-имидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(6,8-дифтор-имидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(6-фтор-имидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(6-фтор-3-метансульфонил-имидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-циано-азетидин-1-карбонил)-2,2-диметил-пропил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-фтор-1,2-диметил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1,2,2-триметил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-гидрокси-циклопентил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-гидрокси-циклопентил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-2-ил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-оксазол-2-ил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-оксазол-4-ил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-изоксазол-3-ил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(5-метил-изоксазол-3-ил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-изоксазол-5-ил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-цианометил-циклопентил)-амид,
2-(6-фтор-имидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксазол-2-ил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-фтор-азетидин-1-карбонил)-бутил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4,5-дигидро-оксазол-2-ил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2,2-дифтор-1-метил-3-фенил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-цианометил-оксазол-2-ил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(S)-1-(тетрагидрофуран-2-ил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-(R)-1-(тетрагидрофуран-2-ил)-этил]-амид,
2-(5-гидрокси-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(5-хлор-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-цианопиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид,
2-(5,6-дихлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид,
2-(5,6-дихлор-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(4-циано-пиперидин-1-ил)-1-циклопропил-2-оксо-этил]-амид,
2-(5-хлор-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(1,6,6-триметил-4,5,6,7-тетрагидро-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метансульфонил-азетидин-3-ил)-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-3-оксо-3-пирролидин-1-ил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-гидрокси-циклобутил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-циано-циклобутил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(транс-3-гидрокси-циклобутил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(цис-3-циано-циклобутил)-этил]-амид,
2-изохинолин-1-ил-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-пиридин-2-ил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-трифторметил-пиридин-2-ил)-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-циано-1,2,2-триметил-этил)-амид,
2-(6-трет-бутил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(1,6-диметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-метокси-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-этил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6,7-дифтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-этил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(4,6-дифтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(1,6-диметил-1Н-пиразоло[3,4-b]пиридин-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-[6-хлор-1-(2-гидрокси-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-изопропил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-пропил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-цианометил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-[6-хлор-1-(2,3-дигидроксипропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-[6-хлор-1-(2-гидроксипропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-[6-хлор-1-(3-гидроксипропил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(4,6-дихлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(1-метил-1Н-пиразоло[4,3-b]пиридин-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(1-метил-1Н-тиено[3,2-с]пиразол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(1-циано-циклопентил)-этил]-амид,
2-(4,6-дифтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(6-фтор-1-оксетан-3-ил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(6-фтор-1-оксетан-3-ил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(1-азетидин-3-ил-6-фтор-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метансульфонил-1-метил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты циклопентиламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (тетрагидрофуран-3-ил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты этиламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты циклогексиламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (тетрагидропиран-3-ил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (тетрагидропиран-4-ил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1,1-диоксо-тетрагидро-1H-тиофен-3-ил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-2,2-диметил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2,2-диметил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изобутил-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты циклопропилметил-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((S)-3-фторпирролидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((R)-3-фторпирролидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-фторазетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((R)-3-фторпирролидин-1-ил)-1-метил-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-((S)-3-фторпирролидин-1-ил)-1-метил-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-фторазетидин-1-ил)-1-метил-этил]-амид,
2-(6-хлор-4-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-(3-цианопирролидин-1-ил)-1-метил-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-этил]-амид,
2-(6-хлор-4-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-[6-хлор-1-(2-диметиламино-этил)-4-фтор-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-[6-хлор-4-фтор-1-(2-морфолин-4-ил-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-[6-хлор-1-(3-диметиламино-пропил)-4-фтор-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-[6-хлор-1-(3-диметиламино-пропил)-4-фтор-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-[6-хлор-4-фтор-1-(3-морфолин-4-ил-пропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метил-2-пиразол-1-ил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-имидазол-1-ил-1-метил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-циано-2-метил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-карбамоил-пропил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (S)-тетрагидропиран-3-иламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (R)-тетрагидропиран-3-иламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-циклопропил-этил)-амид,
2-(6-хлор-4-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-циклопропил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-циано-1-метил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-амино-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-4-гидроксициклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-4-амино-циклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-4-амино-циклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-оксо-циклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-гидроксициклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-гидроксициклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-фенил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,3S)-3-гидрокси-циклопентил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-метокси-1-метил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-метил-циклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(тетрагидрофуран-2-ил)-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-карбамоил-циклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-циано-циклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (R)-индан-1-иламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-4-гидрокси-циклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-метокси-1-метил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2,2,2-трифтор-1-метил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-гидроксиметил-пропил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-метоксиметил-пропил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (5-гидрокси-1,5-диметил-гексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-метокси-1-метоксиметил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-циано-циклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(2,2,2-трифтор-этил)-пиперидин-3-ил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-амино-циклогексил)-амид,
2-(6-хлор-4-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-этокси-1-метил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1-метил-пропил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метоксиметил-пропил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-фторазетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-цианоазетидин-1-ил)-1-метоксиметил-2-оксо-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-гидроксиметил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2R)-2-гидрокси-1-метоксиметил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-втор-бутил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метоксиметил-3-метил-бутил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-втор-бутил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-метил-2-тридейтерометокси-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-1,3-диметил-бутил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-бутил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3,3,3-трифтор-1-метил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-циклопропил-1-метил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1,3-диметил-бутил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-гидрокси-1-метоксиметил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-метокси-1-метоксиметил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-гидрокси-1-(тетрагидрофуран-2-ил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [2-метокси-1-(тетрагидрофуран-2-ил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-3-метансульфонил-1-метоксиметил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-дифторметокси-1-метил-этил)-амид,
2-(5-циклопропил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(5-циклопропил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(5-циклопропил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(5-циклопропил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(1R,2R)-1-(3-фтор-азетидин-1-карбонил)-2-гидрокси-пропил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-метил-1Н-имидазол-2-ил)-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-2-гидрокси-1-метил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-2-гидрокси-1-метил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-фенокси-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [цис-2-гидрокси-1-метил-2-(тетрагидропиран-4-ил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [транс-2-гидрокси-1-метил-2-(тетрагидропиран-4-ил)-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-3-циано-1-метил-пропил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-((1R,2S)-2-циано-циклопропил)-этил]-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-((1S,2R)-2-циано-циклопропил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(4-бром-фенил)-циклопропил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(3-бром-фенил)-циклобутил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(4-бром-фенил)-циклобутил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-бром-фенил)-2,2,2-трифтор-этил]-амид,
2-(5,6-дифтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-бензил-пирролидин-3-ил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-цианометил-пирролидин-3-ил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-бром-фенил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-бром-фенил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-циано-фенил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(4-циано-фенил)-этил]-амид,
2-(6-фтор-1-метил-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-цианометокси-1-метил-этил)-амид,
2-имидазо[1,2-а]пиридин-3-ил-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(7-хлор-имидазо[1,2-а]пиридин-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-циано-азетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(7-циано-имидазо[1,2-а]пиридин-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(5-хлор-бензоимидазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(6-хлор-бензоимидазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(5-хлор-бензоимидазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-цианоазетидин-1-ил)-1-метил-2-оксо-этил]-амид,
(6-хлор-3-{7-[(R)-2-(3-цианоазетидин-1-ил)-1-метил-2-оксо-этилкарбамоил]-5Н-пирроло[2,3-b]пиразин-2-ил}-индазол-1-ил)-уксусная кислота,
2-(6-хлор-1-диметилкарбамоилметил-1H-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-цианоазетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-[6-хлор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-цианоазетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-[6-хлор-1-(2-диметиламино-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-цианоазетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-[6-хлор-1-(2-диметиламино-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-цианоазетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-[6-хлор-1-(2-морфолин-4-ил-этил)-1Н-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-цианоазетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-[6-хлор-1-(2-пиридин-2-ил-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-цианоазетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-(6-хлор-1-пиридин-2-илметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-2-(3-цианоазетидин-1-ил)-1-метил-2-оксо-этил]-амид,
2-[6-хлор-1-(2-диметиламино-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(6-хлор-1-пиридин-3-илметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-[6-хлор-1-(2-морфолин-4-ил-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-[6-фтор-1-(6-морфолин-4-ил-пиридин-3-илметил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-[6-фтор-1-(2-морфолин-4-ил-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-[1-(2-диметиламино-этил)-6-фтор-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(6-фтор-1-пиридин-2-илметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-(6-фтор-1-пиридин-3-илметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-[6-фтор-1-(2-пирролидин-1-ил-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-{6-фтор-1-[2-((S)-3-фтор-пирролидин-1-ил)-этил]-1Н-индазол-3-ил}-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-[6-фтор-1-(2-пиразол-1-ил-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-метокси-1-метил-этил)-амид,
2-[6-хлор-1-(2-морфолин-4-ил-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид,
2-[6-хлор-1-(2-диметиламино-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-3-ил-этил)-амид,
2-[6-фтор-1-(2-морфолин-4-ил-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амид,
2-[1-(2-диметиламино-этил)-6-фтор-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-пиридин-4-ил-этил)-амид,
2-[6-фтор-1-(2-пирролидин-1-ил-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-2-пиридин-2-ил-этил)-амид,
2-[6-фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((R)-1-оксетан-3-ил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(S)-1-(3-трифторметокси-фенил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(R)-1-(3-трифторметокси-фенил)-этил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [1-(1-гидрокси-1,1-метил-этил)-циклобутил]-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-гидроксиметил-циклобутил)-амид,
2-(6-фтор-1-пиперидин-4-ил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1-пирролидин-3-ил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1-метил-1Н-пиразоло[4,3-b]пиридин-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-циано-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-дифторметокси-1-пиперидин-4-ил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
4-[3-(7-трет-бутилкарбамоил-5Н-пирроло[2,3-b]пиразин-2-ил)-5-дифторметокси-индазол-1-ил]-масляная кислота,
2-[5-дифторметокси-1-(1-метил-пиперидин-4-ил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-дифторметокси-1-пиридин-3-илметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-дифторметокси-1-пирролидин-3-илметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(7-гидроксиметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1-пиперидин-4-ил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-амино-циклопентил)-амид,
2-[7-(1-гидрокси-1-метил-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-(1-гидрокси-этил)-1-метил-1Н-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(6-метансульфонил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-амино-циклобутил)-амид,
2-(1-метил-1,4,5,6,7,8-гексагидро-циклогептапиразол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-гидроксиметил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-дифторметокси-1-(1-метил-1Н-пиразол-4-илметил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5,6,7,8-тетрагидроимидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-амино-циклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-амино-циклогексил)-амид,
2-(1,5,5-триметил-4,5,6,7-тетрагидро-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(1,6,6-триметил-4,5,6,7-тетрагидро-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-[5-(3-хлор-фенокси)-1-метил-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(1-метил-5-трифторметокси-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(1-метил-1,4,5,6-тетрагидро-циклопентапиразол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(5-дифторметокси-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(5-дифторметокси-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-дифторметокси-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(5-дифторметокси-1-метил-1Н-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (4-гидроксиметил-тетрагидропиран-4-ил)-амид,
2-(5-метокси-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-метокси-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(5-дифторметокси-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-метокси-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((3R,4R)-3-амино-тетрагидропиран-4-ил)-амид,
2-(5-метокси-1-метил-1Н-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((1R,2S)-2-аминоциклогексил)-амид,
2-[5-дифторметокси-1-(3-диметиламино-пропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1-метил-2-окси-4,5,6,7-тетрагидро-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(1-метил-2-окси-4,5,6,7-тетрагидро-1Н-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1-метил-4,5,6,7-тетрагидро-1H-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-{1-[3-(3,3-дифторазетидин-1-ил)-пропил]-5-дифторметокси-1H-индазол-3-ил}-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-дифторметокси-1-(2-[1,3]диоксан-2-ил-этил)-1H-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-дифторметокси-1-(3-гидроксипропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-дифторметокси-1-(3-морфолин-4-ил-пропил)-1H-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-{5-дифторметокси-1-[3-(3-гидроксиазетидин-1-ил)-пропил]-1Н-индазол-3-ил}-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-{1-[3-(3-циано-азетидин-1-ил)-пропил]-5-дифторметокси-1Н-индазол-3-ил}-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[1-(2-азетидин-3-ил-этил)-6-фтор-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(2-метил-1Н-индол-7-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1Н-индол-7-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-хлор-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(6-хлор-1-этил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(1-бензил-6-хлор-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(6-хлор-1-циклопропилметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(6-хлор-1-изоксазол-3-илметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-[6-хлор-1-(1-метил-1Н-имидазол-2-илметил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-[6-хлор-1-(5-метил-изоксазол-3-илметил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-[1-(2-диметиламино-этил)-6-фтор-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[6-фтор-1-(2-морфолин-4-ил-2-оксо-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты d9-трет-бутиламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1-гидроксиметил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты циклопропилметил-амид,
2-(5-хлор-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(5-хлор-3-метил-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(5-фтор-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-индазол-1-ил-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(6-хлор-индазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(5-метокси-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-хлор-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-дифторметокси-индазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-фтор-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5,6-дифтор-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1H-пирроло[2,3-с]пиридин-7-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-хлор-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-трифторметил-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-метил-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-индазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-метил-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(3-трифторметил-5,6-дигидро-4Н-циклопентапиразол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(3-хлор-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-метил-пиразоло[3,4-b]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-трифторметил-индазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-метокси-индазол-1-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-дифторметокси-1-(2-диметилкарбамоил-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[1-(4-бензил-морфолин-2-илметил)-5-дифторметокси-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-дифторметокси-1-(1-метил-азетидин-3-илметил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-дифторметокси-1-(4-метил-морфолин-2-илметил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-{5-дифторметокси-1-[3-(3,3-дифтор-пирролидин-1-ил)-пропил]-1Н-индазол-3-ил}-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(3-метокси-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-[5-дифторметокси-1-(3-метиламино-пропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-{1-[3-(ацетил-метил-амино)-пропил]-5-дифторметокси-1Н-индазол-3-ил}-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(3-пиперидин-4-ил-индазол-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-[3-(1-метил-пиперидин-4-ил)-индазол-1-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(1-азетидин-3-илметил-6-фтор-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1-азетидин-3-илметил-5-дифторметокси-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1-циклопропилметил-5-дифторметокси-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-дифторметокси-1-{2-оксо-2-[4-(2,2,2-трифтор-этил)-пиперазин-1-ил]-этил}-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-{5-дифторметокси-1-[2-(4-метил-пиперазин-1-ил)-2-оксо-этил]-1Н-индазол-3-ил}-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(5-дифторметокси-1-метилкарбамоилметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(7-этил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-хлор-имидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-имидазо[1,5-а]пиридин-1-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты [(S)-1-(5-трифторметил-1Н-имидазол-2-ил)-этил]-амид,
2-((S)-1-{[2-(6-фтор-1-метил-1H-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбонил]-амино}-этил)-3H-имидазол-4-карбоновой кислоты метиловый эфир,
(3-этинил-азетидин-1-ил)-[2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-ил]-метанон,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты метокси-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(6-метокси-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(6-метокси-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-этил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1,6-диметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(7-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1-метил-6-трифторметокси-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1-метил-6-трифторметокси-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(7-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(1-метил-1Н-пиразоло[3,4-b]пиридин-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-гидроксиметил-циклопропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1,1-диметил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-циклобутил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (циано-диметил-метил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-циклопропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-амино-1,1-диметил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1,1-диметил-проп-2-инил)-амид,
2-{[2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбонил]-амино}-2-метил-пропионовой кислоты трет-бутиловый эфир,
2-{[2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбонил]-амино}-2-метил-пропионовая кислота,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1-гидроксиметил-1-метил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-циклопентил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (4-метил-пиперидин-4-ил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-метил-оксетан-3-ил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-циано-циклопропил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-1-фенил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-1-фенил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2,2,2-трифтор-1,1-диметил-этил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1,1-диметил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-циклогексил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-амино-1,1,2-триметил-пропил)-амид,
2-(6-циано-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-циклопропил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты фениламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-амино-1,1-диметил-этил)-амид,
2-(6-циано-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(1Н-индазол-4-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-1,1-диметил-пропил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-циклопропил-1-метил-этил)-амид,
2-(5-дифторметокси-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-4-амино-циклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-амино-циклогексил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-циано-фенил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты пиридин-3-иламид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-метил-пирролидин-3-ил)-амид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (циано-диметил-метил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (4-амино-1,1-диметил-бутил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-метил-азетидин-3-ил)-амид,
2-(1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1H-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1-метил-5-трифторметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-пропил)-амид,
2-(6-хлор-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-амино-1,1-диметил-пропил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-4-амино-1-метил-циклогексил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-4-амино-1-метил-циклогексил)-амид,
2-[6-фтор-1-(2,2,2-трифтор-этил)-1H-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-хлор-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты ((S)-2-гидрокси-1-метил-этил)-амид,
2-(1-метил-6-трифторметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1Н-индазол-7-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-амино-1-метил-циклобутил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-амино-1-метил-циклобутил)-амид,
2-(1,6-диметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-циано-циклопропил)-амид,
2-(1,6-диметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-метил-пирролидин-3-ил)-амид,
2-[1-(2-диметиламино-этил)-6-метил-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-[1-(3-диметиламино-пропил)-6-метил-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(1,6-диметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-циклопропил-1-метил-этил)-амид,
2-(1,6-диметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-гидроксиметил-циклопропил)-амид,
2-(1,6-диметил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-диметиламино-1,1-диметил-этил)-амид,
2-(6-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-метил-пирролидин-3-ил)-амид,
2-(6-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-гидроксиметил-циклопропил)-амид,
2-(6-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-циклопропил-1-метил-этил)-амид,
2-(6-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(6-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-амино-1,1-диметил-этил)-амид,
2-(6-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-диметиламино-1,1-диметил-этил)-амид,
2-(6-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-циано-циклопропил)-амид,
2-[6-метил-1-(3-морфолин-4-ил-пропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-[6-метил-1-(2-морфолин-4-ил-2-оксо-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-[1-(3-диметиламинопропил)-6-метил-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-[5-дифторметокси-1-(3-диметиламино-пропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
(3-{[2-(6-хлор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбонил]-амино}-циклогексил)-карбаминовой кислоты трет-бутиловый эфир,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-аминометил-циклопропил)-амид,
2-изохинолин-8-ил-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[6-метил-1-(2-морфолин-4-ил-этил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-[5-дифторметокси-1-(3,4-дигидрокси-бутил)-1H-индазол-3-ил]-5H-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-дифторметокси-1-(3-гидрокси-бутил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-дифторметокси-1-(3-метансульфонил-пропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-(4-амино-4-метил-пентилокси)-1-метил-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-дифторметокси-1-(3-диметиламино-пропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты изопропиламид,
2-(1-метил-1Н-индазол-4-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[5-дифторметокси-1-(3-диметиламино-пропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (1-метил-циклопропил)-амид,
2-[5-дифторметокси-1-(3-диметиламино-пропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты этиламид,
2-[1-(4-амино-4-метил-пентил)-5-дифторметокси-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[1-(3,4-дигидрокси-бутил)-6-фтор-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[6-фтор-1-(3-метансульфонил-пропил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (5-амино-тетрагидропиран-3-ил)-амид,
2-(5-изопропил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-(6-фтор-1-метил-1H-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-5-амино-тетрагидропиран-3-ил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-5-амино-тетрагидропиран-3-ил)-амид,
2-(5-метансульфонил-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты трет-бутиламид,
2-[6-фтор-1-(3-гидрокси-бутил)-1Н-индазол-3-ил]-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (2-гидрокси-1,1-диметил-этил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (3-гидрокси-азетидин-3-илметил)-амид,
2-(6-фтор-1-(3-(метилсульфонил)пропил)-1Н-индазол-3-ил)-N-(1-гидрокси-2-метилпропан-2-ил)-5Н-пирроло[3,2-b]пиразин-7-карбоксамид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (цис-3-гидрокси-циклобутил)-амид,
2-(6-фтор-1-метил-1Н-индазол-3-ил)-5Н-пирроло[2,3-b]пиразин-7-карбоновой кислоты (транс-3-гидрокси-циклобутил)-амид.
14. Фармацевтическая композиция, обладающая ингибиторной активностью в отношении киназ JAK3 и/или SYK, содержащая эффективное количество соединения по любому из пп. 1-13, смешанного по меньшей мере с одним фармацевтически приемлемым носителем, эксципиентом или разбавителем.
15. Применение соединения по любому из пп. 1-13 в изготовлении лекарственного средства для лечения воспалительного или аутоиммунного состояния.
16. Применение соединения по любому из пп. 1-13 в изготовлении лекарственного средства для лечения артрита или астмы.
17. Соединение по любому из пп. 1-13 для применения в лечении артрита или астмы.
| US 20090215785 A1, 27.08.2009 | |||
| WO 2009106442 A1, 03.09.2009 | |||
| WO 2009106443 A1, 03.09.2009 | |||
| RU 2007123235 A, 10.02.2009. |
Авторы
Даты
2018-11-22—Публикация
2012-08-27—Подача