Область изобретения
Настоящее изобретение относится к области медицины и к производному имидазоизоиндола, к способу его получения и его медицинскому применению. Настоящее изобретение раскрывает, что это производное используют в качестве ингибитора ИДО (индоламинпиррол-2,3-диоксигеназы) для лечения заболевания с патологическим признаком пути метаболизма триптофана, опосредованного ИДО. Это заболевание включает рак, болезнь Альцгеймера, аутоиммунное заболевание, депрессию, тревожное расстройство, катаракту, психологическое расстройство и СПИД.
Предшествующий уровень техники
Опухоль является одним из основных заболеваний, которые серьезно угрожают жизни человека, причем более половины опухолей наблюдается в развивающихся странах. Общая распространенность злокачественных опухолей в Китае растет, увеличиваясь в среднем на 3-5% в год. Прогнозируют, что к 2020 году от рака будут страдать 4 миллиона человек, а 3 миллиона человек погибнут от рака. Основные причины связаны со старением, урбанизацией, индустриализацией и изменениями образа жизни. На рынке лекарств Китая объем продаж противоопухолевых препаратов в последние годы неуклонно рос. В 2012 году этот рынок достиг 66,42 млрд. юаней с приростом 13,07% в год; ожидается, что к 2017 году объем рынка противоопухолевых лекарств достигнет 105,57 млрд. юаней с приростом 7,57% в год.
Из-за неограниченного роста, инфильтрации и метастазов злокачественных опухолей опухолевые клетки нельзя полностью вырезать или уничтожить тремя традиционными методами лечения (хирургией, лучевой терапией и химиотерапией), которые используются в клинической практике, и часто возникают метастазы или рецидивы опухолей. Опухолевая биотерапия - это новая терапия для профилактики и лечения опухолей с использованием современной биотехнологии и связанных с ней продуктов. Из-за их безопасности, эффективности и редких побочных реакций биотерапия опухолей становится четвертым способом опухолевой терапии после хирургической операции, лучевой терапии и химиотерапии, которая достигает противоопухолевого эффекта путем мобилизации естественного защитного механизма хозяина (такого как ингибирование ИДО-опосредованного механизма ускользания опухоли от иммунного надзора) или путем введения природных высоконаправленных веществ.
Индоламинпиррол-2,3-диоксигеназа (ИДО) представляет собой гемсодержащий мономерный белок, состоящий из 403 аминокислотных остатков, включающий два сложенных α-спиральных домена, где большой домен содержит каталитический карман, в котором может происходить гидрофобное взаимодействие и тому подобное между субстратом и ИДО. ИДО - это фермент, который катализирует превращение триптофана в формилкинуренин, широко распространенный в тканях человека и других млекопитающих (кроликов, мышей), за исключением печени. Это единственный ограничивающий скорость фермент, который может катализировать метаболизм фермента триптофана, в дополнение к печени. Известно, что триптофан является не только незаменимой аминокислотой для поддержания активации и пролиферации клеток, но и важным незаменимым компонентом для образования белка. ИДО тесно связана со многими видами цитокинов, такими как интерферон (IFN), интерлейкин (IL), фактор некроза опухолей (TNF) и т.д., которые могут активировать ИДО при определенных условиях. Существует точка регуляции, которая очень чувствительна к уровню триптофана в клеточном цикле Т-клетки. С одной стороны, ИДО может привести к снижению уровня локального триптофана, что приводит к задержке Т-клеток в середине фазы G1, тем самым ингибируя пролиферацию Т-клеток; с другой стороны, кинуренин, который является основным продуктом метаболизма триптофана, катализируемого ИДО, индуцирует апоптоз Т-клеток путем изменений внутриклеточных окислителей и антиоксидантов, вызванных посредничеством свободных от кислорода радикалов, что является имманентным механизмом иммуносупрессии в организме. Большое количество исследований показало, что ИДО высоко экспрессируется в лейкемических клетках, ингибируется пролиферация локального Т-клеточного и опосредованного Т-клетками иммунного ответа, блокируется трансдукция сигнала активации Т-клеток, тем самым опосредуется ускользание опухолевой клетки от атаки иммунной системы. Было обнаружено, что ИДО экспрессируется конститутивно в большинстве опухолей человека. Таким образом, ИДО является потенциальной мишенью для иммунотерапии рака.
Патентные заявки, раскрывающие селективные ингибиторы ИДО, включают WO 2012142237, WO 2004094409, WO 2006122150, WO 2007075598, WO 2010005958 и WO 2014066834, и др.
Ингибиторы ИДО имеют хорошие перспективы применения в качестве лекарственного средства в фармацевтической промышленности, но к настоящему времени хороший ингибитор ИДО, который можно использовать в качестве продаваемого препарата, не найден. Для достижения лучшего лечения опухолей и для лучшего удовлетворения потребностей рынка изобретатели надеются разработать новое поколение селективных ингибиторов ИДО с высокой эффективностью и низкой токсичностью. Настоящее изобретение относится к новому соединению в качестве селективного ингибитора ИДО, и установлено, что соединение, имеющее такую структуру, обладает превосходными действием и функцией, в частности отличной фармакокинетической активностью.
Сущность изобретения
Настоящее изобретение направлено на соединение формулы (I) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смеси, или на его фармацевтически приемлемую соль, причем структура соединения, представленного формулой (I), является следующей:
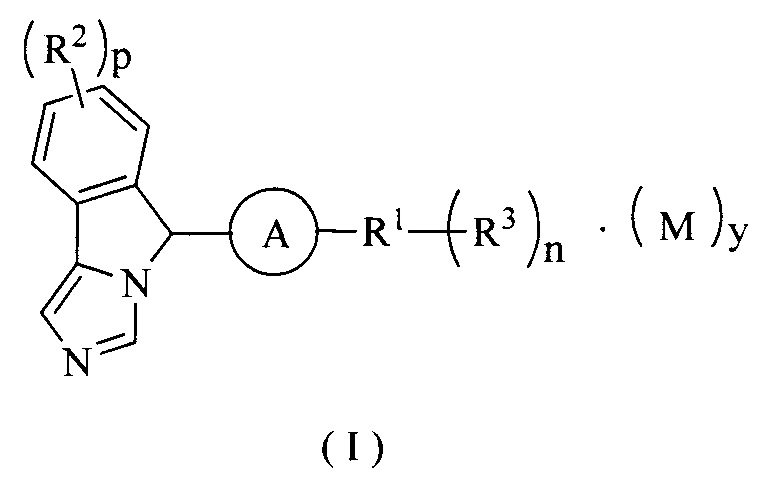
где:
М представляет собой неорганическую кислоту или органическую кислоту, предпочтительно трифторуксусную кислоту;
А выбран из группы, состоящей из циклоалкила, гетероциклила, арила и гетероарила, где каждый циклоалкил, гетероциклил, арил и гетероарил возможно замещен одной или более группами, выбранными из группы, состоящей из алкила, галогена, амино, нитро, гидрокси, циано, алкокси, гидроксиалкила, циклоалкила, гетероциклила, арила и гетероарила;
R1 выбран из группы, состоящей из водорода, алкила, циклоалкила, гетероциклила, арила, гетероарила, -OR4, -C(O)R4, -C(O)OR4, -S(O)mR4, -NR5R6, -C(O)NR5R6, -C(O)NHR5, -NR5C(O)R6 и -NR5S(O)mR6;
R2 являются одинаковыми или различными, и каждый независимо выбран из группы, состоящей из водорода, алкила, галоалкила, алкокси, галоалкокси, галогена, амино, нитро, гидрокси, циано, циклоалкила, гетероциклила, арила и гетероарила;
R3 являются одинаковыми или различными и каждый независимо выбран из группы, состоящей из водорода, алкила, галоалкила, алкокси, галоалкокси, галогена, амино, нитро, гидрокси, циано, циклоалкила, гетероциклила, арила, гетероарила, -OR4, -C(O)R4, -C(O)OR4, -S(O)mR4, -NR5R6, -C(O)NR5R6, -NR5C(O)R6 и -NR5S(O)mR6, где каждый алкил, галоалкил, циклоалкил, гетероциклил, арил и гетероарил возможно замещен одной или более группами, выбранными из группы, состоящей из алкила, галоалкила, галогена, амино, нитро, циано, гидрокси, алкокси, галоалкокси, гидроксиалкила, циклоалкила, гетероциклила, арила, гетероарила, -Ra, -OR7, -C(O)R7, -C(O)OR7, -S(O)mR7, -NR7R8, -C(O)NR7R8, -NR7C(O)R8 и -NR7S(O)mR8;
Ra выбран из группы, состоящей из алкила, галоалкила, циклоалкила, гетероциклила, арила и гетероарила, где каждый алкил, галоалкил, циклоалкил, гетероциклил, арил и гетероарил возможно замещен одной или более группами, выбранными из группы, состоящей из алкила, галогена, амино, нитро, гидрокси, алкокси, гидроксиалкила, циано, циклоалкила, гетероциклила, арила, гетероарила, -OR4, -C(O)R4, -C(O)OR4, -S(O)mR4, -NR5R6, -C(O)NR5R6, -NR5C(O)R6 и -NR5S(O)mR6;
R4 выбран из группы, состоящей из водорода, алкила, галоалкила, гидрокси, амино, алкокси, галоалкокси, циклоалкила, гетероциклила, арила и гетероарила, где каждый алкил, галоалкил, циклоалкил, гетероциклил, арил и гетероарил возможно замещен одной или более группами, выбранными из группы, состоящей из алкила, галогена, амино, нитро, циано, гидрокси, гидроксиалкила, алкокси, циклоалкила, гетероциклила, арила, гетероарила, -Ra, -OR7, -C(O)R7, -C(O)OR7, -S(O)mR7, -NR7R8, -C(O)NR7R8, -NR7C(O)R8 и -NR7S(O)mR8;
R5 и R6 являются одинаковыми или различными, и каждый независимо выбран из группы, состоящей из водорода, алкила, гидрокси, амино, циклоалкила, гетероциклила, арила и гетероарила, где каждый алкил, циклоалкил, гетероциклил, арил и гетероарил возможно замещен одной или более группами, выбранными из группы, состоящей из алкила, галогена, гидрокси, амино, нитро, циано, алкокси, гидроксиалкила, циклоалкила, гетероциклила, арила, гетероарила, -Ra, -OR7, -C(O)R7, -C(O)OR7, -S(O)mR7, -NR7R8, -C(O)NR7R8, -NR7C(O)R8 и -NR7S(O)mR8;
R7 и R8 являются одинаковыми или различными, и каждый независимо выбран из группы, состоящей из водорода, алкила, гидрокси, амино, циклоалкила, гетероциклила, арила и гетероарила, где каждый алкил, циклоалкил, гетероциклил, арил и гетероарил возможно замещен одной или более группами, выбранными из группы, состоящей из алкила, галогена, гидрокси, амино, нитро, циано, алкокси, гидроксиалкила, циклоалкила, гетероциклила, арила и гетероарила;
р является целым числом 0, 1, 2, 3 или 4;
у является целым числом 0, 1, 2 или 3;
m является целым числом 0, 1 или 2; и
n является целым числом 0, 1, 2, 3, 4 или 5.
В предпочтительном варианте осуществления настоящего изобретения в соединении формулы (I) или в его таутомере, мезомере, рацемате, энантиомере, диастереомере или их смеси, или в его фармацевтически приемлемой соли, у представляет собой 0, 1 или 3, в частности 0.
В предпочтительном варианте осуществления настоящего изобретения в соединении формулы (I) или в его таутомере, мезомере, рацемате, энантиомере, диастереомере или их смеси, или в его фармацевтически приемлемой соли, А выбран из группы, состоящей из гетероциклила и циклоалкила, где каждый гетероциклил и циклоалкил возможно замещен одной или более группами, выбранными из группы, состоящей из алкила, галогена, амино, нитро, гидрокси, циано, алкокси, гидроксиалкила, циклоалкила, гетероциклила, арила и гетероарила.
В предпочтительном варианте осуществления настоящего изобретения в соединении формулы (I) или в его таутомере, мезомере, рацемате, энантиомере, диастереомере или их смеси, или в его фармацевтически приемлемой соли, n является целым числом 0, 1 или 2.
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемая соль представляет собой соединение формулы (II) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемую соль,
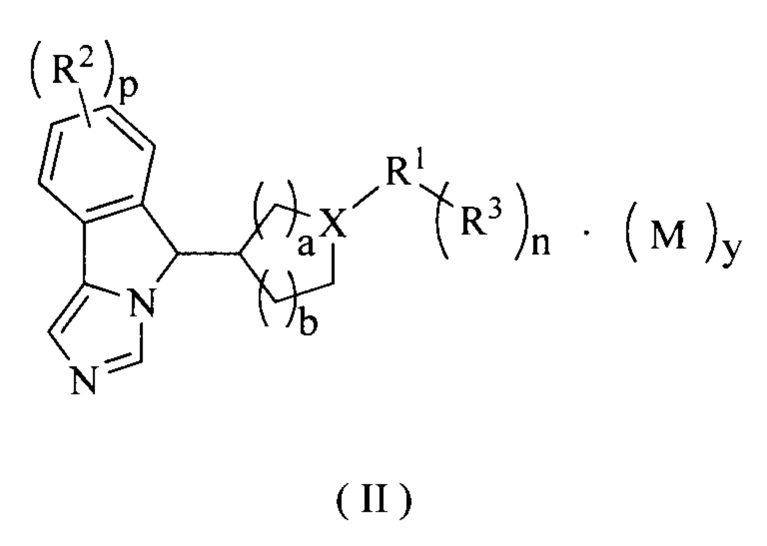
где:
X представляет собой СН или N;
R1-R3, М, p, n и у являются такими, как определено в формуле (I);
а является целым числом 0, 1, 2 или 3; и
b является целым числом 0, 1, 2 или 3.
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемая соль представляет собой соединение формулы (II-А) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемую соль,
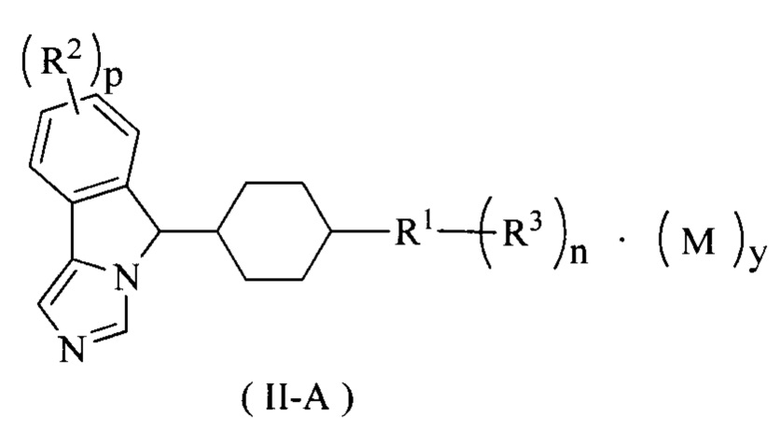
где R1-R3, М, p, n и у являются такими, как определено в формуле (I).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемая соль представляет собой соединение формулы (II-В) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемую соль,
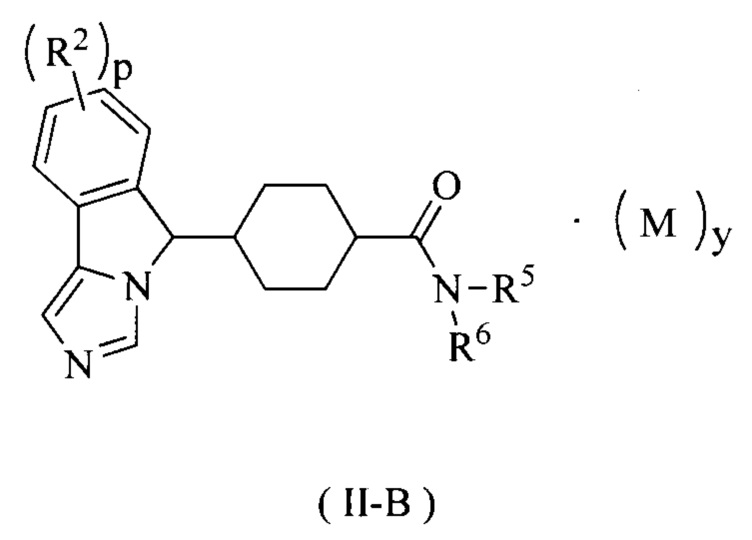
где R2, R5, R6, M, p и у являются такими, как определено в формуле (I).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (II) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемая соль представляет собой соединение формулы (III) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемую соль,
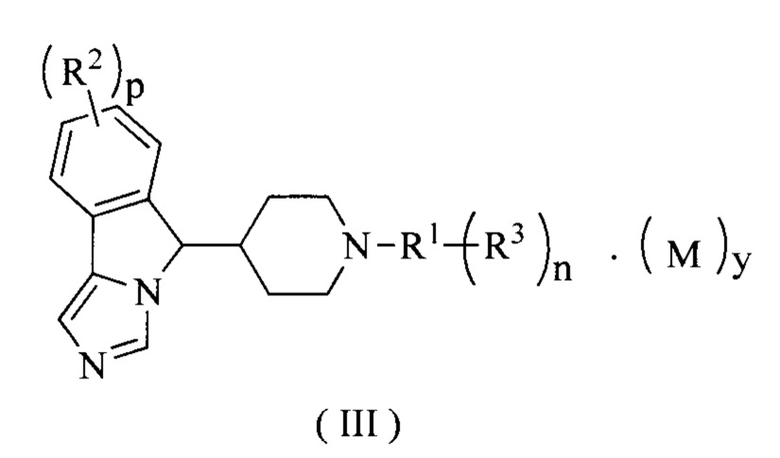
где R1-R3, М, p, n и у являются такими, как определено в формуле (I).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (III) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемая соль представляет собой соединение формулы (IV) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемую соль,
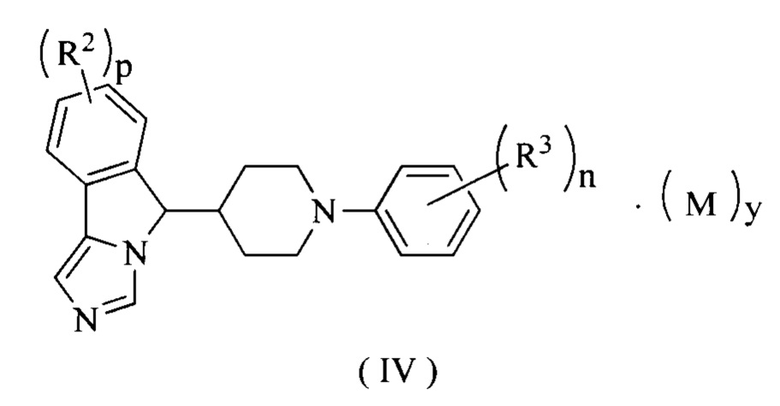
где R2, R3, М, p, n и у являются такими, как определено в формуле (I).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (III) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемая соль представляет собой соединение формулы (IV-1) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемую соль,
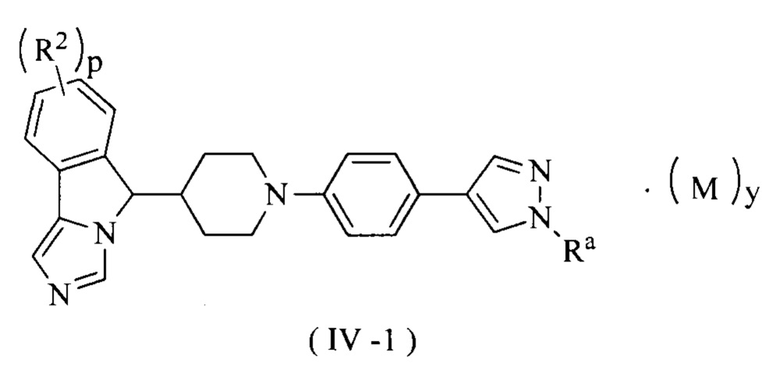
где R2, Ra, М, p и у являются такими, как определено в формуле (I).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (III) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемая соль представляет собой соединение формулы (IV-2) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемую соль,
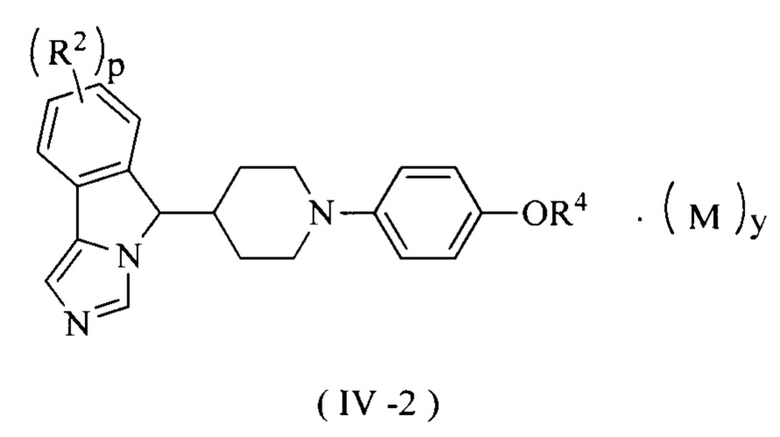
где R2, R4, М, p и у являются такими, как определено в формуле (I).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (IV) или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемая соль представляет собой соединение формулы (IV-A) или формулы (IV-B)
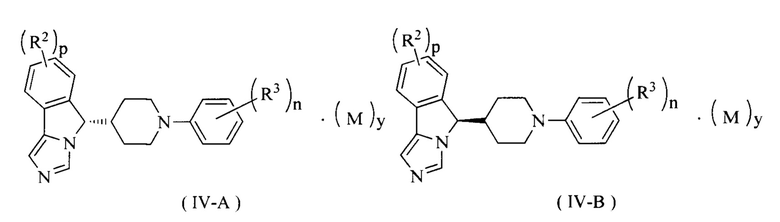
где R2, R3, М, p, n и у являются такими, как определено в формуле (I).
В другом аспекте настоящее изобретение также относится к соединению формулы (V) или к его таутомеру, мезомеру, рацемату, энантиомеру, диастереомеру или их смеси, которое является промежуточным соединением для получения соединения формулы (II) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси,
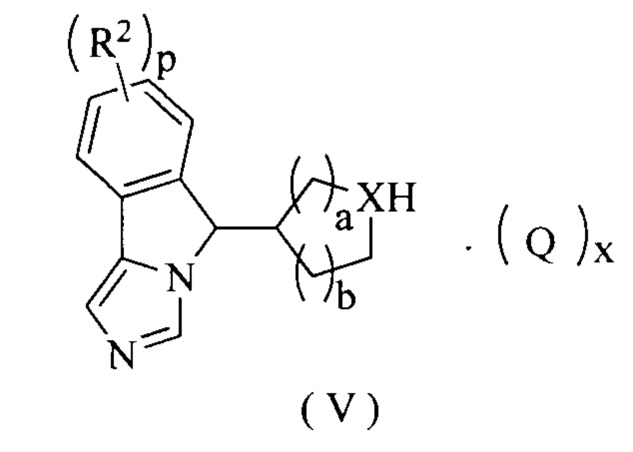
где:
Q представляет собой неорганическую кислоту или органическую кислоту, предпочтительно трифторуксусную кислоту;
X представляет собой СН или N;
R2, p, а и b являются такими, как определено в формуле (II); и
х является целым числом 0, 1, 2 или 3.
В другом аспекте настоящее изобретение также относится к способу получения соединения формулы (II-1) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли, включающему следующие стадии:
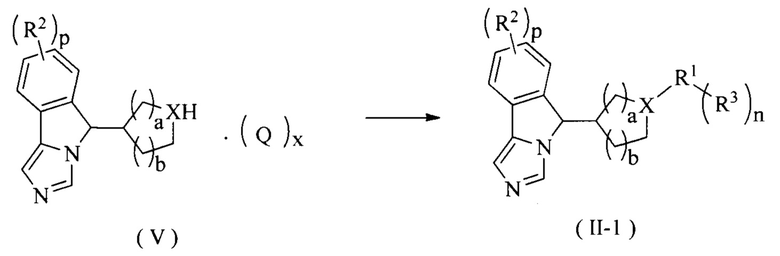
связывания соединения формулы (V) с галидом R1 в щелочных условиях в присутствии катализатора, затем, возможно, взаимодействия полученного продукта с борной кислотой или сложным эфиром борной кислоты с R3 с получением соединения формулы (II-1);
где:
X представляет собой N;
R1-R3, p, n, а и b являются такими, как определено в формуле (II); и
Q и x являются такими, как определено в формуле (V).
В другом аспекте настоящее изобретение также относится к способу получения соединения формулы (II) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, включающему стадию:
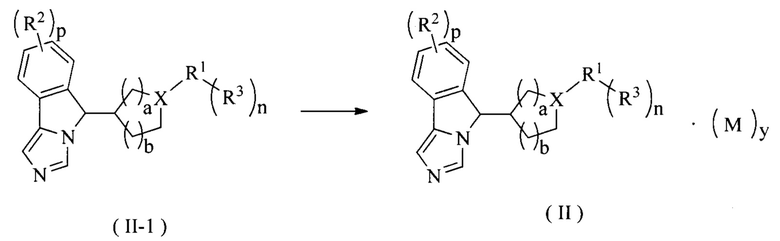
образования соли соединения формулы (II-1) в кислых условиях с получением соединения формулы (II);
где:
X представляет собой CH или N;
R1-R3, М, p, у, n, а и b являются такими, как определено в формуле (II).
В другом аспекте настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли, и фармацевтически приемлемый носитель, разбавитель или эксципиент. Настоящее изобретение также относится к способу получения указанной композиции, включающему стадию смешивания соединения каждой из формул или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли, с фармацевтически приемлемым носителем, разбавителем или эксципиентом.
Настоящее изобретение также относится к применению соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли, или фармацевтической композиции, содержащей их, для получения лекарственного средства для предотвращения и/или лечения заболевания с патологическим признаком пути метаболизма триптофана, опосредованного ИДО. Ингибиторы ИДО могут быть использованы для ингибирования сердечных расстройств и при лечении других заболеваний с патологическим признаком пути метаболизма триптофана, опосредованного ИДО, которые включают в себя вирусную инфекцию (такую как СПИД), клеточную инфекцию (такую как болезнь Лайма и стрептококковая инфекция), нейродегенеративное расстройство (такое как болезнь Альцгеймера, болезнь Хантингтона и болезнь Паркинсона), аутоиммунное заболевание, депрессию, тревожное расстройство, катаракту, психологическое расстройство, СПИД, раковые заболевания (включая Т-клеточную лейкемию и рак толстой кишки), заболевание глаз (такое как катаракта и связанное с возрастом пожелтение) и аутоиммунное заболевание, где рак может быть выбран из группы, состоящей из рака груди, рака шейки матки, рака кишечника, рака легких, рака желудка, рака прямой кишки, рака поджелудочной железы, рака мозга, рака кожи, рака полости рта, рака простаты, рака костей, рака почек, рака яичника, рака мочевого пузыря, рака печени, опухоли труб, овариальной опухоли, перитонеальной опухоли, меланомы IV фазы, глиомы, нейробластомы, гепатоцеллюлярной карциномы, папилломатоза, рака головы и шеи, лейкоза, лимфомы, миеломы и немелкоклеточного рака легких.
Настоящее изобретение также относится к соединению формулы (I) или к его таутомеру, мезомеру, рацемату, энантиомеру, диастереомеру или их смеси, или к его фармацевтически приемлемой соли, или фармацевтической композиции, содержащей их, для применения в предотвращении и/или лечении заболевания с патологическим признаком пути метаболизма триптофана, опосредованного ИДО, которое включает вирусную инфекцию (такую как СПИД), клеточную инфекцию (такую, как болезнь Лайма и стрептококковая инфекция), нейродегенеративное расстройство (такое как болезнь Альцгеймера, болезнь Хантингтона и болезнь Паркинсона), аутоиммунное заболевание, депрессию, тревожное расстройство, катаракту, психологическое расстройство, СПИД, рак (включая Т-клеточную лейкемию и рак толстой кишки), заболевание глаз (такое как катаракта и связанное с возрастом пожелтение) и аутоиммунное заболевание, где рак может быть выбран из группы, состоящей из рака груди, рака шейки матки, рака кишечника, рака легких, рака желудка, рака прямой кишки, рака поджелудочной железы, рака мозга, рака кожи, рака полости рта, рака простаты, рака костей, рака почек, рака яичника, рака мочевого пузыря, рака печени, опухоли труб, овариальной опухоли, перитонеальной опухоли, меланомы IV фазы, глиомы, нейробластомы, гепатоцеллюлярной карциномы, папилломатоза, рака головы и шеи, лейкоза, лимфомы, миеломы и немелкоклеточного рака легких.
Настоящее изобретение также относится к способу предотвращения и/или лечения заболевания с патологическим признаком пути метаболизма триптофана, опосредованного ИДО, который включает стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли, или фармацевтической композиции, содержащей их, где заболевание включает вирусную инфекцию (такую как СПИД), клеточную инфекцию (такую, как болезнь Лайма и стрептококковая инфекция), нейродегенеративное расстройство (такое как болезнь Альцгеймера, болезнь Хантингтона и болезнь Паркинсона), аутоиммунное заболевание, депрессию, тревожное расстройство, катаракту, психологическое расстройство, СПИД, рак (включая Т-клеточную лейкемию и рак толстой кишки), заболевание глаз (такое как катаракта и связанное с возрастом пожелтение) и аутоиммунное заболевание, где рак может быть выбран из группы, состоящей из рака груди, рака шейки матки, рака кишечника, рака легких, рака желудка, рака прямой кишки, рака поджелудочной железы, рака мозга, рака кожи, рака полости рта, рака простаты, рака костей, рака почек, рака яичника, рака мочевого пузыря, рака печени, опухоли труб, овариальной опухоли, перитонеальной опухоли, меланомы IV фазы, глиомы, нейробластомы, гепатоцеллюлярной карциномы, папилломатоза, рака головы и шеи, лейкоза, лимфомы, миеломы и немелкоклеточного рака легких.
В другом аспекте настоящее изобретение также относится к способу лечения рака, который включает стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли. Этот способ демонстрирует значительную эффективность и меньшее количество побочных эффектов, где рак может быть выбран из группы, состоящей из рака груди, рака шейки матки, рака кишечника, рака легких, рака желудка, рака прямой кишки, рака поджелудочной железы, рака мозга, рака кожи, рака полости рта, рака простаты, рака костей, рака почек, рака яичника, рака мочевого пузыря, рака печени, опухоли труб, овариальной опухоли, перитонеальной опухоли, меланомы IV фазы, глиомы, нейробластомы, гепатоцеллюлярной карциномы, папилломатоза, рака головы и шеи, лейкоза, лимфомы, миеломы и немелкоклеточного рака легких, предпочтительно опухоли труб, перитонеальной опухоли, меланомы IV фазы, миеломы и рака груди, более предпочтительно рака груди.
Фармацевтические композиции, содержащие активный ингредиент, могут быть в форме, пригодной для перорального введения, например, в форме таблетки, пастилки, лепешки, водной или масляной суспензии, диспергируемого порошка или гранулы, эмульсии, твердой или мягкой капсулы, или сиропа, или эликсира. Пероральные композиции могут быть получены в соответствии с любым известным способом получения фармацевтических композиций в данной области. Такие композиции могут содержать один или более агентов, выбранных из группы, состоящей из подсластителей, ароматизаторов, красителей и консервантов, чтобы обеспечить приятную и аппетитную фармацевтическую композицию. Таблетка содержит активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, подходящими для изготовления таблетки. Эти эксципиенты могут быть инертными эксципиентами, гранулирующими агентами, дезинтегрирующими агентами и лубрикантами. Таблетка может быть без покрытия или покрыта известными способами для маскировки вкуса лекарственного средства или задержки дезинтеграции и абсорбции лекарственного средства в желудочно-кишечном тракте, что обеспечивает замедленное высвобождение в течение длительного периода.
Пероральные композиции также могут быть снабжены мягкими желатиновыми капсулами, в которых активный ингредиент смешан с инертным твердым разбавителем, водорастворимым носителем, масляной средой или оливковым маслом.
Водная суспензия содержит активный ингредиент в смеси с эксципиентами, подходящими для получения водной суспензии. Такими эксципиентами являются суспендирующие агенты, диспергирующие или смачивающие агенты. Водная суспензия также может содержать один или более консервантов, таких как этилпарабен или н-пропилпарабен, один или более красителей, один или более ароматизаторов и один или более вкусовых агентов.
Масляную суспензию можно приготовить путем суспендирования активного ингредиента в растительном масле или в минеральном масле. Масляная суспензия может содержать загуститель. Подсластители и ароматизаторы, упомянутые выше, могут быть добавлены для получения препарата, приемлемого для употребления. Эти композиции могут быть сохранены путем добавления антиоксиданта.
Активный ингредиент в смеси с диспергирующими или смачивающими агентами, суспендирующим агентом или одним или более консервантами может быть получен в виде диспергируемого порошка и гранул, подходящих для приготовления водной суспензии путем добавления воды. Подходящими диспергирующими или смачивающими агентами и суспендирующими агентами являются примеры, упомянутые выше. Также могут быть добавлены дополнительные эксципиенты, такие как подсластители, ароматизаторы и красители.
Фармацевтическая композиция согласно изобретению также может быть в виде эмульсии масло-в-воде. Масляная фаза может быть растительным маслом, минеральным маслом или их смесью. Подходящим эмульгатором может быть природный фосфатид или неполный сложный эфир. Эмульсия может также содержать подсластители, ароматизаторы, консерванты и антиоксиданты. Фармацевтическая композиция может быть в виде стерильного водного раствора для инъекций. Приемлемыми носителями и растворителями, которые могут быть использованы, являются вода, раствор Рингера и изотонический раствор хлорида натрия. Стерильный инъецируемый препарат может также представлять собой стерильную микроэмульсию для инъекций «масло-в-воде», в которой активный ингредиент растворен в масляной фазе. Инъекционный раствор или микроэмульсию можно вводить в кровоток человека путем местной болюсной инъекции.
Фармацевтическая композиция может быть в виде стерильной инъекционной водной или масляной суспензии для внутримышечного и подкожного введения. Такая суспензия может быть приготовлена с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, как описано выше, в соответствии с известными способами. Стерильный препарат для инъекций может также представлять собой стерильный раствор или суспензию для инъекций, которые приготовлены в нетоксичных парентерально приемлемых разбавителях или растворителях. Кроме того, стерильное нелетучее масло может легко использоваться в качестве растворителя или суспендирующей среды.
Соединение согласно изобретению можно вводить в виде суппозиториев для ректального введения. Эти фармацевтические композиции могут быть получены смешиванием лекарственного средства с подходящим нераздражающим эксципиентом, который является твердым при обычных температурах, но жидким в прямой кишке, расплавляясь в прямой кишке, чтобы высвободить лекарственное средство.
Для специалистов в данной области хорошо известно, что дозировка лекарственного средства зависит от множества факторов, включая следующие факторы, но не ограничиваясь ими: активность конкретного соединения, возраст пациента, вес пациента, общее состояние здоровья пациента, поведение пациента, диета пациента, время введения, путь введения, скорость экскреции, комбинацию лекарств и тому подобное. Кроме того, наилучший способ лечения, например, режим лечения, суточную дозу соединения формулы (I) или его фармацевтически приемлемой соли можно проверить с помощью традиционных терапевтических схем.
Подробное описание изобретения
Если не указано иное, термины, используемые в описании и формуле изобретения, имеют значения, описанные ниже.
«Алкил» относится к насыщенной алифатической углеводородной группе, включающей группы с C1-С20 прямой и разветвленной цепью, предпочтительно к алкилу, имеющему от 1 до 12 атомов углерода, и более предпочтительно к алкилу, имеющему от 1 до 6 атомов углерода. Неограничивающие примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, 1,1-диметил пропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, 2-метилбутил, 3-метилбутил, н-гексил, 1-этил-2-метилпропил, 1,1,2-триметилпропил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2-этилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3-диметилбутил, н-гептил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилпентил, 2,4-диметилпентил, 2,2-диметилпентил, 3,3-диметилпентил, 2-этилпентил, 3-этилпентил, н-октил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилгексил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил, н-нонил, 2-метил-2-этилгексил, 2-метил-3-этилгексил, 2,2-диэтилпентил, н-децил, 3,3-диэтилгексил, 2,2-диэтилгексил и их разветвленные изомеры. Более предпочтительно алкильная группа представляет собой низший алкил, имеющий от 1 до 6 атомов углерода, и неограничивающие примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, 2-метилбутил, 3-метилбутил, н-гексил, 1-этил-2-метилпропил, 1,1,2-триметилпропил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2-этилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3-диметилбутил и т.п. Алкильная группа может быть замещенной или незамещенной. При замещении замещающая группа может быть заместителем в любой доступной точке соединения Замещающая группа (группы) предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси циклоалкилтио, гетероциклоалкилтио, оксо, карбоксила и алкоксикарбонила.
"Алкилен" относится к алкилу, в котором атом водорода дополнительно замещен например, "метилен" относится к -СН2-, "этилен" относится к -(СН2)2-, "пропилен" относится к -(СН2)3-, "бутилен" относится к -(СН2)4-, и т.п. «Алкенил» относится к алкилу, как определено выше, который имеет по меньшей мере два атома углерода и по меньшей мере одну углерод-углеродную двойную связь, например, к этенилу, 1-пропенилу, 2-пропенилу, 1-, 2- или 3-бутенилу и т.п. Алкенильная группа может быть замещена или незамещена. При замещении замещающая группа (группы) предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио и гетероциклоалкилтио.
«Циклоалкил» относится к насыщенной или частично ненасыщенной моноциклической или полициклической углеводородной группе, содержащей от 3 до 20 атомов углерода, предпочтительно от 3 до 12 атомов углерода, более предпочтительно от 3 до 8 атомов углерода и наиболее предпочтительно от 3 до 6 атомов углерода. Неограничивающие примеры моноциклического циклоалкила включают циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогексадиенил, циклогептил, циклогептатриенил, циклооктил и т.п. Полициклический циклоалкил включает циклоалкил, имеющий спиро-кольцо, конденсированное кольцо или мостиковое кольцо.
«Спироциклоалкил» относится к 5-20-членной полициклической группе с кольцами, связанными через один общий атом углерода (называемый спироатомом), где одно или более колец могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной пи-электронной системы, предпочтительно к 6-14-членному спироциклоалкилу, и более предпочтительно к 7-10-членному спироциклоалкилу. В соответствии с числом спироатомов, общих для колец, спироциклоалкилы можно разделить на моноспироциклоалкил, диспироциклоалкил или полиспироциклоалкил, и предпочтительно моноспироциклоалкил или ди-спироциклоалкил, и более предпочтительно 4-членный/4-членный, 4-членный/5-членный, 4-членный/6-членный, 5-членный/5-членный или 5-членный/6-членный моноспироциклоалкил. Неограничивающие примеры спироциклоалкилов включают:
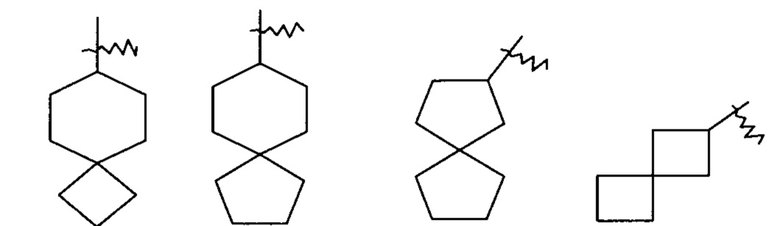 и
и 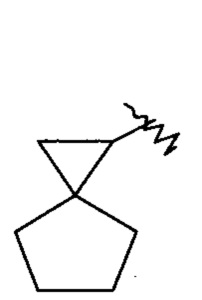 .
.
«Конденсированный циклоалкил» относится к 5-20-членной углеродной полициклической группе, где каждое кольцо в системе имеет общую пару атомов углерода с другим кольцом, где одно или более колец могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной пи-электронной системы, предпочтительно к 6-14-членному конденсированному циклоалкилу, и более предпочтительно к 7-10-членному конденсированному циклоалкилу. В соответствии с количеством содержащихся колец, конденсированные циклоалкилы можно разделить на бициклические, трициклические, тетрациклические или полициклические конденсированные циклоалкилы, предпочтительно бициклические или трициклические конденсированные циклоалкилы, и более предпочтительно 5-членный/5-членный или 5-членный/6-членный бициклический конденсированный циклоалкил. Неограничивающие примеры конденсированных циклоалкилов включают:
 и
и 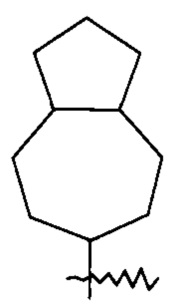 .
.
"Мостиковый циклоалкил" относится к 5-20-членной углеродной полициклической группе, где каждые два кольца в системе имеют два общих не связанных друг с другом атома углерода, где кольца могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной пи-электронной системы, предпочтительно к 6-14-членному мостиковому циклоалкилу, и более предпочтительно к 7-10-членному мостиковому циклоалкилу. В соответствии с количеством содержащихся колец, мостиковые циклоалкилы можно разделить на бициклические, трициклические, тетрациклические или полициклические мостиковые циклоалкилы, предпочтительно бициклические, трициклические или тетрациклические мостиковые циклоалкилы, и более предпочтительно бициклические или трициклические мостиковые циклоалкилы. Неограничивающие примеры мостиковых циклоалкилов включают:
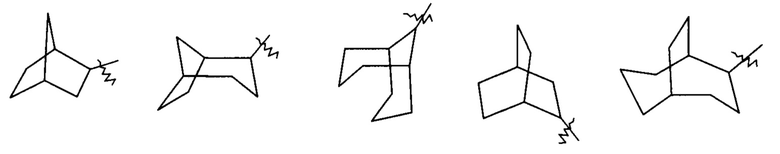
 и
и  .
.
Кольцо циклоалкила может быть сконденсировано с кольцом арила, гетероарила или гетероциклила, где кольцо, связанное с родительской структурой, является циклоалкилом. Неограничивающие примеры включают инданил, тетрагидронафтил, бензоциклогептил и т.п. Циклоалкил может быть замещенным или незамещенным. При замещении замещающая группа (группы) предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклоалкилтио, оксо, карбоксила, алкоксикарбонила.
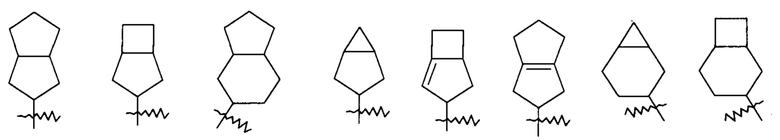
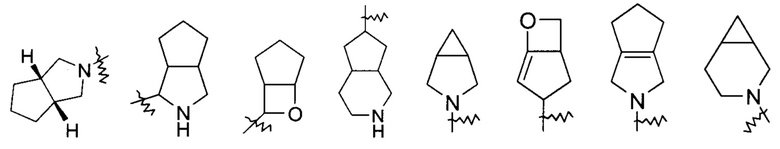
"Гетероциклил" относится к 3-20-членной насыщенной или частично ненасыщенной моноциклической или полициклической углеводородной группе, имеющей один или более гетероатомов, выбранных из группы, состоящей из N, О и S(O)m (где m является целым числом от 0 до 2), в качестве кольцевых атомов, исключая -O-O-, -O-S- или -S-S- в кольце, где остальные кольцевые атомы являются атомами углерода. Предпочтительно, гетероциклил имеет 3-12 атомов, где 1-4 атома являются гетероатомами, более предпочтительно 3-6 атомов. Неограничивающие примеры моноциклического гетероциклила включают пирролидинил, имидазолидинил, тетрагидрофуранил, тетрагидротиенил, дигидроимидазолил, дигидрофуранил, дигидропиразолил, дигидропирролил, пиперидил, пиперазинил, морфолинил, тиоморфолинил, гомопиперазинил и т.п., предпочтительно пиперидил или пирролидинил. Полициклический гетероциклил включает гетероциклил, имеющий спирокольцо, конденсированное кольцо или мостиковое кольцо.
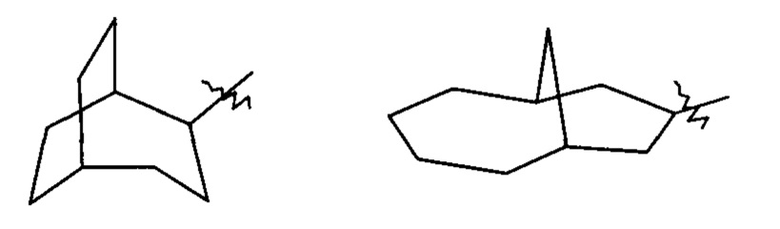
«Спирогетероциклил» относится к 5-20-членному полициклическому гетероциклилу с кольцами, связанными через один общий атом углерода (называемый спироатомом), где кольца имеют один или более гетероатомов, выбранных из группы, состоящей из N, О и S(O)m (где m является целым числом от 0 до 2), в качестве кольцевых атомов, где остальные кольцевые атомы являются атомами углерода, где одно или более колец могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной пи-электронной системы, предпочтительно к 6-14-членному спирогетероциклилу, и более предпочтительно к 7-10-членному спирогетероциклилу. В соответствии с числом спироатомов, общих для колец, спирогетероциклилы можно разделить на моноспирогетероциклил, диспирогетероциклил или полиспирогетероциклил, и предпочтительно моноспирогетероциклил или диспирогетероциклил, и более предпочтительно 4-членный/4-членный, 4-членный/5-членный, 4-членный/6-членный, 5-членный/5-членный или 5-членный/6-членный моноспирогетероциклил. Неограничивающие примеры спирогетероциклилов включают:
 и
и 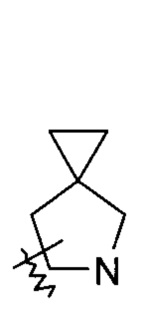 .
.
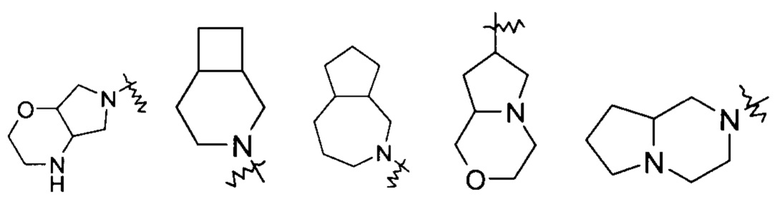
«Конденсированный гетероциклил» относится к 5-20-членной полициклической гетероциклильной группе, где каждое кольцо в системе имеет общую пару атомов с другим кольцом, где одно или более колец могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной пи-электронной системы, и где кольца имеют один или более гетероатомов, выбранных из группы, состоящей из N, О и S(O)m (где m является целым числом от 0 до 2), в качестве кольцевых атомов, где остальные кольцевые атомы являются атомами углерода, предпочтительно к 6-14-членному конденсированному гетероциклилу, и более предпочтительно к 7-10-членному конденсированному гетероциклилу. В соответствии с количеством содержащихся колец, конденсированные гетероциклилы можно разделить на бициклические, трициклические, тетрациклические или полициклические конденсированные гетероциклилы, предпочтительно бициклические или трициклические конденсированные гетероциклилы, и более предпочтительно 5-членный/5-членный или 5-членный/6-членный бициклический конденсированный гетероциклил. Неограничивающие примеры конденсированных гетероциклилов включают:
 и
и 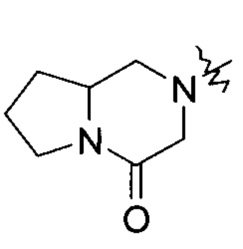 .
.
"Мостиковый гетероциклил" относится к 5-14-членной полициклической гетероциклильной группе, где каждые два кольца в системе имеют два общих не связанных друг с другом атома, где кольца могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной пи-электронной системы, и где кольца имеют один или более гетероатомов, выбранных из группы, состоящей из N, О и S(O)m (где m является целым числом от 0 до 2), в качестве кольцевых атомов, где остальные кольцевые атомы являются атомами углерода, предпочтительно к 6-14-членному мостиковому гетероциклилу, и более предпочтительно к 7-10-членному мостиковому гетероциклилу. В соответствии с количеством содержащихся колец, мостиковые гетероциклилы можно разделить на бициклические, трициклические, тетрациклические или полициклические мостиковые гетероциклилы, предпочтительно бициклические, трициклические или тетрациклические мостиковые гетероциклилы, и более предпочтительно бициклические или трициклические мостиковые гетероциклилы. Неограничивающие примеры мостиковых гетероциклилов включают:
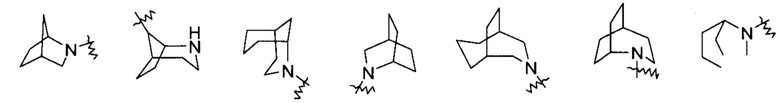 и
и 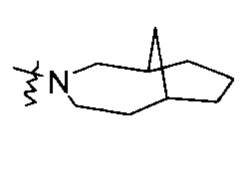 .
.
Кольцо гетероциклила может быть сконденсировано с кольцом арила, гетероарила или циклоалкила, где кольцо, связанное с родительской структурой, является гетероциклилом. Неограничивающие примеры включают:
 и
и  , и т.п.
, и т.п.
Гетероциклил может быть замещенным или незамещенным. При замещении замещающая группа (группы) предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклоалкилтио, оксо, карбоксила, алкоксикарбонила.
«Арил» относится к 6-14-членному полностью углеродному моноциклическому кольцу или полициклическому конденсированному кольцу (то есть, каждое кольцо в системе имеет общие соседние пары атомов углерода с другим кольцом в системе), имеющему полностью сопряженную пи-электроную систему; предпочтительно к 6-10-членному арилу, например, к фенилу и нафтилу, и более предпочтительно к фенилу. Арил может быть сконденсирован с кольцом гетероарила, гетероциклила или циклоалкила, где кольцо, связанное с родительской структурой, является арилом. Неограничивающие примеры включают:
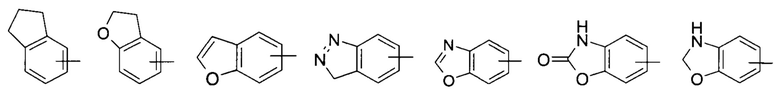
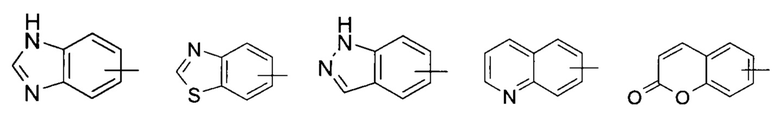 и
и 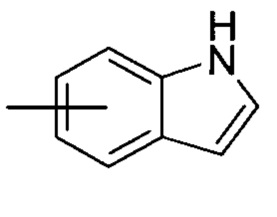 ; предпочтительно
; предпочтительно 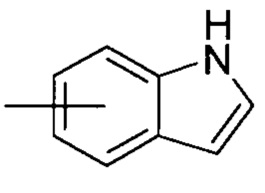 .
.
Арил может быть замещенным или незамещенным. При замещении, замещающая группа (группы) предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклоалкилтио, оксо, карбоксила, алкоксикарбонила.
«Гетероарил» относится к 5-14-членной гетероароматической системе, имеющей от 1 до 4 гетероатомов, выбранных из группы, состоящей из О, S и N, в качестве кольцевых атомов; предпочтительно к 5-10-членному гетероарилу, и более предпочтительно к 5-6-членному гетероарилу, например, к имидазолилу, фурилу, тиенилу, тиазолилу, пиразолилу, оксазолилу, пирролилу, тетразолилу, пиридилу, пиримидинилу, тиадиазолилу, пиразинилу и т.п., предпочтительно к имидазолилу, пиразолилу, пимидинилу или тиазолилу, и более предпочтительно к пиразолилу. Гетероарил может быть сконденсирован с кольцом арила, гетероциклила или циклоалкила, где кольцо, связанное с родительской структурой, является гетероарилом. Неограничивающие примеры включают:
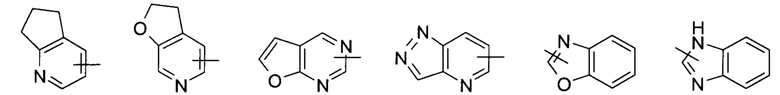
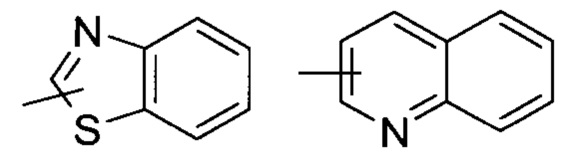 и
и 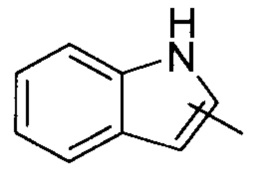 ; предпочтительно
; предпочтительно 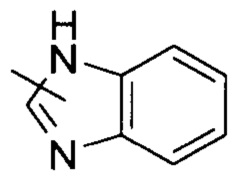 .
.
Гетероарил может быть замещенным или незамещенным. При замещении, замещающая группа (группы) предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклоалкилтио, карбоксила или алкоксикарбонила.
"Алкокси" относится к -О-(алкил) или -O-(незамещенный циклоалкил) группе, где алкил является таким, как определено выше. Неограничивающие примеры включают метокси, этокси, пропокси, бутокси, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и т.п. Алкокси может быть замещенным или незамещенным. При замещении заместитель предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклоалкилтио, карбоксила, алкоксикарбонила.
"Галоалкил" относится к алкилу, замещенному одним или более галогенами, где алкил является таким, как определено выше.
"Галоалкокси" относится к алкокси, замещенному одним или более галогенами, где алкокси является таким, как определено выше.
"Гидроксиалкил" относится к алкилу, замещенному гидроксигруппой, где алкил является таким, как определено выше.
"Гидрокси" относится к -ОН группе.
"Галоген" относится к фтору, хлору, брому или иоду.
"Амино" относится к -NH2 группе.
"Циано" относится к -CN группе.
"Нитро" относится к -NO2 группе.
"Оксо" относится к = O.
"Карбоксил" относится к -С(O)ОН группе.
"Алкоксикарбонил" относится к -С(O)O(алкил) или (циклоалкил) группе, где алкил и циклоалкил являются такими, как определено выше.
"Ацилгалид" относится к -С(O)-галоген группе.
Все из выражений "X выбран из группы, состоящей из А, В или С", "X выбран из группы, состоящей из А, В и С", "X представляет собой А, В или С", "X представляет собой А, В и С" и т.п. имеют одинаковое значение. Это означает, что X может быть любым из А, В и С.
«Возможный» или «возможно» означает, что событие или обстоятельство, описанное далее, может иметь место, но не обязательно, и данное описание включает ситуацию, в которой это событие или обстоятельство происходит или не происходит. Например, «гетероциклическая группа, возможно замещенная алкилом» означает, что алкильная группа может присутствовать, но не обязательно, и данное описание включает ситуацию, когда гетероциклическая группа замещена алкилом и когда гетероциклическая группа не замещена алкилом.
«Замещенный» относится к одному или более атомов водорода в группе, предпочтительно до 5, более предпочтительно к 1-3 атомам водорода, независимо замещенным соответствующим количеством заместителей. Само собой разумеется, что заместители существуют только в их возможном химическом положении. Специалист в данной области способен определить, возможно ли замещение или не возможно, путем экспериментов или теории без приложения излишних усилий. Например, комбинация амино или гидрокси, имеющих свободные атомы водорода и углерода, имеющих ненасыщенные связи (такие как олефиновые), может быть нестабильной.
«Фармацевтическая композиция» относится к смеси одного или более соединений согласно настоящему изобретению или их физиологически/фармацевтически приемлемых солей или пролекарств и других химических компонентов, таких как физиологически/фармацевтически приемлемые носители и эксципиенты. Назначение фармацевтической композиции заключается в том, чтобы облегчить введение соединения в организм, которое способствует абсорбции активного ингредиента, проявляя таким образом биологическую активность.
«Фармацевтически приемлемая соль» относится к соли соединения согласно настоящему изобретению, которая является безопасной и эффективной у млекопитающих и имеет желаемую биологическую активность.
Способ синтеза соединения согласно настоящему изобретению
Для того чтобы решить задачу настоящего изобретения, применяются следующие технические решения.
Способ получения соединения формулы (II) и формулы (II-1) по настоящему изобретению или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли включает следующие стадии:
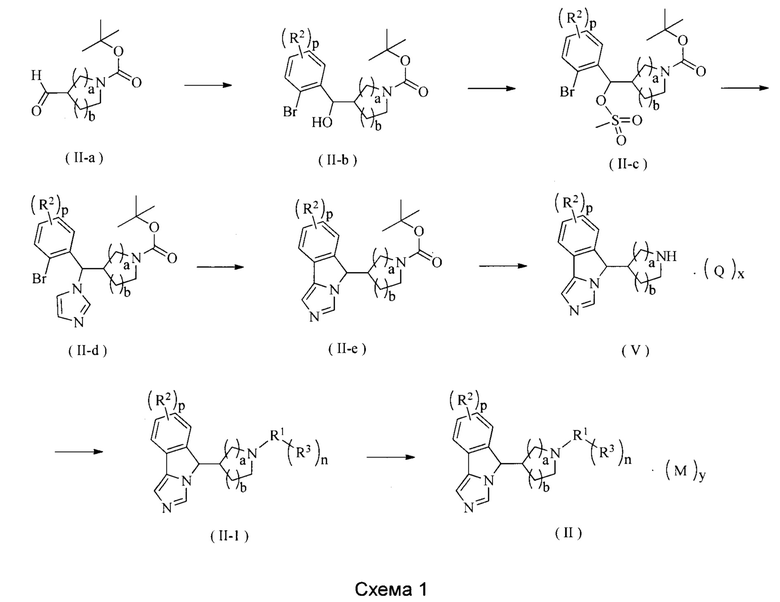
Соединение формулы (II-а) подвергают взаимодействию с бромбензольным соединением посредством реакции присоединения в щелочных условиях (реагент, который обеспечивает щелочные условия, предпочтительно представляет собой диизопропиламид лития) при низкой температуре с получением соединения формулы (II-b); соединение формулы (II-b) подвергают взаимодействию с соединением метансульфонилхлорида в щелочных условиях (реагент, который обеспечивает щелочные условия, предпочтительно представляет собой гидрид натрия или триэтиламин) с получением соединения формулы (II-c); полученное соединение формулы (II-с) подвергают взаимодействию с имидазолом в щелочных условиях с получением соединения формулы (II-d); полученное соединение формулы (II-d) внутримолекулярно конденсируют при нагревании в присутствии основания и катализатора на основе фосфинпалладия (катализатор предпочтительно представляет собой трифенилфосфин и ацетат палладия) с получением соединения формулы (II-е); с полученного соединения формулы (II-е) снимают защиту в кислых условиях с получением соединения формулы (V) или его соли; соединение формулы (V) дополнительно связывают с галидом R3 в щелочных условиях (реагентом, который обеспечивает щелочные условия, является предпочтительно трет-бутоксид натрия), в присутствии катализатора на основе фосфинпалладия, затем полученный продукт возможно дополнительно связывают с борной кислотой или сложным эфиром борной кислоты с R3 с получением соединения (II-1); и соединение формулы (II-1) превращают в соль в кислых условиях с получением соединения (II-b).
Агент, который обеспечивает щелочные условия, включает органическое основание и неорганическое основание, где органическое основание включает, но не ограничивается этим, триэтиламин, N,N-диизопропилэтиламин, н-бутиллитий, диизопропиламид лития, ацетат калия, трет-бутоксид натрия или трет-бутоксид калия, где неорганическое основание включает, но не ограничивается этим, гидрид натрия, фосфат калия, карбонат натрия, карбонат калия или карбонат цезия.
Указанный катализатор на основе фосфинпалладия включает, но не ограничивается этим, 2-(дициклогексилфосфино)-2,4,6-триизопропилбифенил, (±)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил, трис(дибензилиденацетон)-дипалладий, диацетат палладия, [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий, трифенилфосфин и тетракис(трифенилфосфин)палладий.
Где:
R1-R3, М, p, n, a, b и у являются такими, как определено в формуле (II); и Q, х являются такими, как определено в формуле (V).
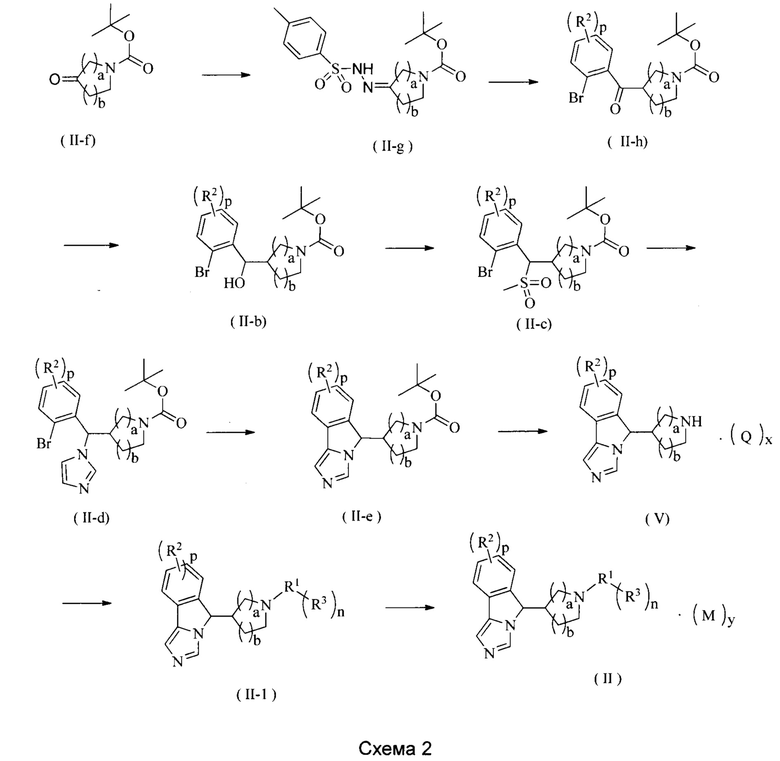
Соединение формулы (II-f) подвергают взаимодействию с п-толуолсульфонилгидразидом с получением соединения формулы (II-g); полученное соединение формулы (II-g) подвергают взаимодействию с соединением бромбензальдегида в щелочных условиях с получением соединения формулы (II-h); полученное соединение формулы (II-h) восстанавливают до соединения формулы (II-b) в присутствии восстановителя (предпочтительно восстановителем является боргидрид натрия); соединение формулы (II-b) подвергают взаимодействию с сульфонилхлоридным соединением в щелочных условиях (реагент, который обеспечивает щелочные условия, представляет собой предпочтительно гидрид натрия или триэтиламин) с получением соединения формулы (II-с); полученное соединение формулы (II-с) подвергают взаимодействию с имидазолом в щелочных условиях с получением соединения формулы (II-d). Полученное соединение формулы (II-d) внутримолекулярно конденсируют при нагревании в присутствии основания и фосфинпалладиевого катализатора (катализатор предпочтительно представляет собой трифенилфосфин и ацетат палладия) с получением соединения формулы (II-е); с полученного соединения формулы (II-е) снимают защиту в кислых условиях с получением соединения формулы (V) или его соли; соединение формулы (V) дополнительно связывают с галидом R3 в щелочных условиях (реагентом, который обеспечивает щелочные условия, является предпочтительно трет-бутоксид натрия), в присутствии катализатора на основе фосфинпалладия, затем полученный продукт возможно дополнительно подвергают взаимодействию с борной кислотой или сложным эфиром борной кислоты с R3 с получением соединения формулы (II-1); и соединение формулы (II-1) превращают в соль в кислых условиях с получением соединения формулы (II-b).
Агент, который обеспечивает щелочные условия, включает органическое основание и неорганическое основание, где органическое основание включает, но не ограничивается этим, триэтиламин, N,N-диизопропилэтиламин, н-бутилллитий, диизопропиламид лития, ацетат калия, трет-бутоксид натрия или трет-бутоксид калия, где неорганическое основание включает, но не ограничивается этим, гидрид натрия, фосфат калия, карбонат натрия, карбонат калия или карбонат цезия.
Упомянутый катализатор на основе фосфинпалладия включает, но не ограничивается этим, 2-(дициклогексилфосфино)-2,4,6-триизопропилбифенил, (±)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил, трис(дибензилиденацетон)-дипалладий, диацетат палладия, [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий, трифенилфосфин и тетракис(трифенилфосфин)палладий.
Упомянутый восстановитель включает, но не ограничивается этим, порошок Fe, порошок Zn, Н2, боргидрид натрия, триацетоксиборгидрид натрия, цианоборгидрид натрия или литийалюминийгидрид.
Где:
R1-R3, М, p, n, a, b и у являются такими, как определено в формуле (II); и Q, х являются такими, как определено в формуле (V).
Схема 3
Существует несколько способов синтеза для получения соединения формулы (11-1) из соединения формулы (V) с использованием различных реагентов, как представлено далее:
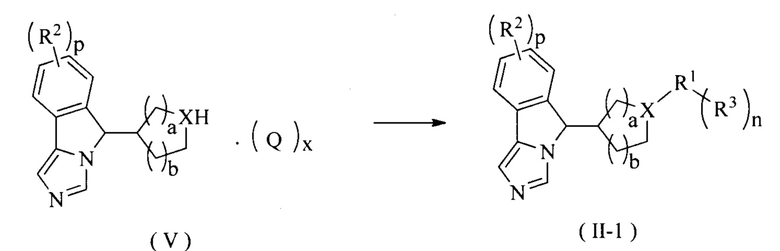
Способ 1: Соединение формулы (V) связывают с галидом R1 при прямом нагревании или в микроволновом реакторе в атмосфере инертного газа при высокой температуре в щелочных условиях и в присутствии фосфинпалладиевого катализатора, полученный продукт возможно дополнительно связывают с бороновой кислотой или сложным эфиром борной кислоты с R1 с получением соединения формулы (II-1); где галид R3 предпочтительно представляет собой арилгалидное соединение, а щелочным агентом является предпочтительно трет-бутоксид натрия.
Способ 2: Соединение формулы (V) непосредственно связывают с галидом R1 при высокой температуре в щелочных условиях, полученный продукт возможно дополнительно связывают с бороновой кислотой или сложным эфиром борной кислоты с R3 с получением соединения формулы (II-1); где галид R1 предпочтительно представляет собой гетероарилгалидное соединение, а щелочным агентом является предпочтительно триэтиламин.
Способ 3: Соединение формулы (V) непосредственно вводят во взаимодействие с галидом R3 с получением соединения формулы (II-1) при комнатной температуре в щелочных условиях; где используемый в реакции галид предпочтительно представляет собой иодид или высокоактивное ацилгалидное соединение, а щелочным агентом является предпочтительно карбонат калия.
Упомянутый катализатор на основе фосфинпалладия включает, но не ограничивается этим, 2-(дициклогексилфосфино)-2,4,6-триизопропилбифенил, (±)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил, трис(дибензилиденацетон)-дипалладий, диацетат палладия, [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий, трифенилфосфин и тетракис(трифенилфосфин)палладий.
Агент, который обеспечивает щелочные условия, включает органическое основание и неорганическое основание, где органическое основание включает, но не ограничивается этим, трет-бутоксид натрия, триэтиламин, N,N-диизопропилэтиламин, н-бутилллитий, диизопропиламид лития, трет-бутоксид натрия, ацетат калия или трет-бутоксид калия, где неорганическое основание включает, но не ограничивается этим, гидрид натрия, фосфат калия, карбонат натрия, карбонат калия или карбонат цезия.
Где:
Х представляет собой N;
R1-R3, р, n, а и b являются такими, как определено в формуле (II); и Q и х являются такими, как определено в формуле (V).
Предпочтительные варианты осуществления изобретения
Настоящее изобретение будет дополнительно описано со ссылкой на следующие примеры, но эти примеры не следует рассматривать как ограничивающие объем изобретения.
Примеры
Структуры соединений идентифицированы с помощью ядерного магнитного резонанса (ЯМР) и/или масс-спектрометрии (МС). ЯМР определяют на приборе Bruker AVANCE-400. Растворителями для определения являются дейтерированный диметилсульфоксид (ДМСО-d6), дейтерированный хлороформ (CDCl3) и дейтерированный метанол (CD3OD), а внутренним стандартом - тетраметилсилан (ТМС). ЯМР-химические сдвиги (δ) приведены в 10-6 (ppm).
МС определяют с помощью масс-спектрометра FINNIGAN LCQAd (ESI) (производитель: Thermo, тип: Finnigan LCQ advantage MAX).
Высокоэффективную жидкостную хроматографию (ВЭЖХ) осуществляют на спектрометре для жидкостной хроматографии при высоком давлении Agilent 1200DAD (хроматографическая колонка Sunfire C18 150×4,6 мм) и спектрометре для жидкостной хроматографии при высоком давлении Waters 2695-2996 (хроматографическая колонка Gimini C18 150×4,6 мм).
Среднюю скорость ингибирования киназы и значения IC50 определяют с помощью NovoStar ELISA (BMG Co., Германия).
Пластину силикагеля Yantai Huanghai HSGF254 или Qingdao GF254 используют для тонкослойной хроматографии на силикагеле (ТСХ). Толщина пластины силикагеля, используемой в ТСХ, составляет от 0,15 до 0,2 мм, а толщина пластины силикагеля, используемой для очистки продукта, составляет от 0,4 мм до 0,5 мм.
В качестве носителя для колоночной хроматографии используют силикагель Yantai Huanghai 200-300 меш.
Известные исходные вещества для настоящего изобретения можно получить обычными в данной области способами синтеза или можно приобрести у ABCR GmbH & Со. KG, Acros Organnics, Aldrich Chemical Company, Accela ChemBio Inc. или Dari chemical Company и др.
Если не указано иное, реакции проводят в атмосфере азота или атмосфере аргона.
Термин «атмосфера азота» или «атмосфера аргона» означает, что реакционная колба оснащена баллоном азота или аргона емкостью 1 л.
Термин «атмосфера водорода» означает, что реакционная колба оснащена баллоном водорода емкостью 1 л.
Реакции гидрирования под давлением проводят с использованием прибора гидрирования Parr 3916EKX и генератора водорода QL-500, или прибора гидрирования HC2-SS.
В реакциях гидрирования реакционная система, как правило, подвергается вакуумированию и заполнению водородом, и вышеуказанная операция повторяется три раза.
Микроволновый реактор СЕМ Discover-S 908860 используется в микроволновой реакции.
Если не указано иное, раствор, используемый в реакциях, относится к водному раствору.
Если не указано иное, температура реакции в реакциях относится к комнатной температуре.
Комнатная температура является наиболее подходящей температурой реакции, а диапазон температуры составляет от 20°С до 30°С.
Процесс реакции контролируется тонкослойной хроматографией (ТСХ), а система проявляющего растворителя включает: А: систему дихлорметана и метанола, В: систему н-гексана и этилацетата, С: систему петролейного эфира и этилацетата, D: ацетон. Соотношение объема растворителей можно регулировать в соответствии с полярностью соединений.
Система элюирования для очистки соединений колоночной хроматографией и тонкослойной хроматографией включает: А: систему дихлорметана и метанола, В: систему н-гексана и этилацетата, С: систему н-гексана, этилацетата и дихлорметана, D: систему петролейного эфира и этилацетата, Е: этилацетат. Соотношение объема растворителей можно регулировать в соответствии с полярностью соединений, и иногда может быть добавлено немного щелочного реагента, такого как триэтиламин, или кислого реагента.
Пример 1
6-Фтор-5-(1-фенилпиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат
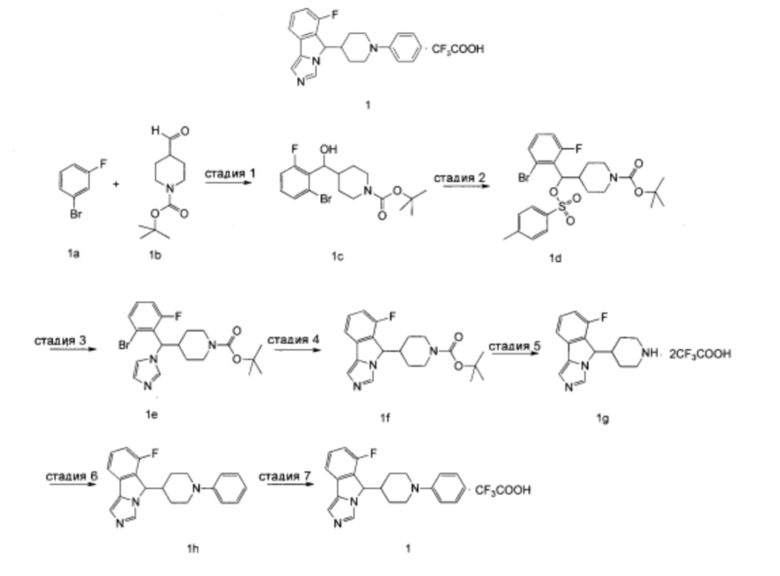
Стадия 1
трет-Бутил-4-((2-бром-6-фторфенил)(гидрокси)метил)пиперидин-1-карбоксилат 1с
Диизопропиламид лития (32,5 мл, 65,0 мммоль) добавляли в 50 мл тетрагидрофурана, затем добавляли 25 мл предварительно приготовленного раствора 1-бром-3-фторбензола 1а (8,75 г, 50,0 мммоль) в тетрагидрофуране по каплям при -78°С и полученную смесь перемешивали в течение 1 часа при -78°С. Затем добавляли по каплям при -78°С 25 мл предварительно приготовленного раствора трет-бутил 4-формилпиперидин-1-карбоксилата 1b (8,75 г, 50,0 мммоль) в тетрагидрофуране. Реакционную смесь непрерывно перемешивали в течение 1 часа при -78°С. По завершении реакции по каплям добавляли 25 мл метанола для гашения реакции при -78°С и реакционный раствор концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле с помощью системы элюирования В с получением соединения 1с (16,3 г, выход 84,0%) в виде желтого сиропообразного твердого вещества.
МС m/z (ЖХ-МС): 332,0 [М-56]
Стадия 2
трет-Бутил-4-((2-бром-6-фторфенил)(тозилокси)метил)пиперидин-1-карбоксилат 1d
Соединение 1с (15 г, 38,63 мммоль) растворяли в 350 мл тетрагидрофурана, затем добавляли гидрид натрия (3,09 г, 77,26 мммоль), полученную смесь перемешивали до тех пор, пока не выделялся газ. Затем добавляли по каплям 250 мл предварительно приготовленного раствора п-толуолсульфонилхлорида (8,10 г, 42,49 мммоль) в тетрагидрофуране. Реакционную смесь перемешивали при комнатной температуре в течение 30 минут, затем кипятили с обратным холодильником в течение 4 часов и затем при 70°С в течение еще 48 часов. По завершении реакции смесь охлаждали до 0°С, добавляли по каплям 50 мл воды для гашения реакции. Добавляли 50 мл насыщенного раствора хлорида натрия, затем разделяли две фазы и органическую фазу сушили над безводным сульфатом натрия. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с помощью системы элюирования В с получением соединения 1d (6,6 г, выход 31,8%) в виде светло-желтого вязкого твердого вещества.
МС m/z (ЖХ-МС): 314,0/316,0 [M-56-TsO]
Стадия 3
трет-Бутил-4-((2-бром-6-фторфенил)(1H-имидазол-1-ил)метил)пиперидин-1-карбоксилат 1е
Имидазол (12,5 г, 184,3 мммоль) растворяли в 50 мл N,N-диметилформамида, затем добавляли порциями гидрид натрия (7,40 г, 184,3 мммоль). Полученную смесь перемешивали в течение 1 часа при комнатной температуре. Затем по каплям добавляли 20 мл предварительно приготовленного раствора соединения 1d (10,0 г, 18,43 мммоль) в N,N-диметилформамиде. Реакционную смесь перемешивали в течение 12 часов при 100°С. По завершении реакции добавляли 300 мл этилацетата, смесь промывали насыщенным раствором хлорида натрия (150 мл × 3), затем органическую фазу сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с помощью системы элюирования А с получением соединения 1е (1,90 г, выход 23,5%) в виде коричневого вязкого твердого вещества.
МС m/z (ESI): 438,1/440,1 [М+1]
Стадия 4
трет-Бутил-4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-карбоксилат 1f
Соединение 1е (1,90 г, 4,33 мммоль), N,N-дициклогексилэтамин (1,35 г, 6,93 мммоль) и трифенилфосфин (908 мг, 3,46 мммоль) растворяли в 10 мл N,N-диметилформамида. В атмосфере аргона добавляли ацетат палладия (390 мг, 1,74 мммоль). Реакционную смесь перемешивали в течение 4,5 ч при 100°С. После завершения реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с помощью системы элюирования В с получением соединения 1f (1,30 г, выход 83,8%) в виде желтого вязкого твердого вещества.
МС m/z (ЖХ-МС): 358,1 [М+1]
Стадия 5
6-Фтор-5-(пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола дитрифторацетат 1g
Соединение 1f (1,30 г, 3,64 мммоль) растворяли в 5 мл дихлорметана, затем добавляли по каплям 5 мл трифторацетата. Полученную смесь перемешивали в течение 1 часа при комнатной температуре. По окончании реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 1g (1,77 г) в виде коричневого вязкого твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки.
МС m/z (ЖХ-МС): 258,3 [М+1]
Стадия 6
6-Фтор-5-(1-фенилпиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндол 1h
Неочищенное соединение 1g (230 мг, 0,50 мммоль), бромбензол (314 мг, 2,00 мммоль), (±)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил (39 мг, 0, 0625 мммоль), трет-бутоксид натрия (192 мг, 2,0 мммоль) растворяли в 5 мл 1,4-диоксана, затем добавляли три(дибензилиденацетон)дипалладий (46 мг, 0,05 мммоль) в атмосфере аргона. Полученную смесь перемешивали в течение 4 часов при 100°С. По завершении реакции добавляли 20 мл этилацетата, смесь промывали водой (10 мл × 3), затем органическую фазу сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 1h (6,3 мг, выход 3,6%) в виде коричневого вязкого твердого вещества.
МС m/z (ESI): 334,3 [М+1]
Стадия 7
6-Фтор-5-(1-фенилпиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндола трифторацетат 1
Соединение 1h (6,3 мг, 0,018 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,01 мл трифторуксусной кислоты. Полученную смесь перемешивали в течение 60 минут при комнатной температуре. После завершения реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 1 (8,3 мг, выход 100%) в виде коричневого твердого вещества.
MC m/z (ESI): 334,3 [М+1]
1Н ЯМР (400 МГц, CD3OD) δ 9,35 (s, 1Н), 7,93 (s, 1H), 7,74 (d, 1H), 7,69-7,64 (m, 1H), 7,60-7,50 (m, 5H), 7,38-7,34 (m, 1H), 6,15 (d, 1H), 3,79-3,71 (m, 1H), 3,69-3,61 (m, 2H), 3,61-3,51 (m, 1H), 3,02-2,92 (m, 1H), 2,14-2,04 (m, 2H), 1,76-1,59 (m, 2H).
Пример 2
7-Фтор-5-(1-фенилпиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат
Стадия 1
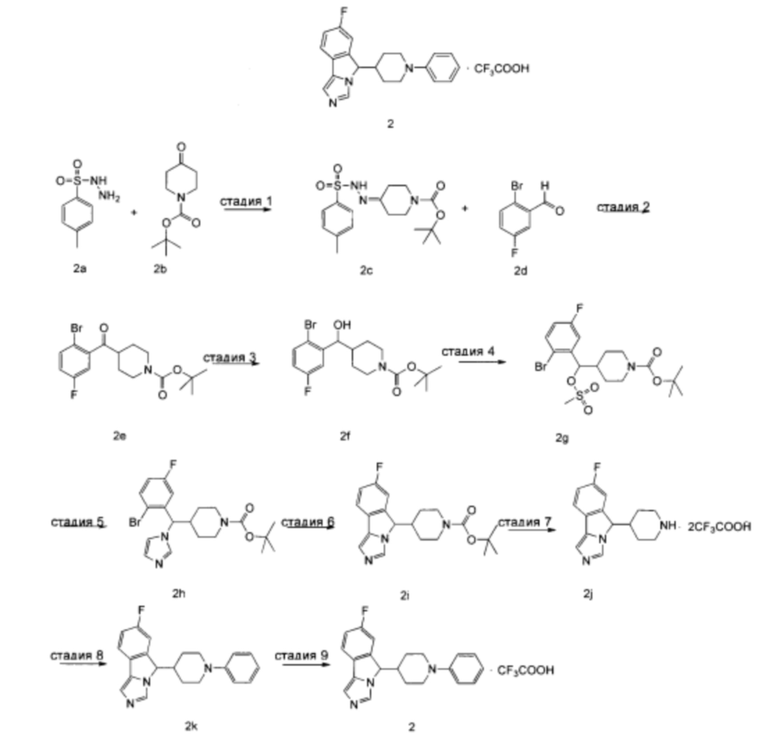
трет-Бутил-4-(2-тозилгидразоно)пиперидин-1-карбоксилат 2с
п-Толуолсульфонилгидразид 2а (9,31 г, 50,0 ммоль) растворяли в 100 мл метанола, затем добавляли н-трет-бутоксикарбонил-4-пиперидон 2b (9,96 г, 50,0 ммоль, полученный известным способом, описанным в «ACS Medicinal Chemistry Letters, 2014, 5 (5), 550-555»), и полученную смесь перемешивали в течение 2 часов при комнатной температуре. После завершения реакции реакционный раствор концентрировали при пониженном давлении. Полученный остаток сушили с получением неочищенного соединения 2с (18,37 г) в виде белого твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки.
МС m/z (ЖХ-МС): 368,0 [М+1]
Стадия 2
трет-Бутил-4-(2-бром-5-фторбензоил)пиперидин-1-карбоксилат 2е
Неочищенное соединение 2с (5,52 г, 15,0 ммоль), 2-бром-5-фторбензальдегид 2d (3,05 г, 15,0 ммоль) и карбонат цезия (7,33 г, 22,5 ммоль) добавляли в герметичную пробирку. Добавляли 60 мл 1,4-диоксана и реакционную смесь перемешивали в течение 10 часов при 110°С в атмосфере аргона. По завершении реакции добавляли 20 мл этилацетата, смесь промывали водой (100 мл × 1) и насыщенным раствором хлорида натрия (100 мл × 2), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного соединения 2е (6,17 г) в виде желтого вязкого твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки.
МС m/z (ЖХ-МС): 330,0/332,0 [М-56]
Стадия 3
трет-Бутил-4-((2-бром-5-фторфенил)(гидрокси)метил)пиперидин-1-карбоксилат 2f
Неочищенное соединение 2е (6,17 г, 16,0 ммоль) растворяли в 100 мл метанола и реакционную систему охлаждали до 0°С. При 0°С медленно добавляли боргидрид натрия (1,21 г, 32,0 ммоль). Реакционную систему перемешивали в течение 1 часа при 0°С. По завершении реакции добавляли 200 мл этилацетата. Смесь промывали насыщенным раствором хлорида натрия (100 мл × 3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения 2f (6,21 г) в виде желтого сиропа, который использовали непосредственно на следующей стадии без дополнительной очистки.
МС m/z (ESI): 332,0/334,0 [М-56]
Стадия 4
трет-Бутил-4-((2-бром-5-фторфенил)((метилсульфонил)окси)метил)пиперидин-1-карбоксилат 2g
Неочищенное соединение 2f (6,21 г, 16,0 ммоль) растворяли в 100 мл дихлорметана и полученную смесь охлаждали до 0°С. Добавляли триэтиламин (3,24 г, 32,0 ммоль). Затем добавляли по каплям метилсуфонилхлорид (2,75 г, 24,0 ммоль). Реакционную систему перемешивали в течение 1 часа при 0°С. После завершения реакции реакционный раствор промывали водой (50 мл × 3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, получая при этом неочищенное соединение 2g (7,46 г) в виде коричневого вязкого твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия 5
трет-Бутил-4-((2-бром-5-фторфенил)(1H-имидазол-1-ил)метил)пиперидин-1-карбоксилат 2h
Неочищенное соединение 2g (7,46 г, 16,0 ммоль), 1-Н-имидазол (10,89 г, 160,0 ммоль) и N,N-диизопропилэтиламин (20,68 г, 160,0 ммоль) добавляли в герметичную пробирку. Добавляли 50 мл ацетонитрила. Реакционную систему перемешивали в течение 12 часов при 120°С. После завершения реакции реакционную систему охлаждали до комнатной температуры. Добавляли 200 мл этилацетата, смесь промывали водой (100×3) и насыщенным раствором хлорида натрия (100 мл × 3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с помощью системы элюирования А с получением соединения 2h (4,68 г, выход 66,7%) в виде твердого коричневого пузырчатого вещества.
МС m/z (ЖХ-МС): 438,1/440,1 [М+1]
Стадия 6
трет-Бутил-4-(7-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-карбоксилат 2i
Соединение 2h (4,68 г, 10,68 ммоль), N,N-дициклогексилметиламин (3,34 г, 17,08 ммоль) и трифенилфосфин (2,24 г, 8,54 ммоль) растворяли в 50 мл N,N-диметилформамида. Ацетат палладия (960 мг, 4,28 ммоль) добавляли в атмосфере аргона. Реакционную систему перемешивали в течение 17 часов при 100°С. После завершения реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с помощью системы элюирования А с получением соединения 2i (3,81 г, выход 99,0%) в виде желтого твердого вещества.
МС m/z (ЖХ-MC): 358,1 [М+1]
Стадия 7
7-Фтор-5-(пиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндола дитрифторацетат 2j
Соединение 2i (3,81 г, 10,68 ммоль) растворяли в 10 мл дихлорметана, затем добавляли по каплям 10 мл трифторуксусной кислоты. Полученную смесь перемешивали в течение 2 часов при комнатной температуре. После завершения реакции реакционный раствор концентрировали при пониженном давлении с получением неочищенного соединения 2j (5,18 г) в виде коричневого вязкого твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки.
MC m/z (ESI): 258,3 [М+1]
Стадия 8
7-Фтор-5-(1-фенилпиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндол 2k
Неочищенное соединение 2j (115 мг, 0,25 ммоль), бромбензол (47 мг, 0,30 ммоль), 2-(дициклогексилфосфино)-2,4,6-триизопропилбифенил (6 мг, 0,025 ммоль), трет-бутоксид натрия (96 мг, 1,0 ммоль) и ацетат палладия (6,0 мг, 0,025 ммоль) растворяли в 1,8 мл смеси толуола и трет-бутанола (V:V = 5:1). Реакционную систему перемешивали в течение 1 часа при 120°С в микроволновом реакторе. По завершении реакции добавляли 50 мл дихлорметана. Смесь промывали насыщенным раствором сульфита натрия (25 мл × 3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 2k (12,6 мг, выход 15,2%) в виде коричневого сиропа.
MC m/z (ESI): 334,3 [М+1]
Стадия 9
7-Фтор-5-(1-фенилпиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат 2
Соединение 2k (12,6 мг, 0,038 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,01 мл трифторуксусной кислоты. Полученную смесь перемешивали в течение 60 минут при комнатной температуре. После завершения реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 2 (16,9 мг, выход 100%) в виде светло-коричневого твердого вещества.
MC m/z (ESI): 334,3 [М+1]
Пример 3
6-Фтор-5-(1-(3-фторфенил)пиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндола трифторацетат
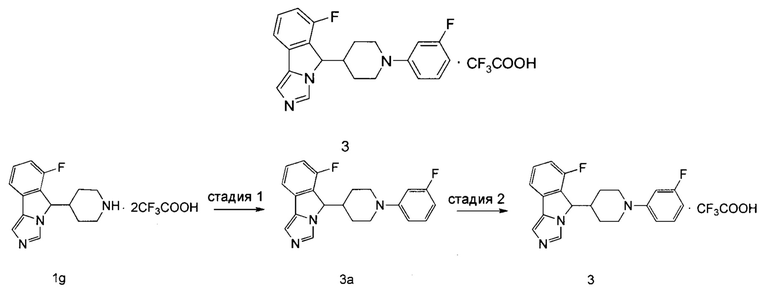
Стадия 1
6-Фтор-5-(1-(3-фторфенил)пиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндол 3а
Неочищенное соединение 1g (230 мг, 0,5 ммоль), 3-фтор-1-бромбензол (105 мг, 0,6 ммоль), 2-(дициклогексилфосфино)-2,4,6-триизопропилбифенил (24 мг, 0, 05 ммоль), трет-бутоксид натрия (192 мг, 2,0 ммоль) растворяли в 3 мл смеси толуола и трет-бутанола (V:V = 5:1). Затем в атмосфере аргона добавляли ацетат палладия (12,0 мг, 0,05 ммоль). Реакционную систему перемешивали в течение 12 часов при 120°С. По завершении реакции добавляли 20 мл дихлорметана. Смесь промывали водой (10 мл × 3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 3а (17,3 мг, выход 10%) в виде черного сиропа.
MC m/z (ESI): 352,3 [М+1]
Стадия 2
6-Фтор-5-(1-(3-фторфенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат 3
Соединение 3а (17,3 мг, 0,05 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,01 мл трифторуксусной кислоты. Полученную смесь перемешивали в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 3 (23 мг, выход 100%) в виде светло-коричневого твердого вещества.
MC m/z (ESI): 352,3 [М+1]
1Н ЯМР (400 МГц, DMCO-d6) δ 9,51 (s, 1H), 8,06 (s, 1H), 7,76 (d, 1H), 7,67-7,62 (m, 1H), 7,47-7,32 (m, 1H), 7,23-7,10 (m, 1H), 6,76-6,62 (m, 2H), 6,57-6,45 (m, 1H), 6,12 (d, 1Н), 3,85-3,73 (m, 1H), 3,73-3,63 (m, 1H), 2,79-2,67 (m, 1H), 2,67-2,50 (m, 2H), 1,83-1,68 (m, 1H), 1,61-1,45 (m, 1H), 1,35-1,23 (m, 1H), 1,10-0,94 (m, 1H).
Пример 4
6-Фтор-5-(1-(4-метоксифенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат
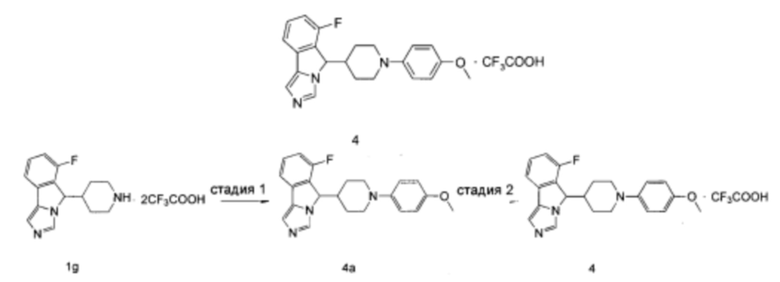
Стадия 1
6-Фтор-5-(1-(4-метоксифенил)пиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндол 4а
Неочищенное соединение 1g (115 мг, 0,25 ммоль), 4-иоданизол (70 мг, 0,3 ммоль), 2-(дициклогексилфосфино)-2,4,6-триизопропилбифенил (12 мг, 0,025 ммоль), трет-бутоксид натрия (96 мг, 1,0 ммоль) растворяли в 1,8 мл смеси толуола и трет-бутанола (V:V = 5:1). Затем добавляли ацетат палладия (6,0 мг, 0,025 ммоль) в атмосфере аргона. Реакционную систему перемешивали в течение 30 мин при 160°С в микроволновом реакторе. По завершении реакции смесь промывали насыщенным раствором сульфита натрия (25 мл × 3), экстрагировали дихлорметаном (20 мл × 3), объединенные органические фазы промывали насыщенным раствором сульфита натрия (25 мл × 3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 4а (29 мг, выход 33,6%) в виде коричневого сиропа.
MC m/z (ESI): 364,3 [М+1]
Стадия 2
6-Фтор-5-(1-(4-метоксифенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат 4
Соединение 4а (29 мг, 0,084 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,5 мл трифторуксусной кислоты. Полученную смесь перемешивали в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 4 (40 мг, выход 100%) в виде светло-коричневого твердого вещества.
MC m/z (ESI): 364,3 [М+1]
1H ЯМР (400 МГц, DMCO-d6) δ 9,41 (s, 1Н), 8,02 (s, 1H), 7,75 (d, 1H), 7,68-7,63 (m, 1H), 7,44-7,39 (m, 1H), 7,21-7,10 (m, 2H), 6,97-6,87 (m, 2H), 6,14 (d, 1H), 3,71 (s, 3H), 3,59-3,50 (m, 1H), 3,49-3,40 (m, 1H), 3,18-2,82 (m, 2H), 2,69-2,55 (m, 2H), 1,95-1,83 (m, 1H), 1,83-1,66 (m, 1H), 1,42-1,30 (m, 1H), 1,26-1,10 (m, 1H).
Пример 5
4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)бензонитрила трифторацетат
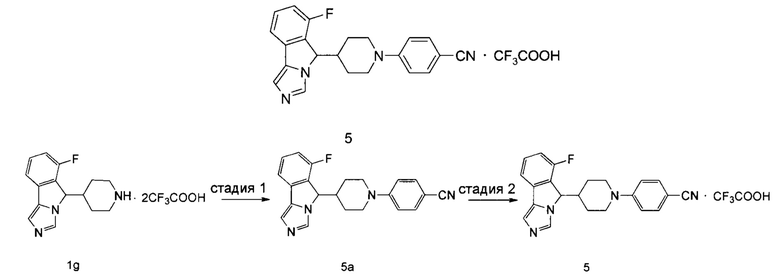
Стадия 1
4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)бензонитрил 5а
Неочищенное соединение 1g (230 мг, 0,5 ммоль), 4-иодобензонитрил (137 мг, 0,6 ммоль), 2-(дициклогексилфосфино)-2,4,6-триизопропилбифенил (24 мг, 0,05 ммоль), трет-бутоксид натрия (192 мг, 2,0 ммоль) и ацетат палладия (12,0 мг, 0,05 ммоль) растворяли в 3 мл смеси толуола и трет-бутанола (V:V = 5:1). Полученную смесь перемешивали в течение 1 часа при 120°С в микроволновом реакторе в атмосфере аргона. По завершении реакции добавляли 20 мл дихлорметана. Смесь промывали насыщенным раствором сульфита натрия (10 мл × 3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 5а (67 мг, выход 29,7%) в виде коричневого сиропа.
MC m/z (ESI): 359,1 [М+1]
Стадия 2
4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)бензонитрила трифторацетат 5
Соединение 5а (67 мг, 0,188 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,1 мл трифторуксусной кислоты. Полученную смесь перемешивали в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 5 (70 мг, выход 100%) в виде светло-коричневого твердого вещества.
MC m/z (ESI): 359,1 [М+1]
Пример 6
4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)бензамида трифторацетат
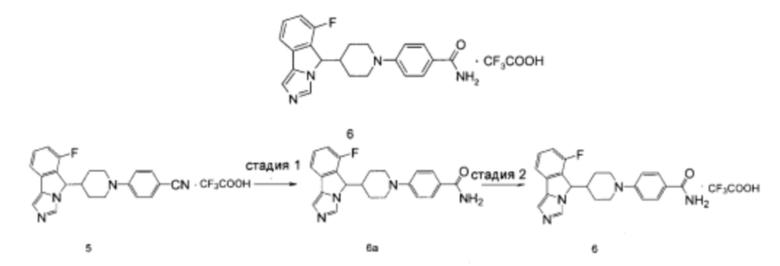
Стадия 1
4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)бензамид 6а
Соединение 5 (60 мг, 0,127 ммоль), порошок цинка (340 мг, 5,2 ммоль), 3 мл уксусной кислоты и 0,2 мл концентрированной соляной кислоты добавляли в колбу. Полученную смесь перемешивали в течение 19 часов при 125°С. По завершении реакции порошок цинка отфильтровывали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 6а (4,5 мг, выход 9,4%) в виде коричневого сиропа.
MC m/z (ESI): 377,4 [М+1]
Стадия 2
4-(4-(6-Фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)бензамида трифторацетат 6
Соединение 6а (4,5 мг, 0,012 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,1 мл трифторуксусной кислоты. Полученную смесь перемешивали в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 6 (5,8 мг, выход 100%) в виде светло-коричневого твердого вещества.
MC m/z (ESI): 377,4 [М+1]
Пример 7
6-Фтор-5-(1-(4-(метилсульфонил)фенил)пиперидин-4-ил)-5Н-имидазо[5,1-а]-изоиндола трифторацетат
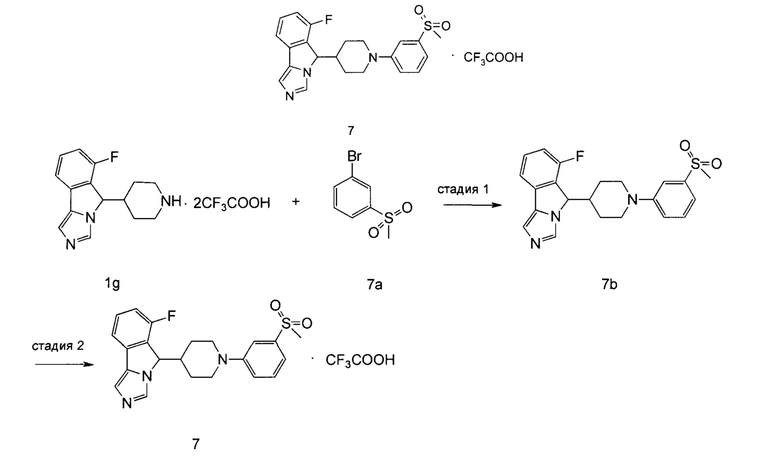
Стадия 1
6-Фтор-5-(1-(3-(метилсульфонил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]-изоиндол 7b
Неочищенное соединение 1g (150 мг, 0,33 ммоль), 1-бром-3-(метилсульфонил)бензол 7а (93 мг, 0,40 ммоль), 2-(дициклогексилфосфино)-2,4,6-триизопропилбифенил (16 мг, 0,033 ммоль), трет-бутоксид натрия (158 мг, 1,65 ммоль) и ацетат палладия (20,0 мг, 0,083 ммоль) растворяли в 3 мл смеси толуола и трет-бутанола (V:V = 5:1). Реакционную систему перемешивали в течение 30 мин при 160°С в микроволновом реакторе. По завершении реакции реакционную смесь фильтровали через диатомит. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 7b (14,5 мг, выход 13,0%) в виде светло-оранжевого твердого вещества.
MC m/z (ESI): 412,0 [М+1]
Стадия 2
6-Фтор-5-(1-(3-(метилсульфонил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]-изоиндола трифторацетат 7
Соединение 7b (14,5 мг, 0,035 ммоль) растворяли в 5 мл дихлорметана, затем добавляли 0,5 мл трифторуксусной кислоты. Полученную смесь перемешивали в течение 12 часов при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 7 (18 мг, выход 100%) в виде светло-оранжевого твердого вещества.
MC m/z (ESI): 412,0 [М+1]
1Н ЯМР (400 МГц, CDCl3) δ 9,05 (br. s, 1H), 7,60-7,56 (m, 3H), 7,45-7,38 (m, 3H), 7,26-7,22 (t, 1H), 7,14-7,12 (d, 1H), 5,75 (s, 1H), 3,06 (s, 3H), 2,91-2,75 (m, 2H), 1,94-1,74 (m, 2H), 1,49-1,46 (m, 1H), 1,37-1,19 (m, 4H).
Пример 8
6-Фтор-5-(1-(3-(1-метил-1H-пиразол-4-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]-изоиндол
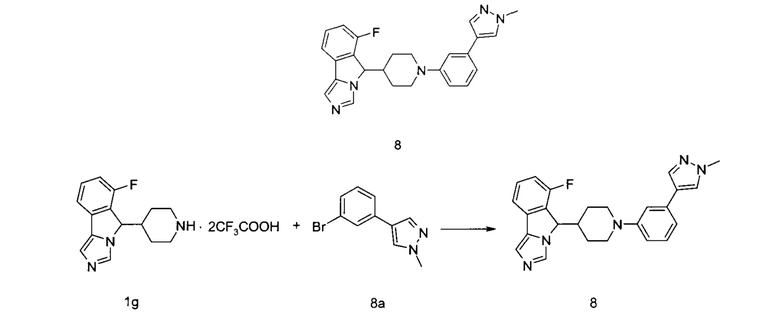
Неочищенное соединение 1g (229 мг, 0,5 ммоль) и 4-(3-бромфенил)-1-метил-1H-пиразол 8а (236 мг, 1 ммоль, полученный способом, описанным в патентной заявке "WO 2013043946") растворяли в 10 мл толуола, затем добавляли (±)2,2'-бис(дифенилфосфино)-1,1'-бинафтил (31,1 мг, 0,05 ммоль), трет-бутоксид натрия (192 мг, 2 ммоль) и три(дибензилиденацетон)дипалладий (45,78 мг, 0,05 ммоль). Реакционную систему перемешивали в течение 1 часа при 120°С в микроволновом реакторе. По завершении реакции фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 8 (30 мг, выход 11,3%) в виде белого твердого вещества.
MC m/z (ESI): 414,2 [M+1]
1H ЯМР (400 МГц, CDCl3) δ 8,18-8,16 (m, 2H), 7,99-7,93 (m, 1H), 7,90-7,85 (m, 2H), 7,74-7,72 (m, 1H), 7,69-7,65 (m, 4H), 7,36-7,32 (m, 1H), 6,66 (s, 1H), 3,96 (s, 3H), 3,36 (m, 1H), 3,15 (m, 1H), 2,78 (m, 1H), 2,66 (m, 1H), 2,40 (m, 1H), 2,03 (m, 1H), 1,78 (m, 1H), 1,28 (m, 1H), 1,01 (m, 1H).
Пример 9
6-Фтор-5-(1-(4-(1-метил-1H-пиразол-4-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]-изоиндол
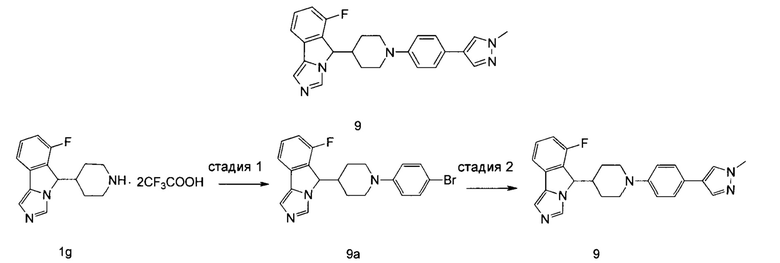
Стадия 1
5-(1-(4-Бромфенил)пиперидин-4-ил)-6-фтор-5H-имидазо[5,1-а]изоиндол 9а
Неочищенное соединение 1g (1,45 г, 3 ммоль) растворяли в 30 мл толуола, затем добавляли 1,4-дибромбензол (1,41 г, 6 ммоль), (±)2,2'-бис(дифенилфосфино)-1,1'-бинафтил (187 мг, 0,3 ммоль), трет-бутоксид натрия (1,15 г, 12 ммоль) и три(дибензилиденацетон)дипалладий (275 мг, 0,3 ммоль) в атмосфере аргона. Реакционную систему перемешивали в течение 12 часов при 80°С. По завершении реакции фильтрат концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с использованием системы элюирования А с получением соединения 9а (670 мг, выход 50%) в виде желтого твердого вещества.
MC m/z (ESI): 412,2 [М+1]
Стадия 2
6-Фтор-5-(1-(4-(1-метил-1H-пиразол-4-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]-изоиндол 9
Неочищенное соединение 9а (165 мг, 0,4 ммоль) растворяли в 5 мл 1,2-диметоксиэтана, затем добавляли 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (166 мг, 0,8 ммоль), карбонат натрия (127 мг, 1,2 ммоль) и воду (0,5 мл). После однородного смешивания добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий (29 мг, 0,04 ммоль) и реакционную систему перемешивали в течение 40 мин при 120°С в микроволновом реакторе в атмосфере аргона. По завершении реакции добавляли 50 мл этилацетата и 20 мл воды. Две фазы разделяли и водную фазу экстрагировали этилацетатом (30 мл). Органические фазы объединяли, промывали насыщенным раствором хлорида натрия (40 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 9 (10 мг, выход 6,06%) в виде белого твердого вещества.
МС m/z (ЖХ-МС): 414,4 [М+1]
1H ЯМР (400 МГц, DMCO-d6) δ 7,99 (s, 1H), 7,95 (s, 1H), 7,71 (s, 1H), 7,51-7,46 (m, 2H), 7,35 (d, 2H), 7,23 (s, 1H), 7,16-7,13 (m, 1H), 6,87 (d, 2H), 5,70 (s, 1H), 3,83 (s, 3Н), 3,76-3,73 (m, 1H), 3,63-3,60 (m, 1H), 2,70-2,64 (m, 1H), 2,37-2,34 (m, 1H), 1,79-1,76 (m, 1H), 1,70-1,65 (m, 1H), 1,34-1,30 (m, 1H), 1,20-1,17 (m, 1H), 0,91-0,87 (m, 1H).
Пример 10
6-Фтор-5-(1-(4-(пиперазин-1-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]-изоиндола трифторацетат
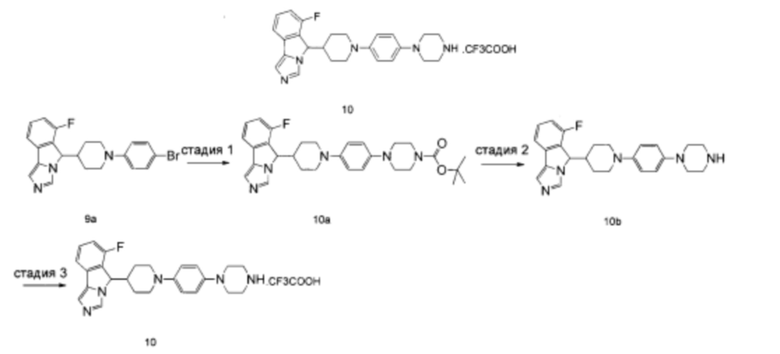
Стадия 1
трет-Бутил-4-(4-(4-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)пиперазин-1-карбоксилат 10а
Соединение 9а (82 г, 2 ммоль) и трет-бутил-1-пиперазинкарбоксилат (760 мг, 4 ммоль) растворяли в 15 мл толуола, затем добавляли (±)2,2'-бис(дифенилфосфино)-1,1'-бинафтил (125 мг, 0,2 ммоль), трет-бутоксид натрия (576 г, 6 ммоль) и три(дибензилиденацетон)дипалладий (183 мг, 0,2 ммоль). Реакционную систему перемешивали в течение 75 мин при 120°С в микроволновом реакторе. По завершении реакции реакционную смесь фильтровали через диатомит. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с использованием системы элюирования А с получением соединения 10а (517 мг, выход 50%) в виде желтого твердого вещества.
MC m/z (ESI): 518,2 [М+1]
Стадия 2
6-Фтор-5-(1-(4-(пиперазин-1-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]-изоиндол 10b
Соединение 10а (517 мг, 1 ммоль) растворяли в 16 мл дихлорметана, затем добавляли 4 мл трифторуксусной кислоты. Реакцию проводили при перемешивании в течение ночи при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 10b (15,4 мг, выход 3,7%) в виде светло-желтого твердого вещества.
МС m/z (ЖХ-МС): 418,2 [М-1]
Стадия 3
6-Фтор-5-(1-(4-(пиперазин-1-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]-изоиндола трифторацетат 10
Соединение 10b (14,5 мг, 0,035 ммоль) растворяли в 5 мл дихлорметана, затем добавляли 0,5 мл трифторуксусной кислоты. Реакцию перемешивали в течение 12 часов при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 10 (20 мг, выход 100%) в виде светло-желтого твердого вещества.
MC m/z (ESI): 418,2 [M+1]
1H ЯМР (400 МГц, CDCl3) δ 7,77 (s, 1H), 7,34-7,38 (m, 3H), 7,22 (s, 1H), 6,98-6,96 (m, 1H), 6,85-6,84 (m, 3H), 5,38 (s, 1H), 3,65 (m, 1H), 3,62 (m, 1H), 3,34 (m, 1H), 3,09 (m, 1H), 2,70 (m, 1H), 2,56 (m, 2H), 2,38 (m, 2H), 1,86 (m, 3H), 1,31-1,16 (m, 5H).
Пример 11
4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)-N-(тетрагидро-2H-пиран-4-ил)бензамида трифторацетат
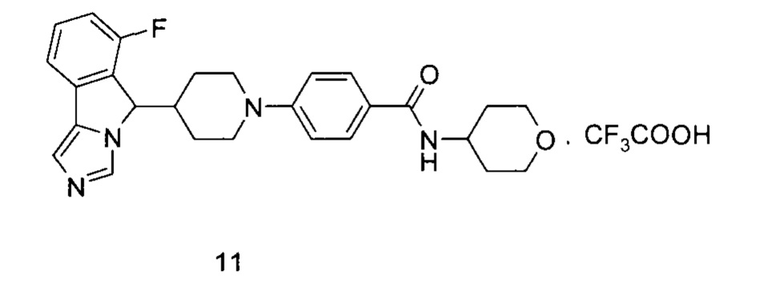
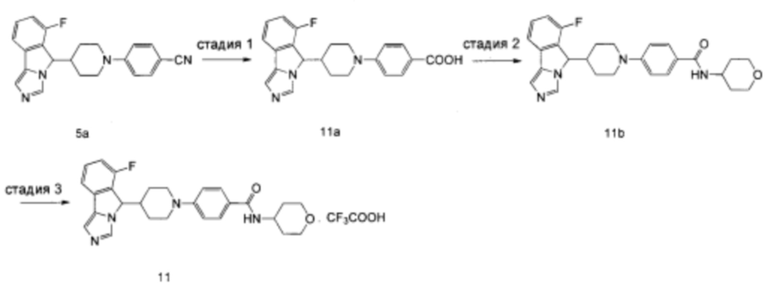
Стадия 1
4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)бензойная кислота 11а
Соединение 5а (630 г, 1,76 ммоль) добавляли в 15 мл 6н соляной кислоты. Реакционную систему перемешивали в течение 12 часов при 100°С. По завершении реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток сушили с получением неочищенного соединения 11а (664 мг) в виде светло-коричневого твердого вещества, которое использовали непосредственно без дополнительной очистки на следующей стадии.
МС m/z (ЖХ-МС): 378,1 [М+1]
Стадия 2
4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)-N-(тетрагидро-2H-пиран-4-ил)бензамид 11b
Неочищенное соединение 11а (75 мг, 0,2 ммоль), 4-аминотетрагидропиран (40 мг, 0,4 ммоль) и триэтиламин (0,14 мл, 1,0 ммоль) растворяли в 1,0 мл N,N-диметилформамида, затем добавляли 2-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (152 мг, 0,4 ммоль). Реакционную систему перемешивали в течение 12 часов при 50°С. По завершении реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 11b (48 мг, выход 52,1%) в виде светло-коричневого твердого вещества.
МС m/z (ЖХ-МС): 461,4 [М+1]
Стадия 3
4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)-N-(тетрагидро-2H-пиран-4-ил)бензамида трифторацетат 11
Соединение 11b (48 мг, 0,104 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,1 мл трифторуксусной кислоты. Реакцию проводили при перемешивании в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 11 (60 мг, выход 100%) в виде светло-коричневого твердого вещества.
MC m/z (ESI): 461,4 [M+1]
1Н ЯМР (400 МГц, DMCO-d6) δ 9,46 (s, 1H), 8,04 (s, 1H), 7,98 (d, 1H), 7,76-7,63 (m, 4H), 7,44-7,39 (m, 1H), 6,89 (d, 2H), 6,11 (d, 1H), 3,98-3,80 (m, 5H), 3,38-3,32 (m, 2H), 2,83-2,73 (m, 1H), 2,73-2,63 (m, 1H), 2,62-2,54 (m, 1H), 1,79-1,68 (m, 3H), 1,59-1,48 (m, 3Н), 1,34-1,25 (m, 1H), 1,05-0,95 (m, 1H).
Пример 12
N-(3-(4-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)ацетамида трифторацетат
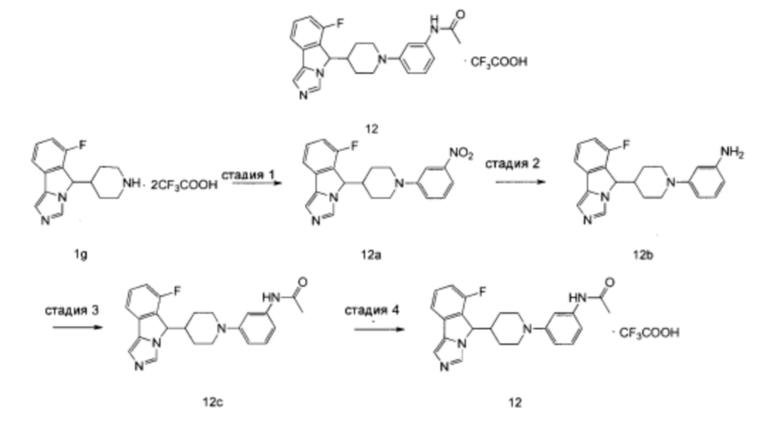
Стадия 1
6-Фтор-5-(1-(3-нитрофенил)пиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндол 12а
Неочищенное соединение 1g (230 мг, 0,5 ммоль), 1-иодо-3-нитробензол (149 мг, 0,6 ммоль), 2-(дициклогексилфосфино)-2,4,6-триизопропилбифенил (24 мг, 0,05 ммоль), трет-бутоксид натрия (192 мг, 2,0 ммоль) и ацетат палладия (12,0 мг, 0,05 ммоль) растворяли в 3 мл смеси толуола и трет-бутанола (V:V = 5:1). Реакционную систему перемешивали в течение 30 мин при 160°С в микроволновом реакторе. По завершении реакции добавляли 20 мл насыщенного раствора хлорида натрия и смесь экстрагировали дихлорметаном (20 мл × 3). Органические фазы объединяли, промывали насыщенным раствором сульфита натрия (20 мл × 3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с использованием системы элюирования А с получением соединения 12а (50 мг, выход 26,5%) в виде коричневого вязкого материала.
МС m/z (ЖХ-МС): 379,1 [М+1].
Стадия 2
3-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)анилин 12b
Соединение 12а (50 мг, 0,132 ммоль) и 10% Pd/C (10 мг) добавляли в 2 мл смеси метанола и тетрагидрофурана (V:V = 1:1). Реакционную систему продували водородом три раза и перемешивали при комнатной температуре в течение 3 часов. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением неочищенного соединения 12b (46 мг) в виде красно-коричневого твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки.
МС m/z (ЖХ-МС): 349,0 [М+1]
Стадия 3
N-(3-(4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)ацетамид 12с
Неочищенное соединение 12b (46 мг, 0,132 ммоль), уксусную кислоту (16 мг, 0,264 ммоль), 1-гидроксибензотриазол (36 мг, 0,264 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (51 мг, 0,264 ммоль) и N,N-диизопропилэтиламин (85 мг, 0,66 ммоль) добавляли в 1 мл N,N-диметилформамида. Реакционную систему перемешивали в течение 2 часов при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 12с (8,4 мг, выход 16,3%) в виде коричневого сиропа.
МС m/z (ЖХ-МС): 391,4 [М+1]
Стадия 4
N-(3-(4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)ацетамида трифторацетат 12
Соединение 12с (8,4 мг, 0,021 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,05 мл трифторуксусной кислоты. Реакцию перемешивали в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 12 (10,8 мг, выход 100%) в виде светло-коричневого твердого вещества.
МС m/z (ЖХ-МС): 391,4 [М+1]
Пример 13
2-(3-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-N-метил-ацетамида трифторацетат
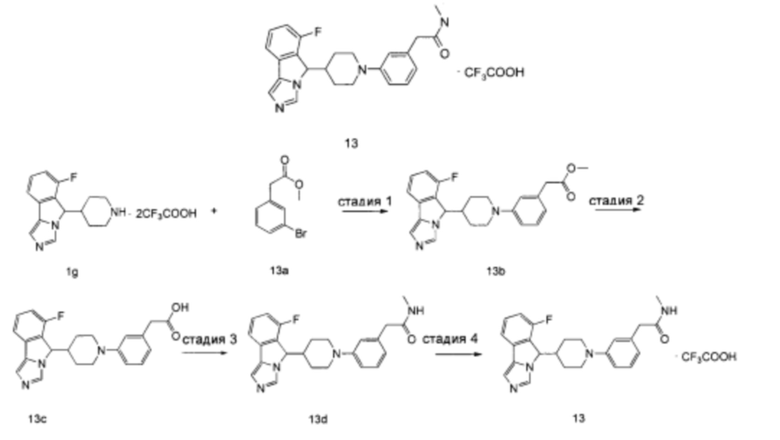
Стадия 1
Метил-2-(3-(4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)ацетат 13b
Неочищенное соединение 1g (1,21 г, 2,5 ммоль), метил-2-(3-бромфенил)ацетат 13а (1,15 г, 5,0 ммоль, полученный хорошо известным способом, описанным в "Journal of Medicinal Chemistry, 2008, 51 (3), 392-395"), иодид меди (95 мг, 0,5 ммоль), L-пролин (115 мг, 1 ммоль) и карбонат натрия (1,38 г, 10,0 ммоль) добавляли в 10 мл диметилсульфоксида. Реакционную систему перемешивали в течение 24 часов при 90°С в атмосфере аргона. По завершении реакции добавляли 100 мл этилацетата. Смесь промывали водой (250 мл × 3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с использованием системы элюирования А с получением указанного в заголовке соединения 13b (410 мг, выход 40,5%) в виде коричневого сиропа.
МС m/z (ЖХ-МС): 406,0 [М+1]
Стадия 2
2-(3-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)уксусная кислота 13с
Соединение 13b (410 мг, 1,0 ммоль) растворяли в 4 мл тетрагидрофурана, затем добавляли 4 мл 1M раствора гидроксида натрия. Полученную смесь перемешивали в течение 12 часов при комнатной температуре. По завершении реакции добавляли 40 мл воды. Смесь экстрагировали этилацетатом (25 мл × 3). В водную фазу добавляли по каплям уксусную кислоту до достижения рН 6 и экстрагировали дихлорметаном (20 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного соединения 13с (190 мг) в виде коричневого твердого вещества, которое использовали непосредственно без дополнительной очистки на следующей стадии.
МС m/z (ЖХ-МС): 392,0 [М+1]
Стадия 3
2-(3-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-N-метил-ацетамид 13d
Неочищенное соединение 13с (190 мг, 0,485 ммоль), метиламина гидрохлорид (65 мг, 0,97 ммоль), 2-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (369 мг, 0,097 ммоль) и триэтиламин (245 мг, 2,425 ммоль) добавляли в 2 мл N,N-диметилформамида. Реакционную систему перемешивали в течение 12 часов при 50°С. По завершении реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 13d (39 мг, выход 19,9%) в виде коричневого твердого вещества.
МС m/z (ЖХ-МС): 405,0 [М+1]
Стадия 4
2-(3-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-N-метил-ацетамида трифторацетат 13
Соединение 13d (39 мг, 0,096 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,05 мл трифторуксусной кислоты. Реакцию перемешивали в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 13 (50 мг, выход 100%) в виде светло-коричневого твердого вещества.
MC m/z (ESI): 405,0 [M+1]
1H ЯМР (400 МГц, DMCO-d6) δ 9,52 (s, 1Н), 8,07 (s, 1H), 7,97-7,89 (m, 1H), 7,76 (d, 1H), 7,70-7,64 (m, 1H), 7,46-7,41 (m, 1H), 7,22-7,14 (m, 1H), 7,04-6,73 (m, 3Н), 6,14 (d, 1H), 3,73-3,63 (m, 1H), 3,63-3,53 (m, 1H), 3,32 (s, 2H), 3,00-2,70 (m, 2H), 2,63-2,53 (m, 1H), 2,55 (d, 3Н), 1,91-1,81 (m, 1H), 1,73-1,58 (m, 1H), 1,38-1,28 (m, 1H), 1,10-1,00 (m, 1H).
Пример 14
6-Фтор-5-(1-(1-метил-1H-индол-4-ил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат
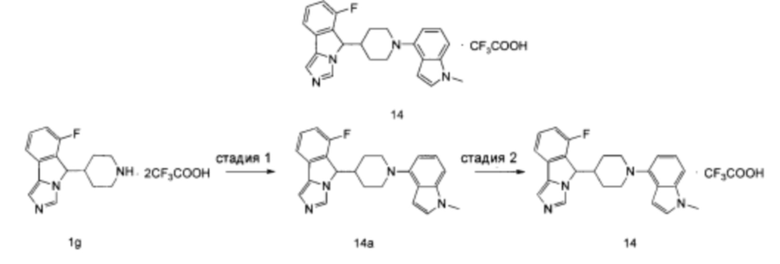
Стадия 1
6-Фтор-5-(1-(1-метил-1H-индол-4-ил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол 14а
Неочищенное соединение 1g (367 мг, 0,76 ммоль), 4-бром-1-метил-1H-индол (150 мг, 0,714 ммоль) растворяли в 15 мл смеси толуола и трет-бутанола (V:V = 5:1), затем добавляли 2-(дициклогексилфосфино)-2,4,6-триизопропилбифенил (34 мг, 0,071 ммоль), трет-бутоксид натрия (274 мг, 2,86 ммоль) и ацетат палладия (16,0 мг, 0,071 ммоль) в атмосфере аргона. Реакционную систему перемешивали в течение 12 часов при 120°С. По завершении реакции реакционный раствор фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 14а (23 мг, выход 8,4%) в виде желтого твердого вещества.
MC m/z (ESI): 387,4 [М-1].
Стадия 2
6-Фтор-5-(1-(1-метил-1H-индол-4-ил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат 14
Соединение 14а (23 мг, 0,06 ммоль) растворяли в 2 мл дихлорметана, затем добавляли 0,1 мл трифторуксусной кислоты. Реакцию перемешивали в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 14 (30 мг, выход 100%) в виде желтого твердого вещества.
МС m/z (ЖХ-МС): 387,4 [М+1]
1H ЯМР (400 МГц, DMCO-d6) δ 9,54 (s, 1H), 8,09 (s, 1H), 7,78 (d, 1H), 7,65-7,71 (m, 1H), 7,45 (t, 1H), 7,02-7,33 (m, 3Н), 6,75 (br. s, 1H), 6,41 (br. s, 1H), 6,12 (s, 1H), 3,75 (s, 3Н), 3,55-3,74 (m, 2H), 2,52-2,80 (m, 2H), 1,70-2,00 (m, 3Н), 1,30-1,40 (m, 1Н), 1,20-1,30 (m, 1H).
Пример 15
6-Фтор-5-(1-(пиридин-2-ил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат
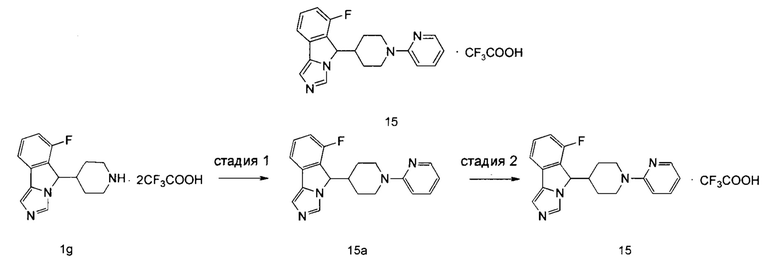
Стадия 1
6-Фтор-5-(1-(пиридин-2-ил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол 15а
Неочищенное соединение 1g (115 мг, 0,25 ммоль), 2-бромпиридин (47 мг, 0,30 ммоль), 2-(дициклогексилфосфино)-2,4,6-триизопропилбифенил (12,0 мг, 0,025 ммоль) и трет-бутоксид натрия (96 мг, 1,0 ммоль) растворяли в 1,8 мл смеси толуола и трет-бутанола (V:V = 5:1). После однородного смешивания добавляли ацетат палладия (6,0 мг, 0,025 ммоль). Реакционную систему перемешивали в течение 30 мин при 160°С в микроволновом реакторе. По завершении реакции добавляли 20 мл воды. Смесь экстрагировали дихлорметаном (20×3 мл). Органические фазы объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 15а (7,1 мг, выход 6,8%) в виде коричневого сиропа.
МС m/z (ЖХ-МС): 335,0 [М+1].
Стадия 2
6-Фтор-5-(1-(пиридин-2-ил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат 15
Соединение 15а (7,1 мг, 0,21 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,1 мл трифторуксусной кислоты. Реакцию перемешивали в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 15 (9,5 мг, выход 100%) в виде коричневого твердого вещества.
МС m/z (ЖХ-МС): 335,0 [М+1]
Пример 16
6-Фтор-5-(1-(пиримидин-2-ил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат
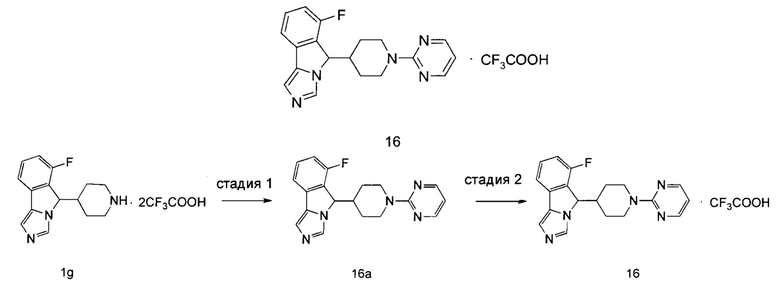
Стадия 1
6-Фтор-5-(1-(пиримидин-2-ил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол 16а
Неочищенное соединение 1g (230 мг, 0,5 ммоль), 2-хлорпиримидин (57 мг, 0,50 ммоль), триэтиламин (202 мг, 2,0 ммоль) добавляли в герметичную пробирку. Добавляли 5 мл этанола. Реакционную систему перемешивали в течение 12 часов при 100°С. По завершении реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 16а (127 мг, выход 75,5%) в виде светло-коричневого сиропа.
МС m/z (ЖХ-МС): 336,0 [М+1]
Стадия 2
6-Фтор-5-(1-(пиримидин-2-ил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат 16
Соединение 16а (127 мг, 0,38 ммоль) растворяли в 2 мл дихлорметана, затем добавляли 0,5 мл трифторуксусной кислоты. Реакцию проводили при перемешивании в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 16 (170 мг, выход 100%) в виде светло-коричневого твердого вещества.
МС m/z (ESI): 336,0 [М+1]
1H ЯМР (400 МГц, DMCO-d6) δ 9,48 (s, 1Н), 8,31 (d, 2Н), 8,04 (s, 1H), 7,75 (d, 1H), 7,67-7,61 (m, 1H), 7,42-7,37 (m, 1H), 6,58-6,56 (m, 1H), 6,10 (d, 1H), 4,85-4,75 (m, 1H), 4,71-4,61 (m, 1H), 2,93-2,81 (m, 1H), 2,81-2,62 (m, 3H), 1,85-1,74 (m, 1H), 1,46-1,36 (m, 1H), 1,32-1,22 (m, 1H), 0,87-0,77 (m, 1H).
Пример 17
4-(2-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)пиримидин-4-ил)-морфолина трифторацетат
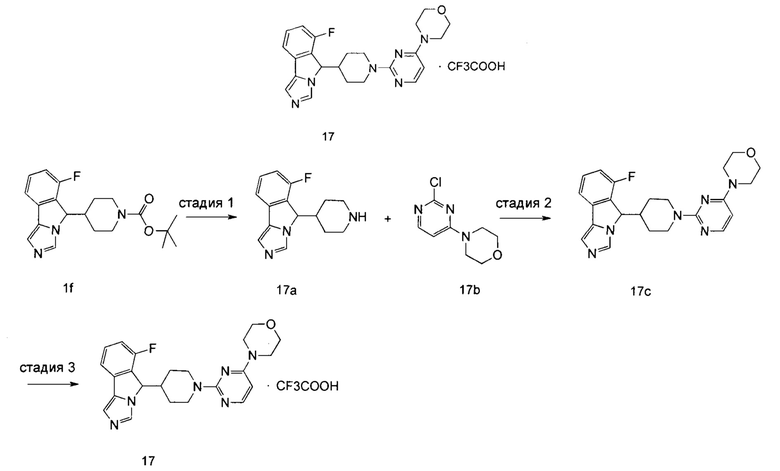
Стадия 1
6-Фтор-5-(пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол 17а
Соединение 1f (17,1 г, 47,9 ммоль) растворяли в 100 мл дихлорметана, затем добавляли 50 мл трифторуксусной кислоты. Реакцию перемешивали в течение 12 часов при комнатной температуре. По завершении реакции основную часть дихлорметана и трифторуксусной кислоты удаляли путем концентрирования при пониженном давлении. Добавляли 100 мл дихлорметана. Насыщенный раствор бикарбоната натрия добавляли по каплям до прекращения выделения пузырьков и доводили рН до 7. Две фазы разделяли и водную фазу экстрагировали дихлорметаном (200 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного соединения 17а (12,3 г) в виде коричневого сиропа, которое использовали непосредственно без дополнительной очистки на следующей стадии.
МС m/z (ЖХ-МС): 258,3 [М+1]
Стадия 2
4-(2-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)пиримидин-4-ил)-морфолин 17с
Неочищенное соединение 17а (260 мг, 1,005 ммоль) растворяли в 2,5 мл этанола, затем добавляли 4-(2-хлорпиримидин-4-ил)морфолин 17b (100 мг, 0,503 ммоль, полученный хорошо известным способом, описанным в "Chemistry & Biology Interface, 2012, 2(5), 347-361") и триэтиламин (203 мг, 2,012 ммоль). Реакцию перемешивали в течение 48 часов при 100°С в герметичном сосуде. По завершении реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 17с (59 мг, выход 30%) в виде желтого твердого вещества.
МС m/z (ЖХ-МС): 421,3 [М+1].
Стадия 3
4-(2-(4-(6-Фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)пиримидин-4-ил)-морфолина трифторацетат 17
Соединение 17с (59 мг, 0,14 ммоль) растворяли в 3 мл дихлорметана, затем добавляли 0,1 мл трифторуксусной кислоты. Реакцию перемешивали в течение 30 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 17 (75 мг, выход 100%) в виде желтого желе.
MC m/z (ESI): 421,3 [М+1]
1H ЯМР (400 МГц, DMCO-d6) δ 9,36 (s, 1Н), 8,03 (s, 1Н), 7,86 (d, 1H), 7,75 (d, 1H), 7,63-7,68 (m, 1H), 7,41 (t, 1H), 6,52 (d, 1H), 6,10 (d, 1H), 4,30-4,55 (m, 2H), 3,60-3,85 (m, 8H), 3,09 (t, 1H), 2,99 (t, 1H), 2,70-2,80 (m, 1H), 1,82-1,88 (m, 1H), 1,36-1,55 (m, 1H), 1,30-1,36 (m, 1H), 0,88-1,05 (m, 1H).
Пример 18
6-Фтор-5-(1-(5-(1-(тетрагидро-2Н-пиран-4-ил)-1H-пиразол-4-ил)пиримидин-2-ил)-пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол
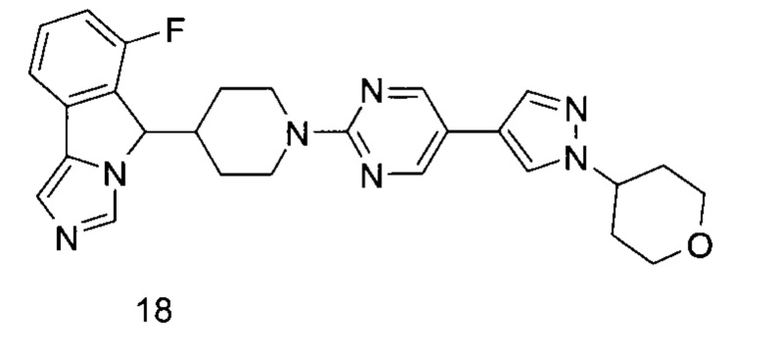
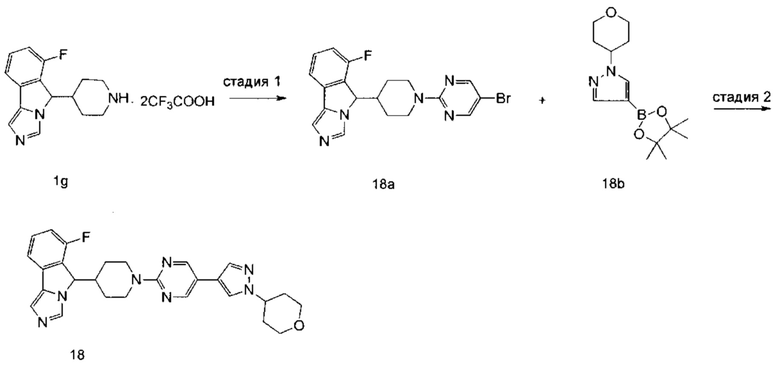
Стадия 1
5-(1-(5-Бромпиримидин-2-ил)пиперидин-4-ил)-6-фтор-5H-имидазо[5,1-а]-изоиндол 18а
Неочищенное соединение 1g (1,0 г, 2,2 ммоль), 5-бром-2-хлорпиримидин (468 мг, 2,42 ммоль) и триэтиламин (1,1 г, 11 ммоль) добавляли в 20 мл этанола в герметичной пробирке. Реакцию проводили при перемешивании в течение 12 часов при 90°С. По завершении реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с использованием системы элюирования А с получением соединения 18а (730 мг, выход 80,2%) в виде оранжево-желтого твердого вещества.
МС m/z (ЖХ-МС): 414,2 [М+2]
Стадия 2
6-Фтор-5-(1-(5-(1-(тетрагидро-2Н-пиран-4-ил)-1H-пиразол-4-ил)пиримидин-2-ил)-пиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндол 18
Соединение 18а (124 мг, 0,3 ммоль) растворяли в 5 мл смеси 1,2-диметоксиэтана и воды, затем добавляли 1-(тетрагидро-2Н-пиран-4-ил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол 18b (125 мг, 0,45 ммоль, полученный хорошо известным способом, описанным в "Bioorganic & Medicinal Chemistry, 2013, 21(21), 6804-6820"), тетракис(трифенилфосфин)палладий (69 мг, 0,06 ммоль) и карбонат натрия (63,6 мг, 0,6 ммоль) в атмосфере аргона. Реакцию проводили при перемешивании в течение 12 часов при 80°С. По завершении реакции добавляли 30 мл воды. Смесь экстрагировали дихлорметаном (40×3 мл). Органические фазы объединяли, промывали насыщенным раствором хлорида натрия (40 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 18 (30 мг, выход 20,7%) в виде белого твердого вещества.
МС m/z (ЖХ-МС): 486,5 [М+1]
1Н ЯМР (400 МГц, DMCO-d6) δ 8,56 (s, 2Н), 8,18 (s, 1Н), 7,94 (s, 1Н), 7,82 (s, 1Н), 7,48-7,46 (m, 2Н), 7,20 (s,1H), 7,16-7,11 (m, 1Н), 5,68 (s, 1Н), 4,81-4,78 (m, 1Н), 4,64-4,61 (m, 1Н), 4,42-4,36 (m, 1Н), 3,98-3,95 (m, 2H), 3,50-3,44 (m, 2H), 2,92-2,86 (m, 1H), 2,78-2,72 (m, 1H), 2,01-1,89 (m, 4H), 1,81-1,78 (m, 1H), 1,53-1,45 (m, 1H), 1,26-1,24 (m, 1H), 1,19-1,17 (m, 1H), 0,73-0,63 (m, 1H).
Пример 19
6-Фтор-5-(1-метилпиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндола трифторацетат
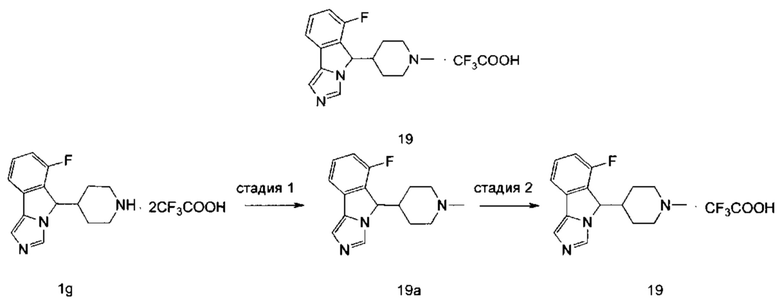
Стадия 1
6-Фтор-5-(1-метилпиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндол 19а
Неочищенное соединение 1g (121 мг, 0,25 ммоль) растворяли в 2 мл N,N-диметилформамида, затем добавляли карбонат калия (173 мг, 1,25 ммоль). После однородного смешивания добавляли метилиодид (21 мг, 0,15 ммоль). Реакцию проводили при перемешивании в течение 48 часов при комнатной температуре. По завершении реакции добавляли 20 мл этилацетата. Смесь промывали водой (10 мл×3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 19а (16,0 мг, выход 38,9%) в виде светло-коричневого вязкого материала.
МС m/z (ЖХ-МС): 272,0 [М+1]
Стадия 2
6-Фтор-5-(1-метилпиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндола трифторацетат 19
Неочищенное соединение 19а (16,0 мг, 0,59 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,05 мл трифторуксусной кислоты. Реакцию проводили при перемешивании в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 19 (22,6 мг, выход 100%) в виде светло-коричневого твердого вещества.
МС m/z (ЖХ-МС): 272,0 [М+1]
1Н ЯМР (400 МГц, CD3OD) δ 9,31 (s, 1Н), 7,91 (s, 1Н), 7,73 (d, 1Н), 7,67-7,62 (m, 1Н), 7,36-7,31 (m, 1Н), 6,08 (d, 1Н), 3,61-3,52 (m, 1Н), 3,52-3,43 (m, 1Н), 3,12-2,98 (m, 2Н), 2,88-2,76 (m, 1Н), 2,83 (s, 3Н), 2,01-1,92 (m, 1Н), 1,87-1,73 (m, 1Н), 1,73-1,62 (m, 1Н), 1,54-1,39 (m, 1Н).
Пример 20
1-(4-(6-Фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)этанона трифторацетат
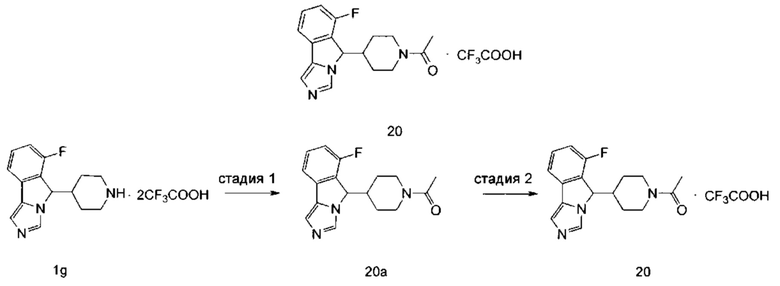
Стадия 1
1-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)этанон 20а
Неочищенное соединение 1g (31 мг, 0,084 ммоль) растворяли в 2 мл дихлорметана, затем добавляли триэтиламин (13 мг, 0,168 ммоль). Смесь однородно перемешивали и добавляли ацетилхлорид (13 мг, 0,168 ммоль). Реакцию проводили при перемешивании в течение 48 часов при комнатной температуре. По завершении реакции смесь концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 20а (7,2 мг, выход 40%) в виде коричневого твердого вещества.
МС m/z (ЖХ-МС): 300 [М+1]
Стадия 2
1-(4-(6-Фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)этанона трифторацетат
Неочищенное соединение 20а (7,2 мг, 0,024 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,01 мл трифторуксусной кислоты. Реакцию проводили при перемешивании в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 20 (10 мг, выход 100%) в виде светло-коричневого твердого вещества.
МС m/z (ЖХ-МС): 300,0 [М+1]
Пример 21
4-(6-Фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-N-фенилпиперидин-1-карбоксамида трифторацетат
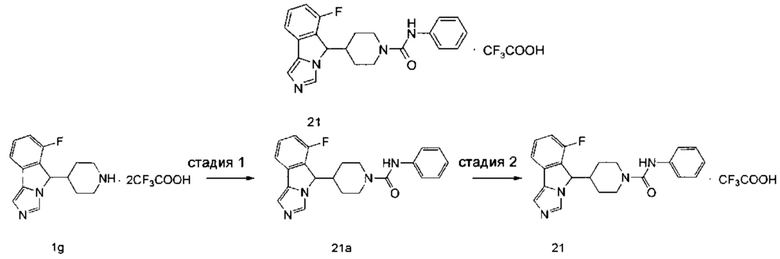
Стадия 1
4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)-N-фенилпиперидин-1-карбоксамид 21а
Бис(трихлорметил)карбонат (297 мг, 1,0 ммоль) растворяли в 2 мл дихлорметана, затем добавляли 2 мл предварительно приготовленного раствора фениламина (93 мг, 1,0 ммоль) в дихлорметане и 1 мл предварительно приготовленного раствора триэтиламина (0,28 мл) в дихлорметане по каплям. Реакцию проводили при перемешивании в течение 10 мин при комнатной температуре. Затем смесь концентрировали при пониженном давлении, добавляли 5 мл тетрафурана, 0,28 мл триэтиламина и соединение 1g (243 мг, 0,5 ммоль). Реакцию проводили при перемешивании в течение 12 часов при комнатной температуре. По завершении реакции добавляли 20 мл этилацетата и 20 мл воды. Две фазы разделяли и органическую фазу сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 21а (92 мг, выход 48,9%) в виде светло-коричневого твердого вещества.
МС m/z (ЖХ-МС): 377,0 [М-1]
Стадия 2
4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)-N-фенилпиперидин-1-карбоксамида трифторацетат 21
Неочищенное соединение 21а (92 мг, 0,244 ммоль) растворяли в 2 мл дихлорметана, затем добавляли 0,5 мл трифторуксусной кислоты. Реакцию проводили при перемешивании в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 21 (120 мг, выход 100%) в виде светло-коричневого твердого вещества.
МС m/z (ЖХ-МС): 377,0 [М-1]
1Н ЯМР (400 МГц, DMCO-d6) δ 9,47 (s, 1Н), 8,45 (s, 1Н), 8,04 (s, 1Н), 7,75 (d, 1Н), 7,68-7,63 (m, 1Н), 7,43-7,37 (m, 3Н), 7,21-7,17 (m, 2Н), 6,91-6,88 (m, 1Н), 6,08 (d, 1Н), 4,28-4,18 (m, 1Н), 4,15-4,05 (m, 1Н), 2,83-2,68 (m, 2Н), 2,64-2,54 (m, 1Н), 1,76-1,67 (m, 1Н), 1,42-1,32 (m, 1Н), 1,28-1,19 (m, 1Н), 0,91-0,81 (m, 1Н).
Пример 22
N-(4-цианофенил)-4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-карбоксамида трифторацетат
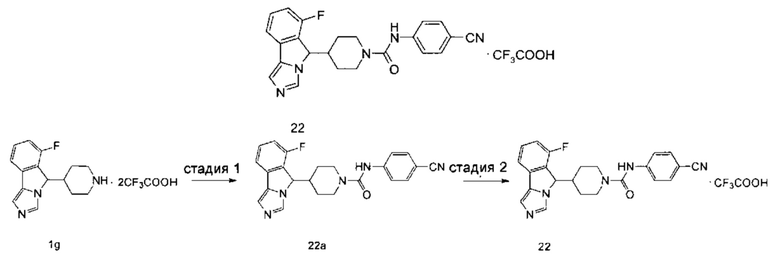
Стадия 1
N-(4-цианофенил)-4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-карбоксамид 22а
Бис(трихлорметил)карбонат (297 мг, 1,0 ммоль) растворяли в 2 мл дихлорметана, затем добавляли 2 мл предварительно приготовленного раствора 4-аминобензонитрила (118 мг, 1,0 ммоль) в дихлорметане и 1 мл предварительно приготовленного раствора триэтиламина (0,28 мл) в дихлорметане по каплям. Реакцию проводили при перемешивании в течение 1 часа при комнатной температуре. Затем смесь концентрировали при пониженном давлении, добавляли 5 мл тетрафурана, 0,28 мл триэтиламина и соединение 1g (243 мг, 0,5 ммоль). Реакцию проводили при перемешивании в течение 12 часов при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 22а (101 мг, выход 50,5%) в виде светло-коричневого твердого вещества.
МС m/z (ЖХ-МС): 402,0 [М+1]
Стадия 2
N-(4-цианофенил)-4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-карбоксамида трифторацетат 22
Неочищенное соединение 22а (101 мг, 0,25 ммоль) растворяли в 2 мл дихлорметана, затем добавляли 0,5 мл трифторуксусной кислоты. Реакцию проводили при перемешивании в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 22 (130 мг, выход 100%) в виде светло-коричневого твердого вещества.
МС m/z (ЖХ-МС): 402,0 [М+1]
1Н ЯМР (400 МГц, DMCO-d6) δ 9,47 (s, 1Н), 8,99 (s, 1Н), 8,06 (s, 1Н), 7,76 (d, 1Н), 7,68-7,60 (m, 5Н), 7,44-7,39 (m, 1Н), 6,09 (d, 1Н), 4,30-4,20 (m, 1Н), 4,15-4,05 (m, 1Н), 2,91-2,81 (m, 1Н), 2,81-2,71 (m, 1Н), 2,68-2,58 (m, 1Н), 1,79-1,68 (m, 1Н), 1,44-1,34 (m, 1Н), 1,31-1,21 (m, 1Н), 0,93-0,83 (m, 1Н).
Пример 23
2-(4-(6-Фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)-5-фенилтиазола трифторацетат
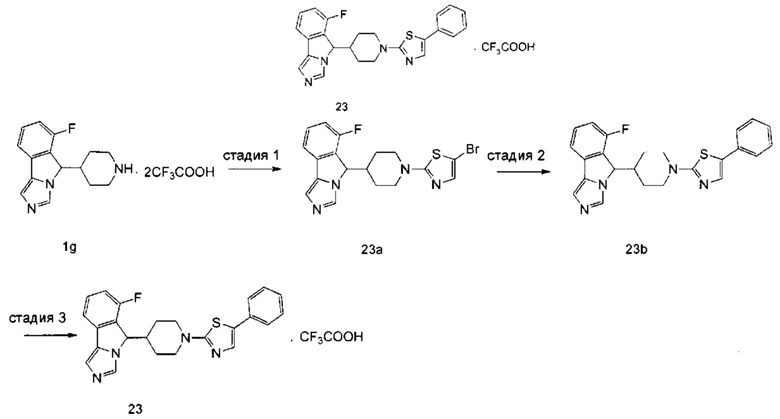
Стадия 1
5-Бром-2-(4-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)тиазол 23а
Неочищенное соединение 1g (2,43 г, 5,0 ммоль), 2,5-дибромтиазол (1,82 г, 7,5 ммоль) и триэтиламин (2,02 г, 20,0 ммоль) растворяли в 15 мл метилсульфоксида. Реакционную систему перемешивали в микроволновом реакторе в течение 1,5 часов при 120°С. По завершении реакции добавляли 250 мл этилацетата. Смесь промывали водой (150 мл×3) и насыщенным раствором хлорида натрия (150 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле с использованием системы элюирования А с получением соединения 23а (710 мг, выход 33,9%) в виде коричневого твердого вещества.
МС m/z (ЖХ-МС): 420,0 [М+1]
Стадия 2
2-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)-5-фенилтиазол 23b
Соединение 23а (105 мг, 0,25 ммоль), фенилбороновую кислоту (46 мг, 0,375 ммоль), тетракис(трифенилфосфин)палладий (58 мг, 0,05 ммоль), тригидрат фосфата калия (133 мг, 0,5 ммоль) растворяли в 1,4 мл смеси N,N-диметилформамида и воды (V:V=6:1). Реакционную систему перемешивали в микроволновом реакторе в течение 35 мин при 120°С. По завершении реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 23b (24 мг, выход 22,7%) в виде коричневого сиропа.
МС m/z (ЖХ-МС): 417,0 [М+1]
Стадия 3
2-(4-(6-Фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)-5-фенилтиазола трифторацетат 23
Соединение 23b (24 мг, 0,057 ммоль) растворяли в 0,5 мл дихлорметана, затем добавляли 0,05 мл трифторуксусной кислоты. Реакцию проводили при перемешивании в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 23 (30 мг, выход 100%) в виде светло-коричневого твердого вещества.
МС m/z (ЖХ-МС): 417 [М+1]
1Н ЯМР (400 МГц, DMCO-d6) δ 9,42 (s, 1Н), 8,02 (s, 1Н), 7,74 (d, 1Н), 7,68-7,62 (m, 1Н), 7,57 (s, 1Н), 7,44-7,38 (m, 3Н), 7,35-7,31 (m, 2Н), 7,18-7,22 (m, 1Н), 6,11 (d, 1Н), 4,06-3,99 (m, 1Н), 3,92-3,84 (m, 1Н), 3,17-3,07 (m, 1Н), 3,04-2,94 (m, 1Н), 2,70-2,60 (m, 1Н), 1,91-1,81 (m, 1Н), 1,67-1,52 (m, 1Н), 1,34-1,25 (m, 1Н), 1,04-0,93 (m, 1Н).
Пример 24
5-(1-(1Н-бензо[d]имидазол-2-ил)пиперидин-4-ил)-6-фтор-5Н-имидазо[5,1-а]-изоиндол
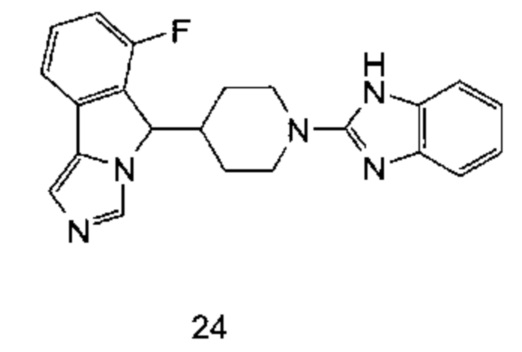
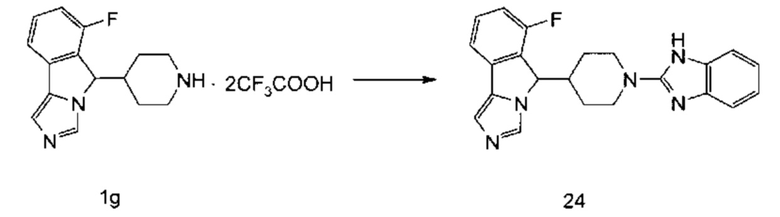
Неочищенное соединение 1g (257 мг, 1,0 ммоль) и 2-хлорбензимидазол (153 мг, 1 ммоль) растворяли в 10 мл н-метилпирролидинона, затем добавляли N,N-диизопропилэтиламин (390 мг, 3 ммоль). Реакцию проводили при перемешивании в течение 12 часов при 90°С. По завершении реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с использованием системы элюирования А с получением соединения 24 (20 мг, выход 41%) в виде белого твердого вещества.
МС m/z (ЖХ-МС): 374,2 [М-1]
1Н ЯМР (400 МГц, CDCl3) δ 7,74 (s, 1Н),7,38-7,17 (m, 5Н), 7,17 (s, 1Н), 6,98 (s, 2Н), 5,32 (s, 1Н), 4,38-4,21 (m, 2Н), 3,04-2,93 (m, 2Н), 2,48 (m 1Н), 1,82-1,71 (m, 2Н), 1,29-1,23 (m, 1Н), 0,92 (m, 1Н).
Пример 25
6-Фтор-5-(1-фенилпирролидин-3-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат
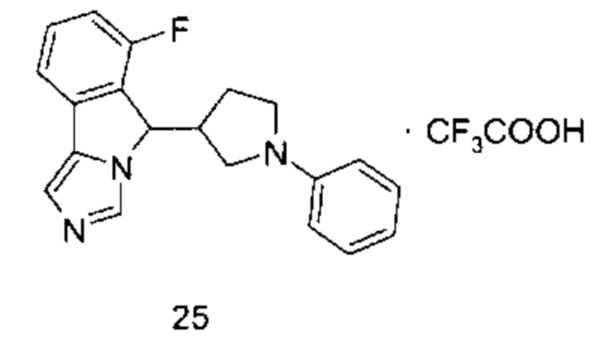
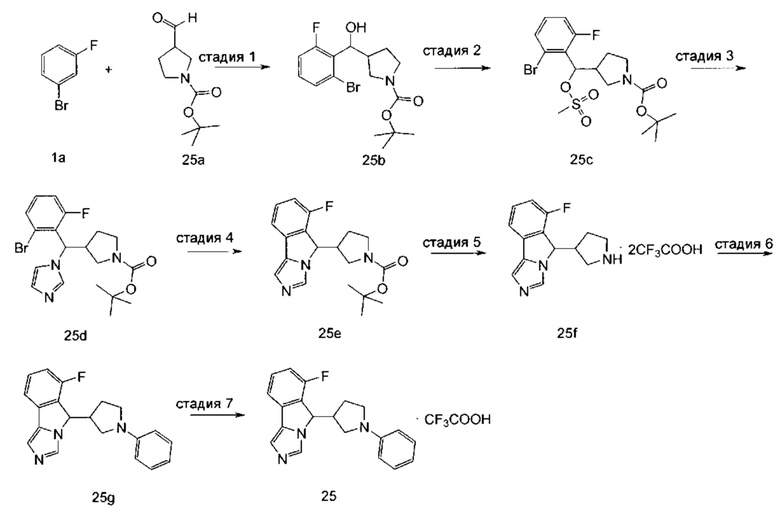
Стадия 1
трет-Бутил-3-((2-бром-6-фторфенил)(гидрокси)метил)пирролидин-1-карбоксилат 25b
Диизопропиламид лития (13 мл, 26 ммоль) добавляли в 20 мл тетрагидрофурана в атмосфере аргона. Смесь охлаждали до -78°С, 10 мл предварительно приготовленного раствора 1-бром-3-фторбензола 1а (3,5 г, 20,0 ммоль) в тетрагидрофуране добавляли по каплям при -78°С, полученную смесь перемешивали в течение 1 часа при -78°С. Затем добавляли 15 мл предварительно приготовленного раствора трет-бутил-3-формилпирролидин-1-карбоксилата 25а (3,985 г, 20,0 ммоль, полученного хорошо известным способом, описанным в "Jpn. Tokkyo Koh, 2009, 03 Jun, 4272338") в тетрагидрофуране по каплям при -78°С. Реакцию непрерывно перемешивали в течение 1 часа при -78°С. После завершения реакции 10 мл метанола добавляли по каплям для гашения реакции при -78°С. Реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования В с получением соединения 25b (5,15 г, выход 68,8%) в виде желтого масла.
МС m/z (ЖХ-МС): 320,0 [М-56]
Стадия 2
трет-Бутил-3-((2-бром-6-фторфенил)((метилсульфонил)окси)метил)пирролидин-1-карбоксилат 25с
Соединение 25b (5,1 г, 13,6 ммоль) растворяли в 50 мл дихлорметана, затем добавляли триэтиламин (3,8 мл, 27,7 ммоль), добавляли по каплям метансульфонилхлорид (1,639 г, 14,3 ммоль) на бане с ледяной водой. Реакцию проводили при перемешивании в течение 1 часа при комнатной температуре. По завершении реакции добавляли 50 мл дихлорметана. Смесь промывали водой (60 мл) и 60 мл насыщенного раствора хлорида натрия, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного соединения 25с (5,9 г) в виде желтого вязкого твердого вещества, которое использовали непосредственно без дополнительной очистки на следующей стадии.
МС m/z (ЖХ-МС): 300,0 [М-56-95]
Стадия 3
трет-Бутил 3-((2-бром-6-фторфенил)(1Н-имидазол-1-ил)метил)пирролидин-1-карбоксилат 25d
Неочищенное соединение 25с (2,4 г, 5,3 ммоль) растворяли в 10 мл ацетонитрила, затем добавляли имидазол (3,6 г, 53 ммоль) и N,N-диизопропилэтиламин (6,85 г, 53 ммоль). Полученную смесь перемешивали в микроволновом реакторе в течение 1 ч 40 мин при 120°С. По завершении реакции добавляли 100 мл этилацетата. Смесь промывали водой (60 мл×2) и насыщенным раствором хлорида натрия (60 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением соединения 25d (2,7 г) в виде коричневого вязкого твердого вещества, которое использовали непосредственно без дополнительной очистки на следующей стадии.
МС m/z (ЖХ-МС): 424,3 [М+1]
Стадия 4
трет-Бутил-3-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пирролидин-1-карбоксилат 25е
Неочищенное соединение 25d (2,4 г, 5,66 ммоль) растворяли в 10 мл N,N-диметилформамида, затем добавляли N,N-дициклогексилметиламин (1,77 г, 9,05 ммоль), трифенилфосфин (594 мг, 2,264 ммоль) и ацетат палладия (254 мг, 1,132 ммоль). Реакционную смесь перемешивали в микроволновом реакторе в течение 1 часа при 120°С. По завершении реакции реакционную смесь концентрировали при пониженном давлении для удаления N,N-диметилформамида. Добавляли 100 мл этилацетата, смесь промывали водой (40 мл×2) и насыщенным раствором хлорида натрия (60 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с использованием системы элюирования В с получением соединения 25е (1,62 г, выход 78,3%) в виде светло-коричневого вязкого твердого вещества.
МС m/z (ЖХ-МС): 344,2 [М+1]
Стадия 5
6-Фтор-5-(пирролидин-3-ил)-5H-имидазо[5,1-а]изоиндола дитрифторацетат 25f
Соединение 25е (1,62 г, 4,71 ммоль) растворяли в 20 мл дихлорметана, затем добавляли 2,69 мл трифторацетата по каплям. Полученную смесь перемешивали в течение 4 часов при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением неочищенного соединения 25f (2,76 г) в виде коричневого масла, которое использовали непосредственно на следующей стадии без дополнительной очистки.
МС m/z (ЖХ-МС): 243,9 [М+1]
Стадия 6
6-Фтор-5-(1-фенилпирролидин-3-ил)-5H-имидазо[5,1-а]изоиндол 25g
Неочищенное соединение 25f (292 мг, 0,50 ммоль) растворяли в 1,5 мл смеси толуола и этанола (V:V=5:1), затем добавляли бромбензол (94 мг, 0,6 ммоль), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (24 мг, 0,05 ммоль), трет-бутоксид натрия (240 мг, 2,50 ммоль) и ацетат палладия (11 мг, 0,05 ммоль) в атмосфере аргона. Полученную смесь перемешивали в течение 50 мин при 120°С в микроволновом реакторе. По завершении реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 25g (23 мг, выход 14,3%) в виде коричневого масла.
МС m/z(ESI): 320,3 [М+1]
Стадия 7
6-Фтор-5-(1-фенилпирролидин-3-ил)-5Н-имидазо[5,1-а]изоиндола трифторацетат 25
Соединение 25g (23 мг, 0,072 ммоль) растворяли в 5 мл дихлорметана, затем добавляли 0,5 мл трифторуксусной кислоты. Полученную смесь перемешивали в течение 60 мин при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 25 (31 мг, выход 100%) в виде коричневого твердого вещества.
МС m/z(ESI): 320,3 [М+1]
Пример 26
6-Фтор-5-(1-(3-фторфенил)пиперидин-3-ил)-5Н-имидазо[5,1-а]изоиндола трифторацетат
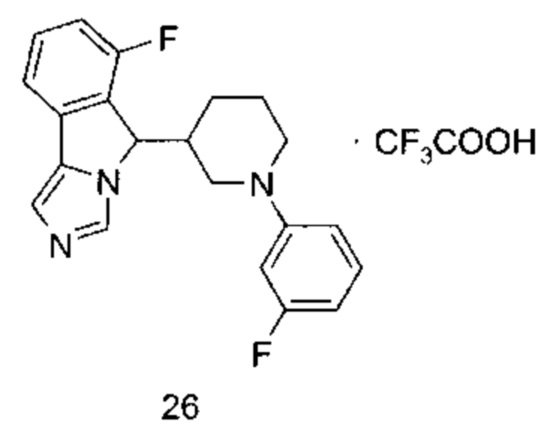
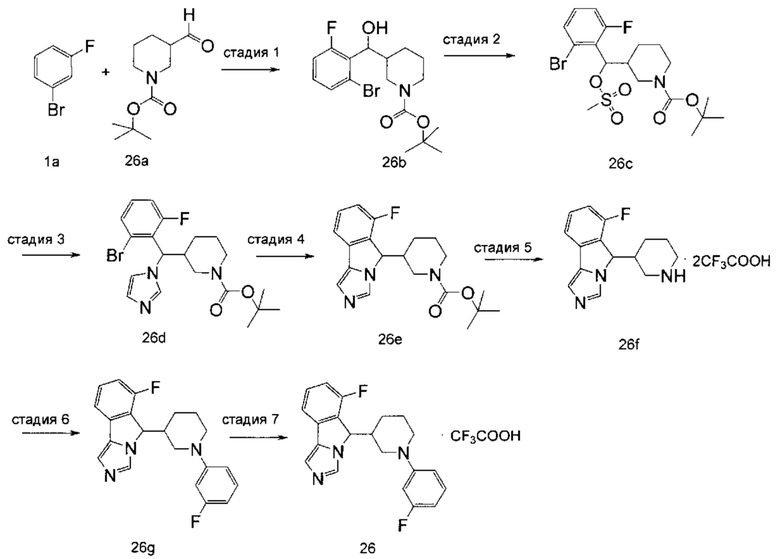
Стадия 1
трет-Бутил-3-((2-бром-6-фторфенил)(гидрокси)метил)пиперидин-1-карбоксилат 26b
15 мл тетрагидрофурана добавляли в колбу, затем раствор охлаждали до -78°С в атмосфере аргона. Добавляли диизопропиламид лития (9,3 мл, 18,6 ммоль), добавляли по каплям 1-бром-3-фторбензол 1а (2,5 г, 14,3 ммоль), полученную смесь перемешивали в течение 1 часа при -78°С. Затем добавляли 5 мл предварительно приготовленного раствора трет-бутил-3-формилпиперидин-1-карбоксилата 26а (3,0 г, 14,3 ммоль) в тетрагидрофуране по каплям. Реакцию проводили при непрерывном перемешивании в течение 1 часа при -78°С. После завершения реакции 15 мл метанола добавляли по каплям для гашения реакции при -78°С. Реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования В с получением соединения 26b (3,9 г, выход 34%) в виде светло-желтого твердого вещества.
МС m/z (ЖХ-МС): 334,0 [М-55]
Стадия 2
трет-Бутил-3-((2-бром-6-фторфенил)((метилсульфонил)окси)метил)пиперидин-1-карбоксилат 26с
Соединение 26b (3,9 г, 10 ммоль) растворяли в 40 мл дихлорметана, добавляли триэтиламин (2,02 г, 20 ммоль), затем добавляли по каплям метансульфонилхлорид (1,2 г, 10,05 мммоль). Реакцию перемешивали в течение 12 часов при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования В с получением соединения 26с (1,9 г, выход 40,7%) в виде светло-желтого масла.
МС m/z (ЖХ-МС): 314,0 [М-152]
Стадия 3
трет-Бутил 3-((2-бром-6-фторфенил)(1Н-имидазол-1-ил)метил)пиперидин-1-карбоксилат 26d
Соединение 26с (2,0 г, 4,28 ммоль) растворяли в 5 мл ацетонитрила, добавляли имидазол (2,9 г, 42,8 ммоль) и N,N-диизопропилэтиламин (5,5 г, 42,8 ммоль). Полученную смесь перемешивали в микроволновом реакторе в течение 1 часа при 120°С. По завершении реакции реакционный раствор концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования А с получением указанного в заголовке соединения 26d (0,85 г, выход 47%) в виде светло-коричневого масла.
МС m/z (ЖХ-МС): 440,0 [М+2]
Стадия 4
трет-Бутил-3-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-карбоксилат 26е
Соединение 26d (1,0 г, 2,28 ммоль) растворяли в 5 мл N,N-диметилформамида, затем добавляли N,N-дициклогексилметиламин (712 мг, 3,65 ммоль), трифенилфосфин (239 мг, 0,91 ммоль) и ацетат палладия (100 мг, 0,45 ммоль). Реакционную смесь перемешивали в микроволновом реакторе в течение 1 часа при 120°С. По завершении реакции реакционный раствор концентрировали с получением указанного в заголовке соединения 26е (1,21 г) в виде оранжевого масла, которое использовали непосредственно на следующей стадии без дополнительной очистки.
МС m/z (ЖХ-МС): 358,2 [М+1]
Стадия 5
6-Фтор-5-(пиперидин-3-ил)-5H-имидазо[5,1-а]изоиндола дитрифторацетат 26f
Неочищенное соединение 26е (1,7 г, 4,76 ммоль) растворяли в 20 мл дихлорметана, затем добавляли 1 мл трифторацетата по каплям. Полученную смесь перемешивали в течение 48 часов при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением неочищенного соединения 26f (2,5 г) в виде коричневого масла, которое использовали непосредственно без дополнительной очистки на следующей стадии.
МС m/z (ЖХ-МС): 258,0 [М+1]
Стадия 6
6-Фтор-5-(1-(3-фторфенил)пиперидин-3-ил)-5H-имидазо[5,1-а]изоиндол 26g
Неочищенное соединение 26f (200 мг, 0,44 ммоль), 1-бром-3-фторбензол (93 мг, 0,53 ммоль), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (21 мг, 0,044 ммоль), трет-бутоксид натрия (211 мг, 2,20 ммоль) и ацетат палладия (20 мг, 0,089 ммоль) растворяли в 5 мл смеси толуола и этанола (V:V=5:1). Полученную смесь перемешивали в микроволновом реакторе в течение 1 часа при 120°С. По завершении реакции смесь фильтровали через диатомит. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением соединения 26g (3,7 мг, выход 3%) в виде коричневого масла.
МС m/z(ESI): 352,0 [М+1]
Стадия 7
6-Фтор-5-(1-(3-фторфенил)пиперидин-3-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат 26
Соединение 26g (3,7 мг, 0,01 ммоль) растворяли в 5 мл дихлорметана, затем добавляли 0,5 мл трифторуксусной кислоты. Полученную смесь перемешивали в течение 12 часов при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении с получением соединения 26 (4,8 мг, выход 100%) в виде коричневого масла.
МС m/z(ESI): 352,0 [М+1]
Примеры 27, 28
(R)-6-Фтор-5-(1-(4-(1-метил-1H-пиразол-4-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол 27
(S)-6-Фтор-5-(1-(4-(1-метил-1Н-пиразол-4-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол 28
Стадия 1
Соединение 9 хирально разделяли (условия разделения: хиральная колонка CHIRALPAK IF, мобильная фаза: дихлорметан:метанол=70:30, скорость потока: 30 мл/мин), соответствующие фракции собирали и концентрировали при пониженном давлении с получением соединения 27 (700 мг, 1,69 ммоль) с выходом 73,7% и соединения 28 (640 мг, 1,54 ммоль) с выходом 67,4%.
27:
МС m/z(ESI): 414,4 [М+1]
Анализ хиральной ВЭЖХ: время удерживания: 2,466 мин, чистота >99,0%. (хроматографическая колонка: CHIRALPAK ID; мобильная фаза: ДХМ/МеОН/ТЭА=80/20/0,1 (об/об/об)
1Н ЯМР (400 МГц, DMCO-d6) δ 7,98 (s, 1Н), 7,94 (s, 1Н), 7,70 (s, 1Н), 7,44-7,51 (m, 2Н), 7,34 (d, 2Н), 7,22 (s, 1Н), 7,11-7,17 (m, 1Н), 6,86 (d, 2Н), 5,69 (s, 1Н), 3,82 (s, 3Н), 3,73 (d, 1Н), 3,60 (d, 1Н), 2,63-2,69 (m, 1Н), 2,33-2,36 (m, 1Н), 1,75-1,78 (m, 1Н), 1,64-1,69 (m, 1Н), 1,16-1,33 (m, 2Н), 0,87-0,90 (m, 1Н).
28:
МС m/z(ESI): 414,4 [М+1]
Анализ хиральной ВЭЖХ: время удерживания: 4,122 мин, чистота >99,0%. (хроматографическая колонка: CHIRALPAK ID; мобильная фаза: ДХМ/МеОН/ТЭА=80/20/0,1 (об/об/об)
1Н ЯМР (400 МГц, DMCO-d6) δ 7,98 (s, 1Н), 7,94 (s, 1Н), 7,70 (s, 1Н), 7,44-7,51 (m, 2Н), 7,34 (d, 2Н), 7,22 (s, 1Н), 7,11-7,17 (m, 1Н), 6,86 (d, 2Н), 5,69 (s, 1Н), 3,82 (s, 3), 3,73 (d, 1Н), 3,60 (d, 1Н), 2,63-2,69 (m, 1Н), 2,33-2,36 (m, 1Н), 1,75-1,78 (m, 1Н), 1,64-1,69 (m, 1Н), 1,16-1,33 (m, 2Н), 0,87-0,90 (m, 1Н).
Пример 29
(2S)-3-(4-(4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1Н-пиразол-1-ил)пропан-1,2-диол
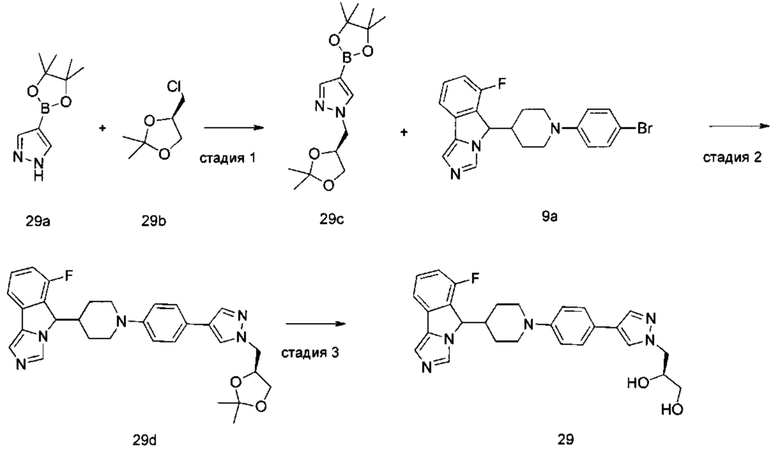
Стадия 1
(S)-1-((2,2-Диметил-1,3-диоксолан-4-ил)метил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол 29с
4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол 29а (1 г, 5,15 ммоль) растворяли в 6 мл N,N-диметилформамида, затем добавляли гидрид натрия (250 мг, 60%) при комнатной температуре. После того, как реакционную смесь перемешивали в течение 20 мин при комнатной температуре, добавляли (R)-4-(хлорметил)-2,2-диметил-1,3-диоксолан 29b (1,164 г, 7,73 ммоль). Реакционную смесь нагревали до 100°С и перемешивали в течение 12 часов. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с использованием системы элюирования А с получением указанного в заголовке соединения 29с (790 мг, выход 50%) в виде желтого масла.
Стадия 2
5-(1-(4-(1-(((S)-2,2-Диметил-1,3-диоксолан-4-ил)метил)-1Н-пиразол-4-ил)фенил)-пиперидин-4-ил)-6-фтор-5H-имидазо[5,1-а]изоиндол 29d
Соединения 9а (250 мг, 0,606 ммоль) и 29с (560 мг, 1,82 ммоль) растворяли в 7 мл н-бутанола, добавляли фосфат калия (386 мг, 1,82 ммоль), трис(дибензилиденацетон)дипалладий (41,7 мг, 0,0455 ммоль) и 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (87 мг, 0,182 ммоль). Реакцию нагревали до 100°С и перемешивали в течение 12 часов. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с использованием системы элюирования А, затем тонкослойной хроматографией с использованием системы элюирования А с получением указанного в заголовке соединения 29d (120 мг, выход 38,6%) в виде желтого твердого вещества.
Стадия 3
(2S)-3-(4-(4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1Н-пиразол-1-ил)пропан-1,2-диол 29
Соединение 29d (120 мг, 0,234 ммоль) растворяли в 4 мл метанола, затем добавляли 2 мл 2н соляной кислоты. Реакцию перемешивали в течение 3 часов при комнатной температуре. По завершении реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 29 (95 мг, выход 79%) в виде оранжево-желтого твердого вещества.
МС m/z(ESI): 474,5 [М+1]
1Н ЯМР(400 МГц, DMCO-d6) δ 9,59 (s, 1Н), 8,17 (s, 1Н), 8,12 (s, 1Н), 7,92 (s, 1Н), 7,65-7,83 (m, 6Н), 7,46 (t, 1Н), 6,24 (s, 1Н), 4,23 (dd,1H), 3,95-4,05 (m, 1Н), 3,80-3,86 (m,1H), 3,50-3,75 (m, 2H), 3,25-3,50 (m, 4H), 2,78-2,95 (m, 1H), 2,00-2,30 (m, 2H), 1,50-1,70 (m, 2H).
Пример 30
(2R)-3-(4-(4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1Н-пиразол-1-ил)пропан-1,2-диола трифторацетат
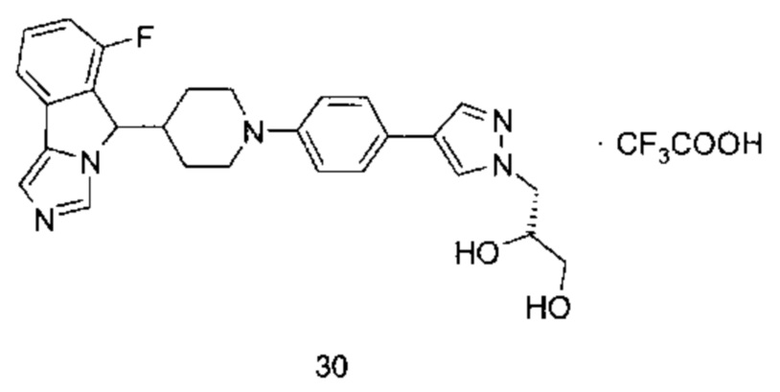
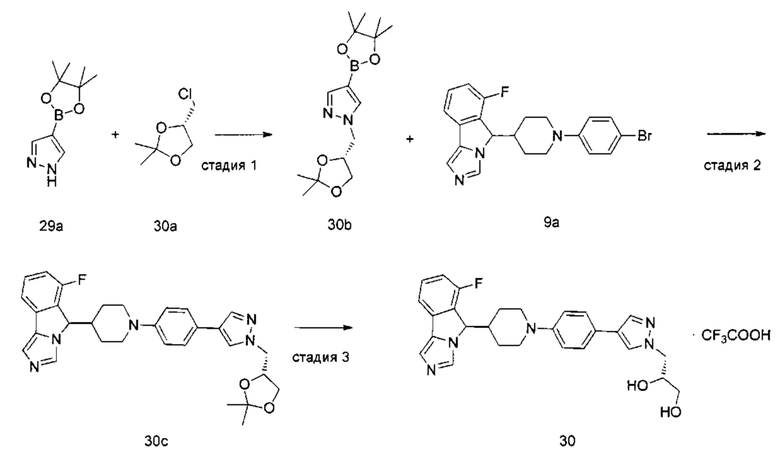
Стадия 1
(R)-1-((2,2-Диметил-1,3-диоксолан-4-ил)метил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол 30b
Соединение 29а (500 мг, 2,58 ммоль) растворяли в 3 мл N,N-диметилформамида, затем добавляли гидрид натрия (113 мг, 60%) при комнатной температуре. Затем реакцию перемешивали в течение 20 мин при комнатной температуре, добавляли (S)-4-(хлорметил)-2,2-диметил-1,3-диоксолан 30а (505 мг, 3,35 ммоль). Реакцию нагревали до 100°С и перемешивали в течение 12 часов. 0,5 мл метанола добавляли в реакционный раствор для гашения реакции. Смесь концентрировали при пониженном давлении для удаления N,N-диметилформамида. Добавляли 50 мл этилацетата и 5 мл воды к полученному остатку. Две фазы разделяли, затем органическую фазу сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения 30b (400 мг) в виде желтого масла, которое использовали непосредственно без дополнительной очистки на следующей стадии.
Стадия 2
5-(1-(4-(1-(((R)-2,2-Диметил-1,3-диоксолан-4-ил)метил)-1Н-пиразол-4-ил)фенил)-пиперидин-4-ил)-6-фтор-5H-имидазо[5,1-а]изоиндол 30с
Соединение 9а (250 мг, 0,606 ммоль) и неочищенное соединение 30b (223 мг, 0,726 ммоль) растворяли в 5 мл н-бутанола, затем добавляли фосфат калия (154 мг, 0,726 ммоль), трис(дибензилиденацетон)дипалладий (22 мг, 0,0242 ммоль) и 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (46 мг, 0,0968 ммоль). Реакцию нагревали до 100°С и перемешивали в течение 12 часов. Реакционный раствор охлаждали до комнатной температуры, затем получали неочищенное указанное в заголовке соединение 30с (150 мг) в виде коричневого-желтого масла, которое использовали непосредственно без дополнительной очистки на следующей стадии.
Стадия 3
(2R)-3-(4-(4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1Н-пиразол-1-ил)пропан-1,2-диола трифторацетат 30
Соединение 30с (150 мг, 0,292 ммоль) растворяли в 5 мл метанола, затем добавляли 5 мл 2н соляной кислоты. Реакцию перемешивали в течение 12 часов при комнатной температуре. Затем реакционный раствор концентрировали при пониженном давлении, полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 30 (8 мг, выход 5,8%) в виде белого твердого вещества.
МС m/z(ESI): 474,4 [М+1]
1Н ЯМР(400 МГц, DMCO-d6) δ 9,51 (s, 1Н), 8,07 (s, 1Н), 8,01 (s, 1Н), 7,75-7,80 (m, 2Н), 7,65-7,70 (m, 1Н), 7,40-7,55 (m, 3Н), 7,00-7,10 (m, 2Н), 6,15 (s, 1Н), 4,20 (dd, 1Н), 3,94-4,02 (m, 1Н), 3,60-3,85 (m, 3Н), 3,25-3,40 (m, 2Н), 2,70-3,02 (m, 2Н), 2,60-2,70 (m, 1Н), 1,82-1,90 (m,1H), 1,65-1,80 (m, 1Н), 1,30-1,40 (m, 1Н), 1,15-1,20 (m, 1Н).
Пример 31
6-Фтор-5-(1-(4-(1-(1-(метилсульфонил)пиперидин-4-ил)-1Н-пиразол-4-ил)фенил)-пиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндола трифторацетат
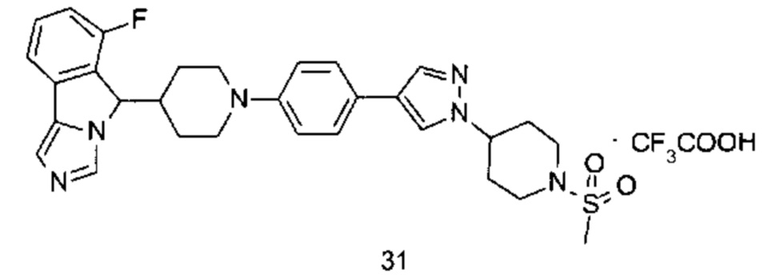
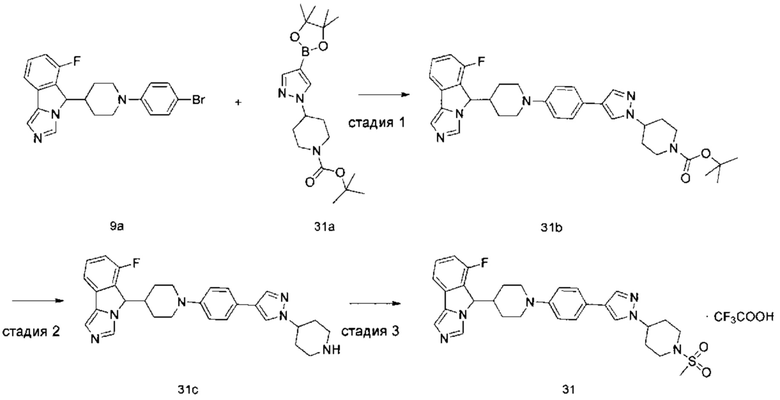
Стадия 1
трет-Бутил 4-(4-(4-(4-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1H-пиразол-1-ил)пиперидин-1-карбоксилат 31b
Соединение 9а (250 мг, 0,606 ммоль) и трет-бутил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол-1-ил)пиперидин-1-карбоксилат 31а (343 мг, 0,91 ммоль, полученный хорошо известным способом, описанным в "Bioorganic & Medicinal Chemistry, 2013, 21(21), 6804-6820") растворяли в 5 мл н-бутанола, затем добавляли фосфат калия (260 мг, 1,212 ммоль), трис(дибензилиденацетон)дипалладий (17 мг, 0,018 ммоль) и 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (35 мг, 0,073 ммоль). Реакцию нагревали до 100°С и перемешивали в течение 12 часов. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле с использованием системы элюирования А с получением указанного в заголовке соединения 31b (160 мг, выход 45,3%) в виде желтого твердого вещества.
Стадия 2
6-Фтор-5-(1-(4-(1-(пиперидин-4-ил)-1H-пиразол-4-ил)фенил)пиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндол 31с
Соединение 31b (160 мг, 0,275 ммоль) растворяли в 3 мл дихлорметана, затем добавляли 0,5 мл трифторуксусной кислоты. Реакцию перемешивали в течение 2 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения 31с (250 мг) в виде желтого масла, которое использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия 3
6-Фтор-5-(1-(4-(1-(1-(метилсульфонил)пиперидин-4-ил)-1Н-пиразол-4-ил)фенил)-пиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндола трифторацетат 31
Неочищенное соединение 31с (125 мг, 0,138 ммоль) растворяли в 3 мл дихлорметана, затем добавляли 0,5 мл трифторуксусной кислоты и метилсульфонилхлорид (47 мг, 0,412 ммоль). Реакцию перемешивали в течение 2 часов при комнатной температуре. Добавляли 10 мл дихлорметана и 2 мл воды в реакционный раствор. Две фазы разделяли, затем органическую фазу концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 31 (12 мг, выход 12,9%) в виде белого твердого вещества.
МС m/z(ESI): 561,5 [М+1]
1Н ЯМР(400 МГц, DMCO-d6) δ 9,47(s, 1Н), 8,16 (s, 1Н), 8,05 (s, 1 Н),7,74-7,80 (m, 2Н), 7,63-7,70 (m, 1Н),7,38-7,50 (m, 3Н), 6,96 (d, 2Н), 6,13 (s, 1Н), 4,25-4,34 (m, 1Н), 3,60-3,80 (m, 4Н), 2,90-3,00 (m, 5Н), 2,50-2,70 (m, 3Н), 2,10-2,20 (m, 2Н), 1,92-2,05 (m, 2Н), 1,81-1,85 (m, 1Н), 1,61-,165 (m, 1Н), 1,30-1,34 (m, 1Н), 1,00-1,15 (m, 1Н).
Пример 32
6-Фтор-5-(1-(4-(1-((R)-тетрагидрофуран-3-ил)-1Н-пиразол-4-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат
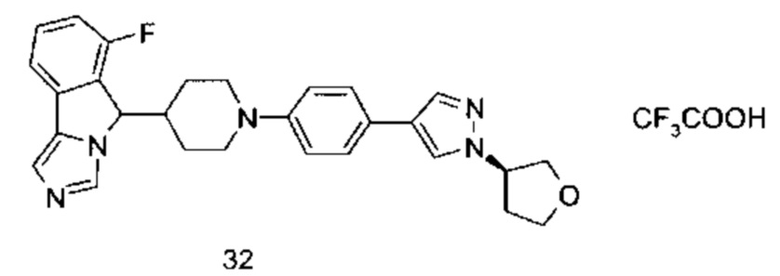
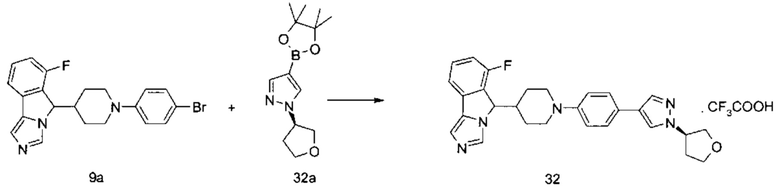
Соединение 9а (103 мг, 0,25 ммоль) и (R)-1-(тетрагидрофуран-3-ил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол 32а (99 мг, 0,375 ммоль, полученный способом, описанным в патентной заявке WO 201493647) растворяли в 3 мл н-бутанола, затем добавляли фосфат калия (106 мг, 0,5 ммоль), трис(дибензилиденацетон)дипалладий (17 мг, 0,018 ммоль) и 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (36 мг, 0,075 ммоль). Реакцию нагревали до 100°С и перемешивали в течение 12 часов. После охлаждения до комнатной температуры реакционный раствор фильтровали через диатомит. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 32 (55 мг, выход 37,9%) в виде белого твердого вещества.
МС m/z(ESI): 470,5 [М+1];
1Н ЯМР (400 МГц, DMCO-d6) δ 9,49 (s, 1Н), 8,10 (s, 1Н), 8,06 (s, 1Н), 7,8 (s, 1Н), 7,76-7,78 (m, 1Н), 7,41-7,45 (m, 3Н), 6,97 (d, 2Н), 6,14 (s, 1Н), 4,98-5,00 (m, 1Н), 3,97-4,02 (m, 2Н), 3,89-3,92 (m, 1Н), 3,80-3,86 (m, 1Н), 3,73-3,76 (m, 1Н), 3,63-3,66 (m, 1Н), 2,75-2,85 (m, 1Н), 2,62-2,75 (m, 1Н), 2,53-2,59 (m, 1Н), 2,29-2,41 (m, 2Н), 1,82-1,85 (m, 1Н), 1,62-1,64 (m, 1Н), 1,31-1,34 (m, 1Н), 1,07-1,13 (m, 1Н), 0,85-0,87 (m, 1Н).
Пример 33
(1S,4s)-4-((R)-6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)-N-(3-метоксифенил)-циклогексанкарбоксамид
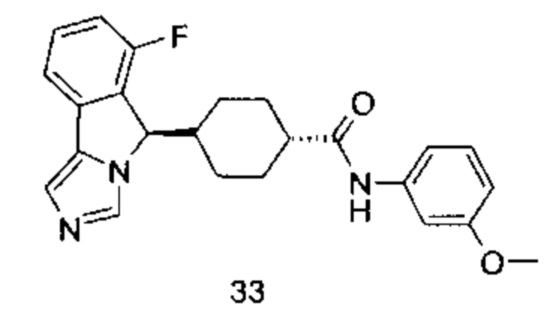
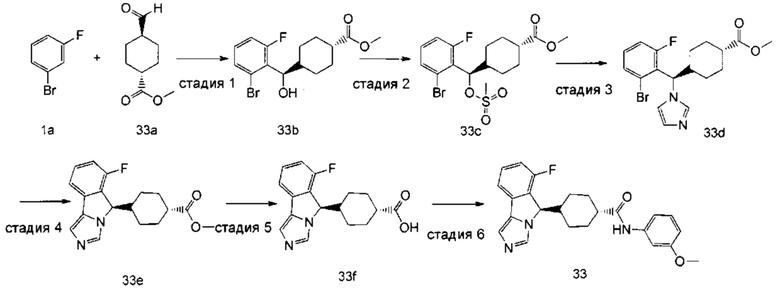
Стадия 1
(1S,4s)-Метил 4-((R)-(2-бром-6-фторфенил)(гидрокси)метил)-циклогексанкарбоксилат 33b
Диизопропиламид лития (26,8 мл) растворяли в 50 мл тетрагидрофурана, затем раствор охлаждали до -78°С. 20 мл предварительно приготовленного раствора соединения 1а (7,2 г, 41,18 ммоль) в тетрагидрофуране добавляли по каплям, полученную смесь перемешивали в течение 1 час. Затем добавляли 50 мл предварительно приготовленного раствора (1r,4r)-метил-4-формилциклогексанкарбоксилата 33а (7 г, 41,18 ммоль, полученного способом, описанным в патентной заявке WO 2013050334) в тетрагидрофуране по каплям. Реакцию непрерывно перемешивали в течение 2 часов. 10 мл метанола добавляли в реакционный раствор для гашения реакции. Реакцию нагревали до комнатной температуры, затем добавляли 100 мл этилацетата. Смесь промывали водой (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования В с получением указанного в заголовке соединения 33b (6,8 г, выход 47,9%) в виде коричнево-желтого масла.
Стадия 2
(1S,4s)-Метил 4-((R)-(2-бром-6-фторфенил)((метилсульфонил)окси)метил)-циклогексанкарбоксилат 33с
Соединение 33b (6,8 г, 19,7 ммоль) растворяли в 100 мл дихлорметана, затем добавляли триэтиламин (3,99 г, 39,4 ммоль) и по каплям добавляли метанасульфонилхлорид (2,48 г, 21,67 ммоль). Реакцию перемешивали в течение 12 часов при комнатной температуре. 50 мл дихлорметана добавляли в реакционный раствор, затем смесь промывали насыщенным раствором хлорида натрия (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного соединения 33с (8,33 г) в виде коричневого масла, которое использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия 3
(1S,4s)-Метил 4-((R)-(2-бром-6-фторфенил)(1H-имидазол-1-ил)метил)-циклогексанкарбоксилат 33d
Неочищенное соединение 33с (1,4 г, 3,3 ммоль) растворяли в 5 мл ацетонитрила, затем добавляли 1Н-имидазол (2,25 г, 33 ммоль) и N,N-диизопропилэтиламин (4,26 г, 33 ммоль). Полученную смесь перемешивали в микроволновом реакторе в течение 45 мин при 130°С. После охлаждения до комнатной температуры реакционный раствор концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования В с получением указанного в заголовке соединения 33d (2,8 г, выход 35,95%) в виде коричневого масла.
Стадия 4 (1S,4s)-Метил-4-((R)-6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)циклогексанкарбоксилат 33е
Соединение 33d (2,8 г, 7,08 ммоль) растворяли в 12 мл N,N-диметилформамида, затем добавляли N,N-дициклогексилметиламин (2,2 мг, 11,328 ммоль), трифенилфосфин (743 мг, 2,8 ммоль) и ацетат палладия (318 мг, 1,4 ммоль). Реакционную смесь перемешивали в микроволновом реакторе в течение 1 часа при 120°С. После охлаждения до комнатной температуры реакционный раствор концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования В с получением указанного в заголовке соединения 33е (628 мг, выход 28,5%) в виде коричневого твердого вещества.
Стадия 5
(1S,4s)-4-((R)-6-Фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)циклогексанкарбоновая кислота 33f
Соединение 33е (628 мг, 2 ммоль) растворяли в 20 мл метанола, затем добавляли 5 мл воды и гидроксид натрия (400 мг, 10 ммоль). Полученную смесь перемешивали в течение 12 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении для удаления метанола. В полученный остаток добавляли 30 мл воды и экстрагировали этилацетатом (50 мл). В водную фазу добавляли по каплям 6 М соляную кислоту для доведения рН до 5-6 и экстрагировали смесью дихлорметана и метанола (V/V=5:1) (60 мл×3). Органические фазы объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения 33f (600 мг) в виде коричневого масла, которое использовали непосредственно без дополнительной очистки на следующей стадии.
Стадия 6
(1S,4s)-4-((R)-6-Фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)-N-(3-метоксифенил)-циклогексанкарбоксамид 33
Неочищенное соединение 33f (60 мг, 0,2 ммоль) растворяли в 2 мл N,N-диметилформамида, затем добавляли 3-метоксианилин (25 мг, 0,2 ммоль), 1-гидроксибензотриазол (32 мг, 0,24 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (46 мг, 0,24 ммоль) и н-диизопропилэтиламин (129 мг, 1 ммоль). Полученную смесь перемешивали в течение 48 часов при комнатной температуре. Реакционный раствор очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 33 (13 мг, выход 16,25%) в виде белого твердого вещества.
МС m/z(ESI): 406,4[М+1]
1Н ЯМР (400 МГц, DMCO-d6) δ 9,72 (s, 1Н), 7,97 (s, 1Н), 7,44-7,49 (m, 2Н), 7,26-7,3 (m, 1Н), 7,21 (s, 1Н), 7,11-7,18 (m,2Н), 7,05-7,10 (m, 1Н), 6,56-6,59 (m, 1Н), 5,60 (s, 1Н), 3,69 (s, 3Н), 2,10-2,36 (m, 3Н), 1,69-1,92 (m, 3Н), 1,44-1,58 (m, 1Н), 1,28-1,43 (m, 2Н), 0,55-0,68 (m, 1Н).
Пример 34
6-Фтор-5-(1-(2-фтор-4-(1-метил-1H-пиразол-4-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол
Стадия 1
6-Фтор-5-(1-(2-фтор-4-нитрофенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол 34а
Неочищенное соединение 1g (1,7 г, 3,51 ммоль) растворяли в 20 мл диметилсульфоксида, затем добавляли 1,2-дифтор-4-нитробензол (0,557 г, 3,51 ммоль) и триэтиламин (1,42 г, 14,04 ммоль). Полученную смесь перемешивали в течение 2,5 часов при комнатной температуре. В реакционный раствор добавляли 150 мл этилацетата и промывали водой (100 мл×2). Органическую фазу концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования А с получением указанного в заголовке соединения 34а (970 мг, выход 53,8%) в виде желтого твердого вещества.
Стадия 2
3-Фтор-4-(4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)анилин 34b
Соединение 34а (970 мг, 2,45 ммоль) растворяли в 20 мл метанола, затем добавляли 10% Pd/C (200 мг). Реакционную систему продували водородом три раза и перемешивали в течение 12 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении с получением неочищенного соединения 34b (920 мг) в виде желтого твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия 3
5-(1-(4-Бром-2-фторфенил)пиперидин-4-ил)-6-фтор-5H-имидазо[5,1-а]изоиндол 34с
Неочищенное соединение 34b (620 мг, 1,692 ммоль) растворяли в 40% растворе бромистоводородной кислоты, затем реакционную систему охлаждали до 0-5°С. 1 мл предварительно приготовленного раствора нитрита натрия (128 мг, 1,86 ммоль) добавляли по каплям. После завершения добавления реакцию перемешивали в течение 40 мин при 0°С, затем реакционный раствор выливали в раствор бромистоводородной кислоты, который охлаждали до 0°С. Смесь нагревали до 60°С и перемешивали в течение 2 часов. рН доводили до 8-9 раствором 2н гидроксида натрия. Смесь экстрагировали этилацетатом (100 мл×2). Органические фазы объединяли, промывали водой (100 мл) и насыщенным раствором хлорида натрия (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования А с получением указанного в заголовке соединения 34с (450 мг, выход 61,8%) в виде белого твердого вещества.
Стадия 4
6-Фтор-5-(1-(2-фтор-4-(1-метил-1Н-пиразол-4-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол 34
Соединение 34с (200 мг, 0,465 ммоль) растворяли в 11 мл смеси 1,2-диметоксиэтана и воды (V:V=10:1), затем добавляли 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол (145 мг, 0,697 ммоль), тетракис(трифенилфосфин)палладий (54 мг, 0,0465 ммоль) и карбонат натрия (99 мг, 0,93 ммоль). Реакционную смесь нагревали до 80°С и перемешивали в течение 48 часов. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении. Полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 34 (160 мг, выход 35%) в виде коричневого твердого вещества.
МС m/z(ESI): 432,4 [М+1]
1Н ЯМР (400 МГц, DMCO-d6) δ 8,06 (s, 2Н), 7,80 (s, 1Н), 7,45-7,55 (m, 2Н), 7,22-7,40 (m, 3Н), 7,16-7,21 (m, 1Н), 6,97 (t, 1Н), 5,71 (s, 1Н), 3,83 (s, 3Н), 3,20-3,45 (m, 2Н), 2,68 (t, 1Н), 2,56 (t, 1Н), 2,35 (t, 1Н), 1,65-1,85 (m, 2Н), 1,14-1,25 (m, 1Н), 0,85-1,00 (m, 1Н).
Пример 35
6-Фтор-5-(1-(3-фтор-4-(1-метил-1Н-пиразол-4-ил)фенил)пиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндола трифторацетат
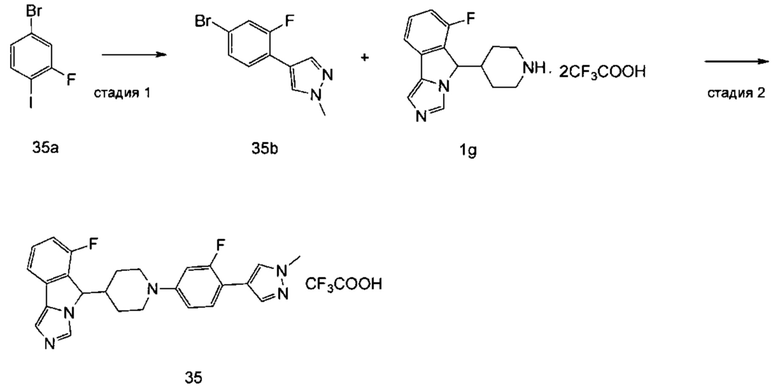
Стадия 1
4-(4-Бром-2-фторфенил)-1-метил-1Н-пиразол 35b
4-бром-2-фтор-1-иодобензол 35а (301 мг, 1 ммоль) растворяли в 3 мл диметилсульфоксида, затем добавляли 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол (139 мг, 0,67 ммоль), (1,1'-бис(дифенилфосфино)-ферроцен)дихлорпалладий (49 мг, 0,067 ммоль), ацетат калия (66 мг, 0,67 ммоль) и карбонат цезия (650 мг, 2,01 ммоль). Смесь нагревали до 80°С и перемешивали в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры, затем добавляли 350 мл воды. Смесь экстрагировали этилацетатом (60 мл×3). Органические фазы объединяли, промывали водой (120 мл×2) и насыщенным раствором хлорида натрия (60 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения 35b (170 мг) в виде коричневого твердого вещества, которое использовали непосредственно без дополнительной очистки на следующей стадии.
Стадия 2
6-Фтор-5-(1-(3-фтор-4-(1-метил-1Н-пиразол-4-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат 35
Неочищенное соединение 1g (200 мг, 0,41 ммоль) растворяли в 10 мл толуола, затем добавляли неочищенное соединение 35d (170 мг, 0,67 ммоль), трис(дибензилиденацетон)дипалладий (61 мг, 0,067 ммоль), (±)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил (442 мг, 0,067 ммоль) и трет-бутоксид натрия (257 мг, 2,68 ммоль). Реакцию нагревали до 80°С и перемешивали в течение 12 часов. Реакционный раствор охлаждали до комнатной температуры, затем добавляли 30 мл воды. Смесь экстрагировали дихлорметаном (30 мл×3). Органические фазы объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования А с получением указанного в заголовке соединения 35 (5 мг, выход 2,8%) в виде белого твердого вещества.
МС m/z(ESI): 432,3[М+1]
Пример 36
4-(5-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)-1,3,4-тиадиазол-2-ил)пиридин-2-амина трифторацетат
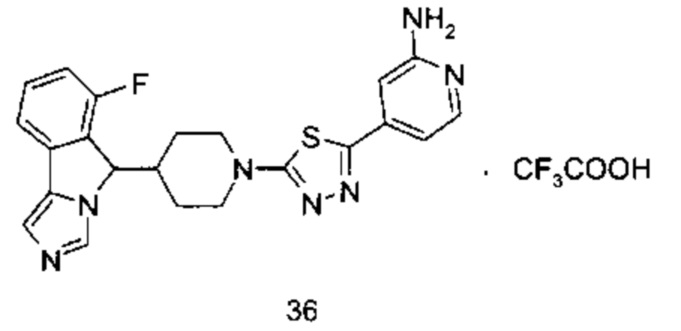
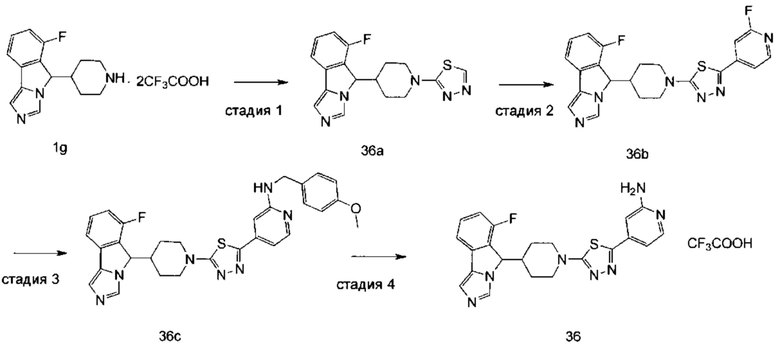
Стадия 1
2-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)-1,3,4-тиадиазол 36а
Неочищенное соединение 1g (4,85 г, 10,0 ммоль), 2-бром-1,3,4-тиадиазол (1,65 г, 10,0 ммоль) и триэтиламин (10,1 г, 100,0 ммоль) растворяли в 20 мл диметилсульфоксида. Полученную смесь нагревали до 120°C и перемешивали в течение 12 часов в герметичной пробирке. Реакционный раствор охлаждали до комнатной температуры, затем добавляли 200 мл дихлорметана. Смесь промывали водой (200 мл×3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования А с получением указанного в заголовке соединения 36а (1,09 г, выход 31,9%) в виде светло-коричневого твердого вещества.
Стадия 2
2-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)-5-(2-фторпиридин-4-ил)-1,3,4-тиадиазол 36b
Соединение 36а (800 мг, 2,34 ммоль), 4-бром-2-фторпиридин (824 мг, 4,68 ммоль), ацетат палладия (76 мг, 0,334 мммоль), три-трет-бутилфосфин (1,35 г, 0,668 ммоль) и карбонат цезия (1,52 г, 4,68 ммоль) растворяли в 10 мл N,N-диметилформамида. Реакцию нагревали до 150°C и перемешивали в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры, затем добавляли 150 мл дихлорметана. Смесь промывали водой (100 мл×3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования А с получением указанного в заголовке соединения 36b (260 мг, выход 25,5%) в виде коричневого твердого вещества.
Стадия 3
4-(5-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)-1,3,4-тиадиазол-2-ил)-N-(4-метоксибензил)пиридин-2-амин 36с
Соединение 36b (260 мг, 0,60 ммоль) растворяли в 3 мл диметилсульфоксида, затем добавляли N-бензил-4-метоксибензиламин (823 мг, 6,0 ммоль). Реакцию нагревали до 130°C и перемешивали в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры, затем добавляли 100 мл дихлорметана. Смесь промывали водой (100 мл×3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования А с получением указанного в заголовке соединения 36с (130 мг, выход 39,1%) в виде светло-коричневого твердого вещества.
Стадия 4
4-(5-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)-1,3,4-тиадиазол-2-ил)пиридин-2-амин трифторацетат 36
Соединение 36с (130 мг, 0,235 ммоль) растворяли в 5 мл трифторуксусной кислоты. Реакцию нагревали до 60°C и перемешивали в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 36 (30 мг, выход 23,4%) в виде коричневого твердого вещества.
МС m/z (ЖХ-МС): 434,3 [М+1]
Пример 37
6-Фтор-5-(1-(5-((1-(метилсульфонил)пиперидин-3-ил)окси)пиримидин-2-ил)-пиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндола трифторацетат
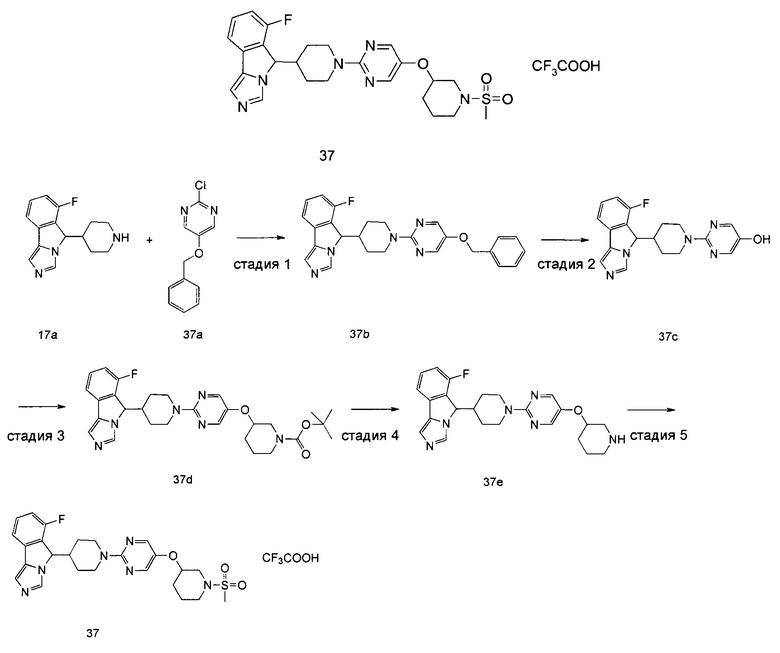
Стадия 1
5-(1-(5-(Бензилокси)пиримидин-2-ил)пиперидин-4-ил)-6-фтор-5Н-имидазо[5,1-а]-изоиндол 37а
Неочищенное соединение 17а (1,5 г, 5,83 ммоль) и 5-(бензилокси)-2-хлорпиримидин 37а (1,29 г, 5,83 ммоль) растворяли в 10 мл N,N-диметилацетамида, затем добавляли N,N-диизопропилэтиламин (3,76 г, 29,1 ммоль). Полученную смесь перемешивали в течение 1 часа при 150°C в микроволновом реакторе. Реакционный раствор охлаждали до комнатной температуры и фильтровали. В фильтрат добавляли 100 мл этилацетата и 50 мл воды. Две фазы разделяли. Органическую фазу промывали водой и насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования А с получением указанного в заголовке соединения 37а (600 мг, выход 40%) в виде светло-коричневого масла.
Стадия 2
2-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)пиримидин-5-ол 37с
Соединение 37b (600 мг, 1,36 ммоль) растворяли в 15 мл метанола, затем добавляли Pd/C (10%). Реакционную систему продували водородом три раза и перемешивали в течение 3 часов. Реакционный раствор фильтровали для удаления Pd/C. Фильтрат концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения 37с (455 мг) в виде желтого твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия 3 трет-Бутил-3-((2-(4-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)пиримидин-5-ил)-окси)пиперидин-1-карбоксилат 37d
Неочищенное соединение 37с (200 мг, 0,57 ммоль), 1-Вос-3-гидроксипиперидин (114 мг, 0,57 ммоль), диизопропилазодикарбоксилат (162 мг, 0,856 ммоль) и трифенилфосфин (224 мг, 0,856 ммоль) растворяли в 5 мл тетрагидрофурана. Реакцию перемешивали в течение 12 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования А с получением указанного в заголовке соединения 37d (100 мг, выход 33,1%) в виде светло-коричневого твердого вещества.
Стадия 4
6-Фтор-5-(1-(5-((1-(метилсульфонил)пиперидин-3-ил)окси)пиримидин-2-ил)-пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат 37
Соединение 37d (38 мг, 0,087 ммоль) растворяли в 5 мл дихлорметана, затем добавляли 0,25 мл трифторуксусной кислоты и 11 капель метилсульфонилхлорида. Реакцию перемешивали в течение 12 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении. Полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 37 (14 мг, выход 20%) в виде белого твердого вещества.
MC m/z (ESI): 513,3 [M+1]
Пример 38
6-Фтор-5-(1-(4-((тетрагидрофуран-3-ил)окси)фенил)пиперидин-4-ил)-5Н-имидазо-[5,1-а]изоиндол
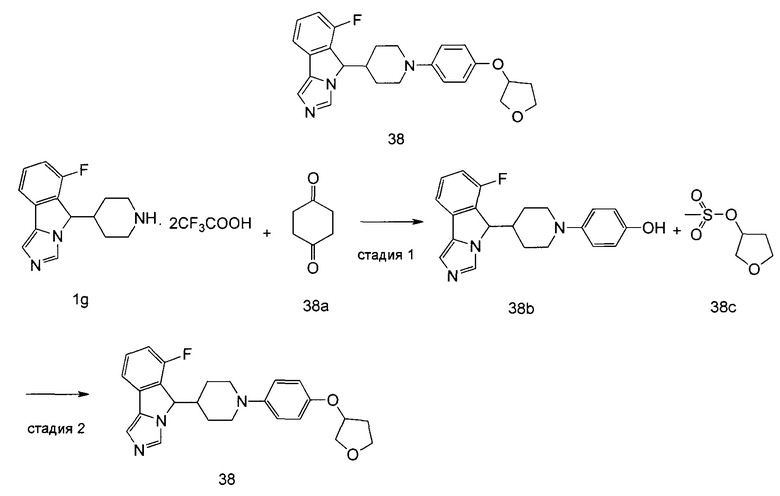
Стадия 1
4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенол 38b
Соединение 1g (5,82 г, 12 ммоль) и циклогексан-1,4-дион 38а (1,61 г, 14,4 ммоль) растворяли в 40 мл этанола, затем добавляли триэтиламин (2,424 г, 24 ммоль) и Pd/C (10%, 200 мг). Смесь нагревали до 85°C и перемешивали в течение 12 часов. Реакционный раствор охлаждали до комнатной температуры, добавляли воду и экстрагировали дихлорметаном (50 мл×3). Органические фазы объединяли, промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения 38b (4,19 г) в виде коричневого твердого вещества, которое использовали непосредственно без дополнительной очистки на следующей стадии.
Стадия 2
6-Фтор-5-(1-(4-((тетрагидрофуран-3-ил)окси)фенил)пиперидин-4-ил)-5H-имидазо-[5,1-а]изоиндол 38
Неочищенное соединение 38b (349 мг, 1 ммоль) растворяли в 5 мл этанола, затем добавляли тетрагидрофуран-3-илметансульфонат 38с (333 мг, 2 ммоль, полученный способом, описанным в патентной заявке WO 2014049133) и карбонат калия (420 мг, 3 ммоль). Реакцию перемешивали в течение 1 часа в микроволновом реакторе при 125°C. Реакционный раствор охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали при пониженном давлении. В полученный остаток добавляли воду и экстрагировали дихлорметаном (20 мл×3). Органические фазы объединяли, промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 38 (20 мг, выход 4,8%) в виде светло-желтого твердого вещества.
MC m/z (ESI): 420,5 [М+1]
Пример 39
6-Фтор-5-(1-(4-((1-(метилсульфонил)пиперидин-4-ил)окси)фенил)пиперидин-4-ил)-5Н-имидазо[5,1-а]изоиндол
Стадия 1
4-(4-Иодофенокси)-1-(метилсульфонил)пиперидин 39b
4-(4-Иодофенокси)пиперидин 39а (600 мг, 2 ммоль, полученный способом, описанным в патентной заявке WO 2004089373) растворяли в 15 мл дихлорметана, затем добавляли триэтиламин (404 мг, 4 ммоль) и метилсульфонилхлорид (273,6 мг, 2,4 ммоль). Полученную смесь перемешивали в течение 1 часа при комнатной температуре. В реакционный раствор добавляли воду и экстрагировали этилацетатом (20 мл×3). Органические фазы объединяли, промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения 39b (100 мг) в виде светло-желтого твердого вещества, которое использовали непосредственно без дополнительной очистки на следующей стадии.
Стадия 2
6-Фтор-5-(1-(4-((1-(метилсульфонил)пиперидин-4-ил)окси)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол 39
Неочищенное соединение 39b (114 мг, 0,3 ммоль) и 1g (122 мг, 0,25 ммоль) растворяли в 5 мл толуола, затем добавляли трис(дибензилиденацетон)дипалладий (22,9 мг, 0,025 ммоль), 2-(дициклогексилфосфино)-2',4',6'-триизопропилбифенил (12 мг, 0,025 ммоль) и трет-бутоксид натрия (36 мг, 0,375 ммоль). Реакцию перемешивали в течение 40 мин в микроволновом реакторе при 156°C. Реакционный раствор охлаждали до комнатной температуры. Полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 39 (10 мг, выход 7,8%) в виде светло-желтого твердого вещества.
MC m/z (ESI): 511,6 [M+1]
Примеры 40, 41
(R)-2-(4-(4-(4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1H-пиразол-1-ил)этанол 40
(S)-2-(4-(4-(4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1Н-пиразол-1-ил)этанол 41
Стадия 1
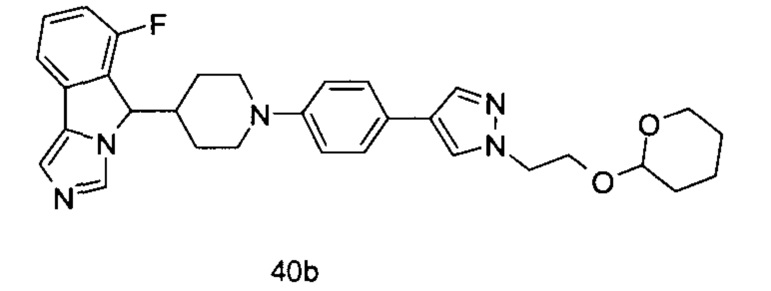
6-Фтор-5-(1-(4-(1-(2-((тетрагидро-2H-пиран-2-ил)окси)этил)-1H-пиразол-4-ил)фенил)-пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол 40b
4-(4-Бромфенил)-1-(2-((тетрагидро-2H-пиран-2-ил)окси)этил)-1H-пиразол 40а (14,8 г, 42 ммоль) и 6-фтор-5-(пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндол 17а (13,9 г, 42 ммоль) растворяли в 300 мл N,N-диметилформамида, затем добавляли три-трет-бутилфосфоний тетрафторборат (1,863 г, 64,5 ммоль) и фосфат калия (35 г, 168 ммоль) и реакционную систему продували аргоном три раза. Добавляли трис(дибензилиденацетон)дипалладий (2,92 г, 3,19 ммоль) и реакционную систему продували аргоном один раз. Полученный раствор нагревали до 110°C и перемешивали в течение 2 часов. По завершении реакции реакционный раствор фильтровали и фильтрат концентрировали при пониженном давлении для удаления N,N-диметилформамида. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования А с получением соединения 40b (6,38 г, выход 29%) в виде серого масла.
МС m/z (ЖХ-МС): 528,3 [М+1]
Стадия 2
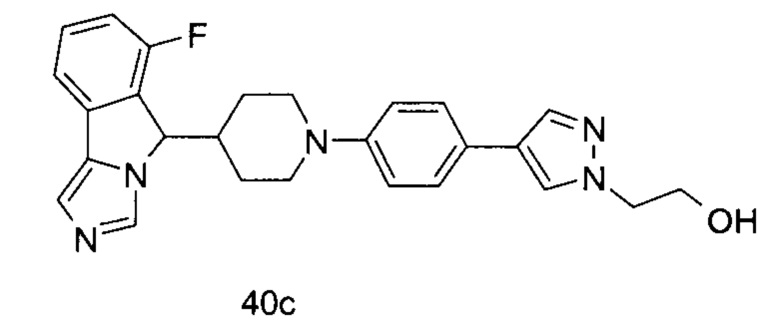
2-(4-(4-(4-(6-Фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1H-пиразол-1-ил)этанол 40с
Соединение 40b (9 г, 17,1 ммоль) растворяли в 100 мл метанола, затем добавляли 5,7 мл концентрированной соляной кислоты (12М). Реакционный раствор нагревали до 45°C и перемешивали в течение 1 часа. По завершении реакции реакционный раствор охлаждали до комнатной температуры, pH доводили до 8 насыщенным раствором карбоната натрия. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования А с получением соединения 40с (5,2 г, выход 65%) в виде желтого твердого вещества.
Стадия 3
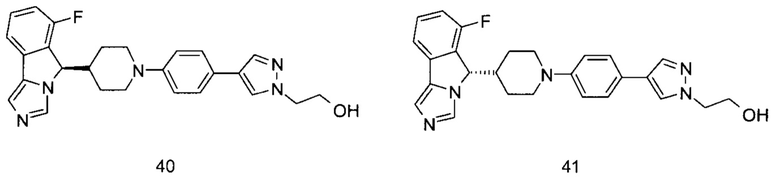
(R)-2-(4-(4-(4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1Н-пиразол-1-ил)этанол 40
(S)-2-(4-(4-(4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1H-пиразол-1-ил)этанол 41
Соединение 40с (1,4 г, 3,16 ммоль) хирально разделяли (условия разделения: хиральная препаративная колонка: Superchiral S-AS (Chiralway), 2 см I.D.*25 см длиной, 5 мкм; мобильная фаза: CO2/MeOH/DEA=60/40/0,05 (об/об), скорость потока: 50 мл/мин), соответствующие фракции собирали и концентрировали в вакууме с получением соединения 40 (630 мг, желтое твердое вещество) и соединения 41 (652 мг, желтое твердое вещество).
40:
MC m/z (ESI): 444,5 [М+1];
Анализ хиральной ВЭЖХ: время удерживания: 3,064 мин, хиральная чистота 97,79%. (хроматографическая колонка: Superchiral S-AS (Chiralway), 0,46 см I.D.*25 см длиной, 5 мкм; мобильная фаза: CO2/MeOH/DEA=60/40/0,05 (об/об)
1H ЯМР (400 МГц, DMCO-d6) δ 9,97 (s, 2H), 7,73 (s, 1H), 7,44-7,51 (m, 2H), 7,36 (d, 2H), 7,22 (s, 1H), 7,10-7,19 (m, 1H), 6,87 (d, 2H), 5,70 (d, 1H), 4,91 (t, 1H), 4,12 (t, 2H), 3,70-3,79 (m, 3Н), 3,62 (d, 1H), 2,62-2,73 (m, 1H), 2,52-2,58 (m, 1H), 2,31-2,43 (m, 1H), 1,55-1,83 (m, 2H), 1,13-1,23 (m, 1H), 0,82-0,96 (m, 1H).
41:
MC m/z (ESI): 444,5 [М+1];
Анализ хиральной ВЭЖХ: время удерживания: 4,280 мин, хиральная чистота: 99,52%. (хроматографическая колонка: Superchiral S-AS (Chiralway), 0,46 см I.D.*25 см длиной, 5 мкм; мобильная фаза: CO2/MeOH/DEA=60/40/0,05 (об/об)
1Н ЯМР (400 МГц, DMCO-d6) δ 9,97 (s, 2H), 7,73 (s, 1H), 7,44-7,51 (m, 2H), 7,36 (d, 2H), 7,22 (s, 1H), 7,10-7,19 (m, 1H), 6,87 (d, 2H), 5,70 (d, 1H), 4,91 (t, 1H), 4,12 (t, 2H), 3,70-3,79 (m, 3Н), 3,62 (d, 1H), 2,62-2,73 (m, 1H), 2,52-2,58 (m, 1H), 2,31-2,43 (m, 1H), 1,55-1,83 (m, 2H), 1,13-1,23 (m, 1H), 0,82-0,96 (m, 1H).
Пример 42
6-Фтор-5-(1-(4-(1-(2-метоксиэтил)-1Н-пиразол-4-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат
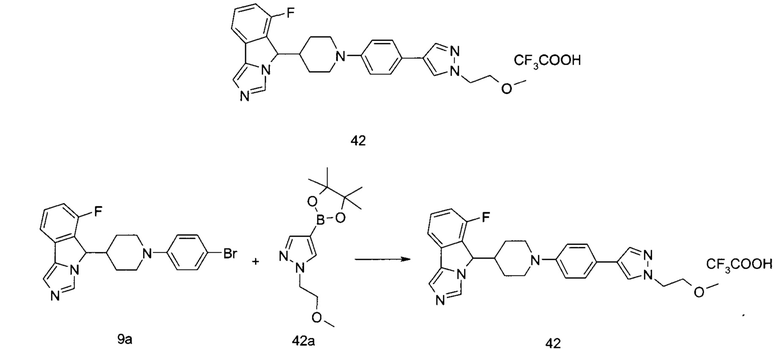
Соединение 9а (100 мг, 0,242 ммоль) и 1-(2-метоксиэтил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол 42а (91 мг, 0,363 ммоль, полученный способом, описанным в патентной заявке WO 2014015088) растворяли в 5 мл н-бутанола, затем добавляли трис(дибензилиденацетон)дипалладий (13 мг, 0,0142 ммоль), 2-(дициклогексилфосфино)-2',4',6'-триизопропилбифенил (28 мг, 0,0581 ммоль) и фосфат калия (154 мг, 0,726 ммоль). Реакцию перемешивали в течение 2 часов при 100°C. Реакционный раствор охлаждали до комнатной температуры. Полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 42 (8 мг, выход 5,8%) в виде белого твердого вещества.
MC m/z (ESI): 458,4 [М+1]
Пример 43
N-(2-(4-(4-(4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1H-пиразол-1-ил)этил)ацетамида трифторацетат
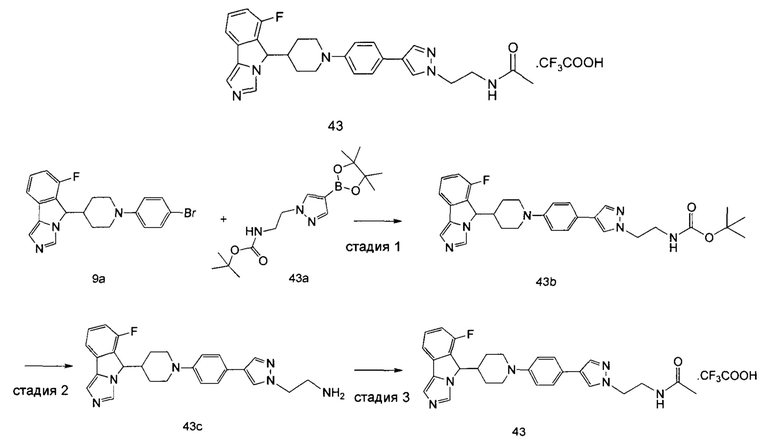
Стадия 1
трет-Бутил-(2-(4-(4-(4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1H-пиразол-1-ил)этил)карбамат 43b
Соединение 9а (100 мг, 0,243 ммоль) растворяли в 3 мл н-бутанола, затем добавляли трет-бутил-(2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол-1-ил)-этил)карбамат 43а (123 мг, 0,364 ммоль, полученный способом, описанным в патентной заявке CN 103087050), трис(дибензилиденацетон)дипалладий (11 мг, 0,0122 ммоль), 2-(дициклогексилфосфино)-2',4',6'-триизопропилбифенил (23 мг, 0,0486 ммоль) и фосфат калия (103 мг, 0,486 ммоль). Реакционную систему нагревали до 100°C и перемешивали в течение 2 часов. Реакционный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле системой элюирования А с получением указанного в заголовке соединения 43b (50 мг, выход 38%) в виде желтого твердого вещества.
Стадия 2
2-(4-(4-(4-(6-Фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1Н-пиразол-1-ил)этанамин 43с
Соединение 43b (50 мг, 0,092 ммоль) растворяли в 3 мл дихлорметана, затем добавляли 0,5 мл трифторуксусной кислоты. Реакцию перемешивали в течение 2 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения 43с (60 мг) в виде коричневого масла, которое использовали непосредственно без дополнительной очистки на следующей стадии.
Стадия 3
N-(2-(4-(4-(4-(6-фтор-5Н-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)фенил)-1Н-пиразол-1-ил)этил)ацетамида трифторацетат 43
Неочищенное соединение 43с (60 мг, 0,092 ммоль) растворяли в дихлорметане, затем добавляли ацетилхлорид (14 мг, 0,184 ммоль) и триэтиламин (28 мг, 0,276 ммоль). Реакцию перемешивали в течение 3 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 43 (7 мг, выход 13%) в виде не совсем белого твердого вещества.
MC m/z (ESI): 485,5 [М+1];
1H ЯМР (400 МГц, DMCO-d6) δ 9,51 (s, 1Н), 8,00-8,20 (m, 3H), 7,75-7,95 (m, 2H), 7,64-7,73 (m, 1Н), 7,40-7,60 (m, 3H), 7,00-7,18 (m, 2H), 6,16 (s, 1Н), 4,14 (t, 2H), 3,72 (d, 1Н), 3,62 (d, 1Н), 3,41-3,46 (m, 2H), 2,70-3,00 (m, 2H), 2,55-2,70 (m, 1Н), 1,60-1,90 (m, 5H), 1,30-1,40 (m, 1Н), 1,10-1,20 (m, 1Н).
Пример 44
6-Фтор-5-(1-(4-(1-((R)-тетрагидрофуран-3-ил)-1Н-пиразол-4-ил)фенил)пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола трифторацетат
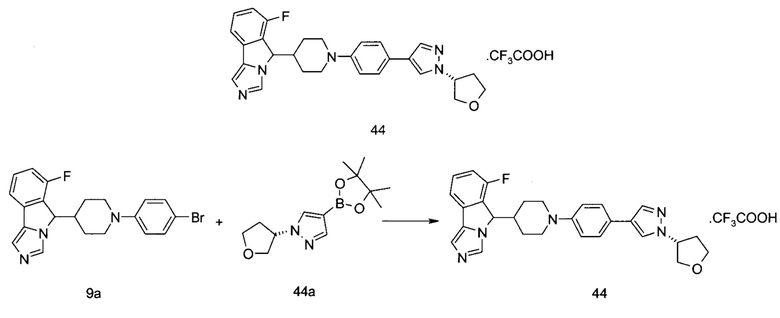
Соединение 9а (103 мг, 0,25 ммоль) растворяли в 3 мл н-бутанола, затем добавляли (S)-1-(тетрагидрофуран-3-ил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол 44а (99 мг, 0,375 ммоль, полученный способом, описанным в патентной заявке US 20080167287), трис(дибензилиденацетон)дипалладий (17 мг, 0,01875 ммоль), 2-(дициклогексилфосфино)-2',4',6'-триизопропилбифенил (36 мг, 0,075 ммоль) и фосфат калия (106 мг, 0,5 ммоль). Реакционную систему нагревали до 100°C и перемешивали в течение 2 часов. Реакционный раствор охлаждали до комнатной температуры и фильтровали через диатомит для удаления нерастворимых веществ. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 44 (30 мг, выход 40,3%) в виде белого твердого вещества.
MC m/z (ESI): 470,5 [М+1];
1Н ЯМР (400 МГц, DMCO-d6) δ 9,49 (s, 1Н), 8,10 (s, 1Н), 8,06 (s, 1H), 7,8 (s, 1H), 7,76-7,78 (m, 1H), 7,41-7,45 (m, 3Н), 6,97 (d, 2H), 6,14 (s, 1H), 4,98-5,00 (m, 1H), 3,97-4,02 (m, 2H), 3,89-3,92 (m, 1H), 3,80-3,86 (m, 1H), 3,73-3,76 (m, 1H), 3,63-3,66 (m, 1H), 2,75-2,85 (m, 1H), 2,62-2,75 (m, 1H), 2,53-2,59 (m, 1H), 2,29-2,41 (m, 2H), 1,82-1,85 (m, 1H), 1,62-1,64 (m, 1H), 1,31-1,34 (m, 1H), 1,07-1,13 (m, 1H), 0,85-0,87 (m, 1H).
Пример 45
2-Фтор-4-(4-(6-фтор-5H-имидазо[5,1-а]изоиндол-5-ил)пиперидин-1-ил)-бензонитрил
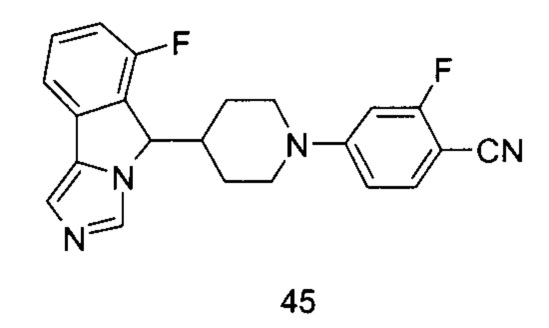
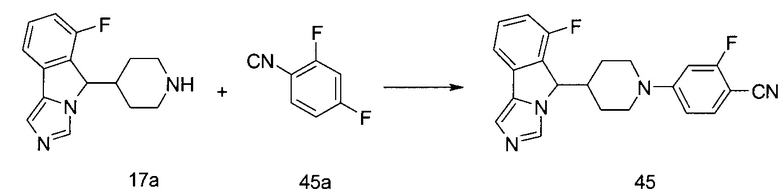
Соединение 17а (500 мг, 1,94 ммоль), 2,4-дифторбензонитрил 45а (270 мг, 1,94 ммоль) и триэтиламин (216 мг, 2,14 ммоль) растворяли в 5 мл диметилсульфоксида. Реакционную систему нагревали до 80°C и перемешивали в течение 12 часов. Реакционный раствор охлаждали до комнатной температуры и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 45 (190 мг, выход 26%) в виде светло-коричневого твердого вещества.
MC m/z (ESI): 377,1 [М+1]
1H ЯМР (400 МГц, DMCO-d6) δ 8,1 (s, 1Н), 7,74 (dd, 1H), 7,46-7,49 (m, 2H), 7,24 (s, 1H), 7,17-7,12 (m, 1Н), 6,96 (dd, 1Н), 6,88 (td, 1H), 5,72 (s, 1H), 3,49-3,59 (m, 2H), 2,88 (t, 1H), 2,73 (t, 1H), 2,37-3,43 (m, 1H), 1,76-1,84 (m, 1H), 1,61-1,71 (m, 1H), 1,20-1,29 (m, 1H), 0,91-1,01 (m, 1H).
Пример 46
5-(1-(3,4-Дифторфенил)пиперидин-4-ил)-6-фтор-5H-имидазо[5,1-а]изоиндол
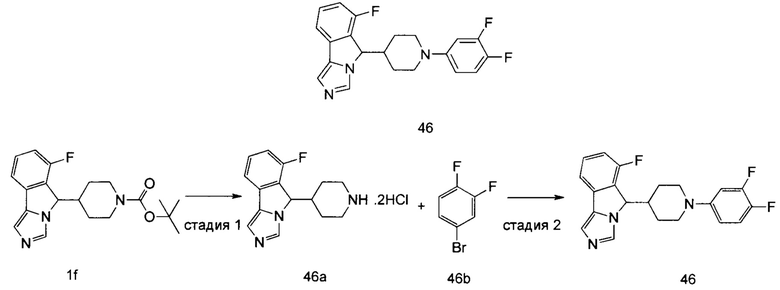
Стадия 1
6-Фтор-5-(пиперидин-4-ил)-5H-имидазо[5,1-а]изоиндола гидрохлорид 46а
Соединение 1f (17,7 г, 49,6 ммоль) растворяли в 180 мл смеси дихлорметана и 1,4-диоксана (V/V-5:1). После охлаждения смеси на ледяной бане добавляли по каплям 41,2 мл концентрированной соляной кислоты. Реакцию перемешивали в течение 2 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения 46а (16,37 мг) в виде белого твердого вещества, которое использовали непосредственно без дополнительной очистки на следующей стадии.
Стадия 2
5-(1-(3,4-Дифторфенил)пиперидин-4-ил)-6-фтор-5H-имидазо[5,1-а]изоиндол 46
Неочищенное соединение 46а (165 мг, 0,5 ммоль) и 4-бром-1,2-дифторбензол 46b (116 мг, 0,6 ммоль) растворяли в 6 мл смеси толуола и трет-бутанола (V/V=5:1), затем добавляли ацетат палладия (11,22 мг, 0,05 ммоль), 2-(дициклогексилфосфино)-2',4',6'-триизопропилбифенил (24 мг, 0,05 ммоль) и натрий трет-бутанол (200 мг, 2 ммоль). Реакцию перемешивали в течение 0,5 час в микроволновом реакторе при 160°C. Реакционный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 46 (10 мг, выход 5,4%) в виде белого твердого вещества.
MC m/z (ESI): 370,4 [М+1]
1H ЯМР (400 МГц, CDCl3) δ 7,72 (s, 1H), 7,34 (dd, 1H), 7,22-7,26 (m, 2H), 6,96 (s, 2H), 6,54-6,65 (m, 2H), 5,57 (dd, 1H), 3,49-3,59 (m, 2H), 2,61 (t, 1H), 2,58 (t, 1H), 2,54 (m, 1H), 1,76-1,84 (m, 1H), 1,61-1,71 (m, 1H), 1,20-1,29 (m, 1H), 0,91-1,01 (m, 1H).
Пример 47
5-(1-(5-Хлорпиридин-2-ил)пиперидин-4-ил)-6-фтор-5H-имидазо[5,1-а]изоиндол
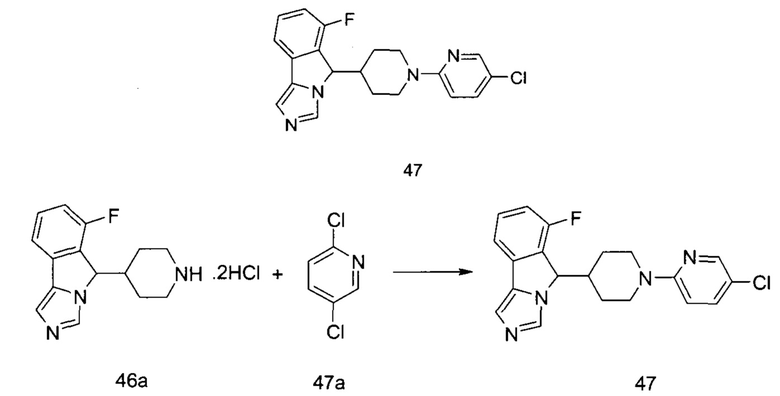
Неочищенное соединение 46а (500 мг, 1,52 ммоль) и 2,5-дихлорпиридин 47а (292 мг, 1,97 ммоль) растворяли в 10 мл диметилсульфоксида, затем добавляли N,N-диизопропилэтиламин (980 мг, 7,6 ммоль). Реакцию перемешивали в течение 3,5 часов в микроволновом реакторе при 140°C. Реакционный раствор охлаждали до комнатной температуры и полученный остаток очищали с помощью высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения 47 (105 мг, выход 18,7%) в виде оранжево-желтого твердого вещества.
MC m/z (ESI): 369,8 [M+1]
1H ЯМР (400 МГц, DMCO-d6): δ 8,05-8,04 (d, 1H), 7,97 (s, 1H), 7,54-7,51 (dd, 1H), 7,48-7,46 (m, 2H), 7,23 (s, 1H), 7,17-7,12 (m, 1H), 6,81-6,79 (d, 1H), 6,70-6,69 (d, 1H), 4,39-4,36 (d, 1H), 4,22-4,19 (d, 1H), 2,85-2,79 (m, 1H), 2,72-2,66 (m, 1H), 1,54-1,45 (m, 1H), 1,30-1,24 (m,2H), 1,97-1,14 (m, 2H).
Биологические испытания
Настоящее изобретение будет дополнительно описано со ссылкой на последующие тестовые примеры, но эти примеры не следует рассматривать как ограничивающие объем изобретения.
Тестовый Пример 1. Анализ для определения ингибирующей активности соединений согласно изобретению в отношении человеческой ИДО1.
Активность человеческой ИДО1 тестировали in vitro следующим способом.
Этот способ используется для определения ингибирующего действия соединений согласно настоящему изобретению на активность человеческой ИДО1.
1. Экспериментальные материалы и оборудование
(1) Устройство считывания микропланшетов Synergy HT (BIOTEK)
(2) Триптофан (T0254-5G, Sigma-Aldrich)
(3) Каталаза из печени коровы (С1345-1G, Sigma-Aldrich)
(4) Метиленовый синий (M9140-25G, Sigma-Aldrich)
(5) L-аскорбат натрия (A7631-25G, Sigma-Aldrich)
(6) 4-(Диметиламино)бензальдегид (D2004-25G, Sigma-Aldrich)
(7) Трихлоруксусная кислота (T9159-100G, Sigma-Aldrich)
(8) Ген человеческой ИДО1 (SC126221, Origene)
2. Процедура эксперимента
Получение ИДО1
Ген человеческой ИДО1 переносили на плазмиды Pet30a путем клонирования генов, а затем переносили в компетентную Escherichia coli Rosseta; этот ген ИДО1 культивировали в жидкой среде LB (Luria-Bertani) [которая была приготовлена на литр в соответствии с «Лабораторным руководством по молекулярному клонированию» ("Molecular Cloning A Laboratory Manual" J. Sambrook, D.W. Russell)]), бактерии собирали и разбивали ультразвуковой волной. Очищенную ИДО1 получали путем элюирования через колонку.
Тестирование соединения:
24 мкл фермента (ИДО1) разводили в 100 раз с использованием 50 мМ KPB до 2400 мкл. Концентрация раствора фермента составляла 2,6 нг/мкл. В 96-луночную реакционную планшету (AXYGEN, PCR-96-FLT-C) (далее называемую реакционной планшетой) добавляли раствор фермента в количестве 24 мкл/лунку. В пустую лунку добавляли 24 мкл KPB [Получение буфера KPB (50 мМ): 6,805 г KH2PO4 взвешивали на аналитических весах и помещали в стакан на 1000 мл, добавляли деионизированную воду с помощью мерного цилиндра до 900 мл, pH доводили до 6,5 с помощью 1 М КОН, затем смесь вводили в мерный цилиндр на 1 л и добавляли воду до 1 л. Хранили при температуре 4°C]. В соответствующие лунки в реакционной планшете добавляли 1 мкл соединения или ДМСО. Приготовление раствора А: в 200 мкл 500 мМ аскорбата натрия добавляли 1050 мкл KPB, затем смесь перемешивали равномерно в течение 3 секунд с максимальной скоростью в турбинном смесителе. Раствор В: в 100 мкл 10 мМ триптофана добавляли 100 мкл каталазы 100000 единиц/мл, 5 мкл 10 мМ метиленового синего и 1050 мкл KPB, затем смесь перемешивали равномерно в течение 3 секунд с максимальной скоростью в турбинном смесителе. 1200 мкл раствора А и 1200 мкл раствора В брали и равномерно перемешивали в течение 3 секунд с максимальной скоростью в турбинном смесителе. Смесь добавляли к реакционную планшету в количестве 24 мкл/лунку. Реакционную планшету помещали в центрифугу для планшет и центрифугировали в течение 15 секунд с максимальной скоростью, так что реакционные жидкости собирались на дне. Реакционную смесь перемешивали равномерно в течение 30 секунд на шейкере и инкубировали в течение 1 часа при 37°C в инкубаторе с постоянной температурой. В реакционную планшету добавляли 30% (мас./об.) трихлоруксусную кислоту в количестве 10 мкл/лунку, затем смесь инкубировали в течение 15 минут при 65°C в инкубаторе. Реакционную планшету центрифугировали в центрифуге в течение 5 минут при 4700 об/мин при комнатной температуре. 40 мкл надосадочной жидкости переносили из реакционной планшеты в соответствующую 96-луночную планшету (Corning, №3599) с помощью многоканальной пипетки. 2% (мас./об.) раствор 4-(диметиламино)бензальдегида и ледяной уксусной кислоты добавляли в количестве 40 мкл/лунку, затем смесь перемешивали равномерно в течение 1 минуты на шейкере с максимальной скоростью. После инкубации в течение 2 минут при комнатной температуре считывали поглощение при 480 нм на Synergy HT (BIOTEK).
Ингибирующую активность соединений согласно настоящему изобретению в отношении человеческой ИДО1 тестировали с помощью описанного выше анализа. Значения IC50 показаны в таблице 1 ниже.
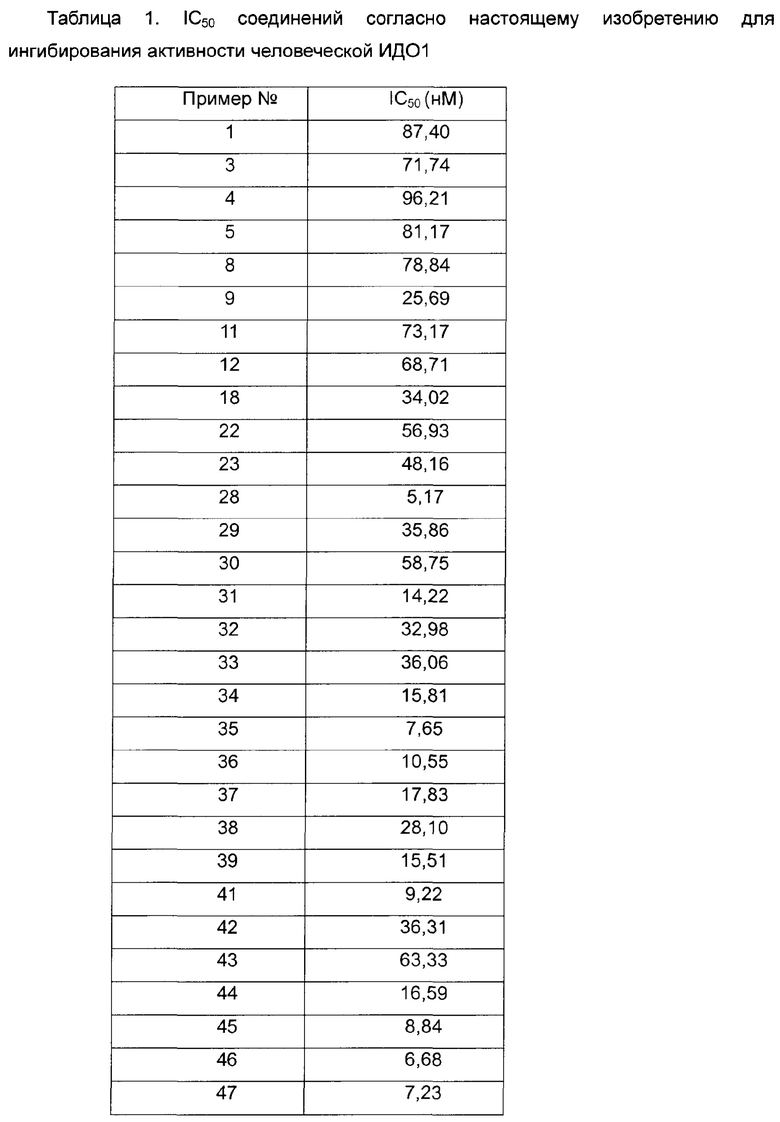
Вывод: Соединения согласно настоящему изобретению оказывают значительное ингибирующее действие на активность человеческой ИДО1.
Тестовый Пример 2. Анализ для определения ингибирующей активности соединений согласно настоящему изобретению в отношении человеческой ТДО (триптофан-2,3-диоксигеназы).
Активность человеческой ТДО тестировали in vitro следующим способом. Этот способ используется для определения ингибирующего действия соединений согласно настоящему изобретению на активность человеческой ТДО.
1. Экспериментальные материалы и оборудование
(1) Устройство считывания микропланшетов Synergy HT (BIOTEK)
(2) Триптофан (T0254-5G, Sigma-Aldrich)
(3) Каталаза из печени коровы (С1345-1G, Sigma-Aldrich)
(4) Метиленовый синий (M9140-25G, Sigma-Aldrich)
(5) L-аскорбат натрия (A7631-25G, Sigma-Aldrich)
(6) 4-(Диметиламино)бензальдегид (D2004-25G, Sigma-Aldrich)
(7) Трихлоруксусная кислота (T9159-100G, Sigma-Aldrich)
(8) Человеческая ТДО (U32989.1, Suzhou Genewiz Biological Technology Co., Ltd.)
(9) Rosseta (CW0811A, Beijing Kangwei Century Biotechnology Co., Ltd.)
(10) Турбомиксер (6776, Corning)
(11) Центрифуга для минипланшет (Mini-P25, оборудование для биотехнологии ABSON)
2. Процедура эксперимента
Получение ТДО
Плазмиды, сконструированные с геном человеческой ТДО, переносили в компетентную Escherichia coli Rosseta; этот ген ТДО культивировали в жидкой среде LB (Luria-Bertani) [которая была приготовлена на литр в соответствии с «Лабораторным руководством по молекулярному клонированию» ("Molecular Cloning A Laboratory Manual" J. Sambrook, D.W. Russell)]), бактерии собирали и разбивали ультразвуковой волной. Очищенную ТДО получали путем элюирования через колонку.
Тестирование соединения:
24 мкл фермента (ТДО) разводили в 100 раз с использованием 50 мМ KPB до 2400 мкл. Концентрация раствора фермента составляла 2,6 нг/мкл. В 96-луночную реакционную планшету (AXYGEN, PCR-96-FLT-C) (далее называемую реакционной планшетой) добавляли раствор фермента в количестве 24 мкл/лунку. В пустую лунку добавляли 24 мкл KPB [Получение буфера KPB (50 мМ): 6,805 г KH2PO4 взвешивали на аналитических весах и помещали в стакан на 1000 мл, добавляли деионизированную воду с помощью мерного цилиндра до 900 мл, pH доводили до 6,5 с помощью 1 М КОН, затем смесь вводили в мерный цилиндр на 1 л и добавляли воду до 1 л. Хранили при температуре 4°C]. В соответствующие лунки в реакционной планшете добавляли 1 мкл соединения или ДМСО. Приготовление раствора А: в 200 мкл 500 мМ аскорбата натрия добавляли 1050 мкл KPB, затем смесь перемешивали равномерно в течение 3 секунд с максимальной скоростью в турбинном смесителе. Раствор В: в 100 мкл 10 мМ триптофана добавляли 100 мкл каталазы 100000 единиц/мл, 5 мкл 10 мМ метиленового синего и 1050 мкл KPB, затем смесь перемешивали равномерно в течение 3 секунд с максимальной скоростью в турбинном смесителе. 1200 мкл раствора А и 1200 мкл раствора В брали и равномерно перемешивали в течение 3 секунд с максимальной скоростью в турбинном смесителе. Смесь добавляли в реакционную планшету в количестве 24 мкл/лунку Реакционную планшету помещали в центрифугу для планшет и центрифугировали в течение 15 секунд с максимальной скоростью, так что реакционные жидкости собирались на дне. Реакционную смесь перемешивали равномерно в течение 30 секунд на шейкере и инкубировали в течение 1 часа при 37°C в инкубаторе с постоянной температурой. В реакционную планшету добавляли 30% (мас./об.) трихлоруксусную кислоту в количестве 10 мкл/лунку, затем смесь инкубировали в течение 15 минут при 65°C в инкубаторе. Реакционную планшету центрифугировали в центрифуге в течение 5 минут при 4700 об/мин при комнатной температуре. 40 мкл надосадочной жидкости переносили из реакционной планшеты в соответствующую 96-луночную планшету (Corning, №3599) с помощью многоканальной пипетки. 2% (мас./об.) раствор 4-(диметиламино)бензальдегида и ледяной уксусной кислоты добавляли в количестве 40 мкл/лунку, затем смесь перемешивали равномерно в течение 1 минуты на шейкере с максимальной скоростью. После инкубации в течение 2 минут при комнатной температуре считывали поглощение при 480 нм на Synergy HT (BIOTEK).
Ингибирующую активность соединений согласно настоящему изобретению в отношении человеческой ТДО тестировали с помощью описанного выше анализа. Значения IC50 показаны в таблице 2 ниже.
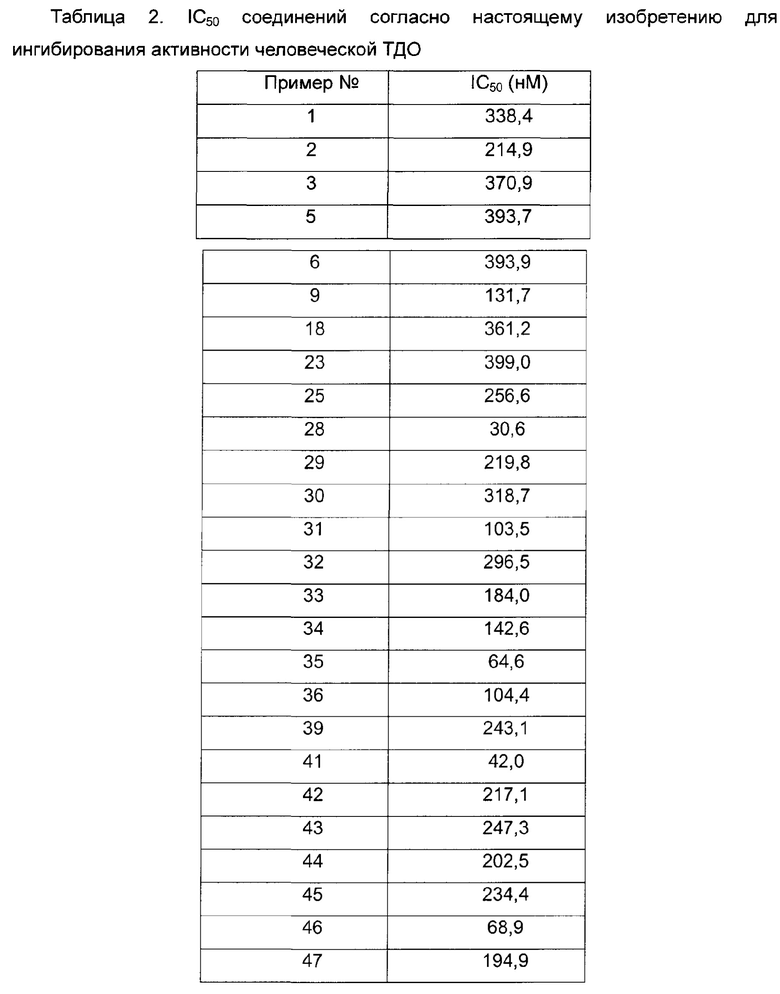
Вывод: Соединения согласно настоящему изобретению оказывают значительное ингибирующее действие на активность человеческой ТДО.
Тестовый Пример 3. Анализ для определения ингибирующей активности соединений согласно изобретению в отношении ИДО в клетках HeLa.
Активность ИДО в клетках HeLa тестировали in vitro следующим способом.
Этот способ используется для определения ингибирующего действия соединений согласно настоящему изобретению на активность ИДО в клетках HeLa. (Примечание: индоламин-2,3-диоксигеназа (ИДО) экспрессируется в линии клеток HeLa и индуцируется гамма-интерфероном (INF-γ)).
1. Экспериментальные материалы и оборудование
(1) Устройство считывания микропланшетов Synergy HT (BIOTEK)
(2) Триптофан (T0254-5G, Sigma-Aldrich)
(3) 4-(Диметиламино)бензальдегид (D2004-25G, Sigma-Aldrich)
(4) Трихлоруксусная кислота (T9159-100G, Sigma-Aldrich)
(5) Линия клеток Hela (CCL-2, АТСС)
2. Процедура эксперимента
Суспензию клеток HeLa готовили со свежей клеточной средой и добавляли в 96-луночную планшету с 100 мкл культуральной системы в количестве 10000 клеток/лунку, затем инкубировали в течение 24 часов в 5% углекислого газа при 37°C. Супернатант удаляли, добавляли бессывороточную среду с высоким содержанием глюкозы DMEM в количестве 90 мкл/лунку, затем добавляли соединения, содержащиеся в культуральной среде с INF-γ и триптофаном, в количестве 10 мкл/лунку (конечная концентрация: 10000, 1000, 100, 10, 1, 0,1 нМ), смесь инкубировали в течение 48 часов в 5% углекислого газа при 37°C. 80 мкл супернатата переносили из 96-луночной планшеты для культивирования клеток на 96-луночную круглодонную планшету, затем добавляли 30% (масса/объем) трихлоруксусную кислоту в количестве 16 мкл/лунку, затем смесь инкубировали в течение 25 мин при 65°C в инкубаторе. Реакционную планшету центрифугировали в центрифуге в течение 5 минут при 4700 об/мин. 50 мкл надосадочной жидкости переносили из реакционной планшеты в 96-луночную плоскодонную прозрачную планшету с помощью многоканальной пипетки. 2% (мас./об.) раствора 4-(диметиламино)бензальдегида и ледяной уксусной кислоты добавляли в количестве 50 мкл/лунку, затем смесь перемешивали равномерно в течение 1 минуты на шейкере. После инкубации в течение 2 минут при комнатной температуре считывали поглощение при 480 нм на устройстве считывания Synergy НТ.
Ингибирующую активность соединений согласно настоящему изобретению в отношении ИДО в клетках HeLa тестировали с помощью описанного выше анализа. Значения IC50 показаны в таблице 3 ниже.
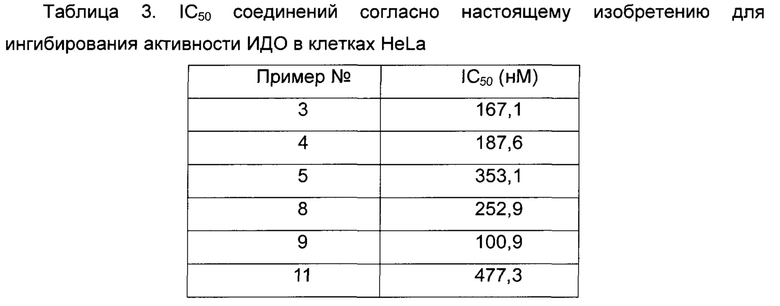
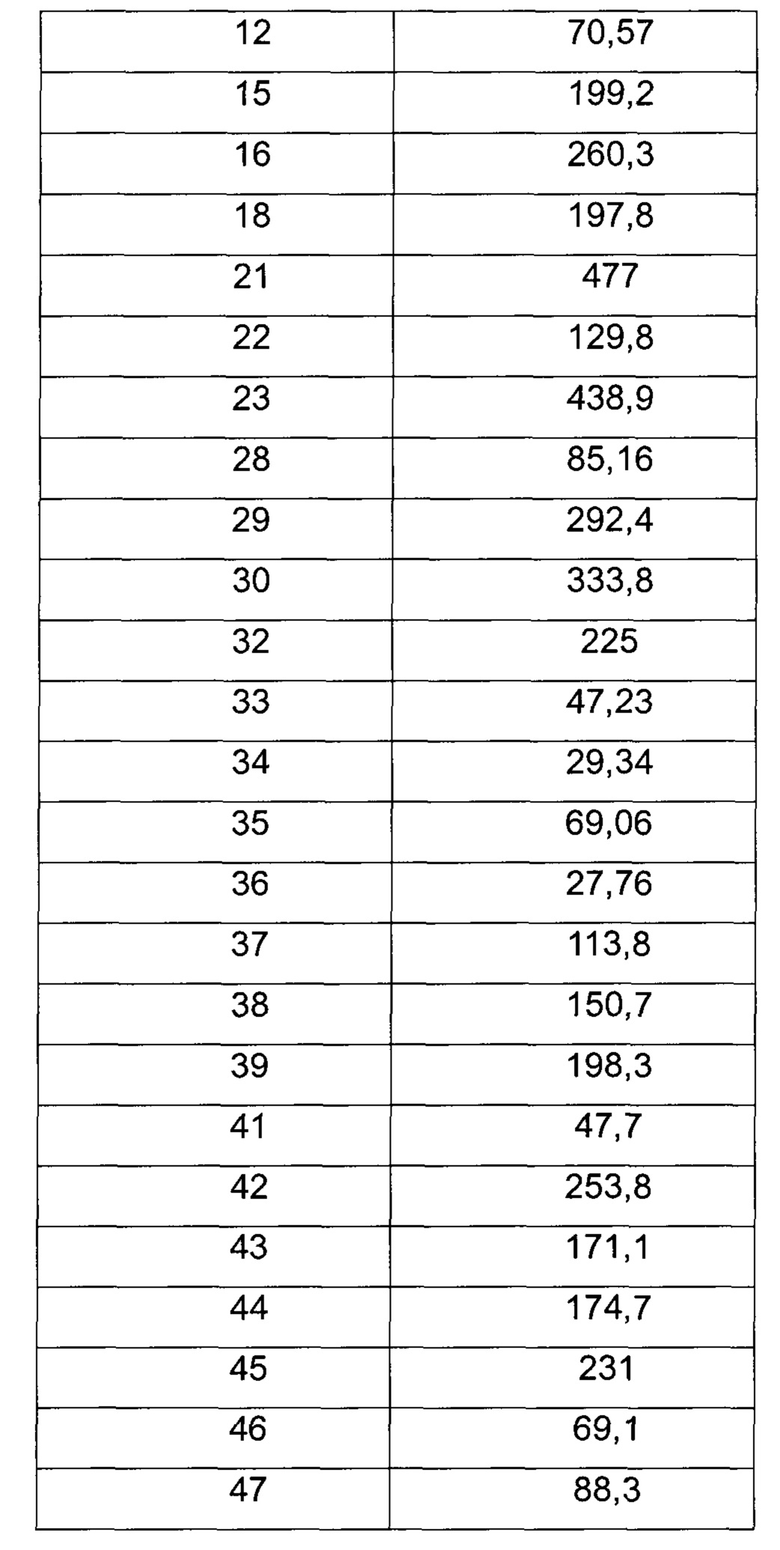
Вывод: Соединения согласно настоящему изобретению оказывают значительное ингибирующее действие на активность человеческой ИДО в клетках HeLa.
Фармакокинетический анализ
Тестовый Пример 4. Фармакокинетический анализ соединений Примера 3 и Примера 9 согласно настоящему изобретению
1. Краткое описание
Крыс Sprague-Dawley (SD) использовали в качестве животных для испытаний. Концентрацию лекарства в плазме в разные моменты времени определяли с помощью ЖХ/МС/МС после внутрижелудочного введения крысам соединений Примера 3 и Примера 9. Фармакокинетическое поведение соединений согласно настоящему изобретению изучали и оценивали на крысах.
2. Протокол
2.1 Образцы
Соединения Примера 3 и Примера 9
2.2 Животные для испытаний
8 здоровых взрослых крыс SD, самцы и самки пополам, которые были приобретены у SINO-BRITSH SIPPR/BK LAB. ANIMAL LTD., CO, с сертификатом №: SCXK (Шанхай) 2008-0016.
2.3 Приготовление тестируемых соединений
Соответствующее количество тестируемых соединений взвешивали и добавляли 0,5% CMC-Na для получения суспензии 0,5 мг/мл ультразвуковым способом.
2.4 Введение
После голодания в течение ночи 8 крыс SD разделяли поровну на 2 группы: по половине самцов и половине самок, и вводили тестируемые соединения внутрижелудочно при объеме введения 10 мл/кг.
3. Способ
Отбирали 0,2 мл крови из орбитального синуса перед введением и через 0,5 ч, 1,0 ч, 2,0 ч, 4,0 ч, 6,0 ч, 8,0 ч, 11,0 ч и 24,0 ч после введения. Образцы хранили в гепаринизированных пробирках и центрифугировали в течение 10 мин при 3500 об/мин для отделения плазмы крови. Образцы плазмы хранили при -20°C. Крыс кормили через 2 часа после введения.
Концентрацию тестируемых соединений в плазме крыс после внутрижелудочного введения определяли с помощью ЖХ/МС/МС.
4. Результаты фармакокинетических параметров
Фармакокинетические параметры соединений Примера 3 и Примера 9 показаны ниже.
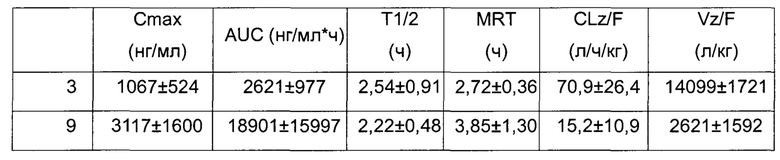
Вывод: Соединения согласно настоящему изобретению хорошо абсорбируются и обладают замечательным фармакологическим эффектом поглощения.
Тестовый Пример 5. Фармакокинетический анализ соединений Примера 28 и Примера 41 согласно настоящему изобретению
1. Краткое описание
Мышей c57bl/6 использовали в качестве животных для испытаний. Концентрацию лекарства в плазме в разные моменты времени определяли с помощью ЖХ/МС/МС после внутрижелудочного введения мышам c57bl/6 соединений Примера 28 и Примера 41. Фармакокинетическое поведение соединений согласно настоящему изобретению изучали и оценивали на мышах c57bl/6.
2. Протокол
2.1 Образцы
Соединения Примера 28 и Примера 41
2.2 Животные для испытаний
18 самок мышей c57bl/6, которые были приобретены у SINO-BRITSH SIPPR/BK LAB. ANIMAL LTD., CO.
2.3 Приготовление тестируемых соединений
Соответствующее количество тестируемых соединений взвешивали и добавляли 0,5% CMC-Na для получения суспензии 1 мг/мл ультразвуковым способом.
2.4 Введение
После голодания в течение ночи 18 мышей c57bl/6 разделяли поровну на 2 группы: по 9 в группе, и вводили тестируемые соединения внутрижелудочно при объеме введения 0,2 мл/кг.
3. Способ
Отбирали 0,2 мл крови из орбитального синуса перед введением и через 0,5 ч, 1,0 ч, 2,0 ч, 4,0 ч, 6,0 ч, 8,0 ч, 11,0 ч и 24,0 ч после введения. Образцы хранили в гепаринизированных пробирках и центрифугировали в течение 10 мин при 3500 об/мин для отделения плазмы крови. Образцы плазмы хранили при -20°C.
Концентрацию тестируемых соединений в плазме после внутрижелудочного введения определяли с помощью ЖХ/МС/МС.
4. Результаты фармакокинетических параметров
Фармакокинетические параметры соединений Примера 28 и Примера 41 показаны ниже.
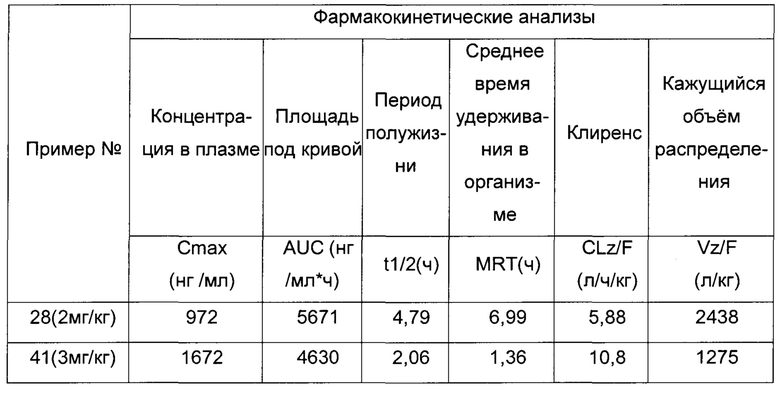
Вывод: Соединения согласно настоящему изобретению хорошо абсорбируются и обладают замечательным фармакологическим эффектом поглощения.
Изобретение относится к производному имидазоизоиндола формулы (I), обладающему свойствами ингибитора индоламинпиррол-2,3-диоксигеназы (ИДО), к способу его получения и его фармацевтической композиции на его основе и его применению для получения лекарственного средства для лечения рака с патологическим признаком пути метаболизма триптофана, опосредованного ИДО. В формуле (I) M представляет собой трифторуксусную кислоту; А выбран из группы, состоящей из 6-членного циклоалкила или 5-6-членного гетероциклила с 1 атомом азота; R1 выбран из группы, состоящей из C1-6алкила, фенила, 5-9-членного гетероарила с 1-3 гетероатомами, выбранными из азота и серы, -C(O)R4 и -C(O)NR5R6; R2 выбран из группы, состоящей из водорода и галогена; R3 являются одинаковыми или различными, и каждый независимо выбран из группы, состоящей из водорода, C1-6алкила, алкокси, галогена, амино, циано, 6-членного гетероциклила с 2 гетероатомами, выбранными из азота и кислорода, фенила, 5-6-членного гетероарила с 1-2 атомами азота, -OR4, -S(O)mR4, -C(O)NR5R6 и -NR5C(O)R6, где каждый алкил и гетероарил возможно замещен одной или более группами, выбранными из группы, состоящей из C1-6алкила, амино, гидрокси-C1-6алкила, 5-6-членного гетероциклила с 1-2 гетероатомами, выбранными из азота и кислорода, -Ra, -C(O)NR7R8; Ra выбран из группы, состоящей из C1-6алкила, 6-членного гетероциклила с 1 атомом азота, где каждый алкил и гетероциклил возможно замещен одной или двумя группами, выбранными из группы, состоящей из гидрокси, алкокси, -S(O)mR4 и -NR5C(O)R6; R4 выбран из группы, состоящей из C1-6алкила, 5-6-членного гетероциклила с 1 гетероатомом, выбранным из азота и кислорода, где каждый гетероциклил возможно замещен одной группой -S(O)mR7; R5 и R6 являются одинаковыми или различными, и каждый независимо выбран из группы, состоящей водорода, C1-6алкила, 6-членного циклоалкила, 6-членного гетероциклила с 1 атомом кислорода и фенила, где каждый циклоалкил и фенил возможно замещен одной группой, выбранной из группы, состоящей из циано и алкокси; R7 и R8 являются одинаковыми или различными, и каждый независимо выбран из группы, состоящей водорода и C1-6алкила; р является целым числом 1; y является целым числом 0 или 1; m является целым числом 2; и n является целым числом 0, 1 или 2. 7 н. и 8 з.п. ф-лы, 5 табл., 52 пр.
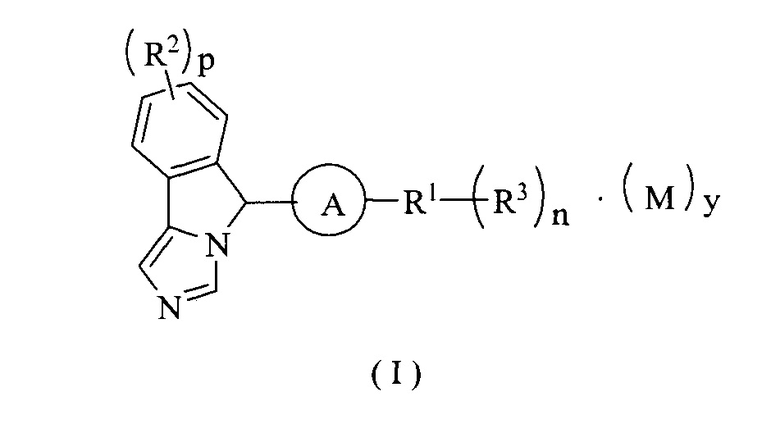
1. Соединение формулы (I):
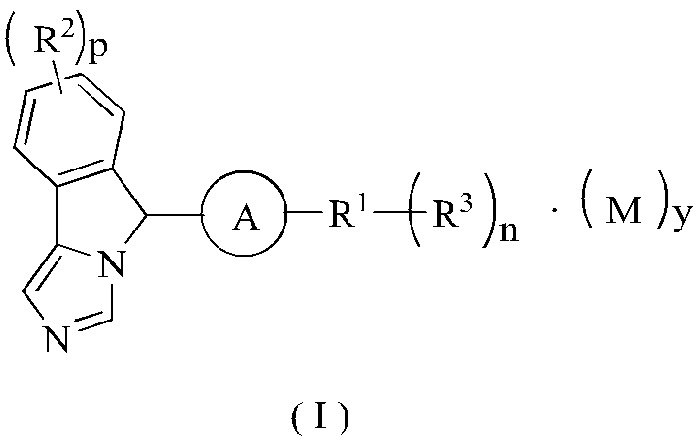
где:
M представляет собой трифторуксусную кислоту;
А выбран из группы, состоящей из 6-членного циклоалкила или 5-6-членного гетероциклила с 1 атомом азота;
R1 выбран из группы, состоящей из C1-6алкила, фенила, 5-9-членного гетероарила с 1-3 гетероатомами, выбранными из азота и серы, -C(O)R4 и -C(O)NR5R6;
R2 выбран из группы, состоящей из водорода и галогена;
R3 являются одинаковыми или различными, и каждый независимо выбран из группы, состоящей из водорода, C1-6алкила, алкокси, галогена, амино, циано, 6-членного гетероциклила с 2 гетероатомами, выбранными из азота и кислорода, фенила, 5-6-членного гетероарила с 1-2 атомами азота, -OR4, -S(O)mR4, -C(O)NR5R6 и -NR5C(O)R6, где каждый алкил и гетероарил возможно замещен одной или более группами, выбранными из группы, состоящей из C1-6алкила, амино, гидрокси-C1-6алкила, 5-6-членного гетероциклила с 1-2 гетероатомами, выбранными из азота и кислорода, -Ra, -C(O)NR7R8;
Ra выбран из группы, состоящей из C1-6алкила, 6-членного гетероциклила с 1 атомом азота, где каждый алкил и гетероциклил возможно замещен одной или двумя группами, выбранными из группы, состоящей из гидрокси, алкокси, -S(O)mR4 и -NR5C(O)R6;
R4 выбран из группы, состоящей из C1-6алкила, 5-6-членного гетероциклила с 1 гетероатомом, выбранным из азота и кислорода, где каждый гетероциклил возможно замещен одной группой -S(O)mR7;
R5 и R6 являются одинаковыми или различными, и каждый независимо выбран из группы, состоящей из водорода, C1-6алкила, 6-членного циклоалкила, 6-членного гетероциклила с 1 атомом кислорода и фенила, где каждый циклоалкил и фенил возможно замещен одной группой, выбранной из группы, состоящей из циано и алкокси;
R7 и R8 являются одинаковыми или различными, и каждый независимо выбран из группы, состоящей из водорода и C1-6алкила;
р является целым числом 1;
y является целым числом 0 или 1;
m является целым числом 2; и
n является целым числом 0, 1 или 2.
2. Соединение формулы (I) по п. 1, где y представляет собой 0.
3. Соединение формулы (I) по п. 1, которое представляет собой соединение формулы (II):
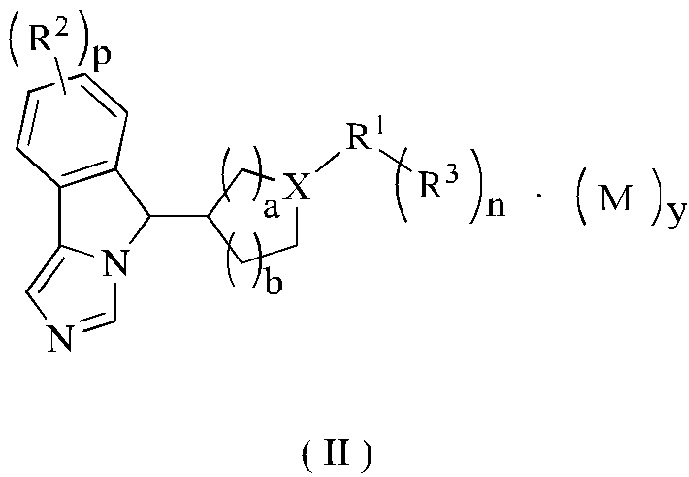
где:
X представляет собой СН или N;
R1 - R3, М, р, n и y являются такими, как определено в п. 1;
а является целым числом 1 или 2; и
b является целым числом 1 или 2.
4. Соединение формулы (I) по любому из пп. 1-3, которое представляет собой соединение формулы (III):
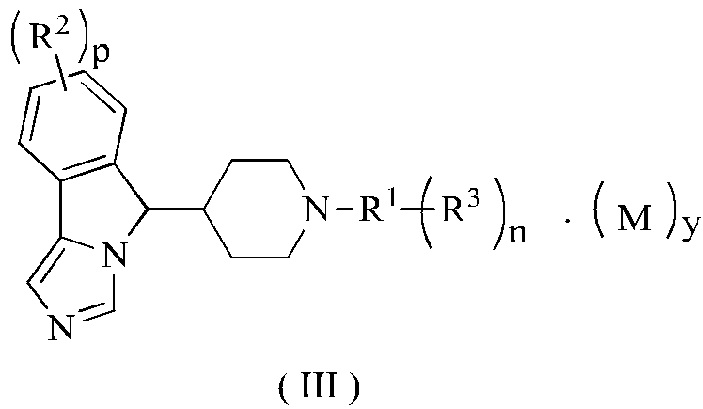
где R1 - R3, М, р, n и y являются такими, как определено в п. 1.
5. Соединение формулы (I) по любому из пп. 1, 3 и 4, которое представляет собой соединение формулы (IV):
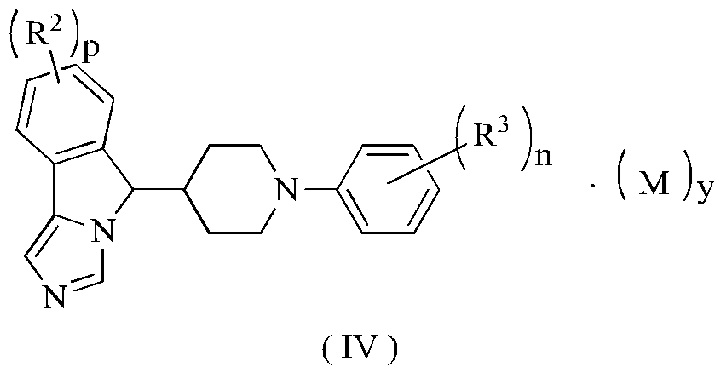
где R2, R3, M, p, n и y являются такими, как определено в п. 1.
6. Соединение формулы (I) по любому из пп. 1, 3, 4 и 5, которое представляет собой соединение формулы (IV-1):
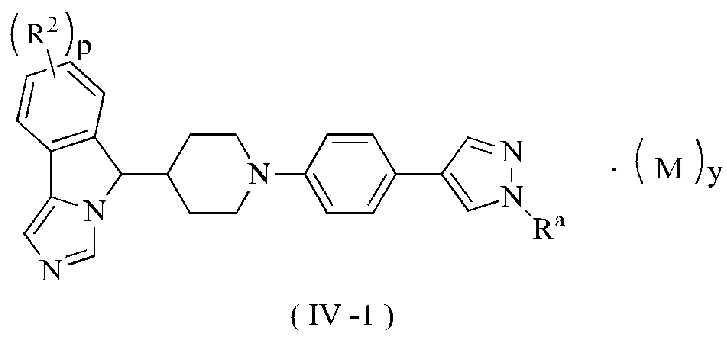
где R2, Ra, М, р и y являются такими, как определено в п. 1.
7. Соединение формулы (I) по любому из пп. 1, 3, 4 и 5, которое представляет собой соединение формулы (IV-2):
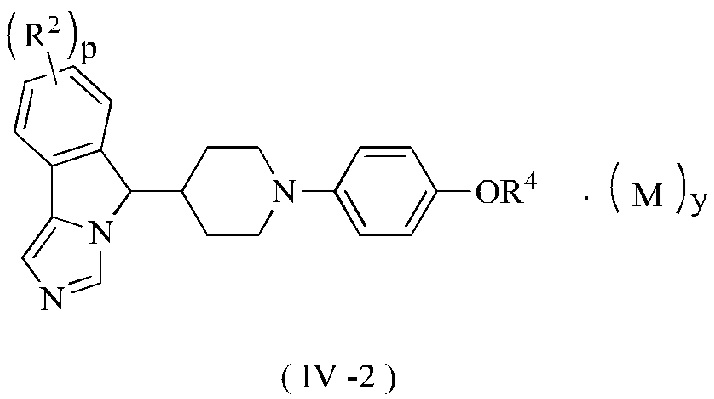
где R2, R4, М, р и y являются такими, как определено в п. 1.
8. Соединение формулы (I) по любому из пп. 1, 3, 4 и 5, которое представляет собой соединение формулы (IV-A) или формулы (IV-B):
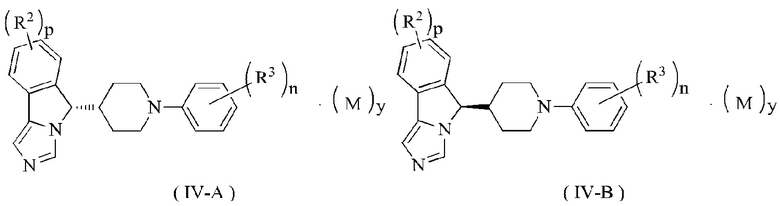
где R2, R3, М, р, n и y являются такими, как определено в п. 1.
9. Соединение, выбранное из группы, состоящей из:
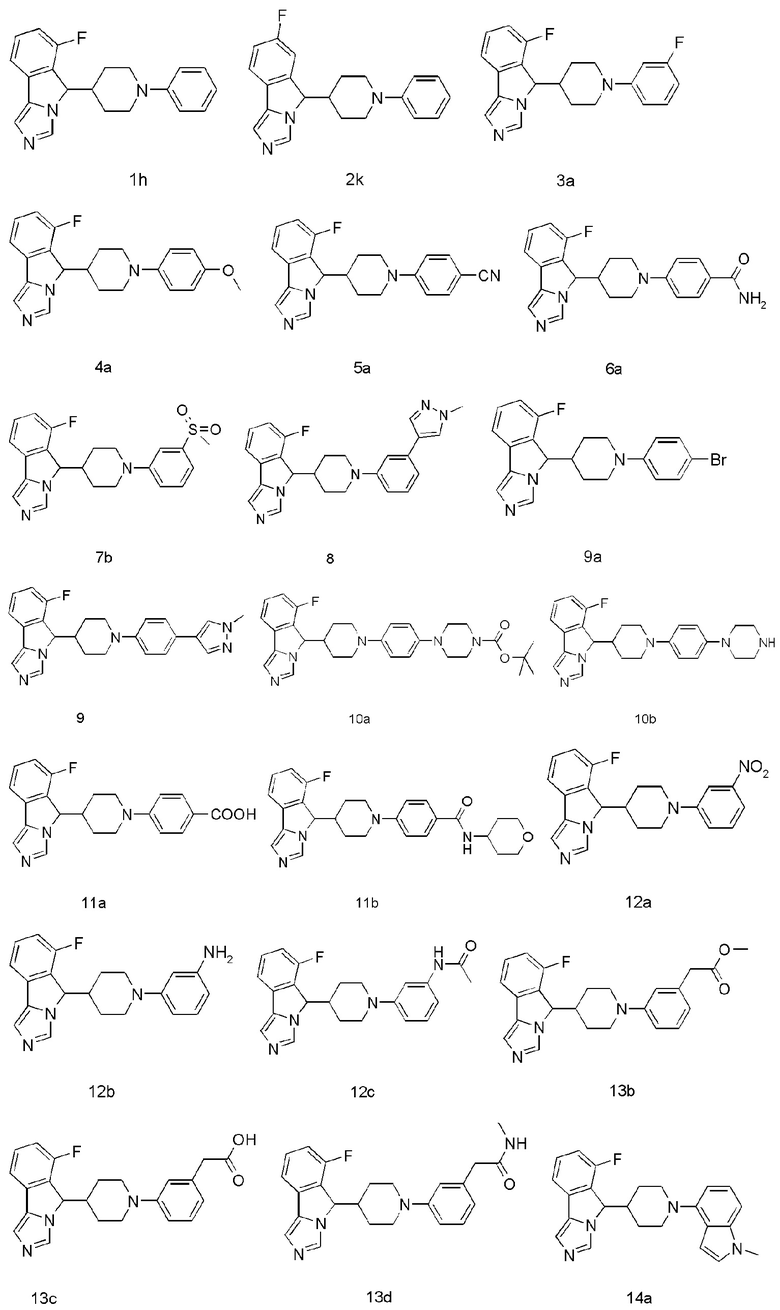
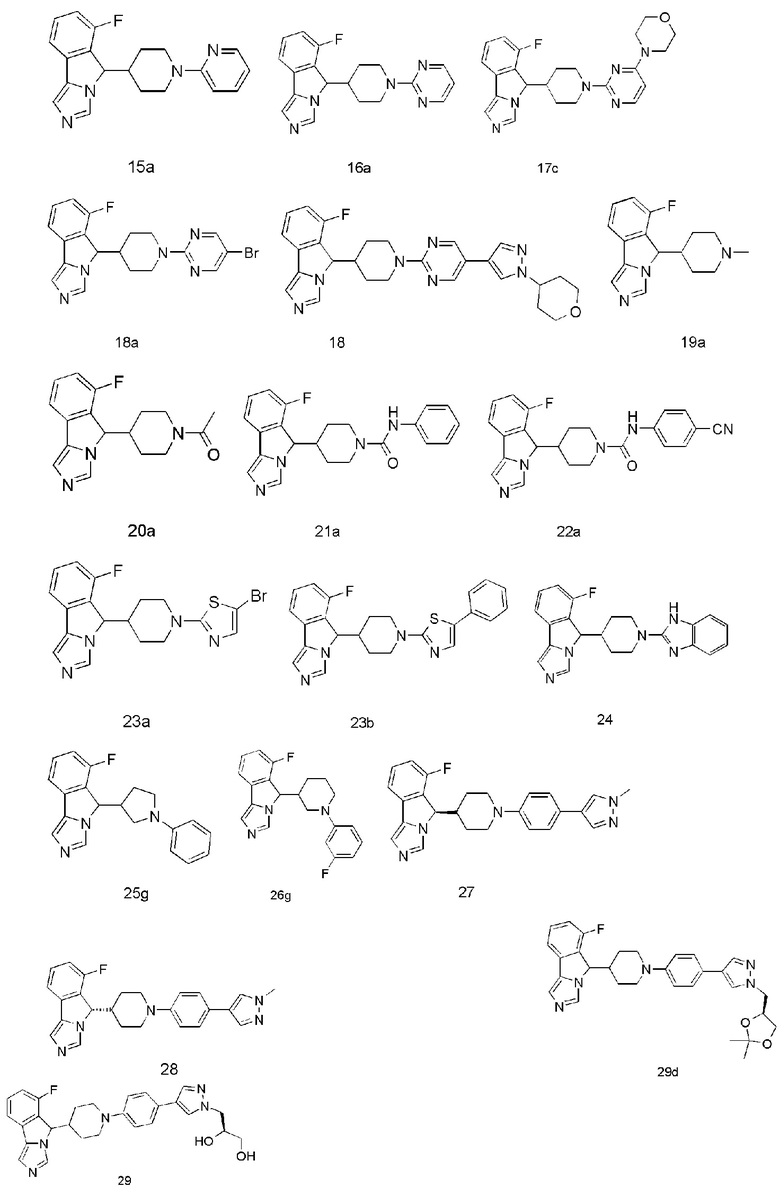
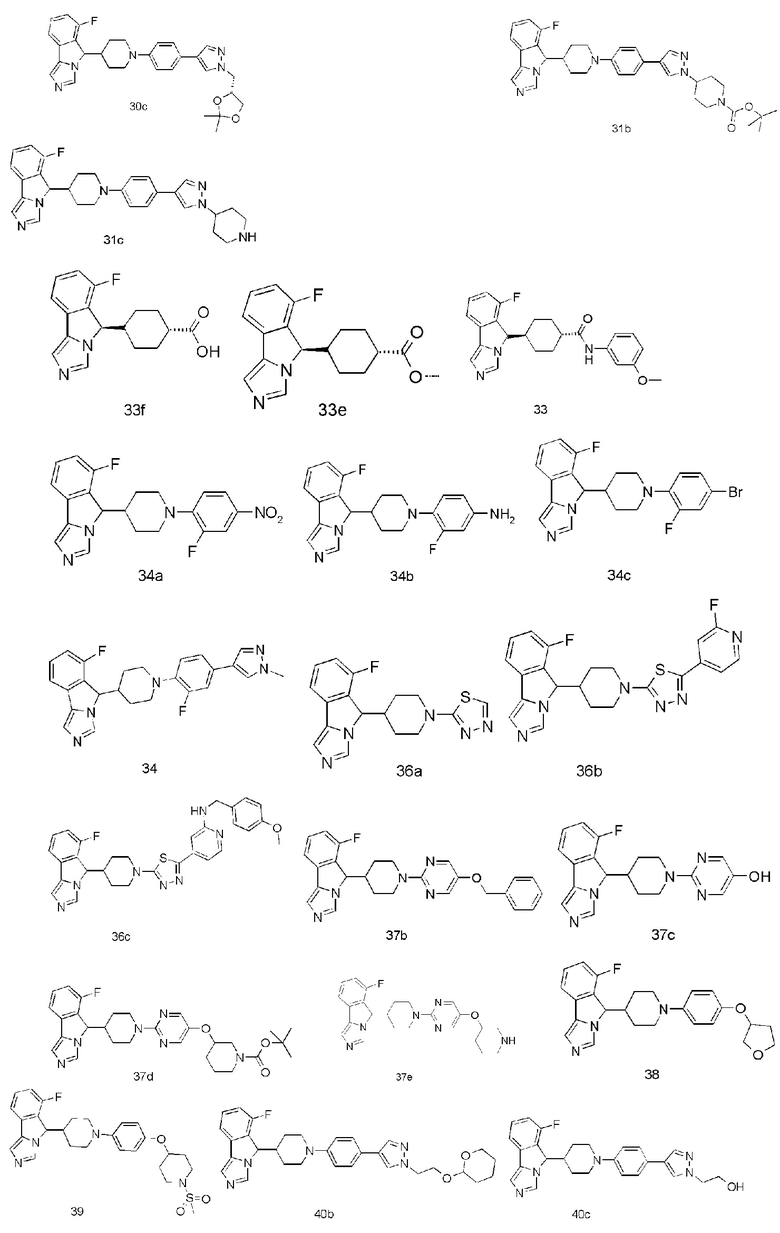
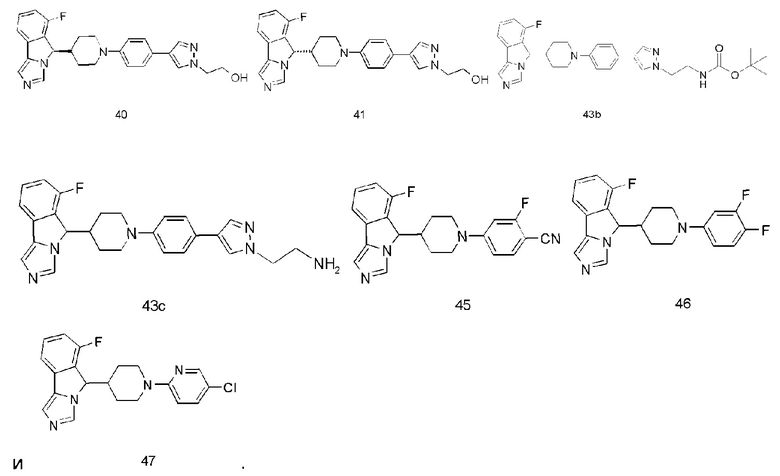
10. Соединение формулы (I) по любому из пп. 1-8, выбранное из группы, состоящей из:
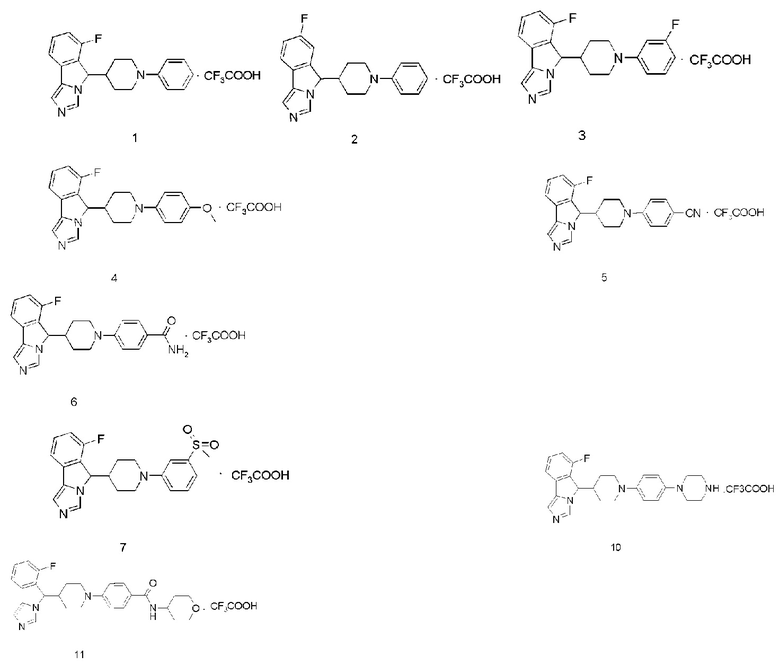
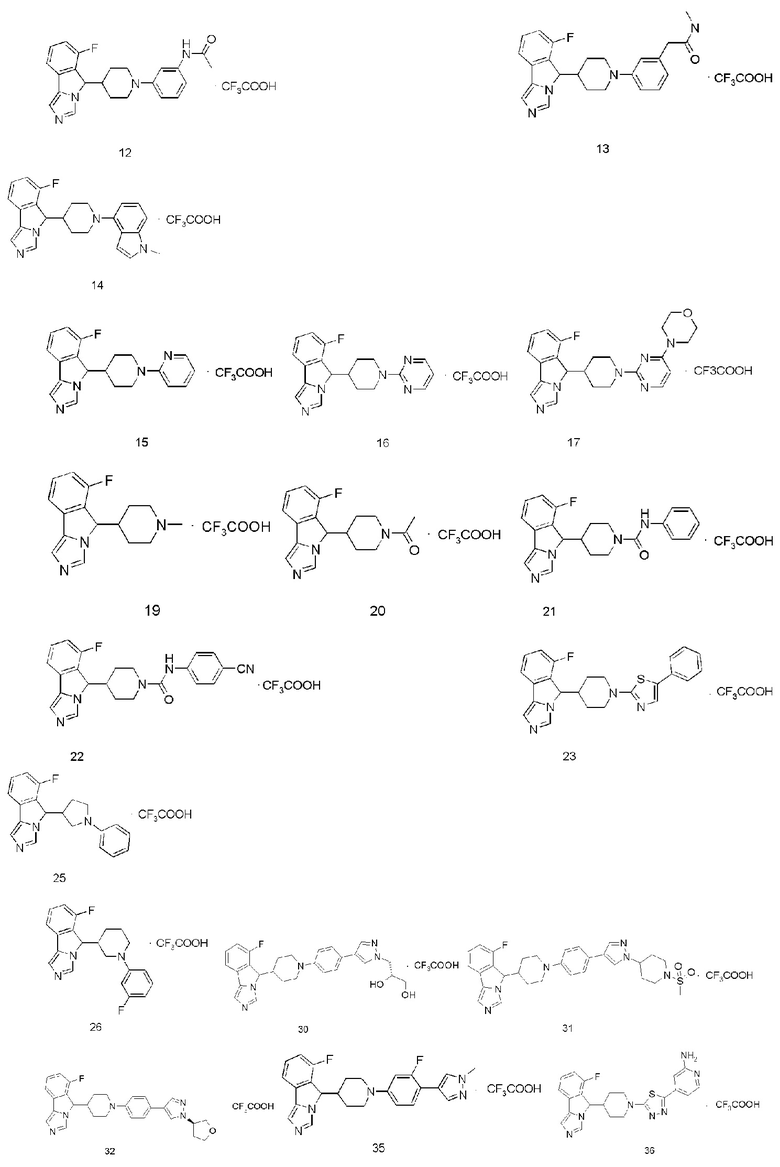
11. Соединение формулы (V):
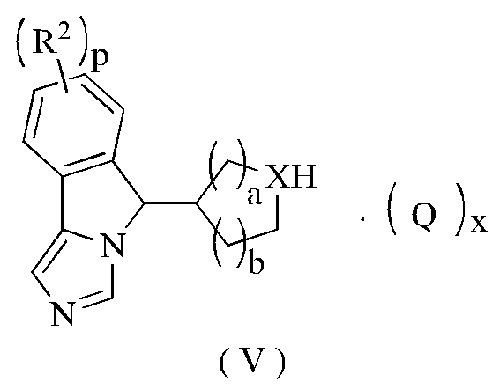
где
Q представляет собой трифторуксусную кислоту;
X представляет собой N;
R2 и р являются такими, как определено в п. 1;
а является целым числом 1 или 2;
b является целым числом 1 или 2; и
х является целым числом 0, 1 или 2.
12. Способ получения соединения формулы (II-1), включающий стадию:
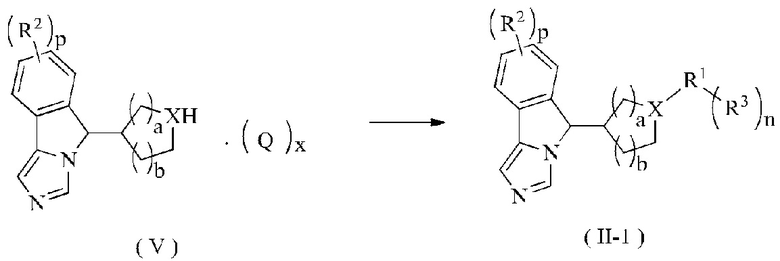
связывания соединения формулы (V) с галидом R1 в щелочных условиях в присутствии катализатора с получением соединения формулы (II-1);
где:
X представляет собой N;
R1 - R3, р, n, а и b являются такими, как определено в п. 3; и
Q и х являются такими, как определено в п. 11.
13. Способ получения соединения формулы (II) по п. 3, включающий стадию:
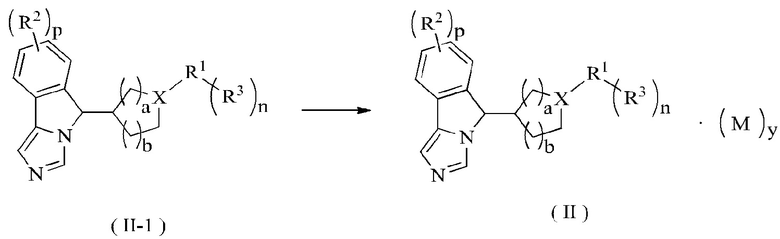
образования соли соединения формулы (II-1) в кислых условиях с получением соединения формулы (II);
где:
X представляет собой N;
R1 - R3, М, р, y, n, а и b являются такими, как определено в п. 3.
14. Фармацевтическая композиция, обладающая свойством ингибитора индоламинпиррол-2,3-диоксигеназы (ИДО), содержащая терапевтически эффективное количество соединения формулы (I) по любому из пп. 1-10 и фармацевтически приемлемый носитель, разбавитель или эксципиент.
15. Применение соединения формулы (I) по любому из пп. 1-10 или фармацевтической композиции по п. 14 для получения лекарственного средства для лечения рака с патологическим признаком пути метаболизма триптофана, опосредованного ИДО, где рак выбран из группы, состоящей из рака груди, рака шейки матки, рака кишечника, рака легких, рака желудка, рака прямой кишки, рака поджелудочной железы, рака мозга, рака простаты, рака почек, рака яичника, рака мочевого пузыря, рака печени, меланомы IV фазы, гепатоцеллюлярной карциномы, лейкоза, лимфомы и немелкоклеточного рака легких.
| WO 2012142237 A1, 18.10.2012 | |||
| Днище печи для сухой перегонки дерева | 1927 |
|
SU13182A1 |
Авторы
Даты
2020-03-24—Публикация
2016-04-12—Подача