Область техники, к которой относится изобретение
Изобретение относится к медицине, в частности к экспериментальной биологии, дерматовенерологии, а именно к модели в медицине, и касается способа моделирования пузырчатки у мышей.
Уровень техники
Пузырчатка (пемфигус) - тяжелое аутоиммунное буллезное заболевание, характеризующееся образованием пузырей и эрозий на коже и/или слизистых оболочках [Кубанов А.А., Абрамова Т.В. Пузырчатка: учеб. пособие / А.А. Кубанов, Т.В. Абрамова; ГБОУ ДПО «Российская медицинская академия последипломного образования». - М.: ГБОУ ДПО РМАПО, 2015. - 54 с.; Grando S.A. Pemphigus autoimmunity: hypotheses and realities // Autoimmunity. - 2012. - Vol. 45. - №1. - P. 7-35.].
Патогенетическую роль в формировании пузырей при дерматозе - пузырчатке играют циркулирующие аутоантитела, обладающие высокой тканевой специфичностью, относящиеся к классу иммуноглобулинов G (IgG), и вызывающие разрушение десмосом вследствие выделения протеолитических ферментов, что приводит к акантолизу [Матушевская Е.В., Кубанова А.А., Самсонов В.А. и др. Аутоантитела и аутоантигены при пузырчатке и пемфигоиде // Вестник дерматологии и венерологии. - 1995. - №5. - С. 28-33; Кубанов А.А., Знаменская Л.Ф., Абрамова Т.В., Свищенко С.И. К вопросам диагностики истинной акантолитической пузырчатки // Вестник дерматологии и венерологии. - 2014. - №6. - С. 121-130.; Joly Р., Bernard P., Bedane С. et al. Pemphigus. Guidelines for the diagnosis and treatment. Centres de reference des maladies huileuses auto-immunes. Societe Francaise de Dermatologie // Ann Dermatol Venereol. - 2011. - Vol. 138. - P. 252-258.]. Установлено, что основными структурами, к которым вырабатываются аутоантитела при вульгарной пузырчатке, являются белки десмосомального аппарата - десмоглеины 3 типа (Dsg 3)) [Stanley J.R., Yaar M., Hawley-Nelson P. et al. Pemphigus antibodies identify a cell surface glycoprotein synthesized by human and mouse keratinocytes // J. Clin. Invest. - 1982. - Vol. 70. - P. 281-288.; Stanley J.R., Koulu L., and Тhivolet C. Distinction between epidermal antigensbinding pemphigus vulgaris and pemphigus foliaceus autoantibodies // J. Clin. Invest. - 1984. - Vol. 74. - P. 313-320; Ohyama M, Ota T., Aoki M. et al. Suppression of the immune response against exogenous desmoglein 3 in desmoglein 3 knockout mice: an implication for gene therapy // J Invest Dermatol. - 2003 Apr. - Vol. 120(4). - P. 610-615.].
Первыми моделями для исследования патогенности антител при пузырчатки были экспланты человеческой кожи [Schiltz J.R., Michel В. Production of epidermal acantholysis in normal human skin in vitro by the IgG fraction from pemphigus serum // J. Invest Dermatol. - 1976 Aug. - Vol. 67, №2. - P. 254-260.] и культуры клеток кератиноцитов мыши [Farb R.M., Dykes R., Lazarus G.S. Anti-epidermal-cell-surface pemphigus antibody detaches viable epidermal cells from culture plates by activation of proteinase. Proc Natl AcadSci USA 1978 Jan; 75(1): 459-463.].
J.R. Schiltz и B. Michel (1976) продемонстрировали патогенность антител фракции сыворотки крови, полученной от больных пузырчаткой, in vitro на эксплантах человеческой кожи [Schiltz J.R., Michel В. Production of epidermal acantholysis in normal human skin in vitro by the IgG fraction from pemphigus serum. J. Invest Dermatol 1976 Aug; 67(2): 254-60.]. Несколько позже R.M. Farb и соавт.выявили, что IgG фракция сыворотки больных пузырчаткой приводит к разъединению эпидермальных мышиных клеток культуры BALB/c, выращенных в среде с низким содержанием комплемента [Farb R.M., Dykes R., Lazarus G.S. Anti-epidermal-cell-surface pemphigus antibody detaches viable epidermal cells from culture plates by activation of proteinase. Proc Natl AcadSci USA 1978 Jan; 75(1):459-463.].
Однако при использовании клеточной линии кератиноцитов не наблюдается акантолиз, так как клетки в культуре формируют только монослой.
У мышей в природных условиях не развиваются заболевания, напоминающие пузырчатку. Введение антител, полученных от больных пузырчаткой, взрослым мышам также не вызывает акантолиза [van der Wier G., Pas H.H., Jonkman M.F. Experimental human cell and tissue models of pemphigus // Dermatol Res Pract. - 2010. - 143871.].
Впервые модель на лабораторных животных (ближайший аналог-прототип) с пассивным переносом антител больных пузырчаткой была получена группой японских ученых в 1982 г. Антитела, выделенные от одного больного пузырчаткой, вводились новорожденным мышам, и через 8-24 часа у мышей появлялись признаки пузырчатки [Anhalt G.J., Labib R.S., Voorhees J.J. et al. Induction of pemphigus in neonatal mice by passive transfer of IgG from patients with the disease // J. Med 1982. - Vol. 306, №20. - P. 1189-1196.]. Однако недостатками описанной модели является недостаточно высокая воспроизводимость (менее чем у 50% животных), проблема с подбором доз препаратов иммуноглобулинов, полученных от одного больного. У части мышей признаки пузырчатки не развивались, что связано с толерантностью иммунитета.
В последующем было показано, что Fab фрагменты IgG больных вульгарной пузырчаткой вызывают появление пузырей у новорожденных мышей [ J.M. Jr.,
J.M. Jr.,  Α., Liu Ζ., Ding Χ., Swartz S.J., Fairley J.A., Diaz L.A. Mechanisms of acantholysis in pemphigus vulgaris: role of IgG valence // Clin Immunol Immunopathol. - 1997 Oct. - Vol. 85, №1. - P. 90-96.].
Α., Liu Ζ., Ding Χ., Swartz S.J., Fairley J.A., Diaz L.A. Mechanisms of acantholysis in pemphigus vulgaris: role of IgG valence // Clin Immunol Immunopathol. - 1997 Oct. - Vol. 85, №1. - P. 90-96.].
Однако получение Fab фрагментов IgG трудоемко и финансово затратно.
Заявляемый способ отличается от прототипа тем, что лабораторным животным вводятся препараты IgG, полученные от нескольких больных пузырчаткой, что повышает воспроизводимость эксперимента до 100%.
Задачей изобретения является создание способа моделирования пузырчатки у лабораторных животных - новорожденных мышей линии BALB/c методом введения иммуноглобулинов класса G, полученных от нескольких больных пузырчаткой.
Целью изобретения является создание экспериментальной модели (моделирование) пузырчатки у новорожденных мышей линии BALB/c методом введения IgG, выделенных от нескольких больных пузырчаткой, т.е. точное воспроизведение клинических, патоморфологических, иммунологических признаков этого заболевания.
Сущность изобретения
Способ моделирования пузырчатки, заключающийся во внутрибрюшинном введении новорожденным мышам линии BALB/c IgG, выделенных от нескольких больных пузырчаткой, в дозе 30 мг/мышь, вводимых однократно, и временем экспозиции 48 часов. Этого времени достаточно для появления клинических, патоморфологических и иммунологических признаков пузырчатки у животных.
Использование изобретения позволяет получить следующий технический результат.
Способ позволяет моделировать пузырчатку у новорожденных мышей путем введения препарата IgG, полученного от нескольких больных пузырчаткой. В связи с этим данным способ воспроизводим в 100% случаев. С помощью предложенного способа на лабораторных животных воспроизводятся клинические, гистологические и иммунологические признаки пузырчатки, что актуально для поиска новых молекулярно-биологических мишеней, изучения патогенетических механизмов развития заболевания, разработки новых методов диагностики и терапии тяжелого аутоиммунного дерматоза.
Технический результат достигается за счет того, что авторами впервые после введения препаратов IgG, полученных от нескольких (пяти) больных пузырчаткой, создана экспериментальная модель пузырчатки на лабораторных животных со 100% воспроизводимостью.
Полученные результаты могут объясняться тем, что иммуноглобулины класса G (IgG) составляют около 80% сывороточных иммуноглобулинов и подразделяются на четыре подкласса IgG1, IgG2, IgG3 и IgG4, каждый со своими биологическими свойствами. IgG образуются на высоте первичного иммунного ответа и при повторном введении антигена (вторичный ответ). Наиболее часто встречается IgG1 (67%), реже IgG2 и IgG3 (22 и 7% соответственно), самым редким является подкласс IgG4 (4%). При аутоимунных буллезных дерматозах вырабатываются аутоантитела, обладающие высокой тканевой специфичностью и относящиеся к IgG [Schroeder H.W. Jr., Cavacini L. Structure and function of immunoglobulins // J Allergy Clin Immunol. - 2010. - Vol.125(2 Suppl 2). - P. S41-52.].
Наличие или преобладание тех или иных подвидов антител IgG у разных людей, в том числе болеющих пузырчаткой, вероятно, может разниться, ввиду чего общая совокупность нескольких подвидов (подклассов) дает в итоге всегда необходимую их концентрацию для возникновения болезни.
Осуществление изобретения
Для осуществления изобретения используются сыворотки крови не менее чем от 5 больных с диагнозом пузырчатка, содержащие антитела к десмоглеину 3 типа (Dsg3) и 5 здоровых лиц, объединенные в пулы сывороток больных и здоровых лиц соответственно. Наличие антител к Dsg3 у больных пузырчаткой определяется методом ИФА с помощью наборов Anti-Desmoglein 3 ELISA (Euroimmun AG, ФРГ). Для контроля эксперимента используются сыворотки крови здоровых лиц, не содержащие антитела к Dsg3 (Euroimmun AG, ФРГ). Исследования проводятся согласно инструкции производителя.
В основе метода выделения IgG из сыворотки крови человека лежит способность бактериального белка G специфически связываться с Fc-фрагментами иммуноглобулинов класса G. Белок G, иммобилизованный на носителе, через который пропускают сыворотку крови, связывает и удерживает сывороточные IgG больных пузырчаткой.
Ход работы
Колонку хроматографическую разборную BioScale 10 мл (Bio-Rad, США) заполняют суспензией G-сефарозы (сефароза с иммобилизованным белком G) (Биалекса, Россия), подсоединяют к перистальтическому насосу (BioRad, США) и уравновешивают буфером для промывки (0,1 M фосфатный буфер, 0,15М NaCl, рН 7,2-7,4) (5-10 объемов колонки). Далее в колонку вносят сыворотку крови больных пузырчаткой из расчета 2 мл сыворотки на 1 мл G-сефарозы. Затем колонку промывают буфером для промывки с периодическим измерением оптической плотности выходящего с колонки буфера в спектрофотометре BioPhotometer с длиной волны 280 нм (Eppendorf, ФРГ) до тех пор, пока уровень оптической плотности жидкости не сравняется с оптической плотностью чистого буфера для промывки. При промывке выходящий с колонки буфер собирают в отдельную емкость, формируя т.н. "проскок" - смесь белков, содержащихся в сыворотке крови.
Далее колонку промывают буфером для элюции (0,1М глицин, рН 2,5). Элюат собирают в пробирки с 1 M трис-буфером (рН 8,0) в соотношении 1 часть трис-буфера на 4 части элюата (процедура проводится для нейтрализации рН элюата). Длительность элюции контролируется путем измерения оптической плотности вытекающего из колонки раствора элюата на спектрофотометре с длиной волны 280 нм. Элюцию прекращают, когда оптическая плотность раствора элюата снижается до уровня оптической плотности буфера для элюции.
Элюат и "проскок" проверяют методом электрофореза в полиакриламидном геле (ПААГ) по Лэммли на наличие и степень очистки антител. Если в проскоке обнаруживают IgG, то проскок заново наносят на колонку и очистка повторяется. Фракции элюата, содержащие IgG, объединяют и центрифугируют в центрифуге с охлаждением Allegra X-12R (Beckman-Coulter, США) при 3000g в центрифужных фильтрах Amicon (Millipore, Франция) с пределом фильтрации 100 kDа для концентрирования IgG. В процессе центрифугирования в фильтры добавляют стерильный изотонический буфер, в результате чего получается концентрированный раствор IgG в буфере. Далее из фильтров (Амикон) полученный препарат IgG количественно переносят в пробирки типа «эппендорф» объемом 1,5 мл.
В последующем 1 мкл препарата IgG растворяют в 1 мл 0,9% NaCl. Концентрацию белка измеряют в лабораторных условиях по оптической плотности УФ-методом при длине волны 280 нм. Полученное значение оптической плотности умножают на коэффициент 1,4 и получают концентрацию IgG в мг/мл. После определения концентрации IgG в препарате, для приготовления необходимых доз для введения животным, препарат разводят 0,9% NaCl. Полученный препарат IgG хранят при - t-4°C.
Препараты IgG вводят инсулиновым шприцом с иглой 27G внутрибрюшинно новорожденным мышам инбредной линии BALB/c с массой 2,5-3,5 г, в возрасте менее 24 часов от рождения, однократно в дозе 30 мг/мышь с последующей эвтаназией через 48 часов.
Практическая применимость заявляемого способа моделирования пузырчатки у мышей методом введения иммуноглобулинов класса G, полученных от 5 больных пузырчаткой, подтверждается для получения 100% воспроизводимости, но не исчерпывается следующими примерами.
Пример 1
Предлагаемый способ моделирования пузырчатки был изучен в серии экспериментов на неонатальных мышах - самцах инбредной линии BALB/c с массой 2,5-3,5 г, в возрасте менее 24 часов от рождения, предоставленных НИИ «Питомник лабораторных животных» Филиала ИБХ РАН г. Пущино. Производитель животных предоставил данные последнего контроля здоровья животных, подтверждающие их SPF-статус (животные, свободные от патогенов). В эксперимент были отобраны животные без признаков отклонений здоровья, таким образом, чтобы индивидуальные значения массы не отклонялись от среднего значения в пределах одного пола более чем на 20%. Основные правила содержания и ухода соответствовали нормативам, указанным в руководстве Guide for Care and Use of Laboratory Animals. (ILAR publication, 1996, National Academy Press). Животные содержались в стандартных условиях и получали корм и воду ad libitum.
Все манипуляции с животными выполнялись в соответствии с протоколом, утвержденным биоэтической комиссией ФИБХ РАН. Исследование выполняется в соответствии с Национальным стандартом Российской Федерации «Принципы надлежащей лабораторной практики» (Гост 53434-2009); Руководством OECDTG407 Repeated Dose 28-Day Oral Toxicity Studyin Rodents. Все процедуры в исследовании выполнены согласно утвержденному письменному Плану исследований и Стандартным операционным процедурам. Все процедуры с животными в исследовании рассматривались и утверждались комиссией по уходу и использованию животных (IACUC) на предмет соответствия регулирующим актам. Копия утвержденного протокола IACUC помещалась в папку данных по исследованию.
Выделение препаратов IgG из пула сывороток крови 5 больных пузырчаткой (производилось по описанной выше методике), содержащей антитела к Dsg3 (наличие антител к Dsg3 определялось методом ИФА с помощью наборов Anti-Desmoglein 3 ELISA, Euroimmun AG, ФРГ) и 5 здоровых добровольцев производилось стандартным способом - методом аффиной хроматографии на колонке с белок G - сефарозой (сефароза с иммобилизованным белком G) (Биалекса, Россия).
Препараты IgG, полученные от больных пузырчаткой и здоровых лиц, вводили животным из одного помета, которых распределили на две группы: опытную и контрольную. Мышам из опытных групп (n=31) вводили препараты антител, полученные из пула сывороток больных пузырчаткой, содержащих антитела к Dsg3. Животным контрольных групп (n=15) вводили препараты IgG, полученные из сыворотки здоровых добровольцев, не содержащие IgG к Dsg3.
Препараты IgG вводили инсулиновым шприцом с иглой 27G внутрибрюшинно по следующим схемам:
- однократно в дозах 10, 15, 20, 30 мг/мышь;
Отклонений в процедуре введения не было.
Животных подвергали эвтаназии путем ингаляции СО2 через определенный промежуток времени (время экспозиции) - 24-48 часов после введения препаратов IgG, после чего проводили осмотр кожных покровов и получали аутопсийный материал кожи для патоморфологического исследования (пузырный элемент) и исследования методом реакции непрямой иммунофлюоресценции (нРИФ) (видимо, здоровый участок кожи) (табл. 1).
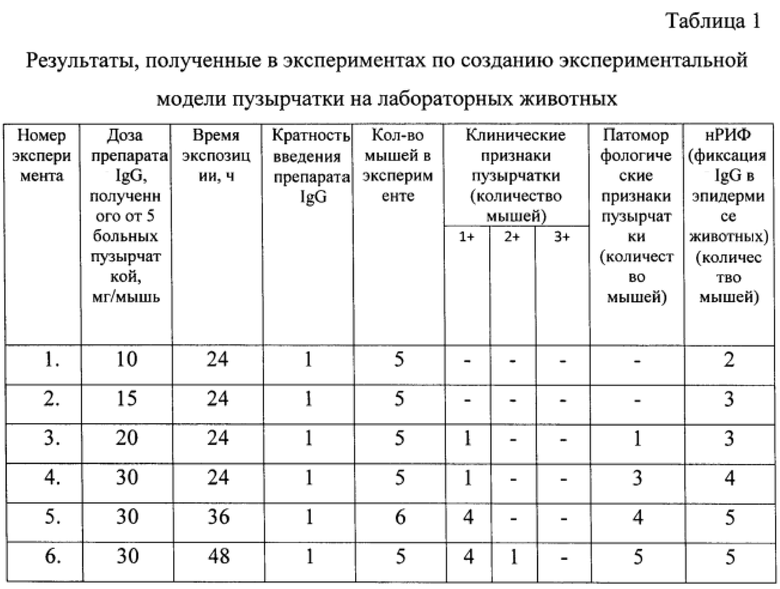
При визуальном осмотре проводили оценку выраженности поражений кожи в виде пузырей и/или эрозий по следующей шкале: 1+ - три или менее морфологических элемента; 2+ - от 4 до 10; 3+ - более 10 или наличие на поверхности участков некроза кожи, составляющей более 20% эпидермиса лабораторного животного.
Клинические симптомы пузырчатки были выявлены у животных, которым вводили 30 мг препаратов IgG однократно со временем экспозиции 48 часов (n=5). У 4 мышей наблюдались эрозии в абдоминальной области, по 3-балльной шкале оцениваемые как 1+ (т.е. три или менее поражений кожи), у 1 мыши - 2+ (Фиг. 1. Эрозии на коже новорожденных мышей).
При патоморфологическом исследовании аутопсийного материала кожи мышей патогномоничный признак пузырчатки – акантолиз - выявлялся во всех гистологических препаратах животных из опытных групп, которым были введены антитела в количестве 30 мг/мышь однократно и временем экспозиции 48 часов (Фиг. 2. Гистологическая картина. Эпидермис обычной толщины, слои дифференцированы. Небольшой рыхлый кератоз. В краевой зоне биоптата присутствует внутриэпидермальный пузырь (на уровне верхних рядов шиповатого слоя эпидермиса), в полости которого обнаруживаются акантолитические клетки, лимфоциты и лейкоциты. Также в препарате присутствуют фрагменты лежащей изолированно покрышки пузыря. В дерме присутствуют фрагменты фолликулов. Вокруг сосудов небольшая гистиолимфоцитарная инфильтрация, г-э, х200).
При исследовании криосрезов кожи мышей из опытных групп методом нРИФ обнаружена фиксация IgG в межклеточных промежутках эпидермиса у всех мышей, которым введен препарат IgG от больных пузырчаткой в дозе 30 мг/мышь (Фиг. 3. нРИФ. Препарат IgG от больного пузырчаткой. Фиксация IgG в межклеточных промежутках эпидермиса, х20).
В контрольных группах животных, которым вводили препараты IgG, полученные из сывороток крови здоровых лиц (n=15), однократно в дозах 10, 20, 30 мг/мышь, клинических, патоморфологических признаков пузырчатки, а также фиксации IgG в эпидермисе не наблюдались.
Наличие акантолитических изменений в эпидермисе мышей опытной группы при патоморфологическом исследовании, а также фиксация человеческих IgG в эпидермисе, выявляемая методом нРИФ только у животных, которым вводили препараты IgG, содержащие антитела к Dsg3, свидетельствуют о том, что антитела, содержащиеся в сыворотках крови больных пузырчаткой, индуцируют в коже животных процессы, сходные с симптомами пузырчатки.
Клинические, гистологические и гистохимические признаки пузырчатки наблюдались при введении IgG в дозе 30 мг/мышь, вводимых однократно, и временем экспозиции 48 часов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ СЕЛЕКТИВНОГО ИММУНОСОРБЕНТА ДЛЯ УДАЛЕНИЯ АНТИТЕЛ К ДЕСМОГЛЕИНУ 3 ТИПА ИЗ СЫВОРОТКИ КРОВИ У БОЛЬНЫХ ПУЗЫРЧАТКОЙ | 2016 |
|
RU2627652C1 |
| СПОСОБ ПОЛУЧЕНИЯ СЕЛЕКТИВНОГО ИММУНОСОРБЕНТА ДЛЯ УДАЛЕНИЯ АНТИТЕЛ-IgG К ДЕСМОГЛЕИНУ 3 ТИПА ИЗ СЫВОРОТКИ КРОВИ БОЛЬНЫХ ПУЗЫРЧАТКОЙ | 2015 |
|
RU2622005C2 |
| СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ПУЗЫРЧАТКИ, СОДЕРЖАЩИЕ АНТИТЕЛА ПРОТИВ ЛИГАНДА Fas | 2009 |
|
RU2556818C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВОЗМОЖНОСТИ ИЗМЕНЕНИЯ КЛИНИЧЕСКОЙ ФОРМЫ ПУЗЫРЧАТКИ | 2008 |
|
RU2386400C1 |
| РЕКОМБИНАНТНЫЕ БЕЛКИ-АНТИГЕНЫ И СПОСОБ ОПРЕДЕЛЕНИЯ ЭПИТОПНОЙ СПЕЦИФИЧНОСТИ АУТОРЕАКТИВНЫХ АНТИТЕЛ К ОТДЕЛЬНЫМ ФРАГМЕНТАМ ЭКСТРАЦЕЛЛЮЛЯРНОГО ДОМЕНА ДЕСМОГЛЕИНА 3-ГО ТИПА ЧЕЛОВЕКА У БОЛЬНЫХ ОБЫКНОВЕННОЙ ПУЗЫРЧАТКОЙ, ТЕСТ-СИСТЕМА НА ИХ ОСНОВЕ | 2021 |
|
RU2770444C1 |
| ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ПЕМФИГУСА, СОДЕРЖАЩИЕ АНТИТЕЛА К Fas-ЛИГАНДУ | 2008 |
|
RU2558260C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ХАРАКТЕРА ТЕЧЕНИЯ АУТОИММУННОЙ ПУЗЫРЧАТКИ | 2010 |
|
RU2429482C1 |
| СПОСОБ ДИАГНОСТИКИ ПУЗЫРЧАТКИ | 1994 |
|
RU2097768C1 |
| Способ подготовки пробы для проведения иммунофлюоресцентного исследования при диагностике болезни Хейли-Хейли | 2015 |
|
RU2624501C2 |
| Способ прогнозирования характера течения изолированной формы акантолитической пузырчатки полости рта | 2018 |
|
RU2688209C1 |

Изобретение относится к медицине, в частности к экспериментальной дерматовенерологии, и касается способа моделирования вульгарной пузырчатки. Для этого способ включает введение новорожденным мышам препарата иммуноглобулинов класса G (IgG), выделенных от больных вульгарной пузырчаткой. При этом IgG выделяют не менее чем от 5 больных. Полученный препарат вводят в дозе IgG 30 мг/мышь с последующей эвтаназией животных через 48 часов. Способ воспроизводим в 100% случаев и обеспечивает клинические, гистологические и иммунологические признаки пузырчатки, что актуально для изучения патогенетических механизмов развития заболевания и разработки новых методов диагностики и терапии тяжелого аутоиммунного дерматоза. 1 пр., 1 табл., 3 ил.
морфологическим и иммуногистохимическим признакам идентична изменениям кожи при пузырчатке у человека. Способ эффективен в отношении создания экспериментальной модели пузырчатки с целью получения возможности изучения патогенеза, разработки новых методов диагностики и лечения пузырчатки. 1 пр., 1 табл.
Способ моделирования вульгарной пузырчатки, включающий введение новорожденным мышам препарата иммуноглобулинов класса G (IgG), выделенных от больных вульгарной пузырчаткой, отличающийся тем, что IgG выделяют не менее чем от 5 больных и полученный препарат вводят в дозе IgG 30 мг/мышь с последующей эвтаназией животных через 48 часов.
| ANHALT G.J | |||
| et al | |||
| Induction of pemphigus in neonatal mice by passive transfer of IgG from patients with the disease | |||
| J | |||
| Устройство для видения на расстоянии | 1915 |
|
SU1982A1 |
| Телефонно-осведомительный аппарат | 1921 |
|
SU306A1 |
| СПОСОБ ДИАГНОСТИКИ АУТОИММУННЫХ БУЛЛЕЗНЫХ ДЕРМАТОЗОВ | 2008 |
|
RU2352947C1 |
| СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ПУЗЫРЧАТКИ, СОДЕРЖАЩИЕ АНТИТЕЛА ПРОТИВ ЛИГАНДА Fas | 2009 |
|
RU2556818C2 |
| US 20050025760 A1, 03.02.2005 | |||
| US 7060868 B1, 13.06.2006 | |||
| КОЦАРЕВА О | |||
| Д | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Автореф | |||
| дис | |||
| канд | |||
| биол | |||
| наук, Москва, 2007, 22 с | |||
| GIL MP et al Inhibition of FAK prevents blister formation in the neonatal mouse model of pemphigus vulgaris | |||
| Exp Dermatol | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2017-03-21—Публикация
2015-11-24—Подача