Изобретение относится к микробиологии и биотехнологии и касается получения трансформантов дрожжей Schizosaccharomyces pombe, способных продуцировать молочную кислоту.
Молочную кислоту (МК) широко используют в пищевой промышленности для консервирования и ароматизации и в производстве биодеградируемой пластмассы - полилактата. Другая сфера использования молочной кислоты - получение биодеградируемого растворителя этиллактата, который применяют при производстве электротехники, лаков и красок, текстиля, смазок, клеев и т.д. Нетоксичные эфиры молочной кислоты потенциально могут заменить более 80% растворителей, используемых в мире в настоящее время. В связи с этим актуальной становится задача разработки эффективных способов производства молочной кислоты.
Традиционно для получения МК используют микробиологические способы получения, основанные на культивировании бактериальных штаммов молочнокислых бактерий. Недостатком бактериальных штаммов-продуцентов молочной кислоты является их чувствительность к низким значениям рН и высоким концентрациям молочной кислоты, что приводит к замедлению роста культуры, снижению скорости синтеза молочной кислоты и, как следствие, преждевременному завершению процесса ферментации.
Особый интерес для создания продуцентов молочной кислоты представляет конструирование штаммов микроорганизмов, в меньшей степени чувствительных к низким значениям рН и высоким концентрациям молочной кислоты.
Перспективным объектом для производства молочной кислоты являются дрожжи, многие из которых способны расти и осуществлять брожение в условиях повышенной кислотности [Бабьева И.П., Чернов И.Ю. Биология дрожжей, Товарищество научных изданий КМК, М., 2004].
В норме дрожжи не продуцируют значимых количеств молочной кислоты, однако, экспрессия гена лактатдегидрогеназы (ldh) в дрожжевых клетках позволяет получить штаммы, продуцирующие молочную кислоту в количествах, сравнимых с производственным уровнем [Biotechnol Genet Eng Rev., 2010, v. 27, №1, p. 9-256]. В качестве реципиента в таких случаях используют штаммы таких дрожжей, как Saccharomyces cerevisiae, Kluyveromyces sp., Pichia sp., Schizosaccharomyces sp. и Hansenula sp., а в качестве источника гена лактатдегидрогеназы - молочнокислые бактерии (Lactobacillus), грибы (Rhizopus oryzae) и ткани млекопитающих (ген ldh из клеток мышечной ткани быка или человека).
Дрожжи Pichia stipitis, несущие ген лактатдегидрогеназы из Lactobacillus helveticus, способны продуцировать молочную кислоту в количестве 41 г/л культуральной жидкости [Appl Environ Microbiol., 2007, v. 73, p. 117-123].
Трансформант дрожжей Saccharomyces cerevisiae JnvScl, содержащая ген лактатдегидрогеназы из гриба Rhizopus oryzae (J. Ind. Microbiol. Biotechnol., 2003, v. 30, p. 22-27), продуцирует молочную кислоту в количестве до 40 г/л культуральной жидкости, а его отличительной способностью является неизменная скорость образования молочной кислоты в интервале рН 3,5-6,0.
Известен [Enzyme Microbial Technology., 2003, v. 33, №1, p. 38-46] трансформант на основе дрожжей Saccharomyces cerevisiae, несущий ген лактатдегидрогеназы из бактерий Lactobacillus plantarum, который продуцирует молочную кислоту в количестве 58 г/л культуральной жидкости при рН 3,6. Основным недостатком дрожжей Saccharomyces cerevisiae является то, что процесс синтеза молочной кислоты у них чувствителен к ее высоким концентрациям, что отрицательно влияет на выход конечного продукта.
Известно, что высокой устойчивостью к низким значениям рН среды и высоким концентрациям молочной кислоты обладают дрожжи Schizosaccharomyces pombe [RU 2268304]. Они хорошо генетически изучены, не требуют для своего роста сложных органических сред и удобны для промышленной ферментации, что делает их перспективным объектом для создания продуцентов молочной кислоты.
Показано, что дрожжи Schizosaccharomyces pombe, содержащие ген лактатдегидрогеназы из грибов Rhizopus oryzae [RU 2268304], продуцируют молочную кислоту в количестве 58 г/л культуральной жидкости. Однако они не подходят для промышленного применения, так как требуют двухстадийного культивирования и тщательной отмывки клеток. Кроме того, время культивирования для достижения указанного количества молочной кислоты очень велико и составляет 8 суток.
Штамм Schizosaccharomyces pombe АТСС №2476, несущий ген лактатдегидрогеназы млекопитающих (Homo sapiens), продуцирует молочную кислоту в количестве 88 г/л культуральной жидкости [US 20120214214].
Известно [WO 2014030655], что гены лактатдегидрогеназ экспрессируются в дрожжах Schizosaccharomyces pombe с различной эффективностью, а кодируемые ими ферменты лактатдегидрогеназы могут не проявлять активности. Показано, что трансформанты, несущие в составе хромосомы гены лактатдегидрогеназ из Lactobacillus bulgaricus, Staphylococcus aureus, не способны продуцировать молочную кислоту, а трансформанты, несущие в составе хромосомы гены лактатдегидрогеназ из Homo sapiens, Lactobacillus pentosus, Pediococcus acidilactici, продуцируют молочную кислоту в разных количествах: 83,2 г/л, 78,9 г/л и 22,0 г/л культуральной жидкости соответственно. В работе исследованы также трансформанты, несущие одновременно несколько генов лактатдегидрогеназ из различных источников. Так, трансформант, несущий гены лактатдегидрогеназ из Homo sapiens и Lactobacillus plantarum продуцирует молочную кислоту в количестве 64,8 г/л культуральной жидкости, а трансформант, несущий гены лактатдегидрогеназ из Homo sapiens и Lactobacillus pentosus - в количестве 91,5 г/л культуральной жидкости. Однако, представленные результаты получены в модельной системе с использованием сгущенной культуры клеток, процесс культивирования осуществляется в две стадии, а ферментационная среда для успешного культивирования должна содержать редкую и дорогую добавку - протеолипиды (белково-липидные соединения, экстрагируемые органическими растворителями из ткани мозга).
Выбор генов, кодирующих лактатдегидрогеназы, эффективно работающие в дрожжах S. pombe, и создание на их основе промышленно значимых продуцентов молочной кислоты является важной задачей.
Задачей заявляемого изобретения является расширение арсенала рекомбинантных микроорганизмов, продуцирующих молочную кислоту, и расширение арсенала способов микробиологического синтеза молочной кислоты.
Задача решена путем получения:
- трансформанта дрожжей Schizosaccharomyces pombe, продуцирующего молочную кислоту, содержащего ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%;
- трансформанта дрожжей Schizosaccharomyces pombe, продуцирующего молочную кислоту, содержащего ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%, в котором инактивирован или делетирован один или несколько генов, кодирующих ферменты, участвующие в пути биосинтеза этанола;
- трансформанта дрожжей Schizosaccharomyces pombe, продуцирующего молочную кислоту, содержащего ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%, и ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus plantarum или Lactobacillus pentosus;
- трансформанта дрожжей Schizosaccharomyces pombe продуцирующего молочную кислоту, содержащего ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%, и ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus plantarum или Lactobacillus pentosus, в котором инактивирован или делетирован один или несколько генов, кодирующих ферменты, участвующие в пути биосинтеза этанола.
К ферментам, аминокислотная последовательность которых гомологична лактатдегидрогеназе из Lactobacillus acidophilus [NCBI: WP 003549000.1] не менее чем на 93% относятся, например, лактатдегидрогеназа из Lactobacillus kitasatonis [NCBI: WP 025014735.1], или Lactobacillus ultunensis [NCBI: WP 007126779.1], или Lactobacillus crispatus [NCBI: WP 005721100.1], или Lactobacillus gallinarum [NCBI: WP 025005283.1], или Lactobacillus amylovorus [NCBI: WP 013437112.1], или Lactobacillus kefiranofaciens [NCBI: WP 013855318.1].
Аминокислотные последовательности лактатдегидрогеназ из Lactobacillus plantarum и Lactobacillus pentosus приведены в базе NCBI: [GenBank: ACJ15334.1] и [NCBI: WP_003638120.1] соответственно.
К ферментам, участвующим в биосинтезе этанола у дрожжей S. pombe, относятся алкогольдегидрогеназы ADH1, ADH2, ADH3, ADH4 и пируватдекарбоксилазы PDC1, PDC2, PDC3, PDC4.
Получение заявленных трансформантов включает введение выбранного гена или генов ldh в клетки дрожжей S. pombe с помощью подходящего плазмидного вектора, содержащего экспрессионную кассету, включающую в свой состав ген ldh, промотор, работающий в дрожжах S. pombe, терминатор, маркерный ген и, предпочтительно, сайт для гомологичной интеграции в хромосому. Интеграция может быть осуществлена путем как гомологичной, так и негомологичной рекомбинации. Примеры векторов можно найти, например, в [http://www-bcf.usc.edu/~forsburg/vectortable.html]. Плазмидные вектора или экспрессионные кассеты трансформируют в клетки дрожжей S. pombe методом электоропорации [Yeast, 2002, v. 18, p. 1015-1021], методом с использованием ацетата лития или протопластов [http://www-bcf.usc.edu/~forsburg/tfmn.html] или другими.
Конструирование векторов и экспрессионных кассет осуществляют стандартными методами генетической инженерии [Рыбчин В.Н. Основы генетической инженерии. - СПб.: СПбГТУ, 1999. Sambrook J., Maniatis Т., Fritsch Е. Molecular cloning: a laboratory manual. - N.Y.: Cold Spring Harbor Laboratory, 1989] с использованием генетических элементов, подходящих для работы с дрожжами S. pombe. В качестве промоторов используют adh, nmtl, nmt41, nmt81, hCMV, CV40 или другие [http://www-bcf.usc.edu/~forsburg/vectortable.html]. В качестве селективных маркеров используют гены can1 или kanMX [http://www-bcf.usc.edu/~forsburg/drugs.html], придающие клеткам устойчивость к канаванину или G418, а также гены комплементирующие ауксотрофные мутации в геноме S. pombe, например, URA4 или LEU2 [http://www-bcf.usc.edu/~forsburg/vectortable.html]. В качестве плечей для гомологичной интеграции используют последовательности транспозонов Tf1 [Eukaryotic Cell, Feb. 2002, p. 44-55] или Tf2 [US 20120214214] или последовательность гена LEU1 [РФ 2539092] или другие последовательности, гомологичные участкам хромосомы дрожжей S. pombe.
Получение других заявленных трансформантов, кроме введения выбранного гена или генов в клетки дрожжей S. pombe, дополнительно включает инактивацию или делетирование генов, кодирующих ферменты, участвующие в пути биосинтеза этанола, что позволяет уменьшить количество этого побочного продукта.
Нуклеотидные последовательности генов, кодирующих алкогольдегидрогеназы ADH1, ADH2, ADH3, ADH4 и пируватдекарбоксилазы PDC1, PDC2, PDC3, PDC4 приведены в геномном сиквенсе дрожжей S. pombe [Nature, 2002, v. 415, p. 871-880]. Инактивацию или делетирование генов осуществляют любым подходящим способом, например, методом Латура [Nucleic. Acids Res., 2006, v. 34, p. 11] или с помощью ПЦР, допускающей ошибки [PCR Methods Appl., 1992, v. 2, p. 28-33], или методами, основанными на использовании Cre-lox системы [Biosci. Biotechnol. Biochem., 68 (3), 545-550, 2004], или методами [Yeast Protocols, Methods in Molecular Biology, vol. 1163, p. 45-72] или другими.
Задача решена также тем, что предложен способ микробиологического синтеза молочной кислоты, включающий культивирование в питательной среде заявленных трансформантов.
Заявленный способ включает культивирование полученных трансформантов в подходящих для продукции молочной кислоты питательных средах и условиях, например [RU 2268304; WO 2014030655; RU 2539092].
В приведенных примерах в качестве штамма-реципиента используют штамм Schizosaccharomyces pombe ВКПМ Y-3106. Плазмидные вектора, содержащие интегративные экспрессионные кассеты, конструируют методом клонирования [Sambrook J., Maniatis Т., Fritsch Е. Molecular cloning: a laboratory manual. - N.Y.: Cold Spring Harbor Laboratory, 1989.] генетических элементов (описанных в примерах) в коммерческий вектор pUC19. Генетические элементы - дрожжевой селективный маркер kanMX, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора, CMV промотор, нуклеотидную последовательность ретротранспозона Tf1 - синтезируют стандартным методом ПЦР [http://www.gene-quantification.de/ras-pcr-application-manual-3rd-ed.pdf]. Дрожжи S. pombe трансформируют интегративными экспрессионными кассетами методом электропорации [http://www-bcf.usc.edu/~forsburg/tfmn.html]. Продуктивные трансформанты отбирают на селективной среде, содержащей мел.
Ферментацию полученных трансформантов в приведенных примерах осуществляют при 30°С в питательной среде, содержащей дрожжевой экстракт, пептон и глюкозу, в пробирках (50 мл) с рабочим объемом 5 мл.
Концентрацию молочной кислоты в культуральной жидкости определяют согласно методу ВЭЖХ [Acta Biotechnol. 1990. v. 10 (5) р. 459-468]. Концентрацию этанола определяют согласно методу ГХ [Chromatogr. Sci. 2009. v. 47 (4). p. 272-278].
Изобретение проиллюстрировано чертежами, где приведено:
Фиг. 1. Плазмидный вектор pCMV-aci-Tf1.
Фиг. 2. Плазмидный вектор pCMV-amy-Tf1.
Фиг. 3. Плазмидный вектор pCMV-cri-Tf1.
Фиг. 4. Плазмидный вектор pCMV-aci-adh1.
Фиг. 5. Электрофореграмма ПЦР-анализа трансформанта с отключенным геном adh1.
Фиг. 6. Плазмидный вектор pCMV-aci-pdc2.
Фиг. 7. Электрофореграмма ПЦР-анализа трансформанта с отключенным геном pdc2.
Фиг. 8. Плазмидный вектор pCMV-pla-Tf1-Hyg.
Фиг. 9. Плазмидный вектор pCMV-pen-Tf1-Hyg.
Фиг. 10. Электрофореграмма ПЦР-анализа трансформантов по примерам 1-7.
Пример 1. Получение трансформанта дрожжей S. pombe, несущего ген ldh из Lactobacillus acidophilus
Получают плазмидный вектор pCMV-aci-Tf1, содержащий интегративную экспрессионную кассету. В качестве источника гена ldh используют тотальную геномную ДНК Lactobacillus acidophilus ВКПМ В-4625. Синтезируют ДНК гена ldh методом ПЦР с использованием праймеров pr-aci-1 и pr-aci-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Nhe1 и Pme1 соответственно:
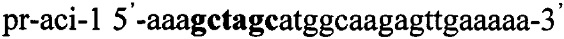 ,
,
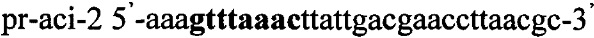 .
.
Полученную ДНК, дрожжевой селективный маркер kanМХ, нуклеотидную последовательность ретротранспозона Тf1 клонируют в вектор pUC19. Полученный таким образом плазмидный вектор pCMV-aci-Tf1 (фиг. 1) содержит в своем составе следующие генетические элементы:
1. Дрожжевой селективный маркер kanМХ, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора.
2. Ген ldh Lactobacillus acidophilus, под контролем CMV промотора.
3. Область для интеграции - нуклеотидная последовательность ретротранспозона Tf1.
4. Селективный маркер для клеток E. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину.
5. Бактериальный pUC origin.
Для получения интегративной экспрессионной кассеты плазмиду pCMV-aci-Tf1 обрабатывают эндонуклеазами рестрикции BamH1, Nae1. Полученные ДНК фрагменты разделяют в агарозном геле, выделяют и очищают ДНК фрагмент размером 5326 п.о. Полученный ДНК фрагмент является интегративной экспрессионной кассетой, содержащей в своем составе ген ldh Lactobacillus acidophilus, под контролем CMV промотора; маркерный ген kanМХ, фланкированный сайтами lox 66 и lox 71 и обуславливающий у дрожжей S. pombe устойчивость к антибиотику G418; и плечи для гомологичной интеграции в хромосому. В качестве плечей для интеграции используют нуклеотидную последовательность ретротранспозона Tf1.
Дрожжи S. pombe трансформируют указанной интегративной экспрессионной кассетой.
Штамм S. pombe Y-3106 предварительно выращивают в жидкой питательной среде YPD (мас. %: дрожжевой экстракт - 1, пептон - 2, вода - остальное) до концентрации 1×108 клеток на 1 мл. Клетки центрифугируют, промывают в ледяной стерильной воде, а затем в ледяном растворе 1 М сорбитола. Клетки инкубируют в 25 мМ растворе дитиотрейтола в течение 15 минут, затем промывают в ледяном растворе 1М сорбитола. Клетки ресуспендируют в ледяном растворе 1 М сорбитола в концентрации 1-5×109 клеток на 1 мл. Аликвоту, объемом 40 мкл клеточной суспензии, переносят в охлажденный эппендорф, добавляют 400 нг ДНК экспрессионной интеграционной кассеты, и инкубируют во льду 5 минут. Смесь клеток и ДНК переносят в предварительно охлажденную кювету для электропорации. Электропорацию проводят при следующих условиях: 1,5 кВ, 400 Ом, 25 uF. После порации добавляют 1 мл ледяного раствора 1 М сорбитола.
Селекцию трансформантов ведут на агаризованной среде среде YES [http://www-bcf.usc.edu/~forsburg/media.html] с добавлением глюкозы (2 мас. %) в течение 5 суток при температуре 30°С. В качестве селективного агента добавляют антибиотик G418 в количестве 130 мкг/мл.
Продукцию молочной кислоты трансформантами оценивают в чашечном тесте по зонам гидролиза. В тесте используют агаризованную среду YPD (мас. %: дрожжевой экстракт - 1, пептон - 2, агар - 2, вода - остальное) с добавлением глюкозы (2 мас. %) и мела (0,5 мас. %). В качестве контроля используют штамм Schizosaccharomyces pombe ВКПМ Y-3106.
Наиболее продуктивные трансформанты, показавшие наибольшее соотношение диаметра зоны гидролиза к диаметру колонии на чашках с мелом, отбирают и культивируют в жидкой питательной среде в пробирке.
Посевную культуру выращивают в пробирках (50 мл) с 10 мл жидкой питательной среды YPD с добавлением глюкозы (2 мас. %) при 30°С в течение 24 ч на качалке с 250 об/мин. Посев ферментационной среды осуществляют в соотношении 1/10 об.
Ферментацию проводят при 30°С в термостате без аэрации в питательной среде состава (мас. %): дрожжевой экстракт - 0,5, пептон - 1, вода - остальное с добавлением глюкозы (18 мас. %) в пробирках (50 мл) с рабочим объемом 5 мл. Ферментацию продолжают в течение 72 часов.
По результатам ферментации отобран трансформант, который при культивировании в пробирках синтезирует молочную кислоту в количестве 40 г/л культуральной жидкости, а побочный продукт - этанол в количестве 39 г/л.
Пример 2. Получение трансформанта дрожжей S. pombe, несущего ген ldh из Lactobacillus amylovorus
Получают плазмидный вектор pCMV-amy-Tf1, содержащий интегративную экспрессионную кассету. В качестве источника гена ldh используют тотальную геномную ДНК Lactobacillus amylovorus, DSM 20531. Синтезируют ДНК гена ldh методом ПЦР с использованием праймеров pr-amy-1 и pr-amy-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Nhe1 и Pme1 соответственно:
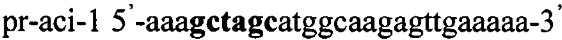 ,
,
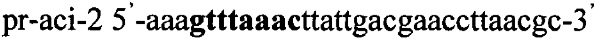 .
.
Полученную ДНК, дрожжевой селективный маркер kanМХ, нуклеотидную последовательность ретротранспозона Tf1 клонируют в вектор pUC19. Полученный таким образом плазмидный вектор pCMV-amy-Tf1 (фиг. 2) содержит в своем составе следующие генетические элементы:
1. Дрожжевой селективный маркер kanМХ, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора.
2. Ген ldh Lactobacillus amylovorus под контролем CMV промотора
3. Область для интеграции - нуклеотидная последовательность ретротранспозона Tf1.
4. Селективный маркер для клеток E. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину.
5. Бактериальный pUC origin.
Для получения интегративной экспрессионной кассеты плазмиду pCMV-amy-Tf1 обрабатывают эндонуклеазами рестрикции BamH1, Nae1. Полученные ДНК фрагменты разделяют в агарозном геле, выделяют и очищают ДНК фрагмент, размером 5319 п.о. Полученный ДНК фрагмент является интегративной экспрессионной кассетой, содержащей в своем составе ген ldh Lactobacillus amylovorus, под контролем CMV промотора; маркерный ген kanМХ, фланкированный сайтами lox 66 и lox 71, и обуславливающий у дрожжей S. pombe устойчивость к антибиотику G418; и плечи для гомологичной интеграции в хромосому. В качестве плечей для интеграции используют нуклеотидную последовательность ретротранспозона Tf1.
Дрожжи S. pombe трансформируют указанной интегративной экспрессионной кассетой.
Получение, отбор и культивирование трансформантов осуществляют по примеру 1.
По результатам ферментации отобран трансформант, который при культивировании в пробирках синтезирует молочную кислоту в количестве 45 г/л культуральной жидкости, а побочный продукт - этанол в количестве 36 г/л.
Пример 3. Получение трансформанта дрожжей S. pombe, несущих ген ldh из Lactobacillus crispatus
Получают плазмидный вектор pCMV-cri-Tf1, содержащий интегративную экспрессионную кассету. В качестве источника гена ldh используют тотальную геномную ДНК Lactobacillus crispatus DSM 20584. Синтезируют ДНК гена ldh методом ПЦР с использованием праймеров pr-cri-1 и pr-cri-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Nhe1 и Pme1 соответственно:
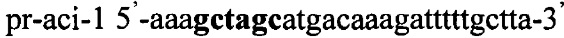 ,
,
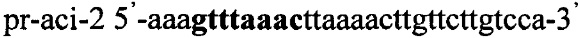 .
.
Полученную ДНК, дрожжевой селективный маркер kanМХ, нуклеотидную последовательность ретротранспозона Tf1 клонируют в вектор pUC19. Полученный таким образом плазмидный вектор pCMV-cri-Tf1 (фиг. 3) содержит в своем составе следующие генетические элементы:
1. Дрожжевой селективный маркер kanМХ, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора.
2. Ген ldh Lactobacillus crispatus, под контролем CMV промотора.
3. Область для интеграции - нуклеотидная последовательность ретротранспозона Tf1.
4. Селективный маркер для клеток E. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину.
5. Бактериальный pUC origin.
Для получения интегративной экспрессионной кассеты плазмиду pCMV-cri-Tf1 обрабатывают эндонуклеазами рестрикции BamH1, Nae1. Полученные ДНК фрагменты разделяют в агарозном геле, выделяют и очищают ДНК фрагмент, размером 5322 п.о. Полученный ДНК фрагмент является интегративной экспрессионной кассетой, содержащей в своем составе ген ldh Lactobacillus crispatus, под контролем CMV промотора; маркерный ген капМХ, фланкированный сайтами lox 66 и lox 71, и обуславливающий у дрожжей S. pombe устойчивость к антибиотику G418; и плечи для гомологичной интеграции в хромосому. В качестве плечей для интеграции используют нуклеотидную последовательность ретротранспозона Tf1.
Дрожжи S. pombe трансформируют указанной интегративной экспрессионной кассетой.
Получение, отбор и культивирование трансформантов осуществляют по примеру 1.
По результатам ферментации отобран трансформант, который при культивировании в пробирках синтезирует молочную кислоту в количестве 38 г/л культуральной жидкости, а побочный продукт - этанол в количестве 40 г/л.
Пример 4. Получение трансформанта дрожжей S. pombe с инактивированным геном adhl. в хромосому которого интегрирован ген ldh из Lactobacillus acidophilus
Инактивацию гена adh1 [NCBI: NC_003421.2] осуществляют методом двойного кроссинговера [http://www-bcf.usc.edu/~forsburg/disruptions.html]. Для этого получают плазмидный вектор pCMV-aci-adh1, содержащий интегративную экспрессионную кассету, включающую в свой состав в качестве плечей для интеграции фрагменты гена adh1: 5'- adh1 и 3'- adh1. ДНК фрагмент 5'- adh1 синтезируют методом ПЦР с использованием праймеров pr-5'-adh1-1 и pr-5'-adh1-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Sma1 и Есо321 соответственно:
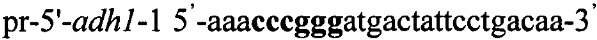 ,
,
 .
.
ДНК фрагмент 3'-adh1 синтезируют методом ПЦР с использованием праймеров рr-3'-adh1-1 и pr-3'-adh1-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Есо321 и BamH1 соответственно:
 ,
,
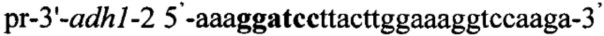 .
.
В качестве источника гена ldh используют тотальную геномную ДНК Lactobacillus acidophilus ВКПМ В-4625. Синтезируют ДНК гена ldh методом ПЦР с использованием праймеров pr-aci-1 и pr-aci-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Nhe1 и Pme1 соответственно:
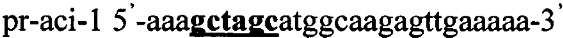 ,
,
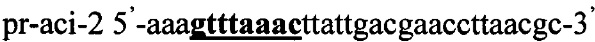 .
.
Полученную ДНК, ДНК фрагменты 5'-adh1 и 3'-adh1, дрожжевой селективный маркер kanМХ клонируют в вектор pUC19. Полученный таким образом плазмидный вектор pCMV-aci-adh1 (фиг 4), содержит в своем составе следующие генетические элементы:
1. Дрожжевой селективный маркер kanМХ, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора.
2. Ген ldh Lactobacillus acidophilus под контролем CMV промотора.
3. Область для интеграции - фрагменты нуклеотидной последовательности гена алкогольдегидрогеназы adh1 дрожжей S. pombe.
4. Селективный маркер для клеток E. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину.
5. Бактериальный pUC origin.
Для получения интегративной экспрессионной кассеты плазмиду pCMV-aci-adh1 обрабатывают эндонуклеазами рестрикции BamH1, Sma1. Полученные ДНК фрагменты разделяют в агарозном геле, выделяют и очищают ДНК фрагмент, размером 5428 п.о. Полученный ДНК фрагмент является интегративной экспрессионной кассетой, содержащей в своем составе фрагмент ДНК, кодирующий аминокислотную последовательность гена ldh Lactobacillus acidophilus, под контролем CMV промотора; маркерный ген kanМХ, фланкированный сайтами lox 66 и lox 71, и обуславливающий у дрожжей S. pombe устойчивость к антибиотику G418; и плечи для гомологичной интеграции в хромосому. В качестве плечей для интеграции используют нуклеотидную последовательность гена adh1.
Дрожжи S. pombe трансформируют указанной интегративной экспрессионной кассетой.
Получение и селекцию трансформантов осуществляют по примеру 1. Далее проводят отбор трансформантов с отключенным геном adh1 по стандартной методике [http://www-bcf.usc.edu/~forsburg/disruptions.html]. Для этого проводят ПЦР с использованием праймеров pr-5'-adh1-1 и pr-3'-adh1-1, гомологичных началу и концу последовательности гена adhl. Отбирают трансформанты, у которых в результате ПЦР, не нарабатывается полноразмерный ген adh1 (фиг. 5: 1 - полноразмерный ген adh1 отсутствует, 2 - полноразмерный ген adh1 присутствует, 3 - контроль). Для контроля величины фрагментов ДНК при электрофорезе используют молекулярный маркер O'GeneRuler 1000 bp DNA Ladder, размер фрагментов (сверху вниз) 250, 500, 750, 1000, 1500, 2000, 2500, 3000, 3500,4000, 5000, 6000, 8000, 10000 п.н,
Культивирование трансформантов и оценку продукции молочной кислоты осуществляют по примеру 1. Однако ферментацию проводят аэробно на качалке с 250 об/мин.
По результатам ферментации отобран трансформант, который при культивировании в пробирках синтезирует молочную кислоту в количестве 50 г/л культуральной жидкости, а побочный продукт - этанол в количестве 20 г/л.
Пример 5. Получение трансформантов дрожжей S. pombe с инактивированным геном pdc2, в хромосому которых интегрирован ген ldh из Lactobacillus acidophilus
Инактивацию гена pdc2 [NCBI Reference Sequence: NC 003421.2] осуществляют методом двойного кроссинговера [http://www-bcf.usc.edu/~forsburg/disruptions.html]. Для этого получают плазмидный вектор pCMV-aci-pdc2, содержащий интегративную экспрессионную кассету, включающую в свой состав в качестве плечей для интеграции фрагменты гена pdc2: 5'-pdc2 и 3'-pdc2. ДНК фрагмент 5'-pdc2 синтезируют методом ПЦР с использованием праймеров pr-5'-pdc21 и pr-5'-pdc2-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - BamH1 и Есо321 соответственно:
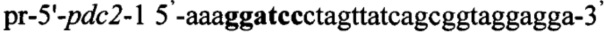 ,
,
 .
.
ДНК фрагмент 3'-pdc2 синтезируют методом ПЦР с использованием праймеров pr-3'-pdc2-1 и pr-3'-pdc2-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Есо321 и Kpn1 соответственно:
 ,
,
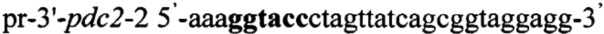 .
.
В качестве источника гена ldh используют тотальную геномную ДНК Lactobacillus acidophilus ВКПМ В-4625. Синтезируют ДНК гена ldh методом ПЦР с использованием праймеров pr-aci-1 и pr-aci-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Nhe1 и Pme1 соответственно:
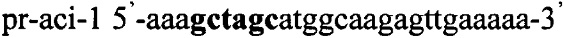 ,
,
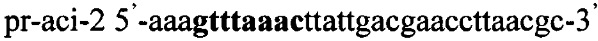 .
.
Полученную ДНК, ДНК фрагменты 5'- pdc2 и 3'- pdc2, дрожжевой селективный маркер kanМХ клонируют в вектор pUC19. Полученный таким образом плазмидный вектор pCMV-aci-pdc2 (фиг. 6), содержит в своем составе следующие генетические элементы:
1. Дрожжевой селективный маркер kanМХ, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора.
2. Ген ldh Lactobacillus acidophilus под контролем CMV промотора.
3. Область для интеграции - нуклеотидная последовательность гена pdc2.
4. Селективный маркер для клеток E. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину.
5. Бактериальный pUC origin.
Для получения интегративной экспрессионной кассеты плазмиду pCMV-aci-pdc2 обрабатывают эндонуклеазами рестрикции BamH1, Kpn1. Полученные ДНК фрагменты разделяют в агарозном геле, выделяют и очищают ДНК фрагмент, размером 5716 и.о. Полученный ДНК фрагмент является интегративной экспрессионной кассетой, содержащей в своем составе ген ldh Lactobacillus acidophilus под контролем CMV промотора; маркерный ген kanМХ, фланкированный сайтами lox 66 и lox 71, и обуславливающий у дрожжей S. pombe устойчивость к антибиотику G418; и плечи для гомологичной интеграции в хромосому. В качестве плечей для интеграции используют нуклеотидную последовательность гена pdc2.
Дрожжи S. pombe трансформируют указанной интегративной экспрессионной кассетой.
Получение и селекцию трансформантов осуществляют по примеру 1. Далее проводят отбор трансформантов с отключенным геном pdc2 по стандартной методике [http://www-bcf.ucs.edu/~forsburg/disruptions.html]. Для этого проводят ПЦР с использованием праймеров pr-5'-pdc2-1 и pr-3'-pdc2-2, гомологичных началу и концу последовательности гена pdc2. Отбирают трансформанты, у которых в результате ПЦР, не нарабатывается полноразмерный ген pdc2 (фиг. 7: 1 - контроль, 2 - полноразмерный ген pdc2 присутствует, 3 - полноразмерный ген pdc2 отсутствует). Для контроля величины фрагментов ДНК при электрофорезе используют молекулярный маркер O'GeneRuler 1000 bp DNA Ladder.
Культивирование трансформантов и оценку продукции молочной кислоты осуществляют по примеру 1. Однако ферментацию проводят аэробно на качалке с 250 об/мин.
По результатам ферментации отобран трансформант, который при культивировании в пробирках синтезирует молочную кислоту в количестве 45 г/л культуральной жидкости, а побочный продукт - этанол в количестве 25 г/л.
Пример 6. Получение трансформанта дрожжей S. pombe с инактивированным геном adh1, в хромосому которого интегрированы гены ldh из Lactobacillus acidophilus и Lactobacillus plantarum
Получают плазмидный вектор pCMV-pla-Tf1-Hyg, содержащий интегративную экспрессионную кассету. В качестве источника гена ldh используют тотальную геномную ДНК Lactobacillus plantarum ВКПМ В-7636. Синтезируют ДНК гена ldh методом ПЦР с использованием праймеров pr-pla-1 и pr-pla-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Nhe1 и Pme1 соответственно:
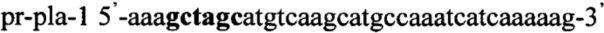 ,
,
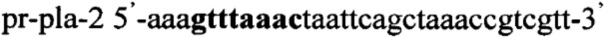 .
.
Полученную ДНК, дрожжевой селективный маркер hph, нуклеотидную последовательность ретротранспозона Tf1 клонируют в вектор pUC19. Полученный таким образом плазмидный вектор pCMV-pla-Tf1-Hyg (фиг 8) содержит в своем составе следующие генетические элементы:
1. Дрожжевой селективный маркер hph, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора.
2. Ген ldh Lactobacillus plantarum, под контролем CMV промотора; Область для интеграции - нуклеотидная последовательность ретротранспозона Tf1.
3. Селективный маркер для клеток E. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину.
4. Бактериальный pUC origin.
Для получения интегративной экспрессионной кассеты плазмиду pCMV-pla-Tf1-Hyg обрабатывают эндонуклеазами рестрикции BamH1, Nae1. Полученные ДНК фрагменты разделяют в агарозном геле, выделяют и очищают ДНК фрагмент, размером 5461 п.о. Полученный ДНК фрагмент является интегративной экспрессионной кассетой, содержащей в своем составе ген ldh Lactobacillus plantarum, под контролем CMV промотора; маркерный ген hph, фланкированный сайтами lox 66 и lox 71, и обуславливающий у дрожжей S. pombe устойчивость к антибиотику гигромицину; и плечи для гомологичной интеграции в хромосому. В качестве плечей для интеграции используют нуклеотидную последовательность ретротранспозона Tf1.
Клетки трансформанта дрожжей S. pombe с инактивированным геном adh1, несущих ген ldh из Lactobacillus acidophilus, по примеру 4, трансформируют указанной интегративной экспрессионной кассетой.
Получение, отбор и культивирование трансформантов осуществляют по примеру 1. Однако в качестве селективного агента добавляют антибиотик гигромицин в количестве 5 мг/мл, а ферментацию проводят аэробно на качалке с 250 об/мин.
По результатам ферментации отобран трансформант, который при культивировании в пробирках синтезирует молочную кислоту в количестве 90 г/л культуральной жидкости, а побочный продукт - этанол в количестве 10 г/л.
Пример 7. Получение трансформантов дрожжей S. pombe с инактивированным геном adh1, в хромосому которых интегрирован ген ldh из Lactobacillus acidophilus и Lactobacillus pentosus
Получают плазмидный вектор pCMV-pen-Tf1-Hyg, содержащий интегративную экспрессионную кассету. В качестве источника гена ldh используют тотальную геномную ДНК Lactobacillus pentosus ВКПМ В-7667. Синтезируют ДНК гена ldh методом ПЦР с использованием праймеров pr-pla-1 и pr-pla-2, содержащих на 5'-концах сайты рестрикции (выделены жирным шрифтом) для клонирования - Nhe1 и Pme1 соответственно:
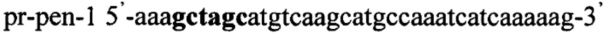 ,
,
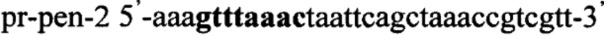 .
.
Полученную ДНК, дрожжевой селективный маркер hph, нуклеотидную последовательность ретротранспозона Tf1 клонируют в вектор pUC19. Полученный таким образом плазмидный вектор pCMV-pen-Tf1-Hyg (фиг. 9) содержит в своем составе следующие генетические элементы:
1. Дрожжевой селективный маркер hph, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора.
2. Ген ldh Lactobacillus pentosus, под контролем CMV промотора.
3. Область для интеграции - нуклеотидная последовательность ретротранспозона Tf1.
4. Селективный маркер для клеток E. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину.
5. Бактериальный pUC origin.
Для получения интегративной экспрессионной кассеты плазмиду pCMV-pen-Tf1-Hyg обрабатывают эндонуклеазами рестрикции BamH1, Nae1. Полученные ДНК фрагменты разделяют в агарозном геле, выделяют и очищают ДНК фрагмент, размером 5461 п.о. Полученный ДНК фрагмент является интегративной экспрессионной кассетой, содержащей в своем составе ген ldh Lactobacillus pentosus под контролем CMV промотора; маркерный ген hph, фланкированный сайтами lox 66 и lox 71, и обуславливающий у дрожжей S. pombe устойчивость к антибиотику гигромицину; и плечи для гомологичной интеграции в хромосому. В качестве плечей для интеграции используют нуклеотидную последовательность ретротранспозона Tf1.
Клетки трансформанта дрожжей S. pombe с инактивированным геном adh1, несущих ген ldh из Lactobacillus acidophilus, по примеру 4, трансформируют указанной интегративной экспрессионной кассетой.
Получение, отбор и культивирование трансформантов осуществляют по примеру 1. Однако в качестве селективного агента добавляют антибиотик гигромицин в количестве 5 мг/мл, а ферментацию проводят аэробно на качалке с 250 об/мин.
По результатам ферментации отобран трансформант 7-5, который при культивировании в пробирках синтезирует молочную кислоту в количестве 90 г/л культуральной жидкости, а побочный продукт - этанол в количестве 10 г/л.
Важно отметить, что общей характеристикой для всех трансформантов, полученных по примерам 1-7 является следующее. Если для любого из полученных в примерах трансформантов при проведении ПЦР использовать его хромосому и проверочные селективные праймеры Pr-1 и Pr-2
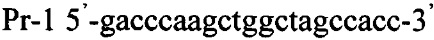 ,
,
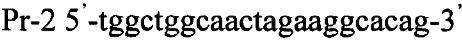 ,
,
то образующийся в ходе полимеразной цепной реакции ДНК фрагмент характеризуется размером, попадающим в интервал 1031-1050 п.н., что дает возможность осуществлять их идентификацию.
На фиг. 10 приведена электрофореграмма ПЦР-анализа полученных трансформантов (примеры 1-7, 8-контроль). Для контроля величины фрагментов ДНК при электрофорезе используют молекулярный маркер O'GeneRuler 1000 bp DNA Ladder.
Пример 8. Способ микробиологического синтеза молочной кислоты с использованием трансформанта с инактивированным геном adh1. в хромосому которого интегрирован ген ldh из Lactobacillus acidophilus и Lactobacillus pentosus
В качестве посевной культуры используют клетки трансформанта 7.5, полученного по примеру 7.
Посевную культуру выращивают при 30°С в течение 2 суток на чашках Петри на агаризованной среде YPD (мас. %: дрожжевой экстракт - 1, пептон - 2, агар - 2, вода - остальное) с добавлением глюкозы (2 мас. %).
Для получения инокулята пробирки (50 мл) с 10 мл жидкой питательной среды YPD с добавлением глюкозы (2 мас. %) засевают посевной культурой. Пробирки инкубируют на качалке (240 об/мин) при 30°С в течение 24 ч.
Колбу объемом 750 мл, содержащую 95 мл среды состава (мас. %): дрожжевой экстракт - 0,5, пептон - 1, вода - остальное с добавлением глюкозы (18 мас. %), засевают 5 мл инокулята.
Культивирование осуществляют на качалке со скоростью 250 об/мин при температуре 30°С в течение 72 часов. При культивировании в колбе трансформант 7.5 секретирует молочную кислоту в количестве 98 г/л культуральной жидкости, продукция побочного продукта этанола составляет 6 г/л.
Таким образом, полученные трансформанты могут быть использованы в качестве продуцентов молочной кислоты, позволяющих в промышленно приемлемых условиях получать хорошую продукцию молочной кислоты при небольшой концентрации побочного продукта.
Показано, что совместная работа нескольких предложенных лактатдегидрогеназ в дрожжах S. pombe позволяет получать штаммы, эффективно продуцирующие молочную кислоту, сравнимые по уровню продукции с лучшими мировыми аналогами.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ модификации дрожжей Schizosaccharomyces pombe с помощью Cre-lox системы бактериофага Р1, трансформант, полученный таким способом | 2016 |
|
RU2652877C9 |
| Штамм Schizosaccharomyces pombe - продуцент молочной кислоты | 2016 |
|
RU2650669C1 |
| Мутант Schizosaccharomyces pombe в качестве штамма-реципиента и продуценты молочной кислоты, полученные на его основе | 2023 |
|
RU2827573C1 |
| Штамм дрожжей Schizosaccharomyces pombe, продуцирующий L-молочную кислоту, содержащий в составе хромосомы гены трех различных гетерологичных лактатдегидрогеназ | 2020 |
|
RU2752896C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ Schizosaccharomyces pombe - ПРОДУЦЕНТ МОЛОЧНОЙ КИСЛОТЫ | 2013 |
|
RU2539092C1 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА МОЛОЧНОЙ КИСЛОТЫ И РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ SCHIZOSACCHAROMYCES POMBE ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2004 |
|
RU2268304C1 |
| Микроорганизм, продуцирующий молочную кислоту, и способ продуцирования молочной кислоты с его использованием | 2016 |
|
RU2711983C2 |
| ПОЛИПЕПТИД, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ D-ЛАКТАТДЕГИДРОГЕНАЗЫ, ПОЛИНУКЛЕОТИД, КОДИРУЮЩИЙ ЭТОТ ПОЛИПЕПТИД, И СПОСОБ ПОЛУЧЕНИЯ D-МОЛОЧНОЙ КИСЛОТЫ | 2010 |
|
RU2553563C2 |
| Трансформант дрожжей Pichia pastoris, продуцирующий ксиланазу | 2019 |
|
RU2714113C1 |
| Трансформант дрожжей Pichia pastoris, продуцирующий бета-глюканазу | 2019 |
|
RU2720914C1 |
Группа изобретений относится к микробиологии и биотехнологии и касается получения трансформантов дрожжей Schizosaccharomyces pombe, продуцирующих молочную кислоту. Предложен трансформант, несущий ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%. Также предложен трансформант, несущий ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%, в котором инактивирован или делетирован один или несколько генов, кодирующих ферменты, участвующие в пути биосинтеза этанола. Предложен трансформант, несущий ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus acidophilus, или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%, и ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus plantarum или Lactobacillus pentosus. Предложен трансформант, несущий ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%, и ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus plantarum или Lactobacillus pentosus, в котором инактивирован или делетирован один или несколько генов, кодирующих ферменты, участвующие в пути биосинтеза этанола. Также предложены варианты способа получения указанных трансформантов и способ микробиологического синтеза молочной кислоты. Группа изобретений обеспечивает эффективную продукцию молочной кислоты при небольшой концентрации побочного продукта. 9 н. и 4 з.п. ф-лы, 10 ил., 8 пр.
1. Трансформант дрожжей Schizosaccharomyces pombe, продуцирующий молочную кислоту, содержащий ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%.
2. Трансформант по п.1, в котором указанный ген ldh интегрирован в состав хромосомы.
3. Трансформант по п.1, в котором в качестве фермента, аминокислотная последовательность которого гомологична лактатдегидрогеназе из Lactobacillus acidophilus не менее чем на 93%, используют лактатдегидрогеназу из Lactobacillus kitasatonis, или Lactobacillus ultunensis, или Lactobacillus crispatus, или Lactobacillus gallinarum, или Lactobacillus amylovorus, или Lactobacillus kefiranofaciens.
4. Трансформант дрожжей Schizosaccharomyces pombe, продуцирующий молочную кислоту, содержащий ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%, в котором инактивирован или делетирован один или несколько генов, кодирующих ферменты, участвующие в пути биосинтеза этанола.
5. Трансформант по п.4, в котором инактивирован ген adh1 и/или pdc2.
6. Трансформант дрожжей Schizosaccharomyces pombe, продуцирующий молочную кислоту, содержащий ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%, и ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus plantarum или Lactobacillus pentosus.
7. Трансформант дрожжей Schizosaccharomyces pombe продуцирующий молочную кислоту, содержащий ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее, чем на 93%, и ген ldh, кодирующий лактатдегидрогеназу из Lactobacillus plantarum или Lactobacillus pentosus, в котором инактивирован или делетирован один или несколько генов, кодирующих ферменты, участвующие в пути биосинтеза этанола.
8. Трансформант по п.7, в котором инактивирован ген adh1 и/или pdc2.
9. Способ получения трансформанта по п.1, включающий введение в клетки дрожжей Schizosaccharomyces pombe гена ldh, кодирующего лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%.
10. Способ получения трансформанта по п.4, включающий введение в клетки дрожжей Schizosaccharomyces pombe гена ldh, кодирующего лактатдегидрогеназу, из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%, и инактивацию или делетирование одного или нескольких генов, кодирующих ферменты, участвующие в пути биосинтеза этанола.
11. Способ получения трансформанта по п.6, включающий введение в клетки дрожжей Schizosaccharomyces pombe гена ldh, кодирующего лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%, и гена ldh, кодирующего лактатдегидрогеназу из Lactobacillus plantarum или Lactobacillus pentosus.
12. Способ получения трансформанта по п.7, включающий введение в клетки дрожжей Schizosaccharomyces pombe гена ldh, кодирующего лактатдегидрогеназу из Lactobacillus acidophilus или фермент, аминокислотная последовательность которого гомологична ей не менее чем на 93%, гена ldh, кодирующего лактатдегидрогеназу из Lactobacillus plantarum или Lactobacillus pentosus, и инактивацию или делетирование одного или нескольких генов, кодирующих ферменты, участвующие в пути биосинтеза этанола.
13. Способ микробиологического синтеза молочной кислоты, включающий культивирование дрожжей Schizosaccharomyces pombe в питательной среде, отличающийся тем, что для культивирования используют трансформант по пп.1-8.
| US 20150232895 A1, 20.08.2015 | |||
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ Schizosaccharomyces pombe - ПРОДУЦЕНТ МОЛОЧНОЙ КИСЛОТЫ | 2013 |
|
RU2539092C1 |
| US 20120214214 A1, 23.08.2012 | |||
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА МОЛОЧНОЙ КИСЛОТЫ И РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ SCHIZOSACCHAROMYCES POMBE ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2004 |
|
RU2268304C1 |
| СПОСОБ ПОЛУЧЕНИЯ АРОМАТИЧЕСКОЙ L-АМИНОКИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН ydiB, СПОСОБ ПОЛУЧЕНИЯ СЛОЖНОГО ЭФИРА НИЗШИХ АЛКИЛОВ АЛЬФА-L-АСПАРТИЛ-L-ФЕНИЛАЛАНИНА | 2007 |
|
RU2355759C1 |
| US 20050112737 A1, 26.05.2005. | |||
Авторы
Даты
2017-03-23—Публикация
2015-12-22—Подача