Изобретение относится к фармацевтической промышленности и касается новой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида (диоксидин - международное непатентованное название), которая может быть использована в медицине в качестве противомикробного, антибактериального и бактерицидного средства.
Известны фармацевтические композиции, содержащие 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксид (диоксидин) [ФС 42-2550-94; ФС 42-2308-97; ФС 42-1858-98; ФС 42-2805-97], [RU №2535156 C1 от 11.10.2013, RU №2491069 C1 от 22.05.2012, RU №2471477 C1 от 24.10.2011, RU №2455992 С1 от 13.07.2011, RU №2436567 С1 от 24.12.2010, RU №2362543 С1 от 12.12.2007, RU №2355750 С1 от 12.12.2007, RU №2354353 С1 от 02.10.2007, RU №2333759 С1 от 10.07.2007, RU №2323718 С2 от 17.04.2006, RU №2304589 С1 от 15.02.2006, RU №2284824 С1 от 18.03.2005, RU №2278668 C1 от 08.12.2004, RU №2259820 С1 от 23.01.2004, RU №2384335 С1 от 17.11.2008, RU №2371166 С2 от 12.12.2007, RU №2286800 С1 от 11.05.2005, RU №2272627 С1 от 14.07.2004, RU №2272614 С1 от 23.06.2004, RU №2246292 С2 от 22.04.2003, RU №2192850 С2 от 20.07.2000, RU №2180559 С1 от 18.04.2001, RU №2175549 С1 от 26.10.2000, RU №2160092 С2 от 16.02.1998, RU №2144816 С1 от 07.08.1997, RU №2013145666 A от 11.10.2013, RU №2007112568 А от 04.04.2007, RU №2004129492 A от 08.10.2004, RU №97111624 А от 09.07.1997, RU №97109470 A от 23.06.1997, RU №96121717 А от 30.10.1996, RU №96117139 А от 22.08.1996, RU №96116440 А от 08.08.1996, RU №95118013 А от 12.10.1995, RU №95108977 A1 от 30.05.1995, RU №94023800 A1 от 28.04.1995, RU №94003881 A1 от 25.01.1994, RU №94001992 A1 от 18.01.1994, RU №93010126 А от 26.02.1993, RU №93003030 А от 21.01.1993], и те, которые могут содержать кристаллическую α-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида как один из возможных компонентов [RU №2489147 С2 от 31.08.2011, RU №2354379 С1 от 13.08.2007, RU №2275179 С2 от 22.07.2004, RU №2209067 С1 от 28.12.2001, RU №2220740 С1 от 30.08.2002, RU №2220738 С1 от 30.08.2002, RU №2545798 С1 от 24.03.2014, RU №2010145246 A от 09.11.2010, RU №2008100440 A от 09.01.2008, RU №2003103114 A от 04.02.2003, RU №2002133111 А от 11.12.2002, RU №2002131487 А от 25.11.2002, RU №94006956 А1 от 28.02.1994], в том числе композиции, содержащие, помимо кристаллической α-модификации диоксидина, наночастицы серебра [RU №2545798 С1 от 24.03.2014, RU №2220738 C1 от 30.08.2002, RU №2012141671 A от 02.10.2012, RU №2008149066 A от 15.12.2008, RU №2002123272 A от 10.03.2004, RU №96117139 A от 22.08.1996, RU №2006124431 A от 10.07.2006, RU №2003115756 A от 29.05.2003]. Недостатком вышеописанных композиций является их сложный состав (большое число компонентов), а также использование кристаллической α-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, обладающей меньшей противомикробной, антибактериальной и бактерицидной активностью по сравнению с кристаллической β-модификацией диоксидина.
Наиболее близкой по технической сущности и достигаемому результату является фармацевтическая композиция, содержащая терапевтически эффективное количество кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида и, по меньшей мере, один фармацевтически приемлемый растворитель [положительное решение от 23.06.2015 на заявку RU №2014114406 от 11.04.2014]. Кристаллическая β-модификация 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида отличается от известной кристаллической модификации диоксидина дифрактограммой рентгенофазового анализа: определенного набора межплоскостных расстояний 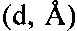 , углов 2θ° и их интенсивностей (Iотн., = Ii/Imax×100, %). Кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида для композиции [положительное решение от 23.06.2015 на заявку RU №2014114406 от 11.04.2014] получают сублимационной сушкой в течение 22-27 часов замороженного при скорости не менее 60 град/мин водного раствора диоксидина, имеющего температуру от 20°C до 100°C. Известная композиция обладает противомикробной, антибактериальной и бактерицидной активностью.
, углов 2θ° и их интенсивностей (Iотн., = Ii/Imax×100, %). Кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида для композиции [положительное решение от 23.06.2015 на заявку RU №2014114406 от 11.04.2014] получают сублимационной сушкой в течение 22-27 часов замороженного при скорости не менее 60 град/мин водного раствора диоксидина, имеющего температуру от 20°C до 100°C. Известная композиция обладает противомикробной, антибактериальной и бактерицидной активностью.
Сходство заявляемой фармацевтической композиции, содержащей β-модификацию диоксидина с известной композицией [положительное решение от 23.06.2015 на заявку RU №2014114406 от 11.04.2014], заключается в том, что они содержат кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида.
Отличие заявляемой фармацевтической композиции, содержащей кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, обладающую противомикробной, антибактериальной и бактерицидной активностью, от известной композиции, содержащей β-модификацию диоксидина и, по меньшей мере, один фармацевтически приемлемый растворитель [положительное решение от 23.06.2015 на заявку RU №2014114406 от 11.04.2014], состоит в том, что предлагаемая композиция дополнительно содержит наночастицы серебра. Кроме того, известная композиция представляет собой раствор, а заявляемая новая фармацевтическая композиция - представляет собой легкий, пушистый порошок от желтоватого до светло-коричневого цвета, без запаха.
Целью изобретения является улучшение противомикробной, антибактериальной и бактерицидной активности фармацевтической композиции на основе β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида и разработка способа ее получения.
Поставленная цель достигнута предложенной композицией, обладающей противомикробной, антибактериальной и бактерицидной активностью, состоящей из кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, характеризующейся следующим набором межплоскостных расстояний d, 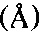 и соответствующих им интенсивностей I/I100 (%): 8,742-82,6%; 8,058-75,8%; 7,721-22,8%; 6,936-56,3%; 6,695-31,9%; 6,297-52,9%; 6,007-41,6%; 5,796-11,3%; 5,402-17,4%; 5,212-18,8%; 4,957-32,4%; 4,503-22,5%; 4,354-26,5%; 4,092-27,0%; 4,022-21,0%; 3,920-24,9%; 3,686-29,4%; 3,542-18,9%; 3,455-41,6%; 3,362-100,0%; 3,313-70,0%; 3,215 -32,6%; 3,159-21,2%; 2,991-12,6%; 2,911-15,3%; 2,797-10,7%; 2,669 -9,0%; 2,608-10,5%; 2,542-9,5%; 2,488-8,6%; 2,376-10,8%; 2,290-8,1%; 2,255-9,9%; 2,082-7,9%; 1,970-7,2%; 1,705-7,1%, и наночастиц серебра, при следующем соотношении компонентов, мас. %:
и соответствующих им интенсивностей I/I100 (%): 8,742-82,6%; 8,058-75,8%; 7,721-22,8%; 6,936-56,3%; 6,695-31,9%; 6,297-52,9%; 6,007-41,6%; 5,796-11,3%; 5,402-17,4%; 5,212-18,8%; 4,957-32,4%; 4,503-22,5%; 4,354-26,5%; 4,092-27,0%; 4,022-21,0%; 3,920-24,9%; 3,686-29,4%; 3,542-18,9%; 3,455-41,6%; 3,362-100,0%; 3,313-70,0%; 3,215 -32,6%; 3,159-21,2%; 2,991-12,6%; 2,911-15,3%; 2,797-10,7%; 2,669 -9,0%; 2,608-10,5%; 2,542-9,5%; 2,488-8,6%; 2,376-10,8%; 2,290-8,1%; 2,255-9,9%; 2,082-7,9%; 1,970-7,2%; 1,705-7,1%, и наночастиц серебра, при следующем соотношении компонентов, мас. %:
Выбор соотношения компонентов заявляемой фармацевтической композиции обусловлен тем, что уменьшение содержания серебра в составе композиции меньше 0,05 мас. % приводит к снижению ее противомикробной, антибактериальной и бактерицидной активности. Она становится равной активности чистой β-модификации диоксидина.
Увеличение содержания серебра в заявляемой фармацевтической композиции больше 4,00 мас. % нежелательно в связи с токсичным действием композиций с высоким содержанием серебра (серебро относят к тяжелым металлам) на организм человека.
Предложенная фармацевтическая композиция может быть использована для приготовления различных лекарственных форм: растворов, суспензий, мазей, кремов, свечей, таблеток и др.
Поставленная цель достигнута также способом получения заявляемой фармацевтической композиции, который состоит в том, что к водному раствору 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, имеющему температуру от 20°C до 100°C, добавляют при перемешивании наночастицы серебра или диоксидин при температурах от 20°C до 100°C, растворяют в смеси, содержащей необходимое количество приготовленных ранее наночастиц серебра, и полученную систему замораживают при скорости не менее 60 град/мин с последующей сублимационной сушкой в течение 22-27 часов. При этом в качестве исходной субстанции при растворении используют как α- так и β-кристаллические модификации диоксидина.
В качестве суспензии, содержащей наночастицы серебра, могут быть использованы как готовые промышленные коллоидные растворы, так и системы, синтезированные специально для получения фармацевтической композиции.
Приготовление водного раствора исходного диоксидина при повышенных температурах было использовано для ускорения процесса его растворения.
Уменьшение температуры растворения диоксидина ниже комнатной температуры (20°C) нецелесообразно, поскольку требует дополнительных затрат энергии на охлаждение системы.
Увеличение температуры растворения диоксидина выше 100°C также нецелесообразно из-за необходимости применения специального оборудования.
При уменьшении скорости замораживания менее 60 град/мин скорость криокристаллизации водного раствора диоксидина уменьшается и приближается к равновесному процессу. Это приводит к получению фармацевтической композиции, состоящей из нанокристаллов как β-, так и α-модификаций диоксидина, включающих наночастицы серебра. Это уменьшает противомикробную, антибактериальную и бактерицидную активность получаемой фармацевтической композиции.
Сублимационная сушка замороженной смеси «диоксидин-наночастицы серебра» необходима для получения однородного, не агрегированного порошка фармацевтической композиции. Предпочтительным режимом сублимационной сушки является сушка, которую проводят при температурах: на конденсаторе (-40…-56)°C; на продукте (-196…+50)°C и остаточном давлении в камере (3-8)⋅10-2 Topp в течение 22-27 ч.
Уменьшение времени сублимационной сушки меньше 22 ч приводит к получению невысохшего продукта: «порошок диоксидина - его замороженный раствор». Система при комнатной температуре плавится, порошок частично растворяется и перекристаллизовывается, что также приводит к получению композиции, состоящей из кристаллов как β-, так и α-модификации диоксидина, включающих наночастицы серебра. Это уменьшает противомикробную, антибактериальную и бактерицидную активность получаемой фармацевтической композиции.
Увеличение времени сублимационной сушки больше 27 ч нецелесообразно, так как не приводит к увеличению выхода целевого продукта - фармацевтической композиции - кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, содержащей наночастицы серебра и лишь удорожает процесс.
Из патентной и научно-технической литературы не известны заявляемая фармацевтическая композиция, обладающая противомикробной, антибактериальной и бактерицидной активностью, состоящая из кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, характеризующаяся определенным набором дифракционных максимумов 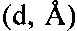 , их интенсивностью (Iотн., %), и наночастиц серебра, и способ ее получения.
, их интенсивностью (Iотн., %), и наночастиц серебра, и способ ее получения.
Нами предложена новая, неизвестная ранее фармацевтическая композиция, обладающая противомикробной, антибактериальной и бактерицидной активностью, состоящая из кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, характеризующаяся определенным набором дифракционных максимумов 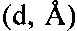 и их интенсивностью (Iотн., %), и наночастиц серебра, и предложен способ ее получения.
и их интенсивностью (Iотн., %), и наночастиц серебра, и предложен способ ее получения.
Для пояснения сущности заявляемого технического решения к описанию приложены следующие таблицы:
Таблица 1. Углы 2θ, межплоскостные расстояния 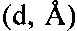 и их интенсивности (Iотн., %) кристаллической β-модификации диоксидина [положительное решение от 23.06.2015 на заявку RU №2014114406 от 11.04.2014].
и их интенсивности (Iотн., %) кристаллической β-модификации диоксидина [положительное решение от 23.06.2015 на заявку RU №2014114406 от 11.04.2014].
Таблица 2. Углы 2θ, межплоскостные расстояния 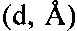 и их интенсивности (Iотн., %) фармацевтической композиции, содержащей кристаллическую β-модификацию диоксидина и наночастицы серебра.
и их интенсивности (Iотн., %) фармацевтической композиции, содержащей кристаллическую β-модификацию диоксидина и наночастицы серебра.
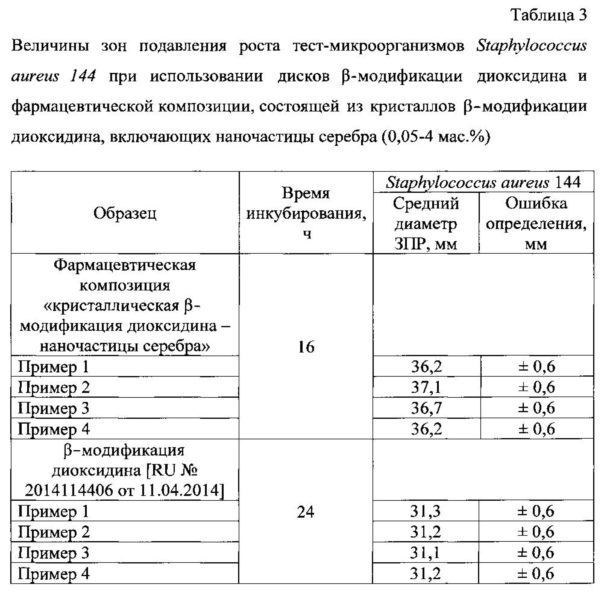
Таблица 3. Величины зон подавления роста тест-микроорганизмов Staphylococcus aureus 144 при использовании дисков β-модификации диоксидина и фармацевтической композиции, состоящей из кристаллов β-модификации диоксидина, включающих наночастицы серебра (0,05-4 мас. %).
Таблица 4. Величины зон подавления роста тест-микроорганизмов Escherichia coli 52 при использовании дисков, пропитанных водным раствором β-модификации диоксидина, водным раствором фармацевтической композиции, состоящей из кристаллической β-модификации диоксидина, включающей наночастицы серебра (0,05-4 мас. %), и водными растворами коллоидного серебра с концентрацией серебра, и способов приготовления, аналогичных концентрации серебра и способу приготовления в фармацевтической композиции.
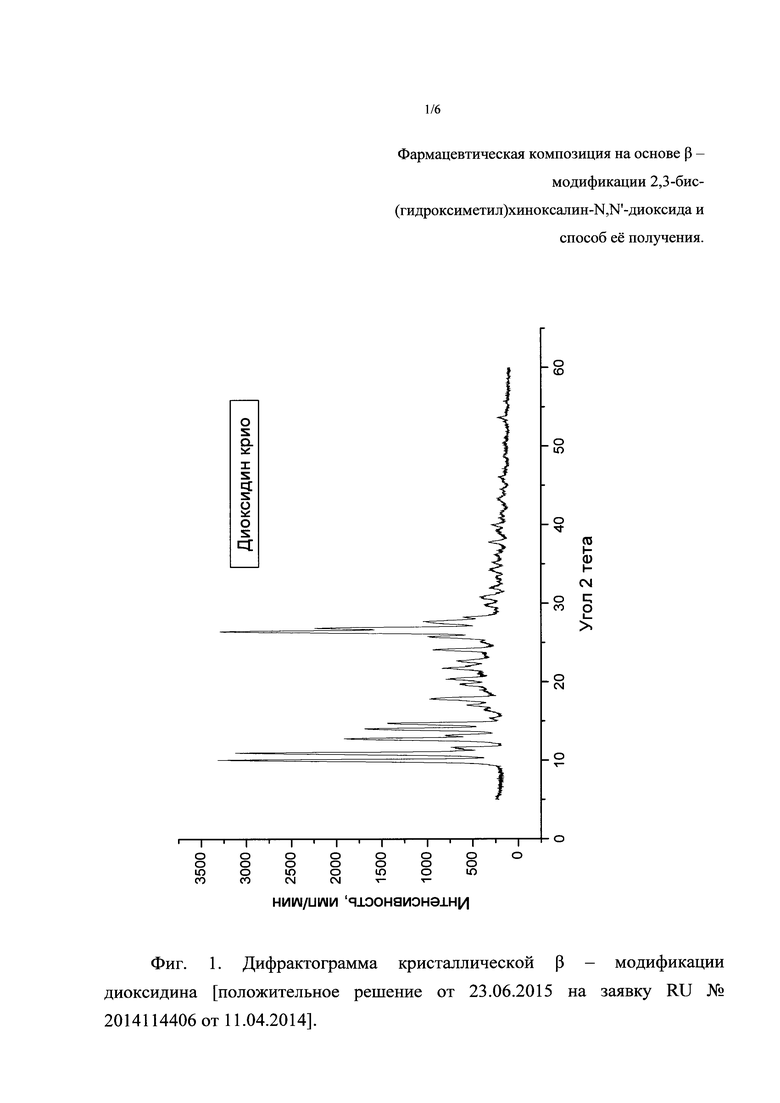
Фиг. 1. Дифрактограмма кристаллической β-модификации диоксидина [положительное решение от 23.06.2015 на заявку RU №2014114406 от 11.04.2014].
Фиг. 2. Типичная дифрактограмма фармацевтической композиции, содержащей кристаллическую β-модификацию диоксидина и наночастицы серебра.
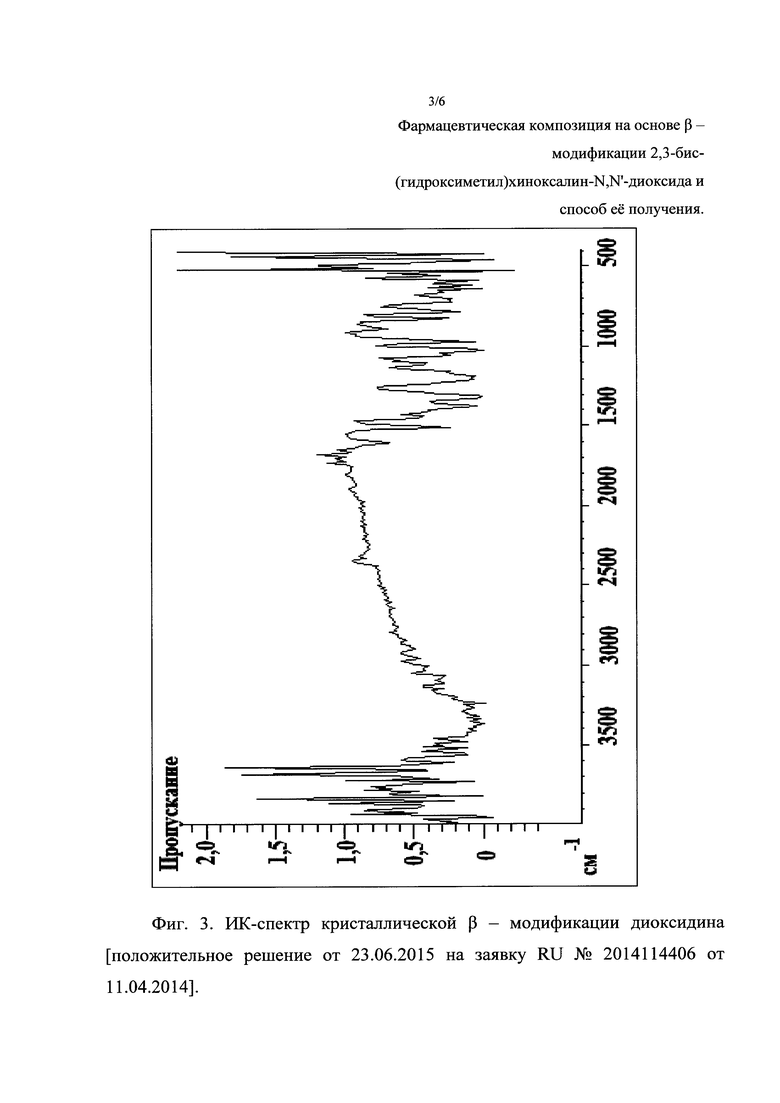
Фиг. 3. ИК-спектр кристаллической β-модификации диоксидина [положительное решение от 23.06.2015 на заявку RU №2014114406 от 11.04.2014].
Фиг. 4. Типичный ИК-спектр фармацевтической композиции, содержащей кристаллическую β-модификацию диоксидина и наночастицы серебра.
Фиг. 5. Типичная электронная микрофотография фармацевтической композиции, содержащей кристаллическую β-модификацию диоксидина и наночастицы серебра.
Фиг. 6. Типичная электронная дифрактограмма наночастиц серебра в фармацевтической композиции, содержащей кристаллическую β-модификацию диоксидина и наночастицы серебра.
Возможность осуществления предлагаемого изобретения иллюстрируется следующими примерами, но не ограничивается ими.
Пример 1. Для получения заявляемой фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра», содержащей 0,05 мас. % наночастиц серебра, 2,00 г кристаллической α-модификации диоксидина, при температуре 100°C при интенсивном перемешивании растворяют в 47,50 г дистиллированной воды и добавляют 0,50 г 0,2 мас. % раствора коллоидного серебра. Полученную смесь замораживают со скоростью (3-4)⋅102 град/мин вливанием раствора в предварительно охлажденный и наполненный жидким азотом (Ткип=-196°C) поддон из нержавеющей стали. Замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе (-40…45)°C; на продукте (-196…+30)°C, и остаточном давлении в камере (3-6)⋅10-2 Topp в течение 27 ч. Выход продукта составил 1,96 г (98,0 мас. %).
Для подтверждения состава и определения противомикробной, антибактериальной и бактерицидной активности фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» был проведен комплекс физико-химических и биологических методов анализа.
Рентгенофазовый анализ (РФА) фармацевтической композиции проводили на дифрактометре Rigaku D/MAX-2500 (Rigaku, Япония) на CuKα излучении (λ=1,54056  ). Известная из литературного источника [положительное решение от 23.06.2015 на заявку RU №2014114406 от 11.04.2014] дифрактограмма кристаллической β-модификации диоксидина, набор межплоскостных расстояний и их интенсивности представлены на фиг. 1 и в табл. 1. Дифрактограмма полученной фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра», набор межплоскостных расстояний и их интенсивности представлены на фиг. 2 и в табл. 2. Сравнение полученных данных, представленных в табл. 1 и табл. 2, а также на фиг. 1 и фиг. 2, свидетельствует о том, что, в пределах ошибки определения, полученная композиция содержит кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида. Отметим, что несовпадение интенсивностей дифракционных максимумов кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида и фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» связано с текстурированием (упорядочением частиц порошка) образцов фармацевтической композиции.
). Известная из литературного источника [положительное решение от 23.06.2015 на заявку RU №2014114406 от 11.04.2014] дифрактограмма кристаллической β-модификации диоксидина, набор межплоскостных расстояний и их интенсивности представлены на фиг. 1 и в табл. 1. Дифрактограмма полученной фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра», набор межплоскостных расстояний и их интенсивности представлены на фиг. 2 и в табл. 2. Сравнение полученных данных, представленных в табл. 1 и табл. 2, а также на фиг. 1 и фиг. 2, свидетельствует о том, что, в пределах ошибки определения, полученная композиция содержит кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида. Отметим, что несовпадение интенсивностей дифракционных максимумов кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида и фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» связано с текстурированием (упорядочением частиц порошка) образцов фармацевтической композиции.
ИК-спектры фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» получали на ИК-фурье-спектрометре марки "ИКАР" опытного производства ФИАН РАН. Регистрацию ИК-спектров порошкообразных образцов осуществляли по стандартной методике в прессованных таблетках бромистого калия. Содержание фармацевтической композиции по массе в смеси с бромистым калием составляло 0,6 мас. %, толщина таблетки 0,5 мм. Полученные результаты приведены на фиг. 3. Сравнение ИК-спектра полученной фармацевтической композиции (фиг. 3) и ИК-спектра известной из литературного источника [положительное решение от 23.06.2015 на заявку RU №2014114406 от 11.04.2014] (фиг. 4) кристаллической β-модификации диоксидина показало, что спектры в инфракрасной области (400-4000) см-1 практически полностью идентичны. Это свидетельствует о том, что полученная фармацевтическая композиция содержит кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида.
Просвечивающую электронную микроскопию (ПЭМ) проводили на электронном микроскопе JSM 6380 LA при увеличениях ×100-×20000. Электронная микрофотография полученной композиции и электронная дифрактограмма наночастиц серебра, входящих в состав полученной фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» представлены на фиг. 5 и фиг. 6 соответственно. Полученные данные свидетельствуют о том, что полученная фармацевтическая композиция содержит наночастицы серебра со средним диаметром частиц 9-11 нм, заключенные внутри наночастиц β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида диаметром 50-500 нм.
Таким образом, проведенные физико-химические эксперименты показали, что заявляемая фармацевтическая композиция «диоксидин-наночастицы серебра» содержит как кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, так и наночастицы серебра.
Определение активности кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида и предлагаемой фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» осуществляли по изучению устойчивости микроорганизмов диско-диффузионным методом [Определение чувствительности к антибактериальным препаратам. Под ред. Онищенко Г.Г. «Клиническая микробиология, антимикробная химиотерапия», 2004 г., том 6, №4, с. 306-359]. В качестве тест-культур использовали бактерии, полученные из коллекции культур кафедры микробиологии, биологического факультета МГУ им. М.В. Ломоносова: Staphylococcus aureus 144. Эксперименты проводили в стерильных чашках Петри, содержащих по 20 мл агаризованной (ПД-агар) питательной среды (толщина слоя 4 мм), выдержанной в течение суток. Приготовление бактериальной суспензии исследуемого тест-микроорганизма и посев ею среды проводили следующим образом. Одну или две полные микробиологические петли с культурой вносили в 5 мл стерильной дистиллированной воды. Взбалтывали полученную суспензию в течение 30 сек и определяли ее концентрацию по оптической плотности [спектрофотометр ПЭ-530 ВИ (РФ)] при λ=625 нм, сравнивая полученную величину с оптической плотностью предварительно приготовленного 0,5 стандарта МакФарланда (эквивалентна 1,5⋅108 КОЕ/мл). После этого 100 мкл суспензии культуры помещали на поверхность среды в чашки Петри, тщательно растирали стерильным шпателем, через 15 мин в них вносили кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида и предлагаемой фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» в виде спрессованных дисков диаметром (6,00±0,02) мм, высотой (3,11±0,06) мм и массой (96±2) мг, помещали в термостат и инкубировали при 30°C. Для получения надежных результатов в параллельных сериях опытов использовали не менее 5ти дисков. Контроль результатов роста тест-культур и измерение зон подавления их роста проводили через 16 и 24 ч инкубации. Диаметр зон подавления роста (ЗПР) измеряли линейкой в 3х направлениях для каждого диска, с точностью до 0,5 мм. Полученные в микробиологических экспериментах результаты приведены в табл. 3 (Пример 1). Видно, что зоны подавления роста тест-культур предлагаемой фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» больше при всех временах инкубации, чем при использовании дисков из кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида и, следовательно, заявляемая новая композиция более активна к процессам подавления роста микроорганизмов, то есть обладает более выраженным противомикробным, антибактериальным и бактерицидным действием.
Определение активности кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, предлагаемой фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» и раствора коллоидного серебра с концентрацией серебра и способом приготовления, аналогичными концентрации серебра и способу приготовления в фармацевтической композиции по примеру 1, осуществляли по изучению устойчивости микроорганизмов Escherichia coli 52 диско-диффузионным методом при использовании дисков из фильтровальной бумаги «черная лента», пропитанных водными растворами 500, 1000 и 2000 мкг/мл β-модификации диоксидина, фармацевтической композиции, состоящей из кристаллической β-модификации диоксидина, включающих наночастицы серебра, или раствором коллоидного серебра с концентрацией серебра и способом приготовления, аналогичными концентрации серебра и способу приготовления в фармацевтической композиции по примеру 1. Контроль результатов роста тест-культур и измерение зон подавления их роста проводили через 24 и 48 ч инкубации. Полученные данные приведены в табл. 4 (Пример 1). Видно, что зоны подавления роста тест-культур предлагаемой фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» больше при всех временах инкубации, чем при использовании дисков, пропитанных растворами кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, и дисков, пропитанных растворами коллоидного серебра, с концентрацией серебра и способом приготовления, аналогичными концентрации серебра и способу приготовления в фармацевтической композиции по примеру 1, и, следовательно, предложенная фармацевтическая композиция более активна к процессам подавления роста микроорганизмов и из раствора, т.е. обладает более выраженным противомикробным, антибактериальным и бактерицидным действием.

Пример 2. Для получения заявляемой фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра», содержащей 4,00 мас. % наночастиц серебра, 20,00 г раствора коллоидного серебра с концентрацией 0,40 мас. % прибавляют к 78,00 г дистиллированной воды и в полученной смеси при температуре 50°C при интенсивном перемешивании растворяют 1,92 г кристаллической β-модификации диоксидина. Полученную смесь замораживают со скоростью 2⋅103 град/мин распылением раствора пневматической форсункой при избыточном давлении 0,7 кг/см2 в реактор, наполненный жидким азотом (Ткип.=-196°C). Полученный замороженный продукт помещают на поддон из нержавеющей стали, переносят его в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе (-50…-56)°C; на продукте (-196…+50)°C, и остаточном давлении в камере (5-8)⋅10-2 Topp в течение 22 ч. Выход продукта составил 1,90 г (95,00 мас. %).
Для подтверждения состава фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» был проведен комплекс физико-химических методов анализа аналогично примеру 1. Оказалось, что полученная фармацевтическая композиция «кристаллическая β-модификация диоксидина-наночастицы серебра» состоит из кристаллической β-модификации диоксидина и наночастиц серебра. Причем наночастицы серебра имеют средний диаметр частиц 9-11 нм и заключены в крупные, диаметром 50-500, нм наночастицы β-модификации диоксидина.
Определение активности предлагаемой фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра», кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида и водного раствора коллоидного серебра с концентрацией серебра и способом приготовления, аналогичными концентрации серебра и способу приготовления в фармацевтической композиции по примеру 2, осуществляли по изучению устойчивости микроорганизмов диско-диффузионным методом и проводили по методикам, представленным в примере 1. Полученные данные приведены в табл. 3 (Пример 2) и в табл. 4 (Пример 2). Видно, что зоны подавления роста тест-культур заявляемой фармацевтической композицией «кристаллическая β-модификация диоксидина-наночастицы серебра» больше при всех временах инкубации, чем при использовании спрессованных дисков и дисков, пропитанных водным раствором β-модификации диоксидина, а также дисков, пропитанных раствором коллоидного серебра, с концентрацией серебра и способом приготовления, аналогичными концентрации серебра и способу приготовления в фармацевтической композиции по примеру 2, и, следовательно, предложенная фармацевтическая композиция более активна к процессам подавления роста микроорганизмов, т.е. обладает более выраженным противомикробным, антибактериальным и бактерицидным действием.
Пример 3. Для получения заявляемой фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра», содержащей 2,00 мас. % наночастиц серебра, 10,00 г раствора коллоидного серебра с концентрацией 0,4 мас. % прибавляют к 88,00 г дистиллированной воды и в полученной смеси при температуре 80°C при интенсивном перемешивании растворяют 1,96 г кристаллической α-модификации диоксидина. Полученную смесь замораживают со скоростью 2⋅103 град/мин распылением раствора пневматической форсункой при избыточном давлении 0,7 кг/см2 в реактор, наполненный жидким азотом (Ткип.=-196°C). Полученный замороженный продукт помещают на поддон из нержавеющей стали, переносят его в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе (-50…-56)°C; на продукте (-196…+50)°C, и остаточном давлении в камере (5-8)⋅10-2 Торр в течение 25 ч. Выход продукта составил 1,92 г (96,00 мас. %).
Для подтверждения состава фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» был проведен комплекс физико-химических методов анализа аналогично примеру 1. Оказалось, что полученная фармацевтическая композиция «кристаллическая β-модификация диоксидина-наночастицы серебра» состоит из кристаллической β-модификации диоксидина и наночастиц серебра. Причем наночастицы серебра имеют средний диаметр частиц 9-11 нм и заключены в крупные, диаметром 50-500 нм, наночастицы β-модификации диоксидина.
Определение активности предлагаемой фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра», кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида и водного раствора коллоидного серебра с концентрацией серебра и способом приготовления, аналогичными концентрации серебра и способу приготовления в фармацевтической композиции по примеру 3, осуществляли по изучению устойчивости микроорганизмов диско-диффузионным методом и проводили по методикам, представленным в примере 1. Полученные данные приведены в табл. 3 (Пример 3) и табл. 4 (Пример 3). Видно, что зоны подавления роста тест-культур заявляемой фармацевтической композицией «кристаллическая β-модификация диоксидина-наночастицы серебра» больше при всех временах инкубации, чем при использовании спрессованных дисков и дисков, пропитанных водным раствором β-модификации диоксидина, а также дисков, пропитанных раствором коллоидного серебра, с концентрацией серебра и способом приготовления, аналогичными концентрации серебра и способу приготовления в фармацевтической композиции по примеру 3, и, следовательно, предложенная фармацевтическая композиция более активна к процессам подавления роста микроорганизмов, т.е. обладает более выраженным противомикробным, антибактериальным и бактерицидным действием.
Пример 4. Для получения заявляемой фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра», содержащей 0,37 мас. % наночастиц серебра, 0,012 г нитрата серебра, растворенного в 4,00 г дистиллированной воды, по каплям прибавляют к 0,014 г боргидрида натрия, растворенного в 6,00 г дистиллированной воды, при перемешивании. К полученной смеси приливают 190,00 г дистиллированной воды и при 20°C при интенсивном перемешивании растворяют 2 г кристаллической α-модификации диоксидина. Полученную смесь замораживают со скоростью (3-4)⋅102 град/мин вливанием раствора в предварительно охлажденный и наполненный жидким азотом (Ткип=-196°C) поддон из нержавеющей стали. Полученный замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе (-50…-55)°C; на продукте (-196…+40)°C, и остаточном давлении в камере (6-8)⋅10-2 Торр в течение 26 ч. Выход продукта составил 1,93 г (96,14 мас. %).
Для подтверждения состава фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра» был проведен комплекс физико-химических методов анализа аналогично примеру 1. Оказалось, что полученная фармацевтическая композиция «кристаллическая β-модификация диоксидина-наночастицы серебра» состоит из кристаллической β-модификации диоксидина и наночастиц серебра. Причем наночастицы серебра имеют средний диаметр частиц 9-11 нм, которые заключены в крупные, диаметром 50-500 нм, наночастицы β-модификации диоксидина.
Определение активности предлагаемой фармацевтической композиции «кристаллическая β-модификация диоксидина-наночастицы серебра», кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида и водного раствора коллоидного серебра с концентрацией серебра и способом приготовления, аналогичными концентрации серебра и способу приготовления в фармацевтической композиции по примеру 4, осуществляли по изучению устойчивости микроорганизмов диско-диффузионным методом по методикам, представленным в примере 1. Полученные данные приведены в табл. 3 (Пример 4) и табл. 4 (Пример 4). Видно, что зоны подавления роста тест-культур заявляемой фармацевтической композицией «кристаллическая β-модификация диоксидина-наночастицы серебра» больше при всех временах инкубации, чем при использовании спрессованных дисков и дисков, пропитанных водным раствором β-модификации диоксидина, а также дисков, пропитанных раствором коллоидного серебра, с концентрацией серебра и способом приготовления, аналогичными концентрации серебра и способу приготовления в фармацевтической композиции по примеру 4, и, следовательно, предложенная фармацевтическая композиция более активна к процессам подавления роста микроорганизмов, т.е. обладает более выраженным противомикробным, антибактериальным и бактерицидным действием.

Таким образом, нами предложена композиция, обладающая противомикробной, антибактериальной и бактерицидной активностью, состоящей из кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, характеризующейся следующим набором межплоскостных расстояний d, 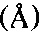 и соответствующих им интенсивностей I/I100 (%): 8,742-82,6%; 8,058-75,8%; 7,721-22,8%; 6,936-56,3%; 6,695-31,9%; 6,297-52,9%; 6,007-41,6%; 5,796-11,3%; 5,402-17,4%; 5,212-18,8%; 4,957-32,4%; 4,503-22,5%; 4,354-26,5%; 4,092-27,0%; 4,022-21,0%; 3,920-24,9%; 3,686-29,4%; 3,542-18,9%; 3,455-41,6%; 3,362-100,0%; 3,313-70,0%; 3,215-32,6%; 3,159-21,2%; 2,991-12,6%; 2,911-15,3%; 2,797-10,7%; 2,669-9,0%; 2,608-10,5%; 2,542-9,5%; 2,488-8,6%; 2,376-10,8%; 2,290-8,1%; 2,255-9,9%; 2,082-7,9%; 1,970-7,2%; 1,705-7,1%, и наночастиц серебра, при следующем соотношении компонентов, мас. %:
и соответствующих им интенсивностей I/I100 (%): 8,742-82,6%; 8,058-75,8%; 7,721-22,8%; 6,936-56,3%; 6,695-31,9%; 6,297-52,9%; 6,007-41,6%; 5,796-11,3%; 5,402-17,4%; 5,212-18,8%; 4,957-32,4%; 4,503-22,5%; 4,354-26,5%; 4,092-27,0%; 4,022-21,0%; 3,920-24,9%; 3,686-29,4%; 3,542-18,9%; 3,455-41,6%; 3,362-100,0%; 3,313-70,0%; 3,215-32,6%; 3,159-21,2%; 2,991-12,6%; 2,911-15,3%; 2,797-10,7%; 2,669-9,0%; 2,608-10,5%; 2,542-9,5%; 2,488-8,6%; 2,376-10,8%; 2,290-8,1%; 2,255-9,9%; 2,082-7,9%; 1,970-7,2%; 1,705-7,1%, и наночастиц серебра, при следующем соотношении компонентов, мас. %:
и предложен способ ее получения.
Кроме того, заявляемая фармацевтическая композиция «кристаллическая β-модификация диоксидина-наночастицы серебра» отличается повышенной противомикробной, антибактериальной и бактерицидной активностью как в виде спрессованного порошка, так и в виде раствора по сравнению с действием кристаллической β-модификацией диоксидина, а также водного раствора коллоидного серебра.
Из вышеизложенного можно сделать вывод о том, что заявляемая фармацевтическая композиция «кристаллическая β-модификация 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида-наночастицы серебра», обладающая противомикробной, антибактериальной и бактерицидной активностью, и способ ее получения являются новыми и удовлетворяют критериям «изобретательский уровень» и «промышленная применимость».
| название | год | авторы | номер документа |
|---|---|---|---|
| КРИСТАЛЛИЧЕСКАЯ β-МОДИФИКАЦИЯ 2,3-БИС-(ГИДРОКСИМЕТИЛ)ХИНОКСАЛИН-N,N'-ДИОКСИДА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЁ ОСНОВЕ | 2014 |
|
RU2563256C1 |
| Местное гемостатическое антибактериальное средство | 2021 |
|
RU2776015C1 |
| НОВЫЕ КОМПОЗИЦИИ 2,3-БИС-(ГИДРОКСИМЕТИЛ)ХИНОКСАЛИН 1,4-ДИ-N-ОКСИДА ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 2021 |
|
RU2791248C2 |
| АНТИСЕПТИЧЕСКАЯ КОМПОЗИЦИЯ "ХЛОРДИКС" | 2007 |
|
RU2351365C2 |
| СПОСОБ СТЕРИЛИЗАЦИИ И ПРЕДИМПЛАНТАЦИОННОГО ХРАНЕНИЯ БИОЛОГИЧЕСКИХ ПРОТЕЗОВ ИЗ КСЕНОГЕННОЙ И АЛЛОГЕННОЙ ТКАНИ ДЛЯ СЕРДЕЧНО-СОСУДИСТОЙ ХИРУРГИИ | 2011 |
|
RU2457867C1 |
| Биоактивный гидрогель на основе хитозана высокой молекулярной массы и способ его экстемпорального получения | 2021 |
|
RU2810573C2 |
| Фармацевтическая комбинированная композиция для местного и наружного применения на основе диоксидина | 2016 |
|
RU2667974C2 |
| Фармацевтическая комбинированная композиция для местного и наружного применения на основе бактериолитического и протеолитического комплекса ферментов | 2016 |
|
RU2655808C2 |
| ГИГИЕНИЧЕСКОЕ СРЕДСТВО ДЛЯ КОПЫТ | 2019 |
|
RU2729193C1 |
| Композиция с пролонгированным биоцидным эффектом и ополаскиватель полости рта на ее основе | 2022 |
|
RU2788728C1 |




Группа изобретений относится к медицине. Описана фармацевтическая композиция, содержащая кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, характеризующуюся определенным набором дифракционных максимумов  и их интенсивностью (Iотн., %), и наночастицы серебра. Описан способ ее получения. Фармацевтическая композиция, обладающая противомикробной, антибактериальной и бактерицидной активностью, состоит из кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, характеризующейся определенным набором дифракционных максимумов
и их интенсивностью (Iотн., %), и наночастицы серебра. Описан способ ее получения. Фармацевтическая композиция, обладающая противомикробной, антибактериальной и бактерицидной активностью, состоит из кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N'-диоксида, характеризующейся определенным набором дифракционных максимумов  и их интенсивностью (Iотн., %), и наночастиц серебра, представляет собой легкий, пушистый порошок от желтоватого до светло-коричневого цвета, без запаха. 2 н. и 5 з.п. ф-лы, 6 ил., 4 пр.
и их интенсивностью (Iотн., %), и наночастиц серебра, представляет собой легкий, пушистый порошок от желтоватого до светло-коричневого цвета, без запаха. 2 н. и 5 з.п. ф-лы, 6 ил., 4 пр.
1. Фармацевтическая композиция, обладающая противомикробной, антибактериальной и бактерицидной активностью, содержащая основное действующее вещество - кристаллическую β-модификацию 2,3-бис-(гидроксиметил) хиноксалин-N,N'-диоксид, характеризующуюся следующим набором межплоскостных расстояний d,( ) и соответствующих им интенсивностей I/I100 (%): 8,742 - 82,6%; 8,058 - 75,8%; 7,721 - 22,8%; 6,936 - 56,3%; 6, 695 - 31,9%; 6,297 - 52,9%; 6,007 - 41,6%; 5,796 - 11,3%; 5,402 - 17,4%; 5,212 - 18,8%; 4,957 - 32,4%; 4,503 - 22,5%; 4,354 - 26,5%; 4,092 - 27,0%; 4,022 - 21,0%; 3,920 - 24,9%; 3,686 - 29,4%; 3,542 - 18,9%; 3,455 - 41,6%; 3,362 - 100,0%; 3,313 - 70,0%; 3,215 - 32,6%; 3,159 - 21,2%; 2,991 - 12,6%; 2,911 - 15,3%; 2,797 - 10,7%; 2,669 - 9,0%; 2,608 - 10,5%; 2,542 - 9,5%; 2,488 - 8,6%; 2,376 - 10,8%; 2,290 - 8,1%; 2,255 - 9,9%; 2,082 - 7,9%; 1,970 - 7,2%; 1,705 - 7,1%, и наночастицы серебра при следующем соотношении компонентов, мас. %:
) и соответствующих им интенсивностей I/I100 (%): 8,742 - 82,6%; 8,058 - 75,8%; 7,721 - 22,8%; 6,936 - 56,3%; 6, 695 - 31,9%; 6,297 - 52,9%; 6,007 - 41,6%; 5,796 - 11,3%; 5,402 - 17,4%; 5,212 - 18,8%; 4,957 - 32,4%; 4,503 - 22,5%; 4,354 - 26,5%; 4,092 - 27,0%; 4,022 - 21,0%; 3,920 - 24,9%; 3,686 - 29,4%; 3,542 - 18,9%; 3,455 - 41,6%; 3,362 - 100,0%; 3,313 - 70,0%; 3,215 - 32,6%; 3,159 - 21,2%; 2,991 - 12,6%; 2,911 - 15,3%; 2,797 - 10,7%; 2,669 - 9,0%; 2,608 - 10,5%; 2,542 - 9,5%; 2,488 - 8,6%; 2,376 - 10,8%; 2,290 - 8,1%; 2,255 - 9,9%; 2,082 - 7,9%; 1,970 - 7,2%; 1,705 - 7,1%, и наночастицы серебра при следующем соотношении компонентов, мас. %:
2. Способ получения фармацевтической композиции, содержащей кристаллическую β-модификацию 2,3-бис-(гидроксиметил) хиноксалин-N,N'-диоксид и наночастицы серебра по п. 1, характеризующийся тем, что к водному раствору 2,3-бис-(гидроксиметил) хиноксалин-N,N'-диоксида добавляют при перемешивании наночастицы серебра, полученную смесь замораживают при скорости не менее 60 град/мин с последующей сублимационной сушкой в течение 22 и более часов.
3. Способ получения по п. 2, характеризующийся тем, что перемешивание водного раствора 2,3-бис-(гидроксиметил) хиноксалин-N,N'-диоксида и наночастиц серебра проводят при температуре от 20°С до 100°С.
4. Способ получения фармацевтической композиции по п. 1, характеризующийся тем, что 2,3-бис-(гидроксиметил) хиноксалин-N,N'-диоксид при температурах от 20°С до 100°С растворяют в коллоидном растворе, содержащем необходимое количество приготовленных ранее наночастиц серебра, полученную смесь замораживают при скорости не менее 60 град/мин с последующей сублимационной сушкой в течение 22 и более часов.
5. Способ по пп. 2-4, характеризующийся тем, что в качестве исходной субстанции при растворении используют кристаллическую α-модификацию 2,3-бис-(гидроксиметил) хиноксалин-N,N'-диоксида.
6. Способ по пп. 2-4, характеризующийся тем, что в качестве исходной субстанции при растворении используют кристаллическую β-модификацию 2,3-бис-(гидроксиметил) хиноксалин-N,N'-диоксида.
7. Способ по п. 2, характеризующийся тем, что сублимационную сушку замороженной смеси «раствор 2,3-бис-(гидроксиметил) хиноксалин-N,N'-диоксид - наночастицы серебра» проводят при температурах: на конденсаторе (-40…-56)°С; на продукте (-196…+50)°С, и остаточном давлении в камере (3-8)⋅10-2 Торр в течение 22-27 ч.
| ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ПОСЛЕРОДОВОГО ЭНДОМЕТРИТА У КОРОВ | 2011 |
|
RU2455992C1 |
| МАЗЬ С БИСУЛЬФАМИНОМ И ДИОКСИДИНОМ ДЛЯ КОМПЛЕКСНОГО ЛЕЧЕНИЯ ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНЫХ ГИНЕКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2436567C1 |
| КОМПОЗИЦИЯ КОМПЛЕКСА СУКЦИНАТА ХИТОЗАНА И ДИОКСИДИНА С ХЛОРГЕКСИДИНОМ, ОБЛАДАЮЩАЯ АНТИБАКТЕРИАЛЬНЫМ И РАНОЗАЖИВЛЯЮЩИМ ЭФФЕКТОМ | 2011 |
|
RU2471477C1 |
Авторы
Даты
2017-03-28—Публикация
2015-07-10—Подача