Изобретение относится к медицине и ветеринарии, а именно к фармацевтическим препаратам, применяемым при лечении обширных гнойно-некротических посттравматических, послеоперационных ран, обширных ожогов, а также ран после хирургического лечения острых гнойных заболеваний кожи и мягких тканей (абсцедирурющие фурункулы, карбункулы, маститы, гидрадениты, рожа и др.), при лечении больных с обширными атеросклеротическими и венозными трофическими язвами, с синдромом диабетической стопы, осложненных инфекционным процессом, вызванным высокорезистентными грамположительными и грамотрицательными аэробными и анаэробными микроорганизмами, грибами, устойчивыми к подавляющему большинству антимикробных и противогрибковых препаратов.
Разработанная комбинированная композиция для местного и наружного применения на основе лизоамидазы создает оптимальные условия для сокращения сроков проведения системной антимикробной и противогрибковой терапии, позволяют ускорить процесс заживления, улучшить условия для заживления ран.
Известно, что развитие инфекции может происходить, если количество микробов превышает 105 на 1 г ткани раны. "Критический" уровень бактериальной обсемененности может быть значительно меньшим при наличии в ране мертвых тканей или инородных тел, а также при нарушении факторов сопротивляемости организма, нарушении кровообращения, иннервации (Блатун Л.А. и др. «Клинико-лабораторная эффективность современных мазей на полиэтиленгликолевой основе при лечении гнойных ран», Антибиотики и химиотерапия, 1999 г., № N7, стр. 25-31).
Гнойно-воспалительный процесс заболевания мягких тканей представляет собой сложный комплекс реакций, развивающихся в организме в ответ на повреждение тканей. Течение раневого процесса условно делится на три основных фазы.
Фаза I - фаза воспаления, состоящая из двух последовательных периодов: сосудистых изменений и очищения раны за счет подавления микрофлоры и отторжения (рассасывания) нежизнеспособных тканей. В сосудистый период фазы воспаления расширяются сосуды в тканях, прилегающих к стенкам и дну раны; начинается и постепенно усиливается экссудация плазмы и выход лейкоцитов из кровеносных сосудов. Экссудат и клеточные элементы, выделяющие протеолитические ферменты, разжижают участки омертвевших тканей.
Сосудистый период сменяется периодом очищения, разжижением некротических тканей, с отторжением вместе с мелкими инородными телами, удалением их из раны током экссудата, приобретающего характер гноя (//feldsherstvo.ru/186.html). При наличии гноя, очага тканевого распада в ране повышается концентрация парааминобензойной кислоты (ПАБК), которая необходима для жизнедеятельности микроорганизмов.
В I фазе раневого процесса характерной особенностью гнойной раны является наличие в ней гнойно-некротического детрита. Первичные некрозы в ране возникают в результате прямого воздействия механической травмы и микробных токсинов в зоне повреждения. Механизм образования вторичных некрозов более сложен. Развитие гнойного процесса в ране происходит путем разрушения иммунолейкоцитарного барьера экзо- и эндотоксинами бактерий, оказывающими некротизирующее действие на ткани, а также их протеолитическими ферментами и гиалуронидазой, вызывающей деполяризацию основного вещества соединительной ткани.
Таким образом, инфекция проникает в более глубоко расположенные ткани, вызывая их некроз и создавая тем самым благоприятные условия для дальнейшей жизнедеятельности микроорганизмов.
Причиной "вторичных" некрозов является также расстройство регионарной микроциркуляции, вызванное гнойным расплавлением. Нарушение обменных процессов с накоплением недоокисленных продуктов и прогрессирующая локальная гипоксия обусловливают развитие ацидоза, гиперкалиемии и увеличение осмотического давления в тканях. Результатом этих реакций является прогрессирующая гипергидратация тканей, крайняя степень которой ведет к развитию и распространению некроза. Некротические ткани в начальной фазе воспаления обычно плотно фиксированы к дну и краям раны, количество их при неблагоприятном течении процесса может возрастать за счет вторичных некрозов.
При этом возникает ситуация, когда для местного лечения раны необходим подбор препарата, высокоактивного в отношении основного возбудителя (как аэробного, так и анаэробного компонента гнойного процесса), обладающего некролитическими свойствами, длительной осмотической активностью или, наоборот, свойствами, направленными на предупреждение высыхания раневой поверхности, стимуляцию роста грануляций, а в дальнейшем - не препятствующими формированию эпителия (Блатун Л.А. и др. «Клинико-лабораторная эффективность современных мазей на полиэтиленгликолевой основе при лечении гнойных ран», Антибиотики и химиотерапия, 1999 г., №7, стр. 25-31).
После очищения раны в ближайшие сутки (на 3 день) начинается фаза II раневого процесса - фаза регенерации, для которой характерно развитие грануляционной ткани вследствие новообразования капилляров и миграции значительного количества фибробластов. Максимальное количество макрофагов достигается на 6 день и сохраняется на высоком уровне на протяжении 2 недель. Фибробласты раны в этот период активно продуцируют фибронектин и коллаген III типа, замещая ими утраченный матрикс. Постепенно на смену этого процесса начинается продукция коллагена I типа, волокна которого стабилизируются мукополисахаридами межуточного вещества соединительной ткани. Синтез коллагена и белково-полисахаридных комплексов соединительно-тканного матрикса непосредственно связан с процессом новообразования капилляров. Формирующиеся ткани представляют собой своеобразную биологическую основу, из которых происходит миграция фибробластов, продуцирующих коллаген. На ранних стадиях заживления раны молодые микрососуды обеспечивают доставку кислорода к клеткам, активно синтезирующим белок в ране, так как процессы синтеза в очаге воспаления требуют значительного энергетического обеспечения. Эпителизация раны начинается в первые часы после повреждения. Клетки эпителия, расположенные по краям раны, сдвигаются в сторону раны. В этот период они теряют свою дифференцировку. Грануляционная ткань становится более плотной, число микрососудов, макрофагов, тучных клеток и фибробластов уменьшается. В течение первых суток образуется 2-4 слоя клеток базального эпителия. При этом эпителий может наползать на покрывающий рану фибрин, лейкоцитарно-некротические массы или грануляционную ткань. Прочной эпителизация раны становится лишь при нарастании эпителия на грануляционную ткань, в других случаях эпителий погибает. Эпителизация небольших по величине ран осуществляется в основном за счет миграции клеток, начинающейся с базального слоя. Рана размером более 0,1 см эпителизируются за счет не только миграции, но и митотического деления клеток эпителия. Дифференцировка мигрирующего эпидермиса выявляется уже в период миграции. При дифференцировке растущего эпителия в клетках его появляется зернистость, поверхностные слои подвергаются ороговению, базальный слой клеток по своей структуре приближается к структуре клеток переходного эпителия. Новообразованный эпителиальный покров отличается от здорового отсутствием потовых и сальных желез, а так же волосяных фолликулов.
В настоящее время, в связи с увеличением числа ран с вялотекущим процессом заживления за счет снижения иммунного статуса, высокой аллергизации пациентов лечение ран в фазе регенерации требует учета возможностей перевязочных средств. Перевязочные средства во 2-й фазе раневого процесса, особенно на ранней стадии регенерации, должны обеспечивать условия для нормального течения процессов пролиферации клеток регенераторной ткани, благотворно влиять на ангиогенез, подвижность и синтез эпителиальных клеток.
Фаза III - фаза организации рубца и эпителизации характеризуется уменьшением числа фибробластов, снижением активности ферментов, упорядочиванием коллагеновых волокон под воздействием коллагеназы нарастающего эпидермиса. За счет сокращения гладкомышечных клеток происходит сближение краев раны. Первичный нежный коллаген замещается более прочным, в результате чего образуется рубец.
Нормальное заживление ран с формированием полноценного рубца завершается через 25-29 дней с момента их возникновения. В тоже время нередко выявляются признаки перехода острого раневого воспалительного процесса в хронический. В такой ране отмечается возрастание миграции в рану мононуклеарных клеток и уменьшение гранулоцитарных клеток, миграция Т- и В-лимфоцитов. Замедленное течение воспалительного процесса, тенденция к хронизации могут быть обусловлены прогрессированием аутоиммунного механизма
Перечисленные фазы раневого процесса наблюдают при всех ранах, но они бывают выражены в разной степени, в зависимости от вида заживления: первичным натяжением, вторичным натяжением или под струпом - фаза регенерации, образования и созревания грануляционной ткани.
Необходимо учитывать, что между фазами нет резкой границы. Более того, в обширных ранах с рваными ушибленными краями все три фазы могут наблюдаться одновременно, в то время как на одном участке рана уже очистилась и заполняется грануляциями, на другом - еще только разрастается молодая грануляционная ткань на дне раны, а на третьем - еще продолжается затянувшийся период очищения, т.е. первая воспалительная фаза, и отчетливо видны участки некротизированных тканей, отграниченные от прилежащих тканей ростом грануляционной ткани (http://feldsherstvo.ni/186.html).
Свежие раны до момента покрытия их грануляциями способны всасывать токсины, бактерии, продукты распада тканей. Раны, покрытые грануляциями, практически не обладают всасывающей способностью.
Нарушение процесса заживления находится в прямой зависимости не только от общих и местных факторов, но и от неправомерного использования устаревших препаратов для местного лечения ран: гипертонического раствора хлорида натрия, ихтиоловой, стрептоцидовой, тетрациклиновой, фурациллиновой, гентамициновой и др. мазей на жировой основе.
В I фазе раневого процесса все лечебные препараты должны обеспечивать противовоспалительное и обезболивающее действие, обладать широким спектром антимикробного действия (с антибактериальной, антикандидозной и вирулоцидной активностью), высокими осмотическими свойствами, чтобы был возможен интенсивный отток экссудата из глубины раны в повязку, отторжение и расплавление некротических тканей, эвакуация раневого содержимого. Также они должны обеспечивать проникновение лекарства в зону повреждения для создания терапевтической эффективности. При этом всасывание в кровь должно быть минимальным для снижения общих токсических эффектов («Фармакокоррекция раневого процесса», http://www.provisor.com.ua/archive/2007/N15/process.php).
Во II фазе раневого процесса наряду с подавлением оставшихся в небольшом количестве микробов или вновь появившихся госпитальных штаммов в ране вследствие нарушения асептики и антисептики в момент перевязок, препарат должен обеспечивать оптимальные условия для роста грануляций. Нередки случаи, когда оперативное закрытие раны невозможно без этапа медикаментозного лечения раны с учетом фазы раневого процесса.
Лекарственные препараты, применяемые для местного лечения ран, должны соответствовать современным требованиям, предъявляемым к лекарственным средствам этой фармакотерапевтической группы: обладать противовоспалительным действием, тормозить развитие раневого и перифокального воспаления в тканях, подавлять рост микроорганизмов в ране и, что особенно важно, оказывать антибактериальное действие в отношении госпитальных штаммов бактерий, полирезистентных к антибиотикам и антисептикам.
Полимерным гидрофильным водорастворимым основам таких препаратов должны быть присущи осмотические и сорбционные свойства, то есть они должны адсорбировать некротизированные клетки, продукты распада и воспаления, очищая, таким образом, рану, и не должны вызывать осмотического лизиса здоровых клеток, не препятствовать росту грануляций.
Многие современные препараты для местного лечения ран перестали обладать необходимой антимикробной активностью из-за формирования к ним резистентности микроорганизмов. Изменилась структура возбудителей гнойных осложнений ран. Наряду с традиционными грамположительными и грамотрицательными аэробными микроорганизмами значительная доля приходится на анаэробные микроорганизмы, грибы («Биофармацевтические аспекты создания мазей», http://bibliofond.ru/view.aspx?id=556568).
Широкое, зачастую бесконтрольное и недостаточно обоснованное использование в медицине антибиотиков, антимикотиков, кортикостероидов и иммунодепрессантов, нарушение рекомендаций по применению привело к распространению штаммов, обладающих множественной устойчивостью к антимикробным препаратам.
Известны плазмиды стафилококков, несущие гены устойчивости к пенициллину, гентамицину, тетрациклину, метициллину, линкомицину, сульфаниламидам, а также к антибиотикам нового поколения: фторхинолонам, цефалоспоринам II и III поколений, гликопептидам и другим. («Современные подходы к терапии инфекционных заболеваний кожи», И.М. Кириченко, http://old.consilium-medicum.com/media/consilium/06_01c/12.shtml).
Наблюдается низкая чувствительность протеев и стафилококков в ассоциации к наиболее широко применяемым в практике «старым» антибиотикам (ампициллину, карбенициллину, эритромицину, линкомицину, ристомицину, левомицетину, тетрациклину). При этом большинство штаммов протеев и стафилококков, выделенных в монокультуре, оказались резистентными к «старым» антибиотикам: пенициллину, тетрациклину и левомицетину.
С учетом этого, является оправданной разработка лекарственных форм для лечения ран, содержащих не антибиотики, а антисептики, резистентность микроорганизмов к которым развивается медленнее. («Разработка состава и технологии получения мази, содержащей биокомплекс кобальта с фуразолидоном». Медицина, здоровье, http://uchi-referat.ru/medicina-zdorove/2921-razrabotka-sostava-i-tehnologii-polucheniya-mazi-soderzhashhey-biokompleks-kobalta-s-urazolidonom.html).
Применение антисептиков при местных и системных инфекционных процессах вызвано рядом целей:
1) предупреждение генерализации процесса;
2) снижение численности популяции и подавление жизнедеятельности находящихся в инфекционном очаге микробов;
3) предупреждение перехода острых местных инфекционных процессов в хроническую форму; в результате суперинфекции, реинфекции и вторичной инфекции, в результате заноса микроорганизмов из внешней среды, с других областей тела больного или в результате активации местной аутофлоры;
4) сохранение нормальной микрофлоры в пораженном органе, а в случае изменения - ее восстановление.
Для профилактической и терапевтической антисептики ран имеется большой выбор антисептиков. Однако и для антисептиков в настоящее время наблюдается снижение к ним чувствительности бактерий (Эффективность лечения гнойно-палительных заболеваний мягких тканей препаратом «Абсил1»», автореферат дисс. канд. мед. наук (14.00.27)/Л.А. Лацерус. Иркутск, 1999 г.).
В настоящее время отмечается значительное распространение среди больничных и внебольничных штаммов-микроорганизмов биологически устойчивых форм к широко применяемым антисептикам («Разработка состава и технологии получения мази, содержащей биокомплекс кобальта с фуразолидоном», «Медицина, здоровье», http://uchi-referat.ru/medicina-zdorove/2921-razrabotka-sostava-i-tehnologii-polucheniya-mazi-soderzhashhey-biokompleks-kobalta-s-furazo lidonom.html).
К 90-м годам XX века появились публикации о микробной контаминации почти всех используемых в практике медицины типов антисептиков и обнаружении в них представителей всех систематических групп бактерий и грибов (Суфияров Р.С. «Лечение гнойно-воспалительных заболеваний мягких тканей протейно-стафилококковой природы», автореферат дисс. канд. мед. наук (14.00.27)/Р.С. Суфияров - Уфа, 1998 г.).
Несколько лет назад в Индии был обнаружен ген NDM-1, который обеспечивает бактерии устойчивостью к огромному числу антибиотиков, включая карбапенемы. Появление этого гена уже зафиксированы и в других странах, включая Великобританию и США. Инфекции, содержащие ген NDM-1, становятся очень опасными и поддаются лечению сложной смесью препаратов (https://nplus1.ru/news/2015/11/19/panresistance).
Формирование устойчивости микроорганизмов к широко используемым в клиниках препаратам диктует необходимость разработки и внедрения новых комплексных лекарственных средств широкого спектра терапевтической активности не только в отношении аэробных, но и анаэробных компонентов и грибов, а также для соответствующих фаз раневого процесса.
Следует отметить, что все травматические раны - большинство ожоговых ран и многие хирургические раны - первично микробно загрязнены. Первоначальное загрязнение раны состоит их сапрофитов, насчитывающих более 200 видов. В течение 24 часов из загрязненной раны исчезают сенные бациллы и почвенные бактерии и остаются обычно стафилококки, как господствующая микрофлора. Стрептококки и грамотрицательные бактерии проникают вторично. Поэтому основным объектом борьбы с нагноением ран в начальной стадии I фазы раневого процесса следует считать стафилококки.
Известны комплексы бактериолитических ферментов, лизирующие грамположительные микроорганизмы, в первую очередь стафилококки, устойчивые к антибиотикам. Описан такой комплекс, используемый в медицине под названием лизоамидаза, (патенты RU 1549227, C12N 9/00, 1995.12.20; RU 2193063, C12N 9/00, 2002.11.20), а ветеринарии - лизомаст (патент RU 2064299, A61K 35/74, 1996.07.27)
В состав лизоамидазы входят: бактериолитические ферменты: мурамидаза, мурамоилаланинамидаза, эндопептидаза 0,1-2,0%; протеаза 0,5-2,0%; балластные компоненты 4,0-8,0%, остальное - полисахарид. Три бактериолитических фермента обладают разной субстратной специфичностью по отношению к пептидогликанам клеточных стенок микроорганизмов: мурамидаза -аналог лизоцима по специфичности, мурамоилаланинамидаза - отщепляет пептидную часть пептидогликана от полисахаридной, эндопептидаза - разрушает связи внутри межпептидных мостиков клеточной стенки.
За счет этого лизоамидаза активно разрушает клетки широкого спектра грамположительных микроорганизмов, в том числе патогенных стафилококков и стрептококков. Благодаря наличию в лизоамидазе протеазы и двух бактериолитических ферментов - эндопептидазы и мурамоилаланинамидазы, обладающих одновременно и протеолитической активностью, препарат на основе лизоамидазы хорошо очищает раны от некротических масс.
Полисахарид в составе комплекса обеспечивает стабильность бактериолитических ферментов. Он представляет собой высокополимерное соединение, образованное повторяющимся звеном, состоящим из N-ацетилглюкозамина, N-ацетилманнуроновой и N-ацетилгалактуроновой кислот. Полисахарид обеспечивает длительное (в течение нескольких лет) сохранение высокой активности входящих в него ферментов, а также иммуностимулирующие свойства препарата лизоамидаза.
Особенно важно отметить, что применение лизоамидазы исключает вероятность возникновения резистентных штаммов патогенных микроорганизмов.
Лизоамидаза - аморфный порошок серо-коричневого цвета, без запаха, без вкуса, гигроскопичен, рН лизоамидазы от 3,5 до 5,5. Она малорастворима в воде. Ферментный комплекс растворим в 0,01М натрий-фосфатном буфере с рН 8,0. Протеолитическая активность лизоамидазы выражается в ПЕ. 1 мг субстанции содержит не менее 0,7 ПЕ. Бактериолитическая активность лизоамидазы выражется в ЛЕ. 1 мг субстанции содержит не менее 12 ЛЕ. Лизоамидаза термофильна, допускается нагрев не выше +37°С. Она хранится в сухом, защищенном от света месте, при температуре не выше +10°.
На основе данного комплекса разработан фармакологический препарат, выпускаемый в виде лиофилизированного порошка, упакованного в 10 мл флаконы по 50 ПЕ, 100 ПЕ с герметично укупоренными резиновыми пробками. При этом в комплект поставки входит основа - растворитель в ампулах по 5 мл из расчета 1 ампула на 50 ПЕ. (фармакопейные статьи ФС 42-3329-96 и ФС 42-3332-96). Препарат применяется в жидком виде в фосфатном буферном растворе с концентрацией 5 ПЕ (50 ЛЕ) в 1 мл, 10 ПЕ (100 ЛЕ) в 1 мл, 25 ПЕ (250 ЛЕ) в 1 мл.
Наибольшей активностью препарат обладает по отношению к группе стафилококков: полный лизис клеток, определенный по оптической плотности, наступает через 1-30 мин для различных штаммов. При этом наибольшей чувствительностью обладают штаммы бактерий Staphylococcus aureus (снижение оптической плотности до 0 за 5 минут), наиболее патогенные для человека. Таким образом, лизоамидаза обладает сильным антистафилококковым действием - 100 мкг препарата лизирует 109 микробных клеток стафилококка за 5-10 минут.
Лизоамидаза ускоряет на 4-6 дней процесс очищения ран от некротических масс, кроме того применение препарата в ранние сроки после операции вызывает более быстрое (на 5-7 дней) заживление ран.
Использование известного препарата лизоамидазы в виде жидких растворов обладает рядом недостатков, а именно: препарат плохо фиксируется и удерживается на раневой поверхности, что приводит к повышенному расходу активного вещества при лечении. Кроме того, он требует предварительного разведения в буферном растворе и специальных мер по предотвращению быстрого высыхания, срок хранения приготовленного раствора ограничен 3-5 днями, что неудобно при лечебном процессе. Все это снижает мотивацию пациента к лечению.
Кроме того, данный препарат не способен лизировать нативные клетки грамотрицательных бактерий, так как их поверхностные структуры являются барьером на пути литического действия лизоамидазы, и поэтому процесс лизиса либо удлиняется, либо не происходит вовсе.
Недостатками данного препарата является также то, что он не обладает местным анестезирующим действием, не улучшает микроциркуляцию при воспалительном процессе, не обладает антиоксидантным действием.
Известна фармакологическая композиция, обладающая антибактериальным и некролитическим действием, содержащая активный комплекс бактериолитических и протеолитических ферментов - лизоамидазу, мягкую основу, состоящую в основном из гидрофильных компонентов (патент RU 2367456, A61K 35/74, 20.09.2009). Кроме того она может содержать целевую добавку, выбранную из ряда: анестетик, стимулятор репаративных процессов или их смесь.
Однако указанная композиция имеет следующий недостаток. Мягкие формы на основе данной композиции не способны лизировать нативные клетки грамотрицательных бактерий, так как поверхностные структуры грамотрицательных бактерий являются барьером на пути литического действия лизоамидазы, и поэтому процесс лизиса либо удлиняется, либо не происходит вовсе. То есть эта композиция имеет достаточно узкую терапевтическую активность.
Известна фармацевтическая композиция для наружного и местного применения, обладающая антибактериальным и протеолитическим действием, которая содержит активный комплекс бактериолитических и протеолитических ферментов - лизоамидазу, основу, состоящую в основном из гидрофильных компонентов, по меньшей мере, одну целевую добавку, выбранную из ряда: вещество, нарушающее структуру мембран грамотрицательных микроорганизмов, антибиотик, анестетик, стимулятор репаративных процессов или их физиологически приемлемую смесь (патент RU 2367455, A61K 35/74, 20.09.2009).
В этой композиции вместе с лизоамидазой содержится полимиксин В - антибиотик, дезорганизующий клеточную мембрану грамотрицательных микроорганизмов, что приводит к гибели их клеток. Это вещество электростатически связывается вместо двухвалентных катионов с отрицательно заряженными мембранами грамотрицательных бактерий. Гидрофобная жирнокислотная цепочка полимиксина входит в гидрофобную область мембраны, резко повышая ее проницаемость, что обусловливает нарушение целостности мембраны.
Полимиксин В является бактерицидным антибиотиком, обладающим узким спектром активности против грамотрицательной флоры, антибиотиком резерва и применяется при инфекциях, вызванных полирезистентными штаммами бактерии P. aeruginosa, а также некоторыми другими грамотрицательными бактериями, кроме, например, штаммов бактерий Proteus spp. Основное клиническое значение имеет активность полимиксина В именно в отношении штаммов бактерий Р. aeruginosa.
Таким образом, недостатками полимиксина В является узкий спектр активности и ограниченное применение в клинической практике из-за тяжелых побочных эффектов в виде нефро- и нейротоксичности.
Резистентность к полимиксину В, как и к другим полимиксинам, оставалась низко стабильной, за исключением некоторых штаммов Klebsiella spp. (www.antibiotic.ru/index.php?article=2123).
Однако недавно был обнаружен новый ген MCR-1 устойчивости к антибиотикам полимиксиновой группы. Ген MCR-1 расположен на плазмиде, и способен к горизонтальному переносу. Появление гена MCR-1 указывает на падение последней группы антибиотиков - полимиксинов перед передающейся с плазмидами резистентностью (https://nplus1.ru/news/2015/11/19/panresistance).
Другим антибиотиком, предлагаемым в известном решении, является эритромицин. Этот антибиотик обладает довольно широким спектром антимикробной активности, который включает многие грамположительные кокки (стрептококки, стафилококки) и палочки, некоторые грамотрицательные микроорганизмы, спирохеты, хламидии, микоплазмы, легионеллы, анаэробы.
Однако в последние годы выявлена резистентность к эритромицину некоторых штаммам стрептококка, стафилококка, грамотрицательных палочек (www.antibiotic.ru/books/macrolid/mcld06.shtml).
Таким образом, при длительном применении антибиотиков в составе фармацевтической композиции с комплексом бактерио- и протеолитических ферментов может наступить резистентность госпитальных штаммов микроорганизмов к их действию, что будет снижать терапевтическую активность композиции.
Наиболее перспективный и реальный метод, ограничивающий появление и накопление устойчивых бактерий в организме или компенсирующий снижение терапевтической активности фармацевтической композиции из-за резистентности к ним патогенных микроорганизмов - это повышение эффективности терапии за счет использования комбинаций различных антимикробных компонентов в одном фармакологическом препарате.
Задачей предлагаемого изобретения является создание фармацевтической комбинированной композиции в виде жидкой, мягкой, твердой и газообразной лекарственной формы на основе комплекса бактериолитических и протеолитических ферментов - лизоамидазы, основы и целевых добавок, обеспечивающей лечение гнойных ран и ожогов, гнойно-воспалительных заболеваний кожи и др. и улучшающей условия очищения ран от гнойно-некротических тканей, подавляющей рост микрофлоры, резистентной к подавляющему числу антибактериальных препаратов, сокращающей сроки периода острого гнойного процесса.
Технические результаты, которые могут быть получены при использовании предлагаемого изобретения: повышение по сравнению с известными средствами терапевтической активности фармацевтической композиции, в том числе к штаммам, резистентным к отдельным компонентам композиции, улучшение течения раневого процесса, быстрое очищение раны, снижение содержания гнойного отделяемого и признаков местных воспалительных реакций, обеспечения анестезирующего эффекта, сокращение времени реконвалесценции.
Для решения поставленной задачи в настоящем изобретении предлагается фармацевтическая комбинированная композиция для наружного и местного применения, содержащая активный комплекс бактериолитических и протеолитических ферментов, например, лизоамидазу, основу, и, по меньшей мере, одну целевую добавку, выбранную из ряда: антибиотик, синтетическое антибактериальное средство, в том числе вещество, снижающее резистентность микроорганизмов, антимикотик, анестетик, стимулятор репаративных процессов или их физиологически приемлемую смесь, при следующем соотношении компонентов (мас. %):
Предлагаемая фармацевтическая комбинированная композиция в качестве антибиотика содержит вещество, выбранное из ряда: офлоксацин, ципрофлоксацин, левомицетин, нетилмицин, амикацин, не ограничиваясь ими.
В предлагаемой композиции в качестве анестетика содержится лидокаин или тримекаин, не ограничиваясь ими.
Предлагаемая фармацевтическая комбинированная композиция в качестве стимулятора репаративных процессов содержит вещество, выбранное из ряда: ксимедон, метилурацил, пантотеновая кислота в виде, например, кальция пантотената, солкосерил, этаден, или их физиологически приемлемую смесь, не ограничиваясь ими.
Предлагаемая фармацевтическая комбинированная композиция в качестве синтетического антибактериального средства содержит вещество (не антибиотик) выбранное из ряда: диоксидин, нитазол, сульфадиметаксин, стрептоцид, мафенида ацетат, или их физиологически приемлемую смесь, не ограничиваясь ими.
Предлагаемая фармацевтическая комбинированная композиция в качестве синтетического антибактериального средства, снижающего резистентность микроорганизмов, содержит вещество (не являющееся антибиотиком), выбранное из ряда: хинифурил, этилендиаминтетрауксусная кислота, ее динатриевая соль - трилон Б, димексид, производное диаминопиримидина в виде триметоприма поверхностно-активный антисептик, или их физиологически приемлемую смесь, не ограничиваясь ими.
Предлагаемая фармацевтическая комбинированная композиция в качестве синтетического антибактериального средства в виде поверхностно-активного антисептика, снижающего резистентность микроорганизмов, содержит вещество, выбранное из ряда: мирамистин, декаметоксин, катапол, полигексанид, октенидин, натрия лаурилсульфат, не ограничивается ими.
Предлагаемая фармацевтическая комбинированная композиция в качестве антимикотика содержит клотримозол или циклопироксоламин, не ограничиваясь ими.
Предлагаемая фармацевтическая комбинированная композиция содержит, при необходимости, по крайней мере, одни компонент из ряда: консервант, стабилизатор, неионогенный детергент, солюбилизатор или их смесь.
Предлагаемая фармацевтическая комбинированная композиция в качестве основы содержит гидрофильные вещества, выбранные из ряда: проксанол (эмуксол), полиэтиленоксид, пропиленгликоль, поливинилпирролидон, гидрогель полиэтиленоксида 1500 (типа «Геко»), глицерогидрогель на основе глицератов кремния, альгинат кальция или магния, сополимер акриловой кислоты, натрий-карбоксиметилцеллюлозу, окисленную целлюлозу, метилцеллюлозу, глицерин, или физиологически приемлемая смесь в различных их сочетаниях, обеспечивающих реологические требования к основе в зависимости от лекарственной формы фармацевтической комбинированной композиции. А в случае необходимости указанные гидрофильные вещества могут быть использованы в смеси, по меньшей мере, с одним веществом из ряда: фосфатный буферный раствор, очищенная вода, вазелиновое масло, эмульгатор, спирты высших жирных синтетических фракций, цетиловый спирт, стеариновый спирт, винилин, повидон или их комбинации.
Предлагаемая фармацевтическая комбинированная композиция выполнена в виде жидкой лекарственной формы: раствора, суспензии, или в виде мягкой лекарственной формы: мази, геля, линимента, суппозиториев, или в виде твердой лекарственной формы: капсул для ректального или вагинального применения, или в виде газообразной лекарственной формы: аэрозоля или спрея, не ограничиваясь ими
Для эффективного лечения гнойных ран в настоящее время достаточно широко применяются комбинированные препараты, которые выпускаются в фиксированных лекарственных формах, в том числе в виде мягких форм для наружного и местного применения. В их состав обычно входят два-три антимикробных средства.
Выбор сочетания компонентов комбинированных композиций предусматривает:
1. Усиление активности комбинированной композиции по сравнению с действием препарата с одним активным компонентом.
2. Расширение спектра действия комбинированной композиции, включая активность и в отношении резистентных штаммов к тому или другому компоненту в сочетании.
3. Возможность снижения частоты развития лекарственной устойчивости к определенной группе антимикробных препаратов.
4. Улучшение переносимости лекарств, уменьшение частоты и тяжести побочных реакций, в первую очередь за счет снижения лечебных доз препарата («Антимикробные препараты в ряду производных сульфаниламида, диаминопиримидина, 5-нитроимидазола, ди-N-оксихиноксалина», Падейская Е.Н., РМЖ №21 от 04.11.1997 г., стр. 1-6).
Базовым соединением в предлагаемой фармацевтической комбинированной композиции является активный комплекс бактериолитических и протеолитических ферментов - лизоамидаза. Бактериолитические ферменты, входящие в лизоамидазу, лизируют определенный спектр грамположительных патогенных микроорганизмов, таких, как стафилококки и стрептококки, в том числе имеющих множественную резистентность к антибиотикам, радиоустойчивые микрококки, менингококки, гонококки, грамположительные бациллы.
В настоящее время резистентность грамположительных микроорганизмов к лизоамидазе не обнаружена. Грамотрицательные бактерии имеют естественную резистентность к лизоамидазе за счет строения клеточной оболочки, которая имеет внешнюю мембрану, устойчивую к действию любых литических ферментов. Они не могут гидролизовать пептидогликановый слой наружной оболочки бактерий без удаления внешней мембраны. Это удается сделать с помощью хелатирующих агентов, например, этилендиаминтетрауксусной кислоты (ЭДТА) или ее динатриевой соли трилона Б («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье»», 1995 г., стр. 139, 143), а также поверхностно-активных веществ (ПАВ) при их совместном применении в одной фармацевтической комбинированной композиции.
Благодаря наличию в лизоамидазе ферментов, обладающих одновременно бактериолитической и протеолитической активностью, препарат хорошо очищает раны от некротических масс. При этом фрагменты разрушенных клеток обладают иммуностимулирующим действием.
Клинические исследования препарата показали, что лизоамидаза при лечении гнойных ран мягких тканей ускоряет по сравнению с другими традиционными и нетрадиционными средствами, течение раневого процесса: быстрее снижается содержание микрофлоры и нормализуется цитограмма, быстрее идет отторжение некротических масс, на дне ран быстрее появляются грануляции и начинается процесс эпителизации раневого дефекта.
При лечении гнойных ран мягких тканей под повязками с лизоамидазой сроки очищения от некротических тканей сокращались во многих случаях в 2 раза.
Лизоамидаза стимулирует репаративные процессы, оказывая, помимо протеолитического и бактериолитического действия, влияние на течение 2-ой фазы воспаления, причем не только за счет сокращения 1-ой фазы, но и за счет непосредственно стимулирующего влияния на клетки грануляционной ткани, воздействуя непосредственно на клетки пролиферата.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,01 до 5,00 мас. % лизоамидазы, более предпочтительно - от 0,5 до 1,5 мас.%.
Предлагаемая фармацевтическая композиция вместе с лизоамидазой содержит в своем составе не являющееся антибиотиком синтетическое антибактериальное вещество - диоксидин (1,4-ди-N-окись-2,3-бис-(оксиметил)-хиноксалина). Он представляет собой зеленовато-желтый кристаллический порошок без запаха горького вкуса. При комнатной температуре это вещество растворимо в воде до 1%, при 37°С - до 3%. («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье», 1995 г., стр. 152).
В основе механизма действия диоксидина лежит повреждение биосинтеза ДНК микробной клетки с глубокими нарушениями структуры нуклеотида при действии субингибирующих концентраций. Диоксидин избирательно тормозит образование ДНК в клетке микроорганизма, не влияя на образование РНК и протеина. Он провоцирует структурные нарушения мембраны клетки и нуклеотида микроорганизма, ингибирует действие бактериальной нуклеазы и токсинов.
Производные диаминопиримидина потенцируют активность ди-N-окисей хиноксалина, к которым относится диоксидин. Это позволяет снизить концентрацию диоксидина при их совместном применении. Такими производными диаминопиримидина являются: пириметамин, триметоприм, тетроксоприм, метиоприм, бродимоприм. («Антимикробные препараты в ряду производных сульфаниламида, диаминопиримидина, 5-нитроимидазола, ди-N-оксихиноксалина», Падейская Е.Н., РМЖ №21 от 04.11.1997 г., стр. 1-6). В России пириметамин и триметоприм зарегистрированы как лекарственное средство.
Диоксидин характеризуется широким антибактериальным спектром, бактерицидным типом действия. Он высокоактивен в отношении анаэробных бактерий с преимущественной наиболее высокой активностью в отношении широкого спектра облигатных анаэробов - спорообразующих и не образующих споры (неклостридиальных). Кроме того, препарат активен в отношении грамотрицательных и грамположительных аэробных условно-патогенных бактерий - возбудителей гнойной инфекции, а также в отношении некоторых облигатных (чувствительных к двухатомному кислороду) патогенов - сальмонелл, шигелл, холерного вибриона, иерсиний. В опытах с аэробными микроорганизмами диоксидин наиболее активен в отношении грамотрицательных бактерий: нейссерий, энтеробактерий - сальмонелл, шигелл, холерного вибриона, кишечной палочки, клебисиелл. Штаммы синегнойной палочки и грамположительные бактерии - стафилококки, стрептококки более устойчивы к диоксидину. (Е.Н. Падейская «Сложные вопросы антимикробной химиотерапии», «Инфекции и антимикробная терапия», том 3, №5, 2001 г). Диоксидин менее активен в отношении некоторых грамположительных бактерий - Staphylococcus spp., S. aureus, S. pyogenes (Руководство «Рациональная антимикробная фармакотерапия» под редакцией д.м.н. В.П. Яковлева и д.м.н. С.В. Яковлева, изд-во «Литтерра», 2003 г., стр. 750-752).
Диоксидин действует на штаммы бактерий, устойчивых к другим противобактериальным лекарственным средствам, включая антибиотики. Возможно развитие лекарственной устойчивости бактерий к нему.
При местном применении диоксидин не обладает раздражающим действием. Причем наряду с антибактериальным действием, он способствует более быстрому течению репаративных процессов и эпителизации раны («Антибактериальный препарат диоксидин: особенности биологического действия и значение в терапии различных форм гнойной инфекции», Падейская Е.Н., «Инфекция и антимикробная терапия», 2001; 5, 150-155»). При обработке ожогов и нагноившихся ран препарат эффективно очищает поверхность раны и стимулирует процесс восстановления тканей («Все о диоксидине», www.tiensmed.ru/news/dioxidin-x2a.html).
Бактерицидные концентрации диоксидина зависят от вида бактерий, микробной нагрузки и экспозиции, они превышают МПК в 2-4 раза. К диоксидину чувствительны клинические штаммы бактерий с полирезистентностью к антибиотикам. В отношении бактероидов МПК диоксидина составляет 0,062-2,0 мкг/мл, пептококков - 0,2-0,5 мкг/мл, клостридий - 1-2 мкг/мл («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье», 1995 г., стр. 152, 153).
Выработка устойчивости бактерий к диоксидину и возможность появления госпитальных штаммов, резистентных к нему, имеет место в единичных случаях и значительно ниже, чем развитие резистентности микробов к антибиотикам, т.е. лекарственная устойчивость развивается медленно. Как правило, отсутствует перекрестная устойчивость с другими классами антимикробных препаратов.
Диоксидин хорошо сочетается с антибактериальными лекарственными средствами других фармакологических групп. Обоснованно введение диоксидина в комбинированную антибактериальную терапию, когда необходима активность в отношении анаэробной флоры, синегнойной палочки, полирезистентных штаммов стафилококков. Возможно комбинированное применение диоксидина с бета-лактамами, ванкомицином, аминогликозидами, фторхинолонами (Руководство «Рациональная антимикробная фармакотерапия» под редакцией д.м.н. В.П. Яковлева и д.м.н. С.В. Яковлева, изд-во «Литтерра», 2003 г., стр. 750-752).
Диоксидин проявляет бактерицидную активность в диапазоне концентраций от 0,1 % до 1,0%. Он выпускается в виде 0,5% и 1,0% водного раствора, 1% и 5% мази, а также в виде аэрозолей. В сочетании с полиэтиленоксидами антибактериальная активность диоксидина усиливается в 18-20 раз. («Теория и практика местного лечения гнойных ран» под редакцией Б.М. Даценко, Киев, изд-во «Здоровье», 1995 г., стр. 152-154).
Активность диоксидина повышается в анаэробных условиях, причем величины МПК в этом случае могут быть снижены в 8-128 раз. Происходит активация свободнорадикальных процессов в условиях анаэробиоза. Повышение активности в анаэробных условиях характерно для всех производных ди-N-хиноксалина с антимикробной активностью, и не описано для других классов антимикробных веществ. В этом принципиальное отличие механизма действия диоксидина от механизма действия других антимикробных препаратов. В условиях анаэробиоза, в том числе и в инфицированном организме, диоксидин активирует свободнорадикальные процессы, индуцируя образование активных форм кислорода (Е.Н. Падейская «Сложные вопросы антимикробной химиотерапии», «Инфекции и антимикробная терапия», 2001 г., том 3, №5).
Диоксидин индуцирует генные мутации, а также летальные мутации в зародышевых клетках млекопитающих. Это свидетельствует о потенциальной генетической опасности диоксидина. При этом токсические эффекты диоксидина проявляются в основном при внутривенном введении. Мутагенная активность диоксидина непосредственно связана с ДНК-тропным действием препарата. Это дозозависимый процесс и проявляется, как в опытах с микроорганизмами, так и в отношении клеток млекопитающих.
Прослеживается связь между мутагенностью диоксидина и эффектом стимуляции образования свободных радикалов. Препараты с антирадикальной активностью и другие антимутагены (например, биметил, метапрот) снижают мутагенное действие диоксидина. (Е.Н. Падейская «Сложные вопросы антимикробной химиотерапии», «Инфекции и антимикробная терапия», том 3, №5, 2001 г.).
При местном и наружном применении в рекомендуемых терапевтических дозах диоксидин не повышает частоты мутаций в клетках крови человека, и нет противопоказаний для его наружного применения.
В первую очередь диоксидин следует рассматривать как средство для применения местно в виде мазевых форм и для введения в полости, эндобронхиально или ингаляционно в виде растворов. Раствор или мазь диоксидина эффективно абсорбируется с поверхности раны. Диоксидин обладает ранозаживляющим действием. При обработке ожогов и нагноившихся ран препарат эффективно очищает поверхность раны и стимулирует процесс восстановления тканей. Механизм развития лекарственной резистентности к диоксидину не изучен. (Е.Н. Падейская «Сложные вопросы антимикробной химиотерапии», «Инфекции и антимикробная терапия», 2001 г., том 3, №5,).
При местном и внутриполостном использовании диоксидина следует учитывать возможность резорбтивного эффекта, особенно при обширном характере поражения («Диоксидин: антимикробная активность и перспективы клинического применения на современном этапе», Д.А. Попов и др., «Антибиотики и химиотерапия», 2013 г, 58; 3-4)
В настоящее время приобретенная клиническая устойчивость к диоксидину выявлена у внебольничных штаммов стафилококка - 71,3%. У псевдомонад повысился процент клинически устойчивых штаммов к диоксидину («Разработка состава и технологии получения мази, содержащей биокомплекс кобальта с фуразолидоном». Медицина, здоровье, http://uchi-referat.ru/medicina-zdorove/2921-razrabotka-sostava-i-tehnologii-polucheniya-mazi-soderzhashhey-biokompleks-kobalta-s-furazolidonom.html).
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,1 до 5,0 мас. % диоксидина, более предпочтительно от 0,5 до 1,0 мас. %.
В предпочтительном варианте осуществления композиция имеет соотношение: производное диаминопиримидина (например, триметоприм) : диоксидин ≈ от 1:5 до 1:40, более предпочтительно - от 1:5 до 1:10.
В предложенной композиции диоксидин используется с лизоамидазой для лечения ран с поливалентной микрофлорой, в состав которой входят грамположительные и грамотрицательные микроорганизмы. Поскольку некоторые штаммы грамположительных бактерии - стафилококкоков, стрептококкоков более устойчивы к диоксидину, а бактериолитические ферменты, входящие в лизоамидазу, лизируют грамположительные патогенные микроорганизмы такие, как стафилококки и стрептококки, то совместное применение лизоамидазы и диоксидина в одной комбинированной композиции расширяет ее терапевтическую активность, в том числе, включая активность и в отношении резистентных штаммов к тому или другому компоненту в сочетании, по сравнению с монопрепаратами, применяемыми раздельно.
Лизоамидаза хорошо очищает раны от некротических масс. Фрагменты разрушенных клеток обладают иммуностимулирующим действием, которое при лечении гнойных ран мягких тканей ускоряет течение раневого процесса. При этом быстрее происходит грануляция и даже эпителизация тканей.
Диоксидин при обработке ожогов и нагноившихся ран тоже эффективно очищает поверхность раны и стимулирует процесс восстановления тканей. При их совместном применении в одной комбинированной композиции за счет аддитивного эффекта усиливается очищение раны и ускорение течения раневого процесса.
В составе предлагаемой фармацевтической комбинированной композиции вместе с лизоамидазой используется синтетическое антибактериальное вещество - нитазол. Нитазол (аминитрозол) - N-(5-Нитро-2-тиазолил)ацетамид - желтый с зеленоватым оттенком кристаллический порошок, который практически нерастворим в воде, малорастворим в спирте. Он является антианаэробным препаратом, причем резистентность анаэробов к нему отмечается редко.
Нитазол является антибактериальным препаратом специфического действия, так как активен только в отношении бактерий, имеющих анаэробный механизм. Препарат избирательно действует на анаэробы, функционирующие при сравнительно низком окислително-восстановительном потенциале, достаточном для обеспечения восстановления нитрогруппы нитазола, что сопровождается генерацией нестабильных промежуточных продуктов, биологически активных в отношении ДНК. Восстановленный нитазол связывается с ДНК и вызывает разрушение цепи, результатом чего является прекращение репликации и транскрипции ДНК.
Нитазол обладает высокой активностью в отношении аспорогенных анаэробов (бактероидов, пептококков, пептострептококков) и спорообразующих анаэробов клостридий, а также в отношении факультативных анаэробов: стафилококка, кишечной палочки, клебсиеллы и других.
Нитазол проявляет выраженный ингибирующий эффект как на антибиотикочувствительные, так и на резистентные к ним штаммы бактерий. Он подавляет развитие Trichomonas vaginalis и других простейших, оказывает также противомикробное действие в отношении патогенных микроорганизмов: Staphylococcus spp., Streptococcus spp., Escherichia coli и некоторых других. Он неактивен в отношении Proteus spp.и Pseudomonas aeruginosa.
Нитазол имеет прямое противовоспалительное действие: препарат снижает степень отечной реакции при экссудативном воспалении как в случаях его системного применения, так и местного применения. Предпочтительным является применение нитазола на гидрофильной основе.
Противоотечное действие нитазола выше, чем гидрокортизона ацетата. В составе комбинированных препаратов противовоспалительный эффект может быть усилен за счет синергидного действия ряда компонентов, проявляющих свою активность по различным механизмам. («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье», 1995 г., стр. 164, 165, 181).
Формирование лекарственной устойчивости к нитазолу, относящемуся к группе 5-нитроимидазолов, связано со снижением активности нитроредуктаз и степени внутриклеточной трансформации соединений, снижением образований комплексов с ДНК и концентрации цитотоксических продуктов метаболизма. Возможно также снижение проницаемости клеточной стенки микроорганизмов для нитазола.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,5 до 4,0 мас. % нитазола.
В состав некоторых композиций с лизоамидазой и нитазолом входят сульфаниламиды и антибиотики. Для увеличения проницаемости клеточной стенки микроорганизмов для нитазола в комбинированную композицию вводится вещество, нарушающее целостность мембран клеточной оболочки бактерий, например, этилдиаминтетрауксусная кислота (ЭДТА) или трилон Б.
Лизоамидаза лизирует широкий спектр грамположительных патогенных микроорганизмов, таких как стафилококки и стрептококки. Нитазол активен только в отношении бактерий, имеющих анаэробный механизм. Их совместное применение в одной композиции позволяют охватить достаточно широкий спектр подавления поливалентной бактериальной микрофлоры гнойных ран. Нитазол не активен в отношении Proteus spp. и Pseudomonas aeruginosa. Поэтому в составе данной композиции должно быть антибактериальное вещество, проявляющее бактериостатическое или бактерицидное действие по отношению к штаммам бактерий P. aeruginosa, штаммам протея и другим, устойчивым к нитазолу микроорганизмам. Таким веществом является, например, трилон Б или поверхностно-активные вещества (ПАВ).
В составе предлагаемой фармацевтической комбинированной композиции вместе с лизоамидазой используются синтетические антибактериальные вещества, не являющееся антибиотиками, - сульфадиметаксин, сульфаниламид (стрептоцид), или их смесь, а также мафенида ацетат. Эти препараты относится к сульфаниламидам - веществам, действующим на метаболизм фолиевой кислоты.
Сульфаниламиды являются антимикробными препаратами с гермистатическим типом действия. Они оказывают антибактериальное действие за счет конкурентного антагонизма между ними и n-аминобензойной кислотой, которая служит фактором роста для бактерий. Сульфаниламиды избирательно нарушают синтез дигидрофолиевой кислоты в микробной клетке, ингибируя активность фермента синтетеазы дигидрофолиевой кислоты, и конкурируют с парааминобензойной кислотой (ПАБК) в процессе синтеза дигидрофолиевой кислоты. Некоторые сульфаниламиды, кроме того, могут подавлять активность другого важного для фолиевых кислот фермента - дигидрофолатредуктазы (ДФР), что усиливает их антимикробную активность.
Действие сульфаниламидов по принципу двойной мишени потенцируют производные диаминопиримидина, например, такие как триметоприм, пириметамин. Диаминопиримидины имеют широкий антимикробный спектр. Например, триметоприм активен в отношении грамположительных и грамотрицательных аэробных бактерий. К нему наиболее чувствительны: штаммы бактерий Staphylococcus spp., S. aureus, Streptococcus spp., S. pyogenes, S. pneumoniae, E. faecalis, Enterobacteriaceae, E. coli, Shigella spp., Salmonella spp., Klebsiella spp., менее чувствительны: H. influenzae, N. meningitidis, N. gonorrhoeae, Proteus spp., P. vulgaris, P. mira-bilis, P. rettgeri, малочувствительны: H. pertussis, M. catarrhalis, P. aeruginosa, Clostridium spp., Bacteroides spp. Тиметоприм активен в отношении простейших: пневмоцист (наибольшая активность), токсоплазм и др. (http://www.zdravosil.ru/lekarstvennye-sredstva-dlya-lecheniya-bakterialnyx/page/126/).
Производные диаминопиримидинов избирательно ингибируют в микробной клетке фермент ДФР с последующим нарушением синтеза тетрагидрофолиевой кислоты (следующая стадия синтеза фолатов). Это позволяет успешно сочетать производные диаминопиримидина с сульфаниламидами на основе так называемого принципа двойной мишени. В результате достигается полная блокада синтеза фолиевых кислот, обеспечивается бактерицидный эффект, расширяется спектр действия, снижается частота развития лекарственной устойчивости к производным сульфониламидов и диаминопиримидина. Существенным при таком сочетании является возможность снижения дозировок каждого из препаратов («Антимикробные препараты в ряду производных сульфаниламида, диаминопиримидина, 5-нитроимидазола, ди-N-оксихиноксалина», Падейская Е.Н., РМЖ №21 от 04.11.1997 г., стр. 1-6).
При лечении бактериальных инфекций у человека используют сочетание сульфаниламидов с производными диаминопиримидина: пириметамином, триметопримом, тетроксопримом, метиопримом или бродимопримом. При разработке фиксированных лекарственных форм этих препаратов (сульфаниламидов с производными диаминопиримидина) на первых этапах основное значение придавали фармакокинетическим показателям: равному значению Т1/2 из крови для обеспечения необходимой концентрации в крови и тканях одновременно двух компонентов препарата. С этой точки зрения наиболее рациональны сочетания сульфаниламидов средней длительности действия (Т1/2 - 12-24 часа) с триметопримом и ультрапролонгированных сульфаниламидов (T1/2 - 24-72 часа) с пириметамином. Потенцирующий эффект производных диаминопиримидина очень высок и синергизм отмечается в широком диапазоне доз (например, при дозе триметоприма в 40 раз меньшей, чем доза сульфаметоксазола). Оказалось, что при выборе сочетаний, кроме фармакокинетических параметров, существенное значение имеет и критерий активности (степень потенцирующего эффекта при сочетании препаратов, степень активности сульфаниламидов в монотерапии). Показано, что при сочетании триметоприма с некоторыми действующими длительно сульфаниламидами достигается высокий лечебный эффект при значительном снижении лечебных доз (например, сульфатон и келфиприм) («Антимикробные препараты в ряду производных сульфаниламида, диаминопиримидина, 5-нитроимидазола, ди-N-оксихиноксалина», Падейская Е.Н., РМЖ №21 от 04.11.1997 г., стр. 1-6).
Спектр действия комбинированных с триметопримом сульфаниламидных препаратов приближается к спектру действия антибиотика левомицетина. К ним чувствительны до 50-90% штаммов стафилококков, кишечной палочки, энтеробактерий, сальмонелл, шигелл, псевдомонад (http://medbe.ru/materials/obshchie-voprosy-stomatologii-i-chlkh/sulfanilamidnye-preparaty/).
В зависимости от способности всасываться из желудочно-кишечного тракта, системного или местного действия и показаний к применению сульфаниламиды можно разделить на четыре основных группы, в каждой из которых имеются сульфаниламиды короткого действия и депо-сульфаниламиды («Антимикробные препараты в ряду производных сульфаниламида, диаминопиримидина, 5-нитроимидазола, ди-N-оксихиноксалина», Падейская Е.Н., РМЖ №21 от 04.11.1997 г., стр. 1-6).
Сульфаниламид (стрептоцид) относится к веществам короткого действия с периодом полувыведения 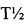 =8-10 часов. Сульфадиметаксин относится к веществам длительного действия с периодом полувыведения
=8-10 часов. Сульфадиметаксин относится к веществам длительного действия с периодом полувыведения 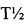 =24-48 часов.
=24-48 часов.
Бактериостатический эффект сульфаниламидов основан на структурном сходстве с парааминобензойной кислотой (ПАБК), которая необходима для жизнедеятельности микроорганизмов. В средах, где имеется много ПАБК (гной, очаг тканевого распада), сульфаниламиды малоэффективны. По этой же причине они слабо действуют в присутствии прокаина (новокаина) и бензокаина (анестезина), гидролизующихся с образованием ПАБК.
Сульфаниламид (стрептоцид) оказывают бактериостатическое действие на стрептококки, пневмококки, стафилококки, менингококки, гонококки, кишечную палочку и палочку сине-зеленого гноя, палочки дизентерии, вульгарный протей, возбудитель пахового лимфогранулематоза и ряд крупных вирусов - возбудителей трахомы и фолликулярного конъюнктивита (http://pharmacotherapy.com.ua/streptocid.html).
Клиническая значимость стрептоцида определяется его активностью в отношении синегнойной палочки и протея («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье» 1995 г., стр. 159, 160).
Сульфадиметоксин - сульфаниламидный препарат пролонгированного действия, превосходящий по своей активности многие антибиотики. Его противомикробное действие проявляется в отношении гноеродных кокков, некоторых штаммов протея, кишечной палочки. Препарат хорошо сочетается с левомицетином и другими антибиотиками. Сульфадиметоксин довольно быстро всасывается и обнаруживается в биологических жидкостях через 30 мин после приема, но уровень его концентрации возрастает сравнительно медленно, достигая максимальных показателей в крови через 8-12 часов. Через 48 часов в крови содержится до 56% введенное дозы («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье» 1995 г., стр. 236).
Со стрептоцидом и сульфадиметоксином ранее выпускались эффективные мази для лечения гнойных ран в I фазе раневого процесса «Левонорсин», «Левосин», «Нитацид», для лечения ран во II фазе раневого процесса - мазь «Стрептонитол». Эти мази не имели выраженного некролитического действия. Кроме того, к компонентам этих мазей (стрептоциду, сульфадиметоксину, левомицетину, и, в меньшей степени, к нитазолу) появилась устойчивость госпитальных штаммов патогенных бактерий.
В предлагаемой композиции ее основным компонентом в сочетании с сульфаниламидами, нитазолом и левомицетином является лизоамидаза, обладающая некролитическим действием, и к которой отсутствует резистентность грамположительной стафилококковой и стрептококковой микрофлоры.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,5 до 5,0 мас. % сульфадиметоксина.
В предпочтительном варианте осуществления композиция содержит от 1,0 до 10,0 мас. % стрептоцида (сульфаниламида), более предпочтительно - от 4,0 до 5,0 мас. %.
В предпочтительном варианте осуществления композиция имеет соотношение производное диаминопиримидина (например, триметоприм или пириметамин): сульфаниламид ≈ от 1:5 до 1:40, более предпочтительно - от 1:5 до 1:20.
Лизоамидаза за счет протеолитических свойств хорошо очищает раны от гноя, продуктов тканевого распада (ПАБК), при которых сульфаниламиды малоэффективны. Таким образом, при совместном применении лизоамидазы с сульфаниламидами в одной комбинированной композиции повышается эффективность сульфаниламидов. Кроме того, поскольку многие микроорганизмы, в том числе грамположительные, приобрели устойчивость к сульфаниламидам, а лизоамидаза имеет широкий спектр бактериолитической активности по отношению к грамположительным бактериям, то антибактериальное действие лизоамидазы будет компенсировать в комбинированной композиции снижение антибактериального эффекта сульфаниламидов из-за резистентности этих бактерий к ним.
Мафенида ацетат - 4-аминометилбензолсульфамид. Препарат в отличие от сульфаниламидов не является антагонистом n-аминобензойной кислоты, так как продукты гнойного отделяемого раны не дезактивируют его действие. Мафенида ацетат обладает достаточно широким спектром антибактериального действия, хотя его МПК по отношению к различным бактериям сравнительно высоки, что требует применения этого препарата в больших концентрациях.
Мафенида ацетат эффективен в отношении грамположительных и грамотрицательных бактерий и патогенных анаэробов. Он не инактивируется парааминобензойной кислотой и не меняет активности в кислой среде («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье» 1995 г., стр. 161).
К мафениду ацетату практически не развивается устойчивость бактерий. Мазь мафенида ацетата является препаратом выбора при инфицировании ран палочкой сине-зеленого гноя, но оказывает также антибактериальное действие на другие бактерии («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье» 1995 г., стр. 245-247).
Мафенида ацетат эффективен in vitro в отношении грамположительных и грамотрицательных бактерий (Citrobacter, Enterobacter, энтерококки, Escherichia coli, Klebsiella, Mima-Herelia, Proteus morganii, Proteus mirabilis, Proteus vulgaris, Proteus rettgeri, Pseudomonas aeruginosa, Serratia, Staphylococcus aureus, Staphylococcus epidermidis и бета-гемолитический стрептококк), патогенных анаэробов, в т.ч. возбудителя газовой гангрены (Clostridium perfringens), а также в отношении Candida albicans. Его МПК, в зависимости от вида микроорганизма составляет 30-5000 мкг/мл, снижается. В концентрации 5-10% он эффективен при местном лечении гнойной инфекции (http://med36.com/drug/2726).
10% мазь мафенида ацетата проявляет избирательно высокую активность в отношении штаммов синегнойной палочки, что дает основание рекомендовать ее в качестве препарата выбора при лечении гнойных ран и ожогов, инфицированных госпитальными высокорезистентными штаммами P. aeruginosa (Блатун Л.А. и др. «Клинико-лабораторная эффективность современных мазей на полиэтиленгликолиевой основе при лечении гнойных ран», Антибиотики и химиотерапия, 1999 г., №7, стр. 25-31).
В предпочтительном варианте осуществления предлагаемая композиция содержит от 5,0 до 10,0 мас. % мафенида ацетата.
В предложенной фармацевтической комбинированной композиции сульфаниламиды, тримекаин и мафенида ацетат используются совместно с лизоамидазой для лечения гнойных ран с поливалентной микрофлорой, содержащей штаммы стафилококков, стрептококков, к которым лизоамидаза активна, а также синегнойной палочки и других грамотрицательных микроорганизмам, к которым у лизоамидазы активность отсутствует.
В составе предлагаемой композиции используется синтетическое антибактериальное вещество, снижающее резистентность микроорганизмов - хинифурил-Н-(5-диэтиламинопентил-2)-2-[2'-(5''-нитрофурил-2'')-винил]-4-хинолинкарбоксамид. Это зеленовато-желтый аморфный порошок, практически нерастворимый в воде, малорастворимый в спирте. Хинифурил относится к нитрофуранам, которые выступают в роли акцепторов через восстановление нитрогруппы с генерацией биологически активных промежуточных продуктов. Этот процесс ведет к воздействию на ДНК.
Нитрофураны более активны в отношении аэробных бактерий. Они относятся к соединениям, подавляющим процесс переноса детерминанты устойчивости (предупреждение распространения плазмид резистентности) при конъюгации бактерий. Являясь акцепторами кислорода, нитрофураны нарушают процесс клеточного дыхания бактерий, ингибируют биосинтез нуклеиновых кислот, в зависимости от концентрации они оказывают бактериостатический или бактерицидный эффект. В концентрации 0,5% и более нитрофуран оказывает бактерицидное действие.
К нитрофуранам редко развивается лекарственная резистентность микроорганизмов. Они характеризуются достаточно широким спектром действия и в высоких концентрациях in vitro активны в отношении многих аэробных грамотрицательных (Е. coli, K. pneumoniae и др.) и грамположительных бактерий, некоторых анаэробов, грибов рода Candida. К нитрофуранам малочувствительны энтерококки, устойчивы P. aeruginosa, большинство штаммов протея, серрации, провиденции, ацинетобактера («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье», 1995 г., стр. 163). Они применяются только местно в виде 0,5% мази.
В предпочтительном варианте осуществления композиция содержит от 0,1 до 1,0 мас. % хинифурила, более предпочтительно от 0,2 до 0,5 мас. %.
В предлагаемой комбинированной композиции хинифурил целесообразно применять вместе с лизоамидазой, имеющей механизм действия на патогенные грамположительные бактерии, отличный от механизма действия нитрофуранов, что расширяет активность предлагаемой комбинированной композиции по отношению к грамположительным микроорганизмам.
Кроме того, в составе данной композиции должно быть антибактериальное вещество, обладающее бактериостатическим или бактерицидным действием по отношению к штаммам бактерий P. aeruginosa, штаммам протея и другим, устойчивым к хинифурилу. Таким веществом является, например, трилон Б.
В составе предлагаемой композиции используются синтетические антибактериальные вещества, снижающее резистентность микроорганизмов: этилендиаминтетрауксусная кислота (ЭДТА), ее динатриевая соль (трилон Б) или их смесь. Этилендиаминтетрауксусная кислота - четырехосновная карбоновая кислота, комплексон II, белый мелкокристаллический порошок, который малорастворим в воде, нерастворим в большинстве органических растворителей, растворим в щелочах, с катионами металлов образует соли этил ендиаминтетраацетаты.
Динатриевая соль этилендиаминтетрауксусной кислоты (комплексон-III, трилон Б, хелатон III) представляет собой белый кристаллический порошок или кристаллы белого цвета. Он хорошо растворяется в воде и щелочах, очень слабо - в спирте; рН 1%-ного водного раствора - 4,5; рН препарата с массовой долей 5% - 4-5,5. Образуются очень устойчивые комплексные соединения этой соли с большинством катионов, она вступает в реакцию с сильными окислителями.
ЭДТА и трилон Б - вещества, изменяющие структуру цитоплазматической мембраны микроорганизмов. Они нарушают целостность мембран клеточной оболочки бактерий, что снижает резистентность бактерий к антибиотикам и другим антибактериальным веществам, особенно тех, для которых ионы кальция и магния являются антагонистами проявления их антимикробного действия, например, полимиксинов и аминогликозидов.
В результате достаточно длительного контакта раствора ЭДТА с различными видами микроорганизмов в клетках последних происходит разрушение нуклеиновых кислот, что ведет к их лизису. Кроме влияния на клеточную оболочку и метаболизм бактерий ЭДТА индуцирует потерю плазмид у штаммов - трансдуктантов стафилококка, а также препятствует генетическому переносу R-плазмид в опытах in vivo у стафилококка.
Воздействие ЭДТА и трилона Б на мембрану микробной клетки приводит к лизису половых пилей, обеспечивающих перенос плазмид. В связи с этим в резистентной популяции микроорганизмов в первую очередь снижается количество имеющих половые пили R+-клеток, ответственных за межбактериальную передачу плазмид в процессе конъюгации.
Основное различие в строении клеточной оболочки грамположительных и грамотрицательных микроорганизмов заключается в наличии у грамотрицательных форм внешней мембраны. Любые литические ферменты не могут гидролизовать пептидогликановый слой наружной оболочки бактерий без удаления внешней мембраны, что удается сделать с помощью хелатирующих агентов и детергентов, включаемых в состав комбинированных препаратов.
Трилон Б - является хелатообразующим веществом, связывающим ионы двухвалентных металлов, что обусловливает потерю липополисахаридного комплекса мембраной. В результате этого клеточная стенка становится хрупкой, увеличивается ее проницаемость для различных веществ, в том числе обладающих антимикробным действием. Это оказывает выраженное повреждающее действие на микробную клетку.
Для лечения ран с поливалентной микрофлорой этот препарат может использоваться в сочетании с антимикробными средствами направленного действия. В этих случаях трилон Б, повышая проницаемость микробной клетки, усиливает чувствительность микроорганизмов к антибактериальным препаратам, например, левомицетину и тетрациклину.
Трилон Б проявляет бактериостатическое действие по отношению к штаммам грамотрицательных и грамположительных гноеродных бактерий: к стафилококку и палочке сине-зеленого гноя - в концентрации более 0,075%, к протею и кишечной палочке - в концентрации более 0,15%. Минимальная бактериостатическая концентрация (МБК) трилона Б по отношению к Staphylococcus aureus АТСС 25923 составляет 2%, к Pseudomonas aeruginosa АТСС 27858 - 0,5%.
Трилон Б может применяться местно в качестве бактериостатического вещества при лечении ран, инфицированных палочкой сине-зеленого гноя, а также для консервации лекарственных препаратов. Кишечная палочка эффективно лизируется при комбинировании трилона Б и лизоцима.
Палочка сине-зеленого гноя, а также протей менее чувствительны к катионным антисептикам, чем стафилококки, стрептококки, пневмококки, кишечные и тифозные палочки, и др. Комбинация трилона Б с катионными ПАВ, к которым у палочки сине-зеленого гноя и протея нет ни приобретенной, ни природной резистентности, повышает бактерицидное действие к этим микроорганизмам. Комбинация трилона Б с катионными антисептиками перспективна для использования их в составе лекарственных препаратов в качестве консервантов.
Учитывая данные о зависимости активности гистамина от ионов Са2+, рационально в состав препаратов для лечения ран в I фазу раневого процесса вводить комплексоны, в частности трилон Б (или ЭДТА) для улучшения процессов микроциркуляции в тканях раны.
Трилон Б относится к водорастворимым антиоксидантам, которые снижают вторичный некроз тканей в окружности раны, связанный с избыточным свободнорадикальным окислением («Теория и практика местного лечения гнойных ран» под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье», 1995 г., стр. 139, 143, 144, 146, 180, 185, 228).
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,001 до 0,500 мас. % ЭДТА.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,005 до 10,000 мас. % трилона Б, более предпочтительно от 0,01 до 4,00 мас. %.
В предложенной комбинированной композиции ЭДТА и трилон Б используются с лизоамидазой для лечения ран с поливалентной микрофлорой, в состав которой входят грамположительные и грамотрицательные микроорганизмы.
Поскольку механизмы действия ЭДТА и трилона Б на грамотрицательные микроорганизмы различен, то для усиления лизиса грамотрицательных микроорганизмов целесообразно совместное применение этих веществ в одной комбинированной композиции. Совместное применение лизоамидазы с веществами, нарушающими структуру мембран микроорганизмов, индуцирующими потерю плазмид у штаммов - транедуктантов стафилококка, а также препятствующими генетическому переносу R-плазмид (ЭДТА, трилон Б), разрушающими нуклеиновые кислоты (ЭДТА), в виде монокомпонента или в виде смеси компонентов, значительно усиливает антибактериальное действие предложенной комбинированной композиции.
Вторичный некроз тканей в окружности раны частично связан с избыточным свободнорадикальным окислением. Поскольку трилон Б является водорастворимым антиоксидантом, то применение его в предложенной фармацевтической комбинированной композиции с лизоамидазой уменьшает вторичный некроз тканей в окружности раны.
В составе предлагаемой комбинированной композиции используется синтетическое антибактериальное вещество, снижающее резистентность микроорганизмов - димексид (диметилсульфоксид, ДМСО).
Димексид - биполярный апротонный растворитель - нашел широкое применение в различных областях химии, а также в качестве лекарственного средства. Он представляет собой вязкую бесцветную жидкость или бесцветные кристаллы, плавящиеся при температуре 18,5°С, со специфическим запахом. Димексид гигроскопичен, смешивается во всех соотношениях с водой и спиртом, при смешивании с водой сильно нагревается.
Применяют димексид как в неразведенном виде, так и в виде растворов в дважды дистиллированной воде. Димексид оказывает местное анестезирующее, местное противовоспалительное, противомикробное (антисептическое) и фибринолитическое действие. Кроме этого димексид имеет противовирусное, противогрибковое, сосудорасширяющее действие, снижает уровень свободных радикалов, стимулирует различные типы иммунитета.
Димексид быстро и хорошо проникает через биологические мембраны, в том числе через кожу и слизистые оболочки, повышает их проницаемость для других лекарственных средств. Его молекулярная связь с водой в 1,3 раза сильнее, чем молекулярная связь воды с водой. Вследствие этого он замещает воду при движении через мембраны клеток и транспортирует с собой вещества, которые обычно сами не могут проникать через мембрану в клетку. За счет этого он усиливает терапевтический эффект некоторых транспортируемых лекарственных веществ, например, антибиотиков.
В этом случае они могут быть использованы в меньших дозах, чем обычно, без снижения их терапевтической эффективности и с уменьшением их нежелательных побочных эффектов.
Димексид гидратизирует клетки, вызывая изменения в структуре жидкости клеточной воды. Он изменяет чувствительность микрофлоры, резистентной к антибиотикам. Димексид действует на мембрану микробной клетки, что приводит к лизису половых пилей, обеспечивающих перенос плазмид. В связи с этим в резистентной популяции микроорганизмов в первую очередь снижается количество имеющих половые пили R+-клеток, ответственных за межбактериальную передачу плазмид в процессе конъюгации.
В большинстве случаев димексид применяют в сочетании с другими лекарственными веществами (предварительно растворив в нем) для лучшего и более глубокого их проникновения в ткани в виде компонента гидрофильных основ (http://www.rlsnet.ru/mnn_index_id_64.htm).
Введение в основу более 5% легкопроникающего диоксида вызывает значительное ухудшение жизнеспособности клеток ткани.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,5 до 5,0 мас. % димексида, более предпочтительно от 1,0 до 3,0 мас. %.
В предложенной фармацевтической комбинированной композиции димексид используется совместно с лизоамидазой для лечения гнойных ран с поливалентной микрофлорой, содержащей кроме грамположительных бактерий, к которым лизоамидаза активна, грамотрицательные бактерии, а также грибы, к которым лизоамидаза не активна.
Применение димексида в предлагаемой композиции оказывает также местное анестезирующее, местное противовоспалительное, сосудорасширяющее действие, а также снижает уровень свободных радикалов, стимулирует различные типы иммунитета.
В составе предлагаемой комбинированной композиции используются синтетические антибактериальные вещества, снижающие резистентность микроорганизмов, в виде поверхностно-активных веществ (ПАВ).
ПАВ - большая группа веществ с дифильным строением молекул, которые способны в жидкой среде адсорбироваться из раствора на поверхность раздела фаз (например, поверхность микробных клеток) с понижением свободной поверхностной энергии. Применение катионных и анионных ПАВ в медицинской практике связано с их способностью нарушать барьеры проницаемости микробных клеток. При этом ПАВ разрушают мембрану, связывая внутренние белки или выстраиваясь между молекулами липидов, увеличивают их подвижность. Связывание с мембранами бактерий ионогенных ПАВ вызывает выход из бактериальных клеток жизненно важных метаболитов, ионов калия, неорганического фосфора, сахаров, пуриновых и пиримидиновых оснований. Из клеток стафилококка и кишечной палочки, обработанных как катионным, так и анионным ПАВ, наблюдается интенсивный выход веществ с максимумом поглощения 260 нм, свойственным нуклеиновым кислотам. При этом количество «поглощаемого» клетками стафилококка антибиотика увеличивается в 3 (катионным) и 2 (анионным) раза. Внутриклеточное накопление антибиотиков сопровождается существенным повышением их антимикробного действия, в том числе и в отношении резистентных форм бактерий.
ПАВ способны выполнять самостоятельно функцию антимикробного вещества, что наиболее характерно для катионных ПАВ. Особенно важной для клинической практики является способность ПАВ влиять на элиминацию и перенос плазмид лекарственной устойчивости у бактерий.
Существуют два вида элиминации плазмид: один - вследствие подавления репликации плазмидной ДНК, другой за счет преимущественного угнетения роста бактериальных клеток, которые являются носителями плазмид, что приводит к отбору бактерий, спонтанно теряющих внехромосомные факторы.
Свойства ПАВ - изменять проницаемость клеточных стенок и угнетать действие β-лактамаз - не связаны друг с другом. Однако они оба усиливают действие антибиотиков в отношении резистентных бактерий. При этом эффект усиления не зависит от типа устойчивости бактерий - хромосомного или плазмидного.
Ингибиторами ферментов, инактиваторов антибиотиков являются некоторые анионактивные и неионогенные ПАВ. В суббактериостатических концентрациях анионные ПАВ (алкилсульфаты) в опытах in vitro снижали в 100 и более раз частоту передачи Em-устойчивости у стафилококков, в то время как катионные ПАВ (роккал, катамин АБ, хлоргексидина биглюконат) такой способностью не обладали. В опытах in vivo на модели гнойно-воспалительного процесса у крыс было выявлено, что натрия лаурилсульфат в концентрации 0,1% подавлял у стафилококков (в ряде случаев полностью) трансдукцию плазмиды Em-устойчивости. Анионные ПАВ полностью подавляют генетический перенос R-плазмид у кишечной палочки как при конъюгации, так и при трансдукции.
Активный центр пенициллиназы содержит основные аминокислоты. Поэтому эффективными ингибиторами этого фермента являются вещества, активно взаимодействующие с его аминогруппами. Этим требованиям более всего удовлетворяют анионные ПАВ, представляющие собой натриевые соли алкилсульфатов и алкилсульфонатов высших жирных кислот (ВЖС) с количеством атомов углерода в алкильных цепях от 12 до 16.
К анионным ПАВ относятся натриевые соли сульфоэфиров высших жирных спиртов, например, натрия лаурилсульфат. Аниононные ПАВ содержат в молекуле полярные группы и диссоциируют в воде с образованием отрицательно заряженных длинноцепочечных органических ионов, определяющих их поверхностную активность. Натриевые, аммониевые и триэтаноламиновые соли растворимы в воде.
Анионные ПАВ - натрия лаурилсульфат, алкилбензолсульфонат натрия (С10-C16) - являются эффективными ингибиторами ферментов, инактивирующих аминогликозиды, в частности, неомицин, канамицин, стрептомицин. Эти ПАВ полностью подавляют активность соответствующих ферментов в дозах в 2,5 раз меньших, чем катионные ПАВ. Так, например, алкилбензолсульфонат натрия - инактиватор β-лактамаз кишечной палочки. Эффективным ингибитором хлорамфеникол-ацетилтрансферазы является натрия лаурилсульфат («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье», 1995 г., стр. 142,143, 144-146).
В предлагаемой комбинированной композиции используется анионный ПАВ в виде натрия лаурилсульфата.
Катионоактивные ПАВ диссоциируют в воде с образованием положительно заряженных органических ионов, определяющих их поверхностную активность. Проникшие в цитоплазму клетки катионные ПАВ вызывают осаждение внутриклеточных белков и нуклеиновых кислот, что приводит к необратимым нарушениям жизнедеятельности микроорганизмов. Спектр их действия включает в себя стафилококки, стрептококки, пневмококки, кишечную и тифозную палочки, холерный вибрион и др. Менее чувствительны к катионным антисептикам палочка сине-зеленого гноя, а также протей. Катионоактивные ПАВ, особенно соли четвертичных аммониевых и пиридиновых соединений, обладают сильным бактерицидным свойством («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье», 1995 г., стр. 145-147).
В предлагаемой комбинированной композиции используются малотоксичные катионные ПАВ: катапол, хлоргексидин, мирамистин, декаметоксин, полигексанид, октенидин.
Катапол - n-алкилдиметилбензиламмония хлорид + поливинилпирролидон + кротоновая кислота (бензалкония хлорид + повидона сополимер с кротоновой кислотой).
Катапол, представляющий комплекс катамина АБ с полимером в форме 10% раствора, из которого перед употреблением готовят 1% раствор. Он относится к группе катионных ПАВ и является антисептиком широкого спектра действия, разрешенным к применению в медицине, ветеринарии и птицеводстве, в пищевой и рыбоперерабатывающей промышленности. Катапол выпускается в виде 10%-ного водного раствора, содержащего кроме основного вещества еще и хлористый натрий. В медицинской, ветеринарной и санитарной практике препарат используется в виде разбавленных растворов с концентрациями 0,01-1,00 мас. %.
Катапол - антисептическое средство для наружного применения широкого спектра действия, проявляет бактерицидную активность в отношении стафилококков, стрептококков, грамотрицательных бактерий (в т.ч. кишечной и синегнойной палочек, протея, клебсиеллы), анаэробных бактерий, грибов и плесеней. Он действует на штаммы бактерий, устойчивых к антибиотикам и другим химиотерапевтическим лекарственным средствам. Катапол усиливает действие различных антибиотиков при совместном применении; подавляет ферменты патогенности бактерий (плазмокоагулазу и гиалуронидазу стафилококков) (www.recipe.ru; «Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье», 1995 г., стр. 145-147). Катапол стимулирует регенерацию тканей. Кроме того, он обладает противовоспалительным и противоожоговым действием (http://www.recipe.ru/docs/ls/index.php?fllter=bysearch&fllter_param=Катапол&action=descr-drug-table&drugid=5777).
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,01 до 1,00 мас. % катапола.
В такой композиции катапол используется совместно с лизоамидазой для лечения гнойных ран с поливалентной микрофлорой, содержащей штаммы стафилококков, стрептококков и др., к которым лизоамидаза активна, а также штаммы грамотрицательных бактерий и грибы, по отношению к которым лизоамидаза не активна.
Применение катапола в предлагаемой композиции оказывает также противовоспалительный эффект и стимулирует регенерацию тканей.
Хлоргексидин - N,N''-бис(4-хлорфенил)-3,12-диимино-2,4,11,13-тетрааза-тетра декандиимидамид - белый кристаллический порошок без запаха, который плохо растворим в воде и спирте. Хлоргексидин глюконат содержит значительное количество действующего вещества, а именно на 1 мл препарата приходится 0,2 грамма, а на 1 мл хлоргексидина биглюконата приходится 0,5 мг действующего вещества.
Хлоргексидин активен (бактерициден) в отношении большинства грамположительных и грамотрицательных аэробных и анаэробных бактерий, трепонем, гонококков, трихомонад, он не действует на вирусы и споры.
Хлоргексидина биглюконат является эффективным ингибитором пенициллиназы. Он также инактивирует хлорамфеникол-ацетилтрасферазу кишечной палочки и стафиллококка. Хлоргексидина биглюконат обладает выраженным антимикробным действием в отношении основных возбудителей гнойной раневой инфекции уже в концентрациях 10-50 мкг/мл. При более высоких концентрациях наступает быстрый бактерицидный эффект. Благодаря низкой токсичности и слабому раздражающему действию хлоргексидин биглюконт используется в виде 0,02-0,50% раствора в 70% этиловом спирте или очищенной воде («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье», 1995 г., стр. 147).
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,01 до 1,00 мас. % хлоргексидина биглюконата.
В предложенной фармацевтической комбинированной композиции хлоргексидина биглюконат используется совместно с лизоамидазой для лечения гнойных ран с поливалентной микрофлорой, содержащей штаммы стафилококков, стрептококков и др., в отношении которых лизоамидаза активна, а также штаммы грамотрицательных бактерий и грибы, по отношению к которым лизоамидаза не активна.
Декаметоксин - 1,10-декаметилен-бис(N,N-диметилментоксикарбонил-метил) аммония дихлорид - белый кристаллический порошок со слабым характерным запахом, который хорошо растворим в воде, этаноле и хлороформе с образованием слегка опалесцирующих растворов, малорастворим в ацетоне, практически нерастворим в эфире и бензоле.
Декаметоксин - малотоксичный катионный антисептик. Он является антисептическим средством группы четвертичных аммониевых соединений. Препарат концентрируется на цитоплазматической мембране (ЦПМ) микробной клетки и соединяется с фосфатидными группами липидов мембраны, нарушая проницаемость ЦПМ микроорганизмов.
В основе действия лежит следующий механизм - декаметоксин разрушает верхнемембранный слой, разрыхляет мембрану и повышает ее проницаемость для крупномолекулярных веществ. Поскольку на мембранных структурах фиксируется большинство ферментов, декаметоксин изменяет энзиматическую активность клетки, угнетая ферментативные системы. Гидрофобный радикал декаметоксина способствует максимальному связыванию препарата с клеточной мембраной микроорганизмов, а катионный - сначала уменьшает, а затем нейтрализует заряд микробной клеточной стенки. Декаметоксин не действует на мембраны клеток человека, поскольку они имеют значительно большую длину липидных радикалов и поэтому гидрофобного взаимодействия не происходит.
Фармакологическое действие декаметоксина - противомикробное, противогрибковое. Он оказывает выраженное бактерицидное действие на стафилококки, стрептококки, дифтерийную и синегнойную палочки, капсульные бактерии и фунгицидное действие на дрожжи, дрожжеподобные грибы, возбудителей епидермофитии, трихофитии, микроспории, еритразмы, некоторые виды плесневых грибов (аспергиллы, пенициллы), протистоцидное действие на трихомонады, лямблии, вирусоцидное действие на вирусы.
Декаметоксин высокоактивен относительно микроорганизмов, стойких к антибиотикам (пенициллин, левомицетин, тетрациклины, стрептомицин, мономицин, канамицин, неомицины, новобиоцин, эритромицин, олеандомицин и др.). Образование стойких к декаметоксину форм при длительном применении происходит медленно и не превышает эффективных концентраций препарата. Бактериостатические, фунгистатические концентрации сходны с его бактерицидными, фунгицидными, вирусоцидными, протистоцидными концентрациями. В процессе лечения декаметоксином повышается чувствительность антибиотикорезистентных микроорганизмов к антибиотикам, а также потенцируется действие других противомикробных средств при комплексном лечении.
При гнойных и грибковых заболеваниях используют 0,01-0,50% водный раствор декаметоксина для промываний. В состав раствора входят другие ингредиенты: этанол 96%, глицерин, цитраля раствор спиртовый 1,0%, вода очищенная (http://www.rlsnet.ru/mnn_index_id_689.htm; http://compendium.com.ua/akt/68/610/decametoxinum)
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,01 до 0,50 мас. % декаметоксина.
В предложенной комбинированной фармацевтической композиции декаметоксин используется совместно с лизоамидазой для лечения гнойных ран с поливалентной микрофлорой, содержащей штаммы стафилококков, стрептококков и др., к которым лизоамидаза активна, а также штаммы грамотрицательных бактерий, дрожжи, простейшие и вирусы, по отношению к которым лизоамидаза не активна.
Мирамистин - бензилдиметил[3-(миристоиламино)пропил]аммоний хлорид моногидрат - белый мелкокристаллический порошок без запаха. Он хорошо (медленно) растворим в воде, 95% спирте, хлороформе. Мирамистин - малотоксичный катионный антисептик. Он является антисептическим средством группы четвертичных аммониевых соединений, обладает антимикробным эффектом в отношении грамположительных микроорганизмов. На грамотрицательную флору действует хуже. По силе бактерицидной эффективности мирамистин мало уступает катамину АБ, входящему в состав катапола. Их МБК по отношению к стафилококку и палочке сине-зеленого гноя составляют, соответственно, 0,003% и 0,008%, 0,1% и 0,63%. Кроме того, мирамистин применяется в качестве стабилизатора дисперсных систем, служащих основами для пен и мазей.
Мирамистин обладает широким спектром антимикробного действия, включая госпитальные штаммы, резистентные к антибиотикам. Препарат оказывает выраженное бактерицидное действие в отношении грамположительных, грамотрицательных, аэробных и анаэробных бактерий, определяемых в виде монокультур и микробных ассоциаций, включая госпитальные штаммы с полирезистентностью к антибиотикам. Он оказывает противогрибковое действие на аскомицеты и дрожжеподобные грибы, дерматофиты, а также на другие патогенные грибы в виде монокультур и микробных ассоциаций, включая грибковую микрофлору с резистентностью к химиотерапевтическим препаратам. Мирамистин подавляет микробные ассоциации (стафилококки и эшерихии, стафилококки и синегнойные палочки), пенициллиназопродуцирующие госпитальные штаммы.
Это соединение повышает функциональную активность иммунных клеток, стимулирует местный неспецифический иммунный ответ, ускоряет процесс заживления ран, снижает резистентность микроорганизмов к антибактериальным препаратам, эффективно предотвращает инфицирование ран и ожогов, активизирует процессы регенерации, стимулирует защитные реакции в месте применения за счет активации поглотительной и переваривающей функции фагоцитов, потенцирует активность моноцитарно-макрофагальной системы. Он обладает выраженной гиперосмолярной активностью, вследствие чего купирует раневое и перифокальное воспаление, абсорбирует гнойный экссудат, способствуя формированию сухого струпа, не повреждает грануляции и жизнеспособные клетки кожи, не угнетает краевую эпителизацию, не обладает местнораздражающим действием и аллергизирующими свойствами.
Препарат выпускается в виде 0,01% водного раствора (http://www.rlsnet.ru/tn_index_id_4800.htm), а также в виде 0,5% мази «Мирамистин» и мази «Стрептолавен». На мазь с мирамистином «Лавендула» имеется патент RU 2484811, A61K 9/06, 20.06.2013.
В предпочтительном варианте осуществления композиция содержит от 0,01 до 1,00 мас. % мирамистина.
В предложенной комбинированной фармацевтической композиции мирамистин используется совместно с лизоамидазой для лечения гнойных ран с поливалентной микрофлорой, содержащей штаммы стафилококков, стрептококков и др. к которым лизоамидаза активна, а также штаммы грамотрицательных бактерий, грибы, дрожжи, простейшие и вирусы, по отношению к которым лизоамидаза не активна.
Полигексанид - производные бигуанида и амида (катионный дигуанидин). Химически стабилен, не летуч, не имеет запаха, растворим в воде, этаноле, глицерине, пропиленгликоле и других растворителях.
Гуанидины относятся к катионным ПАВ. Представителями этой группы являются производные гуанидина: хлоргексидин биглюконат, хлоргексидин дигидрохлорид, хлоргексидин диацетат, полимерные производные гуанидина - полигексаметиленгуанидин гидрохлорид, (ПГМГ-х), полигексаметиленгуанидин фосфат (ПГМГ-ф), катионный дигуанидин - полигексанид.
Гуанидины обладают стабильностью, низкой токсичностью и щадящим действием на объекты. В чистом виде гуанидины активны в отношении грамотрицательных и грамположительных микроорганизмов (за исключением микроорганизмов, вызывающих туберкулез), не проявляют активности к вирусам, грибам, спорам. Полимерные производные гуанидина активны в отношении микобактерий туберкулеза в достаточно высоких концентрациях (1,0-2,0%).
Расширение спектра их антимикробной активности происходит при сочетании их с другими ПАВ-ами, спиртом (приобретают вирулицидные свойства) и т.д.
Оптимальная среда для этих соединений - щелочная, рН 10,0-11,0. Повышение температуры до 50°С повышает активность растворов в 3-4 раза, а присутствие белка снижает активность незначительно - в 1,5 раза.
Гуанидины входят в состав препаратов, предназначенных для дезинфекции, а также в состав кожных антисептиков.
Полигексанид - мембраноспецифическая молекула с многочисленными активными участками, которые обеспечивают эффективное антимикробное действие при низкой концентрации. Активные бигуанидные участки молекулы обладают высокой молекулярной эффективностью против бактерий, оставаясь при этом нетоксичными для плазматических мембран клеток человека. Он проявляет антибактериальное действие широкого спектра и фунгицидное действие. Активен в отношении штаммов бактерий Pseudomonas aeruginosa, Escherichia coli, Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus pneumoniae и др. (http://www.lsgeotar.ru/pharma_mnn/1928.html)
Полигексанид применяется в виде 0,1% или 0,2% раствора «Лавасепт», а также 0,1% геля «Пронтосан» (http://www.piluli.ru/product/Prontosan).
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,05 до 2,00 мас. % полигексанида, более предпочтительно от 0,1 до 0,5 мас. %.
В предлагаемой комбинированной фармацевтической композиции полигексанид используется совместно с лизоамидазой для лечения гнойных ран с поливалентной микрофлорой, к которым лизоамидаза активна, а также штаммы грамотрицательных бактерий, по отношению к которым лизоамидаза не активна.
Октенидин в виде дигидрохлорида - дигидрохлорид N,N'-(1,10-декандиил-ди-1-[4Н]-пиридинил-4-илиден)-бис(1-октамина) - катионное поверхностно-активное вещество, обладающее антимикробной активностью в отношении широкого спектра микроорганизмов. Он похож по своему действию на четвертичные аммониевые соединения (ЧАС), но имеет более широкий спектр активности.
Являясь производным гуанидинов, октенидин отличается от них тем, что имеет более широкий спектр микроцидного действия: микробы, вирусы, грибы, не активен в отношении спор. Октенидин применяется в качестве антисептика для кожи и слизистых, не обладает кумулятивным (накапливающим) эффектом. Он стал полноценным заменителем традиционных антисептиков - йода и спирта. http://ww.epidemiolog.ru/anti/disinfection/?SECTION_ID=&ELEMENT_ID=466). Октенидин более активен, чем хлоргексидин (http://mmtd.kz/sravnitelnaya_ocenkah).
Промышленно выпускается препарат «Октенисепт» в виде раствора, в котором содержится 0,1% октенидина дигидрохлорида и 2,0% 2-феноксиэтанола (http://www.rlsnet.ru/tn_index_id_2418.htm). Феноксиэтанол проявляет выраженные антибактериальные свойства, а именно активность по отношению к грамположительным и грамотрицательным бактериям, некоторым липофильным вирусам, грибам и дерматофитам (http://medside.ru/fenoksietanol).
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,005 до 5,000 мас. % октенидина гидрохлорида, более предпочтительно от 0,01 до 2,00 мас. %.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,5 до 4,0 мас. % 2- феноксиэтанола, более предпочтительно от 1,0 до 2,0 мас. %.
В предлагаемой комбинированной фармацевтической композиции октенидин используется совместно с лизоамидазой для лечения гнойных ран с поливалентной микрофлорой, содержащей штаммы стафилококков, стрептококков и др., к которым лизоамидаза активна, а также штаммы грамотрицательных бактерий, грибов и вирусов по отношению к которым лизоамидаза не активна.
Натрия лаурилсульфат (додецилсульфат натрия) - натриевая соль лаурилсерной кислоты, анионактивное поверхностно-активное вещество. Это порошок белого цвета, он горюч, температура самовозгорания 310,5°С, растворимость в воде - не менее 130 г/л (при 20°С). В водных растворах он образует стойкую пену. Лаурилсульфат натрия входит в состав мази, предполагающей длительный контакт с кожей. В этом случае безвредной его концентрация не выше 1,0%. (https://ru.wikipedia.org/wiki/%D0%9B%D0 %B0%D1%83%D1%80%D0%B8%D0%BB%D1%81%D1%83%D0%BB%D1%8C%D1%84
%D0%B0%D1%82_%D0%BD%D0%B0%D1%82%D1%80%D0%B8%D1%8F). Натрия лаурилсульфат является эффективным и ингибитором ферментов, инактивирующих аминогликозиды (неомицин, канамицин, стрептомицин) и эффективным ингибитором хлорамфеникол-ацетилтрансферазы.
В предпочтительном варианте осуществления композиция содержит от 0,001 до 2,000 мас. % натрия лаурилсульфата, более предпочтительно - от 0,1 до 1,0 мас. %.
В предложенной фармацевтической комбинированной композиции натрия лаурилсульфат используется как ингибитор резистентности микроорганизмов, при сочетании в этой композиции лизоамидазы с антибиотиками аминогликозидами (нетилмицин, амикацин) и левомицетином.
В состав предлагаемой комбинированной композиции входят следующие антибиотики: нетилмицин, амикацин, офлоксацин, ципрофлоксацин, левомицетин.
Нетилмицин обладает минимальной ототоксичностью и нефротоксичностью по сравнению с другими аминогликозидами (Г.К. Решедько «Нетилмицин» Клиническая микробиология антимикробной химиотерапии, 2007 г., том 9, №3, стр. 253-267).
Нетилмицин (нетилмицина сульфат) - полусинтетический антибиотик из группы аминогликозидов III поколения, производное сизомицина. Он растворим в воде, обладает широким бактерицидным спектром действия. Связывается с 30S субъединицей рибосом и нарушает синтез белка, препятствуя образованию комплекса транспортной и матричной РНК, при этом происходит ошибочное считывание генетического кода и образование нефункциональных белков. В больших концентрациях нетилмицин нарушает проницаемость цитоплазматической мембраны и вызывает гибель микроорганизмов.
Необходимо избегать применения нетилмицина совместно с полимиксином В, другими аминогликозидами, этакриновой кислотой, фуросемидом, миорелаксантами, анестетиками (www.rlsnet.ru/mnn_index_id_196.htm) ванкомицином, колистином, препаратами платины, метотрексатом (в высоких дозах), ифосфамидом, пентамидином, фоскарнетом натрия, некоторыми противовирусными средствами (ацикловир, ганцикловир, адефовир, цидофовир, тенофовир), амфотерицином В, иммунодепрессантами, такими как циклоспорин или такролимус, и йодоконтрастными веществами (www.medi.ru/doc/x1338.htm).
Нетилмицин активен даже в низких концентрациях в отношении широкого спектра патогенных бактерий, включая Escherichia coli, Klebsiella spp., Enterobacter spp., Serratia spp., Citrobacter spp., Proteus spp.(индол-положительных и индол-отрицательных), включая Proteus mirabilis, Proteus morganii, Proteus rettgeri, Proteus vulgaris, Pseudomonas aeruginosa и Neisseria gonorrhoeae. In vitro нетилмицин активен также в отношении штаммов Haemophilus influenzae, Salmonella spp., Shigella spp.и в отношении пенициллиназо- и непенициллиназообразующих штаммов Staphylococcus, включая метициллин-резистентные. Некоторые штаммы Providencia spp., Acinetobacter spp. и Aeromonas spp. также чувствительны к нетилмицину. Многие штаммы микроорганизмов, резистентные к другим аминогликозидам, таким как канамицин, гентамицин, тобрамицин и сизомицин, in vitro чувствительны к нетилмицину. В некоторых случаях устойчивые к амикацину штаммы чувствительны к нетилмицину (www.medi.ru/doc/x1338.htm).
Нетилмицин не активен по отношению к анаэробам (Г.К. Решедько «Нетилмицин» Клиническая микробиология антимикробной химиотерапии, 2007 г., том 9, №3, стр. 253-267, таблица 6 и 7).
Препарат выпускается в виде раствора нетилмицина для внутривенного и внутримышечного введения 25 мг/мл (2,5%) и 100 мг/мл (10%) (www.medi.ru/doc/x1338.htm), а также в виде 0,3% глазной мази и глазных капель. Состав на 1,0 г: активное вещество - нетилмицина сульфат - 4,55 мг (в пересчете на нетилмицин - 3,00 мг) (www.ros-med.info/reestr-ls/info.php?action=info&id=18900).
В предпочтительном варианте осуществления предлагаемая композиция содержит от ОД до 4,0 мас. % нетилмицина, более предпочтительно - от 0,2 до 2,0 мас. %.
Амикацин (амикацина сульфат) - полусинтетический антибиотик-аминоглиикозид широкого спектра действия, в основном бактерицидного. Он связывается с 30S субъединицей рибосом и блокирует синтез белка.
Амикацин - аморфный порошок белого или белого с желтоватым оттенком цвета, легко растворим в воде, гигроскопичен 20 мг в 1 мл воды. Раствор амикацина, полученный растворением 10 мг на мл воды, имеет рН 2,0-4,0.
Он действует на многие штаммы грамотрицательных бактерий (в том числе на штаммы P. aeruginosa), резистентных к гентамицину и другим аминогликозидам II поколения, активен в отношении некоторых штаммов грамположительных микроорганизмов - Enterococcus faecalis, Staphylococcus spp. (в том числе устойчивых к пенициллину), не активен в отношении стрептококков/ пневмококков, Е. faecium, метициллинрезистентных штаммов стафилококков.
Амикацин применяется преимущественно в комбинации с другими антибактериальными средствами. Наиболее обосновано применение амикацина при инфекциях, связанных со штаммами бактерий P. aeruginonosa. Он используется при инфекционно-воспалительных заболеваниях, вызванных грамотрицательными микроорганизмами или ассоциациями грамположительных и грамотрицательных микроорганизмов, в том числе для лечения инфицированных ожогов, гнойных инфекций кожи и мягких тканей, раневой инфекции. При взаимодействии амикацина с анестетиками, миорелаксантами, полимиксинами усиливается нервномышечное блокирующее действие.
Амикацин фармацевтически не совместим с витаминами группы В и С, амфотерицином, гепарином, калием хлоридом, нитрофуранами, пенициллином, хлортиазидом, цефалоспоринами, эритромицином.
При взаимодействии амикацина с диуретиками, НПВС, пенициллинами, сульфаниламидами повышается концентрация амикацина в сыворотке крови и наблюдается усиление нефро- и нейротоксичности. Выпускается препарат в виде раствора для инъекций и геля 5,0% (Руководство «Рациональная антимикробная фармакотерапия» под редакцией д.м.н. В.П. Яковлева и д.м.н. С.В. Яковлева, изд-во «Литтерра», 2003 г., стр. 708-709,).
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,5 до 5,0 мас. % амикацина сульфата.
В фармацевтической комбинированной композиции нетилмицин и амикацин используется с лизоамидазой для лечения гнойных ран с поливалентной микрофлорой, в том числе содержащей штаммы стрептококков, метициллинрезистентные штаммы стафилококков, в отношении которых лизоамидаза активна, а амикацин не активен. Для снижения резистентности микроорганизмов к нетилмицину и амикацину, в состав композиции включен ингибитор ферментов, инактивирующих аминогликозиды, - лаурилсульфат натрия.
Поскольку к вышеуказанным аминогликозидам особенно чувствительны грамотрицательные бактерии и в меньшей степени грамположительные, а также устойчивы анаэробы (Руководство «Рациональная антимикробная фармакотерапия» под редакцией д.м.н. В.П. Яковлева и д.м.н. С.В. Яковлева, изд-во «Литтерра», 2003 г., стр. 95), целесообразно применять их в комбинированной фармацевтической композиции совместно с лизоамидазой, подавляющей определенный спектр грамположительных микроорганизмов, и с диоксидином или нитазолом, или ПАВ, высокоактивными к анаэробам.
Офлоксацин относится к фторхинолонам. Он обладает широким антимикробным спектром действия. Это - кристаллический порошок слегка желтоватого цвета, без запаха, горького вкуса, он малорастворим в воде и спирте.
Офлоксацин оказывает бактерицидное действие за счет блокады ДНК-гиразы в бактериальных клетках, ДНК-гираза необходима для репликации, транскрипции, рапарации и рекомбинации бактериальной ДНК. Ее ингибирование приводит к раскручиванию и дестабилизации бактериальной ДНК и вследствие этого к гибели микробной клетки. Бактерицидная эффективность офлоксацина проявляется достаточно быстро, резистентность микроорганизмов к этому препарату развивается редко. Это обусловлено его бактерицидным механизмом действия, влияющим только на один ген ДНК-гиразы и на топоизомеразу.
Офлоксацин наиболее активен в отношении некоторых грамположительных и большинства грамотрицательных бактерий (включая семейство Enterobacteriaceae, гемофильную палочку, нейссерии), стафилококков и внутриклеточных патогенов (хламидий, микоплазм, уреаплазм). В отношении стрептококков, пневмококков, синегнойной палочки и микобактерий он менее активен, мало активен или не проявляет активности в отношении энтерококков и большинства анаэробов (Руководство «Рациональная антимикробная фармакотерапия» под редакцией д.м.н. В.П. Яковлева и д.м.н. С.В. Яковлева, изд-во «Литтерра», 2003 г., стр. 846-849).
Офлоксацин активен против узкого спектра возбудителей хирургической инфекции. Он обладает умеренным антимикробным действием при местном применении, позиционируется как замена препаратов с хлорамфениколом (В.В. Привольнее «Выбор препарата для местного лечения инфицированных ран», журнал им. проф. Б.М. Костюченко «Раны и раневые инфекции», 2015 г., том 2, стр. 13-18, таблица 3).
По действию на грамотрицательные бактерии (особенно на штаммы бактерий P. aeruginosa) офлоксацин уступает ципрофлоксацину, а по действию на стафилококки в ряде случаев превосходит его.
Офлоксацин может применяться при тяжелых инфекциях кожи, мягких тканей, костей, суставов. Его можно назначать одновременно со многими антибактериальными препаратами (макролидами, b-лактамными антибиотиками, цефалоспоринами). Благодаря этому свойству препарат широко используют в составе комбинированной терапии при инфекционных заболеваниях.
Офлоксацин, в отличие от ципрофлоксацина, сохраняет активность при одновременном применении с хлорамфениколом (левомицетин) и рифампицином-ингибиторами синтеза РНК-полимеразы. Выпускается в виде таблеток, раствора, 1,0%-ой мази «Офломелид» и 0,1% мази «Олокаин-Дарница».
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,05 до 2,00 мас. % офлоксацина.
Ципрофлоксацин относится к фторхинолонам. Он обладает широким антимикробным спектром действия. Это - кристаллический порошок слегка желтоватого цвета, без запаха, горького вкуса, который малорастворим в воде и спирте, растворим в 0,1 н соляной кислоте.
Ципрофлоксацин оказывает бактерицидное действие за счет ингибирования ДНК-гиразы (топоизомеразы II и IV, ответственных за процесс укладки хромосомной ДНК в суперспираль вокруг ядерной РНК), нарушения биосинтеза ДНК, роста и деления бактерий, а также за счет нанесения выраженных морфологических изменений (в т.ч. клеточной стенки и мембран) и быстрой гибель клетки. Он действует на микроорганизмы в период роста и покоя.
Ципрофлоксацин наиболее активен в отношении аэробных грамотрицательных бактерий, менее активен в отношении неферментирующих грамотрицательных микроорганизмов, в частности - P. aeruginosa, Acinetobacter. Тем не менее, из всех фторхинолонов, разрешенных в России к медицинскому применению, он наиболее активен к P. aeruginosa. В отношении грамположительных микробов (стафилококков и стрептококков) активность ципрофлоксацина ниже, чем в отношении грамотрицательных, кроме того он малоактивен в отношении энтерококков и большинства анаэробов (Руководство «Рациональная антимикробная фармакотерапия» под редакцией д.м.н. В.П. Яковлева и д.м.н. С.В. Яковлева, изд-во «Литтерра», 2003 г., стр. 952-956). В кислой среде его активность снижается.
Большинство стафилококков, устойчивых к метициллину, резистентны к ципрофлоксацину. К ципрофлоксацину резистентны большинство штаммов Burkholderia cepacia и некоторые штаммы Stenotrophomonas maltophilia, а также Bacteroides fragilis, Pseudomonas cepacia, Pseudomonas maltophilia, Ureaplasma urealyticum, Clostridium difficile, Nocardia asteroides. Он не эффективен в отношении Treponema pallidum.
Резистентность к нему развивается медленно и постепенно («многоступенчатый» тип). Отсутствует перекрестная устойчивость с пенициллинами, цефалоспоринами, аминогликозидами. Активность возрастает при сочетании с бета-лактамными антибиотиками, аминогликозидами, ванкомицином, клиндамицином, метронидазолом. Его применяют при тяжелых инфекциях кожи, мягких тканей, костей, суставов. Выпускается препарат в виде таблеток, растворов, глазных капель 0,3%.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,1 до 5,0 мас. % ципрофлоксацина.
Производные диаминопиримидина (пириметамином, триметопримом, тетроксопримом, метиопримом, бродимопримом) потенцируют по принципу двойной мишени активность фторхинолонов, к которым относятся офлоксацин и ципрофлоксацин («Антимикробные препараты в ряду производных сульфаниламида, диаминопиримидина, 5-нитроимидазола, ди-N-окси-хиноксалина», Падейская Е.Н., РМЖ №21 от 04.11.1997 г., стр. 1-6). Существенным при сочетании фторхинолонов и производных диаминопиримидина является возможность снижения дозировок каждого из препаратов.
В предпочтительном варианте осуществления композиция имеет соотношение производное диаминопиримидина (например, триметоприм) : фторхинолон ≈ от 1:5 до 1:40, в более предпочтительном варианте - от 1:5 до 1:10.
Поскольку активность вышеуказанных фторхинолонов в отношении грамположительных микроорганизмов менее выражена, чем в отношении грамотрицательных, а также они малоактивны в отношении энтерококков и большинства анаэробов (Н.Н. Козачок и др. «Фторхинолоны - взгляд в будущее», таблица 3, www.mit-ua.com/arhive/article/3015), целесообразно применять их в комбинированной фармацевтической композиции совместно лизоамидазой, высоко активной к грамположительным микроорганизмам, и с диоксидином или с нитазолом, высокоактивным к анаэробам.
Левомицетин (хлорамфеникол) - синтетический антибиотик, идентичный природному продукту жизнедеятельности микроорганизма Streptomyces venezuelae. Это белый или белый со слабым желтовато-зеленым оттенком кристаллический порошок, горький на вкус, который малорастворим в воде, легко - в этаноле, растворим в этилацетате, практически не растворим в хлороформе.
Левомицетин - антимикробное лекарственное средство широкого спектра действия, активное в отношении большинства грамположительных и грамотрицательных аэробных и анаэробных бактерий, хламидий, спирохет и риккетсий.
Левомицетин относится к ингибиторам синтеза белка на уровне рибосомы 70S. Эта мишень состоит из двух субъединиц: большой 50S и малой 30S. Левомицетин подавляет синтез белка, связываясь с белком субъединицы 50S рибосомы, нарушает процесс синтеза белка на стадии переноса аминокислот от аминоацил т-РНК на рибосомы, подавляет энзиматическую реакцию - ингибирует фермент пептидилтрансферазу, которая катализирует процесс формирования пептидных связей в процессе синтеза белка. РНК клеток бактерий изменяется под действием левомицетина и отличается от нормальных клеток.
Левомицетин подавляет синтез белка в размножающихся клетках и в стационарной культуре. В отношении большинства чувствительных микроорганизмов препарат оказывает бактериостатическое действие. В высоких концентрациях или в отношении высокочувствительных микроорганизмов левомицетин может оказывать бактерицидное действие. Левомицетин хорошо проникает в клетки микроорганизма, что обеспечивает его активность в отношении ряда патогенов с внутриклеточной локализацией: риккетсий, хламидий, легионелл (Руководство «Рациональная антимикробная фармакотерапия» под редакцией д.м.н. В.П. Яковлева и д.м.н. С.В. Яковлева, изд-во Литтерра, 2003 г., стр. 921-927)
Левомицетин является антагонистом пенициллина, аминогликозида, снижает антибактериальный эффект пенициллинов и цефалоспоринов. При одновременном применении с эритромицином, клиндомицином, линкомицином отмечается взаимное ослабление действия за счет того, что левомицетин может вытеснять эти препараты из связанного состояния или препятствовать их связыванию с субъединицей 50S бактериальных рибосом.
Левомицетин активен против узкого спектра возбудителей хирургических инфекций, он имеет слабое антимикробное действие при местном применении, рекомендован для поверхностных инфекций кожи (В.В. Привольнев «Выбор препарата для местного лечения инфицированных ран», журнал им. проф. Б.М. Костюченко «Раны и раневые инфекции», 2015 г., том 2, стр. 13-18, таблица 3).
На пневмококк, менингококк и гемофильную палочку левомицетин действует бактерицидно, на другую чувствительную микрофлору - бактериостатически. Препарат не действует на кислотоустойчивые бактерии, синегнойную палочку, клостридии, устойчивые к метициллину штаммы: стафилококки, Acinetobacter, Enterobacter, Serratia marcescent, индоположительные штаммы Proteus spp., Pseudomonas aeruginosa spp., простейшие и грибы. Применяется он ограниченно из-за тяжелых нежелательных реакций и вторичной резистентности многих возбудителей («Разработка состава и технологии получения мази, содержащей биокомплекс кобальта с фуразолидоном». Медицина, здоровье, http://uchi-referat.ru/medicina-zdorove/2921-razrabotka-sostava-i-tehnologii-polucheniya-mazi-soderzhashhey-biokompleks-kobalta-s-furazolidonom.html).
Резистентность к левомицетину развивается чаще всего у энтеробактерий (20-60% штаммов), реже у менингококков, нейссерий, грамположительных кокков (0,25-1,00% штаммов). Процесс находится в прямой зависимости от широты использования и длительности применения препарата в соответствующих регионах и стационарах, механизм передачи - плазмидный.
В большинстве случаев устойчивость микроорганизмов к левомицетину обусловлена кодируемым плазмидными генами бактериальным ферментом хлорамфеникол-ацетилтрансферазой, который инактивирует препарат. Штаммы, синтезирующие хлорамфеникол-ацетилтрансферазу, все чаще встречаются среди стафилококков. Распространенность таких штаммов колеблется, в некоторых больницах она достигает 50% и более, особенно среди метициллино-устойчивых стафилококков. Описаны и другие механизмы устойчивости к левомицетину - уменьшение проницаемости бактериальных мембран (у Escherichia coli и Pseudomonas spp.), снижение сродства рибосом к препарату, обусловленное мутацией, (http://sportwiki.to/%D0%9В%D0%В5%D0%В2%D0%ВЕ%D0%ВС %D0%В8%D1%86%D0%В5%D1%82%D0%В8%D0%BD%D1%85%D0%ВВ%D0%ВЕ%D1%80D0%В0%D0%ВС%D1%84%D0%В5%D0%BD%D0%B8%D0%BA%D0%BE %D0%BB).
Как указывалось выше, трилон Б, повышая проницаемость микробной клетки, усиливает чувствительность микроорганизмов к антибактериальным препаратам, например, левомицетину. Эффективным ингибитором хлорамфеникол-ацетилтрансферазы является натрия лаурилсульфат и хлоргексидин биглюконат («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье», 1995 г., стр. 142,143, 144-146).
Левомицетин широко применяется для лечения гнойных ран и инфильтратов («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, из-во «Здоровье», 1995 г., стр. 155, 235).
Местно левомицетин применяется при гнойно-воспалительных заболеваниях кожи и мягких тканей: гнойных ранах, инфицированных ожоговых поверхностях и др.
Его выпускают в виде таблеток, капсул, растворов для наружного применения 0,25%, 1%, 2%, 2,5%, 3%, 5%, глазных капель 0,25%, суспензий оральных 5%, линимента для наружного применения 1%,5%,10%, мази 0,75% и 1%, суппозиториев, аэрозолей.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,1 до 10,0 мас. % левомицетина, более предпочтительно - от 0,5 до 5,0 мас. %.
В предложенной фармацевтической комбинированной композиции левомицетин используется совместно с лизоамидазой для лечения гнойных ран с поливалентной микрофлорой, в том числе содержащей грамположительные метициллинрезистентные штаммы стафилококков и др., к которым лизоамидаза активна, а левомицетин не активен.
Целесообразно в предлагаемой композиции с лизоамидазой и левомицетином использовать компоненты - трилон Б, катапол, декаметоксин, мирамистин, активные в отношении синегнойной палочки, Proteus spp., Pseudomonas aeruginosa spp., простейших и грибов, к которым левомицетин также мало активен.
Представляется полезным также в данной композиции использовать ингибиторы хлорамфеникол-ацетилтрансферазы - лаурилсульфат натрия или хлоргексидина биглюконат для снижения резистентности микроорганизмов к левомицетину.
Одну из долей в раневой поливалентной микрофлоре занимает грибковая инфекция. Определенные виды грибов, конкурирующие с бактериями за источники питания, продуцируют антибиотики, угнетающие жизнедеятельность бактерий, что ведет к увеличению доли грибковой инфекции в ране. Для обеспечения подавления грибковой инфекции в составе предлагаемой комбинированной композиции вместе с лизоамидазой используются следующие антимикотики: клотримазол или циклопироксоламин.
Клотримазол - производное имидазола, противогрибковый препарат для наружного и местного применения. Механизм его действия заключается в торможении синтеза эргостерола, необходимого для построения клеточной мембраны грибов, что приводит к нарушению ее проницаемости и последующему лизису клетки. Препарат вызывает также повышение проницаемости фосфолипидной оболочки липосом, вакуолизацию цитоплазмы, снижение количества рибосом. Кроме того клотримазол угнетает активность пероксидаз, что облегчает накопление в грибной клетке перекиси водорода, которая принимает участие в ее разрушении.
Он обладает широким спектром действия: эффективен по отношению к дерматофитам, дрожжевым грибам, оказывает антибактериальное действие на стафилококки и стрептококки.
Клотримазол после нанесения на кожу всасывается в количестве, не превышающем 1%, но проникает в роговой слой эпидермиса и там накапливается. В незначительной степени всасывается из слизистых оболочек (3%). Абсорбированный препарат метаболизируется в печени и выводится почками; период полураспада составляет 3-5 часов (//medi.ru/doc/g2713.htm).
Препарат применяется в виде 1% мази, 1% крема, 2% геля и 1% раствора для наружного применения.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,5 до 3,0 мас. % клотримазола.
Циклопироксоламин - антимикотик широкого спектра действия, высокоактивен в отношении дерматомицетов, а также дрожжевых грибов, грамположительных и грамотрицательных бактерий, микоплазм и трихомонад. Фунгицидное действие препарата связано с подавлением трансмембранного транспорта аминокислот, К+ и фосфатов в растущих клетках грибов. Данный препарат почти не оказывает токсического действия на организм, хорошо высвобождается из основы, избирательно накапливается в эпидермисе и его дериватах (www.medicreferat.com.ru/pageid-1053-4.html). Препарат выпускается в виде 1,0% раствора для наружного применении, 1,0% крема (www.yarapteka.ru/modules.php?name=spr&inf=283).
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,2 до 1,0% (масс) циклопироксоламина.
В предложенной комбинированной фармацевтической композиции клотримазол или циклопироксоламин используется совместно с лизоамидазой в одной композиции для лечения гнойных ран с поливалентной микрофлорой, в том числе содержащей грибы, к которым лизоамидаза не активна.
Для обеспечения дополнительного стимулирования процессов репарации в ране предложенная фармацевтическая комбинированная композиция содержит вещество ранозаживляющего действия: ксимедон, метилурацил, декспантенол, солкосерил или их физиологически приемлемую смесь.
Ксимедон - N-(β-оксиэтил)-4,6-диметилдигидропиримедон-2, пиримидиновое производное 3-го поколения, обладающее высокой регенеративной активностью (авт. св. SU 1685454, A61K 31/513, опубл. 23.10.1991). Препарат представляет собой кристаллический порошок белого или с розовым оттенком цвета, без запаха, горьковатого вкуса, с температурой плавления 139-143°С, легко растворимый в воде, спирте, физиологическом растворе. Стандартная лечебная дозировка - 100 мг/кг; для человека суточная доза обычно составляет 30 мг/кг.
Ксимедон стимулирует обменные процессы, в первую очередь за счет биосинтеза белка. Препарат воздействует также на систему регуляции активного транспорта кальция в клетке, влияет на процессы тканевого дыхания, перекисного окисления липидов и активность антиоксидантной системы.
Ксимедон оказывает действие на сульфгидрильный статус иммунокомпетентных клеток, обладает антимутагенной активностью, антимикробным эффектом. Установлено, что стимулирующий эффект ксимедона наиболее полно проявляется в первые 5-7 дней, заживление ран происходит значительно быстрее, чем в контрольной группе (метилурацил), формирующийся рубец созревает быстрее, менее выражено разрастание грануляционной ткани, раньше запускается процесс коллагеногенеза.
Ксимедон по репаративной активности превосходит известные до настоящего времени методы медикаментозного и физиотерапевтического воздействия. При этом он не меняет нормального хода заживления ран: наблюдаются те же фазы раневого процесса, но со значительным их укорочением. Интересной особенностью воздействия препарата является его способность регулировать коллагеногенез, препятствуя образованию келоидных рубцов.
В отличие от многих лекарственных средств, угнетающих воспалительную реакцию, ксимедон оказывает регулирующее воздействие на инфламаторный процесс. В первой стадии воспаления препарат оказывает протективное влияние на клеточном уровне за счет мембраностабилизирующего (в том числе и мембран лизосом лейкоцитов), антиоксидантного, адаптогенного, антибактериального эффектов. Морфологически доказано, что ксимедон препятствует большинству некробиотических процессов фазы альтерации, кроме того, этот период значительно укорачивается.
Во второй фазе воспаления ксимедон оказывает выраженное противоотечное действие, улучшает микроциркуляцию. Период экссудации резко укорачивается. Мощное воздействие препарата проявляется в раннем начале фазы пролиферации, быстрой активации коллагеногенеза, наилучшей васкуляризации, ускоренной эпителизации зоны шва. Все перечисленное имеет большое значение для повышения прочности ушитых ран полых органов в течение известных всем хирургам «опасных» дней послеоперационного периода.
Иммуностимулирующий эффект ксимедона доказан в экспериментах, выполненных в системах «in vitro» и «in vivo», а также полностью подтвержден в клинике. При лечении ксимедоном фагоцитарный индекс и показатель завершенности фагоцитоза увеличиваются в 2 раза по сравнению с их значениями у контрольных животных, получавших метилурацил.
Антибактериальный эффект ксимедона выгодно отличает его от метилурацила. При воздействии на бактериально контаминированную среду 5% раствор оказывает бактериостатическое действие, а 10%-ный раствор ксимедона обладает бактерицидной активностью.
Антибактериальными свойствами обладают и другие лекарственные формы ксимедона (присыпка, мазь).
Антиоксидантный эффект ксимедона выражается в мембрано-стабилизирующем действии (http://www.medicum.nnov.ru/nmj/2002/3/18.php).
В предпочтительном варианте осуществления предлагаемая композиция содержит от 1,0 до 10,0 мас. % ксимедона, более предпочтительно от 4,0 до 10,0%.
Метилурацил, являясь производным пиримидина, обладает анаболической и антикатаболической активностью. Вещество не оказывает местного раздражающего действия, ускоряет процессы клеточной регенерации, сокращая сроки заживления ран, стимулирует клеточные и гуморальные факторы защиты, оказывает противовоспалительное действие, стимулирует эритро- и лейкопоэз.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 1,0 до 10,0 мас. % метилурацила, более предпочтительно от 4,0 до 10,0%.
Пантотеновая кислота в виде кальция пантотената (витамина В5) является перспективным ранозаживляющим средством. Применяется для лечения ожогов и вяло заживающих ран. В организме пантотеновая кислота входит в состав кофермента А, который играет важную роль в процессах ацетилирования и окисления. Витамин В5 играет ключевую роль в метаболизме углеводов, белков и жиров, и поэтому важен для поддержания и восстановления всех клеток тканей.
Пантотеновая кислота стимулирует регенерацию кожи, нормализует клеточный метаболизм, увеличивает прочность коллагеновых волокон. Оптимальная молекулярная масса, гидрофильность и низкая полярность делают возможным ее проникновение во все слои кожи. Она оказывает регенерирующее, слабое противовоспалительное действие.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 1,0 до 10,0 мас. % кальция пантотената, более предпочтительно от 4,0 до 10,0 мас. %.
Солкосерил - экстракт крови крупного рогатого скота, освобожденный от протеинов и не обладающий антигенной активностью. Он представляет собой депротеинизированный гемодиализат, содержащий широкий спектр низкомолекулярных компонентов клеточной массы и сыворотки крови молочных телят с молекулярной массой 5000 D.
Фармакологическое действие солкосерила - антигипоксическое, цитопротективное, регенерирующее, мембраностабилизирующее, ангио-протективное, ранозаживляющее.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,2 до 5,0 мас. % солкосерила.
Этаден стимулирует репаративные процессы в эпителиальной и кроветворной тканях, активирует метаболизм нуклеиновых кислот. Он показан для лечения термических и лучевых поражений кожи, слизистой оболочки прямой кишки, длительно незаживающих гранулирующих ран.
В предпочтительном варианте осуществления предлагаемая композиция содержит от 0,5 до 2,0 мас. % этадена.
Одной из главных задач местного лечения ран и ожогов является проблема подавления болевого синдрома. Для решения этой задачи в предлагаемой комбинированной композиции применено местно-анестезирующее вещество, в качестве которого использованы лидокаин или тримекаин.
Лидокаин - (2-диэтиламино)-N-(2,6-диметилфенил)ацетамид (и в виде гидрохлорида) - это белый или почти белый кристаллический порошок, плохо растворимый в воде. Он используется в виде солянокислой соли, легко растворимой в воде. Механизм местноанестезирующего эффекта лидокаина заключается в стабилизации нейрональной мембраны, снижении ее проницаемости для ионов натрия, что препятствует возникновению потенциала действия и проведению импульсов. Возможен антагонизм с ионами кальция.
Лидокаин быстро гидролизуется в слабощелочной среде тканей и после короткого латентного периода действует в течение 60-90 мин. При воспалении (тканевой ацидоз) его анестезирующая активность снижается. Он эффективен при всех видах местного обезболивания. Расширяет сосуды, не оказывает раздражающего действия на ткани.
Для удлинения действия анестетика возможно добавление 1 капли 0,1% раствора адреналина на 5-10 мл лидокаина (при этом максимальная допустимая доза увеличивается до 500 мг). (http://www.rlsnet.ru/mnn_index_id_843.htm).
Лидокаин дешевле и имеет более низкую токсичность, чем тримекаин (патент RU 2283088, A61K 9/06, 10.09.2006).
Тримекаин - 2-(диэтиламино)-N-(2,4,6-триметилфенил)ацетамид (в виде гидрохлорида) - белый или белый с желтоватым оттенком кристаллический порошок. Он растворим в воде и спирте. Обладая достаточной липофильностью, проникает через оболочку нервного волокна, связывается с рецепторами и нарушает процессы деполяризации, блокируя проведение нервного импульса. (http://www.rlsnet.ru/mnn_index_id_1292.htm).
Анестетики в составе полимерных основ способствуют высвобождению и всасыванию антисептиков. Например, тримекаин усиливает антимикробные свойства мирамистина, входящего в состав мази на гидрофильной основе (И.М. Кириченко «Современные подходы к терапии инфекционных заболеваний кожи», http://old.consilium-medicum.com/media/consilium/06_01c/12.shtml).
В предлагаемой композиции допустимый диапазон применения анестетика от 0,5 до 6,0 мас. %. Однако, наиболее оптимальное применение анестетиков в предлагаемой композиции по отношению к воздействию на активность лизоамидазы, находится в диапазоне от 0,5 до 3,0%.
В качестве консерванта предлагаемая композиция содержит описанный ранее трилон Б, а также парабены: нипагин, нипазол или их смесь.
Нипагин или метиллпарабен (метилпарагидроксибензоат) - метиловый эфир параоксибензойной кислоты активно подавляет рост грамположительных бактерий, он менее активен против грамотрицательных бактерий и плесневых грибов. Лучше других эфиров пара-гидроксибензойной кислоты он растворяется в воде, но менее эффективен в антибактериальных целях.
В основном нипагин применяется в комбинации с другими консервантами (например, феноксиэтанолом, имидазолидинмочевиной и другими). Нипагин малорастворим в воде - 0,25% при 20°С - и дает хорошие результаты как консервант уже в концентрации 0,05%, применяется в концентрации 0,25%, в которой его бактерицидность превышает таковую фенола в 2,6 раза.
Нипазол или пропилпарабен (пропилпарагидроксибензоат) - пропиловый эфир п-гидроксибензойной кислоты. Нипазол малорастворим в воде - 0,03% при 20°С. Бактерицидность его более чем в 5 раз выше, чем нипагина. Ввиду малой растворимости в воде рекомендуется применять 0,07% раствор нипазола.
Эти консерванты совместимы практически со всеми лекарственными средствами, за исключением натрия гидрокарбоната, натрия тетрабората и серебра нитрата.
Предлагаемая композиция может содержать смесь нипагина и нипазола, в частности, в соотношении 1:3.
Малая токсичность этих парабенов позволяет использовать их в лекарственных препаратах для местного применения - суспензий, линиментов, растворов, суппозиториев желатиновых капсул и др. (СИ. Марченко «Конспект лекций по курсу технология лекарственных форм и галеновых препаратов», лекция №6 т, www.opu.odessa.ua/konsp/KI.229.doc).
Предлагаемая фармацевтическая композиции в качестве неионогенного детергента содержит твин-80 или твин-20. Неиногенные детергенты, обладающие высокой поверхностной активностью, не создающие ионов в водных растворах, обладают растворяющим и дезинфицирующим действием Неиногенные детергенты позволяют подвергать белковые препараты усилию сдвига и поверхностным перегрузкам, не вызывая денатурации белка
Твины - моноэфиры полиоксиэтилированного сорбитана (спена) и высших жирных кислот - растворяются в воде и органических растворителях. В фармацевтике они применяется для стабилизации эмульсий и суспензий.
Кроме того твин-80 используется в качестве солюбилизатора - вещества, увеличивающего растворимость труднорастворимых или нерастворимых лекарственных веществ. Солюбилизация - это процесс самопроизвольного перехода нерастворимого в воде вещества в водный раствор поверхностно-активного вещества. В качестве солюбилизатора может использоваться также, например, поверхностно-активное вещество додецилсульфат натрия (натрия лаурилсульфат).
Предлагаемая фармацевтическая композиции в качестве стабилизатора содержит вещества, выбранные из группы: этоний, лимонная кислота, мирамистин.
Этоний проявляет также бактериостатический и бактерицидный эффект в отношении стрептококков, стафилококков и других микроорганизмов. Он обладает местноанестезирующей активностью, стимулирует заживление ран.
Лимонная кислота является важным продуктом обмена в живых организмах, участвует в цикле трикарбоновых кислот и глиоксилатном цикле. Она обладает свойствами, как стабилизатора, так и антиоксиданта, и кроме того, и свойствами хелатообразователя.
Гидрофильные основы для фармацевтических композиций более предпочтительны, так как служат проводниками лекарственных средств в микробную клетку в связи с наличием внешних полисахаридных оболочек и гидрофильных капсул у грамотрицательных и грамположительных бактерий, которые препятствуют проникновению в микробные клетки гидрофобных антибактериальных веществ.
Гидрофильные основы, которые могут быть применены с комплексом бактериолитических и протеолитических ферментов, например, лизоамидазой в предлагаемом препарате разделены на две группы:
- водорастворимые основы, которые, как правило, содержат воду очищенную, гидрофильные неводные растворители: полиэтиленоксид, например, ПЭО-400; 1,2-пропиленгликоль, глицерин, этилцеллозольв, димексид, поливинилпирролидон, - и водорастворимые полимеры: полиэтиленоксид, например ПЭО-1500, проксанол, например, проксанол-268;
- водосмываемые основы, которые кроме водорастворимых полимеров и гидрофильных неводных растворителей содержат липофильные вещества: высшие жирные спирты, вазелин, вазелиновое масло, ланолин, воски (эти основы, как правило, представляют собой эмульсии типа масло/вода и требуют присутствия эмульгатора типа масло/вода).
Основы с гиперосмолярными свойствами играют важную роль при местной терапии гнойных ран. Они обеспечивают отток гнойного экссудата из раны, оказывают противовоспалительное действие за счет абсорбции жидкости и снижения отека тканей раны, а также предохраняют ткани от гипергидратации. Часто они способствуют усилению действия антибактериальных веществ.
К веществам, обладающим высокими гиперосмолярными свойствами, относятся полиэтиленоксиды - водорастворимые продукты полимеризации окиси этилена, которые являются физиологически индифферентными соединениями. Полиэтиленоксиды и полиэтиленгликоли имеют аналогичное химическое строение. Полиэтиленоксиды получаются в результате полимеризации окиси этилена, а полиэтиленгликоли в процессе поликонденсации молекул этиленгликоля. Учитывая то обстоятельство, что окись этилена в воде легко раскрывает эпоксидный цикл, превращаясь в этиленгликоль, можно сделать заключение о тождественности этих полимерных систем.
В класс гиперосмолярных веществ входят гидрофильные неводные растворители (ПЭО-400, 1,2-пропиленгликоль, глицерин, этилцеллозольв, димексид) и полимеры (полиэтиленоксид, например ПЭО-1500, проксанол-268 или эмуксол-268). Они легко наносятся на раневую поверхность и равномерно по ней распределяются, улучшая контакт мази с тканями и содержимым раны, хорошо смешиваются с раневым экссудатом и сохраняют при этом свою однородность, малотоксичны и не оказывают раздражающего действия на ткани, не нарушают их физиологических функций.
В гнойной ране ПЭО разной молекулярной массы ведут себя по-разному. Так, молекулы ПЭО-1500 стабильно сохраняют первичную локализацию: они остаются в полости раны и активно связывают воспалительный экссудат, отдавая его в повязку, с которой жидкость испаряется. Освободившиеся молекулы ПЭО-1500 вновь присоединяют к себе воду, и процесс повторяется. Более мелкие молекулы ПЭО-400 обладают способностью проникать вглубь тканей и уже через 2 часа определяются в дне и стенках раны. Образуя комплексы с антибактериальными веществами. ПЭО-400 проводит их в ткани раны, где локализуются микробы.
Способность полиэтиленоксидов обеспечивать антимикробному препарату внутритканевое действие принципиально отличает эту мазевую основу от жировых основ или растворов антибиотиков (антисептиков), противомикробное действие которых ограничивается только поверхностью раны, хотя именно глубинная микрофлора определяет выраженность и направленность течения гнойного процесса.
Основное свойство ПЭО состоит в том, что они обладают выраженным влагопоглащающим действием на ткани. Благодаря высокой способности гидратироваться, эти полимеры активно абсорбируют раневой экссудат, а вместе с ним и микробные токсины, продукты распада тканей, а также различные биологически активные вещества - лизосомальные ферменты и другие медиаторы воспалительного процесса, прерывая тем самым его прогрессирующее течение.
Принципиальное значение имеет тот факт, что в гнойной ране дегидрирующее действие ПЭО распространяется не только на ткани, образующие дно и стенки раневой полости, но и на содержащиеся в ране микробные клетки. Обезвоживание микробных клеток ведет к существенному снижению ее биологической активности и, в том числе, устойчивости к действию тех или иных лекарственных средств. Поэтому в присутствии ПЭО в десятки раз повышается антимикробное действие антибиотиков.
Имеет также значение то, что растворение антибиотиков, сульфаниламидов и других веществ в ПЭО приводит к повышению их дисперсности с увеличением терапевтической активности, чему также способствует более быстрое высвобождение из основы антимикробных веществ. ПЭО является активным проводником лекарственных средств через кожный барьер. Важно то, что эта пенетрирующая без повреждения клеток способность ПЭО усиливается в условиях воспаления.
Гидрофильные основы на полиэтиленоксидах способны растворяться в секретах слизистых оболочек, полностью высвобождать лекарственные вещества, не раздражать слизистую, имеют большой срок годности, высокую физиологическую индифферентность, что способствует их применению в жидких, мазеобразных и формируемых мягких лекарственных формах.
Важным медико-биологическим требованием, предъявляемым к мазевым мягким лекарственным формам, является способность смачивать раневую поверхность и растекаться по ней, что обусловлено поверхностно-активными свойствами растворителей, полимеров, ПАВ и основы в целом. Наиболее выраженную поверхностную активность имеют спирты и этилцеллозольв, которые, однако, непригодны для включения в состав основы в больших концентрациях. Из гликолей предпочтительно применение 1,2-пропиленгликоля и ПЭО-400 по сравнению с глицерином, обладающим слабыми поверхностно-активными свойствами.
В Государственном реестре лекарственных средств зарегистрировано 5 полиэтиленоксидов (ПЭО) с различной молекулярной массой: ПЭО-400; ПЭО-1000; ПЭО-1500; ПЭО-2000 и ПЭО-4000.
При смешивании растворителя ПЭО-400 с полимером ПЭО-1500 последний выступает в роли загустителя, который в зависимости от количества в общей массе обеспечивает требуемую консистенцию создаваемой лекарственной формы. Кроме того, ПЭО-1500 является осмотически активным веществом, поглощающим гнойный экссудат за счет связывания молекул воды с гидроксильными и простыми эфирными группами. Данная основа рекомендована для мазевых лекарственных форм, применяемых при местном лечении ран в I фазе раневого процесса.
Проксанол-268 (эмуксол-268) – блок-сополимер окисей пропилена и этилена. Проксанол-268 как осмотически активное вещество обеспечивает более равномерный характер абсорбции и обладает более длительным периодом осмотического действия. Общая масса абсорбируемой воды растворами проксанола-268 за 24 часа существенно превосходит таковую в случае применения ПЭО-1500. Это связано с более высокой массой проксанола-268, которая в 8,7 раза больше, чем у ПЭО-1500.
Кинетика абсорбции воды растворителями и полимерами зависит от их молекулярной массы, концентрации и строения молекул. Так ПЭО-400 абсорбирует больше воды, чем 1,2-полиэтиленгликоль, и обладает более длительным периодом осмотического действия. Сорбционная активность 1,2-пропиленгликоля сохраняется в течение 4-6 часов. Это обусловлено как более низкой его молекулярной массой по сравнению с ПЭО-400, так и более низким гидрофильно-липофильным балансом (ГЛБ), который для пропиленгликоля составляет 9,38. Значение ГЛБ тем больше, чем большей гидрофильностью обладает вещество. Поэтому, чем выше ГЛБ и молекулярная масса, тем сильнее и длительнее будет проявляться осмотическое действие вещества при данной концентрации.
Значения ГЛБ для некоторых веществ:
1,2-Пропиленгликоль, ПЭО-400, ПЭО-1500, проксанол-268 могут использоваться в качестве консервантов в разрабатываемых мягких лекарственных формах.
Полиэтиленоксидная основа мазей обладает рядом недостатков, к которым следует отнести опасность повреждения клеточных мембран, избыточной дегидратации клеток ткани, осмотического шока, ведущего к их гибели.
Исследования показали, что использование гидрофильных растворителей и полимеров в отдельности негативно влияет на клетки ткани. Причем цитотоксическое действие оказывают проникающие, полупроникающие и полностью проникающие гидрофильные вещества. Ситуация резко меняется при сочетании растворителей и полимеров. Клетки сохраняют жизнеспособность при разведениях на 1-3 порядка более низких.
При этом при сравнении влияния на клетки выяснено, что вместо ПЭО-1500 в основах предпочтительнее использовать проксанол-268.
Для устранения этих недостатков разработаны основы, оказывающие наиболее мягкое цитотоксическое действие на клетки ткани. К таким основам относятся:
1) смесь 1,2-пропиленгликоля, ПЭО-400 и проксанола-268 в соотношениях 48:32:20;
2) ПЭО-400 и проксанола-268 в соотношении 8:2;
3) ПЭО-400 и ПЭО-1500 в соотношении 8:2 (основы указаны по степени повышения цитотоксического действия на клетки ткани).
Соотношение между 1,2-пропиленгликолем и ПЭО-400 в гидрофильной основе считается важным биофармацевтическим фактором, который не только влияет на высвобождение лекарственных веществ через пролупроницаемую мембрану и осмотические свойства, но от которого также зависят зоны задержки роста бактерий. Преобладание в дисперсной среде основы ПЭО-400 (более 50%) отрицательно сказывается на антибактериальных свойствах мази.
Основы с проксанолом-268 пенетрируют под струп лучше, чем основы с ПЭО-1500. Это объясняется лучшей способностью к смачиванию раневой поверхности и растеканию по ней проксанола-268, у которого поверхностно-активные свойства выше, чем у ПЭО-1500.
Результаты проведенных исследований позволили обосновать составы гидрофильных основ, обладающих выраженным осмотическим действием, но не повреждающих ткани. С этих позиций перспективными являются основы, состоящие из проксанола-268, ПЭО-400 и 1,2-пропиленгликоля, к которым можно добавлять воду, например, вышеуказанная основа: смесь 1,2-пропиленгликоля, ПЭО-400 и проксанола-268 в соотношениях 48:32:20. Эта основа оказывает наиболее мягкое действие на клетки.
Несмотря на значительную концентрацию низкомолекулярного 1,2-пропиленгликоля, цитотоксическое действие этой основы минимальное, поскольку скорость ее диффузии снижена за счет образования водородных связей между гидроксильными группами пропиленгликоля и простыми эфирными группами проксанола-268 и ПЭО-400 («Теория и практика местного лечения гнойных ран» под ред. проф. Б.М. Даценко, Киев, изд-во «Здоровье», 1995 г., стр. 255-260).
Полимерные системы типа полиэтиленгликолей и полиэтиленоксидов вне зависимости от способа получения и величины молекулярной массы могут иметь заметное количество концевых альдегидных групп. Так как при окислении этиленгликоля образуется гликолевый альдегид, то фрагмент гликолевого альдегида может завершать цепь молекулы полиэтиленоксида.
Действительно, в геле полиэтиленоксида с помощью реакции с динитрофенилгидразином обнаружены карбонильные группы. Наличие концевых альдегидных групп в высокополимерных системах, не способных к преодолению трансдермального барьера, не представляет опасности. Наоборот, в силу высоких биоцидных свойств альдегидные фрагменты могут оказывать благоприятное воздействие, например, при лечении ожоговых ран и других видов нарушений кожного покрова, сопровождающихся развитием микрофлоры (монография А.Н. Децины "Теория мягких косметологических воздействий. Современная косметология", Новосибирск, "Наука", 2000, стр. 217,218, www.golkom.ru/book/48_1.htm).
В предлагаемой фармацевтической комбинированной композиции гидрофильная основа из полиэтиленгликолей и полиэтиленоксидов и других компонентов используется для изготовления мазей для I и II фазы раневого процесса.
В настоящее время в фармакологии активно применяются конъюгированные с носителем (иммобилизованные) фармакологические средства. Известно, что гидрофильные полимеры, такие как полиэтиленгликоль, гидроксиэтиленкрахмал, поливинилпирролидон и другие могут быть связаны с биологически активными веществами путем адсорбции на их поверхности или образование химических связей.
При этом может происходить значительная модификация свойств активного вещества, способная приводить к его стабильности, увеличению периода полувыведения, снижению токсичности и увеличению избирательности действия за счет качественных изменений фармакокинетических и фармакодинамических параметров. Одним из вариантов получения подобного рода конъюгированных активных веществ является реакция пегилирования (пегиляции) - присоединения молекул полиэтиленгликоля (ПЭГ). При этом наличие атомов водорода позволяет одной молекуле ПЭГ связывать 2-3 молекулы воды, и тем самым при присоединении нескольких молекул ПЭГ формировать «водяное облако» вокруг пегилированной частицы, увеличивая ее гидродинамический радиус.
В случае если фармакологически активное вещество остается стабильным при облучении, то процесс образования конъюгатов проводится в один этап путем облучения ионизирующим излучением смеси водного раствора полимерного носителя и лекарственного вещества. Если же при радиационном воздействии биологически активное соединение теряет свои фармакологические свойства, используют двухступенчатый подход: облучают только полимерный носитель и в дальнейшем смешивают его с активной формой лекарственной субстанции («Нанотехнологии в фармакологии», A.M. Дыгай и др., Москва, 2011 г., стр. 39-41, стр. 49).
С помощью технологии обработки раствора полиэтиленоксида 1500 в воде ускоренными электронами получен гидрогель, содержащий от 1 до 4% полиэтиленоксида. Этим гелем является гидрогель «Геко» - бесцветная гелеобразная масса. Получаемый по такой технологии гидрогель, кроме того, что он наиболее безопасен, обладает некоторыми уникальными свойствами. Под действием ионизирующего излучения в результате образования межмолекулярных сшивок получается сетчатый многослойный полимер (в виде геля с водой), имеющий ячеистую структуру - ячейки типа А (определяют гидрофильность системы) и Б (определяют сродство к жирам - липофильность).
Наличие таких фрагментов в структуре геля определяет свойства системы в целом, которая, наряду с возможностью введения растворимых в воде добавок (соли, спирт, глицерин и т.п.), неплохо удерживает значительное количество липофильных систем - например, масла - без добавления эмульгаторов.
С другой стороны, гель полиэтиленоксида 1500, представляющий смесь воды и больших молекул сшитого или сетчатого полиэтиленоксида в достаточно низкой концентрации, при его использовании в качестве основы мазей не образует плотной пленки, которая могла бы препятствовать процессам дыхания и выделению продуктов клеточного метаболизма. Наличие в структуре геля свободной и связанной воды позволяет отнести гель полиэтиленоксида 1500 к увлажняющим кремовым основам. Гидрогель «Геко» имеет варьируемую в широких пределах структурную вязкость, он склонен к разжижению при добавлении спирта, глицерина, при интенсивном механическом воздействии. Химический состав: вода дистиллированная - 96%; полиэтиленоксид -1500 - 3,5%; бензоат натрия - 0,5%. Физико-химические свойства: рН 20%-ной водной суспензии - 4,0-8,0; динамическая вязкость при 30°С при скорости сдвига 16 с - 1 - 2,0-6,0 Па с.
Гидрогель «Геко» с полиэтиленоксидом-1500 используется в предлагаемой фармацевтической комбинированной композиции в качестве основы с растворением в ней лизоамидазы, для изготовления мази (геля) для лечения гнойных ран.
В 2000 годы в России были разработаны глицераты кремния и глицерогидрогели на их основе. По физическим свойствам кремниевый глицерогидрогель (КГГ-гель), прозрачный или полупрозрачный, бесцветный или белого цвета, не имеет запаха, устойчив при хранении, КГГ-гель нетоксичен, безопасен в применении, не оказывает местного раздражающего действия на кожу и слизистые оболочки, не имеет аллергизирующих свойств, обладает анестезирующими свойствами, противоотечным, жаропонижающим и антиоксидантным действием. КГГ-гель может быть использован, как источник эссенциального микроэлемента - кремния для регуляции кремниевого обмена в организме. КГГ-гель обладает транскутанной активностью, способствует трансдермальному проникновению низкомолекулярных веществ.
В предлагаемой фармацевтической комбинированной композиции кремниевый глицерогидрогель используется для изготовления мазей (кремов) для лечения гнойных.
Гиалуроновая кислота - полисахарид из семейства глюкозаминогликанов, обладает способностью связывать в 1000 раз больше воды, чем весит сама. Гиалуроновая кислота нетоксична. Гиалуроновая кислота имеет самую высокую гигроскопичность по сравнению с другими увлажняющими агентами, такими, как глицерин и сорбитол. В силу своей высокой гидрофильности гиалуроновая кислота образует с водой высоковязкие гели, которые увлажняют кожу и слизистые оболочки. При этом поглощенная вода удерживается внутри геля и не испаряется даже при понижении относительной влажности окружающего воздуха.
В составе гелей гиалуроновая кислота оказывает антимикробное, ранозаживляющее и противовоспалительное действие, способствует регенерации эпителия, предотвращает образование грануляционных тканей, спаек, рубцов, нормализирует кровообращение, не вызывает клинических осложнений. Гиалуроновая кислота положительно влияет на течение местных воспалительных процессов, связывает микрофлору, а также продукты ее распада и жизнедеятельности, обладает выраженным противовоспалительным действием и местноанестезирующим эффектом. В то же время гиалуроновая кислота осуществляет и механическую защиту ран, так как образует тонкую пленку, которая препятствует проникновению в рану факторов внешней среды - болезнетворных агентов. Гели на основе гиалуроновой кислоты используют для лечения местных и общих гнойно-воспалительных процессов, термических и химических ожогов, трофических язв при хронической венозной недостаточности, лучевых поражений кожи, трещин, ссадин, а также для лечения длительно незаживающих ран различной этиологии (патент RU 2195262, A61K 9/06, 27.12.2002).
Гиалуронат натрия - натриевая соль гиалуроновой кислоты, хорошо растворима в воде с образованием вязкого бесцветного геля с рН 6,0-7,5 (0,1% раствор). По своей активности гиалуронат натрия полный аналог гиалуроновой кислоты, способствует регенерации тканей без образования шрамов, обладает способностью стимулировать клеточную миграцию и пролиферацию, он используется в концентрациях, начиная от 0,01 до 0,5%.
В предлагаемой фармацевтической комбинированной композиции гиалуроновая кислота или гиалуронат натрия используется для изготовления мазей (кремов).
Гидрофильным компонентом основ является поливинилпирролидон - синтетический полимер, инертный для организма и не расщепляющийся ферментными системами. Поливинилпирролидон входит в состав дезинтоксикационной кровезамещающей жидкости, которая связывает токсические вещества различной структуры и выводит их организма. (Кровозамещающие жидкости, www.nedug.ru/libraru/doc.aspx?item=38053).
Состав растворителей позволяет регулировать температуру плавления мазевых основ, а также реологические свойства мазей.
Вышеприведенный анализ известных свойств гиперосмолярных веществ и их сочетаний для мягких лекарственных форм позволил использовать вышеуказанные основы с гиперосмолярными свойствами для предлагаемой фармацевтической комбинированной композиции, содержащей комплекс бактериолитических и протеолитических ферментов - лизоамидазу.
С использованием этих основ для жидких, мягких и мягких формируемых лекарственных форм, а также комплекса бактериолитических и протеолитических ферментов, антибиотиков, анестетиков стимуляторов репаративного процесса, синтетических антибактериальных средств, антимикотиков, предлагаются фармацевтические комбинированные композиции гидрофильных жидких препаратов, мазей, кремов, гелей, капсул и суппозиториев для ректального применения, а также аэрозолей и спреев.
Вид лекарственной формы предлагаемой фармацевтической композиции зависит от молекулярной массы используемых гиперосмолярных веществ, их соотношения в составе смеси, а также количественного соотношения гиперосмолярной основы с другими компонентами композиции. Исходя из этих количественных соотношений, лекарственная форма предлагаемой фармацевтической композиции может быть раствор, суспензия, линимент, мазь гель, суппозитории, капсулы для ректального или вагинального применения, аэрозоль или спрей.
Наиболее предпочтительной для наружного применения является мазевая форма, так как она хорошо фиксируется и удерживается на раневой поверхности, дольше обладает терапевтической активностью, дешевле в изготовлении, удобна в использовании, что усиливает мотивацию больного к лечению. Гидрофильные мази являются гиперосмолярными, вследствие чего при применении могут абсорбировать значительное количество экссудата.
Кремы представляют собой двух- или многофазные дисперсные системы, дисперсионная среда которых при установленной температуре хранения, как правило, имеет ньютоновсий тип течения и низкие значения реологических параметров. Гидрофильные кремы приготовлены на основе эмульсии вода/масло или вода/масло/вода, стабилизированной подходящими эмульгаторами, либо готовых к использованию гидрофильных основ. К ним также относятся коллоидные дисперсные системы, состоящие из диспергированных в воде или смешенных вводно-гликолевых растворителей высших жирных спиртов или кислот, стабилизированные гидрофильными ПАВ.
Гели представляют собой одно-, двух- или многофазные дисперсные системы с жидкой дисперсной средой, реологические свойства которых обусловлены присутствием гелеобразователей в сравнительно небольших концентрациях. Гидрофильные гели (гидрогели) приготовлены на основах, состоящих из воды, гидрофильного смешенного или неводного растворителя (глицерин, 1,2-пропиленгликоль, полиэтиленоксид ПЭО-400) и гидрофильного гелеобразователя (карбомеры, производные целлюлозы, трагакант, гиалуронат натрия, гиалуроновая кислота и др.). В этой лекарственной форме гелеобразователи дополнительно могут исполнять роль стабилизаторов дисперсных систем, в частности, суспензий.
Гидрофильные суппозитории, приготовленные на вышеуказанных основах, легко растворяются в кишечнике, равномерно распределяя по слизистой лекарственные вещества, оказывающие на организм как местное, так и резорбтивное действие.
Желатиновые капсулы для ректального применения более перспективны по сравнению с суппозиториями с технологической, биофармацевтической и экономической точки зрения. Желатиновая оболочка предохраняет лекарственные вещества от воздействия факторов внешней среды и имеет преимущества перед суппозиториями, так как в ней могут капсулироваться вещества в виде мази, линимента, крема, геля, эмульсии, суспензии и др.
Высвобождение лекарственного вещества капсулы происходит быстрее и легче, чем у суппозиториев, так как под влиянием слабощелочной среды (рН 7,3-7,6) содержимого прямой кишки, желатиновые оболочки набухают, и в таком состоянии даже слабая перестальтика стенки прямой кишки достаточна для ее разрыва и высвобождения содержимого. Количество лекарственного вещества в капсуле, оказывающее необходимый терапевтический эффект, составляет двойную дозу суппозиториев. Таким образом, производство ректальных средств в желатиновой оболочке позволяет экономить дорогостоящие биологически активные ингредиенты и уменьшить себестоимость препаратов. Ректальные желатиновые капсулы с предлагаемым фармакологическим препаратом отвечают всем требованиям к идеальным суппозиториям и могут применяться в медицине для лечения проктологических заболеваний.
Аэрозоли - это жидкие пенные препараты в аэрозольной упаковке для местного лечения ран и ожогов. С учетом осмотической активности пенных основ и широты их антибактериального действия эти препараты показаны к применению в I или II фазе раневого процесса, однако по этим же критериям они могут быть использованы также для лечения ран в период перехода раневого процесса из I фазы во II.
Основные преимущества лекарственной формы аэрозоль следующие:
- применение аэрозолей удобно, гигиенично;
- обеспечивается точная дозировка при использовании дозирующих устройств;
- приводит к быстрому терапевтическому эффекту при сравнительно малых затратах лекарственных веществ;
- аэрозольный баллон герметически закрыт, что исключает загрязнение лекарственного препарат извне;
- аэрозольный баллон защищает препарат от высыхания, действия света и влаги;
- на протяжении всего срока годности аэрозоли сохраняют стерильность.
Аэрозолям присущи и некоторые недостатки:
- сравнительно высокая стоимость;
- возможность взрыва баллона при ударе или действия высокой температуры;
- загрязнение воздуха помещения лекарственными препаратами и пропеллентами при манипуляциях («Промышленная технология лекарств», Харьков, 2002 г., том. 2, В.И. Чуешов и др., стр. 640).
Спреи как лекарственная форма сейчас активно используются в медицинской практике. Это связано с разработкой высокоэффективных и качественных микронасосов, обеспечивающих создание газожидкостной струи с определенными параметрами. Спрей фактически приходит на смену аэрозолям.
Основным принципиальным отличием является то, что в аэрозоли подача препарата производится за счет избыточного давления, а извлечение происходит посредством клапана. При этом создается мелкодисперсная взвесь - размер частиц 1-5 мкм - с высокой кинетической энергией.
При использовании спрея подача препарата производится за счет его механического выдавливания поршнем микронасоса, при этом давление во флаконе близко к атмосферному. Размеры частиц у спрея больше, чем у аэрозоля - 10-50 мкм, скорость их не высокая. Лекарства в форме спрея используются для местного, наружного, интерназального применения.
Основные преимущества лекарственной формы спрей следующие:
- лекарственный препарат в форме спрей приводит к быстрому терапевтическому эффекту;
- при диспергировании повышается химическая и, следовательно, фармакологическая активность лекарственного средства, вследствие этого терапевтический эффект можно получить при меньшей дозе препарата;
- небольшой размер частиц обуславливает высокую степень их проникновения в складки, карманы, полости раны или слизистой и в других труднодоступных местах;
- не существует опасности загрязнения лекарственного препарата извне, так как баллон герметически закрыт. Это также предотвращает высыхание препарата и защищает гигроскопические вещества от влаги;
- обеспечивается точная дозировка при использовании дозирующих клапанов;
- способ применения является удобным и быстрым. (http://pharmspray.vipsmed.ru/publikacii/novaja-lekarstvennaja-forma-sprej/)
Комплекс бактериолитических и протеолитических ферментов - лизоамидаза в предлагаемой фармацевтической композиции лизирует грамположительные микроорганизмы, в том числе устойчивые к антибиотикам, а также за счет своей протеолитической активности очищает раны от некротических масс, оказывая при этом иммуностимулирующее действие.
Кроме этого, лизоамидаза стимулирует репаративные процессы за счет влияния на клетки грануляционной ткани.
Лизоамидаза не активна в отношении грамотрицательных бактерий. В связи с этим для расширения терапевтической активности и снижения устойчивости микроорганизмов к предлагаемой композиции в нее введены вместе с лизоамидазой синтетические антибактериальные вещества в основном с разным механизмом и спектром действия, в том числе поверхностно-активные вещества, а также антибиотики в различных физиологически приемлемых сочетаниях, имеющих аддитивный или синергический эффект.
При этом антибактериальные компоненты в предлагаемой композиции имеют в основном различные механизмы антимикробного действия и различную устойчивость к ним патогенной микрофлоры. Это позволяет, комбинируя компоненты в физиологически приемлемой смеси на одной основе, расширять активность предлагаемой композиции и снижать к ней резистентность раневой микрофлоры. Совместное применение лизоамидазы и других антибактериальных компонентов в одной фармацевтической композиции усиливает активность композиции за счет разных механизмов воздействия на патологическую раневую микрофлору, а в некоторых случаях в разные периоды времени заживления.
Применение антимикотиков в предлагаемом препарате совместно с лизоамидазой и другими целевыми добавками, обеспечивает комплексное воздействие предлагаемой фармацевтической композиции при грибковом поражении кожи и ран.
Другими положительными эффектами от применения антибактериальных компонентов в предлагаемой композиции является улучшение микроциркуляции в тканях раны за счет снижения активности гистамина, уменьшение вторичного некроза тканей в окружности раны, снижения степени отечной реакции при экссудативном воспалении, дополнительного улучшения очистки поверхности раны и стимуляции процесса восстановления тканей.
Применение в предлагаемой фармацевтической комбинированной композиции анестетиков в виде монокомпонентов или их смеси, значительно подавляет болевой синдром при лечении ран и ожогов.
Для обеспечения дополнительного стимулирования процессов репарации в ране в предложенной фармацевтической композиции применено как в виде монокомпонента, так и в виде смеси компонентов, вещества, стимулирующие процессы заживления в ране. При этом ксимедон помимо стимулирования обменных репаративных процессов в ране дополнительно обеспечивает антибактериальное действие, иммуностимулирующий эффект, регулирующее воздействие на воспалительный процесс за счет мембраностабилизирующего, антиоксидантного и адаптогенного эффектов, оказывает выраженное противоотечное действие, улучшает микроциркуляцию. Кроме того, он регулирует коллагеногенез, препятствуя образованию келоидных рубцов.
Использование гидрофильной основы, состоящей из смеси полиэтиленоксидов и проксанола в предлагаемой фармакологической композиции, обеспечивает быструю доставку активных веществ, как к микробным клеткам, так и к клеткам ткани, что повышает терапевтическую активность предложенного препарата. Кроме того, дигидрирование гидрофильной основой клеток грамположительных и грамотрицательных микроорганизмов снижает их сопротивляемость разрушающему воздействию комплекса бактерио- и протеолитических ферментов, а также другим антибактериальным веществам, входящим в состав предлагаемой фармацевтической композиции. Это также повышает ее терапевтическую активность.
Применение гиперосмолярной основы дополнительно улучшает микроциркуляцию в тканях раны за счет ее дегидратирующего действия, а также оказывает дополнительное противовоспалительное действие за счет абсорбции жидкости и снижения отека тканей раны. Гипреосмолярная основа обеспечивает отток гнойного экссудата из раны и предохраняет ткани от гипергидратации. Она легко наноситься на раневую поверхность, хорошо на ней удерживается, равномерно по ней распределяется, улучшая контакт мази с тканями и содержимым раны, хорошо проникает под струп, хорошо смешивается с раневым экссудатом, сохраняя при этом свою однородность, малотоксична и не оказывает раздражающего действия на ткани, не нарушает их физиологических функций.
Растворение активных веществ в полиэтиленоксидной основе повышает их дисперсность и способность к более быстрому высвобождению из основы, что также увеличивает терапевтическую активность предлагаемой фармацевтической комбинированной композиции. Данная основа является проводником активных веществ через кожный барьер, при этом такая пенетрирующая без повреждения клеток способность усиливается в условиях воспаления. Гидрофильная основа на полиэтиленоксидах способна растворяться в секретах слизистых оболочек, полностью высвобождая лекарственные вещества, не раздражая при этом слизистую, имеет большой срок годности и высокую физиологическую индифферентность.
Консерванты, стабилизаторы, неионогенные детергенты обеспечивают длительное хранение фармацевтической композиции с сохранением ее активности в случае, если активные вещества композиции и ее целевые добавки, а также основа, подвержены деструкции или воздействию микроорганизмов. Неионогенные детергенты и солюбилизаторы обеспечивают растворение плохо растворимых веществ в основе.
Вышеуказанная совокупность свойств предлагаемой фармакологической комбинированной композиции ранее не была известна, что говорит о новизне предложенного решения.
В предложенном препарате применены вещества, разрешенные для изготовления лекарственных средств.
Предлагаемую фармацевтическую композицию получают путем смешивания компонентов известными методами.
Возможность реализации предлагаемого изобретения иллюстрируется следующими примерами, но не ограничивается ими.
Примеры для I фазы раневого процесса.
Жидкие лекарственные формы для наружного и местного применения
Пример 1.
Раствор для наружного и местного применения №1.
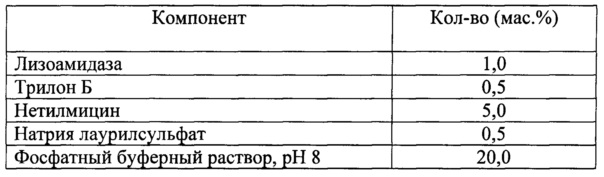

Пример 2.
Раствор для наружного и местного применения №2.
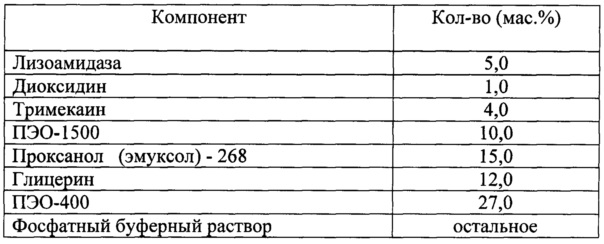
Пример 3.
Раствор для наружного и местного применения №3.

Пример 4.
Линимент для наружного и местного применения №1.
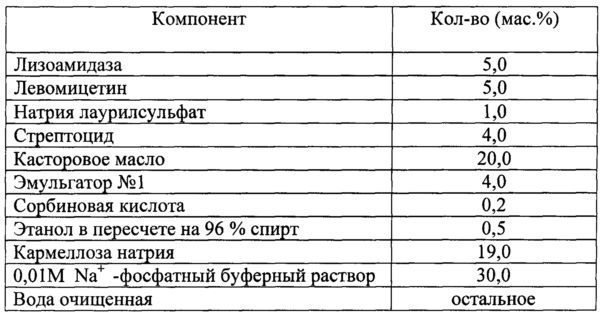
Пример 5.
Линимент для наружного и местного применения №2

Пример 6.
Линимент для наружного и местного применения №3
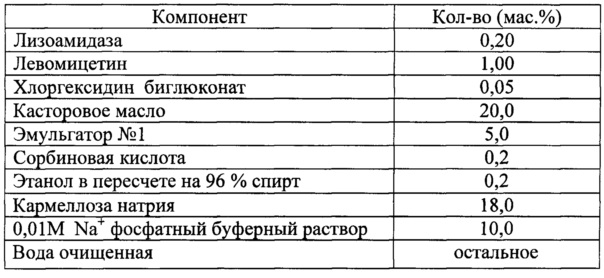
Пример 7.
Суспензия для наружного и местного применения №1


Пример 8.
Суспензия для наружного и местного применения №2.

Мягкие лекарственные формы для наружного и местного применения
Пример 9.
Мазь для наружного и местного применения №1.

Пример 10.
Мазь для наружного и местного применения №2.

Пример 11.
Мазь для наружного и местного применения №3

Пример 12.
Мазь для наружного и местного применения №4.

Пример 13.
Мазь для наружного и местного применения №5.

Пример 14.
Мазь для наружного и местного применения №6.
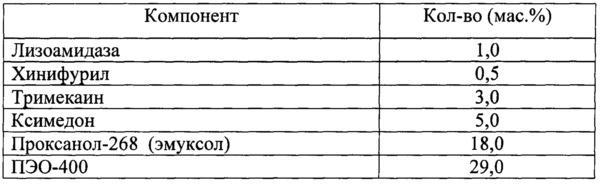

Пример 15.
Мазь для наружного и местного применения №7.

Пример 16.
Мазь для наружного и местного применения №8

Пример 17.
Мазь для наружного и местного применения №9.

Пример 18.
Мазь для наружного и местного применения №10


Пример 19.
Мазь для наружного и местного применения №11

Пример 20.
Мазь для наружного и местного применения №12.

Пример 21.
Мазь для наружного и местного применения №13

Пример 22.
Мазь для наружного и местного применения №14.

Пример 23.
Мазь для наружного и местного применения №15

Пример 24.
Мазь для наружного и местного применения №16.

Пример 25.
Мазь для наружного и местного применения №17.
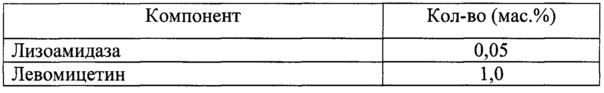

Пример 26.
Гель для наружного и местного применения №18.

Пример 27.
Гель для наружного и местного применения №19.
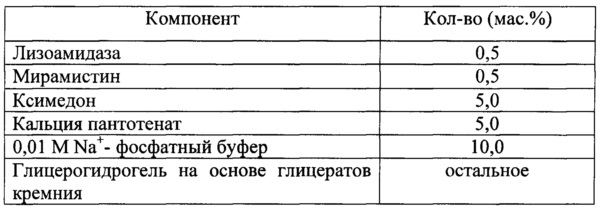
Пример 28.
Гель для наружного и местного применения №20.

Пример 29.
Гель для наружного и местного применения №21.

Пример 30.
Мазь для наружного и местного применения №22.

Пример 31.
Гель для наружного и местного применения №23
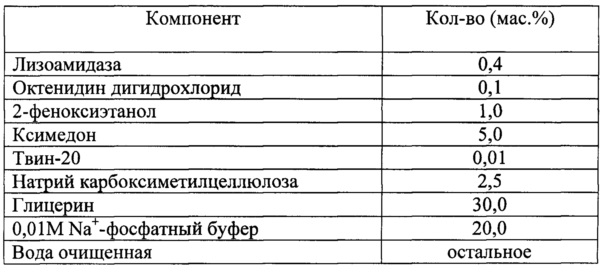
Пример 32.
Гель для наружного и местного применения №24.

Пример 33.
Гель для наружного и местного применения №25.
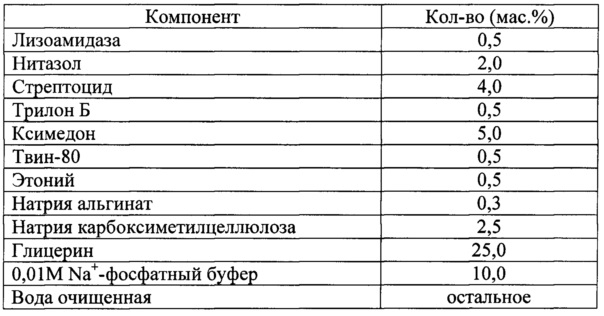
Примеры фармацевтических комбинированных композиций для мягких формируемых форм (суппозиториев, капсул)
Пример 34.
Композиция для приготовления суппозиториев №1.
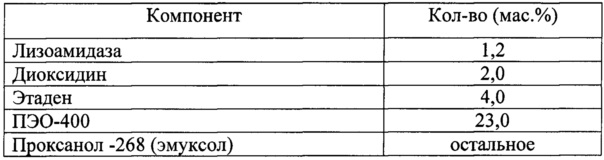
Из данной смеси изготовлено 100 штук ректальных суппозиториев в форме «сигары» диаметром 10 мм, длиной 32 мм, весом 2,5 г. Растворимость суппозиториев на гидрофильной основе составляет не более 1 часа при температуре (37±1)°С, что соответствует требованиям ГФ XI (ст. Суппозитории, стр. 151-153).
Пример 35.
Композиция для приготовления суппозиториев №2.

Из данной смеси изготовлено 100 штук ректальных суппозиториев в форме «сигары» диаметром 10 мм, длиной 32 мм, весом 2,9 г. Растворимость суппозиториев на гидрофильной основе составляет не более 1 часа при температуре (37±1)°С, что соответствует требованиям ГФ XI (ст. Суппозитории, стр. 151-153).
Пример 36.
Композиция для приготовления суппозиториев №3.
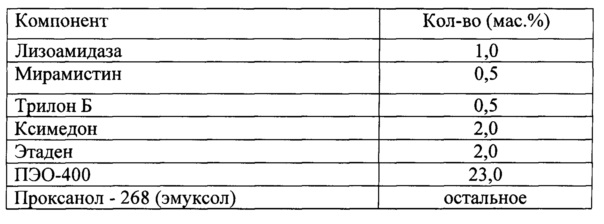
Из данной смеси изготовлено 100 штук ректальных суппозиториев в форме «сигары» диаметром 10 мм, длиной 32 мм, весом 3,1 г. Растворимость суппозиториев на гидрофильной основе составляет не более 1 часа при температуре (37±1)°С, что соответствует требованиям ГФ XI (ст. Суппозитории, стр. 151-153).
Пример 37.
Мазью из примера №13 (мазь для наружного и местного применения №5) было заполнено 100 штук желатиновых капсул №00, объемом 0,95 мл. Распадаемость полученных капсул менее 20 мин, что отвечает требованиям ГФ XI (ст. Капсулы, стр. 143).
Примеры фармацевтической комбинированной композиции для заполнения аэрозольных баллонов.
Пример 38.
Фармацевтическая комбинированная аэрозольная композиция №1.

Пример 39.
Фармацевтическая комбинированная аэрозольная композиция №2.
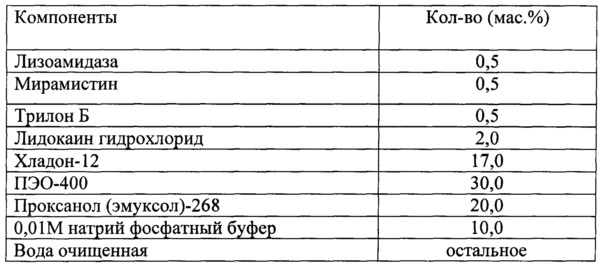
Примеры фармацевтической комбинированной композиции применяемой в форме спрея.
Пример 40.
Фармацевтическая комбинированная композиция для спрея №1.


Пример 41.
Фармацевтическая комбинированная композиция для спрея №2.
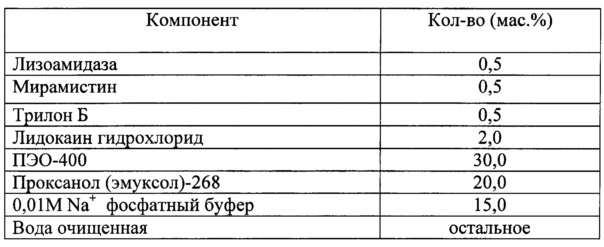
Пример 42.
Фармацевтическая комбинированная композиция для спрея №3.
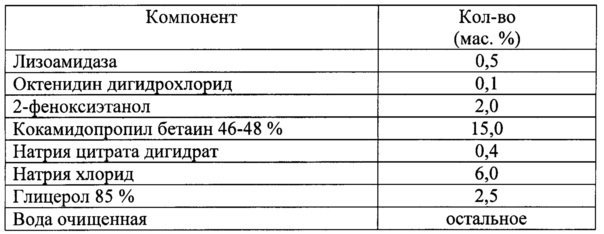
Активность фармацевтических композиций проверяли следующим образом.
Суспензия клеток Micrococcus luteus и все растворы, кроме растворов исследуемых композиций, были приготовлены в соответствии с требованиями ФС 42-3330-96 и ФС 42-3329-96.
Растворы исследуемых композиций лизоамидазы были приготовлены следующим образом: в пластиковые градуированные пробирки вместимостью 1,5 мл вносили по 300 мг мазевой композиций лизоамидазы и 700 мг фосфатного буфера (30% раствор, w/w). После тщательного перемешивания и встряхивания в течение 2-х минут пробирки центрифугировали 5 мин при 5000 об/мин для осаждения нерастворимых компонентов.
Для определения протеолитической активности исходный раствор был разбавлен в 15 раз (для получения 2% раствора композиции лизоамидазы, 0,024% действующего вещества).
В микроцентрифужные пробирки вместимостью 1,5 мл вносили по 250 мкл 1% раствора казеина (по 3 опытных и 3 контрольных пробирки на каждую исследуемую композицию). Затем их прогревали в твердотельном термостате при 37°С в течение 10 минут. В каждую из трех опытных пробирок вносили по 250 мкл 2% раствора композиции лизоамидазы и прогревали пробирки при 37°С в течение 10 минут.Во все пробирки вносили по 1 мл 5% раствора ТХУ, а в контрольные дополнительно по 250 мкл 2% раствора композиции лизоамидазы. Прогревали при 37°С в течение 10 мин, затем центрифугировали 5 мин при 15000 об/мин для осаждения белка, денатурировавшего под воздействием ТХУ.
Измерение оптической плотности полученных супернатантов проводили при 260 нм на спектрофотометре Beckman Coulter DU800.
Расчет протеолитической активности проводили по формуле из ФС 42-3330-96 с учетом особенностей проведения опыта
ПА=(D0-Dk)/20,
где D0 и Dk - значения оптических плотностей супернатантов в опытной и контрольной пробирке, соответственно;
20 - количество композиции лизоамидазы в мг, взятой для анализа, в расчете на 1 мл раствора казеина.
Для определения бактериолитической активности суспензию клеток Micrococcus luteus вносили по 1 мл в микроцентрифужные пробирки вместимостью 1,5 мл (3 пробирки на каждый исследуемый образец и 3 пробирки - контроль). После прогрева в твердотельном термостате при 37°С в течение 5 мин в контрольные пробирки вносили по 25 мкл фосфатного буфера, а в опытные - по 25 мкл исходного (30%) раствора композиций лизоамидазы. После прогрева при 37°С в течение 5 мин во все пробирки вносили по 50 мкл 4 М NaCl. Измерение оптической плотности проводили при 540 нм на спектрофотометре Beckman Coulter DU800, пробирки тщательно встряхивались непосредственно перед внесением измеряемого образца в кювету.
Расчет бактериолитической активности проведен по формуле из ФС 42-3330-96 с учетом особенностей проведения опыта
ЛА, ед/мг=(Dk-Do)×0,44,
где Dk и Do - значения оптических плотностей в контрольной и опытной пробирке, соответственно;
0,44 - коэффициент, учитывающий количество внесенной композиции, время реакции и коэффициент пересчета, учитывающий условия проведения реакции.
Измерение количества белка проводили по методу Бредфорд. К 2 мл реактива Бредфорд добавляли 40 мкл неразведенного супернатанта. Измерение оптической плотности проводили при 595 нм на спектрофотометре Beckman Coulter DU800. Калибровочную кривую строили по данным, полученным для бычьего сывороточного альбумина (10-100 мкг белка на 100 мкл раствора).
Экспериментально было определено изменение протеолитической и бактериолитической активности двух мазей в течение 12 месяцев в сравнении с субстанцией лизоамидазы, хранящейся в виде лиофилизированного герметично упакованного порошка при температуре +4°С.
В таблицах 1 и 2 представлено сравнение активности монокомпозиций с лизоамидазой. Из приведенных в этих таблицах результатов видно, что протеолитическая активность монокомпозиций возросла в сравнении с протеолитической активностью субстанции приблизительно в 2,5 раза для монокомпозиции 1, и приблизительно в 4 раза - для монокомпозиции 2.
Это возрастание протеолитической активности зависит от наличия в составе предлагаемой фармацевтической композиции гидрофильной основы и ее компонентов. Такие результаты в известной литературе не обнаружены. Возрастание протеолитической активности лизоамидазы связано с ее иммобилизацией в смеси полиэтиленоксидов и проксанола (эмуксола).
Бактериолитическая активность лизоамидазы в монокомпозициях в среднем больше, чем у субстанции лизоамидазы, но незначительно.
В прилагаемых к описанию таблицах 3 и 4 даны результаты экспериментальной проверки стабильности протеолитической активности и бактериолитической активности некоторых предлагаемых фармацевтических комбинированных композиций в течение 12 месяцев.
Бактериолитическая активность лизоамидазы на полиэтиленоксидной основе в условиях хранения при температуре +4 ÷ +8°С (в герметичной посуде) снижается не более, чем на 20% в течение 1 года.
Антимикробная активность мазей на основе некоторых предлагаемых фармацевтически комбинированных композиций изучалась согласно «Методическим рекомендациям по экспериментальному изучению лекарственных препаратов для лечения гнойных ран», М, 1989. В качестве тест-культур использовали госпитальные штаммы грамположительных и грамотрицательных микроорганизмов, выделенных от больных, находившихся на лечении. Микробную взвесь готовили в концентрациях 105-106 КОЕ в 1 мл и вносили в чашку Петри с агаром.
В соответствии с инструкцией при определении активности антибактериальных средств с помощью метода диффузии в агар (метод колодцев) пользовались следующими критериями для оценки чувствительности микроорганизмов к изучаемым препаратам:
- отсутствие зон задержки роста вокруг лунки, а также зона задержки роста до 10 мм рассматривались, как отсутствие чувствительности к препарату;
- зоны задержки роста диаметром 11-15 мм рассматривались, как малая чувствительность;
- зоны задержки роста диаметром от 15-20 мм рассматривались, как показатель хорошей чувствительности;
- зоны задержки роста диаметром более 25 мм рассматривались, как показатель высокой чувствительности.
В прилагаемой к описанию таблице 5 даны результаты экспериментальной проверки антимикробной активности известных мазей в отношении госпитальных штаммов по сравнению с некоторыми предлагаемыми комбинированными мазевыми композициями на гидрофильной основе. Из приведенных в таблице данных видно, что антимикробная активность некоторых предлагаемых композиций по отношению к госпитальным штаммам имеет высокую чувствительность, и в ряде случаев выше, чем у известных мазей.
Клиническое апробирование образца мази для наружного и местного применения №1 (пример 9 в описании заявки) было осуществлено у животных с тяжелыми резистентными гнойно-некротическими поражениями. Мазь применялась при гнойно-некротических процессах локализованных в тканях эпидермиса, флегмонозных поражениях подкожной жировой клетчатки и глубоких слоев мышечной ткани, вызванных трофическими нарушениями, травматическими повреждениями с контаминацией микроорганизмами, в том числе выделенной культурой синегнойной палочки, контаминированными поражениями неясной этиологии.
Следует отметить, что клинический эффект от применения мази с лизоамидазой и диоксидином был значительно выше, чем от препаратов «Суралан» (в составе на 1 г: миконазол нитрат - 23 мг, полимиксин В сульфат - 0,696 мг, ацетат преднизолона 0,5 мг, вспомогательные ингредиенты), «Панолог» (в составе на 1 г: триамицинолона ацетонида - 1 мг; неомицина сульфата - 2,5 мг, тиострептона - 2500 ME, нистатина - 100000 ME, вспомогательные ингредиенты); «Левомеколь» (в составе на 1 г: левомицетин - 7,5 мг; метилурацил - 40 мг, вспомогательные ингредиенты - остальное).
Применение мази с лизоамидазой давало положительный эффект. Введение этой мази в схему лечения улучшало течение раневого процесса, приводило к быстрому очищению раны, снижению гнойного отделяемого и признаков местных воспалительных реакций, сокращало время реконвалесценции.
На базе предложенного решения может быть создан ряд новых лекарственных препаратов в виде жидких лекарственных форм, мягких лекарственных форм, в том числе, формируемых, а также аэрозолей и спреев, содержащих комплекс бактериолитических и протеолитических ферментов лизоамидазу.
Предлагаемая фармацевтическая комбинированная композиция на основе лизоамидазы с вышеуказанными целевыми добавками лизирует как грамположительные, так и грамотрицательные микроорганизмы, в том числе резистентные к антибиотикам, имеет высокую терапевтическую активность, улучшает удобство использования, снижает расход активного вещества, способствует очищению ран от гнойно-некротических масс, дает анестезирующий эффект. Она дополнительно стимулирует репаративные процессы в ране, улучшает микроциркуляцию, снижает вторичный некроз тканей в окружности раны, связанный с избыточным свободно радикальным окислением, снижает вероятность появления резистентных штаммов к антимикробному комплексу композиции.
Проведенный поиск информации не выявил идентичных и сходных технических решений.
Вышеуказанная совокупность признаков предлагаемой фармацевтической композиции (состав композиции, количественные соотношения компонентов в ней и ее лекарственная форма) ранее не была известна, что говорит о новизне предложенного решения.
Совокупность отличительных существенных признаков предлагаемой фармацевтической комбинированной композиции не следует очевидным образом из существующего уровня техники, поскольку ранее не было известно, что лизоамидаза сохраняет бактериолитическую и протеолитичеокую активность в композиции, содержащей активные целевые добавки, указанные в рассматриваемом техническом решении.
Таким образом, предлагаемая композиция отвечает критерию «изобретательский уровень», так как неожиданно было показано, что ее антибактериальная активность не менее, а в некоторых случаях выше, чем у существующих аналогов и сохраняется в течение длительного времени.
Поэтому заявитель считает, что предлагаемая фармацевтическая комбинированная композиция для местного и наружного применения на основе комплекса бактериолитических и протеолитических ферментов - лизоамидаза соответствует критерию «новизна» и имеет изобретательский уровень.
Заявляемая фармацевтическая комбинированная композиция может быть рекомендована при лечении обширных гнойно-некротических посттравматических, послеоперационных ран, ожогов, а также ран после хирургического лечения острых гнойных заболеваний кожи и мягких тканей (абсцедирурющие фурункулы, карбункулы, маститы, гидрадениты, рожа и др.), при лечении больных с обширными атеросклеротическими и венозными трофическими язвами, с синдромом диабетической стопы, осложненных инфекционным процессом, вызванным высокорезистентными грамположительными и грамотрицательными аэробными и анаэробными микроорганизмами, грибами, устойчивыми к подавляющему большинству системных антимикробных и противогрибковых препаратов. Предлагаемые композиции могут быть рекомендованы для использования в хирургических, травматологических, акушерско-гинекологических, проктологических стационаров, а также для оказания помощи пострадавшим при техногенных и природных катастрофах, при лечении больных на амбулаторно-поликлиническом этапе.
Предлагаемая фармацевтическая комбинированная композиция для местного и наружного применения на основе комплекса бактериолитических и протеолитических ферментов - лизамимидазы может быть использована для промышленного серийного выпуска жидких лекарственных форм, например, таких, как растворы, линименты, суспензии, мазеобразные мягкие формы, например, таких, как мази, гели, а также - формируемых мягких лекарственных форм, таких, как суппозитории и желатиновые капсулы для ректального применения, кроме того - средств в газообразной форме: аэрозолей, спреев.
При использовании предлагаемая композиция обеспечивает получение следующих технических результатов: повышение терапевтической активности в сравнении с известными препаратами, в том числе к штаммам микроорганизмов, резистентных к отдельным компонентам композиции, улучшение течения раневого процесса, быстрое очищение раны, снижение содержания гнойного отделяемого и признаков местных воспалительных реакций, сокращение времени реконвалесценции.

Исходная активность субстанции: протеолитическая - 0,8 ПЕ/мг
Состав композиции:
1. Лизоамидаза - 1,2%; ПЭО-400 - 85,8%; эмуксол-268 - 13,0%
2. Лизоамидаза - 1,2%; ПЭО-400 - 85,8%; ПЭО-1500 - 13,0%

Исходная активность субстанции: бактериолитическая активность - 12,3 ЛЕ/мг.
Состав композиции:
№1. Лизоамидаза - 1,2%; ПЭО-400 - 85,8%; эмуксол-268 - 13,0%
№2. Лизоамидаза -1,2%; ПЭО-400- 85,8%; ПЭО-1500 - 13,0%
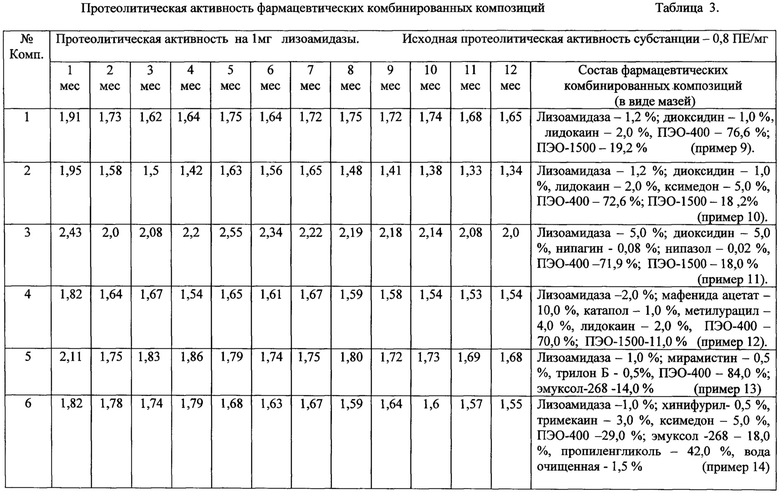
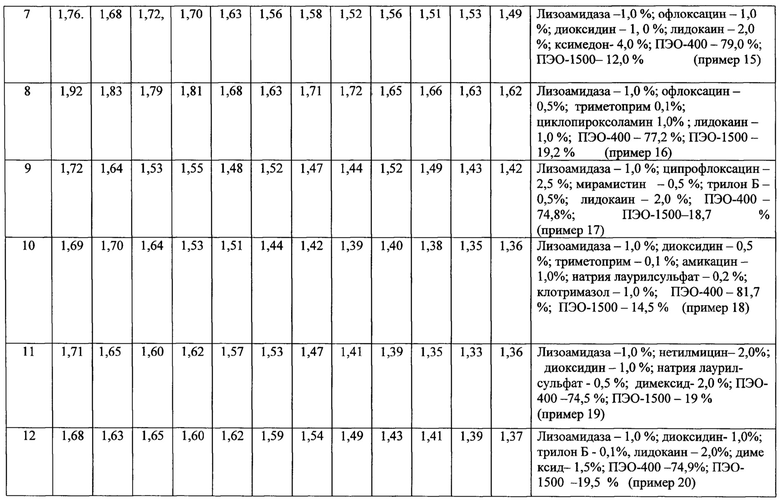

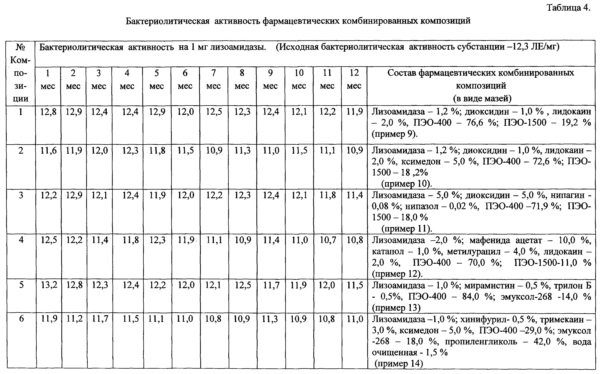


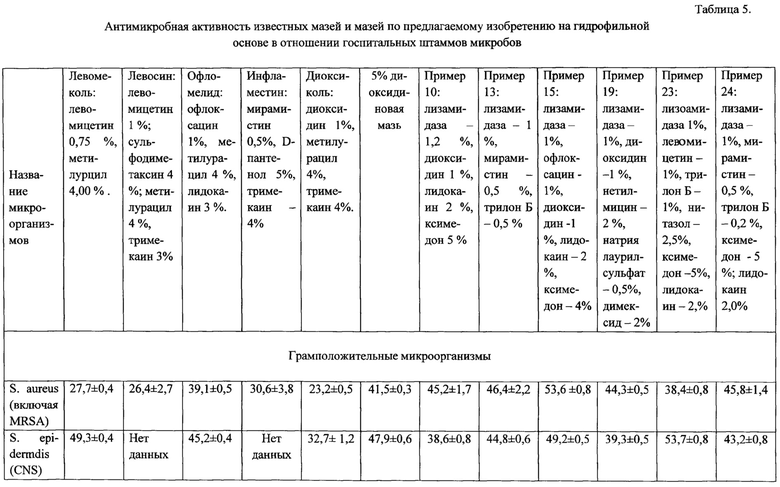
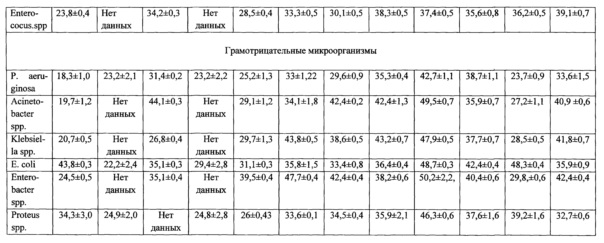
| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтическая комбинированная композиция для местного и наружного применения на основе диоксидина | 2016 |
|
RU2667974C2 |
| Фармацевтическая комбинированная композиция для лечения гнойных ран на основе фторхинолонов (варианты) | 2016 |
|
RU2682171C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ НАРУЖНОГО И МЕСТНОГО ПРИМЕНЕНИЯ, ОБЛАДАЮЩАЯ АНТИБАКТЕРИАЛЬНЫМ И НЕКРОЛИТИЧЕСКИМ ДЕЙСТВИЕМ, НА ОСНОВЕ ЛИЗОАМИДАЗЫ | 2007 |
|
RU2367457C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ МЕСТНОГО И НАРУЖНОГО ПРИМЕНЕНИЯ НА ОСНОВЕ НИЗКОМОЛЕКУЛЯРНОГО ИНДУКТОРА ИНТЕРФЕРОНА | 2007 |
|
RU2353354C1 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ МЕСТНОГО И НАРУЖНОГО ПРИМЕНЕНИЯ НА ОСНОВЕ НИЗКОМОЛЕКУЛЯРНОГО ИНДУКТОРА ИНТЕРФЕРОНА | 2007 |
|
RU2348400C1 |
| Стабильная комбинированная фармацевтическая композиция диоксидина и анестетиков | 2017 |
|
RU2733714C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ, ОБЛАДАЮЩАЯ АНТИБАКТЕРИАЛЬНЫМ И НЕКРОЛИТИЧЕСКИМ ДЕЙСТВИЕМ, НА ОСНОВЕ ЛИЗОАМИДАЗЫ | 2007 |
|
RU2367469C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ЦИКЛОФЕРОНА МЕСТНОГО И НАРУЖНОГО ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ГНОЙНО-ДЕСТРУКТИВНЫХ ПОРАЖЕНИЙ СЛИЗИСТОЙ И КОЖИ, ОБЩЕСИСТЕМНЫХ ЗАБОЛЕВАНИЙ ПРИ ИММУНОДЕФИЦИТНЫХ СОСТОЯНИЯХ | 2008 |
|
RU2414221C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ, ОБЛАДАЮЩАЯ АНТИБАКТЕРИАЛЬНЫМ И НЕКРОЛИТИЧЕСКИМ ДЕЙСТВИЕМ | 2007 |
|
RU2367456C2 |
| Фармацевтическая субстанция для лечения инфицированных ран различного генеза | 2018 |
|
RU2697869C1 |
Группа изобретений относится к области фармацевтической промышленности, а именно к вариантам фармацевтической комбинированной композиции антибактериального и некролитического действия для наружного и местного применения. В первом или втором варианте композиция содержит (в мас.%) основу, 0,01-5,0% лизоамидазы, 0,5-6,5% анестетика и 0,1-5,0% диоксидина или его смеси с 0,01-2,0% трилона Б; в третьем варианте композиция содержит (в мас.%) гидрофильную основу, 0,01-5,0% лизоамидазы, 0,5-6,5% анестетика, 0,01-2,0% мирамистина или декаметоксина и 0,005-4,0% трилона Б или ЭДТА; в четвертом варианте композиция включает (в мас.%) гидрофильную основу, 0,01-5,0% лизоамидазы, 0,5-6,5% анестетика, 0,01-2,5% офлоксацина или ципрофлоксацина, 0,01-2,0% диоксидина или триметоприма, 0,5-10,5% ксимедона; в пятом варианте композиция включает (в мас.%) основу, 0,01-5,0% лизоамидазы, 0,5-6,5% анестетика, 0,2-5,0% нетилмицина или амикацина, 0,1-2,0% лаурилсульфата натрия, диоксидина, триметоприма или их смеси. Группа изобретений обеспечивает повышение антибактериальной и/или противогрибковой активности. 5 н. и 10 з.п. ф-лы, 42 пр., 5 табл.
1. Фармацевтическая комбинированная композиция для наружного и местного применения, обладающая антибактериальным и некролитическим действием, включающая лизоамидазу, синтетическое антибактериальное средство, анестетик и основу, отличающаяся тем, что в качестве синтетического антибактериального средства она содержит диоксидин при следующем соотношении компонентов, мас.%:
лизоамидаза 0,01-5,0
диоксидин 0,1-5,0
анестетик 0,5-6,5
основа – остальное
2. Фармацевтическая композиция по п.1, отличающаяся тем, что в качестве анестетика она содержит лидокаин или тримекаин.
3. Фармацевтическая композиция по п.1, отличающаяся тем, что она дополнительно включает димексид в количестве от 0,5 до 5,0 мас.%.
4. Фармацевтическая комбинированная композиция для наружного и местного применения, обладающая антибактериальным и некролитическим действием, включающая лизоамидазу, синтетическое антибактериальное средство, анестетик и основу, отличающаяся тем, что в качестве синтетического антибактериального средства она содержит диоксидин и трилон Б при следующем соотношении компонентов, мас.%:
лизоамидаза 0,01-5,00
диоксидин 0,1-5,0
трилон Б 0,01-2,00
анестетик 0,5-6,5
основа – остальное
5. Фармацевтическая композиция по п.4, отличающаяся тем, что в качестве анестетика она содержит лидокаин или тримекаин.
6. Фармацевтическая композиция по п.4, отличающаяся тем, что она дополнительно включает димексид в количестве от 0,5 до 5,0 мас.%.
7. Фармацевтическая комбинированная композиция для наружного и местного применения, обладающая антибактериальным и некролитическим действием, включающая лизоамидазу, вещество, нарушающее структуру мембран грамотрицательных микроорганизмов, анестетик и гидрофильную основу, отличающаяся тем, что она дополнительно содержит поверхностно-активный антисептик при следующем соотношении компонентов, мас.%:
лизоамидаза 0,01-5,00
поверхностно-активный антисептик 0,01-2,00
вещество, нарушающее структуру мембран
грамотрицательных микроорганизмов 0,005-4,000
анестетик 0,5-6,5
основа – остальное,
при этом в качестве поверхностно-активного антисептика она содержит мирамистин или декаметоксин, а вещество, нарушающее структуру мембран грамотрицательных микроорганизмов, выбирается из трилона Б или ЭДТА.
8. Фармацевтическая композиция по п.7, отличающаяся тем, что в качестве анестетика она содержит тримекаин или лидокаин.
9. Фармацевтическая композиция по п.7, отличающаяся тем, что она дополнительно включает димексид в количестве от 0,5 до 5,0 мас.%.
10. Фармацевтическая комбинированная композиция для наружного и местного применения, обладающая антибактериальным и некролитическим действием, включающая лизоамидазу, антибиотик, синтетическое антибактериальное средство, анестетик, стимулятор репаративных процессов и гидрофильную основу, отличающаяся тем, что в качестве антибиотика она содержит фторхинолон при следующем соотношении компонентов, мас.%:
лизоамидаза 0,01-5,00
фторхинолон 0,01-2,50
синтетическое антибактериальное средство 0,01-2,00
анестетик 0,5-6,5
стимулятор репаративных процессов 0,5-10,5
основа – остальное,
при этом фторхинолон выбирается из офлоксацина или ципрофлоксацина, синтетическое антибактериальное средство – из диоксидина или триметоприма, стимулятором репаративных процессов является ксимедон.
11. Фармацевтическая композиция по п.10, отличающаяся тем, что в качестве анестетика она содержит тримекаин или лидокаин.
12. Фармацевтическая композиция по п.10, отличающаяся тем, что она дополнительно включает димексид в количестве от 0,5 до 5,0 мас.%.
13. Фармацевтическая комбинированная композиция для наружного и местного применения, обладающая антибактериальным и некролитическим действием, включающая лизоамидазу, антибиотик, синтетическое антибактериальное средство, анестетик и основу, отличающаяся тем, что в качестве антибиотика она содержит аминогликозид при следующем соотношении компонентов, мас.%:
лизоамидаза 0,01-5,00
аминогликозид 0,2-5,0
синтетическое антибактериальное средство 0,1-2,0
анестетик 0,5-6,5
основа – остальное,
при этом аминогликозид выбирается из нетилмицина или амикацина, а синтетическое антибактериальное средство – из лаурилсульфата натрия, диоксидина, триметоприма или их смеси.
14. Фармацевтическая композиция по п.13, отличающаяся тем, что в качестве анестетика она содержит тримекаин или лидокаин.
15. Фармацевтическая композиция по п.13, отличающаяся тем, что она дополнительно включает димексид в количестве от 0,5 до 5,0 мас.%.
| RU 2367455 C2, 20.09.2009 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ЦИКЛОФЕРОНА МЕСТНОГО И НАРУЖНОГО ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ГНОЙНО-ДЕСТРУКТИВНЫХ ПОРАЖЕНИЙ СЛИЗИСТОЙ И КОЖИ, ОБЩЕСИСТЕМНЫХ ЗАБОЛЕВАНИЙ ПРИ ИММУНОДЕФИЦИТНЫХ СОСТОЯНИЯХ | 2008 |
|
RU2414221C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ НАРУЖНОГО И МЕСТНОГО ПРИМЕНЕНИЯ, ОБЛАДАЮЩАЯ АНТИБАКТЕРИАЛЬНЫМ И НЕКРОЛИТИЧЕСКИМ ДЕЙСТВИЕМ, НА ОСНОВЕ ЛИЗОАМИДАЗЫ | 2007 |
|
RU2367457C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ, ОБЛАДАЮЩАЯ АНТИБАКТЕРИАЛЬНЫМ И НЕКРОЛИТИЧЕСКИМ ДЕЙСТВИЕМ | 2007 |
|
RU2367456C2 |
| Харкевич Д.А | |||
| Фармакология: Учебник | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| - М.: ГЭОТАР-Медиа, 2006 | |||
| ЦУГАЛЬТНЫЙ ВИСЯЧИЙ ЗАМОК | 1923 |
|
SU736A1 |
| Венгеровский А.И | |||
| Фармакологическая несовместимость / Бюллетень сибирской медицины, 2003, N.3, с.49-56. | |||
Авторы
Даты
2018-05-29—Публикация
2016-10-11—Подача