Изобретение относится к медицине, а именно к терапии и хирургии, и может быть использовано для прогнозирования генетической предрасположенности или повышенного риска развития инфекционного эндокардита (ИЭ) у пациентов из группы риска.
Известно, что многие широко распространенные заболевания - рак, иммунодефициты, аллергические состояния и другие, связаны с воздействием на организм вредных факторов внешней среды - ксенобиотиков. Их обезвреживание и удаление из организма осуществляется системой детоксикации, состоящей более чем из 200 ферментов. Детоксикация происходит в три этапа -1 фаза (активация), II фаза (конъюгирование или нейтрализация) и III фаза (утилизация). Ферменты I фазы осуществляют процессы окисления жирорастворимых токсинов супероксидными радикалами, что приводит к образованию на них реактивных участков для присоединения водорастворимых молекул ферментами II фазы и последующего выведения из организма. Риск развития патологии максимален при высокой активности ферментов I фазы, поскольку образованные при их участии реактивные сайты на молекулах ксенобиотиков обеспечивают легкое прикрепление последних к ДНК и белкам, что приводит к повреждению клеток. В то же время при инертности ферментов II фазы происходит накопление в организме токсичных для клеток реактантов.
ИЭ, являющийся тяжелой нозологией, нередко с летальным исходом, часто развивается на фоне приема наркотиков, глюкокортикостероидов, цитостатиков, при СПИДе, у лиц с врожденными или приобретенными пороками сердца, протезированными клапанами и с иммунодефицитными состояниями. Тем не менее, связь ИЭ с ферментами системы детоксикации, которые осуществляют метаболизм наркотических и лекарственных средств, не изучена. Активность ферментов детоксикации зависит от особенностей аллельных вариантов (полиморфизмов) кодирующих их генов. Ассоциация ИЭ с полиморфизмами генов ферментов детоксикации не исследовалась. Поиск связи ИЭ с аллельными вариантами иных генов пока малорезультативен. Так, показано, что полиморфизмы в гене рецептора тромбоцитов не влияют на течение ИЭ (Daga S., Shepherd J.G., Callaghan J.G., Hung R.K., Dawson D.K., Padfield G.J., Hey S.Y., Cartwright R.A., Newby D.E., Fitzgerald J.R. Platelet receptor polymorphisms do not influence Staphylococcus aureus-platelet interactions or infective endocarditis. Microbes Infect. 2011; 13 (3):216-225). Не обнаружено несомненных ассоциаций с ИЭ вариантов генов некоторых толл-подобных рецепторов и интерлейкинов - TLR4, IL 10, IL IB, IL6 (M. Weinstock, I. Grimm, J. Dreier, C. Knabbe, T. Vollmer. Genetic Variants in Genes of the Inflammatory Response in Association with Infective Endocarditis. PLoS One. 2014; 9 (10): el 10151. Published online Oct 9, 2014. doi: 10.1371/journal.pone.0110151 PMCID: PMC4192365).
Наиболее близким к заявляемому способу является способ определения высокого риска развития ИЭ у носителей варианта Q полиморфизма R753Q (rs 5743708) в гене толл-подобного рецептора 2 (TLR2) (Bustamante J., Tamayo Ε., Florez S., Telleria J.J., Bustamante Ε., Lopez J., San Roman J.A., Alvarez F.J. Toll-Like Receptor 2 R753Q Polymorphisms Are Associated With an Increased Risk of Infective Endocarditis. Rev. Esp. Cardiol. 2011; 64 (11): 1056-1059). Способ заключается в выделении геномной ДНК из образцов крови, взятой в пробирки с антикоагулянтом - этилендиаминтетрауксусной кислотой (ЭДТА), определении полиморфизма R753Q в гене TLR2 с помощью по-лимеразной цепной реакции и рестрикционного анализа полученных ПЦР-продуктов. Авторами было обследовано 65 больных инфекционным эндокардитом в сравнении с 66 практически здоровыми индивидами. При статистическом анализе результатов генотипирования авторами была найдена значительная ассоциация с ИЭ полиморфизма R753Q гена TLR2 и установлен повышенный риск (в 3-13 раз) развития ИЭ у носителей аллеля Q. Однако указанный патологический вариант (аллель Q) был обнаружен авторами только у 33% больных инфекционным эндокардитом и у 12,9% практически здоровых людей. Выявленная относительно низкая частота аллеля Q у пациентов с ИЭ побуждает к поиску других более информативных генетических маркеров риска. Кроме этого, другие исследователи заявленную связь полиморфизма R753Q в гене TLR2 с ИЭ не подтвердили (Golovkin A.S., Ponasenko A.V., Yuzhalin А.Е., Salakhov R.R., Khutornaya M.V., Kutikhin A.G., Rutkovskaya N.V., Savostyanova Y.Y., Barbarash L.S. An association between single nucleotide polymorphisms within TLR and TREM-1 genes and infective endocarditis. Cytokine. 2014, 8; 71(1): 16-21).
Задачей настоящего изобретения явилось исследование ассоциации ИЭ с полиморфизмами генов ферментов I и II фаз системы детоксикации и разработка нового способа прогнозирования риска развития ИЭ.
Поставленная задача была достигнута проведением забора венозной крови у пациентов, выделением ДНК, проведением полимеразной цепной реакции, определением полиморфизма гена. Проводят генотипирование по полиморфному локусу 1462V гена CYP1A1 и по полиморфному локусу I105V гена глутатион-S-трансферазы Пи1 GSTP1 у пациентов группы риска и при выявлении носительства сочетания генотипов CYP1A1 14621 и GSTP1 I105V у их носителей прогнозируют 22,6-кратный риска развития инфекционного эндокардита.
В группу риска входят лица с внутривенной наркоманией, врожденными и приобретенными пороками сердца, протезированными клапанами и другими операциями на сердце, коронарных артериях, иммунодефицитными состояниями.
Новизна изобретения
1. Генотипирование по полиморфным локусам 1462V гена цитохрома Р-450 1А1 CYP1A1 и I105V гена глутатион-S-трансферазы Пи1 GSTP1 пациентов группы риска позволяет прогнозировать 22,6-кратный риск развития ИЭ у носителей сочетания генотипов CYP1A114621 и GSTP1 I105V.
2. В группу риска входят лица с внутривенной наркоманией, врожденными и приобретенными пороками сердца, протезированными клапанами и другими операциями на сердце, коронарных артериях, иммунодефицитными состояниями.
В патентной и научной литературе отсутствуют сведения об аналогичном способе определения генетического риска ИЭ.
Совокупность существенных признаков изобретения позволила получить новый технический результат, заключающийся в установлении генетической предрасположенности к ИЭ у пациентов из группы риска, что поможет определить тактику ведения пациентов и индивидуализировать комплекс профилактических и лечебных мероприятий.
Впервые предлагается использовать генотипирование по полиморфным локусам генов ферментов I и II фаз детоксикации CYP1A1 I462V и GSTP1 I105V для выявления максимального генетического риска ИЭ. У носителей сочетания генотипов CYP1A1 I462I и GSTP1 I105V среди пациентов с внутривенной наркоманией, врожденными и приобретенными пороками сердца, протезированными клапанами и другими операциями на сердце, коронарных артериях, иммунодефицитными состояниями выявлен 22,6-кратный риск развития ИЭ. Склонность к ИЭ, основным этиологическим фактором которого являются патогенные бактерии, преимущественно Staphylococcus и Streptococcus, у пациентов группы риска, по-видимому, связана с ослаблением врожденного и адаптивного иммунитета вследствие накопления в организме токсических реактантов в связи с генетически зависимой высокой активностью фермента Р-450 CYP1A1 и сниженной - фермента GSTP1.
Способ осуществляется следующим образом.
Геномную ДНК выделяют из клеток периферической крови с помощью коммерческих реагентов «ДНК-экспресс-кровь-плюс» или «ДНК-экспресс-кровь» (НПФ «Литех», Москва). Для генотипирования используют коммерческие комплекты реагентов для выявления мутаций (полиморфизмов) в геноме человека - «SNP-экспресс» (НПФ Литех, Москва). Генотипирование проводят по локусам I462V (нуклеотидная замена 2455A/G, аминокислотная замена Ile462Val) гена цитохрома Р-450 1А1 CYP1A1 [мутация -4 цитохрома Р450] и I105V (нуклеотидная замена 313A/G, аминокислотная замена Ile 105 Val) гена GSTP1 (мутация 1 Пи-глутатион-S-трансферазы) [НПФ Литех, Москва] с помощью метода аллель-специфической полимеразной реакции. Согласно инструкции к комплектам, с образцом выделенной ДНК осуществляют одновременно две реакции амплификации - с двумя парами аллель-специфичных праймеров, на параллельное выявление аллелей мутантного и нормального типа. Реакционная смесь для ПЦР состоит из 5 мкл исследуемого образца ДНК и 20 мкл рабочей амплификационной смеси, содержащей 0,2 мкл рабочего раствора Taq-полимеразы. Амплификацию проводят в автоматическом термоциклере Терцик («ДНК-Технология», Москва). Программа амплификации, соответственно инструкции, включает следующий температурный режим - 1 цикл при 93 С в течение 1 мин, 35 циклов с этапами денатурации ДНК в течение 10 сек при 93°С, отжига праймеров в течение 10 сек при 64°С и синтеза цепей в течение 20 сек при 72°С, и 1 цикл при 72°С в течение 1 мин. Анализ ПЦР-продуктов проводят после их электрофоретического разделения в 50 мл 3%-агарозного геля на 50×ТАЕ-буфере, в который до застывания вносят 5 мкл 1% раствора бромистого этидия. В каждом геле вырезают два ряда лунок - для детекции аллеля нормального типа и мутантного аллеля. Фрагменты анализируемой ДНК проявляются в виде светящихся полос. Гели анализируют в УФ-трансиллюминаторе ЕСХ-15М (Vilber Lourmat, Франция) с помощью гельдокументирующей видеосистемы GL-2 (Россия) и/или фотографируют при помощи цифрового фотоаппарата Canon PowerShot А590 IS в проходящем ультрафиолетовом свете с длиной волны 310 нм.
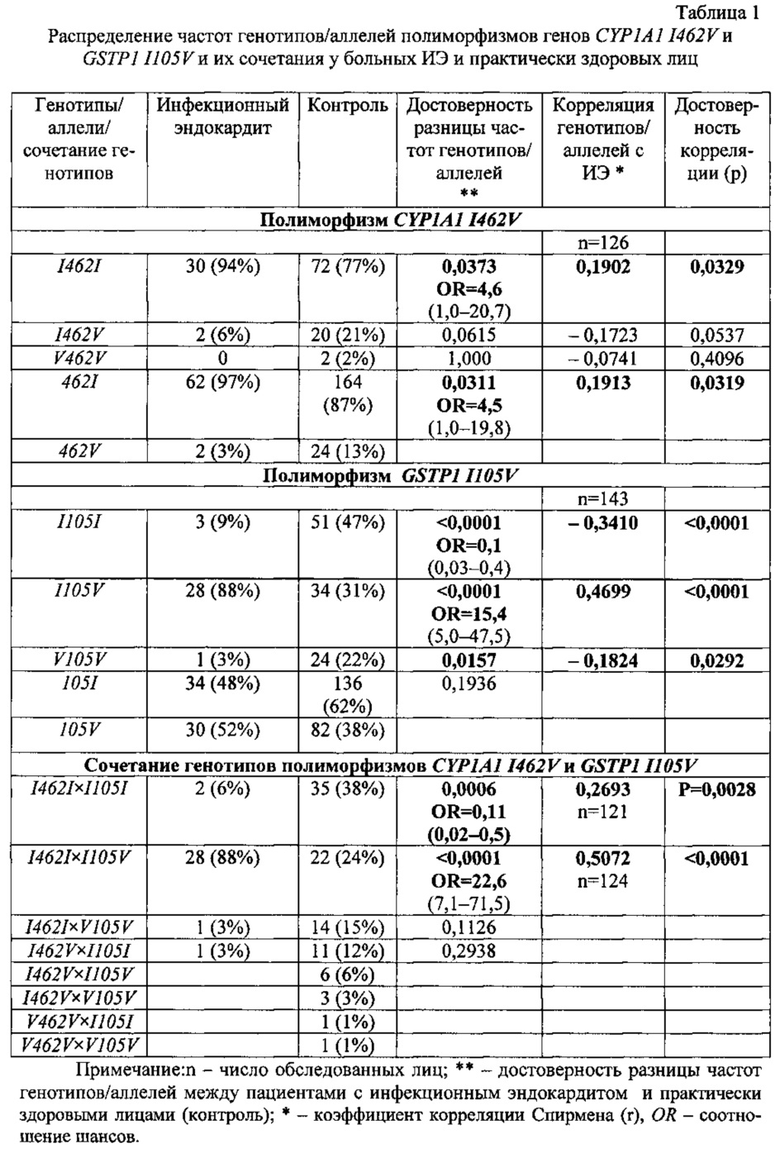
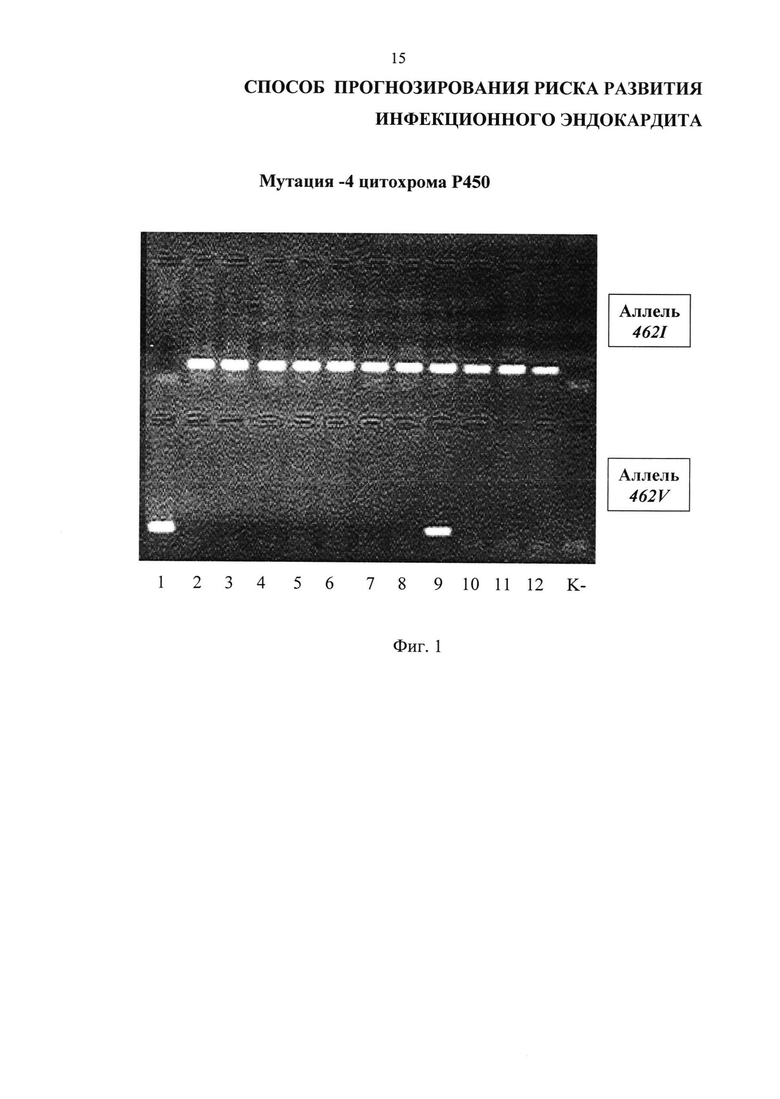
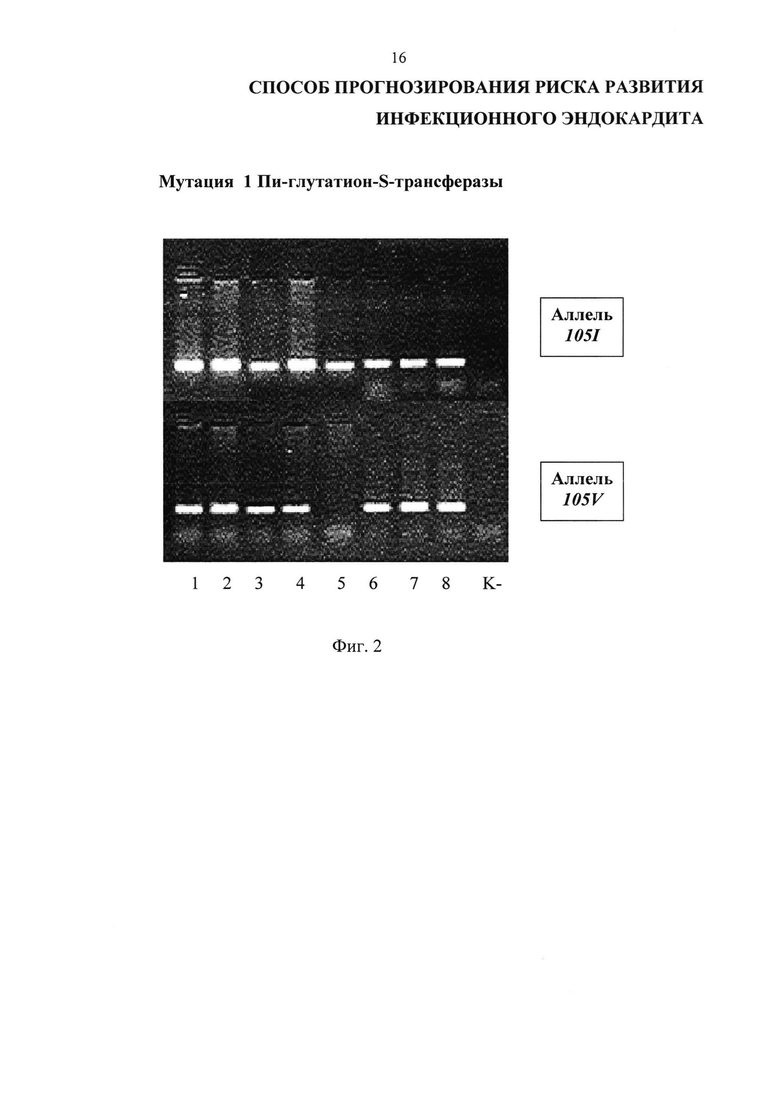
Изобретение иллюстрируется Фиг. 1 и Фиг. 2.
На Фиг. 1 представлены результаты проведения генотипирования 12 человек по полиморфизму I462V гена CYP1A1 в виде электрофореграммы, на которой показаны продукты амплификации исследуемого локуса в виде светящихся полос. К- - отрицательный контроль; дорожки 2-8, 10-12 - гомозиготный нормальный генотип I462I, дорожка 1 - гомозиготный мутантный генотип V462V, дорожка 9 - гетерозиготный генотип I462V.
На Фиг. 2 представлены результаты проведения генотипирования 8 пациентов с инфекционным эндокардитом по полиморфизму I105V гена GSTP1 в виде электрофореграммы, на которой показаны продукты амплификации исследуемого локуса в виде светящихся полос. К- - отрицательный контроль; дорожки 1-4, 6-8 - гетерозиготный генотип I105V, дорожка 5 - гомозиготный генотип I105I.
Всего обследовано 32 пациента (14 женщин и 18 мужчин) в возрасте от 23 до 75 лет, находившихся на стационарном лечении в терапевтических клиниках г. Новокузнецка с диагнозом «инфекционный эндокардит». Большинство пациентов страдали внутривенной наркоманией - 13 человек, у 5 человек обнаружен ревматический порок митрального и аортальных клапанов (МК, АК), проведено протезирование, у 2 - пролапс МК 2-3 степени, у 4 человек - атеросклеротические изменения МК и АК, у 2 - тяжелая вирусная инфекция без отягощенного ранее анамнеза, у 5 человек - хроническая болезнь почек с необходимостью проведения гемодиализа и выраженным иммунодефицитным состоянием, 1-му проведено аортокоронарное шунтирование.
Группу контроля составили 109 практически здоровых лиц. Забор крови и молекулярно-генетические исследования осуществляли на основании информированного согласия обследованных лиц. Математическую обработку результатов исследований проводили с помощью пакетов статистических программ InStatII, Microsoft Excel. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05. Достоверность различий в распределении частот аллелей и генотипов между группами больных и здоровых индивидов оценивали двусторонним точным критерием Фишера. Частота аллеля/генотипа определялась по соотношению количества его носителей к общему количеству носителей тестируемых аллелей/генотипов в исследуемой выборке. Относительный риск заболевания по конкретному признаку вычисляли как соотношение шансов (OR-odds ratio): OR=(a×d)/(b×с), где a и b - количество больных, имеющих и не имеющих мутантный аллель (генотип) соответственно; с и d - количество человек в группе контроля, имеющих и не имеющих мутантный аллель (генотип) соответственно.
Результаты генотипирования по полиморфным локусам I462V гена CYP1A1 и I105V гена GSTP1 пациентов с ИЭ и практически здоровых лиц представлены в таблице 1. Они свидетельствуют, что 94% больных ИЭ являлись носителями гомозиготного варианта I462I полиморфизма CYP1A1 I462V, 2% больных ИЭ - носители гетерозиготного варианта CYP1A1 I462V, гомозигот по мутантному аллелю CYP1A1 462V среди больных лиц не обнаружено. Гомозиготных носителей CYP1A1 I105I в контроле было на 18% меньше. Риск заболевания среди носителей данного генотипа в группе риска оказался высоким. При сравнении частот аллелей этого полиморфизма выявлен сходный риск заболевания у носителей аллеля CYP1A1 462I.
Среди больных лиц наибольшее количество человек оказались носителями гетерозиготного генотипа GSTP1 I105V, и эти лица продемонстрировали высокую предрасположенность к ИЭ с 15-кратным риском его развития в сравнении с контролем. Анализ носительства сочетания исследуемых генотипов позволил обнаружить максимальную генетическую предрасположенность к заболеванию у носителей гомозиготного варианта CYP1A1 I462I и гетерозиготного варианта GSTP1 I105V c 22,6-кратным риском развития ИЭ. Анализ корреляционной связи исследуемых генотипов с ИЭ подтвердил положительную ассоциацию генотипа I462I и аллеля 462I гена CYP1A1 и генотипа I105 V гена GSTP1 с ИЭ. Наиболее сильная связь с ИЭ обнаружена у носителей сочетания генотипов CYP1A1 I462I и GSTP1 I105V.
Таким образом, нами выявлена ассоциация ИЭ с вариантами генов системы детоксикации ксенобиотиков, кодирующими антиоксидантный фермент I фазы детоксикации, цитохром Р-450 1А1, и антиоксидантный фермент II фазы детоксикации, глутатион-S-трансферазу P1. Был определен высокий риск развития ИЭ у носителей гомозиготного варианта I462I гена CYP1A1, у которых присутствие нормального аллеля CYP1A1 462I в обеих хромосомах обусловливает максимальную каталитическую активность фермента, а также у носителей гетерозиготного варианта I105V гена GSTP1, у которых присутствие молекул мутантной формы глутатион-S-трансферазы Р1 приводит к снижению каталитической способности фермента в отношении ряда субстратов. Сочетание данных вариантов в геноме приводит к 22,6-кратному усилению риска заболеть ИЭ в сравнении с контролем.
Таким образом, предложенный способ генотипирования по полиморфным локусам I462V гена CYP1Al и I105V гена GSTP1 позволяет обнаружить очень высокий риск развития инфекционного эндокардита у носителей гомозиготного генотипа I462I гена CYP1A1 при сочетании его с носительством гетерозиготного варианта I105V гена GSTP1 среди лиц с внутривенной наркоманией, врожденными и приобретенными пороками сердца, протезированными клапанами и другими операциями на сердце, коронарных артериях, иммунодефицитными состояниями.
Клинический пример №1. Пациент Р., 36 лет, поступил 12.12.2014 г. в отделение терапии с жалобами на слабость, потливость, одышку при обычной физической нагрузке, боль в грудной клетке, усиливающуюся при глубоком вдохе, кашле, трудноотделяемую гнойную мокроту, повышение температуры тела до 39-40°С, ознобы, боли в мышцах, в суставах. Болен в течение 2 недель, лечился самостоятельно безрезультатно жаропонижающими препаратами, цефтриаксоном. Доставлен бригадой скорой помощи. В анамнезе: гепатит, туберкулез, ВИЧ - отрицает. Прием наркотиков в/в в течение 15 лет (ханка, соли, героин). Курит в течение 15 лет по 1 пачке в сутки. Простудные заболевания 3-4 раза в год. Постоянной работы нет. При осмотре состояние средней степени тяжести, температура тела 38°С, кожа сухая, бледная, отеков нет, пониженного питания. В легких дыхание везикулярное, рассеянные сухие хрипы над всей легочной поверхностью, ЧД 22 в мин. Тоны сердца глухие ритмичные, ЧСС 110 в мин, систолический шум во всех точках, АД 120/80 мм рт. ст. Живот мягкий, безболезненный. Печень +1,5 см из под края реберной дуги. Стул, диурез в норме. При обследовании: AT к ВИЧ, ВГВ, трепонеме - не выявлены. Обнаружены AT к ВГС. Общий анализ крови - Нв 112 г/л, эр. 3,5, лейк. 8,4, п/я 20, лимф.- 13, СОЭ 50 мм/ч. Общий анализ мочи - уд. вес 1012, белок 0,3 г/л, лейк. в большом количестве, эр. -1-2 в п/зр, цилиндры гиалиновые 1-2 в п/зр. Анализ мочи по Нечипоренко: лейк. - 201500, эр. 2500, цилиндры 3000. Б/х ан. крови: сахар 5,7, креатинин 155 (№40-140) мкмоль/л, мочевина 8,0, АЛТ 132, ACT- 66 (повышены), фибриноген 5,25, белок 78,1, билирубин 11,7. Кровь на гемокультуру №3 - отрицательно. УЗИ - спленомегалия, печень +1,5 см из подкрая реберной дуги, размеры в норме. Диффузные изменения в паренхиме почек. ЭХО КГ - умеренно расширены правые полости, на ТК гипоэхогенный очаг вегетаций 13×5 мм, регургитация 2-3 ст, незначительный перикардиальный выпот, признаков легочной гипертензии не выявлено, ФВ 67%. ЭКГ - синусовая тахикардия 117 в мин. Рентгенография органов грудной клетки - двусторонняя септическая пневмония с распадом. Результаты генотипирования по полиморфным локусам I462V гена CYP1A1 и I105V гена GSTP1: выявлено сочетание генотипов CYP1A1 I462I и GSTP1 I105V, указывающее на 22,6-кратный риск заболевания ИЭ.
Дз: Острый инфекционный эндокардит с поражением трехстворчатого клапана, первичный. Недостаточность ТК. ХСН 1-2а ст. Двусторонняя септическая пневмония, с распадом, тяжелое, затяжное течение. Наркомания. Хр. вирусный гепатит С.
Проведено лечение: цефуроксим, ванкомицин, фраксипарин, гентамицин. Выписан с улучшением на дальнейшее амбулаторное лечение.
Клинический пример №2. Больная М., 26 лет. Госпитализирована в отделение пульмонологии с жалобами на сухой кашель, одышку при незначительной физической нагрузке, озноб, повышение температуры тела до 39°С, потливость по ночам, кашель с небольшим количеством гнойной мокроты. Больна в течение 2-3 недель, накануне перенесла ОРВИ, не обращалась за медицинской помощью, лечение симптоматическое, повышение температуры тела - в дебют заболевания в течение 3-4 дней. На фоне лечения - улучшение состояния, катаральные явления купированы, температура вернулась к норме. Сохранялась выраженная слабость, одышка при умеренной физической нагрузке. В течение последних 2 недель появились ознобы, вновь отмечалось повышение температуры до 39°С без эффекта от жаропонижающих препаратов, нарастала слабость, появился кашель, потливость по ночам. В анамнезе нередкие простудные заболевания до 4-6 раз в год, частое использование антибактериальных препаратов без назначения врача. В 2009 г. выявлен порок сердца, документов с результатами обследования нет, не наблюдалась. Прием наркотиков отрицает. Работа связана с переохлаждением (работала на хладокомбинате фасовщицей). Питание однообразное, мясо, фрукты - редко. Объективно: состояние средней степени тяжести за счет интоксикационного синдрома, температура тела - 38,5°С. Носовое дыхание не затруднено. Кожа бледная, влажная, чистая, отеков нет. В легких дыхание жесткое, ослаблено в подлопаточной области справа, хрипов нет, ЧД 18 в минуту, тоны сердца глухие, ритмичные ЧСС 110 в минуту, аускультативно - грубый систолический шум во всех точках. При обследовании: общий анализ крови -Нв. 91 г/л, эр. 3,4, л. 15,0, п/я. 14, лимф. 10,5, юные -1, тромбоциты - 415, СОЭ 52 мм/ч. Общий анализ мочи - уд. вес 1005, белок 2,5 гр/л, эр. 40-50 в п/зр., л. - 2-6 в п/зр. Б/х ан. крови: АЛТ 2,26, ACT- 3,0, мочевина 10,2, креатинин 106, белок 59,6, сахар 5,0, прокальцитонин 6,1, СРБ 460,3 мг/л. Д-димер 2350, AT к ВГВ, ВГС, ВИЧ не выявлены. ЭКГ - синусовая тахикардия, нарушение процессов реполяризации в задней стенке левого желудочка. Рентгенография органов грудной клетки - полисигментарная пневмония справа с распадом. ЭХО-КГ - признаки ревматического поражения митрального клапана, стеноз створок МК. Smo 1,62 см2, регургитация 1-2 ст. Аортальный клапан - стеноз не выявлен, кальциноз и фиброз створок, регургитация 2 степени. Уплотнены створки трикуспидального клапана и клапана легочной артерии, регургитация ТК-2 ст. В правом предсердии по в/стенке дополнительное округлое образование, подвижное, средней эхогенности 2,7×1,75 см. Дилятация полостей обоих предсердий, больше левого, ФВ 47,8%, пародоксальное движение МЖП. По УЗИ - гепатоспленомегалия. Диффузное изменение паренхимы почек. В динамике - появилась свободная жидкость в брюшной полости. По результатам посева крови на стерильность выявлены Staphylococcus aureus. В последующих посевах появилась Pseudo-monas stutseri. Учитывая тяжесть состояния, проводимую инфузионную, антибактериальную терапию, больной был поставлен подключичный катетер. Состояние ухудшилось: присоединился тромбоз подколенной артерии справа, рецидивировали ТЭЛА, нарастала сердечная, дыхательная недостаточность. Проведена ампутация правой нижней конечности до средней трети бедра. Результаты генотипирования по полиморфным локусам I462V гена CYP1A1 и I105V гена GSTP1: выявлено сочетание генотипов CYP1A1 I462I и GSTP1 I105V, указывающее на 22,6-кратный риск заболевания ИЭ.
Дз: Вторичный инфекционный эндокардит. Хр. ревматическая болезнь сердца: комбинированный митральный порок с преобладанием стеноза. Недостаточность АК, ТК, ХСН 2Б. ФК III. Состояние после ампутации правой нижней конечности до ср./ трети бедра по поводу острого артериального тромбоза. Полисегментарная пневмония справа с распадом. Рецидивирующие ТЭЛА.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ИНФЕКЦИОННОГО ЭНДОКАРДИТА | 2015 |
|
RU2587753C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНЕТИЧЕСКОЙ ПРЕДРАСПОЛОЖЕННОСТИ К ЗАБОЛЕВАНИЮ ИНФЕКЦИОННЫМ ЭНДОКАРДИТОМ | 2016 |
|
RU2618459C1 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ ОСТРОГО ИНФЕКЦИОННОГО ЭНДОКАРДИТА | 2017 |
|
RU2651769C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА ИНФЕКЦИОННОГО ЭНДОКАРДИТА | 2018 |
|
RU2677469C1 |
| Способ прогнозирования врожденной расщелины губы и нёба у ребёнка при планировании беременности в регионе с экотоксикантами с применением генетических маркеров | 2021 |
|
RU2760786C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ РОЖИ | 2018 |
|
RU2683314C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ТЯЖЕЛОЙ ФОРМЫ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ С ПОЧЕЧНЫМ СИНДРОМОМ | 2009 |
|
RU2406450C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ТИМОЛОЛОМ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ | 2018 |
|
RU2694744C1 |
| СПОСОБ РАННЕГО ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ У ПАЦИЕНТОВ С САХАРНЫМ ДИАБЕТОМ 2 ТИПА | 2022 |
|
RU2812643C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНЕТИЧЕСКОЙ ПРЕДРАСПОЛОЖЕННОСТИ К РАЗВИТИЮ ТУБЕРКУЛЕЗА С МНОЖЕСТВЕННОЙ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТЬЮ MYCOBACTERIUM TUBERCULOSIS ПРИ ВИЧ-ИНФЕКЦИИ | 2020 |
|
RU2750715C1 |
Изобретение относится к медицине, а именно к терапии и хирургии, и может быть использовано для прогнозирования генетической предрасположенности или повышенного риска развития инфекционного эндокардита (ИЭ) у пациентов из группы риска. Сущность способа: проводят генотипирование по полиморфному локусу I462V гена CYP1A1 и по полиморфному локусу I105V гена глутатион-S-трансферазы Пи1 GSTP1 у пациентов группы риска, при выявлении носительства сочетания генотипов CYP1A1 I462I и GSTP1 I105V у их носителей прогнозируют 22,6-кратный риск развития инфекционного эндокардита. В группу риска входят лица с внутривенной наркоманией, врожденными и приобретенными пороками сердца, протезированными клапанами и другими операциями на сердце, коронарных артериях, иммунодефицитными состояниями. Способ позволяет установить генетическую предрасположенность к ИЭ у пациентов из группы риска, помогает определить тактику ведения пациентов и индивидуализировать комплекс профилактических и лечебных мероприятий. 1 з.п. ф-лы, 2 ил., 1 табл.
1. Способ прогнозирования риска развития инфекционного эндокардита, включающий забор венозной крови, выделение ДНК, проведение полимеразной цепной реакции, определение полиморфизма гена, отличающийся тем, что проводят генотипирование по полиморфному локусу I462V гена цитохрома Р450 1А1 CYP1A1 и по полиморфному локусу I105V гена глутатион-S-трансферазы Пи1 GSTP1 пациентов группы риска и при выявлении сочетания генотипов CYP1A1 I462I и GSTP1 I105V у их носителей прогнозируют 22,6-кратный риск развития инфекционного эндокардита.
2. Способ по п. 1, отличающийся тем, что в группу риска входят лица с внутривенной наркоманией, врожденными и приобретенными пороками сердца, протезированными клапанами и другими операциями на сердце, коронарных артериях, иммунодефицитными состояниями.
| Bustamante J., Tamayo Ε., Florez S., Telleria J.J., Bustamante Ε., Lopez J., San Roman J.A., Alvarez F.J | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Rev | |||
| Esp | |||
| Cardiol | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| US 2011053170 A1, 03.03.2011 | |||
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ОСЛОЖНЕННОГО СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА У ПАЦИЕНТОВ С ИНФЕКЦИОННЫМ ЭНДОКАРДИТОМ | 2013 |
|
RU2520753C1 |
| Мильченко М | |||
| В | |||
| Особенности инфекционного эндокардита у больных, направленных на хирургическое лечение; вопросы ранней диагностики, прогнозирования и профилактики протезного эндокардита | |||
| Автореф | |||
| дисс | |||
| к | |||
| м | |||
| н | |||
| Новосибирск, 2009 | |||
| Juan Bustamante et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| J | |||
| Bustamante et al | |||
| / Rev Esp Cardiol | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2017-04-19—Публикация
2015-12-03—Подача