Данное изобретение относится к способу получения продуктов расщепления углеводов, в частности сахаров, таких как пентозы и гексозы, из лигноцеллюлозных материалов. Далее, изобретение относится к способу получения спирта из сахаров. Для целей данного описания и данной заявки понятие «сахар» включает также понятие «олигомеры сахара».
В связи с дефицитом сырой нефти и обсуждением возможности применения зерна как источника энергии, возобновляемое сырье лигноцеллюлоза (солома, древесина, бумажные отходы и т.д.) приобретает большое значение как исходный материал для горючего или химических продуктов. Преобразование лигноцеллюлозы может происходить двумя основными различными путями: 1) «Thermochemical Platform» (термохимическая платформа), в котором лигноцеллюлозу сначала газифицируют и из синтез-газа синтезируют желаемые продукты, и 2) «Sugar Platform» (сахарная платформа), в котором главный интерес для использования представляет связанный в полимерах целлюлозы и гемицеллюлозы сахар, в то время как лигнин преимущественно используется для энергетических целей. Данное изобретение относится ко второму пути.
В противоположность крахмалам сахар лигноцеллюлозы находится в тесно связанных полимерных кристаллических структурах целлюлозы и гемицеллюлозы, которые дополнительно защищены оболочкой лигнина, вследствие чего получается в высшей степени плотный комплекс. Самым очевидным способом получения сахаров из лигноцеллюлозы было бы непосредственное использование целлюлаз и гемицеллюлаз. Однако данный способ является затруднительным для соломы или древесины в качестве исходного сырья из-за плотности вышеупомянутого комплекса. Из-за высокой молекулярной массы ферменты не способны проникать через узкие поры лигноцеллюлозы. Это означает, что в первую очередь необходимо принять меры для повышения пористости лигноцеллюлозы, чтобы вследствие этого сделать возможным последующее ферментное превращение в сахар.
Эту первую стадию обозначают как «Pretreatment» (предварительная обработка, подготовка). Данная подготовка всегда является очень дорогостоящей, так, например, при получении «second generation biofuels» (вторично переработанное биотопливо) на подготовку расходуются до 1/3 производственных затрат, что отрицательно влияет на рентабельность. Целью применяемых способов является либо перевод исходной гемицеллюлозы в жидкое состояние (например, steam explosion, dilute acid-pretreatment) (паровой взрыв, предварительная обработка разбавленными кислотами) или повышение пористости путем перевода в жидкое состояние лигнина (например, lime-, ammonia-pretreatment) (обработка известью, амииаком).
Субстрат из обработанной лигноцеллюлозы может подвергаться дальнейшей ферментной обработке для получения сахаров или их олигомеров, причем вид предварительной обработки может сильно влиять на ферментативную активность и выход продукта. При высокой температуре реакции часто образуются токсичные продукты разложения (например фурфурол), которые в случае непосредственно следующего за этим этанольного брожения могут препятствовать дрожжам; см. например, Chandra et al., Advances in Biochemical Engineering/Biotechnology, 108:67, 2007; Mansfield et al., Biotechnol. Prog. 15:804, 1999.
Данные способы имеют существенный недостаток, заключающийся в том, что они являются энергозатратными и преимущественно протекают при температурах почти 200°C.
Технологическое усовершенствование в данной области, например с помощью разработки низкотемпературного способа, (то есть протекающего при температуре до 100°C), означало бы решающий прогресс в любом применении лигноцеллюлозы в качестве сырья. Это является задачей данного изобретения.
Из EP 1025305 B1 известен химический способ деполимеризации лигнина (Cu-система). Данный способ основывается на каталитическом действии образующей комплексы меди в сочетании с пероксидом водорода или органическими гидропероксидами, и делает возможным расщеплять лигнин окислением при температуре ниже 100°C. Применяемые при этом комплексообразователи представляют собой производные пиридина. Для синтетических моделей лигнина было подтверждено, что при применении H2O2 в качестве окислителя происходит расщепление простых эфирных связей молекул лигнина, вследствие чего полимеры лигнина распадаются на олигомеры. При применении Cu-систем с избытком органических гидропероксидов возможно делигнифицировать древесину. Основанная на H2O2 система являлась технически лучше осуществимой, испытывалась как отбеливающая добавка при перекисной отбелке крафтцеллюлозы и приводила к улучшению делигнификации и повышению степени белизны.
Далее, из «Oxidation of wood and ist components in water-organic media», Chupka et al., Proceedings: Seventh International Symposium on wood and pulping chemistry, Vol. 3, 373-382, Beijing P.R. China, 25.-28. May 1993, известно, что эффективность щелочного катализа окисления древесины и лигнина значительно возрастает, если к водной реакционной среде добавляли органический растворитель, например DMSO, ацетон, этанол. Далее авторы указывают, что при значениях pH больше 11 происходил резкий рост окисления древесины и лигнина.
Из WO 01/059204 известен способ получения целлюлозы, в котором исходный материал подвергается предварительной обработке, причем данный материал обрабатывают с буферным раствором и катализатором делигнификации (переходный металл). Делигнификацию проводят в присутствии кислорода, пероксида водорода или озона.
В противоположность этому, согласно способу по изобретению, получение продуктов расщепления углеводов, в частности сахаров, отличается тем, что:
- лигноцеллюлозные материалы обрабатывают водными растворами, которые содержат спирт, в частности C1-4-спирт или фенол, и имеют значение рН от 11,0 до 14,0 для того, чтобы расщепить лигноцеллюлозу и отделить продукты расщепления от материала, при этом получают материал, насыщенный целлюлозой и гемицеллюлозой; и
- полученный, насыщенный целлюлозой и гемицеллюлозой материал обрабатывают расщепляющим углеводы ферментом для того, чтобы получить продукты расщепления углеводов.
В качестве спиртов пригодны алифатические или циклоалифатические, одно- или многоатомные спирты или фенолы, как например, C1-6 спирты, в частности C1-4 спирты, такие как метанол, этанол, пропанол и бутанол, включая их изомеры; гликоли (этандиол, пропан-, бутан-, пентан-, гександиолы), глицерин, пропенол, бутенол, циклопентанол, циклогексанол, бензиловый спирт; или фенолы, такие как фенолы, крезолы, катехолы, нафтолы, а также аминоспирты, такие как этаноламин, метаноламин и гексаноламин. Предпочтительными являются C1-4 спирты. Для целей данной заявки фенолы включены в видовое понятие «спирты».
Кроме того спиртовые растворы экстрактов лигнина обнаруживают выгодные преимущества в последующей переработке продуктов расщепления лигнина или ксилана.
Согласно способу по изобретению спирт находится в водном растворе предпочтительно в количестве от 10 до 70 об.%, например от 20 до 50 об.%, предпочтительно от 30 до 40 об.%.
Согласно способу по изобретению лигноцеллюлозные материалы находятся в водном растворе предпочтительно в концентрации от 3 до 40 масс.%, например, от 5 до 40 масс.%, в частности от 5 до 20% масс.%.
Предпочтительно расщепление лигноцеллюлозы происходит при температуре ниже 100°C, например, ниже 80°C или ниже 60°C.
Значение рН можно устанавливать основанием, предпочтительно неорганическим основанием, например раствором едкого натра.
Данное изобретение основывается на данных, что лигноцеллюлозные материалы, обработанные основным водным раствором, который содержит спирт, в частности C1-4 спирт или фенол и имеет значение рН от 11,0 до 14,0, могут быть ферментативно переработаны с более высоким выходом продуктов расщепления углеводов, таких как сахаров, а также других видов делигнифицированных материалов, в частности без добавления спиртов.
В качестве продуктов расщепления углеводов предпочтительно образуются сахара, главным образом пентоза и гексоза. Предпочтительными сахарами являются также ксилоза и глюкоза.
Предпочтительный вариант осуществления способа по изобретению отличается тем, что материалы, насыщенные целлюлозой и гемицеллюлозой обрабатывают ксиланазой и целлюлазой для того, чтобы получать сахар.
В качестве лигноцеллюлозных материалов предпочтительно применяют солому, энергетические злаки, такие как просо прутьевидное, мискантус, абака, сизаль, багасса, или нетипичные лигноцеллюлозные материалы, такие как оболочка зерна (лузга), например рисовая лузга; предпочтительно используют солому, энергетические злаки, багассу или лузгу, особенно предпочтительно применяют солому или багассу, например, солому. Солома имеет сильно гидрофобную поверхность, так что смачивание водными растворами представляет проблему. Обнаружили, что с помощью использования спирта стало возможным, без применения давления вводить реакционный раствор в поры материала и имеющийся воздух замещать реакционным раствором. В дальнейшем оказалось, что спирт ускоряет экстракцию продуктов расщепления из соломы и способствует тому, чтобы продукты расщепления лигнина оставались в растворе. В дальнейшем оказалось, что в противоположность этому из-за спирта растворимость гемицеллюлозы и продуктов ее расщепления снижается и, таким образом, гемицеллюлоза остается в материале.
Благодаря выдавливанию жидкой фазы из субстрата, согласно способу расщепления, концентрация субстрата повышается, вследствие чего требуется меньшее количество ферментов для ферментативного гидролиза или для другой последующей ферментативной переработки.
При производстве спирта стоимость ферментов является решающим фактором затрат. Наличие спирта приводит к тому, что растворимость в щелочной области в течение реакции высвобожденных дополнительно к лигнину гемицеллюлозы и ее продуктов расщепления сильно снижается и они остаются связанными с субстратом. Преимуществом для процесса является высокая избирательность извлечения лигнина, в случае отделения экстракционного раствора от твердых веществ концентрация гемицеллюлозы и продуктов ее расщепления в экстракционном растворе слишком низкая, так как гемицеллюлоза остается в твердом веществе и вследствие этого сохраняется для ферментативного гидролиза и получения сахара.
Спиртовой раствор экстракта лигнина предоставляет хорошие возможности для дальнейшей переработки лигнина и получения продуктов из лигнина.
В дальнейшем оказалось, что разложение гемицеллюлозы в значительной мере предотвращается при применении спирта, в частности, С1-4 спирта или фенола, в случае щелочной подготовки при менее чем 100°C, так что почти вся гемицеллюлоза остается для последующего ферментативного расщепления и преобразования ксилозы в более ценные продукты и не разлагается частично при подготовке, как в других способах, и выделяется как смесь лигнин/сахар.
Благодаря подготовке к проведению делигнификации пористость стенок клеток лигноцеллюлозных материалов повышается, например, в случае соломы пористость повышается настолько высоко, что почти вся ксилоза становится доступной для ксиланазы, приблизительно 100% ксиланов гидролизуется и вся ксилоза может быть получена. Этот факт делает данный способ согласно данному изобретению особенно пригодным для того, чтобы производить более ценные продукты в сочетании с ферментативным преобразованием ксилозы. Ферментативное преобразование может при этом происходить либо непосредственно в смеси раствора ксилозы и твердых веществ, либо в отделенном от твердых веществ растворе ксилозы.
Согласно способу по изобретению в последующем за ферментативным гидролизом ксиланов и преобразованием ксилозы в ксилитол производством спирта из оставшихся твердых веществ, стоимость ферментов является решающим фактором затрат. Частично затраты следуют из неспецифических связей ферментов с лингнином, см., например, Chandra et al., 2007. Частичное удаление лигнина сокращает эту потерю активности и мало отражается на затратах.
Преимуществом следующего ферментативного способа является, например то, что из высокой избирательности извлечения лигнина при почти полном сохранении полимеров сахара следует очень низкая концентрация гемицеллюлозы и продуктов ее расщепления в экстракционном растворе, гемицеллюлоза остается в твердых веществах и вследствие этого сохраняется для ферментативного гидролиза и получения сахара, а также для их последующего преобразования. Исходя из этого получают согласно способу по изобретению максимальный процент использования материала и, например, в сочетании с применением ксилозодегидрогеназы, высокую рентабельность описанного процесса.
Проведение процесса преобразования ксилозы в ксилитол может происходить после ферментативного высвобождения ксилозы непосредственно в смеси твердое вещество/жидкость, которые получаются согласно способу по изобретению, что повышает рентабельность общего процесса.
В случае преобразования с получением ксилитола может быть использован оставшийся спирт из процесса подготовки, после отжима твердых веществ, непосредственно как субстрат для алкогольдегидрогеназы для восстановления NAD в NADH. Если процесс рассчитан таким образом, что для этого расходуются остающиеся в реакционной смеси остатки спирта из стадии подготовки (частично), удаление лишнего спирта из раствора продуктов (частично) более ненужно и вследствие этого увеличивается эффективность общего процесса.
В случае преобразования продуктов расщепления лигнина спирт действует как Radikal-Scavenger (акцептор радикалов) и растворитель для продуктов расщепления, полученных в ходе ферментативной, биомиметической или химической деполимеризации высокомолекулярных продуктов расщепления лигнина в низкомолекулярные.
Незначительное содержание гемицеллюлозы и продуктов ее расщепления в экстракте и повышенная растворимость лигнина, повышают нормы пропускной способности при отделении твердых веществ от продуктов преобразования, а также при их фильтрации.
Согласно способу по изобретению можно, например, разделять три основных компонента соломы, а именно глюкозы, ксилозы, а также лигнина в очень бедных веществом массовых потоках и затем преобразовывать их в ценные продукты, такие как ксилитол, и выполнять таким образом требования идеального способа биопереработки.
Следующее преимущество способа по изобретению сравнительно с другими способами подготовки, которые главным образом протекают в температурном диапазоне от 150°C до 200°C, состоит в том, что температура может оставаться ниже 100°C. Низкие энергозатраты позволяют использовать полученный при подготовке лигнин не в качестве источника энергии для процесса подготовки, а как ценный материал.
После обработки водным раствором спирта, в частности C1-4 спирта или фенола, и содержащего H2O2, согласно способу по изобретению, раствор, содержащий лигнин отделяют и подготовленное твердое вещество предпочтительно обрабатывают ксиланазой, например, 6-72 часов при 30-90°C, и затем отделяют жидкую фазу от твердого вещества, после чего жидкую фазу предпочтительно преобразуют, с образованием побочных продуктов, например, ксилитола.
После отделения жидкой фазы остающееся твердое вещество предпочтительно обрабатывают целлюлазой, причем с помощью последующей ферментации твердого вещества/раствора глюкозы можно получать этанол, бутанол или другие продукты ферментации; или оставшееся твердое вещество подвергают термическому или термохимическому преобразованию и отделяют полученные продукты, такие как компоненты топлива, присадки к топливу и/или другие химические продукты, как например фенолы; или оставшееся твердое вещество подвергают микробиологическому преобразованию с помощью бактерий, дрожжей или грибов; или оставшееся твердое вещество подвергают следующей стадии делигнификации с целью получения целлюлозных волокнистых материалов.
Оставшееся твердое топливо можно ферментировать в устройстве для получения биогаза и перерабатывать в биогаз.
Одним из самых экономически интересных побочных продуктов ксилозы является ксилитол.
Основной источник для получения ксилозы представляет собой варочный щелок из целлюлозного производства, который содержит множество продуктов расщепления, преимущественно лигнина и гемицеллюлозы, вследствие чего ксилозу должны получать в ходе дорогостоящих стадий отделения и очистки. Так, например, в работе H. Harms «Willkommen in der natürlichen Welt von Lenzing weltweit führend in der Cellulosefaser Technologie», Herbsttagung der österreichischen Papierindustrie, Frantschach (15. 11. 2007) описано получение ксилозы из концентрированного щелока способом гель-фильтрации, технически очень сложным способом, который обычно не находит применения для массовых продуктов. Полученную таким образом ксилозу превращают затем в ксилитол.
В следующем аспекте способа по изобретению полученная ксилоза свободно с помощью ферментации превращается в ксилитол преобразованием с ксилозоредуктазой, например, с ксилозодегидрогеназой, например из Candida tenuis, причем при необходимости к раствору ксилозы добавляют ксилозоредуктазу косубстрат для регенерации кофактора, алкогольдегидрогеназу, NAD(P)H; при этом полученный ксилитол отделяют фильтрацией от продуктов расщепления лигнина.
Следующими примером 1 и сравнительным примером 1A подтверждается влияние предварительной обработки в присутствие спирта на выход восстановленного сахара после ферментативного гидролиза.
Пример 1
Предварительная обработка соломы пшеницы.
Солому пшеницы измельчали до частиц размером около 2 см. 5 г измельченной соломы пшеницы суспендировали в реакционном сосуде объемом 500 мл в 200 мл раствора, состоящего из 49,5% воды, 50% этанола и 0,5% пероксида водорода. Суспензию нагревали на водяной бане до 50°C, термостатировали и устанавливали значение pH суспензии водным раствором NaOH на конечное значение pH, равное 12. Смесь непрерывно перемешивали на магнитной мешалке со скоростью 200 оборотов в минуту, при 60°C, 24 часа. Затем твердую часть фильтровали и промывали 1 л дистиллированной воды.
Для ферментативного гидролиза параллельно в каждых 100 мг подготовленного субстрата устанавливали рН с помощью 9,8 мл 50 мМ буферного раствора ацетата натрия на значение 4,8 и смешивали с 200 мкл суспензии Accellerase 1000 (www.genencor.com). Accellerase представляет собой смесь ферментов из целлюлазы и гемицеллюлазы. Ферментативный гидролиз проводили при 50°С в вибро-водяной бане. Высвобожденные после 48 часов растворимые мономеры из гексозы и пентозы определяли в виде восстановленного сахара ДНК методом (Miller et al., Analytical Chemistry 31(3):426, 1959) в 1 мл жидкой фракции, относили к массе взвешенного, предварительно обработанного субстрата и переводили в проценты от максимального теоретического выхода продукта.
Теоретический максимальный выход восстановленного сахара определяли отдельно, и он составил 705 мг+/-5% на г неподготовленной соломы.
За один эксперимент проводили 5 параллельных опытов. Выход восстановленного сахара составил 99%+/-4%.
Сравнительный пример 1А
Повторяли пример 1, только без добавления спирта. Выход восстановленного сахара составил лишь 64%+/-3%.
Пример 2
Предварительная обработка соломы пшеницы.
Солому пшеницы измельчали до частиц размером около 2 см. 2,5 г измельченной соломы пшеницы суспендировали в реакционном сосуде объемом 500 мл в 200 мл раствора, состоящего из 50% воды, 50% изопропанола. Суспензию нагревали на водяной бане до 50°С, термостатировали и устанавливали значение рН суспензии водным раствором NaOH на конечное значение рН, равное 13 (или 14). Смесь непрерывно перемешивали на магнитной мешалке со скоростью 200 оборотов в минуту, при 60°C, 24 часа. Затем твердую часть фильтровали и промывали 1 л дистиллированной воды.
Для ферментативного гидролиза параллельно в каждых 100 мг подготовленного субстрата устанавливали рН с помощью 9,8 мл 50 мМ буферного раствора ацетата натрия на значение 4,8 и смешивали с 200 мкл суспензии Accellerase 1000 (www.genencor.com). Accellerase представляет собой смесь ферментов из целлюлазы и гемицеллюлазы. Ферментативный гидролиз проводили при 50°C в вибро-водяной бане. Высвобожденные после 48 часов растворимые мономеры из гексозы и пентозы определяли в виде восстановленного сахара ДНК методом в 1 мл жидкой фракции, относили к массе взвешенного, предварительно обработанного субстрата и переводили в проценты от максимального теоретического выхода продукта.
Теоретический максимальный выход восстановленного сахара определяли отдельно, и он составил 705 мг+/-5% на г неподготовленной соломы.
За один эксперимент проводили 5 параллельных опытов. Выход восстановленного сахара составил 97%+/-4%.
Пример 3
Производили ферментативный ксилитол из раствора ксилозы, которая была получена из соломы согласно способу, описанному в примере 2. В качестве косубстрата применяли изопропанол.
Реакционный раствор содержал 5 мг/мл ксолозы.
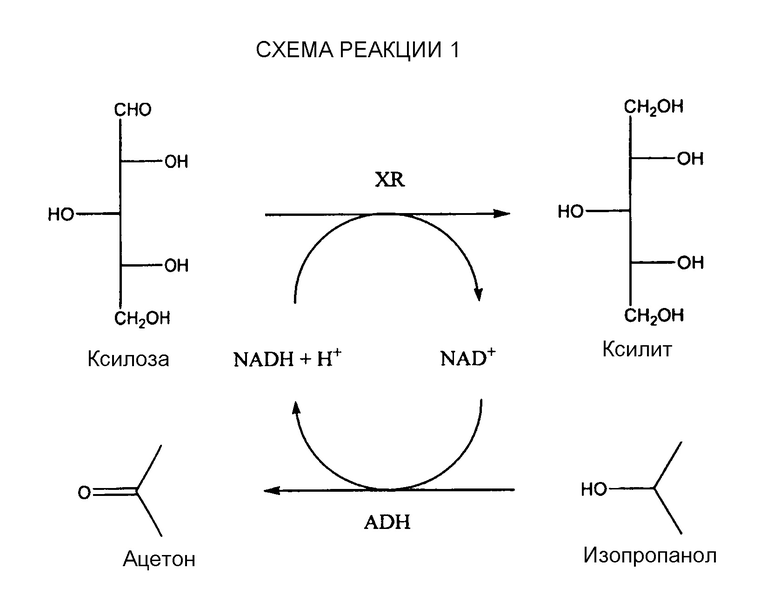
Ксилозоредуктаза (XR) из Candida tenuis восстанавливает ксилозу до ксилитола. Данная XR нуждается в коферменте NADH (никотинамидадениндинуклеотид восстановленный), который при реакции окисляется до кофермента NAD+. Восстановление окисленного кофактора происходит с помощью параллельного действия алкогольдегидрогеназы (ADH: связанная регенерация ферментов). В качестве косубстрата применяли изопропанол. Изопропанол и NAD+ с помощью ADH превращаются в NADH и ацетон, как показано на схеме реакции 1:
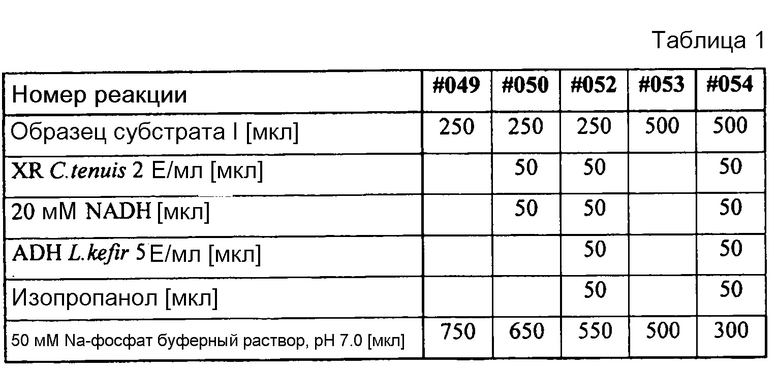
В таблице 1 представлены реакционные соотношения в 5 различных опытах № 049, № 050, № 051, № 052, № 053 и № 054:
Общий объем: 1 мл
Температура: 26±2°C
Магнитная мешалка: 200 оборотов в минуту
Продолжительность: 15 часов.
Для деактивации ферментов все пробы нагревали 15 минут до 95°C и центрифугировались для подготовки для последующего анализа HPLC (высокопроизводительная жидкостная хроматография).
Анализ HPLC:
Колонна SUGAR SP0810+предварительная колонна SUGAR SP-G
Детектор: детектор показателя преломления
Элюент: деионизованная H2O
Поток: 0,75 мл/мин
Количество образца: 10 мкл
HPLC точность количественного выражения: ±10%
Время удерживания:
Ксилоза: 13,97 мин
Ксилитол: 37,73 мин
Изопропанол: 16,69 мин
Ацетон: 16,54 мин
Результаты:
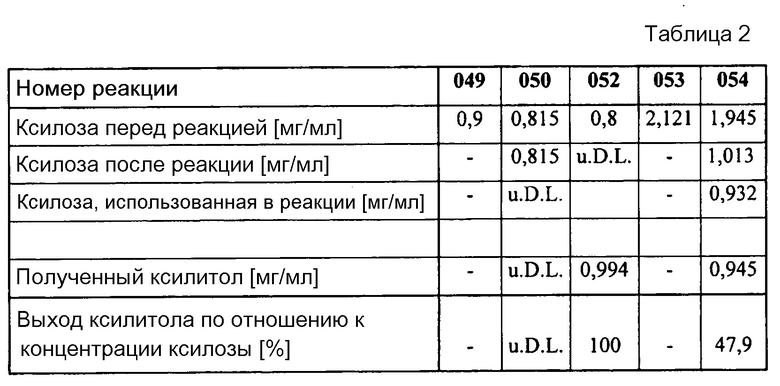
Концентрацию субстрата образца №049 определяли с помощью HPLC и она составила 0,9 мг/мл.
Реакционная смесь №050 содержала только ксилозоредуктазу (0,1 Е/мл) и NADH (1 мМ). После 15 часов продолжения реакции было израсходовано 0,085 мг ксилозы. Концентрация ксилитола находилась ниже порога определения.
Реакция №052 сравнима с реакцией №050, однако с тем отличием, что в данном случае применяли систему регенерации. Вследствие чего происходило полное преобразование ксилозы. Используемые концентрации: XR (0,1 Е/мл), NADH (1 мМ), ADH (0,25 Е/мл) и изопропанол (5%).
Концентрация ксилозы в образце №053 была определена как 2,121 мг/мл, что соответствует ожидаемой концентрации ксилозы.
Реакция №054 сравнима с реакцией №052, однако начальная концентрация ксилозы была в два раза больше (50% субстрата в реакции). Концентрацию полученного ксилитола определили как 0,945 мг ксилитола. Используемые концентрации: XR (0,1 Е/мл), NADH (1 мМ), ADH (0,25 Е/мл) и изопропанол (5%).
В таблице 2 представлены общие результаты реакций основанные на данных измерений HPLC (использованная ксилоза и полученный ксилитол; u.D.L. означает «ниже порога определения»):
Пример 4
Ферментативный ксилитол получали из раствора ксилозы, которая была получена из соломы согласно способу, описанному в примере 2. В качестве косубстрата использовали этанол.
Объем раствора субстрата (сравнительный пример 2) с помощью ротационного испарителя уменьшили до 50% для того, чтобы повысить концентрацию ксилозы (~10 мг/мл ксилозы).
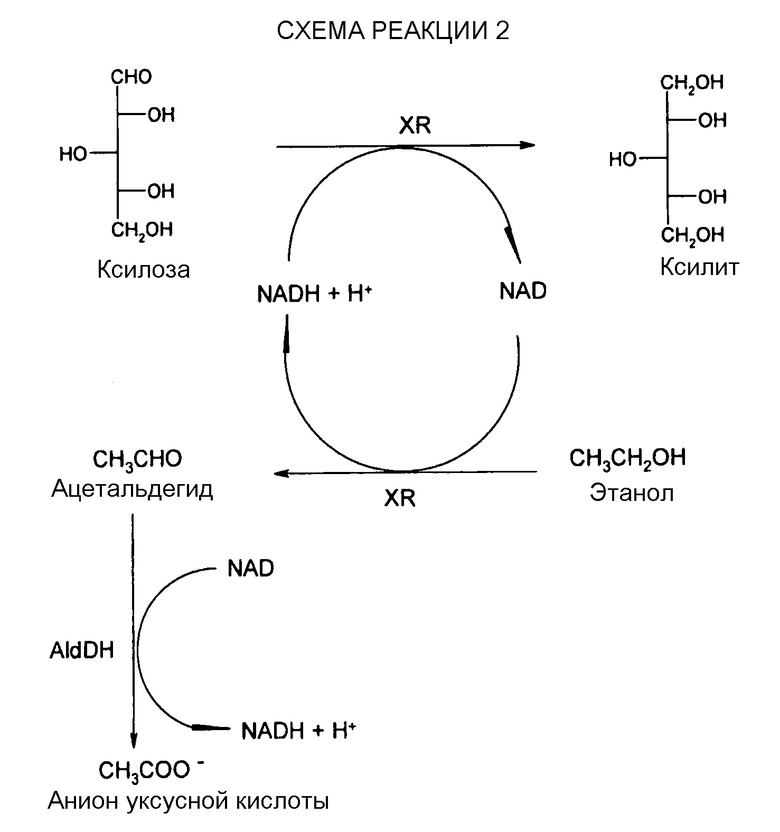
Восстановление окисленного кофактора происходило с помощью действия добавленной ксилозоредуктазы (XR) из Candida tenius и дополнительно действием добавленной альдегидодегидрогеназы из Saccharomyces cerevisiae (Sigma-Aldrich: Katalognummer A6338; (EC) Number: 1.2.1.5; CAS Number: 9028-88-0). При этом речь идет как об объединенных субстратах, так и об объединенной реакции ферментов. В качестве косубстрата использовали этанол. Этанол и NAD+ на первой стадии под действием XR превращались в NADH и ацетальдегид. На второй стадии ацетальдегид и NAD+ под действием альдегидодегидрогеназы (AldDH) превращались в ацетат (см. Sigma-Aldrich: Katalognummer A6338; или «Characterization and Potential Roles of Cytosolic and Mitochondrial Aldehyde Dehydrogenases in Ethanol Metabolism in Saccharomyces cerevisiae», Wang et al., Molecular Cloning, 1998, Journal of Bacteriology, p. 822-830). На один моль прореагировавшего косубстрата в данном случае должны образовываться 2 моль восстановительных эквивалента (NADH) (см. схему реакции 2).
В таблице 3 представлены реакционные соотношения 4 различных опытных реакций 247, 249, 250 и 253. Использовали разные концентрации этанола и AldDH. Концентрации кофактора и субстрата были постоянными.
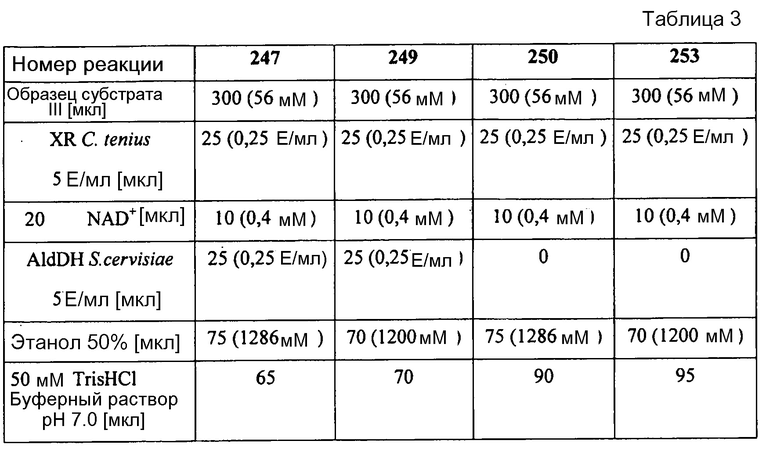
Общий объем: 0,5 мл
температура: 25±2°C
Термомешалка: 500 оборотов в мин.
Продолжительность: 112 часов
Для деактивации ферментов все пробы нагревали 15 минут до 70°C, затем центрифугировали и фильтровали (PVDF; 0,2 мкм) для подготовки для последующего анализа HPLC (высокопроизводительная жидкостная хроматография).
Анализ HPLC:
Колонна SUGAR SP0810+предварительная колонна SUGAR SP-G
Температура колонны 90°C.
Детектор: детектор показателя преломления
Элюент: деионизованная H2O
Поток: 0,90 мл/мин
Количество образца: 10 мкл
HPLC точность количественного выражения: ±10%
Результаты:
Максимального выхода продукта (реакция 249) достигали при концентрации этанола 1,2 моль/л. При этом всего быль получено 1,38 мг/мл ксилитола, что соответствует выходу ксилитола 21,2% от теоретического.
В таблице 4 объединены результаты реакций не основе данных измерений HPLC.
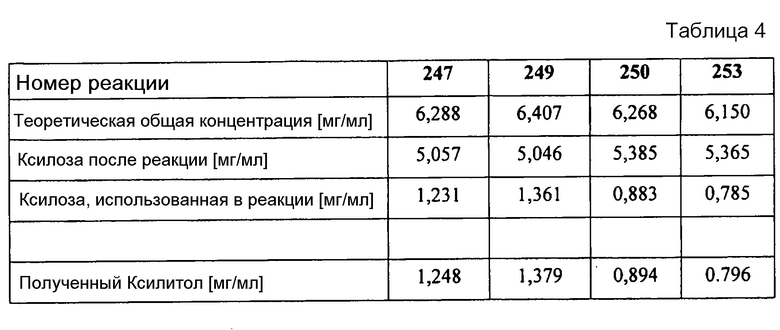
Из результатов очевидно, что этанол можно применять как косубстрат. Как видно из сравнения реакции 249 (реакционная смесь содержит AldDH) и 253 (реакционная смесь без AldDH), однозначно добавка альдегидодегидрогеназы приводит к явному повышению выхода ксилитола. Отличие количества ксилозы, превращенной в ксилитол, составляет ~8%. Этот результат в сочетании с вышеупомянутыми литературными цитатами позволяет сделать вывод о том, что образующийся из AldDH в первой части восстановления ацетальдегид далее окисляется до уксусной кислоты (см. схема реакции 2). Данная энергетически благоприятная реакция и вместе с ней происходящее повышение концентрации NADH сдвигают равновесие от исходных веществ в направлении продукта реакции - ксилитола в первой части реакции.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СПИРТА В КОНТЕКСТЕ БИОРАФИНИРОВАНИЯ | 2008 |
|
RU2508403C2 |
| СПОСОБ ПОЛУЧЕНИЯ СПИРТОВ И/ИЛИ РАСТВОРИТЕЛЕЙ ИЗ ЛИГНОЦЕЛЛЮЛОЗНОЙ БИОМАССЫ С КИСЛОТНОЙ РЕЦИРКУЛЯЦИЕЙ ТВЕРДЫХ ОСТАТКОВ | 2010 |
|
RU2545392C2 |
| СПОСОБ ПОЛУЧЕНИЯ МОНОСАХАРИДОВ ИЛИ ЭТАНОЛА ВМЕСТЕ С СУЛЬФИНИРОВАННЫМ ЛИГНИНОМ ИЗ ЛИГНОЦЕЛЛЮЛОЗНОЙ БИОМАССЫ | 2009 |
|
RU2525163C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТОВ ФЕРМЕНТАЦИИ | 2008 |
|
RU2486235C2 |
| СПОСОБ ПОЛУЧЕНИЯ СПИРТА, ВКЛЮЧАЮЩИЙ ЭТАП ПОЛУЧЕНИЯ ФУРФУРАЛЯ | 2010 |
|
RU2542473C2 |
| ЭФФЕКТИВНЫЙ ГИДРОЛИЗ ЛИГНОЦЕЛЛЮЛОЗЫ, СОВМЕЩЕННЫЙ С ВЫРАБОТКОЙ ФЕРМЕНТОВ | 2012 |
|
RU2550265C2 |
| УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТОВ ЦЕЛЛЮЛАЗЫ И/ИЛИ ГЕМИЦЕЛЛЮЛАЗЫ | 2011 |
|
RU2565560C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОНЕФТИ | 2009 |
|
RU2501840C2 |
| ПОДВЕРГНУТАЯ ПРЕДВАРИТЕЛЬНОЙ ОБРАБОТКЕ БИОМАССА, ХАРАКТЕРИЗУЮЩАЯСЯ УЛУЧШЕННОЙ ФЕРМЕНТАТИВНОЙ ДОСТУПНОСТЬЮ | 2010 |
|
RU2545576C2 |
| ГИДРОЛИЗ И ФРАКЦИОНИРОВАНИЕ БИОМАССЫ ЛИГНОЦЕЛЛЮЛОЗЫ | 1997 |
|
RU2194078C2 |
Изобретение относится к получению ксилитола. Способ предусматривает обработку лигноцеллюлозного материала водным раствором, который содержит спирт, в частности C1-4 спирт или фенол, и имеет значение pH от 11,0 до 14,0, для расщепления лигноцеллюлозы. Отделяют продукты расщепления от указанного лигноцеллюлозного материала, при этом получают обогащенный целлюлозой и гемицеллюлозой материал. Полученный обогащенный целлюлозой и гемицеллюлозой материал обрабатывают ксиланазой, чтобы получить ксилозу, и ферментативно преобразуют ксилозу в ксилитол. Изобретение обеспечивает повышение выхода целевого продукта. 12 з.п. ф-лы, 4 табл., 4 пр.
1. Способ получения ксилитола, отличающийся тем, что
- лигноцеллюлозный материал обрабатывают водным раствором, который содержит спирт, в частности C1-4 спирт или фенол, и имеет значение pH от 11,0 до 14,0, с расщеплением лигноцеллюлозы и с отделением продуктов расщепления от указанного материала, при этом получают обогащенный целлюлозой и гемицеллюлозой материал,
- полученный обогащенный целлюлозой и гемицеллюлозой материал обрабатывают ксиланазой, чтобы получить ксилозу и
- ферментативно преобразуют ксилозу в ксилитол.
2. Способ по п. 1, отличающийся тем, что водный раствор имеет значение pH от 11,0 до 13,0.
3. Способ по п. 1 или 2, отличающийся тем, что расщепление проходит при температуре меньше 100°C.
4. Способ по п. 1 или 2, отличающийся тем, что в качестве лигноцеллюлозного материала используют солому, багассу, энергетическое зерно и/или лузгу.
5. Способ по п. 1 или 2, отличающийся тем, что лигноцеллюлозный материал в водном растворе находится в концентрации 5-40 мас.%.
6. Способ по п. 1 или 2, отличающийся тем, что глюкозу, ксилозу и лигнин - компоненты лигноцеллюлозного материала получают в отдельных массовых потоках.
7. Способ по п. 1 или 2, отличающийся тем, что ферменативное преобразование ксилозы в ксилитол осуществляют непосредственно в смеси раствора ксилозы и твердого вещества, полученной в результате обработки ксиланазой обогащенного целлюлозой и гемицеллюлозой материала.
8. Способ по п. 1 или 2, отличающийся тем, что после обработки водным раствором, содержащим спирт, раствор, содержащий лигнин, отделяют, обрабатывают обогащенный целлюлозой и гемицеллюлозой материал ксиланазой и отделяют жидкую фазу от твердого вещества.
9. Способ по п. 8, отличающийся тем, что обработку ксиланазой проводят при 30-90°C.
10. Способ по п. 1 или 2, отличающийся тем, что обогащенный целлюлозой и гемицеллюлозой материал взаимодействует с ксиланазой, и полученная жидкая фаза ферментативно преобразуется в ксилитол, и оставшееся твердое вещество
- далее взаимодействует с целлюлазой с образованием различных продуктов ферментации; или
- подвергается термическому или термохимическому преобразованию; или
- подвергается микробиологическому преобразованию с бактериями, дрожжами или грибами;
или
- подвергается дальнейшей стадии делигнификации с целью получения целлюлозно-волокнистых материалов.
11. Способ по п. 10, отличающийся тем, что обогащенный целлюлозой и гемицеллюлозой материал взаимодействует с ксиланазой, и полученная жидкая фаза с помощью ксилозоредуктазы ферментативно превращается в ксилитол, и оставшееся твердое вещество
- далее взаимодействует с целлюлазой с образованием различных продуктов ферментации; или
- подвергается термическому или термохимическому преобразованию; или
- подвергается микробиологическому преобразованию с бактериями, дрожжами или грибами;
или
- подвергается дальнейшей стадии делигнификации с целью получения целлюлозно-волокнистых материалов.
12. Способ по п. 10, отличающийся тем, что после отделения продуктов (ферментации) оставшееся твердое вещество ферментируют в установке для получения биогаза и дальше перерабатывают в биогаз.
13. Способ по п. 11, отличающийся тем, что после отделения продуктов (ферментации) оставшееся твердое вещество ферментируют в установке для получения биогаза и дальше перерабатывают в биогаз.
| AVGERINOS G.C | |||
| ET AL | |||
| Selective solvent delignification for fermentation enhancement // Biotechnology and Bioengineering, 1983, vol | |||
| XXV, pp | |||
| Приспособление для получения кинематографических стерео снимков | 1919 |
|
SU67A1 |
| PAN X | |||
| ET AL | |||
| Bioconversion of hybrid poplar to ethanol and co-products using an organosolv fractionation process: optimization of process yields // Biotechnology and Bioengineering, vol | |||
| Экономайзер | 0 |
|
SU94A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Приспособление для подачи коробок в машинах для наполнения коробок | 1925 |
|
SU851A1 |
| US 20070031918 A1, 08.02.2007 | |||
| ГИДРОЛИЗ И ФРАКЦИОНИРОВАНИЕ БИОМАССЫ ЛИГНОЦЕЛЛЮЛОЗЫ | 1997 |
|
RU2194078C2 |
| WO 1989009547 A1, 19.10.1989 | |||
| MARTIN C | |||
| ET AL | |||
| Comparision between wet oxidation and steam explosion as pretreatment methods for enzymatic hydrolysis of sugarcane bagasse // BioResources, 2008, 3(3), рp | |||
| Пневматический прибор для заправки нити в челнок | 1924 |
|
SU670A1 |
| Шеститрубный элемент пароперегревателя для котлов с жаровыми и прогарными трубами | 1918 |
|
SU678A1 |
Авторы
Даты
2017-04-28—Публикация
2010-04-30—Подача