Предметом настоящего изобретения является фармацевтическая композиция, предназначенная для применения при предупреждении и/или лечении нейродегенеративного заболевания, причем указанная композиция содержит desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль и, необязательно, фармацевтически приемлемый носитель, адъювант и/или вспомогательное вещество.
Болезнь Альцгеймера
Болезнь Альцгеймера (БА) представляет собой нейродегенеративное расстройство, результатом которого является утрата кортикальных нейронов, особенно в ассоциативном неокортексе и гиппокампе, что в свою очередь приводит к медленной и прогрессирующей потере когнитивных функций, в итоге приводящей к деменции и смерти. Главными признаками этого заболевания являются агрегация и отложение неправильно свернутых белков (Bertram et al 2010; Mancuso et al 2010): (1) агрегированного бета-амилоидного (Aβ) пептида в виде внеклеточных сенильных или нейритических «бляшек» и (2) гиперфосфорилированного тау-белка в виде внутриклеточных нейрофибриллярных «клубков» (NFT).
Генетически БА подразделяют на две формы: (1) семейная БА с ранним началом (<60 лет) и (2) спорадическая БА с поздним началом (>60 лет). Известно, что семейная БА с ранним началом является результатом редких патогенных мутаций в генах белка-предшественника амилоида (АРР), пресенелина 1 (PSEN1) и пресенелина 2 (PSEN2), тогда как единственным наиболее важным фактором риска для БА с поздним началом является APOE (аполипопротеин Е) (аллель 4) (Bertram et al 2010).
Характерными особенностями мозга при БА являются нарушения функций митохондрий и окислительный стресс, проявляющийся как окисление белков и перекисное окисление липидов. Дисбаланс между продуцированием активных форм кислорода (ROS) и разрушением химически активных форм антиоксидантами приводит к окислительному стрессу. Aβ обладает прямыми окислительными эффектами, но, кроме того, он может нарушать окислительно-восстановительную активность митохондрий, результатом чего является увеличение свободных радикалов. Нейроны менее способны защищаться против увеличения ROS, т.к. они имеют низкие уровни антиоксидантов по сравнению с другими типами клеток у млекопитающих, и поэтому их считают весьма чувствительными к окислительному стрессу. Добавление Aβ к первичным культурам нейронов приводит к ингибированию АТPas, изменениям клеточного потенциала и притока Са2+ (Varadarajan et al 2000; Higginsa et al 2010).
В настоящее время не существует способов лечения этого тяжелого заболевания, а несколько методик, одобренных Управлением по контролю за пищевыми продуктами и лекарственными средствами США (FDA), оказались неспособными остановить прогрессирующее течение БА, создавая лишь эффект частичного ослабления симптомов (Wollen 2010, Aderinwale et al 2010). Лицензированными средствами фармацевтической терапии БА в настоящее время являются ингибиторы ацетилхолинэстеразы, такие как такрин, донепизил, ривастигмин, галантамин, и мемантин (антагонист рецептора N-метил-D-аспартата, NMDA). Эффект этих лекарственных средств является весьма ограниченным, их основное действие заключается в ослаблении симптомов без влияния на развитие заболевания. Можно назначать и другие лекарственные препараты, такие как статины (средства, понижающие уровень холестерина), антигипертензивные препараты, противовоспалительные средства и др., хотя их назначение в этих случаях не предусмотрено утвержденными инструкциями по применению. Ни для одного из этих лекарственных средств не была доказана способность замедлять прогредиентное течение БА (Kaduszkiewicz et al 2005; Hölscher, 2005). Испытываются и другие стратегии лечения БА. Было обнаружено, что нейрональный фактор роста α (NGF) может уменьшать сенильные бляшки и улучшать когнитивную функцию (De Rosa et al 2005). Поскольку, как известно, одной из главных проблем при БА является резистентность к инсулину (Hölscher и Li, 2010), в преклинических исследованиях вместо самого инсулина хорошие эффекты демонстрируют и другие ростовые факторы, такие как глюкагоноподобный пептид-1 (GLP-1) (один из инкретиновых гормонов). Лираглутид (аналог инкретинового GLP-1) уменьшал число амилоидных бляшек, снижал уровни бета-амилоида, предотвращал когнитивные нарушения и нарушение синаптических функций, ослаблял воспалительную реакцию и усиливал рост синапсов и нейрогенез в мозге трансгенных мышей с моделью БА (McClean et al 2011). Амилоидные бляшки и связанная с ними воспалительная реакция в мозге являются основными признаками БА. Сходные защитные эффекты были найдены и с другим агонистом рецептора аналогов GLP-1 в модели БА у трансгенных мышей (Li et al 2010).
Болезнь Паркинсона
Болезнь Паркинсона (БП) представляет собой хроническое нейродегенеративное расстройство движения мышц, обычно характеризующееся избирательной дегенерацией нигростриарных нейронов, сильно сниженной способностью к синтезу дофамина и, как следствие, неспособностью активировать дофаминовые рецепторы в стриатуме (Gandhi et al 2005). Еще до того, как заболевание проявится клинически, незаметно происходит гибель нигростриарных нейронов в компактной части черной субстанции (SNc) - вероятно, в результате одновременных апоптозных, эксайтотоксичных, нейровоспалительных явлений, опосредуемых свободными радикалами. Терапевтическая стратегия, обеспечивающая излечение или средства устранения патологии при БП, остается трудноосуществимой. Общепринятая лекарственная терапия является, по существу, паллиативной; кроме того, не у всех пациентов она является эффективной. Поскольку апоптозная гибель клеток является одним из центральных компонентов в избирательной гибели нигростриарных нейронов (Schapira 2001), будущие терапевтические стратегии могли бы направленно применять биологические молекулы с антиапоптозными свойствами. В качестве альтернативы, положительный терапевтический эффект могли бы произвести молекулы, обладающие нейротрофическими свойствами или способные стимулировать нейрогенез клеток с дофаминергическим фенотипом. Согласно недавним наблюдениям, эксендин-4 (агонист рецептора глюкагоноподобного пептида-1, GLP-1) демонстрирует нейротрофические (Perry et al 2002) и нейропротективные (Perry et al 2002) свойства в культурах клеток РС12, подвергнутых эксайтотоксичному стрессу. Недавно было также показано (Harkavyi et al 2008), что эксендин-4 останавливает дальнейшее развитие повреждений черной субстанции, созданных в двух моделях БП у мышей или даже изменяет его на обратное. В дополнение к этому, было показано, что обработка эксендином-4 защищает дофаминергические нейроны от дегенерации, сохраняет уровни дофамина и улучшает моторные функции у мышей с моделью БП, вызванной 1-метил-4-фенил-1,2,3,6-тетрагидропиридином (MPTP) (Li et al 2009).
Болезнь Гентингтона
Болезнь Гентингтона (БГ) представляет собой наследственное нейродегенеративное расстройство, для которого типичным является непроизвольное движение тела, а также психиатрические и когнитивные аномалии. Генетический дефект, лежащий в основе БГ, заключается в экспансии тринуклеотидных повторов CAG в экзоне 1 гена БГ, результатом чего является экспансия полиглутамина в белке хантингтине (htt). Это приводит к аномальному процессингу и неблагоприятной внутриклеточной агрегации. Недавно было показано, что обработка эксендином-4 подавляет развитие мутантных включений htt в поджелудочной железе и мозге, ослабляет метаболические эффекты и двигательные дисфункции и продлевает жизнь мышей с БГ (Martin et al 2009).
Инсульт
Патофизиология инсульта включает в себя апоптозную гибель кортикальных и стриарных нейронов (Mattson, 2007).
Недавно было показано, что введение эксендина-4 уменьшало повреждение мозга и улучшало функциональный исход в модели инсульта, вызванного временной окклюзией средней мозговой артерии у мышей (Li et al 2009). В модели ишемии головного мозга у песчанок, было, кроме того, показано, что стимуляция рецептора GLP-1 эксендином-4, ингибируя активацию микроглии, уменьшала степень ишемической гибели нейронов при временном ишемическом повреждении головного мозга (Lee et al 2011). Teramoto et al (2011) показали, что эксендин-4 эффективен в модели повреждения головного мозга при церебральной ишемии-реперфузии у мышей. Воздействие эксендином-4 значительно уменьшало объем инфаркта и улучшало состояние функциональной недостаточности.
Периферическая сенсорная нейропатия
Приблизительно 60-70% индивидов с диабетом, в той или иной степени, имеют неврологические нарушения, в частности, нейропатии, которые являются причиной болезненных ощущений в руках и/или ногах, нарушений перистальтики желудка или кистевого туннельного синдрома. В настоящее время нет ни одного способа терапии с доказанной способностью устранять неврологические нарушения, обусловленные длительной гипергликемией и ассоциированными метаболическими нарушениями. Экспрессия GLP-1 была обнаружена в нейронах нодозного ганглия, что свидетельствует о возможной роли GLP-1 в периферической нейротрансмиссии (Nakagawa 2004). На модели периферической нейропатии, индуцированной пиридоксином у грызунов без диабета, было показано, что GLP-1 и подкожно вводимый эксендин-4 частично защищают от развития нескольких функциональных и морфологических дефектов и способствуют нормализации размеров аксонов (Perry et al 2007).
Когнитивная функция, настроение и память
По результатам измерений в водном лабиринте Морриса, агонисты рецептора GLP-1 способны повысить когнитивные функции у грызунов; мыши с нокаутом рецептора GLP-1 имеют фенотип, характеризующийся дефицитом обучаемости, который устраняется после переноса гена гиппокампального рецептора GLP-1 (During et al 2003). Недавно Isacson et al (2010) показали эффект хронического воздействия эксендина-4 на ассоциированные с гиппокампом когнитивные функции и поведение, связанное с настроением, у взрослых грызунов. В другом исследовании полинейропатия в ганглии заднего корешка у мышей с моделью диабета была устранена эксендином-4 (Himeno et al 2011). Другой аналог GLP-1, лираглутид, как было показано, производил благоприятные эффекты на когнитивные функции и синаптическую пластичность в гиппокампе мышей с резистентностью к инсулину и с ожирением, индуцированным диетой с высоким содержанием жира (Porter et al 2010).
Глюкагоноподобный пептид 1
Глюкагоноподобный пептид 1, GLP-1 или GLP-1(7-36), представляет собой пептидный гормон, состоящий из 30 аминокислот, который кодируется геном проглюкагона. Он продуцируется, главным образом, в энтероэндокринных L-клетках кишечника и секретируется в кровоток, когда пища, содержащая жиры, белковый гидролизат и/или глюкозу, входит в двенадцатиперстную кишку. Наиболее широко изученными клетками, активируемыми GLP-1, являются секретирующие инсулин бета-клетки поджелудочной железы, где его определяющим действием является усиление секреции инсулина, индуцированной глюкозой. После активации рецептора GLP-1 (GLP-1R) в бета-клетках происходит активация аденилилциклазы (АС) и генерируется сАМР, что в свою очередь приводит к сАМР-зависимой активации путей вторичных мессенджеров, таких как пути протеинкиназы А (РКА) и Ерас. Так же как при краткосрочных эффектах усиления секреции инсулина, индуцированной глюкозой, непрерывная активация GLP-1R усиливает и синтез инсулина, пролиферацию бета-клеток и неогенез (Doyle et al 2007). Кроме того, GLP-1 в целом регулирует концентрации глюкагонов, замедляет опорожнение желудка, стимулирует биосинтез проинсулина, увеличивает чувствительность к инсулину и стимулирует инсулинозависимый биосинтез гликогена (Holst (1999); Curr. Med. Chem 6: 1005; Nauck et al (1997) Exp Clin Endocrinol Diabetes 105: 187; Lopez-Delgado et al (1998) Endocrinology 139: 2811).
Особые эффекты, оказываемые GLP-1 на секрецию инсулина и глюкагона, в последние 20 лет стимулировали исследовательскую активность, кульминацией которой оказался естественный агонист рецептора GLP-1 (GLP-1R) - эксендин-4, который в настоящее время применяют для лечения сахарного диабета типа 2 (T2DM) (Doyle et al 2007).
В тканях, отличных от поджелудочной железы (в мозге, почках, легких, сердце и главных кровеносных сосудах), GLP-1 может активировать специфический рецептор, соединенный с белком, связывающим гуаниновые нуклеотиды (с G-белком).
GLP-1 демонстрировал нейропротективные способности и свойства, подобные свойствам ростовых факторов (McClean et al 2010). Кроме того, GLP-1 ослабляет индукцию апоптоза нейронов гиппокампа и улучшает пространственное и ассоциативное обучение (During et al 2003). Perry et al (2002) сообщали, что GLP-1 был способен полностью защищать культивируемые нейроны гиппокампа крысы от апоптоза, индуцированного глутаматом. Было показано, что такие аналоги GLP-1, как (Val8)GLP-1 и N-ацетил-GLP-1, оказывают выраженные эффекты на долговременную потенциацию синаптической передачи (LTP) в гиппокампе (McClean et al 2010). Аналог GLP-1 (лираглутид) уменьшал число амилоидных бляшек, понижал уровни бета-амилоида, предотвращал развитие когнитивных нарушений и депрессию LTP, ослаблял воспалительную реакцию и усиливал синаптический рост и нейрогенез в гиппокампе у трансгенных мышей с моделью БА (McClean et al 2011).
Было показано, что GLP-1, лираглутид и эксендин-4 проникают через гематоэнцефалический барьер (ВВВ) (Kastin et al 2001; McClean et al 2011). Perry et al (2003) обнаружили, что GLP-1 и эксендин-4 снижали уровни бета-амилоида в мозге, а белка-предшественника амилоида - в нейронах. Хроническое воздействие эксендина-4 или лираглутида влияет на пролиферацию клеток и дифференцировку нейробластов в зубчатой извилине гиппокампа взрослых мышей (Li et al 2010; Hamilton et al 2011).
Лираглутид представляет собой аналог GLP-1, имеющий формулу Arg34,Lys26(Nε(γ-глутамил(Nα-гексадеканоил)))GLP-1(7-37). Лираглутид обычно вводят парентерально.
Соединение desPro36эксендин-4(1-39)-Lys6-NH2 (AVE0010, ликсисенатид) представляет собой аналог эксендина-4. Ликсисенатид описан как SEQ ID NO:93 в WO 01/04156:
SEQ ID NO: 1: Ликсисенатид (44 AS)
H-G-E-G-T-F-T-S-D-L-S-K-Q-M-E-E-E-A-V-R-L-F-I-E-W-L-K-N-G-G-P-S-S-G-A-P-P-S-K-K-K-K-K-K-NH2
SEQ ID NO: 2: эксендин-4 (39 AS)
H-G-E-G-T-F-T-S-D-L-S-K-Q-M-E-E-E-A-V-R-L-F-I-E-W-L-K-N-G-G-P-S-S-G-A-P-P-P-S-NH2
SEQ ID NO: 3: GLP-1(7-36) (30 AS)
H-A-E-G-T-F-T-S-D-V-S-S-Y-L-E-G-Q-A-A-K-E-F-I-A-W-L-V-K-G-R
Эксендины представляют собой группу пептидов, которые могут снижать концентрацию глюкозы в крови. Эксендины имеют аминокислотную последовательность, приблизительно только на 50% совпадающую с последовательностью GLP-1(7-36). Поэтому эксендины, как правило, не считают аналогами GLP-1.
Ликсисенатид характеризуется укорочением С-концевой последовательности нативного эксендина-4. Ликсисенатид содержит шесть С-концевых остатков лизина, отсутствующих в эксендине-4. До настоящего времени ликсисенатид не рассматривали в качестве лекарственного средства, подходящего для лечения расстройств ЦНС (в частности, нейродегенеративных заболеваний), поскольку указанные С-концевые остатки лизина могут сделать невозможным проникновение этого лекарственного средства через гематоэнцефалический барьер. В настоящее время нет признаков того, что ликсисенатид мог бы переноситься через гематоэнцефалический барьер каким-либо специфическим и/или регулируемым механизмом.
В примере 1 настоящего изобретения было продемонстрировано, что ликсисенатид превосходит по своим свойствам эксендин-4 и такой аналог GLP-1, как лираглутид, которые в настоящее время применяют для лечения диабета типа 2.
(а) Неожиданно оказалось, что ликсисенатид может проникать через гематоэнцефалический барьер. Данные настоящего изобретения свидетельствуют, что этот транспорт является регулируемым, поскольку при высоких концентрациях его скорость ограничивается некоторым максимальным уровнем. Кроме того, по сравнению с лираглутидом, ликсисенатид поступает в мозг при более низкой парентеральной дозе.
(b) Ликсисенатид активирует рецепторы GLP-1 в мозге и индуцирует продуцирование cAMP. Неожиданно было обнаружено, что ликсисенатид производит более высокие уровни сАМР, чем лираглутид, демонстрируя при той же дозе более высокую эффективность при активации рецептора GLP-1.
(c) Ликсисенатид может индуцировать пролиферацию прогениторных клеток в зубчатой извилине. По сравнению с эксендином-4 или с лираглутидом, ликсисенатид производит больший эффект при введении в такой же дозе. При нейродегенеративных заболеваниях эти эффекты могут составить эффект, модифицирующий заболевание.
(d) По сравнению с лираглутидом, ликсисенатид показывал более сильные нейропротективные эффекты (против клеточного стресса) в зубчатой извилине.
(e) Неожиданно было обнаружено, что предварительная обработка ликсисенатидом в дозе 10 нМ была достаточной для защиты клеток нейробластомы SH-SY5Y от стресса, производимого 1200 мкМ метилглиоксаля (MG). Для защиты клеток от стресса, производимого 1200 мкМ метилглиоксаля, требовалась доза лираглутида, составлявшая 200 нМ, что свидетельствует о том, что для индуцирования защиты достаточна более низкая доза ликсисенатида (см. также данные примера 2, полученные при предварительной обработке агонистами GLP-1).
Пример 2 демонстрирует, что последующая обработка ликсисенатидом была достаточной для защиты клеток нейробластомы SH-SY5Y от стресса, вызываемого 2 мМ метилглиоксаля или 1 мМ H2O2. В отличие от этого, лираглутид не защищал клетки от стресса, вызываемого MG или H2O2.
В примере 3 ликсисенатид демонстрировал значительные нейропротективные эффекты против нейродегенерации в клетках LUHMES, обработанных ротеноном. Ликсисенатид имеет преимущества по сравнению с другими агонистами рецептора GLP-1 (GLP-1R). В клетках LUHMES, обработанных ротеноном, ликсисенатид проявляет значительную активность при 3-кратно более низких концентрациях, чем лираглутид, что согласуется с неожиданно более активным эффектом, наблюдавшимся в модели с метилглиоксалем примера 1. Эксенатид не производит никакого значительного эффекта в концентрациях 0,3 и 1 мкМ. В отличие от этого, ликсисенатид в этих концентрациях обеспечивает дозозависимое улучшение жизнеспособности.
В примере 4 продемонстрировано, что лечение ликсисенатидом in vivo приводит к уменьшению массы амилоидных бляшек в мозге трансгенных мышей с моделью болезни Альцгеймера. Таким образом, в добавление к его нейропротективным свойствам, ликсисенатид может уменьшать такие патологические повреждения в головном мозге, как амилоидные бляшки, и поэтому он привлекает внимание как возможное средство предупреждения и/или лечения болезни Альцгеймера. Активность наблюдается при более низкой дозе (10 нмоль/кг), чем было описано ранее для лираглутида (25 нмоль/кг) у McLean et al (2011).
Поэтому ликсисенатид подходит для лечения и/или предупреждения нейродегенеративного заболевания, как описано в настоящем документе (например, болезни Альцгеймера, болезни Паркинсона и/или инсульта).
Первым аспектом настоящего изобретения является фармацевтическая композиция, предназначенная для применения при предупреждении и/или лечении нейродегенеративного заболевания, причем указанная композиция содержит desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль и, необязательно, фармацевтически приемлемый носитель, адъювант и/или вспомогательное вещество.
Другим аспектом настоящего изобретения является фармацевтическая композиция, предназначенная для применения при лечении нейродегенеративного заболевания, причем указанная композиция содержит desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль и, необязательно, фармацевтически приемлемый носитель, адъювант и/или вспомогательное вещество.
Указанное нейродегенеративное заболевание может быть любым нейродегенеративным заболеванием, в частности, нейродегенеративным заболеванием, которое может быть связанным с окислительным стрессом, утратой целостности нейритов, апоптозом, потерей нейронов и/или воспалительной реакцией.
Согласно настоящему изобретению, к утрате целостности нейритов относится потеря дендритных шипиков, утрата синаптической пластичности и/или отсутствие нового компенсаторного спраутинга нейритов.
Нейродегенеративное заболевание может быть связано с когнитивным нарушением.
В частности, указанное нейродегенеративное заболевание выбрано из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, прогрессирующего супрануклеарного паралича (PSP), множественной системной атрофии (MSA), деменции с тельцами Леви, деменции при болезни Паркинсона, эпилепсии, инсульта, хореи Гентингтона, гипоксии головного мозга, рассеянного склероза и периферической нейропатии. Указанная периферическая нейропатия может быть связана с сахарным диабетом.
Предпочтительно, указанное нейродегенеративное заболевание выбрано из группы, состоящей из болезни Альцгеймера, болезни Паркинсона и инсульта.
Также предпочтительно, чтобы указанное нейродегенеративное заболевание было выбранным из группы, состоящей из прогрессирующего супрануклеарного паралича, множественной системной атрофии, деменции с тельцами Леви, болезни Паркинсона и деменции при болезни Паркинсона. Любое из этих заболеваний может быть связано с паркинсонизмом.
Прогрессирующий супрануклеарный паралич и множественная системная атрофия обобщенно известны как синдромы «Паркинсон-плюс».
В настоящем изобретении термин «паркинсонизм» относится к неврологическому синдрому, который характеризуется сочетанием таких специфических симптомов, как тремор, гипокинезия, ригидность и/или постуральная неустойчивость.
В одном варианте осуществления настоящего изобретения указанное нейродегенеративное заболевание представляет собой болезнь Альцгеймера. Болезнь Альцгеймера может быть связана с окислительным стрессом и утратой нейронов.
В другом варианте осуществления настоящего изобретения указанное нейродегенеративное заболевание представляет собой болезнь Паркинсона. Болезнь Паркинсона может быть связана с окислительным стрессом, воспалительной реакцией, апоптозом, утратой нейронов, в частности, с утратой дофаминергических нейронов, например, с утратой нейронов в черной субстанции, результатом чего является недостаток дофамина.
Утрата нейронов может быть обусловлена апоптозом.
В другом варианте осуществления настоящего изобретения указанное нейродегенеративное заболевание представляет собой прогрессирующий супрануклеарный паралич. Прогрессирующий супрануклеарный паралич может быть связанным с утратой нейронов, в частности, с утратой дофаминергических нейронов.
В другом варианте осуществления настоящего изобретения указанное нейродегенеративное заболевание представляет собой множественную системную атрофию. Множественная системная атрофия может быть связана с утратой нейронов, в частности, с утратой дофаминергических нейронов.
В другом варианте осуществления настоящего изобретения указанное нейродегенеративное заболевание представляет собой деменцию с тельцами Леви. Деменция с тельцами Леви может быть связана с утратой нейронов, в частности, с утратой дофаминергических нейронов. Деменция с тельцами Леви может быть связана с болезнью Паркинсона.
В другом варианте осуществления настоящего изобретения указанное нейродегенеративное заболевание представляет собой деменцию при болезни Паркинсона. Деменция при болезни Паркинсона может быть связана с утратой нейронов, в частности, с утратой дофаминергических нейронов. В частности, деменция при болезни Паркинсона может быть связана с болезнью Паркинсона.
В еще одном варианте осуществления настоящего изобретения указанное нейродегенеративное заболевание представляет собой инсульт. Инсульт может быть связан с утратой нейронов, обусловленной ишемией, причем ишемия может быть вызвана закупоркой сосуда (как при тромбозе или артериальной эмболии) или кровоизлиянием.
И еще в одном варианте осуществления настоящего изобретения указанное нейродегенеративное заболевание представляет собой рассеянный склероз, который может быть связан с воспалительными процессами в ЦНС.
Данные настоящего изобретения демонстрируют, что (а) ликсисенатид производит нейропротективные и/или нейрорегенеративные эффекты и (b) ликсисенатид превосходит другие агонисты GLP-1, такие как эксендин-4 или лираглутид. Таким образом, ликсисенатид может создать эффект модифицирования заболевания при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, болезнь Паркинсона и инсульт. В частности, введение ликсисенатида возможно при лечении ранней стадии нейродегенеративного заболевания, поскольку нейропротективные и нейрорегенеративные эффекты могут замедлить прогрессирующее течение заболевания и тем самым улучшить качество жизни.
Поэтому в одном аспекте настоящего изобретения нейродегенеративное заболевание находится на ранней стадии. Например, болезнь Альцгеймера может представлять собой раннюю стадию болезни Альцгеймера. Раннюю стадию болезни Альцгеймера (БА) также называют продромальной болезнью Альцгеймера или предеменцией болезни Альцгеймера (Dubois et al. 2010). Раннюю стадию болезни Альцгеймера можно охарактеризовать следующим образом: пациенты демонстрируют объективные жалобы на память, сопровождаемые вспомогательными данными биологических маркеров или патологическими признаками болезни Альцгеймера - в спинномозговой жидкости находят низкие уровни отношения β-амилоидного пептида-42 (Ab42) к тау-белку или в мозге детектируют амилоидные бляшки посредством ПЭТ-исследования на амилоид (позитронно-эмиссионной томографии) с использованием такого средства, как AmyVidTM от E. Lilly (Avid).
В другом примере болезнь Паркинсона может быть ранней стадией болезни Паркинсона. Еще в одном примере прогрессирующий супрануклеарный паралич может быть ранней стадией прогрессирующего супрануклеарного паралича. И еще в одном примере множественная системная атрофия может быть ранней стадией множественной системной атрофии. В другом примере деменция с тельцами Леви может быть ранней стадией деменции с тельцами Леви. И еще в одном примере деменция при болезни Паркинсона может быть ранней стадией деменции при болезни Паркинсона.
Кроме того, ликсисенатид подходит для предупреждения нейродегенеративного заболевания, в частности, у тех пациентов, у которых можно подозревать наличие нейродегенеративного заболевания, но которые не имеют ясного диагноза. В другом аспекте настоящего изобретения фармацевтическая композиция, как описано в настоящем документе, предназначена для применения при предупреждении нейродегенеративного заболевания.
В контексте настоящего изобретения desPro36эксендин-4(1-39)-Lys6-NH2 (ликсисенатид) включает в себя его фармацевтически приемлемые соли. Квалифицированному специалисту в данной области известны фармацевтически приемлемые соли ликсисенатида. Предпочтительной фармацевтически приемлемой солью ликсисенатида, применяемой согласно настоящему изобретению, является ацетат.
Согласно настоящему изобретению, desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить пациенту, нуждающемуся в этом, в количестве, достаточном для индуцирования терапевтического эффекта.
Согласно настоящему изобретению, desPro36эксендин-4(1-39)- Lys6-NH2 и/или его фармацевтически приемлемую соль можно составлять в препарате с подходящими фармацевтически приемлемыми носителями, адъювантами и/или вспомогательными веществами.
Фармацевтическая композиция согласно настоящему изобретению предоставляет эффект модифицирования заболевания, обусловленный ее нейропротективными и нейрорегенеративными эффектами, как описано в настоящем документе, при нейродегенеративном заболевании, как описано в настоящем документе. В частности, эффект модифицирования заболевания может быть получен при лечении нейродегенеративного заболевания, как описано в настоящем документе, например, при болезни Альцгеймера, болезни Паркинсона, прогрессирующем супрануклеарном параличе, множественной системной атрофии, деменции с тельцами Леви, деменции при болезни Паркинсона, эпилепсии, инсульте, хорее Гентингтона, гипоксии головного мозга, рассеянном склерозе и периферической нейропатии, как описано в настоящем документе.
Фармацевтическую композицию согласно настоящему изобретению можно вводить парентерально, например, посредством инъекции (такой как внутримышечная или подкожная инъекция). Известны подходящие инъекционные устройства, например, так называемые «шприцы-авторучки», содержащие картридж с активным ингредиентом и инъекционную иглу. Соединение desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить в подходящем количестве, например, в количестве, находящемся в диапазоне от 1 до 50 мкг на дозу, от 5 до 40 мкг на дозу, от 10 до 30 мкг на дозу, от 10 до 15 мкг на дозу или от 15 до 20 мкг на дозу.
Согласно настоящему изобретению, соединение desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить в ежедневной дозе в диапазоне от 1 до 50 мкг, в диапазоне от 5 до 40 мкг, в диапазоне от 10 до 30 мкг, в диапазоне от 10 до 20 мкг, в диапазоне от 10 до 15 мкг или в диапазоне от 15 до 20 мкг. Композицию согласно настоящему изобретению можно вводить посредством одной инъекции в день.
Согласно настоящему изобретению, композиция настоящего изобретения может быть предоставлена в виде жидкой композиции. Квалифицированному специалисту известны жидкие композиции ликсисенатида, подходящие для парентерального введения. Жидкая композиция согласно настоящему изобретению может иметь кислый или физиологический рН. Кислый рН, предпочтительно, находится в диапазоне pH 1-6,8, pH 3,5-6,8 или pH 3,5-5. Физиологический рН, предпочтительно, находится в диапазоне pH 2,5-8,5, pH 4,0-8,5 или pH 6,0-8,5. Значение рН можно регулировать, добавляя фармацевтически приемлемую разбавленную кислоту (обычно HCl) или фармацевтически приемлемое разбавленное основание (обычно NaOH).
Жидкая композиция согласно настоящему изобретению может содержать подходящий консервант. Подходящий консервант может быть выбран из фенола, м-крезола, бензилового спирта и сложного эфира п-гидроксибензойной кислоты. Предпочтительным консервантом является м-крезол.
Жидкая композиция согласно настоящему изобретению может содержать вещество, регулирующее тоничность. Подходящее вещество, регулирующее тоничность, можно выбирать из глицерина, лактозы, сорбита, маннита, глюкозы, NaCl, соединений, содержащих кальций или магний, таких как CaCl2. Концентрация глицерина, лактозы, сорбита, маннита и глюкозы может быть в диапазоне 100-250 мМ. Концентрация NaCl может составлять до 150 мМ. Предпочтительным веществом, регулирующим тоничность, является глицерин.
Жидкая композиция согласно настоящему изобретению может содержать метионин в концентрации от 0,5 мкг/мл до 20 мкг/мл, предпочтительно, от 1 мкг/мл до 5 мкг/мл. Предпочтительно, указанная жидкая композиция содержит L-метионин.
Еще один другой аспект настоящего изобретения относится к способу предупреждения и/или лечения по некоторому медицинскому показанию, как описано в настоящем документе. Например, указанный способ может включать в себя введение фармацевтической композиции, как описано в настоящем документе. Указанный способ может представлять собой способ предупреждения и/или лечения нейродегенеративного заболевания, как описано в настоящем документе.
В частности, указанный способ, как описано в настоящем документе, способствует реакции модифицирования заболевания, например, посредством нейропротективного или нейрорегенеративного эффектов.
В способе согласно настоящему изобретению терапию, модифицирующую заболевание и осуществляемую посредством ее нейропротективного или нейрорегенеративного эффектов, предоставляют посредством введения фармацевтической композиции, как описано в настоящем документе, при нейродегенеративном заболевании, как описано в настоящем документе. В частности, реакция, модифицирующая заболевание, может быть получена при лечении нейродегенеративного заболевания, как описано в настоящем документе, например, при болезни Альцгеймера, болезни Паркинсона, прогрессирующем супрануклеарном параличе, множественной системной атрофии, деменции с тельцами Леви, деменции при болезни Паркинсона, эпилепсии, инсульте, хорее Гентингтона, гипоксии головного мозга, рассеянном склерозе и периферической нейропатии, как описано в настоящем документе.
В способе согласно настоящему изобретению вводят терапевтически эффективное количество фармацевтической композиции, как описано в настоящем документе.
Еще один другой аспект настоящего изобретения относится к применению композиции, как описано в настоящем документе, для изготовления лекарственного средства, предназначенного для лечения по медицинскому показанию, как описано в настоящем документе. Например, композицию согласно настоящему изобретению можно применять для изготовления лекарственного средства, предназначенного для предупреждения и/или лечения нейродегенеративного заболевания, как описано в настоящем документе.
Настоящее изобретение дополнительно проиллюстрировано следующими примерами и фигурами.
Описание графического материала
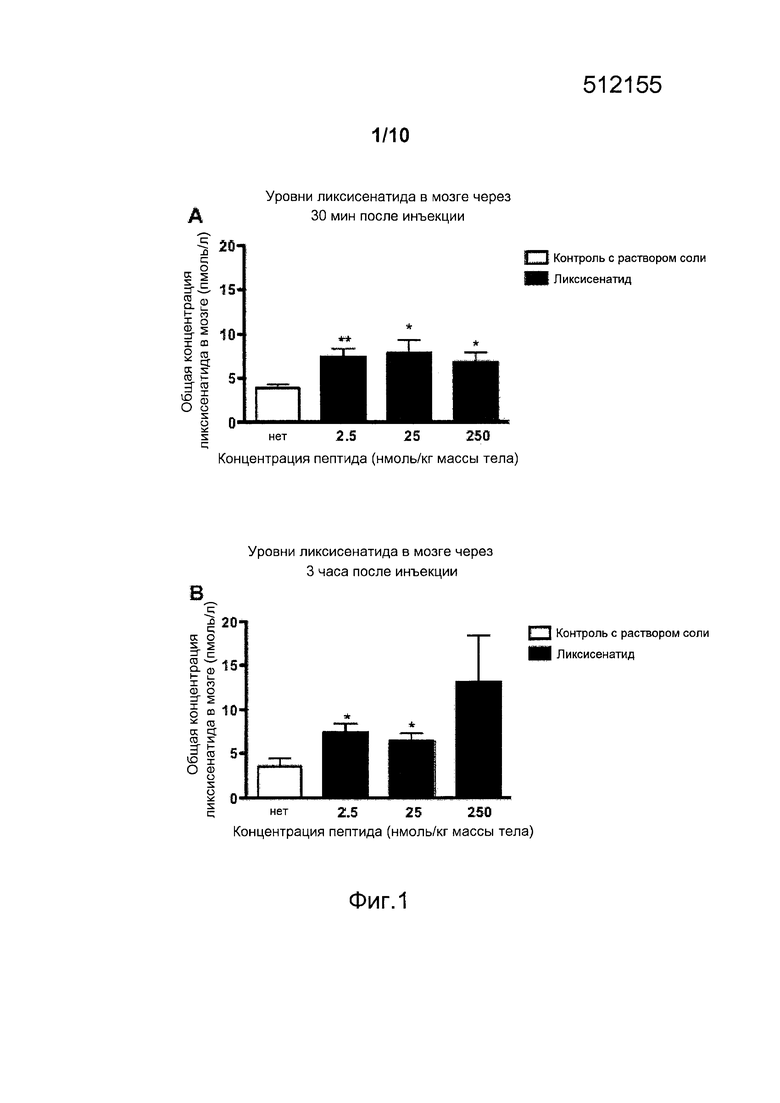
Фигура 1. (A) Общая концентрация ликсисенатида (пмоль/л), измеренная в мозге самок мышей дикого типа (n=5, средний возраст 24 недели) спустя 30 мин после в/бр инъекции солевого плацебо (0,9% масс./об. NaCl) или в/бр инъекции ликсисенатида (2,5, 25 или 250 нмоль/кг массы тела). Данные представлены как средние значения ± стандартные ошибки средних значений, *p<0,05, **p<0,01. (B) Общая концентрация ликсисенатида (пмоль/л), измеренная в мозге самок мышей дикого типа (n=5, средний возраст 24 недели) спустя 3 ч после в/бр инъекции солевого плацебо (0,9% масс./об. NaCl) или в/бр инъекции ликсисенатида (2,5, 25 или 250 нмоль/кг массы тела). Данные представлены как средние значения ± стандартные ошибки средних значений, *p<0,05.
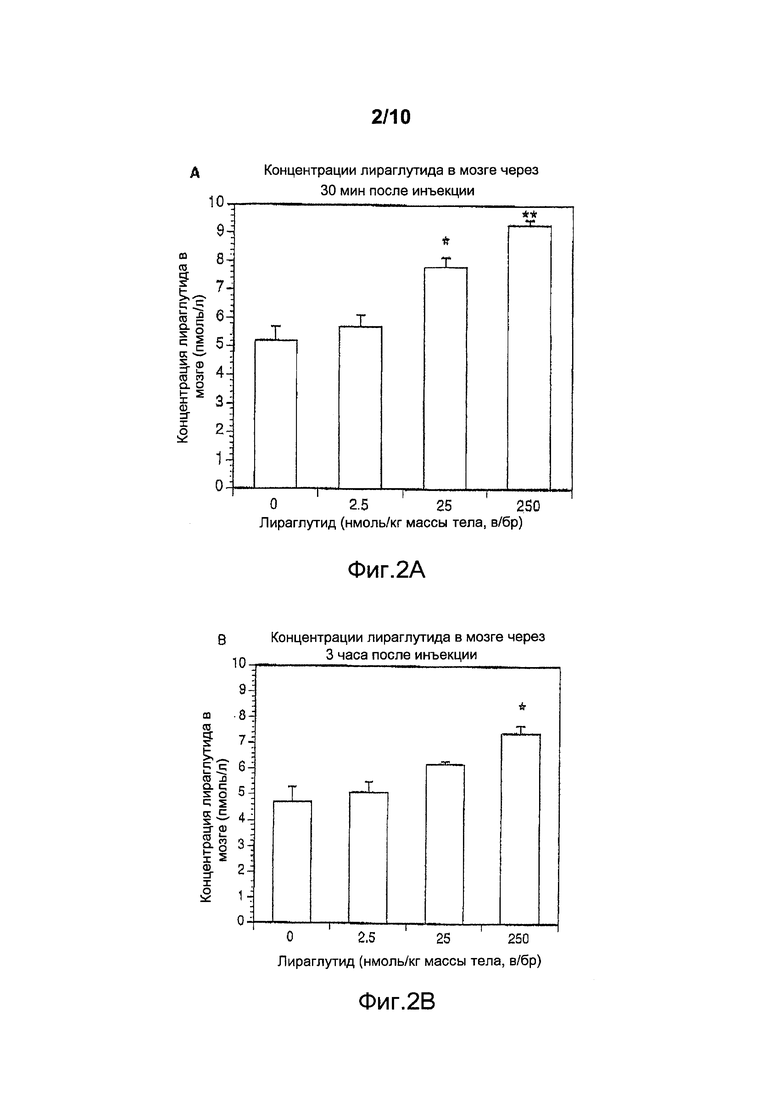
Фигура 2. (A) Общая концентрация лираглутида (пмоль/л), измеренная в мозге самок мышей дикого типа (n=5) спустя 30 мин после в/бр инъекции солевого плацебо (0,9% масс./об. NaCl) или в/бр инъекции лираглутида (2,5, 25 или 250 нмоль/кг массы тела). Данные представлены как средние значения ± стандартные ошибки средних значений, *p<0,05, **p<0,01. (B) Общая концентрация лираглутида (пмоль/л), измеренная в мозге самок мышей дикого типа спустя 3 ч после в/бр инъекции солевого плацебо (0,9% масс./об. NaCl) или в/бр инъекции лираглутида (2,5, 25 или 250 нмоль/кг массы тела). Данные представлены как средние значения ± стандартные ошибки средних значений, *p<0,05.
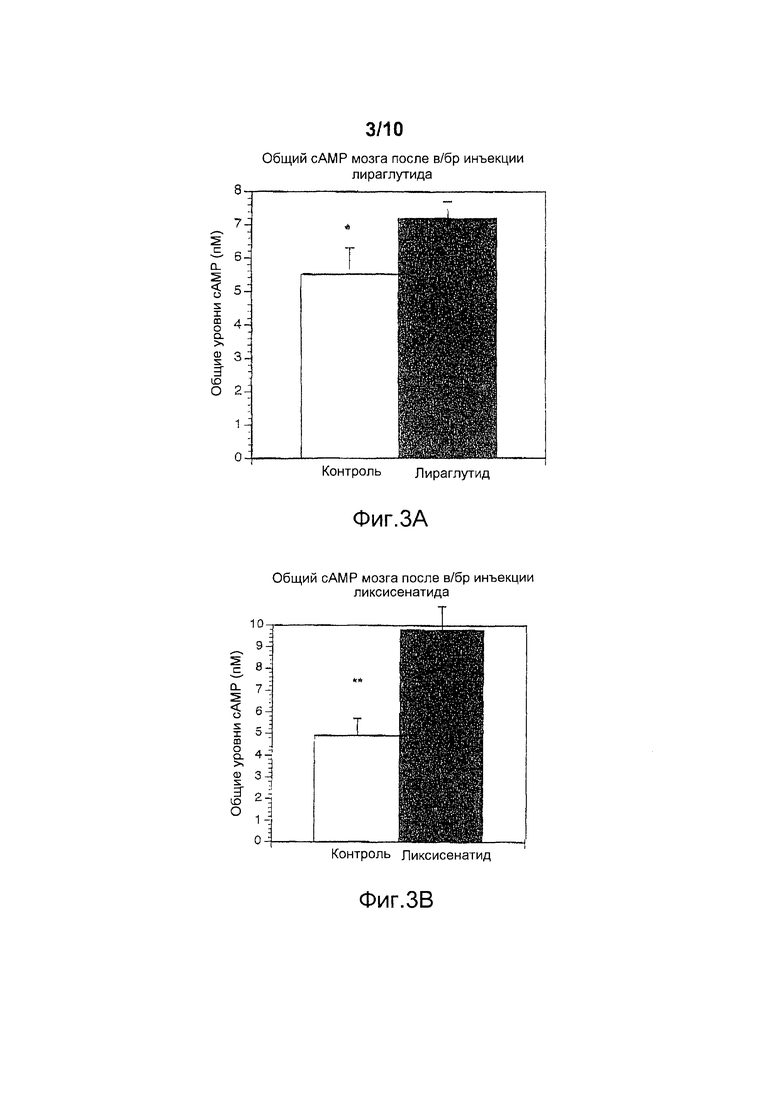
Фигура 3. (A) После внутрибрюшинной инъекции 25 нмоль/кг массы тела лираглутида, произведенной за 30 мин до анализа, наблюдалось значительное повышение уровня сАМР в мозге по сравнению с контролем (p<0,05; t-критерий). (B) После внутрибрюшинной инъекции 25 нмоль/кг массы тела ликсисенатида, произведенной за 30 мин до анализа, наблюдалось значительное повышение уровня сАМР в мозге по сравнению с контролем (p<0,01; t-критерий). (С) При прямом сравнении эффектов лираглутида и ликсисенатида обнаружено значительное различие между лекарственными средствам (p<0,05; t-критерий).
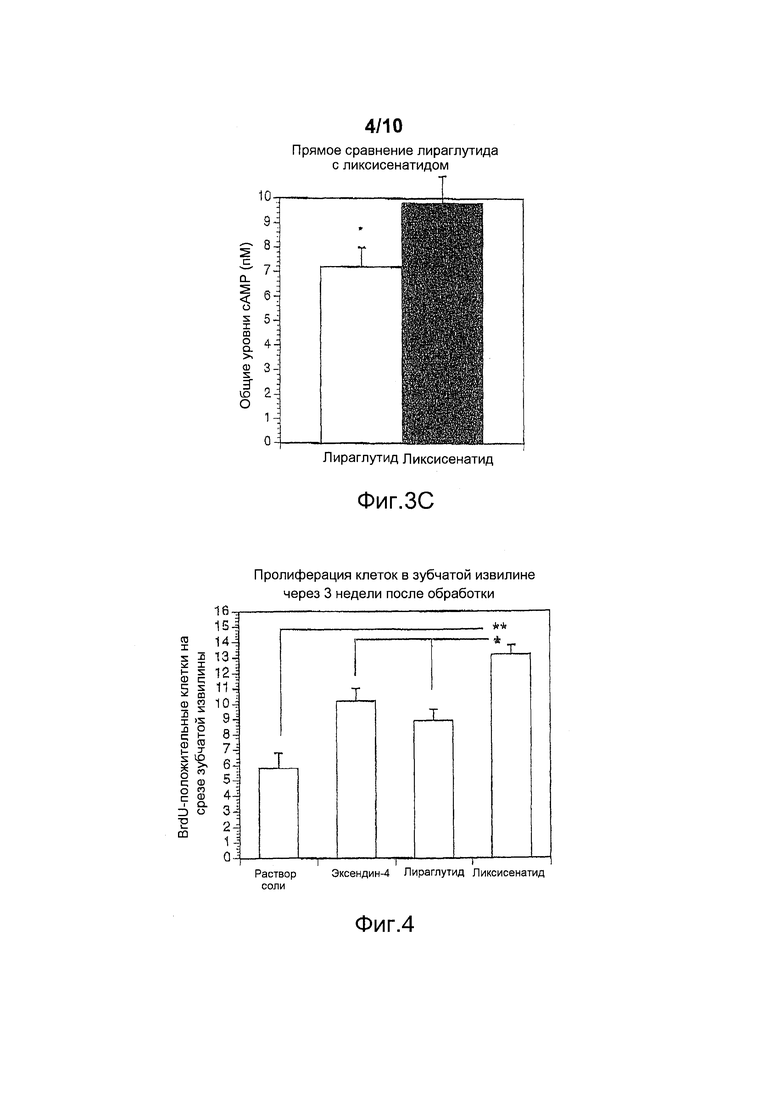
Фигура 4. Эффект инъекций эксендина-4, лираглутида или ликсисенатида, по 25 нмоль/кг массы тела, один раз в день в течение 3 недель на клеточную пролиферацию в зубчатой извилине (окрашивание с BrdU). Данные представлены как средние значения ± стандартные ошибки средних значений, *p<0,05, **p<0,01. Ликсисенатид показывает увеличенную клеточную пролиферативную активность по сравнению с эксендином-4 и лираглутидом (p<0,05) и контролем (p<0,01).
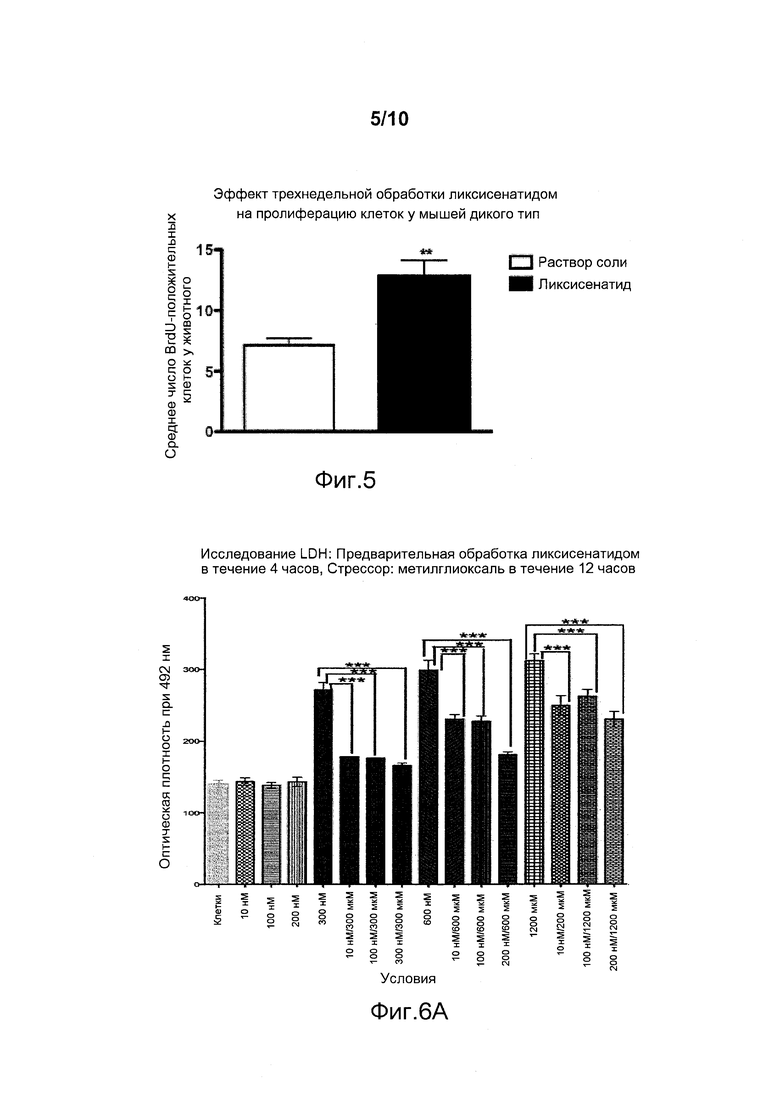
Фигура 5. Гистологический анализ на курсе в/бр инъекций ликсисенатида один раз в день в течение 3 недель (25 нмоль/кг массы тела). При иммуногистологическом анализе с BrdU было найдено большее число новых клеток в зубчатой извилине мозга. Кроме того, было найдено больше молодых нейронов (окрашивание с даблкортином). Данные представлены как средние значения ± стандартные ошибки средних значений, *p<0,05, **p<0,01.
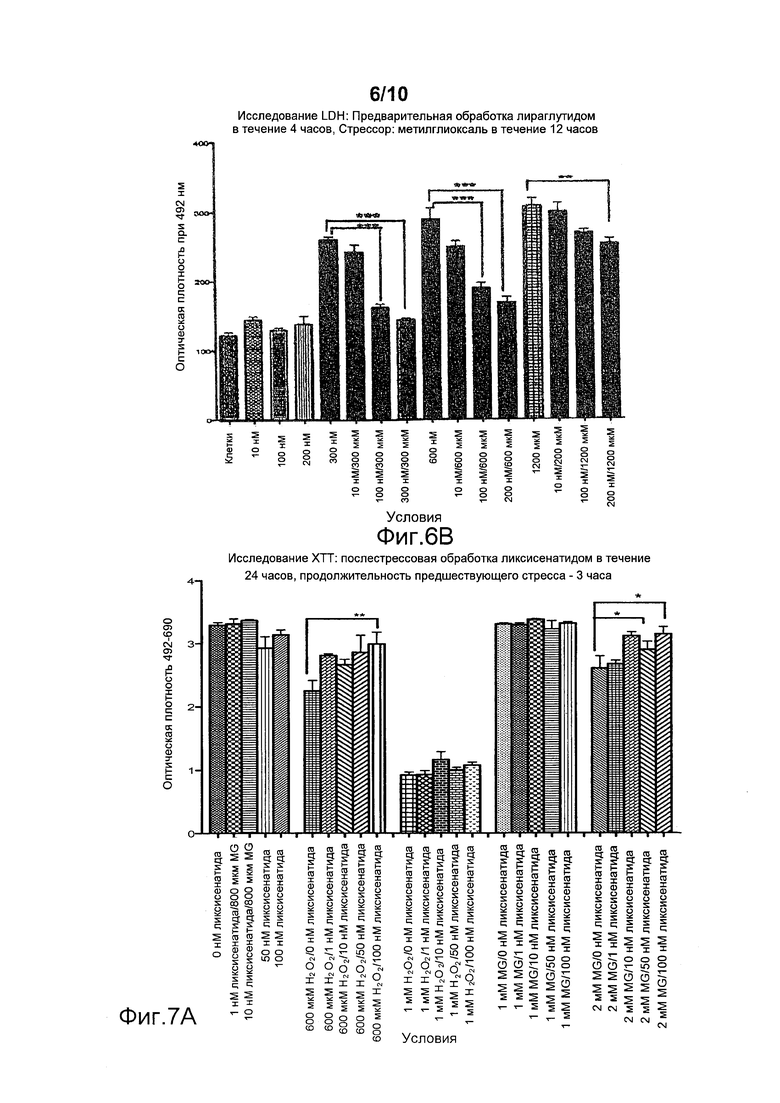
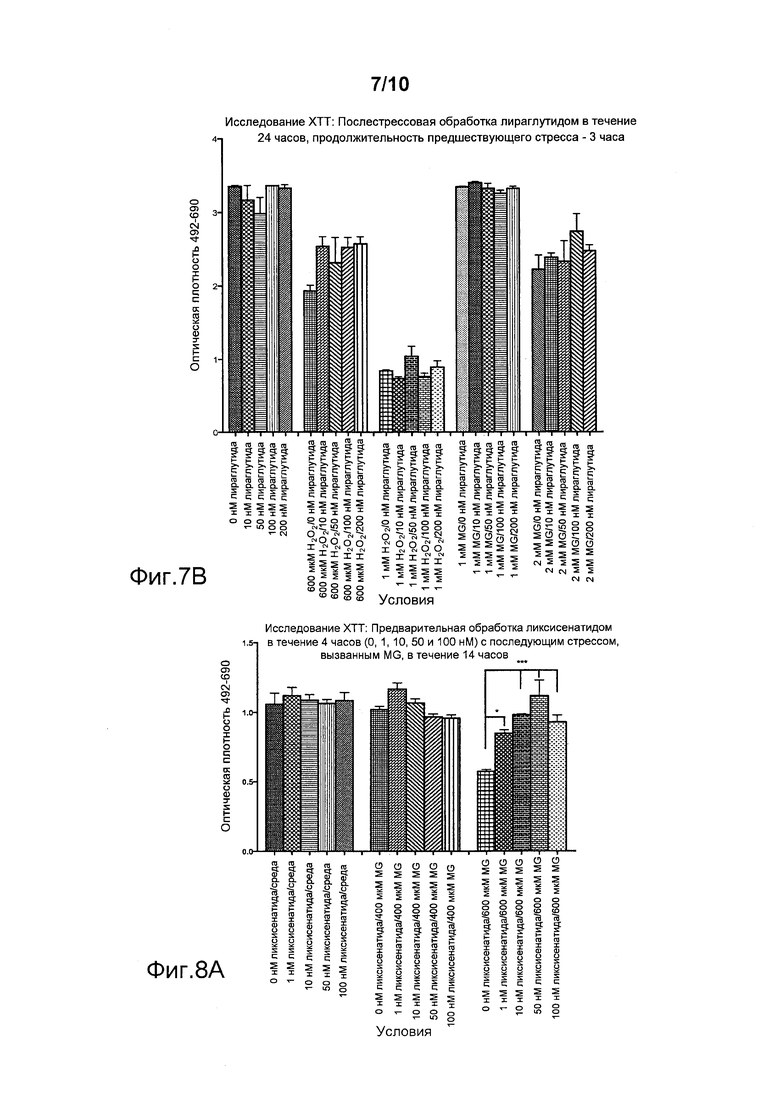
Фигура 6. (A) Исследование LDH. Предварительная обработка клеток SH-SY5Y ликсисенатидом с последующим стрессом, вызванным метилглиоксалем. (***p<0,0001). Для защиты клеток от стресса, вызванного 1200 мкМ метилглиоксаля, была достаточной доза ликсисенатида, составлявшая 10 нМ. (В) Исследование LDH. Предварительная обработка клеток SH-SY5Y лираглутидом с последующим стрессом, вызванным метилглиоксалем. (*p<0,05, ***p<0,001, ***p<0,0001). Для защиты клеток от стресса, вызванного 1200 мкМ метилглиоксаля, была достаточной доза лираглутида, составлявшая 200 нМ. Меньшие дозы (10 нМ или 100 нМ) не показали никакого эффекта.
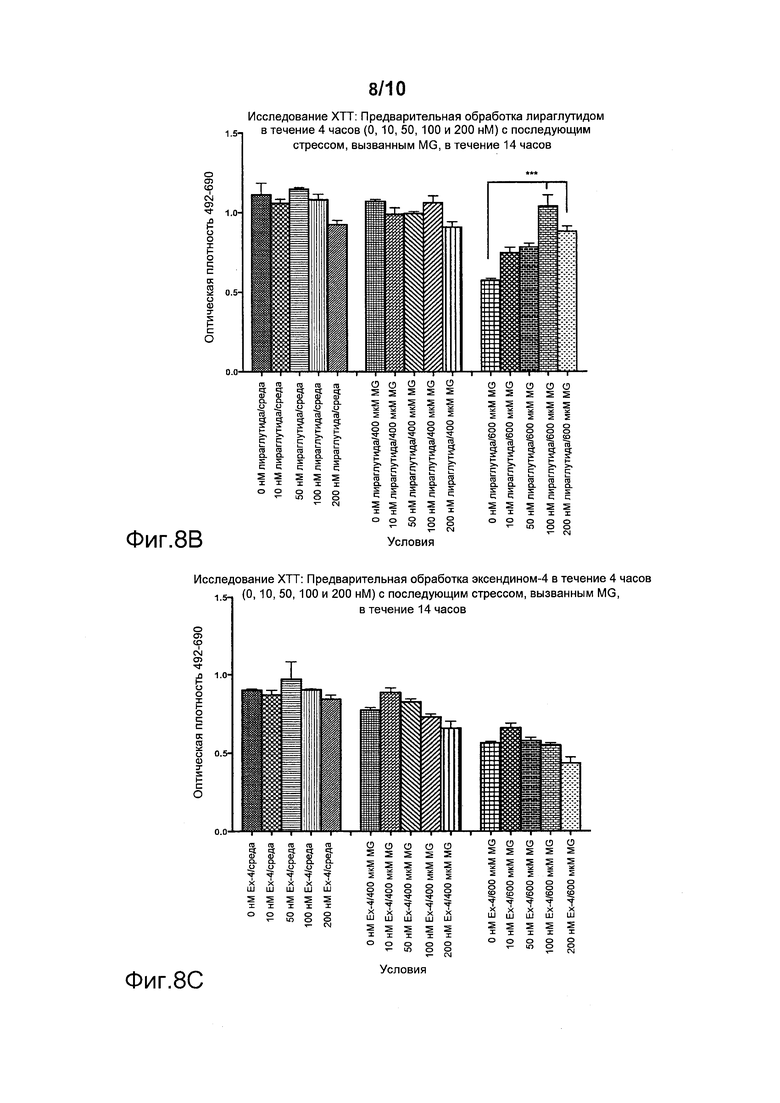
Фигура 7. Послестрессовая обработка ликсисенатидом или лираглутидом после обработки метилглиоксалем (MG) и пероксидом водорода (H2O2). По оси Х указаны различные условия эксперимента, а на оси Y представлены значения оптической плотности. *p<0,05, **p<0,01. (A) Послестрессовая обработка ликсисенатидом, (B) Послестрессовая обработка лираглутидом.
Фигура 8. Предварительная обработка ликсисенатидом или лираглутидом с последующим стрессом, вызванным метилглиоксалем (MG). По оси Х указаны различные условия эксперимента, а на оси Y представлены значения оптической плотности. *p<0,05, ***p<0,001. Эффекты предварительной обработки (А) ликсисенатидом, (B) лираглутидом и (C) эксендином-4.
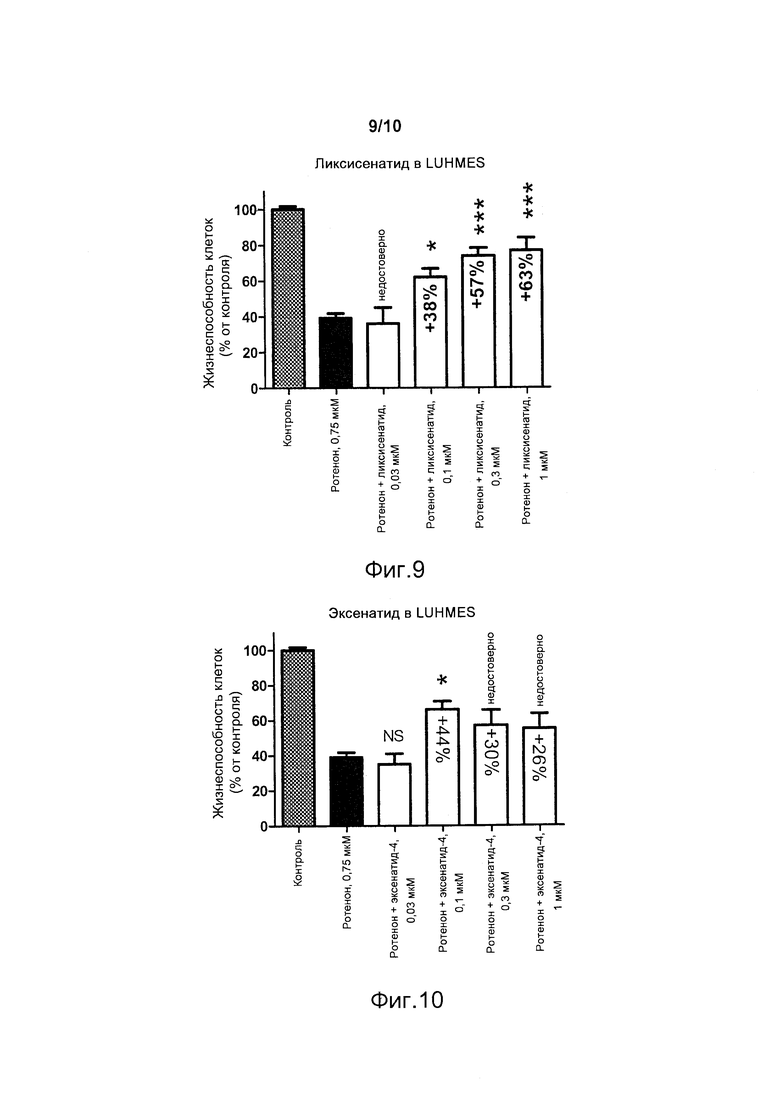
Фигура 9. Нейропротективное действие в клетках LUHMES (выраженное в процентах преодоления вызванного ротеноном снижения нормализованной жизнеспособности клеток) в присутствии различных концентраций ликсисенатида. Rot. - ротенон. NS - недостоверно; *p<0,05; ***p<0,001.
Фигура 10. Нейропротективное действие в клетках LUHMES (выраженное в процентах преодоления вызванного ротеноном снижения нормализованной жизнеспособности клеток) в присутствии различных концентраций эксендина-4/эксенатида. Rot. - ротенон. NS - недостоверно; *p<0,05.
Фигура 11. Нейропротективное действие в клетках LUHMES (выраженное в процентах преодоления вызванного ротеноном снижения нормализованной жизнеспособности клеток) в присутствии различных концентраций лираглутида. Rot. - ротенон. NS - недостоверно; ***p<0,001.
Фигура 12. Обработка ликсисенатидом уменьшает общую массу амилоидных бляшек в мозге трансгенных мышей с болезнью Альцгеймера. Обработка ликсисенатидом 7-месячных трансгенных мышей APP/PS1 в течение 70 дней (10 нмоль/кг, в/бр, ежедневно) уменьшает общую массу бета-амилоидных бляшек в мозге, как было количественно определено посредством иммуногистохимического анализа на бета-амилоид с расчетом процентной доли участков, положительных по β-амилоиду, в срезах коры мозга. Данные представлены как средние значения ± стандартные ошибки средних значений (**p<0,01).
Фигура 13. Обработка ликсисенатидом уменьшает общую массу амилоидных бляшек в мозге трансгенных мышей с болезнью Альцгеймера. Обработка ликсисенатидом 7-месячных трансгенных мышей APP/PS1 (с моделью болезни Альцгеймера) в течение 70 дней (10 нмоль/кг, в/бр, ежедневно) уменьшает общую массу зрелых амилоидных бляшек в мозге, как было количественно определено посредством гистологического окрашивания конго красным с расчетом процентной доли участков, положительных по конго красному, в срезах коры мозга. Данные представлены как средние значения ± стандартные ошибки средних значений (*p<0,05).
Пример 1
Ликсисенатид представляет собой пептидное лекарственное средство, которое обычно вводят парентерально. Для того чтобы проявить свою активность против нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, прогрессирующий супрануклеарный паралич, множественная системная атрофия, деменция с тельцами Леви, деменция при болезни Паркинсона или инсульт, ликсисенатид должен проникнуть через гематоэнцефалический барьер. Ликсисенатид, особенно при парентеральном введении, подходит для лечения и/или предупреждения нейродегенеративных заболеваний, если он обладает одним или более из следующих свойств:
(а) ликсисенатид может проникать через гематоэнцефалический барьер,
(b) ликсисенатид активирует рецепторы GLP-1 в мозге и индуцирует физиологические эффекты посредством активации рецепторов,
(с) ликсисенатид предоставляет эффекты, модифицирующие заболевание, в подходящих моделях,
(d) ликсисенатид является нейропротективным в подходящих моделях и
(е) ликсисенатид предоставляет преимущества по сравнению с другими агонистами рецептора GLP-1, такими как лираглутид или эксенатид.
Поступление ликсисенатида в мозг
В настоящем примере описано, проникает ли такой агонист рецептора GLP-1, как ликсисенатид, через гематоэнцефалический барьер (ВВВ). Испытывали три дозы (2,5 нмоль/кг массы тела, 25 нмоль/кг массы тела и 250 нмоль/кг массы тела, в/бр.) и исследовали уровни, обнаруженные в ткани мозга через 30 мин и 3 ч после инъекции. Уровни ликсисенатида были повышенными через 30 мин после введения всех доз; кроме того, они были детектированы как при низкой дозе ликсисенатида (2,5 нмоль/кг массы тела), так и при его средней дозе (25 нмоль/кг массы тела), но не при высокой дозе (250 нмоль/кг массы тела). Это различие свидетельствует о том, что транспорт ликсисенатида в мозг является регулируемым, с ограничением притока высоких концентраций ликсисенатида, испытанных в данном случае (фигура 1).
Сравнение поступления ликсисенатида с поступлением лираглутида в мозг
Указанные выше результаты для ликсисенатида сравнивали с результатами для агониста GLP-1, лираглутида (Victoza от Novo Nordisk). Как обсуждалось выше и как показано на фигурах 1 и 2, уровни ликсисенатида показывали значительное повышение в мозге при самой низкой дозе, составлявшей 2,5 нмоль/кг массы тела (в/бр), тогда как лираглутид в этой дозе не показывал никакого увеличения (фигура 2), что означает, что ликсисенатид поступает в мозг при более низких концентрациях, чем лираглутид.
На основании этих результатов сделано заключение, что для проникновения ликсисенатида через гематоэнцефалический барьер требуется его доза, которая является более низкой, чем у лираглутида, в результате чего он может оказывать терапевтический эффект при нейродегенеративных заболеваниях, как описано в настоящем документе, при более низкой дозе по сравнению с лираглутидом.
Активация рецептора GLP-1 в мозге/продуцирование cAMP
Предварительные исследования показали, что ликсисенатид активирует панкреатический рецептор GLP-1, который связан с повышением уровней сАМР (см., например, обзор Doyle et al., 2007).
В настоящем примере впервые показано, что в/бр инъекции ликсисенатида повышали количество сАМР в мозге, свидетельствуя о том, что ликсисенатид активирует рецепторы GLP-1 в мозге (фигура 3b). Прямое сравнение эффектов ликсисенатида (25 нмоль/кг массы тела, в/бр) и лираглутида (25 нмоль/кг массы тела, в/бр; результаты см. на фигуре 3a) на рецептор GLP-1 показано на фигуре 3с. При одной и той же дозе ликсисенатид производит значительно более высокие уровни сАМР, чем лираглутид (*p<0,05), чем демонстрируется более высокая эффективность ликсисенатида.
Нейрорегенеративные эффекты/эффекты, модифицирующие заболевание, ликсисенатида в мозге
Исследовали эффекты трехнедельного курса внутрибрюшинных инъекций ликсисенатида, эксендина-4 и лираглутида на пролиферацию нейрональных прогениторных стволовых клеток. Была обнаружена повышенная пролиферация стволовых клеток в зубчатой извилине (окрашивание с BrdU, фигуры 4 и 5). Неожиданно было обнаружено, что ликсисенатид значительно повышал пролиферацию клеток (*p<0,05) по сравнению с эксендином-4 или лираглутидом, что указывает на то, что ликсисенатид является более эффективным в мозге, чем эксендин-4 и лираглутид, инъецированные в той же дозе.
Кроме того, число молодых нейронов в зубчатой извилине увеличивалось после инъекции ликсисенатида по сравнению с лираглутидом (окрашивание с даблкортином, данные не показаны), свидетельствуя о том, что происходит дифференцировка прогениторных клеток в нейроны. Это показывает, что ликсисенатид индуцирует действительно стойкие улучшения.
Эти эффекты, производимые ликсисенатидом на стволовые клетки (пролиферация и дифференцировка), являются важным аспектом восстановления нормального состояния мозга, т.е. эти эффекты могут произвести эффект модифицирования заболевания при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, болезнь Паркинсона и инсульт.
Нейропротективные эффекты ликсисенатида в мозге
В исследованиях клеточных культур нейронов испытывали ликсисенатид, чтобы проверить наличие у него нейропротективных эффектов в условиях клеточного стресса. Токсичное вещество метилглиоксаль применяли для того, чтобы понизить жизнеспособность клеток. При добавлении ликсисенатида наблюдались дозозависимые нейропротективные эффекты (фигура 6a), обеспечивавшие 100%-ную защиту при всех дозах, когда концентрация метилглиоксаля была самой низкой, и поддерживавшие защиту даже при самой высокой тестовой концентрации метилглиоксаля. Доза ликсисенатида, составлявшая 10 нМ, была достаточной для защиты клеток от стресса, вызванного 1200 мкМ метилглиоксаля.
Кроме того, ликсисенатид показывал лучшую защиту по сравнению с лираглутидом. На фигуре 6B показано, что лираглутид в дозе 10 нМ не был способен защищать клетки. Для защиты клеток от стресса, вызванного 1200 мкМ метилглиоксаля, требовалась доза 200 нМ лираглутида, более низкие дозы (10 или 100 нМ) не показывали никакого эффекта.
Материалы и методики
Измерение сАМР в мозге
Животные
Использовали самок мышей дикого типа (на основе C57BL/6), по 5 животных в группе. Для измерения сАМР мышам внутрибрюшинно инъецировали 25 нмоль/на кг массы лираглутида или ликсисенатида тела или раствор соли (0,9% масс./об.) в качестве контроля в двух отдельных экспериментах. Через 30 мин после инъекции мозг быстро извлекали и мгновенно замораживали.
Экстракция сАМР из ткани
Каждый мозг подвергали экстракции, используя 0,1 M HCl. На 1 г ткани добавляли по 10 мл 0,1 M HCl. Образцы обрабатывали ультразвуком, затем центрифугировали при 10000 об/мин в течение 15 мин и при 4°С. Супернатант сливали и непосредственно использовали для измерения сАМР с набором реактивов для прямого анализа по методике ELISA (Enzo Life Sciences). Разведения производили, используя 0,1 M HCl, поставляемую с указанным набором.
Иммуногистохимия
Животным вводили BrdU (180 мг/кг массы тела; в/бр) за 18 часов до проведения анестезии пентобарбитоном (0,3 мл; Euthanal, Bayer AG, Leverkusen, Germany) и транскардиальной перфузии PBS и 4% параформальдегидом. Мозг извлекали и помещали на ночь в 30%-ный раствор сахарозы. Иммуногистохимический анализ на BrdU или даблкортин (DCX) проводили на 45-микронных свободно плавающих срезах. Активность эндогенной пероксидазы гасили, инкубируя срезы в 3%-ном пероксиде водорода. Для денатурации ДНК срезы инкубировали в 2н HCl, затем в 0,1 M растворе тетрабората натрия в течение 10 мин. Срезы инкубировали с первичными антителами к BrdU (1:200, мышиные моноклональные анти-BrdU, Sigma) или к DCX (поликлональные козьи антитела к даблкортину; 1:200, Santa Cruz, USA, sc-710) в течение ночи при 4°C. Затем наносили вторичные антитела (1:200, лошадиные против мышиных, Vector elite ABC kit, mouse, Vector laboratories). Срезы инкубировали с авидин-биотиновым ферментным реагентом и с хромогенным субстратом Vector SG (подробности см. в работе Gengler et al. 2010).
Микроскопия
Срезы анализировали с использованием микроскопа Olympus CX 40, применяя стереологическую технику. Она включает в себя случайное начало изготовления срезов и отбор каждого пятого среза по всему слою гранулярных клеток (GCL) зубчатой извилины (DG). Анализ проводили, используя объектив 40×, демонстрационные снимки выполняли с 5,1-мегапиксельной цифровой камерой. Для каждой группы лекарственных препаратов проводили анализ образцов мозга от 4-6 мышей. Для каждого мозга отбирали 8-12 срезов. Анализируемые области мозга находились на участке от -1,3 до -2,5 мм от брегмы. Все положительные клетки в зубчатой извилине подсчитывали с использованием программы ImageJ (бесплатное программа от NIH, http://rsbweb.nih.govl/ij/). В слое гранулярных клеток подсчитывали клетки, положительные на BrdU или DCX.
Клетки линии SH-SY5Y
SH-SY5Y - трижды клонированная линия клеток нейробластомы, произведенная в 1970 г. из биоптата костного мозга в локусе метастатической нейробластомы четырехлетней девочки. Эти клетки проявляют активность дофамин-бета-гидроксилазы, они являются ацетилхолинергическими, глутаматергическими и аденозинергичекими. Клетки SH-SY5Y растут в виде смеси плавающих и прикрепленных клеток, а также в форме кластеров нейробластных клеток с множеством коротких и тонких клеточных отростков. Обработка ретиноевой кислотой и холестерином может стимулировать эти клетки к росту дендритов и к дифференцировке.
Предварительная обработка клеток SH-SY5Y ликсисенатидом или лираглутидом с последующим метилглиоксалевым стрессом
Клетки SH-SY5Y культивировали в минимальной эссенциальной среде Дульбекко с F12 (1:1) и Glutamax с добавлением 10% термоинактивированной (нагреванием при 56°С в течение 20 мин) эмбриональной телячьей сыворотки, пенициллина и стрептомицина, инкубированной во влажном инкубаторе с 5% CO2 при 37°С. При 80% конфлюэнтности клетки обрабатывали трипсином и после подсчета по методике исключения с трипановым синим (Countess, Invitrogen), 2×104 клеток с 95%-ной жизнеспособностью высевали в 96-луночный планшет, покрытый ламинином (Nunc, Inc). После 12 часов инкубации, проводимой для прикрепления клеток, их обрабатывали ликсисенатидом или лираглутидом в разных дозах, составлявших 10 нМ, 100 нМ и 200 нМ, после чего добавляли стрессор метилглиоксаль в бессывороточных средах в концентрациях 300 мкМ, 600 мкМ и 1200 мкМ (фигуры 6A и 6B). Данные анализировали по программе PRISM 5.0C (GraphPad Software, Inc.) и в качестве уровня достоверности принимали р<0,05 или еще менее.
Эффект предварительной обработки ликсисенатидом или лираглутидом на клетки SH-SY5Y при стрессе, вызванном пероксидом водорода
Клетки обрабатывали 10 нМ и 100 нМ лираглутида или ликсисенатида, после чего в бессывороточных средах добавляли в качестве стрессора пероксид водорода в концентрациях 200 мкМ, 400 мкМ и 800 мкМ.
Исследование LDH
Культуральные среды клеточных культур анализировали, применяя набор реагентов для высокочувствительного анализа на лактатдегидрогеназу (LDH) (от Sigma). Анализ на LDH характеризует число погибших клеток по величине общей цитоплазматической LDH или по целостности мембран как функции количества цитоплазматической LDH, высвобожденной в среду. Измерение высвобожденной LDH основано на восстановлении NAD под действием LDH. Образующийся в результате этого восстановленный NAD (NADH) используют для стехиометрического преобразования тетразолиевого красителя. Конечное окрашенное соединение измеряют колориметрически.
Резюме
Данные настоящего примера демонстрируют, что ликсисенатид является подходящим для лечения и/или предупреждения нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, прогрессирующий супрануклеарный паралич, множественная системная атрофия, деменция с тельцами Леви, деменция при болезни Паркинсона или инсульт. Кроме того, ликсисенатид превосходит по свойствам эксендин-4 и такой аналог GLP-1, как лираглутид, каждый из которых в настоящее время применяют для лечения диабета типа 2.
В частности, данные настоящего примера демонстрируют, что
(а) неожиданным образом, ликсисенатид может проникать через гематоэнцефалический барьер. Данные настоящего изобретения свидетельствуют, что этот транспорт является регулируемым, поскольку при высоких концентрациях его скорость ограничивается некоторым максимальным уровнем. Кроме того, по сравнению с лираглутидом, ликсисенатид поступает в мозг при более низкой парентеральной дозе.
(b) ликсисенатид активирует рецепторы GLP-1 в мозге и индуцирует продуцирование cAMP. Неожиданным образом, ликсисенатид производит более высокие уровни сАМР, чем лираглутид, демонстрируя при той же дозе более высокую эффективность в отношении активации рецептора GLP-1.
(c) ликсисенатид может индуцировать пролиферацию прогениторных клеток в зубчатой извилине. По сравнению с эксендином-4 или с лираглутидом, ликсисенатид производит больший эффект при введении в одинаковой с ними дозе. При нейродегенеративных заболеваниях эти эффекты могут составить эффект модифицирования заболевания.
(d) по сравнению с лираглутидом, ликсисенатид неожиданно показывал более сильные нейропротективные эффекты (против клеточного стресса) в зубчатой извилине.
(e) неожиданным образом, предварительная обработка ликсисенатидом в дозе 10 нМ была достаточной для защиты клеток нейробластомы SH-SY5Y от стресса, производимого 1200 мкМ метилглиоксаля (MG). Для защиты клеток от стресса, производимого 1200 мкМ метилглиоксаля, требовалась доза лираглутида, составлявшая 200 нМ, что свидетельствует о том, что для индуцирования защиты достаточна более низкая доза ликсисенатида.
Пример 2
Послестрессовая обработка ликсисенатидом или лираглутидом после обработки метилглиоксалем (MG) и пероксидом водорода (H2O2)
Клетки SHSY-5Y высевали в 96-луночные планшеты и после 12 часов инкубирования без сыворотки подвергали стрессу с 600 мкМ и 1 мМ H2O2 и 1 мМ и 2 мМ MG в течение 3 ч. Клетки обрабатывали 0, 1, 10, 50 и 100 нМ ликсисенатида и 0, 10, 50, 100 и 200 нМ лираглутида. Спустя 24 ч добавляли 50 мкл реагента ХТТ и инкубировали в течение 8 ч. Рабочий объем составлял 100 мкл.
Фигура 7 демонстрирует, что послестрессовая обработка ликсисенатидом дозозависимым образом достоверно увеличивала число клеток, выживших после стресса, вызванного MG или H2O2 (см., в частности, данные, полученные с 600 мкМ H2O2 и с 2 мМ MG на фигуре 7A). Лираглутид не защищал клетки от стресса, вызванного MG или H2O2 (фигура 7B).
Предварительная обработка ликсисенатидом или лираглутидом с последующим стрессом, вызванным метилглиоксалем (MG)
Клетки SHSY-5Y высевали в 96-луночные планшеты и после 12 часов инкубирования без сыворотки обрабатывали 0, 1, 10, 50 и 100 нМ ликсисенатида и 0, 10, 50, 100 и 200 нМ лираглутида и эксендина-4 в течение 4 ч, после чего подвергали стрессу с 400 мкМ и 600 мкМ MG в течение 14 ч. Добавляли 50 мкл реагента ХТТ и инкубировали в течение 8 ч.
Фигура 8 демонстрирует, что предварительная обработка ликсисенатидом перед стрессом, вызванным MG или H2O2, дозозависимым образом достоверно увеличивала число выживших клеток, начиная с минимальной дозы 1 нМ, и с наилучшим результатом при 50 нМ (фигура 8А). Лираглутид тоже защищал эти клетки, но только в более высокой дозе, составлявшей 100 нМ (фигура 8B). Эксендин-4 не защищал клетки от стресса, вызванного MG или H2O2 (фигура 8B).
Материал и методики
Исследование с предварительной обработкой клеток SHSY-5Y при использовании метилглиоксаля в качестве стрессора
1. Клетки SHSY-5Y содержали в средах DMEM+F12 Glutamax (каталожный № 313310, Invitrogen Inc.) с 10% FBS (каталожный № 10437, Invitrogen Inc.) и 1% Penn Strep (каталожный № 15070063, Invitrogen Inc.).
2. Культуры, конфлюэнтные на 80-90%, трипсинизировали, используя 0,25× раствор трипсина с ЭДТА, и высевали в 96-луночные планшеты (каталожный № 55301, Orange Scientific), которые предварительно покрывали ламинином (L2020, Sigma) в концентрации 1 мкг/см2 в течение 2 часов при 37°C в CO2-инкубаторе и два раза промывали стерильной дважды дистиллированной водой.
3. Спустя 12-15 часов среды, содержавшие 10% FBS, заменяли на бессывороточные среды (SFM) в течение следующих 12 часов.
4. Клетки подвергали предварительной обработке инкретинами в течение 4 часов, анализ проводили в объеме 150 мкл с разными концентрациями, добавляя в контрольные образцы в течение 4 часов свежую среду SFM.
5. Лунки промывали 1× HBSS и в испытуемые и контрольные лунки добавляли по 150 мкл 600 мкМ метилглиоксаля (каталожный № M0252, Sigma) и SFM, соответственно, в течение 12 часов.
6. Для проведения анализа на LDH собирали супернатант, который хранили при -20°С.
7. К оставшимся клеткам добавляли 75 мкл раствора ХТТ (каталожный № 11465015001, Roche Inc.) (содержавшего связующий реагент) и инкубировали при 37°С в течение 4 часов. Этот анализ основан на способности метаболически активных клеток восстанавливать соль тетразолия ХТТ до окрашенных соединений, которые можно определять, измеряя оптическую плотность. Увеличение оптической плотности свидетельствует об увеличении числа метаболически активных клеток.
8. Значения оптической плотности получали, проводя измерения в каждой лунке при 492 нм и 690 нм и вычитая A690 из A492.
9. Для анализа на LDH (каталожный № G1780, Promega) 50 мкл супернатанта добавляли в лунки 96-луночного планшета вместе с 50 мкл субстрата и инкубировали в темноте при комнатной температуре в течение 60 минут.
10. Добавляли 50 мкл останавливающего раствора и измеряли оптическую плотность при 490 нм.
11. Данные исследований с ХТТ и LDH анализировали с использованием Prism V.
Резюме
Данные примера 2 демонстрируют, что ликсисенатид является подходящим для лечения и/или предупреждения нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, прогрессирующий супрануклеарный паралич, множественная системная атрофия, деменция с тельцами Леви, деменция при болезни Паркинсона или инсульт. Кроме того, ликсисенатид превосходит по свойствам эксенатид и такой аналог GLP-1, как лираглутид.
Предварительная обработка ликсисенатидом в дозе 10 нМ была достаточной для защиты клеток нейробластомы SH-SY5Y от стресса, вызванного 600 мкМ метилглиоксаля. Для защиты клеток от стресса, вызванного 600 мкМ метилглиоксаля, лираглутидом достаточной была его доза в 100-200 нМ, что свидетельствует о том, что для индуцирования защиты достаточна меньшая доза ликсисенатида. Таким образом, ликсисенатид является подходящим для предупреждения заболеваний, указанных выше. Эти данные согласуются с данными, полученными в примере 1 (фигуры 6A и B) и демонстрирующими, что ликсисенатид производил более значительные нейропротективные эффекты (против клеточного стресса) в клетках нейробластомы SH-SY5Y по сравнению с лираглутидом.
Более того, послестрессовая обработка ликсисенатидом была достаточной для защиты клеток нейробластомы SH-SY5Y после стресса, вызванного 2 мМ метилглиоксаля или 1 мМ H2O2. В отличие от этого, лираглутид не защищал клетки от стресса, вызванного MG или H2O2.
Пример 3
Обработка ликсисенатидом, являющимся агонистом рецептора глюкагоноподобного пептида-1 (GLP-1R), защищает нейрональные клетки человека от ротеноновой токсичности
В настоящем примере описаны эксперименты по нейропротективному действию в клеточных моделях, которые свидетельствуют в пользу применения ликсисенатида при лечении болезни Паркинсона, деменции при болезни Паркинсона, прогрессирующего супрануклеарного паралича, множественной системной атрофии и деменции с тельцами Леви. Настоящий пример демонстрирует, что ликсисенатид мог бы замедлять развитие заболевания, останавливать его или изменять его течение на обратное при болезни Паркинсона, деменции при болезни Паркинсона, прогрессирующем супрануклеарном параличе, множественной системной атрофии и деменции с тельцами Леви, защищая нейроны, повреждаемые при таком заболевании. Эти заболевания связаны с утратой нейронов, использующих дофамин в качестве нейромедиатора.
Настоящий пример относится к исследованиям, проведенным in vitro с культурами линий клеток человека, которые по своей природе являются дофаминергическими и которые называют человеческими мезэнцефалическими нейронами Lund (Lund human mesencephalic neurons, LUHMES). Эти клетки описаны в публикации Lotharius et al. (2002). Культуры этих клеток подвергали in vitro воздействию ротенона, который, как известно, убивает дофаминергические клетки и случайное или экологически неблагоприятное воздействие которого связывают с болезнью Паркинсона у людей. Связь ротенона с болезнью Паркинсона описана в публикациях Sherer et al., 2003 и Tanner et al., 2011. Ротенон, убивая нейроны, продуцирующие дофамин, может вызывать паркинсонизм, и поэтому с его помощью можно экспериментально воспроизводить на моделях главные особенности болезни Паркинсона у человека.
В настоящем примере ликсисенатид, являющийся агонистом рецептора глюкагоноподобного пептида-1 (GLP-1R), демонстрирует значительные нейропротективные эффекты в клетках LUHMES против нейродегенерации, индуцируемой ротеноном (фигура 9). Ликсисенатид предоставляет преимущества по сравнению с другими агонистами рецептора GLP-1 (GLP-1R). Нейропротективный эффект ликсисенатида против ротенона в клетках LUHMES является достоверно активным при концентрациях, которые в три раза меньше концентраций лираглутида (фигуры 9 и 11), причем этот результат согласуется с неожиданным более значительным по активности эффектом ликсисенатида, наблюдавшимся ранее в модели примера 1 с метилглиоксалем.
Эксенатид не индуцирует улучшения жизнеспособности при концентрации 0,3 мкМ или 1 мкМ. В отличие от этого, ликсисенатид при этих концентрациях обеспечивает значительное улучшение жизнеспособности (фигуры 9 и 10).
Материал и методики
Чтобы оценить нейропротективное действие против ротенона, клетки LUHMES выращивали при 37°С в атмосфере воздуха с 95%-ной влажностью и 5% CO2 в стандартных средах для культивирования клеток. После 2 дней культивирования в пластиковых сосудах добавляли дифференцировочную среду, содержавшую ростовые факторы, и клетки инкубировали еще в течение 2 дней. Клетки подвергали диссоциированию, высевали в покрытые многолуночные планшеты, добавив свежую дифференцировочную среду, и инкубировали в течение следующих 4 дней. На шестой день дифференцировки клетки обрабатывали разными концентрациями ликсисенатида, эксенатида (эксендина-4) или лираглутида и через 1 час после этого проводили обработку ротеноном (0,75 мкМ). Нейропротективный эффект измеряли спустя 72 часа, применяя анализ с резазурином (индикатор метаболически активных клеток, образующий флуоресцентный продукт в результате клеточной окислительно-восстановительной реакции). Произведенная флуоресценция пропорциональна числу жизнеспособных клеток в культурах, и таким образом измеряют степень защиты нейрональных клеток LUHMES, создаваемой проведенной обработкой. Данные измерений (n=12) сравнивали после нормализации результатов измерений жизнеспособности клеток по контрольным значениям без ротенона. Для статистического сравнения экспериментальных групп применяли однофакторный дисперсионный анализ с последующим анализом по критерию Даннета. Достоверными считали значения с p<0,05, на графиках они обозначены следующим образом: *p<0,05; **p<0,01; ***p<0,001; NS - недостоверно. Нейропротективный эффект выражали в процентах восстановления жизнеспособности, уменьшенной под влиянием ротенона.
Резюме
Данные примера 3 демонстрируют, что ликсисенатид является подходящим для лечения и/или предупреждения нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, прогрессирующий супрануклеарный паралич (PSP), множественная системная атрофия (MSA), деменция с тельцами Леви, деменция при болезни Паркинсона или инсульт. Кроме того, ликсисенатид превосходит по свойствам эксендин-4 и такой аналог GLP-1, как лираглутид.
В настоящем примере ликсисенатид демонстрирует значительные нейропротективные эффекты в клетках LUHMES против нейродегенерации, индуцированной ротеноном (фигура 9). Ликсисенатид предоставляет преимущества по сравнению с другими агонистами рецептора GLP-1 (GLP-1R). В клетках LUHMES, обработанных ротеноном, ликсисенатид является достоверно активным при концентрациях, которые в три раза меньше концентраций лираглутида. При концентрациях эксенатида, составлявших 0,3 мкМ или 1 мкМ, не наблюдали никакого значительного эффекта. В отличие от этого, ликсисенатид при этих концентрациях дозозависимым образом обеспечивает улучшение жизнеспособности.
Пример 4: Эффект ликсисенатида в трансгенных мышах APPswe/PS1∆E9
Чтобы дополнительно продемонстрировать важность ликсисенатида для лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера, в настоящем примере описан эффект лечения ликсисенатидом трансгенных мышей, несущих в мозге амилоидные бляшки. Трансгенные мыши APPswe/PS1∆E9 представляют собой хорошо охарактеризованную модель болезни Альцгеймера с выраженной амилоидной патологией мозга. Лечение трансгенных мышей APP/PS1 ликсисенатидом (10 нмоль/кг, в/бр, ежедневно) начинали в возрасте 7 месяцев, когда амилоидные бляшки в мозге уже образовались, и продолжали в течение 70 дней.
Трансгенные животные
Мыши APPswe/PS1∆E9 на основе линии C57Bl/6 были получены из Jackson lab (http://research.jax.org/repository/alzheimers.html). Гетерозиготных самцов скрещивали с самками C57Bl/6 дикого типа, приобретенными на местном рынке (Harlan, UK). У потомства делали проколы ушей и проводили генотипирование, используя ПЦР с праймерами, специфичными для последовательности АРР (в прямом направлении: “GAATTCCGACATGACTCAGG, SEQ ID NO:4”, в обратном: “GTTCTGCTGCATCTTGGACA, SEQ ID NO:5”). Мышей, не экспрессирующих трансген, использовали в качестве контроля дикого типа. Для всех исследований использовали только самцов. Животных содержали в индивидуальных клетках при 12/12-цикле чередования света и темноты (включение света в 8:00, выключение в 20:00) в термостатируемом помещении (Т: 21,5±1°С). Корм и вода были доступными свободно. Животные получали ежедневный уход в течение двух недель до начала исследования.
Лечение ликсисенатидом
В начале лечения возраст мышей составлял 7 месяцев. В это время у мышей уже наблюдалась амилоидная патология мозга. Один раз в день в течение 70 дней этим мышам внутрибрюшинно (в/бр) инъецировали ликсисенатид (10 нмоль/кг массы тела) или раствор соли (0,9% масс./об.). На эксперименты было получено разрешение Министерства внутренних дел Великобритании в соответствии с законом 1986 г. о научных процедурах в отношении животных.
Ликсисенатид получали от Sanofi. Лиофилизованный пептид растворяли в воде Milli-Q в концентрации 1 мг/мл. Аликвоты хранили в морозильной камере и для инъекции разбавляли 0,9%-ным раствором соли.
Гистологические препараты
Животных транскардиально перфузировали сначала буфером PBS, затем ледяным 4%-ным раствором параформальдегида в PBS. Мозг извлекали и фиксировали в 4%-ном параформальдегиде не менее 24 ч, после чего переносили на ночь в 30%-ный раствор сахарозы. Затем мозг мгновенно замораживали с использованием EnvirofreezTM и на глубине от -2 до -3 от брегмы на криостате Leica делали 40-микронные срезы коры. Срезы отбирали согласно стереологическим правилам, по которым первый срез и каждый шестой срез после него производятся случайным образом.
Используя стандартные методики (подробности см. у McClean et al. 2011), бета-амилоид окрашивали кроличьими поликлональными антителами к бета-амилоидному пептиду (1:200, Invitrogen, UK, 71-5800), а плотные бляшки в коре окрашивали конго красным. Бета-амилоид и конго красный анализировали, выполняя по 2 снимка (используя объектив 10×) коры на один срез (по 7-10 срезов на мозг; n=6 для ликсисенатида в дозе 10 нмоль/кг массы тела, n=12 для раствора соли). Все окрашивание визуализировали с помощью Axio Scope 1 (Zeiss, Germany) и анализировали, применяя многопороговое дополнение к Image J (NIH, USA).
Результаты
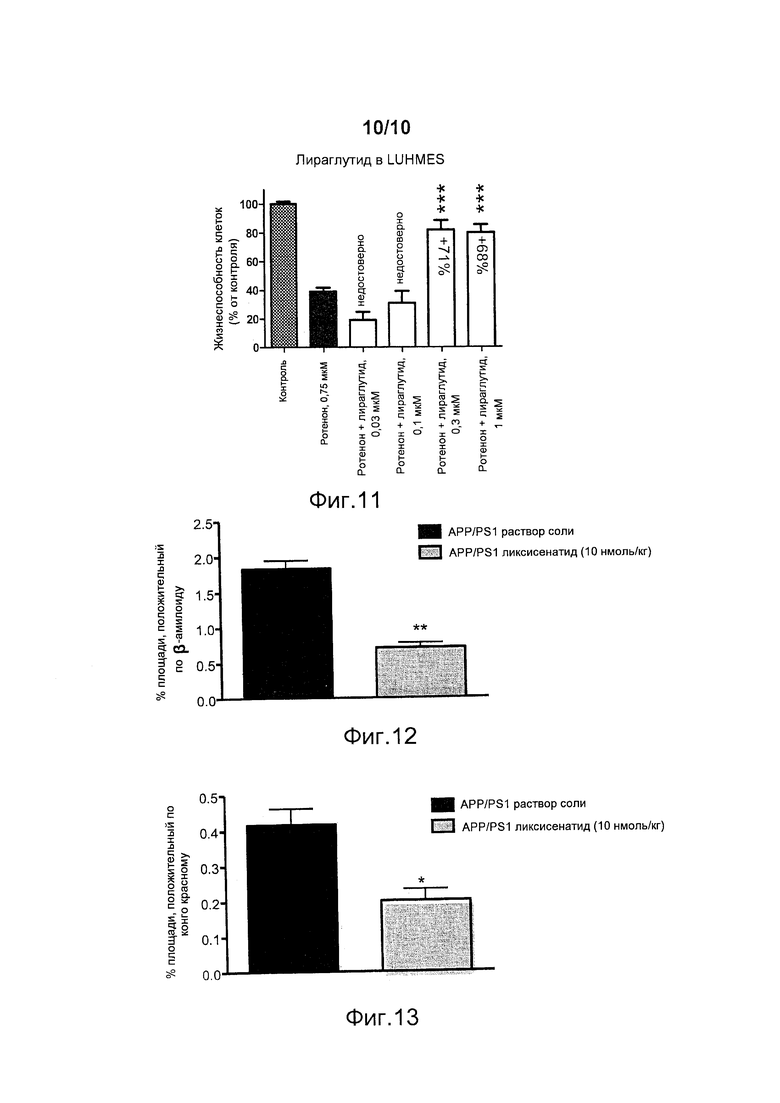
В трансгенных мышах APPswe/PS1∆E9, уже несущих амилоидную патологию мозга в начале эксперимента, лечение ликсисенатидом в течение 70 дней приводило к 62%-ному уменьшению общей массы амилоидных бляшек, измеренной по иммунореактивности бета-амилоида (p<0,0039; t-критерий для повторных измерений), по сравнению с мышами, которым вводили раствор соли (фигура 12).
Аналогичным образом, лечение ликсисенатидом на 52% уменьшало общую массу плотных амилоидных бляшек в коре, которую количественно определяли по гистологическому окрашиванию с конго красным (p=0,0419; t-критерий для повторных измерений), по сравнению с соответствующими мышами APP/PS1, которым вводили раствор соли (фигура 13).
Эту активность наблюдали при более низкой дозе (10 нмоль/кг), чем было описано ранее для лираглутида (25 нмоль/кг, McClean et al 2011).
Резюме
Эти данные, полученные с применением двух независимых технических подходов, демонстрируют, что ликсисенатид может уменьшать амилоидную патологию мозга в модели болезни Альцгеймера у животных. Эти данные демонстрируют, что ликсисенатид является подходящим для лечения и/или предупреждения нейродегенеративных заболеваний, таких как болезнь Альцгеймера, посредством уменьшения патологии мозга, обусловленной амилоидными бляшками. Поэтому, в дополнение к его нейропротективным свойства, ликсисенатид может уменьшать патологические повреждения, такие как амилоидные бляшки, и поэтому он представляет собой привлекательное средство для лечения и/или предупреждения болезни Альцгеймера. Кроме того, его активность достигается при дозе, которая является более низкой, чем описано ранее для такого аналога GLP-1, как лираглутид, как можно ожидать на основании данных примера 1.






Группа изобретений относится к медицине, а именно к неврологии, и относится к фармацевтической композиции, предназначенной для применения при предупреждении и/или лечении нейродегенеративного заболевания. Причем указанная композиция содержит desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, и нейродегенеративное заболевание представляет собой раннюю стадию болезни Альцгеймера или раннюю стадию болезни Паркинсона. Также предложен способ лечения с использованием указанной композиции. Группа изобретений обеспечивает возможность лечения ранних стадий болезни Альцгеймера и болезни Паркинсона за счет того, что ликсисенатид является более эффективным, чем лираглутид в части нейропротективного и нейродегенеративного эффекта, а также то, что эффекты ликсисенатида достигаются в более низкой дозе. 2 н. и 5 з.п. ф-лы, 13 ил., 4 пр.
1. Фармацевтическая композиция, предназначенная для применения при предупреждении и/или лечении нейродегенеративного заболевания, причем указанная композиция содержит desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, и нейродегенеративное заболевание представляет собой раннюю стадию болезни Альцгеймера или раннюю стадию болезни Паркинсона.
2. Фармацевтическая композиция, предназначенная для применения по п. 1, где нейродегенеративное заболевание связано с окислительным стрессом, утратой целостности нейритов, апоптозом, утратой нейронов и/или воспалительной реакцией.
3. Фармацевтическая композиция, предназначенная для применения по п. 1, где desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемая соль приготовлены для парентерального введения.
4. Фармацевтическая композиция, предназначенная для применения по п. 1 или 2, где нейродегенеративное заболевание связано с когнитивным нарушением.
5. Фармацевтическая композиция, предназначенная для применения по п. 1 или 2, где desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль готовят для введения в ежедневной дозе, выбранной из диапазона от 10 мкг до 20 мкг.
6. Способ предупреждения и/или лечения нейродегенеративного заболевания, включающий в себя введение фармацевтической композиции по любому из пп. 1-5 пациенту, нуждающемуся в этом, где нейродегенеративное заболевание представляет собой раннюю стадию болезни Альцгеймера или раннюю стадию болезни Паркинсона.
7. Способ по п. 6, где фармацевтическая композиция вызывает реакцию, модифицирующую заболевание.
| US 20050209142 A1, 22.09.2005 | |||
| WO2007120899 A2, 25.10.2007 | |||
| US2004242853 A1, 02.12.2004 | |||
| McCLEAN PL et al | |||
| The diabetes drug liraglutide prevents degenerative processes in a mouse model of Alzheimer's disease.// Neurosci | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| CHRISTENSEN M ET AL, "Lixisenatide, a novel GLP-1 receptor agonist for the treatment of type 2 diabetes mellitus", I DRUGS: THE INVESTIGATIONAL DRUGS JOURNAL, CURRENT DRUGS LTD, GB, (20090801), vol | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
Авторы
Даты
2017-05-03—Публикация
2012-09-03—Подача