Уровень техники настоящего изобретения
Аспекты и варианты осуществления настоящего изобретения относятся к лечению неврологических нарушений, таких как, например, болезнь Альцгеймера и болезнь Паркинсона. В частности, определенные варианты осуществления относятся к пептидам- коагонистам рецепторов GIP/GLP-1 для применения в лечении этих двух неврологических нарушений. Также в настоящее изобретение включены, среди прочего, фармацевтические композиции, содержащие пептиды-коагонисты рецепторов GIP/GLP-1, вместе со способами лечения таких нарушений, а также другие заявляемые объекты.
Предшествующий уровень техники настоящего изобретения
Болезнь Альцгеймера (БА) представляет собой хроническое нейродегенеративное нарушение, для которого в настоящее время не существует лечения. На сегодняшний день прописываемые лекарства лишь временно облегчают некоторые из симптомов. Основными признаками заболевания являются дезориентация, потеря памяти, потеря нейронов и синапсов в головном мозге, накопление бета-амилоидного белка в головном мозге (амилоидные бляшки) и внутриклеточная агрегация гиперфосфорилированного тау-белка (клубки) (LaFerla and Oddo, 2005; Blennow et al., 2006).
Болезнь Паркинсона (БП) также представляет собой хроническое нейродегенеративное заболевание, для которого в настоящее время доступными являются только замедляющие течение болезни лекарства. Основными признаками являются тремор, мышечная ригидность и потеря способности двигаться, дегенерация нейронов в стволе мозга (черной субстанции) и недостаточное высвобождение нейромедиатора дофамина (Shen, 2010).
Диабет 2 типа (T2DM) был идентифицирован как фактор риска развития БА и БП (Holscher, 2014), что указывает на то, что нарушение передачи сигнала с участием инсулина может являться фактором инициации или ускорения развития БА. С помощью эпидемиологических исследований была обнаружена очевидная взаимосвязь между T2DM и риском развития БА или других нейродегенеративных нарушений на более поздней стадии (Luchsinger et al., 2004; Ristow, 2004; Ohara et al., 2011). Также было показано, что передача сигнала с участием инсулина в головном мозге десенсибилизирована у пациентов с БА. В последних исследованиях было продемонстрировано, что в головном мозге пациентов с БА наблюдались повышенные уровни инактивированных фосфорилированных рецепторов инсулина и вторичных мессенджеров IRS-1, что в обоих случаях указывает на десенсибилизацию к инсулину (Moloney et al., 2010; Bomfim et al., 2012; Talbot et al., 2012). При БП также было обнаружено нарушение передачи сигнала с участием инсулина, и это связано с прогрессированием заболевания (Morris et al., 2011; Cereda et al., 2012).
Глюкагоноподобный пептид (GLP-1) является эндогенным инкретиновым гормоном, представляющим собой пептид из 30 аминокислот (Baggio and Drucker, 2007). Стимуляция рецептора GLP-1 усиливает пролиферацию бета-клеток в поджелудочной железе, активируя пролиферацию стволовых клеток, способствует зависимой от глюкозы секреции инсулина и обеспечивает снижение уровней глюкозы в крови у пациентов с T2DM (Lovshin and Drucker, 2009). В настоящее время на рынке представлены три аналога GLP-1 для лечения диабета, эксендин-4 (Byetta®, Bydureon®), ликсисенатид (Lyxumia®) и лираглутид (Victoza®) (Campbell and Drucker, 2013; Elkinson and Keating, 2013).
Глюкозозависимый инсулинотропный пептид (GIP), также известный как желудочный ингибиторный пептид, представляет собой состоящий из 42 аминокислот инкретиновый гормон, который активирует островки Лангерганса для усиления секреции инсулина и для содействия снижению постпрандиальной гипергликемии, подобно GLP-1 (Gault et al., 2003). GIP является членом семейства секретина/глюкагона нейрорегуляторных полипептидов, которые также включают соматотропин-рилизинг-фактор. Он экспрессируется в альфа-клетках поджелудочной железы, эндокринных клетках, а также в нейронах в головном мозге (Nyberg et al., 2007; Campbell and Drucker, 2013). Также было показано, что GIP способствует росту, дифференцировке, пролиферации и клеточному выживанию бета-клеток поджелудочной железы, что является доказательством его свойств как гормона роста (Gault et al., 2003). Следовательно, продолжаются исследования по разработке GIP как терапевтического инструмента для лечения T2DM (Irwin et al., 2006). На сегодняшний день не существует аналогов GIP, утвержденных для лечения T2DM.
Пептиды-двойные агонисты, которые целенаправленно воздействуют более чем на
один рецептор, рассматриваются для лечения T2DM. На сегодняшний день несколько пептидов-коагонистов рецепторов GIP/GLP-1 находятся на стадии разработки для лечения T2D. Однако, на сегодняшний день не существует двойных агонистов рецепторов GIP/GLP-
1, утвержденных для применения в лечении T2DM.
Последние исследования свойств GLP-1 и GIP в отношении нервной системы свидетельствуют о том, что эти пептиды могут играть роль в предупреждении нейродегенеративных симптомов в нескольких мышиных моделях болезни Альцгеймера (БА), а также в животных моделях болезни Паркинсона (БП).
Инсулин, а также инкретины, не только обладают подобными ростовым факторам свойствами в головном мозге, но также модулируют синаптическую активность (Holscher,
2014). Синапсы представляют собой контакты между нейронами, и они являются важными
для формирования памяти и обработки информации в головном мозге. Прямое введение GLP-1 или аналогов GLP-1 длительного действия в головной мозг заметно усиливает долговременную потенциацию синаптической передачи (LTP) в гиппокампе, области головного мозга, которая вовлечена в формирование памяти. LTP считается клеточным коррелятом формирования памяти (Bliss and Collingridge, 1993). Было показано, что аналог GLP-1, лираглутид, активирует LTP в головном мозге крыс (McClean et al., 2010).
Кроме того, аналоги GLP-1 могли предупреждать нарушение LTP, которое индуцировалось фрагментами бета-амилоида (Gault and Holscher, 2008a; McClean et al.,
2011; Gengler et al., 2012; Han et al., 2013). Такое нарушение LTP, обусловленное амилоидным белком, может быть механизмом, посредством которого амилоид вызывает потерю памяти (Cleary et al., 2005). В исследовании, в котором тестировали лираглутид в модели БА на мышах APP/PS1, было показано, что лекарственное средство может предупреждать нарушение формирования памяти и синаптической пластичности, уменьшение общего числа синапсов, нормализовать пролиферацию стволовых клеток и нейрогенез в зубчатой извилине, уменьшать воспалительный ответ и, более того, уменьшать нагрузку амилоидными бляшками в коре головного мозга и общие уровни амилоида в головном мозге (McClean et al., 2011). В другом исследовании лираглутид также оказывал защитные и регенерирующее эффекты у очень старых трансгенных мышей, демонстрируя, что даже на поздней стадии течения заболевания может быть улучшена память и до некоторой степени уменьшена нагрузка бляшками (McClean and Holscher, 2014).
На основании этих результатов в животных моделях было проведено пилотное клиническое испытание у пациентов с болезнью Альцгеймера. Было установлено, что аналог GLP-1 лираглутид обеспечивал защиту от индуцированного заболеванием ухудшения активности головного мозга и использования энергии. Это демонстрирует, что лекарственное средство проникает в головной мозг и защищает нейроны от повреждающих эффектов болезни Альцгеймера, сохраняя при этом нейроны активными и функциональными (Gejl et al., 2016). Началось клиническое испытание фазы II лираглутида у пациентов с БА (NCT01843075).
Кроме того, в одном исследовании из уровня техники изучали эффекты агониста рецептора GLP-1 эксендина-4 в модели БП, вызванной введением 6-гидроксидофамина. После того, как повреждение было индуцировано, крыс обрабатывали эксендином-4, и наблюдали защиту в отношении двигательной функции. В гистологическом анализе было показано, что эксендин-4 в обеспечивал существенное увеличение числа нейронов в черной субстанции, положительных как по тирозингидроксилазе, так и по везикулярному транспортеру моноаминов 2 (Bertilsson et al., 2008). Во втором исследовании для тестирования эффектов эксендина-4 применяли две крысиные модели БП, вызванной введением 6-гидроксидофамина (6-OHDA) и липополисахарида (LPS). Регуляция двигательной активности была значительно улучшена в группе лекарственного средства, и концентрации дофамина в тканях полосатого тела были заметно выше. Кроме того, эксендин-4 обеспечивал обращение потери внеклеточного DA в полосатом теле (Harkavyi et al., 2008). В случае тестирования агонистов рецептора GLP-1 лираглутида и ликсисенатида в мышиной модели болезни Паркинсона, вызванной MPTP, было обнаружено, что оба лекарственных средства оказывают надлежащие эффекты в отношении предупреждения нарушения двигательной функции, хронического воспаления в головном мозге и потери дофаминергических нейронов, индуцированных токсином MPTP (Liu et al., 2015).
На основании этих исследований было инициировано клиническое испытание эксендина-4 у пациентов с БП. В этом исследовании было показано, что в нескольких оценках двигательной функции и в когнитивном тестировании у пациентов наблюдалось улучшение, и улучшения сохранялись даже после отмены лекарственного средства в течение 12 месяцев (Aviles-Olmos et al., 2013; Aviles-Olmos et al., 2014). Началось клиническое испытание фазы II с участием пациентов с болезнью Паркинсона, в котором тестируют лекарственное средство лираглутид (NCT02953665).
Также проводили исследования для определения того, оказывают ли аналоги GIP или GIP эффект в отношении БА. Было обнаружено, что аналоги GIP могут предупреждать нарушение LTP, которое индуцируют фрагменты бета-амилоида в отношении синаптической передачи в головном мозге (Gault and Holscher, 2008b). У штамма мышей с делецией рецептора GIP LTP также была нарушена, и была снижена парная фасилитация, что указывает на снижение высвобождения синаптических везикул (Faivre et al., 2011). Аналог GIP D-Ala2-GIP длительного действия также оказывал нейропротекторные эффекты в модели БА на мышах APP/PS1. У мышей 12-месячного возраста, синаптическая пластичность в области CA1 гиппокампа и формирование пространственной памяти ухудшались в случае мышей APP/PS1, а у обработанных D-Ala2-GIP мышей APP/PS1 оставались незатронутыми. Кроме того, нагрузка амилоидными бляшками была значительно уменьшена, что демонстрирует значительные эффекты в отношении уменьшения выраженности основных признаков БА (Faivre and Holscher, 2013b).
У мышей с БА возрастом 19 месяцев лекарственное средство все еще могло обращать некоторые из симптомов БА, такие как потеря синапсов (Faivre and Holscher, 2013a). В продолжительном исследовании оксидативный стресс и воспалительный ответ в головном мозге были значительно уменьшены у мышей APP/PS1 (Duffy and Holscher, 2013). Это свидетельствует о том, что эти аналоги обладают нейропротекторными свойствами при БА и обеспечивают защиту синапсов от негативного воздействия бета-амилоида.
В мышиной модели болезни Паркинсона, вызванной MPTP, аналог GIP D-Ala2-GIP оказывал защитное действие и предупреждал ухудшение двигательной функции, потерю дофаминергических нейронов, потерю синапсов и хронический воспалительный ответ, индуцированный MPTP (Li et al., 2015).
При тестировании нового двойного агониста рецепторов GLP-1/GIP в этой мышиной модели было обнаружено, что он демонстрирует надлежащие защитные эффекты (Ji et al., 2015). Однако конкретно эта молекула не была так же эффективна, как аналоги GLP-1.
Остается необходимость в идентификации лекарственных препаратов для неврологических нарушений, таких как, например, нейродегенеративные заболевания, болезнь Альцгеймера и болезнь Паркинсона.
Целью определенных вариантов осуществления настоящего изобретения является по меньшей мере частичное решение проблем, связанных с предшествующим уровнем техники.
Целью определенных вариантов осуществления настоящего изобретения является обеспечение терапевтического пептида для применения в лечении и/или предупреждении нейродегенеративного нарушения, такого как, например, болезнь Альцгеймера и/или болезнь Паркинсона.
Целью определенных вариантов осуществления настоящего изобретения является обеспечение новых пептидов-двойных агонистов рецепторов GIP/GLP-1, которые обладают превосходящей эффективностью по сравнению с лучшим в своем классе агонистом GLP-1 однонаправленного действия лираглутидом, для применения в лечении и/или предупреждении болезни Альцгеймера или Паркинсона.
Целью определенных вариантов осуществления настоящего изобретения является обеспечение пептидов-двойных агонистов рецепторов GIP/GLP-1, которые обладают превосходящими свойствами по сравнению с агонистом GIP однонаправленного действия. Примеры превосходящих свойств включают, например, большую степень уменьшения нагрузки бета-амилоидными бляшками и/или уменьшения нарушения двигательных навыков.
Целью определенных вариантов осуществления настоящего изобретения является обеспечение новых пептидов-двойных агонистов рецепторов GIP/GLP-1 для применения в лечении и/или предупреждении нейродегенеративного нарушения, такого как, например, болезнь Альцгеймера и/или болезнь Паркинсона.
Краткое раскрытие настоящего изобретения
Согласно одному аспекту настоящего изобретения предусмотрен пептид-коагонист рецепторов GIP/GLP-1 или его фармацевтически приемлемая соль или сольват для применения в лечении и/или профилактике неврологического нарушения, где пептид- коагонист представлен общей формулой 1:
Tyr-Aib-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Ile-Tyr-Leu-Asp-Lys-Gln-Ala-Ala-Aib-Glu-Phe-Val-Xaa24-Trp-Leu-Leu-Ala-Gly-Y1-Y2-R2
(I) (SEQ. ID. No. 1),
где Xaa24 выбран из Asn и Cys;
Y1 выбран из удлинения, предусматривающего по меньшей мере восемь молекул аминокислот, или отсутствует;
Y2 выбран из:
Lys-Lys-Lys-Lys-Lys (SEQ. ID. No. 2);
Lys-Lys-Lys-Lys-Lys-Lys (SEQ. ID. No. 3)
Arg-Arg-Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr (SEQ. ID. No. 4); и
Lys-Arg-Arg-Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr (SEQ. ID. No. 5); и
R2 выбран из -NH2 или -OH,
или производным, или фармацевтически приемлемой солью или сольватом пептида или производного.
Согласно определенным вариантам осуществления Y2 представляет собой Lys-Lys-Lys-Lys-Lys или Lys-Lys-Lys-Lys-Lys-Lys.
Согласно определенным вариантам осуществления Y2 представляет собой Arg-Arg- Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr или Lys-Arg-Arg-Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr.
Согласно определенным вариантам осуществления Xaa24 представляет собой Cys.
Согласно определенным вариантам осуществления Xaa24 представляет собой Asn.
Согласно определенным вариантам осуществления Y1 представляет собой удлинение, предусматривающее по меньшей мере 10 аминокислот, например, по меньшей мере 11 аминокислот.
Согласно определенным вариантам осуществления Y1 выбран из:
Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser (SEQ. ID. No. 6);
Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Lys (SEQ. ID. No. 7);
Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Cys (SEQ. ID. No. 8);
Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser (SEQ. ID. No. 9);
Pro-Ser-Ser-Gly-Ala-Pro-Pro-Ser (SEQ. ID. No. 10); и его
отсутствия.
Соответствующим образом, Y1 представляет собой Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser (SEQ. ID. No. 6). Согласно определенным вариантам осуществления Y1 представляет собой Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Cys (SEQ. ID. No 8). Согласно альтернативному варианту осуществления Y1 представляет собой Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Lys (SEQ. ID. No. 7).
Согласно определенным вариантам осуществления пептид содержит гидрофильный фрагмент, ковалентно связанный с аминокислотой. Согласно определенным вариантам осуществления пептид содержит гидрофильный фрагмент, ковалентно связанный с аминокислотой в положении 24.
Согласно определенным вариантам осуществления пептид содержит гидрофильный фрагмент, ковалентно связанный с аминокислотой в положении 39 или 40, если Y1 представляет собой удлинение, предусматривающее по меньшей мере 10 аминокислот или по меньшей мере 11 аминокислот.
Согласно определенным вариантам осуществления Xaa39 или Xaa40 представляет собой Cys, и пептид содержит гидрофильный фрагмент, ковалентно связанный с Cys(39) или Cys(40).
Согласно определенным вариантам осуществления Xaa24 представляет собой Cys, и пептид содержит гидрофильный фрагмент, ковалентно связанный с Cys(24).
Согласно определенным вариантам осуществления гидрофильный фрагмент представляет собой водорастворимый полимер.
Согласно определенным вариантам осуществления водорастворимый полимер представляет собой полиэтиленгликолевый фрагмент, и необязательно представляет собой полиэтиленгликолевый фрагмент с молекулярной массой от приблизительно
20000 Дальтон до приблизительно 60000 Дальтон. Согласно определенным вариантам осуществления пептид конъюгирован с липофильным заместителем.
Согласно определенным вариантам осуществления липофильный заместитель содержит углеводородную цепь с 8-24 атомами углерода (C). Согласно определенным вариантам осуществления липофильный заместитель содержит ацильную группу.
Согласно определенным вариантам осуществления липофильный заместитель представляет собой молекулу жирной кислоты. Соответствующим образом, молекула жирной кислоты выбрана из C-8-октаноильной группы, C-10-деканоильной группы, C-12- лауроильной группы, C-14-миристоильной группы, C-16-пальмитоильной группы, C-18- стеароильной группы и C-20-ацильной группы.
Согласно определенным вариантам осуществления липофильный заместитель соединен с аминокислотой по карбоксильному концу пептида. Согласно определенным вариантам осуществления липофильный заместитель соединен с аминокислотой в положении 40. Соответствующим образом, липофильный заместитель ковалентно связан с боковой цепью аминокислоты пептида.
Согласно определенным вариантам осуществления пептид содержит спейсер,
который обеспечивает конъюгацию липофильного заместителя с аминокислотным остатком. Соответствующим образом, спейсер представляет собой остаток из встречающейся в природе или не встречающейся в природе аминокислоты, где спейсер предусматривает остаток Gly, Pro, Ala, Val, Leu, Ile, Met, Cys, Phe, Tyr, Trp, His, Lys, Arg, Gln, Asn, α-Glu, γ-Glu, ε-Lys, Asp, Ser, Thr, ГАМК, Aib, β-аминогексаноила, 7- аминогептаноила, 8-аминооктаноила, 9-аминононаноила, 10-аминодеканоила или 8-амино-3,6-диоксаоктаноила.
Согласно определенным вариантам осуществления спейсер представляет собой γ-Glu. Согласно определенным вариантам осуществления спейсер представляет собой дипептид, где необязательно спейсер предусматривает две отрицательно заряженные аминокислоты, и где дополнительно необязательно спейсер представляет собой γ-Glu-γ-Glu.
Согласно определенным вариантам осуществления пептид дополнительно предусматривает одну или несколько консервативных замен.
Согласно определенным вариантам осуществления пептид содержит аминокислотную последовательность:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKKKKKK-NH2 (SEQ. ID. No. 11),
где X = аминоизомасляная кислота.
Согласно определенным вариантам осуществления пептид состоит главным образом из аминокислотной последовательности:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKKKKKK-NH2 (SEQ. ID. No. 11),
где X = аминоизомасляная кислота.
Согласно определенным вариантам осуществления пептид содержит аминокислотную последовательность:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKRRQRRKKRGY-NH2 (SEQ. ID. No. 12),
где X = аминоизомасляная кислота.
Соответствующим образом, пептид состоит главным образом из аминокислотной последовательности:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKRRQRRKKRGY-NH2 (SEQ. ID. No. 12),
где X = аминоизомасляная кислота.
Согласно дополнительному аспекту настоящего изобретения предусмотрен описанный в настоящем документе пептид для применения в лечении и/или профилактике неврологического нарушения.
Согласно дополнительному аспекту настоящего изобретения предусмотрен описанный в настоящем документе пептид для применения в лечении неврологического нарушения, которое обусловлено или ассоциировано с отложением в виде бляшек бета- амилоидного белка в области у пациента. Согласно определенным вариантам осуществления отложение в виде бета-амилоидных бляшек имеет место в головном мозге пациента.
Согласно дополнительному аспекту настоящего изобретения предусмотрен описанный в настоящем документе пептид для применения в лечении и/или профилактике неврологического нарушения, обусловленного или ассоциированного с дисфункцией долговременной потенциации синаптической передачи.
Согласно дополнительному аспекту настоящего изобретения предусмотрен описанный в настоящем документе пептид для применения в лечении и/или профилактике неврологического нарушения, обусловленного или ассоциированного с воспалением.
Согласно дополнительному аспекту настоящего зобретения редусмотрен описанный в настоящем документе пептид для применения в лечении неврологического нарушения, ассоциированного с нарушением двигательной функции.
Согласно дополнительному аспекту настоящего изобретения предусмотрен описанный в настоящем документе пептид для применения в лечении и/или профилактике неврологического нарушения, затрагивающего когнитивную функцию, например, деменции, инсульта, шизофрении и/или биполярного расстройства.
Согласно определенным вариантам осуществления нарушение представляет собой ишемию головного мозга, ассоциированную с инсультом.
Согласно определенным вариантам осуществления пептид предназначен для применения в лечении и/или профилактике нарушения, выбранного из посттравматического стрессового расстройства, эпилепсии, синдрома Туретта и галлюцинаций; и дисфункциональных когнитивных процессов, необязательно выбранных из внимания, вычислений, памяти, умозаключения, понимания, обучения и логического мышления.
Согласно определенным вариантам осуществления пептид предназначен для применения в лечении и/или профилактике нейродегенеративного нарушения, например, болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического склероза, периферической невропатии, болезни Хантингтона и болезни Крейтцфельда-Якоба.
Соответствующим образом, неврологическое нарушение представляет собой рассеянный склероз.
Согласно определенным вариантам осуществления пептид предназначен для применения в лечении и/или профилактике неврологического нарушения, выбранного из болезни Альцгеймера на клинической или доклинической стадии, болезни Альцгеймера на продромальной стадии и амилоидной ангиопатии (ЦАА) на клинической или доклинической стадии.
Соответствующим образом, пептид предназначен для применения в лечении и/или профилактике болезни Альцгеймера на клинической стадии.
Согласно дополнительному аспекту настоящего изобретения предусмотрен описанный в настоящем документе пептид для применения в лечении и/или профилактике болезни Паркинсона.
Также предусмотрен способ лечения и/или предупреждения описанного в настоящем документе неврологического нарушения, причем способ предусматривает введение фармацевтически эффективного количества описанного в настоящем документе пептида-коагониста рецепторов GIP/GLP-1 нуждающемуся в этом субъекту.
Согласно дополнительному аспекту настоящего изобретения предусмотрен способ лечения и/или предупреждения неврологического нарушения, предусматривающий введение нуждающемуся в этом пациенту фармацевтической композиции, содержащей пептид-коагонист рецепторов GIP/GLP-1 или производное, или фармацевтически приемлемую соль или сольват пептида или производного,
где указанный пептид-коагонист представлен общей формулой I:
Tyr-Aib-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Ile-Tyr-Leu-Asp-Lys-Gln-Ala-Ala-Aib- Glu-Phe-Val-Xaa24-Trp-Leu-Leu-Ala-Gly-Y1-Y2-R2
(I) (SEQ. ID. No. 1),
где Xaa24 выбран из Asn и Cys;
Y1 выбран из удлинения, предусматривающего по меньшей мере восемь молекул аминокислот, или отсутствует;
Y2 выбран из:
Lys-Lys-Lys-Lys-Lys (SEQ. ID. No. 2);
Lys-Lys-Lys-Lys-Lys-Lys (SEQ. ID. No. 3),
Arg-Arg-Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr (SEQ. ID. No. 4); и
Lys-Arg-Arg-Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr (SEQ. ID. No. 5); и
R2 выбран из -NH2 или -OH,
или производным, или фармацевтически приемлемой солью или сольватом пептида или производного.
Соответствующим образом, пептид является таким, как описано в настоящем документе.
Согласно определенным вариантам осуществления неврологическое нарушение выбрано из посттравматического стрессового расстройства, эпилепсии, синдрома Туретта и галлюцинаций; и дисфункциональных когнитивных процессов, необязательно выбранных из внимания, вычислений, памяти, умозаключения, понимания, обучения и логического мышления.
Согласно определенным вариантам осуществления неврологическое нарушение представляет собой нейродегенеративное нарушение. Соответствующим образом, нейродегенеративное нарушение выбрано из болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, бокового амиотрофического склероза, периферической невропатии и болезни Крейтцфельда-Якоба.
Согласно определенным вариантам осуществления неврологическое нарушение представляет собой неврологическое нарушение, выбранное из болезни Альцгеймера на клинической или доклинической стадии, болезни Альцгеймера на продромальной стадии и амилоидной ангиопатии (ЦАА) на клинической или доклинической стадии. Соответствующим образом, неврологическое нарушение представляет собой болезнь Альцгеймера на клинической стадии.
Согласно дополнительному аспекту настоящего изобретения предусмотрен пептид для применения в лечении и/или профилактике болезни Альцгеймера на клинической стадии, причем пептид состоит из следующей последовательности:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKKKKKK-NH2 (SEQ. ID. No. 11),
где X = аминоизомасляная кислота.
Согласно дополнительному аспекту настоящего изобретения предусмотрен пептид для применения в лечении и/или профилактике болезни Альцгеймера на клинической стадии, причем пептид состоит из следующей последовательности:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKRRQRRKKRGY-NH2 (SEQ. ID. No. 12),
где X = аминоизомасляная кислота.
Согласно одному варианту осуществления пептид содержит следующую аминокислотную последовательность:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKKKKKK-NH2 (SEQ. ID. No. 11),
где X = аминоизомасляная кислота, или состоит из нее.
Этот пептид в настоящем документе называется «DA4», и имеет аминокислотную последовательность, изложенную в SEQ. ID. No. 11.
Согласно одному варианту осуществления пептид содержит следующую аминокислотную последовательность:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKRRQRRKKRGY-NH2 (SEQ. ID. No. 12),
где X = аминоизомасляная кислота, или состоит из нее.
Этот пептид в настоящем документе называется «DA5», и имеет аминокислотную последовательность, изложенную в SEQ. ID. № 12.
При лечении нейродегенеративных нарушений может использоваться способность проходить гематоэнцефалический барьер. Не вдаваясь в теорию, считается, что пептиды согласно определенным вариантам осуществления настоящего изобретения способны проходить гематоэнцефалический барьер. Кроме того, пептиды согласно определенным вариантам осуществления проходят гематоэнцефалический барьер с более высокой скоростью, по сравнению с известными пептидами-коагонистами рецепторов GIP/GLP-1.
Следует отметить, что могут иметь место множество трудностей в отношении переноса пептида через гематоэнцефалический барьер. Был рассмотрен ряд различных механизмов улучшения доступа через гематоэнцефалический барьер, одним из которых является модификация пептидных последовательностей. Однако, хотя известно, что ряд модификаций пептидов потенциально способствуют прохождению гематоэнцефалического барьера, их поведение in vivo трудно предсказать. Введение их в молекулу пептида или белка может быть неэффективным или может привести к инактивации пептида или белка, например, за счет процессов разрушения белка, некорректных паттернов фолдинга пептидов и/или изменения свойств связывания рецептора пептида.
Соответствующим образом, пептид предназначен для применения в лечении и/или предупреждении болезни Альцгеймера или болезни Паркинсона.
Также в настоящем документе предусмотрена фармацевтическая композиция, которая содержит пептиды-коагонисты рецепторов GIP/GLP-1, описанные в настоящем документе, и фармацевтически приемлемый носитель для применения в лечении и/или профилактике описанного в настоящем документе неврологического нарушения. Дополнительно в настоящем раскрытии предусмотрен набор, включающий такую фармацевтическую композицию.
Краткое описание чертежей
Дополнительные подробности вариантов осуществления настоящего изобретения со ссылкой на прилагаемые чертежи, исключительно в качестве примера, представлены ниже: В контексте настоящего документа сокращение «DA4» относится к коагонисту рецепторов GIP/GLP-1, состоящему из аминокислотной последовательности, показанной в
SEQ ID. No. 11.
В контексте настоящего документа сокращение «DA5» относится к коагонисту рецепторов GIP/GLP-1, состоящему из аминокислотной последовательности, показанной в SEQ ID. № 12.
На фиг. 1 представлены результаты иммуногистохимического измерения нагрузки бета-амилоидными бляшками в коре головного мозга трансгенных мышей (модель болезни Альцгеймера). Все пептиды уменьшали нагрузку бляшками. Оба пептида-коагониста (DA4 и DA5) согласно вариантам осуществления настоящего изобретения превосходили отдельные аналоги GIP или GLP-1, и введение DA4 и DA5 обеспечивает уменьшение нагрузки бета-амилоидными бляшками, как количественно определено с помощью иммуногистохимического исследования в отношении бета-амилоида и определения % площади, положительной по бета-амилоиду в поперечных срезах коры головного мозга.
*= p<0,05, **=p<0,01; ***=p<0,001. N=6 на группу.
Фиг. 2 представляет собой график, на котором показано, что пептиды DA4 и DA5 обеспечивали защиту от потери синапсов в коре головного мозга трансгенных мышей (модель болезни Альцгеймера), как количественно определено с помощью иммуногистохимического измерения синаптической плотности в коре головного мозга трансгенных мышей. Все пептиды обеспечивали защиту от потери синапсов. Оба пептида-коагониста согласно вариантам осуществления настоящего изобретения превосходили отдельные аналоги GIP или GLP-1. *= p<0,05, **=p<0,01; ***=p<0,001. N=6 на группу.
Фиг. 3 представляет собой график, на котором показано, что пептиды DA4 и DA5 обеспечивают у мышей защиту от нарушения двигательных навыков, индуцированного MPTP для снижения уровней дофамина. Тест вращающегося стержня для оценки двигательных навыков осуществляли, как описано ниже. Регистрировали продолжительность удерживания для каждого животного, и рассчитывали среднее значение. Данные анализировали с применением однофакторного дисперсионного анализа с апостериорным критерием Бонферрони. Оба пептида-коагониста согласно вариантам осуществления настоящего изобретения превосходили отдельные аналоги GIP или GLP-1. Контроль = мышь дикого типа без введения MPTP. *= p<0,05, **=p<0,01; ***=p<0,001. N=6 на группу.
На фиг. 4 представлено MPTP-индуцированное уменьшение количества фермента
TH, который обеспечивает синтез дофамина в компактной части черной субстанции. Как DA4, так и DA5 обеспечивал защиту дофаминергических нейронов в большей степени, чем отдельные аналоги GIP и GLP-1. *= p<0,05, **=p<0,01; ***=p<0,001. N=6 на группу.
На фиг. 5 представлено, что пептид DA5 не влияет на двигательное и исследовательское поведение мышей APP/PS1 и мышей дикого типа. Тест «открытое поле» осуществляли для исследования спонтанного поведения мышей, обработанных солевым раствором/DA5. В статистическом анализе (p=>0,05) не было показано какой-либо разницы между группами, получающими солевой раствор/DA5 (a,b).
На фиг. 6 показано улучшение кратковременной пространственной памяти мышей APP/PS1 в тесте Y-образного лабиринта после обработки пептидом DA5. Процентная доля правильного чередования у мышей APP/PS1 была значимо снижена. *= p<0,05, **=p<0,01;
***=p<0,001. N=8-14 на группу.
На фиг. 7 показано, что нарушение пространственной памяти, наблюдаемое у мышей APP/PS1, может быть облегчено с помощью лечения пептидом DA5. Осуществляли классический тест водного лабиринта Морриса и оценивали пространственную память мышей с помощью проверочного испытания, как описано ниже. (Фиг. 7а, 7b) Для каждого животного записывали латентные периоды нахождения платформы в течение периода обучения и рассчитывали среднее значение. (Фиг. 7c, 7d). Проверочный тест указывал на то, что обработанные DA5 мыши APP/PS1 вспоминали путь спасения лучше, чем мыши APP/PS1, обработанные солевым раствором. *= p<0,05, **=p<0,01; ***=p<0,001. N=8-14 на группу.
На фиг. 8 показано, что пептид DA5 обеспечивает у мышей APP/PS1 защиту от снижения когнитивной гибкости и восстановление способности к переобучению. Реверсивный тест водного лабиринта Морриса осуществляли, как описано ниже. (Фиг. 8a, фиг. 8b). Для каждого животного записывали латентные периоды нахождения платформы в течение увеличенного периода обучения и рассчитывали среднее значение (фиг. 8c, 8d). Проверочный тест указывал на то, что обработанные DA5 мыши APP/PS1 вспоминали изменение пути спасения лучше, чем мыши APP/PS1, обработанные солевым раствором.
*= p<0,05, **=p<0,01; ***=p<0,001. N=8-14 на группу.
На фиг. 9 показано, что пептид DA5 обеспечивает сохранение силы синапса у мышей APP/PS1 (фиг. 9a). Предварительная обработка мышей DA5 может обращать снижение L-LTP, наблюдаемое у трансгенных мышей APP/PS1 (фиг. 9b) Кроме того, у обработанных DA5 мышей APP/PS1 сохранялись высокие уровни L-LTP после стимуляций нейронов. *= p<0,05, **=p<0,01; ***=p<0,001. N=6 на группу.
Фиг. 10 представляет собой график, на котором показано, что DA5 уменьшает количество нейрофибриллярных клубков у мышей APP/PS1. Количественное определение иммунофлуоресцентного окрашивания ф-тау-белка указывает на уменьшение нейрофибриллярных клубков у мышей APP/PS1, обработанных DA5, по сравнению с мышами APP/PS1, обработанными солевым раствором.
*= p<0,05, **=p<0,01; ***=p<0,001. N=4 на группу.
На фиг. 11 показаны результаты вестерн-блоттинга и графики, на которых показано, что DA5 может обеспечивать защиту в отношении познавательного поведения и улучшение в отношении патологических изменений у мышей с БА. Обработка мышей APP/PS1 DA5 предотвращает избыточную активацию GSKβ за счет активации сигнального пути P13/AKT (a-g). *= p<0,05, N=6 на группу.
На фиг. 12 представлены аминокислотные последовательности пептидов, описанных в настоящем документе.
Подробное раскрытие вариантов осуществления настоящего изобретения
Для выполнения на практике вариантов осуществления настоящего изобретения будут использоваться, если не указано иное, традиционные методики молекулярной биологии, микробиологии, технологии рекомбинантных ДНК и иммунологии, которые находятся в компетенции специалистов в данной области.
Самые общие методики молекулярной биологии, микробиологии, технологии
рекомбинантных ДНК и иммунологии можно найти в Sambrook et al, Molecular Cloning, A Laboratory Manual (2001) Cold Harbor-Laboratory Press, Колд Спринг Харбор, Нью-Йорк, или Ausubel et al., Current protocols in molecular biology (1990) John Wiley and Sons, Нью- Йорк. Если не указано иное, все применяемые в настоящем документе технические и научные термины имеют те же значения, которые обычно понятны рядовому специалисту в данной области, к которой относится настоящее раскрытие. Например, Concise Dictionary of Biomedicine and Molecular Biology, Juo, Pei-Show, 2-е издание, 2002 г, CRC Press; The Dictionary of Cell and Molecular Biology, 3-е издание, Academic Press; и издания Oxford University Press, предоставляют специалисту в данной области общий словарь множества применяемых в настоящем раскрытии терминов.
Настоящее раскрытие относится к применению пептидов-коагонистов рецепторов GIP/GLP-1. Последовательности нативных пептида GLP-1 и пептида GIP человека известны в данной области. Термин «GLP-1» или «hGLP-1» в контексте настоящего документа относится к глюкагоноподобному пептиду-1 (GLP-1 (7-37)) человека, последовательность которого включена в настоящий документ как SEQ ID. No. 13.
Пептид с последовательностью SEQ ID. No 13 также может называться «нативным» GLP-1.
Последовательность GLP-1 (7-37) Homo sapiens представляет собой:
HAEGTFTSDV SSYLEGQAAK EFIAWLVKGR G-OH (SEQ ID No. 13).
Термин «GIP» или «hGIP» в контексте настоящего документа относится к желудочному ингибиторному пептиду человека (также известному как глюкозозависимый инсулинотропный пептид), последовательность которого включена в настоящий документ как SEQ. ID. No. 14. Пептид с последовательностью SEQ. ID. No. 14 также может называться «нативным» GIP:
YAEGTFISDYSIAMDKIHQQDFVNWLLAQKGKKNDWKHNITQ-OH (SEQ ID. No 14).
Подразумевается, что в контексте настоящего документа общее упоминание «GIP» или «GLP-1» в отсутствие какого-либо дополнительного обозначения означает нативный GIP или нативный GLP-1 соответственно.
В контексте настоящего документа термин «пептид» охватывает последовательность из 3 или более аминокислот и, как правило, менее 50 аминокислот, где аминокислоты являются встречающимися в природе или не встречающимися в природе аминокислотами. Не встречающиеся в природе аминокислоты относятся к аминокислотам, которые не встречаются в природе in vivo, но которые, тем не менее, могут быть включены в описанные в настоящем документе пептидные структуры.
В контексте настоящего документа термины «полипептид» и «белок» являются терминами, которые применяют взаимозаменяемо для обозначения полимера из аминокислот, независимо от длины полимера. Как правило, полипептиды и белки имеют длину полимера, которая превышает таковую «пептидов».
В контексте настоящего документа аминокислотная «модификация» относится к
замене, добавлению или делеции аминокислоты, и включает замену или добавление любой из 20 аминокислот, обычно встречающихся в белках человека, а также нетипичных или не встречающихся в природе аминокислот. По всему тексту заявки все упоминания конкретного положения аминокислоты по номеру (например, положение 28) относятся к аминокислоте в таком положении в двойном агонисте рецепторов GIP/GLP-1 согласно вариантам осуществления настоящего изобретения.
В настоящем описании применяют традиционные однобуквенные и трехбуквенные коды для встречающихся в природе аминокислот, а также общепринятые трехбуквенные коды для других аминокислот, таких как, например, Aib (α-аминоизомасляная кислота).
Таким образом, согласно определенному аспекту настоящего изобретения предусмотрен пептид-коагонист рецепторов GIP/GLP-1, или производное, или фармацевтически приемлемая соль или сольват пептида или производного, для применения в лечении и/или профилактике неврологического нарушения. Соответствующим образом, пептид-коагонист характеризуется процентной активностью в отношении рецептора GLP-
1, приблизительно в 10 раз превышающей процентную активность в отношении GIP.
В контексте настоящего документа термин «агонист» относится к веществу (лиганду), которое активирует данный тип рецептора. Термины «двойной агонист» и «коагонист» применяют в настоящем документе взаимозаменяемо, и они относятся к веществу (лиганду), которое активирует два типа рецепторов. Соответствующим образом, описанные в настоящем документе пептиды-коагонисты рецепторов GIP/GLP-1 характеризуются равновесной активностью в отношении как GLP-1R, так и GIPR. Согласно одному варианту осуществления пептид-коагонист характеризуется EC50 в отношении рецептора GLP-1 человека, приблизительно в 10 раз превышающим EC50 в отношении рецептора GIP человека. Активность в in vitro анализах можно применять в качестве меры активности пептидов.
Соответствующим образом, описанные в настоящем документе пептиды синтезируют с помощью твердофазного или жидкофазного синтеза пептидов, как описано, например, в WO98/11125. Соответствующим образом, пептиды можно синтезировать, как описано в Finan et al. (Sci. Transl. Med. 5 209ra151 (2013) pp 1-16).
Пептиды по настоящему раскрытию могут быть составлены в виде фармацевтических композиций, полученных для хранения или введения, для применения в лечении и/или предупреждении описанного в настоящем документе неврологического нарушения. Такая композиция, как правило, содержит терапевтически эффективное количество пептида-коагониста рецепторов GIP/GLP-1, в соответствующей форме, в фармацевтически приемлемом носителе.
Терапевтически эффективное количество описанного в настоящем документе пептида-коагониста рецепторов GIP/GLP-1 будет зависеть от пути введения, вида подлежащего лечению млекопитающего и физических характеристик данного конкретного млекопитающего. Эти факторы и их взаимосвязь для определения такого количества хорошо известны практикующим специалистам в области медицины. Такое количество и способ введения могут быть адаптированы для достижения оптимальной эффективности, и могут зависеть от таких факторов, как вес, рацион, сопутствующая лекарственная терапия и другие факторы, хорошо известные специалистам в области медицины. Пептиды по настоящему раскрытию могут быть особенно пригодными для лечения людей.
Эффективная дозировка и протокол лечения могут быть определены с помощью традиционных способов, начиная с низкой дозы у лабораторных животных, а затем повышая дозировку с отслеживанием при этом эффектов, а также систематически варьируя схему применения. При определении оптимальной дозировки для данного субъекта клиницист может учитывать множество факторов. Такие учитываемые факторы известны специалисту в данной области.
Термин «фармацевтически приемлемый носитель» включает любой из стандартных фармацевтических носителей. Фармацевтически приемлемые носители для терапевтического применения хорошо известны в области фармацевтики, и описаны, например, в Remington’s Pharmaceutical Sciences, Mack Publishing Co. (A.R.Gennaro edit. 1985). Например, можно применять стерильный солевой раствор и забуференный фосфатом солевой раствор со слабокислым или физиологическим pH. Средства, поддерживающие pH в определенном диапазоне, могут представлять собой фосфат, цитрат, ацетат, трис/гидроксиметил)аминометан (TRIS), N-трис(гидроксиметил)метил-3- аминопропансульфоновую кислоту (TAPS), гидрокарбонат аммония, диэтаноламин, гистидин, аргинин, лизин или ацетат, или их смеси. Термин дополнительно охватывает любые средства, представленные в фармакопеи США для применения у животных, включая людей.
Термин «фармацевтически приемлемая соль» относится к соли любого из пептида- коагониста рецепторов GIP/GLP-1 согласно вариантам осуществления настоящего изобретения. Соли включают фармацевтически приемлемые соли, такие как соли присоединения кислоты и основные соли. Примеры солей присоединения кислоты включают хлористоводородные соли, соли лимонной кислоты и соли уксусной кислоты.
Примеры основных солей включают соли, в которых катион выбран из щелочных металлов, таких как натрий и калий, щелочноземельных металлов, таких как кальций, и аммоний- ионов +N(R3)3(R4), в которых R3 и R4 независимо обозначают необязательно замещенный C1-6-алкил, необязательно замещенный C2-6-алкенил, необязательно замещенный арил или необязательно замещенный гетероарил. Другие примеры фармацевтически приемлемых солей описаны в “Remington’s Pharmaceutical Sciences”, 17-е издание. Ed. Alfonoso R. Gennaro (Ed.), Mark Publishing Company, Истон, Пенсильвания США, 1985 г и более поздние издания, и в химико-технологической энциклопедии (Encyclopaedia of Pharmaceutical Technology).
Термин «сольват» в контексте настоящего раскрытия относится к комплексу определенной стехиометрии, образующемуся между растворенным веществом (например, пептидом или его фармацевтически приемлемой солью в соответствии с настоящим раскрытием) и растворителем. Растворитель в этой связи может представлять собой, например, воду, этанол или другие фармацевтически приемлемые, как правило, низкомолекулярные органические вещества, такие как без ограничения уксусная кислота или молочная кислота. Если данным растворителем является вода, такой сольват обычно называют гидратом.
«Лечение» является подходом для получения благоприятных или требуемых клинических результатов. Для целей настоящего раскрытия благоприятные или требуемые клинические результаты включают без ограничения ослабление симптомов, уменьшение степени заболевания, стабилизированное (т. е. без ухудшения) течение заболевания, задержку или замедление прогрессирования заболевания, облегчение или смягчение течения заболевания и ремиссию (частичную или полную), выявляемую или невыявляемую. «Лечение» также может означать продление выживания по сравнению с ожидаемым выживанием в случае отсутствия получения лечения. «Лечение» представляет собой вмешательство, осуществляемое с целью предупреждения развития или изменения патологической картины при нарушении. Соответственно, «лечение» относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам, согласно определенным вариантам осуществления. Нуждающиеся в лечении включают таковых с уже существующим нарушением, а также таковых, у которых нарушение подлежит предупреждению. Под лечением подразумевается ингибирование или уменьшение увеличения выраженности патологии или симптомов, по сравнению с отсутствием лечения, и оно не обязательно подразумевает полное устранение соответствующего состояния.
Фармацевтические композиции для применения в лечении неврологического нарушения могут находиться в стандартной лекарственной форме. В такой форме композиция разделена на разовые дозы, содержащие соответствующие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, при этом упаковка содержит дискретные количества препаратов, например, упакованные таблетки, капсулы и порошки во флаконах или ампулах. Стандартная лекарственная форма также может представлять собой собственно капсулу, облатку или таблетку, или она может представлять собой соответствующее количество любой из этих упакованных форм. Она может быть представлена в виде инъецируемой формы для введения однократной дозы, например, в форме шприц-ручки. Согласно определенным вариантам осуществления упакованные формы включают этикетку или вкладыш с инструкциями по применению. Композиции могут быть составлены для любого подходящего пути и способа введения. Фармацевтически приемлемые носители или разбавители включают таковые, применяемые в составах, подходящих для перорального, ректального, назального, местного (включая буккальное и сублингвальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и чрескожное) введения. Составы обычно могут быть представлены в виде стандартной лекарственной формы, и могут быть получены с помощью способов, хорошо известных в области фармации.
В контексте настоящего документа «эффективное» количество или «терапевтически эффективное количество» пептида относится к нетоксичному, но достаточному количеству пептида для обеспечения требуемого эффекта. Количество, которое является «эффективным», будет варьироваться от субъекта к субъекту в зависимости от возраста и общего состояния индивидуума, способа введения и т. д. Соответствующее «эффективное» количество в каждом отдельном случае может быть определено специалистом в данной области с применением стандартных экспериментов.
Термины «пациент», «субъект» и «индивидуум» можно применять взаимозаменяемо, и они относятся либо к человеку, либо к отличному от человека млекопитающему. Соответствующим образом, субъектом является человек.
Описанные в настоящем документе пептиды можно применять для лечения и/или предупреждения неврологического нарушения, например, нейродегенеративного нарушения. Согласно одному варианту осуществления пептид предназначен для применения в лечении и/или предупреждении болезни Альцгеймера. Болезнь Альцгеймера (БА) представляет собой нейродегенеративное нарушение, которое приводит к потере кортикальных нейронов, особенно в ассоциативных зонах коры головного мозга и гиппокампе, что в свою очередь приводит к медленной и прогрессивной потере когнитивных функций, что в конечном итоге приводит к деменции и смерти. Основными признаками заболевания являются агрегация и отложение неправильно свернутых белков, таких как агрегированный бета-амилоидный пептид, в виде внеклеточных сенильных или нейритных «бляшек», и гиперфосфорилированный тау-белок, в виде внутриклеточных нейрофибриллярных «клубков» (NFT).
С генетической точки зрения БА делится на две формы: (1) семейная БА с ранним началом (<60 лет) и (2) спорадическая БА с поздним началом (>60 лет). Известно, что обуславливающие заболевание мутации в генах белка-предшественника амилоида (APP), пресенилина 1 (PSEN1) и пресенилина 2 (PSEN2) изредка приводят к развитию семейной БА с ранним началом, тогда как APOE (аллель 4) является наиболее важным фактором риска развития БА с поздним началом.
Хотя болезнь Альцгеймера развивается по-разному у каждого индивидуума, существует множество общих симптомов. Ранние симптомы зачастую ошибочно считают «возрастными» проблемами или проявлениями стресса. На ранних стадиях наиболее распространенным симптом является затруднение в запоминании последних событий. Если есть подозрение на БА, диагноз обычно подтверждают с использованием тестов, с помощью которых оценивается поведение и интеллектуальные способности, зачастую, если возможно, с последующим сканированием мозга, однако для окончательного диагноза требуется исследование ткани мозга.
По мере развития болезни симптомы могут включать спутанность сознания, раздражительность, агрессию, перепады настроения, проблемы с речью и потерю долгосрочной памяти. Когда состояние больного ухудшается, зачастую он может покидать семью и общество. Постепенно утрачиваются функции организма, что в конечном итоге приводит к смерти. Поскольку течение заболевания отличается у каждого индивидуума, предсказать, как оно повлияет на личность, сложно. БА развивается в течение неизвестного и вариабельного периода времени, прежде чем становится полностью очевидным, и может прогрессировать без постановки диагноза годами. В среднем ожидаемая продолжительность жизни после постановки диагноза составляет примерно семь лет. Менее трех процентов индивидуумов живут более четырнадцати лет после постановки диагноза.
Согласно одному варианту осуществления пептид-коагонист предназначен для применения в лечении болезни Альцгеймера. Пептид можно применять для замедления и/или остановки прогрессирования болезни Альцгеймера у субъекта. Пептид может быть предназначен для применения с целью замедления и/или предупреждения прогрессирования до клинической стадии болезни Альцгеймера у субъекта, страдающего от болезни Альцгеймера на доклинической стадии.
Согласно одному варианту осуществления пептид-коагонист предназначен для применения в лечении и/или предупреждении болезни Паркинсона. Болезнь Паркинсона представляет собой нейродегенеративное нарушение, характеризующееся прогрессивной потерей нейронов, в частности, дофаминергических нейронов черной субстанции, что приводит к двигательным нарушениям, таким как тремор, ригидность, замедление движений и постуральная неустойчивость. Согласно одному варианту осуществления пептид предназначен для применения с целью уменьшения проявлений и/или предупреждения двигательных нарушений, ассоциированных с болезнью Паркинсона.
Кроме того, наблюдается рост числа атипичных синдромов Паркинсона и подклассов болезни Паркинсона, которые ассоциированы с нарушением обучаемости и памяти. Типичными примерами являются деменция при болезни Паркинсона (PDD), деменция с тельцами Леви (LBD) и мультисистемная атрофия (MSA). Пептид может быть предназначен для применения в восстановлении или улучшении в отношении связанных с обучаемостью процессов или нарушения обучаемости и/или предупреждении, восстановлении или улучшении в отношении потери памяти или ухудшения памяти у субъекта, страдающего от болезни Паркинсона.
По тексту описания и формулы изобретения настоящей заявки слова «предусматривать» и «содержать» и их варианты означают «включая без ограничения», и они не предназначены для исключения (и не исключают) другие фрагменты, добавки, компоненты, целые числа или стадии. По тексту описания и формулы изобретения настоящей заявки формы единственного числа охватывают формы множественного числа, если контекст не требует иного. В частности, при использовании форм единственного числа в описании их следует понимать как подразумевающие как формы множественного числа, так и формы единственного числа, если контекст не требует иного.
Признаки, целые числа, характеристики или группы, описанные в сочетании с конкретным аспектом, вариантом осуществления или примером настоящего изобретения, следует понимать как применимые к другому аспекту, варианту осуществления или примеру, описанным в настоящем документе, если только они не являются несовместимыми с ними. Все раскрытые в настоящем описании признаки (включая любое из прилагаемой формулы изобретения, реферата и чертежей) и/или все стадии любого раскрытого таким образом способа или процесса могут быть объединены в любую комбинацию, за исключением комбинаций, в которых по меньшей мере некоторые из признаков и/или стадий являются взаимоисключающими. Настоящее изобретение не ограничивается какими-либо подробностями любых вариантов осуществления, раскрытых в настоящем документе. Настоящее изобретение распространяется на любой новый признак или новую комбинацию признаков, раскрытых в настоящем описании (включая любое из прилагаемой формулы изобретения, реферата и чертежей), или любую новую стадию или любую новую комбинацию стадий любого раскрытого таким образом способа или процесса.
Внимание читателя направлено на все статьи и документы, поданные одновременно
с настоящим описанием или до него, вместе с настоящей заявкой, и которые открыты для всеобщего ознакомления с настоящим описанием, и содержания всех таких статей и документов включены в настоящий документ посредством ссылки.
Единицы, префиксы и символы обозначены в их принятой согласно Международной системе единиц (СИ) форме. Числовые диапазоны включают числа, определяющие диапазон. Если не указано иное, аминокислотные последовательности записаны слева направо в направлении от амино- к карбокси-концу. Все аминокислотные остатки в пептидах согласно вариантам осуществления настоящего изобретения предпочтительно находятся в L-конфигурации. Однако D-конфигурация аминокислот также может быть представлена.
Примеры
Молекулярные структуры
Синтез пептидов
Пептиды были синтезированы GL Biochem Ltd. (Shanghai). Чистоту пептида анализировали с помощью обращенно-фазовой HPLC и определяли характеристики с применением матричной лазерной десорбционной ионизационной времяпролетной масс- спектрометрии, с чистотой > 99%.
Пептиды разбавляли в воде ultrapure® до концентрации 1 мг/мл в полипропиленовых пробирках и замораживали в аликвотах для возможности свежего приготовления доз, требуемых для инъекции.
Тестируемые пептиды представляли собой:
1. Лираглутид (аналог GLP-1) -
лираглутид представляет собой пептидное лекарственное средство, которое, как правило, вводят парентерально. Лираглутид утвержден для лечения диабета 2 типа. Лираглутид раскрыт в WO98/08871 A1, пример 37. Аминокислотная последовательность лираглутида показана в SEQ ID. No. 15.
Жирная кислота связана с аминокислотой Lys в положении 26. Аминокислота Lys в положении 34 была замещена аминокислотой Arg.
2. DAla2GIP-Lys37-γ-Glu-PAL (аналог GIP)
Последовательность DAla2GIP-Lys37-γ-Glu-PAL представляет собой:
Yd-AEGTFISDYSIAMDKIHQQDFVNWLLAQKGKK(γ-E-C16)NDWKHNITQ
Лираглутид представляет собой агонист рецептора GLP-1 однонаправленного действия, тогда как DAla2GIP--Lys37-γ-Glu-PAL представляет собой агонист рецептора GIP однонаправленного действия.
3. Пептид, называемый в настоящем документе DA4, который имеет следующую аминокислотную последовательность:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKKKKKK-NH2
X = аминоизомасляная кислота
Пептид DA4 представляет собой двойной агонист рецепторов GLP-1/GIP.
4. Пептид, называемый в настоящем документе DA5, который имеет следующую аминокислотную последовательность:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKRRQRRKKRGY-NH2
X = аминоизомасляная кислота
Пептид DA5 представляет собой двойной агонист рецепторов GLP-1/GIP.
Пример 1.
Модель болезни Альцгеймера на трансгенных мышах
Для тестирования новых лекарственных средств были созданы животные модели. Стандартной моделью болезни Альцгеймера являются трансгенные мыши, у которых экспрессируются мутантные гены человека для выработки амилоида, который, как известно, индуцирует болезнь Альцгеймера у людей. У таких трансгенных мышей APP/PS1 повторяются некоторые из симптомов болезни Альцгеймера, такие как агрегация амилоида в головном мозге, потеря памяти и потеря синапсов (Radde et al., 2006).
У мышей APP/PS1 экспрессируется APP человека с мутацией Swedish и мутантный пресенилин-1, которые индуцируют болезнь Альцгеймера у людей.
Доза тестируемого пептида составляла 10 нмоль/кг веса тела. Пептиды вводили путем внутрибрюшинной инъекции один раз в сутки в течение 8 недель. Инъекции солевого раствора вводили в качестве контроля. Шести животным на группу путем инъекции вводили пептид или солевой раствор в качестве контроля.
Анализ ткани головного мозга на наличие амилоидных бляшек и число синапсов у мышей с БА
У животных (6 на группу) проводили транскардиальную перфузию 30 мл охлажденного на льду PBS и 30 мл охлажденного на льду 4% параформальдегида для вторичной фиксации головного мозга. Головной мозг удаляли и помещали в свежий 30% раствор сахарозы в PBS для криопротекции ткани, и нарезали на криостате с толщиной 40 мкм. Срезы выбирали в соответствии со стереологическими правилами: первый срез выбирался случайным образом, а затем выбирался каждый 5-ый. На один головной мозг анализировали от 7 до 13 срезов.
Методики иммуноокрашивания применяли для оценки нагрузки нейрональными бляшками (поликлональное антитело кролика к бета-амилоиду (1:200, поликлональное антитело кролика Invitrogen 71-5800) и синаптофизина (первичное поликлональное антитело кролика к синаптофизину, 1:2000, Abcam, Кембридж, Великобритания) для измерения количества синапсов в коре головного мозга. Образцы головного мозга сперва подвергали воздействию 99% муравьиной кислоты в течение 7 минут, а затем промывали
3 раза в течение 10 минут в TBS. Известно, что предварительная обработка 99% муравьиной кислотой существенно усиливает обнаружение бета-амилоида в образцах головного мозга, фиксированных формалином. Затем образцы инкубировали в 0,3% H2O2 (Sigma Aldrich; номер по каталогу: 516813) в TBS в течение 30 минут на шейкере с целью уменьшения активности эндогенных пероксидов, а затем 3 раза промывали в TBS в течение 10 минут.
Для увеличения проницаемости мембран в ткани головного мозга образцы подвергали воздействию 0,3% Triton X-100 (Sigma Aldrich; номер по каталогу: 516813) в TBS в течение 10 минут на шейкере. Неспецифическое связывание белков в ткани насыщали путем инкубации образцов с 5% козьей сывороткой (Gibco; номер по каталогу:
16210-064) в TBS в течение 30 минут на шейкере.
Добавляли первичное антитело к бета-амилоиду или синаптофизину, и инкубировали в течение ночи на шейкере при 4°C. Антитело было поликлональным и вырабатывалось в ответ на синтетический бета-амилоидный пептид 1-43 у кролика. Первичное антитело применяли в конечном разведении 1-250 в TBS, содержащем 2% козью сыворотку и 10% Triton X-100. Затем образцы промывали TBS 3 раза в течение 10 минут и добавляли вторичное антитело на 90 минут на шейкере при 4°C. Вторичное антитело представляло собой биотинилированное антитело к IgG кролика, вырабатываемое у козы (набор Vectastain ABC Kit, Rabbit IgG; Vector Laboratories; номер по каталогу: PK-6101), и его применяли в конечном разведении 1-60 в TBS, содержащем 1% козью сыворотку и 10% Triton-X-100.
После промывки 3 раза в течение 10 минут в TBS образцы инкубировали в TBS, содержащем 3% раствор авидина (набор Vectastain ABC Kit, Rabbit IgG; Vector Laboratories; номер по каталогу: PK-6101) и 3% раствор биотинилированной пероксидазы хрена (набор Vectastain ABC Kit, Rabbit IgG; Vector Laboratories; номер по каталогу: PK-6101) в течение 90 минут при 4°C на шейкере. Образцы затем промывали 3 раза в TBS в течение 10 минут, а затем окрашивали путем добавления забуференного фосфатом солевого раствора, содержащего 3% раствор SG для получения синего продукта реакции (набор SG Blue Peroxidase Kit; Vector Laboratories; номер по каталогу: SK-4700) и 3% раствор H2O2, в течение 5 минут, а затем снова промывали 3 раза в течение 10 минут забуференным фосфатом солевым раствором.
Для усиления окрашивания образцы инкубировали с ddH2O, содержащей 0,5% CuSO4 (вес/вес), в течение 5 минут. После промывки 3 раза в течение 10 минут в ddH2O срезы головного мозга помещали на покрытые силаном предметные стекла с помощью тонкой кисточки, где они могли высохнуть в течение ночи. Наконец, предметные стекла накрывали покровным стеклом с использованием водной гистологической среды (гистологическая среда VectaMountAQ; Vector Laboratories, номер по каталогу: H-5501). В качестве контроля служил набор образцов от 17-месячных нетрансгенных мышей того же помета, обработанных вместе с экспериментальными образцами.
Срезы фотографировали под микроскопом (Zeiss, Германия), рандомизированные несмещенные диссекторы накладывали на изображения срезов мозга и анализировали с применением плагина Multi threshold с использованием программного обеспечения Image J (NIH, США). Данные анализировали с применением однофакторного дисперсионного анализа с апостериорным критерием Бонферрони.
Мышиная модель болезни Паркинсона
Стандартной моделью индукции у мышей симптомов, подобных таковым при болезни Паркинсона, является инъекция химического вещества (MPTP) (Li et al., 2009). Химическое вещество повреждает или уничтожает нейроны в головном мозге, которые вырабатывают дофамин. У мышей развиваются нарушения двигательной функции, и происходит уменьшение числа дофаминергических нейронов в головном мозге и их функциональности. Для синтеза дофамина необходим фермент тирозингидроксилаза (TH). Потеря TH означает потерю выработки дофамина (Harkavyi et al., 2008).
Взрослым самцам мышей C57BL/6 давали дофаминергический токсин MPTP
(20 мг/кг в 0,1 мл PBS i.p. с интервалами в 2 ч 4 доз MPTP; Sigma) или среду-носитель (PBS) в течение одного дня. Такая обработка обеспечивает избирательное воздействие на дофаминергические нейроны и индуцирует у мышей симптомы, подобные таковым при болезни Паркинсона. Одна группа не получала MPTP, в качестве контроля без повреждений.
Доза тестируемого пептида составляла 10 нмоль/кг веса тела. Пептиды вводили путем внутрибрюшинной инъекции один раз в сутки в течение 2 недель. Инъекции солевого раствора вводили в качестве контроля. Шести животным на группу путем инъекции вводили пептид или солевой раствор в качестве контроля.
Тест вращающегося стержня для проверки двигательной функции
Тест вращающегося стержня предусматривает вращающийся стержень, который со временем ускоряется. Мышей помещают на стержень, и тестируют двигательные навыки по мере ускорения вращения. По мере увеличения вращения животные срываются и падают на подушку, расположенную под стержнем. Мыши проходили три испытания с 45- минутными интервалами между испытаниями в каждый из 2 последовательных дней в течение 3 недель. Регистрировали продолжительность удерживания для каждого животного, и рассчитывали среднее значение. Данные анализировали с применением однофакторного дисперсионного анализа с апостериорным критерием Бонферрони.
Иммуногистохимическое исследование для TH в компактной части черной субстанции и полосатом теле
У шести животных на группу проводили анализ на экспрессию тирозингидроксилазы (TH), маркера выработки дофамина. Фронтальные срезы головного мозга (20 мкм) из полосатого тела (брегма 11-10,2) и SNpc (брегма 24,80-26,04) анализировали в иммуногистохимическом исследовании с применением антител, распознающих TH.
Срезы нарезали на криостате и подвергали вторичной фиксации в 4% параформальдегиде, промывали в PBS, обрабатывали 0,3% H2O2 в метаноле в течение
20 мин и снова промывали. Инкубацию с антителом к TH (1:800) проводили при 48°C в течение ночи в PBS с 0,1% Tween и 10% козьей сывороткой. Срезы инкубировали в течение
1 ч при комнатной температуре с биотинилированным вторичным антителом, разведенным в 0,1% PBS-Tween. Окрашивание DAB осуществляли в соответствии с инструкциями из набора Vectastain ABC (Vector Laboratories). Для каждого животного окрашивали три среза ткани из одного уровня полосатого тела и анализировали в отношении TH-положительной иннервации волокна. Для обеспечения подсчета экспрессирующих TH клеток, репрезентативного для всей SN, для каждого животного проводили анализ на четырех и трех рострокаудальных уровнях (брегма - 4,80-6,04). В иммуногистохимическом исследовании количественно оценивали два среза ткани из каждого уровня.
Данные анализировали с применением однофакторного дисперсионного анализа с
апостериорным критерием Бонферрони. Результаты представлены на фигурах 1-4.
Вывод:
Из результатов видно, что оба пептида-двойные агонисты GIP/GLP-1 (DA4 и DA5) характеризуются превосходящими нейропротекторными свойствами по сравнению с отдельными аналогами GLP-1 и GIP в животных моделях болезни Альцгеймера и Паркинсона. Таким образом, из данных настоящих примеров видно, что оба пептида DA4 и DA5 могут считаться подходящими для применения в лечении и/или предупреждении нейродегенеративных нарушений, таких как, например, болезнь Альцгеймера и/или болезнь Паркинсона.
Пример 2.
Материалы и способы в примере 2 являются такими же, как в примере 1, за исключением указанных случаев. Применяемые в примере 2 реагенты включают только антитела к p-PI3Kp85, PI3Kp85, p-Akt (ser473), Akt, p-GSK3β (Y216) и GSK3β от Abcam, Inc. Кембридж, Великобритания. Антитело к ф-тау (AT8) от Thermo Scientific, США. Антитела мыши к β-актину, антитела к IgG кролика, антитела к IgG мыши, антитела CY3 к IgG мыши, лизат RIPA, набор для белкового анализа BCA (BCA Protein Assay Kit), раствор для окрашивания DAPI и средство, обеспечивающее уменьшение затухания флуоресценции, от Boster (Ухань, Китай).
Тест «открытое поле» для изучения двигательной активности и исследовательского поведения.
Перед экспериментом животные проходили 30-минутную адаптацию в лаборатории.
«Открытое поле» было разделено на 16 квадратов равных размеров с 4 выделяющимися квадратами в середине в качестве центральной области и остальными квадратами в качестве периферической области. Каждую мышь по отдельности помещали в аппарат (40 см × 40 см × 40 см) в центр на 5 мин, и одновременно регистрировали общее пройденное расстояние, а также время в процентах, проведенное в центре, с использованием системы программного обеспечения Smart 3.0 (Panlab, Испания). Перед каждым тестом аппарат очищали 70% этанолом.
Тест с использованием Y-образного лабиринта для измерения кратковременной памяти у мышей с БА
Кратковременную пространственную память оценивали путем регистрации поведения спонтанного чередования в Y-образном лабиринте. Длина лабиринта составляла 30 см, высота составляла 7 см, ширина рукавов составляла 15 см, и рукава сходились в равносторонней треугольной центральной области. Каждую мышь помещали в центральную треугольную область и позволяли ей свободно перемещаться по лабиринту в течение 8-минутной сессии. Общее число входов в рукава и порядок рукавов записывали с помощью системы программного обеспечения Smart 3.0. Чередование было определено как успешные входы в три рукава, в перекрывающихся сериях из трех повторов. Процент чередования рассчитывали как соотношение фактических и вероятных чередований (определено как общее число входов в рукава минус 2), умноженное на 100.
Классический тест водного лабиринта Морриса и реверсивный тест водного лабиринта Морриса для определения пространственного обучения и памяти.
Классический тест «водный лабиринт Морриса» (MWM) применяли для изучения пространственной долговременной памяти мыши. Водный лабиринт главным образом включал бассейн из нержавеющей стали и платформу в бассейне для спасения. К стенкам водного лабиринта были прикреплены несколько ориентиров. Бассейн был заполнен водопроводной водой при 22±2°С. Первая фаза представляла собой фазу испытания по научению, которая состояла из пяти дней обучения (дни 1-5) и четырех испытаний каждый день. Бассейн (диаметр 120 см; высота 50 см) был разделен на четыре квадранта, и спасательная платформа (диаметр 12 см), спрятанная на 1 см ниже поверхности воды, была помещена в центр первого квадранта. В качестве исходной позиции служили четыре точки, равномерно распределенные по периметру бассейна, которые выбирали случайным образом в четырех испытаниях в день. Когда мышь забиралась на платформу, или проходила 1 минута, записи прекращали. Латентные периоды нахождения платформы записывали с помощью системы программного обеспечения Ethovision 3.0 (Noldus Information Technology, Нидерланды). Вторая фаза представляла собой фазу проверочного испытания. Через один день после окончания задачи по научению (день 6) осуществляли проверочное испытание для оценки пространственной памяти. Платформу убирали из бассейна, и животным давала свободно плавать в течение 1 мин. Записывали процент времени плавания в целевом квадранте (первый квадрант) и частоту пересечения места расположения платформы. Реверсивный тест MWM применяли для наблюдения за способностью мышей переучиваться и когнитивной гибкостью. После проведения классического теста MWM платформу убирали в квадрант для реверсивного теста (третий квадрант), и мышей помещали в воду для проведения аналогичного четырехдневного испытания по научению и однодневного проверочного испытания, как упоминалось выше. Третья фаза представляла собой тест с видимой платформой. Платформу поднимали на 1 см выше уровня воды, и мышей помещали в два выбранных случайным образом квадранта. Записывали время, за которое мыши доплывали до цели.
Измерения L-LTP в гиппокампе у мышей с БА in vivo
Мышей анестезировали уретаном (Sigma, Великобритания, 1,5 г/кг, i.p.) и помещали в стереотаксический аппарат (RWD Life Science, Китай) для записи L-LTP. Срезали кожу головы и обнажали череп, на одной стороне черепа были просверлены небольшие отверстия (2,0 мм позади брегмы и 1,5 мм сбоку от срединной линии).
Пару параллельных стимулирующих/регистрирующих электродов (Секим, Вашингтон, США) вставляли в области коллатералей Шаффера и молекулярного слоя в участке CA1 гиппокампа. Исходные fEPSP вызывали с помощью тестовых стимулов с интервалом в 30 секунд, и fEPSP спустя 30 минут записывали для наблюдения того, затрагивается ли основная синаптическая передача. Затем перед HFS два парных тестовых стимула с интервалом в 50 мс прикладывали для индукции парной фасилитации (PPF). Изменение соотношения PPF, рассчитанное путем деления величины наклона второго fEPSP на величину наклона первого fEPSP, рассматривается как связанное с изменениями высвобождения нейротрансмиттеров из пресинаптических окончаний. L-LTP индуцировали тремя сериями высокочастотной стимуляции (HFS) с интервалом в 5 минут. Каждая серия HFS включает три пакета из 20 импульсов с интервалом между стимулами в 5 мс (200 Гц). fEPSP записывали в течение 180 минут после HFS. Все события записывали с помощью системы обработки биологических сигналов (Chengdu Instruments Ltd, Китай). Процентное изменение fEPSP в каждой группе после HFS подвергали сравнению.
Иммуноокрашивание в отношении фосфорилированного тау-белка в гиппокампе
После in vivo записи L-LTP в гиппокампе мышей анестезировали хлоральгидратом (0,007 мл/г) путем внутрибрюшинной инъекции, а затем ткань головного мозга фиксировали параформальдегидом в течение 24 часов, после чего ткань переносили в 30% раствор сахарозы для дегидратации. Ткань головного мозга собирали, замораживали при -80°С, а затем делали срезы толщиной 30 мкм, помещали замороженные срезы в PBS, блокировали нормальной козьей сывороткой (Solarbio, Пекин, Китай), с последующим добавлением первичного антитела, вторичного антитела и DAPI. Фосфорилированный тау- белок наблюдали с помощью конфокальной лазерной сканирующей микроскопии.
Вестерн-блоттинг для оценки уровней PI3K/AKT/GSK3β в гиппокампе
Гиппокамп мыши вырезали и гомогенизировали в реагенте для экстракции тканевого белка, и измеряли концентрацию белка с применением набора для белкового анализа BCA. Всего применяли 50 мкг белка из каждого образца. Белки из образцов разделяли в 12% SDS-полиакриламидных гелях. После этого белки переносили на PVDF- мембраны и блокировали сайты неспецифического связывания с помощью 5% BSA. Первичное антитело применяли для инкубации мембран в течение ночи при 4°C, с последующей инкубацией с вторичным антителом в течение 2 ч. Оптическую плотность целевой полоски (p-PI3K, t-PI3K, p-AKT, t-AKT, p-GSK3β и t-GSK3β) анализировали с применением гель-документирующей системы.
Данные анализировали с применением однофакторного дисперсионного анализа с апостериорным критерием Бонферрони. Результаты представлены на фигурах 5-11.
Вывод:
Результаты, представленные в этом исследовании, подтверждают защитные эффекты пептида-двойного агониста GLP-1/GIP DA5 в отношении когнитивной функции и патологических характеристик у трансгенных мышей APP/PS1 с БА. Нейропротекторные свойства пептида DA5 могут быть ассоциированы с улучшением в отношении синаптической пластичности в гиппокампе и сигнального пути PI3K/AKT/GSK3β. Вышеизложенные результаты свидетельствуют о том, что пептид DA5 может быть пригодным в лечении нейродегенеративного заболевания, и, в частности, может быть эффективным для пациентов с БА, особенно таковых, у которых наблюдается T2DM или гипергликемия.
Настоящее раскрытие также охватывает заявляемые объекты согласно следующим пронумерованным пунктам:
1. Пептид-коагонист рецепторов GIP/GLP-1, представленный общей формулой I:
Tyr-Aib-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Ile-Tyr-Leu-Asp-Lys-Gln-Ala-Ala-Aib-
Glu-Phe-Val-Xaa24-Trp-Leu-Leu-Ala-Gly-Y1-Y2-R2
где Xaa24 выбран из Asn и Cys;
(I) (SEQ. ID. No. 1),
Y1 выбран из удлинения, предусматривающего по меньшей мере восемь молекул аминокислот, или отсутствует;
Y2 выбран из:
Lys-Lys-Lys-Lys-Lys (SEQ. ID. No. 2);
Lys-Lys-Lys-Lys-Lys-Lys (SEQ. ID. No. 3),
Arg-Arg-Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr (SEQ. ID. No. 4); и
Lys-Arg-Arg-Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr (SEQ. ID. No. 5); и
R2 выбран из -NH2 или -OH,
или производное, или фармацевтически приемлемая соль или сольват пептида или производного.
2. Пептид в соответствии с пунктом 1, где Y2 представляет собой Lys-Lys-Lys-Lys-Lys или Lys-Lys-Lys-Lys-Lys-Lys.
3. Пептид в соответствии с пунктом 1, где Y2 представляет собой Arg-Arg-Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr или Lys-Arg-Arg-Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr.
4. Пептид в соответствии с любым из предыдущих пунктов, где Xaa24 представляет собой Cys.
5. Пептид в соответствии с любым из пунктов 1-3, где Xaa24 представляет собой Asn.
6. Пептид в соответствии с любым из предыдущих пунктов, где Y1 представляет собой удлинение, предусматривающее по меньшей мере 10 аминокислот.
7. Пептид в соответствии с любым из предыдущих пунктов, где Y1 выбран из:
Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser (SEQ. ID. No. 6);
Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Lys (SEQ. ID. No. 7);
Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Cys (SEQ. ID. No. 8);
Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser (SEQ. ID. No. 9);
Pro-Ser-Ser-Gly-Ala-Pro-Pro-Ser (SEQ. ID. No. 10); и его
отсутствия.
8. Пептид в соответствии с пунктом 7, где Y1 представляет собой Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser.
9. Пептид в соответствии с пунктом 7, где Y1 представляет собой Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Cys.
10. Пептид в соответствии с пунктом 7, где Y1 представляет собой Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Lys.
11. Пептид в соответствии с пунктом 1, который содержит аминокислотную последовательность:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKKKKKK-NH2 (SEQ. ID. No. 11),
где X = аминоизомасляная кислота.
12. Пептид в соответствии с пунктом 1, который состоит главным образом из аминокислотной последовательности:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKKKKKK-NH2 (SEQ. ID. No. 11),
где X = аминоизомасляная кислота.
13. Пептид в соответствии с пунктом 1, который содержит аминокислотную последовательность:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKRRQRRKKRGY-NH2 (SEQ. ID. No. 12),
где X = аминоизомасляная кислота.
14. Пептид в соответствии с пунктом 1, который состоит главным образом из аминокислотной последовательности:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKRRQRRKKRGY-NH2 (SEQ. ID. No. 12),
где X = аминоизомасляная кислота.
15. Пептид в соответствии с любым из предыдущих пунктов, который содержит гидрофильный фрагмент, ковалентно связанный с аминокислотой.
16. Пептид в соответствии с пунктом 15, который содержит гидрофильный фрагмент, ковалентно связанный с аминокислотой в положении 24.
17. Пептид в соответствии с пунктом 15, который содержит гидрофильный фрагмент, ковалентно связанный с аминокислотой в положении 39 или 40, если Y1 представляет собой удлинение, предусматривающее по меньшей мере 10 аминокислот или по меньшей мере одиннадцать аминокислот.
18. Пептид в соответствии с пунктом 17, где Xaa39 или Xaa40 представляет собой Cys, и где пептид содержит гидрофильный фрагмент, ковалентно связанный с Cys(39) или Cys(40).
19. Пептид в соответствии с пунктом 15, где Xaa24 представляет собой Cys, и где пептид содержит гидрофильный фрагмент, ковалентно связанный с Cys(24).
20. Пептид в соответствии с любым из пунктов 15-19, где гидрофильный фрагмент представляет собой водорастворимый полимер.
21. Пептид в соответствии с пунктом 20, где водорастворимый полимер представляет собой полиэтиленгликолевый фрагмент, и необязательно представляет собой полиэтиленгликолевый фрагмент с молекулярной массой от приблизительно 20000 Дальтон до приблизительно 60000 Дальтон.
22. Пептид в соответствии с любым из предыдущих пунктов, где пептид конъюгирован с липофильным заместителем.
23. Пептид в соответствии с пунктом 22, где липофильный заместитель содержит углеводородную цепь с 8-24 атомами углерода (C).
24. Пептид в соответствии с пунктом 22 или пунктом 23, где липофильный заместитель содержит ацильную группу.
25. Пептид в соответствии с пунктом 24, где липофильный заместитель представляет собой молекулу жирной кислоты.
26. Пептид в соответствии с пунктом 25, где молекула жирной кислоты выбрана из C-8-октаноильной группы, C-10-деканоильной группы, C-12-лауроильной группы, C-14- миристоильной группы, C-16-пальмитоильной группы, C-18-стеароильной группы и C-20- ацильной группы.
27. Пептид в соответствии с любым из пунктов 22-26, где липофильный заместитель соединен с аминокислотой по карбоксильному концу пептида.
28. Пептид в соответствии с пунктом 27, где липофильный заместитель соединен с аминокислотой в положении 40.
29. Пептид в соответствии с любым из пунктов 22-28, где липофильный заместитель ковалентно связан с боковой цепью аминокислоты пептида.
30. Пептид в соответствии с любым из пунктов 22-29, который содержит спейсер, который обеспечивает конъюгацию липофильного заместителя с аминокислотным остатком.
31. Пептид в соответствии с пунктом 30, где спейсер представляет собой остаток из встречающейся в природе или не встречающейся в природе аминокислоты, причем спейсер предусматривает остаток Gly, Pro, Ala, Val, Leu, Ile, Met, Cys, Phe, Tyr, Trp, His, Lys, Arg, Gln, Asn, α-Glu, γ-Glu, ε-Lys, Asp, Ser, Thr, ГАМК, Aib, β-аминогексаноила, 7- аминогептаноила, 8-аминооктаноила, 9-аминононаноила, 10-аминодеканоила или 8-амино-3,6-диоксаоктаноила.
32. Пептид в соответствии с пунктом 31, где спейсер представляет собой γ-Glu.
33. Пептид в соответствии с пунктом 31 или пунктом 32, где спейсер представляет собой дипептид, причем необязательно спейсер предусматривает две отрицательно заряженные аминокислоты, и причем дополнительно необязательно спейсер представляет собой γ-Glu-γ-Glu.
34. Пептид в соответствии с любым из предыдущих пунктов, дополнительно предусматривающий одну или несколько консервативных замен.
35. Пептид в соответствии с любым из предыдущих пунктов, который предназначен для применения в лечении и/или профилактике неврологического нарушения.
36. Пептид в соответствии с пунктом 35, где пептид предназначен для применения в лечении неврологического нарушения, которое обусловлено или ассоциировано с отложением в виде бляшек бета-амилоидного белка в области у пациента.
37. Пептид в соответствии с пунктом 36, где отложение в виде бета-амилоидных
бляшек имеет место в головном мозге пациента.
38. Пептид в соответствии с пунктом 35, который предназначен для применения в лечении и/или профилактике неврологического нарушения, обусловленного или ассоциированного с дисфункцией долговременной потенциации синаптической передачи.
39. Пептид в соответствии с пунктом 35, который предназначен для применения в лечении и/или профилактике неврологического нарушения, обусловленного или ассоциированного с воспалением.
40. Пептид в соответствии с пунктом 35, который предназначен для применения в лечении неврологического нарушения, ассоциированного с нарушением двигательной функции.
41. Пептид в соответствии с пунктом 35, который предназначен для применения в лечении и/или профилактике неврологического нарушения, затрагивающего когнитивную функцию, например, деменции, инсульта, шизофрении и/или биполярного расстройства.
42. Пептид в соответствии с пунктом 41, где нарушение представляет собой
ишемию головного мозга, ассоциированную с инсультом.
43. Пептид в соответствии с пунктом 35, который предназначен для применения в лечении и/или профилактике нарушения, выбранного из посттравматического стрессового расстройства, эпилепсии, синдрома Туретта и галлюцинаций; и дисфункциональных когнитивных процессов, необязательно выбранных из внимания, вычислений, памяти, умозаключения, понимания, обучения и логического мышления.
44. Пептид в соответствии с пунктом 35, который предназначен для применения в лечении и/или профилактике нейродегенеративного нарушения, например, болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического склероза, периферической невропатии, болезни Хантингтона и болезни Крейтцфельда-Якоба.
45. Пептид в соответствии с пунктом 35, где неврологическое нарушение представляет собой рассеянный склероз.
46. Пептид в соответствии с пунктом 45, который предназначен для применения в лечении и/или профилактике неврологического нарушения, выбранного из болезни Альцгеймера на клинической или доклинической стадии, болезни Альцгеймера на продромальной стадии и амилоидной ангиопатии (ЦАА) на клинической или доклинической стадии.
47. Пептид в соответствии с пунктом 46, который предназначен для применения в лечении и/или профилактике болезни Альцгеймера на клинической стадии.
48. Пептид в соответствии с пунктом 46, который предназначен для применения в лечении и/или профилактике болезни Паркинсона.
49. Способ лечения и/или предупреждения неврологического нарушения, предусматривающий введение нуждающемуся в этом пациенту фармацевтической композиции, содержащей пептид-коагонист рецепторов GIP/GLP-1 или производное, или фармацевтически приемлемую соль или сольват пептида или производного, где указанный пептид-коагонист представлен общей формулой I:
Tyr-Aib-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Ile-Tyr-Leu-Asp-Lys-Gln-Ala-Ala-Aib-Glu-Phe-Val-Xaa24-Trp-Leu-Leu-Ala-Gly-Y1-Y2-R2
(I) (SEQ. ID. No. 1),
где Xaa24 выбран из Asn и Cys;
Y1 выбран из удлинения, предусматривающего по меньшей мере восемь молекул аминокислот, или отсутствует;
Y2 выбран из:
Lys-Lys-Lys-Lys-Lys (SEQ. ID. No. 2);
Lys-Lys-Lys-Lys-Lys-Lys (SEQ. ID. No. 3),
Arg-Arg-Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr (SEQ. ID. No. 4); и
Lys-Arg-Arg-Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr (SEQ. ID. No. 5); и
R2 выбран из -NH2 или -OH,
или производным, или фармацевтически приемлемой солью или сольватом пептида или производного.
50. Способ в соответствии с пунктом 49, где пептид является таким, как заявлено в любом из пунктов 1-34.
51. Способ в соответствии с пунктом 49 или пунктом 50, где неврологическое нарушение выбрано из посттравматического стрессового расстройства, эпилепсии, синдрома Туретта и галлюцинаций; и дисфункциональных когнитивных процессов, необязательно выбранных из внимания, вычислений, памяти, умозаключения, понимания, обучения и логического мышления.
52. Способ в соответствии с пунктом 49 или пунктом 50, где неврологическое нарушение представляет собой нейродегенеративное нарушение.
53. Способ в соответствии с пунктом 52, где нейродегенеративное нарушение выбрано из болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, бокового амиотрофического склероза, периферической невропатии и болезни Крейтцфельда-Якоба.
54. Способ в соответствии с пунктом 53, где неврологическое нарушение представляет собой неврологическое нарушение, выбранное из болезни Альцгеймера на клинической или доклинической стадии, болезни Альцгеймера на продромальной стадии и амилоидной ангиопатии (ЦАА) на клинической или доклинической стадии.
55. Способ в соответствии с пунктом 54, где неврологическое нарушение представляет собой болезнь Альцгеймера на клинической стадии.
56. Пептид для применения в лечении и/или профилактике болезни Альцгеймера на клинической стадии, причем пептид состоит из следующей последовательности:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKKKKKK-NH2
где X = аминоизомасляная кислота.
57. Пептид для применения в лечении и/или профилактике болезни Альцгеймера на клинической стадии, причем пептид состоит из следующей последовательности:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKRRQRRKKRGY-NH2
где X = аминоизомасляная кислота.
Список литературы
Aviles-Olmos I, Dickson J, Kefalopoulou Z, Djamshidian A, Ell P, Soderlund T, Whitton P, Wyse R, Isaacs T, Lees A, Limousin P, Foltynie T (2013) Exenatide and the treatment of patients with Parkinson's disease. The Journal of clinical investigation 123:2730-6.
Aviles-Olmos I, Dickson J, Kefalopoulou Z, Djamshidian A, Kahan J, Fmedsci PE, Whitton P, Wyse R, Isaacs T, Lees A, Limousin P, Foltynie T (2014) Motor and Cognitive Advantages Persist 12 Months After Exenatide Exposure in Parkinson's Disease. Journal of Parkinson's disease 4:337-344.
Baggio LL, Drucker DJ (2007) Biology of incretins: GLP-1 and GIP. Gastroenterology 132:2131-2157.
Bertilsson G, Patrone C, Zachrisson O, Andersson A, Dannaeus K, Heidrich J, Kortesmaa J, Mercer A, Nielsen E, Ronnholm H, Wikstrom L (2008) Peptide hormone exendin-4 stimulates subventricular zone neurogenesis in the adult rodent brain and induces recovery in an animal model of Parkinson's disease. Journal of neuroscience research 86:326-338.
Blennow K, de Leon MJ, Zetterberg H (2006) Alzheimer's disease. Lancet 368:387-403. Bliss TVP, Collingridge GL (1993) A synaptic model of memory: long-term potentiation in the hippocampus. Nature 361:31-39.
Bomfim TR, Forny-Germano L, Sathler LB, Brito-Moreira J, Houzel JC, Decker H, Silverman MA, Kazi H, Melo HM, McClean PL, Holscher C, Arnold SE, Talbot K, Klein WL, Munoz DP, Ferreira ST, De Felice FG (2012) An anti-diabetes agent protects the mouse brain from defective insulin signaling caused by Alzheimer's disease-associated Abeta oligomers. The Journal of clinical investigation 122:1339-53.
Campbell JE, Drucker DJ (2013) Pharmacology, physiology, and mechanisms of incretin hormone action. Cell metabolism 17:819-837.
Cereda E, Barichella M, Cassani E, Caccialanza R, Pezzoli G (2012) Clinical features of Parkinson disease when onset of diabetes came first: A case-control study. Neurology 78:1507-1511.
Christensen M, Knop FK, Holst JJ, Vilsboll T (2009) Lixisenatide, a novel GLP-1 receptor agonist for the treatment of type 2 diabetes mellitus. IDrugs : the investigational drugs journal 12:503-513.
Cleary JP, Walsh DM, Hofmeister JJ, Shankar GM, Kuskowski MA, Selkoe DJ, Ashe KH (2005) Natural oligomers of the amyloid-beta protein specifically disrupt cognitive function. Nature neuroscience 8:79-84.
Duffy AM, Holscher C (2013) The incretin analogue D-Ala(2)GIP reduces plaque load, astrogliosis and oxidative stress in an APP/PS1 mouse model of Alzheimer's disease. Neuroscience 228:294-300.
Elkinson S, Keating GM (2013) Lixisenatide: first global approval. Drugs 73:383-391. Faivre E, Holscher C (2013a) D-Ala2GIP facilitated synaptic plasticity and reduces plaque load in aged wild type mice and in an Alzheimer's disease mouse model. Journal of Alzheimer's disease : JAD 35:267-283.
Faivre E, Holscher C (2013b) Neuroprotective effects of D-Ala2GIP on Alzheimer's disease biomarkers in an APP/PS1 mouse model. Alzheimer's research & therapy 5:20-28.
Faivre E, Gault VA, Thorens B, Holscher C (2011) Glucose-dependent insulinotropic polypeptide receptor knockout mice are impaired in learning, synaptic plasticity, and neurogenesis. J Neurophysiol 105:1574-1580.
Gault V, Holscher C (2008a) GLP-1 agonists facilitate hippocampal LTP and reverse the impairment of LTP induced by beta-amyloid. European journal of pharmacology 587:112-117.
Gault VA, Holscher C (2008b) Protease-resistant glucose-dependent insulinotropic polypeptide agonists facilitate hippocampal LTP and reverse the impairment of LTP induced by beta-amyloid. J Neurophysiol 99:1590-1595.
Gault VA, Flatt PR, O'Harte FP (2003) Glucose-dependent insulinotropic polypeptide analogues and their therapeutic potential for the treatment of obesity-diabetes. Biochemical and biophysical research communications 308:207-213.
Gejl M, Gjedde A, Egefjord L, Møller A, Hansen SB, Vang K, Rodell AB, Braendgaard H, Gottrup H, Schacht A, Møller N, Brock B, Rungby J (2016) In Alzheimer's Disease, Six-Month Treatment with GLP-1 Analogue Prevents Decline of Brain Glucose Metabolism: Randomized, Placebo-Controlled, Double-Blind Clinical Trial. Frontiers in aging neuroscience 8:1-10.
Gengler S, McClean P, McCurtin R, Gault V, Holscher C (2012) Val(8)GLP-1 rescues synaptic plasticity and reduces dense core plaques in APP/PS1 mice. Neurobiology of aging 33:265-276.
Han B, Hu J, Shen J, Gao Y, Lu Y, Wang T (2013) Neuroprotective effect of hydroxysafflor yellow A on 6-hydroxydopamine-induced Parkinson's disease in rats. European journal of pharmacology 714:83-88.
Harkavyi A, Abuirmeileh A, Lever R, Kingsbury AE, Biggs CS, Whitton PS (2008) Glucagon-like peptide 1 receptor stimulation reverses key deficits in distinct rodent models of Parkinson's disease. Journal of neuroinflammation 5:19(11-19).
Holscher C (2014) Insulin, incretins and other growth factors as potential novel treatments for Alzheimer's and Parkinson's diseases. Biochemical Society transactions 42:593-599.
Hunter K, Holscher C (2012) Drugs developed to treat diabetes, liraglutide and lixisenatide, cross the blood brain barrier and enhance neurogenesis. BMC neuroscience 13:33-38.
Irwin N, O'Harte F P, Gault VA, Green BD, Greer B, Harriott P, Bailey CJ, Flatt PR (2006) GIP(Lys(16)PAL) and GIP(Lys(37)PAL): Novel Long-Acting Acylated Analogues of Glucose- Dependent Insulinotropic Polypeptide with Improved Antidiabetic Potential. Journal of medicinal chemistry 49:1047-1054.
Ji C, Xue GF, Lijun C, Feng P, Li D, Li L, Li G, Holscher C (2015) A novel dual GLP-1 and GIP receptor agonist is neuroprotective in the MPTP mouse model of Parkinson's disease by increasing expression of BNDF. Brain research 1634:1-11.
LaFerla FM, Oddo S (2005) Alzheimer's disease: Abeta, tau and synaptic dysfunction. Trends Mol Med 11:170-176.
Li Y, Liu W, Li L, Holscher C (2015) Neuroprotective effects of a GIP analogue in the MPTP Parkinson's disease mouse model. Neuropharmacology 101:255-263.
Li Y, Perry T, Kindy MS, Harvey BK, Tweedie D, Holloway HW, Powers K, Shen H, Egan JM, Sambamurti K, Brossi A, Lahiri DK, Mattson MP, Hoffer BJ, Wang Y, Greig NH (2009) GLP-1 receptor stimulation preserves primary cortical and dopaminergic neurons in cellular and rodent models of stroke and Parkinsonism. Proceedings of the National Academy of Sciences of the United States of America 106:1285-1290.
Liu L, Venkatraman SS, Yang YY, Guo K, Lu J, He B, Moochhala S, Kan L (2008) Polymeric micelles anchored with TAT for delivery of antibiotics across the blood-brain barrier. Biopolymers 90:617-623.
Liu W, Jalewa J, Sharma M, Li G, Li L, Hölscher C (2015) Neuroprotective effects of lixisenatide and liraglutide in the MPTP mouse model of Parkinson's disease. Neuroscience 303:42-50.
Lovshin JA, Drucker DJ (2009) Incretin-based therapies for type 2 diabetes mellitus. Nature reviews Endocrinology 5:262-269.
Luchsinger JA, Tang MX, Shea S, Mayeux R (2004) Hyperinsulinemia and risk of Alzheimer disease. Neurology 63:1187-1192.
McClean P, Holscher C (2014) Liraglutide can reverse memory impairment, synaptic loss and reduce plaque load in aged APP/PS1 mice, a model of Alzheimer's disease. Neuropharmacol 76:57-67.
McClean P, Parthsarathy V, Faivre E, Hölscher C (2011) The diabetes drug Liraglutide prevents degenerative processes in a mouse model of Alzheimer's disease. The Journal of neuroscience : the official journal of the Society for Neuroscience 31:6587-6594.
McClean PL, Gault VA, Harriott P, Holscher C (2010) Glucagon-like peptide-1 analogues enhance synaptic plasticity in the brain: A link between diabetes and Alzheimer's disease. European journal of pharmacology 630:158-162.
Moloney AM, Griffin RJ, Timmons S, O'Connor R, Ravid R, O'Neill C (2010) Defects in IGF-1 receptor, insulin receptor and IRS-1/2 in Alzheimer's disease indicate possible resistance to IGF-1 and insulin signalling. Neurobiology of aging 31:224-243.
Morris JK, Bomhoff GL, Gorres BK, Davis VA, Kim J, Lee PP, Brooks WM, Gerhardt GA, Geiger PC, Stanford JA (2011) Insulin resistance impairs nigrostriatal dopamine function. Experimental neurology 231:171-180.
Nyberg J, Jacobsson C, Anderson MF, Eriksson PS (2007) Immunohistochemical distribution of glucose-dependent insulinotropic polypeptide in the adult rat brain. Journal of neuroscience research 85:2099-2119.
Ohara T, Doi Y, Ninomiya T, Hirakawa Y, Hata J, Iwaki T, Kanba S, Kiyohara Y (2011) Glucose tolerance status and risk of dementia in the community: The Hisayama Study. Neurology 77:1126-1134.
Radde R, Bolmont T, Kaeser SA, Coomaraswamy J, Lindau D, Stoltze L, Calhoun ME, Jaggi F, Wolburg H, Gengler S, Haass C, Ghetti B, Czech C, Holscher C, Mathews PM, Jucker M (2006) Abeta42-driven cerebral amyloidosis in transgenic mice reveals early and robust pathology. EMBO Rep 7:940-647.
Ristow M (2004) Neurodegenerative disorders associated with diabetes mellitus. J Mol Med 82:510-529.
Scherrmann JM (2002) Drug delivery to brain via the blood-brain barrier. Vascul Pharmacol 38:349-354.
Shen J (2010) Impaired neurotransmitter release in Alzheimer's and Parkinson's diseases. Neuro-degenerative diseases 7:80-83.
Talbot K, Wang HY, Kazi H, Han LY, Bakshi KP, Stucky A, Fuino RL, Kawaguchi KR, Samoyedny AJ, Wilson RS, Arvanitakis Z, Schneider JA, Wolf BA, Bennett DA, Trojanowski JQ, Arnold SE (2012) Demonstrated brain insulin resistance in Alzheimer's disease patients is associated with IGF-1 resistance, IRS-1 dysregulation, and cognitive decline. The Journal of clinical investigation 122:1316-38.
Windisch M, Gschanes A, Hutter-Paier B (1998) Neurotrophic activities and therapeutic experience with a brain derived peptide preparation. Journal of neural transmission Supplementum 53:289-298.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Ланкастер Юниверсити Бизнес Энтерпрайзес Лимитед
Хольшер, Кристиан
<120> Лечение неврологических заболеваний
<130> P031098
<140> GB1620611.2
<141> 2016-12-05
<160> 16
<170> PatentIn версии 3.5
<210> 1
<211> 31
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетический пептид
<220>
<221> ВАРИАНТ
<222> (2), (20)
<223> Xaa = альфа-аминоизомасляная кислота
<220>
<221> ВАРИАНТ
<222> (24)
<223> Xaa = Cys или Asn
<220>
<221> ВАРИАНТ
<222> (30)
<223> Xaa = отсутствие или удлинение, предусматривающее по меньшей мере
восемь молекул аминокислот
<220>
<221> ВАРИАНТ
<222> (31)
<223> Xaa = удлинение, предусматривающее Lys Lys Lys Lys Lys
или Lys Lys Lys Lys Lys Lys или Arg Arg Gln Arg Arg Lys Lys Arg Gly Tyr
или Lys Arg Arg Gln Arg Arg Lys Lys Arg Gly Tyr
<400> 1
Tyr Xaa Glu Gly Thr Phe Thr Ser Asp Tyr Ser Ile Tyr Leu Asp Lys
1 5 10 15
Gln Ala Ala Xaa Glu Phe Val Xaa Trp Leu Leu Ala Gly Xaa Xaa
20 25 30
<210> 2
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетический пептид
<400> 2
Lys Lys Lys Lys Lys
1 5
<210> 3
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетический пептид
<400> 3
Lys Lys Lys Lys Lys Lys
1 5
<210> 4
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетический пептид
<400> 4
Arg Arg Gln Arg Arg Lys Lys Arg Gly Tyr
1 5 10
<210> 5
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетический пептид
<400> 5
Lys Arg Arg Gln Arg Arg Lys Lys Arg Gly Tyr
1 5 10
<210> 6
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетический пептид
<400> 6
Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетический пептид
<400> 7
Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser Lys
1 5 10
<210> 8
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетический пептид
<400> 8
Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser Cys
1 5 10
<210> 9
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетический пептид
<400> 9
Pro Ser Ser Gly Ala Pro Pro Pro Ser
1 5
<210> 10
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетический пептид
<400> 10
Pro Ser Ser Gly Ala Pro Pro Ser
1 5
<210> 11
<211> 45
<212> PRT
<213> Искусственная последовательность
<220>
<223> пептид-коагонист рецепторов GIP/GLP-1
<220>
<221> ВАРИАНТ
<222> (2), (20)
<223> Xaa = альфа-аминоизомасляная кислота
<400> 11
Tyr Xaa Glu Gly Thr Phe Thr Ser Asp Tyr Ser Ile Tyr Leu Asp Lys
1 5 10 15
Gln Ala Ala Xaa Glu Phe Val Asn Trp Leu Leu Ala Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser Lys Lys Lys Lys Lys Lys
35 40 45
<210> 12
<211> 50
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид-коагонист рецепторов GIP/GLP-1
<220>
<221> ВАРИАНТ
<222> (2), (20)
<223> Xaa = альфа-аминоизомасляная кислота
<400> 12
Tyr Xaa Glu Gly Thr Phe Thr Ser Asp Tyr Ser Ile Tyr Leu Asp Lys
1 5 10 15
Gln Ala Ala Xaa Glu Phe Val Asn Trp Leu Leu Ala Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser Lys Arg Arg Gln Arg Arg Lys Lys Arg
35 40 45
Gly Tyr
50
<210> 13
<211> 31
<212> PRT
<213> Искусственная последовательность
<220>
<223> Глюкагоноподобный пептид-1 человека
<400> 13
His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly
20 25 30
<210> 14
<211> 42
<212> PRT
<213> Искусственная последовательность
<220>
<223> Желудочный ингибиторный пептид человека (глюкозозависимый
инсулинотропный пептид)
<400> 14
Tyr Ala Glu Gly Thr Phe Ile Ser Asp Tyr Ser Ile Ala Met Asp Lys
1 5 10 15
Ile His Gln Gln Asp Phe Val Asn Trp Leu Leu Ala Gln Lys Gly Lys
20 25 30
Lys Asn Asp Trp Lys His Asn Ile Thr Gln
35 40
<210> 15
<211> 31
<212> PRT
<213> Искусственная последовательность
<220>
<223> Лираглутид
<220>
<221> ВАРИАНТ
<222> (20)
<223> Xaa = остаток Lys, предусматривающий гамма-глутаматный
линкер между C16-пальмитоильной группой и аминогруппой боковой
цепи лизина.
<400> 15
His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Xaa Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
20 25 30
<210> 16
<211> 42
<212> PRT
<213> Искусственная последовательность
<220>
<223> DAla2-GIP-Lys37- y-Glu-PA
<220>
<221> ВАРИАНТ
<222> (2)
<223> Xaa = d-Ala
<220>
<221> ВАРИАНТ
<222> (33)
<223> Xaa = Lys (y-E-C16)
<400> 16
Tyr Xaa Glu Gly Thr Phe Ile Ser Asp Tyr Ser Ile Ala Met Asp Lys
1 5 10 15
Ile His Gln Gln Asp Phe Val Asn Trp Leu Leu Ala Gln Lys Gly Lys
20 25 30
Xaa Asn Asp Trp Lys His Asn Ile Thr Gln
35 40
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ БЕЛКОВЫЙ КОНЪЮГАТ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ НЕАЛКОГОЛЬНОГО СТЕАТОГЕПАТИТА, ОЖИРЕНИЯ И ДИАБЕТА | 2021 |
|
RU2822001C1 |
| АНТИТЕЛО К GIPR И ЕГО СЛИТЫЙ С GLP-1 БЕЛОК, А ТАКЖЕ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800370C2 |
| СОЕДИНЕНИЯ-АГОНИСТЫ GIP И СПОСОБЫ | 2015 |
|
RU2716985C2 |
| КОМПОЗИЦИИ И СПОСОБЫ БОРЬБЫ С НАКОПЛЕНИЕМ ЖИРОВОЙ ТКАНИ | 2014 |
|
RU2711478C2 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ КОНЪЮГАТА ТРОЙНОГО АГОНИСТА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ, ОБЛАДАЮЩЕГО АКТИВНОСТЯМИ В ОТНОШЕНИИ ВСЕХ ИЗ РЕЦЕПТОРОВ ГЛЮКАГОНА /GLP-1/GIP, ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ ЛЕГКОГО | 2020 |
|
RU2829342C1 |
| СЛИТЫЙ БЕЛОК FGF21 FC, СЛИТЫЙ БЕЛОК GLP-1 FC И КОМБИНИРОВАННЫЙ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ, ВКЛЮЧАЮЩИЙ ИХ, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2804335C2 |
| ДВОЙНЫЕ АГОНИСТЫ GLP1/GIP ИЛИ ТРОЙНЫЕ АГОНИСТЫ GLP1/GIP/ГЛЮКАГОНА | 2013 |
|
RU2652783C2 |
| КОАГОНИСТЫ РЕЦЕПТОРОВ ГЛЮКАГОНА И GLP-1 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2018 |
|
RU2779314C2 |
| КОНЪЮГАТЫ ИНСУЛИН-ИНКРЕТИН | 2014 |
|
RU2678134C2 |
| ОСНОВАННЫЕ НА АМИДАХ ПРОЛЕКАРСТВА ПЕПТИДОВ ГЛЮКАГОНОВОГО НАДСЕМЕЙСТВА | 2009 |
|
RU2550696C2 |
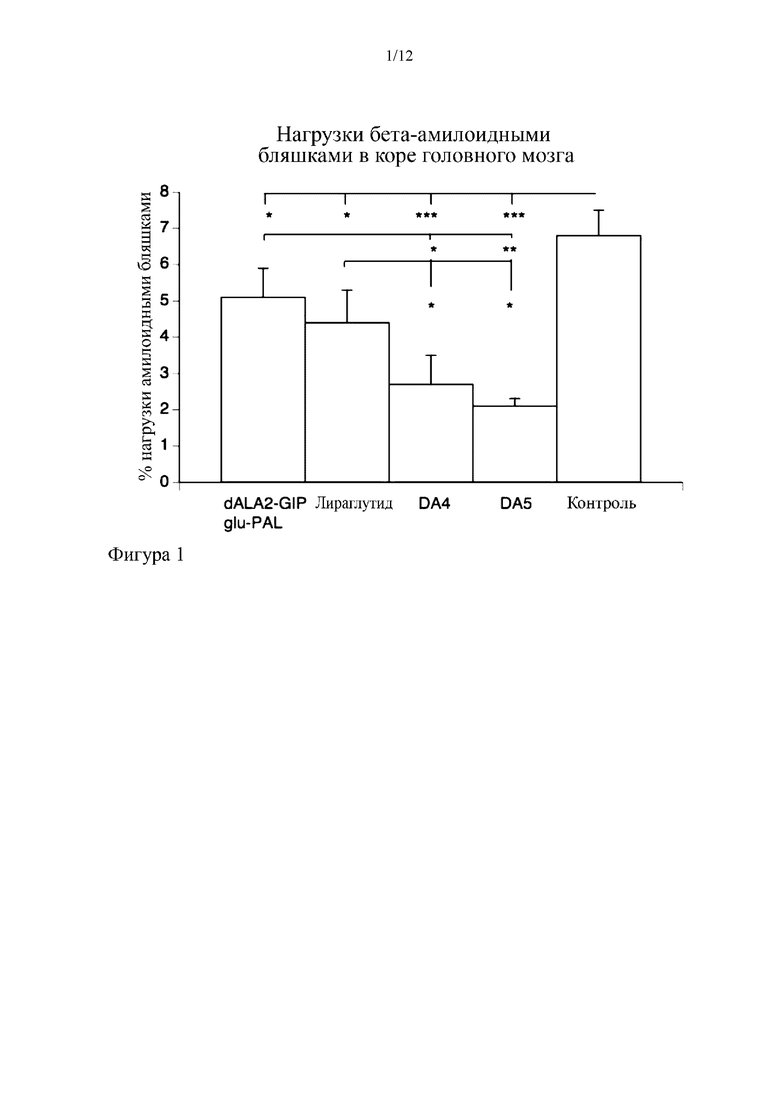
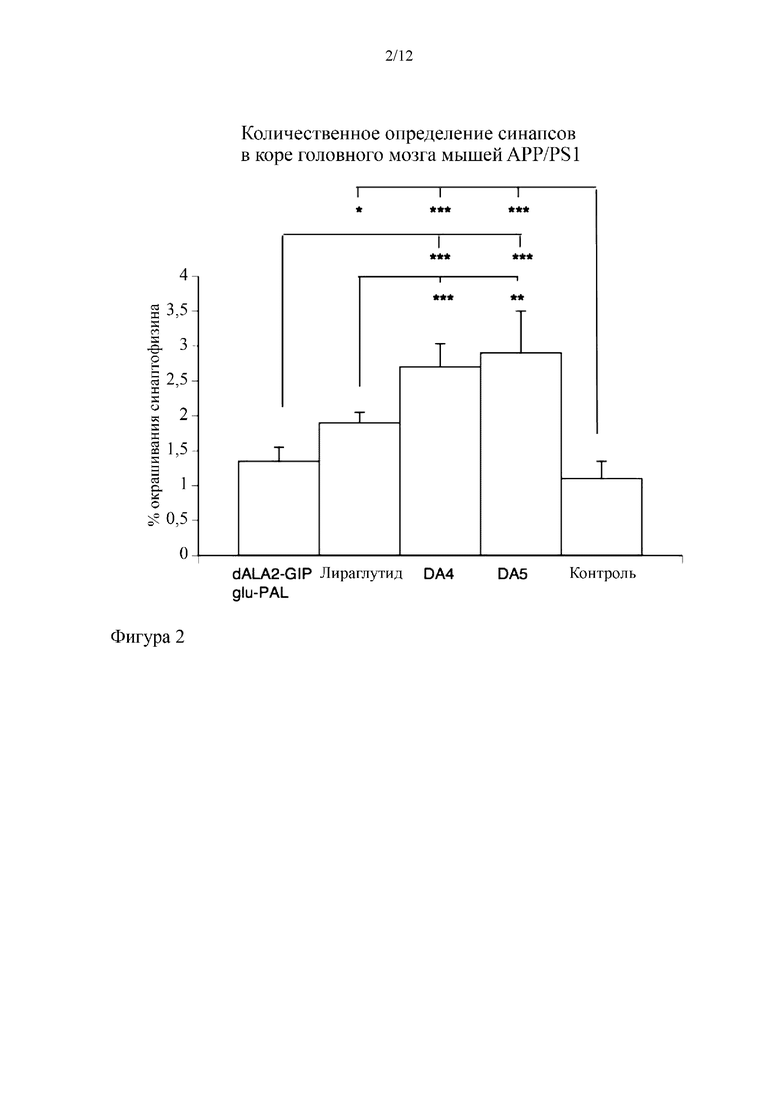
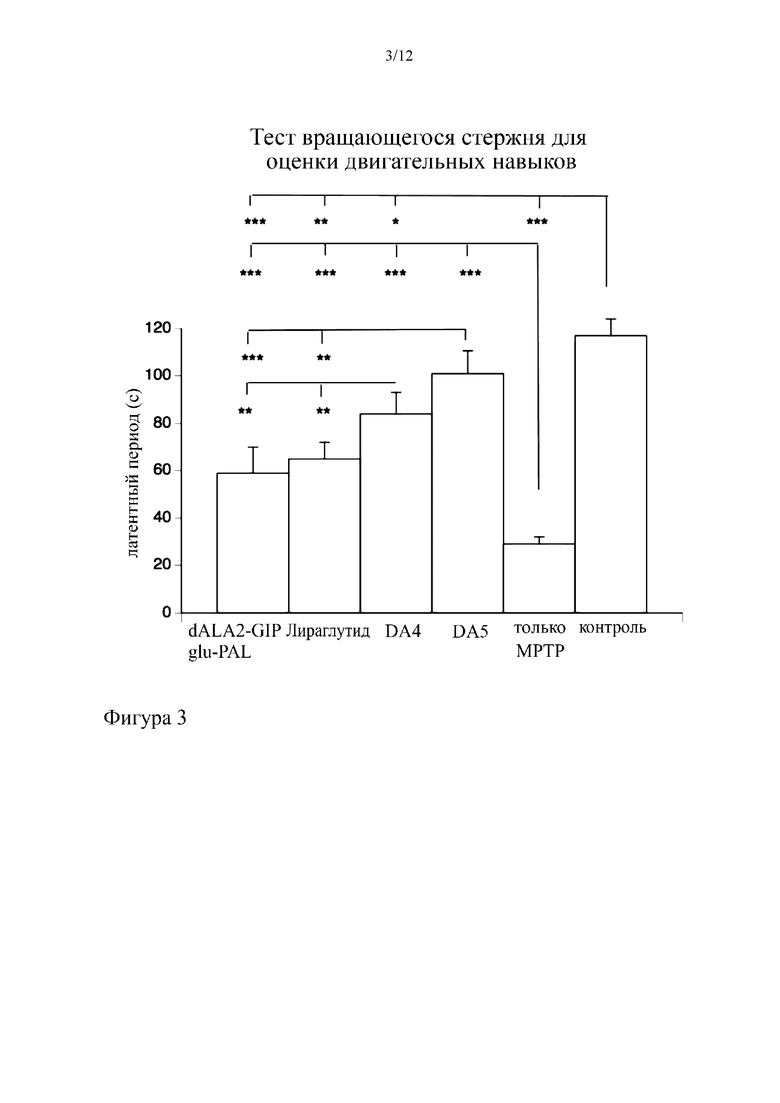
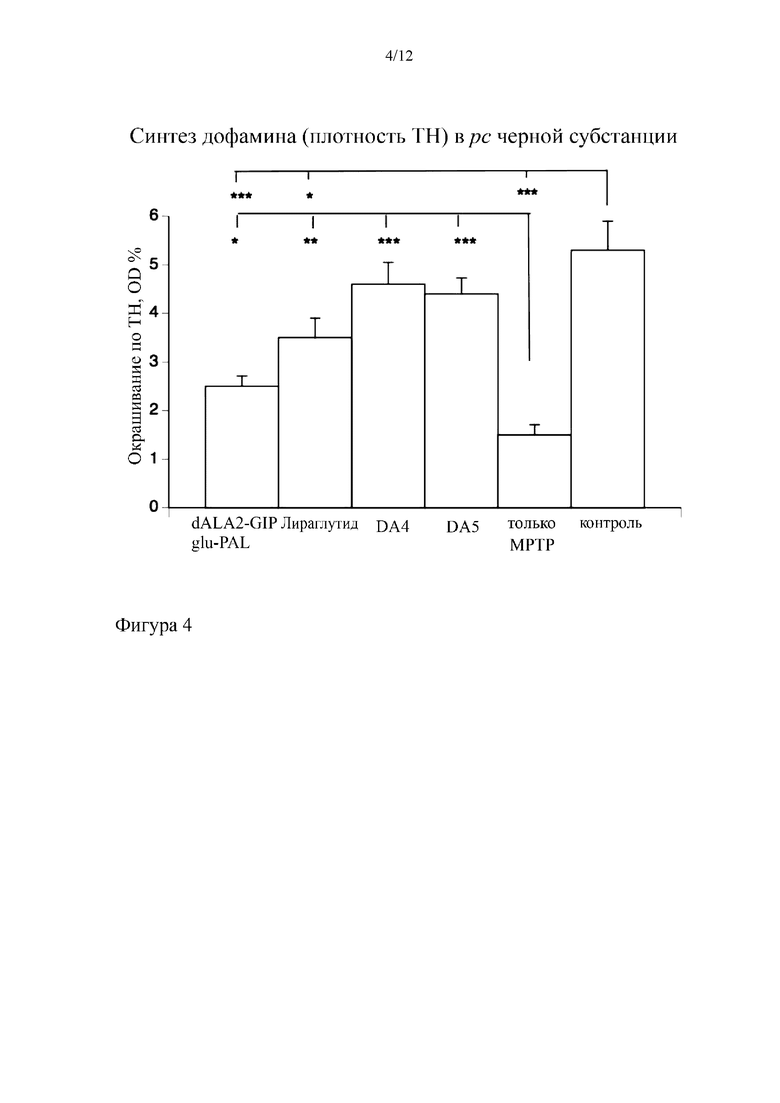
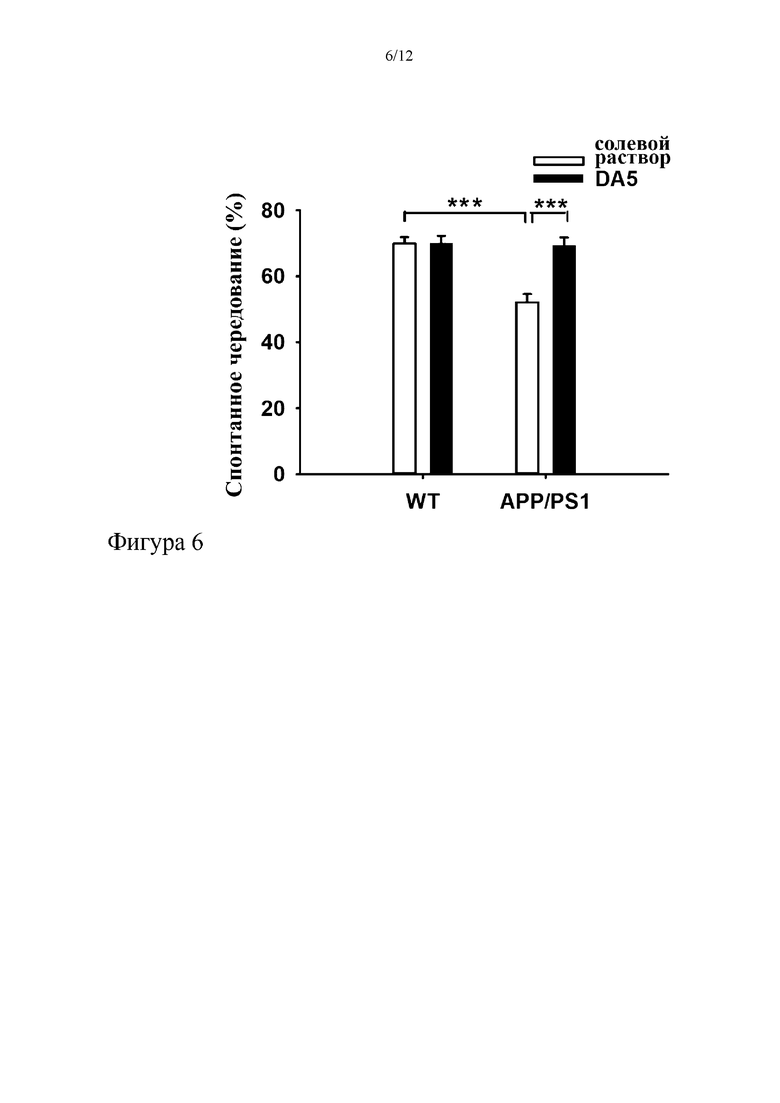
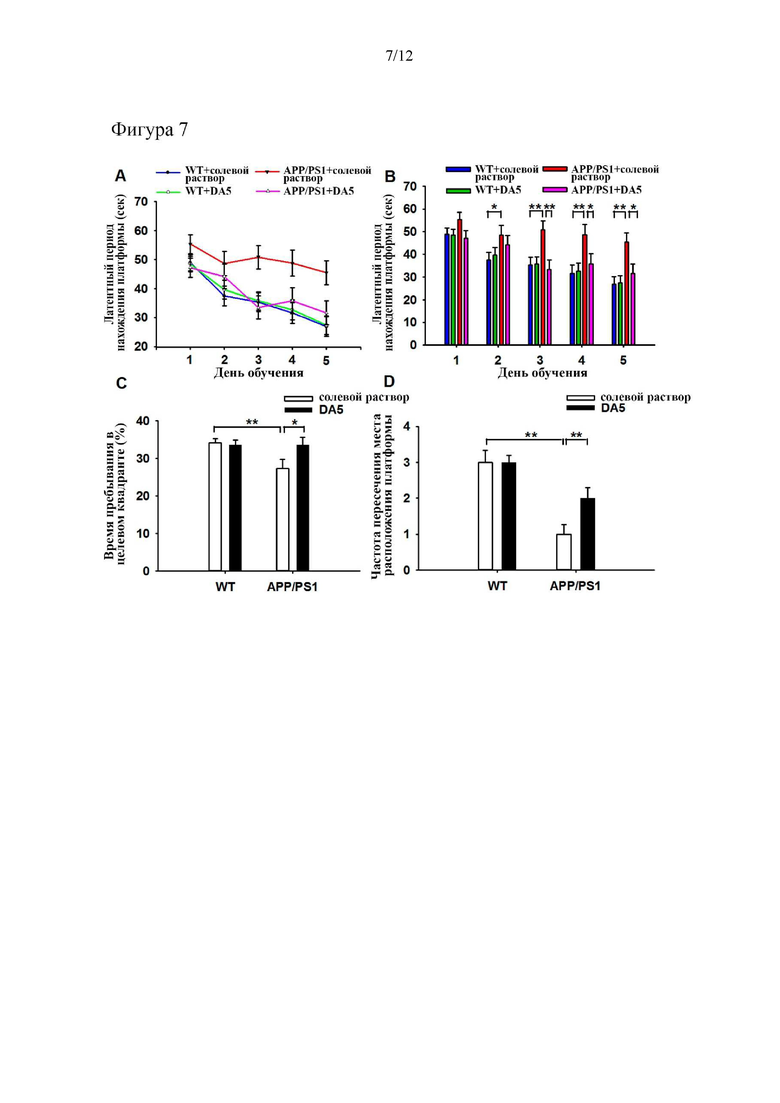
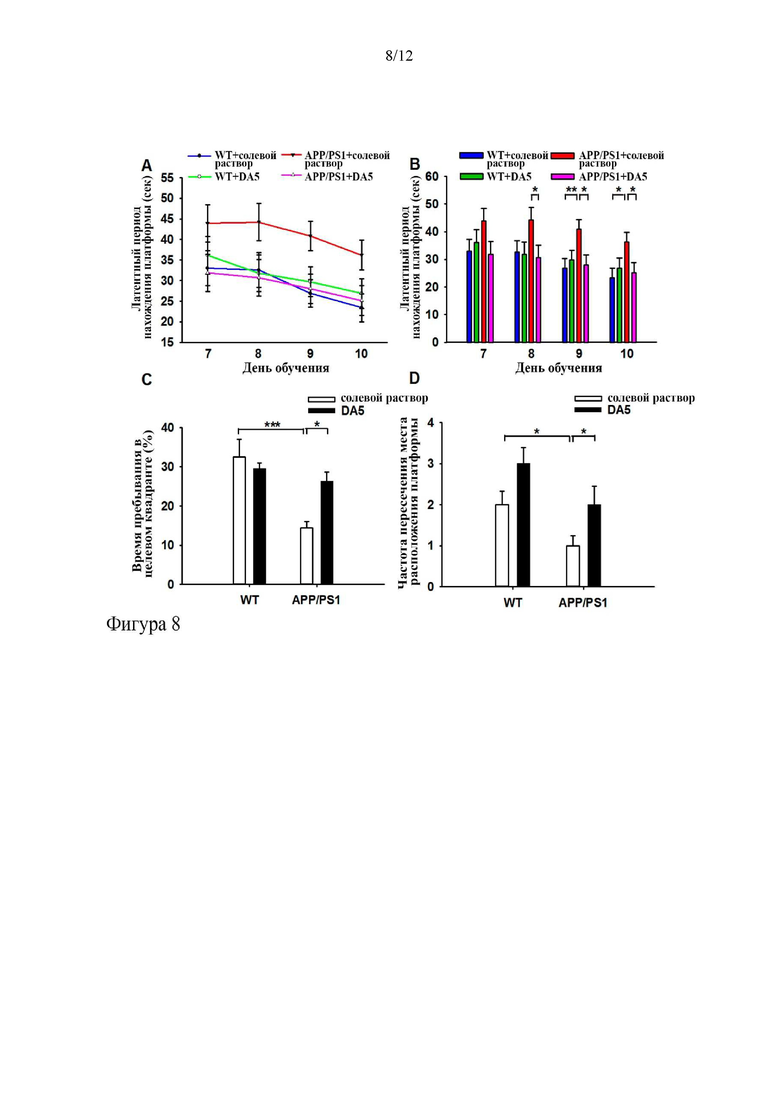
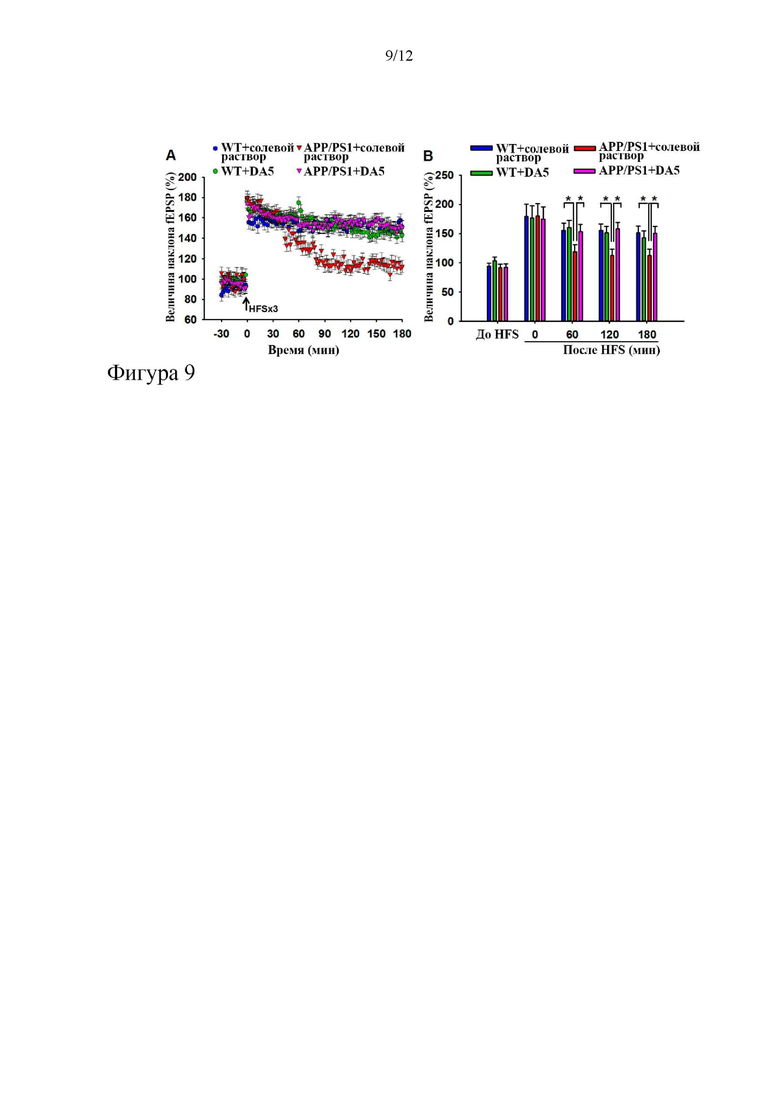

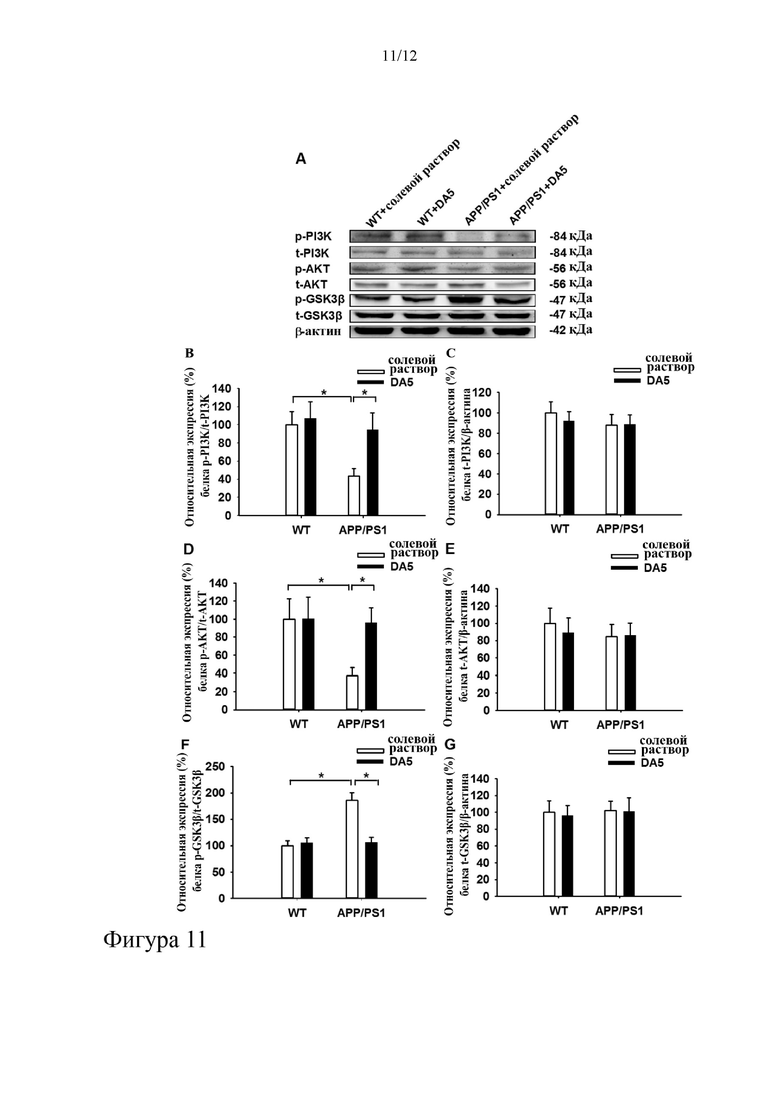

Изобретение относится к области биотехнологии, конкретно к пептидам-коагонистам глюкозозависимого инсулинотропного пептида/глюкагоноподобного пептида-1 (GIP/GLP-1), и может быть использовано в медицине для получения лекарственного средства для лечения или профилактики болезни Альцгеймера или болезни Паркинсона. Получены пептиды 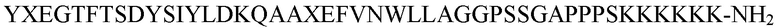 ,
, 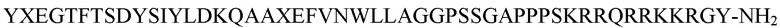 ,
,
где X = аминоизомасляная кислота. Дополнительно пептиды могут быть ковалентно связаны с гидрофильным фрагментом. Изобретение обеспечивает получение коагонистов GIP/GLP-1 с усиленными нейропротекторными свойствами по сравнению с отдельными аналогами GLP-1 и GIP в животных моделях болезни Альцгеймера и Паркинсона. 2 н. и 25 з.п. ф-лы, 12 ил., 2 пр.
1. Пептид-коагонист глюкозозависимого инсулинотропного пептида/глюкагоноподобного пептида-1 (GIP/GLP-1), представленный общей формулой I:
Tyr-Aib-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Ile-Tyr-Leu-Asp-Lys-Gln-Ala-Ala-Aib-Glu-Phe-Val-Xaa24-Trp-Leu-Leu-Ala-Gly-Y1-Y2-R2 (I) (SEQ ID No. 1),
где Xaa24 представляет собой Asn;
Y1 представляет собой Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Lys (SEQ ID No. 7);
Y2 выбран из:
Lys-Lys-Lys-Lys-Lys-Lys (SEQ ID No. 3); и Arg-Arg-Gln-Arg-Arg-Lys-Lys-Arg-Gly-Tyr (SEQ ID No. 4) и
R2 представляет собой -NH2,
или фармацевтически приемлемая соль или сольват пептида.
2. Пептид по п. 1, который состоит из аминокислотной последовательности:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKKKKKK-NH2 (SEQ ID No. 11),
где X = аминоизомасляная кислота.
3. Пептид по п. 1, который состоит из аминокислотной последовательности:
YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKRRQRRKKRGY-NH2 (SEQ. ID. No. 12),
где X = аминоизомасляная кислота.
4. Пептид по любому из пп. 1-3, который содержит гидрофильный фрагмент, ковалентно связанный с аминокислотой.
5. Пептид по п. 4, который содержит гидрофильный фрагмент, ковалентно связанный с (i) аминокислотой в положении 24 или (ii) аминокислотой в положении 39 или 40.
6. Пептид по любому из пп. 1-3, где пептид конъюгирован с липофильным заместителем.
7. Пептид по п. 6, где липофильный заместитель содержит ацильную группу и необязательно представляет собой молекулу жирной кислоты, и причем дополнительно необязательно молекула жирной кислоты выбрана из C-8-октаноильной группы, C-10-деканоильной группы, C-12-лауроильной группы, C-14-миристоильной группы, C-16-пальмитоильной группы, C-18-стеароильной группы и C-20-ацильной группы.
8. Пептид по п. 6, где липофильный заместитель соединен с аминокислотой по карбоксильному концу пептида.
9. Пептид по п. 8, где липофильный заместитель содержит ацильную группу и необязательно представляет собой молекулу жирной кислоты, и причем дополнительно необязательно молекула жирной кислоты выбрана из C-8-октаноильной группы, C-10-деканоильной группы, C-12-лауроильной группы, C-14-миристоильной группы, C-16-пальмитоильной группы, C-18-стеароильной группы и C-20-ацильной группы.
10. Пептид по п. 6, который содержит спейсер, который обеспечивает конъюгацию липофильного заместителя с аминокислотным остатком.
11. Пептид по п. 10, где липофильный заместитель содержит ацильную группу и необязательно представляет собой молекулу жирной кислоты, и причем дополнительно необязательно молекула жирной кислоты выбрана из C-8-октаноильной группы, C-10-деканоильной группы, C-12-лауроильной группы, C-14-миристоильной группы, C-16-пальмитоильной группы, C-18-стеароильной группы и C-20-ацильной группы.
12. Пептид по п. 11, где липофильный заместитель соединен с аминокислотой по карбоксильному концу пептида.
13. Пептид по п. 10, где спейсер представляет собой остаток из встречающейся в природе или не встречающейся в природе аминокислоты, причем спейсер включает остаток Gly, Pro, Ala, Val, Leu, Ile, Met, Cys, Phe, Tyr, Trp, His, Lys, Arg, Gln, Asn, α-Glu, γ-Glu, ε-Lys, Asp, Ser, Thr, ГАМК, Aib, β-аминогексаноила, 7-аминогептаноила, 8-аминооктаноила, 9-аминононаноила, 10-аминодеканоила или 8-амино-3,6-диоксаоктаноила.
14. Пептид по п. 13, где спейсер представляет собой γ-Glu, или где спейсер представляет собой дипептид, причем необязательно спейсер включает две отрицательно заряженные аминокислоты, и причем дополнительно необязательно спейсер представляет собой γ-Glu-γ-Glu.
15. Применение пептида по п. 1, или, 2 или, 3 для получения лекарственного средства для лечения или профилактики неврологического нарушения, выбранного из группы, состоящей из болезни Альцгеймера и болезни Паркинсона.
16. Применение по п. 15, где пептид содержит гидрофильный фрагмент, ковалентно связанный с аминокислотой.
17. Применение по п. 16, где пептид содержит гидрофильный фрагмент, ковалентно связанный с (i) аминокислотой в положении 24 или (ii) аминокислотой в положении 39 или 40.
18. Применение по п. 17, где пептид конъюгирован с липофильным заместителем.
19. Применение по п. 18, где липофильный заместитель содержит ацильную группу и необязательно представляет собой молекулу жирной кислоты, и причем дополнительно необязательно молекула жирной кислоты выбрана из C-8-октаноильной группы, C-10-деканоильной группы, C-12-лауроильной группы, C-14-миристоильной группы, C-16-пальмитоильной группы, C-18-стеароильной группы и C-20-ацильной группы.
20. Применение по п. 19, где липофильный заместитель соединен с аминокислотой по карбоксильному концу пептида.
21. Применение по п. 20, отличающееся тем, что пептид содержит спейсер, который обеспечивает конъюгацию липофильного заместителя с аминокислотным остатком.
22. Применение по п. 21, где спейсер представляет собой остаток из встречающейся в природе или не встречающейся в природе аминокислоты, причем спейсер включает остаток Gly, Pro, Ala, Val, Leu, Ile, Met, Cys, Phe, Tyr, Trp, His, Lys, Arg, Gln, Asn, α-Glu, γ-Glu, ε-Lys, Asp, Ser, Thr, ГАМК, Aib, β-аминогексаноила, 7-аминогептаноила, 8-аминооктаноила, 9-аминононаноила, 10-аминодеканоила или 8-амино-3,6-диоксаоктаноила.
23. Применение по п. 22, где спейсер представляет собой γ-Glu или где спейсер представляет собой дипептид, причем необязательно спейсер включает две отрицательно заряженные аминокислоты и причем дополнительно необязательно спейсер представляет собой γ-Glu-γ-Glu.
24. Применение по п. 15, где неврологическое нарушение обусловлено или ассоциировано с отложением в виде бляшек бета-амилоидного белка в области у пациента.
25. Применение по п. 15, где неврологическое нарушение обусловлено или ассоциированно с:
a) дисфункцией долговременной потенциации синаптической передачи или
b) воспалением.
26. Применение по п. 15, где неврологическое нарушение затрагивает когнитивную функцию.
27. Применение по п. 15, где пептид состоит из следующей последовательности:
(a) YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKKKKKK-NH2 (SEQ ID No. 11),
где X = аминоизомасляная кислота; или
(b) YXEGTFTSDYSIYLDKQAAXEFVNWLLAGGPSSGAPPPSKRRQRRKKRGYNH2
(SEQ ID No. 12),
где X = аминоизомасляная кислота.
| US 2016015788 А1, 21.01.2016 | |||
| WO 2013192129 А1, 27.12.2013 | |||
| VERSPOHL E.J | |||
| ET AL., Novel therapeutics for type 2 diabetes: Incretin hormone mimetics (glucagon-like peptide-1 receptor agonists) and dipeptidyl peptidase-4 inhibitors, PHARMACOLOGY AND THERAPEUTICS, 2009, v.124, n.1, p | |||
| Способ обработки грубых шерстей на различных аппаратах для мериносовой шерсти | 1920 |
|
SU113A1 |
| CHENHUI J | |||
| ET AL., A novel dual GLP-1 and GIP receptor | |||
Авторы
Даты
2021-09-24—Публикация
2017-12-04—Подача