Изобретение относится к области медицины и может быть использовано для прогнозирования, оценки и предупреждения развития дополнительных случаев ожирения и избытка массы тела у детского населения, потребляющего питьевую воду с повышенным содержанием остаточных количеств продуктов хлорирования питьевой воды (хлороформа и тетрахлорметана) выше 1,0 предельно-допустимой концентрации (ПДК) и наличием неприемлемого риска формирования гормональных нарушений.
Актуальность предлагаемого способа определяется тем, что повышенный уровень продуктов хлорирования в воде может явиться причиной патологии эндокринной системы. По данным Федерального информационного фонда социально-гигиенического мониторинга (ФИФ СГМ) в 2014 году в каждом пятом субъекте РФ содержание хлорорганических соединений в воде централизованного хозяйственно-питьевого водоснабжения не соответствовало гигиеническому нормативу (ГН 2.1.5.2280-07), в семи территориях страны доля проб питьевой воды с превышением ПДК по хлороформу (0,06 мг/л) составляла от 22,6 до 84,6%, в Пермском крае - 33,2% (4 ранговое место). На отдельных территориях ПК содержание хлорорганических соединений в питьевой воде по хлороформу достигало 2,8 ПДК (в концентрации до 0,15-0,17 мг/л), по тетрахлорметану - до 3,7 ПДК (0,0044-0,0074 мг/л), доля нестандартных проб по содержанию хлороформа составляла 78-100% от общего количества исследованных проб, по тетрахлорметану - 12,5-14,3%.
Результаты оценки параметров зависимости «доза загрязняющего вещества - концентрация химического соединения в крови» выявили адекватные модели зависимости (критерий Фишера 2,41≤F≥3,96, уровень статистической значимости р≤0,05) между суточной дозой хлороформа и тетрахлометана (коэффициент корреляции r=0,27-0,38), поступающих с питьевой водой, и концентрацией данных токсических соединений в крови детей.
По результатам эпидемиологических исследований, в Российской Федерации распространенность избыточной массы тела у детей в разных регионах России колеблется от 5,5 до 11,8%, а ожирением страдают около 5,5% детей, проживающих в сельской местности, и 8,5% детей - в городской. Ожирение и избыток массы тела (согласно Международной классификации болезней МКБ-10: Е66.0-Е67.8) в 2013 г. впервые вышли на первое место и составили - 10,98%о (48,1% случаев в структуре эндокринной заболеваемости), опередив патологию щитовидной железы - 10,65%о (46,6% случаев). При этом Пермский край по уровню распространенности ожирения занимает 4 ранговое место в РФ и 2 место в Приволжском федеральном округе (18,0%). Рост данной патологии за последние 6 лет составил 40% и превысил среднероссийский показатель в 1,6 раза. У детей, потребляющих питьевую воду с повышенным содержанием продуктов хлорирования, установлена достоверная причинно-следственная связь вероятности развития заболеваний эндокринной системы и избыточного питания с повышенным содержанием хлороформа в крови (доля дисперсии зависимой переменной R2=0,57-0,8; 289,5≤F≥708,9; р=0,001).
Согласно рекомендациям экспертов по питанию, в качестве высокоинформативного показателя избыточной массы тела и ожирения используется индекс массы тела (ИМТ) или индекс Кетле, определяемый как отношение массы тела (в кг) к росту (в метрах), возведенному в квадрат. Применительно ко взрослым об ожирении говорится, когда индекс массы их тела больше или равен 30 кг/м2 (Проблема ожирения в Европейском регионе ВОЗ и стратегии ее решения / Под ред. F. Branca, H. Nikogosian, T. Lobsteim. - Европейское региональное бюро ВОЗ, 2007, - С. 1-7). ИМТ для взрослых и для детей рассчитывается немного по-разному. Дополнительными параметрами при расчете индекса для детей становятся возраст и пол ребенка.
Нормальный ИМТ у детей меньше, чем у взрослых - от 15 до 18,5 в зависимости от возраста. Это связано с тем, что у детей и взрослых разные пропорции тела и, соответственно, соотношения роста и веса.
Из уровня техники известны различные прогностические подходы к установлению возможного ожирения и избыточной массы тела.
Например, известен способ прогнозирования прогрессирования абдоминального ожирения у больных метаболическим синдромом, при котором в крови определяется уровень С-пептида (Патент РФ №2297002). При его значении более 3,5 нг/мл прогнозируют прогрессирование абдоминального ожирения. Однако, данный известный способ учитывает риск прогрессирования ожирения только в случаях метаболического синдрома и не рассматривает таковую вероятность задолго до метаболических нарушений, что снижает его прогностическую ценность и возможность использования в доклинический период.
Также известен способ дифференциальной диагностики экзогенно-конституциональной и гипоталамической форм первичного ожирения у женщин (Патент РФ №1442189), согласно которому исследуют динамику секреции пролактина на введение нейропептида - люлиберина путем определения в пробе венозной крови исходного уровня гормона и последующего введения внутривенно люлиберина в дозе 100 мкг однократно. Затем исследуют кровь на пролактин на 30, 60, 90 и 120-й минуте после введения препарата. И при повышении уровня секреции по сравнению с исходным делают вывод об экзогенно-конституциональной форме ожирения, а при стабильном уровне в сравнении с исходным определяют гипоталамическую форму первичного ожирения. Способ направлен на постановку правильного диагноза в спорных случаях.
Недостатками указанного способа является то, что данная методика лишь уточняет клинический диагноз, не определяя вероятность развития нарушений углеводного и жирового обменов ассоциированных с воздействием негативных факторов среды обитания.
В уровне техники описан способ оценки показания для медикаментозной терапии ожирения в сочетании с инсулинорезистентностью у детей (Патент РФ №2279080). Сущность способа: в эритроцитах капиллярной крови у детей с ожирением и подтвержденной инсулинорезистентностью определяют соотношение водных фракций - коэффициент гидратации и при его значении равном или выше 5,36 состояние расценивают как требующее медикаментозной терапии метформином. Применение способа, при простоте выполнения, позволяет осуществлять индивидуальный подход к назначению метформина у детей с ожирением и сформировавшейся инсулинорезистентностью.
Его недостатками является то, что данный способ применим лишь для коррекции лечения, а не для определения индивидуальной чувствительности и всего комплекса медико-профилактических мероприятий (формирование контингентов риска, подбор индивидуальной диеты и физической нагрузки, медикаментозной коррекции и др).
Из Патента РФ №2452966 известен способ прогнозирования риска развития ожирения у практически здоровых людей, согласно которому в крови людей определяют концентрацию α-фетопротеина (АФП) и содержание Т-лимфоцитов с рецептором к трансферрину (CD71+). На основании полученных данных рассчитывают прогностический индекс (ПИ) как результат отношения концентрации АФП в МЕ/л к абсолютному содержанию лимфоцитов CD71+ в кл/л (ПИ=АФПЛ1Ю71). При величине ПИ равной 8,1 и более прогнозируется риск развития ожирения. Заявленный способ можно применять для выявления риска развития ожирения у лиц, ведущих малоподвижный образ жизни, а также при назначении глюкокортикоидов и иммунодепрессивной терапии, при наследуемой патологии с метаболическим дефектом. Его недостатком является то, что данный способ не учитывает вероятность формирования ожирения у детей в условиях воздействия негативных факторов среды обитания.
Наиболее близким к предлагаемому изобретению является способ, описанный в презентации «Риск ассоциированные механизмы формирования избытка массы тела и ожирения в условиях пероральной экспозиции остаточными количествами продуктов гиперхлорирования питьевой воды (хлороформ, тетрахлорметан)», автор Лужецкий К.П., 2015 г. (http://fcrisk.m/sites/default/files/upload/conference/953/fcrisk_conf_13-15.05.2015_luzhetskiy.pdf).
Согласно этому известному способу проводят отбор пробы крови у ребенка, устанавливают в ней концентрацию хлороформа и тетрахлорметана; далее определяют ряд лабораторных показателей, по отклонению которых от нормы судят о возможности ожирения у ребенка. В известном способе указано, что в качестве основных риск ассоциированных механизмов формирования избытка массы тела и ожирения у детей в условиях пероральной экспозиции остаточными количествами продуктов гиперхлорирования выступают:
- дисфункция гипоталамо-адреналовой (лабораторные маркеры-показатели: повышение уровня адреналина, норадреналина, серотонина, кортизола) и гипофизарно-тиреоидной системы (маркеры: снижение гормоны щитовидной железы Т3 и Т4, повышение тиреотропного гормона ТТГ),
- развивающаяся на фоне активации процессов свободнорадикального окисления, накопления продуктов пероксидации, перенапряжения и истощение ресурсов антиоксидантной защиты (маркеры: повышение гидроперекисей липидов, малонового диальдегида (МДА), глутатионпероксидазы, снижение антиоксидантной активности сыворотки и супероксиддисмутазы),
- с нарушением нейромедиаторных процессов (маркеры: снижение γ-Аминомасляной кислоты (ГАМК), повышение глутомата),
- и последующей дисрегуляцией жирового и углеводного обмена (резкая дисгармоничность физического развития, формирование избытка массы тела и ожирения, повышение уровня лептина и С-пептида в крови).
Все это позволяет обосновать комплекс информативных биохимических показателей ранней донозологической диагностики избытка массы тела и ожирения.
Недостатком указанного известного способа является его сложность выполнения, ввиду того, что требуется определять уровень множества лабораторных показателей. А, кроме того, известный способ не позволяет учитывать наследственную предрасположенность и индивидуальный генный полиморфизм у экспонированного населения, что снижает точность и достоверность способа.
Технический результат, достигаемый предлагаемым способом, заключается в обеспечении возможности оценки, прогнозирования индивидуального риска формирования избыточной массы тела и ожирения у детей, подверженных сочетанному воздействию повышенного содержания хлороформа и тетерахлорметана, которые поступают в организм с питьевой водой.
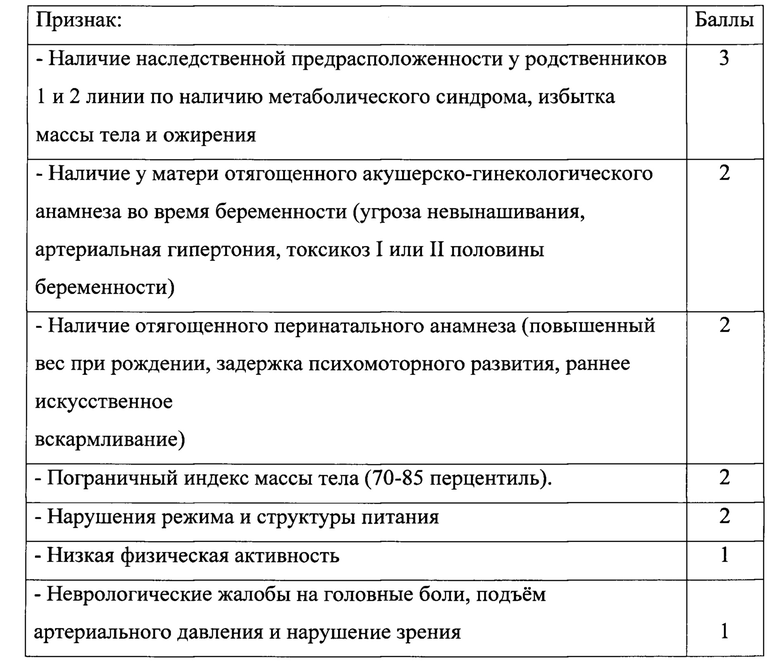
Поставленный технический результат достигается предлагаемым способом оценки индивидуального риска формирования избыточной массы тела и ожирения у детей, потребляющих питьевую воду с повышенным содержанием хлороформа и тетрахлорметана, включающим отбор пробы крови, определение в ней концентрации хлороформа и тетрахлорметана, определение лабораторных показателей, по которым судят о риске формирования избыточной массы тела и ожирения, при этом новым является то, что в качестве лабораторных показателей используют уровни общего холестерина и липопротеида низкой плотности ЛПНП, и при обнаружении в пробе крови концентрации хлороформа и тетрахлорметана выше референтной, при одновременном установлении уровня общего холестерина выше 3,9 ммоль/л и уровня ЛПНП выше 1,8 ммоль/л, проводят анамнестическое обследование ребенка для выяснения предрасположенности к формированию нарушения жирового и углеводного обмена по семи признакам по трехбалльной шкале:

и при наличии у ребенка суммарной балльной оценки 6 и более баллов при указанном анамнестическом обследовании, проводят генетическое исследование, заключающееся в том, что отбирают у ребенка пробу буккального эпителия, осуществляют выделение из указанной пробы дезоксирибонуклеиновой кислоты ДНК сорбентным методом, затем на детектирующем амплификаторе с использованием полимеразной цепной реакции проводят генотипирование полиморфизма, используя в качестве праймера участок ДНК гена кодирующего серотониновый рецептор HTR2A rs7997012, путем исследования его аллельного состояния, устанавливая при этом для участка гена HTR2A rs7997012 одно из следующих его состояний: гомозиготное нормальное, гомозиготное вариантное, гетерозиготное, и при одновременном выполнении следующих условий: повышение уровня общего холестерина выше 3,9 ммоль/л и уровня ЛПНП выше 1,8 ммоль/л; наличие у ребенка 6 и более баллов при анамнестическом обследовании; наличие гетерозиготного генотипа гена HTR2A rs7997012; повышение концентрации тетрахлорметана в крови выше референтной и концентрации хлороформа в пределах 5,17-5,59 мкг/л, прогнозируют риск формирования у ребенка избыточной массы тела, а при концентрации хлороформа равной или более 5,79 мкг/л, прогнозируют риск формирования ожирения.
Указанный технический результат достигается за счет следующего.
Приоритетным направлением современной профилактической медицины является предупреждение развития заболеваний, ассоциированных с негативным воздействием факторов среды обитания. Данные эпидемиологических и клинических наблюдений свидетельствуют о том, что на территориях загрязнения объектов среды обитания заболеваемость населения хронической соматической патологией в 1,2-2,6 раза превышает среднероссийские показатели. Среди химических техногенных факторов, загрязняющих питьевую воду, серьезную опасность из-за возможности нарушения состояния здоровья, в т.ч. патологии эндокринной системы, жирового и углеводного обмена, при хроническом пероральном поступлении представляют хлорорганические соединения (далее - ХОС) в воде (преимущественно, это хлороформ и тетрахлорметан).
Хлор и его соединения при поступлении в организм в процессе биотрансформации обладают способностью образовывать более токсичные, по сравнению с исходными загрязнениями, метаболиты, способные преодолевать гематоэнцефалический и плацентарный барьеры, кумулироваться в жировой ткани, путем алкилирования и (или) стимуляции перекисного окисления липидов, повреждать плазматические и внутриклеточные мембраны, запуская кальциевый механизм гибели клеток и нарушение липидного обмена.
Следует пояснить, что избыточная масса тела хоть у взрослого, хоть у ребенка, сопровождается снижением чувствительности тканей к инсулину. Известно, что при увеличении размеров адипоцитов в них уменьшается число рецепторов к инсулину и снижается чувствительность к нему, усиливаются процессы липолиза, то есть инсулинорезистентность является защитным механизмом, направленным на ограничение чрезмерного образования жира из глюкозы при ожирении. Это сопровождается повышением концентрации жирных кислот. При ожирении отмечаются структурно-функциональные изменения клеточных мембран.
Большое значение имеет нарушение метаболизма внутриклеточного кальция. Известно, что инсулин модифицирует мембранно-связанные ферменты, способствуя структурным перестройкам мембран. Изменения структуры клеточных мембран связаны с активацией процессов перекисного окисления липидов при ожирении. Следует отметить, что ожирение тесно связано с развитием ишемической болезни сердца и артериальной гипертензии, возникновением сахарного диабета 2 типа. Сопутствующими патологиями ожирения являются синдром обструктивных апноэ во сне, артрозы, выявлено увеличение частоты регистрации рака толстого кишечника и желчного пузыря. Вот почему ранняя оценка риска развития ожирения или избыточной массы тела у детей является важной задачей для современной педиатрии и эндокринологии.
Благодаря использованию в качестве исследуемого материала пробы крови обеспечивается простота, надежность и доступность исследований, а также получение результатов нужной информативности.
Установление содержания хлороформа и тетрахлорметана именно в крови обусловлено тем, что кровь является самой гомеостатичной средой (управляемость и регулируемость концентраций составляющих ее компонентов) и единственной, имеющей реферируемые константы в отношении техногенных химических веществ. Такие хлорорганические соединения как хлороформ и тетрахлорметан являются истинными ксенобиотиками и их содержание в крови не допускается (референтная концентрация 0,0 мг/л).
Применение в предлагаемом способе в качестве лабораторных показателей уровня общего холестерина и уровня ЛПНП обусловлено связью этих показателей с формированием нарушения жирового и углеводного обмена. Впервые установлено, что у детей потребляющих питьевую воду с повышенным содержанием ХОС и имеющих в биосредах концентрации хлороформа и тетрахлорметана, при повышении в крови уровня общего холестерина выше 3,9 ммоль/л (возрастная норма 3,11-5,18 ммоль/л) и ЛПНП выше 1,8 ммоль/л (возрастная норма 1,55-3,63 ммоль/л), возрастает вероятность формирования нарушений жирового и углеводного обмена (избытка массы тела и ожирения, R2=0,57-0,6; 289,5≤F≥708,9; р<0,001). А обычно из уровня техники известно, что все прогнозы и диагностика обеспечиваются показателями, значения которых выше или ниже физиологической нормы.
Благодаря тому, что в предлагаемом способе дополнительно используют информацию о предрасположенности к формированию нарушения жирового и углеводного обмена через анамнестическое обследование ребенка по семи признакам, которые оценивают по трехбалльной шкале, обеспечивается более точное и достоверное прогнозирование вероятности возникновения избыточной массы тела и ожирения. Указанная шкала получена и применена впервые для этой цели.
С целью более точной персонализации индивидуального риска формирования метаболических нарушений на последнем этапе предлагаемого способа применяется генетическое исследование вариации гена HTR2A (rs7997012), определяющего передачу сигнала к рецептору серотонина и патогенетически связанного с формированием нарушений жирового и углеводного обмена), т.к. именно он характеризовался достоверным увеличением частоты встречаемости вариантного гомозиготного и гетерозиготного генотипа, относительно неэкспонированного хлороформом населения. Методами корреляционного анализа и математического моделирования между указанными диагностическими и клинико-лабораторными показателями (уровень общего холестерина и ЛПНП); наследственная предрасположенность (по индивидуальной шкале); генетическими показателями полиморфизма и содержанием в крови хлороформа и тетрахлорметана, установлена достоверная зависимость.
Благодаря использованию в качестве исследуемого материала буккального эпителия (пробы биологического материала из ротоглотки), обеспечивается простота и надежность исследований, а также получение нужной информативности, в плане выделения из указанной пробы дезоксирибонуклеиновой кислоты (ДНК) и посредством полимеразной цепной реакции (ПНР) проведения генотипирования полиморфизма используется в качестве праймера участок ДНК гена HTR2A (rs7997012) путем исследования его аллельного состояния, устанавливая при этом для исследуемого гена одно из следующих его состояний: гомозиготное нормальное, гомозиготное вариантное, гетерозиготное. Это необходимо для того, чтобы выявить наличие вариантного аллеля гена HTR2A, функционально связанного с формированием избытка массы тела и ожирения.
Кроме того, в предлагаемом способе выделена определенная последовательность операций. Это обусловлено тем, чтобы генные исследования, как самые дорогостоящие, выполняются в последнюю очередь, при наличии предварительных подтвержденных данных о вероятности формирования метаболических нарушений. Это позволяет исключить дополнительные затраты на реализацию предлагаемого способа.
Таким образом, при оценке индивидуального риска у ребенка влияния хлороформа и тетрахлорметана на формирование нарушений углеводного и жирового обмена в предлагаемом способе рекомендуется использовать следующие одновременно присутствующие критерии: повышение уровня общего холестерина в крови ребенка выше 3,9 ммоль/л и уровня ЛПНП выше 1,8 ммоль/л; наличие у ребенка 6 и более баллов при анамнестическом обследовании; наличие гетерозиготного генотипа гена HTR2A rs7997012; повышение концентрации тетрахлорметана в крови выше референтной и концентрации хлороформа в пределах 5,17-5,59 мкг/л (прогноз риска формирования у ребенка избыточной массы тела при потреблении питьевой воды с хлороформом и тетрахлорметаном), а при концентрации хлороформа равной или более 5,79 мкг/л - прогноз риска формирования ожирения.
Именно благодаря расширению информационных показателей, связанных с избытком массы тела и ожирением, их объективных числовых значений, и одновременно с количеством химических токсикантов - хлороформа и тетрахлорметана в крови, и будет обеспечена точность и достоверность оценки влияния этих ХОС на развитие указанной патологии. А при отсутствии хотя бы одного из вышеуказанных критериев оценивают процесс формирования избыточной массы тела и ожирения у ребенка в присутствии хлороформа и тетрахлорметана как нормальный.
Исходя из вышеизложенного можно сделать вывод, что поставленный технический результат обеспечивается за счет совокупности всех операций предлагаемого способа, их последовательности и режимов его реализации.
Предлагаемый способ реализуется следующим образом.
1. Выбирают территорию экологического риска, характеризующуюся наличием повышенного содержания хлороформа и тетрахлорметана в воде, использующейся населением, в частности, детским, в качестве питьевой воды. Оценку полученных концентраций хлороформа и тетрахлорметана в питьевой воде выполняют на основании сравнительного анализа с предельно допустимыми концентрациями в воде водных объектов в соответствии с ГН 2.1.5.1315-03 «Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования»; так же используют результаты мониторинговых наблюдений за период 2013-2014 гг. (данные ФБУЗ «Центр гигиены и эпидемиологии в Пермском крае» или данных Роспотребнадзора своей территории) и натурные исследования любого учреждения, имеющего аккредитацию на выполнение данных исследований.
2. На указанной территории производят отбор группы детей одной этнической популяции. Затем производят отбор пробы крови у обследуемого ребенка для определения содержания хлороформа и тетрахлорметана. Определение уровня хлороформа и тетрахлорметана в крови детей выполняют методом анализа равновесной паровой фазы на газовом хроматографе «Кристалл-5000» с капиллярной колонкой DB-624 и селективным детектором электронного захвата в соответствии с МУК 4.1.2115-06. И при обнаружении хлороформа и тетрахлорметана в пробе крови (каждого более 0,0 мкг/л), выполняется биохимическое определение в крови уровня общего холестерина и ЛПНП.
3. При превышении уровня общего холестерина выше 3,9 ммоль/л (возрастная физиологическая норма 3,11-5,18 ммоль/л) и ЛПНП выше 1,8 ммоль/л (возрастная физиологическая норма 1,55-3,63 ммоль/л) проводят последующее анамнестическое обследование ребенка для выяснения предрасположенности к формированию нарушения жирового и углеводного обмена по семи признакам по трехбалльной шкале:


и при наличии у ребенка суммарной балльной оценки 6 и более баллов при указанном анамнестическом обследовании, проводят последующее генетическое исследование.
4. При генетическом исследовании у ребенка отбирают пробу, буккального эпителия (в виде мазка со слизистой оболочки ротоглотки), причем забор осуществляют сухими стерильными зондами с ватными тампонами вращательными движениями без травматизации после предварительного полоскания полости рта водой.
После забора материала тампон (рабочую часть зонда с ватным тампоном) помещают в стерильную пробирку типа «Эппендорф» с 500 мкл транспортной среды (стерильный 0,9%-ный раствор NaCl). Конец зонда отламывают или отрезают, с расчетом, чтобы он позволил плотно закрыть крышку пробирки. Пробирку с раствором и рабочей частью зонда закрывают.
Далее производят выделение ДНК из пробы. Для этого пробы в количестве 100 мкл лизируют 300 мкл лизирующего раствора, представляющего собой 0,5%-ный раствор саркозила и протеиназы K (20 мг/мл) в ацетатном буфере (pH 7,5). Затем добавляют сорбент (каолин) и последовательными процедурами промывки отмывают фосфатно-солевым буфером (pH 7,2) пробы от белков и смесью изопропиловый спирт: ацетон от липидов. Нуклеиновые кислоты остаются при этом на сорбенте. Далее адсорбированные на сорбенте ДНК из пробы экстрагируют ТЕ-буфером, представляющим собой смесь 10 мМ трис-HCl и 1 мМ ЭДТА (pH 8,0). Экстракт подвергают центрифугированию. После центрифугирования пробирки надосадочная жидкость содержит очищенную ДНК.
5. Затем на детектирующем амплификаторе с использованием полимеразной цепной реакции (ПЦР) проводят генотипирование полиморфизма, используя в качестве праймера участок ДНК гена кодирующего серотониновый рецептор - HTR2A (rs7997012), путем исследования его аллельного состояния, устанавливая при этом для гена HTR2A одно из следующих его состояний: гетерозиготное или гомозиготное.
ПНР проводят на детектирующем амплификаторе с гибридизационно-флуоресцентной детекцией в режиме «реального времени» с использованием готовых наборов праймеров и зондов производства ЗАО «Синтол» (Россия, Москва), в котором в качестве амплифицируемой цепочки нуклеотидов использовался участок ДНК гена HTR2A (rs7997012). ПЦР проводили, используя информацию из Методических рекомендаций MP 4.2.0075-13 «Перечень маркеров генного полиморфизма, отвечающих за особенности мутагенной активности техногенных химических факторов».
Проводят реакцию амплификации, это достигается тем, что для исследования аллельного состояния каждого гена у отдельного человека готовят свою реакционную смесь. В пробирку вносят 0,1 мкл готовой смеси праймеров (принятый в генетике термин, обозначающий конечные нуклеотиды с меткой, ограничивающие (отрезающие) амплифицируемую цепочку нуклеотидов гена) и зондов для выбранного гена HTR2A (rs7997012). В эту же пробирку добавляют остальные компоненты необходимые для осуществления ПЦР: нуклеотиды (дезоксинуклеозидтрифосфаты: по 10 мМ дАТФ, дТТФ, дГТФ, дЦТФ), буфера (100 мМ трис-НСl-буфера, 500 мМ KCl, 40 мМ MgCl2) и Tag F-полимеразы. Вносят пробу в количестве 10 мкл. Таким образом, общий объем реакционной смеси составляет 25 мкл.
Пробирка плотно закрывается пробкой и устанавливается в амплификатор. При проведении ПЦР амплификацию и детекцию проводят на детектирующем амплификаторе CFX96 фирмы Bio-Rad.
Используется универсальная программа амплификации, подобранная производителем прибора CFX96 фирмой Bio-Rad (USA). Она включает в себя несколько этапов: 1 этап - активация TaqF-полимеразы (режим «горячего старта») продолжается 15 мин при 95°C; 2 этап - установочные циклы амплификации без измерения флуоресценции (5 циклов); 3 этап - рабочие циклы амплификации с измерением флюоресценции (40 циклов).
Каждый цикл амплификации включает в себя денатурацию ДНК (5 с при 95°C), отжиг праймеров (20 с при 60°C) и саму реакцию полимеризации ДНК (15 с при 72°C).
Регистрация сигнала флюоресценции, возникающего при накоплении продуктов амплификации участков ДНК проводится в режиме «реального времени» после стадии отжига праймеров для выбранных генов по каналу VIC - для детекции одного из аллельных вариантов генов, и по каналу FAM - для альтернативного варианта.
Результаты интерпретируются на основании наличия (или отсутствия) пересечения кривой флюоресценции с установленной на заданном уровне пороговой линией, что соответствует наличию (или отсутствию) значения порогового цикла (N) в соответствующей графе в таблице результатов, отображаемой в программном обеспечении для амплификатора CFX96.
По соотношению пороговых циклов, полученных по двум каналам детекции, определяют состояние гена HTR2A (rs7997012) в исследуемом участке ДНК (метод аллельной дискриминации). Возможных вариантов состояния гена было два: гомозиготное - в случае, когда одно из значений порогового цикла не определяется (ниже пороговой линии) и гетерозиготное - в случае, когда получено два значения пороговых циклов и по этим каналам получены параболические кривые флюоресценции. В зависимости от того, накопление какого продукта амплификации происходит в реакции, устанавливается гетерозиготное или гомозиготное (нормальное или вариантное) состояние гена HTR2A.
6. И при одновременном выполнении следующих условий: повышение уровня общего холестерина выше 3,9 ммоль/л и уровня ЛПНП выше 1,8 ммоль/л; наличие у ребенка 6 и более баллов при анамнестическом обследовании; наличие гетерозиготного генотипа гена HTR2A rs7997012; повышение концентрации тетрахлорметана в крови выше референтной и концентрации хлороформа в пределах 5,17-5,59 мкг/л, прогнозируют риск формирования у ребенка избыточной массы тела, а при концентрации хлороформа равной или более 5,79 мкг/л, прогнозируют риск формирования ожирения.
При проведении испытаний по реализации предлагаемого способа выполнено обследование детского населения, проживающего в различных по содержанию хлороформа и тетрахлорметана в питьевой воде условиях среды обитания.
Группу наблюдения составили 192 ребенка (94 мальчика и 98 девочек) (6,33±0,13 лет), потребляющих питьевую воду ненормативного качества по содержанию хлорорганических соединений (хлороформ до 2,8 ПДК, в концентрации 0,15-0,17 мг/л, тетрахлорметан - до 3,7 ПДК, 0,0044-0,0074 мг/л). Доля нестандартных проб по содержанию хлороформа составила 78-100% от общего количества исследованных проб, тетрахлорметана - 12,5-14,3%.
Группу сравнения составили 133 ребенка (68 мальчиков и 64 девочки, р≥0,05) аналогичного возраста (6,07±0,14 лет, р≥0,05), потребляющих питьевую воду, соответствующую гигиеническим нормативам (содержание хлороформа - 0,0003-0,0004 мг/л, тетрахлорметан - 0,0003-0,0004 мг/л). Других загрязняющих питьевую воду веществ, превышающих ПДК и способных оказывать негативное влияние на эндокринную систему и гормоногенез, на территориях исследования выявлено не было.
Группы исследования были сопоставимы по возрасту, полу, этническому составу, сопутствующей патологии, социально-экономическому уровню семьи, качеству и составу питания.
В качестве маркеров экспозиции, для каждого обследуемого ребенка, рассматривалось содержание хлороформа и тетрахлорметана в крови. Определение уровня хлороформа и тетрахлорметана в крови детей выполнялось методом анализа равновесной паровой фазы на газовом хроматографе «Кристалл-5000» с капиллярной колонкой DB-624 и селективным детектором электронного захвата в соответствии с МУК 4.1.2115-06.
Лабораторную диагностику уровня общего холестерина и ЛПНП выполняли по стандартным методикам с помощью биохимического анализатора «Konelab 20» (ThermoFisher, Финляндия).
У детей, потребляющих питьевую воду с повышенным содержанием ХОС, установлена достоверная причинно-следственная связь развития избытка массы тела с повышенным содержанием хлороформа и тетрахлорметана в крови (с увеличением концентрации ХОС в крови вероятность развития метаболических нарушений увеличивается, R2=0,57-0,6; 289,5≤F≥708,9; р<0,001).
При проведении исследований были рассмотрены вариации 9 патогенетически значимых для развития метаболических и антиоксидантных нарушений генов: глутатионтрансферазы (GSTA4 rs3756980), сульфотрансферазы (SULT1A1 Arg213His), супероксиддисмутазы-2 (SOD2 С14510А), эстрогенового рецептора (ESR1 2152A/G), серотонинового рецептора (HTR2A rs7997012), белка сиртуина (SIRT1 rs7069102), гамма-рецептора пероксисом (PPARG rs2016520), белка апо-Е (АРОЕ 471С/Т) и глюкокортикоидного рецептора (NR3C1 Asn363Ser). Все они идентифицировались как маркеры индивидуальной чувствительности, т.е. маркеры предрасположенности к негативным ответам на воздействие хлороформа и тетрахлорметана. Для исследования полиморфных вариантов в указанных генах использовали методику ПЦР, в основе которой лежит реакция амплификации и детекция продуктов этой реакции. Забор материала для ПЦР проводился методом взятия у ребенка мазков со слизистой оболочки ротоглотки. Затем проводили выделение ДНК с помощью сорбентного метода. Для определения генотипа человека использовали метод аллельной дискриминации (MP 4.2.0075-13 «Перечень маркеров генного полиморфизма, отвечающих за особенности мутагенной активности техногенных химических факторов»).
Моделирование влияния хлороформа и тетрахлорметана в крови на вероятность формирования нарушений жирового и углеводного обмена, как для всей субпопуляции, так и для наиболее чувствительных подгрупп, выполнено в соответствии с MP 2.1.10.0062-12. «Количественная оценка неканцерогенного риска при воздействии химических веществ на основе построения эволюционных моделей», при помощи построения моделей логистической регрессии для различных уровней экспозиции. Вероятность развития различных форм нарушения жирового и углеводного обмена в зависимости от экспозиции (концентрации хлороформа, тетрахлорметана в крови), у детей с вариациями генов, описывается логистической функцией:
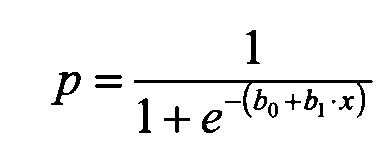 ,
,
где р - вероятность;
b0, b1 - параметры уравнения, определяемые с помощью регрессионного анализа;
x - концентрация хлороформа (концентрация тетрахлорметана), мкг/л.
Оценка риска здоровью (R) производилась с учетом вероятности (р) и тяжести (g) заболевания с использованием формулы R=р⋅g. Показатель тяжести формирования нарушений жирового и углеводного обменов (МКБ10: Е67.8 - избыток массы тела, Е66.0 - ожирение) оценивался в соответствии со шкалой степени тяжести нарушений здоровья на уровне верхней границы для заболеваний легкой тяжести - 0,0004 (Патент РФ №2368322 «Способ определения интегрального допустимого риска отдельных классов и видов продукции для здоровья человека»).
Сравнение групп по количественным признакам проводили с использованием двухвыборочного критерия Стьюдента; оценку зависимостей между признаками - методом корреляционно-регрессионного анализа для количественных переменных. Значимость взаимосвязей и различия между выборками считались достоверными при значении для р<0,05. Корреляционный анализ выполнен по методу Спирмена. Тесты на соблюдение равновесия Харди - Вайнберга и выявление ассоциаций методом Пирсона χ2 выполняли с помощью программы «ГенЭксперт» (Государственный Научный Центр Российской Федерации "ГосНИИ генетика"). Исследуемые группы находились в равновесном (устойчивом) состоянии по частотам генотипов изученных генов (р<0,05). Анализ полученной информации осуществлялся статистическими методами (Statistica 7.0) и с помощью программных продуктов, сопряженных с приложениями MS-Office.
По данным обращаемости за медицинской помощью в 2013 г. количество случаев выявленной эндокринной патологии у детей, проживающих на территории исследования, откуда были выбраны дети группы наблюдения, составляло - 175%, что в 2,3 раза выше уровня заболеваемости на территории сравнения - 74,9%. В качестве приоритетной эндокринной патологии у детей на территории исследования диагностировались различные формы нарушения жирового и углеводного обмена (избыток массы тела - 17,4%, ожирение - 30,6%), уровень распространенности которых на протяжении последних трех лет в 4,2-7,0 и 6,4-8,5 раза превышал показатели территории сравнения (2,4-4,1% и 3,6-9,4% соответственно, р=0,001-0,041).
На основании проведенной оценки риска установлено, что при пероральном поступлении с питьевой водой хлороформа и тетрахлорметана, у экспонированного населения на территории исследования формируется неприемлемый неканцерогенный риск (HQ) развития патологии эндокринной системы, который равен 1,75, что в 11,3 раз выше, чем на территории сравнения (HQ=0,14). Вклад ХОС: хлороформа и тетрахлорметана, в индекс опасности развития эндокринных нарушений достигает 85,7%.
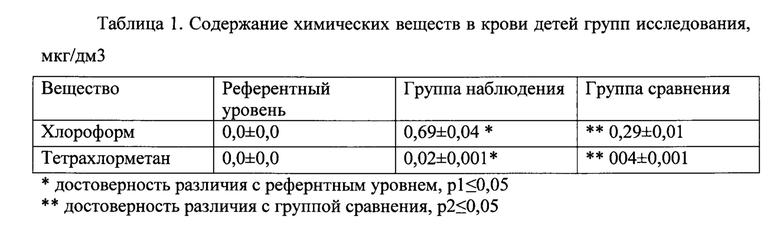
Содержание хлороформа у детей группы наблюдения составляло 0,69±0,04 мкг/л (референтная концентрация - 0,0±0,0 мкг/л, р<0,01), тетрахлорметана - 0,02±0,001 мкг/л (референтная концентрация - 0,0±0,0 мкг/л, р<0,01), что в 2,3-5,0 раз выше показателей группы сравнения (0,29±0,01 и 004±0,001 мкг/л соответственно) (р<0,05). Данные приведены в таблице 1.
В ходе химико-аналитического исследования проб крови у детей группы наблюдения диапазон индивидуальных концентраций маркерного показателя (хлороформа) составлял от 0,1 до 6,0 мкг/л.
По результатам углубленного клинического врачебного обследования патология эндокринной системы в общей структуре заболеваний в группе наблюдения занимала третье ранговое место и диагностировалась в два раза чаще (23,8%), чем в группе сравнения (10,7%, р=0,05). При этом вероятность развития эндокринных нарушений в 2,4 раза превышала показатели в группе сравнения (отношение шансов ОШ=2,39; доверительный интервал ДИ 0,84-6,82; р<0,05). В качестве основных нозологических форм в структуре заболеваемости детей из группы наблюдения преобладали: избыточная масса тела (МБК: Е67.8) - 10,7% и ожирение (МБК: Е66.0) - 5,3%, что в 2,4 раз чаще, чем в группе сравнения (4,3% и 2,2% соответственно, р=0,021-0,14).
На основании эпидемиологических исследований установлена достоверная причинно-следственная связь развития избытка массы тела за счет избыточного питания (МКБ10: Е67.8, R2=0,84; F - 280,5; р<0,001) и ожирения (МКБ: Е66.0, R2=0,1; F - 868,01; р<0,001) с повышенным содержанием хлороформа в крови.
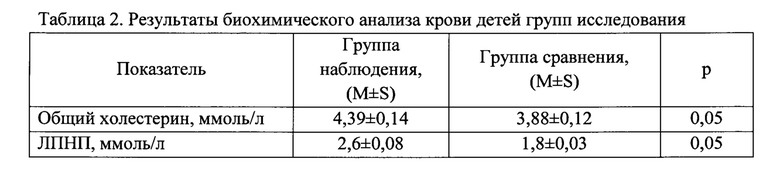
При проведении биохимического исследования содержание общего холестерина (4,39±0,14 ммоль/л) и ЛПНП (2,6±0,08 ммоль/л) в 1,13-1,4 раза превышало показатель группы сравнения (3,88±0,12 ммоль/л и 1,8±0,03 ммоль/л соответственно), хотя и находилось в пределах физиологической нормы (р=0,05-0,05) (таблица 2). Исходя из этих результатов, были установлены нижние пределы уровней общего холестерина и ЛПНП в крови детей, характеризующихся повышенным содержанием хлороформа и тетрахлорметана, а именно: уровень общего холестерина должен быть выше 3,9 ммоль/л и уровень ЛПНП - выше 1,8 ммоль/л.
По данным анамнестического исследования с использованием диагностической балльной шкалы у детей, приживающих в условиях пероральной экспозиции ХОС, выявлена статистически достоверная зависимость отягощенного перинатального анамнеза и наследственной предрасположенности с формированием избытка массы тела и ожирением (таблица 5). У детей, набирающих в ходе опроса 6 баллов и более, коэффициент корреляции составлял r=0,31-0,52 (р=0,01-0,05). При меньшем уровне наследственной предрасположенности достоверные связи выявлены не были.
По данным генетического тестирования у детей, потребляющих питьевую воду с повышенным содержанием хлороформа и тетрахлорметана, полиморфизм только гена HTR2A (rs7997012) (из 9-ти исследованных), характеризовался увеличением в 1,8 раза частоты встречаемости вариантного гомозиготного и гетерозиготного генотипа, относительно группы сравнения (р=0,003).
В качестве маркера индивидуальной чувствительности к экспозиции ХОС: хлороформа и тетрахлорметана, для развития метаболических нарушений рассматривались вариации гена рецептора серотонина HTR2A (rs7997012), как наиболее патогномоничного для формирования нарушений углеводного и жирового обмена.
По результатам генетического обследования распространенность в исследуемой выборке вариации нормального гомозиготного АА состояния гена HTR2A (rs7997012) достигает 50,5%, вариации гетерозиготного AG состояния гена HTR2A (rs7997012) - 33,3%, вариации вариантного гомозиготного GG состояния гена HTR2A (rs7997012) - 16,2%.
Для выборки в целом (т.е. и для группы наблюдения и для группы сравнения) определены коэффициенты, характеризующие зависимость вероятности формирования избыточного питания (b0=-2,13, b1=238,4) и ожирения (b0=-3,25, b1=294,6) от экспозиции хлороформа (при этом в качестве маркера потому использован хлороформ, т.к. его вклад в индекс опасности развития эндокринных нарушений при пероральном поступлении максимальный и достигает 85,7%). Параметры моделей для данной зависимости, определяющие индивидуальную чувствительность составили: при избыточности питания для детей с вариацией AG гена HTR2A (rs7997012) a0=1,73, a1=1,53, с вариацией АА - a0=1,73; a1=1,41; при ожирении для детей с вариацией AG - a0=1,36; a1=4,65, с вариацией АА - a0=1,43; a1=0,06. При этом следует указать, что при вариации патологического гомозиготного GG состояния гена HTR2A (rs7997012) полученные данные были не достоверные (р>0,05), потому и не были приняты во внимание.
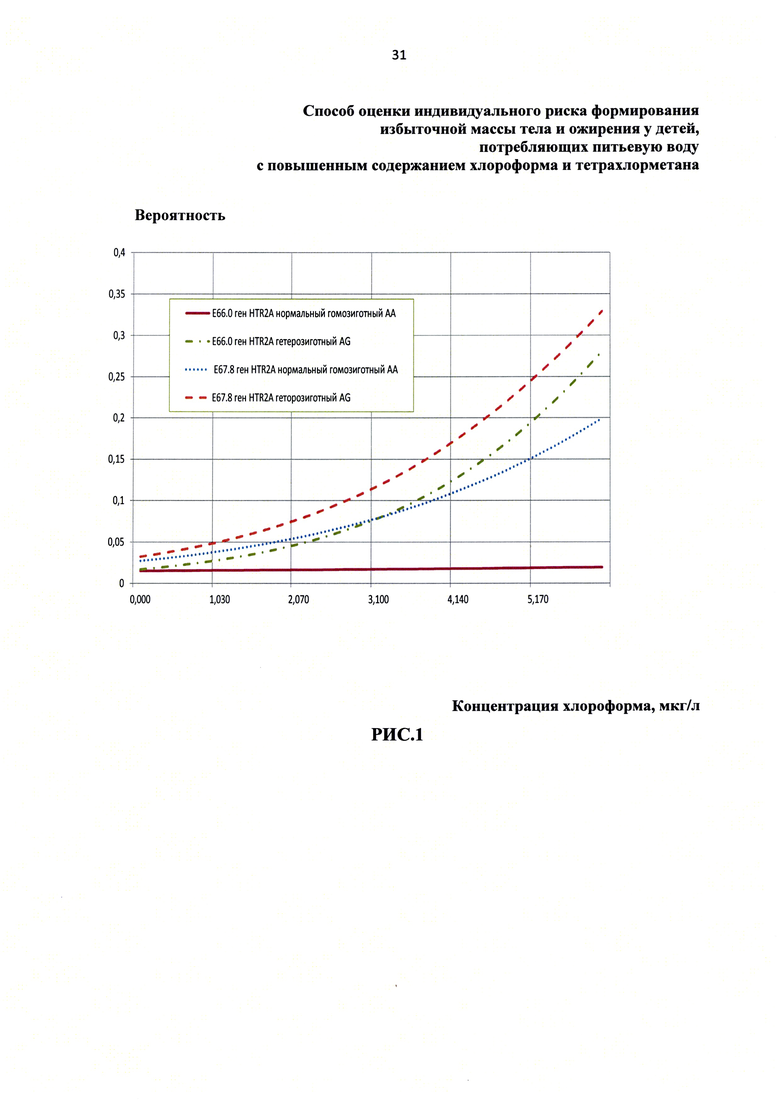
Результаты математического моделирования вероятности развития различных форм нарушений жирового и углеводного обмена (МКБ10: Е67.8-Е66.0), в зависимости от величины маркера экспозиции хлороформа у детей (концентрации хлороформа в крови детей) с различными вариациями гена HTR2A (rs7997012) представлены на рисунке 1.
Результаты, приведенные на рис. 1, показывают, что у детей с гетерозиготным вариантом гена HTR2A (rs7997012) с увеличением концентрации хлороформа в крови вероятность формирования избытка массы тела и ожирения возрастает и превышает частоту негативных ответов у детей, с нормальным гомозиготным вариантом гена HTR2A (rs7997012).
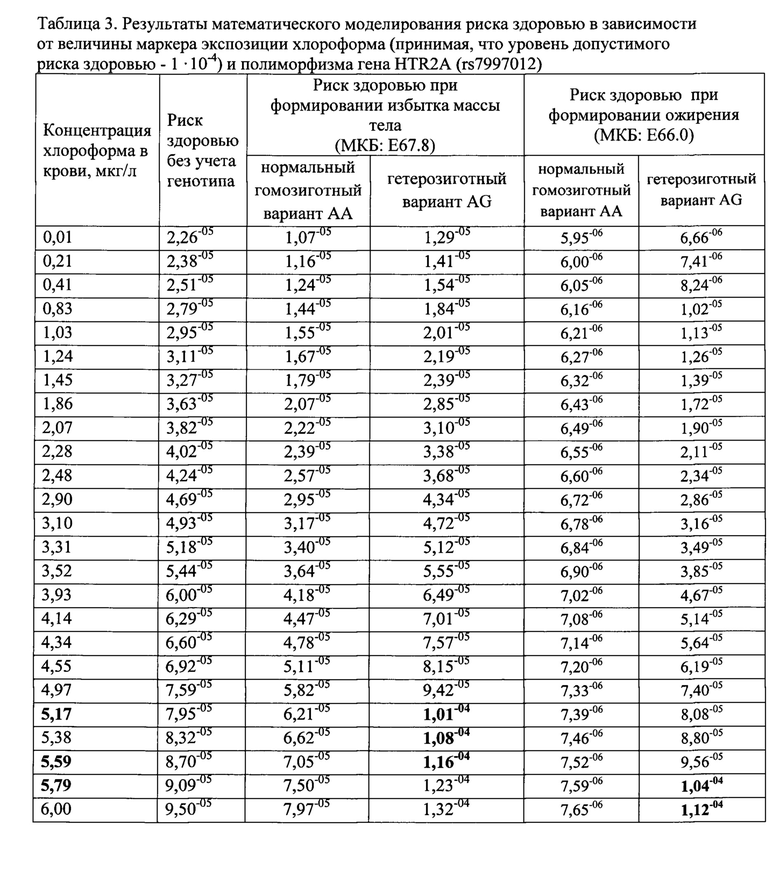
Ниже в таблице 3 представлены результаты математического моделирования риска здоровью в зависимости от величины маркера экспозиции хлороформа (уровень допустимого риска здоровью - 1⋅10-4), в то время, как было установлено, что по тетрахлорметану допускается только его присутствие в пробе крови в концентрации, выше референтной.
Результаты оценки риска здоровью, представленные в таблице 1, свидетельствуют о различии в индивидуальной чувствительности к экспозиции хлороформа у детей с вариациями гена HTR2A (rs7997012), определяющего передачу сигнала к рецептору серотонина и патогенетически связанного с формированием нарушений жирового и углеводного обмена. Так, если в изучаемой субпопуляции (у детей группы сравнения) в целом уровень риска здоровью, проявляющегося в виде нарушений нарушениями жирового и углеводного обмена, оценивается как приемлемый во всем диапазоне величин маркера экспозиции, то у детей с вариацией AG гена HTR2A (rs7997012), недопустимый уровень риска формирования избытка массы тела регистрируется, начиная с уровня содержания хлороформа в крови 5,17-5,59 мкг/л, а ожирения - с уровня 5,79 мкг/л и более.
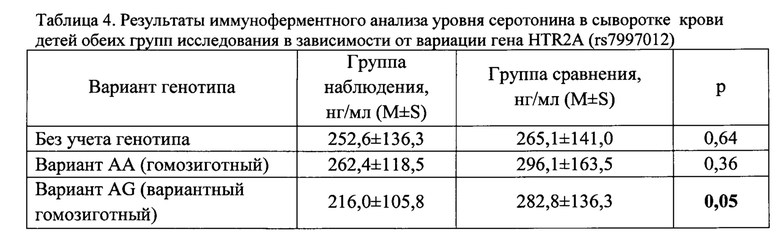
Полученные оценки риска, приведенные в таблице 1, подтверждаются результатами иммуноферментного анализа уровня серотонина в сыворотки крови, функционально связанного с указанными вариациями гена HTR2A (rs7997012), отвечающего за пищевую мотивацию и кодирующего серотониновые рецепторы. У детей группы наблюдения с гетерозиготным вариантом гена HTR2A (rs7997012), в условиях пероральной экспозиции хлороформа, отмечается тенденция к снижению содержания серотонина в сыворотке крови в 1,3 раза (216,0±105,8 нг/мл), относительно показателя в группе сравнения (282,8±136,3 нг/мл) (таблица 4).
Нарушение синтеза серотонина через центральные механизмы регуляции может способствовать изменению нормальной структуры пищевого поведения, потенцировать нарушения жирового и углеводного обмена (Kim М., Bae S., Lim K. М. // Biomol. Therapeut. - 2013. - Vol. 21, №6. - Р. 476--480).
В ходе исследований установлено, что повышенный риск болезней эндокринной системы (нарушения жирового и углеводного обмена), ассоциированный с пероральной экспозицией хлороформа в питьевой воде, характеризующийся индексом опасности (HQ) 1,75 может реализоваться у детей с гетерозиготной вариацией AG гена HTR2A. При оценке риска здоровью при уровне маркера экспозиции - концентрации хлороформа, в крови в диапазоне от 0,1 до 6,0 мкг/л риск в целом по выборке характеризуется как допустимый (менее 1,0⋅10-4). В то же время, начиная с уровня содержания хлороформа в крови в диапазоне 5,17-5,59 мкг/л и равном и более 5,79 мкг/л, величина индивидуального риска формирования избыточности массы тела и ожирения (МКБ: Е67.7-66.0), может достигать недопустимых уровней у лиц с вариацией AG гена HTR2A (rs7997012)- 1,32⋅10-4 и 1,12⋅10-4 соответственно.
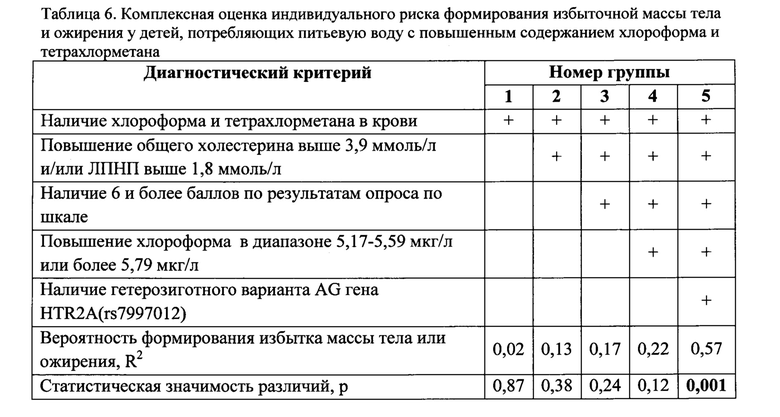
Для оценки достоверности полученных результатов все дети проходившие обследование были разделены на 5 групп по наличию или отсутствию исследуемых диагностических критериев. В ходе комплексной оценки индивидуального риска формирования избыточной массы тела и ожирения у детей, потребляющих питьевую воду с повышенным содержанием хлороформа и тетрахлорметана, выявлено, что только при наличии всех 5 диагностических критериев выявленные связи имеют статистическую достоверность, R20,57-0,6, р=0,001 (таблица 6).
Полученные в ходе оценки параметры математических моделей могут быть использованы для прогнозирования индивидуального риска здоровью, в ходе проведения санитарно-гигиенических и эпидемиологических экспертиз, установления ущерба и иных видов оценок, связанных с внешнесредовой экспозицией хлороформа и тетрахлорметана. Результаты специальных эпидемиологических исследований позволяют учесть индивидуальные особенности генотипа человека, модифицирующие развитие таких ответов на влияние факторов среды обитания. К относительной серотониновой недостаточности, помимо несбалансированного питания, также может приводить потребление питьевой воды с повышенным содержанием хлорорганических соединений. Лиц с вариацией AG гена HTR2A (rs7997012) целесообразно рассматривать как контингента, наиболее чувствительные к воздействию таких соединений, а данные вариации генов как маркеры индивидуальной чувствительности.
Предлагаемый способ позволяет обосновать комплекс информативных показателей ранней донозологической диагностики избытка массы тела и ожирения, разработать и реализовать технологии профилактики формирующихся метаболических и функциональных нарушений жирового и углеводного обмена у детей, потребляющих питьевую воду с повышенным содержанием хлорорганических соединений.

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления предрасположенности к развитию метаболического синдрома в виде ожирения у школьников 7-10 лет | 2022 |
|
RU2779085C1 |
| Способ сравнительной индикаторной оценки на популяционном уровне риска формирования нарушений жирового и углеводного обмена у детей, потребляющих питьевую воду с различным содержанием хлорорганических соединений | 2019 |
|
RU2711600C1 |
| Способ определения предрасположенности к развитию ожирения у детей в условиях избыточной контаминации алюминием | 2019 |
|
RU2700565C1 |
| Способ оценки вероятности формирования у школьников патологии эндокринной системы в виде ожирения, связанной с сочетанным комплексным воздействием таких факторов окружающей среды, как марганец, свинец и толуол, современного образовательного процесса, питания и образа жизни | 2021 |
|
RU2771145C1 |
| Способ прогнозирования индивидуального риска развития ожирения у человека на различные по продолжительности периоды жизни | 2018 |
|
RU2677274C1 |
| Способ диагностики у детей хронического гастродуоденита, ассоциированного с воздействием хрома, никеля, марганца, хлороформа и тетрахлорметана техногенного происхождения | 2016 |
|
RU2616326C1 |
| Способ диагностики у детей функционального расстройства желудка и 12-перстной кишки, ассоциированного с воздействием хрома, никеля, марганца и хлорорганических соединений: хлороформа и тетрахлорметана, техногенного происхождения | 2016 |
|
RU2618926C1 |
| Способ диагностики синдрома утомляемости после перенесенной вирусной болезни у детей 4-7 лет в условиях контаминации алюминием | 2023 |
|
RU2811523C1 |
| Способ прогнозирования риска развития у мужчин эссенциальной гипертензии, ассоциированной с ожирением | 2018 |
|
RU2693469C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ДИСМЕТАБОЛИЧЕСКОЙ НЕФРОПАТИИ У ДЕТЕЙ, АССОЦИИРОВАННОЙ С ТОКСИЧЕСКИМ ДЕЙСТВИЕМ КАДМИЯ, СВИНЦА, ХРОМА И ФЕНОЛА ТЕХНОГЕННОГО ПРОИСХОЖДЕНИЯ, И ДИСМЕТАБОЛИЧЕСКОЙ НЕФРОПАТИИ НЕТОКСИЧЕСКОЙ ПРИРОДЫ | 2015 |
|
RU2594428C1 |
Изобретение относится к области медицины и предназначено для оценки индивидуального риска формирования избыточной массы тела и ожирения у детей, потребляющих питьевую воду с повышенным содержанием хлороформа и тетрахлорметана. Осуществляют отбор пробы крови, определение в ней концентрации хлороформа и тетрахлорметана, определение уровней общего холестерина и липопротеида низкой плотности ЛПНП. Проводят анамнестическое обследование ребенка по трехбалльной шкале и генотипирование. Риск формирования у ребенка избыточной массы тела прогнозируют в случае повышения уровня общего холестерина выше 3,9 ммоль/л и уровня ЛПНП выше 1,8 ммоль/л, наличия у ребенка 6 и более баллов при анамнестическом обследовании, наличия гетерозиготного генотипа гена HTR2A rs7997012, повышения концентрации тетрахлорметана в крови выше референтной и концентрации хлороформа в пределах 5,17-5,59 мкг/л. Риск формирования ожирения прогнозируют при концентрации хлороформа равной или более 5,79 мкг/л. Изобретение обеспечивает эффективный способ оценки индивидуального риска формирования избыточной массы тела и ожирения у детей. 1 ил., 8 табл.
Способ оценки индивидуального риска формирования избыточной массы тела и ожирения у детей, потребляющих питьевую воду с повышенным содержанием хлороформа и тетрахлорметана, включающий отбор пробы крови, определение в ней концентрации хлороформа и тетрахлорметана, определение лабораторных показателей, по которым судят о риске формирования избыточной массы тела и ожирения, отличающийся тем, что в качестве лабораторных показателей используют уровни общего холестерина и липопротеида низкой плотности ЛПНП и при обнаружении в пробе крови концентрации хлороформа и тетрахлорметана выше референтной при одновременном установлении уровня общего холестерина выше 3,9 ммоль/л и уровня ЛПНП выше 1,8 ммоль/л проводят анамнестическое обследование ребенка для выяснения предрасположенности к формированию нарушения жирового и углеводного обмена по семи признакам по трехбалльной шкале:
и при наличии у ребенка суммарной балльной оценки 6 и более баллов при указанном анамнестическом обследовании, проводят генетическое исследование, заключающееся в том, что отбирают у ребенка пробу буккального эпителия, осуществляют выделение из указанной пробы дезоксирибонуклеиновой кислоты ДНК сорбентным методом, затем на детектирующем амплификаторе с использованием полимеразной цепной реакции проводят генотипирование полиморфизма, используя в качестве праймера участок ДНК гена кодирующего серотониновый рецептор HTR2A rs7997012, путем исследования его аллельного состояния, устанавливая при этом для участка гена HTR2A rs7997012 одно из следующих его состояний: гомозиготное нормальное, гомозиготное вариантное, гетерозиготное, и при одновременном выполнении следующих условий: повышение уровня общего холестерина выше 3,9 ммоль/л и уровня ЛПНП выше 1,8 ммоль/л; наличие у ребенка 6 и более баллов при анамнестическом обследовании; наличие гетерозиготного генотипа гена HTR2A rs7997012; повышение концентрации тетрахлорметана в крови выше референтной и концентрации хлороформа в пределах 5,17-5,59 мкг/л, прогнозируют риск формирования у ребенка избыточной массы тела, а при концентрации хлороформа равной или более 5,79 мкг/л прогнозируют риск формирования ожирения.
| ЛУЖЕЦКИЙ К.П | |||
| и др | |||
| Формирование нарушений жирового и углеводного обмена, обусловленных потреблением питьевой воды с повышенным содержанием хлорорганических соединений | |||
| Медицина труда и промышленная экология | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| ЗЕМЛЯНОВА М.А | |||
| и др | |||
| Оценка стабильности генома у детей при длительной экспозиции тетрахлорметаном из питьевой воды | |||
| Здоровье населения и среда обитания | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Перечень маркеров генного полиморфизма, отвечающих за особенности мутагенной активности техногенных химических факторов: методические рекомендации | |||
| М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2013 | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| СПОСОБ ОЦЕНКИ ПОКАЗАНИЯ ДЛЯ МЕДИКАМЕНТОЗНОЙ ТЕРАПИИ ОЖИРЕНИЯ В СОЧЕТАНИИ С ИНСУЛИНОРЕЗИСТЕНТНОСТЬЮ У ДЕТЕЙ | 2005 |
|
RU2279080C1 |
| FIOCCO A.J | |||
| et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Front Behav Neurosci | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| УПРАВЛЕНИЕ ПЕРЕРЫВАМИ ПОДАЧИ ЭНЕРГИИ И СОСТОЯНИЕМ НЕИСПРАВНОСТИ ЭЛЕКТРОЭНЕРГЕТИЧЕСКОЙ СИСТЕМЫ | 2009 |
|
RU2525859C2 |
Авторы
Даты
2017-05-18—Публикация
2016-11-25—Подача