Изобретение относится к медицине, в частности к хирургии сочетанных повреждений, и предназначено для ранней интраоперационной коррекции ишемических и реперфузионных повреждений поджелудочной железы и печени.
Острый травматический панкреатит - этапное осложнение травматической болезни, а значит, попадает под категорию патологических процессов, которые поддаются прогнозированию развития и медико-хирургической коррекции в плане исключения этого осложнения из факторов, неблагоприятно сказывающихся на исходах лечения сочетанной шокогенной травмы.
Современное лечение тяжелых сочетанных травм должно осуществляться быстро и в таком объеме, чтобы опережать патологические процессы, не допускать необратимости последних и декомпенсаци жизненно важных функций (Гуманенко Е.К. Политравма. Актуальные проблемы и новые технологи в лечении. // Тез. Докл. Междунар. Конф. «Новые технологии военно-полевой хирургии и хирургии повреждений мирного времени». Спб., 2006, с. 4-14).
Отмечено, что острый панкреатит часто развивается у пострадавших с политравмой и шоком при отсутствии прямого механического повреждения органа (Гринев М.В., 1989; Толстой А.Д., 1988; Филин В.И., 1994; A.Liolios, 1999; Копылов А.Б., 2003; Багненко С.Ф., Гольцов В.Р., 2010).
Острый панкреатит - достаточно частая находка при аутопсии погибших в результате тяжелой шокогенной травмы. Вашетко Р.В. и соавт. (1993) панкреатит обнаружили в 3,1% случаев, а по данным Warshaw A.L. (1978) патоморфологические изменения в поджелудочной железе, характерные для острого панкреатита, регистрируются при аутопсии у 25% погибших в результате шока.
Главной в патогенезе данного осложнения причиной развития панкреатита в отсутствии механических повреждений поджелудочной железы является ишемия органа, вызванная шоковыми расстройствами гемодинамики и нарушениями микроциркуляции в спланхническом бассейне (Гринев М.В. и соавт., 1989; Филин В.И и соавт. 1994; Селезнев С.А. и соавт., 1999; Warshaw A.L. et al., 1978; Hegewald G. et al., 1985; Takahashi T. et al., 1985; Liolios A. et al., 1999; Tribl B. et al., 2000; Копылов А.Б., 2003).
Падение кровотока в поджелудочной железе при циркуляторном шоке происходит на 30-94% (Гринев М.В. и соавт., 1989; Lefer F.M. et al., 1974; Manabe T. et al., 1978; Reilly P.M. et al., 1997), a в печени микроциркуляторные нарушения отмечаются уже при первой стадии - вазоконстрикции, в виде увеличения вязкости крови, уменьшения скорости кровотока, возникновения "сладжа" - агрегации форменных элементов и секвестрации крови (Messmer К., 1974; Takahashi T. et al., 1985; Menger M.D. et al., 1996).
Интерес представляют работы, доказывающие, что при шоке микроциркуляторные нарушения в поджелудочной железе носят более тяжелый характер, чем в других органах спланхнической области (Menger M.D. et al., 1996; Krejci V. et al., 2000).
Часто именно шок, острая кровопотеря, гипоксия и гиповолемия, а не степень механических повреждений органа могут явиться причиной гибели клетки поджелудочной железы, печени от энергетического голода, предопределяют развитие травматического панкреатита и печеночной недостаточности после различных по виду и характеру механических повреждений (Толстой А.Д., 1988; Филин В.И. и соавт., 1990; Молитвословов А.Б., 1994; Владимиров Ю.А., 1987; Collard CD. et al., 2001).
При сочетанной и изолированной травме живота операционная активность достигает 88% и значительно превосходит таковую при травме конечностей, таза, груди и черепно-мозговой травме (ЧМТ) (Абакумов М.М., Лебедев Н.В., Малярчук В.И., 2001; 2003; Брюсов П.Г., Ефименко Η.Α., Розанов В.Е., 2001; Гуманенко Е.К., 1992; Лебедев Н.В., 2003). Повреждения селезенки при этом встречаются в 23-40% наблюдений. Более чем в 99% наблюдений основной операцией при ее разрывах является спленэктомия, несмотря на развитие эндоскопических и методов органосохраняющих операций (Балалыкин А.А., Алимов А.Н., Отлыгин Ю.В. и др., 2002).
У превалирующего большинства пострадавших с сочетанием повреждения селезенки и поджелудочной железы наблюдается тяжелая политравма (С.А. Афендулова, 1988); закрытые сочетанные повреждения поджелудочной железы и селезенки являются тяжелой абдоминальной травмой и наблюдаются у 12,5% больных с закрытой травмой селезенки и у 8,8% с травмой поджелудочной железы (С.А. Афендулова, 1988).
Во многих исследованиях после удаления селезенки сообщается о значительном увеличении числа папкреатогенных осложнений (Bonencamp J.J., Hermans J., Sasako M., 1999; Cushieri Α., Weeden S., Fielding J., 1999; Griffith J.P., Sue-Ling Η.M., 2005; Lee K.Y., Noh S.H., Hyung W.J., 2000; A. Shmid и соавт., 2000 г. и J. Weilz и соавт., 2004). Сам факт спленэктомии расценивается подавляющим большинством авторов, занимающихся абдоминальной патологией, в том числе и СТ, как фактор негативного влияния на частоту развития послеоперационных панкреатогенных осложнений (Bonencamp J.J., Hermans J., Sasako M., 1999; Cushieri Α., Weeden S., Fielding J., 1999; Griffith J.P., Sue-Ling Η.M., 2005; Lee Κ.Y., Noh S.H., Hyung W.J., 2000; A. Shmid и соавт., 2000 г. и J. Weilz и соавт., 2004; Сотниченко Б.Α., 1995; Юдин М.Я., 1990; Cooper V.J., Williamson C.N., B.C. Алексеев, Е.С. Катанов, С.В. Алексеев, 2009).
В структуре осложнений ближайшего послеоперационного периода после спленэктомии острый панкреатит занимает ведущее место и диагностируется у 15,6-47,6% больных (Сотниченко Б.Α., 1995; Юдин М. Я., 1990; Cooper V.J., Williamson C.N.; B.C. Алексеев, E.C. Катанов, С.В. Алексеев, 2009).
Между получением травмы и появлением первых признаков острого травматического панкреатита проходит 6-12 ч. Именно это время клиницисту необходимо использовать для проведения лечебных мероприятий, направленных на снижение вероятности развития острого травматического панкреатита.
Исходя из ишемической концепции развития острого панкреатита и острой печеночной недостаточности в постшоковом периоде травматической болезни, Гринев М.В. с соавт., 1989; Толстой А.Д., 1988; Гринев М.В. с соавт., 1989; Филин В.И. с соавт. 1994, считают, что основной путь профилактики заболевания - это своевременная и полная коррекция шоковых гемоциркуляторных нарушений.
Методы предупреждения развития острого травматического панкреатита при сочетанной травме условно можно разделить на 2 группы: хирургическая профилактика и медикаментозная профилактика.
Только хирургическая профилактика не предотвращает развитие тяжелых форм травматического панкреатита. Поэтому хирургическая профилактика, эффективно снижающая частоту развития тяжелых травматических панкреонекрозов, должна дополняться и медикаментозной профилактикой травматического панкреатита, включающей в себя применение широкого арсенала лекарственных средств.
Особенности патогенетической природы и характера течения травматического панкреатита и острой печеночной постшоковой недостаточности заставляют не только разрабатывать более эффективные методы их лечения, но и искать пути их полноценной профилактики.
Проведенное изучение патентной и научно-медицинской литературы позволило разделить все имеющиеся методы лечебной профилактики острого травматического панкреатита на хирургические и медикаментозные методы. В связи с вышесказанным все выявленные аналоги разделены по данным категориям.
Известна методика, описанная в «Саратовском научно-медицинском журнале «Хирургия», 2009, Том 5, №3, стр. 440, в статье «Методика профилактики осложнений при повреждениях поджелудочной железы» М.С. Громов, Д.А. Александров, A.M. Скороход, C.B. Капралов, И.А. Самедов, B.C. Тарасенко. Применяется интраоперационная профилактика тяжелых осложнений травмы поджелудочной железы. Суть хирургических мероприятий методики сводится к соблюдению принципа «минимальная активность по отношению к ткани железы - максимальная активность по отношению к дренированию зоны повреждения»; отказались от «расширенных» вмешательств и подведения к железе тампонов, применяются полуоткрытые способы дренирования двухпросветными трубками и латексной резиной; с момента установления факта травмы ПЖ проводят ее локальную гипотермию и комплексную медикаментозную терапию (антисекреторные, антиферментные, реотропные, противовоспалительные и антибактериальные препараты); особое внимание уделяется ранним противошоковым мероприятиям.
Недостаток методики: используемые хирургические и медикаментозные мероприятия не учитывают селективный (регионарный) характер гипоперфузии в панкреато-билиарной зоне при шоковой сочетанной травме (СТ), используется при видимых повреждениях поджелудочной железы.
Известна также методика, приведенная в журнале «Хирургия» им. Н.И. Пирогова, №6, 2009, стр. 17, в статье «Развитие острого послеоперационного панкреатита при лечении травмы селезенки», авторы В.С. Алексеев, Е.С. Катанов, С.В. Алексеев. Использована методика прецизионной обработки хвоста поджелудочной железы при спленэктомии. При травме хвоста поджелудочной железы во время спленэктомии использовалась методика предупреждения развития острого послеоперационного панкреатита с помощью интраоперационного введения антиферментных препаратов (контрикал по 60000 ТИЕ в сутки) и цитостатиков (5-фторурацил по 250 мг в сутки) внутривенно; для создания физиологического покоя поджелудочной железы (ПЖ) после спленэктомии оставляли назогастральный зонд для декомпрессии желудка, аспирации содержимого и промывания верхних отделов желудочно-кишечного тракта холодным 4% содовым раствором; уже с 1-го дня после операции применяли средства, снижающие секрецию желудка и поджелудочной железы (ранитидин, омепразол), использовался также кальцитонин, который устраняет болевой синдром, амилаземию, лейкоцитоз.
Недостатком предлагаемого способа является - отсутствие учета характера шокогенности травмы (регионарная гипоперфузия), методика более характерна не для шокогенной СТ, а для изолированной травмы селезенки.
В проекте резолюции XIX международного конгресса хирургов-гепатологов России и стран СНГ «Актуальные проблемы хирургической гепатологии», Иркутск, 19-21 сентября 2012 года, Раздел: «Осложнения операций на поджелудочной железе в раннем послеоперационном периоде» отмечено: «… интраоперационной профилактикой панкреатита является соблюдение соответствующих показаний, правильной технологии вмешательств на паренхиме и протоках железы, применение «октреотида» и других мероприятий по угнетению панкреатической секреции, обеспечение надежного дренирования зоны операции».
Недостатком данных рекомендаций является их применение только при плановых оперативных вмешательствах на панкреато-билиарной зоне, а также не учитывается характер шокогенности СТ с этапом гипоперфузии, как один из определяющих панкреатогенные осложнения.
Известен патент РФ №2517210 от 02.07.2012 «Способ профилактики острого послеоперационного панкреатита». По приводимой методике к базисной терапии дополнительно назначают мексидол по 300 мг внутривенно капельно за час до оперативного вмешательства и 300 мг 2 р/д в последующие 3 суток после операции; сандостатин при операциях на поджелудочной железе - по 100 мкг подкожно за 2 часа до оперативного вмешательства, в последующие 3 суток после операции подкожно по 100 мкг 3 раза в день; при операциях на органах брюшной полости, анатомически граничащих с поджелудочной железой - по 100 мкг подкожно за 2 часа до оперативного вмешательства, в последующие 3 суток после операции - подкожно по 100 мкг 2 раза в день.
Недостатком известного способа являются фармакологические свойства сандостатина, а именно наличие побочных эффектов: торможение моторной активности желудочно-кишечного тракта, снижение скорости анаболических процессов, в том числе регенерации кишечного анастомоза и послеоперационной раны передней брюшной стенки, торможение секреции инсулина и других гормонов, нарушение функции печени, феномен отдачи. В связи с данными побочными эффектами применение сандостатина (октреатида) при тяжелой сочетанной травме, с превалированием патологии брюшной полости, нецелесообразно.
Близкими по методике регионарного введения лекарственных препаратов к заявляемому способу являются способы лечения больных с острым панкреатитом и острым травматическим панкреатитом, при которых медикаментозные препараты вводятся путем катетеризации чревного ствола через бедренную артерию по Сельдингеру (Gazet, Smith 1974). Эта методика использована в ниже приводимых аналогах:
- Журнал «Клиническая медицина», Москва, №11, 1971, стр. 134, в статье «Методика ангиографического исследования поджелудочной железы» А.П. Савченко, Г.П. Филимонов, Т.В. Привезенцева;
- Odman P., Acta radiol. (Stockh.), 1958, Suppl. 159;
- Кубышкин Β.Α., Гогодзе А.В. и др.//Всесоюзн. съезд рентгенологов и радиологов, XI: Тез. докл. - М. - Обнинск, 1984. - С. 203-204;
- Мардна П.Л., Пыдер К.К. // Всесоюзн. съезд рентгенологов и радиологов, XI: Тез. докл. - М. - Обнинск, 1984. - С. 226-227;
- Нестеренко Ю.Α., Лаптев В.В. // Всесоюзн. съезд хирургов, XXX: Тез. докл. - Минск, 1983. - С. 425-427;
- Огнев Ю.В., Прокубовский В.И. и др.//Вестн. хир. - 1974. - №12. - С. 36-41;
- Ли А.Б. // Клиническая хирургия - 1974. - №6. - С. 33-37;
- патент РФ №2449795 «Способ лечения хронического панкреатита»;
«Клиническая хирургия» №11, 1981 год, стр. 28, в статье «Интенсивная терапия после радикальных операций по поводу новообразований поджелудочной железы и периампулярной зоны», автор А.Е. Дубицкий;
- «Клиническая хирургия» №11 за 1981 год в статье «Эффективная терапия острого послеоперационного панкреатита на фоне декомпенсированного сахарного диабета» авторы В.В. Силантьев, А.Е. Дубицкий;
- Вафин А.З. и др. Регионарная инфузирнная терапия деструктивного панкреатита // Мат-лы межд. конгр. хир - Петрозаводск, 2002 - С. 49;
- Лубянский В.Г. и др. Показания и эффективность применения внутриаортальной инфузии в лечении панкреонекроза // Мат-лы междунар. конгр. Хир., - 2002. – Петрозаводск. – С. 142-143;
- Влияние селективного внутриартерильного введения лекарственных препаратов в комплексном лечении острого деструктивного панкреатита изучено коллективом авторов - Д.А. Благовестнов, Г.П. Гришин, Д.С. Зинин, С.Н. Новосел, 2003;
- патент РФ №2222269 от 27.01.2004 на изобретение «Способ лечения панкреонекроза».
Общая характеристика методики селективной внутриартериальной инфузии через чревный ствол приведена на примере из статьи «Вестник новых медицинских технологий, Том X, №3, 2003 г., Периодический теоретический и научно-практический журнал, Тематический выпуск: «Новые диагностические и лечебно-восстановительные технологии», Тула, 2003 г. стр. 63, статья «Селективная внутриартериальная инфузионная терапия в комплексном лечении деструктивного панкреатита и его осложнении», Д.А. Благовестнов, Г.П. Гришин, Д.С. Зинин, С.Н. Новосел.
В качестве доступа для системного инфузионного лечения применили селективную катетеризацию чревной артерии (СКЧА); СКЧА велась чрезбедренным доступом по Сельдингеру с последующим круглосуточным дозированным введением препаратов на базе автоматического дозатора «TERUFUSION STC-508» фирмы «TERUMO» Япония.
Для катетеризации аорты и ее ветвей использовали рентгеноконтрастные катетеры 5,0F различной степени кривизны типа «Кобра». В рентгеноперационный зонд под контролем рентгенотелевизионного просвечивания на ангиографической установке Angiostar Plus фирмы «Sirnens» проводили до уровня DXII СКЧА, проводили на уровне DXII - LI, направляя конец зонда кпереди и влево. После завершения катетеризации подготавливали систему автоматического введения контрастного вещества (омнипак, ультравист) в количестве 20-30 мл со скоростью введения 5-7 мл/с, проводили внутриартериальное контрастирование бассейна чревного ствола. Оценивали полученные целиакограммы - степень перфузии ткани поджелудочной железы в различных ее отделах, наличие или отсутствие перфузионного блока, наличие коллатерального кровотока. Затем налаживали внутриартериальную селективную инфузионную терапию в чревный ствол через дозатор, непрерывно из расчета 50-90 мл/кг массы тела больного в сутки со скоростью 70-80 мл/час.
Катетер оставляли в аорте на 3-5 дней в зависимости от выраженности патологического процесса и эффективности лечения. Для профилактики тромбоза катетера во вливаемые инфузионные растворы добавляли раствор гепарина (из расчета по 1500-2000 ЕД гепарина на каждые 500 мл вводимого раствора).
По анализу целиакограмм выделяли две основные группы больных ОДП: с сохраненной перфузией ткани поджелудочной железы и больных с перфузионным блоком.
К недостаткам методик катетеризации чревного ствола и его ветвей по Сельдингеру и регионарной селективной внутриартериальной инфузионной терапии относятся:
- применение вышеперечисленных способов ограничивается отсутствием в подавляющем большинстве хирургических стационаров специальной дорогостоящей аппаратуры.
- невозможность создания высокой концентрации медикаментозных препаратов в ткани поджелудочной железы и парапанкреальной клетчатке как непосредственно во время проведения оперативного вмешательства, так и в послеоперационном периоде;
- доступ селективный регионарный, осуществленный чрезбедренно по Сельдингеру через чревный ствол, технически сложен, требует наличия специализированного оборудования и подготовленных специалистов, в связи с этим сомнительно применение в условиях сочетанной шокогенной травмы;
- чрезбедренный доступ при шокогенной СТ мало приемлем в связи с тем, что травма органов живота часто сочетается с травмой таза и переломами бедренных костей;
- обобщенные осложнения для методик селективной катетеризации чревной артерии: в 2,8% случаев встретились гематомы мягких тканей бедра после катетеризации бедренной артерии, отмечены случаи тромбоэмболических осложнений при длительном нахождении катетера в бедренной артерии.
Кроме этого, данные способы сложны и не приемлемы в экстренной хирургии сочетанных повреждений.
Методика ретроградного внутриартериального введения медикаментозных препаратов через выделенные панкреатические артерии использована в следующей группе аналогов.
Известен способ катетеризации правой желудочно-сальниковой артерии (ПЖСА) во время лапаротомии, предпринятой у больных острым панкреатитом (Григорьев В.А. Медикаментозное купирование панкреатитов методом интраоперационной эндоартериальной инфузии. В кн.: Эндоваскулярная катетерная терапия. М., 1979, с. 94-95). Сущность способа заключается в следующем - после выполнения лапаротомии в большом сальнике на расстоянии 5-6 см от привратника выделяют и перевязывают ПЖСА; проксимальнее лигатуры через поперечный разрез артерии вводят канюлю, которую фиксируют к стенке артерии второй лигатурой; интраоперационную внутриартериальную инфузию осуществляют в течение 10-12 мин; после окончания инфузии артерию перевязывают.
В другом известном способе катетеризацию ПЖСА выполняют с целью предупреждения и лечения острого панкреатита после резекции желудка по поводу язвенной болезни (Авдалбекян С.Х. и др. Регионарная внутрисосудистая лекарственная терапия в профилактике и лечении острых панкреатитов. В кн.: Тезисы пятого Всероссийского съезда хирургов. Свердловск, 1978, с. 168-169). При этом способе производят лапаротомию, резекцию желудка, катетеризацию ПЖСА в 6-8 см от привратника; участок желудочно-ободочной связки подшивают к передней брюшной стенке, катетер выводят наружу через отдельной прокол; с целью профилактики и лечения послеоперационного панкреатита проводят инфузию лекарственных веществ в ПЖСА в течение 5-6 дней после операции.
Известен способ катетеризации сосудов брюшной полости, разработанный Е.В. Малышко (Малышко Е.В. Метод лапароскопической катетеризации сосудов брюшной полости: Дисс. канд. мед. наук. Свердловск, 1986, 225 с.). Способ заключается в следующем: в толще желудочно-ободочной связки, на границе антрального отдела и тела желудка выделяют ПЖСА и берут ее на держалки; дистальный отдел артерии перевязывают, вскрывают ее просвет и через разрез вводят катетер, который продвигают в проксимальном направлении на 6-8 см. Катетер фиксируют в просвете сосуда второй лигатурой; через прокол в передней брюшной стенке катетер вместе с артерией выводят наружу, прошивают края апоневроза теми же лигатурами; ушивают рану так, чтобы вскрытый участок сосуда находился внебрюшинно, в тканях брюшной стенки.
Известен патент РФ №2164089, дата публикации 20.03.2001, «Способ катетеризации правой желудочно-сальниковой артерии», по которому выполняют катетеризацию культи правой желудочно-сальниковой артерии; катетер проводят через пупочную вену круглой связки печени; накладывают артериовенозный анастомоз; катетер выводят наружу внебрюшинно через отдельный прокол передней брюшной стенки; метод предназначен для подведения лекарственных веществ к органам панкреатогастродуоденальной зоны через ПЖСА, с целью профилактики и лечения различных послеоперационных осложнений (острый панкреатит, гнойно-септические осложнения, несостоятельность культи двенадцатиперстной кишки и др.) после дистальной и проксимальной резекции желудка и гастроэктомии путем длительного введения лекарственных веществ в послеоперационном периоде.
Известен патент РФ №2154500, опубликован 20.08.2000, «Способ лечения злокачественных опухолей поджелудочной железы». Используется в онкологии при лечении опухолей поджелудочной железы - производят перевязку проксимального отдела a. pancreatoduodenalis sup.; катетеризируют ее дистальный участок; вводят в дистальный участок артерии контрастное вещество; после идентификации всего венозного коллектора выполняют легирование до 50% ее венозного оттока; затем проводят внутриартериальную регионарную монохимиотерапию с помощью 5-фторурацила; вводят цитостатик во время операции и в послеоперационном периоде.
Недостатками приведенных методик катетеризации ПЖСА являются:
- внутриартериальная инфузия в ПЖСА не обеспечит должного реперфузионного эффекта в зоне кровоснабжения ПЖ, так как 2/3 ПЖ кровоснабжаются ветвями селезеночной артерии (СА);
- дополнительная травматичность и времязатратность манипуляций по мобилизации ПЖСА недопустимы при шокогенной СТ;
- шокогенная СТ с нестабильной гемодинамикой является противопоказанием для эндоскопических методов;
- все вышеприведенные методики используются для профилактики гнойно-септических послеоперационных осложнений, профилактики несостоятельности швов анастомозов, профилактики острого послеоперационного панкреатита в гастродуоденальной плановой хирургии и не применяются для хирургии сочетанных повреждений;
- способы трудоемки, времязатратны, используются в желудочно-дуоденальной хирургии и онкологии;
- технические решения не приемлемы для экстренной хирургии сочетанных шокогенных травм;
- во всех методиках используется легирование сосудов, что также не приемлемо при тяжелой травме панкреато-билиарной зоны.
Учитывая интраоперационные катетеризационные манипуляции на удаляемой селезенке близка методика, приводимая в журнале «Клиническая хирургия», Киев, №3, 1990 год, стр. 67 в разделе «Рационализаторские предложения и изобретения» в статье К.А. Цыбырнэ, М.А. Барган, Б.А. Барган «Способ интраоперационного возврата крови из удаляемой селезенки». Описана нижеследующая методика интраоперационного возврата крови из подлежащей удалению селезенки. После выделения и перевязки селезеночной артерии мобилизуют селезенку. Дистальнее наложенной лигатуры через толстую иглу под постоянным давлением 20,0 кПа (150 мм рт. ст.) нагнетают полиглюкин, гепаринизированный изотонический раствор натрия хлорида, желатиноль и т.п. Объем возвращенной крови определяют но объему введенного раствора и изменению цвета селезенки. Селезеночную вену перевязывают после полного обескровливания селезенки, затем выполняют спленэктомию. При полном отмывании селезенки расходуют от 800 до 3500 мл (в среднем 2000 мл) жидкости.
Недостаток предлагаемого способа - методика используется в плановой хирургии патологии селезенки и не приемлема в условиях экстренных оперативных вмешательств у пострадавших с шокогенной СТ.
Таким образом, ни один из вышеописанных методов не отвечает патогенетически обусловленному требованию - раннее восполнение микроциркуляторного русла панкреатобилиарной зоны и профилактирующее лечение травматически и шокогенно поврежденного микроциркуляторного русла в панкреатобилиарной зоне, лечебная ранняя профилактика прогрессирования ишемически индуцированного острого травматического панкреатита и печеночной недостаточности.
Использование магистральных селезеночной артерии и селезеночной вены (зоны спланхнического кровообращения) для проведения канюлирования сосудов, и выполнения регионарной (внутриартериальной и внутривенной) инфузионной терапии в объеме «операции-реанимации» с использованием термостатированных (37°С) панкреато-гепато-эндотелиопротективных медицинских препаратов с индивидуально подобранными объемно-скоростными характеристиками реперфузионной инфузионно-трансфузионной терапии, на фоне локальной гипотермии панкреато-билиарной зоны, и с индивидуальным интраоперационным вариантом завершения методики авторам неизвестны.
Задачей настоящего изобретения является создание способа раннего интраоперационного профилактического лечения острого травматического панкреатита и острой печеночной недостаточности у пострадавших с сочетанной шокогенной травмой для восполнения микроциркуляторного русла органов и устранения ишемического поражения печени и поджелудочной железы.
Задача достигается тем, что осуществляют спленэктомию при травматическом повреждении, проводят канюлирование селезеночной артерии и селезеночной вены, после этого осуществляют регионарную внутриартериальную и внутривенную реперфузионную инфузионную терапию комбинацией панкреато-гепатопротективных препаратов, причем внутриартериально вводят перфторан - 400,0 мл, раствор новокаина 0,25% 100,0, контрикал 300 тыс. ЕД, мексидол 300 мг, 5-фторурацил 500 мг на инфузионных растворах, и одновременно внутривенно вводят перфторан 400,0 мл, реополиглюкин 400 мл, гелафузин 500 мл, при этом инфузию осуществляют в термостатированном варианте при 37°С на фоне локальной гипотермии панкреатобилиарной зоны.
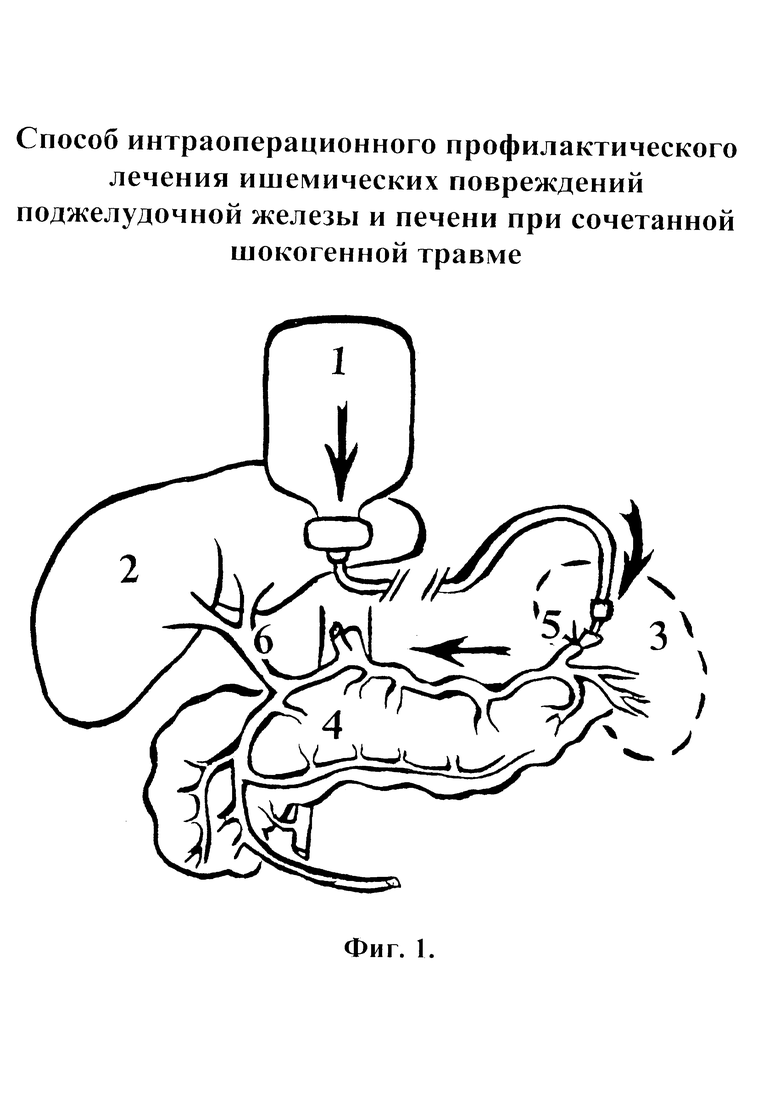
Заявляемый способ иллюстрируется чертежами и фотографией, где
на фиг. 1 - схема интраоперационной инфузии в катетеризированную селезеночную артерию;
на фиг. 2 - схема интраоперационной инфузии в катетеризированную селезеночную вену.
На фиг. 1 и фиг. 2 цифрами обозначены:
1- система инфузии, 2 - печень, 3 - селезенка (удаленная), 4 - поджелудочная железа, 5 - катетеризированная селезеночная артерия (СА), 6 - общая печеночная артерия, 7 - катетеризированная селезеночная вена (СВ), 8 - воротная вена.
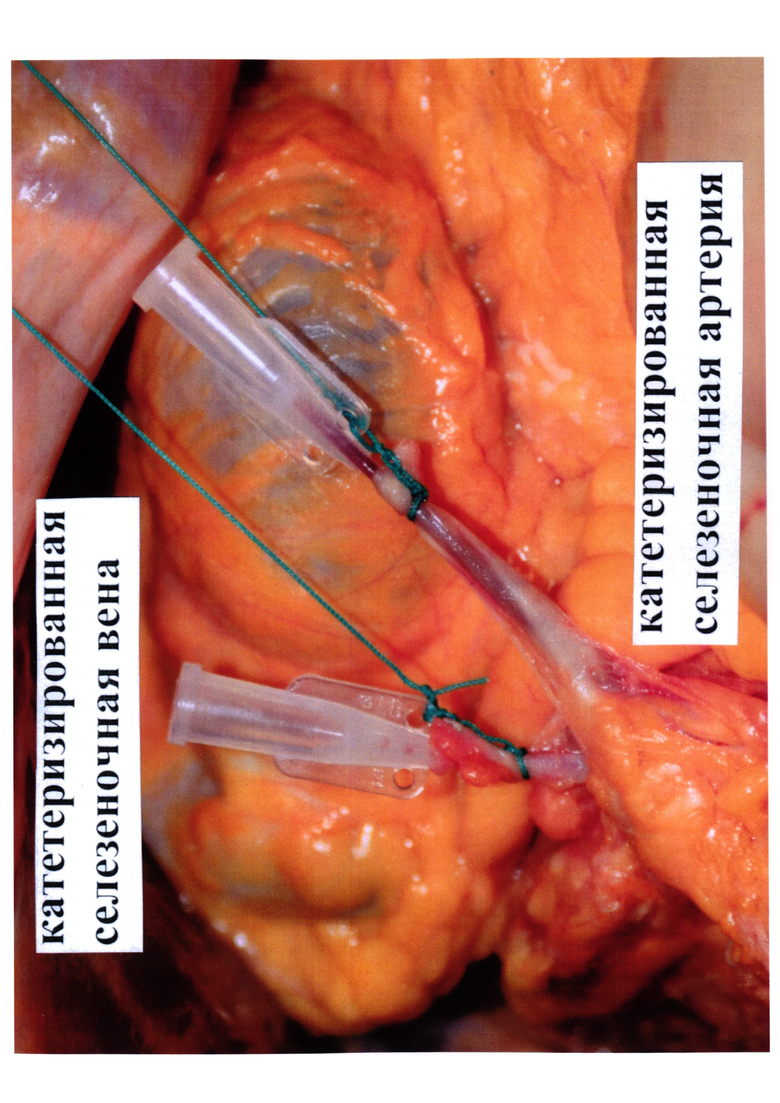
На фото 1 представлены катетеризированные по предлагаемой методике селезеночные артерия и вена.
Способ осуществляют следующим образом.
Заявляемый способ представляет из себя интраоперационную комбинацию хирургического и инфузионно-медикаментозного реанимационного методов профилактического лечения острого травматического панкреатита (ОТП) и постшоковой острой печеночной недостаточности (ОПечНед) и состоит из пошаговых индивидуально адаптированных интраоперационных действий.
Шаг 1 -
- Ревизия органов брюшной полости, определение характера абдоминальных повреждений, источников шокогенного внутрибрюшного кровотечения, исходного уровня гемодинамических шокогенных нарушений;
- Учет признаков высокого риска развития ОТП и ОПечНед.:
сочетание наличия шокогенной СТ (гипотония 60-70 мм рт.ст.) и признаки повреждения панкреато-билиарной зоны (кровоподтеки, надрывы-отрывы связочного аппарата, разрывы печени, наличие забрюшинной гематомы зон, повреждение капсулы и паренхимы поджелудочной железы, разрушение селезенки, не подлежащее методам органосохраняющих операций (ОСО);
- Принятие решения о выполнении спленэктомии.
Шаг 2 -
при травматическом повреждении селезенки, не подлежащем методу органосохраняющих операций, чтобы избежать дополнительной травмы ПЖ, применяется прецизионная техника обработки хвоста поджелудочной железы при спленэктомии.
В условии нормализации АД интраоперационно на фоне проводимой анестезиологами-реаниматологами противошоковой инфузионно-трансфузионной терапии вмешательство останавливается на этапе прецизионной спленэктомии.
В условиях сохраняющейся нестабильной гемодинамики (гипотония АД≤60-70 мм рт. ст.) по одной артериальной и венозной ветви канюлируются.
Для этого могут быть использованы катетеры российского производства (катетер подключичный однократного применения стерильный «Синтез» с внутренним диаметром 1,4-1,0 мм), а также катетеры иностранного производства («Certofix/Mono/Cateter venose central mono lumen» размер 1.4×2,1 мм/14G L=20 см) - согласно прилагаемой инструкции объемная скорость введения ≥85 мл/мин.
Катетер фиксируют в просвете артерии (вены) с помощью лигатуры (фото 1), катетеры подключаются к инфузионной системе.
В ситуации, изначально подлежащей методу многоэтапного хирургического вмешательства «demege control», используются удлиненные катетеры с первичным выведением на переднюю брюшную стенку.
Шаг 3 -
проведение интраоперационной инфузионно-трансфузионной терапии (ИТТ) через канюлированные СА и СВ (фиг. 1, фиг. 2), использование термостатированных - 37°С - инфузионных растворов на фоне локальной гипотермии панкреато-билиарной зоны с индивидуальными с объемно-скоростными характеристиками.
Решающим параметром проводимой ИТТ является не столько ее объем, сколько скорость инфузии, которая определяется исключительно реакцией гемодинамики пострадавшего на терапию. Растворы вводятся с такой объемной скоростью, которая позволяет добиться максимально быстрой нормализации системного артериального давления, при этом оно не должно быть менее 70 мм рт. ст.
Одним из ключевых показателей метаболической активности организма при перфузионных нарушениях являются центральная и периферическая температуры, терапевтически значимой представляется рекомендация, касающаяся уменьшения теплоотдачи путем использования термостатированных инфузионных растворов до 36-37°С (С.Ф. Багненко и совт., СПб, 2008) в сочетании с локальной гипотермией (замедляет пара- и некробиотическое паренхиматозное повреждение ПЖ и печени, связанные с гипоперфузией).
Деструктивные изменения в поджелудочной железе после травмы развиваются с началом реперфузии. Локальная гипотермия железы замедляет темп реперфузии и уменьшает тяжесть посттравматического панкреатита, а термостатированная (нормотермия) инфузионно-трансфузионная терапия позволит нормализовать микроциркуляторные нарушения и пресечь пара-некробиотические эффекты этапа гипоперфузии острого периода ТБ при шокогенной ТСТ.
В стандартный алгоритм ИТТ целесообразно включение дополнительных методов коррекции нарушений гомеостаза у пострадавших с тяжелой сочетанной травмой, направленных на уменьшение последствий гипоксических и реперфузионных повреждений и включают в себя назначение антиоксидантов, ингибиторов протеолиза, применение ингибиторов NO-синтазы, использование препаратов с газотранспортными свойствами.
Выбрана максимальная объемная скорость инфузионно-трансфузионной терапии ≥85 мл/мин. (с учетом применяемых катетерных систем) одновременно в селезеночную артерию (+10-20 мм рт. ст. над центральным АД на момент введения) и в селезеночную вену с учетом контроля стабилизации АД.
Темп и объем инфузии должен своевременно восполнить циркуляторное русло панкреато-билиарной зоны, а следовательно, и магистральный сосудисто-сердечный коллектор.
Объем инфузионных жидкостей может интраоперационно достигать 5000-6000 мл, учитывая противошоковую ИТТ в периферические и магистральные вены, осуществленные анестезиологами-реаниматологами (рекомендации ИТТ- при шоке I степени 20-30 мл, II степени 40-50 мл, III степени 60-80 мл на 1 кг массы тела, скорость инфузии должна быть такой, чтобы обеспечить максимально быструю стабилизацию АД на цифрах, превышающих критические (70 мм рт. ст.) (Б.Н. Шах, С.Ф. Багненко, В.Н. Лапшин, 2005), при этом до 60% инфузионного объема приходится на артериальный доступ. Растворы предварительно термостатируют до 37°С. Внутриартериальная инфузия вводится под перфузионным давлением, на 10-20 мм рт.ст. превышающим центральное артериальное систолическое давление, повышая давление внутриартериального введения, согласно росту системного АД до цифр АД 90-100 мм рт. ст.
Цель предпринимаемых интраоперационных мер: снять циркуляторно-спастический перфузионный блок, профилактировать микротромботический постшоковый перфузионный блок микроциркуляторного русла, эндотелиопротективное медикаментозное воздействие.
Используемый препарат перфторан, согласно инструкции по применению, используется в дозе 10 мл/кг массы тела; в нашей методике рекомендуемый объем распределяется равномерно по артериальному и венозному секторам.
Состав инфузионно-трансфузионной терапии:
Раствор №1 (внутриартериальный доступ) - перфторан 400,0 мл, раствор новокаина 0,25% 100,0, раствор NaCl 0,9% 400,0 + ингибиторы протеаз (контрикал 300 тыс. ЕД), раствор Рингера 500,0 + мексидол 300 мг; раствор NaCl 0,9% 400,0 + 5-фторурацил 500 мг;
Раствор №2 (внутривенный доступ) - перфторан 400,0 мл, реополиглюкин 400 мл, гелафузин 500 мл.
Использование перфузата в предложенном выше составе позволяет восстановить регионарную микроциркуляцию панкреатобилиарной зоны, стабилизировать клеточные мембраны панкреатоцитов и гепатоцитов, позволяет уменьшить отек эндотелия, улучшить транскапиллярный обмен, позволяет улучшить доставку кислорода к тканям, улучшить метаболизм и газообмен на уровне тканей, сочетание локальной гипотермии интраоперационного и термостатированного (37°С) перфузата позволяет поддерживать минимальный уровень метаболизма перфузируемых тканей, а значит, профилактировать прогрессирование ишемического повреждения паренхимы поджелудочной железы и печени.
Шаг 4 -
Выполнение экстренных оперативных вмешательств по поводу сочетанных повреждений; оценка интраоперационной ситуации - темп нормализации центрального артериального давления, темп нормализация диуреза; характеристика микроциркуляции в панкреато-билиарной зоне (возможно использование интраоперационной флоуметрии панкреато-билиарной зоны); оценка сочетанности повреждений.
В случае травмы ПЖ интраоперационная хирургическая профилактика ОТП включает соблюдение принципа «минимальная активность по отношению к ткани железы - максимальная активность по отношению к дренированию зоны повреждения», использование полуоткрытых способов дренирования двухпросветными трубками и латексной резиной; с момента установления факта травмы ПЖ интраоперационно проводим ее локальную гипотермию на фоне противошоковой и панкреатопротективной инфузионно-медикаментозной терапии.
Шаг 5 -
После окончания оперативных вмешательств на органах брюшной полости и сочетанных травматических повреждений производится оценка течения острого периода травматической болезни - учет состояния центральной гемодинамики, артериального давления, темп мочевыведения.
В ситуации нормализации АД, диуреза и флоуметрических показателей микроциркуляции панкреато-билиарной зоны интраоперационно, после окончания объема абдоминальных оперативных вмешательств, по результатам системного интраоперационного контроля выделяем два варианта окончания предлагаемой методики.
Вар. 1 - ситуация расценивается как стабизированная (переход в фазу периода устойчивой стабилизации - период компенсации функций острого периода ТБ), каннюлирование СА и СВ устраняется, сосуды лигируются, в брюшную полость устанавливается дренажная система (по принципам дренирования, изложенным в шаге №4).
Проведение перфузии панкреато-билиарного артериоло-венозного кровеносного русла в течение 1-2 часов, с условием восстановления интраоперационно нормотонии на фоне комплексной противошоковой терапии до 90-100 мм рт. ст. и выше (признаки положительной ответной реакции на проводимое лечение), является необходимым и достаточным временно-терапевтическим промежутком, в течение которого происходит максимально полное восстановление микроциркуляции, восстановление функционального и энергетического потенциала ишемически поврежденных тканей поджелудочной железы и печени за счет восстановления микроциркуляции, поставки питательных веществ и кислорода к тканям, профилактировать посттравматическое и постшоковое повреждение микроциркуляторного русла.
В случае интраоперационной нормализации показателей давления без инотропной поддержки, а интраоперационная ситуация свидетельствует об отсутствии тяжелых повреждений органов брюшной полости, интраоперационная внутриартериальная и внутривенная противошоковая регионарная инфузия завершается, катетеры удаляются, артериальный и венозный сосуды легируются окончательно, в брюшную полость и сальниковую сумку устанавливается дренажная система, лапаротомная рана ушивается. В послеоперационном периоде продолжается комплексная панкреато-гепатотропная терапия, как элемент комплексного лечения. При таком варианте развития интраоперационная ситуация расценивается как период устойчивой стабилизации-период компенсации функций острого периода ТБ.
Устраняется канюлирование, осуществляется дренирование брюшной полости и сальниковой сумки - принципы операций на ПЖ и дренирования при ТПЖ (изложенной в шаге №4).
Вар. 2 -
ситуация, требующая применения методики этапных оперативных вмешательств (хирургическая тактика «damage control»).
Важным аспектом хирургического лечения тяжело пострадавших в лечении пострадавших с шокогенной ТСТ является использование концепции «damage control» с целью сокращения объема дополнительного травмирующего воздействия неотложных и срочных операций; сокращенные лапаротомии с последующими программированными релапаротомиями (тактика «damage control») показаны пострадавшим с тяжелой шокогенной сочетанной травмой (шок III-IV ст.).
В ситуации тяжелой сочетанной травмы, требующей применения методики запрограммированного многоэтапного хирургического лечения пострадавших («damage control»), после окончания оперативного вмешательства на органах брюшной полости (первый этап - устранение жизнеугрожающих повреждений) при наличии нестабильной гемодинамики (системная АД 60-70 мм рт. ст. и менее), в брюшную полость устанавливается дренажная система (принцип дренирования в шаге №4), катетеры для внутриартериальной и внутривенной инфузии выводятся на переднюю брюшную стенку (с продолжением регионарной противошоковой терапии в комплексе противошоковой терапии), накладывается лапаростома. На 2-3 сутки проводится программируемая релапаротомия, выполняется окончательный объем вмешательства на органах брюшной полости, устраняется катетеризация сосудов, артериальный и венозный доступы лигируются.
Таким образом, разработанный способ позволяет в любых ситуациях шокогенной сочетанной травмы индивидуально интраоперационно, с учетом конкретного клинического случая, проводить раннее комбинированное хирургическое и медикаментозное профилактирование развития острого травматического панкреатита и постшоковой печеночной недостаточности в объеме описанной дифференцированно пошаговой «операции - реанимации».
Клинические примеры.
Клинический пример №1. Пострадавший К., 47 лет, поступил в хирургическое отделение №1 МБУЗ ЦГБ г. Батайска в порядке оказания экстренной помощи 05.02.2016 г. Доставлен бригадой скорой медицинской помощи с места ДТП (водитель автомобиля); при поступлении состояние тяжелое, транспортирован на фоне противошоковых мероприятий через кабинет КТ в операционный зал; 05.02.2016 - операция - двухсторонняя диагностическая пункция, лапароцентез (кровь в животе), срединная лапаротомия, ревизия ОБП, спленэктомия с прецизионной обработкой хвоста поджелудочной железы, канюллирование СА и СВ, интраоперационная реперфузионная регионарная селективная инфузионная терапия, санация, дренирование брюшной полости. Интраоперационная ситуация: гипотония 70/40 мм рт. ст., гемоперитонеум до 1 л свежей крови и в сгустках, реинфузия 400,0 мл аутокрови, источник кровотечения - увеличенная в размерах (14×6 см) селезенка с массивными разрывами через ворота селезенки, в области тела и хвоста поджелудочной железы кровоподтеки, забрюшинная гематома левого поддиафрагмального пространства, данных за повреждение левой почки нет; на фоне интраоперационной регионарной селективной реперфузионной терапии с локальной гипотермией панкреатобилиарной зоны интраоперационная стабилизация АД на цифрах 110/70 мм рт. ст., темп мочеотделения достаточен, без геморрагического компонента; завершение метода - ликвидация канюлирования, дренирование брюшной полости, сальниковой сумки. Послеоперационный период в условиях отделения анестезиологии и реанимации (АРО). Контроль диастазурии, амилаземии, содержания амилазы в перитонеальном выпоте, темп изменения печеночных фракций (ACT, АЛТ) - незначительно повышены. Дренажная система брюшной полости по этапам ликвидирована на 3-4 сутки. КТ от 05.02.2016 - патологических изменений головного мозга и костей черепа не выявлено, КТ-признаки шокового легкого, ушиба легких, переломов ребер слева. ЭКГ контроль и осмотр кардиолога в динамике - данных за ушиб сердца не получено. Посттравматический период осложнился респираторным дистресс синдромом, в связи с чем 07.02.2016 выполнена трахеостомия с пролонгированной ИВЛ. До 16.02.2016 находился на ИТ в АРО. В дальнейшем течение травматической болезни проходило гладко. Учитывая характер травмы, интраоперационную ситуацию и темп лабораторных показателей, клиническая ситуация оценена как отсутствие признаков постшоковой печеночной недостаточности, легкая форма интерстициального травматического панкреатита на фоне ушиба тела и хвоста поджелудочной железы. 02.03.2016 пострадавший выписан на амбулаторное лечение в удовлетворительном состоянии. Заключительный клинический диагноз: Тяжелая сочетанная травма. ЗЧМТ: сотрясение головного мозга. Закрытая травма груди: перелом 8, 9, 10 ребер слева, ушиб обоих легких, ушиб мягких тканей левой половины грудной клетки, поясничной области слева. Закрытая травма живота: травматический разрыв селезенки, ушиб хвоста, тела поджелудочной железы, гемоперитонеум (1000 мл). Забрюшинная гематома левого поддиафрагмального пространства. Шок II-III. РДС с исходом в посттравматическую левостороннюю пневмонию. Острый травматический интерстициальный панкреатит, легкая форма.
Клинический пример №2. Пострадавший А., 33 лет, военнослужащий МО. Травма в ДТП на трассе М-4 ДОН, водитель легкового автомобиля. С места ДТП доставлен бригадой скорой медицинской помощи, госпитализирован в хирургическое отделение №1 МБУЗ ЦГБ г. Батайска 20.03.2016 в 01:00. На фоне противошоковых мероприятий транспортирован через кабинет КТ в операционный зал. 20.02.2016 - операция - диагностическая лапароскопия, срединная лапаротомия, ревизия ОБП, спленэктомия, интраоперационная регионарная селективная реперфузионная терапия, санация, дренирование брюшной полости; блокада мест переломов, скелетное вытяжение за левую пяточную кость, хирургическая обработка раны левой боковой поверхности живота. Интраоперационная ситуация - лапароскопия - свежая крови и сгустки в брюшной полости, преимущественно по левому боковому каналу, в тазу; лапаротомия - частичный отрыв селезенки по корню с разрушением нижнего полюса, забрюшинная гематома левого поддиафрагмального пространства без повреждения левой почки, визуальные ушибы хвоста поджелудочной железы; спленэктомия с катетеризацией селезеночной артерии и вены, на фоне интраоперационной регионарной селективной реперфузионной терапии с локальной гипотермией панкреатобилиарной зоны интраоперационная стабилизация центральной гемодинамики с 70/40 мм рт. ст.на цифрах 110/70 мм рт. ст., темп мочеотделения достаточен, без геморрагического компонента; завершение метода - ликвидация канюлирования, дренирование брюшной полости, сальниковой сумки.
Послеоперационный диагноз: Тяжелая сочетанная травма. ЗЧМТ средней степени тяжести: ушиб головного мозга в лобной доле справа 2 вида, в затылочной доле 1 вида, субарахноидальное травматическое кровоизлияние. Закрытая травма шейного отдела позвоночного столба: перелом тела, зубовидного отростка С2 с переходом на дужку С2 слева и суставные отростки С2 и С3 позвонков слева без значительного смещения отломков; перелом суставных отростков дужки С5 позвонка слева; перелом поперечных отростков L2, L3 слева. Закрытая травма груди: перелом 6, 7, 8 ребер слева, перелом грудинного конца ключицы справа, разрыв 1 реберно-грудинного сочленения справа, ушиб легких. Закрытая травма живота с повреждением селезенки, гемоперитонеум. Ушиб левой почки. Обширная непроникающая ушибленная рана левой боковой поверхности живота. Закрытый внутрисуставной перелом проксимального метафиза левой большеберцовой кости. Шок II-III.
Ранний посттравматический период протекал благополучно. Период нестабильности гемодинамики (гипотония) купирован интраоперационно. За время наблюдения темп ферментативного отклонения (амилаземия, диастазурия), содержимое амилазы в перитонеальном выпоте, темп изменения трансаминаз (ACT, АЛТ) в пределах верхней границы нормы. Применение методики позволило быстро стабилизировать пострадавшего, перевести в ранг транспортабельности. По согласованию с медицинской службой военного округа пострадавший для дальнейшего преемственного ведомственного лечения 22.03.2016 переведен в ОВКГ г. Ростова-на-Дону.
Таким образом, предлагаемый способ лечения является эффективным и безопасным и может внедряться в лечебную практику хирургических стационаров, оказывающих помощь пострадавшим с сочетанной шокогенной травмой, применение способа позволяет снизить частоту ОТП и ОПечНед при сочетанной шокогенной травме, повысить выживаемость (категория пострадавших с ТСТ в ДТП - пациенты молодого и среднего трудоспособного возраста), исключить тяжелые этапные осложнения, снизить летальность у данной категории пострадавших.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования вероятности развития острого травматического панкреатита при сочетанной шокогенной травме | 2018 |
|
RU2685468C1 |
| Способ диагностики вариантов острого ишемического повреждения поджелудочной железы в случаях острой сердечно-сосудистой недостаточности с нарушением микроциркуляторного кровотока и централизацией кровообращения различной этио-патогенетической природы | 2018 |
|
RU2681264C1 |
| Способ диагностики травматической дисфункции эндотелия при сочетанной шокогенной травме | 2021 |
|
RU2782135C1 |
| Способ определения периода жизни после травматического воздействия у погибшего с летальной сочетанной травмой | 2022 |
|
RU2787232C1 |
| СПОСОБ ВЫПОЛНЕНИЯ ЛАПАРОСКОПИЧЕСКОЙ СПЛЕНЭКТОМИИ | 2010 |
|
RU2444309C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАНКРЕОНЕКРОЗА | 2002 |
|
RU2222269C2 |
| СПОСОБ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЙ ДИСТАЛЬНОЙ ЧАСТИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ У ДЕТЕЙ | 2013 |
|
RU2523147C1 |
| СПОСОБ ВЫБОРА ТАКТИКИ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ТРАВМАТИЧЕСКИМ ПОВРЕЖДЕНИЕМ СЕЛЕЗЕНКИ (ВАРИАНТЫ) | 2024 |
|
RU2825960C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ПАНКРЕАТИТА | 2010 |
|
RU2449795C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЗОНЫ ПОРАЖЕНИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ПРИ ОСТРОМ ПАНКРЕАТИТЕ | 2001 |
|
RU2202956C2 |

Изобретение относится к медицине, а именно к хирургии сочетанных повреждений. Методом канюлирования селезеночной артерии и селезеночной вены после осуществленной спленэктомии проводят регионарную внутриартериальную и внутривенную перфузионную терапию. Растворы вводят с такой объемной скоростью, которая позволяет добиться максимально быстрой нормализации системного артериального давления, которое не должно быть менее 70 мм рт. ст.. При этом до 60% инфузионного объема вводят через артериальный доступ, и внутриартериальная инфузия включает перфторан - 400,0 мл, раствор новокаина 0,25% 100,0, раствор NaCl 0,9% 400,0 и контрикал 300 тыс. ЕД, раствор Рингера 500,0 и мексидол 300 мг, раствор NaCl 0,9% 400,0 и 5-фторурацил 500 мг, одновременно внутривенно вводят перфторан 400,0 мл, реополиглюкин 400 мл, гелафузин 500 мл. Инфузию осуществляют в термостатированном варианте при 37°С на фоне локальной гипотермии панкреатобилиарной зоны. В ситуации, требующей применения методики этапных оперативных вмешательств «damage control», катетеры для внутриартериальной и внутривенной инфузии выводят на переднюю брюшную стенку, продолжая регионарную противошоковую терапию в комплексе противошоковой терапии. Накладывают лапаростому, при этом на 2-3 сутки проводят программируемую релапаротомию. Выполняют окончательный объем вмешательства на органах брюшной полости, устраняют катетеризацию сосудов, артериальный и венозный доступы лигируют. Способ позволяет снизить частоту острого травматического панкреатита и острой печеночной недостаточности при сочетанной шокогенной травме, повысить выживаемость пациентов молодого и среднего трудоспособного возраста с тяжелой шокогенной сочетанной травмой, исключить тяжелые этапные осложнения травматической болезни, снизить летальность у данной категории пострадавших.1 з.п.ф-лы, 2 пр., 3 ил.
1. Способ интраоперационной профилактики ишемических повреждений поджелудочной железы и печени при сочетанной шокогенной травме, характеризующийся тем, что методом канюлирования селезеночной артерии и селезеночной вены после осуществленной спленэктомии проводят регионарную внутриартериальную и внутривенную перфузионную терапию, при этом растворы вводят с такой объемной скоростью, которая позволяет добиться максимально быстрой нормализации системного артериального давления, которое не должно быть менее 70 мм рт.ст, при этом до 60% инфузионного объема вводят через артериальный доступ, и внутриартериальная инфузия включает перфторан - 400,0 мл, раствор новокаина 0,25% 100,0, раствор NaCl 0,9% 400,0 и контрикал 300 тыс. ЕД, раствор Рингера 500,0 и мексидол 300 мг, раствор NaCl 0,9% 400,0 и 5-фторурацил 500 мг, одновременно внутривенно вводят перфторан 400,0 мл, реополиглюкин 400 мл, гелафузин 500 мл, при этом инфузию осуществляют в термостатированном варианте при 37°С на фоне локальной гипотермии панкреатобилиарной зоны.
2. Способ по п. 1, характеризующийся тем, что в ситуации, требующей применения методики этапных оперативных вмешательств «damage control», катетеры для внутриартериальной и внутривенной инфузии выводят на переднюю брюшную стенку, продолжая регионарную противошоковую терапию в комплексе противошоковой терапии, накладывают лапаростому, при этом на 2-3 сутки проводят программируемую релапаротомию, выполняют окончательный объем вмешательства на органах брюшной полости, устраняют катетеризацию сосудов, артериальный и венозный доступы лигируют.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ПАНКРЕАТИТА | 2010 |
|
RU2449795C1 |
| СПОСОБ ЛЕЧЕНИЯ МЕТАСТАЗОВ КОЛОРЕКТАЛЬНОГО РАКА В ПЕЧЕНИ | 2003 |
|
RU2241459C2 |
| Мембранный насос для перекачки растворов | 1948 |
|
SU90963A1 |
| PURI A, et al | |||
| Pseudoaneurysm of the radial branch of the splenic artery with pancreatic pseudocyst in a child with recurrent acute pancreatitis: treatment with endovascular stent graft and cystogastrostomy | |||
| J Pediatr Surg | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| ТЕЛЕФОННЫЙ АППАРАТ ДЛЯ ПАРАЛЛЕЛЬНОГО ВКЛЮЧЕНИЯ В ЛИНИЮ | 1923 |
|
SU1012A1 |
| BRIAN F | |||
| IMBROGNO, et al.Splenic artery embolization in blunt trauma | |||
| Semin Intervent Radiol | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Раздвижной паровозный золотник со скользящими по его скалке поршнями и упорными для них шайбами | 1922 |
|
SU147A1 |
Авторы
Даты
2017-05-25—Публикация
2016-05-23—Подача