ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка притязает на приоритет предварительной патентной заявки серийный номер 61/378448, поданной 31 августа 2010 г, которая включена в настоящий документ посредством ссылки.
Область применения изобретения
В данном изобретении описываются способы содействия дифференциации плюрипотентных стволовых клеток в клетки, вырабатывающие инсулин. В частности, настоящее изобретение относится к способу получения популяции клеток, в которой более 80% клеток экспрессирует маркеры, характерные для линии сформированной эндодермы.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Последние достижения в области заместительной клеточной терапии для лечения сахарного диабета 1 типа и нехватка островков Лангерганса для трансплантации заставили обратить внимание на разработку источников инсулин-продуцирующих клеток, или β-клеток, подходящих для трансплантации. Одним из подходов является формирование функциональных β-клеток из плюрипотентных стволовых клеток, таких как, например, эмбриональные стволовые клетки.
При эмбриональном развитии позвоночных плюрипотентные клетки дают начало группе клеток, формирующих три зародышевых листка (эктодерму, мезодерму и эндодерму) в ходе процесса, именуемого гаструляцией. Такие ткани, как, например, щитовидная железа, тимус, поджелудочная железа, кишечник и печень, будут развиваться из эндодермы через промежуточную стадию. Промежуточной стадией данного процесса является образование сформированной эндодермы. Клетки сформированной энтодермы экспрессируют ряд маркеров, как например, HNF3 бета, GATA4, MIXL1, CXCR4 и SOX17.
Формирование поджелудочной железы происходит при дифференцировании сформированной эндодермы в панкреатическую эндодерму. Клетки панкреатической эндодермы экспрессируют ген панкреатическо-дуоденального гомеобокса, Pdx1. При отсутствии Pdx1 развитие поджелудочной железы не идет дальше формирования вентрального и дорзального зачатков. Таким образом, экспрессия PDX1 характеризует критическую стадию органогенеза поджелудочной железы. Зрелая поджелудочная железа содержит, помимо других типов клеток, экзокринную ткань и эндокринную ткань. Экзокринная и эндокринная ткани образуются при дифференцировании панкреатической эндодермы.
По имеющимся данным, клетки, обладающие свойствами островковых клеток, были получены из эмбриональных клеток мыши. Например, Lumelsky et al. описывают дифференцирование мышиных эмбриональных стволовых клеток в инсулин-секретирующие структуры, аналогичные островкам поджелудочной железы. Soria et al. (Diabetes 49:157, 2000) описывают инсулин-секретирующие клетки, производные мышиных эмбриональных стволовых клеток, которые нормализуют гликемию у мышей с диабетом, индуцированным стрептозотоцином.
В одном примере, Hori et al. (PNAS 99: 16105, 2002) описывается, что обработка мышиных эмбриональных стволовых клеток ингибиторами фосфоинозитид-3-киназы (LY294002) приводила к получению клеток, подобных β-клеткам.
В другом примере, Blyszczuk et al. (PNAS 100:998, 2003), сообщается о получении инсулин-продуцирующих клеток из мышиных эмбриональных стволовых клеток с конститутивной экспрессией Pax4.
В публикации Micallef et al. сообщается, что ретиноевая кислота может регулировать способность эмбриональных стволовых клеток формировать Pdx1-положительную панкреатическую эндодерму. Ретиноевая кислота с наибольшей эффективностью индуцирует экспрессию Pdx1 при добавлении в культуру на 4 день дифференцирования эмбриональных стволовых клеток в течение периода, соответствующего концу гаструляции эмбриона (Diabetes 54:301, 2005).
В публикации Miyazaki et al. сообщается о линии мышиных эмбриональных стволовых клеток со сверхэкспрессией Pdx1. Результаты показывают, что экспрессия экзогенного Pdx1 очевидно повышает экспрессию генов инсулина, соматостатина, глюкокиназы, нейрогенина 3, p48, Pax6 и HNF6 в образующихся дифференцированных клетках (Diabetes 53: 1030, 2004).
В публикации Skoudy et al. сообщается, что активин A (входящий в надсемейство TGF-β) повышает экспрессию экзокринных панкреатических генов (p48 и амилазы) и генов эндокринных клеток (Pdx1, инсулина и глюкагона) в эмбриональных стволовых клетках мыши. Максимальный эффект наблюдался при добавлении 1 нмоль/л активина A. Кроме того, авторы отметили, что экспрессия мРНК инсулина и Pdx1 не изменялась под действием ретиноевой кислоты; однако добавление 3nM FGF7 привело к повышению концентрации транскрипта Pdx1 (Biochem. J. 379: 749, 2004).
В работе Shiraki et al. изучались эффекты факторов роста, специфически ускоряющих дифференцирование эмбриональных стволовых клеток в Pdx1-положительные клетки. По наблюдению этих авторов, TGF-β2 приводил к воспроизводимому увеличению доли Pdx1-положительных клеток (Genes Cells. 2005 Jun; 10(6): 503-16).
В работе Gordon et al. показана индукция образования брахиурических [положительных]/HNF3 бета [положительных] энтодермальных клеток из эмбриональных стволовых клеток мыши в отсутствие сыворотки и в присутствии активина в сочетании с ингибитором сигнального каскада Wnt (патент США № 2006/0003446A1).
Gordon et al. (PNAS, т. 103, с. 16806“, 2006) утверждают: «Для образования передней первичной полоски одновременно требовались сигнальные пути Wnt и TGF-бета/nodal/активин».
Однако модель развития эмбриональных стволовых клеток на мышах может не имитировать в точности программу развития у высших млекопитающих, например, у человека.
В работе Thomson et al. эмбриональные стволовые клетки выделяли из человеческих бластоцист (Science 282:114, 1998). Параллельно с этим Gearhart и соавторы получили клеточные линии эмбриональных зародышевых клеток человека (hEG) из ткани половых желез эмбриона (Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998). В отличие от эмбриональных стволовых клеток мыши, воспрепятствовать дифференцированию которых можно путем простого культивирования с фактором, ингибирующим лейкемию (LIF), эмбриональные стволовые клетки человека необходимо культивировать в крайне специфических условиях (патент США № 6,200,806; WO 99/20741, WO 01/51616).
D’Amour et al. описывают производство обогащенных культур сформированной эндодермы, производной от человеческих эмбриональных стволовых клеток, в присутствии высокой концентрации активина и низкой концентрации сыворотки (Nature Biotechnology 2005). Трансплантация этих клеток под почечную капсулу мышей привела к их дифференцированию в более зрелые клетки, обладающие характерными особенностями некоторых эндодермальных органов. Клетки сформированной эндодермы, производные от эмбриональных стволовых клеток человека, могут подвергаться дальнейшему дифференцированию в Pdx1-положительные клетки после добавления FGF-10 (US 2005/0266554A1).
D’Amour et al. (Nature Biotechnology-24, 1392-1401 (2006)) утверждают: “Мы разработали процесс дифференцировки, преобразующий эмбриональные клетки человека (hES) в эндокринные клетки, способные синтезировать гормоны поджелудочной железы: инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Данный процесс имитирует органогенез поджелудочной железы in vivo, проводя клетки через фазы, напоминающие образование сформированной эндодермы, эндодермы кишечной трубки, панкреатической эндодермы и превращение предшественников эндокринных клеток в клетки, экспрессирующие эндокринные гормоны”.
В другом примере, в публикации Fisk et al., сообщается о системе для производства островковых клеток поджелудочной железы из эмбриональных стволовых клеток человека (US2006/0040387A1). В данном случае процесс дифференцирования был разделен на три стадии. Человеческие эмбриональные стволовые клетки были впервые дифференцированы до эндодермы с помощью сочетания бутирата натрия и активина A. Затем клетки культивировали с антагонистами ФНО-β, например, Noggin в сочетании с EGF или бетацеллюлином для получения PDX1-положительных клеток. Окончательное дифференцирование запускалось никотинамидом.
Таким образом, сохраняется значительная потребность в разработке лабораторных способов создания in vitro функциональной экспрессирующей инсулин клетки, которая была бы более близка к β-клетке. Настоящее изобретение представляет альтернативный подход к повышению эффективности дифференцирования эмбриональных стволовых клеток человека в экспрессирующие инсулин клетки путем получения популяции клеток, в которых более 80% клеток экспрессирует маркеры, характерные для линии сформированной панкреатической энтодермы.
Краткое описание
В одном варианте осуществления настоящее изобретение относится к способу получения популяции клеток, в которой более 80% клеток экспрессирует маркеры, характерные для линии сформированной эндодермы.
В одном варианте осуществления настоящего изобретения представлен метод получения популяции клеток, более 80% которых экспрессирует маркеры, характерные для линии сформированной эндодермы, состоящий из следующих стадий:
a) культивирование популяции плюрипотентных стволовых клеток;
b) дифференциация популяции плюрипотентных стволовых клеток в популяцию, в которой более 80% клеток экспрессирует маркеры, характерные для линии сформированной эндодермы, в среде с концентрацией глюкозы не более 10,5 ммоль/л.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
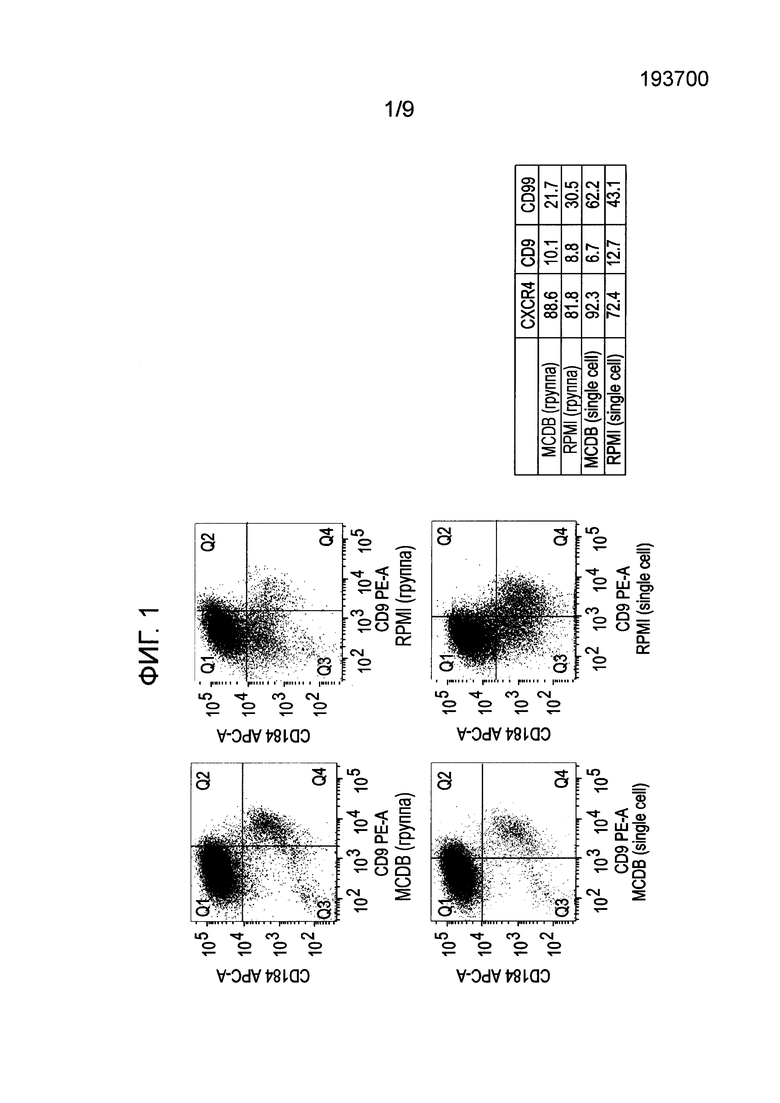
На фиг. 1 показаны результаты анализа экспрессии белков в клетках человеческой эмбриональной линии H1, дифференцированной по способам, описанным в Примере 1, методом флуоресцентной проточной цитометрии (FACS, ФПЦ).
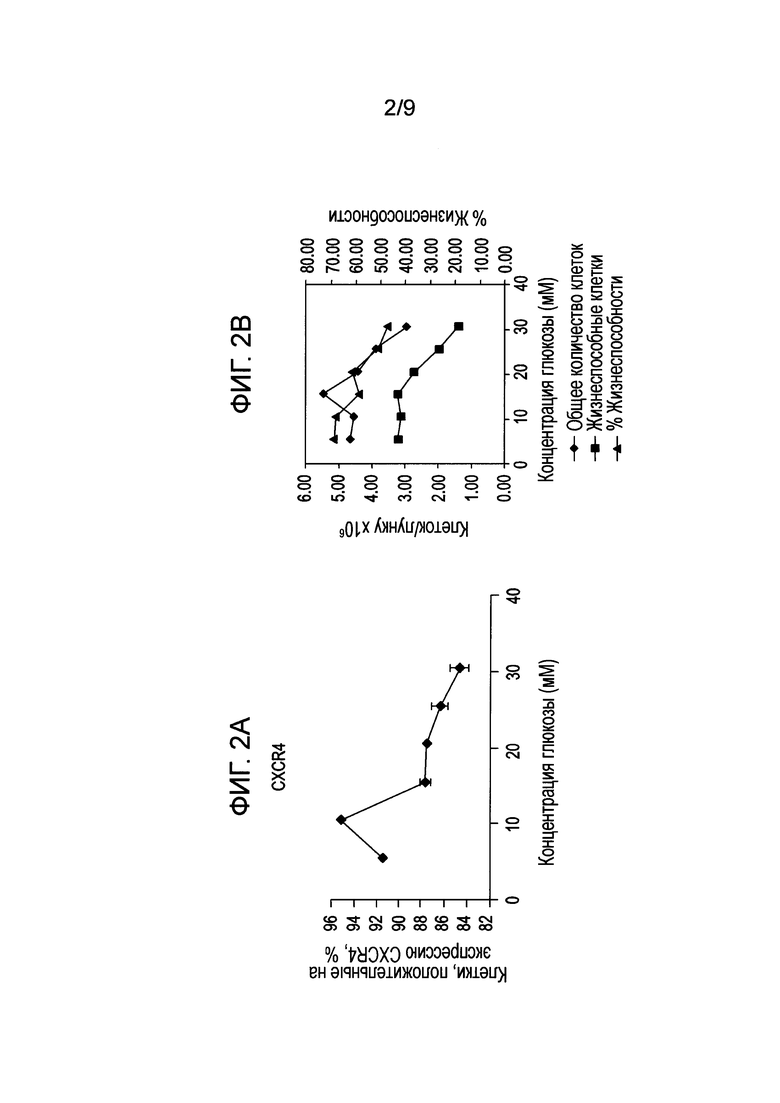
На фиг. 2 показано влияние концентрации глюкозы в среде на степень экспрессии CXCR4 (панель B) и число клеток, а также жизнеспособность клеток (панель В) человеческой эмбриональной клеточной линии H1, дифференцированной по способам, описанным в примере 2.
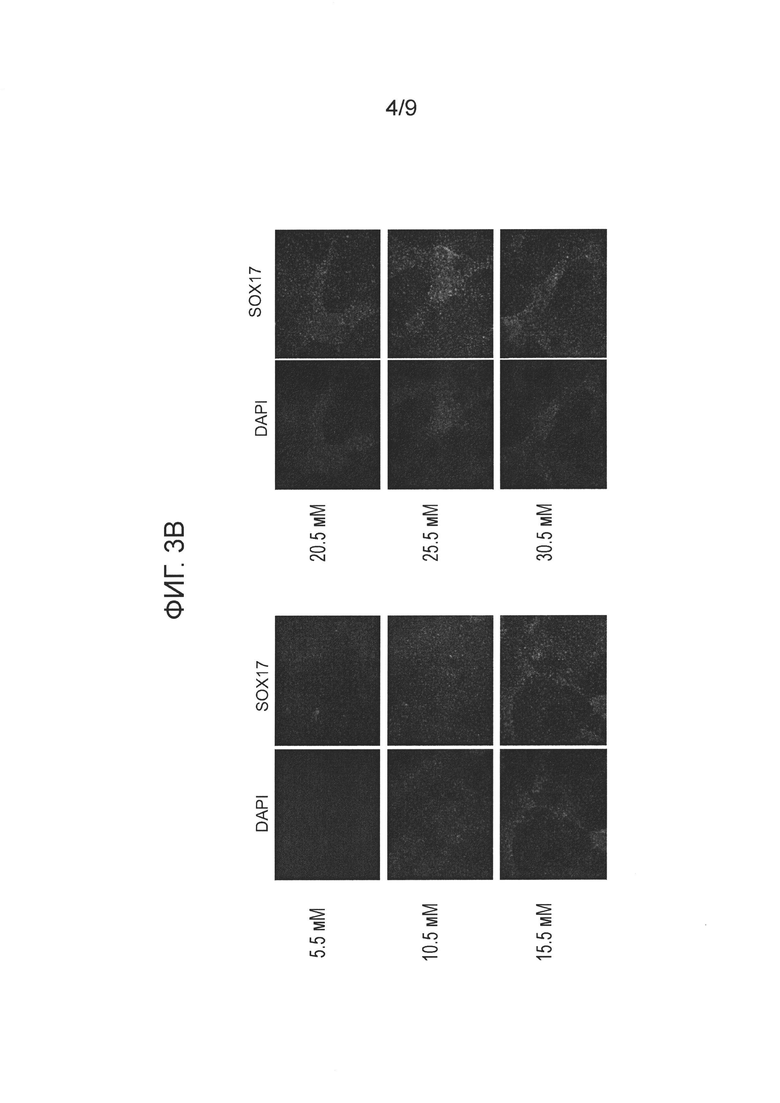
На фиг. 3 показано влияние концентрации глюкозы в среде на степень экспрессии CXCR4 и внешний вид культуры (панель А) и экспрессию SOX17 в клетках человеческой эмбриональной клеточной линии H1, дифференцированной по способам, описанным в примере 2.
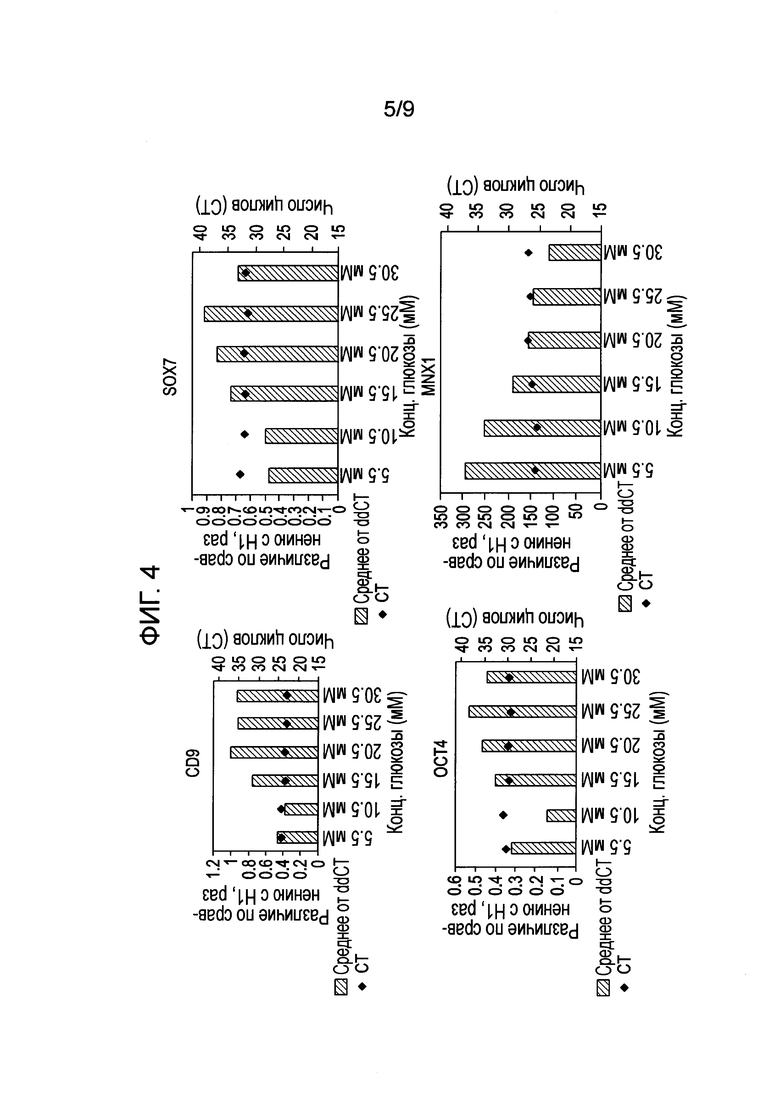
На фиг. 4 показаны результаты анализа экспрессии генов в клетках человеческой эмбриональной линии H1, дифференцированной по первому способу, описанному в Примере 2, методом ПЦР в реальном времени.
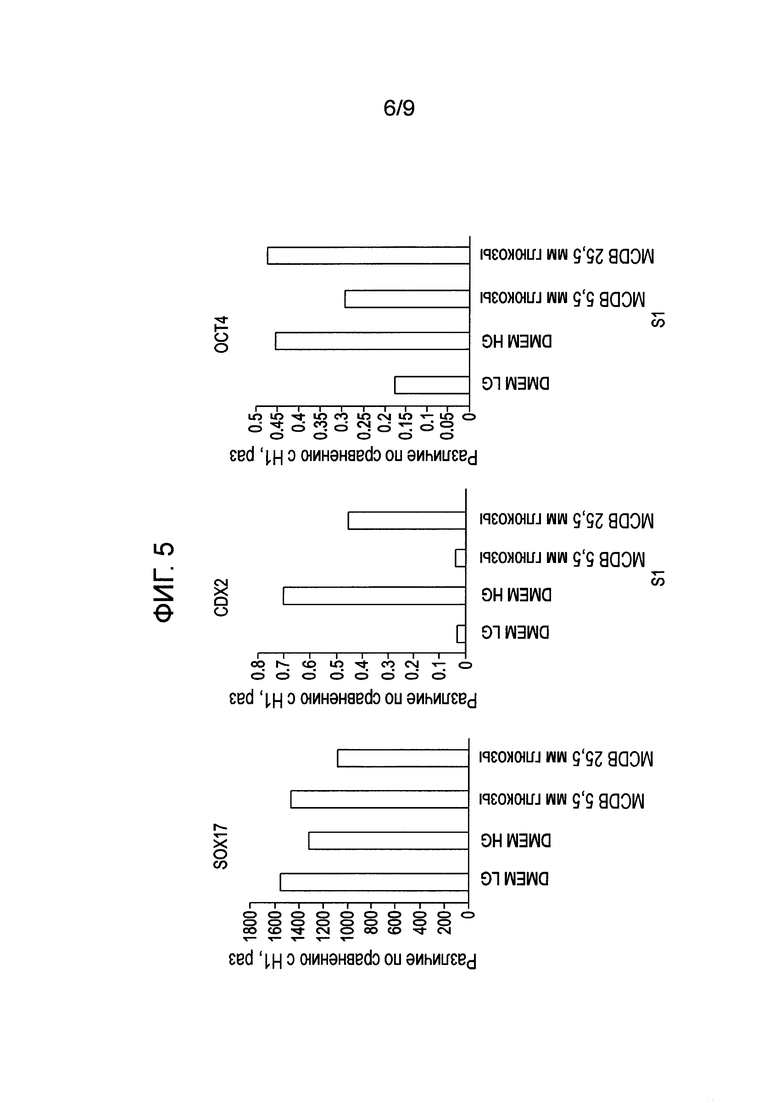
На фиг. 5 показан анализ экспрессии генов в клетках человеческой эмбриональной линии H1, дифференцированной по второму способу, описанному в Примере 2, методом ПЦР в реальном времени.
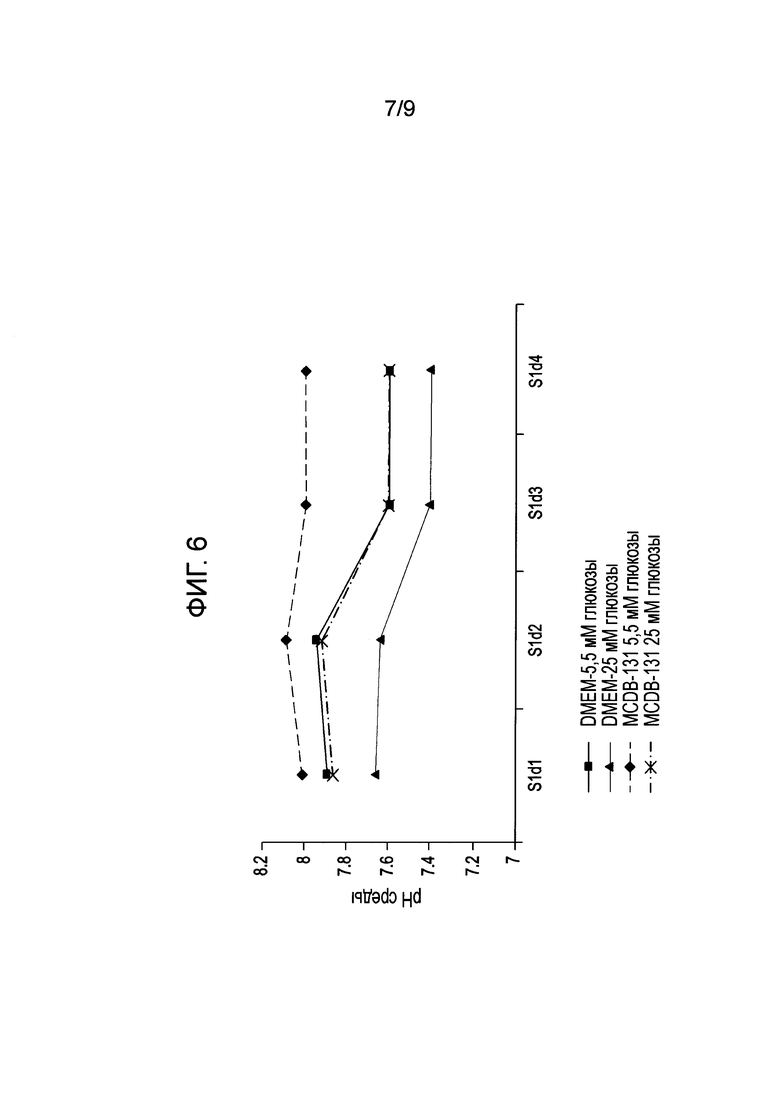
На фиг. 6 показан рН разных сред после 24-часового культивирования клеток на 1-4 сутки согласно способам, описанным в Примере 2.
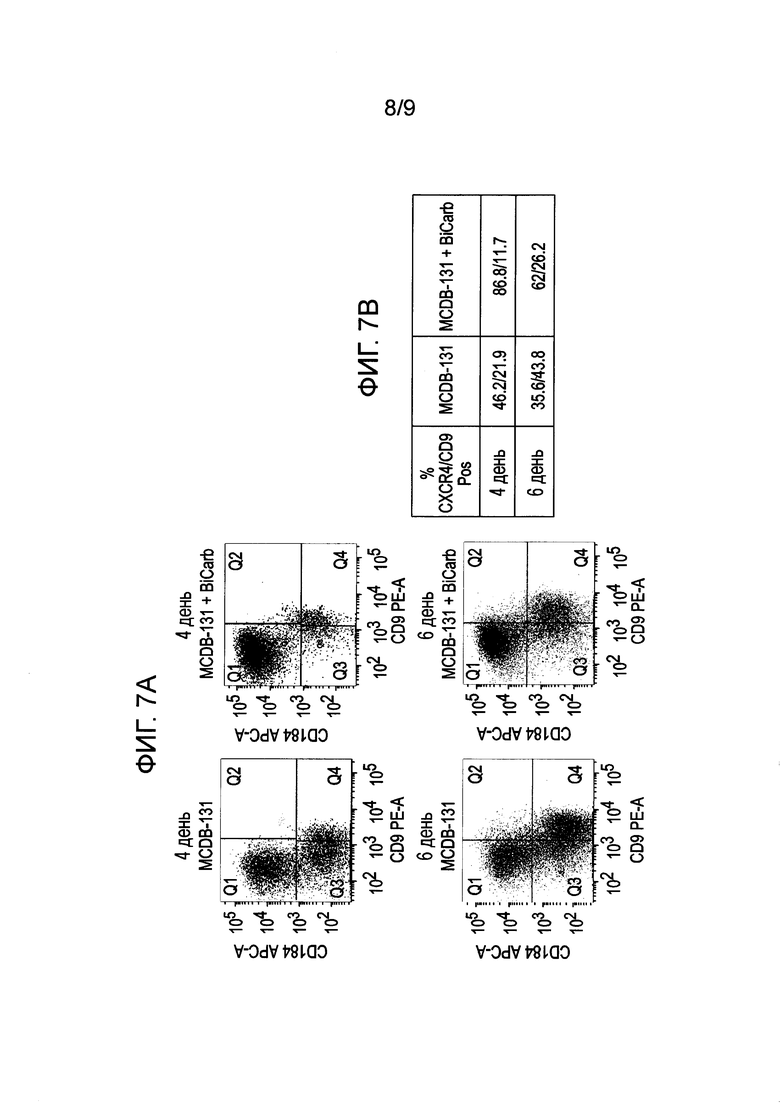
На фиг. 7 показано влияние рН на экспрессию указанных генов в клетках человеческой эмбриональной линии H1, дифференцированной по второму способу, описанному в Примере 3.
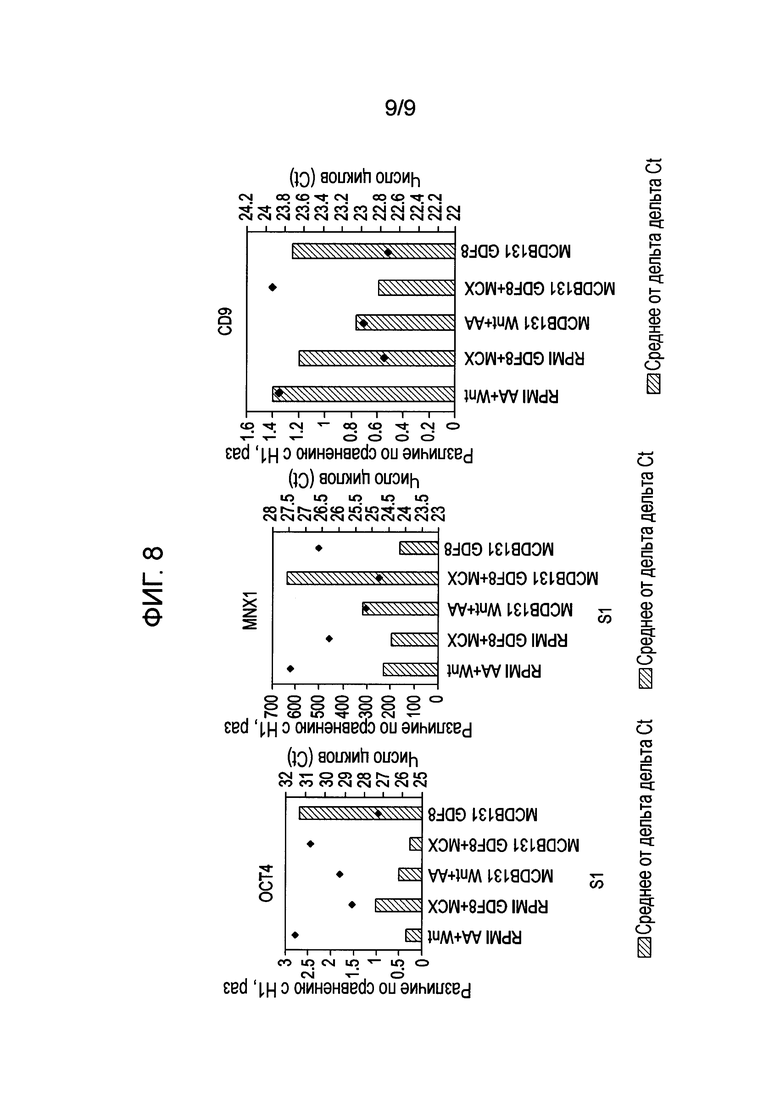
На фиг. 8 показан анализ экспрессии генов в клетках человеческой эмбриональной линии H1, дифференцированной по способу, описанному в Примере 4, методом ПЦР в реальном времени.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для ясности описания, а не для ограничения изобретения, подробное описание изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
Определения
Стволовые клетки представляют собой недифференцированные клетки, определяемые по их способности на уровне единичной клетки как самообновляться, так и дифференцироваться с образованием клеток-потомков, таких как самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются способностью дифференцироваться in vitro в функциональные клетки различных клеточных линий дифференцирования из нескольких зародышевых листков (эндодермы, мезодермы и эктодермы), а также после трансплантации давать начало тканям, происходящим от нескольких зародышевых листков, и вносить существенный вклад в формирование большинства, если не всех, тканей после инъекции в бластоцисты.
Стволовые клетки классифицируют по потенциалу развития: (1) тотипотентные, то есть способные преобразоваться в любой из эмбриональных и внеэмбриональных типов клеток; (2) плюрипотентные, то есть способные преобразоваться во все типы эмбриональных клеток; (3) мультипотентные, то есть способные преобразоваться во множество клеточных линий, но в рамках одной ткани, органа или физиологической системы (например, гемопоэтические стволовые клетки (ГСК) могут порождать ГСК (самообновление), олигопотентные ограниченные клетки-предшественники крови и все типы клеток и элементов (например, тромбоциты), являющиеся стандартными составляющими крови); (4) олигопотентные, то есть способные преобразоваться в более ограниченное подмножество клеточных линий, чем мультипотентные стволовые клетки; и (5) унипотентные, то есть способные преобразоваться в единственную клеточную линию (например, сперматогенные стволовые клетки).
Дифференцирование представляет собой процесс, при помощи которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает свойства специализированной клетки, например, нервной или мышечной клетки. Дифференцированная клетка или клетка с индуцированным дифференцированием представляет собой клетку, занявшую более специализированное («коммитированное») положение в линии дифференцирования клетки. Термин «коммитированная» применительно к процессу дифференцирования обозначает клетку, дошедшую в ходе процесса дифференцирования до стадии, от которой в нормальных условиях она продолжит дифференцироваться до определенного типа клеток или набора типов клеток и не сможет в нормальных условиях дифференцироваться в иной тип клеток или вернуться обратно к менее дифференцированному типу. Дедифференцированием называется процесс, в ходе которого клетка возвращается к менее специализированному (или коммитированному) положению в линии дифференцирования. Используемый в настоящей заявке термин «линия дифференцирования клетки» определяет наследственность клетки, то есть определяет, из какой клетки произошла данная клетка и каким клеткам она может дать начало. В линии дифференцирования клетка помещается в наследственную схему развития и дифференцирования. Маркером, специфичным для линии дифференцирования, называется характерная особенность, специфически ассоциированная с фенотипом клеток конкретной линии дифференцирования, которая может использоваться для оценки дифференцирования некоммитированных клеток в клетки данной линии дифференцирования.
Используемые в настоящей заявке термины «клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы», «клетки стадии 1» или «стадия 1», относятся к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: SOX17, GATA4, HNF3 beta, GSC, CER1, Nodal, FGF8, Brachyury, Mix-подобный гомеобоксовый белок, FGF4 CD48, эомезодермин (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 или OTX2. К клеткам, экспрессирующим маркеры, характерные для линии сформированной эндодермы, относятся клетки-предшественники первичной полоски, клетки первичной полоски, клетки мезэндодермы и клетки сформированной эндодермы.
Используемый в настоящей заявке термин «клетки с экспрессией маркеров, характерных для линии панкреатической эндодермы» относится к клеткам с экспрессией по меньшей мере одного из следующих маркеров: PDX1, NKX6.1, HNF1-бета, PTF1-альфа, HNF6, HNF4-альфа, SOX9, HB9 или PROX1. К клеткам, экспрессирующим маркеры, характерные для линии панкреатической эндодермы, относятся клетки панкреатической эндодермы, клетки первичной кишечной трубки и клетки поздней передней кишки.
Используемый в настоящей заявке термин «сформированная эндодерма» относится к клеткам, обладающим характерными особенностями клеток, происходящих в ходе гаструляции от эпибласта, и формирующим желудочно-кишечный тракт и его производные. Клетки сформированной энтодермы экспрессируют следующие маркеры: HNF3-бета, GATA4, SOX17, Cerberus, OTX2, goosecoid, C-Kit, CD99 и MIXL1.
Используемый в настоящей заявке термин «маркеры» означает молекулы нуклеиновых кислот или полипептидов с дифференциальной экспрессией в интересующих клетках. В данном контексте под дифференциальной экспрессией подразумевается повышение уровня экспрессии для положительного маркера и понижение уровня экспрессии для отрицательного маркера. Поддающийся обнаружению уровень маркерной нуклеиновой кислоты или полипептида в интересующих клетках оказывается значительно выше или ниже по сравнению с другими клетками, что позволяет идентифицировать интересующую клетку и отличить ее от других клеток с помощью любого из множества известных в данной области способов.
«Панкреатической эндокринной клеткой», «клеткой, экспрессирующей гормон поджелудочной железы» или «клеткой, экспрессирующей характеристики эндокринной линии поджелудочной железы» в настоящем документе называется клетка, способная экспрессировать по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид.
Выделение, размножение и культивирование полипотентных стволовых клеток
Характеристика плюрипотентных стволовых клеток
Плюрипотентные стволовые клетки могут экспрессировать один или более стадийно-специфичных эмбриональных антигенов (SSEA) 3 и 4, а также маркеры, определяемые антителами, обозначенными как Tra-1-60 и Tra-1-81 (Thomson et al., Science 282:1145, 1998). Дифференцирование плюрипотентных стволовых клеток in vitro приводит к потере экспрессии SSEA-4, Tra 1-60 и Tra 1-81 (при наличии) и к повышению экспрессии SSEA-1. В недифференцированных полипотентных стволовых клетках, как правило, активна щелочная фосфатаза, которая может быть обнаружена путем фиксации клеток с помощью 4% параформальдегида, с последующим обнаружением с помощью Vector Red, применяемого в качестве субстрата, в соответствии с инструкциями производителя (Vector Laboratories, Burlingame Calif.). Недифференцированные плюрипотентные стволовые клетки также, как правило, экспрессируют OCT4 и TERT, определяемые с помощью ПЦР в реальном времени.Другим желательным фенотипическим свойством выращенных плюрипотентных стволовых клеток является потенциал дифференцирования в клетки всех трех зародышевых листков: в энтодермальные, мезодермальные и эктодермальные ткани. Полипотентность полипотентных стволовых клеток может быть подтверждена, например, путем инъекции клеток мышам с тяжелым комбинированным иммунодефицитом (SCID), фиксирования образующихся тератом с помощью 4% параформальдегида, и их гистологического исследования для получения доказательств наличия клеточных типов, происходящих от трех зародышевых листков. В качестве альтернативы плюрипотентность можно определить по созданию эмбриоидных телец и анализа их на предмет присутствия маркеров, ассоциирующихся с тремя зародышевыми листками.
Выращенные линии плюрипотентных стволовых клеток могут быть кариотипированы с применением стандартного способа окрашивания с использованием красителя Гимза (G-banding) и сравнения с опубликованными кариотипами соответствующих видов приматов. Желательно получить клетки, имеющие «нормальный кариотип», т.е. эуплоидные клетки, в которых все человеческие хромосомы присутствуют и не имеют видимых изменений.
Источники плюрипотентных стволовых клеток
К типам плюрипотентных стволовых клеток, которые можно использовать, относятся устойчивые линии плюрипотентных клеток, получаемые из формируемой после вынашивания плода ткани, в том числе из преэмбриональной ткани (такой как бластоциста), эмбриональной ткани или ткани плода, взятой в любой момент в ходе вынашивания, как правило, но не обязательно, до срока приблизительно 10-12 недель беременности. Примерами, не ограничивающими настоящее изобретение, являются стабильные линии человеческих эмбриональных стволовых клеток или человеческих эмбриональных зародышевых клеток, например, клеточные линии человеческих эмбриональных стволовых клеток H1, H7 и H9 (WiCell). Также возможно использование описываемых в настоящей заявке составов в ходе первоначального установления или стабилизации таких клеток, в этом случае исходными клетками являются первичные плюрипотентные клетки, взятые напрямую из тканей-источников. Также соответствуют целям настоящего изобретения клетки, взятые из популяции плюрипотентных стволовых клеток, уже культивированных в отсутствие питающих клеток. Также соответствуют целям настоящего изобретения клетки мутантных линий эмбриональных стволовых клеток человека, таких как, например, BG01v (BresaGen, Атенс, Джорджия, США).
В одном варианте осуществления подготовка человеческих эмбриональных стволовых клеток была описана Thomson et al. (патент США № 5843780; Science 282:1145, 1998; Curr. Top. Dev. Biol. 38:133 ff., 1998; Proc. Natl. Acad. Sci. U.S.A. 92:7844, 1995).
Культивирование плюрипотентных стволовых клеток
В одном варианте осуществления плюрипотентные стволовые клетки культивируют на слое питающих клеток, которые поддерживают плюрипотентные стволовые клетки в различных отношениях. Как вариант, полипотентные стволовые клетки культивируются в культуральной системе, по существу не содержащей питающих клеток, но, тем не менее, поддерживающей пролиферацию полипотентных стволовых клеток и не допускающей существенной дифференцировки. Рост плюрипотентных стволовых клеток в свободной от питающих клеток культуральной системе без дифференцирования поддерживается путем использования среды, кондиционированной посредством предварительного культивирования клеток иного типа. В качестве альтернативы рост плюрипотентных стволовых клеток в свободной от питающих клеток культуральной системе без дифференцирования поддерживается путем использования среды с химически определенным составом.
В одном варианте осуществления изобретения плюрипотентные стволовые клетки можно культивировать на питающем слое фибробластов эмбриона мыши в соответствии со способами, изложенными в работе Reubinoff et al. (Nature Biotechnology 18: 399-404 (2000)). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать на питающем слое фибробластов эмбриона мыши в соответствии со способами, изложенными в работе Thompson et al. (Science 6, ноябрь 1998 г.: Vol. 282. no. 5391, pp. 1145-1147). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать на любом из питающих слоев клеток, описанных в работе Richards et al. (Stem Cells 21: 546-556, 2003).
В одном варианте осуществления плюрипотентные стволовые клетки можно культивировать на питающем слое клеток человека в соответствии со способами, изложенными в работе Wang et al. (Stem Cells 23: 1221-1227, 2005). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать на питающем слое клеток человека, описанном в работе Stojkovic et al. (Stem Cells 2005 23: 306-314, 2005). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать на питающем слое клеток человека, описанном в работе Miyamoto et al. (Stem Cells 22: 433-440, 2004). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать на питающем слое клеток человека, описанном в работе Amit et al. (Biol. Reprod 68: 2150-2156, 2003). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать на питающем слое клеток человека, описанном в работе Inzunza et al. (Stem Cells 23: 544-549, 2005).
В одном варианте осуществления плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в патенте США № 20020072117. В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в патенте США № 6642048. В альтернативном варианте осуществления изобретения плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в международной заявке WO2005014799. В альтернативном варианте осуществления изобретения плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в работе Xu et al. (Stem Cells 22: 972-980, 2004). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в патенте США № 20070010011. В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в патенте США № 20050233446. В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в патенте США № 6800480. В альтернативном варианте осуществления изобретения плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, описанными в международной заявке WO2005065354.
В одном варианте осуществления изобретения плюрипотентные стволовые клетки можно культивировать в среде, описанной в международной заявке WO2005065354. Альтернативно, плюрипотентные стволовые клетки можно культивировать в среде, описанной в международной заявке WO2005086845.
В одном варианте осуществления плюрипотентные стволовые клетки можно культивировать по методам, описанным Cheon et al. (BioReprod DOI:10.1095/biolreprod.105.046870, October 19, 2005). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в соответствии со способами, представленными в работе Levenstein et al. (Stem Cells 24: 568-574, 2006). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в соответствии со способами, представленными в патенте США № 20050148070. В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в соответствии со способами, представленными в патенте США № 20050244962. В альтернативном варианте осуществления изобретения плюрипотентные стволовые клетки можно культивировать в соответствии со способами, описанными в международной заявке WO2005086845.
Плюрипотентные стволовые клетки могут быть высеяны на соответствующий культуральный субстрат. В одном из вариантов осуществления соответствующим культуральным субстратом является компонент внеклеточного матрикса, такой как, например, компонент, полученный из базальной мембраны, или компонент, который может участвовать в лиганд-рецепторном взаимодействии с участием молекулы адгезивного слоя. В одном из вариантов осуществления подходящим культуральным субстратом является МАТРИГЕЛЬ® (Becton Dickenson). МАТРИГЕЛЬ® представляет собой растворимый препарат из клеток опухоли Энгельбрета-Холма-Суорма, который при комнатной температуре превращается в гель и образует восстановленную базальную мембрану.
В качестве альтернативы можно использовать другие компоненты внеклеточного матрикса и смеси компонентов. В зависимости от типа пролиферирующих клеток, это может быть ламинин, фибронектин, протеогликан, энтактин, гепарансульфат и т.п., по отдельности или в различных сочетаниях.
Плюрипотентные стволовые клетки могут высеиваться на субстрат с соответствующим распределением по поверхности и в присутствии среды, поддерживающей выживание, размножение и сохранение требуемых характеристик клеток. Все эти характеристики улучшаются при тщательном подходе к распределению клеток при посеве и могут быть определены специалистом в данной области.
Подходящая культуральная среда может быть изготовлена, например, из следующих компонентов модифицированная по способу Дульбекко среда Игла (DMEM), Gibco № 11965-092, нокаутная модифицированная по способу Дульбекко среда Игла (KO DMEM), Gibco №10829-018, базовая среда Хэма F12/50% DMEM, 200 ммоль/л L-глутамина, Gibco № 15039-027; раствор неосновных аминокислот, Gibco 11140-050; β-меркаптоэтанол, Sigma № M7522; человеческий рекомбинантный основной фактор роста фибробластов (bFGF), Gibco № 13256-029.
Формирование клеток, экспрессирующих маркеры, характерные для линии сформированной панкреатической энтодермы, из плюрипотентных стволовых клеток
Настоящее изобретение представляет способы получения популяций клеток, экспрессирующих маркеры, характерные для клеточной линии сформированной эндодермы, из популяций плюрипотентных стволовых клеток. В одном варианте осуществления настоящее изобретение представляет способы дальнейшей дифференциации клеток, экспрессирующих маркеры ростка эндокринных клеток поджелудочной железы. В одном варианте осуществления это достигается пошаговым протоколом дифференцирования, в котором популяции плюрипотентных стволовых клеток сначала дифференцируются в популяции клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы. Далее, популяции клеток, экспрессирующих маркеры, характерные для клеточной линии сформированной эндодермы, дополнительно дифференцируются в популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы. Далее, популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, дополнительно дифференцируются в популяции клеток, экспрессирующих маркеры, характерные для линии эндокринных клеток поджелудочной железы.
В настоящем изобретении представлена популяция, в которой более 80% клеток экспрессирует маркеры, характерные для линии сформированной эндодермы. Популяция клеток может подвергаться дальнейшей обработке для получения популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы. Популяция клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, можно дополнительно обрабатывать для получения популяции клеток, экспрессирующих маркеры, характерные для линии эндокринных клеток поджелудочной железы.
Эффективность дифференцирования может быть определена путем обработки популяции клеток агентом (например, антителом), специфически распознающим белковый маркер, экспрессируемый клетками, экспрессирующими маркеры, характерные для желательного вида клеток.
Способы оценки экспрессии маркеров белков и нуклеиновых кислот в культивированных или выделенных клетках являются стандартными для данной области. Сюда относятся количественная ревертазная полимеразная цепная реакция (ОТ-ПЦР), Нозерн-блот, гибридизация in situ (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001, доп.)), а также способы иммунологического анализа, такие как иммуногистохимический анализ среза материала, Вестерн-блоттинг, а для маркеров, доступных в интактных клетках, - способ проточной цитометрии (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Характеристики плюрипотентных стволовых клеток хорошо известны специалистам в данной области, и продолжается выявление дополнительных характеристик плюрипотентных стволовых клеток. К маркерам плюрипотентных стволовых клеток относится, например, экспрессия одного или нескольких следующих маркеров: ABCG2, CRIPTO, FOXD3, Connexin43, Connexin45, OCT4, SOX2, Nanog, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60, Tra 1-81.
После обработки плюрипотентных стволовых клеток с применением способов, составляющих предмет настоящего изобретения, дифференцированные клетки могут быть выделены путем воздействия на популяцию клеток агентом (например, антителом), специфически распознающим белковый маркер, например CXCR4, экспрессируемый клетками, экспрессирующими маркеры, характерные для линии сформированной эндодермы.
К плюрипотентным стволовым клеткам, которые могут использоваться в настоящем изобретении, относятся, например, человеческие эмбриональные стволовые клетки линии H9 (код NIH: WA09), человеческие эмбриональные стволовые клетки линии H1 (код NIH: WA01), человеческие эмбриональные стволовые клетки линии H7 (код NIH: WA07) и человеческие эмбриональные стволовые клетки линии SA002 (Cellartis, Швеция). Также для использования в рамках настоящего изобретения подходят клетки, экспрессирующие по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, cripto, CD9, FOXD3, CONNEXIN43, CONNEXIN45, OCT4, SOX2, Nanog, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60 и Tra 1-81.
Маркеры, характерные для сформированной линии энтодермы, выбираются из группы, содержащей SOX17, GATA4, HNF3-бета, GSC, CER1, Nodal, FGF8, Brachyury, Mix-подобный гомеобоксовый белок, FGF4, CD48, эомезодермин (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 и Otx2. Подходит для использования в настоящем изобретении клетка, экспрессирующая, как минимум, один из маркеров, характерных для линии сформированной эндодермы. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой клетку-предшественника первичной полоски. В другом аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой мезэндодермальную клетку. В другом аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой клетку сформированной эндодермы.
Маркеры, характерные для линии энтодермы поджелудочной железы, выбираются из группы, содержащей PDX1, NKX6.1, HNF1-бета, PTF1-альфа, HNF6, HNF4-альфа, SOX9, HB9 и PROX1. Подходит для использования в настоящем изобретении клетка, экспрессирующая, как минимум, один из маркеров, характерных для линии панкреатической эндодермы. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии панкреатической эндодермы, представляет собой клетку панкреатической эндодермы.
Маркеры, характерные для линии дифференцирования панкреатических эндокринных клеток, выбирают из группы, состоящей из следующих маркеров: NGN3, NEUROD, ISL1, PDX1, NKX6.1, PAX4, NGN3 и PTF-1-альфа. В одном варианте осуществления панкреатическая эндокринная клетка способна к экспрессии по меньшей мере одного из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид. Соответствующей целям настоящего изобретения является клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии панкреатических эндокринных клеток. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии панкреатических эндокринных клеток, представляет собой панкреатическую эндокринную клетку. Панкреатическая эндокринная клетка может представлять собой панкреатическую клетку, экспрессирующую гормоны. В альтернативном варианте осуществления панкреатическая эндокринная клетка может представлять собой панкреатическую клетку, секретирующую гормоны.
В одном аспекте настоящего изобретения панкреатическая эндокринная клетка представляет собой клетку с экспрессией маркеров, характерных для линии дифференцирования β-клеток. Клетка с экспрессией маркеров, характерных для линии β-клеток, экспрессирует PDX1 и по меньшей мере один из следующих транскрипционных факторов: NGN3, NKX2.2, NKX6.1, NEUROD, ISL1, HNF3-бета, MAFA, PAX4 и PAX6. В одном аспекте настоящего изобретения клетка с экспрессией маркеров, характерных для линии дифференцирования β-клеток, представляет собой β-клетку.
Получение клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, из плюрипотентных стволовых клеток
В одном аспекте настоящего изобретения популяции плюрипотентных стволовых клеток могут дифференцироваться в популяции клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, путем культивирования плюрипотентных стволовых клеток в среде с концентрацией глюкозы, не превышающей 10,5 ммоль/л. В одном варианте осуществления изобретения дифференциация популяции плюрипотентных стволовых клеток в направлении популяции клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, достигается обработкой плюрипотентных стволовых клеток активином А и лигандом Wnt.
В альтернативном варианте осуществления дифференциация популяции плюрипотентных стволовых клеток в направлении популяции клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, достигается обработкой плюрипотентных стволовых клеток GDF-8 и по меньшей мере одним из факторов, выбранных из группы, состоящей из нижеперечисленных: анилин-пиридинотриазин, циклический анилин-пиридинотриазин, N-{[1-(фенилметил)азепан-4-ил]метил}-2-пиридин-3-илацетамид, 4-{[4-(4-{[2-(пиридин-2-иламино)этил]амино}-1,3,5-триазин-2-ил)пиридин-2-ил]окси}бутан-1-ол, 3-({3-[4-({2-[метил(пиридин-2-ил)амино]этил}амино)-1,3,5-триазин-2-ил]пиридин-2-ил}амино)пропан-1-ол, N~4~-[2-(3-фторфенил)этил]-N~2~-[3-(4-метилпиперазин-1-ил)пропил]пиридо[2,3-d]пиримидин-2,4-диамин, 1-метил-N-[(4-пиридин-3-ил-2-{[3-(трифторметил)фенил]амино}-1,3-тиазол-5-ил)метил]пиперидин-4-карбоксамид, 1,1-диметилэтил {2-[4-({5-[3-(3-гидроксипропил)фенил]-4H-1,2,4-триазол-3-ил}амино)фенил]этил}карбамат, 1,1-диметилэтил{[3-({5-[5-(3-гидроксипропил)-2-(метилокси)фенил]-1,3-оксазол-2-ил}амино)фенил]метил}карбамат, 1-({5-[6-({4-[(4-метилпиперазин-1-ил)сульфонил]фенил}амино)пиразин-2-ил]тиофен-2-ил}метил)пиперидин-4-ол, 1-({4-[6-({4-[(4-метилпиперазин-1-ил)сульфонил]фенил}амино)пиразин-2-ил]тиофен-2-ил}метил)пиперидин-4-карбоксамид и 2-{[4-(1-метилэтил)фенил]амино}-N-(2-тиофен-2-илэтил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксамид. Примеры факторов, подходящих для использования, можно найти в заявке на патент США с серийным № 12/494789. В одном варианте осуществления по меньшей мере один из факторов представляет собой 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он.
Популяция плюрипотентных стволовых клеток может культивироваться в среде с концентрацией глюкозы не более 10,5 ммоль/л от примерно одних суток до примерно семи суток. Альтернативно, популяция плюрипотентных стволовых клеток может культивироваться в среде с концентрацией глюкозы не более 10,5 ммоль/л от примерно одних суток до примерно шести суток. Альтернативно, популяция плюрипотентных стволовых клеток может культивироваться в среде с концентрацией глюкозы не более 10,5 ммоль/л от примерно одних суток до примерно пяти суток. Альтернативно, популяция плюрипотентных стволовых клеток может культивироваться в среде с концентрацией глюкозы не более 10,5 ммоль/л от примерно одних суток до примерно четырех суток. Альтернативно, популяция плюрипотентных стволовых клеток может культивироваться в среде с концентрацией глюкозы не более 10,5 ммоль/л от примерно одних суток до примерно четырех суток.
В одном из вариантов осуществления GDF-8 используется в концентрации от приблизительно 5 нг/мл до приблизительно 500 нг/мл. В альтернативном варианте осуществления GDF-8 используется в концентрации от приблизительно 5 нг/мл до приблизительно 50 нг/мл. В альтернативном варианте осуществления GDF-8 используется в концентрации от приблизительно 5 нг/мл до приблизительно 25 нг/мл. В альтернативном варианте осуществления GDF-8 используется в концентрации приблизительно 25 нг/мл.
Активин-А может использоваться в концентрациях от приблизительно 1 пг/мл до приблизительно 100 мкг/мл. В альтернативном варианте осуществления концентрация может составлять от примерно 1 пг/мл до примерно 1 мкг/мл. В другом альтернативном варианте осуществления концентрация может составлять от примерно 1 пг/мл до примерно 100 нг/мл. В другом альтернативном варианте осуществления концентрация может составлять от приблизительно 1 пг/мл до приблизительно 100 нг/мл. В другом альтернативном варианте осуществления концентрация может составлять примерно 100 нг/мл.
Лиганд Wnt может выбираться из группы, состоящей из Wnt-1, Wnt-3a, Wnt-5a и Wnt-7a. В одном варианте осуществления лиганд Wnt представляет собой Wnt-1. В альтернативном варианте осуществления лиганд Wnt представляет собой Wnt-3a.
Лиганд Wnt может использоваться в концентрации от приблизительно 1 нг/мл до приблизительно 1000 нг/мл. В альтернативном варианте осуществления лиганд Wnt может использоваться в концентрации от приблизительно 10 нг/мл до приблизительно 100 нг/мл. В одном варианте осуществления лиганд Wnt используется в концентрации приблизительно 20 нг/мл.
Образование клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы
В одном варианте осуществления изобретения популяцию клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, которая была получена методами настоящего изобретения, далее дифференцируют в популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, любым известным способом.
Например, популяции клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, полученные в соответствии со способами настоящего изобретения, могут быть дополнительно дифференцированы в популяции клеток, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, путем обработки популяции клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, в соответствии со способами, представленными в работе D’Amour et al., Nature Biotechnology, 24, 1392-1401 (2006)
Например, популяции клеток, экспрессирующие маркеры, характерные для линии сформированной эндодермы, полученные по способам настоящего изобретения, могут быть дополнительно дифференцированы в популяции клеток, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, путем обработки популяции клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, в соответствии со способами, представленными в заявке на патент США Сер. № 11/736908.
Создание клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток
В одном варианте осуществления популяции клеток, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, дополнительно дифференцируются в популяции клеток, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, с использованием любого способа, известного специалистам в данной области.
Например, популяции клеток, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, могут быть дополнительно дифференцированы в популяции клеток, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, в соответствии со способами, представленными в работе D’Amour et al., Nature Biotechnology, 2006.
Например, популяции клеток, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, могут быть дополнительно дифференцированы в популяции клеток, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, в соответствии со способами, представленными в работе D’Amour et al., Nature Biotechnology, 2006.
Например, популяции клеток, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, могут далее дифференцироваться в популяции клеток, экспрессирующие маркеры, характерные для линии эндокринных клеток поджелудочной железы, путем обработки популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в соответствии с методами, описанными в заявке на патент США Сер. № 11/736908.
Например, популяции клеток, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, могут далее дифференцироваться в популяции клеток, экспрессирующие маркеры, характерные для линии эндокринных панкреатических клеток, путем обработки популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в соответствии с методами, описанными в заявке на патент США Сер. № 11/779311.
Например, популяции клеток, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, могут далее дифференцироваться в популяции клеток, экспрессирующие маркеры, характерные для линии эндокринных панкреатических клеток, путем обработки популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в соответствии с методами, описанными в заявке на патент США Сер. № 60/953178.
Например, популяции клеток, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, могут далее дифференцироваться в популяции клеток, экспрессирующие маркеры, характерные для линии эндокринных панкреатических клеток, путем обработки популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в соответствии с методами, описанными в заявке на патент США Сер. № 60/990529.
Настоящее изобретение далее иллюстрируется, помимо прочих, следующими примерами.
ПРИМЕРЫ
Пример 1
Роль среды и методики посева в дифференциации человеческих плюрипотентных клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы
Клетки эмбриональной линии стволовых клеток H1 при 41 пересеве (p41) обрабатывали реактивом для диссоциации TrypLE (кат. № 12604-013, Invitrogen, Калифорния), высевали как отдельные клетки из суспензии с плотностью 100000 кл./см2 на чашки, покрытые субстратом МАТРИГЕЛЬ® (разведение 1:30), и культивировали в среде, кондиционированной мышиными эмбриональными фибробластами (MEF-CM), с добавлением 20 нг/мл FGF2 (кат. № 100-18B, PeproTech, Нью Джерси) и 10 мкМ Y-27632 (Ингибитор Rho киназы, Кат. № Y0503, Sigma, Миссури).
Параллельно клетки человеческой эмбриональной клеточной линии H1 после 41 пересева высевали в виде колоний на чашки, покрытые субстратом МАТРИГЕЛЬ® (разведение 1:30), соотношение объемов культуры и свежей среды составляло 1:3, для диссоциации клеток использовали диспазу (кат. № 17105-041, Invitrogen, Калифорния), и культивировали клетки на чашках с MEF-CM+20 нг/мл FGF2. В обеих культурах после посева одиночных клеток и колоний среду заменяли через 24 и 48 ч после посева свежей средой MEF-CM с добавлением 20 нг/мл FGF2.
Через 72 ч после посева культуры дифференцировали в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, описанным ниже способом:
a) Среда MCDB-131 (кат. № 10372-019, Invitrogen, Калифорния) с добавлением 0,0025 г/мл натрия бикарбоната (кат. № S3187, Sigma, Миссури) и 2% БСА без жирных кислот (кат. № 68700, Proliant, Айова), 1X ГлутаМакса™ (кат. № 35050-079, Invitrogen, Калифорния) и 100 нг/мл активина A (RD Systems, Миннесота)+20 нг/мл WNT-3a (кат. № 1324-WN-002, RD Systems, Миннесота) в первые сутки, затем MCDB-131 с добавлением 0,0025 г/мл натрия бикарбоната, 2% БСА, Глутамакса и 100 нг/мл активина A в течение трех суток (Условие 1); или
b) Среда RPMI-1640 (Кат. № 22400-105, Invitrogen, Калифорния) с добавлением 2% БСА без жирных кислот (кат. № 68700, Proliant, Айова) и 100 нг/мл активина A (RD Systems, Миннесота)+20 нг/мл WNT-3a (Кат. № 1324-WN-002, RD Systems, Миннесота) в течение одних суток, затем среда RPMI-1640 с добавлением 2% БСА и 100 нг/мл активина A ежедневно на протяжении трех суток (Условие 2).
На 4 день отбирали пробы для анализа методом флуоресцентной проточной цитометрии. На фиг. 1 показаны результаты флуоресцентной проточной цитометрии для определения экспрессии CXCR4 и CD9 в виде графика разброса с экспрессией CXCR4 по оси Y и экспрессией CD9 по оси Х. Процент клеток, экспресирующих CXCR4, CD9 и CD99 (дополнительный маркер дифференциации), представлен в таблице 1. Дифференциация, измеряемая по усилению экспрессии поверхностных маркеров CXCR4 и CD99, была более выраженной при использовании сред MCDB-131, а экспрессия CXCR4 и CD99 повышалась еще сильнее при переходе от культивирования колоний к культивированию отдельных клеток. Кроме того, по результатам проточной цитометрии эти данные коррелировали со снижением экспрессии CD9 - клеточного маркера недифференцированных клеток.
Интересно, что при использовании MCDB-131 в формате кластеров или колоний отмечено меньшее число клеток, отрицательных по CXCR4-/CD9-, на фиг. 1, что указывает на меньшую частоту неспецифичной дифференциации или меньшее число клеток, не экспрессирующих маркеры, характерные для линии сформированной эндодермы, в культурах на среде MCDB-131. В целом эти данные указывают, что человеческие эмбриональные стволовые клетки эффективнее дифференцируются в присутствии среды MCDB-131, чем среды RPMI-1640, и дифференциацию клеток MCDB-131 можно дополнительно улучшить посевом и культивированием отдельных клеток по сравнению с посевом и культивированием колоний.
(одиночная клетка)
(одиночная клетка)
Пример 2
Роль глюкозы в дифференциации человеческих плюрипотентных клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы
Глюкоза представляет собой растворимый сахар - гексозу, входящую в состав почти всех питательных сред, включая следующие: среду Эймса; Основную среду Игла (BME); Модификацию среды Фиттона-Джексона BGJb; Среду Клика; Среду CMRL-1066; Среду Игла, модифицированную Дульбекко (DMEM); Питательную смесь DMEM/Хэма F-12 (50:50); Модификацию Куна F-12; Среду Фишера; Среду H-Y (Hybri-Max®); Среду Искова - модифицированную среду Дульбекко (IMDM); Модифицированную среду МакКоя 5A; Среды MCDB; Среду 199; Минимальную питательную среду Игла (EMEM); Среду NCTC; Питательную смесь Хэма F-10; Питательную смесь Хэма F-12; Питательную смесь Хэма F-12 в модификации Кайна (F12K); RPMI-1640; Бессывороточную/безбелковую среду для гибридом; Среду Веймаута MB; Среду Вильямса и различные патентованные среды (См. http://www.sigmaaldrich.com/life-science/cell-culture/learning-center/media-expert/glucose.html).
Содержание глюкозы в средах для культур клеток варьируется. Хотя среды серии MCDB содержат глюкозу в концентрации от 3,9 до 10 ммоль/л, концентрация глюкозы в большинстве сред составляет от 1 г/л (5,5 ммоль/л) до 10 г/л (55 ммоль/л), а среда RPMI-1640 содержит 11 ммоль/л глюкозы. Концентрации глюкозы выше 10 ммоль/л аналогичны диабетическому состоянию в культуре клеток. Это важно, так как процессы, воздействующие на клетки и молекулы in vivo, могут действовать и in vitro. Последствия роста клеток в условиях, по существу являющихся диабетическими, выражаются в том, что клетки и клеточные продукты изменяются из-за процессов гликирования и глиоксидации, и могут повреждаться из-за окислительного и карбонильного стресса, опосредованного глюкозой (См. http://www.sigmaaldrich.com/life-science/cell-culture/learning-center/media-expert/glucose.html).
Одной из сред, в настоящее время использующихся для получения клеток сформированной эндодермы, является среда Дульбекко в модификации Искова (IMDM), содержащая 25 ммоль/л глюкозы (Kubo et al; April 1, 2004, Development 131, 1651-1662), RPMI с 11 ммоль/л глюкозы (D’Amour et al. Nat Biotechnol. 2005 Dec; 23(12):1534-41), или среда DMEM-F12 с 17,5 ммоль/л глюкозы. Каждая из этих сред содержит более 10 ммоль/л глюкозы, что аналогично условиям при диабете. Следовательно, для уменьшения стресса для клеток, который может индуцироваться высокой концентрацией глюкозы в культуральной среде, мы предприняли попытку найти среду с концентрацией глюкозы ниже 10 ммоль/л для дифференциации человеческих эмбриональных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы. Одной из таких сред с концентрацией глюкозы ниже 10 ммоль/л является MCDB-131, содержащая глюкозу в концентрации 5,5 ммоль/л.
Клетки эмбриональной линии стволовых клеток H1 после 41 пересева (p41) были обработаны реактивом для диссоциации TrypLE (кат. № 12604-013, Invitrogen, Калифорния), высеяны как отдельные клетки из суспензии с плотностью 100000 кл./см2 на чашки, покрытые субстратом МАТРИГЕЛЬ® (разведение 1:30), и культивировались в среде, кондиционированной мышиными эмбриональными фибробластами (MEF-CM), с добавкой 20 нг/мл FGF2 (кат. № 100-18B PeproTech, Нью Джерси) и 10 мкмоль/л Y-27632 (Ингибитор Rho киназы, Кат. № Y0503, Sigma, Миссури). Среды заменяли через 24 и 48 ч после посева свежей средой MEF-CM с 20 нг/мл FGF2. Через 72 ч после посева культуры дифференцировали в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, описанным ниже способом:
a) Среда MCDB-131 (Кат. № 10372-019, Invitrogen, Калифорния) с добавлением 2% БСА без жирных кислот (Кат. № 68700, Proliant, Айова), 0,0025 г/мл натрия бикарбоната (Кат. № S3187, Sigma, Миссури), 1X ГлутаМакса™ (Кат. № 35050-079, Invitrogen, Калифорния), 100 нг/мл активина A (RD Systems, Миннесота), 20 нг/мл WNT-3a (Кат. № 1324-WN-002, RD Systems, Миннесота), и 0, 5, 10, 15, 20 или 25 ммоль/л глюкозы (Кат. № G8769, Sigma, Миссури) в течение одних суток, затем
b) среда MCDB-131 с добавлением 2% БСА, бикарбоната натрия, Глутамакса, 100 нг/мл активина A и 0, 5, 10, 15, 20, или 25 ммоль/л глюкозы еще в течение 3 суток.
На 4 день собирали образцы для анализа методом флуоресцентной проточной цитометрии и анализа генной экспрессии с использованием ПЦР в реальном времени, а также подсчета с помощью ViaCount® (Guava®, Millipore, Биллерика, Массачусетс). В соответствии с результатами, приведенными в Примере 1, дифференциация плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, приводила к устойчивой экспрессии маркеров, связанных с линией сформированной эндодермы (фиг. 2A). Когда к среде, содержащей глюкозу, добавляли дополнительно 0, 5, 10, 15, 20 или 25 ммоль/л глюкозы (конечная концентрация: 5,5, 10,5, 15,5, 20,5, 25,5 или 30,5 ммоль/л глюкозы соответственно), в образцах с добавлением дополнительных 10 ммоль/л глюкозы (конечная концентрация глюкозы 15,5 ммоль/л) было отмечено умеренное увеличение концентрации клеток, как показано на фиг. 2B. Умеренное повышение экспрессии CXCR4 наблюдали также в клетках на среде с добавлением 5 ммоль/л глюкозы (конечная концентрация глюкозы 10,5 ммоль/л), как показано на фиг. 2A. Однако такое увеличение числа клеток CXCR4 было нивелировано снижением общей жизнеспособности клеток (фиг. 2B).
При исходной концентрации глюкозы (5,5 ммоль/л) почти все клетки в культуре были SOX17-положительными, и клетки распределялись по культуральной чашке однородно (фиг. 3 A и B). При увеличении концентрации глюкозы высокая экспрессия SOX17 сохранялась, однако клетки образовывали скопления. Следовательно, распределение таких клеток в группах по поверхности среды было менее однородным, чем при обычной концентрации глюкозы в среде. Этот эффект коррелировал с незначительным усилением экспрессии клеточных маркеров CD9 и OCT4- маркеров недифференцированных клеток, SOX7-клеточного маркера экстраэмбриональной эктодермы, а также со снижением генной экспрессии гомеобокса 1 поджелудочной железы (MNX1), также известного как гомеобокс HB9 (HLXB9), в клетках, располагающихся группами (фиг. 4).
Сходное влияние глюкозы на дифференциацию наблюдали также в культурах, дифференцированных с помощью среды DMEM, содержащей 5,5 ммоль/л (низкую концентрацию) или 24 ммоль/л (высокую концентрацию) глюкозы (кат. №10567-014 и 21063-029, Invitrogen, Калифорния). Как описано выше, для контроля клетки высевали одиночно, культивировали 3 дня в среде, кондиционированной MEF, и дифференцировали в среде MCDB-131 с 5,5 или 25 ммоль/л глюкозы, или в среде DMEM с высокой концентрацией глюкозы и добавлением 2% БСА без жирных кислот, 100 нг/мл активина A и 20 нг/мл WNT-3a на первый день и 2% БСА без жирных кислот и 100 нг/мл активина А в следующие три дня с ежедневной заменой среды.
Сходно с результатами, полученными на средах MCDB-131, когда повышенная концентрация глюкозы подавляла образование клеток сформированной эндодермы по сравнению с низкой концентрацией глюкозы, на среде DMEM с высокой концентрацией глюкозы также отмечено снижение дифференциации клеток hES. Исследование методом проточной цитометрии после дифференциации до сформированной эндодермы показало, что в средах, содержащих 5,5 ммоль/л глюкозы, 88,6% клеток были положительны по CXCR4, в то время как в средах, содержащих 25 ммоль/л глюкозы, эта доля составила 80%. Кроме того, в средах с высокой концентрацией глюкозы концентрация маркеров дифференциации сформированной эндодермы по результатам ОТ-ПЦР (SOX17) была снижена, а маркеров недифференцированных клеток (OCT4) или альтернативной дифференциации (CDX2) - повышена по сравнению со средами с низкой концентрацией глюкозы (фиг. 5). Этот эффект был по меньшей мере частично обусловлен рН среды, поскольку мы отметили снижение рН среды через 48 ч после 48 ч дифференциации на протяжении четырех дней дифференциации. Кроме того, чем выше был начальный и конечный рН питательной среды (8,1>pH>7,6) (фиг. 6) при получении сформированной эндодермы, тем более полной была конверсия в сформированную эндодерму.
В целом, наши результаты показывают, что исходная концентрация глюкозы (5,5 ммоль/л) в среде для дифференциации достаточна для получения популяции клеток, в которой более 80% клеток экспрессирует маркеры, характерные для линии сформированной эндодермы. Повышение концентрации глюкозы в среде для дифференциации до 10,5 ммоль/л достаточно для получения сходной популяции, однако повышение концентрации глюкозы свыше 10,5 ммоль/л может привести к усилению экспрессии маркеров плюрипотентности/меньшей дифференциации, например, CD9 или OCT4, или повышению экспрессии маркеров альтернативной дифференциации/экстраэмбриональной эктодермы, например, SOX7 или CDX2.
Пример 3
Роль контроля рН в дифференциации человеческих плюрипотентных клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы
Параллельно с этим клетки человеческой эмбриональной клеточной линии H1 (hES) после 46 пересевов (p46) высевали как клеточные колонии на чашки с субстратом МАТРИГЕЛЬ (разведение 1:30), соотношение культуры и свежей среды при пересеве составляло 1:3, для диссоциации клеток использовали диспазу (кат. № 17105-041, Invitrogen, Калифорния) и культивировали на чашках с MEF-CM с 20 нг/мл FGF2. Среды заменяли свежими средами MEF-CM с 20 нг/мл FGF2 до начала дифференциации в сформированную эндодерму (СЭ) описанным ниже способом:
a. Среда MCDB-131 (кат № 10372-019, Invitrogen, Калифорния) с добавлением 2% БСА без жирных кислот (кат. № 68700, Proliant, Айова), 1X ГлутаМакса™ (кат. № 35050-079, Invitrogen, Калифорния) и 100 нг/мл активина A (R&D Systems, Миннесота)+20 нг/мл WNT-3a (кат № 1324-WN-002, R&D Systems, Миннесота) в течение одних суток, затем использовали MCDB-131 с добавлением 2% БСА, Глутамакса и 100 нг/мл активина А ежедневно в течение дополнительных трех суток; или
b. среда MCDB131 с добавлением 0,0025 г/мл натрия бикарбоната (кат. № S3187, Sigma, Миссури) с добавлением 2% БСА без жирных кислот (кат. № 68700, Proliant, Айова), 1X ГлутаМакса™ (кат. № 35050-079, Invitrogen, Калифорния) и 100 нг/мл активина A (R&D Systems, Миннесота)+20 нг/мл WNT-3a (кат. № 1324-WN-002, R&D Systems, Миннесота) в течение суток, затем использовали MCDB-131 с добавлением 0,0025 г/мл натрия бикарбоната с 2% БСА, Глутамакса и 100 нг/мл активина A ежедневно в течение последующих трех суток.
На 4 день отбирали пробы для анализа методом флуоресцентной проточной цитометрии и анализа генной экспрессии методом ПЦР в реальном времени, а также подсчитывали клетки с помощью ViaCount® (Guava®, Millipore, Биллерика, Массачусетс). Как показано в примере 2, мы отметили, что относительно большая кислотность среды для дифференциации (<7,6 pH) может уменьшить экспрессию CXCR4 за счет менее направленной дифференциации и усиления альтернативной дифференциации.
Чтобы установить, обусловлен ли этот эффект рН, мы дифференцировали клетки на основной среде MCDB-131, содержавшей согласно описанию 1 г/л натрия бикарбоната, а также в среде DMEM с добавлением бикарбоната до концентрации 3,7 г/л. Мы отметили, что дифференциация, измеряемая по усиленной экспрессии маркеров клеточной поверхности CXCR4 и сниженной экспрессии CD9, была лучше в присутствии буферного агента. Среда MCDB-131 с концентрацией натрия бикарбоната 3,7 г/л в качестве буфера обеспечивала значительно более выраженную экспрессию CXCR4 и меньшую экспрессию CD9 в сравнении с клетками, дифференцированными на среде MCDB-131 с обычной концентрацией бикарбоната (1 г/л) (фиг. 7А и B). Это частично обусловлено тем, что среды MCDB-131 обладают рН 7,5, и добавление 2,7 г/л бикарбоната натрия повышает рН до 7,6.
Кроме того, в конце дифференциации среды (содержащие рН-индикатор феноловый красный) с культурами, выращенными на недифференцирующей среде, имели значительно более выраженную желтую окраску и более кислую реакцию, чем среды культур с дополнительным добавлением бикарбоната натрия, которые оставались красными. Эти результаты показывают, что повышение рН до 7,6 или более способствует более эффективной дифференциации эндодермы из плюрипотентных стволовых клеток, и что повышение и стабилизация рН среды возможна с помощью альтернативных буферных агентов, кроме бикарбоната, неограниченно включая повышение концентрации CO2 в инкубаторе или использование растворимых буферных систем, например, HEPES или фосфатного буфера.
Пример 4
Роль сред RPMI-1640 или MCDB-131 и членов надсемейства TGF-бета, активина A и GDF-8 в дифференциации человеческих плюрипотентных клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы
Клетки эмбриональной линии стволовых клеток H1 после 47 пересевов (р47) обрабатывали реактивом для диссоциации TrypLE (кат. № 12604-013, Invitrogen, Калифорния), высевали как отдельные клетки из суспензии 100000 кл./см2 на чашки с субстратом МАТРИГЕЛЬ® (разведение 1:30) и культивировали в среде, кондиционированной мышиными эмбриональными фибробластами (MEF-CM), с добавкой 20 нг/мл FGF2 (кат. № 100-18B, PeproTech, Нью Джерси) и 3 мкм Н-1152, глицила (Ингибитор Rho киназы, кат. № 555554, EMD chemicals, Гиббстаун, Нью Джерси).
Через 72 ч после посева культуры дифференцировали в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, описанным ниже способом:
a) Среда MCDB-131 (кат. № 10372-019, Invitrogen, Калифорния) с добавлением 0,0025 г/мл натрия бикарбоната (кат. № S3187, Sigma, Миссури) и 2% БСА без жирных кислот (кат. № 68700, Proliant, Айова), 1X Глутамакса™ (кат. № 35050-079, Invitrogen, Калифорния) и 100 нг/мл активина A (R&D Systems, Миннесота) + 20 нг/мл WNT-3a (кат. № 1324-WN-002, R&D Systems, Миннесота) в первые сутки, затем среда MCDB-131 с добавлением 0,0025 г/мл натрия бикарбоната, 2% БСА, Глутамакса и 100 нг/мл активина A в течение трех суток, или
b) Среда MCDB-131 (кат. № 10372-019, Invitrogen, Калифорния) с добавлением 0,0025 г/мл натрия бикарбоната (кат. № S3187, Sigma, Миссури), 2% БСА без жирных кислот (кат. № 68700, Proliant, Айова), 1X ГлутаМакса™ (кат. № 35050-079, Invitrogen, Калифорния) и 100 нг/мл GDF (R&D Systems, Миннесота)+2,5 мкмоль/л ингибитора GSK3B+2 нг/мл проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-она первые сутки, затем среда MCDB-131 с добавлением 0,0025 г/мл натрия бикарбоната, 2% БСА, Глутамакса и 100 нг/мл GDF-8 в течение трех суток, или
с) Среда MCDB-131 (Кат. № 10372-019, Invitrogen, Калифорния) с добавлением 0,0025 г/мл натрия бикарбоната (Кат. № S3187, Sigma, Миссури), 2% БА без жирных кислот (Кат. № 68700, Proliant, Айова), 1X Глутамакса™ (Кат. № 35050-079, Invitrogen, Калифорния) и 100 нг/мл GDF-8 (R&D Systems, Миннесота) в течение 4 суток, или
d). Среда RPMI-1640 (Кат. № 22400-105, Invitrogen, Калифорния) с добавлением 2% БСА без жирных кислот (кат. № 68700, Proliant, Айова) и 100 нг/мл активина A (R&D Systems, Миннесота)+20 нг/мл WNT-3a (Кат. № 1324-WN-002, R&D Systems, Миннесота) в течение одних суток, затем среда RPMI-1640 с добавкой 2% БСА и 100 нг/мл активина A ежедневно на протяжении трех суток.
е) Среда RPMI-1640 (Кат. № 22400-105, Invitrogen, Калифорния) с добавлением 2% БСА без жирных кислот (Кат. № 68700, Proliant, Айова) и 100 нг/мл GDF-8 (R&D Systems, Миннесота)+2,5 мкмоль/л ингибитора GSK3B 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он в течение одних суток, затем среда PMI-1640 с добавлением 2% БСА и 100 нг/мл GDF-8 ежедневно в течение трех дополнительных суток.
На 4 день отбирали пробы для анализа методом флуоресцентной проточной цитометрии и количественной ОТ-ПЦР. В таблице 2 показан процент клеток, экспрессирующих CXCR4, CD9 и CD99 (дополнительный маркер дифференциации). Дифференциация, измеряемая по усилению экспрессии маркера клеточной поверхности CXCR4, усиливалась при использовании сред MCDB-131 по сравнению с RPMI-1640, а экспрессия CXCR4 дополнительно усиливалась при использовании GDF-8 в сочетании с ингибитором GSK3B по сравнению с добавлением активина А и Wnt3a. Сходные результаты, показывающие усиление дифференциации при использовании сред MCDB-131 по сравнению со средами RPMI-1640, а также при использовании GDF-8 в сочетании с ингибитором GSK3B по сравнению с активином А и Wnt3a, получены при анализе гена MNX-1 методом количественной ОТ-ПЦР (фиг. 8). Кроме того, эти данные коррелируют со сниженной экспрессией CD9, клеточного маркера недифференцированных клеток, по результатам проточной цитометрии (таблица 2), или с OCT4 и CD9 по результатам измерения методом количественной ОТ-ПЦР (фиг. 8). Эти данные показывают, что эмбриональные стволовые клетки человека H1 эффективнее дифференцируются в присутствии среды MCDB-131, чем RPMI-1640, и что дифференциация в MCDB-131 может быть дополнительно улучшена в присутствии GDF-8 и ингибитора GSK3B по сравнению с активином A и Wnt3a.
Публикации, цитируемые в настоящем документе, полностью включаются в настоящий документ посредством ссылки. Хотя различные аспекты изобретения иллюстрируются выше ссылками на примеры и предпочтительные варианты осуществления, подразумевается, что область изобретения ограничивается не упомянутым выше описанием, а следующими пунктами формулы изобретения, составленными в соответствии с принципами патентного законодательства.

Изобретения касаются способов (варианты) формирования и дифференциации популяции клеток, в которой более 80% клеток популяции экспрессирует маркеры, характерные для линии сформированной эндодермы. Способ включает дифференциацию популяции эмбриональных стволовых клеток человека в среде DMEM или MCDB-131, содержащей активин А и лиганд Wnt, или GDF-8 и 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он, где концентрация глюкозы не превышает 10,5 ммоль/л, где эмбриональные стволовые клетки человека представляют собой клетки стабильных линий эмбриональных стволовых клеток человека, клетки стабильных линий эмбриональных зародышевых клеток человека, такие как клетки H1, клетки Н7, клетки Н9 или клетки BG01V. Изобретения могут быть использованы в лабораторной практике для создания in vitro функциональной экспрессирующей инсулин клетки, которая была бы более близка к β-клетке. 3 н. и 7 з.п. ф-лы, 9 ил., 2 табл., 4 пр.
1. Способ формирования популяции клеток, в которой более 80% клеток популяции экспрессирует маркеры, характерные для линии сформированной эндодермы, который включает дифференциацию популяции эмбриональных стволовых клеток человека в популяцию клеток, в которой более 80% клеток популяции экспрессирует маркеры, характерные для линии сформированной эндодермы, в среде DMEM или MCDB-131, содержащей активин А и лиганд Wnt, где концентрация глюкозы не превышает 10,5 ммоль/л, где эмбриональные стволовые клетки человека представляют собой клетки стабильных линий эмбриональных стволовых клеток человека, клетки стабильных линий эмбриональных зародышевых клеток человека, клетки H1, клетки Н7, клетки Н9 или клетки BG01V.
2. Способ формирования популяции клеток, в которой более 80% клеток популяции экспрессирует маркеры, характерные для линии сформированной эндодермы, который включает дифференциацию популяции эмбриональных стволовых клеток человека в популяцию клеток, в которой более 80% клеток популяции экспрессирует маркеры, характерные для линии сформированной эндодермы, в среде DMEM или MCDB-131, содержащей GDF-8 и 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он, где эмбриональные стволовые клетки человека представляют собой клетки стабильных линий эмбриональных стволовых клеток человека, клетки стабильных линий эмбриональных зародышевых клеток человека, клетки H1, клетки Н7, клетки Н9 или клетки BG01V.
3. Способ по п. 1, в котором маркеры, характерные для линии сформированной эндодермы, выбраны из группы, состоящей из SOX17, GATA4, HNF3 бета, GSC, CER1, Nodal, FGF8, Brachyury, Mix-подобный гомеобоксовый белок, FGF4 CD4 8, эомезодермин (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 и ОТХ2.
4. Способ по п. 1, в котором клетки, экспрессирующие маркеры, характерные для линии сформированной энтодермы, являются клетками сформированной энтодермы.
5. Способ дифференциации эмбриональных стволовых клеток человека в клетки сформированной эндодермы, включающий культивирование эмбриональных стволовых клеток человека в среде DMEM или MCDB-131, дополненной (1) активином А и лигандом Wnt или (2), GDF-8 и 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-оном, где концентрация глюкозы не превышает 10,5 ммоль/л, где эмбриональные стволовые клетки человека представляют собой клетки стабильных линий эмбриональных стволовых клеток человека, клетки стабильных линий эмбриональных зародышевых клеток человека, клетки H1, клетки Н7, клетки Н9 или клетки BG01V.
6. Способ по любому из пп. 1-5, отличающийся тем, что концентрация глюкозы не превышает 5,5 ммоль/л.
7. Способ по любому из пп. 1-5, отличающийся тем, что способ дополнительно включает культивирование эмбриональных стволовых клеток человека до дифференцировки.
8. Способ по любому из пп. 1-5, отличающийся тем, что среда обладает рН 7,6 или выше.
9. Способ по п. 2, в котором маркеры, характерные для линии сформированной эндодермы, выбраны из группы, состоящей из SOX17, GATA4, HNF3 бета, GSC, CER1, Nodal, FGF8, Brachyury, Mix-подобный гомеобоксовый белок, FGF4 CD48, эомезодермин (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 и ОТХ2.
10. Способ по п. 2, в котором клетки, экспрессирующие маркеры, характерные для линии сформированной энтодермы, являются клетками сформированной энтодермы.
| US 20050158853 A1, 21.07.2005 | |||
| KR 1020080020098 A,, 05.03.2008 | |||
| US 20070254359 A1, 01.11.2007 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА (ВАРИАНТЫ) | 2008 |
|
RU2359030C1 |
Авторы
Даты
2017-05-30—Публикация
2011-08-17—Подача