Изобретение относится к области медицины и фармацевтической промышленности и касается способа получения и выделения биологически активного соединения - эремомицина для использования в качестве антибиотика.
Антибиотик эремомицин относится к группе полициклических гликопептидов (далгапептидов), в которую входят антибиотики ристомицин (ристоцетин), актиноидин, ванкомицин, тейкопланин, авопарцин [1].
Эремомицин эффективен при лечении заболеваний, вызываемых грамположительными возбудителями включая метициллинрезистентные штаммы золотистого стафилококка (MRSA) и анаэроба Clostridium difficile - возбудителя псевдомембранного колита.
Эремомицин обладает более высокой химиотерапевтической активностью, чем известные антибиотики этой группы, и в 2-3,5 раза меньшей токсичностью. Эремомицин в 2-4 раза более активен в отношении метициллин-устойчивых штаммов стафилококка (MRSA), различных штаммов стрептококка, а также анаэробных грамположительных бактерий - клостидий и кокков, и в отличие от ванкомицина эремомицин не обладает местно-раздражающим действием и поэтому может вводиться не только внутривенно, но и внутримышечно [2].
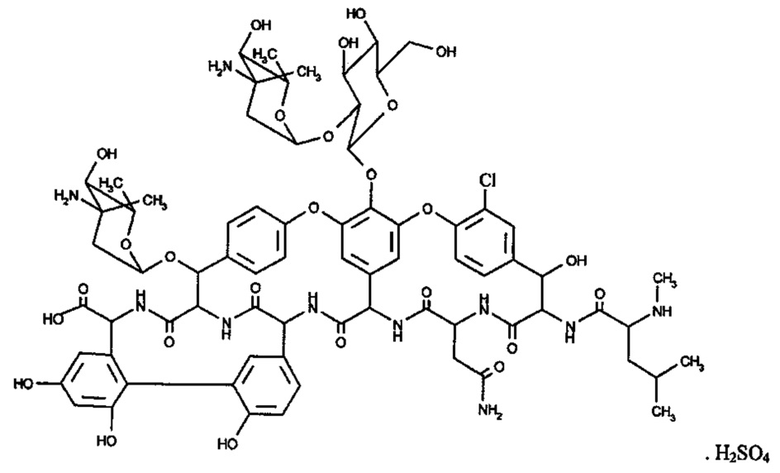
Эремомицин сульфат
С 1997 года известен (Авторское свид. 1475150) антибиотик и способ получения антибиотика эремомицина, заключающийся в том, что культуру продуцента Nocardia orientalis штамма ИНА 238 выращивают на питательной среде, содержащей источники углерода, органические и неорганические источники азота и минеральные соли, далее полученный нативный раствор собирают на смоле Амберлит ХАД-2 и целевой продукт элюируют смесью ацетон н-бутанол вода, взятых в соотношении 1:1:1 при рН 3, а затем осаждают целевой продукт из водного концентрата избытком ацетона и очищают хроматографически при рН 6,5 на карбоксильной смоле КБ-2 (NH+4) 0,5 н раствором аммиака, далее осаждают антибиотик ацетоном и кристаллизуют из водного этанола [3].
Недостатком данного штамма является низкий уровень содержания антибиотика в культуральной жидкости (не более 150 мг эремомицина на 1 л культуральной жидкости). Выход целевого продукта - эремомицина основания 35-37% от содержания в нативном растворе, чистота препарата 86,0-87,0%.
В патенте RU 2110578 описывается получение антибиотика с использованием штамма ΒΚΜΠ-S 892, обладающего повышенной продуктивностью эремомицина (1800 мг в 1 л культуральной жидкости (КЖ)). Способ получения антибиотика эремомицина путем биосинтеза штамма-продуцента, сорбции нативного раствора, элюции антибиотика с последующим его выделением, концентрацией и кристаллизацией, отличающийся тем, что в качестве продуцента используют штамм Amycolatopsis orientalis subsp. eremomycini ΒКΠΜ-S 892, сорбцию проводят на карбоксильном катионите КБ-2 в солевой форме, элюируют раствором аммиака, элюат нейтрализуют, обеззоливают, пропускают через сорбент ПТФЭ, антибиотик с сорбента вытесняют водой, концентрируют до содержания антибиотика 120-140 мг/мл и кристаллизуют в форме сульфата. Выход очищенного кристаллического препарата эремомицина сульфата от содержания в нативном растворе составляет 60,0-65,0%, чистота целевого продукта 97,0% (метод ВЭЖХ) [4].
Наиболее близким к заявляемому изобретению является способ получения эремомицина, описанный в патенте RU 2352631 С2. Штамм ВКПМ-АС 807 - продуцент антибиотика эремомицина, имеющий уровень антибиотической активности - 2300 мг/л эремомицина в ферментационной жидкости, определенный методом диффузии в агар, используется для получения эремомицина.
С целью выделения эремомицина проводят его сорбцию из нативного раствора (отфильтрованной от мицелия культуральной жидкости) на карбоксильном катионите КБ-2 в солевой форме, элюируют раствором аммиака, элюат нейтрализуют, обеззоливают, пропускают через сорбент ПТФЭ, антибиотик с сорбента вытесняют водой, концентрируют в вакууме до содержания эремомицина (120-140) мг/мл и кристаллизуют в форме сульфата. Выход эремомицина составляет 1200 мг с 1 литра нативного раствора [5].
Многостадийность процесса усложняет реализацию способа в условиях производства.
Задачей настоящего изобретения являлось создание нового продуцента антибиотика с высокой продуктивностью и оптимального способа выделения и очистки эремомицина.
Получен новый штамм - продуцент эремомицина штамм Amycolatopsis orientalis ТЛ-1.
Штамм получен путем многоступенчатой селекции с применением мутагенных факторов и направленных методов отбора модификантов известного штамма Amycolatopsis orientalis ВКПМ Ас-807. В качестве мутагенного фактора были использованы УФ-лучи с длиной волны 254 нм (лампа Mineralight, мощность 12,5 Вт). Водную суспензию спор помещали на расстоянии 40 см от лампы, при этом интенсивность излучения лампы составляла 0,25 мВт/см2. Высокопродуктивный штамм был выделен после облучения исходной культуры в течение 15 минут.
Продуктивность штамма Amycolatopsis orientalis ТЛ-1 определялась методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Диапазон продуктивности штамма, зависящий от условий культивирования, составляет 3300-3900 мг в 1 л КЖ. Полученный новый штамм депонирован во Всероссийской коллекции культур Федерального государственного бюджетного учреждения науки Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина Российской академии наук под номером VKM Ac-2717D согласно правилам международного депонирования по правилам Будапештского договора.
Штамм VKM Ac-2717D обладает повышенной продуктивностью эремомицина (3300-3900 мг в 1 л КЖ).
Культурально-морфологические признаки штамма VKM Ac-2717D. Температура 28°С; длительность выращивания 5-7 суток.
Морфологические признаки. Гифы воздушного мицелия прямые или слегка извилистые, распадающиеся на фрагменты различной длины; поверхность спор гладкая.
Физиолого-биохимические свойства. Аэроб. Растет при (24-37)°С, оптимум роста 28°С и в диапазоне значений рН (6,0-9,0) с оптимумом роста при рН 7,5; желатину разжижает, молоко пептонизирует. Сахарозу инвертирует. Крахмал гидролизует. На клетчатке не растет. Восстанавливает нитраты до нитритов. Меланоидные пигменты не образует при росте на среде Треснера с лимоннокислым железом.
Использование источников углерода. Хорошо утилизирует глюкозу, фруктозу, лактозу, сахарозу, рамнозу, ксилозу, рибозу, арабинозу, маннит, мальтозу; не утилизирует рафинозу, сорбит, маннозу, целлюлозу.
Антагонистические свойства
Штамм Amycolatopsis orientalis VKM Ac-2717D при росте на агаровых средах угнетает рост грамположительных бактерий Staphylococcus aureus, Bacillus subtilis, Bacillus mycoides, Micrococcus luteus и не действует на грамотрицательные бактерии Escherichia coli, Comamonas terrigena, Providencia stuartii.
ПИТАТЕЛЬНЫЕ СРЕДЫ
Агаризованная питательная среда
Для поддержания, хранения и приготовления посевного материала культуры используется агаризованная среда состава, %: глюкоза - 2,0; соевый пептон - 1,5; дрожжевой экстракт - 0,1; агар - 2,0; рН - 7,0-7,2.
Вегетативная питательная среда

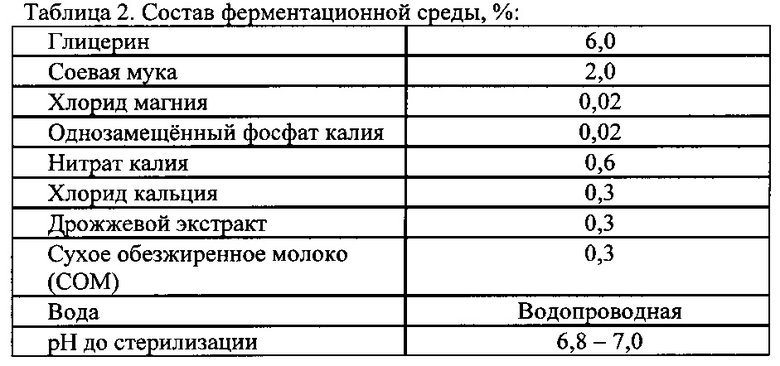
Ферментационная питательная среда
Хранение культуры
Штамм Amycolatopsis orientalis VKM Ac-2717D хранят на агаризованной среде состава, %: глюкоза - 2,0; соевый пептон - 1,5; дрожжевой экстракт - 0,1; агар - 2,0; рН - 7,0-7,2 не более трех месяцев при температуре около 5°С в холодильной камере. Для длительного хранения культуру лиофилизируют или хранят в жидком глицерине при - 70°С.
Поддержание культуры
Культуру продуцента эремомицина Amycolatopsis orientalis VKM Ас-2717D поддерживают на синтетической среде Эмерсона, состава, %: мясной экстракт - 0,4; дрожжевой экстракт - 0,1; мясной пептон - 0,4; глюкоза - 1,0; NaCl - 0,25; агар - 2,0 рН=7,0-7,2. Для поддержания уровня продуктивности культуры, перед каждым пересевом ее на свежие питательные среды, проводят моноспоровый рассев на чашки Петри.
Выращивание культуры продуцента в чашках Петри проводят в течение 10-14 суток при температуре 28°С.
Для пересева на чашки Петри отбирают от 20 до 30 типичных колоний продуцента.
Таким образом, создан новый мутантный штамм Amycolatopsis orientalis VKM Ac-2717D, отличающийся от известного по характеру роста на диагностических агаровых средах, по степени усвоения источников углерода (сахароза, инозит, галактоза) и по продуктивности, которая на 30% превосходит продуктивность штамма-прототипа Amycolatopsis orientalis ВКПМ - Ас-807. Продуктивность нового штамма Amycolatopsis orientalis VKM Ac-2717D, определенная методом ВЭЖХ, составляет 3300-3900 мг в 1 л культуральной жидкости, в зависимости от условий культивирования, что значительно превосходит продуктивность известных штаммов продуцентов эремомицина. Использование нового штамма Amycolatopsis orientalis VKM Ac-2717D, как продуцента для биосинтеза эремомицина, позволяет значительно увеличить выход целевого продукта в культуральной жидкости. Кроме этого, авторами проведено успешное масштабирование процесса биосинтеза и тем самым продемонстрирована возможность проведения процесса биосинтеза в промышленном масштабе.
Согласно настоящему изобретению предлагается следующий способ выделения и очистки препарата.
Эмпирическим путем были подобраны гелевые полиакриловые слабокислотные сорбенты Пьюролайт С104 и С106 в Н+-форме, которые добавляют прямо в культуральную жидкость и которые позволяют очень избирательно сорбировать антибиотик из культуральной жидкости. Сорбент способен работать при повышенных температурах (это позволяет не проводить охлаждения культуральной жидкости) и понижает уровень рН, что также позволяет сократить еще одну операцию при обработке культуральной жидкости. Сорбент способствует практически полному устранению сопутствующих целевому продукту примесей - минорных компонентов, пигментов, продуктов белкового характера, солей и др., которые остаются в культуральной жидкости. Затем сорбент отделяют от культуральной жидкости, тщательно отмывают водой и десорбируют антибиотик раствором аммиака, элюат нейтрализуют, концентрируют до 2/3 первоначального объема и кристаллизуют в форме сульфата. Получают эремомицин сульфат с выходом 75-80% (от содержания в культуральной жидкости) с содержанием основного вещества не менее 98%.
Предложенный способ позволяет существенно упростить выделение и очистку целевого продукта при сохранении высокого выхода и качества препарата (существующие способы, описанные выше, предполагают проведение как минимум 15 операций по выделению и очистке антибиотика, а предлагаемый способ только 7).
Изобретение поясняется следующими примерами.
Пример 1
Биосинтез эремомицина в ферментере объемом 15 литров.
Подготовка посевного материала.
Для приготовления посевного материала в чашках Петри используют агаризованную среду состава, %: глюкоза - 2,0; соевый пептон - 1,5; дрожжевой экстракт - 0,1; агар - 2,0; рН=7,0 до стерилизации.
Проверенную агаризованную среду засевают мицелием исходной посевной культуры, полученной моноспоровым рассевом, и выдерживают в термостате от 5 до 7 суток, при температуре 28°С. Культура на чашках должна давать сплошной газон, поверхность складчатая, мицелий бежевого цвета.
Выращивание посевного материала.
Выращивание посевного материала в колбах проводят в одну стадию на вегетативной среде, %: соевая мука - 0,5, глицерин - 3,0, калий азотнокислый - 1,0, натрия хлорид - 1,0, магний сернокислый - 0,01, вода водопроводная до 1 л, рН 7,0 до стерилизации.
Мицелием культуры Amycolatopsis orientalis VKM Ac-2717D, после инкубации в течение 5-7 суток при 28°С на агаризованной среде состава, %: глюкоза - 2,0; соевый пептон - 1,5; дрожжевой экстракт - 0,1; агар - 2,0, засевают питательную среду (100 мл в колбах Эрленмейера объемом 1,0 л), и выращивают при 28°С в течение 24-48 часов на термостатируемой качалочной установке при 230-250 об/мин (эксцентриситет 5 см). При микроскопии наблюдается негустая базофильная сетка, протоплазма в гифах дифференцирована.
Биосинтез эремомицина.
В ферментер заливают питьевую воду и при перемешивании загружают навески всех компонентов, %: глицерин - 6,0; соевая мука - 2,0; калий фосфорнокислый однозамещенный - 0,02; хлорид магния - 0,02; нитрат калия - 0,6; хлорид кальция - 0,3; дрожжевой экстракт - 0,3; СОМ - 0,3. Доводят объем среды питьевой водой до 9 литров.
В качестве дополнительного источника углеводов используется глицерин, в количестве 5 г/л среды в сутки. Подпитку глицерина вносят на 2-е, 3-е и 4-е сутки культивирования.
В питательной среде создают рН (7,0±0,2) с помощью 20%-го раствора едкого натра и стерилизуют в течение часа. После стерилизации ферментер со средой охлаждают до 29-30°С. Среда должна быть стерильна и иметь рН (7,6±0,3).
Посев ферментера осуществляют в асептических условиях, при этом количество посевного материала составляет 10% от объема среды в ферментере. После засева ферментера температуру культуральной жидкости поддерживают на уровне 28±1°С.
В ферментер непрерывно подают стерильный воздух в количестве 300-600 л/час. Перемешивание со скоростью 100-500 об/мин. Концентрация растворенного кислорода поддерживается на уровне 50%.
Время ферментации 144-168 часов.
Начиная с 72 часов роста ведут контроль содержания эремомицина методом ВЭЖХ. При максимальном накоплении эремомицина на 6-7 сутки процесс ферментации прекращают.
К концу биосинтеза (144±24 часа) культуральная жидкость имеет значение рН 8,3±0,25.
Содержание эремомицина не менее 3300 мг/л (ВЭЖХ).
Микроскопическое описание мицелия: в препарате, окрашенном метиленовым синим, наблюдаются короткие, слабоветвящиеся, членистые, базофильные гифы.
Пример 2
Биосинтез эремомицина в ферментере объемом 100 литров.
Подготовка посевного материала.
Для приготовления посевного материала в чашках Петри используют агаризованную среду состава, %: глюкоза - 2,0; соевый пептон - 1,5; дрожжевой экстракт - 0,1; агар - 2,0; рН=7,0 до стерилизации.
Проверенную агаризованную среду засевают мицелием исходной посевной культуры, полученной моноспоровым рассевом, и выдерживают в термостате от 5 до 7 суток при температуре 28°С. Культура на чашках должна давать сплошной газон, поверхность складчатая, мицелий бежевого цвета.
Выращивание посевного материала 1 генерации.
Выращивание посевного материала в колбах проводят в одну стадию на вегетативной среде, %: соевая мука - 0,5, глицерин - 3,0, калий азотнокислый - 1,0, натрия хлорид - 1,0, магний сернокислый - 0,01, вода водопроводная до 1 л, рН 7,0 до стерилизации.
Мицелием культуры Amycolatopsis orientalis VKMAc-2717D, после инкубации в течение 5-7 суток при 28°С на агаризованной среде состава, %: глюкоза - 2,0; соевый пептон - 1,5; дрожжевой экстракт - 0,1; агар - 2,0, засевают питательную среду (100 мл в колбах Эрленмейера объемом 1,0 л), и выращивают при 28°С в течение 24-48 часов на термостатируемой качалочной установке при (230-250) об/мин (эксцентриситет 5 см). При микроскопии наблюдается негустая базофильная сетка, протоплазма в гифах дифференцирована. Посторонняя микрофлора в посевном материале должна отсутствовать.
Выращивание посевного материала 2 генерации.
В ферментер заливают 2,0 л питьевой воды и при перемешивании загружают навески всех компонентов, %: соевая мука - 0,5, глицерин - 3,0, калий азотнокислый - 1,0, натрия хлорид - 1,0, магний сернокислый - 0,01. Доводят объем среды питьевой водой до 6 литров.
В питательной среде создают рН (7,2±0,1) с помощью 20%-го раствора едкого натра и стерилизуют в течение часа. После стерилизации ферментер со средой охлаждают до 29-30°С. Среда должна быть стерильна и иметь рН (7,2±0,3).
Посев ферментера осуществляют в асептических условиях, при этом количество посевного материала составляет 10% от объема среды в ферментере. После засева ферментера температуру культуральной жидкости поддерживают на уровне 28±1°С.
В ферментер непрерывно подают стерильный воздух в количестве 210 л/час. Перемешивание со скоростью 250 об/мин. Концентрация растворенного кислорода поддерживается на уровне 50%. Время ферментации 12-24 часов.
Биосинтез эремомицина.
Ферментационную среду состава, %: глицерин - 6,0; соевая мука - 2,0; калий фосфорнокислый однозамещенный - 0,02; хлорид магния - 0,02; нитрат калия - 0,6; хлорид кальция - 0,3; дрожжевой экстракт - 0,3; СОМ - 0,3, растворяют в 10 л горячей водопроводной воды в ферментере и доводят объем до 60 литров.
В качестве дополнительного источника углеводов используется глицерин, в количестве 5 г/л среды в сутки. В качестве дополнительного источника азота используют дрожжевой экстракт, в количестве 3 г/л среды в сутки. Подпитку глицерина и дрожжевого экстракта вносят на 2-е, 3-е и 4-е сутки культивирования.
В питательной среде создают рН (7,0±0,2) с помощью 20%-го раствора едкого натра и стерилизуют в течение часа. После стерилизации ферментер со средой охлаждают до 29-30°С. Среда должна быть стерильна и иметь рН (7,6±0,3).
Посев ферментера осуществляют в асептических условиях, при этом количество посевного материала составляет 10% от объема среды в ферментере. После засева ферментера температуру культуральной жидкости поддерживают на уровне 28±1°С.
В ферментер непрерывно подают стерильный воздух в количестве 2,1-4,2 м3/час. Перемешивание со скоростью 100-350 об/мин. Концентрация растворенного кислорода поддерживается на уровне 50%. Время ферментации 144-168 часов.
Начиная с 72 часов роста ведут контроль содержания эремомицина методом ВЭЖХ. При максимальном накоплении эремомицина на 6-7 сутки процесс ферментации прекращают.
К концу биосинтеза (144±24) часа культуральная жидкость имеет следующие показатели:
рН достигает значения (8,3±0,25);
содержание эремомицина не менее 3900 мг в 1 л культуральной жидкости (ВЭЖХ).
Микроскопическое описание мицелия: в препарате, окрашенном метиленовым синим, наблюдаются короткие, слабоветвящиеся, членистые, базофильные гифы.
Пример 3
Сорбция на катионите С104 в Н+ -форме.
К культуральной жидкости объемом 10 л (содержание эремомицина 3300 мг/л) добавляют в один прием 150 г слабокислотного катионита Purolite С104 в Н+ -форме (далее по тексту - катионит), перемешивают суспензию в течение 1,5 часов и отбирают пробу для определения остаточного содержания эремомицина в культуральной жидкости (ВЭЖХ). При отсутствии эремомицина в отобранной пробе перемешивание останавливают и отделяют катионит от культуральной жидкости. Катионит тщательно трижды промывают водой. Затем к отмытому таким образом катиониту добавляют 600 мл воды и при интенсивном перемешивании по каплям добавляют аммиак до рН 9. Отфильтровывают смолу и повторно обрабатывают ее так, как описано выше. Фильтраты, полученные после первой и второй обработки, объединяют и концентрируют в вакууме при температуре 29-34°С до 2/3 исходного объема, а затем нейтрализуют 40%-ным раствором серной кислоты до рН 6,9.
Из полученного концентрата эремомицин кристаллизуют в форме сульфата при добавлении двухкратного объема изопропилового спирта, охлаждают до 8-10°С и выдерживают в течение 2 часов. Затем фильтруют, промывают на фильтре небольшим количеством изопропилового спирта и сушат в вакууме при 30°С в течение 6 часов. Получают 28 г эремомицина сульфата. Выход целевого продукта от содержания в культуральной жидкости составляет 80% (содержание основного вещества не менее 98%)
Пример 4
Сорбция на катионите С106 в Н+ -форме.
Обработка проводится аналогично примеру 3 при использовании сорбента Purolite С106 в Н+ -форме.
Получают 26,9 г эремомицина сульфата. Выход целевого продукта от содержания в культуральной жидкости составляет 77% (содержание основного вещества 98%).
Источники информации
1. Van Bambeke F., Van Laethem Y., Courvalin P., Tulkens P.M. Glycopeptide antibiotics: from conventional molecules to new derivatives. // Drugs. - 2004. - V. 64. - P. 913-936.
2. Gause G.F., Brazhnikova M.G., Lomakina N.N., Berdnikova T.F., Fedorova G.B., Tokareva N.L., Borisova V.N., Batta G. Eremomycin - new glycopeptide antibiotics. Chemical properties and structure. J. Antibiotics, 1989, V. 42, P. 1790-1799.
3. Гаузе Г.Ф., Преображенская Т.П., Лайко А.В., Селезнева Т.И., Свешникова М.А., Бражникова М.Г. Антибиотик "эремомицин" и способ его получения. Авторское свидетельство РФ №1475150, 06.02.1981.
4. Бражникова М.Г., Лайко А.В., Федорова Г.Б., Преображенская Т.П., Свешникова М.А., Лапчинская О.А., Сабурова Т.П., Погожева В.В. Штамм Amycolatopsis orientalis subsp. eremomycini ВКПМ S-892 - продуцент антибиотика эремомицина и способ получения антибиотика эремомицина. Патент РФ №2110578, 18.06.1997.
5. Лапчинская О.А., Федорова Г.Б., Погожева В.В., Преображенская М.Н., Катруха Г.С, Пономаренко В.И. Штамм Amycolatopsis orientalis ВКПМ-Ас-807-продуцент эремомицина. Патент РФ №2352631, 26.03.2007.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ Amycolatopsis orientalis ВКПМ-Ас-807-ПРОДУЦЕНТ ЭРЕМОМИЦИНА | 2007 |
|
RU2352631C2 |
| ШТАММ AMYCOLATOPSIS ORIENTALIS SUBSP. EREMOMYCINI ВКПМ-S892 - ПРОДУЦЕНТ АНТИБИОТИКА ЭРЕМОМИЦИНА И СПОСОБ ПОЛУЧЕНИЯ АНТИБИОТИКА ЭРЕМОМИЦИНА | 1997 |
|
RU2110578C1 |
| Штамм Amycolatopsis umgeniensis - продуцент антибиотика эремомицина | 2018 |
|
RU2689699C1 |
| ШТАММ STREPTOMYCES TSUKUBENSIS - ПРОДУЦЕНТ ТАКРОЛИМУСА И СПОСОБ ПОЛУЧЕНИЯ ТАКРОЛИМУСА | 2018 |
|
RU2686779C1 |
| НОВЫЙ ШТАММ-ПРОДУЦЕНТ ВАНКОМИЦИНА AMYCOLATOPSIS KERATINIPHILA | 2023 |
|
RU2801749C1 |
| НОВЫЙ ШТАММ - ПРОДУЦЕНТ ВАНКОМИЦИНА AMYCOLATOPSIS JAPONICA | 2022 |
|
RU2788348C1 |
| Штамм Streptomyces virginiae - продуцент вирджиниамицина и способ получения вирджиниамицина | 2016 |
|
RU2637857C1 |
| ШТАММ STREPTOMYCES HYGROSCOPICUS BKM AC-2737D - ПРОДУЦЕНТ АНТИБИОТИКА РАПАМИЦИНА И СПОСОБ УВЕЛИЧЕНИЯ ЕГО ПРОДУКТИВНОСТИ | 2018 |
|
RU2679051C1 |
| НОВЫЙ ШТАММ-ПРОДУЦЕНТ ХЛОРЭРЕМОМИЦИНА KIBDELOSPORANGIUM ARIDUM | 2022 |
|
RU2788347C1 |
| Штамм Amycolatopsis orientalis - продуцент антибиотика диметилванкомицина и способ получения антибиотика | 2016 |
|
RU2633511C1 |
Группа изобретений относится к биотехнологии и может быть использована для производства антибиотика эремомицина. Предложены штамм Amycolatopsis orientalis и способ получения антибиотика эремомицина. Штамм Amycolatopsis orientalis, обладающий высокой продуктивностью антибиотика эремомицина, депонирован во Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН под регистрационным номером VKMAc-2717D. Способ получения антибиотика эремомицина включает сорбцию антибиотика из культуральной жидкости на карбоксильный катионит Пьюролайт С104 или С106 в Н+-форме, элюирирование антибиотика раствором аммиака, концентрирование элюата с последующей нейтрализацией и кристаллизацией в форме сульфата путем высаживания изопропанолом. Группа изобретений обеспечивает высокий выход целевого продукта. 2 н.п. ф-лы, 2 табл., 4 пр.
1. Штамм Amycolatopsis orientalis VKMAc-2717D - продуцент антибиотика эремомицина.
2. Способ получения антибиотика эремомицина путем биосинтеза штамма-продуцента, сорбции и элюции антибиотика с последующей концентрацией элюата до 2/3 первоначального объема с последующей нейтрализацией и кристаллизацией в форме сульфата путем высаживания изопропанолом, отличающийся тем, что в качестве продуцента антибиотика используют штамм Amycolatopsis orientalis VKMAc-2717D, сорбцию проводят из культуральной жидкости карбоксильным катионитом Пьюролайт С104 или С106 в H+-форме.
| ШТАММ Amycolatopsis orientalis ВКПМ-Ас-807-ПРОДУЦЕНТ ЭРЕМОМИЦИНА | 2007 |
|
RU2352631C2 |
| EP 1959006 A1, 20.08.2008 | |||
| ХРОМАТОГРАФИЧЕСКИЙ СПОСОБ ОЧИСТКИ ЭРЕМОМИЦИНА | 2006 |
|
RU2333963C1 |
Авторы
Даты
2017-06-07—Публикация
2016-04-12—Подача