Настоящая заявка в целом относится к медицинской визуализации. Она находит конкретное применение в сочетании с идентификацией конкретных тканей организма и описана с конкретной ссылкой на нее. Однако, следует понимать, что она также находит применение в других сценариях использования и необязательно ограничена указанным выше применением.
Количественное определение серой зоны является важным в некоторых клинических применениях. В новой медицинской литературе сообщают о том, что размеры нездоровых типов тканей, таких как инфаркт и серая зона, являются предикторами инфаркта миокарда (ИМ). Например, «у пациентов с предшествующим ИМ протяженность периинфарктной зоны, охарактеризованной с помощью сердечного магнитного резонанса, предоставляет инкрементное прогностическое значение, помимо индекса систолического объема левого желудочка или фракции изгнания. Характеристики инфаркта с помощью CMR могут оказаться уникальным и значимым неинвазивным предиктором смертности после ИМ» [Circulation 2006; 114:32-29]. Серая зона включает в себя периинфаркт и гетерогенный инфаркт. Также «Гетерогенность ткани имеет место и поддается количественному определению при инфаркте человека. Более экстенсивная гетерогенность ткани коррелирует с увеличенной желудочковой раздражимостью посредством запрограммированной электрической стимуляции. Эти находки подтверждают гипотезу о том, что анатомическая гетерогенность ткани увеличивает подверженность желудочковым аритмиям у пациентов с предшествующим инфарктом миокарда и дисфункции левого желудочка» [Circulation 2007; 115:2006-2014]. Наконец, «гетерогенность ткани инфаркта на контрастно усиленной МРТ является самым мощным предиктором самопроизвольной желудочковой аритмии с последующей терапией имплантируемым кардиовертерным дефибриллятором (в качестве заменителя внезапной сердечной смерти) среди других клинических и МРТ переменных, то есть полного размера инфаркта и функции и объемов левого желудочка, у пациентов с предыдущим инфарктом миокарда» [Circulation 2009. 2:183-190].
Предыдущие попытки были сфокусированы на увеличении контраста нездоровой ткани на изображении и сегментировании области посредством мануального очерчивания для того, чтобы измерять объем, или посредством полуавтоматической сегментации на основе интенсивности сигнала единичных изображений. Усилению контраста недостает точности, поскольку вовлечено множество типов тканей, и происходит перекрытие контраста типов здоровой ткани и нездоровой ткани, такой как инфаркт и серая зона. Необходимо множество настроек контраста, что делает задачу сегментации или идентификации нездоровой ткани трудоемкой при мануальном очерчивании конкретного типа ткани для измерения.
Кроме того, множество изображений содержат множество модальностей, машин, калибровок катушки, настроек и т.п. Использование различных способов сопоставления между одним и другим изображением для того, чтобы усилить контраст областей, вносит ошибку из-за различий, таких как калибровки катушек, конкретные настройки и т.п. Например, в одном способе используется количественное определение на основе изображений интенсивности сигнала и T1 карт. Чувствительности катушек в этом способе оказывают влияние на изображения, и они не дают дополнительного контраста для T1 карты.
Типично магнитно-резонансные методики оценивают область с использованием традиционной МР поздно усиливающей последовательности сканирования, такой как градиентное эхо с инверсионным восстановлением (IR-GE). Эта последовательность восприимчива к движению сердца и требует точного времени инверсии (TI) для того, чтобы отдельно идентифицировать шрамы или инфаркт, серую зону и здоровый миокард. Точная идентификация различных типов ткани требует времени. Оптимальное TI варьируется от пациента к пациенту и также варьируется вместе со временем, прошедшим между инъекцией контрастного агента и получением изображения. Оптимальное время инверсии наступает, когда сигналы от здорового миокарда являются нулевыми и кажутся черными, а области инфаркта являются светлыми (выглядят белыми), с серой зоной между ними. Мануально очерчиваются эндокард и кровь, которые могут быть неясными там, где на границе эндокарда и крови есть шрам. Анализ изображения для сегментации на основе интенсивности сигнала классифицирует серую зону между шрамом и здоровым миокардом. Интенсивность сигнала от пула крови очень близка к ткани инфаркта из-за распределения контрастного агента. Шум в миокарде может иметь значительное влияние на сегментацию и может быть спутан с серой зоной.
В настоящей заявке раскрыто новое и улучшенное автоматизированное обнаружение областей риска, которое направлено на упомянутые выше и другие вопросы.
В соответствии с одним аспектом система медицинской визуализации содержит хранилище данных, модуль кластеризации и устройство отображения. Хранилище данных содержит первый набор данных визуализации и второй набор данных визуализации, причем каждый набор данных создан с использованием одного и того же устройства визуализации и одного и того же измеренного значения. Измеренные значения первого и второго типов ткани перекрываются в первом наборе данных визуализации. Измеренные значения второго и третьего типов ткани перекрываются во втором наборе данных. Наборы данных являются взаимно совмещаемыми, а внешнее событие меняет измеренное значение второго набора данных. Модуль кластеризации классифицирует тип ткани на основе нечеткой кластеризации измеренного значения первого набора данных и измеренного значения второго набора данных для каждого местоположения. Устройство отображения отображает медицинское изображение, на котором контрастно сопоставлен каждый классифицированный тип ткани.
В соответствии с другим аспектом способ медицинской визуализации включает в себя получение первого медицинского изображения и, после внешнего события, получение второго медицинского изображения, которое содержит то же измеренное значение с того же устройства медицинской визуализации, что и первое медицинское изображение. Внешнее событие изменяет измеренное значение. Изображения являются взаимно совмещаемыми. Тип ткани классифицируется в каждом местоположении с использованием нечеткой кластеризации на основе измеренного значения первого медицинского изображения и измеренного значения второго медицинского изображения. Диагностическое медицинское изображение отображается с контрастом, показывающим классифицированные типы тканей.
В соответствии с другим аспектом система медицинской визуализации содержит хранилище данных, модуль кластеризации и сегментатор. Хранилище данных содержит первый набор данных визуализации и второй набор данных визуализации, причем каждый набор данных создан с использованием одного и того же устройства и одного и того же измеренного значения. Наборы данных являются взаимно совмещаемыми, а внешнее событие меняет измеренное значение второго набора данных. Модуль кластеризации классифицирует тип ткани на основе нечеткой кластеризации измеренного значения первого набора данных и измеренного значения второго набора данных для каждого местоположения. Сегментатор вычисляет измерение объема для каждой классифицированной рисковой ткани.
Одно преимущество включает в себя идентификацию и измерение ткани серой зоны.
Другое преимущество включает в себя независимость от чувствительностей катушек.
Другое преимущество заключается в сниженной зависимости от точного хронирования введения контраста.
Другое преимущество заключается в автоматизированной классификации типов тканей.
Другое преимущество включает легкость и скорость, с которыми классифицируются типы тканей и вычисляются объемы.
При этом дополнительные преимущества настоящей заявки оценят обычные специалисты в данной области после прочтения и осмысления следующего подробного описания.
Изобретение может принимать форму различных компонентов и компоновок компонентов и различных этапов и компоновок этапов. Чертежи служат только цели иллюстрирования предпочтительных вариантов осуществления, и их не следует толковать в качестве ограничения изобретения.
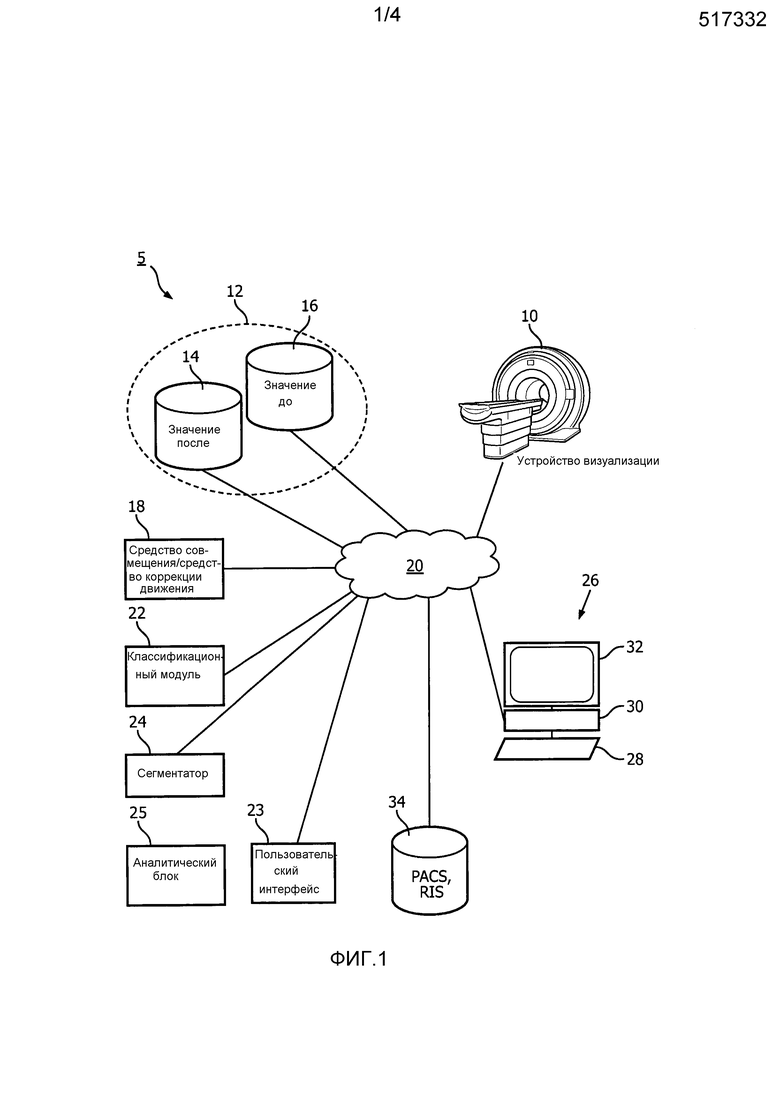
На фиг. 1 схематически проиллюстрирован вариант осуществления системы медицинской визуализации.
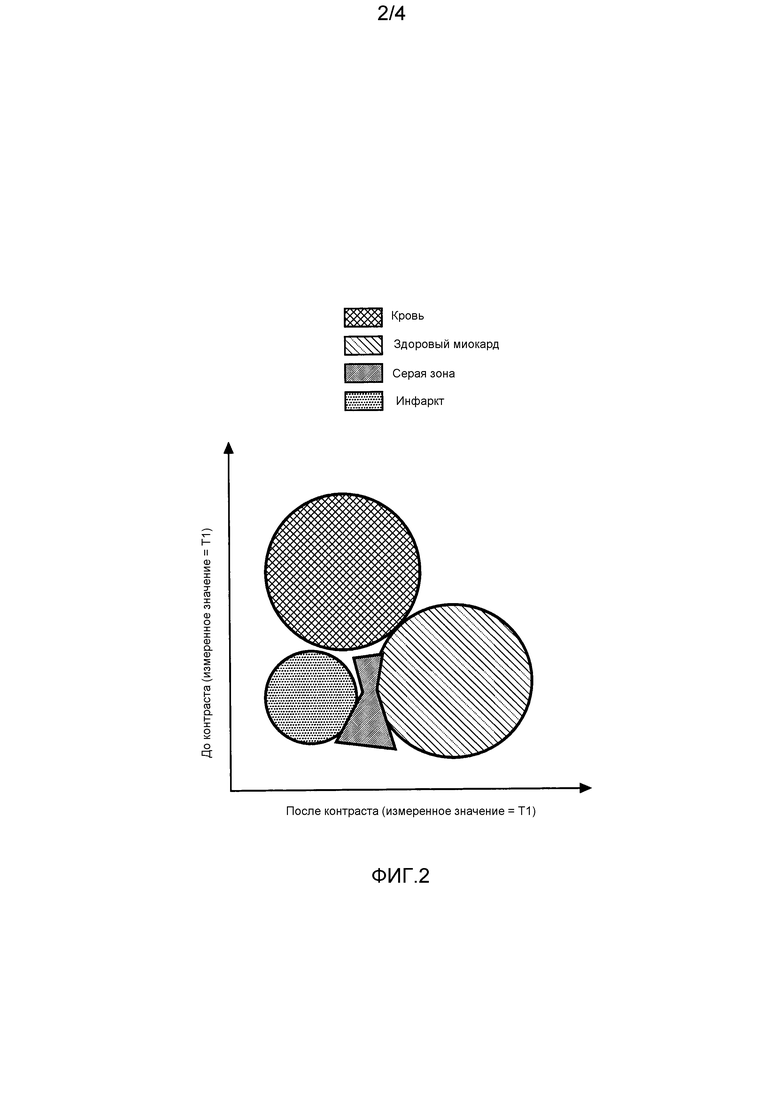
На фиг. 2 графически проиллюстрирован пример ожидаемой кластеризации ткани на графике аналитического сердечного магнитного резонанса с измеренным значением T1.
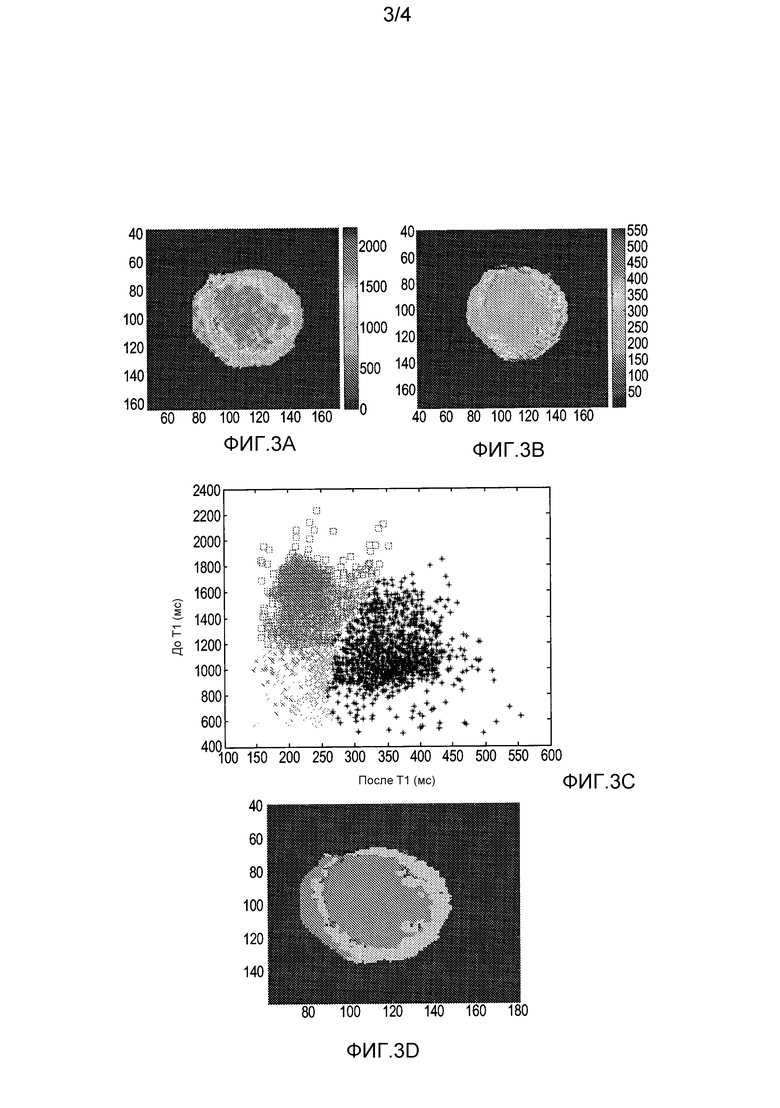
На фиг. 3A-D представлен образцовый результат системы с анализом левого желудочка сердца одного субъекта.
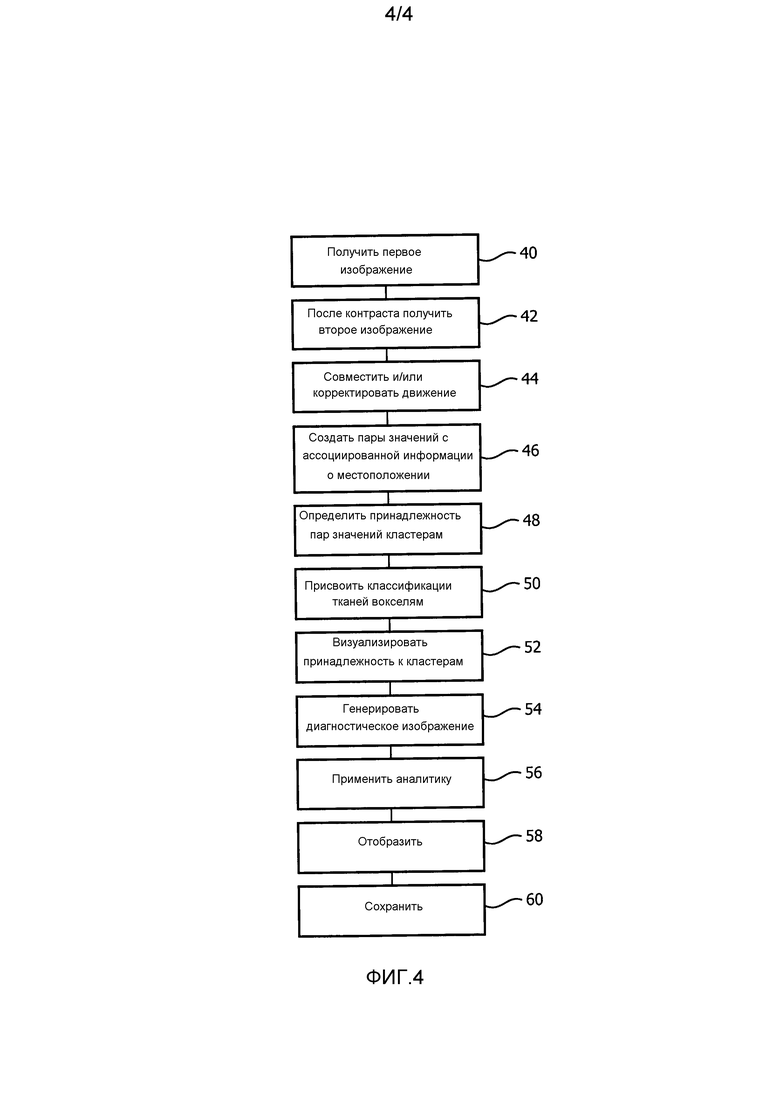
На фиг. 4 представлена блок-схема одного способа использования варианта осуществления системы медицинской визуализации.
Со ссылкой на фиг. 1, схематически проиллюстрирован вариант осуществления системы медицинской визуализации. Устройство 10 медицинской визуализации, такой как магнитный резонанс (МР), рентгеновская компьютерная томография (КТ), позитронно-эмиссионная томография (ПЭТ), однофотонная эмиссионная томография (ОФЭКТ), комбинация или гибрид и т.п., создают наборы данных медицинской визуализации, которые хранят в хранилище 12 данных. Хранилище данных может представлять собой локальную память на сервере, накопитель хранилище на локальном диске, накопитель на подключенном к сети запоминающем устройстве и т.п. Хранилище данных или устройство 12 памяти содержит данные 14 первой визуализации, получаемые по методике, которая генерирует изображения с первым контрастом, и данные 16 второй визуализации, получаемые по методике, которая генерирует второй контраст. Различие в контрасте в одном из вариантов осуществления основано на введении контрастного агента. Пример измеренных значений в МР включает T1 взвешенные изображения, T2 взвешенные изображения и т.п. Измеренные значения могут включать в себя непосредственные измерения, такие как измеренное T1 значение, или опосредованное измерение, такое как T1 значение, нормализованное по шкале серого и т.п. Измеряемые изображения имеют различные относительные контрасты для каждого из по меньшей мере трех различных типов тканей, таких как кровь, здоровый миокард, инфаркт и серая зона. В других вариантах осуществления также предусмотрены больше чем два набора данных визуализации, где дополнительные наборы данных визуализации включают в себя различные временные интервалы после введения контрастного агента.
Регистратор 18 взаимно совмещает данные первой и второй визуализации, если они еще не или по существу взаимно не совмещены. Регистратор 18 корректирует любое движение в данных первой и второй визуализации. Регистратор соединяется с хранилищем 12 данных и/или устройством медицинской визуализации через сеть 20. Сеть может быть проводной или беспроводной, внутренней или внешней, частной или публичной, такой как интернет, или представлять собой какую-либо комбинацию.
Классификационный модуль 22 генерирует пары измеренного значения из данных первой и второй визуализации соответствующих вокселей. Генерируемые пары измеренного значения включают в себя пару измеренных значений контраста соответствующих вокселей, пикселей или других областей (далее в настоящем документе в общем «вокселей») первого и второго изображений. Например, если на T1 взвешенном изображении воксель является гиперинтенсивным на первом или втором изображении, то включается пара измеренного значения. Если воксель не сопоставлен контрастно ни на одном изображении, тогда его можно пропустить. Пары измеренного значения можно представлять в виде сетки рассеивания, массива или списка значений, которые включают два измеренных значения в местоположении соответствующего вокселя. Классификационный модуль кластеризует пары измеренных значений по кластерам или группам, и классифицирует каждый кластер в качестве типа ткани. Классификационный модуль 22 соединяется с регистратором 18 и/или хранилищем 12 данных через сеть 20. Классификационный модуль 22 может использовать один или несколько процессоров совместно с регистратором 18 или быть отдельным. В других вариантах осуществления предусмотрено n-кратных измеренных значений из n наборов данных визуализации, где n представляет собой множественное значение. Соответствующие измеренные значения n, подлежащие кластеризации, можно выбирать из каждого n-кратного, что обеспечивает разделение контрастов. Наборы n данных визуализации можно получать за интервал времени, который не требует точной калибровки.
В одном из вариантов осуществления пользовательский интерфейс 23 может визуализировать кластеризованные пары измеренного значения с использованием диаграмм, таких как диаграмма рассеивания или контурный график. Каждая ось представляет измеренные значения одного изображения. Каждая пара измеренного значения наносится на график в виде точки, на котором точка представлена в виде классифицированного типа ткани. Например, на диаграмме рассеивания, каждая точка наносится на график и ей присваивается символ и/или цвет, указывающий на принадлежность кластеру, посредством алгоритма кластеризации. Кластер помечается в легенде как классифицированный тип ткани. В примере контурного графика высота контура представляет частоту встречаемости.
Сегментатор 24, такой как процессор, который реализует алгоритм сегментации, сегментирует или кластеризует классифицированные типы тканей на основе соответствующих вокселей пар измеренного значения с использованием алгоритма кластеризации. Например, если пара измеренного значения классифицируется в качестве инфаркта на основе принадлежностей кластеру, то соответствующий воксель пары измеренных значений классифицируется как инфаркт. Соответствующий объем, или первое или второе изображение, можно использовать для того, чтобы присваивать классификацию типа ткани вокселям.
Аналитический блок 25 применяет аналитику, такую как измерения объема, к сегментированным типам тканей или классифицированным областям. Например, объем серой зоны и объем инфаркта вычисляются на основе областей, классифицированных в качестве серой зоны и инфаркта соответственно. Сегментатор 24 и аналитический блок 25 соединяются с сетью 20 и могут использовать один или несколько процессоров совместно с регистратором 18 и/или классификационным модулем 22 или могут быть отдельными.
Рабочая станция 26 содержит одно или несколько устройств 28 ввода, один или несколько процессоров 30 и устройство 32 отображения. Рабочая станция 28 включает в себя настольные компьютеры, портативные компьютеры, планшетные компьютеры, смартфоны и т.п. Одно или несколько устройств 28 ввода вводят команды от медицинского работника, выбирают изображения и т.п. Устройство 32 отображения отображает изображения, меню, формы, панели, диаграммы, графики и т.п. Устройство отображения включает в себя отображение данных, таких как аналитика, вычисленная с помощью сегментатора. Устройство отображения отображает диагностическое изображение, которое содержит различные цвета или контрасты для каждого классифицированного типа ткани. Диагностическое изображение можно хранить в системе 34 управления накопителями, такой как PACS, RIS и т.п.
На фиг. 2 графически проиллюстрирован пример ожидаемой кластеризации тканей на магнитно-резонансном графике анализа сердца с использованием измеренного T1 значения. Измеренное T1 значение до введения контрастного агента, такого как поздний галлиевый усиливающий агент, выше для крови, но перекрывается для инфаркта, серой зоны и здорового миокарда. Измеренное T1 значение после введения контрастного агента выше для здорового миокарда, но перекрывается для крови, инфаркта и серой зоны. Здоровые ткани включают в себя кровь и здоровый миокард. Типы рисковых тканей включают в себя серую зону и инфаркт. На график наносятся измеренные T1 значения пар вокселей по оси y из изображения или карты до контраста и измеренные T1 значения по оси x из изображения после контраста для каждого местоположения в качестве пары координат для соответствующих вокселей.
Два изображения или карты картируют значения шкалы серого или контраста, соответствующие общим вокселям. Например, T1 не нужно калибровать, поскольку одна и та же последовательность используется для обоих изображений, такая как стандартное градиентное эхо с инверсией-восстановлением. Поскольку измеренное значение измеряется с использованием одной и той же калибровки, одного и того же пациента, одних и тех же параметров, одного и того же алгоритма и т.д., модуль кластеризации не должен учитывать машинные различия, различия в последовательности, различия в пациентах и т.д. Многие источники возможных ошибок устранены.
Кластеризация классифицирует типы тканей посредством группировки пар значения шкалы серого или контраста соответствующего вокселя с использованием и без использования контрастного агента или других модификаций контраста. Измеренные значения на одном изображении перекрываются для одного здорового типа ткани и рискового типа ткани, и измеренные значения на другом изображении перекрываются для другого здорового типа ткани и рискового типа ткани. Например, в T1 до контраста здоровая ткань включает в себя здоровый миокард, но не кровь, перекрывается с областями риска, которые включают в себя инфаркт и серую зону. В T1 после контраста здоровая ткань включает в себя кровь, но не здоровый миокард, перекрывается с областями риска. Каждый контрастный агент обеспечивает оптимальное отделение значений в точке времени, но время варьирует в зависимости от субъекта и также потенциально в пределах субъекта из-за факторов окружающей среды и других факторов. Оптимальное время обеспечивает наилучшее различие, но его не нужно измерять точно, поскольку оно представляет собой не количественное определение контрастного агента, которое измеряется, а классификацию местоположения, на которую влияет введенный контрастный агент. Множество наборов данных визуализации можно получать для того, чтобы выбирать оптимальный момент времени контраста для пациента вместо того, чтобы полагаться на предварительно определенную точку измерения.
Сегментирующий модуль 24 в одном из вариантов осуществления использует алгоритм нечетких c-средних, такой как модификация Густавсона-Кесселя (FCGK). FCGK минимизирует функцию:
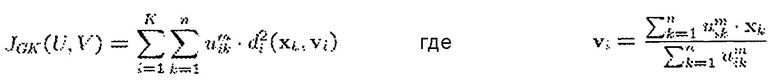
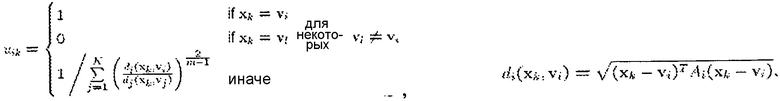
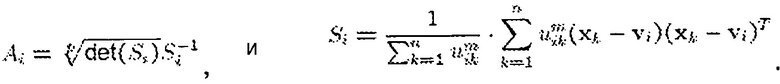
U представляет нечеткие c-разбиения, V представляет вектор центров, m представляет собой весовую экспоненту, xk представляет собой пару измеренного значения, а vi представляет собой центр кластера i. Число кластеров фиксируется до запуска алгоритма. Например, когда k=2, например, когда кластеры представляют кровь и здоровый миокард, местоположения с вероятностью Ρi<0,75 принадлежности к крови и вероятностью Ρj<0,45 принадлежности к здоровому миокарду определяют инфаркт. Местоположения с вероятностью Ρi<0,75 принадлежности к крови и вероятностью 0,45<Ρj<0,65 принадлежности к здоровому миокарду определяют серую зону. Альтернативно k=3, например, когда кластеры представляют кровь, здоровый миокард и инфаркт, серую зону определяют как вероятность Ρi<0,75 принадлежности к инфаркту и вероятность Pj<0,65 принадлежности к здоровому миокарду. Пределы вероятностей можно уточнять с использованием более крупных когорт пациентов или больших зон образцов. Алгоритмы нечетких c-средних (FCM) относят принадлежность точек, таких как пары измеренного значения, нечетким кластерам.
На фиг. 3A-D представлен пример системы с анализом левого желудочка (LV) сердца одного субъекта. На фиг. 3A представлена T1 карта или изображение без усиления контраста для LV области в виде короткой оси. Кровь контрастно сопоставлена с перекрывающимся здоровым миокардом, инфарктом и серой зоной. Кровь преобладает на изображении.
На фиг. 3B представлена взаимно совмещенная T1 карта LV после введения контрастного агента. Здоровый миокард контрастно сопоставлен с перекрывающейся кровью, инфарктом и серой зоной. Здоровый миокард формирует кольцевую область.
На фиг. 3C проиллюстрирована визуализация кластеризации с использованием графика рассеивания значений шкалы серого или контрастных величин каждого соответствующего вокселя на фиг. 3A и 3B. С использованием алгоритма кластеризации идентифицируются расстояния от точек до центров кластеров и минимизируются расстояния, например, с использованием функции стоимости, чтобы генерировать кластеры, соответствующие каждому типу ткани. В этом случае алгоритм FCM с использованием модификации FCGK относит принадлежность пар T1 значений с фиг. 3A и 3B. В других вариантах осуществления другие способы FCM делят точки с фиг. 3C на кластеры.
Точки с фиг. 3C, которые находятся в кластере крови, представлены маленькими квадратами (вверху слева). Точки, которые относятся к кластеру здорового миокарда, представлены маленькими знаками плюса (внизу справа). Точки в кластере инфаркта представлены маленьким «x» (под кластером крови и слева от здорового миокарда). Точки в кластере серой зоны представлены маленькими кругами (справа от инфаркта и ниже крови). Кластеры графически изображены на фиг. 2.
На фиг. 3D представлено изображение LV с местоположениями, контрастно сопоставленными по классифицированному типу ткани. Представленные типы тканей включают в себя кровь, здоровый миокард, инфаркт и серую зону. Сегментатор использует местоположение пар измеренного значения из соответствующего вокселя с фиг. 3A и 3B для того, чтобы определять тип ткани каждого вокселя. Каждому вокселю придают контраст или цвет, присваиваемый определяемому типу ткани, для того, чтобы генерировать изображение LV на фиг. 3D. Объем, сегментированный сегментатором и измеренный аналитическим блоком, в этом примере содержит серую зону 85 мм2 и инфаркт 154 мм2. Инфаркт можно отличить на крае от большой кольцевой области здорового миокарда. Сложность мануального измерения инфаркта и серой зоны с использованием других способов можно видеть при сравнении изображения с фиг. 3D с изображением с фиг. 3A и/или фиг. 3B.
На фиг. 4 представлена блок-схема варианта осуществления способа медицинской визуализации. На этапе 40 первое изображение получается и сохраняется в хранилище данных. Изображение можно получать непосредственно от устройства визуализации или опосредованно с помощью выборки из памяти накопителя, такого как дисковый накопитель. После введения контрастного агента на этапе 42 получается второе изображение. В других вариантах осуществления повторные получения выполняются с различными временными интервалами, чтобы гарантированно обеспечить оптимальный контраст. На этапе 44 изображения взаимно совмещаются и/или корректируются по движению посредством регистратора.
Классификационный модуль на стадии 46 создает или генерирует пары измеренного значения. Пары измеренного значения включают в себя измеренные значения из соответствующих вокселей первого и второго изображений, в которых по меньшей мере одно измеренное значение превышает порог или находится в диапазоне измеренных значений, отражающем контрастно сопоставляемый тип ткани. Пары измеренного значения и ассоциированное местоположение вокселя можно представлять в виде матрицы значений, такой как (измеренное значение 1, измеренное значение 2, местоположение вокселя).
Классификационный модуль на этапе 48 относит принадлежность пар измеренного значения к кластерам. Каждый кластер классифицируется в качестве типа ткани. Отнесение принадлежности основано на алгоритме нечетких c-средних (FCM), таком как FCM с модификацией FCGK.
Сегментатор присваивает на этапе 50 классифицированный тип ткани каждой пары измеренного значения объему, соответствующему первому и второму изображениям. Альтернативно, одно из первого и второго изображений можно использовать для того, чтобы отображать классифицированные типы тканей, например задавать интенсивности и/или цвету вокселя значение, отражающее классифицированные типы тканей.
На этапе 52 пользовательский интерфейс конструирует визуализацию пар измеренного значения и принадлежность кластеру, такую как диаграмма рассеивания или контурный график. Визуализацию можно использовать для сравнения кластеризации между изображениями, полученными в различные временные интервалы, и/или различных алгоритмов кластеризации или параметров.
Диагностическое изображение конструируется на этапе 54. Диагностическое изображение содержит отображение визуализированной области, помеченной для того, чтобы обозначать каждый классифицированный тип ткани. В одном из примеров диагностическое изображение может содержать первое или второе изображение, которое показывает другие анатомические ориентиры или пространственные взаимосвязи, окрашенные для обозначения типов тканей.
На этапе 56 аналитический блок анализирует диагностическое изображение, например вычисляет измерение объема сегментированных типов тканей. Вычисляются рисковые типы тканей и необязательно здоровые типы тканей. Другая применяемая аналитика может включать в себя сравнения, такие как соотношения между сегментированными объемами, сравнение с различными популяциями пациентов и т.п. Аналитика также может включать в себя другую статистику, такую как длина, средняя плотность, максимальная глубина и т.п.
Устройство отображения на этапе 58 отображает диагностическое изображение, на котором контрастно сопоставлены различные типы тканей и/или измерен объем рисковых типов тканей, таких как инфаркт и серая зона. Необязательно на этапе 60 диагностическое изображение, аналитику и/или визуализацию кластеров можно сохранять в системе управления данными пациентов.
Следует принимать во внимание, что применительно к конкретным образцовым вариантам осуществления, представленным в настоящем документе, определенные структурные и/или функциональные признаки описаны как встроенные в определенные элементы и/или компоненты. Однако предусмотрено, что эти признаки для такого же или схожего эффекта также аналогичным образом можно встраивать в другие элементы и/или компоненты, где это применимо. Также следует принимать во внимание, что различные аспекты образцовых вариантов осуществления можно избирательно использовать соответствующим образом для того, чтобы получать другие альтернативные варианты осуществления, подходящие для желаемых применений, другие альтернативные варианты осуществления тем самым реализуют соответствующие преимущества аспектов, внедренных в них.
Также следует принимать во внимание, что конкретные элементы или компоненты, описанные в настоящем документе, могут иметь свою функциональность, соответственно реализованную через аппаратное обеспечение, программное обеспечение, программно-аппаратное обеспечение или их сочетание. Дополнительно следует принимать во внимание, что определенные элементы, описанные в настоящем документе как внедренные вместе, могут при подходящих обстоятельствах представлять собой обособленные элементы или быть иным образом разделены. Аналогичным образом, множество конкретных функций, описанных в качестве осуществляемых одним конкретным элементом, можно осуществлять с помощью множества отдельных элементов, действующих независимо, чтобы осуществлять индивидуальные функции, или определенные индивидуальные функции можно разделять и осуществлять с помощью множества отдельных элементов, действующих совместно. С другой стороны, где это применимо, можно физически или функционально комбинировать некоторые элементы или компоненты, которые в других случаях описаны и/или показаны в настоящем документе как отдельные друг от друга.
Вкратце, данное описание изложено со ссылкой на предпочтительные варианты осуществления. Очевидно, модификации и изменения будут приходить на ум при прочтении и осмыслении данного описания. Подразумевается, что изобретение толкуется как включающее в себя все такие модификации и изменения до тех пор, пока они входят в объем приложенной формулы изобретения или ее эквивалентов. То есть, следует принимать во внимание, что различные раскрытые выше и другие признаки и функции или их альтернативы можно по желанию комбинировать во многих других отличающихся системах или приложениях, а также, что специалисты в данной области могут впоследствии осуществлять в них различные в настоящее время непредусмотренные или непредвиденные альтернативы, модификации, вариации или улучшения, которые аналогичным образом предназначены быть охваченными следующей формулой изобретения.
Группа изобретений относится к медицинской технике, а именно к средствам медицинской визуализации. Система медицинской визуализации содержит хранилище данных, выполненное с возможностью хранить карту изображения до контраста, сгенерированную перед инъекцией контрастного агента, и карту изображения после контраста, сгенерированную после инъецирования контрастной области, причем каждая карта изображения взаимно совмещается и имеет отличающийся контраст, один или более процессоров, выполненных с возможностью кластеризовывать значения пар соответствующих пар вокселей карт изображений до контраста и после контраста на графике рассеивания, на котором нанесены значения карты изображения до контраста со значениями карты изображения после контраста, чтобы идентифицировать кластеры, соответствующие каждому из множества типов ткани, причем типы ткани включают в себя здоровый миокард, кровь, инфаркт и серую зону, причем серая зона включает в себя преинфаркт и гетерогенный инфаркт, присваивать один из типов ткани каждой паре вокселей, и устройство отображения. Способ медицинской визуализации включает в себя этапы, на которых получают первое изображение, получают второе изображение с контрастом, отличным от контраста первого изображения T1, причем первое изображение T1 и второе изображение T1 получают с использованием одной и той же последовательности градиентного эхо с инверсионным восстановлением, взаимно совмещают первое и второе изображения T1, создают пары измеренного значения контраста соответствующих вокселей из первого и второго изображений T1, относят принадлежность пар измеренного значения к кластерам, причем каждый кластер соответствует одному из множества типов ткани, присваивают один из множества типов ткани каждому вокселю диагностического изображения соответствующей визуализированной области с использованием первого и второго изображений T1 и отображают диагностическое изображение. Для осуществления способа используется система медицинской визуализации, которая содержит один или несколько процессоров. Система обработки изображений содержит хранилище данных, классификационный модуль и устройство отображения диагностического изображения с каждым классификационным типом ткани, изображенным с отличающимся контрастом и цветом. Использование изобретений позволяет улучшить автоматизированное обнаружение областей риска за счет точной идентификации различных типов тканей. 5 н. и 14 з.п. ф-лы, 4 ил.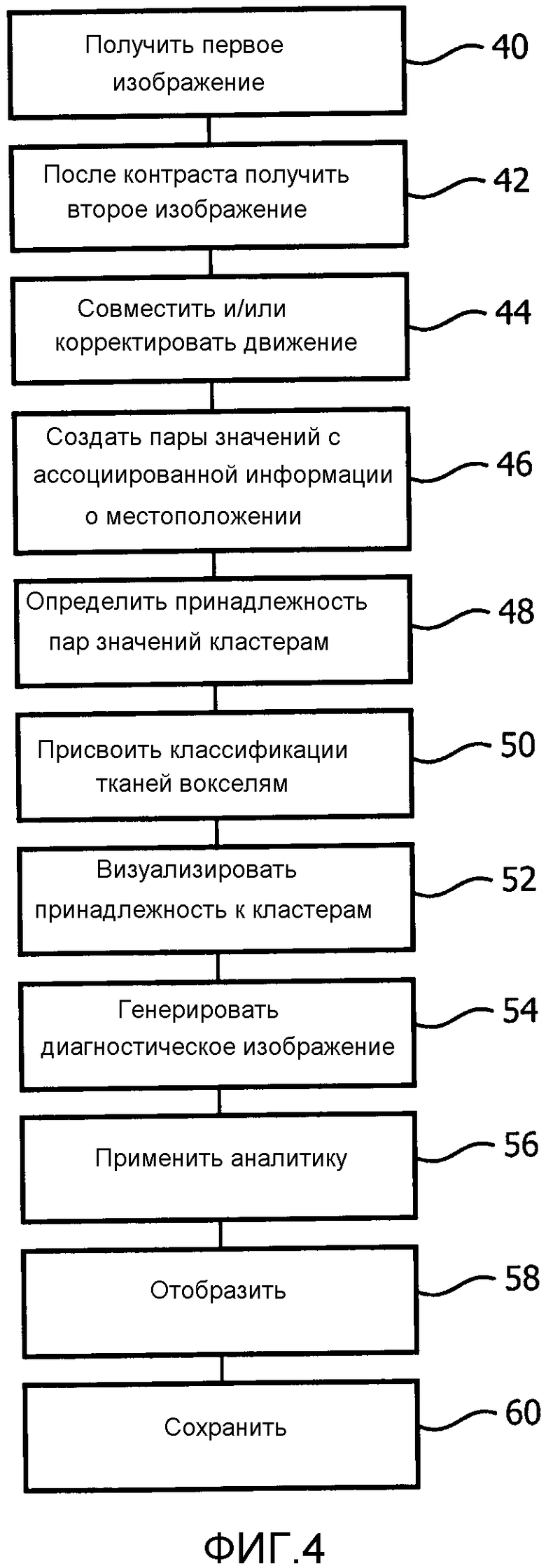
1. Система медицинской визуализации (5), которая содержит:
хранилище (12) данных, выполненное с возможностью хранить карту изображения до контраста, сгенерированную перед инъекцией контрастного агента, и карту изображения после контраста, сгенерированную после инъецирования контрастной области, причем каждая карта изображения взаимно совмещается и имеет отличающийся контраст;
один или более процессоров (22, 24), выполненных с возможностью:
кластеризовывать значения пар соответствующих пар вокселей карт изображений до контраста и после контраста на графике рассеивания, на котором нанесены значения карты изображения до контраста со значениями карты изображения после контраста, чтобы идентифицировать кластеры, соответствующие каждому из множества типов ткани, причем типы ткани включают в себя здоровый миокард, кровь, инфаркт и серую зону, причем серая зона включает в себя преинфаркт и гетерогенный инфаркт;
присваивать один из типов ткани каждой паре вокселей; и
устройство (32) отображения, выполненное с возможностью отображать диагностическое изображение с каждым классифицированным типом ткани, изображенным отличающимся контрастом или цветом.
2. Система медицинской визуализации (5) по п. 1, в которой один или более процессоров дополнительно запрограммированы, чтобы:
кластеризовывать пары вокселей на основе алгоритма нечетких с-средних (FCM), причем каждый кластер соответствует одному из типов тканей.
3. Система медицинской визуализации (5) по п. 1 или 2, в которой и карты изображения до контраста и после контраста создаются на одном и том же устройстве визуализации (10).
4. Система медицинской визуализации (5) по п. 3, в которой устройство визуализации (10) включает в себя по меньшей мере одно из: магнитного резонанса (MR); однофотонной эмиссионной компьютерной томографии (SPECT); позитронно-эмиссионной томографии (PET); и рентгеновской компьютерной томографии (СТ).
5. Система медицинской визуализации (5) по п. 1, в которой карта изображения до контраста контрастно сопоставляет первый здоровый тип ткани со вторым здоровым типом ткани, который включает в себя рисковые типы тканей, а карта изображения после контраста контрастно сопоставляет первый здоровый тип ткани, который включает в себя рисковые типы тканей, со вторым здоровым типом ткани.
6. Система медицинской визуализации (5) по п. 5, в которой контрастно сопоставленная здоровая ткань включает в себя одно из крови и здорового миокарда.
7. Система медицинской визуализации (5) по п. 1, в которой один или более процессоров дополнительно запрограммированы, чтобы:
вычислять объем по меньшей мере одного классифицированного типа ткани; и
при этом устройство отображения выполнено с возможностью отображать объем, вычисленный для классифицированного типа ткани.
8. Система медицинской визуализации (5) по п. 7, в которой дисплей (32) выполнен с возможностью отображать объем рискового типа ткани.
9. Система медицинской визуализации по п. 1, в которой карты изображения до контраста и после контраста являются картами изображения T1.
10. Система медицинской визуализации по п. 1, в которой карты изображения до контраста и после контраста сгенерированы последовательностью градиентного эхо с магнитно-резонансным инверсионным восстановлением.
11. Способ медицинской визуализации, который включает в себя этапы, на которых:
получают (40) первое изображение T1;
получают (42) второе изображение с контрастом, отличным от контраста первого изображения T1, причем первое изображение T1 и второе изображение T1 получают с использованием одной и той же последовательности градиентного эхо с инверсионным восстановлением, причем первое изображение T1 контрастно сопоставляет первый тип здоровой ткани со вторым типом здоровой ткани, который включает в себя рисковые типы ткани, и второе изображение T1 контрастно сопоставляет первый тип здоровой ткани, который включает в себя рисковые типы ткани, со вторым типом здоровой ткани, причем первый тип здоровой ткани включает в себя миокард, при этом второй тип здоровой ткани включает в себя кровь, при этом рисковый тип ткани включает в себя серую зону и инфаркт;
взаимно совмещают (44) первое и второе изображения T1;
создают (46) пары измеренного значения контраста соответствующих вокселей из первого и второго изображений T1, каждая пара измеренного значения включает в себя одно значение из первого изображения T1 и одно значение из второго изображения T1 для соответствующего вокселя;
относят (48) принадлежность пар измеренного значения к кластерам, причем каждый кластер соответствует одному из множества типов ткани;
присваивают один из множества типов ткани каждому вокселю диагностического изображения соответствующей визуализированной области с использованием первого и второго изображений T1;
отображают (50) диагностическое изображение, на котором каждый классифицированный тип ткани изображен отличающимся контрастом или цветом.
12. Способ медицинской визуализации по п. 11, в котором при отнесении (48) принадлежности пар измеренного значения к кластерам используют алгоритм нечетких с-средних (FCM).
13. Способ медицинской визуализации по п. 11 или 12, в котором первое и второе изображения T1 генерируются на одном и том же устройстве визуализации и по существу взаимно совмещаются.
14. Способ медицинской визуализации по п. 11, в котором первое изображение является изображением до контраста и второе изображение является изображением после контраста.
15. Способ медицинской визуализации по п. 11, который дополнительно включает в себя этапы, на которых:
отображают (52) кластеризованные пары измеренного значения на диаграмме рассеивания пар измеренного значения, причем каждая пара измеренного значения контрастно сопоставлена по принадлежности кластеру.
16. Способ медицинской визуализации по п. 11, который дополнительно включает в себя этапы, на которых:
вычисляют (48) объем выбранного классифицированного типа ткани на диагностическом изображении; и в котором отображение дополнительно включает в себя:
отображение вычисленного объема выбранного классифицированного типа ткани.
17. Невременный машиночитаемый носитель для системы медицинской визуализации, который несет программное обеспечение, выполненное с возможностью управления одним или несколькими процессорами, чтобы осуществлять любое одно из пп. 1-16.
18. Система медицинской визуализации, которая содержит:
один или несколько процессоров, запрограммированных, чтобы осуществлять способ по любому одному из пп. 11-16.
19. Система (5) обработки изображений, которая содержит:
хранилище (12) данных, которое хранит изображение до контраста, сгенерированное перед инфекцией контрастного агента, и изображение после контраста, сгенерированное после инъекции контрастного агента, причем каждое изображение взаимно совмещается и имеет отличающийся контраст,
классификационный модуль (22), который кластеризует значения кластеров пар соответствующих пар вокселей карт изображений до контраста и после контраста на графике рассеивания, на котором нанесены значения карты изображения до контраста со значениями карты изображения после контраста, чтобы идентифицировать кластеры, соответствующие каждому из множества типов ткани, причем типы ткани включают в себя здоровый миокард, кровь, инфаркт и серую зону, причем серая зона включает в себя преинфаркт и гетерогенный инфаркт; сегментатор, который присваивает один из типов ткани каждой паре вокселей; и
устройство (32) отображения, которое отображает диагностическое изображение с каждым классификационным типом ткани, изображенным с отличающимся контрастом и цветом.
| Jay S | |||
| Detsky et al | |||
| Reproducible Classification of Infarct Heterogeneity Using Fuzzy Clustering on Multicontrast Delayed Enhancement Magnetic Resonance Images, IEEE TRANSACTIONS ON MEDICAL IMAGING, VOL | |||
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| US 2009275822 A1, 05.11.2009 | |||
| US 2004218794 A1, 04.11.2004 | |||
| US 6842638 B1, 11.01.2005 | |||
| ЭЛЕКТРОМАГНИТНЫЕ ОТОБРАЖАЮЩИЕ И ЛЕЧЕБНЫЕ (ЭМОЛ) СИСТЕМЫ | 1998 |
|
RU2234244C2 |
Авторы
Даты
2017-08-02—Публикация
2013-01-22—Подача