Область техники
[0001] Настоящее изобретение относится к молекуле одноцепочечной нуклеиновой кислоты, которая подавляет экспрессию генов, к композиции, содержащей молекулу одноцепочечной нуклеиновой кислоты, а также к применению молекулы одноцепочечной нуклеиновой кислоты.
Уровень техники
[0002] Примером технологии подавления экспрессии генов является РНК-интерференция (RNAi) (непатентный документ 1). Обычно подавление экспрессии генов посредством РНК-интерференции осуществляется, например, путем введения короткой молекулы двухцепочечной РНК в клетку или подобным образом. Молекулу двухцепочечной РНК обычно называют миРНК (малая интерферирующая РНК). Сообщалось, что экспрессию генов может подавлять не только миРНК, но также и кольцевые молекулы РНК, которые оказываются частично двухцепочечными благодаря межмолекулярному отжигу (патентный документ 1). Тем не менее, существуют следующие проблемы при использовании молекул РНК в этих методиках для индукции подавления экспрессии генов.
[0003] Во-первых, для получения миРНК необходимо по отдельности синтезировать смысловую цепь и антисмысловую цепь и по окончании этого синтеза провести гибридизацию этих цепей. Таким образом, существует проблема низкой промышленной эффективности. Кроме того, в отношении введения миРНК: введение миРНК в клетку необходимо осуществлять с одновременным подавлением диссоциации одноцепочечной РНК, для чего необходимо решить трудоемкую задачу создания условий для обработки миРНК. С другой стороны, существует проблема затрудненного синтеза кольцевых молекул РНК. Перечень ссылок:
Патентный документ (документы)
[0004] Патентный документ 1: JP 2008-278784А
Непатентный документ (документы)
[0005] Непатентный документ 1: Fire. et al., Nature, Vol. 391, стр. 806-811, 1998 год.
Краткое описание изобретения
[0006] С учетом вышеизложенного целью настоящего изобретения является создание новой молекулы нуклеиновой кислоты со способностью к подавлению экспрессии генов, производство которой при этом также может быть легким и эффективным.
[0007] Для достижения вышеуказанной цели в настоящем изобретении рассмотрено создание молекулы одноцепочечной нуклеиновой кислоты, включающей последовательность, подавляющую экспрессию, и указанная последовательность ингибирует экспрессию целевого гена. Молекула одноцепочечной нуклеиновой кислоты включает, в порядке от 5'-конца к 3'-концу: 5'-концевой участок (Xc), внутренний участок (Z) и 3'-концевой участок (Yc). Внутренний участок (Z) состоит из внутреннего участка со стороны 5'-конца (X) и внутреннего участка со стороны 3'-конца (Y), которые связаны друг с другом. Участок 5'-конца (Xc) является комплементарным для внутреннего участка со стороны 5'-конца (X). Участок 3'-конца (Yc) является комплементарным для внутреннего участка со стороны 3'-конца (Y). По меньшей мере один из следующих участков: внутренний участок (Z), 5'-концевой участок (Xc) и 3'-концевой участок (Yc), включает последовательность, подавляющую экспрессию.
[0008] Настоящее изобретение также относится к композиции, подавляющей экспрессию целевого гена. Композиция содержит молекулу одноцепочечной нуклеиновой кислоты согласно настоящему изобретению.
[0009] Настоящее изобретение также относится к фармацевтической композиции, содержащей молекулу одноцепочечной нуклеиновой кислоты согласно настоящему изобретению.
[0010] Настоящее изобретение также относится к способу подавления экспрессии целевого гена. В этом способе используют молекулу одноцепочечной нуклеиновой кислоты согласно настоящему изобретению.
[0011] Настоящее изобретение также относится к способу лечения заболевания, который включает этап введения пациенту молекулы одноцепочечной нуклеиновой кислоты согласно настоящему изобретению. В качестве последовательности, подавляющей экспрессию, молекула одноцепочечной нуклеиновой кислоты включает последовательность, которая подавляет экспрессию гена, вызывающего болезнь.
[0012] С помощью молекулы одноцепочечной нуклеиновой кислоты по настоящему изобретению можно подавлять экспрессию гена. Кроме того, молекулу одноцепочечной нуклеиновой кислоты можно легко синтезировать, поскольку она не является циркулярной. Также производство молекулы одноцепочечной нуклеиновой кислоты может быть эффективным, так как молекула имеет одну цепь, и не требуется проводить этап отжига, необходимый при получении двойной цепи.
[0013] Авторам настоящего изобретения принадлежит открытие, что подавление экспрессии гена может соответствовать структуре молекулы одноцепочечной нуклеиновой кислоты по настоящему изобретению. Они предположили, что эффект подавления генов молекулой одноцепочечной нуклеиновой кислоты по настоящему изобретению обусловлен феноменом, сходным с РНК-интерференцией. Вместе с тем, необходимо отметить, что в настоящем изобретении подавление экспрессии генов не ограничено или не связано исключительно с РНК-интерференцией.
Краткое описание чертежей
[0014] Фигура 1 представляет собой схематическое изображение примера молекулы одноцепочечной нуклеиновой кислоты по настоящему изобретению.
Фигура 2 представляет собой схематическое изображение другого примера молекулы одноцепочечной нуклеиновой кислоты по настоящему изобретению.
Фигура 3 представляет собой схематическое изображение других примеров молекулы одноцепочечной нуклеиновой кислоты по настоящему изобретению.
Фигура 4 представляет собой график, показывающий уровень относительной экспрессии гена GAPDH в примере настоящего изобретения.
Фигура 5 представляет собой график, показывающий уровень относительной экспрессии гена GAPDH в другом примере настоящего изобретения.
Фигура 6 представляет собой график, показывающий уровень относительной экспрессии гена GAPDH в клетках A549 еще в одном примере настоящего изобретения
Фигура 7 представляет собой график, показывающий уровень относительной экспрессии гена GAPDH в клетках 293 в примере настоящего изобретения.
Фигура 8 представляет собой график, показывающий уровень экспрессии гена TGF-β1 еще в одном примере настоящего изобретения.
Фигура 9 представляет собой график, показывающий уровень экспрессии TGF-β1 на единицу веса легкого в каждой группе введения еще в одном примере настоящего изобретения.
Фигура 10 представляет собой график, показывающий количество клеток в образце BALF в каждой группе введения в примере настоящего изобретения.
Фигура 11 представляет собой график, показывающий количество нейтрофилов в образце BALF в каждой группе введения в примере настоящего изобретения.
Фигура 12 представляет фотографии, каждая из которых показывает результат окрашивания клеток по Гимзе в образце BALF в примере настоящего изобретения.
Фигура 12А показывает результат, полученный в группе введения 4 (ЛПС(+)/РНК(-)). Фигура 12B показывает результат, полученный в группе введения 6 (ЛПС(+)/отрицательный контроль NK-0035(+)). Фигура 12С показывает результат, полученный в группе введения 5 (ЛПС(+)/NK-0033(+)).
Фигура 13 представляет фотографии, каждая из которых показывает результат окрашивания гематоксилином и эозином (ГЭ) ткани легкого в примере настоящего изобретения. Фигура 13А показывает результат, полученный в группе введения 4 (ЛПС(+)/РНК(-)). Фигура 13B показывает результат, полученный в группе введения 6 (ЛПС(+)/отрицательный контроль NK-0035(+)). Фигура 13С показывает результат, полученный в группе введения 5 (ЛПС(+)/NK-0033(+)).
Фигура 14А показывает результат измерения уровня экспрессии гена TGF-β1 еще в одном примере настоящего изобретения. Фигура 14B показывает результат измерения уровня экспрессии гена IFH-α в примере настоящего изобретения. Фигура 14С показывает результат измерения уровня экспрессии гена IFH-β в примере настоящего изобретения.
Фигура 15 представляет собой график, показывающий относительное значение уровня экспрессии гена TGF-β1 еще в одном примере настоящего изобретения.
Фигура 16 представляет собой график, показывающий относительное значение уровня экспрессии гена TGF-β1 в примере настоящего изобретения.
Фигура 17 представляет собой график, показывающий уровень экспрессии гена TGF-β1 на единицу веса легкого в каждой группе введения еще в одном примере настоящего изобретения.
Фигура 18А представляет собой график, показывающий количество TNF-α в образце BALF в каждой группе введения в примере настоящего изобретения. Фигура 18B представляет собой график, показывающий количество IFH-β в образце BALF в каждой группе введения в примере настоящего изобретения.
Фигура 19 представляет собой график, показывающий относительный уровень экспрессии гена LAMA1 в клетках 293 еще в одном примере настоящего изобретения.
Фигура 20 представляет собой график, показывающий относительный уровень экспрессии гена LMNA в клетках A549 еще в одном примере настоящего изобретения.
Фигура 21 показывает одноцепочечную РНК (оцРНК), используемую еще в одном примере настоящего изобретения.
Фигура 22 представляет собой график, показывающий относительный уровень экспрессии гена GAPDH в примере настоящего изобретения.
Фигура 23 показывает одноцепочечную РНК, используемую еще в одном примере настоящего изобретения.
Фигура 24 представляет собой график, показывающий относительный уровень экспрессии гена GAPDH в примере настоящего изобретения.
Фигура 25 показывает одноцепочечную РНК, используемую еще в одном примере настоящего изобретения.
Фигура 26 представляет собой график, показывающий относительный уровень экспрессии гена GAPDH в примере настоящего изобретения.
Фигура 27 показывает одноцепочечную РНК, используемую еще в одном примере настоящего изобретения.
Фигура 28 представляет собой график, показывающий относительный уровень экспрессии гена GAPDH в примере настоящего изобретения.
Фигура 29 представляет собой график, показывающий относительный уровень экспрессии гена GAPDH еще в одном примере настоящего изобретения.
Фигура 30 представляет собой график, показывающий относительный уровень экспрессии гена GAPDH в клетках HCT116 еще в одном примере настоящего изобретения.
Фигура 31 представляет собой электрофореграмму, показывающую устойчивость к рибонуклеазе еще в одном примере настоящего изобретения.
Фигура 32 представляет собой электрофореграмму, показывающую устойчивость к S7 нуклеазе еще в одном примере настоящего изобретения.
Способ осуществления изобретения
[0015] Каждый из терминов, используемых в настоящем описании, имеет значение, обычно применяемое в данной области, если не указано иначе.
1. Молекула одноцепочечной нуклеиновой кислоты (оцНК)
[0016] Молекула одноцепочечной нуклеиновой кислоты (оцНК) по настоящему изобретению, как описано выше, представляет собой молекулу одноцепочечной нуклеиновой кислоты, включающую последовательность, подавляющую экспрессию, и указанная последовательность подавляет экспрессию целевого гена. Молекула одноцепочечной нуклеиновой кислоты включает, в порядке от 5'-конца к 3'-концу: 5'-концевой участок (Xc), внутренний участок (Z) и 3'-концевой участок (Yc). Внутренний участок (Z) состоит из внутреннего участка со стороны 5'-конца (X) и внутреннего участка со стороны 3'-конца (Y), которые связаны друг с другом. Участок 5'-конца (Xc) является комплементарным для внутреннего участка со стороны 5'-конца (X). Участок 3'-конца (Yc) является комплементарным для внутреннего участка со стороны 3'-конца (Y). По меньшей мере один из следующих участков: внутренний участок (Z), 5'-концевой участок (Xc) и 3'-концевой участок (Yc) включает последовательность, подавляющую экспрессию.
[0017] В настоящем изобретении "подавление экспрессии целевого гена" означает, например, нарушение экспрессии целевого гена. Механизм, посредством которого достигается подавление, конкретно не ограничен и может представлять собой, например, даун-регуляцию или сайленсинг. Подавление экспрессии целевого гена может быть подтверждено, например, следующими фактами: уменьшение количества продукта транскрипции, происходящего от целевого гена, снижение активности продукта транскрипции; уменьшение количества продукта трансляции, происходящего от целевого гена; снижение активности продукта трансляции, или подобные способы. Перед тем, как белки подвергают процессированию или пост-трансляционной модификации и тому подобному, эти белки могут представлять собой, например, зрелые белки и белки предшественники.
[0018] Одноцепочечная молекула нуклеиновой кислоты по настоящему изобретению в дальнейшем описании также может называться "молекулой одноцепочечной НК" по настоящему изобретению. Такую молекулу одноцепочечной НК по настоящему изобретению можно использовать для подавления экспрессии целевого гена, например, in vivo или in vitro, то есть ее можно также называть "молекулой одноцепочечной НК для подавления экспрессии целевого гена" или "ингибитором экспрессии целевого гена". Кроме того, молекула одноцепочечной НК по настоящему изобретению может подавлять экспрессию целевого гена, например, посредством РНК-интерференции, то есть она также может называться "молекулой одноцепочечной НК для РНК-интерференции", "молекулой, индуцирующей РНК-интерференцию", "агентом РНК-интерференции" или "агентом, индуцирующим РНК-интерференцию". Молекула одноцепочечной НК по настоящему изобретению также может ингибировать побочные эффекты, например, такие как индукция интерферона.
[0019] В молекуле одноцепочечной НК по настоящему изобретению 5'-конец и 3'-конец не связаны друг с другом. Таким образом, молекулу одноцепочечной НК по настоящему изобретению также можно называть "линейной молекулой одноцепочечной нуклеиновой кислоты". Конфигурация молекулы одноцепочечной НК по настоящему изобретению такова, что, например, внутренний участок (Z), внутренний 5'-концевой участок (X) и внутренний 3'-концевой участок (Y) напрямую связаны друг с другом.
[0020] В молекуле одноцепочечной НК по настоящему изобретению 5'-концевой участок (Xc) является комплементарным внутреннему 5'-концевому участку (X), и 3'-концевой участок (Yc) комплементарен внутреннему 3'-концевому участку (Y). Таким образом, двойная цепь на 5'-конце может быть образована путем конъюгации "в себе" участка (Xc) к участку (X) и самоотжига участков (Хс) и (X). Двойная цепь на 3'-конце может быть образована путем конъюгации "в себе" участка (Yc) к участку (Y) и самоотжига участков (Yc) и (Y). Молекулы одноцепочечной НК по настоящему изобретению могут образовывать двойные цепи внутримолекулярно, как описано выше. Таким образом, строение молекулы одноцепочечной НК полностью отличается от строения двухцепочечной РНК, полученной путем отжига двух отдельных одноцепочечных РНК, например, таких как миРНК, обычно используемых для РНК-интерференции.
[0021] В молекуле одноцепочечной НК по настоящему изобретению последовательность, подавляющая экспрессию, представляет собой последовательность, которая проявляет действие подавления экспрессии целевого гена, например, при введении в клетку in vivo или in vitro молекулы одноцепочечной НК по настоящему изобретению. Нет конкретных ограничений для последовательности, подавляющей экспрессию, и ее можно выбирать подходящим образом в зависимости от вида целевого гена, экспрессию которого необходимо подавлять. В качестве последовательности, подавляющей экспрессию, можно использовать, в зависимости от ситуации, например, последовательность, вовлеченную в РНК-интерференцию, которая опосредована миРНК. В общем, РНК-интерференция представляет собой феномен расщепления дайсером длинной двухцепочечной РНК (дцРНК) в клетке для получения двухцепочечной РНК (миРНК: малой интерферирующей РНК), состоящей примерно из 19-21 пары оснований и имеющей выступающий 3'-конец, и одной из одноцепочечных РНК, и состоит в связывании миРНК с целевой мРНК до разрушения мРНК, в результате чего подавляется трансляция мРНК. В качестве последовательности одноцепочечной РНК известны, например, разные виды целевых генов для связывания миРНК с целевой мРНК. В настоящем изобретении в качестве последовательности, подавляющей экспрессию, например, можно использовать последовательности одноцепочечной РНК из миРНК.
[0022] Следует отметить, что информация о последовательности, подавляющей экспрессию целевого гена, не является целью настоящего изобретения. Фактически настоящее изобретение относится к структуре молекулы нуклеиновой кислоты, которая позволит последовательности, подавляющей экспрессию целевого гена, функционировать в клетке, например, проявлять ингибирующее действие, направленное на целевой ген. Таким образом, в настоящем изобретении в качестве последовательности, подавляющей экспрессию, можно использовать не только последовательности одноцепочечной РНК из миРНК, известные на момент регистрации настоящей заявки, но также, например, последовательности, которые будут идентифицированы в будущем.
[0023] Последовательность, подавляющая экспрессию, предпочтительно является комплементарной заданному участку целевого гена, например, по меньшей мере на 90%, более предпочтительно комплементарна на 95%, еще более предпочтительно комплементарна на 98%, и особенно предпочтительно комплементарна на 100%. Если последовательность, подавляющая экспрессию, соответствует указанной выше степени комплементарности, то можно, например, адекватно уменьшить нецелевое действие.
[0024] Конкретные примеры последовательности, подавляющей экспрессию, состоят в следующем: например, если целевой ген представляет собой ген GAPDH, можно использовать 19-мерную последовательность, показанную в SEQ ID NO: 1; например, если целевой ген представляет собой ген TGF-β1, можно использовать 21-мерную последовательность, показанную в SEQ ID NO: 16; например, если целевой ген представляет собой ген LAMA1, можно использовать 19-мерную последовательность, показанную в SEQ ID NO: 5; и, например, если целевой ген представляет собой ген LMNA, можно использовать 19-мерную последовательность, показанную в SEQ ID NO: 6.
5'-GUUGUCAUACUUCUCAUGG-3' (SEQ ID NO: 1)
5'-AAAGUCAAUGUACAGCUGCUU-3' (SEQ ID NO: 16)
5'-AUUGUAACGAGACAAACAC-3' (SEQ ID NO: 5)
5'-UUGCGCUUUUUGGUGACGC-3' (SEQ ID NO: 6)
[0025] Предполагается, что подавление экспрессии целевого гена с помощью молекулы одноцепочечной НК по настоящему изобретению достигается посредством РНК-интерференции или явления, сходного с РНК-интерференцией (феномена по типу РНК-интерференции), обусловленного структурой молекулы одноцепочечной НК, в которую, например, включена последовательность, подавляющая экспрессию, по меньшей мере в одном из внутреннего участка (Z), 5'-концевого участка (Xc) и 3'-концевого участка (Yc). Вместе с тем, следует отметить, что настоящее изобретение никоим образом не ограничено указанным механизмом. Например, в отличие от так называемых миРНК, молекула одноцепочечной НК по настоящему изобретению не вводится в клетку или в подобную единицу в виде дцРНК, состоящей из двух одноцепочечных РНК, и не всегда является необходимым разрушать последовательность, подавляющую экспрессию в клетке. Таким образом, например, можно сказать, что молекула одноцепочечной НК по настоящему изобретению проявляет действие по типу РНК-интерференции.
[0026] В молекуле одноцепочечной НК по настоящему изобретению последовательность, подавляющая экспрессию, включена по меньшей мере в один участок из внутреннего участка (Z), 5'-концевого участка (Xc) и 3'-концевого участка (Yc), как описано выше. Молекула одноцепочечной НК по настоящему изобретению может включать одну последовательность, подавляющую экспрессию, или, например, две или более последовательности, подавляющие экспрессию.
[0027] В последнем случае молекула одноцепочечной НК по настоящему изобретению может включать, например, две или более одинаковых подавляющих экспрессию последовательности для одного и того же целевого гена; две или более разных подавляющих экспрессию последовательности для одного и того же целевого гена, или две или более разных последовательности, подавляющих экспрессию, для разных целевых генов. Если молекула одноцепочечной НК по настоящему изобретению включает две или более последовательности, подавляющие экспрессию, то нет конкретных ограничений для местоположения соответствующих последовательностей, подавляющих экспрессию, и они могут располагаться в одном участке или в разных участках, выбираемых из внутреннего участка (Z), 5'-концевого участка (Xc) и 3'-концевого участка (Yc). Если молекула одноцепочечной НК по настоящему изобретению включает две или более последовательности, подавляющие экспрессию, для разных целевых генов, молекула одноцепочечной НК по настоящему изобретению может подавлять экспрессию, например, двух или более видов разных целевых генов.
[0028] Как описано выше, внутренний участок (Z) состоит из внутреннего 5'-концевого участка (X) и внутреннего 3'-концевого участка (Y), которые связаны друг с другом. Например, участки (X) и (Y) связаны непосредственно друг с другом без промежуточных последовательностей между ними. Внутренний участок (Z) указан просто для обозначения окружения последовательности между 5'-концевым участком (Xc) и 3'-концевым участком (Yc) и описывается как участок, "состоящий из внутреннего 5'-концевого участка (X) и внутреннего 3'-концевого участка (Y), которые связаны друг с другом". В настоящем описании не рассмотрено в качестве ограничения, что при использовании молекулы одноцепочечной НК 5'-концевой участок (Xc) и 3'-концевой участок (Xc) во внутреннем участке (Z) представляют собой, например, дискретные независимые участки. Таким образом, например, если последовательность, подавляющая экспрессию, включена во внутренний участок (Z), то последовательность, подавляющая экспрессию, может быть расположена так, что она проходит через участки (X) и (Y) во внутреннем участке (Z).
[0029] В молекуле одноцепочечной НК по настоящему изобретению 5'-концевой участок (Xc) является комплементарным для внутреннего 5'-концевого участка (X). Необходимым условием является наличие в участке (Xc) последовательности, комплементарной для всего участка или части участка (X). В частности, например, желательно, чтобы участок (Xc) включал последовательность, комплементарную для всего участка или для части участка (X), или состоял из упомянутых участков. Например, участок (Xc) может быть абсолютно комплементарным для всего участка или части участка (X), или одно или несколько оснований в участке (Xc) может быть некомплементарным для упомянутых участков. Предпочтительно, чтобы участок (Xc) был абсолютно комплементарным для упомянутых участков. В молекуле одноцепочечной НК по настоящему изобретению 3'-концевой участок (Yc) является комплементарным внутреннему 3'-концевому участку (Y). Необходимым условием является наличие в участке (Yc) последовательности, комплементарной для всего участка или части участка (Y). В частности, например, желательно, чтобы участок (Yc) включал последовательность, комплементарную для всего участка или для части участка (Y), или состоял из упомянутых участков. Например, участок (Yc) может быть абсолютно комплементарным для всего участка или части участка (Y), или одно или несколько оснований в участке (Yc) могут быть некомплементарными для упомянутых участков. Предпочтительно, чтобы участок (Yc) был абсолютно комплементарным для упомянутых участков. Экспрессия "одного или нескольких оснований" означает, например, от 1 до 3 оснований, предпочтительно экспрессию 1 основания или 2 оснований.
[0030] В молекуле одноцепочечной НК по настоящему изобретению 5'-концевой участок (Xc) и внутренний 5'-концевой участок (X) могут быть связаны друг с другом, например, прямым или опосредованным образом. В первом случае участки (Xc) и (X) могут быть связаны прямым образом, например, посредством фосфодиэфирной связи. В последнем случае строение молекулы одноцепочечной НК может быть, например, таковым, что молекула имеет линкерный участок (Lx) между участками (Xc) и (X), и участки (Xc) и (X) связаны через линкерный участок (Lx).
[0031] В молекуле одноцепочечной НК по настоящему изобретению 3'-концевой участок (Yc) и внутренний 3'-концевой участок (Y) могут быть связаны друг с другом, например, прямо или опосредованно. В первом случае участки (Yc) и (Y) могут быть связаны, например, прямым образом посредством фосфодиэфирной связи. В последнем случае молекула одноцепочечной НК может иметь, например, такое строение, что в ней имеется линкерный участок (Ly) между участками (Yc) и (Y), и участки (Yc) и (Y) связаны через линкерный участок (Ly).
[0032] Молекула одноцепочечной НК по настоящему изобретению может иметь, например, или оба линкерных участков (Lx) и (Ly), или может иметь один из упомянутых участков. В последнем случае строение молекулы одноцепочечной НК по настоящему изобретению может быть таковым, что, например, эта молекула имеет линкерный участок (Lx) между 5'-концевым участком (Xc) и внутренним 5'-концевым участком (X), при этом линкерный участок (Ly) между 3'-концевым участком (Yc) и внутренним 3'-концевым участком (Y) отсутствует, то есть участки (Yc) и (Y) связаны друг с другом прямым образом. Также в последнем случае строение молекулы одноцепочечной НК по настоящему изобретению может быть таковым, например, что молекула имеет линкерный участок (Ly) между 3'-концевым участком (Yc) и внутренним 3'-концевым участком (Y), при этом отсутствует линкерный участок (Lx) между 5'-концевым участком (Xc) и внутренним 5'-концевым участком (X), то есть участки (Xc) и (X) связаны друг с другом прямым образом.
[0033] Предпочтительно, каждый из линкерных участков (Lx) и (Ly) имеет такую структуру, что внутри этих участков не происходит самоотжига.
[0034] Фигура 1 показывает схематическое изображение примера молекулы одноцепочечной НК по настоящему изобретению, не включающей линкерный участок. Фигура 1А представляет собой схематическое изображение, показывающее порядок соответствующих участков от 5'-конца к 3'-концу в молекуле одноцепочечной НК. Фигура 1В представляет собой схематическое изображение, показывающее состояние, при котором образуются двойные цепи в молекуле одноцепочечной НК. Как показано на фиг. 1B, в молекуле одноцепочечной НК 5'-концевой участок (Xc) конъюгирует "в себе", при этом двойная цепь образована 5'-концевым участком (Xc) и внутренним 5'-концевым участком (X), и 3'-концевой участок (Yc) конъюгирует "в себе", при этом двойная цепь образована 3'-концевым участком (Yc) и внутренним 3'-концевым участком (Y). Схематические изображения на фигуре 1 показывают, например, только порядок связывания соответствующих участков друг с другом и взаимное расположение соответствующих участков, образующих двойные цепи, и указанные изображения не ограничивают длину и т.п. каждого участка.
[0035] Фигура 2 показывает схематические изображения примера молекулы одноцепочечной НК по настоящему изобретению, включающей линкерные участки. Фигура 2А представляет собой схематическое изображение, показывающее порядок соответствующих участков от 5'-конца к 3'-концу в молекуле одноцепочечной НК, в качестве иллюстративного примера. Фигура 2В представляет собой схематическое изображение, показывающее состояние, при котором происходит образование двойных цепей в молекуле одноцепочечной НК. Как показано на фигуре 2В, в молекуле одноцепочечной НК двойные цепи образуются между 5'-концевым участком (Xc) и внутренним 5'-концевым участком (X) и, соответственно, между внутренним 3'-концевым участком (Y) и 3'-концевым участком (Yc), и каждый из Lx-участка и Ly-участка имеет структуру петли. Схематические изображения на фигуре 2 показывают, например, только порядок связывания соответствующих участков друг с другом и взаимное расположение соответствующих участков, образующих двойные цепи, и указанные изображения не ограничивают длину и т.п. каждого участка.
[0036] В молекуле одноцепочечной НК по настоящему изобретению конкретно не ограничено количество оснований в каждом из 5'-концевого участка (Xc), внутреннего 5'-концевого участка (X), внутреннего 3'-концевого участка (Y) и 3'-концевого участка (Yc), и это количество может в качестве примера иметь нижеуказанные значения. В настоящем изобретении "количество оснований" означает, например, "длину" и также может называться "длиной в основаниях".
[0037] Как описано выше, 5'-концевой участок (Xc) может быть комплементарным, например, для всего участка из внутреннего 5'-концевого участка (X). В этом случае является предпочтительным, например, чтобы участок (Xc) имел такую же длину в основаниях, как и участок (X), и состоял из последовательности оснований, которая комплементарна для всего участка на протяжении от 5'-конца к 3'-концу участка (X). Более предпочтительно, например, чтобы участок (Xc) имел такую же длину в основаниях, как и участок (X), и все основания в участке (Xc) были комплементарными для всех оснований в участке (X), т.е., чтобы участок (Xc) был полностью комплементарен участку (X). Вместе с тем, следует отметить, что строение участка (Xc) не ограничено описанием выше, и например, одно или несколько оснований в участке (Xc) могут быть некомплементарными соответствующим основаниям в участке (X), как описано выше.
[0038] Кроме того, согласно описанию выше, 5'-концевой участок (Xc) может быть комплементарным, например, для части внутреннего 5'-концевого участка (X). В этом случае, например, является предпочтительным, чтобы участок (Xc) имел такую же длину в основаниях, как и часть участка (X), т.е., чтобы участок (Xc) состоял из последовательности оснований, длина которой по количеству оснований меньше на одно или несколько оснований, чем длина в основаниях участка (X). Более предпочтительно, чтобы участок (Xc) имел такую же длину в основаниях, как часть участка (X), и все основания в участке (Xc) были бы комплементарны всем основаниям в части участка (X), т.е., например, чтобы участок (Xc) был полностью комплементарен части участка (X). Например, часть участка (X) предпочтительно представляет собой участок (сегмент), имеющий последовательность оснований, которая состоит из последовательных оснований, начиная с основания на 5'-конце (первое основание) в участке (X).
[0039] Как описано выше, 3'-концевой участок (Yc) может быть комплементарным, например, для всего участка из внутреннего 3'-концевого участка (Y). В этом случае является предпочтительным, чтобы, например, участок (Yc) имел такую же длину в основаниях, как участок (Y), и состоял из последовательности оснований, комплементарных для всего участка на протяжении от 5' конца к 3'-концу участка (Y). Более предпочтительно, чтобы участок (Yc) имел такую же длину в основаниях, как участок (Y), и все основания в участке (Yc) были бы комплементарными для всех оснований в участке (Y), т.е., например, чтобы участок (Yc) был полностью комплементарен участку (Y). Вместе с тем, следует отметить, что строение участка (Yc) не ограничено вышеуказанным, и одно или несколько оснований в участке (Yc) могут быть некомплементарными соответствующим основаниям в участке (Y), например, как описано выше.
[0040] Кроме того, 3'-концевой участок (Yc) может быть комплементарным для части внутреннего 3'-концевого участка (Y), например, как описано выше. В этом случае является предпочтительным, чтобы, например, участок (Yc) имел такую же длину в основаниях, как часть участка (Y), т.е., чтобы участок (Yc) состоял из последовательности оснований, длина которой по количеству оснований была меньше на одно или несколько оснований, чем длина в основаниях участка (Y). Более предпочтительно, чтобы участок (Yc) имел такую же длину в основаниях, как часть участка (Y), и чтобы все основания в участке (Yc) были бы комплементарны всем основаниям в части участка (Y), т.е., например, чтобы участок (Yc) был полностью комплементарен для части участка (Y). Часть участка (Y) предпочтительно представляет собой, например, участок (сегмент), имеющий последовательность оснований, которая состоит из последовательных оснований, начиная с основания на 3'-конце (первое основание) в участке (Y).
[0041] В молекуле одноцепочечной НК по настоящему изобретению соотношения числа оснований (Z) во внутреннем участке (Z) к числу оснований (X) во внутреннем 5'-концевом участке (X) и к числу оснований (Y) во внутреннем 3'-концевом участке (Y), и отношение числа оснований (Z) во внутреннем участке (Z) к числу оснований (X) во внутреннем 5'-концевом участке (X) и к числу оснований (Xc) в 5'-концевом участке (Xc) удовлетворяют условиям выражений (1) и (2), например:
Z=X+Y (1)
Z≥Xc+Yc (2)
[0042] В молекуле одноцепочечной НК по настоящему изобретению нет конкретного ограничения для соотношения длины между числом оснований (X) во внутреннем 5'-концевом участке (X) и числом оснований (Y) во внутреннем 3'-концевом участке (Y), и это соотношение может соответствовать любым условиям согласно следующим выражениям, например:
X=Y (19)
X<Y (20)
X>Y (21)
[0043] В молекуле одноцепочечной НК по настоящему изобретению соотношение между числом оснований (X) во внутреннем 5'-концевом участке (X) и числом оснований (Xc) в 5'-концевом участке (Xc), и соотношение между числом оснований (Y) во внутреннем 3'-концевом участке (Y) и числом оснований (Yc) в 3'-концевом участке (Yc) соответствуют любому из следующих условий: от (а) до (d), например:
(a) соответствуют условиям выражений (3) и (4).
X>Хс (3)
Y=Yc (4)
(b) соответствуют условиям выражений (5) и (6).
X=Xc (5)
Y>Yc (6)
(c) соответствуют условиям выражений (7) и (8).
X>Хс (7)
Y>Yc (8)
(d) соответствуют условиям выражений (9) и (10).
X=Xc (9)
Y=Yc (10)
[0044] Согласно вышеуказанным условиям от (а) до (d), разница между числом оснований (X) во внутреннем 5'-концевом участке (X) и числом оснований (Xc) в 5'-концевом участке (Xc) и разница между числом оснований (Y) во внутреннем 3'-концевом участке (Y) и числом оснований (Yc) в 3'-концевом участке (Yc) предпочтительно соответствуют следующим условиям от (а) до (d), например:
(а) соответствуют условиям выражений (11) и (12).
X-Xc=от 1 до 10, предпочтительно 1, 2, 3 или 4,
и более предпочтительно 1, 2 или 3 (11)
Y-Yc=0 (12)
(b) соответствуют условиям выражений (13) и (14).
X-Xc=0 (13)
Y-Yc=от 1 до 10, предпочтительно 1, 2, 3 или 4,
и более предпочтительно 1, 2 или 3 (14)
(c) соответствуют условиям выражений (15) и (16).
X-Xc=от 1 до 10, предпочтительно 1, 2 или 3,
и более предпочтительно 1 или 2 (15)
Y-Yc=0 (16)
(d) соответствуют условиям выражений (17) и (18).
X-Xc=0 (17)
Y-Yc=0 (18)
[0045] В отношении молекул одноцепочечной НК, соответствующих условиям от (а) до (d), примеры их структуры показаны в схематическом виде соответственно на фиг. 3. Фигура 3 показывает молекулы одноцепочечной НК, включающие линкерные участки (Lx) и (Ly). Фигура 3А показывает пример молекулы одноцепочечной НК, соответствующей условию (а), фигура 3B показывает пример молекулы одноцепочечной НК, соответствующей условию (b), фиг. 3C показывает пример молекулы одноцепочечной НК, соответствующей условию (c), и фиг. 3D показывает пример молекулы одноцепочечной НК, соответствующей условию (d). Пунктирные линии на фиг. 3 указывают состояние, при котором образуются двойные цепи путем самоотжига. Молекулы одноцепочечной НК, показанные на фиг. 3, относятся к примерам, в которых соотношения между числом оснований (X) во внутреннем 5'-концевом участке (X) и числом оснований (Y) во внутреннем 3'-концевом участке (Y) соответствуют условию "X<Y" выражения (20). Вместе с тем, следует отметить, что соотношения не ограничены вышеуказанным, и условиям может соответствовать отношение "X=Y" из выражения (19) или "X>Y" из выражения (21). Схематические изображения на фигуре 3 просто показывают соотношение между внутренним 5'-концевым участком (X) и 5'-концевым участком (Xc), и соотношение между внутренним 3'-концевым участком (Y) и 3'-концевым участком (Yc), и не ограничивают, например, показатели длины, формы и т.п. для каждого участка, а также наличие или отсутствие линкерных участков (Lx) и (Ly).
[0046] Каждая из молекул одноцепочечной НК, соответствующая условиям от (а) до (с), имеет такое строение, что, например, при образовании двойной цепи 5'-концевым участком (Xc) и внутренним 5'-концевым участком (X) и 3'-концевым участком (Yc) и внутренним 3'-концевым участком (Y), соответственно, внутренний участок (Z) включает по меньшей мере одно основание, в связи с чем невозможно его выравнивание как с 5'-концевым участком (Xc), так и с 3'-концевым участком (Yc). Основание во внутреннем участке (Z), которое невозможно выровнять (основание, которое не образует двойную цепь), далее в изобретении также называется "непарным основанием". На фиг. 3 участок, состоящий из непарного основания (оснований), обозначен как участок "F". Количество оснований в участке (F) не имеет конкретных ограничений. Количество оснований (F) в участке (F) является следующим, например: "Xc-X" в случае соответствия молекулы одноцепочечной НК условию (а); "Y-Yc" в случае соответствия молекулы одноцепочечной НК условию (b); и общее количество "Xc-X" и "Y-Yc" в случае соответствия молекулы одноцепочечной НК условию (c).
[0047] С другой стороны, соответствующая условию (d) молекула одноцепочечной НК имеет такое строение, что, например, вся область внутреннего участка (Z) совпадает с 5'-концевым участком (Xc) и 3'-концевым участком (Yc), другими словами, вся область внутреннего участка (Z) образует двойную цепь. В молекуле одноцепочечной НК, соответствующей условию (d), 5'-конец 5'-концевого участка (Xc) и 3'-конец 3'-концевого участка (Yc) не связаны друг с другом.
[0048] Примеры длины соответствующих участков в молекуле одноцепочечной НК по настоящему изобретению приведены ниже. Вместе с тем, следует отметить, что это никоим образом не ограничивает настоящее изобретение. В настоящем изобретении, например, числовой диапазон, относящийся к количеству оснований, охватывает все положительные целые числа, входящие в этот диапазон. Например, упомянутое в описании количество "от 1 до 4 оснований" охватывает все значения "1, 2, 3 и 4 основания" (и аналогичный подход применяется в дальнейшем описании).
[0049] Общее число оснований в 5'-концевом участке (Xc), оснований в 3'-концевом участке (Yc) и непарных оснований (F) во внутреннем участке (Z) равно, например, числу оснований во внутреннем участке (Z). Таким образом, можно считать подходящей длину 5'-концевого участка (Xc) и длину 3'-концевого участка (Yc), и это зависит, например, от длины внутреннего участка (Z), от числа непарных оснований (F) и расположения непарных оснований.
[0050] Число оснований во внутреннем участке (Z) составляет, например, 19 или более. Нижней границей количества оснований, является, например, 19, предпочтительно 20 и более предпочтительно 21 основание. Верхней границей количества оснований, например, является 50, предпочтительно 40 и более предпочтительно 30 оснований. Конкретный пример числа оснований во внутреннем участке (Z) составляет 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30.
[0051] Если внутренний участок (Z) включает последовательность, подавляющую экспрессию, внутренний участок (Z) может представлять собой, например, участок, который состоит только из последовательности, подавляющей экспрессию, или участок, включающий последовательность, подавляющую экспрессию. Количество оснований в последовательности, подавляющей экспрессию, составляет, например, от 19 до 30, предпочтительно 19, 20 или 21 основание. Если внутренний участок (Z) включает последовательность, подавляющую экспрессию, эта последовательность, подавляющая экспрессию, также может иметь дополнительную последовательность на своем 5'-конце и/или 3'-конце. Количество оснований в дополнительной последовательности составляет, например, от 1 до 31, предпочтительно от 1 до 21, более предпочтительно от 1 до 11, и еще более предпочтительно от 1 до 7 оснований.
[0052] Число оснований в 5'-концевом участке (Xc) составляет, например, от 1 до 29, предпочтительно от 1 до 11, более предпочтительно от 1 до 7, еще более предпочтительно от 1 до 4, и особенно предпочтительно 1, 2 или 3 основания. Если внутренний участок (Z) или 3'-концевой участок (Yc) включает последовательность, подавляющую экспрессию, предпочтительным является, например, количество оснований, указанное выше. Конкретный пример представляет собой следующее: если число оснований во внутреннем участке (Z) составляет от 19 до 30 (например, 19), то количество оснований в 5'-концевом участке (Xc) составляет, например, от 1 до 11, предпочтительно от 1 до 7, более предпочтительно от 1 до 4, и еще более предпочтительно 1, 2 или 3 основания.
[0053] Если 5'-концевой участок (Xc) включает последовательность, подавляющую экспрессию, 5'-концевой участок (Xc) может представлять собой, например, участок, который состоит исключительно из последовательности, подавляющей экспрессию, или участок, включающий последовательность, подавляющую экспрессию. Длиной последовательности, подавляющей экспрессию, является, например, длина, указанная выше. Если 5'-концевой участок (Xc) включает последовательность, подавляющую экспрессию, эта последовательность, подавляющая экспрессию, также может иметь дополнительную последовательность на своем 5'-конце и/или 3'-конце. Количество оснований в дополнительной последовательности составляет, например, от 1 до 11, предпочтительно от 1 до 7 оснований.
[0054] Число оснований в 3'-концевом участке (Yc), например, составляет от 1 до 29, предпочтительно от 1 до 11, более предпочтительно от 1 до 7, еще более предпочтительно от 1 до 4, и особенно предпочтительно 1, 2 или 3 основания. Если внутренний участок (Z) или 5'-концевой участок (Xc) включает последовательность, подавляющую экспрессию, то предпочтительным является количество оснований, например, указанное выше. Конкретный пример представляет собой следующее: если количество оснований во внутреннем участке (Z) составляет от 19 до 30 (например, 19), то количество оснований в 3'-концевом участке (Yc), например, составляет от 1 до 11, предпочтительно от 1 до 7, более предпочтительно от 1 до 4, и еще более предпочтительно 1, 2 или 3 оснований.
[0055] Если 3'-концевой участок (Yc) включает последовательность, подавляющую экспрессию, то 3'-концевой участок (Yc) может представлять собой, например, участок, который состоит только из последовательности, подавляющей экспрессию, или участок, включающий последовательность, подавляющую экспрессию. Длиной последовательности, подавляющей экспрессию, является, например, длина, указанная выше. Если 3'-концевой участок (Yc) включает последовательность, подавляющую экспрессию, то эта последовательность, подавляющая экспрессию, может также иметь дополнительную последовательность на своем 5'-конце и/или 3'-конце. Количество оснований в дополнительной последовательности составляет, например, от 1 до 11, предпочтительно от 1 до 7 оснований.
[0056] Как описано выше, соотношение числа оснований во внутреннем участке (Z), числа оснований в 5'-концевом участке (Xc) и числа оснований в 3'-концевом участке (Yc) можно обозначить, например, выражением (2): "Z≥Xc+Yc". В частности, например, число оснований согласно выражению "Xc+Yc" равно числу оснований во внутреннем участке (Z) или меньше, чем число оснований во внутреннем участке (Z). В последнем случае значение "Z-(Xc+Yc)" составляет, например, от 1 до 10, предпочтительно от 1 до 4, и более предпочтительно 1, 2 или 3. Значение "Z-(Xc+Yc)" соответствует, например, числу оснований (F) в участке (F) непарных оснований во внутреннем участке (Z).
[0057] В молекуле одноцепочечной НК по настоящему изобретению значения длины линкерных участков (Lx) и (Ly) не имеют конкретных ограничений. Длина линкерного участка (Lx) предпочтительно такова, что, например, внутренний 5'-концевой участок (X) и 5'-концевой участок (Xc) могут образовывать двойные цепи. Длина линкерного участка (Ly) предпочтительно такова, что, например, внутренний 3'-концевой участок (Y) и 3'-концевой участок (Yc) могут образовывать двойные цепи. Если компоненты (конструктивные блоки) линкерных участков (Lx) и (Ly) включают основания, количество оснований в линкерном участке (Lx) может быть равным или отличаться от количества оснований в линкерном участке (Ly). Также последовательности оснований указанных участков могут быть одинаковыми или разными. Нижней границей количества оснований в каждом из линкерных участков (Lx) и (Ly) является, например, 1, предпочтительно 2, и более предпочтительно 3 основания, и верхней границей этого значения является, например, 100, предпочтительно 80 и более предпочтительно 50 оснований. В частности, количество оснований в каждом из линкерных участков составляет, например, от 1 до 50, от 1 до 30, от 1 до 20, от 1 до 10, от 1 до 7 или от 1 до 4 оснований, но не ограничено этими примерами.
[0058] Общая длина молекулы одноцепочечной НК по настоящему изобретению не имеет конкретных ограничений. В молекуле одноцепочечной НК по настоящему изобретению нижней границей общего количества оснований (количества оснований в полноразмерной молекуле одноцепочечной НК), является, например, 38, предпочтительно 42, более предпочтительно 50, еще более предпочтительно 51 и особенно предпочтительно 52 основания, и верхней границей этого значения является, например, 300, предпочтительно 200, более предпочтительно 150, еще более предпочтительно 100 и особенно предпочтительно 80 оснований. В молекуле одноцепочечной НК по настоящему изобретению нижней границей общего количества оснований, за исключением оснований в линкерных участках (Lx) и (Ly), является, например, 38 оснований, предпочтительно 42, более предпочтительно 50, еще более предпочтительно 51 и особенно предпочтительно 52 оснований, и верхней границей этого значения, является, например, 300 оснований, предпочтительно 200, более предпочтительно 150, еще более предпочтительно 100 и особенно предпочтительно 80 оснований.
[0059] Компоненты молекулы одноцепочечной НК по настоящему изобретению конкретно не ограничены, и в число их примеров включены нуклеотидные остатки. Примеры нуклеотидных остатков включают рибонуклеотидные остатки и дезоксирибонуклеотидные остатки. Нуклеотидный остаток может представлять собой, например, остаток, который не подвергался модификации (немодифицированный нуклеотидный остаток), или остаток, который был модифицирован (модифицированный нуклеотидный остаток). Путем создания такой конфигурации молекулы одноцепочечной НК по настоящему изобретению, чтобы она включала модифицированный нуклеотидный остаток, можно улучшать, например, устойчивость молекулы одноцепочечной НК к нуклеазам, что таким образом позволяет повысить стабильность молекулы одноцепочечной НК. Кроме того, молекула одноцепочечной НК по настоящему изобретению также может включать в дополнение к нуклеотидному остатку, например, ненуклеотидный остаток. Подробное описание нуклеотидного остатка и ненуклеотидного остатка приведено ниже.
[0060] В молекуле одноцепочечной НК по настоящему изобретению в качестве компонента каждого из внутреннего участка (Z), 5'-концевого участка (Xc) и 3'-концевого участка (Yc) предпочтительным является нуклеотидный остаток. Каждый из участков состоит из любого из следующих остатков от (1) до (3), например:
(1) из немодифицированного нуклеотидного остатка (остатков);
(2) из модифицированного нуклеотидного остатка (остатков);
(3) из немодифицированного нуклеотидного остатка (остатков) и модифицированного нуклеотидного остатка (остатков).
[0061] В молекуле одноцепочечной НК по настоящему изобретению компоненты линкерных участков (Lx) и (Ly) не имеют конкретных ограничений, и примеры этих компонентов включают описанные выше нуклеотидные остатки и ненуклеотидные остатки. Каждый из линкерных участков может состоять исключительно из нуклеотидного остатка (остатков), исключительно из ненуклеотидного остатка (остатков) или из обоих типов остатков: нуклеотидного остатка (остатков) и ненуклеотидного остатка (остатков). Например, каждый из линкерных участков состоит из любого из нижеперечисленных остатков от (1) до (7):
(1) из немодифицированного нуклеотидного остатка (остатков);
(2) из модифицированного нуклеотидного остатка (остатков);
(3) из немодифицированного нуклеотидного остатка (остатков) и модифицированного нуклеотидного остатка (остатков);
(4) из ненуклеотидного остатка (остатков);
(5) из ненуклеотидного остатка (остатков) и немодифицированного нуклеотидного остатка (остатков);
(6) из ненуклеотидного остатка (остатков) и модифицированного нуклеотидного остатка (остатков);
(7) из ненуклеотидного остатка (остатков), немодифицированного нуклеотидного остатка (остатков) и модифицированного нуклеотидного остатка (остатков).
[0062] Если молекула одноцепочечной НК по настоящему изобретению имеет оба линкерных участка (Lx) и (Ly), компоненты обоих участков могут быть, например, одинаковыми или разными. Конкретные примеры представляют собой следующее: компонентами обоих участков являются нуклеотидные остатки; компонентами обоих участков являются ненуклеотидные остатки; и компонентом одного из участков является нуклеотидный остаток, при этом компонентом другого линкерного участка является ненуклеотидный остаток.
[0063] Примеры молекул одноцепочечной НК по настоящему изобретению включают: молекулы, состоящие исключительно из нуклеотидных остатков; и молекулы, включающие ненуклеотидный остаток (остатки) в дополнение к нуклеотидным остаткам. Например, в молекуле одноцепочечной НК по настоящему изобретению нуклеотидные остатки могут представлять собой исключительно немодифицированные нуклеотидные остатки; исключительно модифицированные нуклеотидные остатки; или оба типа остатков: и немодифицированный нуклеотидный остаток (остатки), и модифицированный нуклеотидный остаток (остатки), как описано выше. Если молекула одноцепочечной НК включает и немодифицированный нуклеотидный остаток (остатки), и модифицированный нуклеотидный остаток (остатки), то количество модифицированных нуклеотидных остатков (остатка) не имеет конкретных ограничений, и составляет, например, "один или более", в частности, например, от 1 до 5, предпочтительно от 1 до 4, более предпочтительно от 1 до 3 и наиболее предпочтительно 1 или 2 остатка. Если молекула одноцепочечной НК по настоящему изобретению включает ненуклеотидный остаток (остатки), количество ненуклеотидных остатков (остатка) не имеет конкретных ограничений и составляет, например, "один или более", в частности, например, от 1 до 8, от 1 до 6, от 1 до 4 или 1, 2 или 3 остатка.
[0064] В молекуле одноцепочечной НК по настоящему изобретению нуклеотидным остатком предпочтительно является, например, рибонуклеотидный остаток. В этом случае молекулу одноцепочечной НК по настоящему изобретению также называют, например, "молекулой РНК" или "одноцепочечной молекулой РНК" (оцРНК). Примеры молекул оцРНК включают: молекулы, состоящие исключительно из рибонуклеотидных остатков; и молекулу, включающую ненуклеотидный остаток (остатки) в дополнение к рибонуклеотидным остаткам. Как описано выше, в качестве рибонуклеотидных остатков молекулы оцРНК могут включать, например: исключительно немодифицированные рибонуклеотидные остатки; исключительно модифицированные рибонуклеотидные остатки; или оба типа остатков: и немодифицированный рибонуклеотидный остаток (остатки), и модифицированный рибонуклеотидный остаток (остатки).
[0065] Если молекула оцРНК включает модифицированный рибонуклеотидный остаток (остатки) в дополнение к немодифицированным рибонуклеотидным остаткам, то, например, количество модифицированных рибонуклеотидных остатков (остатка) не имеет конкретных ограничений и составляет, например, "один или более", в частности, например, от 1 до 5, предпочтительно от 1 до 4, более предпочтительно от 1 до 3 и наиболее предпочтительно 1 или 2 остатка. Альтернативно, модифицированным рибонуклеотидным остатком, в отличие от немодифицированного рибонуклеотидного остатка, может быть дезоксирибонуклеотидный остаток, например, полученный путем замены остатка рибозы на остаток дезоксирибозу. Если молекула оцРНК включает дезоксирибонуклеотидный остаток (остатки) в дополнение к немодифицированному рибонуклеотидному остатку (остаткам), то, например, количество дезоксирибонуклеотидных остатков (остатка) не имеет конкретных ограничений и составляет, например, "один или более", в частности, например, от 1 до 5, предпочтительно от 1 до 4, более предпочтительно от 1 до 3 и наиболее предпочтительно 1 или 2 остатка.
[0066] Молекула одноцепочечной НК по настоящему изобретению может включать, например, маркирующее вещество (маркер), и может иметь метку маркирующим веществом. Маркирующее вещество без конкретных ограничений может представлять собой, например, флуоресцентное вещество, краситель, изотоп, или подобное вещество. Примеры флуоресцентных веществ включают: флуорофоры, такие как пирен, TAMRA, флуоресцеин, краситель Cy3 и краситель Cy5. Примеры красителей включают красители Alexa, такие как Alexa 488. Примеры изотопов включают стабильные изотопы и радиоизотопы. Среди них предпочтительными являются стабильные изотопы. Стабильные изотопы имеют, например, низкий риск радиационного облучения, и для них не требуется специального оснащения. Таким образом, стабильные изотопы обладают превосходным удобством в применении и могут способствовать снижению затрат. Кроме того, стабильные изотопы не изменяют, например, физические свойства меченного ими соединения и, следовательно, обладают свойством превосходного индикатора. Примеры стабильных изотопов включают без конкретных ограничений 2H, 13C, 15N, 17O, 18O, 33S, 34S и 36С.
[0067] Как описано выше, молекула одноцепочечной НК по настоящему изобретению может подавлять экспрессию целевого гена. Таким образом, молекулу одноцепочечной НК по настоящему изобретению можно применять, например, в качестве терапевтического средства для лечения заболеваний, вызванных геном. Если молекула одноцепочечной НК в качестве подавляющей экспрессию последовательности включает последовательность, которая подавляет экспрессию гена, вызывающего болезнь, эту болезнь, например, можно лечить путем подавления экспрессии целевого гена. В настоящем изобретении термин "лечение" охватывает, например, профилактику заболеваний, улучшение состояния при заболевании и улучшение прогноза, и "лечение" может означать любое из указанных понятий.
[0068] Способ использования молекулы одноцепочечной НК по настоящему изобретению не имеет конкретных ограничений. Например, молекулу одноцепочечной НК можно вводить субъекту, имеющему целевой ген.
[0069] Примеры субъектов, которым вводят молекулу одноцепочечной НК по настоящему изобретению, включают клетки, ткани и органы. Примеры субъектов также включают людей и животных нечеловеческого происхождения, таких как млекопитающие нечеловеческого происхождения, т.е. млекопитающие за исключением людей. Введение можно осуществлять, например, в условиях in vivo или in vitro. Примеры клеток включают без ограничения различные клеточные культуры, такие как клетки HeLa, клетки 293, клетки NIH3T3 и клетки COS, стволовые клетки, такие как клетки ES, и гемопоэтические стволовые клетки, и клетки, выделенные из живых организмов, такие как первичные культуры клеток.
[0070] В настоящем изобретении конкретно не ограничен выбор целевого гена, экспрессию которого необходимо подавлять, и любой желательный ген можно вставлять в целевой ген. Последовательность, подавляющую экспрессию, можно конструировать после вставки целевого гена подходящим способом в зависимости от типа целевого гена, как описано выше.
[0071] Конкретные примеры молекулы одноцепочечной НК по настоящему изобретению описаны ниже. Вместе с тем, следует отметить, что настоящее изобретение не ограничено приведенными примерами. Примеры последовательности оснований в молекуле одноцепочечной НК включают: последовательности оснований от SEQ ID NO: 2, 7, 8, 13, 14, 29 до SEQ ID NO: 35, 37, 43, 44, 47, 48 и от 51 до 80 последовательности; и последовательности оснований, которые получены, например, путем делеции, замены и/или добавления одного или нескольких оснований в указанных последовательностях оснований. Если целевым геном является ген GAPDH, примеры последовательностей оснований в молекуле одноцепочечной НК включают последовательности оснований SEQ ID NO: 2, 7, 8, 13, 37 и от 51 до 80 последовательности. Если целевым геном является TGF-β1, примеры последовательностей оснований в молекуле одноцепочечной НК включают последовательности оснований SEQ ID NO: 14 и от 29 до 35 последовательности. Если целевым геном является ген LAMA1, примеры последовательностей оснований в молекуле одноцепочечной НК включают последовательности оснований SEQ ID NO: 43 и 44. Если целевым геном является ген LMNA, примеры последовательностей оснований в молекуле одноцепочечной НК включают последовательности оснований SEQ ID NO: 47 и 48.
[0072] В отношении использования молекулы одноцепочечной НК по настоящему изобретению, далее представлено следующее описание, рассматривающее композицию, способ подавления, способ лечения и подобное, согласно настоящему изобретению.
[0073] Поскольку молекула одноцепочечной НК по настоящему изобретению может подавлять экспрессию целевого гена, как описано выше, она полезна, например, в качестве фармацевтического, диагностического агента, сельскохозяйственного химического препарата, а также инструмента для проведения исследований с сельскохозяйственными химикатами, в области естественных наук, в медицинской науке и подобных исследований.
[0074] 2. Нуклеотидный остаток
Нуклеотидный остаток включает в качестве компонентов сахар, основание и фосфат. Нуклеотидным остатком может являться, например, рибонуклеотидный остаток или дезоксирибонуклеотидный остаток, как описано выше. Рибонуклеотидный остаток имеет, например, остаток рибозы в качестве сахара; и аденин (A), гуанин (G), цитозин (C) или урацил (U) в качестве основания. Дезоксирибозный остаток имеет, например, остаток дезоксирибозы в качестве сахара; и аденин (A), гуанин (G), цитозин (C) или тимин (Т) в качестве основания.
[0075] Нуклеотидный остаток может представлять собой, например, немодифицированный нуклеотидный остаток или модифицированный нуклеотидный остаток. Например, компоненты немодифицированного нуклеотидного остатка идентичны или по существу идентичны компонентам нуклеотидных остатков природного происхождения. Предпочтительно компоненты являются идентичными или по существу идентичными компонентам нуклеотидных остатков природного происхождения, встречающихся в организме человека.
[0076] Модифицированный нуклеотидный остаток представляет собой нуклеотидный остаток, полученный, например, путем модификации немодифицированного нуклеотидного остатка. Модифицированный нуклеотидный остаток может быть таковым, что модификации подвергается, например, любой из компонентов немодифицированного нуклеотидного остатка. Термин "модификация" в настоящем изобретении означает, например, замену, добавление и/или делецию какого-либо из компонентов; и замену, присоединение и/или удаление атома (атомов) и/или функциональной группы (групп) в компоненте (компонентах). Это явление также может называться "альтерацией". Примеры модифицированного нуклеотидного остатка включают нуклеотидные остатки природного происхождения и искусственно модифицированные нуклеотидные остатки. См., например, ссылку на публикацию по модифицированным нуклеотидным остаткам природного происхождения авторов Limbach et al. (1994, Summary: the modified nucleosides of RNA, Nucleic Acids Res. 22: pp. 2183 to 2196). Модифицированный нуклеотидный остаток может представлять собой, например, остаток альтернативного нуклеотида.
[0077] Примеры модификации нуклеотидных остатков включают модификацию рибозо-фосфатного скелета (далее в изобретении называемого "рибозофосфатным скелетом").
[0078] Рибозный остаток в рибозофосфатном скелете может быть, например, модифицирован. В рибозном остатке может быть модифицирован, например, углерод во 2'-положении. В частности, гидроксильную группу, связанную с углеродом во 2'-положении, можно замещать водородом или галогеном, например, фтором. Путем замещения водородом гидроксильной группы, связанной с углеродом во 2'-положении, можно заменять рибозный остаток на дезоксирибозу. Например, можно замещать рибозный остаток на его стереоизомер, и, например, его можно замещать на арабинозный остаток.
[0079] Рибозофосфатный скелет можно заменять, например, на нерибозофосфатный скелет, несущий нерибозный остаток и/или нефосфатный остаток. Нерибозофосфатный скелет может представлять собой, например, рибозофосфатный скелет, модифицированный таким образом, чтобы не нести заряд. Альтернативные примеры, полученные путем замены в нуклеотиде рибозофосфатного скелета на нерибозофосфатный скелет, включают морфолино, циклобутил и пирролидин. Другие примеры альтернативных остатков включают мономерные остатки искусственных нуклеиновых кислот. Конкретные примеры таких кислот включают PNA (пептидно-нуклеиновую кислоту), LNA (закрытую нуклеиновую кислоту) и ENA (2'-O,4'-C-этилен-мостиковую нуклеиновую кислоту). Из указанных кислот предпочтительной является PNA.
[0080] В рибозофосфатном скелете модифицированными могут быть, например, фосфатные группы. В рибозофосфатном скелете фосфатная группа, расположенная в непосредственной близости к сахарному остатку, называется «α-фосфатной группой". Эта α-фосфатная группа имеет отрицательный заряд, и электрические заряды распределены равномерно между двумя атомами кислорода, которые не связаны с сахарным остатком. Из четырех атомов кислорода в α-фосфатной группе два не связанные с сахарным остатком атома кислорода в фосфодиэфирной связи между нуклеотидными остатками далее в изобретении называются "несвязывающими атомами кислорода". С другой стороны, два атома кислорода, которые связаны с сахарным остатком в фосфодиэфирной связи между нуклеотидными остатками, далее в изобретении называются "связывающими атомами кислорода". Предпочтительно α-фосфатная группа модифицирована, например, таким образом, чтобы не иметь заряд, или таким образом, чтобы распределение заряда между несвязывающими атомами кислорода было асимметричным.
[0081] Несвязывающий атом (атомы) кислорода в фосфатной группе может быть, например, замещенным. Атом (атомы) кислорода можно замещать на любой атом, например, выбираемый из S (серы), Se (селена), B (бора), C (углерода), H (водорода), N (азота) и OR (где R представляет собой алкильную группу или арильную группу), и предпочтительным является замещение серой. Например, желательно замещать оба несвязывающих атома кислорода, и более предпочтительно, если оба несвязывающих атома кислорода замещаются S. Примеры таких модифицированных фосфатных групп включают фосфоротиоаты, фосфородитиоаты, фосфороселенаты, боранофосфаты, боранофосфатные эфиры, гидрофосфонаты, фосфороамидаты, алкил- или арил-фосфонаты и фосфотриэфиры. В частности, предпочтительным является фосфородитиоат, в котором оба из двух несвязывающих атомов кислорода замещены на S.
[0082] В фосфатной группе связывающий атом (атомы) кислорода, например, может быть замещенным. Атом (атомы) кислорода можно замещать на любой атом, выбираемый, например, из S (серы), C (углерода) и N (азота). Примеры модифицированной таким способом фосфатной группы включают: мостиковые фосфороамидаты, получаемые путем замещения на N; мостиковые фосфоротиоаты, получаемые путем замещения на S, и мостиковые метиленфосфонаты, получаемые путем замещения на C. Предпочтительно, замещение связывающего атома (атомов) кислорода осуществляют, например, по меньшей мере в одном из 5'-концевых нуклеотидных остатков и 3'-концевых нуклеотидных остатков молекулы одноцепочечной НК по настоящему изобретению. Если замещение осуществляют на 5'-конце, предпочтительным является замещение на C. Если замещение осуществляют на 3'-конце, предпочтительным является замещение на N.
[0083] Фосфатную группу можно замещать, например, линкером, не содержащим фосфат. Линкер может содержать силоксан, карбонат, карбоксиметил, карбамат, амид, тиоэфир, этиленоксидный линкер, сульфонат, сульфонамид, тиоформацеталь, формацеталь, оксим, метиленимино, метиленметилимино, метиленгидразо, метилендиметилгидразо, метиленоксиметилимино и тому подобное. Предпочтительно, линкер может содержать метиленкарбониламино-группы и метиленметилимино-группы.
[0084] В молекуле одноцепочечной НК по настоящему изобретению модифицированным может быть, например, по меньшей мере один из нуклеотидных остатков на 3'-конце и нуклеотидных остатков на 5'-конце. Например, модифицированным может быть нуклеотидный остаток как на 3'-конце, так и на 5'-конце, или нуклеотидные остатки на обоих концах - 3'-конце и 5'-конце. Модификацию можно осуществлять, например, как описано выше, и предпочтительной является модификация фосфатной группы (групп) на конце (на концах). Например, можно модифицировать фосфатную группу полностью, или модифицировать один или несколько атомов в фосфатной группе. В первом случае, например, вся фосфатная группа может подвергаться замещению или удалению.
[0085] Модификация нуклеотидного остатка (остатков) на конце (на концах) может представлять собой, например, добавление какой-либо другой молекулы. Примеры других молекул включают функциональные молекулы, такие как вещества-маркеры, описанные выше, и защитные группы. Примеры защитных групп включают S (серу), Si (кремний), B (бор) и группы, содержащие сложные эфиры. Например, функциональные молекулы, такие как вещества-маркеры, можно использовать для обнаружения молекулы одноцепочечной НК по настоящему изобретению и подобных тестов.
[0086] К фосфатной группе нуклеотидных остатков можно добавлять другие молекулы, или, например, их можно добавлять к фосфатной группе или к сахарному остатку через спейсер. Например, конечный атома спейсера можно добавлять или замещать одним из связывающих атомов кислорода фосфатной группы, или O, N, S, или атомом С сахарного остатка. Участок связывания в сахарном остатке предпочтительно представляет собой, например, атом C в 3'-положении, C в 5'-положении, или любой атом, связанный с указанным. Также спейсер можно добавлять или замещать его на концевой атом альтернативного нуклеотида, например, PNA.
[0087] Примеры спейсеров включают без ограничения -(CH2)н-, -(CH2)nH-, -(CH2)nO-, -(CH2)nS-, O(CH2CH2O)nCH2CH2OH, абазические сахара, амид, карбокси, амин, оксиамин, оксиимин, тиоэфир, дисульфид, тиомочевину, сульфонамид и морфолино, а также реагенты биотина и реагенты флуоресцеина. В вышеприведенных формулах n является целым положительным числом, и предпочтительное значение n=3 или 6.
[0088] Другие примеры молекул, предназначенных для добавления в концевой участок, включают красители, интеркалирующие агенты (например, акридины), сшивающие агенты (например, псорален, митомицин C), порфирины (TPPC4, тексафирин, Саффирин), полициклические ароматические углеводороды (например, феназин, дигидрофеназин), искусственные эндонуклеазы (например, ЭДТА), липофильные носители (например, холестерин, холевая кислота, адамантан-уксусная кислота, 1-пирен-масляная кислота, дигидротестостерон, 1,3-бис-O(гексадецил)глицерин, группа геранилоксигексила, гексадецилглицерин, борнеол, ментол, 1,3-пропандиол, группа гептадецила, пальмитиновая кислота, миристиновая кислота, O3-(олеоил)литохолевая кислота, O3-(олеоил)холевая кислота, диметокситритил или феноксазин), пептидные комплексы (например, пептид Antennapedia, пептид Tat), алкилирующие агенты, фосфаты, амино, меркапто, полиэтиленгликоль (ПЭГ) (например, ПЭГ-40К), МПЭГ [МПЭГ]2, полиамино, алкил, замещенный алкил, радиомеченные маркеры, ферменты, гаптены (например, биотин), стимуляторы транспорта/абсорбции (например, аспирин, витамин Е, фолиевая кислота) и синтетические рибонуклеазы (например, имидазол, бис-имидазол, гистамин, имидазоловые кластеры, комплексы акридин-имидазол, Eu3+ комплексы тетраазомакроциклов).
[0089] В молекуле одноцепочечной НК по настоящему изобретению 5'-конец может быть модифицирован, например, с помощью фосфатной группы или аналога фосфатной группы. Примеры фосфатных групп включают:
5'-монофосфат ((HO)2(O)P-O-5');
5'-дифосфат ((HO)2(O)P-O-P(HO)(O)-O-5');
5'-трифосфат ((HO)2(O)P-O-(HO)(O)P-O-P(HO)(O)-O-5');
5'-гуанозиновый кэп (7-метилированный или неметилированный,
7m-G-O-5'-(HO)(O)P-O-(HO)(O)P-O-P(HO)(O)-O-5');
5'-аденозиновый кэп (Appp);
любая кэп-структура модифицированного или немодифицированного нуклеотида
(NO-5'-(HO)(O)P-O-(HO)(O)P-O-P(HO)(O)-O-5');
5'-монотиофосфат (фосфоротиоат: (HO)2(S)P-O-5');
5'-монодитиофосфат (фосфородитиоат: (HO)(HS)(S)P-O-5');
5'-фосфоротиолат ((HO)2(O)P-S-5');
серозамещенный монофосфат, дифосфат и трифосфат (например, 5'-α-тиотрифосфат, 5'-γ-тиотрифосфат и т.п.);
5'-фосфорамидаты ((HO)2(O)P-NH-5', (HO)(NH2)(O)PO-5');
5'-алкилфосфонаты (например, RP(OH)(O)-O-5', (OH)2(O)P-5'-CH2, где R представляет собой алкил (например, метил, этил, изопропил, пропил и т.п.)) и
5'-алкилэфирфосфонаты (например, RP(OH)(O)-O-5', где R представляет собой алкилэфир (например, метоксиметил, этоксиметил и т.п.)).
[0090] Конкретных ограничений для типа основания в нуклеотидном остатке не существует. Например, основание может быть природным или неприродным основанием. Например, основание может представлять собой основание природного происхождения или синтетического происхождения. В качестве основания можно использовать, например, общепринятое (универсальное) основание, его модифицированный аналог и тому подобное.
[0091] Примеры оснований включают: пуриновые основания, такие как аденин и гуанин, и пиримидиновые основания, такие как цитозин, урацил и тимин. Другие примеры оснований включают инозин, тимин, ксантин, гипоксантин, нубуларин, изогуанидин и туберцидин. Примеры оснований также включают следующее: производные алкила, такие как 2-аминоаденин, 6-метилированный пурин и 2-пропилированный пурин; 5-галоурацил и 5-галоцитозин, 5-пропинилурацил и 5-пропинилцитозин; 6-азо-урацил, 6-азо-цитозин и 6-азо-тимин; 5-урацил (псевдоурацил), 4-тиоурацил, 5-галоурацил, 5-(2-аминопропил)урацил, 5-аминоаллил-урацил; 8-галогенированные, аминированные, тиолированные, тиоалкилированные, гидроксилированные и другие 8-замещенные пурины; 5-трифторметилированные и другие 5-замещенные пиримидины; 7-метилгуанин; 5-замещенные пиримидины; 6-азапиримидины; Н-2, Н-6 и О-6 замещенные пурины (включающие 2-аминопропиладенин); 5-пропинилурацил и 5-пропинилцитозин; дигидроурацил; 3-деаза-5-азацитозин; 2-аминопурин; 5-алкилурацил; 7-алкилгуанин; 5-алкилцитозин; 7-деазааденин; N6,N6-диметиладенин; 2,6-диаминопурин; 5-аминоаллил-урацил; N3-метилурацил; замещенные 1,2,4-триазолы; 2-пиридинон; 5-нитроиндол; 3-нитропиррол; 5-метоксиурацил; урацил-5-оксиуксусная кислота; 5-метоксикарбонилметилурацил; 5-метил-2-тиоурацил; 5-метоксикарбонилметил-2-тиоурацил; 5-метиламинометил-2-тиоурацил; 3-(3-амино-3-карбоксипропил)урацил; 3-метилцитозин; 5-метилцитозин; N4-ацетилцитозин; 2-тиоцитозин; N6-метиладенин; N6-изопентиладенин; 2-метилтио-N6-изопентиниладенин; Н-метилгуанин, и O-алкилированные основания. Примеры пуринов и пиримидинов включают примеры, описанные в патенте США № 3687808, "Concise Encyclopedia of Polymer Science and Engineering", стр. 858-859, под редакцией Kroschwitz J. I, John Wiley & Sons, 1990, и в публикации Englisch et al., Angewandte Chemie, International Edition, 1991, том 30, стр. 613.
[0092] Другие примеры модифицированных нуклеотидных остатков включают остатки, не содержащие оснований, т.е. остатки, имеющие абазический рибозофосфатный скелет. Кроме того, в качестве модифицированных нуклеотидных остатков можно использовать, например, остатки, описанные в предварительной заявке США 60/465665 (дата подачи заявки: 25 апреля 2003 г.) и в международной заявке PCT/US04/07070 (дата подачи: 8 марта 2004 г.), и указанные документы включены в настоящее описание путем ссылки.
[0093] 3. Ненуклеотидные остатки
Тип ненуклеотидных остатков конкретно не ограничен. Молекула одноцепочечной НК по настоящему изобретению может включать в качестве ненуклеотидных остатков ненуклеотидную структуру, которая содержит, например, пирролидиновый скелет или пиперидиновый скелет. Предпочтительным является, например, наличие ненуклеотидного остатка по меньшей мере в одном из линкерных участков (Lx) и (Ly). Например, ненуклеотидный остаток может располагаться в линкерном участке (Lx), в линкерном участке (Ly) или в обоих типах линкерных участков. Линкерные участки (Lx) и (Ly) могут быть, например, одинаковыми или разными.
[0094] Пирролидиновый скелет может представлять собой каркас из пирролидинового производного, которое получено, например, путем замещения по меньшей мере одного атома углерода, составляющего 5-членное кольцо пирролидина. В случае замены предпочтительным является, например, замещение атома (атомов) углерода, кроме C-2. Углерод может быть замещен, например, азотом, кислородом или серой. Пирролидиновый скелет может содержать, например, двойную связь углерод-углерод или двойную связь углерод-азот, например, в 5-членном пирролидиновом кольце. В пирролидиновом скелете каждый из атомов углерода и азота, составляющих 5-членное пирролидиновое кольцо, может иметь, например, связанную с ними водородную группу, или связанный с ними заместитель, который описан ниже. Линкерный участок (Lx) может быть связан с участками (X) и (Xc) посредством, например, любой группы в пирролидиновом скелете, предпочтительно связан с каким-либо атомом углерода или азота в 5-членном кольце, и более предпочтительно с атомом углерода во 2-ом положении (С-2) или азотом в 5-членном кольце. Примеры пирролидинового скелета включают пролиновые скелеты и пролиноловые скелеты. Например, пролиновые скелеты, пролиноловые скелеты и сходные структуры обладают превосходными свойствами с точки зрения безопасности, поскольку они являются веществами, присутствующими в живых организмах, и их восстановителями.
[0095] Пиперидиновый скелет может представлять собой каркас из пиперидинового производного, которое получено, например, путем замещения по меньшей мере одного атома углерода, составляющего 6-членное кольцо пиперидина. В случае замены предпочтительным является, например, замещение атома (атомов) углерода, кроме C-2. Углерод может быть замещен, например, азотом, кислородом или серой. Пиперидиновый скелет может содержать, например, двойную связь углерод-углерод или двойную связь углерод-азот, например, в 6-членном пиперидиновом кольце. В пиперидиновом скелете каждый из атомов углерода и азота, составляющих 6-членное пиперидиновое кольцо, может иметь, например, связанную с ними водородную группу, или связанный с ними заместитель, который описан ниже. Линкерный участок (Lx) может быть связан с участками (X) и (Xc) посредством, например, любой группы в пиперидиновом скелете, предпочтительно связан с каким-либо атомом углерода или азота в 6-членном кольце, и более предпочтительно с атомом углерода во 2-ом положении (С-2) или азотом в 6-членном кольце. То же самое относится и к линкерному участку (Ly).
[0096] Каждый из линкерных участков может состоять, например, из ненуклеотидного остатка (остатков), имеющих только ненуклеотидную структуру, или может содержать нуклеотидный остаток (остатки) и ненуклеотидный остаток (остатки) с ненуклеотидными структурами.
[0097] Линкерный участок представлен, например, следующей формулой (I).
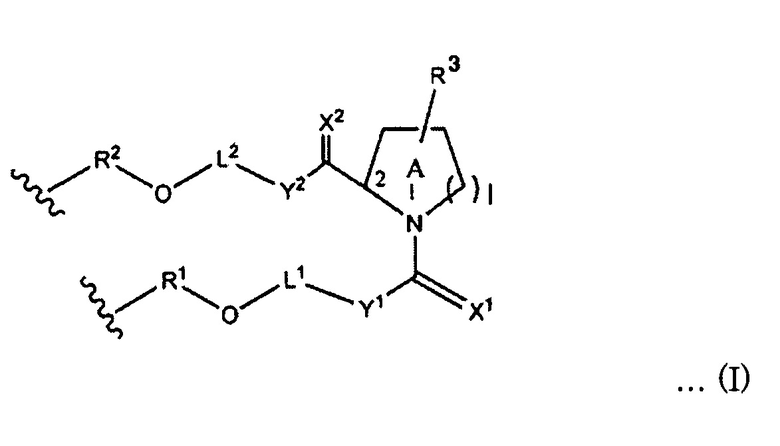
[0098] В формуле (I)
каждый из X1 и X2 независимо представляет собой H2, O, S или NH;
каждый из Y1 и Y2 независимо представляет собой одинарную связь, CH2, NH, О или S;
R3 представляет собой атом водорода или заместитель, который связан с C-3, C-4, C-5 или C-6 на кольце А;
заместителями являются ОН, OR4, NH2, NHR4, NR4R5, SH, SR4 или оксогруппы (=O);
если заместителями являются R3, их число может составлять один заместитель R3, два или более заместителя R3, или заместитель R3 отсутствует, и при наличии нескольких заместителей R3 они могут быть одинаковыми или разными;
каждый из R4 и R5 представляет собой заместитель или защитную группу, и они могут быть одинаковыми или разными;
L1 представляет собой алкиленовую цепь, состоящую из n атомов, и атом (атомы) водорода на атоме (атомах) углерода алкилена может быть замещен или не замещен OH, ORa, NH2, NHRa, NRaRb, SH или SRa, или
L1 представляет собой полиэфирные цепи, полученные путем замещения по меньшей мере одного атома углерода в алкиленовой цепи на атом кислорода,
при условии, что если Y1 является NH, О или S, атом, связанный с Y1 в L1, представляет собой углерод, атом, связанный с OR1 в L1, представляет собой углерод, и атомы кислорода не являются смежными;
L2 представляет собой алкиленовую цепь, состоящую из m атомов, и атом (атомы) водорода на атоме (атомах) углерода алкилена может быть замещен или не замещен OH, ORc, NH2, NHRc, NRcRd, SH или SRc, или
L2 представляет собой полиэфирную цепь, полученную путем замещения по меньшей мере одного атома углерода в алкиленовой цепи на атом кислорода,
при условии, что если Y2 является NH, О или S, атом, связанный с Y2 в L2, представляет собой углерод, атом, связанный с OR2 в L2, представляет собой углерод, и атомы кислорода не являются смежными;
каждый из R, Rb, Rc и Rd независимо представляет собой заместитель или защитную группу;
l равен 1 или 2;
m является целым числом в диапазоне от 0 до 30;
n является целым числом в диапазоне от 0 до 30;
на кольце А один атом углерода, кроме C-2, может быть замещен азотом, кислородом или серой, и
кольцо А может содержать двойную связь углерод-углерод или двойную связь углерод-азот. Если линкерный участок (Lx) представлен формулой (I), каждый из участков (Xc) и (X) связан с линкерным участком (Lx) посредством -OR1- или -OR2-. Кроме того, если линкерный участок (Ly) представлен формулой (I), каждый из участков (Yc) и (Y) связан с линкерным участком (Ly) посредством -OR1- или -OR2-. Следует отметить, что R1 и R2 могут присутствовать или могут отсутствовать, и в случае их присутствия каждый из R1 и R2 независимо представляет собой нуклеотидный остаток или структуру формулы (I).
[0099] В формуле (I) каждый из X1 и X2 независимо представляет собой, например, H2, O, S или NH. В формуле (I) "X1 представляет собой H2" означает, что X1 образует CH2 (метиленовую группу) вместе с атомом углерода, с которым соединен X1. То же относится к X2.
[0100] В формуле (I) l в кольце А равен 1 или 2. При l=1 кольцо А представляет собой 5-членное кольцо, которое является, например, пирролидиновым скелетом. Пирролидиновый каркас, например, представляет собой пролиновый скелет, пролиноловый скелет и т.п., и конкретные примеры включают двухвалентные структуры пролинового скелета и пролинолового скелета. При l=2 кольцо А представляет собой 6-членное кольцо, которое является, например, пиперидиновым скелетом. На кольце А один атом углерода, кроме C-2, может быть замещен азотом, кислородом или серой. Кроме того, кольцо может содержать двойную связь углерод-углерод или двойную связь углерод-азот. Кольцо А может находиться, например, или в L-форме, или в D-форме.
[0101] В формуле (I) каждый из Y1 и Y2 независимо представляет собой одинарную связь, CH2, NH, О или S.
[0102] В формуле (I) R3 представляет собой атом водорода или заместитель, который связан с C-3, C-4, C-5 или C-6 на кольце А. Заместителями являются ОН, OR4, NH2, NHR4, NR4R5, SH, SR4, или оксогруппы (=O). Если заместителями являются R3, их число может составлять один заместитель R3, два или более заместителя R3, или заместитель R3 отсутствует, и при наличии нескольких заместителей R3 они могут быть одинаковыми или разными. Каждый из R4 и R5 представляет собой заместитель или защитную группу, и они могут быть одинаковыми или разными.
[0103] Примеры заместителей включают галогены, алкилы, алкенилы, алкинилы, галогеналкилы, арилы, гетероарилы, арилалкилы, циклоалкилы, циклоалкенилы, циклоалкилалкилы, циклоалкилы, гидроксиалкилы, алкоксиалкилы, аминоалкилы, гетероциклилалкенилы, гетероциклилалкилы, гетероарилалкилы, силилы и силилоксиалкилы. Далее в описании применяются сходные заместители.
[0104] Защитной группой является, например, функциональная группа, которая инактивирует функциональные группы с высокой реакционной способностью. Примеры защитной группы включают известные защитные группы. Защитные группы описаны в литературе, например (J. F. W. McOmie, "Protecting Groups in Organic Chemistry", Plenum Press, London and New York, 1973), включенной в изобретение в качестве ссылки. Примеры защитных групп включают без конкретных ограничений: группу трет-бутилдиметилсилил (TBDMS), группу бис(2-ацетоксиэтилокси)метил (ACE), группу триизопропилсилилоксиметил (TOM), группу 1-(2-цианоэтокси)этил (CEE), группу 2-цианоэтоксиметил (CEM), группу толилсульфонилэтоксиметил (TEM) и группу диметокситритил (DMTr). Если R3 представляет собой OR4, защитная группа не имеет конкретных ограничений, и ее примеры включают группу TBDMS, группу ACE, группу TOM, группу CEE, группу CEM и группу TEM. Другие примеры защитных групп включают силилсодержащие группы, которые описаны ниже. Далее описано применение аналогичных заместителей.
[0105] В формуле (I) L1 представляет собой алкиленовую цепь, состоящую из n атомов. Атом (атомы) водорода на атоме (атомах) углерода алкилена может быть замещенным или незамещенным, например, на OH, ORa, NH2, NHRa, NRaRb, SH или SRa. Альтернативно, L1 может представлять собой полиэфирную цепь, полученную путем замещения по меньшей мере одного атома углерода в алкиленовой цепи на атом кислорода. Полиэфирной цепью, является, например, полиэтиленгликоль. Если Y1 является NH, О или S, атом, связанный с Y1 в L1, представляет собой углерод, атом, связанный с OR1 в L1, представляет собой углерод, и атомы кислорода не являются смежными. Так, например, если Y1 представляет собой О, этот атом кислорода и атом кислорода в L1 не являются смежными, и атом кислорода в OR1 и атом кислорода в L1 не являются смежными.
[0106] В формуле (I) L2 представляет собой алкиленовую цепь, состоящую из m атомов. Атом (атомы) водорода на атоме (атомах) углерода алкилена может быть замещенным или незамещенным, например, на OH, ORc, NH2, NHRc, NRcRd, SH или SRc. Альтернативно, L2 может представлять собой полиэфирную цепь, полученную путем замещения по меньшей мере одного атома углерода в алкиленовой цепи на атом кислорода. Если Y2 является NH, О или S, атом, связанный с Y2 в L2, представляет собой углерод, атом, связанный с OR2 в L2, представляет собой углерод, и атомы кислорода не являются смежными. То есть, например, если Y2 представляет собой О, этот атом кислорода и атом кислорода в L2 не являются смежными, и атом кислорода в OR2 и атом кислорода в L2 не являются смежными.
[0107] Значения n в L1 и m в L2 конкретно не ограничены, и нижней границей каждого из этих значений, например, может быть 0, верхняя граница также не имеет конкретных ограничений. Можно устанавливать подходящие значения n и m, например, в зависимости от желательной длины линкерного участка (Lx). Например, с точки зрения производственных затрат, выхода продукта и тому подобного, каждое из значений n и m предпочтительно составляет от 0 до 30, более предпочтительно от 0 до 20 и еще более предпочтительно от 0 до 15. Значения n и m могут быть одинаковыми (n=m) или разными. Например, значение n+m составляет от 0 до 30, предпочтительно от 0 до 20 и более предпочтительно от 0 до 15.
[0108] Каждый из Ra, Rb, Rc и Rd независимо может быть заместителем или защитной группой. Например, заместитель и защитная группа соответствует вышеприведенному описанию.
[0109] В формуле (I) каждый из атомов водорода независимо может замещаться галогеном, таким как, например, Cl, Br, F или I.
[0110] Если линкерный участок (Lx) представлен формулой (I), например, каждый из участков (Xc) и (X) связан с линкерным участком (Lx) посредством -OR1- или -OR2-. R1 и R2 могут присутствовать или могут отсутствовать. В случае наличия R1 и R2, каждый из R1 и R2 независимо представляет собой нуклеотидный остаток или структуру, имеющую формулу (I). Если R1 и/или R2 представляет собой нуклеотидый остаток, то линкерный участок (Lx) состоит, например, из ненуклеотидных остатков, имеющих структуру формулы (I), за исключением нуклеотидных остатков R1 и/или R2 и нуклеотидного остатка (остатков). Если R1 и/или R2 является структурой, представленной формулой (I), то линкерный участок (Lx) имеет такое строение, что, например, два или более ненуклеотидных остатков, имеющих структуру формулы (I), связаны друг с другом. Количество элементов в формуле (I) может составлять, например, 1, 2, 3 или 4. Если линкерный участок (Lx) включает множество элементов, эти элементы формулы (I) могут быть связаны, например, или прямым образом, или посредством нуклеотидного остатка (остатков). С другой стороны, например, при отсутствии R1 и R2 линкерный участок (Lx) состоит из ненуклеотидных остатков, имеющих исключительно структуру формулы (I). Если линкерный участок (Lx) представлен формулой (I), вышеприведенное описание линкерного участка (Lx) также относится к участку (Yc), участку (Y) и линкерному участку (Ly).
[0111] Нет конкретных ограничений для комбинации участков (Хс) и (X) с -OR1- или -OR2- и комбинации участков (Yc) и (Y) с -OR1- или -OR2-, таким образом могут существовать, например, любые из следующих условий:
Условие (1):
участки (Хс) и (X) связаны со структурой формулы (I) посредством, соответственно, -OR2- и –OR1-; и
участки (Yc) и (Y) связаны со структурой формулы (I) посредством, соответственно, -OR1- и -OR2-.
Условие (2):
участки (Хс) и (X) связаны со структурой формулы (I) посредством, соответственно, -OR2- и -OR1-; и
участки (Yc) и (Y) связаны со структурой формулы (I) посредством, соответственно, -OR2- и -OR1-.
Условие (3):
участки (Хс) и (X) связаны со структурой формулы (I) посредством, соответственно, -OR1- и -OR2-; и
участки (Yc) и (Y) связаны со структурой формулы (I) посредством, соответственно, -OR1- и -OR2-.
Условие (4):
участки (Хс) и (X) связаны со структурой формулы (I) посредством, соответственно, -OR1- и -OR2-; и
участки (Yc) и (Y) связаны со структурой формулы (I) посредством, соответственно, -OR2- и -OR1-.
[0112] Примеры структуры формулы (I) включают структуры формул от (I-1) до (I-9). В следующих ниже формулах значения n и m аналогичны соответствующим значениям в формуле (I). В приведенных ниже формулах q является целым числом от 0 до 10.
[0113] В формулах от (I-1) до (I-9) значения n, m и q конкретно не ограничены и соответствуют указанным выше значениям. Конкретными примерами являются следующие: в формуле (I-1) n=8; в формуле (I-2) n=3; в формуле (I-3) n=4 или 8; в формуле (I-4) n=7 или 8; в формуле (I-5) n=3 и m=4; в формуле (I-6) n=8 и m=4; в формуле (I-7) n=8 и m=4; в формуле (I-8) n=5 и m=4; в формуле (I-9) q=1 и m=4. Формула (I-4а), ниже, показывает пример формулы (I-4) (n=8), и формула (I-6а), ниже, показывает пример формулы (I-6) (n=5, m=4).
[0114] В настоящем изобретении термин "алкил" охватывает, например, прямые и разветвленные алкильные группы. Число атомов углерода в алкиле конкретно не ограничено и составляет, например, от 1 до 30, предпочтительно от 1 до 6 или от 1 до 4. Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, н-гептил, н-октил, н-нонил и н-децил. Более предпочтительными из перечисленных являются, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил и тому подобное.
[0115] В настоящем изобретении термин "алкенил" охватывает, например, прямые и разветвленные алкенилы. Примеры алкенилов включают описанные выше алкилы, имеющие одну или более двойных связей. Количество атомов углерода в алкениле конкретно не ограничено и является, например, аналогичным количеству атомов углерода в алкиле, предпочтительно от 2 до 8. Примеры алкенилов включают винил, 1-пропенил, 2-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 1,3-бутадиенил и 3-метил-2-бутенил.
[0116] В настоящем изобретении термин "алкинил" охватывает, например, прямые и разветвленные алкинилы. Примеры алкинилов включают описанные выше алкилы, имеющие одну или более тройных связей. Количество атомов углерода в алкиниле конкретно не ограничено и является, например, аналогичным количеству атомов углерода в алкиле, предпочтительно от 2 до 8. Примеры алкинилов включают этинил, пропинил и бутинил. Алкинил может дополнительно включать, например, одну или более двойных связей.
[0117] В настоящем изобретении термин "арил" охватывает, например, моноциклические ароматические углеводородные группы и полициклические ароматические углеводородные группы. Примеры моноциклических ароматических углеводородных групп включают фенил. Примеры полициклических ароматических углеводородных групп включают 1-нафтил, 2-нафтил, 1-антрил, 2-антрил, 9-антрил, 1-фенантрил, 2-фенантрил, 3-фенантрил, 4-фенантрил и 9-фенантрил. Предпочтительными группами из вышеперечисленного являются, например, фенил, нафтилы, такие как 1-нафтил и 2-нафтил, и тому подобное.
[0118] В настоящем изобретении термин "гетероарил" охватывает, например, моноциклические ароматические гетероциклические группы и конденсированные ароматические гетероциклические групп. Примеры гетероарилов включают фурилы (например: 2-фурил, 3-фурил), тиенилы (например: 2-тиенил, 3-тиенил), пирролилы (например: 1-пирролил, 2-пирролил, 3-пирролил), имидазолилы (например: 1-имидазолил, 2-имидазолил, 4-имидазолил), пиразолилы (например: 1-пиразолил, 3-пиразолил, 4-пиразолил), триазолилы (например, 1,2,4-триазол-1-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-4-ил), тетразолилы (например: 1-тетразолил, 2-тетразолил, 5-тетразолил), оксазолилы (например: 2-оксазолил, 4-оксазолил, 5-оксазолил), изоксазолилы (например: 3-изоксазолил, 4-изоксазолил, 5-изоксазолил), тиазолилы (например: 2-тиазолил, 4-тиазолил, 5-тиазолил), тиадиазолилы, изотиазолилы (например: 3-изотиазолил, 4-изотиазолил, 5-изотиазолил), пиридилы (например: 2-пиридил, 3-пиридил, 4-пиридил), пиридазинилы (например, 3-пиридазинил, 4-пиридазинил), пиримидинилы (например: 2-пиримидинил, 4-пиримидинил, 5-пиримидинил), фуразанилы (например: 3-фуразанил), пиразинилы (например: 2-пиразинил), оксадиазолилы (например: 1,3,4-оксадиазол-2-ил), бензофурилы (например: 2-бензо[b]фурил, 3-бензо[b]фурил, 4-бензо[b]фурил, 5-бензо[b]фурил, 6-бензо[b]фурил, 7-бензо[b]фурил), бензотиенилы (например: 2-бензо[b]тиенил, 3-бензо[b]тиенил, 4-бензо[b]тиенил, 5-бензо[b]тиенил, 6-бензо[b]тиенил, 7-бензо[b]тиенил), бензимидазолилы (например: 1-бензимидазолил, 2-бензимидазолил, 4-бензимидазолил, 5-бензимидазолил), дибензофурилы, бензоксазолилы, бензотиазолилы, хиноксалилы (например: 2-хиноксалинил, 5-хиноксалинил, 6-хиноксалинил), циннолинилы (например: 3-циннолинил, 4-циннолинил, 5-циннолинил, 6-циннолинил, 7-циннолинил, 8-циннолинил), хиназолилы (например: 2-хиназолинил, 4-хиназолинил, 5-хиназолинил, 6-хиназолинил, 7-хиназолинил, 8-хиназолинил), хинолилы (например: 2-хинолил, 3-хинолил, 4-хинолил, 5-хинолил, 6-хинолил, 7-хинолил, 8-хинолил), фталазинилы (например: 1-фталазинил, 5-фталазинил, 6-фталазинил), изохинолилы (например: 1-изохинолил, 3-изохинолил, 4-изохинолил, 5-изохинолил, 6-изохинолил, 7-изохинолил, 8-изохинолил), пурилы, птеридинилы (например: 2-птеридинил, 4-птеридинил, 6-птеридинил, 7-птеридинил), карбазолилы, фенантридинилы, акридинилы (например: 1-акридинил, 2-акридинил, 3-акридинил, 4-акридинил, 9-акридинил), индолилы (например: 1-индолил, 2-индолил, 3-индолил, 4-индолил, 5-индолил, 6-индолил, 7-индолил), изоиндолилы, феназинилы (например: 1-феназинил, 2-феназинил) и фенотиазинилы (например: 1-фенотиазинил, 2-фенотиазинил, 3-фенотиазинил, 4-фенотиазинил).
[0119] В настоящем изобретении термин "циклоалкил" относится к циклическим насыщенным углеводородным группам, например, и число атомов углерода в циклоалкиле составляет, например, от 3 до 15. Примеры циклоалкилов включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, мостиковые циклические углеводородные группы и спиро-углеводородные группы. Предпочтительными из перечисленных групп являются циклопропил, циклобутил, циклопентил, циклогексил, мостиковые циклические углеводороды и т.п.
[0120] В настоящем изобретении примеры "мостиковых циклических углеводородных групп" включают бицикло[2.1.0]пентил, бицикло[2.2.1]гептил, бицикло[2.2.2]октил и бицикло[3.2.1]октил, трицикло[2.2.1.0]гептил, бицикло[3.3.1]нонан, 1-адамантил и 2-адамантил.
[0121] В настоящем изобретении примеры "спиро-углеводородных групп" включают спиро[3.4]октил.
[0122] В настоящем изобретении термин "циклоалкенил" охватывает, например, ненасыщенные циклические алифатические углеводородные группы, и число атомов углерода в циклоалкениле составляет, например, от 3 до 7. Примеры циклоалкенильных групп включают циклопропенил, циклобутенил, циклопентенил, циклогексенил и циклогептенил. Предпочтительными из перечисленных групп являются циклопропенил, циклобутенил, циклопентенил, циклогексенил и тому подобное. Термин "циклоалкенил" также охватывает мостиковые циклические углеводородные группы и спиро-углеводородные группы, например, имеющие в своих кольцах одну ненасыщенную связь.
[0123] В настоящем изобретении примеры "арилалкилов" включают бензил, 2-фенэтил и нафталенилметил. Примеры "циклоалкилалкила" и "циклоалкила" включают циклогексилметил и адамантилметил. Примеры "гидроксиалкила" включают гидроксиметил и 2-гидроксиэтил.
[0124] В настоящем изобретении термин "алкокси" охватывает группы, состоящие из любого из вышеуказанных алкилов и кислорода (алкил-O-группы), и примеры этих групп включают метокси, этокси, н-пропокси, изопропокси и н-бутокси. Примеры "алкоксиалкила" включают метоксиметил. Примеры "аминоалкила" включают 2-аминоэтил.
[0125] В настоящем изобретении примеры "гетероциклилов" включают 1-пирролинил, 2-пирролинил, 3-пирролинил, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил, пирролидинон, 1-имидазолинил, 2-имидазолинил, 4-имидазолинил, 1-имидазолидинил, 2-имидазолидинил, 4-имидазолидинил, имидазолидинон, 1-пиразолинил, 3-пиразолинил, 4-пиразолинил, 1-пиразолидинил, 3- пиразолидинил, 4-пиразолидинил, пиперидинон, пиперидино, 2-пиперидинил, 3-пиперидинил, 4-пиперидинил, 1-пиперазинил, 2-пиперазинил, пиперазинон, 2-морфолинил, 3-морфолинил, морфолино, тетрагидропиранил и тетрагидрофуранил.
[0126] В настоящем изобретении примеры "гетероциклилалкилов" включают пиперидинилметил и пиперазинилметил. Примеры "гетероциклилалкенила" включают 2-пиперидинил-этенил. Примеры "гетероарилалкила" включают пиридилметил и хинолин-3-илметил.
[0127] В настоящем изобретении термин "силил" охватывает группы, представленные формулой R3Si-, где R можно независимо выбирать из описанных выше алкилов, арилов и циклоалкилов. Примеры силилов включают группу триметилсилила и группу трет-бутилдиметилсилила. Примеры "силилокси" включают группу триметилсилилокси. Примеры "силилоксиалкила" включают триметилсилилоксиметил.
[0128] В настоящем изобретении примеры "алкиленов" включают метилен, этилен и пропилен.
[0129] В настоящем изобретении разные вышеописанные группы могут быть замещенными. Примеры заместителей включают гидрокси, карбокси, галогены, алкилгалогениды (например, CF3, CH2CF3, CH2CCl3), нитро-, нитрозо-, циано, алкилы (например, метил-, этил, изопропил, трет-бутил), алкенилы (например, винил), алкинилы (например, этинил), циклоалкилы (например, циклопропил, адамантил), циклоалкилалкилы (например: циклогексилметил, адамантилметил), циклоалкенилы (например: циклопропенил), арилы (например, фенил, нафтил), арилалкилы (например, бензил, фенэтил), гетероарилы (например, пиридил, фурил), гетероарилалкилы (например: пиридилметил), гетероциклилы (например: пиперидил), гетероциклилалкилы (например: морфолилметил), алкокси (например, метокси, этокси, бутокси), галогенированные алкокси (например, OCF3), алкенилокси (например: винилокси, аллилокси), арилокси (например: фенилокси), алкилоксикарбонилы (например, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил), арилалкилокси (например, бензилокси), амины [алкиламины (например: метиламино, этиламино, диметиламино), ациламины (например, ацетиламино, бензоиламино), арилалкиламины (например: бензиламино, тритиламино), гидроксиамино], алкиламиноалкилы (например: диэтиламинометил), сульфамоил и оксо.
[0130] 4. Способ синтеза молекулы одноцепочечной НК по настоящему изобретению
Способ синтеза молекулы одноцепочечной НК по настоящему изобретению конкретно не ограничен, и можно применять общепринятый способ. Примеры способов включают способы синтеза согласно генно-инженерным технологиям и способы химического синтеза. Примеры генно-инженерных технологий включают: способы синтеза с применением транскрипции in vitro; способы с использованием вектора; и способы, осуществляемые с помощью кассеты ПЦР. Примеры векторов включают без конкретных ограничений невирусные векторы, такие как плазмиды, и вирусные векторы. Примеры способов химического синтеза векторов включают без конкретных ограничений фосфорамидитный способ и Н-фосфонатный способ. Способы химического синтеза можно осуществлять, например, с помощью коммерчески доступного автоматизированного синтезатора нуклеиновых кислот. В способах химического синтеза обычно используют амидит. Конкретных ограничений амидита нет. Примеры коммерчески доступных амидитов включают фосфорамидиты РНК (торговое наименование 2'-O-TBDMSi, Samchully Pharm., Ltd), амидит ACE, амидит TOM, амидит CEE, амидит CEM и амидит ТЕА.
[0131] 5. Композиция
Ингибирующая композиция согласно настоящему изобретению, как описано выше, представляет собой композицию для подавления экспрессии целевого гена, содержащую молекулу одноцепочечной НК по настоящему изобретению. Композиция по настоящему изобретению отличается тем, что она содержит молекулу одноцепочечной НК по настоящему изобретению, и никоим образом не ограничивает возможность других конфигураций. Ингибирующие композиции согласно настоящему изобретению также могут относиться, например, к подавляющему реагенту.
[0132] Согласно настоящему изобретению,экспрессию целевого гена можно подавлять, например, путем введения композиции субъекту, у которого имеется целевой ген.
[0133] Кроме того, как описано выше, фармацевтическая композиция по настоящему изобретению содержит молекулу одноцепочечной НК по настоящему изобретению. Фармацевтическая композиция по настоящему изобретению отличается тем, что она содержит молекулу одноцепочечной НК по настоящему изобретению, и никоим образом не ограничивает возможность других конфигураций. Фармацевтическая композиция по настоящему изобретению также может относиться, например, к фармацевтическому препарату.
[0134] Согласно настоящему изобретению экспрессию гена можно подавлять, например, путем введения фармацевтической композиции пациенту с заболеванием, вызванным геном, и тем самым осуществлять лечение этого заболевания. В настоящем изобретении термин "лечение" охватывает, например, профилактику заболеваний, улучшение состояния при заболеваниях и улучшение прогноза, и указанный термин может означать любое из этих понятий.
[0135] В настоящее изобретение примеры заболеваний, которые необходимо лечить, включают без конкретных ограничений заболевания, вызванные экспрессией генов. В зависимости от вида заболевания, ген, который вызывает заболевание, может считаться целевым геном, и далее, в зависимости от целевого гена, можно подходящим образом определять последовательности, подавляющие экспрессию.
[0136] Ниже приведен конкретный пример. Используя в качестве целевого гена ген TGF-β1 и с помощью вставки в молекулу одноцепочечной НК последовательности, подавляющей экспрессию этого гена, можно применять молекулу одноцепочечной НК для лечения, например, воспалительных заболеваний, в частности, острого поражения легких и т.п.
[0137] Способ использования ингибирующей композиции и фармацевтической композиции по настоящему изобретению (далее в изобретении обе упомянутые композиции называют просто "композициями") конкретно не ограничен, и примеры их использования включают введение молекулы одноцепочечной НК субъекту, имеющему целевой ген.
[0138] Примеры субъектов, в которые вводят молекулы одноцепочечной НК по настоящему изобретению, включают клетки, ткани и органы. Примеры субъектов также включают людей и животных нечеловеческого происхождения, таких как млекопитающие нечеловеческого происхождения, т.е. млекопитающие за исключением людей. Введение можно осуществлять, например, в условиях in vivo или in vitro. Примеры клеток включают без конкретных ограничений различные культивируемые клетки, такие как клетки HeLa, клетки 293, клетки NIH3T3 и клетки COS, стволовые клетки, такие как клетки ES и гемопоэтические стволовые клетки, и клетки, выделенные из живых организмов, такие как первичные культуры клеток.
[0139] Способ введения конкретно не ограничен и может считаться подходящим в зависимости, например, от субъекта. Если субъектом является культивируемая клетка, способом введения может быть, например, способ с использованием реагентов трансфекции, способ электропорации или подобные способы.
[0140] Каждая из композиций по настоящему изобретению может содержать исключительно молекулы одноцепочечной НК по настоящему изобретению или может дополнительно содержать, например, вспомогательное вещество (вещества) в добавление к молекуле одноцепочечной НК. Это вспомогательное вещество конкретно не ограничено, и предпочтительными являются, например, фармацевтически приемлемое вспомогательное вещество. Вид этого вспомогательного вещества не ограничен, и подходящее вещество можно выбирать, например, в зависимости от вида субъекта.
[0141] В композиции по настоящему изобретению молекулы одноцепочечной НК, например, могут образовывать комплекс со вспомогательным веществом. Это вспомогательное вещество также может называться, например, комплексообразующим агентом. Образование комплекса позволяет, например, эффективно доставлять молекулы одноцепочечной НК. Примеры связи между молекулой одноцепочечной НК и комплексообразующим агентом включают без ограничений нековалентные связи. Комплекс может представлять собой, например, комплекс включения.
[0142] Примеры комплексообразующих агентов включают без ограничения полимеры, циклодекстрины и адамантин. Примеры циклодекстринов включают линейные сополимеры циклодекстрина и линейные сополимеры окисленного циклодекстрина.
[0143] Другие примеры вспомогательных веществ включают носитель, связующее вещество, которое связывается с целевой клеткой, конденсирующий агент, фузогенный агент и наполнитель.
[0144] Носители предпочтительно представляет собой, например, полимер, более предпочтительно биополимер. Предпочтительно, носитель является, например, биоразлагаемым. Примеры носителей включают: белки, такие как человеческий сывороточный альбумин (HSA), липопротеины низкой плотности (ЛПНП) и глобулин; углеводы, такие как, например, декстран, пуллулан, хитин, хитозан, инулин, циклодекстрин и гиалуроновая кислота; и липиды. В качестве носителя также можно использовать, например, синтетический полимер, такой как синтетическая полиаминокислота. Примеры полиаминокислот включают полилизин (PLL), поли-L-аспарагиновую кислоту, поли-L-глутаминовую кислоту, сополимер стирола и малеинового ангидрида, сополимер поли(L-лактид-ко-гликолид), сополимер дивинилэфира и малеинового ангидрида, сополимер Н-(2-гидроксипропил)метакриламид (ГМФА), полиэтиленгликоль (ПЭГ), поливиниловый спирт (ПВС), полиуретан, поли(2-этилакриловую кислоту), полимер Н-изопропилакриламид и полифосфазин.
[0145] Примеры связующего вещества включают тирестимулирующий гормон, меланоцит-стимулирующий гормон, лектин, гликопротеины, сурфактантный белок А, углевод муцин, поливалентную лактозу, поливалентную галактозу, Н-ацетил-галактозамин, Н-ацетил-глюкозамин, поливалентную маннозу, поливалентную фукозу, гликозилированную полиаминокислоту, поливалентную галактозу, трансферрин, бисфосфонат, полиглутаминовую кислоту, полиаспарагиновую кислоту, липиды, холестерин, стероиды, желчные кислоты, фолат, витамин В12, биотин, Непроксин, RGD пептид и миметик RGD пептида.
[0146] Примеры фузогенного агента и конденсирующего агента включают полиамино-цепи, такие как полиэтиленимин (PEI). Например, PEI может быть или линейным, или разветвленным, а также может быть или синтетическим, или природным. PEI может быть замещен, например, алкилом или липидом. В качестве фузогенного агента также можно использовать, например, полигистидин, полиимидазол, полипиридин, полипропиленимин, меллитин, полиацетальное соединение (например, катионный полиацеталь и т.п.) или подобные соединения. Фузогенный агент может иметь, например, α-спиральную структуру. Фузогенный агент может представлять собой мембраноразрушающий агент, например, такой как меллитин.
[0147] Образование комплекса и подобная информация, относящаяся к композиции согласно настоящему изобретению, описано, например, в патенте США № 6509323, патенте США № 2003/0008818, PCT/US04/07070 и др., которые включены в изобретение путем ссылки.
[0148] Другие примеры вспомогательных веществ включают амфифильные молекулы. Амфифильные молекулы представляют собой молекулы, имеющие, например, гидрофобный участок и гидрофильный участок. Эта молекула предпочтительно представляет собой, например, полимер. Полимер может иметь, например, вторичную структуру, желательно повторяемую вторичную структуру. В частности, предпочтительным является полипептид, и более предпочтительным является, например, α-спиральный полипептид.
[0149] Амфифильный полимер может представлять собой полимер, имеющий, например, две или более амфифильных субъединицы. Примеры субъединиц включают субъединицы с циклической структурой, имеющие по меньшей мере одну гидрофильную группу и одну гидрофобную группу. Субъединица может содержать стероиды, например, такие как желчные кислоты, ароматические структуры и т.п. Полимер может содержать, например, одновременно и циклическую структурную субъединицу, такую как ароматическую субъединицу, и аминокислоту.
[0150] 6. Способ подавления
Способ подавления по настоящему изобретению, как описано выше, представляет собой способ подавления экспрессии целевого гена, для чего используется молекула одноцепочечной НК по настоящему изобретению. Способ подавления по настоящему изобретению отличается тем, что в нем используются молекулы одноцепочечной НК по настоящему изобретению, и никоим образом не ограничены другие этапы и условия.
[0151] В способе подавления по настоящему изобретению примеры механизма, посредством которого подавляется экспрессия генов, включают без ограничения подавление экспрессии с помощью феномена РНК-интерференции или феномена, сходного с РНК-интерференцией. Способ подавления по настоящему изобретению представляет собой, например, способ индукции РНК-интерференции, которая подавляет экспрессию целевого гена, и это также можно отнести к способу подавления, который отличается использованием молекулы одноцепочечной НК по настоящему изобретению.
[0152] Способ подавления по настоящему изобретению включает, например, этап введения молекулы одноцепочечной НК субъекту, у которого имеется целевой ген. Например, в этапе введения молекула одноцепочечной НК вступает в контакт с субъектом, которому вводят молекулу одноцепочечной НК. Примеры субъектов включают клетки, ткани и органы. Примеры субъектов также включают людей и животных нечеловеческого происхождения, таких как млекопитающие нечеловеческого происхождения, т.е. млекопитающие за исключением людей. Введение можно осуществлять, например, in vivo или in vitro.
[0153] В способе подавления по настоящему изобретению молекулу одноцепочечной НК можно вводить единственной, или можно вводить, например, композиции по настоящему изобретению, содержащие молекулу одноцепочечной НК. Способ введения конкретно не ограничен, и подходящий способ можно выбирать, например, в зависимости от вида субъекта.
[0154] 7. Способ лечения
Как описано выше, способ лечения заболевания согласно настоящему изобретению включает этап введения пациенту молекулы одноцепочечной НК по настоящему изобретению, при этом молекула одноцепочечной НК в качестве последовательности, подавляющей экспрессию, включает последовательность, которая подавляет экспрессию гена, вызывающего это заболевание. Способ лечения по настоящему изобретению отличается использованием молекулы одноцепочечной НК по настоящему изобретению, и никоим образом не ограничивает другие этапы и условия.
[0155] Описание, относящееся к способу подавления по настоящему изобретению, также применимо, например, к способу лечения по настоящему изобретению. Способ введения конкретно не ограничен и может представлять собой, например, или пероральное введение, или парентеральное введение.
[0156] 8. Применение молекулы одноцепочечной НК
Применением согласно настоящему изобретению является применение молекулы одноцепочечной НК по настоящему изобретению для подавления экспрессия целевого гена. Также применением согласно настоящему изобретению является применение молекулы одноцепочечной НК по настоящему изобретению для индукции РНК-интерференции.
[0157] Молекула нуклеиновой кислоты по настоящему изобретению представляет собой молекулу нуклеиновой кислоты для применения в лечении заболевания. Молекула нуклеиновой кислоты представляет собой молекулу одноцепочечной НК по настоящему изобретению, и молекула одноцепочечной НК в качестве последовательности, подавляющей экспрессию, включает последовательность, которая подавляет экспрессию гена, вызывающего это заболевание.
[0158] Далее следует подробное описание настоящего изобретения со ссылкой на примеры и тому подобное. Вместе с тем, следует отметить, что настоящее изобретения никоим образом не ограничено.
Примеры
[0159] (Пример А1) Синтез РНК
В качестве РНК (Пример) в данном примере синтезировали оцРНК (NK-0016), показанную ниже. NK-0016 включает 19-мерную последовательность, подавляющую экспрессию (SEQ ID NO: 1), которая подавляет экспрессию гена GAPDH. В последовательности NK-0016 участок между участком (Xc) и участком (X) является линкерным участком (Lx), и участок между участком (Y) и участком (Yc) является линкерным участком (Ly) (и аналогично в дальнейшем описании). В этой последовательности 5'-участок (Хс) и 3'-участок (Yc) обозначены строчными буквами (и аналогично в дальнейшем описании).
Последовательность, подавляющая экспрессию гена GAPDH (SEQ ID NO: 1) 5'-GUUGUCAUACUUCUCAUGG-3'
Пример: NK-0016 (SEQ ID NO: 2)

[0160] Синтезировали в качестве РНК для сравнительного примера дцРНК (NI-0011), как PHKi положительного контроля (ПК), см. ниже. NI-0011 имеет "липкий" конец из двух оснований на 3'-конце каждой одиночной цепи, и одиночная цепь SEQ ID NO: 4 имеет описанную выше 19-мерную последовательность, подавляющую экспрессию, сходную с NK-0016.
[0161] ПК: NI-0011
5'- CCAUGAGAAGUAUGACAACAG -3' (SEQ ID NO: 3)
3'- UUGGUACUCUUCAUACUGUUG -5' (SEQ ID NO: 4)
[0162] РНК были синтезированы в соответствии с фосфорамидитным способом с использованием синтезатора нуклеиновых кислот (торговое наименование: ABI Expedite (зарегистрированный товарный знак) 8909 Nucleic Acid Synthesis System, Applied Biosystems). При синтезе в качестве РНК амидитов использовали РНК фосфорамидиты (2'-O-TBDMSi, торговое наименование, Samchully Pharm. Ltd) (и аналогично далее в описании). Защиту амидитов снимали общепринятым способом. Синтезированные РНК очищали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Каждую из очищенных РНК лиофилизировали. В следующих примерах синтез РНК осуществляли аналогичным способом, как в данном примере, если не указано иное.
[0163] Для достижения желательной концентрации лиофилизированную РНК растворяли в дистиллированной воде для инъекций (Otsuka Pharmaceutical Co, Ltd, далее в описании аналогично).
[0164] (Пример А2) Эффект подавления экспрессии гена GAPDH в клетках HCT116
С помощью оцРНК по настоящему изобретению изучали подавление экспрессии гена GAPDH in vitro.
[0165] (1) Материалы и способы
В качестве РНК (Пример) в данном примере использовали оцРНК (NK-0016) из примера А1.
Пример: NK-0016 (SEQ ID NO: 2)
[0166] Растворы РНК получали путем растворения РНК в дистиллированной воде для инъекций для достижения желательной концентрации. Использовали клетки HCT116 (DS Pharma Biomedical Co, Ltd). В качестве среды использовали среду 5A McCoy`s (Invitrogen) с содержанием 10% эмбриональной бычьей сыворотки (FBS). Устанавливали следующие условия культивирования: 37°C и 5% CO2.
[0167] Вначале клетки HCT116 культивировали в среде, и распределяли в 24-луночный планшет таким образом, чтобы каждая лунка содержала 400 мкл среды для достижения плотности 2×104 клеток/на лунку. Клетки в лунках культивировали в течение следующих 24 часов. После этого клетки трансфицировали РНК с использованием трансфицирующего реагента Липофектамин 2000 (торговое наименование, Invitrogen) в соответствии с протоколом производителя. В частности, трансфекцию осуществляли путем введения композиции в лунку следующим образом. Конечная концентрация РНК в лунке составляла 5 нмоль/л, 10 нмоль/л, 20 нмоль/л или 40 нмоль/л.
[0168] [Таблица 1]
(Композиция для лунки: мкл)
Среда 400
(A) Липофектамин 2000 1,5
(B) Opti-MEM (Invitrogen) 98
(C) раствор РНК 0,5
Всего 500
[0169] После трансфекции клетки культивировали в лунках в течение 48 часов, и затем собирали РНК, используя набор RNeasy Mini Kit (торговое наименование, Qiagen) в соответствии с протоколом изготовителя. Затем синтезировали кДНК из РНК с использованием обратной транскриптазы (торговое наименование: SuperScript III, Invitrogen) в соответствии с протоколом изготовителя. Затем проводили ПЦР с использованием в качестве матрицы синтезированных указанным способом кДНК, и измеряли уровень экспрессии гена GAPDH и уровень экспрессии гена β-актина в качестве внутреннего стандарта. Уровень экспрессии гена GAPDH корректировали с учетом уровня экспрессии гена β-актина.
[0170] ПЦР проводили с использованием реагента LightCycler FastStart DNA Master SYBR Green I (торговое наименование, Roche) и оборудование Light Cycler DX400 (торговое наименование, Roche) (далее аналогично). Ген GAPDH и ген β-актин амплифицировали с использованием следующих наборов праймеров, соответственно.
Набор праймеров для гена GAPDH
5'-GGAGAAGGCTGGGGCTCATTTGC-3' (SEQ ID NO: 9)
5'-TGGCCAGGGGTGCTAAGCAGTTG -3' (SEQ ID NO: 10)
Набор праймеров для β-актина
5'-GCCACGGCTGCTTCCAGCTCCTC-3' (SEQ ID NO: 11)
5'-AGGTCTTTGCGGATGTCCACGTCAC-3' (SEQ ID NO: 12)
[0171] Для контроля 1 использовали клетки, к которым добавляли по 100 мкл только (B), и также измеряли уровни экспрессии генов (-). Кроме того, для контроля 2 использовали клетки, которые подвергали аналогичным процедурам трансфекции, как и в предыдущем случае, за исключением добавления раствора РНК, при этом добавляли (В) и 1,5 мкл (A), таким образом, общее количество (A) и (B) составляло 100 мкл, затем также измеряли уровень экспрессии гена (пробный тест).
[0172] Затем скорректированный уровень экспрессии гена GAPDH в контроле (-) считали за 1, и уровень экспрессии в клетках, трансфицированных РНК при каждой концентрации, представляли как относительное значение по сравнению с контролем (-).
[0173] (2) Результаты
Результаты исследований представлены на фиг. 4. Фигура 4 представляет график, показывающий относительный уровень экспрессии гена GAPDH. Как видно из фиг. 4, при использовании NK-0016 наблюдали менее выраженную экспрессию, чем в контрольном тесте (-), в котором не добавляли РНК. Таким образом, было установлено, что NK-0016 подавляет экспрессию гена GAPDH. Так же, как показано на фиг. 4, было установлено, что NK-0016 проявляет действие подавления в зависимости от дозы.
[0174] (Пример А3) Эффект подавления экспрессии гена GAPDH в клетках HCT116
Изучали подавление экспрессии гена GAPDH in vitro в отношении оцРНК по настоящему изобретению.
[0175] (1) Материалы и способы
В качестве РНК (Пример) в данном примере использовали оцРНК (NK-0016) из примера 1. Использовали в качестве РНК для сравнительного примера дцРНК (NI-0011), как PHKi положительного контроля (ПК). Раствор РНК приготовляли путем растворения каждой из РНК в дистиллированной воде для инъекций для достижения концентрации 40 мкмоль/л.
[0176] Уровень экспрессии гена GAPDH в клетках HCT116 изучали аналогичным образом, как в примере A2, за исключением использования вышеуказанного раствора РНК. Концентрация РНК на момент трансфекции составляла 40 нмоль/л.
[0177] (2) Результаты
Результаты исследований представлены на фиг. 5. Фигура 5 представляет график, показывающий относительный уровень экспрессии гена GAPDH, и вертикальная ось отражает относительный количественный показатель экспрессии гена. Как показано на фиг. 5, NK-0016 данного примера проявляют очень мощное действие подавления по сравнению с NI-0011 в сравнительном примере.
[0178] (Пример A4) Эффект подавления экспрессии гена GAPDH в клетках A549 и клетках 293
Подавление экспрессии гена GAPDH in vitro изучали в отношении оцРНК по настоящему изобретению.
(1) Материалы и способы
[0179] В качестве РНК (Пример) в данном примере использовали НК-0016 из Примера А1 и пример-оцРНК (PK-0004), показанные ниже. Линкерный участок (Lx) и линкерный участок (Ly) в PK-0004 были получены путем связывания соединения 10 (L-пролин-диамид-амидит) в схеме 3, что показано в примерах B между Xc и X, а также между Yc и Y, соответственно. Химическая формула обоих линкеров показана ниже. Последовательности NK-0016 и PK-0004 являются идентичными, за исключением линкерного участка (Lx) между Xc и X и линкерного участка (Ly) между Yc и Y.
Пример: NK-0016 (SEQ ID NO: 2)
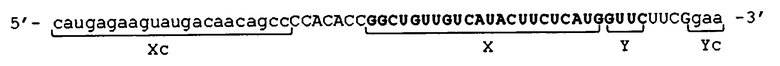
Пример: PK-0004 (SEQ ID NO: 13)
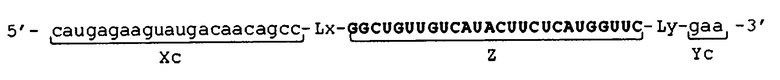
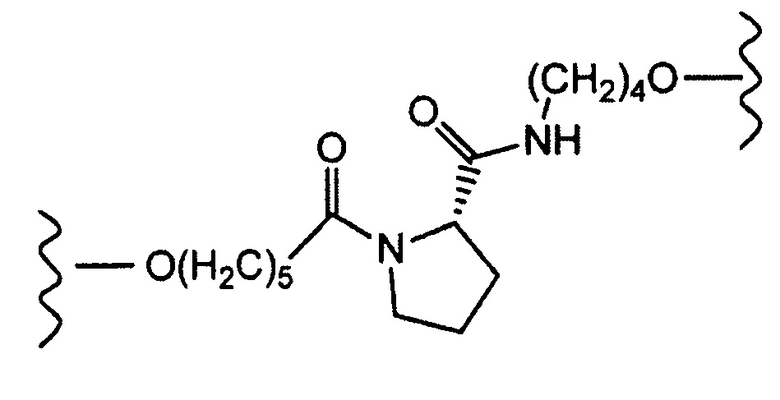
[0180] Раствор РНК готовили путем растворения каждой из РНК в дистиллированной воде для инъекций для достижения концентрации 20 мкмоль/л. Использовали клетки A549 и клетки 293 (DS Pharma Biomedical Co, Ltd). В качестве среды для указанных клеток использовали среду DMEM (Invitrogen), содержащую 10% FBS, и среду МЕМ (Invitrogen), содержащую 10% FBS, соответственно. Устанавливали условия культивирования: 37°C и 5% CO2.
[0181] Вначале клетки каждого типа культивировали в среде и распределяли в 24-луночный планшет таким образом, чтобы каждая лунка содержала 400 мкл среды для достижения плотности 5×104 клеток/на лунку. Клетки в лунках культивировали в течение следующих 24 часов. После этого клетки трансфицировали РНК с использованием трансфицирующего реагента Липофектамин 2000 (торговое наименование, Invitrogen) в соответствии с протоколом производителя. В частности, трансфекцию осуществляли путем введения композиции в лунку в клетки A549 и клетки 293 следующим образом. Указанная композиция (В) представляла собой Opti-MEM (торговое наименование, Invitrogen), и композиция (C) представляла собой раствор РНК 20 мкммоль/л, и эти композиции добавляли с тем, чтобы общее количество (B) и (C) составляло 98,5 мкл или 99 мкл. Конечная концентрация РНК в лунке составляла 1 нмоль/л, 3 нмоль/л или 10 нмоль/л.
[0182] После трансфекции клетки культивировали в течение 48 часов. После этого осуществляли сбор РНК, синтез кДНК и проводили ПЦР таким же образом, как в примере А2, после чего определяли относительные количественные показатели экспрессии гена GAPDH.
(2) Результаты
[0183] Результаты исследований показаны на фиг. 6 и 7. Фигура 6 показывает результат, полученный с клетками А549, и фиг. 7 показывает результат, полученный с клетками 293. НА фигурах 6 и 7 представлены графики относительного уровня экспрессии гена GAPDH. Как показано на фиг. 6 и 7, было обнаружено, что NK-0016 и PK-0004, согласно данному примеру, проявляют мощное действие подавления, при этом проявление подавляющего действия зависит от концентрации.
[0184] (Пример А5) Эффект подавления экспрессии гена TGF-β1 в клетках Hepa1-6
Изучали эффект подавления экспрессии гена TGF-β1 in vitro в отношении оцРНК по настоящему изобретению.
(1) Материалы и способы
[0185] В качестве РНК (Пример) в данном примере использовали оцРНК (NK-0033), показанную ниже. NK-0033 включает показанную ниже 21-мерную последовательность, которая подавляет экспрессию гена TGF-β1. Эта последовательность была сконструирована на основе использования миРНК авторами Cheng et al. (Mol. Pharm., 2009, 6, стр. 772-779).
Последовательность, подавляющая экспрессию гена TGF-β1 (SEQ ID NO: 16)
5'-AAAGUCAAUGUACAGCUGCUU-3'
[0186] В качестве РНК сравнительного примера использовали оцРНК (NK-0035), показанную ниже, как PHKi отрицательного контроля (ОК). NK-0035 создавали с тем, чтобы вместо последовательности, подавляющей экспрессию, встроить в нее скремблированную последовательность, которая не вовлечена в экспрессию подавления.
Пример: NK-0033 (SEQ ID NO: 80)

ОК: NK-0035 (SEQ ID NO: 15)
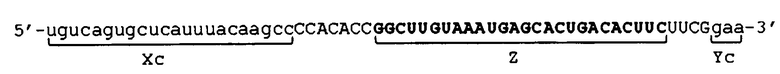
[0187] Раствор РНК готовили путем растворения каждой из РНК в дистиллированной воде для инъекций. Использовали клетки Hepa1-6 (RIKEN BioResourse Center), и в качестве среды использовали DMEM (Invitrogen), содержащую 10% FBS. Были установлены следующие условия культивирования: 37°C и 5% CO2.
[0188] Вначале клетки Hepa1-6 культивировали в среде и распределяли в 24-луночный планшет таким образом, чтобы каждая лунка содержала 400 мкл среды для достижения плотности 3×104 клеток/на лунку. Клетки в лунках культивировали в течение следующих 24 часов. После этого клетки трансфицировали оцРНК с использованием трансфицирующего реагента Липофектамин 2000 (торговое наименование, Invitrogen) в соответствии с протоколом производителя. В частности, трансфекцию осуществляли путем введения композиции в лунку следующим образом. Указанная композиция (В) представляла собой Opti-MEM (торговое наименование, Invitrogen), и композиция (C) представляла собой раствор РНК 20 мкмоль/л, и эти композиции добавляли с тем, чтобы общее количество (B) и (C) составляло 98,5 мкл. Конечная концентрация РНК в лунке составляла 10 нмоль/л, 25 нмоль/л, 50 нмоль/л или 100 нмоль/л.
[0189] После трансфекции клетки в лунках культивировали в течение 48 часов и после этого осуществляли сбор РНК, используя набор RNeasy Kit Mini (торговое наименование, Qiagen) в соответствии с протоколом изготовителя. Затем кДНК синтезировали из РНК с помощью обратной транскриптазы (торговое наименование: SuperScript III, Invitrogen) в соответствии с протоколом изготовителя. Затем проводили ПЦР таким же способом, как в примере A2, за исключением использования указанного ниже набора праймеров для гена TGF-β1 и указанного ниже набора праймеров для β-актина, после чего измеряли уровень экспрессии гена TGF-β1 и β-актина в качестве внутреннего стандарта. Уровень экспрессии гена TGF-β1 корректировали с учетом уровня экспрессии β-актина.
Набор праймеров для гена TGF-β1
5'-CCATTGCTGTCCCGTGCAGAGCTG-3' (SEQ ID NO: 17)
5'-ATGGTAGCCCTTGGGCTCGTGGATC-3' (SEQ ID NO: 18)
Набор праймеров для амплификации гена β-актина
5'-GTCGTACCACAGGCATTGTGATGG-3' (SEQ ID NO: 19)
5'-GCAATGCCTGGGTACATGGTGG-3' (SEQ ID NO: 20)
[0190] В отношении каждого из контрольных тестов (-) и контрольных (пробных тестов), уровень экспрессии измеряли таким же образом, как в примере A2. За единицу считали скорректированный уровень экспрессии гена TGF-β1 в контроле (-), и показатель уровня экспрессии в клетках, трансфицированных каждой РНК, был представлен как относительная величина по сравнению с контролем.
[0191] (2) Результаты
Результаты представлены на фиг. 8. Фигура 8 представляет график, показывающий относительный уровень экспрессии гена TGF-β1. Как показано на фиг. 8, NK-0033 согласно примеру подавляет экспрессию гена TGF-β1 in vitro. С другой стороны, NK-0035 в качестве отрицательного контроля не подавляет экспрессию гена TGF-β1.
[0192] (Пример A6) Эффект подавления экспрессии гена TGF-β1 и острое поражение легких in vivo
Исследовали эффект подавления экспрессии и эффект при остром поражении легких in vivo в отношении оцРНК по настоящему изобретению. Эти эффекты были изучены в соответствием со способом, описанным авторами Takagi et al. (J. Thromb Hemost 2009; 7: стр. 2053-2063).
[0193] (1) Материалы и способы
(1.1) Введение оцРНК мышам с острым поражением легких
В качестве РНК (Пример) в данном примере использовали оцРНК (NK-0033) из примера A5. В качестве РНК сравнительного примера использовали оцРНК (NK-0035), как PHKi отрицательного контроля (ОК), что показано в примере A5.
[0194] Раствор РНК готовили путем растворения 100 мкг каждой из оцРНК в 80 мкл стерильного физиологического раствора (Nippon Kayaku Co, Ltd, далее аналогично). С другой стороны, раствор ЛПС получали путем растворения 100 мкг липополисахарида (ЛПС) в 50 мкл стерильного физиологического раствора.
[0195] Вначале в трахею мышей вливали по капле 80 мкл раствора РНК. Затем через 1 час после закапывания в трахею мышей вливали по капле 50 мкл раствора ЛПС, чтобы вызвать поражение легких.
[0196] В качестве отрицательного контроля для ЛПС вместо раствора ЛПС использовали 50 мкл стерильного физиологического раствора, не содержащего ЛПС. Также в качестве отрицательного контроля для раствора РНК использовали 80 мкл стерильного физиологического раствора.
[0197] Группы введения описаны ниже. В каждой группе введения было от четырех до шести мышей.
Группа введения 1:
Через 1 час после введения 80 мкл стерильного физиологического раствора вводили 50 мкл стерильного физиологического раствора.
Группа введения 2:
Через 1 час после введения 80 мкл раствора РНК (NK-0033) вводили 50 мкл стерильного физиологического раствора.
Группа введения 3:
Через 1 час после введения 80 мкл раствора РНК (NK-0035) вводили 50 мкл стерильного физиологического раствора.
Группа введения 4:
Через 1 час после введения 80 мкл стерильного физиологического раствора вводили 50 мкл раствора ЛПС.
Группа введения 5:
Через 1 час после введения раствора РНК (NK-0033) вводили 50 мкл раствора ЛПС.
Группа введения 6:
Через 1 час после введения раствора РНК (NK-0035) вводили 50 мкл раствора ЛПС.
[0198] (1.2) Забор проб жидкости бронхоальвеолярного лаважа (BALF)
Через 24 часа после закапывания раствора ЛПС мышей подвергали эвтаназии путем введения избыточного количества пентобарбитала в брюшную полость, затем мышей использовали как образцы для биохимического анализа и гистологического анализа. В качестве отрицательного контроля вместо раствора ЛПС использовали стерильный физиологический раствор.
[0199] Образцы крови мышей забирали путем сердечной пункции. Каждый образец крови помещали в тестовую пробирку, содержащую 3,8% водного раствора цитрата натрия. Количество (объем) водного раствора цитрата натрия составлял 1/10 от образца крови. Образцы BALF забирали из указанной смеси способом, описанным авторами Yasui et al. (Am J Respir Crit Care Med 2001: 163: 1660-8). Затем подсчитывали общее количество клеток в образце BALF с помощью счетчика Nucleo Counter (торговое наименование, ChemoMetec).
[0200] Образцы BALF центрифугировали, затем собирали супернатант образцов BALF. Супернатант хранили при -80°C до проведения биохимического анализа. Кроме того, для подсчета разных типов клеток, содержащихся в образце BALF, образец BALF центрифугировали с использованием Cytospin, и сепарированные клетки подвергали окрашиванию по Гимзе с использованием красителя Май-Грюнвальда-Гимзы (торговое наименование, Merck). Дополнительно, у мышей осуществляли забор тканей легкого, после чего их окрашивали гематоксилин-эозином (ГЭ).
(2) Результаты
(2.1) Подавление экспрессии TGF-β1 в легких
[0201] В каждом образце легких от мышей измеряли уровень экспрессии гена TGF-β1 на единицу веса легких с помощью колориметрического сэндвич-анализа ELISA TGF-β1 (Quantikine Colorimetric Sandwich ELISA, торговое наименование, R&D Systems).
[0202] Результаты исследований представлены на фиг. 9. Фигура 9 представляет график, показывающий уровень экспрессии TGF-β1 на единицу веса легкого в каждой группе введения. В группе введения 4 (ЛПС (+)/РНК (-)) уровень экспрессии TGF-β1 был повышен в результате введения ЛПС, по сравнению с уровнем экспрессии в группе введения 1 (ЛПС (-)/РНК (-)). В группе введения 5 (ЛПС (+)/NK-0033 (+)) из этого примера повышение уровня экспрессии TGF-β1 было подавлено по сравнению с уровнем экспрессии в группе введения 4 (ЛПС (+)/РНК (-)). Этот эффект подавления отсутствовал в группе введения 6 (ЛПС (+)/отрицательный контроль NK-0035 (+)). Данные результаты показывают, что NK-0033 из этого примера может эффективно подавлять экспрессию гена TGF-β1.
[0203] (2.2) Эффект подавления при остром поражении легких
Воспаление при остром поражении легких вызвано инфильтрацией в легкие клеток, таких как нейтрофилы. Таким образом, препараты, которые ингибируют инфильтрацию в легкие клеток, например, нейтрофилов, можно применять в качестве терапевтических агентов для лечения воспаления при остром поражении легких. Таким образом, фармакологический эффект оцРНК по настоящему изобретению был изучен путем подсчета количества клеток в жидкости бронхоальвеолярного лаважа (BALF) в качестве показателя числа клеток, инфильтрировавших легкие.
[0204] Результаты подсчета количества клеток в образце BALF показаны на фиг. 10. Фигура 10 представляет график, показывающий количество клеток в образце BALF в каждой группе введения. В группе введения 4 (ЛПС (+)/РНК (-)) количество клеток в образце BALF увеличено в результате введения ЛПС, по сравнению с количеством клеток в группе введения 1 (ЛПС (-)/РНК (-)). Это означает, что ЛПС индуцирует воспалительное действие, в результате чего клетки получают возможность инфильтрировать легкие. В группе введения 5 (ЛПС (+)/NK-0033 (+)) из этого примера рост числа клеток был ингибирован по сравнению с таковым в группе введения 4 (ЛПС (+)/РНК (-)). Это означает, что воспаление при остром поражении легких было ингибировано посредством NK-0033. Этот эффект не наблюдался в группе введения 6 (ЛПС (+)/отрицательный контроль NK-0035 (+)). Данные результаты показывают, что NK-0033 из этого примера может эффективно подавлять воспаление при остром поражении легких.
[0205] Результаты измерения количества нейтрофилов в образце BALF показаны на фиг. 11. Фигура 11 представляет график, показывающий количество нейтрофилов в образце BALF в каждой группе введения. В группе введения 4 (ЛПС (+)/РНК (-)) количество нейтрофилов в образце BALF увеличено в результате введения ЛПС, по сравнению с количеством нейтрофилов в группе введения 1 (ЛПС (-)/РНК (-)). Это означает, что ЛПС индуцирует воспалительное действие, в результате чего нейтрофилы получают возможность инфильтрировать легкие. В группе введения 5 (ЛПС (+)/NK-0033 (+)) из этого примера рост числа нейтрофилов в образце BALF был ингибирован по сравнению с таковым в группе введения 4 (ЛПС (+)/оцРНК (-)). Это означает, что воспаление при остром поражении легких подавляется посредством NK-0033. Этот эффект отсутствовал в группе введения 6 (ЛПС (+)/отрицательный контроль NK-0035 (+)). Эти результаты показывают, что NK-0033 из этого примера может эффективно подавлять воспаление при остром поражении легких.
(2.3) Гистологическое исследование: окрашивание по Гимзе
[206] Результаты окрашивания Гимза показаны на фиг. 12. Фигура 12 представляет фотографии (×100), каждая из которых показывает результат окрашивания по Гимзе клеток в образце BALF. Фиг. 12А показывает результат, полученный в группе введения 4 (ЛПС (+)/РНК (-)). Фиг. 12B показывает результат, полученный в группе введения 6 (ЛПС (+)/отрицательный контроль NK-0035 (+)). Фиг. 12С показывает результат, полученный в группе введения 5 (ЛПС (+)/NK-0033 (+)).
[0207] Как показано на фиг. 12, в группе введения 5 (фиг. 12С: ЛПС (+)/NK-0033 (+)) из этого примера количество клеток, инфильтрировавших легкие, было заметно меньше, чем в группе введения 4 (фиг. 12A: ЛПС (+)/РНК (-)) и в группе введения 6 (фиг. 12В: ЛПС (+)/отрицательный контроль NK-0035 (+)). Результаты гистологического исследования согласуются с результатами подсчета количества клеток в образце BALF, описанными выше.
(2.4) Гистологическое исследование: окрашивание ГЭ
[0208] Результаты окрашивания ГЭ показаны на фиг. 13. Фигура 13 представляет фотографии (×10), каждая из которых показывает результат окрашивания ГЭ ткани легкого. Фиг. 13А показывает результат, полученный в группе введения 4 (ЛПС (+)/РНК (-)). Фиг. 13B показывает результат, полученный в группе введения 6 (ЛПС (+)/отрицательный контроль NK-0035 (+)). Фиг. 13С показывает результат, полученный в группе введения 5 (ЛПС (+)/NK-0033 (+)). Согласно фиг. 13 было обнаружено уменьшение клеточной инфильтрации, например, нейтрофилами, в зоне кровеносных сосудов, альвеолярного пространства, альвеолярных стенок и в зоне бронхов, и уменьшение повреждения легочных тканей.
[0209] (Пример A7) Оценка побочных эффектов с использованием в качестве индикатора индукции интерферона
Известно, что общепринятые агенты PHKi вызывают побочный эффект, при котором по принципу независимой последовательности происходит индукция интерферона, и этот побочный эффект представляет собой проблему. Таким образом, используя оцРНК по настоящему изобретению, проводили оценку побочного эффекта в виде индукции интерферона.
[0210] (1) Материалы и способы
Мышам с острым поражением легких вводили оцРНК в том же порядке и при аналогичных условиях, как в примере A6. Затем, через 24 часа после капельного введения раствора ЛПС или стерильного физиологического раствора (отрицательный контроль для ЛПС), мышей умерщвляли и осуществляли забор тканей легких.
[0211]
[0212] Для измерения уровня экспрессии каждого гена из каждого образца тканей легких выделяли РНК с помощью TRIZOL (торговое наименование, Invitrogen). Затем синтезировали кДНК из РНК с помощью обратной транскриптазы (торговое наименование: SuperScriptII, Invitrogen) согласно протоколу изготовителя. После этого проводили ПЦР с использованием в качестве матрицы синтезированных указанным способом кДНК, затем измеряли уровни экспрессии гена TGF-β1, гена IFH-α и гена IFH-β.
[0213] ПЦР проводили с использованием реагента Gold AmpliTaq (торговое наименование, Applied Biosystem, USA) и измерительного оборудования AB Applied Biosystem 7600 (торговое наименование, Applied Biosystem). Амплификацию гена TGF-β1, гена IFH-α и гена IFH-β осуществляли с помощью следующих наборов праймеров, соответственно.
Набор праймеров для гена GAPDH
5'-CCCTTATTGACCTCAACTACATGGT-3' (SEQ ID NO: 21)
5'-GAGGGGCCATCCACAGTCTTCTG-3' (SEQ ID NO: 22)
Набор праймеров для гена TGF-β1
5'-ACTCCACGTGGAAATCAACGG-3' (SEQ ID NO: 23)
5'-TAGTAGACGATGGGCAGTGG-3' (SEQ ID NO: 24)
Набор праймеров для гена IFN-α
5'-ATGGCTAGRCTCTGTGCTTCCT-3' (SEQ ID NO: 25)
5'-AGGGCTCTCCAGAYTTCTGCTCTG-3' (SEQ ID NO: 26)
Набор праймеров для гена IFN-β
5'-CATCAACTATAAGCAGCTCCA-3' (SEQ ID NO: 27)
5'-TTCAAGTGGAGAGCAGTTCAG-3' (SEQ ID NO: 28)
[0214] Затем каждый из полученных указанным способом продуктов ПЦР подвергали электрофорезу в агарозном геле. Анализ плотности в агарозном геле проводили с помощью системы визуализации NIH, и измеряли уровни экспрессии соответствующих генов. Уровни экспрессии гена TGF-β1, гена IFH-α и гена IFH-β оценивали по отношению к уровню экспрессии гена GAPDH в качестве стандарта. В частности, за единицу считали измеренную интенсивность продукта ПЦР, полученного с использованием набора праймеров для GAPDH, и интенсивность для соответствующих генов оценивали как относительное значение по сравнению с этим значением для GAPDH.
[0215] (2) Результаты и обсуждение
Результаты количественного анализа в отношении уровня экспрессии гена TGF-β1, гена IFH-α и гена IFH-β показаны на графиках фигур 14A-14С, соответственно. Группы введения, описанные ниже, аналогичны группам введения из примера A6.
[0216] Фигура 14А представляет результаты измерения уровня экспрессии гена TGF-β1. Как показано на фиг. 14А, в группе введения 5 из этого примера, в которой вводили NK-0033, ингибировалось повышение экспрессии гена TGF-β1, индуцируемое ЛПС, по сравнению с экспрессией в группе введения 4 (РНК (-)). Этот результат согласуется с результатами измерения уровня экспрессии TGF-β1 из примера A5, который показан на фиг. 8.
[0217] Фигура 14B показывает результаты измерения уровня экспрессии гена IFH-α, и фигура 14С показывает результаты измерения уровня экспрессии гена IFH-β. Как показано на фиг. 14В и 14С, при сравнении группы введения 1 (РНК (-)) и группы введения 2 (РНК (+)), когда не вводили ЛПС, было обнаружено, что не происходит индукции экспрессии гена IFH-α и гена IFH-β, оба из которых представляют собой интерферон I типа, что обусловлено капельным введением оцРНК. Также на фиг. 14В и 14С показано, что при капельном введении ЛПС при сравнении группы введения 4 (РНК (-)) и группы введения 5 (NK-0033 (+)) было обнаружено отсутствие индукции экспрессии гена IFH-α и гена IFH-β, что обусловено капельным введением оцРНК.
[0218] Эти результаты противоречат факту, что использование общепринятых миРНК вызывает побочный эффект, который индуцирован интерфероном I типа. То есть, было неожиданно показано, что оцРНК по настоящему изобретению не вызывает побочный эффект в виде индукции интерферона, что считается проблемой для общепринятых миРНК.
[0219] (Пример A8) Эффект подавления экспрессии гена TGF-β1 в клетках Hepa1-6
Изучали эффект подавления экспрессии гена TGF-β1 in vitro в отношении оцРНК по настоящему изобретению.
[0220] (1) Материалы и способы
В качестве РНК (Пример) в данном примере использовали NK-0033 из примера A5 и NK-0061, NK-0055 и NK-0062, показанные ниже. В последовательностях, показанных далее, "*" обозначает непарное основание.
Пример: NK-0033 (SEQ ID NO: 80)

Пример: NK-0061 (SEQ ID NO: 29)

Пример: NK-0055 (SEQ ID NO: 30)
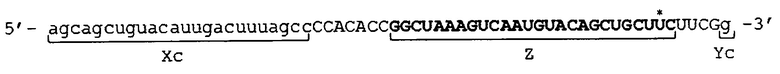
Пример: NK-0062 (SEQ ID NO: 31)
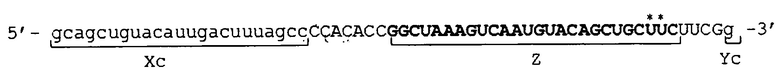
[0221] Также в качестве РНК (Пример) данного примера использовали PK-0007, PK-0026, PK-0027 и PK-0028, показанные ниже. В каждой из этих оцРНК создавали линкерный участок (Lx) и линкерный участок (Ly) путем связывания соединения 10 (L-пролин-диамид-амидит) между Xc и X, а также между Yc и Y, соответственно, согласно схеме 3, показанной в примерах B.
Пример: PK-0007 (SEQ ID NO: 32)
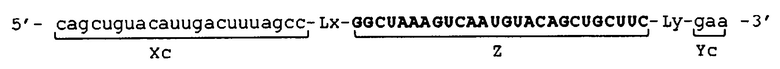
Пример: PK-0026 (SEQ ID NO: 33)
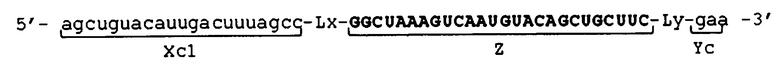
Пример: PK-0027 (SEQ ID NO: 34)
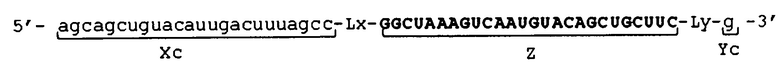
Пример: PK-0028 (SEQ ID NO: 35)
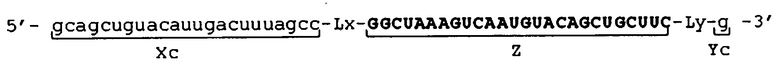
[0222] Последовательности NK-0033, NK-0061, NK-0055 и NK-0062 аналогичны последовательностям PK-0007, PK-0026, PK-0027 и PK-0028, соответственно, за исключением первого линкера (L1) и второго линкера (L2). Все они имеют последовательность, которая подавляет экспрессию гена TGF-β1 (SEQ ID NO: 16).
[0223] (1.2) Подавление экспрессии гена
Раствор РНК готовили путем растворения каждой из криоконсервированых РНК в дистиллированной воде для инъекций для достижения концентрации 20 мкмоль/л. Затем трансфицировали оцРНК в клетки Hepa1-6, проводили сбор РНК, синтез кДНК, ПЦР и определяли относительный уровень экспрессии гена TGF-β1 таким же образом, как в примере A5, за исключением использования вышеуказанного раствора РНК. Концентрацию РНК во время трансфекции устанавливали на уровне 1 нмоль/л.
[0224] (2) Результаты
Результаты исследований представлены на фиг. 15 и 16. Фигуры 15 и 16 представляют графики, показывающие относительный уровень экспрессии гена TGF-β1. Фигура 15 показывает результаты, полученные при использовании NK-0033, NK-0061, NK-0055 и NK-0062, и фигура 16 показывает результаты, полученные при использовании PK-0007, PK-0026, PK-0027 и PK-0028. Как можно отметить, согласно фиг. 15 и 16, все из этих оцРНК проявляют мощное действие подавления.
[0225] (Пример A9) Эффект подавления экспрессии гена TGF-β1 и эффект при остром поражении легких in vivo
[0226] (A9-1) Эффект подавления экспрессии гена TGF-β1 in vivo.
Изучали эффект подавления экспрессии гена TGF-β1 in vivo в отношении оцРНК по настоящему изобретению.
[0227] (1) Материалы и способы
Введение РНК мышам при остром поражении легких проводили таким же образом, как в примере A6, если не указано иное.
[0228] В качестве РНК (Пример) данного примера использовали PK-0007 и NK-0033 из примера A8. Кроме того, использовали PK-0008 как РНК сравнительного примера, НК-0035 как PHKi отрицательного контроля (ОК), дцРНК (NI-0030) как PHKi положительного контроля (ПК), и дцРНК (NI-0031) как PHKi отрицательного контроля (ОК), показанные ниже. PK-0008 из отрицательного контроля имеет линкеры Lx и Ly, происходящие из вышеописанного амидита (соединение 10 на схеме 3: L-пролин-диамид-амидит), и эти линкеры аналогичны линкерам в PK-0007.
[0229]
Пример: PK-0007 (SEQ ID NO: 32)

ОК: PK-0008 (SEQ ID NO: 36)
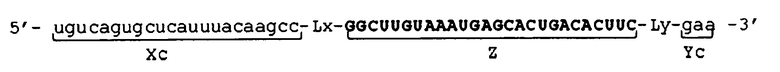
Пример: NK-0033 (SEQ ID NO: 80)

ОК: NK-0035 (SEQ ID NO: 15)
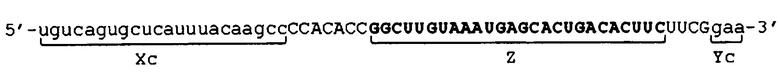
ПК: NI-0030
5'-GCAGCUGUACAUUGACUUUAG-3' (SEQ ID NO: 39)
3'-UUCGUCGACAUGUAACUGAAA-5' (SEQ ID NO: 40)
ОК: NI-0031
5'-GUGUCAGUGCUCAUUUACAAG -3' (SEQ ID NO: 41)
3'- UUCACAGUCACGAGUAAAUGU-5' (SEQ ID NO: 42)
[0230] Раствор РНК готовили путем растворения 100 мкг каждой из РНК в 75 мкл стерильного физиологического раствора. С другой стороны, раствор ЛПС получали путем растворения 100 мкг липополисахарида (ЛПС) в 50 мкл стерильного физиологического раствора.
[0231] Группы введения описаны ниже. Если не указано иное, введение осуществляли таким же образом, как в примере A6. В каждой группе введения было от четырех до шести мышей.
Группа введения 1:
Через 5 минут после введения 75 мкл стерильного физиологического раствора вводили 50 мкл стерильного физиологического раствора.
Группа введения 2:
Через 5 минут после введения 75 мкл стерильного физиологического раствора вводили 50 мкл раствора ЛПС.
Группа введения 3:
Через 5 минут после введения 75 мкл раствора РНК (PK-0007) вводили 50 мкл раствора ЛПС.
Группа введения 4:
Через 5 минут после введения 75 мкл раствора РНК (PK-0008) вводили 50 мкл раствора ЛПС.
Группа введения 5:
Через 5 минут после введения 75 мкл раствора РНК (NK-0033) вводили 50 мкл раствора ЛПС.
Группа введения 6:
Через 5 минут после введения 75 мкл раствора РНК (NK-0035) вводили 50 мкл раствора ЛПС.
Группа введения 7:
Через 5 минут после введения 75 мкл раствора РНК (NI-0030) вводили 50 мкл раствора ЛПС.
Группа введения 8:
Через 5 минут после введения 50 мкл раствора РНК (NI-0031) вводили 50 мкл раствора ЛПС.
[0232] Затем подготавливали образцы легких и измеряли уровень экспрессии TGF-β1 на единицу веса легких тем же способом, как в примере A6.
[0233] Результаты исследований представлены на фиг. 17. Фигура 17 представляет график с показателями на единицу веса легких в каждой группе введения. В группе введения 3 (ЛПС (+)/PK-0007 (+)) и в группе введения 5 (ЛПС (+)/NK-0033 (+)) уровень экспрессии гена TGF-β1 был снижен по сравнению с уровнем экспрессии в группе введения 2 (ЛПС (+)/оцРНК (-)). Было выявлено, что эти эффекты подавления превышали эффект подавления в группе введения 7 (ЛПС (+)/положительный контроль NI-0030). В частности, в группе введения 3 (ЛПС (+)/PK-0007 (+)) наблюдали выраженный эффект подавления. Эффект подавления не выявлен в группах введения, в которых вводили РНК отрицательного контроля, а именно в группе введения 4 (PK-0008), группе введения 6 (NK-0035) и группе введения 8 (NI-0031).
[0234] (A9-2) Нецелевой эффект in vivo
Изучали нецелевой эффект in vivo и оценивали побочный эффект с использованием оцРНК по настоящему изобретению.
[0235] В качестве РНК данного примера использовали оцРНК (PK-0007) из примера A8. Использовали РНК из сравнительного примера, оцРНК (PK-0008) как PHKi отрицательного контроля (ОК), дцРНК (NI-0030) как PHKi положительного контроля (ПК), и дцРНК (NI-0031) в качестве PHKi отрицательного контроля, как показано в примере A9-1. Раствор РНК готовили путем растворения 100 мкг каждой из РНК в 75 мкл стерильного физиологического раствора.
[0236] Ниже описаны группы введения. В каждой группе введения было от двух до четырех мышей.
Группа введения 1:
Вводили 75 мкл стерильного физиологического раствора.
Группа введения 2:
Вводили 75 мкл раствора РНК (PK-0007).
Группа введения 3:
Вводили 75 мкл раствора РНК (PK-0008).
[0237] Затем через 24 часа после введения образцы BALF забирали из мышей и получали супернатанты образцов BALF таким же способом, как в примере A6. В каждом супернатанте измеряли количество TNF-α и количество IFH-β. Количество TNF-α подсчитывали с помощью набора Mouse TNF set II (торговое наименование, Beckton Dickinson and Company) согласно инструкциям изготовителя. Количество IFH-β подсчитывали с помощью планшета ELISA, изготовленного с использованием кроличьего анти-мышиного интерферона β (торговое наименование, PBL Interferon Source) и набора Biotin Labeling Kit-NH2 (торговое наименование, Dojindo Laboratories) согласно инструкциям изготовителя по применению.
[0238] Результаты исследований представлены на фиг. 18. Фиг. 18А представляет график, показывающий количество TNF-α в образце BALF в каждой группе введения, и фиг. 18B представляет собой график, показывающий количество IFH-β в образце BALF в каждой группе введения. По горизонтальным осям на фиг. 18А и 18В обозначены соответствующие количества. В группе введения 2 (PK-0007 (+)) не возникало экспрессии TNF-α и IFH-β по сравнению с группой введения 1 (РНК (-)).
[0239] (Пример А10) Эффект подавления экспрессии гена LAMA1 в клетках 293
Исследовали подавление экспрессии гена LAMA1 in vitro в отношении оцРНК по настоящему изобретению.
[0240] (1) Материалы и способы
В качестве РНК (Пример) в данном примере использовали NK-0043 и NK-0064, показанные ниже. В указанных ниже последовательностях "*" обозначает непарное основание (далее аналогично).
Пример: NK-0043 (SEQ ID NO: 43)

Пример: NK-0064 (SEQ ID NO: 44)
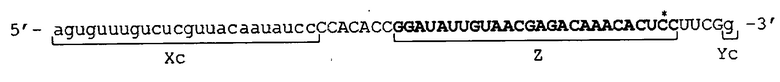
[0241] Трансфекцию в клетки 293 проводили таким же способом, как в примере A4, за исключением использования каждой из вышеперечисленных РНК, затем клетки культивировали в течение 48 часов. Концентрация РНК во время трансфекции составляла 10 нмоль/л. После этого проводили сбор РНК, синтез кДНК и ПЦР таким же способом, как в примере A2, за исключением использования набора праймеров для гена LAMA1, описанного ниже, затем измеряли уровень экспрессии гена LAMA1 и уровень экспрессии β-актина в качестве внутреннего стандарта. Уровень экспрессии гена LAMA1 корректировали с учетом уровня экспрессии β-актина в качестве внутреннего стандарта.
Набор праймеров для гена LAMA1
5'-AAAGCTGCCAATGCCCCTCGACC-3' (SEQ ID NO: 45)
5'-TAGGTGGGTGGCCCTCGTCTTG-3' (SEQ ID NO: 46)
[0242] В отношении каждого из контроля 1 (-) и контроля 2 (пробный тест), уровень экспрессии измеряли тем же способом, как в примере A2. За единицу принимали скорректированный уровень экспрессии гена LAMA1 в контроле 1 (-), и уровень экспрессии в клетках, трансфицированных каждой РНК, был представлен как относительное значение по сравнению с контролем.
[0243] (2) Результаты
Результаты исследований представлены на фиг. 19. Фигура 19 представляет график, показывающий относительный уровень экспрессии гена LAMA1 в клетках 293. Как показано на фиг. 19, было обнаружено, что и NK-0043 и NK-0064 из этого примера проявляют мощное действие подавления.
[0244] (Пример А11) Эффект подавления экспрессии генов LMNA в клетках A549
Исследовали эффект подавления экспрессии гена LMNA in vitro посредством РНК-интерференции в отношении оцРНК по настоящему изобретению.
[0245] (1) Материалы и способы
В качестве РНК (Пример) в данном примере использовали NK-0063 и NK-0066, показанные ниже. В указанных ниже последовательностях "*" обозначает непарное основание.
Пример: NK-0063 (SEQ ID NO: 47)

Пример: NK-0066 (SEQ ID NO: 48)
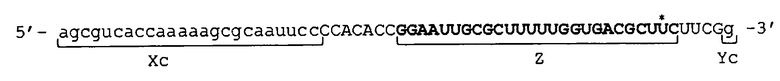
[0246] Трансфекцию в клетки А549 проводили таким же способом, как в примере A4, за исключением использования каждой из вышеперечисленных РНК, затем клетки культивировали в течение 48 часов. Концентрация РНК во время трансфекции составляла 3 нмоль/л. После этого проводили сбор РНК, синтез кДНК и ПЦР таким же способом, как в примере A2, за исключением использования набора праймеров для гена LMNA, описанного ниже, затем измеряли уровень экспрессии гена LMNA и уровень экспрессии β-актина в качестве внутреннего стандарта. Уровень экспрессии гена LMNA корректировали с учетом уровня экспрессии β-актина в качестве внутреннего стандарта.
Набор праймеров для гена LMNA
5'-CTGGACATCAAGCTGGCCCTGGAC-3' (SEQ ID NO: 49)
5'-CACCAGCTTGCGCATGGCCACTTC-3' (SEQ ID NO: 50)
[0247] В отношении каждого из контроля 1 (-) и контроля 2 (пробный тест), уровень экспрессии измеряли тем же способом, как в примере A2. За единицу принимали скорректированный уровень экспрессии гена LMNA в контроле (-), и уровень экспрессии в клетках, трансфицированных каждой РНК, был представлен как относительное значение по сравнению с контролем.
[0248] (2) Результаты
Результаты исследований представлены на фиг. 20. Фигура 20 представляет график, показывающий относительный уровень экспрессии гена LMNA в клетках А549. Как показано на фиг. 20, было обнаружено, что и NK-0063 и NK-0066 из этого примера проявляют мощное действие подавления.
[0249] (Пример A12) Длина Xc и Yc
Используя оцРНК по настоящему изобретению, изменяли длину 5'-концевого участка (Xc), комплементарного внутреннему 5'-концевому участку (X), и длину 3'-концевого участка (Yc), комплементарного внутреннему 3'-концевому участку (Y), и изучали подавление экспрессии гена GAPDH in vitro.
[0250] (1) Материалы и способы
В качестве РНК в данном примере использовали оцРНК, показанные на фиг. 21. На фигуре 21 цифры справа указывают идентификационные номера последовательностей. На фигуре 21, с 5'-конца, участок с подчеркнутыми буквами нижнего регистра обозначает участок (Xc); участок с подчеркнутыми заглавными буквами обозначает внутренний участок (Z); и участок с подчеркнутыми буквами нижнего регистра обозначает участок (Yc). Участок между Хс и Z представляет собой линкерный участок (Lx), и участок между Z и Yc является линкерным участком (Ly). Также "Xc/Yc" обозначает соотношение длины в основаниях (Xc) участка (Xc) и длины в основаниях (Yc) участка (Yc). На фиг. 21 "*" обозначает непарное основание.
[0251] В каждой из оцРНК длина в основаниях внутреннего участка (Z) составляет 26, длина в основаниях линкерного участка (Lx) составляет 7, и длина в основаниях линкерного участка (Ly) составляет 4. В NK-0036 и NK-0040 общее количество оснований (Xc+Yc) в участках (Хс) и (Yc) составляет 26. В молекулах оцРНК, кроме NK-0036 и NK-0040, общее количество оснований (Xc+Yc) в участках (Хс) и (Yc) составляет 25. Затем при указанных условиях изменяли длину в основаниях участков (Хс) и (Yc). В результате NK-0036 и NK-0040 превращались в молекулы без непарных оснований. Кроме того, каждая из оцРНК, кроме NK-0036 и NK-0040, стала молекулой, в которой внутренний участок (Z) включает только одно непарное основание, которое не образует двойную цепь, и положение непарного основания во внутреннем участке (Z) переместилось с 3'-конца на 5'-конец.
[0252] Трансфекцию в клетки HCT116, культивирование, сбор РНК, синтез кДНК и ПЦР проводили таким же образом, как в примере A2, за исключением использования каждой из вышеуказанных РНК, и определяли относительный уровень экспрессии гена GAPDH. Концентрация РНК в момент трансфекции составляла 10 нмоль/л.
[0253] (2) Результаты и обсуждение
Результаты исследований представлены на фиг. 22. Фигура 22 представляет график, показывающий относительный уровень экспрессии гена GAPDH, при конечной концентрации каждой используемой РНК 10 нмоль/л. Как показано на фиг. 22, было установлено, что все молекулы оцРНК с разными показателями длины 5'-концевого участка (Xc) и 3'-концевого участка (Yc) подавляют экспрессию гена GAPDH.
[0254] В частности, установлено, что с увеличением разницы между длиной в основаниях участка (Xc) и длиной в основаниях участка (Yc) наблюдалось относительное снижение уровня экспрессии гена, т.е. повышалась активность подавления. Таким образом, установлено, что активность подавления можно повысить путем расположения непарного основания во внутреннем участке (Z) ближе к 5'-концу или к 3'-концу по отношению к середине внутреннего участка.
[0255] В примере A2 было обнаружено, что NK-0016 обладает очень мощным подавляющим действием. В данном примере было выявлено, что активность подавления NK-0025 и NK-0037 превышала активность NK-0016.
[0256] В отношении положения непарного основания, эффект, аналогичный данному примеру, также был получен в примерах изучения разных генов, например, в примере A8 (ген TGF-β1), в примере A10 (ген LAMA1) и в примере A11 (ген LMNA).
[0256] Таким образом, в примере A8, как показано в описанных выше последовательностях, обе молекулы NK-0033 и NK-0055 имеют одно непарное основание. В NK-0033 непарное основание является 4-ым основанием от 3'-конца внутреннего участка (Z). В NK-0055 непарное основание является 2-ым основанием с 3'-конца внутреннего участка (Z). При этом, как показано на фиг. 15 выше, NK-0055, имеющая непарное основание в положении ближе к 3'-концу, проявляет более высокую активность подавления. Аналогичный результат был получен при сравнении NK-0061 и NK-0062, каждая из которых имеет два непарных основания. Также, согласно примерам A9 и A10, положение непарного основания изменяли при аналогичных условиях, как в примере A8. Как результат, оцРНК, сходным образом имеющая непарное основание в положении, близком к 3'-концу, проявляет более высокую активность подавления.
[0258] Дополнительно, полученные результаты свидетельствуют, что оцРНК по настоящему изобретению проявляет сходные свойства независимо от вида целевого гена и последовательности, подавляющей экспрессию целевого гена. Таким образом, можно сказать, что оцРНК по настоящему изобретению является инструментом, который можно применять независимо от вида целевого гена.
[0259] (Пример А13) Длина X, Xc, Y и Yc
Используя оцРНК по настоящему изобретению, изменяли длину внутреннего 5'-концевого участка (X), 5'-концевого участка (Xc), внутреннего 3'-концевого участка (Y) и 3'-концевого участка (Yc), и изучали подавление экспрессии гена GAPDH in vitro.
[0260] (1) Материалы и способы
В качестве РНК в данном примере использовали оцРНК, показанную на фиг. 23. На фигуре 23 цифры справа указывают идентификационные номера последовательностей. На фигуре 23, с 5'-конца, участок с подчеркнутыми буквами нижнего регистра обозначает участок (Xc); участок с подчеркнутыми заглавными буквами обозначает внутренний участок (Z); и участок с подчеркнутыми буквами нижнего регистра обозначает участок (Yc). Также "Xc+Yc/X+Y" обозначает соотношение общей длины в основаниях участков (Xc) и (Yc) и общей длины в основаниях участков(X) и (Y). На фиг. 23 "*" обозначает непарное основание.
[0261] В каждой из оцРНК длина в основаниях линкерного участка (Lx) составляет 7, длина в основаниях линкерного участка (Ly) составляет 4, длина в основаниях участка (Yc) составляет 1, и 2-ое основание с 3'-конца внутреннего участка (Z) является непарным основанием. Затем изменяли длину в основаниях внутреннего участка (Z) и длину в основаниях участка (Xc).
[0262] Если не указано иное, трансфекцию каждой из РНК в клетки HCT116, культивирование, сбор РНК, синтез кДНК и ПЦР проводили таким же способом, как в примере A2, и затем измеряли уровень экспрессии гена GAPDH. Трансфекцию осуществляли путем введения композиции в лунку следующим образом. Указанные ниже композиции: (В) представляет собой Opti-MEM (торговое наименование, Invitrogen), (C) представляет собой раствор РНК 20 мкмоль/л; эти композиции добавляли таким образом, что их общее количество составляло 98,5 мкл. Конечная концентрация РНК в лунке составляла 1 нмоль/л. Коррекцию с внутренним стандартом и вычисление относительного значения уровня экспрессии осуществляли таким же способом, как в примере A2.
(2) Результаты и обсуждение
[0263] Результаты исследований представлены на фиг. 24. Фигура 24 представляет график, показывающий относительный уровень экспрессии гена GAPDH при условии конечной концентрации каждой используемой РНК 1 нмоль/л. Как показано на фиг. 24, было установлено, что все оцРНК с разными показателями длины участков (X), (Xc), (Y) и (Yc) подавляли экспрессию гена GAPDH. В примере A2 было показано, что NK-0016 обладает очень мощным подавляющим действием. В данном примере было установлено, что активность подавления всех оцРНК, исключая NK-0016, превышает активность даже NK-0016.
[0264] (Пример А14) Длина Xc
Используя оцРНК по настоящему изобретению, изменяли длину внутреннего 5'-концевого участка (Xc), комплементарного внутреннему 5'-концевому участку (X), и изучали подавление экспрессии гена GAPDH in vitro.
[0265] (1) Материалы и способы
В качестве РНК данного примера были использованы оцРНК, показанные на фиг. 25. На фигуре 25, с 5'-конца, участок с подчеркнутыми буквами нижнего регистра обозначает участок (Xc); участок с подчеркнутыми заглавными буквами обозначает внутренний 5'-концевой участок (Х); и участок с подчеркнутыми буквами нижнего регистра обозначает участок (Yc). Также "Xc/Y" обозначает соотношение длины в основаниях (Xc) участка (Xc) и длины в основаниях (X) участка (X). (На фиг. 25 "*" обозначает непарное основание. SEQ ID NO: от 74 до 76 показывают последовательности нижеуказанных РНК.
[0266] В каждой из оцРНК длина в основаниях внутреннего участка (Z) составляет 26; длина в основаниях участка (X) составляет 25, длина в основаниях участка (Y) составляет 1, длина в основаниях участка (Yc) составляет 1, длина в основаниях линкерного участка (Lx) составляет 7, и длина в основаниях линкерного участка (Ly) составляет 4. Затем при указанных условиях изменяли длину в основаниях участка (Xc). Таким образом, в каждой из оцРНК были изменения в отношении наличия или отсутствия непарного основания, которое не образует двойную цепь, и в количестве таких непарных оснований. В NK-0001 непарные основания отсутствуют.
[0267] Трансфекцию в клетки HCT116, культивирование, сбор РНК, синтез кДНК и ПЦР проводили таким же способом, как в примере A13, за исключением использования каждой из вышеперечисленных РНК, и затем измеряли уровень экспрессии гена GAPDH. Коррекцию с внутренним стандартом и вычисление относительного значения уровня экспрессию осуществляли таким же способом, как в примере A13.
(2) Результаты и обсуждение
[0268] Результаты исследований представлены на фиг. 26. Фигура 26 представляет график, показывающий относительный уровень экспрессии гена GAPDH, при использовании каждой из РНК в конечной концентрации 1 нмоль/л. Как показано на фиг. 26, было выявлено, что все оцРНК с вариабельной длиной 5'-концевого участка (Xc) подавляют экспрессию гена GAPDH. В частности, если оцРНК имеют непарное основание (основания), предполагается повышение активности подавления, поскольку уменьшается количество непарных оснований. В примере A2 было обнаружено, что NK-0016 обладает очень мощным подавляющим действием. В данном примере установлено, что все используемые в данном примере оцРНК, отличающиеся от NK-0016, обладают активностью подавления, которая даже превышает активность NK-0016.
[0269] В отношении числа непарных оснований, эффект, аналогичный данному примеру, также был получен в примере A8, в котором изучали другой ген (ген TGF-β1), отличающийся от гена данного примера. А именно, в примере A8, как показано в приведенной выше последовательности, NK-0033 имеет одно непарное основание, и NK-0061 имеет два непарных основания. Таким образом, как показано в вышеописанной фиг. 15, имеющая меньшее количество непарных оснований NK-0033 проявляет более высокую активность подавления. Кроме того, высокой активностью подавления обладают NK-0055 и NK-0062, в которых положения непарных оснований были изменены таким образом, чтобы они были ближе к 3'-концу внутреннего участка (Z) по сравнению положениями в NK-0033 и NK-0061, как описано в примере A12. Также полученные результаты свидетельствуют, что оцРНК по настоящему изобретению проявляет сходные свойства независимо от вида целевого гена и вида последовательности, подавляющей экспрессию целевого гена. Таким образом, можно сказать, что оцРНК по настоящему изобретению является инструментом, который можно применять независимо от вида целевого гена.
[0270] (Пример А15) Взаимозаменяемость линкеров
Используя оцРНК по настоящему изобретению, подвергали изменению линкерный участок (Lx) между внутренним 5'-концевым участком (X) и 5'-концевым участком (Xc) и линкерный участок (Ly) между внутренним 3'-концевым участком (Y) и 3'-концевым участком (Yc), и изучали подавление экспрессии гена GAPDH in vitro.
(1) Материалы и способы
[0271] В качестве РНК данного примера использовали оцРНК, показанные на фиг. 27. На фигуре 27, с 5'-конца, участок с подчеркнутыми буквами нижнего регистра обозначает 5'-концевой участок (Xc); участок с подчеркнутыми заглавными буквами обозначает внутренний участок (Z); и участок с подчеркнутым буквами нижнего регистра обозначает 3'-концевой участок (Yc). Последовательность между X и Хс является линкерным участком (Lx), и последовательность между Y и Yc является линкерным участком (Ly). Кроме того, в отношении каждой из РНК, показано соотношение (Lx/Ly) между длиной в основаниях (Lx) линкерного участка (Lx) и длиной в основаниях (Ly) линкерного участка (Ly). На фигуре 27 "*" обозначает непарное основание.
[0272] Трансфекцию в клетки HCT116, культивирование, сбор РНК, синтез кДНК и ПЦР проводили таким же образом, как в примере A13, за исключением использования каждой из вышеперечисленных РНК, и измеряли уровень экспрессии гена GAPDH. Коррекцию внутреннего стандарта и вычисление относительного значения уровня экспрессии также осуществляли таким же способом, как в примере A13.
[0273] (2) Результаты и обсуждение
Результаты исследований представлены на фиг. 28. Фигура 28 представляет график, показывающий относительный уровень экспрессии гена GAPDH, при использовании каждой из РНК в конечной концентрации 1 нмоль/л. Как показано на фиг. 28, все оцРНК с разными свойствами линкерных участков (Lx) и (Ly), т.е. с вариабельными показателями их длины, соотношений длины, их последовательностей и других показателей, подавляют экспрессию гена GAPDH сходным образом. Полученный результат свидетельствует, что свойства линкерных участков (Lx) и (Ly) конкретно не ограничены, и их можно конструировать таким образом, чтобы они имели различные показатели длины, последовательностей и тому подобное.
[0274] (Пример А16) Эффект подавления экспрессии гена GAPDH в клетках HCT116
Исследовали эффект подавления экспрессии гена GAPDH в клетках HCT116 с использованием оцРНК, в которой осуществили замещение линкером, включающим пролин или пролинол.
[0275] (1) Материалы и способы
В качестве РНК (Пример) в данном примере синтезировали РНК (Пример оцРНК), показанную ниже. Кроме того, как РНК из сравнительного примера, синтезировали оцРНК отрицательного контроля, как PHKi отрицательного контроля (ОК), показанную ниже. В каждой из указанных ниже последовательностей были образованы линкерный участок (Lx) и линкерный участок (Ly) посредством связывания амидита, имеющего пролин или пролинол, между Xc и X, а также между Yc и Y, как показано в таблице ниже (см. примеры B).
Пример: оцРНК (SEQ ID NO: 13)

ОК: оцРНК (SEQ ID NO: 38)
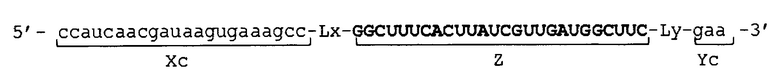
[0276]
[0277] Трансфекцию в клетки HCT116, культивирование, сбор РНК, синтез кДНК и ПЦР проводили таким же образом, как в примере A13, за исключением использования каждой из вышеперечисленных РНК, и измеряли уровень экспрессии гена GAPDH. Коррекцию внутреннего стандарта и вычисление относительного значения уровня экспрессии также осуществляли таким же способом, как в примере A13.
[0278] (2) Результаты
Результаты исследований представлены на фиг. 29. Фигура 29 представляет график, показывающий относительный уровень экспрессии гена GAPDH. Как показано на фиг. 29, было выявлено, что все примеры оцРНК, включающие пролин или пролинол в качестве линкерного участка (Lx) и линкерного участка (Ly), обладают высокой активностью подавления, и характер проявления эффекта подавления зависит от концентрации. С другой стороны, эффект подавления отсутствует при использовании оцРНК как отрицательного контроля.
[0279] (Пример А17) Эффект подавления экспрессии гена GAPDH в клетках HCT116
Исследовали эффект подавления экспрессии гена GAPDH в клетках HCT116 с использованием оцРНК, в которой осуществили замещение линкером, включающим пролин.
[0280] (1) Материалы и способы
В качестве РНК (Пример) в данном примере синтезировали РНК (Пример оцРНК), показанную ниже. Кроме того, как РНК из сравнительного примера, синтезировали оцРНК отрицательного контроля, как PHKi отрицательного контроля (ОК), показанную ниже. В каждой из указанных ниже последовательностей были образованы линкерный участок (Lx) и линкерный участок (Ly) посредством связывания амидита, имеющего пролин между Xc и X, а также между Yc и Y, как показано в таблице ниже (см. примеры B).
Пример: оцРНК (SEQ ID NO: 13)

ОК: оцРНК (SEQ ID NO: 38)
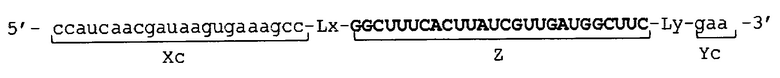
[0281]
[0282] Трансфекцию в клетки HCT116, культивирование, сбор РНК, синтез кДНК и ПЦР проводили таким же образом, как в примере A13, за исключением использования каждой из вышеперечисленных РНК, и измеряли уровень экспрессии гена GAPDH. Коррекцию внутреннего стандарта и вычисление относительного значения уровня экспрессии также осуществляли таким же способом, как в примере A13.
[0283] (2) Результаты
Результаты исследований представлены на фиг. 30. Фигура 30 представляет график, показывающий относительный уровень экспрессии гена GAPDH в клетках НСТ116. Как показано на фиг. 30, примеры оцРНК, включающие пролин в качестве линкерного участка (Lx) и линкерного участка (Ly), обладают высокой активностью подавления, и обнаружено, что характер проявления эффекта подавления зависит от концентрации. С другой стороны, эффект подавления отсутствует при использовании оцРНК как отрицательного контроля.
[0284] (Пример А18) Устойчивость к рибонуклеазе
оцРНК по настоящему изобретению исследовали на устойчивость к рибонуклеазе.
[0285] (1) Материалы и способы
В качестве РНК (Пример) в данном примере использовали NK-0033 из примера A5 и PK-0007 из примера A8. Кроме того, как РНК сравнительного примера, использовали дцРНК (NI-0030) в качестве положительного контроля (ПК) в примере A9.
[0286] Вначале смешивали 60 пмоль каждой из указанных выше РНК, 5×10-5 единиц РНКазы А (Roche) и 5×10-5 единиц РНКазы T1 (Roche) с 20 ммоль/л Трис-HCl (рН 8), и полученную смесь инкубировали при 37°C. Через 10 минут, 20 минут и 30 минут после начала инкубации останавливали реакцию РНКазы общепринятым способом. Затем реакционный раствор подвергали электрофорезу с 15% полиакриламидным гелем. После этого гель окрашивали SYBR Green II (Lonza, Швейцария), а затем анализировали с помощью E-BOX-VX2 (M&S Instruments Inc, Токио).
[0287] (2) Результаты
Результаты исследований представлены на фиг. 31. Фигура 31 представляет электрофореграмму, показывающую устойчивость к рибонуклеазе. На фиг. 31 строка "M" обозначает молекулярный вес маркера, и "min" обозначает время инкубации в минутах.
[0288] Как показано на фиг. 31, почти полное расщепление NI-0030 из сравнительного примера происходило через 10 минут инкубации. Напротив, NK-0033 и PK-0007 из этого примера оставались в образце даже после 10 минут инкубации. Эти результаты показывают, что оцРНК по настоящему изобретению обладает более высокой устойчивостью к рибонуклеазе, чем дцРНК.
[0289] (Пример А19) Устойчивость к нуклеазе
оцРНК по настоящему изобретению исследовали на устойчивость к нуклеазе.
(1) Материалы и способы
[0290] Использовали аналогичные РНК, как в примере A18. Вначале 60 пмоль каждой РНК и 0,5 единиц S7 нуклеазы (Roche) смешивали с 50 ммоль/л Трис-HCl (рН 8), содержащего 5 ммоль/л CaCl2, и полученную смесь инкубировали при 37°C. Через 0,5 часа после начала инкубации (0 ч), реакцию S7 нуклеазы останавливали общепринятым способом. Затем реакционный раствор подвергали электрофорезу с использованием 7М мочевины и 15% полиакриламидного геля в соответствии с общепринятым способом. После этого гель окрашивали SYBR Green II (торговое наименование, Lonza), а затем анализировали с помощью E-BOX-VX2 (торговое наименование, M&S Instruments Inc.)
[0291] (2) Результаты
Результаты исследований представлены на фиг. 32. Фигура 32 на электрофореграмме показывает устойчивость к S7 нуклеазе. На фиг. 32 строка "M" обозначает молекулярный вес маркера, и "h" обозначает время инкубации в часах.
[0292] Как показано на фиг. 32, почти полное расщепление NI-0030 из сравнительного примера происходило через 0,5 часа инкубации. Напротив, NK-0033 и PK-0007 из этого примера оставались в образце даже после 0,5 часа инкубации. Эти результаты показывают, что оцРНК по настоящему изобретению обладает более высокой устойчивостью к S7 нуклеазе, чем дцРНК.
[0293] По соответствующим результатам, полученным в примерах А, было установлено, что оцРНК по настоящему изобретению можно конструировать, например, независимо от вида целевого гена. В частности, выявлено, что в оцРНК можно осуществлять модификации в отношении, например: длины двойной цепи, образованной участками (X) и (Xc), и длины двойной цепи, образованной участками (Y) и (Yc); наличия или отсутствия непарного основания, которое не образует двойную цепь во внутреннем участке (Z), количества и положения таких непарных оснований; наличия или отсутствия линкерных участков (Lx) и (Ly), типа и длины линкерных участков (Lx) и (Ly); и подобных модификаций. Таким образом, можно считать, что оцРНК по настоящему изобретению является новым универсальным инструментом, который можно использовать для подавления экспрессии целевого гена независимо от типа целевого гена.
[0294] (Пример B1)
1. Синтез пролинола
Согласно схеме 1, показанной ниже, осуществляли синтез пролинола, защищенного группой диметокситритила.
[0295]
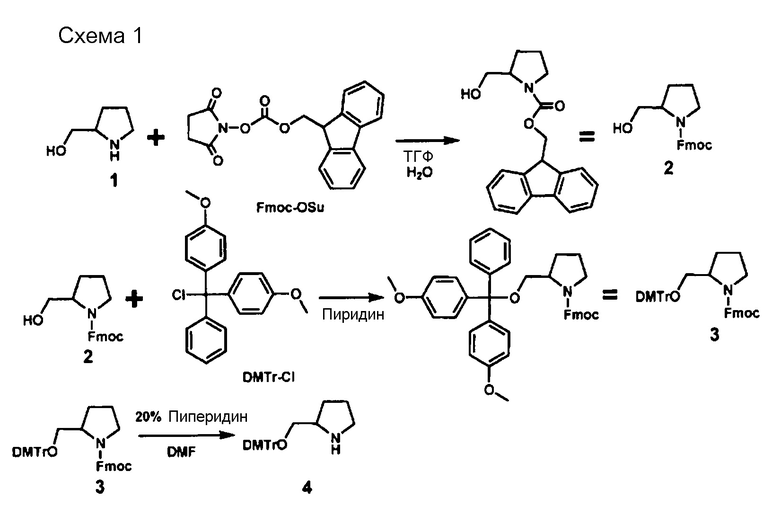
[0296] 1) Fmoc-L-пролинола (соединение 2)
L-пролинол (соединение 1) (0,61 г, 6,0 ммоль) растворяли в 70 мл чистой воды, таким образом готовили водный раствор L-пролинола. Н-(9-флуоренилметоксикарбонилокси)сукцинимид (Fmoc-OSu) (2,0 г, 6,0 ммоль) растворяли в 10 мл ТГФ. Этот раствор ТГФ добавляют к водному раствору L-пролинола и перемешивали в течение 1 часа для осуществления реакции L-пролинола и Fmoc-OSu. Реакционную смесь разделяли на жидкую фракцию и фракцию преципитата. Эти фракции соответственно подвергали экстракции этилацетатом, и собирали из них, соответственно, органические слои. Полученные таким образом органические слои смешивали и для абсорбции влаги добавляли безводный сульфат натрия (далее этот этап называется этапом 'сушки'). Органические слои фильтровали, и полученный фильтрат выпаривали в вакууме. Полученное оставшееся вещество очищали колоночной хроматографией на силикагеле (элюент: гексан:этилацетат=1:1). Таким образом, получали соединение 2 (1,4 г, выход 74%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,77 (2H, д, J=7,7 Гц, Ar-H), 7,60 (2H, д, J=7,3 Гц, Ar-H), 7,40 (2H, т, J=7,5 Гц, Ar-H), 7,31 (2H, т, J=7,6 Гц, Ar-H), 4,40-4,50 (2H, м, COOCH2), 4,22 (1H, т, J=6,5 Гц, Ar-CH), 3,20-3,80 (5H, м, H-5, H-6), 1,75 (3H, м, H-3, H-4), 1,40 (1H, м, H-3).
[0297] (2) Fmoc-DMTr-L-пролинол (соединение 3)
Fmoc-L-пролинол (соединение 2) (1,4 г, 4,3 ммоль) растворяли в 20 мл пиридина и подвергали азеотропии три раза. Остаточное вещество растворяли в 20 мл пиридина. При перемешивании этого раствора в ледяной бане в атмосфере аргона к нему добавляли 4,4'-диметокситритилхлорида (DMTr-Cl) (1,8 г, 5,3 ммоль). После реакции этот реакционный раствор анализировали тонкослойной хроматографией (ТСХ), используя хлороформ/метанол, и реакцию оставляли для проведения в течение 4 часов, до исчезновения пятна Fmoc-L-пролинола. Чтобы погасить избыточное количество DMTr-Cl, к реакционному раствору добавляли 3 мл метанола и полученную смесь перемешивали в течение 10 минут. К реакционной смеси также добавляли хлороформ, после чего собирали органический слой. Собранный органический слой промывали насыщенным солевым раствором, затем 5%-ым водным раствором гидрокарбоната натрия, и снова насыщенным солевым раствором. Промытый таким образом органический слой высушивали с помощью безводного сульфата натрия. Затем органический слой фильтровали, и полученный фильтрат выпаривали в вакууме. Полученное остаточное вещество очищали колоночной хроматографией на силикагеле (элюент: хлороформ, 1% пиридин). Таким образом получали соединение 3 (2,0 г, выход 74%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,77 (2H, д, J=7,7 Гц, Ar-H), 7,60 (2H, д, J=7,3 Гц, Ar-H), 7,40-7,18 (13H, м, Ar-H), 6,89 (4H, д, J=8,6 Гц, Ar-H), 4,20-4,40 (2H, м, COOCH2), 4,02 (1H, т, J=6,5 Гц, Ar-CH), 3,80-3,10 (5H, м, H-5, H-6), 3,73 (с, 6H, ОСН3), 1,84 (3H, м, H-3, H-4), 1,58 (1H, м, H-3).
[0298] (3) DMTr-L-пролинол (соединение 4)
Fmoc-DMTr-L-пролинол (соединение 3) (2,0 г, 3,2 ммоль) растворяли в 25 мл раствора DMF, содержащего 20% пиперидина, и эту смесь перемешивали в течение 12 часов. Раствор выпаривали в вакууме, и полученное остаточное вещество очищали колоночной хроматографией на силикагеле (хлороформ:метанол=85:15, содержание пиридина 1%). Таким образом получали соединение 4 (1,0 г, выход 78%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, д, J=8,6 Гц, Ar-H), 3,78 (6H, с, ОСН3), 3,31 (1H, м, H-6), 3,07 (2H, м, H-2, H-6), 2,90 (2H, м, H-5), 1,84 (3H, м, H-3, H-4), 1,40 (1H, м, H-3).
[0299] 2. Синтез производных амидита
Далее, согласно схеме 2, показанной ниже, синтезировали производные амидита, имеющие пролинол. Далее в изобретении
1-этил-3-(3-диметиламинопропил)карбодиимид называется "EDC", и N,Н-диметиламинопиридин (4-диметиламинопиридин) называется "DMAP".
[0300]
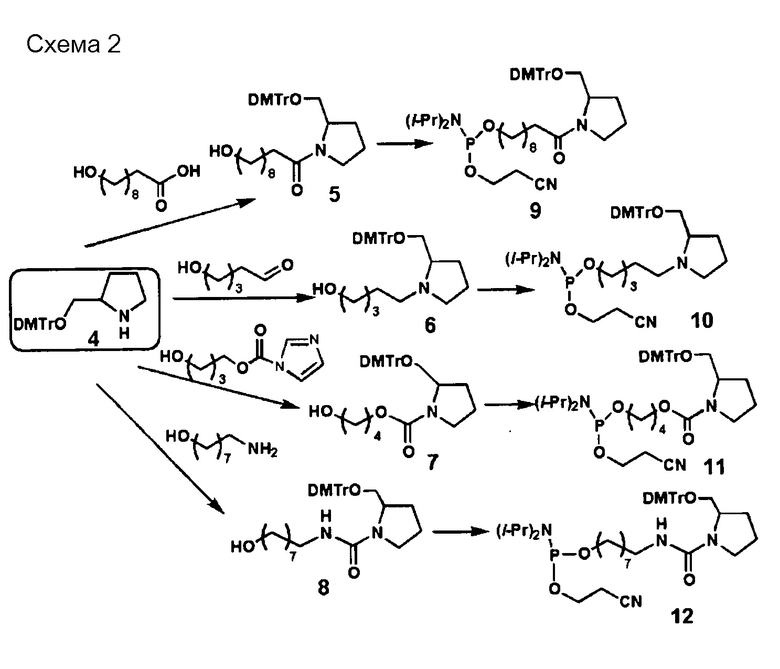
[0301] 1) DMTr-амид-L-пролинол (соединение 5)
DMTr-L-пролинол (соединение 4) (0,80 г, 2,0 ммоль), EDC (0,46 г, 2,4 ммоль) и DMAP (0,29 г, 2,4 ммоль) растворяли в 20 мл дихлорметана и полученную смесь перемешивали. К этому раствору добавляли 10-гидроксидекановую кислоту (0,45 г, 2,4 ммоль) и затем смесь перемешивали. После реакции этой реакционной смеси проводили тонкослойную хроматографию с использованием этилацетата, и оставляли для осуществления реакции в течение 20 часов до исчезновения пятна DMTr-L-пролинола. Затем к реакционному раствору добавляли дихлорметан, после чего собирали органический слой. Собранный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Органический слой фильтровали, и полученный фильтрат выпаривали в вакууме. Остаточное вещество очищали с помощью колоночной хроматографии на силикагеле (этилацетат, содержание пиридина 1%). Таким образом получали соединение 5 (0,71 г, выход 62%). Результат анализа ЯМР указанного соединения показан ниже.
1Н-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, д, J=8,6 Hz, Ar-H), 3,78 (6H, с, OCH3), 3,68-2,93 (7H, м, H-2, H-5, H-6), 2,27-1,72 (6H, м, алкил, H-3, H-4), 1,58 (4H, с, алкил), 1,30 (10H, с, алкил).
[0302] (2) DMTr-алкил-L-пролинол (соединение 6)
DMTr-L-пролинол (соединение 4) (0,80 г, 2,0 ммоль) растворяли в 15 мл метанола. К смеси добавляли к 5-гидроксипентанал (0,31 г, 3,0 ммоль) и перемешивали. К этому раствору добавляли цианоборгидрид натрия (0,25 г, 4,0 ммоль) и смесь дополнительно перемешивали. После реакции эту реакционную смесь подвергали ТСХ с использованием смеси этилацетат/гексан, и оставляли для проведения реакции в течение 24 часов до исчезновения пятна DMTr-L-пролинола. К реакционному раствору добавляли этилацетат, и собирали органический слой. Собранный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Органический слой фильтровали, и полученный фильтрат выпаривали в вакууме. Остаточное вещество очищали с помощью колоночной хроматографии на силикагеле (гексан:этилацетат=1:1, содержание пиридина 1%). Таким образом получали соединение 6 (0,62 г, выход 63%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, д, J=8,6 Гц, Ar-H), 3,78 (6H, с, ОСН3), 3,70-2,86 (4H, м, CH2OH, H-6), 2,06-1,79 (5H, м, алкил, H-2, H-5), 1,74-1,49 (6H, м, алкил, H-3, H-4), 1,45-1,27 (4H, м, алкил).
[0303] (3) DMTr-уретан-L-пролинол (соединение 7)
1,4-бутандиол (0,90 г, 10 ммоль) растворяли в 30 мл дихлорметана. Затем к смеси добавляли карбонилдиимидазол (1,4 г, 8,6 ммоль), и эту смесь перемешивали в течение 3 часов. Органический слой полученного реакционного раствора промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Органический слой фильтровали, и полученный фильтрат выпаривали в вакууме. Остаточное вещество очищали колоночной хроматографией на силикагеле (хлороформ:метанол=9:1). Таким образом получали соединение, в котором один конец 1,4-бутандиола был активирован карбонилдиимидазолом (0,25 г, 1,5 ммоль). Это соединение растворяли в 15 мл дихлорметана. К смеси добавляли DMTr-L-пролинол (соединение 4) (0,6 г, 1,5 ммоль), и полученную смесь перемешивали в течение 24 часов. После этого в эту смесь добавляли этилацетат, и собирали органический слой. Собранный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Органический слой фильтровали, и полученный фильтрат выпаривали в вакууме. Остаточное вещество очищали с помощью колоночной хроматографии на силикагеле (гексан:этилацетат=1:1, содержание пиридина 1%). Таким образом получали соединение 7 (0,61 г, выход 77%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, д, J=8,6 Гц, Ar-H), 4,24-3,94 (2H, м, COOCH2), 3,78 (с, 6H, OCH3), 3,72-2,96 (7H, м, алкил, H-2, H-5, H-6), 2,10-1,30 (8H, м, алкил, H-3, H-4).
[0304] (4) DMTr-уреидо-L-пролинол (Соединение 8)
DMTr-L-пролинол (соединение 4) (0,50 г, 1,2 ммоль) и трифосген (0,12 г, 0,40 ммоль) растворяли в 8 мл дихлорметана и полученную смесь перемешивали на ледяной бане в атмосфере аргона. К раствору добавляли N,Н-диизопропилэтиламин (0,31 г, 2,4 ммоль) и эту смесь перемешивали в течение 1 часа. Затем к полученной смеси также добавляли 8-амино-1-октанол (0,17 г, 1,2 ммоль) и перемешивали в течение 30 минут на ледяной бане таким же способом, как описано выше. После этого смесь дополнительно перемешивали при комнатной температуре в течение 20 часов. К раствору добавляли дихлорметан, и собирали органический слой. Собранный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Органический слой фильтровали, и полученный фильтрат выпаривали в вакууме. Остаточное вещество очищали с помощью колоночной хроматографии на силикагеле (гексан:этилацетат=4:1, содержание триэтиламина 1%). Таким образом получали соединение 8 (0,44 г, выход 62%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, м, Ar-H), 3,78 (с, 6H, ОСН3), 3,68-3,25 (9H, м, CH2NH, CH2OH, H-2, H-5, H-6), 1,74-1,18 (16H, м, алкил, H-3, H-4).
[0305] (5) Производные амидита, имеющие пролинол (соединения 9-12)
Соединения с 9 по 12 были синтезированы следующим способом с использованием в качестве сырья модифицированных пролинолов (соответственно, соединения от 5 до 8). Каждый из модифицированных пролинолов и 5-бензилтио-1Н-тетразол растворяли в 3 мл ацетонитрила. Использовали следующее количество модифицированного пролинола: соединение 5: 0,69 г (1,2 ммоль), соединение 6: 0,60 г (1,2 ммоль), соединение 7: 0,60 г (1,2 ммоль) и соединение 8: 0,25 г (0,43 ммоль). Использовали следующее количество 5-бензилтио-1Н-тетразола: 0,15 г (0,78 ммоль) для соединения с 5 по 7, и 54 мг (0,15 ммоль) для соединения 8. В раствор добавляли 2-цианоэтил N,N,N',N'-тетраизопропилфосфородиамидит в атмосфере аргона и смесь перемешивали в течение 2 часов. Добавляли следующее количество 2-цианоэтил-N,N,N',N'-тетраизопропил фосфородиамидита: 0,54 г (1,8 ммоль) в реакционные системы с использованием соединений от 5 до 7, и 0,19 г (0,64 ммоль) в реакционную систему, используя соединение 8. Затем к раствору добавляли насыщенный водный раствор гидрокарбоната натрия, органический слой экстрагировали дихлорметаном и собирали. Собранный органический слой высушивали с помощью безводного сульфата натрия. Органический слой фильтровали, и полученный фильтрат выпаривали в вакууме. Остаточное вещество очищали с помощью колоночной хроматографии на силикагеле (гексан:этилацетат=1:1, содержание триэтиламина 1%). Таким образом получали соединения 9-12. Результаты ЯМР-анализа указанных соединений приведены ниже.
[0306] DMTr-амид-L-пролинол-амидит (соединение 9, 0,60 г, выход 55%)
1H-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, д, J=8,6 Гц, Ar-H), 3,78 (6H, с, ОСН3), 3,68-2,93 (11H, м, CH20, POCH2, CHCH3, H-2, H-5, H-6), 2,58 (2H, м, CH2CN), 2,27-1,72 (6H, м, алкил, H-3, H-4), 1,58 (4H, с, алкил), 1,30 (22H, с, алкил, CHCH3).
[0307] DMTr-алкил-L-пролинол-амидит (соединение 10, 0,71 г, выход 60%)
1H-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, д, J=8,6 Гц, Ar-H), 3,78 (6Н, с, ОСН3), 3,70-2,86 (8Н, м, СН2О, РОСН2, СНСН3, Н-6), 2,58 (2Н, м, CH2CN), 2,06-1,79 (5Н, м, алкил, H-2, H-5), 1,74-1,49 (6H, м, алкил, H-3, H-4), 1,37-1,10 (16H, м, алкил, СНСН3).
[0308] DMTr-уретан-L-пролинол-амидит (соединение 11, 0,67 г, выход 52%)
1H-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, д, J=8,6 Гц, Ar-H), 4,24-3,94 (2H, м, COOCH2), 3,78 (с, 6H, ОСН3), 3,72-2,96 (11H, м, CH20, POCH2, СНСН3, H-2, H-5, H-6), 2,58 (2H, м, CH2CN), 2,10-1,46 (8H, м, алкил, H-3, H-4), 1,34-1,10 (12H, м, СНСН3).
[0309] DMTr-уреидо-L-пролинол-амидит (соединение 12, 0,20 г, выход 61%)
1H-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, м, Ar-H), 3,78 (с, 6H, ОСН3), 3,65-3,25 (13H, м, СН2О, POCH2, СНСН3, H-2, CH2NH, CH2OH, H-2, H-5, H-6), 2,73 (2H, м, CH2CN), 2,10-1,48 (16H, м, алкил, H-3, H-4), 1,35-1,10 (12H, м, СНСН3).
[0310] (Пример B2)
Далее, согласно схеме 3, показанной ниже, были синтезированы производные амидита, имеющие L-пролин.
[0311]
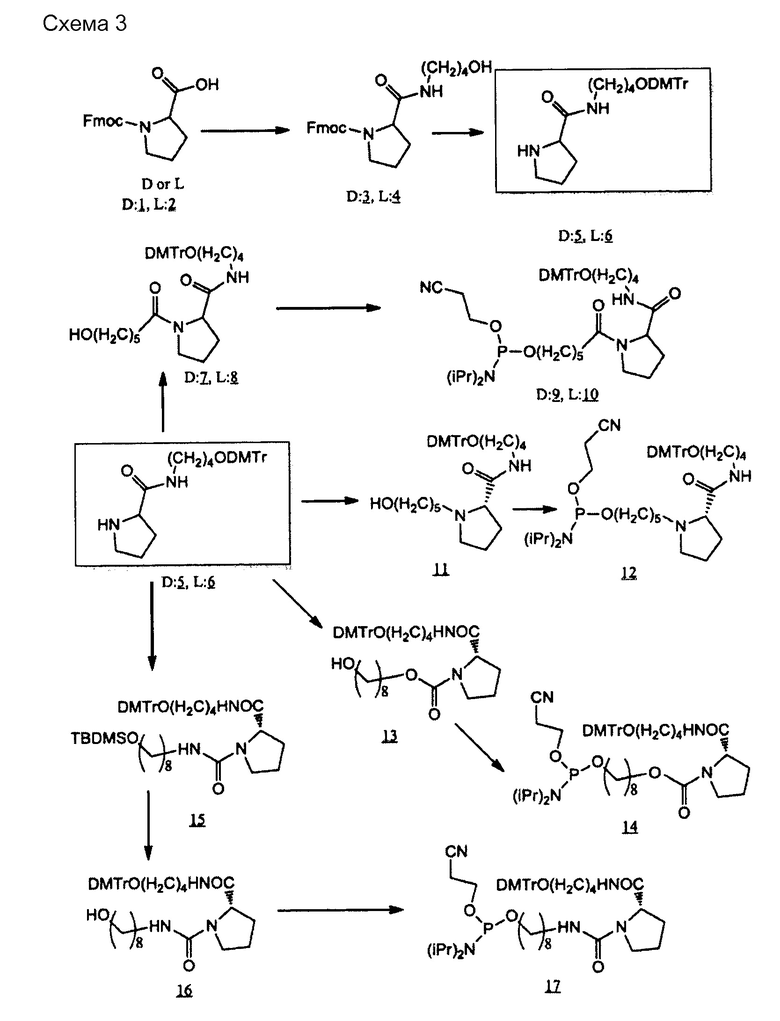
[0312] 1) DMTr-гидроксиамид-амино-L-пролин (соединение 11)
Буферный раствор уксусной кислоты (7 мл) добавляли в раствор этанола (7 мл), содержащий DMTr-амид-L-пролин (соединение 6) (1,00 г, 2,05 ммоль) и 5-гидроксипентанал (0,33 г, 3,07 ммоль) при охлаждении на льду. Полученную смесь перемешивали в течение 20 минут при охлаждении на льду. После этого к смеси добавляли цианобор натрия (0,77 г, 12,28 ммоль) и перемешивали в течение 7 часов при комнатной температуре. Полученную смесь разбавляли дихлорметаном, промывали водой, а затем дополнительно промывали насыщенным солевым раствором. Затем органический слой собирали и высушивали сульфатом натрия. Органический слой фильтровали, затем удаляли растворитель из полученного фильтрата путем выпаривания при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии на силикагеле (элюент: CH2Cl2:CH3OH=98:2, содержание пиридина 0,05%). После этого полученный продукт подвергали колоночной хроматографии на силикагеле (элюент: CH2Cl2:CH3OH=98:2, содержание пиридина 0,05%), и проводили дополнительную колоночную хроматографию полученного продукта на силикагеле (элюент: дихлорметан:ацетон=7:3, содержание пиридина 0,05%). Таким образом получали соединение 11 в виде бесцветного сиропа (0,49 г, выход 41%). Ms (FAB+): m/z 575 (M+), 303 (DMTr+).
[0313] (2) DMTr-амид-амино-L-пролин-амидит (соединение 12)
Полученный указанным способом DMTr-гидроксиамид-амино-L-пролин (соединение 11) (0,50 г, 0,87 ммоль) смешивали с безводным ацетонитрилом и смесь азеотропным способом высушивали при комнатной температуре. К полученному остаточному веществу добавляли диизопропиламмония тетразолид (178 мг, 1,04 ммоль). Полученную смесь деаэрировали при пониженном давлении и заполняли газом аргоном. К смеси добавляли безводный ацетонитрил (1 мл), после чего к этой смеси добавляли 2-цианэтокси-N,N,N',N'-тетраизопропил-фосфородиамидит (313 мг, 1,04 ммоль) в безводном растворе ацетонитрила (1 мл). Эту смесь перемешивали в течение 4 часов при комнатной температуре в атмосфере аргона. Затем смесь разводили дихлорметаном, после этого промывали насыщенным раствором бикарбоната натрия и снова промывали насыщенным солевым раствором. Органический слой собирали и высушивали сульфатом натрия. После этого органический слой фильтровали. Из полученного фильтрата удаляли растворитель путем выпаривания при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии с использованием амино-силикагеля в качестве наполнителя (элюент: гексан:ацетон=7:3, содержание пиридина 0,05%). Таким образом получали соединение 12 в виде бесцветного сиропа (0,57 г, чистота: 93%, выход: 79%). Чистоту измеряли с помощью ВЭЖХ (далее аналогично). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,41-7,43 (м, 2H, Ar-H), 7,28-7,32 (м, 4H, Ar-H), 7,25-7,27 (м, 2H, Ar-H), 7,18-7,21 (м, 1H, Ar-H), 6,80-6,84 (м, 4H, Ar-H), 3,73-3,84 (м, 1H), 3,79 (с, 6H, ОСН3), 3,47-3,64 (м, 3Н), 3,12-3,26 (м, 2H), 3,05 (т, J=6,4 Гц, 2H, CH2), 2,98-2,02 (м, 2Н), 2,61 (т, J=5,8 Гц, 2H, СН2), 2,55-2,63 (м, 2Н), 2,27-2,42 (м, 1Н, CH), 2,31 (т, 7,8 Гц, 2H, CH2), 2,03-2,19 (м, 1H, CH), 1,40-1,90 (м, 8H), 1,23-1,33 (м, 5H), 1,14-1,20 (м, 12H, CH3);
P-ЯМР (CDCl3): δ 146,91;
Ms (FAB+): м/z 774 (М+), 303 (DMTr+), 201 (C8H19N2OP+).
[0314] (3) DMTr-гидроксиамид-карбамоил-L-пролин (соединение 13)
К безводному раствору ацетонитрила (10 мл), в котором был растворен DMTr-амид-L-пролин (соединение 6) (1,00 г, 2,05 ммоль), добавляли безводный раствор ацетонитрила (20 мл), в котором был растворен 1-имидазо-карбонилокси-8-гидроксиоктан (1,12 г, 4,92 ммоль) при комнатной температуре в атмосфере аргона. Эту смесь нагревали от 40°C до 50°C в течение 2 дней, а затем выдерживали при комнатной температуре в течение 5 дней. Растворитель из смеси удаляли выпариванием при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии на силикагеле (элюент: дихлорметан:ацетон=4:1, содержание пиридина 0,05%). Таким образом получали соединение 13 в виде бесцветного сиропа (0,68 г, выход 50%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,40-7,42 (м, 2H, Ar-H), 7,27-7,31 (м, 6H, Ar-H), 7,17-7,21 (м, 1H, Ar-H), 6,79-6,82 (м, 4H, Ar-H), 4,23-4,30 (м, 1H), 4,05-4,10 (м, 2H), 3,79 (с, 6H, ОСН3), 3,60-3,65 (м, 2H), 3,32-3,55 (м, 2H), 3,16-3,29 (м, 2H), 3,01-3,07 (м, 2H), 2,38-2,40 (м, 1H, CH), 1,83-1,90 (м, 2H), 1,57-1,69 (м, 8H),1,26-1,36 (м, 2Н);
Ms (FAB+): м/z 602 (М+), 303 (DMTr+).
[0315] (4) DMTr-амид-карбамоил-L-пролин-амидит (соединение 14)
Полученный указанным способом DMTr-гидроксиамид-карбамоил-L-пролин (соединение 13) (0,63 г, 1,00 ммоль) смешивали с безводным пиридином, затем полученную смесь азеотропным способом высушивали при комнатной температуре. К полученному остаточному веществу добавляли диизопропиламмония тетразолид (206 мг, 1,20 ммоль) и полученную смесь деаэрировали при пониженном давлении и затем заполняли газом аргоном. К смеси добавляли безводный ацетонитрил (1 мл), после чего к полученной смеси добавляли 2-цианоэтокси-N,N,N',N'-тетраизопропил-фосфородиамидит (282 мг, 1,12 ммоль) в безводном растворе ацетонитрила (1 мл). Эту смесь перемешивали в течение 4 часов при комнатной температуре в атмосфере аргона. Затем смесь разводили дихлорметаном, промывали ее насыщенным водным раствором бикарбоната натрия и затем насыщенным солевым раствором. Органический слой собирали и высушивали сульфатом натрия. После этого органический слой фильтровали. Растворитель из полученного фильтрата удаляли путем выпаривания при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии с использованием наполнителя амино-силикагеля (элюент: гексан:ацетон=7:3, содержание пиридина 0,5%). Таким образом получали соединение 14 в виде бесцветного сиропа (0,74 г, чистота: 100%, выход: 87%). Результат анализа ЯМР указанного соединения показан ниже.
P-ЯМР (CDCl3): δ 147,19;
Ms (FAB+): м/z 860 (М+), 303 (DMTr+), 201 (C8H19N2OP+).
[0316] (5) DMTr-трет-бутил-диметилсилоксиамид-уреидо-L-пролин (соединение 15)
Безводный раствор тетрагидрофурана (10 мл) добавляли к трифосгену (1,22 г, 4,10 ммоль) при охлаждении на льду в атмосфере аргона. Безводный раствор тетрагидрофурана (10 мл), в котором был растворен DMTr-амид-L-пролин (соединение 6) (1,00 г, 2,05 ммоль) и диизопропилэтиламин (DIEA) (9,80 г, 75,8 ммоль), вводили по капле в эту смесь при охлаждении на льду в атмосфере аргона в течение 30 минут. После этого смесь перемешивали в течение 1 часа при комнатной температуре. Безводный раствор тетрагидрофурана (20 мл), в котором был растворен 10-амино-1-трет-бутилдиметилсилокси-декан (2,66 г, 10,25 ммоль) и DIEA (3,20 г, 24,76 ммоль), вливали по капле в полученную смесь при охлаждении на льду в атмосфере аргона в течение 45 минут. Затем смесь перемешивали в течение ночи при комнатной температуре в атмосфере аргона. Эту смесь разводили этилацетатом (200 мл), и собирали органический слой. Органический слой промывали насыщенным водным раствором бикарбоната натрия, а затем дополнительно промывали насыщенным солевым раствором. Затем органический слой собирали и высушивали сульфатом натрия. Органический слой фильтровали, и удаляли растворитель из полученного фильтрата выпариванием при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии на силикагеле (элюент: дихлорметан:ацетон=4:1, содержание пиридина 0,05%). Таким образом получали соединение 15 в виде бесцветного сиропа (0,87 г, выход 55%).
[0317] (6) DMTr-гидроксиамид-уреидо-L-пролин (16)
К полученному указанным способом DMTr-трет-бутил-диметил-силоксиамид-уреидо-L-пролину (15) (0,87 г, 1,12 ммоль) добавляли раствор безводного дихлорметана в тетрагидрофуране (10 мл) при комнатной температуре в атмосфере аргона. К этой смеси добавляли раствор тетрагидрофурана, содержащий 1 моль/л тетрабутиламмонийфторида (4,69 мл, Tokyo Chemical Industry Co, Ltd), и полученную смесь перемешивали в течение 3 дней при комнатной температуре в атмосфере аргона. Смесь разбавляли дихлорметаном (150 мл), промывали водой, а затем дополнительно промывали насыщенным солевым раствором. Органический слой собирали и высушивали сульфатом натрия. После этого органический слой фильтровали. Из полученного фильтрата удаляли растворитель выпариванием при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии на силикагеле (элюент: дихлорметан:ацетон=1:1, содержание пиридина 0,05%). Таким образом получали соединение 16 в виде бесцветного сиропа (0,68 г, выход 92%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,41-7,43 (м, 2H, Ar-H), 7,27-7,31 (м, 4H, Ar-H), 7,19-7,26 5 (м, 2H, Ar-H), 7,19-7,21 (м, 1H, Ar-H), 6,80-6,83 (м, 4H, Ar-H), 4,34 (т, 2H, CH2), 3,79 (с, 6H, ОСН3), 3,63 (д, 1H, J=6,4 Гц, СН2), 3,61 (д, 1H, J=6,4 Гц, CH2), 3,34-3,37 (м, 1H, CH), 3,16-3,27 (м, 5H), 3,04 (т, J=5,9 Гц, 2H, СН2), 2,38-2,45 (м, 1H, CH), 1,83-2,05 (м, 3H), 1,45-1,64 (м, 8H), 1,25-1,38 (м, 7H).
[0318] (7) DMTr-амид-уреидо-L-пролин-амидит (соединение 17)
Полученный указанным способом DMTr-гидрокси-амид-уреидо-L-пролин (соединение 16) (0,62 г, 0,94 ммоль) смешивали с безводным ацетонитрилом и полученную смесь высушивали азеотропным способом при комнатной температуре. К полученному остаточному веществу добавляли диизопропиламмония тетразолид (192 мг, 1,12 ммоль), затем полученную смесь деаэрировали при пониженном давлении и заполняли газом аргоном. К смеси добавляли безводный ацетонитрил (1 мл), после чего к этой смеси добавляли 2-цианоэтокси-N,N,N',N'-тетраизопропил-фосфородиамидит (282 мг, 1,12 ммоль) в безводном растворе ацетонитрила (1 мл). Эту смесь перемешивали в течение 4 часов при комнатной температуре в атмосфере аргона. Затем смесь разводили дихлорметаном, промывали насыщенным водным раствором бикарбоната натрия и затем промывали насыщенным солевым раствором. Органический слой собирали и высушивали сульфатом натрия. После этого органический слой фильтровали. Из полученного фильтрата удаляли растворитель путем выпаривания при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии с использованием наполнителя амино-силикагеля (элюент: гексан:ацетон=1:1, содержащий 0,05% пиридина). Таким образом получали соединение 17 в виде бесцветного сиропа (0,77 г, чистота: 88%, выход: 84%). Результат анализа ЯМР указанного соединения показан ниже.
P-ЯМР (CDCl3): δ 147,27;
Ms (FAB+): м/z 860 (М++1), 303 (DMTr+), 201 (C8H19N2OP+).
[0319] (Пример B3) синтез пролин-диамид-амидита
Для получения молекулы нуклеиновой кислоты по настоящему изобретению, включающей линкер с пролиновым скелетом, осуществляли синтез L-пролин-диамид-амидита и D-пролин-диамид-амидита согласно схеме 3.
[0320] (B3-1) L-пролин-диамид-амидит
(1) Fmoc-гидрокси-амид-L-пролин (соединение 4)
Соединение 2 (Fmoc-L-пролина) из схемы 3 использовали в качестве исходного материала. Смешивали друг с другом соединение 2 (10,00 г, 29,64 ммоль), 4-амино-1-бутанол (3,18 г, 35,56 ммоль) и 1-гидроксибензотриазол (10,90 г, 70,72 ммоль). Смесь деаэрировали при пониженном давлении и заполняли газом аргоном. Безводный ацетонитрил (140 мл) добавляли в смесь при комнатной температуре, затем к полученной смеси добавляли дициклогексилкарбодиимид (7,34 г, 35,56 ммоль) в безводном растворе ацетонитрила (70 мл). После этого полученную смесь перемешивали в течение 15 часов при комнатной температуре в атмосфере аргона. После завершения реакции полученный осадок удаляли фильтрацией, затем из собранного фильтрата удаляли растворитель выпариванием при пониженном давлении. К полученному остаточному веществу добавляли дихлорметан (200 мл), затем смесь промывали насыщенным водным бикарбонатом натрия (200 мл). Затем собирали органический слой и высушивали сульфатом магния. После этого органический слой фильтровали, и удаляли растворитель из полученного фильтрата выпариванием при пониженном давлении. К остаточному веществу добавляли диэтиловый эфир (200 мл), благодаря чему остаточное вещество превращалось в порошок. Полученный таким образом порошок собирали фильтрацией. Таким способом получали соединение 4 в виде бесцветного порошка (10,34 г, выход 84%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,76-7,83 (м, 2H, Ar-H), 7,50-7,63 (м, 2H, Ar-H), 7,38-7,43 (м, 2H, Ar-H), 7,28-7,33 (м, 2H, Ar-H), 4,40-4,46 (м, 1H, CH), 4,15-4,31 (м, 2H, CH2), 3,67-3,73 (м, 2H, СН2), 3,35-3,52 (м, 2H, СН2), 3,18-3,30 (м, 2Н, СН2), 2,20-2,50 (м, 4Н), 1,81-2,03 (м, 3Н), 1,47-1,54 (м, 2Н); Ms (FAB+): m/z 409 (M+H+).
[0321] (2) DMTr-амид-L-пролин (соединение 6)
Fmoc-гидрокси-амид-L-пролин (соединение 4) (7,80 г, 19,09 ммоль) смешивали с безводным пиридином (5 мл), и полученную смесь азеотропным способом дважды высушивали при комнатной температуре. К полученному остаточному веществу добавляли 4,4'-диметокситритилхлорид (8,20 г, 24,20 ммоль), диметиламинопиридин (DMAP) (23 мг, 0,19 ммоль) и безводный пиридин (39 мл). Эту смесь перемешивали в течение 1 часа при комнатной температуре. После этого к смеси добавляли метанол (7,8 мл) и перемешивали в течение 30 минут при комнатной температуре. Полученную смесь разводили дихлорметаном (100 мл) и промывали насыщенным водным раствором бикарбоната натрия (150 мл). После этого отделяли органический слой. Органический слой высушивали над сульфатом натрия, затем фильтровали. Из полученного фильтрата удаляли растворитель выпариванием при пониженном давлении. К полученному указанным способом неочищенному остаточному веществу добавляли безводный диметилформамид (39 мл) и пиперидин (18,7 мл, 189 ммоль), затем перемешивали в течение 1 часа при комнатной температуре. После завершения реакции растворитель удаляли из смеси путем выпаривания при пониженном давлении и комнатной температуре. Полученное остаточное вещество подвергали колоночной хроматографии на силикагеле (торговое наименование: Wakogel C-300, элюент: CH2Cl2:CH3OH=9:1, содержащий 0,05% пиридин). Таким образом получали соединение 6 в виде светло-желтого масла (9,11 г, выход 98%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,39-7,43 (м, 2H, Ar-H), 7,30 (д, J=8,8 Гц, 4H, Ar-H), 7,21 (тт, 1H, 4,9, 1,3 Гц, Ar-H), 6,81 (д, J=8,8 Гц, 4H, Ar-H), 3,78 (с, 6H, ОСН3), 3,71 (дд, H, J=6,3 Гц, 5,4 Гц, CH), 3,21 (2H, 12,9, 6,3 Гц, 2H, СН2), 3,05 (т, J=6,3 Гц, 2H, СН2), 2,85-2,91 (м, 2H, СН2), 2,08-2,17 (м, 1Н, CH), 1,85-2,00 (м, 3H), 1,55-1,65 (м, 5H);
Ms (FAB+); m/z 489 (M+H+), 303 (DMTr+).
[0322] (3) DMTr-гидрокси-диамид-L-пролин (соединение 8)
Безводный раствор дихлорметана получали путем смешивания полученного указанным способом DMTr-амид-L-пролина (соединение 6) (6,01 г, 12,28 ммоль), этилендихлорида (EDC) (2,83 г, 14,74 ммоль), 1-гидроксибензотриазола (3,98 г, 29,47 ммоль) и триэтиламина (4,47 г, 44,21 ммоль) в безводном дихлорметане (120 мл). Затем к этому раствору добавляли 6-гидроксигексановую кислоту (1,95 г, 14,47 ммоль) при комнатной температуре в атмосфере аргона, и эту смесь затем перемешивали в течение 1 часа при комнатной температуре в атмосфере аргона. Полученную смесь разводили дихлорметаном (600 мл), после чего трижды промывали насыщенным солевым раствором (800 мл). Затем собирали органический слой. Органический слой высушивали над сульфатом натрия, после чего фильтровали. Из полученного фильтрата удаляли растворитель выпариванием при пониженном давлении. Таким образом получали соединение 8 в виде светло-желтой пены (6,29 г, выход 85%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,41-7,43 (м, 2H, Ar-H), 7,27-7,31 (м, 4H, Ar-H), 7,19-7,26 (м, 2H, Ar-H), 7,17-7,21 (м, 1H, Ar-H), 6,79-6,82 (м, 4H, Ar-H), 4,51-4,53 (м, 1H, CH), 3,79 (с, 6H, ОСН3), 3,61 (т, 2H, J=6,4 Гц, СН2), 3,50-3,55 (м, 1H, CH), 3,36-3,43 (м, 1H, CH), 3,15-3,24 (м, 2H, СН2), 3,04 (т, J=6,3 Гц, 2H, CH2), 2,38-2,45 (м, 1H, CH), 2,31 (т, 6,8 Гц, 2H, СН2), 2,05-2,20 (м, 1H, CH), 1,92-2,00 (м, 1H, CH), 1,75-1,83 (м, 1H, CH), 1,48-1,71 (м, 8H), 1,35-1,44 (м, 2H, CH2);
Ms (FAB+): m/z 602 (M+), 303 (DMTr+).
[0323] (4) DMTr-диамид-L-пролин-амидит (соединение 10)
Полученный указанным способом DMTr-гидрокси-диамид-L-пролин (соединение 8) (8,55 г, 14,18 ммоль) смешивали с безводным ацетонитрилом и полученную смесь высушивали азеотропным способом трижды при комнатной температуре. К полученному остаточному веществу добавляли диизопропиламмония тетразолид (2,91 г, 17,02 ммоль). Полученную смесь деаэрировали при пониженном давлении и заполняли газом аргоном. К смеси добавляли безводный ацетонитрил (10 мл), после чего в эту смесь добавляли 2-цианоэтокси-N,N,N',N'-тетраизопропил-фосфородиамидит (5,13 г, 17,02 ммоль) в безводном растворе ацетонитрила (7 мл). Эту смесь перемешивали в течение 2 часов при комнатной температуре в атмосфере аргона. Затем смесь разводили дихлорметаном, трижды промывали насыщенным водным бикарбонатом натрия (200 мл), а затем промывали насыщенным солевым раствором (200 мл). Органический слой собирали и высушивали сульфатом натрия. После этого органический слой фильтровали. Из полученного фильтрата удаляли растворитель выпариванием при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии с использованием наполнителя амино-силикагеля (элюент: гексан:этилацетат=1:3, содержащий 0,05% пиридин). Таким образом получали соединение 10 в виде бесцветного сиропа (10,25 г, чистота: 92%, выход: 83%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,40-7,42 (м, 2H, Ar-H), 7,29-7,31 (м, 4H, Ar-H), 7,25-7,27 (м, 2H, Ar-H), 7,17-7,21 (м, 1H, Ar-H), 6,80-6,82 (м, 4H, Ar-H), 4,51-4,53 (м, 1H, CH), 3,75-3,93 (м, 4H), 3,79 (с, 6H, OCH3), 3,45-3,60 (м, 4H), 3,35-3,45 (м, 1H, CH), 3,20-3,29 (м, 1H), 3,04 (т, J=6,4 Гц, 2H, CH2), 2,62 (т, J=5,8 Гц, 2H, CH2), 2,40-2,44 (м, 1H, CH), 2,31 (т, 7,8 Гц, 2H, CH2), 2,03-2,19 (м, 1H, CH), 1,92-2,02 (м, 1H, CH), 1,70-1,83 (м, 1H, CH), 1,51-1,71 (м, 8H), 1,35-1,44 (м, 2H, СН2), 1,18 (д, J=6,8 Гц, 6H, CH3), 1,16 (д, J=6,8 Гц, 6H, CH3);
P-ЯМР (CDCl3): Ms δ l47,17;
Ms (FAB+): m/z 802 (M+), 303 (DMTr+), 201 (C8H19N2OP+).
[0324] (B3-2) D-пролин-диамид-амидит
(1) Fmoc-гидрокси-амид-D-пролин (соединение 3)
Соединение 1 (Fmoc-D-пролин) использовали в качестве исходного материала согласно схеме 3. Смесь соединения 1 (1,5 г, 4,45 ммоль), дициклогексилкарбодиимида (1,1 г, 5,34 ммоль) и 1-гидроксибензотриазола (1,5 г, 10,69 ммоль) деаэрировали при пониженном давлении и заполняли газом аргоном. К смеси добавляли безводный ацетонитрил (24 мл) при комнатной температуре, после чего к этой смеси добавляли 4-амино-1-бутанол (0,48 г, 5,34 ммоль) в безводном растворе ацетонитрила (6 мл). После этого смесь перемешивали в течение 15 часов при комнатной температуре в атмосфере аргона. После завершения реакции полученный осадок удаляли фильтрацией, затем удаляли растворитель из собранного фильтрата путем выпаривания при пониженном давлении. К полученному остаточному веществу добавляли дихлорметан, затем смесь промывали три раза буферным раствором уксусной кислоты (pH 4,0), после чего три раза промывали насыщенным водным раствором бикарбоната натрия. Затем органический слой собирали и высушивали сульфатом магния. После этого органический слой фильтровали, затем удаляли растворитель из полученного фильтрата выпариванием при пониженном давлении. К остаточному веществу добавляли диэтиловый эфир (50 мл), тем самым превращая остаточное вещество в порошок. Полученный таким образом порошок собирали фильтрацией. Таким способом получали соединение 3 в виде белого порошка. Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (400 МГц, CDCl3): δ 7,77 (д, J=7,3 Гц, 2H); 7,58 (уш., 2H); 7,41 (т, J=7,3 Гц, 2H); 7,32 (т, J=7,3 Гц, 2H); 4,25-4,43 (м, 4H); 3,25-3,61 (м, 6H); 1,57-1,92 (м, 8H).
MS (FAB+): m/z 409 (M+H+).
[0325] (2) DMTr-амид-D-пролин (соединение 5)
Fmoc-гидрокси-амид-D-пролин (соединение 3) (1,0 г, 2,45 ммоль) смешивали с безводным пиридином (5 мл), и полученную смесь азеотропным способом высушивали дважды при комнатной температуре. К полученному остаточному веществу добавляли 4,4'-диметокситритилхлорид (1,05 г, 3,10 ммоль), DMAP (3 мг, 0,024 ммоль) и безводный пиридин (5 мл). Эту смесь перемешивали в течение 1 часа при комнатной температуре. После этого к смеси добавляли метанол (1 мл) и перемешивали в течение 30 минут при комнатной температуре. Полученную смесь разводили дихлорметаном и промывали насыщенным водным бикарбонатом натрия. После этого органический слой отделяли. Органический слой высушивали над сульфатом натрия, затем фильтровали. Из полученного фильтрата удаляли растворитель путем выпаривания при пониженном давлении. К полученному таким способом неочищенному остаточному веществу добавляли безводный диметилформамид (5 мл) и пиперидин (2,4 мл, 24 ммоль), затем перемешивали в течение 1 часа при комнатной температуре. После завершения реакции растворитель удаляли из смеси путем выпаривания при пониженном давлении и комнатной температуре. Полученное остаточное вещество подвергали колоночной хроматографии на силикагеле (торговое наименование Wakogel C-300, элюент: CH2Cl2:CH3OH=9:1, содержащий 0,05% пиридин). Таким образом получали соединение 5 в виде светло-желтого масла (1,26 г, выход 96%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (400 МГц, CDCl3): δ 7,62 (уш., 1H); 7,41-7,44 (м, 2H); 7,26-7,33 (м, 6H); 7,17-7,22 (м, 1H); 6,80-6,84 (м, 4H); 3,78 (с, 6H); 3,71 (дд, J=8,8, 5,4 Гц, 1H); 3,22 (кв., 6,5 Гц, 2H); 3,07 (т, J=6,1 Гц, 2H); 2,97-3,03 (м, 1H); 2,85-2,91 (м, 1H); 1,85-2,15 (м, 3H); 1,55-1,73 (м, 6H).
MS (FAB+): m/z 489 (M+H+), 303 (DMTr+).
[0326] (3) DMTr-гидрокси-диамид-D-пролин (соединение 7)
Безводный раствор дихлорметана получали путем смешивания полученного указанным способом DMTr-амид-D-пролина (соединение 5) (1,2 г, 2,45 ммоль), EDC (566 мг, 2,95 ммоль), 1-гидроксибензотриазола (796 мг, 5,89 ммоль) и триэтиламина (1,2 мл, 8,84 ммоль) в безводном дихлорметане (24 мл). Затем к этому раствору добавляли 6-гидроксигексановую кислоту (390 мг, 2,95 ммоль) при комнатной температуре в атмосфере аргона, после чего эту смесь перемешивали в течение 1 часа при комнатной температуре в атмосфере аргона. Смесь разводили дихлорметаном, затем три раза промывали насыщенным водным раствором бикарбоната натрия. Органический слой собирали и высушивали сульфатом натрия. После этого органический слой фильтровали. Из полученного фильтрата растворитель удаляли путем выпаривания при пониженном давлении. Таким образом получали соединение 7 в виде светло-желтого масла (1,4 г, выход 95%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (400 МГц, CDCl3): δ 7,40-7,43 (м, 2H); 7,25-7,32 (м, 6H); 7,17-7,22 (м, 1H); 6,79-6,83 (м, 4H); 3,79 (с, 6H); 3,58-3,63 (м, 2H); 3,49-3,55 (м, 1H); 3,15-3,26 (м, 2H); 3,02-3,07 (м, 2H); 2,30-2,33 (м, 2H); 2,11-2,20 (м, 1H); 1,50-1,99 (м, 13H); 1,36-1,43 (м, 2H).
MS (FAB+): m/z 602 (M+), 303 (DMTr+).
[0327] (4) DMTr-диамид-D-пролин-амидит (соединение 9)
Полученный указанным способом DMTr-гидрокси-диамид-D-пролин (соединение 7) (1,2 г, 1,99 ммоль) смешивали с безводным ацетонитрилом и полученную смесь высушивали трижды азеотропным способом при комнатной температуре. Диизопропиламмония тетразолид (410 мг, 2,40 ммоль) добавляли к полученному остаточному веществу. Полученную смесь деаэрировали при пониженном давлении и заполняли газом аргоном. К смеси добавляли безводный ацетонитрил (2,4 мл), после этого к смеси добавляли 2-цианоэтокси-N,N,N',N'-тетраизопропил-фосфородиамидит (722 мг, 2,40 ммоль). Полученную смесь перемешивали в течение 2 часов при комнатной температуре в атмосфере аргона. Затем смесь разводили дихлорметаном, трижды промывали насыщенным водным раствором бикарбоната натрия, затем промывали насыщенным солевым раствором. Органический слой собирали и высушивали сульфатом натрия. После этого органический слой фильтровали. Из полученного фильтрата удаляли растворитель путем выпаривания при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии с использованием в качестве наполнителя амино-силикагель (элюент: гексан:этилацетат=1:3). Таким образом получали соединение 9 в виде бесцветного масла (1,4 г, чистота: 95%, выход: 83%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (400 МГц, CDCl3): δ 7,40-7,43 (м, 2H); 7,25-7,32 (м, 6H); 7,14-7,21 (м, 1H); 6,80-6,83 (м, 4H); 3,80-3,85 (м, 2H); 3,79 (с, 6H); 3,49-3,65 (м, 5H); 3,02-3,06 (м, 2H); 2,60-2,63 (м, 2H); 2,29-2,33 (м, 2H); 1,77-1,82 (м, 2H); 1,56-1,68 (м, 8H); 1,38-1,43 (м, 2H); 1,15-1,29 (м, 18H).
31P-ЯМР (162 МГц, CDCl3): δ 146,94.
MS (FAB+): m/z 802 (M+), 303 (DMTr+), 201 (C8H19N2OP+).
[0328] (Пример B4)
Для получения молекулы нуклеиновой кислоты по настоящему изобретению, включающей линкер с пролиновым скелетом, осуществляли синтез L-пролин-диамид-амидита (тип B) согласно схеме 4, показанной ниже.
[0329]
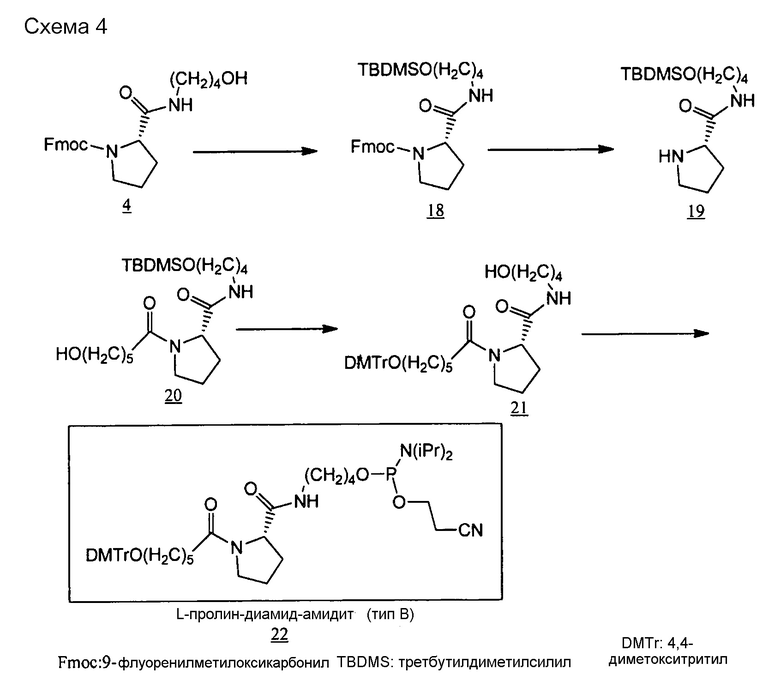
[0330] (1) Fmoc-трет-бутил-диметил-силоксиамид-L-пролин (соединение 18)
Смешивали Fmoc-гидроксиамид-L-пролин (соединение 4) (2,00 г, 30 ммоль), трет-бутил-диметил-силилхлорид (1,11 г, 35 ммоль) и имидазол (10,90 г, 71 ммоль). Смесь деаэрировали при пониженном давлении и заполняли газом аргоном. К смеси добавляли безводный ацетонитрил (20 мл) при комнатной температуре, затем смесь перемешивали в течение ночи при комнатной температуре в атмосфере аргона. После завершения реакции к смеси добавляли дихлорметан (150 мл). Полученную смесь промывали водой трижды, затем промывали насыщенным солевым раствором. Органический слой собирали и высушивали сульфатом магния. После этого органический слой фильтровали. Из полученного фильтрата удаляли растворитель путем выпаривания при пониженном давлении, затем остаточное вещество подвергали колоночной хроматографии на силикагеле (элюент: CH2Cl2:CH3OH=95:5). Таким образом получали соединение 18 в виде бесцветного сиропа (2,35 г, выход 92%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,76-7,78 (м, 2H, Ar-H), 7,50-7,63 (м, 2H, Ar-H), 7,38-7,42 (м, 2H, Ar-H), 7,29-7,34 (м, 2H, Ar-H), 4,10-4,46 (м, 4H, CH2), 3,47-3,59 (м, 4H, CH2), 3,20-3,26 (м, 2H, CH), 1,85-1,95 (м, 2H), 1,42-1,55 (м, 6H), 0,96 (с, 9H, t-Bu), 0,02 (с, 6H, SiCH3);
Ms (FAB+): m/z 523 (M+H+).
[0331] (2) трет-бутил-диметил-силоксиамид-L-пролин (соединение 19)
К полученному указанным способом Fmoc-трет-бутил-диметил-силоксиамид-L-пролину (соединение 18) (1,18 г, 2,5 ммоль) добавляли безводный ацетонитрил (5 мл) и пиперидин (2,4 мл), и эту смесь перемешивали в течение 1 часа при комнатной температуре. После завершения реакции к смеси добавляли ацетонитрил (50 мл), и нерастворимые вещества удаляли фильтрацией. Из полученного фильтрата удаляли растворитель выпариванием при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии на силикагеле (элюент: CH2Cl2:CH3OH=9:1). Таким образом получали соединение 19 в виде бесцветного сиропа (0,61 г, выход 90). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 3,71 (дд, 1H, J=9,0 Гц, 5,2 Гц, CH), 3,61-3,64 (м, 2H, СН2), 3,22-3,28 (м, 2Н, СН2), 2,98-3,04 (м, 1H, CH), 2,86-2,91 (м, 1H, CH), 2,08-2,17 (м, 1H, CH), 1,86-1,93 (м, 1H, CH), 1,66-1,75 (м, 2H, СН2), 1,52-1,57 (м, 4H), 0,89 (с, 9H, t-Bu), 0,05 (с, 6H, SiCH3);
Ms (FAB+); m/z 301 (M+H+).
[0332] (3) трет-бутил-диметил-силоксиамид-гидроксиамид-L-пролин (соединение 20)
Безводный раствор дихлорметана получали путем смешивания полученного указанным способом трет-бутил-диметил-силоксиамид-L-пролина (соединение 19) (550 мг, 1,8 ммоль), 6-гидроксигексановой кислоты (300 мг, 2,3 ммоль), EDC (434 мг, 2,3 ммоль) и 1-гидроксибензотриазола (695 мг, 4,5 ммоль) в безводном дихлорметане (20 мл). К этому раствору добавляли триэтиламин (689 мг, 6,8 ммоль) при комнатной температуре в атмосфере аргона, затем полученную смесь перемешивали в течение ночи при комнатной температуре в атмосфере аргона. Смесь промывали насыщенным солевым раствором. Органический слой собирали, и собранный органический слой высушивали над сульфатом натрия. После этого органический слой фильтровали. Из полученного фильтрата растворитель удаляли выпариванием при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии на силикагеле (элюент: CH2Cl2:CH3OH=9:1). Таким образом получали соединение 20 в виде бесцветного сиропа (696 мг, выход: 92%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 4,54 (д, 1H, CH), 3,58-3,67 (м, 5H), 3,52-3,56 (м, 1H, CH), 3,32-3,39 (м, 1H), 3,20-3,25 (м, 2H), 2,40-2,43 (м, 1H, CH), 2,33 (т, J=7,3 Гц, 2H, CH2), 2,05-2,25 (м, 2H), 1,93-2,03 (м, 1H, CH), 1,75-1,85 (м, 1H, CH), 1,50-1,73 (м, 8H), 1,37-1,46 (м, 2H, СН2), 0,87 (с, 9H, t-Bu), 0,04 (с, 6H, SiCH3);
Ms (FAB+): m/z 415 (M++1).
[0333] (4) DMTr-гидрокси-диамид-L-пролин (тип B) (соединение 21)
Полученный указанным способом трет-бутил-диметил-силоксиамид-гидроксиамид-L-пролин (соединение 20) (640 мг, 1,54 ммоль) смешивали с безводным пиридином (1 мл), затем смесь высушивали азеотропным способом при комнатной температуре. К полученному остаточному веществу добавляли 4,4'-диметокситритилхлорид (657 мг, 1,85 ммоль), DMAP (2 мг) и безводный пиридин (5 мл), и эту смесь перемешивали в течение 4 часов при комнатной температуре. После этого к смеси добавляли метанол (1 мл) и перемешивали в течение 30 минут при комнатной температуре. Смесь разводили дихлорметаном и промывали насыщенным водным бикарбонатом натрия. Органический слой собирали и высушивали сульфатом натрия. После этого органический слой фильтровали. Из полученного фильтрата растворитель удаляли выпариванием при пониженном давлении. К полученному остаточному веществу добавляли безводный ацетонитрил (5 мл) и раствор тетрагидрофурана 1 моль/л, содержащего тетрабутиламмонийфторид (1,42 мл, тетрабутиламмонийфторид 1,42 ммоль), затем полученную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции к смеси добавляли этилацетат (100 мл). Полученную смесь промывали водой и затем насыщенным солевым раствором. Органический слой собирали и высушивали сульфатом натрия. После этого органический слой фильтровали. Из полученного фильтрата удаляли растворитель выпариванием при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии на силикагеле (элюент: CH2Cl2:CH3OH=95:5, содержащий 0,05% пиридин). Таким образом получали соединение 21 в виде бесцветного сиропа (680 мг, выход 73%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,41-7,44 (м, 2H, Ar-H), 7,26-7,33 (м, 4H, Ar-H), 7,18-7,21 (м, 2H, Ar-H), 7,17-7,21 (м, 1H, Ar-H), 6,80-6,84 (м, 4H, Ar-H), 4,51-4,53 (д, 6,8 Гц, 1H, CH), 3,79 (с, 6H, OCH3), 3,61 (дд, 2H, J=11 Гц, 5,4 Гц, CH2), 3,50-3,54 (м, 1H, CH), 3,36-3,43 (м, lH, CH), 3,20-3,26 (м, 2H, CH2), 3,05 (т, J=6,4 Гц, 2H, СН2), 2,38-2,45 (м, 1H, CH), 2,30 (т, J=7,8 Гц, 2H, СН2), 2,05-2,25 (м, 1H, CH), 1,92-2,00 (м, 1H, CH), 1,75-1,83 (м, 1H, CH), 1,52-1,67 (м, 8H), 1,35-1,45 (м, 2H, CH2);
Ms (FAB+): m/z 602 (M+), 303 (DMTr+).
[0334] (5) DMTr-диамид-L-пролин-амидит (тип B) (соединение 22)
Полученный указанным способом DMTr-гидрокси-диамид-L-пролин (тип B) (соединение 21) (637 мг, 1,06 ммоль) смешивали с безводным ацетонитрилом и полученную смесь высушивали азеотропным способом при комнатной температуре. К полученному остаточному веществу добавляли диизопропиламмония тетразолид (201 мг, 1,16 ммоль), затем полученную смесь деаэрировали при пониженном давлении и заполняли газом аргоном. К смеси добавляли безводный ацетонитрил (1 мл), после чего в эту смесь добавляли 2-цианоэтокси-N,N,N',N'-тетраизопропил-фосфородиамидит (350 мг, 1,16 ммоль) в безводном растворе ацетонитрила (1 мл). Полученную смесь перемешивали в течение 4 часов при комнатной температуре в атмосфере аргона. Смесь разводили дихлорметаном и промывали насыщенным водным бикарбонатом натрия и насыщенным солевым раствором. Органический слой собирали и высушивали сульфатом натрия. После этого органический слой фильтровали. Из полученного фильтрата удаляли растворитель выпариванием при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии с использованием амино-силикагеля в качестве наполнителя (элюент: гексан:ацетон=7:3). Таким образом получали соединение 22 в виде бесцветного сиропа (680 мг, чистота: 95%, выход: 76%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,41-7,43 (м, 2H, Ar-H), 7,25-7,32 (м, 4H, Ar-H), 7,17-7,22 (м, 2H, Ar-H), 6,80-6,83 (м, 4H, Ar-H), 4,53 (д, J=7,8 Гц, 1H, CH), 3,75-3,93 (м, 3H), 3,79 (с, 6H, OCH3), 3,46-3,68 (м, 5H), 3,34-3,41 (м, 1H, CH), 3,10-3,31 (м, 1H, CH), 3,05 (т, J=6,3 Гц, 2H, CH2), 2,62 (т, J=6,3 Гц, 2H, CH2), 2,39-2,46 (м, 1H, CH), 2,29 (т, 7,3 Гц, 2H, СН2), 2,03-2,19 (м, 1H, CH), 1,90-2,00 (м, 1H, CH), 1,70-1,83 (м, 1H, CH), 1,51-1,71 (м, 8H), 1,35-1,45 (м, 2H, СН2), 1,18 (д, J=6,4 Гц, 6H, CH3), 1,16 (д, J=6,4 Гц, 6H, CH3);
P-ЯМР (CH3CN): δ 146,90;
Ms (FAB+): m/z 803 (M++l), 303 (DMTr+).
[0335] (Пример B5)
Для получения молекулы нуклеиновой кислоты по настоящему изобретению, включающей линкер с пролиновым скелетом, осуществляли синтез DMTr-амид-этилен-оксиэтил-амино-L-пролин-амидита (далее называемого "ПЭГ спейсерного типа") в соответствии со схемой 5, показанной ниже.
[0336]
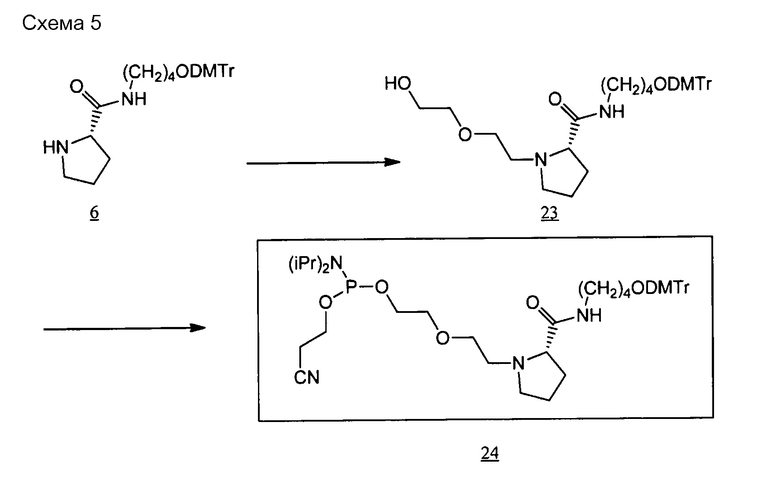
[0337] (1) DMTr-амид-гидрокси-этокси-этил-амино-L-пролин (соединение 23)
Смешивали DMTr-амид-L-пролин (соединение 6) (1,00 г, 2,05 ммоль), 2-(2-гидрокси)этиловый эфир 4-толуолсульфоновой кислоты (3,10 г, 12,30 ммоль) и безводный раствор диметилформамид (10 мл) карбоната калия (0,85 г, 6,15 ммоль), затем полученную смесь перемешивали в течение 4 дней при комнатной температуре в атмосфере аргона. Растворитель из смеси удаляли путем выпаривания при комнатной температуре при пониженном давлении. После этого к смеси добавляли дихлорметан (20 мл), и полученную смесь фильтровали. Фильтрат выпаривали, и полученное остаточное вещество подвергали колоночной хроматографии на силикагеле. В качестве элюентов в хроматографической колонке на силикагеле вначале использовали этилацетат, содержащий 0,05% пиридина, а затем использовали смесь CH2Cl2 и CH3OH (CH2Cl2:CH3OH=9:1), содержащую 0,05% пиридина. В результате получали соединение 23 в виде бесцветного сиропа (1,15 г, выход 97%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CDCl3): δ 7,41-7,45 (м, 2H, Ar-H), 7,27-7,31 (м, 6H, Ar-H), 7,17-7,21 (м, 1H, Ar-H), 6,79-6,82 (м, 4H, Ar-H), 3,79 (с, 6H, OCH3), 3,60-3,70 (м, 2H), 3,39-3,57 (м, 4H), 3,13-3,27 (м, 3H), 3,07-3,08 (м, 2H), 2,71-2,84 (м, 1H), 2,38-2,46 (м, 1H), 2,14-2,19 (м, 1H), 1,84-1,87 (м, 1H), 1,57-1,76 (м, 8H).
[0338] (2) DMTr-амид-этилен-оксиэтил-амино-L-пролин-амидит (соединение 24)
Полученный указанным способом DMTr-амид-гидроксиэтокси- этил-амино-L-пролин (соединение 23) (0,63 г, 1,00 ммоль) смешивали с безводным пиридином, и полученную смесь высушивали азеотропным способом при комнатной температуре. К полученному остаточному веществу добавляли диизопропиламмония тетразолид (206 мг, 1,20 ммоль). Полученную смесь деаэрировали при пониженном давлении и заполняли газом аргоном. К смеси добавляли безводный ацетонитрил (1 мл), после чего в эту смесь добавляли 2-цианоэтокси-N,N,N',N'-тетраизопропил-фосфородиамидит (282 мг, 1,12 ммоль) в безводном растворе ацетонитрила (1 мл). Полученную смесь перемешивали в течение 4 часов при комнатной температуре в атмосфере аргона. Затем смесь разводили дихлорметаном и промывали насыщенным водным бикарбонатом натрия и насыщенным солевым раствором. Органический слой собирали и высушивали сульфатом натрия. После этого органический слой фильтровали. Из полученного фильтрата удаляли растворитель путем выпаривания при пониженном давлении. Полученное остаточное вещество подвергали колоночной хроматографии с использованием амино-силикагеля в качестве наполнителя (элюент: гексан:ацетон=7:3, содержащий 0,05% пиридин). Таким образом получали соединение 24 в виде бесцветного сиропа (0,74 г, чистота: 100%, выход: 87%). Результат анализа ЯМР указанного соединения показан ниже.
1H-ЯМР (CD3CN): δ 7,41-7,43 (м, 2H, Ar-H), 7,28-7,31 (м, 6H, Ar-H), 7,18-7,22 (м, 1H, Ar-H), 6,84-6,86 (м, 4H, Ar-H), 3,73-3,84 (м, 2H, СН2), 3,79 (с, 6H, ОСН3), 3,47-3,64 (м, 7Н), 3,15-3,23 (м, 1Н), 3,11 (т, J=6,4 Гц, 2H, CH2), 3,01 (т, J=5,9 Гц, 2H, CH2), 2,95-2,99 (м, 1H), 2,58-2,63 (м, 2H), 2,31-2,35 (м, 1H, CH), 2,03-2,19 (м, 1H, CH), 1,48-1,78 (м, 10H), 1,12-1,57 (м, 12H, CH3);
P-ЯМР (CD3CN): δ 148,00;
Ms (FAB+): m/z 776 (M+), 303 (DMTr+), 201 (C8H19N2OP+).
[0339] (Пример B6)
1. Синтез защищенного пролинола
Согласно схеме 6, показанной ниже, осуществляли синтез пролинола, защищенного группой диметокситритила (соединение 3).
[0340]
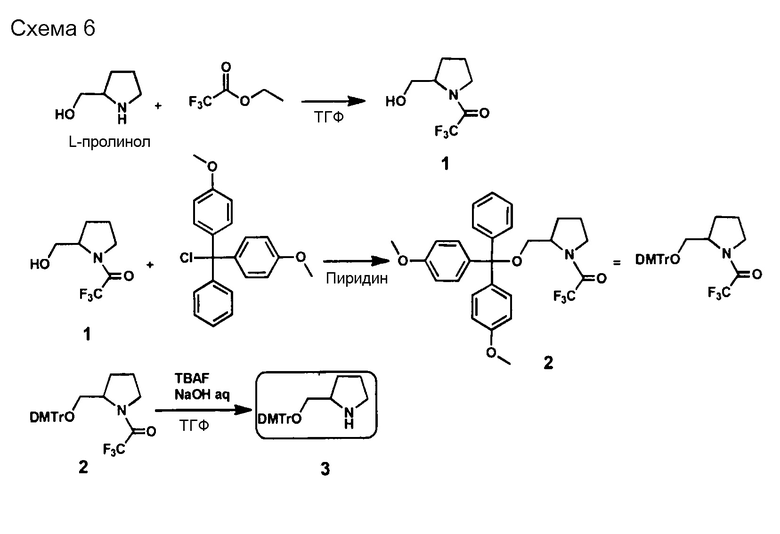
[0341] (1) Трифторацетил-L-пролинол (соединение 1)
L-пролинол (2,0 г, 20 ммоль) растворяли в 20 мл ТГФ. Одновременно в 20 мл ТГФ растворяли этилтрифторацетат (3,0 г, 21 ммоль). Затем последний раствор ТГФ по каплям добавляли в предыдущий раствор ТГФ, содержащий L-пролинол, и эту смесь перемешивали в течение 12 часов. Полученный реакционный раствор выпаривали в вакууме. Таким образом получали соединение 1 (3,7 г, выход 97%). Результат анализа ЯМР указанного соединения показан ниже.
1Н-ЯМР (CDCl3): δ 4,28-4,23 (1,0Н, м, OH), 3,90-3,41 (5Н, Н-2, Н-5, Н-6, м), 2,27-1,77 (4Н, H-3, H-4, м).
[0342] (2) Трифторацетил-DMTr-L-пролинол (соединение 2)
Полученный указанным способом трифторацетил-L-пролинол (соединение 1) (3,7 г, 19 ммоль) растворяли в пиридине, после чего эту смесь высушивали трижды азеотропным способом при комнатной температуре. Полученное остаточное вещество растворяли в 15 мл пиридина, затем к этой смеси добавляли 4,4'-диметокситритилхлорид (DMTr-Cl) (8,1 г, 24 ммоль) при взбалтывании смеси на ледяной бане в атмосфере аргона. Затем смесь оставляли для дальнейшей реакции в течение 4 часов при комнатной температуре. После этого, чтобы погасить избыточный DMTr-Cl, к реакционному раствору также добавляли 10 мл метанола и эту смесь перемешивали в течение 10 минут. После этого к реакционному раствору добавляли дихлорметан, затем полученную смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой, собранный после промывания, высушивали сульфатом натрия. Органический слой фильтровали, затем полученный фильтрат выпаривали в вакууме. Полученное остаточное вещество анализировали на колонке с силикагелем (элюент CH2Cl2:CH3OH=95:5, содержащий 0,1% пиридин). Таким образом получали очищенное соединение 2 (8,5 г, выход 89%). Результат анализа ЯМР указанного соединения показан ниже.
1Н-ЯМР (CDCl3): δ 7,39-7,18 (9H, м, Ar-H), 6,82 (4H, д, J=8,6 Гц, Ar-H), 3,78 (6Н, с, OCH3), 3,70-3,41 (5Н, Н-2, Н-5, Н-6, м), 2,19-1,85 (4H, H-3, H-4, м).
[0343] (3) DMTr-L-пролинол (соединение 3)
Полученный указанным способом трифторацетил-DMTr-L-пролинол (соединение 2) (5 г, 10 ммоль) растворяли в 100 мл ТГФ. К этому раствору ТГФ добавляли 100 мл 5%-го водного раствора гидроксида натрия, и эту смесь перемешивали. К этому раствору добавляли 5 мл 1М раствора фторида тетра-н-бутиламмония (TBAF), затем полученную смесь перемешивали в течение 12 часов при комнатной температуре. Этот реакционный раствор промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой, собранный после промывания, высушивали сульфатом натрия. Органический слой фильтровали, и полученный фильтрат выпаривали в вакууме. Таким образом получали соединение 3 (3,6 г, выход 90%). Результат анализа ЯМР указанного соединения показан ниже.
1Н-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, д, J=8,6 Гц, Ar-H), 3,78 (6H, с, ОСН3), 3,31 (1H, м, H-6), 3,07 (2H, м, H-2, H-6), 2,90 (2H, м, H-5), 1,84 (3H, м, H-3, H-4), 1,40 (1H, м, H-3).
[0344] 2. Синтез амидитного производного
Синтез амидитных производных, имеющих пролинольные связи в разных формах связывания, осуществляли с использованием защищенного пролинола (соединение 3), синтезированного в вышеупомянутом разделе "1", согласно схеме 7, показанной ниже.
[0345]
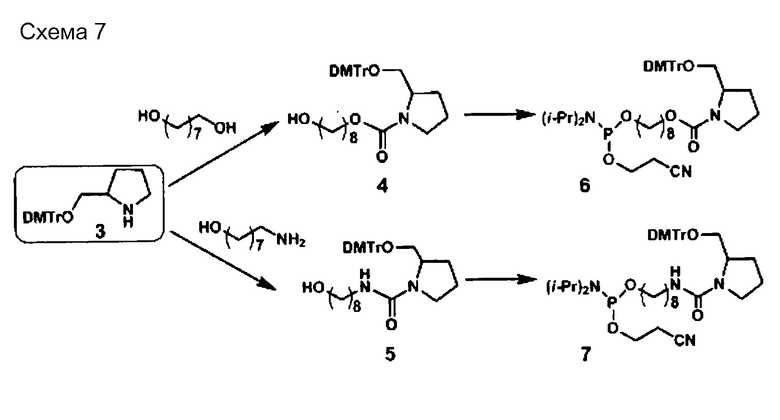
[0346] (1) DMTr-уретан-L-пролинол (соединение 4)
1,8-Октандиол (9,0 г, 62 ммоль) растворяли в 90 мл ТГФ, и этот раствор помещали в атмосферу аргона. Одновременно в 10 мл ТГФ растворяли карбонилдиимидазол (2,0 г, 12 ммоль). Последний раствор ТГФ добавляли к первому раствору ТГФ и перемешивали в течение 1 часа при комнатной температуре. Этот реакционный раствор промывали водой до исчезновения пятна 1,8-остандиола при ТСХ. Дополнительно, собранный после промывания органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Органический слой фильтровали, затем полученный фильтрат выпаривали в вакууме. Полученное остаточное вещество подвергали колоночной хроматографии на силикагеле (элюент: CH2Cl2:CH3OH=95:5). Таким образом получали указанное в названии очищенное соединение. В этом соединении один конец 1,8-октандиола активировался карбонилдиимидазолом (2,3 г, выход 77%).
[0347] В 10 мл ацетонитрила растворяли 0,9 г этого соединения, и полученный раствор помещали в атмосферу аргона. Одновременно в 20 мл ацетонитрила растворяли DMTr-L-пролинол (соединение 3) (1,9 г, 4,8 ммоль). Последний раствор ацетонитрила добавляли к первому раствору ацетонитрила, и перемешивали в течение 24 часов при комнатной температуре. Затем этот реакционный раствор промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой собирали и высушивали над безводным сульфатом натрия. Органический слой фильтровали, затем полученный фильтрат выпаривали в вакууме. Полученное остаточное вещество подвергали колоночной хроматографии на силикагеле (элюент: дихлорметан:ацетон=9:1, содержащий 0,1% пиридин). Таким образом получали очищенное соединение 4 (пролинол-уретан-амидит) (1,5 г, выход 65%). Результат анализа ЯМР указанного соединения показан ниже.
1Н-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, д, J=8,6 Гц, Ar-H), 4,24-3,94 (2H, м, COOCH2), 3,78 (с, 6H, OCH3), 3,72-2,96 (7H, м, алкил, H-2, H-5, H-6), 2,10-1,30 (16H, м, алкил, H-3, H-4).
FAB-MS: 576 [M+H]+
[0348] (2) DMTr-уреидо-L-пролинол (соединение 5)
В атмосфере аргона растворяли трифосген (2,0 г, 6,7 ммоль) в 10 мл ТГФ и эту смесь перемешивали при 0°C. Одновременно в 10 мл ТГФ растворяли DMTr-L-пролинол (соединение 3) (1,3 г, 3,2 ммоль) и N,Н-диизопропилэтиламин (16 г, 124 ммоль), и полученный раствор по капле добавляли в раствор трифосгена в ТГФ. Полученный реакционный раствор перемешивали в течение 1 часа при температуре 0°С, затем в течение 2 часов при комнатной температуре. После этого в 30 мл ТГФ растворяли 8-амино-1-октанол (2,3 г, 16 ммоль) и N,Н-диизопропилэтиламин (5,0 г, 38 ммоль). Реакционный раствор после взбалтывания по каплям добавляли в этот раствор ТГФ и перемешивали в течение 1 часа при температуре 0°С, затем в течение 48 часов при комнатной температуре. Полученный реакционный раствор выпаривали в вакууме, и остаточное вещество растворяли в дихлорметане. Этот раствор промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой собирали и высушивали над безводным сульфатом натрия. Органический слой фильтровали, и полученный фильтрат выпаривали в вакууме. Полученное остаточное вещество подвергали обращенно-фазовой колоночной хроматографии на силикагеле. В этом случае в качестве элюента использовали смешанный растворитель из ацетона и воды, содержащий 0,1% пиридина, и соотношение в смеси ацетона и воды изменяли поэтапно. В частности, молярное соотношение между ацетоном и водой (ацетон:вода) градиентно изменяли таким образом, чтобы оно составляло 2:8, 3:7, 4:6, 5:5 в указанном порядке. Фракцию, содержащую соединение 5 в качестве целевого соединения, экстрагировали дихлорметаном, и полученный таким образом органический слой высушивали с помощью безводного сульфата натрия. Органический слой фильтровали, и полученный фильтрат выпаривали в вакууме. Таким образом получали соединение 5 (пролинол-уреидо-амидит) (0,9 г, выход 49%). Результат анализа ЯМР указанного соединения показан ниже.
1Н-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, м, Ar-H), 3,78 (с, 6H, ОСН3), 3,68-3,25 (9H, м, CH2NH, CH2OH, H-2, H-5, H-6), 1,74-1,18 (16H, м, алкил, H-3, H-4).
FAB-MS: 575 [M+H]+.
[0349] (3) Амидитные производные, имеющие пролинол (соединения 6 и 7)
Модифицированное пролинолом соединение 4 (0,80 г, 1,4 ммоль), полученное указанным способом, растворяли в ацетонитриле, после этого смесь высушивали трижды азеотропным способом при комнатной температуре. Полученное остаточное вещество растворяли в 1 мл ацетонитрила и раствор помещали в атмосферу аргона. К этому раствору ацетонитрила добавляли диизопропиламмония тетразолид (0,24 г, 1,4 ммоль), получая таким образом реакционный раствор. Одновременно в 1 мл ацетонитрила растворяли 2-цианоэтил-N,N,N',N'-тетраизопропил-фосфородиамидит (0,50 г, 1,7 ммоль). Эту смесь добавляли к реакционному раствору и полученную смесь перемешивали в течение 4 часов при комнатной температуре. К реакционному раствору добавляли дихлорметан и полученную смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой, собранный после промывания, высушивали безводным сульфатом натрия. Органический слой фильтровали, и полученный фильтрат выпаривали в вакууме. Полученное остаточное вещество подвергали колоночной хроматографии на амино-силикагеле (элюент: гексан:ацетон=10:1, содержащий 0,1% пиридин). Таким образом получали очищенное соединения 6 (DMTr-уретан-L-пролинол-амидит) (0,90 г, выход 83%). Результат анализа ЯМР указанного соединения показан ниже.
1Н-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, д, J=8,6 Гц, Ar-H), 4,24-3,94 (2H, м, COOCH2), 3,78 (с, 6H, OCH3), 3,72-2,96 (11H, м, CH2O, POCH2, СНСН3, H-2, H-5, H-6), 2,58 (2H, м, CH2CN), 2,10-1,46 (16H, м, алкил, H-3, H-4), 1,34-1,10 (12H, м, ÇHCH3),
31P-ЯМР (CD3CN) δ 146,82.
FAB-MS: 776 [M+H]+.
[0350] Очищенное соединение 7 (DMTr уреидо-L-пролинол-амидит) (0,80 г, выход 74%) получали таким же способом, как указано выше, за исключением использования соединения 5 в качестве модифицированного пролинола вместо соединения 4. Результат анализа ЯМР указанного соединения показан ниже.
1Н-ЯМР (CDCl3): δ 7,40-7,14 (9H, м, Ar-H), 6,82 (4H, м, Ar-H), 3,78 (с, 6H, ОСН3), 3,65-3,25 (13H, м, CH2O, POCH2, СНСН3, H-2, CH2NH, CH2OH, H-2, 15 H-5, H-6), 2,73 (2H, м, CH2CN), 2,10-1,48 (16H, м, алкил, H-3, H-4), 1,35-1,10 (12H, м, СНСН3).
31P-ЯМР (CD3CN) δ 146,83,
FAB-MS: 775 [M+H]+.
[0351] Настоящее изобретение описано со ссылкой на иллюстративные варианты осуществления и примеры, но вместе с тем, настоящее изобретение никоим образом не ограничено этими вариантами осуществления и примерами. Различные изменения и модификации, которые будут очевидными для специалистов в данной области техники, можно вносить в содержание и конкретные свойства настоящего изобретения без отхода от объема настоящего изобретения.
[0352] Настоящая заявка претендует на приоритет: японской патентной заявки № 2010-156122, зарегистрированной 8 июля 2010 года; японской патентной заявки № 2010-230808, зарегистрированной 13 октября 2010 г.; японской патентной заявки № 2010-269824, зарегистрированной 2 декабря 2010 г.; японской патентной заявки № 2010-174915, зарегистрированной 3 августа 2010 г.; японской патентной заявки № 2010-230806, зарегистрированной 13 октября 2010 г., и японской патентной заявки № 2010-269823, зарегистрированной 2 декабря 2010 года. Все раскрытия указанных японских патентных заявок включены в изобретение путем ссылки.
Промышленная применимость
[0353] С помощью одноцепочечной молекулы нуклеиновой кислоты по настоящему изобретению можно подавлять экспрессию гена. Кроме того, поскольку одноцепочечная молекула нуклеиновой кислоты не является кольцевой, ее можно легко синтезировать. Также, поскольку молекула имеет одну цепь, не требуется этап отжига, который является необходимым для получения двойной цепи, таким образом производство такой молекулы является эффективным. Как описано выше, поскольку молекула одноцепочечной НК по настоящему изобретению может подавлять экспрессию целевого гена, она является полезной, например, в качестве фармацевтического, диагностического средства, сельскохозяйственного химического препарата, и в качестве инструмента для проведения исследований с сельскохозяйственными химикатами и в области медицинской науки, естественных наук и в других областях.

















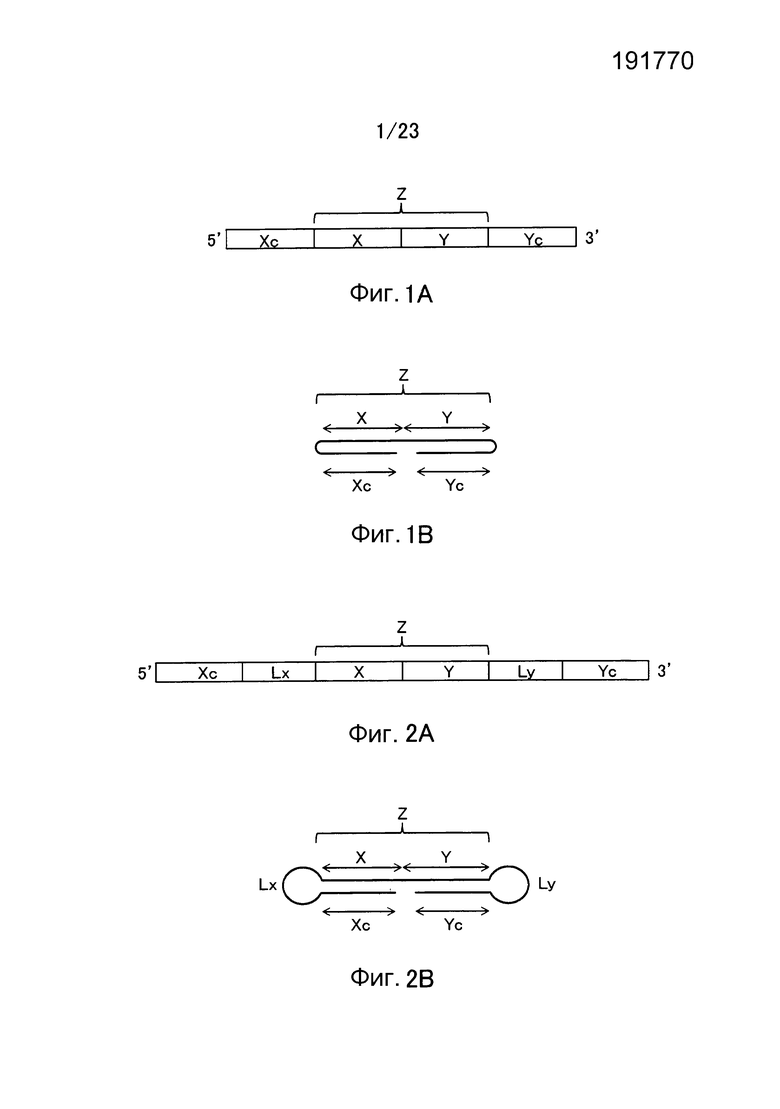
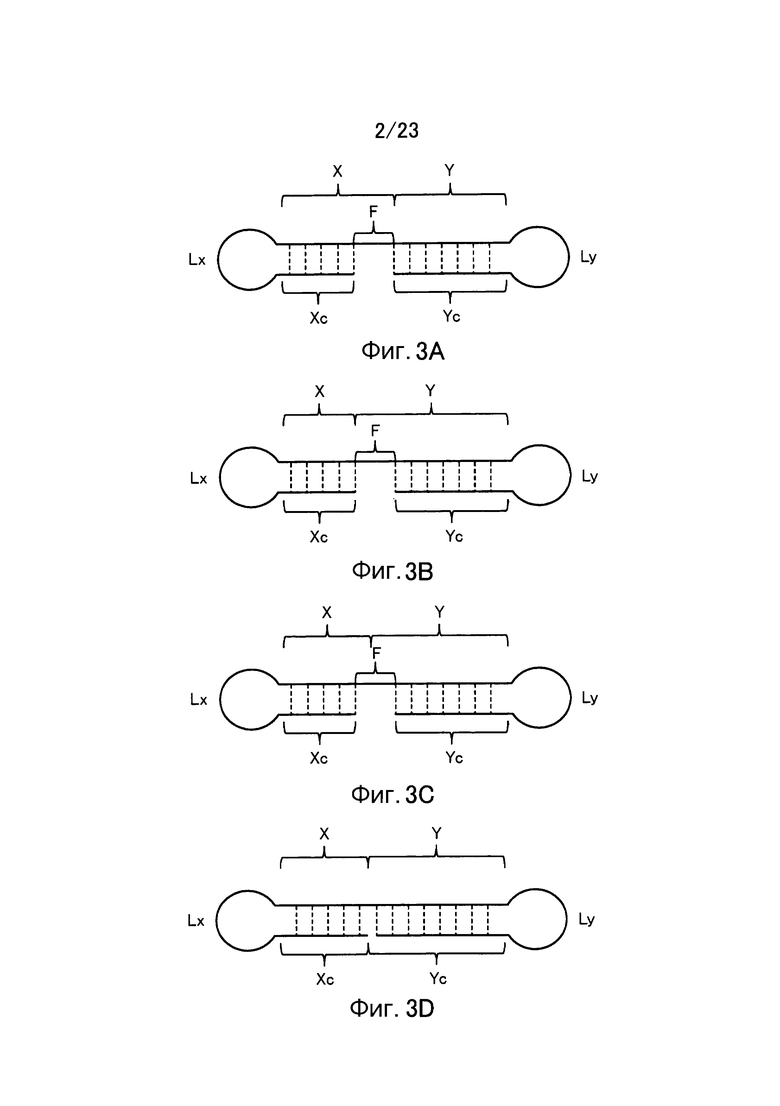
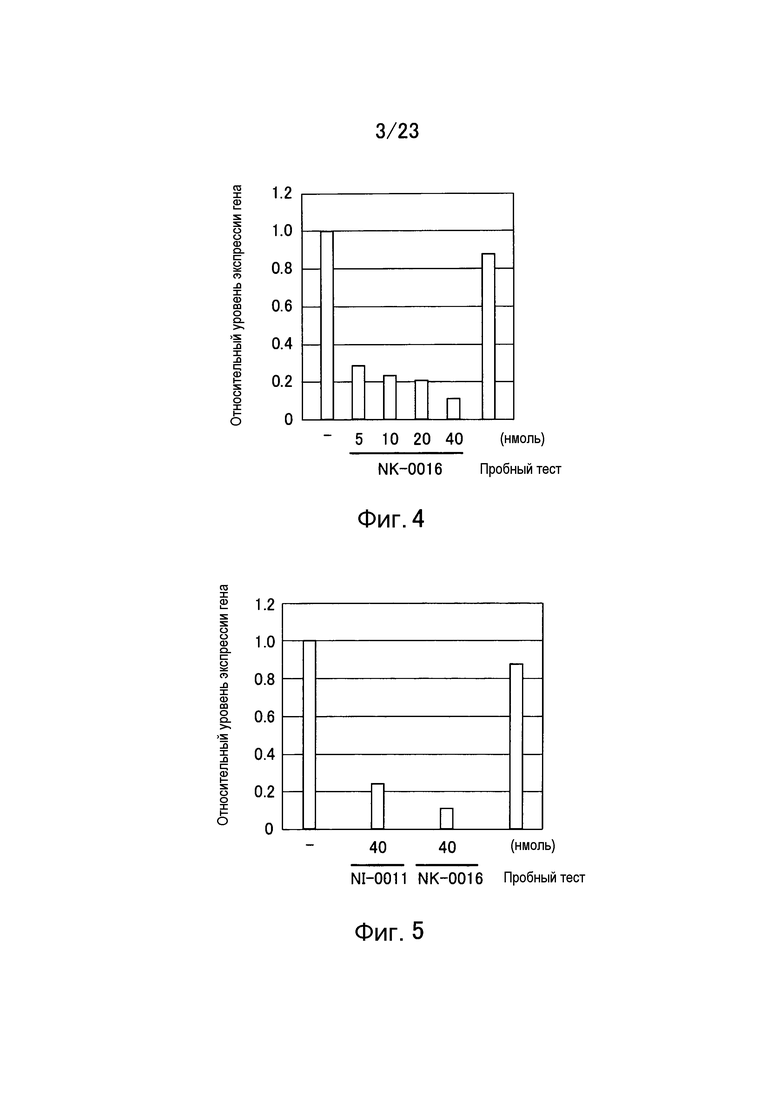
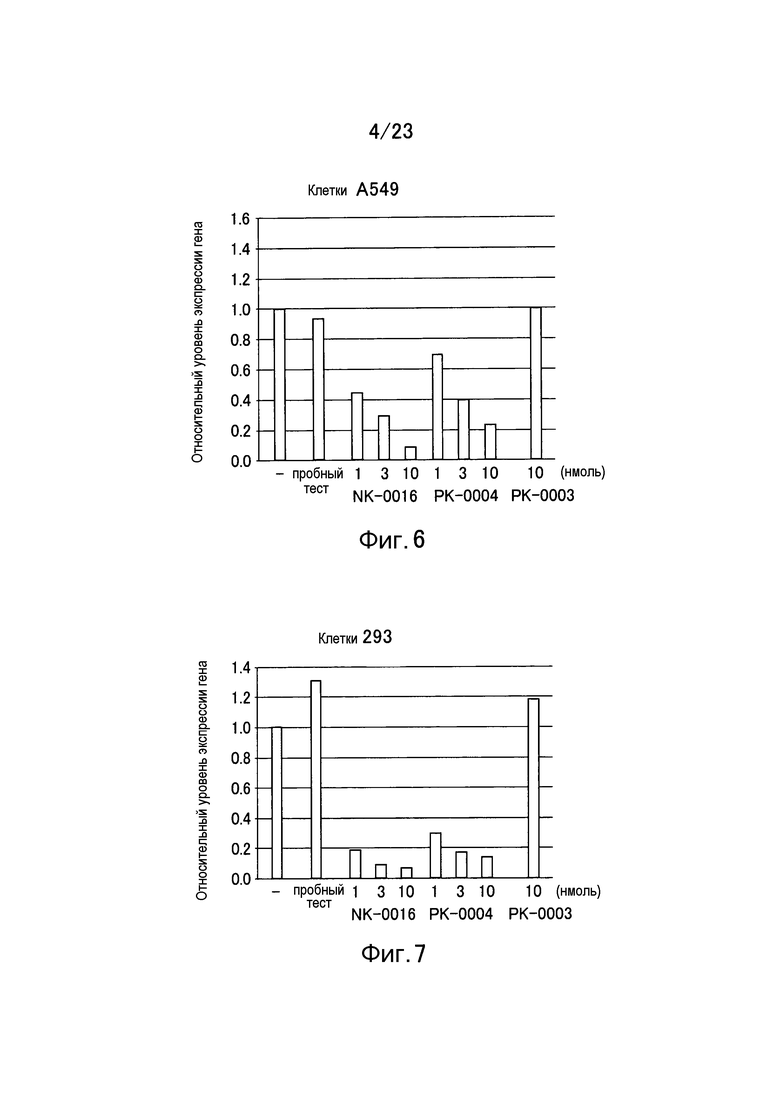
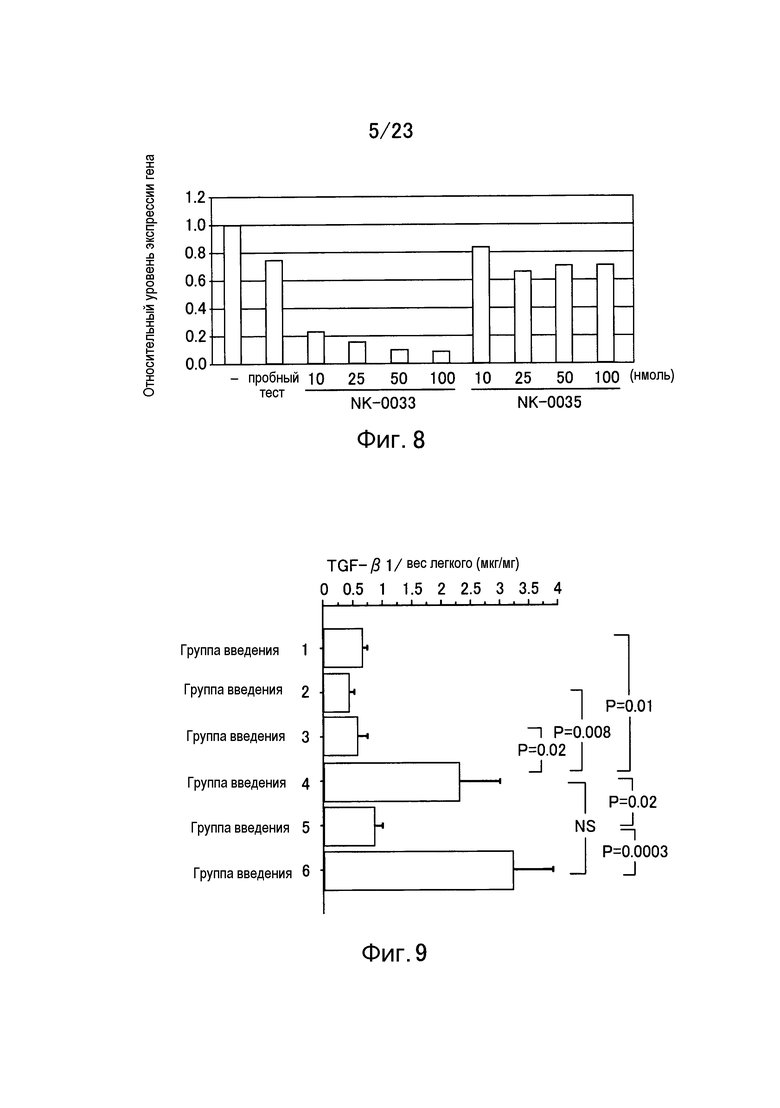
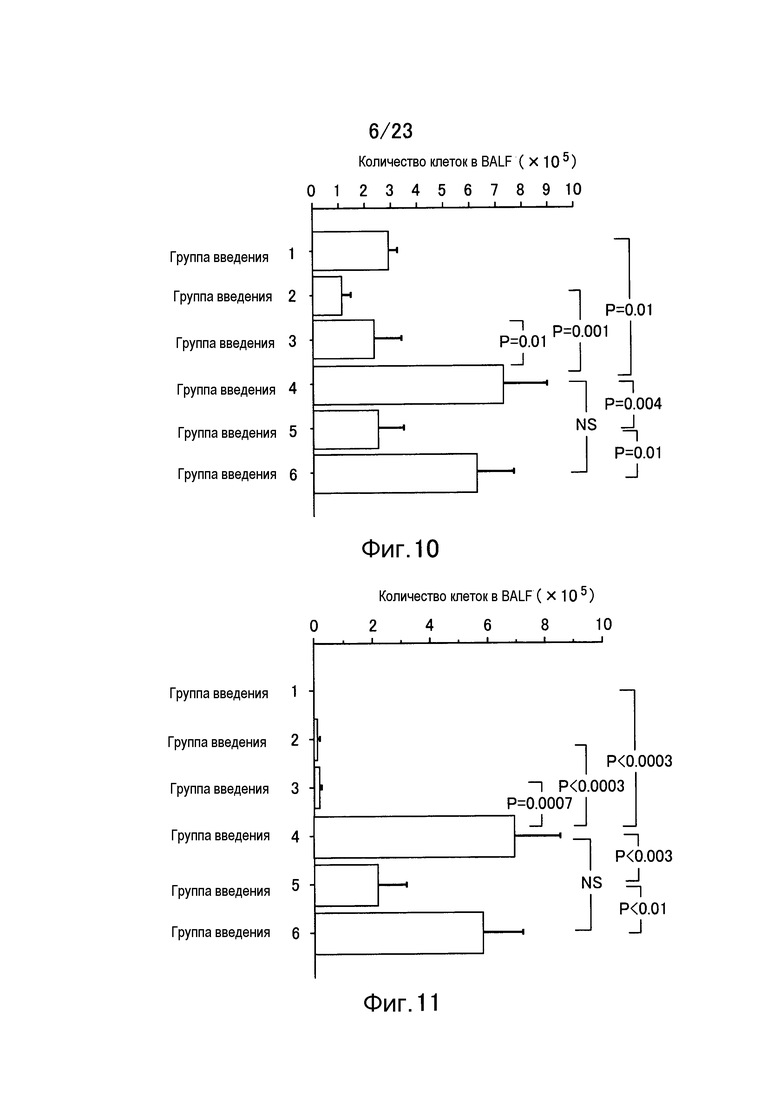


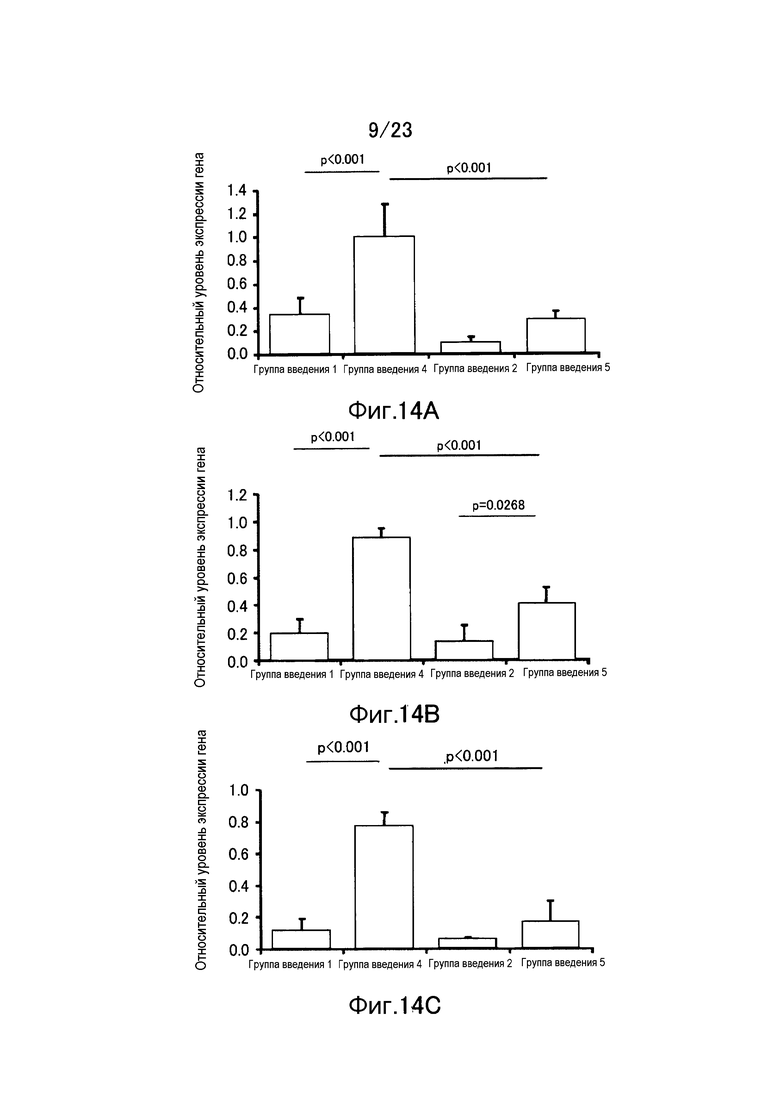
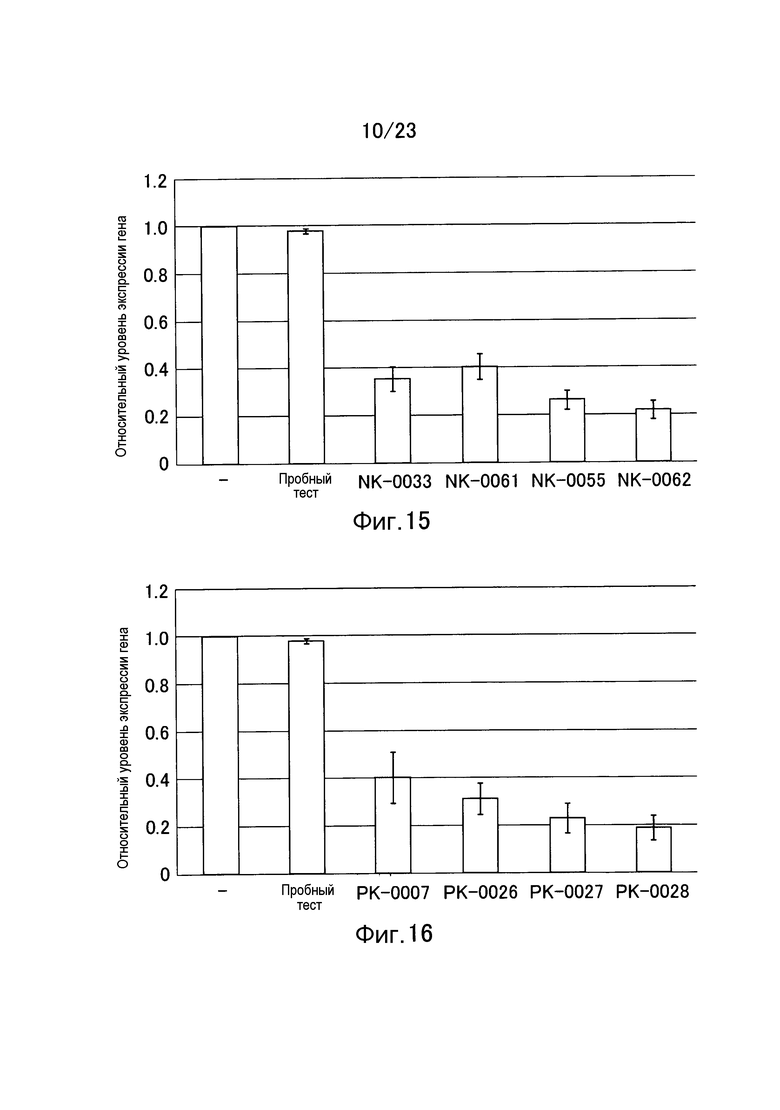
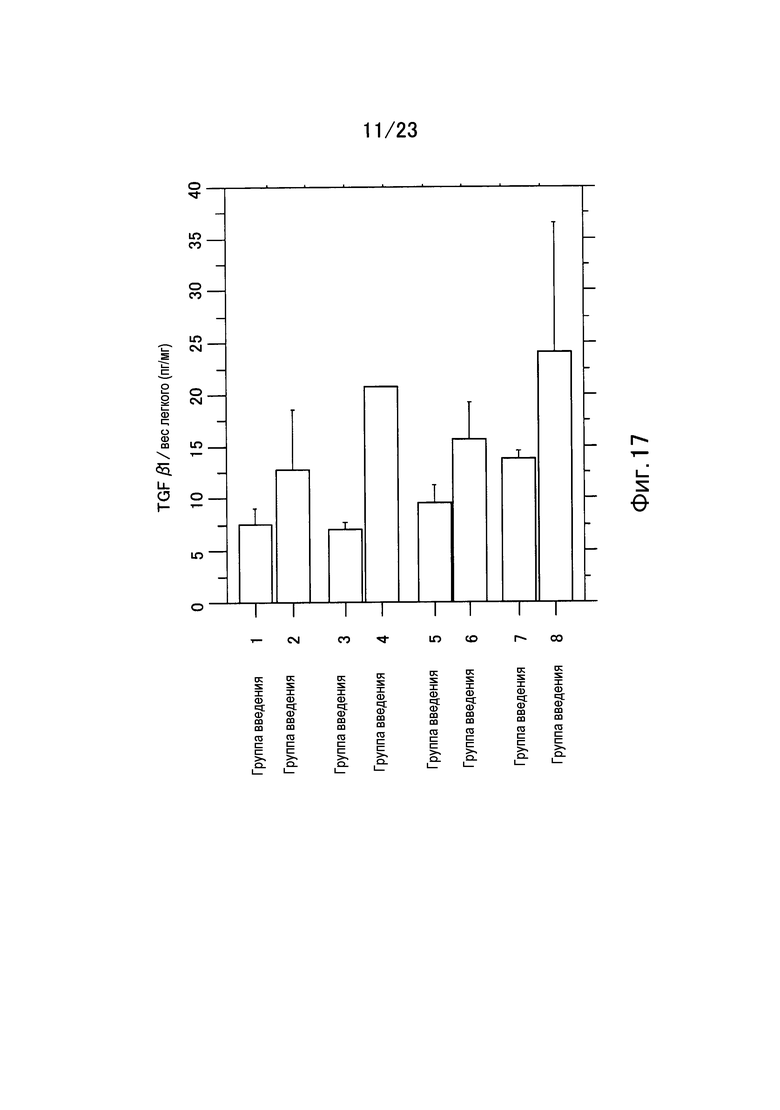
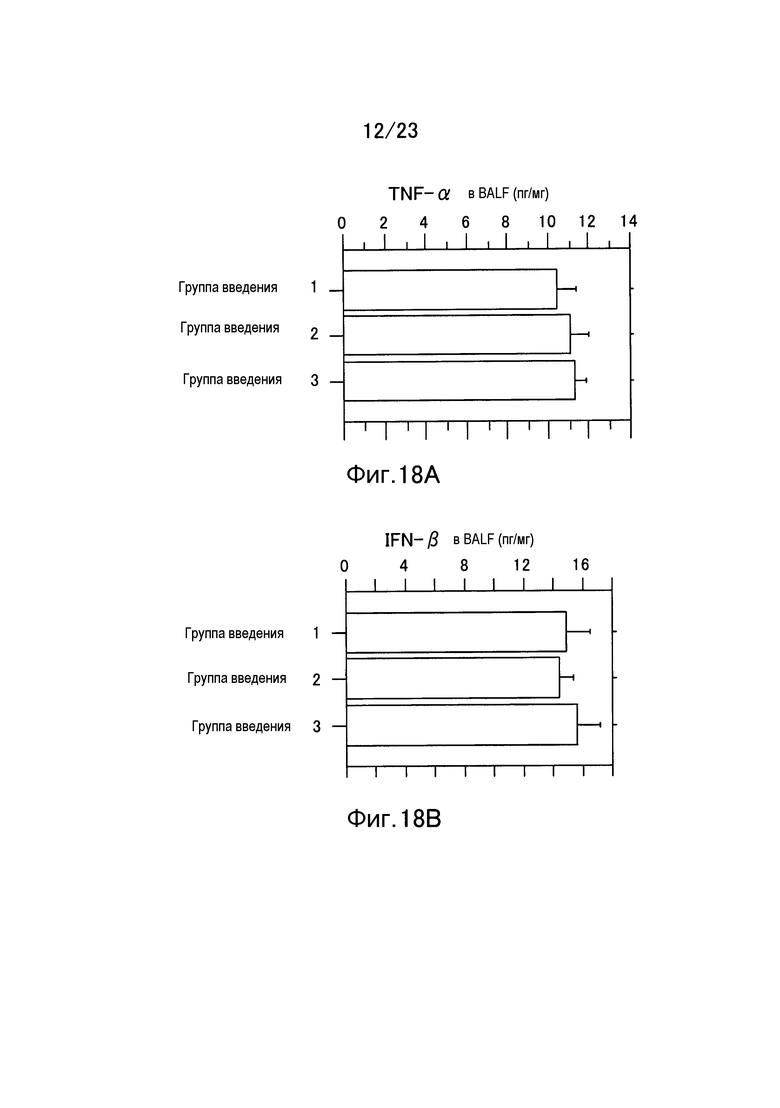
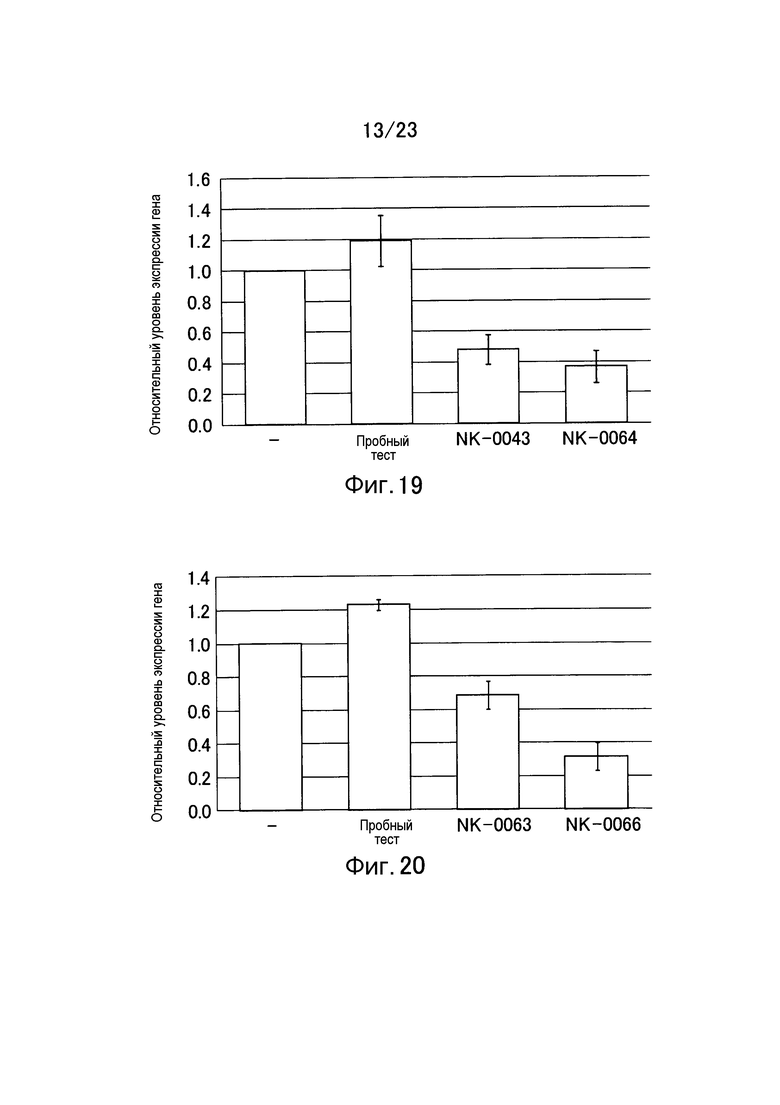

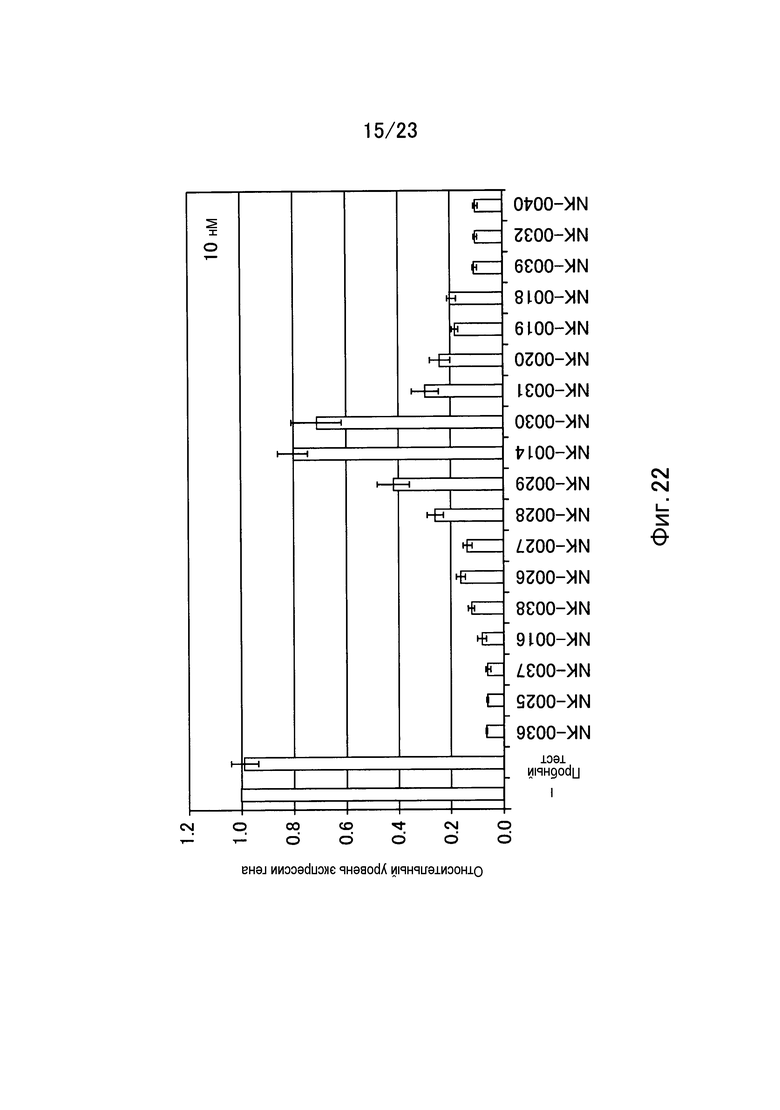

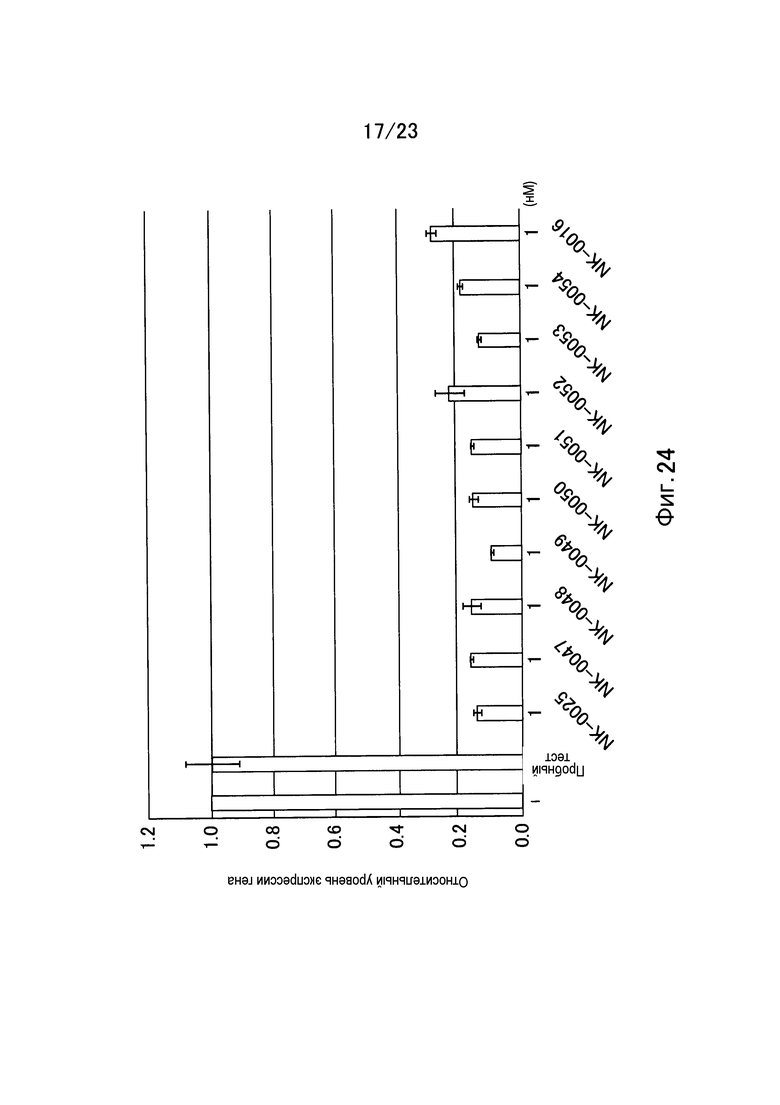

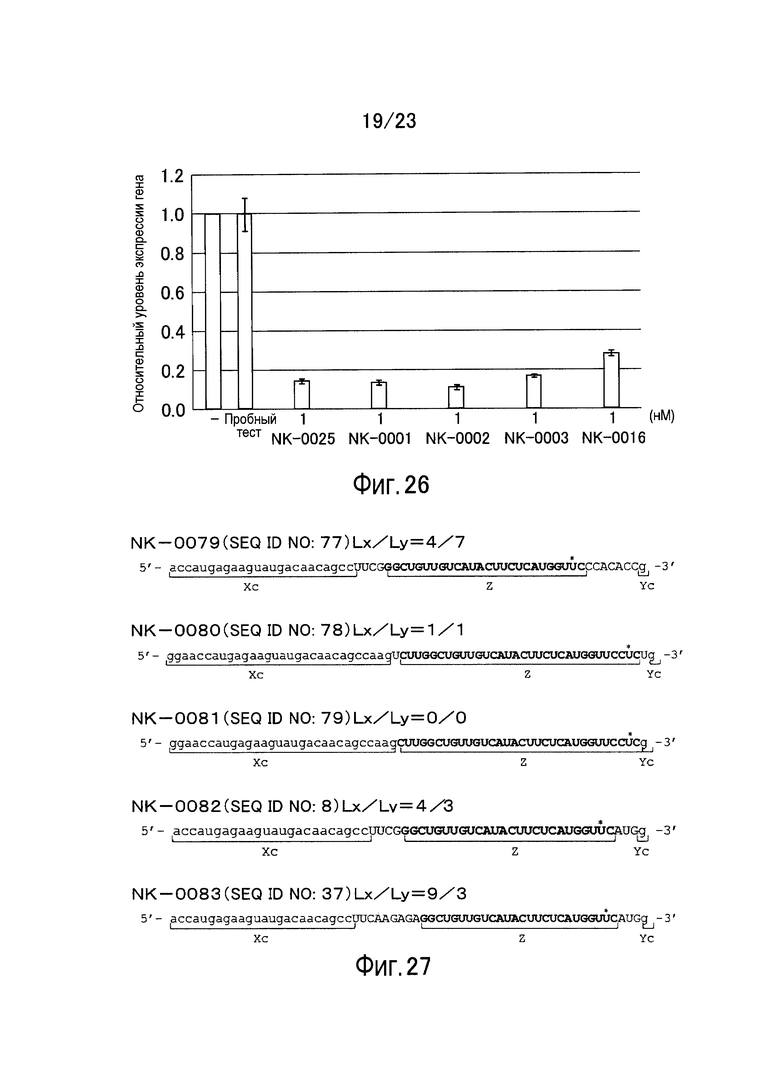
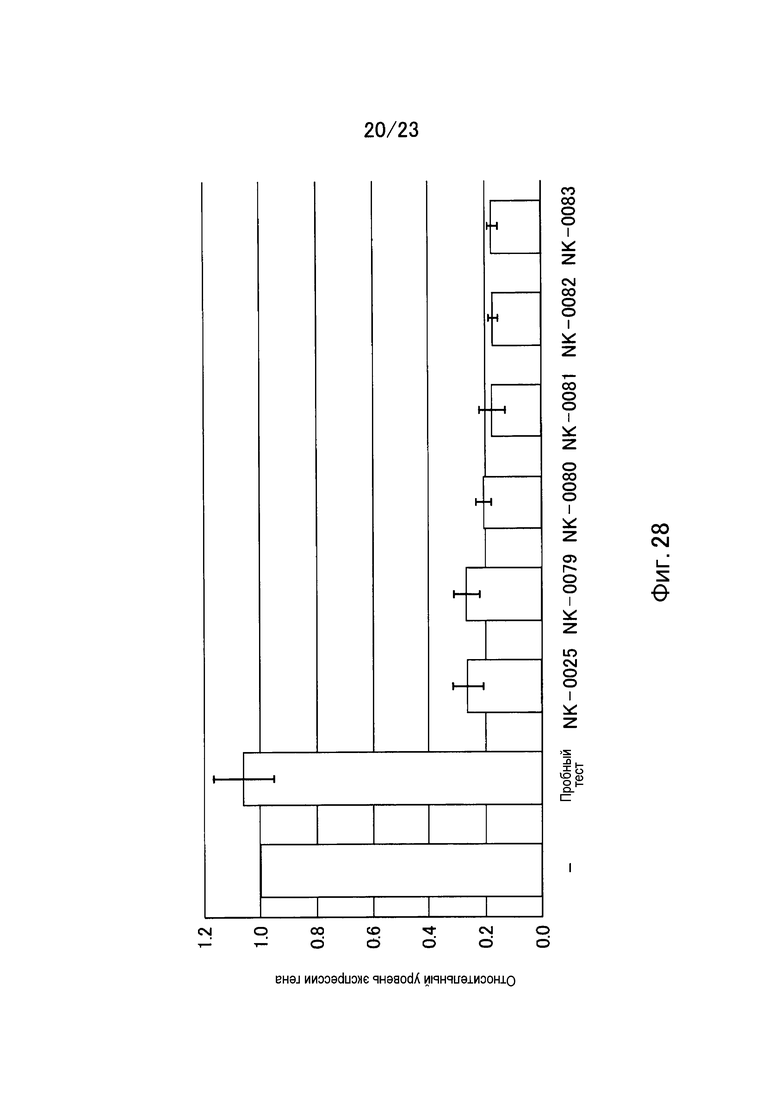
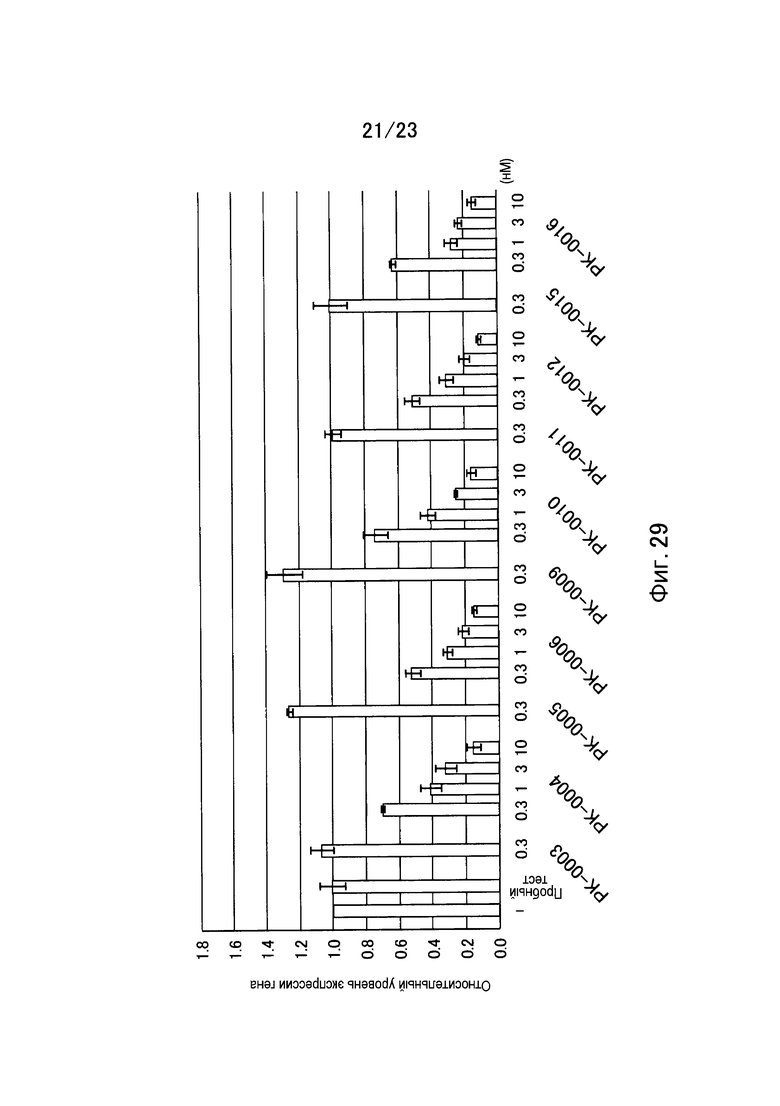
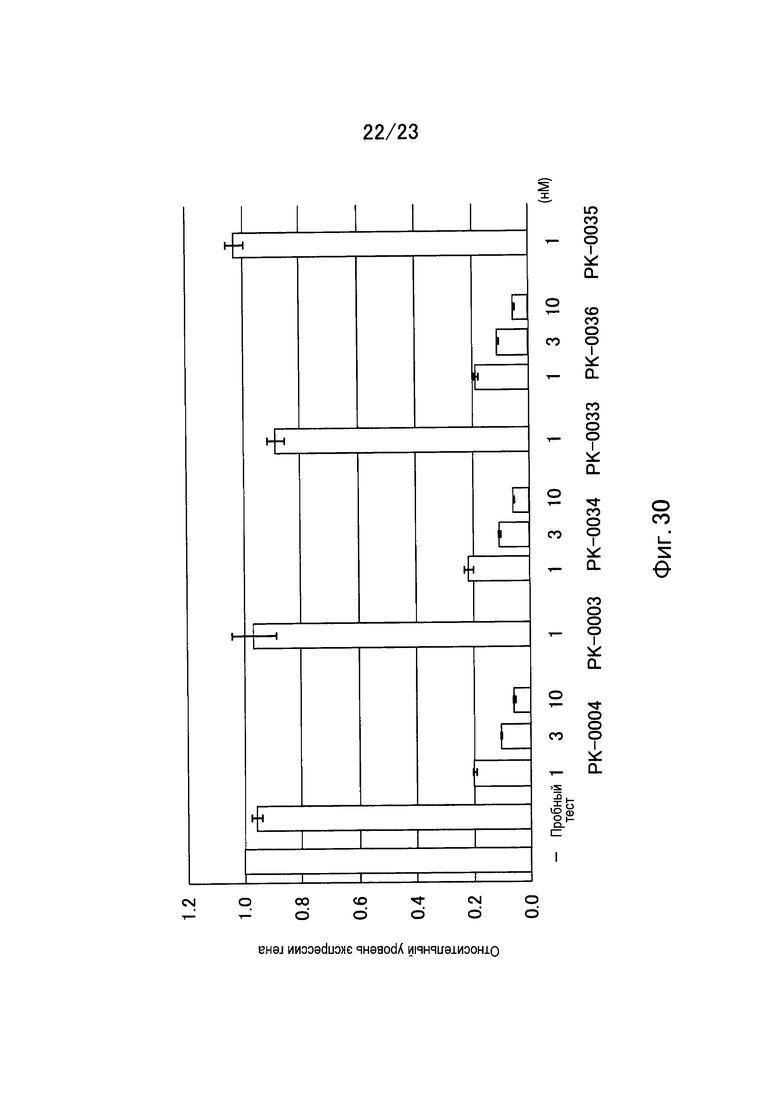
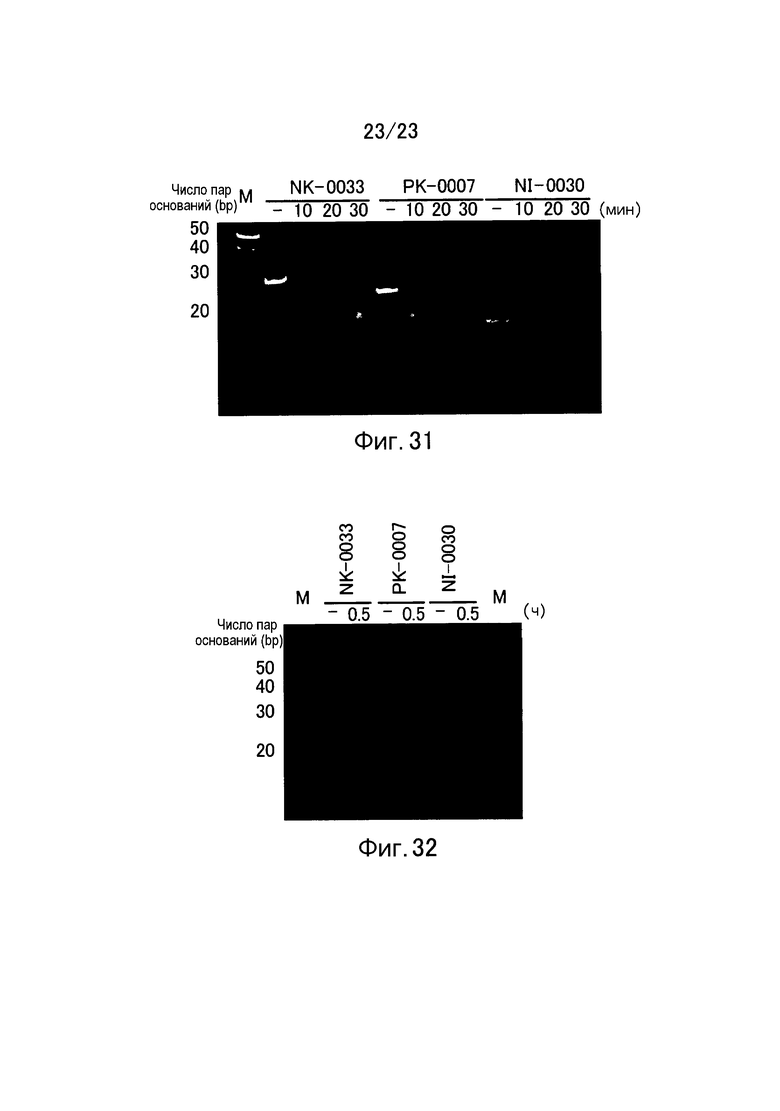
Настоящее изобретение относится к биохимии, в частности к одноцепочечной молекуле нуклеиновой кислоты, которая подавляет экспрессию целевого гена. Указанная молекула в порядке от 5’-конца к 3’-концу содержит 5’-концевой участок Xc, линкерный участок Lx, внутренний участок Z, линкерный участок Ly и 3’-концевой участок Yc. При этом внутренний участок Z состоит из внутреннего 5’-концевого участка X, который комплементарен 5’-концевому участку Xc, и внутреннего 3’-концевого участка Y, который комплементарен 3’-концевому участку Yc. При этом Z состоит из 19-30 оснований и содержит последовательность, подавляющую экспрессию целевого гена. Z-(Xc+Yc) от 0 до 4 оснований, Xc от 1 до 11 оснований и Yc от 1 до 11 оснований. Настоящее изобретение также раскрывает способ, применение и композицию для подавления экспрессии целевого гена, способ, применение и фармацевтическую композицию для лечения заболевания, вызванного повышением экспрессии целевого гена, использующие указанную выше молекулу нуклеиновой кислоты и применение такой молекулы для индукции РНК-интерференции. Настоящее изобретение позволяет использовать одноцепочечную молекулу нуклеиновой кислоты для лечения пациентов, поскольку таковая не вызывает побочный эффект в виде индукции интерферона. 8 н. и 24 з.п. ф-лы, 32 ил., 7 табл., 25 пр.
1. Одноцепочечная молекула нуклеиновой кислоты, подавляющая экспрессию целевого гена, содержащая:
последовательность, подавляющую экспрессию, которая подавляет экспрессию целевого гена, при этом
одноцепочечная молекула нуклеиновой кислоты содержит, в порядке от 5'-конца к 3'-концу: 5'-концевой участок (Хс); линкерный участок (Lx); внутренний участок (Z); линкерный участок (Ly) и 3'-концевой участок (Yc),
внутренний участок (Z) состоит из внутреннего 5'-концевого участка (X) и внутреннего 3'-концевого участка (Y), которые связаны друг с другом,
5'-концевой участок (Хс) является комплементарным внутреннему 5'-концевому участку (X),
3'-концевой участок (Yc) является комплементарным внутреннему 3'-концевому участку (Y), и
по меньшей мере один из внутреннего участка (Z), 5'-концевого участка (Хс) и 3'-концевого участка (Yc) содержит последовательность, подавляющую экспрессию,
где последовательность, подавляющая экспрессию, предпочтительно по меньшей мере на 90% комплементарна предварительно определенному участку целевого гена, и
где количество оснований (Z) во внутреннем участке (Z) составляет от 19 до 30,
где внутренний участок (Z) содержит последовательность, подавляющую экспрессию,
Z-(Хс+Yc)=0-4 оснований,
Хс=1-11 или Yc=1-11.
2. Одноцепочечная молекула нуклеиновой кислоты по п. 1, в которой количество оснований (Z) во внутреннем участке (Z), количество оснований (X) во внутреннем 5'-концевом участке (X), количество оснований (Y) во внутреннем 3'-концевом участке (Y), количество оснований (Хс) в 5'-концевом участке (Хс) и количество оснований (Yc) в 3'-концевом участок (Yc) соответствует условиям выражений (1) и (2):
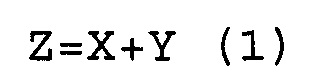
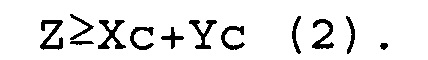
3. Одноцепочечная молекула нуклеиновой кислоты по п. 1 или 2, в которой количество оснований (X) во внутреннем 5'-концевом участке (X), количество оснований (Хс) в 5'-концевом участке (Хс), количество оснований (Y) во внутреннем 3'-концевом участке (Y) и количество оснований (Yc) в 3'-концевом участке (Yc) удовлетворяет любому из условий (а)-(d):
(a) соответствует условиям выражений (3) и (4):
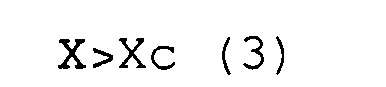
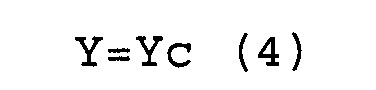
(b) соответствует условиям выражений (5) и (6):
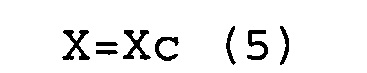
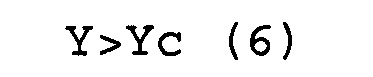
(c) соответствует условиям выражений (7) и (8):
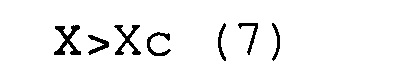
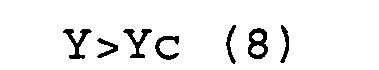
(d) соответствует условиям выражений (9) и (10).
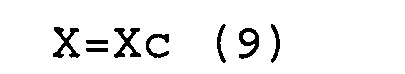
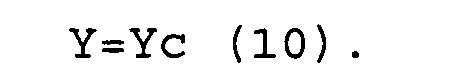
4. Одноцепочечная молекула нуклеиновой кислоты по п. 3, в которой при условиях (а)-(d) разница между количеством оснований (X) во внутреннем 5'-концевом участке (X) и количеством оснований (Хс) в 5'-концевом участке (Хс), и разница между количеством оснований (Y) во внутреннем 3'-концевом участке (Y) и количеством оснований (Yc) в 3'-концевом участке (Yc) удовлетворяет следующим условиям:
(a) соответствует условиям выражений (11) и (12):
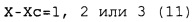
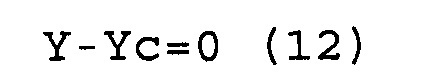
(b) соответствует условиям выражений (13) и (14):
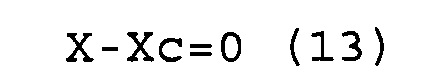
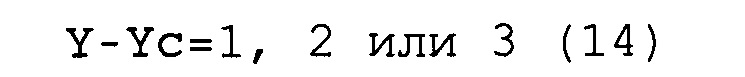
(c) соответствует условиям выражений (15) и (16):
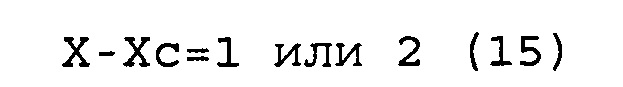
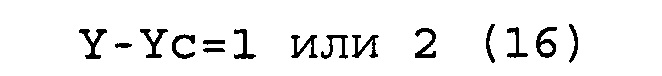
(d) соответствует условиям выражений (17) и (18):
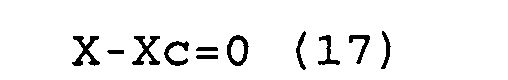
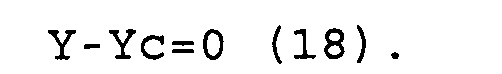
5. Одноцепочечная молекула нуклеиновой кислоты по п. 1, где
(1) 5'-конец и 3'-конец не связаны друг с другом;
(2) одноцепочечная молекула нуклеиновой кислоты представляет собой одноцепочечную молекулу РНК;
(3) Хс=1-7 или Yc=1-7;
и каждый Lx и Ly имеет такую структуру, что внутри этих участков не происходит самоотжига.
6. Одноцепочечная молекула нуклеиновой кислоты по п. 5, где Lx и Ly=3-50 оснований.
7. Одноцепочечная молекула нуклеиновой кислоты по п. 1 или 4, в которой количество оснований (Хс) в 5'-концевом участке (Хс) составляет от 1 до 11.
8. Одноцепочечная молекула нуклеиновой кислоты по п. 7, в которой количество оснований (Хс) в 5'-концевом участке (Хс) составляет от 1 до 7.
9. Одноцепочечная молекула нуклеиновой кислоты по п. 7, в которой количество оснований (Хс) в 5'-концевом участке (Хс) составляет от 1 до 3.
10. Одноцепочечная молекула нуклеиновой кислоты по любому из пп. 1, 4, 8 или 9, в которой количество оснований (Yc) в 3'-концевом участке (Yc) составляет от 1 до 11.
11. Одноцепочечная молекула нуклеиновой кислоты по п. 10, в которой количество оснований (Yc) в 3'-концевом участке (Yc) составляет от 1 до 7.
12. Одноцепочечная молекула нуклеиновой кислоты по п. 10, в которой количество оснований (Yc) в 3'-концевом участке (Yc) составляет от 1 до 3.
13. Одноцепочечная молекула нуклеиновой кислоты по любому из пп. 1, 4, 8, 9, 11 или 12, при этом одноцепочечная молекула нуклеиновой кислоты содержит по меньшей мере один модифицированный остаток.
14. Одноцепочечная молекула нуклеиновой кислоты по любому из пп. 1, 4, 8, 9, 11 или 12, дополнительно содержащая вещество-маркер.
15. Одноцепочечная молекула нуклеиновой кислоты по любому из пп. 1, 4, 8, 9, 11 или 12, дополнительно содержащая стабильный изотоп.
16. Одноцепочечная молекула нуклеиновой кислоты по любому из пп. 1, 4, 8, 9, 11 или 12, которая представляет собой молекулу РНК.
17. Одноцепочечная молекула нуклеиновой кислоты по любому из пп. 1, 4, 8, 9, 11 или 12, в которой линкерный участок (Lx) и/или линкерный участок (Ly) состоит по меньшей мере из одного нуклеотидного остатка и одного ненуклеотидного остатка.
18. Одноцепочечная молекула нуклеиновой кислоты по п. 17, в которой нуклеотидным остатком является немодифицированный нуклеотидный остаток и/или модифицированный нуклеотидный остаток.
19. Одноцепочечная молекула нуклеиновой кислоты по п. 17, в которой линкерный участок (Lx) и/или линкерный участок (Ly) состоит из любых остатков (1)-(7):
(1) из немодифицированного нуклеотидного остатка;
(2) из модифицированного нуклеотидного остатка;
(3) из немодифицированного нуклеотидного остатка и модифицированного нуклеотидного остатка;
(4) из ненуклеотидного остатка;
(5) из ненуклеотидного остатка и немодифицированного нуклеотидного остатка;
(6) из ненуклеотидного остатка и модифицированного нуклеотидного остатка;
(7) из ненуклеотидного остатка, немодифицированного нуклеотидного остатка и модифицированного нуклеотидного остатка.
20. Одноцепочечная молекула нуклеиновой кислоты по любому из пп. 1, 4, 8, 9, 11, 12, 18 или 19, при этом общее количество оснований в одноцепочечной молекуле нуклеиновой кислоты составляет 50 и более.
21. Одноцепочечная молекула нуклеиновой кислоты по любому из пп. 1, 4, 8, 9, 11, 12, 18 или 19, в которой экспрессия гена подавляется посредством РНК-интерференции.
22. Одноцепочечная молекула нуклеиновой кислоты по любому из пп. 1, 4, 8, 9, 11, 12, 18 или 19, при этом последовательность оснований в одноцепочечной молекуле нуклеиновой кислоты представляет собой любую из SEQ ID NO: 2, 7, 8, 13, 14, 29-35, 37, 43, 44, 47, 48 и 51-80.
23. Композиция для подавления экспрессии целевого гена, отличающаяся тем, что она содержит:
одноцепочечную молекулу нуклеиновой кислоты согласно любому из пп. 1-22 в эффективном количестве.
24. Фармацевтическая композиция для лечения заболевания, вызванного целевым геном, отличающаяся тем, что она содержит:
одноцепочечную молекулу нуклеиновой кислоты по любому из пп. 1-22 в эффективном количестве.
25. Фармацевтическая композиция по п. 24, предназначенная для применения в лечении воспаления.
26. Способ подавления экспрессии целевого гена, включающий этап введения одноцепочечной молекулы нуклеиновой кислоты по любому из пп. 1-22 в клетку, ткань или орган.
27. Способ по п. 26, в котором одноцепочечную молекулу нуклеиновой кислоты вводят in vivo или in vitro.
28. Способ по п. 26 или 27, в котором экспрессия гена подавляется посредством РНК-интерференции.
29. Способ лечения заболевания, вызванного геном, причем указанный способ содержит этап введения пациенту одноцепочечной молекулы нуклеиновой кислоты по любому из пп. 1-22,
при этом одноцепочечная молекула нуклеиновой кислоты в качестве последовательности, подавляющей экспрессию, содержит последовательность, которая подавляет экспрессию гена, вызывающего это заболевание.
30. Применение одноцепочечной молекулы нуклеиновой кислоты по любому из пп. 1-22 для подавления экспрессии целевого гена.
31. Применение одноцепочечной молекулы нуклеиновой кислоты по любому из пп. 1-22 для индукции РНК-интерференции.
32. Применение молекулы нуклеиновой кислоты для лечения заболевания, вызванного геном, при этом
молекулой нуклеиновой кислоты является одноцепочечная молекула нуклеиновой кислоты по любому из пп. 1-22, и
одноцепочечная молекула нуклеиновой кислоты в качестве последовательности, подавляющей экспрессию, содержит последовательность, которая подавляет экспрессию гена, вызывающего это заболевание.
| LEIRDAL M., et al., Gene silencing in mammalian cells by performed small RNAduplexes, Biochemical and biophysical research communication, 2001, No.295, pp.744-748 | |||
| JIA Y., et al., Characterization of the glyceraldehyde-3-phosphate dehydrogenase (GAPDH) gene from halotolerant alga Dunaliella salina and inhibition of its expression by RNAi, Curr Microbiol, 2009, 58, 426-431 | |||
| WO2007108621 A1, 27.09.2007 | |||
| РУСИН И.В., РНК-интерференция: микро-РНК как новые регуляторы работы генов и перспективные терапевтические мишени, Электронный сборник научных трудов "Здоровье и образование в XXI веке", 2009, No.6, том 11, с.268-269. |
Авторы
Даты
2017-08-15—Публикация
2011-07-08—Подача