Область, к которой относится изобретение
[0001]
Настоящее изобретение относится к производному нуклеиновой кислоты, обладающему иммуностимулирующей активностью. Более конкретно, оно относится к двухцепочечному олигонуклеотиду, где первая цепь представляет собой CpG олигонуклеотид, а вторая цепь связывается с липидом.
Предпосылки создания изобретения
[0002]
Вакцина, которая представляет собой лекарственное средство от инфекционного заболевания или рака, использует антиген-специфический иммунный ответ. Адъювант представляет собой соединение, обладающее иммуностимулирующей активностью, которое используют для повышения эффективности или долговечности вакцины, и были исследованы и разработаны различные типы адъювантов, такие как алюминиевая соль, эмульсия и липосома (Непатентный Документ 1 или т.п.).
[0003]
Одноцепочечный олигодезоксинуклеотид, включающий динуклеотидный мотив неметилированного цитозин-гуанина (5'-CpG-3') (ssCpG ODN), известен как один из адъювантов. ssCpG ODNs являются лигандами TLR9 (Toll-подобного рецептора 9) и чрезвычайно эффективными индукторами Th1 иммунного или опосредованного цитотоксическими T-лимфоцитами (CTL) ответов через TLR9 для стимуляции иммунной системы (Непатентный Документ 1). Однако существуют проблемы, связанные с in vivo стабильностью, токсичностью, фармакокинетикой или т.п. ssCpG ODNs при использовании отдельно. Способ, в котором ssCpG ODN инкапсулирован в наночастице, образованной из липидного бислоя (Непатентный Документ 2), способ, в котором липид связывается с 5' концом ssCpG ODN (Непатентный Документ 3 или Патентный документ 1) или т.п., известны как средство для решения этих проблем.
[0004]
Кроме того, известно, что характерные свойства адъюванта исчезали, когда ssCpG ODN вводили в виде двухцепочечной ДНК (dsCpG ODN) путем отжига первой цепи и второй цепи (Непатентный Документ 4). Непатентный Документ 5 раскрывает, что отдельно dsCpG ODN не проявлял иммуностимулирующую активность, но когда dsCpG ODN был инкапсулирован в липофектиновой частице, dsCpG ODN, включающий либо CpG мотив, либо GpC мотив, показал иммуностимулирующую активность.
Документ предшествующего уровня техники
Патентный документ
[0005]
Патент Документ 1: WO2013/151771
Непатентный документ
[0006]
Непатентный документ 1: Trends in immunology, 2009, 30(1), 23-32
Непатентный документ 2: Advanced Drug Delivery Review, 2009, 61(3), 233-242
Непатентный документ 3: Nature, 2014, 507, 519-522
Непатентный документ 4: Eur. J. Immunol., 2003, 33, 1382-1392
Непатентный документ 5: BMB reports, 2010, 43(3), 164-169
Сущность изобретения
Задачи, решаемые настоящим изобретением
[0007]
Целью настоящего изобретения является обеспечение новых производных нуклеиновой кислоты, обладающих иммуностимулирующей активностью, которые являются полезными в качестве адъюванта вакцины и/или вакцины как таковой.
Средства решения задачи
[0008]
Непатентные документы 4 и 5 раскрывают, что введение dsCpG ODN не показало иммуностимулирующую активность. Кроме того, Непатентный документ 5 раскрывает, что, когда dsCpG ODN был инкапсулирован в липофектиновой частице, dsCpG ODN, включающий либо CpG мотив (ODN4531), либо GpC мотив (ODN4531GC), индуцировал экспрессию IL-8 и HLR-DRA, а именно, способом, который является независимым от CG последовательности. На основании этого факта предполагают, что dsCpG ODN быстро расщеплялся в клетках по сравнению с ssCpG ODN, что причина, почему dsCpG ODN, инкапсулированный в липофектиной частице, показал иммуностимулирующую активность, состоит в том, что инкапсулирование dsCpG ODN может зищитить от быстрого расщепления (стр. 167, правая колонка, строки 10-16).
[0009]
Авторы настоящего изобретения глубоко исследовали синтез двухцепочечного олигонуклеотида (связывающийся с липидом двухцепочечный олигонуклеотид по настоящему изобретению), где первая цепь представляет собой CpG олигонуклеотид, а вторая цепь представляет собой олигонуклеотид, включающий последовательность, способную гибридизоваться с первой цепью, и связывается с липидом. Было обнаружено, что индубельность антиген-специфических CTL при использовании вакцины повышалась, и был показан противоопухолевый эффект путем введения связывающегося с липидом двухцепочечного олигонуклеотида по настоящему изобретению в качестве адъюванта с опухолевым антигенным пептидом (когда связывающийся с липидом двухцепочечный олигонуклеотид по настоящему изобретению используют в качестве адъюванта, его также называют ʺадъювантом по настоящему изобретениюʺ). Кроме того, было обнаружено, что имеется связывающийся с липидом двухцепочечный олигонуклеотид, представленный в настоящем изобретении, который показывает сильный противоопухолевый эффект как таковой, то есть который полезен в качестве противораковой вакцины (когда связывающийся с липидом двухцепочечный олигонуклеотид по настоящему изобретению используют в качестве вакцины, его также называют ʺвакциной по настоящему изобретениюʺ). То есть, связывающийся с липидом двухцепочечный олигонуклеотид по настоящему изобретению обладает иммуностимулирующей активностью. Кроме того, связывающиеся с липидами двухцепочечные олигонуклеотиды по настоящему изобретению имеют высокую метаболическую стабильность, водорастворимость и более низкую токсичность, что делает их достаточно безопасными в качестве лекарственного средства.
[0010]
Например, когда адъювант по настоящему изобретению, где вторая цепь представляет собой ДНК олигонуклеотид, олигонуклеотид, состоящий из нуклеозидных производных, содержащих OMe в 2' положении сахара, или олигонуклеотид, состоящий из нуклеозидных производных, содержащих F в 2' положении сахара, вводили с опухолевым антигенным пептидом, они показали повышенную CTL-индуцибельность или сильный противоопухолевый эффект по сравнению с ssCpG ODN (например, Результат 1-A, B, Результат 7-A, B и Результат 9-A, B в Примере 3). С другой стороны, связывающийся с липидом двухцепочечный олигонуклеотид, где вторая цепь представляет собой РНК олигонуклеотид (SEQ-40), не показал противоопухолевый эффект (Результат 7-B).
Когда адъювант по настоящему изобретению, где липид, включающий две из ацильных цепей, содержащих 14-24 атомов углерода, связывается на 3' или 5' конце второй цепи, вводили с опухолевым антигенным пептидом, это давало сильный противоопухолевый эффект по сравнению с ssCpG ODN (например, Результат 2-A, B в Примере 3). С другой стороны, когда двухцепочечный олигонуклеотид, где липид, включающий две ацильные цепи, содержащие 10 атомов углерода, связывается на 5' конце второй цепи (SEQ-12), вводили с опухолевым антигенным пептидом, это не давало повышенный противоопухолевый эффект по сравнению с ssCpG ODN. Кроме того, когда адъювант по настоящему изобретению, где липид, включающий две из ацильных цепей, содержащих 12-20 атомов углерода, связывается на 3' или 5' конце второй цепи и, кроме того, липид связывается на другом конце, вводили с опухолевым антигенным пептидом, это давало повышенную CTL-индуцибельность или сильный противоопухолевый эффект по сравнению с ssCpG ODN (например, Результат 3-A, B в Примере 3).
Когда адъювант по настоящему изобретению, где длина второй цепи составляет 50% - 100% от длины первой цепи (CpG олигонуклеотид), вводили с опухолевым антигенным пептидом, это давало повышенную CTL-индуцибельность или сильный противоопухолевый эффект по сравнению с ssCpG ODN (например, Результат 4-A, B, Результат 5-A, Результат 8-A, B и Результат 9-A, B в Примере 3).
Когда адъювант по настоящему изобретению, где липид связывается с второй цепью через олигонуклеотидный линкер (например, dGdG, dTdT и dAdA), вводили с опухолевым антигенным пептидом, это давало еще более высокую CTL-индуцибельность или более сильный противоопухолевый эффект по сравнению с адъювантом по настоящему изобретению без линкера (например, Результат 8-A, B в Примере 3).
[0011]
Кроме того, связывающиеся с липидами двухцепочечные олигонуклеотиды по настоящему изобретению не имеют системной токсичности, и это предполагает высокую безопасность (Пример 5).
[0012]
Кроме того, результат иммунизации адъювантом по настоящему изобретению и PCRV белком, происходящим из Pseudomonas aeruginosa, который вызывает инфекционное заболевание, также дал основание предположить иммуностимулирующую активность в качестве адъюванта вакцины против инфекционного заболевания (Пример 6).
[0013]
Когда адъювант по настоящему изобретению, где липид связывается с второй цепью через олигонуклеотидный линкер (dGdGdGdGdG) (SEQ-121), вводили отдельно, это давало сильный противоопухолевый эффект по сравнению с ssCpG ODN (Пример 4).
[0014]
Таким образом, настоящее изобретение относится к следующему.
(A1) Двухцепочечный олигонуклеотид, где
первая цепь представляет собой CpG олигонуклеотид, состоящий из 8-50 нуклеотидов,
вторая цепь представляет собой олигонуклеотид, состоящий из 8-60 нуклеотидов и включающий последовательность, способную гибридизоваться с первой цепью, но за исключением РНК олигонуклеотида,
длина второй цепи составляет 50% или больше от длины первой цепи, и
липид, включающий C12 - C30 углеводородную цепь(цепи), связывается с второй цепью через линкер или без линкера.
(A2) Двухцепочечный олигонуклеотид по пункту (A1), где олигонуклеотид второй цепи представляет собой олигонуклеотид, состоящий из ДНК нуклеозидов и/или нуклеозидных производных.
(A3) Двухцепочечный олигонуклеотид по пункту (A2), где нуклеозидное производное представляет собой нуклеозид, содержащий заместитель в 2' положении сахара, и/или нуклеозид, содержащий мостиковую структуру между 4' и 2' положениями сахара.
(A4) Двухцепочечный олигонуклеотид по пункту (A3), где мостиковая структура между 4' и 2' положениями сахара представляет собой 4'-(CH2)m-O-2', где m представляет собой целое число, имеющее значение 1-4.
(A5) Двухцепочечный олигонуклеотид по любому из пунктов (A1) - (A4), где липид представляет собой диацильный липид.
(A6) Двухцепочечный олигонуклеотид по пункту (A1) - (A5), где липид связывается на 3' конце и/или 5' конце второй цепи.
(A7) Двухцепочечный олигонуклеотид по любому из пунктов (A1) - (A6), где липид связывается через линкер.
(A8) Двухцепочечный олигонуклеотид по пункту (A7), где линкер представляет собой олигонуклеотидный линкер.
(A9) Двухцепочечный олигонуклеотид по пункту (A8), где линкер представляет собой -(dX1)u-, где X1 каждый независимо представляет собой A, G, C или T, и u представляет собой целое число, имеющее значение 1-8.
(A10) Двухцепочечный олигонуклеотид по пункту (A1), выбранный из группы, состоящей из SEQ-61, SEQ-119, SEQ-121, SEQ-170 и SEQ-192.
(A11) Двухцепочечный олигонуклеотид по пункту (A1), выбранный из группы, состоящей из SEQ-59, SEQ-166, SEQ-168, SEQ-216, SEQ-272, SEQ-280, SEQ-290, SEQ-294, SEQ-310, SEQ-373 и SEQ-384.
(A12) Фармацевтическая композиция, включающая двухцепочечный олигонуклеотид по любому из пунктов (A1) - (A11).
(A13) Фармацевтическая композиция по пункту (A12), дополнительно включающая антиген.
(A14) Способ для лечения или профилактики рака или инфекционного заболевания, включающий введение двухцепочечного олигонуклеотида по любому из пунктов (A1) - (A11).
(A15) Применение двухцепочечного олигонуклеотида по любому из пунктов (A1) - (A11) для получения средства для лечения или профилактики рака или инфекционного заболевания.
(A16) Двухцепочечный олигонуклеотид по любому из пунктов (A1) - (A11) для лечения или профилактики рака или инфекционного заболевания.
[0015]
(A17) Фармацевтическая композиция по пункту (A13), где антиген представляет собой микробный антиген, аутоантиген или вещество, вызывающее зависимость.
(A19) Фармацевтическая композиция по пункту (A17), где микробный антиген представляет собой бактериальный антиген, вирусный антиген или паразитарный антиген.
(A19) Фармацевтическая композиция по пункту (A17), где аутоантиген представляет собой опухолевый антиген, антиген, ассоциированный с болезнью Альцгеймера, антиген против человеческого антитела или антиген, который экспрессирован из элементов эндогенных ретровирусов человека.
(A20) Фармацевтическая композиция по пункту (A17), где вещество, вызывающее зависимость, представляет собой никотин или кокаин.
(A21) Способ усиления иммунного ответа у пациента, включающий введение пациенту эффективного количества фармацевтической композиции по любому из пунктов (A13), (A17) - (A20).
(A22) Способ по пункту (A21), где иммунный ответ представляет собой повышение индуцибельности специфических цитотоксических T-лимфоцитов по сравнению с контролем.
(A23) Способ по пункту (A21) или (A22), где пациент имеет рак или инфекционное заболевание.
[0016]
Кроме того, настоящее изобретение включает следующее.
(B1) Адъювант, состоящий из двухцепочечного олигонуклеотида, где
первая цепь представляет собой CpG олигонуклеотид, состоящий из 8-50 нуклеотидов,
вторая цепь представляет собой олигонуклеотид, состоящий из 8-60 нуклеотидов и включающий последовательность, способную гибридизоваться с первой цепью, и
липид связывается с второй цепью через линкер или без линкера.
(B2) Адъювант по пункту (B1), где олигонуклеотид второй цепи представляет собой олигонуклеотид, состоящий из ДНК нуклеозидов и/или нуклеозидных производных.
(B3) Адъювант по пункту (B2), где нуклеозидное производное представляет собой нуклеозид, содержащий заместитель в 2' положении сахара, и/или нуклеозид, содержащий мостиковую структуру между 4' и 2' положениями сахара.
(B4) Адъювант по пункту (B3), где заместитель представляет собой OCH3.
(B5) Адъювант по любому из пунктов (B1) - (B4), где липид представляет собой диацильный липид.
(B6) Адъювант по пункту (B5), где ацильная цепь диацильного липида содержит 14-30 атомов углерода.
(B7) Адъювант по пункту (B5) или (B6), где липид связывается на 5' конце второй цепи.
(B8) Адъювант по любому из пунктов (B1) - (B7), где длина второй цепи составляет 50% или больше от длины первой цепи.
(B9) Адъювант по любому из пунктов (B1) - (B8), где липид связывается через линкер.
(B10) Адъювант по пункту (B9), где линкер представляет собой олигонуклеотидный линкер.
(B11) Адъювант по пункту (B10), где линкер представляет собой dX1dX2, где Х1 или X2 представляет собой A, G, C или T.
(B12) Вакцинная композиция, включающая антиген и адъювант по любому из пунктов (B1) - (B11).
[0017]
(B13) Вакцинная композиция по пункту (B12), где антиген представляет собой микробный антиген, аутоантиген или вещество, вызывающее зависимость.
(B14) Вакцинная композиция по пункту (B13), где микробный антиген представляет собой бактериальный антиген, вирусный антиген или паразитарный антиген.
(B15) Вакцинная композиция по пункту (B13), где аутоантиген представляет собой опухолевый антиген, антиген, ассоциированный с болезнью Альцгеймера, антиген против человеческого антитела или антиген, который экспрессирован из элементов эндогенных ретровирусов человека.
(B16) Вакцинная композиция по пункту (B13), где вещество, вызывающее зависимость, представляет собой никотин или кокаин.
(B17) Способ усиления иммунного ответа у пациента, включающий введение пациенту эффективного количества вакцинной композиции по любому из пунктов (B12) - (B16).
(B18) Способ по пункту (B17), где иммунный ответ представляет собой повышение индуцибельности специфических цитотоксических T-лимфоцитов по сравнению с контролем.
(B19) Способ по пункту (B17) или (B18), где пациент имеет рак или инфекционное заболевание.
(B20) Способ лечения рака или инфекционного заболевания, включающий введение пациенту эффективного количества вакцинной композиции по любому из пунктов (B12) - (B15) для облегчения одного или нескольких симптомов рака или инфекционного заболевания по сравнению с контролем.
Эффект изобретения
[0018]
Связывающиеся с липидами двухцепочечные олигонуклеотиды по настоящему изобретению показывают превосходную иммуностимулирующую активность против антигена-мишени. Никакой системной токсичности не было обнаружено, и поэтому ожидают, что их можно использовать для лекарственного средства в качестве адъюванта вакцины и/или вакцины как таковой.
Краткое описание чертежей
[0019]
[Фиг. 1] Противоопухолевый эффект, когда ssCpG ODN (ODN1826, SEQ-1), dsCpG ODN (SEQ-4) или адъювант по настоящему изобретению (SEQ-16) вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 2] Противоопухолевый эффект, когда ssCpG ODN (ODN1826, SEQ-1) или адъювант по настоящему изобретению, содержащий липиды на обоих концах (SEQ-46 или SEQ-48), вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 3] Противоопухолевый эффект, когда ssCpG ODN (ODN1826, SEQ-1), ssCpG ODN, вводящий липидный лиганд (SEQ-2), или адъювант по настоящему изобретению, длина комплементарной цепи которого различается (SEQ-8 или SEQ-10), вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 4] Противоопухолевый эффект, когда ssCpG ODN (ODN1826, SEQ-1), ssCpG ODN, вводящий липидный лиганд (SEQ-2), адъювант по настоящему изобретению (SEQ-26) или Монтанид вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 5] Противоопухолевый эффект, когда ssCpG ODN (ODN1826, SEQ-1), ssCpG ODN, вводящий липидный лиганд (SEQ-2), или адъювант по настоящему изобретению (SEQ-38) вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 6] Противоопухолевый эффект, когда ssCpG ODN (ODN2006, SEQ-49), адъювант по настоящему изобретению, длина комплементарной цепи которого различается (SEQ-51 или SEQ-61), или адъювант по настоящему изобретению, содержащий линкер (SEQ-63 или SEQ-65), вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 7] Противоопухолевый эффект, когда ssCpG ODN (ODN2006, SEQ-49) или адъювант по настоящему изобретению, где мономер нуклеиновой кислоты комплементарной цепи представляет собой 2'-OMe-RNA (SEQ-67 или SEQ-69), вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 8] Противоопухолевый эффект, когда ssCpG ODN (ODN2006, SEQ-49) или адъювант по настоящему изобретению, содержащий олигонуклеотидный линкер (SEQ-119 или SEQ-192), вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 9] Противоопухолевый эффект, когда ssCpG ODN (ODN2006, SEQ-49) или адъювант по настоящему изобретению, содержащий олигонуклеотидный линкер (SEQ-121), вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 10] Противоопухолевый эффект, когда ssCpG ODN (ODN2006, SEQ-49) или адъювант по настоящему изобретению, содержащий олигонуклеотидный линкер (SEQ-152 или SEQ-158), вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 11] Противоопухолевый эффект, когда ssCpG ODN (ODN2006, SEQ-49) или адъювант по настоящему изобретению, где липид связывается на 3' конце и/или 5' конце (SEQ-188, SEQ-192 или SEQ-194), вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 12] Противоопухолевый эффект, когда ssCpG ODN (ODN2006, SEQ-49) или адъювант по настоящему изобретению, содержащий олигонуклеотидный линкер (SEQ-164), вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 13] Противоопухолевый эффект, когда ssCpG ODN (ODN2006, SEQ-49) или адъювант по настоящему изобретению, где липид связывается только на 3' конце (SEQ-170), вводили с опухолевым антигенным пептидом (TRP2 пептид).
[Фиг. 14] Противоопухолевый эффект ssCpG ODN (ODN2006, SEQ-49) или вакцины по настоящему изобретению (SEQ-121) в отсутствие опухолевого антигенного пептида.
[Фиг. 15] Титр антител после подкожного введения вакцины на основе PCRV антигена с ssCpG ODN (ODN2006, SEQ-49), адъювантом по настоящему изобретению (SEQ-61 или SEQ-121) или адъювантом Фрейнда.
Варианты осуществления изобретения
[0020]
Используемые термины, если не указано иное, используются в смысле, обычно используемом в данной области.
В настоящем изобретении можно использовать метод генетической манипуляции, который хорошо известен в данной области техники. Например, он представляет собой метод, описанный в Molecular Cloning, A Laboratory Manual, Forth Edition, Cold Spring Harbor Laboratory Press (2012) или Current Current Protocols Essential Laboratory Techniques, Current Protocols (2012).
[0021]
Термины, используемые в настоящем описании, объясняются ниже. Каждый термин, если не указано иное, имеет одинаковое значение при использовании отдельно или вместе с другими терминами.
[0022]
В настоящем описании ʺадъювантʺ означает соединение, обладающее иммуностимулирующей активностью, которое используют для повышения эффективности или устойчивости иммунного ответа на вакцинный антиген.
[0023]
ʺНуклеозидʺ означает соединение, в котором основание нуклеиновой кислоты и сахар связаны N-гликозидной связью.
ʺОлигонуклеотидʺ означает нуклеотиды, где несколько одинаковых или разных типов нуклеотидов связаны.
[0024]
Связь между сахаром и сахаром в олигонуклеотиде (межнуклеозидная связь) может представлять собой связь, содержащую природную нуклеиновую кислоту, фосфодиэфир (D-олиго), искусственно модифицированную связь или связь без атома фосфора. Можно использовать любую связь, которая хорошо известна в данной области. Примерами искусственно модифицированной связи являются фосфоротиоат (S-олиго), метилфосфонат (M-олиго) и боранофосфат. Кроме того, можно использовать связь, описанную в WO2013/022966, WO2011/005761, WO2014/012081, WO2015/125845 или т.п. Примером связи без атома фосфора является двухвалентный заместитель, происходящий из неароматического карбоциклила или т.п., замещенный алкилом, неароматическим карбоциклилом, галогеналкилом или галогеном. Примером является двухвалентный заместитель, происходящий из силоксана, сульфида, сульфоксида, сульфона, ацетила, ацетилформиата, ацетилтиоформиата, ацетилметиленформиата, ацетилтиоформиата, алкенила, сульфамата, метиленимино, метиленгидразино, сульфоната, сульфонамида, амида или т.п. В олигонуклеотиде связи могут быть одинаковыми или отличными друг от друга.
[0025]
В настоящем описании ʺДНК нуклеозидʺ или ʺРНК нуклеозидʺ означает природный ДНК нуклеозид или природный РНК нуклеозид и часть нуклеотида, которая представляет собой 1 звено для компонента олигонуклеотида. ʺПриродный ДНК нуклеозидʺ представлен ниже.

где BX1 представляет собой аденин, гуанин, цитозин или тимин.
ʺПриродный РНК нуклеозидʺ представлен ниже.
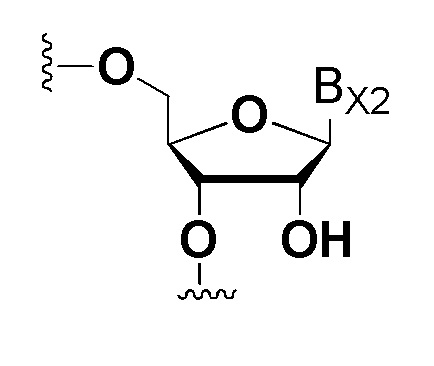
где BX2 представляет собой аденин, гуанин, цитозин или урацил.
[0026]
ʺДНК олигонуклеотидʺ означает олигонуклеотид, в котором несколько ДНК нуклеозидов являются связанными, и ʺРНК олигонуклеотидʺ означает олигонуклеотид, в котором несколько РНК нуклеозидов являются связанными.
[0027]
В настоящем описании ʺнуклеозидное производноеʺ означает нуклеозид, в котором нуклеиновое основание и/или сахарная часть ДНК нуклеозида или РНК нуклеозида были искусственно модифицированы. Можно использовать любую хорошо известную в данной области модификацию для нуклеозида.
[0028]
Примеры модификации для нуклеинового основания включают 5-метилцитозин, 5-гидроксиметилцитозин и 5-пропинилцитозин.
[0029]
Примером модификации для сахарной части является заместитель в 2' положении сахара. Примеры включают 2'-F, 2'-OCH3 (2'-OMe) и 2'-OCH2CH2OCH3 (2'-MOE).
Другим примером является следующая мостиковая структура между 4' и 2' положениями сахара.
4'-(CR1R2)m-O-2', 4'-(CR1R2)m-S-2', 4'-(CR1R2)m-O-C(=O)-2', 4'-(CR1R2)m-NR3-O-(CR1R2)m1-2', 4'-(CR1R2)m1-C(=O)-NR3-2', 4'-(CR1R2)m2-C(=O)-NR3-Y4-2', 4'-(CR1R2)m1-SO2-NR3-2', или
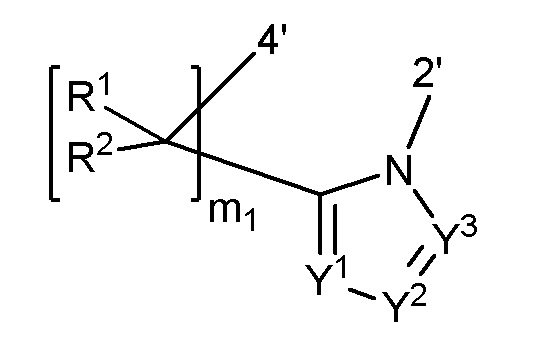
где
Y4 представляет собой O, S, NH или CH2,
R1 каждый независимо представляет собой атом водорода, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил или замещенный или незамещенный алкинил,
R2 каждый независимо представляет собой атом водорода, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил или замещенный или незамещенный алкинил,
R3 представляет собой атом водорода, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил или замещенный или незамещенный неароматический гетероциклилалкил,
Y1 представляет собой CR4 или N,
Y2 представляет собой CR5 или N,
Y3 представляет собой CR6 или N,
R4, R5 и R6 каждый независимо представляет собой атом водорода, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный амино, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилкарбониламино, замещенный или незамещенный алкенилкарбониламино, замещенный или незамещенный алкинилкарбониламино, замещенный или незамещенный алкилкарбамоил, замещенный или незамещенный алкенилкарбамоил, или замещенный или незамещенный алкинилкарбамоил,
m представляет собой целое число, имеющее значение 1-4,
m1 представляет собой целое число, имеющее значение 0-3, и
m2 имеет значение 0 или 1.
[0030]
R1 и R2 предпочтительно представляет собой атом водорода.
[0031]
R3 предпочтительно представляет собой атом водорода, алкил, алкенил, алкинил, ароматический карбоциклил, неароматический карбоциклил, ароматический гетероциклил, неароматический гетероциклил, ароматический карбоциклилалкил, неароматический карбоциклилалкил, ароматический гетероциклилалкил или неароматический гетероциклилалкил, и может содержать один или несколько заместителей, выбранных из Группы α.
Групп α: гидроксильная группа, алкил, алкилокси, меркапто, алкилтио, амино, алкиламино и галоген.
[0032]
Мостиковая структура предпочтительно представляет собой 4'-(CR1R2)m-O-2' или 4'-(CR1R2)m1-C(=O)-NR3-2' (AmNA, связанная мостиковой связью нуклеиновая кислота),
где
R1 каждый независимо представляет собой атом водорода, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, или замещенный или незамещенный алкинил,
R2 каждый независимо представляет собой атом водорода, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, или замещенный или незамещенный алкинил,
R3 представляет собой атом водорода, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, или замещенный или незамещенный алкинил,
m представляет собой целое число, имеющее значение 1-4, and
m1 представляет собой целое число, имеющее значение 0-2.
[0033]
Мостиковая структура более предпочтительно представляет собой 4'-(CH2)m-O-2', где m представляет собой целое число, имеющее значение 1-4, или 4'-C(=O)-NR3-2', где R3 представляет собой атом водорода или алкил.
4'-(CH2)m-O-2', где m представляет собой целое число, имеющее значение 1-4, более предпочтительно 4'-CH2-O-2' (LNA, закрытая нуклеиновая кислота). Примеры и способы получения описаны в WO98/39352, WO2003/068795, WO2005/021570 или т.п.
4'-C(=O)-NR3-2', где R3 представляет собой атом водорода или алкил, более предпочтительно 4'-C(=O)-NCH3-2'. Примеры и способы получения описаны в WO2011/052436.
[0034]
Примеры хорошо известной модификации нуклеотидов и способ модификации, используемый в данной области, описаны в следующих патентных документах.
WO98/39352, WO99/014226, WO2000/056748, WO2005/021570, WO2003/068795, WO2011/052436, WO2004/016749, WO2005/083124, WO2007/143315, WO2009/071680, WO2014/112463, WO2014/126229 и т.п.
[0035]
ʺГалогенʺ включает атом фтора, атом хлора, атом брома и атом иода. Атом фтора и атом хлора являются особенно предпочтительными.
[0036]
ʺАлкилʺ включает C1 - C15, предпочтительно 1 - C10, более предпочтительно C1 - C6, и еще более предпочтительно C1 - C4 линейную или разветвленную углеводородную группу. Примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, н-гептил, изогептил, н-октил, изооктил, н-нонил и н-децил.
Предпочтительным вариантом осуществления ʺалкилаʺ является метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил или н-пентил. Более предпочтительным вариантом осуществления является метил, этил, н-пропил, изопропил или трет-бутил.
[0037]
ʺАлкенил" включает C2 - C15, предпочтительно C2 - C10, более предпочтительно C2 - C6, и еще более предпочтительно C2 - C4 линейную или разветвленную углеводородную группу, содержащую одну или несколько двойных связей в любом положении(положениях). Примеры включают винил, аллил, пропенил, изопропенил, бутенил, изобутенил, пренил, бутадиенил, пентенил, изопентенил, пентадиенил, гексенил, изогексенил, гексадиенил, гептенил, октенил, ноненил, деценил, ундеценил, додеценил, тридеценил, тетрадеценил и пентадеценил.
Предпочтительным вариантом осуществления ʺалкенилаʺ является винил, аллил, пропенил, изопропенил или бутенил.
[0038]
ʺАлкинилʺ включает C2 - C10, предпочтительно C2 - C8, более предпочтительно C2 - C6 и еще более предпочтительно C2 - C4 линейную или разветвленную углеводородную группу, содержащую одну или несколько тройных связей в любом положении(положениях). Примеры включают этинил, пропинил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил и децинил. Кроме того, она может содержать двойную связь(связи) в любом положении(положениях).
Предпочтительным вариантом осуществления ʺалкинилаʺ является этинил, пропинил, бутинил или пентинил.
[0039]
ʺАроматический карбоциклилʺ означает циклическую ароматическую углеводородную группу, которая является моноциклической или полициклической, содержащей два или более колец. Примеры включают фенил, нафтил, антрил и фенантрил.
Предпочтительным вариантом осуществления ʺароматического карбоциклилаʺ является фенил.
[0040]
ʺНеароматический карбоциклилʺ означает циклическую насыщенную углеводородную группу или циклическую ненасыщенную неароматическую углеводородную группу, которая является моноциклической или полициклической, содержащей два или более колец. Примеры неароматический карбоциклил, который является полициклическим, содержащим два или более колец, включают конденсированную кольцевую группу, где неароматический карбоциклил, который является моноциклическим или полициклическим, содержащим два или более колец, является конденсированным с кольцом указанного выше ʺароматического карбоциклилаʺ.
Кроме того, примеры ʺнеароматического карбоциклилаʺ также включают группу, содержащую мостик, и группу для образования спиро кольца, как показано ниже:
Неароматический карбоциклил, который является моноциклическим, предпочтительно представляет собой C3 - C16, более предпочтительно C3 - C12 и еще более предпочтительно C4 - C8 карбоциклил. Примеры включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил и циклогексадиенил.
Примеры неароматического карбоциклила, который является полициклическим, содержащим два или более колец, включают инданил, инденил, аценафтил, тетрагидронафтил и флуоренил.
[0041]
ʺАроматический гетероциклилʺ означает ароматический циклил, который является моноциклическим или полициклическим, содержащим два или более колец, содержащим один или несколько гетероатомов, выбранных независимо из O, S и N.
Примеры ароматического гетероциклила, который является полициклическим, содержащим два или более колец, включают конденсированную кольцевую группу, где ароматический гетероциклил, который является моноциклическим или полициклическим, содержащим два или более колец, является конденсированным с кольцом указанного выше ʺароматического карбоциклилаʺ и/или ʺнеароматического карбоциклилаʺ.
Ароматический гетероциклил, который является моноциклическим, предпочтительно представляет собой 5-8-членное, и более предпочтительно 5-6-членное кольцо. Примеры включают пирролил, имидазолил, пиразолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазолил, триазинил, тетразолил, фурил, тиенил, изоксазолил, оксазолил, оксадиазолил, изотиазолил, тиазолил и тиадиазолил.
Примеры ароматического гетероциклила, который является бициклическим, включают индолил, изоиндолил, индазолил, индолизинил, хинолинил, изохинолинил, циннолинил, фталазинил, хиназолинил, нафтиридинил, хиноксалинил, пуринил, птеридинил, бензимидазолил, бензизоксазолил, бензоксазолил, бензоксадиазолил, бензизотиазолил, бензотиазолил, бензотиадиазолил, бензофурил, изобензофурил, бензотиенил, бензотриазолил, имидазопиридил, триазолoпиридил, имидазотиазолил, пиразинoпиридазинил, оксазолoпиридил и тиазолoпиридил.
Примеры ароматического гетероциклила, который является полициклическим, содержащим три или более колец, включают карбазолил, акридинил, ксантенил, фенотиазинил, феноксатиинил, феноксазинил и дибензофурил.
[0042]
ʺНеароматический гетероциклилʺ означает неароматический циклил, который является моноциклическим или полициклическим, содержащим два или более колец, содержащим один или несколько гетероатомов, выбранных независимо из O, S и N.
Примеры неароматического гетероциклила, который является полициклическим, содержащим два или более колец, включают конденсированную кольцевую группу, где неароматический гетероцикл, который является моноциклическим или полициклическим, содержащим два или более колец, является конденсированным с кольцом ʺароматического карбоциклилаʺ, ʺнеароматического карбоциклилаʺ и/или ʺароматического гетероциклилаʺ.
Кроме того, примеры ʺнеароматического гетероциклилаʺ также включают группу, содержащую мостик, и группу для образования спиро кольца, как показано ниже:
Неароматический гетероциклил, который является моноциклическим, предпочтительно представляет собой 3-8-членное, и более предпочтительно 5-6-членное кольцо. Примеры включают диоксанил, тииранил, оксиранил, оксетанил, оксатиоланил, азетидинил, тианил, тиазолидинил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперидил, пиперазинил, морфолинил, морфолино, тиоморфолинил, тиоморфолинo, дигидропиридил, тетрагидропиридил, тетрагидрофурил, тетрагидропиранил, дигидротиазолил, тетрагидротиазолил, тетрагидроизотиазолил, дигидрооксазинил, гексагидроазепинил, тетрагидродиазепинил, тетрагидропиридазинил, гексагидропиримидинил, диоксоланил, диоксазинил, азиридинил, диоксолинил, оксепанил, тиоланил, тиинил и тиазинил.
Примеры неароматического гетероциклила, который является полициклическим, содержащим два или более колец, включают индолинил, изоиндолинил, хроманил и изохроманил.
[0043]
ʺАлкилоксиʺ означает группу, где ʺалкилʺ связывается с атомом кислорода. Примеры включают метилокси, этилокси, н-пропилокси, изопропилокси, н-бутилокси, трет-бутилокси, изобутилокси, втор-бутилокси, пентилокси, изопентилокси и гексилокси.
Предпочтительным вариантом осуществления ʺалкилоксиʺ является метилокси, этилокси, н-пропилокси, изопропилокси или трет-бутилокси.
[0044]
ʺГалогеналкилʺ означает группу, где один или несколько ʺгалогеновʺ связываются с ʺалкиломʺ. Примеры включают монофторметил, монофторэтил, монофторпропил, 2,2,3,3,3-пентафторпропил, монохлорметил, трифторметил, трихлорметил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил, 1,2-дибромэтил и 1,1,1-трифторпропан-2-ил.
Предпочтительным вариантом осуществления ʺгалогеналкилаʺ является трифторметил или трихлорметил.
[0045]
ʺАлкилтиоʺ означает группу, где ʺалкилʺ связывается с атомом серы.
[0046]
ʺАлкиламиноʺ включает моноалкиламино и диалкиламино.
ʺМоноалкиламиноʺ означает группу, где атом водорода, связанный с атомом азота амино группы, замещен ʺалкиломʺ. Примеры включают метиламино, этиламино и изопропиламино. Предпочтительным является метиламино или этиламино.
ʺДиалкиламиноʺ означает группу, где два атома водорода, связанные с атомом азота амино группы, замещены двумя ʺалкиламиʺ. Эти две алкильные группы могут быть одинаковыми или отличными друг от друга. Примеры включают диметиламино, диэтиламино, N, N-диизопропиламино, N-метил-N-этиламино и N-изопропил-N-этиламино. Предпочтительным является диметиламино или диэтиламино.
[0047]
ʺАлкилкарбониламиноʺ означает группу, где один или два атома водорода, связанные с атомом азота амино группы, замещены одной или двумя алкилкарбонильными группами. Эти две алкилкарбонильные группы могут быть одинаковыми или отличными друг от друга. Примеры включают метилкарбониламино, этилкарбониламино, пропилкарбониламино, изопропилкарбониламино, трет-бутилкарбониламино, изобутилкарбониламино, втор-бутилкарбониламино, диметилкарбониламино, диэтилкарбониламино и N, N-диизопропилкарбониламино.
Предпочтительным вариантом осуществления ʺалкилкарбониламиноʺ является метилкарбониламино и этилкарбониламино.
[0048]
ʺАлкенилкарбониламиноʺ означает группу, где один или два атома водорода, связанные с атомом азота амино группы, замещены одной или двумя алкенилкарбонильными группами. Эти две алкенилкарбонильные группы могут быть одинаковыми или отличными друг от друга. Примеры включают винилкарбониламино и пропенилкарбониламино.
[0049]
ʺАлкинилкарбониламиноʺ означает группу, где один или два атома водорода, связанные с атомом азота амино группы, замещены одной или двумя алкинилкарбонильными группами. Эти две алкинилкарбонильные группы могут быть одинаковыми или отличными друг от друга. Примеры включают этинилкарбониламино и пропинилкарбониламино.
[0050]
ʺАлкилкарбамоилʺ означает группу, где один или два атома водорода, связанные с атомом азота карбамоильной группы, замещены одним или двумя ʺалкиламиʺ. Эти две алкильные группы могут быть одинаковыми или отличными друг от друга. Примеры включают метилкарбамоил, этилкарбамоил, диметилкарбамоил и диэтилкарбамоил.
[0051]
ʺАлкенилкарбамоилʺ означает группу, где один или два атома водорода, связанные с атомом азота карбамоильной группы, замещены одним или двумя ʺалкенильными группамиʺ. Эти две алкенильные группы могут быть одинаковыми или отличными друг от друга. Примеры включают винилкарбамоил и пропенилкарбамоил.
[0052]
ʺАлкинилкарбамоилʺ означает группу, где один или два атома водорода, связанные с атомом азота карбамоильной группы, замещены одним или двумя ʺалкинильными группамиʺ. Эти две алкинильные группы могут быть одинаковыми или отличными друг от друга. Примеры включают этинилкарбамоил и пропинилкарбамоил.
[0053]
Алкильная часть ʺароматического карбоциклилалкилаʺ, ʺнеароматического карбоциклилалкилаʺ, ʺароматического гетероциклилалкилаʺ или ʺнеароматического гетероциклилалкилаʺ является такой же, как ʺалкилʺ.
[0054]
ʺАроматический карбоциклилалкилʺ означает алкил, замещенный одним или несколькими ʺароматическиими карбоциклиламиʺ. Примеры включают бензил, фенетил, фенилпропил, бензгидрил, тритил, нафтилметил и группу формулы
 .
.
Предпочтительным вариантом осуществления ʺароматического карбоциклилалкилаʺ является бензил, фенетил или бензгидрил.
[0055]
ʺНеароматический карбоциклилалкилʺ означает алкил, замещенный одним или несколькими ʺнеароматическими карбоциклиламиʺ. ʺНеароматический карбоциклилалкилʺ также включает ʺнеароматический карбоциклилалкилʺ, где алкильная часть замещена ʺароматическим карбоциклиломʺ. Примеры включают циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил и группу формулы
 .
.
[0056]
ʺАроматический гетероциклилалкилʺ означает алкил, замещенный одним или несколькими ʺароматическими гетероциклиламиʺ. ʺАроматический гетероциклилалкилʺ также включает ʺароматический гетероциклилалкилʺ, где алкильная часть замещена указанным выше ʺароматическим карбоциклиломʺ и/или ʺнеароматическим карбоциклиломʺ. Примеры включают пиридилметил, фуранилметил, имидазолилметил, индолилметил, бензотиофенилметил, оксазолилметил, изоксазолилметил, тиазолилметил, изотиазолилметил, пиразолилметил, изопиразолилметил, пирролидинилметил, бензоксазолилметил и группы формулы
 .
.
[0057]
ʺНеароматический гетероциклилалкилʺ означает алкил, замещенный одним или несколькими ʺнеароматическиими гетероциклиламиʺ. ʺНеароматический гетероциклилалкилʺ также включает ʺнеароматический гетероциклилалкилʺ, где алкильная часть замещена ʺароматическим карбоциклиломʺ, ʺнеароматическим карбоциклиломʺ и/или ʺароматическим гетероциклиломʺ. Примеры включают тетрагидропиранилметил, морфолинилэтил, пиперидинилметил, пиперазинилметил и группы формулы
 .
.
[0058]
Примеры заместителей для ʺзамещенного или незамещенного алкилаʺ, ʺзамещенного или незамещенного алкенилаʺ, ʺзамещенного или незамещенного алкинилаʺ, ʺзамещенного или незамещенного алкилоксиʺ, ʺзамещенного или незамещенного алкилкарбониламиноʺ, ʺзамещенного или незамещенного алкенилкарбониламиноʺ, ʺзамещенного или незамещенного алкинилкарбониламиноʺ, ʺзамещенного или незамещенного алкилкарбамоилаʺ, ʺзамещенного или незамещенного алкенилкарбамоилаʺ или ʺзамещенного или незамещенного алкинилкарбамоилаʺ включают следующие заместители. Атом углерода в любом положении(положениях) может быть связан с одной или несколькими группами, выбранными из следующих заместителей.
Заместитель: галоген, гидрокси, карбокси, амино, имино, гидроксиамино, гидроксиимино, формил, формилокси, карбамоил, сульфамоил, сульфанил, сульфино, сульфо, тиоформил, тиокарбокси, дитиокарбокси, тиокарбамоил, циано, нитро, нитрозо, азид, гидразино, уреидо, амидино, гуанидино, триалкилсилил, алкилокси, алкенилокси, алкинилокси, галогеналкилокси, алкилкарбонил, алкенилкарбонил, алкинилкарбонил, моноалкиламино, диалкиламино, алкилсульфонил, алкенилсульфонил, алкинилсульфонил, моноалкилкарбониламино, диалкилкарбониламино, моноалкилсульфониламино, диалкилсульфониламино, алкилимино, алкенилимино, алкинилимино, алкилкарбонилимино, алкенилкарбонилимино, алкинилкарбонилимино, алкилоксиимино, алкенилоксиимино, алкинилоксиимино, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилоксикарбонил, алкенилоксикарбонил, алкинилоксикарбонил, алкилсульфанил, алкенилсульфанил, алкинилсульфанил, алкилсульфинил, алкенилсульфинил, алкинилсульфинил, моноалкилкарбамоил, диалкилкарбамоил, моноалкилсульфамоил, диалкилсульфамоил, ароматический карбоциклил, неароматический карбоциклил, ароматический гетероциклил, неароматический гетероциклил, ароматический карбоциклилокси, неароматический карбоциклилокси, ароматический гетероциклилокси, неароматический гетероциклилокси, ароматический карбоциклилкарбонил, неароматический карбоциклилкарбонил, ароматический гетероциклилкарбонил, неароматический гетероциклилкарбонил, ароматический карбоциклилоксикарбонил, неароматический карбоциклилоксикарбонил, ароматический гетероциклилоксикарбонил, неароматический гетероциклилоксикарбонил, ароматический карбоциклилалкилокси, неароматический карбоциклилалкилокси, ароматический гетероциклилалкилокси, неароматический гетероциклилалкилокси, ароматический карбоциклилалкилоксикарбонил, неароматический карбоциклилалкилоксикарбонил, ароматический гетероциклилалкилоксикарбонил, неароматический гетероциклилалкилоксикарбонил, ароматический карбоциклилалкиламино, неароматический карбоциклилалкиламино, ароматический гетероциклилалкиламино, неароматический гетероциклилалкиламино, ароматический карбоциклилсульфанил, неароматический карбоциклилсульфанил, ароматический гетероциклилсульфанил, неароматический гетероциклилсульфанил, неароматический карбоциклилсульфонил, ароматический карбоциклилсульфонил, ароматический гетероциклилсульфонил и неароматический гетероциклилсульфонил.
[0059]
Примеры заместителей на кольце ʺароматического карбоциклилаʺ, ʺнеароматического карбоциклилаʺ, ʺароматического гетероциклилаʺ или ʺнеароматического гетероциклилаʺ из ʺзамещенного или незамещенного ароматического карбоциклилаʺ, ʺзамещенного или незамещенного неароматического карбоциклилаʺ, ʺзамещенного или незамещенного ароматического гетероциклилаʺ и ʺзамещенного или незамещенного неароматического гетероциклилаʺ включают следующие заместители. Атом в любом положении(положениях) на кольце может быть связан с одной или несколькими группами, выбранными из следующих заместителей.
Заместитель: галоген, гидрокси, карбокси, амино, имино, гидроксиамино, гидроксиимино, формил, формилокси, карбамоил, сульфамоил, сульфанил, сульфино, сульфо, тиоформил, тиокарбокси, дитиокарбокси, тиокарбамоил, циано, нитро, нитрозо, азид, гидразино, уреидо, амидино, гуанидино, триалкилсилил, алкил, алкенил, алкинил, галогеналкил, алкилокси, алкенилокси, алкинилокси, галогеналкилокси, алкилоксиалкил, алкилоксиалкилокси, алкилкарбонил, алкенилкарбонил, алкинилкарбонил, моноалкиламино, диалкиламино, алкилсульфонил, алкенилсульфонил, алкинилсульфонил, моноалкилкарбониламино, диалкилкарбониламино, моноалкилсульфониламино, диалкилсульфониламино, алкилимино, алкенилимино, алкинилимино, алкилкарбонилимино, алкенилкарбонилимино, алкинилкарбонилимино, алкилоксиимино, алкенилоксиимино, алкинилоксиимино, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилоксикарбонил, алкенилоксикарбонил, алкинилоксикарбонил, алкилсульфанил, алкенилсульфанил, алкинилсульфанил, алкилсульфинил, алкенилсульфинил, алкинилсульфинил, моноалкилкарбамоил, диалкилкарбамоил, моноалкилсульфамоил, диалкилсульфамоил, ароматический карбоциклил, неароматический карбоциклил, ароматический гетероциклил, неароматический гетероциклил, ароматический карбоциклилокси, неароматический карбоциклилокси, ароматический гетероциклилокси, неароматический гетероциклилокси, ароматический карбоциклилкарбонил, неароматический карбоциклилкарбонил, ароматический гетероциклилкарбонил, неароматический гетероциклилкарбонил, ароматический карбоциклилоксикарбонил, неароматический карбоциклилоксикарбонил, ароматический гетероциклилоксикарбонил, неароматический гетероциклилоксикарбонил, ароматический карбоциклилалкил, неароматический карбоциклилалкил, ароматический гетероциклилалкил, неароматический гетероциклилалкил, ароматический карбоциклилалкилокси, неароматический карбоциклилалкилокси, ароматический гетероциклилалкилокси, неароматический гетероциклилалкилокси, ароматический карбоциклилалкилоксикарбонил, неароматический карбоциклилалкилоксикарбонил, ароматический гетероциклилалкилоксикарбонил, неароматический гетероциклилалкилоксикарбонил, ароматический карбоциклилалкилоксиалкил, неароматический карбоциклилалкилоксиалкил, ароматический гетероциклилалкилоксиалкил, неароматический гетероциклилалкилоксиалкил, ароматический карбоциклилалкиламино, неароматический карбоциклилалкиламино, ароматический гетероциклилалкиламино, неароматический гетероциклилалкиламино, ароматический карбоциклилсульфанил, неароматический карбоциклилсульфанил, ароматический гетероциклилсульфанил, неароматический гетероциклилсульфанил, неароматический карбоциклилсульфонил, ароматический карбоциклилсульфонил, ароматический гетероциклилсульфонил и неароматический гетероциклилсульфонил.
[0060]
Кроме того, ʺзамещенный или незамещенный неароматический карбоциклилʺ и ʺзамещенный или незамещенный неароматический гетероциклилʺ могут быть замещены ʺоксоʺ группой. В этом случае, это означает группу, где два атома водорода на атоме углерода замещены, как показано ниже.
[0061]
Далее настоящее изобретение объясняется подробно.
Связывающийся с липидом двухцепочечный олигонуклеотид по настоящему изобретению состоит из двухцепочечного олигонуклеотида, где
первая цепь представляет собой CpG олигонуклеотид, состоящий из 8-50 нуклеотидов,
вторая цепь представляет собой олигонуклеотид, состоящий из 8-60 нуклеотидов и включающий последовательность, способную гибридизоваться с первой цепью, и
липид связывается с второй цепью через линкер или без линкера.
Более предпочтительно, он представляет собой двухцепочечный олигонуклеотид, где
первая цепь представляет собой CpG олигонуклеотид, состоящий из 8-50 нуклеотидов,
вторая цепь представляет собой олигонуклеотид, состоящий из 8-60 нуклеотидов и включающий последовательность, способную гибридизоваться с первой цепью, но за исключением РНК олигонуклеотида,
длина второй цепи составляет 50% или больше от длины первой цепи, и
липид, включающий C12 - C30 углеводородную цепь(цепи) связывается с второй цепью через линкер или без линкера.
[0062]
Первая цепь связывающегося с липидом двухцепочечного олигонуклеотида по настоящему изобретению представляет собой CpG олигонуклеотид, состоящий из 8-50 нуклеотидов.
[0063]
ʺCpG олигонуклеотид (CpG ODN)ʺ означает одноцепочечный олигонуклеотид, включающий динуклеотид неметилированного цитозин-гуанин (5'-CpG-3') мотива (CpG мотив), и хорошо известно, что он может быть полезным в качестве адъюванта вакцины, поскольку он индуцирует приобретенный иммунный ответ через TLR9 (Nat Rev Drug Discov, 2006, 5, 471-484, Expert Rev Vaccines., 2011, 10(4), 499-511). CpG олигонуклеотид, используемый для настоящего изобретения, включает по меньшей мере один CpG мотив и может включать несколько CpG мотивов.
[0064]
Длина CpG олигонуклеотида, используемого для настоящего изобретения, составляет 8-50 нуклеотидов. Например, она составляет 8-50 нуклеотидов, 8-40 нуклеотидов, 8-30 нуклеотидов, 10-25 нуклеотидов, 15-25 нуклеотидов или 18-25 нуклеотидов.
[0065]
Что касается ʺCpG олигонуклеотидаʺ, он не ограничивается специально CpG олигонуклеотидом, который хорошо известен как обладающий иммуностимулирующей активностью, и может использоваться в данной области. Например, CpG олигонуклеотид или способ получения описаны в WO2006/065751, WO2007/092315, WO2008/068638, WO2010/067262, WO2010/125480, WO2014/047588, WO2014/134698, WO2015/041318, US2011/0300163 или т.п. Эти CpG олигонуклеотиды можно синтезировать, следуя способам, описанным в вышеприведенных документах.
CpG олигонуклеотиды классифицированы на основании последовательности, вторичной структуры и эффекта на мононуклеарные клетки периферической крови человека (PBMC) на класс A, класс B, класс C, класс P или класс S (Advanced drug delivery reviews, 2009, 61(3),195-204).
Класс A: ODN1585, ODN2216, ODN2336 или т.п.;
Класс B: ODNBW006, ODN D-SL01, ODN1668 (WO2005/063264), ODN1826 (WO2007/030580), ODN2006 (CpG7909, PF-3512676) (WO98/18810), ODN2007, ODN684 или т.п.; и
Класс C: ODN D-SL03, ODN 2395, ODN M362 или т.п. Их можно приобрести у InvivoGen в виде реагента для анализов. Кроме того,
CpG-28 (WO2000/056342),
CpG-685(GNKG-168) (Blood, 2010, 115(24), 5041),
CpG-ODN C274 (PLoS ONE, 2013, 8(4), e62373),
KSK-13 (KSK-CpG) (US7408050),
CpG ODN 10104 (CpG-10104) (Drug Data Rep, 2006, 28(3), 258),
CpG ODN-1585 (WO2001/022990),
ODN-5890 (WO2006/080946),
1018-ISS (WO2008/073661),
EMD-1201081 (HYB-2055, IMO-2055) (WO2005/009355),
D35-CpG, K3-CpG (GeneDesign, Inc.),
или т.п. Для настоящего изобретения можно использовать CpG олигонуклеотиды любого класса. CpG олигонуклеотиды класса A (например, ODN2216, ODN2336 и D35-CpG), CpG олигонуклеотиды класса B (например, ODN1826, ODN2006, CpG-28, 1018-ISS, IMO2055, K3-CpG, ODN684 и D-LS01) или CpG олигонуклеотиды класса C (например, D-LS03, ODN2395 и ODN M362) являются предпочтительными. Особенно предпочтительным является ODN1826 или ODN2006.
[0066]
Вторая цепь связывающегося с липидом двухцепочечного олигонуклеотида по настоящему изобретению представляет собой олигонуклеотид, состоящий из 8-60 нуклеотидов и включающий последовательность, способную гибридизоваться с CpG олигонуклеотидом, который представляет собой первую цепь, но за исключением РНК олигонуклеотида,
[0067]
Предпочтительно, вторая цепь представляет собой олигонуклеотид, состоящий из 8-60 нуклеотидов и включающий последовательность, способную гибридизоваться с CpG олигонуклеотидом, который представляет собой первую цепь, в жестких условиях.
Любой олигонуклеотид можно использовать для второй цепи при условии, что он может гибридизоваться с CpG олигонуклеотидом в жестких условиях, и в качестве примера можно привести такой, который включает 1 или несколько ошибочных спариваний оснований в части гибридизации.
Например, это олигонуклеотид, в котором часть для гибридизации имеет по меньшей мере 70% или больше, предпочтительно 80% или больше, более предпочтительно 90% или больше, и наиболее предпочтительно 95% или больше гомологии с комплементарной последовательностью CpG олигонуклеотида первой цепи.
Гомология показывает сходство как оценку, например, при помощи BLAST, поисковой программы с использованием алгоритма, открытого Altschul et al. (Journal of Molecular Biology, 215, 403-410 (1990).)
[0068]
ʺЖесткие условияʺ означают условия, при которых последовательность оснований образует гибрид (так называемый специфический гибрид) с определенной последовательностью, но любая последовательность оснований без эквивалентной функции не образует гибрид (так называемый неспецифический гибрид) со специфическими последовательностями. Специалисты в данной области могут легко выбирать условия путем изменения температуры в процессе реакции гибридизации или промывки, концентрации соли в гибридизационном или промывочном буфере или т.п. В частности, пример жестких условий в соответствии снастоящим изобретением включает, но не ограничивается этим, условия, когда олигонуклеотид гибридизуют в 6 × SSC (0,9 М NaCl, 0,09 М тринатрийцитрат) или 6 × SSPE (3 М NaCl, 0,2 M NaH2PO4, 20 мМ EDTA・2Na, pH 7,4) при 42°C и промывают при помощи 0,5 × SSC при 42°C. В качестве способа гибридизации можно использовать методы, хорошо известные в данной области, например, сазерн-блот гибридизацию или т.п. В частности, это можно осуществить в соответствии со способом, описанным в Molecular Cloning: A Laboratory Manual, Second Edition (1989) (Cold Spring Harbor Laboratory Press), Current Protocols in Molecular Biology (1994) (Wiley-Interscience), DNA Cloning 1: Core Techniques, A Practical Approach, Second Edition (1995) (Oxford University Press) или т.п.
[0069]
ʺ1 или несколько ошибочных спариваний основанийʺ означает 1-5, предпочтительно 1-3, и более предпочтительно 1 или 2 ошибочных спаривания.
[0070]
Длина второй цепи связывающегося с липидом двухцепочечного олигонуклеотида по настоящему изобретению составляет 8-60 нуклеотидов. Например, она составляет 8-60 нуклеотидов, 8-50 нуклеотидов, 8-40 нуклеотидов, 8-30 нуклеотидов, 10-25 нуклеотидов или 15-25 нуклеотидов. Длина второй цепи может быть такой же, как у CpG олигонуклеотида, который представляет собой первую цепь, и на 1 или несколько нуклеотидов короче длины CpG олигонуклеотида при условии, что она может гибридизоваться с CpG олигонуклеотидом. Кроме того, длина второй цепи может быть больше, чем длина CpG олигонуклеотида, при добавлении 1 или нескольких нуклеотидов с одной или обеих сторон части, гибридизующейся с CpG олигонуклеотидом.
ʺ1 или несколько нуклеотидовʺ означает 1-10, 1-5, 1-3, или 1 или 2 нуклеотида.
Предпочтительная длина второй цепи зависит от длины CpG олигонуклеотида первой цепи. Например, она составляет 50% или больше, 60% или больше, 70% или больше, 50-100%, 60-100% или 70-100% от длины первой цепи. Особенно предпочтительно 50-100% длины первой цепи.
[0071]
Олигонуклеотид второй цепи связывающегося с липидом двухцепочечного олигонуклеотида по настоящему изобретению представляет собой олигонуклеотид, нуклеозиды которого, выбранные из группы, состоящей из ДНК нуклеозидов, РНК нуклеозидов и нуклеозидных производных, являются связанными. Все нуклеозиды могут быть одинаковыми, или может быть два или более видов нуклеозидов. Однако, РНК олигонуклеотид, в котором все нуклеозиды являются РНК нуклеозидами, исключается. В качестве нуклеозида, содержащегося во второй цепи, предпочтительным является олигонуклеотид, в котором ДНК-нуклеозиды и/или нуклеозидные производные являются связанными. Все нуклеозиды могут представлять собой ДНК нуклеозид, нуклеозидное производное или и то и другое.
Когда олигонуклеотид включает ДНК нуклеозиды и нуклеозидные производные, примером является олигонуклеотид, включающий центральную область и концевые области по обеим сторонам центральной области, и включающий по меньшей мере одно нуклеозидное производное в концевой области с обеих сторон. Более подробно, 5' и/или 3' концевая область(области) включает 1 или больше, предпочтительно 1-5, и более предпочтительно 2-3 нуклеозидных производных. Тип, количество и положение модификации(модификаций) в одной концевой области может быть таким же или отличным от типа, количества, и положения в другой концевой области. В другом варианте осуществления, это олигонуклеотид, рандомизированно включающий нуклеозидные производные.
[0072]
В качестве нуклеозидного производного во второй цепи связывающегося с липидом двухцепочечного олигонуклеотида по настоящему изобретению можно использовать любую модификацию(модификации) для нуклеозида, которая хорошо известна в данной области, такую как приведенные в качестве примеров выше.
Нуклеозид, содержащий заместитель в 2' положении сахара, и/или нуклеозид, содержащий мостиковую структуру между 4' и 2' положениями сахара, являются предпочтительными.
В качестве заместителя в 2' положении сахара предпочтительным является F, OCH3 или OCH2CH2OCH3. OCH3 является особенно предпочтительными.
В качестве мостиковой структуры между 4' и 2' положениями сахара предпочтительным является 4'-(CH2)m-O-2', где m представляет собой целое число, имеющее значение 1-4, или 4'-C(=O)-NR3-2', где R3 представляет собой атом водорода или алкил.
[0073]
В качестве межнуклеозидной связи в олигонуклеотиде второй цепи связывающегося с липидом двухцепочечного олигонуклеотида по настоящему изобретению, можно использовать любую хорошо известную в данной области межнуклеозидную связь, такую как приведенная в примерах выше. Все межнуклеозидные связи могут быть одинаковыми, или могут представлять собой два или более типов связи. Предпочтительными являются D-олиго и/или S-олиго.
Когда присутствуют 2 или более типов межнуклеозидных связей, такие как D-олиго и S-олиго, примером является олигонуклеотид, включающий центральную область и концевые области по обеим сторонам центральной области, и включающий по меньшей мере одну неприродную межнуклеозидную связь (например, S-олиго) в концевой области с обеих сторон и природнную межнуклеозидную связь (например, D-олиго) в центральной области. Например, 5' и/или 3' концевая область(области) включает 1 или больше, предпочтительно 1-5, и более предпочтительно 2-3 неприродные межнуклеозидные связи. Тип, количество и положение модификации(модификаций) в одной концевой области могут быть такими же или отличными от тех, которые присутствуют в другой концевой области. В другом варианте осуществления, он представляет собой олигонуклеотид, рандомизированно включающий неприродные межнуклеозидные связи.
[0074]
CpG олигонуклеотид первой цепи и олигонуклеотид второй цепи в связывающемся с липидом двухцепочечном олигонуклеотиде по настоящему изобретению можно синтезировать в соответствии с обычными способами, известными в данной области. Например, их можно легко синтезировать с помощью автоматизированного синтезатора нуклеиновых кислот, который является коммерчески доступным (например, синтезатор от AppliedBiosystems и Dainippon Seiki). Способ синтеза представляет собой твердофазный синтез с использованием фосфорамидита, твердофазный синтез с использованием гидрофосфоната или т.п. Примеры раскрыты в следующем примере 1, Tetrahedron Letters 22, 1859-1862 (1981) и т.п.
[0075]
Синтезированные первая и вторая цепи образуют двухцепочечный олигонуклеотид путем гибридизации в соответствии с хорошо известным способом. Примеры раскрыты в следующем Примере 1, Примере 1 в WO2013/089283 и т.п.
[0076]
В связывающемся с липидом двухцепочечном олигонуклеотиде по настоящему изобретению липид связывается с второй цепью через линкер или без линкера.
[0077]
ʺЛипидʺ означает гидрофобное соединение. Он не ограничивается при условии, что он является хорошо известным липидом, и может иметь линейную, разветвленную или циклическую форму. Примерами являются жирная кислота с С8-С30 алифатической цепью(цепями) (например, фарнезол), диациллипид, холестерин, производные холестерина, стероидная кислота (например, желчная кислота), липид А, токоферол и их комбинация. Примерами жирной кислоты с алифатической цепью(цепями) являются, но не ограничиваются этим, ненасыщенные или насыщенные жирные кислоты в линейной или разветвленной форме и производные жирных кислот (например, эфиры жирных кислот, амиды жирных кислот и тиоэфиры жирных кислот).
[0078]
В качестве липида, используемого для настоящего изобретения, предпочтительным является липид, содержащий углеводородную цепь (цепи). Предпочтительным является липид, содержащий 1 или 2 углеводородные цепи или т.п. Особенно предпочтительно, связывающийся с липидом двухцепочечный олигонуклеотид по настоящему изобретению содержит диацильный липид. Когда липиды связываются в двух или более положениях, а один липид представляет собой диацильный липид, другой липид может быть липидом, отличным от диацильного липида.
ʺДиацильный липидʺ представляет собой фосфолипид, гликолипид, сфинголипид или их комбинацию, который включает две углеводородные цепи. Предпочтительно, это группа из следующих (а) или (f).
Углеводородные цепи в липиде независимо включают около C8 - C30 атомов углерода. Они могут быть насыщенными, ненасыщенными или комбинированными, и разветвленными. Когда липид содержит одну цепь, длина цепи предпочтительно составляет C8 - C30, и более предпочтительно C8 - C20. Когда липид содержит две цепи, длина цепей предпочтительно составляет C10 - C30, более предпочтительно C12 - C30, и наиболее предпочтительно C14 - C24. Когда липид содержит две цепи, длина двух цепей может быть одинаковой или разной. Цепи в липиде связываются с частью, включающей фосфорную кислоту, сахар или т.п. (положение, связывающееся с олигонуклеотидом), через эфирную связь, амидную связь, тиоэфирную связь, их комбинацию или т.п.
Связывающийся с липидом двухцепочечный олигонуклеотид по настоящему изобретению содержит липид, включающий C12 - C30 углеводородную цепь(цепи) во второй цепи. Когда липиды связываются в 2 или более положениях и один липид представляет собой липид, включающий C12 - C30 углеводородную цепь(цепи), количество атомов углерода углеводородной цепи(цепей) в другом липиде может быть меньше чем 12.
[0079]
Примеры ʺлипидаʺ включают следующие.
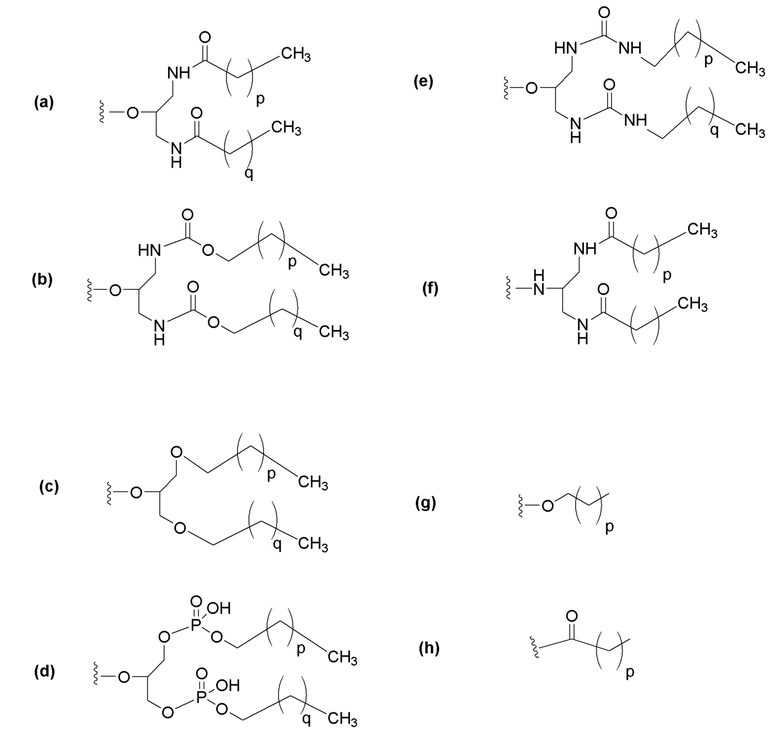
где p и q каждый независимо представляет собой целое число, имеющее значение 6-28, предпочтительно 8-28, более предпочтительно 10-28, и наиболее предпочтительно 12-22.
[0080]
В связывающемся с липидом двухцепочечном олигонуклеотиде по настоящему изобретению, липид может связываться в любом положении второй цепи. Он может связываться на 3' конце, 5' конце или во второй цепи. Когда липид связывается во второй цепи, например, он может связываться, как показано ниже.
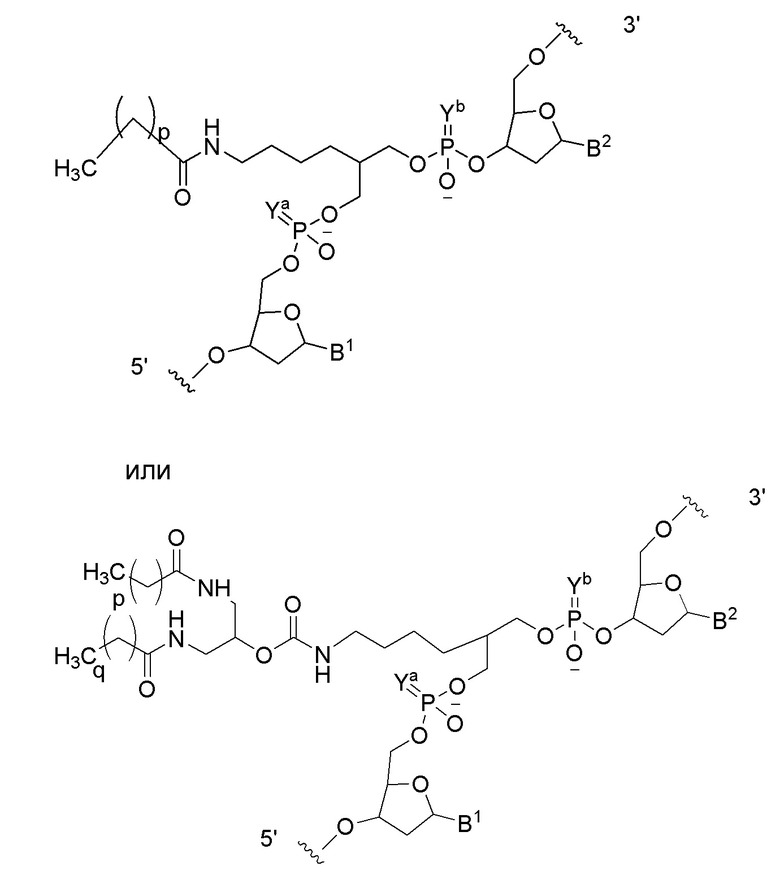
где B1 или B2 представляет собой аденин(A), гуанин(G), цитозин (C), 5-метилцитозин (5-Me-C), тимин (T) или урацил(U), Ya или Yb представляет собой O или S, и p и q каждый независимо представляет собой целое число, имеющее значение 6-28, и предпочтительно 10-18.
Кроме того, липид предпочтительно связывается в одном или двух положениях во второй цепи. Он предпочтительно связывается на 3' и/или 5' конце. Более предпочтительно, он связывается на 5' конце.
[0081]
Липид можно синтезировать в соответствии с хорошо известными в данной области способами. Примеры липида или способов получения раскрыты в следующем Примере 1, Патентном документе 1 и т.п.
[0082]
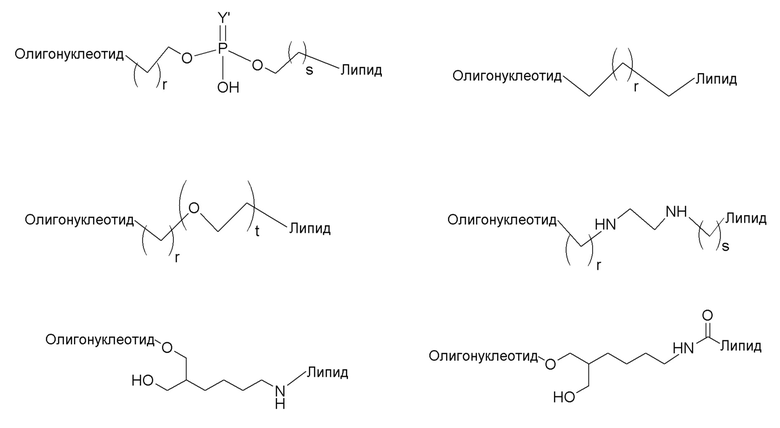
В связывающемся с липидом двухцепочечном олигонуклеотиде по настоящему изобретению липид может свяываться с второй цепью непосредственно или через линкер. В качестве ʺлинкераʺ можно использовать любой линкер, используемый в данной области. Примеры включают полярный линкер, алкиленовый линкер, этиленгликолевый линкер и этилендиаминовый линкер. Когда липид представляет собой фосфолипид, используют линкер, который представляет собой 4-26 атомов между атомом кислорода второй цепи и атомом фосфора липида. Примеры включают олигонуклеотидный линкер или следующие линкеры.
[0083]
где Y' представляет собой O или S, и r или s представляет собой целое число, имеющее значение 1-10, предпочтительно 1-5 и более предпочтительно 1-3. t представляет собой целое число, имеющее значение 1-4, предпочтительно 1-3 и более предпочтительно 2 или 3.
Линкер можно синтезировать в соответствии с хорошо известным в данной области способом. Олигонуклеотидный линкер можно синтезировать способом, аналогичным способу синтеза олигонуклеотидов в представленном выше примере.
[0084]
Линкер предпочтительно представляет собой олигонуклеотидный линкер. Длина олигонуклеотидного линкера составляет 2-10, 2-5, 2, 3, 4 или 5 нуклеотидов. Примером является следующий.
[0085]
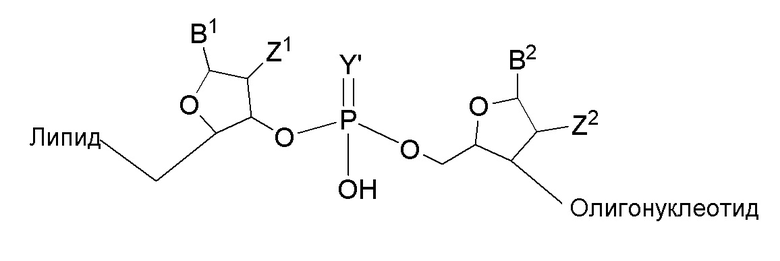
где B1 или B2 представляет собой аденин(A), гуанин(G), цитозин (C), 5-метилцитозин (5-Me-C), тимин (T) или урацил(U). Y' представляет собой O или S. Z1 или Z2 представляет собой H или OH, и предпочтительно H.
Примером олигонуклеотидного линкера является ДНК линкер, а именно -(dX1)u-, где X1 каждый независимо представляет собой A, G, C или T, и u представляет собой целое число, имеющее значение 1-8. В частности, он представляет собой dG, dGdG, dGdGdGdG, dGdGdGdGdG, дт, dTdT, dTdTdTdT, dTdTdTdTdT или т.п. dGdG, dGdGdGdGdG или dTdT является особенно предпочтительным. Межнуклеозидная связь в ДНК линкере предпочтительно представляет собой фосфоротиоатную связь.
[0086]
3' конец, 5' конец или линкер, не связывающийся с липидом, в связывающемся с липидом двухцепочечном олигонуклеотиде по настоящему изобретению могут быть дополнительно модифицированы. Для возможности отслеживания олигонуклеотида, для улучшения фармакокинетики или фармакодинамики олигонуклеотида или для повышения стабильности или аффинности связывания олигонуклеотида можно использовать хорошо известную в данной области модифицированную группу. Примеры включают защитную группу для гидроксильной группы, репортерную молекулу, холестерин, фосфолипид, пигмент, флуоресцентную молекулу и т.п.
Кроме того, 3' или 5' конец, не связывающийся с липидом, в связывающемся с липидом двухцепочечном олигонуклеотиде по настоящему изобретению могут включать фосфатный сложный эфир. ʺФосфатный сложный эфирʺ означает фосфатную группу на конце, включающую фосфатный сложный эфир или модифицированный фосфатный сложный эфир. Хотя группа фосфатного эфира может быть на любом конце, предпочтительно она представляет собой 5'-концевой нуклеозид. Более подробно, она представляет собой группу формулы: -O-P(=O)(OH)OH или модифицированную группу. То есть, один или несколько из O или OH необязательно замещены группой H, O, OR', S, N(R'), где R' представляет собой H, амино-защитную группу или замещенный или незамещенный алкил, или алкил. 5' или 3' конец каждый независимо может включать замещенные или незамещенные 1-3 фосфатные группы.
[0087]
Настоящее изобретение охватывает фармацевтическую композицию (фармацевтическая композиция по настоящему изобретению) или вакцинную композицию (вакцинная композиция по настоящему изобретению), включающую связывающийся с липидом двухцепочечный олигонуклеотид по настоящему изобретению (вакцина или адъювант по настоящему изобретению).
Кроме того, настоящее изобретение охватывает фармацевтическую или вакцинную композицию, включающую антиген и связывающийся с липидом двухцепочечный олигонуклеотид по настоящему изобретению (адъювант по настоящему изобретению).
[0088]
ʺАнтигенʺ представляет собой молекулу, которая способна индуцировать иммунный ответ. Примеры включают, но не ограничиваются этим, клетки, клеточные экстракты, белки, рекомбинантные белки, очищенные белки, полипептиды, пептиды, полисахариды, полисахаридные конъюгаты, пептидные или непептидные миметики полисахаридов, другие молекулы, кодируемые плазмидной ДНК, гаптены, малые молекулы, липиды, гликолипиды, углеводы, целые убитые патогены, вирусы, вирусные экстракты, живой аттенуированный вирус, вирусный вектор, живые аттенуированные бактерии, бактериальные векторы, многоклеточные организмы, такие как паразиты, и аллергены.
Антиген может быть представлен как один антиген или комбинация антигенов. Антиген может быть представлен как сложная смесь полипептида или олигонуклеотида.
Антигены включают, но не ограничиваются этим, микробные антигены, аутоантигены и вызывающие привыкание вещества.
[0089]
ʺМикробный антигенʺ означает антиген микроорганизма, и микроорганизм включает, но не ограничивается этим, бактерию, вирус, паразит и гриб.
ʺБактерияʺ конкретно не ограничивается при условии, что она представляет собой бактерию, которая вызывает заболевание у человека, домашнего животного, домашнего скота или т.п. Более подробно, она представляет собой Streptococcus (Streptococcus pyogens, Streptococcus pneumoniae или т.п.), Staphylococcus aureus (MSSA, MRSΑ или т.п.), Staphylococcus epidermidis, Enterococcus, бактерии, относящиеся к роду Listeria, бактерии, вызывающие менингит, Gonococcus, патогенную Escherichia coli, Friedländer bacilli, Proteus bacilli, Bordetella pertussis, Pseudomonas aeruginosa, Serratia marcescens, Citrobacter, Acinetobacter, Enterobacter, Mycoplasma, Clostridia, Tubercle bacilli, Cholera bacilli, Yersinia pestis, Corynebacterium diphtheriae, Dysentery bacillus, Bacillus anthracis, Treponema pallidum, Tetanus bacillus, Mycobacterium leprae, Legionella pneumophila, Leptospira, Borrelia, Francisella, Coccella, Rickettsia, Chlamydia, Burkholderia mallei, Helicobacter pylori или т.п.
ʺВирусʺ конкретно не ограничивается при условии, что он является вирусом, который вызывает заболевание у человека, домашнего животного, домашнего скота или т.п. Примерами являются вирус гриппа, респираторно-синцитиальный вирус (RSV), вирус папилломы, вирус гепатита (тип A, Β, C, D, E, F, G, TΤ или т.п.), риновирус, вирус натуральной оспы, морбилливирус, вирус краснухи, полиовирус, вирус ветряной оспы, норовирус, вирус Норуолк, саповирус, вирус Саппоро, вирус свинки, аденовирус, энтеровирус, ротавирус, вирус иммунодефицита человека, такой как ВИЧ-1 и ВИЧ-2, вирус бешенства, Т-лимфотропный вирус, вирус желтой лихорадки, цитомегаловирус, SARS-CoV, коронавирус, такой как MERS-CoV, вирус эбола, полиомавирус, JC вирус, ΒΚ вирус, вирус герпеса, такой как вирус простого герпеса 1 (HSV1) и вирус простого герпеса 2 (HSV2), лимфокриптовирус, розеоловирус, вирус японского энцефалита, вирус Коксаки, вирус денге, вирус Западного Нила, коронавирус, парвовирус, вирус Эпштейна-Барра, вирус Марбурга, хантавирус, вирус Ласса, вирус Чикунгунья, вирус Хантаан, вирус шотландского энцефалита, вирус лимфоцитарного хориоменингита, vornavirus, лихорадка Рифт-Валли, вирус Тогото, Вирус Дори, вирус ящура, вирус болезни Ньюкасла, вирус папулезного стоматита крупного рогатого скота, вирус чумы крупного рогатого скота, вирус везикулярной болезни свиней, калицивирус, торовирус, вирус африканской болезни лошадей, артеривирус, вирус оспы овец, каприпоксвирус, овечий злокачественный вирус катаральной лихорадки, вирус геморрагической септицемии и вирус везикулярного стоматита.
ʺПаразитʺ конкретно не ограничивается при условии, что он является паразитом, который вызывает заболевание у человека, домашнего животного, домашнего скота или т.п. Примерами являются entamoeba histolytica, малярия, токсоплазма, лейшмания, криптоспоридий, трипаносома, эхинококк, шистосома japonicum, филярия, круглый червь и дифиллоботриум.
ʺГрибʺ конкретно не ограничивается при условии, что он представляет собой гриб, который вызывает заболевание у человека, домашнего животного, домашнего скота или т.п. Более подробно, он представляет собой aspergilloma, candida, cryptococcus, trichophyton, histoplasma, pneumocystis или т.п.
[0090]
ʺАутоантигенʺ означает опухолевый антиген, антиген, ассоциированный с болезнью Альцгеймера, антиген против человеческого антитела, антиген, экспрессированный из элементов эндогенных ретровирусов человека, или т.п.
Примером ʺопухолевого антигенаʺ является антиген, специфически экспрессируемый в раковых клетках. Примеры включают белок, пептид и включающий их гибридный пептид. Примеры включают пептиды, описанные в WO2006/090810, WO2007/145318, WO2008/047473, WO2008/102557, WO2009/025117, WO2009/025196, WO2009/1539992, WO2010/013485, WO2010/021112, WO2010/073551, WO2010/095428, WO2010/131452, WO2010/137295, WO2011/067920, WO2011/074236, WO2011/089921, WO2011/111392, WO2012/053200, WO2012/053206, WO2012/169200, WO2013/024582, WO2013/061594, WO2014/041784, WO2014/087626 и т.п.
Примеры антигена, ассоциированного с болезнью Альцгеймера, включают tau и β-амилоид.
Примером антигена против человеческого антитела является IgE.
[0091]
ʺВещество, вызывающее зависимостьʺ означает никотин, кокаин или т.п. Примером никотинового антигена является никотиновый гаптен, конъюгированный с носителем (например, дифтерийным токсином).
[0092]
Фармацевтическая или вакцинная композиция по настоящему изобретению дополнительно может включать хорошо известный адъювант(адъюванты) при условии, что сохраняется эффект связывающегося с липидом двухцепочечного олигонуклеотида по настоящему изобретению. Например, он представляет собой холерный токсин, токсин сальмонелл, квасцы или агонист для Toll-подобного рецептора (TLR), который является отличным от TLR9. Примеры агонистов для TLR включают агонист для TLR3, такой как стабилизированный поли(I:C); агонист для TLR4, такой как производное липополисахарида (LPS) (например, MPL и GLA); агонист для TLR5, такой как флагеллин; агонист для TLR7; и агонист для TLR8. Примеры включают соль алюминия, такую как гидроксид алюминия, иммуностимулирующий комплекс (ISCOM), эмульсию масло-в-воде или вода-в-масле, липосому и систему доставки, такую как наночастица и микрочастица.
[0093]
В качестве следующих примеров, фармацевтическая или вакцинная композиция по настоящему изобретению, включающая опухолевый антиген, обладает любой или всеми из следующих отличных характеристик:
a) CTL-индуцибельность 1% или более.
b) Ингибирование имплантированной опухоли.
c) Эффект регрессии опухоли
d) Хорошая фармакокинетика, такая как высокая биодоступность и умеренный клиренс. Особенно, эффективная доставка в лимфоузлы.
e) Высокая метаболическая стабильность.
f) Отсутствие синдрома высвобождения цитокинов.
g) Слабое местное раздражение.
h) Отсутствие мутагенности.
i) Низкий риск сердечно-сосудистых осложнений.
j) Низкий риск острой токсичности.
[0094]
Можно использовать любой способ введения и формулирования фармацевтической или вакцинной композиции по настоящему изобретению, если он является хорошо известным в данной области способом введения и формулирования.
[0095]
Фармацевтическую или вакцинную композицию по настоящему изобретению можно вводить различными способами в зависимости от того, желательно ли местное или системное лечение, и от области, подлежащей лечению. Примеры способа введения включают местный (включая офтальмологический, интравагинальный, интраректальный, интраназальный и трансдермальный), пероральный и парентеральный. Примеры парентерального введения включают внутривенную инъекцию или капельное введение, подкожную, внутрибрюшинную или внутримышечную инъекцию, введение в легкие путем вдыхания или ингаляции, интратекальное введение и интравентрикулярное введение. Предпочтительными являются внутривенные инъекции или подкожное введение.
[0096]
Когда фармацевтическую или вакцинную композицию по настоящему изобретению вводят местно, можно использовать такую лекарственную форму, как трансдермальный пластырь, мазь, лосьон, крем, гель, капли, суппозиторий, спрей, жидкость и порошок.
Примеры композиции для перорального введения включают порошок, гранулу, суспензию или раствор, растворенный в воде или неводном носителе, капсулу, порошок и таблетку.
Примеры композиции для парентерального, интратекального или интравентрикулярного введения включают стерильные водные растворы, которые содержат буферы, разбавители и другие подходящие добавки.
[0097]
Фармацевтическую или вакцинную композицию по настоящему изобретению можно получить путем смешивания эффективного количества с различными фармацевтическими добавками, подходящими для формы введения, такими как эксципиенты, связующие вещества, увлажнители, разрыхлители, смазывающие вещества и разбавители, по мере необходимости. Когда композиция представляет собой инъекцию, ее вместе с подходящим носителем можно стерилизовать для получения композиции.
[0098]
Примеры наполнителей включают лактозу, сахарозу, глюкозу, крахмал, карбонат кальция и кристаллическую целлюлозу.
Примеры связующих включают метилцеллюлозу, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, желатин и поливинилпирролидон.
Примеры разрыхлителей включают карбоксиметилцеллюлозу, натрийкарбоксиметилцеллюлозу, крахмал, альгинат натрия, агар и лаурилсульфат натрия.
Примеры смазывающих веществ включают тальк, стеарат магния и макрогол. Масло какао, макрогол, метилцеллюлозу или т.п. можно использовать в качестве основы для суппозиториев.
Когда композицию получают в виде растворов, эмульгированных инъекций или суспендированных инъекций, при необходимости можно добавлять солюбилизирующие агенты, суспендирующие агенты, эмульгаторы, стабилизаторы, консерванты, изотонические агенты и т.п., которые обычно используются. Для перорального введения можно добавлять подсластители, отдушки или т.п.
[0099]
Дозировка зависит от тяжести и респонсивности болезненного состояния, подлежащего лечению, с длительностью лечения от нескольких дней до нескольких месяцев или вплоть до излечения или уменьшения тяжести болезненного состояния. Оптимальные схемы введения можно рассчитать на основе измерений накопления фармацевтической или вакцинной композиции в организме. Специалисты в данной области могут определить оптимальные дозы, методики дозирования и частоту повторения.
[0100]
Концентрация липид-связывающего двухцепочечного олигонуклеотида по настоящему изобретению в фармацевтической или вакцинной композиции по настоящему изобретению составляет, но специально не ограничивается этим, обычно от 0,01 до 99,99% масс. от 100% масс. фармацевтической или вакцинной композиции.
Когда композиция включает антиген, учитывая концентрацию антигена и адъюванта по настоящему изобретению, адъювант обычно составляет от 10 до 1000 массовых частей на 1 часть по массе антигена.
Дозировка фармацевтической или вакцинной композиции варьируется в зависимости от желаемой степени иммунной стимуляции, возраста пациента, пола или т.п., поэтому ее можно соответствующим образом установить, например, от 0,001 до 10 мг/кг массы тела/день, но этим она конкретно не ограничивается.
Кроме того, в зависимости от степени эффективности желаемой фармацевтической или вакцинной композиции, возраста пациента введения, пола или т.п., фармацевтическую или вакцинную композицию по настоящему изобретению можно вводить одному и тому же пациенту несколько раз, например, примерно до 2-4 раз. Когда фармацевтическую или вакцинную композицию по настоящему изобретению вводят одному и тому же пациенту несколько раз, интервал может быть соответствующим образом установлен, например, приблизительно от 14 до 30 дней.
[0101]
Фармацевтическую или вакцинную композицию по настоящему изобретению можно вводить в комбинации из 1 или более видов лекарственных средств. В качестве лекарственных средств можно использовать терапевтическое средство, известное в данной области как терапевтическое средство для целевого заболевания. Например, когда заболевание представляет собой рак, фармацевтическую или вакцинную композицию по настоящему изобретению можно вводить совместно с химиотерапевтическим средством(средствами). Когда заболевание представляет собой бактериальные инфекции, фармацевтическую или вакцинную композицию по настоящему изобретению можно вводить совместно с антибиотиком(ами). Фармацевтическую или вакцинную композицию по настоящему изобретению можно вводить одновременно или раздельно с таким средством(средствами). Кроме того, фармацевтическую или вакцинную композицию по настоящему изобретению и терапевтическое средство(средства) можно вводить в виде разных композиций, независимо включающих каждое средство, или в виде одной композиции, включающей фармацевтическую или вакцинированную композицию и терапевтическое средство(средства). Кроме того, когда заболевание представляет собой рак, фармацевтическую или вакцинную композицию по настоящему изобретению можно вводить в комбинации с хирургическим лечением, которое известно в данной области.
[0102]
Кроме того, настоящее изобретение охватывает способ усиления иммунного ответа у пациента, включающий введение пациенту эффективного количества фармацевтической или вакцинной композиции по настоящему изобретению. Примером ʺиммунного ответаʺ является повышение индуцибельности специфического цитотоксического Т-лимфоцита (CTL) по сравнению с контролем. Конкретный способ измерения CTL-индуцибельности раскрыт, например, в следующем Примере 3 и WO 02010/024582.
[0103]
Кроме того, настоящее изобретение охватывает способ лечения рака или инфекционного заболевания, включающий введение пациенту эффективного количества фармацевтической или вакцинной композиции по настоящему изобретению для облегчения одного или нескольких симптомов рака или инфекционного заболевания по сравнению с контролем.
[0104]
ʺПациентʺ означает любое лицо, которое является мишенью для лечения фармацевтической или вакцинной композицией по настоящему изобретению. Примеры включают млекопитающих, таких как люди, лабораторных животных (например, мышей и крыс), домашних животных (например, собак, кошек, хорьков и птиц) и скот (например, крупный рогатый скот, свиней, цыплят, коз, страусов, овец и лошадей).
[0105]
ʺЭффективное количествоʺ означает достаточную дозу для индукции или усиления иммунного ответа, обеспечения желаемого фармакологического и/или физиологического эффекта или обеспечения лечения расстройства, заболевания или состояния. Точная дозировка может изменяться в зависимости от различных факторов, таких как зависящая от пациента переменная (например, возраст и состояние здоровья иммунной системы), заболевание, стадия заболевания и предоставленное лечение.
[0106]
ʺРакʺ конкретно не ограничивается, при условии, что это рак, которым может заболеть человек, домашнее животное, скот или т.п. Примерами являются хронический миелоидный лейкоз (CML), острый миелоидный лейкоз (AML), лимфома, болезнь Ходжкина, неходжкинская лимфома, множественная миелома, опухоль головного мозга, рак молочной железы, карцинома эндометрия, рак шейки матки, рак яичников, рак пищевода, рак желудка, такой как диффузный рак желудка, рак пищевода, колоректальный рак, рак печени, гепатоцеллюлярная карцинома, рак желчного пузыря, холангиокарцинома, рак поджелудочной железы, рак надпочечников, желудочно-кишечная стромальная опухоль, мезотелиома, рак головы и шеи, рак гортани, рак полости рта, рак десны, рак языка, рак слизистой оболочки ротовой полости, рак слюнных желез, параназальный рак, карцинома верхнечелюстного синуса, карцинома лобного синуса, рак шейки матки, рак щитовидной железы, рак почки, рак легкого, такой как немелкоклеточный рак легкого (NSCLC) и мелкоклеточный рак легкого (SCLC), остеосаркома, рак предстательной железы, тестикулярный рак, рак мочевого пузыря, рабдомиосаркома, рак кожи, анальная карцинома, хондросаркома, синовиальная саркома, эндометриоз, опухоль мягких тканей и остеобластома.
[0107]
ʺИнфекционное заболеваниеʺ означает острое или хроническое инфекционное заболевание, особенно вирусное инфекционное заболевание. Примеры включают, но не ограничиваются этим, местные или системные вирусные инфекции, такие как иммунодефицит, вызываемый ВИЧ, или т.п., папиллома, вызываемая HPV, или т.п., герпес, вызываемый HSV, или т.п., энцефалит, грипп, вызываемый вирусом гриппа A человека, или т.п., и простуда, вызываемая человеческим риновирусом.
[0108]
В настоящем описании каждая аббревиатура имеет значение, показанное ниже:
Ac: ацетил
CPG: стекло с заданным размером пор
DIEA: N,N-диизопропилэтиламин
DMAP: 4-диметиламинопиридин
DMTr: диметокситритил
DMT-MM: 4-(4,6-диметокси1,3,5-триазин-2-ил)-4-метилморфолиний хлорид
DMF: N,N'-диметилформамид
Et: этил
Fmoc: 9-флуоренилметилоксикарбонил
HBTU: O-бензотриазол-N,N,N',N'-тетраметилуроний-гексафторфосфат
Me: метил
MMTr: 4-метоксифенилдифенилметил
MMTrCl: 4-метокситритилхлорид
PBS: фосфатно-солевой буферный раствор
TBS: трет-бутилдиметилсилил
TBAF: тетрабутиламмоний фторид
TFA: трифторуксусная кислота
THF: тетрагидрофуран
Примеры
[0109]
Настоящее изобретение будет описано более подробно со ссылкой на, но не ограничиваясь этим, следующие Примеры, Ссылочные примеры и Примеры испытаний.
ЯМР анализ каждого соединения, полученного в Примерах, осуществляли при 300 МГц или 400 МГц с использованием CD3OD, CDCl3 или DMSO-d6.
[0110]
СВЭЖХ анализ осуществляли в следующих условиях.
Подвижные фазы: [A] 0,1% водный раствор муравьиной кислоты, [B] ацетонитрильный раствор, содержащий 0,1% водный раствор муравьиной кислоты
Градиент: линейный градиент 5% до 100% растворителя [B] в течение 3,5 минут, и 100% растворителя [B] поддерживали в течение 0,5 минут.
Колонка: ACQUITY UPLC (зарегистрированная торговая марка) BEH C18 (1,7 мкм, в.д. 2,1 × 50 мм) (Waters)
Скорость потока: 0,8 мл/мин
Длина волны PDA детекции: 254 нм (Диапазон детекции 210-500 нм)
[0111]
Пример 1 Синтез связывающегося с липидом двухцепочечного олигонуклеотида по настоящему изобретению
A) Синтез липидов
[0112]
1-1) Синтез 4-n

где n представляет собой целое число, имеющее значение 6-28.
[0113]
1-1-1) Синтез соединения 3-6
Стадия 1
Соединение 2-6 (3,20 г, 22,2 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в THF-DMF (5:1, 60 мл) и добавляли DIEA (4,84 мл, 27,7 ммоль) и HBTU (8,84 г, 23,3 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли по каплям соединение 1 (2,2 г, 24,41 ммоль) в DMF растворе (5 мл) в течение 10 минут и перемешивали в течение 3 часов. Объем реакционной смеси концентрировали до половины при пониженном давлении и смесь добавляли по каплям в воду (100 мл). Смесь перемешивали в течение 10 минут и полученное твердое вещество собирали фильтрованием. Твердое вещество промывали водой (50 мл) и ацетонитрилом (150 мл) с получением соединения 3-6 (3,2 г, 9,34 ммоль) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 6,45 (2H, т, J=6,0 Гц), 4,39 (1H, с), 3,78-3,73 (1H, м), 3,33 (4H, т, J=5,6 Гц), 2,22 (4H, т, J=7,7 Гц), 1,67 (4H, дт, J=31,0, 14,1 Гц), 1,30-1,27 (16H, м), 0,88 (6H, т, J=6,8 Гц).
[0114]
1-1-2) Синтез соединения 4-8
Стадия 1
Соединение 2-8 (7,65 г, 44,40 ммоль, Wako Pure Chemical Industries, Ltd.) растворяли в DMF (50,0 мл) и дихлорметане (100,0 мл). К смеси добавляли DIEA (8,72 мл, 66,6 ммоль) и HBTU (18,52 г, 48,8 ммоль) и смесь интенсивно перемешивали при комнатной температуре в течение 30 минут. К полученному суспендированному раствору добавляли соединение 1 (2,0 г, 22,2 ммоль) при комнатной температуре и смесь интенсивно перемешивали в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия (20 мл), полученное белое твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водой (100 мл) и ацетонитрилом (100 мл) и сушили с получением соединения 3-8 (6,6 г, 16,6 ммоль) в виде белого твердого вещества.
1H-ЯМР(CDCl3)δ:6,29 (шир.с, 2H), 4,12 (с, 1H), 3,76 (дд, 1H, J=4,5, 4,5 Гц), 3,42-3,35 (м, 2H), 3,31-3,25 (м, 2H), 2,22 (т, 4H, J=7,5 Гц), 1,65-1,60 (м, 4H), 1,29-1,26 (м, 24H), 0,88 (т, 6H, J=6,5 Гц).
ESI-MS(m/z): 340 (M+1).
Стадия 2
Соединение 3-8 (2,88 г, 7,22 ммоль) суспендировали в дихлорметане (60 мл) к смеси добавляли и DIEA (5,30 мл, 30,3 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (3,23 мл, 14,5 ммоль) при комнатной температуре и смесь нагревали с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры, реакционную смесь разделяли с использованием делительной воронки и органический слой, разбавленный дихлорметаном (80 мл), промывали два раза насыщенным водным раствором бикарбоната натрия (20 мл), два раза водой (20 мл) и один раз насыщенным солевым раствором (20 мл). После сушки полученного органического слоя над сульфатом магния, растворитель концентрировали при пониженном давлении. Полученное коричневое масло, Соединение 4-8 (2,88 г, 4,81 ммоль), было получено в виде неочищенного продукта. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 148,2 (с)
[0115]
1-1-3) Синтез соединения 4-10
Стадия 1
Соединение 2-10 (9,78 г, 48,8 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в DMF (150 мл) и дихлорметане (75 мл). К смеси добавляли DIEA (12,79 мл, 73,2 ммоль) и HBTU (20,37 г, 53,7 ммоль) и смесь интенсивно перемешивали при комнатной температуре в течение 45 минут. К полученному суспендированному раствору добавляли соединение 1 (2,2 г, 24,41 ммоль) при комнатной температуре и смесь интенсивно перемешивали. Затем смесь нагревали до 80°C и затем перемешивали в течение 4 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия (200 мл) и воду (50 мл), полученное белое твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водой (200 мл) и ацетонитрилом (400 мл) с получением соединения 3-10 (9,95 г, 21,88 ммоль) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 6,25 (2H, т, J=5,8 Гц), 4,07 (1H, с), 3,75 (1H, с), 3,44-3,38 (2H, м), 3,29-3,23 (2H, м), 2,22 (4H, т, J=7,6 Гц), 1,67-1,59 (4H, м), 1,30-1,25 (64H, м), 0,88 (6H, т, J=6,8 Гц).
Стадия 2
Соединение 3-10 (230 мг, 0,506 ммоль) суспендировали в дихлорметане (11 мл) и к смеси добавляли DIEA (0,353 мл, 2,023 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (0,226 мл, 1,012 ммоль) при комнатной температуре и смесь нагревали с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь разделяли с использованием делительной воронки и органический слой промывали два раза насыщенным водным раствором бикарбоната натрия (10 мл), пять раз водой (10 мл) и один раз насыщенным солевым раствором (10 мл). После сушки полученного органического слоя над сульфатом магния растворитель концентрировали при пониженном давлении. Полученное коричневое масло, соединение 4-10 (365 мг), было получено в виде неочищенного продукта. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 148,2 (с)
[0116]
1-1-4) Синтез соединения 4-12
Стадия 1
Соединение 2-12 (5,07 г, 22,19 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в DMF (51,8 мл) и дихлорметане (28,6 мл). К смеси добавляли DIEA (5,81 мл, 33,3 ммоль) и HBTU (9,26 г, 24,4 ммоль) и смесь интенсивно перемешивали при комнатной температуре в течение 30 минут. К полученному суспендированному раствору добавляли соединение 1 (1,0 г, 11,1 ммоль) при комнатной температуре и смесь интенсивно перемешивали. Затем смесь нагревали до 40°C и затем перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия (10 мл), полученное белое твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водой (50 мл), ацетонитрилом (50 мл) и дихлорметаном (50 мл) с получением соединения 3-12 (4,8 г, 9,4 ммоль) в виде белого твердого вещества.
1H-ЯМР(CDCl3)δ: 6,20 (шир.с, 2H), 3,96 (д, 1H, J=4,0 Гц, 1H), 3,75 (м, 1H), 3,40 (дд, 2H, J=4,0, 12,0 Гц), 3,25 (дд, 2H, J=4,0, 12,0 Гц), 2,22 (т, 4H, J=12,0 Гц, 2H), 1,62 (д, 4H, J=8,0 Гц), 1,29-1,25 (м, 40H), 0,90-0,86 (м, 6H)
ESI-MS(m/z): 512 (M+1).
Стадия 2
Соединение 3-12 (5,10 г, 9,98 ммоль) суспендировали в дихлорметане (257 мл) и к смеси добавляли DIEA (6,97 мл, 39,9 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (4,46 мл, 20,0 ммоль) при комнатной температуре и смесь нагревали с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь разделяли с использованием делительной воронки и органический слой промывали два раза насыщенным водным раствором бикарбоната натрия (100 мл), два раза водой (100 мл) и один раз насыщенным солевым раствором (100 мл). После сушки полученного органического слоя над сульфатом магния растворитель концентрировали при пониженном давлении. Полученное коричневое масло, соединение 4-12 (4,80 г, 6,75 ммоль), было получено в виде неочищенного продукта. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ:148,2 (с)
[0117]
1-1-5) Синтез соединения 4-14
Соединение 2-14 (12,52 г, 48,8 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в DMF (150 мл) и дихлорметане (75 мл). К смеси добавляли DIEA (12,79 мл, 73,2 ммоль) и HBTU (20,37 г, 53,7 ммоль) и смесь интенсивно перемешивали при комнатной температуре в течение 2,5 часов. К полученному суспендированному раствору добавляли соединение 1 (2,2 г, 24,41 ммоль) при комнатной температуре и смесь интенсивно перемешивали. Затем смесь нагревали до 80°C и затем перемешивали в течение 5 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия (800 мл) и воду (50 мл), полученное белое твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водой (500 мл), ацетонитрилом (300 мл) и дихлорметаном (100 мл) с получением соединения 3-14 (10,9 г, 19,23 ммоль) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 6,21 (2H, с), 3,97 (1H, д, J=4,0 Гц), 3,77-3,74 (1H, м), 3,45-3,38 (2H, м), 3,28-3,22 (2H, м), 2,22 (4H, т, J=7,6 Гц), 1,65-1,61 (4H, м), 1,29-1,25 (48H, м), 0,88 (6H, т, J=6,8 Гц).
Стадия 2
Соединение 3-14 (1,00 г, 1,76 ммоль) суспендировали в дихлорметане (50 мл) и к смеси добавляли DIEA (0,924 мл, 5,29 ммоль). Затем 2-цианоэтил добавляли N,N-диизопропилхлорфосфорамидит (0,870 мл, 3,53 ммоль) при комнатной температуре и смесь нагревали с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли дихлорметаном (50 мл). Раствор разделяли с использованием делительной воронки и затем органический слой промывали два раза насыщенным водным раствором бикарбоната натрия (100 мл), два раза водой (100 мл) и один раз насыщенным солевым раствором (100 мл). После сушки полученного органического слоя над сульфатом магния растворитель концентрировали при пониженном давлении. Полученное белое аморфное вещество, соединение 4-14 (1,00 г, 1,30 ммоль), было получено в виде неочищенного продукта. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ:148,2 (с)
[0118]
1-1-6) Синтез соединения 4-16
В соответствии со способами, описанными в непатентном документе 3, соединение 3-16 синтезировали из соединения 2-16 и затем синтезировали соединение 4-16.
Соединение 3-16: 1H-ЯМР(CDCl3)δ: 6,20 (шир.с, 2H), 3,95 (м, 1H), 3,76 (м, 1H), 3,40 (м, 2H), 3,25 (м, 2H), 2,24 (м, 4H), 1,68-1,20 (м, 60H), 0,88 (т, 6H, J=8,0 Гц)
Соединение 4-16: 31P-ЯМР(CDCl3)δ: 148,2 (с)
[0119]
1-1-7) Синтез соединения 4-18
Стадия 1
Соединение 2-18 (13,9 г, 44,4 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в DMF (207 мл) и дихлорметане (214 мл). К смеси добавляли DIEA (16,3 мл, 93 ммоль) и HBTU (18,5 г, 48,8 ммоль) и смесь интенсивно перемешивали при комнатной температуре в течение 30 минут. К полученному суспендированному раствору добавляли соединение 1 (2,0 г, 22,2 ммоль) при комнатной температуре и смесь интенсивно перемешивали. Затем смесь нагревали до 40°C и затем перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия (10 мл), полученное белое твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водой (100 мл), ацетонитрилом (100 мл) и дихлорметаном (100 мл) с получением соединения 3-18 (10,0 г, 14,7 ммоль) в виде белого твердого вещества.
1H-ЯМР(CDCl3)δ: 6,20 (шир.с, 2H), 3,96 (м, 1H), 3,75 (м, 1H), 3,42 (м, 2H), 3,23 (м, 2H), 2,22 (м, 4H), 1,68-1,20 (м, 68H), 0,88 (м, 6H)
Стадия 2
Соединение 3-18 (3,8 г, 5,60 ммоль) суспендировали в дихлорметане (230 мл), к смеси добавляли DIEA (5,86 мл, 33,6 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (3,74 мл, 16,79ммоль) при комнатной температуре и смесь нагревали с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь разделяли с использованием делительной воронки и органический слой промывали два раза насыщенным водным раствором бикарбоната натрия (100 мл), один раз водой (50 мл) и один раз насыщенным солевым раствором (50 мл). После сушки полученного органического слоя над сульфатом магния растворитель концентрировали при пониженном давлении. После добавления ацетонитрила к остатку белое твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водным раствором бикарбоната натрия, водой и ацетонитрилом с получением соединения 4-18 (4,13 г, 4,70 ммоль) в виде белого твердого вещества. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 148,2 (с)
[0120]
1-1-8) Синтез соединения 4-20
Стадия 1
Соединение 2-20 (10,2 г, 30,0 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в DMF (250 мл) и дихлорметане (250 мл). К смеси добавляли DIEA (7,86 мл, 45 ммоль) и HBTU (12,52 г, 33,0 ммоль) и смесь интенсивно перемешивали при комнатной температуре в течение 30 минут. К полученному суспендированному раствору добавляли соединение 1 (1,35 г, 15,0 ммоль) при комнатной температуре и смесь интенсивно перемешивали. Затем смесь нагревали до 40°C и затем перемешивали в течение 2 часов. К реакционной смеси добавляли водный раствор бикарбоната натрия (50 мл), полученное белое твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водой (50 мл), ацетонитрилом (50 мл) и дихлорметаном (50 мл) с получением соединения 3-20 (7,20 г, 9,79 ммоль) в виде белого твердого вещества.
1H-ЯМР(CDCl3)δ: 6,18 (шир.с, 2H), 3,75 (м, 1H), 3,41 (м, 2H), 3,27 (м, 2H), 2,22 (м, 4H), 1,58-1,25 (м, 76H), 0,89-0,86 (м, 6H)
Стадия 2
Соединение 3-20 (1,0 г, 1,36 ммоль) суспендировали в хлороформе (50 мл) и к смеси добавляли DIEA (0,713 мл, 4,08 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (0,607 мл, 2,72 ммоль) при комнатной температуре и смесь нагревали с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь добавляли по каплям к ацетонитрилу (300 мл) при интенсивном перемешивании. Осажденное твердое вещество собирали фильтрованием и твердое вещество промывали два раза насыщенным водным раствором бикарбоната натрия (20 мл), два раза водой (20 мл) и два раза ацетонитрилом (20 мл). Полученное твердое вещество сушили при пониженном давлении с получением соединения 4-20 (843 мг, 0,901 ммоль) в виде белого твердого вещества. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ:148,2 (с)
[0121]
1-1-9) Синтез соединения 4-22
Стадия 1
Соединение 2-22 (8,79 г, 23,8 ммоль, Wako Pure Chemical Industries, Ltd.) растворяли в DMF (250 мл) и дихлорметане (250 мл). К смеси добавляли DIEA (6,25 мл, 35,8 ммоль) и HBTU (9,95 г, 26,2 ммоль) и смесь интенсивно перемешивали при комнатной температуре в течение 30 минут. К полученному суспендированному раствору добавляли соединение 1 (1,07 г, 11,9 ммоль) при комнатной температуре и смесь интенсивно перемешивали. Затем смесь нагревали до 40°C и затем перемешивали в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия (50 мл), полученное белое твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водой (50 мл), ацетонитрилом (50 мл) и дихлорметаном (50 мл) с получением соединения 3-22 (8,10 г, 8,17 ммоль) в виде белого твердого вещества.
1H-ЯМР(CDCl3)δ: 6,06 (шир.с, 2H), 3,73 (м, 1H), 3,36 (дд, 2H, J=6,0, 14,4 Гц), 3,22 (дд, 2H, J=5,2, 14,4 Гц), 2,17 (м, 4H), 1,61 (м, 4H), 1,59-1,24 (м, 80H), 0,87-0,84 (м, 6H)
Стадия 2
Соединение 3-22 (1,0 г, 1,36 ммоль) суспендировали в хлороформе (50 мл) и к смеси добавляли DIEA (0,713 мл, 4,08 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (0,607 мл, 2,72 ммоль) при комнатной температуре и смесь нагревали с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь добавляли по каплям к ацетонитрилу (300 мл) при интенсивном перемешивании. Осажденное твердое вещество собирали фильтрованием и твердое вещество промывали два раза насыщенным водным раствором бикарбоната натрия (20 мл), два раза водой (20 мл) и два раза ацетонитрилом (20 мл). Полученное твердое вещество сушили при пониженном давлении с получением соединения 4-22 (814 мг, 0,821 ммоль) в виде белого твердого вещества. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 148,2 (с)
[0122]
1-2) Синтез соединения 4-n,o

где n или o представляет собой целое число, имеющее значение 6-28.
[0123]
1-2-1) Синтез соединения 4-8,18
Стадия 1
Соединение 2-8 растворяли в DMF и дихлорметане. К смеси добавляли DIEA и HBTU и смесь перемешивали при комнатной температуре. К полученному суспендированному раствору добавляли соединение 1 при комнатной температуре и смесь перемешивали. Активированный раствор соединения 2-18, который был получен отдельно [Соединение 2-18 растворяли в DMF и дихлорметане. К смеси добавляли DIEA и HBTU и смесь перемешивали при комнатной температуре], добавляли в реакционный сосуд и смесь перемешивали при комнатной температуре. Смесь нагревали до 40°C и затем перемешивали. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, полученное твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водой, ацетонитрилом и дихлорметаном с получением соединения 6-8,18.
Стадия 2
Соединение 6-8,18 суспендировали в хлороформе и к смеси добавляли DIEA. Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит при комнатной температуре и смесь нагревали с обратным холодильником. После охлаждения до комнатной температуры реакционную смесь добавляли по каплям к ацетонитрилу при перемешивании. Осажденное твердое вещество собирали фильтрованием и твердое вещество промывали два раза насыщенным водным раствором бикарбоната натрия, два раза водой и два раза ацетонитрилом. Полученное твердое вещество сушили при пониженном давлении с получением соединения 4-8,18. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
[0124]
2) Синтез соединения 8-n
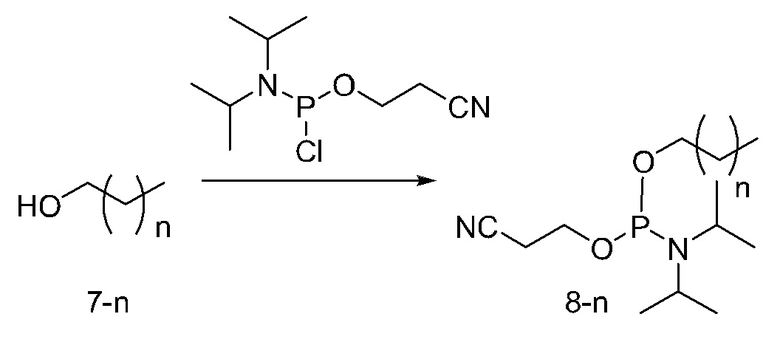
где n представляет собой целое число, имеющее значение 6-28.
[0125]
2-1) Синтез соединения 8-6
Соединение 7-6 (1,00 г, 7,68 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в дихлорметане (15 мл) и к смеси добавляли триэтиламин (2,13 мл, 15,4 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (1,71 мл, 7,68 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 3 часов. Реакцию останавливали насыщенным водным раствором бикарбоната натрия и смесь экстрагировали два раза этилацетатом (50 мл). Органический слой промывали один раз насыщенным водным раствором бикарбоната натрия (10 мл), три раза водой (10 мл) и один раз насыщенным солевым раствором (10 мл) и затем сушили над сульфатом магния. Органический слой концентрировали при пониженном давлении с получением коричневого масла, соединения 8-6 (2,60 г), в виде неочищенного продукта. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 147,2 (с)
[0126]
2-2) Синтез соединения 8-10
Соединение 7-10 (1,00 г, 5,37 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в дихлорметане (15 мл) и к смеси добавляли триэтиламин (1,49 мл, 10,7 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (1,20 мл, 5,37 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 3 часов. Реакцию останавливали насыщенным водным раствором бикарбоната натрия и смесь экстрагировали два раза этилацетатом (50 мл). Органический слой промывали один раз насыщенным водным раствором бикарбоната натрия (10 мл), три раза водой (10 мл) и один раз насыщенным солевым раствором (10 мл) и затем сушили над сульфатом магния. Органический слой концентрировали при пониженном давлении с получением коричневого масла, соединения 8-10 (2,09 г), в виде неочищенного продукта. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 147,2 (с)
[0127]
2-3) Синтез соединения 8-12
Соединение 7-12 (4,29 г, 20,0 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в дихлорметане (52 мл) и к смеси добавляли DIEA (10,5 мл, 60,0 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (5,36 мл, 24,00 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 12 часов. Реакцию останавливали насыщенным водным раствором бикарбоната натрия (20 мл) и затем смесь разделяли с использованием делительной воронки. Органический слой промывали один раз водой (100 мл), затем органический слой промывали один раз насыщенным водным раствором бикарбоната натрия (100 мл) и два раза водой (100 мл) и затем сушили над сульфатом магния. Органический слой концентрировали при пониженном давлении с получением коричневого масла, соединения 8-12 (4,80 г, 11,6 ммоль), в виде неочищенного продукта. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 147,3 (с)
[0128]
2-4) Синтез соединения 8-14
Соединение 7-14 (1,00 г, 4,12 ммоль, NACALAI TESQUE, INC.) растворяли в дихлорметане (15 мл) и к смеси добавляли триэтиламин (1,14 мл, 8,25 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (0,92 мл, 4,12 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 3 часов. Реакцию останавливали насыщенным водным раствором бикарбоната натрия и смесь экстрагировали два раза этилацетатом (50 мл). Органический слой промывали один раз насыщенным водным раствором бикарбоната натрия (10 мл), три раза водой (10 мл) и один раз насыщенным солевым раствором (10 мл) и затем сушили над сульфатом магния. Органический слой концентрировали при пониженном давлении с получением коричневого масла, соединения 8-14 (1,87 г). Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 147,2 (с)
[0129]
2-5) Синтез соединения 8-16
Соединение 7-16 (5,41 г, 20,0 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в дихлорметане (52 мл) и к смеси добавляли DIEA (10,5 мл, 60,0 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (4,91 мл, 22,00ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 12 часов. Реакцию останавливали насыщенным водным раствором бикарбоната натрия (20 мл) и затем смесь разделяли с использованием делительной воронки. Органический слой промывали водой (100 мл), затем органический слой промывали один раз насыщенным водным раствором бикарбоната натрия (100 мл) и два раза водой (100 мл) и затем сушили над сульфатом магния. Органический слой концентрировали при пониженном давлении с получением коричневого масла, соединения 8-16 (4,60 г, 9,77 ммоль), в виде неочищенного продукта. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 147,3 (с)
[0130]
2-6) Синтез соединения 8-18
Соединение 7-18 (2,99 г, 10,0 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в хлороформе (81 мл) и к смеси добавляли DIEA (3,67 мл, 21,0 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (2,34 мл, 10,5 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь концентрировали и остаток промывали ацетонитрилом (50 мл). Осажденное твердое вещество собирали фильтрованием и промывали ацетонитрилом (50 мл). Затем желтое твердое вещество сушили при пониженном давлении с получением соединения 8-18 (1,22 г, 2,45 ммоль). Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 147,2 (с)
[0131]
2-7) Синтез соединения 8-20
Соединение 7-20 (3,27 г, 10,0 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в хлороформе (81 мл) и к смеси добавляли DIEA (3,67 мл, 21,0 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (2,34 мл, 10,5 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь концентрировали и остаток промывали ацетонитрилом (50 мл). Осажденное твердое вещество собирали фильтрованием и промывали ацетонитрилом (50 мл). Затем желтое твердое вещество сушили при пониженном давлении с получением соединения 8-20 (3,19 г, 6,06 ммоль). Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 147,2 (с)
[0132]
2-8) Синтез соединения 8-22
Соединение 7-22 (3,55 г, 10,0 ммоль, Tokyo Chemical Industry Co., Ltd.) растворяли в хлороформе (81 мл) и к смеси добавляли DIEA (3,67 мл, 21,0 ммоль). Затем добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (2,34 мл, 10,5 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь концентрировали и остаток промывали ацетонитрилом (50 мл). Осажденное твердое вещество собирали фильтрованием и промывали ацетонитрилом (50 мл). Затем желтое твердое вещество сушили при пониженном давлении с получением соединения 8-22 (4,97 г, 8,96 ммоль). Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 147,2 (с)
[0133]
3) Синтез соединения 10-n
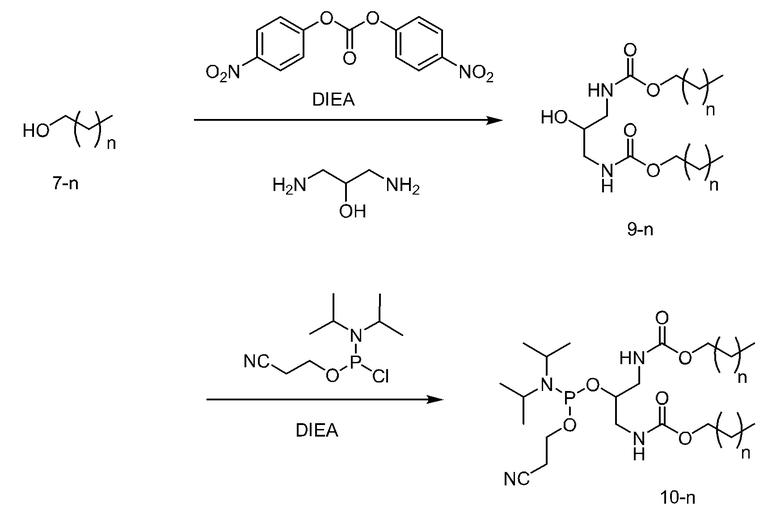
где n представляет собой целое число, имеющее значение 6-28.
[0134]
3-1) Синтез соединения 10-16
Стадия 1
В атмосфере азота к соединению 7-16 (12,1 г, 44,4 ммоль) в растворе DMF (104 мл)-дихлорметан (57,1 мл) добавляли бис-(п-нитрофенил)карбонат (13,5 г, 44,4 ммоль) и DIEA (11,6 мл, 66,6 ммоль) и затем смесь перемешивали при комнатной температуре в течение 8 часов. Затем к смеси добавляли соединение 1 (2,0 г, 22,2 ммоль) и смесь нагревали с обратным холодильником при 60°C в течение 2 часов. Полученное твердое вещество собирали фильтрованием и промывали дихлорметаном (100 мл), водой (100 мл) и ацетонитрилом (100 мл) и затем сушили при пониженном давлении с получением соединения 9-16 (15,44 г, 22,6 ммоль) в виде белого твердого вещества.
1H-ЯМР(CDCl3)δ: 5,20 (шир.с, 2H), 4,05 (м, 4H), 3,79 (м, 1H), 3,24 (м, 4H), 1,55-1,21 (м, 68H), 0,88 (м, 6H)
Стадия 2
В атмосфере азота к соединению 9-16, суспендированному в дихлорметане (582 мл), добавляли DIEA (15,8 мл, 90,0 ммоль) и 2-цианоэтил N,N-диизопропилхлорфосфорамидит (10,1 мл, 45,2 ммоль) и затем смесь нагревали с обратным холодильником при 50°C в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры органический слой промывали два раза насыщенным водным раствором бикарбоната натрия (300 мл), один раз водой (300 мл) и один раз насыщенным солевым раствором (300 мл). Органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток растворяли в дихлорметане (50 мл) и добавляли по каплям к ацетонитрилу (150 мл) для превращения в порошок. Полученное твердое вещество сушили при пониженном давлении с получением соединения 10-16 (14,2 г, 16,1 ммоль).
31P-ЯМР(CDCl3)δ: 149,1 (с)
[0135]
3-2) Синтез соединения 10-18
Стадия 1
В атмосфере азота к соединению 7-18 (4 г, 13,4 ммоль) в растворе DMF (60 мл)-дихлорметан (40 мл) добавляли бис-(п-нитрофенил)карбонат (4,1 г, 13,4 ммоль) и DIEA (3,5 мл, 20,1 ммоль) и затем смесь перемешивали при комнатной температуре в течение 5 часов. Затем к смеси добавляли соединение 1 (0,6 г, 6,7 ммоль) в DMF растворе (5 мл) и смесь перемешивали в течение ночи. Полученное твердое вещество собирали фильтрованием и промывали дихлорметаном, водой и ацетонитрилом и затем сушили при пониженном давлении с получением соединения 9-18 (4,1 г, 5,55 ммоль) в виде белого твердого вещества.
1H-ЯМР(CDCl3)δ: 5,20 (шир.с, 2H), 4,05 (т, 4H, J=8Гц), 3,79 (с, 1H), 3,32 (м, 2H), 3,23 (м, 2H), 1,25 (с, 72H), 0,88 (т, 6H, J=8Гц)
Стадия 2
В атмосфере азота к соединению 9-18 (1,0 г, 1,35 ммоль), суспендированному в дихлорметане (60 мл), добавляли DIEA (1,2 мл, 6,8 ммоль) и 2-цианоэтил N,N-диизопропилхлорфосфорамидит (0,75 мл, 3,4 ммоль) и смесь перемешивали при 50°C в течение 1,5 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли дихлорметаном (40 мл) и промывали насыщенным водным раствором бикарбоната натрия (40 мл × 2), водой (40 мл) и насыщенным солевым раствором (40 мл). Органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток растворяли в дихлорметане (15 мл) и добавляли по каплям к ацетонитрилу (150 мл) для превращения в порошок. Полученное твердое вещество сушили при пониженном давлении с получением соединения 10-18 (0,98 г, 1,04 ммоль) в виде белого твердого вещества.
31P-ЯМР(CDCl3)δ:149,1 (с)
[0136]
4) Синтез соединения 15-n
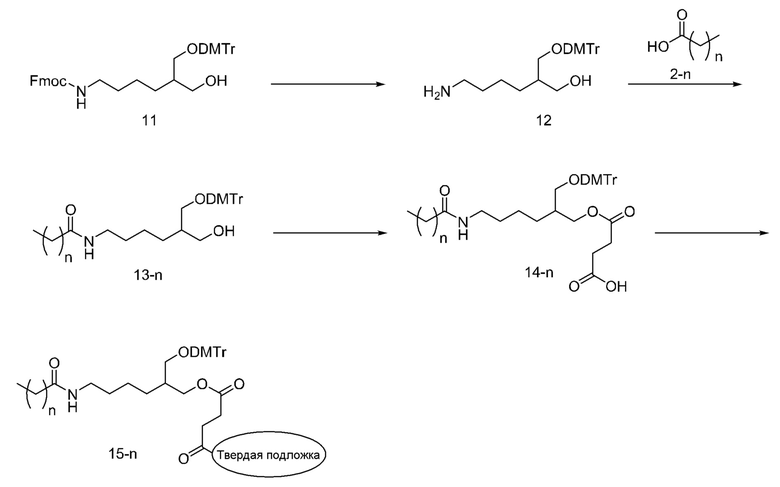
где n представляет собой целое число, имеющее значение 6-28.
[0137]
4-1) Синтез соединения 15-6
Стадия 1 и 2
К соединению 11 (US2014/0142253) (722 мг, 1,075 ммоль) в дихлорметане (5,6 мл) добавляли диэтиламин (1,4 мл, 13,40 ммоль) и смесь перемешивали при комнатной температуре в течение 17 часов. К реакционной смеси добавляли этанол и смесь перемешивали, затем растворитель концентрировали при пониженном давлении. Полученный остаток совместно упаривали два раза с этанолом с получением неочищенного продукта соединения 12.
К соединению 2-6 (239 мг, 1,505 ммоль) в этанольном растворе (5,0 мл) добавляли DMT-MM (476 мг, 1,720 ммоль), смесь перемешивали при комнатной температуре в течение 15 минут. Полученную реакционную смесь добавляли к неочищенному продукту соединения 12 в этанольном растворе (2,5 мл) и смесь перемешивали при комнатной температуре в течение 4,5 часов. Растворитель концентрировали при пониженном давлении, затем к полученному остатку добавляли насыщенный водный раствор бикарбоната натрия и воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над сульфатом натрия. Растворитель концентрировали при пониженном давлении и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=70:30→20:80) с получением соединения 13-6 (320 мг, выход 52%) в виде бесцветного масла.
1H-ЯМР (CDCl3)δ: 7,42-7,40 (2H, м), 7,32-7,26 (6H, м), 7,21 (1H, т, J=7,2 Гц), 6,83 (4H, д, J=8,8 Гц), 5,37 (1H, с), 3,79 (6H, с), 3,71-3,65 (1H, м), 3,63-3,57 (1H, м), 3,27 (1H, дд, J=9,2, 4,0 Гц), 3,25-3,15 (2H, м), 3,07 (1H, дд, J=9,2, 7,2 Гц), 2,45 (1H, т, J=5,6 Гц), 2,12 (2H, т, J=7,6 Гц), 1,78 (1H, с), 1,62-1,58 (2H, м), 1,47-1,40 (2H, м), 1,36-1,20 (12H, м), 0,87 (3H, т, J=6,8 Гц).
Стадия 3
К соединению 13-6 (310 мг, 0,538 ммоль) в дихлорметане (3,0 мл) добавляли DMAP (6,6 мг, 0,054 ммоль), DIEA (0,282 мл, 1,614 ммоль) и янтарный ангидрид (81 мг, 0,807 ммоль) и смесь перемешивали при комнатной температуре в течение 2 дней. Растворитель концентрировали при пониженном давлении и затем полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→90:10) с получением соединения 14-6 (360 мг, выход 99%) в виде бесцветного масла.
1H-ЯМР (CDCl3)δ: 7,42-7,40 (2H, м), 7,31-7,25 (6H, м), 7,19 (1H, т, J=7,2 Гц), 6,82 (4H, д, J=8,8 Гц), 5,74 (1H, т, J=5,6 Гц), 4,24 (1H, дд, J=10,8, 5,2 Гц), 4,12 (1H, дд, J=10,8, 6,0 Гц), 3,79 (6H, с), 3,52-3,45 (1H, м), 3,24-2,98 (4H, м), 2,90 (1H, кв., J=7,2 Гц), 2,59-2,50 (3H, м), 2,14 (2H, т, J=7,6 Гц), 1,90-1,85 (1H, м), 1,61-1,58 (2H, м), 1,48-1,18 (14H, м), 0,87 (3H, т, J=6,8 Гц).
Стадия 4
К соединению 14-6 (216 мг, 0,320 ммоль) в ацетонитрильном растворе (42 мл) добавляли DIEA (0,186 мл, 1,065 ммоль) и HBTU (89 мг, 0,234 ммоль) и смесь встряхивали при комнатной температуре в течение 15 минут. К реакционной смеси добавляли Native Amino lcaa CPG 1000Å (ChemGenes Corporation) (4,2 г) и смесь встряхивали в течение 24 часов. Реакционную смесь фильтровали, затем CPG смолу промывали три раза ацетонитрилом и три раза диэтиловым эфиром и сушили при пониженном давлении. К высушенной CPG добавляли смесь CapA (PROLIGO, L840045-06) и CapB (PROLIGO, L850045-06) (1:1, 42 мл) и смесь встряхивали в течение 1,5 часов. После фильтрования реакционной смеси CPG смолу промывали два раза пиридином, два раза изопропанолом и два раза диэтиловым эфиром и сушили при пониженном давлении. Количество соединения 14-6 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 15-6 с количеством на подложке, составляющим 53 мкмоль/г.
[0138]
4-2) Синтез соединения 15-10
Стадии 1 и 2
Таким же способом, как на Стадии 1 4-1), был получен неочищенный продукт соединения 12 (392 мг).
К соединению 2-10 (155 мг, 0,772 ммоль) в этанольном растворе (2,6 мл) добавляли DMT-MM (214 мг, 0,772 ммоль), смесь перемешивали при комнатной температуре в течение 30 минут. Полученную реакционную смесь добавляли к неочищенному продукту соединения 12 (392 мг) в этанольном растворе (1,3 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. К соединению 2-10 (71 мг, 0,356 ммоль) в этанольном растворе (1,3 мл) добавляли DMT-MM (99 мг, 0,356 ммоль) и смесь перемешивали при комнатной температуре в течение 15 минут. Смесь объединяли с другой реакционной смесью и перемешивали при комнатной температуре в течение 1,5 часов. Растворитель концентрировали при пониженном давлении, затем к полученному остатку добавляли насыщенный водный раствор бикарбоната натрия и воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель концентрировали при пониженном давлении и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (н-гексан: этилацетат =80:20→30:70) с получением соединения 13-10 (165 мг, 44%) в виде бесцветного масла.
1H-ЯМР (CDCl3)δ: 7,41 (2H, д, J=8,0 Гц), 7,31-7,26 (6H, м), 7,21 (1H, т, J=6,6 Гц), 6,83 (4H, д, J=8,4 Гц), 5,35 (1H, с), 3,79 (6H, с), 3,70-3,57 (2H, м), 3,28-3,16 (3H, м), 3,07 (1H, т, J=8,0 Гц), 2,43 (1H, с), 2,12 (2H, т, J=7,2 Гц), 1,78 (1H, с), 1,61-1,58 (2H, м), 1,46-1,39 (2H, м), 1,25 (20H, с), 0,87 (3H, т, J=6,0 Гц).
Стадия 3
К соединению 13-10 (222 мг, 0,352 ммоль) в дихлорметане (2,2 мл) добавляли DMAP (4,3 мг, 0,035 ммоль), DIEA (0,184 мл, 1,055 ммоль) и янтарный ангидрид (53 мг, 0,528 ммоль) и смесь перемешивали при комнатной температуре в течение 2 дней. Растворитель концентрировали при пониженном давлении и затем полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→90:10) с получением соединения 14-10 (243 мг, 94%) в виде бесцветного масла.
1H-ЯМР (CDCl3)δ: 7,41 (2H, д, J=6,0 Гц), 7,31-7,26 (6H, м), 7,20 (1H, д, J=7,2 Гц), 6,82 (4H, д, J=7,6 Гц), 5,59 (1H, с), 4,29 (1H, д, J=10,4 Гц), 4,17-4,13 (1H, м), 3,79 (6H, с), 3,23-2,98 (4H, м), 2,58 (4H, с), 2,16 (2H, т, J=8,0 Гц), 1,90 (1H, с), 1,60 (2H, с), 1,42-1,19 (22H, м), 0,88 (3H, т, J=6,8 Гц).
Стадия 4
К соединению 14-10 (209 мг, 0,285 ммоль) в ацетонитрильном растворе (38 мл) добавляли DIEA (0,166 мл, 0,950 ммоль) и HBTU (79 мг, 0,209 ммоль) и смесь встряхивали при комнатной температуре в течение 15 минут. К реакционной смеси добавляли Native Amino lcaa CPG 1000Å (ChemGenes Corporation) (3,8 г) и смесь встряхивали в течение 23 часов. Реакционную смесь фильтровали, затем CPG смолу промывали три раза ацетонитрилом и три раза диэтиловым эфиром и сушили при пониженном давлении. К высушенной CPG добавляли смесь CapA (PROLIGO, L840045-06) и CapB (PROLIGO, L850045-06) (1:1, 38 мл) и смесь встряхивали в течение 1,5 часов. После фильтрования реакционной смеси CPG смолу промывали два раза пиридином, два раза изопропанолом и два раза диэтиловым эфиром и сушили при пониженном давлении. Количество соединения 14-10 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 15-10 с количеством на подложке, составляющим 40 мкмоль/г.
[0139]
4-3) Синтез соединения 15-14
Стадии 1 и 2
Таким же способом, как на Стадии 1 4-1), был получен неочищенный продукт соединения 12 (392 мг).
К соединению 2-14 (345 мг, 1,346 ммоль) в этанольном растворе (4,0 мл) добавляли DMT-MM (372 мг, 1,346 ммоль) и смесь перемешивали при комнатной температуре в течение 15 минут. Полученную реакционную смесь добавляли к неочищенному продукту соединения 12 в этанольном растворе (2,0 мл) и смесь перемешивали при комнатной температуре в течение 28 часов. Растворитель концентрировали при пониженном давлении, затем к полученному остатку добавляли насыщенный водный раствор бикарбоната натрия и воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель концентрировали при пониженном давлении и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=70:30→20:80) с получением соединения 13-14 (228 мг, выход 37%) в виде бесцветного масла.
1H-ЯМР (CDCl3)δ: 7,40 (2H, д, J=6,8 Гц), 7,31-7,21 (7H, м), 6,83 (4H, д, J=6,4 Гц), 5,35 (1H, с), 3,79 (6H, с), 3,67 (1H, с), 3,61 (1H, с), 3,28-3,19 (3H, м), 3,07 (1H, т, J=7,2 Гц), 2,43 (1H, с), 2,12 (2H, т, J=6,0 Гц), 1,77 (1H, с), 1,59 (2H, с), 1,43 (2H, с), 1,25 (28H, с), 0,88 (3H, с).
Стадия 3
К соединению 13-14 (224 мг, 0,326 ммоль) в дихлорметане (2,2 мл) добавляли DMAP (4,0 мг, 0,033 ммоль), DIEA (0,171 мл, 0,977 ммоль) и янтарный ангидрид (49 мг, 0,488 ммоль) и смесь перемешивали при комнатной температуре в течение 2 дней. Растворитель концентрировали при пониженном давлении и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→90:10) с получением соединения 14-14 (163 мг, выход 64%) в виде бесцветного масла.
1H-ЯМР (CDCl3)δ: 7,40 (2H, д, J=6,4 Гц), 7,30-7,26 (6H, м), 7,19 (1H, т, J=7,2 Гц), 6,81 (4H, д, J=7,2 Гц), 5,57 (1H, с), 4,29 (1H, д, J=10,8 Гц), 4,17-4,13 (1H, м), 3,79 (6H, с), 3,23-2,98 (4H, м), 2,58 (4H, с), 2,15 (2H, т, J=7,2 Гц), 1,90 (1H, с), 1,59 (4H, с), 1,46-1,25 (28H, м), 0,87 (3H, т, J=5,6 Гц).
Стадия 4
К соединению 14-14 (162 мг, 0,206 ммоль) в ацетонитрильном растворе (28 мл) добавляли DIEA (0,122 мл, 0,700 ммоль) и HBTU (58 мг, 0,154 ммоль) и смесь встряхивали при комнатной температуре в течение 15 минут. К реакционной смеси добавляли Native Amino lcaa CPG 1000Å (ChemGenes Corporation) (2,8 г) и смесь встряхивали в течение 24 часов. Реакционную смесь фильтровали, затем CPG смолу промывали три раза ацетонитрилом и три раза диэтиловым эфиром и сушили при пониженном давлении. К высушенной CPG добавляли смесь CapA (PROLIGO, L840045-06) и CapB (PROLIGO, L850045-06) (1:1, 28 мл) и смесь встряхивали в течение 1,5 часов. После фильтрования реакционной смеси CPG смолу промывали два раза пиридином, два раза изопропанолом и два раза диэтиловым эфиром и сушили при пониженном давлении. Количество соединения 14-14 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 15-14 с количеством на подложке, составляющим 42 мкмоль/г.
[0140]
4-4) Синтез соединения 15-18
Стадии 1 и 2
Таким же способом, как на Стадии 1 4-1 был получен неочищенный продукт соединения 12 (392 мг).
К соединению 2-18 (466 мг, 1,490 ммоль) в этанольном растворе (5,0 мл) добавляли DMT-MM (471 мг, 1,702 ммоль), смесь перемешивали при комнатной температуре в течение 15 минут. Полученную реакционную смесь добавляли к неочищенному продукту соединения 12 в этанольном растворе (2,5 мл), смесь перемешивали при комнатной температуре в течение 4,5 часов. Растворитель концентрировали при пониженном давлении, затем к полученному остатку добавляли насыщенный водный раствор бикарбоната натрия и воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель концентрировали при пониженном давлении и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=70:30→20:80) с получением соединения 13-18 (494 мг, выход 62%) в виде бесцветного масла.
1H-ЯМР (CDCl3)δ: 7,41 (2H, д, J=7,2 Гц), 7,32-7,26 (6H, м), 7,21 (1H, т, J=7,2 Гц), 6,83 (4H, д, J=8,8 Гц), 5,36 (1H, с), 3,79 (6H, с), 3,70-3,65 (1H, м), 3,63-3,57 (1H, м), 3,27 (1H, дд, J=9,2, 4,0 Гц), 3,24-3,13 (2H, м), 3,07 (1H, дд, J=9,2, 7,2 Гц), 2,45 (1H, т, J=5,6 Гц), 2,12 (2H, т, J=7,6 Гц), 1,78 (1H, с), 1,63-1,25 (40H, м), 0,88 (3H, т, J=6,8 Гц).
Стадия 3
К соединению 13-18 (352 мг, 0,473 ммоль) в дихлорметане (3,5 мл) добавляли DMAP (5,8 мг, 0,047 ммоль), DIEA (0,248 мл, 1,419 ммоль) и янтарный ангидрид (71 мг, 0,709 ммоль) и смесь перемешивали при комнатной температуре в течение 2 дней. Растворитель концентрировали при пониженном давлении и затем полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→90:10) с получением соединения 14-18 (225 мг, 56%) в виде бесцветного масла.
1H-ЯМР (CDCl3)δ: 7,41 (2H, д, J=7,2 Гц), 7,31-7,26 (6H, м), 7,20 (1H, т, J=6,4 Гц), 6,82 (4H, д, J=7,6 Гц), 5,57 (1H, с), 4,30 (1H, дд, J=10,4, 2,4 Гц), 4,15 (1H, дд, J=10,4, 6,4 Гц), 3,79 (6H, с), 3,24-2,98 (4H, м), 2,59 (4H, с), 2,16 (2H, т, J=7,6 Гц), 1,90 (1H, с), 1,59 (4H, с), 1,44-1,21 (36H, м), 0,88 (3H, т, J=5,6 Гц).
Стадия 4
К соединению 14-18 (223 мг, 0,264 ммоль) в ацетонитрильном растворе (35 мл) добавляли DIEA (0,154 мл, 0,880 ммоль) и HBTU (73 мг, 0,194 ммоль) и смесь встряхивали при комнатной температуре в течение 15 минут. К реакционной смеси добавляли Native Amino lcaa CPG 1000Å (ChemGenes Corporation) (3,5 г) и смесь встряхивали в течение 24 часов. Реакционную смесь фильтровали, затем CPG смолу промывали три раза ацетонитрилом и три раза диэтиловым эфиром и сушили при пониженном давлении. К высушенной CPG добавляли смесь CapA (PROLIGO, L840045-06) и CapB (PROLIGO, L850045-06) (1:1, 35 мл) и смесь встряхивали в течение 1,5 часов. После фильтрования реакционной смеси CPG смолу промывали два раза пиридином, два раза изопропанолом и два раза диэтиловым эфиром и сушили при пониженном давлении. Количество соединения 14-18 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 15-18 с количеством на подложке, составляющим 56 мкмоль/г.
[0141]
5) Синтез соединения 17
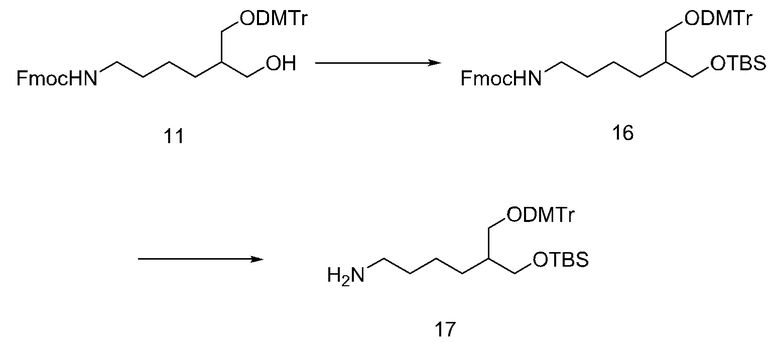
Стадии 1 и 2
К соединению 11 (US2014/0142253, 292 мг, 0,435 ммоль) в DMF растворе (2,0 мл) добавляли имидазол (71 мг, 1,044 ммоль) и трет-бутилхлордиметилсилан (79 мг, 0,522 ммоль) и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли водой и экстрагировали циклопентилметиловым эфиром. Органический слой промывали водой и насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель концентрировали при пониженном давлении с получением неочищенного продукта соединения 16 (352 мг).
К неочищенному продукту соединения 16 (352 мг) в дихлорметане (2,4 мл) добавляли диэтиламин (0,6 мл, 5,74 ммоль) и смесь перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли этанол, затем растворитель концентрировали при пониженном давлении. Остаток совместно упаривали два раза с этанолом и полученный неочищенный продукт очищали колоночной хроматографией на амино-силикагеле (хлороформ) с получением соединения 17 (190 мг, 78%) в виде бесцветного масла.
1H-ЯМР (CDCl3)δ: 7,45-7,43 (2H, м), 7,32 (4H, д, J=8,8 Гц), 7,29-7,25 (2H, м), 7,22-7,18 (1H, м), 6,81 (4H, д, J=8,8 Гц), 3,79 (6H, с), 3,68-3,61 (2H, м), 3,08-3,02 (2H, м), 2,63 (2H, т, J=7,2 Гц), 1,75-1,69 (1H, м), 1,41-1,30 (6H, м), 1,27-1,15 (2H, м), 0,84 (9H, с), 0,01 (6H, с).
[0142]
6) Синтез соединения 22-n
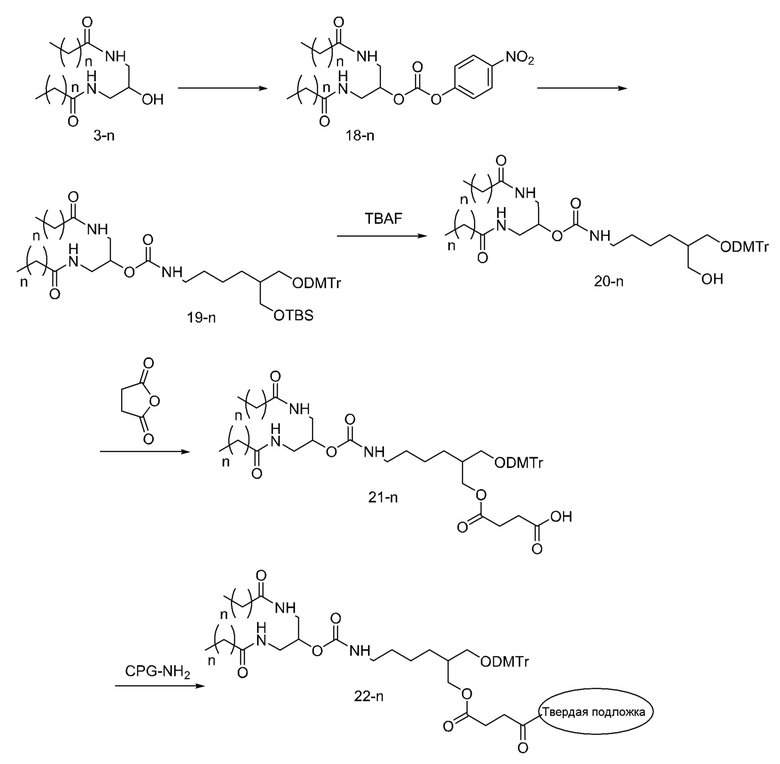
где n представляет собой целое число, имеющее значение 6-28.
[0143]
6-1) Синтез соединения 22-6
Стадия 1
К соединению 3-6 (1,0 г, 2,92 ммоль) в растворе THF (20 мл)-хлороформ (20 мл), DIEA (1,53 мл, 8,76 ммоль) добавляли бис(нитрофенил)карбонат (1,33 г, 4,38 ммоль) и DMAP (178 мг, 1,46 ммоль) и смесь перемешивали при 60°C в течение 1 часа. Реакционную смесь фильтровали. После концентрирования маточного раствора при пониженном давлении полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:этилацетат=60:40→20:80) с получением соединения 18-6 (982 мг, 66%) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 8,32-8,26 (2H, м), 7,42 (2H, дт, J=9,9, 2,5 Гц), 6,36 (2H, т, J=6,4 Гц), 4,80 (1H, ддд, J=10,7, 5,6, 3,3 Гц), 3,65-3,50 (4H, м), 2,26 (4H, т, J=7,6 Гц), 1,69-1,62 (4H, м), 1,28 (16H, дт, J=19,1, 4,7 Гц), 0,87 (6H, т, J=6,8 Гц).
Стадия 2
К соединению 17 (500 мг, 0,89 ммоль) в дихлорметане (10,0 мл) добавляли соединение 18-6 (450 мг, 0,89 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и очищали колоночной хроматографией на амино-силикагеле (гексан:этилацетат=65:35→10:90) с получением соединения 19-6 (625 мг, 76%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 7,42 (2H, д, J=7,4 Гц), 7,31 (4H, т, J=6,2 Гц), 7,26 (3H, т, J=3,9 Гц), 7,19 (1H, т, J=7,2 Гц), 6,82 (4H, т, J=6,0 Гц), 6,25 (2H, т, J=5,8 Гц), 4,70 (2H, дд, J=10,3, 5,3 Гц), 3,79 (6H, д, J=4,4 Гц), 3,62 (2H, дд, J=10,1, 5,1 Гц), 3,51 (2H, дд, J=13,3, 6,4 Гц), 3,32-3,26 (2H, м), 3,08 (4H, дт, J=20,2, 6,6 Гц), 2,19 (4H, т, J=7,7 Гц), 1,70 (1H, т, J=5,7 Гц), 1,61 (8H, т, J=9,3 Гц), 1,42 (2H, т, J=7,3 Гц), 1,26 (20H, тт, J=26,0, 10,5 Гц), 0,88 (6H, дд, J=12,0, 5,3 Гц), 0,83 (9H, с).
Стадия 3
К соединению 19-6 (625 мг, 0,67 ммоль) в THF (10 мл) добавляли TBAF (1M THF, 1,34 мл, 1,34 ммоль) и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь концентрировали при пониженном давлении и полученный неочищенный продукт очищали колоночной хроматографией на диол-силикагеле (гексан:этилацетат=50:50→10:90) с получением соединения 20-6 (541 мг, 99%) в виде бесцветной жидкости.
1H-ЯМР (CDCl3) δ: 7,41 (2H, т, J=4,3 Гц), 7,26 (9H, ддт, J=31,6, 12,0, 4,9 Гц), 6,83 (4H, д, J=8,8 Гц), 6,38 (2H, кв., J=6,1 Гц), 4,88 (1H, т, J=5,6 Гц), 4,67 (1H, т, J=5,0 Гц), 3,79 (6H, т, J=7,5 Гц), 3,69-3,61 (2H, м), 3,50-3,44 (2H, м), 3,30 (3H, тт, J=20,6, 6,5 Гц), 3,15-3,06 (3H, м), 2,63 (1H, с), 2,21-2,17 (4H, м), 1,78 (1H, с), 1,62 (4H, т, J=6,9 Гц), 1,43 (2H, т, J=5,4 Гц), 1,30 (20H, дт, J=29,2, 11,0 Гц), 0,87 (6H, т, J=6,9 Гц).
[0144]
Стадия 4
К соединению 20-6 (541 мг, 0,66 ммоль) в дихлорметане (2 мл) добавляли DIEA (0,35 мл, 1,98 ммоль), DMAP (8,0 мг, 0,066 ммоль) и янтарный ангидрид (132 мг, 1,32 ммоль) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=40:1→10:1) с получением соединения 21-6 (591 мг, 97%) в виде бесцветной жидкости.
1H-ЯМР (CDCl3) δ: 7,41 (2H, д, J=7,5 Гц), 7,31-7,25 (8H, м), 7,20 (1H, т, J=7,2 Гц), 6,82 (4H, д, J=8,5 Гц), 6,62 (1H, т, J=6,3 Гц), 6,48 (1H, т, J=6,5 Гц), 5,91 (1H, т, J=5,5 Гц), 4,71 (1H, т, J=5,3 Гц), 4,42 (1H, дд, J=11,0, 3,2 Гц), 4,14 (1H, дд, J=10,9, 5,9 Гц), 3,79 (6H, с), 3,40 (4H, тт, J=20,4, 7,0 Гц), 3,08 (4H, дкв., J=33,3, 8,0 Гц), 2,69-2,49 (4H, м), 2,20 (4H, дд, J=15,6, 8,2 Гц), 1,95 (1H, с), 1,61 (4H, д, J=7,0 Гц), 1,27 (22H, д, J=5,0 Гц), 0,87 (6H, дд, J=6,8, 5,1 Гц).
Стадия 5
К соединению 21-6 (312 мг, 0,34 ммоль) в смеси ацетонитрил/дихлорметан (4:1, 25 мл) добавляли DIEA (0,30 мл, 1,70 ммоль) и HBTU (142 мг, 0,37 ммоль) и смесь встряхивали при комнатной температуре в течение 15 минут. К реакционной смеси добавляли HybridCPG амино форму 2000Å (Prime Synthesis, Inc.) (2,8 г) и смесь встряхивали в течение 24 часов. Реакционную смесь фильтровали, затем HybridCPG смолу промывали три раза ацетонитрилом и три раза диэтиловым эфиром и сушили при пониженном давлении. К высушенной HybridCPG добавляли смесь THF/уксусной ангидрид/пиридин (8:1:1, 30 мл) и смесь встряхивали в течение 3 часов. Реакционную смесь фильтровали, затем HybridCPG смолу промывали два раза пиридином, два раза изопропанолом и два раза диэтиловым эфиром и сушили при пониженном давлении. Количество соединения 21-6 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 22-6 с количеством на подложке, составляющим 114 мкмоль/г.
[0145]
6-2) Синтез соединения 22-8
Стадия 1
К соединению 3-8 (1 г, 2,5 ммоль) в THF (20 мл) и хлороформе (20 мл) добавляли бис(нитрофенил)карбонат (1,14 г, 3,76 ммоль), DIEA (1,3 мл, 7,5 ммоль) и DMAP (0,15 г, 1,25 ммоль) и смесь перемешивали при 60°C в течение 1 часа. Реакционную смесь фильтровали. После концентрирования маточного раствора при пониженном давлении полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:этилацетат=60:40→20:80) с получением соединения 18-8 (1,17 г, 83%) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 8,27 (2H, дт, J=9,9, 2,5 Гц), 7,41 (2H, дт, J=9,9, 2,5 Гц), 6,42 (2H, т, J=6,5 Гц), 4,81-4,78 (1H, м), 3,65-3,50 (4H, м), 2,26 (4H, т, J=7,6 Гц), 1,68-1,62 (4H, м), 1,28 (24H, т, J=9,5 Гц), 0,87 (6H, т, J=6,8 Гц).
Стадия 2
К соединению 17 (500 мг, 0,89 ммоль) в дихлорметане (10,0 мл) добавляли соединение 18-8 (500 мг, 0,89 ммоль) и DIEA (0,23 мл, 1,33 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и затем очищали колоночной хроматографией на амино-силикагеле (гексан:этилацетат=50:50→10:90) с получением соединения 19-8 (661 мг, 75%) в виде бледно-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 7,42 (2H, д, J=7,4 Гц), 7,31 (4H, т, J=6,3 Гц), 7,26 (3H, т, J=3,9 Гц), 7,19 (1H, т, J=7,2 Гц), 6,81 (4H, д, J=8,8 Гц), 6,25 (2H, т, J=6,0 Гц), 4,70 (2H, кв., J=5,4 Гц), 3,79 (6H, с), 3,63 (2H, т, J=5,3 Гц), 3,51 (2H, дд, J=13,1, 6,5 Гц), 3,29 (2H, дд, J=12,9, 7,0 Гц), 3,08 (4H, дт, J=20,0, 6,5 Гц), 2,18 (4H, т, J=7,7 Гц), 1,70 (1H, т, J=5,8 Гц), 1,62 (6H, д, J=11,2 Гц), 1,42 (2H, т, J=7,2 Гц), 1,27 (28H, дт, J=37,9, 14,6 Гц), 0,87 (6H, т, J=6,8 Гц), 0,83 (9H, с).
Стадия 3
К соединению 19-8 (661 мг, 0,669 ммоль) в THF (10 мл) добавляли TBAF (1 M THF, 1,34 мл, 1,34 ммоль) и смесь перемешивали при комнатной температуре в течение 25 часов. Реакционную смесь концентрировали при пониженном давлении и затем очищали колоночной хроматографией на диол-силикагеле (гексан:этилацетат= 50:50→10:90) с получением соединения 20-8 (549 мг, 94%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 7,41 (2H, т, J=4,4 Гц), 7,32-7,19 (9H, м), 6,84 (4H, д, J=8,8 Гц), 6,35 (2H, кв., J=6,1 Гц), 4,85 (1H, т, J=5,8 Гц), 4,67 (1H, т, J=5,1 Гц), 3,79 (6H, с), 3,64 (2H, дд, J=14,3, 7,4 Гц), 3,47 (2H, дт, J=14,1, 5,8 Гц), 3,30 (3H, тт, J=19,5, 6,2 Гц), 3,15-3,06 (3H, м), 2,60 (1H, с), 2,21-2,17 (4H, м), 1,78 (1H, с), 1,62 (4H, с), 1,44 (2H, д, J=5,1 Гц), 1,27 (28H, дд, J=11,0, 3,7 Гц), 0,87 (6H, т, J=6,8 Гц).
[0146]
Стадия 4
К соединению 20-8 (549 мг, 0,63 ммоль) в дихлорметане (10 мл) добавляли DMAP (7,7 мг, 0,063 ммоль), янтарный ангидрид (126 мг, 1,25 ммоль) и DIEA (0,32 мл, 1,88 ммоль) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении, затем полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=20:1→10:1) с получением соединения 21-8 (582 мг, 95%) в виде бесцветной жидкости.
1H-ЯМР (CDCl3) δ: 7,41 (2H, д, J=7,5 Гц), 7,31-7,25 (8H, м), 7,20 (1H, т, J=7,2 Гц), 6,82 (4H, д, J=8,7 Гц), 6,61 (1H, т, J=6,2 Гц), 6,47 (1H, т, J=6,4 Гц), 5,91 (1H, т, J=5,6 Гц), 4,71 (1H, т, J=5,1 Гц), 4,42 (1H, дд, J=11,0, 3,2 Гц), 4,14 (1H, дд, J=10,9, 5,8 Гц), 3,80 (6H, д, J=6,1 Гц), 3,47-3,33 (4H, м), 3,08 (4H, ддд, J=33,6, 15,6, 8,5 Гц), 2,69-2,49 (4H, м), 2,20 (4H, дд, J=15,6, 8,2 Гц), 1,95 (1H, с), 1,55 (4H, дт, J=34,3, 6,5 Гц), 1,27 (30H, т, J=7,2 Гц), 0,87 (6H, т, J=6,8 Гц).
Стадия 5
К соединению 21-8 (300 мг, 0,31 ммоль) в смеси ацетонитрил/дихлорметан (4:1, 25 мл) добавляли DIEA (0,27 мл, 1,54 ммоль) и HBTU (128 мг, 0,34 ммоль) и смесь встряхивали при комнатной температуре в течение 15 минут. К реакционной смеси добавляли HybridCPG амино форму 2000Å (Prime Synthesis, Inc.)(2,5 г) и смесь встряхивали в течение 24 часов. Реакционную смесь фильтровали, затем HybridCPG смолу промывали три раза ацетонитрилом и три раза диэтиловым эфиром и сушили при пониженном давлении. К высушенной HybridCPG добавляли смесь THF/уксусной ангидрид/пиридин (8:1:1, 30 мл) и смесь встряхивали в течение 3 часов. Реакционную смесь фильтровали, затем HybridCPG смолу промывали два раза пиридином, два раза изопропанолом и два раза диэтиловым эфиром и сушили при пониженном давлении. Количество соединения 21-8 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 22-8 с количеством на подложке, составляющим 107 мкмоль/г.
[0147]
6-3) Синтез соединения 22-10
Стадия 1
К соединению 3-10 (2,0 г, 3,92 ммоль) в THF (50 мл) добавляли пиридин (0,379 мл, 4,70 ммоль) и 4-нитрофенилхлорформиат (947 мг, 4,70 ммоль) и смесь перемешивали при 60°C в течение 1 часа. Реакционную смесь фильтровали. После концентрирования маточного раствора при пониженном давлении полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→90:10) с получением соединения 18-10 (1,1 г, 42%) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 8,28 (2H, д, J=8,8 Гц), 7,42 (2H, д, J=8,8 Гц),6,91 (2H, д, J=9,1 Гц),4,80 (1H, с),3,57 (4H, м),2,26 (4H, т, J=7,6 Гц),1,66 (4H, т, J=6,9 Гц),1,27 (40H, д, J=20,2 Гц),0,88 (6H, т, J=6,7 Гц).
Стадия 2
К соединению 17 (41 мг, 0,074 ммоль) в дихлорметане (5,0 мл) добавляли соединение 18-10 (50 мг, 0,074 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→90:10) с получением соединения 19-10 (80 мг, 98%) в виде желтой жидкости.
1H-ЯМР (CDCl3)δ: 7,42 (2H, д, J=7,5 Гц),7,31 (7H, т, J=6,4 Гц),6,81 (4H, д, J=8,8 Гц),6,23 (2H, д, J=5,5 Гц),4,68 (1H, с),3,79 (6H, с),3,63 (2H, т, J=5,4 Гц),3,52 (2H, т, J=6,8 Гц),3,28 (2H, т, J=7,3 Гц),3,11-3,04 (4H, м),2,18 (4H, т, J=7,5 Гц),1,62 (6H, т, J=7,2 Гц),1,25 (40H, с),0,88 (6H, т, J=6,8 Гц),0,84 (9H, с), 0,01 (6H, с)
Стадия 3
К соединению 19-10 (559,2 мг, 0,535 ммоль) в THF (5 мл) добавляли триэтиламин (4,4 мл, 7,21 ммоль) и TBAF (1 M THF, 0,4 мл, 0,40 ммоль) и смесь перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь разбавляли хлороформом (10 мл) и затем промывали насыщенным водным раствором бикарбоната натрия (10 мл). Полученный органический слой концентрировали при пониженном давлении, затем полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→90:10) с получением соединения 20-10 (384 мг, 77%) в виде бесцветной жидкости.
1H-ЯМР (CDCl3)δ: 7,41 (2H, т, J=4,3 Гц),7,31 (7H, д, J=8,5 Гц),6,84 (4H, д, J=8,8 Гц),6,32 (2H, т, J=6,3 Гц),4,83 (1H, т, J=6,0 Гц),4,67 (1H, c, J=5,2 Гц),3,79 (6H, с),3,68-3,63 (2H, м),3,47 (2H, дд, J=12,9, 6,1 Гц),3,34-3,24 (3H, м),3,10 (3H, дт, J=17,5, 5,6 Гц),2,59 (1H, с),2,21-2,17 (4H, м),1,71 (1H, м),1,62 (4H, т, J=7,2 Гц),1,25 (36H, с),0,88 (6H, т, J=6,8 Гц).
[0148]
Стадия 4
К соединению 20-10 (384 мг, 0,431 ммоль) в дихлорметане (10,1 мл) добавляли DMAP (5,04 мг, 0,041 ммоль) и янтарный ангидрид (62,0 мг, 0,619 ммоль) и смесь перемешивали при комнатной температуре в течение 1 дня. Реакционную смесь концентрировали при пониженном давлении, затем полученный неочищенный продукт очищали колоночной хроматографией на диол-силикагеле (хлороформ:метанол=100:0→90:10) с получением соединения 21-10 (308 мг, 71%) в виде бесцветной жидкости.
1H-ЯМР (CDCl3)δ: 7,41 (2H, т, J=4,3 Гц),7,31 (6H, д, J=8,5 Гц),6,84 (4H, д, J=8,8 Гц), 6,81 (1H, шир.с),6,61 (1H, шир.с),5,83 (1H, шир.с),4,70 (1H, с),4,38 (1H, м),4,13 (1H, д, J=10,4 Гц),3,79 (6H, с),3,78-3,41 (6H, м),3,05 (6H, м),2,89 (6H, м),2,62-2,55 (6H, м),2,20 (4H, д, J=7,2 Гц),1,94 (1H, с),1,62 (4H, т, J=7,2 Гц),1,25 (36H, с),0,88 (6H, т, J=7,2 Гц).
Стадия 5
К соединению 21-10 (247 мг, 0,240 ммоль) в смеси ацетонитрил/дихлорметан (1:1, 20 мл) добавляли DIEA (0,168 мл, 0,982 ммоль) и HBTU (100 мг, 0,264 ммоль) и смесь встряхивали при комнатной температуре в течение 20 минут. К реакционной смеси добавляли Native Amino lcaa CPG 1000 Å (ChemGenes Corporation)(2,0 г) и смесь встряхивали в течение 12 часов. Реакционную смесь фильтровали, затем CPG смолу промывали три раза дихлорметаном и три раза диэтиловым эфиром и сушили при пониженном давлении. К высушенной HybridCPG добавляли смесь CapA (PROLIGO, L840045-06) и CapB (PROLIGO, L850045-06) (1:1, 20 мл) и смесь встряхивали в течение 30 минут. Реакционную смесь фильтровали, затем CPG смолу промывали два раза дихлорметаном и два раза диэтиловым эфиром и сушили при пониженном давлении. Количество соединения 21-10 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 22-10 с количеством на подложке, составляющим 69 мкмоль/г.
[0149]
6-4) Синтез соединения 22-12
Стадия 1
К соединению 3-12 (2,0 г, 3,92 ммоль) в THF (50 мл) добавляли пиридин (0,379 мл, 4,70 ммоль) и 4-нитрофенилхлорформиат (947 мг, 4,70 ммоль) и смесь перемешивали при 60°C в течение 1 часа. Реакционную смесь фильтровали. После концентрирования маточного раствора при пониженном давлении полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→90:10) с получением соединения 18-12 (1,1 г, 42%) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 8,28 (2H, д, J=8,8 Гц), 7,42 (2H, д, J=8,8 Гц),6,91 (2H, д, J=9,1 Гц),4,80 (1H, с),3,57 (4H, м),2,26 (4H, т, J=7,6 Гц),1,66 (4H, т, J=6,9 Гц),1,27 (40H, д, J=20,2 Гц),0,88 (6H, т, J=6,7 Гц).
Стадия 2
К соединению 17 (41 мг, 0,074 ммоль) в дихлорметане (5,0 мл) добавляли соединение 18-12 (50 мг, 0,074 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→90:10) с получением соединения 19-12 (80 мг, 98%) в виде желтой жидкости.
1H-ЯМР (CDCl3)δ: 7,42 (2H, д, J=7,5 Гц),7,31 (6H, т, J=6,4 Гц),6,81 (4H, д, J=8,8 Гц),6,23 (2H, д, J=5,5 Гц),4,68 (1H, с),3,79 (6H, с),3,63 (2H, т, J=5,4 Гц),3,52 (2H, т, J=6,8 Гц),3,28 (2H, т, J=7,3 Гц),3,11-3,04 (4H, м),2,18 (4H, т, J=7,5 Гц),1,62 (6H, т, J=7,2 Гц),1,25 (40H, с),0,88 (6H, т, J=6,8 Гц),0,84 (6H, с), 0,01 (6H, с)
Стадия 3
К соединению 19-12 (90 мг, 0,082 ммоль) в THF (5 мл) добавляли триэтиламин (1,0 мл, 7,21 ммоль) и TBAF (1 M THF, 0,4 мл, 0,40 ммоль) и смесь перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь разбавляли хлороформом (10 мл) и затем промывали насыщенным водным раствором бикарбоната натрия (10 мл). Полученный органический слой концентрировали при пониженном давлении, затем полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→95:5) с получением соединения 20-12 (84 мг, 100%) в виде бесцветной жидкости.
1H-ЯМР (CDCl3)δ: 7,41 (2H, т, J=4,3 Гц),7,31 (6H, д, J=8,5 Гц),6,84 (4H, д, J=8,8 Гц),6,34 (2H, т, J=6,3 Гц),4,83 (1H, с),4,67 (1H, с),3,79 (6H, с),3,68-3,63 (2H, м),3,47 (2H, дд, J=12,9, 6,1 Гц),3,34-3,24 (3H, м),3,10 (3H, дт, J=17,5, 5,6 Гц),2,60 (1H, с),2,21-2,17 (4H, м),1,62 (4H, т, J=6,9 Гц),1,25 (40H, с),0,88 (6H, т, J=6,8 Гц).
[0150]
Стадия 4
К соединению 20-12 (60 мг, 0,061 ммоль) в пиридиновом растворе (2 мл) добавляли DMAP (0,7 мг, 0,006 ммоль) и янтарный ангидрид (7,3 мг, 0,073 ммоль) и смесь перемешивали при комнатной температуре в течение 4 дней. Реакционную смесь концентрировали при пониженном давлении, затем полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→95:5) с получением соединения 21-12 (56 мг, 85%) в виде бесцветной жидкости.
ESI-MS (m/z): 1085 (M-H).
Стадия 5
К соединению 21-12 (52 мг, 0,048 ммоль) в смеси ацетонитрил/хлороформ (1:1, 10 мл) добавляли DIEA (0,043 мл, 0,248 ммоль) и HBTU (31 мг, 0,083 ммоль) и смесь встряхивали при комнатной температуре в течение 15 минут. К реакционной смеси добавляли Native Amino lcaa CPG 1000Å (ChemGenes Corporation) (0,5 г) и смесь встряхивали в течение 23 часов. Реакционную смесь фильтровали, затем CPG смолу промывали три раза ацетонитрилом и три раза диэтиловым эфиром и сушили при пониженном давлении. К высушенной CPG добавляли смесь CapA (PROLIGO, L840045-06) и CapB (PROLIGO, L850045-06) (1:1, 5 мл) и смесь встряхивали в течение 1,5 часов. Реакционную смесь фильтровали, затем CPG смолу промывали два раза пиридином, два раза изопропанолом и два раза диэтиловым эфиром и затем сушили при пониженном давлении. Количество соединения 21-12 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 22-12 с количеством на подложке, составляющим 31 мкмоль/г.
[0151]
6-5) Синтез соединения 22-14
Стадия 1
К соединению 3-14 (1,5 г, 3,92 ммоль) в THF (60 мл) добавляли пиридин (0,320 мл, 3,97 ммоль) и 4-нитрофенилхлорформиат (800 мг, 3,97 ммоль) и смесь нагревали с обратным холодильником в течение 3 часов. Реакционную смесь фильтровали. После концентрирования маточного раствора при пониженном давлении полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:этилацетат=66:34→45:55) с получением соединения 18-14 (1,56 г, 81%) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 8,29 (2H, д, J=10,0 Гц), 7,43 (2H, д, J=10,0 Гц), 6,31 (2H, т, J=6,4 Гц), 4,81-4,76 (1H, м), 3,65-3,58 (2H, м), 3,55-3,48 (2H, м), 2,25 (4H, т, J=7,6 Гц), 1,67-1,61 (4H, м), 1,25 (48H, с), 0,88 (6H, т, J=6,8 Гц).
Стадия 2
К соединению 17 (1,06 г, 1,88 ммоль) в дихлорметане (30 мл) добавляли соединение 18-14 (1,38 г, 1,88 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель концентрировали при пониженном давлении, затем полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:этилацетат=66:34→45:55) с получением соединения 19-14 (1,47 г, 68%) в виде белого твердого вещества.
ESI-MS (m/z): 1155 (M-H).
Стадия 3
К соединению 19-14 (1,47 г, 1,27 ммоль) в THF (30 мл) добавляли TBAF (1 M THF, 3,81 мл, 3,81 ммоль) и смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли этилацетатом, затем растворитель концентрировали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:этилацетат=50:50→5:95) с получением соединения 20-14 (1,04 г, 79%) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 7,41 (2H, д, J=7,6 Гц), 7,32-7,27 (6H, м), 7,21 (1H, т, J=7,2 Гц), 6,83 (4H, д, J=8,8 Гц), 6,37-6,35 (2H, м), 4,86 (1H, т, J=5,6 Гц), 4,69-4,64 (1H, м), 3,79 (6H, с), 3,69-3,61 (2H, м), 3,50-3,24 (6H, м), 3,15-3,06 (3H, м), 2,61 (1H, с), 2,21-2,17 (4H, м), 1,25 (58H, с), 0,88 (6H, т, J=6,8 Гц).
[0152]
Стадия 4
К соединению 20-14 (1,04 г, 0,998 ммоль) в дихлорметане (20 мл) добавляли DMAP (12 мг, 0,10 ммоль), DIEA (0,523 мл, 2,99 ммоль) и янтарный ангидрид (170 мг, 1,70 ммоль) и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении, затем полученный неочищенный продукт очищали колоночной хроматографией на диол-силикагеле (хлороформ) с получением соединения 21-14 (1,17 г) в виде белого твердого вещества.
ESI-MS (m/z): 1141 (M-H).
Стадия 5
К соединению 21-14 (585 мг, 0,512 ммоль) в смеси ацетонитрил/дихлорметан (1:1, 40 мл) добавляли DIEA (0,447 мл, 2,56 ммоль) и HBTU (214 мг, 0,563 ммоль) и смесь встряхивали при комнатной температуре в течение 15 минут. К реакционной смеси добавляли Native Amino lcaa CPG 1000Å (ChemGenes Corporation) (4,0 г) и смесь встряхивали в течение 21 часа. Реакционную смесь фильтровали, затем CPG смолу промывали смесью ацетонитрил/дихлорметан (1:1, 120 мл) и диэтиловым эфиром (60 мл) и затем сушили при пониженном давлении. К высушенной CPG добавляли смесь CapA (PROLIGO, L840045-06) и CapB (PROLIGO, L850045-06) (1:1, 40 мл) и смесь встряхивали в течение 1,5 часов. Реакционную смесь фильтровали, затем CPG смолу промывали пиридином (40 мл), изопропанолом (60 мл) и диэтиловым эфиром (60 мл) и затем сушили при пониженном давлении. Количество соединения 21-14 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 22-14 с количеством на подложке, составляющим 40 мкмоль/г.
[0153]
6-6) Синтез соединения 22-18
Стадия 1
К соединению 3-18 (1,0 г, 1,47 ммоль) в THF (40 мл) добавляли пиридин (0,143 мл, 1,76 ммоль) и 4-нитрофенилхлорформиат (356 мг, 1,77 ммоль) и смесь перемешивали при 60°C в течение 1 часа. Реакционную смесь фильтровали, затем маточный раствор концентрировали при пониженном давлении. Полученное неочищенное твердое вещество промывали этилацетатом с получением соединения 18-18 (508 мг, 41%) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 8,29 (2H, д, J=8,8 Гц),7,43 (2H, д, J=9,1 Гц),6,29 (2H, с),3,60-3,50 (4H, м),2,25 (4H, т, J=7,6 Гц),1,64 (4H, д, J=6,6 Гц),1,25 (64H, с),0,88 (6H, т, J=6,4 Гц).
Стадия 2
К соединению 17 (62 мг, 0,110 ммоль) в дихлорметане (4,0 мл) добавляли соединение 18-18 (93 мг, 0,110 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→90:10) с получением соединения 19-18 (113 мг, 81%) в виде желтой жидкости.
1H-ЯМР (CDCl3)δ: 7,42 (2H, д, J=13,4 Гц),7,31 (7H, д, J=9,3 Гц),6,81 (4H, д, J=8,8 Гц),6,22 (2H, с),4,69 (1H, с),3,78 (6H, с),3,62 (2H, т, J=5,6 Гц),3,51 (2H, дд, J=10,9, 6,1 Гц),3,32-3,27 (2H, м),3,11-3,04 (4H, м), 2,17 (4H, т, J=3,7 Гц),1,62 (6H, дд, J=10,5, 4,7 Гц),1,25 (64H, с),0,88 (6H, т, J=6,8 Гц),0,83 (9H, с), 0,01 (6H, с).
Стадия 3
К соединению 19-18 (100 мг, 0,079 ммоль) в THF (4 мл) добавляли триэтиламин (0,1 мл, 0,79 ммоль) и TBAF (1 M THF, 0,32 мл, 0,32 ммоль) и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь разбавляли хлороформом (10 мл) и затем промывали насыщенным водным раствором бикарбоната натрия (10 мл). После сушки полученного органического слоя над сульфатом магния и концентрирования при пониженном давлении полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→95:5) с получением соединения 20-18 (90 мг, 99%) в виде бесцветной жидкости.
1H-ЯМР (CDCl3)δ: 7,41 (2H, д, J=8,6 Гц),7,31 (7H, д, J=8,8 Гц),6,84 (4H, д, J=8,6 Гц),6,31 (2H, с),4,81 (1H, с),4,67 (1H, с),3,79 (6H, с),3,71-3,63 (2H, м),3,49 (2H, дд, J=14,7, 11,1 Гц),3,30 (3H, тт, J=18,8, 7,4 Гц),3,13-3,07 (3H, м),2,58 (1H, с),2,18 (4H, д, J=7,6 Гц),1,60 (6H, дд, J=9,2, 4,4 Гц)1,25 (64H, с),0,88 (6H, т, J=6,3 Гц).
[0154]
Стадия 4
К соединению 20-18 (87 мг, 0,075 ммоль) в пиридиновом растворе (2 мл) добавляли DMAP (0,9 мг, 0,007 ммоль) и янтарный ангидрид (15,8 мг, 0,151 ммоль) и смесь перемешивали при комнатной температуре в течение 7 дней. Реакционную смесь концентрировали при пониженном давлении, затем полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→95:5) с получением соединения 21-18 (85 мг, 90%) в виде бесцветной жидкости.
ESI-MS (m/z): 1253 (M-H).
Стадия 5
К соединению 21-18 (85 мг, 0,068 ммоль) в смеси ацетонитрил/хлороформ (1:1, 10 мл) добавляли DIEA (0,043 мл, 0,248 ммоль) и HBTU (38 мг, 0,10 ммоль) и смесь перемешивали при комнатной температуре в течение 15 минут. К реакционной смеси добавляли Native Amino lcaa CPG 1000Å (ChemGenes Corporation) (0,5 г) и смесь встряхивали при комнатной температуре в течение 23 часов. Реакционную смесь фильтровали, затем CPG смолу промывали три раза ацетонитрилом и три раза диэтиловым эфиром и сушили при пониженном давлении. К высушенной CPG добавляли смесь CapA (PROLIGO, L840045-06) и CapB (PROLIGO, L850045-06) (1:1, 5 мл) и смесь встряхивали в течение 1,5 часов. Реакционную смесь фильтровали, затем CPG смолу промывали два раза пиридином, два раза изопропанолом и два раза диэтиловым эфиром и сушили при пониженном давлении. Количество соединения 21-18 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 22-18 с количеством на подложке, составляющим 15 мкмоль/г.
[0155]
6-7) Синтез соединения 22-20
Стадия 1
К соединению 3-20 (1,0 г, 1,36 ммоль) в THF (35 мл) добавляли бис(4-нитрофенил)карбонат (1,241 мл, 4,08 ммоль) и DMAP (498 мг, 4,08 ммоль) и смесь перемешивали при 55°C в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли ацетонитрил (50 мл) и смесь перемешивали до осаждения твердого вещества. К суспендированному раствору добавляли воду (20 мл) и смесь интенсивно перемешивали. Полученное твердое вещество собирали фильтрованием и промывали водой (50 мл) и ацетонитрилом (50 мл) с получением соединения 18-20 (1,1 г, 92%) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 8,28 (2H, дд, J=2,0, 6,8 Гц), 7,42 (2H, дд, J=2,4, 7,2 Гц),6,30 (2H, с),4,79 (1H, с),3,61 (2H, м),3,52 (2H, м),2,20 (4H, м),1,66 (4H, м),1,25 (72H, м),0,88 (6H, т, J=6,8 Гц).
Стадия 2
К соединению 17 (219 мг, 0,388 ммоль) в THF (6,5 мл) добавляли соединение 18-20 (350 мг, 0,388 ммоль) и DMAP (47,5 мг, 0,388 ммоль) и смесь перемешивали при 65°C в течение 2 часов. К реакционной смеси добавляли 10% водный раствор ацетонитрила (70 мл) и смесь перемешивали в течение некоторого времени. Осажденное твердое вещество собирали фильтрованием с получением соединения 19-20 (420 мг, 82%) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 7,43 (2H, д, J=7,6 Гц),7,31 (7H, м),6,81 (4H, д, J=8,4 Гц),6,26 (2H, шир.с),4,73 (1H, шир.с),4,69 (1H, шир.с),3,79 (6H, с),3,79 (6H, с),3,63 (2H, м),3,49 (2H, м),3,29 (2H, д, J=14,0 Гц),3,10-3,06 (4H, м),2,18 (4H, т, J=7,6 Гц),1,68 (4H, м),1,42-1,25 (м, 72H),0,88 (6H, т, J=6,4 Гц),0,83 (с, 9H),0,00 (с, 6H).
Стадия 3
К соединению 19-20 (559 мг, 0,422 ммоль) в THF (5 мл) добавляли TBAF (1 M THF, 0,506 мл, 0,506 ммоль) и смесь перемешивали при 50°C в течение 5 часов. Реакционную смесь добавляли по каплям к 10% водному раствору ацетонитрила (100 мл) и затем осажденное твердое вещество собирали фильтрованием с получением соединения 20-20 (344 мг, 67%) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 7,41 (2H, т, J=4,3 Гц),7,31 (7H, д, J=8,5 Гц),6,84 (4H, д, J=8,8 Гц),6,35 (2H, шир.с),4,85 (1H, с),4,67 (1H, с),3,79 (6H, с),3,68 (2H, м),3,47 (2H, дд, J=12,9, 6,1 Гц),3,34-3,24 (3H, м),3,10 (3H, дт, J=17,5, 5,6 Гц),2,60 (1H, с),2,21-2,17 (4H, м),1,62 (4H, м), 1,60-1,45 (м, 4H),1,25-1,01 (72H, м),0,88 (6H, т, J=6,8 Гц).
[0156]
Стадия 4
К соединению 20-20 (344 мг, 0,284 ммоль) в дихлорметане (10 мл) добавляли DMAP (3,5 мг, 0,0284 ммоль) и янтарный ангидрид (42,6 мг, 0,426 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь добавляли по каплям к 10% водному раствору ацетонитрила (100 мл) и осажденное твердое вещество собирали фильтрованием с получением соединения 21-20 (361 мг, 97%) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 7,42 (2H, д, J=7,6 Гц),7,31-7,26 (7H, м),6,83 (4H, т, J=8,4 Гц),6,56 (1H, шир.с),6,40 (1H, шир.с),5,89 (1H, шир.с),4,71 (1H, м),4,41 (1H, д, J=8,0 Гц),4,14 (1H, дд, J=6,0,11,2 Гц),3,79 (6H, с),3,65 (1H, м), 3,43-3,37 (4H, м),3,05-3,02 (4H, м),2,19-2,17 (4H, м),1,61-1,25 (76H, м),0,88 (6H, т, J=6,8 Гц).
Стадия 5
К соединению 21-20 (190 мг, 0,145 ммоль) в смеси ацетонитрил/хлороформ (1:3, 10 мл) добавляли DIEA (0,127 мл, 0,725 ммоль) и HBTU (60,5 мг, 0,159 ммоль) и смесь встряхивали при 40°C в течение 15 минут. К реакционной смеси добавляли Native Amino lcaa CPG 1000Å (ChemGenes Corporation) (3,0 г) и смесь встряхивали в течение 2 часов. Реакционную смесь фильтровали, затем CPG смолу промывали три раза хлороформом, один раз этанолом и три раза ацетонитрилом и сушили при пониженном давлении. К высушенной CPG добавляли смесь CapA (PROLIGO, L840045-06) и CapB (PROLIGO, L850045-06) (1:1, 20 мл) и смесь встряхивали в течение 1,5 часов. Реакционную смесь фильтровали, затем CPG смолу промывали три раза хлороформом и три раза ацетонитрилом и затем сушили при пониженном давлении. Количество соединения 21-20 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 22-20 с количеством на подложке, составляющим 48 мкмоль/г.
[0157]
6-8) Синтез соединения 22-22
Стадия 1
К соединению 3-22 (2,0 г, 2,53 ммоль) в THF (35 мл) добавляли бис-(п-нитрофенил)карбонат (1,54 г, 5,05 ммоль) и DMAP (618 мг, 5,05 ммоль) и смесь перемешивали при 65°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли ацетонитрил (100 мл) и смесь перемешивали до осаждения твердого вещества. К реакционной смеси добавляли воду (20 мл) и смесь интенсивно перемешивали. Полученное твердое вещество собирали фильтрованием и промывали поочередно водой (100 мл) и ацетонитрилом (100 мл) с получением соединения 18-22 (2,27 г, 89%) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 8,28 (2H, д, J=8,8 Гц), 7,43 (2H, д, J=8,82 Гц),6,29 (2H, br т, J=6,4 Гц),4,79 (1H, шир.с),3,61 (2H, м),3,52 (2H, м),2,25 (4H, т, J=7,6 Гц),1,64 (4H, м),1,26 (84H, м),0,88 (6H, т, J=6,0 Гц)
Стадия 2
К соединению 17 (666 мг, 1,81 ммоль) в THF (10,0 мл) добавляли DMAP (144 мг, 1,81 ммоль) и соединение 18-22 (1,13 г, 1,18 ммоль) и смесь перемешивали при 65°C в течение 2 часов. К реакционной смеси медленно добавляли ацетонитрил (150 мл). Образовавшийся осадок собирали фильтрованием и промывали три раза ацетонитрилом с получением соединения 19-22 (1,5 г, 92%) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 7,42 (2H, д, J=6,8 Гц),7,32-7,20 (7H, м),6,81 (4H, д, J=6,8 Гц),6,26 (2H, шир.м),4,70 (2H, с),3,63 (2H, м),3,49 (2H, м),3,31 (2H, м),3,09-3,04 (4H, м),2,18 (4H, м),1,60 4H, м),1,25 (84H, м),0,86 (6H, т, J=6,8 Гц),0,84 (9H, с), 0,01 (6H, с)
Стадия 3
К соединению 19-22 (1,5 г, 1,07 ммоль) в THF (8,9 мл) добавляли TBAF (1 M THF, 1,64 мл, 1,69 ммоль) и смесь перемешивали при 65°C в течение 2 часов. К реакционной смеси медленно добавляли ацетонитрил (150 мл). Образовавшийся осадок собирали фильтрованием и промывали три раза ацетонитрилом с получением соединения 20-22 (1,2 г, 87%) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 7,41 (2H, т, J=7,2 Гц),7,31-7,21 (7H, м),6,84 (4H, д, J=8,0 Гц),6,34 (2H, м),4,83 (1H, с),4,67 (1H, с),3,79 (6H, с),3,67 (2H, м),3,46 (2H, м),3,33-3,24 (3H, м),3,10 (3H, м),2,17 (4H, т, J=7,6 Гц),1,78 (4H, м),1,44-1,25 (84H, м),0,88 (6H, т, J=6,0 Гц).
[0158]
Стадия 4
К соединению 20-22 (100 мг, 0,079 ммоль) в дихлорметане (3 мл) добавляли DMAP (1 мг, 0,008 ммоль) и янтарный ангидрид (11,9 мг, 0,118 ммоль) и смесь перемешивали при 45°C в течение 4 часов. К реакционной смеси добавляли по каплям ацетонитрил (10 мл) и осажденное твердое вещество собирали фильтрованием. Полученное твердое вещество промывали три раза ацетонитрилом с получением соединения 21-22 (361 мг, 97%) в виде белого твердого вещества.
1H-ЯМР (CDCl3)δ: 7,42 (2H, д, J=7,6 Гц),7,31-7,26 (7H, м),6,81 (4H, т, J=8,8 Гц),6,58 (1H, шир.м),6,43 (1H, шир.м),5,88 (1H, шир.м),4,71 (1H, м),4,40 (1H, д, J=8,0 Гц),4,14 (1H, дд, J=6,0,10,8 Гц),3,79 (6H, с),3,65 (1H, м), 3,43-3,37 (4H, м),3,13-3,02 (4H, м),2,63-2,53 (4H, м),2,23-2,18 (4H, дд, J=7,2, 14,8 Гц),2,00-1,25 (4H, м) 1,25-1,11(84H, м),0,88 (6H, т, J=6,8 Гц).
Стадия 5
К соединению 21-22 (92 мг, 0,067 ммоль) в смеси ацетонитрил/дихлорметан/хлороформ (1:2:2, 10 мл) добавляли DIEA (0,059 мл, 0,336 ммоль) и HBTU (28 мг, 0,074 ммоль) и смесь встряхивали при 40°C в течение 15 минут. К реакционной смеси добавляли Native Amino lcaa CPG 1000Å (ChemGenes Corporation) (0,9 г) и смесь встряхивали при 40°C в течение 3 часов. Реакционную смесь фильтровали, затем CPG смолу промывали три раза хлороформом, три раза ацетонитрилом и три раза этанолом и сушили при пониженном давлении. К высушенной CPG добавляли смесь CapA (PROLIGO, L840045-06) и CapB (PROLIGO, L850045-06) (1:1, 60 мл) и смесь встряхивали в течение 1,5 часов. Реакционную смесь фильтровали, затем CPG смолу промывали три раза ацетонитрилом и сушили при пониженном давлении. Количество соединения 21-22 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 22-22 с количеством на подложке, составляющим 47 мкмоль/г.
[0159]
8-1) Синтез соединения 26

В атмосфере азота к холестеринe (Соединение 25, 1,00 г, 2,59 ммоль, Wako Pure Chemical Industries, Ltd.) в дихлорметане (10 мл) добавляли DIEA (0,9 мл, 5,17 ммоль) и смесь охлаждали ледяной водой. К смеси добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (0,86 мл, 3,85 ммоль) и смесь перемешивали при охлаждении льдом в течение 40 минут. Реакционную смесь разбавляли дихлорметаном и этилацетатом (100 мл) и затем промывали насыщенным водным раствором бикарбоната натрия (100 мл) и насыщенным солевым раствором (100 мл). Органический слой сушили над сульфатом магния, фильтровали и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (SiO2:20 г, н-гексан:этилацетат=50:50→0:100) с получением соединения 26 (1,45 г, выход 95%) в виде бесцветного пенистого вещества. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
31P-ЯМР(CDCl3)δ: 145,46 (д)
[0160]
8-2) Синтез соединения 53
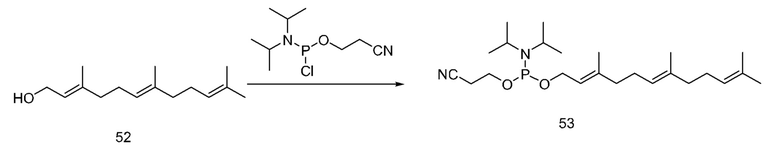
Фарнезол (Соединение 52, 1,0 мл, 3,99 ммоль, Junsei Chemical Co., Ltd.) растворяли в дихлорметане (8,9 мл) и к смеси добавляли DIEA (1,53 мл, 8,78 ммоль). Затем к смеси добавляли 2-цианоэтил N, N-диизопропилхлорфосфорамидит (0,98 мл, 4,39 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 40 минут. Дихлорметан (90 мл) и насыщенный водный раствор бикарбоната натрия (100 мл) добавляли к реакционному растворителю для остановки реакции и затем смесь разделяли с использованием делительной воронки. Органический слой промывали насыщенным солевым раствором (100 мл) и затем сушили над сульфатом магния. Органический слой концентрировали при пониженном давлении с получением неочищенного продукта соединения 53 (1,20 г, 2,84 ммоль) в виде бледно-желтого масла. Образование соединения определяли на основании введения трехвалентного фосфора при помощи 31P-ЯМР.
1H-ЯМР (CDCl3) δ: 5,37 (1H, т, J=6,6 Гц), 5,10-5,08 (2H, м), 4,19-4,13 (2H, м), 3,90-3,77 (2H, м), 3,66-3,54 (2H, м), 2,64 (2H, т, J=6,6 Гц), 2,08-1,99 (8H, м), 1,68-1,67 (6H, м), 1,61-1,60 (6H, м), 1,20-1,17 (12H, м).
31P-ЯМР (CDCl3) δ: 147,92 (1H, с).
[0161]
9) Синтез соединения 36-n

где n представляет собой целое число, имеющее значение 6-28.
[0162]
9-1) Синтез соединения 36-16
Стадия 1
В соответствии со способами, описанными в Nucleic Acids Research, 42, 8796-8807 (2014), соединение 28 синтезировали из соединения 27 в две стадии.
Стадия 2
К соединению 28 (5,0 г, 7,79 ммоль) в DMF растворе (20 мл) добавляли поочередно имидазол (690мг, 10,1ммоль, 1,3 экв.) и трет-бутилдиметилсилилхлорид (1,29 г, 8,57 ммоль, 1,1 экв.) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли этилацетатом, промывали насыщенным солевым раствором и затем сушили над сульфатом магния. Растворитель концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (SiO2:120 г, н-гексан:этилацетат: триэтиламин=90:10:1→65:35:1) с получением соединения 29 (5,50 г, выход 93%) в виде бесцветного пенистого вещества. Согласно данным 1H-ЯМР, наблюдали смесь ротамеров 1:1.
ESI-MS (m/z): 778 (M+H).
1H-ЯМР(CDCl3)δ: 7,68 (д, J=7,5Гц, 1H), 7,62 (д, J=7,5Гц, 1H), 7,58-7,51 (м, 1H), 7,40-7,05 (м, 14H), 6,74-6,63 (м, 5H), 4,61-4,49 (м, 1H), 4,33-4,15 (2m, 1H), 4,12-4,03 (м, 1H), 3,93-3,85 (м, 1H), 3,62 (с, 6H), 3,56 (дд, J=10,7, 5,4Гц, 0,5H), 3,41-3,31 (м, 1H), 3,16 (дд, J=9,0, 4,3Гц, 0,5H), 3,00 (м, 0,5H), 2,90 (м, 0,5H), 2,13-2,02 (м, 1H), 1,97-1,82 (м, 1H), 0,82 (с, 1,5H), 0,81 (с, 3H), 0,779 (с, 3H), 0,787 (с, 1,5H), 0,007 (с, 1,5H), 0,000 (с, 1,5H), -0,015 (с, 1,5H), -0,026 (с, 1,5H).
Стадия 3
К соединению 29 (2,63 г, 3,48 ммоль) в DMF растворе (10 мл) добавляли пиперидин (0,379 мл, 3,83 ммоль, 1,1 экв.). Смесь перемешивали при комнатной температуре в течение 2 часов и затем концентрировали при пониженном давлении. Остаток разбавляли этилацетатом, промывали насыщенным солевым раствором и затем сушили над сульфатом магния. Растворитель концентрировали при пониженном давлении. К смеси добавляли метанол (10 мл) и образовавшийся осадок фильтровали. Фильтрат концентрировали с получением неочищенного продукта соединения 30 (2,20 г).
ESI-MS (m/z): 524 (M+H). ВЭЖХ пик RT=3,29 мин.
Стадия 4
К соединению 30 (2,20 г, неочищенное) в дихлорметане (15 мл) добавляли поочередно триэтиламин (3,65 мл, 36,9 ммоль) и ацетоксиацетилхлорид (3,65 мл, 36,9 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли этилацетатом, промывали насыщенным солевым раствором и затем сушили над сульфатом магния. Растворитель концентрировали при пониженном давлении с получением неочищенного продукта соединения 31.
ESI-MS (m/z): 634 (M+H). ВЭЖХ пик RT=3,40 мин.
Стадия 5
Соединение 31, полученное на Стадии 4, растворяли в метаноле (10 мл), затем к смеси добавляли 28% раствор метоксида натрия в метаноле (0,60 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли этилацетатом, промывали насыщенным солевым раствором и затем сушили над сульфатом магния. Растворитель концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (SiO2:80 г, н-гексан:этилацетат:триэтиламин=80:20:1→65:35:1) с получением соединения 32 (1,45 г, выход, исходя из соединения 30: 71%) в виде бесцветного пенистого вещества. Согласно данным 1H-ЯМР, наблюдали смесь ротамеров 78:22.
ESI-MS (m/z): 592 (M+H). ВЭЖХ пик RT=3,36 мин.
1H-ЯМР(CDCl3)δ: (Основной) 7,39-7,32 (м, 2H), 7,32-7,18 (м, 7H), 6,86-6,79 (м, 4H), 4,73 (м, 1H), 4,35 (м, 1H), 4,06 (дд, J=15,1, 4,4Гц, 1H), 3,98 (дд, J=15,1, 4,4Гц, 1H), 3,79 (с, 6H), 3,57 (дд, J=10,0, 4,0Гц, 1H), 3,52 (дд, J=10,0, 6,0Гц, 1H), 3,47 (дд, J=4,4, 4,4Гц, 1H), 3,13 (дд, J=10,0, 2,5Гц, 1H), 3,08 (дд, J=10,0, 5,0Гц, 1H), 2,19 (м, 1H), 1,93 (ддд, J=13,0, 8,8, 6,0Гц, 1H), 0,87 (с, 9H), 0,08 (с, 3H), 0,07 (с, 3H). (Второстепенный) 7,39-7,32 (м, 2H), 7,32-7,18 (м, 7H), 6,86-6,79 (м, 4H), 4,54 (м, 1H), 4,06-3,98 (м, 1H), 3,92 (дд, J=14,6, 4,3Гц, 1H), 3,79 (с, 6H), 3,68 (дд, J=12,0, 4,0Гц, 1H), 3,62-3,42 (м, 2H), 3,16-3,02 (м, 2H), 2,11 (ддд, J=13,0, 5,8, 4,0Гц, 1H), 2,02 (м, 1H), 0,86 (с, 9H), 0,051 (с, 3H), 0,049 (с, 3H).
[0163]
Стадия 6
К соединению 3-16 (2,00 г, 3,21 ммоль), которое синтезировали таким же способом, как 1-1-6), суспендированному в дихлорметане (60 мл) добавляли DIEA (3,36 мл, 19,3 ммоль, 4,0 экв.) и этот раствор добавляли к метил N,N-диизопропилхлорфосфорамидиту (2,54 г, 12,8 ммоль, 2,0 экв.) в дихлорметане (10 мл). Смесь перемешивали при 45°C в течение 10 минут.
После охлаждения до комнатной температуры смесь выливали в насыщенный водный раствор бикарбоната натрия, экстрагировали хлороформом и затем промывали насыщенным солевым раствором. После сушки над сульфатом магния растворитель концентрировали при пониженном давлении. При перемешивании к полученному остатку добавляли ацетонитрил (20 мл). Осажденное вещество собирали фильтрованием с получением соединения 33-16 (2,36 г, выход 94%) в виде белого твердого вещества.
1H-ЯМР(CDCl3)δ: 6,39 (т, J=5,5 Гц, 1H, -NH), 6,18 (т, J=5,5 Гц, 1H, -NH),3,95 (м, 0,5H), 3,67-3,51 (м, 4,5H), 3,42 (с, 1,5H), 3,39 (с, 1,5H), 3,19-3,11 (м, 1H), 3,05-2,97 (м, 1H), 2,30-2,15 (м, 4H), 1,70-1,57 (м, 4H), 1,36-1,23 (м, 56H), 1,23-1,14 (м, 12H), 0,88 (т, J=6,5Гц, 6H). 31P-ЯМР(CDCl3)δ: 149,06
Стадия 7
К соединению 32 (70 0мг, 1,18 ммоль) и соединению 33-16 (1,87 г, 2,37 ммоль, 2,0 экв.), растворенным в дихлорметане (14 мл), добавляли 1H-тетразол (124 мг, 1,77 ммоль, 1,5 экв.) и смесь перемешивали при комнатной температуре в течение 2 часов. К смеси добавляли раствор 0,5 M DDTT ([(диметиламино-метилиден)амино]-3H-1,2,4-дитиазаолин-3-тион, 4,73 мл, растворенный в 3-пиколине:ацетонитриле=1:1) и смесь перемешивали при этой же температуре в течение 1 часа. Реакционную смесь разбавляли этилацетатом, промывали поочередно 10% раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и затем сушили над сульфатом магния. Растворитель концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (SiO2:45 г, н-гексан:этилацетат:триэтиламин=75:25:1→50:50:1) с получением соединения 34-16 (1,19 г, выход 79%) в виде бесцветного пенистого вещества.
1H-ЯМР(CDCl3)δ: 7,40-7,11 (м, 9H), 6,87-6,78 (м, 4H), 4,94-4,84 (м, 1H), 4,82-4,72 (м, 1H), 4,58-4,43 (м, 2H), 4,38-4,31 (м, 1H), 3,86-3,53 (м, 4H), 3,80 (с, 3H), 3,79 (с, 6H), 3,33-2,99 (м, 4H), 2,30-1,88 (м, 6H), 1,65-1,55 (м, 4H), 1,35-1,20 (м, 56H), 0,91-0,84 (м, 15H), 0,08 (с, 3H), 0,01 (с, 3H).
Стадия 8
К соединению 34-16 (1,02 г, 0,780 ммоль) в THF (10 мл) добавляли 1 моль/л TBAF-THF (0,937 мл, 1,2 экв.) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (SiO2:30 г, хлороформ:метанол:триэтиламин=97,5:2,5:1→90:10:1) с получением соединения 35-16 (608 мг, выход 65%).
1H-ЯМР(CDCl3)δ: 7,40-7,17 (м, 9H), 6,91 (м, 1H, -NH), 6,88-6,78 (м, 5H),5,00-4,35 (м, 5H), 3,85-3,44 (м, 4H), 3,79 (с, 3H), 3,78 (с, 6H), 3,35-3,06 (м, 4H), 2,31-2,09 (м, 5H), 2,06-1,94 (м, 1H), 1,68-1,52 (м, 4H), 1,36-1,18 (м, 56H), 0,88 (т, J=7,0Гц, 6H).
Стадия 9
К соединению 35-16 (210 мг, 0,176 ммоль) в дихлорметане (3 мл) добавляли поочередно триэтиламин (0,073 мл, 0,528 ммоль, 3,0 экв.), янтарный ангидрид (35 мг, 0,352 ммоль, 2,0 экв.) и DMAP (4 мг, 0,033 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (SiO2:24 г, хлороформ:метанол:триэтиламин=100:0:1→95:5:1) с получением соединения 36-16 (172 мг, выход 76%) в виде бесцветного твердого вещества.
1H-ЯМР(CDCl3)δ: 7,38-7,32 (м, 2H), 7,38-7,32 (м, 7H), 6,90-6,76 (м, 4H), 5,42 (шир.с, 1H), 5,04-4,39 (м, 4H), 3,87-3,55 (м, 4H), 3,79 (с, 3H), 3,78 (с, 6H), 3,31-3,07 (м, 4H), 2,65-2,43 (м, 4H), 2,38-2,28 (м, 1H), 2,28-2,08 (м, 5H), 1,67-1,53 (м, 4H), 1,35-1,19 (м, 56H), 0,88 (т, J=6,5Гц, 6H).
[0164]
10) Синтез соединения 46-n

где n представляет собой целое число, имеющее значение 6-28.
[0165]
10-1) Синтез соединения 46-16
Стадия 1
В соответствии со способами, описанными в Nucleic Acids Research, 42, 8796-8807 (2014), соединение 37 синтезировали из соединения 28.
Стадия 2
К соединению 37 (3,00 г, 7,15 ммоль) в дихлорметане (15 мл) добавляли триэтиламин (1,98 мл, 14,3 ммоль, 2,0 экв.) и янтарный ангидрид (751 мг, 7,51 ммоль, 1,05 экв.) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (SiO2:120 г, хлороформ:метанол:триэтиламин=95:5:1→75:25:1) с получением соединения 38 (3,37 г, выход 91%) в виде бесцветного порошка. Согласно данным 1H-ЯМР, наблюдали смесь ротамеров 63:37.
ESI-MS (m/z): 530 (M+H). ВЭЖХ пик RT=1,86 мин.
1H-ЯМР(CDCl3)δ: (Основной) 7,39-7,33 (м, 2H), 7,30-7,22 (м, 6H), 7,22-7,16 (м, 1H), 6,85-6,77 (м, 4H), 4,50 (шир.с, 1H), 4,41 (м, 1H), 3,88 (д, J=11,0Гц, 1H), 3,775 (с, 6H), 3,65 (дд, J=11,0, 4,0Гц, 1H), 3,43 (дд, J=9,2, 4,5Гц, 1H),3,14 (дд, J=9,2, 2,7Гц, 1H), 2,85-1,97 (м, 6H). (Второстепенный) 7,39-7,33 (м, 2H), 7,30-7,22 (м, 6H), 7,22-7,16 (м, 1H), 6,85-6,77 (м, 4H), 4,41 (м, 1H), 4,31 (шир.с, 1H), 4,11 (д, J=12,3Гц, 1H), 3,783 (с, 6H), 3,25 (дд, J=12,3, 3,5Гц, 1H), 3,18 (дд, J=9,5, 4,8Гц, 1H),3,10 (дд, J=9,5, 4,8Гц, 1H), 2,85-1,97 (м, 6H).
Стадия 3
В соответствии со способами, описанными в Journal of Medicinal Chemistry, 48, 7781 (2005), соединение 39 синтезировали из соединения 1.
Стадия 4
К соединению 39 (3,00 г, 7,15 ммоль) в смеси THF-вода (9:1) (30 мл) добавляли трифенилфосфин (1,98 мл, 14,3 ммоль, 2,0 экв.) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 1 часа. Температуру повышали до 70°C и смесь перемешивали в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении с получением неочищенного продукта, соединения 40, в виде бесцветного масла.
Стадия 5
К соединению 40 (7,15 ммоль) в дихлорметане (30 мл) добавляли триэтиламин (2,10 мл, 15,1 ммоль, 1,2 экв.) и Fmoc-Cl (3,59 г, 13,9 ммоль, 1,1 экв.) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли хлороформом, промывали насыщенным солевым раствором и затем сушили над сульфатом магния. Растворитель концентрировали при пониженном давлении. Полученное твердое вещество промывали н-гексаном и небольшим количеством хлороформа и затем очищали колоночной хроматографией на силикагеле (SiO2:120 г, н-гексан:этилацетат=75:25→0:100) с получением соединения 41 (4,18 г, выход из соединения 39: 65%) в виде бесцветного пенистого вещества.
ESI-MS (m/z): 512 (M+H). ВЭЖХ пик RT=2,71 мин.
1H-ЯМР(CDCl3)δ: 7,80 (д, J=7,5Гц, 2H), 7,60 (д, J=7,5Гц, 2H), 7,40 (дд, J=7,5, 7,5Гц, 2H), 7,30 (дд, J=7,5, 7,5Гц, 2H), 6,02 (шир.с, 1H), 5,21 (шир.с, 2H), 4,46-4,27 (м, 2H), 4,21 (м, 1H), 3,59 (м, 1H), 3,45-3,29 (м, 2H), 3,27-3,13 (м, 2H), 1,46 (с, 18H).
[0166]
Стадия 6
К соединению 41 (3,00 г, 7,15 ммоль) добавляли TFA (30 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Смесь концентрировали при пониженном давлении с получением неочищенного продукта соединения 42.
ESI-MS (m/z): 312 (M+H). ВЭЖХ пик RT=1,00 мин.
Стадия 7
К соединению 42 в дихлорметане (10 мл) добавляли триэтиламин (1,17 мл, 8,44 ммоль, 6,0 экв.) и стеароилхлорид (938 мг, 3,10 ммоль, 2,2 экв.) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 1 часа. Полученный белый осадок собирали фильтрованием, промывали небольшим количеством хлороформа, водой и н-гексаном и затем сушили при пониженном давлении с получением соединения 43-16 (888 мг, выход из соединения 40: 75%) в виде бесцветного твердого вещества.
1H-ЯМР(CDCl3)δ: 7,76 (д, J=7,5Гц, 2H), 7,60 (д, J=7,5Гц, 2H), 7,34 (д, J=7,5, 7,5Гц, 2H), 7,31 (д, J=7,5, 7,5Гц, 2H), 6,51 (шир.с, 2H), 6,39 (шир.с, 1H), 4,39-4,26 (м, 2H), 4,21 (м, 1H), 3,68-3,54 (м, 2H), 3,26-3,07 (м, 2H), 2,29-2,18 (м, 4H), 1,70-1,58 (м, 4H), 1,37-1,17 (м, 56H), 0,88 (т, J=7,0Гц, 6H).
Стадия 8
К соединению 43-16 (860 мг, 1,02 ммоль) в DMF растворе (5 мл) добавляли пиперидин (0,111 мл, 1,12 ммоль, 1,1 экв.) и смесь перемешивали при 80°C в течение 1,5 часов. После выстаивания при комнатной температуре в течение 2 часов образовавшийся осадок собирали фильтрованием, промывали н-гексаном и сушили при пониженном давлении. Полученное твердое вещество очищали колоночной хроматографией на силикагеле (SiO2:24 г, хлороформ:метанол=98:2→75:25) с получением соединения 44-16 (198 мг, выход 31%) в виде бесцветного твердого вещества.
1H-ЯМР(CDCl3)δ: 6,34 (шир.с, 2H), 3,48-3,36 (м, 2H), 3,06-2,98 (м, 2H), 2,99 (с, 1H), 2,25-2,18 (м, 4H), 1,70-1,58 (м, 4H), 1,37-1,18 (м, 56H), 0,88 (т, J=7,0Гц, 6H).
Стадия 9
К соединению 38 (134 мг, 0,257 ммоль), полученному на Стадии 2, в DMF растворе (2 мл) добавляли DIEA(225 мкл, 1,29 ммоль) и HBTU (127 мг, 0,334 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 10 минут. Смесь добавляли к соединению 44-16 (218 мг, 17,1 ммоль) в дихлорметане (3 мл) при 45°C и затем смесь перемешивали в течение 30 минут при 45°C. Реакционную смесь промывали насыщенным солевым раствором. После сушки над сульфатом магния растворитель концентрировали при пониженном давлении. Полученный остаток растворяли в этилацетате и к смеси добавляли н-гексан при 80°C. Осажденное вещество собирали фильтрованием с получением соединения 45-16 (244 мг, выход 85%) в виде бесцветного твердого вещества. Согласно данным 1H-ЯМР, наблюдали смесь ротамеров 63:37.
1H-ЯМР(CDCl3)δ: (Основной) 7,35-7,32 (м, 2H), 7,31-7,16 (м, 7H), 6,85-6,77 (м, 4H), 6,46 (шир.с, 1H, -NH), 4,38 (шир.с, 1H), 3,781 (с, 6H), 3,72-3,58 (м, 2H), 3,51-3,36 (м, 2H), 3,28-3,08 (м, 3H), 2,78-2,60 (м, 2H), 2,48-1,98 (м, 7H), 1,64-1,56 (м, 4H), 1,35-1,19 (м, 56H), 0,88 (т, J=7,0Гц, 6H). (Второстепенный) 7,35-7,32 (м, 2H), 7,31-7,16 (м, 7H), 6,85-6,77 (м, 4H), 6,46 (шир.с, 1H, -NH), 4,53 (шир.с, 1H), 3,783 (с, 6H), 3,72-3,58 (м, 2H), 3,51-3,36 (м, 2H), 3,28-3,08 (м, 3H), 2,48-1,98 (м, 7H), 1,64-1,56 (м, 4H), 1,35-1,19 (м, 56H), 0,88 (т, J=7,0Гц, 6H).
Стадия 10
К соединению 45-16 (340 мг, 0,303 ммоль) в дихлорметане (3 мл) добавляли поочередно триэтиламин (0,237 мл, 1,71 ммоль, 5,6 экв.), янтарный ангидрид (85 мг, 0,844 ммоль, 2,8 экв.) и DMAP (4 мг) при комнатной температуре. После перемешивания смеси при 45°C в течение 2 часов реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (SiO2:12 г, хлороформ:метанол:триэтиламин=100:0:1→80:20:1) и затем промывали н-гексаном с получением соединения 46-16 (246 мг, выход 66%) в виде бесцветного твердого вещества. Согласно данным 1H-ЯМР, наблюдали смесь ротамеров 77:23.
1H-ЯМР(CDCl3)δ: (Основной) 7,38-7,31 (м, 2H), 7,31-7,12 (м, 6H), 7,17-7,11 (м, 1H), 7,00 (шир.с, 1H), 6,85-6,77 (м, 4H), 6,74 (шир.с, 1H, -NH), 5,33 (шир.с, 1H), 4,34 (шир.с, 1H), 3,90-3,74 (м, 2H), 3,788 (с, 6H), 3,64-3,37 (м, 2H), 3,35-3,11 (м, 2H), 3,11-2,92 (м, 2H), 2,68-2,07 (м, 11H), 1,68-1,51 (м, 4H), 1,37-1,16 (м, 56H), 0,88 (т, J=6,6Гц, 6H). (Второстепенный) 7,38-7,31 (м, 2H), 7,31-7,12 (м, 6H), 7,17-7,11 (м, 1H), 7,00 (шир.с, 1H), 6,85-6,77 (м, 4H), 6,74 (шир.с, 1H, -NH), 5,20 (шир.с, 1H), 4,17 (шир.с, 1H), 3,90-3,74 (м, 2H), 3,678 (с, 6H), 3,64-3,37 (м, 2H), 3,35-3,11 (м, 2H), 3,11-2,92 (м, 2H), 2,68-2,07 (м, 11H), 1,68-1,51 (м, 4H), 1,37-1,16 (м, 56H), 0,88 (т, J=6,6Гц, 6H).
[0167]
11) Синтез соединения 49-n

где n представляет собой целое число, имеющее значение 6-28.
[0168]
11-1) Синтез соединения 49-16
Стадия 1
Способом, аналогичным способу синтеза соединения 34-16, описанному в 9-1), соединение 47-16 было получено в виде бесцветного пенистого вещества (Выход 78%).
1H-ЯМР(CDCl3)δ: 7,34 (д, J=8,0Гц, 2H), 7,31-7,21 (м, 6H), 7,18 (м, 1H), 6,87-6,79 (м, 4H), 3,78 (с, 6H), 2,25-2,02 (м, 5H), 1,94-1,84 (м, 1H), 1,64-1,49 (м, 4H), 1,33-1,16 (м, 56H), 0,88 (т, J=7,0Гц, 6H), 0,87 (с, 9H), 0,06 (с, 6H).
Стадия 2
Способом, аналогичным способу синтеза соединения 35-16, описанному в 9-1), соединение 48-16 было получено в виде бесцветного пенистого вещества (Выход 61%).
ESI-MS (m/z): 1177 (M+). ВЭЖХ пик RT=3,64 мин.
1H-ЯМР(CDCl3)δ: 7,35 (д, J=7,8Гц, 2H), 7,31-7,16 (м, 7H), 6,87-6,78 (м, 4H), 4,98-4,49 (м, 3H), 4,48-4,31 (м, 2H), 3,91-3,44 (м, 5H), 3,78 (с, 6H), 3,37-3,08 (м, 4H), 2,27-2,11 (м, 5H), 2,08-1,94 (м, 1H), 1,66-1,52 (м, 4H), 1,34-1,21 (м, 56H), 0,88 (т, J=6,7Гц, 6H).
Стадия 3
К соединению 48-16 (624 мг, 0,529 ммоль) в дихлорметане (5 мл) добавляли поочередно триэтиламин (0,330 мл, 2,39 ммоль, 4,5 экв.), янтарный ангидрид (106 мг, 0,159 ммоль, 3,0 экв.) и DMAP (13 мг, 10,6 мкмоль, 0,2 экв.) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (SiO2:24 г, хлороформ:метанол:триэтиламин=97,5:2,5:1→80:20:1) с получением соединения 49-16 (482 мг, выход 71%) в виде бесцветного твердого вещества.
[0169]
Хотя соединение 49-16 представляло собой смесь 2 типов изомеров, часть смеси разделяли колоночной хроматографией на силикагеле, и данные были получены на разном оборудовании.
Изомер 1 соединения 49-16 (изомер, который имел более высокое Rf значение на основании ТСХ с использованием в качестве растворителя хлороформ:метанол=5:1): Согласно 1H-ЯМР, наблюдали смесь ротамеров 65:35.
ESI-MS (m/z): 1277 (M+). ВЭЖХ пик RT=3,72 мин.
1H-ЯМР(CDCl3)δ: (Основной) 7,34 (д, J=7,5Гц, 2H), 7,31-7,14 (м, 7H), 6,83 (д, J=8,3Гц, 4H), 5,45 (шир.с, 1H), 4,75 (дд, J=14,1, 8,3Гц, 1H), 4,55-4,38 (м, 2H), 4,33 (м, 1H), 3,79 (с, 6H), 3,72-3,48 (м, 4H), 3,44-3,08 (м, 4H), 2,70-2,44 (м, 4H), 2,38-2,14 (м, 6H), 1,68-1,51 (м, 4H), 1,34-1,21 (м, 56H), 0,88 (т, J=6,7Гц, 6H). (Второстепенный) 7,34 (д, J=7,5Гц, 2H), 7,31-7,14 (м, 7H), 6,83 (д, J=8,3Гц, 4H), 5,20 (шир.с, 1H), 4,84 (м, 1H), 4,55-4,38 (м, 2H), 4,33 (м, 1H), 3,79 (с, 6H), 3,72-3,48 (м, 4H), 3,44-3,08 (м, 4H), 2,70-2,44 (м, 4H), 2,38-2,14 (м, 6H), 1,68-1,51 (м, 4H), 1,34-1,21 (м, 56H), 0,88 (т, J=6,7Гц, 6H). 31P-ЯМР(CDCl3)δ: 58,1
Изомер 2 соединения 49-16 (изомер, который имел более низкое Rf значение на основании ТСХ с использованием в качестве растворителя хлороформ:метанол=5:1)
ESI-MS (m/z): 1277 (M+). ВЭЖХ пик RT=3,72 мин.
1H-ЯМР(CDCl3)δ: 7,83 (шир.с, 1H), 7,37-7,10 (м, 9H), 6,74 (д, J=8,6Гц, 4H), 5,30 (шир.с, 1H), 4,62 (дд, J=14,0, 9,2Гц, 1H), 4,42-4,33 (м, 2H), 4,30 (дд, J=14,0, 9,2Гц, 1H), 3,71 (с, 6H), 2,63-2,34 (м, 4H),2,31-2,21 (м, 1H), 2,16-2,03 (м, 5H), 1,59-1,42 (м, 4H), 1,24-1,09 (м, 56H), 0,81 (т, J=6,7Гц, 6H). 31P-ЯМР(CDCl3)δ: 57,3
[0170]
12) Синтез соединения 50-n
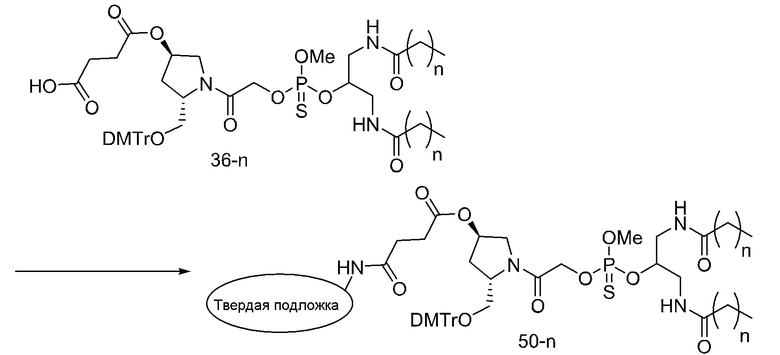
где n представляет собой целое число, имеющее значение 6-28.
[0171]
12-1) Синтез соединения 50-16
Соединение 50-16 получали, подвергая соединение 36-16, полученное в 9-1), таким же условиям реакции для нанесения на твердую подложку из смолы, как в 4). Количество соединения 36-16 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 50-16 с количеством на подложке, составляющим 32 мкмоль/г.
Таким же способом соединение 49-n можно нанести на твердую подложку из смолы.
[0172]
13) Синтез соединения 51-n

где n представляет собой целое число, имеющее значение 6-28.
[0173]
13-1) Синтез соединения 51-16
Соединение 51-16 получали, подвергая соединение 46-16, полученное в 10-1), таким же условиям реакции для нанесения на твердую подложку из смолы, как в 4). Количество соединения 46-16 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 51-16 с количеством на подложке, составляющим 33 мкмоль/г.
[0174]
14) Синтез соединения 55

Соединение 55 получали, подвергая соединение 54, описанное в US2008/0085869, таким же условиям реакции для нанесения на твердую подложку из смолы, как в 4). Количество соединения 54 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 55 с количеством на подложке, составляющим 90 мкмоль/г.
[0175]
15) Синтез соединения 63-n
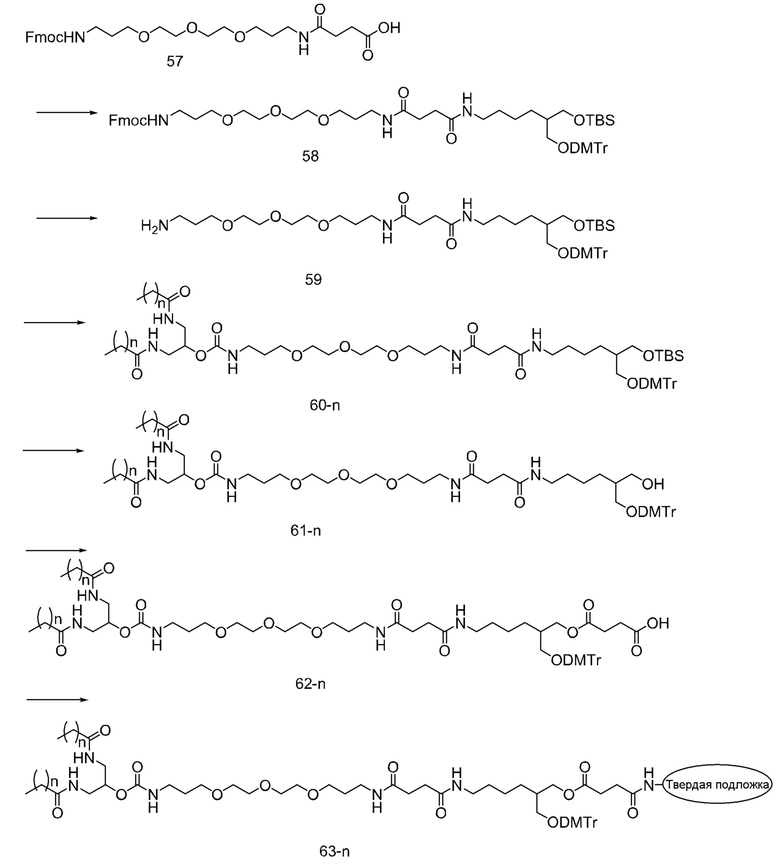
где n представляет собой целое число, имеющее значение 6-28.
[0176]
15-1) Синтез соединения 63-18
Стадия 1
К соединению 57 (Sigma-Aldrich, 0,517 г, 0,952 ммоль) в DMF растворе (4,9 мл) добавляли DIEA (0,447 мл, 3,46 ммоль) и HBTU (349 мг, 1,04 ммоль) и смесь перемешивали при комнатной температуре в течение 30 минут. Затем к смеси добавляли соединение 17 (0,488 г, 0,865 ммоль) в DMF растворе и смесь перемешивали в течение ночи. После разделения и экстрагирования гексаном/этилацетатом=1:1 (2×50 мл) и насыщенным водным раствором бикарбоната натрия (50 мл) органические слои объединяли, промывали насыщенным солевым раствором (50 мл) и сушили над безводным сульфатом магния. После фильтрования смесь концентрировали на роторном испарителе при пониженном давлении и очищали колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→70:30) с получением соединения 58 (0,837 г, 85%) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 7,75 (2H, д, J=7,5 Гц), 7,60 (2H, д, J=7,4 Гц), 7,42-7,38 (4H, м), 7,32-7,28 (7H, м), 7,24 (1H, с), 7,18 (1H, т, J=7,3 Гц), 6,81 (4H, д, J=8,9 Гц), 6,49 (1H, с), 6,08 (1H, с), 5,56 (1H, с), 4,39 (2H, д, J=6,9 Гц), 4,21 (1H, т, J=6,7 Гц), 3,79 (6H, с), 3,63-3,52 (15H, м), 3,34-3,28 (4H, м), 3,14 (2H, дд, J=13,9, 6,4 Гц), 3,03 (2H, д, J=5,6 Гц), 1,80-1,65 (5H, м), 1,63 (4H, с), 1,43-1,36 (2H, м), 1,31-1,26 (2H, м), 1,18-1,12 (2H, м), 0,84 (9H, с), 0,01 (6H, с).
Стадия 2
К соединению 58 (800 мг, 0,735 ммоль) в DMF растворе (8 мл) добавляли пиперидин (80 мкл) и смесь перемешивали при комнатной температуре в течение 2 часов. После разделения и экстрагирования гексаном/этилацетатом =1:4 и водой смесь сушили над безводным сульфатом натрия в течение ночи. После фильтрования смесь концентрировали на роторном испарителе при пониженном давлении и очищали колоночной хроматографией на амино-силикагеле (хлороформ:метанол=100:0→97:3) с получением соединения 59 (0,178 г, 0,205 ммоль) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 7,37 (8H, дт, J=50,4, 5,2 Гц), 7,26-7,18 (2H, м), 6,89 (1H, с), 6,82 (4H, т, J=5,9 Гц), 6,25 (1H, т, J=5,1 Гц), 3,81 (6H, с), 3,66-3,53 (15H, м), 3,35 (2H, кв., J=6,0 Гц), 3,16 (2H, дд, J=13,9, 6,5 Гц), 3,04 (2H, д, J=5,5 Гц), 2,80 (2H, т, J=6,7 Гц), 1,80-1,17 (17H, м), 0,85 (9H, с), 0,03-0,01 (6H, м).
Стадия 3
После того как соединение 3-18 (140 мг, 0,205 ммоль) и DMAP (63 мг, 0,514 ммоль) измельчали на небольшие частицы в колбе, их растворяли в THF (1,8 мл). К смеси добавляли бис(4-нитрофенил)карбонат (156 мг, 0,514 ммоль), смесь перемешивали при 55°C в течение 30 минут. После охлаждения до комнатной температуры THF концентрировали при пониженном давлении и остаток снова суспендировали в ацетонитриле (10 мл). После нагревания до почти растворения смесь охлаждали до комнатной температуры, и происходило осаждение твердого вещества. Затем осаждение промотировали ультразвуковым раздроблением. Осажденное твердое вещество собирали фильтрованием, промывали поочередно ацетонитрилом (10 мл), водой (10 мл) и ацетонитрилой (10 мл) и затем сушили в вакууме с получением соединения 18-18 (196 мг, 0,232 ммоль) в виде бледно-желтого твердого вещества. Соединение 18-18 (196 мг) растворяли в THF (1,8 мл). К смеси добавляли соединение 59 (178 мг, 0,205 ммоль) и DMAP (25 мг, 0,205 ммоль) и смесь перемешивали при 55°C в течение 2 часов. После охлаждения до комнатной температуры происходило осаждение твердого вещества, и к смеси добавляли ацетонитрил (18 мл). После нагревания и дробления ультразвуком к смеси добавляли воду (1,8 мл) и затем получали целевое соединение 60-18 (251 мг, 0,160 ммоль) в виде бледно-желтого твердого вещества путем фильтрования через воронку Кирияма.
[0177]
Стадия 4
После того как соединение 60-18 (246 мг, 0,157 ммоль) в THF (4,9 мл) охлаждали льдом, к смеси добавляли TBAF раствор (1 M THF, 495 мкл, 0,495 ммоль) и смесь перемешивали и нагревали до комнатной температуры в течение 30 минут. Растворитель концентрировали при пониженном давлении, затем полученный неочищенный продукт очищали колоночной хроматографией на амино-силикагеле (только хлороформ) с получением соединения 61-18 (192 мг, 0,132 ммоль) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 7,41 (2H, д, J=7,3 Гц), 7,30 (5H, дд, J=8,9, 2,1 Гц), 7,21 (1H, т, J=7,2 Гц), 6,83 (5H, д, J=8,7 Гц), 6,76 (1H, т, J=6,2 Гц), 6,44 (1H, т, J=6,6 Гц), 5,63 (1H, т, J=5,7 Гц), 4,72-4,66 (1H, м), 3,79 (6H, с), 3,76-3,74 (1H, м), 3,64-3,48 (17H, м), 3,39-3,14 (6H, м), 3,06 (2H, дд, J=9,0, 7,6 Гц), 2,76 (1H, т, J=5,8 Гц), 2,50-2,46 (6H, м), 2,19 (6H, т, J=7,6 Гц), 1,79-1,73 (7H, м), 1,49-1,42 (6H, м), 1,24 (68H, д, J=11,8 Гц), 0,89-0,87 (6H, т, J=6,3 Гц).
Стадия 5
К соединению 61-18 (191 мг, 0,131 ммоль) в дихлорметане (1,9 мл) добавляли DIEA (0,069 мл, 0,393 ммоль), DMAP (1,6 мг, 0,013 ммоль) и янтарный ангидрид (20 мг, 0,197 ммоль) и смесь перемешивали при кипячении с обратным холодильником в течение 3 часов. Растворитель концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диол-силикагеле (только хлороформ) с получением соединения 62-18 (201 мг, 0,129 ммоль) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 7,42 (2H, д, J=7,4 Гц), 7,30 (5H, д, J=8,7 Гц), 7,19 (1H, т, J=7,2 Гц), 6,81 (5H, д, J=8,7 Гц), 6,74 (1H, т, J=5,8 Гц), 6,26 (1H, т, J=5,9 Гц), 5,55 (1H, т, J=5,9 Гц), 4,72-4,67 (1H, м), 3,79 (6H, с), 3,58-3,49 (17H, м), 3,32-3,27 (6H, м), 3,14 (2H, кв., J=6,5 Гц), 3,04 (2H, д, J=5,4 Гц), 2,49-2,46 (4H, м), 2,20 (5H, т, J=7,5 Гц), 1,76-1,72 (4H, м), 1,65-1,62 (10H, м), 1,42-1,41 (3H, м), 1,25 (68H, с), 0,88 (6H, т, J=6,6 Гц).
Стадия 6
После того как соединение 62-18 (153 мг, 0,098 ммоль) растворяли в смеси ацетонитрил/дихлорметан (1:1, 10 мл), к смеси добавляли DIEA (0,067 мл, 0,392 ммоль) и HBTU (41 мг, 0,108 ммоль) и смесь встряхивали при комнатной температуре в течение 20 минут. К реакционной смеси добавляли Native Amino lcaa CPG 1000Å (ChemGenes Corporation)(1,0 г) и смесь встряхивали в течение 24 часов. Реакционную смесь фильтровали, затем CPG смолу промывали два раза ацетонитрилом, два раза дихлорметаном и два раза диэтиловым эфиром и сушили при пониженном давлении. К высушенной CPG добавляли смесь CapA (PROLIGO, L840045-06) и CapB (PROLIGO, L850045-06) (1:1, 20 мл) и смесь встряхивали в течение 30 минут. Реакционную смесь фильтровали, затем CPG смолу промывали два раза ацетонитрилом, два раза дихлорметаном и два раза диэтиловым эфиром и сушили при пониженном давлении. Количество соединения 62-18 на подложке рассчитывали при помощи колориметрического анализа DMTr катиона, и было получено соединение 63-18 с количеством на подложке, составляющим 56 мкмоль/г.
[0178]
B) Синтез олигонуклеотидов
Олигонуклеотиды, используемые в примерах настоящего описания, синтезировали с использованием фосфорамидитного способа при помощи AKTA Oligopilot10 (GE Healthcare), NS-8-I (Dainippon Seiki co., ltd.) или NS-8-II (Dainippon Seiki co., ltd.). Мономер получали в 0,1 M ацетонитрильном растворе с использованием амидита, полученного в описанном выше синтезе амидита. Время связывания составляло от 32 секунд до 10 минут, и 8-10 эквивалентов амидитного звена использовали для конденсации с одним мономером. 0,02 M Окислителя (Sigma-Aldrich) и смесь иод/пиридин/вода/=12,7/9/1 (масс/об/об) использовали для PO окисления. 50 мМ DDTT ((диметиламино-метилидин)амино-3H-1,2,4-дитиазолин-3-тион) в ацетонитриле/3-пиколине 1/1(об/об) или 1/4(об/об) и раствор ацетонитрил/пиридин 1/4 (об/об) использовали для PS окисления. ETT активатор (5-этилтио)-1H-тетразол) (Sigma-Aldrich) использовали в качестве активатора, CapA и CapB (Sigma-Aldrich) использовали в качестве кэппирующего реагента. Deb (3 масс/об% TCA CH2Cl2 раствор) (Wako Pure Chemical Industries, Ltd.) или Deb (Раствор 3 масс/об% дихлоруксусная кислота, толуол) использовали в качестве реагента для детритилирования.
SEQ-321, SEQ-323, SEQ-340, SEQ-343, SEQ-346, SEQ-349, SEQ-352, SEQ-355 и SEQ-358 были получены путем предоставления Соединения 22-18 компании GeneDesign Inc. для препоручения им синтеза нуклеиновых кислот и очистки олигонуклеотидов. DMT-бутандиолфосфорамидит, используемый для синтеза SEQ-316, закупали у ChemGenes Corporation.
[0179]
C) Синтез липид-связывающих олигонуклеотидов
1) Синтез из синтезированного амидитного звена
Смеситель, Молекулярные сита 4A 1/16 и амидит, синтезированный в A) выше (например, соединение 4-n, соединение 4-n,o, соединение 8-n и Соединение 10-n. 10-100 эквивалентов в расчете на олигонуклеотид) помещали в микроволновую пробирку (2-5 мл, 10-20 мл), изготовленную Biotage, и раствор доводили до 0,2 M хлороформом (добавляли 2-метил-2-бутан в качестве стабилизатора). После сушки в течение 5 часов добавляли олигонуклеотиды на твердофазной подложке (CPG смола или полистирольная смола) и 0,25 M ETT активатора, который представлял собой ((5-этилтио)-1H-тетразол)дихлорметан (такое же количество хлороформа), герметично закрывали и нагревали при 40°C в течение 10 минут - 1 часа. После охлаждения до комнатной температуры реакционную смесь разбавляли два раза хлороформом и смолу собирали фильтрованием. Полученную смолу использовали в PS окислении в NS-8-I (Dainippon Seiki co., ltd.) или NS-8-II (Dainippon Seiki co., ltd.). Затем высушенную смолу подвергали следующим условиям снятия защиты I или II для синтеза целевого липид-связывающего олигонуклеотида.
2) Синтез из липида на подложке из смолы
С использованием липида на подложке из смолы, синтезированного в A) выше (например, соединение 15-n, соединение 22-n, соединение 50-n, соединение 51-n, соединение 55 и Соединение 63-n), целевые липид-связывающие олигонуклеотиды синтезировали таким же способом, как в B) выше.
[0180]
D) Снятие защиты
1) Отщепление от смолы и снятие защиты фосфата и снятие защиты основания
Для выделения ДНК олигонуклеотида использовали 28% водный раствор аммиака (SEQ-1, 3 или 49) или 28% водный раствор аммиака/EtOH4/1(об/об)(Одноцепочечные олигонуклеотиды, описанные в Примерах, за исключением SEQ-1, 3 и 49) и раствор встряхивали при комнатной температуре в течение 1 часа и при 55°C в течение 5 часов. 1 мл, 5 мл или 10 мл водного раствора аммиака использовали для 1 мкмоль, 5 мкмоль или 10 мкмоль синтеза, соответственно, для реакции отсоединения. После того как смолу промывали 50% водным раствором этанола, фильтрат концентрировали при пониженном давлении до около 1-5 мл.
Когда последовательность содержала РНК, полученный раствор лиофилизировали с получением белого порошка и затем осуществляли следующую реакцию удаления защитной группы 2'-TBS.
[0181]
2) Удаление защитной группы 2'-TBS
К полученному белому порошку добавляли N-метилпирролидон/триэтиламин/триэтиламин тригидрофторид=6/1/2(об/об) и раствор перемешивали при 65°C в течение 1,5 часов. К реакционной смеси добавляли такое же количество этокситриметилсилана и раствор интенсивно перемешивали при комнатной температуре в течение 10 минут с получением осадка. После центрифугирования при 2500 × g (2 минут) слой органического растворителя осторожно удаляли. К полученному осадку добавляли диэтиловый эфир и раствор интенсивно перемешивали. Затем таким же образом осуществляли центрифугирование и удаляли органический растворитель с получением неочищенного РНК звена (белое твердое вещество).
[0182]
E) Очистка
Олигонуклеотиды без липидного лиганда, такие как SEQ-1, 3 и 49, очищали обращенно-фазовой ВЭЖХ с использованием Условия 1.
Условия для обращенно-фазовой ВЭЖХ
Условие 1
Подвижные фазы
Буфер A: 100 мМ водный раствор TEAA (ацетат триэтиламмония, pH 7,0) или 100 мМ водный раствор AcONa (pH5,4)
Буфер B: ацетонитрил
Градиент концентрации B: 10-30%
(Условие 1-1)
Колонка: Hydrosphere C18 (YMC co., ltd.) 100×20мм в.д., S-5 мкм, 12 нм
Скорость потока: 10 мл/мин
Температура колонки: комнатная температура
Детекция УФ: 260 нм
(Условие 1-2)
Колонка: Hydrosphere C18 (YMC co., ltd.) 150×10мм в.д., S-5 мкм, 12 нм
Скорость потока: 4 мл/мин
Температура колонки: комнатная температура
Детекция УФ: 260 нм
Одноцепочечные олигонуклеотиды с липидным лигандом(лигандами) (Одноцепочечные олигонуклеотиды, описанные в Примерах, за исключением SEQ-1, 3 и 49) очищали обращенно-фазовой ВЭЖХ с использованием Условия 2.
Условие 2
Условие для обращенно-фазовой ВЭЖХ
В соответствии с липидной растворимостью соединения, концентрацию B в начале доводили от 20% до 50%.
Подвижные фазы
Буфер A: 100 мМ водный раствор TEAA (ацетат триэтиламмония pH7,0) или 100 мМ водный раствор AcONa (pH5,4)
Буфер B: ацетонитрил
Градиент концентрации B: 20-80% (соединения, содержащие L4-8 или L4-10),
30-60% (соединения, содержащин LToc или Lchol),
30-80% (соединения, содержащие L4-12, L4-14, L4-16, L4-18, M22-12 или M51-16),
40-80% (соединения, содержащие L4-20 или L4-22),
50-80% (соединения, содержащие M22-18)
(Условие 2-1)
Колонка: YMC-Pack C4 (YMC co., ltd.) 100×20мм в.д., S-5 мкм, 12 нм
Скорость потока: 10 мл/мин
Температура колонки: комнатная температура
Детекция УФ: 260 нм
(Условие 2-2)
Колонка: YMC-Pack C4 (YMC co., ltd.)150×10мм в.д., S-5 мкм, 12 нм
Скорость потока: 4 мл/мин
Температура колонки: комнатная температура
Детекция УФ: 260 нм
[0183]
F) Обессоливание и лиофилизация очищенного олигонуклеотида
С использованием VivaSpin20 (MWCO 3000) (Sartorius) и центрифужного фильтра Amicon Ultra-4 Centrifugal Filter Units-3K ультрафильтрацию повторяли для полученного олигонуклеотида для удаления солевого компонента из фракции. Затем смесь лиофилизировали с получением целевого олигонуклеотида в виде порошка. Для олигонуклеотидов, очищенных с использованием TEAA растворителя, процедуру обессоливания осуществляли после преобразования солевой формы с использованием 100 мМ раствора ацетат натрия (20 мл).
[0184]
G) Анализ чистоты олигонуклеотидов
Полученный олигонуклеотид был подтвержден как имеющий целевую последовательность путем сопоставления найденных молекулярных масс, определенных методом СВЭЖХ/МС, и рассчитанных молекулярных масс.
Условие 1 (SEQ-1, 3 или 49)
Xevo G2 Tof System (Waters)
Колонка: Aquity OST C18 (2,1×50 мМ) (Waters)
Подвижные фазы
Буфер A: 200 мМ 1,1,1,3,3,3-гексафтор-2-пропанола/8мМ триэтиламина
Буфер B: метанол
Градиент концентрации B: 10-30% (10 мин)
Температура: 50°C
Скорость потока: 0,2 мл/мин
Условие 2 (Одноцепочечные олигонуклеотиды, описанные в Примерах, за исключением SEQ-1, 3 и 49)
Xevo G2 Tof System (Waters)
Колонка: ACQUITY UPLC Protein BEH C4 Column, 300Å, 1,7мкм, 2,1мм×100мм, 1/pkg (Waters)
Подвижные фазы
Буфер A: 200 мМ 1,1,1,3,3,3-гексафтор-2-пропанола/8мМ триэтиламина
Буфер B: метанол
Градиент концентрации B: 10-95% (10 мин)
Температура: 50°C
Скорость потока: 0,2 мл/мин
[0185]
Результаты показаны в Таблицах 1-3.
[0186]
Таблица 1
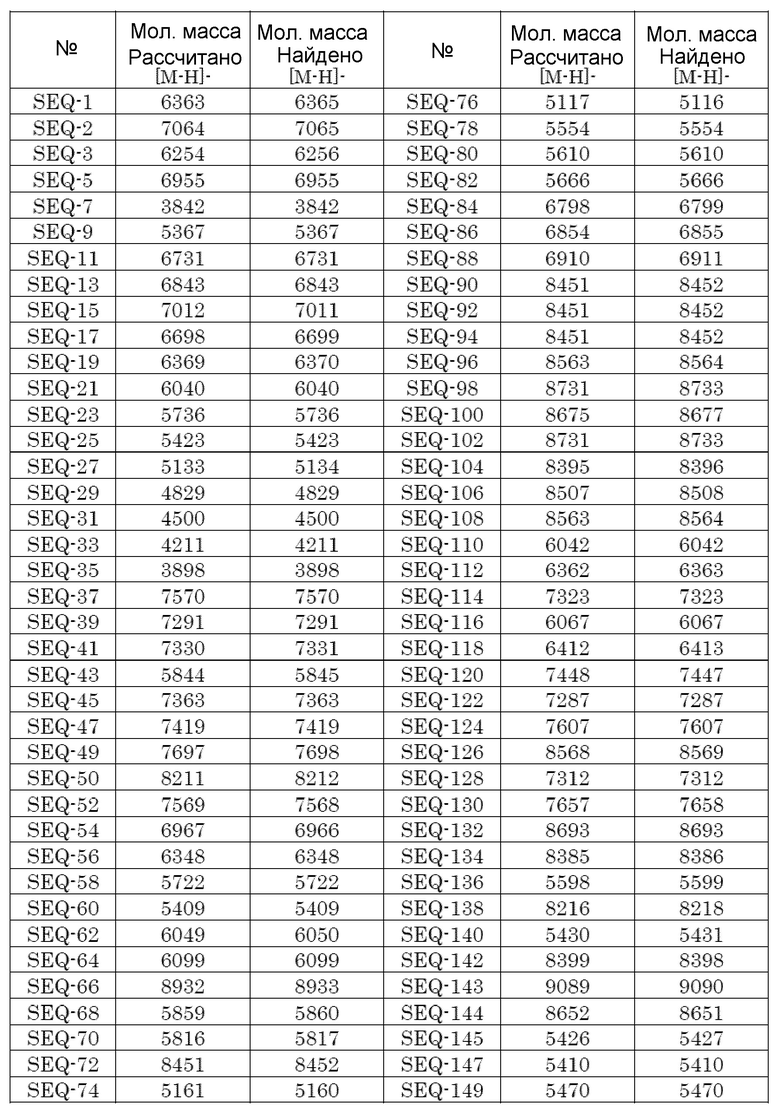
[0187]
Таблица 2
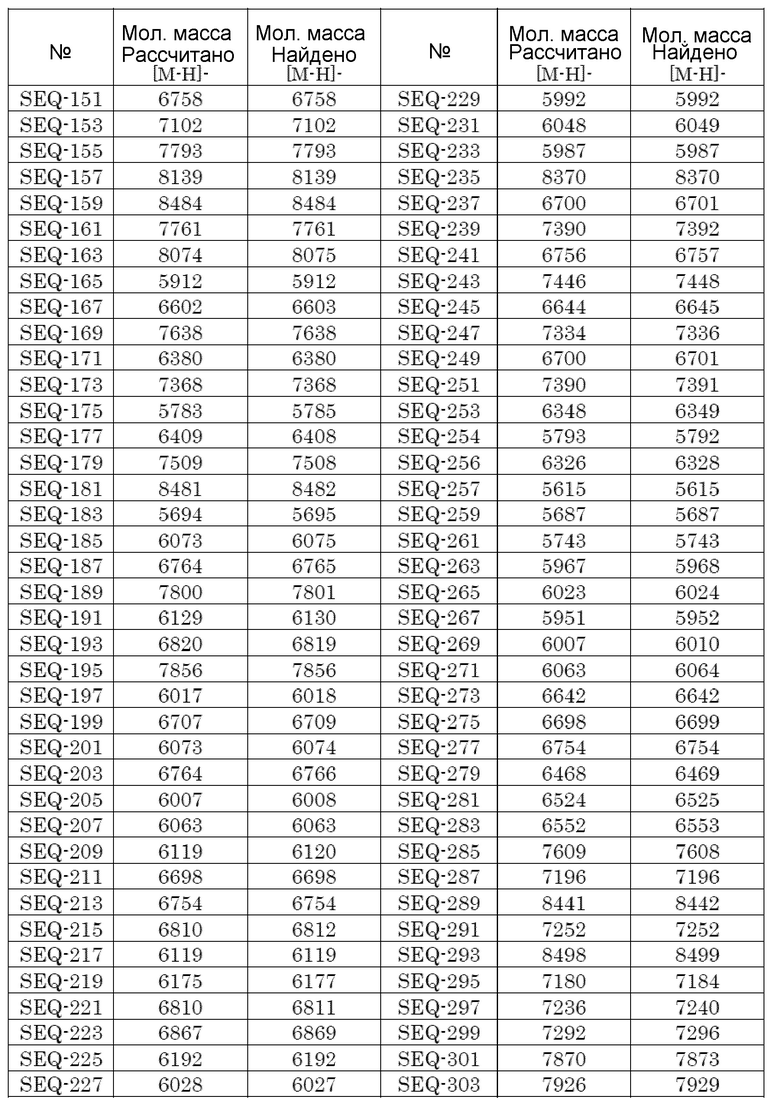
[0188]
Таблица 3
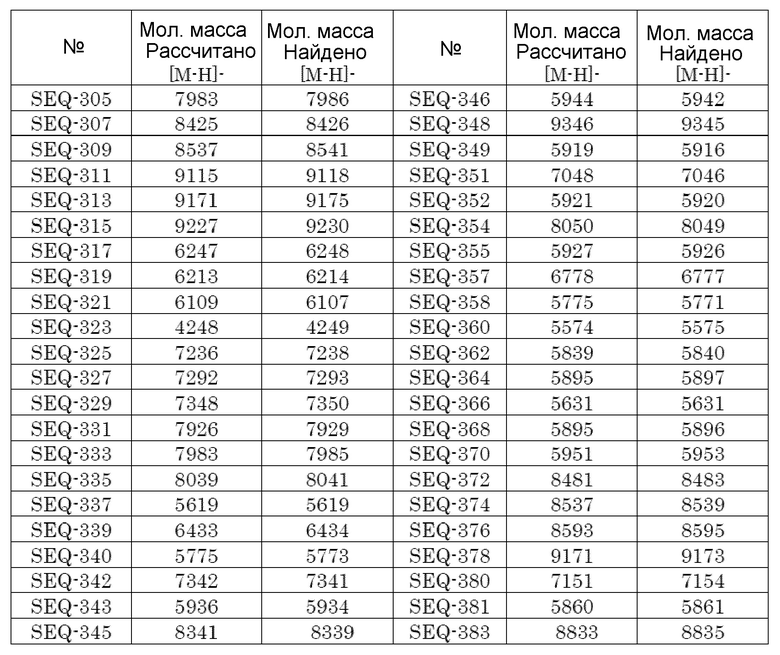
[0189]
I) Получение двухцепочечного олигонуклеотида
Связывающиеся с липидами двухцепочечные олигонуклеотиды по настоящему изобретению получали, как показано ниже. После смешивания эквимолярного количества 100 мкм раствора каждого олигонуклеотида раствор нагревали при 75°C в течение 5 минут и охлаждали естественным образом до комнатной температуры с получением двухцепочечных нуклеиновых кислот. Подтверждение образования двухцепочечных структур осуществляли при помощи эксклюзионной хроматографии.
Колонка: YMC-PAC Диол-120 (4,6 × 300 мм) (YMC co., ltd.)
Подвижные фазы: 40% ацетонитрила в 1 × PBS растворе
Скорость потока: 0,5 мл/мин
Температура: комнатная температура
[0190]
Синтезированные олигонуклеотиды показаны в Таблицах 4-27.
[0191]
Таблица 4

[0192]
Таблица 5
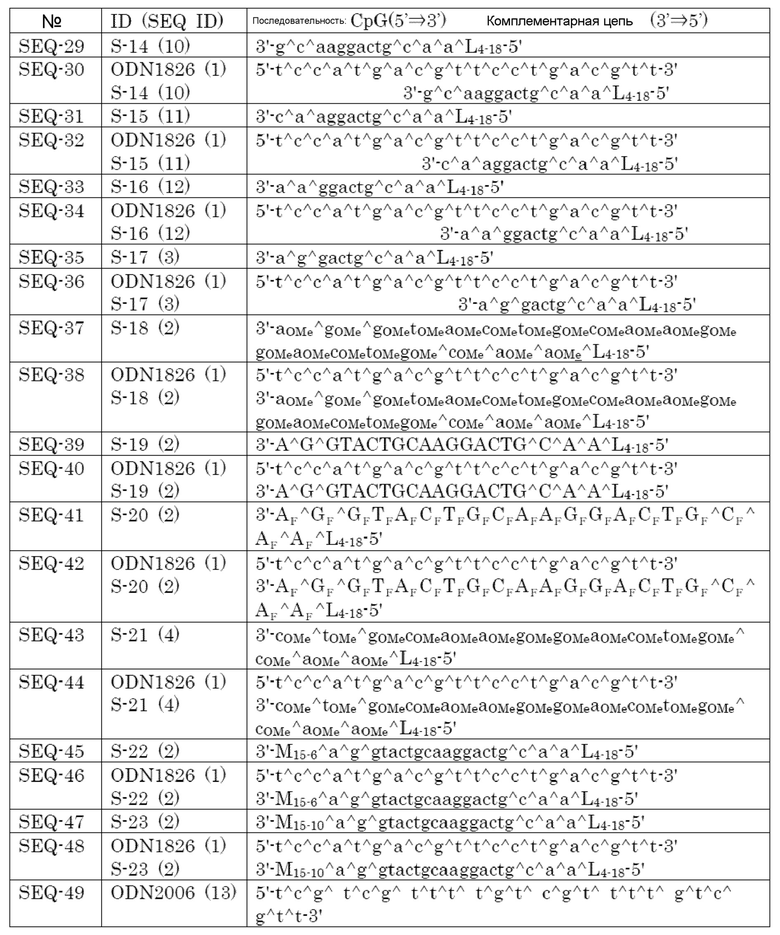
[0193]
Таблица 6
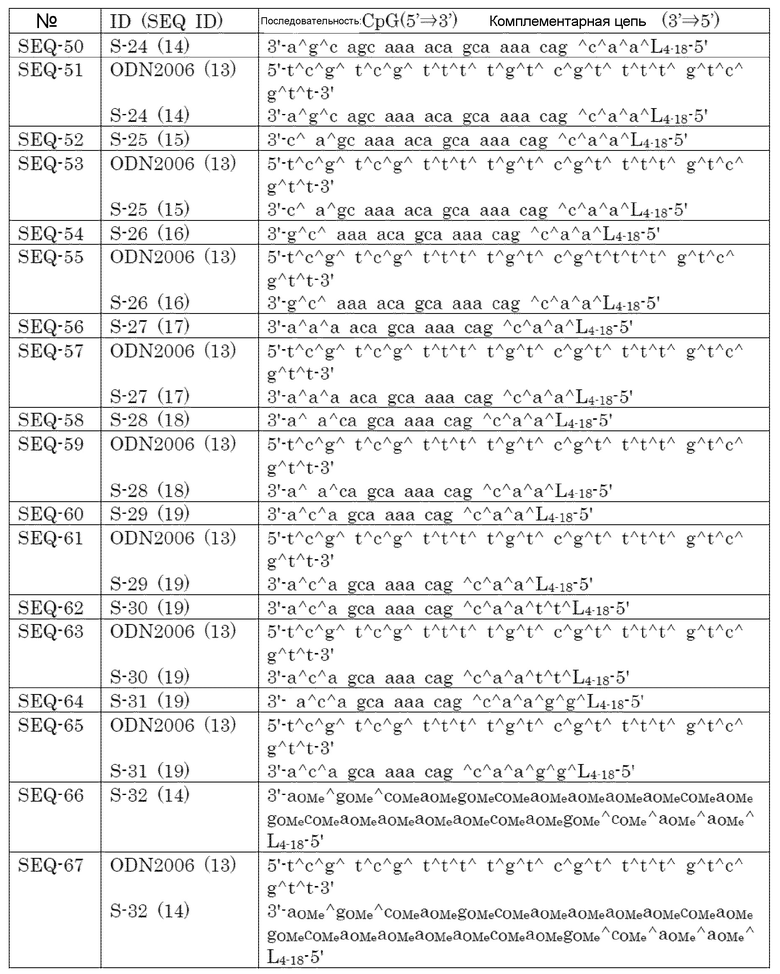
[0194]
Таблица 7
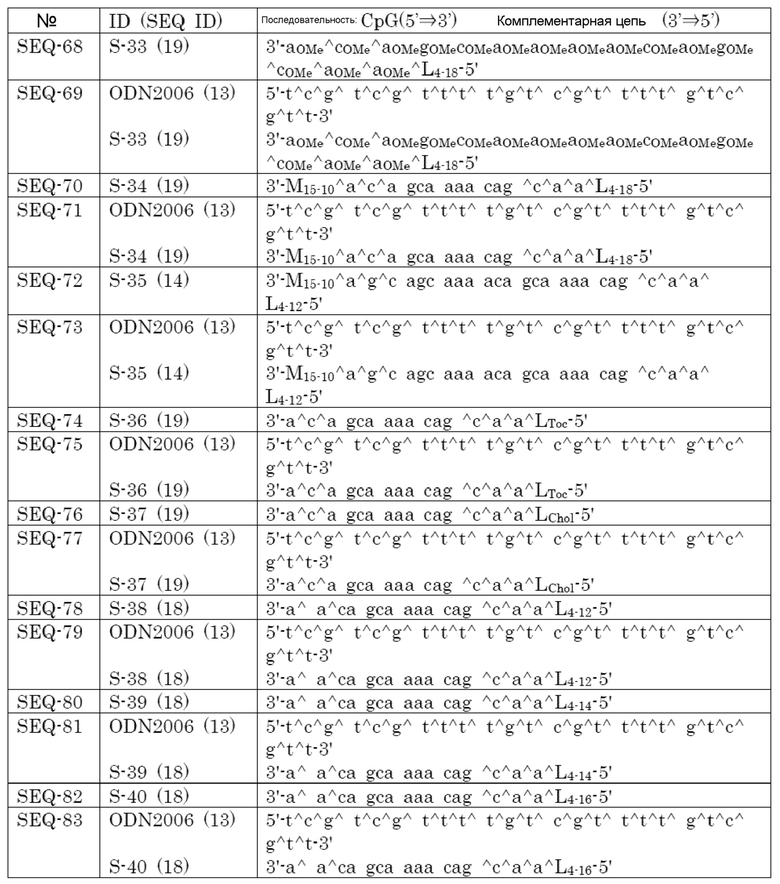
[0195]
Таблица 8

[0196]
Таблица 9
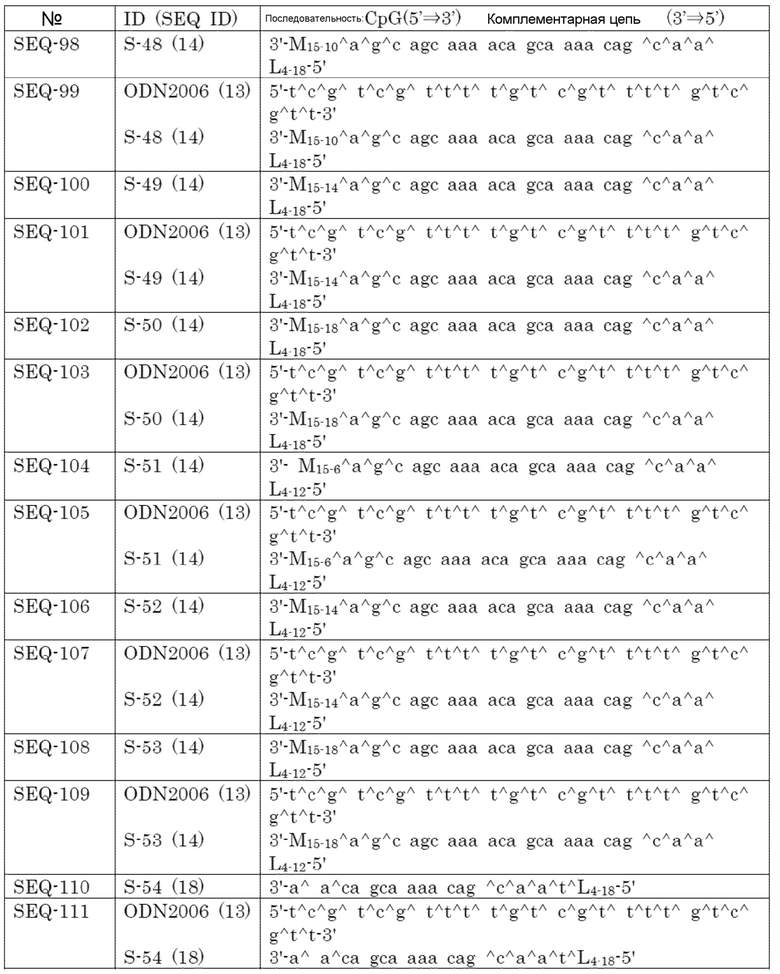
[0197]
Таблица 10
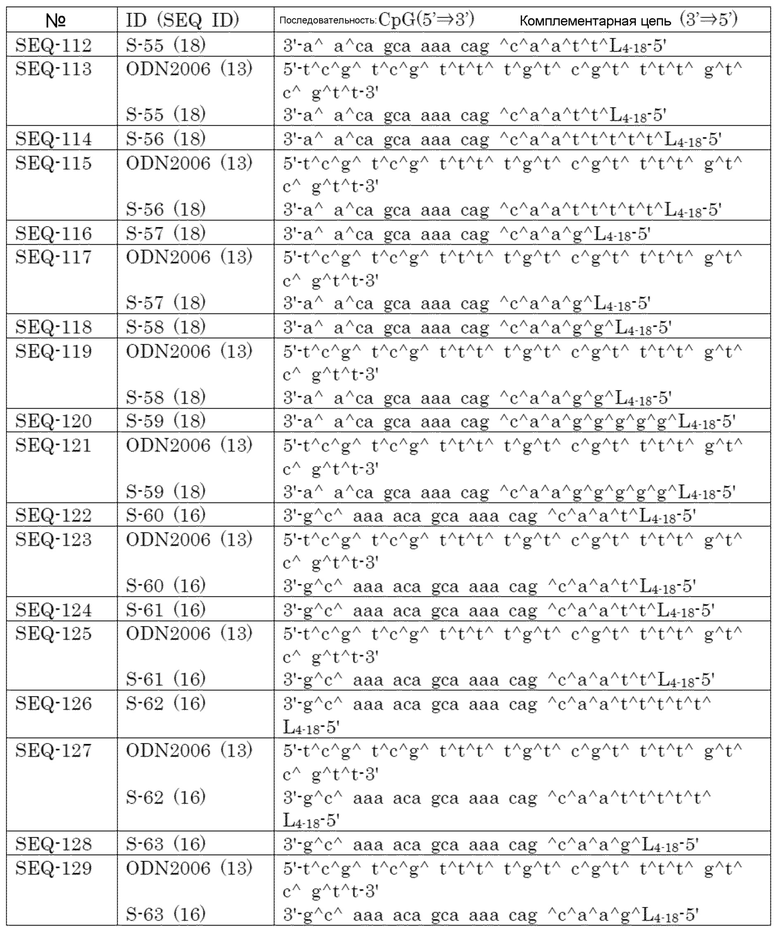
[0198]
Таблица 11
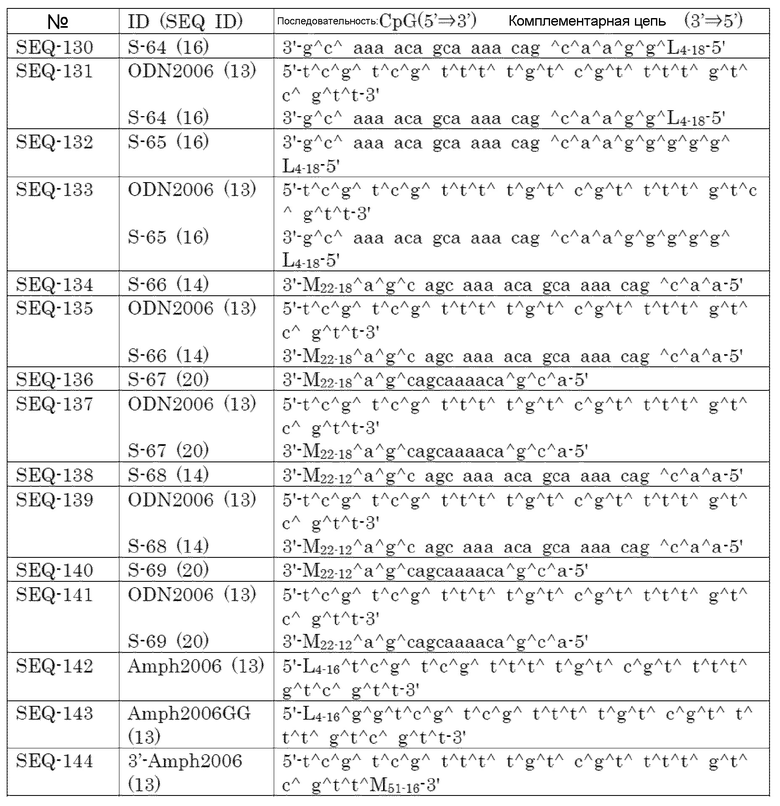
[0199]
Таблица 12
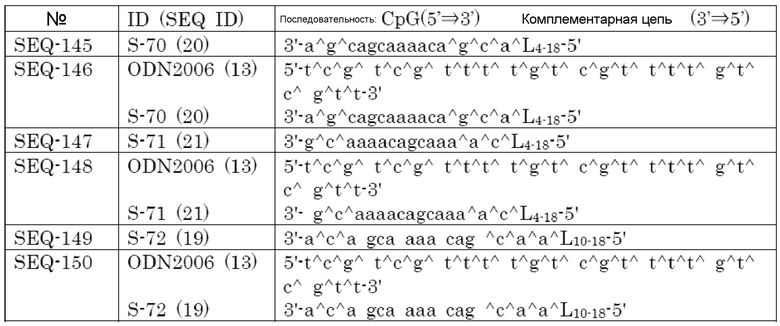
[0200]
Таблица 13

[0201]
Таблица 14
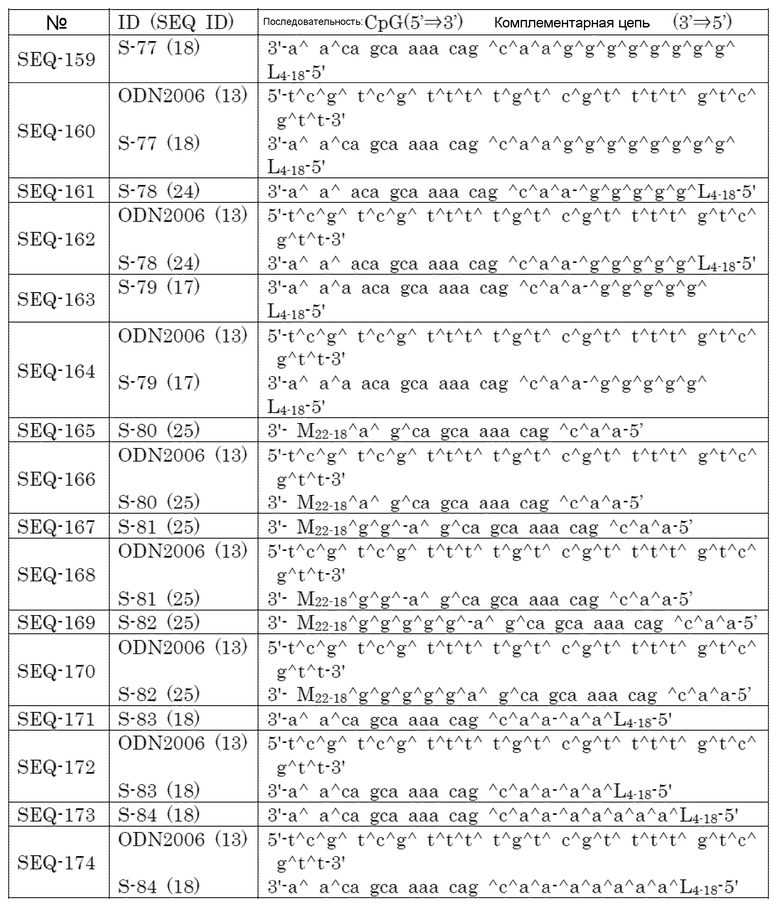
[0202]
Таблица 15
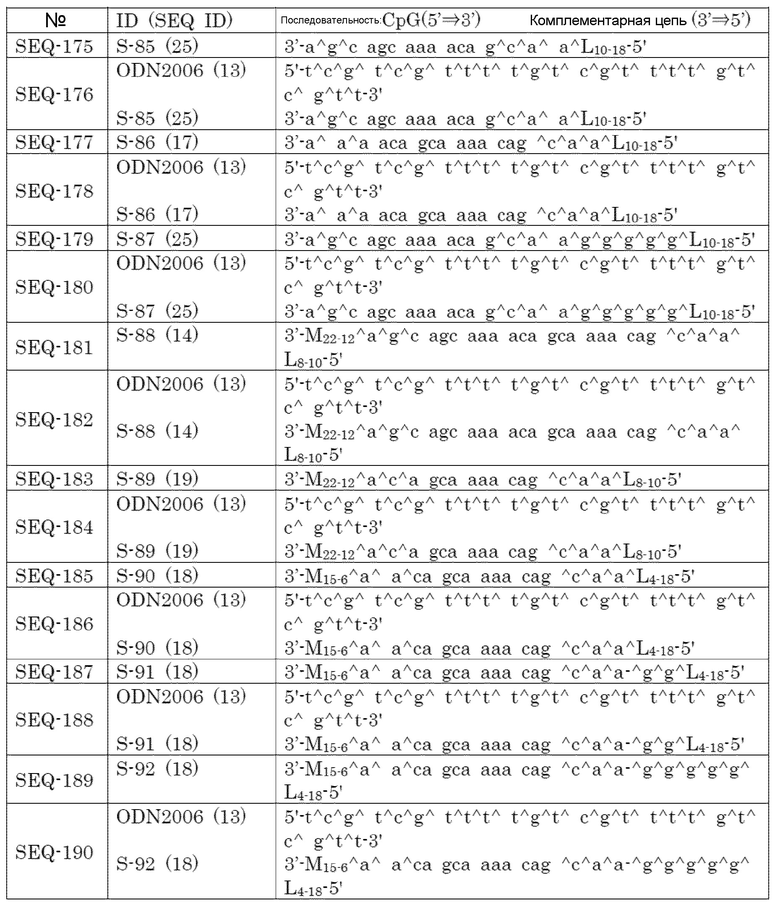
[0203]
Таблица 16
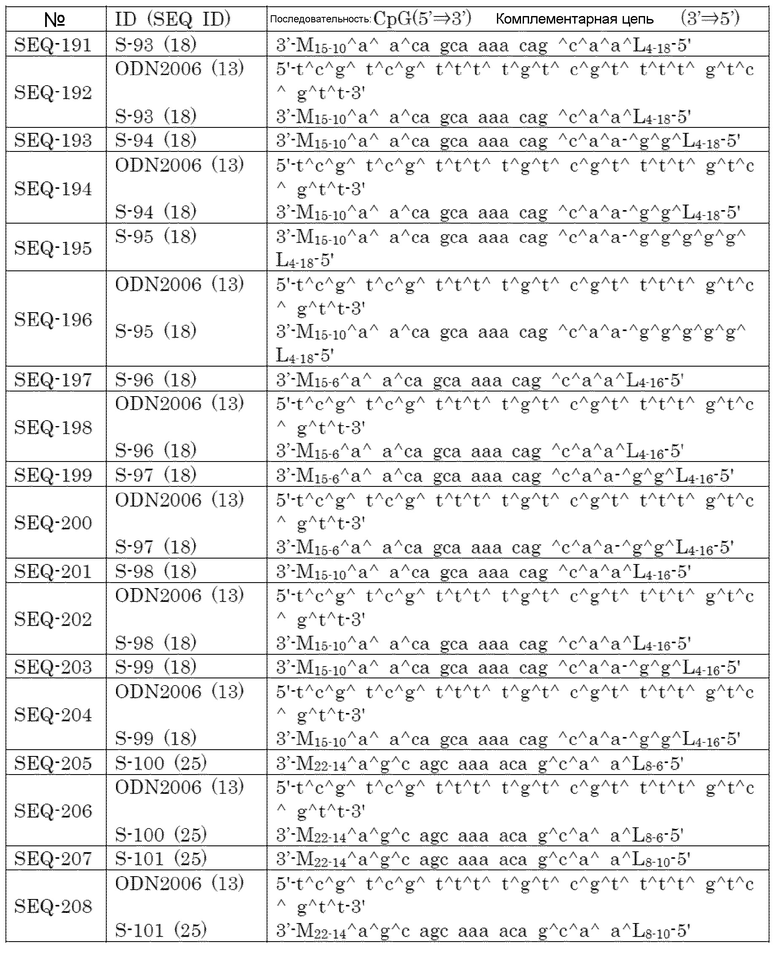
[0204]
Таблица 17
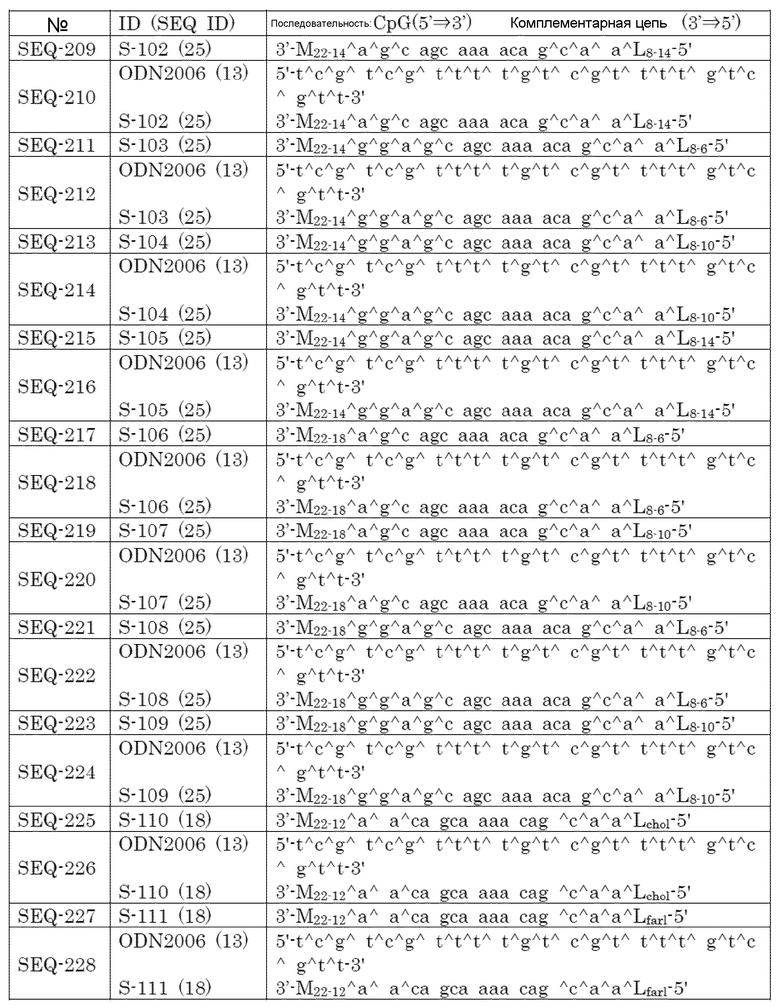
[0205]
Таблица 18
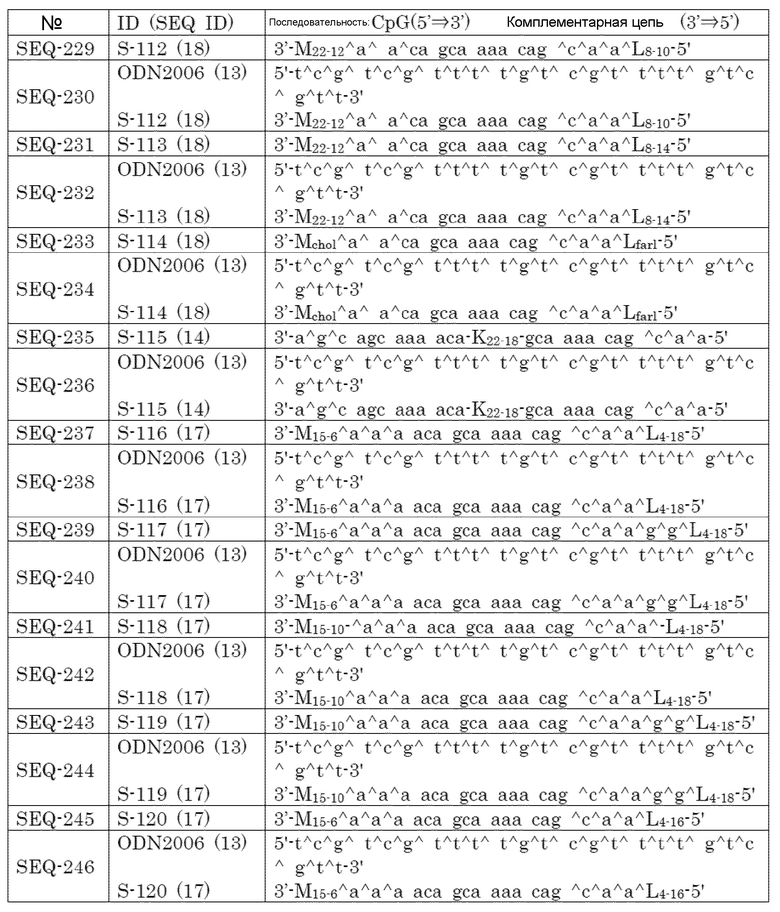
[0206]
Таблица 19
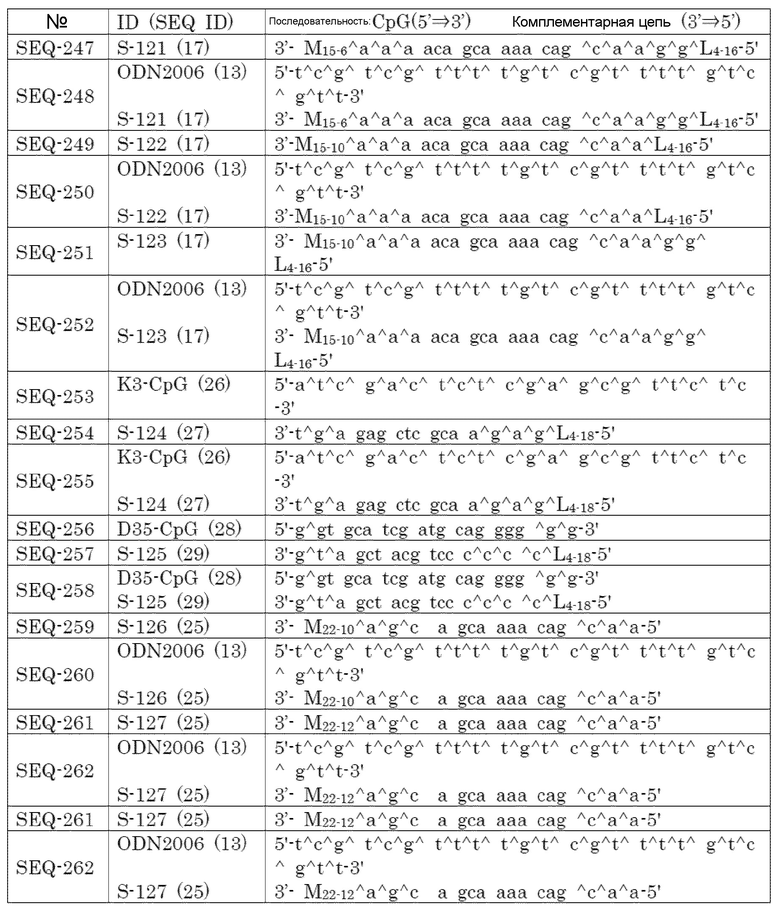
[0207]
Таблица 20

[0208]
Таблица 21
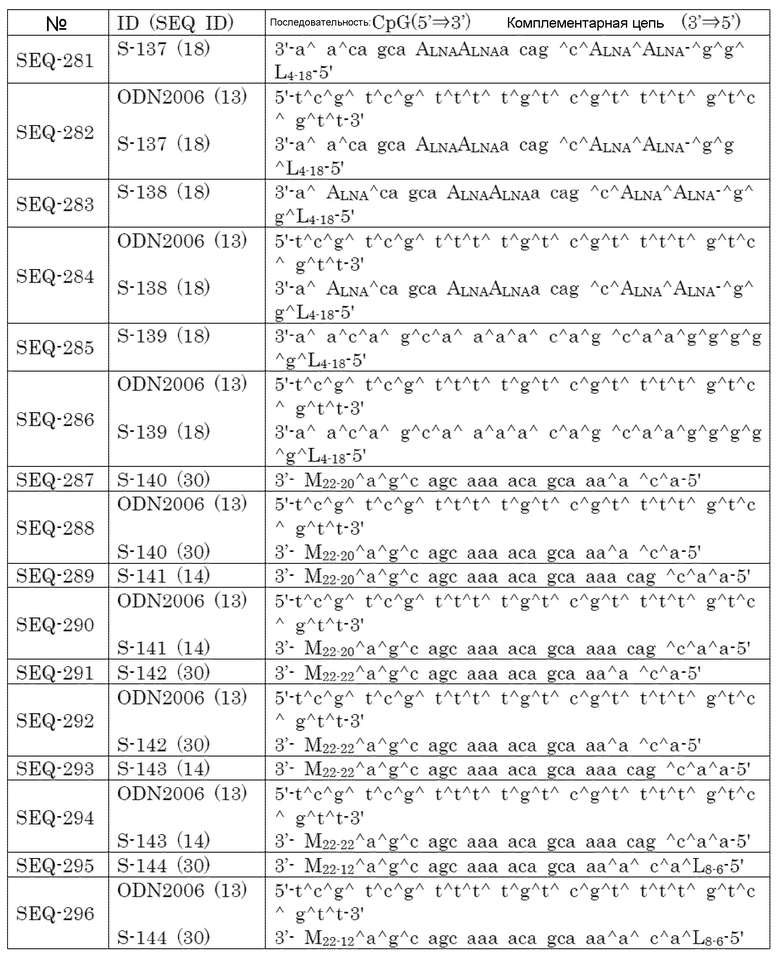
[0209]
Таблица 22
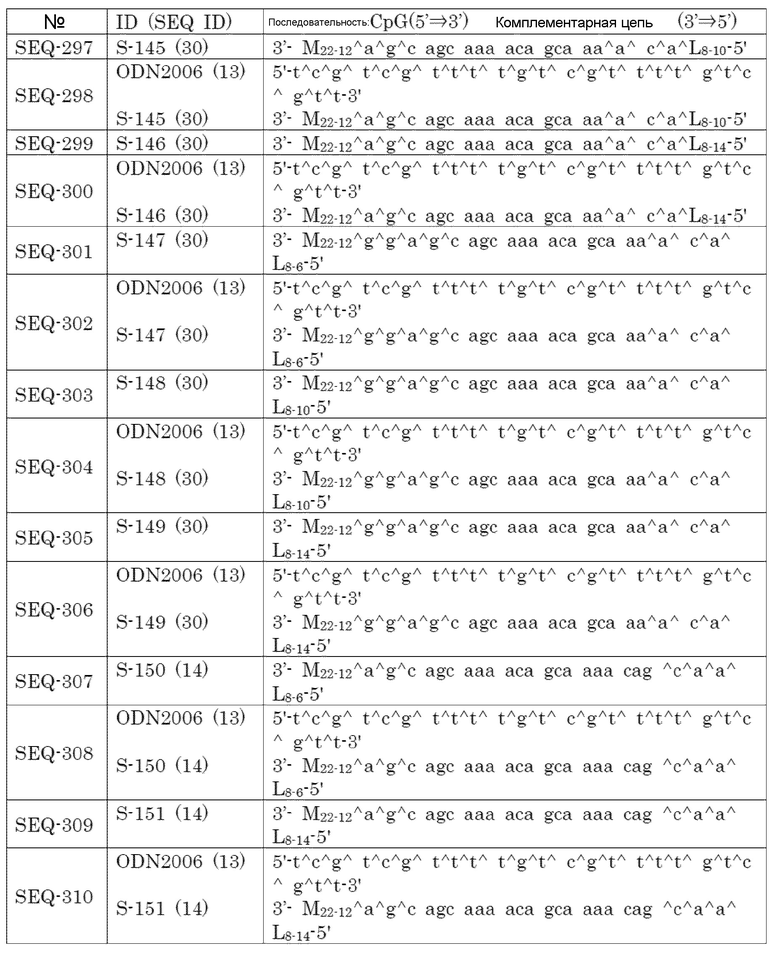
[0210]
Таблица 23
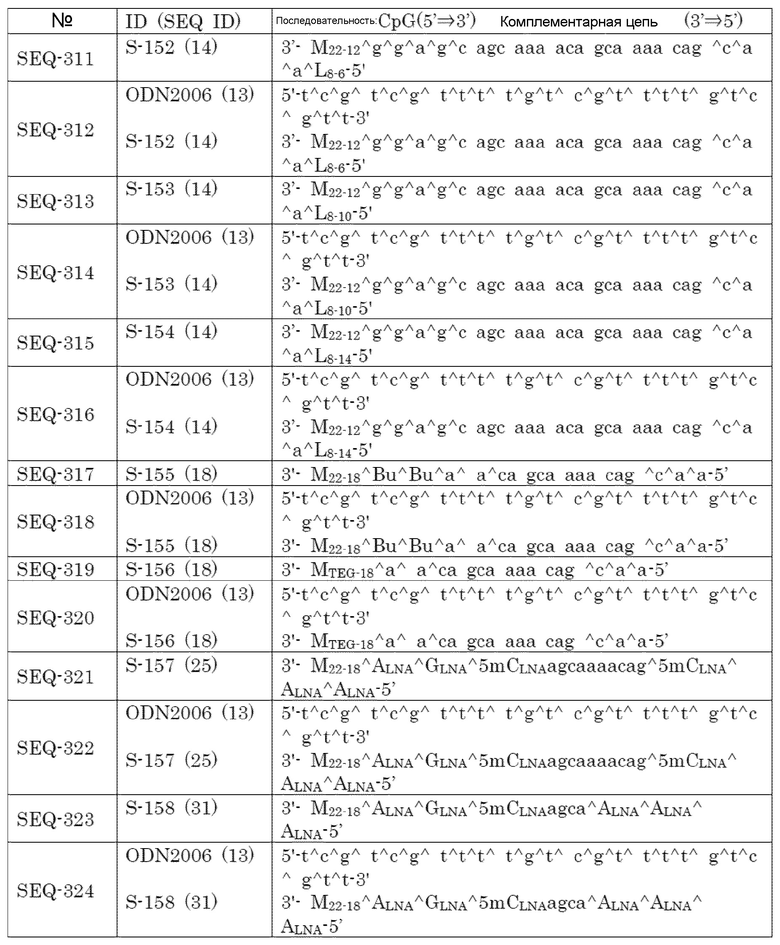
[0211]
Таблица 24

[0212]
Таблица 25
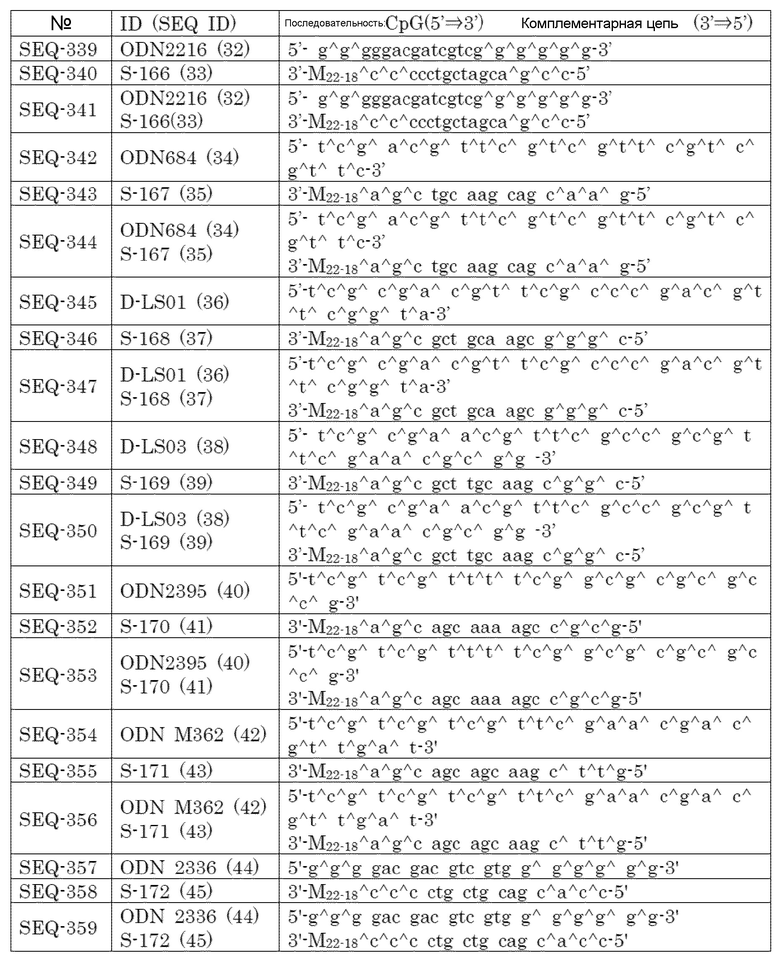
[0213]
Таблица 26
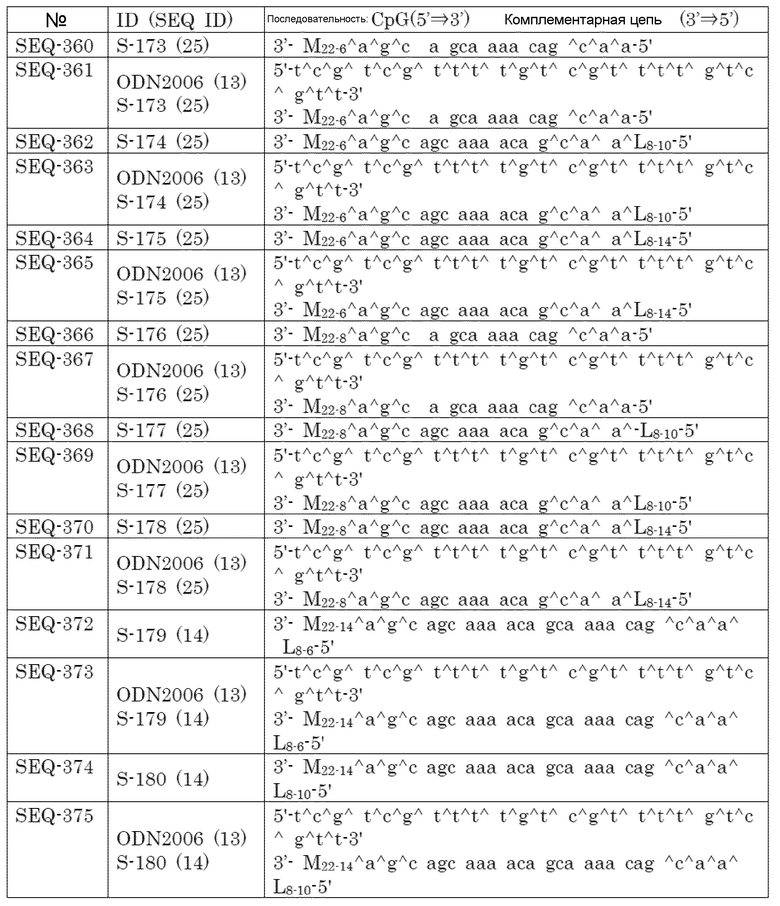
[0214]
Таблица 27
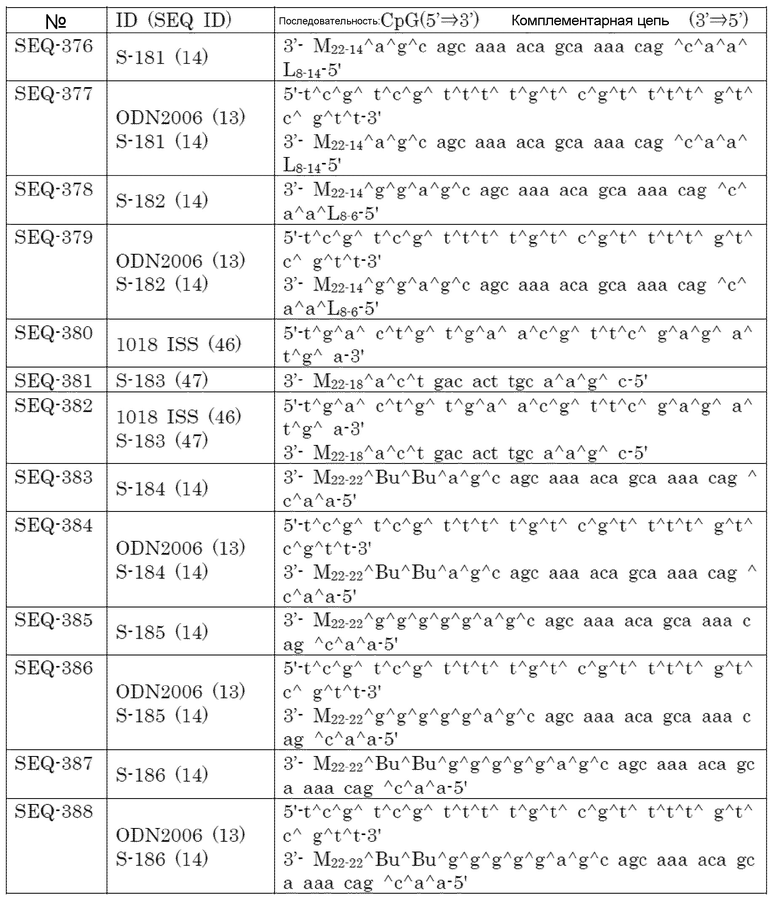
[0215]
В Таблицах 4-27, n (строчная буква) означает ДНК, nOMe означает 2'-OMe-РНК, N (заглавная буква) означает РНК, NF (заглавная буква) означает 2'-дезокси-2'-F-РНК, и 5mC означает 5-метилцитозин. ^ означает фосфоротиоатную связь, и связь без какого-либо символа означает фосфодиэфирную связь.
Lx-n представляет собой соединение, введенное на 5' конце, и ковалентно связывается с гидроксильной группой через описанную связь. Mx-n представляет собой соединение, введенное на 3' конце, и ковалентно с гидроксильной группой через описанную связь. В Lx-n, x представляет собой цифру, соответствующую структуре соединения 4-n или соединения 10-n, которое является двухцепочечным, или соединения 8-n, которое является одноцепочечным, и n представляет собой целое число, имеющее значение 6-28, соответствующее углеродной цепи(цепям). В Mx-n, x представляет собой цифру, соответствующую структуре соединения 22-n, соединения 49-n или соединения 51-n, которое является двухцепочечным, или соединения 15-n, которое является одноцепочечным, и n представляет собой целое число, имеющее значение 6-28, соответствующее углеродной цепи(цепям).
[0216]
Более подробно, Lx-n представляет собой группу, описанную ниже.
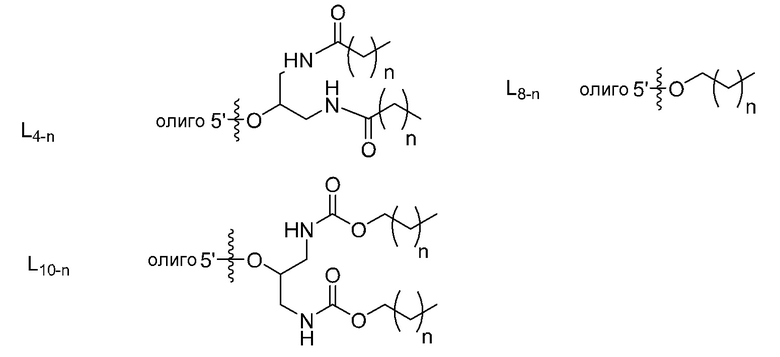
где n представляет собой целое число, имеющее значение 6-28.
L4-n представляет собой группу, происходящую из соединения 4-n, которое синтезировано в 1-1) в разделе A) выше. L8-n представляет собой группу, происходящую из соединения 8-n, которое синтезировано в 2) в разделе A) выше. L10-n представляет собой группу, происходящую из соединения 10-n, которое синтезировано в 3) в разделе A) выше. [0217]
Lchol или LTOC в Таблице представляет собой группу, описанную ниже.
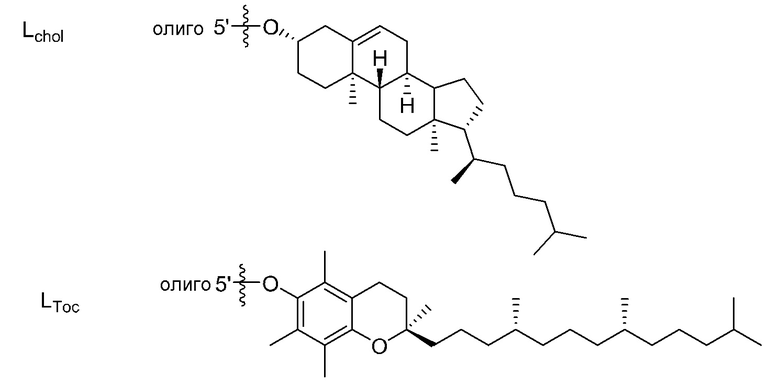
Lchol представляет собой группу, происходящую из соединения 26, которое синтезировано в 8-1) в разделе A) выше. LToc представляет собой группу, происходящую из соединения 5'-Токоферол-CE-Фосфорамидита, которое закупали у Link Technologies Ltd.
[0218]
Lfarl в Таблице представляет собой группу, описанную ниже.
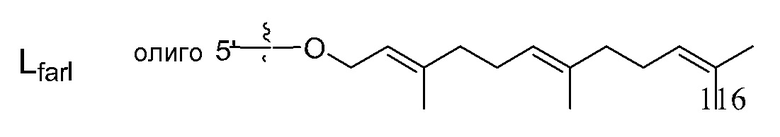
Lfarl представляет собой группу, происходящую из соединения 53, синтезированного в 8-2) в разделе A) выше.
[0219]
Mx-n представляет собой группу, описанную ниже.
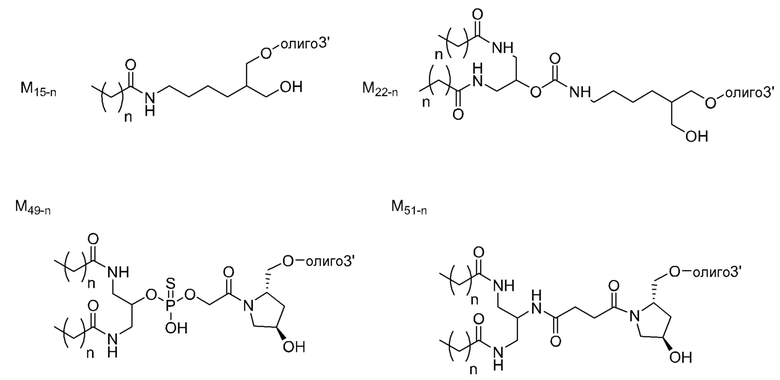
где n представляет собой целое число, имеющее значение 6-28.
M15-n представляет собой группу, происходящую из соединения 15-n, синтезированного в 4) в разделе A) выше, M22-n представляет собой группу, происходящую из соединения 22-n, синтезированного в 6) в разделе A) выше, M49-n представляет собой группу, происходящую из соединения 49-n, синтезированного в 11) в разделе A) выше, и M51-n представляет собой группу, происходящую из соединения 51-n, синтезированного в 13) в разделе A) выше.
[0220]
Mchol в Таблице представляет собой группу, описанную ниже.
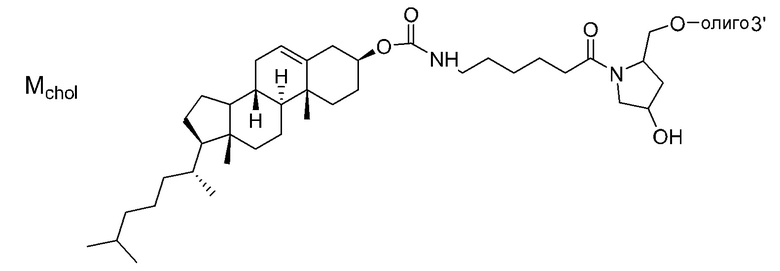
Mchol представляет собой группу, происходящую из соединения 55, синтезированного в 14) в разделе A) выше.
[0221]
MTEG-n в Таблице представляет собой группу, описанную ниже.
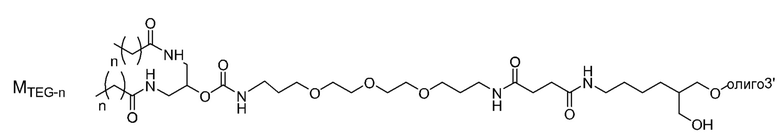
MTEG-n представляет собой группу, происходящую из соединения 63-n, синтезированного в 15) в разделе A) выше.
[0222]
K22-n в Таблице представляет собой группу, описанную ниже.
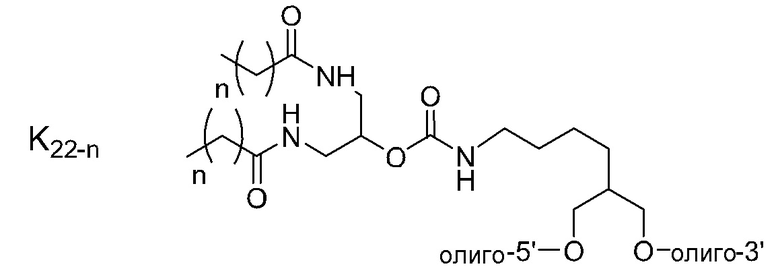
K22-n представляет собой группу, происходящую из соединения 22-n, синтезированного в 6) в разделе A) выше.
[0223]
Следующий линкер (^Bu^Bu в Таблице) используют для S-155 или S-184.

[0224]
Пример 2 Оценка активности связывающихся с липидами двухцепочечных олигонуклеотидов по настоящему изобретению с использованием репортерного анализа
(Материалы и методы)
HEK-BlueTM hTLR9 клетки (Invivogen), используемые для репортерного анализа, получали путем введения человеческого TLR9 гена и репортерного гена, который представлял собой секреторный ген щелочной фосфатазы, связанный с последовательностью области связывания NF-kB・AP-1 в клетках HEK293, и они представляли собой клетки, стабильно экспрессирующие оба гена. 3,6×104 клеток, суспендированных в среде для детекции HEK-BlueTM (Invitrogen), содержащей субстраты против щелочной фосфатазы, высевали в 96-луночный планшет и добавляли 3 нМ - 30 мкМ связывающегося с липидом двухцепочечного олигонуклеотида по настоящему изобретению, известные CpG олигонуклеотиды (ODN2006, SEQ-49), или адъювант на основании конструкции, раскрытой в патентном документе 1, т.е. ssCpG ODN, вводящий липидный лиганд (SEQ-142, 143 или 144). После культивирования в 37°C, 5% CO2 инкубаторе в течение 16 часов измеряли поглощение при 620 нм с использованием проявляющего цвет культурального супернатанта. Полученное значение анализировали с использованием программы TIBCO Spotfire и рассчитывали 50% эффективную концентрацию (EC50) каждого олигонуклеотида.
[0225]
(Результат)
Как описано выше, известно, что характерные свойства адъюванта исчезали, когда ssCpG ODN вводили в виде двухцепочечной ДНК (dsCpG ODN) путем отжига первой и второй цепи (Непатентный документ 4). Для проверки, проявляет ли адъювант на основе двухцепочечной нуклеиновой кислоты активность в качестве TLR9 агониста, осуществляли оценку активности двухцепочечного олигонуклеотида с использованием репортерного анализа.
Как показано в Таблице 28 и 29, ODN2006 (SEQ-49), который представляет собой ssCpG ODN, показал активность в качестве TLR9 агониста, и EC50 значение было около 467 нМ (Эксперимент 1, Таблица 28) и около 245 нМ (Эксперимент 2, Таблица 29). С другой стороны, связывающийся с липидом двухцепочечный олигонуклеотид по настоящему изобретению, включающий ODN2006 в качестве CpG олигонуклеотида, показал TLR9-агонистическую активность в диапазоне от нескольких десятков до одной тысячи и нескольких сотен нМ. Большинство адъювантов по настоящему изобретению, описанных в Таблице 28 и 29, имели тенденцию к повышению активности по сравнению с ODN2006. Кроме того, 16 последовательностей SEQ-57, SEQ-59, SEQ-61, SEQ-63, SEQ-65, SEQ-111, SEQ-117, SEQ-135, SEQ-146, SEQ-226, SEQ-282, SEQ-284, SEQ-294, SEQ-324, SEQ-361 и SEQ-363 имели тенденцию к несколько более низкой активности по сравнению с ODN2006, но разница была примерно в 3 раза. Поэтому стало ясно, что связывающиеся с липидами двухцепочечные олигонуклеотиды по настоящему изобретению обладают активностью в качестве агониста TLR9.
Кроме того, для проверки, проявляет ли модифицированная форма SEQ-2, раскрытая в патентном документе 1, заявленная для ODN2006, которая представляет собой олигонуклеотидную последовательность CpG человеческого типа, активность в качестве TLR9 агониста, оценку активности осуществляли таким же образом (SEQ-141, 142 или 143). SEQ-142, 143 или 144 не могли индуцировать активацию TLR9 в измеряемом диапазоне концентраций, невозможно было рассчитать EC50 значения (ʺнет данныхʺ в Таблице 28). Таким образом, предполагают, что конструкция (ssCpG ODN, вводящий липидный лиганд), раскрытая в патентном документе 1, не может быть полезной в качестве адъюванта вакцины и/или вакцины как таковой, поскольку она показала активность для ODN1826 (мышиного типа), но не показала активность для ODN2006 (человеческого типа), как описано в примере.
Напротив, предполагают, что связывающийся с липидом двухцепочечный олигонуклеотид по настоящему изобретению может быть полезным в качестве адъюванта вакцины и/или вакцины как таковой, независимо от последовательности CpG олигонуклеотидов, поскольку он показал активность для ODN2006, а также для ODN1826.
[0226]
Эксперимент 1
Таблица 28
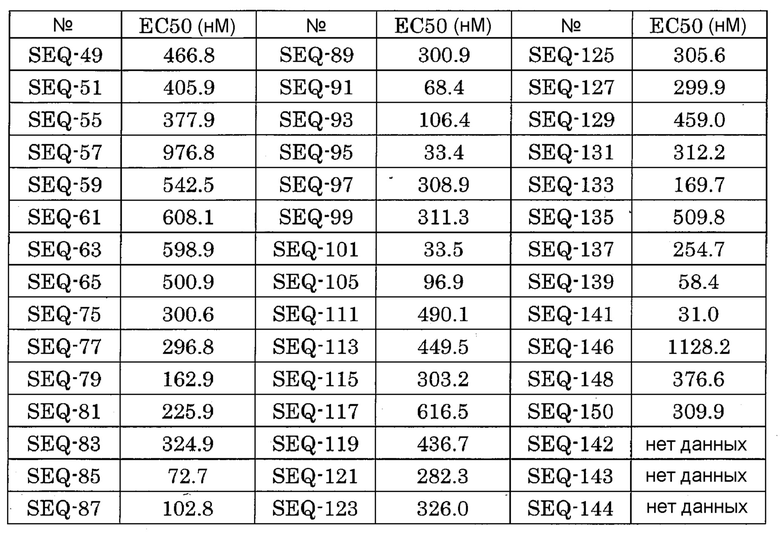
[0227]
Эксперимент 2
Таблица 29
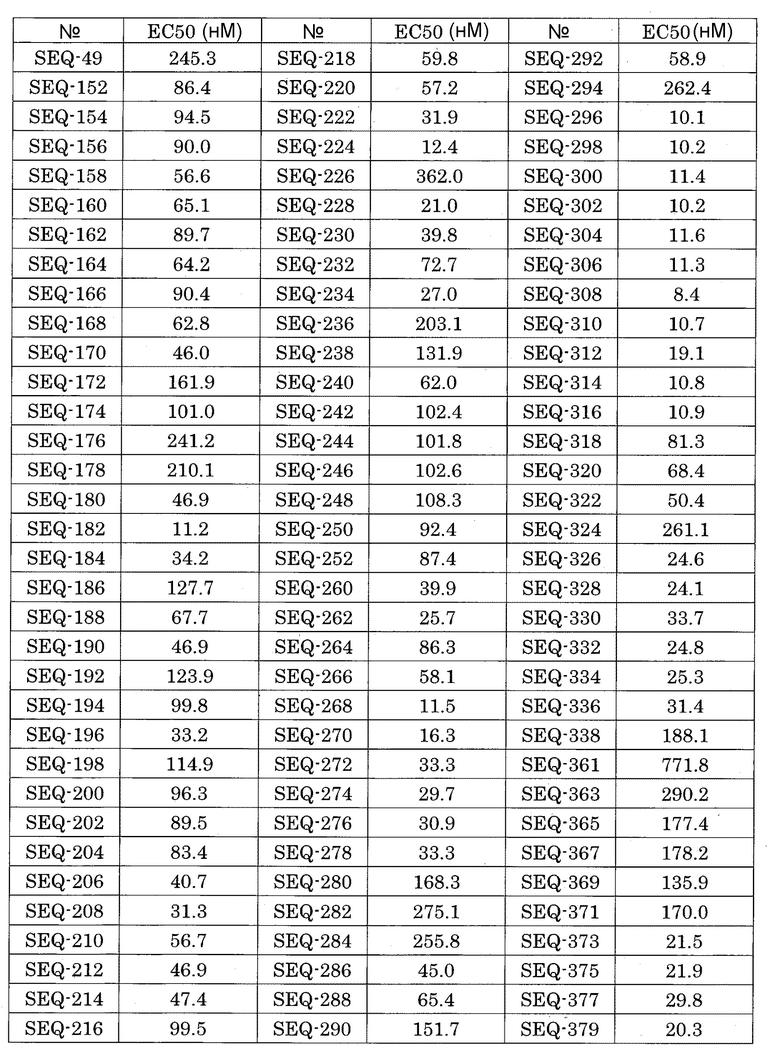
[0228]
Как показано в Таблице 30, даже когда использовали CpG олигонуклеотиды, за исключением ODN2006, большинство адъювантов по настоящему изобретению показали тенденцию повышения активности по сравнению с ssCpG ODN. Стало ясно, что каждый связывающийся с липидом двухцепочечный олигонуклеотид по настоящему изобретению показывает активность в качестве TLR9 агониста.
[0229]
Таблица 30

[0230]
Пример 3 in vivo оценка адъювантов по настоящему изобретению
А) Оценка CTL-индуцибельности
(Животные)
C57BL/6JJcl мышей (возраст 6-8 недель) закупали у CLEA Japan, Inc.
(Компоненты Вакцины 1)
OVA257-264 пептид (SIINFEKL, SEQ ID NO: 22), который синтезировали и очищали обращенно-фазовой ВЭЖХ и закупали у Sigma-Aldrich.
адъювант по настоящему изобретению или хорошо известный CpG ODN
(Компоненты Вакцины 2)
TRP2180-188 пептид (CSVYDFFVWL, SEQ ID NO: 23), который синтезировали и очищали обращенно-фазовой ВЭЖХ и закупали у Sigma-Aldrich.
адъювант по настоящему изобретению или хорошо известный CpG ODN
(Компоненты Вакцины 3)
OVA257-264 пептид или TRP2180-188 пептид
Монтанид ISA51 (SEPPIC)
[0231]
(Получение Вакцины 1)
Специфический иммунитет индуцировали путем вакцинации мыши два раза с интервалом 7 дней. Каждая вакцина включала 100 мкг OVA пептида и 1,57 или 4,71 нмоль адъюванта по настоящему изобретению или хорошо известного CpG ODN, которые растворяли в 1×PBS. 100 мкл вакцины вводили путем подкожной инъекции в бок мыши.
(Получение Вакцины 2)
Специфический иммунитет индуцировали путем вакцинации мыши два раза с интервалом 7 дней. Каждая вакцина включала 100 мкг TRP2 пептида и 1,57 или 4,71 нмоль адъюванта по настоящему изобретению или хорошо известного CpG ODN, которые растворяли в 1×PBS. 100 мкл вакцины вводили путем подкожной инъекции в бок мыши.
(Получение Вакцины 3)
1:1 2 мг/мл TRP2 пептида в PBS и Монтанид (указанный выше компонент вакцины 3) смешивали с использованием цилиндра и насосного коннектора для образования эмульсии. 100 мкл вакцины в виде эмульсии вводили путем подкожной инъекции в бок мыши два раза с интервалом 7 дней.
[0232]
(Окрашивание тетрамера)
На 7 день после второй вакцинации собирали кровь, красные кровяные клетки удаляли при помощи BD Pharm Lyse (BD pharmingen) и клетки суспендировали в FACS буфере (1% фетальной бычьей сыворотки, 2 мМ PBS с EDTA). К смеси добавляли анти-мышиное CD16/32 моноклональное антитело (BioXcell) и блокирование Fc рецептора осуществляли при 4°C в течение 30 минут. Затем к смеси добавляли PE-меченный H-2Kb тетрамер, соответствующий вакцинному антигену (T-Select H-2Kb OVA Тетрамер-SIINFEKL или T-Select H-2Kb TRP-2 Тетрамер-SVYDFFVWL; оба закупали у Medical & Biological Laboratories Co., Ltd.) и Alexa 647-меченное анти-CD8 антитело (Medical & Biological Laboratories Co., Ltd.) и окрашивание осуществляли при комнатной температуре в течение 45 минут. Затем окрашивание осуществляли с DAPI (Invitrogen) и клетки промывали два раза FACS буфером. Затем ресуспендировали в FACS буфере и анализировали с использованием проточного цитометра FACS verse Flow Cytometer (BD bioscience) и FAC Suite программы (BD bioscience). Для анализа, после блокирования DAPI отрицательной фракции получали фракцию белых кровяных клеток с использованием прямого и поперечного рассеяния в качестве индикаторов. В фракции белых кровяных клеток как положительные клетки Alexa 647-CD8, так и PE-H-2Kb Тетрамер были определены как CTL. Относительное количество CTL в белых кровяных клетках использовали для оценки.
Метод расчета показателя CTL-индуцибельности
После вычисления средней CTL индуцибельности для каждой группы на один эксперимент рассчитывали отношение средних значений CTL-индуцибельности ssCpG ODN, ODN1826 (SEQ-1) или ODN2006 (SEQ-49) в качестве контроля.
В случае адъюванта, включающего ODN1826
(Среднее значение CTL индуцибельности группы адъюванта)/ (Среднее значение CTL индуцибельности группы ODN1826)=отношение средних значений
CTL-индуцибельность каждого адъюванта была показана, когда CTL-индуцибельность ssCpG ODN принимали за 1, таким образом, более высокое значение означает более высокую CTL индуцибельность.
[0233]
B) Оценка противоопухолевого эффекта вакцины на основе TRP2 пептида с использованием адъюванта по настоящему изобретению
После иммунизации вакциной на основе TRP2 пептида B16F10 клетки (ATTC), которые представляют собой клетки мышиной меланомы, экспрессирующие TRP2 белок, подкожно трансплантировали для оценки противоопухолевого эффекта. Таким же способом, как в Примере 3 A), на следующий день, когда наблюдали тетрамер-положительное отношение в периферической крови мыши, вакцинированной два раза каждые 7 дней, B16F10 клетки (1×105 клеток/мышь) подкожно трансплантировали в правое плечо. Большую и малую оси привитой опухоли измеряли каждые 2-3 дня и объем опухоли рассчитывали по формуле:
(большая ось × малая ось2)/2
Способ расчета для индикаторов противоопухолевого эффекта
Для адъюванта, включающего ODN1826
100-(средний объем опухоли группы адъюванта)/(средний объем опухол ODN1826 группы)
Для адъюванта, включающего ODN2006
100-(средний объем опухол группы адъюванта)/(средний объем опухоли ODN2006 группы)
Соединение с более высоким значением имело более сильную противоопухолевую активность.
[0234]
(Результат с использованием ODN1826 в качестве CpG олигонуклеотида)
Результат 1-A: Сравнение CTL-индуцибельности между адъювантои по настоящему изобретению и известными адъювантами
Когда мышей иммунизировали TRP2 пептидом и ODN1826 (SEQ-1), происходила индукция TRP2-специфических CTL. Когда использовали dsCpG ODN (SEQ-4), TRP2-специфическая CTL-индуцибельность снижалась в 0,46 раза по сравнению с ODN1826. То есть, двойные цепи приводили к снижению CTL-индуцибельности по сравнению с одноцепочечным адъювантом. Это дает основание предположить, что, когда CpG олигонуклеотид просто получают в двухцепочечной форме, иммуностимулирующая активность снижается, как раскрыто в непатентном документе 4 и т.п. С другой стороны, когда адъювант по настоящему изобретению, т.е. связывающий с липидом двухцепочечный олигонуклеотидный адъювант (SEQ-16) использовали для иммунизации, CTL индуцибельность повышалась в 1,46 раза по сравнению с ODN1826. Поэтому, предполагается, что адъювант по настоящему изобретению неожиданно дает усиление активности. Результаты показаны в Таблице 31.
[0235]
Таблица 31
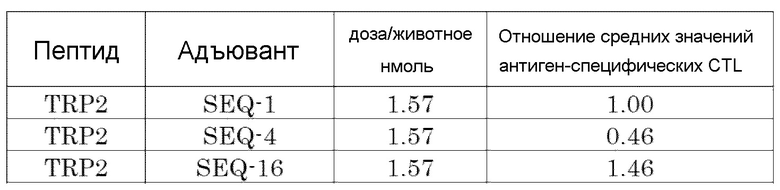
[0236]
Результат 1-B: Сравнение противоопухолевого эффекта между адъювантом по настоящему изобретению и известными адъювантами
Когда мышей иммунизировали TRP2 пептидом и ODN1826 (SEQ-1), они имели незначительный эффект ингибирования на прогрессирование опухоли из B16F10 клеток. Кроме того, dsCpG ODN (SEQ-4) имел незначительный эффект ингибирования на прогрессирование опухоли из B16F10 клеток. С другой стороны, адъювант по настоящему изобретению (SEQ-16) показал сильный эффект ингибирования на прогрессирование опухоли из B16F10 клеток, 43% по сравнению с ODN1826 на день 14 после трансплантации. Результаты показаны на Фиг. 1.
[0237]
Результат 2-A, B: CTL-индуцибельность и противоопухолевый эффект адъювантов по настоящему изобретению, включающих липидный лиганд с разным числом атомов углерода
Активность адъюванта по настоящему изобретению, содержащего липид, включающий две ацильные цепи, включающие 10-20 атомов углерода, в качестве лиганда исследовали с использованием OVA пептида. CTL индуцибельность и процент ингибирования опухоли в случае SEQ-12 (10 атомов углерода) были ниже по сравнению с ODN1826 (SEQ-1). С другой стороны, существует тенденция повышения CTL индуцибельности с увеличением длины цепи, например, SEQ-14 (14 атомов углерода), SEQ-6 (18 атомов углерода) и SEQ-16 (20 атомов углерода). Кроме того, что касается ингибирования опухоли, SEQ-14 показал около 94% ингибирование роста опухоли по сравнению с ODN1826 на день 14 после трансплантаци, и SEQ-6 и SEQ-16 совершенно ингибировали рост опухоли на день 14 после трансплантации. Результаты показаны в Таблице 32.
[0238]
Таблица 32
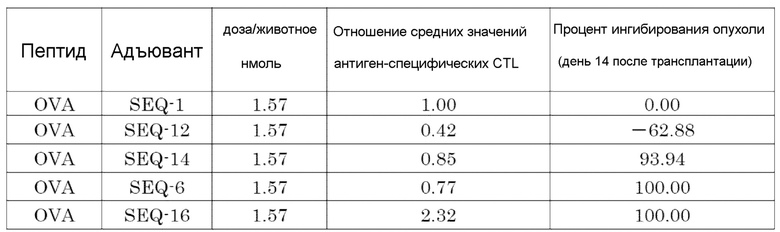
[0239]
Результат 3-A: CTL индуцибельность адъювантов по настоящему изобретению с введением липидов на обоих концах
Активность адъюванта по настоящему изобретению с липидом, включающим две ацильные цепи, включающие 20 атомов углерода, в качестве лиганда и дополнительно включающего одноцепочечный липид, включающий 8 или 12 атомов углерода на 3' конце CpG олигонуклеотида (SEQ-46 или SEQ-48), исследовали с использованием TRP2 пептида. Обе CTL-индуцибельности повышались примерно в 2,8 раза по сравнению с ODN1826 (SEQ-1). Результаты показаны в Таблице 33.
[0240]
Таблица 33
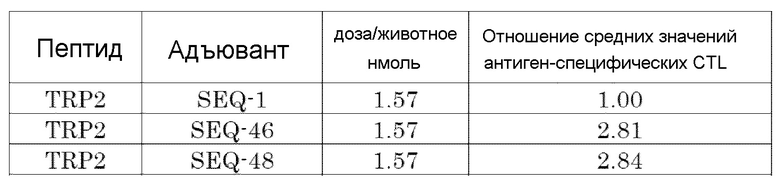
[0241]
Результат 3-B: Противораковый эффект адъювантов по настоящему изобретению с введением липидов на обоих концах
Когда мышей иммунизировали TRP2 пептидом и адъювантом по настоящему изобретению, SEQ-46 или SEQ-48, это давало сильный эффект ингибирования на прогрессирование опухоли из B16F10 клеток, соответственно 52% или 43% на день 13 после трансплантаци по сравнению с ODN1826 (SEQ-1). Результаты показаны на Фиг. 2.
[0242]
Результат 4-A: CTL индуцибельность адъювантов по настоящему изобретению с разными длинами комплементарной цепи
В конструкции двухцепочечного олигонуклеотидного адъюванта необходимо, чтобы происходило высвобождение CpG олигонуклеотида, который является активным ингредиентом, в лимфоузлах. Скорость диссоциации двойной цепи пропорциональна теплостойкости, и чем более комплементарными являются сайты в двухцепочечной структуре, тем более стабильно существует двойная цепь. Затем исследовали активность адъювантов по настоящему изобретению с разной длиной комплементарной цепи с использованием TRP2 пептида.
Использовали адъювант, комплементарная цепь которого составляет 10 мер для ODN1826 (20 мер), т.е. длина комплементарной цепи для CpG олигонуклеотида составляет 50% (SEQ-8), и адъювант, комплементарная цепь которого составляет 15 мер, т.е. длина составляет 75% (SEQ-10). Оба SEQ-8 и SEQ-10 в основном повышали CTL индуцибельность по сравнению с ODN1826 (SEQ-1) примерно в 1,2 и 2,5 раза, соответственно. Результаты показаны в Таблице 34.
[0243]
Таблица 34
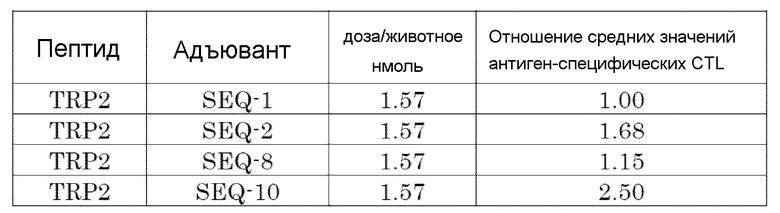
[0244]
Результат 4-B: Противораковый эффект адъювантов по настоящему изобретению с разными длинами комплементарной цепи
Когда мышей иммунизировали TRP2 пептидом и ssCpG ODN, вводящим липидный лиганд, который раскрыт в патентном документе 1 (SEQ-2), процент ингибирования опухоли составил около 3,5% на день 12 после трансплантации по сравнению с ODN1826 (SEQ-1). С другой стороны, SEQ-8, который представляет собой адъювант по настоящему изобретению с 10 мер комплементарной цепи, показал процент ингибирования опухоли около 50% по сравнению с ODN1826 на день 12 после трансплантаци. Кроме того, SEQ-10 с комплементарной цепью 15 мер показал сильный эффект ингибирования на прогрессирование опухоли из B16F10 клеток, около 76% по сравнению с ODN1826 на день 12 после трансплантации. Результаты показаны на Фиг. 3.
[0245]
Результат 5-A: CTL-индуцибельность адъювантов по настоящему изобретению с разной длиной комплементарной цепи
Активность адъюванта по настоящему изобретению, длина комплементарной цепи которого составляет 10-20 мер, против ODN1826 (20 мер), т.е. комплементарная цепь составляет 50-100% относительно CpG олигонуклеотида, исследовали с TRP2 пептидом. Адъювант, длина комплементарной цепи которого составляет 14 мер (SEQ-28), 15 мер (SEQ-26), 17 мер (SEQ-22), 19 мер (SEQ-18) и 20 мер (SEQ-16), показал усиление CTL индуцибельности по сравнению с ODN1826 (SEQ-1). В частности, адъювант с 19 мер (SEQ-18), 17 мер (SEQ-22) и 15 мер (SEQ-26) показал CTL-индуцибельность примерно в 3 раза больше по сравнению с ODN1826 (SEQ-1). Результаты показаны в Таблице 35.
[0246]
Таблица 35
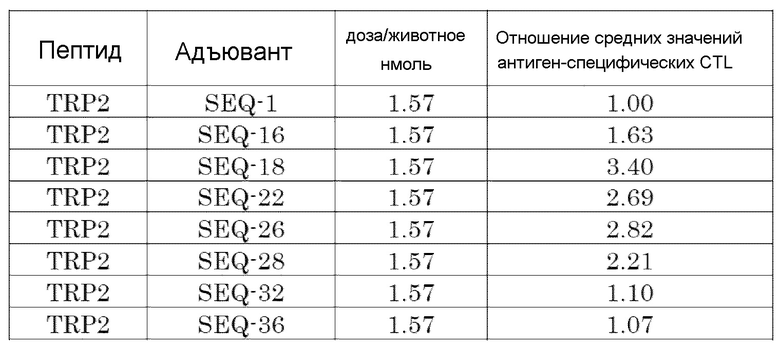
[0247]
Результат 6-A: Сравнение CTL-индуцибельности с Монтанидом
Активности ODN1826 (SEQ-1), ssCpG ODN, вводящего липидный лиганд (SEQ-2), адъюванта по настоящему изобретению (SEQ-26) и Монтанида, который представляет собой адъювант, широко используемый в клинических испытаниях в качестве адъюванта пептидной вакцины, сравнивали с TRP2 пептидом в качестве антигена. SEQ-2 и SEQ-26 показали более высокую CTL индуцибельность по сравнению с ODN1826. С другой стороны, CTL индуцибельность Монтанида была ниже на 1/7 по сравнению с ODN1826. Результаты показаны в Таблице 36.
[0248]
Таблица 36
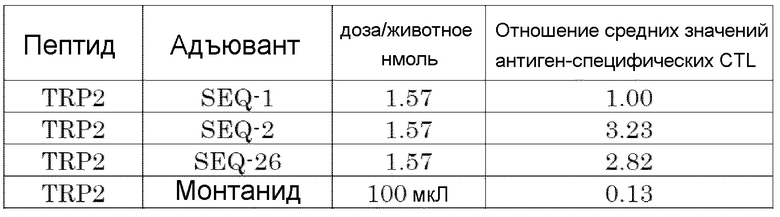
[0249]
Результат 6-B: Сравнение противоопухолевого эффекта против ssCpG ODN, вводящего липидный лиганд
Когда мышей иммунизировали TRP2 пептидом и адъювантом по настоящему изобретению, SEQ-26, это давало очень сильный эффект ингибирования на прогрессирование опухоли из B16F10 клеток, 76,8% на день 12 после трансплантации, по сравнению с ODN1826 (SEQ-1). Процент ингибирования опухоли для ssCpG ODN, вводящего липидный лиганд (SEQ-2), составил 64,3% на день 12 после трансплантации по сравнению с ODN1826. То есть, адъювант по настоящему изобретению показал более сильный эффект ингибирования на прогрессирование опухоли из B16F10 клеток, чем адъювант SEQ-2. С другой стороны, Монтанид, используемый в качестве адъюванта, не имел никакого противоопухолевого эффекта. Результаты показаны на Фиг. 4.
[0250]
Результат 7-A: CTL индуцибельность адъювантов по настоящему изобретению с разными типами мономера нуклеиновой кислоты в комплементарной цепи
Активность адъюванта по настоящему изобретению, в котором мономеры нуклеиновой кислоты в комплементарной цепи представляли собой РНК, 2'-OMe-РНК или 2'-F-РНК, исследовали с использованием TRP2 пептида. Адъювант, в котором все мономеры нуклеиновой кислоты были РНК (SEQ-40) или 2'-F-РНК (SEQ-42), не показал большого повышения CTL индуцибельности по сравнению с ODN1826 (SEQ-1). С другой стороны, адъювант с 2'-OMe-РНК в качестве мономера нуклеиновой кислоты (SEQ-38 и SEQ-44) показал повышение CTL индуцибельности в 2,9 или 2,4 раза, соответственно, по сравнению с ODN1826. Эти результаты предполагают, что 2'-OMe-РНК является полезным в качестве мономера нуклеиновой кислоты адъюванта по настоящему изобретению, также как и ДНК. Результаты показаны в Таблице 37.
[0251]
Таблица 37
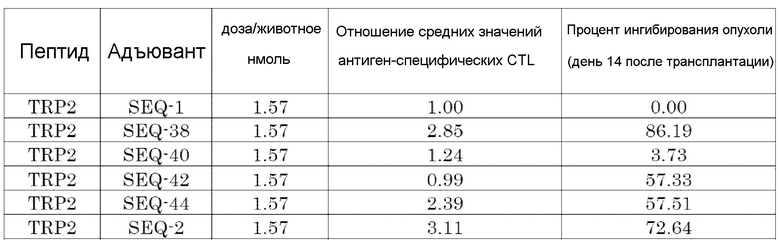
[0252]
Результат 7-B: Противоопухолевый эффект адъювантов по настоящему изобретению с разными типами мономера нуклеиновой кислоты в комплементарной цепи
Когда мышей иммунизировали TRP2 пептидом и адъювантом по настоящему изобретению с 2'-OMe-РНК в качестве мономеров нуклеиновой кислоты (SEQ-38), это давало очень сильный эффект ингибирования на прогрессирование опухоли из B16F10 клеток, около 86,2% на день 14 после трансплантации, по сравнению с ODN1826 (SEQ-1). Процент ингибирования опухоли для ssCpG ODN, вводящего липидный лиганд (SEQ-2), составил около 72,6% на день 14 после трансплантации по сравнению с ODN1826. То есть, адъювант по настоящему изобретению показал более сильный эффект ингибирования на прогрессирование опухоли из B16F10 клеток, чем адъювант SEQ-2. Кроме того, адъювант, длина цепи которого SEQ-38 была укорочена (SEQ-44), и адъювант с 2'-F-РНК в качестве мономера нуклеиновой кислоты (SEQ-42) показали эффект ингибирования на прогрессирование опухоли в B16F10 клетках. С другой стороны, адъювант с РНК в качестве мономера нуклеиновой кислоты (SEQ-40) не показал никакого эффекта ингибирования на прогрессирование опухоли из B16F10 клеток. Результаты показаны в Таблице 37 и Фиг. 5.
[0253]
(Результат с использованием ODN2006 в качестве CpG олигонуклеотида)
Результат 8-A: CTL-индуцибельность адъювантов по настоящему изобретению с разной длиной цепи комплементарной цепи или линкером
Активности ODN2006 (SEQ-49, 24 мер) и адъювантов по настоящему изобретению сравнивали с TRP2 пептидом в качестве антигена. Использовали адъювант, длина комплементарной цепи которого составляет 24 мер, т.е. длина комплементарной цепи относительно CpG олигонуклеотида составляет 100% (SEQ-51), и адъювант, длина комплементарной цепи которого составляет 15 мер, т.е. длина комплементарной цепи относительно CpG олигонуклеотида составляет 62,5% (SEQ-61). Оба SEQ-51 и SEQ-61 показали высокую CTL индуцибельность, больше чем в 5 раз по сравнению с ODN2006. Кроме того, использовали адъювант с dTdT в качестве линкера (SEQ-63) или dGdG (SEQ-65). Оба SEQ-63 и SEQ-65 показали очень высокую CTL индуцибельность, больше чем в 10 раз по сравнению с ODN2006. Результаты показаны в Таблице 38.
[0254]
Таблица 38
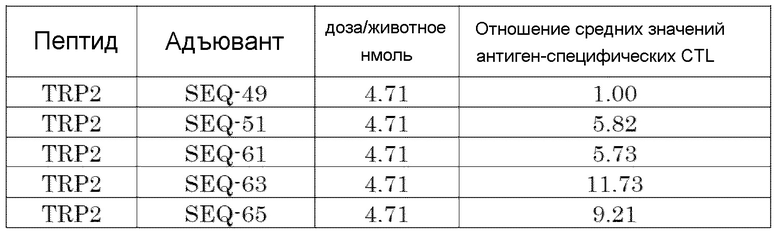
[0255]
Результат 8-B: Противоопухолевый эффект адъюванта по настоящему изобретению с разной длиной цепи комплементарной цепи или линкером
Когда мышей иммунизировали TRP2 пептидом и ODN2006 (SEQ-49), это давало незначительный эффект ингибирования на прогрессирование опухоли из B16F10 клеток. С другой стороны, адъювант по настоящему изобретению, длина комплементарной цепи которого составляет 100% относительно CpG олигонуклеотида (SEQ-51), показал 20% от эффекта ингибирования на прогрессирование опухоли из B16F10 клеток на день 10 после трансплантации по сравнению с ODN2006. Кроме того, каждый адъювант, длина комплементарной цепи которого составляет 62,5% относительно CpG олигонуклеотида (SEQ-61), и адъювант с dTdT в качестве линкера (SEQ-63) или dGdG (SEQ-65) показал около 50% от эффекта ингибирования на прогрессирование опухоли из B16F10 клеток на день 10 после трансплантации по сравнению с ODN2006. Результаты показаны на Фиг. 6.
[0256]
Результат 9-A: CTL-индуцибельность адъювантов по настоящему изобретению, в которых мономер нуклеиновой кислоты в комплементарной цепи представляет собой 2'-OMe-РНК
Активность адъюванта по настоящему изобретению, в котором мономер нуклеиновой кислоты в комплементарной цепи представляет собой 2'-OMe-РНК, исследовали с использованием TRP2. Использовали длину комплементарной цепи 24 мер, т.е. адъювант, длина комплементарной цепи которого относительно CpG олигонуклеотида составляет 100% (SEQ-67), и адъювант, длина комплементарной цепи которого составляет 15 мер, т.е. адъювант, длина комплементарной цепи которого относительно CpG олигонуклеотида составляет 62,5% (SEQ-69). SEQ-67 и SEQ-69 показали CTL индуцибельность больше в 1,4 или 1,2 раза, соответственно, по сравнению с ODN2006 (SEQ-49). Результаты показаны в Таблице 39.
[0257]
Таблица 39
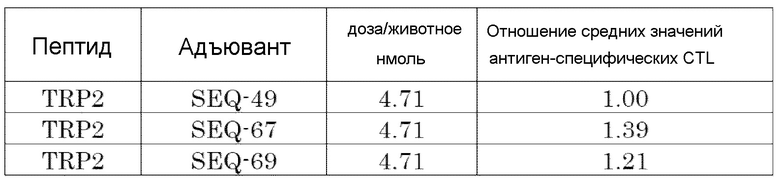
[0258]
Результат 9-B: Противоопухолевый эффект адъювантов по настоящему изобретению, в которых мономер нуклеиновой кислоты в комплементарной цепи представляет собой 2'-OMe-РНК
Когда мышей иммунизировали TRP2 пептидом и адъювантом по настоящему изобретению с 2'-OMe-РНК в качестве мономера нуклеиновой кислоты, адъювант, длина комплементарной цепи которого относительно CpG олигонуклеотида составляет 100% (SEQ-67), показал очень сильный эффект ингибирования на прогрессирование опухоли из B16F10 клеток, около 75% на день 10 после трансплантации по сравнению с ODN2006 (SEQ-49). Адъювант, длина комплементарной цепи которого относительно CpG олигонуклеотида составляет 62,5% (SEQ-69), показал около 20% от эффекта ингибирования на прогрессирование опухоли из B16F10 клеток на день 10 после трансплантации по сравнению с ODN2006. Результаты показаны на Фиг. 7.
Результаты предполагают, что 2'-OMe-РНК полезен также для ODN2006 в качестве мономера нуклеиновой кислоты для адъюванта по настоящему изобретению, а также и ДНК.
[0259]
Аналогичными способами измеряли CTL-индуцибельность или противоопухолевый эффект адъювантов по настоящему изобретению. Результаты представлены в Таблицах 40-68 и Фиг. 8-13 отдельно при помощи экспериментов. Для этих экспериментов использовали TRP2 пептид, и доза адъюванта по настоящему изобретению составляла 4,71 нмоль. NT в таблицах означает ʺне испытывалиʺ.
[0260]
Таблица 40
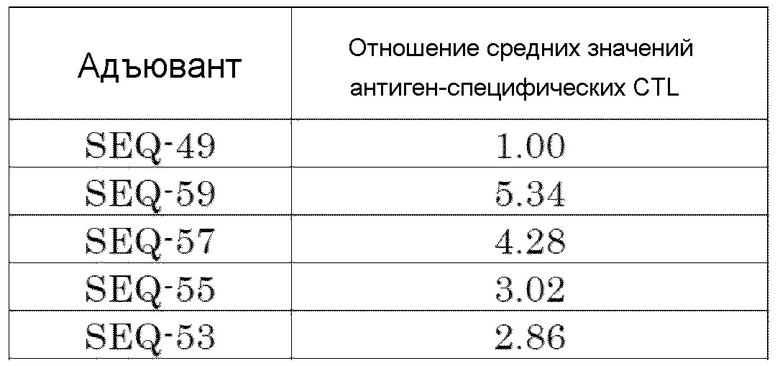
[0261]
Таблица 41

[0262]
Таблица 42

[0263]
Таблица 43
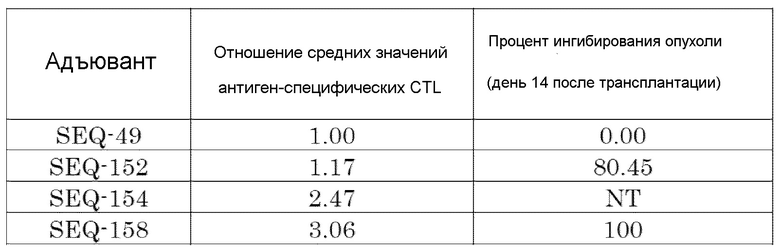
[0264]
Таблица 44
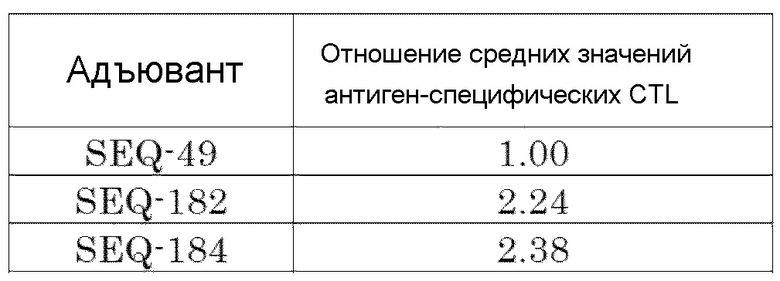
[0265]
Таблица 45
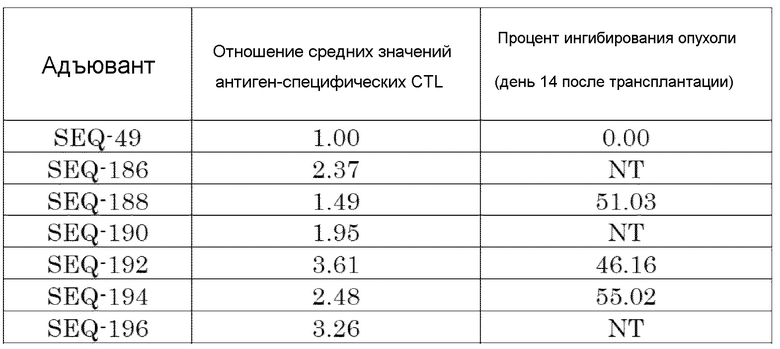
[0266]
Таблица 46
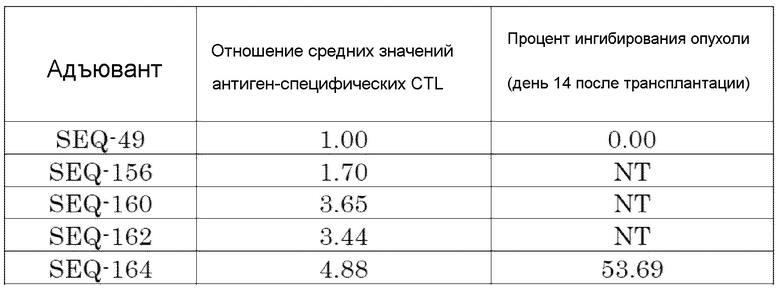
[0267]
Таблица 47

[0268]
Таблица 48
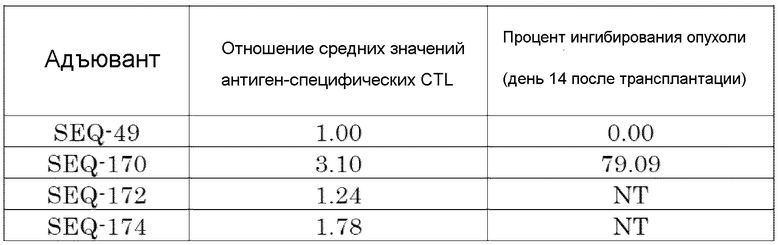
[0269]
Таблица 49

[0270]
Таблица 50

[0271]
Таблица 51
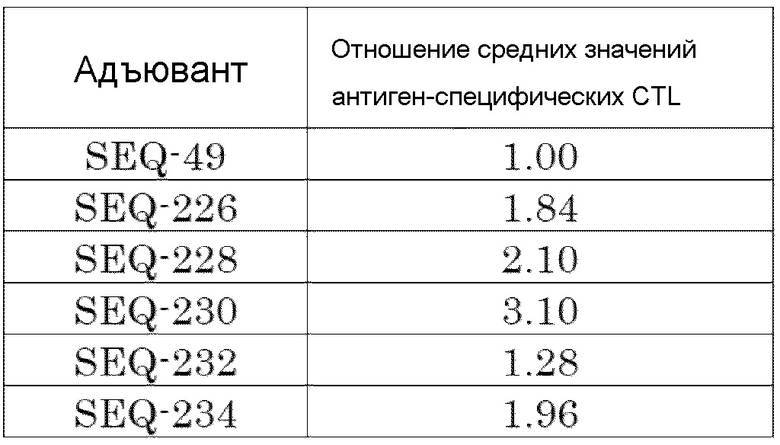
[0272]
Таблица 52
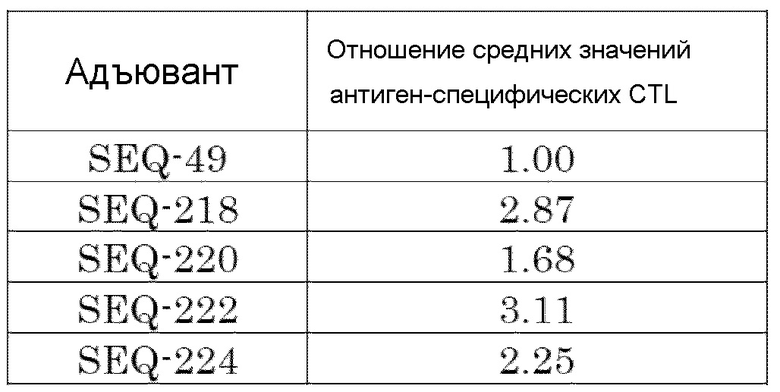
[0273]
Таблица 53

[0274]
Таблица 54
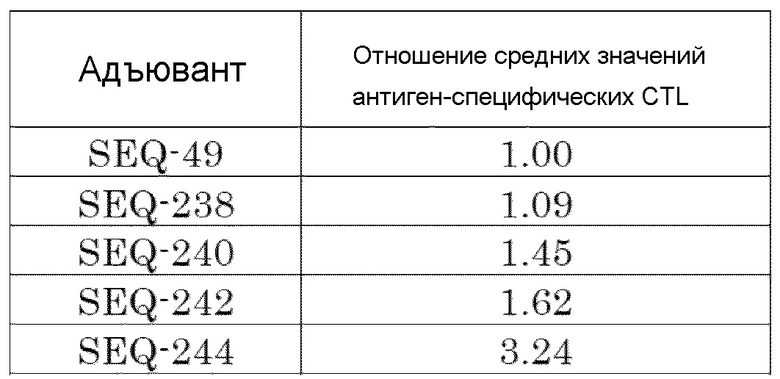
[0275]
Таблица 55
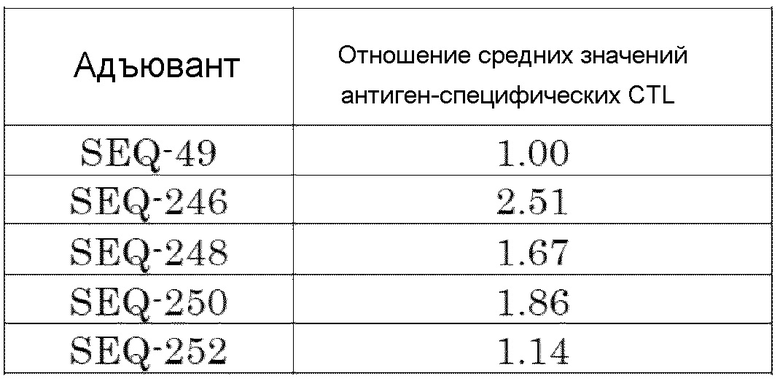
[0276]
Таблица 56

[0277]
Таблица 57

[0278]
Таблица 58

[0279]
Таблица 59
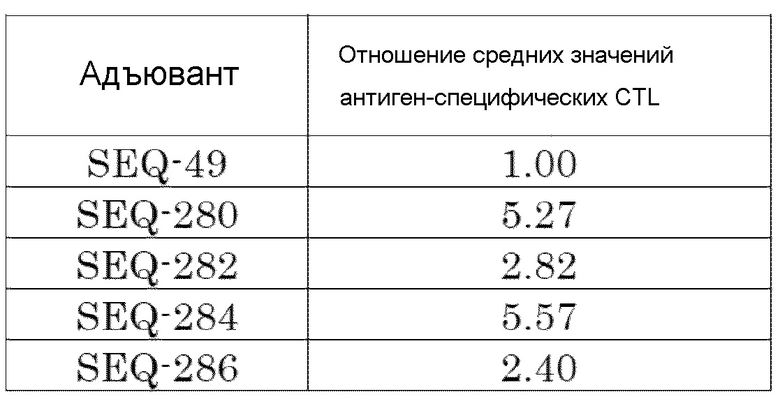
[0280]
Таблица 60

[0281]
Таблица 61
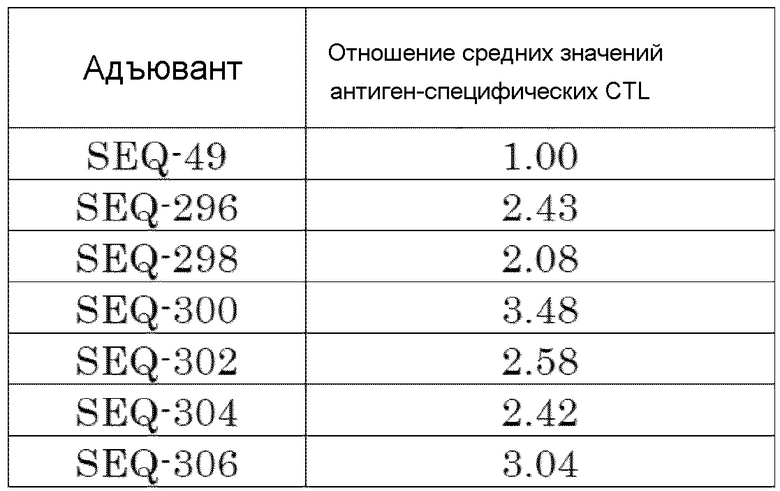
[0282]
Таблица 62

[0283]
Таблица 63

[0284]
Таблица 64
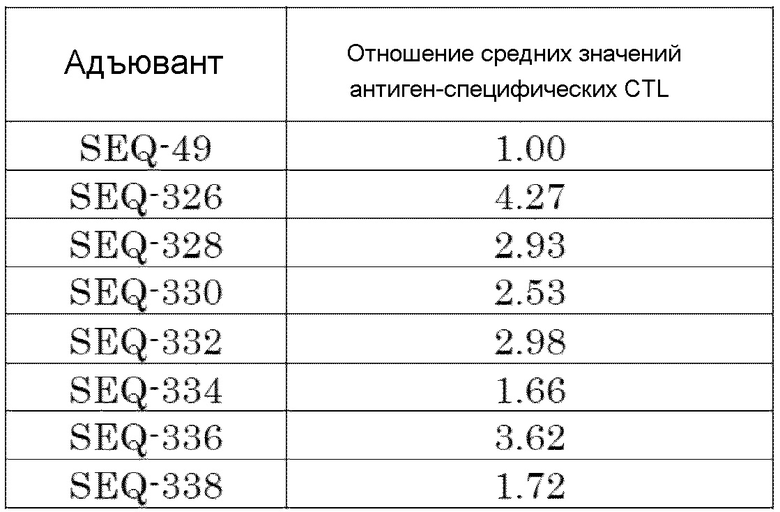
[0285]
Таблица 65
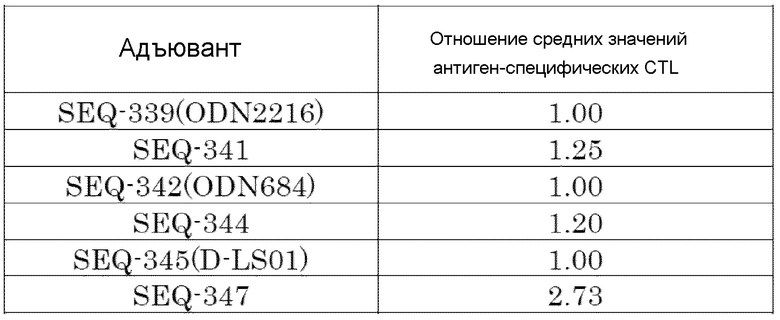
[0286]
Таблица 66

[0287]
Таблица 67
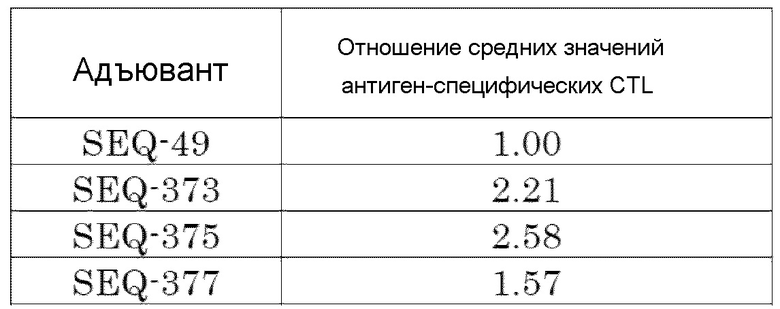
[0288]
Таблица 68
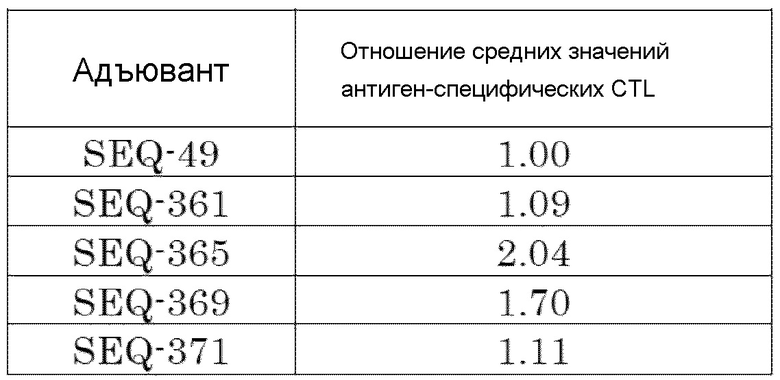
[0289]
Пример 4
Оценивали антиген-специфическую CTL индуцибельность и противоопухолевый эффект ODN2006 (SEQ-49) и SEQ-121 в отсутствие опухолевого антигенного пептида. Способами, аналогичными A) и B) Примера 3, подтверждали эффект вакцины без опухолевого антигенного пептида. Оба значения антиген-специфических CTL для SEQ-49 и SEQ-121 были неопределяемыми. С другой стороны, что касается противоопухолевого эффекта, SEQ-121 показал 85,3% от эффекта ингибирования на прогрессирование опухоли из B16F10 клеток на день 12 после трансплантации по сравнению с ODN2006. На основании этих результатов, SEQ-121, как ожидается, применим для терапевтической вакцины с противоопухолевым эффектом, даже как отдельное средство (Таблица 69, Фиг. 14).
[0290]
Таблица 69

[0291]
Пример 5 Испытание на раздражение при введении разовой дозы адъювантов по настоящему изобретению
A) Испытание подкожного раздражения при разовой дозе
Подкожное раздражение, вызываемое соединением по настоящему изобретению, оценивали путем макроскопическго исследования и гистопатологического исследования кожи при аутопсии через один день, одну и четыре недели после подкожного введения в разовой дозе.
Соединение по настоящему изобретению подкожно вводили в центр спины между лопатками крыс. При аутопсии через один день, одну и четыре недели после введения (изофлурановая анестезия, эвтаназия путем обескровливания) кожу в месте введения собирали, макроскопически исследовали и фиксировали в 10% нейтральном буферном растворе формалина. Фиксированную кожу вырезали, заделывали в препарат тонким срезами обычными методами и получали окрашенные гематоксилином-эозином (HE) секции. Наблюдатели исследовали патологию в HE-окрашенных секциях под оптическим микроскопом и фиксировали гистопатологические показатели. Патологические изменения оценивали по четырем степеням минимальные: ±; легкие: +; умеренные: 2+ и выраженные: 3+. Когда какая-либо степень не подходила для оценки, это отмечали как ʺПоложительныйʺ.
[0292]
(Результат)
Для проверки безопасности адъювантов по настоящему изобретению в качестве лекарственного средства подкожное раздражение сравнивали с подкожным раздражением, вызываемым Монтанидом, используемым в клинических испытаниях в качестве адъюванта, Amph1826 (SEQ-2) или ODN2006 (SEQ-49), который является хорошо известным адъювантом.
Монтанид является адъювантом, состоящим из минерального масла и поверхностно-активного вещества, и используется в клинических испытаниях в качестве адъюванта пептидной вакцины путем получения эмульсии в виде водного состава. Несмотря на то, что он является адъювантом с отличным профилем безопасности, что касается системной безопасности, возникает проблема с появлением уплотнения кожи, вызванного остаточной эмульсией в месте введения. В этом эксперименте реакцию в месте введения двухцепочечного олигонуклеотида сравнивали с реакцией на Монтанид, и исследовали, может ли это быть адъювант со слабым локальным раздражением.
Испытания подкожного раздражения у крыс при разовой дозе осуществляли для Монтанида, SEQ-2, SEQ-49 или адъюванта по настоящему изобретению (SEQ-61, SEQ-119, SEQ-121, SEQ-170, SEQ-192 или SEQ-216). Монтанид вводили при дозе 1 мл/участок в эмульсии Монтанид:физиологический раствор (1:1). SEQ-2, SEQ-49 или адъювант по настоящему изобретению растворяли в фосфатно-солевом буферном растворе и вводили соответственно при 4,71, 15,7 или 47,1 нмоль/1 мл/участок.
В результате, стало очевидно, что Монтанид не абсорбировался/разлагался/элиминировался, поскольку аккумуляция белого вещества или белые узелки были можно было макроскопически наблюдать под кожей, а кистоподобные структуры были гистологически подтверждены через один день, один и четыре недели после введения. Остающийся под кожей Монтанид продолжал вызывать воспаление от одного дня до четырех недель после введения. Через день после введения наблюдали инфильтрацию нейтрофилами и отеки. Через неделю после введения инфильтрация нейтрофилами и отек оставались, но воспаление стало немного хроническим, и его можно было наблюдать как гранулематозное воспаление. Через четыре недели после введения была образована толстая фиброзная капсула с инкапсулированным Монтанидом. Воспаление слегка уменьшалось по сравнению с одной неделей после введения, но даже через четыре недели после введения были обнаружены животные с постоянной инфильтрацией нейтрофилами или отеком.
В случае SEQ-2, воспаление, клеточная инфильтрация, отек и струп наблюдали через один день и через неделю после введения. Даже через четыре недели после введения воспаление кожи не проходило, и наблюдали гранулематозное воспаление путем непрерывной активации системы моноцитов/макрофагов.
В случае SEQ-49 и SEQ-61, SEQ-119, SEQ-121, SEQ-170, SEQ-192 и SEQ-216, который является адъювантом по настоящему изобретению, острое воспаление, в основном, инфильтрацию нейтрофилами, наблюдали под кожей через день после введения. Через неделю после введения воспаление, главным образом лимфоциты и макрофаги, наблюдали от подкожной области до ткани дермы, а через четыре недели после введения воспаление почти исчезало. Что касается SEQ-119, SEQ-121 и SEQ-170, оценка подкожного раздражения через четыре недели после введения не осуществляли, но когда вызываемое ими подкожное раздражение через один день и одну неделю после введения сравнивали с вызываемым SEQ-119, SEQ-121, SEQ-170 и SEQ-61, раздражение было таким же или слабее, чем в случае SEQ-61. Эти результаты дают основание предположить, что касается SEQ-119, SEQ-121 и SEQ-170, что воспаление почти полностью восстанавливалось через четыре недели после введения.
Таблицы 70-72 представляют результаты через один день после введения, таблицы 73-75 представляют результаты через неделю после введения, а таблицы 76-77 представляют результаты через четыре недели после введения. Примечания к таблицам приведены ниже.
1) Значения после данных - это число наблюдаемых животных.
2) Значения после данных - это оценки. Оценки были рассчитаны как общая оценка, при условии, что степень для каждого пациента определяли как минимальную: 1, легкую: 2 и умеренную: 3.
[0293]
Вышеизложенное показало, что при сравнении адъювантов по настоящему изобретению и Монтанида, адъюванты по настоящему изобретению не вызывали накопления соединений под кожей (низкий риск уплотнения), некроз или инфильтрация нейтрофилами не наблюдались даже через неделю после введения, и воспаление почти полностью восстановилось через четыре недели после введения. Поэтому было сделано заключение, что подкожное раздражение, вызываемое адъювантами по настоящему изобретению, было слабее, чем вызываемое Монтанидом. Кроме того, при сравнении с адъювантов по настоящему изобретению и Amph1826 (SEQ-2) воспаление, вызванное адъювантами по настоящему изобретению, почти полностью восстанавливалось через четыре недели после введения, но, с другой стороны, воспаление кожи, вызванное SEQ-2, не проходило, и гранулематозное воспаление путем непрерывной активации системы моноцитов/макрофагов наблюдалось даже через четыре недели после введения. Таким образом, был сделан вывод, что подкожное раздражение, вызываемое адъювантами по настоящему изобретению, было слабее, чем вызываемое SEQ-2. Подкожное раздражение, вызываемое адъювантами по настоящему изобретению, существенно не отличалось от вызываемого ODN2006 (SEQ-49).
[0294]
Таблица 70
[0295]
неминуемые диссекции
Аккумуляция белого вещества
Красные пятна, покраснение
Инфильтрация нейтрофилами2)
Отек2)
Кровоизлияние2)
Кистовидная структура1)
Инфильтрация нейтрофилами2)
Отек2)
Таблица 71
неминуемые диссекции
[0296]
Таблица 72
неминуемые диссекции
[0297]
Таблица 73
неминуемые диссекции
Белые узелки
некроз2)
Инфильтрация нейтрофилами2)
Инфильтрация моноцитами2)
Гранулематозное воспаление2)
отек2)
Кистовидная структура1)
[0298]
Таблица 74
неминуемые диссекции
Таблица 75
неминуемые диссекции
оценка1)
[0300]
Таблица 76
неминуемые диссекции
Белые узелки
Инфильтрация нейтрофилами2)
Гранулематозное воспаление2)
отек2)
Кистовидная структура, сопровождающаяся образованием фиброзной капсулы1)
[0301]
Таблица 77
неминуемые диссекции
[0302]
B) Испытание на внутрикожное раздражение при разовой дозе
Подкожное раздражение, вызываемое адъювантами по настоящему изобретению по настоящему изобретению, оценивали путем макроскопического исследования и гистопатологического исследования кожи при аутопсии через один день, одну и четыре недели после подкожного введения в разовой дозе.
Адъювант по настоящему изобретению подкожно вводили крысам в область спины. Следующую процедуру осуществляли способом, аналогичным описанному в А) Примера 5.
[0303]
Пример 6 Оценка индуцибельности продукции антител с использованием адъюванта по настоящему изобретению при иммунизации Pseudomonas aeruginosa PCRV антигенной вакциной
Когда антиген и адъювант вводят в качестве вакцины против инфекционного заболевания и индуцируют продукцию антител из В-лимфоцитов у иммунированного животного, ожидается эффект профилактики и лечения инфекционного заболевания. Поэтому, ожидая применение этого адъюванта для вакцины против инфекционного заболевания, осуществляли оценку продукции антител из В-лимфоцитов. PCRV антиген, который представляет собой Pseudomonas aeruginosa, использовали для исследования в качестве антигена. Уже сообщалось, что антиген PCRV Pseudomonas aeruginosa имеет эффект вакцины (Moriyama et al., Infect. Immun., Sep. 2001, том 69, № 9, 5908-5910), и, следовательно, эффект индуцибельности продукции антител, обеспечиваемый адъювантом, оценивали по сравнению с группой введения антигена PCRV. Адъювант Фрейнда использовали для контрольной группы. Адъювант Фрейнда представляет собой адъювант, который содержит туберкулезну бактерию, убитую нагреванием, смешанную в масле, состоящем из парафинового масла и моноолеата маннида, и известен как адъювант, сильно индуцирующий продукцию антител в неклинических исследованиях. Адъювант Фрейнда демонстрирует сильный эффект в неклинических исследованиях, но использование в клинических испытаниях было запрещено из-за опасения побочных эффектов (The European Agency for the Evaluation of Medical Products Evaluation of Medicines for Human Use, 25 March 2004, Internet URL:
http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/11/WC500015469.pdf)).
[0304]
Pcrv нуклеотидную последовательность (SEQ ID NO: 48), происходящую из Pseudomonas aeruginosa Штамм PAO1, клонировали по NdeI-XhoI сайту в pET21a вектор, и Escherichia coli штамм BL21 (DE3) трансформировали полученной плазмидой. Штамм pcrV-BL21 (DE3) культивировали в 500 мл жидкой среды LB/Ампициллин при 37°C и добавляли 200 мкл 0,1 M IPTG, когда OD600 значение достигало 0,5, для индукции экспрессии рекомбинантного PCRV белка. После культивировани при 16°C в течение 18 часов бактерии разделяли центрифугированием и добавляли 15 мл Буфера A (50 мМ Tris-HCl (pH8,0), 0,2M NaCl), включающего 0,5% лизозима (SIGMA Corporation). После выдерживания при 4°C в течение 30 минут осуществляли обработку ультразвуком. После центрифугирования при 12000 об/мин в течение 10 минут была получена растворимая фракция. 1 мл Ni-NTA агарозного геля (QIAGEN) добавляли в колонку Polyprep (BIO-RAD Laboratories, Inc) и уравновешивали при помощи 10 мл Буфера A. Растворимую фракцию добавляли в колонку и пропускали через нее. Колонку промывали при помощи 20 мл Буфера A+20 мМ имидазола и элюировали при помощи 1 мл Буфера A+250 мМ имидазола. Колонку Superdex 200 16/60 GL соединяли с AKTA Explorer (GE Healthcare) и уравновешивали при помощи 1,5 CV Буфера A. Фракцию, которую элюировали имидазолом, очищали гель-фильтрацией, и был очищен рекомбинантный PCRV белок с HIS на C-конце (SEQ ID NO: 49). Концентрацию полученного рекомбинантного PCRV белка определяли с использованием набора для анализа BCA (PIERCE) и белок хранили при -80°C.
[0305]
70 мкг рекомбинантного PCRV белка и 33 нмоль адъюванта по настоящему изобретению смешивали с физиологическим солевым раствором с получением объема 0,7 мл. Каждой из 5 самок A/J мышей 5-недельного возраста (Japan SLC, Inc.) вводили путем внутрикожной инъекции 0,1 мл иммуногена в день 0, 7 и 27. В качестве контроля использовали только рекомбинантный PCRV белок для иммунизации аналогичным способом. Что касается адъюванта Фрейнда, 100 мкг рекомбинантного PCRV белка смешивали с физиологическим солевым раствором с получением объема 0,5 мл и получали эмульсию с использованием такого же количества полного адъюванта Фрейнда (Difco Laboratories). 0,1 мл вводили путем внутрикожной инъекции в день 7 в качестве первичной иммунизации. В день 27 использовали неполный адъювант Фрейнда (Difco Laboratories) для иммунизации аналогичным способом. В день 33 собирали кровь из хвостовой вены мышей с использованием гепарина и центрифугировали при 6000 об/мин в течение 15 минут. Собирали супернатант в качестве антисыворотки и хранили при -40°C.
[0306]
Титр антител измеряли следующим образом. Рекомбинантный PCRV белок смешивали с PBS (pH7,4) (Invitrogen) с получением 1 мкг/мл и этот раствор добавляли в 384-луночный планшет Nunc Maxisorp (Thermo) при 20 мкл/лунка. Планшет герметично закрывали пленкой для планшетов и осуществляли инкубацию при 4°C в течение ночи. После промывки два раза 90 мкл/лунка промывочным буфером (9 г/л NaCl, 0,5 г/л Proclin 150, 0,1 г/л Tween-20) добавляли 60 мкл/лунка 1×аналитического буфера (Invitrogen). Планшет герметично закрывали пленкой для планшетов и блокирование осуществляли при комнатной температуре в течение 2 часов. После удаления жидкости путем постукивания антисыворотку разбавляли 1×аналитическим буфером в 103-107 раз и добавляли 20 мкл/лунка раствора. Планшет герметично закрывали пленкой для планшетов и осуществляли инкубацию при 4°C в течение ночи. После промывки три раза промывочным буфером, козлиное анти-мышиное IgG Fc-HRP (JacksonImmunoResearch) разбавляли 20000-кратно 1×аналитическим буфером и добавляли 20 мкл/лунка этого раствора. Планшет герметично закрывали пленкой для планшетов и осуществляли инкубацию при комнатной температуре в течение 2 часов. После промывки три раза промывочным буфером добавляли 20 мкл/лунка TMB
субстрата (Dako) и осуществляли инкубацию при комнатной температуре в течение 30 минут. Добавляли 20 мкл/лунка 0,5 N раствора серной кислоты (Nacalai) и измеряли поглощение при 450 нм при помощи планшет-ридера. Степень разведения рассчитывали, когда поглощение при 450 нм составляло 1,0, и значение представляли как титр антител. Результаты показаны на Фиг. 15.
[0307]
Титры антител были 3,0×106 для SEQ-121, что является самым высоким, 2,5×106 для адъюванта Фрейнда, 7,1×105 для SEQ-61 и 5,3×105 для ODN2006 (SEQ-49). Титр антител для только PCRV белка был 1,3×105. Эти результаты предполагают, что адъюванты по настоящему изобретению обладают сильной иммуностимулирующей активностью относительно B клеток. В частности, титр антител для SEQ-121 показал более высокую индуцибельность продукции антител, чем ODN2006, и почти такой же результат быт с титром антител для адъюванта Фрейнда. Тогда было сделано предположение, что адъюванты по настоящему изобретению являются отличными в качестве адъюванта для вакцины против инфекционных заболеваний. На основании этих результатов ожидают, что адъюванты по настоящему изобретению можно применять для вакцины против инфекционных заболеваний.
Промышленная применимость
[0308]
Как ясно видно из приведенных выше примеров, связывающиеся с липидами двухцепочечные олигонуклеотиды по настоящему изобретению показывают отличную иммуностимулирующую активность. Поэтому они являются чрезвычайно полезными, особенно в качестве адъюванта для повышения эффекта вакцины.
Перечень последовательностей
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Shionogi & Co., Ltd.
<120> Нуклеиновокислотное производное, обладающее иммуностимулирующей активностью
<130> 16P00047WO
<160> 49
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> ДНК
<213> искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 1
tccatgacgt tcctgacgtt 20
<210> 2
<211> 20
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 2
aacgtcagga acgtcatgga 20
<210> 3
<211> 10
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 3
aacgtcagga 10
<210> 4
<211> 15
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 4
aacgtcagga acgtc 15
<210> 5
<211> 19
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 5
aacgtcagga acgtcatgg 19
<210> 6
<211> 18
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 6
aacgtcagga acgtcatg 18
<210> 7
<211> 17
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 7
aacgtcagga acgtcat 17
<210> 8
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 8
aacgtcagga acgtca 16
<210> 9
<211> 14
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 9
aacgtcagga acgt 14
<210> 10
<211> 13
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 10
aacgtcagga acg 13
<210> 11
<211> 12
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 11
aacgtcagga ac 12
<210> 12
<211> 11
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 12
aacgtcagga a 11
<210> 13
<211> 24
<212> ДНК
<213> искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 13
tcgtcgtttt gtcgttttgt cgtt 24
<210> 14
<211> 24
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 14
aacgacaaaa cgacaaaacg acga 24
<210> 15
<211> 22
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 15
aacgacaaaa cgacaaaacg ac 22
<210> 16
<211> 20
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 16
aacgacaaaa cgacaaaacg 20
<210> 17
<211> 18
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 17
aacgacaaaa cgacaaaa 18
<210> 18
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 18
aacgacaaaa cgacaa 16
<210> 19
<211> 15
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 19
aacgacaaaa cgaca 15
<210> 20
<211> 15
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 20
acgacaaaac gacga 15
<210> 21
<211> 15
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 21
caaaacgaca aaacg 15
<210> 22
<211> 8
<212> Белок
<213> искусственная последовательность
<220>
<223> OVA Пептид
<400> 22
Ser Ile Ile Asn Phe Glu Lys Leu
1 5
<210> 23
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> TRP2 пептид
<400> 23
Cys Ser Val Tyr Asp Phe Phe Val Trp Leu
1 5 10
<210> 24
<211> 17
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 24
aacgacaaaa cgacaaa 17
<210> 25
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 25
aacgacaaaa cgacga 16
<210> 26
<211> 20
<212> ДНК
<213> искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 26
atcgactctc gagcgttctc 20
<210> 27
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 27
gagaacgctc gagagt 16
<210> 28
<211> 20
<212> ДНК
<213> искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 28
ggtgcatcga tgcagggggg 20
<210> 29
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 29
cccccctgca tcgatg 16
<210> 30
<211> 20
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 30
acaaaacgac aaaacgacga 20
<210> 31
<211> 10
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 31
aaaacgacga 10
<210> 32
<211> 20
<212> ДНК
<213> искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 32
gggggacgat cgtcgggggg 20
<210> 33
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 33
ccgacgatcg tccccc 16
<210> 34
<211> 23
<212> ДНК
<213> искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 34
tcgacgttcg tcgttcgtcg ttc 23
<210> 35
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 35
gaacgacgaa cgtcga 16
<210> 36
<211> 26
<212> ДНК
<213> искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 36
tcgcgacgtt cgcccgacgt tcggta 26
<210> 37
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 37
cgggcgaacg tcgcga 16
<210> 38
<211> 29
<212> ДНК
<213> искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 38
tcgcgaacgt tcgccgcgtt cgaacgcgg 29
<210> 39
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 39
cggcgaacgt tcgcga 16
<210> 40
<211> 22
<212> ДНК
<213> искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 40
tcgtcgtttt cggcgcgcgc cg 22
<210> 41
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 41
gcgccgaaaa cgacga 16
<210> 42
<211> 25
<212> ДНК
<213> искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 42
tcgtcgtcgt tcgaacgacg ttgat 25
<210> 43
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 43
gttcgaacga cgacga 16
<210> 44
<211> 21
<212> ДНК
<213> искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 44
ggggacgacg tcgtgggggg g 21
<210> 45
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 45
ccacgacgtc gtcccc 16
<210> 46
<211> 22
<212> ДНК
<213> искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 46
tgactgtgaa cgttcgagat ga 22
<210> 47
<211> 16
<212> ДНК
<213> искусственная последовательность
<220>
<223> олигонуклеотид
<400> 47
cgaacgttca cagtca 16
<210> 48
<211> 882
<212> ДНК
<213> Pseudomonas aeruginosa
<400> 48
atggaagtca gaaaccttaa tgccgctcgc gagctgttcc tggacgagct cctggccgcg 60
tcggcggcgc ctgccagtgc cgagcaggag gaactgctgg ccctgttgcg cagcgagcgg 120
atcgtgctgg cccacgccgg ccagccgctg agcgaggcgc aagtgctcaa ggcgctcgcc 180
tggttgctcg cggccaatcc gtccgcgcct ccggggcagg gcctcgaggt actccgcgaa 240
gtcctgcagg cacgtcggca gcccggtgcg cagtgggatc tgcgcgagtt cctggtgtcg 300
gcctatttca gcctgcacgg gcgtctcgac gaggatgtca tcggtgtcta caaggatgtc 360
ctgcagaccc aggacggcaa gcgcaaggcg ctgctcgacg agctcaaggc gctgaccgcg 420
gagttgaagg tctacagcgt gatccagtcg cagatcaacg ccgcgctgtc ggccaagcag 480
ggcatcagga tcgacgctgg cggtatcgat ctggtcgacc ccacgctata tggctatgcc 540
gtcggcgatc ccaggtggaa ggacagcccc gagtatgcgc tgctgagcaa tctggatacc 600
ttcagcggca agctgtcgat caaggatttt ctcagcggct cgccgaagca gagcggggag 660
ctcaagggcc tcagcgatga gtaccccttc gagaaggaca acaacccggt cggcaatttc 720
gccaccacgg tgagcgaccg ctcgcgtccg ctgaacgaca aggtcaacga gaagaccacc 780
ctgctcaacg acaccagctc ccgctacaac tcggcggtcg aggcgctcaa ccgcttcatc 840
cagaaatacg acagcgtcct gcgcgacatt ctcagcgcga tc 882
<210> 49
<211> 302
<212> Белок
<213> Искусственная последовательность
<220>
<223> PcrV Рекомбинантный белок (C-His tag)
<400> 49
Met Glu Val Arg Asn Leu Asn Ala Ala Arg Glu Leu Phe Leu Asp Glu
1 5 10 15
Leu Leu Ala Ala Ser Ala Ala Pro Ala Ser Ala Glu Gln Glu Glu Leu
20 25 30
Leu Ala Leu Leu Arg Ser Glu Arg Ile Val Leu Ala His Ala Gly Gln
35 40 45
Pro Leu Ser Glu Ala Gln Val Leu Lys Ala Leu Ala Trp Leu Leu Ala
50 55 60
Ala Asn Pro Ser Ala Pro Pro Gly Gln Gly Leu Glu Val Leu Arg Glu
65 70 75 80
Val Leu Gln Ala Arg Arg Gln Pro Gly Ala Gln Trp Asp Leu Arg Glu
85 90 95
Phe Leu Val Ser Ala Tyr Phe Ser Leu His Gly Arg Leu Asp Glu Asp
100 105 110
Val Ile Gly Val Tyr Lys Asp Val Leu Gln Thr Gln Asp Gly Lys Arg
115 120 125
Lys Ala Leu Leu Asp Glu Leu Lys Ala Leu Thr Ala Glu Leu Lys Val
130 135 140
Tyr Ser Val Ile Gln Ser Gln Ile Asn Ala Ala Leu Ser Ala Lys Gln
145 150 155 160
Gly Ile Arg Ile Asp Ala Gly Gly Ile Asp Leu Val Asp Pro Thr Leu
165 170 175
Tyr Gly Tyr Ala Val Gly Asp Pro Arg Trp Lys Asp Ser Pro Glu Tyr
180 185 190
Ala Leu Leu Ser Asn Leu Asp Thr Phe Ser Gly Lys Leu Ser Ile Lys
195 200 205
Asp Phe Leu Ser Gly Ser Pro Lys Gln Ser Gly Glu Leu Lys Gly Leu
210 215 220
Ser Asp Glu Tyr Pro Phe Glu Lys Asp Asn Asn Pro Val Gly Asn Phe
225 230 235 240
Ala Thr Thr Val Ser Asp Arg Ser Arg Pro Leu Asn Asp Lys Val Asn
245 250 255
Glu Lys Thr Thr Leu Leu Asn Asp Thr Ser Ser Arg Tyr Asn Ser Ala
260 265 270
Val Glu Ala Leu Asn Arg Phe Ile Gln Lys Tyr Asp Ser Val Leu Arg
275 280 285
Asp Ile Leu Ser Ala Ile Leu Glu His His His His His His
290 295 300
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЬЮГАТЫ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ НИКОТИНОВОЙ ЗАВИСИМОСТИ | 2011 |
|
RU2574032C2 |
| СИНТЕТИЧЕСКИЕ ГЛЮКОПИРАНОЗИЛЛИПИДНЫЕ АДЪЮВАНТЫ | 2010 |
|
RU2560182C2 |
| СИНТЕТИЧЕСКИЕ ГЛЮКОПИРАНОЗИЛЛИПИДНЫЕ АДЪЮВАНТЫ | 2010 |
|
RU2732574C2 |
| КАТИОННЫЙ ЛИПИД | 2017 |
|
RU2740921C2 |
| СОЕДИНЕНИЕ, ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2095366C1 |
| МОДИФИЦИРОВАННЫЕ ОЛИГОДЕЗОКСИРИБОНУКЛЕОТИДЫ, КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1994 |
|
RU2111971C1 |
| ПРОИЗВОДНЫЕ ГЛИЦЕРИНА, СРЕДСТВО ДЛЯ ДОСТАВКИ ФИЗИОЛОГИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2123492C1 |
| ХИРАЛЬНЫЕ РЕАГЕНТЫ ДЛЯ ПОЛУЧЕНИЯ ГОМОГЕННЫХ ОЛИГОМЕРОВ | 2016 |
|
RU2791532C2 |
| НОВЫЕ КАРБОСИЛАНОВЫЕ ДЕНДРИМЕРЫ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2006 |
|
RU2422474C2 |
| 6-5 КОНДЕНСИРОВАННЫЕ КОЛЬЦА КАК ИНГИБИТОРЫ С5а | 2018 |
|
RU2780338C2 |



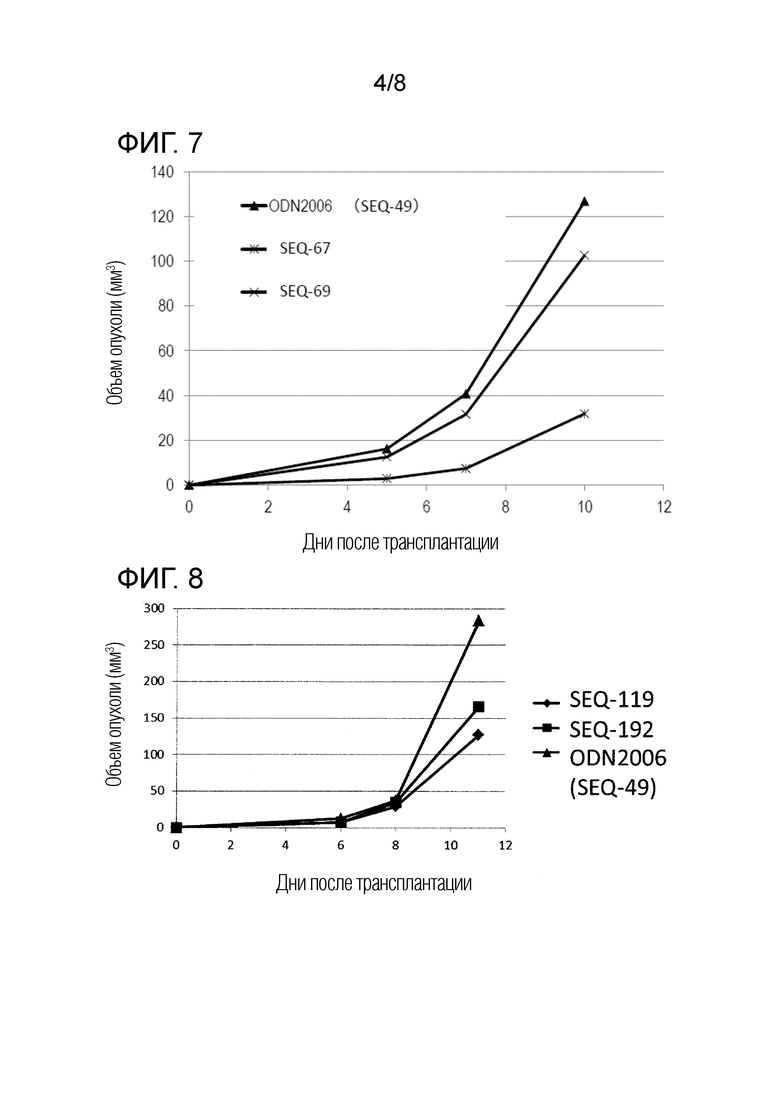
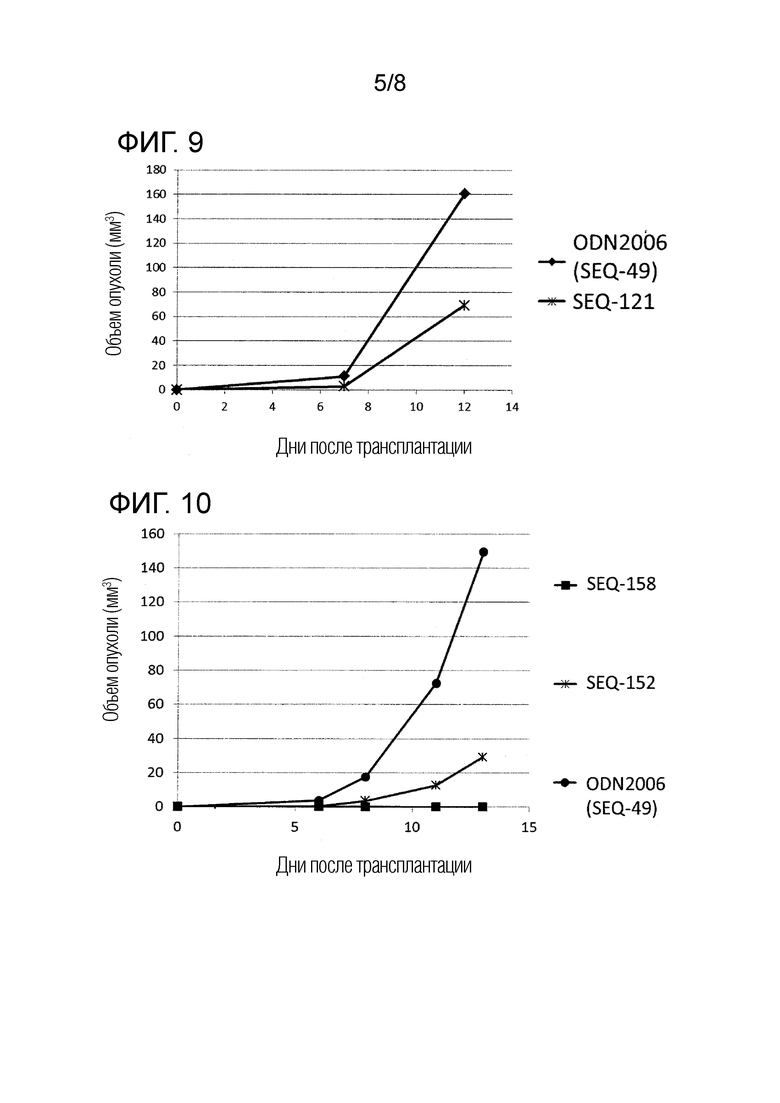
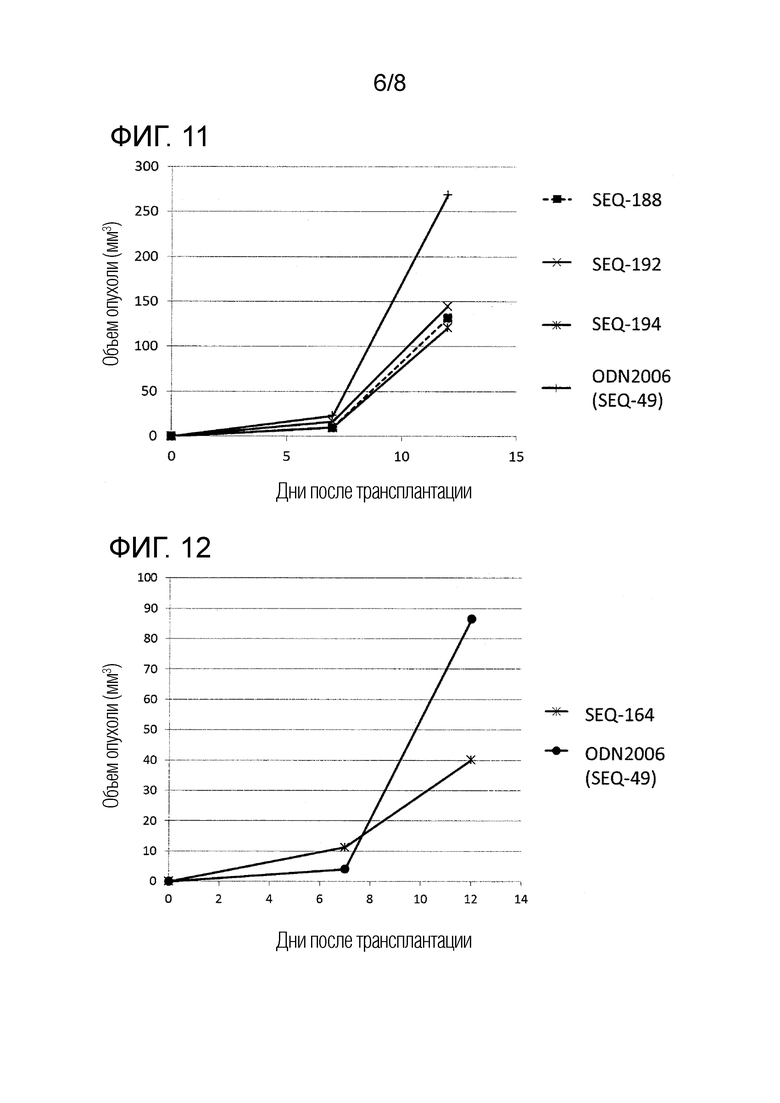
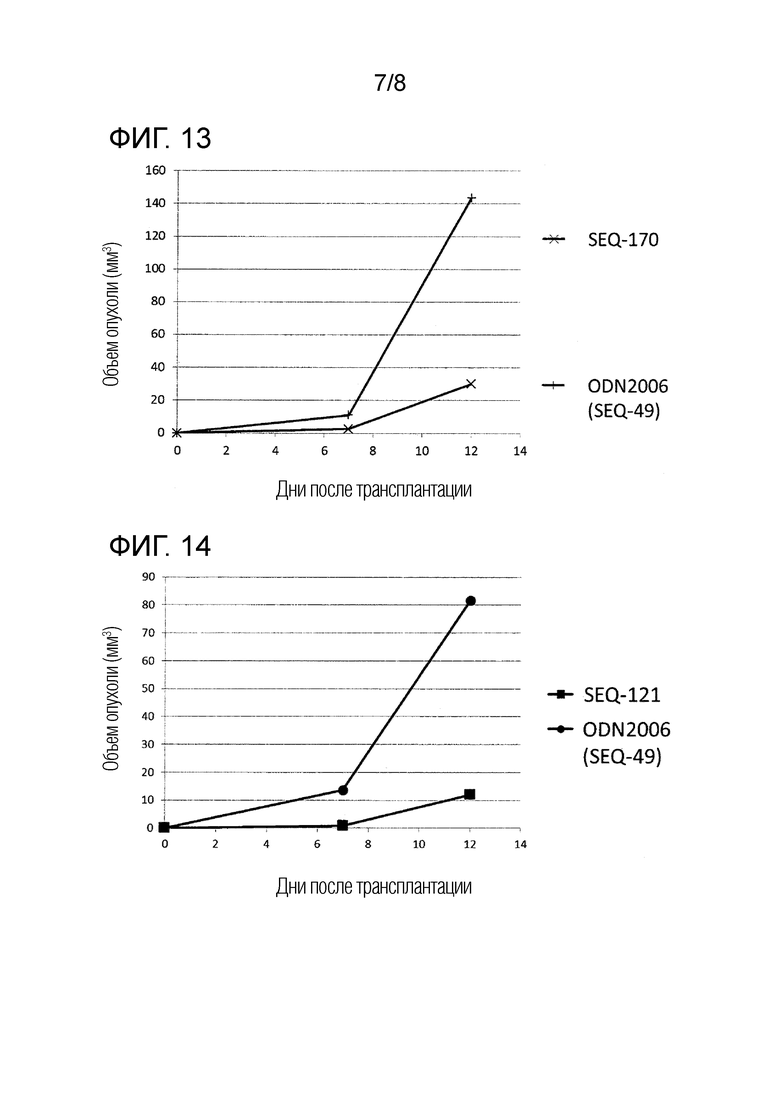

Группа изобретений относится к иммунологии и медицине, в частности к производным нуклеиновой кислоты, обладающим иммуностимулирующей активностью, которые являются полезными в качестве адъюванта вакцины и/или вакцины как таковой. Предложено соединение, имеющее иммуностимулирующую активность, которое состоит из первой цепи и второй цепи, причем первая цепь представлена формулой ODN2006, а вторая цепь представляет собой олигонуклеотид, включающий последовательность, способную гибридизоваться с первой цепью, связанный с липидом. Соединения пригодны в качестве адъюванта для лечения или профилактики рака или инфекционного заболевания при их введении с опухолевым или микробным антигеном. Кроме того, соединения в отсутствии опухолевого антигенного пептида показывают сильный противоопухолевый эффект в отношении меланомы, экспрессирующей TRP2 белок. 10 н.п. ф-лы, 15 ил., 77 табл., 6 пр.
1. Соединение, имеющее иммуностимулирующую активность, состоящее из первой цепи и второй цепи, способной гибридизоваться с первой цепью, причем первая цепь представлена формулой:
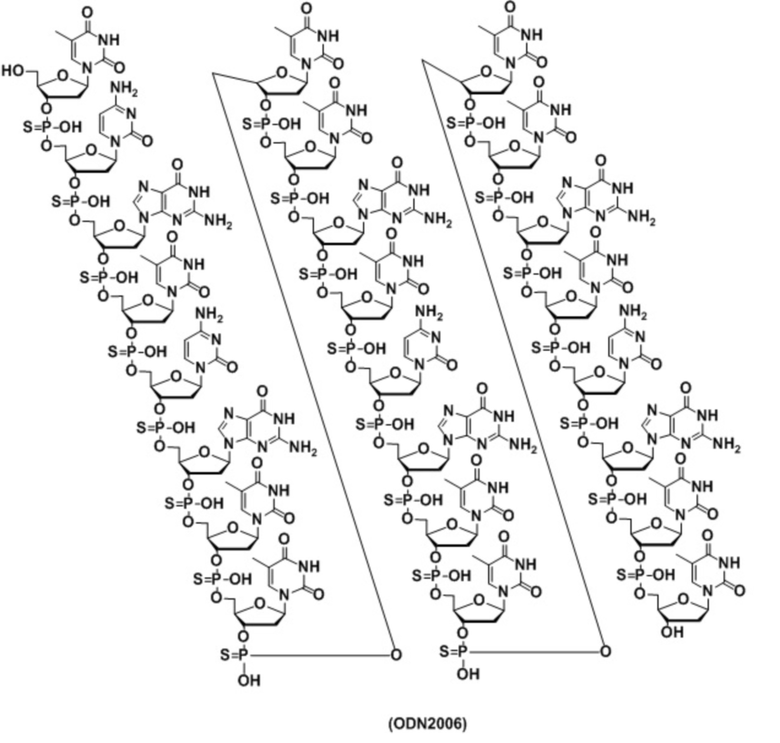
и причем вторая цепь выбрана из группы, состоящей из (A) и (B), ниже:
(А) цепь, представленная формулой:
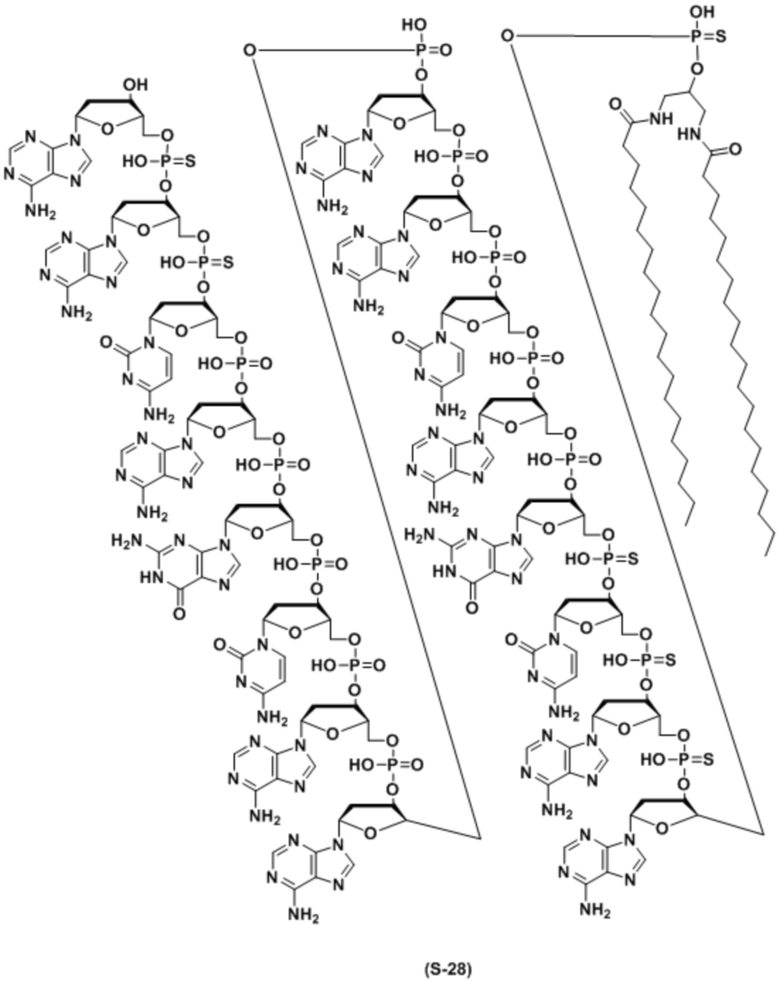 ;
;
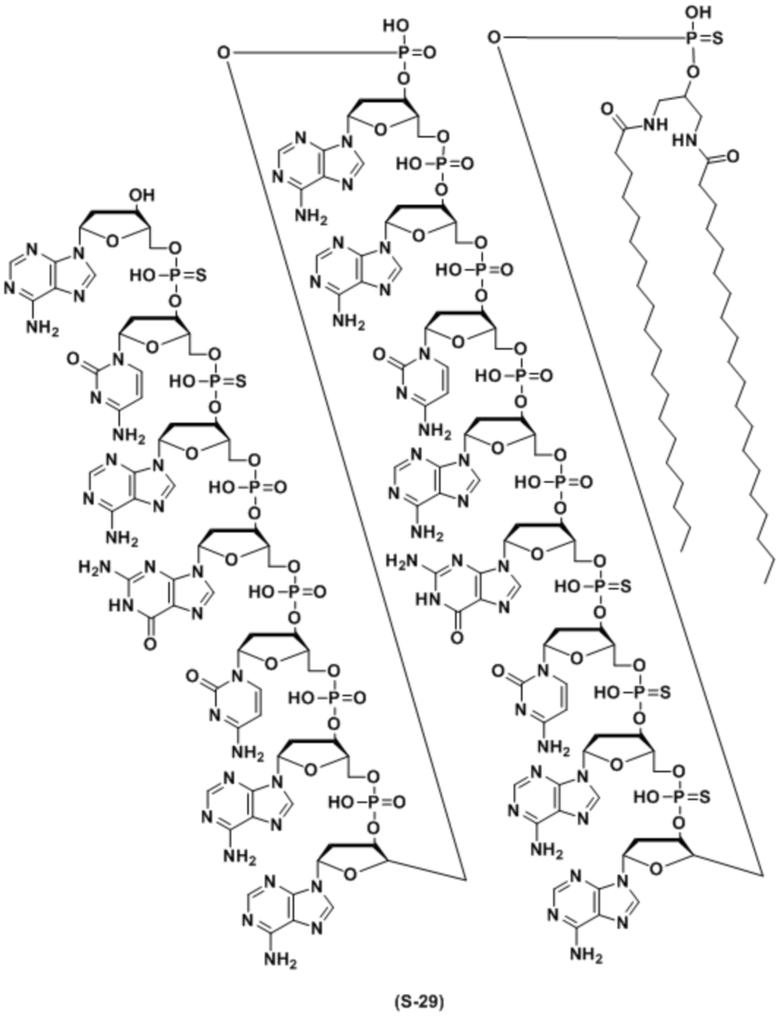 ;
;
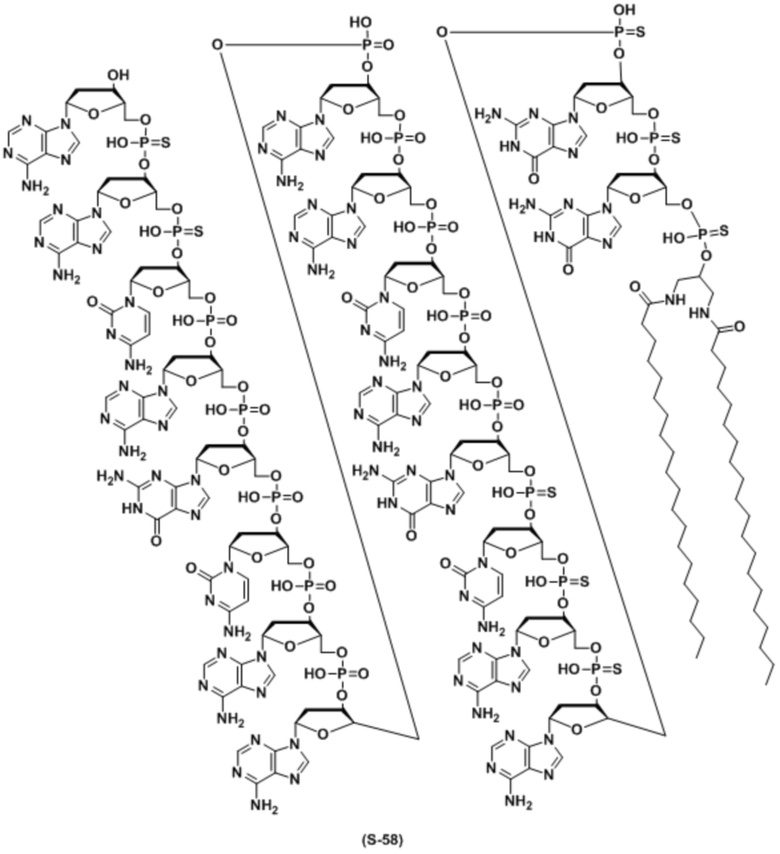 ;
;
 ;
;
 ;
;
или
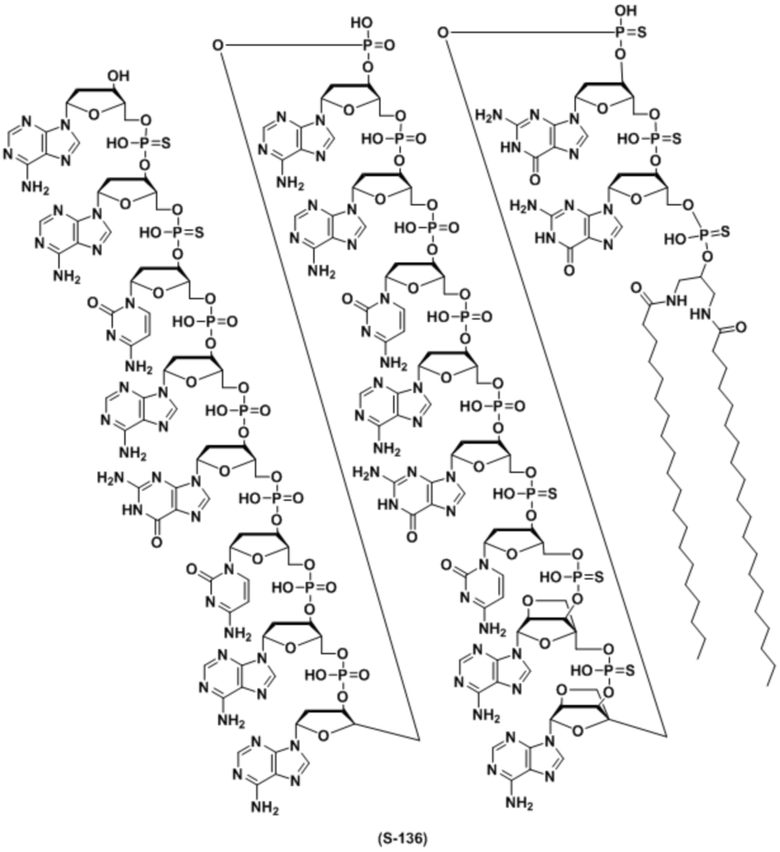
и
(В) цепь, представленная формулой:
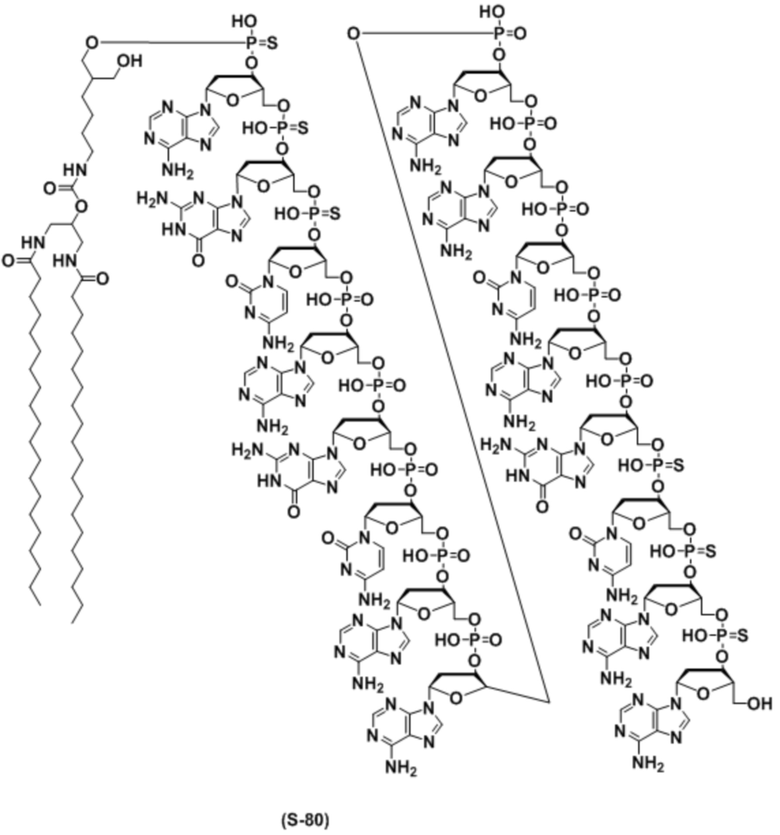 ;
;
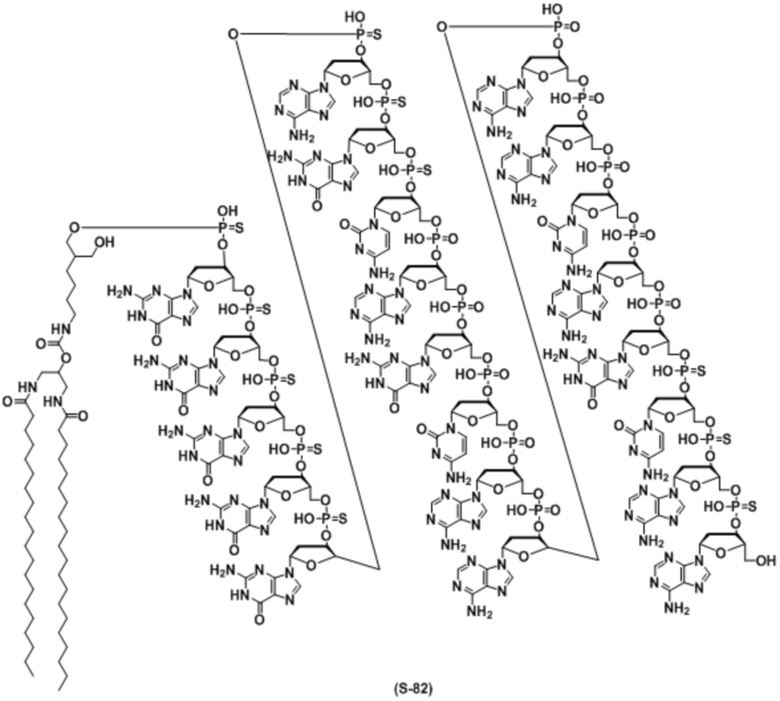 ;
;
 ;
;
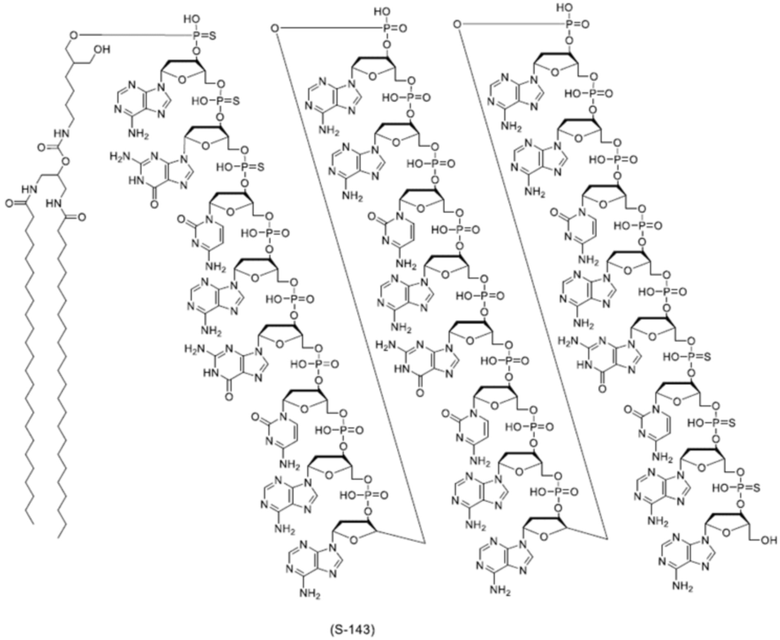 ;
;
 ;
;
или

2. Фармацевтическая композиция для лечения или профилактики меланомы, экспрессирующей TRP2 белок, включающая эффективное количество соединения по п.1, в котором вторая цепь выбрана из группы, состоящей из (А).
3. Фармацевтическая композиция для лечения или профилактики рака, включающая соединение по п.1 и опухолевый антиген.
4. Фармацевтическая композиция для лечения или профилактики инфекционного заболевания, включающая соединение по п.1 и микробный антиген.
5. Способ лечения или профилактики меланомы, экспрессирующей TRP2 белок, включающий введение эффективного количества соединения по п.1, в котором вторая цепь выбрана из группы, состоящей из (А).
6. Способ лечения или профилактики рака, включающий введение эффективного количества соединения по п.1 и опухолевого антигена.
7. Способ лечения или профилактики инфекционного заболевания, включающий введение эффективного количества соединения по п.1 и микробного антигена.
8. Применение соединения по п.1, в котором вторая цепь выбрана из группы, состоящей из (А), для получения средства для лечения или профилактики меланомы, экспрессирующей TRP2 белок.
9. Применение соединения по п.1 для получения средства с опухолевым антигеном для лечения или профилактики рака.
10. Применение соединения по п.1 для получения средства с микробным антигеном для лечения или профилактики инфекционного заболевания.
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| US2011159081 A1, 30.06.2011 | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| PARK B.K | |||
| et al., "The production and immunostimulatory activity of double-stranded CpG-DNA", BMB reports, 2010, vol | |||
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2020-08-26—Публикация
2016-09-29—Подача