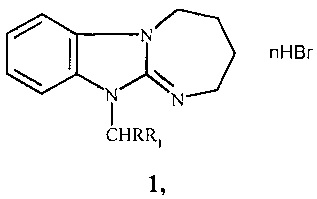
Изобретение относится к новым производным в ряду 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола, а именно к неописанным ранее 11-(4-трет-бутилбензил)- и 1-фенацилзамещенным 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола общей формулы 1:
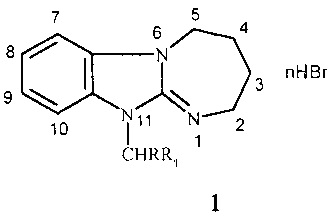
где n=0,1; R=Н, Br; R1=4-(СН3)3СС6Н4, 4-FC6H4CO, 3,4-(ОН)2С6Н3СО;
в том числе, при
n=1; R=Н, R1=4-(СН3)3СС6Н4 (a); R=Н, R1=4-FC6H4CO (б);
n=0; R=Br, R1=3,4-(ОН)2С6Н3СО (в),
обладающими анксиолитической активностью.
Невротические расстройства в настоящее время являются одной из ведущих медико-социальных проблем. Распространенность их среди населения развитых странах чрезвычайно высока (10-20%), причем средний ежегодный показатель прироста их распространенности в мире превышает 10%. Поэтому проблема эффективной диагностики и лечения невротических расстройств выходит сегодня на одно из ведущих мест в медицине и фармакологии. Одним из наиболее характерных клинических проявлений неврозов (прежде всего неврастении), а также психоэмоциональных расстройств в рамках психосоматических заболеваний являются тревожные расстройства [1]. Современная медицина располагает большим количеством разнообразных препаратов для предупреждения и лечения нервно-психических заболеваний: агонисты бензодиазепиновых рецепторов (диазепам, феназепам и др.); агонисты серотониновых рецепторов (буспирон); вещества разного типа действия (бенактизин и др.) [2]. Большинство препаратов обладает неблагоприятными побочными эффектами, заключающимися в угнетении ЦНС: сонливость в дневное время, вялость, мышечная слабость, притупление эмоций, головная боль, головокружение, атаксия и др. Возможно нарушение когнитивных функций, а при длительном применении - привыкание, лекарственная зависимость [3]. В связи с этим актуальным является поиск новых эффективных транквилизаторов, которые на фоне высокой биологической активности не оказывали бы токсического действия и обладали минимальными побочными эффектами [4].
В ранних исследованиях психотропная активность была установлена у производных бензимидазола, у которых так же отмечался низкий риск проявления нежелательных эффектов. Экспериментальные исследования, проведенные ранее на базе Волгоградского государственного медицинского университета, позволили выявить у производных бензимидазола анксиолитическую активность. В связи с этим перспективным является исследование комбинации двух привилегированных структур - производных диазепина и бензимидазола - диазепинобензимидазола, которые отличаются высокой эффективностью и низким риском появления нежелательных реакций.
В ряду 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола известны гидрохлориды 11-фенацилпроизводных 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола, обладающие гипотензивными свойствами [5].
Наиболее близкими по структуре являются гидрогалогениды 11-феноксиэтил- и бензилзамещенных 2,3,4,5-тетерагидро[1,3]диазепино[1,2-а]бензимидазола, обладающие антиагрегантной активностью [6].
В ряду 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола не известны соединения, проявляющие анксиолитическую активность.
Техническим результатом изобретения являются новые соединения в ряду 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола, проявляющие достаточно эффективную и неизвестную для данного ряда анксиолитическую активность, не вызывающую миорелаксацию и гипногенное действие.
Технический результат достигается соединениями 1.
Синтез соединений при n=1, в том числе 1а, б заключается в алкилировании 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола (2) аналогично методике [7] 2-(4-трет-бутилбензил)бромидом или 4-фторфенацилбромидом при кипячении в нитрометане или ацетонитриле:
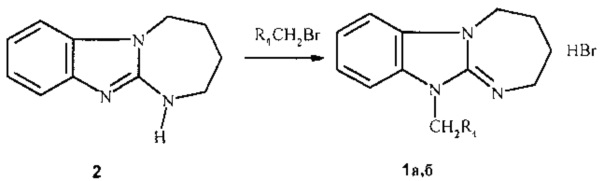
1a R1=4-(СН3)3СС6Н4; 1b R1=4-FC6H4CO
Синтез соединений при n=0, в том числе 1в осуществляют в 2 стадии. Вначале диазепинобензимидазол 2 алкилируют 3,4-диметоксифенацилбромидом в нитрометане, а затем образующееся фенацилпроизводное 3 вводят в реакцию гидролиза бромистоводородной кислотой, которая сопровождается бромированием метиленовой группы фенацильного фрагмента.
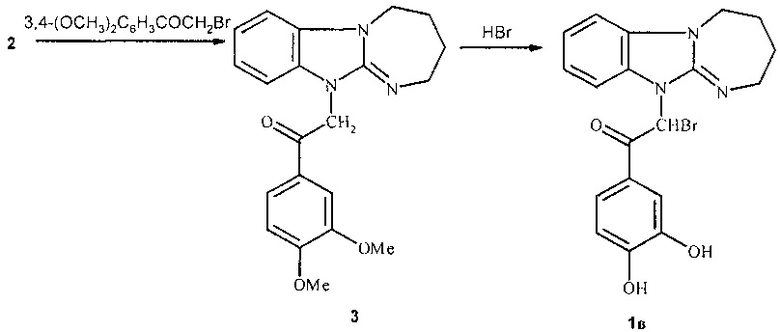
Ниже приведены примеры синтеза предлагаемых соединений.
Пример 1. Гидробромид 11-(2-(4-трет-бутилбензил)-2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазол (1а).
Смесь 1.87 г (10 ммоль) 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола (2), 2.27 г (10 ммоль), 2-(4-трет-бутилбензилбромида и 10 мл нитрометана кипятили в течение 5 ч. Затем смесь охлаждали, отфильтровывали 3.72 г (90%) гидробромида 11-[2-(4-трет-бутилбензил)-2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола (1а). Бесцветные кристаллы с т.пл. 249-251°С (из изопропанола).
Спектр ЯМР 1Н, (300 МГц), δ, м.д. (ДМСО-d6): 1-20 (с, 9Н, С(СН3)3), 1.97-2.10 (м, 4Н, 2Н(3), 2Н(4)); 3.57-3.58 (м, 2Н, С(5)Н2); 4.35-4.36 (м, 2Н, С(2)Н2); 5.46 (с, 2Н, CH2Ar); 7.22-7.39 (м, 6Н, Н(8), Н(9), Н(2'), Н(3'), Н(5'), Н(6'))1 (1 Здесь и далее цифрами со штрихом показаны протоны арильного заместителя в положении 11 диазепинобензимидазола 1); 7.48 (д, 1Н, Н(10) или Н(7), J=7.6 Гц), 7.71 (д, 1Н, Н(7) или Н(10)); 9.05 (с, 1H, +NH).
Найдено, (%): С 63.52; Н 6.95; Br 19.07; N 10.20. C22H27N3⋅HBr. Вычислено, (%): С 63.77; Н 6.81; Br 19.28; N 10.14.
Пример 2. Гидробромид 1-(4-фторфенил)-2-(2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазол-11-ил)этанона (1б).
Раствор 0.37 г (2 ммоль) 2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазола и 0.44 г (2 ммоль) 4-фторфенацилбромида в 10 мл ацетонитрила кипятили 12 ч. Выделяющийся осадок после охлаждения отфильтровывали, промывали ацетоном. Выход 0.68 г (84%). Бесцветные кристаллы с т.пл. 246-247°С (из этанола).
Спектр ЯМР 1Н, (600 МГц), δ, м.д. (ДМСО-d6): 1.95-2.11 (м, 4Н, С(3)Н2, С(4)Н2); 3.47-3.48 (м, 2Н, С(5)Н2); 4.37-4.38 (м, 2Н, С(2)Н2); 5.99 (с, 2 Н, CH2Ar); 7.32 (т, 1Н, Н(8) или Н(9), J=7.6 Гц); 7.38 (т, 1Н, Н(9) или Н(8), J=1.1 Гц); 7.49 (т, 2Н, Н(3'), H(5'), J=8.8 Гц); 7.62 (д, 1H, Н(7) или Н(10), J=7.9 Гц); 7.72 (д, 1H, Н(10) или Н(7), J=8.1 Гц); 8.18 (д.д, 2Н, Н(2'), Н(6'), J1=8.8, J2=5.4 Гц); 8.83 (с, 1H, +NH).
Найдено, (%): N 10.25. C19H18FN3O⋅HBr. Вычислено, (%): N 10.39
Пример 3. 2-Бром-1-(3,4-дигидроксифенил)-2-(2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазол-11-ил)этанон (1в).
Стадия 1. Гидробромид 1-(3,4-диметоксифенил)-2-(2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазол-11-ил)этанона (3). Раствор 0.37 г (2 ммоль) диазепинобензимидазола 2 и 0.52 г (2 ммоль) 3,4-диметоксифенацилбромида в 5 мл нитрометана кипятили 6 ч. Охлаждали, добавляли 15 мл ацетона и отфильтровывали выделяющийся осадок. Выход 0.80 г (90%). Бесцветные кристаллы с т.пл. 233-234°С (из этанола). Спектр ЯМР 1Н, (300 МГц), δ, м.д. (ДМСО-d6): 1.95-2.10 (м, 4Н, С(3)Н2, С(4)Н2); 3.47-3.48 (м, 2Н, С(5)Н2); 3.84 (с, 3Н, ОСН3); 3.89 (с, ОСН3); 4.37 (т, 2 Н, С(2)Н2, J=5.1 Гц); 5.95 (с, 2Н, CH2Ar); 7.20 (д, 1H, Н(5'), J=8.7 Гц); 7.28-7.41 (м, 2Н, Н(8), Н(9)); 7.51 (д, 1Н, Н(2'), J=1.8 Гц); 7.59 (д, 1Н, Н(7) или Н(10), J=1.5 Гц); 7.73 (д, 1Н, Н(10) или Н(7), J=8.4 Гц); 7.78-7.81 (д.д, 1Н, Н(6'), J1=8.4, J2=1.8 Гц); 8.81 (уш. с., +NH).
Найдено, (%): С 56.37; Н 5.21; Br 17.74; N 9.62. C21H23N3O3⋅HBr. Вычислено, (%): С 56.51; Н 5.42; Br 17.90; N 9.41.
Стадия 2. 2-Бром-1-(3,4-дигидроксифенил)-2-(2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазол-11-ил)этанон (1в). Раствор 0.45 г (1 ммоль) диметоксипроизводного (3) в 5 мл 48% HBr кипятили 4 часа. Выделяющийся после охлаждения осадок отфильтровывали, промывали 10 мл ледяной воды. Выход 0.35 г (84%), т.пл.>305°С (разл., из воды). Спектр ЯМР 1Н, (600 МГц), δ, м.д. (ДМСО-d6): 2.23-2.32 (м, 4Н, С(3)Н2, С(4)Н2); 4.07 (т, 2Н, С(5)Н2, J=5.2 Гц); 4.30 (т, 2Н, С(2)Н2, J=5.2 Гц); 6.89-6.97 (м, 3Н, Н(2'), Н(5'), Н(6')); 7.52 (т, 1Н, Н(8) или Н(9); J=7.6 Гц); 7.60 (т, 1H, Н(9) или Н(8); J=7.6 Гц); 7.89 (д, 1Н, Н(10) или Н(7), J=8.2 Гц); 8.08 (д, 1Н, Н(7) или Н(10), J=8.1 Гц); 8.28 (с, 1Н, CHBr); 9.34 (с, 1H, ОН); 9.54 (с, 1H, ОН). Спектр ЯМР 13С, (150 МГц), δ, м.д. (ДМСО-d6): 25.02, 25.03, 46.60, 48.60, 106.0, 112.44, 112.59, 115.98, 116.77, 117.02, 121.01, 123.12, 123.55, 125.51, 134.63, 135.35, 142.81, 145.68, 147.32.
Найдено, (%): С 54.90; Н 4.18; Br 19.03; N 10.17. C19H18BrN3O3. Вычислено, (%): С 54.82; Н 4.36; Br 19.19; N 10.09.
Исследование анксиолитической активности.
Материалы и методы.
Эксперименты проводили на половозрелых мышах-самцах массой 18-23 г. Животные содержались в условиях вивария с естественным световым режимом на стандартной диете лабораторных животных, без ограничения доступа к еде и воде (ГОСТ Р 50258-92) с соблюдением Международных рекомендаций по защите позвоночных животных, используемых при экспериментальных исследованиях (1997). Животных разделили на группы по 10 особей в каждой.
Изучаемые вещества в эквимолярных дозах (диазепаму 2 мг/кг) вводили за 30 минут до начала теста. Животным опытных групп внутрибрюшинно вводили исследуемое вещество либо препараты сравнения. Контрольным группам крыс вводился изотонический раствор хлорида натрия. Препаратом сравнения выступал диазепам в дозе 2 мг/кг [9, 10].
Метод изучения анксиолитической активности в тесте «приподнятый крестообразный лабиринт» был основан на естественном предпочтении грызунами темных нор, а также на страхе нахождения на открытых площадках и падения с высоты [8].
Животных помещали в приподнятый крестообразный лабиринт и в течение 3 минут регистрировали следующие показатели анксиолитической активности: латентный период до выхода в открытый рукав (сек); количество выходов в открытый рукав; суммарное время, проведенное в открытых рукавах лабиринта (сек); общее число переходов из рукава в рукав (с указанием переходов типов рукавов); количества свешиваний; реактивность, время ухода из центра (сек); общее время нахождения в центре (сек); количество выглядываний из закрытого рукава; количество болюсов.
Для изучения локомоторной активности животных помещали в актометр «Activity cage 7401» (Ugo Basil), в камере которого расположены датчики, фиксирующие горизонтальную активность животного [9, 10].
Для определения ректальной температуры использовали термодатчики (AnD DT-623). Температура определяется при погружении электрода на глубину 1,5-1,8 см [11].
Оценку прогипногенного эффекта проводили с использованием теста «гексеналового сна». Об уровне нейролептического действия судили по изменению продолжительности сна в опытных группах по сравнению с контрольной. Регистрировали время засыпания (принятие «бокового положения») и окончания сна (появление первых признаков активности, выход из бокового положения). Отсутствие у изучаемого вещества влияния на длительность гексеналового сна позволяет предположить, что он не оказывает угнетающего влияния на микросомальные системы печени, метаболизирующие барбитураты. Препарат сравнения - диазепам в дозе 2,0 мг/кг [9-11].
Статистическая обработка результатов исследования проводилась с использованием теста Вилкоксона, критерия Краскела-Уолиса с постобработкой тестом Данна, либо с использованием однофакторного дисперсионного анализа и теста Ньюмана-Кеулса, в случае нормального распределения данных. Обсчет реализован в программе GraphPad Prism 5.0.
Результаты и обсуждения
Об уровне транквилизирующего действия судили по изменению фиксируемых показателей в опытных группах по сравнению с контрольной.

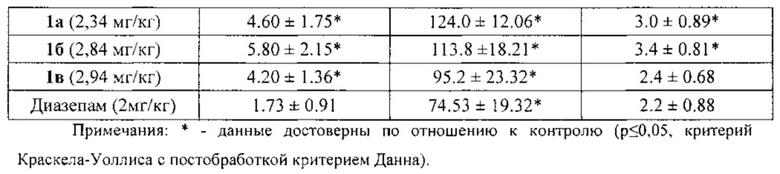
По результатам исследования анксиолитической активности в приподнятом крестообразном лабиринте (табл. 1) было показано, что соединения 1а, 1б, 1в снижают эмоциональную тревожность, превышая по эффективности (время нахождения в светлом рукаве) препарат сравнения диазепам на 40%, 35% и 22%, соответственно. У всех животных, опытных групп статистически значимо увеличивалось количество переходов по сравнению с контрольной группой и относительно препарата сравнения диазепама, что свидетельствует о повышении исследовательской и поисковой активностей. Также увеличивалось и количество выходов в светлый рукав, что говорит о снижении чувства страха и подавлении естественного стресса.
При дальнейшем изучении было выявлено, что соединения 1а и 1б не оказывают влияния на локомоторную активность, температуру тела животных, а так же продолжительность сна, то есть не обладают гипногенным и миорелаксирующим эффектами, в отличие от препарата сравнения диазепама (табл. 2).
Соединение 1в достоверно снижало двигательную активность животных в актометре, но на температуру тела животных и продолжительность их сна не влияло. Таким образом, соединение 1в обладает миорелаксирующим эффектом, характерным для бензодиазепинов, но в отличие от них не проявляет гипногенного эффекта.

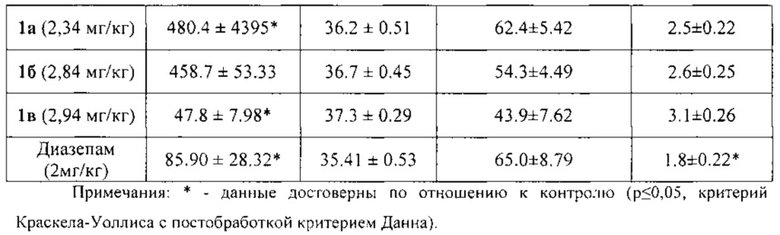
Таким образом, соединения 1а и 1б обладают выраженным анксиолитическим эффектом, превосходящим по эффективности препарат сравнения диазепам, и не вызывают миорелаксацию и гипногенное действие. Соединение 1в по анксиолитической активности превосходит препарат сравнения диазепам, не влияет на длительность сна и имеет миорелаксирующее действие.
Литература
1. Бурчинский С.Г. Анксиолитики нового поколения - новые возможности лечения тревожных состояний в общемедицинской практике / Новости медицины и фармации. 2007, №14, с. 220.
2. Справочник лекарств РЛС.
3. Гурович И.Я., Шмуклер А.Б. Купирующая терапия атипичными антипсихотиками больных с впервые возникшими психотическими состояниями // Социальная и клиническая психиатрия. 2011, Т. 21, №4, с. 51-57.
4. Фаттахов Ш.А. Направленный синтез N-содержащих производных фосфорилуксусных кислот, обладающих биологической активностью: автореф. дис. канд. хим. наук / Ш.А. Фаттахов. - Казань: КГТУ, 2010.
5. Anisimova V.A., Osipova М.М., Kuzmenko Т.A., Caignard D.-H., Renard P., Manechez D. // Nouveaux derives tricycliques de benzimidazoles, leur precede de preparation et les compositions pharma-ceutiques qui les contiennent. Fr. Pat. 2765 223, C07D 487/04, 1998, WO/1999/000390.
6. Диваева Л.Н., Кузьменко Т.А., Спасов А.А., Морковник А.С., Анисимова В.A., Кучерявенко А.Ф., Сиротенко B.C. Патент РФ №2582618, C07D 487/04, 2016.
7. Анисимова В.А., Кузьменко В.В., Кузьменко Т.А., Морковник А.С. Изв. АН. Сер. хим., 2007, с. 2237.
8. Воронина Т.А., Середенин СБ. Методические указания по изучению транквилизирующего (анксиолитического) действия фармакологических веществ. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Ремедиум, 2000. с. 126-136.
9. Yakovlev D., Kolobrodova N., Spasov A., Anisimova V. Anxiolytic profile of 5-НТ3-antagonist RU 1204 versus tropisetron and diazepam / European neuropsychopharmacology / 21 № S2 2011.
10. Maltsev D.V., Yakovlev D.S., Matokhin D.G., Samsonik Y.V., Spasov A.A., Anisimova V.A. Anxiolytic action of a new 5-HT2A antagonist RU-476 / European neuropsychopharmacology / 23 № S2 2013.
11. Миронов A.H. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. - М.: Гриф и К, 2012, с. 944.
| название | год | авторы | номер документа |
|---|---|---|---|
| Гидробромид 11-(4-трет-бутилбензил)-2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазола, обладающий анксиолитической и противосудорожной активностью | 2017 |
|
RU2662242C1 |
| Гидрогалогенид 1-(3,4-диметоксифенил)-2-(7,8-диметил-2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазол-11-ил)этанона, обладающий обезболивающей и анксиолитической активностью | 2016 |
|
RU2636785C1 |
| ГИДРОГАЛОГЕНИДЫ 11-[(4-ТРЕТ-БУТИЛФЕНОКСИ)ЭТИЛ]- И 11-БЕНЗИЛЗАМЕЩЁННЫХ 2,3,4,5-ТЕТРАГИДРО[1,3]ДИАЗЕПИНО[1,2-A]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ АЛЬФА-ГЛЮКОЗИДАЗА ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 2015 |
|
RU2602504C1 |
| Способ получения 1(11)H-2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазола | 2023 |
|
RU2814769C1 |
| ГИДРОГАЛОГЕНИДЫ 11-ФЕНОКСИЭТИЛ- И 11-БЕНЗИЛЗАМЕЩЁННЫХ 2,3,4,5-ТЕТРАГИДРО[1,3]ДИАЗЕПИНО[1,2-а]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2582618C1 |
| N-замещенные 4-(1-гидрокси-1-метил-2-аминоэтил)бензойные кислоты, обладающие анксиолитической активностью, их фармацевтически приемлемые соли и способ их получения | 2021 |
|
RU2780531C1 |
| 9-Замещенные-2-бифенилимидазо[1,2-а]бензимидазолы и их фармацевтически приемлемые соли, обладающие антиоксидантными и антирадикальными свойствами | 2017 |
|
RU2649979C1 |
| Способ получения 2a,4-дифенил-5-(4-(трифторметил)бензоил)-2a,3,4,5-тетрагидро-1H-спиро[азето[1,2-d]бензо[b][1,4]диазепин-2,1'-циклопропан]-1-она, проявляющего цитотоксичность в отношении клеток HEK 293 | 2024 |
|
RU2829460C1 |
| 1-имино-2,3,4,5-тетрагидро-1Н-пирроло[3,4-с]пиридин-3,4-дионов | 2016 |
|
RU2613967C1 |
| 2-ЗАМЕЩЕННЫЕ-1,2,4,5-ТЕТРАГИДРО-3H-ПИРРОЛО[1,2-a][1,4]ДИАЗЕПИН-3-ОНЫ | 2011 |
|
RU2472795C1 |
Изобретение относится к новым производным в ряду 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола, общей формулы 1:
Технический результат: получены новые гидробромиды 11-(4-трет-бутилбензил)- и 11-фенацилзамещенные 2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазолы, обладающие анксиолитической активностью. 3 з.п. ф-лы, 2 табл., 3 пр.
1. 11-(4-трет-бутилбензил)- и 11-фенацилзамещенные 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола общей формулы 1:
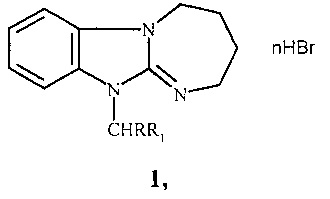
где n=0,1; R=Н, Br; R1=4-(СН3)3СС6Н4, 4-FC6H4CO, 3,4-(ОН)2С6Н3СО.
2. 11-(4-трет-бутилбензил)- и 11-фенацилзамещенные 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола по п. 1, где n=1, R=Н, R1=4-(СН3)3СС6Н4.
3. 11-(4-трет-бутилбензил)- и 11-фенацилзамещенные 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола по п. 1, где n=1, R=Н, R1=4-FC6H4CO.
4. 11-(4-трет-бутилбензил)- и 11-фенацилзамещенные 2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола по п. 1, где n=0, R=Br, R1=3,4-(ОН)2С6Н3СО.
| Morkovnik A | |||
| S | |||
| et al, Prototropic equilibrium in 1(11)H-2,3,4,5-tetrahydro[1,3]diazepin[1,2-a]benzimidazole, synthesis and pharmacological properties of its N-substituted derivatives | |||
| Russian Chemical Bulletin, 64(11), 2622-2631, 2015 | |||
| ГИДРОГАЛОГЕНИДЫ 11-ФЕНОКСИЭТИЛ- И 11-БЕНЗИЛЗАМЕЩЁННЫХ 2,3,4,5-ТЕТРАГИДРО[1,3]ДИАЗЕПИНО[1,2-а]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2582618C1 |
Авторы
Даты
2017-08-24—Публикация
2016-10-14—Подача