ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым аналогам молекул, принадлежащих к семейству циклоспорина, включая аналоги Циклоспорина A (CsA) и включая аналоги, обладающие пониженной или не обладающие иммунодепрессивной активностью и связывающие циклофилин (CyP).
УРОВЕНЬ ТЕХНИКИ
Циклоспорины являются представителями класса циклических полипептидов, обладающих высокой иммунодепрессивной активностью. По меньшей мере некоторые из этих соединений, такие как Циклоспорин A (CsA), вырабатываются видами Tolypocladium inflatum в качестве вторичных метаболитов. CsA является высокоактивным иммунодепрессивным агентом, который подавляет гуморальный иммунитет и клеточно-опосредованные иммунные реакции, такие как отторжение аллотрансплантата, гиперчувствительность замедленного типа, экспериментальный аллергический энцефаломиелит, адъювантный артрит Фрейнда и реакция «трансплантат против хозяина». Он используется для профилактики отторжения органов при трансплантации органов, для лечения ревматоидного артрита и для лечения псориаза.
Несмотря на то, что известно множество соединений семейства циклоспорина, CsA, пожалуй, наиболее широко применяется в медицине. Иммунодепрессивные эффекты CsA связаны с ингибированием явлений, опосредованных активацией Т-клеток. Иммунодепрессия осуществляется путем связывания циклоспорина с повсеместно распространенным внутриклеточным белком циклофилином (CyP). Указанный комплекс, в свою очередь, ингибирует активность кальций и кальмодулин-зависимой серин-треонин фосфатазы фермента кальциневрина. Ингибирование кальциневрина предотвращает активацию факторов транскрипции, таких как NFATp/c и NF-κВ, которые необходимы для индукции генов цитокинов (IL-2, IFN-γ, IL-4 и GM-CSF) в ходе активации Т-клеток.
Со времени открытия циклоспорина, было выделено и идентифицировано большое количество природных циклоспоринов. Кроме того, множество циклоспоринов, которые не встречаются в природе, было получено частично или полностью синтетическими способами и путем применения модифицированных методов для клеточных культур. Таким образом, класс, включающий циклоспорины, является значительным и включает, например, естественные циклоспорины A-Z; различные неприродные производные циклоспорина, искусственные или синтетические циклоспорины, включая дигидро- и изоциклоспорины; дериватизированные циклоспорины (например, либо 3'-О-атом остатка MeBmt может быть ацилирован либо дополнительный заместитель может быть введен в саркозильный остаток в положении 3); циклоспорины, в которых остаток MeBmt присутствует в изомерной форме (например, в которой конфигурация в положениях 6' и 7' остатка MeBmt представляет собой цис-, а не транс-) и циклоспорины, в которых различные аминокислоты введены в конкретных положениях в пределах пептидной последовательности.
Аналоги циклоспорина, содержащие модифицированные аминокислоты в положении 1, представлены в WO 99/18120 и WO 03/033527, содержание которых включено в настоящую заявку посредством ссылок во всей их полноте. В указанных заявках описано производное циклоспорина, известное как “ISATX247” или “ISA247» или «ISA». Указанный аналог структурно идентичен CsA за исключением модификации остатка аминокислоты-1. Ранее, Заявители обнаружили, что определенные смеси цис- и транс-изомеров ISA247, включая смеси, которые преимущественно состоят из транс- ISA247, проявляют комбинацию повышенной иммунодепрессивной активности и пониженной токсичности, относительно естественных и известных в настоящее время циклоспоринов.
Циклоспорин имеет три хорошо известные клеточные мишени; кальциневрин, изоформы CyP (которые включают, но не ограничиваются ими, CyP-A, CyP-В и CyP-D) и Р-гликопротеин (PgP). Связывание циклоспорина с кальциневрином приводит к значительной иммунодепрессии и отвечает за свою традиционную связь с трансплантацией и аутоиммунными показаниями.
Семейство циклофилина
CyP (номер по классификации ферментов Комиссии по ферментам (ЕС) 5.1.2.8) принадлежат к группе белков, которые обладают пептидил-пролил-цис-транс-изомеразной активностью; такие белки в целом известны как иммунофилины и также включают FK-506-связывающие белки и парвулины. CyP встречаются во всех клетках всех изученных организмов, как в прокариотах, так и в эукариотах, и структурно консервативны в ходе эволюции. Существует 7 основных CyP в организме человека, а именно CyP-A, CyP-В, CyP-С, CyP-D, CyP-Е, CyP-40, и CyP-NK (впервые идентифицирован из человеческих естественных клеток-киллеров) и всего 16 уникальных белков (Galat A. Peptidylprolyl cis/trans isomerases (immunophilins): biological diversity - targets - functions. Curr Top Med Chem 2003, 3: 1315-1347; Waldmeier PC et al. Cyclophilin D as a drug target. Curr Med Chem 2003, 10: 1485-1506).
Первым идентифицированным представителем CyP у млекопитающих был CyP-A. CyP-A представляет собой 18-кДа цитозольный белок и является наиболее распространенным белком для связывания CsA. Подсчитано, что CyP-составляет 0,6% от всех цитозольных белков (Mikol V et al. X-ray structure of monmeric cyclophilin A-cycloporin A crystal complex at 2.1 A resolution. J. Mol. Biol. 1993, 234: 1119-1130; Galat A, Metcalfe SM. Peptidylproline cis/trans isomerases. Prog. Biophys. Mol. Biol. 1995, 63: 67-118).
Локализация циклофилинов в клетках
CyP могут быть найдены в большинстве клеточных частей в большинстве тканей и кодируют уникальные функции. У млекопитающих CyP-A и CyP-40 являются цитозольными, в то время как CyP-В и CyP-С имеют аминоконцевые сигнальные последовательности, которые направляют их в секреторный путь белков эндоплазматического ретикулюма (рассмотрено в Galat, 2003; Dornan J et al. Structures of immunophilins and their ligand complexes. Curr Top Med Chem 2003, 3: 1392-1409). CyP-D имеет сигнальную последовательность, которая направляет его в митохондрию (Andreeva L et al. Cyclophilins and their possible role in the stress response. Int J Exp Pathol 1999, 80: 305-315; Hamilton GS et al. Immunophilins: beyond immunosuppression. J Med Chem 1998, 41: 5119-5143); CyP-E имеет аминоконцевой РНК-связывающий домен и расположен в ядре (Mi Н et al. А nuclear RNA-binding cyclophilin in human T cells. FEBS Lett 1996, 398: 201-205) и CyP-40 имеет TPR (тетратрикопептидный повтор) и расположен в цитозоле (Kieffer LJ et al. Cyclophilin-40, a protein with homology to the P59 component of the steroid receptor complex. Cloning of the cDNA and further characterization. J Biol Chem 1993, 268: 12303-12310). Человеческий CyP-NK представляет собой наибольший CyP с большим гидрофильным и положительно заряженным карбоксильным концом и расположен в цитозоле (Anderson SK et al. A cyclophilin-related protein involved in the function of natural killer cells. Proc Natl Acad Sci USA 1993, 90: 542-546; Rinfret A et al. The N-terminal cyclophilin-homologous domain of a 150-kilodalton tumor recognition molecule exhibits both peptidylprolyl cis-trans isomerase and chaperone activities. Biochemistry 1994, 33: 1668-1673).
Функция и активность циклофилинов
CyP представляют собой многофункциональные белки, которые участвуют во многих клеточных процессах. Поскольку CyP были высоко консервативны в ходе эволюции, это говорит о существенной роли CyP. Первоначально было установлено, что CyP обладают специфическим ферментативным свойством катализировать цис-транс-изомеризацию связей пептидил-пролил (Galat, 1995; Fisher GA et al. A phase I study of paclitaxel (taxol) (T) in combination with SDZ valspodar, a potent modulator of multidrug resistance (MDR). Anticancer Drugs. 1994; 5 (Suppl 1): 43). Таким образом, CyP называют пептидил-пролил-цис-транс-изомеразой (PPI-аза), которая может выступать в качестве ускоряющего фактора для правильного сворачивания синтезированных белков, PPI-азы также участвуют в восстановлении белков, поврежденных в результате стрессов, вызванных окружающей средой, включая тепловой стресс, ультрафиолетовое облучение, изменения в pH клеточной среды и обработку окислителями. Эта функция называется молекулярной шаперонной активностью _(Yao Q et al. Roles of Cyclophilins in Paks and Other Organs Systems. World J. Surg. 2005, 29: 276-280).
Кроме того, недавно было обнаружено, что PPI-азная активность CyP задействована в разнообразных клеточных процессах, включая перенос внутриклеточного белка (Andreeva, 1999; Caroni Р et al. New member of the cyclophilin family associated with the secretory pathway. J Biol Chem 1991, 266: 10739-42), митохондриальную функцию (Halestrap АР et al. CsA binding to mitochondrial cyclophilin inhibits the permeability transition pore and protects hearts from ischaemia/reperfusion injury. Mol Cell Biochem 1997, 174: 167-72; Connern CP, Halestrap AP. Recruitment of mitochondrial cyclophilin to the mitochondrial inner membrane under conditions of oxidative stress that enhance the opening of a calcium-sensitive non-specific channel. Biochem J 1994, 302: 321-4), процессинг пре-мРНК (Bourquin JP et al. A serine/argininerich nuclear matrix cyclophilin interacts with the Cterminal domain of RNA polymerase II. Nucleic Acids Res 1997, 25: 2055-61) и поддержание стабильности белкового комплекса (Andreeva, 1999).
Циклоспорин связывается с наномолярным сродством с CyP-A посредством контакта с гидрофобным карманом (Colgan J et al. Cyclophilin A-Deficient Mice Are Resistant to Immunosuppression by Cyclosporine. The Journal of Immunology 2005, 174: 6030-6038, Mikol, 1993) и ингибирует активность PPI-азы. Однако полагают, что указанный эффект не относится к иммунодепрессии. Скорее, комплекс между CsA и CyP-A создает смешанную поверхность, которая связывается с кальциневрином и не позволяет кальциневрину регулировать трансткрипцию генов цитокина (Friedman J et al. Two cytoplasmic candidates for immunophilin action are revealed by affinity for a new cyclophilin: one in the presence and one in the absence of CsA. Cell 1991, 66: 799-806; Liu J et al. Calcineurin is a common target of cyclophilin-CsA and FKBP-FK506 complexes. Cell 1991, 66: 807-815).
Гомология циклофилинов
CyP-A, прототипичный представитель семейства, представляет собой высококонсервативный белок в клетках млекопитающих (Handschumacher RE et al. Cyclophilin: a specific cytosolic binding protein for CsA. Science 1984, 226: 544-7). Анализ гомологии последовательностей человеческого CyP-A показывает, что он высоко гомологичен человеческим CyP-В, CyP-С и CyP-D (Harding MW, Handschumacher RE, Speicher DW. Isolation and аmino acid sequence of cyclophilin. J Biol Chem 1986, 261: 8547-55). Связывающий карман циклоспоринов для всех CyP образован высококонсервативным участком из приблизительно 109 аминокислот. Из известных CyP, CyP-D обладатет наиболее высокой гомологичностью с CyP-A. Фактически, на указанном участке идентичность последовательностей CyP-A и CyP-D составляет 100% (Waldmeier 2003; Kristal BS et al. The Mitochondrial Permeability Transition as a Target for Neuroprotection. Journal of Bioenergetics and Biomembranes 2004, 36(4); 309-312). Соответственно, сродство CyP-A является очень хорошим предсказателем сродства CyP-D, и наоборот (Hansson MJ et al. The Nonimmunosuppressive Cyclosporine analogues NIM811 and UNIL025 Display Nanomolar Potencies on Permeability Transition in Brain-Derived Mitochondria. Journal of Bioenergetics and Biomembranes, 2004, 36(4): 407-413). Указанная взаимосвязь была неоднократно эмпирически продемонстрирована с аналогами циклоспорина (Hansson, 2004; Ptak Rg et al. Inhibition of Human Immunodeficiency Virus Type 1 Replication in Human Cells by Debio-025, a Novel Cyclophilin Binding Agent. Antimicrobial Agents and Chemotherapy 2008: 1302-1317; Millay DP et al. Genetic and pharmacologic inhibition of mitochondrial dependent necrosis attenuates muscular dystrophy. Nature Medicine 2008, 14(4): 442-447; Harris R et al. The Discovery of Novel Non-lmmunosuppressive Cyclosporine Ethers and Thioethers With Potent HCV Activity. Poster # 1915, 59th Annual Meeting of the American Association for the Study of Liver Diseases (AASLD), 2008). Гомология последовательности CyP предполагает, что все CyP являются потенциальными мишенями для аналогов циклоспорина. Поскольку CyP задействованы во множестве клеточных процессов, можно также предположить, что аналоги CsA, обладающие значительным связыванием с CyP, могут подходить для лечения множества показателей заболеваний.
Заболевания, опосредованные циклофилином
Вирус иммунодефицита человека (ВИЧ):
ВИЧ представляет собой лентивирус из семейства ретровирусов и служит примером участия CyP в процессе инфекции и репликации некоторых вирусов. Более десяти лет назад было установлено, что CyP-A является важной мишенью в химиотерапии против ВИЧ (Rosenwirth ВА et al. Cyclophilin A as a novel target in anti-HIV-1 chemotherapy. Int. Antivir. News 1995, 3: 62-63). CyP-A выполняет важную функцию в начале цикла репликации ВИЧ-1. Было обнаружено, что он специфически связывается с полипротеином Gag ВИЧ-1 (Luban JKL et al. Human immunodeficiency virus type 1 Gag protein binds to cyclophilins A and B. Cell 1993, 73: 1067-1078). Определенная аминокислотная последовательность около G89 и Р90 капсидного белка р24 (СА) была идентифицирована как участок связывания для CyP-A (Bukovsky AAA et al. Transfer of the HIV-1 cyclophilin-binding site to simian immunodeficiency virus from Macaca mulatta can confer both cyclosporine sensitivity and cyclosporine dependence. Proc. Natl. Acad. Sci. USA 1997, 94: 10943-10948; Gamble TRF et al. Crystal structure of human cyclophilin A bound to the amino-terminal domain of HIV-1 capsid. Cell 1996, 87: 1285-1294). Сродство CyP-A к CA способствует включению CyP-A в вирионные частицы в процессе сборки (Thali MA et al. Functional association of cyclophilin A with HIV-1 virions. Nature 1994, 372: 363-365). Экспериментальные данные свидетельствуют о том, что взаимодействие CyP-A-СА является существенным для репликации ВИЧ-1; ингибирование этого взаимодействия ухудшает репликацию ВИЧ-1 в клетках человека (Hatziioannou TD et al. Cyclophilin interactions with incoming human immunodeficiency virus type 1 capsids with opposing effects on infectivity in human cells. J. Virol. 2005, 79: 176-183; Steinkasserer AR et al. Mode of action of SDZ NIM 811, a nonimmunosuppressive CsA analog with activity against human immunodeficiency virus type 1 (HIV-1): interference with early and late events in HIV-1 replication. J. Virol 1995, 69: 814-824). Было показано, что стадия цикла репликации вируса, на которой задействован CyP-A, осуществляется после проникновения указанной частицы вируса и до интеграции двухцепочечной вирусной ДНК в клеточный геном (Braaten DEK et al. Cyclophilin A is required for an early step in the life cycle of human immunodeficiency virus type 1 before the initiation of reverse transcription. J. Virol 1996 70: 3551-3560; Mlynar ED et al. The non-immunosuppressive CsA analogue SDZ NIM 811 inhibits cyclophilin A incorporation into virions and virus replication in human immunodeficiency virus type 1-infected primary and growth-arrested T cells. J. Gen. Virol 1996, 78: 825-835; Steinkasserer, 1995). Активность CsA против ВИЧ-1 была впервые отмечена в 1988 году (Wainberg MA et al. The effect of CsA on infection of susceptible cells by human immunodeficiency virus type 1. Blood 1998, 72: 1904-1910). Оценка CsA и множества других производных на способность ингибировать репликацию ВИЧ-1 выявила, что неиммунодепрессивные аналоги CsA обладают активностью против ВИЧ-1, равной или даже большей, по сравнению с указанными иммунодепрессивными аналогами (Bartz SRE et al. Inhibition of human immunodeficiency virus replication by nonimmunosuppressive analogs of CsA. Proc. Natl. Acad. Sci. USA 1995, 92: 5381-5385; Billich AF et al. Mode of action of SDZ NIM 811, a nonimmunosuppressive CsA analog with activity against human immunodeficiency virus (HIV) type 1: interference with HIV protein-cyclophilin A interactions. J. Virol 1995, 69: 2451-2461; Ptak, 2008).
Воспаление
Воспаление при болезни включает приток лейкоцитов («белые кровяные тельца») к области инфекции. Лейкоциты притягиваются к области хемокинами, семейством хемоатрактантов. Исследования in vitro показали, что внеклеточный CyP-A является высокоактивным хемоатрактантом для человеческих лейкоцитов и Т-клеток (Kamalpreet A et al. Extracellular cyclophilins contribute to the regulation of inflammatory responses Journal of Immunology 2005; 175: 517-522; Yurchenko VG et al. Active-site residues of cyclophilin A are crucial for its signaling activity via CD147. J. Biol. Chem. 2002; 277: 22959-22965; Xu QMC et al. Leukocyte chemotactic activity of cyclophilin. J. Biol. Chem. 1992; 267: 11968-11971; Allain FC et al. Interaction with glycosaminoglycans is required for cyclophilin В to trigger integrin-mediated adhesion of peripheral blood T lymphocytes to extracellular matrix. Proc. Natl. Acad. Sci. USA 2002; 99: 2714-2719). Кроме того, при введении in vivo CyP-A может вызывать быстрый воспалительный ответ, характеризующийся притоком лейкоцитов (Sherry BN et al. Identification of cyclophilin as a proinflammatory secretory product of lipopolysaccharide-activated macrophages. Proc. Natl. Acad. Sci. USA 1992; 89: 3511-3515). CyP-A повсеместно распределен внутриклеточно, однако в ходе воспалительных ответов CyP-A высвобождается во внеклеточные тканевые пространства как живыми, так и умирающими клетками (Sherry, 1992). И действительно, повышенные уровни CyP-A были отмечены при нескольких различных воспалительных заболеваниях, в том числе сепсисе, ревматоидном артрите и заболевании, связанном с гладкомышечными клетками сосудов (Jin ZG et al. Cyclophilin A is a secreted growth factor induced by oxidative stress. Circ. Res. 2000; 87: 789-796; Teger, 1997; Billich, 1997). В случае ревматоидного артрита, сообщалось о прямой корреляции между уровнями CyP-A и количеством нейтрофилов в синовиальной жидкости пациентов с ревматоидным артритом (Billich, 1997).
Рак
Недавно было показано, что CyP-A чрезмерно экспрессируется во многих раковых тканях и клеточных линиях, включая, но не ограничиваясь ими, мелкоклеточный и немелкоклеточный рак легкого, рак мочевого пузыря, гепатоцеллюлярный рак, рак поджелудочной железы и рак молочной железы (Li, 2006; Yang Н et al. Cyclophilin A is upregulated in small cell lung рак and activates ERK1/2 signal. Biochemical and Biophysical Research Communications 2007; 361: 763-767; Campa, 2003). Было показано, что в случаях, когда подавался экзогенный CyP-A, стимулировался рост раковых клеток (Li, 2006; Yang, 2007), в то время как CsA останавливал рост (Campa, 2003). Совсем недавно было показано, что CyP (А и В) сложным образом участвует в биохимическом пути, вызывая рост человеческих клеток рака молочной железы и что эксперименты с нокдауном CyP снижали рост, пролиферацию и подвижность клеток рака (Fang F et al. The expression of Cyclophilin В is Associated with Malignant Progression and Regulation of Genes Implicated in the Pathogenesis of Breast Рак. The American Journal of Pathology 2009; 174(1): 297-308; Zheng J et al. Prolyl Isomerase Cyclophilin A Regulation of Janus-Activated Kinase 2 and the Progression of Human Breast Cancer. Cancer Research 2008; 68 (19): 7769-7778). Самое интересное, лечение мышей с ксенотранстплантированными клетками рака молочной железы с помощью CsA привело к увеличению некроза опухоли и полностью подавило метостазирование (Zheng, 2008). Исследователи пришли к выводу, что “действие Циклофилина В может внести значительный вклад в патогенез рака молочной железы человека” и что “ингибирование циклофилина может стать новой терапевтической стратегией для лечения рака молочной железы человека” (Fang, 2009; Zheng, 2008).
Гепатит C
Вирус гепатита C (ВГС) является наиболее распространенным заболеванием печени в мире и рассматривается Всемирной организацией здравоохранения как эпидемический. Поскольку ВГС может инфицировать пациента на протяжении десятилетий, прежде чем будет обнаружен, его часто называют “тихой” эпидемией. На основании результатов исследований, полагают, что более 200 миллионов человек по всему миру инфицированы ВГС, общая заболеваемость составляет около 3,3% мирового населения. Только в США почти 4 миллиона человек являются или были инфицированы ВГС и из них 2,7 миллиона имеют постоянную хроническую инфекцию. Все индивидуумы, инфицированные ВГС, подвержены риску развития тяжелых угрожающих жизни заболеваний печени. Современная стандартная терапия хронического гепатита С включает комбинацию пегилированного интерферона в комбинации с рибавирином, оба из которых являются распространенными противовирусными агентами (Craxi A et al. Clinical trial results of peginterferons in combination with ribavirin. Semin Liver Dis 2003; 23 (Suppl 1): 35-46). Failure rate for the treatment is approximately 50% (Molino BF. Strategic Research Institute: 3rd annual viral hepatitis in drug discovery and development world summit 2007. AMRI Technical Reports; 12(1)).
Недавно было показано, что CyP-В важен для эффективной репликации генома ВГС (Watashi K et al. Cyclophilin В Is a Functional Regulator of Hepatitis С Virus RNA Polymerase. Molecular Cell 2005, 19: 111-122). Эффективная репликация генома вирусов зависит от факторов хозяина, таких как CyP-В. CyP-В взаимодействует с РНК-полимеразой NS5B ВГС с непосредственным стимулированием его РНК-связывающей активности. Как РНК-интерференция (иРНК)-опосредованного снижения экспрессии эндогенного CyP-В, так и индуцированное предотвращение связывания NS5B с CyP-В снижает степень репликации ВГС. Таким образом, CyP-В действует в качестве стимулирующего регулятора NS5B в механизме репликации ВГС. Указанный механизм регулирования вирусной репликации позволяет идентифицировать CyP-В в качестве мишени для противовирусных терапевтических стратегий.
В отличие от других видов лечения ВГС, ингибирование CyP не нацелено непосредственно на ВГС. Поэтому полагают, что устойчивость к лекарственным средствам, связывающим CyP, будет возникать медленнее, чем у современных лекарственных средств против ВГС (Manns MP, et al. The way forward in HCV treatment-finding the right path. Nature Reviews Drug Discovery 2007; 6: 991-1000). Кроме того, за счет вмешательства на уровне взаимодействия хозяин-вирус, ингибирование CyP может открыть путь для нового подхода к лечению ВГС, которое сможет дополнять не только подходы лечения на основе интерферона, но и будущие подходы лечения, непосредственно направленные на ферменты репликации ВГС, такие как ингибиторы протеазы и полимеразы (Flisiak R, Dumont JM, Crabbé R. Cyclophilin inhibitors in hepatitis С viral infection. Expert Opinion on Investigational Drugs 2007, 16(9): 1345-1354). Разработка новых лекарственных средств против ВГС, действующих на вирусную репликацию ВГС, сильно затруднена вследствие отсутствия подходящих лабораторных моделей ВГС. Данное обстоятельство только недавно было преодолено путем разработки нескольких подходящих моделей клеточных культур (системы субгеномного репликона ВГС) и модели на мышах, содержащей человеческие клетки печени (Goto K, et al. Evaluation of the anti-hepatitis С virus effects of cyclophilin inhibitors, CsA, and NIM811. Biochem Biophys Res Comm 2006; 343: 879-884; Mercer DF, et al. Hepatitis С virus replication in mice with chimeric human livers. Nat Med 2001; 7: 927-933). Недавно было показано, что циклоспорин обладает активностью против ВГС в скрининговых моделях и в небольших клинических испытаниях (Watashi K, et al. CsA suppresses replication of hepatitis С virus genome in cultured hepatocytes. Hepatology 2003; 38: 1282-1288; Inoue K, Yoshiba M. Interferon combined with cyclosporine treatment as an effective countermeasure against hepatitis С virus recurrence in liver transplant patients with end-stage hepatitis С virus related disease. Transplant Proc 2005; 37: 1233-1234).
Мышечные дегенеративные заболевания
CyP-D является неотъемлемой частью митохондриальных проницаемых временных пор (МТР) во всех клетках. Функция МТР пор состоит в обеспечении кальциевого гомеостаза в клетке. При нормальных условиях открытие и закрытие пор МТР являются обратимыми. При патологических состояниях, которые связаны с чрезмерным притоком кальция в клетку, перегружается митохондрия и вызывается необратимое открытие МРТ поры, что приводит к гибели клеток или апоптозу. Сообщалось, что CsA исправляет митохондриальную дисфункцию и мышечный апоптоз у пациентов с врожденной мышечной дистрофией Ульриха и миопатией Бетлема [(Merlini L et al. CsA corrects mitochondrial dysfunction and muscle apoptosis in patients with collagen VI myopathies. PNAS 2008; 105(13): 5225-5229]. Было показано, что CsA in vitro в зависимости от дозы ингибирует открытие МТР в изолированных сердечных митохондриях, тем самым предотвращая апоптоз и предоставляя клетке драгоценное время для восстановления (Gomez L et al. Inhibition of mitochondrial permeability transition improves functional recovery and reduces mortality following acute myocardial infarction in mice Am J Physiol Heart Circ Physiol 2007, 293: H1654-H1661). Клиническое исследование 58 пациентов с острым инфарктом миокарда показало, что введение CsA во время реперфузии связано с меньшим инфарктом, чем с использованием плацебо (Piot С et al. Effect of Cyclosporine on Reperfusion Injury in Acute Myocardial Infarction. New England Journal of Medicine 2008; 395(5): 474-481)).
Хронические нейродегенеративные заболевания
CsA может действовать в качестве нейропротекторного агента при острой ишемии головного мозга и повреждения в результате травмы головы (Keep М, et al. Intrathecal cyclosporine prolongs survival of late-stage ALS mice. Brain Research 2001; 894: 327-331). Для животных, которых подвергали лечению с помощью CsA, был показан исключительный 80% уровень выживаемости, по сравнению с только 10% выживаемостью при отсутствии лечения. Позднее было установлено, что это было в значительной степени результатом связывания CsA с митохондриальным CyP-D. Было впоследствии установлено, что полезность CsA распространяется на хроническую нейродегенерацию, что впоследствии было показано на модели болезни Лу Герига (ALS) на крысах (патент США №5972924), где лечение с помощью CsA более чем в два раза увеличило оставшуюся продолжительность жизни. Кроме того, недавно было показано, что инактивация CyP-D у CyP-D нокаутной мыши позволяет защитить аксоны при экспериментальном аутоиммунном энцефаломиелите, модели рассеянного склероза на животных (Forte М et al. Cyclophilin D inactivation protects axons in experimental autoimmune encephalomyelitis, an animal model of multiple sclerosis. PNAS 2007; 104(18): 7558-7563). При болезни Альцгеймера модель дефицита CyP-D на мышах позволила существенно улучшить обучение, память и синаптическую функцию (Du Н et al. Cyclophilin D deficiency attenuates mitochondrial and neuronal perturbation and ameliorates learning and memory in Alzheimer’s disease Nature Medicine 2008, 14(10): 1097-1105). Кроме того, было показано, что CsA эффективен в модели болезни Хантингтона на крысах (Leventhal L et al. CsA protects striatal neurons in vitro and in vivo from 3-nitropropionic acid toxicity. Journal of Comparative Neurology 2000, 425(4): 471-478), и частично эффективн в модели болезни Паркинсона на мышах (Matsuura K et al. CsA attenuates degeneration of dopaminergic neurons induced by 6-hydroxydopamine in the mouse brain. Brain Research 1996, 733(1): 101-104). Таким образом, митохондриально-зависимый некроз является очевидным механизмом заболевания, свидетельствующим о том, что ингибирование CyP-D может обеспечить новую стратегию фармакологического лечения указанных заболеваний (Du, 2008).
Повреждения клеток, тканей и органов, вызванные нарушением гомеостаза ионов кальция в клетке (Са2+)
Са2+ участвует в ряде физиологических процессов на клеточном уровне, в том числе здоровых функциях митохондрий. При некоторых патологических состояниях, таких как инфаркт миокарда, инсульт, острая гепатотоксичность, холестаз и повреждение трансплантата органов при хранении/реперфузии, митохондрии теряют способность регулировать уровень кальция, и избыточное накопление кальция в митохондриальном матриксе приводит к открытию больших пор на внутренней митохондриальной мембране (Rasola A. et al. The mitochondrial permeability transition pore and its involvement in cell death and in disease pathogenesis. Apoptosis 2007, 12: 815-833). Неселективная проводимость ионов и молекул до 1,5 кДа через пору, процесс, называемый переходом митохондриальной проницаемости, приводит к набуханию митохондрии и другим событиям, приводящим к смерти клетки, включая индукцию апоптоза. Одним из компонентов МТР является CyP-D. CyP-D представляет собой молекулу иммунофилина, изомеразная активность которой регулирует открытие МРТР, и ингибирование изомеразной активности с помощью CsA или аналогов CsA приводит к подавлению образования МРТР, и таким образом, предотвращает смерть клетки.
Неиммунодепрессивные ингибиторы циклофилина на основе аналогов циклоспорина
Несмотря на предпочтительные эффекты CsA при указанных выше показаниях, сопутствующие эффекты иммунодепрессии ограничивают применимость CsA в качестве ингибитора CyP в клинической практике. В настоящее время существует лишь несколько аналогов CsA, для которых было доказано наличие небольшой или сниженной иммунодепрессивной активности (например, <10% от иммунодепрессивной активности CsA) и сохранение при этом способности связывать CyP (например, >10% CyP связующей способности по сравнению с CsA).
NIM 811 (Melle4-Циклоспорин)
NIM 811 представляет собой продукт ферментации гриба Tolypocladium niveum, модифицированного по аминокислоте 4 и не проявляет иммунодепрессивной активности (вследствие отсутствия связывания кальциневрина), но сохраняет связывающую способность к CyP-A (Rosenwirth ВА et al. Inhibition of human immunodeficiency virus type 1 replication by SDZ NIM 811, a nonimmunosuppressive Cyclosporine Analogue. Antimicrob Agents Chemother 1994, 38: 1763-1772).
DEBIO 025 (MeAla3EtVal4-Циклоспорина)
DEBIO 025 представляет собой двойную химическую модификацию CsA по аминокислотам 3 и 4. DEBIO 025 также не проявляет иммунодепрессивной активности, но сохраняет при этом связывающую способность к CyP-A PPI-азной активности (Kristal, 2004).
SCY-635 (ДиметиламиноэтилтиоSar3-гидроксиLeu4-Циклоспорина)
SCY-635 представляет собой двойную химическую модификацию CsA по 3 и 4 аминокислотам. SCY-635 также не проявляет иммунодепрессивной активности, но сохраняет при этом связывающую способность к CyP-A PPI-азной активности (РСТ Publication No. WO 2006/039668).
В целом, указанные соединения имеют модификацию на внешней стороне CsA, которая ответственна за связывание кальциневрина, и, в целом, нуждаются в модификации 3 и 4 аминокислот. Модификация 3 и 4 аминокислот является трудна и сложна, поскольку данный подход требует раскрытия циклоспоринового кольца, замещения и/или модификации указанных аминокислот и, затем закрытия кольца с получением модифицированного циклоспорина.
Напротив, модификация боковой цепи по аминокислоте 1 не требует открытия циклоспоринового кольца. Однако аминокислота 1 связана со связыванием CyP (в противоположность связыванию кальциневрина) и была модифицирована для увеличения иммунодепрессивной эффективности CsA. Например, в патенте США 6605593 описана одиночная модификация аминокислоты 1, приводящая к получению аналога CsA, обладающего повышенной иммунодепрессивной активностью.
Таким образом, существует потребность в обеспечении молекулы аналога циклоспорина, (“САМ”), легко синтезируемой и эффективной для лечения заболеваний, опосредованных CyP. Также необходимо обеспечить аналог CsA, который мог бы обеспечить по меньшей мере некоторую функциональность нативного CsA, но при этом обладающего улучшенными или дополнительными свойствами, действием или функциями, по сравнению с нативным CsA.
Краткое описание изобретения
Согласно одному из аспектов, соединения согласно настоящему изобретению включают аналоги циклоспорина-А, которые не являются иммунодепрессивными, согласно определению, приведенному в настоящем описании. Согласно другому аспекту, указанные соединения обладают сродством к циклофилину, включая циклофилин-А. Согласно другим аспектам, соединения согласно настоящему изобретению включают аналоги циклоспорина-А, полезные в отношении заболеваний или состояний, опосредованных циклофилином, и для разработки терапии в отношении таких заболеваний и состояний.
Согласно одному из аспектов настоящее изобретение относится к соединению формулы L:
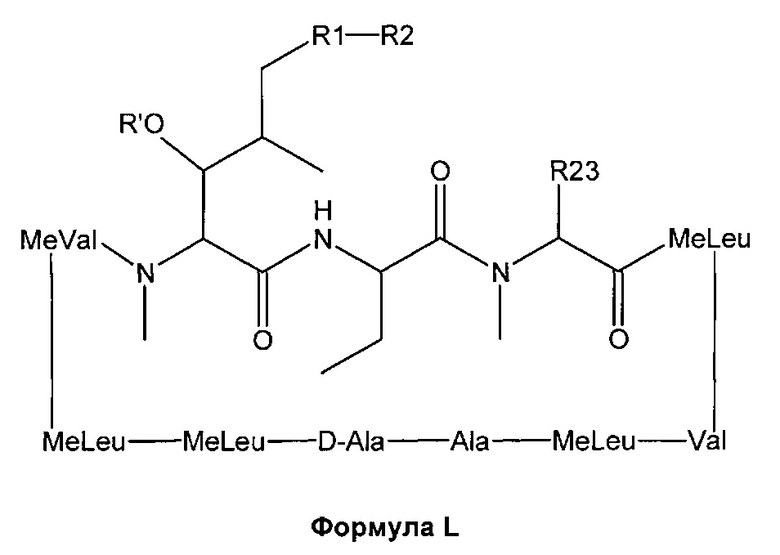
где a. R' представляет собой Н или ацетил;
b. R1 представляет собой насыщенную или ненасыщенную линейную цепь или разветвленную алифатическую углеродную цепь длиной от 2 до 15 атомов углерода;
c. R2 выбран из группы, состоящей из:
i. Н;
ii. незамещенного, N-замещенного или N,N-дизамещенного амида;
iii. N-замещенного или незамещенного защищенного ацилом амина;
iv. карбоновой кислоты;
v. N-замещенного или незамещенного амина;
vi. нитрила;
vii. сложного эфира;
viii. кетона;
ix. гидрокси-, дигидрокси-, тригидрокси- или полигидроксиалкила; и
x. замещенного или незамещенного арила;
xi. замещенной или незамещенной линейной или разветвленной алифатической цепи, необязательно содержащей заместитель, выбранный из группы, состоящей из водорода, кетонов, гидроксилов, нитрилов, карбоновых кислот, сложных эфиров, 1,3-диоксоланов, галогенов и оксо;
xii. ароматической группы, содержащей заместитель, выбранный из группы, состоящей из галогенидов, сложных эфиров и нитро; и
xiii. комбинации замещенной или незамещенной, линейной или разветвленной алифатической цепи (xi) и ароматической группы (xii); и
d. R23 представляет собой а насыщенную или ненасыщенную линейную цепь или разветвленную, необязательно замещенную алифатическую углеродную цепь.
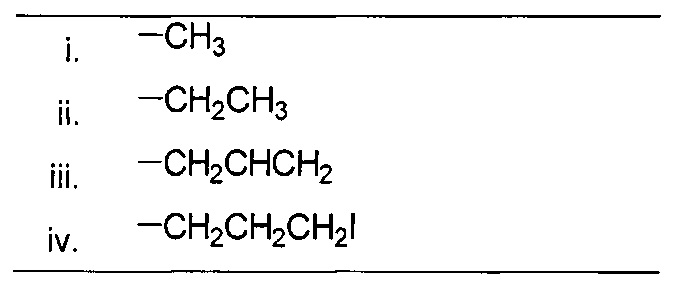
В одном из аспектов, заместитель R1-R2 выбран из группы, состоящей из:
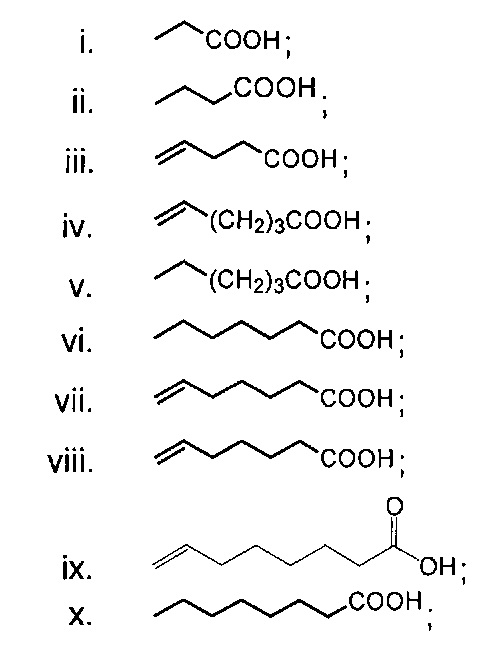
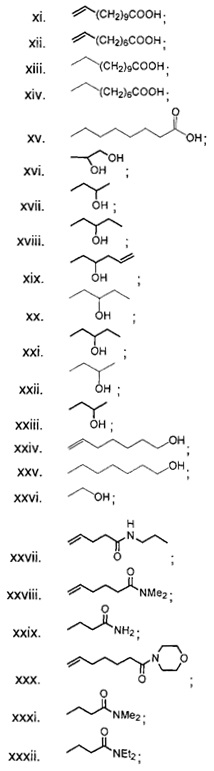
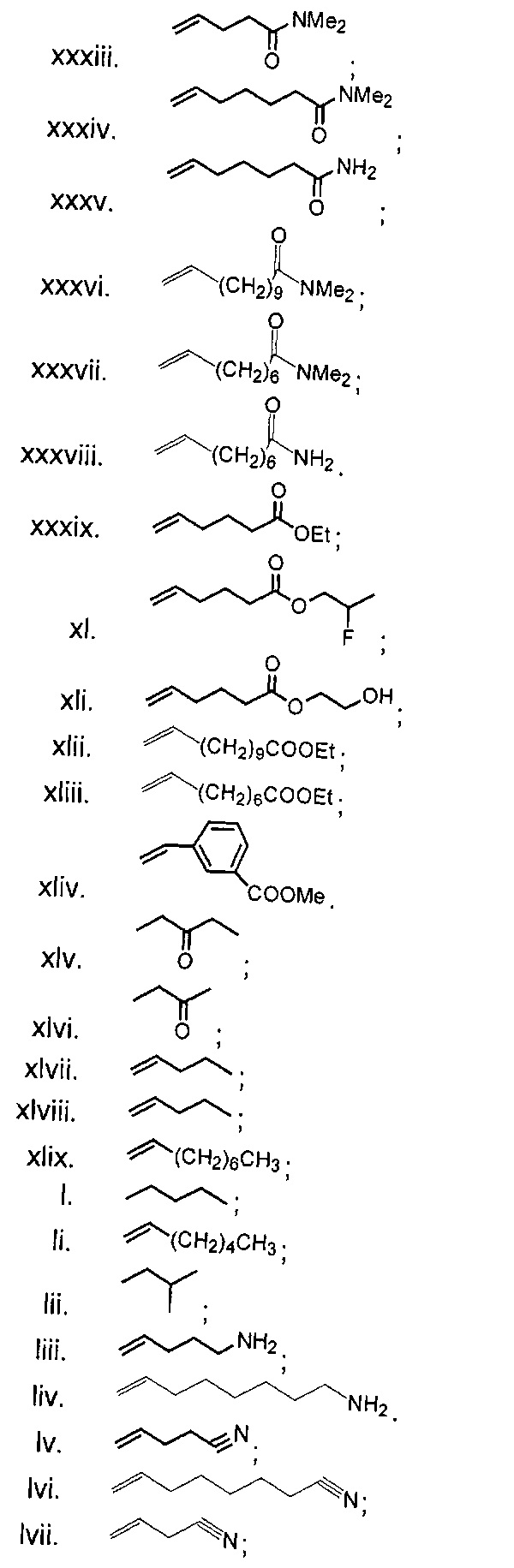
В другом аспекте, R2 выбран из группы, состоящей из:
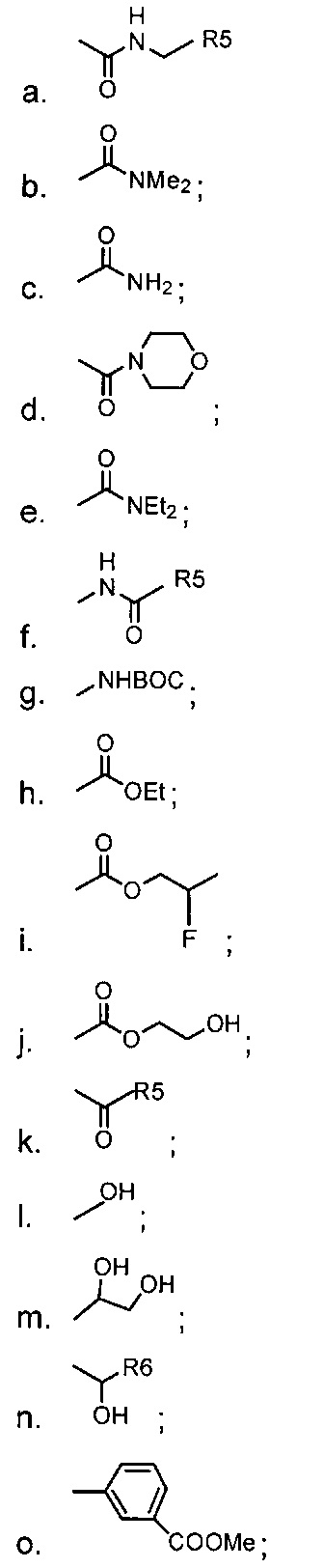
 и
и
где i. R5 представляет собой насыщенную или ненасыщенную линейную цепь или разветвленную алифатическую углеродную цепь длиной от 1 до 10 атомов углерода; и
ii. R6 представляет собой а моногидроксилированную, дигидроксилированную, тригидроксилированную или полигидроксилированную насыщенную или ненасыщенную линейную цепь или разветвленную алифатическую углеродную цепь длиной от 1 до 10 атомов углерода.
В одном из аспектов, R1-R2 содержит замещенную или незамещенную линейную или разветвленную алифатическую цепь от 2 до 5 атомов углерода, необязательно замещенную заместителем, выбранным из группы, состоящей из водорода, кетонов, гидроксилов, нитрилов, галогенов, оксо, карбоновых кислот, сложных эфиров и 1,3-диоксоланов;
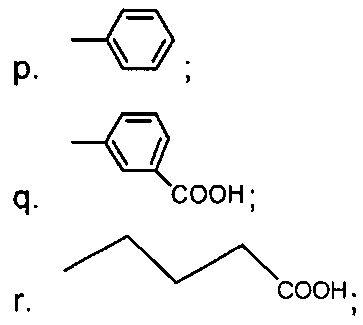
В одном из аспектов, R23 выбран из группы, состоящей из:
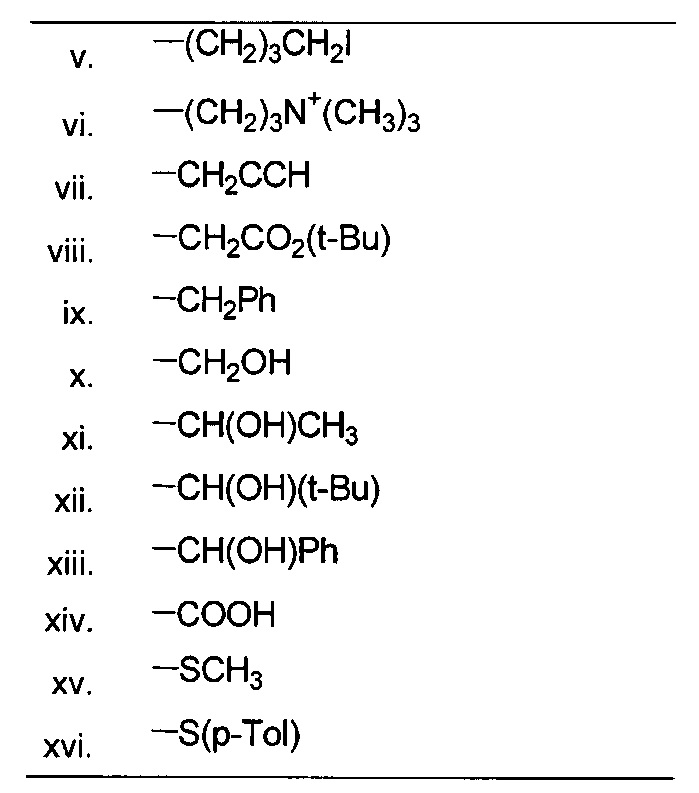
В одном из аспектов, R23 содержит необязательно замещенный алкил, включая необязательно замещенный С1-С3 алкил. Указанный алкил может быть замещен амино и может содержать С1-С3-Ala, причем указанное соединение содержит D-эпимер. В указанном варианте реализации, R23 может представлять собой MeAla.
В одном из аспектов, в указанной выше формуле L

выбран из группы, состоящей из:
и
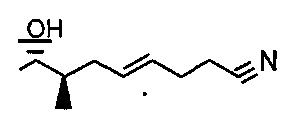
В одном из аспектов, R23 представляет собой линейную или разветвленную алифатическую углеродную цепь длиной от 1 до 6, от 1 до 5, от 1 до 4, от 1 до 3 или 2 атомов углерода.
В одном из аспектов, изобретение относится к способу лечения или предотвращения заболевания, опосредованного циклофилином, у млекопитающего, включающий введение соединения, описанного в настоящей заявке, указанному млекопитающему, при необходимости лечения указанного заболевания или повреждения, опосредованных циклофилином, или применению указанного соединения или композиции для лечения указанного заболевания или повреждения, или применению соединения для получения лекарственного средства для указанного применения или лечения. Указанное заболевание или повреждение может быть опосредованно сверхэкспрессией циклофилина или указанное заболевание представляет собой врожденную сверхэкспрессию циклофилина. Указанное заболевание или повреждение, опосредованное циклофилином, может быть выбрано из группы, состоящей из:
a. вирусной инфекции;
b. воспалительного заболевания;
c. рака;
d. мышечного нарушения;
e. неврологического нарушения; и
f. повреждения, связанного с ишемией, реперфузией, нарушением гомеостаза кальция в клетке, нарушением ионного гомеостаза, увеличением выработки свободных радикалов или токсинами, которые индуцируют митохондриальную дисфункцию;
причем указанная вирусная инфекция необязательно вызвана вирусом, выбранным из группы, состоящей из вируса иммунодефицита человека, гепатита А, гепатита В, гепатита С, гепатита D, гепатита Е, SARS-CoV, hCoV-NL63, hCoV-HKU-1, hCoV-OC43, hCOV-229E, коронавируса, вируса инфекционного перитонита кошек и вируса трансмиссивного гастроэнтерита;
причем указанное воспалительное заболевание необязательно выбрано из группы, состоящей из астмы, аутоиммунного заболевания, хронического воспаления, хронического простатита, гломерулонефрита, гиперчувствительности, воспалительного заболевания кишечника, сепсиса, заболевания, связанного с гладкомышечными клетками сосудов, аневризмов, тазового воспалительного заболевания, реперфузионного повреждения, ревматоидного артрита, отторжения трансплантата и васкулита;
причем указанный рак необязательно выбран из группы, состоящей из мелкоклеточного и немелкоклеточного рака легкого, рака мочевого пузыря, гепатоцеллюлярного рака, рака поджелудочной железы, рака молочной железы, глиобластомы, колоректального рака, плоскоклеточного рака, меланомы и рака предстательной железы;
причем указанное мышечное нарушение необязательно выбрано из группы, состоящей из реперфузионного повреждения миокарда, мышечной дистрофии, миопатий коллагена VI, синдрома после остановки сердца (PCAS), сердечной недостаточности, атеросклероза и аневризма брюшной аорты;
причем указанное неврологическое нарушение необязательно выбрано из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, множественной системной атрофии, рассеянного склероза, церебрального паралича, эпилепсии, инсульта, диабетической нейропатии, бокового амиотрофического склероза (болезни Лу Герига), биполярного расстройства, эксайтотоксического повреждения, печеночной энцефалопатии, гипогликемии, токсичного действия марганца, нейронной направленной депривации, токсичного действия жирных кислот, таких как арахидоновая кислота, механического повреждения нерва, повреждения спинного мозга и повреждения головного мозга; и
причем указанное повреждение, связанное с нарушением гомеостаза кальция в клетке, необязательно выбрано из группы, состоящей из инфаркта миокарда, инсульта, острой гепатотоксичности, холестаза и повреждения при хранении/реперфузионного повреждения трансплантата органов.
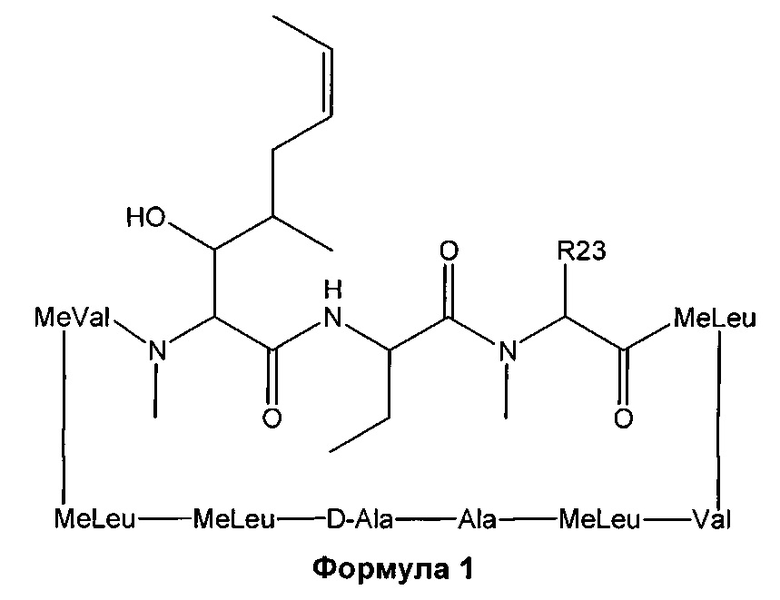
В одном из аспектов, изобретение относится к способу получения соединения указанной выше Формулы L, включающему стадии:
1) взаимодействие циклоспорина-А (CsA) с основным алкиламидом лития в присутствии подходящего растворителя, с последующим взаимодействием с подходящим электрофилом с получением соединения Формулы 1:
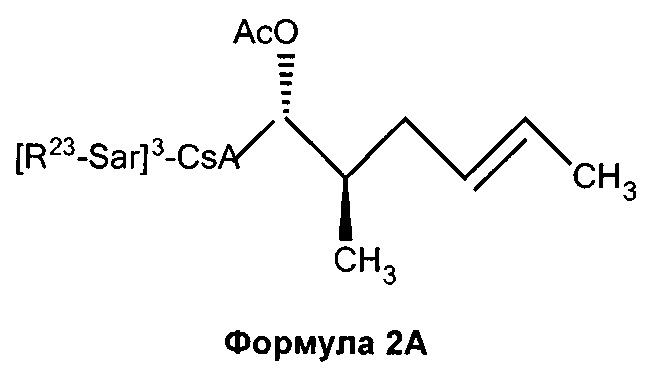
2) взаимодействие соединения Формулы 1 с АС2О в присутствии подходящего растворителя с получением соединения Формулы 2А:
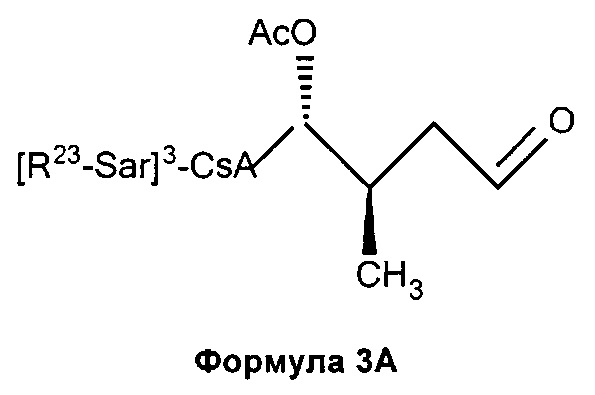
3) взаимодействие соединения Формулы 2А с окислителем с получением соединения Формулы 3А:
4) взаимодействие соединения Формулы 3А с электрофилом с получением соединения Формулы 4А:
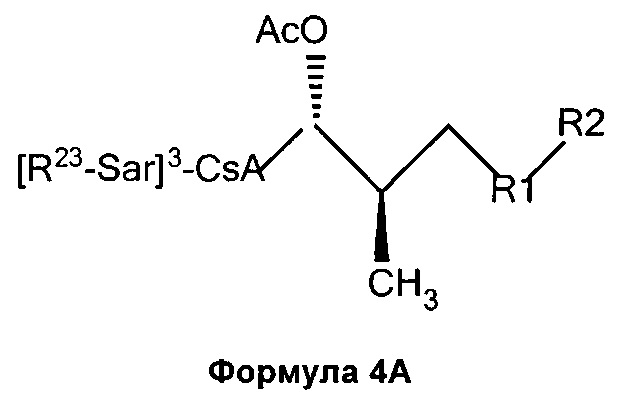
5) необязательно, деацилирование соединения Формулы 4А.
В одном из аспектов, указанное выше получение соединения Формулы L включает добавление избытка LiCl в указанном растворителе, с получением, преимущественно, L-эпимера Формулы L, или указанное получение соединения Формулы L проводят в отсутствие LiCl, с получением, преимущественно, D-эпимера Формулы L. Указанный основной алкиламид лития может включать диизопропиламид лития.
В одном из аспектов, указанный электрофил выбран из группы, определенной в следующей таблице, для образования соответствующего R23, приведенного в указанной таблице:

В одном из аспектов, изобретение относится к способу получения соединения Формулы L, определенной в настоящей заявке, включающему стадии: 1) взаимодействие соединения формулы 1А с диметиламинопиридином в присутствии подходящего растворителя, с получением соединения формулы 2:
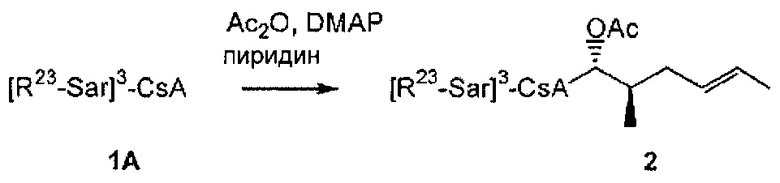
необязательно с последующим получением альдегида формулы 3:
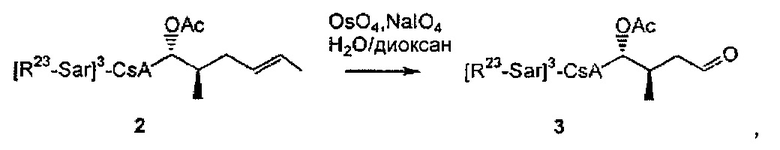
необязательно с последующей реакцией Виттига, с получением соединений Формулы L, где R23 выбран из группы, состоящей из:
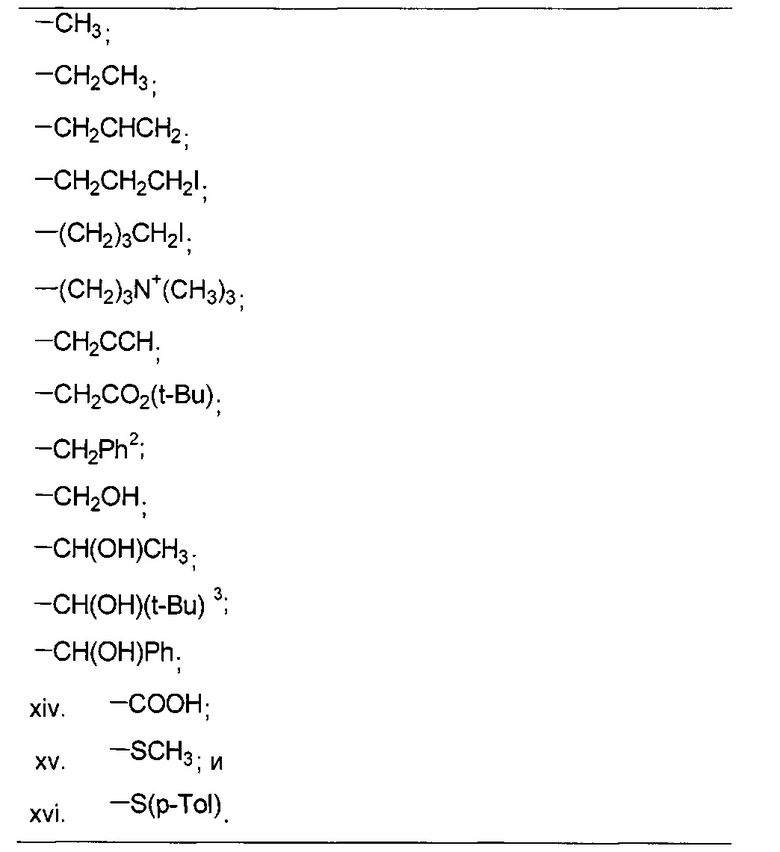
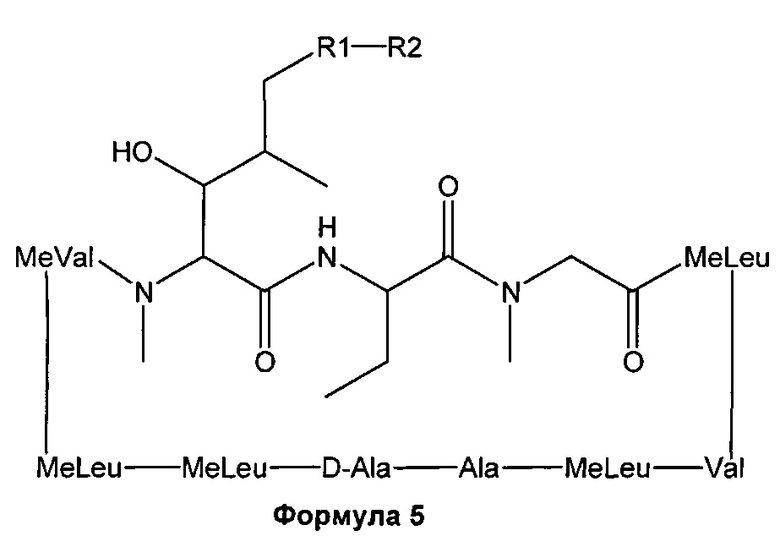
В одном из аспектов, изобретение относится к получению Формулы L, определенной в настоящей заявке, включающему стадии: взаимодействие соединения Формулы 5 с основным алкиламидом лития, необязательно содержащим диизопропиламид лития, в присутствии подходящего электрофила в подходящем растворителе, с получением соединения Формулы L, где R23 содержит необязательно замещенный С1-С3алкил.
В целом, для всех химических формул, приведенных в настоящем документе:
“Карбоновая кислота” включает группу, в которой фрагмент карбоновой кислоты присоединен к одному из следующих заместителей:
1. алкил, который может быть замещен (например, алкил длиной от 2 до 15 атомов углерода);
2. алкенил, который может быть замещен (например, алкенил длиной от 2 до 15 атомов углерода); и
3. алкинил, который может быть замещен (например, алкинил длиной от 2 до 15 атомов углерода).
Указанные выше заместители могут включать галоген (например, фтор, хлор, бром, йод и т.д.), нитро, циано, гидрокси, тиол, который может быть замещен (например, тиол, C1-4 алкилтио и т.д.), амино, который может быть замещен (например, амино, моно-С1-4 алкиламино, ди-С1-4 алкиламино, 5-6-членный циклоамино, такой как тетрагидропиррол, пиперазин, пиперидин, морфолин, тиоморфолин, пиррол, имидазол, и т.д.), С1-4 алкокси, который может быть галогенирован (например, метокси, этокси, пропокси, бутокси, трифторметокси, трифторэтокси и т.д.), С1-4 алкокси-С1-4 алкокси, который может быть галогенирован (например, метоксиметокси, метоксиэтокси, этоксиэтокси, трифторметоксиэтокси, трифторэтоксиэтокси и т.д.), формил, С2-4 алканоил (например, ацетил, пропионил и т.д.), С1-4 алкилсульфонил (например, метансульфонил, этансульфонил и т.д.) и т.п., и количество заместителей предпочтительно составляет от 1 до 3.
Кроме того, указанные выше заместители “амино, который может быть замещен” могут связываться с образованием циклической аминогруппы (например, группы, образованной путем удаления атома водорода из кольца, содержащего атом азота 5-6-членного кольца, такого как тетрагидропиррол, пиперазин, пиперидин, морфолин, тиоморфолин, пиррол, имидазол и т.д., таким образом, чтобы заместитель можно было присоединить к атому водорода и т.п). Циклическая аминогруппа может быть замещена и примеры заместителя включают галоген (например, фтор, хлор, бром, йод и т.д.), нитро, циано, гидрокси, тиол, который может быть замещен (например, тиол, С1-4 алкилтио и т.д.), амино, который может быть замещен (например, амино, моно-С1-4 алкиламино, ди-С1-4 алкиламино, 5-6-членный циклический амино, такой как тетрагидропиррол, пиперазин, пиперидин, морфолин, тиоморфолин, пиррол, имидазол, и т.д.), карбоксил, который может быть этерифицирован или амидирован (например, карбоксил, С1-4 алкоксикарбонил, карбамоил, моно-С1-4 алкилкарбамоил, ди-С1-4 алкилкарбамоил и т.д.), С1-4 алкокси, который может быть галогенирован (например, метокси, этокси, пропокси, бутокси, трифторметокси, трифторэтокси и т.д.), С1-4 алкокси-С1-4 алкокси, который может быть галогенирован (например, метоксиметокси, метоксиэтокси, этоксиэтокси, трифторметоксиэтокси, трифторэтоксиэтокси и т.д.), формил, С2-4 алканоил (например, ацетил, пропионил и т.д.), С1-4 алкилсульфонил (например, метансульфонил, этансульфонил) и т.п., и количество заместителей предпочтительно составляет от 1 до 3.
“Амин” включает группу, которая может быть незамещенной, или в которой аминный фрагмент является N-замещенным или N,N-дизамещенным, содержащим один или два заместителя, которые могут быть независимо выбраны из:
1. алкила, который может быть замещен (например, алкил длиной от 2 до 15 атомов углерода);
2. алкенила, который может быть замещен (например, алкенил длиной от 2 до 15 атомов углерода);
3. алкинила, который может быть замещен (например, алкинил длиной от 2 до 15 атомов углерода);
4. формила или ацила, которые могут быть замещены (например, алканоил от 2 до 4 атомов углерода (например, ацетил, пропионил, бутирил, изобутирил и т.д.), алкилсульфонил от 1 до 4 атомов углерода (например, метансульфонил, этансульфонил и т.д., и т.п.);
5. арила, который может быть замещен (например, фенил, нафтил и т.д., и т.п.),
и соединена с заместителем, независимо выбранным из заместителей, определенных выше для “карбоновой кислоты”.
“Амид” включает соединение, в котором карбоксильная группа амидного фрагмента соединена с заместителем, независимо выбранным из заместителей, определенных выше для «карбоновой кислоты», соединена аминогруппой амидного фрагмента, который является N-замещенным или N,N-дизамещенным, содержащим один или два заместителя, соответственно, которые могут быть независимо выбраны из:
1. алкила, который может быть замещен (например, алкил длиной от 2 до 15 атомов углерода);
2. алкенила, который может быть замещен (например, алкенил длиной от 2 до 15 атомов углерода);
3. алкинила, который может быть замещен (например, алкинил длиной от 2 до 15 атомов углерода);
4. формила или ацила, которые могут быть замещены (например, алканоил от 2 до 4 атомов углерода (например, ацетил, пропионил, бутирил, изобутирил и т.д.), алкилсульфонил от 1 до 4 атомов углерода (например, метансульфонил, этансульфонил и т.д.) и т.п.);
5. арила, который может быть замещен (например, фенил, нафтил и т.д.); и т.п.
“Арил” может быть представлен с помощью моноциклической или конденсированной полициклической ароматической углеводородной группы, и например, С6-14 арильной группы, такой как фенил, нафтил, антрил, фенантрил или аценафтиленил, и т.п. предпочтительны, при этом фенил предпочтителен. Указанный арил может быть замещен одним или более заместителем, таким как низший алкокси (например, С1-6 алкокси, такой как метокси, этокси или пропокси и т.д.), атом галогена (например, фтор, хлор, бром, йод и т.д.), низший алкил (например, С1-6 алкил, такой как метил, этил или пропил и т.д.), низший алкенил (например, С2-6 алкенил, такой как винил или аллил и т.д.), низший алкинил (например, С.2-6 алкинил, такой как этинил или пропаргил и т.д.), амино, который может быть замещен, гидроксил, который может быть замещен, циано, амидино, который может быть замещен, карбоксил, низший алкоксикарбонил (например, С1-6 алкоксикарбонил, такой как метоксикарбонил или этоксикарбонил и т.д.), карбамоил, который может быть замещен (например, карбамоил, который может быть замещен С1-6 алкилом или ацил (например, формил, С2-6 алканоил, бензоил, С1-6 алкоксикарбонил, который может быть галогенирован, С1-6 алкилсульфонил, который может быть галогенирован, бензолсульфонил и т.д.), который может быть замещен 5-6-членной ароматической моноциклической гетероциклической группой (например, пиридинил и т.д.), 1-азетидинилкарбонил, 1-пирролидинилкарбонил, пиперидинокарбонил, морфолинокарбонил, тиоморфолинокарбонил (атом серы может быть окислен), 1-пиперазинилкарбонил и т.д.) или и т.п.. Любой из указанных заместителей может быть независимо замещен по 1-3 подходящим положениям.
“Кетон” включает соединение, в котором карбонильная группа амидного фрагмента соединена с одним или двумя заместителями, независимо выбранными из заместителей, определенных выше для «карбоновой кислоты».
“Сложный эфир” включает либо карбоксильный, либо спиртовой сложный эфир, причем сложноэфирная группа состоит из одного или двух заместителей, независимо выбранных из заместителей, определенных выше для “карбоновой кислоты” или “арила”.
“Алкил”, если не указано иное, предпочтительно представляет собой алкил длиной от 1 до 15 атомов углерода.
“Ароматическая группа” может быть представлена арилом, как определено выше, или а 5-6-членной ароматической моноциклической гетероциклической группой, такой как фурил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, пиразолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, фуразанил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазинил или т.п.; и 8-16-членной (предпочтительно, 10-12-членной) ароматической конденсированной гетероциклической группой.
“Неиммунодепрессивный” относится к способности соединения проявлять существенно сниженную степень супрессии иммунной системы, по сравнению с CsA, измеренной через способность соединения ингибировать пролиферацию человеческих лимфоцитов в клеточной культуре и, предпочтительно, измеренной с помощью способа, приведенного в Примере 19, ниже.
“Аналог” означает структурный аналог CsA, который отличается от CsA одной или более функциональной группой. Предпочтительно, такие аналоги сохраняют по меньшей мере существенную часть способности CsA связывать CyP.
Предпочтительными примерами соединений Формулы I являются соединения, в которых R' представляет собой Н, R1 представляет собой насыщенный или ненасыщенный алкил длиной от 2 до 15 атомов углерода и R2 выбран из:
1. карбоновой кислоты, содержащей карбоксильную группу;
2. N-замещенного или N,N-дизамещенного амида, в котором заместители независимо выбраны из Н, алкила длиной от 1 до 7 атомов углерода или указанные заместители образуют гетероциклическое кольцо, гетероцикл которого выбран из О, N или S;
3. сложного эфира длиной от 1 до 7 атомов углерода;
4. моногидроксилированного или дигидроксилированного алкила длиной от 1 до 7 атомов углерода;
5. N-замещенного или незамещенного защищенного ацилом амина длиной от 1 до 7 атомов углерода;
6. нитрила;
7. кетона, причем карбоксильная группа кетона соединена с R1 и насыщенной или ненасыщенной алкильной цепью длиной от 1 до 7 атомов углерода;
8. фенил, необязательно замещенный одним или более заместителями независимо выбранными из диоксида азота, фтора, амина, сложного эфира или карбоксильной группы.
Соединения согласно настоящему изобретению могут существовать в форме оптически активных соединений. Настоящее изобретение включает все энантиомеры оптически активных соединений в объеме указанных выше формул, как индивидуальные, так и смеси рацематов. Также, настоящее изобретение включает пролекарства соединений, описанных в настоящей заявке.
Согласно другому аспекту, соединения согласно настоящему изобретению могут подходить для лечения или предотвращения или изучения заболеваний, опосредованных CyP у млекопитающего, предпочтительно человека. Такое заболевание обычно опосредовано сверхэкспрессией CyP, например, врожденной сверхэкспрессией CyP.
Заболевания, опосредованные CyP, которые можно лечить с помощью соединения согласно настоящему изобретению, включают:
a. вирусную инфекцию;
b. воспалительное заболевание;
c. рак;
d. мышечное дегенеративное нарушение;
e. нейродегенеративное нарушение; и
f. повреждение, связанное с нарушением гомеостаза кальция в клетке.
Указанная вирусная инфекция может быть вызвана вирусом, выбранным из группы, состоящей из вируса иммунодефицита человека, гепатита А, гепатита В, гепатита С, гепатита D, гепатита Е. Указанное воспалительное заболевание выбрано из группы, состоящей из астмы, аутоиммунного заболевания, хронического воспаления, хронического простатита, гломерулонефрита, гиперчувствительности, воспалительного заболевания кишечника, сепсиса, заболевания, связанного с гладкомышечными клетками сосудов, аневризмов, тазового воспалительного заболевания, реперфузионного повреждения, ревматоидного артрита, отторжения трансплантата и васкулита. Указанный рак может быть выбран из группы, состоящей из мелкоклеточного и немелкоклеточного рака легкого, рака мочевого пузыря, гепатоцеллюлярного рака, рака поджелудочной железы, рака молочной железы. Указанное мышечное дегенеративное нарушение может быть выбрано из группы, состоящей из реперфузионного повреждения миокарда, мышечной дистрофии и миопатий коллагена VI. Указанное неврологическое нарушение может быть выбрано из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, множественной системной атрофии, рассеянного склероза, церебрального паралича, инсульта, диабетической нейропатии, бокового амиотрофического склероза (болезни Лу Герига), повреждения спинного мозга и повреждения головного мозга. Указанное повреждение, связанное с нарушением гомеостаза кальция в клетке, может быть выбрано из группы, состоящей из инфаркта миокарда, инсульта, острой гепатотоксичности, холестаза и повреждения при хранении/реперфузионного повреждения трансплантата органов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно одному из аспектов, соединение согласно настоящему изобретению можно вводить в чистом виде или с фармацевтическим носителем теплокровному животному, нуждающемуся в этом. Фармацевтический носитель может представлять собой твердое вещество или жидкость. Соединение можно вводить перорально, местно, парентерально, путем ингаляции распылением или ректально в виде единичных лекарственных форм, содержащих традиционные нетоксичные фармацевтически приемлемые носители, вспомогательные вещества и наполнители. В настоящей заявке, термин «парентерально» включает подкожные инъекции, внутривенные, внутримышечные, внутригрудинные инъекции или методы инфузии.
Фармацевтические композиции, содержащие смесь согласно изобретению, могут быть в форме, подходящей для перорального применения, например, в виде таблеток, пастилок, леденцов, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул или сиропов, или эликсиров. Композиции, предназначенные для перорального применения, могут быть получены в соответствии со способами, известными в данной области для получения фармацевтических композиций, и такие композиции могут содержать один или более агентов, выбранных из группы, состоящей из подсластителей, ароматизаторов, красителей и консервантов, с тем, чтобы обеспечить фармацевтически приемлемые и приятные на вкус препараты. Таблетки, содержащие активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми вспомогательными веществами могут быть также изготовлены согласно известным способам. Используемые вспомогательные вещества могут представлять собой, например: (1) инертные разбавители, такие как карбонат кальция, лактоза, фосфат кальция или фосфат натрия; (2) гранулирующие и разрыхляющие агенты, такие как кукурузный крахмал или альгиновая кислота; (3) связующие агенты, такие как крахмал, желатин или гуммиарабик; и (4) смазывающие агенты, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут быть непокрытыми или они могут быть покрыты согласно известным способам, чтобы отсрочить разложение и абсорбцию в желудочно-кишечном тракте и тем самым обеспечить пролонгированное действие в течение более длительного периода времени. Например, можно применять материал для временной задержки, такой как моностеарат глицерина или дистеарат глицерина. Они также могут быть покрыты с помощью методов, описанных в патентах США №4256108, 4160452 и 4265874, с получением осмотических терапевтических таблеток с контролируемым высвобождением.
В некоторых случаях составы для перорального введения могут быть в форме твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином. Они также могут быть в виде мягких желатиновых капсул, где активный ингредиент смешан с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом.
Водные суспензии обычно содержат активные материалы в смеси со вспомогательными веществами, подходящими для получения водных суспензий. Такие вспомогательные вещества могут включать: (1) суспендирующие агенты, такие как карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь; или (2) диспергирующие или смачивающие агенты, которые могут представлять собой природные фосфатиды, такие как лецитин, продукт конденсации алкиленоксида с жирной кислотой, например, стеарат полиоксиэтилена, продукт конденсации этиленоксида с длинноцепочечным алифатическим спиртом, например, гептадекаэтиленоксицетанол, продукт конденсации этиленоксида с неполным эфиром жирной кислоты и гексита, такие как полиоксиэтиленсорбитмоноолеат, или продукт конденсации этиленоксида с неполным эфиром жирной кислоты и ангидрида гексита, например полиоксиэтиленсорбитан моноолеат.
Водные суспензии могут также содержать один или более консервантов, например, этил или н-пропил-п-гидроксибензоат, один или более красителей, один или более ароматизирующих агентов и один или более подсластителей, таких как сахароза, аспартам или сахарин.
Масляная суспензия может быть получена суспендированием активного ингредиента в растительном масле, например арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, рыбьем жиру, который содержит омега-3 жирные кислоты, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Подсластители и ароматизирующие агенты могут быть добавлены, чтобы обеспечить приятный вкус перорального препарата. Указанные композиции могут быть сохранены путем добавления антиоксиданта, такого как аскорбиновая кислота.
Диспергируемые порошки и гранулы подходят для получения водной суспензии. Они содержат активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или более консервантами. Подходящие диспергирующие или смачивающие агенты и суспендирующие агенты представлены теми, которые уже упомянуты выше. Дополнительные вспомогательные вещества, например, подслащивающие, ароматизирующие и окрашивающие агенты, описанные выше, могут также присутствовать.
Фармацевтические композиции, содержащие смеси согласно изобретению могут также быть в форме эмульсий масло-в-воде. Масляная фаза может представлять собой растительное масло, например оливковое масло или арахисовое масло, или минеральное масло, например жидкий парафин, или их смеси. Подходящие эмульгаторы могут представлять собой: (1) природные камеди, такие как аравийская камедь и трагакантовая камедь; (2) природные фосфатиды, такие как соевые бобы и лецитин; (3) сложные эфиры или неполные эфиры 30, полученные из жирных кислот и ангидридов гексита, например, моноолеат сорбитана; (4) продукты конденсации указанных неполных эфиров с этиленоксидом, например, моноолеат полиоксиэтиленсорбитана. Эмульсии могут также содержать подсластители и ароматизаторы.
Сиропы и эликсиры могут быть получены с подсластителями, например, глицерином, пропиленгликолем, сорбитом, аспартамом или сахарозой. Такие составы могут также содержать смягчающее средство, консервант, ароматизаторы и красители.
Фармацевтические композиции могут быть в форме стерильных инъекционных водных или масляных суспензий. Указанные суспензии могут быть получены в соответствии с известными способами с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были упомянуты выше. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например как раствор в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые можно использовать, можно указать воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используют в качестве растворителя или суспендирующей среды. Для этой цели может быть использовано любое мягкое нелетучее масло, в том числе синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят применение при получении лекарственных форм для инъекций.
Соединение согласно изобретению также можно вводить в форме суппозиториев для ректального введения лекарственного средства. Подходящие композиции могут быть получены путем смешивания соединения с подходящим нераздражающим вспомогательным веществом, который является твердым при обычных температурах, но жидким при ректальной температуре и, следовательно, будет плавиться в прямой кишке с высвобождением лекарственного средства. Такими материалами являются масло какао и полиэтиленгликоли.
Для местного применения могут быть использованы подходящие кремы, мази, желе, растворы или суспензии и т.д., которые обычно используются с циклоспорином.
В особенно предпочтительном варианте реализации, в качестве неактивного ингредиента используют жидкий раствор, содержащий поверхностно-активное вещество, этанол, липофильный и/или амфифильный растворитель, В частности, используют состав пероральной гетерогенной эмульсии, содержащей смеси изомерных аналогов и следующие нелекарственные вещества: Д-альфа-токоферилполиэтиленгликольсукцинат (витамин Е TPGS), масло триглицерида со средней длиной цепи (МСТ), Tween 40 и этанол. Предпочтительно также используют мягкую желатиновую капсулу (содержащую желатин, глицерин, воду и сорбит), содержащую соединение и те же немедицинские ингредиенты, как пероральный раствор.
Однако следует понимать, что конкретный уровень доз для любого конкретного пациента будет зависеть от множества факторов, включающих активность конкретного применяемого соединения, возраст, вес тела, общее состояние здоровья, пол, диету, время введения, путь введения, скорость экскреции, комбинацию лекарств, характер и тяжесть конкретного заболевания или состояния, подвергаемого лечению.
Методики
Реакции, приведенные ниже, представляют собой общие примеры химических реакций, позволяющих синтезировать требуемые соединения, модифицированные по аминокислотному остатку 1 (АК1) и аминокислотному остатку 3 (АК3) CsA. Модификации по АК1 показаны как:
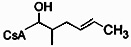
и модификации по АК3 показаны как
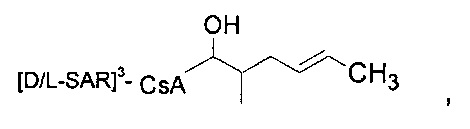
где обе модификации по АК1 и АК3 требуют применения реагентов, обладающих соответствующими химическими свойствами, и специалисту в данной области будет понятно, что для таких реагентов может быть найдена замена.
Соответствие и чистоту полученных соединений, в целом, устанавливали с помощью методик, включающих масс-спектрометрию, ВЭЖХ и ЯМР-спектроскопию. Масс-спектры (ИЭР-МС) были получены на системе Hewlett Packard 1100 MSD. ЯМР-спектры были получены на спектрометре MercuryPlus Varian 400 МГц в дейтерированных растворителях (ДМСО для фосфониевых солей, бензол для всех других соединений). Аналитическую и препаративную обращенно-фазовую ВЭЖХ проводили на системе Agilent 1100 Series.
Синтез соединений соли фосфония
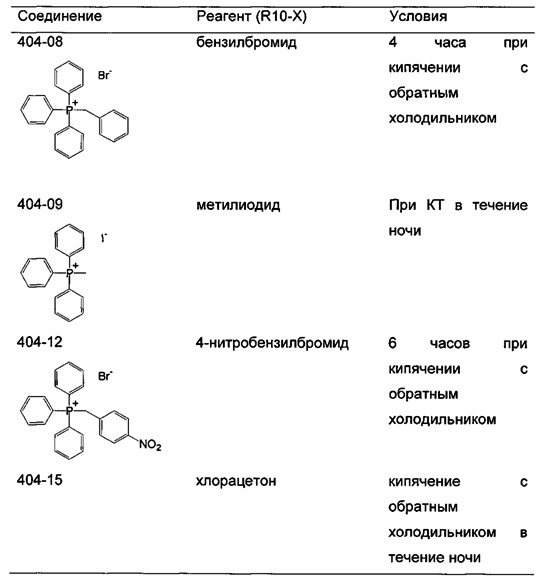
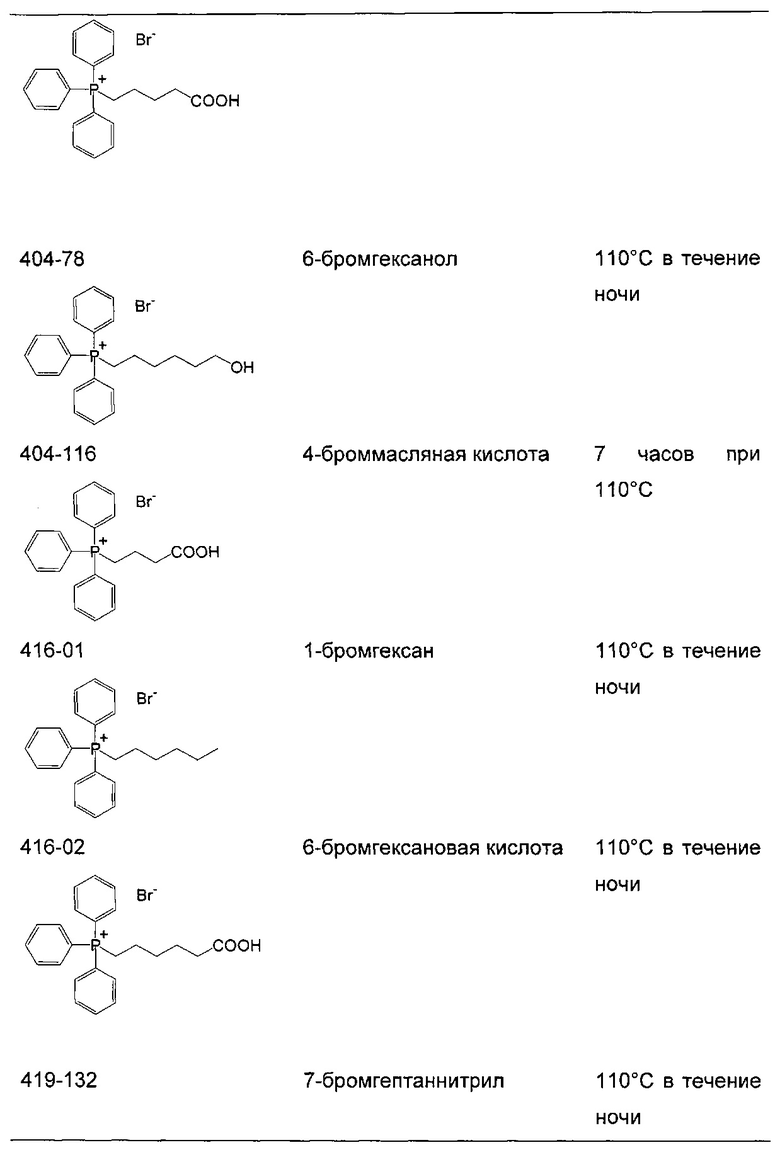
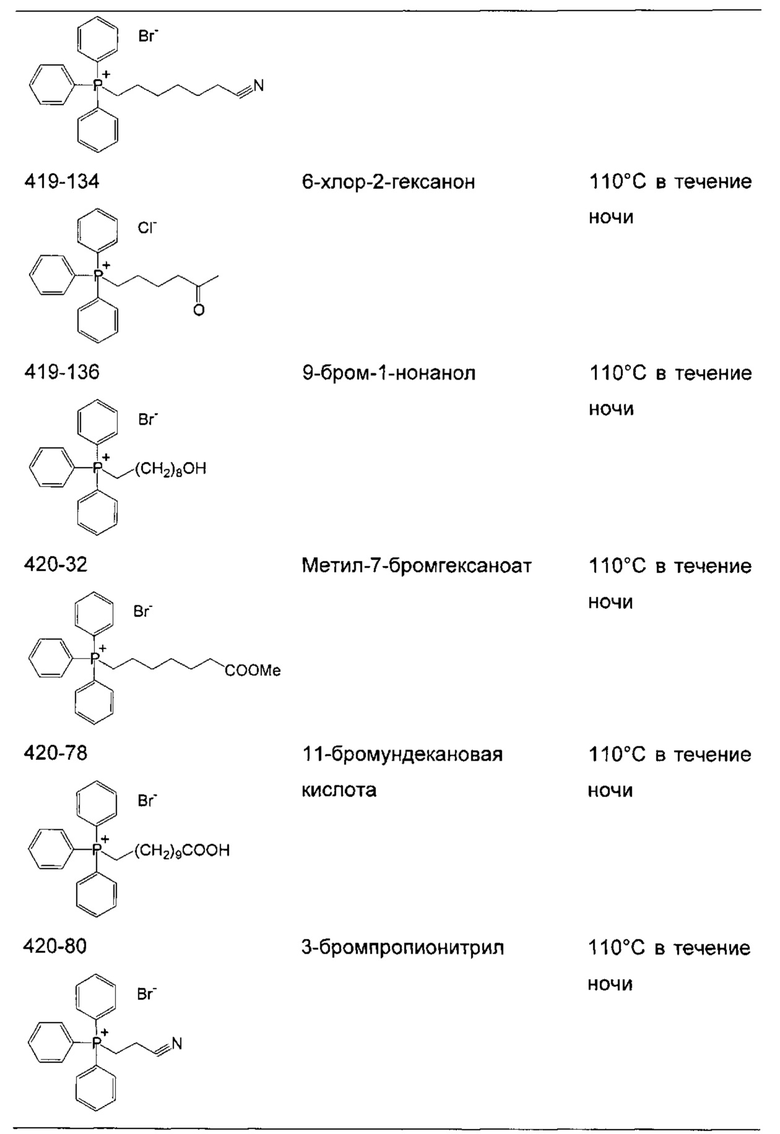
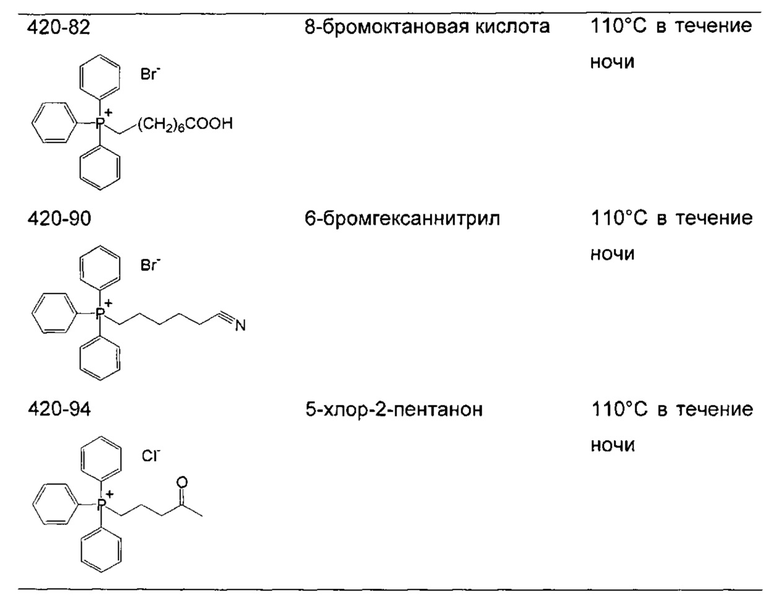
Соли фосфония получают в результате реакции трифенилфосфина или любого другого подходящего фосфина с алкилгалогенидами (R-X, X=Cl, Br или I). Подходящие алкилгалогениды представляют собой любые первичные или вторичные алифатические галогениды любой длины цепи или молекулярной массы. Указанные алкилгалогениды могут быть разветвленными или неразветвленными, насыщенными или ненасыщенными.
Если реакцию проводят в толуоле (Реакция 1), продукт осаждается непосредственно из реакционного раствора. Однако для нереагирующих субстратов требуются более полярные растворители, такие как диметилформамид (ДМФА) (Реакция 2), чтобы сократить время реакции и достичь удовлетворительного выхода.
Реакция 1:

где X представляет собой галогенид (включая, но не ограничиваясь, Cl, Br и I), и R10 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, необязательно содержащую заместитель, выбранный из группы кетонов, гидроксилов, нитрилов, карбоновых кислот, сложных эфиров и 1,3-диоксоланов, ароматическую группу, необязательно содержащую заместитель, выбранный из группы, включающей галогениды, сложные эфиры и нитро; или комбинации упомянутой выше насыщенной или ненасыщенной, линейной или разветвленной алифатической цепи и упомянутых выше ароматических групп
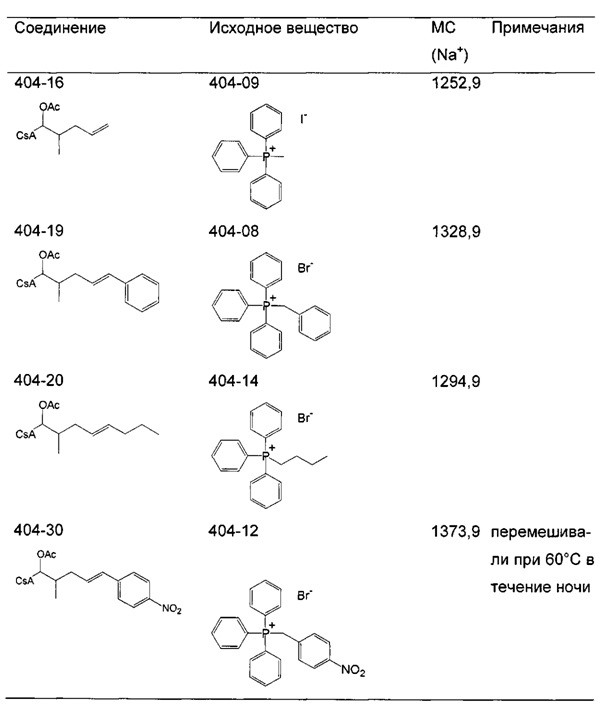
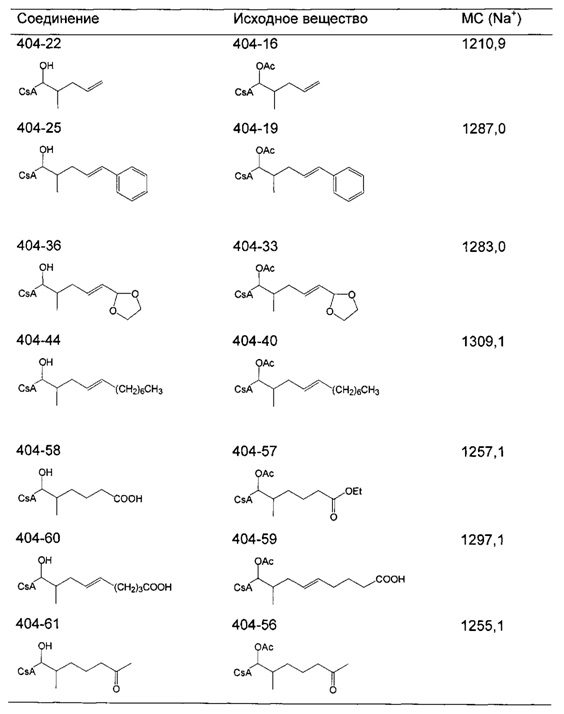
Пример 1. Синтез 404-15

В качестве иллюстративного примера, трифенилфосфин (13 ммоль) растворяли в 50 мл толуола и добавляли хлорацетон (10 ммоль) с получением прозрачного раствора. Реакционную смесь перемешивали с обратным холодильником в течение ночи. Бесцветное твердое вещество отфильтровывали, промывали толуолом и гексаном и сушили в вакууме.
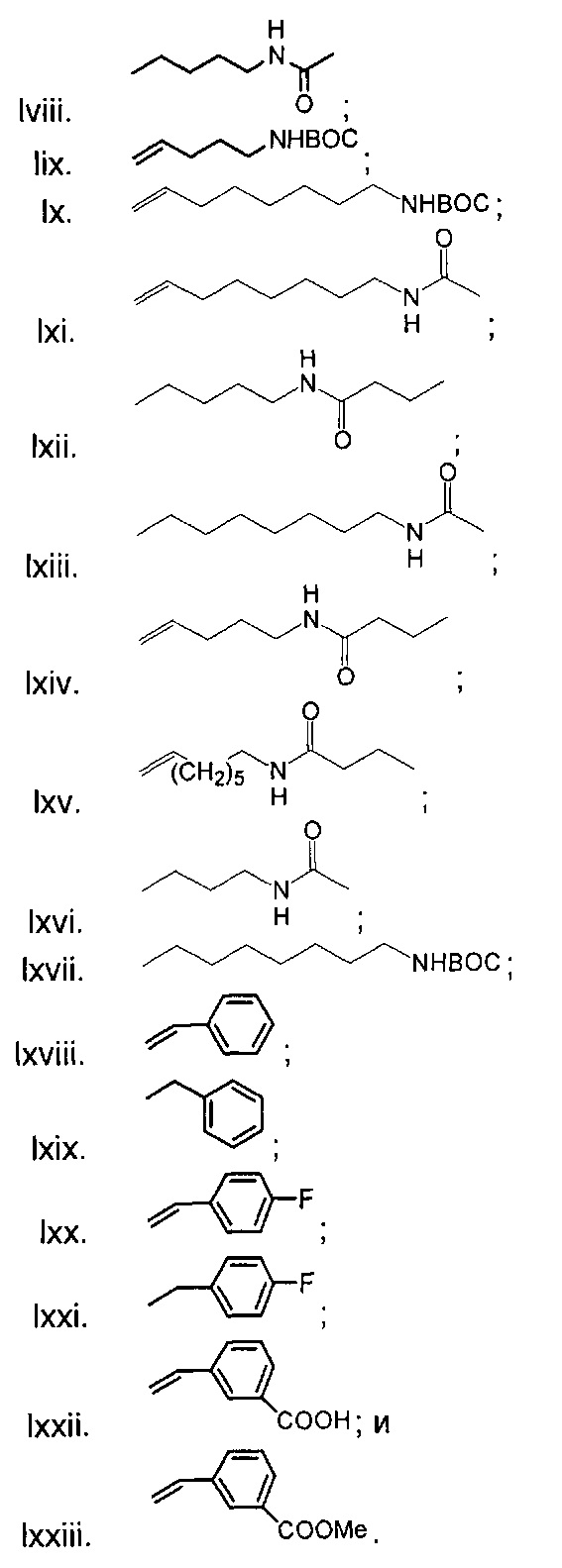
Следующие соединения являются дополнительными примерами соединений, которые могут быть синтезированы посредством реакции 1:
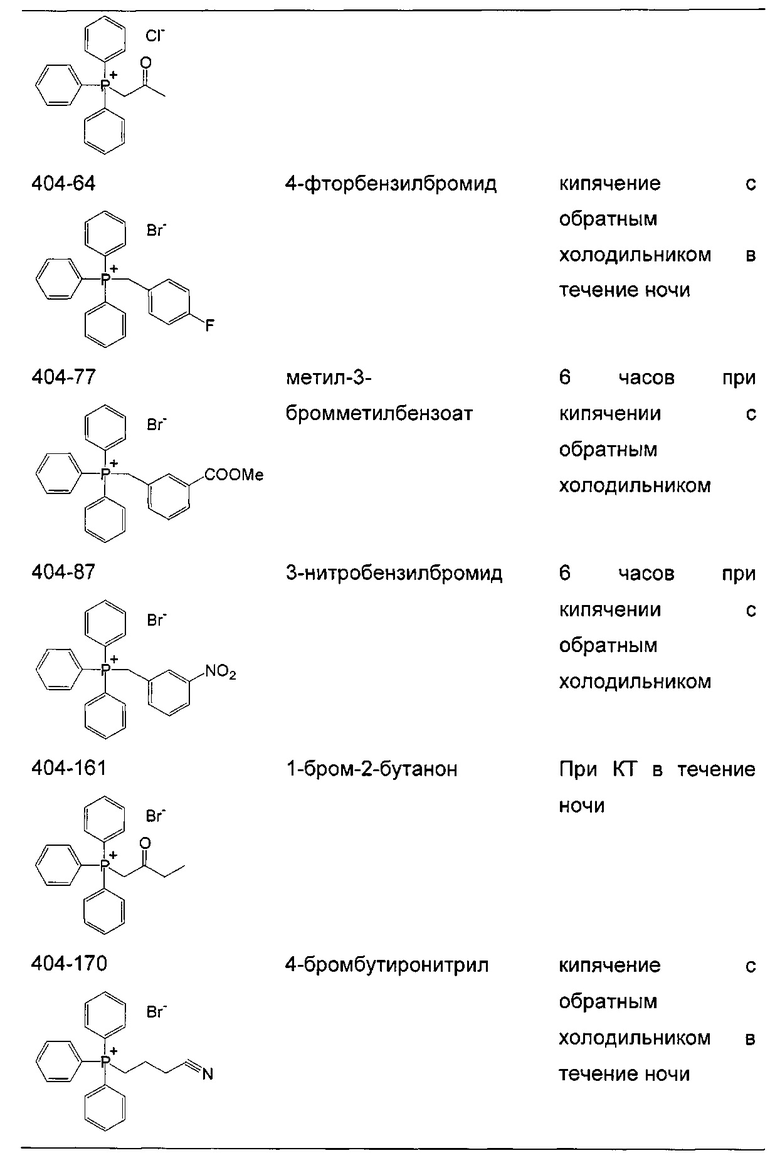
Кроме того, подходящие соли фосфония могут быть синтезированы посредством Реакции 2, как показано ниже:
Реакция 2:
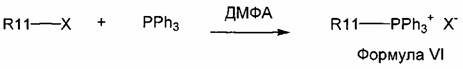
где X представляет собой галогенид (включая, но не ограничиваясь Cl, Br и I), и R10 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, необязательно содержащую заместитель, выбранный из группы, кетонов, гидроксилов, нитрилов, карбоновых кислот, сложных эфиров и 1,3-диоксоланов; ароматическую группу, необязательно содержащую заместитель, выбранный из группы, включающей галогениды, сложные эфиры и нитро; или комбинации упомянутой выше насыщенной или ненасыщенной, линейной или разветвленной алифатической цепи и упомянутых выше ароматических групп.
Пример 2: Синтез 404-51
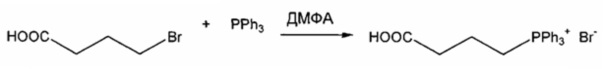
В качестве иллюстративного примера, трифенилфосфин (11 ммоль) растворяли в 10 мл ДМФА и добавляли 4-броммасляную кислоту (10 ммоль). Реакционную смесь перемешивали в течение 7 ч при 110°C и затем охлаждали в течение ночи. Добавляли 50 мл толуола и кристаллическое бесцветное твердое вещество собирали фильтрованием. Продукт промывали толуолом и гексаном и сушили в вакууме в течение ночи.
Если кристаллизация не происходила после обработки толуолом, продукт экстрагировали 20 мл МеОН/H2O (смесь 1:1). Водную фазу промывали толуолом и гексаном и высушивали досуха. Остаток перемешивали с 50 мл этилацетата (EtOAc) с обратным холодильником в течение 20-30 мин. Если получали кристаллическое твердое вещество, продукт собирали фильтрованием, промывали EtOAc и гексаном и сушили. В случае, если продукт получали в виде масла или смолы, EtOAc декантировали, а оставшийся продукт сушили в вакууме.
Следующие соединения являются дополнительными примерами соединений, которые могут быть синтезированы посредством реакции 2.
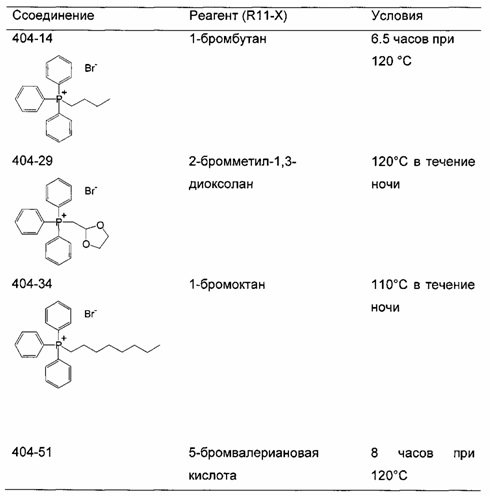
Реакция Виттига
Реакцию Виттига широко применяют для широкого диапазона субстратов и реагентов. Боковая цепь, которую вводят в субстрат в указанной реакции, может представлять любое число разветвленных и неразветвленных, насыщенных и ненасыщенных алифатических соединений переменной длины (R') и может содержать широкий спектр функциональных групп.
В реакции Виттига для получения илида из фосфониевой соли используют основание, такое как трет-бутоксид калия (KOtBu). Илид взаимодействует с карбонильной группой субстрата, CsA-альдегидом, с образованием алкена. Фосфониевые соли, содержащие карбоновую кислоту, в боковой цепи требуют по меньшей мере два эквивалента основания для формирования илида.
Реакция 3: синтез промежуточного ацетилированного аналога циклоспорина с использованием соединения соли фосфония по реакции Виттига
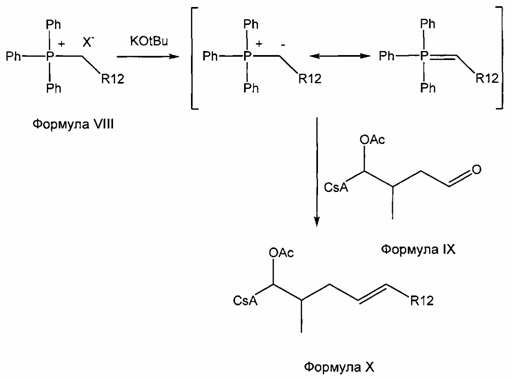
где X представляет собой галогенид (включая, но не ограничиваясь, Cl, Br и I), и R12 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, необязательно содержащую заместитель, выбранный из группы кетонов, гидроксилов, нитрилов, карбоновых кислот, сложных эфиров и 1,3-диоксоланов; ароматическую группу, необязательно содержащую заместитель, выбранный из группы, включающей галогениды, сложные эфиры и нитро; или комбинации упомянутой выше насыщенной или ненасыщенной, линейной или разветвленной алифатической цепи и упомянутых выше ароматических групп.
Пример 3: Синтез соединения 404-20 с применением соединения соди фосфония по реакции Виттига
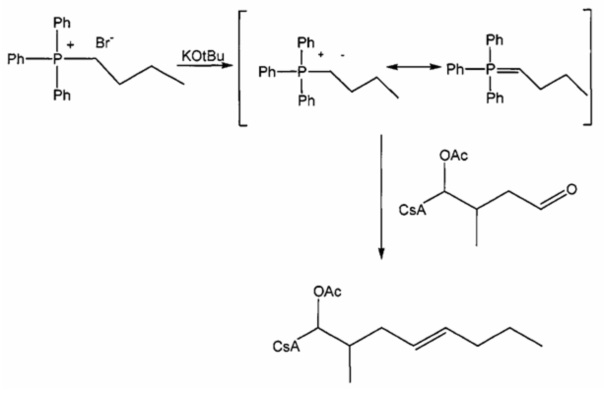
В качестве иллюстративного примера, в высушенную в печи 250-мл колбу в атмосфере аргона загружали с бромид трифенилбутилфосфония (6,0 ммоль) и 40 мл безводного тетрагидрофурана (ТГФ). Суспензию охлаждали до 0°C и добавляли трет-бутоксид калия (6,0 ммоль) с получением оранжевого цвета. Реакционную смесь перемешивали при комнатной температуре в течение 1-2 часов, с последующим добавлением CsA-альдегида (2,0 ммоль, растворенного в 20 мл безводного ТГФ). Перемешивание продолжали в течение 3 часов при комнатной температуре. Реакцию гасили 10 мл насыщенного NH4Cl и 20 мл ледяной воды. Слои разделяли и водную фазу экстрагировали EtOAc. Органические слои объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли и неочищенный продукт очищали на силикагеле (гексан/ацетон 3:1).
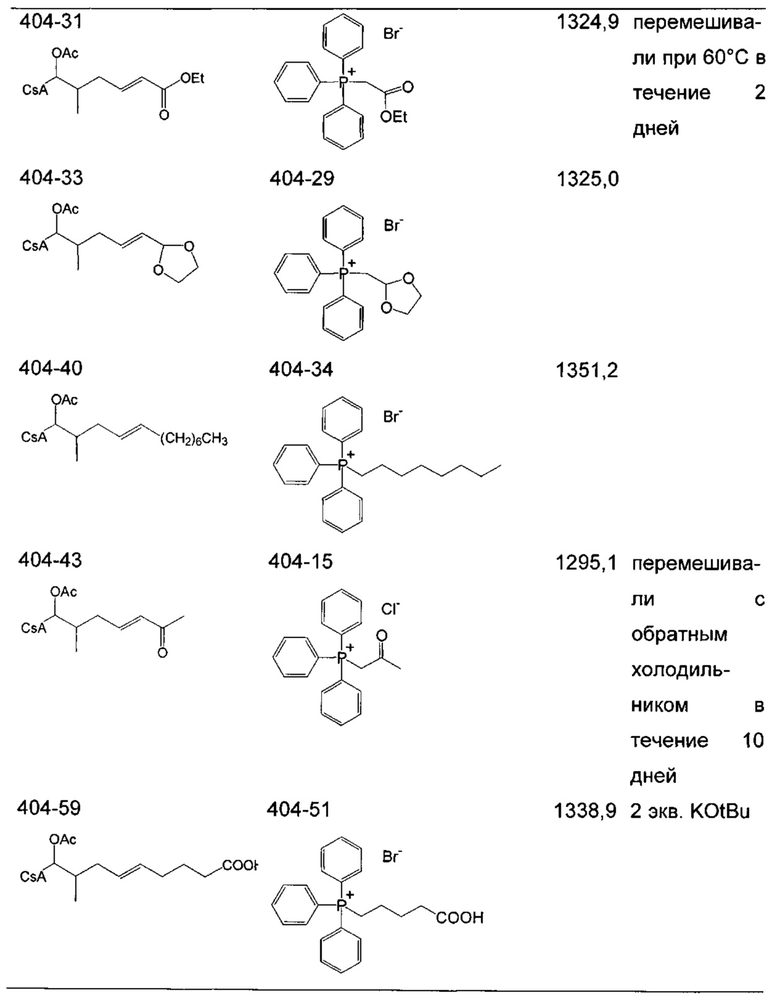
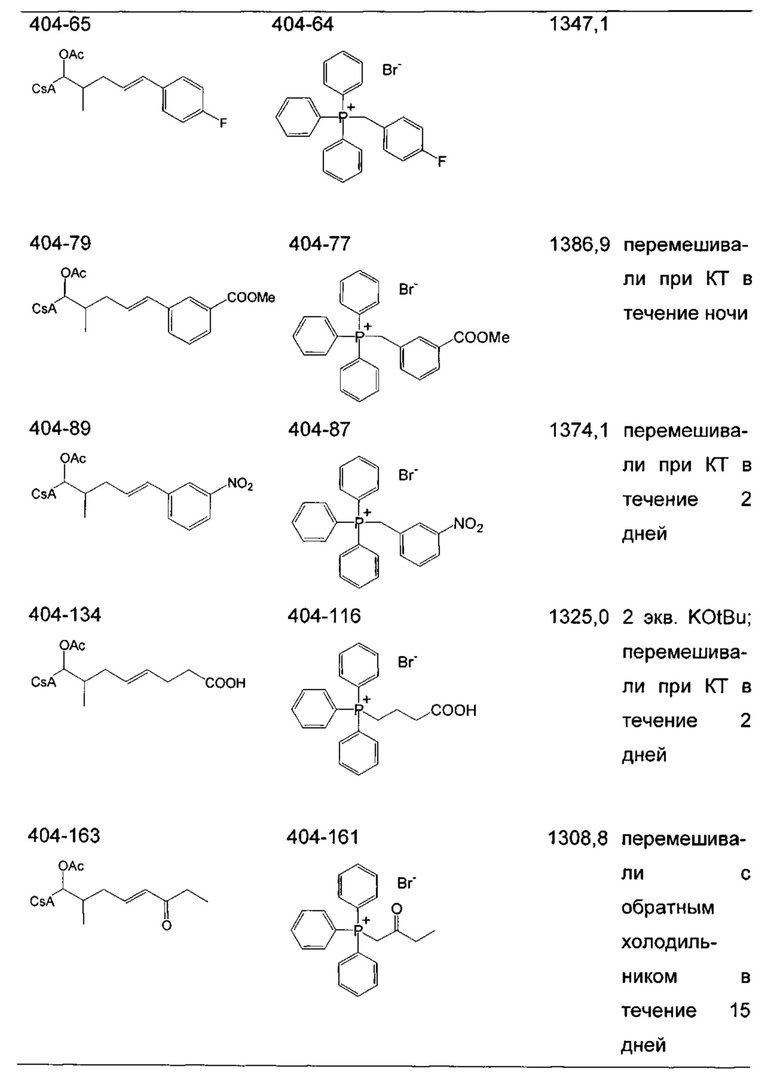
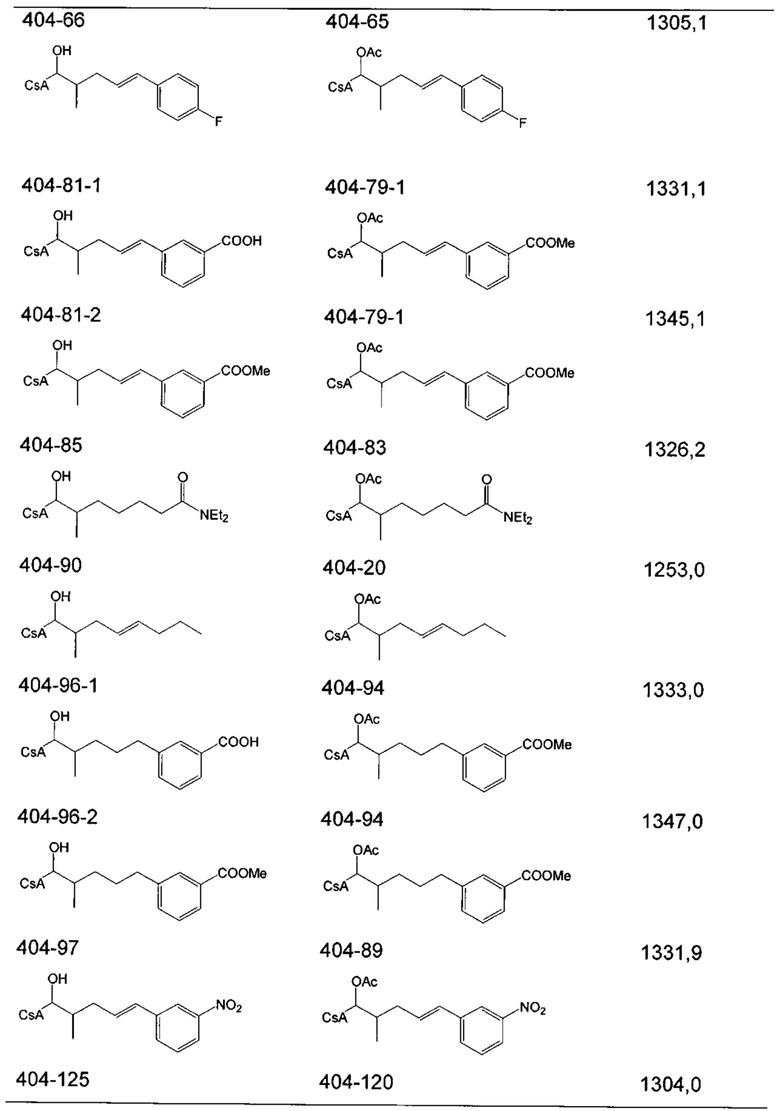
Следующие соединения являются дополнительными примерами соединений, которые могут быть синтезированы посредством реакции 3:
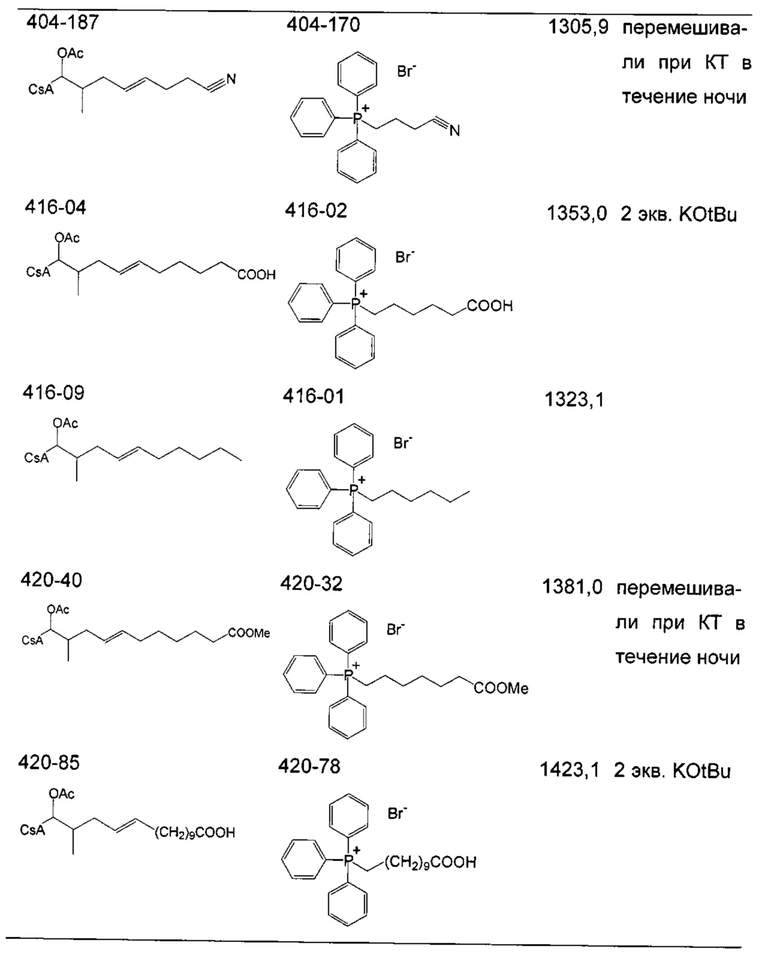
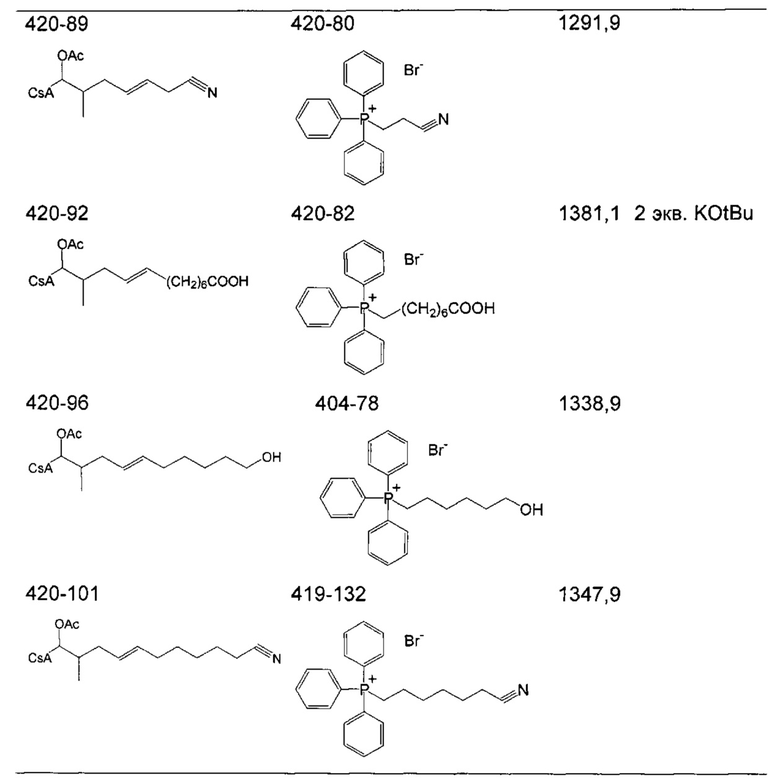
Деацетилирование
Реакция 4: Деацетилирование ацетилированных аналогов циклоспорина
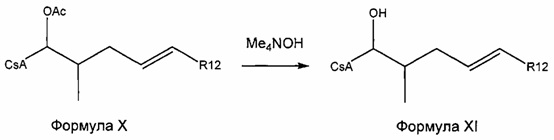
где R12 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, необязательно содержащую заместитель, выбранный из группы, кетонов, гидроксилов, нитрилов, карбоновых кислот, сложных эфиров, амидов, защищенных ацилом аминов и 1,3-диоксоланов; ароматическую группу, необязательно содержащую заместитель, выбранный из группы, включающей галогениды, сложные эфиры, амины и нитро; или комбинации упомянутой выше насыщенной или ненасыщенной, линейной или разветвленной алифатической цепи и упомянутых выше ароматических групп.
Пример 4: Синтез соединения 404-90 посредством деацилирования
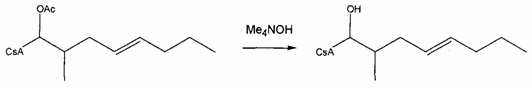
В качестве иллюстративного примера, раствор 404-20 (0,16 ммоль) в 10 мл МеОН, смешивали с раствором пентагидрата гидроксида тетраметиламмония (0,47 ммоль) в 2 мл H2O. Смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь концентрировали в вакууме и добавили 5 мл H2O. Реакционную смесь экстрагировали этилацетатом, экстракт промывали солевым раствором, сушили над Na2SO4 и концентрировали досуха. Неочищенный продукт очищали с помощью обращенно-фазовой препаративной ВЭЖХ.
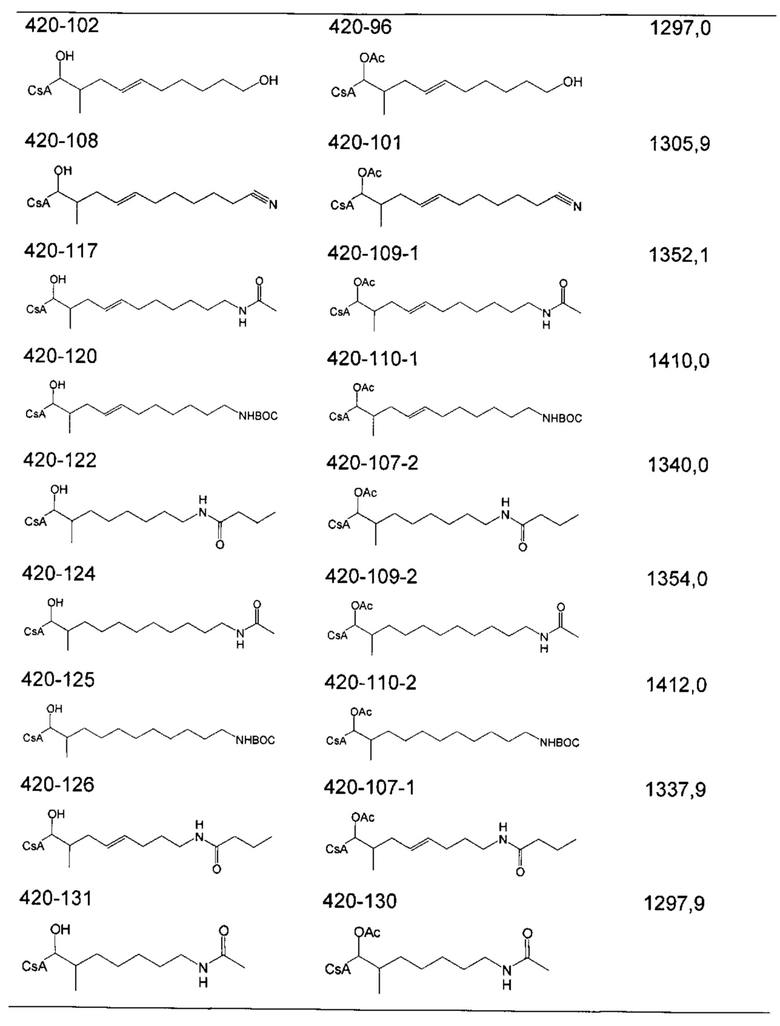
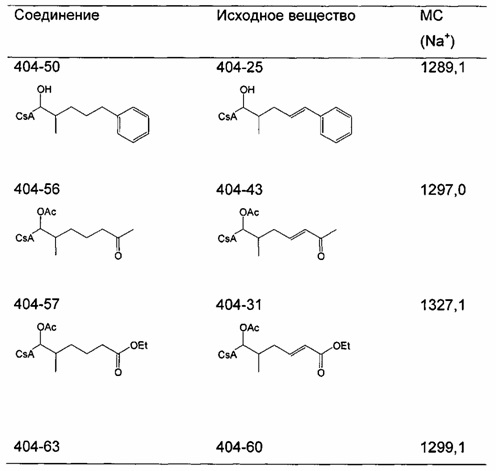
Очистку деацетилированных соединений обычно проводили на силикагеле (гексан/ацетон 2:1) или посредством препаративной ВЭЖХ. В случае соединений 404-60, 404-137, 416-08, 420-98 и 420-100 (карбоновые кислоты), реакционную смесь подкисляли до pH 2-3 с помощью 1 М HCl до экстракции.
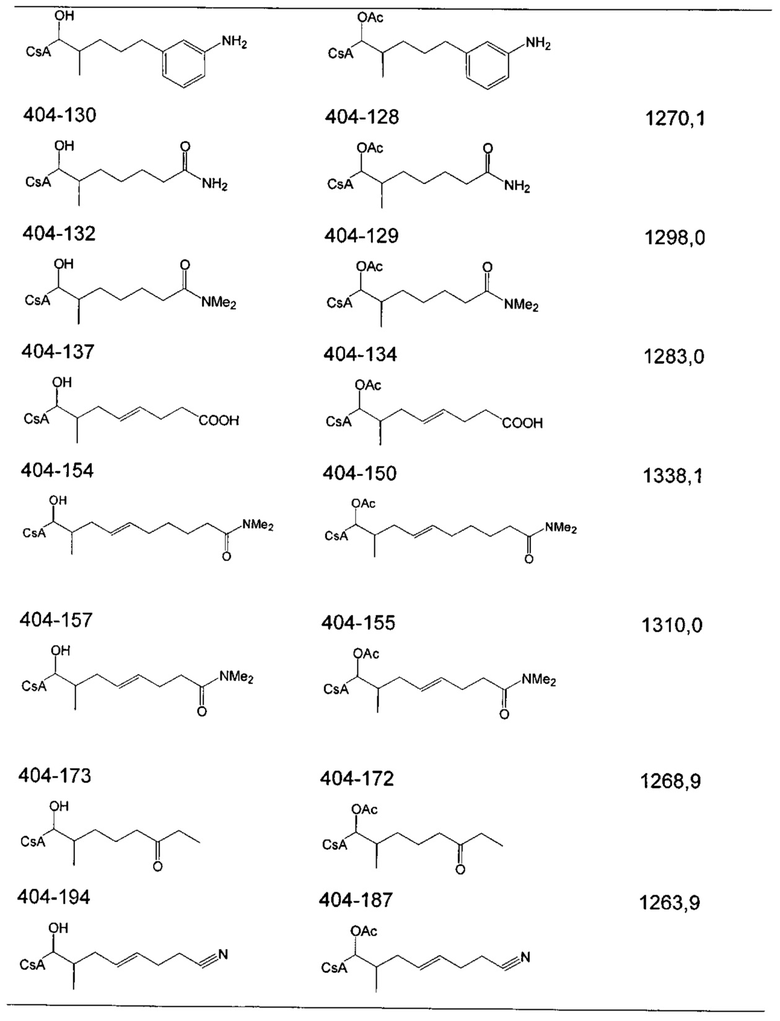
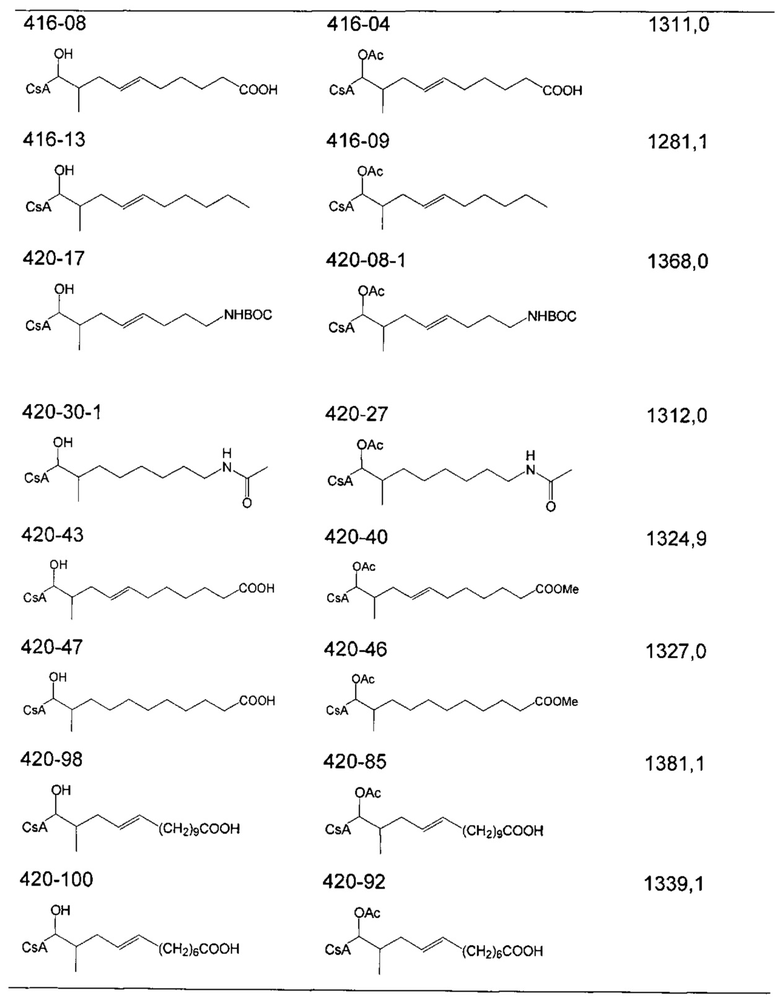
Следующие соединения являются дополнительными примерами соединений, которые могут быть синтезированы посредством реакции 4:
Гидрирование двойной связи
Двойную связь можно гидрировать при атмосферном давлении с получением насыщенной боковой цепи. Функциональные группы, такие как гидроксильные, карбонильные и карбоксильные группы, являются стабильными при указанных условиях и не требуют защиты. R' представляет собой либо ацетильную группу, либо или водород. В случае α,β-ненасыщенных карбонильных соединений двойная связь должна быть восстановлена до деацетилирования, чтобы избежать циклизации путем нуклеофильного присоединения свободной гидроксильной группы на активированную двойную связь.
Реакция 5:
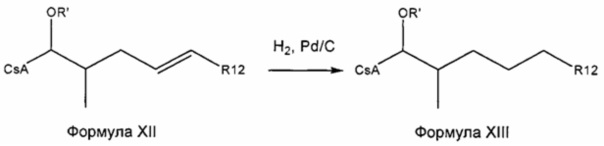
где R12 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, необязательно содержащую заместитель, выбранный из группы, кетонов, гидроксилов, нитрилов, карбоновых кислот, сложных эфиров, амидов, защищенных ацилом аминов и 1,3-диоксоланов; ароматическую группу, необязательно содержащую заместитель, выбранный из группы, включающей галогениды, сложные эфиры, амины и нитро; или комбинации упомянутой выше насыщенной или ненасыщенной, линейной или разветвленной алифатической цепи и упомянутых выше ароматических групп, и R` представляет собой либо Н, либо ацетильную группу.
Пример 5: Синтез 404-56:
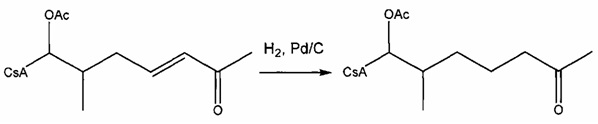
В качестве иллюстративного примера, 404-43 (0,34 ммоль) растворяли в 40 мл безводного EtOH и 43 мг Pd/C (10%) и 0,2 мл уксусной кислоты. Смесь перемешивали в атмосфере водорода при атмосферном давлении в течение 2 дней. Реакционную смесь фильтровали через целит и концентрировали в вакууме. Неочищенный продукт очищали с помощью препаративной ВЭЖХ.
Следующие соединения являются дополнительными примерами соединений, которые могут быть синтезированы посредством реакции 5:

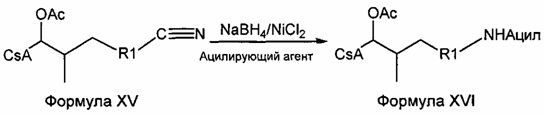
Восстановление нитрильной группы
Восстановление нитрильной группы до соответствующего первичного амина можно провести с помощью борида никеля, получающегося in situ из борогидрид натрия (NaBH4) и хлорида никеля (II) (NiCl2). Добавление подходящего захватывающего реагента приводит к получению ацил-защищенных первичных аминов (карбаматов или амидов, соответственно) и позволяет предотвратить образование вторичных аминов в нежелательных побочных реакциях. Двойную связь частично восстанавливают при данных условиях и получают продукт смеси. Оба насыщенные и ненасыщенные защищенные аминные соединения были выделены и очищены. Для реакции 420-123 смесь не разделяли. Вместо этого смесь подвергали каталитическому гидрированию с получением полностью насыщенного соединения.
Реакция 6:
где ацил представляет собой любой из ВОС, ацетила или бутирила, ацилирующий агент представляет собой любой из ди-трет-бутилдикарбоната, уксусного ангидрида и масляного ангидрида, и R1 представляет собой насыщенную или ненасыщенную линейную или разветвленную алифатическую группу. Специалистам в данной области техники будет понятно, что ацилирующие агенты, описанные выше, можно заменить широким спектром ацилирующих агентов с получением такого же широкого спектра ацил-защищенных аминов.
Пример 6: Синтез 420-08
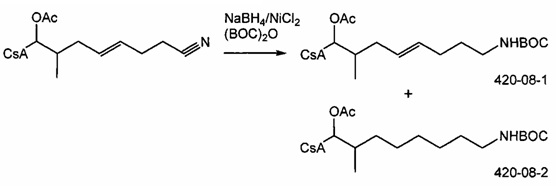
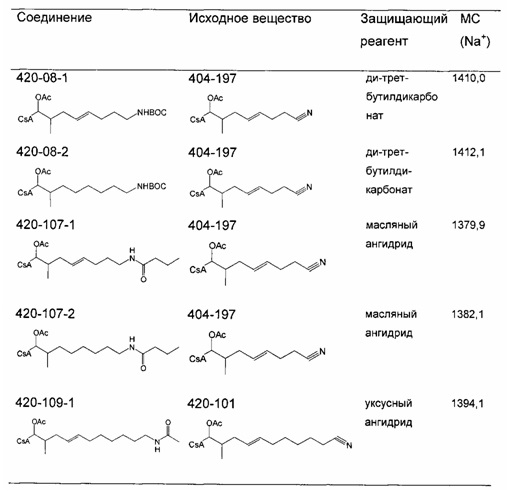
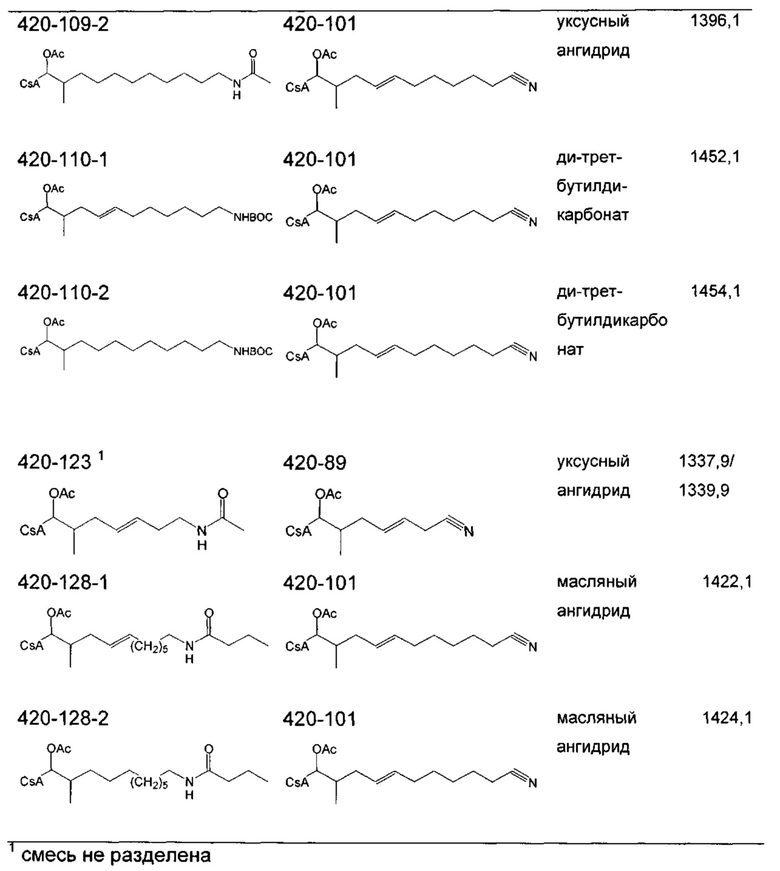
В качестве иллюстративного примера, 404-187 (0,257 ммоль) растворяли в 15 мл метанола и охлаждали до 0°C. Добавляли ди-трет-бутилдикарбонат (0,514 ммоль) и хлорид никеля (II) (0,025 ммоль) с получением прозрачного раствора. Борогидрид натрия (3,85 ммоль) добавляли порциями в течение 1 часа. Полученную смесь перемешивали при комнатной температуре в течение ночи. Дополнительный борогидрид натрия (1,95 ммоль) добавляли при 0°C и перемешивание продолжали в течение 3 часов при комнатной температуре. ВЭЖХ показала смесь 420-08-1 (карбаматное соединение) и 420-08-2 (карбаматное соединение с восстановленной двойной связью). Реакционную смесь перемешивали в течение 30 минут с диэтилентриамином (0,257 ммоль) и затем концентрировали в вакууме. Остаток растворяли в 75 мл EtOAc, промывали 20 мл насыщенного раствора NaHCO3 и сушили над Na2SO4. Растворитель удаляли в вакууме. Неочищенный продукт очищали с помощью препаративной ВЭЖХ.
Следующие соединения являются дополнительными примерами соединений, которые могут быть синтезированы посредством реакции 6.
Снятие защиты с амина
ВОС-защищенный амин (карбамат) можно превратить в свободный амин посредством кислотного гидролиза с использованием трифторуксусной кислоты (TFA).
Реакция 7:
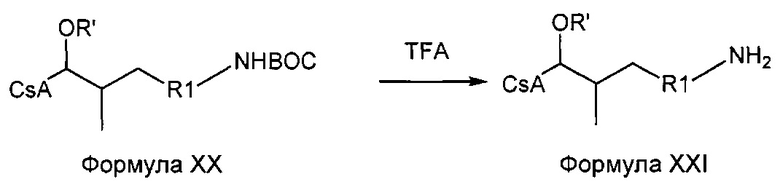
где R1 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, и R' представляет собой либо водород, либо ацетильную группу.
Пример 7: Синтез 420-23
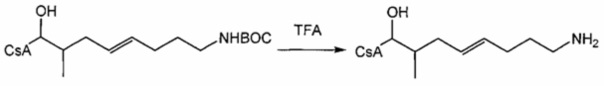
В качестве иллюстративного примера, 420-17 (0,026 ммоль) растворяли в 4 мл безводного дихлорметана и 2 мл трифторуксусной кислоты при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли 20 мл дихлорметана. Реакционную смесь промывали H2O и насыщенным раствором NaHCO3 и сушили над Na2SO4. Растворитель удаляли и сырой продукт очищали с помощью препаративной ВЭЖХ.
Следующие соединения являются дополнительными примерами соединений, которые могут быть синтезированы посредством реакции 7:
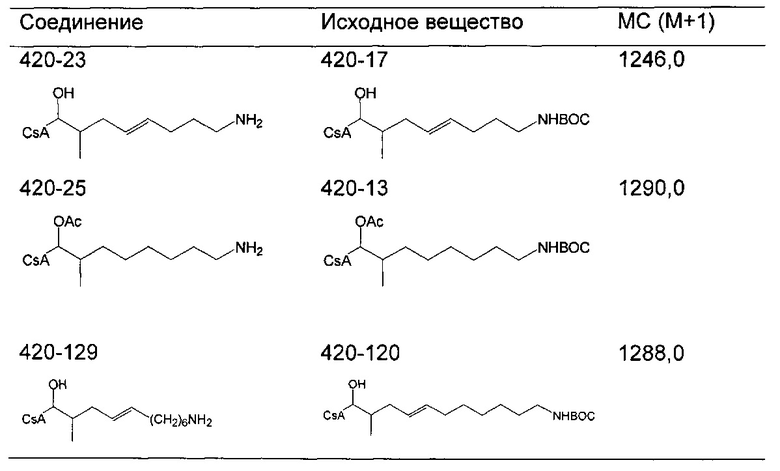
Защита аминогруппы
Свободные аминогруппы можно защищать с использованием широкого спектра защитных групп с использованием известных методов. По сравнению с восстановительным введением, начиная с нитрила, доступен более широкий диапазон защитных агентов. Вместе реакции 7 и 8 обеспечивают альтернативный путь для реакции 6 для получения ацил-защищенных аминосоединений.
Реакция 8:
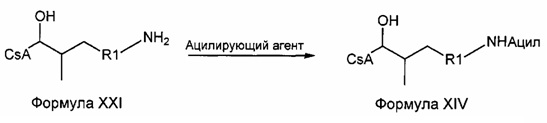
где ацил представляет собой любой из ВОС, ацетила или бутирила, ацилирующий агент представляет собой любой из ди-трет-бутилдикарбоната, уксусного ангидрида и масляного ангидрида, специалистам в данной области техники будет понятно, что можно применять широкий спектр ацилирующих агентов, включая дикарбонаты, ангидриды и ацилгалогениды с получением широкого спектра ацил-защищенных аминов, и R1 представляет собой насыщенную или ненасыщенную линейную или разветвленную алифатическую группу.
Пример 8: Синтез 420-27
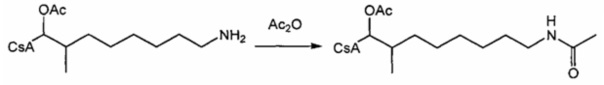
В качестве иллюстративного примера, 420-25 (0,039 ммоль) растворяли в 3 мл безводного пиридина в атмосфере азота. Реакционную смесь охлаждали до 0°C и добавляли уксусный ангидрид (0,59 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в вакууме и остаток растворяли в 25 мл EtOAc. Реакционную смесь промывали 2×10 мл 1 М HCl, 2×10 мл насыщ. раствором NaHCO3 и 10 мл солевого раствора, и сушили над Na2SO4. Растворитель удаляли в вакууме с получением продукта в виде бесцветного твердого вещества.
Снятие защиты с альдегида
1,3-диоксолановый фрагмент превращают в альдегидную функцию посредством кислотного гидролиза.
Реакция 9 и Пример 9: Синтез 404-47
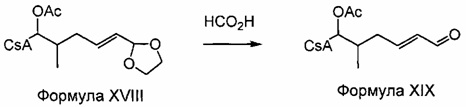
В качестве иллюстративного примера, раствор 404-33 (0,246 ммоль) в 20 мл муравьиной кислоты перемешивали при комнатной температуре в течение 45 минут. Сто мл ледяной воды и 200 мл насыщ. раствора NaHCO3 медленно добавляли к реакционной смеси (сильное пенообразование). Реакционную смесь экстрагировали 2×150 мл EtOAc. Объединенные экстракты промывали насыщ. раствором NaHCO3, водой и солевым раствором и сушили над Na2SO4. Растворитель удаляли и продукт сушили в вакууме.
Восстановление нитрогруппы
Ароматическое нитросоединение восстанавливают до анилина посредством каталитического гидрирования. Указанная реакция приводит к восстановлению двойной связи.
Реакция 10 и Пример 10: Синтез 404-120
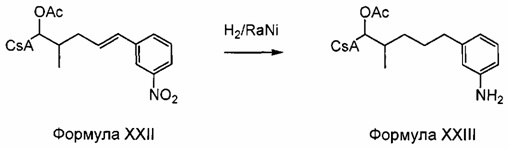
В качестве иллюстративного примера, 404-89 (0,13 ммоль) растворяли в 2 мл этанола и никеля Ренея (0,18 г, 50% H2O, 3 раза промывали этанолом, а затем суспендировали в 2 мл этанола) и добавляли 0,1 мл уксусной кислоты. Реакционную смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь фильтровали через цеолит и фильтрационный остаток промывали метанолом. Фильтрат упаривали досуха. Остаток растворяли в EtOAc, промывали раствором NaHCO3 и солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме. Неочищенный продукт очищали на силикагеле (гексан/ацетон 2:1).
Синтез амида
Амиды получают из карбоновых кислот посредством реакции амина с соответствующим хлорангидридом кислоты (реакция 11). Синтез также можно проводить непосредственно из кислоты с использованием соответствующих реагентов сочетания, таких как DCC и HOBt (реакция 12).
Реакция 11:
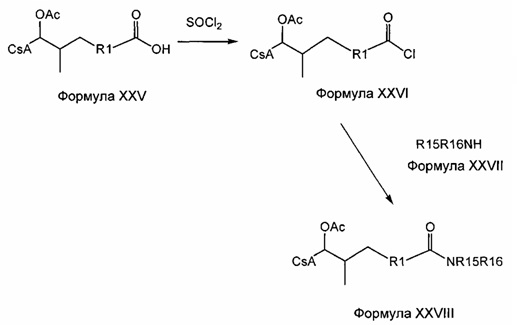
где R1 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, R15 и R16 независимо представляют собой водород или насыщенную, или ненасыщенную, линейную или разветвленную алифатическую цепь, или где NR15R16 вместе образуют морфолинильный фрагмент.
Пример 11: Синтез 404-85
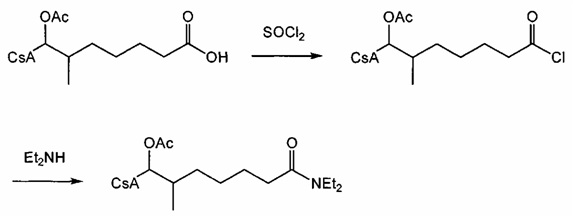
В качестве иллюстративного примера, 365-73 (0,04 ммоль) и тионилхлорида (68 ммоль) смешивали в атмосфере азота и нагревали с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали и концентрировали досуха. Добавляли 20 мл толуола и реакционную смесь снова концентрировали досуха (2 раза). Остаток растворяли в 5 мл безводного толуола и диэтиламина (0,48 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли 5 мл H2O и смесь экстрагировали 20 мл этилацетата. Экстракт промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме и неочищенный продукт очищали на силикагеле (гексан/ацетон 3:1).
Следующие соединения являются дополнительными примерами соединений, которые могут быть синтезированы посредством реакции 11:
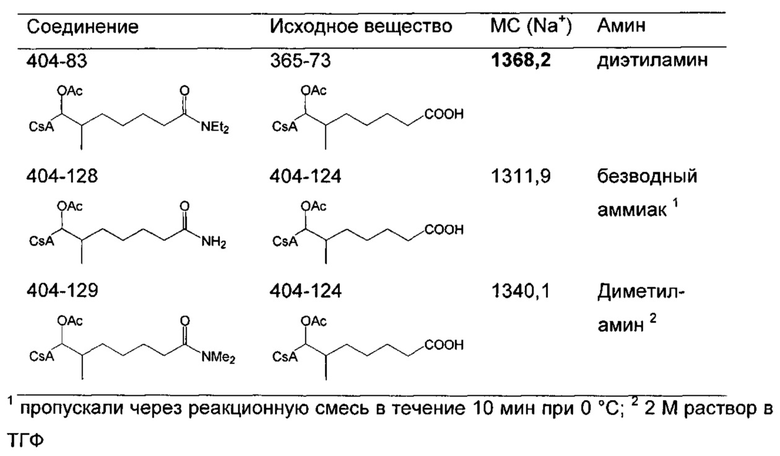
Реакция 12:

где R1 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, R15 и R16 независимо представляют собой водород или насыщенную, или ненасыщенную, линейную или разветвленную алифатическую цепь или где NR15R16 вместе образует морфолинильный фрагмент.
Пример 12: Синтез 420-104
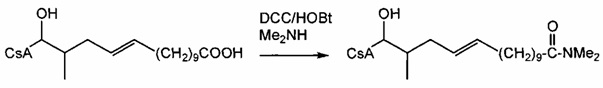
В качестве иллюстративного примера, 420-98 (0,078 ммоль) растворяли в 10 мл безводного дихлорметана в атмосфере азота. Дициклогексилкарбодиимид (DCC, 0,117 ммоль) и гидрат 1-гидроксибензотриазола (HOBt, 0,078 ммоль) добавляли при 0°C и смесь перемешивали в течение 15 минут. Добавляли диметиламин (0,78 ммоль) с получением прозрачного, бесцветного раствора. Охлаждающую баню удаляли через 15 минут и перемешивание продолжали при комнатной температуре в течение 5 дней. Реакционную смесь переносили в делительную воронку и добавляли 20 мл дихлорметана и 10 мл 0,5 М соляной кислоты. Органический слой отделяли, сушили над Na2SO4 и концентрировали досуха. Остаток растворяли в 10 мл ацетонитрила. Нерастворимое твердое вещество отфильтровывали и фильтрат концентрировали в вакууме. Неочищенный продукт очищали с помощью препаративной ВЭЖХ.
Следующие соединения являются дополнительными примерами соединений, которые могут быть синтезированы посредством реакции 12.
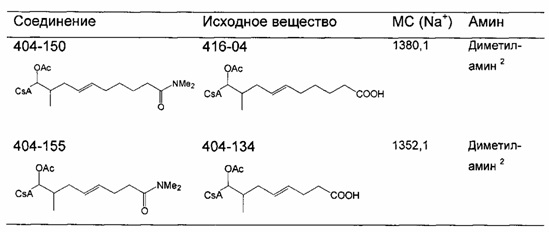
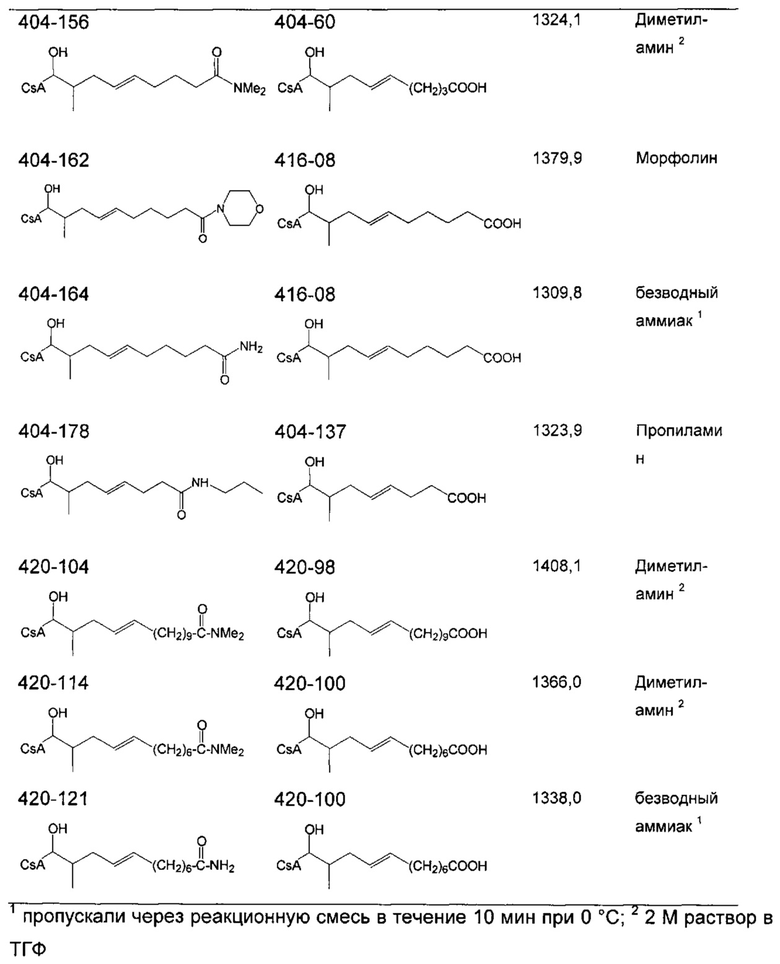
Этерификация
Сложные эфиры карбоновых кислот получают из соответствующих карбоновых кислот и спирта, либо с помощью кислотного катализа (реакция 13), либо реагентов сочетания (DCC и DMAP, реакция 14).
Реакция 13:
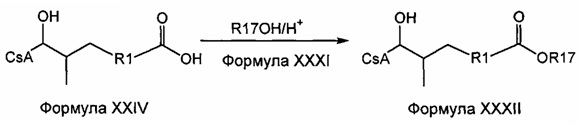
где R1 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, и R17 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, необязательно содержащую галогеновый или гидроксильный заместитель.
Пример 13: Синтез 404-171
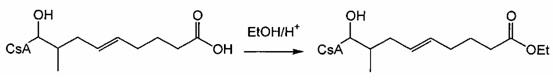
В качестве иллюстративного примера, смесь 404-60 (0,059 ммоль), 4 мл EtOH и 2 мкл конц. H2SO4 нагревали с обратным холодильником в течение 4 часов. Растворитель выпаривали и остаток растворяли в ацетонитриле. Неочищенный продукт очищали помощью препаративной ВЭЖХ.
Следующие соединения являются дополнительными примерами соединений, которые могут быть синтезированы посредством реакции 13.
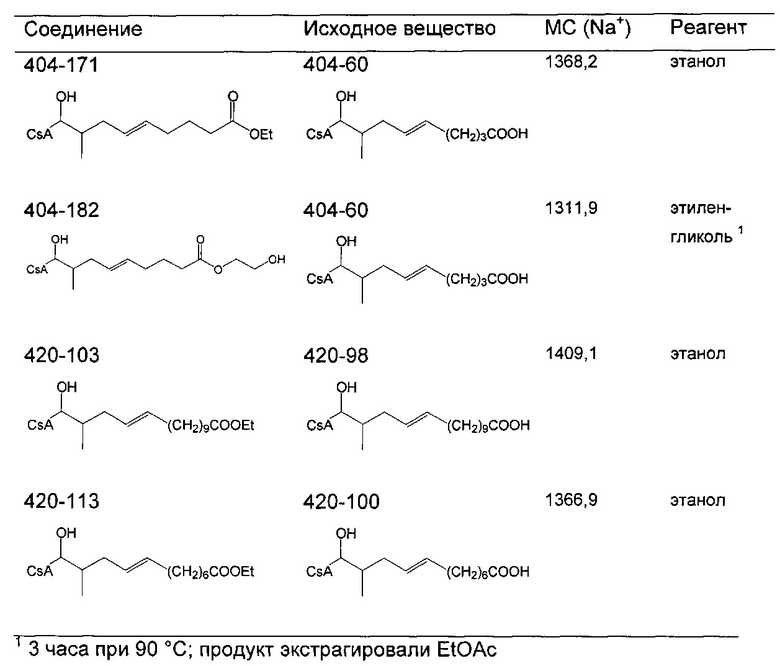
Реакция 14:
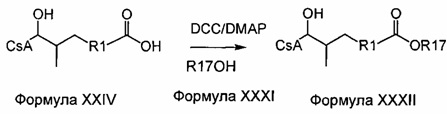
где R1 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, и R17 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, необязательно содержащую галогеновый или гидроксильный заместитель.
Пример 14: Синтез 420-24
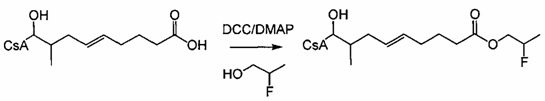
В качестве иллюстративного примера, 404-60 (0,053 ммоль) растворяли в 4 мл безводного дихлорметана и охлаждали до 0°C в атмосфере азота. Добавляли диметиламинопиридин (ДМАП, 0,005 ммоль), 2-фторпропанол (0,27 ммоль) и дициклогексилкарбодиимид (DCC, 0,058 ммоль) и реакционную смесь перемешивали в течение 15 мин при 0°C. Охлаждающую баню удаляли и перемешивание продолжали в течение ночи при комнатной температуре. Добавляли 20 мл ДХМ, затем реакционную смесь промывали H2O и выпаривали досуха. Остаток растворяли в 10 мл ацетонитрила и фильтровали. Фильтрат концентрировали в вакууме. Неочищенный продукт очищали с помощью препаративной ВЭЖХ.
Спирты
Помимо прямого синтеза в реакции Виттига, спирты получают с помощью ряда реакций. Восстановление карбонильной группы борогидридом натрия приводит к получению первичных (начиная с альдегида) или вторичных (начиная с кетона) спиртов, соответственно.
Окисление двойной связи посредством метода гидроборирования может привести к получению смеси изомеров. Реакция протекает преимущественно в анти-Марковниковой ориентации. В случае концевым олефином первичный спирт является основным продуктом.
Олефин может быть преобразован в диол посредством окисления перекисью водорода.
Реакция карбонильного соединения с реагентом Гриньяра приводит к получению вторичного (начиная с альдегида) и третичного (начиная с кетона) спирта. Данный способ позволяет удлинить углеродную цепь.
Реакция 15:
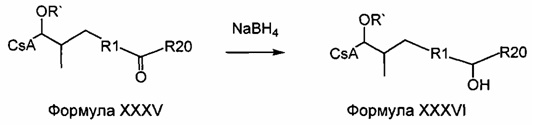
где R1 представляет собой Н или ацетил, R1 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, и R20 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь.
Реакция 15: Синтез 404-98
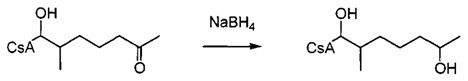
В качестве иллюстративного примера, 404-61 (0,0365 ммоль) растворяли в 4,5 мл безводного этанола в атмосфере азота. Борогидрид натрия (0,15 ммоль, суспендированного в 0,5 мл безводного EtOH) добавляли при 0°C и полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли дополнительный борогидрид натрия (0,08 ммоль) и перемешивание продолжали в течение ночи. Реакционную смесь гасили 5 мл 1 М HCl при охлаждении на ледяной бане и экстрагировали EtOAc. Экстракт промывали солевым раствором, сушили над Na2SO4 и концентрировали досуха. Неочищенный продукт очищали с помощью препаративной ВЭЖХ.
Следующие соединения являются дополнительными примерами соединений, которые могут быть синтезированы посредством реакции 15:
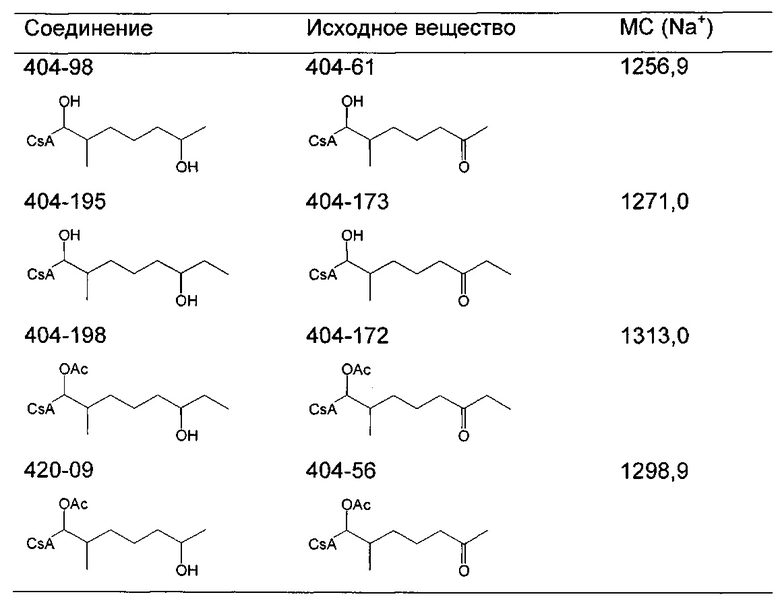
Реакция 16:
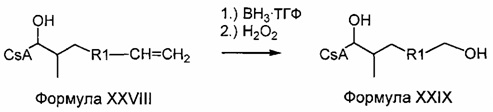
где R1 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь.
Пример 16: Синтез 420-28-1
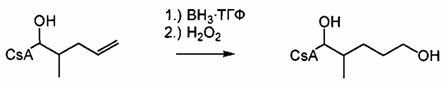
В качестве иллюстративного примера, 404-16 (0,081 ммоль) растворяли в атмосфере азота в 4 мл безводного ТГФ. Реакционную смесь охлаждали до 0°C и добавляли BH3⋅ТГФ (1 М раствор в ТГФ, 0,06 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. ВЭЖХ показала, что реакция не завершена. Добавляли дополнительный ВН3⋅ТГФ (0,5 ммоль) и перемешивание продолжали в течение 4 часов при комнатной температуре. Реакционную смесь охлаждали до 0°C и добавляли 1,0 мл 1 М раствора NaOH и 0,30 мл 30%-ного раствора перекиси водорода. Смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь экстрагировали 25 мл этилацетата. Экстракт промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали досуха. Продукт очищали с помощью препаративной ВЭЖХ.
Реакция 17:
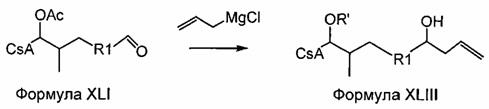
где R1 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, R' представляет собой либо водород, либо ацетильную группу.
Пример 17: Синтез 420-49
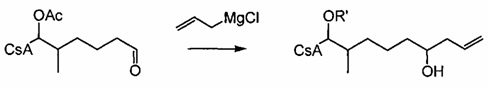
В качестве иллюстративного примера, 420-49 (0,037 ммоль) растворяли в атмосфере аргона в 5 мл безводного ТГФ. Реакционную смесь охлаждали до -70°C и добавляли хлорид аллилмагния (1 М раствор в ТГФ, 0,22 ммоль). Реакционную смесь перемешивали в течение 15 минут при -70°C и затем оставляли нагреваться до комнатной температуры. Через 90 минут реакционную смесь гасили насыщ. раствором NH4Cl. Реакционную смесь экстрагировали 25 мл этилацетата. Экстракт промывали солевым раствором, сушили над Na2SO4 и концентрировали досуха. Продукт очищали с помощью препаративной ВЭЖХ. Получали смесь ацетилированного и деацетилированного соединения.
Реакция 18:
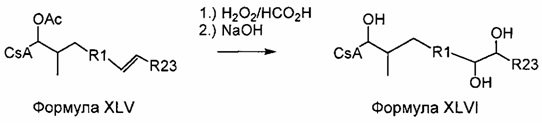
где R1 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь, и R23 представляет собой насыщенную или ненасыщенную, линейную или разветвленную алифатическую цепь.
Пример 18: Синтез 404-126
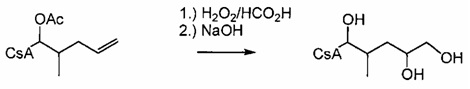
В качестве иллюстративного примера, 404-16 (0,054 ммоль) растворяли в 1 мл муравьиной кислоты и перекиси водорода (30% водный раствор, 0,52 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и затем концентрировали досуха. Остаток растворяли в 25 мл EtOAc, промывали насыщ. раствором NaHCO3 и сушили над Na2SO4. Растворитель удаляли в вакууме. Реакционную смесь переносили в 9 мл ТГФ и 3 мл 1 М NaOH и перемешивали в течение 4 часов при комнатной температуре. Растворитель удаляли и остаток распределяли между 25 мл этилацетата и 5 мл H2O. Органический слой промывали солевым раствором и сушили над Na2SO4. Растворитель выпаривали и неочищенный продукт очищали с помощью препаративной ВЭЖХ.
Пример 19: Модификация аминокислоты 3
CsA подвергали замещению на АК3 как описано ниже. Реакция с избытком LDA (диизопропиламид лития) приводила к получению гексалитиопроизводного, содержащего четыре звена азаенолата лития, а также блок алкоксида лития на боковой цепи аминокислоты 1 и звено енолята лития на АК3 соответственно. Последующее взаимодействие с подходящим электрофилом позволяет получить продукты замещения на остатке АК3 саркозин). Подходящие электрофилы представляют собой, например, алкилгалогениды, альдегиды, диоксид углерода и алкилдисульфиды (Таблица 1). Можно получить оба D и L эпимера, с относительными соотношениями в зависимости от условий реакции. Путь А (см. ниже) приводит преимущественно к получению D продукта, в то время как путь В (добавление избытка LiCl) приводит к получению смеси обоих эпимеров.
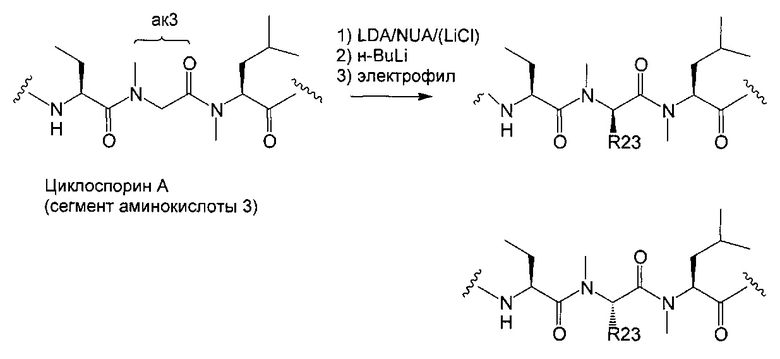
Пример 19: Реакция замещения на АК3 Циклоспорина А. Получили D и L стереоизомеры.
Путь A: [D-MeSar]3-CsA
В высушенную в сушильной печи колбу в атмосфере аргона загружали в 160 мл безводного ТГФ и диизопропиламина (2,07 мл, 14,8 ммоль). Раствор охлаждали до -78°C и добавляли н-бутиллитий (2,5 М в гексане, 5,4 мл, 13,5 ммоль). После перемешивания в течение 30 минут, добавляли CsA (2,40 г, 2,0 ммоль, растворенный в 40 мл безводного ТГФ). Реакционную смесь перемешивали в течение 1 часа при -78°C. Добавляли дополнительный н-бутиллитий (3,2 мл, 8,0 ммоль) с последующим добавлением метилиодида (1,25 мл, 20,0 ммоль). Перемешивание продолжали при -78°C в течение 1,5 часов, и затем реакционную смесь оставляли нагреваться до комнатной температуры в течение дополнительных 1,5 часов. Добавляли 20 мл H2O и удаляли ТГФ в вакууме. Добавляли дополнительные 50 мл H2O и проводили экстракцию 150 мл EtOAc. Экстракт промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме и неочищенный продукт очищали на силикагеле (гексан/ацетон 3:1). Выход: 0,74 г (0,61 ммоль, 30%).
Путь В: [MeSar]3-CsA
В сухую 100 мл колбу в атмосфере аргона загружали 7,5 мл безводного ТГФ и диизопропиламина (0,46 мл, 3,3 ммоль). Раствор охлаждали до 0°C и добавляли н-бутиллитий (1,32 мл, 2,5 М раствор в гексане, 3,3 ммоль). Реакционную смесь перемешивали в течение 20 минут при 0°C и затем охлаждали до -78°C. Получали раствор CsA (601 мг, 0,5 ммоль) и хлорида лития (636 мг, 15 ммоль) в 12 мл безводного ТГФ и охлаждали его до -78°C в атмосфере аргона. Затем раствор LDA переносили в указанную смесь через канюлю. Реакционную смесь перемешивали при -78°C в течение 2 часов. Добавляли дополнительный н-бутиллитий (1,20 мл, 3,0 ммоль), с последующим добавлением метилйодида (0,62 мл, 10 ммоль). Смесь оставляли нагреваться до -20°C и перемешивали при указанной температуре в течение 3 часов. Реакционную смесь оставляли нагреваться до комнатной температуры, гасили насыщенным раствором NH4Cl, экстрагировали EtOAc (2×20 мл), промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме и неочищенный продукт очищали на силикагеле (гексан/ацетон 3:1). Выход: [L-MeAla3]-CsA: 302 мг (0,25 ммоль, 50%). [D-MeAla3]-CsA: 76 мг (0,06 ммоль, 12%).


Примеры 20 и 21, приведенные ниже, являются общими примерами химических реакций, позволяющих синтезировать требуемые соединения, модифицированные по аминокислоте 1 и 3 CsA с использованием реагентов, которые обладают необходимыми химическими свойствами, и специалисту в данной области будет понятно, что некоторые реагенты можно заменить.
Пример 20: Модификация АК1 алкилированного CsA
Пример 20 описывает путь синтеза для введения заместителей в положение 3CsA перед модификацией боковой цепи АК1. После 3-алкилирования, в результате двухстадийной процедуры получают ацетилированный альдегид (соединение 3 в приведенном ниже примере), который является подходящим субстратом для модификации в 1-положении посредством реакции Виттига. Указанный способ позволяет ввести в боковую цепь АК1 остатки, которые обладают ограниченной стабильностью в условиях реакции, используемой на стадиях 1-3, такие как сильные основания и окислители.
Дополнительные примеры соединений, полученных с помощью указанной последовательности, приведены в таблице 2.
Стадия 1: алкилирование боковой цели АК3
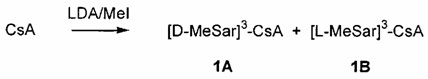
Синтез проводят в соответствии со способом А или В, соответственно, как описано выше.
Стадия 2: Ацетилирование гидроксигруппы на боковой цели АК1
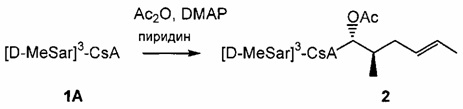
В высушенную в сушильной печи колбу в атмосфере азота загружали [D-MeSar]3-CsA (1,84 г, 1,51 ммоль), N,N-диметиламинопиридин (19 мг, 0,15 ммоль) и 20 мл безводного пиридина, с последующим добавлением уксусного ангидрида (10 мл, 0,1 моль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь выливали в 100 мл ледяной воды и перемешивали до расплавления льда. Твердое вещество собирали фильтрованием и сушили на воздухе. Твердое вещество растворяли в 50 мл EtOAc и промывали 1 М HCl (2 раза), насыщ. раствором NaHCO3 и солевым раствором. Органическую фазу высушивали над Na2SO4 и выпаривали. Неочищенный продукт очищали на силикагеле (смесь гексан/EtOAc/МеОН 10:10:0,5).
Стадия 3: Образование альдегида
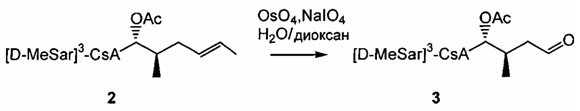
В колбу, содержащую соединение 2 (800 мг, 0,636 ммоль), добавляли 10 мл диоксана и 10 мл H2O. Добавляли NaIO4 (544 мг, 2,54 ммоль) и OsO4 (7,9 мМ раствора в смеси вода/диоксан 1:1, 4,05 мл, 32 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли 75 мл H2O и реакционную смесь экстрагировали 3×25 мл EtOAc. Экстракты промывали водой, насыщ. раствором NaHCO3, водой и солевым раствором (25 мл каждого) и сушили над MgSO4. Растворитель удаляли в вакууме и неочищенный продукт очищали на силикагеле (гексан/EtOAc, 3:1).
Стадия 4: реакция Виттига
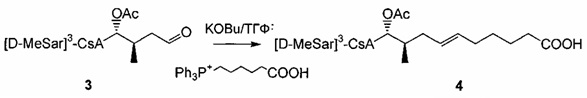
В высушенную в сушильной печи колбу в атмосфере аргона загружали бромид фосфония трифенил-6-гексановой кислоты (90 мг, 0,195 ммоль) и 5 мл безводного ТГФ. Трет-бутоксид калия (1 М раствор в ТГФ, 0,39 мл, 0,39 ммоль) добавляли при 0°C и указанный раствор перемешивали в течение 30 мин с получением ярко-оранжевого цвета. Соединение 3 (81 мг, 0,065 ммоль, растворенное в 1 мл безводного ТГФ) по каплям добавляли к реакционной смеси и перемешивание продолжали при комнатной температуре в течение ночи. Реакционную смесь гасили насыщ. раствором NH4Cl и экстрагировали с помощью EtOAc. Экстракт промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме и неочищенный продукт очищали на силикагеле (толуол/ацетон 3:1).
Стадия 5: Деацилирование
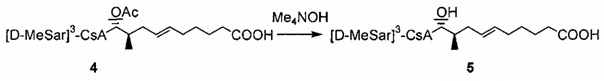
Соединение 4 (30 мг, 0,022 ммоль) растворяли в 2 мл метанола и 0,5 мл воды и добавляли пентагидрат гидроксида тетраметиламмония (12 мг, 0,066 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение нескольких дней, до тех пор, пока ВЭЖХ не подтвердила завершение снятия защиты. Реакционную смесь подкисляли до pH 2 с помощью 1 М HCl и концентрировали в вакууме. Остаток растворяли в EtOAc, промывали водой и сушили над Na2SO4. Растворитель выпаривали и неочищенный продукт очищали с помощью препаративной ВЭЖХ.
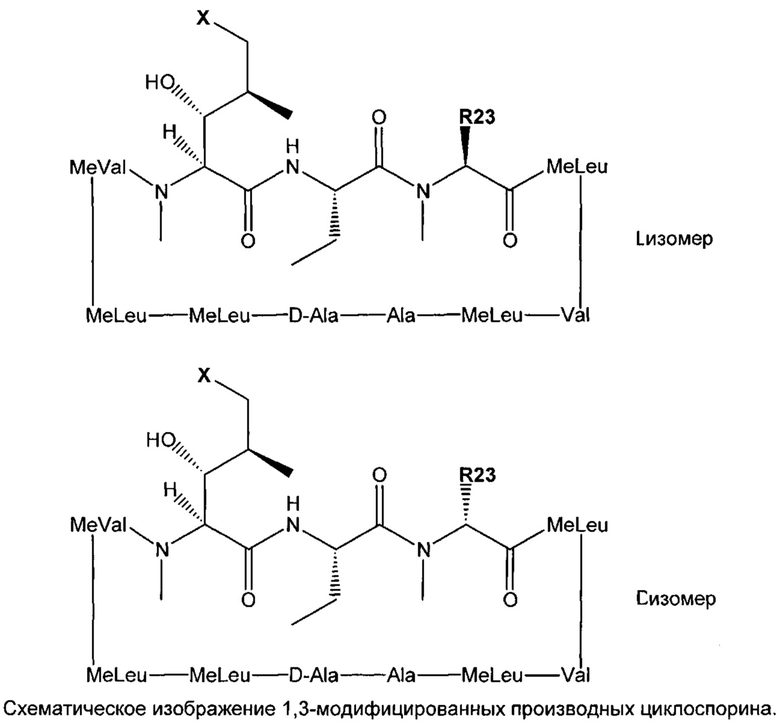
Используя способ согласно примеру 20, получали следующие соединения, которые являются дополнительными примерами соединений, которые могут быть синтезированы (X и Y по отношению к указанному выше схематическому изображению; и ссылка R в X является указанием на место присоединения к структуре АК1 в CsA).
Таблица 2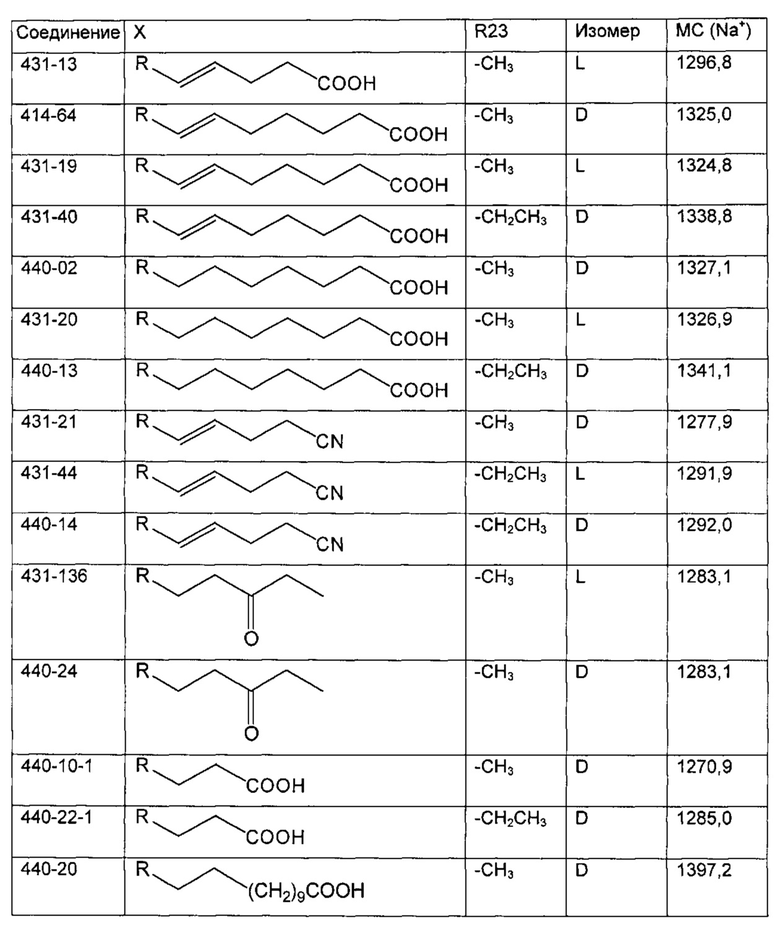
Алкилирование АК1 модифицированных соединений
В результате Реакции 21 вводили заместители к остатку АК3 соединений, ранее модифицированных по боковой цепи АК1. В дополнение к группам, доступным посредством Реакции 19, указанный путь позволяет ввести в АК3 заместители, которые нестабильны в условиях реакции, используемых в Реакции 20, например, остаток тиометила может подвергаться окислению при образовании альдегида на стадии 3 указанного способа.
Пример 21
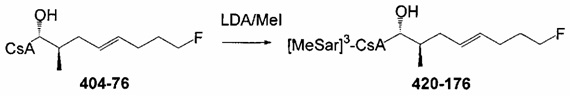
В сухую 25 мл колбу в атмосфере аргона загружали 1,5 мл безводного ТГФ и диизопропиламина (87 мкл, 0,62 ммоль). Раствор охлаждали до 0°C и добавляли н-бутиллитий (2,5 М в гексане, 0,25 мл, 0,62 ммоль). Смесь перемешивали в течение 20 минут при 0°C и затем охлаждали до -70°C. Прозрачный раствор LDA переносили в раствор 404-76 (118 мг, 0,095 ммоль) и хлорида лития (120 мг, 2,84 ммоль) в 1,5 мл безводного ТГФ при -70°C. Перемешивание продолжали в течение 2 часов при -70°C. Добавляли дополнительный н-бутиллитий (0,23 мл, 0,58 ммоль), с последующим добавлением метилйодида (118 мкл, 1,89 ммоль). Реакционную смесь оставляли нагреваться до -20°C и выдерживали при этой температуре в течение ночи. Реакционную смесь гасили насыщ. раствором NH4Cl и экстрагировали с помощью EtOAc. Экстракт промывали солевым раствором соли, сушили над Na2SO4 и выпаривали досуха. Неочищенный продукт очищали на силикагеле (гексан/ацетон 3:1→2:1).
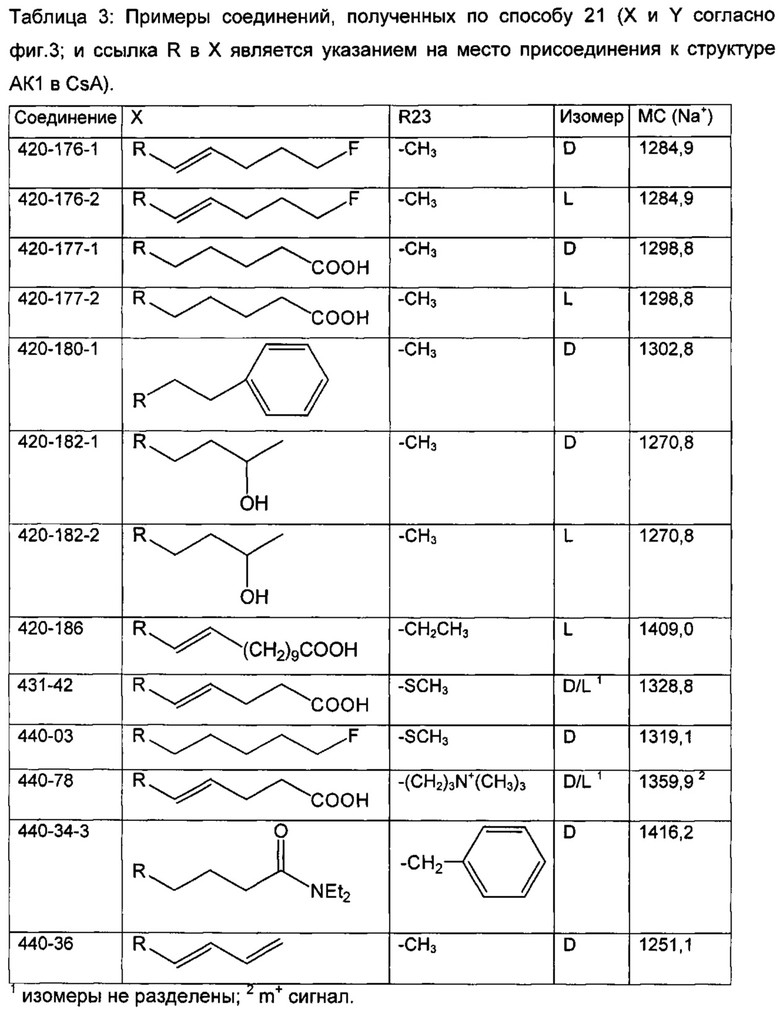
Дополнительные модификации функциональных групп в остатках АК1 (или АК3, соответственно) можно осуществить с получением различных производных соединений, таких как сложные эфиры, амиды, спирты и т.д. Насыщенные соединения можно получить посредством восстановления двойной связи в ходе реакции Виттига.
Пример 22: Образование амида из карбоновой кислоты - Синтез 440-08
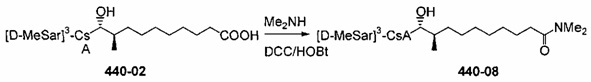
440-02 (48 мг, 0,037 ммоль) растворяли в атмосфере азота в 5 мл безводного дихлорметана и охлаждали до 0°C. Добавляли дициклогексилкарбодиимид (DCC, 11,6 мг, 0,056 ммоль) и 1-гидроксибензотриазол (HOBt, 5,0 мг, 0,037 ммоль) и смесь перемешивали в течение 15 минут при 0°C. Добавляли диметиламин (2 М раствор в ТГФ, 0,19 мл, 0,38 ммоль) и перемешивание продолжали при комнатной температуре в течение 3 дней. Реакционную смесь разбавляли 20 мл дихлорметана и промывали 15 мл 0,5 М HCl. Органическую фазу сушили над Na2SO4 и затем выпаривали досуха. Неочищенную смесь очищали с помощью препаративной ВЭЖХ.
Пример 23: Образование сложного эфира - Синтез 440-31
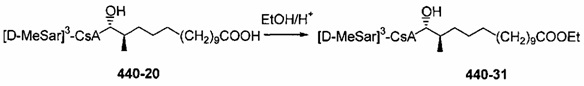
440-20 (30 мг, 0,022 ммоль) растворяли в 4 мл безводного этанола и 2 мкл конц. H2SO4. Реакционную смесь кипятили с обратным холодильником в течение 3 часов и затем охлаждали до комнатной температуры. Реакционную смесь сушили досуха. Неочищенный продукт очищали с помощью препаративной ВЭЖХ.
Пример 24: Образование амида из нитрильного соединения (обратный амид) - Синтез 440-15
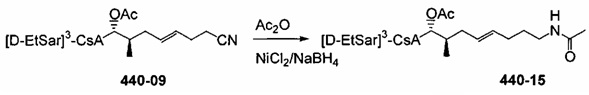
В 50 мл колбу в атмосфере азота загружали 440-09 (80 мг, 0,061 ммоль) и 5 мл МеОН. Реакционную смесь охлаждали до 0°C и добавляли Ni(II)Cl2⋅6H2O (1,4 мг, 0,006 ммоль) и уксусный ангидрид (19 мкл, 0,20 ммоль). Борогидрид натрия (104 мг, 2,75 ммоль) добавляли двумя порциями с интервалом 2 часа. Затем реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. После завершения реакции добавляли 7 мл 1 М соляной кислоты. Раствор концентрировали в вакууме примерно до половины его первоначального объема. Полученную смесь экстрагировали этилацетатом, экстракт промывали насыщ. раствором NaHCO3 и солевым раствором, и сушили над Na2SO4. Растворитель удаляли в вакууме. Продукт, который содержит некоторое количество насыщенного соединения, использовали на следующей стадии без дополнительной очистки.
Пример 25: Синтез 440-25
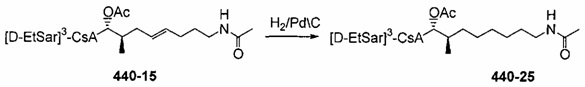
440-15 (83 мг, 0,061 ммоль) растворяли в 10 мл безводного этанола. Добавляли палладий (10 мас. % на угле, 8 мг) и 3-4 капли уксусной кислоты. Реакционную смесь гидрировали при атмосферном давлении и при комнатной температуре в течение нескольких дней, пока ВЭЖХ не подтверждала завершение. Реакционную смесь фильтровали через цеолит и фильтрат выпаривали досуха. Неочищенный продукт очищали с помощью препаративной ВЭЖХ и затем подвергали стадии деацетилирования.
Пример 26: Синтез 440-32
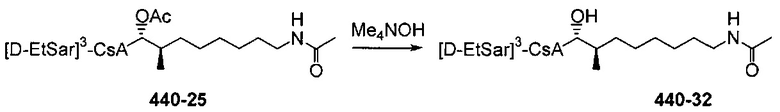
440-25 (41 мг, 0,03 ммоль) растворяли в 4 мл метанола и добавляли пентагидрат гидрохлорида тетраметиламмония (16 мг, 0,09 ммоль, растворенный в 1 мл H2O). Реакционную смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь концентрировали в вакууме. Добавляли 5 мл H2O и продукт экстрагировали EtOAc. Экстракт промывали солевым раствором, сушили над Na2SO4 и выпаривали досуха. Неочищенный продукт очищали с помощью препаративной ВЭЖХ.

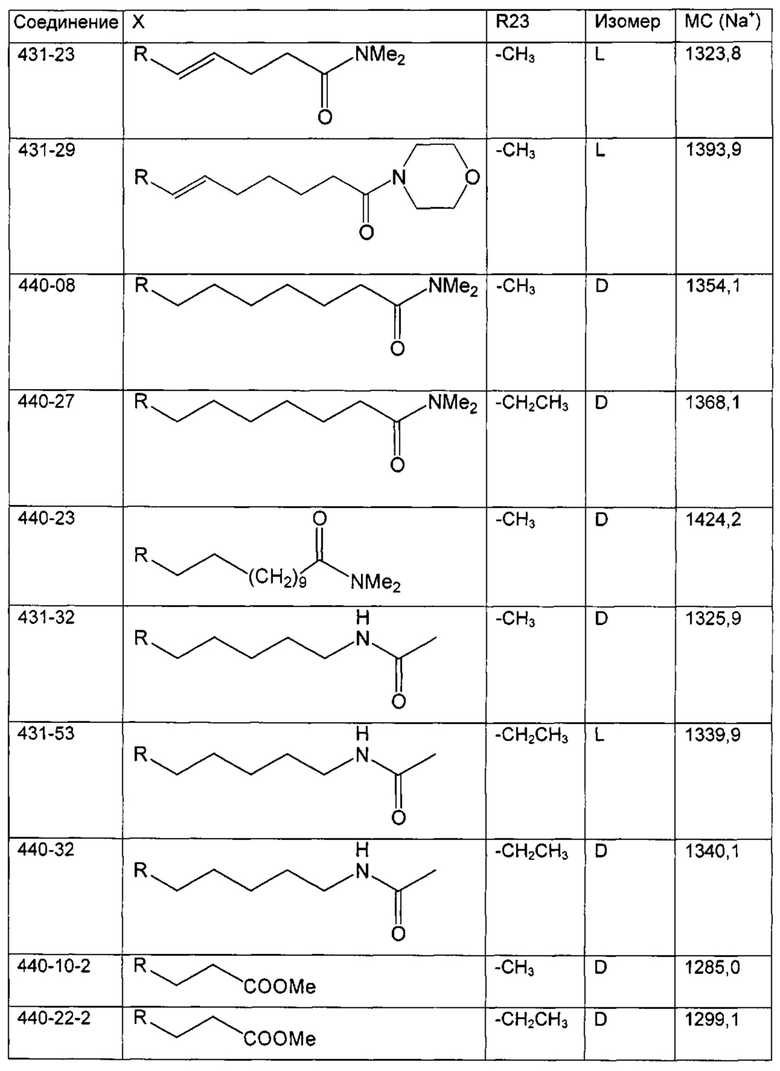

Анализ ингибирования изомеразы Циклофилина А
Для измерения ингибирующей активности 1,3-аналогов CsA согласно настоящему изобретению в отношении CyP-A использовали ферментативный анализ в соответствии с протоколом, описанным в научной литературе с незначительными изменениями. Анализ основан на способности CyP-A катализировать конформационное изменение в пролинсодержащих пептидах с цис- на транс-изомерую конформацию. Вкратце, пептидный субстрат, содержащий фрагмент нитроанилида помещали в реакционную смесь, содержащую CyP-A, исследуемое соединение (аналог CsA, CsA или диметилсульфоксидный носитель) и второй фермент, альфа-химотрипсин. Каждое исследуемое соединение тестировали при 10 концентрациях в трех или четырех повторностях. Пептид переходил из цис-конформации в транс-конформацию посредством как некаталитических, так и CyP каталитических процессов. Транс-изомер указанного пептида, но не цис-изомер, является субстратом для альфа-химотрипсина. Альфа-химотрипсин немедленно отщеплял нитроанилид от остальной части пептида и свободный нитроанилид накапливался со скоростью, пропорциональной к цис-транс-изомеризации. Поскольку свободный нитроанилид является окрашенным продуктом, его накопление количественно измеряли путем измерения его поглощательной способности с помощью спектрофотометра. Накопление нитроанилида измеряли в течение 6 минут, и константу скорости первого порядка для каждой реакции рассчитывали с использованием программного обеспечения GraphPad Prism. CyP-каталитические константы скорости для каждой реакции определяли путем вычитания некаталитической константы скорости (полученный из реакции без CyP-A) из общей константы скорости реакции. Графики каталитических констант скорости как функции от концентраций ингибитора демонстрируют активности соединений, определяемых значениями IC50.
ПОДРОБНЫЙ ПРОТОКОЛ
A. Пептид
Пептид для анализа представлял собой N-сукцинил-аланин-аланин-пролин-фенилаланин-п-нитроанилид. Его растворяли до концентрации 3 мМ в растворе трифторэтаноламина и хлорида лития (ТФЭ/LiCl). Свежий ТФЭ/LiCl готовили каждый день путем растворения хлорида лития в трифторэтаноламине до концентрации 17 мг/мл. После растворения LiCl, содержание воды в растворе ТФЭ/LiCl уменьшали путем добавления молекулярных сит, подвергнутых тепловой сушке, и осторожного перемешивания раствора в течение по меньшей мере 30 минут. Затем пептид растворяли в ТФЭ/LiCl, и раствор охлаждали до 4°С-8°С до начала анализа. Растворение пептида в сухом ТФЭ/LiCl способствовало нахождению большего количества пептида в цис-конформации в начале каждой реакции анализа. Анализ данных показал, что приблизительно 60% пептида в наших анализах начали как цис-изомеры, что согласуется с данными в научной литературе. В ферментативных реакциях пептид разбавляли в 20 раз до конечной концентрации 150 мкМ.
B. Исследуемые соединения
Исследуемые соединения состояли из CsA, аналогов CsA или диметилсульфоксида (ДМСО). Исходные растворы CsA и аналогов CsA были получены путем растворения в ДМСО до концентрации 10 мг/мл в стерильных пробирках для микроцентрифуги. Исходные растворы хранили при -20°C, когда они не использовались. Дополнительные разведения исследуемых соединений получали на каждый день анализа. ДМСО и CsA были исследованы в каждом эксперименте в качестве контрольного носителя и контрольного соединения, соответственно.
10 мг/мл исходных растворов CsA и аналогов CsA разбавляли ДМСО до 50 мкМ в микроцентрифужных пробирках на основе молекулярных масс указанных соединений. Девять 3-кратных разведений каждого соединения в ДМСО были получены в 96-луночных полистирольном планшете. Аликвоту раствора ДМСО или носителя ДМСО в отдельности разбавляли в 50 раз реакционным буфером (рецепт см. ниже), чтобы конечные концентрации CsA или аналогов CSA составляли 1000, 333, 111, 37, 12, 4,1, 1,4, 0,46, 0,15 и 0,05 нМ. Растворы реакционного буфера хранили при 4°C-8°C в течение по меньшей мере одного часа до анализа.
C. Реакционный буфер
Исходный раствор (солевой буфер) для реакционного буфера состоял из 50 мМ Hepes, 100 мМ хлорида натрия и 1 мг/мл человеческого сывороточного альбумина, доведенного до pH 8,0 с помощью гидроксида натрия. Солевой буфер хранили при 4°C, когда он не использовался. На каждой день анализа бычий альфа-химотрипсин растворяли в объеме солевого буфера до концентрации 1 мг/мл. Аликвоту раствора альфа-химотрипсина удаляли для использования в качестве некаталитического контрольного реакционного буфера. Рекомбинантный человеческий CyP-A добавляли к остатку раствора химотрипсина до концентрации 5 нМ. Раствор, содержащий альфа-химотрипсин и CyP-A, был обозначен как реакционный буфер и использован для получения реакционных растворов.
D. Протокол реакции
Все реакции для анализа проводили в холодильной камере при температуре от 4°C-8°C течение по меньшей мере 1 часа до анализов. Низкая температура была необходима для протекания реакций с достаточно медленной скоростью, чтобы провести измерения с имеющимся оборудованием. Измерительное устройство представляло собой микропланшет-ридер BMG Polarstar, настроенный на считывание оптической плотности при 405 нм. Реакции проводили в 96-луночных плоскодонных пенополистирольных планшетах для анализа. Каждый анализ состоял из 12 отдельных реакций в одном ряду планшета. Пептиды разделяли на аликвоты по 5 мкл на лунку с помощью одноканального дозатора в один ряд планшета, затем планшеты помещали в держатель микропланшет-ридера. Реакции начинали путем распределения 95 мкл реакционного буфера в каждую пептидсодержащую лунку с использованием 12-канального дозатора и тщательного перемешивания каждой реакционный смеси посредством повторного раскапывания для обеспечения равномерного растворения пептида. 12 реакций в каждом анализе были представлены следующим:
a) 10 реакций, представляющих по одному репликату для каждой их 10 концентраций исследуемого соединения (CyP-A в реакционном буфере);
b) 1 реакция с 5 мкл носителя в виде ДМСО (CyP-A в реакционном буфере);
c) 1 реакция с 5 мкл носителя в виде ДМСО (CyP-A отсутствует в реакционном буфере).
Записи поглощения начинали сразу же после смешивания. Примерно 15 секунд прошло с добавления реакционного буфера до первого показания OD405 вследствие времени смешивания и настройки прибора. Последующие показания были сделаны с 6-секундными интервалами в общей сложности 60 показаний в течение 360 секунд. Три или четыре реакции были проведены для каждого исследуемого соединения для получения повторностей данных.
Е. Анализ данных
Необработанные данные состояли из зависимого от времени увеличения OD405. В присутствии CyP-A и в отсутствие ингибитора пептид полностью превращался в транс-изомер в течение приблизительно 150 секунд, как показано на плато в OD405. Данные OD405 от времени были преобразованы в график с помощью программного обеспечения Graphpad Prism и преобразован с помощью экспоненциального уравнения, соответствующего одной фазе, для получения константы скорости первого порядка K для каждой реакции. В реакциях без CyP-A константа скорости полностью отражала спонтанную некаталитическую, термическую от цис- до транс-изомеризацию пептида и была обозначена как некаталитического константа скорости K0. В реакциях, содержащих CyP-A, изомеризация проходила как за счет некаталитического, так и ферментативного процесса. Таким образом, константа скорости K в CyP-A содержащих реакциях отражала сумму некаталитическими константы скорости K0 и каталитической константы скорости Kcat. Kcat рассчитывали путем вычитания К0 (полученной по реакции без CyP-A) из общей константы скорости K. Kcat обычно была в 3 раза выше чем K0 в реакциях с 5 нМ CyP-A, 150 мкМ пептидного субстрата и отсутствием ингибитора.
График Kcat от концентрации ингибитора был обработан с помощью сигмоидальной нелинейной регрессии зависимости доза-ответ, чтобы продемонстрировать потенциал ингибиторования. Программное обеспечение рассчитало значения ЕС50, которые отображают концентрации исследуемого 10 соединения, которые ингибируют Kcat на 50%. Для нормализации внутри экспериментальной вариабельности условий анализа, CsA был использован в каждом эксперименте в качестве контрольного соединения, и активность аналога CsA выражали как раз активность по сравнению с CsA на основе значений ЕС50. Например, ЕС50 аналога CsA, которое составляло 
В Таблице 5, приведенной на фиг.1А-С, показано ингибирование циклофилина А и иммунодепрессия аналогов CsA, модифицированных по положению 1 и по положениям 1 и 3 в соответствии с настоящим изобретением.
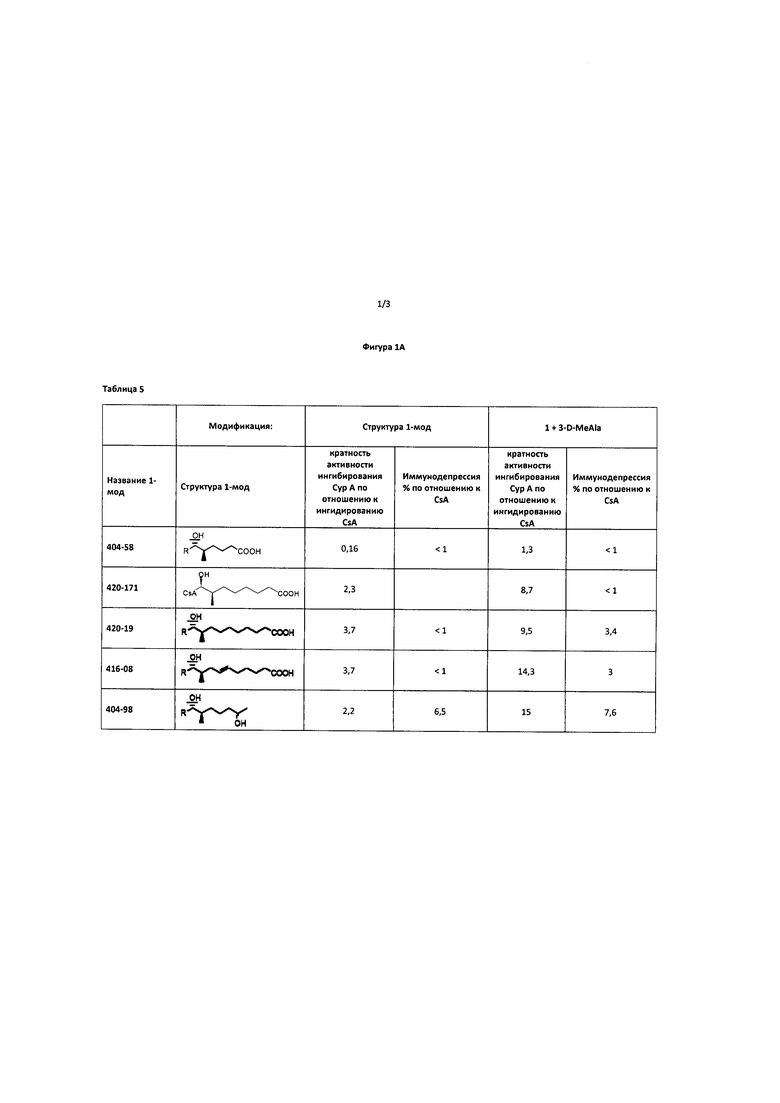
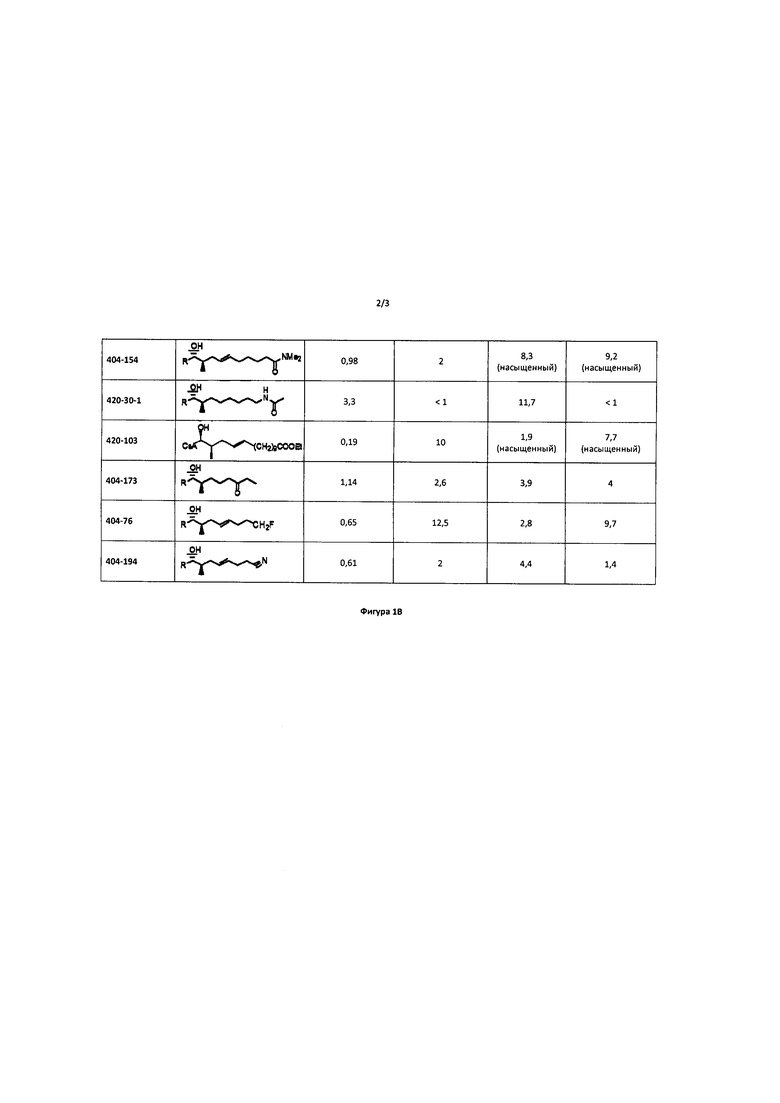
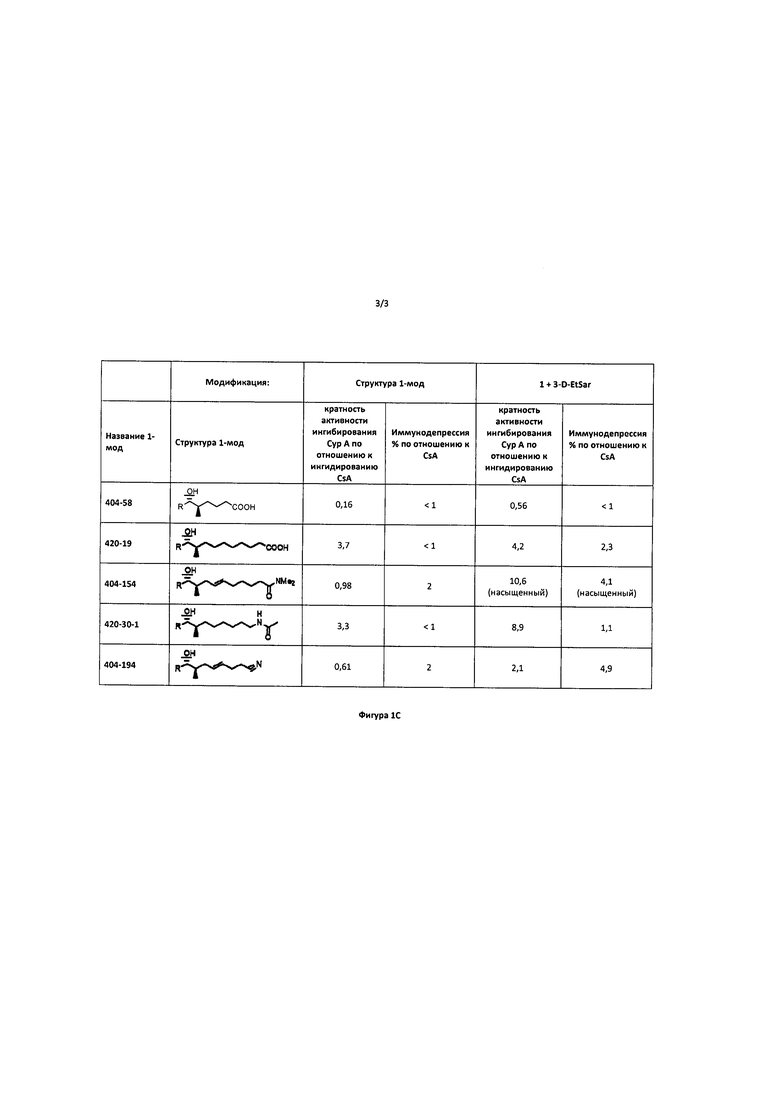
Изобретение относится к аналогам циклоспорина-А, содержащим модификации заместителей по положениям 1 и 3 аминокислот, согласно следующей Формуле (I). Предложенные соединения обладают сродством к циклофилину, включая циклофилин-А, и сниженной иммунодепрессивной активностью по сравнению с циклоспорином-А и его аналогами, модифицированными только по положению 1. 8 н. и 14 з.п. ф-лы, 1 ил., 5 табл., 26 пр.
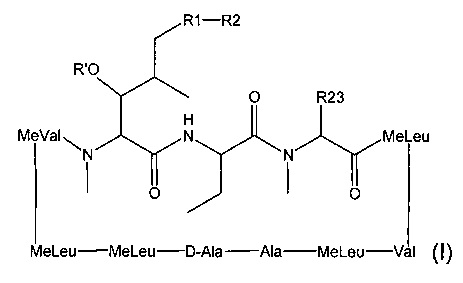
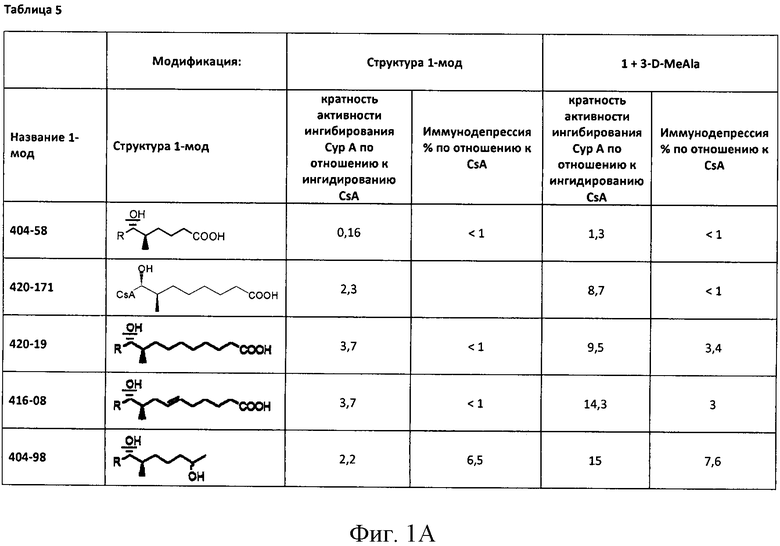
1. Соединение формулы L:
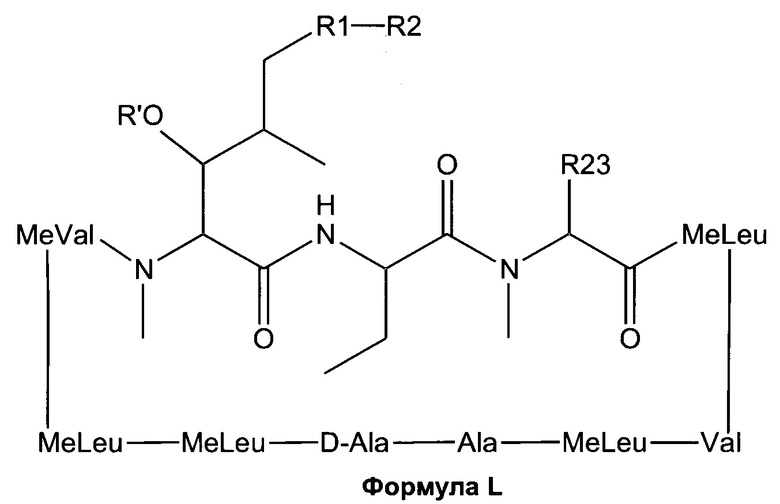
где a. R' представляет собой Н или ацетил;
b. R1 представляет собой насыщенную или ненасыщенную линейную алифатическую углеродную цепь длиной от 2 до 15 атомов углерода;
c. R2 выбран из группы, состоящей из:
i. незамещенного, N-замещенного или N,N-дизамещенного амида, где указанный N-замещенный или N,N-дизамещенный амид замещен алкилом длиной от 1 до 4 атомов углерода;
ii. N-замещенного или незамещенного ацил-защищенного амина, где указанный N-замещенный ацил-защищенный амин замещен алкилом длиной от 1 до 4 атомов углерода;
iii. карбоновой кислоты;
iv. N-замещенного или незамещенного амина, где указанный N-замещенный амин замещен алкилом длиной от 1 до 4 атомов углерода;
v. нитрила;
vi. сложного эфира, где алкильный фрагмент указанного сложного эфира имеет длину от 1 до 7 атомов углерода;
vii. кетона;
viii. гидрокси-, дигидрокси-, тригидрокси- или полигидроксиалкила, где указанный алкил имеет длину от 1 до 7 атомов углерода; и
ix. незамещенного фенила или фенила, замещенного заместителем, выбранным из группы, состоящей из галогена, карбоксила и алкоксикарбонила, где указанный алкокси-фрагмент имеет длину от 1 до 4 атомов углерода; и
х. насыщенной или ненасыщенной линейной алифатической углеродной цепи длиной от 1 до 15 атомов углерода, замещенной заместителем, выбранным из группы, состоящей из кетонов, гидроксилов, нитрилов, карбоновых кислот, сложных эфиров, 1,3-диоксоланов, галогенов и оксо; и
d. R23 представляет собой незамещенный метил или этил.
2. Соединение по п. 1, отличающееся тем, что R1-R2 выбран из группы, состоящей из:
i.  ;
;
ii.  ;
;
iii.  ;
;
iv. 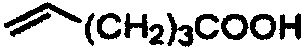 ;
;
v. 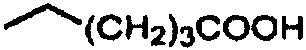 ;
;
vi.  ;
;
vii.  ;
;
viii. 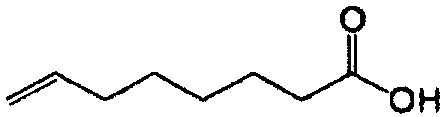 ;
;
ix.  ;
;
x. 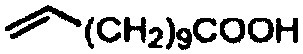 ;
;
xi. 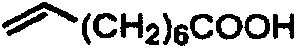 ;
;
xii. 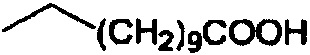 ;
;
xiii. 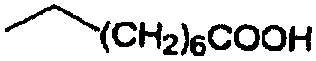 ;
;
xiv. 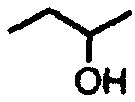 ;
;
xv. 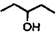 ;
;
xvi. 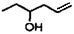 ;
;
xvii.  ;
;
xviii. 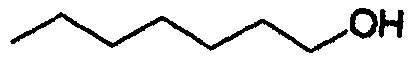 ;
;
xix. 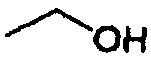 ;
;
xx. 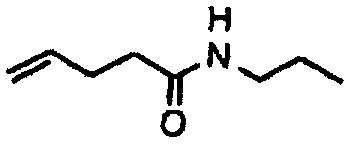 ;
;
xxi. 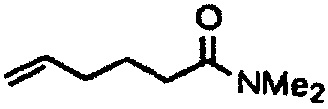 ;
;
xxii. 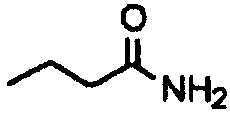 ;
;
xxiii. 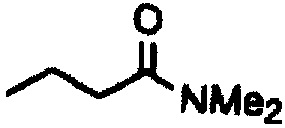 ;
;
xxiv. 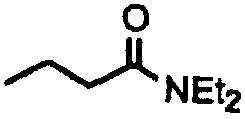 ;
;
xxv. 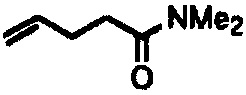 ;
;
xxvi.  ;
;
xxvii.  ;
;
xxviii. 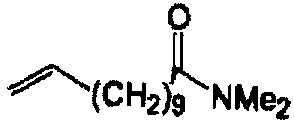 ;
;
xxix. 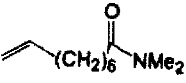 ;
;
xxx. 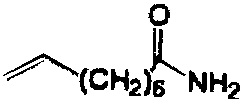 ;
;
xxxi.  ;
;
xxxii. 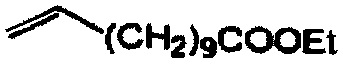 ;
;
xxxiii. 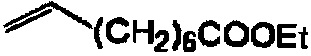 ;
;
xxxiv. 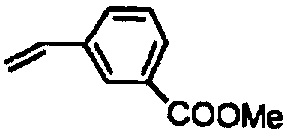 ;
;
xxxv.  ;
;
xxxvi.  ;
;
xxxvii.  ;
;
xxxviii.  ;
;
xxxix.  ;
;
xl.  ;
;
xli.  ;
;
xlii.  ;
;
xliii. 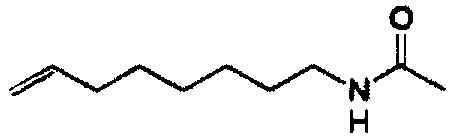 ;
;
xliv. 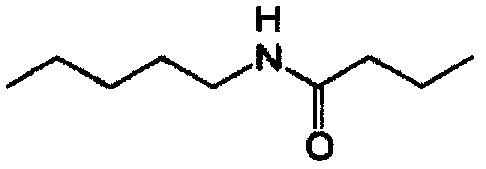 ;
;
xlv. 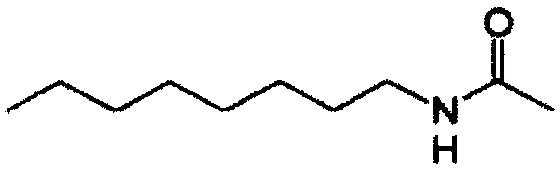 ;
;
xlvi. 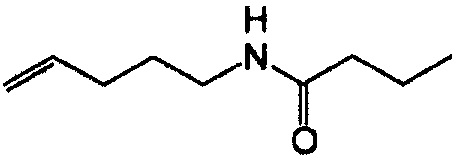 ;
;
xlvii.  ;
;
xlviii.  ;
;
xlix.  ;
;
I.  ;
;
Ii.  ;
;
Iii. 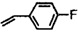 ;
;
Iiii. 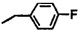 ;
;
Iiv. 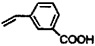 и
и
Iv. 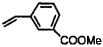 .
.
3. Соединение по п. 1, отличающееся тем, что R2 выбран из группы, состоящей из:
а. 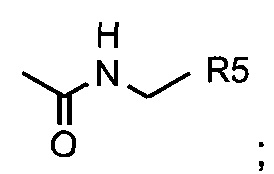
b. 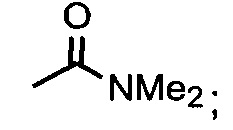
с. 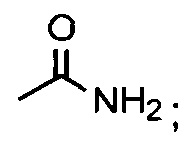
d. 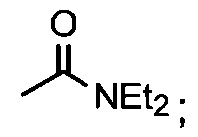
е. 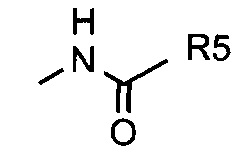
f. 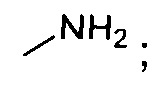
g. 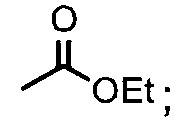
h. 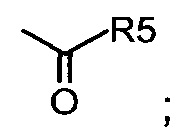
i. 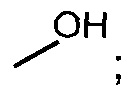
j. 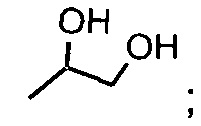
k. 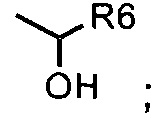
I. 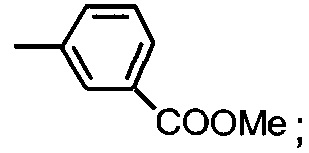
m. 
n. 
о.  и
и
p. 
где i. R5 представляет собой алкил с углеродной цепью длиной от 1 до 3 атомов углерода; и
ii. R6 представляет собой моногидроксилированную, дигидроксилированную, тригидроксилированную или полигидроксилированную насыщенную или ненасыщенную линейную алифатическую углеродную цепь длиной от 1 до 7 атомов углерода.
4. Соединение по п. 1, отличающееся тем, что R' представляет собой Н.
5. Соединение по п. 1, отличающееся тем, что R1-R2 содержит насыщенную или ненасыщенную линейную алифатическую углеродную цепь длиной от 2 до 5 атомов углерода, замещенную заместителем, выбранным из группы, состоящей из кетонов, гидроксилов, нитрилов, галогенов, оксо, карбоновых кислот, сложных эфиров и 1,3-диоксоланов.
6. Соединение по любому из пп. 1-5, отличающееся тем, что R23 выбран из группы, состоящей из:
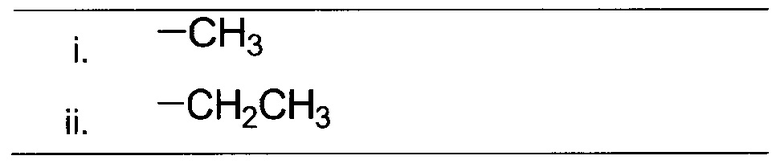
7. Соединение по п. 6, отличающееся тем, что R23 представляет собой этил и указанное соединение представляет собой D-эпимер, при этом хиральный центр указанного D-эпимера представляет собой атом углерода, к которому присоединен R23.
8. Соединение по п. 6, отличающееся тем, что R23 представляет собой метил и указанное соединение представляет собой D-эпимер, при этом хиральный центр указанного D-эпимера представляет собой атом углерода, к которому присоединен R23.
9. Соединение по п. 7 или 8, отличающееся тем, что
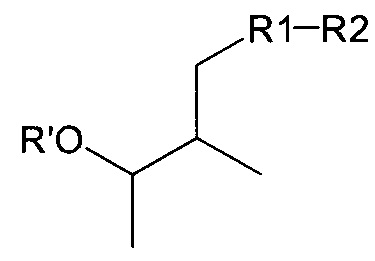
выбран из группы, состоящей из:
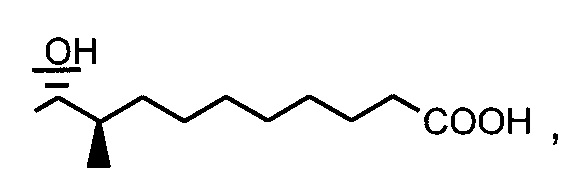
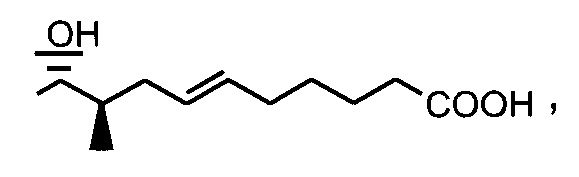
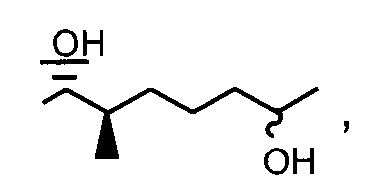
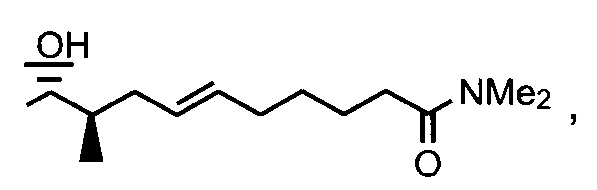
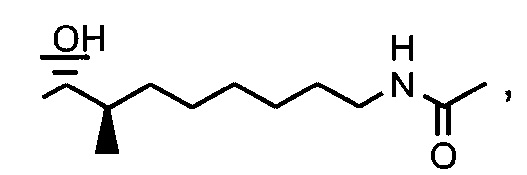
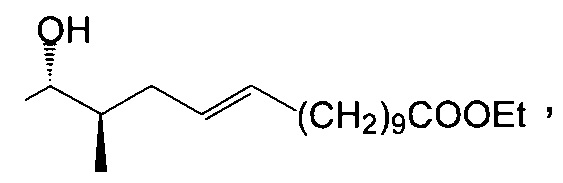
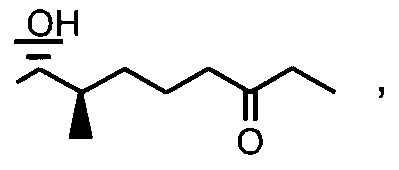
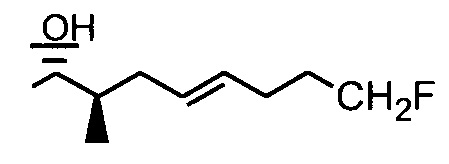
и
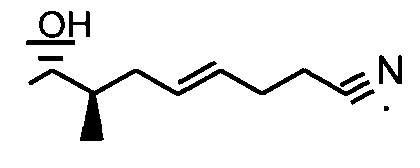
10. Соединение формулы:
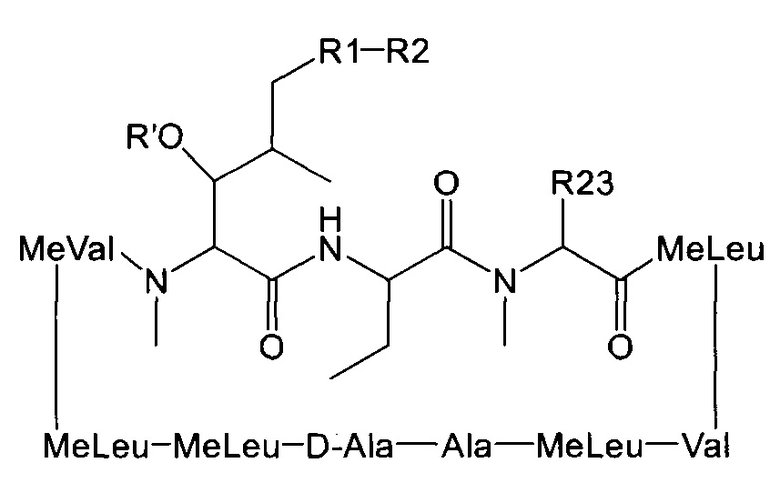
где R' представляет собой Н или ацетил;
R1-R2 представляет собой  ; и
; и
R23 представляет собой этил или метил, и
где указанное соединение представляет собой D-эпимер, при этом хиральный центр указанного D-эпимера представляет собой атом углерода, к которому присоединен R23.
11. Соединение по п. 10, отличающееся тем, что R23 представляет собой метил.
12. Соединение формулы:
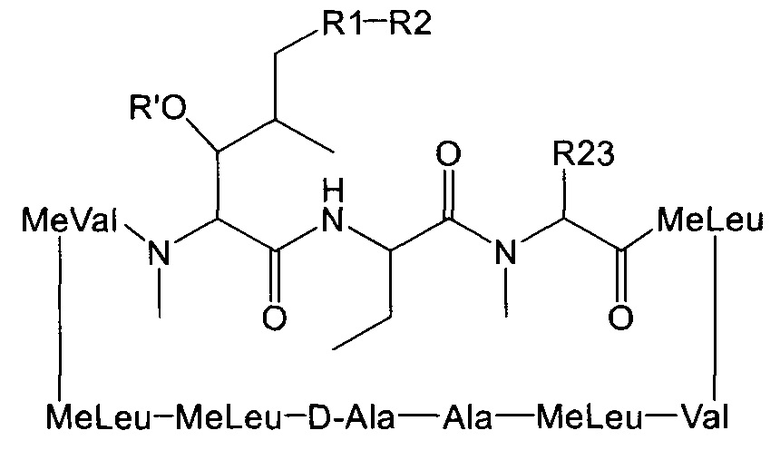
где R' представляет собой Н или ацетил;
R1-R2 представляет собой  ; и
; и
R23 представляет собой метил, и
где указанное соединение представляет собой D-эпимер, при этом хиральный центр указанного D-эпимера представляет собой атом углерода, к которому присоединен R23.
13. Фармацевтическая композиция для лечения или предотвращения заболевания, опосредованного циклофилином, содержащая эффективное количество соединения по любому из пп. 1-12 в качестве активного ингредиента и одно или более фармацевтических вспомогательных веществ.
14. Способ получения соединения по п. 1, включающий стадии:
1) взаимодействие циклоспорина-А (CsA) с основным алкиламидом лития в присутствии подходящего растворителя, с последующим взаимодействием с подходящим электрофилом, с получением соединения формулы 1:
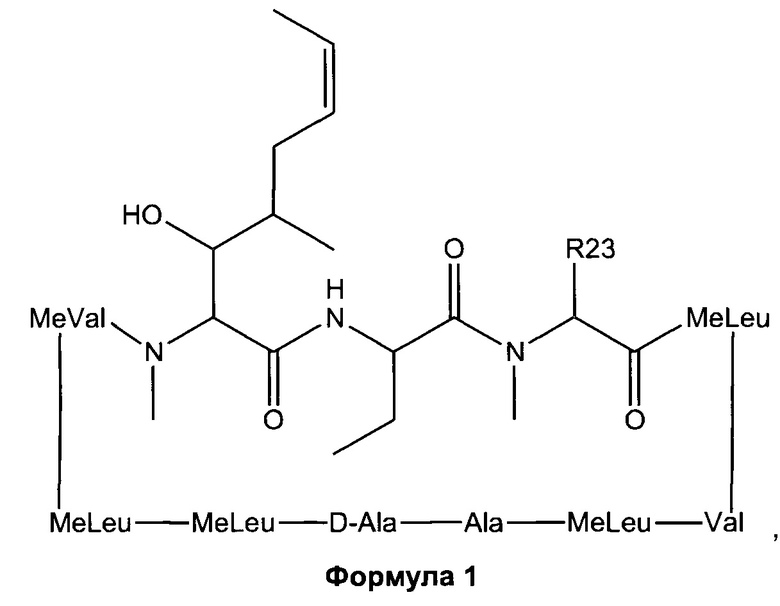
2) взаимодействие соединения формулы 1 с АС2О в присутствии подходящего растворителя с получением соединения формулы 2А:
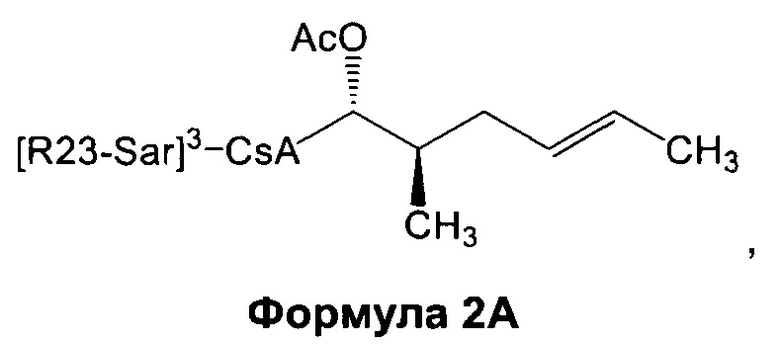
3) взаимодействие соединения формулы 2А с окислителем с получением соединения формулы 3А:
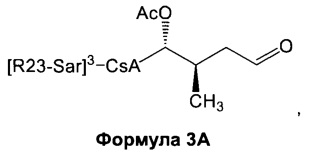
4) взаимодействие соединения формулы 3А с электрофилом с получением соединения формулы 4А:
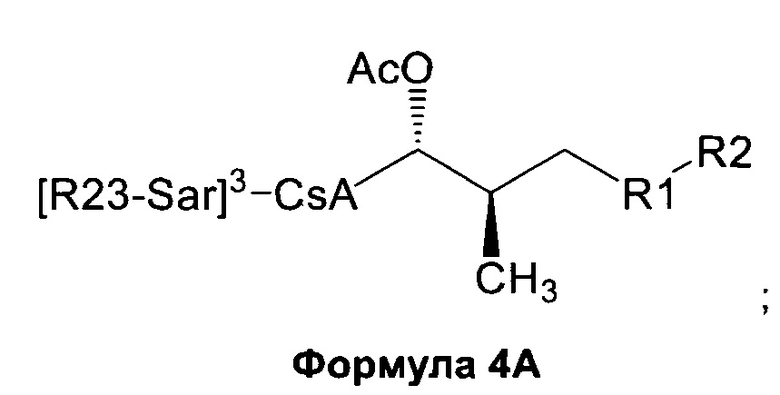 и
и
5) необязательно, деацилирование соединения формулы 4А.
15. Способ по п. 14, отличающийся тем, что указанное получение включает добавление избытка LiCl в подходящий растворитель на стадии 1) с получением преимущественно L-эпимера указанного соединения, или указанное получение проводят в отсутствие LiCl в подходящем растворителе на стадии 1) с получением преимущественно D-эпимера указанного соединения, при этом хиральный центр указанного D-эпимера или L-эпимера представляет собой атом углерода, к которому присоединен R23.
16. Способ по п. 14, отличающийся тем, что указанный основной алкиламид лития представляет собой диизопропиламид лития.
17. Способ по п. 15, отличающийся тем, что указанный основной алкиламид лития представляет собой диизопропиламид лития.
18. Способ по любому из пп. 14-17, отличающийся тем, что указанный электрофил, применяемый на стадии 1), выбран из группы, определенной в следующей таблице, для получения соответствующего R23, указанного в таблице:
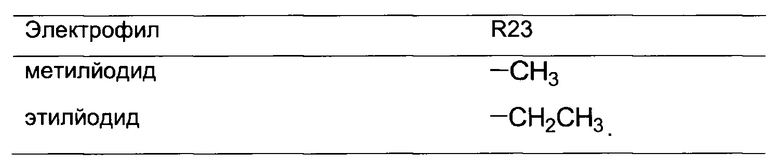
19. Способ получения соединения по п. 1, включающий стадии:
взаимодействия соединения формулы 1А с уксусным ангидридом в присутствии подходящего растворителя с получением соединения формулы 2:
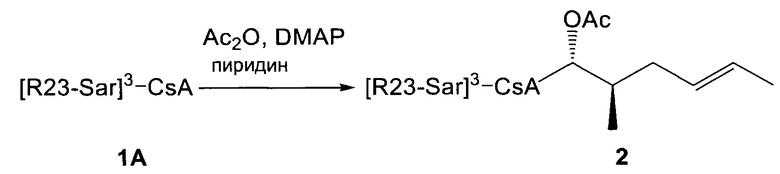 ,
,
необязательно, с последующим получением альдегида формулы 3:
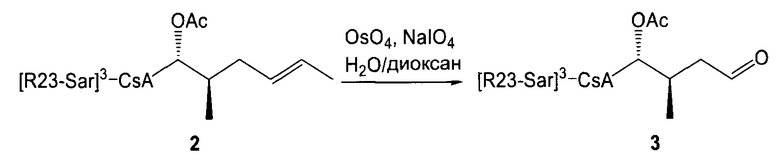 ,
,
необязательно, с последующей реакцией Виттига с получением соединения формулы L, где R23 выбран из группы, состоящей из:

20. Способ получения соединения по п. 1, включающий стадии: взаимодействие соединения формулы 5:
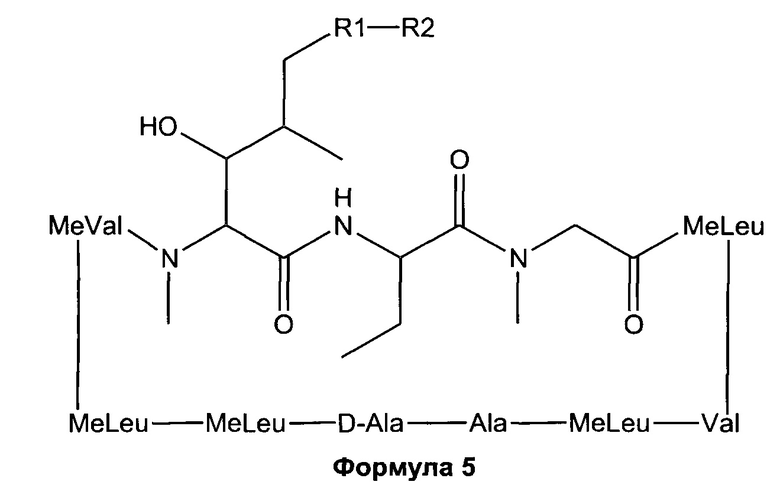
с основным алкиламидом лития в присутствии подходящего электрофила в подходящем растворителе с получением указанного соединения, где R23 представляет собой метил или этил.
21. Способ по п. 20, отличающийся тем, что указанный основной алкиламид лития представляет собой диизопропиламид лития.
22. Применение соединения по любому из пп. 1-12 или фармацевтической композиции по п. 13 для получения лекарственного средства, обладающего ингибиторной активностью по отношению к циклофилину А.
| US 7696166 B2, 13.04.2010 | |||
| WO 2010138422 A1, 02.12.2010 | |||
| ПРОИЗВОДНЫЕ ЦИКЛОСПОРИНА ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ И КОЖНЫХ ЗАБОЛЕВАНИЙ И СОСТОЯНИЙ | 2009 |
|
RU2521358C2 |
| АНТИЭМИССИОННЫЙ СПЛАВ | 0 |
|
SU194972A1 |
| US 20060069015 A1, 30.03.2006 | |||
| AEBI JOHANNES D et al | |||
| "Synthesis, conformation and immunosuppressive activity of a conformationally restricted cyclosporin lactam analogue", Journal of Medicinal Chemistry, 1988, Vol:31, Page(s):1805 - 1815 | |||
| QUESNIAUX V F J et al | |||
| "CYCLOPHILIN BINDS TO THE REGION OF CYCLOSPORINE INVOLVED IN ITS IMMUNOSUPPRESSIVE ACTIVITY", EUROPEAN JOURNAL OF IMMUNOLOGY, 1987, Vol:17, Nr:9, Page(s):1359 - 1365. | |||
Авторы
Даты
2017-09-12—Публикация
2011-12-14—Подача