Данная заявка имеет приоритет предварительной заявки на патент США №61/139687, поданной 22 декабря 2008 г., и предварительной заявки на патент США №61/164491, поданной 30 марта 2009 г., полностью включенных сюда посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В целом, настоящее изобретение относится к способу лечения и профилактики боли. Согласно настоящему изобретению предложено, что антагонисты гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) эффективны в лечении боли. Антагонисты GM-CSF включают, без ограничения, антитела, специфичные в отношении GM-CSF или рецептора GM-CSF. Согласно настоящему изобретению также предложены трансгенные животные, такие как мышь-нокаут по GM-CSF, полезные для исследования антагонистов в определенных моделях заболеваний.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Боль
Боль любого типа является наиболее частой причиной обращения к врачу в Соединенных Штатах, ежегодно вынуждая половину американцев обращаться за медицинской помощью. Она является основным симптомом при многих медицинских состояниях, значительно снижая качество жизни и общее функционирование человека. Диагностика основана на описании боли различными способами по продолжительности, интенсивности, типу (тупая, жгучая или колющая), источнику или локализации в организме. Обычно боль проходит без лечения или в ответ на простые меры, такие как отдых или прием обезболивающего средства, и в этом случае ее называют острой болью. Однако она также может становиться некупируемой и развиваться в состояние, называемое хронической болью, при котором боль более не рассматривают как симптом, но рассматривают как заболевание само по себе.
Боль можно классифицировать по многим схемам и обстоятельствам. Существует два основных типа боли: острая и хроническая. Острая боль возникает в течение коротких периодов времени и связана с временными расстройствами. Тем не менее, она всегда является сигналом тревоги о том, что что-то может быть не в порядке. Хроническая боль сохраняется и рецидивирует. на связана с хроническими заболеваниями и является одним из их симптомов. Интенсивность боли зависит не только от типа стимула, вызвавшего ее, но также от субъективного восприятия боли. Несмотря на широкий спектр субъективного восприятия, выделяют несколько типов боли в зависимости от:
- стимула, вызвавшего боль;
- продолжительности боли;
- свойств боли (интенсивности, локализации и тому подобного).
Другая система классификации представляет собой следующее:
- постоянная ноющая боль, продолжительная с постоянной интенсивностью, обычно она усиливается при движении;
- пульсирующая боль, это типично для боли при мигрени, она обусловлена расширением и сужением кровеносных сосудов головного мозга;
- колющая боль, интенсивная и тяжелая, обусловлена механическими стимулами;
- жгучая боль, постоянная, ощущаемая как жжение, такая как, например, тип боли, обусловленный изжогой;
- давящая боль, обусловлена сдавлением кровеносных сосудов или мышц.
Также существуют специфические типы боли:
- мышечная боль, также известная как миалгия, эта боль поражает мышцы и возникает после чрезмерной нагрузки или при воспалении;
- схваткообразная боль, вызвана мышечными сокращениями определенных органов, как например матки в течение менструального периода, обычно циклическая по своей природе;
- отраженная боль, возникает при восприятии болезненного ощущения в месте, отличном от того, где оно возникает на самом деле, в зависимости от того, как головной мозг интерпретирует информацию, получаемую им от тела;
- боль после хирургического вмешательства или послеоперационная боль, возникает после хирургического вмешательства и обусловлена повреждениями в связи с хирургическими процедурами;
- боль, обусловленная раком кости; определенные типы рака, такие как рак предстательной железы, молочной железы и другие опухоли мягких тканей, могут прогрессировать с развитием болезненного расстройства кости, известного как метастатическое заболевание кости.
Стандартное лечение боли
Существует много способов лечения боли. Лечение варьирует в зависимости от причины боли. Основные возможности лечения представляют собой следующее.
Ацетаминофен. Тайленол (ацетаминофен) используют для лечения боли. В отличие от некоторых других лекарственных средств от боли тайленол не имеет противовоспалительных эффектов. Однако, часто в случаях хронической боли в месте возникновения боли нет воспаления, и, таким образом, тайленол может быть подходящим выбором лечения. Тайленол безопасен при надлежащем применении, но может быть опасен при чрезмерном применении. Также тайленол может оказывать нежелательные эффекты при применении с определенными другими лекарственными средствами.
Нестероидные противовоспалительные лекарственные средства (НПВС). НПВС (такие как ибупрофен, мотрин, алив и тому подобные) наиболее полезны в случаях острой боли или при внезапных обострениях у пациентов с хронической болью. НПВС также очень эффективны при лечении воспалительных состояний, включая тендинит, бурсит и артрит.В целом, применение НПВС у пациентов с хронической болью ограничено ввиду опасений развития проблем с желудком. Несмотря на то, что во избежание этого осложнения были разработаны новые так называемые ингибиторы циклооксигеназы-2 (ЦОГ-2), такие как целебрекс, при применении этих лекарственных средств в течение длительных периодов времени все еще следует соблюдать осторожность.
Кортикостероиды. Как и НПВС, кортикостероиды являются сильными противовоспалительными лекарственными средствами, и их лучше всего использовать для лечения острой боли или внезапных обострений хронической воспалительной проблемы. Кортикостероиды можно применять либо перорально (как например медрол, преднизон), либо в форме инъекций в мягкие ткани или суставы (инъекции кортизона).
Наркотики. Наркотики следует рассматривать, если боль нельзя контролировать иным образом. Многие наркотики могут быть опасными и вызывать зависимость. Несмотря на то, что наркотические лекарственные средства полезны при лечении острой боли, они также имеют существенные побочные эффекты. Применение короткодействующих типов этих лекарственных средств может приводить к чрезмерному использованию и развитию устойчивости. Длительнодействующие варианты имеют меньше побочных эффектов и позволяют лучше контролировать хроническую боль. Наркотики могут приводить к развитию зависимости при их использовании в течение длительных периодов времени без постепенного снижения дозы или при приеме данных лекарственных средств по причинам, отличным от боли.
Противосудорожные лекарственные средства. Противосудорожные лекарственные средства являются категорией лекарственных средств, эффективной для облегчения невралгии. Эти лекарственные средства изменяют функционирование нерва и сигналы, посылаемые в головной мозг. Наиболее часто применяемое противосудорожное лекарственное средство для лечения невралгии называется нейронтин (габапентин). Другой недавно появившийся вариант, специально для лечения фибромиалгии, называется лирика (прегабалин).
Местные анестетики. Местные анестетики могут обеспечить временное облегчение боли в некоторой области. При применении в условиях хронической боли местные анестетики часто используют в форме пластыря для местного применения в области боли. Лидодерм (Lidoderm) поставляют в форме пластыря, фиксируемого на коже и снижающего чувствительность данной области.
Все упомянутые выше варианты лечения имеют недостатки, побочные эффекты, или их применение ограничено определенными типами боли. Таким образом, все еще сохраняется неудовлетворенная медицинская потребность в лечении боли.
GM-CSF
Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) представляет собой цитокин, функционирующий как фактор роста лейкоцитов. GM-CSF стимулирует образование гранулоцитов (нейтрофилов, эозинофилов и базофилов) и моноцитов из стволовых клеток. Моноциты покидают кровообращение и мигрируют в ткань, где происходит их созревание с образованием макрофагов. Таким образом, он является частью природного иммунного/воспалительного каскада, посредством которого активация небольшого числа макрофагов может быстро приводить к увеличению их числа, что является критически важным процессом для борьбы с инфекцией. Активная форма GM-CSF обнаружена внеклеточно в виде гомодимера. В частности, было установлено, что GM-CSF является медиатором воспаления при аутоиммунных расстройствах, таких как ревматоидный артрит (РА), приводя к повышенному образованию провоспалительных цитокинов, хемокинов и протеаз, и посредством этого в конечном счете к деструкции сустава.
GM-CSF является цитокином, вовлеченным в различные процессы в организме человека и животных. Также, недавно была установлена связь GM-CSF с определенными заболеваниями и патологиями, такими как воспалительные заболевания, и было предложено, что GM-CSF может быть потенциальной точкой вмешательства. Согласно настоящему изобретению впервые раскрыто, что GM-CSF также является эффективной мишенью для лечения боли.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении впервые продемонстрировано, что GM-CSF является эффективной мишенью для лечения боли. Это обнаружение является новым, и в предшествующем уровне техники отсутствуют идеи, предположения или предложения о каком-либо обосновании такой точки вмешательства при лечении боли. Соответственно, согласно изобретению предложен, например, способ лечения боли у субъекта, включающий стадию введения эффективного количества антагониста GM-CSF указанному субъекту.
В другом аспекте согласно настоящему изобретению предполагают способ профилактики боли у субъекта, включающий стадию введения эффективного количества антагониста GM-CSF указанному субъекту.
В другом аспекте настоящее изобретение направлено на композицию, содержащую антагонист GM-CSF, способный антагонизировать способность GM-CSF приводить к активации, пролиферации, индукции роста и/или выживания клеток у субъекта, страдающего от боли или предположительно страдающего от боли, дополнительно содержащую один или более чем один фармацевтически приемлемый носитель и/или разбавитель.
В другом аспекте настоящее изобретение направлено на композицию, содержащую антагонист GM-CSF, полезный в лечении боли, дополнительно содержащую один или более чем один фармацевтически приемлемый носитель и/или разбавитель.
В определенных аспектах настоящего изобретения антагонист GM-CSF представляет собой антитело, специфичное в отношении GM-CSF.
В альтернативных аспектах настоящего изобретения антагонист GM-CSF представляет собой антитело, специфичное в отношении рецептора GM-CSF.
В других аспектах настоящее изобретение направлено на применение антагониста GM-CSF в изготовлении лекарственного средства для лечения боли.
В других аспектах согласно настоящему изобретению предложены антагонисты GM-CSF для лечения боли.
В определенных аспектах настоящего изобретения указанная боль представляет собой послеоперационную боль, В альтернативных аспектах настоящего изобретения указанная боль представляет собой боль, обусловленную раком кости. В других альтернативных аспектах настоящего изобретения антагонисты GM-CSF имеют болеутоляющий эффект.
В определенных аспектах настоящего изобретения указанная боль представляет собой воспалительную боль.
В другом аспекте настоящего изобретения предложено сконструированное с помощью генной инженерии млекопитающее, имеющее генотип GM-CSF-/-. В определенных аспектах указанное млекопитающее представляет собой мышь.
В данном описании, если контекст не требует иного, слова «содержать», «иметь» и «включать» и их соответствующие варианты, такие как «содержит», «содержащий», «имеет», «имеющий», «включает» и «включающий», следует понимать как подразумевающие включение указанного элемента, или целого, или группы элементов или целых, но не исключение любого другого элемента, или целого, или группы элементов или целых.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
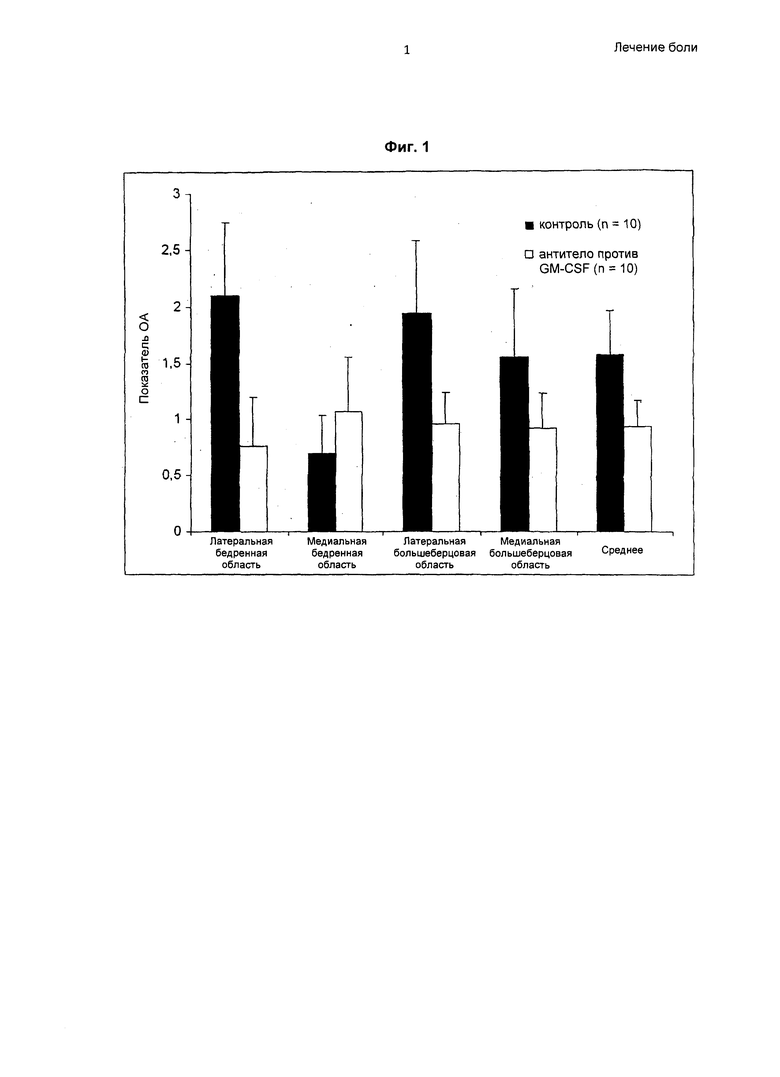
На Фиг.1 показаны гистологические показатели коленных суставов при терапевтическом лечении антителом против GM-CSF в модели остеоартрита (ОА) на мышах. Lat. = латеральный. Med. = медиальный. Результаты представлены как среднее ± стандартная ошибка среднего (SEM). Для всех областей, за исключением медиальной бедренной, у мышей, получавших лечение антителом против GM-CSF, наблюдали менее выраженное заболевание по сравнению с контрольными мышами.
На Фиг.2 показан результат эксперимента по оценке распределения массы тела по задним конечностям с использованием устройства для измерения нарушения функции. Данные значимы (непарный критерий Стьюдента), начиная с 27 суток после индукции ОА, как показано на графике. Результаты представлены как среднее ± SEM. *р=0,04, **р=0,04, ***р=0,02, ****р=0,005, непарный критерий Стьюдента.
На Фиг.3 показан результат эксперимента, демонстрирующего эффективность антагонистов GM-CSF в лечении воспалительного заболевания (моносуставного артрита, индуцированного метилированным бычьим сывороточным альбумином (mBSA)/интерлейкином-1 (IL-1)). Показаны клинические показатели коленных суставов на 7 сутки после лечения. Закрашенными столбцами показаны результаты, полученные для мышей C57BL/6, незакрашенными столбцами показаны результаты для мышей-нокаутов по GM-CSF. Слева: мыши, получавшие лечение индометацином. Справа: мыши, не получавшие лечение индометацином.
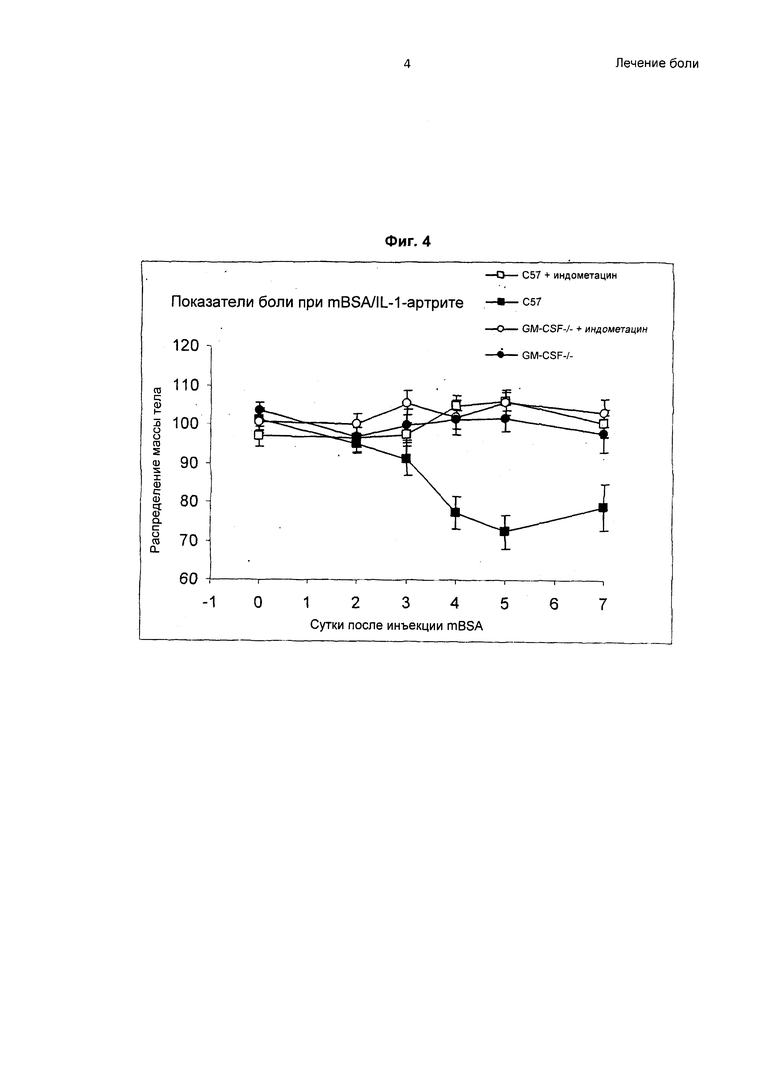
На Фиг.4 показан результат эксперимента, демонстрирующего эффективность антагонистов GM-CSF в лечении воспалительной боли (моносуставного артрита, индуцированного mBSA/IL-1). Показано распределение массы тела, измеренное устройством для измерения нарушения функции, в качестве критерия боли у мышей с моносуставным артритом, индуцированным mBSA/IL-1. Результаты представлены как конечность с инъекцией/контрольная конечность * 100.
На Фиг.5 показан результат эксперимента, демонстрирующего эффективность антагонистов GM-CSF в лечении воспалительной боли. Показана степень воспаления, как измерено по изменению толщины лапы после инъекции полного адъюванта Фрейнда (CFA) в подушечку левой лапы (L). Подушечка правой лапы (R) была нормальной. Группа «+ индометацин» получала лечение индометацином (1 мг/кг) внутрибрюшинно за 1 час перед каждым измерением. N=12 мышей на группу.
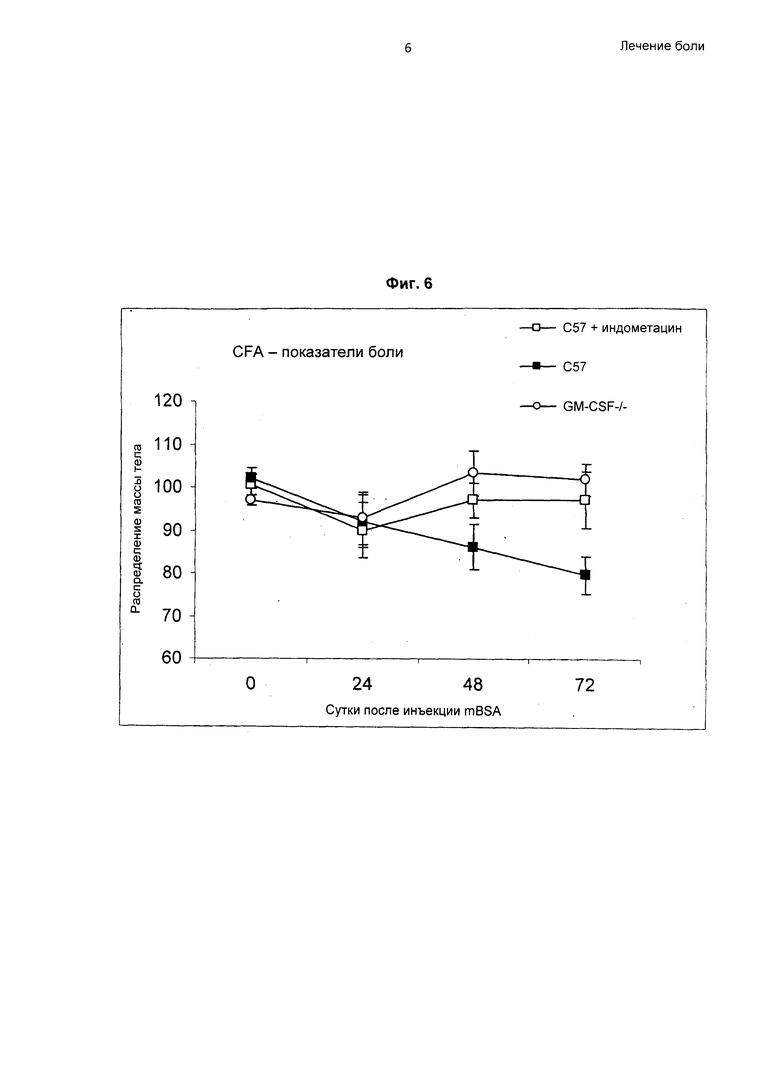
На Фиг.6 показан результат эксперимента, демонстрирующего эффективность антагонистов GM-CSF в лечении воспалительной боли. Показано распределение массы тела, измеренное устройством для измерения нарушения функции, в качестве критерия боли после инъекции CFA в подушечку левой лапы. Подушечка правой лапы была нормальной. Группа «+ индометацин» получала лечение индометацином (1 мг/кг) внутрибрюшинно за 1 час перед каждым измерением. Результаты представлены как конечность с инъекцией/контрольная конечность × 100. N=12 мышей на группу.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении продемонстрировано, что GM-CSF является эффективной мишенью для лечения боли. В этом отношении в одном аспекте согласно изобретению предложены способы применения антагониста GM-CSF для обеспечения профилактической или терапевтической пользы в области боли.
Согласно настоящему изобретению предложены терапевтические способы, включающие введение терапевтически эффективного количества антагониста GM-CSF субъекту, нуждающемуся в таком лечении. «Терапевтически эффективное количество» или «эффективное количество» при использовании здесь относится к количеству антагониста GM-CSF, необходимому для обеспечения желаемого биологического ответа. Согласно данному изобретению терапевтически эффективное количество представляет собой количество антагониста GM-CSF, необходимое для лечения и/или предотвращения боли.
В определенных аспектах согласно настоящему изобретению предложен способ лечения послеоперационной боли. В других аспектах согласно настоящему изобретению предложен способ лечения боли, обусловленной раком кости. В других аспектах согласно настоящему изобретению предложены антагонисты GM-CSF, имеющие болеутоляющий эффект. В других аспектах согласно настоящему изобретению предложен способ лечения боли, обусловленной ревматоидным артритом. Антагонисты GM-CSF способны ингибировать или блокировать боль, связанную с ревматоидным артритом. В других аспектах согласно изобретению предложены способы снижения частоты боли, обусловленной ревматоидным артритом, облегчения боли, обусловленной ревматоидным артритом, подавления боли, обусловленной ревматоидным артритом, ослабления боли, обусловленной ревматоидным артритом, и/или задержки появления, развития или прогрессирования боли, обусловленной ревматоидным артритом, у субъекта, включающие введение эффективного количества антагониста GM-CSF субъекту. В других аспектах согласно настоящему изобретению предложен способ предотвращения или лечения боли, обусловленной остеоартритом, у индивида введением эффективного количества антагониста GM-CSF индивиду. В другом аспекте согласно изобретению предложены способы лечения воспалительной кахексии (снижения массы тела), связанной с ревматоидным артритом, у индивида, включающие введение эффективного количества антагониста GM-CSF. В другом аспекте согласно изобретению предложены способы снижения частоты боли, обусловленной остеоартритом, облегчения боли, обусловленной остеоартритом, подавления боли, обусловленной остеоартритом, ослабления боли, обусловленной остеоартритом, и/или задержки появления, развития или прогрессирования боли, обусловленной остеоартритом, у индивида, включающие введение эффективного количества антагониста GM-CSF индивиду.
«Ослабление» боли или одного или более чем одного симптома боли (такой как боль, обусловленная ревматоидным артритом, или боль, обусловленная остеоартритом) означает уменьшение степени одного или более чем одного нежелательного клинического проявления послеоперационной боли у индивида или популяции индивидов, получающих лечение антагонистом GM-CSF по изобретению.
В определенных аспектах облегчение боли происходит в пределах приблизительно 24 часов после введения антагониста GM-CSF. В других аспектах облегчение боли происходит в пределах приблизительно 4 суток после введения антагониста GM-CSF.
«Антагонисты GM-CSF» при использовании здесь включают антагонисты GM-CSF в наиболее широком смысле; включена любая молекула, ингибирующая активность или функцию GM-CSF или любым другим образом оказывающая терапевтический эффект на GM-CSF. Термин «антагонисты GM-CSF» включает, без ограничения, антитела, специфично связывающиеся с GM-CSF, ингибирующие нуклеиновые кислоты, специфичные в отношении GM-CSF, или небольшие органические молекулы, специфичные в отношении GM-CSF. Значение термина «антагонист GM-CSF» также включает антитела, специфично связывающиеся с рецептором GM-CSF, ингибирующие нуклеиновые кислоты, специфичные в отношении рецептора GM-CSF, или небольшие органические молекулы, специфичные в отношении рецептора GM-CSF.
Ингибирующие нуклеиновые кислоты включают, без ограничения, антисмысловую ДНК, триплекс-образующие олигонуклеотиды, внешние вспомогательные последовательности, малую интерферирующую РНК (миРНК) и микроРНК. Полезные ингибирующие нуклеиновые кислоты включают ингибирующие нуклеиновые кислоты, уменьшающие экспрессию РНК, кодирующей GM-CSF по меньшей мере на 20, 30, 40, 50, 60, 70, 80, 90 или 95 процентов по сравнению с контролями. Ингибирующие нуклеиновые кислоты и способы их получения хорошо известны в данной области техники. Доступно программное обеспечение для разработки миРНК.
Небольшие органические молекулы (SMOL), специфичные в отношении GM-CSF или рецептора GM-CSF, могут быть идентифицированы скринингом природных продуктов или скринингом химических библиотек. Типично молекулярная масса SMOL составляет менее 500 дальтон, более типично от 160 до 480 дальтон. Другими типичными свойствами SMOL являются одно или более из следующего:
- коэффициент распределения log P в диапазоне от -0,4 до +5,6;
- молярная преломляющая способность от 40 до 130;
- число атомов от 20 до 70.
См. обзоры в Ghose et al, J Combin. Chem: 1:55-68, 1999 и Lipinski et al, Adv Drug Del Rev: 23:3-25, 1997.
Предпочтительно антагонист GM-CSF для использования в настоящем изобретении представляет собой антитело, специфичное в отношении GM-CSF или специфичное в отношении рецептора GM-CSF. Такое антитело может представлять собой антитело любого типа, такое как мышиное, крысиное, химерное, гуманизированное или человеческое антитело. «Человеческое» антитело или функциональный фрагмент человеческого антитела определены таким образом как антитело или функциональный фрагмент антитела, не являющиеся химерными (например, не являющиеся «гуманизированными») и не имеющие происхождение (либо полностью, либо частично) от вида, не являющегося человеком. Человеческое антитело или функциональный фрагмент антитела могут иметь происхождение от человека или могут представлять собой синтетическое человеческое антитело. «Синтетическое человеческое антитело» определено таким образом как антитело, имеющее последовательность, имеющую происхождение, полностью или частично, in silico от синтетических последовательностей, основанных на анализе известных последовательностей человеческих антител. Разработка последовательности человеческого антитела или его фрагмента in silico может быть осуществлена, например, анализом базы данных последовательностей человеческих антител или фрагментов антител и разработкой полипептидной последовательности с использованием полученных таким образом данных. Другим примером человеческого антитела или функционального фрагмента антитела являются антитело или функциональный фрагмент антитела, кодируемые нуклеиновой кислотой, выделенной из библиотеки последовательностей антител человеческого происхождения (то есть, библиотеки, основанной на антителах, полученных от природного источника, являющегося человеком).
«Гуманизированное антитело» или функциональный фрагмент гуманизированного антитела определены таким образом как (1) антитело или функциональный фрагмент антитела, имеющие происхождение от источника, не являющегося человеком (например, трансгенной мыши с гетерологичной иммунной системой), основанные на человеческой последовательности зародышевого типа; или (2) химерные антитело или функциональный фрагмент антитела, где вариабельный домен имеет происхождение от источника, не являющегося человеком, и константный домен имеет происхождение от источника, являющегося человеком, или (3) антитело или функциональный фрагмент антитела с перенесенными гипервариабельными участками (CDR), где CDR вариабельного домена имеют происхождение от источника, не являющегося человеком, в то время как одна или более чем одна каркасная область вариабельного домена имеет происхождение от источника, являющегося человеком, и константный домен (если он присутствует) имеет происхождение от источника, являющегося человеком.
Термин «химерное антитело» или функциональный фрагмент химерного антитела определены таким образом как молекула-антитело, имеющая константные области антитела, имеющие происхождение от последовательностей, обнаруженных у одного вида, или соответствующие последовательностям, обнаруженным у одного вида, и вариабельные области антитела, имеющие происхождение от другого вида. Предпочтительно константные области антитела имеют происхождение от последовательностей, обнаруженных у людей, например, в человеческой зародышевой линии или соматических клетках, или соответствуют этим последовательностям, и вариабельные области антитела (например, вариабельные области тяжелой цепи (VH), вариабельные области легкой цепи (VL), CDR или каркасные области (FR)) имеют происхождение от последовательностей, обнаруженных у животного, не являющегося человеком, например, мыши, крысы, кролика или хомяка.
При использовании здесь антитело «связывается специфично с», «специфично связывается с», «специфично в отношении» или «специфично распознает» антиген (здесь, GM-CSF или альтернативно рецептор GM-CSF), если такое антитело способно различать такой антиген и один или более чем один контрольный антиген, поскольку специфичность связывания является не абсолютным, а относительным свойством. Контрольный антиген (антигены) может представлять собой один или более чем один близкородственный антиген (антигены), используемый в качестве контрольной точки, например, интерлейкин-3 (IL-3), интерлейкин-5 (IL-5), интерлейкин-4 (IL-4), интерлейкин-13 (IL-13) или макрофагальный колониестимулирующий фактор (M-CSF). В наиболее общей форме (и без упоминания определенной ссылки) «специфичное связывание» относится к способности антитела различать интересующий антиген и неродственный антиген, как определено, например, в соответствии с одним из следующих способов. Такие способы включают, без ограничения, вестерн-блоттинг, твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (RIA), электрохемилюминесцентый анализ (ECL), иммунорадиометрический анализ (IRMA) и пептидные сканирования. Например, может быть проведен стандартный ELISA-анализ. Оценку можно проводить стандартным цветовым проявлением (например, вторичным антителом с пероксидазой хрена и тетраметилбензидином с перекисью водорода). Реакцию в определенных лунках оценивают по оптической плотности, например, при 450 нм. Обычный фон (= отрицательная реакция) может составлять 0,1 оптической плотности (OD), типичная положительная реакция может составлять 1 OD. Это означает, что разница положительный/отрицательный может составлять более 10 раз. Обычно определение специфичности связывания проводят с использованием не одного контрольного антигена, а набора из приблизительно трех-пяти неродственных антигенов, таких как сухое молоко, бычий сывороточный альбумин (BSA), трансферрин или тому подобное. В дополнение, «специфичное связывание» может относиться к способности антитела различать разные части его антигена-мишени, например, разные домены или области GM-CSF или рецептора GM-CSF, или один или более чем один ключевой аминокислотный остаток или группу аминокислотных остатков GM-CSF или рецептора GM-CSF.
Также при использовании здесь «иммуноглобулин» (Ig) определен таким образом как белок, принадлежащий к классу IgG, IgM, IgE, IgA или IgD (или любому их подклассу), и данный термин включает все общеизвестные антитела и их функциональные фрагменты. «Функциональный фрагмент» антитела/иммуноглобулина определен таким образом как фрагмент антитела/иммуноглобулина (например, вариабельная область IgG), сохраняющий антиген-связывающую область. «Антиген-связывающую область» антитела обычно обнаруживают в одном или более чем одном гипервариабельном участке антитела, то есть, CDR1, CDR2 или CDR3; тем не менее, вариабельные «каркасные» области также могут играть важную роль в связывании с антигеном, как например, предоставляя каркас для CDR. Предпочтительно «антиген-связывающая область» включает по меньшей мере аминокислотные остатки 4-103 вариабельной области легкой цепи (VL) и 5-109 вариабельной области тяжелой цепи (VH), более предпочтительно аминокислотные остатки 3-107 VL и 4-111 VH, и особенно предпочтительны полноразмерные цепи VL и VH (аминокислотные положения 1-109 VL и 1-113 VH; нумерация согласно WO 97/08320). Предпочтительным классом иммуноглобулинов для использования в настоящем изобретении являются IgG. «Функциональные фрагменты» по изобретению включают домен F(ab’)2-фрагмента, Fab-фрагмента, scFv или конструкции, содержащие полипептиды отдельных вариабельных доменов иммуноглобулинов или отдельных однодоменных антител, например, отдельных вариабельных доменов тяжелой цепи или отдельных вариабельных доменов легкой цепи. F(ab')2 или Fab могут быть сконструированы для минимизации или полного устранения межмолекулярных дисульфидных взаимодействий, происходящих между доменами CH1 и CL.
Антитело по изобретению может иметь происхождение от библиотеки рекомбинантных антител, основанной на аминокислотных последовательностях, разработанных in silico и кодируемых синтетически полученными нуклеиновыми кислотами. Разработка последовательности антитела in silico проводят, например, анализом базы данных человеческих последовательностей и разработкой полипептидной последовательности с использованием полученных таким образом данных. Способы разработки и получения in silico-получаемых последовательностей описаны, например, в Knappik et al., J. Mol. Biol. 296:57, 2000; Krebs et al., J. Immunol. Methods. 254:67, 2001, Rothe et al., J. Mol. Biol. 376:1182, 2008, и патенте США №6300064, выданном Knappik et al. 2000 supra, полностью включенных сюда посредством ссылки.
В настоящем изобретении может быть использовано любое антитело, специфичное в отношении GM-CSF. Типичные антитела раскрыты в US 11/914599, полностью включенной сюда посредством ссылки. Другие типичные антитела включают антитела, содержащие аминокислотную последовательность вариабельной области тяжелой цепи, как показано в SEQ ID NO:1, или аминокислотную последовательность вариабельной области легкой цепи, как показано в SEQ ID NO:2. Другие типичные антитела включают антитела, имеющие происхождение от антител, содержащих вариабельную область тяжелой цепи, как показано в SEQ ID NO:1, или аминокислотную последовательность вариабельной области легкой цепи, как показано в SEQ ID NO:2. Другие типичные антитела включают антитела, имеющие такую же специфичность и/или связывающиеся с тем же эпитопом, что и антитела, содержащие вариабельную область тяжелой цепи, как показано в SEQ ID NO:1, или аминокислотную последовательность вариабельной области легкой цепи, как показано в SEQ ID NO:2. Другие типичные антитела включают антитела, содержащие вариабельную область тяжелой цепи, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 95% гомологичную последовательности, показанной в SEQ ID NO:1. Другие типичные антитела включают антитела, содержащие вариабельную область легкой цепи, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 95% гомологичную последовательности, показанной в SEQ ID NO:2.


Альтернативные типичные антитела, которые могут быть использованы в настоящем изобретении, представляют собой антитела, содержащие аминокислотную последовательность вариабельной области тяжелой цепи, как показано в SEQ ID NO:3, или аминокислотную последовательность вариабельной области легкой цепи, как показано в SEQ ID NO:4. Другие типичные антитела включают антитела, имеющие происхождение от антител, содержащих вариабельную область тяжелой цепи, как показано в SEQ ID NO:3, или аминокислотную последовательность вариабельной области легкой цепи, как показано в SEQ ID NO:4. Другие типичные антитела включают антитела, имеющие такую же специфичность и/или связывающиеся с тем же эпитопом, что и антитела, содержащие вариабельную область тяжелой цепи, как показано в SEQ ID NO:3, или аминокислотную последовательность вариабельной области легкой цепи, как показано в SEQ ID NO:4. Другие типичные антитела включают антитела, содержащие вариабельную область тяжелой цепи, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 95% гомологичную последовательности, показанной в SEQ ID NO:3. Другие типичные антитела включают антитела, содержащие вариабельную область легкой цепи, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 95% гомологичную последовательности, показанной в SEQ ID NO:4.

Альтернативные типичные антитела, которые могут быть использованы в настоящем изобретении, представляют собой антитела, содержащие последовательность CDR3 тяжелой цепи (H-CDR3), выбранную из:


и

Предпочтительно антитела, содержащие последовательность H-CDR3, выбранную из любой из SEQ ID NO:5-16, дополнительно содержат следующую последовательность CDR1 тяжелой цепи (H-CDR1):

и/или следующую последовательность CDR2 тяжелой цепи (H-CDR2):

и/или следующую последовательность CDR1 легкой цепи (L-CDR1):

и/или следующую последовательность CDR2 легкой цепи (L-CDR2):

и/или следующую последовательность CDR3 легкой цепи (L-CDR3):

Альтернативные типичные антитела, которые могут быть использованы в настоящем изобретении, представляют собой антитела, содержащие следующую последовательность L-CDR1:

и/или следующую последовательность L-CDR2:

и/или следующую последовательность L-CDR3:

и/или следующую последовательность H-CDR1:

и/или следующую последовательность H-CDR2:

и/или следующую последовательность H-CDR3:

Предпочтительно указанное антитело содержит все CDR SEQ ID NO:22-27.
Рецептор GM-CSF является членом суперсемейства гемопоэтиновых рецепторов. Он является гетеродимерным и состоит из альфа- и бета-субъединицы. Альфа-субъединица высокоспецифична в отношении GM-CSF, в то время как бета-субъединица является общей с рецепторами других цитокинов, включая IL-3 и IL-5. Это отражено в более широком тканевом распределении бета-субъединицы рецептора. Альфа-субъединица, GM-CSFRα, экспрессирована главным образом на миелоидных клетках и негемопоэтических клетках, таких как нейтрофилы, макрофаги, эозинофилы, дендритные клетки, эндотелиальные клетки и клетки респираторного эпителия. Полноразмерная GM-CSFRα представляет собой мембранный гликопротеин 1 типа из 400 аминокислот, который принадлежит к семейству рецепторов цитокинов 1 типа и состоит из сигнального пептида из 22 аминокислот (положения 1-22), внеклеточного домена из 298 аминокислот (положения 23-320), трансмембранного домена с положения 321 до положения 345 и короткого внутриклеточного домена из 55 аминокислот. Происходит отщепление сигнального пептида с образованием зрелой формы GM-CSFRα в виде белка из 378 аминокислот. Доступны клоны комплементарной ДНК (кДНК-клоны) человеческой и мышиной GM-CSFRα, и идентичность субъединиц рецептора на уровне белков составляет 36%. GM-CSF способен связываться с относительно низкой аффинностью с α-субъединицей самой по себе (Kd 1-5 нМ), но не способен связываться с β-субъединицей самой по себе. Тем не менее, присутствие обеих α- и β-субъединиц приводит к образованию высокоаффинного комплекса лиганд-рецептор (Kd>>100 пМ). GM-CSF-сигнализация происходит через его начальное связывание с α-цепью GM-CSFR и затем перекрестное связывание с более крупной субъединицей общей β-цепи с установлением высокоаффинного взаимодействия, приводящего к фосфорилированию через метаболический путь JAK-STAT.
В настоящем изобретении может быть использовано любое антитело, специфичное в отношении рецептора GM-CSF. Типичные антитела включают антитела, содержащие аминокислотную последовательность последовательности H-CDR3, показанной в любой из SEQ ID NO:28-46. Другие типичные антитела включают антитела, имеющие происхождение от антител, содержащих аминокислотную последовательность последовательности Н-CDR3, показанной в любой из SEQ ID NO:28-46. Другие типичные антитела включают антитела, имеющие такую же специфичность и/или связывающиеся с тем же эпитопом, что и антитела, содержащие аминокислотную последовательность последовательности H-CDR3, показанной в любой из SEQ ID NO:28-46. Другие типичные антитела включают антитела, содержащие последовательность H-CDR3, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 95% гомологичную последовательности H-CDR3, показанной в любой из SEQ ID NO:28-46.



В определенных аспектах согласно настоящему изобретению предложены способы лечения боли у субъекта, включающие стадию введения антагониста GM-CSF указанному субъекту. «Субъект» при использовании в данном контексте относится к любому млекопитающему, включая грызунов, таких как мышь или крыса, и приматов, таких как яванский макак (Масаса fascicularis), макак-резус (Масаса mulatta) или люди (Homo sapiens). Предпочтительно субъект представляет собой примата, наиболее предпочтительно человека.
В определенном аспекте согласно настоящему изобретению предложена композиция, содержащая антагонист GM-CSF, способный антагонизировать способность GM-CSF приводить к активации, пролиферации, индукции роста и/или выживания клеток у субъекта, страдающего от боли или предположительно страдающего от боли, дополнительно содержащая один или более чем один фармацевтически приемлемый носитель и/или разбавитель. Антитела против GM-CSF по настоящему изобретению могут антагонизировать любую из функций GM-CSF при боли.
В другом аспекте согласно настоящему изобретению предложен способ профилактики боли у субъекта, включающий введение антагониста GM-CSF указанному субъекту. «Профилактика» при использовании в данном контексте относится к способам, направленным на предотвращение начала заболевания или приводящим к задержке начала заболевания.
В определенном аспекте согласно настоящему изобретению предложена композиция, содержащая антагонист GM-CSF, полезный в лечении боли, дополнительно содержащая один или более чем один фармацевтически приемлемый носитель и/или разбавитель.
В других аспектах согласно настоящему изобретению предложено применение антагониста GM-CSF в изготовлении лекарственного средства для лечения боли.
В других аспектах согласно настоящему изобретению предложены антагонисты GM-CSF для лечения боли.
Композиции по настоящему изобретению предпочтительно представляют собой фармацевтические композиции, содержащие антагонист GM-CSF и фармацевтически приемлемый носитель, разбавитель или эксципиент, для лечения боли. Такие носители, разбавители и эксципиенты хорошо известны в данной области техники, и специалист в данной области техники найдет композицию и путь введения, наиболее подходящие для лечения субъекта антагонистами GM-CSF по настоящему изобретению.
В другом аспекте согласно настоящему изобретению предложено сконструированное с помощью генной инженерии млекопитающее, имеющее генотип GM-CSF-/-. В определенных аспектах указанное млекопитающее представляет собой мышь. Термины «мышь-нокаут» (или «млекопитающее-нокаут»), мышь (или млекопитающее) «с нарушением в» определенном гене и мышь (или млекопитающее) с «генотипом -/-» использованы в настоящем изобретении взаимозаменяемо и признаны в данной области техники. Соответствующие животные дефектны по соответствующему гену, здесь GM-CSF, в обоих аллелях хромосомы.
Пример 1
Получение мыши GM-CSF-/-
Получение мышей GM-CSF-/- описано в Stanley et al. (1994). Proc. Natl. Acad. Sci. USA 91:5592. Кратко, химерных мышей получали микроинъекцией клеток ES, имеющих происхождение от 129/OLA (Н-2b), с нарушением в гене GM-CSF в бластоцисты хозяина C57BL/6 (Н-2b). Переносчиков зародышевой линии с мутированным аллелем GM-CSF скрещивали с мышами C57BL/6 в 11 поколениях с получением мышей GM-CSF+/-, которых скрещивали между собой с получением мышей GM-CSF-/-, GM-CSF+/- и GM-CSF+/+, используемых для экспериментов. Состояние генотипа GM-CSF определяли анализом полимеразной цепной реакцией (ПЦР) хвостовой ДНК. Животных кормили стандартным кормом для грызунов и водой в свободном доступе и содержали с однопометными животными того же пола в клетках, выстланных опилками. Мышей обоих полов включали в эксперименты в возрасте от 8 до 15 недель.
Пример 2
Антагонисты GM-CSF эффективны в лечении послеоперационной боли
Используют модель боли, имитирующую послеоперационную боль, для оценки эффективности лечения антагонистами GM-CSF.
Животные
Самцам крыс Sprague Dawley с массой тела 220-240 грамм дают привыкнуть к виварию в течение одной недели перед хирургическим вмешательством.
Хирургическое вмешательство
Хирургическое вмешательство основано на способе, описанном в Brennan et al., Pain 64:493-501, 1996. Животным проводят анестезию 2% изофлураном в воздушной смеси, которую поддерживают во время хирургического вмешательства посредством носового конуса. Подошвенную поверхность правой задней лапы подготавливают тампоном с повидон-йодом и производят центральный продольный разрез длиной 1 см через кожу и фасцию, начиная от 0,5 см от края пятки и продолжая в направлении пальцев. Измерения проводят линейкой, удерживая лапу в фиксированном положении. Подошвенную мышцу поднимают с использованием пинцета с изогнутыми браншами и рассекают продольно. Мышцу рассекают на всю глубину от начала до места прикрепления. В процессе хирургического вмешательства кровотечение контролируют давлением, оказываемым посредством марлевого компресса. Рану закрывают двумя матрацными швами (черная этиленовая мононить 5-0). Швы фиксируют 5-6 узлами, не затягивая первый узел. Область раны протирают раствором бацитрацина. Животным оставляют восстанавливаться и отдыхать в чистых клетках в течение двух часов или более перед началом исследования поведения.
Оценка боли в покое
Для оценки боли, связанной с весовой нагрузкой, используют кумулятивный показатель боли. Животных помещают на пластиковую сетку (решетка: 8 мм2) в чистых пластиковых клетках, поднятых на платформу (высота 18 дюймов (45,72 см)), что позволяет наблюдать за нижней поверхностью их лап. После периода адаптации продолжительностью 20 минут оценивают весовую нагрузку по шкале от 0 до 2. Показатель 0 присваивают при побледнении или прижатии лапы к сетке, что указывает на полную весовую нагрузку. Показатель 1 присваивают при щадящем использовании лапы лишь с прикосновением кожей к сетке без побледнения или вдавливания кожи. Показатель 2 присваивают при полном удержании лапы над сеткой. Отдергивание лапы расценивают как 2, если крыса все еще отдыхает. Каждое животное наблюдают в течение 1 минуты каждые 5 минут в течение 30 минут. Сумму 6 показателей (0-12), полученных за полчаса, используют для оценки боли в лапе с разрезом. Также вычисляют частоту показателей 2 и используют ее для оценки частоты сильной боли или полной защиты лапы животным. Каждое животное исследуют за 24 часа до хирургического вмешательства (исходный уровень) и через 2 ч, 24 ч, 48 ч и 72 ч после хирургического вмешательства. Результаты этого эксперимента показывают, что кумулятивный показатель боли в покое, наблюдаемый у животных, получавших лечение антагонистами GM-CSF, значительно снижен по сравнению с контрольными животными. Весовая нагрузка хорошо коррелирует с желанием животного использовать конечность и, следовательно, является эффективным критерием облегчения боли. Предпочтительно антагонист GM-CSF представляет собой антитело, специфичное в отношении GM-CSF или специфичное в отношении рецептора GM-CSF. Такие антитела вводят внутрибрюшинно при различных концентрациях антитела (например, 0,004, 0,01, 0,02, 0,1, 0,6 и 1 мг на килограмм массы тела животного) за 15 часов до разреза. Группа отрицательного контроля не получает антитело, но ей внутрибрюшинно вводят физиологический раствор. Фентанил в дозе 0,01 мг/кг вводят внутрибрюшинно в качестве положительного контроля за 30 минут до исследования и через 24 часа после хирургического вмешательства. Каждый эксперимент включает 8 животных (n=8 на группу) для каждого условия, и контрольная группа имеет 56 животных. Проводят хирургическое вмешательство и кумулятивный показатель боли измеряют, как описано выше. Боль в покое оценивают через двадцать четыре часа после хирургического вмешательства.
Антагонисты GM-CSF значительно снижают боль в покое после хирургического вмешательства при введении в дозе от 0,02 мг/кг до 1 мг/кг.
В другом эксперименте исследуют эффективность антагонистов GM-CSF в снижении послеоперационной боли при введении после хирургического вмешательства. Антитела, специфичные в отношении GM-CSF или специфичные в отношении рецептора GM-CSF, вводят внутривенно через два часа после хирургического вмешательства. Контрольная группа не получает антитело, но ей внутривенно вводили физиологический раствор. Проводят хирургическое вмешательство и боль в покое, представленную как кумулятивный показатель боли, оценивают через 24 часа после хирургического вмешательства. Лечение антагонистом GM-CSF значительно снижает боль в покое через двадцать четыре часа после разреза при введении антитела через 2 часа после разреза. Эти результаты продемонстрировали, что антагонист GM-CSF эффективно облегчал послеоперационную боль при введении после хирургического вмешательства.
Оценка температурной гипералгезии
Температурную гипералгезию оценивают подошвенным тестом на крысах (Ugo Basile, Italy), следуя модифицированному методу Hargreaves et al. (1988). Крыс приучают к аппарату, состоящему из четырех отдельных камер из органического стекла на приподнятом стеклянном столе. Под столом расположен подвижный источник теплового излучения, и он сфокусирован на заднюю лапу. Когда животное не движется, но не спит, происходит нажатие кнопки на контрольной камере, включение источника теплового излучения и автоматическая запись времени, проходящего до отдергивания животным лапы от источника тепла. Это время до отдергивания лапы (POOL) определяют оптическим датчиком, встроенным в источник теплового излучения, определяющим движение крысиной лапы по изменению коэффициента отражения источника излучения. Проводили запись времени до отдергивания лапы (PWL) в секундах. Существует автоматическая точка отсечки 22,5 с для предотвращения повреждения тканей. PWL получают три-четыре раза для обеих задних лап каждого животного, среднее которых отражает исходные данные для правой и левой задних лап. Результаты показаны как отношение показателя, измеренного на правой лапе (месте хирургического вмешательства) и левой лапе. Аппарат калибруют один раз (в начале исследования) и устанавливают на интенсивность 40 для получения нормального PWL приблизительно 6 секунд. Каждое животное исследуют за 24 часа до хирургического вмешательства (исходный уровень) и через 3 ч, 24 ч, 48 ч и 72 ч после хирургического вмешательства. Измерения температурной гипералгезии проводят после измерений тактильной аллодинии. Эти результаты продемонстрировали, что лечение антагонистами GM-CSF значительно снижало послеоперационную температурную гипералгезию.
Пример 3
Антагонисты GM-CSF эффективны в лечении боли, обусловленной раком кости
Антагонисты GM-CSF, такие как антитела, специфичные в отношении GM-CSF, или антитела, специфичные в отношении рецептора GM-CSF, эффективны в лечении боли, обусловленной раком, связанной с метастазами в кости.
Авторы изобретения используют модель боли, обусловленной раком кости, на мышах для оценки эффективности лечения антагонистами GM-CSF. Эту модель боли, обусловленной раком кости, на мышах получают введением в костный мозг бедренной кости мыши клеток остеолитической саркомы и отверстие от иглы затем заполняют амальгамой для зубных пломб для ограничения опухоли костью (см. Schwei et al., J: Neuroscience 19:10886-10897, 1999 и Luger et al., Pain 99:397-406, 2002). Эксперименты проводят на взрослых самцах мышей С3Н/HeJ. На 0 сутки производят артротомию после введения в наркоз пентобарбиталом натрия (50 мг/кг, внутрибрюшинно). Иглу вводят в костномозговой канал для создания пути для клеток саркомы. Затем делают вдавливание с использованием высокоскоростного пневматического наконечника для стоматологической бормашины. В дополнение к интактным животным (n=5) животных с имитацией (n=5) получают инъекцией минимальной поддерживающей среды (20 мкл, Sigma, St. Louis, МО) в костномозговой канал бедренной кости (обозначены «имитация»), в то время как животным с саркомой (n=5 для каждого исследованного условия) вводят среду, содержащую клетки остеолитической саркомы 1052472 (обозначены «саркома» или «загс») (20 мкл, Американская коллекция типовых культур (АТСС), Rockville, MD). Для всех животных место инъекции герметизируют пломбой из амальгамы для зубных пломб для ограничения клеток или введенной среды костномозговым каналом с последующим промыванием стерильной водой (гипотоническим раствором). В завершение, разрез закрывают раневыми клипсами. Клипсы удаляют на 5 сутки, чтобы они не мешали исследованию поведения. Второй группе животных, которым вводили саркому, проводят лечение антителами, специфичными в отношении GM-CSF или специфичными в отношении рецептора GM-CSF (например, 10 мг/кг внутрибрюшинно) на 6 и 13 сутки.
Анализ поведения
Поведение животных, связанное с болью, исследуют на 10 сутки и 14 сутки после имплантации опухоли. Поведение животных исследуют с применением следующих исследований: исследования постоянной боли (спонтанной защиты и отдергивания), исследования боли при передвижении (использования конечности и способности удерживаться на вращающемся стержне) и боли, вызванной движением (защиты, вызванной пальпацией, и отдергивания, вызванного пальпацией). Животных помещают в прозрачную пластиковую камеру для наблюдения с полом из проволочной сетки и дают им привыкнуть в течение 30 минут. После адаптации оценивают спонтанную защиту, спонтанное отдергивание, использование конечности при нормальном передвижении по открытому пространству и защиту при вынужденном передвижении. Защиту и отдергивание, вызванные пальпацией, измеряют после двухминутного периода безболезненной в норме пальпации дистальной части бедра животных, которым вводили саркому, и животных с имитацией.
Число спонтанных отдергиваний и время до прекращения защиты, отражающие ноцицептивное поведение, записывают одновременно в течение двухминутного периода наблюдения. Защиту определяют как время удержания задней лапы в воздухе, в то время как передвижение и отдергивания представляют собой число раз, когда животное держало конечность в воздухе. Нормальное использование конечности при спонтанном передвижении оценивают по шкале от 5 до 0: (5) нормальное использование и (0) полное отсутствие использования конечности.
Защиту при вынужденном передвижении определяют с применением оценки способности удерживаться на вращающемся стержне (Columbus Instruments, Columbus, ОН). Вращающееся устройство имеет вращающийся стержень и оборудовано контролем скорости, ускорения и чувствительности. Животных помещают на стержень при скорости Х4, ускорении 8,0 и чувствительности 2,5. Защиту при вынужденном передвижении оценивают по шкале от 5 до 0: (5) нормальное использование и (0) полное отсутствие использования. После безболезненной в норме пальпации дистальной части бедра животных каждую секунду в течение 2 минут животных помещают в камеру для наблюдения и их защиту, вызванную пальпацией, и отдергивание, вызванное пальпацией, измеряют в течение еще 2 минут.
Лечение антагонистами GM-CSF
На 6 сутки и 13 сутки животным, которым вводили саркому, внутрибрюшинно вводят антагонисты GM-CSF, такие как антитело против GM-CSF или против рецептора GM-CSF (n=5), или животным, которым вводили саркому, и животным с имитацией внутрибрюшинно вводили физиологический раствор (n=5 для каждого условия). Поведение всех животных анализировали на 10 и 14 сутки.
Оценка поведения, связанного с постоянной болью
У животных, которым вводили саркому (которым вводили физиологический раствор), развивается статистически значимое поведение, связанное с постоянной болью, что оценивают по спонтанной защите и спонтанному отдергиванию, по сравнению с животными с имитацией (которым вводили физиологический раствор).
Введение антагонистов GM-CSF значительно уменьшает спонтанную защиту и спонтанное отдергивание у мышей, которым вводили саркому, на 10 сутки и 14 сутки после имплантации саркомы по сравнению с введением физиологического раствора мышам, которым вводили саркому. Эти результаты указывают на то, что антагонисты GM-CSF уменьшают постоянную боль у мышей, которым вводили саркому.
Оценка поведения, связанного с болью при передвижении
У животных, которым вводили саркому (которым вводили физиологический раствор), развивается поведение, связанное с болью при передвижении, что оценивают по использованию конечности и защите при вынужденном передвижении (способности удерживаться на вращающемся стержне), по сравнению с животными с имитацией (которым вводили физиологический раствор). Введение антагонистов GM-CSF значительно повышает показатель использования конечности и показатель защиты при вынужденном передвижении у мышей, которым вводили саркому, на 10 сутки и 14 сутки после имплантации саркомы по сравнению с введением физиологического раствора мышам, которым вводили саркому. Эти результаты указывают на то, что антагонисты GM-CSF уменьшают боль при передвижении у мышей, которым вводили саркому.
Оценка поведения, связанного с болью, вызванной прикосновением
У животных, которым вводили саркому (которым вводили физиологический раствор), развивается поведение, связанное с болью, вызванной прикосновением, что оценивают по защите, вызванной пальпацией, и отдергиванию, вызванному пальпацией, по сравнению с животными с имитацией (которым вводили физиологический раствор). Введение антагонистов GM-CSF значительно снижает защиту, вызванную пальпацией, и отдергивание, вызванное пальпацией, у мышей, которым вводили саркому, на 10 сутки и 14 сутки после имплантации саркомы по сравнению с введением физиологического раствора мышам, которым вводили саркому. Эти результаты указывают на то, что антагонисты GM-CSF уменьшают боль, вызванную прикосновением, у мышей, которым вводили саркому.
Пример 4
Болеутоляющие эффекты антагонистов GM-CSF
Болеутоляющие эффекты антагонистов GM-CSF при хроническом артрите, индуцированном полным адъювантом Фрейнда (CFA), у крыс исследуют с применением исследования вокализации в сравнении с индометацином, использованным в качестве контрольного вещества.
В данное исследование включены пятьдесят (50) самцов крыс Lewis (LEWIS LEW/Crl Ico) с массой тела от 150 г до 220 г в начале экспериментальной фазы. Всех животных держат по меньшей мере 5 суток перед экспериментом и содержат в помещении с контролируемой температурой (19,5-24,5°С), относительной влажностью (45-65%) и двенадцатичасовым циклом света и темноты при свободном доступе к фильтрованной водопроводной воде и стандартному гранулированному лабораторному корму на протяжении всего исследования. На хвостах животных делают индивидуальные идентификаторы.
На 0 сутки (D0) у крыс индуцируют артрит внутрикожной инъекцией в хвост 0,05 мл суспензии Mycobacterium butyricum в минеральном масле (10 мг/мл). На 14 сутки (D14) крыс с артритом включают в исследование согласно их способности к вокализации при аккуратном сгибании задней лапы и по их показателю артрита, оцениваемому с использованием показателя воспаления для каждой задней и передней лапы (см. Kuzuna et al., Chem. Pharm. Bull. (Tokyo) 23:1184-1191, 1975 и Pearson et al., Arthritis Rheum. 2:440-459, 1959).
Показатели животных определяют на основании следующих критериев: показатель 0: нормальный внешний вид; показатель 1: эритема; показатель 2: эритема с незначительным отеком; показатель 3: выраженное воспаление без анкилоза; показатель 4: анкилоз. В исследование включают только животных, способных к вокализации при осторожном сгибании и демонстрирующих показатель 2 или 3.
В исследование включают четыре группы по 10 крыс в каждой. В группе 1 (наполнитель) на 14 сутки (D14) после отбора крысам внутривенно вводят наполнитель (физиологический раствор). На 18 сутки (D18) оценивают интенсивность ноцицепции осторожным сгибанием задней лапы и для каждого животного отмечают интенсивность уровня вокализации. В группе 2 (4 суток) на 14 сутки (D14) после отбора крысам внутривенно вводят антитело, специфичное в отношении GM-CSF. На 18 сутки (D18) оценивают интенсивность ноцицепции осторожным сгибанием задней лапы и для каждого животного отмечают интенсивность уровня вокализации. В группе 3 (24 часа) на 17 сутки после инъекции CFA крысам внутривенно вводят антитело, специфичное в отношении GM-CSF, или антитело, специфичное в отношении рецептора GM-CSF. Через 24 часа оценивают интенсивность ноцицепции осторожным сгибанием задней лапы и для каждого животного отмечают интенсивность уровня вокализации. В группе 4 (индометацин) на 18 сутки (D18) оценивают интенсивность ноцицепции осторожным сгибанием задней лапы через час после перорального введения индометацина (10 мг/кг). Также для каждого животного отмечают интенсивность уровня вокализации. Исследуемые вещества вводят слепым и случайным образом внутривенным способом введения в объеме 5 мл/кг, в то время как индометацин вводили пероральным способом введения в объеме 10 мл/кг.
Антагонисты GM-CSF демонстрируют существенные болеутоляющие эффекты. Статистическую значимость между группами лечения и группой наполнителя определяют критерием Даннета с применением остаточной дисперсии после однофакторного дисперсионного анализа. Антитело, специфичное в отношении GM-CSF, и антитело, специфичное в отношении рецептора GM-CSF, значительно уменьшают боль в модели ревматоидного артрита на крысах через 24 часа или через 4 суток после однократного введения антител.
Пример 5
Антагонисты GM-CSF эффективны в лечении боли, обусловленной остеоартритом
В данном эксперименте авторы изобретения использовали моноклональное антитело, специфичное в отношении GM-CSF, для демонстрации того, что антагонист GM-CSF может быть эффективен для лечения боли, обусловленной остеоартритом.
Модель коллаген-индуцированного остеоартрита (ОА) на мышах
Мышам C57BL/6 проводят внутрисуставное введение 1 единицы коллагеназы VII типа в правый коленный сустав на 0 и 2 сутки для индукции нестабильности сустава (см. Blom et al. (2004) Osteoarthritis Cartilage. 12; 627-35).
Лечение антителом против GM-CSF
20 мышей случайным образом разделяли на 2 группы (10 мышей на группу).
Группа 1 (n=10): антитело против GM-CSF (22E9).
Группа 2 (n=10): контрольное антитело изотипа lgG2a.
Мышам проводили внутрибрюшинные введения три раза в неделю на протяжении 6 недель в дозе 250 мкг/мышь/введение антитела против GM-CSF (22E9) или контрольного антитела изотипа lgG2a. Лечение начинали за 4 суток до индукции ОА (профилактическое), то есть мышам проводили введения на -4 сутки, -2 сутки, 0 сутки (сутки первой инъекции коллагеназы), затем 3 раза в неделю до окончания эксперимента через 6 недель. На 2, 4 и 6 неделях у мышей проводили забор крови. Проводили очистку как контрольного антитела, так и антитела против GM-CSF, чтобы они содержали менее 10 эндотоксиновых единиц на мл.
Антитело 22E9 использовали в качестве типичного антитела против GM-CSF. 22E9, изотипа lgG2a, представляет собой крысиное противомышиное антитело, специфичное в отношении GM-CSF. 22E9 получали от AbD Serotec (Martinsried, Germany; номер по каталогу 1023501). Существуют альтернативные поставщики, например eBioscience (SanDiego, CA, USA, номер по каталогу 14-7331).
Гистологическое исследование
Через 6 недель после последних инъекций проводили гистологическое исследование коленных суставов мышей. Коленные суставы собирали, фиксировали, декальцинировали, заключали в парафин и проводили приготовление срезов толщиной 7 мкм на микротоме. Микропрепараты окрашивали сафранином-O/быстрым зеленым и гематоксилином/эозином для демонстрации патологии суставов. Исследованная патология включала повреждение хряща, синовит, образование остеофитов и деформацию суставов.
Система оценки, использованная для патологии хряща, представляла собой следующее.
Степень
Стадия
Для получения показателя степень умножали на стадию.
Эта система оценки основана на признанном способе оценки гистопатологии ОА при клиническом и экспериментальном ОА. См. Pritzker et al. (2006) Osteoarthritis Cartilage; 14; 13-29. Степень определяют как глубину прогрессирования ОА в хрящ. Стадию определяют как горизонтальную степень поражения хряща, то есть, насколько поражен хрящ. Степень умножают на стадию с получением показателя для получения общего показателя, чтобы представить комбинированную оценку тяжести и степени ОА. Оценивают до шести срезов на мышь.
Для получения показателя степень умножали на стадию.
Следующую систему оценки использовали для синовита (система оценки синовиального слоя).
Измерения боли
Индикатором боли, используемым в моделях ОА, является дифференциальное распределение массы тела, измеряемое с использованием устройства для измерения нарушения функции. Это устройство измеряет изменения в распределении массы тела между оперированной и противоположной неоперированной задней конечностью. Мышам дают привыкнуть к оборудованию три раза перед экспериментом. Массу тела, распределенную на каждую заднюю конечность, измеряли на протяжении пятисекундного периода. Затем усредняли три независимых измерения, проведенных у каждой мыши для каждой временной точки. Измерения проводили 2 раза в неделю на всем протяжении эксперимента. Результаты представлены как конечность с инъекцией коллагеназы/контрольная конечность × 100.
Результаты
Для всех проанализированных при гистологическом исследовании областей (за исключением медиальной бедренной), то есть, латеральной бедренной, латеральной большеберцовой и медиальной большеберцовой, у мышей, получавших лечение антителом против GM-CSF, была отчетливая тенденция к менее выраженному заболеванию. Результаты показаны на Фиг.1.
Оценка распределения массы тела в качестве критерия боли, связанной с артритом, продемонстрировала значительное смещение массы тела от колена с артритом, начиная с 27 суток в группе, получавшей лечение моноклональным антителом (mAb) против GM-CSF, по сравнению с группой, получавшей лечение контрольным mAb. Результаты показаны на Фиг.2.
Мыши, получавшие лечение антагонистом GM-CSF, продемонстрировали менее выраженное заболевание по сравнению с мышами, получавшими лечение контрольным антителом. Мыши, получавшие лечение антагонистом GM-CSF, также продемонстрировали значительно менее выраженную боль на поздних стадиях заболевания по сравнению с мышами, получавшими лечение контрольным антителом. Мыши, получавшие лечение антителом контроля изотипа, продемонстрировали значительно более выраженные признаки остеоартрита по сравнению с мышами, получавшими антитело, специфичное в отношении GM-CSF. Это демонстрирует, что антагонисты GM-CSF эффективны в лечении боли, обусловленной остеоартритом.
Пример 6
Антагонисты GM-CSF эффективны в лечении воспалительной боли/модель с mBSA
Следующий эксперимент демонстрирует, что антагонисты GM-CSF также эффективны в лечении воспалительной боли. Для этого у мышей-нокаутов по GM-CSF и у контрольных мышей индуцировали моносуставной mBSA/IL-1-артрит. Боль оценивали с или без введения индометацина, вещества, облегчающего боль, в различных временных точках с использованием устройства для измерения нарушения функции.
Мыши
В четырех группах лечения использовали 24 самца мышей C57BL/6 и 24 самца мышей GM-CSF-/- (см. Пример 1).
Группа 1: GM-CSF КО (n=12): моделированный BSA/IL-1.
Группа 2: GM-CSF КО (n=12): метилированный mBSA/IL-1 + индометацин.
Группа 3: C57BL/6 дикого типа (n=12): метилированный BSA/IL-1.
Группа 4: C57BL/6 дикого типа (n=12): метилированный BSA/IL-1 + индометацин.
Индукция моносуставного артрита
Моносуставной артрит индуцировали внутрисуставной инъекцией 10 мкл mBSA (20 мг/мл) в физиологическом растворе в коленный сустав и 10 мкл физиологического раствора в противоположный коленный сустав. 20 мкл IL-1β (250 нг) подкожно вводили ежедневно в течение 3 суток. Ответ обычно развивается между 4 и 7 сутками после инъекции mBSA и проходит к 28 суткам. Нарушение функции исследовали на 2, 3, 4, 5 и 7 сутки.
Индометацин (Sigma) представляет собой нестероидное противовоспалительное лекарственное средство, обычно используемое для уменьшения лихорадки, боли, тугоподвижности и отека. Он действует, ингибируя образование простагландинов. 1 мг/кг индометацина вводили внутрибрюшинно в группах 2 и 4 за один час перед оценкой боли с использованием устройства для измерения нарушения функции.
Определение боли
Устройство для измерения нарушения функции (Dual Weight Averager) использовали для автоматической и воспроизводимой оценки обезболивающей активности измерением распределения массы тела по двум задним лапам. Силу, прикладываемую каждой конечностью (измеренную в граммах), усредняют за выбранный пользователем период времени, выявляя посредством этого любую тенденцию животного к смещению массы тела с одной стороны на другую, обеспечивая таким образом количественное измерение нарушения функции.
Массу тела, распределенную на каждую заднюю конечность, измеряли на протяжении пятисекундного периода. Затем усредняли 3 независимых измерения, проведенных у каждой мыши для каждой временной точки. Результаты представлены как конечность с инъекцией/контрольная конечность × 100. Таким образом, значение 100 означает равное распределение массы тела между правой и левой конечностью. Значение меньше 100 означает распределение на конечность с инъекцией (левую) меньшей массы по сравнению с контрольной конечностью (правой).
Результаты
В данной модели инъекцией mBSA индуцируют синовит в коленном суставе. На 7 сутки коленные суставы исследовали визуально и присваивали им показатель от 0 (норма) до 3 (тяжелое воспаление) (Фиг.3). Левое колено, в которое вводили mBSA, было значительно более воспаленным по сравнению с правым коленом (в которое вводили физиологический раствор) (р>0,001 для мышей С57 и р=0,02 для мышей GM-CSF-/-) (Фиг.3). Действительно, всем правым коленям, в которые вводили физиологический раствор, был присвоен показатель 0. Для обеих линий не было значимых различий между мышами, получавшими и не получавшими лечение индометацином.
Мыши C57BL/6 продемонстрировали значительно более выраженную боль (как измерено по смещению массы тела от колена, в которое вводили mBSA) по сравнению с мышами GM-CSF-/- после индукции моносуставного mBSA/IL-1-артрита (Фиг.4). Это было значимо, начиная с 4 суток.
Мыши C57BL/6, получавшие лечение индометацином, продемонстрировали значительно менее выраженную боль по сравнению с мышами, не получавшими лечение индометацином, после индукции моносуставного mBSA/IL-1-артрита (Фиг.4), таким образом, что результаты были похожи на результаты у мышей GM-CSF-/-. Поскольку мыши GM-CSF-/- не демонстрировали боли, лечение индометацином не имело эффекта.
Уровни значимости являются следующими.
Мыши C57BL/6: группа, получавшая лечение индометацином, против группы, не получавшей лечение индометацином (группа 4 против группы З): 4 сутки, р<0,0001; 5 сутки, р<0,001; 7 сутки, р=0,007.
Мыши GM-CSF-/- против мышей C57BL/6 (группа 1 против группы 3): 4 сутки, р<0,0001; 5 сутки, р<0,0001; 7 сутки, р=0,022.
Эти результаты указывают на то, что в модели моносуставного mBSA/IL-1-артрита у мышей C57BL/6 значительная боль развивается, начиная с 4 суток, в то время как мыши GM-CSF-/- не демонстрируют каких-либо существенных признаков боли. Следовательно, антагонисты GM-CSF высокоэффективны в лечении воспалительной боли.
Пример 7
Антагонисты GM-CSF эффективны в лечении воспалительной боли/модель с CFA
Следующий эксперимент является дополнительным экспериментом, демонстрирующим эффективность антагонистов GM-CSF в лечении воспалительной боли. В этом эксперименте воспалительную боль индуцировали полным адъювантом Фрейнда. Как в Эксперименте 5, боль оценивали с или без введения индометацина, вещества, облегчающего боль, в различных временных точках с использованием устройства для измерения нарушения функции.
Мыши
В каждой из трех групп лечения использовали 12 самцов мышей C57BL/6 и 12 самцов мышей GM-CSF-/- (см. Пример 1).
Группа 1: C57BL/6 дикого типа (n=12): CFA.
Группа 2: C57BL/6 дикого типа (n=12): CFA + индометацин.
Группа 3: GM-CSF КО (n=12): CFA.
Индукция воспалительной боли
Полный адъювант Фрейнда (CFA) (Sigma) содержит инактивированный нагреванием штамм Mycobacterium tuberculosis H37Ra в минеральном масле в концентрации 1 мг/мл. CFA тщательно перемешивали на вортексе для обеспечения включения инактивированных нагреванием бактерий в суспензию (Kamala Т (Hock immunization: a humane alternative to mouse footpad injections. J Immunol Methods 328:204-214. 2007). Сразу после перемешивания на вортексе адъювант набирали в стеклянный шприц с использованием иглы 19 размера. Из шприца аккуратно удаляли пузырьки и снимали иглу. Каждой мыши проводили подкожную инъекцию 20 мкл эмульсии CFA в левую заднюю лапу (подушечку лапы). 1 мг/кг индометацина вводили внутрибрюшинно (см. Эксперимент 5) мышам в группе 2 за один час перед оценкой боли.
Определение боли
Как в Эксперименте 5, устройство для измерения нарушения функции (Dual Weight Averager) использовали для автоматической и воспроизводимой оценки обезболивающей активности измерением распределения массы тела по двум задним лапам. Массу тела, распределенную на каждую заднюю конечность, измеряли на протяжении пятисекундного периода. Затем усредняли 3 независимых измерения, проведенных у каждой мыши для каждой временной точки. Результаты представлены как конечность с инъекцией/контрольная конечность × 100. Таким образом, значение 100 означает равное распределение массы тела между правой и левой конечностями. Значение меньше 100 означает распределение на конечность с инъекцией (левую) меньшей массы по сравнению с контрольной конечностью (правой). Нарушение функции исследовали через 24, 48 и 72 часа после инъекции CFA.
Результаты
После подкожной инъекции CFA в подушечку левой лапы у мышей развивался отек подушечки левой лапы, сходный по величине с мышами C57BL/6 (группа 1) и GM-CSF-/- (группа 3). Мыши C57BL/6, получавшие лечение индометацином (группа 2), также продемонстрировали отсутствие различий степени отека (см. Фиг.5). Ни в одной группе не было отека противоположной (правой) лапы.
Оценка распределения массы тела в качестве критерия боли показала, что у мышей C57BL/6 со временем развивалась значительно более выраженная боль, чем у мышей GM-CSF-/- через 48 (р=0,03) и 72 (р=0,0009) часов после инъекции CFA (Фиг.6). Удивительно, развития боли у мышей GM-CSF-/- не было. Лечение мышей C57BL/6 индометацином облегчало боль, таким образом, что показатели не отличались от показателей мышей GM-CSF-/- (Фиг.6). Через 72 часа после инъекции CFA боль у мышей C57BL/6, получавших лечение индометацином, была значительно менее выраженной, чем у мышей C57BL/6, не получавших лечение индометацином (р=0,05).
Описание уровней статистической значимости.
48 часов:
группа 3 против группы 1, р=0,03;
группа 2 против группы 1, р=0,09.
72 часа:
группа 3 против группы 1, р=0,0009;
группа 2 против группы 1, р=0,05.
Степень отека подушечек лап после инъекции CFA не отличалась у мышей GM-CSF-/- по сравнению с мышами C57BL/6. Кроме того, лечение мышей C57BL/6 индометацином не оказывало эффекта на отек, вероятно, ввиду того факта, что индометацин вводили только за час до измерения нарушения функции. Таким образом, отек большей частью уже развивался до осуществления первой инъекции индометацина через 24 часа.
В отличие от этого, после инъекции CFA у мышей C57BL/6 развивалась значительно выраженная боль, которую уменьшало введение индометацина. Мыши GM-CSF-/-, с другой стороны, не демонстрировали никаких признаков боли. Таким образом, эти эксперименты неожиданно демонстрируют, что несмотря на воспаление подушечек лап после инъекции CFA у всех мышей, мыши GM-CSF-/- не демонстрируют никаких признаков боли.
Пример 8
Терапевтическая эффективность антитела, специфичного в отношении GM-CSF, содержащего SEQ ID NO:1 или 2
Повторяют Примеры 2-7, где в качестве антагониста GM-CSF используют антитело, специфичное в отношении GM-CSF, содержащее аминокислотную последовательность вариабельной области тяжелой цепи, как показано в SEQ ID NO:1, или содержащее аминокислотную последовательность вариабельной области легкой цепи, как показано в SEQ ID NO:2. Может быть использован другой вид, не являющийся мышью, в частности, вид, в отношении которого антитело, используемое в данном эксперименте, является перекрестно реактивным. Предпочтительно, видом животного, используемым в данном эксперименте, является крыса.
Животные, получавшие лечение контрольным антителом, демонстрируют значительно более выраженные признаки боли по сравнению с животными, получавшими антитело, специфичное в отношении GM-CSF, содержащее аминокислотную последовательность вариабельной области тяжелой цепи, как показано в SEQ ID NO:1, или содержащее аминокислотную последовательность вариабельной области легкой цепи, как показано в SEQ ID NO:2. Это демонстрирует эффективность антител в лечении боли.
Пример 9
Терапевтическая эффективность антитела, специфичного в отношении GM-CSF, содержащего SEQ ID NO:3 или 4
Повторяют Примеры 2-7. В качестве антагониста GM-CSF используют антитело, специфичное в отношении GM-CSF, содержащее аминокислотную последовательность вариабельной области тяжелой цепи, как показано в SEQ ID NO:3, или содержащее аминокислотную последовательность вариабельной области легкой цепи, как показано в SEQ ID NO:4. Может быть использован другой вид, не являющийся мышью, в частности, вид, в отношении которого антитело, используемое в данном эксперименте, является перекрестно реактивным. Предпочтительно, видом животного, используемым в данном эксперименте, является крыса.
Животные, например, крысы, получавшие лечение контрольным антителом, демонстрируют значительно более выраженные признаки боли по сравнению с животными, получавшими антитело, специфичное в отношении GM-CSF, содержащее аминокислотную последовательность вариабельной области тяжелой цепи, как показано в SEQ ID NO:3, или содержащее аминокислотную последовательность вариабельной области легкой цепи, как показано в SEQ ID NO:4. Это демонстрирует эффективность антител в лечении боли.
Пример 10
Терапевтическая эффективность антител, специфичных в отношении GM-CSF, содержащих SEQ ID NO:5-20
Повторяют Примеры 2-7. В качестве антагониста GM-CSF используют антитело, специфичное в отношении GM-CSF, содержащее последовательность H-CDR3, выбранную из любой из SEQ ID NO:5-16. Предпочтительно указанные антитела дополнительно содержат последовательность H-CDR1 с SEQ ID NO:16, и/или последовательность Н-CDR2 с SEQ ID NO:18, и/или последовательность L-CDR1 с SEQ ID NO:19, и/или последовательность L-CDR2 с SEQ ID NO:20, и/или последовательность L-CDR3 с SEQ ID NO:21. Может быть использован другой вид, не являющийся мышью, в частности, вид, в отношении которого антитело, используемое в данном эксперименте, является перекрестие реактивным. Предпочтительно, видом животного, используемым в данном эксперименте, является крыса.
Животные, например крысы, получавшие лечение контрольным антителом, демонстрируют значительно более выраженные признаки боли по сравнению с животными, получавшими антитело, специфичное в отношении GM-CSF, использованное в данном примере. Это демонстрирует эффективность антител в лечении боли.
Пример 11:
Терапевтическая эффективность антител, специфичных в отношении GM-CSF, содержащих SEQ ID NO:21-26
Повторяют Примеры 2-7. В качестве антагониста GM-CSF используют антитело, специфичное в отношении GM-CSF, содержащее последовательность L-CDR1 с SEQ ID NO:22, и/или последовательность L-CDR2 с SEQ ID NO:23, и/или последовательность L-CDR3 с SEQ ID NO:24, и/или последовательность H-CDR1 с SEQ ID NO:25, и/или последовательность H-CDR2 с SEQ ID NO:26, и/или последовательность H-CDR3 с SEQ ID NO:27. Предпочтительно указанное антитело содержит все CDR с SEQ ID NO:22-28. Может быть использован другой вид, не являющийся мышью, в частности, вид, в отношении которого антитело, используемое в данном эксперименте, является перекрестно реактивным. Предпочтительно, видом животного, используемым в данном эксперименте, является крыса.
Животные, например крысы, получавшие лечение контрольным антителом, демонстрируют значительно более выраженные признаки боли по сравнению с животными, получавшими антитело, специфичное в отношении GM-CSF, использованное в данном примере. Это демонстрирует эффективность антител в лечении боли.
Пример 12:
Терапевтическая эффективность антител, специфичных в отношении рецептора GM-CSF
Повторяют Примеры 2-7. В качестве антагониста GM-CSF используют антитело, специфичное в отношении рецептора GM-CSF, содержащее аминокислотную последовательность последовательности H-CDR3, показанной в любой из SEQ ID NO:28-46. Может быть использован другой вид, не являющийся мышью, в частности, вид, в отношении которого антитело, используемое в данном эксперименте, является перекрестно реактивным. Предпочтительно, видом животного, используемым в данном эксперименте, является крыса.
Животные, например крысы, получавшие лечение контрольным антителом, демонстрируют значительно более выраженные признаки боли по сравнению с животными, получавшими антитело, специфичное в отношении рецептора GM-CSF, использованное в данном примере. Это демонстрирует эффективность антител в лечении боли.
Специалистам в данной области техники будет ясно, что изобретение, описанное здесь, может быть изменено и модифицировано иным образом, чем конкретно описано здесь. Следует понимать, что изобретение включает все такие изменения и модификации. Изобретение также включает все стадии, признаки, композиции и соединения, упомянутые или указанные в данном описании, по отдельности или совместно, и все и любые комбинации любых двух или более из указанных стадий или признаков.
СПИСОК ЛИТЕРАТУРЫ
Brennan et al., Pain 64:493-501, 1996.
Ghose et al., J Combin Chem: 1:55-68, 1999.
Hargreaves et al., 1988.
Knappik et al., J. Mol. Biol. 296:57, 2000.
Krebs et al., J. Immunol. Methods. 254:67, 2001.
Kuzuna et al., Chem. Pharm. Bull. (Tokyo) 23:1184-1191, 1975.
Lipinski et al., Adv Drug Del Rev: 23:3-25, 1997.
Luger et al., Pain 99:397-406, 2002.
Pearson et al., Arthritis Rheum. 2:440-459, 1959.
Rothe et al., J. Mol. Biol. 376:1182, 2008.
Schwei et al., J: Neuroscience 19:10886-10897, 1999.
| название | год | авторы | номер документа |
|---|---|---|---|
| Лечение боли | 2009 |
|
RU2712166C2 |
| Лечение остеоартрита | 2009 |
|
RU2712273C2 |
| ЛЕЧЕНИЕ РАССЕЯННОГО СКЛЕРОЗА | 2010 |
|
RU2539034C2 |
| АНТИТЕЛА, НЕЙТРАЛИЗУЮЩИЕ GM-CSF, ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ РЕВМАТОИДНОГО АРТРИТА ИЛИ В КАЧЕСТВЕ АНАЛЬГЕТИКОВ | 2014 |
|
RU2714919C2 |
| СПОСОБЫ ЛЕЧЕНИЯ БОЛИ, ВЫЗВАННОЙ ОСТЕОАРТРИТОМ, ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА ФАКТОРА РОСТА НЕРВОВ И СОДЕРЖАЩИХ ЕГО КОМПОЗИЦИЙ | 2006 |
|
RU2429013C2 |
| АНТИ-GM-CSF АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2447085C2 |
| АНТИТЕЛА ЧЕЛОВЕКА С ВЫСОКОЙ АФФИННОСТЬЮ К ФАКТОРУ РОСТА НЕРВОВ ЧЕЛОВЕКА | 2008 |
|
RU2473564C2 |
| СПОСОБ ИНГИБИРОВАНИЯ GMCSFRa У ПАЦИЕНТА | 2012 |
|
RU2639546C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ДИАБЕТА АНТАГОНИСТАМИ DLL4 | 2011 |
|
RU2587624C2 |
| АНТИ-IL-17F АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2605318C2 |
















Изобретение относится к медицине, а именно к терапии, и может быть использовано для лечения боли. Для лечения боли применяют антагонист гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) в качестве средства анальгетического действия. При этом средство применяют для лечения боли, выбранной из боли, обусловленной раком кости, боли, обусловленной остеоартритом, и послеоперационной боли. Антагонист представляет собой специфичное в отношении GM-CSF антитело, содержащее аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO:3 и аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO:4. Использование антагониста гранулоцитарно-макрофагального колониестимулирующего фактора эффективно при лечении боли различного генеза. 12 пр., 6 ил.
Применение антагониста гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) в качестве средства анальгетического действия для лечения боли, выбранной из боли, обусловленной раком кости, боли, обусловленной остеоартритом, и послеоперационной боли, где антагонист представляет собой специфичное в отношении GM-CSF антитело, содержащее аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO:3 и аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO:4.
| КРОВЕЛЬНЫЙ РУЛОННЫЙ МАТЕРИАЛ | 1993 |
|
RU2100387C1 |
| WO 2007092939 A2, 16.08.2007 | |||
| US 2007243225 A1, 18.10.2007 | |||
| WO 2006122797 A2, 23.11.2006. | |||
Авторы
Даты
2017-09-15—Публикация
2009-12-21—Подача