Создание новых рекомбинантных эластомерных белков является актуальной проблемой современной биомедицинской науки, так как находит свое приложение в разработках, связанных с расширением спектра универсальных биоматериалов для тканевой инженерии. Несмотря на значительные успехи, достигнутые в биоматериаловедении на сегодняшний день такие материалы все еще остро дефицитны [1].
В настоящее время в мировой практике тканевого инжиниринга используются несколько видов природных биокаркасных материалов, обладающих эластомерными свойствами, среди которых можно выделить коллаген, фибрин, фиброин (спидроин) [2].
Основными проблемами, стоящими на пути широкомасштабного производства и использования данных материалов являются: дороговизна их получения, необходимость проведения затратных процедур по обеззараживанию для предотвращения возможной передачи пациентам вирусных и прионных инфекций (в случае коллагена и фибрина), низкий уровень экспрессии подобных полипептидов в бактериальных продуцирующих системах, отсутствие выраженных элементарных эластомерных мотивов [3-5].
Науке, между тем, известен класс природных биополимеров называемых резилинами [6], выполняющих функцию прыжковых и маховых «пружин» у таких насекомых как: блоха, саранча, чернотелки и т.д. Вставки из резилина находятся в главных суставах прыгательных конечностей и крыльев данных насекомых, удерживаемые специальными хитиновыми «триггерами». Перед прыжком резилиновые элементы запасают энергию, а когда насекомое спускает «триггер», упругий белок за одну миллисекунду распрямляет лапки или крылья, придавая насекомому мощный импульс [7-9]. За жизнь насекомого эти сочленения срабатывают миллионы раз, и резилин, входящий в состав этих сочленений, не обновляясь, нисколько не срабатывается, не устает и не теряет своих свойств. Расправляясь, сжатый резилин отдает 92% запасенной энергии, в то время как белки эластины и коллагены, входящие в состав связок у млекопитающих, - до 90%, а лучшая резина – лишь 80%. Из сказанного следует, что подобные белки имеют ценность не только как материалы для биомедицины, но и обладают определенным потенциалом для технологических целей, где требуется высокая эластичность [7].
В базах данных аннотирован белок класса резилинов насекомых чернотелок (Tribolium castaneum, T. castaneum) (NCBI Reference Sequence: NP_001182329.1). Между тем, из нашего опыта стало очевидно, что эффективность продукции подобного полноразмерного резилина в прокариотических экспрессирующих системах в рекомбинантном виде также не достаточно высока, поэтому была проанализирована аминокислотная последовательность данного белка, в ходе чего выявлен минимальный мотив, состоящий из 23 аминокислотных остатков QNGGXZSSTYGPPGQGGNGFGGG («X»=аминокислоты R, K; «Z»=аминокислоты P, L). Этот мотив, периодически и последовательно повторяется в центральной части молекулы резилина T. castaneum, образуя его центральный домен, ответственный, по всей видимости, за эластомерные свойства.
Данный минимальный мотив получил название минимального эластомерного мотива резилина чернотелок (триболин-1, tribolinum-1, Trib-1) (см. табл.1.).
Домен, состоящий, как минимум, из 4-х повторяющихся минимальных эластомерных мотивов, получил название эластомерного домена белка резилина (триболин-2, tribolinum-2, Trib-2) (см. приложения SEQ ID NO:4).
Нами разработан подход, который также явился предметом данного изобретения, направленный на повышение уровня экспрессии белка резилина в прокариотических системах, за счет его усечения до четырех последовательно объединенных друг с другом минимальных эластомерных мотивов. Важно отметить, что в таком виде резилин сохраняет эластомерную составляющую, обладает меньшей молекулярной массой и оптимальным аминокислотным составом, позволяющим получать его с высокой степенью эффективности рекомбинантным путем в бактериальных продуцирующих системах, таких как Escherichia coli.
Между тем, при разработке каркасных 3D-биоматериалов для инжиниринга тканей, возникает необходимость обеспечения возможности планирования шага поперечной химической «сшивки» цепей пептида, лежащего в основе графта, что используется при создании материалов с разной степенью пористости. С учетом всего этого, последовательность минимального эластомерного мотива Trib-1 была оптимизирована на генно-инженерном уровне. При этом, комплекс мер, направленных на оптимизацию, также явился предметом настоящего изобретения. Для этой цели последовательность Trib-1 подвергалась сайт-направленному мутагенезу, при котором производились следующие аминокислотные замены: Q1E, N2D, Q15K (см. табл.1.). Необходимость данных замен продиктована тем, что для последующей химической сшивки карбодиимидным способом, более удобно, когда в положениях «1» и «2» молекулы Trib-1 находятся не амиды аспарагиновой и глутаминовой кислот, а сами кислоты. В случае же использования глутарового альдегида в качестве сшивающего агента, удобно, когда в положении «15» будет располагаться аминокислота лизин.
Таблица 1
Технический результат настоящего изобретения заключается в создании синтетического гена, кодирующего мутантный эластомерный домен белка резилина T. castaneum (tribolinum-2mut, Trib-2mut), состоящий из четырех повторяющихся минимальных эластомерных мотивов резилина (Trib-1mut), создании экспрессионной плазмиды pGDTrib2mut c геном trib-2mut (см. SEQ ID NO:3), получении собственно мутантного эластомерного домена резилина T. castaneum (Trib-2mut), а также создании полимерного материала на основе данного белка посредством обработки очищенного рекомбинантного белка Trib-2mut специфическими реагентами для химической перекрестной сшивки входящих в его состав аминокислот.
Позиционируемый технический результат достигается созданием рекомбинантного белка Trib-2mut с молекулярным весом около 15 кДа.
Технический результат настоящего изобретения достигается за счет использования минимального эластомерного мотива резилина T. castaneum (Trib-1mut) в качестве элементарного эластомерного звена рекомбинантного домена Trib-2mut.
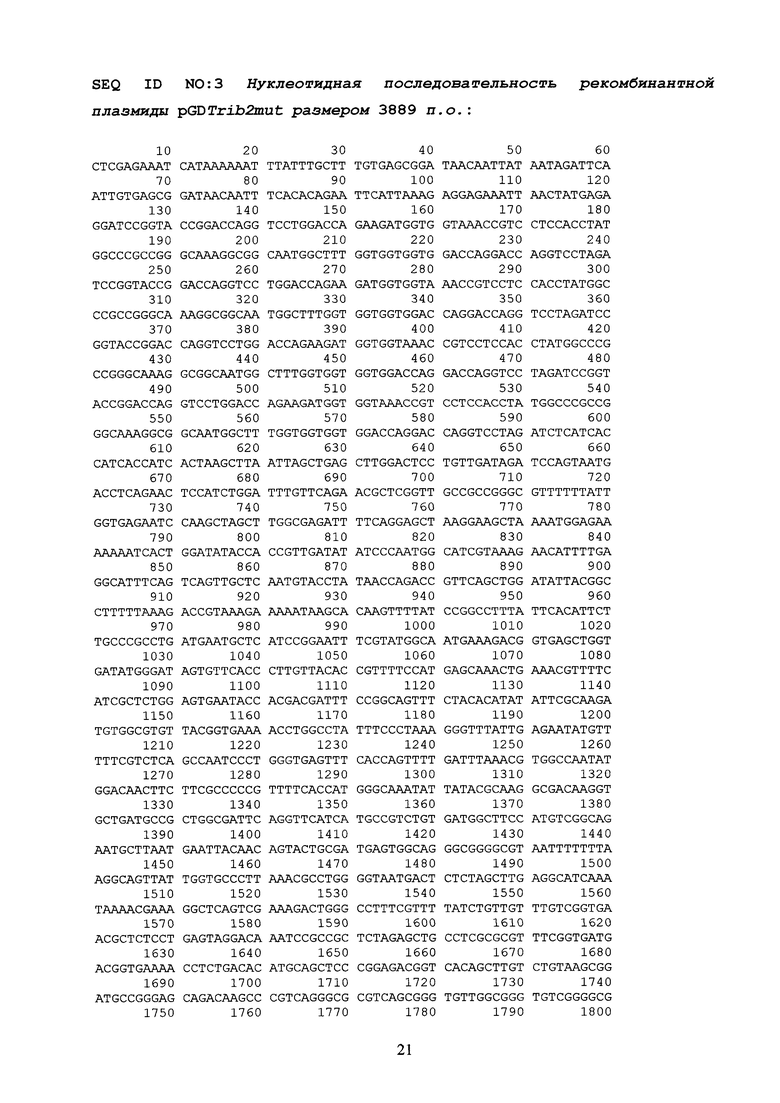
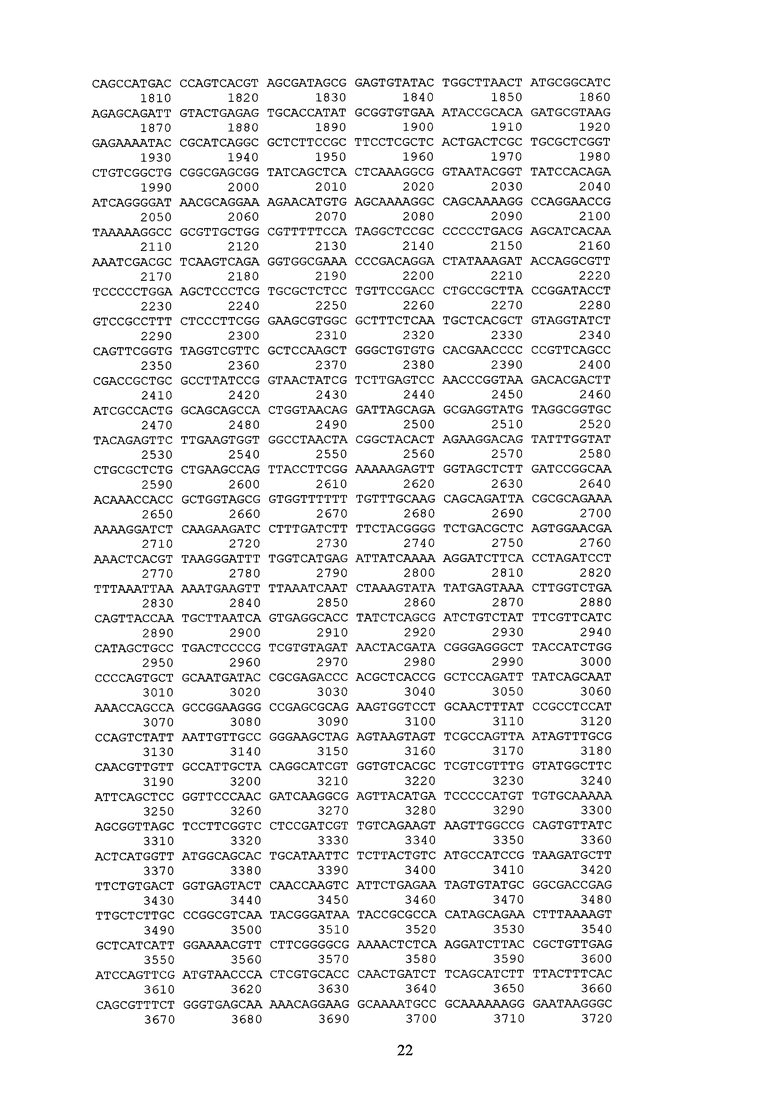
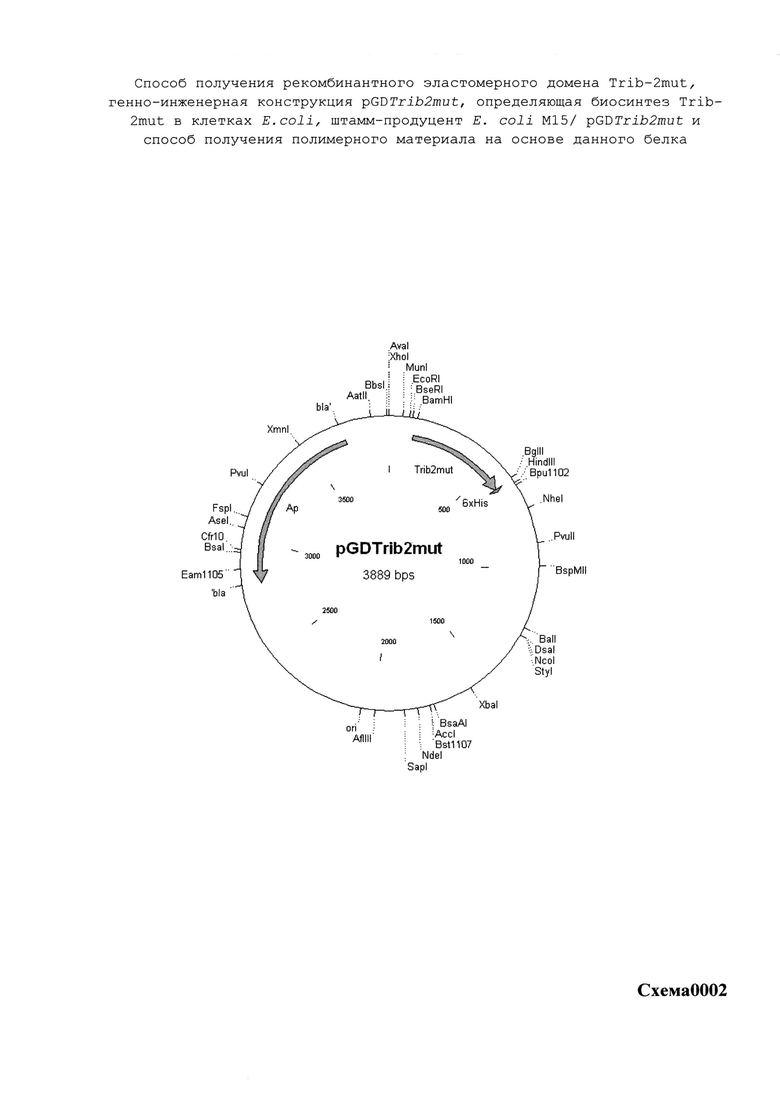
Указанный технический результат достигается созданием рекомбинантной плазмидной ДНК pGDTrib2mut 3889 п.н. (см. SEQ ID NO:3) содержащей синтетический оперон с геном эластомерного домена trib-2mut (115 - 595 п.н.), включающий ранний промотор бактериофага Т5, нуклеотидную последовательность, кодирующую собственно белок Trib-2mut и терминатор транскрипции; ген бета-лактамазы, детерминирующий устойчивость к антибиотику ампициллину и сайт инициации репликации типа ColE1. Таким образом, рекомбинантная плазмидная ДНК pGDTrib2mut призвана обеспечить эффективную экспрессию белка Trib-2mut в клетках E.coli.
Технический результат достигается также тем, что штамм E.coli M15 (Qiagen), трансформированный экспрессионным плазмидным вектором pGDTrib2mut является продуцентом целевого белка Trib-2mut.
Технический результат также достигается посредством специфической обработки очищенного рекомбинантного белка Trib-2mut химическим реагентом для сшивки аминокислот (1-Этил-3-(3-диметиламинопропил)карбодиимид, глутаровый альдегид) посредством формирования ковалентных связей между такими аминокислотами как лизин, глутаминовая кислота, аспарагиновая кислота.
ОПИСАНИЕ ПРОЦЕССА ДОСТИЖЕНИЯ ТЕХНИЧЕСКОГО РЕЗУЛЬТАТА
1. Создание плазмидного экспрессионного вектора pGDTrib2mut
1.1. Химический синтез олигонуклеотидов
Все олигонуклеотиды были синтезированы твердофазным амидофосфитным методом и очищены с помощью электрофореза в ПААГ (ЗАО «Евроген»).
1.2. Получение и клонирование гена trib-2mut
В соответствии с замыслом настоящего изобретения предложен ступенчатый способ получения, клонирования и экспрессии синтетического гена, кодирующего мутантный триболин-2 (Trib-2mut).
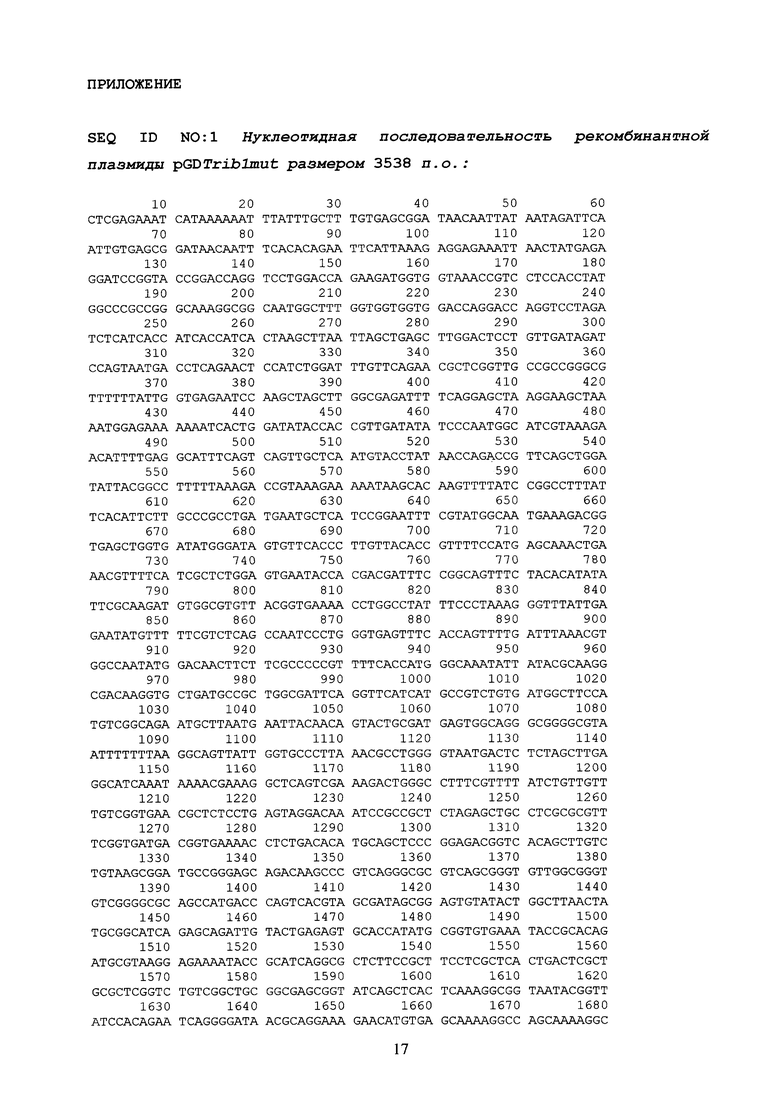
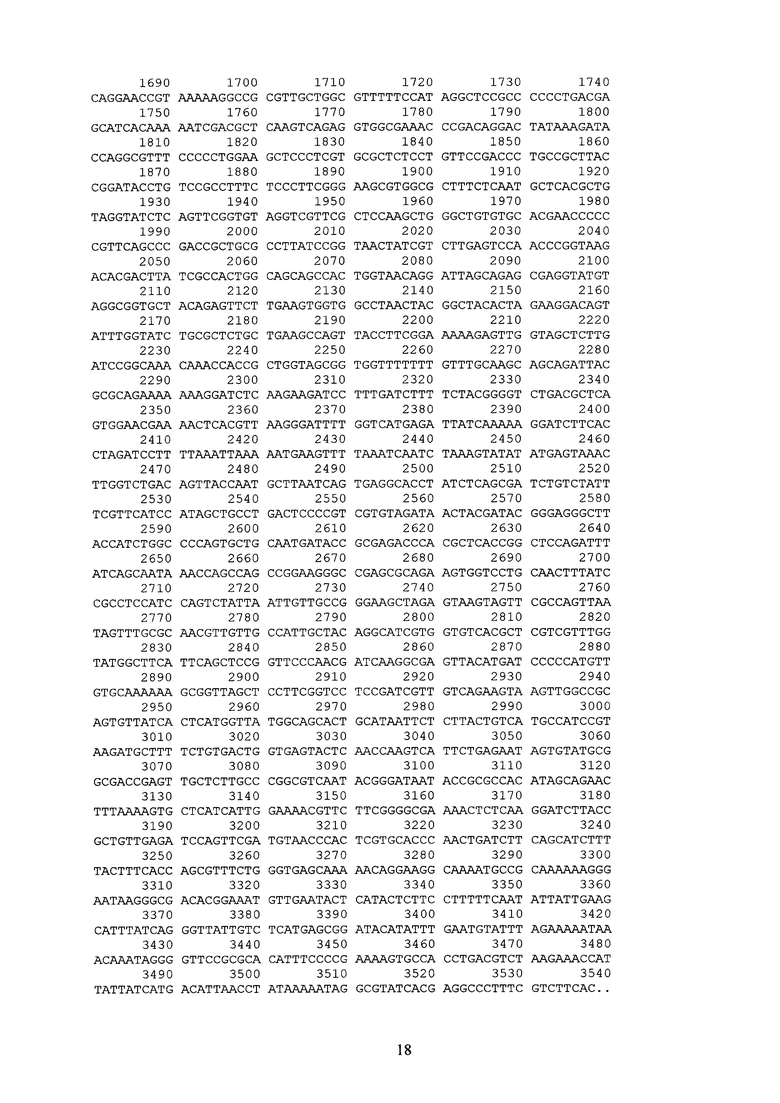
1 стадия: получение и клонирование гена trib-1mut в составе промежуточного вектора pGDTrib1mut (см. SEQ ID NO:1 приложения);
2-я стадия: получение и клонирование гена trib-2mut в составе конечного вектора pGDTrib2mut (см. SEQ ID NO:3 приложения).
1.2.1. Получение и клонирование гена trib-1mut
Сборка гена trib-1mut производилась безлигазным методом PIPE (Polymerase Incomplete Primer Extension) [10]. Данный метод заключается в том, что встраивание целевого гена в необходимый вектор сводится к последовательному концевому наращиванию ферментативно линеаризованного плазмидного вектора (в нашем случае pQE16-BamHI/BglII) с помощью ПЦР при участии синтетических корректирующих праймеров.
Как рекомендовано в методических пособиях [11], последовательности прямого и обратного корректирующих праймеров (см. табл.2.) были спланированы таким образом, чтобы один из их концов был комплементарен концевым участкам линеаризованного вектора, в то время как некомплементарные концы служили для наращивания гена trib-1mut (в табл.2. комплементарные области к вектору подчеркнуты).
Размер данных олигонуклеотидов был лимитирован, т.к. рекомендуемая область перекрывания корректирующего праймера и вектора должна быть более 20 п.н. [11]. По этой причине, процесс синтеза гена методом PIPE был разбит на два этапа, на каждом из которых использовалась новая пара корректирующих праймеров спланированных внахлест с вектором.
При реализации методики PIPE, последовательность действий, на каждом из двух этапов, подтверждается следующими примерами:
a) в 0,5 мл пробирке для ПЦР были смешаны следующие реагенты:
• 1 мкл (приблизит.5 нг) предварительно линеаризованного по сайтам BamHI и BglII (Fermentas, Литва) плазмидного вектора pQE16((QIAGEN)), полученного из штамма E.coli (dam+), с целью метилирования сайтов узнавания для селективной рестриктазы DpnI. Исходный вектор pQE-16 обладал следующими характеристиками: размер вектора (п.н.) - 3996 п.н., T5-промотер/lac-оператор элемент - 7–87 п.н., T5 сайт инициации транскрипции – 61 п.н., последовательность гена дегидрофолатредуктазы - 133–690 п.н. (в дальнейшем удаляется из вектора), 6xHis-tag - 703–720 п.н., регион терминации транскрипции Lambda t0 - 743–837 п.н., сайт инициации репликации ColE1 – 2173 п.н., ген β-лактамазы - 3791–2931 п.н.
• 0,5 мкл прямого корректирующего праймера FT (50 пмоль/мкл) (табл.2)
• 0,5 мкл обратного корректирующего праймера RT (50 пмоль/мкл) (табл.2)
• 2 мкл смеси dNTP mix (2,5 mM каждого)
• 2,5 мкл 10x буфера для ДНК-полимеразы
• стерильная вода до 24,5 мкл
• 0,5 мкл Pfu Ultra ДНК-полимеразы(2,5 Ед/мкл, Agilent)
б) Параметры амплификации: 95оС – 2 мин; (95оС – 30 с, 55 оС - 45 с, 68оС – 10 мин)x25циклов; 10оС – хранение. Режим амплификации – точный.
в) продукты ПЦР инкубировались в течение 2 часов при 37 °C с 1 мкл (10U) эндонуклеазы рестрикции DpnI (Fermentas, Литва) в соответствующем буфере. Данная стадия необходима для разрушения исходной плазмидной ДНК pQE16 BamHI/BglII, полученной из штамма E.coli (dam+), т.к. она может осложнить реализацию последующих этапов.
Таблица 2
RT1: AGCTTAGTGATGGTGATGGTGATGAGATCTAGGACCTGGTCCTGGTCCACCACCACCAAAGCCATTG
2-й этап сборки trib-1mut и 2-я пара праймеров
RT2: GGTCCTGGTCCACCACCACCAAAGCCATTGCCGCCTTTGCCCGGCGGGCCATAGGTGGAGGACGGTT
г) 5 – 10 мкл данной смеси использовались в дальнейшем для трансформации химически или электрокомпетентных клеток E.coli (M15, DH5a) в соответствии со стандартными протоколами трансформации [12]. После проведения процедуры трансформации и стадии предварительной инкубации, 20-100 мкл трансформированных клеток переносились на агар LB с антибиотиком ампицилином для последующей селекции трансформантов.
д) Плазмидная ДНК выделялась методом SDS щелочного лизиса [13], проверялась методом рестрикционного анализа и секвенирования на автоматическом секвенаторе.
Таким образом, была получена промежуточная векторная конструкция pGDTrib1mut (см. SEQ ID NO:1) содержавшая мутантную нуклеотидную последовательность trib-1mut, гомологичную минимальному эластомерному мотиву известной последовательности гена резилина T. castaneum.
1.2.2. Получение и клонирование гена trib-2mut.
Ген trib-2mut (SEQ ID NO:4; схема0001) был собран посредством 2-х-этапного лигирования основанного на использовании комплекса генно-инженерных приемов, получившего название fusion-технологии.
На 1-ом этапе производилась обработка молекул первого промежуточного вектора pGDTrib1mut системами эндонуклеаз рестрикции BamHI/PvuI и BglII/PvuI (двум системам соответствовали две микропробирки: №1 и №2). После 1,5 часовой экспозиции в термостате при 37оС, содержимое пробирок №1 и №2 наносили на треки №1 и №2 заранее подготовленного 1% агарозного геля, при этом, в качестве маркера молекулярных весов, на трек №3, наносили ДНК фага лябда, гидролизованную по рестрикционным сайтам EcoRI/HindIII. После завершения процедуры электрофореза, из агарозного геля вырезались необходимые для дальнейшего лигирования фрагменты плазмиды pGDTrib1mut. Из соответствующей области трека №1 вырезался BamHI/PvuI-фрагмент размером 2795 п.о., в то время как из трека №2 экстрагировался BglII/PvuI-фрагмент размером 860 п.о.
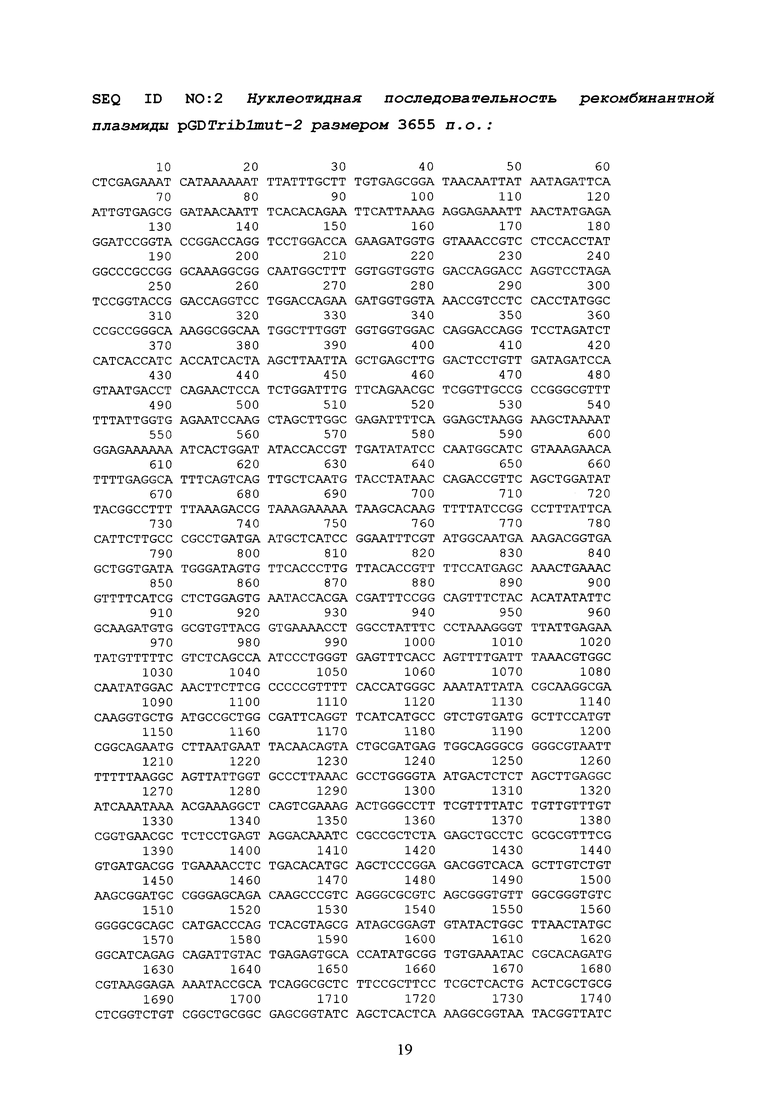
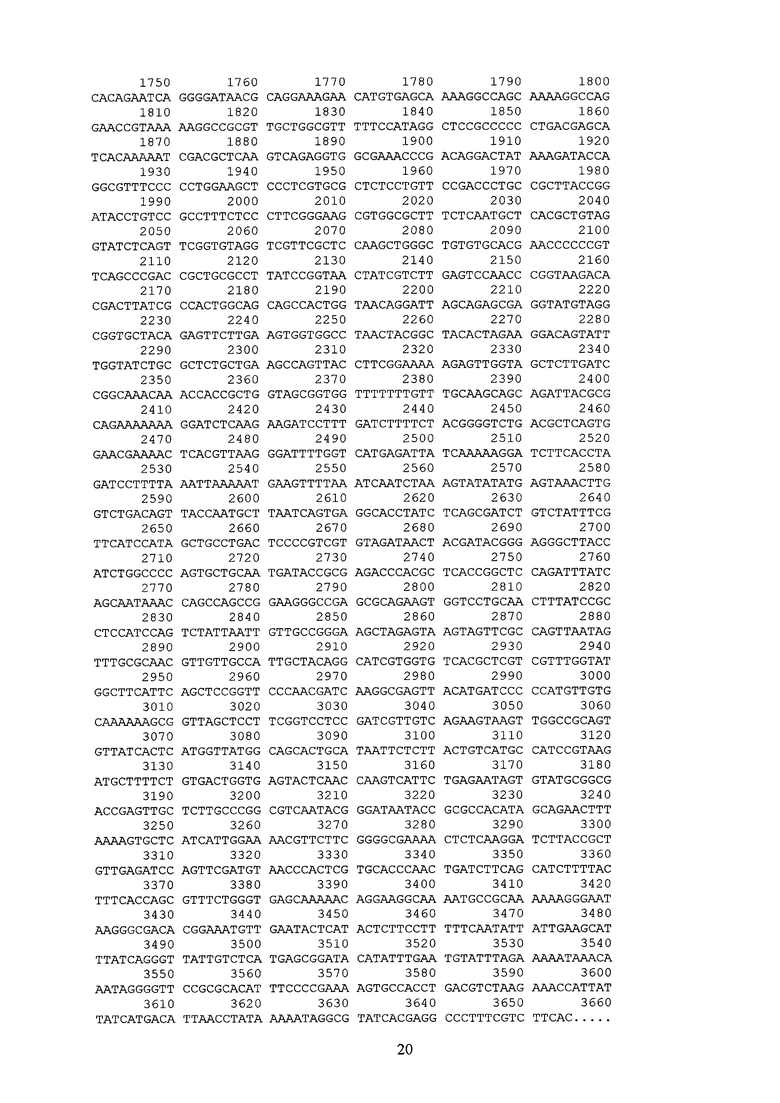
После стандартной процедуры очистки выделенных фрагментов при помощи набора реагентов для извлечения ДНК из агарозного геля GeneJET™ (Fermentas, Литва), объединение гомологичных «липких» концов фрагментов проводилось посредством ДНК-лигазы фага Т4 (Сибэнзим, Россия) при 4оС в соответствующем буфере. По истечении 24 часов, лигазной смесью трансформировали клетки E.coli DH5a (Qiagen) [fhuA2 lac(del)U169 phoA glnV44 Φ80' lacZ(del)M15 gyrA96 recA1 relA1 endA1 thi-1 hsdR17], которые затем отбирали на агаризованной среде LB с антибиотиками (ампициллин, налидиксовая кислота). Отобранные клоны наращивали в препаративных количествах, после чего целевая плазмидная ДНК выделялась методом SDS щелочного лизиса [13], валидировалась методами рестрикционного анализа и секвенирования на автоматическом секвенаторе. Полученная плазмида pGDTrib1mut-2 (SEQ ID NO:2) размером 3655 п.н. была первичным производным от промежуточного вектора pGDTrib1mut и содержала две объединенные последовательности trib1mut.
На 2-ом этапе, манипуляции по рестрикции и лигированию фрагментов, полностью совпадали с действиями, осуществляемыми на 1-ом этапе, только с тем отличием, что проводились они уже с двумя молекулами вектора pGDTrib1mut-2.
Итоговой лигазной смесью также трансформировали клетки E.coli DH5a (Qiagen), которые затем селекционировали на агаризованной среде LB с необходимыми антибиотиками. После стандартной процедуры выделения [13], первичная структура полученной плазмидной ДНК идентифицировалась методом рестрикционного анализа и секвенирования. Таким образом, в результате оптимизации генноинженерных конструкций, была получена конечная экспрессионная плазмида pGDTrib2mut (SEQ ID NO:3; схема0002), имеющая 3889 пар оснований (п.о.) и характеризующаяся наличием BglII/BamHI-фрагмента плазмиды pQE16 (QIAGEN) и синтетического фрагмента ДНК размером 480 п.о., содержащего химерный ген trib-2mut (SEQ ID NO:4; схема0001), представленный четырьмя последовательно (голова к хвосту) объединенными последовательностями минимального эластомерного мотива trib-1mut с шестью остатками гистидинов (His-таг) на С-конце, что призвано повысить эффективность выделения рекомбинантного белка на аффинном металлосодержащем сорбенте.
1.3. Получение штамма E.coli М15/pGDTrib2mut и экспрессия гена trib-2mut в клетках E.coli
Культуру клеток E.coli M15 (Qiagen) [F-, Φ80ΔlacM15, thi, lac-, mtl-, recA+, KmR] трансформировали созданными на предыдущей стадии плазмидными конструкциями pGDTrib2mut. Выросшие на агаризованной питательной среде, после процедуры химической трансформации, отдельные колонии изолировали и инокулировали в 100 мл среды TB (1,2% бактотриптон, 2,4% дрожжевой экстракт, 4% глицерин, 17 мМ KH2PO4, 72 мМ К2НРО4), содержащей антибиотики ампициллин (50 мкг/мл) и канамицин (25 мкг/мл), после чего растили при температуре 37°С и постоянном встряхивании до достижения культурой оптической плотности OD600=1 - 1,2. Экспрессию гена целевого белка индуцировали добавлением изопропил-b-D-тиогалактозида (ИПТГ) до конечной концентрации 0,2 мМ. Культуры инкубировали до 17 часов при 32-35°С и постоянном встряхивании, центрифугировали при 6000g 30 мин, осадки замораживали при -75°С.Наличие целевого белка подтверждали с помощью электрофореза на оборудовании для вертикального электрофореза VE-20 («Хеликон», Россия), в 12-17% полиакриламидном геле согласно стандартной методике Laemmli [14].
Уровень синтеза белков в Е. coli определяли, сравнивая интенсивность окрашивания полосы рекомбинантного белка с полосой соответствующего белка-стандарта Unstained Protein Molecular Weight Marker (BioRad, США). При сравнении спектра белков в материнском штамме Е. coli M15 [pREP4] и рекомбинантном штамме Е. coli M15 [pREP4, pGDTrib2mut] (или E.coli М15/pGDTrib2mut) обнаруживалось появление дополнительной белковой полосы, молекулярная масса которой 14,5 – 15,0 кДа соответствовала расчетной для белка Trib-2mut.
2. Выделение рекомбинантного белка Trib-2mut
Присутствие His-tag на C-конце рекомбинантного белка Trib-2mut упрощает процедуру очистки рекомбинантного белка благодаря тому, что полигистидиновый спейсер специфически связывается с Ni-NTA-агарозой. Осадок индуцированной биомассы бактерий E.coli ресуспендируют в 30 мл буфера для нанесения на колонку (15 мМ Трис-HCl, рН 7,8, 10 мМ имидазола) и разрушают ультразвуком при 0 -+4 °С. Лизат осветляли центрифугированием при 14000 об/мин в течение 20 мин. Супернатант содержал растворимый рекомбинантный белок. Надосадочную жидкость дополнительно фильтровали через 0,45 мкм фильтр (Corning, США), после чего переносили на колонку (BioRad, США) объемом 10 мл с Ni-NTA-агарозой (Invitrogen, США), которая предварительно уравновешена буфером для нанесения. Осветленный и фильтрованный бактериальный лизат инкубируют с Ni-NTA-агарозой в течение 40 мин при+4 °С. Затем, колонку промывают 100 мл раствора следующего состава: 12 мМ Трис-HCl рН 7,8, 20 мМ имидазола. Элюцию белка проводят 10 мл буфера: 12 мМ Трис-HCl, рН 7,8, 250 мМ имидазола. Белок диализуют против 1×PBS (1,7 мМ KH2PO4, 5,2 мМ Na2HPO4, 150 мМ NaCl, рН 7,4) и концентрируют до 5-10 мг/мл. Молекулярный вес и чистота целевого белка, оцениваемые по электрофорезу в 12-17% полиакриламидном геле (ПААГ), составляли около 15 кДа и более 95%, соответственно. Электрофорез белков проводился в денатурирующих условиях (в присутствии SDS) по стандартной методике Laemmli [14]. В работе использовалиь 5% концентрирующий и 17% разрешающий ПААГ на трис-буфере (130 мМ Трис-HCl, рН 6,8, для концентрирующего и 375 мМ Трис-HCl, рН 8,8, для разрешающего), содержащие 0,1% SDS, 0,1% PSA и 0,08% TEMED. Электродным буфером служил раствор: 25 мМ Триса, 250 мМ глицина и 0,1% SDS. Электрофорез в концентрирующем геле проводился при силе тока 15 мА (10-15 мин), затем в разрешающем геле при 25 мА (45-50 мин). Окрашивание геля проводилось с помощью красителя Comassie Brilliant Blue R-250 («Fluka», США).
3. Полимеризация белка Trib-2mut, посредством глутарового альдегида
Выделенные рекомбинантные полипептиды представляют собой периодически повторяющиеся мотивы, содержащие в своем составе, в строго определенной позиции, остатки аминокислоты лизин (K), между которыми возможно создавать химическую «сшивку», посредством образования оснований Шиффа, используя глутаровый альдегид [15, 16]. Созданные «мостики» способны объединить разрозненные полипептидные цепочки в упорядоченную мелкопористую структуру. Обработку глутаровым альдегидом проводили в буферных системах свободных от аминов. При этом наиболее применимыми буферами являлись HEPES и фосфатный буфер при рН=7,5 - 8,0. Для проведения реакции по пептидной сшивке на 100 мкг целевого белка добавляли 5 мкг 2,3% альдегида в тотальном реакционном объеме 100 мкл. Смесь выдерживали 5 минут при 37оС.Реакция прерывалась посредством добавления в реакционную смесь 10 мкл 1М Tris-HCl, pH 8,0. По мере завершения химической реакции в растворе, в пробирке образовываются светлые агломерирующие тяжи полимеризованного белка триболина-2 (Trib-2mut).
4. Полимеризация белка Trib-2mut, посредством 1-Этил-3-(3-диметиламинопропил)карбодиимида
Другая стратегия полимеризации сводилась к активации радикальной карбоксильной группы аспарагиновой и глутаминовой аминокислот 1-Этил-3-(3-диметиламинопропил)карбодиимидом (EDC) (Fluka, Germany) для последующего связывания с радикальным амином аминокислоты лизин с образованием амидной связи. Для повышения эффективности связывания, EDC использовался в комбинации с N-гидроксисукцинимидом (NHS) (Fluka, Germany)[16]. Данная стратегия потенциально способна привести к созданию крупнопористого биоматрикса.
Процедура состояла из следующих этапов: на 1 мл образца исследуемого белка с концентрацией 5 - 10 мг/мл, растворенного в 0,1 M активирующем буфере MES при рН=5,5, добавлялся 1 мл реагента содержащего 20 мг/мл EDC и 5 мг/мл NHS. Продолжительность реакции составила не менее 2 часов при комнатной температуре.
На исходе двух часов реакция останавливалась посредством добавления к реакционной смеси глицина в конечной концентрации 50 мМ. Конец химической реакции ознаменовывался появлением в растворе белых опалесцирующих хлопьев полимеризованного белка Trib-2mut.
Таким образом, генно-инженерным путем, были получены образцы белка Trib-2mut – рекомбинантного гомолога эластомерного домена резилина Tribolium castaneum - в основе которого лежит периодически повторяющийся минимальный эластомерный мотив Trib-1mut, а также созданы лабораторные образцы нового полимерного биоматериала на его основе.
СПИСОК ЛИТЕРАТУРЫ
1. Волова Т. Г. Материалы для медицины, клеточной и тканевой инженерии [Электронный ресурс]: электрон. учеб. пособие / Т. Г. Волова, Е. И. Шишацкая, П. В. Миронов. – Электрон. дан. (6 Мб). – Красноярск: ИПК СФУ, 2009.
2. Burdick J.A., Mauck R.L. Biomaterials for Tissue Engineering Applications: A Review of the Past and Future Trends Editors: Burdick J.A., Mauck R.L. (Eds.), Published: Wien; New York: Springer, 2011, P. 564.
3. Faraj K.A., Brouwer K.M., Geutjes P.J., Versteeg E.M., Wismans R.G., Deprest J.A., Chajra H., Tiemessen D.M., Feitz W.F.J., Oosterwijk E., Daamen W.F., and van Kuppevelt T.H. The Effect of Ethylene Oxide Sterilisation, Beta Irradiation and Gamma Irradiation on Collagen Fibril-Based Scaffolds. Tissue Engineering and Regenerative Medicine, 2011, 8(5):460-70,
4. Eyrich D., Göpferich A., Blunk T.. Fibrin in Tissue Engineering. Tissue Engineering. Advances in Experimental Medicine and Biology, 2007, 585:379-92,
5. Gosline J.M., Guerette P.A., Ortlepp C.S., Savage K.N. The mechanical design of spider silks: from fibroin sequence to mechanical function. J Exp Biol., 1999, 202(23):3295-303.
6. Wong D.C., Pearson R.D., Elvin C.M., Merritt D.J. Expression of the rubber-like protein, resilin, in developing and functional insect cuticle determined using a Drosophila anti-Rec 1 resilin antibody. Dev Dyn., 2012, 241(2):333-9.
7. Gosline J., Lillie M., Carrington E., Guerette P., Ortlepp C., Savage K. Elastic proteins: biological roles and mechanical properties, Philos Trans R Soc Lond B Biol Sci., 2002, 357(1418):121-32.
8. Burrows M., Sutton G.P. Locusts use a composite of resilin and hard cuticle as an energy store for jumping and kicking. J. Exp.Biol., 2012, vol. 215, pp.3501-3512.
9. Burrows M. Energy storage and synchronisation of hind leg movements during jumping in planthopper insects (Hemiptera, Issidae). J. Exp.Biol., 2010, vol. 213, pp.469–478.
10. Stevenson J, Krycer J.R., Phan L, Brown A.J. A practical comparison of ligation-independent cloning techniques. PLoS. 2013;8(12):e83888. doi: 10.1371/journal.pone.0083888.
11. Zhu B., Cai G, Hall E., Freeman G.J.In-fusion assembly: seamless engineering of multidomain fusion proteins, modular vectors, and mutations. Biotechniques. 2007 Sep;43(3):354-9.
12. Janjua S., Younis S., Deeba F. and Naqvi S.M.S., High efficiency DNA transformation protocol for Escherichia Coli using combination of physico-chemical methods. Int. J. Agric. Biol., 2014; 16: 132-138.
13. Маниатис Т., Молекулярное клонирование: учебник/ Т. Маниатис и др. - М.: Мир, 1984. – С.450.
14. Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970, 227(5259):680-5.
15. David B. McIntosh. Glutaraldehyde Cross-links Lys-492 and Arg-678 at the Active Site of Sarcoplasmic Reticulum Ca2+-ATPase. J Biol Chem, JBC, 1992, 267(31):22328-35.
16. Englert C, Blunk T, Müller R, von Glasser S.S, Baumer J, Fierlbeck J, Heid I.M., Nerlich M, Hammer J. Bonding of articular cartilage using a combination of biochemical degradation and surface cross-linking. Arthritis Res Ther., 2007, 9(3):R47.


Изобретение относится к области биотехнологии, конкретно к получению каркасных материалов на основе белковых конструкций, и может быть использовано в медицине. На основе минимального рекомбинантного эластомерного мотива (триболин-1, Trib-1mut) белка резилина насекомых Tribolium castaneum (триболин-2, Trib-2mut) рекомбинантным путем получена белковая конструкция, которую используют в способах агрегации с целью формирования основы сетки биоматрикса. Изобретение позволяет получить полимерный каркасный биоматериал для инжиниринга тканей. 5 н.п. ф-лы, 2 ил., 2 табл., 4 пр.
1. Белковая конструкция Trib-2mut для получения каркасного материала для инжиниринга тканей, с аминокислотной последовательностью, приведенной в виде SEQ ID NO: 4, представляющая собой рекомбинантный гомолог эластомерного домена резилина Tribolium castaneum, в основе которого лежит периодически повторяющийся минимальный эластомерный мотив Trib-1mut резилина T. continuum с аминокислотной последовательностью, приведенной в виде SEQ ID NO: 5.
2. Синтетический ген Trib-2mut, кодирующий гомолог нативного эластомерного домена резилина Т. castaneum по п. 1, с установленной нуклеотидной последовательностью SEQ ID NO: 4.
3. Плазмидная ДНК pGDTrib2mut, определяющая биосинтез белка Trib-2mut по п. 1 в клетках Escherichia coli и характеризующаяся последовательностью нуклеотидов, приведенной в виде SEQ ID NO: 3.
4. Штамм Escherichia coli М15/pGDTrib2mut - продуцент рекомбинантной белковой конструкции Trib-2mut по п. 1, полученный путем трансформации клеток материнского штамма E. coli М15 плазмидной ДНК pGDTrib2mut по п. 3.
5. Полимерный каркасный биоматериал для инжиниринга тканей, полученный посредством специфической обработки очищенного рекомбинантного белка Trib-2mut по п. 1 глутаровым альдегидом для молекулярной сшивки по аминокислоте лизин или 1-этил-3-(3-диметиламинопропил)карбодиимидом для молекулярной сшивки по аспарагиновой/глутаминовой аминокислотам.
| ZHEN LI, INVESTIGATION OF TRIBOLIUM CASTANEUM RESILIN, A RUBBER-LIKE INSECT CUTICULAR PROTEIN, 2013, A THESIS, KANSAS STATE UNIVERSITY, Manhattan, Kansas, 73 p., найдено в Интернет [09.09.2016] по адресу: http://krex.k-state.edu/dspace/handle/2097/16287, весь документ, особенно с.16-19, 57-59, фиг.3 | |||
| RU 2012146368 A, 10.05.2014 | |||
| US 9109047 B2, 18.08.2015. |
Авторы
Даты
2017-09-15—Публикация
2015-09-16—Подача