ИНФОРМАЦИЯ О ПРАВИТЕЛЬСТВЕННОЙ ПОДДЕРЖКЕ
Настоящее изобретение выполнено при поддержке правительства за счет гранта №P01 CA018029, предоставленного Национальными институтами здоровья/Национальным институтом онкологии США. Правительство обладает определенными правами на данное изобретение.
ИНФОРМАЦИЯ О ПЕРЕЧНЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Перечень последовательностей, связанный с настоящей заявкой, приводится в текстовом формате вместо бумажной копии, и тем самым включен с помощью ссылки в описание изобретения. Название текстового файла, содержащего перечень последовательностей, 360056_407WO_SEQUENCE_LISTING.txt. Текстовый файл имеет размер приблизительно 9 килобайт, создан 9 ноября 2012 года и в данной заявке представлен в электронном виде с помощью EFS-Web.
ПРЕДПОСЫЛКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Область техники, к которой относится настоящее изобретение
Настоящее раскрытие, в целом, относится к способам индукции антигенспецифических Т-клеточных иммунных ответов на антиген, ассоциированный с раком. Более конкретно, полипептид изоформы с человеческого циклина A1 (CCNA1) идентифицируется в данном документе как содержащий эпитопы, пригодные для получения специфических Т-клеточных ответов против лейкозных клеток, которые сверхэкспрессируют CCNA1, включая лейкемические стволовые клетки (LSC) и клетки острого миелоидного лейкоза (AML).
Уровень техники настоящего изобретения
У высших позвоночных иммунная система отличает «свои» молекулярные структуры в клетках и тканях от «чужих» и обеспечивает организм-хозяин средствами быстрого и специфического наращивания защитных реакций, таких как уничтожение патогенных микроорганизмов и отторжение злокачественных опухолей. Иммунные ответы описаны, в целом, как ответы, включающие гуморальные ответы, при которых антитела, специфичные к антигенам, продуцируются дифференцированными В-лимфоцитами, и клеточно-опосредованные ответы, при которых различные типы Т-лимфоцитов удаляют антигены с помощью различных механизмов. Например, CD4 (также называемые CD4+) хелперные Т-клетки, которые способны распознавать специфические антигены, могут реагировать путем высвобождения растворимых медиаторов, таких как цитокины, для мобилизации дополнительных клеток иммунной системы для участия в иммунном ответе с помощью различных механизмов. CD8 (также называемые CD8+) цитотоксические Т-лимфоциты (CTL) также способны распознавать специфические антигены и могут связываться с клеткой, несущей антиген, или частицей и уничтожать или повреждать их. В частности, клеточно-опосредованные иммунные ответы, которые включают ответ цитотоксических Т-лимфоцитов (CTL), могут являться важными для элиминации опухолевых клеток, а также для элиминации клеток, инфицированных патогенами, такими как вирусы, бактерии или микробные паразиты.
Хорошо известно, что острый миелоидный лейкоз (AML) организуется иерархически, инициируется и поддерживается небольшой популяцией клеток, называемых лейкемические стволовые клетки (LSC), которые характеризуются не только неограниченной репродуктивной способностью, но также повышенной устойчивостью к химиотерапии и облучению. Данная популяция примитивных клеток, которая, как обнаружено, является отрицательной по экспрессии маркеров линии дифференцировки и CD38, но положительной по CD34, является необходимой для долгосрочного приживления клеток первичного AML в моделях трансплантации NOD/SCID (Bonnet et al., 1997 Nat Med 3 (7):730-737; Lapidot et al., 1994 Nature 367 (6464):645-648. doi:10.1038/367645a0; Blair et al., 1998 Blood 92 (11):4325-4335). Гипотеза лейкемических стволовых клеток предполагает, что для достижения лечебного терапевтического эффекта против AML у пациентов эффективные стратегии должны включать такие, которые эффективно удаляют компартмент LSC, который устойчив к традиционным подходам терапии.
У пациентов с промежуточным и высоким риском и/или рецидивирующим AML эффект «трансплантат против лейкоза», опосредованный аллогенными Т-клетками, обнаруживаемый у некоторых индивидуумов после трансплантации гемопоэтических стволовых клеток (HSCT) или после инфузии полученных от донора лимфоцитов в посттрансплантационном периоде, как показано, является необходимым для достижения долгосрочных полных ремиссий (Cornelissen et al., 2007 Blood 109 (9):3658-3666. doi:blood-2006-06-025627 [pii] 10.1182/blood-2006-06-025627; Yanada et al., 2005 Cancer 103 (8):1652-1658. doi:10.1002/cncr.20945; Breems et al., 2005 J Clin Oncol 23 (9):1969-1978. doi:JCO. 2005.06.027 [pii] 10.1200/JCO.2005.06.027; Levine et al., 2002 J Clin Oncol 20 (2):405-412). Однако инфузии аллогенных HSCT и неотобранных донорских лимфоцитов связаны со значительной токсичностью вследствие как режима кондиционирования, так и активности «трансплантат против хозяина» у донорских лимфоцитов. Альтернативной стратегией для обеспечения компонента цитотоксических Т-лимфоцитов (CTL) против LSC для лечения пациентов с AML могло бы являться осуществление дополнительно направленной T-клеточной терапии, включающей либо адоптивный перенос T-клеток, специфичных к антигенам, ассоциированным с лейкозом (LAA), либо вакцинацию против этих антигенов (Van Driessche et al., 2005 Leukemia 19 (11):1863-1871. doi: 2403930 [pii] 10.1038/sj.leu.2403930; Rezvani et al., 2008 Blood 111 (1):236-242. doi: blood-2007-08-108241 [pii] 10.1182/blood-2007-08-108241). Способность антигенспецифических Т-клеток опосредовать элиминацию LSC AML уже продемонстрирована в моделях трансплантации NOD/SCID (Bonnet et al., 1999 Proc Natl Acad Sci USA 96 (15):8639-8644; Rosinski et al., 2008 Blood 111 (9):4817-4826. doi:blood-2007-06-096313 [pii] 10.1182/blood-2007-06-096313; Xue et al., 2005 Blood 106 (9):3062-3067. doi:2005-01-0146 [pii] 10.1182/blood-2005-01-0146).
Направленная терапия Т-клетками представляет потенциально менее токсичную стратегию, чем трансплантация аллогенных гемопоэтических стволовых клеток с получением цитотоксического противолейкозного эффекта для удаления компартмента лейкемических стволовых клеток (LSC) у пациентов с острым миелоидным лейкозом (AML). Однако данная стратегия требует идентификации ассоциированных с лейкозом антигенов (LAA), которые демонстрируют избирательную высокую экспрессию в LSC AML, для максимального повышения противолейкозного эффекта и сведения к минимуму иммуноопосредованной токсичности в нормальных тканях.
Предварительным условием для достижения максимального эффекта направленной терапии Т-клетками против AML, который сопровождался бы минимальной иммунологической токсичностью, является, следовательно, идентификация LAA с высокой экспрессией в компартменте злокачественных клеток и презентацией на них, но без значительной экспрессии в здоровых тканях. Хотя были описаны несколько LAA AML, только белок 1 опухоли Вильмса (WT1), как показано, экспрессируется в компартменте LSC у большинства пациентов с AML при значительно более высоких уровнях, чем в физиологических гемопоэтических стволовых клетках (HSC). В настоящее время в клинических испытаниях WT1 является мишенью как адоптивного переноса T-клеток, так и вакцинации пептидами (например, патенты США №№7342092; 7608685; 7622119), и у некоторых пациентов наблюдаются объективные ремиссии (Cheever et al., 2009 Clin Cancer Res 15 (17):5323-5337. doi:15/17/5323 [pii] 10.1158/1078-0432.CCR-09-0737; Majeti et al., 2009 Proc Natl Acad Sci USA 106 (9): 3396-3401. doi: 0900089106 [pii] 10.1073/pnas.0900089106; Xue et al., 2005 Blood 106 (9):3062-3067; Keilholz et al., 2009 Blood 113 (26):6541-6548. doi:blood- 2009-02-202598 [pii] 10.1182/blood-2009-02-202598). У некоторых пациентов с AML, однако, WT1 не экспрессируется или не обнаруживается на уровнях, достаточно отличающихся от таковых в HSC, или невозможно вызвать T-клеточный ответ против WT1. Экспрессия WT1 также была обнаружена в некоторых органах, не относящихся к гемопоэтическим, таких как селезенка, яичник и почка, на уровнях, которые могут являться столь же высокими или более высокими, чем в лейкозных бластных клетках, что вызывает опасения относительно того, что направленная на WT1 иммунотерапия будет давать токсичность в данных тканях в качестве нежелательных и потенциально вредных побочных эффектов.
Очевидно, что существует потребность в дополнительных ассоциированных с лейкозом антигенах-кандидатах, которые экспрессируются в злокачественных клетках, включая клетки AML, и в частности в лейкемических стволовых клетках AML, для применения в качестве иммуногенов для разработки высокоспецифической направленной иммунотерапии для лечения форм рака, в том числе лейкозов, таких как AML. Раскрытые в данном документе варианты осуществления настоящего изобретения удовлетворяют данную потребность и обеспечивают другие сопутствующие преимущества.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение предусматривает, в соответствии с определенными вариантами осуществления, выделенный пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), включающий полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8 или 7 аминокислот, где полипептид содержит последовательность по меньшей мере из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных аминокислот из аминокислотной последовательности CCNA1, изложенной в SEQ ID NO:9.
В другом варианте осуществления предусматривается выделенный пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), включающий полипептид общей формулы I: N-X-C [I], где (a) N-X-C представляет собой полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, в котором X включает аминокислотную последовательность, выбранную из: CCNA1(120-131) VDTGTLKSDLHF [SEQ ID NO:1], CCNA1(218-226) AETLYLAVN [SEQ ID NO:2], CCNA1(227-235) FLDRFLSCM [SEQ ID NO:3], CCNA1(253-261) ASKYEEIYP [SEQ ID NO:4], CCNA1(118-127) YEVDTGTLKS [SEQ ID NO:5], CCNA1(167-175) YAEEIYQYL [SEQ ID NO:6], CCNA1(330-339) LEADPFLKYL [SEQ ID NO:7] и CCNA1(341-351) SLIAAAAFCLA [SEQ IN NO:8], (b) N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и (c) C представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот.
В определенных дополнительных вариантах осуществления антигенспецифический Т-клеточный ответ включает ограниченное по главному комплексу гистосовместимости (MHC) распознавание пептида T-клетками. В определенных других дополнительных вариантах осуществления выделенный пептид способен вызывать антигенспецифический ответ на человеческий циклин A1 (CCNA1), реализуемых CD8+T-клетками, при ограничении по человеческому лейкоцитарному антигену (HLA) класса I. В еще одном дополнительном варианте осуществления HLA-антиген класса I представляет собой HLA-A*201. В определенных других дополнительных вариантах осуществления выделенный пептид способен вызывать антигенспецифический ответ на человеческий циклин A1 (CCNA1), реализуемый CD4+T-клетками, при ограничении по человеческому лейкоцитарному антигену (HLA) класса II. В определенных других дополнительных вариантах осуществления антигенспецифический Т-клеточный ответ включает ответ, реализуемый интерфероном-гамма (IFN-γ). В определенных других дополнительных вариантах осуществления антигенспецифический Т-клеточный ответ включает по меньшей мере один из ответа, реализуемого CD4+хелперными Т-лимфоцитами (Th), и ответа, реализуемого CD8+цитотоксическими Т-лимфоцитами (CTL). В определенных дополнительных вариантах осуществления реализуемый CTL ответ направлен против клетки, сверхэкспрессирующей CCNA1. В других определенных дополнительных вариантах осуществления клетка, сверхэкспрессирующая CCNA1, представляет собой клетку острого миелоидного лейкоза (AML) или лейкемическую стволовую клетку (LSC).
Обращаясь к другому варианту осуществления, предусматривается выделенный полинуклеотид, который кодирует пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), причем пептид включает полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8 или 7 аминокислот, где полипептид содержит последовательность по меньшей мере из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных аминокислот из аминокислотной последовательности CCNA1, изложенной в SEQ ID NO:9.
В другом варианте осуществления предусматривается выделенный полинуклеотид, который кодирует пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), причем пептид включает полипептид общей формулы I: N-X-C [I], где (а) N-X-C представляет собой полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, в котором X включает аминокислотную последовательность, выбранную из группы, состоящей из: CCNA1(120-131) VDTGTLKSDLHF [SEQ ID NO:1], CCNA1(218-226) AETLYLAVN [SEQ ID NO:2], CCNA1(227-235) FLDRFLSCM [SEQ ID NO:3], CCNA1(253-261) ASKYEEIYP [SEQ ID NO:4], CCNA1(118-127) YEVDTGTLKS [SEQ ID NO:5], CCNA1(167-175) YAEEIYQYL [SEQ ID NO:6], CCNA1(330-339) LEADPFLKYL [SEQ ID NO:7] и CCNA1(341-351) SLIAAAAFCLA [SEQ IN NO:8], (b) N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и (c) C представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот.
В определенных других вариантах осуществления предусматривается иммуногенная композиция, содержащая рекомбинантный вектор экспрессии, содержащий любой из вышеописанных полинуклеотидов, функционально связанных с последовательностью, контролирующей экспрессию. В дополнительном варианте осуществления вектор способен доставлять полинуклеотид к антигенпрезентирующей клетке. В еще одном дополнительном варианте осуществления антигенпрезентирующая клетка представляет собой дендритную клетку. В определенных других дополнительных вариантах осуществления антигенспецифический Т-клеточный ответ включает ограниченное по главному комплексу гистосовместимости (MHC) распознавание пептида T-клетками. В определенных других дополнительных вариантах осуществления иммуногенная композиция способна вызывать антигенспецифический ответ на человеческий циклин A1 (CCNA1), реализуемый CD8+T-клетками, при ограничении по человеческому лейкоцитарному антигену (HLA) класса I. В еще одном дополнительном варианте осуществления HLA-антиген класса I представляет собой HLA-A*201. В определенных других дополнительных вариантах осуществления иммуногенная композиция способна вызывать антигенспецифический ответ на человеческий циклин A1 (CCNA1), реализуемый CD4+T-клетками, при ограничении по человеческому лейкоцитарному антигену (HLA) класса II. В определенных других дополнительных вариантах осуществления антигенспецифический Т-клеточный ответ включает ответ, реализуемый интерфероном-гамма (IFN-γ). В определенных других дополнительных вариантах осуществления антигенспецифический Т-клеточный ответ включает по меньшей мере один из ответа, реализуемого CD4+хелперными Т-лимфоцитами (Th), и ответа, реализуемого CD8+цитотоксическими Т-лимфоцитами (CTL). В определенных дополнительных вариантах осуществления реализуемый CTL ответ направлен против клетки, сверхэкспрессирующей CCNA1, которая в других определенных дополнительных вариантах осуществления представляет собой клетку острого миелоидного лейкоза (AML) или лейкемическую стволовую клетку (LSC).
В соответствии с определенными другими вариантами осуществления предусматривается способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий введение субъекту эффективного количества композиции, которая содержит один или несколько выделенных пептидов, способных вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), причем каждый из указанных выделенных пептидов включает полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8 или 7 аминокислот, где полипептид содержит последовательность по меньшей мере из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных аминокислот из аминокислотной последовательности CCNA1, изложенной в SEQ ID NO:9.
В другом варианте осуществления предусматривается способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий введение субъекту эффективного количества композиции, которая содержит один или несколько выделенных пептидов, способных вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), причем каждый из указанных выделенных пептидов включает полипептид общей формулы I: N-X-C [I], где (a) N-X-C представляет собой полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, в котором X включает аминокислотную последовательность, которая выбрана из: CCNA1(120-131) VDTGTLKSDLHF [SEQ ID NO:1], CCNA1(218-226) AETLYLAVN [SEQ ID NO:2], CCNA1(227-235) FLDRFLSCM [SEQ ID NO:3], CCNA1(253-261) ASKYEEIYP [SEQ ID NO:4], CCNA1(118-127) YEVDTGTLKS [SEQ ID NO:5], CCNA1(167-175) YAEEIYQYL [SEQ ID NO:6], CCNA1(330-339) LEADPFLKYL [SEQ ID NO:7] и CCNA1(341-351) SLIAAAAFCLA [SEQ IN NO:8], (b) N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и (c) C представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот.
В другом варианте осуществления предусматривается способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий введение субъекту эффективного количества композиции, которая содержит один или несколько выделенных полинуклеотидов, каждый из которых кодирует пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), причем каждый из указанных пептидов включает полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8 или 7 аминокислот, где полипептид содержит последовательность по меньшей мере из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных аминокислот из аминокислотной последовательности CCNA1, изложенной в SEQ ID NO:9.
В другом варианте осуществления предусматривается способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий введение субъекту эффективного количества композиции, которая содержит один или несколько выделенных полинуклеотидов, каждый из которых кодирует пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), причем каждый из указанных пептидов включает полипептид общей формулы I: N-X-C [I], где (a) N-X-C представляет собой полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, в котором X включает аминокислотную последовательность, которая выбрана из группы, состоящей из: CCNA1(120-131) VDTGTLKSDLHF [SEQ ID NO:1], CCNA1(218-226) AETLYLAVN [SEQ ID NO:2], CCNA1(227-235) FLDRFLSCM [SEQ ID NO:3], CCNA1(253-261) ASKYEEIYP [SEQ ID NO:4], CCNA1(118-127) YEVDTGTLKS [SEQ ID NO:5], CCNA1(167-175) YAEEIYQYL [SEQ ID NO:6], CCNA1(330-339) LEADPFLKYL [SEQ ID NO:7] и CCNA1(341-351) SLIAAAAFCLA [SEQ IN NO:8], (b) N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и (c) C представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот.
В определенных дополнительных вариантах осуществления вышеописанных способов этап введения включает введение иммуногенной композиции, содержащей один или несколько рекомбинантных векторов экспрессии, которые содержат один или несколько выделенных полинуклеотидов, причем каждый из указанных выделенных полинуклеотидов функционально связан с последовательностью, контролирующей экспрессию. В дополнительном варианте осуществления вектор способен доставлять полинуклеотид к антигенпрезентирующей клетке. В еще одном дополнительном варианте осуществления антигенпрезентирующая клетка представляет собой дендритную клетку. В определенных других дополнительных вариантах осуществления вышеописанных способов состояние, которое характеризуется сверхэкспрессией CCNA1, представляет собой лейкоз, который в определенных дополнительных вариантах осуществления является острым миелоидным лейкозом.
Обращаясь к другому варианту осуществления, предусматривается способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий: (A) контакт in vitro в условиях и в течение периода времени, достаточных для того, чтобы произошло процессирование и перезентирование антигена антигенпрезентирующими клетками, (i) популяции антигенпрезентирующих клеток, которые иммуносовместимы с субъектом, и (ii) выделенного пептида, способного вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), который включает полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8 или 7 аминокислот, где полипептид содержит последовательность по меньшей мере из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных аминокислот из аминокислотной последовательности CCNA1, изложенной в SEQ ID NO:9; и (B) введение одной или множества указанных «обученных» антигенпрезентирующих клеток субъекту в количестве, эффективном для того, чтобы вызывать указанный антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1).
В другом варианте осуществления предусматривается способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий: (A) контакт in vitro в условиях и в течение периода времени, достаточных для того, чтобы произошло процессирование и перезентирование антигена антигенпрезентирующими клетками, (i) популяции антигенпрезентирующих клеток, которые иммуносовместимы с субъектом, и (ii) выделенного пептида, способного вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), который включает полипептид общей формулы I: N-X-C [I], где (a) N-X-C представляет собой полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, в котором X включает аминокислотную последовательность, которая выбрана из: CCNA1(120-131) VDTGTLKSDLHF [SEQ ID NO:1], CCNA1(218-226) AETLYLAVN [SEQ ID NO:2], CCNA1(227-235) FLDRFLSCM [SEQ ID NO:3], CCNA1(253-261) ASKYEEIYP [SEQ ID NO:4], CCNA1(118-127) YEVDTGTLKS [SEQ ID NO:5], CCNA1(167-175) YAEEIYQYL [SEQ ID NO:6], CCNA1(330-339) LEADPFLKYL [SEQ ID NO:7] и CCNA1(341-351) SLIAAAAFCLA [SEQ IN NO:8], (b) N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и (c) C представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и получение таким образом популяции «обученных» антигенпрезентирующих клеток; и (B) введение одной или множества указанных «обученных» антигенпрезентирующих клеток субъекту в количестве, эффективном для того, чтобы вызывать указанный антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1).
В другом варианте осуществления предусматривается способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий: (A) контакт in vitro в условиях и в течение периода времени, достаточных для того, чтобы произошло процессирование и перезентирование антигена антигенпрезентирующими клетками, (i) популяции антигенпрезентирующих клеток, которые иммуносовместимы с субъектом, и (ii) композиции, которая содержит выделенный полинуклеотид, который может экспрессироваться указанными антигенпрезентирующими клетками и который кодирует пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), причем пептид включает полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8 или 7 аминокислот, где полипептид содержит последовательность по меньшей мере из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных аминокислот из аминокислотной последовательности CCNA1, изложенной в SEQ ID NO:9; и (B) введение одной или множества указанных «обученных» антигенпрезентирующих клеток субъекту в количестве, эффективном для того, чтобы вызывать указанный антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1).
В другом варианте осуществления предусматривается способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий: (A) контакт in vitro в условиях и в течение периода времени, достаточных для того, чтобы произошло процессирование и перезентирование антигена антигенпрезентирующими клетками, (i) популяции антигенпрезентирующих клеток, которые иммуносовместимы с субъектом, и (ii) композиции, которая содержит выделенный полинуклеотид, который может экспрессироваться указанными антигенпрезентирующими клетками и который кодирует пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), причем пептид включает полипептид общей формулы I: N-X-C [I], где (a) N-X-C представляет собой полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, в котором X включает аминокислотную последовательность, которая выбрана из: CCNA1(120-131) VDTGTLKSDLHF [SEQ ID NO:1], CCNA1(218-226) AETLYLAVN [SEQ ID NO:2], CCNA1(227-235) FLDRFLSCM [SEQ ID NO:3], CCNA1(253-261) ASKYEEIYP [SEQ ID NO:4], CCNA1(118-127) YEVDTGTLKS [SEQ ID NO:5], CCNA1(167-175) YAEEIYQYL [SEQ ID NO:6], CCNA1(330-339) LEADPFLKYL [SEQ ID NO:7] и CCNA1(341-351) SLIAAAAFCLA [SEQ IN NO:8], (b) N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и (c) C представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и получение таким образом популяции «обученных» антигенпрезентирующих клеток; и (B) введение одной или множества указанных «обученных» антигенпрезентирующих клеток субъекту в количестве, эффективном того, чтобы вызывать указанный антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1).
В определенных дополнительных вариантах осуществления вышеописанных способов способ дополнительно включает этап увеличения количества антигенпрезентирующих клеток посредством культивирования антигенпрезентирующих клеток после этапа контакта и перед этапом введения. В определенных других дополнительных вариантах осуществления вышеописанных способов способ дополнительно включает (C) (1) контакт «обученных» антигенпрезентирующих клеток с одной или множеством иммуносовместимых T-клеток после этапа (A) в условиях и в течение периода времени, достаточных для генерирования специфических к CCNA1 Т-клеток, и (2) адоптивный перенос специфических к CCNA1 Т-клеток субъекту. В других определенных дополнительных вариантах осуществления этап (B) опускается.
В определенных других дополнительных вариантах осуществления вышеописанных способов способ дополнительно включает (C) (1) контакт «обученных» антигенпрезентирующих клеток с одной или множеством иммуносовместимых T-клеток после этапа (A) в условиях и в течение периода времени, достаточных для генерирования специфических к CCNA1 Т-клеток, (2) увеличение количества специфических к CCNA1 T-клеток с получением одного или нескольких клонов указанных специфических к CCNA1 Т-клеток в количествах, достаточных для структурной характеристики T-клеточных рецепторов, (3) определение последовательности нуклеиновой кислоты, кодирующей полипептид T-клеточного рецептора, для одной или нескольких из указанных специфических к CCNA1 Т-клеток, (4) трансфекция T-клеточной популяции для адоптивного переноса по меньшей мере одной нуклеиновой кислотой, кодирующей полипептид T-клеточного рецептора, с последовательностью, определенной в (3), с получением сконструированных специфических к CCNA1 Т-клеток для адоптивного переноса и 4) адоптивный перенос сконструированных специфических к CCNA1 Т-клеток для адоптивного переноса субъекту. В других определенных дополнительных вариантах осуществления этап (B) опускается.
Эти и другие аспекты и варианты осуществления описанного в данном документе изобретения станут очевидными при ссылке на следующее подробное описание и прилагаемые графические материалы. Все патенты США, публикации заявок на патент США, заявки на патенты США, патенты других стран, заявки на патенты других стран и непатентные публикации, упоминаемые в данном описании и/или перечисленные в сведениях о заявке, включены в данный документ с помощью ссылки во всей своей полноте, как если бы каждая была включена отдельно. Аспекты и варианты осуществления настоящего изобретения можно модифицировать, если необходимо, с использованием идей различных патентов, заявок и публикаций, с получением других вариантов осуществления.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 показана основанная на модели экспрессия набора зондов 205899_at, представляющих CCNA1: (A) экспрессия в LSC AML по сравнению с HSC/CD34+мононуклеарными клетками BM (костный мозг), PBMC (мононуклеарные клетки периферической крови) и тканями, не относящимися гемопоэтическими тканями, * p<0,001 (эксплоративное), (B) экспрессия в LSC и соответствующих бластных клетках AML.
На фигуре 2 показана экспрессия CCNA1, количественно определенная с помощью количественной ПЦР с обратной транскрипцией (qRT PCR): (A) в AML, здоровых субпопуляциях гемопоэтических клеток и тканях, (B) в FAB подтипах AML и BM от пациентов с MDS (миелодиспластический синдром) и CML (хронический миелоидный лейкоз), (C) в здоровых тканях.
На фигуре 3 показаны ограниченные HLA A*0201 эпитопы CCNA1227-235 (A-C) и CCNA1341-351 (D-F): (A, D) результаты картирования минимальной иммуногенной AA последовательности с использованием внутриклеточного окрашивания (ICS) по IFNγ. +/- относится к положительному результату окрашивания по IFNγ после совместного инкубирования соответствующей линии Т-клеток с «обученными» пептидом аутологичными лимфобластными клеточными линиями (LCL), (B, E) иммуногенные пептиды, стабилизированные HLA A*0201 на T2 клетках. Отрицательными контролями являлись T2 клетки, «обученные» нерелевантным олигомером с 15 мономерными единицами (затушевано), (C, F) активация конкретных клонов зависела от пептида и экспрессии HLA A*0201. ICS по IFNγ аутологичных LCL, 721.211 клеток и 721.221 клеток, устойчиво трансфицированных HLA A*0201, в качестве APC.
На фигуре 4 показана цитотоксическая активность, продемонстрированная клонами T-клеток против CCNA1227-235 [SEQ ID NO:3] и CCNA1341-351 [SEQ ID NO:8]. (A) Экспрессия CCNA1 в нескольких линиях миелоидных клеток, количественно определяемая с помощью qRT PCR, (B) ICS по IFNγ: высокоавидные клоны 2196.D9 и D11 продуцировали IFNγ в присутствии CCNA1+/HLA A*0201+клеточной линии THP-1 независимо от экзогенного пептида; низкоавидный клон 2196.E1 только распознавал «обученные» пептидом клеточные линии, (C) 6 часовой тест с высвобождением 51Cr. Клон 2196.D11 вызывал специфический лизис в THP-1. Низкоавидный клон 2196.E1 показан для сравнения, (D) анализ активности каспазы-3. Клоны к обоим эпитопам индуцировали апоптоз в THP-1. Отрицательный контроль: только мишени (затушевано) и клон 2264.A1, специфический к эпитопу CCNA1118-127 [SEQ ID NO:5], ограниченный по HLA B*4001 (данные не показаны, THP-1 являлся отрицательным по B*4001), положительный контроль: мишени в присутствии 4 мкМ камптотецина. 2196.D9, 2196.D11 являлись специфическими к эпитопу CCNA1227-235 [SEQ ID NO:3], клон 2264.E30 являлся специфическим к эпитопу CCNA1341-351 [SEQ ID NO:8].
На фигуре 5 показана аминокислотная последовательность изоформы c человеческого циклина A1 (CCNA1) (фигура 5A) (SEQ ID NO:9) и кодирующая последовательность полинуклеотида (фигура 5B) (SEQ ID NO:10).
На фигуре 6 показана активность клона T-клеток 2196.D11b, специфического к CCNA1227-235 [SEQ ID NO:3], в анализе индукции апоптоза (каспаза-3) (фигура 6A) и в анализе цитолиза по высвобождению радиоактивного 51Cr (фигура 6B).
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Варианты осуществления настоящего изобретения, которые раскрыты в данном документе, относятся к неожиданным открытиям того, что внутриклеточный белок человеческий циклин A1 (CCNA1, например, эталонная последовательность NCBI (изоформа c) NP_001104517.1, GI:161377472; NM_001111047.1 GI:161377471) является ассоциированным с лейкозом антигеном (LAA), и что определенные специфические короткие пептиды по меньшей мере из 9, 10, 11 или 12 смежных аминокислот из последовательности CCNA1 содержат иммуногенные эпитопы, которые распознаются Т-клетками при ограничении иммунного ответа по антигенам главного комплекса гистосовместимости (MHC) (например, при ограничении по HLA). К удивлению, несмотря на присутствие CCNA1 как внутриклеточного белка с ограниченным профилем экспрессии и распределением в ограниченном числе тканей, CCNA1, как раскрыто в данном документе, является ассоциированным с раком антигеном, и полученные из CCNA1 пептиды способны вызывать специфические к CCNA1 T-клеточные ответы. В некоторых предпочтительных вариантах осуществления описанные в данном документе полученные из CCNA1 пептиды способны вызывать специфические к CCNA1 ответы, реализуемые цитотоксическими лимфоцитами (CTL), с помощью CD8+T-клеток, ограниченных по HLA класса I.
Как более подробно описано ниже, внутриклеточный белок CCNA1, который, как показано ранее в исследованиях на мышах, участвует в возникновении и развитии лейкоза и способствует клеточной пролиферации и выживанию, обнаружен в компартменте LSC приблизительно у 50% всех пациентов с AML и не обнаруживается в других тканях, за исключением семенников. Применяя дендритные клетки, «обученные» библиотекой пептидов, охватывающей всю изоформу c CCNA1, которая обнаруживается в LSC, получали T-клетки, которые были способны отвечать на многие различные полученные из CCNA1 олигопептиды. Идентифицировали восемь полученных из CCNA1 пептидов, которые являлись иммуногенными для Т-клеток, два из которых более полно охарактеризованы как иммуногенные ограниченные по HLA A*0201 эпитопы CCNA1. T-клеточные клоны, специфические к этим эпитопам, распознавали «обученные» пептидом клетки-мишени, а также демонстрировали цитотоксичность против, THP-1, линии AML, положительной по HLA A*0201, которая эндогенно экспрессирует CCNA1.
Композиции и способы, описанные в данном документе, в определенных вариантах осуществления будут иметь терапевтическое применение для лечения заболеваний и состояний, ассоциированных со сверхэкспрессией CCNA1 (например, выявляемая экспрессия CCNA1 на уровне, который превышает по величине, при статистической значимости отличий, уровень экспрессии CCNA1, выявляемый в нормальной клетке или клетке без признаков заболевания). Такие заболевания включают различные формы рака и включают без ограничения гемобластозы, которые происходят из лейкемических стволовых клеток (LSC), сверхэкспрессирующих CCNA1, например, острый миелоидный лейкоз (AML). Неограничивающие примеры указанных и связанных применений описаны в данном документе и включают in vitro и in vivo стимуляцию антигенспецифических Т-клеточных ответов против CCNA1, например, путем применения иммуногенных пептидов CCNA1 в вакцинах на основе пептидов, применения вакцин на основе сконструированных полинуклеотидов, которые кодируют такие иммуногенные пептиды CCNA1 или дополнительные иммуногенные пептиды, присутствующие в CCNA1, или применения более крупных фрагментов или целого белка CCNA1 для индукции Т-клеточных ответов.
Также предусматриваются, в качестве иллюстрации, а не ограничения, иммунотерапевтические протоколы, включающие адоптивный перенос субъекту (например, пациенту с AML) антигенпрезентирующих клеток, которые были «обучены» in vitro иммуногенными пептидами CCNA1 или белком CCNA1 или которые были модифицированы для экспрессии иммуногенных пептидов CCNA1, и/или адоптивный перенос субъекту специфических к CCNA1 T-клеток, которые были индуцированы in vitro путем воздействия антигенпрезентирующих клеток, которые были «обучены» in vitro иммуногенными пептидами CCNA1. Принципы процессирования антигена антигенпрезентирующими клетками (APC), такими как дендритные клетки, макрофаги, лимфоциты и другие типы клеток, и презентирования антигена с помощью APC T-клеткам, включая ограниченное по антигенам главного комплекса гистосовместимости (MHC) презентирование иммуносовместимыми (например, обладающими по меньшей мере одной общей аллельной формой гена MHC, которая является релевантной для презентации антигена) APC и T-клетками, являются хорошо известными (см., например, Murphy, Janeway’s Immunobiology (8th Ed.) 2011 Garland Science, NY; главы 6, 9 и 16). Протоколы адоптивного переноса с использованием неселектируемых или селектируемых Т-клеток известны в данной области (например, заявки на патент США №№2011/0052530, 2010/0310534; Ho et al., 2006 J. Imm. Meth. 310:40; Ho et al., 2003 Canc. Cell 3:431) и могут модифицироваться в соответствии с идеей, изложенной в данном документе, для применения с популяциями переносимых клеток, содержащими Т-клетки, которые специфически индуцированы одним или несколькими иммуногенными, полученными из CCNA1 пептидами, содержащими Т-клеточные эпитопы.
В качестве другого неограничивающего примера, определенные раскрытые в настоящем документе варианты осуществления предусматривают клонирование CCNA1-реактивных Т-клеток, которые были индуцированы in vitro путем воздействия на антигенпрезентирующие клетки, которые были «обучены» in vitro иммуногенными пептидами CCNA1, и идентификацию в таких Т-клетках и клонирование из них функциональных (например, перегруппированных для продуцирования) генов, кодирующих T-клеточные рецепторы (TCR), которые затем можно применять для трансфекции/трансдукции популяции Т-клеток для адоптивного переноса субъекту. Последние достижения в секвенировании TCR описаны (например, Robins et al., 2009 Blood 114:4099; Robins et al., 2010 Sci. Translat. Med. 2:47ra64, PMID: 20811043; Robins et al. 2011 (Sept. 10) J. Imm. Meth. Epub ahead of print, PMID: 21945395; Warren et al., 2011 Genome Res. 21:790) и могут использоваться в ходе практического применения данных вариантов осуществления в соответствии с настоящим раскрытием. Аналогично, были описаны способы трансфекции/трансдукции T-клеток необходимыми нуклеиновыми кислотами (например, заявка на патент США №2004/0087025), также как и процедуры адоптивного переноса с использованием T-клеток с требуемой специфичностью к антигену (например, Schmitt et al., 2009 Hum. Gen. 20:1240; Dossett et al., 2009 Mol. Ther. 17:742; Till et al., 2008 Blood 112:2261; Wang et al., 2007 Hum. Gene Ther. 18:712; Kuball et al., 2007 Blood 109:2331; заявки на патент США №№2011/0243972; 2011/0189141; Leen et al., 2007 Ann. Rev. Immunol. 25:243), таким образом, предполагается адаптация данных методик к раскрытым в данном документе вариантам осуществления на основании идей, изложенных в данном документе, в том числе тех, которые направлены на специфические полученные из CCNA1 пептиды, которые способны вызывать антигенспецифические Т-клеточные ответы.
Раскрытые в данном документе T-клеточные иммуногены для применения в индукции или вызове иммунных ответов против клеток, ненадлежащим образом сверхэкспрессирующих CCNA1, таких как раковые клетки, включают выделенные пептиды, которые способны вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), причем каждый пептид включает по меньшей мере один полипептид CCNA1 полной длины или полипептид, полученный из CCNA1, не более чем из 400, 350, 300, 250, 200, 150, 125, 100, 80, 70, 60, 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8 или 7 аминокислот, где полипептид включает последовательность по меньшей мере из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, или 20, или 400, 350, 300, 250, 200, 150, 125, 100, 80, 70, 60, 50, 40, 30, 25 смежных аминокислот из аминокислотной последовательности CCNA1, изложенной в SEQ ID NO:9. Раковые клетки, сверхэкспрессирующие CCNA1, включают клетки гемобластозов, таких как лимфома и лейкоз, и, в частности, лейкемические стволовые клетки и/или клетки острого миелоидного лейкоза.
В соответствии с определенными раскрытыми в данном документе вариантами осуществления выделенный пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), включает полипептид общей формулы I:
N-X-C [I],
где:
(a) N-X-C представляет собой полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, в котором X включает аминокислотную последовательность, которая выбрана из
а также где:
(b) N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и где (c) C представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот.
В соответствии с данными и другими вариантами осуществления следует принимать во внимание, что амино-конец определенных полученных из CCNA1 пептидов, раскрытых в данном документе как содержащие Т-клеточные иммуногенные эпитопы, может состоять из 1-11 независимо выбранных природных и не встречающихся в природе аминокислот, и/или что в определенных вариантах осуществления карбокси-конец таких определенных пептидов может состоять из 1-11 независимо выбранных природных и не встречающихся в природе аминокислот, где такие амино- и карбокси-концы могут иметь любую последовательность, при условии что выделенный пептид имеет длину не более 9-20 аминокислот, и включает N-X-C, как изложено в данном документе, и способен специфически вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1).
В данном документе раскрыт ряд типичных полученных из CCNA1 пептидов, которые включают N-X-C в соответствии с формулой [I], как изложено в данном документе, и которые способны специфически вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1). Предусматриваемые в данном документе варианты осуществления данного изобретения, тем не менее, как предполагается, не являются ограничивающими, так что, принимая во внимание настоящее раскрытие, специалисты в данной области смогут легко получать и применять дополнительные пептиды CCNA1 (и их варианты), которые являются иммуногенными для T-клеток.
Например, определение трехмерных структур типичных полученных из CCNA1 иммуногенных пептидов, несущих Т-клеточные эпитопы, как описано в данном документе, может осуществляться с использованием обычных методик, таким образом, что замену одной или нескольких аминокислот выбранными природными или не встречающимися в природе аминокислотами можно смоделировать виртуально с целью определения того, сохраняет ли полученный таким образом структурный вариант пространственную конфигурацию, заряд, гидрофильные и/или гидрофобные свойства раскрытых в данном документе молекул, включая моделирование потенциальных пептидных аффинных взаимодействий с пептидсвязывающими желобками MHC (например, программное обеспечение для молекулярного моделирования BIMAS, описываемое Parker et al., J. Immunol. 152:163, 1994; Tsites database, Feller et al. 1991 Nature 349:720; Rothbard et al., 1988 EMBO J. 7:93-100; Deavin et al., 1996 Mol. Immunol. 33:145-155; и другие анализы, прогнозирующие связывание пептида HLA). См. также, например, Donate et al., 1994 Prot. Sci. 3:2378; Bradley et al., Science 309: 1868-1871 (2005); Schueler-Furman et al., Science 310:638 (2005); Dietz et al., Proc. Nat. Acad. Sci. USA 103:1244 (2006); Dodson et al., Nature 450:176 (2007); Qian et al., Nature 450:259 (2007); Raman et al. Science 327:1014-1018 (2010). Эти и другие ссылки описывают компьютерные алгоритмы, которые могут применяться в соответствующих вариантах осуществления, например, для рационального конструирования вариантов пептидов, полученных из CCNA1, несущих Т-клеточные эпитопы, которые предусматриваются в данном документе (например, SEQ ID NO:1-8), например, обеспечивающие определение атомных размеров в пространственных моделях (Ван-дер-Ваальсовы радиусы) для конформаций с минимальной свободной энергией.
Принимая во внимание настоящее раскрытие того, что полипептид CCNA1 и полученные из CCNA1 пептиды содержат иммуногенные эпитопы, например, молекулярные структуры, которые специфически распознаются T-клетками через Т-клеточный рецептор (TCR), в том числе через ограниченное по антигенам MHC распознавание T-клетками, таким образом, определенно предполагается, что изменения (например, увеличения или уменьшения, которые являются обнаружимыми при статистической значимости изменений) иммуногенности любого указанного содержащего эпитоп пептида CCNA1 можно вводить с помощью структурной модификации, например, с получением иммуногенных, полученных из пептида CCNA1 вариантов. Средства усиления иммуногенности определяемого пептидом эпитопа известны в данной области и могут включать подход измененного пептидного лиганда (APL), с помощью которого осуществляются структурные модификации указанного пептида. Пептиды-варианты с повышенной иммуногенностью были созданы как APL, как описано в других антигенных системах, например, Abdul-Alim et al. (2010 J. Immunol. 184:6514); Douat-Casassus et al. (2007 J. Med. Chem. 50:1598); Carrabba et al. (2003 Canc. Res. 63:1560); и Shang et al. (2009 Eur. J. Immunol. 39:2248). Соответственно, из настоящего раскрытия следует понимать, что пептидные последовательности CCNA1 включают большое количество иммуногенных эпитопов для T-клеток, таким образом, что фрагменты CCNA1 (например, последовательности по меньшей мере из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, или 20, или 400, 350, 300, 250, 200, 150, 125, 100, 80, 70, 60, 50, 40, 30, 25 смежных аминокислот из аминокислотной последовательности CCNA1, изложенной в SEQ ID NO:9) и/или варианты, которые предусматриваются в данном документе (включая APL), могут охватываться определенными вариантами осуществления.
Некоторые дополнительные неограничивающие примеры компьютерных алгоритмов, которые могут применяться в указанных и связанных вариантах осуществления, например, для рационального конструирования вариантов описанных в данном документе иммуногенных пептидных эпитопов CCNA1 (например, SEQ ID NO:1-8), включают NAMD, параллельный код для изучения молекулярной динамики, разработанная для высокопроизводительной симуляции больших биомолекулярных систем, и VMD, которая является программой визуализации молекул для отображения, анимации и анализа больших биомолекулярных систем с использованием 3-D графики и встроенных сценариев (см. Phillips, et al., Journal of Computational Chemistry, 26:1781-1802, 2005; Humphrey, et al., "VMD - Visual Molecular Dynamics", J. Molec. Graphics, 1996, vol. 14, pp. 33-38; см. также веб-сайт группы теоретической и вычислительной биофизики при университете Иллинойса в Урбана-Шампейне (Urbana-Champagne), по адресу ks.uiuc.edu/Research/vmd/). Многие другие компьютерные программы известны в данной области и доступны специалистам в данной области, и позволяют определять атомные размеры в пространственных моделях (Ван-дер-Ваальсовы радиусы) для конформаций с минимальной свободной энергией; например, GRID, которая направлена на определение участков с высокой аффинностью для различных химических групп, тем самым усиливая связывание; поиски методом Монте-Карло, которые вычисляют математическое выравнивание; и CHARMM (Brooks et al. (1983) J. Comput. Chem. 4:187-217) и AMBER (Weiner et al (1981) J. Comput. Chem. 106: 765), которая оценивает расчеты и анализ силовых полей (см. также, Eisenfield et al. (1991) Am. J. Physiol. 261:C376-386; Lybrand (1991) J. Pharm. Belg. 46:49-54; Froimowitz (1990) Biotechniques 8:640-644; Burbam et al. (1990) Proteins 7:99-111; Pedersen (1985) Environ. Health Perspect. 61:185-190; и Kini et al. (1991) J. Biomol. Struct. Dyn. 9:475-488). Различные соответствующие вычислительные компьютерные программы также коммерчески доступны, например, от Schrödinger (Мюнхен, Германия).
«Природная или не встречающаяся в природе аминокислота» включает любую из обычных встречающихся в природе аминокислот, которые служат в качестве строительных блоков для биосинтеза пептидов, полипептидов и белков (например, аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, метионин, аспарагин, пролин, глутамин, аргинин, серин, треонин, валин, триптофан, тирозин), а также включает модифицированные, дериватизированные, энантиомерные, редкие и/или необычные аминокислоты либо встречающиеся в природе, либо синтетические, например, гидроксипролин, гидроксилизин, десмозин, изодесмозин, ε-N-метиллизин, ε-N-триметиллизин, метилгистидин, дегидробутирин, дегидроаланин, α-аминомасляную кислоту, β-аланин, γ-аминомасляную кислоту, гомоцистеин, гомосерин, цитруллин, орнитин и другие аминокислоты, которые можно выделить из природного источника и/или которые можно химически синтезировать, например, как можно найти в Proteins, Peptides and Amino Acids Sourcebook (White, J.S. and White, D.C., 2002 Humana Press, Тотова, Нью-Джерси), или в Amino Acid and Peptide Synthesis (Jones, J., 2002 Oxford Univ. Press, США, Нью-Йорк), или в Unnatural Amino Acids, ChemFiles Vol.1, No. 5 (2001 Fluka Chemie GmbH; Sigma-Aldrich, Сент-Луис, Миссури), или в Unnatural Amino Acids II, ChemFiles Vol.2, No. 4 (2002 Fluka Chemie GmbH; Sigma-Aldrich, Сент-Луис, Миссури). Дополнительные описания природных и/или не встречающихся в природе аминокислот можно найти, например, в Kotha, 2003 Acc. Chem. Res. 36:342; Maruoka et al., 2004 Proc. Nat. Acad. Sci. USA 101:5824; Lundquist et al., 2001 Org. Lett. 3:781; Tang et al., 2002 J. Org. Chem. 67:7819; Rothman et al., 2003 J. Org. Chem. 68:6795; Krebs et al., 2004 Chemistry 10:544; Goodman et al., 2001 Biopolymers 60:229; Sabat et al., 2000 Org. Lett. 2:1089; Fu et al., 2001 J. Org. Chem. 66:7118; и Hruby et al., 1994 Meths. Mol. Biol. 35:249. Для обозначения природных и не встречающихся в природе аминокислот в данном документе применяются стандартные трехбуквенные сокращения и однобуквенные символы.
Другие не встречающиеся в природе аминокислоты или аналоги аминокислот известны в данной области и включают без ограничения не встречающиеся в природе L- или D-производные (такие как D-аминокислоты, присутствующие в пептидах), аминокислоты с флуоресцентной меткой, а также конкретные примеры, включающие O-метил-L-тирозин, L-3-(2-нафтил)аланин, 3-метилфенилаланин, 3-йодтирозин, О-пропаргилтирозин, гомоглутамин, O-4-аллил-L-тирозин, 4-пропил-L-тирозин, 3-нитро-L-тирозин, три-O-ацетил-GlcNAcβ-серин, L-ДОФА, фторированный фенилаланин, изопропил-L-фенилаланин, пара-азидо-L-фенилаланин, пара-ацил-L-фенилаланин, пара-ацетил-L-фенилаланин, мета-ацетил-L-фенилаланин, селенометионин, теллурометионин, селеноцистеин, алкинфенилаланин, O-аллил-L-тирозин, О-(2-пропинил)-L-тирозин, пара-этилтиокарбонил-L-фенилаланин, пара-(3-оксобутаноил)-L-фенилаланин, пара-бензоил-L-фенилаланин, L-фосфосерин, фосфоносерин, фосфонотирозин, гомопропаргилглицин, азидогомоаланин, пара-йодфенилаланин, пара-бром-L-фенилаланин, дигидроксифенилаланин, дигидроксил-L-фенилаланин, пара-нитро-L-фенилаланин, мета-метокси-L-фенилаланин, пара-йодфенилаланин, пара-бромфенилаланин, пара-амино-L-фенилаланин и изопропил-L-фенилаланин, трифторлейцин, норлейцин («Nle»), D-норлейцин («dNle» или «D-Nle»), 5-фтортриптофан, пара-галогенфенилаланин, гомофенилаланин («гомо-Phe»), селенометионин, этионин, S-нитрозогомоцистеин, тиапролин, 3-тиенилаланин, гомоаллилглицин, трифторизолейцин, транс- и цис-2-амино-4-гексеновую кислоту, 2-бутинилглицин, аллилглицин, пара-азидофенилаланин, пара-цианофенилаланин, пара-этинилфенилаланин, гексафторлейцин, 1,2,4-триазол-3-аланин, 2-фторгистидин, L-метилгистидин, 3-метил-L-гистидин, β-2-тиенил-L-аланин, β-(2-тиазолил)-DL-аланин, гомопропаргилглицин (HPG), и азидогомоаланин (AHA), и т.п.
В определенных вариантах осуществления может присутствовать природная или не встречающаяся аминокислота, которая содержит ароматическую боковую цепь, как обнаружено, например, в фенилаланине или триптофане или их аналогах, в том числе в других природных и не встречающихся в природе аминокислотах, на основании структур которых специалист в данной области легко поймет, когда присутствует ароматическая циклическая система, она, как правило, присутствует в виде ароматической моноциклической или полициклической углеводородной циклической системы, состоящей только из водорода и углерода и содержащей от 6 до 19 атомов углерода, где циклическая система может являться частично или полностью насыщенной, и которая может присутствовать в виде группы, которая включает без ограничения такие группы, как флуоренил, фенил и нафтил.
В определенных вариантах осуществления может присутствовать природная или не встречающаяся в природе аминокислота, которая содержит гидрофобную боковую цепь, как обнаружено, например, в аланине, валине, изолейцине, лейцине, пролине, фенилаланине, триптофане или метионине или их аналогах, в том числе в других природных и не встречающихся в природе аминокислотах, на основании структур которых специалист в данной области легко поймет, когда присутствует гидрофобная боковая цепь (например, как правило, такая, которая является неполярной, находясь в физиологической среде). В определенных вариантах осуществления может присутствовать природная или не встречающаяся в природе аминокислота, которая содержит основную боковую цепь, как обнаружено, например, в лизине, аргинине или гистидине или их аналогах, в том числе в других природных и не встречающихся в природе аминокислотах, на основании структур которых специалист в данной области легко поймет, когда присутствует основная (например, как правило, полярная и имеющая положительный заряд, находясь в физиологической среде).
Полипептиды, раскрытые в данном документе, могут включать L- и/или D-аминокислоты при условии, что биологическая активность (например, CCNA1-специфическая иммуногенность для Т-клеток) полипептида сохраняется. Выделенные полученные из CCNA1 полипептиды в определенных вариантах осуществления могут содержать любую из ряда известных природных и искусственных посттрансляционных или постсинтетических ковалентных химических модификаций с помощью реакций, которые могут включать гликозилирование (например, присоединение N-связанных олигосахаридов к остаткам аспарагина, присоединение О-связанных олигосахаридов к остаткам серина или треонина, гликирование или тому подобное), ацилирование жирной кислотой, ацетилирование, пегилирование и фосфорилирование. Полипептиды, раскрытые в данном документе, могут дополнительно включать аналоги, аллели и аллельные варианты, которые могут содержать делеции аминокислот или вставки или замены одного или нескольких аминокислотных остатков другими встречающимися в природе аминокислотными остатками или не встречающимися в природе аминокислотными остатками.
Пептидные и непептидные аналоги могут называться пептидными миметиками или пептидомиметиками и являются известными в фармацевтической отрасли (Fauchere, J. Adv. Drug Res. 15:29 (1986); Evans et al. J. Med. Chem. 30: 1229 (1987)). Данные соединения могут содержать один или несколько не встречающихся в природе аминокислотных остатков, один или несколько фрагментов с химическими модификациями (например, гликозилирование, пегилирование, фрагмент с флуоресценцией, радиоактивностью или другой фрагмент) и/или одну или несколько не встречающиеся в природе пептидную связь (связи) (например, восстановленную пептидную связь: --CH2-NH2--). Пептидомиметики можно разрабатывать с помощью различных способов, в том числе с помощью компьютерного молекулярного моделирования, случайного или сайтнаправленного мутагенеза, стратегий на основе ПЦР, химического мутагенеза и других.
Термин «выделенный» означает, что материал удален из своего первоначального окружения (например, природного окружения, если он встречается в природе). Например, встречающаяся в природе нуклеиновая кислота или полипептид, присутствующие в живом организме животного, не являются выделенными, но та же нуклеиновая кислота или полипептид, отделенные от некоторых или всех совместно присутствующих в природной системе материалов, являются выделенными. Такая нуклеиновая кислота может являться частью вектора, и/или такая нуклеиновая кислота или полипептид могут являться частью композиции (например, клеточного лизата) и при этом все же являться выделенными, поскольку такой вектор или композиция не является частью природного окружения для нуклеиновой кислоты или полипептида. Термин «ген» означает сегмент ДНК, участвующий в продуцировании полипептидной цепи; он включает участки, которые предшествуют кодирующему участку и следуют за ним, «лидерную и трейлерную последовательности», а также промежуточные последовательности (интроны) между отдельными кодирующими сегментами (экзонами).
Определенные варианты осуществления относятся к нуклеиновым кислотам, которые кодируют полипептиды, предусмотренные в данном документе, например, полученные из CCNA1 полипептиды, которые содержат эпитопы, распознаваемые Т-клетками и иммуногенные для них. Как будет понятно специалисту в данной области, нуклеиновая кислота может означать одно- и/или двухцепочечную ДНК, кДНК или РНК в любой форме, а также может включать положительную и отрицательную цепь нуклеиновой кислоты, которые комплементарны друг другу, в том числе антисмысловую ДНК, кДНК и РНК. Также включены миРНК, микроРНК, гибриды РНК-ДНК, рибозимы, и другие различные встречающиеся в природе или синтетические формы ДНК или РНК.
Определенные варианты осуществления включают нуклеиновые кислоты, содержащиеся в векторе. Специалист в данной области может легко установить векторы, пригодные для применения в определенных, раскрытых в данном документе вариантах осуществления. Типичный вектор может содержать молекулу нуклеиновой кислоты, способную транспортировать другую нуклеиновую кислоту, с которой она была связана, или которая способна к репликации в организме-хозяине. Некоторые примеры векторов включают плазмиды, вирусные векторы, космиды и другие. Некоторые векторы могут обладать способностью к автономной репликации в клетке-хозяине, в которую они были введены (например, бактериальные векторы, имеющие бактериальную точку начала репликации, и эписомные векторы млекопитающих), тогда как другие векторы могут интегрироваться в геном клетки-хозяина при введении в клетку-хозяина и таким образом реплицироваться вместе с геномом хозяина. Кроме того, некоторые векторы способны управлять экспрессией генов, с которыми они функционально связаны (данные векторы могут упоминаться как «векторы экспрессии»). В соответствии со связанными вариантами осуществления следует, кроме того, понимать, что, если одно или несколько средств (например, полинуклеотиды, кодирующие полученные из CCNA1 иммуногенные пептидные эпитопы или их варианты, которые описаны в данном документе) совместно вводят субъекту, то каждое средство может находиться в отдельных векторах или в одном и том же векторе, и несколько векторов (каждый из которых содержит отличное средство или то же средство) можно вводить в клетку или клеточную популяцию или вводить субъекту.
В определенных вариантах осуществления нуклеиновая кислота, кодирующая описанные в данном документе полученные из CCNA1 полипептиды, которые содержат эпитопы, распознаваемые Т-клетками и иммуногенные для них, может являться функционально связанной с определенными элементами вектора. Например, последовательности полинуклеотидов, которые необходимы для осуществления экспрессии и процессинга кодирующих последовательностей, с которыми они лигированы, могут являться функционально связанными. Контролирующие экспрессию последовательности могут включать соответствующие последовательности инициации транскрипции, терминации, промоторные и энхансерные последовательности; эффективные сигналы процессинга РНК, такие как сигналы сплайсинга и полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые повышают эффективность трансляции (т.е. консенсусные последовательности Kozak); последовательности, которые повышают стабильность белка; и, возможно, последовательности, которые усиливают секрецию белка. Последовательности, контролирующие экспрессию, могут являться функционально связанными, если они являются смежными с геном, представляющим интерес, и контролирующими экспрессию последовательностями, которые способствуют контролю гена, представляющего интерес, издали (in trans) или на расстоянии.
В конкретных вариантах осуществления рекомбинантный вектор экспрессии доставляют в соответствующую клетку, например, антигенпрезентирующую клетку, т.е. клетку, которая демонстрирует на своей клеточной поверхности комплекс пептид/МНС (например, дендритная клетка), который способен вызывать необходимый специфический к CCNA1 клеточно-опосредованный иммунный ответ, такой как ответ, реализуемый CD8 Т-клетками, в том числе ответ, реализуемый цитотоксическими Т-лимфоцитами (CTL). Рекомбинантные векторы экспрессии, таким образом, могут также включать, например, транскрипционные регуляторные элементы (TRE), специфические для лимфоидной ткани, такие как TRE, специфические для B-лимфоцитов, Т-лимфоцитов или дендритных клеток. В данной области известны TRE, специфические для лимфоидной ткани (см., например, Thompson et al., Mol. Cell. Biol. 12, 1043-53 (1992); Todd et al., J. Exp. Med. 177, 1663-74 (1993); Penix et al., J. Exp. Med. 178:1483-96 (1993)).
В определенных конфигурациях рекомбинантные векторы экспрессии могут содержать последовательности полинуклеотидов, которые кодируют факторы стимуляции/созревания дендритных клеток (DC). Иллюстративные молекулы стимуляции включают GM-CSF, IL-2, IL-4, IL-6, IL-7, IL-15, IL-21, IL-23, TNFα, B7.1, B7.2, 4-1BB, лиганд CD40 (CD40L), индуцируемый лекарственными средствами CD40 (iCD40) и тому подобное. Данные полинуклеотиды, как правило, находятся под контролем одного или нескольких регуляторных элементов, которые управляют экспрессией кодирующих последовательностей в дендритных клетках. Созревание дендритных клеток способствует успешной вакцинации (см., например, Banchereau et al., Nat. Rev. Immunol. 5:296-306 (2005); Schuler et al., Curr. Opin. Immunol. 15:138-147 (2003); Figdor et al., Nat. Med. 10:475-480 (2004)). Созревание может трансформировать DC из клеток, активно участвующих в захвате антигена, в клетки, специализированные для примирования Т-клеток. Например, вовлечение CD40 с помощью CD40L на хелперных CD4 Т-клетках является важным сигналом для созревания DC, приводящим в результате к сильной активации CD8+Т-клеток. Такие стимулирующие молекулы называют также факторами созревания или факторами стимуляции созревания.
В дополнение к векторам определенные варианты осуществления относятся к клеткам-хозяевам, которые содержат векторы, которые раскрыты в данном документе. Специалисту в данной области понятно, что многие подходящие клетки-хозяева доступны в данной области. Клетка-хозяин может включать любую отдельную клетку или клеточную культуру, которая может воспринимать вектор или включение нуклеиновых кислот и/или белков, а также любые клетки-потомки. Термин также охватывает потомство клетки-хозяина, генетически или фенотипически одинаковое или различное. Подходящие клетки-хозяева могут зависеть от вектора и могут включать клетки млекопитающих, клетки животных, клетки человека, клетки обезьян, клетки насекомых, клетки дрожжей и клетки бактерий. Данные клетки можно индуцировать к включению вектора или другого материала путем использования вирусного вектора, трансформации посредством осаждения с фосфатом кальция, DEAE-декстрана, электропорации, микроинъекции или других способов. Например, см. Sambrook et al. Molecular Cloning: A Laboratory Manual 2d ed. (Cold Spring Harbor Laboratory, 1989).
В определенных вариантах осуществления предусматриваются иммуногенные варианты описанных в данном документе полученных из CCNA1 полипептидов, которые содержат эпитопы, распознаваемые T-клетками и иммуногенные для них; данные варианты включают виды полипептидов, которые имеют одну или несколько аминокислотных замен, вставок или делеций в аминокислотной последовательности по сравнению с аминокислотными последовательностями формулы (I) или SEQ ID NO:1-8, которые представлены в данном документе. Консервативные аминокислотные замены хорошо известны и могут происходить естественным образом в полипептиде, или их можно вводить при рекомбинантном получении полипептида. Аминокислотные замены, делеции и вставки можно вводить в полипептид с использованием хорошо известных и обычно практикуемых способов мутагенеза (см., например, Sambrook et al. Molecular Cloning: A Laboratory Manual, 3d ed., Cold Spring Harbor Laboratory Press, NY 2001)). Процедуры сайт-специфического (или сегмент-специфического) мутагенеза с использованием олигонуклеотидов можно использовать для получения измененного полинуклеотида, который имеет определенные кодоны, измененные в соответствии с требуемой заменой, делецией или вставкой. Варианты с делециями или укороченные варианты конкретных пептидов, которые можно применять в качестве иммуногенов, можно также сконструировать с использованием подходящих сайтов рестрикции эндонуклеазами, непосредственно примыкающих к необходимой делеции. После рестрикции «липкие» концы можно заполнять и повторно лигировать ДНК. Альтернативно, методики случайного мутагенеза, такие как мутагенез со сканированием аланином, мутагенез с использованием допускающей ошибки полимеразной цепной реакции и сайтнаправленный мутагенез с использованием олигонуклеотидов можно применять для получения вариантов иммуногенных полипептидов (см., например, Sambrook et al., выше). Виды (или варианты) конкретного полученного из CCNA1 иммуногена (или его полипептидного фрагмента) могут включать полипептидный иммуноген, который характеризуется по меньшей мере 85%, 90%, 95% или 99% идентичностью аминокислотной последовательности с любой из иллюстративных аминокислотных последовательностей, раскрытых в данном документе (например, SEQ ID NO:1-8 или полипептиды не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, в которых может присутствовать по меньшей мере одна из SEQ ID NO:1-8).
Данные варианты полученных из CCNA1 пептидных иммуногенов сохраняют один или несколько видов биологической активности или функций соответствующего полученного из CCNA1 пептида, который является иммуногенным для Т-клеток, как описано в данном документе (например, SEQ ID NO:1-8). В частности, такие иммуногены, которые являются вариантами описанного в данном документе полученного из CCNA1 пептида, статистически, клинически или биологически значимо сохраняют способность индуцировать Т-клеточный ответ (включая ответ, реализуемый цитотоксическими Т-лимфоцитами). Принимая во внимание многие методики и способы молекулярной биологии, экспрессии белков, выделения белков, обычно применяемые в данной области для введения мутаций в полипептид, получения фрагментов полипептидов, выделения фрагментов и вариантов и анализа таких продуктов, иммуногенные варианты полипептида CCNA1 и их фрагменты, обладающие необходимыми видами биологической активности, можно получить легко и без излишнего экспериментирования, исходя из раскрытия, представленного в данном документе.
Разнообразные критерии, известные специалистам в данной области, указывают на то, является ли консервативной (или подобной) аминокислота, которая замещена в определенном положении в пептиде или полипептиде. Например, замена подобной аминокислотой или консервативная аминокислотная замена является такой, при которой аминокислотный остаток заменен аминокислотным остатком с подобной боковой цепью. Подобные аминокислоты можно включить в следующие категории: аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин); аминокислоты с кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота); аминокислоты с незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, гистидин); аминокислоты с неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан); аминокислоты с бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и аминокислоты с ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан). Пролин, который, как считается, сложнее классифицировать, характеризуется общими свойствами с аминокислотами, которые имеют алифатические боковые цепи (например, лейцин, валин, изолейцин и аланин). В определенных обстоятельствах замену глутамина глутаминовой кислотой или аспарагина аспарагиновой кислотой можно рассматривать в качестве подобной замены, поскольку глутамин и аспарагин являются амидными производными глутаминовой кислоты и аспарагиновой кислоты, соответственно. Как понятно в данной области, «подобие» между двумя полипептидами определяется путем сравнения аминокислотной последовательности и консервативных аминокислотных замен в полипептиде с последовательностью второго полипептида (например, применяя GENEWORKS, Align, алгоритм BLAST или другие алгоритмы, описанные в данном документе и практически осуществляемые в данной области).
Как описывается в данном документе для иммуногенных пептидных фрагментов CCNA1, анализы для оценки того, сворачивается ли соответствующий вариант в конформацию, сравнимую с не являющимся вариантом полипептидом или фрагментом, включают, например, способность белка реагировать с моно- или поликлональными антителами, которые являются специфическими к нативным или несвернутым эпитопам, сохранение лиганд-связывающих функций и чувствительность или устойчивость мутантного белка к расщеплению протеазами (см. Sambrook et al., выше). Такие варианты можно идентифицировать, охарактеризовать и/или получить в соответствии со способами, описанными в данном документе, или другими способами, известными в данной области, которые обычно применяются специалистами в данной области.
Выделенные/рекомбинантные иммуногены, включенные в иммуногенные композиции, описанные в данном документе, можно получать и готовить в соответствии с различными способами и методиками, которые обычно применяются в области молекулярной биологии и/или очистки полипептидов. Конструирование вектора экспрессии, который используется для рекомбинантного получения иммуногена, представляющего интерес, может осуществляться с использованием любого из многочисленных подходящих способов конструирования в молекулярной биологии, известных в данной области, включая без ограничения стандартные методики расщепления рестрикционными эндонуклеазами, лигирования, трансформации, плазмидной очистки и секвенирования ДНК, например, как описано в Sambrook et al. (издания 1989 и 2001 года; Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Нью-Йорк) и Ausubel et al. (Current Protocols in Molecular Biology (2003)). Для получения эффективной транскрипции и трансляции последовательность полинуклеотида в каждой рекомбинантной экспрессионной конструкции содержит по меньшей мере одну соответствующую последовательность, контролирующую экспрессию (также называемую регуляторной последовательностью), например, лидерную последовательность и, в частности, промотор, функционально (то есть с возможностью функционирования) связанный с нуклеотидной последовательностью, кодирующей иммуноген.
Способы, которые можно применять для выделения и очистки рекомбинантно полученного иммуногенного пептида, в качестве примера, могут включать получение супернатантов из подходящих систем клетка-хозяин/вектор, которые секретируют рекомбинантный иммуноген в культуральную среду, а затем концентрирование среды с применением коммерчески доступного фильтра. После концентрирования концентрат можно использовать в одной подходящей матрице очистки или в серии подходящих матриц, таких как аффинная матрица или ионообменная смола. Один или несколько этапов обращенно-фазовой HPLC можно использовать для дополнительной очистки рекомбинантного полипептида. Данные способы очистки также могут использоваться при выделении иммуногена из его природного окружения. Способы крупномасштабного получения одного или нескольких выделенных/рекомбинантных иммуногенов, описанных в данном документе, включают периодическую клеточную культуру, которая контролируется и управляется для поддержания соответствующих условий культивирования. Очистку иммуногена можно выполнять в соответствии со способами, которые описаны в данном документе и известны в данной области, и которые соответствуют законам и нормативам местных и иностранных контролирующих органов.
Наличие злокачественных состояний у субъекта относится к наличию диспластических, раковых и/или трансформированных клеток у субъекта, включая, например, неопластические, опухолевые клетки, клетки с отсутствующим контактным торможением или онкогенно трансформированные клетки или подобные (например, клетки гемобластозов, включая лимфомы и лейкозы, таких как острый миелоидный лейкоз, хронический миелоидный лейкоз и т.д.), которые известны в данной области, и для которых установлены критерии диагностики и классификации (например, Hanahan and Weinberg, 2011 Cell 144:646; Hanahan and Weinberg 2000 Cell 100:57; Cavallo et al., 2011 Canc. Immunol. Immunother. 60:319; Kyrigideis et al., 2010 J. Carcinog. 9:3). В предпочтительных вариантах осуществления, предусмотренных настоящим изобретением, например, такие раковые клетки могут представлять собой клетки острого миелоидного лейкоза, В-клеточного лимфобластного лейкоза, Т-клеточного лимфобластного лейкоза или миеломы, включая раковые стволовые клетки, которые способны инициировать и серийно перевивать любую из данных форм рака (см., например, см. Park et al. 2009 Molec. Therap. 17:219).
Полученные из CCNA1 полипептиды, которые содержат эпитопы, распознаваемые Т-клетками и иммуногенные для них, описанные в данном документе (например, SEQ ID NO:1-8, и их варианты), можно функционально охарактеризовать в соответствии с любой из большого числа принятых в данной области методологий для анализа Т-клеточной активности, включающих определение активации или индукции Т-клеток, а также включающих определение Т-клеточных ответов, которые являются антигенспецифическими. Примеры включают определение пролиферации Т-клеток, высвобождения цитокинов Т-клетками, антигенспецифической стимуляции Т-клеток, ограниченной по антигенам MHC стимуляции Т-клеток, активности CTL (например, путем выявления высвобождения 51Cr из предварительно нагруженных клеток-мишеней и/или анализа активности каспазы-3 (например, Jerome et al. 2003 Apoptosis 8:563; He et al., 2005 J. Imm. Meth. 304:43)), изменений экспрессии фенотипического маркера Т-клеток, а также другие измерения функций Т-клеток. Процедуры выполнения данных и подобных анализов можно найти, например, в Lefkovits (Immunology Methods Manual: The Comprehensive Sourcebook of Techniques, 1998). См. также Current Protocols in Immunology; Weir, Handbook of Experimental Immunology, Blackwell Scientific, Бостон, Массачусетс (1986); Mishell and Shigii (eds.) Selected Methods in Cellular Immunology, Freeman Publishing, Сан-Франциско, Калифорния (1979); Green and Reed, Science 281:1309 (1998), и ссылки, приведенные в них).
Уровни цитокинов можно определять в соответствии со способами, описанными в данном документе и применяемыми на практике в данной области, включая, например, ELISA, ELISPOT, внутриклеточное окрашивание цитокинов и проточную цитометрию и их комбинации (например, внутриклеточного окрашивания цитокинов и проточной цитометрии). Пролиферацию иммунных клеток и клональное размножение в результате антигенспецифической активации или стимуляции иммунного ответа можно определять путем выделения лимфоцитов, таких как циркулирующие лимфоциты в образцах клеток периферической крови или клеток из лимфатических узлов, стимулирования клеток антигеном и измерения уровня продукции цитокинов, пролиферации клеток и/или жизнеспособности клеток, например, с помощью введения меченого тритием тимидина или анализов без использования радиоактивности, таких как МТТ анализы и тому подобное. Воздействие иммуногена, описанного в данном документе, на баланс между иммунным ответом, реализуемым Th1, и иммунным ответом, реализуемым Th2, можно исследовать, например, путем определения уровней Th1 цитокинов, таких как IFN-γ, IL-12, IL-2 и TNF-β, и цитокинов 2 типа, таких как IL-4, IL-5, IL-9, IL-10 и IL-13.
Уровень иммунного ответа, реализуемого CTL, таким образом, можно определять любым из многочисленных иммунологических способов, описанных в данном документе и обычно практикуемых в данной области. Уровень иммунного ответа, реализуемого CTL, можно определять до и после введения любого из описанных в данном документе полученных из CCNA1 полипептидов, содержащих эпитопы, распознаваемые Т-клетками и иммуногенные для них, (или введения композиции, содержащей полинуклеотид, кодирующий такой полипептид). Для определения активности CTL можно выполнять анализы цитотоксичности с использованием любой из нескольких методик и способов, обычно практикуемых в данной области (см., например, Henkart et al., “Cytotoxic T-Lymphocytes” in Fundamental Immunology, Paul (ed.) (2003 Lippincott Williams & Wilkins, Филадельфия, Пенсильвания), страницы 1127-50 и ссылки, приведенные в них).
Партнер по связыванию или антитело называется «иммуноспецифическим», «специфичным к» иммуногену, представляющему интерес, или оно «специфически связывается» с ним, если антитело реагирует на выявляемом уровне с иммуногеном или его иммуногенным фрагментом, предпочтительно с константой аффинности, Ka, большей или равной приблизительно 104 M-1, или большей или равной приблизительно 105 M-1, большей или равной приблизительно 106 M-1, большей или равной приблизительно 107 M-1, или большей или равной приблизительно 108 M-1. Аффинность антитела к его когнатному антигену также обычно выражается в виде константы диссоциации, Kd, и антитело специфически связывается с иммуногеном, представляющим интерес, если оно связывается с Kd, меньшей или равной 10-4 M, меньшей или равной приблизительно 10-5 M, меньшей или равной приблизительно 10-6 M, меньшей или равной 10-7 M или меньшей или равной 10-8 M.
Аффинности партнеров по связыванию или антител можно легко определить с использованием обычных методик, например, таких, которые описаны Scatchard et al. (Ann. N.Y. Acad. Sci. USA 51:660 (1949)), и с помощью поверхностного плазмонного резонанса (SPR; BIAcore™, Biosensor, Пискатауэй, Нью-Джерси). Для поверхностного плазмонного резонанса молекулы-мишени иммобилизуют на твердой фазе и подвергают воздействию партнера по связыванию (или лиганда) в подвижной фазе, проходящей через проточную кювету. Если происходит связывание лиганда с иммобилизированной мишенью, изменяется местный показатель преломления, приводя к изменению угла SPR, который можно отслеживать в реальном масштабе времени путем выявления изменений интенсивности отраженного света. Скорости изменения сигнала SPR можно анализировать для получения кажущихся констант скорости для фаз ассоциации и диссоциации в реакции связывания. Отношение данных значений дает кажущуюся константу равновесия (аффинности) (см., например, Wolff et al., Cancer Res. 53:2560-2565 (1993)).
Антигенспецифические Т-клеточные ответы, как правило, определяют путем сравнений наблюдаемых Т-клеточных ответов в соответствии с любым из описанных в данном документе функциональных параметров Т-клеток (например, пролиферация, высвобождение цитокинов, активность CTL, измененный фенотип по маркерам на клеточной поверхности и т.д.), которые можно получить у Т-клеток, которые подвергаются воздействию когнатного антигена в соответствующем контексте (например, антигена, используемого для примирования или активации Т-клеток при презентировании иммуносовместимыми антигенпрезентирующими клетками), и Т-клеток из той же исходной популяции, которые вместо этого подвергаются воздействию отличающегося по структуре или нерелевантного контрольного антигена. Ответ на когнатный антиген, который превышает при статистической значимости отличий ответ на контрольный антиген, является признаком специфичности к антигену.
Можно получить биологический образец от субъекта для определения наличия и уровня иммунного ответа на иммуногенный полученный из CCNA1 полипептид, описанный в данном документе, который содержит эпитоп, распознаваемый Т-клетками и иммуногенный для них. «Биологический образец», как применяется в данном документе, может являться образцом крови (из которого можно получить сыворотку или плазму), биопсийным материалом, жидкостями организма (например, легочный лаваж, асцитная жидкость, смывы со слизистых оболочек, синовиальная жидкость), костным мозгом, лимфатическими узлами, тканевым эксплантатом, культурой органа или любым другим препаратом ткани или клеток из субъекта или биологического источника. Биологические образцы также можно получить от субъекта до получения им любой иммуногенной композиции, причем такой биологический образец пригоден в качестве контроля для получения исходных данных (т.е. до иммунизации).
Что касается всех иммуноанализов и способов, описанных в данном документе, для определения иммунного ответа, специалист в данной области также легко оценит и поймет экспериментальные контрольные условия, которые надлежащим образом включены при практическом осуществлении данных способов. Концентрации компонентов реакционной смеси, типы буферов, температуры и периоды времени, достаточные для обеспечения взаимодействия компонентов реакционной смеси, можно определять и/или регулировать в соответствии со способами, которые описаны в данном документе и известны специалистам в данной области.
Термины идентичность последовательностей и гомология последовательностей, на которые обычно ссылаются в данной области и которые используются в данном документе, можно использовать взаимозаменяемо, и они, в целом, относятся к проценту нуклеотидов или аминокислотных остатков в последовательности-кандидате, которые идентичны, соответственно, нуклеотидам или аминокислотным остаткам в нативной последовательности полинуклеотида или полипептида после выравнивания последовательностей и введения гэпов, если это необходимо, для достижения максимального процента идентичности последовательностей и без учета любых консервативных замен как части идентичности последовательности. Предпочтительно, выделенный пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), описанный в данном документе, или кодирующий его полинуклеотид в соответствии с вариантами осуществления, раскрытыми в данном документе, содержит по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, 96%, 97%, 98% или 99% общих аминокислотных остатков (или нуклеотидов в полинуклеотиде, кодирующем такой полученный из CCNA1 полипептид) с иммуногенными пептидами, раскрытыми в данном документе, как SEQ ID NO:1-8. Такую идентичность последовательностей можно определять в соответствии с хорошо известными алгоритмами анализа последовательностей, в том числе такими, которые доступны от Genetics Computer Group из университета Висконсина (Мадисон, Висконсин), такие как FASTA, Gap, Bestfit, BLAST или другие.
Также в соответствии с некоторыми вариантами осуществления настоящего изобретения было определено, что N-концевые удлинения пептидов, содержащих T-клеточные эпитопы CCNA1, описанных в данном документе, могут изменять аффинность связывания пептида с антигеном класса I главного комплекса гистосовместимости (МНС), в связи с которым пептид может отображаться на поверхности антигенпрезентирующей клетки (АРС), и/или связывания пептида с Т-клеточным рецептором у специфических к CCNA1 Т-клеток, тогда как С-концевые удлинения могут также усиливать связывание и/или повышать активность полученных из CCNA1 пептидов. Соответственно, определенные варианты осуществления предусматривают применение одного или нескольких пептидов с аминокислотными последовательностями, изложенными в SEQ ID NO:1-8, и/или вариантов таких пептидов, описанных в данном документе, и определенные варианты осуществления могут дополнительно или альтернативно включать применение полипептидов не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, которые содержат в своей последовательности любой из данных пептидов. Таким образом, определенные предусматриваемые варианты осуществления относятся к полученным из CCNA1 иммуногенным для Т-клеток пептидам, имеющим удлинениями пептидов на амино-конце и/или карбокси-конце, дополнительно к аминокислотным последовательностям, изложенным в SEQ ID NO:1-8, или их вариантам, которые, как описано в данном документе, можно выбирать по их способности вызывать антигенспецифический Т-клеточный ответ на CCNA1, такой как ответ, реализуемый CTL.
Как понятно специалисту в области медицины, термины «лечить» и «лечение» относятся к медицинскому контролю заболевания, расстройства или состояния у субъекта (т.е. пациента, хозяина, который может являться человеком или животным, помимо человека) (см., например, Stedman’s Medical Dictionary). В целом, соответствующая доза и схема лечения обеспечивают один или несколько из описанных в данном документе полученных из CCNA1 пептидных иммуногенов (например, SEQ ID NO:1-8 и их варианты) и необязательно адъювант, в количестве, достаточном для обеспечения терапевтического и/или профилактического благоприятного воздействия. Терапевтические и/или профилактические благоприятные воздействия, получаемые в результате терапевтического лечения и/или профилактических или превентивных способов, включают, например, улучшение клинического результата, где целью является предупреждение, или замедление, или иное снижение (например, снижение при статистической значимости отличий по сравнению с контролем, не получавшим лечение) нежелательного физиологического изменения или нарушения, или предупреждение, или замедление, или иное снижение распространения или тяжести такого заболевания или нарушения. Благоприятные или желаемые клинические результаты лечения субъекта включают без ограничения ослабление, уменьшение или облегчение симптомов, которые являются результатом или связаны с заболеванием или нарушением, подлежащим лечению; снижение частоты возникновения симптомов; улучшение качества жизни; продление стадии ремиссии (т.е. снижение вероятности или предрасположенности субъекта к проявлению симптомов, на основании которых ставится диагноз заболевания); уменьшение степени заболевания; стабилизированное (т.е. без ухудшения) состояние заболевания; задержка или замедление развития заболевания; ослабление или временное облегчение состояния заболевания; и ремиссия (частичную или полная), либо выявляемая, либо невыявляемая; и/или увеличение общей продолжительности жизни.
«Лечение» может также означать продление жизни по сравнению с предполагаемой продолжительностью жизни, если бы субъект не получал лечения. Субъекты, нуждающиеся в способах и композициях, описанных в данном документе, включают тех, кто уже имеет заболевание или нарушение, а также субъектов, предрасположенных к заболеванию или нарушению или с риском их развития. Субъекты, нуждающиеся в профилактическом лечении, включают субъектов, у которых заболевание, состояние или расстройство необходимо предупредить (т.е. уменьшить вероятность возникновения или повторного появления заболевания или нарушения). Клиническое благоприятное воздействие, обеспечиваемое композициями (и препаратами, содержащими композиции) и способами, описанными в данном документе, можно оценивать путем разработки и осуществления in vitro анализов, доклинических исследований и клинических исследований у субъектов, введение композиций которым иметь целью получение благоприятного воздействия. Разработка и осуществление соответствующих доклинических исследований и клинических исследований могут быть легко выполнены специалистами в данной области (областях) техники.
Выделенные полученные из CCNA1 пептидные иммуногены (включая синтетически или рекомбинантно полученные пептиды) или рекомбинантные векторы экспрессии, кодирующие такой пептид (пептиды), можно вводить субъекту в фармацевтически или физиологически приемлемом или подходящем вспомогательном веществе или носителе. Фармацевтически приемлемые вспомогательные вещества представляют собой биологически совместимые среды, например, физиологический раствор, которые описываются более подробно в данном документе и пригодны для введения субъекту-человеку или другому субъекту, помимо человека, включая субъект-млекопитающее, помимо человека.
Применительно к введению рекомбинантного вектора экспрессии терапевтически эффективное количество предусматривает количество полинуклеотида, которое способно давать клинически желаемый результат (т.е. экспрессируется достаточное количество полученного из CCNA1 пептидного иммуногена для индукции или усиления иммунного ответа, реализуемого Т-клетками, специфическими к CCNA1 (например, клеточно-опосредованного ответа, включая ответ, реализуемый цитотоксическими Т-клетками) при статистической значимости отличий), у подвергающегося лечению человека или животного, помимо человека. Как хорошо известно в области медицины, дозировка для любого пациента зависит от многих факторов, включая рост, вес, площадь поверхности тела, возраст пациента, конкретное соединение, подлежащее введению, пол, время и путь введения, общее состояние здоровья и другие лекарственные средства, вводимые одновременно. Дозы будут варьировать, но предпочтительная доза для введения иммуногенной композиции, содержащей рекомбинантный вектор экспрессии, является достаточной для обеспечения приблизительно от 106 до 1012 копий молекулы векторного полинуклеотида.
Фармацевтические композиции, включая композиции специфических к CCNA1 иммуногенов для Т-клеток, описанные в данном документе, можно вводить способом, соответствующим заболеванию или состоянию, подлежащему лечению (или предупреждению), как определено специалистами в области медицины. Соответствующая доза и подходящая продолжительность и частота введения композиций определяются такими факторами, как состояние здоровья пациента, размерными параметрами пациента (т.е. весом, массой или поверхностью тела), типом и тяжестью заболевания пациента, конкретной формой активного ингредиента и способом введения. В целом, соответствующая доза и схема лечения обеспечивают композицию (композиции) в количестве, достаточном для обеспечения терапевтического и/или профилактического эффекта (такого как описывается в данном документе, включая улучшение клинического результата, например, более частые полные или частичные ремиссии, или более длительное время без признаков заболевания, и/или увеличение общей продолжительности жизни, или уменьшение тяжести симптомов). Для профилактического применения доза должна быть достаточной для предупреждения, задержки проявления или уменьшения тяжести заболевания, связанного с заболеванием или нарушением. Профилактическое полезное воздействие иммуногенных композиций, вводимых в соответствии со способами, описанными в данном документе, можно определять путем проведения доклинических (включая in vitro и in vivo исследования на животных) и клинических исследований и анализа данных, полученных из них, с помощью соответствующих статистических, биологических и клинических способов и методик, все из которых могут быть легко осуществлены специалистом в данной области.
В целом, количество иммуногена, в том числе слитых полипептидов, описанных в данном документе, содержащееся в дозе или продуцируемое in situ с помощью кодирующего полинуклеотида, содержащегося в дозе, находится в диапазоне от приблизительно 0,01 мкг до приблизительно 1000 мкг на кг хозяина. Применение минимальной дозировки, которая является достаточной для обеспечения эффективной терапии, как правило, является предпочтительным. Терапевтическую или профилактическую эффективность у пациентов можно отслеживать с применением анализов, подходящих для состояния, подвергаемого лечению или профилактике, при этом анализы знакомы специалистам в данной области и описываются в данном документе. При введении в жидкой форме удовлетворяющие требованиям величины дозы будут варьировать в зависимости от размерных параметров пациента, но, как правило, находятся в пределах от приблизительно 1 мл до приблизительно 500 мл (включающих от приблизительно 0,01 мкг до приблизительно 1000 мкг на кг) для пациента массой 10-60 кг. Оптимальные дозы, в целом, можно определять с использованием экспериментальных моделей и/или клинических испытаний. Оптимальная доза может зависеть от массы тела, поверхности тела, веса или объема крови субъекта. Как описывается в данном документе, соответствующая доза может также зависеть от состояния пациента (например, человека), то есть стадии заболевания, общего состояния здоровья, а также возраста, пола, и веса, и других факторов, известных специалисту в области медицины.
Для фармацевтических композиций, содержащих молекулу нуклеиновой кислоты, такую как рекомбинантные векторы экспрессии, описанные в данном документе, молекула нуклеиновой кислоты может присутствовать в любой из разнообразных систем доставки, известных специалистам в данной области, включая нуклеиновую кислоту и бактериальные, вирусные системы экспрессии и системы экспрессии у млекопитающих, такие как, например, векторные частицы и рекомбинантные конструкты экспрессии, которые предусматриваются в данном документе. Методики включения полинуклеотида (например, ДНК) в такие системы экспрессии хорошо известны специалистам в данной области. В других определенных вариантах осуществления рекомбинантный вектор экспрессии, который, как правило, представляет собой ДНК, которая также может являться «голой», как описанный, например, в Ulmer et al., Science 259:1745-49 (1993), и упоминаемый в обзоре Cohen, Science 259:1691-92 (1993). Поглощение голой ДНК можно увеличить путем нанесения ДНК на биоразлагаемые гранулы, которые эффективно транспортируются в клетки.
Молекулы нуклеиновых кислот могут доставляться в клетку в соответствии с любым из нескольких способов, описанных в данной области (см., например, Akhtar et al., Trends Cell Bio. 2:139 (1992); Delivery Strategies for Antisense Oligonucleotide Therapeutics, ed. Akhtar, 1995, Maurer et al., Mol. Membr. Biol. 16:129-40 (1999); Hofland and Huang, Handb. Exp. Pharmacol. 137:165-92 (1999); Lee et al., ACS Symp. Ser. 752:184-92 (2000); патент США №6395713; публикация международной заявки №WO 94/02595); Selbo et al., Int. J. Cancer 87:853-59 (2000); Selbo et al., Tumour Biol. 23:103-12 (2002); публикации заявок на патенты США №№2001/0007666 и 2003/077829). Такие способы доставки, известные специалистам в данной области, включают без ограничения инкапсулирование в липосомы, ионтофорез или включение в другие среды, такие как биоразлагаемые полимеры; гидрогели; циклодекстрины (см., например, Gonzalez et al., Bioconjug. Chem. 10:1068-74 (1999); Wang et al., публикации международных заявок №№WO 03/47518 и WO 03/46185); микросферы на основе сополимера молочной и гликолевой кислот (PLGA) и PLCA (также пригодные для доставки пептидов, и полипептидов, и других веществ) (см., например, патент США №6447796; публикацию заявки на патент США №2002/130430); биоразлагаемые нанокапсулы; и биоадгезивные микросферы, или доставку с помощью белковых векторов (публикация международной заявки №WO 00/53722). В другом варианте осуществления молекулы нуклеиновых кислот также могут быть включены в состав или в комплекс с полиэтиленимином и его производными, такими как полиэтиленимин-полиэтиленгликоль-N-ацетилгалактозаминовые (PEI-PEG-GAL) или полиэтиленимин-полиэтиленгликоль-три-N-ацетилгалактозаминовые (PEI-PEG - triGAL) производные (см. также, например, заявку на патент США №2003/0077829).
Некоторые из раскрытых вариантов осуществления настоящего изобретения включают превентивную обработку субъекта или клеток, тканей или органов субъекта, у которого есть подозрение на наличие или восприимчивость к состояниям, ассоциированным со сверхэкспрессией CCNA1. Превентивная обработка может являться таким же или отличаться от схемы (дозировкой и режимом, а также выбором иммуногенного полученного из CCNA1 пептида и/или других терапевтических средств, таких как антигенпрезентирующие клетки или адоптивно переносимые Т-клетки), используемой для лечения субъекта или клетки, ткани или органов субъекта, у которого было подтверждено наличие состояния, ассоциированного со сверхэкспрессией CCNA1. Предупреждение и/или лечение может также включать применение вакцин, содержащих композиции, раскрытые в данном документе, например, в качестве иллюстрации и без ограничения, одного или нескольких полученных из CCNA1 пептидов, которые являются иммуногенными для антигенспецифических Т-клеток.
Конкретные рассматриваемые варианты осуществления относятся к иммунотерапевтическим схемам с использованием описанных в данном документе композиций и способов для того, чтобы вызывать Т-клеточные иммунные ответы, которые направлены против лейкемических стволовых клеток (LSC). Более конкретно и в соответствии с неограничивающей теорией, раскрытой в данном документе, в определенных вариантах осуществления предполагается, что вызываются ответы, реализуемые цитотоксическими Т-лимфоцитами (CTL), которые специфически направлены против LSC. Таким образом, полагают, что данные и связанные варианты осуществления предусматривают высокоспецифический подход для устранения или существенного уменьшения популяции LSC у субъекта, тем самым обеспечивая положительные эффекты лечения лейкозов, которые характеризуются сверхэкспрессией CCNA1, как например, острый миелоидный лейкоз (AML). Данные подходы также предлагают беспрецедентные преимущества, связанные со специчностью, обеспечиваемой ограниченным профилем сверхэкспрессии CCNA1, и с избежанием нежелательных генерализованных токсических эффектов, которые сопровождают многие менее специфические к мишени иммунотерапевтические подходы.
Состояние, ассоциированное со сверхэкспрессией CCNA1, включает любое нарушение или состояние, при котором существует недостаточная активность, повышенная активность или ненадлежащая активность клеточного или молекулярного процесса с участием CCNA1, и оно, как правило, является результатом необычно высоких (при статистической значимости отличий) уровней экспрессии CCNA1 на пораженных клетках (например, лейкозных клетках, таких как клетки AML или лейкемические стволовые клетки) по сравнению с нормальными клетками. На субъекта с таким нарушением или состоянием окажет благоприятное воздействие лечение с помощью композиции или способа согласно описываемым в данном документе вариантам осуществления. Таким образом, некоторые состояния, ассоциированные со сверхэкспрессией CCNA1, могут включать острые, а также хронические нарушения и заболевания, такие как те патологические состояния, которые провоцируют конкретное нарушение у субъекта.
Некоторые неограничивающие примеры состояний, ассоциированных со сверхэкспрессией CCNA1, включают гиперпролиферативные нарушения, которые относятся к состояниям активированных и/или пролиферирующих клеток (которые также могут являться транскрипционно гиперактивными) у субъекта, включая опухоли, неоплазии, рак, злокачественные новообразования и т.д. В дополнение к активированным и/или пролиферирующим клеткам, гиперпролиферативное нарушение также может включать нарушение или неправильную регуляцию процессов клеточной гибели путем либо некроза, либо апоптоза. Такое нарушение процессов клеточной гибели может являться ассоциированным с различными состояниями, включая рак (в том числе первичные, вторичные злокачественные новообразования, а также метастазы) и другие состояния.
В соответствии с определенными вариантами осуществления считается, что фактически любой тип злокачественного новообразования, который характеризуется сверхэкспрессией CCNA1, можно лечить посредством применения композиций и способов, описанных в данном документе, в том числе без ограничений гемобластозы (например, лейкозы, включая острый миелоидный лейкоз (AML), T- или B-клеточные лимфомы, миелому и др.). Кроме того, «рак» может относиться к любой ускоренной пролиферации клеток, включая солидные опухоли, асцитные опухоли, злокачественные новообразования крови или лимфы или другие злокачественные новообразования; злокачественные новообразования соединительной ткани; метастазирующие опухоли; минимальное остаточное заболевание после трансплантации органов или стволовых клеток; формы рака, устойчивые к нескольким видам лекарственных средств, первичные или вторичные злокачественные новообразования, ангиогенез, связанный со злокачественными новообразованиями, или другие формы рака. Также в раскрытых в данном документе вариантов осуществления предусматриваются конкретные варианты осуществления, где включен только один из вышеуказанных видов заболевания, или где конкретные состояния могут быть исключены независимо от того, характеризуются они сверхэкспрессией CCNA1 или нет.
Определенные способы лечения или профилактики, предусмотренные в данном документе, включают введение композиции, которая содержит необходимую молекулу нуклеиновой кислоты, таким образом, что она устойчиво интегрируется в хромосому определенных желаемых клеток. Например, такие композиции можно интегрировать в клетки иммунной системы (например, антигенпрезентирующие клетки и/или Т-клетки) с целью активации требуемого направленного на CCNA1 Т-клеточного ответа.
Как применяется в данном документе, введение композиции или терапевтического средства относится к их доставке субъекту независимо от пути или способа доставки. Введение может осуществляться непрерывно или периодически, системно или локально. Введение может быть предназначено для лечения субъекта с уже подтвержденным наличием определенного состояния, заболевания или болезненного состояния, или для субъектов, восприимчивых к такому состоянию, заболеванию или болезненному состоянию или с риском их развития. Совместное введение может включать одновременную и/или последовательную доставку нескольких средств в любом порядке и в любом режиме дозирования.
Эффективное количество терапевтической или фармацевтической композиции относится к количеству, достаточному в необходимых дозировках и в течение необходимых периодов времени для достижения желаемых клинических результатов или благоприятного воздействия лечения, как описано в данном документе. Эффективное количество можно доставлять одним или несколькими введениями. Если введение осуществляется субъекту с уже известным или подтвержденным наличием заболевания или болезненного состояния, термин «терапевтическое количество» может применяться по отношению к лечению, тогда как «профилактически эффективное количество» может применяться для описания введения эффективного количества субъекту, который восприимчив к развитию заболевания или болезненного состояния или имеет риск их развития, в качестве превентивного курса.
Фармацевтические композиции
В определенных вариантах осуществления раскрытого изобретения субъекту вводят фармацевтическую композицию, содержащую по меньшей мере одну раскрытую в данном документе композицию (например, выделенный пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1, или рекомбинантный вектор экспрессии, кодирующий данный пептид). Как применяется в данном документе, фармацевтическая композиция, в целом, относится к комбинации активного фармацевтического лекарственного средства или другого терапевтического средства и вспомогательного вещества или носителя, либо инертного, либо активного, где фармацевтическая композиция содержит по меньшей мере один выделенный пептид, способный вызывать антигенспецифический Т-клеточный ответ на CCNA1 (или рекомбинантный вектор экспрессии, кодирующий данный пептид), который подходит для терапевтического применения, включающего профилактическое применение, in vivo, in vitro или ex vivo.
В определенных вариантах осуществления настоящее изобретение относится к составам из одной или нескольких композиций, описанных в данном документе, в фармацевтически приемлемых вспомогательных веществах или носителях для введения в клетку или субъекту либо отдельно, либо в комбинации с одним или несколькими другими методами терапии. Понятно, что при необходимости композицию, описанную в данном документе, также можно вводить в комбинации с другими средствами, включающими терапевтические средства. Такие композиции можно синтезировать de novo или очищать от клеток-хозяев или других биологических источников.
Будет очевидно, что любая из фармацевтических композиций, описанных в данном документе, может содержать фармацевтически приемлемые вспомогательные вещества или другие носители и может содержать приемлемые соли. Такие соли можно получать, например, с фармацевтически приемлемыми нетоксичными основаниями, включающими органические основания (например, соли первичных, вторичных и третичных аминов и основных аминокислот) и неорганические основания (например, натриевые, калиевые, литиевые, аммониевые, кальциевые и магниевые соли).
Несмотря на то что любой подходящий носитель, известный специалистам в данной области, можно использовать в описанных в данном документе фармацевтических композициях (например, фармацевтических композициях, которые содержат описанный в данном документе выделенный пептид, способный вызывать специфический к CCNA1 Т-клеточный ответ, или рекомбинантный вектор экспрессии, кодирующий данный пептид), тип носителя, как правило, будет варьировать в зависимости от способа введения. Композиции согласно настоящему изобретению можно в определенных вариантах осуществления составлять для любого применимого способа введения, в том числе, например, местного, перорального, назального, чресслизистого, внутривенного, внутриопухолевого, ректального, парентерального, внутрибрюшинного, подкожного и внутримышечного введения.
Носители для применения с такими фармацевтическими композициями являются биосовместимыми, а также могут являться биоразлагаемыми. В определенных вариантах осуществления состав предпочтительно обеспечивает относительно постоянный уровень высвобождения активного компонента. В других вариантах осуществления, однако, может требоваться более высокая скорость высвобождения сразу после введения. Составление таких композиций с использованием известных методик находится в пределах компетенции специалиста в данной области. Иллюстративные носители, применимые в этом отношении, включают микрочастицы из сополимера лактида и гликолида, полиакрилата, латекса, крахмала, целлюлозы, декстрана и т.п. Другие иллюстративные носители с отсроченным высвобождением включают надмолекулярные биовекторы, которые содержат не являющееся жидким гидрофильное ядро (например, сшитый полисахарид или олигосахарид) и, необязательно, наружный слой, содержащий амфифильное соединение, такое как фосфолипид (см., например, патент США №5151254 и РСТ заявки №№WO 94/20078, WO/94/23701 и WO 96/06638). Количество активного соединения, содержащегося в составе с замедленным высвобождением, зависит от пути введения, скорости и ожидаемой продолжительности высвобождения и природы состояния, подлежащего лечению или предупреждению.
В определенных вариантах осуществления настоящего изобретения можно использовать подщелачивающее средство, которое, как правило, растворимо в водной фазе в условиях физиологического рН. Такие подщелачивающие средства хорошо известны специалистам в данной области и могут включать гидроксиды, карбонаты, бикарбонаты, фосфаты щелочных или щелочноземельных металлов, борат натрия, а также основные соли (как описано в данном документе).
В другом иллюстративном варианте осуществления биоразлагаемые микросферы (например, полилактат-полигликолят) используются в качестве носителей для композиций, раскрытых в данном документе. Пригодные биоразлагаемые микросферы описаны, например, в патентах США №№4897268; 5075109; 5928647; 5811128; 5820883; 5853763; 5814344, 5407609 и 5942252. В другом иллюстративном носителе/системе доставки используется носитель, содержащий комплексы частицы-белок, такие как описанные в патенте США №5928647, которые способны индуцировать у хозяина реализуемый цитотоксическими Т-лимфоцитами ответ, ограниченный по антигенам главного комплекса гистосовместимости класса I.
В другом иллюстративном варианте осуществления частицы с ядром из фосфата кальция используют в качестве носителей, адъювантов или в качестве матриц с контролируемым высвобождением для композиций согласно настоящему изобретению. В определенных вариантах осуществления для повышения иммунного ответа субъекта может требоваться адъювант. Адъюванты хорошо известны в данной области и могут включать цитокины, инактивированные вирусы или бактерии или их фрагменты, антитела или любое другое средство, которое усиливает иммунный ответ.
Фармацевтические композиции, предусматриваемые в данном документе, часто будут дополнительно содержать один или несколько буферов (например, нейтральный буферный солевой раствор или фосфатно-солевой буферный раствор), углеводы (например, глюкозу, маннозу, сахарозу или декстраны), маннит, белки, полипептиды или аминокислоты, такие как глицин, антиоксиданты, бактериостатические средства, хелатирующие средства, такие как EDTA или глутатион, адъюванты (например, гидроксид алюминия), растворенные вещества, которые делают данный состав изотоническим, гипотоническим или слабо гипертоническим по отношению к крови реципиента, суспендирующие средства, загустители и/или консерванты. Альтернативно, композиции, описанные в данном документе, могут быть составлены в виде лиофилизатов.
Фармацевтические композиции, описанные в данном документе, могут быть представлены в контейнерах с одной дозой или несколькими дозами, например, в герметичных ампулах или флаконах. Такие контейнеры, как правило, запечатаны таким образом, чтобы сохранить стерильность и стабильность состава до применения. В целом, составы можно хранить в виде суспензий, растворов или эмульсий в масляных или водных средах. Альтернативно, фармацевтическую композицию можно хранить в лиофилизированном состоянии, требующем только добавления стерильного жидкого носителя непосредственно перед применением.
В данной области хорошо известна разработка соответствующих схем дозирования и лечения для применения конкретных композиций, описанных в данном документе, в различных схемах лечения, включая, например, пероральное, парентеральное, внутривенное, интраназальное и внутримышечное введение и составление, некоторые из них кратко обсуждаются ниже с целью общих иллюстрации.
В определенных применениях фармацевтические композиции, описанные в данном документе, могут доставляться с помощью перорального введения животному. В связи с этим данные композиции могут составляться с инертным разбавителем или с усваиваемым съедобным носителем, или их можно заключать в твердую или мягкую желатиновую капсулу, или их можно спрессовывать в таблетки, или их можно включать непосредственно в пищу из рациона. Фармацевтическая композиция может принимать форму таблеток, пастилок для рассасывания, пилюль, пастилок, капсул, эликсиров, порошков, гранул, суспензий, эмульсий, сиропов или настоек. Также можно получать формы с медленным высвобождением или с отсроченным высвобождением (например, в виде частиц с покрытием, многослойных таблеток или микрогранул).
Композиции также могут содержать любой из разнообразных дополнительных компонентов, например, фармацевтически приемлемые связующие, такие как трагакантовая камедь, аравийская камедь, альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, кукурузный крахмал или желатин; вспомогательные вещества, такие как фосфат дикальция; средство для улучшения распадаемости таблеток, такое как кукурузный крахмал, картофельный крахмал, метилцеллюлоза, поливинилпирролидон, ксантановая камедь, бентонит, агар, альгиновая кислота и т.п.; смазывающее средство, такое как стеарат магния; может добавляться подсластитель, такой как сахароза, лактоза, глюкоза, аспартам или сахарин; разбавитель, такой как лактоза, сорбит, маннит, декстроза, каолин, целлюлоза, карбонат кальция, силикат кальция или фосфат дикальция; ароматизатор, такой как мята перечная, масло грушанки, апельсиновый, малиновый, жевательной резинки или вишневый ароматизатор, покрывающие средства, такие как полимеры или сополимеры акриловой кислоты и/или метакриловой кислоты и/или их сложные эфиры, воски, жирные спирты, зеин, шеллак или глютен; консерванты, такие как бензоат натрия, витамин Е, альфа-токоферол, аскорбиновая кислота, метилпарабен, пропилпарабен или бисульфат натрия; смазывающие средства, такие как стеарат магния, стеариновая кислота, олеат натрия, хлорид натрия или тальк; и/или средства задержки по времени, такие как глицерилмоностеарат или глицерилдистеарат.
В определенных вариантах осуществления, на таблетку или пилюлю можно наносить покрытие путем прессования или, альтернативно, путем распыления. Наносимое путем прессования покрытие может включать небольшую таблетку или пилюлю, используемую как часть прессования второй таблетки, и где небольшая таблетка располагается почти в центре остальной части порошка, напрессовываемого снаружи. Наносимое путем распыления покрытие может включать внешнее покрытие таблетки покрывающим препаратом, содержащим активное вещество.
В определенных вариантах осуществления фармацевтические композиции согласно настоящему изобретению включают формы с «медленным высвобождением» или с «немедленным высвобождением». Как применяется в данном документе, «медленное высвобождение», в целом, относится к высвобождению от 20% до 60% в течение 1 часа и более 70% в течение 6 часов, или от 40% до 80% в течение 2 часов и более 70% в течение 6 часов в 500 мл воды (0,1 N HCl) в аппарате 1 согласно USP (Фармакопея США) (37°C, 100 оборотов в минуту). Тогда как «немедленное высвобождение», в целом, относится к высвобождению более 70% в течение 30 минут в 500 мл воды (0,1 N HCl) в аппарате 1 USP (37°C, 100 оборотов в минуту).
В определенных вариантах осуществления таблетка или пилюля имеет вес в диапазоне 100 мг, 200 мг, 300 мг, 400 мг, 500 мг, 600 мг, 700 мг, 800 мг и любое значения между ними или более. Составы лекарственных форм для перорального применения согласно определенным вариантам осуществления настоящего изобретения можно производить в соответствии с известными в данной области способами, и их могут упаковывать известными способами, в том числе во влаго-, и/или кислородо-, и/или светозащитный упаковочный материал.
Кроме того, жидкие формы фармацевтических композиций могут включать жидкий носитель, такой как вода, масла (оливковое масло, масло земляного ореха, кунжутное масло, подсолнечное масло, сафлоровое масло, арахисовое масло, кокосовое масло), парафиновое масло, этиленгликоль, пропиленгликоль, полиэтиленгликоль, этанол, пропанол, изопропанол, глицерин, жирные спирты, триглицериды или их смеси.
Если рассматриваемую композицию вводят парентерально, композиция может также включать стерильные водные или масляные растворы или суспензии. Подходящие нетоксичные приемлемые для парентерального введения разбавители или растворители включают воду, раствор Рингера, изотонический солевой раствор, 1,3-бутандиол, этанол, пропиленгликоль или полиэтиленгликоли в смесях с водой. Водные растворы или суспензии также могут содержать одно или несколько буферных средств, таких как ацетат натрия, цитрат натрия, борат натрия или тартрат натрия. Конечно, любой материал, применяемый при получении состава в любых единицах дозирования, должен являться фармацевтически чистым и практически нетоксичным в используемых количествах. Кроме того, активные соединения можно вводить в препарат и составы с замедленным высвобождением. Единичная лекарственная форма, как применяется в данном документе, относится к физически дискретным единицам, пригодным в качестве единичных доз для субъекта, подлежащего лечению; каждая единица может содержать предварительно определенное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Требования к единичным лекарственным формам в значительной степени продиктована и непосредственно зависит от уникальных характеристик активного соединения и конкретного терапевтического или профилактического эффекта, который нужно достичь, а также от ограничений, характерных для области составления соединений, таких как активное соединение для лечения субъектов. Иллюстративные и неограничивающие диапазоны доз могут составлять 0,1-10 мг/кг, 1,0-20 мг/кг, 5,0-50 мг/кг, 10-100 мг/кг или любые значения между ними.
Как правило, данные составы будут содержать по меньшей мере приблизительно 0,01% активного соединения или более по весу активного вещества. Однако процент активного ингредиента (ингредиентов) может варьировать и в подходящем случае может составлять приблизительно 1-99%, в том числе приблизительно 60% или 70%, или более от веса или объема всего состава. Естественно, количество активного соединения (соединений) в каждой терапевтически полезной композиции можно получить таким образом, что подходящая дозировка будет получена в любой заданной однократной дозе соединения. Такие факторы, как растворимость, биодоступность, период полувыведения из организма, путь введения, срок хранения продукта, а также другие фармакологические критерии будут учитываться специалистом в области изготовления таких фармацевтических составов, и в связи с этим могут быть желательны различные дозировки и схемы лечения.
В определенных обстоятельствах будет желательно доставлять фармацевтические композиции, раскрытые в данном документе, местно, перорально, подкожно, парентерально, внутривенно, внутримышечно или даже внутрибрюшинно. Специалистам в данной области хорошо известны такие подходы, некоторые из которых дополнительно описаны, например, в патенте США №5543158; патенте США №5641515 и патенте США №5399363. В определенных вариантах осуществления растворы активных соединений в виде свободного основания или фармакологически приемлемых солей можно получить в воде, соответствующим образом смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсии также можно получить в глицерине, жидких полиэтиленгликолях и их смесях, и в маслах. В обычных условиях хранения и применения данные препараты, как правило, будут содержать консервант для предотвращения роста микроорганизмов.
В одном варианте осуществления для парентерального введения в водном растворе раствор должен быть соответствующим образом стабилизирован буфером, если необходимо, а жидкий разбавитель сначала делают изотоническим с помощью достаточного количества солевого раствора или глюкозы. Данные конкретные водные растворы являются особенно подходящими для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. В этой связи, стерильная водная среда, которую можно использовать, будет известна специалистам в данной области в свете настоящего раскрытия. Например, одну дозу можно растворить в 1 мл изотонического раствора NaCl и либо добавить к 1000 мл жидкости для подкожных инъекций либо вводить инъекцией в предложенном месте инфузии (см., например, "Remington's Pharmaceutical Sciences" 15-е издание, страницы 1035-1038 и 1570-1580). Некоторые изменения дозировки обязательно будут иметь место в зависимости от состояния субъекта, подлежащего лечению. Кроме того, для введения человеку препараты предпочтительно отвечают стандартам стерильности, пирогенности и общей безопасности и чистоты, в соответствии с требованиями отделения биологических стандартов FDA (FDA Office of Biologics standards).
В другом варианте осуществления настоящего изобретения композиции, описанные в данном документе, можно составлять в нейтральной или солевой форме. Иллюстративные фармацевтически приемлемые соли включают соли присоединения кислоты (образованные со свободными аминогруппами белка), которые образованы с неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или органическими кислотами, такими как уксусная, щавелевая, винная, миндальная и т.п. Соли, образованные со свободными карбоксильными группами, также можно получить с неорганическими основаниями, такими как, например, гидроксиды натрия, калия, аммония, кальция или железа, и такими органическими основаниями, как изопропиламин, триметиламин, гистидин, прокаин и т.п. После получения растворы будут вводить способом, совместимым с составом лекарственной формы, и в таком количестве, которое является терапевтически эффективным.
Носители могут дополнительно содержать любые и все растворители, дисперсионные среды, среды, покрытия, разбавители, антибактериальные и противогрибковые средства, изотонические и задерживающие всасывание средства, буферы, растворы носителей, суспензии, коллоиды и т.п. Применение таких сред и средств для фармацевтически активных веществ хорошо известно в данной области. За исключением случаев, когда любые обычные среды или средства несовместимы с активным ингредиентом, предусматривается его применение в терапевтических композициях. Дополнительные активные ингредиенты также можно вводить в композиции. Фраза «фармацевтически приемлемый» относится к химическим соединениям и композициям, которые не вызывают аллергическую или подобную нежелательную реакцию при введении человеку.
В определенных вариантах осуществления фармацевтические композиции можно доставлять с помощью интраназальных спреев, ингаляции и/или других сред доставки с помощью аэрозоля. Способы доставки генов, нуклеиновых кислот и пептидных композиций непосредственно в легкие посредством назальных аэрозолей описаны, например, в патенте США №5756353 и патенте США №5804212. Аналогично, доставка лекарственных средств с использованием полимеров для интраназально вводимых микрочастиц (Takenaga et al., J Controlled Release 1998 Mar 2; 52(1-2):81-7) и соединений лизофосфатидилглицерина (патент США №5725871) также хорошо известны в фармацевтической области. Иллюстративный пример чресслизистой доставки лекарственных средств в виде политетрафторэтиленовой поддерживающей матрицы описан в патенте США №5780045.0
В определенных вариантах осуществления липосомы, нанокапсулы, микрочастицы, заключение в микрокапсулы, липидные частицы, везикулы и т.п. применяют для введения описанных в данном документе композиций в соответствующие клетки/организмы-хозяева. В частности, такие композиции можно получать для доставки либо заключенными в капсулу в липидной частице, липосоме, везикуле, наносфере, микросфере, либо в микрочастице, наночастице и т.п. Альтернативно, композиции, раскрытые в данном документе, могут быть либо ковалентно, либо нековалентно связаны с поверхностью таких сред-носителей.
Получение и применение липосом и липосомоподобных препаратов в качестве потенциальных носителей лекарственных средств, в целом, известно специалистам в данной области. Липосомы успешно применялись со многими типами клеток, которые обычно трудно трансфицировать другими способами, в том числе с суспензиями Т-клеток, первичными культурами гепатоцитов и PC 12 клетками (Renneisen et al., J Biol Chem. 1990 Sep 25;265(27):16337-42; Muller et al., DNA Cell Biol. 1990 Apr;9(3):221-9). Кроме того, липосомы свободны от ограничений по длине ДНК, характерных для систем доставки на основе вирусов. Липосомы эффективно применялись для введения генов, различных лекарственных веществ, радиотерапевтических средств, ферментов, вирусов, транскрипционных факторов, аллостерических эффекторов и т.п. в различные культивируемые клеточные линии и животным. Более того, применение липосом, по-видимому, не связано с аутоиммунными реакциями или неприемлемой токсичностью после системной доставки.
В определенных вариантах осуществления липосомы образуются из фосфолипидов, которые диспергируются в водной среде и спонтанно образуют многослойные концентрические бислойные везикулы (также называемые многослойными везикулами (MLV)).
Альтернативно, в других вариантах осуществления настоящее изобретение предусматривает фармацевтически приемлемые нанокапсульные составы композиций согласно настоящему изобретению. Нанокапсулы могут, в целом, стабильно и воспроизводимо захватывать соединения. Во избежание побочных эффектов, обусловленных внутриклеточной перегрузкой полимерами, такие ультратонкие частицы (размером приблизительно 0,1 мкм) можно создавать с использованием полимеров, способных разлагаться in vivo. Такие частицы можно получать, как описано, например, в Couvreur et al., Crit Rev Ther Drug Carrier Syst. 1988;5(1):1-20; zur Muhlen et al., Eur J Pharm Biopharm. 1998 Mar;45(2):149-55; Zambaux et al. J Controlled Release 1998 Jan 2;50(1-3):31-40; и патенте США №5145684.
Режимы дозирования
Пути и частота введения терапевтических композиций, описанных в данном документе, а также дозировка будут варьировать у разных субъектов, и их можно легко установить с использованием стандартных методик. В целом, фармацевтические композиции можно вводить путем инъекции (например, внутрикожной, внутримышечной, внутривенной или подкожной), интраназально (например, путем вдыхания) или перорально. Подходящие составы лекарственных форм и способы введения средств могут быть легко определены специалистами в данной области. В определенных случаях выделенный пептид, способный вызывать специфический к CCNA1 Т-клеточный ответ на человеческий циклин A1 (или рекомбинантный вектор экспрессии, кодирующий данный пептид) можно вводить в дозе приблизительно 1 мг/кг, 5 мг/кг, 10 мг/кг, 20 мг/кг, 25 мг/кг, 30 мг/кг, 35 мг/кг 40 мг/кг, 45 мг/кг, 50 мг/кг, 60 мг/кг, 70 мг/кг, 75 мг/кг, 80 мг/кг, 90 мг/кг, 100 мг/кг, 125 мг/кг, 150 мг/кг, 175 мг/кг, 200 мг/кг, или любое значение между ними, или больше. В определенных случаях дозы (и необязательно по меньшей мере одну дозу другого терапевтического средства) можно доставлять от 1 дня до 14 дней в течение 30-дневного периода. В определенных случаях дозы (и необязательно по меньшей мере одну дозу другого терапевтического средства) можно доставлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней в течение 60-дневного периода. Для отдельных субъектов могут подходить альтернативные протоколы. Подходящая доза является количеством соединения, которое при введении, описываемом выше, способно изменять или облегчать симптомы, или которое превышает по меньшей мере на 10-50% фоновый (т.е. без лечения) уровень, что можно отслеживать с помощью измерения специфических уровней компонентов крови, например, выявляемых уровней циркулирующих лейкозных клеток.
В целом, соответствующая доза и схема лечения обеспечивают активное соединение (соединения) в количестве, достаточном для обеспечения терапевтического и/или профилактического благоприятного воздействия. Такой ответ можно отслеживать по подтверждению улучшенного клинического результата (например, более частые полные или частичные ремиссии или большая продолжительность жизни без признаков заболевания) у субъектов, получавших лечение, по сравнению с субъектами, не получавшими лечение. Усиление ранее существовавших иммунных ответов на белок опухоли обычно коррелирует с улучшенным клиническим результатом. Такие иммунные ответы можно, в целом, оценивать, с использованием стандартных анализов пролиферации, цитотоксичности или цитокинов, которые являются обычными в данной области и могут выполняться с использованием образцов, полученных от субъекта до и после лечения.
Можно применять стандартные методики синтеза рекомбинантной ДНК, пептидов и олигонуклеотидов, иммуноанализов, и культивирования тканей, и трансформации (например, электропорацию, липофекцию). Ферментативные реакции и методики очистки можно осуществлять в соответствии с инструкциями изготовителя, или как обычно осуществляется в данной области, или как описано в данном документе. Эти и подобные методики и процедуры можно, в целом, осуществлять в соответствии с обычными способами, хорошо известными в данной области и описываемыми в различных общих и более конкретных источниках по методикам микробиологии, молекулярной биологии, биохимии, молекулярной генетики, клеточной биологии, вирусологии и иммунологии, которые приведены и обсуждаются в данном описании. См., например, Sambrook, et al., Molecular Cloning: A Laboratory Manual, 3d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Current Protocols in Molecular Biology (John Wiley and Sons, updated July 2008); Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience; Glover, DNA Cloning: A Practical Approach, vol. I & II (IRL Press, Oxford Univ. Press USA, 1985); Current Protocols in Immunology (Edited by: John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober 2001 John Wiley & Sons, NY, NY); Real-Time PCR: Current Technology and Applications, Edited by Julie Logan, Kirstin Edwards and Nick Saunders, 2009, Caister Academic Press, Norfolk, UK; Anand, Techniques for the Analysis of Complex Genomes, (Academic Press, New York, 1992); Guthrie and Fink, Guide to Yeast Genetics and Molecular Biology (Academic Press, New York, 1991); Oligonucleotide Synthesis (N. Gait, Ed., 1984); Nucleic Acid Hybridization (B. Hames & S. Higgins, Eds., 1985); Transcription and Translation (B. Hames & S. Higgins, Eds., 1984); Animal Cell Culture (R. Freshney, Ed., 1986); Perbal, A Practical Guide to Molecular Cloning (1984); Next-Generation Genome Sequencing (Janitz, 2008 Wiley-VCH); PCR Protocols (Methods in Molecular Biology) (Park, Ed., 3rd Edition, 2010 Humana Press); Immobilized Cells And Enzymes (IRL Press, 1986); серия научных публикаций Methods In Enzymology (Academic Press, Inc., N.Y.); Gene Transfer Vectors For Mammalian Cells (J. H. Miller and M. P. Calos eds., 1987, Cold Spring Harbor Laboratory); Harlow and Lane, Antibodies, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1998); Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D. M. Weir and CC Blackwell, eds., 1986); Roitt, Essential Immunology, 6th Edition, (Blackwell Scientific Publications, Oxford, 1988); Embryonic Stem Cells: Methods and Protocols (Methods in Molecular Biology) (Kurstad Turksen, Ed., 2002); Embryonic Stem Cell Protocols: Volume I: Isolation and Characterization (Methods in Molecular Biology) (Kurstad Turksen, Ed., 2006); Embryonic Stem Cell Protocols: Volume II: Differentiation Models (Methods in Molecular Biology) (Kurstad Turksen, Ed., 2006); Human Embryonic Stem Cell Protocols (Methods in Molecular Biology) (Kursad Turksen Ed., 2006); Mesenchymal Stem Cells: Methods and Protocols (Methods in Molecular Biology) (Darwin J. Prockop, Donald G. Phinney, and Bruce A. Bunnell Eds., 2008); Hematopoietic Stem Cell Protocols (Methods in Molecular Medicine) (Christopher A. Klug, and Craig T. Jordan Eds., 2001); Hematopoietic Stem Cell Protocols (Methods in Molecular Biology) (Kevin D. Bunting Ed., 2008) Neural Stem Cells: Methods and Protocols (Methods in Molecular Biology) (Leslie P. Weiner Ed., 2008).
Если не предусмотрены специфические определения, номенклатура, используемая применительно к молекулярной биологии, аналитической химии, синтетической органической химии и медицинской и фармацевтической химии, а также лабораторные процедуры и методики молекулярной биологии, аналитической химии, синтетической органической химии и медицинской и фармацевтической химии, описанные в данном документе, являются хорошо известными и широко применяемыми в данной области. Можно применять стандартные методики технологии рекомбинантной ДНК, молекулярно-биологического, микробиологического, химического синтеза, химических анализов, технологии получения и доставки фармацевтических препаратов и лечения пациентов.
Каждый вариант осуществления, описанный в данном описании, должен применяться mutatis mutandis к любому другому варианту осуществления, если явно не указано иное.
Если контекст не требует иного, в настоящем описании и формуле изобретения слово «содержать» и его варианты, такие как «содержит» и «содержащий», следует толковать в открытом широком смысле, то есть как «включая без ограничений». «Состоящий из» означает включающий и, как правило, ограниченный тем, что следует за фразой «включающий». «Состоящей, по сути, из» означает включающий любые элементы, перечисленные после фразы, и ограниченный другими элементами, которые не препятствуют или способствуют активности или действию, определенному в раскрытии для перечисленных элементов. Таким образом, фраза «состоящий, по сути, из» означает, что перечисленные элементы являются необходимыми или обязательными, но что никакие другие элементы не требуются и могут присутствовать или могут не присутствовать в зависимости от того, влияют ли они или не влияют на активность или действие перечисленных элементов.
В данном описании и прилагаемой формуле изобретения формы единственного числа включают ссылки на множественное число, если в контексте ясно не указано иное. Как применяется в данном документе, в конкретных вариантах осуществления термины «приблизительно» или «примерно», когда они предшествуют численному значению, указывают значение в диапазоне плюс или минус 5%, 6%, 7%, 8% или 9%. В других вариантах осуществления термины «приблизительно» или «примерно», когда они предшествуют численному значению, указывают значение в диапазоне плюс или минус 10%, 11%, 12%, 13% или 14%. В других вариантах осуществления термины «приблизительно» или «примерно», когда они предшествуют численному значению, указывают значение в диапазоне плюс или минус 15%, 16%, 17%, 18%, 19% или 20%.
Ссылка в данном описании на «один вариант осуществления», или «вариант осуществления», или «аспект» означает, что конкретный признак, структура или характеристика, описанные в связи с вариантом осуществления, включены по меньшей мере в один вариант осуществления настоящего изобретения. Таким образом, случаи использования фразы «в одном варианте осуществления» или «в варианте осуществления» в различных местах в данном описании не обязательно все относятся к одному и тому же варианту осуществления настоящего изобретения. Кроме того, конкретные признаки, структуры или характеристики могут сочетаться любым подходящим образом в одном или нескольких вариантах осуществления. Если описываются или заявляются этапы способа, и этапы описаны как осуществляемые в определенном порядке, описание первого этапа, осуществляемого (или выполняемого) «до» (т.е. перед) второго этапа, имеет такое же значение, как если бы текст был переработан с указанием того, что второй этап осуществляют (или выполняют) «после» первого этапа.
Следующие примеры представлены в качестве иллюстрации, а не ограничения.
ПРИМЕРЫ
ПРИМЕР 1
ИДЕНТИФИКАЦИЯ ЧЕЛОВЕЧЕСКОГО ЦИКЛИНА A1 (CCNA1) В КАЧЕСТВЕ ИММУНОТЕРАПЕВТИЧЕСКОЙ МИШЕНИ ПРИ ЛЕЙКОЗЕ И ХАРАКТЕРИСТИКА ЭПИТОПОВ CCNA1, ИММУНОГЕННЫХ ДЛЯ T-КЛЕТОЧНЫХ
В данном примере выполняли анализы дифференциальной экспрессии генов для идентификации циклина A1 (CCNA1), внутриклеточного белка, в качестве кандидатного нового белка-мишени для T-клеток. В качестве краткой справки, CCNA1, как сообщалось, регулирует развитие мужских гоноцитов в ходе мейоза I, и следовательно, избирательно экспрессируется в семенниках (Yang et al., 1997 Cancer Res 57 (5):913-920; Wolgemuth et al., 2004 Int J Androl 27 (4):192-199. doi:10.1111/j.1365- 2605.2004. 00480.x IJA480 [pii]). Опубликованные сообщения показали, что CCNA1 -/- мыши являлись жизнеспособными и фенотипически нормальными, за исключением мужского бесплодия (Krug et al., 2009 Int J Oncol 34 (1):129-136; Nickerson et al., 2007 Dev Biol 306 (2):725-735. doi:S0012-1606 (07) 00783-X [pii] 10.1016/j.ydbio. 2007.04.009). CCNA1 также, как показано, аберрантно экспрессировался в AML, а также других злокачественных новообразованиях (Yang et al., 1997 Cancer Res 57 (5):913-920; Stirewalt et al., 2008 Genes Chromosomes Cancer 47 (1):8-20. doi:10.1002/gcc.20500). При AML CCNA1 сохранял злокачественный фенотип за счет пропролиферативной и антиапоптотической активности (Chan et al., 2009 Oncogene 28 (43):3825-3836. doi: onc 2009236 [pii] 10.1038/onc.2009.236; Jang et al., 2008 Cancer Res 68 (12):4559-4570. doi: 68/12/4559 [pii] 10.1158/0008-5472.CAN- 08-0021; Ji et al., 2007 Int J Cancer 121 (4):706-713. doi:10.1002 /ijc. 22634), и сверхэкспрессия CCNA1 у мышей вызывала диспластический миелопоэз и перевиваемые миелоидные лейкозы у 15% мышей (Liao et al., 2001 Proc Natl Acad Sci USA 98 (12):6853-6858. doi:10.1073/pnas.12154 0098 12154 0098 [pii]).
В данном случае, CCNA1, как показано, действует в качестве семенникового-лейкозного-антигена, несущего множество потенциально иммуногенных эпитопов MHC класса I, которые можно применять для получения CD8+T-клеток от здоровых доноров. Т-клетки, полученные таким образом, были способны распознавать и лизировать лейкозные клетки.
Материалы и способы
Образцы от человека. Для проведения количественной ПЦР в реальном времени (qRT PCR) мононуклеарные клетки пациентов с AML из периферической крови и костного мозга (BM), мононуклеарные клетки BM от пациентов с хроническим миелоидным лейкозом (CML) и пациентов с миелодиспластическим синдромом (MDS) и мобилизированные с помощью GM-CSF CD34+клетки выделяли с помощью лейкафереза или Ficoll-Hypaque (Biochrom, Кембридж, Великобритания). Все образцы AML содержали более 60% злокачественных клеток (в среднем 84%). Клетки собирали в центре исследования рака имени Фреда Хатчинсона (Fred Hutchinson Cancer Research Center) (FHCRC), Сиэтл, Вашингтон, США, и в кампусе Бенджамина Франклина клиники Шарите (Charité Campus Benjamin Franklin), Берлин, Германия. Для создания линий Т-клеток получали продукты лейкафереза от двух здоровых доноров в FHCRC, Сиэтл. Все образцы собирали после письменного информированного согласия и при утверждении наблюдательных советов соответствующих учреждений.
Клеточные линии. Получали линии лимфобластоидных клеток (LCL), трансформированных вирусом Эпштейна-Барра (EBV), как описано (Riddell et al., 1991 J Immunol 146 (8):2795-2804). TM-LCL применяли в качестве питающих клеток в протоколе быстрого роста (Rapid Expansion Protocol) (REP) (Ho et al., 2006 J Immunol Methods 310 (1-2):40-52. doi: S0022-1759 (05) 00429-1 [pii] 10.1016/j.jim.2005. 11.023). Гибридная T-клеточная/B-клеточная клеточная линия T2, применявшаяся для презентации эпитопов, экспрессировала только HLA A*0201, но являлась TAP-дефицитной. LCL 721.221 не экспрессировала HLA класса I вследствие индуцированной облучением делеции соответствующих аллелей и являлась стабильно трансдуцированной ретровирусным вектором pLBPC, содержащим HLA A*0201 (Akatsuka et al., 2002 Tissue Antigens 59 (6):502-511. doi: tan 590607 [pii]). Клетки LCL и T2 поддерживали, как описано (Ho et al., 2006 J Immunol Methods 310 (1-2):40-52. doi: S0022-1759 (05) 00429-1 [pii] 10.1016/j.jim.2005. 11.023). Клеточные линии K562 (CML), THP-1, HL60, KG1 (AML) и U937 (клеточная линия моноцитов) поддерживали в среде RPMI 1640 с добавлением 100 Ед./мл пенициллина, 100 г/мл стрептомицина (Invitrogen, Карлсбад, Калифорния) и 10% фетальной бычьей сыворотки (FBS), а для THP-1 также добавляли 50 M β-меркаптоэтанол (Sigma, Сент-Луис, Миссури). CTL и дендритные клетки (DC) поддерживали, как описано (Ho et al., 2006 J Immunol Methods 310 (1-2):40-52).
Анализ данных с помощью биочипов. В данном исследовании применяли две панели наборов данных, полученных с помощью биочипов (Affymetrix, Санта-Клара, Калифорния): (1) девять образцов LSC AML (Lineage–, CD34+, CD38-, CD90, (Majeti et al., 2009 Proc Natl Acad Sci USA 106 (9):3396-3401)), семь образцов соответствующих лейкозных бластных клеток (Lineage, CD34), четыре образца HSC (Lineage, CD34+, CD38–, CD90+(Majeti et al., 2009 Proc Natl Acad Sci USA 106 (9):3396-3401)) и наборы данных для мононуклеарных клеток периферической крови (PBMC), CD34+мононуклеарных клеток и тканей BM (NCBI GEO сервер GSM279585-279588, 414970, 414972, 414975, 419165-419174, 457175-457177, 483480-483496, 80576, 80582, 80602, 80615, 80619, 80653, 80689, 80712, 80734, 80738, 80739, 80759, 80792, 80824, 80826, 80867, 80869, формат HG U133 плюс 2.0); и (2) 30 образцов клеток AML (>75% злокачественных клеток, Stirewalt et al., 2008 Genes Chromosomes Cancer 47 (1):8-20; и неопубликованное) и 58 образцов тканей (NCBI GEO сервер GSM18873, 18874, 18881, 18882, 18899-18906, 18909, 18910, 18917, 18918, 18921, 18922, 18943-18962, 18965, 18966, 18969-18974, 18977, 18978, 18981, 18982, 18995-18998, 19001, 19002, 19013, 19014, 44671-44693, 44699-44706, формат HG U133A). Образцы нормализовали с применением способа инвариантного множества (программное обеспечение dChip 2.0, Li et al., 2001 Proc Natl Acad Sci USA 98 (1):31-36). Перед анализом панелей на уровне набора с отдельным зондом (single-probe-set) выполняли неконтролируемую иерархическую кластеризацию для исключения кластеризации в соответствии с происхождением образцов вместо биологического фона наборов данных. Значения экспрессии набора зондов 205899_at в LSC сравнивали с другими типами клеток с использованием двустороннего критерия Манна-Уитни. Значения экспрессии CCNA1 семи парных образцов LSC и соответствующими лейкозными бластными клетками (Lineage–, CD34–) сравнивали с использованием двустороннего знакового рангового критерия Вилкоксона.
Количественная ПЦР в реальном времени. Общую РНК экстрагировали с использованием реагента Trizol (Invitrogen) или набора RNeasy Mini Kit (Qiagen, Хильден, Германия). Обратную транскрипцию проводили с использованием Superscript III (Invitrogen) или OmniScript (Qiagen). Панель кДНК из объединенных здоровых тканей приобрели в Clontech (Маунтин-Вью, Калифорния) и пять образцов здорового BM приобрели у Cambrex (Рутерфорд, Нью-Джерси). Количественную двухэтапную RT ПЦР проводили на аппарате ABI 7500 (Applied Biosystems, Карлсбад, Калифорния) с TA=60°С, применяя следующие праймеры и зонды:
Глицеральдегид-3-фосфатдегидрогеназа (GAPDH)_прямой:
GAG TCA ACG GAT TTG GTC GT; [SEQ ID NO:11]
GAPDH_зонд, меченый 6FAM (6-карбоксифлуоресцеин) на 5’-конце и TAMRA (карбокситетраметилродамин) на 3’-конце:
CCNA1_зонд, меченый 6FAM (6-карбоксифлуоресцеин) на 5’-конце и TAMRA (карбокситетраметилродамин) на 3’-конце:
Точки пересечения наносили на график против стандартных кривых для плазмид pCR4-TOPO (Invitrogen), содержащих соответствующий ПЦР продукт, как описано (Keilholz et al., 2004 Clin Cancer Res 10 (5):1605-1612). Все реакции проводили в двух повторностях. Экспрессия CCNA1 представлена как число копий на число копий GAPDH.
Цитокины и пептиды. Рекомбинантные человеческие IL-1, IL-4, IL-7, IL-15 и TNFα получали от R&D Systems (Миннеаполис, Миннесота), IL-2 и GM-CSF от Chiron (Эмеривилл, Калифорния), PGE2 от MP Biomedicals (Ирвайн, Калифорния) и IL-21 от Peprotech (Роки Хилл, Нью-Джерси). Пептидную библиотеку в общей сложности из 103 олигомеров с 15 мономерными единицами с перекрытием 11 аминокислот (AA), охватывающих CCNA1 (изоформа c, NM_001111046) приобрели в Sigma (Сент-Луис, Миссури). Более короткие пептиды были приобретены в Sigma или в JPT (Берлин, Германия).
Создание CCNA1-специфических клонов Т-клеток. Т-клеточные линии получали, как описано, с незначительными модификациями (Ho et al., 2006 J Immunol Methods 310 (1-2):40-52). Вкратце, DC получали из адгезивной к пластику фракции PBMC при культивировании в течение двух дней (дни от -2 до 0) в среде DC (CellGenix, Фрайбург, Германия) с добавлением GM-CSF (800 Ед./мл) и IL-4 (1000 Ед./мл). В день -1 добавляли цитокины созревания TNFα (1100 Ед./мл), IL-1β (2000 Ед./мл), IL-6 (1000 Ед./мл) и PGE2 (1 мкг/мл). В день 0 DC собирали, промывали и сенсибилизировали пептидом (отдельные пептиды в концентрации 10 мкг/мл или пулы пептидов в концентрации 2 мкг/мл) в течение от 2 до 4 часов в бессывороточной среде DC. CD8 T-клетки выделяли из PBMC с использованием микрогранул с антителами к CD8 (Miltenyi, Оберн, Калифорния) и стимулировали DC при соотношении эффектор:мишень (E:T) от 1:5 до 1:10 в присутствии IL-21 (30 нг/мл). В день 3 добавляли IL-2 (12,5 Ед./мл), IL-7 (5 нг/мл) и IL-15 (5 нг/мл). Клетки повторно стимулировали в промежутке между днем 10 и днем 14 с использованием адгезивной к пластику фракцию облученных аутологичных PBMC в качестве антигенпрезентирующих клеток (АРС) после сенсибилизации пептидом в течение двух часов и в присутствии IL-21. После повторной стимуляции к клеткам добавляли, начиная с дня 1, IL-2 (25 Ед./мл), IL-7 (5 нг/мл) и IL-15 (5 нг/мл). Клоны Т-клеток получали путем посева клеток при низкой плотности и разращивания с ТМ-LCL, покрытых OKT3 (OrthoBiotech, Бриджуотер, Нью-Джерси), и аллогенными PBMC в качестве питающих клеток (протокол REP), как описано в (Ho et al., 2006 J Immunol Methods 310 (1-2):40-52).
Внутриклеточное окрашивание (ICS) IFNγ. APC «обучали» 10 мкг/мл пептида в течение ночи и отмывали один раз. Эффекторные клетки инкубировали совместно с АРС в течение 6 часов в среде RPMI, содержащей 10% FBS, в присутствии монензина. Затем клетки окрашивали комплексом антитело к CD8-FITC, пермеабилизировали с использованием набора BD Cytofix/Cytoperm kit, и окрашивали комплексом антитело к IFNγ-аллофикоцианином (все от BD Bioscience, Франклин Лейкс, Нью-Джерси).
Анализ стабилизации HLA. Клетки T2 «обучали» с помощью 100 мкг/мл пептида в бессывороточной среде RPMI, содержащей 1 мкг/мл β-2-микроглобулина (Sigma), в течение 16 часов. Затем клетки промывали и инкубировали в течение 4 ч. в присутствии 5 мкг/мл брефелдина (Sigma), а затем окрашивали меченым FITC антителом к HLA A, B, C (клон W6/32, BD Bioscience).
Анализ активности каспазы-3. Мембраны клеток-мишеней метили с использованием PKH26 (Sigma) в соответствии с инструкциями производителя. Клоны Т-клеток применяли в конце цикла протокола быстрого роста (REP, Riddell and Greenberg, 1990 J. Imm. Meth. 128:189; Ho et al., 2006 J. Imm. Meth. 310:40) (день 12 или позже). Мишени и T-клетки инкубировали при соотношении E:T 3:1 в 96-луночном планшете с круглым дном при 37°C в течение 4 часов. В качестве отрицательного контроля мишени инкубировали без эффекторов и в качестве положительного контроля мишени инкубировали в присутствии 4 мкМ камптотецина (Sigma) или 1 мкМ стауроспорина (Sigma). Затем клетки фиксировали и пермеабилизировали с использованием набора BD Cytofix/Cytoperm™ в соответствии с инструкциями поставщика и окрашивали с помощью антитела к активной форме каспазы-3, конъюгированного либо с FITC, либо с Alexa-Fluor-647 (C92-625, BD Bioscience).
Анализ высвобождения хрома-51. Стандартный анализ с радиоактивным 51Cr проводили, как описано в (Ho et al., 2006 J Immunol Methods 310 (1-2):40-52), с использованием 5000 клеток-мишеней и T-клеток в конце цикла REP (день 12 или позже) при отношениях Е:Т 10-1,25:1 на лунку в трех повторностях. Спонтанное высвобождение оценивали путем инкубирования мишеней в отсутствие эффекторов. Процент специфического лизиса рассчитывали с использованием формулы 100 х (высвобождение в экспериментальной группе - спонтанное высвобождение)/(максимальное высвобождение - спонтанное высвобождение).
Результаты
Избирательная экспрессия CCNA1 в LSC AML, лейкозных бластных клетках и семенниках. Для систематического скрининга на кандидатные гены-мишени для опосредованной T-клетками терапии, которые избирательно экспрессировались в компартменте LSC AML с или без экспрессии в других популяциях лейкозных клеток, девять наборов данных для LSC, полученных с помощью биочипов, анализировали вместе с образцами из различных субпопуляций гемопоэтических клеток и негемопоэтических тканей. Подходящие гены-кандидаты идентифицировали путем математической фильтрации и ручной проверки значений экспрессии на основе модели. На основании данных, полученных с помощью биочипов, и опубликованных данных по онкогенности и клеточной локализации соответствующих генов, идентифицировали восемь кандидатов, включая WT1, но только набор зондов 205899_at, который представляет CCNA1, показал избирательную экспрессию в LSC и бластных клетках AML в двух независимых наборах данных, полученных с помощью биочипов, и третьем наборе образцов, который анализировали с помощью qRT PCR.
В первом наборе биочипов CCNA1 сверхэкспрессировался в шести из девяти проанализированных образцов LSC и семенников. Значения уровня экспрессии CCNA1 в LSC были значительно выше, чем в HSC/CD34+мононуклеарных клетках BM, РВМС и панели из образцов тканей, в том числе ткани семенников (фигура 1А). Статистическое исследование проводили на наборе биочипов, фактически применяемом для выбора мишени. Поскольку не наблюдали значительных различий в экспрессии CCNA1 между LSC и лейкозными бластными клетками, полученными от одних и тех же пациентов (фигура 1B), профиль экспрессии CCNA1 подтверждали в дополнительных наборах образцов, не подвергавшихся отбору по LSC. Часть второй панели данных, полученных с помощью биочипов, в которой ранее идентифицировали экспрессию CCNA1 на значительно более высоких уровнях в клетках AML по сравнению с CD34+мононуклеарными клетками BM, PBMC, мобилизированными CD34+клетками и BM, уже опубликованы (Stirewalt et al., 2008 Genes Chromosomes Cancer 47 (1):8-20). Эти наборы данных AML теперь анализировали вместе с наборами данных для негемопоэтических тканей и лимфатических органов, в том числе двумя образцами ткани семенника. И в этом случае экспрессию CCNA1 выявляли только в AML и семенниках, и его экспрессия была значительно выше в AML, чем в образцах ткани из семенников (р=0,0017).
Для подтверждения полученных in silico данных и достоверности набора зондов 205899_at количественно определяли CCNA1 в образцах AML, в других субпопуляциях гемопоэтических клеток и в панели негемопоэтических тканей с использованием qRT-PCR. Из 33 проанализированных образцов AML 17 образцов показали экспрессию CCNA1 на уровнях по меньшей мере в два раза выше, чем в каждом измеренном физиологическом образце, кроме семенников. Не наблюдали различий между уровнями экспрессии CCNA1 в BM и мобилизированных G-CSF CD34+мононуклеарных клетках, которые в обоих случаях являлись очень низкими. Самые низкие уровни экспрессии обнаружили в максимально пролиферирующих Т-клетках после стимуляции ОКТ3 (фигура 2A). Анализируя различные подтипы AML по франко-американо-британской (FAB) системе и образцы BM от пациентов с CML и MDS, наблюдали изменяющиеся проценты аберрантной экспрессии CCNA1 в AML с самым высоким уровнем экспрессии при остром промиелоцитарном лейкозе (APL) и с отсутствием сверхэкспрессии у пациентов с вторичным AML, MDS или CML (фигура 2 В). Средняя экспрессия по числу копий CCNA1 на GAPDH в образцах AML была примерно на порядок выше, чем экспрессия WT1 в том же наборе образцов. В физиологических тканях CCNA1 экспрессировался на выявляемых уровнях только в семенниках (фигура 2C).
Картирование нескольких иммуногенных олигопептидов на CCNA1. Для идентификации ограниченных по МНС класса I Т-клеточных эпитопов, применяли подход «обратной иммунологии». Описаны четыре различных варианта мРНК CCNA1, которые кодируют три различные изоформы, при этом изоформа с отличается наличием более короткого N-конца. Поскольку функциональных доменов на более длинных N-концах изоформ a и b не идентифицировали, а соответствующие транскрипты данных изоформ невозможно было амплифицировать с помощью гнездовой ПЦР ни из образцов семенников, ни из AML, применяли пептидную библиотеку, представляющую только более короткую изоформу с CCNA1, так что ускользание от иммунного ответа в связи с воздействием на эпитопы на N-концах не могло произойти вследствие переключения изоформ CCNA1 в клетках и экспрессии клетками только данной короткой изоформы.
После четырех стимуляций CD8 Т-клеток, происходящих от HLA A*0201-положительных доноров 2196 и 2264, пептидной библиотекой, более 60% клеток в обеих линиях T-клеток являлись специфическими. После (а) стимуляции Т-клеток аутологичной LCL в качестве APC, «обученных» пулами пептидов, отдельными олигомерами с 15 мономерными единицами, а затем более короткими пептидами, и (b) анализа ответов Т-клеток путем внутриклеточного окрашивания по IFNγ, картировали восемь иммуногенных олигопептидов. В CD8 Т-клетках донора 2196 идентифицировали иммуногенные пептиды CCNA1, которые идентифицированы в данном документе с помощью положений аминокислотных остатков в последовательности изоформы с CCNA1:
В CD8 Т-клетках донора 2264 идентифицировали следующие иммуногенные пептиды из полипептида изоформы c CCNA1:
При использовании двух нормальных доноров для оценки потенциальных Т-клеточных ответов на последовательности изоформы с CCNA1, восемь иммуногенных пептидов стимулировали Т-клетки при ограничении по МНС в отношении по меньшей мере трех различных молекул HLA класса I. CCNA1 экспрессировался строго внутриклеточно, и эпитопы из него процессировались и презентировались в контексте молекул MHC класса I. Таким образом, CCNA1 представлял подходящую мишень для подходов терапии на основе Т-клеток.
Получали клоны Т-клеток против эпитопов, определяемых пептидами изоформы c CCNA1 118-127 [SEQ ID NO:5], 227-235 [SEQ ID NO:3], 167-175 [SEQ ID NO:6] и 341-351 [SEQ ID NO:8]. При использовании клеток 721.221 с и без стабильной трансфекции HLA A*0201 в качестве APC для линий Т-клеток в анализе внутриклеточного окрашивания (ICS) IFNγ обнаружили, что эпитопы 218-226 [SEQ ID NO:2], 227-235 [SEQ ID NO:3] и 341-351 [SEQ ID NO:8] презентируются при ограничении по HLA A*0201. Линии Т-клеток, антигенспецифически нацеленные на все три эпитопа, можно создать с использованием клеток от обоих доноров.
Определение характеристик двух ограниченных по HLA A*0201 эпитопов. Олигомер с 9 мономерными единицами FLDRFLSCM (CCNA1227-235, [SEQ ID NO:3]) идентифицировали как минимальную иммуногенную аминокислотную (AA) последовательность у 56/57 пептидов в библиотеке, которая стимулировала ответы, как показал анализ с линией Т-клеток от донора 2196 (фигура 3A). Олигомер с 9 мономерными единицами усиливал стабилизацию HLA A*0201 на поверхности T2 по сравнению с олигомером с 15 мономерными единицами и нерелевантным олигомером с 15 мономерными единицами (фигура 3B). Продукция IFNγ клонами T-клеток против данного эпитопа была ограниченной по HLA A*0201 (фигура 3C). Олигомер с 11 мономерными единицами SLIAAAAFCLA (CCNA1341-351, [SEQ ID NO:8]) неожиданно идентифицировали, как минимальную иммуногенную AA последовательность у 85/86 пептидов в библиотеке, которая стимулировала ответ в линии T-клеток от донора 2264 (фигура 3D). Несмотря на то, что комплекс олигомера с 10 мономерными единицами SLIAAAAFCL (олигомер с 10 мономерными единицами 1) с MHC являлся более стабильным, чем комплекс с олигомером с 11 мономерными единицами, только последний был способен активировать анализируемые клоны Т-клеток (фигура 3D, 3E). Продукция IFNγ клонами T-клеточных против данного эпитопа зависела от пептида 341-351 [SEQ ID NO:8] и экспрессии HLA A*0201 (фигура 3F).
Цитотоксическая активность клонов Т-клеток, специфичных к CCNA1 227-235 и CCNA1 341-351, против линии лейкозных клеток THP1. Для оценки пригодной экспрессирующей CCNA1 линии лейкозных клеток в качестве клеток-мишеней, определяли количество CCNA1 в пяти линиях клеток миелоидного лейкоза (фигура 4A). Обнаружили, что THP-1, положительная по HLA A*0201 линия FAB M5b AML, экспрессирует наивысшие уровни CCNA1. Клоны 2196.D9, 2196.D11 и 2196.E1, все из которых являлись специфическими к CCNA1 227-235 [SEQ ID NO:3], тестировали относительно реактивности против THP-1. Все три клона продуцировали IFNγ после совместной инкубации с аутологичными LCL, которые «обучали» пептидным эпитопом (фигуры 3C, 3F и данные не показаны), но только клоны D9 и D11 демонстрировали значительную продукцию IFNγ в ответ на THP-1. Данные ответы усиливались при инкубации клеток-мишеней THP-1 с 1000 Ед./мл IFNγ в течение 16 часов перед совместной инкубацией с эффекторами (фигура 4B). Клон D11 проявлял значительную литическую активность против THP-1 в стандартном 6 часовом анализе высвобождения радиоактивного 51Cr, тогда как низкоавидный клон E1 ее не проявлял (фигура 4C). Специфическое расщепление каспазой-3 наблюдали не только для клонов 2196.D9 и 2196.D11, но и для клона 2264.E30, который нацелен на CCNA1341-351 [SEQ ID NO:8], что указывает на надлежащее процессирование и презентирование обоих описанных эпитопов HLA A*0201 (фигуры 4C, 4D).
Распознавание и лизис клеток первичного AML клонами CD8+T-клеток, специфичными к CCNA1 227-235. Для определения того, распознают ли CTL, специфичные к эпитопу циклина A1, клетки первичного AML, бластные клетки, экспрессирующие циклин-A1 от двух положительных по A*0201 и двух отрицательных по A*0201 пациентов тестировали с использованием клона 2196.D11b, («D11b»), который распознавал эпитоп 227-235. 2196. D11b вначале тестировали на индукцию апоптоза в четырехчасовом анализе активности каспазы-3. Для максимального апоптоза данных мишеней применяли стауроспорин. Так как различные образцы AML показывали различные уровни спонтанного апоптоза, данные нормализовали путем расчета специфического расщепления каспазой-3 как 100 x (экспериментальное - спонтанное)/(стауроспорин - спонтанное). При использовании отношения E:T 5:1 2196.D11b индуцировал значительный апоптоз в положительных по A*0201 образцах AML, а не в отрицательных по A*0201 образцах (фигура 6A). Для определения того, отражало ли наблюдаемое расщепление каспазой-3 классическую литическую активность, стандартный четырехчасовый анализ высвобождения 51Cr проводили в диапазоне отношений E:T. Значительный лизис в положительных по A*0201 образцах наблюдали уже при E:T 1,25:1, тогда как в отрицательных по A*0201 мишенях не выявляли специфического лизиса. Таким образом, клетки первичного AML уничтожались при ограничении по HLA (фигура 6B). H001 и 1690-59 являлись положительными по HLA A*0201, а R10009 и R50400 являлись отрицательными по HLA A*0201.
В соответствии с критериями перечня критериев/характеристик взвешенных «идеальных» опухолевых антигенов Национального института онкологии (Cheever et al., 2009 Clin Cancer Res 15 (17):5323-5337), исходя из настоящего раскрытия, CCNA1, по-видимому, является весьма подходящим антигеном для направленного воздействия на AML, так как экспрессировался на высоком уровне в клетках AML, в том числе в компартменте стволовых клеток, приблизительно у 50% пациентов, и распределение экспрессии CCNA1 в тканях было сильно ограниченным. Как WT1, так и CCNA1 экспрессировались на значительно более высоких уровнях в лейкемических стволовых клетках (LSC), чем в гемопоэтических стволовых клетках (HSC) (Majeti et al., 2009 Proc Natl Acad Sci USA 106 (9): 3396-3401). Тем не менее, в отличие от WT1, который экспрессировался в нормальной селезенке, яичнике и почке на более высоких уровнях, чем в лейкозных бластных клетках, значительную экспрессию CCNA1 обнаружили только в семенниках, которые, как правило, рассматриваются как иммунологически привилегированная область (Fijak et al., 2006 Immunol Rev 213:66-81. doi: IMR438 [pii] 10.1111/j.1600-065X.2006.00438.x). Следовательно, маловероятно появление цитотоксических побочных эффектов направленного воздействия на CCNA1. Сообщалось, что CCNA1 являлся онкогенным у мышей, причем его сверхэкспрессия приводила в результате к развитию AML; экспрессия CCNA1 поддерживала злокачественный фенотип при AML (Chan et al., 2009 Oncogene 28 (43):3825-3836. doi: onc 2009236 [pii] 10.1038/onc.2009.236; Jang et al., 2008 Cancer Res 68 (12):4559-4570. doi: 68/12/4559 [pii] 10.1158/0008-5472.CAN- 08-0021; Ji et al., 2007 Int J Cancer 121 (4):706-713. doi:10.1002 /ijc. 22634).
Демонстрация специфической in vitro цитотоксичности клонов T-клеток, созданных против эндогенно экспрессируемых и презентируемых ассоциированных со злокачественными новообразованиями аутоантигенов, являлась предметом предыдущих сообщений (Wilde et al., 2009 Blood 114 (10):2131-2139. doi: blood-2009- 03-209387 [pii] 10.1182/blood-2009-03- 209387; Doubrovina et al., 2004 Clin Cancer Res 10 (21):7207-7219. doi: 10/21/7207 [pii] 10.1158/1078-0432. CCR-04- 1040; Chaise et al., 2008 Blood 112 (7):2956-2964. doi: blood-2008- 02-137695 [pii] 10.1182/blood-2008-02- 137695). Эффективную цитотоксическую активность специфических к CCNA1 клонов T-клеток наблюдали в отношении лейкозных клеток, как описано в данном документе. Уровень экспрессии CCNA1 оказался примерно на порядок выше, чем таковой, о котором сообщалось другими для WT1, уровни экспрессии которого могут колебаться в зависимости от клеточного цикла. Белок CCNA1, как известно, регулируется посредством убиквитин-протеасомного пути (Ekberg et al., 2009 Mol Cell Biochem 320 (1-2):115-124. doi: 10.1007/s11010-008 -9913-3) в соответствии с оптимальным презентированием его эпитопов на поверхности злокачественных клеток.
В связи с его ролью в гаметогенезе и поскольку он представляется аналогичным опубликованной классификации антигенов рака и семенников, на основе настоящего раскрытия CCNA1 настоящим документом классифицируется как антиген лейкоза и семенников типа не-X (Simpson et al., 2005 Nat Rev Cancer 5 (8):615-625. doi: nrc1669 [pii] 10.1038/nrc1669). CCNA1 экспрессировался в LSC и, как раскрыто в данном документе, представляется первым описываемым не-X антигеном лейкоза и семенников (non-X leukemia-testis-antigen). Избирательный профиль экспрессии CCNA1 в тканях, его высокие уровни экспрессии при AML, его функция в онкогенезе и множество иммуногенных Т-клеточных эпитопов CCNA1, описанных в данном документе, делают CCNA1 оптимальной мишенью для терапевтических подходов на основе Т-клеток, включая описанные в данном документе, а также включая вакцинацию и/или адоптивный перенос Т-клеток.
Дополнительная литература: Yang et al., 2010 Cell Oncol 32 (1-2):131-143. doi: G7V87116 LNJ27 053 [pii] 10.3233/CLO-2009-0510; Brait et al., 2008 Cancer Epidemiol Biomarkers Prev 17 (10): 2786-2794. doi:17/10/2786 [pii] 10.1158/1055-9965. EPI-08-0192; Spisak et al., 2010 Dis Markers 28 (1):1-14. doi: K32K0082 1215536H [pii] 10.3233/DMA-2010- 0677; Farhadieh et al., 2009 ANZ J Surg 79 (1-2):48-54. doi: ANS4799 [pii] 10.1111/j.1445-2197. 2008. 04799.x; Wegiel et al., 2008 J Natl Cancer Inst 100 (14):1022-1036. doi: djn214 [pii] 10.1093/jnci/djn214; Coletta et al., 2008 Cancer Res 68 (7):2204-2213. doi: 68/7/2204 [pii] 10.1158/0008-5472. CAN-07-3141; Cho et al., 2006 Cancer Sci 97 (10):1082-1092. doi: CAS292 [pii] 10.1111/j.1349-7006. 2006. 00292.x; Fijak et al., 2006 Immunol Rev 213:66-81. doi: IMR438 [pii] 10.1111/j.1600-065X.2006.00438.x; Rammensee et al., 1999 Immunogenetics 50 (3-4):213-219. doi:90500213.251 [pii]; Lundegaard et al., 2008 Nucleic Acids Res 36 (данные с веб-сервера):W509-512. doi:gkn202 [pii] 10.1093/nar/gkn202.
Различные варианты осуществления, описанные выше, можно комбинировать с получением дополнительных вариантов осуществления. Все патенты США, публикации патентных заявок США, заявки на патенты США, иностранные патенты, иностранные заявки на патенты и непатентные публикации, упоминаемые в данном описании и/или перечисленные в сведениях о заявке, включены в данный документе с помощью ссылки во всей своей полноте. Аспекты вариантов осуществления можно модифицировать, если необходимо, с использованием идей из различных патентов, заявок и публикаций с получением дополнительных вариантов осуществления.
Эти и другие изменения можно выполнять в вариантах осуществления в свете вышеприведенного подробного описания. В целом, в следующей формуле изобретения применяемые термины не следует рассматривать как ограничивающие формулу изобретения конкретными вариантами осуществления, раскрытыми в данном описании и формуле изобретения, а следует толковать как включающие все возможные варианты осуществления вместе с полным объемом эквивалентов, которые относятся к таким пунктам формулы изобретения. Соответственно, пункты формулы изобретения не ограничены настоящим раскрытием.
Эквиваленты
Хотя конкретные этапы, элементы, варианты осуществления и применения настоящего изобретения показаны и описаны в данном документе в целях иллюстрации, будет понятно, конечно, что настоящее изобретение не ограничено ими, поскольку специалистами в данной области могут осуществляться модификации, в частности, в свете вышеизложенных идей, без отклонения от сущности и объема настоящего изобретения. Соответственно, настоящее изобретение не ограничено ничем, кроме приложенной формулы изобретения.




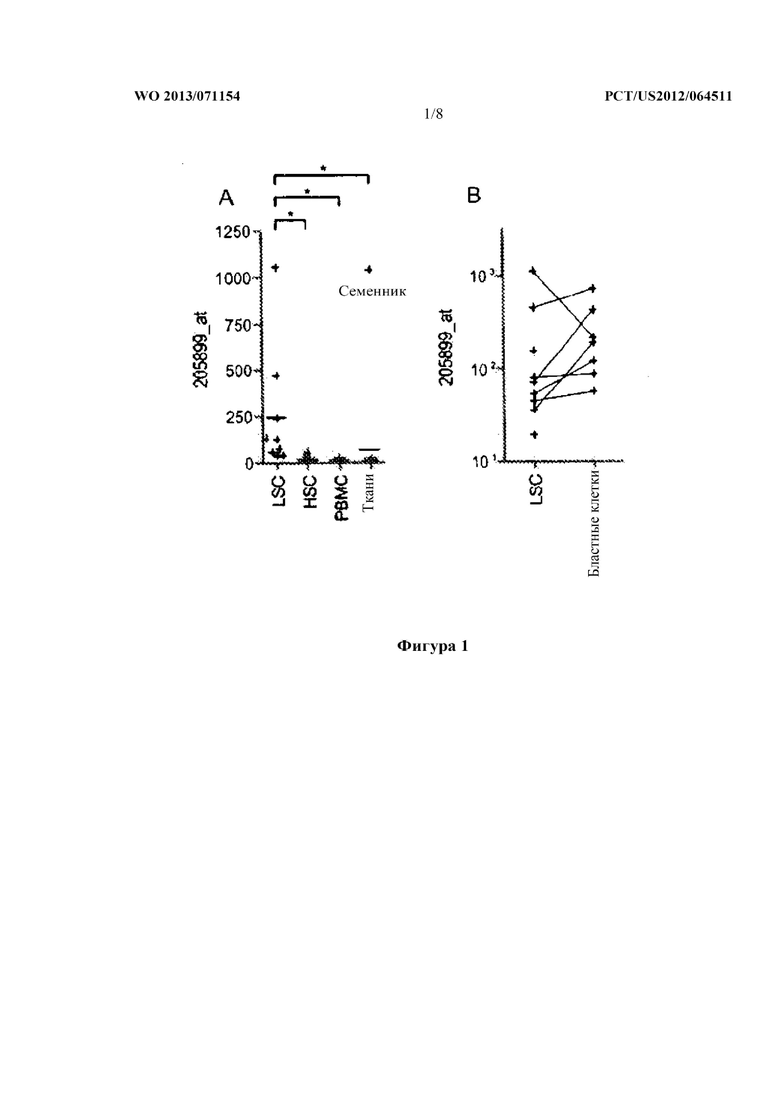

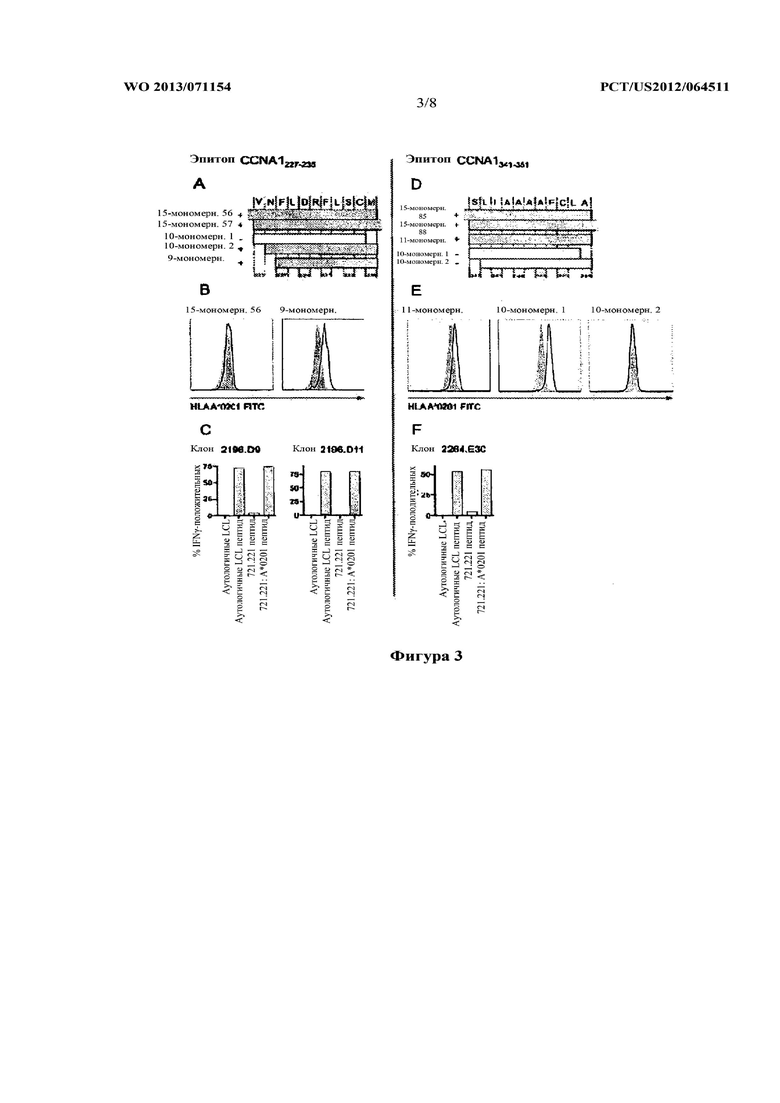
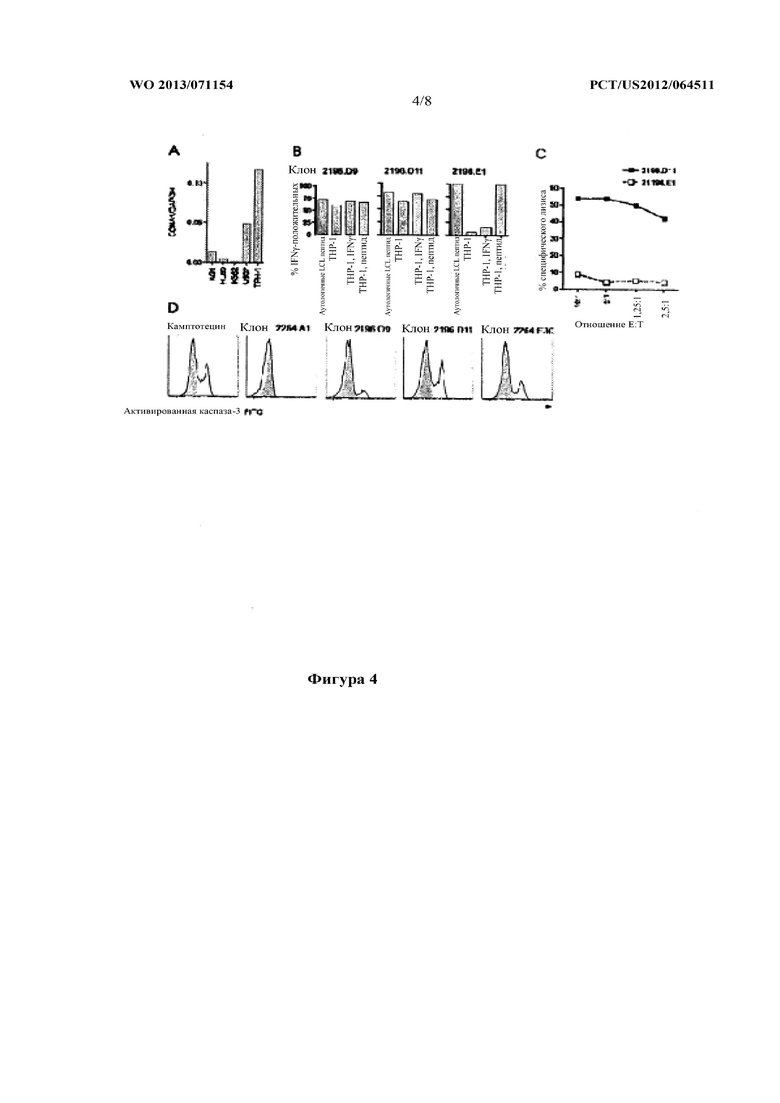



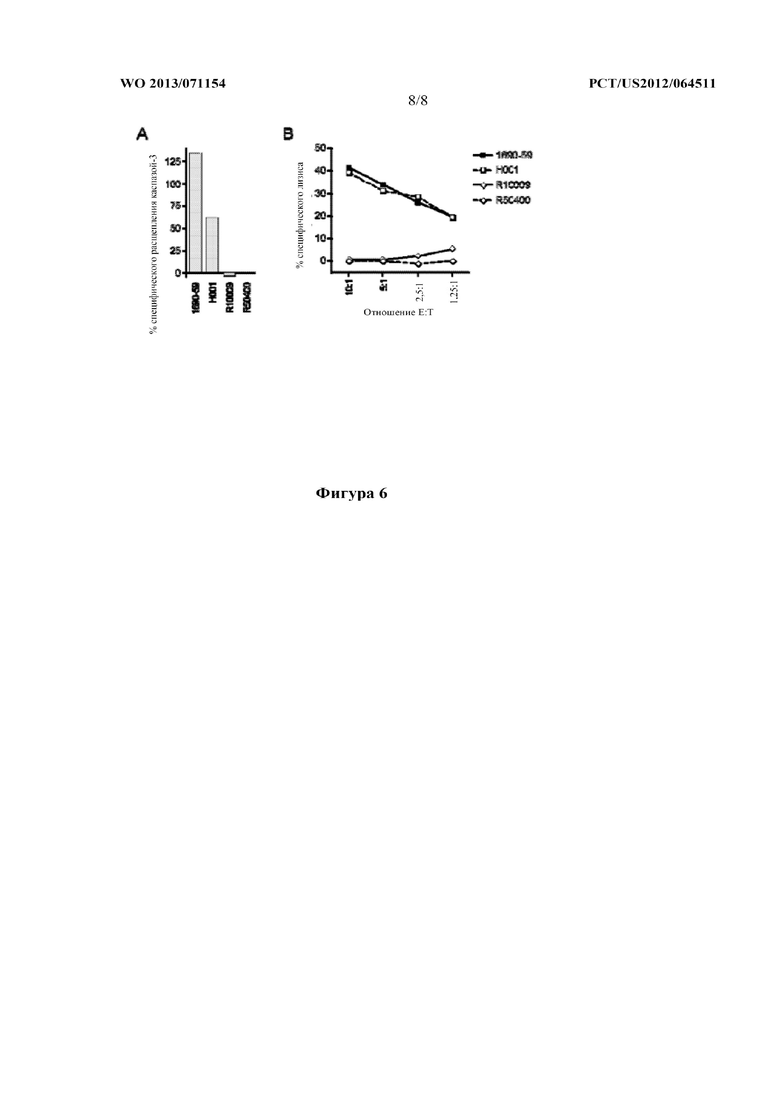
Изобретение относится к выделенным пептидам, способным вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1). Предложены композиции и способы для индукции антигенспецифических Т-клеточных ответов против человеческого циклина A1 (CCNA1), который в данном документе определяется как антиген, ассоциированный с лейкемией, на основании его сверхэкспрессии при остром миелоидном лейкозе (AML), в том числе в лейкемических стволовых клетках (LSC) и в иммунологически привилегированных клетках семенника, но не в других нормальных типах клеток. Также раскрываются иммунотерапевтические подходы, использующие такие пептиды для вакцин и получения терапевтических клеток для адоптивного переноса. 8 н. и 25 з.п. ф-лы, 6 ил., 1 пр.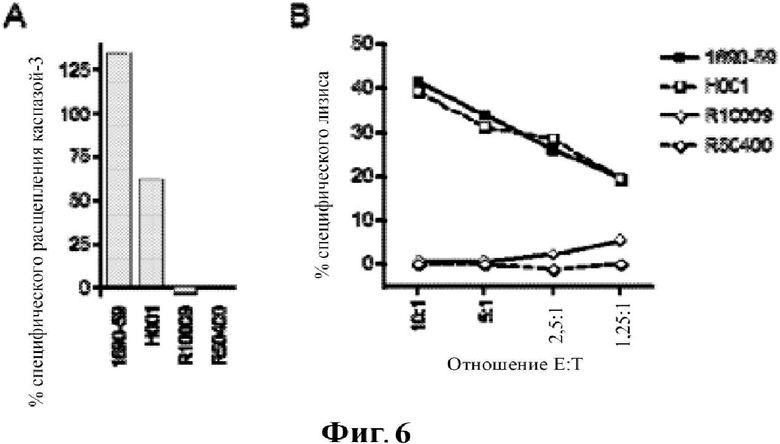
1. Выделенный пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), который включает полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, указанный полипептид представляет собой полипептид общей формулы I:

где N-X-C представляет собой полипептид, в котором:
X включает аминокислотную последовательность, которая выбрана из:
CCNA1 (120-131) VDTGTLKSDLHF [SEQ ID NO: 1],
CCNA1 (227-235) FLDRFLSCM [SEQ ID NO: 3],
CCNA1 (253-261) ASKYEEIYP [SEQ ID NO: 4],
CCNA1 (118-127) YEVDTGTLKS [SEQ ID NO: 5],
CCNA1 (167-175) YAEEIYQYL [SEQ ID NO: 6],
и
CCNA1 (341-351) SLIAAAAFCLA [SEQ IN NO: 8],
N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и/или
С представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот.
2. Выделенный пептид по п. 1, где антигенспецифический Т-клеточный ответ включает ограниченное по главному комплексу гистосовместимости (МНС) распознавание пептида Т-клетками.
3. Выделенный пептид по п. 1, который способен вызывать антигенспецифический ответ на человеческий циклин A1 (CCNA1), реализуемый CD8+ Т-клетками, при ограничении по человеческому лейкоцитарному антигену (HLA) класса I.
4. Выделенный пептид по п. 3, где антиген HLA класса I представляет собой HLA-А*0201.
5. Выделенный пептид по п. 1, который способен вызывать антигенспецифический ответ на человеческий циклин A1 (CCNA1), реализуемый CD4+ Т-клетками, при ограничении по лейкоцитарному антигену человека (HLA) класса II.
6. Выделенный пептид по п. 1, где антигенспецифический Т-клеточный ответ включает ответ, реализуемый интерфероном-гамма (IFN-γ).
7. Выделенный пептид по п. 1, где антигенспецифический Т-клеточный ответ включает по меньшей мере один из ответа, реализуемого CD4+ хелперными Т-лимфоцитами (Th), и ответа, реализуемого CD8+ цитотоксическими Т-лимфоцитами (CTL).
8. Выделенный пептид по п. 7, где ответ, реализуемый CTL, направлен против клетки, сверхэкспрессирующей CCNA1.
9. Выделенный пептид по п. 8, где клетка, сверхэкспрессирующая CCNA1, представляет собой клетку острого миелоидного лейкоза (AML) или лейкемическую стволовую клетку (LSC).
10. Выделенный полинуклеотид, который кодирует пептид, включающий полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), указанный полипептид представляет собой полипептид общей формулы I:

где:
N-X-C представляет собой полипептид, в котором:
X включает аминокислотную последовательность, которая выбрана из:
CCNA1 (120-131) VDTGTLKSDLHF [SEQ ID NO: 1],
CCNA1 (227-235) FLDRFLSCM [SEQ ID NO: 3],
CCNA1 (253-261) ASKYEEIYP [SEQ ID NO: 4],
CCNA1 (118-127) YEVDTGTLKS [SEQ ID NO: 5],
CCNA1 (167-175) YAEEIYQYL [SEQ ID NO: 6],
и
CCNA1 (341-351) SLIAAAAFCLA [SEQ IN NO: 8],
N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и/или
С представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот.
11. Иммуногенная композиция для лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, содержащая рекомбинантный вектор экспрессии, содержащий полинуклеотид по п. 10, функционально связанный с последовательностью, контролирующей экспрессию.
12. Иммуногенная композиция по п. 11, где вектор способен доставлять полинуклеотид к антигенпрезентирующей клетке.
13. Иммуногенная композиция по п. 12, где антигенпрезентирующая клетка представляет собой дендритную клетку.
14. Иммуногенная композиция по п. 11, где антигенспецифический Т-клеточный ответ включает ограниченное по главному комплексу гистосовместимости (МНС) распознавание пептида Т-клетками.
15. Иммуногенная композиция по п. 11, которая способна вызывать антигенспецифический ответ на человеческий циклин A1 (CCNA1), реализуемый CD8+ Т-клетками, при ограничении по лейкоцитарному антигену человека (HLA) класса I.
16. Иммуногенная композиция по п. 15, где антиген HLA класса I представляет собой HLA-A*0201.
17. Иммуногенная композиция по п. 11, которая способна вызывать антигенспецифический ответ на человеческий циклин A1 (CCNA1), реализуемый CD4+ Т-клетками, при ограничении по лейкоцитарному антигену человека (HLA) класса II.
18. Иммуногенная композиция по п. 11, где антигенспецифический Т-клеточный ответ включает ответ, реализуемый интерфероном-гамма (IFN-γ).
19. Иммуногенная композиция по п. 11, где антигенспецифический Т-клеточный ответ включает по меньшей мере один из ответа, реализуемого CD4+ хелперными Т-лимфоцитами (Th), и ответа, реализуемого CD8+ цитотоксическими Т-лимфоцитами (CTL).
20. Иммуногенная композиция по п. 19, где ответ, реализуемый CTL, направлен против клетки, сверхэкспрессирующей CCNA1.
21. Иммуногенная композиция по п. 20, где клетка, сверхэкспрессирующая CCNA1, представляет собой клетку острого миелоидного лейкоза (AML) или лейкемическую стволовую клетку (LSC).
22. Способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий введение субъекту эффективного количества композиции, которая содержит один или несколько выделенных пептидов, способных вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), причем каждый из указанных выделенных пептидов включает полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, указанный полипептид представляет собой полипептид общей формулы I:
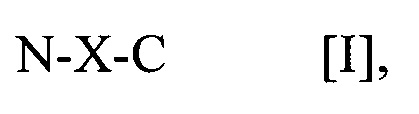
где N-X-C представляет собой полипептид, в котором:
X включает аминокислотную последовательность, которая выбрана из:
CCNA1 (120-131) VDTGTLKSDLHF [SEQ ID NO: 1],
CCNA1 (227-235) FLDRFLSCM [SEQ ID NO: 3],
CCNA1 (253-261) ASKYEEIYP [SEQ ID NO: 4],
CCNA1 (118-127) YEVDTGTLKS [SEQ ID NO: 5],
CCNA1 (167-175) YAEEIYQYL [SEQ ID NO: 6],
и
CCNA1 (341-351) SLIAAAAFCLA [SEQ IN NO: 8],
N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и/или
С представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот.
23. Способ по п. 22, где состояние, характеризующееся сверхэкспрессией CCNA1, представляет собой лейкоз.
24. Способ по п. 23, где лейкоз представляет собой острый миелоидный лейкоз.
25. Способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий введение субъекту эффективного количества композиции, которая содержит один или несколько выделенных полинуклеотидов, каждый из которых кодирует пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), причем каждый из указанных пептидов включает полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, указанный полипептид представляет собой полипептид общей формулы I:
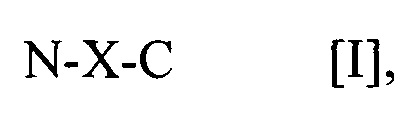
где N-X-C представляет собой полипептид, в котором:
X включает аминокислотную последовательность, которая выбрана из:
CCNA1 (120-131) VDTGTLKSDLHF [SEQ ID NO: 1],
CCNA1 (227-235) FLDRFLSCM [SEQ ID NO: 3],
CCNA1 (253-261) ASKYEEIYP [SEQ ID NO: 4],
CCNA1 (118-127) YEVDTGTLKS [SEQ ID NO: 5],
CCNA1 (167-175) YAEEIYQYL [SEQ ID NO: 6],
и
CCNA1 (341-351) SLIAAAAFCLA [SEQ IN NO: 8],
N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и/или
С представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот.
26. Способ по п. 25, где этап введения включает введение иммуногенной композиции, содержащей один или более рекомбинантных векторов экспрессии, содержащие один или более изолированных полинуклеотидов, при этом каждый из указанных изолированных полинуклеотидов функционально связан с последовательностью, контролирующей экспрессию.
27. Способ по п. 26, где вектор способен доставлять полинуклеотид к антигенпрезентирующей клетке.
28. Способ по п. 27, где антигенпрезентирующая клетка представляет собой дендритную клетку.
29. Способ по п. 25, где состояние, характеризующееся сверхэкспрессией CCNA1, представляет собой лейкоз.
30. Способ по п. 29, где лейкоз представляет собой острый миелоидный лейкоз.
31. Способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий следующее:
(А) контакт в условиях и в течение периода времени, достаточных для того, чтобы произошло процессирование и перезентирование антигена антигенпрезентирующими клетками, (i) популяции антигенпрезентирующих клеток, которые иммуносовместимы с субъектом, и (ii) выделенного пептида, способного вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), который включает полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, указанный полипептид представляет собой полипептид общей формулы I:
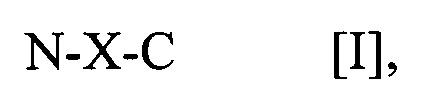
где N-X-C представляет собой полипептид, в котором:
X включает аминокислотную последовательность, которая выбрана из:
CCNA1 (120-131) VDTGTLKSDLHF [SEQ ID NO: 1],
CCNA1 (227-235) FLDRFLSCM [SEQ ID NO: 3],
CCNA1 (253-261) ASKYEEIYP [SEQ ID NO: 4],
CCNA1 (118-127) YEVDTGTLKS [SEQ ID NO: 5],
CCNA1 (167-175) YAEEIYQYL [SEQ ID NO: 6],
и
CCNA1 (341-351) SLIAAAAFCLA [SEQ IN NO: 8],
N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и/или
С представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот,
с получением одной или множества «обученных» антигеном антигенпрезентирующих клеток;
(B) (1) контакт «обученных» антигеном антигенпрезентирующих клеток с одной или множеством иммуносовместимых Т-клеток после этапа (А) в условиях и в течение периода времени, достаточных для получения специфических к CCNA1 Т-клеток,
(2) увеличение количества специфических к CCNA1 Т-клеток с получением одного или нескольких клонов указанных специфических к CCNA1 Т-клеток в количествах, достаточных для структурной характеристики Т-клеточных рецепторов,
(3) определение последовательности нуклеиновой кислоты, кодирующей полипептид Т-клеточного рецептора, для одной или нескольких из указанных специфических к CCNA1 Т-клеток,
(4) трансфекция Т-клеточной популяции для адоптивного переноса по меньшей мере одной нуклеиновой кислотой, кодирующей полипептид Т-клеточного рецептора, с последовательностью, определенной в (3), с получением сконструированных специфических к CCNA1 Т-клеток для адоптивного переноса; и
(C) адоптивный перенос сконструированных специфических к CCNA1 Т-клеток для адоптивного переноса субъекту.
32. Способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий следующее:
(А) контакт в условиях и в течение периода времени, достаточных для того, чтобы произошло процессирование и перезентирование антигена антигенпрезентирующими клетками, (i) популяции антигенпрезентирующих клеток, которые иммуносовместимы с субъектом, и (ii) выделенного пептида, способного вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), который включает полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, указанный полипептид представляет собой полипептид общей формулы I:
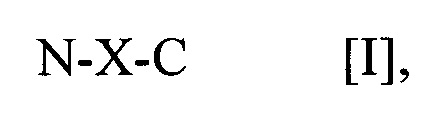
где N-X-C представляет собой полипептид, в котором:
X включает аминокислотную последовательность, которая выбрана из:
CCNA1 (120-131) VDTGTLKSDLHF [SEQ ID NO: 1],
CCNA1 (227-235) FLDRFLSCM [SEQ ID NO: 3],
CCNA1 (253-261) ASKYEEIYP [SEQ ID NO: 4],
CCNA1 (118-127) YEVDTGTLKS [SEQ ID NO: 5],
CCNA1 (167-175) YAEEIYQYL [SEQ ID NO: 6],
и
CCNA1 (341-351) SLIAAAAFCLA [SEQ IN NO: 8],
N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и/или
С представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот,
и получение таким образом популяции «обученных» антигеном антигенпрезентирующих клеток; и
(В) введение одной или множества указанных «обученных» антигеном антигенпрезентирующих клеток субъекту в количестве, эффективном для того, чтобы вызывать указанный антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1).
33. Способ лечения состояния, характеризующегося сверхэкспрессией CCNA1 в клетках субъекта, включающий следующее:
(А) контакт в условиях и в течение периода времени, достаточных для того, чтобы произошло процессирование и перезентирование антигена антигенпрезентирующими клетками, (i) популяции антигенпрезентирующих клеток, которые иммуносовместимы с субъектом, и (ii) композиции, которая содержит выделенный полинуклеотид, который может экспрессироваться указанными антигенпрезентирующими клетками и который кодирует пептид, способный вызывать антигенспецифический Т-клеточный ответ на человеческий циклин A1 (CCNA1), причем пептид включает полипептид не более чем из 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или 9 аминокислот, указанный полипептид представляет собой полипептид общей формулы I:
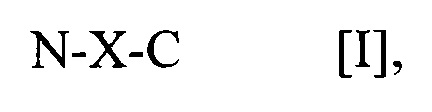
где N-X-C представляет собой полипептид, в котором:
X включает аминокислотную последовательность, которая выбрана из:
CCNA1 (120-131) VDTGTLKSDLHF [SEQ ID NO: 1],
CCNA1 (227-235) FLDRFLSCM [SEQ ID NO: 3],
CCNA1 (253-261) ASKYEEIYP [SEQ ID NO: 4],
CCNA1 (118-127) YEVDTGTLKS [SEQ ID NO: 5],
CCNA1 (167-175) YAEEIYQYL [SEQ ID NO: 6],
и
CCNA1 (341-351) SLIAAAAFCLA [SEQ IN NO: 8],
N представляет собой амино-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот, и/или
С представляет собой карбокси-конец пептида и состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислот, которые независимо выбраны из природных аминокислот и не встречающихся в природе аминокислот,
с получением одной или множества «обученных» антигеном антигенпрезентирующих клеток; и
(B) (1) контакт «обученных» антигеном антигенпрезентирующих клеток с одной или множеством иммуносовместимых Т-клеток после этапа (А) в условиях и в течение периода времени, достаточных для получения специфических к CCNA1 Т-клеток,
(2) увеличение количества специфических к CCNA1 Т-клеток с получением одного или нескольких клонов указанных специфических к CCNA1 Т-клеток в количествах, достаточных для структурной характеристики Т-клеточных рецепторов,
(3) определение последовательности нуклеиновой кислоты, кодирующей полипептид Т-клеточного рецептора, для одной или нескольких из указанных специфических к CCNA1 Т-клеток,
(4) трансфекция Т-клеточной популяции для адоптивного переноса по меньшей мере одной нуклеиновой кислотой, кодирующей полипептид Т-клеточного рецептора, с последовательностью, определенной в (3), с получением сконструированных специфических к CCNA1 Т-клеток для адоптивного переноса; и
(C) адоптивный перенос сконструированных специфических к CCNA1 Т-клеток для адоптивного переноса субъекту.
| ИММУНОГЛОБУЛИН С ДВОЙНЫМИ ВАРИАБЕЛЬНЫМИ ДОМЕНАМИ И ЕГО ПРИМЕНЕНИЯ | 2006 |
|
RU2515108C2 |
| US 2011236375 A1, 29.09.2011 | |||
| KONDO EISEI ET AL, "Using CD40-activated B cells to efficiently identify epitopes of tumor antigens", JOURNAL OF IMMUNOTHERAPY, 2009, vol | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2017-10-05—Публикация
2012-11-09—Подача