Перекрестная ссылка на родственную заявку
Данная заявка заявляет приоритет предварительной заявки № 61/823766, поданной 15 мая 2013, под названием «Композиции ценикривирока и способы их получения и применения», содержание которой включено сюда в виде ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтическим композициям, содержащим ценикривирок или его соль, способам их получения, и к их применению в лечении заболеваний или состояний, в частности, вирусных заболеваний, таких как инфекция, вызванная вирусом иммунодефицита человека (ВИЧ).
УРОВЕНЬ ТЕХНИКИ
Ценикривирок является общим названием (S,E)-8-(4-(2-бутоксиэтокси)фенил)-1-(2-метилпропил)-N-(4-(((1-пропил-1Н-имидазол-5-ил)метил)сульфинил)фенил)-1,2,3,4-тетрагидробензо[b]азоцин-5-карбоксамида, химическая формула которого представлена на фигуре 1. Ценикривирок является слабощелочным и слаборастворимым в воде лекарственным препаратом, который может быть эффективным против вирусов, например, ретровирусов, таких как вирус иммунодефицита человека (ВИЧ). Однако клиническое применение ценикривирока может быть ограничено за счет проблем с биодоступностью и стабильностью, которые свойственны известным композициям ценикривирока. Более того, имеющиеся в настоящее время композиции ценикривирока не могут содержать суточную дозу ценикривирока в одной таблетке, и в результате субъект должен принимать несколько таблеток, чтобы получить достаточный терапевтический эффект. Таким образом, требуются новые композиции и композиции, содержащие ценикривирок, а также способы получения и применения таких композиций и композиций. Настоящее изобретение относится к таким потребностям и обеспечивает другие связанные преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится, среди прочего, к фармацевтическим композициям, содержащим ценикривирок в качестве одного активного агента и в качестве одного из нескольких агентов, к способам их получения и к их применению в лечении заболеваний или состояний, в частности, вирусных заболеваний, таких как инфекция, вызванная вирусом иммунодефицита человека (ВИЧ). В некоторых вариантах осуществления настоящие композиции находятся в твердых лекарственных формах. В некоторых вариантах осуществления настоящие композиции представляют композиции для перорального введения.
В одном варианте осуществления обеспечивается композиция, содержащая ценикривирок или его соль и фумаровую кислоту. В некоторых вариантах осуществления ценикривирок или его соль представляют ценикривирока мезилат.
В дополнительных вариантах осуществления весовое соотношение ценикривирока или его соли к фумаровой кислоте составляет примерно от 7:10 до примерно 10:7, например, примерно от 8:10 до примерно 10:8, примерно от 9:10 до примерно 10:9 или примерно от 95:100 до примерно 100:95 в расчете на массу свободного основания ценикривирока.
В еще одних дополнительных вариантах осуществления фумаровая кислота находится в количестве примерно от 15% до примерно 40%, например, примерно от 20% до примерно 30%, или примерно 30%, или примерно 25% к массе всей композиции.
В еще одних дополнительных вариантах осуществления ценикривирок или его соль находится в количестве примерно от 15% до примерно 40%, например, примерно от 20% до примерно 30%, или примерно 25% к массе всей композиции, в расчете на массу свободного основания ценикривирока.
В еще одних дополнительных вариантах осуществления композиция содержит один или более фармацевтически неактивных ингредиентов, таких как фармацевтически приемлемые эксципиенты, например, наполнители, разрыхлители, смазывающие агенты и т.д.
В еще одних дополнительных вариантах осуществления композиция содержит один или более наполнителей. В более конкретных вариантах осуществления один или более наполнителей выбраны из микрокристаллической целлюлозы, двуосновного фосфата кальция, целлюлозы, лактозы, сахарозы, маннита, сорбита, крахмала и карбоната кальция. Например, в некоторых вариантах осуществления один или более наполнителей представляет микрокристаллическую целлюлозу. В конкретных вариантах осуществления весовое соотношение одного или более наполнителей к ценикривироку или его соли составляет примерно от 25:10 до примерно 10:8, например, примерно от 20:10 до примерно 10:10, или примерно 15:10 в расчете на массу свободного основания ценикривирока. В еще одних конкретных вариантах осуществления один или более наполнителей находится в количестве примерно от 25% до примерно 55%, например, от 30% до примерно 50%, или примерно 40% к массе всей композиции.
В еще одних дополнительных вариантах осуществления композиция дополнительно содержит один или более разрыхлителей. В более конкретных вариантах осуществления один или более разрыхлителей выбраны из поперечно-сшитого поливинилпирролидона, натриевой соли поперечно-сшитой карбоксиметилцеллюлозы и натрия крахмала гликолята. Например, в некоторых вариантах осуществления один или более разрыхлителей представляет натриевую соль поперечно-сшитой карбоксиметилцеллюлозы (натриевую соль кроскармаллозы). В конкретных вариантах осуществления весовое соотношение одного или более разрыхлителей к ценикривироку или его соли находится в пределах примерно от 10:10 до примерно 30:100, например, примерно от 25:100 в расчете на массу свободного основания ценикривирока. В еще одних конкретных вариантах осуществления один или более разрыхлителей находится в количестве примерно от 2% до примерно 10%, например, от 4% до примерно 8%, или примерно 6% к массе всей композиции.
В еще одних дополнительных вариантах осуществления композиция дополнительно содержит один или более смазывающих агентов. В более конкретных вариантах осуществления один или более смазывающих агентов выбраны из стеарина, стеарата магния и стеариновой кислоты. Например, в некоторых вариантах осуществления один или более смазывающих агентов представляет стеарат магния. В конкретных вариантах осуществления один или более смазывающих агентов находится в количестве примерно от 0,25% до примерно 5%, например, примерно от 0,75% до примерно 3%, или примерно 1,25% к массе всей композиции.
В еще одних дополнительных вариантах осуществления композиция дополнительно содержит антиадгезивные агенты, такие как, например, тальк. В еще одних дополнительных вариантах осуществления композиция дополнительно содержит одно или более средств, обеспечивающих оптимальную сыпучесть, например, таких как диоксид кремния.
В еще одних дополнительных вариантах осуществления композиция в основном аналогична композициям, представленным в таблице 3а и таблице 3b.
В еще одних дополнительных вариантах осуществления композиция в основном аналогична композициям, представленным в примере 2b в таблице 3а.
В еще одних дополнительных вариантах осуществления любой из вышеописанных вариантов осуществления получают способом, включающим сухое гранулирование. Например, любой из вышеописанных вариантов осуществления может быть получен способом, включающим сухое гранулирование смеси ценикривирока или его соли и фумаровой кислоты.
В еще одних дополнительных вариантах осуществления любая из вышеописанных композиций имеет содержание воды не более чем 4 масс.%, например, не более чем 2 масс.% через 6 недель воздействия условий с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагопоглотителем в контейнере, таком как флакон в закрытой конфигурации, например, индукционно запаянный флакон.
В еще одних дополнительных вариантах осуществления любая из вышеописанных композиций имеет общее содержание примесей и уровень продуктов деградации не более чем примерно 2,5%, например, не более чем 1,5% через 12 недель воздействия условий с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагопоглотителем в контейнере, таком как флакон в закрытой конфигурации, например, индукционно запаянный флакон.
В еще одних дополнительных вариантах осуществления ценикривирок или его соль в любой из вышеописанных композиций имеет среднюю абсолютную биодоступность после перорального введения, которая по существу аналогична средней абсолютной биодоступности ценикривирока или его соли в растворе после перорального введения. В еще одних дополнительных вариантах осуществления ценикривирок или его соль имеет среднюю абсолютную биодоступность в пределах примерно от 10% до примерно 50%, примерно от 10% до примерно 30%, примерно от 10% до примерно 25%, примерно от 15% до примерно 20%, включая все пределы и субпределы между ними. В конкретном варианте осуществления ценикривирок или его соль имеет среднюю абсолютную биодоступность примерно от 15% до примерно 20%, включая все пределы и субпределы между ними. В одном варианте осуществления ценикривирок или его соль имеет среднюю абсолютную биодоступность, равную примерно 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26% или 27%, включая все пределы и субпределы между ними. В конкретном варианте осуществления ценикривирок или его соль имеет среднюю абсолютную биодоступность примерно 18%. В конкретном варианте осуществления вышеуказанная биодоступность приводится для ценикривирока или его соли в любой из вышеописанных композиций у млекопитающего. В конкретном варианте осуществления млекопитающее представляет собаку, такую как бигль.
В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей примерно 150 мг ценикривирока или его соли, где композиция имеет значение AUC0-last в стационарном состоянии, равное примерно от 7000 ч×нг/мл до примерно 11000 ч×нг/мл, например, примерно от 7500 ч×нг/мл до примерно 9500 ч×нг/мл, или примерно от 8000 ч×нг/мл до примерно 9000 ч×нг/мл, после введения композиции субъекту после приема пищи. В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей примерно 150 мг ценикривирока или его соли, где композиция имеет значение Cmax в стационарном состоянии, равное примерно от 500 нг/мл до примерно 750 нг/мл, например, примерно от 550 нг/мл до примерно 700 нг/мл, после введения композиции субъекту после приема пищи. В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей примерно 150 мг ценикривирока или его соли, где композиция имеет значение Cmin в стационарном состоянии, равное примерно от 100 нг/мл до примерно 230 нг/мл, например, примерно от 130 нг/мл до примерно 200 нг/мл, после введения композиции субъекту после приема пищи.
В еще одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей примерно 200 мг ценикривирока или его соли, где композиция имеет значение AUC0-last, равное примерно от 13200 ч×нг/мл до примерно 14200 ч×нг/мл, и значение Cmax, равное примерно от 550 нг/мл до примерно 700 нг/мл после введения однократной дозы композиции субъекту натощак.
«Состояние натощак» или «натощак» включает состояние у субъекта, например, человека, который не потреблял какой-либо пищи в течение ночи, например, у субъекта, который встал после сна, но еще не ел, или перед сном у него был пустой желудок. Субъект, в частности, человек, в состоянии натощак также может представлять субъекта, который не потреблял какой-либо пищи иной, чем вода, по меньшей мере, в течение 6 ч, в частности, по меньшей мере, 8 ч, в частности, предпочтительно, по меньшей мере, 10 ч и в частности, предпочтительно, по меньшей мере, 12 ч. «Состояние после приема пищи» или «состояние ненатощак» относится к состоянию у субъекта, например, человека, который принимал один или более видов стандартной пищи, пища с высоким содержанием жира, высококалорийная пища, пища из риса, низкокалорийная пища, пища с низким содержанием жира, пища с низким содержанием углеводов, и с или без напитка или питьевого продукта, такого как кофе, чай, вода, фруктовый сок, сода и т.п. Прием пищи может следовать, по меньшей мере, через 6, 8 или 10 ч голодания, например, 10, 11 или 12 ч после голодания, однако это не требуется, если не указано иначе.
В еще одних дополнительных вариантах осуществления любая из вышеописанных композиций имеет значение AUC0-last ценикривирока, которое составляет примерно 175% или выше, например, 200% или выше, или примерно 225% или выше, или примерно 250% или выше, от AUC0-last ценикривирока, которое показывает стандартная твердая композиция после перорального введения. В еще одних дополнительных вариантах осуществления любая из вышеописанных композиций имеет значение Cmax ценикривирока, которое, по меньшей мере, на 40% выше, например, на 50% выше или, по меньшей мере, на 55% выше, чем Cmax ценикривирока, которое показывает стандартная твердая композиция после перорального введения. Под стандартной твердой композицией понимается твердая композиция, содержащая ценикривирок или его соль и один или более фармацевтически приемлемых эксципиентов, но без кислого солюбилизатора и агента для доведения рН в композиции.
В еще одних дополнительных вариантах осуществления любая из вышеописанных композиций дополнительно содержит один или более дополнительных фармацевтически активных агентов.
В более конкретных вариантах осуществления один или более дополнительных фармацевтически активных агентов представляет один или более антиретровирусных препаратов, выбранных из антагонистов CCR5, ингибиторов вхождения вирусов в клетки, нуклеозидных ингибиторов обратной транскриптазы, нуклеотидных ингибиторов обратной транскриптазы, ненуклеозидных ингибиторов обратной транскриптазы, ингибиторов протеазы, ингибиторов интегразы и ингибиторов созревания.
В еще одних дополнительных более конкретных вариантах осуществления один или более дополнительных фармацевтически активных агентов выбран из маравирока, ламивудина, эфавиренза, ралтегравира, вивекона, бевиримата, альфа-интерферона, зидовудина, абакавира, лопинавира, ритонавира, тенофовира, тенофовира дизопроксила, пролекарств тенофовира, эмтрицитабина, элвитегравира, кобицистата, дарунавира, атазанавира, рилпивирина и долутегравира.
В еще одних дополнительных более конкретных вариантах осуществления один или более дополнительных фармацевтически активных агентов включают один или более иммуносупрессивных агентов. В еще одних дополнительных более конкретных вариантах осуществления один или более дополнительных фармацевтически активных агентов выбраны из группы, состоящей из циклоспорина, такролимуса, преднизолона, гидрокортизона, сиролимуса, эверолимуса, азатиоприна, микофеноловой кислоты, метотрексата, базиликсимаба, даклизумаба, ритуксимаба, антитимоцитного глобулина и антилимфоцитного глобулина. В других конкретных вариантах осуществления один или более дополнительных фармацевтически активных агентов представляют одно или более из такролимуса или метотрексата.
В одном варианте осуществления изобретение относится к композиции, содержащей ценикривирок или его соль, фумаровую кислоту и ламивудин (3ТС). В некоторых вариантах осуществления ценикривирок или его соль представляет ценикривирока мезилат. В дополнительных вариантах осуществления весовое соотношение ценикривирока или его соли к ламивудину составляет примерно от 1:15 до примерно 1:1, например, примерно от 1:12 до примерно 2:3; примерно 1:12; примерно 1:4 или примерно 1:2 в расчете на массу свободного основания ценикривирока. В еще одних дополнительных вариантах осуществления ламивудин находится в количестве примерно от 25% до примерно 65%, например, примерно от 30% до примерно 60%, примерно 31,6%; примерно 33,3%; примерно 37,5%; примерно 40,0%; примерно 46,2% или примерно 60% к массе всей композиции. В еще одном варианте осуществления композиция содержит примерно 15,8% ценикривирока или его соли и примерно 31,6% ламивудина к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одном варианте осуществления композиция содержит примерно 16,7% ценикривирока или его соли и примерно 33,3% ламивудина к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одном варианте осуществления композиция содержит примерно 18,8% ценикривирока или его соли и примерно 37,5% ламивудина к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одном варианте осуществления композиция содержит примерно 20% ценикривирока или его соли и примерно 40% ламивудина к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одном варианте осуществления композиция содержит примерно 11,5% ценикривирока или его соли и примерно 46,2% ламивудина к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одном варианте осуществления композиция содержит примерно 5% ценикривирока или его соли и примерно 60% ламивудина к массе всей композиции и в расчете на массу свободного основания ценикривирока.
В еще одних дополнительных вариантах осуществления вышеописанные композиции, содержащие ценикривирок или его соль, фумаровую кислоту и 3ТС, могут дополнительно содержать один или более фармацевтически неактивных ингредиентов, таких как фармацевтически приемлемые эксципиенты, например, наполнители, разрыхлители, смазывающие агенты и т.д.
В еще одних дополнительных вариантах осуществления вышеописанные композиции, содержащие ценикривирок или его соль, фумаровую кислоту и 3ТС, могут дополнительно содержать один или более наполнителей. В более конкретных вариантах осуществления один или более наполнителей выбраны из микрокристаллической целлюлозы, двуосновного фосфата кальция, целлюлозы, лактозы, сахарозы, маннита, сорбита, крахмала и карбоната кальция. Например, в некоторых вариантах осуществления один или более наполнителей представляет микрокристаллическую целлюлозу. В конкретных вариантах осуществления весовое соотношение одного или более наполнителей к ценикривироку или его соли составляет примерно от 5:1 до примерно 1:5, например, примерно от 1:4 до примерно 1:5, или примерно от 2:3 до примерно 1:2, или примерно от 2:1 до примерно 4:3, или примерно от 5:1 до примерно 5:2 в расчете на массу свободного основания ценикривирока. В еще одних конкретных вариантах осуществления один или более наполнителей находится в количестве примерно от 5% до примерно 30%, например, примерно 5,8%; примерно 6,6%; примерно 12,%; примерно 20,5%; примерно 22,2%; примерно 23,4% или примерно 24,8% к массе всей композиции. В еще одном варианте осуществления композиция содержит примерно 15,8% ценикривирока или его соли, примерно 31,6% ламивудина и 24,8% одного или более наполнителей к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одном варианте осуществления композиция содержит примерно 16,7% ценикривирока или его соли, примерно 33,3% ламивудина и 23,4% одного или более наполнителей к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одном варианте осуществления композиция содержит примерно 18,8% ценикривирока или его соли, примерно 37,5% ламивудина и 12,0% одного или более наполнителей к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одном варианте осуществления композиция содержит примерно 20% ценикривирока или его соли, примерно 40,0% ламивудина и 5,8% одного или более наполнителей к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одном варианте осуществления композиция содержит примерно 20% ценикривирока или его соли, примерно 40,0% ламивудина и 6,6% одного или более наполнителей к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одном варианте осуществления композиция содержит примерно 11,5% ценикривирока или его соли, примерно 46,2% ламивудина и 20,5% одного или более наполнителей к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одном варианте осуществления композиция содержит примерно 5% ценикривирока или его соли, примерно 60% ламивудина и 22,2% одного или более наполнителей к массе всей композиции и в расчете на массу свободного основания ценикривирока.
В еще одних дополнительных вариантах осуществления вышеописанные композиции, содержащие ценикривирок или его соль, фумаровую кислоту и 3ТС, могут дополнительно содержать один или более разрыхлителей. В более конкретных вариантах осуществления один или более разрыхлителей выбраны из поперечно-сшитого поливинилпирролидона, натриевой соли поперечно-сшитой карбоксиметилцеллюлозы и натрия крахмала гликолята. Например, в некоторых вариантах осуществления один или более разрыхлителей представляет натриевую соль поперечно-сшитой карбоксиметилцеллюлозы. В конкретных вариантах осуществления весовое соотношение одного или более разрыхлителей к ценикривироку или его соли составляет примерно от 1:4 до примерно 3:2, например, примерно 1:3; примерно 2:5; примерно 1:2 или примерно 1:1 в расчете на массу свободного основания ценикривирока. В еще одних конкретных вариантах осуществления один или более разрыхлителей находится в количестве примерно от 3% до примерно 9% к массе всей композиции.
В еще одних дополнительных вариантах осуществления вышеописанные композиции, содержащие ценикривирок или его соль, фумаровую кислоту и 3ТС, могут дополнительно содержать один или более смазывающих агентов. В более конкретных вариантах осуществления один или более смазывающих агентов выбраны из стеарина, стеарата магния и стеариновой кислоты. Например, в некоторых вариантах осуществления один или более смазывающих агентов представляет стеарат магния. В конкретных вариантах осуществления один или более смазывающих агентов находится в количестве примерно от 0,5% до примерно 4%, например, примерно от 0,75% до примерно 3% к массе всей композиции. В еще одних дополнительных вариантах осуществления композиция дополнительно содержит один или более антиадгезивных агентов, таких как, например, тальк. В еще одних дополнительных вариантах осуществления композиция дополнительно содержит одно или более средств, обеспечивающих оптимальную сыпучесть, например, таких как диоксид кремния.
В еще одних дополнительных вариантах осуществления вышеописанные композиции, содержащие ценикривирок или его соль, фумаровую кислоту и 3ТС, по существу аналогичны примерам, описанным в таблицах 18, 19, 20, 21, 22, 23 и 24.
В еще одних дополнительных вариантах осуществления любая из вышеописанных композиций, содержащих ценикривирок или его соль, фумаровую кислоту и 3ТС, имеют содержание воды не более чем 4 масс.%, например, не более чем 2 масс.% через 4 недели воздействия условий с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагопоглотителем.
В еще одних дополнительных вариантах осуществления любая из вышеописанных композиций, содержащих ценикривирок или его соль, фумаровую кислоту и 3ТС, имеет общее содержание примесей и уровень продуктов деградации не более чем примерно 4%, например, не более чем 2% через 9 недель воздействия условий с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагопоглотителем.
В еще одних дополнительных вариантах осуществления любая из вышеописанных композиций, содержащих ценикривирок или его соль, фумаровую кислоту и 3ТС, может дополнительно содержать эфавиренз. В дополнительных вариантах осуществления весовое соотношение ценикривирока или его соли, ламивудина и эфавиренза составляет примерно 1:2:4 в расчете на массу свободного основания ценикривирока. В еще одних дополнительных вариантах осуществления любая из композиций содержит примерно 10,3% ценикривирока или его соли, примерно 18,2% ламивудина и примерно 36,4% эфавиренза к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одних дополнительных вариантах осуществления любая из композиций содержит примерно 9,5% ценикривирока или его соли, примерно 19,1% ламивудина и примерно 38,1% эфавиренза к массе всей композиции и в расчете на массу свободного основания ценикривирока. В еще одних дополнительных вариантах осуществления любая из композиций по существу аналогична примерам, представленным в таблицах 28 или 29. В еще одних дополнительных вариантах осуществления любая из композиций имеет содержание воды не более чем примерно 4 масс.%, например, не более чем примерно 2,0 масс.% примерно через 4 недели воздействия условий с температурой примерно 40°С и примерно 75% относительной влажностью при упаковке с влагопоглотителем в контейнере, таком как флакона в закрытой конфигурации, например, индукционно запаянный флакон. В еще одних дополнительных вариантах осуществления любая из композиций имеет общее содержание примесей и уровень продуктов деградации не более чем примерно 4,0%, например, не более чем примерно 2,0% через 9 недель воздействия условий с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагопоглотителем в контейнере, таком как флакон в закрытой конфигурации, например, индукционно запаянный флакон.
В одном варианте осуществления изобретение относится к фармацевтическим композициям, содержащим любую из вышеописанных композиций. В одном варианте осуществления изобретение относится к фармацевтическим композициям, содержащим ценикривирок или его соль, ламивудин (3ТС) и один или более фармацевтически приемлемых эксципиентов. В еще одном варианте осуществления изобретение относится к фармацевтическим композициям, содержащим ценикривирок или его соль, эфавиренз (EFV) и один или более фармацевтически приемлемых эксципиентов. В еще одном варианте осуществления изобретение относится к фармацевтическим фомуляциям, содержащим ценикривирок или его соль, 3ТС, EFV и один или более фармацевтически приемлемых эксципиентов. В любом из вышеприведенных вариантов осуществления ценикривирок или его соль представляет ценикривирока мезилат.
В одном варианте осуществления фармацевтической композиции композиции находятся в виде гранулята. В дополнительных вариантах осуществления ценикривирок или его соль находятся в фармацевтической композиции в виде гранулята. В некоторых вариантах осуществления гранулят может содержать кислый солюбилизатор, такой как фумаровая кислота. Например, в одном варианте осуществления ценикривирок или его соль и фумаровая кислота смешаны с подходящими эксципиентами и гранулированы с получением гранул, содержащих ценикривирок или его соль. Гранулы, содержащие ценикривирок или его соль и фумаровую кислоту, могут быть объединены с дополнительными эксципиентами с получением композиций по изобретению. Компоненты, находящиеся в гранулах ценикривирока, относятся к «внутригранулярным» компонентам, в то время как компоненты вне гранул относятся к «внегранулярным» компонентам. В одном варианте осуществления «внутригранулярные» компоненты содержат ценикривирок или его соль и фумаровую кислоту; и «внегранулярные» компоненты содержат один или более фармацевтически активных агентов, таких как 3ТС и/или EFV. В других вариантах осуществления «внутригранулярные» компоненты содержат ценикривирок или его соль, фумаровую кислоту, и один или более фармацевтически активных агентов, таких как 3ТС и/или EFV, и «внегранулярные» компоненты содержат один или более фармацевтически активных агентов иных, чем ценикривирок или его соль, таких как 3ТС и/или EFV. В других вариантах осуществления «внутригранулярные» компоненты содержат ценикривирок или его соль, фумаровую кислоту, и один или более фармацевтически активных агентов, таких как 3ТС и/или EFV; и «внегранулярные» компоненты не содержат какого-либо фармацевтически активного агента.
В еще одном варианте осуществления изобретение относится к фармацевтической композиции, которая содержит композицию по одному из вышеуказанных вариантов осуществления. В еще одних дополнительных вариантах осуществления композиция композиции находится в капсуле. В еще одних дополнительных вариантах осуществления композиция композиции находится в саше. В еще одних дополнительных вариантах осуществления композиция композиции представляет таблетку или компонент таблетки.
В еще одних дополнительных вариантах осуществления композиция композиции находится в одном или более слоев многослойной таблетки. В еще одних дополнительных вариантах осуществления композиция композиции находится в однослойной таблетке.
В одном варианте осуществления многослойной таблетки композиция находится в бислойной таблетке, содержащей одно ядро и слой снаружи одного ядра. В одном варианте осуществления бислойной таблетки ценикривирок или его соль и фумаровая кислота находятся в ядре; и ламивудин находится в слое снаружи одного ядра. В еще одном варианте осуществления бислойной таблетки ценикривирок или его соль, фумаровая кислота и ламивудин находятся в ядре; и эфавиренз находится в слое снаружи одного ядра.
В дополнительных вариантах осуществления любая из композиций в вышеописанных фармацевтических композициях по существу аналогична примерам, представленным в таблицах 3а, 36, 18, 19, 20, 21, 22, 23, 24, 28 или 29. В дополнительных вариантах осуществления фармацевтическая композиция находится в лекарственной форме для перорального введения, такой как таблетка, которая содержит композицию по существу аналогичную представленным в таблицах 3а, 36, 18, 19, 20, 21, 22, 23, 24, 28 или 29.
В дополнительных вариантах осуществления любая из вышеописанных композиций, любая из вышеописанных фармацевтических композиций или любая из вышеописанных таблеток представляет покрытый субстрат.
В еще одном варианте осуществления изобретение относится к способам получения любого из вышеуказанных вариантов осуществления. В дополнительных вариантах осуществления способ включает смешивание ценикривирока или его соли и фумаровой кислоты с получением смеси и сухое гранулирование смеси. В еще одних дополнительных вариантах осуществления способ дополнительно включает смешивание одного или более наполнителей с ценикривироком или его солью и фумаровой кислотой с получением смеси. В более конкретных вариантах осуществления один или более наполнителей выбраны из микрокристаллической целлюлозы, двуосновного фосфата кальция, целлюлозы, лактозы, сахарозы, маннита, сорбита, крахмала и карбоната кальция. Например, в некоторых вариантах осуществления один или более наполнителей представляет микрокристаллическую целлюлозу. В еще одних дополнительных вариантах осуществления способ дополнительно включает смешивание одного или более разрыхлителей с ценикривироком или его солью и фумаровой кислотой с получением смеси. В более конкретных вариантах осуществления один или более разрыхлителей выбраны из поперечно-сшитого поливинилпирролидона, натриевой соли поперечно-сшитой карбоксиметилцеллюлозы и натрия крахмала гликолята. Например, в некоторых вариантах осуществления один или более разрыхлителей представляет натриевую соль поперечно-сшитой карбоксиметилцеллюлозы. В еще одних дополнительных вариантах осуществления способ дополнительно включает смешивание одного или более смазывающих агентов с ценикривироком или его солью и фумаровой кислотой с получением смеси. В более конкретных вариантах осуществления один или более смазывающих агентов выбраны из стеарина, стеарата магния и стеариновой кислоты. Например, в некоторых вариантах осуществления один или более смазывающих агентов представляет стеарат магния. В еще одних дополнительных вариантах осуществления способ дополнительно включает прессование сухой гранулированной смеси в таблетку. В еще одних дополнительных вариантах осуществления способ включает наполнение капсулы смесью, полученной сухим гранулированием.
В еще одних дополнительных вариантах осуществления способ дополнительно включает смешение сухой гранулированной смеси с одним или более внегранулярными веществами. В более конкретных вариантах осуществления одно или более внегранулярных веществ представляет один или более дополнительных фармацевтически активных агентов. В других более конкретных вариантах осуществления один или более фармацевтически активных агентов представляют один или более дополнительных антиретровирусных препаратов. В еще одних более конкретных вариантах осуществления один или более дополнительных антиретровирусных препаратов выбраны из антагонистов CCR5, ингибиторов вхождения вирусов в клетки, нуклеозидных ингибиторов обратной транскриптазы, нуклеотидных ингибиторов обратной транскриптазы, ненуклеозидных ингибиторов обратной транскриптазы, ингибиторов протеазы, ингибиторов интегразы и ингибиторов созревания. В еще одних более конкретных вариантах осуществления один или более дополнительных антиретровирусных препаратов выбраны из маравирока, ламивудина, эфавиренза, ралтегравира, вивекона, бевиримата, альфа-интерферона, зидовудина, абакавира, лопинавира, ритонавира, тенофовира, тенофовира дизопроксила, пролекарств тенофовира, эмтрицитабина, элвитегравира, кобицистата, дарунавира, атазанавира, рилпивирина и долутегравира. В еще одних дополнительных более конкретных вариантах осуществления один или более дополнительных фармацевтически активных агентов включают один или более иммуносупрессивных агентов. В еще одних дополнительных более конкретных вариантах осуществления один или более дополнительных фармацевтически активных агентов выбраны из группы, состоящей из циклоспорина, такролимуса, преднизолона, гидрокортизона, сиролимуса, эверолимуса, азатиоприна, микофеноловой кислоты, метотрексата, базиликсимаба, даклизумаба, ритуксимаба, антитимоцитного глобулина и антилимфоцитного глобулина. В еще одних конкретных вариантах осуществления один или более дополнительных фармацевтически активных агентов представляют один или более из такролимуса или метотрексата.
В некоторых вариантах осуществления часть дополнительного фармацевтически активного агента может быть добавлена внутригранулярно вместе с ценикривироком или его солью.
В еще одном варианте осуществления изобретение относится к способу введения ценикривирока или его соли, включающему введение композиции, композиции, таблетки или композиции, полученной способом по одному из вышеуказанных вариантов осуществления. В еще одном варианте осуществления изобретение относится к способу лечения заболевания, расстройства или состояния, включающему введение терапевтически эффективного количества композиции, композиции, таблетки или композиции, полученной любым из вышеуказанных вариантов осуществления. В дополнительных вариантах осуществления заболевание, расстройство или состояние представляет вирусную инфекцию. В еще одних дополнительных вариантах осуществления вирусная инфекция представляет ретровирусную инфекцию. В еще одних дополнительных вариантах осуществления заболевание, состояние или расстройство представляет гепатит, инфекцию, вызванную вирусом иммунодефицита человека, или вирусную саркому. В некоторых вариантах осуществления заболевание, состояние или расстройство представляет инфекцию, вызванную вирусом иммунодефицита человека. В дополнительных вариантах осуществления заболевание, расстройство или состояние представляет воспаление. В еще одних дополнительных вариантах осуществления заболевание, расстройство или состояние представляет синдром трансплантат против хозяина, воспаление при диабете, воспаление органов сердечно-сосудистой системы или фиброз.
Дополнительные варианты осуществления настоящего изобретения станут очевидными специалистам в данной области из последующего описания и примеров.
Краткое описание фигур
На фигуре 1 представлена химическая формула ценикривирока.
На фигуре 2 представлен график, на котором сравнивается абсолютная биодоступность у собак бигль ценикривирока мезилата, формулированного в виде раствора для перорального введения, с ценикривироком мезилатом, приготовленным влажным гранулированием и смешанным с различными эксципиентами, представляющими собой кислые солюбилизаторы.
На фигуре 3 представлен график, показывающий общее содержание примесей и продуктов деградации в различных композициях ценикривирока, подвергнутых «ускоренному старению» в условиях при 40°С и 75% относительной влажности при упаковке с влагоуловителем в индукционно запаянном флаконе.
На фигуре 4 показан профиль растворения ценикривирока из таблеток после хранения в условиях при 40°С и 75% относительной влажности.
На фигуре 5 показана изотерма динамической сорбции пара для различных композиций ценикривирока.
На фигуре 6 показано всасывание ценикривирока из различных композиций после трех предварительных обработок на собаках бигль.
На фигурах 7 и 8 показан соответственно профиль растворения и профиль распадаемости таблеток из примеров 2а-2е.
На фигуре 9 показана абсолютная биодоступность у собак бигль таблеток из примеров 2а-2е.
На фигуре 10 показан профиль сжимаемости измельченных гранул из примеров 14 и 15.
На фигуре 11 показан профиль сжимаемости измельченных гранул из примера 14 при прессовании с использованием различных роликовых уплотнителей.
На фигуре 12 показан профиль сжимаемости порошковых смесей из примеров 17, 19 и 20.
На фигуре 13 представлены параметры растворения таблеток из примера 28 через 4 недели хранения в условиях при 40°С/75% относительной влажности. На панели А показан профиль растворения 3ТС, на панели В показан профиль растворения CVC и на панели С показан профиль растворения EFV.
На фигуре 14 представлены параметры растворения таблеток из примера 29 через 4 недели хранения в условиях при 40°С/75% относительной влажности. На панели А показан профиль растворения 3ТС, на панели В показан профиль растворения CVC и на панели С показан профиль растворения EFV.
ПОДРОБНОЕ ОПИСАНИЕ
За исключением того, когда это указано, все термины имеют их обычное значение, используемое в данной области, и используются так, как если бы они использовались специалистами в данной области на время раскрытия. Очевидно, понятно, что по тексту данной заявки единственные формы, такие как «а», «an» и «the» часто используются для удобства, однако данные единственные формы включают множественные, если не указано особо, или по контексту точно не требуется только единственная форма. Очевидно, понятно, что все публикации, патенты, книги, статьи из журналов и тому подобное, на которые делаются ссылки в данной заявке, включены для сведения в полном объеме и для всех целей до степени, совместимой с настоящим раскрытием.
Определения
«Ценикривирок» (также известный как CVC) относится к химическому соединению (S,E)-8-(4-(2-бутоксиэтокси)фенил)-1-(2-метилпропил)-N-(4-(((1-пропил-1Н-имидазол-5-ил)метил)сульфинил)фенил)-1,2,3,4-тетрагидробензо[b]азоцин-5-карбоксамиду, который также имеет химическое название 8-[4-(2-бутоксиэтокси)фенил)-1,2,3,4-тетрагидро-1-(2-метилпропил)-N-[4-[(S)-[(1-пропил-1Н-имидазол-5-ил)метил]сульфинил]фенил]-1-бензазоцин-5-карбоксамид. Ценикривирок также имеет регистрационный номер CAS 497223-25-3. В некоторых вариантах осуществления CVC образует аддитивные соли кислоты, такие как соль метансульфоновой кислоты. В одном варианте осуществления настоящие композиции содержат ценикривирока мезилат.
«По существу аналогичны» означает композицию или композицию, которая в большой степени напоминает стандартную композицию или композицию по идентичности и количествам композиции или композиции.
«Примерно» означает наличие значения, которое находится достаточно близко к референс-значению так, чтобы иметь идентичные или по существу идентичные свойства, что и референс-значение. Таким образом, в зависимости от контекста «примерно» может означать, например, ±5%, ±4%, ±3%, ±2%, ±1% или ± менее чем 1%.
Выражение «фармацевтически приемлемый» относится к веществу или способу, которые могут использоваться в медицине или фармации, включая ветеринарию, например, при введении субъекту.
Термины «соль» или «фармацевтически приемлемая соль» включают аддитивные соли кислоты и основания. «Аддитивная соль кислоты» относится к таким солям, которые сохраняют биологическую эффективность или свойства свободных оснований, которые биологически или иначе являются нежелательными, и которые образуются с неорганическими или органическими кислотами. «Аддитивная соль основания» относится к таким солям, которые сохраняют биологическую эффективность или свойства свободных кислот, которые биологически или иначе являются нежелательными, и которые образуются в результате добавления неорганического основания или органического основания к свободной кислоте.
Выражение «фармацевтическая композиция» относится к композиции соединения по изобретению и среды, обычно принятой в данной области, для доставки биологически активного соединения млекопитающим, например, людям. Такая среда включает все фармацевтически приемлемые носители, разбавители или эксципиенты. Фармацевтические композиции, описанные здесь, могут находиться в различных лекарственных формах, таких как лекарственные формы для приема внутрь, твердые лекарственные формы или оба вида лекарственных форм. В некоторых вариантах осуществления фармацевтические композиции по настоящему изобретению находятся в форме лекарственных форм, таких как таблетки или капсулы.
Термин «лечение» включает ослабление, смягчение и снижение случаев заболевания или состояния, или симптомов заболевания или состояния. Поскольку случаи многих заболеваний или состояний можно уменьшить еще до проявления заболевания или состояния, то лечение также включает профилактику.
«Введение» включает любой способ введения, такой как пероральный, подкожный, сублингвальный, трансмукозальный, парентеральный, внутривенный, внутриартериальный, буккальный, сублингвальный, местный, вагинальный, ректальный, внутриглазной, внутриушной, назальный, ингаляционный и трансдермальный. «Введение» также может включать прописывание или заполнение прописывания лекарственной формы, содержащей конкретное соединение. «Введение» также может включать обеспечение указаний для выполнения способа, включающего конкретное соединение или лекарственной формы, содержащей соединение.
Выражение «терапевтически эффективное количество» означает количество активного соединения, которое при введении субъекту для лечения заболевания, расстройства или другого нежелательного патологического состояния, достаточно для того, чтобы обеспечить положительный эффект в отношении заболевания, расстройства или состояния. Терапевтически эффективное количество будет варьировать в зависимости от химической природы и лекарственной формы активного соединения, заболевания или состояния, и его тяжести, и возраста, массы тела и других связанных характеристик пациента, который подвергается лечению. Определить терапевтически эффективное количество конкретного активного соединения может специалист в данной области и, как правило, требуется не более чем обычное экспериментирование.
Как уже указывалось выше, настоящее изобретение относится к композиции, такой как твердая композиция, содержащей ценикривирок или его соль, и фумаровую кислоту. Ценикривирок или его соль могут представлять ценикривирока мезилат. Весовое соотношение ценикривирока или его соли и фумаровой кислоты, в расчете на массу свободного основания ценикривирока, может находиться в пределах примерно от 7:10 до 10:7, например, примерно от 8:10 до примерно 10:8, примерно от 9:10 до примерно 10:9, или примерно от 95:100 до примерно 100:95. Фумаровая кислота находиться в количестве примерно от 15% до примерно 40%, например, примерно от 20% до примерно 30%, или примерно 25% к массе всей композиции. Ценикривирок или его соль могут находиться, в расчете на массу свободного основания ценикривирока, на уровне примерно от 15% до примерно 40%, например, примерно от 20% до примерно 30%, или примерно 25% к массе всей композиции.
Фумаровая кислота в композиции может функционировать в качестве солюбилизатора и придавать композиции полезные свойства. Например, фумаровая кислота может повысить биодоступность композиции по сравнению с композициями, для которых используются другие солюбилизаторы, в частности, лимонная кислота, малеиновая кислота и бисульфат натрия.
В некоторых случаях биодоступность композиций, содержащих ценикривирока мезилат с фумаровой кислотой, может достичь биодоступности, характерной для раствора для перорального введения. На всасывание раствора для перорального введения не оказывает влияние скорость или степень растворения лекарственного препарата. Таким образом, всасывание лекарственного препарата из раствора ограничивается только взаимодействиями между растворенным препаратом, организмом и принятыми веществами, такими как пища, напитки и другие лекарственные препараты. Таким образом, композиции, которые приближаются или равны по биоэквивалентности раствору для перорального введения, могут быть особенно желательными.
Такой результат является удивительным и неожиданным. Как показано в таблице 1, фумаровая кислота имеет существенно более низкое время растворения, чем другие кислоты. Ранее полагалось, что быстро растворяющиеся кислые эксципиенты теоретически обладают более высокой солюбилизирующей способностью так, что эксципиент будет растворяться быстро или быстрее чем активный фармацевтический ингредиент. В нескольких научных журналах обсуждается, что фумаровую кислоту намеренно не используют в лекарственных формах для перорального введения за счет ее низкой растворимости и продолжительного времени растворения. Таким образом, удивительно, что длительное время растворения фумаровой кислоты связано с более высокой биодоступностью ценикривирока.
Результаты, приведенные в таблице 1, были получены при добавлении 200 мг кислоты к 90 мл очищенной воды с использованием камеры для смешения Mettler Toledo при указанной температуре с направленным вверх насосным четырехлопастным колесом при 250 об/мин. Проводили мониторинг за исчезновением частиц при растворении измерением коэффициента отражения сфокусированного луча (FBRM). Данные получали отдельными двумя измерениями, а также измерениями в среднем в течение 10 и 30 сек.
Не желая связываться с теорией, более продолжительное время растворения фумаровой кислоты может быть полезным, поскольку при введении фумаровая кислота не растворяется так быстро, как другие кислые солюбилизаторы. Таким образом, фумаровая кислота может обеспечивать кислую среду вокруг ценикривирока или его соли в течение более длительного периода времени, чем другие более растворимые кислые солюбилизаторы, такие как лимонная кислота.
В дополнении к ценикривироку или его соли композиция может содержать один или более дополнительных ингредиентов, например, один или более наполнителей, один или более разрыхлителей, или один или более смазывающих агентов. Также могут присутствовать другие дополнительные ингредиенты, хотя, очевидно понятно, что особый дополнительный ингредиент не требуется, если не указано иначе.
Один или более наполнителей, когда они используются, могут включать, по меньшей мере, одно из микрокристаллической целлюлозы, двуосновного фосфата кальция, целлюлозы, лактозы, сахарозы, маннита, сорбита, крахмала и карбоната кальция. Например, один или более наполнителей представляет микрокристаллическую целлюлозу. Весовое соотношение одного или более наполнителей, такого как микрокристаллическая целлюлоза, к ценикривироку или его соли составляет примерно от 25:10 до примерно 10:8, например, примерно от 20:10 до примерно 10:10, или примерно 15:10 в расчете на массу свободного основания ценикривирока. Один или более наполнителей, таких как микрокристаллическая целлюлоза, могут находиться в количестве примерно от 25% до примерно 55%, например, от 30% до примерно 50%, или примерно 40% к массе всей композиции.
Один или более разрыхлителей, когда они используются, могут включать, по меньшей мере, одно из поперечно-сшитого поливинилпирролидона, натриевой соли поперечно-сшитой карбоксиметилцеллюлозы и натрия крахмала гликолята. Например, один или более разрыхлителей может представлять натриевую соль поперечно-сшитой карбоксиметилцеллюлозы. Весовое соотношение одного или более разрыхлителей, такого как натриевая соль поперечно-сшитой карбоксиметилцеллюлозы, к ценикривироку или его соли может составлять примерно от 10:100 до примерно 30:100, например, примерно от 25:100, в расчете на массу свободного основания ценикривирока. Один или более разрыхлителей могут находиться в количестве примерно от 2% до примерно 10%, например, от 4% до примерно 8%, или примерно 6% к массе всей композиции.
Один или более смазывающих агентов, когда они используются, могут включать, по меньшей мере, одно из стеарина, стеарата магния и стеариновой кислоты. Например, один или более смазывающих агентов представляет стеарат магния. Один или более смазывающих агентов находятся в количестве примерно от 0,25% до примерно 5%, например, примерно от 0,75% до примерно 3%, или примерно 1,25%, к массе всей композиции.
Другие дополнительные ингредиенты, которые могут использоваться, перечислены в Remington: The Science and Practice of Pharmacy, этот источник в полном объеме включен здесь для сведения для всех целей.
Композиция может находиться в различных формах. Примеры форм, подходящих для фармацевтического применения, приводятся в Remington: The Science and Practice of Pharmacy, этот источник в полном объеме включен здесь для сведения для всех целей. Композиция может представлять, например, гранулят, матрикс, таблетку или часть таблетки, такую как один или более слоев многослойной таблетки. Композиция может представлять порошок, которым можно заполнять капсулу, саше, бутыль, флакон, ампулу и т.д. Композиция может представлять субстрат для одного или более покровных слоев, таких как фармацевтические покровные слои, известные в данной области, которые могут наноситься на композицию. Когда композиция является гранулятом, то средний размер частиц может составлять примерно 75 мкм или более, например, примерно 300 мкм или более.
Композиция может быть получена смешением ценикривирока или его соли, такой как ценикривирока мезилат, с фумаровой кислотой с получением смеси и сухим гранулированием смеси. Примерные способы сухого гранулирования включают роликовое уплотнение, уплотнение прокаткой и окомкование. Размер композиции, полученной сухим гранулированием, может быть уменьшен способами, такими как дробление, если желательно. Однако следует понимать, что не требуется каких-либо конкретных способов гранулирования, для сухого гранулирования или уменьшения размера, если не указано иначе. Одно или более из наполнителей, разрыхлителей, смазывающих агентов и других дополнительных ингредиентов, которые обсуждались выше, также можно смешать в смеси. Соотношение или количества различных компонентов смеси могут быть такими же, как обсуждалось выше в отношении композиции. Смесь, подвергнутая сухому гранулированию, может содержать частицы со средним размером более 75 мкм, например, более 300 мкм.
Сухое гранулирование может дать композицию, которая имеет не только низкий уровень воды, но также не является существенно гигроскопичной, т.е. не адсорбирует значительные количества дополнительной воды из окружающей среды. Например, содержание воды может составлять не более примерно 4 масс.% или не более чем примерно 2 масс.% через 6 недель воздействия в условиях с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагоуловителем.
После сухого гранулирования композицию можно формулировать в одну или более композиций. Например, композиция может быть заполнена в капсулу или саше. В качестве дополнительных примеров смесь, полученную сухим гранулированием, можно формулировать в виде матрикса, таблетки или одного или более слоев однослойной или многослойной таблетки, например, прессованием, или дополнительно формулировать способами, известными в данной области для композиции фармацевтических композиций, такими как описаны в Remington: The Science and Practice of Pharmacy, этот источник в полном объеме включен здесь для сведения для всех целей.
Композиция, например, в форме гранулята может быть смешена с другими гранулятами или порошками, однако, такие внегранулярные вещества, которые не гранулированы с компонентами композиции, не рассматриваются в качестве части композиции, например, при расчете соотношения или относительных количеств различных компонентов. Однако одна или более композиций, содержащих композицию в форме гранулята и дополнительно содержащих внегранулярные вещества, рассматриваются в качестве вариантов осуществления, описанных здесь.
В качестве примера композиция может содержать композицию, описанную здесь, в форме гранулята вместе с одним или более внегранулярными компонентами, такими как один или более дополнительных фармацевтически активных агентов. Один или более дополнительных фармацевтически активных агентов представляет один или более антиретровирусных препаратов, таких как один или более антагонистов CCR5, ингибиторов вхождения вирусов в клетки, нуклеозидных ингибиторов обратной транскриптазы, нуклеотидных ингибиторов обратной транскриптазы, ненуклеозидных ингибиторов обратной транскриптазы, ингибиторов протеазы, ингибиторов интегразы и ингибиторов созревания, например, один или более из маравирока, ламивудина, эфавиренза, ралтегравира, вивекона, бевиримата, альфа-интерферона, зидовудина, абакавира, лопинавира, ритонавира, тенофовира, тенофовира дизопроксила, пролекарств тенофовира, эмтрицитабина, элвитегравира, кобицистата, дарунавира, атазанавира, рилпивирина и долутегравира. В качестве другого примера один или более дополнительных фармацевтически активных агентов может включать один или более иммуносупрессивных агентов, таких как один или более из циклоспорина, такролимуса, преднизолона, гидрокортизона, сиролимуса, эверолимуса, азатиоприна, микофеноловой кислоты, метотрексата, базиликсимаба, даклизумаба, ритуксимаба, антитимоцитного глобулина и антилимфоцитного глобулина, например, такролимус или метотрексат.
Например, композиция, описанная здесь, может быть смешена с одним или более дополнительными фармацевтически активными агентами и необязательно с одним или более эксципиентами, и затем спрессована в монолитную таблетку с фиксированной дозой. В качестве другого примера композиция, описанная здесь, и вторая композиция, содержащая дополнительный фармацевтически активный агент, могут быть формулированы в многослойную таблетку с использованием оборудования для таблетирования, известного в данной области, подходящего для этой цели.
Согласно существующим указаниям по лечению ВИЧ-инфекции предпочтительными является комбинация с фиксированной дозой (FDC) в одной таблетке. Наибольшим преимуществом продуктов FDC является их комплаентность и простота дозирования, что приводит к повышенной комплаентности и улучшенным клиническим результатам. Продукты FDC для лечения ВИЧ-инфекции попадают в три категории: (1) базовые лекарственные составы, в которых 2 агента формулированы совместно в одной таблетке, например, Truvada (эмтрицитабин/тенофовир дизопроксил фумарат) и Epzicom (абакавир/ламивудин); (2) продукты на основе одной таблетки, усиленные двумя ингибиторами протеазы, такие как Kaletra (лопинавир/ратонавир); (3) продукты для схемы одна таблетка один раз в день (STR), содержащие полную схему лечения в одной таблетке для приема один раз в день, такие как Atripla (эфавиренз/эмтрицитабин/тенофовир дизопроксил фумарат), Complera (эмтрицитабин/рилпивирин/тенофовир дизопроксил фумарат) и Stribild (элвитегравир/кобицистат/эмтрицитабин/тенофовир дизопроксил фумарат).
В одном варианте осуществления изобретение относится к композиции, содержащей ценикривирок или его соль и фумаровую кислоту в комбинации с ламивудином (3ТС). В еще одном варианте осуществления изобретение относится к композиции, содержащей ценикривирок или его соль и фумаровую кислоту в комбинации с эфавирензом (EFV). В еще одном варианте осуществления изобретение относится к композиции, содержащей ценикривирок или его соль и фумаровую кислоту в комбинации с 3ТС и EFV. В некоторых вариантах осуществления комбинированные продукты, содержащие ценикривирок, 3ТС и/или EFV, полученные по изобретению, являются эффективными в виде схемы одна таблетка один раз в день для лечения вирусной инфекции, в частности, ВИЧ-инфекции.
В одном варианте осуществления соотношение содержания дозы ценикривирока к 3ТС в комбинированных лекарственных составах равняется примерно от 1:2 до примерно 1:12, например, примерно 1:2; 1:4; 1:10 или 1:12 в расчете на массу свободного основания ценикривирока, включая все диапазоны и субдиапазоны между ними. Например, одна таблетка, содержащая ценикривирок или его соль и 3ТС, может содержать дозу 25 мг свободного основания ценикривирока и 300 мг 3ТС, обеспечивая тем самым соотношение доз, равное 1:12. Альтернативно одна таблетка, содержащая ценикривирок или его соль и 3ТС, может содержать дозу 150 мг свободного основания ценикривирока и 300 мг 3ТС, обеспечивая тем самым соотношение доз, равное 1:2.
В одном варианте осуществления соотношение содержания дозы ценикривирока к EFV в комбинированных лекарственных составах равняется примерно от 1:2 до примерно 1:12, например, примерно 1:2; 1:3; 1:4; 1:10 или 1:12 в расчете на массу свободного основания ценикривирока, включая все диапазоны и субдиапазоны между ними. Например, одна таблетка, содержащая ценикривирок или его соль и EFV, может содержать дозу 150 мг свободного основания ценикривирока и 600 мг EFV, обеспечивая тем самым соотношение дозировок, равное 1:4. Альтернативно одна таблетка, содержащая ценикривирок или его соль и EFV, может содержать дозу 120 мг свободного основания ценикривирока и 600 мг EFV, обеспечивая тем самым соотношение дозировок, равное 1:2.
Изобретение также относится к способам получения комбинированных композиций, содержащих ценикривирок, 3ТС и/или EFV. В одном варианте осуществления способ получения комбинированных композиций включает смешение ценикривирока или его соли, фумаровой кислоты и других фармацевтических эксципиентов с получением смеси, сухое гранулирование смеси с получением гранул ценикривирока, смешение гранул ценикривирока с 3ТС и/или EFV, и подходящими эксципиентами и прессование полученной смеси в таблетки с получением комбинированного продукта. То есть, в данном варианте осуществления дополнительные активные агенты находятся внегранулярно. В альтернативных вариантах осуществления часть или все количество дополнительных активных агентов может находиться внутригранулярно. В еще одном варианте осуществления комбинированные продукты, содержащие ценикривирок, 3ТС и EFV, могут быть получены в виде двухслойной таблетки, где один слой содержит ценикривирок и 3ТС, и другой слой содержит EFV. В одном варианте осуществления бислойных таблеток ценикривирок находится внутригранулярно, и 3ТС находится внегранулярно.
ПРИМЕРЫ
Пример 1
Серии композиций с ценикривироком мезилатом, которые были идентичны, за исключением природы кислого солюбилизатора, готовили влажным гранулированием в чашевом окомкователе Key емкостью 1 л с последующим высушиванием в лотковой сушилке, просеиванием, смешиванием и прессованием в таблетки на прессе Carver. Состав композиций приведен в таблице 2.
Таблетки вводили собакам бигль. Также вводили раствор для перорального введения в качестве контроля. Определяли абсолютную биодоступность композиций и раствора для перорального введения, и результаты приведены на фигуре 2. Результаты показывают, что ценикривирока мезилат с фумаровой кислотой обладает более высокой биодоступностью по сравнению с композициями, содержащими другие тестированные солюбилизаторы.
Примеры 2а-2е
Смешивали ценикривирока мезилат, фумаровую кислоту, микрокристаллическую целлюлозу, поперечно-сшитый поливинилпирролидон (когда он использовался) и стеарат магния, смесь подвергали сухому гранулированию, измельчали, смешивали с внегранулярными микрокристаллической целлюлозой, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы и стеаратом магния, и прессовали в таблетки. В примере 2с фумаровую кислоту не гранулировали с ценикривироком мезилатом и другими эксципиентами; вместо этого ее смешивали с внегранулярной микрокристаллической целлюлозой и данную смесь смешивали с сухим гранулятом перед прессованием в таблетки. В примере 2а 39,00 мг натриевой соли поперечно-сшитой карбоксиметилцеллюлозы составляло часть сухого гранулята; остальную часть смешивали с внегранулярной микрокристаллической целлюлозой, и эту смесь смешивали с сухим гранулятом до прессования в таблетки. Все таблетки имели твердость выше 10 кПа и истираемость ниже, чем 0,8% масс./масс. Таблетки имели состав, показанный в таблице 3а.
bдобавлено во внегранулярную часть порошковой смеси.
Концентрация в процентах (масс./масс.) и масса на таблетку компонентов из примера 2b показаны в таблице 3b.
(% масс./масс.)
Пример 3
Смешивали ценикривирока мезилат, микрокристалическую целлюлозу, натриевую соль поперечно-сшитой карбоксиметилцеллюлозы и стеарат магния, подвергали сухому гранулированию, измельчали, смешивали с внегранулярными микрокристаллической целлюлозой, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы, фумаровой кислотой, коллоидным диоксидом кремния и стеаратом магния, и прессовали в таблетки с твердостью более чем 10 кПа и истираемостью ниже, чем 0,8% масс./масс. Полученные таблетки имели состав, показанный в таблице 4.
(% масс./масс.)
Примечательно, что композиция в таблице 4 имела такое же соотношение компонентов, что и в таблице 3b, и отличался только по общему количеству компонентов, которые использовались для каждой таблетки. Таким образом, в таблице 3b показаны таблетки с 150 мг ценикривирока (в расчете на свободное основание), в то время как в таблице 4 показаны таблетки с 25 мг ценикривирока (в расчете на свободное основание) с одинаковым соотношением компонентов, что и таблетки с 150 мг ценикривирока из примера 2b, показанные в таблице 3b.
Пример 4 - ссылочный
Композицию на основе лимонной кислоты, показанную в таблице 5, готовили следующим образом.
Смешивали ценикривирок, гидроксипропилцеллюлозу, маннит и натриевую соль поперечно-сшитой карбоксиметилцеллюлозы, подвергали влажному гранулированию, измельчали и смешивали с внегранулярными микрокристаллической целлюлозой, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы, лимонной кислотой, коллоидным диоксидом кремния, тальком и стеаратом магния. Полученную смесь прессовали в таблетки, имеющие твердость выше 10 кПа и истираемость ниже, чем 0,8% масс./масс. Таблетки покрывали гидроксипропилметилцеллюлозой, полиэтиленгликолем 8000, диоксидом титана и желтым оксидом железа. Покрытые таблетки, полученные таким образом, были по существу идентичны таблеткам, раскрытым в публикации заявки на патент США № 2008/031942 (см., например, таблицу 3).
Пример 5 - ссылочный
Пример 5а:
Ценикривирок и гидроксипропилметилцеллюлозы ацетат сукцинат растворяли в метаноле и высушивали распылением в мелкий порошок, содержащий 25 масс.% ценикривирока (в расчете на массу свободного основания ценикривирока). Порошок смешивали с коллоидным диоксидом кремния, микрокристаллической целлюлозой, маннитом, лаурилсульфатом натрия, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы и стеаратом магния. Смесь прессовали в таблетки, имеющие твердость выше 10 кПа и истираемость ниже, чем 0,8% масс./масс. Конечный состав таблеток показан в таблице 6а.
(в виде мезилатной соли)
Пример 5b: покрытая пленочной оболочкой композиция из примера 5а
Ценикривирок и гипромеллозы ацетат сукцинат растворяли в метаноле и высушивали распылением в мелкий порошок, содержащий 25 масс.% исходного CVC. Порошок смешивали с коллоидным диоксидом кремния, микрокристаллической целлюлозой, маннитом, лаурилсульфатом натрия, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы и стеаратом магния. Смесь прессовали в таблетки, имеющие твердость выше 10 кПа и истираемость ниже, чем 0,8% масс./масс. Таблетки покрывали пленочной оболочкой из опадрая желтого 21K120001 (Colorcon) до теоретического прибавления массы на 3,5%. Конечный состав таблеток показан в таблице 6b.
(% масс./масс.)
(в виде мезилатной соли)
bопадрай II желтый 21K12001 (Colorcon) содержит этилцеллюлозу; гипромеллозу, Фармакопея США; триацетин; диоксид титана, Фармакопея США; желтый оксид железа
смасса пленочной оболочки представляет теоретическую прибавку массы на 3,5% масс./масс. к массе ядра таблетки.
Пример 6
Абсолютную биодоступность таблеток из примера 3 на собаках бигль сравнивали с биодоступностью таблеток из примеров 4 и 5, а также с раствором ценикривирока мезилата для перорального введения и желатиновой капсулой, содержащей порошок ценикривирока мезилата. Результаты представлены в таблице 7.
В данном примере было показано, что биодоступность ценикривирока в таблетках, полученных сухим гранулированием, с фумаровой кислотой (пример 3) была по существу аналогична раствору для перорального введения, и достоверно выше, чем биодоступность ценикривирока в таблетках, полученных влажным гранулированием, с лимонной кислотой (пример 4), и в два раза превосходила биодоступность ценикривирока в таблетках с аморфным ценикривироком в дисперсии, высушенной распылением, с HPMC-AS (пример 5). Данные результаты являются удивительными, поскольку не было причины предполагать, что сухое гранулирование кристаллического API обеспечивает повышение биодоступности по сравнению с влажным гранулированием и аморфными дисперсиями, полученными сушкой распылением. Это особенно так, поскольку аморфные дисперсии, полученные сушкой распылением, часто используются для повышения биодоступности слаборастворимых в воде лекарственных препаратов. Такие результаты также являются удивительными, поскольку фумаровая кислота имеет более длительное время растворения, чем лимонная кислота, и она использовалась при более низком весовом соотношении с ценикривироком API (3:1 для лимонной кислоты:API против 1,06:1 для фумаровой кислоты:API). Таким образом, установленный факт, что фумаровая кислота является более эффективным солюбилизатором для ценикривирока, чем лимонная кислота, является удивительным и неожиданным.
Пример 7
В тесте «ускоренного старения» оценивали стабильность таблеток из примера 2b в сравнении со стабильностью таблеток из примеров 1b, 4 и 5 при воздействии на таблетки из этих примеров условий с 75% относительной влажностью и температурой 40°С. Все таблетки упаковывали с влагопоглотителем в индукционно запаянном флаконе во время испытания. Как показано на фигуре 3, таблетки из примера 2b были удивительно гораздо более стабильными, чем таблетки, полученные влажным гранулированием, и обладали стабильностью, сходной с таковой для таблеток с дисперсиями, полученными сушкой распылением. Такая разница в стабильности между таблетками из примера 2b и примера 4 была особенно удивительной, поскольку единственным различием между двумя видами таблеток был способ получения композиций (сухое гранулирование против влажного гранулирования). Такие результаты также являются удивительными, поскольку ранее было неизвестно, что способ гранулирования может оказывать влияние на биодоступность ценикривирока и стабильность таблеток.
Пример 8
В тесте «ускоренного старения» анализировали стабильность таблеток из примера 2b, подвергнув таблетки воздействию условий с 75% относительной влажностью и температурой 40°С в течение 6 недель. Все таблетки упаковывали с влагопоглотителем в индукционно запаянных флаконах во время испытания. Таблетки анализировали в отношении содержания воды, содержания активного вещества и общего содержания примесей. Результаты представлены в таблице 8, которые показывают, что таблетки были очень стабильными в этих условиях.
Также тестировали профиль растворения ценикривирока из таблеток примеров 3, 4 и 5 после хранения в условиях, описанных выше. Результаты представлены на фигуре 4, которые показывают, что таблетка, содержащая лимонную кислоту, полученная влажным гранулированием, из примера 4, была существенно менее стабильной, чем таблетка, содержащая фумаровую кислоту, полученная сухим гранулированием, из примера 3 и таблетка с дисперсией, полученной сушкой распылением, из примера 5.
Пример 9
Изотермы динамической сорбции пара при 25°С коррелируют со стабильностью таблеток из примеров 2b и 4 с таковой для ценикривирока мезилата. Сорбцию проводили от 0% относительной влажности до 90% относительной влажности с 5% интервалами. В каждом интервале каждый образец уравновешивали не менее чем в течение 10 мин и не более чем в течение 30 мин. Уравновешивание останавливали, когда скорость прироста массы составляла не более чем 0,03% масс./масс. в минуту или через 30 мин, когда был короче. Результаты, представленные на фигуре 5, показывают, что таблетки из примера 2b достоверно более стабильны, чем таблетки из примера 4. Данный результат согласуется с тем, что пример 2b является менее гигроскопичным, чем пример 4. Повышенная гигроскопичность примера 4 по сравнению с примером 2b может быть связана с более высоким содержанием подвижной воды, что в свою очередь, может вызвать частичное превращение в гель и последующее снижение стабильности примера 4.
Пример 10
Биодоступность таблеток из примера 3 сравнивали с биодоступностью таблеток из примера 5 и порошком ценикривирока мезилата, находящегося в желатиновой капсуле, при различных состояниях желудка у собак бигль (n=5). Биодоступность тестировали в различных состояниях желудка после предварительной обработки, каждая из которых изменяет рН желудка. В частности, предварительная обработка пентагастрином обеспечивает самое низкое значение рН, отсутствие обработки обеспечивает промежуточное значение рН, и обработка фамотидином обеспечивает наиболее высокое значение рН. Пентагастрин представляет синтетический полипептид, который стимулирует продукцию кислоты в желудке, тем самым снижая рН желудка.
Результаты, представленные на фигуре 6, показывают, что таблетки из примера 3 имеют наиболее высокую биодоступность при всех тестированных условиях. Биодоступность примера 3 варьировала в меньшей степени у собак, обработанных пентагастрином, и собак без предварительной обработки, в то время как пример 5 показывал достоверное снижение биодоступности у необработанных собак натощак (промежуточное значение рН) по сравнению с собаками, обработанными пентагастрином (самое низкое значение рН). Предварительная обработка фамотидином, агонистом Н2-рецептора, который снижает кислотность желудка и поднимает значение рН, приводила к снижению биодоступности для всех образцов, однако, снижение для примера 3 было менее выраженным, чем для примера 5.
Данные результаты демонстрируют дополнительное непредполагаемое преимущество композиций ценикривирока, полученных сухим гранулированием, с фумаровой кислотой. В частности, фармакокинетика таких композиций не варьировала в таких широких пределах, как композиция с дисперсией, высушенной распылением, из примера 5 при введении в полном диапазоне потенциальных значений рН желудка человека. Данные результаты являются неожиданными и удивительными, поскольку на биодоступность других слабощелочных антиретровирусных препаратов, таких как атазанавир, сильное влияние оказывает рН желудка. Для таких лекарственных препаратов изменения рН желудка, которые могут быть вызваны заболеванием или патологическим состоянием, например, у пациентов с отсутствием соляной кислоты, или введением лекарственных препаратов, таких как антациды, ингибиторы протонного насоса или агонисты Н2-рецептора, могут снижать биодоступность до субтерапевтического уровня. Данные результаты показывают, что полученная сухим гранулированием композиция ценикривирока мезилата на основе фумаровой кислоты из примера 3 в меньшей степени подвержена изменениям биодоступности за счет изменений рН желудка, и пример 3 является более устойчивой композицией, которая может использоваться у пациентов, которые имеют или имеют вероятность изменения значений рН желудка.
Пример 11
Исследовали профиль растворения композиций из примеров 2а-2е с использованием аппарата USP Type 2 со скоростью вращения лопасти 50 об/мин в 0,1 Н HCl с 0,1% (масс./масс.) СТАВ. Результаты представлены на фигуре 7. Профили разрыхления композиций из примеров 2а-2е определяли с использованием FBRM. Данные результаты представлены на фигуре 8. В совокупности фигуры 7 и 8 показывают, что могут быть получены композиции и композиции, содержащие ценикривирока мезилат и фумаровую кислоту, имеющие различные профили растворения.
Также определяли абсолютную биодоступность на собаках бигль (n=5) образцов 2а-2е, и результаты представлены на фигуре 9. Результаты показывают, что, несмотря на то, что абсолютная биодоступность может варьировать в зависимости от композиции, высокая биодоступность была получена для всех образцов.
Пример 12
В данном опыте таблетки из примера 2 покрывали промышленно доступными композициями для покрытия пленочной оболочкой и оценивали стабильность таблеток, покрытых пленочной оболочкой, в условиях «ускоренного старения» (40°С/75% относительная влажность).
Стадия покрытия пленочной оболочкой обычно используется для маскировки неприятного вкуса или получения уникального торгового внешнего вида для предназначенной промышленно доступной композиции. Таблетки из примера 2 покрывали тремя композициями пленочной оболочки, каждая содержащая различные базовые полимерные системы. В частности, опадрай II белый 57U18539, содержащий гидроксипропилметилцеллюлозу (HPMC или гипромеллозу), опадрай II белый 85F18422 (Colorcon), содержащий полиэтиленгликоль (ПЭГ) и частично гидролизованный поливиниловый спирт (PVA), и опадрай II белый 200F280000, содержащий сополимер метакриловой кислоты использовали для покрытия таблеток.
Таблетки покрывали распылением водной суспензии композиции для покрытия на поверхность таблетки в перфорированном испарителе для покрытия. В испарителе постоянно циркулировал теплый производственный воздух, который обеспечивал конвективный теплообмен для испарения воды с поверхности таблетки, оставляя композицию для покрытия в виде пленочного слоя на поверхности таблетки. Таблетки, покрытые вышеуказанными полимерами, показаны в таблицах 9-11 ниже. Результаты анализа поверхности покрытых пленочной оболочкой таблеток приведены в таблице 12.
Пример 12а
Покрытый HPMC один агент CVC
(% масс./масс.)
bопадрай II белый 57U18539 содержит гипромеллозу, Фармакопея США; мальтодекстрин, NF; среднецепочечные триглицериды, NF; полидекстроза, NF; тальк, Фармакопея США; диоксид титана, Фармакопея США.
смасса пленочной оболочки представляет теоретическую прибавку массы на 4,0% масс./масс. к массе ядра таблетки.
Пример 12b
Покрытый ПЭГ/ПВП один агент CVC
(% масс./масс.)
bопадрай II белый 85F18422 (Colorcon) содержит полиэтиленгликоль 3350, NF; поливиниловый спирт, частично гидролизованный, Фармакопея США; тальк, Фармакопея США; диоксид титана, Фармакопея США.
смасса пленочной оболочки представляет теоретическую прибавку массы на 4,0% масс./масс. к массе ядра таблетки.
Пример 12с
Покрытый метикрилатом один агент CVC
(% масс./масс.)
bопадрай II белый 200F280000 (Colorcon) содержит сополимер метакриловой кислоты типа С, Фармакопея США; полиэтиленгликоль 3350, NF; поливиниловый спирт, частично гидролизованный, Фармакопея США; бикарбонат натрия, Фармакопея США; тальк, Фармакопея США; диоксид титана, Фармакопея США.
смасса пленочной оболочки представляет теоретическую прибавку массы на 4,0% масс./масс. к массе ядра таблетки.
Результаты анализа поверхности покрытых пленочной оболочкой таблетки приведены в таблице 12 ниже. Поскольку покрытие опадраем II белым 200F28000 (таблетки из примера 12с, таблица 11) не показывали однородного покрытия, то таблетки из примера 12с не тестировали на их стабильность. Оболочки примеров 12с и 12b показывали приемлемое покрытие и хорошую адгезию с поверхностью таблетки.
Анализ поверхности пленочных оболочек
Сравнивали стабильность покрытых пленочной оболочкой таблеток из примеров 12а и 12b с таблетками без покрытия из примера 2 после воздействия условий с 75% относительной влажностью и температурой 40°С. Все таблетки упаковывали с влагоуловителем в индукционно запаянные флаконы во время испытания. Результаты по испытанию стабильности приведены в таблице 13.
(без покрытия) общее количество примесей CVC (%)
(с покрытием) общее количество примесей CVC (%)
(с покрытием) общее количество примесей CVC (%)
Как показано в таблице 13, таблетки из примеров 12а и 12b показывали приемлемый профиль стабильности, аналогичный таблеткам без покрытия из примера 2 без существенного образования примесей или продуктов разложения. Эти результаты являются обещающими, поскольку в предыдущих опытах было показано, что процессинг таблеток с ценикривироком в присутствии водной среды оказывал отрицательное действие на химическую и физическую стабильность таблеток.
Пример 13
В данном исследовании определяли фармакокинетические профили (ФК) композиций из примера 2b (показан в таблице 3b), примера 3 (показан в таблице 4) и примера 5b (показан в таблице 6b) в клинических испытаниях у людей. Композицию из примера 5b использовали в качестве стандартной композиции.
Фазу 2b клинического испытания базового исследования («исследование 202») проводили с использованием композиции из примера 5b для установления ФК профиля для рекомендованной дозы ценикривирока 200 мг, принятой во время завтрака. В исследовании 202 пациентам вводили дозу 200 мг композиции из примера 5b один в сутки в течение 10 последовательных суток. Поскольку композиция из примера 5b представляет таблетку массой 50 мг, пациентам требовалось принять 4 таблетки каждый раз для получения дозы, равной 200 мг.
В исследовании 110 оценивали многодозовую схему для композиции из примера 2b. В данном исследовании пациентам вводили дозу 150 мг композиции из примера 2b во время завтрака один раз в сутки в течение 10 последовательных суток. Каждый раз пациенты принимали одну таблетку композиции из примера 2b, содержащую дозу 150 мг.
В исследовании 111 оценивали ФК профиль схемы из одной дозы 200 мг, введенной на пустой желудок непосредственно перед сном или ночью. Дозу 200 мг вводили при приеме одной таблетки из примера 2b (доза 150 мг) и двух таблеток из примера 3 (доза 25 мг/таблетку). Введение трех таблеток для обеспечения дозы 200 мг основывалось только на доступности таблеток из примеров 2b и 3, а не за счет каких-либо ограничений в получении таблетки 200 мг ценикривирока по изобретению.
ФК профили, полученные в вышеуказанных испытаниях, в обобщенной форме представлены в таблице 14 ниже.
Вышеприведенные данные показывают, что значения AUC, полученные в исследовании 110, в котором вводили композицию по изобретению, были в 1,6 раза выше, чем значения AUC, полученные в исследовании 202, в котором вводили референс-композицию. Таким образом, в стационарном состоянии (характеризуется многодозовой экспозицией в течение 10 суток) введение 150 мг ценикривирока в виде композиций по изобретению во время завтрака приводило к более высокой биодоступности ценикривирока по сравнению с введением 200 мг ценикривирока в виде референс-композиции также во время завтрака. Эти данные показывают, что композиции CVC по изобретению, в которых микросреда содержит кислоту и за счет этого доводится значение рН, обладают более высокой биодоступностью, чем композиция на основе высушенной распылением дисперсии. Таким образом, композиции по изобретению делают возможным использовать более низкие количества CVC для пациента в сутки, тем самым снижая стоимость лечения. Применение более низких количеств CVC снижает размер таблеток и упрощает их заглатывание. Необходимость в более низких количествах CVC также делает возможным комбинировать CVC с другими антиретровирусными агентами в одной таблетке.
Исследование 111 проводили для определения ФК параметров при введении композиций по изобретению в ночное время или непосредственно перед сном. Для лечения ВИЧ-инфекции предпочтительной является комбинация двух или более активных веществ в одном активном агенте. Например, эфавиренз (EFV) и ламивудин (3ТС) используются в комбинации друг с другом или другими активными агентами для лечения ВИЧ-инфекции. Рекомендуется, чтобы EFV-содержащие композиции принимались на пустой желудок предпочтительно в ночное время или непосредственно перед сном. Причиной таких рекомендаций является то, что на ФК профиль оказывает влияние содержимое пищи в желудке, и введение EFV связано с побочными эффектами, такими как токсическое влияние на ЦНС (например, головокружение), которые в основном проявляются во время достижения наиболее высокой концентрации в плазме крови (Tmax). Прием в ночное время является предпочтительным для контроля этих аспектов введения EFV. Если ценикривирок вводится вместе или формулируется вместе с EFV, то важно, чтобы при введении ценикривирока достигался желаемый уровень экспозиции при приеме на пустой желудок в ночное время. Кроме того, EFV является метаболическим индуктором Р450 (в частности фермента CYP3A4). Более высокая активность CYP3A4 приводит к более быстрому метаболизму CVC и, следовательно, к более низкому всасыванию CVC. Следовательно, если ценикривирок предназначен для введения в комбинации с EFV на пустой желудок перед сном, то было установлено, что потребуются более высокие количества CVC для обеспечения более высокого уровня экспозиции для того, чтобы компенсировать последствия метаболических эффектов EFV на CVC.
В исследовании 202 был установлен рекомендуемый уровень экспозиции ценикривирока для лечения ВИЧ-инфекции (см. таблицу 14) с использованием референс-композиции, содержащей 200 мг ценикривирока в виде дисперсии, высушенной распылением, при введении во время завтрака. В различных других клинических испытаниях с другими композициями ценикривирока было установлено, что уровень экспозиции в стационарном состоянии (AUC) ценикривирока (характеризуется экспозицией в течение 10 суток) примерно в 1,5 раза выше, чем уровни экспозиции, полученные после введения одной дозы, за счет большого периода полураспада CVC, для которого требуется более чем одно введение для накопления до стационарного уровня. Вероятность того, что потребуются более высокие количества CVC для его комбинации с EFV, согласуется с вышеприведенными данными по уровням экспозиции в стационарном состоянии и воздействия одной дозы.
Неожиданно результаты исследования 111 показали, что при введении 200 мг ценикривирока в виде композиций по изобретению в ночное время на пустой желудок достигались уровни экспозиции одной дозы, которые были в 2,6 раза выше, чем референс-уровни в стационарном состоянии (таблица 14). То есть, однократная доза 200 мг композиции по изобретению, принятая в ночное время, имела более высокую биодоступность, чем многократные дозы 200 мг референс-композиции, введенные во время завтрака. Уровни экспозиции CVC, которые удалось достичь в исследовании 111 с использованием дозы 200 мг композиций по изобретению, были более чем достаточными для противодействия метаболическим эффектам EFV или влиянию пищи. Следовательно, на основе результатов исследования 111 было сделано заключение, что доза CVC ниже, чем 200 мг будет оптимальной для его совместной композиции с EFV в продуктах для схемы одна таблетка один раз сутки (STR), таких как CVC/EFV/3ТС. Следовательно, в других исследованиях по прототипам комбинированного продукта использовали 150 мг CVC для продуктов STR, содержащих CVC/EFV/3ТС.
Пример 14
Готовили композицию CVC, полученную сухим гранулированием, с использованием изготовленного на заказ лабораторного роликового уплотнителя с гладкими вращающимися в противоположные стороны роликами из нержавеющей стали (диаметр 25 мм, ширина 125 мм и ширина зазора от 0,5 до 3 мм). Использовали рукава из олефинового спанбонда (Tyvek®) для вмещения порошков до и после роликового уплотнения, обеспечивая адекватную подачу небольших количеств порошка в зону уплотнения.
Смешивали ценикривирока мезилат, фумаровую кислоту, микрокристаллическую целлюлозу и натриевую соль поперечно-сшитой карбоксиметилцеллюлозы в контейнере подходящего размера и смешивали кантованием в течение в целом 40 оборотов в 2 мин. Добавляли стеарат магния и смесь вновь перемешивали в течение 40 оборотов в течение 2 мин. Для рукава Tyvek размером 100 мм × 480 мм, делали складку с образованием рукава шириной 50 мм для ограниченной зоны уплотнения, которая будет содержать смешанный порошок по мере его прохождения через лабораторный роликовый аппарат для уплотнения. Примерно 10-15 г порошка добавляли в рукав и равномерно распределяли. Содержащий порошок рукав подавали на роликовый уплотнитель с шириной зазора примерно 2 мм и со скоростью 45 об/мин (линейная скорость=0,06 м/сек). Полученные ленты сжимали до толщины примерно от 1,0 до 1,5 мм, что измеряли с использованием цифрового штангенциркуля. Данный способ повторяли с другими порциями, пока вся партия полностью не проходила через роликовый уплотнитель. Затем полученные сжатые ленты измельчали с получением гранул с использованием мельницы с вращающимся ситом 20 меш из нержавеющей стали диаметром 6 дюймов. Гранулы имели состав, показанный в таблице 15.
(% масс./масс.)
Гранулы, полученные как описано выше, затем смешивали с микрокристаллической целлюлозой, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы и стеаратом магния с получением композиции в виде таблетки с одним агентом CVC, имеющей состав, приведенный в таблице 16. Содержание активного вещества в таблетке с одним агентом можно легко изменять простым доведением соответствующим образом общей массы таблетки. Например, можно получить таблетку с общей массой 325 мг просто с использованием половинных количеств компонентов и с содержанием активного вещества 75 мг CVC в виде свободного основания (линейное масштабирование с использованием обычной смеси), одновременно сохраняя такое же соотношение компонентов, как показано в таблице 16.
(% масс./масс.)
Пример 15
Таблеточную композицию с одним агентом CVC, содержащую более низкие количества эксципиентов и имеющую за счет этого более низкую таблеточную массу, готовили с использованием способа, описанного в примере 14. Таблетки имели состав, приведенный в таблице 17. Данная композиция содержит более высокую концентрацию ценикривирока в целях возможности комбинирования с другими антиретровирусными агентами и избежания получения чрезмерно большого общего размера таблетки комбинированного продукта.
Пример 16
Сжимаемость измельченных гранул, полученных на лабораторном роликовом уплотнителе в примерах 14 и 15, определяли с использованием стандартного теста оценки сжимаемости, и результаты приведены на фигуре 10. В частности, профили сжимаемости таблеточных смесей получали с использованием устройства для уплотнения с измерительным оборудованием (Texture Analyzer) c 1/4'' инструментом В с плоской поверхностью. Прессовки массой 100 мг в трех повторностях прессовали при четырех силах в пределах от 100 кг до 700 кг. Извлеченные прессовки сразу же взвешивали на четырехместных весах и определяли толщину прессовок с помощью точных штангенциркулей. Прессовки тестировали с использованием метода диаметрального сжатия для индукции разрушения при растяжении. Прочность при растяжении (TS) прессовок определяли по следующему уравнению:
TS=2⋅F/(π⋅D⋅T),
где F представляет силу, необходимую для получения разрушения при растяжении прессовки, D представляет диаметр прессовки, и Т представляет толщину прессовки. Твердую фракцию (SF) прессовки рассчитывали, используя следующее уравнение:
SF=m/(V⋅ρabsolute)=m/[(π⋅(D/2)2⋅T)⋅ρabsolute,
где m представляет массу прессовки, V представляет объем таблетки, и ρabsolute представляет абсолютную плотность таблеточной смеси, измеренную гелиевым пикнометром.
Сжимаемость размельченных гранул, полученных на лабораторном роликовом уплотнителе в примерах 14 и 15, сравнивали со сжимаемостью гранул, полученных на производственном оборудовании, доступном от промышленных поставщиков. Результаты приведены на фигуре 11. Было установлено, что сжимаемость гранул из примера 14 сравнима со сжимаемостью гранул, полученных с использованием Vector-Freund TF-220 при давлении роликов 500 фунтов/дюйм2 (пример 16а) и Gerteis Minipactor при давлении роликов 4 кН/см (пример 16b). Данные результаты показывают применимость лабораторного роликового уплотнителя в получении давления уплотнения, которое сравнимо с промышленным оборудованием.
Пример 17
Часть гранул из примера 14 (ценикривирока мезилат, фумаровая кислота, микрокристаллическая целлюлоза, натриевая соль поперечно-сшитой карбоксиметилцеллюлозы и стеарат магния) смешивали с внегранулярными ламивудином (3ТС), микрокристаллической целлюлозой, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы и стеаратом магния и прессовали в таблетки, имеющие твердость более 6 кПа и истираемость ниже 0,8% масс./масс. Полученная порошковая смесь и таблетки имели состав, показанный в таблице 18.
(25/300 CVC/3TC)
(% масс./масс.)
Пример 18
Часть гранул из примера 14 (ценикривирока мезилат, фумаровая кислота, микрокристаллическая целлюлоза, натриевая соль поперечно-сшитой карбоксиметилцеллюлозы и стеарат магния) смешивали с внегранулярными ламивудином, микрокристаллической целлюлозой, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы и стеаратом магния и прессовали в таблетки. Полученная порошковая смесь и таблетки имели состав, показанный в таблице 19.
(75/300 CVC/3TC)
(% масс./масс.)
Пример 19
Часть гранул из примера 14 (ценикривирока мезилат, фумаровая кислота, микрокристаллическая целлюлоза, натриевая соль поперечно-сшитой карбоксиметилцеллюлозы и стеарат магния) смешивали с внегранулярными ламивудином (3ТС), микрокристаллической целлюлозой, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы и стеаратом магния и прессовали в таблетки, имеющие твердость более 10 кПа и истираемость ниже 0,8% масс./масс. Полученные таблетки имели состав, показанный в таблице 20.
(150/300 CVC/3TC)
(% масс./масс.)
Пример 20
Часть гранул из примера 15 (ценикривирока мезилат, фумаровая кислота, микрокристаллическая целлюлоза, натриевая соль поперечно-сшитой карбоксиметилцеллюлозы и стеарат магния) смешивали с внегранулярными ламивудином, микрокристаллической целлюлозой, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы и стеаратом магния и прессовали в таблетки, имеющие твердость более 10 кПа и истираемость ниже 0,8% масс./масс. Полученные таблетки имели состав, показанный в таблице 21.
(150/300 CVC концентрированная композиция/3TC)
(% масс./масс.)
Пример 21: Композиция, содержащая внутригранулярный (IG) ценикривирок и половину IG/половину внегранулярного (EG) ламивудина
В данном примере готовили гранулы, как описано в примере 14, за исключением того, что гранулы также содержали половину требуемого количества ламивудина. Гранулы смешивали с оставшейся частью ламивудина, микрокристаллической целлюлозой, натриевой соли поперечно-сшитой карбоксиметилцеллюлозы и стеаратом магния, и порошковую смесь прессовали в таблетки. То есть, половина ламивудина находилась во внутригранулярной части и остальная половина ламивудина находилась во внегранулярной части. Полученная порошковая смесь и таблетки имели состав, показанный в таблице 22.
(% масс./масс.)
Пример 22
В данном примере готовили гранулы, как описано в примере 14, за исключением того, что гранулы содержали все количество ламивудина. То есть, ламивудин находился только в IG части. Гранулы смешивали с микрокристаллической целлюлозой, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы и стеаратом магния, и прессовали в таблетки. Полученная порошковая смесь и таблетки имели состав, показанный в таблице 23.
(% масс./масс.)
Пример 23
Часть гранул из примера 14 (ценикривирока мезилат, фумаровая кислота, микрокристаллическая целлюлоза, натриевая соль поперечно-сшитой карбоксиметилцеллюлозы и стеарат магния) смешивали с внегранулярными микрокристаллической целлюлозой, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы и стеаратом магния с получением порошковой смеси, содержащей гранулы ценикривирока. Ламивудин смешивали по отдельности с микрокристаллической целлюлозой, натриевой солью поперечно-сшитой карбоксиметилцеллюлозы и стеаратом магния с получением порошковой смеси, содержащей ламивудин. Готовили бислойную таблетку с использованием порошковой смеси, содержащей гранулы ценикривирока, и порошковой смеси, содержащей ламивудин. Полученная бислойная таблетка имела состав, представленный в таблице 24.
(% масс./масс.)
Пример 24
Оценивали абсолютную биодоступность таблеток из примеров 18-23 (содержащих комбинацию ценикривирока и 3ТС) и из примера 14 (содержащих ценикривирок в виде одного активного агента) на необработанных собаках бигль натощак. Все таблетки уменьшали для введения постоянной дозы ценикривирока 25 мг с соответствующим пропорциональным снижением содержания ламивудина до 100 мг для примера 18 или 50 мг для примеров 19-23. Данные по абсолютной биодоступности приведены в таблице 25. Биодоступность таблеток из примера 14 (ценикривирок в виде одного агента) и примеров 19-20 (комбинация ценикривирока и 3ТС) также определяли после предварительной обработки пентагастрином, который индуцирует наиболее низкое значение рН, близкое к рН желудка человека.
Данные по абсолютной биодоступности показывают, что экспзиция CVC, полученная с использованием комбинированных композиций из примеров 19 и 21, была сравнима с биодоступностью композиции с одним агентом CVC из примера 14. Результаты определения биодоступности для примера 19 с и без предварительной обработки пентагастрином показывали, что уровень экспозиции CVC был сравним независимо от условий в отношении рН желудка. Гораздо важнее, что данные также показывали, что кислый компонент микросреды композиции CVC сохранялся в композиции данного комбинированного продукта. Данные для примера 21 (1/2 IF 1/2 EG 3TC) показывают, что даже когда половинное количество 3TC, который является слабощелочным соединением, находилось в прямом контакте с гранулами CVC/фумаровая кислота (IG), то полученная экспозиция CVC и 3TC была сравнима с таковой для примера 19, где 3TC полностью находился внегранулярно (EG), что обеспечивало меньший контакт с CVC/фумаровой кислотой. Эти данные указывают, что 3TC, который очень хорошо растворим в воде, растворялся быстрее, чем фумаровая кислота, которая используется в изобретении в качестве солюбилизатора для медленного растворения CVC, тем самым элиминируя возможность того, что слабощелочной 3TC нейтрализует фумаровую кислоту. Также данные подтверждают, что отличительный признак кислой среды по изобретению, основанный на замедлении растворения эксципиента фумаровой кислоты, обеспечивает желаемые характеристики высвобождения in vivo, несмотря на присутствие 3TC, слабощелочного лекарственного препарата. Пример 20, в котором использовались гранулы, приготовленные с применением концентрированной композиции CVC, показывает только 12,0% экспозицию CVC в отсутствии предварительной обработки и 22,1% экспозицию при более низком значении рН желудка. Значения экспозиции для примеров 18, 20, 22 и 23 являются еще приемлемыми, и может потребоваться и нет корректировка дозы при введении людям для сравнения относительной биодоступности. Абсолютная биодоступность ламивудина выше чем 90% для всех композиций является приемлемой, и оказалось, что она не зависит от состава композиции и способа производства.
Пример 25
Оценивали распадаемость таблеток CVC/3ТС помещением одной таблетки каждого образца, приготовленного для фармакокинетических исследований на собаках, примерно в 250 мл воды и наблюдением за ходом и скоростью распадаемости.
В таблице 26 обобщены результаты по оценке распадаемости таблеток из примеров 18 и 20-22. Таблетки из примеров 18 и 20, которые содержали все количество ламивудина внегранулярно, демонстрировали быструю распадаемость, аналогичную для самого активного ингредиента ламивудина, спрессованного в виде таблетки. Примеры 21 и 22, в которых половина всего количества ламивудина находилась внутригранулярно, показывали неожиданный характер распадаемости. В частности, пример 21 с половинным количеством ламивудина, находящимся внутригранулярно, распадался медленно в течение нескольких минут. Пример 22 со всем количеством ламивудина, находящимся внутригранулярно, не распадался вовсе. Данные результаты были неожиданными с учетом высокой растворимости ламивудина в воде на уровне 70 мг/мл. Возможно, что взаимодействие между внутригранулярными компонентами может способствовать правильному смачиванию и распадаемости таблеток и гранул. Даже, несмотря на то, что добавление ламивудина во внутригранулярную часть гранул с ценикривироком является стратегией для сохранения таблеточной массы, особое внимание следует обратить на биофармацевтическую характеристику за счет изменений в распадаемости таблеток.
Пример 26
Таблетки CVC/3ТС из примеров 17, 19 и 20 и таблетки с одним агентом CVC из примера 14 анализировали на общее содержание примесей в условиях «ускоренного старения», подвергнув таблетки воздействию окружающей среды с 75% относительной влажностью при температуре 40°С. Все таблетки были упакованы во флаконы из HDPE с индукционной запайкой и влагоуловителем во время испытания. Как показано в таблицах 27а и 27b, таблетки CVC/3TC из примеров 17, 19 и 20 были такими же стабильными, как и таблетки с одним агентом CVC из примера 14 и промышленно доступные таблетки Epivir с одним агентом 3ТС, не более чем с 0,1% увеличением содержания примесей или продуктов разложения в течение 9 недель хранения в условиях «ускоренного старения». Это указывает на то, что активные ингредиенты были достаточно химически совместимыми и сохраняли стабильность в композициях и способах, описанных здесь. Примесей или продуктов разложения ламивудина не было обнаружено ни в одном из примеров, как показано в таблице 27b.
Пример 27
Определяли профили сжимаемости порошковых смесей CVC/3TC из примеров 17, 19 и 20, и результаты приведены на фигуре 12. Несмотря на то, что добавление 3TC приводило к снижению сжимаемости порошковых смесей с одним агентом CVC, как показано на фигуре 10, все порошковые смеси CVC/3TC по-прежнему показывали приемлемые характеристики сжимаемости, которые требуются для промышленных продуктов. Ламивудин является высоко кристаллическим хрупким веществом с крупными дискретными частицами, которые разрушают порошковый матрикс, подвергающийся процессу сжатия. Примеры 17 и 20 с более высокими концентрациями ламивудина показывают более низкую сжимаемость, чем пример 19, содержащий 150 мг активного вещества на фоне большей массы эксципиентов, чем пример 20.
Пример 28
Готовили бислойные таблетки, содержащие комбинацию трех активных агентов, CVC, 3TC и эфавиренза (EFV), для клинических исследований со схемой одна таблетка один раз в сутки (STR) для лечения ВИЧ-инфекции. В бислойных таблетках комбинация CVC/3TC находилась в виде одного слоя, в то время как третий активный агент, EFV, находился в виде второго слоя. Слой CVC/3TC таблетки готовили с использованием концентрированной композиции из примера 20. Однако все комбинации CVC/3TC, раскрытые выше, или связанные вариации могут аналогично использоваться в данной таблеточной конфигурации STR.
Слой EFV готовили обычным высокоскоростным способом влажного гранулирования с использованием чашевого окомкователя из нержавеющей стали емкостью 5 л. EFV, микрокристаллическую целлюлозу, натриевую соль карбоксиметилцеллюлозы, лаурилсульфат натрия и гидроксипропилцеллюлозу смешивали в высокоскоростном смесителе в течение 2 мин со скоростью, установленной на #2, с получением партии массой 300 г. К смеси добавляли 238 г очищенной воды примерно в течение 6 мин для получения подходящего гранулирования и затем смешивали, при необходимости. Гранулы измельчали на мельнице с загнутой вперед лопаткой типа hammer и высушивали в лотковой сушилке при 80°С. Высушенные гранулы дополнительно измельчали и смешивали со стеаратом магния. Масса слоя EFV в бислойной таблетке составляла 850 мг, что соответствовало 600 мг активного ингредиента EFV, и 250 мг эксципиентов. Отдельные слои CVC/3TC и EFV прессовали в бислойные таблетки, имеющие твердость более 15 кПа и истираемость менее чем 0,8% масс./масс. Бислойные таблетки имели состав, показанный в таблице 28.
(схема-1 с одной таблеткой CVC/EFV/3TC)
Пример 29
Готовили бислойную таблетку, содержащую CVC, 3TC и EFV в качестве активных агентов, как описано в примере 28, за исключением того, что масса слоя EFV составляла 775 мг. Слой CVC/3TC таблетки готовили с использованием концентрированной композиции из примера 20. Однако все комбинации CVC/3TC, раскрытые выше, или связанные вариации могут аналогично использоваться в данной таблеточной конфигурации STR. Таблетки имели твердость более 15 кПа и истираемость менее чем 0,8% масс./масс. Бислойные таблетки имели состав, показанный в таблице 29.
(схема-2 с одной таблеткой CVC/EFV/3TC)
Пример 30
Оценивали абсолютную биодоступность таблеток CVC/3TC/EFV из примеров 28 и 29 на необработанных собаках бигль натощак и сравнивали с таблетками с одним агентом CVC из примера 14. Все таблеток уменьшали для введения постоянной дозы ценикривирока 25 мг с соответствующим пропорциональным снижением содержания ламивудина до 50 мг и в случае эфавиренза для доставки дозы 100 мг. Результаты определения абсолютной биодоступности обобщены в таблице 30.
Результаты определения абсолютной биодоступности показывают значительное снижение экспозиции CVC при введении в присутствии эфавиренза. Эфавиренз является известным индуктором фермента печени CYP3A4, и было показано, что эфавиренз усиливает метаболизм ценикривирока у людей, тем самым снижая концентрацию ценикривирока в плазме крови примерно в 2 раза.
Пример 31
Таблетки из примеров 28 и 29 анализировали на общее содержание примесей в условиях «ускоренного старения», подвергнув таблетки воздействию окружающей среды с 75% относительной влажностью и температурой 40°С. Все таблетки были упакованы во флаконы из HDPE с индукционной запайкой и влагоуловителем во время испытания. Как показано в таблице 31, общее содержание примесей, связанных с CVC, свидетельствовало об отсутствии существенного изменения в течение 4 недель хранения в условиях «ускоренного старения». Примесей или продуктов разложения ламивудина не было обнаружено ни в одном из примеров, как показано в таблице 31. Кроме того, в таблице 17 показано, что отсутствовали существенные изменения в содержании продуктов разложения эфавиренза.
Пример 32
Определяли содержание активных веществ и содержание воды в таблетках из примеров 28 и 29, и таблетках 17, 19 и 20 в условиях «ускоренного старения» при воздействии на упакованные таблетки среды с 75% относительной влажностью и температурой 40°С. Как показано в обобщенной форме в таблицах 32 и 33, отсутствовали существенные изменения в содержании CVC и 3TC в таблетках из примеров 19 и 20 и таблетках STR из примеров 28 и 29. В таблетках из примера 17 отсутствовало значительное изменение через 2 недели, но имело место числовое снижение содержания CVC и 3TC через 4 недели. Результаты дополнительного тестирования подтвердили, что данное снижение не было достоверным, а явилось результатом артефакта в методе анализа.
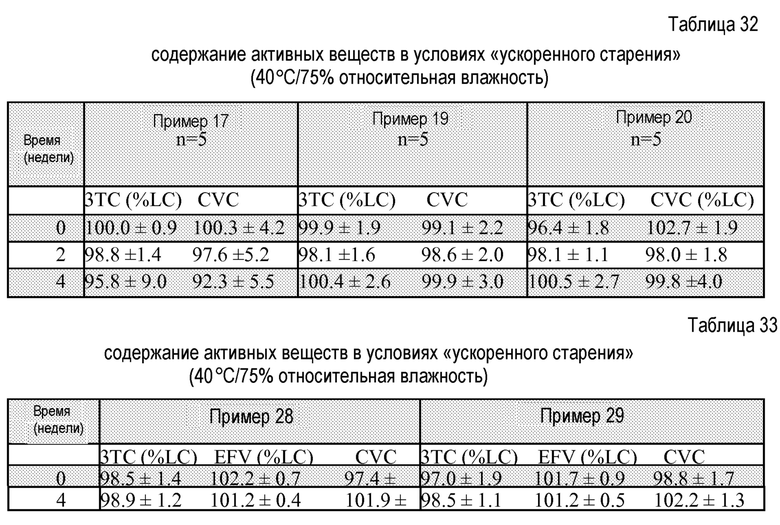
В таблице 34 показано, что отсутствовало значительное изменение в содержании воды, что определяли титрованием по Карлу Фишеру, в таблетках CVC/3TC из примеров 17, 19 и 20 и таблетках STR из примеров 28 и 29 после хранения в течение 4 недель при 40°С/75% относительной влажности.
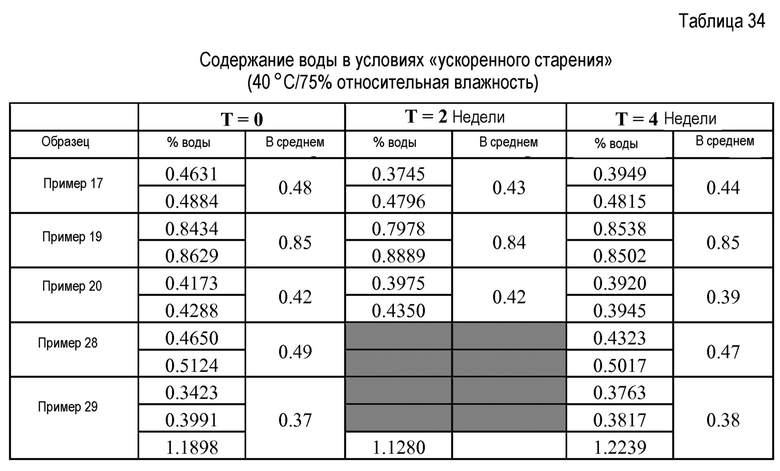
Таблетки из примеров 17, 19 и 20 анализировали на растворение после 9 недель хранения при 40°С/75% относительной влажности. Не наблюдали значимых изменений в профиле растворения 3TC и CVC во время хранения в течение 9 недель при 40°С/75% относительной влажности.
Таблетки из примеров 28 и 29 также анализировали на растворение после 4 недель хранения при 40°С/75% относительной влажности. Данные по растворению обобщены на фигурах 13 и 14.
Пример 33
Таблетки из примеров 17, 19 и 20 также тестировали на образование родственных соединений через 9 недель хранения при 40°С/75% относительной влажности. Для такого анализа одну таблетку из примера 17 помещали в колбу емкостью 100 мл, добавляли 5 мл воды MiliQ, колбу помещали в шейкер на 30 мин при 200 об/мин с последующим добавлением 65 мл метанола. Колбу вновь помещали на шейкер еще на 30 мин при 200 об/мин, и содержимое доводили до объема 100 мл метанолом. Для таблеток из примеров 19 и 20 пробу для ВЭЖХ готовили помещением одной таблетки в колбу емкостью 500 мл, добавляли 25 мл воды MiliQ, колбу помещали в шейкер на 30 мин при 200 об/мин, добавляли 325 мл метанола, и колбу помещали обратно на шейкер еще на 30 мин при 200 об/мин, и содержимое доводили до объема 500 мл метанолом. Пробы анализировали на образование родственных соединений с использованием ВЭЖХ. Содержание родственных для CVC соединений повышалось с <LOQ (0,05%) примерно до 0,2% через 9 недель хранения при 40°С/75% относительной влажности. Не отмечали присутствия родственных для 3TC соединений на уровне, превышающем LOQ (0,05%) через 9 недель хранения при 40°С/75% относительной влажности.
Параметры метода определения на основе ВЭЖХ родственных соединений приведены в таблице ниже:
Пример 34
Анализировали фармакокинетический профиль таблеток из примера 28 (содержащих комбинацию ценикривирока, 3TC и EFV) на необработанных собаках бигль натощак. Все таблетки уменьшали для введения постоянной дозы ценикривирока 25 мг CVC, 50 мг 3TC и 100 мг EFV. Результаты приведены в таблице 36.
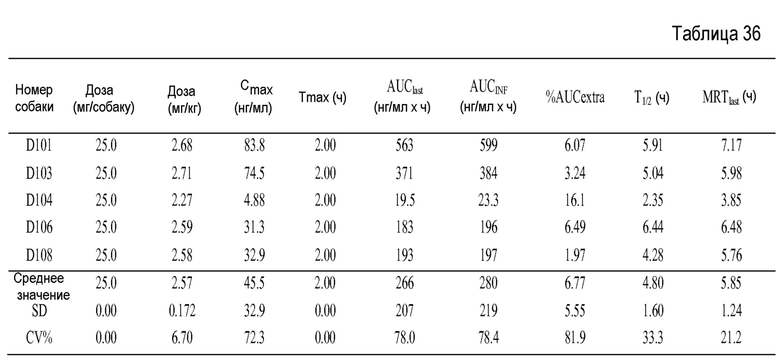
Очевидно, понятно, что, несмотря на то, что приведенное выше описание обеспечивает специалистов в данной области достаточные указания для осуществления, применения и практики раскрытия, оно не предназначается для ограничения. Могут быть сделаны различные модификации для данного описания, не отступая от объема и сущности изобретения. Специалисты в данной области могут использовать различные вариации, как это подходит, и раскрытие может практиковаться иными путями, чем конкретно описанные здесь. Например, несмотря на то, что некоторые варианты осуществления были описаны при обращении к конкретным типам неактивных ингредиентов, таких как наполнители, разрыхлители и тому подобное, специалисту в данной области понятно, что также можно использовать другие неактивные ингредиенты для получения таких же результатов. Следовательно, раскрытие включает все модификации и эквивалентные варианты объекта изобретения, цитированные в прилагаемой формуле изобретения, предусмотренные действующим законодательством. Кроме того, включается любая комбинация вышеописанных элементов во всех возможных вариациях раскрытием, если не указано иначе или четко не указывается по контексту.
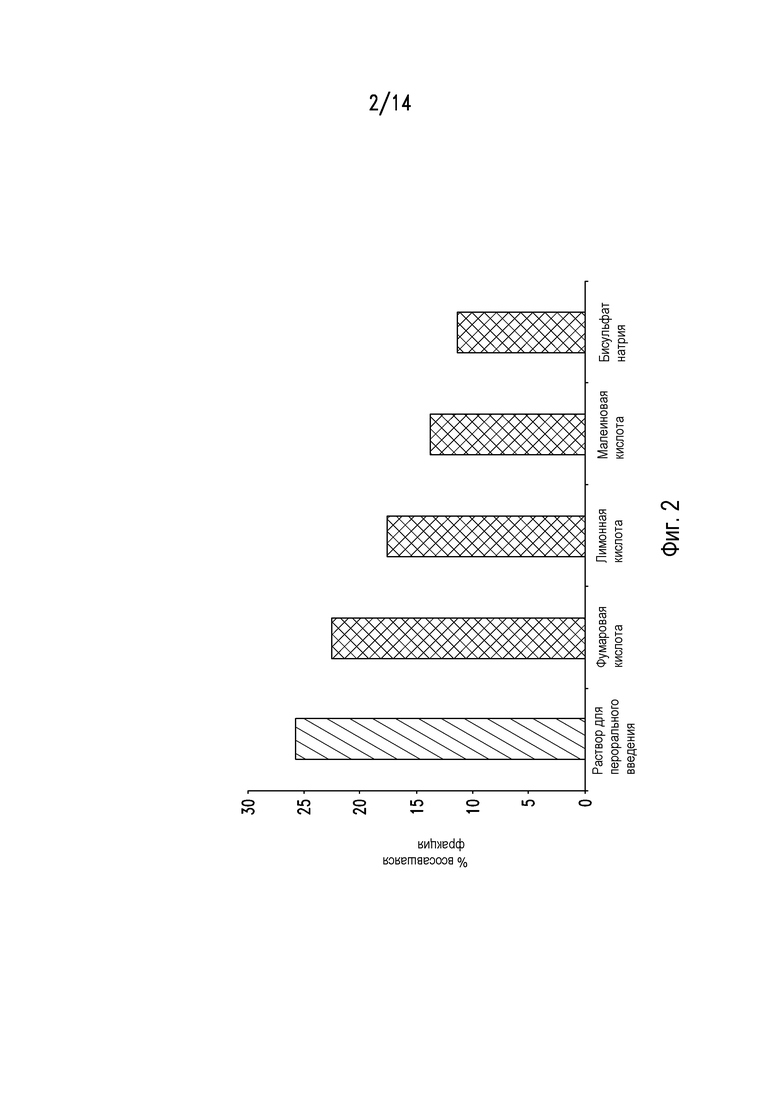
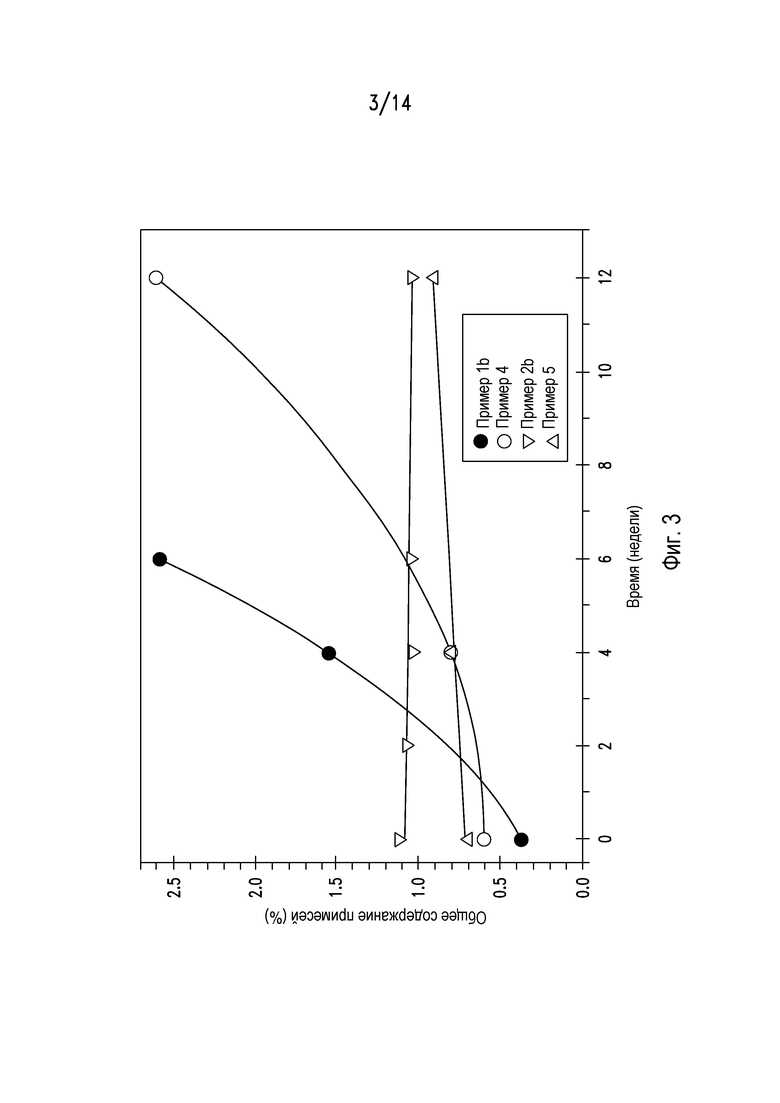
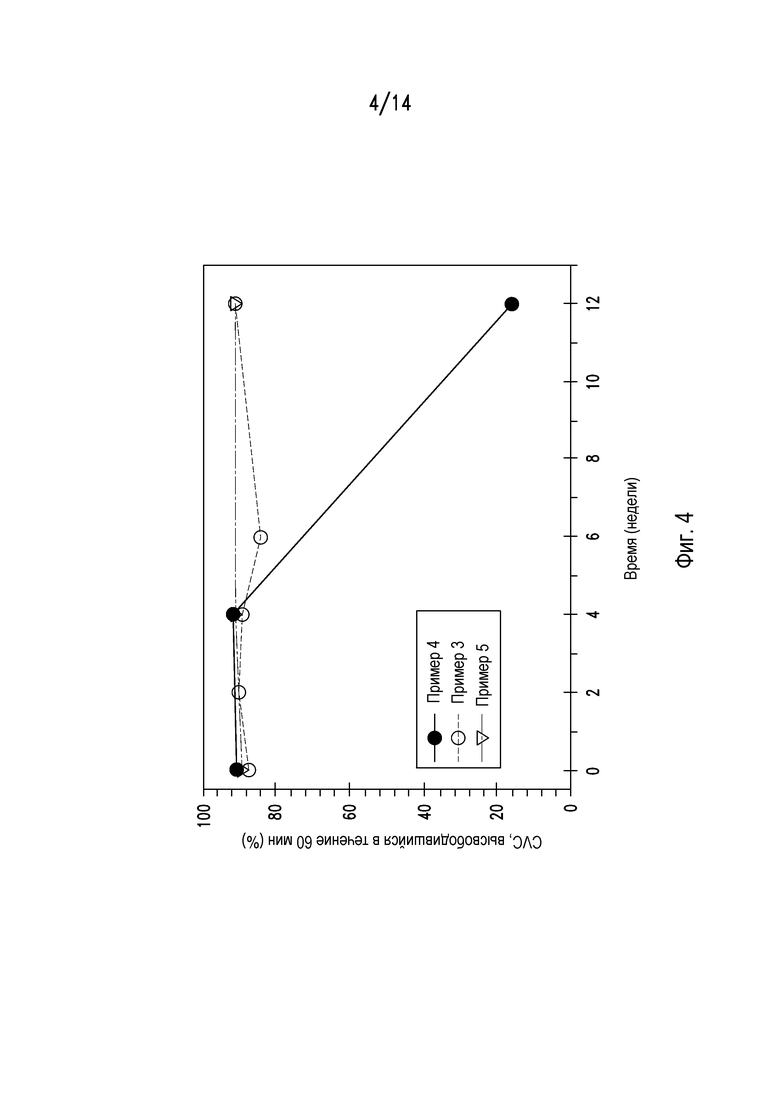
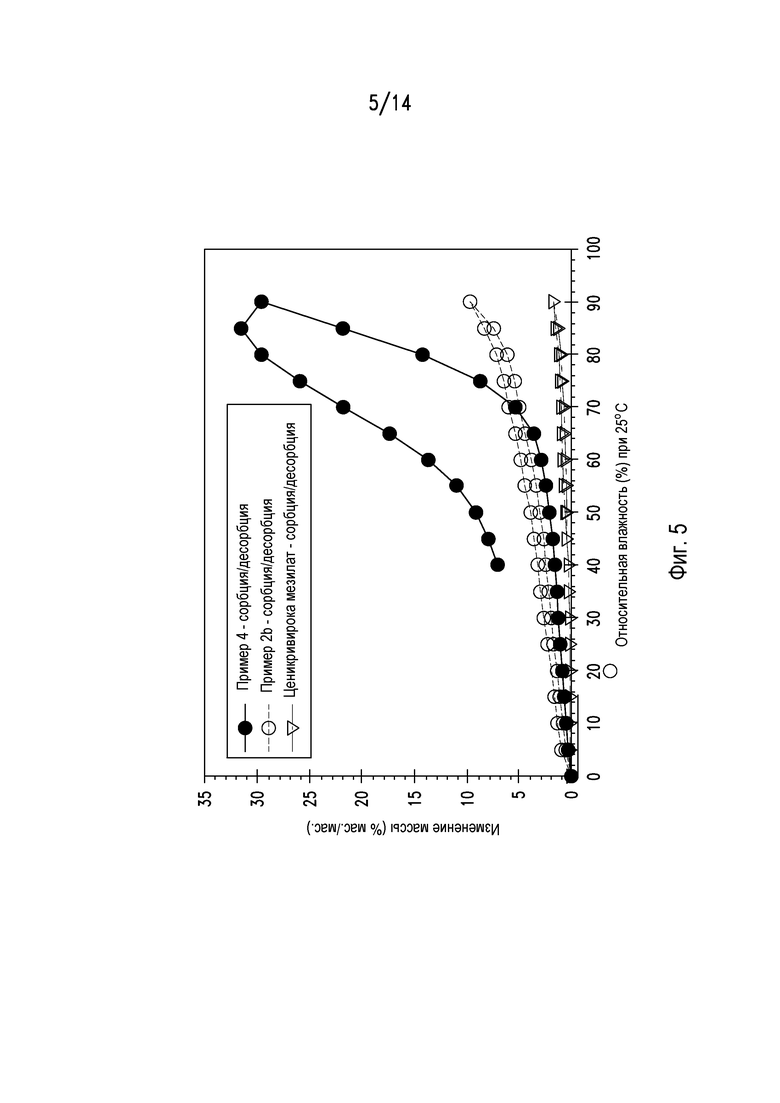
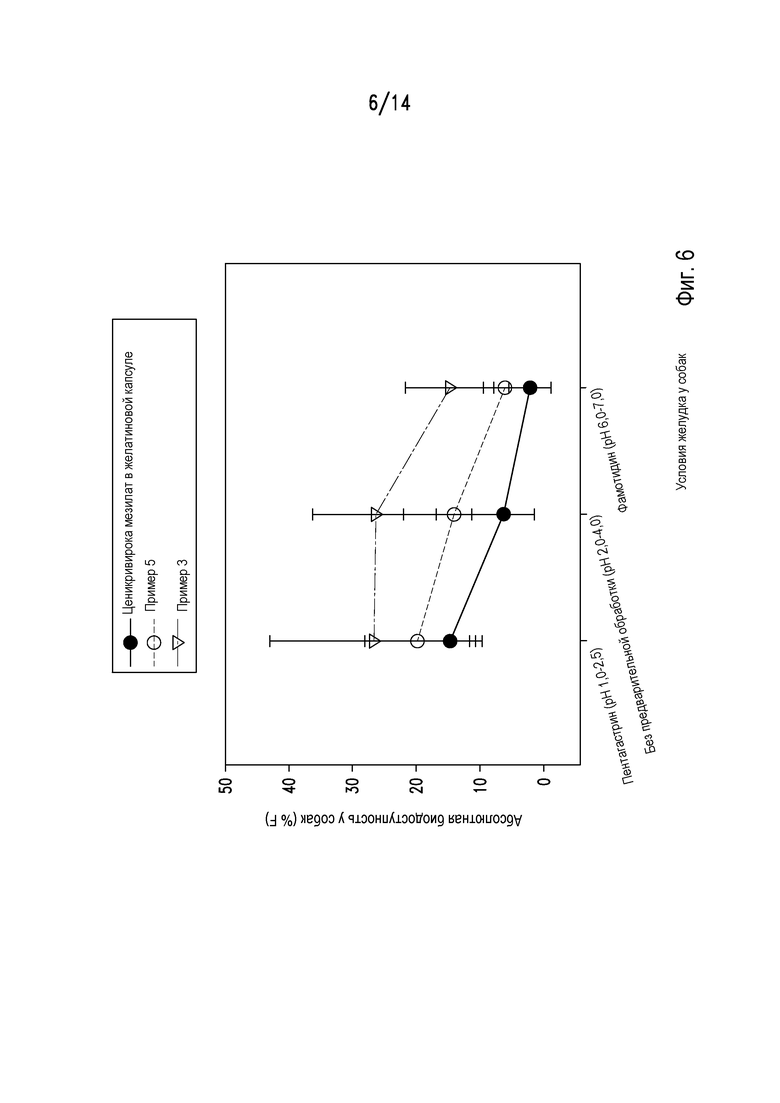
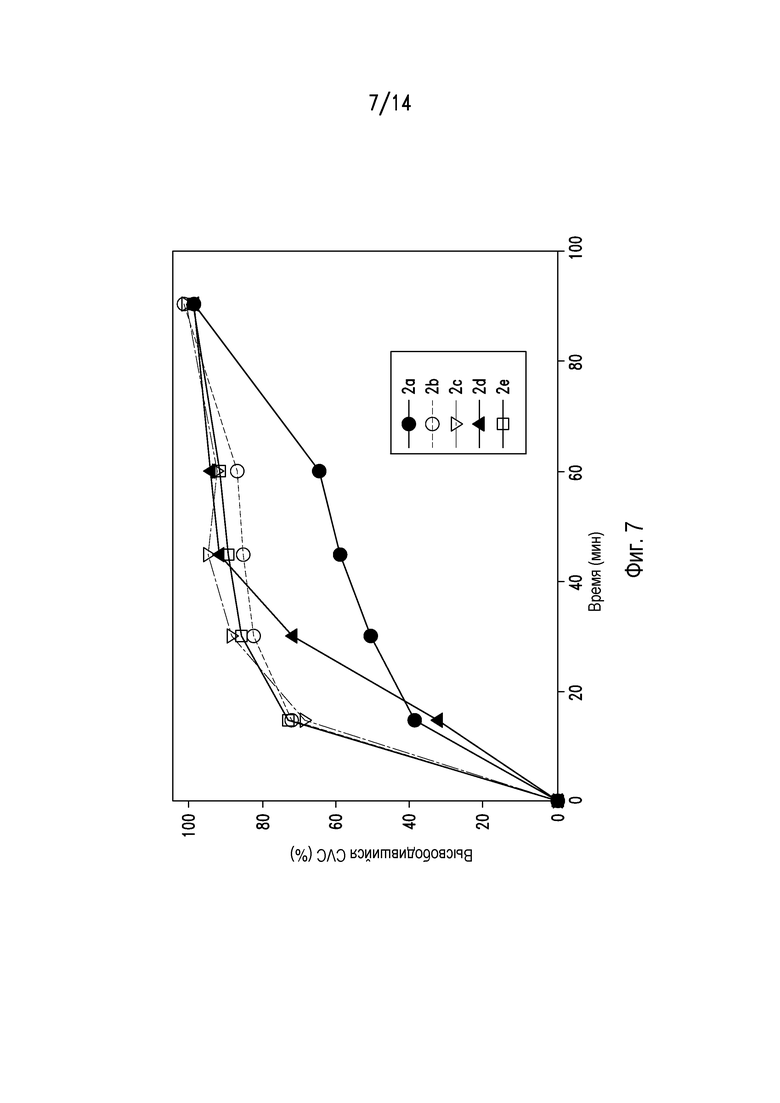
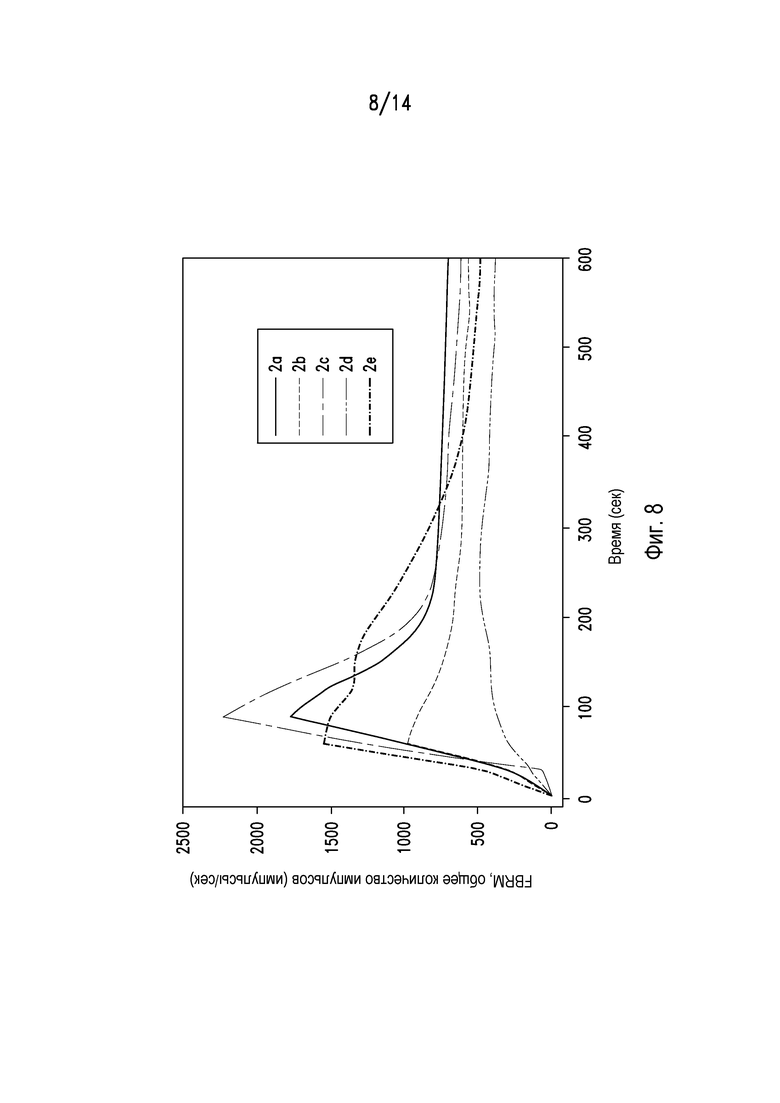
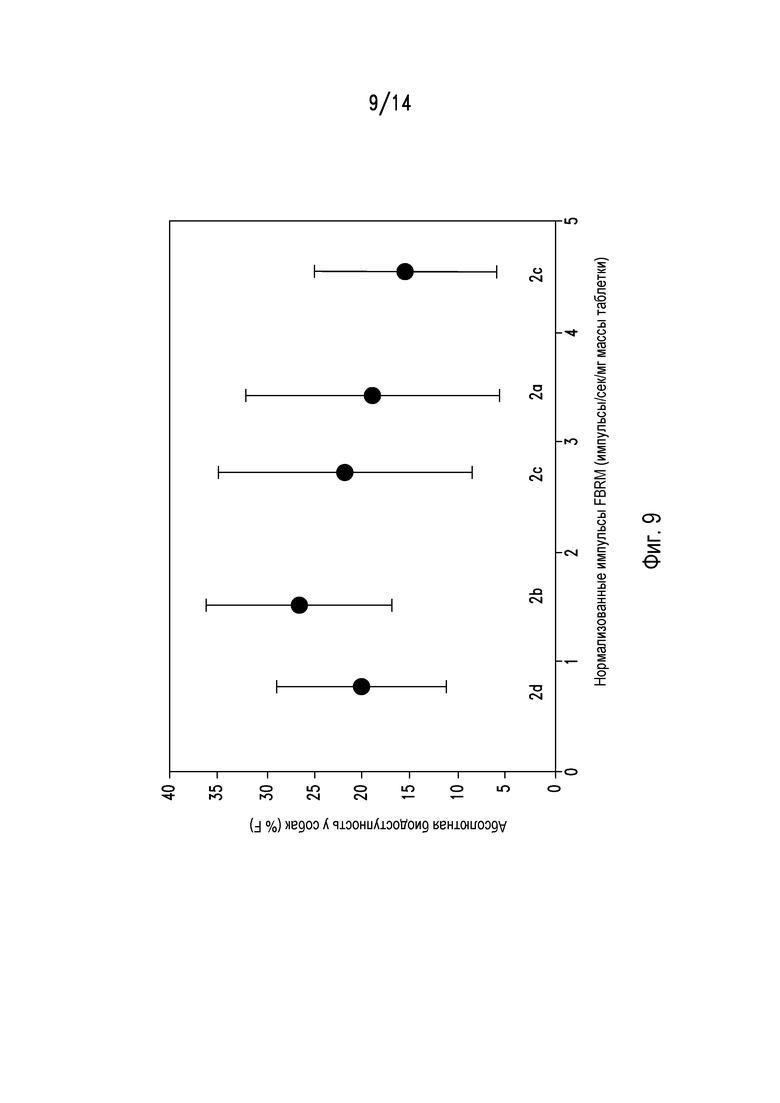
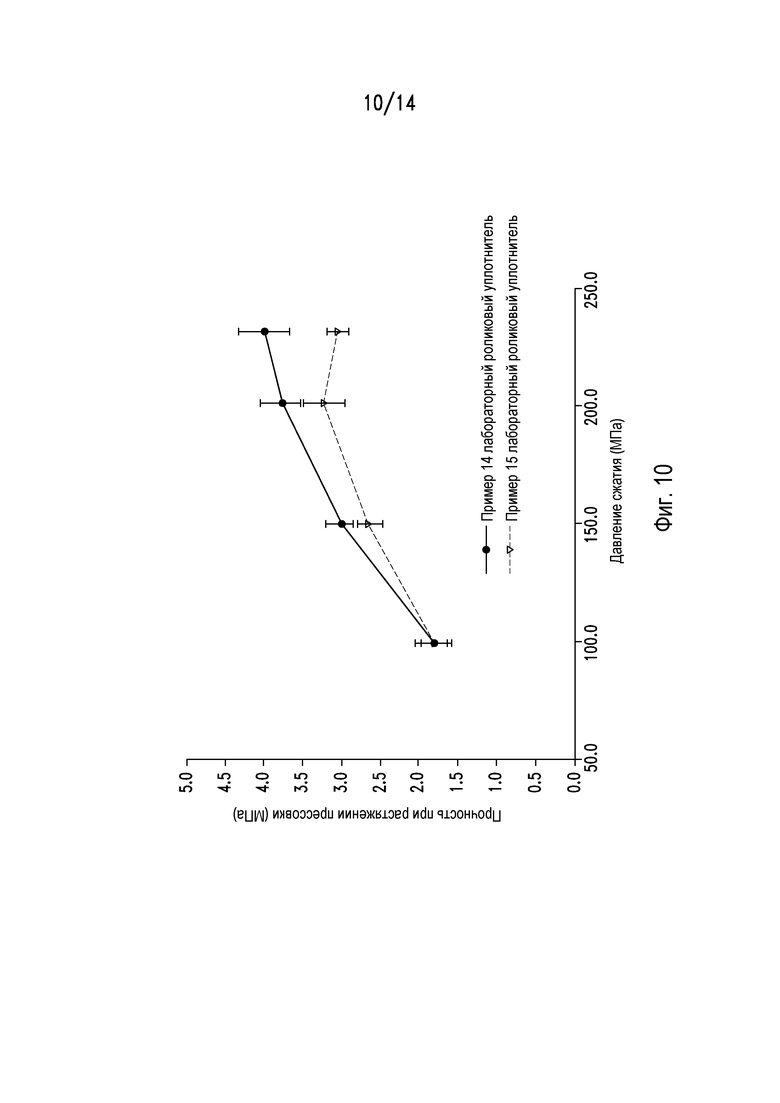
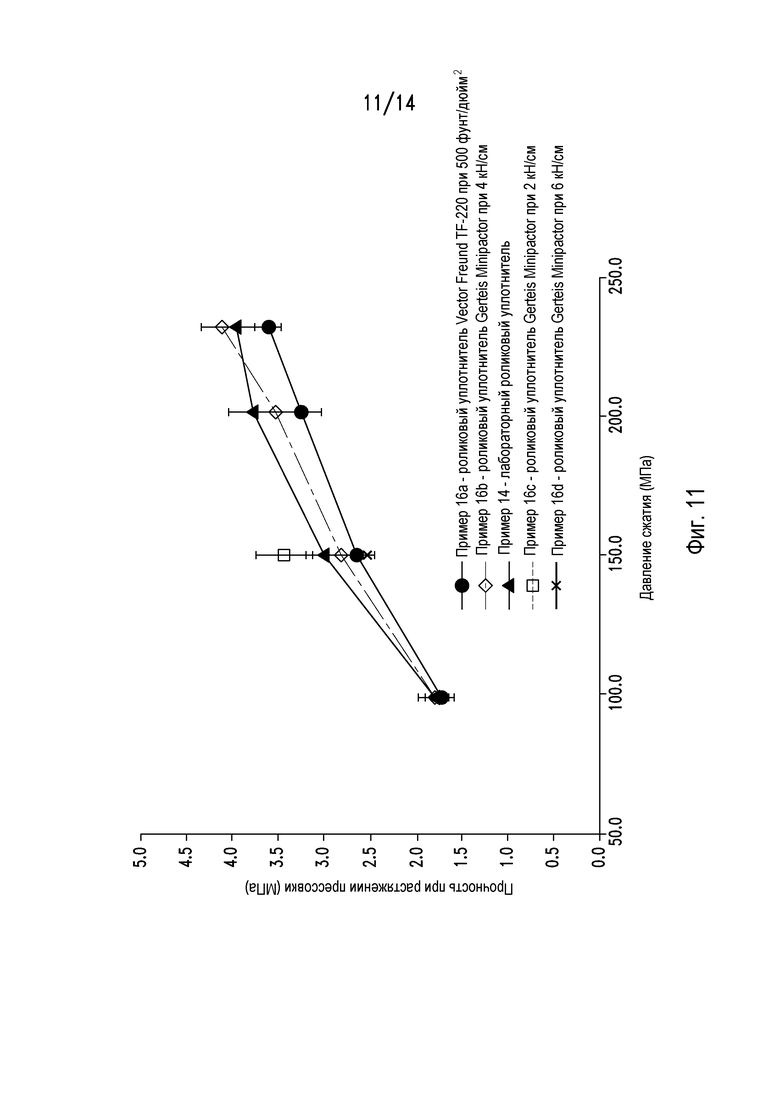
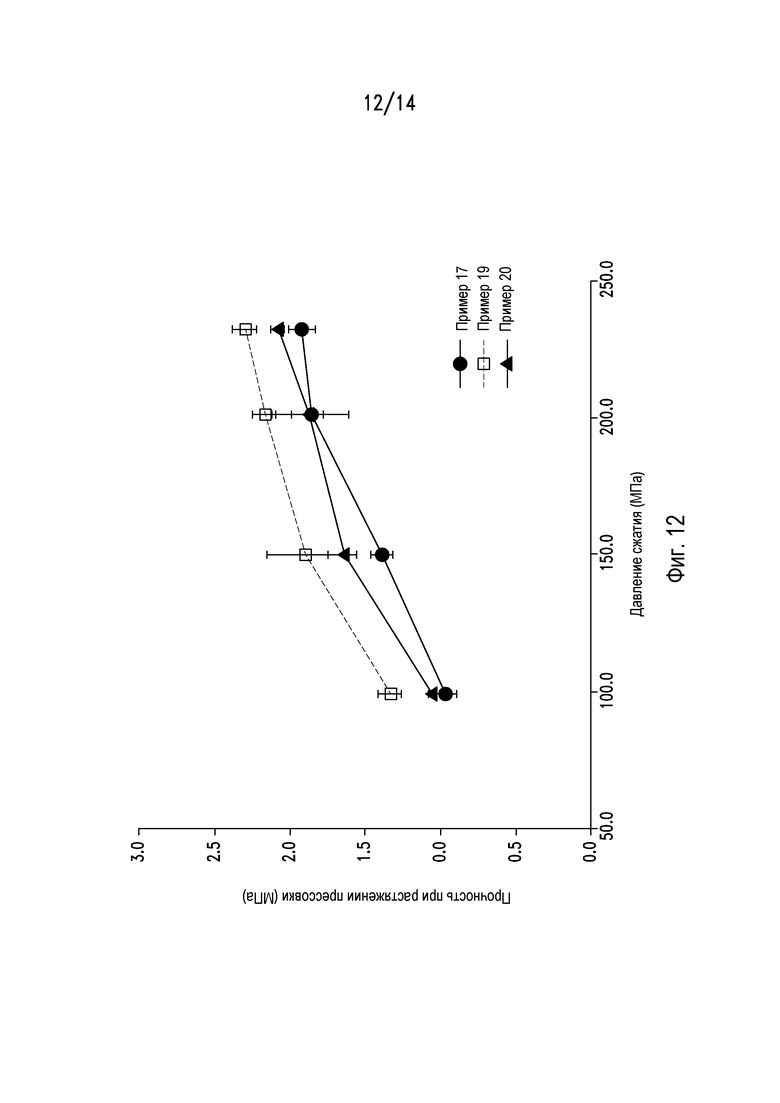
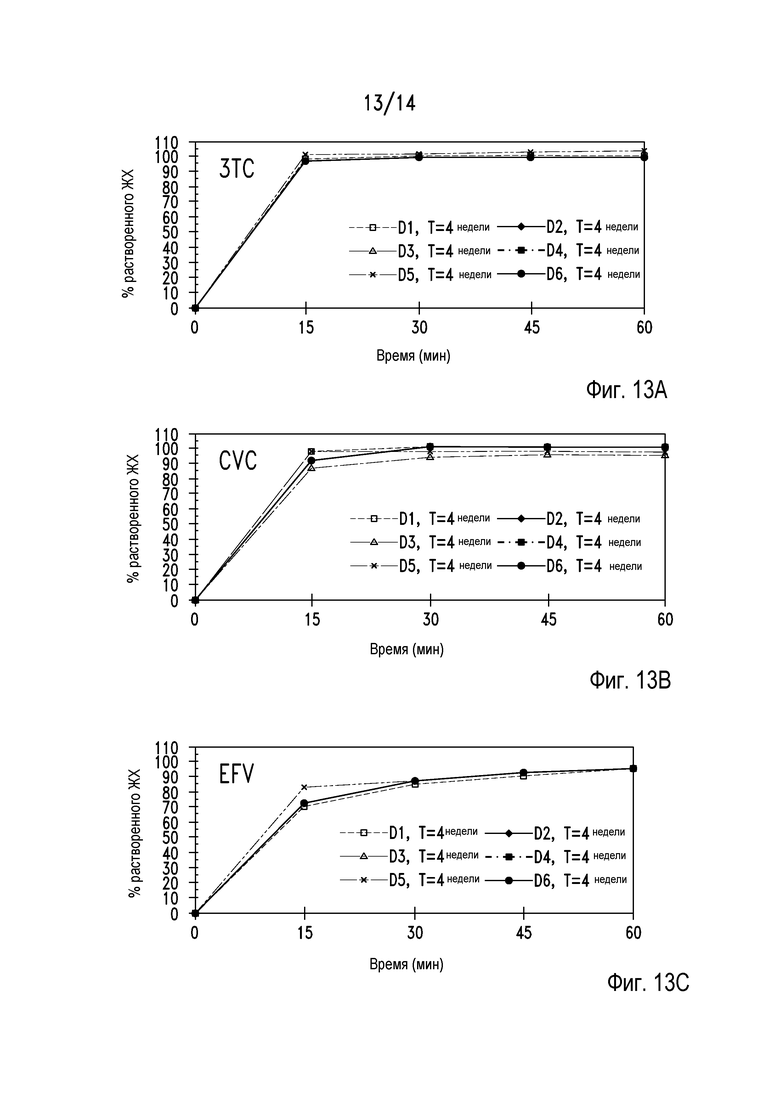
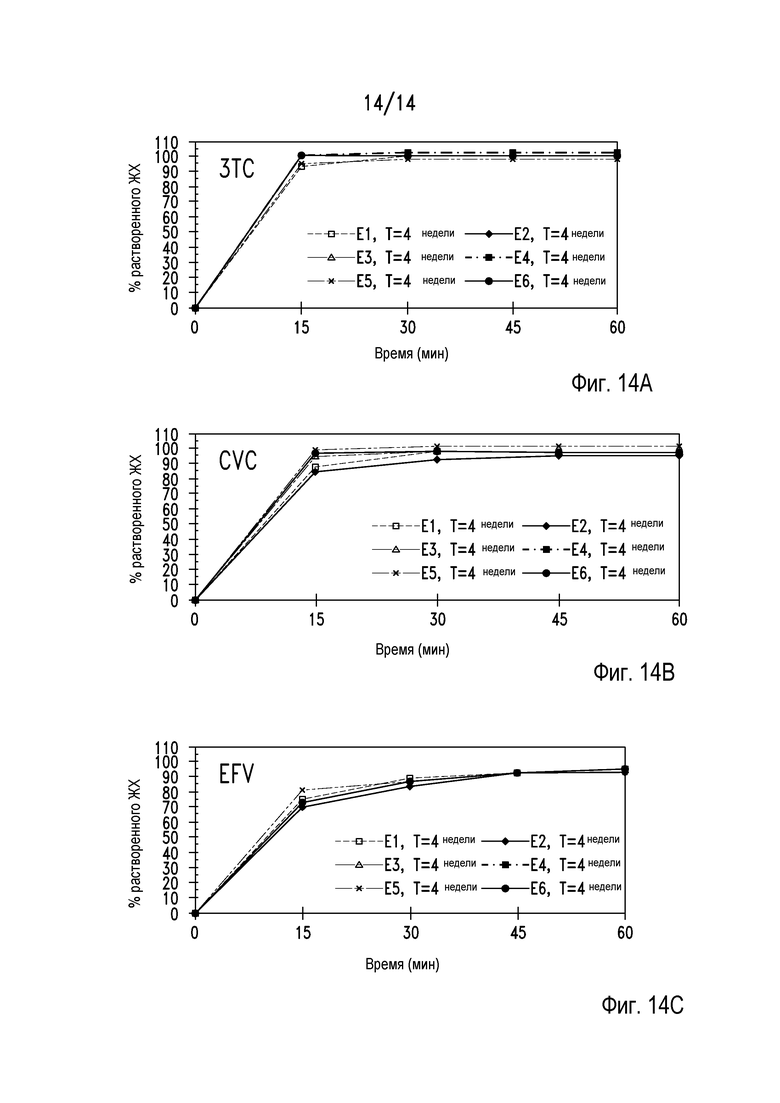
Группа изобретений относится к области медицины, а именно к фармакологии, и описывает композицию, содержащую ценикривирок или его соль и фумаровую кислоту, способ получения указанной композиции, таблетку, способ получения указанной таблетки и способ лечения заболевания, расстройства или состояния, включающий введение терапевтически эффективного количества указанной композиции или таблетки. Группа изобретений может быть использована для лечения вирусной инфекции, воспаления, фиброза или синдрома трансплантат против хозяина. 7 н. и 131 з.п. ф-лы, 14 ил., 36 табл.
1. Композиция, содержащая ценикривирок или его соль и фумаровую кислоту для лечения вирусной инфекции, воспаления, фиброза или синдрома трансплантат против хозяина, где весовое соотношение ценикривирока или его соли к фумаровой кислоте составляет примерно от 7:10 до примерно 10:7 в расчете на массу свободного основания ценикривирока.
2. Композиция по п. 1, где ценикривирок или его соль представляет ценикривирока мезилат.
3. Композиция по п. 1, где весовое соотношение ценикривирока или его соли к фумаровой кислоте составляет примерно от 8:10 до примерно 10:8 в расчете на массу свободного основания ценикривирока.
4. Композиция по п. 1, где весовое соотношение ценикривирока или его соли к фумаровой кислоте составляет примерно от 9:10 до примерно 10:9 в расчете на массу свободного основания ценикривирока.
5. Композиция по п. 1, где весовое соотношение ценикривирока или его соли к фумаровой кислоте составляет примерно от 95:100 до примерно 100:95 в расчете на массу свободного основания ценикривирока.
6. Композиция по п. 1, где фумаровая кислота находится в количестве примерно от 15% до примерно 40% к массе всей композиции.
7. Композиция по п. 1, где фумаровая кислота находится в количестве примерно от 20% до примерно 30% к массе всей композиции.
8. Композиция по п. 1, где фумаровая кислота находится в количестве примерно 25% к массе всей композиции.
9. Композиция по п. 1, где ценикривирок или его соль находится в количестве примерно от 15% до примерно 40% к массе всей композиции в расчете на массу свободного основания ценикривирока.
10. Композиция по п. 1, где ценикривирок или его соль находится в количестве примерно от 20% до примерно 30% к массе всей композиции в расчете на массу свободного основания ценикривирока.
11. Композиция по п. 1, где ценикривирок или его соль находится в количестве примерно 25% к массе всей композиции в расчете на массу свободного основания ценикривирока.
12. Композиция по п. 1, дополнительно содержащая один или более наполнителей.
13. Композиция по п. 12, где один или более наполнителей выбраны из микрокристаллической целлюлозы, двуосновного фосфата кальция, целлюлозы, лактозы, сахарозы, маннита, сорбита, крахмала и карбоната кальция.
14. Композиция по п. 12 или 13, где один или более наполнителей представляет микрокристаллическую целлюлозу.
15. Композиция по п. 12, где весовое соотношение одного или более наполнителей к ценикривироку или его соли составляет примерно от 25:10 до примерно 10:8 в расчете на массу свободного основания ценикривирока.
16. Композиция по п. 12, где весовое соотношение одного или более наполнителей к ценикривироку или его соли составляет примерно от 20:10 до примерно 10:10 в расчете на массу свободного основания ценикривирока.
17. Композиция по п. 12, где весовое соотношение одного или более наполнителей к ценикривироку или его соли составляет примерно 15:10 в расчете на массу свободного основания ценикривирока.
18. Композиция по п. 12, где один или более наполнителей находится в количестве примерно от 25% до примерно 55% к массе всей композиции.
19. Композиция по п. 12, где один или более наполнителей находится в количестве примерно от 30% до примерно 50% к массе всей композиции.
20. Композиция по п. 12, где один или более наполнителей находится в количестве примерно 40% к массе всей композиции.
21. Композиция по п. 1, дополнительно содержащая один или более разрыхлителей.
22. Композиция по п. 21, где один или более разрыхлителей выбраны из поперечно-сшитого поливинилпирролидона, натриевой соли поперечно-сшитой карбоксиметилцеллюлозы и натрия крахмала гликолята.
23. Композиция по п. 21, где один или более разрыхлителей представляет натриевую соль поперечно-сшитой карбоксиметилцеллюлозы.
24. Композиция по п. 21, где весовое соотношение одного или более разрыхлителей к ценикривироку или его соли находится в пределах примерно от 10:100 до примерно 30:100 в расчете на массу свободного основания ценикривирока.
25. Композиция по п. 21, где весовое соотношение одного или более разрыхлителей к ценикривироку или его соли составляет примерно 25:100 в расчете на массу свободного основания ценикривирока.
26. Композиция по п. 21, где один или более разрыхлителей находится в количестве примерно от 2% до примерно 10% к массе всей композиции.
27. Композиция по п. 21, где один или более разрыхлителей находится в количестве примерно от 4% до примерно 8% к массе всей композиции.
28. Композиция по п. 21, где один или более разрыхлителей находится в количестве примерно 6% к массе всей композиции.
29. Композиция по п. 1, дополнительно содержащая один или более смазывающих агентов.
30. Композиция по п. 29, где один или более смазывающих агентов выбраны из стеарина, стеарата магния и стеариновой кислоты.
31. Композиция по п. 29, где один или более смазывающих агентов представляет стеарат магния.
32. Композиция по п. 29, где один или более смазывающих агентов находится в количестве примерно от 0,25% до примерно 5% к массе всей композиции.
33. Композиция по п. 29, где один или более смазывающих агентов находится в количестве примерно от 0,75% до примерно 3% к массе всей композиции.
34. Композиция по п. 29, где один или более смазывающих агентов находится в количестве примерно 1,25% к массе всей композиции.
35. Композиция по п. 1, где композиция представлена в виде таблетки, по существу соответствующей таблетке, имеющей следующий состав, выбранный из:
а) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 252,68 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 58,50 мг и Стеарат магния 8,13 мг;
b) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 272,18 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 39,00 мг, Стеарат магния 8,13 мг или
c) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 272,18 мг, Поперечно-сшитый поливинилпирролидон 19,50 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 19,50 мг, Стеарат магния 8,13 мг.
36. Композиция по п. 1, где композиция представлена в виде таблетки по существу соответствующей имеющей следующий состав, выбранный из:
a) Ценикривирока мезилат 26,26% масс./масс., Фумаровая кислота 24,62% масс./масс., Микрокристаллическая целлюлоза 41,87% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 6,00% масс./масс., Стеарат магния 1,25% масс./масс., или
b) Ценикривирока мезилат 170,69% масс./масс., Фумаровая кислота 160,00% масс./масс., Микрокристаллическая целлюлоза 272,18% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 39,00% масс./масс., Стеарат магния 8,13% масс./масс.
37. Композиция по п. 1, где композицию получают способом, включающим сухое гранулирование.
38. Композиция по п. 1, где композиция имеет содержание воды не более чем 4 масс. % через 6 недель воздействия условий с температурой примерно при 40°С и 75% относительной влажностью при упаковке с влагопоглотителем в контейнере.
39. Композиция по п. 1, где композиция имеет содержание воды не более чем 2 масс. % через 6 недель воздействия условий с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагопоглотителем в контейнере.
40. Композиция по п. 1, где композиция имеет общее содержание примесей и уровень продуктов деградации не более чем примерно 2,5% через 12 недель воздействия условий с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагопоглотителем в контейнере.
41. Композиция по п. 1, где композиция имеет общее содержание примесей и уровень продуктов деградации не более чем примерно 1,5% через 12 недель воздействия условий с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагопоглотителем в контейнере.
42. Композиция по п. 1, где ценикривирок или его соль имеет среднюю абсолютную биодоступность от примерно 10% до примерно 50% после перорального введения, которая по существу аналогична средней абсолютной биодоступности ценикривирока или его соли в растворе после перорального введения.
43. Композиция по п. 1, которая имеет AUC ценикривирока, составляющее 200% или выше от AUC ценикривирока, которое показывает стандартная твердая композиция после перорального введения.
44. Композиция по п. 1, которая имеет значение Cmax ценикривирока по меньшей мере на 50% выше, чем Cmax ценикривирока, которое показывает стандартную твердую композицию после перорального введения.
45. Композиция по п. 1, дополнительно содержащая один или более дополнительных фармацевтически активных агентов, где один или более дополнительных фармацевтически активных агентов представляет собой ламивудин или эфавиренз.
46. Композиция по п. 45, содержащая ценикривирок или его соль, фумаровую кислоту и ламивудин.
47. Композиция по п. 46, где ценикривирок или его соль представляет ценикривилока мезилат.
48. Композиция по п. 46 или 47, где весовое соотношение ценикривирока или его соли к ламивудину находится в пределах примерно от 1:15 до примерно 1:1 в расчете на массу свободного основания ценикривирока.
49. Композиция по п. 46, где весовое соотношение ценикривирока или его соли к ламивудину находится в пределах примерно от 1:12 до примерно 2:3 в расчете на массу свободного основания ценикривирока.
50. Композиция по п. 46, где весовое соотношение ценикривирока или его соли к ламивудину составляет примерно 1:12; примерно 1:4 или примерно 1:2 в расчете на массу свободного основания ценикривирока.
51. Композиция по п. 46, где ламивудин находится в количестве примерно от 25% до примерно 65% к массе всей композиции.
52. Композиция по п. 46, где ламивудин находится в количестве примерно от 30% до примерно 60% к массе всей композиции.
53. Композиция по п. 46, где ламивудин находится в количестве примерно 31,6%; примерно 33,3%; примерно 37,5%; примерно 40,0%; примерно 46,2% или примерно 60% к массе всей композиции.
54. Композиция по п. 46, содержащая:
примерно 15,8% ценикривирока или его соли и примерно 31,6% ламивудина;
примерно 16,7% ценикривирока или его соли и примерно 33,3% ламивудина;
примерно 18,8% ценикривирока или его соли и примерно 37,5% ламивудина;
примерно 20% ценикривирока или его соли и примерно 40% ламивудина;
примерно 11,5% ценикривирока или его соли и примерно 46,2% ламивудина; или
примерно 5% ценикривирока или его соли и примерно 60% ламивудина к массе всей композиции и в расчете на массу свободного основания ценикривирока.
55. Композиция по п. 46, дополнительно содержащая один или более наполнителей.
56. Композиция по п. 55, где один или более наполнителей выбраны из микрокристаллической целлюлозы, двуосновного фосфата кальция, целлюлозы, лактозы, сахарозы, маннита, сорбита, крахмала и карбоната кальция.
57. Композиция по п. 55 или 56, где один или более наполнителей представляет микрокристаллическую целлюлозу.
58. Композиция по п. 55, где весовое соотношение одного или более наполнителей к ценикривироку или его соли составляет примерно от 5:1 до примерно 1:5 в расчете на массу свободного основания ценикривирока.
59. Композиция по п. 55, где весовое соотношение одного или более наполнителей к ценикривироку или его соли составляет примерно от 1:4 до примерно 1:5, или примерно от 2:3 до примерно 1:2, или примерно от 2:1 до примерно 4:3, или примерно от 5:1 до примерно 5:2 в расчете на массу свободного основания ценикривирока.
60. Композиция по п. 55, где один или более наполнителей находится в количестве примерно от 5% до примерно 30% к массе всей композиции.
61. Композиция по п. 55, где один или более наполнителей находится в количестве примерно 5,8%; примерно 6,6%; примерно 12%; примерно 20,5%; примерно 22,2%; примерно 23,4% или примерно 24,8% к массе всей композиции.
62. Композиция по п. 55, содержащая:
примерно 15,8% ценикривирока или его соли, примерно 31,6% ламивудина и 24,8% одного или более наполнителей;
примерно 16,7% ценикривирока или его соли, примерно 33,3% ламивудина и 23,4% одного или более наполнителей;
примерно 18,8% ценикривирока или его соли, примерно 37,5% ламивудина и 12,0% одного или более наполнителей;
примерно 20% ценикривирока или его соли, примерно 40,0% ламивудина и 5,8% одного или более наполнителей;
примерно 20% ценикривирока или его соли, примерно 40,0% ламивудина и 6,6% одного или более наполнителей;
примерно 11,5% ценикривирока или его соли, примерно 46,2% ламивудина и 20,5% одного или более наполнителей; или
примерно 5% ценикривирока или его соли, примерно 60% ламивудина и 22,2% одного или более наполнителей к массе всей композиции и в расчете на массу свободного основания ценикривирока.
63. Композиция по п. 46, дополнительно содержащая один или более разрыхлителей.
64. Композиция по п. 63, где один или более разрыхлителей выбраны из поперечно-сшитого поливинилпирролидона, натриевой соли поперечно-сшитой карбоксиметилцеллюлозы и натрия крахмала гликолята.
65. Композиция по п. 63 или 64, где один или более разрыхлителей представляет натриевую соль поперечно-сшитой карбоксиметилцеллюлозы.
66. Композиция по п. 63, где весовое соотношение одного или более разрыхлителей к ценикривироку или его соли находится в пределах примерно от 1:4 до примерно 3:2 в расчете на массу свободного основания ценикривирока.
67. Композиция по п. 63, где весовое соотношение одного или более разрыхлителей к ценикривироку или его соли составляет примерно 1:3; примерно 2:5; примерно 1:2 или примерно 1:1 в расчете на массу свободного основания ценикривирока.
68. Композиция по п. 63, где один или более разрыхлителей находится в количестве примерно от 3% до примерно 9% к массе всей композиции.
69. Композиция по п. 46, дополнительно содержащая один или более смазывающих агентов.
70. Композиция по п. 69, где один или более смазывающих агентов выбраны из стеарина, стеарата магния и стеариновой кислоты.
71. Композиция по п. 69 или 70, где один или более смазочных агентов представляет стеарат магния.
72. Композиция по п. 69, где один или более смазочных агентов находится в количестве примерно от 0,5% до примерно 4% к массе всей композиции.
73. Композиция по п. 46, где композиция представлена в виде таблетки, по существу соответствующей таблетке, имеющей следующий состав, выбранный из:
a) Ценикривирока мезилат 5,69% масс./масс., Ламивудин 60,00% масс./масс., Фумаровая кислота 5,33% масс./масс., Микрокристаллическая целлюлоза 22,16% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 5,65% масс./масс., Стеарат магния 1,16% масс./масс.;
b) Ценикривирока мезилат 28,45 мг, Ламивудин 300,00 мг, Фумаровая кислота 26,67 мг, Микрокристаллическая целлюлоза 110,82 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 28,25 мг, Стеарат магния 5,81 мг;
c) Ценикривирока мезилат 13,13% масс./масс., Ламивудин 46,15% масс./масс., Фумаровая кислота 12,31% масс./масс.,
Микрокристаллическая целлюлоза 20,54% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 6,50% масс./масс., Стеарат магния 1,38% масс./масс.;
d) Ценикривирока мезилат 85,35 мг, Ламивудин 300,00 мг, Фумаровая кислота 80,00 мг, Микрокристаллическая целлюлоза 133,46 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 42,25 мг, Стеарат магния 8,94 мг;
e) Ценикривирока мезилат 17,97% масс./масс., Ламивудин 31,58% масс./масс., Фумаровая кислота 16,84% масс./масс., Микрокристаллическая целлюлоза 24,78% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 7,31% масс./масс., Стеарат магния 1,51% масс./масс.;
f) Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 235,43 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 69,50 мг, Стеарат магния 14,38;
g) Ценикривирока мезилат 21,34% масс./масс., Ламивудин 37,50% масс./масс., Фумаровая кислота 20,00% масс./масс., Микрокристаллическая целлюлоза 12,01% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 7,64% масс./масс., Стеарат магния 1,53% масс./масс.;
h) Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 96,01 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 61,10 мг, Стеарат магния 12,20 мг;
i) Ценикривирока мезилат 22,76% масс./масс., Ламивудин 40,00% масс./масс., Фумаровая кислота 21,33% масс./масс., Микрокристаллическая целлюлоза 5,82% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 8,55% масс./масс., Стеарат магния 1,53% масс./масс.;
j) Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 43,66 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 64,15 мг, Стеарат магния 11,15 мг;
k) Ценикривирока мезилат 22,76% масс./масс., Ламивудин 40,00% масс./масс., Фумаровая кислота 21,33% масс./масс., Микрокристаллическая целлюлоза 6,60% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 7,61% масс./масс., Стеарат магния 1,69% масс./масс.;
l) Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 49,51 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 57,10 мг, Стеарат магния 12,70 мг;
m) Слой с CVC: Ценикривирока мезилат 18,96% масс./масс., Фумаровая кислота 17,78% масс./масс., Микрокристаллическая целлюлоза 20,53% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 4,34% масс./масс., Стеарат магния 1,17% масс./масс.; Слой с 3ТС: Ламивудин 33,33% масс./масс., Микрокристаллическая целлюлоза 2,85% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 0,74% масс./масс., Стеарат магния 0,30% масс./масс.; или
n) Слой с CVC: Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 184,78 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 39,00 мг, Стеарат магния 10,53 мг; Слой с 3ТС: Ламивудин 300,00 мг, Микрокристаллическая целлюлоза 25,62 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 6,70 мг, Стеарат магния 2,68 мг.
74. Композиция по п. 46, где композиция имеет содержание воды не более чем 4 масс. % примерно через 4 недели воздействия условий с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагопоглотителем в контейнере.
75. Композиция по п. 46, где композиция имеет содержание воды не более чем 2 масс. % примерно через 4 недели воздействия условий с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагопоглотителем в контейнере.
76. Композиция по п. 46, где композиция имеет общее содержание примесей и уровень продуктов деградации не более чем примерно 4,0% через 9 недель воздействия условий с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагопоглотителем в контейнере.
77. Композиция по п. 46, где композиция имеет общее содержание примесей и уровень продуктов деградации не более чем примерно 2,0% через 9 недель воздействия условий с температурой примерно 40°С и 75% относительной влажностью при упаковке с влагопоглотителем в контейнере.
78. Композиция по п. 46, дополнительно содержащая эфавиренз.
79. Композиция по п. 78, где весовое соотношение ценикривирока или его соли, ламивудина и эфавиренза составляет примерно 1:2:4 в расчете на массу свободного основания ценикривирока.
80. Композиция по п.п. 78 или 79, содержащая:
примерно 10,3% ценикривирока или его соли, примерно 18,2% ламивудина и примерно 36,4% эфавиренза;
примерно 9,5% ценикривирока или его соли, примерно 19,1% ламивудина и примерно 38,1% эфавиренза к массе всей композиции и в расчете на массу свободного основания ценикривирока.
81. Композиция по п. 78, где композиция представлена в виде таблетки, по существу соответствующей таблетке, имеющей следующий состав, выбранный из:
a) Слой с CVC/3TC: Ценикривирока мезилат 10,34% масс./масс., Ламивудин 18,18% масс./масс., Фумаровая кислота 9,70% масс./масс., Микрокристаллическая целлюлоза 5,82% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3,70% масс./масс., Стеарат магния 0,74% масс./масс.; Слой с EFV: Эфавиренз 36,36% масс./масс., Микрокристаллическая целлюлоза 7,97% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3,64% масс./масс., Лаурилсульфат натрия 0,73% масс./масс., Гидроксипропилцеллюлоза 2,30% масс./масс., Стеарат магния 0,52% масс./масс.; или
b) Слой с CVC/3TC: Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 96,01 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 61,10 мг, Стеарат магния 12,2 мг; Слой с EFV: Эфавиренз 600,00 мг, Микрокристаллическая целлюлоза 131,50 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 60,00 мг, Лаурилсульфат натрия 12,00 мг, Гидроксипропилцеллюлоза 38,00 мг, Стеарат магния 8,50 мг;
c) Слой с CVC/3TC: Ценикривирока мезилат 10,84% масс./масс., Ламивудин 19,05% масс./масс., Фумаровая кислота 10,16% масс./масс., Микрокристаллическая целлюлоза 6,10% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3,88% масс./масс., Стеарат магния 0,77% масс./масс.; Слой с EFV: Эфавиренз 38,09% масс./масс., Микрокристаллическая целлюлоза 3,82% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3,81% масс./масс., Лаурилсульфат натрия 0,76% масс./масс., Гидроксипропилцеллюлоза 2,22% масс./масс., Стеарат магния 0,50% масс./масс.;
d) Слой с CVC/3TC: Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 96,01 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 61,10 мг, Стеарат магния 12,2 мг; Слой с EFV: Эфавиренз 600,00 мг, Микрокристаллическая целлюлоза 60,20 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 60,00 мг, Лаурилсульфат натрия 12,00 мг, Гидроксипропилцеллюлоза 35,00 мг, Стеарат магния 7,80 мг.
82. Композиция по п. 78, где композиция имеет содержание воды не более чем примерно 4,0 масс. % примерно через 4 недели воздействия условий с температурой примерно 40°С и примерно 75% относительной влажностью при упаковке с влагопоглотителем в контейнере.
83. Композиция по п. 78, где композиция имеет содержание воды не более чем примерно 2,0 масс. % примерно через 4 недели воздействия условий с температурой примерно 40°С и примерно 75% относительной влажностью при упаковке с влагопоглотителем в контейнере.
84. Композиция по п. 78, где композиция имеет общее содержание примесей и уровень продуктов деградации не более чем примерно 4,0% через 9 недель воздействия условий с температурой примерно 40°С и примерно 75% относительной влажностью при упаковке с влагопоглотителем в контейнере.
85. Композиция по п. 78, где композиция имеет общее содержание примесей и уровень продуктов деградации не более чем примерно 2,0% через 9 недель воздействия условий с температурой примерно 40°С и примерно 75% относительной влажностью при упаковке с влагопоглотителем в контейнере.
86. Фармацевтическая композиция, содержащая композицию по одному из пп. 1-85 для лечения вирусной инфекции, воспаления, фиброза или синдрома трансплантат против хозяина.
87. Композиция по п. 86, где композиция находится в форме гранулята.
88. Композиция по п. 86, где композиция находится в форме капсулы.
89. Композиция по п.п. 86, где композиция находится в форме саше.
90. Композиция по п.п. 86, где композиция представлена в таблетке или компоненте таблетки.
91. Композиция по п. 86, дополнительно содержащая фармацевтически неактивные ингредиенты.
92. Композиция по п. 86, где композиция находится в одном или более слоев многослойной таблетки.
93. Композиция по п. 86, где композиция находится в однослойной таблетке.
94. Композиция по п. 92, где композиция находится в бислойной таблетке, содержащей одно ядро и слой снаружи одного ядра.
95. Композиция по п. 94, где композиция дополнительно содержит ламивудин.
96. Композиция по п. 95, где ценикривирок или его соль и фумаровая кислота находятся в ядре и ламивудин находится в слое снаружи одного ядра.
97. Композиция по п. 94, где композиция дополнительно содержит эфавиренз.
98. Композиция по п. 97, где ценикривирок или его соль, фумаровая кислота и ламивудин находятся в ядре и эфавиренз находится в слое снаружи одного ядра.
99. Композиция по п. 86, где композиция представлена в виде таблетки, по существу соответствующей таблетке, имеющей следующий состав, выбранный из:
a) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 252,68 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 58,50 мг и Стеарат магния 8,13 мг;
b) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 272,18 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 39, 00 мг, Стеарат магния 8,13 мг или
c) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 272,18 мг, Поперечно-сшитый поливинилпирролидон 19,50 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 19,50 мг, Стеарат магния 8,13 мг;
d) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 80,00 мг, Микрокристаллическая целлюлоза 66, 35 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 20,70 мг, Стеарат магния 2,55 мг; или
e) Ценикривирока мезилат 26,26% масс./масс., Фумаровая кислота 24,62% масс./масс., Микрокристаллическая целлюлоза 41,87% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 6,00% масс./масс., Стеарат магния 1,25% масс./масс.;
f) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 272,18 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3 9,00 мг, Стеарат магния 8,13 мг; или
g) Ценикривирока мезилат 5,69% масс./масс., Ламивудин 60,00% масс./масс., Фумаровая кислота 5,33% масс./масс., Микрокристаллическая целлюлоза 22,16% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы5,65% масс./масс., Стеарат магния 1,16% масс./масс.;
h) Ценикривирока мезилат 28,45 мг, Ламивудин 300,00 мг, Фумаровая кислота 26,67 мг, Микрокристаллическая целлюлоза 110,82 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 28,25 мг, Стеарат магния 5,81 мг;
i) Ценикривирока мезилат 13,13% масс./масс., Ламивудин 46,15% масс./масс., Фумаровая кислота 12,31% масс./масс., Микрокристаллическая целлюлоза 20,54% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 6,50% масс./масс., Стеарат магния 1,38% масс./масс.;
j) Ценикривирока мезилат 85,35 мг, Ламивудин 300,00 мг, Фумаровая кислота 80,00 мг, Микрокристаллическая целлюлоза 133,46 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 42,25 мг, Стеарат магния 8,94 мг;
k) Ценикривирока мезилат 17,97% масс./масс., Ламивудин 31,58% масс./масс., Фумаровая кислота 16,84% масс./масс., Микрокристаллическая целлюлоза 24,78% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 7,31% масс./масс., Стеарат магния 1,51% масс./масс.;
l) Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 235,43 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 69,50 мг, Стеарат магния 14,38 мг;
m) Ценикривирока мезилат 21,34% масс./масс., Ламивудин 37,50% масс./масс., Фумаровая кислота 20,00% масс./масс., Микрокристаллическая целлюлоза 12,01% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 7,64% масс./масс., Стеарат магния 1,53% масс./масс.;
n) Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 96,01 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 61,10 мг, Стеарат магния 12,20 мг;
о) Ценикривирока мезилат 22,76% масс./масс., Ламивудин 40,00% масс./масс., Фумаровая кислота 21,33% масс./масс., Микрокристаллическая целлюлоза 5,82% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 8,55% масс./масс., Стеарат магния 1,53% масс./масс.;
р) Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 43,66 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 64,15 мг, Стеарат магния 11,15 мг;
q) Ценикривирока мезилат 22, 76% масс./масс., Ламивудин 40,00% масс./масс., Фумаровая кислота 21,33% масс./масс., Микрокристаллическая целлюлоза 6,60% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 7,61% масс./масс., Стеарат магния 1,69% масс./масс.;
r) Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 49,51 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 57,10 мг, Стеарат магния 12,70 мг;
s) Слой с CVC: Ценикривирока мезилат 18,96% масс./масс., Фумаровая кислота 17,78% масс./масс., Микрокристаллическая целлюлоза 20,53% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 4,34% масс./масс., Стеарат магния 1,17% масс./масс.; Слой с 3ТС: Ламивудин 33,33% масс./масс., Микрокристаллическая целлюлоза 2,85% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 0, 74% масс./масс., Стеарат магния 0,30% масс./масс.; или
t) Слой с CVC: Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 184,78 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 39,00 мг, Стеарат магния 10,53 мг; Слой с 3ТС: Ламивудин 300,00 мг, Микрокристаллическая целлюлоза 25,62 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 6,70 мг, Стеарат магния 2,68 мг или
u) Слой с CVC/3TC: Ценикривирока мезилат 10,34% масс./масс., Ламивудин 18,18% масс./масс., Фумаровая кислота 9,70% масс./масс., Микрокристаллическая целлюлоза 5,82% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3,70% масс./масс., Стеарат магния 0,74% масс./масс.; Слой с EFV: Эфавиренз 36,36% масс./масс., Микрокристаллическая целлюлоза 7,97% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3,64% масс./масс., Лаурилсульфат натрия 0,73% масс./масс., Гидроксипропилцеллюлоза 2,30% масс./масс., Стеарат магния 0,52% масс./масс.; или
v) Слой с CVC/3TC: Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 96,01 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 61,10 мг, Стеарат магния 12,2 мг; Слой с EFV: Эфавиренз 600,00 мг, Микрокристаллическая целлюлоза 131,50 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 60,00 мг, Лаурилсульфат натрия 12,00 мг, Гидроксипропилцеллюлоза 38,00 мг, Стеарат магния 8,50 мг;
w) Слой с CVC/3TC: Ценикривирока мезилат 10,84% масс./масс., Ламивудин 19,05% масс./масс., Фумаровая кислота 10,16% масс./масс., Микрокристаллическая целлюлоза 6,10% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3,88% масс./масс., Стеарат магния 0,77% масс./масс.; Слой с EFV: Эфавиренз 38,09% масс./масс., Микрокристаллическая целлюлоза 3,82% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3,81% масс./масс., Лаурилсульфат натрия 0,76% масс./масс., Гидроксипропилцеллюлоза 2,22% масс./масс., Стеарат магния 0,50% масс./масс.;
х) Слой с CVC/3TC: Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 96,01 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 61,10 мг, Стеарат магния 12,2 мг; Слой с EFV: Эфавиренз 600,00 мг, Микрокристаллическая целлюлоза 60,20 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 60,00 мг, Лаурилсульфат натрия 12,00 мг, Гидроксипропилцеллюлоза 35,00 мг, Стеарат магния 7,80 мг.
100. Таблетка для лечения вирусной инфекции, воспаления, фиброза или синдрома трансплантат против хозяина, по существу соответствующая таблетке, имеющей следующий состав, выбранный из:
а) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 252,68 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 58,50 мг и Стеарат магния 8,13 мг;
b) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 272,18 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 39,00 мг, Стеарат магния 8,13 мг или
c) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 272,18 мг, Поперечно-сшитый поливинилпирролидон 19,50 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 19,50 мг, Стеарат магния 8,13 мг;
d) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 80,00 мг, Микрокристаллическая целлюлоза 66,35 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 20,70 мг, Стеарат магния 2,55 мг; или
e) Ценикривирока мезилат 26,26% масс./масс., Фумаровая кислота 24,62% масс./масс., Микрокристаллическая целлюлоза 41,87% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 6,00% масс./масс., Стеарат магния 1,25% масс./масс.;
f) Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 272,18 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 39,00 мг, Стеарат магния 8,13 мг; или
g) Ценикривирока мезилат 5,69% масс./масс., Ламивудин 60,00% масс./масс., Фумаровая кислота 5,33% масс./масс., Микрокристаллическая целлюлоза 22,16% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 5,65% масс./масс., Стеарат магния 1,16% масс./масс.;
h) Ценикривирока мезилат 28,45 мг, Ламивудин 300,00 мг, Фумаровая кислота 26,67 мг, Микрокристаллическая целлюлоза 110,82 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 28,25 мг, Стеарат магния 5,81 мг;
i) Ценикривирока мезилат 13,13% масс./масс., Ламивудин 46,15% масс./масс., Фумаровая кислота 12,31% масс./масс., Микрокристаллическая целлюлоза 20,54% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 6,50% масс./масс., Стеарат магния 1,38% масс./масс.;
j) Ценикривирока мезилат 85,35 мг, Ламивудин 300,00 мг, Фумаровая кислота 80,00 мг, Микрокристаллическая целлюлоза 133,46 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 42,25 мг, Стеарат магния 8,94 мг;
k) Ценикривирока мезилат 17,97% масс./масс., Ламивудин 31,58% масс./масс., Фумаровая кислота 16,84% масс./масс., Микрокристаллическая целлюлоза 24,78% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 7,31% масс./масс., Стеарат магния 1,51% масс./масс.;
l) Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 235,43 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 69,50 мг, Стеарат магния 14,38;
m) Ценикривирока мезилат 21,34% масс./масс., Ламивудин 37,50% масс./масс., Фумаровая кислота 20,00% масс./масс., Микрокристаллическая целлюлоза 12,01% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 7,64% масс./масс., Стеарат магния 1,53% масс./масс.;
n) Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 96,01 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 61,10 мг, Стеарат магния 12,20 мг;
о) Ценикривирока мезилат 22,76% масс./масс., Ламивудин 40,00% масс./масс., Фумаровая кислота 21,33% масс./масс., Микрокристаллическая целлюлоза 5,82% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 8,55% масс./масс., Стеарат магния 1,53% масс./масс.;
р) Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 43,66 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 64,15 мг, Стеарат магния 11,15 мг;
q) Ценикривирока мезилат 22,76% масс./масс., Ламивудин 40,00% масс./масс., Фумаровая кислота 21,33% масс./масс., Микрокристаллическая целлюлоза 6,60% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 7,61% масс./масс., Стеарат магния 1,69% масс./масс.;
r) Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 49,51 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 57,10 мг, Стеарат магния 12,70 мг;
s) Слой с CVC: Ценикривирока мезилат 18,96% масс./масс., Фумаровая кислота 17,78% масс./масс., Микрокристаллическая целлюлоза 20,53% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 4,34% масс./масс., Стеарат магния 1,17% масс./масс.; Слой с 3ТС: Ламивудин 33,33% масс./масс., Микрокристаллическая целлюлоза 2,85% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 0,74% масс./масс., Стеарат магния 0,30% масс./масс.; или
t) Слой с CVC: Ценикривирока мезилат 170,69 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 184,78 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 39,00 мг, Стеарат магния 10,53 мг; Слой с 3ТС: Ламивудин 300,00 мг, Микрокристаллическая целлюлоза 25,62 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 6,70 мг, Стеарат магния 2,68 мг или
u) Слой с CVC/3TC: Ценикривирока мезилат 10,34% масс./масс., Ламивудин 18,18% масс./масс., Фумаровая кислота 9,70% масс./масс., Микрокристаллическая целлюлоза 5,82% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3,70% масс./масс., Стеарат магния 0,74% масс./масс.; Слой с EFV: Эфавиренз 36,36% масс./масс., Микрокристаллическая целлюлоза 7,97% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3,64% масс./масс., Лаурилсульфат натрия 0,73% масс./масс., Гидроксипропилцеллюлоза 2,30% масс./масс., Стеарат магния 0,52% масс./масс.; или
v) Слой с CVC/3TC: Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 96,01 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 61,10 мг, Стеарат магния 12,2 мг; Слой с EFV: Эфавиренз 600,00 мг, Микрокристаллическая целлюлоза 131,50 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 60,00 мг, Лаурилсульфат натрия 12,00 мг, Гидроксипропилцеллюлоза 38,00 мг, Стеарат магния 8,50 мг;
w) Слой с CVC/3TC: Ценикривирока мезилат 10,84% масс./масс., Ламивудин 19,05% масс./масс., Фумаровая кислота 10,16% масс./масс., Микрокристаллическая целлюлоза 6,10% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3,88% масс./масс., Стеарат магния 0,77% масс./масс.; Слой с EFV: Эфавиренз 38,09% масс./масс., Микрокристаллическая целлюлоза 3,82% масс./масс., Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 3,81% масс./масс., Лаурилсульфат натрия 0,76% масс./масс., Гидроксипропилцеллюлоза 2,22% масс./масс., Стеарат магния 0,50% масс./масс.;
х) Слой с CVC/3TC: Ценикривирока мезилат 170,69 мг, Ламивудин 300,00 мг, Фумаровая кислота 160,00 мг, Микрокристаллическая целлюлоза 96,01 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 61,10 мг, Стеарат магния 12,2 мг; Слой с EFV: Эфавиренз 600,00 мг, Микрокристаллическая целлюлоза 60,20 мг, Натриевая соль поперечно-сшитой карбоксиметилцеллюлозы 60,00 мг, Лаурилсульфат натрия 12,0 0 мг, Гидроксипропилцеллюлоза 35,00 мг, Стеарат магния 7,80 мг.
101. Композиция по п. 1, композиция по п. 86 или таблетка по п. 100, которая представляет покрытый субстрат.
102. Способ получения композиции по пп. 1-85, где способ включает:
смешивание ценикривирока или его соли и фумаровой кислоты с получением смеси и
сухое гранулирование смеси.
103. Способ по п. 102, где ценикривирок или его соль представляет ценикривирока мезилат.
104. Способ по п.п. 102 или 103, дополнительно включающий смешивание одного или более наполнителей с ценикривироком или его солью и фумаровой кислотой с получением смеси.
105. Способ по п. 102, где один или более наполнителей выбраны из микрокристаллической целлюлозы, двуосновного фосфата кальция, целлюлозы, лактозы, сахарозы, маннита, сорбита, крахмала и карбоната кальция.
106. Способ по п. 102, где один или более наполнителей представляет микрокристаллическую целлюлозу.
107. Способ по п. 102, дополнительно включающий смешивание одного или более разрыхлителей с ценикривироком или его солью и фумаровой кислотой с получением смеси.
108. Способ по п. 107, где один или более разрыхлителей выбраны из поперечно-сшитого поливинилпирролидона, натриевой соли поперечно-сшитой карбоксиметилцеллюлозы и натрия крахмала гликолята.
109. Способ по п. 107 или 108, где один или более разрыхлителей представляет натриевую соль поперечно-сшитой карбоксиметилцеллюлозы.
110. Способ по п. 102, дополнительно включающий смешивание одного или более смазывающих агентов с ценикривироком или его солью и фумаровой кислотой с получением смеси.
111. Способ по п. 110, где один или более смазывающих агентов выбраны из стеарина, стеарата магния и стеариновой кислоты.
112. Способ по п. 110 или 111, где один или более смазывающих агентов представляет стеарат магния.
113. Способ по п. 102, дополнительно включающий прессование сухой гранулированной смеси в таблетку.
114. Способ по п. 102, дополнительно включающий наполнение капсулы сухой гранулированной смесью.
115. Способ по п. 102, дополнительно включающий смешение сухой гранулированной смеси с одним или более внегранулярными веществами.
116. Способ по п. 115, где одно или более внегранулярных веществ представляет один или более дополнительных фармацевтически активных агентов, выбранных из ламивудина или эфавиренза.
117. Способ по п. 116, где дополнительный фармацевтически активный агент представляет ламивудин.
118. Способ по п. 116, где один или более дополнительных фармацевтически активных агентов представляют ламивудин и эфавиренз.
119. Способ лечения заболевания, расстройства или состояния, включающий введение терапевтически эффективного количества композиции по пп. 1-85, композиции по пп. 86-99, таблетки по п. 100 или композиции, полученной способом по пп. 110-118, субъекту, где заболевание, расстройство или состояние представляет собой вирусную инфекцию, воспаление, фиброз или синдром трансплантат против хозяина.
120. Способ по п. 119, где заболевание, расстройство или состояние представляет вирусную инфекцию.
121. Способ по п. 119 или 120, где заболевание, состояние или расстройство представляет ретровирусную инфекцию.
122. Способ по п. 119, где заболевание, состояние или расстройство представляет гепатит, инфекцию, вызванную вирусом иммунодефицита человека, или вирусную саркому.
123. Способ по п. 119, где заболевание, состояние или расстройство представляет инфекцию, вызванную вирусом иммунодефицита человека.
124. Способ по п. 119, где заболевание, расстройство или состояние представляет воспаление.
125. Способ по п. 119 или 124, где заболевание, расстройство или состояние представляет синдром трансплантат против хозяина, воспаление при диабете или воспаление органов сердечно-сосудистой системы.
126. Способ по п. 119 или 124, где заболевание, расстройство или состояние представляет синдром трансплантат против хозяина или его профилактику.
127. Способ по п. 119, где заболевание, расстройство или состояние представляет собой фиброз.
128. Способ получения композиции по любому из пп. 86-99, где указанный способ включает:
смешивание ценикривирока или его соли и фумаровой кислоты с получением смеси и
сухое гранулирование смеси.
129. Способ по п. 127 или 128, где ценикривирок или его соль представляет ценикривирока мезилат.
130. Способ по п. 127 или 128, дополнительно включающий смешивание одного или более наполнителей с ценикривироком или его солью и фумаровой кислотой с получением смеси.
131. Способ по п. 127 или 128, где один или более наполнителей выбраны из микрокристаллической целлюлозы, двуосновного фосфата кальция, целлюлозы, лактозы, сахарозы, маннита, сорбита, крахмала и карбоната кальция.
132. Способ по п. 127 или 128, где один или более наполнителей представляет микрокристаллическую целлюлозу.
133. Способ по п. 127 или 128, дополнительно включающий смешивание одного или более разрыхлителей с ценикривироком или его солью и фумаровой кислотой с получением смеси.
134. Способ по п. 127 или 128, дополнительно включающий смешивание одного или более смазывающих агентов с ценикривироком или его солью и фумаровой кислотой с получением смеси.
135. Способ по п. 127 или 128, дополнительно включающий прессование сухой гранулированной смеси в таблетку.
136. Способ по п. 127 или 128, дополнительно включающий наполнение капсулы сухой гранулированной смесью.
137. Способ по п. 127 или 128, дополнительно включающий смешение сухой гранулированной смеси с одним или более внегранулярными веществами.
138. Способ получения таблетки по п. 100, причем указанный способ включает:
смешивание ценикривирока или его соли и фумаровой кислоты с получением смеси и
сухое гранулирование смеси.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| 1996 |
|
RU2167649C2 | |
| US2013023496 A1, 24.01.2013 | |||
| US6858230 B1, 22.02.2005 | |||
| US 6194002 B1, 27.02.2001 | |||
| Bruce L Gilliam et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| J Transl Med | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2017-10-11—Публикация
2014-05-15—Подача