Перекрестная ссылка на родственные заявки
Настоящая заявка испрашивает приоритет предварительной патентной заявки ЮАР № 2015/08499, поданной 18 ноября 2015 г., которая включена сюда посредством ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к устройству для обнаружения целевых биомолекул. В частности, оно относится к устройству для обнаружения целевых биомолекул посредством измерения изменения электропроводности электропроводящей мембраны, к которой прикреплен компонент биологического распознавания, выполненный с возможностью связывания целевой биомолекулы.
Предпосылки изобретения
Ранняя диагностика патогенных инфекций может способствовать уменьшению числа вызванных патогенными инфекциями у людей случаев заболевания и смертности. Дальнейшее сокращение инфекций может обеспечиваться посредством обнаружения возбудителей заболеваний в воде или пище до ее употребления. Традиционные способы обнаружения возбудителей заболеваний, такие как полимеразная цепная реакция, способы на иммунологической основе и счет культур и колоний, как правило, занимают продолжительное время на получение точных результатов и могут оказываться дорогостоящими и недоступными в отдаленных местах. Для решения этой проблемы были разработаны разнообразные биосенсоры, которые обнаруживают биомолекулы в целях диагностики или контроля качества.
Электрохимические биосенсоры представляют собой датчики, используемые для обнаружения суспендированных в растворе целевых биомолекул посредством молекулярного распознавания. Типичный электрохимический биосенсор включает в себя по меньшей мере один электрод с иммобилизованными на поверхности электрода компонентами биологического распознавания, которые способны связываться или образовывать комплексы с целевыми биомолекулами в растворе. Компоненты биологического распознавания могут быть, например, патогенами или антигенами, антителами, ферментами или нуклеиновыми кислотами. Биосенсоры выполнены с возможностью измерения изменений электропроводности электрода вследствие образования связей или комплексов между биомолекулами из раствора и иммобилизованными на электроде компонентами биологического распознавания. По сути, измеряют изменения сопротивления электрода при подсоединении к электрической цепи, в которой существуют постоянная разность потенциалов и ток.
Недавние разработки в области электрохимических биодатчиков привели к применению так называемых «электротканей», которые представляют собой мембраны, состоящие из полимерных волокон, на которые было нанесено электропроводящее полимерное покрытие, в качестве электрода. Микроволокна обеспечивают большую площадь поверхности для иммобилизации значительного количества компонентов биологического распознавания на поверхности электрода.
Заявителю известна система лабораторного масштаба, в которой электроткань погружена в буферный раствор и подсоединена к цепи посредством проводящих металлических зажимов, которые служат электродами. Как электроткань, так и зажимы погружены в раствор, содержащий соли – хлорид натрия, хлорид калия, фосфат натрия и фосфат калия. Затем к этому буферному раствору добавляют раствор образца, в котором содержатся подлежащие обнаружению биомолекулы, и измеряют изменения электропроводности электроткани после добавления раствора образца. Однако погруженные электроды принимают участие в электрохимических реакциях с солями в растворе, давая значительные фоновые эффекты в течение процесса обнаружения, что снижает чувствительность системы. В результате погружения в солевой раствор электроды также подвергаются разрушению с течением времени под действием окислительно-восстановительных реакций на поверхности электродов. Кроме того, этой системе требуется относительно большой объем буферного раствора, который может не быть легкодоступным за пределами лабораторного помещения.
Как правило, существующие системы, в которых используются электроткани для обнаружения биомолекул, представляют собой сложные системы лабораторного масштаба, которые могут оказаться не подходящими для использования в полевых условиях или повторного использования и могут быть недостаточно чувствительными для использования с очень малыми образцами текучей среды. Таким образом, по-прежнему существует потребность в экономичном, универсальном, чувствительном и надежном устройстве для обнаружения присутствия биомолекул. В идеале такое устройство должно иметь относительно простую конструкцию и быть легким в эксплуатации, так чтобы оно могло использоваться в полевых условиях в целях быстрого обнаружения биомолекул, с которыми связаны патогенные инфекции или загрязнения.
Предшествующее обсуждение предпосылок изобретения предназначено исключительно для того, чтобы способствовать пониманию настоящего изобретения. Следует понимать, что данное обсуждение не является признанием или допущением того, что какой-либо из вышеупомянутых материалов был общеизвестным в технике по состоянию на дату приоритета заявки.
Сущность изобретения
В соответствии с изобретением предлагается устройство для обнаружения целевых биомолекул, включающее электропроводящую мембрану с иммобилизованным на ней компонентом биологического распознавания, выполненным с возможностью связывания целевой биомолекулы, причем мембрана подсоединена к электрической цепи посредством электродов; источник напряжения для обеспечения напряжения в электрической цепи; и устройство контроля сопротивления, выполненное с возможностью контроля сопротивления мембраны, когда выбранный объем образца текучей среды подается на мембрану.
Другие признаки предусматривают, что мембрана устанавливается на непроводящую опору, которая предназначена для приема и удержания электропроводящей мембраны с возможностью снятия таким образом, что она контактирует с электродами; причем опора образует камеру, в которой заключена мембрана; электроды проходят в камеру для контакта с заключенной в ней мембраной; опора включает впуск для подачи выбранного объема образца текучей среды на мембрану; и выбранный объем образца текучей среды составляет от 10 до 1000 мкл.
Еще другие признаки предусматривают, что мембрана выполнена из обладающих собственной электропроводностью волокон или полимерных волокон с нанесенным на них электропроводящим покрытием; причем это электропроводящее покрытие представляет собой полимерное покрытие, выбранное из группы, которую составляют полипиррол, политиофен, полианилин и полиацетилен, необязательно включающее легирующее вещество.
Дополнительные признаки предусматривают, что компонент биологического распознавания прикрепляется к мембране сшивающим веществом; причем этот компонент биологического распознавания представляет собой антиген для оперативного связывания целевого антитела или антитело для оперативного связывания целевого антигена.
Другие признаки предусматривают, что устройство включает в себя контроллер, выполненный с возможностью выдачи машиночитаемых команд источнику напряжения на подачу напряжения и дополнительно выполненный с возможностью выдачи машиночитаемых команд устройству контроля сопротивления на его контроль и снятие показаний сопротивления на мембране; причем контроллер выполнен с возможностью выдачи машиночитаемых команд сигнальному компоненту, который сигнализирует об обнаружении целевой биомолекулы, если устройством контроля сопротивления измерено сопротивление выше заданного порогового сопротивления, которое представляет собой сопротивление мембраны без поданного на мембрану образца текучей среды; контроллер выполнен с возможностью обработки показаний сопротивления на мембране для определения количества биомолекул в образце и оценки уровня загрязнения или инфицирования образца текучей среды; и контроллер имеет пользовательский интерфейс и дисплей для отображения сигнала, определенного количества биомолекул и/или уровня загрязнения или инфицирования.
Еще один признак предусматривает, что устройство контроля сопротивления представляет собой измеряющее напряжение устройство, подсоединенное на мембране и предназначенное для определения сопротивления мембраны по измеренному на мембране падению напряжения.
Еще один признак предусматривает, что устройство является портативным и запитывается от аккумулятора.
В соответствии со вторым аспектом изобретения предлагается способ обнаружения целевых биомолекул с использованием описанного выше устройства, включающий следующие стадии:
подача выбранного объема образца текучей среды на электропроводящую мембрану, на которой иммобилизован компонент биологического распознавания, выполненный с возможностью связывания целевой биомолекулы;
контроль сопротивления мембраны; и,
если сопротивление больше порогового сопротивления, выдача сигнала об обнаружении целевой биомолекулы.
Далее будет описан вариант осуществления изобретения, исключительно в качестве примера, со ссылкой на сопровождающие чертежи.
Краткое описание чертежей
На чертежах:
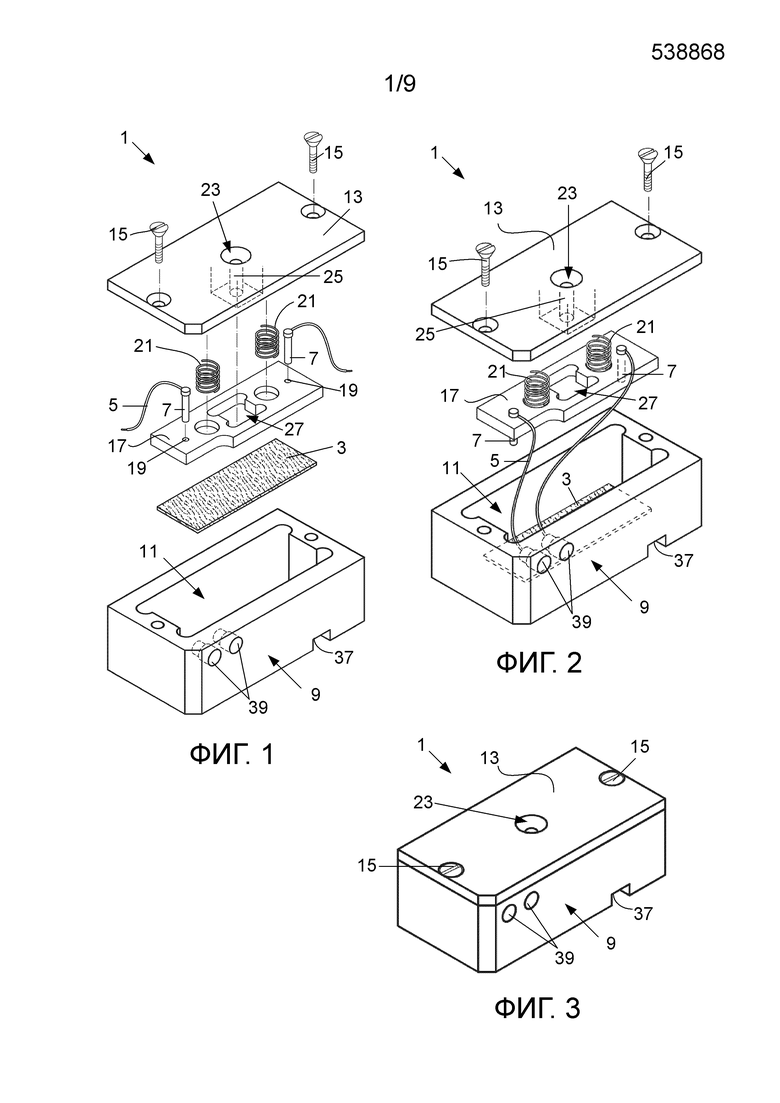
фиг. 1 – трехмерное изображение с пространственным разделением деталей варианта устройства для обнаружения целевых биомолекул в соответствии с изобретением;
фиг. 2 – трехмерное изображение с пространственным разделением деталей варианта по фиг. 1 с разнообразными деталями в своих соответствующих положениях;
фиг. 3 – трехмерное изображение варианта по фиг. 1 в собранном состоянии;
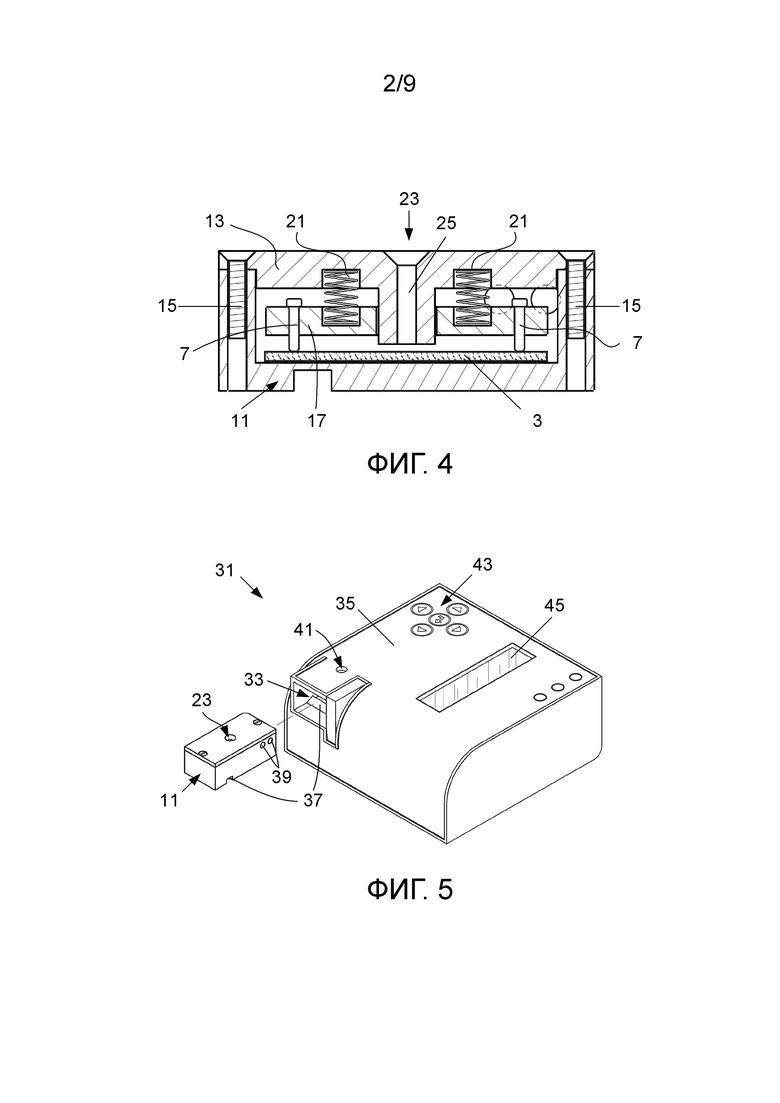
фиг. 4 – изображение в поперечном разрезе варианта по фиг. 1 в собранном состоянии;
фиг. 5 – трехмерное изображение варианта по фиг. 1 в собранном состоянии и контроллера;
фиг. 6 – трехмерное изображение с пространственным разделением деталей другого варианта устройства для обнаружения биомолекул;
фиг. 7 – вид снизу опоры, снабженной электродами;
фиг. 8 – вид сверху опоры по фиг. 7;
фиг. 9 – трехмерное изображение опоры в сборе с крышкой;
фиг. 10 – принципиальная схема электрической цепи по варианту осуществления изобретения;
фиг. 11 – график, показывающий зависимость от времени сопротивления трех различных электропроводящих мембран, изготовленных одинаковым способом;
фиг. 12 – график, показывающий зависимость от времени сопротивления трех различных электропроводящих мембран, к которым прикреплен сшивающий реагент глутаровый альдегид;
фиг. 13 – график, показывающий зависимость от времени сопротивления трех различных электропроводящих мембран, к которым прикреплены сшивающий реагент, глутаровый альдегид, и белок лизоцим;
фиг. 14 – график, показывающий зависимость от времени сопротивления четырех различных электропроводящих мембран с лизоцимом, на которые нанесено 200 мкл раствора 313,6 мкл/мл антител;
фиг. 15 – график, показывающий четыре графика зависимости от времени сопротивления четырех различных электропроводящих мембран с лизоцимом, на которые нанесено 200 мкл раствора 15,8 мкл/мл антител;
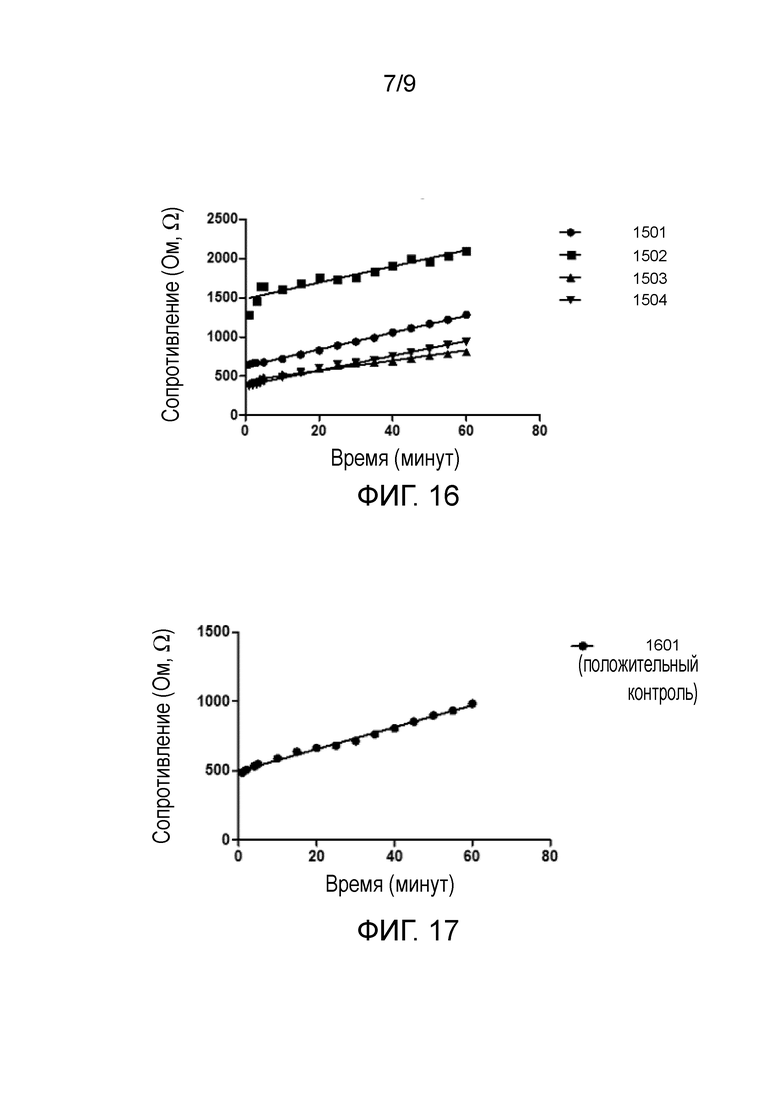
фиг. 16 – график, показывающий четыре графика зависимости от времени сопротивления четырех различных электропроводящих мембран с лизоцимом, на которые нанесено 200 мкл раствора 0,8 мкл/мл антител;
фиг. 17 – график зависимости от времени сопротивления электропроводящей мембраны с лизоцимом, на которую нанесено 200 мкл раствора 15,8 мкл/мл антител, содержащего неспецифические к лизоциму антитела;
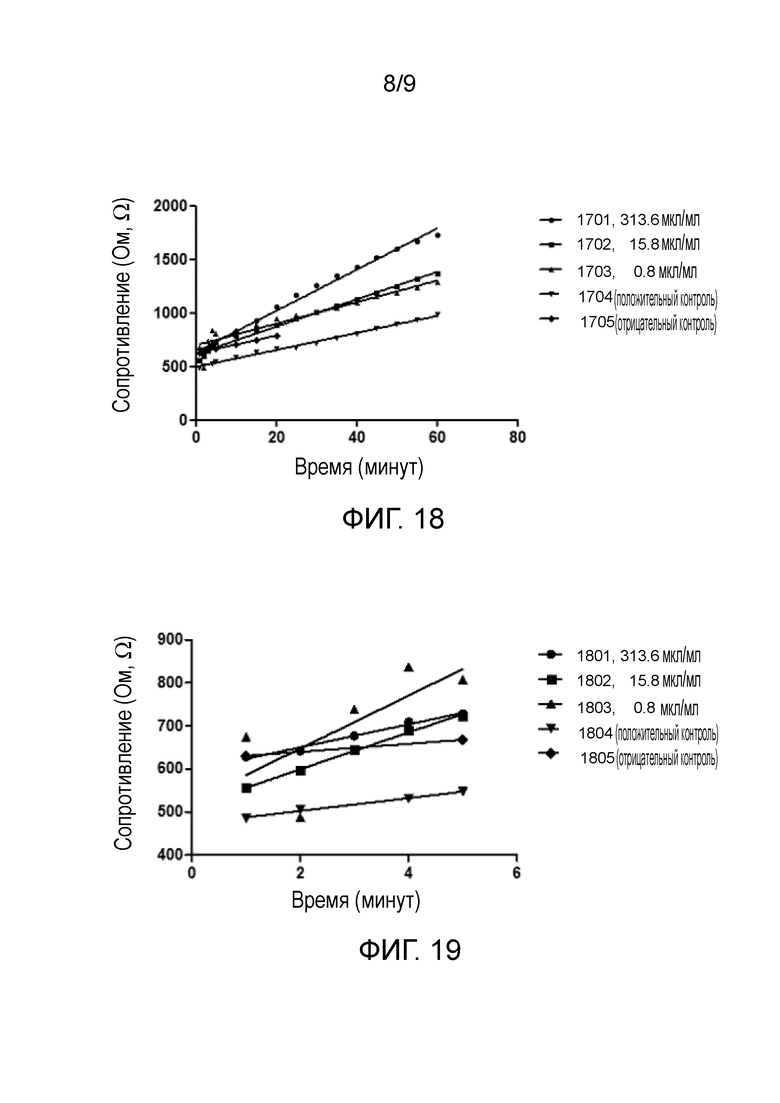
фиг. 18 – график, показывающий объединенные графики зависимости от времени сопротивления мембраны для каждой из различных концентраций нанесенного на мембрану раствора антител (313,6, 15,8 и 0,8 мкл/мл), а также включающий объединенный график для нанесения содержащего неспецифические антитела раствора и не содержащего антител раствора в качестве положительного и отрицательного контроля соответственно;
фиг. 19 – график, показывающий первые пять минут объединенных графиков зависимости от времени сопротивления по фиг. 18;
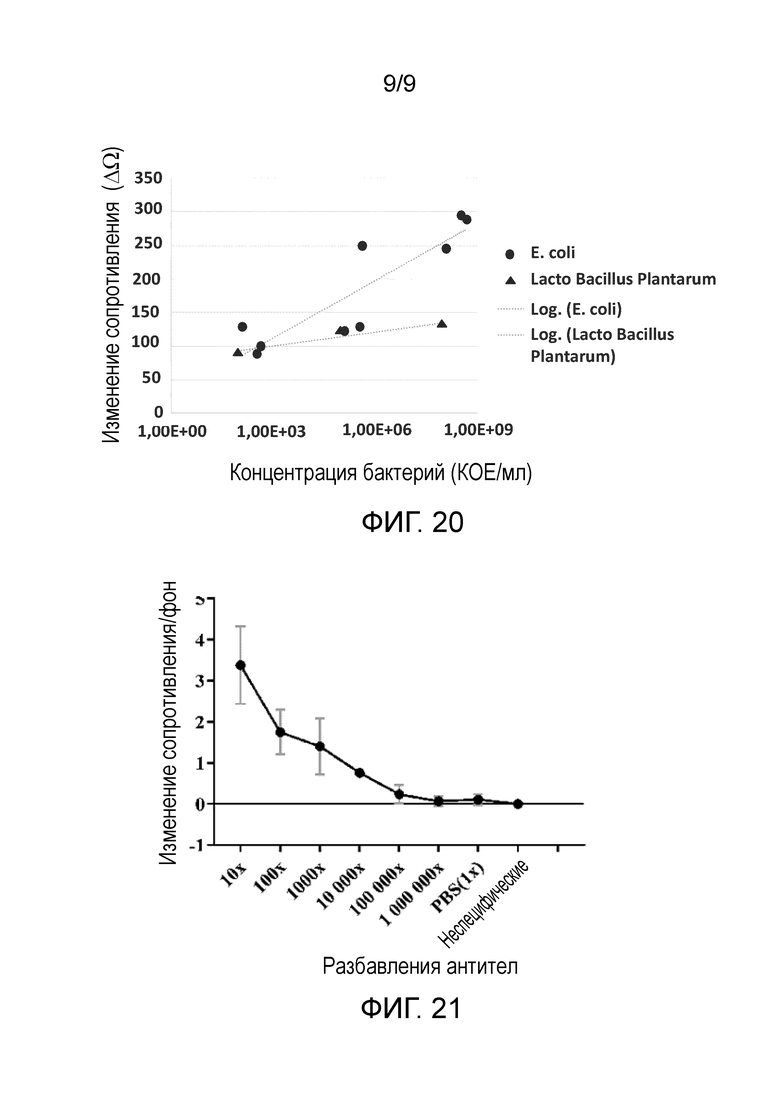
фиг. 20 – график, показывающий увеличение сопротивления мембраны после первых пяти минут в зависимости от концентрации бактерий; и
фиг. 21 – график изменения сопротивления мембран на бумажной основе по отношению к фоновому сопротивлению после помещения раствора антилизоцимных антител на мембрану на бумажной основе с иммобилизованным на ней лизоцимом.
Подробное описание со ссылкой на чертежи
Изобретение предлагает устройство для обнаружения целевых биомолекул в текучей среде с использованием электропроводящей мембраны с иммобилизованным на ней компонентом биологического распознавания, выполненным с возможностью связывания целевой биомолекулы. Мембрана подсоединена к электрической цепи посредством электродов, выполненных из электропроводного металла, такого как золото, медь или платина. Источник напряжения, включенный в цепь, подает на мембрану напряжение, которое выбирается находящимся в таком интервале напряжения, который не вызывает денатурацию или разложение иммобилизованного на мембране компонента биологического распознавания. Устройство контроля сопротивления контролирует (отслеживает) сопротивление мембраны, когда на мембрану подается выбранный объем образца текучей среды, предположительно содержащего биомолекулу, способную соединяться с компонентом биологического распознавания. Устройство контроля сопротивления может представлять собой измеряющее напряжение устройство, подсоединенное на мембране. Сопротивление мембраны затем определяется по измеренному на мембране падению напряжения.
Мембрана устанавливается на непроводящей опоре. Опора выполнена с возможностью приема и удержания электропроводящей мембраны с возможностью снятия таким образом, чтобы она простиралась между электродами. Электроды могут быть прикреплены к или регулируемо закреплены на опоре так, чтобы проходить от опоры к мембране. Мембрана может быть проложена между электродами или между электродами и опорой. Электроды расположены соответствующим образом, чтобы контактировать с мембраной, и могут смешаться в положение, в котором они контактируют с мембраной, посредством подходящего смещающего приспособления, такого как пружина. Опора может образовывать камеру, в которой заключена мембрана, чтобы защищать мембрану от окружающей среды и обеспечивать в ней относительно постоянные условия исследования. Электроды затем проходят от опоры и заходят в камеру, где они входят в контакт с мембраной. Если это требуется, опора может иметь отверстия для доступа к проводам цепи, проходящим через опору к электродам внутри камеры.
Опора может образовывать впуск для подачи на мембрану выбранного объема образца текучей среды, предпочтительно составляющего от 10 до 1000 мкл, а предпочтительнее от 100 до 300 мкл. Впуск может располагаться так, что выбранный объем образца текучей среды подается на центральную область мембраны, и может располагаться между электродами вдоль длины опоры.
Мембрана может быть выполнена из обладающих собственной электропроводностью полимерных волокон или волокон с нанесенным на них электропроводящим покрытием. Мембрану могут составлять очень тонкие, высокографитовые трубчатые углеродные нановолокна, которые термообработаны для карбонизации химически осажденного из паровой фазы углерода, присутствующего на поверхности нановолокон, такие как Pyrograf-III-LHT. В качестве альтернативы, полимерные волокна могут представлять собой натуральные или синтетические волокна, на которые нанесено электропроводящее покрытие, такое как полимерное покрытие, выбранное из группы, которую составляют полипиррол, политиофен, полианилин и полиацетилен. В случае натуральных волокон мембрана может быть выполнена из целлюлозных волокон, спрессованных в бумагу выбранной толщины, на которые нанесено электропроводящее покрытие. В качестве альтернативы, электропроводящее покрытие может быть нанесено на волокна синтетического полимера полипропилена.
Компонентом биологического распознавания может быть антиген, антитело, фермент, нуклеиновая кислота или биомолекула другого типа. Компонент биологического распознавания выполнен с возможностью связывания с целевой биомолекулой. Таким образом, компонент биологического распознавания имеет центр связывания, комплементарный центру связывания на целевой биомолекуле. Например, компонентом биологического распознавания может быть антитело, такое как антитело анти-E. coli, которое может оперативно связывать антиген, такой как бактерии E. coli, обнаруживая загрязнение E. coli в образце воды. В качестве альтернативы, компонентом биологического распознавания может быть антиген, такой как E. coli, который связывает антитело анти-E. coli, обнаруживая инфекцию в образце текучей среды животного происхождения. В том случае, когда компонентом биологического распознавания является нуклеиновая кислота, она может использоваться для обнаружения присутствия целевого вируса.
Компонент биологического распознавания прикрепляется к электропроводящей мембране с помощью подходящего линкера. Любой подходящий линкер может использоваться для того, чтобы прикреплять компонент биологического распознавания к мембране, в зависимости от идентичности и природы компонента биологического распознавания и мембраны соответственно. Линкер должен иметь нужные химические функциональные группы, чтобы и связываться с электропроводящими волокнами посредством функциональных групп, которые могут быть обеспечены на поверхности микроволокон, и связывать выбранный компонент биологического распознавания, предпочтительно ковалентными связями, которые обеспечивают относительно прочную связь.
Устройство может включать в себя контроллер, выполненный с возможностью выдачи машиночитаемых команд источнику напряжения прилагать напряжение и с возможностью выдачи машиночитаемых команд устройству контроля сопротивления контролировать его и снимать показания сопротивления на мембране. Устройство может также включают сигнальный компонент, и в таком случае контроллер дополнительно выполнен с возможностью выдачи машиночитаемых команд сигнальному компоненту, который сигнализирует об обнаружении целевой биомолекулы, если измеряющим напряжение устройством измерено сопротивление, которое больше заданного порогового сопротивления. Заданное пороговое сопротивление может быть установлено соответствующим сопротивлению мембраны без подаваемого на мембрану образца текучей среды; сопротивлению мембраны с поданной на мембрану контрольной текучей средой, практически не содержащей биомолекул; или сопротивлению мембраны с поданной на мембрану контрольной текучей средой, содержащей биомолекулы, которые данный компонент биологического распознавания не распознает и не связывает. В состав устройства может входить вторая контрольная мембрана, сопротивление которой контролируется и измеряется в целях определения порогового сопротивления, используемого для оценки изменения сопротивления первой мембраны с более высокой точностью по сравнению с измеряемым для второй мембраны. Опора может быть соответствующим образом приспособлена для обеспечения возможности приема и удержания второй мембраны и снабжения ее вторым набором электродов и проводов цепи. Опора может также включать второй впуск для подачи контрольного раствора на вторую мембрану, если это требуется.
Контроллер может быть выполнен с возможностью обработки показаний сопротивления на мембране для определения количества биомолекул в образце и оценки уровня загрязнения или инфицирования образца текучей среды. Контроллер может также включать пользовательский интерфейс и дисплей, такой как жидкокристаллический дисплей, ЖКД (LCM1602), для отображения сигнала, определенного количества биомолекул и/или уровня загрязнения или инфицирования.
Устройство может представлять собой портативное, устанавливаемое на месте оказания медицинских услуг устройство, которое запитывается от портативного источника электропитания, такого как батареи (аккумуляторы) или солнечные панели. Источник электропитания может быть выполнен с возможностью одновременной подачи напряжения на электроды, присоединенные к мембране, и питания контроллера и устройства контроля сопротивления.
Вариант устройства (1) для обнаружения биомолекул, проиллюстрированный на фиг. 1-5, включает в себя в целом прямоугольную электропроводящую мембрану (3) размерами примерно 30 мм × 15 мм с иммобилизованным на ее поверхности выбранным компонентом биологического распознавания, таким как антиген или антитело. В данном варианте осуществления мембрана (3) образована из полипропиленовых микроволокон, имея поверхностную плотность 50 г/м2. Микроволокна располагаются, образуя нетканую, фильерную точечно-сплавленную текстильную мембрану. На микроволокна мембраны практически равномерно нанесено проводящее покрытие, в частности полимерное покрытие, с использованием водного процесса осаждения. Проводящее покрытие представляет собой покрытие на основе легированного полипиррола, которое получается посредством сополимеризации микроволокон мембраны с раствором мономера пиррола, содержащим 3-тиофенуксусную кислоту (3TAA). 3TAA обеспечивает включение функциональных групп, с которыми могут образовывать ковалентные связи сшивающие вещества и/или непосредственно компоненты биологического распознавания в целях иммобилизации компонентов биологического распознавания на поверхности микроволокон мембраны. После сополимеризации микроволокна легируются 5-сульфосалициловой кислотой в присутствии раствора хлорида железа(III).
Сшивающее вещество, в данном варианте – глутаровый альдегид, используется для прикрепления компонента биологического распознавания к мембране. Глутаровый альдегид проявляет реакционную способность по отношению к аминогруппам, которые обычно присутствуют в биомолекулах, таких как белки. Электропроводящая мембрана (3), на которой иммобилизован компонент биологического распознавания, присоединяется к электрической цепи посредством электропроводки (5), присоединенной к проводящим электродам (7). В данном варианте электроды выполнены в виде штырьков, изготовленных из золота. Мембрана (3) находится в камере (11), образованной в опоре (9). Камера (11) имеет комплементарную мембране (3) форму. Опора (9) изготовлена из непроводящего материала, такого как пластмассовый материал. Опора (9) включает крышку (13), которая закрывает мембрану (3) внутри камеры (11). Крышка (13) прикрепляется к открытому концу камеры (11) с использованием подходящих креплений или крепежных приспособлений, в данном варианте – винтов (15).
Опора (9) включает монтажную пластину (17) для электродов (7), выполненную с возможностью ее помещения внутрь камеры (11). Монтажная пластина имеет установочные элементы в виде отверстий (19), через которые проходят электроды (7). Отверстия (19) разнесены на выбранное расстояние друг от друга, чтобы позиционировать электроды таким образом, что в собранном состоянии мембрана проходит между ними. Монтажная пластина (17) сдвигается к мембране (3) с помощью сдвигающих приспособлений в виде пружин (21), расположенных при работе между крышкой (13) и монтажной пластиной (17). Пружины (21) своим действием сдвигают электроды к мембране в целях сохранения контакта между электродами (7) и мембраной (3), расположенной на основании камеры (11). Мембрана (3) удерживается в фиксированном положении между электродами (7) и основанием опоры (9). Электроды (7) выполнены с возможностью прикладывать более или менее одинаковое давление к мембране (3) в целях повышения точности показаний сопротивления мембраны (3).
Крышка (13) опоры (9) также образует впуск (23) для подачи (доставки) образца текучей среды в центральную область мембраны при применении. Впуск (23) занимает промежуточное положение между электродами (7) по длине опоры (9). Крышка (13) образует канал (25), проиллюстрированный штриховыми линиями на фиг. 1 и 2 и наиболее четко показанный на фиг. 4. По каналу (25) образец текучей среды направляется на мембрану (3) при применении. Канал (25) проходит через окно (27) в монтажной пластине (17) в направлении мембраны (3) и заканчивается при работе над мембраной (3).
Вариант устройства (31) для обнаружения биомолекул, включающий контроллер, проиллюстрирован на фиг. 5. Опора (9), содержащая мембрану и все собранные компоненты, проиллюстрированная на фиг. 1-4, вставляется в полость (33), образованную в корпусе портативного вычислительного устройства (35). Комплементарные установочные элементы (37) на опоре (9) и вычислительном устройстве (35) обеспечивают то, что опора (9) удерживается на своем месте в полости (33). Корпус вычислительного устройства включает отверстие (41), которое совмещается со впуском (23) опоры (9), когда опора помещена внутрь полости (33), чтобы обеспечивался доступ ко впуску (23) для подачи исследуемого образца текучей среды через отверстие (41) во впуск (23), так что при применении он может проходить на мембрану (3).
Опора (9) имеет два электрических контакта (39), выполненных с возможностью обеспечения электрического соединения между электродами и устройством контроля сопротивления, так что сопротивление мембраны может контролироваться и записываться.
Контроллер, предпочтительно микроконтроллер, выполнен с возможностью выдачи машиночитаемых команд источнику напряжения на приложение напряжения к мембране и выдачи машиночитаемых команд устройству контроля сопротивления на его контроль и снятие показаний сопротивление на мембране после доставки выбранного объема образца текучей среды к мембране. Контроллер дополнительно выполнен с возможностью обрабатывать эти показания сопротивления на мембране, чтобы выдавать сигнал о присутствии биомолекул и/или определять количество биомолекул в образце и оценивать уровень загрязнения или инфицирования образца текучей среды. Контроллер может также включать пользовательский интерфейс (43) для ввода пользователем. ЖКД-дисплей (45) предназначен для отображения сигнала, определенного количества биомолекул и/или уровня загрязнения или инфицирования. В альтернативном варианте осуществления пользовательский интерфейс может быть выполнен с возможностью обеспечения одновременного ввода и вывода пользователем. Вариант по фиг. 5 предусматривает использование портативного, устанавливаемого на месте оказания медицинских услуг устройства для обнаружения целевых биомолекул, запитываемого от аккумулятора. Устройство может быть дополнительно выполнено с возможностью последовательного соединения или беспроводной связи с другим устройством, таким как персональный компьютер или смартфон.
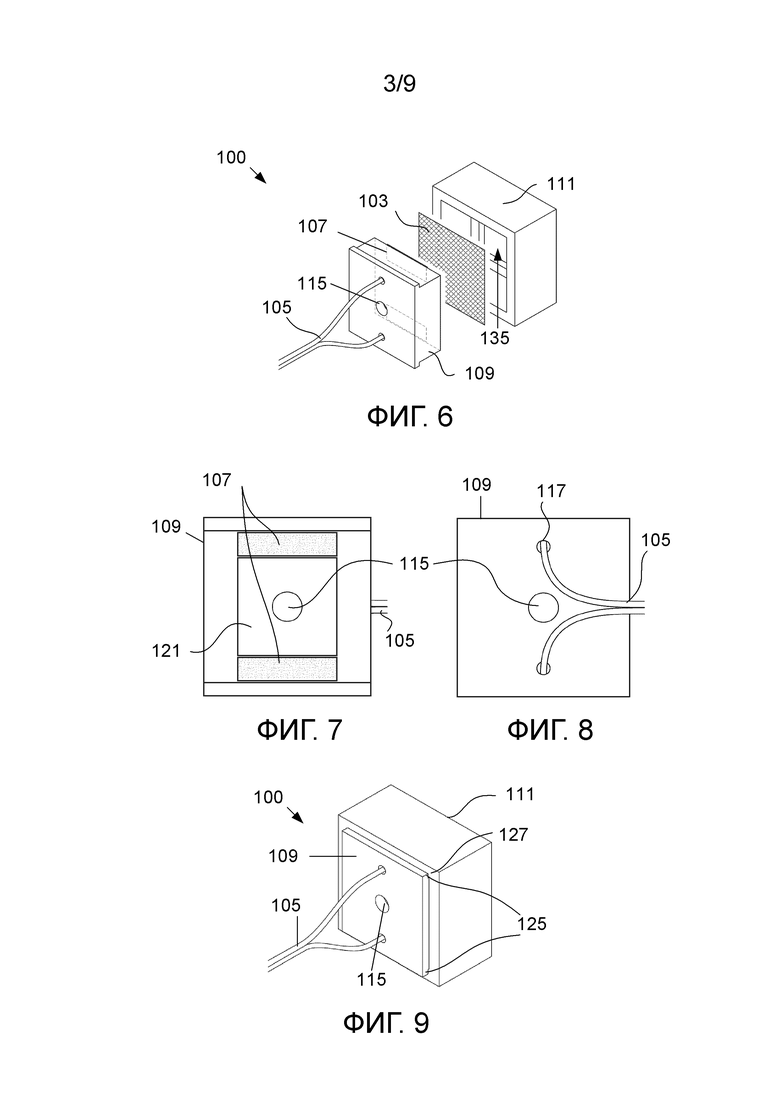
На фиг. 6-9 проиллюстрирован другой вариант устройства (100) для обнаружения биомолекул, которое включает в себя электропроводящую мембрану (103) в целом квадратной формы размерами примерно 30 × 30 мм с иммобилизованным на ней выбранным компонентом биологического распознавания. Электропроводящая мембрана (103), на которой иммобилизован компонент биологического распознавания, присоединяется к электрической цепи посредством электропроводки (105), соединенной с проводящими электродами (107) в виде пластинок, изготовленных из меди. Электроды (107), проиллюстрированные штриховыми линиями на фиг. 6, разнесены друг от друга на расстояние 17 мм и прикреплены к опоре (109). Крышка (111) взаимодействует с опорой, и мембрана (103) удерживается в фиксированном состоянии между крышкой (111) и прикрепленными к опоре (109) электродами (107), когда опора (109), мембрана (103) и крышка (111) собраны.
На фиг. 7 и 8 проиллюстрирована непроводящая опора (109), к которой прикрепляются электроды и которая предпочтительно изготавливается из пластмассы. Опора включает отверстия для доступа (117), проиллюстрированные на фиг. 8, с радиусом 1 мм, обеспечивающие доступ электропроводке (105) проходить через опору (109). Опора дополнительно включает впуск (115) с радиусом 2,2 мм, который располагается между электродами (107) для подачи образца текучей среды на центральную область имеющей квадратную форму мембраны при применении.
Впуск (115) в опоре (109), который обеспечивает впуск образца, сообщается с образованным опорой углублением (121) размерами 17 × 17 мм, на котором находится мембрана в собранном состоянии устройства. Подача через впуск (115), в образованное опорой углубление (121) и на мембрану может осуществляться дозированием выбранного объема образца текучей среды и введением его во впуск (115) с помощью микропипетки. Если микропипетка отсутствует, можно просто накапать несколько капель образца текучей среды через впуск на мембрану. В качестве грубого руководства в отношении объема образца текучей среды, который может быть нанесен капельно, можно вводить приблизительно четыре капли жидкости, что более или менее равно 200 мкл.
Опора (109) выполнена с возможностью взаимодействовать с крышкой (111) для приема и удержания электропроводящей мембраны с возможностью снятия таким образом, что она проходит по меньшей мере частично над электродами с установлением контакта с электродами. Опора (109) и крышка (111) проиллюстрированы на фиг. 9 в собранном состоянии с электропроводкой (105), проходящей к электродам, прикрепленным к опоре (109). Опора (109) имеет такие форму и размеры, чтобы по меньшей мере частично помещаться во внутренней камере крышки (111), так что прикрепленные к поверхности опоры (109) электроды практически примыкают к внутренней поверхности крышки (111) напротив электродов, когда опора (109) и крышка (111) находятся в сборе. Крышка (111) прижимается к электродам (107), когда она собирается с опорой (109), тем самым удерживая мембрану в фиксированном положении между электродами и крышкой (111). Опора (109) включает два выступа (125), проходящих от противоположных сторон опоры (109), которые при сборке с крышкой (111) проходят над частью наружной поверхности (127) крышки (111), ограничивать ту протяженность, на которую опора вставляется в крышку (111).
Крышка (111) обеспечивает то, что среда в непосредственной близости от мембраны является стандартизированной, ограничивая контакт пользователя с мембраной в процессе измерений. В идеальном случае крышка опоры должна оказывать одинаковое усилие на мембрану и электроды, когда она соединяется с опорой. В данном варианте осуществления крышка имеет окно (135) размерами 18 × 18 мм, которое предоставляет пользователю доступ к мембране в целях ее извлечения или модификации. В альтернативном варианте осуществления крышка может иметь закрытый торец.
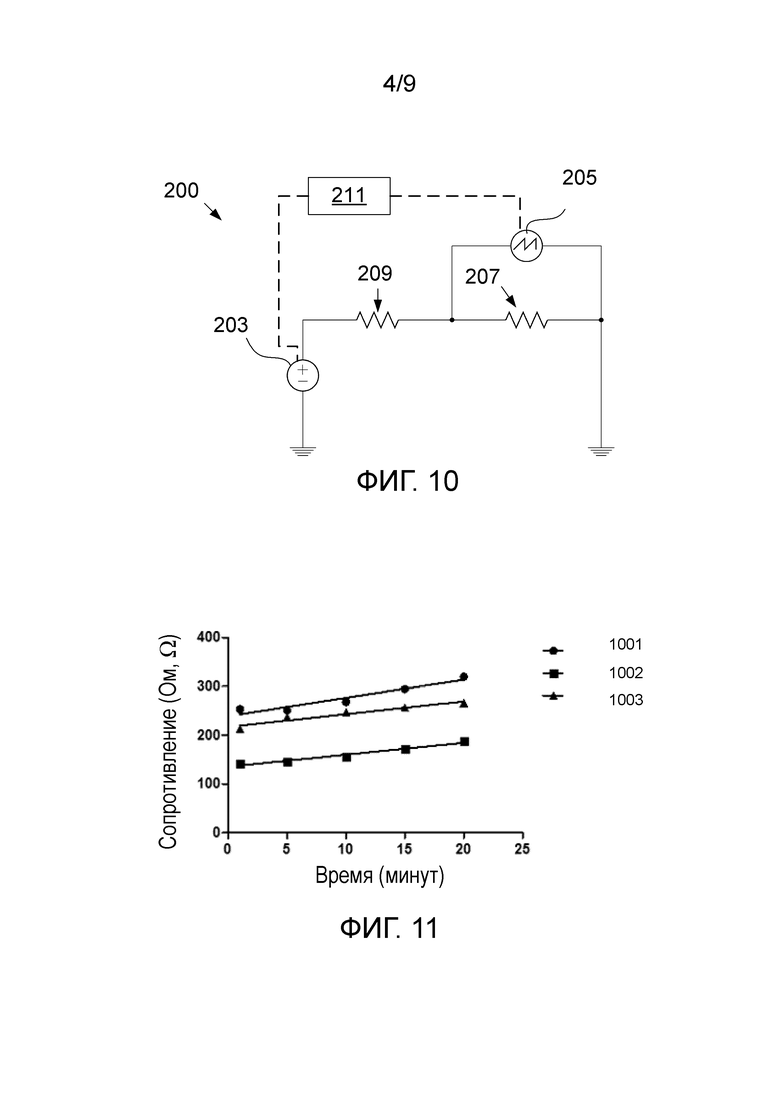
На фиг. 10 схематически проиллюстрирован вариант электрической цепи, к которой присоединяется электропроводка устройства. Электрическая цепь (200) включает в себя источник напряжения (203), который прикладывает напряжение к электродам, а значит, и к мембране (207), которая действует в качестве резистора. Вследствие природы биологических молекул и биологических клеток, прилагается напряжение от 0,2 В до 0,8 В, чтобы избежать повреждения компонента биологического распознавания. Второй переменный резистор (209) соединяется последовательно с источником напряжения (203). Сопротивление переменного резистора (209) известно и может регулироваться для приблизительной корреляции с предполагаемым сопротивлением на мембране (207). Устройство (205) контроля сопротивления предусмотрено в качестве части цепи и выполнено с возможностью контроля (отслеживания) сопротивления мембраны при приложении напряжения к мембране источником напряжения (203), когда выбранный объем образца текучей среды помещается на центральную область мембраны.
Образец текучей среды представляет собой образец, который должен быть исследован на присутствие биомолекул, способных связываться с иммобилизованными на мембране компонентами биологического распознавания. Образцом текучей среды может быть образец биологической жидкости, взятой у человека или животного, образец воды или образец пищи, который был приготовлен так, чтобы получился подходящий образец текучей среды. В этом образце текучей среды может содержаться буферный раствор, такой как фосфатно-солевой буферный раствор.
При применении, специфическое связывание биомолекулы с компонентом биологического распознавания дает более крупный молекулярный комплекс, который обычно не является электропроводящим, таким образом снижая электропроводность мембраны в области связывания. Обнаружение этих комплексов оказывается возможным вследствие измерения повышенного сопротивления и увеличенной скорости изменения сопротивления на мембране. Биомолекула, которую мембрана способна обнаруживать, будет зависеть от типа или конкретного компонента биологического распознавания, иммобилизованного на мембране.
Устройство для обнаружения биомолекул может использоваться в способе обнаружения биомолекул. Такой способ включает на первой стадии обеспечение наличия образца текучей среды, в котором потенциально содержится целевая биомолекула. После этого образец текучей среды подают на мембрану описанного здесь устройства, после чего контролируют и записывают сопротивление мембраны в течение выбранного периода времени. Если сопротивление увеличивается выше порогового сопротивления, что определяется контроллером, сигнальным компонентом выдается сигнал, который означает положительное обнаружение целевой биомолекулы, о которой известно, что она взаимодействует и связывается с выбранным компонентом биологического распознавания на мембране.
Описывается примерный способ измерения первичных антилизоцимных антител в растворах образцов. В данном устройстве компонент биологического распознавания представляет собой лизоцим, который сшит с электропроводящей мембраной.
Примеры
Пример 1
Способность устройства обнаруживать присутствие антилизоцимных антител была исследована с помощью мембраны, на который в качестве компонента биологического распознавания иммобилизован лизоцим.
Способы
1. Изготовление электропроводящей мембраны
Нетканый лист из фильерных точечно-сплавленных микроволокон полипропилена с поверхностной плотностью 50 г/м2 обрезали до квадратного листа размерами 90 × 90 мм. Микроволокна листа были снабжены электропроводящим покрытием, содержащим легированные сополимеры полипиррола. Мономер пиррола был сополимеризован с имеющей карбоксильную функциональную группу 3-тиофенуксусной кислотой (3TAA). Раствор 3TAA с концентрацией 10 мг/мл смешивали с 10% пирролом, и лист из микроволокон погружали в этот раствор на несколько секунд, а затем извлекали. После этого лист из микроволокон помещали в стеклянный реакционный сосуд, содержащий 30 мл раствора 0,1 М хлорида железа(III) (FeCl3) в деионизированной воде. Раствор 0,1 М 5-сульфосалициловой кислоты (5SSA), действующей в качестве легирующего вещества, добавляли в объеме 1 мл в расчете на каждые 10 мл раствора FeCl3, действующего в качестве окислителя. Реагентам давали прореагировать в течение 30 минут при комнатной температуре с медленным перемешиванием для обеспечения протекания окислительной полимеризации мономера пиррола. Лист из микроволокон затем извлекали из раствора, промывали деионизированной водой и оставляли высыхать на 4 часа.
2. Присоединение глутарового альдегида
Листы из микроволокон с электропроводящим покрытием разрезали на мелкие мембраны размерами 30 мм × 30 мм. Эти мелкие мембраны промывали дистиллированной водой и выдерживали для высыхания в течение пяти минут. Листы погружали в раствор 2,5 мМ глутарового альдегида и инкубировали при 4°C в течение одного часа, после чего мембраны из микроволокон повторно промывали дистиллированной водой и высушивали в течение 10 минут.
3. Иммобилизация лизоцима
Покрытые глутаровым альдегидом электропроводящие мембраны из микроволокон промывали дистиллированной водой и выдерживали для высыхания в течение пяти минут. Раствор лизоцима приготавливали в стерильных стеклянных сосудах со 100 мкг/мл лизоцима, произведенного из белка куриного яйца компанией Roche (Мангейм, Германия), в фосфатно-солевом буферном растворе (1X PBS), содержащем 137 ммоль/л NaCl, 2,7 ммоль/л KCl, 10 ммоль/л Na2HPO4 и 1,8 ммоль/л KH2PO4.
Мембраны промывали раствором 1X PBS в течение приблизительно 10 секунд, а затем погружали в раствор лизоцима и инкубировали при 4°C в течение 2 часов. После инкубации мембраны из микроволокон промывали раствором 1X PBS и выдерживали для высыхания в течение 10 минут.
Количество компонентов биологического распознавания, в данном случае – это иммобилизованный на мембране лизоцим, пропорционально количеству глутарового альдегида, присутствующего на микроволокнах мембраны. Чем больше компонентов биологического распознавания на мембране, тем выше чувствительность устройства вследствие потенциальной возможности большего молекулярного связывания биомолекул. Поэтому оказывается предпочтительной иммобилизация значительного количества лизоцима на мембране. Однако, если мембрана выдерживается в растворе лизоцима чрезмерно долго, глутаровый альдегид может отделиться от мембраны вследствие растворения. Было обнаружено, что скорость присоединения лизоцима к сшивающему линкеру обычно превышает скорость растворения глутарового альдегида в растворе 1X PBS.
4. Изготовление опоры и крышки
Чтобы предоставить опору мембране и обеспечить стандартизованные условия исследования для измерения сопротивления мембраны, опору, которая взаимодействует с крышкой, спроектировали с использованием программы AutoCadТМ, и эти опору и крышку изготовили методом трехмерной печати с использованием принтера модели MakerBotТМ Replicator Z18 3D от компании MakerBot Industries, LLC (2009-2015, дом 1, центр MetroTech, этаж 21, Бруклин, Нью-Йорк, штат Нью-Йорк, 11201, США).
5. Приготовление образца текучей среды: раствор антител
Были приготовлены растворы с различными концентрациями первичных антилизоцимных антител: 313,6, 31,6, 15,8 и 0,8 мкг/мл. Эти растворы антител приготовили разбавлением небольшого количества раствора первичных антител в 10X PBS до желательной концентрации.
6. Подготовка к измерениям
Для обеспечения того, чтобы все измерения были стандартизованными, 300 или 500 мкл раствора PBS подавали на различные мембраны с тем, чтобы мембраны в равной степени насыщались PBS перед измерениями. После этого мембрану помещали на опору и закрывали крышкой. Измерения сопротивления осуществляли присоединением мембраны, изготовленной описанными выше способами, к показанной на фиг. 10 электрической цепи посредством прикрепленных к опоре электродов. Осциллограф (Tektronix TDS 1002b) использовали для измерения разности потенциалов на мембране. Осциллограф подсоединяли к компьютеру, который обрабатывал результаты.
Было выбрано постоянное напряжение 0,5 В, и источник напряжения устанавливали на данное значение. Измеряемое напряжение в каждой момент времени можно было использовать для вычисления сопротивления мембраны по закону Ома, R=V/I, где R – сопротивление, V – разность потенциалов (или напряжение) на мембране, а I – сила тока в цепи. Сопротивление мембраны вычисляли по разности между приложенным напряжением и измеренным в цепи напряжением. С помощью закона Кирхгоффа для описанной выше экспериментальной установки было определено следующее уравнение:
-Vi+VR+Vf=0,
где Vi – напряжение источника, VR – напряжение на переменном резисторе, а Vf – разность между приложенным напряжением и измеренным напряжением (падение напряжения) на мембране. Приведенное выше уравнение может быть преобразовано следующим образом:
Vi=Rsi+Vf
Vf непрерывно измеряли с помощью осциллографа. Поскольку единственной неизвестной переменной была сила тока i, с использованием закона Ома (R=V/I), эти два уравнения могут быть объединены для вычисления сопротивления в любой заданный момент времени:
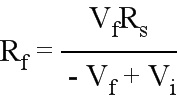 .
.
При предполагаемом сопротивлении мембраны порядка 1000 Ом, выбранное сопротивление переменного резистора (Rs) составляло 1000 Ом. Используя измеренное осциллографом падение напряжения на мембране, сопротивление мембраны можно вычислить на основании следующего уравнения:
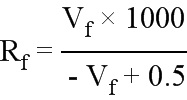 .
.
Измеренные значения сопротивления (падения напряжения) записывали и анализировали, используя Matlab и систему управления Toolbox.
После примерно 10 секунд приложения напряжения к мембране добавляли 200 мкл раствора антител с выбранной концентрацией через отверстие в опоре для подачи раствора на мембрану. Первичные антилизоцимные антитела связывались с лизоцимом, образуя комплекс антиген-антитело, который оказался существующим вплоть до одного часа. Таким образом, после добавления антител сопротивление измеряли и записывали в течение одного часа.
7. Сбор данных
Четыре различных набора данных были собраны в результате следующих экспериментов:
(a) сопротивление мембраны с электропроводящим покрытием;
(b) сопротивление электропроводящих мембран с прикрепленным к ним глутаровым альдегидом;
(c) сопротивление электропроводящих мембран с прикрепленными глутаровым альдегидом и лизоцимом; и
(d) сопротивление электропроводящих мембран с прикрепленными глутаровым альдегидом, лизоцимом и антителами в различных концентрациях.
Каждый из этих экспериментов проводили с набором из трех-четырех различных мембран, изготовленных одинаковым способом, чтобы оценить воспроизводимость результатов и их точность. Данные из каждого исследования интерпретировали и строили график, изображающий изменение сопротивления с течением времени.
На графиках, представленных ниже в разделе «Результаты», не показаны измерения в течение первой минуты от момента начала эксперимента, который представляет собой момент подачи раствора на мембрану, к которой приложено напряжение. Было обнаружено, что добавление раствора в течение этого периода времени приводило к аномальным и неустойчивым измерениям сопротивления, которые были нелинейными. Аномальные показания являются предсказуемыми, потому что трудно регулировать скорость подачи растворов на мембрану.
8. Качественные исследования, проведенные для подтверждения связывания антилизоцимных антител с иммобилизованным на мембране лизоцимом
Положительное связывание антител с белком, а значит, и с мембраной было подтверждено посредством окрашивания микроволокон мембраны вторичным флуоресцентным антителом в отдельном эксперименте. После иммобилизации лизоцима на мембране эту мембрану помещали в контейнер, содержащий 200 мкл раствора 313,6 мкг/мл антилизоцимных антител и инкубировали при 4°C в течение одного часа. Мембрану затем тщательно промывали раствором 1X PBS, чтобы удалить любые избыточные антилизоцимные антитела, которые не связались с лизоцимом. Следующие стадии затем осуществляли в темном помещении вследствие светочувствительности флуорохромных веществ в реагентах. На мембрану подавали 200 мкл вторичных антител, Alexa Fluor488 (Invitrogen), и мембрану инкубировали при комнатной температуре в течение одного часа перед тем, как ее повторно промывали раствором 1X PBS и выдерживали для высыхания. Обработанные образцы затем хранили в светочувствительном контейнере. Подтверждение положительного связывания белка с волокнами и первичных антител с белком осуществляли, используя флуоресцентный конфокальный микроскоп (конфокальный микроскоп Zeiss LSM780). Положительные и контрольные изображения снимали 40-кратным объективом и качественно оценивали флуоресценцию и фазоконтрастные перекрытия. Флуоресцентные вторичные антитела, иммобилизованные на микроволокнах мембраны, четко видны на снятых изображениях.
Экспериментальные результаты
(a) Сопротивление мембраны с электропроводящим покрытием
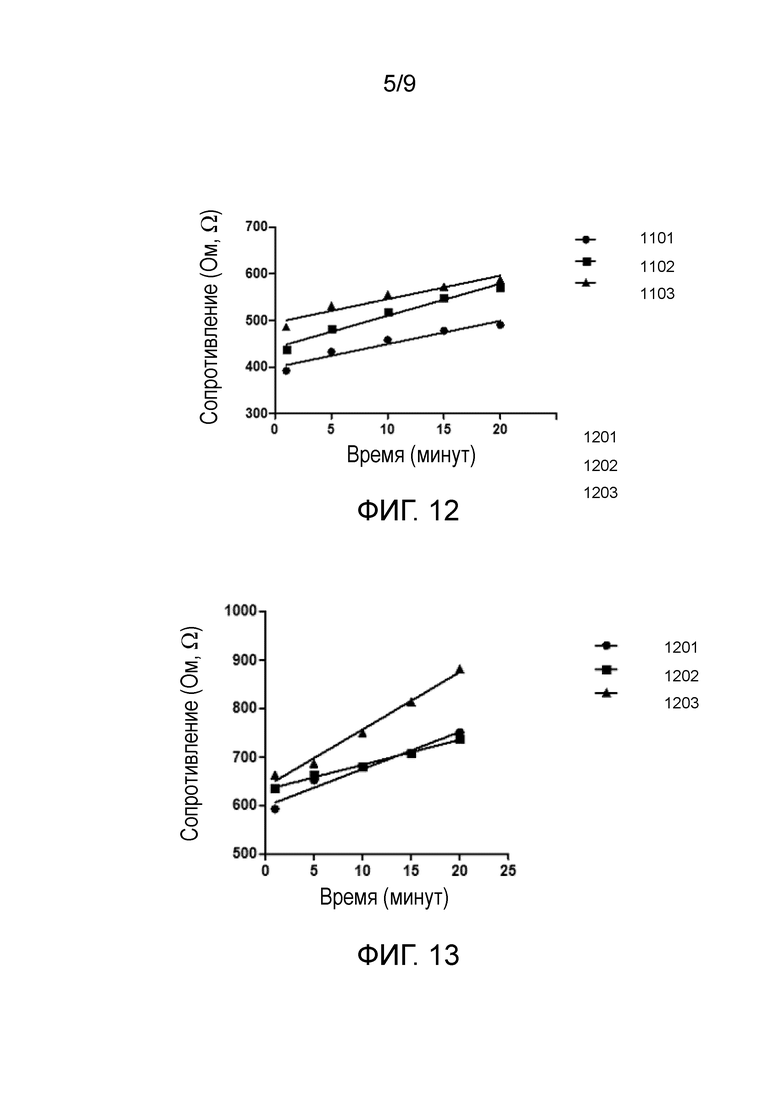
В первом эксперименте сопротивление, вычисляемое по падению напряжения на трех мембранах с нанесенным на них электропроводящим покрытием, измеряли в течение 20 минут. Три мембраны были приготовлены одинаковым способом, описанным выше в подпункте 1. Значения сопротивления трех мембран в зависимости от времени представлены на графике фиг. 11. Линейные тренды подобраны для каждого набора данных (мембрана 1 (1001): y=3,7511x+238,98, R2=0,9231; мембрана 2 (1002): y=2,4567x+135,48, R2=0,9712; мембрана 3 (1003): y=2,5994x+217,12, R2=0,9336)). Увеличение сопротивления или уменьшение электропроводности с течением времени наблюдается для каждой мембраны. Начальное сопротивление и скорость увеличения сопротивления на графиках более или менее аналогичны для различных мембран.
После покрытия листов электропроводящими реагентами были получены низкие значения сопротивления мембран в 140 Ом на 17 мм. 17 мм – это стандартизованное расстояние, на котором осуществлялись измерения. Хотя были получены низкие значения сопротивления, сопротивления трех изготовленных мембран варьировались от 140 Ом до 300 Ом на расстояние 17 мм. Предполагается, что эта изменчивость может быть уменьшена посредством автоматизации процесса изготовления мембран.
Постепенное увеличение сопротивления со временем, проиллюстрированное на фиг. 11, возникает даже без помещения дополнительных растворов или реагентов на мембрану в процессе измерений. Заявитель полагает, что это увеличение сопротивление вызывается взаимодействиями медных электродов и присутствующих на мембране солей, таких как хлорид железа(III), хлорид натрия (NaCl), хлорид калия (KCl), фосфат натрия (Na2HPO4) и фосфат калия (KH2PO4), происходивших из раствора PBS, который наносился на мембрану перед всеми измерениями.
Наблюдаемое линейное увеличение сопротивления предположительно присутствует во всех осуществляемых на мембранах измерениях сопротивления. Оно может быть описано как «базовый уровень» или фоновый уровень, с которым могут сравниваться все последующие измерения. Скорость увеличения сопротивления усреднялась на основании данных с фиг. 11 и составляла приблизительно 2,935 Ом в минуту.
(b) Сопротивление электропроводящих мембран с прикрепленным к ним глутаровым альдегидом
Во втором эксперименте сопротивление, вычисляемое по падению напряжения на трех электропроводящих мембранах, к которым был прикреплен сшивающий реагент - глутаровый альдегид, измеряли в течение 20 минут, и график с результатами показан на фиг. 12. К графикам подгоняли линейные тренды (мембрана 1 (1101): y=4,9836x+399,43, R2=0,9355; мембрана 2 (1102): y=6,8606x+441,49, R2=0,9752; мембрана 3 (1103): y=5,0314x+495,38, R2=0,9231). Начальные сопротивления трех мембран различны, однако скорость увеличения сопротивления со временем весьма близки.
Наслоение на мембране глутарового альдегида уменьшало электропроводность мембраны. Сопротивление электропроводящей мембраны после нанесения глутарового альдегида увеличивалось и составляло между 200 Ом и 350 Ом. Среднее значение измеренного для трех мембран сопротивления показывает линию тренда y=5,6252x+445,43, где градиент показывает увеличение сопротивления в минуту. Скорость увеличения сопротивления оказывается выше по сравнению со скоростями увеличения, наблюдаемыми для мембран без глутарового альдегида, вероятно, вследствие того, что пути проводимости были покрыты сшивающим линкером - глутаровым альдегидом.
Следующие эксперименты показали, что более продолжительные сроки инкубации и более высокие концентрации глутарового альдегида увеличивали сопротивление мембраны также и вследствие многослойности. Таким образом, было обнаружено, что оптимальные продолжительность инкубации и концентрация глутарового альдегида, при которых максимум глутарового альдегида прикрепляется без создания многослойности, составляют соответственно от 1 до 2 часов, предпочтительно 1,5 часа, и концентрацию в 2,5 мМ глутарового альдегида.
(c) Сопротивление электропроводящих мембран с прикрепленными глутаровым альдегидом и лизоцимом
В-третьих, сопротивление, вычисляемое по падению напряжения на трех электропроводящих мембранах, к которым были прикреплены сшивающий реагент - глутаровый альдегид и белок лизоцим, измеряли в течение 20 минут, и график с результатами показан на фиг. 13. Линейные тренды подгоняли к графикам (мембрана 1 (1201): y=7,6702x+598,54, R2=0,9661; мембрана 2 (1202): y=5,1633x+632,5, R2=0,9903; мембрана 3 (1203): y=11,826x+638,53, R2=0,9889).
Иммобилизация лизоцима на мембране дополнительно увеличивала сопротивление мембраны на величину между 100 Ом и 300 Ом. Среднее значение измеренного для трех мембран сопротивления показывает линию тренда, описываемую уравнением: y=8,2199x+623,19.
(d) Сопротивление электропроводящих мембран с введенными на мембраны глутаровым альдегидом, лизоцимом и 200 мкл антител в различных концентрациях
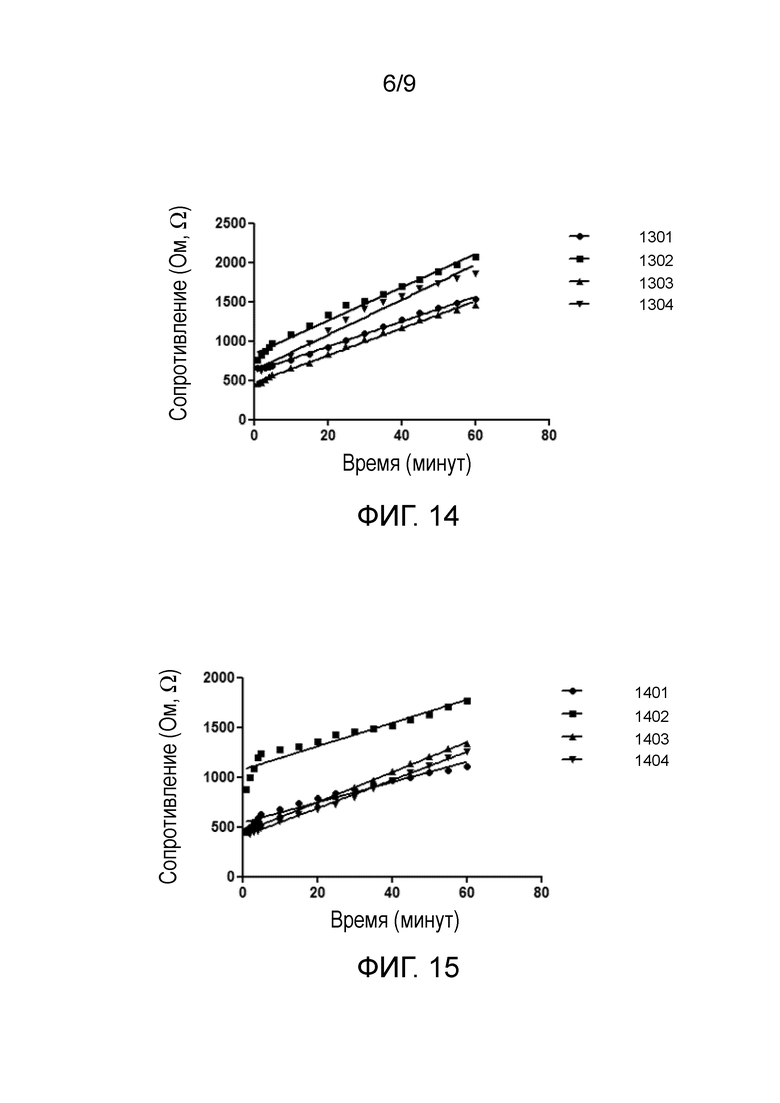
Измерения сопротивления осуществляли каждые 2 секунды в течение первых 5 минут экспериментов, а после этого показания считывали каждую минуту в течение одного часа. На фиг. 14 проиллюстрированы графики сопротивления четырех различных мембран, которые были изготовлены одинаковым способом и на которые наносили по 200 мкл стократно разбавленного раствора 313,6 мкл/мл антител. Линейные тренды, подогнанные для четырех графиков, кратко представлены в таблице 1.
Таблица 1. Линейные тренды графиков на фиг. 14
Фиг. 14 иллюстрирует значительное увеличение сопротивление каждой мембраны за первые 5 минут после помещения раствора антител на мембрану. Через пять минут скорость изменения сопротивления уменьшается. Начальное сопротивление, измеренное для каждой мембраны, отличается приблизительно на 200 Ом. Скорость увеличения сопротивления в течение 60 минут варьируется между приблизительно 16 и 22 Ом в минуту.
На фиг. 15 проиллюстрированы графики сопротивления четырех различных мембран, которые были изготовлены одинаковым способом и на которые помещали по 200 мкл раствора 15,8 мкл/мл антител (разбавленного в 10000 раз). Линейные тренды, подогнанные для последних 55 минут (исключая таким образом первые 5 минут, которые демонстрируют быстрое увеличение сопротивления), четырех графиков кратко представлены в таблице 2:
Таблица 2. Линейные тренды графиков на фиг. 15
Как можно видеть на фиг. 15, даже при такой значительно меньшей концентрации раствора антител в 15,8 мкл/мл имеется немедленное, измеримое увеличение сопротивления мембраны после подачи раствора антител на мембрану. Скорость увеличения сопротивления после 5 минут аналогична для четырех различных мембран.
Далее, на фиг. 16 проиллюстрированы графики сопротивления четырех различных мембран, которые были изготовлены одинаковым способом и на которые помещали по 200 мкл раствора 0,8 мкл/мл антител (разбавленного в 100000 раз). Линейные тренды, подогнанные для четырех графиков, кратко представлены в таблице 3.
Таблица 3. Линейные тренды графиков на фиг. 16
Как очевидно из фиг. 16, даже при предельно низкой концентрации раствора антител в 0,8 мкл/мл наблюдается быстрое увеличение сопротивления мембраны в течение первых 5 минут эксперимента. После этого наблюдается более или менее одинаковая скорость увеличения сопротивления в четырех различных мембранах.
Чтобы проверить результаты, осуществляли исследование с положительным контролем. Наносили 200 мкл раствора 15,8 мкл/мл антител, неспецифических к лизоциму, на электропроводящую мембрану, на которой был иммобилизован лизоцим, и сопротивление мембраны измеряли в течение часа. Результаты исследования с положительным контролем проиллюстрированы на фиг. 17. Линейный тренд (1601) подогнанный к графику, имеет вид: y=7,9448x+495,41, R2=0,9939. Градиент линейного тренда аналогичен тренду электропроводящей мембраны, к которой были прикреплены глутаровый альдегид и лизоцим. Таким образом, график подтверждает, что введение неспецифических антител на мембрану не приводит к быстрому увеличению удельного сопротивления мембраны, которое наблюдалось в случае специфического связывания антилизоцимных антител с иммобилизованным на мембране лизоцимом.
Были объединены результаты, полученные для экспериментов, включающих подачу растворов антилизоцимных антител в трех различных концентрациях на четыре различные мембраны, изготовленные одинаковым способом. На фиг. 18 проиллюстрированы объединенные графики для каждой концентрации и результаты исследования с положительным контролем, а также результаты исследования с отрицательным контролем, в ходе которого на мембрану подавали только раствор PBS, не содержащий биомолекул.
Линейные тренды для соответствующих концентраций и контрольных исследований представлены в таблице 4:
Таблица 4. Линейные тренды графиков на фиг. 18
Как очевидно на фиг. 18, выраженная начальная реакция в виде существенного увеличения сопротивления мембран в течение первых нескольких минут после нанесения антилизоцимных антител на мембрану наблюдается при всех различных концентрациях раствора антител. В этих случаях скорость увеличения сопротивления уменьшается, но остается постоянной после первые 5 минут в течение следующих 55 минут. Из фиг. 18 ясно, что практически никакая подобная реакция не наблюдается в исследованиях с положительным контролем (раствор неспецифических антител) и отрицательным контролем (раствор антител в нулевой концентрации).
Градиенты линейных трендов на фиг. 18 показывают, что скорость увеличения сопротивления мембраны является наивысшей, когда на мембрану нанесен раствор антилизоцимных антител с концентрацией 313,6 мкл/мл. Когда на мембрану нанесены антилизоцимные антитела в концентрациях 15,8 мкл/мл и 0,8 мкл/мл, скорость увеличения сопротивления мембраны ниже, чем в случае концентрации 313,6 мкл/мл. Градиент измеренного сопротивления при концентрации 0,8 мкл/мл весьма сходен случаю концентрации 15,8 мкл/мл, что указывает на чувствительность устройства.
Скорости увеличения сопротивления мембраны, когда она обработана неспецифическими антителами (положительный контроль) или без антитела любого типа (отрицательный контроль), являются аналогичными на уровне приблизительно 8 Ом в минуту.
Фиг. 19 иллюстрирует график полученных в течение первых 5 минут результатов, проиллюстрированных на фиг. 18. Уравнения линейного тренда и скорость увеличения сопротивления мембраны в течение первые 5 минут после помещения раствора на мембрану, к которой прилагается напряжение, кратко представлены в таблице 5.
Таблица 5. Линейные тренды графиков на фиг. 19 и скорость изменения сопротивления
Скорость увеличения сопротивления мембраны в течение пятиминутного периода после нанесения раствора антилизоцимных антител на мембрану намного выше, чем скорость увеличения сопротивления мембраны, на которую нанесен раствор с нулевой концентрацией антител (отрицательный контроль) или раствор неспецифических антител (положительный контроль).
Результаты показывают, что антитела в растворе могут быть обнаружены с использованием варианта устройства для обнаружения биомолекул. Тот факт, что измеримый отклик сопротивления был получен при концентрации антител 0,8 мкл/мл по сравнению с отрицательным контролем, показывает, что мембрана проявляет значительную чувствительность к очень низким концентрациям антител.
Положительный контроль служит для демонстрации того, что увеличение скорости изменения сопротивления наблюдается в результате специфического связывания, происходящего между антилизоцимными антителами и лизоцимом, а не вследствие связывания неспецифических антител или адсорбции антител к мембране.
Нанесение антител на мембрану приводило к связыванию антител с лизоцимом с образованием комплекса антиген-антитело. В течение первых нескольких минут контролирования сопротивления после нанесения раствора антител наблюдалось значительное увеличение сопротивления, при повышенной скорости относительно остального времени измерения сопротивления. Проведенные исследования с положительным и отрицательным контролем показывали в течение первых пяти минут скорость увеличения сопротивления в 14,992 Ом в минуту и 9,4016 Ом в минуту соответственно. Эксперименты, проведенные с различными концентрациями антител, продемонстрировали в течение первых пяти минут средние скорости увеличения сопротивления 26,821, 42,852 и 61,584 Ом в минуту соответственно. Эти результаты предполагают, что связывание между антителом и лизоцимом происходит немедленно после введения антител при относительно высокой скорости.
Эти результаты также указывают на то, что устройство оказывается наиболее эффективным для обнаружения присутствия антител в течение первых пяти минут или менее от добавления образца, а не при проведении эксперимента в течение полного часа. Скорость увеличения сопротивления оказывалась несколько менее выраженной, хотя оставалась все же значительно более высокой по сравнению с контрольными измерениями для оставшегося периода времени с 6 до 60 минут. Увеличивая продолжительность измерений, можно обеспечивать более точное определение приблизительной концентрации антител в растворе образца.
Предполагается, что чем крупнее комплекс антиген-антитело (или сочетание компонента биологического распознавания и биомолекулы), связываемый с мембраной после помещения раствора образца на мембрану, тем выше сопротивление мембраны и тем более выраженной является разность между сопротивлением мембраны с комплексом и сопротивлением мембраны без комплекса.
В осуществленных экспериментах нетканые листы из фильерных точечно-сплавленных микроволокон полипропилена имели толщину или поверхностную плотность 50 г/м2, которая обеспечивала достаточно большую площадь поверхности для иммобилизации компонента биологического распознавания на мембране. Эти листы также имеют желательную долговечность. Предполагается, что в изготовлении мембраны могут использоваться листы различных толщин или поверхностных плотностей, однако использование более толстого материала позволяло подаваемому на мембрану раствору медленнее проникать через микроволокна в процессе использования, давая больше времени для специфического связывания биомолекул с компонентом биологического распознавания. Если используются более тонкие листы, раствор может легко протекать через полости в мембране, не оставляя времени для прохождения связывания.
Пример 2
Была исследована способность устройства по обнаружению бактерий кишечной палочки Escherichia coli (E. coli). Электропроводящая мембрана была изготовлена в соответствии со стадиями в описанном выше примере 1. Однако вместо лизоцима на мембране было иммобилизовано антитело анти-E. coli ab25823.
Способы
Иммобилизацию антитела анти-E. coli ab25823 на мембране осуществляли, сначала промывая электропроводящую мембрану раствором 0,01 М PBS и высушивая ее в течение 10 минут. Мембрану затем инкубировали в растворе 2,5 мМ глутарового альдегида в течение 1 часа при 4 °C. После этого мембрану повторно промывали раствором 0,01 М PBS и высушивали в течение 10 минут. Мембрану инкубировали в 600 мл раствора антитела анти-E. coli (6,67 мкг/мл) при 37 °C в течение 1 часа и после этого промывали раствором 0,01 М PBS и высушивали в течение 10 минут. После этого раствор 5% бычьего сывороточного альбумина (BSA) Blocker помещали на мембрану и давали прореагировать в течение 1 часа при комнатной температуре. Наконец, мембрану промывали три раза, используя раствор 0,01 М PBS.
Изготавливали растворы с разными концентрациями E. coli: 3,4*108, 3,4*105 и 3,4*102 КОЕ/мл, и на мембрану подавали по 100 мкл каждого раствора. Эксперименты повторяли с использованием трех аналогичным образом приготовленных электропроводящих мембран с иммобилизованными на них антителами анти-E. coli. Кроме того, были проведены контрольные эксперименты, в которых по 100 мкл растворов 9,67*107, 9,67*104 и 9,67*10 КОЕ/мл лактобактерий плантарум (Lacto Bacillus Plantarum) подавали на мембраны с иммобилизованными на них антителами анти-E. coli.
Результаты
Результаты экспериментов проиллюстрированы на фиг. 20, который представляет собой график изменения сопротивления мембран в течение первых пяти минут каждого эксперимента после введения бактериальных растворов. Данный график показывает, что при наибольшей концентрации E. coli имеется значительное увеличение скорости изменения сопротивления мембраны, когда на мембрану помещается раствор E. coli. С другой стороны, сколь-либо существенное увеличение не было замечено, когда на мембрану подавали раствор Lacto Baccillus Plantarum. Соответственно, в результате специфического связывания E. coli с иммобилизованным на мембране антителом анти-E. coli происходило значительное увеличение скорости изменения сопротивления мембраны, обеспечивающее обнаружение E. coli.
Связывание E. coli было также подтверждено посредством окрашивания живых клеток бактерий и наблюдения окрашенных бактерий в конфокальном микроскопе.
Пример 3
В данном примере в качестве части устройства использовали электропроводящую мембрану на бумажной основе, чтобы продемонстрировать ее способность обнаружения антилизоцимных антител. Белок лизоцим иммобилизовали на имеющей бумажную основу электропроводящей мембраны, и сопротивление этой мембраны контролировали и записывали. Обработанные результаты измерений сопротивления продемонстрировали, что электропроводящая мембрана на бумажной основе способна обеспечивать резистивное измерение биомолекул.
Способы
По соображениям прочности во влажном состоянии была выбрана и приобретена у компании Sigma Aldrich фильтровальная бумага сортов Whatmann 50 (97 г/м2) и Whatmann 1 (87 г/м2). Фильтровальную бумагу (сорта Whatmann 1,50) разрезали на куски стандартных размеров 180 - 280 мм и использовали для исследований.
1. Электропроводящее покрытие
Целлюлозные волокна фильтровальной бумаги были сделаны электропроводящими посредством нанесения на них раствора легированного полипиррола. Листы размерами 180 - 280 мм сначала погружали в мономер пиррол и выдерживали для замачивания в течение 5 минут, обеспечивая этим полное насыщение бумаги пирролом. Насыщенные пирролом листы затем погружали в раствор, содержащий 0,3 М HCl и 5 г/100 мл FeCl3 в дистиллированной воде, и выдерживали для полимеризации в течение 90 минут. Листы бумаги слегка помешивали, чтобы обеспечить протекание окислительной полимеризации. Волокна извлекали из реакционного сосуда и промывали раствором 0,3 М HCl и деионизированной (ДИ) водой, чтобы удалить избыток пиррола. Листы бумаги затем помещали под дымовыводящий колпак и выдерживали для высыхания в течение 1 часа. Поскольку обработанные листы бумаги проявляли поверхностные отложения избытка пиррола и железа, то электропроводящие листы дополнительно очищали механическими средствами. Механически очищенные листы затем промывали ДИ водой и помещали для высыхания под дымовыводящий колпак. Бумага, покрытая этим способом, представляла собой электропроводящую мембрану, проявлявшую высокую электропроводность (15 См/см) и хорошую механическую стойкость. Куски электропроводящей бумаги размерами 180 - 280 мм проявляли сопротивление в интервале 2-5 Ом при измерении поперек ширины листа, но не его длины.
2. Сшивка глутарового альдегида
Мембраны погружали в раствор, содержащий 2,5 мМ глутарового альдегида в ДИ воде. Инкубацию осуществляли при 4°C в течение часа, после чего мембраны извлекали, промывали ДИ водой и выдерживали до высыхания. После того как глутаровый альдегид связался с мембранами, сопротивление мембран увеличилось на 1-3 Ом.
3. Прикрепление лизоцима
Белок лизоцим, из белка куриного яйца (компания Roche, Мангейм, Германия), готовили в растворе с концентрацией 1 мг/мл в 1X PBS, причем данный раствор приготавливали в стерилизованном стеклянном сосуде. Листы бумаги с полипирролом и глутаровым альдегидом промывали раствором 1X PBS в течение приблизительно 5 секунд и переносили в контейнер с раствором лизоцима. Листы выдерживали для инкубации в растворе лизоцима при 4°C в течение 2 часов. После инкубации помеченные листы бумаги промывали раствором 1X PBS и выдерживали до высыхания.
4. Экспериментальная установка
Резистивное измерение осуществляли посредством использования микропроцессора Arduino Uno и специально приспособленную для этого электрическую схему. Специально приспособленная электрическая схема проиллюстрирована на фиг. 10 и функционирует в качестве омметра, где неизвестное сопротивление электропроводящей мембраны с иммобилизованным на ней лизоцимом измеряется посредством деления напряжения на измеренное падение напряжения на известном резисторе. Данный экспериментальный метод предусматривает использование микропроцессора Arduino для направления информации через его аналоговый ввод (A0) в монитор последовательного интерфейса портативного компьютера. Входное напряжение составляло 0,5 В.
Когда мембраны с иммобилизованным на них лизоцимом высыхали, каждую мембрану помещали на электроды, и базовое сопротивление для этой индивидуальной мембраны измеряли и записывали в течение 1 минуты. Конфигурацию электродов выбирали такой, что мембрана была проложена между медными пластинками, служившими в качестве электродов. При этой конфигурации электродов измеряли сопротивление по ширине электроткани.
5. Приготовление растворов антител для исследований
Концентрации антилизоцимных антител в растворе 1X PBS составляли: 1110,14, 111,01, 11,01, 1,10, 0,11, 0,01 мкг/мл. Этот интервал разбавлений позволил выявить предел обнаружения (LOD).
Раствор антилизоцимных антител в объеме 100 мкл затем наносили на волокна, и выдерживали их для инкубации при 4°C в течение часа. Это обеспечивало использование максимального числа из доступных центров связывания на бумаге. После инкубации листы бумаги быстро промывали раствором 1X PBS, гарантируя, что никакие несвязанные антилизоцимные антитела или другие биологические материалы не остались на поверхности и не влияли на показания сопротивления. После промывания волокон им давали высохнуть на воздухе. Сухие листы бумаги с иммобилизованными антителами затем помещали на опору и записывали индивидуальные измерения сопротивления в течение 10 минут. Измерения, снятые в течение первой минуты, игнорировали.
Исследования повторяли, используя по меньшей мере 3 и вплоть до 7 бумажных листов для каждой концентрации антител, чтобы доказать воспроизводимость и обеспечить больший массив данных. Строили соотношения измеренных после инкубации значений сопротивления к базовым значениям сопротивления, чтобы попытаться понять, существует ли рациональное увеличение сопротивления для каждой концентрации антител.
Результаты
Лизоцим и первичный антитела характеризовали, используя вторичные флуоресцентные антитела (Alexa 20 Fluor 488), и получали флуоресцентные изображения, используя конфокальный микроскоп (Zeiss LSM780). Первичные антилизоцимные антитела помещали на мембраны с иммобилизованным на них лизоцимом. Антитела Alexa Fluor 488 наносили на листы бумаги, обработанные первичными антителами, мембраны только с иммобилизованным на них лизоцимом и мембраны без глутарового альдегида.
Связывание вторичных флуоресцентных антител с первичными антилизоцимными антителами подтверждали методом конфокальной микроскопии. Флуоресценция на изображении указывает на присутствие вторичных и первичных антител, а значит, и белка лизоцима. Наблюдалось однородное покрытие индивидуальных волокон, причем можно было разглядеть отдельные волокна вследствие связывания флуоресцентных антител вокруг волокон. Контрольные исследования осуществляли на мембранах и листах бумаги, не обработанных первичными антителами, причем специфическое связывание было подтверждено из-за отсутствия флуоресценции на контрольных изображениях.
С помощью измерений сопротивления вычисляли рациональное увеличение сопротивления для каждой мембраны, и этими вычисленные значения сравнивали с концентрациями антител, положительным и отрицательным контролями. Результаты проиллюстрированы на фиг. 21. Раствор антител наиболее высокой концентрации проявлял наибольшее рациональное увеличение сопротивления. Было отмечено, что сопротивление резко увеличивалось при более высоких концентрациях антител и экспоненциально уменьшалось при каждом соответствующем разбавлении после этого. Положительный контроль (неспецифические антитела) и отрицательный контроль (1X PBS) были включены для выяснения того, где концентрация антител не дает заметного увеличения над контролями. Был вычислен предел обнаружения (LOD) в 100 нг/мл.
В данном примере с помощью этой конфигурации электродов измерялось сопротивление по толщине мембраны. Показано, что размер мембраны можно значительно уменьшить, обеспечивая миниатюризацию всего устройства. Такая чувствительная бумага может быть встроена в микроконтроллеры, обеспечивая анализ патогенов на чипе.
Результаты демонстрируют, что специфическое антитело целевого патогена может быть иммобилизовано на поверхности волокон целлюлозы, и может применяться одинаковая технология исследования, в результате которой увеличивается сопротивление на мембране. Патогены могут по своим размерам значительно превосходить используемый в исследовании белок (лизоцим) и поэтому могут потенциально вызывать большее увеличение сопротивления, чем измеряемое при исследовании с лизоцимом.
Задача описанного здесь устройства заключается в том, чтобы создать дешевый, эффективный и портативный биосенсор на основе импеданса для быстрого обнаружения патогенов или антител, связанных с патогенными инфекциями, в микрообразцах текучих сред. Могут обнаруживаться, например, такие возбудители заболеваний, как E.coli или туберкулезные микобактерии Mycobacterium tuberculosis. Данное устройство может эксплуатироваться без дополнительного оборудования или глубоких технических знаний. Малый масштаб, на котором анализируют образцы, обеспечивает такие преимущества, как уменьшение требуемых количеств реагентов и образцов, а также высокая пропускная способность скрининга образцов.
По существу, данное устройство состоит из измерительного преобразователя и компонентов биологического распознавания, которые способны обнаруживать присутствие и количество биомолекул, содержащихся в образце. Измерительный преобразователь преобразует биологический отклик, возникающий, когда компонент биологического распознавания взаимодействует с биомолекулами в образце, в электрический сигнал, который может быть количественно определен.
Описываемое здесь устройство для обнаружения целевых биомолекул представляет собой имеющую меньшие размеры и массу альтернативу существующим устройствам и является надежным, быстродействующим и высокочувствительным по отношению к целевым биомолекулам. Описанный способ обнаружения может также быть дешевой альтернативой доступным в настоящее время способам и, таким образом, особенно актуальным тем, что он способствует преодолению проблем с диагностикой определенных патогенов, таких как кишечные палочки или туберкулезные микобактерии. Устройство нацелено на то, чтобы обеспечивать высокоспецифическое и быстрое обнаружение целевой биомолекулы, такой как антиген или антитело.
Тот факт, что мембрана и электроды не погружаются в буферный раствор, приводит к повышенной чувствительности мембраны и исключает необходимость учета параллельного сопротивления раствора.
Следует понимать, что в устройство для обнаружения целевых биомолекул могут быть внесены многочисленные изменения без выхода за пределы объема изобретения. Мембрана и опора могут иметь любые подходящие размер и форму и масштабироваться в соответствии с объемом подаваемого на мембрану образцу. Мембрана может быть изготовлена из любых подходящих микро- или нановолокон, которые предоставляют большую площадь поверхности для иммобилизации элементов биологического распознавания на своей поверхности и которые могут модифицироваться так, чтобы быть электропроводящими. Мембрана может иметь любую подходящую толщину или поверхностную плотность, которая может, например, быть в интервале от 5 до 100 г/м2.
Следует понимать, что компоненты биологического распознавания более чем одного типа могут быть иммобилизованы на поверхности, чтобы обеспечить возможность одновременного исследования на различные патогены, загрязнения или инфекции.
Микро- или нановолокна любого типа в форме текстильного материала могут использоваться в качестве мембраны, при том условии, что они обладают собственной электропроводностью или могут модифицироваться, становясь электропроводящими. Мембрана может быть сделана электропроводящей посредством соответствующих реагентов, чтобы действовать в качестве резистора, который предоставляет большую площадь поверхности для связывания компонентов биологического распознавания и потенциального связывания биомолекул. В зависимости от материалов, используемых для изготовления мембраны, она может иметь различные поверхностные свойства. Например, мембрана, изготовленная из микроволокон полипропилена, покрытых легированным полипирролом, описываемая выше в примерах 1 и 2, приобретает гидрофобную поверхность. Мембрана, изготовленная из целлюлозных волокон, описываемая в примере 3, является более гидрофильной, в результате чего имеет место разное взаимодействие содержащего биомолекулы водного образца с мембраной. Было обнаружено, что бумага, используемая в качестве подложки в электропроводящей мембране, является более впитывающей, что влияет на диспергирование содержащего биомолекулы образца текучей среды по мембране. Использование бумаги в качестве мембраны выгодно вследствие ее широкой доступности и распространенности. Волокна целлюлозы имеют высокую площадь поверхности и широкий интервал диаметров волокон, которые могут присутствовать в составе бумаги.
Опора может иметь любые подходящие форму и вид, при том условии, что она выполнена с возможностью приема и удержания электропроводящей мембраны с возможностью снятия таким образом, что она проходит по меньшей мере частично над электродами в целях вступления в контакт с электродами. Опора может быть снабжена удерживающими элементами, такими как зажимы или крепления (не показаны), которые выполнены из непроводящего материала и которые проходят от противоположных сторон опоры поперек, по меньшей мере частично, по поверхности электродов, чтобы удерживать электропроводящую мембрану на месте и обеспечивать контакт между мембраной и электродами.
В других вариантах осуществления изобретения опора может быть модифицирована путем снабжения ее предназначенной для мембраны рамкой или крышкой, которая взаимодействует с опорой в соединении на защелках, или скользящим элементом, который взаимодействует с опорой, обеспечивая быструю и легкую замену мембраны.
Электроды может быть изготовлены из любого пригодного электропроводного материала. В описанных вариантах осуществления были использованы золотые и медные электроды. Однако платиновые электроды являются менее реакционно-способными и могут быть способными обеспечивать более точные показания сопротивления и скорости изменения сопротивления при молекулярном связывании между компонентом биологического распознавания и биомолекулами образца. Однако медь является более дешевым материалом для изготовления электродов или контактных соединений с мембраной.
Аккумулятор может быть предусмотрен в качестве источника электропитания, чтобы обеспечивать ток в цепи и напряжение в цепи. Аккумулятор может также запитывать контроллер, который в идеальном случае представляет собой микроконтроллер, такой как микроконтроллер Arduino, состоящий из компьютера с подходящими аппаратными средствами и установленным на нем программным обеспечением, который подключен к управляющей схеме и выполнен с возможностью управления измеряющим напряжение устройством и приема показаний от этого устройства в целях вычисления сопротивления мембраны. Устройство может дополнительно включать в себя средства беспроводной связи, такие как Bluetooth, чтобы передавать результаты измерений или сигналы обнаружения на мобильный или другой прибор. Эти компоненты может использоваться для создания компактного и портативного устройства для быстрого и легкого применения в полевых условиях.
Во всем тексте описания и формулы изобретения, если контекст не требует иного, слова «включать» или «содержать» и их грамматические формы, такие как «включает», «содержит», «включающий» или «содержащий», следует понимать как подразумевающие включение указанного элемента или группы элементов, но не как исключение какого-либо другого элемента или группы элементов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ РЕТЕНТАТНОЙ ХРОМАТОГРАФИИ ДЛЯ РАЗДЕЛЕНИЯ АНАЛИТОВ В ОБРАЗЦЕ | 1998 |
|
RU2253116C2 |
| Ферментный электрод для иммуноферментного анализа | 1989 |
|
SU1707522A1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ЭЛЕКТРОХИМИЧЕСКОГО АНАЛИЗА БИОМОЛЕКУЛ | 1998 |
|
RU2161653C2 |
| БИОСЕНСОР С МЕТАЛЛИЧЕСКИМИ НАНОЧАСТИЦАМИ | 2013 |
|
RU2658052C2 |
| УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ И СПОСОБ ИЗГОТОВЛЕНИЯ ЧУВСТВИТЕЛЬНОГО ЭЛЕМЕНТА | 1991 |
|
RU2032908C1 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ОПРЕДЕЛЕНИЯ СПЕЦИФИЧЕСКИХ БИОМОЛЕКУЛ, УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ И ЕГО ВАРИАНТ | 2008 |
|
RU2386135C2 |
| СПОСОБ ВЫЯВЛЕНИЯ БАКТЕРИЙ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2000 |
|
RU2265061C2 |
| УСТРОЙСТВА, СПОСОБЫ И НАБОРЫ ДЛЯ ИММУНОХРОМАТОГРАФИИ | 2011 |
|
RU2568875C2 |
| Способ определения молочной кислоты | 1989 |
|
SU1655988A1 |
| МИКРОФЛЮИДНЫЕ УСТРОЙСТВА И СПОСОБЫ ИХ ПОДГОТОВКИ И ПРИМЕНЕНИЯ | 2006 |
|
RU2423073C2 |
Группа изобретений относится к области биохимии. Предложено устройство и способ для обнаружения целевых биомолекул с использованием вышеуказанного устройства. Устройство включает установленную на электронепроводящей опоре и подсоединенную к электрической цепи посредством электродов электропроводящую мембрану с иммобилизованным на ней компонентом биологического распознавания, источник напряжения и устройство контроля сопротивления. Способ включает подачу образца текучей среды на мембрану, контроль сопротивления мембраны, при котором, если сопротивление больше порогового сопротивления, происходит выдача сигнала об обнаружении целевой биомолекулы. Изобретения обеспечивают высокоспецифичное и быстрое обнаружение целевой биомолекулы. 2 н. и 13 з.п. ф-лы, 21 ил., 5 табл., 3 пр.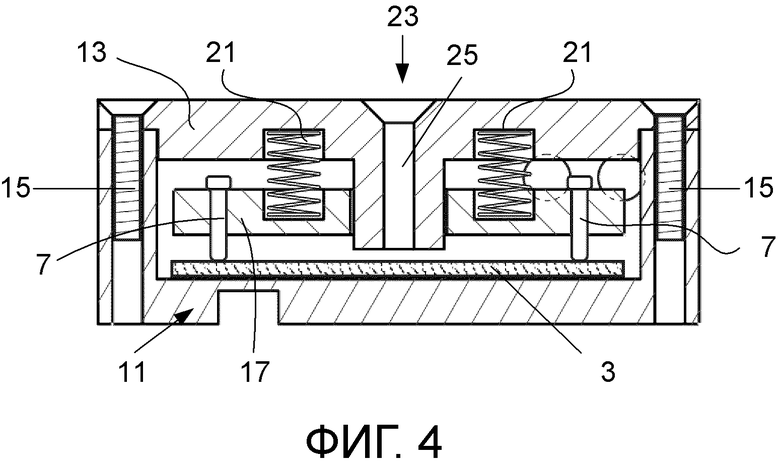
1. Устройство для обнаружения целевых биомолекул, включающее электропроводящую мембрану с иммобилизованным на ней компонентом биологического распознавания, выполненным с возможностью связывания целевой биомолекулы, причем мембрана подсоединена к электрической цепи посредством электродов, причем мембрана установлена на электронепроводящей опоре, которая предназначена для приема и удержания мембраны с возможностью снятия так, что мембрана контактирует с электродами; источник напряжения для обеспечения напряжения в электрической цепи; и устройство контроля сопротивления, выполненное с возможностью контроля сопротивления мембраны, когда выбранный объем образца текучей среды подается на мембрану.
2. Устройство по п. 1, в котором опора образует камеру, в которой заключена мембрана, и при этом электроды проходят в камеру для контакта с заключенной в ней мембраной.
3. Устройство по п. 1, в котором опора включает в себя впуск для подачи выбранного объема образца текучей среды на мембрану, причем выбранный объем образца текучей среды составляет от 10 до 1000 мкл.
4. Устройство по п. 1, в котором мембрана выполнена из обладающих собственной электропроводностью волокон или выполнена из полимерных волокон с нанесенным на них электропроводящим покрытием.
5. Устройство по п. 1, в котором мембрана выполнена из полимерных волокон с нанесенным на них электропроводящим покрытием, причем это электропроводящее покрытие представляет собой полимерное покрытие, выбранное из группы, которую составляют полипиррол, политиофен, полианилин и полиацетилен, необязательно включающее легирующее вещество.
6. Устройство по п. 1, в котором компонент биологического распознавания прикреплен к мембране сшивающим веществом.
7. Устройство по п. 1, в котором компонент биологического распознавания представляет собой антиген для оперативного связывания целевого антитела или антитело для оперативного связывания целевого антигена.
8. Устройство по п. 1, дополнительно включающее в себя контроллер, выполненный с возможностью выдачи машиночитаемых команд источнику напряжения на подачу напряжения и дополнительно выполненное с возможностью выдачи машиночитаемых команд устройству контроля сопротивления на его контроль и снятие показаний сопротивления на мембране.
9. Устройство по п. 8, в котором контроллер выполнен с возможностью выдачи команд сигнальному компоненту, который сигнализирует об обнаружении целевой биомолекулы, если устройством контроля сопротивления измерено сопротивление большее, чем пороговое сопротивление, которое представляет собой сопротивление мембраны без поданного на мембрану образца текучей среды, сопротивление мембраны с поданной на мембрану контрольной текучей средой, не содержащей биомолекул; или сопротивление мембраны с поданной на мембрану контрольной текучей средой, содержащей биомолекулы, которые компонент биологического распознавания не связывает.
10. Устройство по п. 8, в котором контроллер выполнен с возможностью обработки показаний сопротивления на мембране для определения количества целевых биомолекул в образце и оценки уровня загрязнения или инфицирования образца текучей среды.
11. Устройство по п. 8, в котором контроллер имеет пользовательский интерфейс и дисплей для отображения сигнала, определенного количества биомолекул и/или уровня загрязнения или инфицирования.
12. Устройство по п. 1, в котором устройство контроля сопротивления представляет собой измеряющее напряжение устройство, подсоединенное на мембране и предназначенное для определения сопротивления мембраны по измеренному на мембране падению напряжения.
13. Устройство по п. 1, причем это устройство является портативным и запитывается от аккумулятора.
14. Способ обнаружения целевых биомолекул с использованием устройства по п. 1, включающий следующие стадии:
подача выбранного объема образца текучей среды на электропроводящую мембрану, на которой иммобилизован компонент биологического распознавания, выполненный с возможностью связывания целевой биомолекулы;
контроль сопротивления мембраны; и,
если сопротивление больше порогового сопротивления, которое представляет собой сопротивление мембраны без поданного на мембрану образца текучей среды, сопротивление мембраны с поданной на мембрану контрольной текучей средой, не содержащей биомолекул; или сопротивление мембраны с поданной на мембрану контрольной текучей средой, содержащей биомолекулы, которые компонент биологического распознавания не связывает, выдача сигнала об обнаружении целевой биомолекулы.
| US 6835552 B2, 28.12.2004 | |||
| MAEHASHI K., MATSUMOTO K., Label-Free Electrical Detection Using Carbon Nanotube-Based Biosensors // Sensors, 2009, 9, стр.5368-5378 | |||
| THU V.V., TAM P.D., DUNG P.T., Rapid and label-free detection of H5N1 virus using carbon nanotube network field effect transistor // Current Applied Physics, 2013, стр.1-5 | |||
| KURKINA T., Label-free electrical biosensing based on electrochemically functionalized carbon nanostructures // DISSERTATION, 2012, стр.15-28 | |||
| LISDAT F., SCHAFER D., The use of electrochemical impedance spectroscopy for biosensing // Anal Bioanal Chem., 2008, 391, стр.1555-1567 | |||
| WO 2014093639 A1, 19.06.2014 | |||
| ИММУНОСЕНСОР | 2001 |
|
RU2278612C2 |
Авторы
Даты
2017-10-26—Публикация
2016-11-17—Подача