Настоящее изобретение относится к способу выявления бактерий, при котором осуществляют следующие стадии: соединяют бактериофаги и/или белки бактериофагов с носителем; носитель, соединенный с бактериофагами и/или белками бактериофагов, инкубируют с образцом; возможно удаляют образец и бактерии в образце, не связавшиеся с бактериофагами и/или белками бактериофагов; возможно добавляют вещества, пермеабилизирующие мембрану бактерий или разрушающие ее; и выявляют в образце бактерии, связавшиеся с указанными бактериофагами и/или белками бактериофагов, причем связавшиеся бактерии не подвергают какой-либо стадии культивирования.
Быстрое и точное выявление бактерий представляет собой первую необходимую стадию диагностики и лечения бактериальной инфекции у людей и животных, а также начала профилактики. Кроме того, такое выявление полезно для контроля санитарного состояния и качества сырья и обработанных пищевых продуктов и для контроля санитарного состояния и качества пресной воды и промывной воды, а также качества воды общественных водоемов. Кроме того, указанное выявление полезно для мониторинга и оптимизации процессов, а также для контроля качества при анализе окружающей среды. В определенной степени в противоположность большей части применяемых ранее методик описанный здесь способ дает также возможность простого выявления в нужном месте.
Обнаружение бактерий в биологических образцах в большинстве случаев осуществляют посредством комбинации способов культивирования с применением мониторинга метаболических активностей. Для фаготипирования штаммов бактерий одного типа способы выращивания бактерий, имеющие чувствительность в отношении бактерий, объединяют с типирующими бактериофагами. В таком способе густой бактериальный газон на чашке с агаром и анализируемым образцом покрывают суспензией бактериофагов в мягком агаре, причем указанный бактериальный газон получают путем выделения единичной колонии и последующего размножения указанной колонии. Результаты получают после инкубации в течение ночи при оптимальной для роста бактерий температуре, которая в большинстве случаев обычно составляет 37°С, путем подсчета бляшек и контроля морфологии бляшек. Вариант типирования предполагает измерение аденилаткиназы после опосредованного фагами клеточного лизиса. В этом способе анализируемую ночную культуру бактерий разводят буфером, к ней добавляют фаги и измеряют лизис при помощи специфичных в отношении аденилаткиназной активности фагов.
Во всех описанных до сих пор способах до лизиса выявления не происходит или же выявление происходит через лизис. Это дает возможность мониторинга источников инфекций и выявления источников инфекции. Такое типирование в течение многих лет было разработано для большого числа бактерий, таких как Salmonella typhi, Salmonella paratyphi B, Staphylococcus aureus, Pseudomonas aeruginosa, а также множества других бактерий. Эти разработанные способы выявления в большинстве случаев дают результат лишь через несколько дней. Однако, с другой стороны, это является быстрым и точным определением типа бактерий (типированием), которое очень важно для быстрой реакции.
В WO 93/17129 описан способ выявления конкретных бактерий в образце, при этом бактерии выявляют при помощи бактериофага, способного связываться с такой бактерией, к которому прикреплен связующий партнер двухчленной связующей пары. Второй связующий партнер двухчленной связующей пары связан с твердым носителем, который нерастворим в воде, но может быть суспендирован в ней. Если бактерии присутствуют в образце, они связываются с бактериофагами, которые, в свою очередь, связываются с твердым носителем через связующих партнеров.
В последнее время используют более быстрые молекулярные биологические способы выявления, такие как полимеразная цепная реакция, которые, тем не менее, имеют недостаток, заключающийся в том, что они более подвержены загрязнению. При использовании этих способов результат, как правило, также получают лишь через один день.
Кроме того, для идентификации рода бактерий в некоторых случаях даже требуется представление образцов в высокоспециализированные сравнивающие лаборатории, что также приводит в результате к фактору больших затрат времени и расходов.
Соответственно, данное изобретение основано на задаче обеспечить быстрый и экономичный способ выявления бактерий, который может быть осуществлен, с одной стороны, специально обученным микробиологии персоналом в лаборатории, а также, с другой стороны, в упрощенной модификации в требуемом месте и без наличия соответствующих предварительных знаний.
Эту задачу решает объект изобретения, охарактеризованный в формуле изобретения.
Один аспект настоящего изобретения, таким образом, представляет собой систему быстрого и точного выявления бактерий, обеспечивающую информацию относительно типа бактерий и бактериального штамма и, возможно, дающую возможность определения количества бактерий, причем эта система выявления основана на распознавании этих бактерий при помощи бактериофагов или белков бактериофагов.
Традиционные способы выявления бактерий, основанные на бактериофагах, включают в себя требующие много времени стадии культивирования и опосредованного бактериофагами лизиса клеток. Это правда, что в способе по настоящему изобретению также используется специфичное распознавание клеток бактериофагами, но в противоположность описанным до сих пор способам после стадии специфичного распознавания клеток и после отделения неспецифично связавшихся бактерий осуществляют соответствующий анализ связывания, например осуществляют измерение изменения спектроскопического (например, посредством абсорбции, флуоресценции, био- или хемилюминисценции или кругового дихроизма) или электрического (например, путем измерения емкости или изменения электрической проводимости) сигнала. Это дает возможность выявления бактерий уже через несколько минут, нежели чем спустя часы и дни, соответственно, как было возможно раньше. Целевое связывание, в частности, путем ковалентной фиксации бактериофагов на подходящих несущих структурах, например на титрационных микропланшетах, тестовых полосках, предметных стеклах, пластинке, фильтрующих материалах или проточных клеточных камерах, благоприятствует процедурной стадии анализа связывания посредством уменьшения неспецифичного фона и дает возможность широкого применения в отношении всех бактерий. Несущие структуры могут быть, например, из полистирола, полипропилена, поликарбоната, полиметилметакрилата (ПММА), ацетата целлюлозы, нитроцеллюлозы, стекла, кремниевой пластинки. Использование способа по настоящему изобретению, кроме того, дает возможность использования лизогенных бактериофагов для выявления бактерий.
Согласно одному аспекту настоящего изобретения, таким образом, предложен способ выявления бактерий, при котором осуществляют следующие стадии: соединяют бактериофаги и/или белки бактериофагов с носителем; носитель, соединенный с бактериофагами и/или белками бактериофагов, инкубируют с образцом; возможно удаляют образец и бактерии образца, не связавшиеся с бактериофагами и/или белками бактериофагов; возможно добавляют вещества, пермеабилизирующие или разрушающие мембрану бактерий; и выявляют в образце бактерии, связавшиеся с бактериофагами и/или белками бактериофагов, причем указанные связавшиеся бактерии не подвергают какой-либо стадии культивирования.
Предпочтительным является способ, при котором выявление осуществляют посредством колориметрического выявления клеточных компонентов и/или продуктов размножения фагов посредством выявления ДНК и/или РНК или с помощью иммуноанализа. Также предпочтительным является способ, при котором бактериофаги и/или белки бактериофагов соединяют с носителем посредством адсорбции или посредством химического связывания. Дополнительно предпочтительным способом является такой способ, при котором бактериофаги и/или белки бактериофагов демонстрируют модификации. Еще один предпочтительный способ представляет собой такой способ, при котором используют по меньшей мере два разных бактериофага и/или белка бактериофага, распознающих по меньшей мере два разных типа и/или рода бактерий. Еще одним предпочтительным способом является способ, при котором носитель представляет собой, например, титрационный микропланшет, тестовые полоски, предметные стекла, пластинку, фильтрующий материал или проточную клеточную камеру, например, из полистирола, полипропилена, поликарбоната, ПММА, ацетата целлюлозы, нитроцеллюлозы, стекла или кремниевой пластинки. Для выявления желательно использовать бактериофаги, специфичные в отношении бактерий, которых нужно выявить. Эти фаги не обязательно должны быть специфичны в отношении только одного типа бактерий, они могут быть специфичны в отношении нескольких типов бактерий или родов бактерий. Какие фаги должны быть использованы для выявления, зависит от того, какие бактерии нужно выявить. Кроме того, в одном способе выявления могут быть использованы два или более фага для одновременного выявления нескольких типов бактерий или для точного типирования рода бактерий. Используемые бактериофаги могут представлять собой имеющиеся в продаже бактериофаги из базовых коллекций, таких как DSM или Американская коллекция типовых культур (АТСС), или бактериофаги, выделенные конкретно для данной цели. Можно использовать как литические, так и лизогенные бактериофаги, причем литические фаги являются предпочтительными. Морфологические свойства фагов не ограничивают выбор этих фагов, тем не менее, предпочтительными являются миовирусы (myoviridae) (Т4-подобные фаги), сифовирусы (siphoviridae) (λ-подобные фаги) или подовирусы (podoviridae) (T7-, Р22-подобные фаги).
Фаги связываются с соответствующими рецепторами бактерий, что приводит в результате к белок-белковому, или белок-углеводному, или белок-липидному взаимодействию. После высокоспецифичного распознавания своего хозяина фаг вводит свою генетическую информацию (одноцепочечную или двухцепочечную ДНК или РНК) в клетку и либо присутствует в своей лизогенной форме, либо продуцирует, в случае лизиса, новые фаговые частицы. Введение в бактерии нуклеиновой кислоты фагов вызывает связывание бактерий с фагами, в большинстве случаев необратимым образом. В соответствии со способом по настоящему изобретению после окончания стадии распознавания следует выявление бактерий. Этот способ в сущности применим в отношении всех бактерий, для которых фаги были описаны или могут быть выделены. Предпочтительные бактерии представляют собой бактерии, которые важны для пищевой промышленности, медицины или анализа окружающей среды, такие как молочнокислые бактерии, например лейконосток, псевдомонас, и энтеробактерии, например Е.coli, сальмонелла. Стадию распознаванию можно осуществлять при любой температуре в диапазоне от 0 до 90°С, предпочтительно при температуре в диапазоне от 4 до 45°С, особенно предпочтительно при температуре в диапазоне от 15 до 37°С, более предпочтительно при температуре в диапазоне от 20 до 37°С, даже еще более предпочтительно при комнатной температуре.
Кроме того, можно выделить и использовать для выявления отдельные белки фагов, например рецепторы фагов, адгезины фагов или их части, например р12 от Т4 или р9-хвостовой шип от Р22, или разновидности этих белков, нежели фаги целиком. Предпочтительными являются адгезины, необратимо связывающиеся с бактериями, или адгезины, у которых связывающий бактерии "карман" модифицирован рекомбинантными или химическими способами таким образом, чтобы достигнуть необратимого связывания. Примерами рекомбинантно модифицированных белков фагов являются "мутанты по активному сайту" хвостового шипа Р22 (см. Ваха et al., Biophys. J. 71, 2040-2048; 1996). Белки фагов, а также бактериофаги можно использовать в способах по настоящему изобретению.
Эти бактериофаги и/или белки бактериофагов, используемые согласно настоящему изобретению, могут быть адаптированы к несущим структурам по своей специфичности в отношении хозяина и своим связывающим свойствам соответственно путем направленного или случайного мутагенеза. Мутагенез вводит мутации, которые могут представлять собой добавки аминокислот, делеции, замены или химические модификации. Эти мутации имеют эффект, заключающийся в модификации аминокислотной последовательности в связывающей области фагов или белков фагов, приводящий к адаптации специфичности и аффинности связывания к требованиям анализа, например, для того, чтобы сделать связывание бактерий с выделенными фаговыми белками необратимым с целью улучшить возможности отмывки. Дополнительно могут быть осуществлены рекомбинантные или биохимические модификации белков фагов для того, чтобы достичь прекращения возможно присутствующей ферментативной активности, тем самым улучшив связывание или сделав его необратимым.
Для целей выявления в соответствии с настоящим изобретением фаги или белки фагов иммобилизуют на подходящих несущих структурах, например на титрационных микропланшетах, тестовых полосках, предметных стеклах, пластинках, фильтрующих материалах или проточных клеточных камерах. Несущие структуры могут быть, например, из полистирола, полипропилена, поликарбоната, ПММА, ацетата целлюлозы, нитроцеллюлозы, стекла, кремниевой пластинки. Иммобилизацию можно осуществлять путем адсорбции или ковалентного связывания, причем ковалентное связывание является предпочтительным. Важно, чтобы иммобилизация была функциональной, то есть чтобы фаги и белки фагов, соответственно, демонстрировали структуры, доступные для бактерий, несмотря на то, что они связаны с несущим материалом.
Для того чтобы подавить неспецифичную реакцию бактерий, которые нужно исследовать, с несущим материалом, можно осуществлять блокирование бычьим сывороточным альбумином (БСА), или Твином-20, или веществами, которые подобным же образом используются в твердофазных иммуноферментных анализах (ELISA), такими как сухое молоко. Кроме того, для увеличения эффективности адсорбции несущие системы могут быть предварительно покрыты подходящими белками (например, специфичными в отношении белков фагов антителами или неспецифичными белками, такими как БСА), пептидами, сахаридами (например, моно-, олиго- или полисахаридами) или детергентами (например, Твином-20 или октилглюкозидом). Эти процедуры нанесения покрытия могут осуществляться в течение ночи при температуре в диапазоне от 4 до 20°С или в течение промежутка времени, составляющего от 2 до 4 часов, при температуре от 30 до 65°С. Затем избыточную жидкость удаляют и несущую структуру сушат при приблизительно 60-70°С. Основное покрытие должно гарантировать адсорбцию функциональных фагов или белков фагов, с одной стороны, и, с другой стороны, предотвращать неспецифическую адсорбцию тестируемых бактерий на несущей структуре, таким образом повышая эффективность анализа. Вслед за основным покрытием наносят фаги или белки фагов путем нанесения водного буферного раствора фагов или белков фагов на предварительно обработанную несущую структуру. После адсорбции при 4-20°С в течение ночи или при 30-65°С в течение промежутка времени 2-4 часа покрывающий раствор удаляют и несущую структуру сушат, как описано выше. Затем для увеличения эффективности нанесения покрытия может быть осуществлена ковалентная фиксация фагов или белков фагов химическими перекрестносшивающими агентами, такими как глутаровый альдегид.
Для улучшения функциональной иммобилизации может быть задействована техника фагового дисплея (смотри в Gene, 1998, 215, 439-444), где пептиды экспрессируются на белке головки фага или на белках капсида, причем эти пептиды определяют свойства связывания в отношении определенных несущих систем, с применением используемых фагов, например с миовирусами, сифовирусами и подовирирусами.
Иммобилизацию фагов и белков фагов на несущем материале посредством адсорбции можно осуществлять путем инкубации раствора фага в водном буфере, например в 100 мМ Трис с рН 7,3 или 100 мМ фосфате натрия с рН 7,5, в течение нескольких часов или в течение ночи при температуре 5-45°С, предпочтительно при 15-37°С, более предпочтительно при 20-37°С и еще более предпочтительно при комнатной температуре.
Нет необходимости иммобилизировать фаги или белки фагов непосредственно на носителе. Они, предпочтительнее, могут быть связаны с полипептидами, которые, в свою очередь, иммобилизованы на носителе. Эти полипептиды могут представлять собой антитела, пектины, рецепторы или антикалины (anticalin), специфичные в отношении фагов или белков фагов.
В случае иммобилизации фагов или белков фагов путем ковалентного связывания неспецифично связавшиеся бактерии могут быть лучше удалены при более жестких условиях отмывки. В случае применения ковалентного связывания фаги и белки фагов можно связывать с несущими материалами, которые предварительно были активированы производителем, например первичными аминогруппами или карбоксильными группами. Примеры несущих материалов представляют собой, например, титрационные микропланшеты от Nunc, Xenobind или Costar. Кроме того, фаги и белки фагов могут быть ковалентно связаны, например, с -NH2 (Russian Chemical Rev., 1964, 33, 92-103), или СОО- через 1-этил-3'[3'-диметиламинопропил]карбодиимид (ЭДК) (Anal. Biochem. 1990, 185; 131-135) в стандартных реакциях. Кроме того, несущие материалы можно непосредственно активировать подходящими способами. Один вариант, который предпочтителен благодаря его применимости к широкому ряду несущих материалов, представляет собой силанизацию. Силанизацию полистирола можно осуществлять, например, путем пиролиза в пламени. Затем наносят подходящие адгезивы, делающие связывание возможным, например, через первичные аминогруппы или карбоксильные группы.
Для того чтобы осуществить направленную иммобилизацию, например, для Т4-фагов - связывание с носителем через "головку", могут быть использованы способные набухать полимеры, имеющие поры определенного размера, или для иммобилизации на металлических поверхностях - смеси имеющих различную длину алкилтиолов.
Для связывания бактерий, которые нужно анализировать, с иммобилизованными бактериофагами или белками фагов анализируемый образец приводят в контакт и инкубируют в водной форме с этими фагами или белками фагов. Инкубация осуществляется при температуре в диапазоне от 4 до 90°С, предпочтительно при температуре в диапазоне от 4 до 45°С, более предпочтительно при температуре в диапазоне от 15 до 37°С, еще более предпочтительно при температуре в диапазоне от 20 до 37°С, в частности при комнатной температуре, в течение промежутка времени до 6 часов, предпочтительно до 4 часов, более предпочтительно до 2 часов, в частности до 1 часа, более предпочтительно от 1 до 20 минут. Как пример, инкубация может быть осуществлена в течение 2-120 минут при температуре от 4 до 37°С, в течение 20-30 минут при 25 или 37°С, более предпочтительно в течение 35 минут при 37°С. Путем добавления ингибиторов трансляции, таких как рифампицин, можно увеличить время инкубации, чтобы повысить эффективность связывания. После специфичного распознавания и сильного связывания бактерий неспецифично связавшийся материал может быть отделен путем отмывки водным буфером, например фосфатным буферным раствором (ФБР) или ФБР-Твин, предпочтительно при нейтральном значении рН, например 50 мМ фосфатом натрия с рН 7,0. Возможно, что эти детергенты, например Твин 20, Тритон Х-100, или хаотропные агенты, например гидрохлорид гуанидиния или мочевина, можно добавлять в используемый буфер для увеличения эффективности отмывки. Эта стадия отмывки может быть повторена несколько раз независимо от используемого материала образца.
Вслед за отделением неспецифично связавшихся материалов можно осуществлять пермеабилизацию мембраны связанных бактерий или, если желательно (в зависимости от применяемого анализа выявления), разрушить ее путем добавления детергентов (например, додецилсульфата натрия, октилглюкозида), химических веществ (например, полимиксина В), порообразующих полипептидов (например, низина, холина, меллитина) или белков (например, лизоцима). Эта пермеабилизация мембраны может быть осуществлена в течение 5-10 минут при температуре, варьирующей в диапазоне приблизительно от 10 до 50°С. Затем связанные бактерии выявляют.
Когда образец проконтактировал с иммобилизованными фагами или белками фагов, например, в проточной камере или на фильтре, нет жесткой необходимости удалять его после связывания бактерий с фагами или белками фагов перед проведением выявления.
Выявление белков, связавшихся с фагами или белками фагов, можно осуществлять с помощью колориметрического анализа, выявляя, например, восстановленный никотинамид-аденин-динуклеотид (НАДН) (Bergmeyer & Bernt; Methoden der enzymatischen Analyse, Bergmeyer, U. VCH, Weinheim 1974), β-галактозидазную активность (Apte et al., 1995, Wat. Res.29, 1803-1806) или неорганический фосфат (Lanzetta et al., 1979, Anal. Biochem., 100, 95-97). Эти анализы позволяют выявлять по меньшей мере 104 клеток/мл, однако при использовании флуоресцентных красителей чувствительность может быть повышена до 102-103 клеток/мл. Колориметрические анализы, как правило, используются для выявления активности ферментов внутриклеточной мембраны или периплазматических ферментов либо клеточных компонентов, или продуктов размножения фагов, например белков фагов или фаговых нуклеиновых кислот. Фаговые нуклеиновые кислоты могут быть дополнительно модифицированы, например, экзогенная нуклеиновая кислота, например ген пероксидазы хрена, может быть клонирован в фаговый геном. После внедрения фаговой нуклеиновой кислоты в связавшуюся бактерию экзогенный ген экспессируется. Активность генных продуктов можно выявлять традиционными способами. Кроме того, экзогенная нуклеиновая кислота может кодировать какой-нибудь небактериальный полипептид, который можно затем выявить.
Колориметрические анализы могут быть одинаковыми для всех бактерий, которые нужно анализировать, но они также могут быть специфичны в отношении конкретных комбинаций бактерий/фагов. Измерение ферментативной активности цитоплазматических или периплазматических ферментов осуществляется после пермеабилизации мембраны связавшихся бактерий. Предпочтительно выявляют реакционную способность ферментов, встречающихся повсюду, таких как лактатдегидрогеназа или протеин-дисульфид-изомераза. Выбор ферментов может быть сделан с учетом соответствующего тестируемого рода бактерий или постановки задачи, специфичной для этого рода. Для анализов с колориметрическим тестированием используются способы выявления на основе хемилюминесценции или биолюминисценции, абсорбции, флюоресценции или кругового дихроизма в зависимости от требующейся чувствительности.
Выявление бактерий, связавшихся с фагами или белками фагов, также можно осуществлять путем выявления ДНК и/или РНК. С этой целью можно использовать вещества, которые связываются с ДНК и/или РНК. Связывание с ДНК и/или РНК может осуществляться непосредственно на основе мембранной диффузии или, наоборот, на основе пермеабилизации мембраны. Можно использовать имеющиеся в продаже флуоресцентные маркеры, такие как этидийбромид, акридиновый оранжевый, 4',6'-диамидино-2-фенилиндол (DAPI) или SYBR зеленый I, и соответствующие протоколы выявления, описанные в литературе.
Кроме того, выявление бактерий, связавшихся с фагами или белками фагов, можно осуществлять путем выявления вновь синтезированной ДНК и/или РНК. С этой целью проходящие через мембрану меченные флуоресцентной меткой нуклеотиды могут включаться во вновь синтезируемую фаговую ДНК и/или РНК.
Еще один способ выявления представляет собой гибридизацию с меченными флуоресцентной меткой высококонсервативными олигонуклеотидами 16S-рРНК (последовательность Шайна-Далгарно) и выявление сигнала гибридизации с помощью флуоресценции. Предпочтительным является способ выявления с использованием белков фагов или "теней" фагов ("пустые капсиды фагов" без нуклеотидов), поскольку это уменьшает фоновый сигнал фаговой ДНК или РНК.
Еще один способ выявления бактерий, связавшихся с фагами или белками фагов, осуществляют с использованием полипептидов, например, связанных с меткой, например флуоресцеинизотиоцианатом (ФИТЦ) или щелочными фосфатазами, антител к структурам клеточной поверхности бактерий или с использованием пектинов к структурам клеточной поверхности бактерий, где за развитием сигнала, например антителом, связанным с пероксидазой, следят фотометрически. Клеточные поверхности бактерий, которые распознаются антителами или пектинами, могут представлять собой, например, липополисахариды или мембранные белки. Полипептиды также могут представлять собой белки фагов, идентичные иммобилизованным белкам фагов или отличные от этих иммобилизованных белков фагов. Кроме того, выявление можно осуществлять с использованием целых фагов, либо идентичных иммобилизованным фагам, либо отличных от них.
В способе выявления по настоящему изобретению не требуется использование вторичных антител. В противоположность традиционному твердофазному иммуноферментному анализу (ELISA), в котором анализируемые бактерии связывают с несущей системой и выявление проводят последовательно с использованием первичных и вторичных антител, предварительное обогащение и отбор осуществляют путем применения фаговых частиц, связанных с несущими системами. Это радикально уменьшает чувствительность анализа ELISA от 104 бацилл/мл, имеющихся в настоящее время, до 106 бацилл/мл (Blasco et al., 1998; J. Appl. Microbiol., 84, 661-666).
В зависимости от обстоятельств выявляют изменения, например, флуоресценции, люминиценции, абсорбции или кругового дихроизма, проводимости или емкости соответственных образцов в соответствующем стандартном аппарате. Чтобы иметь возможность точного определения концентрации бактерий, можно построить калибровочную кривую с использованием соответствующих стандартных молекул. Для осуществления точного определения рода бактерий можно использовать много типирующих систем, ранее описанных в области техники. В случае необходимости, для точного определения штамма конструируют и используют новые типирующие системы, которые представляют собой подходящие комбинации разных фагов.
Применение способа по изобретению дает возможность быстрого и чувствительного выявления бактерий. Связывание с подходящими несущими структурами, описанными выше, дает возможность быстро и экономично определять многочисленные бактериальные штаммы, очень точно определять род бактерий и/или определять количество бактерий в одном анализе. Среди прочего, точное определение рода бактерий является важным в сфере медицинской диагностики в плане эпидемиологической характеристики патогенов.
Способ по настоящему изобретению можно применять для быстрого, высокочувствительного и экономичного выявления бактерий в любом образце, в частности в области медицины, пищевой промышленности, и в анализе в области животноводства, анализе пресной воды или окружающей среды. Простота выполнения этого способа делает возможными как компактные растворы для наиболее важных комбинаций бактерий, так и системы растворов, приспособленные к потребностям клиентов и таким образом делает возможным универсальное применение способа по настоящему изобретению. Настоящее изобретение дополнительно дает возможность полной автоматизации способа по настоящему изобретению. Кроме того, данный способ применим в отношении всех бактерий, для которых подходящие фаги являются доступными или будут выделены в будущем, или в отношении бактерий, для которых соответствующие типирующие фаги или белки фагов могут быть получены путем отбора. Способ по данному изобретению, кроме того, пригоден для использования в наборах для выявления бактерий для "кого-либо" для домашнего применения.
Еще один аспект данного изобретения относится к набору для выявления бактерий, содержащему носитель с иммобилизованными фагами или белками фагов и растворы с реактивами для анализа, необходимые для обнаружения связавшихся бактерий. Носитель может представлять собой любой из описанных выше носителей, на котором фаги или белки фагов иммобилизуются, как описано выше. Растворы, содержащие реактивы для анализа, также соответствуют описанным веществам для выявления бактерий в способе по настоящему изобретению. Возможно, набор может дополнительно содержать растворы для отмывки, а также ферменты или детергенты, необходимые для разрушения мембраны бактерий.
Следующие примеры поясняют данное изобретение, но их не следует рассматривать как ограничивающие. Если иное не указано, использовали стандартные способы молекулярной биологии в соответствии с тем, например, как описано в Sambrock et al., 1989, Molecular Clonning: A laboratory Manual, 2nd edition. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
1. Выделение и очистка фагов
Очистку фагов Е.coli Т4, Т7, Qβ и PhiX174 осуществляют после культивации фагов на бактериях-хозяевах в соответствии с данными, приведенными DSM, на основе стандартных методик. Для того чтобы осуществить полное отделение бактерий и бактериальных остатков, суспензию фагов центрифугируют при небольшом числе оборотов в минуту (5000×g, 30 минут). Чтобы концентрировать и выделить фаги, осуществляют стандартное препаративное ультрацентрифугирование и осаждение полиэтиленгликолем. Успешное отделение бактерий контролируют с помощью экспериментов с культивированием и после этого фаги хранят на холоду (от 4 до 8°С) или замороженными (от -20 или -80°С).
2. Выделение и очистка рецепторных структур фагов
Рецепторные структуры фагов отделяют из интактных фагов при помощи стандартных способов химического отделения белков или получают рекомбинантными способами и очищают при помощи стандартных способов химического отделения белков и хранят так же, как целые фаговые частицы.
3. Фиксация фагов путем абсорбции
108-1012 фагов/мл в водном буфере (100 мМ Трис, рН 7,4, 150 мМ NaCl, 0,03% (масс./об.) желатин или 50 мМ фосфат натрия, рН 7,0) непосредственно иммобилизируют путем абсорбции на плашетах Nunc Maxisorb либо в течение нескольких часов при 37°С, либо в течение ночи при 20°С. Затем не связавшиеся фаги удаляют путем четырехкратной отмывки 100 мМ Трис, рН 7,3 или 50 мМ фосфатом натрия, рН 7,5.
После этого осуществляют стадию блокирования для подавления неспецифичных побочных взаимодействий бактерий с материалом несущей системы. Обработанную фагами несущую систему инкубируют блокирующим раствором ФБР (4 мМ КН2PO4, 16 мМ Na2PO4, 115 мМ NaCl) и добавкой 0,05-1,00% Твина 20, 1% бычьего сывороточного альбумина либо в течение ночи при температуре в районе 4°С, либо в течение 2 часов при 37°С, супернатант удаляют и несущую систему затем сушат, как описано ранее.
4. Фиксация фагов путем ковалентного связывания
Полистироловые планшеты от Nunc (CovaLink™) и Costar (с группами NH2) активируют цианурхлоридом (48 мг в 3 мл ацетона, 45 мл 100 мМ фосфата натрия, рН 7,0) в соответствии с протоколом производителя. 100-200 мкл цианурхлорида накапывают пипеткой в лунки планшетов в течение промежутка времени 2 минуты и инкубируют при комнатной температуре в течение 5 минут. Затем осуществляют трехкратную отмывку 100 мМ фосфатом натрия с рН 7,0 и сушат при 50°С более 30 минут. Для достижения связывания фаги инкубируют в лунках в течение ночи при комнатной температуре в 100 мМ карбонате натрия с рН 10,0. Несвязавшиеся фаги удаляют путем трехкратной отмывки 50 мМ фосфатом натрия с рН 7,0. После окончания планшеты сушат или покрывают водным буфером и хранят при температуре от 4 до 20°С до использования.
5. Выявление связавшихся бактерий посредством β-галактозидазной активности
Бактериальные образцы (200 мкл образца/лунку) инкубируют при 37°С в течение 35 минут. После этого неспецифично связавшиеся бактерии отделяют при помощи трех отмывочных стадий, используя или 200 мкл 100 мМ Трис с рН 7,0, или 200 мкл фосфатного буфера с рН 7,0. Для анализа с помощью окрашивания добавляют 200 мкл отмывочного буфера, содержащего MgCl2 и меркаптоэтанол, а также 66 мкл о-нитрофенил-β-D-галактопиранозида (ОНФГ, 4 мг/мл). Анализируемый образец инкубируют при 37°С и за протеканием реакции следят спектрофотометрически при 405 нм в течение нескольких (2-5) часов.
Иллюстративные примеры
Пример 1
E.coli MC4100 выявлена колориметрическим β-галактозидазным анализом после связывания с бактериофагом Т4, ковалентно иммобилизованным на микротитрационном планшете
Соединение фага с носителем путем непосредственного связывания (химического связывания) - инкубация с образцом - удаление несвязавшихся бактерий - выявление бактерий (путем колориметрического выявления клеточных компонентов).
Выполнение:
(1) Активация микротитрационных планшетов
Микротитрационные планшеты Nunc CovaLink-NH2 активируют цианурхлоридом согласно инструкциям производителя (Tach Note, Nunc GmbH Wiesbaden Germany).
(2) Соединение фага Т4 с носителем
Лунки заполняют 300 мкл раствора Т4 (108 бое/мл Т4 в 0,1 М карбонатном буфере рН 10). Лунки, используемые в качестве контроля, предварительно блокируют 1%-ным бычьим сывороточным альбумином (BSA) в карбонатном буфере. Планшеты инкубируют в течение ночи при 30°С, промывают трижды 300 мкл TSB-буфера (10 мМ TrisHCl рН 8, 150 мМ NaC) и блокируют TSB-0,1% BSA в течение 1-3 ч при 30°С. Лунки снова промывают трижды и хранят с 300 мкл TSB.
(3) Связывание E.coli MC4100
Удаляют TSB и в лунки добавляют 200 мкл серийных разведении ночной культуры E.coli MC4100 в LB-среде, дополненной антибиотиками. В контрольные лунки добавляют 200 мкл культуры E.coli (108 кое/мл). Планшеты инкубируют при 37°С в течение 1 ч и лунки промывают трижды TSB, дополненным антибиотиками.
Связанные клетки E.coli выявляют по свойственной им β-галактозидазной активности (Apte, S.C. et al., 1995 Rapid detection of faecal coliforms in sewage using a colorimetric assay of beta-D-galactosidase, Water Research 29 (7), 1803-6), которую выявляют в колориметрическом анализе путем измерения поглощения на длине волны 405 нм через 5 ч инкубации при 37°С.
Результаты представлены на Фиг.1.
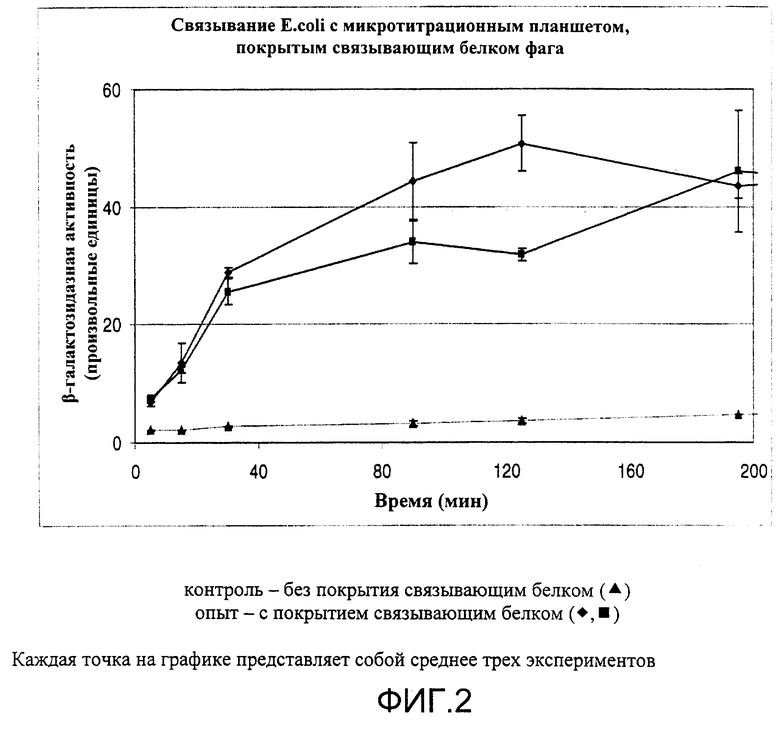
Пример 2
Связывание и выявление E.coli, связанной с модифицированным белком бактериофага, иммобилизованным на микротитрационном планшете, покрытом стрептактином
Соединение белка фага с носителем путем непосредственного связывания с полипептидом - инкубация с образцом - удаление несвязавшихся бактерий - выявление бактерий (путем колориметрического выявления клеточных компонентов).
Выполнение:
Связывающий белок из бактериофага (белок хвостового шипа р12 фага Т4), к N-концу которого присоединена StrepTag (специализированная полипептидная последовательность с высоким сродством к стрептактину), связывали с микротитрационными планшетами, покрытыми стрептактином (рецепторный полипептид) в течение 1 ч при комнатной температуре. Несвязанный материал удаляли повторяющимися промываниями 200 мкл PBST (PBS; 0,05% Tween 20). В лунки добавляли 200 мкл ночной культуры E.coli в LB и инкубировали различное время при комнатной температуре. Связанные клетки выявляли по свойственной им β-галактозидазной активности (см. выше).
Результаты представлены на Фиг.2.
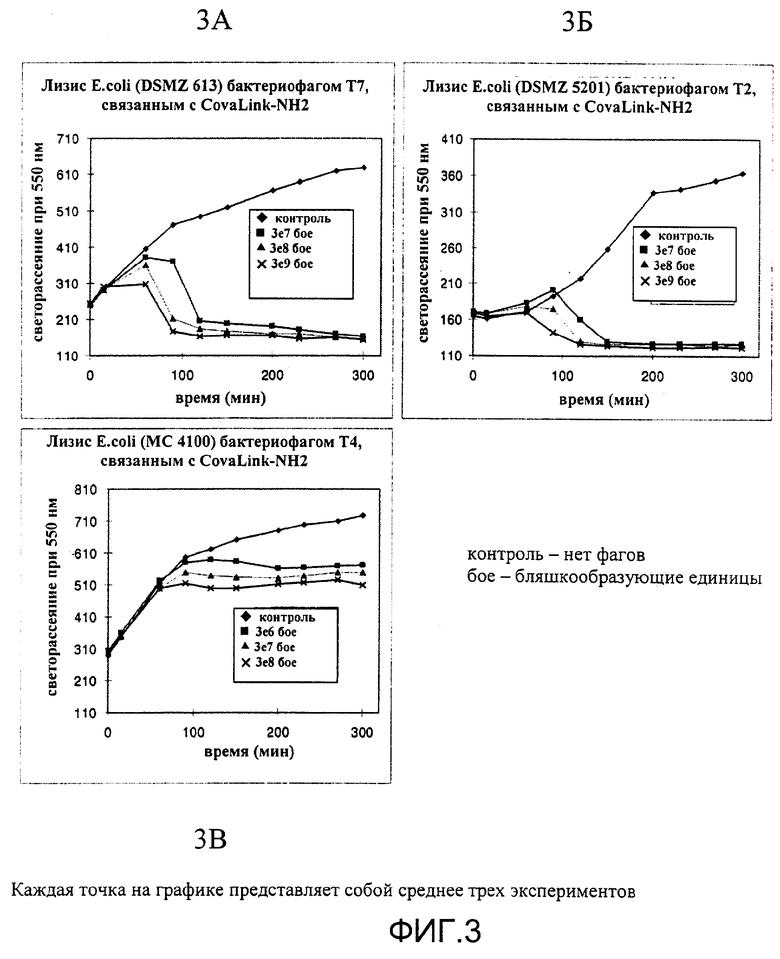
Пример 3
Различные штаммы E.coli связаны и лизированы различными фагами, связанными с микротитрационными планшетами.
Соединение фага с носителем путем непосредственного связывания (химического связывания) - инкубация с образцом - без удаления несвязавшихся бактерий - выявление бактерий (путем колориметрического выявления клеточных компонентов).
Пояснения:
Полные фаги могут оставаться функциональными после аккуратной иммобилизации на носителе. Это означает, что бактерия-хозяин может не только связаться, но и быть лизирована фагами. Бактериальный лизис в случае данного анализа представляет собой одну из реализации метода выявления бактерий: бактериальная популяция в этих условиях должна была бы расти, что подтверждает контрольный эксперимент, но при наличии связывания с бактериофагами и последующего лизиса рост прекращается.
Выполнение:
Микротитрационные планшеты (NovaLink-NH2; Nalge Nunc) активируют цианурхлоридом согласно инструкциям производителя и различные количества различных фагов (Т7, Т2, Т7, контроль:нет фагов) в 100 мкл PBS (20 мМ фосфатного буфера рН 7, 150 мМ хлорида натрия) связывают с планшетами в течение ночи при комнатной температуре при аккуратном встряхивании. Несвязанный материал удаляли повторяющимися промывками 200 мкл PBST (PBS; 0,05% Tween 20). В лунки раскапывали 200 мкл культуры E.coli различных штаммов (как указано на Фиг.3А-3В). Рост E.coli измеряли по увеличению светорассеяния при 550 нм при комнатной температуре путем измерения оптической плотности при 550 нм (ОП550). Уменьшающаяся или постоянная ОП550 означает лизис клеток после связывания с функциональным фагом.
Результаты представлены на Фиг.3.
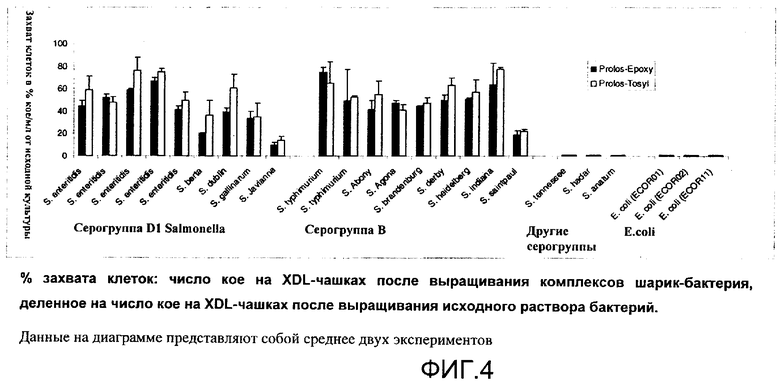
Пример 4
Белок хвостового шипа специфичного к Salmonella бактериофага (Det7) связывается с некоторыми серогруппами Salmonella, но не связывается с другими.
Этот пример демонстрирует специфичность связывания бактериофагов с бактериями-хозяевами. В данном случае бактериофаг Det7 (собственный изолят из группы myoviridae) является специфичным для Salmonella серогрупп В и D1, но не связывается с другими серогруппами Salmonella или родственными группами E.coli.
Соединение белка фага с носителем путем непосредственного связывания (химического связывания) - инкубация с образцом - удаление несвязавшихся бактерий - выявление бактерий (путем удаления комплекса фаг-бактерия и выращивания на чашках с селективной средой (колониеобразующие единицы))
Реализация:
Белок хвостового шипа фага Det7 без ферментативной активности (удаленной сайт-направленным мутагенезом для обеспечения стабильности комплекса фаг-бактерия) был химически связан с шариками Dynal через тозил- или эпоксигруппы (на диаграмме соответственно Profos-Tosyl и Profos-Epoxy) согласно инструкциям производителя (Dynal). Шарики, покрытые фагами (20 мкл), в концентрации 2,5-3,0×107 шариков/мл инкубировали с 1 мл образца с бактериями в концентрации 104 клеток/мл в PBST (20 мМ форсфатного буфера, рН 8, 150 мМ хлорида натрия, 0,55% Tween 20) в течение 20 мин при комнатной температуре. Несвязанные клетки удаляли за одно промывание 2 мл PBST. Комплексы шарик-фаг-бактерия удаляли магнитной сепарацией. 100 мкл каждого комплекса шарик-фаг-бактерия (ресуспендированного в 1 мл) помещали на агаровые чашки селективные для Salmonella (XDL) и инкубировали в течение ночи. Через 12 ч определяли число колиниеобразующих единиц (кое).
Результаты представлены на Фиг.4.
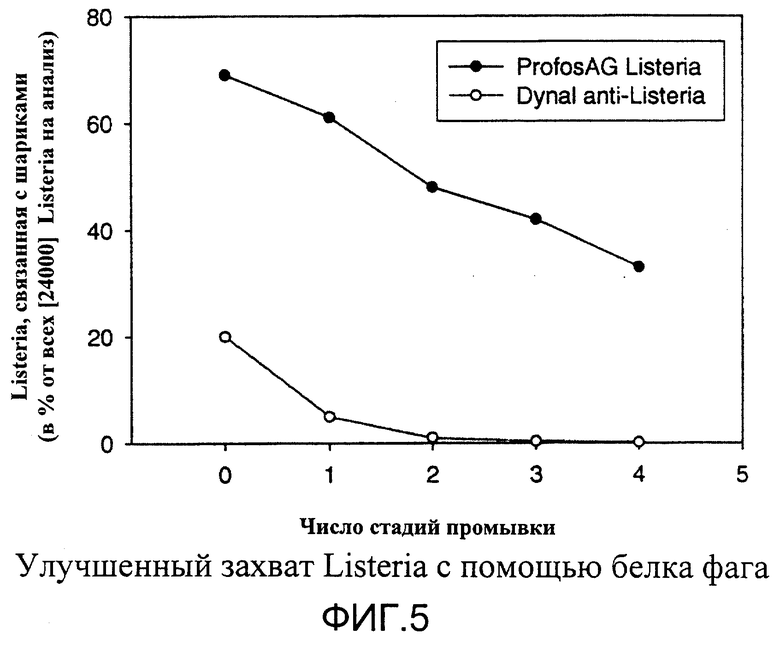
Пример 5
Связывание фаговых белков с бактериями может быть очень сильным.
Сравнение шариков Dynal-анти-Listeria и Profos CBD-Listeria
Сравнение осуществляют при одном и том же количеством клеток (2,4×104) в одном и том же объеме (1 мл) и приблизительно с тем же количеством шариков (3,3-4,0×107)
Способ:
Ночную культуру L.monocytogenes EGD (серотип 1/2а) разводили 1:5 в BHI 1/2 и выращивали при 37°С в течение 2 ч на качалке. Клетки разводили до приблизительно 104 КОЕ на мл в PBS (в случае Dynal-анти-Listeria величина рН составляла 7,4, в случае Profos AG-Listeria-118 использовали рН 8,0). На 1 мл культуры добавляли 20 мкл Dynal-анти-Listeria или 10 мкл Profos AG-Listeria-118. Образцы вращали (над головой) в течение 40 мин, шарики собирали на магнит и супернатант удаляли и хранили в свежей чашке. Шарики ресуспендировали в 1 мл PBS, помещали в вортекс на 3 с и 200 мкл удаляли и хранили. Шарики собирали на магнит и супернатант удаляли и хранили в свежей чашке. Шарики ресуспендировали в 0,8 мл PBS, помещали в вортекс и 200 мкл удаляли и хранили и так далее. После 4 стадии промывки 100 мкл хранящихся образцов наносили на чашки на 1/2 BHI и инкубировали при 37°С в течение 16 ч; подсчитывали колонии, все данные являются средним двух экспертиментов; данные приведены в % от всех КОЕ на анализ (24000 КОЕ/мл и анализ).
Результаты: существенно большая часть клеток Listeria после нескольких стадий отмывки оставалась связанной с шариками, покрытыми белками фага, по сравнению с шариками Dynal-анти-Listeria (фиг.5).
Настоящее изобретение относится к способу выявления бактерий в любом образце, в частности в области медицины, биотехнологии, пищевой промышленности и т.п. Способ предусматривает следующие стадии: а) соединяют бактериофаги и/или белки бактериофагов с носителем; б) носитель, соединенный с бактериофагами и/или белками бактериофагов, инкубируют с образцом, возможно удаляют образец и бактерии в образце, не связавшиеся с бактериофагами и/или белками бактериофагов; возможно добавляют вещества, пермеабилизирующие или разрушающие бактериальную мембрану; в) выявляют в образце бактерии, связавшиеся с бактериофагами и/или белками бактериофагов, причем связавшиеся бактерии не подвергают стадии культивирования. Набор для осуществления способа содержит носитель с иммобилизованными фагами или белками бактериофагов, причем последние соединены непосредственным связыванием с носителем либо непосредственным связыванием с полипептидом, иммобилизованным на носителе, и реактивы для анализа для выявления связавшихся бактерий. Набор дополнительно содержит растворы для отмывки и/или вещества, пермеабилизирующие или разрушающие мембрану бактерий. Изобретение обеспечивает возможность быстрого и чувствительного выявления бактерий. 2 н. и 12 з.п. ф-лы, 5 ил.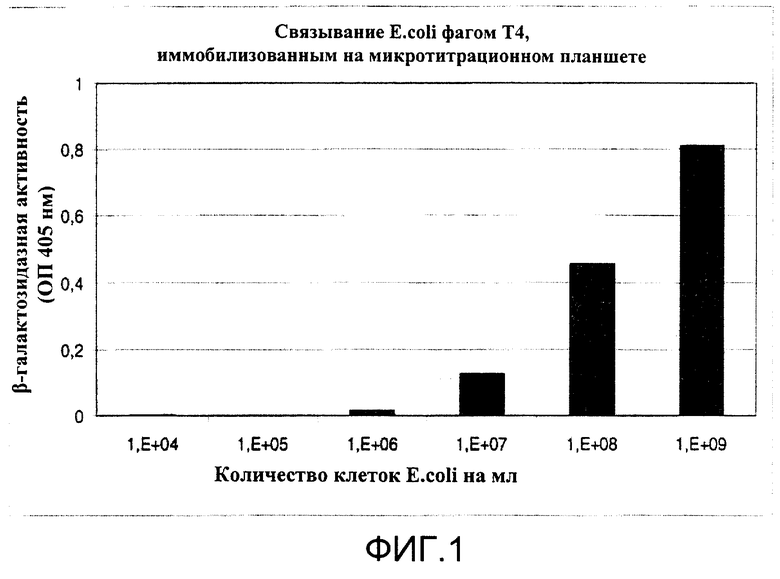
а) соединяют бактериофаги и/или белки бактериофагов с носителем либо соединением бактериофагов и/или белков бактериофагов с носителем путем непосредственного связывания, либо путем непосредственного связывания бактериофагов и/или белков бактериофагов с полипептидом, иммобилизованным на носителе,
б) носитель, соединенный с бактериофагами и/или белками бактериофагов, инкубируют с образцом и
в) выявляют в образце бактерии, связавшиеся с бактериофагами и/или белками бактериофагов, причем указанные связавшиеся бактерии не подвергают стадии культивирования.
| WO 9317129 A1, 02.09.1983 | |||
| СПОСОБ ФАГОТИПИРОВАНИЯ БАКТЕРИАЛЬНЫХ КУЛЬТУР | 1997 |
|
RU2137838C1 |
| Вопросы физиологии, метаболизма и идентификации микроорганизмов | |||
| Сборник научных трудов | |||
| М., 1987, с.92-95. | |||
Авторы
Даты
2005-11-27—Публикация
2000-07-28—Подача