ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области биотехнологии, в частности, к области биосенсоров, в частности, к области биосенсоров с металлическими наночастицами в качестве системы передачи сигнала.
УРОВЕНЬ ТЕХНИКИ
В последние годы биосенсоры рассматривают как альтернативу обычным способам анализа в различных областях. Биосенсор представляет собой аналитическое устройство, состоящее из двух основных элементов: биорецептора (биодатчика: антитела, ДНК-зонда или клетки и т.д.), предназначенного для специфического детектирования некоторого вещества, с использованием преимущества специфичности биомолекулярных взаимодействий, и преобразователя или сенсора, способного интерпретировать реакцию биологического распознавания рецептором и "преобразовывать" ее в количественно измеримый оптический или электрический сигнал. Наиболее выдающимися свойствами данных устройств, которые делают их весьма привлекательными вариантами аналитических средств, являются их специфичность, высокая чувствительность, чувствительность, обеспечивающая меньшее время анализа, возможность включения их в интегрированные системы, простота автоматизации, возможность работы в реальном времени, гибкость в применении и низкая цена.
Прогресс в области биосенсоров основан на накопленном в течение многих лет опыте изучения способности к распознаванию и свойств различных биомолекул. В качестве распознающих элементов применяются многие биологические средства от самых простых, таких как ферменты или антитела, до более сложных продуктов генной инженерии. С другой стороны, недавние достижения в области микроэлектроники, нанотехнологии и уникальные свойства специфических материалов стали ключевыми для таких устройств.
Несмотря на это, современные способы сенсорного детектирования не всегда способны удовлетворить требованиям надежности и скорости. Время, необходимое для осуществления анализа, и чувствительность данной методики являются наиболее существенными ограничениями. Хотя разработка данных устройств была преимущественно сфокусирована на области клинической диагностики, интерес к ним в других областях применения, включая экологическую, агропродовольственную, химическую, фармацевтическую и военную области, на сегодняшний день все возрастает.
В настоящем изобретении предложен новый биосенсор, основанный на способности металлических наночастиц преобразовывать свет в тепло.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Первый аспект настоящего изобретения относится к биосенсору для визуального детектирования аналита, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью, на которой указанная распознающая молекула из этапа a) иммобилизована или иммобилизуется;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит; и
e. Металлическую наночастицу, характеризующуюся полосой поверхностного плазмонного резонанса;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
В предпочтительном варианте реализации первого аспекта настоящего изобретения биосенсор для визуального детектирования аналита включает:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит, иммобилизованную на подложке с теплочувствительной поверхностью;
b. Внешний источник света; и
с. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, связанную с поверхностью металлической наночастицы, характеризущейся полосой поверхностного плазмонного резонанса;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
Второй аспект настоящего изобретения относится к биосенсору для визуального детектирования аналита, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, возможно связанную с молекулой-меткой; и
e. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные биомолекулами, специфично распознающими детектирующую биомолекулу или молекулу-метку, которой модифицирована детектирующая биомолекула;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
Третий аспект настоящего изобретения относится к биосенсору для визуального детектирования аналита, определенному во втором аспекте настоящего изобретения, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, связанную с одной или несколькими молекулами биотина; и
e. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные молекулами стрептавидина, молекулами авидина или тому подобными молекулами, специфично распознающими молекулы биотина;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
Четвертый аспект настоящего изобретения относится к биосенсору для визуального детектирования аналита, определенному во втором аспекте настоящего изобретения, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью;
c. Внешний источник света;
d. Вторую распознающую молекулу, при этом указанная молекула представляет собой антитело (детектирующее антитело), способную распознавать целевой аналит; и
e. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные антителами к Fc, которые связываются с детектирующим антителом;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
В частном варианте реализации любого из аспектов настоящего изобретения распознающие молекулы (осуществляющие захват и детектирующие биомолекулы) выбраны из перечня, состоящего из антител, пептидов, ферментов, полисахаридов, нуклеиновых кислот (ДНК, РНК), аптамеров или пептидо-нуклеиновых кислот (ПНК), предпочтительно из молекул ДНК и антител.
В другом варианте реализации любого из аспектов настоящего изобретения внешний источник света представляет собой лазер, при этом длина волны указанного лазера равна длине волны максимума полосы поверхностного плазмонного резонанса металлической наночастицы.
В другом варианте реализации любого из указанных двух аспектов настоящего изобретения металлическую наночастицу выбирают из перечня, состоящего из:
a. Наночастиц золота;
b. Наночастиц серебра; или
c. Наночастиц меди.
Указанная металлическая наночастица предпочтительно представляет собой треугольную золотую нанопризму.
В другом варианте реализации любого из указанных двух аспектов настоящего изобретения поверхность подложки содержит теплочувствительную бумагу, или целлюлозную мембрану, нитроцеллюлозную мембрану или ацетатцеллюлозную мембрану. Предпочтительно теплочувствительная бумага прикреплена ко второй подложке, выбранной из перечня, состоящего из подложек из стекла, кремния, керамики, полистирола, целлюлозной мембраны, нитроцеллюлозной мембраны или ацетатцеллюлозной мембраны.
Пятый аспект настоящего изобретения относится к применению биосенсора согласно первому аспекту настоящего изобретения для визуального детектирования аналита, которое включает:
а. Добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
b. Инкубацию подложки из этапа а) с металлическими наночастицами, функционализированными второй распознающей аналит молекулой (детектирующей биомолекулой); и
c. Возможно размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
d. Облучение подложки из этапа b) или с) внешним источником света.
Шестой аспект настоящего изобретения относится к применению биосенсора для визуального детектирования аналита, описанного во втором аспекте настоящего изобретения, для детектирования аналита, которое включает:
a. Добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
b. Инкубацию подложки из этапа а) со второй распознающей аналит молекулой (детектирующей биомолекулой), возможно снабженной меткой;
c. Инкубацию подложки из этапа b) с металлическими наночастицами, функционализированными биомолекулой, специфично распознающей детектирующую биомолекулу или метку, которой модифицирована детектирующая биомолекула; и
d. Возможно, размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
e. Облучение подложки из этапа с) или d) внешним источником света.
Предпочтительный вариант реализации шестого аспекта настоящего изобретения относится к применению биосенсора для детектирования аналита, которое включает:
a. Добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
b. Инкубацию подложки из этапа а) со второй распознающей аналит молекулой (детектирующей биомолекулой), меченой по меньшей мере одной молекулой биотина;
c. Инкубацию подложки из этапа b) с металлическими наночастицами, функционализированными стрептавидином; и
d. Возможно размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
e. Облучение подложки из этапа с) или d) внешним источником света.
Другой предпочтительный вариант реализации шестого аспекта настоящего изобретения относится к применению биосенсора для детектирования аналита, которое включает:
a. Добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
b. Инкубацию подложки из этапа а) со второй распознающей молекулой (детектирующей биомолекулой), которая представляет собой антитело;
c. Инкубацию подложки из этапа b) с металлическими наночастицами, функционализированными антителом к Fc; и
d. Возможно, размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
e. Облучение подложки из этапа с) или d) внешним источником света.
Седьмой аспект настоящего изобретения относится к применению биосенсора, описанного в первом аспекте настоящего изобретения, для детектирования аналита, которое включает:
a. Добавление к образцу, в котором присутствует детектируемый аналит, металлических наночастиц, функционализированных второй распознающей аналит молекулой (детектирующей биомолекулой);
b. Выделение аналита, связанного с наночастицами, из образца из этапа а), предпочтительно посредством процесса центрифугирования;
c. Добавление экстракта из этапа b к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
d. Возможно размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
e. Облучение подложки из этапа с) или d) внешним источником света.
Восьмой аспект настоящего изобретения относится к применению биосенсора согласно любому из предшествующих аспектов или вариантов реализации для детектирования примесей, лекарственных средств, патогенных микроорганизмов, пищевых компонентов, пестицидов, токсичных соединений или в анализе биохимического потребления кислорода.
КРАТКОЕ ОПИСАНИЕ ФИГУР
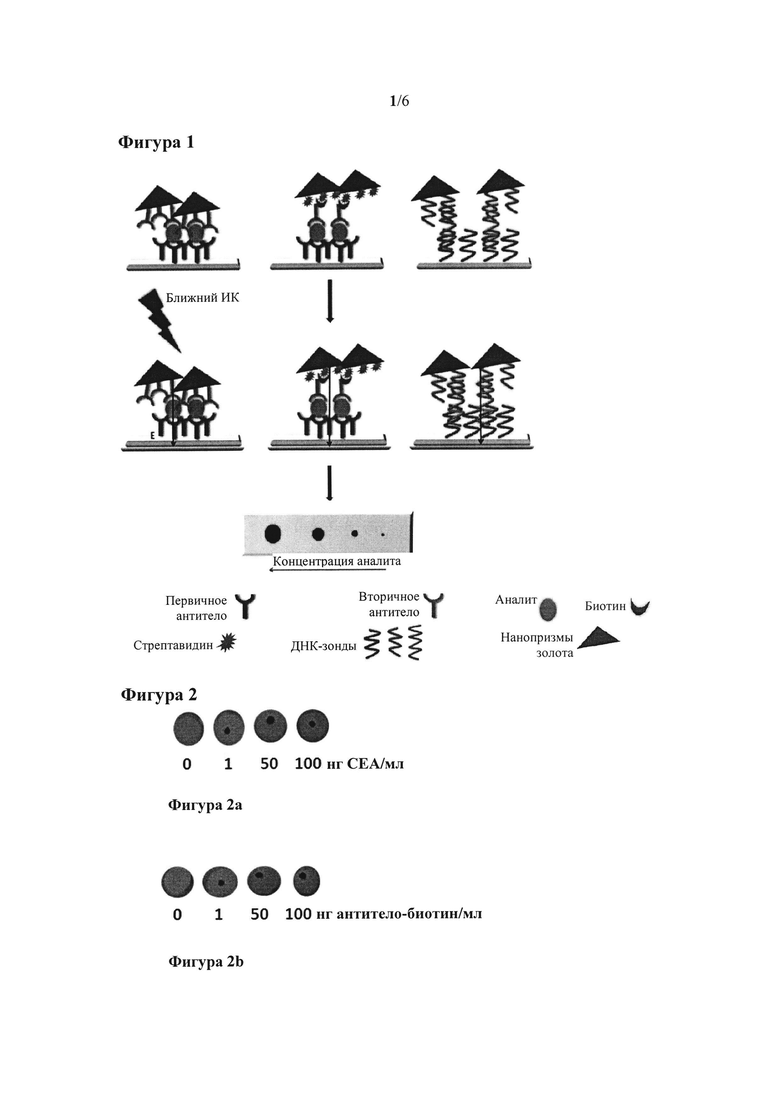
На фигуре 1 показана схема системы распознавания согласно настоящему изобретению.
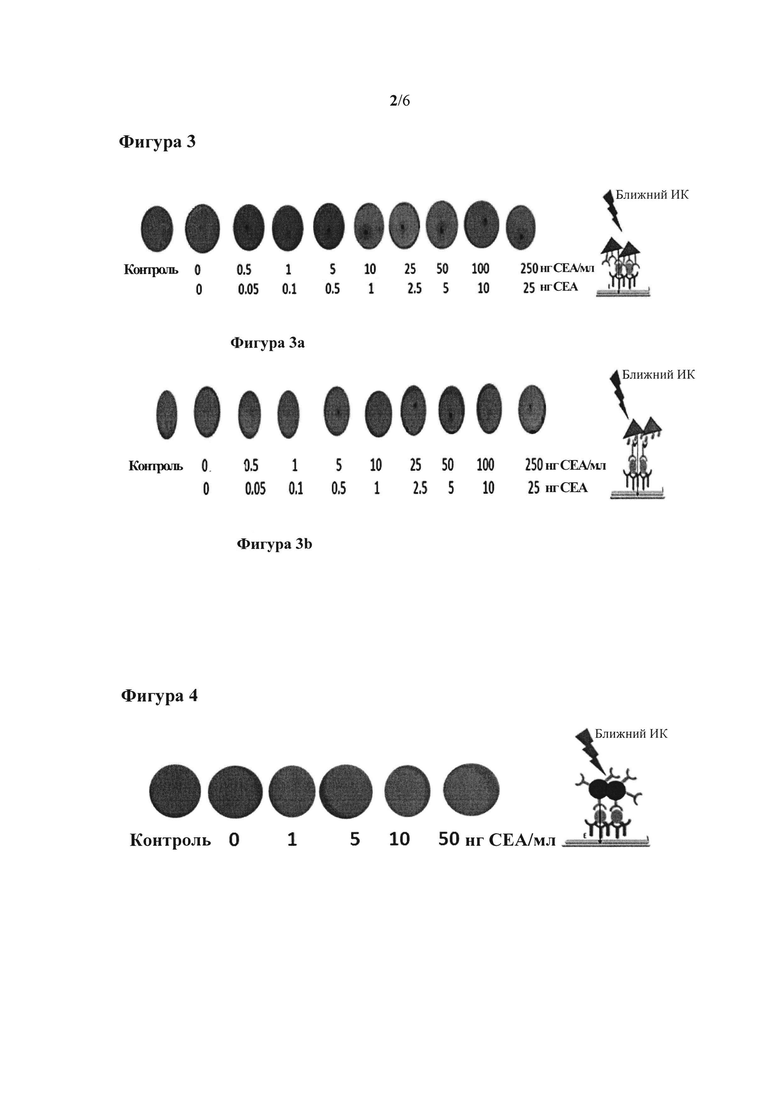
Фигура 2: на фигуре 2а показано распознавание РЭА+антитело к РЭА 3С6-нанопризмы. На фигуре 2b показано распознавание антитело к РЭА 3С6-биотин+стрептавидин-нанопризмы.
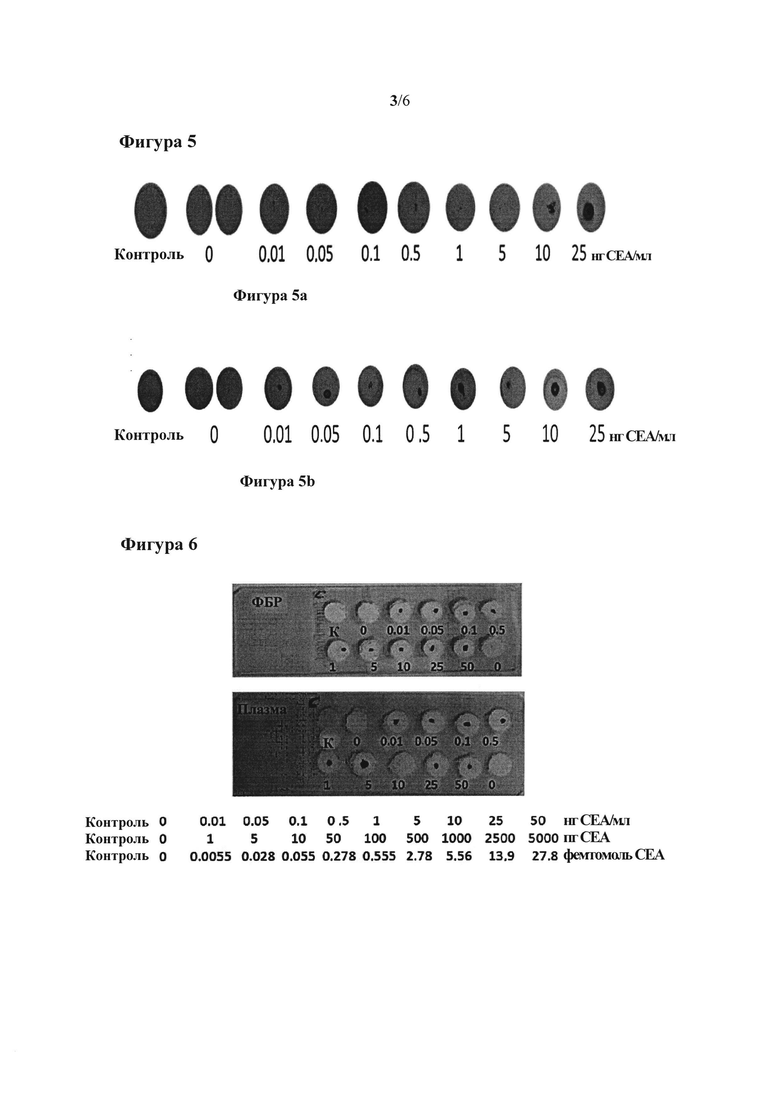
Фигура 3: на фигуре 3а показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-нанопризмы. На фигуре 3b показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-биотин+стрептавидин-нанопризмы.
На фигуре 4 показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-наночастицы золота.
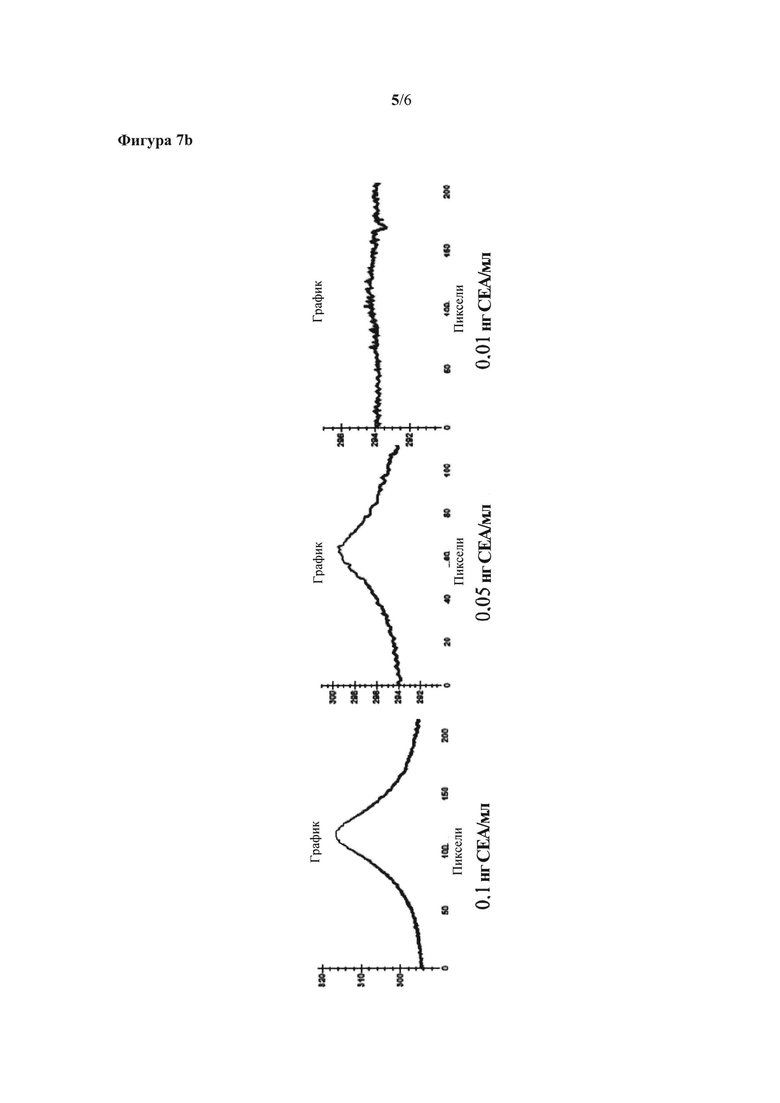
На фигуре 5 показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-нанопризмы золота с различными длительностями облучения и различными расстояниями между поверхностью и лазером. На фигуре 5а показано облучение в течение времени, равного 10 секундам, при большем расстоянии. На фигуре 5b показано облучение в течение времени, равного 2 секундам, при меньшем расстоянии.
На фигуре 6 показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-нанопризмы (в буфере ФБР и в образцах плазмы крови).
На фигуре 7 показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-нанопризмы золота в образцах плазмы крови и детектирование посредством инфракрасной камеры.
На фигуре 8 показаны схемы трех конструкций биосенсора, описанного в примере 5.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к биосенсору, включающему (i) распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит; (ii) подложку с теплочувствительной поверхностью; (iii) внешний источник света; (iv) вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, и (v) металлическую наночастицу, характеризующуюся полосой поверхностного плазмонного резонанса, при этом указанный аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
В биосенсоре согласно настоящему изобретению используется способность металлических наночастиц преобразовывать свет в тепло в качестве системы передачи сигнала. Основанием для применения данной системы в качестве отличительного признака в биосенсорах служит наличие полосы поглощения поверхностного плазмонного резонанса. Данные полосы поглощения возникают, когда частота света, воздействующего на наночастицу, находится в резонансе с частотой коллективных колебаний электронов в полосе проводимости частицы, что вызывает возбуждение. Данное явление известно как "локализованный поверхностный плазмонный резонанс" (ЛППР). Положение в спектре резонансной полосы сильно зависит от формы, размера и структуры частиц (полые или твердые), а также от диэлектрической среды, в которой находится частица. При ЛППР наблюдают высокие молярные коэффициенты экстинкции (~3×1011 М-1 см-1) с эффективностью, эквивалентной 106 молекулам флуорофора, и значительным усилением локального электрического поля вблизи наночастицы.
Металлические наночастицы, такие как наночастицы золота, серебра или меди, обладают эффектом поверхностного плазмонного резонанса. При облучении внешним источником света высокой интенсивности с подходящей частотой, таким как лазер, данные частицы способны высвобождать часть поглощенной энергии в виде тепла, вызывая локальное повышение температуры вблизи их поверхностей.
Такое контролируемое выделение тепла лежит в основе новой разработанной системы детекции. Выделенное тепло вызывает различимое изменение на теплочувствительной поверхности, выбранной подходящим образом. В этом смысле авторы настоящего изобретения обнаружили, что, неожиданно, предел детектирования составляет порядка пикограмм для экспериментов, проводимых с применением изменения цвета в областях подложки, где присутствует аналит, обеспечиваемого металлическими наночастицами при облучении их внешнем источником света в качестве средства детектирования. Соответственно, в примере 4 настоящего изобретения проиллюстрировано, как был получен предел детектирования с применением визуального детектирования согласно настоящему изобретению, причем указанный предел был меньшего порядка и, следовательно, обеспечивал большую чувствительность, по сравнению с таковыми, полученными в экспериментах, осуществленных с применением в качестве средства детектирования инфракрасной камеры. Этот неожиданный результат привел к разработке биосенсора, обладающего следующими свойствами: (i) высокой чувствительностью, (ii) высокой селективностью или специфичностью, благодаря чему указанный биосенсор взаимодействует исключительно с целевым аналитом, но не с другими аналитами, обладающими сходными свойствами; (iii) высокой надежностью, что исклбчает проблемы с шумом в системе передачи, связанных с исследуемым образцом; (iv) низкой стоимостью получения; (v) коротким временем проведения анализа, что позволяет при необходимости быстро провести анализ; (vi) необязательностью предварительной обработкой образца, что позволяет при необходимости сэкономить время, материалы и реагенты; (vii) простотой обращения, благодаря чему для применения биосенсора не требуется квалифицированный персонал; (viii) возможностью осуществления анализов в реальном времени, и (ix) портативностью, что обеспечивает возможность осуществления анализа in situ.
Соответственно, первый аспект настоящего изобретения относится к биосенсору для визуального детектирования аналита, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью, на которой иммобилизована распознающая молекула (осуществляющая захват биомолекула) из этапа а);
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит; и
e. Металлическую наночастицу, характеризующуюся полосой поверхностного плазмонного резонанса;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
Следует подчеркнуть тот факт, что в контексте настоящего изобретения под визуальным детектированием понимают любое детектирование, которое можно осуществить невооруженным глазом без необходимости применения любого типа устройства для детектирования, такого как инфракрасная камера.
Соответственно, в предпочтительном варианте реализации первого аспекта настоящего изобретения биосенсор для визуального детектирования аналита включает:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью, на которой иммобилизована распознающая молекула (осуществляющая захват биомолекула) из этапа а);
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит; и
e. Металлическую наночастицу, характеризующуюся полосой поверхностного плазмонного резонанса;
при этом биосенсор не включает никаких типов устройств, способных обнаружить преобразование света в тепло металлическими наночастицами, облученными внешним источником света.
В другом предпочтительном варианте реализации первого аспекта настоящего изобретения биосенсор включает:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит, иммобилизованную на подложке с теплочувствительной поверхностью;
b. Внешний источник света; и
c. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, связанную с поверхностью металлической наночастицы, характеризующейся полосой поверхностного плазмонного резонанса;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
В контексте настоящего изобретения под внешним источником света понимают любой источник электромагнитного излучения с длиной волны в диапазоне от 380 нм до 1100 нм, способный вызывать возбуждение полосы ЛППР металлических частиц на основе золота, серебра, меди или любого из их сплавов или состояний окисления, предпочтительно в ближнем инфракрасном диапазоне (между 750 и 1100 нм), так как поглощения энергии примесными биомолекулами, присутствующими в образце, которые поглощают в видимом диапазоне спектра (гемоглобин и т.д.), не происходит в данном диапазоне энергий. Указанный внешний источник света может представлять собой источник монохроматического или полихроматического света, предпочтительно источник монохроматического света.
В контексте настоящего изобретения под металлической наночастицей, характеризующейся полосой поверхностного плазмонного резонанса, понимают любой моно- или поликристаллический кластер частиц металлов в любом из состояний окисления, или любой из их сплавов, все геометрические размеры которого находятся в диапазоне от 1 до 1000 нм, предпочтительно между 1 и 200 нм. В предпочтительном варианте реализации настоящего изобретения указанные частицы металлов представляют собой атомы благородных металлов. В более предпочтительном варианте реализации настоящего изобретения указанные частицы металлов представляют собой атомы золота, серебра или меди. В еще более предпочтительном варианте реализации настоящего изобретения они представляют собой цилиндрические или треугольные частицы золота или серебра.
В контексте настоящего изобретения под распознающей молекулой или осуществляющей захват биомолекулой понимают любую молекулу, способную специфично распознавать конкретный аналит за счет любого типа химического или биологического взаимодействия.
В контексте настоящего изобретения под второй распознающей молекулой или детектирующей биомолекулой понимают любую молекулу, способную специфично распознавать конкретный аналит с помощью любого типа химического или биологического взаимодействия.
Молекулы, применяемые в качестве элементов распознавания в биосенсорах согласно настоящему изобретению, должны обладать достаточной селективной аффинностью распознавания конкретного аналита в присутствии других соединений, а также должны быть стабильны во времени и должны сохранять свою структуру, а также биологическую активность после иммобилизации на подложке и на поверхности наночастиц.
Антитела, пептиды, ферменты, белки, полисахариды, нуклеиновые кислоты (ДНК), аптамеры или пептидо-нуклеиновые кислоты (ПНК) можно применять в качестве распознающих молекул в разработанной системе.
В большинстве случаев наиболее широко применяемые биорецепторы представляют собой нуклеиновые кислоты, антитела или фрагменты антител, при этом антитела или фрагменты антител позволили разработать наибольшее количество методик, полезных для диагностики. Основанием для этого является способность иммунной системы вырабатывать практически неограниченное количество антител с различными селективностями и высокой аффинностью к соответствующему антигену. На сегодняшний день могут быть получены моноклональные антитела или фрагменты антител практически из любой молекулы, независимо от ее размера. С другой стороны, одним из преимуществ антител является гомогенность структуры данных белков, которая не зависит от их специфичности. Это позволяет стандартизировать способы, связанные с их применением в качестве иммунохимических реагентов, такие как их сохранение или иммобилизация на поверхности преобразователя. Фрагменты антител (Fab или одноцепочечный фрагмент Fv), сохраняющие структуру и способность распознавать антиген, а также рекомбинантные антитела, такие как моноклональные антитела или миниантитела второго поколения, можно получить в качестве распознающих молекул, применяя методики молекулярной биологии.
С другой стороны, аптамеры представляют собой молекулы, которыми в некоторых приложениях можно заменять антитела благодаря их малому размеру и низкой иммуногенности. Аптамеры представляют собой одноцепочечные нуклеиновые кислоты, обладающие вполне определенными трехмерными формами, позволяющими им связываться с целевой молекулой способом, аналогичным антителам. В аптамерах соединены оптимальные свойства малых молекул (низкая иммуногенность, высокая проникающая способность и т.д.) и антител (высокая специфичность и аффинность и химическая стабильность). Другое преимущество по сравнению с моноклональными антителами состоит в том, что их синтезируют химическим путем, а не экспрессируют биологическим путем.
С помощью нуклеиновых кислот можно обнаружить вариации в отдельном основании в комплементарной последовательности ДНК. Их можно применять в процессах секвенирования генов, анализе экспрессии генов и для детектирования мутаций и изменений в ДНК, связанных с определенными заболеваниями, поскольку можно синтетическим путем сконструировать последовательности нуклеотидов, соответствующие структуре ранее детектированных генов. На сегодняшний день вместо них все чаще применяют нити ПНК, так как последние обладают большей биологической стабильностью (по отношению к разрушению различными ферментами) и химической стабильностью (более устойчивы к изменениям рН или ионной силы). Более того, поскольку, в отличие от ДНК, они не содержат ни единиц 2'-дезокси-D-рибозы, ни фосфодиэфирных связей, ПНК обладают нейтральной структурой, которая вызывает меньшее электростатическое отталкивание в процессе гибридизации, образует более прочные связи; а также обладает низким неспецифическим поглощением.
Распознающий элемент (осуществляющая захват биомолекула) указанного сенсора, как правило, будет иммобилизован на подложке с теплочувствительной поверхностью путем физического удерживания внутри матрицы (захвата), физической адсорбции на матрице посредством ионных или гидрофобных взаимодействий, или путем связывания ковалентной связью.
В этом смысле, в контексте настоящего изобретения под подложкой с теплочувствительной поверхностью понимают любую поверхность, способную претерпевать структурное изменение при нагреве, в результате чего появляется изображение. В предпочтительном варианте в качестве теплочувствительной поверхности будут применять термобумагу, которая благодаря своей теплочувствительности обеспечивает генерацию сигнала после воздействия повышенной температуры. Термобумагой считают любую бумагу, содержащую термочувствительный слой, в состав которого входит краситель, сенсибилизатор и проявитель цвета (независимо от химических компонентов, из которых они получены), способные взаимодействовать друг с другом, что приводит к появлению изображения после воздействия на термочувствительный слой подвергнут воздействию повышенной температуры. В другом предпочтительном варианте реализации в качестве теплочувствительной поверхности будут применять любой высокотехнологичный полимер, который, после воздействия внешнего стимула, такого как изменение температуры, отреагирует изменением своих свойств, таким как: сворачивание, изгиб, изменение цвета, изменение состояния, люминесценция и т.д. Типы термочувствительных полимеров включают: PNIPAM, поли-N-изопропилакриламид, поли-N-винилпиперидин или поли-N-винилкапролактам.
В одном варианте реализации настоящего изобретения подложка с теплочувствительной поверхностью указанной системы включает по меньшей мере одну теплочувствительную подложку, на которой происходит молекулярное распознавание, такую как мембрана, выполненная из целлюлозы или ее производных (нитрата целлюлозы, ацетата целлюлозы и т.д.), или теплочувствительная бумага.
В другом варианте реализации настоящего изобретения подложка с теплочувствительной поверхностью указанной системы содержит две подложки. На первой подложке будет иммобилизована осуществляющая захват биомолекула, и при этом указанная подложка представляет собой мембрану, полученную из целлюлозы или ее производных (нитрата целлюлозы, ацетата целлюлозы и т.д.) или из других материалов, таких как полистирол, керамика, кремний или стекло. Вторая подложка, состоящая из теплочувствительной поверхности, которая обеспечивает генерацию сигнала после воздействия повышенной температуры, будет прикреплена к указанной первой подложке.
Второй аспект настоящего изобретения относится к биосенсору для визуального детектирования аналита, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, возможно связанную с молекулой-меткой; и
e. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные биомолекулами, специфично распознающими детектирующую биомолекулу или метку, которой модифицирована детектирующая биомолекула;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, под действием тепла, выделяемого металлическими наночастицами, при облучении их внешним источником света. Снова стоит отметить, что под визуальным детектированием понимают любое детектирование, которое можно осуществить невооруженным глазом без необходимости применения устройства какого-либо для детектирования, такого как инфракрасная камера. Соответственно, биосенсор согласно второму аспекту настоящего изобретения не включает устройство любого типа, способное обнаружить преобразование света в тепло металлическими наночастицами, облученными внешним источником света.
В контексте настоящего изобретения под молекулами-метками понимают такие молекулы, которые распознаются за счет аффинности во взаимодействиях типа лиганд-белок или по молекулярному узнаванию при гибридизации нитей нуклеиновых кислот. В первом случае очевидно, что детектирующая биомолекула модифицирована антигеном, гормоном, витамином полигистидиновой меткой или доменами лектина, среди прочего. Соответственно, очевидно, наночастицы (НЧ) функционализованы антителами, аптамерами, рецепторами, связывающими белками, трикарбоновыми кислотами, модифицированными двухвалентными ионами металлов, или сахарами, способными специфично взаимодействовать с соответствующей меткой детектирующей биомолекулы. Во втором случае очевидно, что как детектирующая биомолекула, так и НЧ золота функционализованы комплементарными встречающимися в природе нитями нуклеиновых кислот (дезоксирибонуклеиновой кислоты или ДНК, рибонуклеиновой кислоты или РНК), или комплементарными искусственными нитями нуклеиновых кислот (пептидо-нуклеиновой кислоты или ПНК, морфолинов и т.д.), или комплементарными комбинациями нитей (ДНК-ДНК, ПНК-ДНК, ДНК-ПНК, ПНК-ПНК и т.д.).
Третий аспект настоящего изобретения относится к биосенсору для визуального детектирования, описанного во втором аспекте настоящего изобретения, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, связанную с одной или несколькими молекулами биотина; и
e. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные молекулами стрептавидина, молекулами авидина или тому подобными молекулами, специфично распознающими молекулы биотина;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
Четвертый аспект настоящего изобретения относится к биосенсору для визуального детектирования, описанного во втором аспекте настоящего изобретения, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующее антитело), способную распознавать целевой аналит; и
e. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные антителами к Fc или к IgG, которые связываются с детектирующим антителом;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
Предложенное устройство представляет собой систему распознавания типа "сэндвич" между "распознающей" молекулой, осуществляющей захват биомолекулой (которая представляет собой либо белок, такой как антитело, либо ДНК-зонд, либо ПНК-зонд и т.д.), иммобилизованной на подложке, на которой происходит распознавание аналита, и второй детектирующей молекулой, детектирующей биомолекулой (вторым антителом или комплементарным ДНК-зондом), связанной с поверхностью металлической наночастицы, либо непосредственно, либо опосредованно с помощью считывающего (reader) белка и/или метки. Функционализация подложек и наночастиц соответствующими распознающими молекулами позволяет детектировать множество аналитов, следуя одной и той же стратегии.
Кроме того, второй, третий и четвертый аспекты настоящего изобретения, в частности, относятся к универсальной системе детектирования. В действительности, в третьем аспекте настоящего изобретения показано, как с помощью меченых биотином детектирующих биомолекул и функционализации металлических наночастиц стрептавидином можно применять одни и те же наночастицы, конъюгированные с данным белком, для распознавания различных аналитов на основе взаимодействия авидин-биотин, что позволяет избежать необходимости получения отдельного конъюгата наночастица-детектирующая биомолекула для каждого конкретного аналита. Другим примером будет четвертый аспект настоящего изобретения, в котором в системе детектирования, основанной на функционализации металлических наночастиц антителом к Fc, способным распознавать Fc-область любого другого антитела, можно применять одни и те же наночастицы для распознавания различных аналитов, при условии, что детектирующая биомолекула в данной системе представляет собой антитело.
Соответственно, устройство согласно настоящему изобретению обеспечивает возможность анализа множества образцов в рамках одного анализа с пределом чувствительности порядка пикограммов.
В чисто иллюстративном варианте реализации настоящего изобретения детектирование аналита в конкретном образце можно осуществить путем иммобилизации распознающей молекулы (осуществляющей захват биомолекулы) на первом этапе на подложке, например, на нитроцеллюлозной мембране. Затем осуществляют второй этап путем добавления к подложке образца, в котором присутствует детектируемый аналит, который оставляют на подложке в течение времени, достаточного для того, чтобы произошло распознавание антиген-антитело. Наконец, на третьем этапе подложку инкубируют с наночастицами, функционализированными второй распознающей молекулой (детектирующей биомолекулой). После реакции молекулярного распознавания подложку помещают на теплочувствительную поверхность, в том случае, если подложка еще не содержит теплочувствительную поверхность, для облучения внешним источником света, например, лазером с излучением в ближнем инфракрасном диапазоне, и таким образом детектируют аналит.
В случае второго, третьего и четвертого аспектов настоящего изобретения анализ включает дополнительный этап. Например, в случае применения устройства, описанного в третьем аспекте настоящего изобретения, на третьем этапе подложку инкубируют с раствором распознающей молекулы (детектирующей биомолекулы), например, меченого биотином вторичного антитела. После проведения соответствующих промывок осуществляют четвертый этап инкубации с наночастицами, функционализированными стрептавидином, и в конце облучают подложку излучающим лазером после того, как из указанной подложки вымыли несвязавшиеся наночастицы.
В случае четвертого аспекта настоящего изобретения, в котором наночастицу функционализовали антителами к Fc, после этапа инкубации с образцом для захвата детектируемого аналита, осуществляют третий этап инкубации с антителом в качестве детектирующей биомолекулы. После проведения соответствующих промывок на четвертом этапе добавляют наночастицы, функционализированные антителом к Fc, чтобы, наконец, облучить подложку излучающим лазером после промывки указанной подложки.
Возможность улучшения предела детектирования у биосенсора согласно настоящему изобретению состоит, во-первых, в осуществлении распознавания аналита в образце путем добавления функционализированных наночастиц непосредственно на образец. Соответственно, после того, как произошло распознавание антиген-антитело, аналит с наночастицами можно выделить путем центрифугирования. Данный этап позволяет сконцентрировать аналит независимо от объема образца и позволяет отделить аналит от остальных компонентов образца, в котором оно было детектировано. Остальные этапы указанного способа будут осуществлять тем же путем, который описан выше: после получения наночастиц с аналитом их будут инкубировать с чувствительной поверхностью, на которой иммобилизована распознающая молекула.
Соответственно, с помощью описанного биосенсора, основанного на свойствах металлических наночастиц, образующих полосу поверхностного плазмонного резонанса, в качестве системы преобразования сигнала (эффект поверхностного плазмонного резонанса), можно быстро и селективно обнаружить различные аналиты непосредственно в образце при очень низких концентрациях порядка пикограммов.
С другой стороны, настоящее изобретение также относится к биосенсорам, полезным для способов детектирования аналита не только визуальными методами. В частности, настоящее изобретение относится к биосенсору (в дальнейшем называемому "биосенсором 1 на основе термопары"), включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку, на которой иммобилизована распознающая молекула из этапа а);
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит;
e. Термопару; и
f. Металлическую наночастицу, характеризующуюся полосой поверхностного плазмонного резонанса;
при этом аналит детектируют, когда термопара регистрирует преобразование света в тепло металлических наночастиц, облученных внешним источником света.
Устройство этого типа биосенсора показано на фигуре 8 и в примере 5.
В другом предпочтительном варианте реализации настоящего изобретения биосенсор 1 на основе термопары включает:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит, иммобилизованную на подложке с теплочувствительной поверхностью;
b. Внешний источник света; и
c. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, связанную с поверхностью металлической наночастицы, характеризующейся полосой поверхностного плазмонного резонанса.
Другой аспект настоящего изобретения относится к биосенсору (в дальнейшем называемому "биосенсором 2 на основе термопары"), включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, возможно связанную с молекулой-меткой;
e. Термопару; и
f. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные биомолекулами, специфично распознающими детектирующую биомолекулу или метку, которой модифицирована детектирующая биомолекула;
при этом аналит детектируют, когда термопара регистрирует преобразование света в тепло металлическими наночастицами, облученными внешним источником света.
Дополнительный аспект настоящего изобретения относится к биосенсору 2 на основе термопары, согласно определению выше, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, связанную с одной или несколькими молекулами биотина;
e. Термопару; и
f. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные молекулами стрептавидина, молекулами авидина или тому подобными молекулами, специфично распознающими молекулы биотина.
Другой дополнительный аспект настоящего изобретения относится к биосенсору 2 на основе термопары, согласно определению выше, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующее антитело), способную распознавать целевой аналит;
e. Термопару; и
f. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные антителами к Fc или к IgG, которые связываются с детектирующим антителом.
Предложенное устройство представляет собой систему распознавания типа "сэндвич" между "распознающей" молекулой, осуществляющей захват биомолекулой (которая представляет собой либо белок, такой как антитело, либо ДНК-зонд, либо ПНК и т.д.), иммобилизованной на подложке, на которой происходит распознавание аналита, и второй детектирующей молекулой, детектирующей биомолекулой (вторым антителом или комплементарным ДНК-зондом), связанной с поверхностью металлической наночастицы, либо непосредственно, либо опосредованно с помощью считывающего белка и/или метки. Функционализация подложек и наночастиц соответствующими распознающими молекулами позволяет детектировать множество аналитов, следуя одной и той же стратегии.
Кроме того, последние два аспекта настоящего изобретения, в частности, относятся к универсальной системе детектирования. Фактически, согласно этим аспектам настоящего изобретения можно проверить, как применение меченых биотином детектирующих биомолекул и функционализация металлических наночастиц стрептавидином позволяет применять одни и те же наночастицы, конъюгированные с данным белком, для распознавания различных аналитов на основе взаимодействия авидин-биотин, что позволяет избежать необходимости получения отдельного конъюгата наночастица-детектирующая биомолекула для каждого конкретного детектируемого аналита. В системе детектирования, основанной на функционализации металлических наночастиц антителом к Fc, способным распознавать Fc-область любого другого антитела, можно применять одни и те же наночастицы для распознавания различных аналитов, при условии, что детектирующая биомолекула в данной системе представляет собой антитело.
Далее, настоящее изобретение относится к следующим способам детектирования аналита.
(1) Способ детектирования аналита, который включает:
a. Добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
b. Инкубацию подложки из этапа а) с металлическими наночастицами, функционализированными второй распознающей аналит молекулой (детектирующей биомолекулой);
c. Облучение подложки из этапа b) или с) внешним источником света; и
d. Детектирование аналита с применением термопары, способной детектировать преобразование света в тепло металлическими наночастицами, облученными внешним источником света.
(2) Способ детектирования аналита, который включает:
a. Добавление образца, в котором присутствует аналит, которое необходимо определить, к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
b. Инкубацию подложки из этапа а) со второй распознающей аналит молекулой (детектирующей биомолекулой), связанной с по меньшей мере одной молекулой-меткой;
c. Инкубацию подложки из этапа b) с металлическими наночастицами, функционализированными по меньшей мере одной молекулой, которая специфично связывается с меткой;
d. Облучение подложки из этапа с) или d) внешним источником света; и
e. Детектирование аналита с применением термопары, способной детектировать преобразование света в тепло металлических наночастиц, облученных внешним источником света.
В предпочтительном варианте реализации описанного выше способа молекула-метка представляет собой биотин, а молекула, которая специфично связывается с меткой, представляет собой авидин или стрептавидин, или молекула-метка представляет собой авидин или стрептавидин, а молекула, которая специфично связывается с меткой, представляет собой биотин.
(3) Способ детектирования аналита, который включает:
a. Добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
b. Инкубацию подложки из этапа а) со второй распознающей молекулой (детектирующей биомолекулой), которая представляет собой детектирующее антитело;
c. Инкубацию подложки из этапа b) с металлическими наночастицами, функционализированными антителами к Fc;
d. Облучение подложки из этапа с) внешним источником света и
e. Детектирование аналита с применением термопары, способной детектировать преобразование света в тепло металлических наночастиц, облученных внешним источником света.
(4) Способ детектирования аналита, который включает:
a. Добавление к образцу, в котором присутствует детектируемый аналит, металлических наночастиц, функционализированных второй распознающей аналит молекулой (детектирующей биомолекулой);
b. Выделение аналита с наночастицами из образца из этапа а);
c. Добавление экстракта из этапа b к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
e. Облучение подложки из этапа с) внешним источником света; и
f. Детектирование аналита с применением термопары, способной детектировать преобразование света в тепло металлических наночастиц, облученных внешним источником света.
Биосенсоры согласно настоящему изобретению можно применять, без каких бы то ни было ограничений, для детектирования примесей, лекарственных средств, патогенных микроорганизмов, пищевых компонентов, пестицидов, токсичных соединений или в анализе биохимической потребности в кислороде. Биосенсоры согласно настоящему изобретению можно применять для детектирования любого типа аналита, как качественного, так и количественного.
Следующие примеры служат исключительно для иллюстрации настоящего изобретения.
ПРИМЕРЫ
Пример 1. Синтез металлических наночастиц.
- Синтез наночастиц золота. Синтез наночастиц золота осуществлялив соответствии с методом, описанным у Turkevich и др. "A study of the nucleation and growth processes in the synthesis of colloidal gold", Discussions of the Faraday Society 1951, 11, 55-75. Согласно данному способу 200 мл 0,01% раствора тетрахлорзолотой кислоты в воде нагревали до 100°C при перемешивании, а затем добавляли 5 мл 1% раствора трехзамещенного цитрата натрия в качестве восстановителя. После образования наночастиц раствор красного цвета оставляли при перемешивании до достижения комнатной температуры. Таким образом получили сферические наночастицы золота диаметром 14-16 нм, образующие полосу поверхностного плазмонного резонанса на 519 нм.
- Синтез золотых треугольных нанопризм. Синтез треугольных золотых нанопризм осуществляли, в соответствии с методом, описанным у Pelaz и др. "Tailoring the synthesis and heating ability of gold nanoprisms for bioapplications", Langmuir 2012, 28, 8965-70. Согласно данному способу 100 мл 2 мМ раствора тетрахлорзолотой кислоты смешивали с 120 мл 0,5 мМ раствора Na2S2O3, оставляли при перемешивании на 9 минут, после чего еще раз добавляли 0,5 мМ раствор Na2S2O3 объемом 20-50 мл. Получали нанотреугольники из золота размером от 100 до 160 нм, характеризующиеся полосой поверхностного плазмонного резонанса на 750-1075 нм. Прежде, чем конъюгировать их с различными биомолекулами, полученные нанопризмы необходимо пассивировать посредством связывания с полиэтиленгликолем (HS-ПЭГ-СООН, 5000 г/моль). Для этого 10 мл раствора нанопризм инкубировали с 1 мг ПЭГ в растворе NaOH, pH 12, в течение ночи. Наконец, данные нанопризмы центрифугировали в течение 15 минут при 10000 об/мин, чтобы удалить неиспользованные реагенты.
- Синтез серебряных треугольных нанопризм. Синтез осуществляли, в соответствии с методом, описанным у Zhang, Q и др., "A systematic study of the synthesis of silver nanoplates: Is citrate a "Magic" reagent?", Journal of the American Chemical Society 2011, 133 (46), 18931-18939. Согласно данному способу 24,14 мл воды Milli Q добавляли к водному раствору нитрата серебра (0,05 М, 50 мкл), трехзамещенного цитрата натрия (75 мМ, 0,5 мл) и перекиси водорода (30% по массе, 60 мкл) и смешивали путем интенсивного взбалтывания при комнатной температуре. Наконец, быстро добавляли раствор борогидрида натрия (NaBH4, 100 мМ, 250 мкл) с получением данных нанопризм. Приблизительно через 3 минуты цвет коллоидного раствора изменился с темно-желтого цвета, обуславливаемого малыми частицами серебра, до голубоватого цвета, обуславливаемым получаемыми нанопризмами. Получили нанотреугольники серебра диаметром 70 нм, характеризующиеся полосой поверхностного плазмонного резонанса на 700 нм.
- Синтез медных нанокубов. Синтез осуществляли, в соответствии с методом, описанным у Murphy и др. "Solution-phase synthesis of Cu2O nanocubes", Nano Letters 2002, 3 (2), 231-234. Согласно данному способу 0,25 мл водного раствора CuSO4 добавляли к 9 мл водного раствора СТАВ (бромид цетилтриметиламмония) при различных концентрациях от 0,01 до 0,1 М. Затем к раствору Cu(II)-CTAB добавляли 0,5 мл 0,1 М водного раствора аскорбата натрия. Растворы грели в течение 5 минут при 55°C. По истечении этого времени добавляли 0,2 мл 0,5 М гидроксида натрия, что вызывало мгновенное появление желтого цвета в растворе. Растворы выдерживали при 55°C в течение 10 минут и оставляли остывать при комнатной температуре. Через 30 минут растворы приобретали красновато-коричневый, светло-желтый или темно-желтый цвет, в зависимости от используемой концентрации СТАВ. Полученные частицы центрифугировали при 6000 об/мин в течение 15 минут, а затем ресуспендировали в воде. Данный процесс повторяли дважды, чтобы удалить поверхностно-активное вещество. На данном этапе нанокубы в растворе имели кирпично-красный цвет во всех случаях. Получали нанокубы меди размером приблизительно 420 нм с различными изменениями в геометрии в зависимости от количества поверхностно-активного вещества СТАВ, применяемого для их синтеза.
Пример 2. Функционализация металлических наночастиц.
Различные типы наночастиц, синтезированные с различными распознающими элементами, такими как антитела, ДНК или ПНК, функционализировали для реализации настоящего изобретения. Некоторые примеры функционализации описаны ниже.
- Функционализация золотых треугольных нанопризм антителами. Функционализацию осуществляли путем иммобилизации антитела на карбоксильных группах, присутствующих на поверхности наночастицы, применяя химические свойства карбодиимидов. Сначала 0,5 мг наночастиц активировали 1,5 мкмолями 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) и 3,5 мкмолями сульфо-N-гидроксисукцинимида (сульфо-NHS) в конечном объеме 1 мл 10 мМ MES, pH 6, в течение 30 минут при 37°C. Неиспользованные реагенты можно было удалить путем центрифугирования при 6000 об/мин в течение 5 минут, после чего частицы суспендировали в 10 мМ MES, pH 6, или путем применения колонки для гель-фильтрации. После активации карбоксильных групп наночастиц, их инкубировали с 2,5 мкг антитела в конечном объеме 1 мл 10 мМ MES, pH 6, в течение 1 часа при 37°С. После связывания антитела поверхность наночастицы блокировали 50 мМ 750 Да аминированного ПЭГ (α-метокси-ω-аминополиэтиленгликоля). Наконец, полученные наночастицы очищали путем нескольких циклов центрифугирования при 6000 об/мин в течение 5 минут.
- Функционализация золотых треугольных нанопризм стрептавидином. Функционализацию осуществляли путем иммобилизации молекул стрептавидина на карбоксильных группах, присутствующих на поверхности наночастицы, применяя химические свойства карбодиимидов. Сначала 0,5 мг наночастиц активировали 1,5 мкмолями EDC и 3,5 мкмолями сульфо-NHS в конечном объеме 1 мл 10 мМ MES, pH 6, в течение 30 минут при 37°C. Неиспользованные реагенты можно было удалить путем центрифугирования при 6000 об/мин в течение 5 минут, после чего частицы суспендировали в 10 мМ MES, pH 6, или путем применения колонки для гель-фильтрации. После активации карбоксильных групп наночастиц, их инкубировали с 1,25 мкг стрептавидина в конечном объеме 1 мл 10 мМ MES, pH 6, в течение 1 часа при 37°C. После связывания указанного белка поверхность наночастицы блокировали 50 мМ 750 Да аминированного ПЭГ (α-метокси-ω-аминополиэтиленгликоля). Наконец, полученные наночастицы очищали путем нескольких циклов центрифугирования при 6000 об/мин в течение 5 минут.
Пример 3. Детектирование маркера РЭА в образце с применением биосенсора согласно настоящему изобретению.
После того, как нанопризмы золота синтезировали и исследовали (с помощью как сканирующей просвечивающей электронной микроскопии, так и спектроскопии в ультрафиолетовой и видимой области), их функционализировали моноклональными антителами к РЭА, АТ3С6 (моноклональными антителами мыши к раковому эмбриональному антигену 4СА30-3С6, НуTest), а также белком стрептавидином. Чтобы убедиться в том, что молекулы, иммобилизованные на нанопризмах, сохранили свою биологическую активность, соответствующие биомолекулы иммобилизовали при различных концентрациях (маркер РЭА или конъюгированное с биотином антитело) на нитроцеллюлозной мембране; после инкубации с функционализированными наночастицами мембраны, находящиеся на теплочувствительной поверхности, облучали лазером.
Распознавание РЭА+антитело к РЭА 3С6-нанопризмы показано на фигуре 2а.
Распознавание антитело к РЭА 3С6-биотин+стрептавидин-нанопризмы показано на фигуре 2b.
Когда происходит молекулярное распознование, расположенные на мембране золотые нанопризмы после облучения лазером высвобождают энергию, поглощенную наночастицами, в виде тепла, сигнал регистрируется на теплочувствительной поверхности (см. фигуры 2а и 2b). В обоих случаях сигналы, полученные после облучения образцов лазером, указывали на то, что произошло распознавание антиген-антитело или стрептавидин-биотин, и, следовательно, что конъюгированные с нанопризмами биомолекулы сохранили свою активность. С другой стороны, как поверхность, на которой происходило распознавание, так и поверхность наночастицы были пассивированы, благодаря чему не происходили неспецифические взаимодействия при отсутствии иммобилизованного белка на нитроцеллюлозной мембране, что можно наблюдать для образца 0.
Распознающий элемент сенсора, в данном случае антитело к РЭА АТ3С1, моноклональное антитело мыши к раковому эмбриональному антигену 4СА30-3С1, HyTest, иммобилизовали на чувствительной поверхности, следуя различным методикам. Его связывали со стеклянными поверхностями посредством ковалентных связей, а также посредством физической адсорбции на различных целлюлозных и нитроцеллюлозных мембранах. Результаты, полученные с применением нитроцеллюлозных мембран, на поверхностях которых адсорбировано антитело, показаны ниже. Проверяли две описанные выше стратегии: применяли нанопризмы, функционализированные антителом непосредственно, и нанопризмы, функционализированные стрептавидином после добавления антитела к РЭА 3С6, конъюгированного с биотином. Анализировали различные образцы с уменьшающимися концентрациями опухолевого маркера РЭА, разбавленного в ФБР. После осуществления этапов распознавания, описанных в методике проведения эксперимента, и после высыхания мембран их помещали на теплочувствительную поверхность, в данном случае на термобумагу, и облучали в течение нескольких секунд лазером с излучением в ближнем инфракрасном диапазоне (с длиной волны 1000 нм).
Распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-нанопризмы показано на фигуре 3а. Распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-биотин+стрептавидин-нанопризмы показано на фигуре 3b.
Как можно видеть на предыдущих фигурах, интенсивность сигнала от теплочувствительной поверхности, генерируемый в результате облучения нанопризм после того, как произошло распознавание аналита, выше для системы антитело 3С1-РЭА-АТ3С6-нанопризма, чем для системы антитело 3С1-РЭА-АТ3С6 биотин-стрептавидин-нанопризма золота. Тем не менее, в обоих случаях детектируемая концентрация РЭА составляла 0,5 нг/мл. С другой стороны, в качестве отрицательного контроля проверили, что когда тот же самый эксперимент осуществляли, применяя сферические наночастицы золота диаметром 16 нм, функционализированные антителом к РЭА 3С6 (у которых нет полосы поглощения на используемой длине волны, испускаемой лазером), то сигнал не наблюдался, как показано на фигуре 4 (см. фигуру 4, на которой показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-наночастицы золота, когда применяли сферические наночастицы золота диаметром 16 нм, у которых нет полосы поглощения на используемой длине волны, испускаемой лазером).
Для повышения чувствительности способа можно изменять различные параметры, такие как время облучения образца лазером и расстояние от указанного лазера до чувствительной поверхности. На фигуре 5 показано, что в случае меньшего расстояния между лазером и поверхностью требуется меньшее время облучения, и получают более интенсивный сигнал.
На фигуре 5 показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-нанопризмы золота с различными длительностями облучения и различными расстояниями между поверхностью и лазером. Время облучения, равное 10 секундам, на расстоянии 0,5 см использовали на фигуре 5а; время облучения, равное 2 секундам, на расстоянии 0,1 см использовали на фигуре 5b.
Наконец, осуществляли тот же самый эксперимент типа "сэндвич" (АТ3С1+РЭА+АТ3С6-нанопризмы золота) для детектирования опухолевого маркера РЭА в образцах плазмы крови, чтобы проверить специфичность системы, а также предел детектирования аналита в смешанном образце. Его сравнивали с результатами, полученными для определения РЭА, растворенного в буфере ФБР. В обоих случаях получили предел детектирования 10 пг РЭА/мл, что можно увидеть на фигуре 6. Более того, не наблюдалось какого-либо вида неспецифического взаимодействия в контрольном образце или образце плазмы.
Пример 4. Сравнительный пример применения инфракрасной камеры в качестве средства детектирования.
Для данного эксперимента использовали те же самые образцы, которые получали для примера 3. Распознающий элемент сенсора, в данном случае, антитело к РЭА АТ3С1, иммобилизовали посредством физической адсорбции на нитроцеллюлозной мембране. Затем анализировали различные образцы с уменьшающимися концентрациями опухолевого маркера РЭА, разбавленного в плазме крови. После осуществления этапов распознавания с помощью наночастиц, функционализированных антителом к РЭА АТ3С6, описанных в методике проведения эксперимента, и после высыхания мембран, их помещали на термобумагу.
Для облучения наночастиц применяли лазер с излучением в ближнем инфракрасном диапазоне на длине волны 1000 нм. Камеру для термической визуализации в инфракрасной области спектра (ИК-камера), способную преобразовывать тепло, выделенное облученными наночастицами, в измеримый параметр, применяли в качестве системы детектирования тепла, выделенного наночастицами после облучения лазером.
Проверяли повышение температуры с помощью ИК-камеры после облучения образцов, полученных для детектирования антигена РЭА в плазме крови при различных концентрациях. После облучения лазером в течение нескольких секунд ИК-камера зарегистрировала повышение температуры на 2-3°C для образца с 0,05 нг РЭА/мл, но не зарегистрировала сигнал в случае образца с 0,01 нг РЭА/мл. Для тех же указанных концентраций аналита в случае применения термобумаги был детектирован сигнал после того, как их облучили лазером.
Получили более низкий предел детектирования при визуальном детектировании с применением подложки на теплочувствительной поверхности, такой как термобумага, чем при применении в качестве средства детектирования инфракрасной камеры.
На фигуре 7 приведено сравнение распознавания антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-нанопризмы золота при визуальном детектировании с помощью термобумаги (фигура 7а) и ИК-камеры в качестве системы детектирования (фигура 7b).
Пример 5. Эксперименты по детектированию с помощью термопары.
В данном случае тепло, выделенное наночастицами после облучения лазером, измеряли с помощью термопары, способной преобразовывать повышение температуры в определенной области вокруг нее в количественно измеримый электрический сигнал.
Используя конструкции, описанные на фигуре 8 (при мощности 350 мВт), как концентрированный, так и разбавленный образцы облучали лазером на мембране и на покровном стекле. Первая возникшая проблема состояла в том, что когда лазер непосредственно воздействовал на термопару, получали очень высокий фоновый сигнал (таким образом было необходимо повысить температуру до уровня, достаточного, чтобы отличить полученный сигнал от фонового). Отклик также получали, когда просто облучали мембрану или покровное стекло без наночастиц (стекло давало более высокий сигнал, чем нитроцеллюлозная мембрана). Отклик, сходный с контролем, получали для разбавленного образца, тогда как для концентрированного образца можно было прекрасно измерить повышение температуры. Следует отметить, что в данной конструкции образец находился на расстоянии 3-4 см от лазера, так что ожидалась более низкая чувствительность, чем если бы образец находился в непосредственном контакте с лазером.
Попытались осуществить калибровку для конструкций, изображенных на фигуре 8, схемы 2 и 3, с помощью различных концентраций наночастиц, нанесенных на нитроцеллюлозную мембрану. В случае схемы 2 результаты получить не удалось, поскольку в данном положении не удалось осуществить воспроизводимой облучение образца лазером. Данный эксперимент осуществляли с конструкцией, приведенной на схеме 3.
Получали три раствора с концентрацией НЧ 140 мкг/мл, 14 мкг/мл и 1,4 мкг/мл и по 1 мкл каждого наносили на нитроцеллюлозные мембраны (140 нг, 14 нг и 1,4 нг НЧ →6×109, 6×108 и 6×107 наночастиц). Их облучали лазером в течение нескольких секунд и осуществляли считывание сигнала с помощью термопары до и после нанесения образца. Получали фоновый сигнал для образцов. Сигнал, который был немного выше фонового сигнала, зарегистрировали для наиболее разбавленного раствора (1,4 нг НЧ); четко различимый сигнал получили для образца с 14 нг НЧ; для наиболее концентрированного образца получили очень высокий сигнал. Для калибровки, которая соответствует линейному диапазону, следует применять серию растворов с низкой концентрацией, так как после некоторого значения концентрации получают экспоненциальное повышение температуры с увеличением концентрации наночастиц.
| название | год | авторы | номер документа |
|---|---|---|---|
| Биомолекулярный сенсор с микроэлектронным генератором электромагнитной волны | 2020 |
|
RU2749698C1 |
| ДИМЕРНАЯ ОККЛЮДАНТНАЯ НАНОСТРУКТУРА, МЕЧЕННАЯ МОЛЕКУЛОЙ, АКТИВНОЙ В ОТНОШЕНИИ РАМАНОВСКОГО РАССЕЯНИЯ, ЛОКАЛИЗОВАННОЙ В МЕЖЧАСТИЧНОМ СОЕДИНЕНИИ, ЕЕ ИСПОЛЬЗОВАНИЕ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2542386C2 |
| УСТРОЙСТВО И СПОСОБЫ ДЕТЕКТИРОВАНИЯ АНАЛИТОВ В СЛЮНЕ | 2009 |
|
RU2530718C2 |
| СПОСОБЫ ДИАГНОСТИКИ | 2002 |
|
RU2309408C2 |
| Способ детекции антител в биоматериале с использованием стеклянных микроструктурных волноводов | 2021 |
|
RU2753856C1 |
| НАНО- И МИКРОЧАСТИЦЫ ДЛЯ ИЗОЛЯЦИИ СПЕЦИФИЧЕСКИХ СУБПОПУЛЯЦИЙ ЭКЗОСОМ И ИХ АНАЛИЗА | 2020 |
|
RU2733884C1 |
| БИОЛОГИЧЕСКИЙ СЕНСОР И СПОСОБ СОЗДАНИЯ БИОЛОГИЧЕСКОГО СЕНСОРА | 2013 |
|
RU2527699C1 |
| Способ детекции аналита в образце с помощью иммунохроматографии | 2023 |
|
RU2835200C1 |
| СПОСОБ ДЕТЕКЦИИ ЭНАНТИОМЕРОВ ХИРАЛЬНЫХ ОРГАНИЧЕСКИХ МОЛЕКУЛ | 2021 |
|
RU2780990C1 |
| Флуоресцентный оптический ДНК-сенсор | 2018 |
|
RU2684276C1 |


Группа изобретений относится к области биотехнологии, в частности к области биосенсоров с металлическими наночастицами в качестве системы передачи сигнала. Биосенсор для визуального детектирования аналита включает распознающую молекулу, способную распознавать целевой аналит, иммобилизованную на теплочувствительной поверхности, и металлическую наночастицу, характеризующуюся полосой поверхностного плазмонного резонанса, функционализированную второй распознающей молекулой, способной распознавать целевой аналит или другие распознающие молекулы. При этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, возникающему под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света с длиной волны в диапазоне от 380 нм до 1100 нм. Также раскрыты способы детектирования аналита и применение биосенсора для анализа различных объектов. Группа изобретений обеспечивает возможность анализа множества образцов в рамках одного анализа с пределом чувствительности порядка пикограммов. 7 н. и 10 з.п. ф-лы, 8 ил., 5 пр.
1. Биосенсор для визуального детектирования аналита, включающий:
a. распознающую молекулу, способную распознавать целевой аналит, иммобилизованную на подложке с теплочувствительной поверхностью; и
b. металлическую наночастицу, характеризующуюся полосой поверхностного плазмонного резонанса, функционализированную второй распознающей молекулой, способной распознавать целевой аналит;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, возникающему под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света с длиной волны в диапазоне от 380 нм до 1100 нм.
2. Биосенсор для визуального детектирования аналита, включающий:
a. распознающую молекулу, способную распознавать целевой аналит;
b. подложку с теплочувствительной поверхностью;
c. вторую распознающую молекулу, способную распознавать целевой аналит, возможно связанную с молекулой-меткой; и
d. металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные биомолекулами, специфично распознающими вторую распознающую молекулу или метку, которой модифицирована вторая распознающая молекула;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, возникающему под действием тепла, выделяемого металлическими наночастицами, при облучении их внешним источником света с длиной волны в диапазоне от 380 нм до 1100 нм.
3. Биосенсор согласно п. 2, в котором молекула-метка представляет собой биотин, а молекула, которая специфично связывается с меткой, представляет собой авидин или стрептавидин, или молекула-метка представляет собой авидин или стрептавидин, а молекула, которая связывается с меткой, представляет собой биотин.
4. Биосенсор согласно п. 2, в котором указанная вторая распознающая молекула представляет собой антитело и указанная металлическая наночастица, характеризующаяся полосой поверхностного плазмонного резонанса, функционализирована антителом к Fc, способным распознавать Fc-область второй распознающей молекулы.
5. Биосенсор согласно любому из пп. 1-4, в котором распознающие молекулы выбраны из перечня, состоящего из антител, пептидов, ферментов, полисахаридов, нуклеиновых кислот (ДНК), аптамеров или пептидо-нуклеиновых кислот (ПНК).
6. Биосенсор согласно п. 5, в котором распознающие молекулы представляют собой антитела, ДНК или ПНК.
7. Биосенсор согласно пп. 1-4, в котором внешний источник света представляет собой источник монохроматического света.
8. Биосенсор согласно пп. 1-4, в котором металлическую наночастицу выбирают из перечня, состоящего из:
a. наночастиц золота;
b. наночастиц серебра; или
c. наночастиц меди.
9. Биосенсор согласно п. 8, в котором металлическая наночастица представляет собой золотую треугольную нанопризму.
10. Биосенсор согласно любому из пп. 1-4, в котором теплочувствительная поверхность подложки представляет собой теплочувствительную бумагу.
11. Биосенсор согласно п. 10, в котором теплочувствительная бумага присоединена к подложке, выбранной из перечня, состоящего из стекла, кремния, керамики, полистирола, целлюлозной мембраны, нитроцеллюлозной мембраны или ацетатцеллюлозной мембраны.
12. Способ детектирования аналита, который включает:
а. добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой;
b. инкубацию подложки из этапа а) с металлическими наночастицами, функционализированными второй распознающей аналит молекулой; и
c. размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
d. облучение подложки из этапа b) или с) внешним источником света с длиной волны в диапазоне от 380 нм до 1100 нм,
e. при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, возникающему под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света с длиной волны в диапазоне от 380 нм до 1100 нм.
13. Способ детектирования аналита, который включает:
a. добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой;
b. инкубацию подложки из этапа а) со второй распознающей аналит молекулой, связанной с по меньшей мере одной молекулой-меткой;
c. инкубацию подложки из этапа b) с металлическими наночастицами, функционализированными по меньшей мере одной молекулой, которая специфично связывается с меткой; и
d. размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
e. облучение подложки из этапа с) или d) внешним источником света с длиной волны в диапазоне от 380 нм до 1100 нм,
f. при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, возникающему под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света с длиной волны в диапазоне от 380 нм до 1100 нм.
14. Способ согласно п. 13, в котором молекула-метка представляет собой биотин, и молекула, которая специфично связывается с меткой, представляет собой авидин или стрептавидин или молекула-метка представляет собой авидин или стрептавидин и молекула, которая специфично связывается с меткой, представляет собой биотин.
15. Способ детектирования аналита, который включает:
а. добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой;
b. инкубацию подложки из этапа а) со второй распознающей молекулой, которая представляет собой детектирующее антитело;
c. инкубацию подложки из этапа b) с металлическими наночастицами, функционализированными антителами к Fc; и
d. размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
e. облучение подложки из этапа с) или d) внешним источником света с длиной волны в диапазоне от 380 нм до 1100 нм,
f. при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, возникающему под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света с длиной волны в диапазоне от 380 нм до 1100 нм.
16. Способ детектирования аналита, который включает:
a. добавление к образцу, в котором присутствует детектируемый аналит, металлических наночастиц, функционализированных второй распознающей аналит молекулой;
b. выделение аналита с наночастицами из образца из этапа а);
c. добавление выделенного аналита из этапа b) к подложке с иммобилизованной на ней распознающей аналит молекулой;
d. размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
e. облучение подложки из этапа с) или d) внешним источником света с длиной волны в диапазоне от 380 нм до 1100 нм,
f. при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, возникающему под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света с длиной волны в диапазоне от 380 нм до 1100 нм.
17. Применение биосенсора согласно любому из пп. 1-11 для детектирования примесей, лекарственных средств, патогенных микроорганизмов, пищевых компонентов, пестицидов, токсичных соединений или аналита в анализе биохимической потребности в кислороде.
| HAES A.J | |||
| et al | |||
| Detection of a Biomarker for Alzheimer’s Disease from Synthetic and Clinical Samples Using a Nanoscale Optical Biosensor / JACS, 2005, V.127, pp.2264-2271 | |||
| CORTIE М | |||
| et al | |||
| Plasmonic heating of gold nanoparticles and its exploitation / Proceedings of SPIE, 2005, V.5649, pp.565-573 | |||
| KREUZER M.P | |||
| et al | |||
| Quantitative detection of doping substances by a localised surface plasmon sensor / Biosensors and Bioelectronics, 2006, V.21, pp.1345-1349 | |||
| US 20110207237 A1, 25.08.2011 | |||
| СПОСОБЫ ДИАГНОСТИКИ | 2002 |
|
RU2309408C2 |
Авторы
Даты
2018-06-19—Публикация
2013-07-26—Подача