Настоящая заявка испрашивает преимущества предварительной заявки США № 61/665439 от 28 июня 2012 года, полное содержание которой включено в настоящую заявку в виде справочной информации для любых целей.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Изобретение относится к полимерам, содержащим УФ-хромофор. В частности, изобретение относится к полимерным соединениям, содержащим линейный полиэфир, поглощающий ультрафиолетовое излучение, который включает в себя химически связанный УФ-хромофор.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Рак кожи - распространенное серьезное заболевание, на долю которого приходится 50% диагностированных случаев рака в Соединенных Штатах Америки. Ультрафиолетовое излучение (УФ) способно вызывать разрушения на молекулярном и клеточном уровне и считается основным фактором окружающей среды, вызывающим рак кожи. Длительное воздействие ультрафиолетового излучения, например, солнечных лучей, может привести к образованию световых дерматозов и эритем, а также увеличивает риск развития рака кожи, такого как меланома, и ускоряет процессы старения кожи, такие как потеря эластичности и образование морщин.
Разрушающее воздействие ультрафиолета можно ослабить местным применением солнцезащитных фильтров, которые содержат соединения, поглощающие, отражающие или рассеивающие лучи ультрафиолета, как правило, в диапазоне (длина волны приблизительно от 320 до 400 нм) или UVB (длина волны приблизительно от 290 до 320 нм). В продаже есть различные солнцезащитные средства с различной способностью защищать тело от ультрафиолетовых лучей.
Предложено использовать солнцезащитные молекулы с большим молекулярным весом для снижения проникновения солнцезащитных молекул в эпидермис. Однако изобретатели признают, что было бы желательно получить совершенно новые полимерные солнцезащитные соединения (полимеры, поглощающие ультрафиолет) для обеспечения различных преимуществ, таких как повышенная защита от УФ.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение включает полимерные композиции, содержащие линейный полиэфир, поглощающий ультрафиолетовое излучение, который включает в себя химически связанный УФ-хромофор, и соединения, которые обеспечивают защиту от ультрафиолетового излучения и которые содержат такие поглощающие ультрафиолет полимерные соединения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предполагается, что специалист, основываясь на данном описании, сможет использовать настоящее изобретение в его максимальном объеме. Приведенные ниже характерные варианты осуществления изобретения следует рассматривать лишь в качестве примеров, которые ни в коей мере не ограничивают раскрываемую сущность настоящей заявки на изобретение. Все технические и научные термины, используемые в настоящем документе, если только не дано иное их определение, имеют общепринятое значение, понятное любому специалисту, работающему в области, к которой имеет отношение настоящее изобретение. За исключением точных указаний среднечисленного молекулярного веса (Mn), все остальные ссылки на молекулярный вес подразумевают средневесовой молекулярный вес (Mw). Кроме того, все публикации, заявки на получение патента, патенты и другие упоминаемые в настоящем документе источники включены в документ посредством ссылки.
Полимер, поглощающий уф излучение
Варианты осуществления настоящего изобретения относятся к полимерным соединениям, содержащим полиэфир, поглощающий ультрафиолетовое излучение (например, «поглощающий УФ полиэфир»). Под поглощающим УФ полиэфиром понимается полиэфир, который поглощает излучение в некоторой части ультрафиолетового спектра (длина волны от 290 до 400 нм). Поглощающий УФ полиэфир имеет средневесовой молекулярный вес (Mw), который может использоваться для снижения или предотвращения впитывания хромофора через кожу. В соответствии с одним вариантом осуществления, для поглощающего УФ полиэфира подходит молекулярный вес Mw больше, чем 500. В одном варианте осуществления, Mw находится в диапазоне приблизительно от 500 до 50000. В другом варианте осуществления, Mw находится в диапазоне приблизительно от 1000 до 20000, например, от 1000 до 10000.
В настоящей заявке описано полимерное соединение, содержащее поглощающий ультрафиолет полиэфир. Как понятно специалисту, термин «полиэфир» означает, что полимер, поглощающий ультрафиолет, содержит множество эфирных функциональных групп, связанных между собой ковалентной связью. Термин «главная цепь» полиэфира, поглощающего ультрафиолет, обозначает самую длинную непрерывную последовательность эфирных функциональных групп, связанных между собой ковалентной связью. Другие меньшие группы ковалентно связанных атомов считаются боковыми группами, которые ответвляются от главной цепи.
Согласно определенным вариантам осуществления, полиэфир содержит повторяющиеся глицериновые звенья и, соответственно, может быть охарактеризован как полиглицерин. Под “повторяющимися глицериновыми звеньями” (также называемыми в данной заявке "остаточными глицериновыми звеньями") понимают звенья глицерола без нуклеофильных групп, таких как гидроксильные группы. Остаточные глицериновые звенья включают эфирные функциональные группы и, как правило, могут быть представлены как C3H5O для линейных и дендритных остатков (Рокики и соавторы Green Chemistry., 2005, 7, 52). Подходящие остаточные глицериновые звенья включают дегидратированные формы (т.е. убран один моль воды) следующих глицериновых звеньев: линейные-1,4 (L1,4) глицериновые звенья; линейные-1,3 (L1,3) глицериновые повторяющиеся звенья; дендритные (D) глицериновые звенья; концевые-1,2 (T1,2) звенья; и концевые-1,3 (T1,3) звенья. Примеры остаточных глицериновых звеньев и концевых звеньев показаны ниже (справа от стрелок). Соответствующие глицериновые звенья до отщепления воды (слева от стрелок, содержит гидроксильные группы) также представлены:
линейные-1,4 (L1,4) глицериновые повторяющиеся звенья

линейные-1,3 (L1,3) глицериновые повторяющиеся звенья

концевые-1,2 (T1,2) звенья
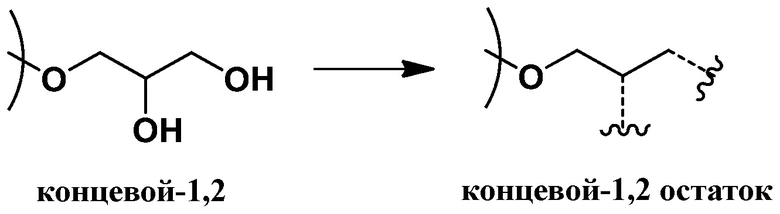
и концевые-1,3 (T1,3) звенья

Полимерное соединение содержит линейный полиэфир, поглощающий ультрафиолетовое излучение, который содержит химически связанный хромофор, поглощающий ультрафиолетовое излучение («УФ-хромофор»). Под термином «линейный» подразумевается, что поглощающий УФ полиэфир имеет главную цепь, то есть не имеет ответвлений.
Согласно определенным вариантам осуществления, полимерное соединение на 50% или более состоит из линейного полиэфира, поглощающего ультрафиолетовое излучение, который содержит химически связанный УФ-хромофор. Согласно другим определенным вариантам осуществления, полимерное соединение на 75% или более состоит из линейного полиэфира, поглощающего ультрафиолетовое излучение, который содержит химически связанный УФ-хромофор. Согласно другим определенным вариантам осуществления, полимерное соединение на 90% или более состоит из линейного полиэфира, поглощающего ультрафиолетовое излучение, например, на приблизительно 95% или более. Согласно другим определенным вариантам осуществления, в дополнение к линейному полиэфиру, поглощающему ультрафиолетовое излучение, полимерное соединение содержит разветвленный полиэфир, поглощающий ультрафиолетовое излучение, который не является гиперразветвленным. В другом варианте осуществления, полимерное соединение практически не содержит гиперразветвленные полиэфиры, поглощающие ультрафиолетовое излучение (например, содержит менее 1% веса гиперразветвленного полиэфира, поглощающего ультрафиолетовое излучение, например, менее 0,1% веса или, например, совершенно не содержащие гиперразветвленные полиэфиры, поглощающие ультрафиолетовое излучение.
В соответствии с определенными вариантами осуществления, линейный полиэфир, поглощающий ультрафиолетовое излучение, включает любой или оба из повторяющихся звеньев (см. формулы IА и IIВ):
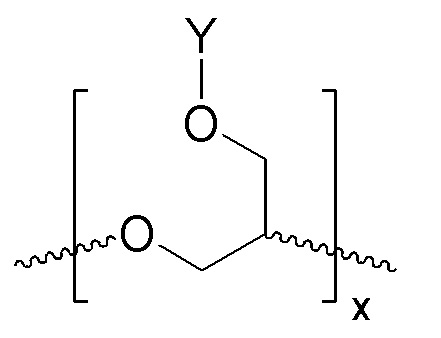
ФОРМУЛА IA. ПОВТОРЯЮЩЕЕСЯ ЗВЕНО ЛИНЕЙНОГО ПОЛИЭФИРА В СОСТАВЕ ПОГЛОЩАЮЩЕГО УФ ПОЛИМЕРА

ФОРМУЛА IIB. ПОВТОРЯЮЩЕЕСЯ ЗВЕНО ЛИНЕЙНОГО ПОЛИЭФИРА В СОСТАВЕ ПОГЛОЩАЮЩЕГО УФ ПОЛИМЕРА
В ФОРМУЛАХ IA и IIB, Y представляет УФ-хромофор, как описано ниже.
Наглядный пример линейного полиэфира, поглощающего ультрафиолетовое излучение, содержащего химически связанный УФ-хромофор, показан в ФОРМУЛЕ IIIC.
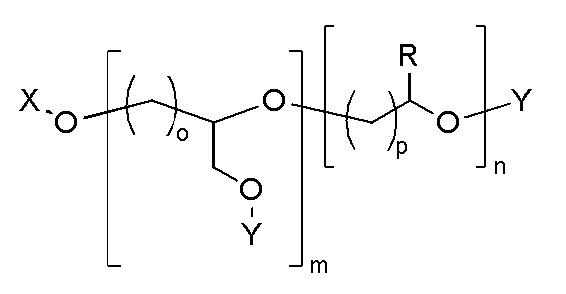
ФОРМУЛА IIIC. ЛИНЕЙНЫЙ ПОЛИЭФИР ПОГЛОЩАЮЩЕГО УФ ПОЛИМЕРА
В приведенной ФОРМУЛЕ IIIC, X - это либо концевая функциональна группа, либо часть главной цепи полимера; R - боковая группа, присоединенная к главной цепи полимера, а Х - концевая группа.
X и R могут быть одинаковыми или могут отличаться. X и R могут быть независимо выбраны из группы, включающей, например, водород, линейный акрил, алкенил или алкениловые углеводородные цепи, линейные силоксаны и т.п. В одном варианте осуществления, группа X представляет октадекан. Y представляет УФ-хромофор; группы, обозначенные как Y, описаны ниже. Соотношение повторяющихся звеньев эфира, несущих замещающее Y, составляет действительное число, выраженное Уравнением 1,
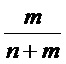
Уравнение 1
где m и n - действительные числа в диапазоне от 0 до 1, а сумма n и m равна 1. В одном варианте осуществления, число m=1, а n=0 (полимер является гомополимером и включает повторяющееся звено из ФОРМУЛЫ IA). В другом варианте осуществления, число m <равно 1 (полимер является кополимером), включает боковые группы R и Y. Для кополимеров, содержащих и боковые группы R, и боковые группы Y распределение боковых групп R и Y вдоль цепи полимера можно изменять для получения оптимальных свойств полимера. В одном варианте осуществления, полимер является статистическим кополимером, в котором группы R и Y статистически распределены вдоль цепи полимера. В другом варианте осуществления, полимер является блок-кополимером, состоящим из чередующихся сегментов главной цепи полимера, функционализированных большим соотношением либо R-групп, либо Y-групп. В другом варианте осуществления, распределение боковых групп R и Y вдоль главной цепи полимера соответствует диапазону где-то между граничными условиями блок-кополимеров и статистических кополимеров. В ФОРМУЛЕ IIIC, целые числа o и p определяют количество групп CH2 в повторяющихся звеньях, несущих группы Y и R.
Включение различных боковых R-групп может достигаться использованием других ко-мономеров во время реакции полимеризации. Размер, химическая композиция, массовая доля этих ко-мономеров, а также их расположение в главной цепи может меняться для изменения физических и химических свойств конечного полимера. Примеры ко-мономеров, которые могут быть включены в состав полимера, включают, но не ограничиваются, этиленоксидом, пропиленоксидом и глицидиловыми эфирами, такими как n-бутилглицидиловый эфир или диэтилгексилглицидиновый эфир.
Специалисту в области полимеров понятно, что полиэфиры типа, описанного в ФОРМУЛАХ IA-C, могут быть получены различными методами синтеза; среди них и полимеризация с раскрытием кольца циклических мономеров и необязательных ко-мономеров эфира. Размер кольца в циклических мономерах эфира определяется величиной o или p, а также результирующей структурой главной цепи полимера полиэфира. Для мономеров и ко-мономеров, которые являются эпоксидами (трехчленные кольца, содержащие 2 атома углерода и один атом кислорода), величина o или p в результирующем поглощающем УФ полиэфире равна 1. Повторяющееся звено, получаемое при использовании эпоксидного ко-мономера, показано в структуре A ФОРМУЛЫ IV. Для (ко-)мономеров, которые являются окситанами (четырех-членные кольца, содержащие три атома углерода и один атом кислорода), величина o или p в результирующем поглощающем УФ полиэфире равна 2. Повторяющееся звено, получаемое при использовании окситанового ко-мономера, показано в структуре A ФОРМУЛЫ IV. Для изменения свойств полимера подбирается длина алкиловой цепи внутри каждого типа мономера. В одном варианте осуществления, и o, и p равны 1. Примером такого случая является случай, когда повторяющиеся звенья, несущие группы Y и R, оба получены из мономеров эпоксидов (o=p=1), или когда оба получены из окситановых мономеров (o=p=2). В другом варианте осуществления, o и p не равны. Примером такого случая является случай, когда повторяющиеся звенья, несущие УФ-хромофор Y, основаны на эпоксидном мономере (o=1), а повторяющиеся звенья, несущие группу R, основаны на окситановом мономере (p=2).

ФОРМУЛА IV. НЕОБЯЗАТЕЛЬНЫЕ ПОВТОРЯЮЩИЕСЯ ЗВЕНЬЯ
Подходящие УФ-хромофоры, которые могут посредством химических связей быть включены в поглощающие УФ полиэфиры настоящего изобретения, включают поглощающие УФ триазолы (часть которых содержит пятичленный гетероцикл с двумя атомами углерода и тремя атомами азота), такие как бензотриазолы. В другом варианте осуществления, структура, представленная группой Y содержит или имеет боковой поглощающий УФ триазин (шестичленный гетероцикл, содержащий три атома азота и три атома углерода). Подходящими УФ-хромофорами являются те, которые обладают способностью поглощать излучение в диапазоне UVA; другими подходящими УФ-хромофорами являются те, которые обладают способностью поглощать излучение в диапазоне UVB. В одном варианте осуществления, УФ-хромофор способен поглощать излучение как в диапазоне длин волн UVA, так и в диапазоне длин волн UVB. В одном варианте осуществления, в котором поглощающий УФ полиэфир формуется в виде пленки, возможно генерировать молярный коэффициент поглощения, равный по меньшей мере для одной длины волны в данном диапазоне длин волн по меньшей мере приблизительно 1000 моль -1 см-1, предпочтительно по меньшей мере около 2000 моль-1 см-1, и еще предпочтительнее около 4000 моль-1 см-1. В одном варианте осуществления, молярный коэффициент поглощения для по меньшей мере 40% длин волн в данной части спектра составляет по меньшей мере около 1000 моль-1 см-1. Примеры УФ-хромофоров, поглощающих в диапазоне длин волн UVA, включают триазолы, такие как бензотриазолы, в частности гидроксифенилбензотриазолы; камфоры, такие как бензилиден камфоры и его производные (такие как терефталидин-дикамфорсульфоновая кислота; дибензоилметаны и их производные.
В одном варианте осуществления, УФ-хромофор является бензотриазолом, который обеспечивает как фотостабильность, так и сильное поглощение ультрафиолетового излучения в диапазоне UVA; его структурная формула показана в ФОРМУЛЕ V.
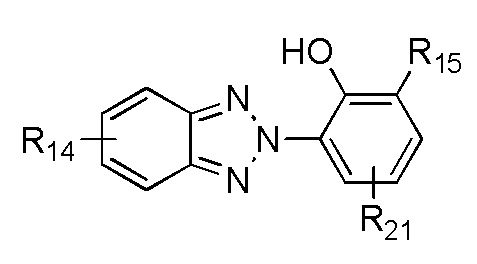
ФОРМУЛА V. БЕНЗОТРИАЗОЛ - ПОГЛОЩАЮЩИЙ УФ ХРОМОФОР
где каждая группа R14 независимо выбирается из группы, состоящей из водорода, C1-C20 алкил, алкокси, ацил, алкилокси, алкиламино и галоген; R15 независимо выбирается из группы, состоящей из водорода, C1-C20 алкил, алкокси, ацил, алкилокси и алкиламино, R21 выбирается из C1-C20 алкил, алкокси, ацил, алкилокси и алкиламино. Каждая из групп R15 или R21 может включать функциональные группы, которые позволяют присоединяться к полимеру. Соединения, напоминающие структуру из ФОРМУЛЫ V, описаны в Патенте США № 5869030, и включают, но не ограничиваются метилен бис-бензотриазолил тетраметилбутилфенолом (соединение, которое продается под торговой маркой TINSORB M производства Корпорации BASF, Виандот, штат Мичиган). В одном варианте осуществления, поглощающий УФ триазол получен из продукта переэтерификации 3-(3-(2H-бензо[d][1,2,3]триазол-2-ил)-5-(трет-бутил)-4-гидроксифенил) пропановой кислоты с полиэтилен гликолем 300, который продается под торговой маркой TINUVIN 213, также производимой Корпорацией BASF. В другом варианте осуществления, поглощающий УФ триазол является гидрокоричной кислотой, 3-(2H-бензотриазол-2-ил)-5-(1, 1-диметилэтил)-4-гидрокси-, C7-9-разветвленные и линейные алкилэфиры, которые продаются под торговой маркой TINUVIN 99, также производимой Корпорацией BASF. В другом варианте осуществления, поглощающая УФ группа содержит молекулы триазина. Примером триазина является 6-октил-2-(4-(4,6-ди([1,1'-бифенил]-4-ил)-1,3,5-триазин-2-ил)-3-гидроксифенокси) эфир пропановой кислоты (соединение, которое продается под торговой маркой TINUVIN 479 производства Корпорации BASF, Виандот, штат Мичиган).
В другом варианте осуществления, УФ-хромофор является молекулой, поглощающей в диапазоне длин волн UVB. Под молекулой, поглощающей в диапазоне длин волн UVB, следует понимать, что УФ-хромофор способен поглощать УФ в части UVB (от 290 до 320 нм) ультрафиолетового спектра. В одном варианте осуществления, критерий определения UVB-поглощающего хромофора такой же, как и критерий, описанный выше для UVA-поглощающего хромофора, с разницей в диапазоне волн (от 290 до 320 нм). Примеры подходящих UVB-поглощающих хромофоров включают 4-аминобензойную кислоту и ее алкановый эфир; ортоаминобензойную кислоту и ее алкановый эфир; салициловую кислоту и ее алкановый эфир; гидроксикоричную кислоту и ее алкановый эфир; дигидрокси-, дикарбокси- и гидроксикарбоксибензофеноны, а также их алкановые эфиры и галоидангидридные производные; дигидрокси-, дикарбокси- и гидроксикарбоксихалконы, а также их алкановые эфиры и галоидангидридные производные; дигидрокси-, дикарбокси- и гидроксикарбоксикумарины, а также их алкановые эфиры и галоидангидридные производные; бензалмоланат (бензилиден малонат); производные бензимидазола (такие как фенил-бензимазол сульфоновая кислота, PBSA), производные бензоксазола и другие подходяще функционализированные виды, способные к ко-полимеризации внутри цепи полимера. В другом варианте осуществления, поглощающий УФ полиэфир содержит более одного УФ-хромофора или более одного класса УФ-хромофоров.
Поглощающие УФ полиэфиры настоящего изобретения могут быть синтезированы, согласно определенным вариантам осуществления, в ходе полимеризации с раскрытием кольца подходящего цикличного мономера эфира для образования полиэфира, с последующим ковалентным связыванием УФ-хромофора к боковым функциональным группам ("постполимеризационное присоединение"). Согласно другим определенным вариантам осуществления, поглощающие УФ полиэфиры могут быть синтезированы в ходе полимеризации цикличного мономера эфира, если эфир сам по себе включает ковалентно связанный УФ-хромофор (т.е. «прямая полимеризация»).
Более того, как должно быть понятно специалисту, в результате синтеза поглощающего УФ полиэфира образуется продукт реакции, который является полимерным соединением, то есть смесью различных молекулярных весов поглощающих УФ полиэфиров. В определенных других вариантах осуществления, продукт реакции может к тому же включать (кроме полимерного соединения) небольшое количество неполимеризованного материала, который может быть удален из смеси использованием общеизвестных методов.
В соответствии с определенными вариантами осуществления, полимерное соединение имеет низкую полидисперсность. Например, коэффициент полидисперсности может составлять около 1,5 или менее, а точнее около 1,2 или менее. Коэффициент полидисперсности определяется как Mw/MN (т.е. отношение средневесового молекулярного веса, Mw к среднечисленному молекулярному весу, MN). Согласно другим определенным вариантам осуществления, полимерное соединение содержит по весу 50% или более специфических молекул полимера.
Полидисперсность полимерного соединения может удерживаться на низком уровне применением, например, специфических методов синтеза, таких как полимеризация с раскрытием кольца циклического мономера эфира и снятие защитных групп (описано ниже). Кроме того, полимерное соединение может быть подвергнуто обработке с применением общеизвестных в данной области знаний методов, таких как экстрагирование растворителями и/или сверхкритическая экстракция углекислотой для очищения либо полиэфира перед постполимеризационным присоединением, либо для очищения конечного полимерного соединения (например, после присоединения УФ-хромофора).
Синтез полимера методом постполимеризационного присоединения УФ-хромофора может включать этап полимеризации с раскрытием кольца циклического мономера эфира для образования полиэфира, имеющего защитные группы; этап снятия защитных групп для удаления по меньшей мере нескольких защитных групп полиэфира; и этап присоединения УФ-хромофора к незащищенному поглощающему УФ полиэфиру для образования поглощающего УФ полиэфира, содержащего химически связанный УФ-хромофор.
Пример постполимеризационного присоединения схематически показан в ФОРМУЛЕ VI. Катализатор I используется для возбуждения реакции полимеризации циклического мономера эфира M, образующей полимер P0, в котором боковые функциональные гидроксигруппы защищены защитной группой (P). Полимер P0 подвергается воздействию условий, которые удаляют защитную группу P, позволяя получить незащищенный полимер Pd. И в завершение, УФ-хромофор Y присоединяется к боковым гидроксильным группам полимера Pd, позволяя получить требуемый конечный полимер, Pf.

ФОРМУЛА VI. СИНТЕЗ ПОГЛОЩАЮЩЕГО УФ ХРОМОФОРА МЕТОДОМ ПОСТПОЛИМЕРИЗАЦИОННОЙ ФУНКЦИОНАЛИЗАЦИИ
Полимеризация с раскрытием кольца циклического эфира, такого как мономер M в ФОРМУЛЕ VI, может достигаться различными методами, включая анионной и катионной полимеризации с раскрытием кольца. В одном варианте осуществления, полимеризация выполняется методом анионной полимеризации с раскрытием кольца. Мономер M в ФОРМУЛЕ VI представляет собой вид глицида, в котором основная гидрогруппа скрыта защитной группой Р. В результате полимеризации незащищенного глицида образуются высоко разветвленные полимеры (US7988953B2, Токар, Р и соавторы Macromolecules 1994, 27, 320-322: Сандер, A. и соавторы Macromolecules 1999: 4240-4246. Рокики, Дж. и соавторы Green Chemistry 2005, 7, 529). И наоборот, анионная полимеризация производных глицида, в которых основная гидроксильная группа была защищена, может образовывать линейные полиэфиры, как показано в структурной схемой P0 в ФОРМУЛЕ VI (Татон, Д. и соавторы. Macromolecular Chemistry and Physics 1994, 195, 139-148: Эрберих, М. и соавторы. Macromolecules 2007, 40, 3070-3079: Хаоует, A. и соавторы. European Polymer Journal 1983, 19, 1089-1098: Обермейер, Б. и соавторы Bioconjugate Chemistry 2011, 22, 436-444: Ли, Б. Ф. и соавторы. Journal of polymer science. Part A, Polymer chemistry 2011, 49, 4498-4504). Защищенные циклические мономеры эфира не ограничиваются производными эпоксидов и включают функционализированные циклические эфиры, содержащие от 3 до 6 сопряженных атомов; В другом варианте осуществления, мономер M является производной окситана, содержащей защищенную основную гидроксильную группу.
Под термином «защищенный» имеется ввиду, что функциональная группа в составе многофункциональной молекулы была выборочно дериватизирована с молекулой, которая предотвращает ковалентное изменение функциональной группы. Молекулы, используемые в качестве защитных групп, обычно присоединяются к необходимым функциональным группам, обладающим свойством вырабатывать отличный выход продукта реакций, и могут быть выборочно удалены, как того требует хороший показатель выхода продукта реакций, высвобождая изначальную функциональную группу. Гидроксильные защитные группы включают, но не ограничиваются эфирами, такими как метил, метоксилметил (MOM), метилтиометил (MTM), t-бутил тиометил, (фенил диметил силил) метоксиметил (SMOM), бензилоксиметил (BOM), p-метоксибензилоксиметил (PMBM), (4-метоксифенокси)метил (p-AOM), t-бутоксиметил, 4-пентенилоксиметил(POM), силоксиметил, 2-метоксиэтоксиметил(MEM), 2,2,2-трихлорэтоксиметил, бис(2-хлорэтокси)метил, 2-(триметил силил)этоксиметил(SEMOR), тетрагидропиранил (THP), аллил, 3-бромотетрагидропиранил, тетрагидротиопиранил, 1-метоксициклогексил, бензилокси-2-фторэтил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, 2-(фенилселенил)этил, t-бутил, аллил, p-хлорофенил, p-метоксифенил, 2,4-динитрофенил, бензил, p-метоксибензил, 3,4-диметоксибензил, o-нитробензил, p-нитробензил, p-галобензил, 2,6-дихлорбензил, триметилсилил(TMS), трэтилсилил(TES), триизопропилсилил (TIPS), t-бутилдиметилсилил(TBDMS), t-бутилдифенилсилил(TBDPS), трибензилсилил, эфирами, такими как эфир муравьиной кислоты, бензилформиат, ацетат, хлорацетат, дихлорацетат, трихлорацетат, трифторацетат, метоксиацетат, трифенилметоксиацетат, феноксиацетат, p-хлорфеноксиацетат, 3-фенилпропионат, 4-оксопентонат(левулинат), 4,4-(этилендитио)пентонат (левулиноилдитиоацетат), пивалят, адамантоат, кротонат, 4-метоксикронат, бензоат, p-фенилбензоат, 2,4,6-триметилбензоат(мезитоат), а также карбонатами, такими как алкил метил карбонат, 9-фторэнилметилкарбонат (Fmoc), алкил этил карбонат, алкил 2,2,2-трихлорэтил карбонат(Troc), 2-(триметилсилил)этил карбонат(TMSEC), 2-(фенилсульфонил)этил карбонат(Psec), 2-(трифенилфосфонио)этил карбонат (Peoc), алкил изобутил карбонат. В одном варианте осуществления, защитная группа является эфиром этоксиэтила; В другом варианте осуществления, защитная группа является эфиром аллила.
Удаление защитных групп из защищенного линейного полиэфира P0 для образования незащищенного полимера Pd достигается применением методов, дополняющих выбор защитной группы P; такие методы общеизвестны специалистам в данной области знания. В одном варианте осуществления, основная гидроксильная группа циклического мономера эфира защищена как 1-этоксиэтил эфир; разрыв химической связи этой защитной группы для образования незащищенного полимера достигается применением условий водной кислой среды, такой как водный раствор уксусной кислоты, водный раствор соляной кислоты или кислая ионообменная смола. В другом варианте осуществления, основная гидроксильная группа циклического мономера эфира защищена как эфир аллила; разрыв химической связи этой защитной группы для образования незащищенного полимера достигается изомеризацией эфира аллила до эфира винила путем обработки его алкоголятом калия, а затем - водным раствором кислоты, изомеризацией с использованием катализаторов переходных металлов с последующим кислотным гидролизом, или прямым удалением с применением катализаторов палладия(0) и нуклеофильного поглотителя.
Анионная полимеризация с раскрытием кольца мономера M, показанная в ФОРМУЛЕ VI, инициируется алкоксидной солью I. Примеры алкоголятов, которые могут использоваться для инициации полимеризации с раскрытием кольца циклических мономеров эфира, включают, но не ограничиваются солями калия линейных гидрокарбонатных спиртов групп C3-C30, полиэтиленгликольметилэфиром и кремнийорганическими полимерами с карбинольными концевыми группами. В одном варианте осуществления, катализатором анионной полимеризации с раскрытием кольца является калиевая соль октадеканола. В другом варианте осуществления настоящего изобретения используются многофункциональные катализаторы, включающие, но не ограничивающиеся полиоксиалкиленами, такими как полиэтиленгликоль, полипропиленгликоль или поли(тетраметилен эфир)гликоль; полиэфирами, такими как поли(этиленадипат), поли(этиленсукцинат); кополимерами, которые обладают функциональностью и оксиалкилена, и эфира в главной цепи, такими как поли[ди(этиленгликоль)адипат]; и спиртами с низким молекулярным весом, таким как 1,4-бутандиол, 1,6-гександиол или неопентилгликоль.
В зависимости от функциональных групп, ответвляющихся от полимера, хромофоры могут быть присоединены ковалентной связью к главной цепи полимера применением различных методов, общеизвестных специалистам в данной области знаний. Следующие методы приведены в описательных целях и не представляют собой исчерпывающий список возможных способов присоединения УФ-хромофора к главной цепи полимера. В случае с использованием полимеров со свободными гидроксильными группами (как показано структурой Pd ФОРМУЛЫ VI) УФ-хромофор, содержащий карбоксилатную группу, может быть присоединен к полимеру применением различных методов, общеизвестных специалистам в данной области знаний. Реактивы реакции конденсации могут использоваться для образования ковалентных связей между УФ-хромофорами с карбоновыми кислотами и гидроксильными группами полимеров, создавая эфирные связи; В одном варианте осуществления, реактивом реакции конденсации является N-(3-диметиламинопропил)-N′-этилкарбодиимид гидрохлорид. Карбоновая кислота УФ-хромофора также может быть присоединена к гидроксильным группам полимера эфирными связями, образуемыми применением катализа переходных металлов; В одном варианте осуществления, катализатором является этилгексаноат олова (II). УФ-хромофор может также быть присоединен к полимеру путем преобразования карбоновой кислоты УФ-хромофора в соответствующий хлорангидрид; хлорангидрид вступает в реакцию с гидроксильными группами функционального полимера, образуя эфирные связи; В одном варианте осуществления, такое превращение в хлорангидрид проводится с использованием трионилхлорида. Карбоновая кислота УФ-хромофора может также быть преобразовано в изоцианат путем перегруппировки Курциуса промежуточного азида кислоты; изоционат хромофора вступает в реакцию с гидроксильными группами функционального полимера, образуя уретановые связи. В другом варианте осуществления, карбоновая кислота УФ-хромофора может преобразовываться в эфир и присоединяться к гидроксильной группе главной цепи путем переэтерификации. Это достигается превращением карбоновой кислоты в эфир в присутствии низкокипящего спирта, такого как метанол; переэтерификация происходит реагированием эфира хромофора с полимером, содержащим боковые гидроксильные группы в присутствии кислого катализатора, например, пара-толуолсульфокислоты.
В случае с использованием полимеров со свободными гидроксильными группами (как показано структурой Pd ФОРМУЛЫ VI) УФ-хромофор, содержащий гидроксильную группу, может быть ковалентно присоединен к полимеру применением различных методов, общеизвестных специалистам в данной области знаний. В одном варианте осуществления, гидроксильная группа УФ-хромофора может активироваться для нуклеофильного замещения с применением реактива, такого как метансульфонилхлорид или р-толуолсульфонилхлорид; гидроксильные группы главной цепи тогда становятся способными вытеснить результирующий мезилат или тозилат при основных условиях для образования эфирных связей между полимером и УФ-хромофором. В другом варианте осуществления, гидроксильная группа УФ-хромофора может быть преобразована в хлорформиат использованием реактива, такого как фосген, дифосген или трифосген; результирующий хлорформиат УФ-хромофора может реагировать с гидроксильными группами главной цепи полимера, образовывая карбоновую связь между полимером и УФ-хромофором.
В случае с использованием полимеров со свободными гидроксильными группами (как показано структурой Pd ФОРМУЛЫ VI) УФ-хромофор, содержащий аминовую группу, может быть ковалентно присоединен к полимеру применением различных методов, общеизвестных специалистам в данной области знаний. В одном варианте осуществления, гидроксильные группы полимера могут быть преобразованы в соответствующий хлорформиат использованием реактива, такого как фосген, дифосген или трифосген; аминовый функционализированный УФ-хромофор может затем реагировать с хлорформиатами полимера, образовывая карбоновую связь между УФ-хромофором и полимером.
В другом варианте осуществления, некоторые из гидроксильных групп линейной главной цепи полимера сохраняются после присоединения кислотных, хлорангидридных и изоцианатных функциональных УФ-хромофоров. Эти непрореагировавшие гидроксильные группы могут быть использованы для присоединения других однофункциональных боковых групп для улучшения физических и химических свойств полимера. Примеры реакционно-способных функциональных групп включают, но не ограничиваются хлорангидридами и изоцианатами. Специфические примеры гидроксильных реакционно-способных функциональных боковых групп включают пальмитаилхлорид и стеарилизоцианат. Другие примеры групп, которые могут ответвляться от полимера и представлять собой места для ковалентного присоединения УФ-хромофоров, включают, но не ограничиваются сопряженными алкенами, аминами и карбоновыми кислотами.
В другом варианте осуществления, главная цепь полиэфира является полиглицерином с боковыми гидроксильными или гидрофобными группами, такими как полиглицерил эфир, например, декаглицерил-моностеарат, доступный в продаже под торговой маркой POLYALDO 10-1-S производства компании Lonza в городе Аллендейл, штат Нью-Джерси или тетрадекаглицерил, доступный в продаже под торговой маркой POLYALDO 14-1-S производства компании Lonza в городе Аллендейл, штат Нью-Джерси. Боковые гидроксильные группы могут подвергаться реакции с УФ-хромофором, содержащим дополнительную функциональную группу, как описано выше, для получения поглощающего УФ полиэфира. В данном варианте осуществления, полимерное соединение будет, к примеру, продуктом реакции полиглицерин эфира и УФ-хромофора, имеющего функциональную группу, подходящую для ковалентного присоединения к упомянутому полиглицерин эфиру. Подходящие функциональные группы УФ-хромофора наряду с другими функциональными группами, описанными ранее, включают карбоксилаты и изоцианаты. Результирующее полимерное соединение может включать линейный поглощающий УФ полиэфир, имеющий повторяющееся звено, показанное в ФОРМУЛЕ IIB. Результирующее полимерное соединение может к тому же включать некоторые нелинейные (например, циклические) компоненты, в зависимости от процентного содержания линейного материала в полиглицерине.
Как описано выше, синтез функционализированных полимеров, таких как полимеры в ФОРМУЛЕ IIIC, также может достигаться путем полимеризации УФ-хромофоров, ковалентно измененных циклическими эфирными группами (прямая полимеризация). Это показано в ФОРМУЛЕ VII, где Y представляет УФ-хромофор, а o является характеристикой размера кольца циклического мономера эфира.
Как будет понятно специалисту в данной области знания, продукт реакции для образования поглощающего УФ полиэфира может включать не только полимерное соединение, но и некоторые непрореагировавшие/неполимеризованные соединения.

ФОРМУЛА VII. ПРЯМАЯ ПОЛИМЕРИЗАЦИЯ УФ-ХРОМОФОРА, КОВАЛЕНТНО ПРИСОЕДИНЕННОГО К ЦИКЛИЧЕСКОМУ ЭФИРУ
Поглощающие УФ полимеры, описанные в настоящей заявке, будут полезны в технологиях, в которых требуется поглощение ультрафиолета. Например, полимер может использоваться в косметологии в комбинации с подходящей косметически приемлемой несущей средой или для снижения степени разрушения ультрафиолетом материалов, путем их комбинации с поглощающим УФ полимером (т.е. смешиванием в расплаве материала и поглощающего УФ полимера или покрытием материала слоем поглощающего УФ полимера). Включение полимеров настоящего изобретения в такие соединения может обеспечивать повышенный солнцезащитный фактор (SPF) (преимущественно поглощение в диапазоне длин волн UVB), повышенного фактора защиты от негативного воздействия лучей в диапазоне UVA (PFA) (преимущественно поглощение в диапазоне длин волн UVA) или повышение обоих этих факторов. Косметически приемлемая несущая среда для местного применения подходит для местного нанесения на кожу человека и может включать, например, один или несколько носителей, таких как вода, этанол, изопропанол, смягчающие средства, увлажняющие средства и/или один или несколько ПАВ/эмульгаторов, отдушек, консервантов, водонепроницаемых полимеров и подобных ингредиентов, часто используемых в составах косметических средств. Так, поглощающий УФ полимер может быть заключен в форму спрея, лосьона, геля, стика или другие формы с использованием технологий, общеизвестных в данной области знаний. Таким образом, в соответствии с определенными вариантами осуществления, можно защитить кожу человека от ультрафиолетового излучения, местно применяя соединение, содержащее поглощающий УФ полимер.
Следующие примеры отражают принципы и практическое исполнение настоящего изобретения, однако не описывают их в полном объеме. Различные дополнительные варианты осуществления в рамках объема и сущности настоящего изобретения станут очевидными для специалистов в данной области знаний после ознакомления с преимуществами этого раскрытия сущности изобретения.
ПРИМЕРЫ
Пример 1. Синтез защищенной формы глицида

ФОРМУЛА VIII. СИНТЕЗ ЗАЩИЩЕННОГО МОНОМЕРА ЭПОКСИДА
Синтез защищенного мономера эпоксида1 был проведен, как показано в ФОРМУЛЕ VIII с использованием вариации процедуры, описанной в литературе (Фиттон, A. и соавторы. Synthesis 1987, 1987, 1140-1142). Глицидол (53 мл, 0,80 моль) и этилфинилэфир (230 мл, 2,40 моль; дистилированные непосредственно перед реакцией) были добавлены в круглодонную колбу с двумя горлышками объемом 500 мл с магнитной мешалкой. Колба была оборудована пробкой и переходником для термометра; термометр был вставлен в переходник и установлен таким образом, что шарик термометра был погружен в жидкость. Колба была погружена в ванночку рассоловодного льда/льда; смесь перемешивали магнитной мешалкой. Когда температура внутри колбы достигла 0°C, небольшими порциями интенсивно размешивая добавили гидрат п-толуолсульфоновой кислоты (pTSA·H2O, 1,43 г, 7,5 ммоль). При добавлении каждой порции pTSA, температура раствора резко повышалась; частота добавления была достаточно редкой, чтобы предотвратить повышение температуры раствора выше 20°C. Последняя порция pTSA была добавлена приблизительно через 5 часов после добавления первой порции и не вызвала экзотермического эффекта; тонкослойная хроматография реакционной смеси не выявила остаточного глицида после добавления последней порции pTSA. Реакционная смесь была перемещена в сепараторную воронку; в воронку медленно влили насыщенный водный раствор NaHCO3 (230 мл). Смесь встряхнули, слои отделились, органический слой был изъят, высушен с помощью натрия сульфата и профильтрован через бумагу. Раствор концентрировали ротационным выпариванием, затем дистиллировали вакуумом (60°C дистиллят при 1066,6 Па (8 торр)), что позволило получить защищенный мономер эпоксида 1 (79,38 г) в виде чистого масла. Был проведен ЯМР-анализ с помощью спектрометра Varian Unity Inova 400 МГц (1H) при температуре 30°C; химические сдвиги фиксировались в частях на миллион (ppm) на шкале δ и соотносились с остаточными протонированными пиками растворителя или тетраметилсилана Спектры, полученные в ДМСО -d6 были соотнесены с (CHD2)(CD3)SO по δH 2,50. 1H ЯМР (400 МГц, CDCl3) δ м.д. 4,76 (кв, J=5,2 Гц, 1H), 3,81 (дд, J=11,5, 3,3 Гц, 1H), 3,60-3,74 (м, 3H), 3,38-3,60 (м, 4H), 3,10-3,20 (м, 2H), 2,81 (ддд, J=5,1, 4,0, 1,3 Гц, 2H), 2,63 (ддд, J=14,6, 5,1, 2,7 Гц, 2H), 1,33 (дд, J=6,2, 5,4 Гц, 6H), 1,21 (тд, J=7,1, 1,3 Гц, 6H).
Пример 2A. Синтез линейного полиглицерина
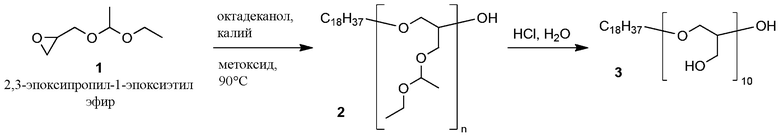
ФОРМУЛА IX. СИНТЕЗ ЛИНЕЙНОГО ПОЛИЭФИРНОГО ПОЛИМЕРА
Полимеризация защищенного мономера эпоксида 1 была достигнута, как показано в ФОРМУЛЕ IX. В круглодонную колбу с двумя горлышками объемом 250 мл с магнитной мешалкой после горячей сушки добавили 1-октадеканол (27,76 г, 102,6 ммоль). Колба была оборудована переходником для подачи азота и резиновой пробкой. Метилат калия (25% веса в метаноле (MeOH), 6,06 мл, 20,52 ммоль) добавили в колбу с помощью шприца через пробку. Круглодонную колбу погрузили в масляную ванночку, предварительно нагретую до 90°C. Пробку проткнули иглой калибра 18, материал в колбе перемешивали при постоянной подаче азота в течение 1 часа, на протяжении которого спирт таял, а метанол испарялся из колбы. Пробку заменили выравнивающей давление капельной воронкой, содержащей мономер 1 (151 г, 1,04 моль). Воронку герметизировали резиновой пробкой. Мономер 1 добавляли по капле в перемешиваемую смесь; реакционную смесь перемешивали при температуре 90°C в течение 15 часов. После охлаждения был получен сырой полиэфир 2 в виде бледно-коричневого слегка вязкого масла, которое использовалось в последующих реакциях без дальнейшего очищения. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 4,48-4,80 (м, 10H), 3,25-3,97 (м, 70H), 1,41-1,64 (м, 2H), 1,23-1,40 (м, 60H), 1,09-1,23 (м, 30H), 0,88 (т, J=7,0 Гц, 3H).
Для определения молекулярного веса была проведена гель-проникающая хроматография при температуре 35°C при помощи аппарата a Waters Alliance 2695 Separations Module (Waters, Миллфорд, штат Массачусетс) при скорости потока THF (стабилизированного с 0,025% BHT) 0,5 мл/мин. Аппарат 2695 был оборудован двумя последовательными колоннами ГПХ (Waters Corp HR 0,5 и HR3) размером 7,8×300 мм с размером частиц 5 мкм) и рефрактометрическим детектором модели Waters 410. Молекулярные веса образцов были определены сравнением с полистиреновыми эталонами. Эталоны были подготовлены взвешиванием 1-2 мг каждого полистиренового (PS) полимера в 2 мл виале с растворителем THF (2 эталона на виалу); перед проведением анализа образцы профильтровали (0,22 мкм). Полистиреновые эталоны охватывали диапазон от 70,000 до 600 Дальтонов и были произведены тремя поставщиками (Polymer Standards Service-USA, Phenomenex и Shodex). Результирующая калибровочная кривая показала r2=0,9999. Экспериментальные образцы были растворены в THF в концентрации 3–5 мг/мл и отфильтрованы (0,22 мкм) перед анализом. ГПХ (THF) для полимера 2: Mw 1724.
Сырой полиэфир 2 был перемещен вместе с тетрагидрофураном (THF, ~500 мл) в круглодонную колбу с магнитной мешалкой объемом 1 л. Концентрированный водный раствор HCl (37%, 20 мл) с помощью стеклянной пипетки добавили в перемешиваемую реакционную смесь. Спустя 16 часов реакционную смесь концентрировали ротационным выпариванием до состояния масла, которое разбавили метанолом до объема ~500 мл. Твердый NaHCO3 добавляли порциями в интенсивно перемешиваемый раствор, что вызывало значительное пузырение. Когда добавление NaHCO3 перестало вызывать пузырение (общее количество добавленного NaHCO3 составило 107 г), смесь профильтровали через бумагу для удаления твердого NaHCO3. Фильтрат концентрировали ротационным выпариванием, что позволило получить линейный полиглицерин 3 в виде коричневой пены. 1H ЯМР (400 МГц, DMSO-d6) δ м.д. 4,43 (ушир.с., 11H), 3,20-3,70 (м, 52H), 1,38-1,55 (м, 2H), 1,23 (с, 30H), 0,85 (т, J=7,0 Гц, 3H).
Пример 2B. Синтез линейного полиглицерина
Другая порция защищенного сырого полимера 2 (260 г) и метанола (класс ACS, 1,25 л) были помещены в круглодонную колбу с двумя горлышками. Сухая, H+ кислая ионообменная смола (форма Dowex DR-2030, Aldrich, 446483; 100,3 г) была добавлена в колбу. Центральное горлышко колбы было оборудовано переходником для механического перемешивания и лопастной мешалкой; боковое горлышко колбы было оборудовано переходником для дистилляции с водным охлаждением. Реакционную колбу погрузили в масляную ванночку. При интенсивном механическом перемешивании реакционную смесь довели до кипения (температура масляной ванночки 85°C). Метанол (и метил эфир, образовавшийся в результате снятия защитных групп) дистиллировали из колбы. После того как собрали 750 мл метанола, дополнительное количество метанола (750 мл) добавили в реакционную смесь. Следующим 750 мл метанола позволили дистиллироваться из колбы. В горячую реакционную смесь добавили обесцвечивающий уголь. Смесь быстро перемешали и отфильтровали через бумагу. Фильтрат концентрировали ротационным выпариванием. Остаточный растворитель удалили в условиях вакуума, что позволило получить конечный линейный полиглицерин в виде желтоватой пены (107 г).
Пример 3A. Синтез хромофора бензотриазол карбоксилата

ФОРМУЛА X. БЕНЗОТРИАЗОЛ КАРБОКСИЛАТ
Полиэтилен гликоль эфир 3-[3-(2H-1,2,3-бензотриазол-2-ил)-5-терт-бутил-4-гидроксифенил]пропаноата (хромофор, который продается под торговой маркой TINUVIN 213 производства Корпорации BASF, Виандот, штат Мичиган) (81,0 г) добавили в круглодонную колбу с магнитной мешалкой объемом 2 л. EtOH (600 мл) через воронку влили в колбу, смесь размешали до однородного состояния. Натрия гидроксид (NaOH, 30,8 г) растворили в H2O (400 мл); щелочной раствор переместили в капельную воронку, расположенную над 2 л колбой. Раствор NaOH медленно добавляли в перемешиваемую смесь; бледно-желтый мутный раствор мгновенно стал прозрачным и темно-оранжевым. После окончания добавления смесь перемешивали на протяжении ночи при комнатной температуре. Раствор концентрировали ротационным выпариванием для удаления большей части EtOH. Результирующее оранжевое масло разбавили до 1400 мл H2O. Смесь перемешивали механически и окислили до ~ pH 1 добавлением 1 M водн. HCl (~700 мл). Образовавшийся белый осадок профильтровали и отжали, чтобы удалить воду, а затем перекристаллизовали из EtOH. Первые побеги кристаллов были длинными, тонкими и бесцветными иглами. Отстоянную жидкость извлекли и концентрировали ротационным выпариванием; вторые побеги материала были изолированы как белые аморфные вещества. Оба побега были совмещены и высушены горячей вакуумной сушкой на протяжении ночи, что позволило получить УФ-хромофор, имеющий карбоксилатную группу, а именно бензотриазал карбоксилат 4, 3-(3-(2H-бензо[d][1,2,3]триазол-2-ил)-5-(терт-бутил)-4-гидроксифенил) пропановую кислоту (37,2 г) в виде белого твердого вещества; Структура показана в ФОРМУЛЕ X. 1H ЯМР (400 МГц, DMSO-d6) δ м.д. 11,25 (ушир.с, 1H), 8,00-8,20 (м, 2H), 7,95 (д, J=2,1 Гц, 1H), 7,50-7,67 (м, 2H), 7,28 (д, J=2,1 Гц, 1H), 2,87 (т, J=7,5 Гц, 2H), 2,56 (т, J=7,5 Гц, 2H), 1,45 (с, 9H).
Пример 3B. Синтез хромофора бензотриазол карбоксилата
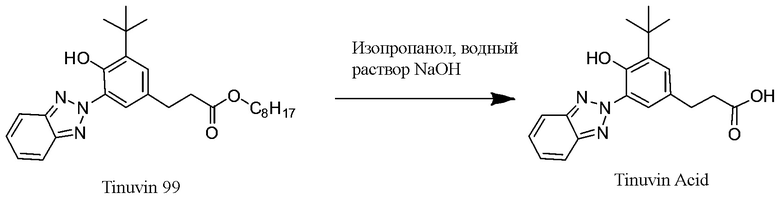
Бензенпропановая кислота, 3-(2H-бензотриазол-2-ил)-5-(1, 1-диметилэтил)-4-гидрокси-, C7-9-разветвленные и линейные алкил эфиры, доступные в продаже под торговой маркой TINUVIN 99 производства Корпорации BASF (120 г, 265,7 ммоль) добавили в круглодонную колбу с одним горлышком и магнитной мешалкой объемом 3 л. Изопропанол (900 мл, класс ACS) добавили в колбу, результирующую смесь перемешивали до полного растворения. Гидроксид натрия (36 г, 900 ммоль) растворили в 600 мл дистиллированной воды, раствор влили в реакционную смесь. Результирующую непрозрачную смесь, которая через 40 минут превратилась в прозрачный оранжевый раствор, перемешивали при комнатной температуре в течение 24 часов, а затем медленно влили в интенсивно перемешиваемую смесь изопропанола (1800 мл, класс ACS) и 1N HCl (1200 мл), охлажденную до температуры 10-15°C. Белый осадок профильтровали, промыли 1,2 л смеси (1:1) изопропанола и 1N HCl, эмульгировали в 2 л 0,25N HCl, перемешивали в течение 1 часа, профильтровали и сушили при температуре 90°C вакуумной горячей сушкой на протяжении ночи. Был получен результирующий УФ-хромофор, имеющий карбоксилатную группу, а именно бензотриазол карбоксилат 4 (37.2 г) в виде бледно желтого кристаллического вещества, 85 г, 94°5%.
Пример 4. Этерификация главной цепи полиэфира бензотриазол карбоксилатом
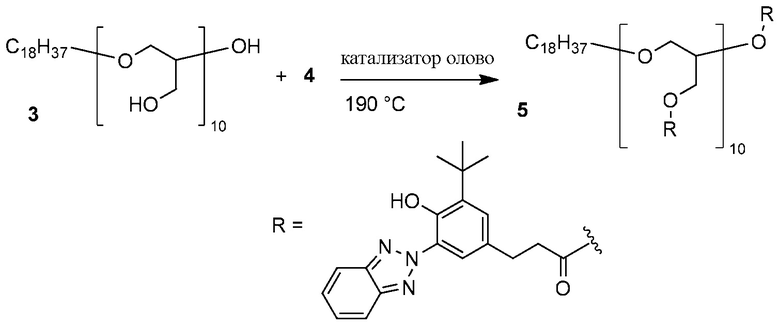
ФОРМУЛА XI. ЭТЕРИФИКАЦИЯ ПОЛИГЛИЦЕРИНА БЕНЗОТРИАЗОЛ КАРБОКСИЛАТОМ
ФОРМУЛА XI иллюстрирует этерификацию полиглицерина 3 бензотриазол карбоксилатом 4 с использованием катализатора олова. Линейный полиглицерол 3 из Примера 2A (5,52 г, 60,1 миллиграмм-эквивалент гидроксила) растворили в метаноле и перелили в круглодонную колбу с двумя горлышками объемом 500 мл. Метанол удалили ротационным выпариванием; в колбу добавили бензотриазол карбоксилат 4 (20,38 г, 60,1 ммоль)) и поместили магнитную мешалку. Колба была оборудована переходником для подачи азота и переходником вакуумной дистилляции с приемной колбой объемом 100 мл. Колбу поместили в вакуум (<133,3 Па (1 Торр)) на 1 час, затем заново наполнили газообразным азотом. Переходник подачи извлекли из колбы объемом 500 мл; этил гексаноат олова (II) (49 мкл, 0,15 ммоль) добавили в колбу шприцем при подаче азота. Аппарат собрали заново и погрузили в масляную ванночку, предварительно нагретую до 200°C. Когда основная масса твердой фазы растаяли, масло охладили до 190°C. Реакционную смесь перемешивали при постоянной подаче азота в течение 16 часов. Поддерживая температуру и продолжая перемешивание, колбу затем поместили в условия вакуума (<133,3 Па (1 Торр)) еще на 24 часа. Затем аппарат заново наполнили газообразным азотом и охладили до комнатной температуры. Материал заморозили и разломили и растерли в порошок пестиком в ступке. Порошок растворили в минимальном количестве THF. Метанол (900 мл) влили в коническую колбу и поместили в нее магнитную мешалку; колбу поместили в ледяную ванночку. При интенсивном перемешивании раствор THF добавили в метанол; результирующий осадок изолировали вакуумной фильтрацией. Остаточный растворитель удалили вакуумированием на протяжении ночи, что позволило получить линейный полиглицерин 5 (18,7 г) в виде серовато-белого кристаллического вещества. 1H ЯМР (400 МГц, CDCl3) δ м.д. 11,71 (ушир.с, 9H), 8,03 (ушир.с, 9H), 7,80 (ушир.с, 18H), 7,28-7,48 (м, 18H), 7,12 (ушир.с, 9H), 5,19 (ушир.с, 1H), 3,98-4,46 (ушир.м, 20H), 3,21-3,61 (ушир.м, 32H), 2,91 (ушир.с, 18H), 2,67 (ушир.с, 18H), 1,38-1,51 (м, 85H), 1,13-1,35 (м, 28H), 087 (т, J=6,6 Гц, 3H). ГПХ (THF): Mw 3299; Mn 2913.
Пример 5. Превращение бензотриазол карбоксилата в хлорангидрид (3-(3-(2H-бензо[d][1,2,3]триазол-2-ил)-5-(терт-бутил)-4-гидроксифенил)пропаноил хлорид)
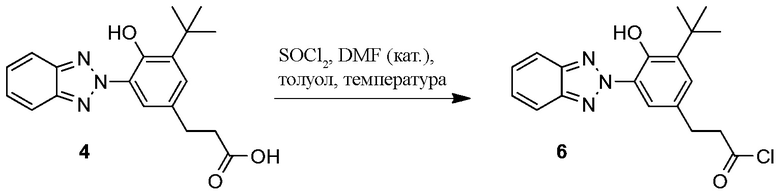
ФОРМУЛА XII. ПРЕВРАЩЕНИЕ БЕНЗОТРИАЗОЛ КАРБОКСИЛАТА В ХЛОРАНГИДРИД
Превращение бензотриазол карбоновой кислоты 4 в соответствующий бензотриазол хлорангидрид 6 показано в ФОРМУЛЕ XII. бензотриазол карбоксилат 4 (50 г 147 ммоль, синтезированный методом, описанным в Примере 3) добавили в колбу с тремя горлышками с магнитной мешалкой объемом 1000 мл; колба была оборудована обратным конденсатором, вводом подачи азота и резиновой пробкой. Безводный толуол (~500 мл) с помощью канюли через пробку добавили в колбу. Тионил хлорид (16,1 мл, 221 ммоль) добавили в колбу с помощью шприца; диметилформамид (2,7 мл) после этого добавили в колбу с помощью шприца. Колбу погрузили в масляную ванночку при температуре 80°C; эмульсию перемешали; твердые частицы стали рассеиваться, в конечном счете получен прозрачный раствор. Спустя ~4 часа реакционной смеси дали остыть, перелили в круглодонную колбу и концентрировали ротационным выпариванием. Результирующее масло растерли в порошок с гексанами, что позволило получить твердое вещество бежевого цвета. Эмульсию материала перекристаллизировали добавлением дополнительных гексанов и разогревом до обратного стока, фильтрацией через бумагу и медленным охлаждением до комнатной температуры при постоянном перемешивании. Результирующие бежевые кристаллы профильтровали и высушили в условиях вакуума при температуре 50°C. Фильтрат концентрировали, перекристаллизацию выполнили во второй раз, позволяя образоваться вторым побегам кристаллов; масса всех побегов кристаллов бензотриазол хлорангидрида 6 составила 44,7 г. 1H ЯМР (400 МГц, CDCl3) δ 11,88 (с, 1H), 8,16 (d, J=2,2 Гц, 1H), 7,91-7,98 (м, 2H), 7,47-7,54 (м, 2H), 7,21 (д, J=2,2 Гц, 1H), 3,29 (т, J=7,5 Гц, 2H), 3,07 (т, J=7,5 Гц, 2H), 1,50-1,53 (с, 9H).
Пример 6. Превращение бензотриазол хлорангидрида в изоцианат (2-(2H-бензо[d][1,2,3]триазол-2-ил)-6-(терт-бутил)-4-(2-изоционатоэтил)фенол)

ФОРМУЛА XIII. ПРЕВРАЩЕНИЕ ХЛОРАНГИДРИДА В ИЗОЦИАНАТ
Синтез бензотриазол изоцианата 7, необходимый для присоединения к боковым функциональным группам, показан в ФОРМУЛЕ XIII. Азид натрия (NaN3, 2,5 г, 38 ммоль: ВНИМАНИЕ! NaN3 является сильным ядом) аккуратно поместили в круглодонную колбу с одним горлышком объемом 500 мл с магнитной мешалкой. В колбу добавили дистиллированную воду (20 мл); NaN3 расстворился при перемешивании, образовав прозрачный раствор. Колбу погрузили в ледяную ванночку. Хлорангидрид 6 (7,0 г 20 ммоль) и безводный ацетон (45 мл) поместили в выравнивающую давление капельную воронку в перчаточном боксе с положительным давлением N2 атмосферы. Хлорангидрид растворился в ацетоне с легким бурлением, образовав прозрачный желтый раствор. Капельная воронка с бензотриазол хлорангидридом 6 была вставлена в колбу, содержащую водный раствор NaN3; верхняя часть капельной воронки была оборудована переходником N2, подключенным к вакуумному газовому коллектору. Раствор бензотриазол хлорангидрида 6 добавили по капле в раствор NaN3. После добавление нескольких капель начал появляться белый осадок, подвешенный в водном растворе. Добавление бензотриазол хлорангидрида 6 завершилось в течение 30 минут; смешивание продолжили в течение 20 минут в ледяной ванночке. В полученную белую кашицу добавили воду (30 мл); твердые частицы собрали фильтрованием через пористую стеклянную воронку в условиях вакуума. Белый осадок поместили в сепараторную воронку, затем в нее добавили CHCl3 (185 мл). Колбу встряхнули, что привело к отделению слоев. Нижний органический слой извлекли из небольшого водянистого слоя и высушили с помощью Na2SO4. Раствор профильтровали; фильтрат поместили в круглодонную колбу с одним горлышком и магнитной мешалкой объемом 500 мл; колба была оборудована обратным конденсатором с переходником подачи и помещена в масляную ванночку. Раствор медленно нагревали до обратного стока более 30 минут. Окончательная температура масла составила 65°C. После того как температура масла превысила 55°C, в растворе наблюдалось пузырение. Реакция привела к обратному стоку в течение 90 мин. Затем ротационным выпариванием удалили CHCl3; полученное масло кристаллизировалось на протяжении ночи выстаиванием, что позволило образовать бензотриазол изоцианат 7 (5.8 г) в виде сероватого кристаллического вещества. 1H ЯМР (400 МГц, CDCl3) δ 11,91 (с, 1H), 8,18 (д, J=1,9 Гц, 1H), 7,92-7,98 (м, 2H), 7,47-7,53 (м, 2H), 7,23 (д, J=2,1 Гц, 1H), 3,59 (т, J=69 Гц, 2H), 2,96 (т, J=6,9 Гц, 2H), 1,52 (с, 9H).
Пример 7. Присоединение изоцианата к полиглицерину
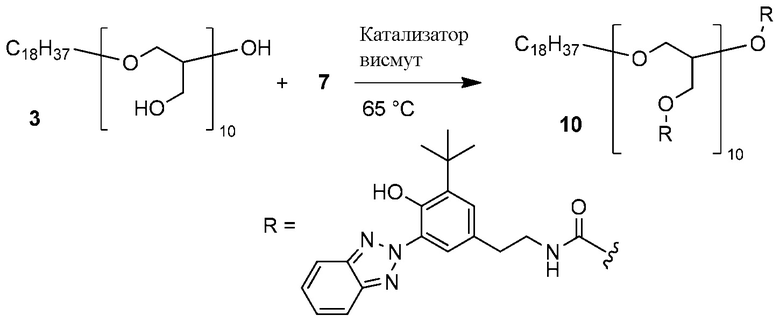
ФОРМУЛА XIV. РЕАКЦИЯ ПОЛИГЛИЦЕРИНА С ИЗОЦИАНАТОМ
Реакция линейного полиглицерина 3 с бензотриазол изоцианатом 7 показана в ФОРМУЛЕ XIV. Раствор полиглицерола 3 в метаноле концентрировали ротационным выпариванием; остаточный растворитель удаляли в вакуумной печи на протяжении ночи при температуре 75°C. Полимер (2,22 г, 24,1 миллиграмм-эквивалент гидроксила) добавили в круглодонную колбу с двумя горлышками и магнитной мешалкой объемом 100 мл. Изоцианат 7 (7,65 г, 22,7 ммоль), катализатор висмут (25 мг; комплекс висмут - карбоксилат, который доступен в продаже под торговой маркой BICAT 8210 производства компании Shepherd Chemical, Норвуд, штат Огайо) и THF (17,4 мл, высушенный с помощью молекулярного сита 3 ангстрем) добавили в колбу. Колбу поместили в разогретую до 65°C масляную ванночку и оборудовали переходником для впуска газа. Реакционную смесь перемешивали в течение 5 часов в присутствии газообразного азота, затем дали остыть до комнатной температуры. Для подтверждения исчезновения сильного пика изоцианата при 2250 см-1 использовали инфракрасную спектроскопию с преобразованием Фурье. Реакционную смесь влили в 160 мл метанола, в результате чего образовался коричневый осадок. Метанол сцедили, а продукт реакции промыли в колбе метанолом (2×75 мл). Остаточный растворитель удаляли в вакуумной печи на протяжении ночи при 60°C; материал растерли в порошок.
Пример 8. Синтез эпоксидного хромофора для метода прямой полимеризации
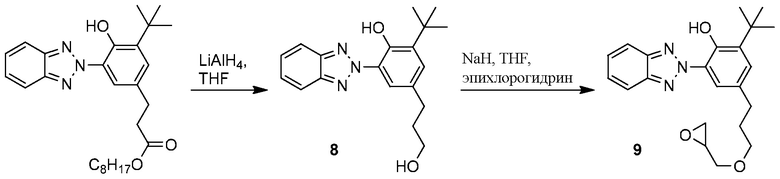
ФОРМУЛА XV. СИНТЕЗ МОНОМЕРА ЭПОКСИДНОГО ХРОМОФОРА
Синтез эпоксидного мономера 9, несущего бензотриазол хромофор, показан в ФОРМУЛЕ XV. Раствор литий алюминий гидрида (LAH) в THF (1 M, 250 мл) поместили с помощью канюли в присутствии газообразного азота в круглодонную колбу с двумя горлышками и магнитной мешалкой объемом 500 мл после горячей сушки, и оборудовали ее резиновой пробкой и выравнивающей давление капельной воронкой. Реакционную колбу погрузили в ледяную ванночку; начали перемешивание. Бензенпропановая кислота, 3-(2H-бензотриазол-2-ил)-5-(1,1-диметилэтил)-4-гидрокси, C7-C9 разветвленный и линейный алкил эфир, содержащий в весовом соотношении 5% 1-метокси-2-пропил ацетата (50,06 г; поглощающий УФ продукт бензотриазола, который доступен в продаже под торговой маркой TINUVIN 99-2 производства Корпорации BASF, Виандот, штат Мичиган) поместили в капельную воронку и растворили в безводном THF (30 мл). Раствор THF, содержащий бензотриазол добавляли по капле в раствор, содержащий LAH; что привело к тихому шипению. После того как добавление было завершено, дополнительное количество раствора LAH (100 мл) добавили в реакционную колбу с помощью канюли. Реакционной смеси дали нагреться до комнатной температуры при ее перемешивании. Спустя 2 часа реакционную смесь перелили в коническую колбу объемом 1 л, которую поместили в ледяную ванночку. Раствор перемешивали механически, медленно добавляя воду (~60 мл), чтобы погасить любые остаточные LAH (ОСОБОЕ ВНИМАНИЕ: гашение LAH водой является экзотермической реакцией, высвобождающей большое количество легко воспламеняющегося газа H2). По завершении гашения LAH (при добавлении воды газ не выделялся), серую эмульсию разбавили до 1 л использованием 1 M водного раствора HCl. Этот раствор переместили в сепараторную воронку объемом 2 л и экстрагировали этил ацетатом (1×400 мл, затем 2×50 мл). Комбинированные слои этил ацетата смыли соленой водой (1×400 мл), высушили с помощью Na2SO4, затем отфильтровали через бумагу. Растворитель удаляли сначала ротационным выпариванием, а затем вакуумной сушкой на протяжении ночи, что позволило получить бензотриазоловый спирт 8 (42,16 г) в виде бежевого кристаллического вещества с сильным неприятным запахом. 1H ЯМР (400 МГц, CDCl3) δ м.д. 11,75 (с, 1H), 8,15 (д, J=2,1 Гц, 1H), 7,88-7,99 (м, 2H), 7,43-7,52 (м, 2H), 7,22 (д, J=2,1 Гц, 1H), 3,75 (м, 2H), 3,62 (ушир.с, 1H), 2,77 (т, J=7,7 Гц, 2H), 1,91-2,06 (м, 2H), 1,52 (с, 9H).
Натрия гидрид (6,0 г, 250 ммоль) добавили в круглодонную колбу с тремя горлышками и магнитной мешалкой после горячей сушки. Колбу оборудовали выравнивающей давление капельной воронкой, переходником подачи азота и резиновой пробкой. Безводный THF (300 мл) добавили в колбу с помощью канюли при подаче азота; затем колбу поместили в ледяную ванночку и начали перемешивание. Бензотриазоловый спирт 8 (20,0 г, 61,5 ммоль) добавили в воронку, а также поместили в нее магнитную мешалку; THF с помощью канюли добавили в капельную воронку, мешалку активировали, чтобы способствовать растворению спирта в THF. Конечный объем спирта/раствора THF составил 65 мл. Раствор добавляли по капле в холодную перемешиваемую эмульсию натрия гидрата. Холодная реакционная смесь перемешивалась 1 час, затем был добавлен эпихлоргидрин (20 мл, 256 ммоль) с помощью шприца через пробку. Капельную воронку заменили обратным конденсатором с переходником для подачи азота, круглодонную колбу погрузили в масляную ванночку с температурой 70°C. Смесь перемешивали 19 часов, затем смесь переместили в сепараторную воронку с 1M водным раствором HCl (750 мл) и этил ацетатом (500 мл). После взбалтывания водянистый слой был удален. Органический слой смыли водой (2×250 мл) и соленым раствором (1×250 мл), а затем высушили с помощью Na2SO4. Раствор концентрировали ротационным выпариванием. Сырой продукт очистили силикагелевой хроматографией (6:1 гексан/этил ацетат). Фракции, содержащие требуемый продукт, объединили и концентрировали ротационным выпариванием; остаточный растворитель удаляли вакуумом на протяжении ночи, что привело к образованию эпоксидного мономера 9, несущего бензотриазол хромофор (7,35 г) в виде бежевого кристаллического вещества. 1H ЯМР (400 МГц, CDCl3) δ м.д. 11,77 (с, 1H), 8,14 (д, J=1,9 Гц, 1H), 7,85-8,00 (м, 2H), 7,41-7,53 (м, 2H), 7,21 (д, J=1,9 Гц, 1H), 3,74 (дд, J=11,5, 3,1 Гц, 1H), 3,57 (ддт, J=19,8, 9,3, 6,4 Гц, 2H), 3,43 (dd, J=11,5, 5,8 Гц, 1H), 3,19 (ддт, J=5,8, 4,0, 2,9 Гц, 1H), 2,82 (ушир.т, J=4,7 Гц, 1H), 2,76 (ушир.т, J=7,7 Гц, 2 H), 2,64 (дд, J=5,1, 2,6 Гц, 1H), 1,93–2,04 (м, 2H), 1,52 (с, 9H).
Пример 9. Этерификация чередующегося полиглицерина бензотриазоловой кислотой
Полиглицерол, частично этерифицированный стеариновой кислотой (2,5 г, 19,8 миллиграмм-эквивалент гидрокси; тетрадекаглицерин моностеарат, который доступен в продаже под торговой маркой POLYALDO 14-1-S производства компании Lonza, Аллендейл, штат Нью-Джерси) и бензотриазол карбоксилат 4 (8,8 г, 23,8 ммоль) поместили в круглодонную колбу с двумя горлышками и магнитной мешалкой объемом 100 мл. Колбу оборудовали переходником для подачи азота и переходником для дистилляции с приемной колбой объемом 100 мл. Аппарат поместили в вакуум, затем повторно заполнили азотом. Дистилляционную головку удалили и в реакционную колбу с помощью шприца в присутствии азота добавили этил гексонат олова (II) (50 мкл). Аппарат собрали заново, очистили в вакууме и заново наполняли азотом трижды. Реакционную колбу погрузили в масляную ванночку, разогретую до 180°C, с постоянной подачей азота в колбу с двумя горлышками через адаптер для дистилляции и с выходом из вакуумного адаптера в помещение. Реакционную смесь перемешивали 3 часа, а затем охладили до комнатной температуры при подаче азота, в результате чего образовался продукт, поглощающий УФ полиглицерин, в виде желтого кристаллического вещества. 1H ЯМР (400 МГц, CDCl3) δ м.д. 11,81 (ушир.с, 2H), 8,15 (ушир.с, 2H), 7,75-8,02 (ушир.с, 4H), 7,34-7,58 (ушир.с, 4H), 7,21 (ушир.с, 2H), 4,93-5,32 (ушир., 1H), 3,17-4,50 (ушир.м, 38H), 2,86-3,11 (ушир.м, 4H), 2,54-2,84 (ушир.м, 4H), 2,31 (ушир.с, 2H), 1,61 (ушир.с, 2H), 1,50 (ушир.с, 18H), 1,26 (ушир.с, 28H), 0,89 (т, J=6,3 Гц, 3H). ГПХ (THF): Mw 1700; Mn 950.
Пример 10. Синтез метил эфира бензотриазольной кислоты

ФОРМУЛА XVI. СИНТЕЗ МЕТИЛ ЭФИРА11
Синтез бензотриазол метил эфира 11 необходим для переэтерификации полимера гидроксильными функциональными группами, как показано в ФОРМУЛЕ XVI. Бета-[3-(2-H-бензотриазол-2-ил)-4-гидрокси-5-терт-бутилфенил]-пропионовая кислота-поли(этиленгликоль) 300-эфир (50.1 г; поглощающий УФ продукт, который доступен в продаже под торговой маркой TINUVIN 1130 производства Корпорации BASF, Виандот, штат Мичиган) добавили в круглодонную колбу с двумя горлышками и магнитной мешалкой объемом 1 л. В колбу добавили метанол (500 мл). Колбу погрузили в масляную ванночку; раствор перемешали. p-TSA·H2O (0,63 г) добавили в раствор. Колба с двумя горлышками была оборудована обратным конденсатором и резиновой пробкой; перемешиваемая реакционная смесь была доведена до обратного стока нагреванием масляной ванночки; обратный сток сохранялся на протяжении 17 часов. Затем колбу достали из масляной ванночки и дали остыть до комнатной температуры; в это время продукт осел в виде белого твердого вещества. Осадок изолировали вакуумной фильтрацией, а затем перекристаллизацией из метанола; твердые частички были изолированы в условиях вакуума при температуре 80°C, что позволило образовать бензотриазол метил эфир 11 (18.27 г) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ м.д. 11,81 (с, 1H), 8,16 (д, J=2,1 Гц, 1H), 7,90-7,98 (м, 2H), 7,45-7,53 (м, 2H), 7,22 (д, J=2,2 Гц, 1H), 3,71 (с, 3H), 3,01 (т, J=7,8 Гц, 2H), 2,71 (т, J=7,8 Гц, 2H), 1,51 (с, 9H).
Пример 11. Переэтерификация бензотриазол метил эфира с полимером полиглицерина
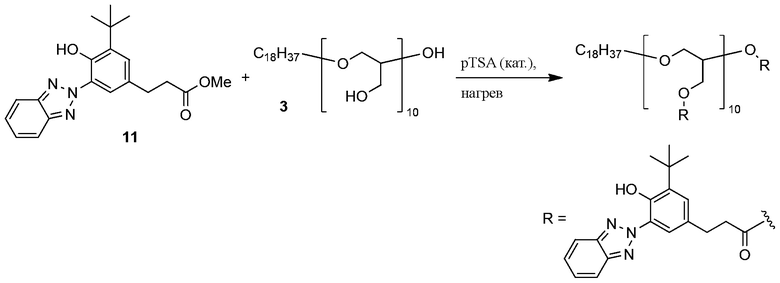
ФОРМУЛА XVII. ПЕРЕЭТЕРИФИКАЦИЯ ПОЛИГЛИЦЕРИНОМ
Переэтерификация бензотриазол метил эфира 11 с полиглицерином 3 показана в ФОРМУЛЕ XVII. Раствор полиглицерина 3 в MeOH концентрировали ротационным выпариванием; остаточный растворитель удаляли в условиях вакуума на протяжении ночи при температуре 75°C. Полиглицерин 3 (1,36 г, 14,9 миллиграмм-эквивалент гидроксила) добавили) добавили в круглодонную колбу с двумя горлышками и магнитной мешалкой объемом 100 мл бензотриазол метил эфир 11 (4,24 г, 12 ммоль) и pTSA·H2O (7,1 мг) добавили в колбу. Колбу оборудовали адаптером подачи азота и дистилляционным адаптером с приемной колбой в 100 мл. Реакционную колбу поместили в масляную ванночку, которую нагрели до 175°C, в течение 20 минут все реагенты растаяли. Реакционную смесь интенсивно перемешивали при подаче азота на протяжении ночи. На следующее утро колбу поместили в вакуум; остаточные УФ-хромофоры сублимировались и собрались в адаптере для дистилляции. Подогрев в вакууме продолжался всю ночь. Реакционную смесь затем охладили до комнатной температуры; продукт, поглощающий УФ полиглицерин, получили в виде желтого, стеклоподобного твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ м.д. 11,71 (ушир.с, 8H), 8,05 (ушир.с, 8H), 7,81 (ушир.с, 16H), 7,36 (ушир.с, 16H), 7,14 (ушир.с, 8H), 5,06-5,32 (ушир.с, 1H), 3,86-4,57 (м, 16H), 3,15-3,82 (м, 30H), 2,92 (ушир.с, 16H), 2,68 (ушир.с, 16H), 1,45 (ушир.с, 76H), 1,24 (ушир.с, 28H), 0,88 (т, J=6,6 Гц, 3H).
Из Примеров 1-11 видно, что аналитическая характеристика результирующих поглощающих ультрафиолет соответствовала ожидаемым структурам. Анализ полимеров, описанных в Примерах, методом высокоэффективной жидкостной хроматографии подтвердили, что в результате описанных методов полимеризации можно получить малые концентрации остаточного поглощающего УФ мономера.
Пример 12. Краткое описание результатов SPF
Измерения солнцезащитного фактора (SPF) поглощающих УФ полимеров проводились следующим лабораторным методом анализа защиты от солнца. Образцы полимера были отмеряны и помещены в 8 мл стеклянные виалы. Смешанные C12-C15 алкил бензонаты (a косметический масляный растворитель, который доступен в продаже под торговой маркой FINSOLV TN производства Innospec, Ньюарк, штат Нью-Джерси) добавили в виалу для получения нужной массовой доли раствора полимера. Магнитную мешалку поместили в виалу, которую затем герметизировали Тефлоновой колпачковой гайкой. Раствор полимера/масла перемешивали в алюминиевом реакционном блоке при температуре 100°C до однородного состояния. После охлаждения 32 мг раствора полимера нанесли на поли(метил метакрилат) (PMMA) пластину (подложка для проведения испытания, которая доступна в продаже под торговой маркой HELIOPLATE HD6 производства компании Helioscience, Марсель, Франция). Раствор был равномерно распределяли по пластине одним пальцем до тех пор, пока вес образца на пластине не снизился до 26 мг. Базовое пропускание было измерена с помощью пластины HD6, полученной от производителя. Поглощение измерялось с использованием калибрированного анализатора пропускания УФ Labsphere UV-1000S UV (Лабсфер, Норд Саттон, штат Нью-Гемпшир, США). Измерения поглощения использовались для расчета показателя SPF. SPF расчитывали с применением общеизвестных в данной области знаний методов. Уравнение, использованной для расчета SPF, представлено в Уравнении 1.
SPFв лабораторных условиях=[∫ E(λ) I(λ)dλ]/[∫ E(λ) I(λ) 10-A0(λ) (dλ)] (1)
где:
E(λ) = спектр, вызывающий покраснение кожи
I(λ) = спектральная плотность потока излучения, полученная от источника УФ
A0(λ) = средняя монохроматическая абсорбция слоя испытываемого продукта до облучения ультрафиолетом.
dλ = шаг длины волны (1 нм)
интегрирование в каждом случае проводится по диапазону длин волн от 290 нм до 400 нм.
Результаты лабораторного исследования SPF полимера изложены в Примерах 4, 7 и 9 [% весового содержания в FINSOLV TN, среднее значение SPF], а также показаны в Таблице 1.
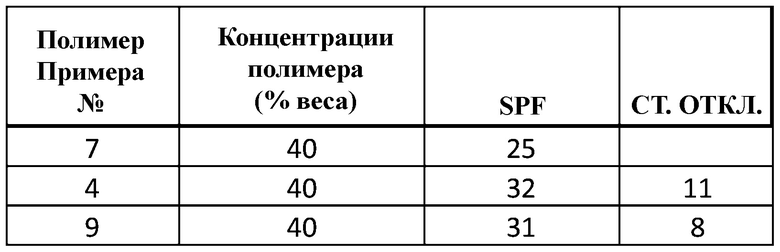
Видно, что поглощающие ультрафиолет полиэфиры растворялись в маслах, часто используемых в косметологии для местного применения. Более того, было показано, что растворы полимеров в этих маслах, использованные в лабораторных методах исследования SPF, имели удовлетворительные значения. SPF.
Изобретение относится к новым поглощающим ультрафиолет полимерным соединениям, предназначенным для снижения разрушающего воздействия ультрафиолетового (УФ) излучения на кожу. Полимерное соединение содержит линейный поглощающий УФ излучение полиэфир, который включает химически связанный УФ-хромофор. Причем указанный полиэфир имеет главную цепь, которая не имеет ответвлений, и УФ-хромофор представляет собой боковую группу, прикрепленную к главной полиэфирной цепи. Описывается также композиция, содержащая косметически приемлемую несущую среду и указанное поглощающее УФ излучение полимерное соединение. Изобретение обеспечивает новые УФ-поглощающие полимерные соединения с повышенной эффективностью защиты эпидермиса кожи от УФ излучения. 2 н. и 15 з.п. ф-лы, 1 табл., 12 пр.
1. Полимерное соединение, содержащее линейный поглощающий ультрафиолетовое излучение полиэфир, который включает в себя химически связанный УФ-хромофор,
где линейный поглощающий ультрафиолетовое излучение полиэфир имеет главную цепь, которая не имеет ответвлений, и УФ-хромофор представляет собой боковую группу, прикрепленную к главной полиэфирной цепи, и
УФ-хромофор выбран из группы, включающей триазин, бензотриазол, триазолы, камфоры, дибензолметаны, 4-аминобензойную кислоту и ее алкановые эфиры, ортоаминобензойную кислоту и ее алкановые эфиры, салициловую кислоту и ее алкановые эфиры, гидроксикоричную кислоту и ее алкановые эфиры, дигидрокси-, дикарбокси- и гидроксикарбоксибензофеноны, а также их алкановые эфиры и галоидангидридные производные, дигидрокси-, дикарбокси- и гидроксикарбоксихалконы, а также их алкановые эфиры и галоидангидридные производные, дигидрокси-, дикарбокси- и гидроксикарбоксикумарины, а также их алкановые эфиры и галоидангидридные производные, бензалмалонат, производные бензимидазола, производные бензоксазола, 3-(3-(2Н-бензо[d][1,2,3]триазол-2-ил)-5-(трет-бутил)-4-гидроксифенил), 6-октил-2-(4-(4,6-ди([1,1'-бифенил]-4-ил)-1,3,5-триазин-2-ил)-3-гидроксифенокси)пропаноат и триоктил 2,2',2''-(((1,3,5-триазин-2,4,6-триил) трис(3-гидроксибенз-4,1-диил))трис(окси))трипропаноат.
2. Полимерное соединение по п. 1, в котором линейный поглощающий ультрафиолетовое излучение полиэфир включает в себя повторяющееся звено, выбранное из группы, включающей в себя
 и
и 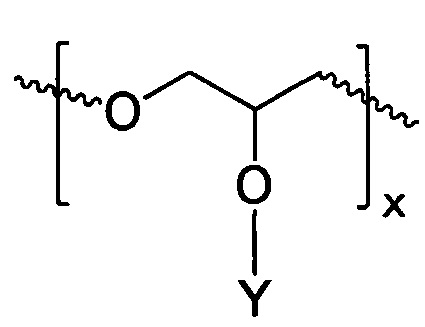
где Y - химически связанный УФ-хромофор.
3. Полимерное соединение по п. 1, в котором линейный поглощающий ультрафиолетовое излучение полиэфир включает в себя повторяющееся звено

где Y - химически связанный УФ-хромофор
4. Полимерное соединение по п. 1, в котором линейный поглощающий ультрафиолетовое излучение полиэфир включает в себя повторяющееся звено
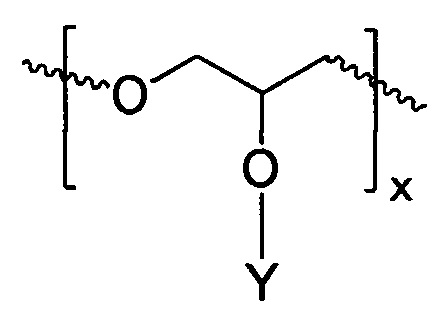
где Y - химически связанный УФ-хромофор.
5. Полимерное соединение по п. 1, которое содержит около 50% или более упомянутого линейного поглощающего ультрафиолетовое излучение полиэфира, включающего в себя химически связанный УФ-хромофор.
6. Полимерное соединение по п. 1, которое содержит около 90% или более упомянутого линейного поглощающего ультрафиолетовое излучение полиэфира, включающего в себя химически связанный УФ-хромофор.
7. Полимерное соединение по п. 1, которое содержит около 95% или более упомянутого линейного поглощающего ультрафиолетовое излучение полиэфира, включающего в себя химически связанный УФ-хромофор.
8. Полимерное соединение по п. 1, в котором линейный поглощающий ультрафиолетовое излучение полиэфир имеет главную цепь, включающую в себя повторяющиеся звенья глицерила.
9. Полимерное соединение по п. 1, линейный поглощающий ультрафиолетовое излучение полиэфир характеризуется, как обладающий структурой

где R - боковая группа, Y - химически связанный УФ-хромофор, X - концевая группа, a m и n - действительные числа в диапазоне от 0 до 1.
10. Полимерное соединение по п. 9, в котором m=1 и n=0.
11. Полимерное соединение по п. 9, в котором X и R независимо выбраны из группы, включающей водород, линейный алкил, алкенил или алкиниловую углеводородную цепь и линейные силоксаны.
12. Полимерное соединение по п. 1, в котором линейный поглощающий ультрафиолетовое излучение полиэфир является продуктом реакции полимеризации с раскрытием кольца мономера, выбранного из группы, включающей этиленоксиды, пропиленоксиды и глицидиловые эфиры.
13. Полимерное соединение по п. 12, в котором глицидил эфир выбран из группы, включающей n-бутилглицидиловый эфир и 2-этилгексилглицидиловый эфир
14. Полимерное соединение по п. 1, обладающее коэффициентом полидисперсности около 1,5 или ниже.
15. Полимерное соединение по п. 1, обладающее коэффициентом полидисперсности около 1,2 или ниже.
16. Полимерное соединение по п. 1, в котором упомянутое полимерное соединение является продуктом реакции эфира полиглицерина и УФ-хромофора, который имеет функциональную группу, способную присоединяться к данному эфиру полиглицерина ковалентной связью.
17. Композиция, содержащая косметически приемлемую несущую среду и полимерное соединение, включающее поглощающий ультрафиолетовое излучение линейный полиэфир, содержащий химически-связанный УФ-хромофор.
| JP 6099186 A, 03.06.1985 | |||
| WO 9603369 A1, 08.02.1996 | |||
| US 5039782 A, 13.08.1991 | |||
| Лигатура | 1974 |
|
SU523955A1 |
| US 4322522 A, 30.03.1982 | |||
| WO 2005092282 A1, 06.10.2005 | |||
| WO 2011070050 A1, 16.06.2011 | |||
| RU 2009124703 А, 10.01.2011. | |||
Авторы
Даты
2017-11-14—Публикация
2013-06-27—Подача