ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к соединениям, которые модулируют функцию LRRK2 и полезны для лечения LRRK2-опосредованных заболеваний и состояний, таких как болезнь Паркинсона.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Нейродегенеративные заболевания, такие как болезнь Паркинсона, деменция с тельцами Леви и болезнь Гентингтона, поражают миллионы людей. Болезнь Паркинсона представляет собой хроническое, прогрессирующее двигательное расстройство, которое поражает приблизительно одного из каждой 1000 человек, при этом наследственная болезнь Паркинсона наблюдается у 5-10% всех пациентов. Причиной болезни Паркинсона является прогрессирующая потеря дофаминовых нейронов среднего мозга, приводящая к нарушению у пациентов способности управлять своими движениями и осуществлять над ними контроль. Первичными симптомами болезни Паркинсона являются дрожь, ригидность, замедленность движений и нарушение равновесия. Многие пациенты с болезнью Паркинсона также испытывают другие симптомы, такие как эмоциональные изменения, потеря памяти, речевые проблемы и расстройства сна.
Ген, кодирующий белок - обогащенную лейциновыми повторами киназу 2 (leucine-rich repeat kinase 2; LRRK2), был идентифицировали совместно с наследственной болезнью Паркинсона (Paisan-Ruiz et al., Neuron, Vol. 44 (4), 2004, pp. 595-600; Zimprich et al., Neuron, Vol. 44 (4), 2004, 601-607). Исследования in vitro показывают, что ассоциированная с болезнью Паркинсона мутация вызывает увеличение киназной активности LRRK2 и уменьшение скорости гидролиза ГТФ по сравнению с диким типом (Guo et al., Experimental Cell Research, Vol. 313 (16), 2007, pp. 3658-3670). Антитела к LRRK2 были использованы для "мечения" телец Леви ствола головного мозга, ассоциированных с болезнью Паркинсона, и наличие кортикальных антител, ассоциированных с деменцией с тельцами Леви, позволяет высказать предположение, что LRRK2 может играть важную роль в образовании и патогенезе телец Леви, ассоциированных с этими заболеваниями (Zhou et al., Molecular Degeneration, 2006, 1: 17 doi: 10.1186/1750-1326-1-17). Ген LRRK2 также был идентифицирован как ген, потенциально ассоциированный с повышенной предрасположенностью к болезни Крона и предрасположенностью к лепре (Zhang et al., New England J. Med. Vol. 361 (2009) pp. 2609-2618).
LRRK2 также ассоциирована с перерождением умеренной когнитивной недостаточности в болезнь Альцгеймера (WO 2007/149789); с L-допаиндуцированной дискинезией (Hurley et al., Eur. J. Neurosci., Vol. 26, 2007, pp. 171-177); расстройствами центральной нервной системы (ЦНС), связанными с дифференцировкой предшественников нейронов (Milosevic et al., Neurodegen., Vol. 4, 2009, p. 25); случаями рака, такого как рак почки, молочной железы, предстательной железы, крови, легкого и острый миелогенный лейкоз (WO 2011/038572); папиллярным раком почки и раком щитовидной железы (Looyenga et al., www.pnas.org/cgi/doi/10.1073/pnas.1012500108): множественной миеломой (Chapman et al., Nature, Vol. 471, 2011, pp. 467-472); боковым амиотрофическим склерозом (Shtilbans et al., Amyotrophic Lateral Sclerosis, "Early Online, 2011, pp. 1-7); ревматоидным артритом (Nakamura et al., DNA Res. Vol. 13 (4), 2006, pp. 169-183) и анкилозирующим спондилитом (Danoy et al., PLoS Genetics, Vol. 6 (12), 2010, e1001195, pp. 1-5).
Соответственно, используя соединения и композиции, эффективные при модулировании активности LRRK2, можно проводить лечение нейродегенеративных заболеваний, таких как болезнь Паркинсона и деменция с тельцами Леви, расстройств ЦНС, таких как болезнь Альцгеймера и L-допаиндуцированная дискинезия, случаев рака, такого как рак почки, молочной железы, предстательной железы, крови, папиллярный рак и рак легкого, острый миелогенный лейкоз и множественная миелома, и воспалительных заболеваний, таких как лепра, болезнь Крона, боковой амиотрофический склероз, ревматоидный артрит и анкилозирующий спондилит. В частности, существует потребность в соединениях с аффинностью к LRRK2, которые селективны в отношении LRRK2, а не других киназ, таких как JAK2 (janus kinase - янус-киназа), и на основе которых могут быть разработаны эффективные лекарственные средства для лечения нейродегенеративных расстройств, таких как болезнь Паркинсона (Parkinson's disease; PD).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Согласно изобретению предложены соединения, выбранные из:
N2-(1',5-диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1',3-диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
4-(циклопропиламино)-2-((5-метил-1-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-4-ил)амино)пиримидин-5-карбонитрила;
4-(циклопропиламино)-2-((3-метил-1-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-4-ил)амино)пиримидин-5-карбонитрила;
2-((1-(1-цианопропил)-5-метил-1Н-пиразол-4-ил)амино)-4-(циклопропиламино)пиримидин-5-карбонитрила;
N2-(1-(1-фтор-2-метилпропан-2-ил)-3-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
2-((5-хлор-1-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-4-ил)амино)-4-(этиламино)пиримидин-5-карбонитрила;
5-бром-N2-(1,5-диметил-1Н-пиразол-4-ил)-N4-метилпиримидин-2,4-диамина;
2-метил-2-(3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)пропан-1-ола;
1-((5-хлор-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)метил)циклопропанола;
N2-(3-хлор-1-(2-(4-этил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(1-этил-1H-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(3-метилоксетан-3-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-(2-(1,4-диметил-1H-имидазол-2-ил)пропан-2-ил)-3-метил-1H-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(2-(5-метилоксазол-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(3-метилоксетан-3-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(1-((2-метоксиэтил)сульфонил)-3-метил-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-((2-метоксиэтил)сульфонил)-3-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-((2-метоксиэтил)сульфонил)-5-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(5-хлор-1-(2-(4-метил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(5-метил-1-(2-(1-метил-1H-пиразол-3-ил)пропил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(2-(пиримидин-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(5-метил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(2-(5-метил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(1-(2-(5-этил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-3-метил-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(1-(2-(1-изопропил-1Н-1,2,4-триазол-3-ил)пропан-2-ил)-3-метил-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(4-метил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(1-метил-1Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(5-метил-1-(2-(1-метил-1Н-пиразол-3-ил)этил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(2-(1-метил-1H-пиразол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(2-(1-метил-1H-пиразол-5-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(2-(1-метил-1Н-пиразол-3-ил)этил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-(3-фтортетрагидро-2Н-пиран-4-ил)-3-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-(3-фтортетрагидро-2Н-пиран-4-ил)-5-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-((3R)-3-фтортетрагидро-2Н-пиран-4-ил)-5-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
3-метил-3-(3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)бутаннитрила;
2-((3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)метил)бутаннитрила;
3-метил-3-(3-метил-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)-1Н-пиразол-1-ил)бутаннитрила;
2-(5-((4-(этиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1-метил-1Н-пиразол-3-ил)-2-метилпропаннитрила;
2-метил-2-(1-метил-5-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-3-ил)пропаннитрила;
2-((1-(2-цианопропан-2-ил)-3-метил-1Н-пиразол-4-ил)амино)-4-(циклопропиламино)пиримидин-5-карбонитрила;
2-((1-(2-цианопропан-2-ил)-3-метил-1Н-пиразол-4-ил)амино)-4-(этиламино)пиримидин-5-карбонитрила;
2-метил-2-(3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)бутаннитрила и
5-((4-(этиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1-метил-1Н-пиразол-3-карбонитрила,
или их фармацевтически приемлемая соль.
Согласно изобретению также предложены фармацевтические композиции, содержащие эти соединения, способы применения соединений и способы получения соединений.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Если не указано иное, следующие термины, использованные в этой заявке, в том числе в описании и формуле изобретения, имеют приведенные ниже определения. Необходимо отметить, что, как использовано в описании и прилагаемой формуле изобретения, формы единственного числа (по англ. выражаемые артиклями "a", "an" и "the") включают объекты в форме множественного числа, если контекст ясно не предусматривает иное.
"Алкил" означает одновалентный линейную или разветвленную насыщенную углеводородную группировку, состоящую исключительно из атомов углерода и водорода, имеющую от одного до двенадцати атомов углерода. "Низший алкил" относится к алкильной группе, содержащей от одного до шести атомов углерода, т.е. C1-6алкилу. Примеры алкильных групп включают, но не ограничиваются этим, метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил, н-гексил, октил, додецил и тому подобное.
"Алкенил" означает линейный одновалентный углеводородный радикал из двух-шести атомов углерода или разветвленный одновалентный углеводородный радикал из трех-шести атомов углерода, содержащий по меньшей мере одну двойную связь, например, этенил, пропенил и тому подобное.
"Алкинил" означает линейный одновалентный углеводородный радикал из двух-шести атомов углерода или разветвленный одновалентный углеводородный радикал из трех-шести атомов углерода, содержащий по меньшей мере одну тройную связь, например, этинил, пропинил и тому подобное.
"Алкилен" означает линейный насыщенный двухвалентный углеводородный радикал, содержащий от одного до шести атомов углерода, или разветвленный насыщенный двухвалентный углеводородный радикал из трех-шести атомов углерода, например, метилен, этилен, 2,2-диметилэтилен, пропилен, 2-метилпропилен, бутилен, пентилен и тому подобное.
Термины "алкокси" и "алкилокси", которые могут быть использованы взаимозаменяемо, означают группировку формулы -OR, где R представляет собой алкильную группировку, которая определена в данном описании. Примеры алкоксигруппировок включают, но не ограничиваются этим, метокси, этокси, изопропокси и тому подобное.
"Алкоксиалкил" означает группировку формулы Ra-O-Rb-, где Ra представляет собой алкил, a Rb представляет собой алкилен, как определено в данном описании. Типичные алкоксиалкильные группы включают, в качестве примера, 2-метоксиэтил, 3-метоксипропил, 1-метил-2-метоксиэтил, 1-(2-метоксиэтил)-3-метоксипропил и 1-(2-метоксиэтил)-3-метоксипропил.
"Алкоксиалкокси" означает группу формулы -O-R-R', где R представляет собой алкилен, a R' представляет собой алкокси, как определено в данном описании.
"Алкилкарбонил" означает группировку формулы -C(O)-R, где R представляет собой алкил, определенный в данном описании.
"Алкоксикарбонил" означает группу формулы -C(O)-R, где R представляет собой алкокси, определенный в данном описании.
"Алкилкарбонилалкил" означает группу формулы -R-C(O)-R', где R представляет собой алкилен, a R' представляет собой алкил, как определено в данном описании.
"Алкоксикарбонилалкил" означает группу формулы -R-C(O)-R', где R представляет собой алкилен, a R' представляет собой алкокси, как определено в данном описании.
"Алкоксикарбонилалкокси" означает группу формулы -O-R-C(O)-R', где R представляет собой алкилен, a R' представляет собой алкокси, как определено в данном описании.
"Гидроксикарбонилалкокси" означает группу формулы -O-R-C(O)-OH, где R представляет собой алкилен, определенный в данном описании.
"Алкиламинокарбонилалкокси" означает группу формулы -O-R-C(O)NHR', где R представляет собой алкилен, a R' представляет собой алкил, как определено в данном описании.
"Диалкиламинокарбонилалкокси" означает группу формулы -O-R-C(O)-NR'R'', где R представляет собой алкилен, a R' и R'' представляют собой алкил, как определено в данном описании.
"Алкиламиноалкокси" означает группу формулы -O-R-NHR', где R представляет собой алкилен, a R' представляет собой алкил, как определено в данном описании.
"Диалкиламиноалкокси" означает группу формулы -O-R-NR'R'', где R представляет собой алкилен, a R' и R'' представляют собой алкил, как определено в данном описании.
"Алкилсульфонил" означает группировку формулы -SO2-R, где R представляет собой алкил, определенный в данном описании.
"Алкилсульфонилалкил" означает группировку формулы -R'-SO2-R'', где R' представляет собой алкилен, a R'' представляет собой алкил, как определено в данном описании.
"Алкилсульфонилалкокси" означает группу формулы -O-R-SO2-R', где R представляет собой алкилен, a R' представляет собой алкил, как определено в данном описании.
"Амино" означает группировку формулы -NRR', где каждый R и R' независимо представляет собой водород или алкил, определенный в данном описании. Так, термин "амино" включает в себя "алкиламино" (один из R и R' представляет собой алкил, а другой представляет собой водород) и "диалкиламино" (где R и R' оба представляют собой алкил).
"Аминокарбонил" означает группу формулы -C(O)-R, где R представляет собой амино, определенный в данном описании.
"Алкоксиамино" означает группировку формулы -NR-OR', где R представляет собой водород или алкил, a R' представляет собой алкил, определенный в данном описании.
"Алкилсульфанил" означает группировку формулы -SR, где R представляет собой алкил, определенный в данном описании.
"Аминоалкил" означает группу -R-R', где R' представляет собой амино, a R представляет собой алкилен, как определено в данном описании. "Аминоалкил" включает аминометил, аминоэтил, 1-аминопропил, 2-аминопропил и тому подобное. Аминогруппировка "аминоалкила" может быть замещена один или два раза алкилом с получением "алкиламиноалкила" и "диалкиламиноалкила", соответственно. "Алкиламиноалкил" включает метиламинометил, метиламиноэтил, метиламинопропил, этиламиноэтил и тому подобное. "Диалкиламиноалкил" включает диметиламинометил, диметиламиноэтил, диметиламинопропил, N-метил-N-этиламиноэтил и тому подобное.
"Аминоалкокси" означает группу -OR-R', где R' представляет собой амино, a R представляет собой алкилен, как определено в данном описании.
"Алкилсульфониламидо" означает группировку формулы -NR'SO2-R, где R представляет собой алкил, a R' представляет собой водород или алкил.
"Аминокарбонилоксиалкил" или "карбамилалкил" означает группу формулы -R-O-C(O)-NR'R'', где R представляет собой алкилен, а каждый из R' и R'' независимо представляет собой водород или алкил, как определено в данном описании.
"Алкинилалкокси" означает группу формулы -O-R-R', где R представляет собой алкилен, a R' представляет собой алкинил, как определено в данном описании.
"Арил" означает одновалентную циклическую ароматическую углеводородную группировку, состоящую из моно-, би- или трициклического ароматического кольца. Арильная группа возможно может быть замещена так, как определено в данном описании. Примеры арильных группировок включают, но не ограничиваются этим, фенил, нафтил, фенантрил, флуоренил, инденил, пенталенил, азуленил, оксидифенил, бифенил, метилендифенил, аминодифенил, дифенилсульфидил, дифенилсульфонил, дифенилизопропилиденил, бензодиоксанил, бензофуранил, бензодиоксилил, бензопиранил, бензоксазинил, бензоксазинонил, бензопиперидинил, бензопиперазинил, бензопирролидинил, бензоморфолинил, метилендиоксифенил, этилендиоксифенил и тому подобное, в том числе их частично гидрированные производные, при этом каждый из них возможно замещен.
"Арилалкил" и "аралкил", которые могут быть использованы взаимозаменяемо, означают радикал -RaRb, где Ra представляет собой алкиленовую группу, a Rb представляет собой арильную группу, как определено в данном описании; например, примерами арилалкила являются фенилалкилы, такие как бензил, фенилэтил, 3-(3-хлорфенил)-2-метилпентил и тому подобное.
"Арилсульфонил" означает группу формулы -SO2-R, где R представляет собой арил, определенный в данном описании.
"Арилокси" означает группу формулы -O-R, где R представляет собой арил, определенный в данном описании.
"Аралкилокси" означает группу формулы -O-R-R', где R представляет собой алкилен, a R' представляет собой арил, как определено в данном описании.
"Карбокси" или "гидроксикарбонил", которые могут быть использованы взаимозаменяемо, означают группу формулы -С(O)-ОН.
"Цианоалкил" означает группировку формулы -R'-R'', где R' представляет собой алкилен, определенный в данном описании, a R'' представляет собой циано или нитрил.
"Циклоалкил" означает одновалентную насыщенную карбоциклическую группировку, состоящую из моно- или бициклических колец. Конкретный циклоалкил является незамещенным, или он замещен алкилом. Циклоалкил возможно может быть замещен одним или более заместителями, при этом каждый заместитель независимо представляет собой гидрокси, алкил, алкокси, атом галогена, галогеналкил, амино, моноалкиламино или диалкиламино, если конкретно не указано иное. Примеры циклоалкильных группировок включают, но не ограничиваются этим, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и тому подобное, в том числе их частично ненасыщенные (циклоалкенильные) производные.
"Циклоалкилалкил", означает группировку формулы -R'-R'', где R' представляет собой алкилен, a R'' представляет собой циклоалкил, определенный в данном описании.
"Циклоалкилалкокси" означает группу формулы -О-R-R', где R представляет собой алкилен, a R' представляет собой циклоалкил, как определено в данном описании.
"Гетероалкил" означает алкильный радикал, определенный в данном описании, где один, два или три атома водорода заменены на заместитель, независимо выбранный из группы, состоящей из -ORa, -NRbRc и -S(O)nRd (где n представляет собой целое число от 0 до 2), при этом понимается, что местом присоединения гетероалкильного радикала будет атом углерода, где Ra представляет собой атом водорода, ацил, алкил, циклоалкил или циклоалкилалкил; каждый из Rb и Rc независимо друг от друга представляет собой атом водорода, ацил, алкил, циклоалкил или циклоалкилалкил; и в том случае, когда n равно 0, Rd представляет собой атом водорода, алкил, циклоалкил или циклоалкилалкил, и когда n равно 1 или 2, Rd представляет собой алкил, циклоалкил, циклоалкилалкил, амино, ациламино, моноалкиламино или диалкиламино. Репрезентативные примеры включают, но не ограничиваются этим, 2-гидроксиэтил, 3-гидроксипропил, 2-гидрокси-1-гидроксиметилэтил, 2,3-дигидроксипропил, 1-гидроксиметилэтил, 3-гидроксибутил, 2,3-дигидроксибутил, 2-гидрокси-1-метилпропил, 2-аминоэтил, 3-аминопропил, 2-метилсульфонилэтил, аминосульфонилметил, аминосульфонилэтил, аминосульфонилпропил, метиламиносульфонилметил, метиламиносульфонилэтил, метиламиносульфонилпропил и тому подобное.
"Гетероарил" означает моноциклический или бициклический радикал из 5-12 атомов в кольце, имеющий по меньшей мере одно ароматическое кольцо, содержащее один, два или три гетероатома в кольце, выбранных из N, О или S, причем остальными атомами в кольце являются атомы C, при этом понимается, что местом присоединения гетероарильного радикала будет ароматическое кольцо. Гетероарильное кольцо возможно может быть замещено так, как определено в данном описании. Примеры гетероарильных группировок включают, но не ограничиваются этим, возможно замещенный имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, пиразинил, тиенил, бензотиенил, тиофенил, фуранил, пиранил, пиридинил, пирролил, пиразолил, пиримидил, хинолинил, изохинолинил, бензофурил, бензотиофенил, бензотиопиранил, бензимидазолил, бензооксазолил, бензооксадиазолил, бензотиазолил, бензотиадиазолил, бензопиранил, индолил, изоиндолил, триазолил, триазинил, хиноксалинил, пуринил, хиназолинил, хинолизинил, нафтиридинил, птеридинил, карбазолил, азепинил, диазепинил, акридинил и тому подобное, в том числе их частично гидрированные производные, при этом каждый из них возможно замещен.
"Гетероарилалкил" или "гетероаралкил" означает группу формулы -R-R', где R представляет собой алкилен, и R' представляет собой гетероарил, как определено в данном описании.
"Гетероарилсульфонил" означает группу формулы -SO2-R, где R представляет собой гетероарил, как определено в данном описании.
"Гетероарилокси" означает группу формулы -O-R, где R представляет собой гетероарил, как определено в данном описании.
"Гетероаралкилокси" означает группу формулы -O-R-R'', где R представляет собой алкилен, и R' представляет собой гетероарил, как определено в данном описании.
Термины "галоген", "атом галогена" и "галогенид", которые могут быть использованы взаимозаменяемо, относятся к заместителю - атому фтора, хлора, брома или йода.
"Галогеноалкил" означает алкил, определенный в данном описании, в котором один или более атомов водорода заменены на одинаковые или разные атомы галогена. Типичные галогеналкилы включают -CH2Cl, -CH2CF3, -CH2CCl3, перфторалкил (например, -CF3) и тому подобное.
"Галогеналкокси" означает группировку формулы -OR, где R представляет собой галогеналкильную группировку, как определено в данном описании. Типичным галогеналкокси является дифторметокси.
"Гетероциклоамино" означает насыщенное кольцо, где по меньшей мере один атом в кольце представляет собой N, NH или N-алкил, а остальны атомы в кольце образуют алкиленовую группу.
"Гетероциклил" означает одновалентную насыщенную группировку, состоящую из одного-трех колец, включающих в себя один, два или три либо четыре гетероатома (выбранных из атома азота, кислорода или серы). Гетероциклильное кольцо возможно может быть замещено так, как определено в данном описании. Примеры гетероциклильных группировок включают, но не ограничиваются этим, возможно замещенный пиперидинил, пиперазинил, гомопиперазинил, азепинил, пирролидинил, пиразолидинил, имидазолинил, имидазолидинил, пиридинил, пиридазинил, пиримидинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, хинуклидинил, хинолинил, изохинолинил, бензимидазолил, тиадиазолилидинил, бензотиазолидинил, бензоазолилидинил, дигидрофурил, тетрагидрофурил, дигидропиранил, тетрагидропиранил, тиаморфолинил, тиаморфолинилсульфоксид, тиаморфолинилсульфонил, дигидрохинолинил, дигидроизохинолинил, тетрагидрохинолинил, тетрагидроизохинолинил и тому подобное.
"Гетероциклилалкил" означает группировку формулы -R-R', где R представляет собой алкилен, a R' представляет собой гетероциклил, как определенно в данном описании.
"Гетероциклилокси" означает группировку формулы -OR, где R представляет собой гетероциклил, определенный в данном описании.
"Гетероциклилалкокси" означает группировку формулы -OR-R', где R представляет собой алкилен, a R' представляет собой гетероциклил, как определено в данном описании.
"Гидроксиалкокси" означает группировку формулы -OR, где R представляет собой гидроксиалкил, определенный в данном описании.
"Гидроксиалкиламино" означает группировку формулы -NR-R', где R представляет собой водород или алкил, a R' представляет собой гидроксиалкил, как определено в данном описании.
"Гидроксиалкиламиноалкил" означает группировку формулы -R-NR'-R'', где R представляет собой алкилен, R' представляет собой водород или алкил, a R'' представляет собой гидроксиалкил, как определено в данном описании.
"Гидроксикарбонилалкил" или "карбоксиалкил" означает группу формулы -R-(CO)-OH, где R представляет собой алкилен, определенный в данном описании.
"Гидроксикарбонилалкокси" означает группу формулы -O-R-C(O)OH, где R представляет собой алкилен, определенный в данном описании.
"Гидроксиалкилоксикарбонилалкил" или "гидроксиалкоксикарбонилалкил" означает группу формулы -R-C(O)-O-R-OH, где каждый R представляет собой алкилен, и они могут быть одинаковыми или разными.
"Гидроксиалкил" означает алкильную группировку, определенную в данном описании, замещенную одной или более, например, одной, двумя или тремя группами гидрокси, при условии, что один и тот же атом углерода не несет более одной гидроксигруппы. Репрезентативные примеры включают, но не ограничиваются этим, гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 1-(гидроксиметил)-2-метилпропил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил, 2,3-дигидроксипропил, 2-гидрокси-1-гидроксиметилэтил, 2,3-дигидроксибутил, 3,4-дигидроксибутил и 2-(гидроксиметил)-3-гидроксипропил.
"Гидроксициклоалкил" означает циклоалкильную группировку, определенную в данном описании, где один, два или три атома водорода в циклоалкильном радикале заменены на заместитель гидрокси. Репрезентативные примеры включают, но не ограничиваются этим, 2-, 3- или 4-гидроксициклогексил и тому подобное.
"Алкоксигидроксиалкил" и "гидроксиалкоксиалкил", которые могут быть использованы взаимозаменяемо, означает алкил, определенный в данном описании, который замещен по меньшей мере один раз группой гидрокси и по меньшей мере один раз группой алкокси. Таким образом, "алкоксигидроксиалкил" и "гидроксиалкоксиалкил" охватывают, например, 2-гидрокси-3-метокси-пропан-1-ил и тому подобное.
Группа "мочевины" или "уреидо" означает группу формулы -NR'-C(O)-NR''R''', где каждый из R', R'' и R''' независимо представляет собой водород или алкил.
"Карбамат" означает группу формулы -O-C(O)-NR'R'', где каждый из R' и R'' независимо представляет собой водород или алкил.
"Карбокси" означает группу формулы -O-С(O)-ОН.
"Сульфонамидо" означает группу формулы -SO2-NR'R'', где каждый из R' и R'' независимо представляет собой водород или алкил.
"Возможно замещенный", при использовании вместе с "арилом", "фенилом", "гетероарилом", "циклоалкилом" или "гетероциклилом", означает арил, фенил, гетероарил, циклоалкил или гетероциклил, который возможно независимо замещен одним-четырьмя заместителями, например одним или двумя заместителями, выбранными из алкила, циклоалкила, циклоалкилалкила, гетероалкила, гидроксиалкила, атома галогена, нитро, циано, гидрокси, алкокси, амино, ациламино, моно-алкиламино, ди-алкиламино, галогеналкила, галогеналкокси, гетероалкила, -COR, -SO2R (где R представляет собой водород, алкил, фенил или фенилалкил), -(CR'R'')n-COOR (где n представляет собой целое число от 0 до 5, R' и R'' независимо представляют собой водород или алкил, и R представляет собой водород, алкил, циклоалкил, циклоалкилалкил, фенил или фенилалкил) или -(CR'R'')n-CONRaRb (где n представляет собой целое число от 0 до 5, R' и R'' независимо представляют собой водород или алкил, и Ra и Rb независимо друг от друга представляют собой водород, алкил, циклоалкил, циклоалкилалкил, фенил или фенилалкил). Некоторые конкретные возможные заместители для "арила", "фенила", "гетероарила", "циклоалкила" или "гетероциклила" включают алкил, атом галогена, галогеналкил, алкокси, циано, амино и алкилсульфонил. В одном из воплощений заместителями являются метил, атом фтора, хлора, трифторметил, метокси, амино и метансульфонил.
"Уходящая группа" означает группу, имеющую значение, традиционно ассоциируемое с ней в синтетической органической химии, т.е. атом или группу, замещаемые в условиях реакции замещения. Примеры уходящих групп включают, но не ограничиваются этим, атом галогена, алкан- или ариленсульфонилокси, такой как метансульфонилокси, этансульфонилокси, тиометил, бензолсульфонилокси, тозилокси и тиенилокси, дигалогенфосфиноилокси, возможно замещенный бензилокси, изопропилокси, ацилокси и тому подобное.
"Модулятор" означает молекулу, которая взаимодействует с мишенью. Во взаимодействия включены, но не ограничиваются этим, агонист, антагонист и тому подобное, определенные в данном описании.
Термин "возможный" или "возможно" означает, что описываемое впоследствии событие или обстоятельство может иметь место, но происходит не обязательно, и что данное описание включает случаи, когда это событие или обстоятельство происходит, и случаи, в которых это не так.
"Заболевание" и "болезненное состояние" означает любое заболевание, состояние, симптом, расстройство или показание.
"Инертный органический растворитель" или "инертный растворитель" означает растворитель, являющийся инертным в условиях реакции, описываемой в связи с ним, включая например, бензол, толуол, ацетонитрил, тетрагидрофуран, N,N-диметилформамид, хлороформ, метиленхлорид или дихлорметан, дихлорэтан, диэтиловый эфир, этилацетат, ацетон, метилэтилкетон, метанол, этанол, пропанол, изопропанол, трет-бутанол, диоксан, пиридин и тому подобное. Если не указано иное, растворители, использованные в реакциях по настоящему изобретению, представляют собой инертные растворители.
"Фармацевтически приемлемый" означает то, что полезно при изготовлении фармацевтической композиции, то есть, как правило, является безопасным, нетоксичным и не является нежелательным ни в биологическом, ни в каком-либо ином отношении, и включает в себя то, что приемлемо для использования в производстве фармацевтических продуктов для ветеринарии, а также для людей.
Термин "фармацевтически приемлемые соли" соединения означает соли, которые являются фармацевтически приемлемыми, как определено в данном описании, и которые обладают желаемой фармакологической активностью исходного соединения.
Следует понимать, что все ссылки на фармацевтически приемлемые соли в случае одной и той же соли присоединения кислоты включают формы присоединения растворителя (сольваты) или кристаллические формы (полиморфы), которые определены в данном описании.
"Защищающая группа" или "защитная группа" означает группу, которая избирательно блокирует один из реакционно-способных центров в многофункциональном соединении, в связи с чем химическая реакция может избирательно протекать по другому незащищенному реакционно-способному центру, то есть группу, имеющую традиционно связываемое с ней значение в синтетической органической химии. Некоторые способы по данному изобретению основаны на том, что в реагентах имеются защищающие группы для блокирования реакционно-способных атомов азота и/или кислорода. Например, термины "амино-защитная группа" и "азот-защитная группа" используются в данном описании взаимозаменяемо и относятся к тем органическим группам, которые предназначены для защиты атома азота от нежелательных реакций во время процедур синтеза. Типичные азот-защитные группы включают, но не ограничиваются этим, трифторацетил, ацетамидо, бензил (Bn), бензилоксикарбонил (карбобензилокси, CBZ), п-метоксибензилоксикарбонил, п-нитробензилокси-карбонил, трет-бутоксикарбонил (ВОС) и тому подобное. Специалисту в данной области техники будет известно, как выбрать группу, удаление которой осуществляется легко и которая обладает способностью быть устойчивой в последующих реакциях.
Термин "сольваты" означает формы присоединения растворителя, которые содержат или стехиометрические, или нестехиометрические количества растворителя. Некоторые соединения в кристаллическом твердом состоянии имеют тенденцию захватывать молекулы растворителя в фиксированном молярном соотношении с образованием таким образом сольвата. Если растворителем является вода, то образованный сольват представляет собой гидрат, в том случае, когда растворителем является спирт, образованный сольват представляет собой алкоголят. Гидраты образуются путем объединения одной или более молекул воды с одним из веществ, в комбинации с которым вода сохраняет свое молекулярное состояние в виде Н2O, при этом в результате такого объединения может образовываться один или более чем один гидрат.
"Болезнь Паркинсона" означает дегенеративное расстройство центральной нервной системы, при котором ухудшаются двигательные навыки, речевая и/или когнитивная функция. Симптомы болезни Паркинсона могут включать, например, мышечную ригидность, тремор, замедление физических движений (брадикинезию) и отсутствие физических движений (акинезию).
"Болезнь с тельцами Леви (Lewie или Lewy)", также называемая "деменцией с тельцами Леви", "болезнью диффузных телец Леви", "кортикальной деменцией с тельцами Леви", означает нейродегенеративное расстройство, морфологически характеризующееся присутствием телец Леви в головном мозге.
"Субъект" относится к млекопитающим и не млекопитающим. Термин "млекопитающие" означает любого представителя класса млекопитающих, включая, но не ограничиваясь этим, людей; не являющихся людьми приматов, таких как шимпанзе и другие обезьяны и виды макак; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы и свиньи; домашних животных, таких как кролики, собаки и кошки; лабораторных животных, в том числе грызунов, таких как крысы, мыши и морские свинки; и им подобных. Примеры немлекопитающих включают, но не ограничиваются этим, птиц и им подобных. Термин "субъект" не указывает на конкретный возраст или пол.
"Терапевтически эффективное количество" означает количество соединения, которое при введении субъекту для лечения болезненного состояния, является достаточным для осуществления такого лечения в отношении данного болезненного состояния. "Терапевтически эффективное количество" будет варьировать в зависимости от соединения, подвергаемого лечению болезненного состояния, тяжести или подвергаемого лечению заболевания, возраста и относительного состояния здоровья субъекта, пути и формы введения, проницательности лечащего врача или ветеринара и других факторов.
Термины "те, которые описаны выше" и "те, которые определены в данном описании", когда они имеют отношение к переменной величине, включают посредством ссылки широкое определение для данной переменной, а также конкретные определения, если таковые имеются.
Термин "подвергание лечению" или "лечение" болезненного состояния включает в себя, помимо прочего, подавление болезненного состояния, т.е. приостановку развития болезненного состояния или его клинических симптомов, и/или облегчение болезненного состояния, т.е. вызывание временной или постоянной ремиссии болезненного состояния или его клинических симптомов.
Термины "обработка", "приведение в контакт" и "подвергание взаимодействию", когда они имеют отношение к химической реакции, означают добавление или смешивание двух или более реагентов в соответствующих условиях с получением указанного и/или желаемого продукта. Должно быть очевидно, что реакция, после выполнения которой получается указанный и/или желаемый продукт, не обязательно должна быть результатом непосредственного объединения двух реагентов, которые были добавлены первоначально, т.е. могут присутствовать одно или более промежуточных соединений, которые образуются в данной смеси, что в конечном итоге приводит к образованию указанного и/или желаемого продукта.
Номенклатура и структуры
В общем случае, использованная в этой заявке номенклатура основывается на компьютеризированной системе института Бейльштейна AUTONOMтм, v. 4.0, для создания систематической номенклатуры IUPAC (International Union of Pure and Applied Chemistry - Международный союз по теоретической и прикладной химии). Химические структуры, показанные в данном описании, получали с использованием ISIS®, версии 2.2. Любая свободная валентность, показанная на атоме углерода, кислорода, серы или азота, в приведенных в данном описании структурах указывает на присутствие атома водорода, если не указано иное. Если азотсодержащее гетероарильное кольцо показано со свободной валентностью на атоме азота, и на этом гетероарильном кольце отмечены переменные, как например, Ra, Rb или Rc, то такие переменные могут быть связаны с азотом, имеющим свободную валентность, или присоединены к нему. Если в структуре существуют один или более хиральных центров, но для этих хиральных центров никакой конкретной стереохимии не показано, то данной структурой охватываются оба энантиомера, ассоциированные с каждым таким хиральным центром. Если структура, показанная в данном описании, может существовать во множественных таутомерных формах, то все такие таутомеры охватываются данной структурой. Подразумевается, что атомы, представленные в данном описании в таких структурах, охватывают все природные изотопы таких атомов. Так, например, подразумевается, что атомы водорода, представленные в данном описании, включают дейтерий и тритий, и подразумевается, что атомы углерода включают изотопы С13 и С14.
Все патенты и публикации, идентифицированные в данном описании, включены в данное описание посредством ссылки во всей своей полноте.
Соединения по изобретению
Одно из воплощений изобретения относится к соединению формулы I:
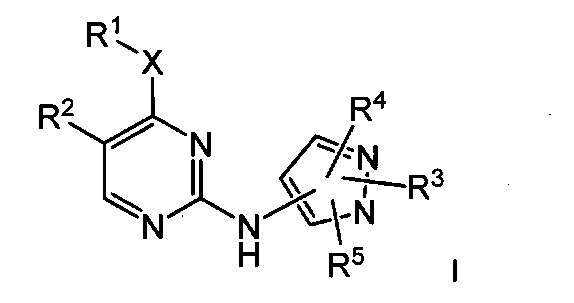
или его фармацевтически приемлемой соли,
где:
X представляет собой -NH;
R1 представляет собой С1-6алкил или С3-6циклоалкил;
R2 представляет собой атом галогена; циано или галоген-С1-6алкил;
R3 представляет собой водород; С1-6алкил; галоген-С1-6алкил; гидрокси-С1-6алкил; циано-С1-6алкил; С1-6алкоксисульфонил; С3-6циклоалкил, возможно замещенный один или более раз группой R6; С3-6циклоалкил-С1-6алкил, где С3-6циклоалкильная часть возможно замещена один или более раз группой R6; гетероциклил, возможно замещенный один или более раз группой R7; гетероциклил-С1-6алкил, где гетероциклильная часть возможно замещена один или более раз группой R7; гетероарил, возможно замещенный один или более раз группой R8; или гетероарил-С1-6алкил, где гетероарильная часть возможно замещена один или более раз группой R8;
R4 представляет собой водород; С1-6алкил или атом галогена;
R5 представляет собой водород или С1-6алкил;
каждый R6 независимо представляет собой С1-6алкил или гидрокси;
каждый R7 независимо представляет собой С1-6алкил или атом галогена; и
каждый R8 независимо представляет собой С1-6алкил или галоген-С1-6алкил;
при этом соединение выбрано из
N2-(1',5-диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)-пиримидин-2,4-диамина;
N2-(1',3-диметил-1'Н-1,4,-бипиразол-4-ил)-N4-метил-5-(трифторметил)-пиримидин-2,4-диамина;
4-(циклопропиламино)-2-((5-метил-1-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-4-ил)амино)пиримидин-5-карбонитрила;
4-(циклопропиламино)-2-((3-метил-1-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-4-ил)амино)пиримидин-5-карбонитрила;
2-((1-(1-цианопропил)-5-метил-1Н-пиразол-4-ил)амино)-4-(циклопропиламино)пиримидин-5-карбонитрила;
N2-(1-(1-фтор-2-метилпропан-2-ил)-3-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
2-((5-хлор-1-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-4-ил)амино)-4-(этиламино)пиримидин-5-карбонитрила;
5-бром-N2-(1,5-диметил-1Н-пиразол-4-ил)-N4-метилпиримидин-2,4-диамина;
2-метил-2-(3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)пропан-1-ола;
1-((5-хлор-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)метил)циклопропанола;
N2-(3-хлор-1-(2-(4-этил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(1-этил-1H-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(3-метилоксетан-3-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-(2-(1,4-диметил-1H-имидазол-2-ил)пропан-2-ил)-3-метил-1H-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(2-(5-метилоксазол-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(3-метилоксетан-3-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(1-((2-метоксиэтил)сульфонил)-3-метил-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-((2-метоксиэтил)сульфонил)-3-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-((2-метоксиэтил)сульфонил)-5-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(5-хлор-1-(2-(4-метил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(5-метил-1-(2-(1-метил-1H-пиразол-3-ил)пропил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(2-(пиримидин-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(5-метил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(2-(5-метил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(1-(2-(5-этил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-3-метил-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(1-(2-(1-изопропил-1Н-1,2,4-триазол-3-ил)пропан-2-ил)-3-метил-1H-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(4-метил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(1-метил-1H-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(5-метил-1-(2-(1-метил-1Н-пиразол-3-ил)этил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(2-(1-метил-1H-пиразол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(2-(1-метил-1Н-пиразол-5-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(2-(1-метил-1Н-пиразол-3-ил)этил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-(3-фтортетрагидро-2Н-пиран-4-ил)-3-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-(3-фтортетрагидро-2Н-пиран-4-ил)-5-метил-1H-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-((3R)-3-фтортетрагидро-2Н-пиран-4-ил)-5-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
3-метил-3-(3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)бутаннитрила;
2-((3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)метил)бутаннитрила;
3-метил-3-(3-метил-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)-1Н-пиразол-1-ил)бутаннитрила;
2-(5-((4-(этиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1-метил-1Н-пиразол-3-ил)-2-метилпропаннитрила;
2-метил-2-(1-метил-5-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-3-ил)пропаннитрила;
2-((1-(2-цианопропан-2-ил)-3-метил-1Н-пиразол-4-ил)амино)-4-(циклопропиламино)пиримидин-5-карбонитрила;
2-((1-(2-цианопропан-2-ил)-3-метил-1Н-пиразол-4-ил)амино)-4-(этиламино)пиримидин-5-карбонитрила;
2-метил-2-(3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)бутаннитрила и
5-((4-(этиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1-метил-1Н-пиразол-3-карбонитрила.
В одном из аспектов изобретения предложено соединение, выбранное из:
N2-(1',5-диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)-пиримидин-2,4-диамина;
N2-(1',3-диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)-пиримидин-2,4-диамина;
4-(циклопропиламино)-2-((5-метил-1-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-4-ил)амино)пиримидин-5-карбонитрила;
4-(циклопропиламино)-2-((3-метил-1-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-4-ил)амино)пиримидин-5-карбонитрила;
2-((1-(1-цианопропил)-5-метил-1Н-пиразол-4-ил)амино)-4-(циклопропиламино)пиримидин-5-карбонитрила;
N2-(1-(1-фтор-2-метилпропан-2-ил)-3-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
2-((5-хлор-1-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-4-ил)амино)-4-(этиламино)пиримидин-6-карбонитрила;
5-бром-N2-(1,5-диметил-1H-пиразол-4-ил)-N4-метилпиримидин-2,4-диамина;
2-метил-2-(3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)пропан-1-ола;
1-((5-хлор-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)метил)циклопропанола;
N2-(3-хлор-1-(2-(4-этил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(1-этил-1H-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(3-метилоксетан-3-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-(2-(1,4-диметил-1H-имидазол-2-ил)пропан-2-ил)-3-метил-1H-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N4-мeтил-N2-(3-мeтил-1-(2-(5-мeтилoкcaзoл-2-ил)пpoпaн-2-ил)-1H-пиpaзoл-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(3-метилоксетан-3-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(1-((2-метоксиэтил)сульфонил)-3-метил-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-((2-метоксиэтил)сульфонил)-3-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-((2-метоксиэтил)сульфонил)-5-метил-1H-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(5-хлор-1-(2-(4-метил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(5-метил-1-(2-(1-метил-1H-пиразол-3-ил)пропил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(2-(пиримидин-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(5-метил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(2-(5-метил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(1-(2-(5-этил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-3-метил-1H-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(1-(2-(1-изопропил-1Н-1,2,4-триазол-3-ил)пропан-2-ил)-3-метил-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(4-метил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(1-метил-1H-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(5-метил-1-(2-(1-метил-1H-пиразол-3-ил)этил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(2-(1-метил-1H-пиразол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(2-(1-метил-1H-пиразол-5-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(2-(1-метил-1H-пиразол-3-ил)этил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-(3-фтортетрагидро-2Н-пиран-4-ил)-3-метил-1H-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-(3-фтортетрагидро-2Н-пиран-4-ил)-5-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-((3R)-3-фтортетрагидро-2Н-пиран-4-ил)-5-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
3-метил-3-(3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)бутаннитрила;
2-((3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)метил)бутаннитрила;
3-метил-3-(3-метил-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)-1Н-пиразол-1-ил)бутаннитрила;
2-(5-((4-(этиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1-метил-1H-пиразол-3-ил)-2-метилпропаннитрила;
2-метил-2-(1-метил-5-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-3-ил)пропаннитрила;
2-((1-(2-цианопропан-2-ил)-3-метил-1Н-пиразол-4-ил)амино)-4-(циклопропиламино)пиримидин-5-карбонитрила;
2-((1-(2-цианопропан-2-ил)-3-метил-1Н-пиразол-4-ил)амино)-4-(этиламино)пиримидин-5-карбонитрила;
2-метил-2-(3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)бутаннитрила и
5-((4-(этиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1-метил-1Н-пиразол-3-карбонитрила,
или их фармацевтически приемлемой соли.
Согласно изобретению также предложен способ лечения заболевания или состояния, опосредованного или иным образом ассоциированного с рецептором LRRK2, включающий введение субъекту, нуждающемуся в этом, эффективного количества соединения по изобретению.
Заболевание может представлять собой нейродегенеративное заболевание, такое как болезнь Паркинсона, болезнь Гентингтона или деменция с тельцами Леви.
Заболевание может представлять собой расстройство ЦНС, такое как болезнь Альцгеймера или L-допа-индуцированная дискинезия.
Заболевание может представлять собой рак или пролиферативное расстройство, такое как рак почки, молочной железы, предстательной железы, крови, папиллярный рак или рак легкого, острый миелогенный лейкоз или множественная миелома.
Заболевание может представлять собой воспалительное заболевание, такое как лепра, болезнь Крона, боковой амиотрофический склероз, ревматоидный артрит или анкилозирующий спондилит.
Согласно изобретению также предложен способ улучшения когнитивной памяти, включающий введение субъекту, нуждающемуся в этом, эффективного количества соединения по изобретению.
Согласно изобретению также предложено соединение, описанное в данной заявке, для применения в качестве терапевтически активного вещества.
Согласно изобретению также предложено соединение, описанное в данной заявке, для применения в качестве терапевтически активного вещества для терапевтического и/или профилактического лечения болезни Паркинсона.
Согласно изобретению также предложено применение соединения, описанного в данной заявке, при терапевтическом и/или профилактическом лечении болезни Паркинсона.
Репрезентативные соединения, соответствующие способам по изобретению, показаны в экспериментальных примерах ниже.
Синтез
Соединения по настоящему изобретению могут быть получены разными способами, представленными на иллюстративных схемах реакций синтеза, показанных и описанных ниже.
Исходные вещества и реагенты, используемые при получении этих соединений, обычно либо приобретают у коммерческих поставщиков, таких как Aldrich Chemical Co., либо получают способами, известными специалистам в данной области техники, следуя методикам, изложенным в таких ссылках, как Fieser L.F. and Fieser М. Reagents for Organic Synthesis; Wiley & Sons: New York, 1991, Volumes 1-15; Rodd (ed.) Chemistry of Carbon Compounds, Elsevier Science Publishers, 1989, Volumes 1-5 and Supplemental; и Organic Reactions, Wiley & Sons: New York, 1991, Volumes 1-40. Приведенные далее схемы реакций синтеза являются лишь иллюстрацией некоторых способов, согласно которым могут быть синтезированы соединения по изобретению, и могут быть выполнены различные модификации этих схем реакций синтеза, и они будут предложены специалисту в данной области со ссылкой на описание, содержащееся в этой заявке.
Исходные вещества и промежуточные соединения, приведенные на схемах реакций синтеза, при желании могут быть выделены и очищены с использованием традиционных методов, включая, но не ограничиваясь этим, фильтрацию, дистилляцию, кристаллизацию, хроматографию и им подобные. Такие вещества могут быть охарактеризованы с использованием традиционных средств, включая данные о физических константах и спектральные данные.
Если не указано иное, реакции, изложенные в данном описании, можно проводить в атмосфере инертного газа при атмосферном давлении в диапазоне температур реакции от примерно -78°C до примерно 150°C, например, от примерно 0°C до примерно 125°C или в целях удобства при температуре приблизительно комнатной (или температуре окружающей среды), например, при приблизительно 20°C.
Приведенная ниже схема А иллюстрирует одну из методик синтеза, используемых для получения конкретных соединений формулы I, где X, R1, R2, R3, R4 и R5 являются такими, как определено в данном описании.

На стадии 1 схемы А дихлорпиримидиновое соединение а приводят во взаимодействие с реагентом b, получая пиримидиновое соединение с. Реакция на стадии 1 может протекать в условиях полярного растворителя. В тех воплощениях изобретения, где X представляет собой -O- (реагент b представляет собой спирт), реакция на стадии 1 может быть осуществлена в присутствии основания.
После стадии 1 осуществляют одну из стадий 2а, 2b и 2с. На стадии 2а пиримидиновое соединение с подвергают взаимодействию с 4-аминопиразоловым соединением d1, получая аминопиримидиновое соединение формулы III. На стадии 2b пиримидиновое соединение с приводят во взаимодействие с 5-аминопиразоловым соединением d2, получая аминопиримидиновое соединение формулы IV. На стадии 2с пиримидиновое соединение с обрабатывают 3-аминопиразоловым соединением d3, получая аминопиримидиновое соединение по изобретению. Реакция на стадиях 2а-2с может протекать в полярном протонном растворителе и в присутствии кислоты, такой как HCl
Возможно существование многих вариантов методики со схемы А, и они будут предложены специалистам в данной области техники. Конкретные детали получения соединений по изобретению описаны в приведенных ниже примерах.
Введение и Фармацевтическая композиция
Изобретение включает фармацевтические композиции, содержащие по меньшей мере одно соединение по настоящему изобретению или один индивидуальный изомер, одну рацемическую или нерацемическую смесь изомеров или их фармацевтически приемлемые соль или сольват вместе по меньшей мере с одним фармацевтически приемлемым носителем и возможно другими терапевтическими и/или профилактическими ингредиентами.
В общем случае соединения по изобретению будут введены в терапевтически эффективном количестве любым из способов введения, приемлемых для средств, используемых при аналогичных состояниях. Подходящие диапазоны дозировок обычно составляют 1-500 мг один раз в сутки, например 1-100 мг один раз в сутки и в некоторых воплощениях 1-30 мг один раз в сутки в зависимости от многочисленных факторов, таких как тяжесть подлежащего лечению заболевания, возраст и относительное состояние здоровья субъекта, эффективность используемого соединения, путь и форма введения, показание, в отношении которого направлено такое введение, а также предпочтения и опыт лечащего врача. Средний специалист в области лечения таких заболеваний будет способен, без излишнего экспериментирования и руководствуясь персональными знаниями и описанием этой заявки, определить терапевтически эффективное количество соединений по настоящему изобретению, необходимое для данного заболевания.
Соединения по изобретению могут быть введены в виде фармацевтических композиций, включая композиции, подходящие для перорального (в том числе трансбуккального и сублингвального), ректального, назального, местного, легочного, вагинального или парентерального (в том числе внутримышечного, интраартериального, интратекального, подкожного и внутривенного) введения, или в форме, подходящей для введения посредством ингаляции или инсуффляции. Конкретным способом введения обычно является пероральный с использованием удобного режима введения один раз в сутки, который может быть откорректирован в соответствии с тяжестью заболевания.
Соединение или соединения по изобретению вместе с одним или более чем одним традиционным адъювантом, носителем или разбавителем могут быть представлены в форме фармацевтических композиций и стандартных лекарственных форм. Фармацевтические композиции и стандартные лекарственные формы могут содержать традиционные ингредиенты в обычных пропорциях с добавлением или без добавления дополнительных активных соединений или действующих начал, и стандартные лекарственные формы могут содержать любое подходящее эффективное количество активного ингредиента в соответствии с предполагаемым диапазоном суточных дозировок, который будет применен. Фармацевтические композиции могут быть использованы в виде твердых веществ, таких как таблетки или заполненные капсулы, полутвердых веществ, порошков, композиций с длительным высвобождением или жидкостей, таких как растворы, суспензии, эмульсии, эликсиры или заполненные капсулы для перорального применения; или в форме суппозиториев для ректального или вагинального введения; или в форме стерильных инъекционных растворов для парентерального применения. Соответственно, композиции, содержащие примерно один (1) миллиграмм активного ингредиента или, в более широком диапазоне, от примерно 0,01 до примерно ста (100) миллиграммов на одну таблетку, представляют собой подходящие репрезентативные стандартные лекарственные формы.
На основе соединений по настоящему изобретению могут быть изготовлены разнообразные лекарственные формы для перорального введения. Фармацевтические композиции и лекарственные формы в качестве активного компонента могут содержать соединение или соединения по настоящему изобретению или их фармацевтически приемлемые соли. Фармацевтически приемлемые носители могут быть или в твердой, или в жидкой форме. Препараты в твердой форме включают порошки, таблетки, пилюли, капсулы, облатки, суппозитории и диспергируемые гранулы. Твердым носителем может быть одно или более веществ, которые также могут действовать в качестве разбавителей, корригентов, солюбилизаторов, смазывающих веществ, суспендирующих агентов, связующих веществ, консервантов, разрыхлителей для таблеток или инкапсулирующего материала. Носитель в порошках обычно является тонкоизмельченным твердым веществом, которое представляет собой смесь вместе с тонкоизмельченным активным компонентом. Активный компонент в таблетках обычно смешан в подходящих пропорциях с носителем, обладающим необходимой связывающей способностью, и скомпактизован до желаемых формы и размера. Порошки и таблетки могут содержать от примерно одного (1) до примерно семидесяти (70) процентов активного соединения. Подходящие носители включают, но не ограничиваются этим, карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, легкоплавкий воск, масло какао и тому подобное. Подразумевается, что термин "препарат" включает в себя композицию активного соединения с инкапсулирующим материалом в качестве носителя, обеспечивающим получение капсулы, в которой активный компонент с носителями или без них окружен носителем, который оказывается ассоциированным с ним. Аналогичным образом включены облатки и пастилки для рассасывания. Таблетки, порошки, капсулы, пилюли, облатки и пастилки для рассасывания могут быть в виде твердых форм, подходящих для перорального введения.
Другие формы, подходящие для перорального введения, включают препараты в жидкой форме, в том числе эмульсии, сиропы, эликсиры, водные растворы, водные суспензии или препараты в твердой форме, предназначенные для преобразования их в препараты в жидкой форме незадолго до применения. Эмульсии могут быть приготовлены в растворах, например, в водно-пропиленгликолиевых растворах, или могут содержать такие эмульгирующие агенты, как лецитин, моноолеат сорбитана или аравийская камедь. Водные растворы могут быть приготовлены путем растворения активного компонента в воде и добавления подходящих красителей, корригентов, стабилизаторов и загустителей. Водные суспензии могут быть приготовлены путем диспергирования тонкоизмельченного активного компонента в воде с вязким веществом, таким как природные или синтетические камеди, смолы, метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и другие хорошо известные суспендирующие агенты. Препараты в жидкой форме включают растворы, суспензии и эмульсии и могут содержать помимо активного компонента красители, корригенты, стабилизаторы, буферы, искусственные и природные подсластители, диспергирующие вещества, загустители, солюбилизирующие агенты и тому подобное.
На основе соединений по настоящему изобретению могут быть изготовлены композиции для парентерального введения (например, путем инъекции, например болюс-инъекции или непрерывной инфузии), которые могут быть представлены в стандартной лекарственной форме в ампулах, предварительно заполненных шприцах, капельницах небольшого объема или в контейнерах для многократного введения с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных разбавителях, например, растворы в водном полиэтиленгликоле. Примеры масляных или неводных носителей, разбавителей, растворителей или наполнителей включают пропиленгликоль, полиэтиленгликоль, растительные масла (например, оливковое масло) и инъекционные органические сложные эфиры (например, этилолеат) и могут содержать такие входящие в состав композиции агенты, как консерванты, увлажняющие, эмульгирующие или суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в порошковой форме, полученной в результате выделения стерильного твердого вещества в асептических условиях или в результате лиофилизации из раствора, для повторного разведения подходящим разбавителем, например стерильной апирогенной водой, перед применением.
На основе соединений по настоящему изобретению могут быть изготовлены композиции для местного введения в эпидермис в виде мазей, кремов или лосьонов или в виде трансдермального пластыря. Мази и кремы могут быть изготовлены, например, с использованием водной или масляной основы с добавлением подходящих загущающих и/или желатинизирующих агентов. Лосьоны могут быть изготовлены с использованием водной или масляной основы и в общем случае также будут содержать один или более эмульгирующих агентов, стабилизирующих агентов, диспергирующих агентов, суспендирующих агентов, загустителей или красителей. Композиции, подходящие для местного введения в ротовую полость, включают пастилки для рассасывания, содержащие активные агенты в корригентной основе, обычно сахарозе и аравийской или трагакантовой камеди; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь; и жидкости для полоскания рта, содержащие активный ингредиент в подходящем жидком носителе.
На основе соединений по настоящему изобретению могут быть изготовлены композиции для введения в виде суппозиториев. Сначала расплавляют легкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, и в нем гомогенно диспергируют активный компонент, например, путем перемешивания. Расплавленную гомогенную смесь затем выливают в формы удобного размера, оставляют охладиться и отвердеть.
На основе соединений по настоящему изобретению могут быть изготовлены композиции для вагинального введения. Пессарии, тампоны, кремы, гели, пасты, пенки или спреи содержат помимо активного ингредиента такие носители, которые известны в данной области как приемлемые.
На основе соединений, являющихся предметом изобретения, могут быть изготовлены композиции для назального введения. Растворы или суспензии вводят непосредственно в носовую полость традиционными способами, например, с использованием капельницы, пипетки или спрея. Композиции могут быть представлены в лекарственной форме для однократного или многократного приема. В последнем случае с использованием капельницы или пипетки этого можно достичь путем введения пациентом соответствующего, предварительно заданного объема раствора или суспензии. В случае спрея этого можно достичь, например, посредством дозирующего мелкодисперсно распыляющего насоса.
На основе соединений по настоящему изобретению могут быть изготовлены композиции для аэрозольного способа введения, в частности в респираторный тракт, и в том числе для интраназального введения. Как правило, частицы, содержащие данное соединение будут иметь размер, соответствующий мелким частицам, например порядка пяти (5) микрон или меньше. Такого размера частиц можно добиться средствами, известными в данной области техники, например путем микронизации. Активный ингредиент представлен в находящейся под давлением упаковке вместе с подходящим пропеллентом, таким как хлорфторуглерод (CFC), например, дихлордифторметан, трихлорфторметан или дихлортетрафторэтан, либо двуокись углерода или другой подходящий газ. Удобно, если аэрозоль также может содержать поверхностно-активное вещество, такое как лецитин. Дозу лекарственного средства можно контролировать посредством дозирующего клапана. Альтернативно, активные ингредиенты могут быть представлены в форме сухого порошка, например порошковой смеси соединения в подходящей порошковой основе, такой как лактоза, крахмал, производные крахмала, например, в гидроксипропилметилцеллюлозе и поливинилпирролидоне (PVP). Порошковый носитель будет образовывать гель в носовой полости. Порошковая композиция может быть представлена в стандартной лекарственной форме, например в капсулах или картриджах из, например желатина, или блистерных упаковках, из которых находящийся там порошок можно вводить посредством ингалятора.
При желании композиции могут быть изготовлены с энтеросолюбильными покрытиями, адаптированными для введения активного ингредиента посредством длительного или регулируемого высвобождения. Например, на основе соединений по настоящему изобретению могут быть изготовлены устройства для трансдермальной или подкожной доставки лекарственных средств. Такие системы доставки имеют преимущество тогда, когда необходимо длительное высвобождение соединения и когда соблюдение больным режима и схемы лечения является принципиальным. Соединения в трансдермальных системах доставки часто нанесены на приклеиваемую к коже твердую подложку. Представляющее интерес соединение также может быть в комбинации с усилителем проницаемости, например, азоном (1-додецилазациклогептан-2-оном). Системы доставки с длительным высвобождением вводят подкожно в субдермальный слой путем хирургической манипуляции или инъекции. В подкожных имплантатах соединение заключено в липидорастворимую оболочку, например, из силиконового каучука или биоразлагаемого полимера, например, полимолочной кислоты.
Фармацевтические препараты предпочтительно находятся в стандартных лекарственных формах. Препарат в такой форме подразделен на стандартные дозы, содержащие соответствующие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, при этом такая упаковка содержит дискретные количества препарата, как например упакованные таблетки, капсулы и порошки во флаконах или ампулах. Кроме того, стандартная лекарственная форма может представлять собой только одну капсулу, таблетку, облатку или пастилку, или это может быть соответствующее количество любой из них в упакованной форме.
Другие подходящие фармацевтические носители и их составы описаны в Remington: The Science and Practice of Pharmacy, 1995, под редакцией E.W. Martin, Mack Publishing Company, 19-е издание, Easton, Pennsylvania. Репрезентативные фармацевтические композиции, содержащие соединение по настоящему изобретению, описаны ниже.
Полезность
Соединения по изобретению полезны для лечения LRRK2-опосредованных заболеваний или состояний, включая нейродегенеративные заболевания, такие как болезнь Паркинсона, деменция с тельцами Леви и болезнь Гентингтона, и для улучшения когнитивной памяти обычно у субъектов, нуждающихся в этом.
Примеры
Далее приведены подготовительные примеры и примеры, дающие возможность специалистам в данной области более четко понимать и применять на практике настоящее изобретение. Их не следует рассматривать как ограничивающие объем данного изобретения, а только как иллюстрирующие и характеризующие его.
Если не указано иное, все температуры, включая точки плавления (т.е. т.пл.), приведены в градусах по Цельсию (°C). Должно быть очевидно, что реакция, после выполнения которой получается указанный и/или желаемый продукт, не обязательно должна быть результатом непосредственного объединения двух реагентов, которые были добавлены первоначально, т.е. могут присутствовать одно или более промежуточных соединений, которые образуются в данной смеси, что в конечном итоге приводит к образованию указанного и/или желаемого продукта. В разделах "Подготовительные примеры" и "Примеры" могут быть использованы следующие сокращения.
Сокращения
АсОН уксусная кислота,
AIBN 2,2'-азобис(2-метилпропионитрил),
ат. атмосфера,
(ВОС)2O ди-трет-бутилдикарбонат,
Dba трис(дибензилиденацетон),
DCM дихлорметан/метиленхлорид,
DIAD диизопропилазодикарбоксилат,
DIPEA диизопропилэтиламин,
DMAP 4-диметиламинопиридин,
DME 1,2-диметоксиэтан,
DMF N,N-диметилформамид,
DMSO диметилсульфоксид,
DPPF 1,1'-бис(дифенилфосфино)ферроцен,
Et2O диэтиловый эфир,
ЕtOН этанол/этиловый спирт,
EtOAc этилацетат,
HATU 2-(1Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония
гексафторфосфат метанаминий,
HBTU O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония гексафторфосфат,
НОВТ 1-гидроксибензотриазол,
HPLC жидкостная хроматография высокого давления,
RP HPLC обращенно-фазовая жидкостная хроматография высокого давления,
i-PrOH изопропанол/изопропиловый спирт,
LCMS жидкостная хроматография/масс-спектроскопия,
МеОН метанол/метиловый спирт,
MW микроволновое излучение,
NBS N-бромсукцинимид,
NMP 1-метил-2-пирролидинон,
ф/кв. дюйм фунт на квадратный дюйм,
КТ комнатная температура,
SFC сверхкритическая жидкостная хроматография,
TBDMS трет-бутилдиметилсилил,
TFA трифторуксусная кислота,
THF тетрагидрофуран,
TLC тонкослойная хроматография,
Xphos 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил.
Жидкостная хроматография-масс-спектрометрия, метод А
LC-MS проводили на жидкостном хроматографе (LC) серии Agilent 1200, соединенном с квадрупольным масс-спектрометром Agilent 6140, используя колонку Agilent SD-C18 (1,8 мкм; 2,1×30 мм) с линейным градиентом смеси 3-95% ацетонитрил/вода (с 0,05% трифторуксусной кислоты в каждой подвижной фазе) в пределах 8,5 минуты и выдерживанием при 95% в течение 2,5 минуты.
Жидкостная хроматография-масс-спектрометрия, метод В
LC-MS проводили на HPLC-системе 2795 Alliance НТ от Waters с диодным матричным детектором 2996 от Waters, соединенным с Micromass ZQ, квадрупольным масс-спектрометром с одиночной фокусировкой, используя колонку Luna С18 (2) от Phenomenex (5 мкм, 100×4,6 мм плюс защитный картридж) с линейным градиентом смеси 5-95% ацетонитрил/вода (с 0,1% муравьиной кислоты в каждой подвижной фазе) в пределах 3,5 минуты и выдерживанием при 95% в течение 2,0 минуты.
Жидкостная хроматография-масс-спектрометрия, метод С
LC-MS проводили на HPLC-системе 2795 Alliance НТ от Waters с диодным матричным детектором 2996 от Waters, соединенным с Micromass ZQ, квадрупольным масс-спектрометром с одиночной фокусировкой, используя колонку Xterra MS С18 от Waters (5 мкм, 100×4,6 мм плюс guard картридж), которую сначала выдерживали в 5%-ном ацетонитриле в воде (с 10 мМ бикарбонатом аммония в водной подвижной фазе) в течение 0,5 минуты, после чего применяли линейный градиент 5-95% в пределах 3,5 минуты и затем выдерживали при 95% в течение 1,5 минуты.
Аналитические методы
Спектроскопию 1Н-ядерного магнитного резонанса (ЯМР) выполняли на приборе Bruker, работающем при 400 или 500 МГц, используя указанный растворитель при температуре примерно комнатной, если не указано иное. Во всех случаях, данные ЯМР находились в соответствии с предполагаемыми структурами. Характерные химические сдвиги (δ) приведены в миллионных долях с использованием традиционных сокращений для обозначения основных пиков: например s, синглет; d, дублет; t, триплет; q, квартет; dd, дублет дублетов; dt, дублет триплетов; br, уширенный. В случае применения тонкослойной хроматографии (TLC) речь идет о TLC на силикагеле с использованием пластинок силикагеля MK6F 60Å, Rf представляет собой расстояние, на которое перемещается соединение, поделенное на расстояние, на которое перемещается растворитель на TLC-пластинке. Флэш-хроматография относится к хроматографии на силикагеле, и ее осуществляют с использованием системы для MPLC (жидкостная хроматография умеренного давления) SP4 или Isolara 4 (производства Biotage); предварительно упакованных силикагелевых картриджей (поставляемых Biotage); или с использованием традиционной хроматографии на стеклянных колонках.
Получение соединений
В тех случаях, когда получение исходных веществ не описано, их приобретают путем закупок, они известны из литературы или могут быть легко получены специалистами в данной области техники с использованием стандартных методик. Если указано, что соединения были получены аналогично соединениям из приведенных ранее примеров или аналогично промежуточным соединениям, то специалисту будет очевидно, что продолжительность реакции, количество эквивалентов реагентов и температура могут быть изменены для каждой конкретной реакции и что может быть необходимо или желательно использовать другие методы обработки и очистки. В тех случах, когда реакции осуществляют с применением облучения микроволнами, используют микроволновой реактор Initiator 60, поставляемый Biotage. Прикладываемую эффективную мощность варьируют в ходе реакции для поддержания постоянной температуры.
Данные для соединений, полученных в следующих далее примерах, суммированы в приведенных ниже таблицах, где показаны значения аффинности в отношении LRRK2 (Ki, микромолярная концентрация) для репрезентативных соединений вместе со значениями, полученными по LCMS-методу (М), т.е. с временем удерживания (retention time; RT) при LC в минутах и значениями m/z (молекулярная масса) при масс-спектрометрии.
Промежуточное соединение 1: 2,5-дихлор-N-метилпиримидин-4-амин

К охлажденному (0°C) раствору 2,4,5-трихлорпиримидина (2,0 г; 11 ммоль) в метаноле (30 мл) по каплям добавляли 2 М раствор метиламина в метаноле (6,3 мл). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Затем реакционную смесь концентрировали и перерастворяли в DCM. Раствор промывали насыщ. NaHCO3, рассолом, сушили над Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали колоночной хроматографией (0-40% EtOAc в гептане), получая 2,5-дихлор-N-метилпиримидин-4-амин (0,9 г; 50%). 1Н-ЯМР (DMSO): δ 8.13 (s, 1Н), 7.89 (s, 1Н), 2.86 (d, J=4,5 Гц, 3Н).
Промежуточное соединение 2: 5-бром-2-хлор-N-метилпиримидин-4-амин

К охлажденному (0°C) раствору 5-бром-2,4-дихлорпиримидина (5,0 г; 22 ммоль) в метаноле (42 мл) по каплям добавляли 33 масс. %-ный раствор метиламина в этаноле (3,3 мл). Реакционную смесь оставляли нагреваться до комнатной температуры. Затем реакционную смесь концентрировали. Неочищенный продукт очищали колоночной хроматографией (0-10% метанола в DCM), получая 5-бром-2-хлор-N-метилпиримидин-4-амин (1,8 г; 39%). 1Н-ЯМР (DMSO): δ 8.22 (s, 1Н), 7.75 (s, 1Н), 2.85 (d, J=3,9 Гц, 3Н).
Промежуточное соединение 3: 2-хлор-N-метил-5-(трифторметил)-пиримидин-4-амин

К охлажденному (-10°C) раствору 2,4-дихлор-5-трифторметилпиримидина (20 г; 0,089 моль) в метаноле (100 мл) добавляли триэтиламин (12,5 мл; 0,089 моль) и 2 М раствор метиламина в метаноле (45 мл). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Затем реакционную смесь концентрировали и перерастворяли в этилацетате. Раствор промывали насыщ. NaHCO3, рассолом, сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали колоночной хроматографией (5-25% EtOAc в гептане), получая 2-хлор-N-метил-5-(трифторметил)пиримидин-4-амин (8,6 г; 45%). 1Н-ЯМР (DMSO): δ 8.37 (s, 1Н), 7.90 (s, 1Н), 2.90 (s, 3Н).
Дополнительные промежуточные соединения, полученные с использованием способов, аналогичных описанным выше, приведены в ТАБЛИЦЕ 1, ниже.

Промежуточные соединения 8 и 9: 1',5-диметил-1'Н-1,4'-бипиразол-4-амин и 1',3-диметил-1'Н-1,4'-бипиразол-4-амин

Стадия 1 - 1',5-диметил-4-нитро-1'Н-1,4'-бипиразол и 1',3-диметил-4-нитро-1'Н-1,4'-бипиразол
К суспензии 3-метил-4-нитро-1Н-пиразола (350 мг; 2,76 ммоль), 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразола (859 мг; 4,13 ммоль) и ацетата меди(II) (150 мг; 0,825 ммоль) в DMF (8 мл) добавляли пиридин (87 мг; 1,1 ммоль). Смесь перемешивали при 95°C в атмосфере кислорода в течение 12 ч. Реакционную смесь разбавляли водой и экстрагировали EtOAc (30 мл×3). Объединенные экстракты промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле с элюированием смесью этилацетат/петролейный эфир (1/5), получая смесь двух региоизомеров (71 мг; 13%) в виде беловатого твердого вещества.
Стадия 2 - 1',5-диметил-1'Н-1,4'-бипиразол-4-амин и 1',3-диметил-1'Н-1,4'-бипиразол-4-амин
Суспензию смеси 1',5-диметил-4-нитро-1'Н-1,4'-бипиразола и 1',3-диметил-4-нитро-1'Н-1,4'-бипиразола (71 мг; 0,34 ммоль) и 10%-ного Pd/C (50 мг) в метаноле (10 мл) перемешивали при 55°C в атмосфере H2 в течение 3 ч. Нерастворенное вещество отфильтровывали и фильтрат концентрировали при пониженном давлении, получая оба указанных в заголовке соединения в виде смеси (50 мг; 83%).
Промежуточное соединение 10: 1-(3-фтор-тетрагидро-2Н-пиран-4-ил)-3-метил-1H-пиразол-4-амин

Стадия 1 - 3-фтор-тетрагидро-2Н-пиран-4-ол
К смеси 3-фтор-тетрагидропиран-4-она (300 мг; 2,50 ммоль) в CH3CN (3 мл) добавляли NaBH4 (190 мг; 5,00 ммоль). После перемешивания при 20°C в течение 10 ч добавляли H2O (10 мл). Полученную смесь экстрагировали этилацетатом (20 мл×3), сушили над сульфатом натрия и концентрировали при пониженном давлении, получая указанные в заголовке соединения (200 мг; 62%) в виде масла.
Стадия 2 - 3-фтор-тетрагидро-2Н-пиран-4-ил метансульфонат
К смеси 3-фтор-тетрагидро-2Н-пиран-4-ола (180 мг; 1,5 ммоль) и триэтиламина (0,5 мл) при 0°C добавляли MsCl (189 мг; 1,65 ммоль). Раствор перемешивали при комнатной температуре в течение 4 ч, добавляли H2O (10 мл) для гашения реакции. Полученную смесь экстрагировали этилацетатом (20 мл×3), сушили над сульфатом натрия и концентрировали при пониженном давлении, получая указанные в заголовке соединения (300 мг; 91%) в виде масла.
Стадия 3 - 1-(3-фтор-тетрагидро-2Н-пиран-4-ил)-3-метил-4-нитро-1Н-пиразол
Смесь 3-фтор-тетрагидро-2Н-пиран-4-илметансульфоната (60 мг; 0,50 ммоль), 3-метил-4-нитро-1Н-пиразола (98 мг; 0,50 ммоль) и Cs2CO3 (243 мг; 0,750 ммоль) в DMF (2,0 мл) перемешивали при 100°C в течение 2 ч. После охлаждения полученную смесь экстрагировали этилацетатом (20 мл×3) и промывали H2O (20 мл). Органические слои объединяли, промывали рассолом (20 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении, получая указанные в заголовке соединения (60 мг; 56%) в виде масла. LC-MS (ESI (electrospray ionization - электрораспылительная ионизация)): m/z=230 (М+Н)+.
Стадия 4 - 1-(3-фтор-тетрагидро-2Н-пиран-4-ил)-3-метил-1Н-пиразол-4-амин
Смесь 1-(3-фтор-тетрагидро-2Н-пиран-4-ил)-3-метил-4-нитро-1H-пиразола (60 мг; 0,26 ммоль) и 10%-ного Pd/C (30 мг) в метаноле (5 мл) перемешивали в атмосфере Н2 при комнатной температуре в течение 5 ч. Нерастворенное вещество отфильтровывали и фильтрат концентрировали при пониженном давлении, получая указанное в заголовке соединение (40 мг; 77%) в виде масла. LC-MS (ESI): m/z=200 (М+Н)+.
Промежуточные соединения 11 и 12: 3-метил-1-(2-(1-метил-1H-пиразол-3-ил)этил)-1Н-пиразол-4-амин и 5-метил-1-(2-(1-метил-1H-пиразол-3-ил)этил)-1Н-пиразол-4-амин
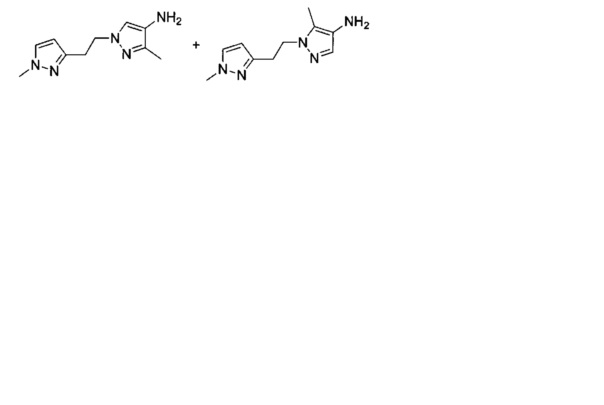
Стадия 1 - 2-(1Н-пиразол-3-ил)ацетогидразид
Раствор 5-нитропиридин-2-ола (5,0 г; 36 ммоль) в гидразина гидрате (20 мл) перемешивали при 100°C в течение 3 ч. После охлаждения смесь концентрировали, получая указанное в заголовке соединение (5,0 г; 100%) в виде красного масла. LC-MS (ESI): m/z=141 (М+Н)+.
Стадия 2 - 2-(1Н-пиразол-3-ил)уксусная кислота
Раствор 2-(1Н-пиразол-3-ил)ацетогидразида (5,0 г; 36 ммоль) в конц. HCl (200 мл) перемешивали при 100°C в течение 3 ч. Нерастворенные вещества отфильтровывали, фильтрат концентрировали, получая указанное в заголовке соединение (4,0 г; 89%) в виде желтого твердого вещества. LC-MS (ESI): m/z=127 (М+Н)+.
Стадия 3 - этил-2-(1Н-пиразол-3-ил)ацетат
Раствор 2-(1Н-пиразол-3-ил)уксусной кислоты (4,0 г; 32 ммоль) и конц. H2SO4 (1,0 мл) в этаноле (100 мл) кипятили с обратным холодильником в течение ночи. После концентрирования остаток обрабатывали водн. NaHCO3, экстрагировали этилацетатом, сушили над Na2SO4. После удаления растворителя получали указанное в заголовке соединение (4,6 г; 94%) в виде коричневого масла. LC-MS (ESI): m/z=155 (М+Н)+.
Стадия 4 - этил-2-(1-метил-1H-пиразол-3-ил)ацетат
К смеси этил-2-(1Н-пиразол-3-ил)ацетата (1,0 г; 6,5 ммоль) и Cs2CO3 (4,2 г; 13 ммоль) в DMF (5 мл) добавляли подметан (1,84 г; 13,0 ммоль). Смесь перемешивали при 0°C в течение 6 ч. Затем добавляли H2O (20 мл) и полученную смесь экстрагировали EtOAc (20 мл×3). Органические слои объединяли, промывали рассолом (20 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении, получая указанное в заголовке соединение (600 мг; 55%) в виде желтого масла. LC-MS (ESI): m/z=169 (М+Н)+.
Стадия 5 - 2-(1-метил-1H-пиразол-3-ил)этанол
К раствору этил-2-(1-метил-1H-пиразол-3-ил)ацетата (600 мг; 3,57 ммоль) в THF (10 мл) добавляли боран-тетрагидрофурановый комплекс (10 мл; 1,0 М). Смесь перемешивали при комнатной температуре в течение 12 ч. Добавляли СН3ОН (10 мл) и H2O (10 мл) и полученную смесь экстрагировали EtOAc (20 мл×3). Органические слои объединяли, промывали рассолом (20 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении, получая указанное в заголовке соединение (400 мг; 89%) в виде желтого масла. LC-MS (ESI): m/z=127 (М+Н)+.
Стадия 6 - 2-(1-метил-1H-пиразол-3-ил)этилметансульфонат
К смеси 2-(1-метил-1H-пиразол-3-ил)этанола (400 мг; 3,18 ммоль), Et3N (641 мг; 6,35 ммоль) в CH2Cl2 (20 мл) по каплям при 0°C добавляли мезилхлорид (579 мг; 5,08 ммоль). После перемешивания при комнатной температуре в течение ночи смесь разбавляли CH2Cl2, промывали водн. NaHCO3, сушили над Na2SO4. После удаления растворителя получали указанное в заголовке соединение (600 мг; 93%) в виде желтого масла. LC-MS (ESI): m/z=205 (М+Н)+.
Стадия 7 - 3-метил-1-(2-(1-метил-1Н-пиразол-3-ил)этил)-4-нитро-1H-пиразол и 5-метил-1-(2-(1-метил-1Н-пиразол-3-ил)этил)-4-нитро-1Н-пиразол
Смесь 2-(1-метил-1Н-пиразол-3-ил)этилметансульфоната (600 мг; 2,94 ммоль), 3-метил-4-нитро-1H-пиразола (373 мг; 2,94 ммоль) и Cs2CO3 (1,92 г; 5,882 ммоль) в DMF (20 мл) перемешивали при 100°C в течение 2 ч. Добавляли H2O (20 мл) и полученную смесь экстрагировали EtOAc (20 мл×3). Органические слои объединяли, промывали рассолом (20 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали препаративной TLC с элюированием смесью петролейный эфир/этилацетат (1/1), получая указанное в заголовке соединение (600 мг; 87%) в виде белого твердого вещества. LC-MS (ESI): m/z=236 (М+Н)+.
Стадия 8 - 3-метил-1-(2-(1-метил-1H-пиразол-3-ил)этил)-1H-пиразол-4-амин и 5-метил-1-(2-(1-метил-1H-пиразол-3-ил)этил)-1H-пиразол-4-амин
К смеси 3-метил-1-(2-(1-метил-1Н-пиразол-3-ил)этил)-4-нитро-1H-пиразола и 5-метил-1-(2-(1-метил-1Н-пиразол-3-ил)этил)-4-нитро-1Н-пиразола (300 мг; 1,28 ммоль) в метаноле (25 мл) добавляли 10%-ный Pd/C (30 мг). Реакционную смесь перемешивали в атмосфере Н2 при комнатной температуре в течение 1 ч. Нерастворенное вещество отфильтровывали и фильтрат концентрировали при пониженном давлении, получая указанное в заголовке соединение (260 мг; 99%) в виде белого твердого вещества. LC-MS (ESI): m/z=206 (М+Н)+.
Промежуточное соединение 13: 3-метил-1-(3-метилоксетан-3-ил)-1Н-пиразол-4-амин

Стадия 1 - диэтил-2-метил-2-(3-метил-4-нитро-1Н-пиразол-1-ил)малонат
К раствору 3-метил-4-нитро-1Н-пиразола (3,81 г; 30,0 ммоль) в DMF (20 мл) добавляли К2СO3 (8,28 г; 60,0 ммоль) и диэтил-2-бром-2-метилмалонат (9,10 г; 36,0 ммоль). Смесь перемешивали при 100°C в течение 20 ч. Затем реакционную смесь обрабатывали H2O (500 мл) и экстрагировали этилацетатом (20 мл×3). Органический слой упаривали и остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этилацетат (10/1), получая указанное в заголовке соединение (3,6 г; 41%) в виде масла. LC-MS (ESI): m/z=300 (М+Н)+.
Стадия 2 - 2-метил-2-(3-метил-4-нитро-1Н-пиразол-1-ил)пропан-1,3-диол
К раствору диэтил-2-метил-2-(3-метил-4-нитро-1H-пиразол-1-ил)малоната (3588 мг; 12,00 ммоль) в метаноле (50 мл) добавляли NaBH4 (890 мг; 24,0 ммоль). После перемешивания при 20°C в течение 2 ч реакционную смесь гасили H2O (500 мл) и экстрагировали этилацетатом (20 мл×3). Органическую фазу упаривали и остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этилацетат (5/1), получая указанное в заголовке соединение (900 мг; 35%) в виде желтого твердого вещества. LC-MS (ESI): m/z=216 (M+H)+.
Стадия 3 - 3-гидрокси-2-метил-2-(3-метил-4-нитро-1Н-пиразол-1-ил)пропил 4-метилбензолсульфонат
К раствору 2-метил-2-(3-метил-4-нитро-1H-пиразол-1-ил)пропан-1,3-диола (860 мг; 4,00 ммоль) в пиридине (10 мл) добавляли 4-метилбензол-1-сульфонилхлорид (760 мг; 4,00 ммоль). Затем смесь кипятили с обратным холодильником в течение 20 ч. После охлаждения смесь концентрировали. Остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этилацетат (5/1), получая указанное в заголовке соединение (670 мг; 45%) в виде белого твердого вещества. LC-MS (ESI): m/z=370 (М+Н)+.
Стадия 4 - 3-метил-1-(3-метилоксетан-3-ил)-4-нитро-1Н-пиразол
К раствору 3-гидрокси-2-метил-2-(3-метил-4-нитро-1Н-пиразол-1-ил)пропил-4-метилбензолсульфоната (660 мг; 1,80 ммоль) в THF (5 мл) добавляли NaH (90 мг; 60%-ный; 2,2 ммоль) при 0°C. Затем смесь нагревали до температуры дефлегмации в течение 2 ч. После охлаждения смесь обрабатывали H2O (1 мл). После концентрирования остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этилацетат (10/1), получая указанное в заголовке соединение (280 мг; 80%) в виде белого твердого вещества. LC-MS (ESI): m/z=198 (М+Н)+.
Стадия 5 - 3-метил-1-(3-метилоксетан-3-ил)-1Н-пиразол-4-амин
К раствору 3-метил-1-(3-метилоксетан-3-ил)-4-нитро-1Н-пиразола (275 мг; 1,40 ммоль) в метаноле (5 мл) добавляли Ni Ренея (20 мг) и гидразина гидрат (80%-ный; 2,0 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Нерастворенное вещество отфильтровывали и фильтрат концентрировали, получая указанное в заголовке соединение (220 мг; 94%) в виде желтого твердого вещества. LC-MS (ESI): m/z=168 (М+Н)+.
Промежуточные соединения 14 и 15: 3-хлор-1-(2-(4-метил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-амин и 3-хлор-1-(2-(1-метил-1H-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-амин

Стадия 1 - этил-2-(3-хлор-4-нитро-1H-пиразол-1-ил)-2-метилпропаноат
К раствору 3-хлор-4-нитро-1H-пиразола (1,0 г; 6,8 ммоль) в DMF (30 мл) добавляли этил-2-бром-2-метилпропаноат (2,00 г; 10,2 ммоль) и Cs2CO3 (4,40 г; 13,6 ммоль). Смесь перемешивали при 100°C в течение 2 ч. После фильтрования раствор выливали в воду и 3 раза экстрагировали этилацетатом. Органические слои объединяли и сушили над безводным Na2SO4. Растворитель выпаривали в вакууме, остаток очищали колоночной хроматографией на силикагеле, получая указанное в заголовке соединение (1,2 г; 68%) в виде желтоватого масла. LC-MS (ESI): m/z=262,0 (М+Н)+.
Стадия 2 - 2-(3-хлор-4-нитро-1H-пиразол-1-ил)-2-метилпропановая кислота
К раствору этил-2-(3-хлор-4-нитро-1H-пиразол-1-ил)-2-метилпропаноата (1,0 г; 3,8 ммоль) в THF (5 мл) добавляли LiOH (500 мг; 22,8 мл), iPrOH (5 мл) и H2O (5 мл). Смесь кипятили с обратным холодильником в течение 2 ч. Растворитель выпаривали в вакууме. Полученную смесь 3 раза экстрагировали этилацетатом. Органические слои объединяли и сушили над безводным Na2SO4. После удаления растворителя получали указанное в заголовке соединение (850 мг; выход 95%) в виде белого твердого вещества. LC-MS (ESI): m/z=234,1 (М+Н)+.
Стадия 3 - 2-(3-хлор-4-нитро-1Н-пиразол-1-ил)-2-метилпропанамид
К раствору 2-(3-хлор-4-нитро-1H-пиразол-1-ил)-2-метилпропановой кислоты (800 мг; 3,40 ммоль) в DCM (10 мл) добавляли SOCl2 (500 мг; 22,8 мл) и DMF (одну каплю). Смесь кипятили с обратным холодильником при 50°C в течение 2 ч. Растворитель выпаривали в вакууме. К полученному остатку в DCM (10 мл) добавляли NH4OH (2 мл). Раствор перемешивали при комнатной температуре в течение 0,5 ч. После выпаривания растворителя в вакууме полученный остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этилацетат (10:1), получая указанное в заголовке соединение (650 мг; 81%) в виде белого твердого вещества. LC-MS (ESI): m/z=233,2 (М+Н)+.
Стадия 4 - (Z)-2-(3-хлор-4-нитро-1H-пиразол-1-ил)-N-((диметиламино)-метилен)-2-метил-пропанамид
Смесь 2-(3-хлор-4-нитро-1H-пиразол-1-ил)-2-метилпропанамида (250 мг; 1,10 ммоль) в DMF-DMA (1,5 мл) перемешивали при 95°C в течение 2 ч. После удаления растворителя получали указанное в заголовке соединение (250 мг; 79%). LC-MS (ESI): m/z=288,1 (М+Н)+.
Стадия 5 - 3-(2-(3-хлор-4-нитро-1H-пиразол-1-ил)пропан-2-ил)-4Н-1,2,4-триазол
К раствору (Z)-2-(3-хлор-4-нитро-1H-пиразол-1-ил)-N-((диметиламино)-метилен)-2-метил-пропанамида (250 мг; 0,867 ммоль) в АсОН (1,5 мл) добавляли гидразин (водный, 85%-ный; 1,0 мл). Смесь перемешивали при 95°C в течение 1,5 ч, затем добавляли насыщ. NaHCO3 и смесь 3 раза экстрагировали этилацетатом. Органические слои объединяли и сушили над безводным Na2SO4. После удаления растворителя получали указанное в заголовке соединение (250 мг; 97%) в виде желтого масла. LC-MS (ESI): m/z=257,2 (М+Н)+.
Стадия 6 - 3-(2-(3-хлор-4-нитро-1H-пиразол-1-ил)пропан-2-ил)-4-метил-4Н-1,2,4-триазол и 3-(2-(3-хлор-4-нитро-1H-пиразол-1-ил)пропан-2-ил)-1-метил-1H-1,2,4-триазол
К раствору 3-(2-(3-хлор-4-нитро-1H-пиразол-1-ил)пропан-2-ил)-4Н-1,2,4-триазола (250 мг; 0,972 ммоль) в CH3CN (10 мл) добавляли Cs2CO3 (650 мг; 2,00 ммоль) и MeI (280 мг; 2,00 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч. После концентрирования остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этил ацетат (5/1), получая указанные в заголовке соединения (235 мг; 87%) в виде бесцветного масла. LC-MS (ESI): m/z=271,2 (М+Н)+.
Стадия 7 - 3-хлор-1-(2-(4-метил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-амин и 3-хлор-1-(2-(1-метил-1H-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-амин
К раствору смеси 3-(2-(3-хлор-4-нитро-1H-пиразол-1-ил)пропан-2-ил)-4-метил-4Н-1,2,4-триазола и 3-(2-(3-хлор-4-нитро-1H-пиразол-1-ил)пропан-2-ил)-1-метил-1H-1,2,4-триазола (100 мг; 0,370 ммоль) в EtOH (2 мл) добавляли Zn (1,0 г) в насыщ. NH4Cl (2,0 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. После фильтрования растворитель выпаривали в вакууме. Остаток перерастворяли в DCM и смесь снова фильтровали. Фильтрат концентрировали, получая указанные в заголовке соединения (80 мг; 90%). LC-MS (ESI): m/z=241,2 (М+Н)+.
Промежуточное соединение 16: 3-метил-1-(2-(5-метил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-1Н-пиразол-4-амин

Стадия 1 - N'-ацетил-2-метил-2-(3-метил-4-нитро-1H-пиразол-1-ил)пропангидразид
К смеси 2-метил-2-(3-метил-4-нитро-1Н-пиразол-1-ил)пропановой кислоты (500 мг; 2,38 ммоль) в DCM (20 мл) добавляли ацетогидразид (211 мг; 2,86 ммоль), HATU (1,8 г; 4,76 ммоль) и DIPEA (618 мг; 4,76 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч. После концентрирования остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этилацетат (1/3), получая указанный в заголовке продукт (600 мг; 95%) в виде светло-желтого масла. LC-MS (ESI): m/z=270,1 (М+Н)+.
Стадия 2 - 2-метил-5-(2-(3-метил-4-нитро-1H-пиразол-1-ил)пропан-2-ил)-1,3,4-оксадиазол
Смесь N'-ацетил-2-метил-2-(3-метил-4-нитро-1H-пиразол-1-ил)пропангидразида (500 мг; 1,73 ммоль) в трихлориде фосфора (2 мл) перемешивали при 100°C в течение 1 ч. Реакцию гасили ледяной водой. Смесь экстрагировали этилацетатом. Органические слои объединяли и сушили над безводным Na2SO4. После выпаривания растворителя в вакууме полученный остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этилацетат (3/1), получая указанное в заголовке соединение (320 мг; 68%) в виде белого твердого вещества. LC-MS (ESI): m/z=252,3 (М+Н)+.
Стадия 3 - 3-метил-1-(2-(5-метил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-1Н-пиразол-4-амин
К смеси 2-метил-5-(2-(3-метил-4-нитро-1H-пиразол-1-ил)пропан-2-ил)-1,3,4-оксадиазола (100 мг; 0,400 ммоль) в метаноле (10 мл) добавляли 10%-ный Pd/C (50 мг). Реакционную смесь перемешивали в атмосфере Н2 при комнатной температуре в течение 2 ч. Нерастворенное вещество отфильтровывали и фильтрат концентрировали при пониженном давлении, получая указанное в заголовке соединение (85 мг; 92%) в виде желтоватого масла. LC-MS (ESI): m/z=222,3 (М+Н)+.
Промежуточное соединение 17: 1-(2-(1-изопропил-1Н-1,2,4-триазол-3-ил)пропан-2-ил)-3-метил-1Н-пиразол-4-амин

Стадия 1 - (Z)-N-((диметиламино)метилен)-2-метил-2-(3-метил-4-нитро-1Н-пиразол-1-ил)-пропанамид
Раствор 2-метил-2-(3-метил-4-нитро-1H-пиразол-1-ил)пропанамида (1,60 г; 7,55 ммоль) в DMF-DMA (8,98 г; 75,5 ммоль) перемешивали при 95°C в течение 2 ч. После охлаждения смесь концентрировали, получая указанное в заголовке соединение (2,10 г; больше 100%). LC-MS (ESI): m/z=268 (М+Н)+.
Стадия 2 - 3-(2-(3-метил-4-нитро-1H-пиразол-1-ил)пропан-2-ил)-4Н-1,2,4-триазол
Раствор (Z)-N-((диметиламино)метилен)-2-метил-2-(3-метил-4-нитро-1Н-пиразол-1-ил)-пропанамида (2,10 г; 7,55 ммоль) и гидразина гидрата (6,0 мл) в АсОН (15 мл) перемешивали при 95°C в течение 1,5 ч. После охлаждения смесь разбавляли водн. NaHCO3 и экстрагировали этилацетатом. Объединенные экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали, получая указанное в заголовке соединение (1,3 г; 73% за 2 стадии). LC-MS (ESI): m/z=237 (М+Н)+.
Стадия 3 - 1-изопропил-3-(2-(3-метил-4-нитро-1H-пиразол-1-ил)пропан-2-ил)-1Н-1,2,4-триазол
К раствору 3-(2-(3-метил-4-нитро-1H-пиразол-1-ил)пропан-2-ил)-4Н-1,2,4-триазола (1,3 г; 5,5 ммоль) в CH3CN (30 мл) добавляли 2-бромпропан (813 мг; 6,60 ммоль) и Cs2CO3 (1,79 г; 5,50 ммоль). Смесь перемешивали при 50°C в течение ночи. После охлаждения смесь разбавляли водой и экстрагировали этилацетатом. Органический слой концентрировали, получая указанное в заголовке соединение (1,06 г; 70%). LC-MS (ESI): m/z=279 (М+Н)+.
Стадия 4 - 1-(2-(1-изопропил-1Н-1,2,4-триазол-3-ил)пропан-2-ил)-3-метил-1H-пиразол-4-амин
Смесь 1-изопропил-3-(2-(3-метил-4-нитро-1H-пиразол-1-ил)пропан-2-ил)-1Н-1,2,4-триазола (600 мг; 2,16 ммоль) и 10%-ного Pd/C (200 мг) в ЕtOH (25 мл) перемешивали в атмосфере водорода при 50°C в течение 2 ч. Нерастворенное вещество отфильтровывали и фильтрат упаривали, получая указанное в заголовке соединение (420 мг; 80%). LC-MS (ESI): m/z=249 (М+Н)+.
Промежуточное соединение 18: 3-метил-1-(2-(5-метилоксазол-2-ил)пропан-2-ил)-1Н-пиразол-4-амин
Стадия 1 - 2-метил-2-(3-метил-4-нитро-1H-пиразол-1-ил)-N-(проп-2-инил)пропанамид
К раствору 2-метил-2-(3-метил-4-нитро-1H-пиразол-1-ил)пропановой кислоты (1,00 г; 4,69 ммоль) и проп-2-ин-1-амина (387 мг; 7,04 ммоль) в DCM (30 мл) добавляли DIPEA (908 мг; 7,04 ммоль) и HATU (2,38 г; 7,04 ммоль). После перемешивания при комнатной температуре в течение 3 ч смесь экстрагировали DCM и промывали водой. Органический слой концентрировали, получая указанное в заголовке соединение (770 мг; 66%). LC-MS (ESI): m/z=251 (М+Н)+.
Стадия 2 - 5-метил-2-(2-(3-метил-4-нитро-1H-пиразол-1-ил)пропан-2-ил)оксазол
Смесь 2-метил-2-(3-метил-4-нитро-1H-пиразол-1-ил)-N-(проп-2-инил)пропанамида (500 мг; 2,00 ммоль) и AuCl3 (61 мг; 0,20 ммоль) в CH3CN (10 мл) перемешивали при комнатной температуре в течение 21 ч. Нерастворенное вещество отфильтровывали и фильтрат концентрировали, получая указанное в заголовке соединение (200 мг; 40%). LC-MS (ESI): m/z=251 (М+Н)+.
Стадия 3 - 3-метил-1-(2-(5-метилоксазол-2-ил)пропан-2-ил)-1Н-пиразол-4-амин
Смесь 5-метил-2-(2-(3-метил-4-нитро-1H-пиразол-1-ил)пропан-2-ил)оксазола (200 мг; 0,800 ммоль) и 10%-ного Pd/C (80 мг) в ЕtOH (10 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 2 ч. Нерастворенное вещество отфильтровывали и фильтрат упаривали, получая указанное в заголовке соединение (175 мг; 100%). LC-MS (ESI): m/z=221 (М+Н)+.
Промежуточное соединение 19: 3-метил-1-(2-(пиримидин-2-ил)пропан-2-ил)-1Н-пиразол-4-амин

Стадия 1 - 2-(2-(3-метил-4-нитро-1H-пиразол-1-ил)пропан-2-ил)пиримидин
Раствор 2-метил-2-(3-метил-4-нитро-1H-пиразол-1-ил)пропанимидамида (500 мг; 2,37 ммоль) и 1,1,3,3-тетраметоксипропана (1,94 мг; 11,1 ммоль) в 1,4-диоксане (20 мл) перемешивали при 130°C в течение ночи. Нерастворенное вещество отфильтровывали и фильтрат концентрировали. Остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этилацетат (3/1), получая указанное в заголовке соединение (220 мг; 34%). LC-MS (ESI): m/z=248 (М+Н)+.
Стадия 2 - 3-метил-1-(2-(пиримидин-2-ил)пропан-2-ил)-1Н-пиразол-4-амин
Смесь 2-(2-(3-метил-4-нитро-1H-пиразол-1-ил)пропан-2-ил)пиримидина (220 мг; 0,890 ммоль) и 10%-ного Pd/C (80 мг) в EtOH (10 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 2 ч. Нерастворенное вещество отфильтровывали и фильтрат упаривали, получая указанное в заголовке соединение (160 мг; 83%). LC-MS (ESI): m/z=218 (М+Н)+.
Промежуточное соединение 20: 1-((4-амино-5-хлор-1H-пиразол-1-ил)метил)циклопропанол
Стадия 1 - этил-1-(тетрагидро-2Н-пиран-2-илокси)циклопропанкарбоксилат
К раствору этил-1-гидроксициклопропанкарбоксилата (1040 мг; 8,000 ммоль) и PTSA (п-толуолсульфоновая кислота) (137 мг; 0,800 ммоль) в DCM (20 мл) по каплям при 0°C добавляли раствор DHP (дигидропиран) (1344 мг; 16,00 ммоль) в DCM (10 мл). Смесь перемешивали в течение 20 ч при комнатной температуре. После концентрирования остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этилацетат (10/1), получая указанное в заголовке соединение (1500 мг; 85%) в виде масла. LC-MS (ESI): m/z=215 (М+Н)+.
Стадия 2 - (1-(тетрагидро-2Н-пиран-2-илокси)циклопропил)метанол
К раствору этил-1-(тетрагидро-2Н-пиран-2-илокси)циклопропанкарбоксилата (1500 мг; 7,000 ммоль) в THF (20 мл) добавляли LiAlH4 (532 мг; 14,0 ммоль) при 0°C. После перемешивания в течение 30 мин при 0°C реакцию гасили H2O (1,0 мл). После концентрирования остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этилацетат (3/1), получая указанное в заголовке соединение (920 мг; 77%) в виде бесцветного масла. LC-MS (ESI): m/z=173 (М+Н)+.
Стадия 3 - 4-нитро-1-((1-(тетрагидро-2Н-пиран-2-илокси)циклопропил)-метил)-1Н-пиразол
К раствору (1-(тетрагидро-2Н-пиран-2-илокси)циклопропил)метанола (515 мг; 3,00 ммоль), 4-нитро-1Н-пиразола (407 мг; 3,60 ммоль) и PPh3 (1180 мг; 4,500 ммоль) в THF (10 мл) добавляли DIAD (606 мг; 3,00 ммоль) при 0°C. Смесь перемешивали при 20°C в течение 20 ч. После концентрирования остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этилацетат (4/1), получая указанное в заголовке соединение (186 мг; 24%) в виде белого твердого вещества. LC-MS (ESI): m/z=268 (М+Н)+.
Стадия 4 - 5-хлор-4-нитро-1-((1-(тетрагидро-2Н-пиран-2-илокси)-циклопропил)метил)-1Н-пиразол
К раствору 4-нитро-1-((1-(тетрагидро-2Н-пиран-2-илокси)циклопропил)-метил)-1Н-пиразола (186 мг; 0,700 ммоль) в THF (5 мл) при -70°C в атмосфере N2 добавляли LHMDS (гексаметилдисилазид лития) (1 M в THF; 1,0 мл). Смесь нагревали до -30°C и перемешивали в течение 30 мин. Добавляли раствор C2Cl6 (344 мг; 1,40 ммоль) в THF (2 мл) при -70°C в атмосфере N2. Полученную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Далее реакцию гасили водой. После удаления летучих веществ остаток очищали колоночной хроматографией на силикагеле с элюированием смесью петролейный эфир/этилацетат (5/1), получая указанное в заголовке соединение (102 мг; 50%) в виде белого твердого вещества. LC-MS (ESI): m/z=302 (М+Н)+.
Стадия 5 - 1-((5-хлор-4-нитро-1H-пиразол-1-ил)метил)циклопропанол
К раствору 5-хлор-4-нитро-1-((1-(тетрагидро-2Н-пиран-2-илокси)-циклопропил)метил)-1Н-пиразола (100 мг; 0,330 ммоль) в метаноле (5 мл) добавляли смесь 2 М HCl/диоксан (1 мл). Смесь перемешивали в течение 2 ч. Смесь концентрировали и остаток очищали обращенно-фазовой комби-флэш-хроматографией, получая указанное в заголовке соединение (66 мг; 90%) в виде белого твердого вещества. LC-MS (ESI): m/z=218 (М+Н)+.
Стадия 6 - 1-((4-амино-5-хлор-1H-пиразол-1-ил)метил)циклопропанол
К раствору 1-((5-хлор-4-нитро-1H-пиразол-1-ил)метил)циклопропанола (66 мг; 0,30 ммоль) в этаноле (5 мл) добавляли цинковую пыль (39 мг; 0,60 ммоль) и 1 М NH4Cl (1 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Смесь упаривали и остаток очищали обращенно-фазовой комби-флэш-хроматографией, получая указанное в заголовке соединение (45 мг; 80%). LC-MS (ESI): m/z=188 (М+Н)+.
Примеры 1 и 2. N2-(1',5-Диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин и N2-(1',3-диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
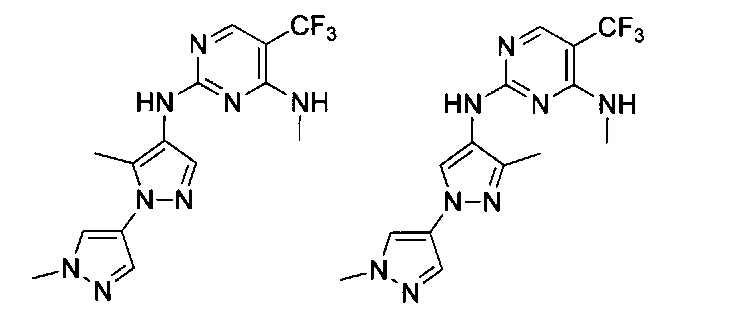
Во флакон для микроволнового реактора, оборудованного магнитной мешалкой, загружали смесь 1',5-диметил-1'Н-1,4'-бипиразол-4-амина и 1',3-диметил-1'Н-1,4'-бипиразол-4-амина (50 мг; 0,28 ммоль), 2-хлор-N-метил-5-(трифторметил)пиримидин-4-амина (60 мг; 0,28 ммоль) и трет-BuOH (3 мл). Смесь нагревали при 100°C, используя облучение микроволнами в течение 1 ч. После удаления летучих веществ остаток очищали препаративной HPLC, получая N2-(1',5-диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин (17 мг; 17%) в виде белого твердого вещества и N2-(1',3-диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин (26 мг; 26%) в виде белого твердого вещества.
N2-(1',5-Диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)-пиримидин-2,4-диамин
1Н ЯМР (500 МГц, DMSO-d6) δ 9.06 (s, 1Н), 8.07 (s, 2Н), 7.90 (s, 1Н), 7.68 (s, 1Н), 6.99 (br s, 1Н), 3.88 (s, 3Н), 2.86 (s, 3Н), 2.24 (s, 3Н). LC-MS (метод В): m/z=353,3 (М+Н)+; 4,42 мин, чистота более 99,0%.
N2-(1',3-Диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)-пиримидин-2,4-диамин
1Н ЯМР (500 МГц, DMSO-d6) δ 9.14 (s, 1Н), 8.28 (s, 1Н), 8.11 (s, 1Н), 8.03 (s, 1Н), 7.69 (s, 1Н), 7.07 (s, 1Н), 3.84 (s, 3Н), 2.91 (d, J=4,5 Гц, 3Н), 2.21 (s, 3Н). LC-MS (метод В): m/z=353,3 (М+Н)+, 4,65 мин, чистота более 99,0%.
Соединения, полученные с использованием указанной выше методики, показаны ниже в ТАБЛИЦЕ 2 вместе с приведенными для отдельных соединений данными по масс-спектрометрии низкого разрешения (М+Н), протонного ЯМР и Ki (микромолярная концентрация) в отношении LRRK2, определенными в описанном ниже анализе.

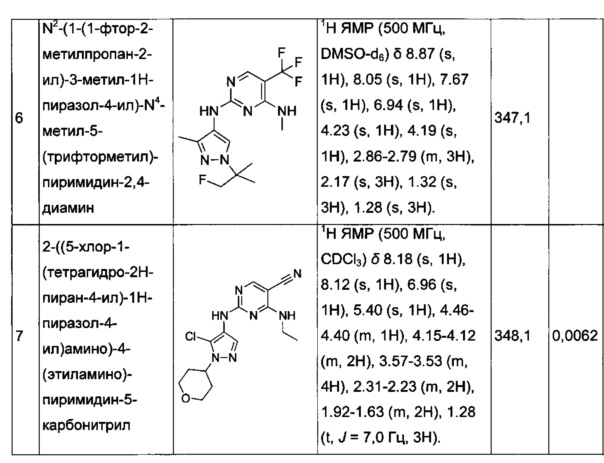
Пример 8. 5-Бром-N2-(1,5-диметил-1H-пиразол-4-ил)-N4-метилпиримидин-2,4-диамин

К смеси 5-бром-2-хлор-N-метилпиримидин-4-амина (0,201 г; 0,903 ммоль) и 1,5-диметил-1Н-пиразол-4-амина (0,12 г; 1,08 ммоль) в 2-метоксиэтаноле (2 мл) добавляли TFA (0,070 мл; 0,9 ммоль). Реакционную смесь перемешивали в герметично закрытой пробирке при 100°C в течение 90 минут. Полученный осадок собирали фильтрованием. Выделенное твердое вещество далее очищали обращенно-фазовой HPLC, получая 5-бром-N2-(1,5-диметил-1Н-пиразол-4-ил)-N4-метилпиримидин-2,4-диамин (46 мг; 17%). LCMS (метод А): [МН+]=297,0 при 2,57 мин. 1Н-ЯМР (DMSO): δ 8.28 (s, 1Н), 7.84 (s, 1Н), 7.49 (s, 1Н), 6.79 (d, J=3,4 Гц, 1Н), 3.67 (s, 3Н), 2.82 (d, J=3,6 Гц, 3Н), 2.14 (s, 3Н). Ki=0,017 мкМ.
Соединения, полученные с использованием указанной выше методики, показаны ниже в ТАБЛИЦЕ 3, вместе с приведенными для отдельных соединений данными по масс-спектрометрии низкого разрешения (М+Н), протонного ЯМР и Ki (микромолярная концентрация) в отношении LRRK2, определенными в описанном ниже анализе.
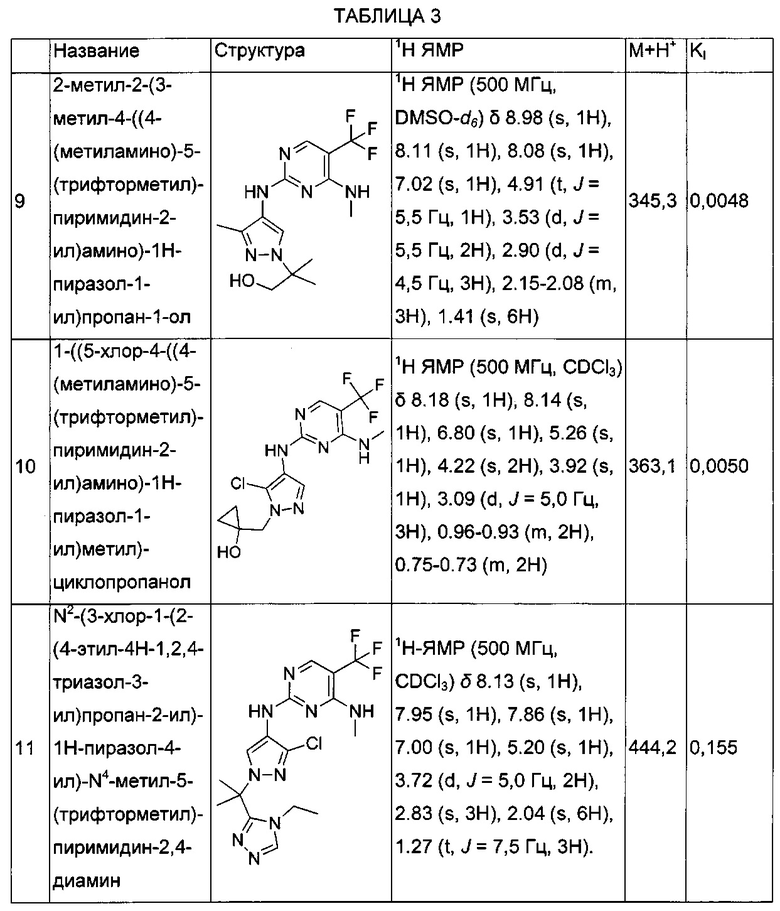

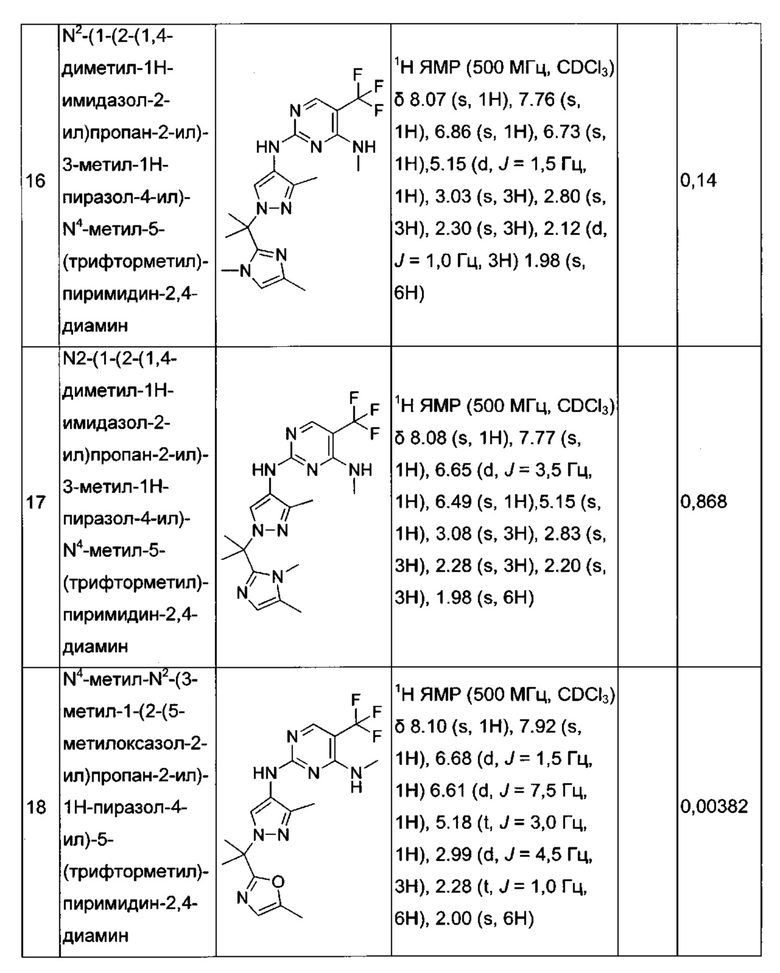


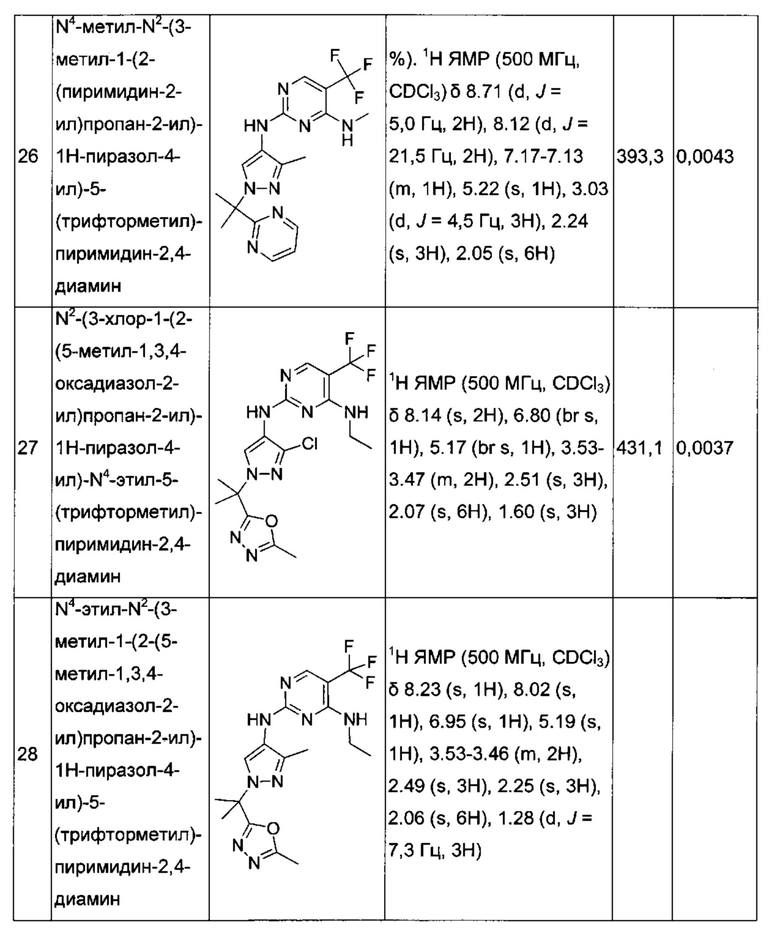

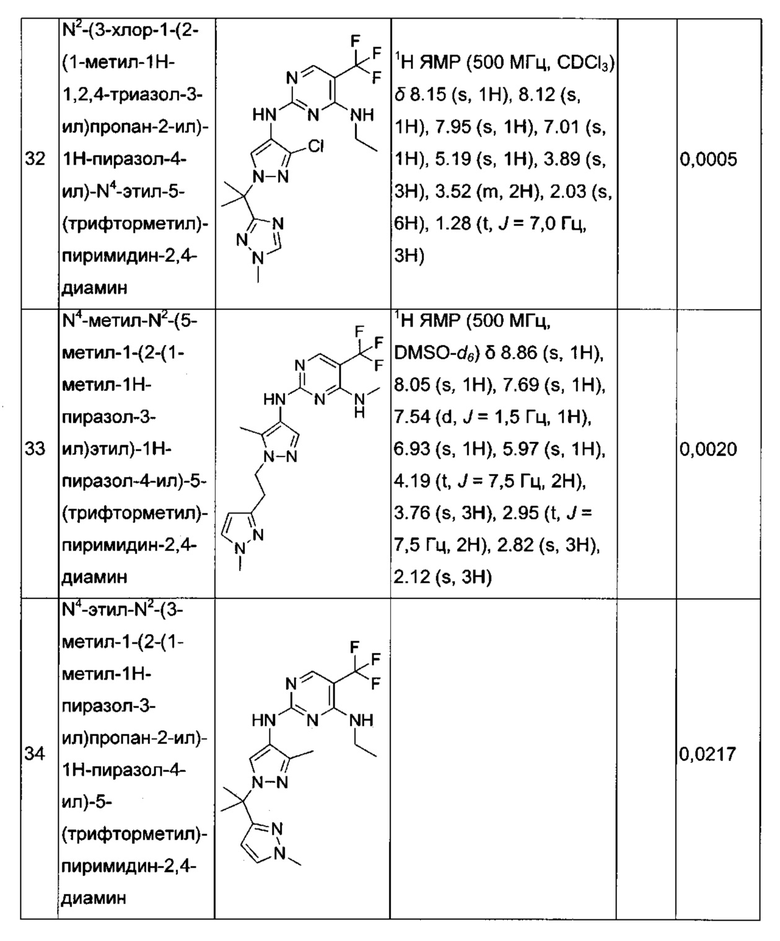



Пример 43. 3-Метил-3-(3-метил-4-(4-(метиламино)-5-(трифторметил)-пиримидин-2-иламино)-1Н-пиразол-1-ил)бутаннитрил

Стадия 1 - метил-3-метил-3-(3-метил-4-нитро-1H-пиразол-1-ил)бутаноат
Раствор 3-метил-4-нитро-1H-пиразола (1,00 г; 7,87 ммоль), метил-3-метилбут-2-еноата (2,20 г; 18,9 ммоль) и DBU (диазабицикло[5.4.0]ундец-7-ен) (3,10 г; 20,5 ммоль) в DMF (5,0 мл) перемешивали в течение ночи. Смесь очищали обращенно-фазовой комби-флэш-хроматографией, получая указанное в заголовке соединение (130 мг; 7%) в виде желтого масла. LC-MS (ESI): m/z=242 (М+Н)+.
Стадия 2 - 3-метил-3-(3-метил-4-нитро-1H-пиразол-1-ил)бутановая кислота
К раствору метил-3-метил-3-(3-метил-4-нитро-1H-пиразол-1-ил)бутаноата (508 мг; 2,10 ммоль) в EtOH (10 мл) и H2O (10 мл) добавляли LiOH (265 мг; 6,30 ммоль). Реакционную смесь перемешивали в течение 12 ч. Смесь подкисляли до pH примерно 5. Полученную смесь экстрагировали EtOAc, промывали рассолом и сушили над Na2SO4. После удаления растворителей получали указанное в заголовке соединение (450 мг; 94%). LC-MS (ESI): m/z=228,1 (М+Н)+.
Стадия 3 - 3-метил-3-(3-метил-4-нитро-1H-пиразол-1-ил)бутанамид
К раствору 3-метил-3-(3-метил-4-нитро-1H-пиразол-1-ил)бутановой кислоты (450 мг; 1,98 ммоль) в SOCl2 (5,0 мл) добавляли каталитическое количество DMF. После перемешивания в течение 3 ч добавляли смесь NH3⋅H2O (173 мг; 4,95 ммоль). Смесь перемешивали далее в течение 3 ч. После удаления летучих веществ остаток экстрагировали EtOAc, промывали рассолом, сушили над Na2SO4 и концентрировали. Остаток очищали препаративной TLC с элюированием смесью этилацетат/петролейный эфир (от 1/3 до 1/1), получая указанное в заголовке соединение (372 мг; 83%). LC-MS (ESI): m/z=227,1 (М+Н)+.
Стадия 4 - 3-(4-амино-3-метил-1H-пиразол-1-ил)-3-метилбутанамид
Смесь 3-метил-3-(3-метил-4-нитро-1H-пиразол-1-ил)бутанамида (372 мг; 1,64 ммоль) и 10%-ного Pd/C (20 мг) в МеОН (10 мл) перемешивали в атмосфере Н2 в течение 4 ч. После отфильтровывания нерастворенного вещества фильтрат концентрировали, получая указанное в заголовке соединение (306 мг; 95%). LC-MS (ESI): m/z=197,1 (М+Н)+.
Стадия 5 - 3-метил-3-(3-метил-4-(4-(метиламино)-5-(трифторметил)-пиримидин-2-иламино)-1Н-пиразол-1-ил)бутанамид
К раствору 3-(4-амино-3-метил-1H-пиразол-1-ил)-3-метилбутанамида (306 мг; 1,56 ммоль) в трет-BuOH (2 мл) добавляли 2-хлор-N-метил-5-(трифторметил)пиримидин-4-амин (329 мг; 1,56 ммоль). Реакционную смесь нагревали при 100°C, используя облучение микроволнами, в течение 1 ч. После концентрирования остаток очищали препаративной TLC с элюированием смесью этилацетат/петролейный эфир (от 1/3 до 1/1), получая указанное в заголовке соединение (347 мг; 60%). LC-MS (ESI): m/z=372,2 (М+Н)+.
Стадия 6 - 3-метил-3-(3-метил-4-(4-(метиламино)-5-(трифторметил)-пиримидин-2-иламино)-1Н-пиразол-1-ил)бутаннитрил
К раствору 3-метил-3-(3-метил-4-(4-(метиламино)-5-(трифторметил)-пиримидин-2-иламино)-1Н-пиразол-1-ил)бутанамида (100 мг; 0,270 ммоль) в DCM (10 мл) по каплям при 0°C добавляли TFA (2 мл). Реакционную смесь перемешивали при 0°C в течение 1 ч. После гашения ледяной водой смесь экстрагировали EtOAc, промывали рассолом, сушили над Na2SO4 и концентрировали. Остаток очищали препаративной HPLC, получая указанное в заголовке соединение (45 мг; 47%). 1Н ЯМР (500 МГц, CDCl3) δ 8.12-8.03 (m, 2Н), 6.69 (s, 1Н), 5.21 (s, 1Н), 3.11 (s, 3Н), 2.98 (s, 2Н), 2.25 (s, 3Н), 1.76 (s, 6Н). LC-MS (метод В): m/z=354,3 (М+Н)+; 5,19 мин, чистота более 99,0%.
Соединения, полученные с использованием указанной выше методики, показаны ниже в ТАБЛИЦЕ 4 вместе с приведенными для отдельных соединений данными по масс-спектрометрии низкого разрешения (М+Н), протонного ЯМР и Ki (микромолярная концентрация) в отношении LRRK2, определенными в описанном ниже анализе.
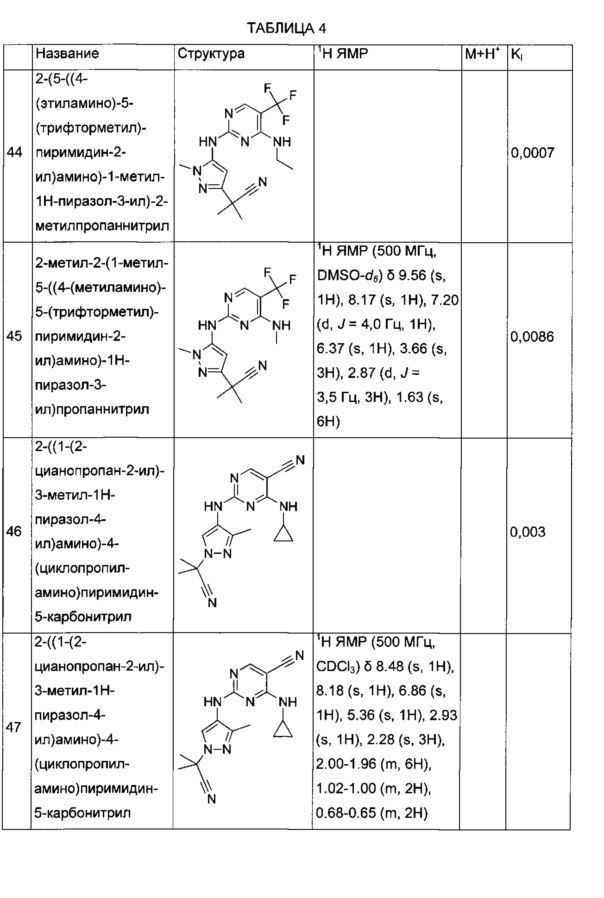
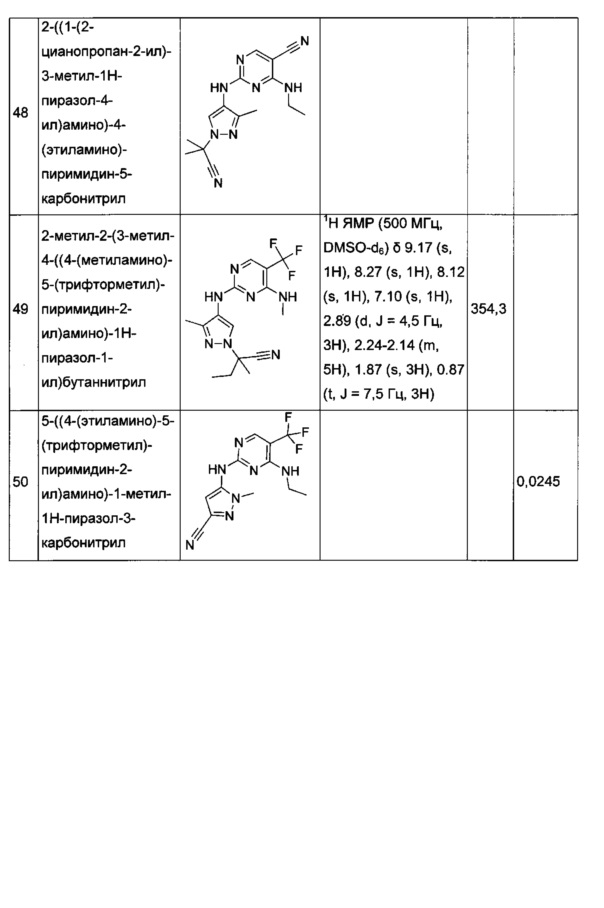
Пример 51. Связывание in vitro с LRRK2 в анализе LanthaScreen
Этот анализ использовали для оценки эффективности соединений в отношении ингибирования активности LRRK2 путем определения величин Kiкаж, IC50 или процента ингибирования. В 384-луночных черных планшетах ProxiPlates F с мелкими лунками совместно инкубировали LRRK2, Eu-антитело к GST (glutathione S-transferase - глутатион-S-трансфераза), конъюгированный с Alexa Fluor® индикатор киназной активности 236 и тестируемое соединение.
Детектирование связывания Alexa Fluor®-"индикатора" с киназой осуществляли, добавляя Eu-меченное антитело к GST. В результате связывания индикатора и антитела с киназой наблюдается высокая степень FRET (fluorescence resonance energy transfer - резонансный перенос энергии флуоресценции), в то время как замена индикатора на ингибитор киназы приводит к затуханию FRET.
При проведении анализа использовали приведенные ниже условия и материалы.
Конечные условия в анализе
Подготовка планшета с соединениями
Выполнить серийные разведения тестируемых соединений (из 10 мМ концентрированных растворов) в соотношении 1:3,16 (20 мкл + 43,2 мкл) в 100%-ном DMSO для получения кривой по 12 точкам. Каждую концентрацию разбавить в соотношении 1:33,3 (3 мкл + 97 мкл) в реакционном буфере. Внести по 5 мкл в анализируемый планшет. Конечная максимальная тестируемая концентрация составляет 100 мкМ.
Подготовка общих и холостых проб
В лунки для общих и холостых проб (total and blank wells) добавляли по 5 мкл DMSO (3%) и в лунки для холостых проб добавляли по 5 мкл Eu-меченного антитела к GST (6 нМ), все в реакционном буфере. В содержащие соединения и в "общие" лунки добавить по 5 мкл смеси LRRK2 (30 нМ)/Eu-меченное антитело к GST (6 нМ).
Процедура анализа
Во все лунки добавить по 5 мкл индикатора киназной активности (25,5 нМ). Инкубирование планшетов осуществить при комнатной температуре в течение 1 часа на планшетном шейкере (слабое встряхивание). Считать протокол анализа гомогенной флуоресценции с разрешением по времени (homogeneous time-resolved fluorescence; HTRF) на ридере EnVision от Perkin Elmer.
Обработка данных
Выполнить расчет соотношения: (665/620)⋅10000. Из данных для всех точек вычесть средние значения для фона (значения лунок с холостой пробой). Рассчитать % от контроля для каждой тестируемой величины. Построить график зависимости % от контроля от концентрации соединения. Рассчитать величину Ki (аппроксимация кривой с помощью уравнения Моррисона с использованием программы XLfit). Результаты выражены в виде Ki в мкМ. Уравнение для Ki:
Y=V0⋅(1-((x+Ki⋅(1+S/Km)+Et)/(2⋅Et)-(((x+Ki⋅(1+S/Km)+Et)^2-(4⋅Et⋅x))^0,5)/(2*Et))),
где Et составляет 4 нМ,
kd (индикатор) составляет 8,5 нМ,
концентрация индикатора (S) составляет 8,5 нМ.
Пример 52. Анализ LRRK2 in vitro
Этот анализ использовали для оценки эффективности соединений в отношении ингибирования активности LRRK2 путем определения величин Kiкаж, IC50 или процента ингибирования. В полипропиленовом планшете инкубировали совместно LRRK2, меченный флуоресцентной меткой пептидный субстрат, АТФ и тестируемое соединение. С использованием LabChip 3000 (Caliper Life Sciences) по окончании реакции проводили разделение субстрата капиллярным электрофорезом на две разновидности: фосфорилированный и нефосфорилированный субстрат. Относительные количества каждого из них количественно определяли по интенсивности флуоресценции. Значение Ki в отношении LRRK2 определяли согласно уравнению:
Y=V0⋅(1-((x+Ki⋅(1+S/Km)+Et)/(2⋅Et)-(((x+Ki⋅(1+S/Km)+Et)^2-(4⋅Et⋅x))^0,5)/(2⋅Et))).
Величины Ki в ТАБЛИЦЕ 4 и где-либо еще в данном описании приведены в мкМ.
При проведении анализа использовали приведенные ниже условия и материалы.
Конечные условия в анализе

Подготовка планшета с соединениями
Для проведения серийных разведений в колонки 3-24 добавляли по 34,6 мкл DMSO. Для контролей в анализе в колонки 1 и 2 рядов А и Р добавляли по 37,5 мкл DMSO. В колонки 1 и 2, ряд В, добавляли a, d и по 50 мкл 25 мкМ G-028831 (стауроспорина). В отношении образцов: для инициирования реакции при 100 мкМ в колонки 1 и 2 добавляли по 37,5 мкл DMSO, затем по 12,5 мкл 10 мМ раствора соединения; для инициирования реакции при 100 мкМ в колонки 1 и 2 добавляли по 78 мкл DMSO, затем по 2 мкл 10 мМ раствора соединения; и для инициирования реакции при 1 мкМ в пустые колонки 1 и 2 добавляли 25 мкМ раствор соединения (2 мкл 10 мМ раствора соединения + 798 мкл DMSO). Для выполнения серийных разведений 1:3,16 ("PLK_BM_serial_halflog") использовали точный прибор.
Подготовка АТФ
Раствор АТФ разбавляли до 282,1 мкМ в полном буфере для киназной реакции (конечная концентрация составляла 130 мкМ).
Подготовка общих и холостых проб
Субстрат разбавляли в полном реакционном буфере до концентрации 4 мкМ. Объединяли равные объемы полного реакционного буфера и 4 мкМ раствора субстрата, получая холостую пробу. Объединяли равные объемы полного реакционного буфера и 4 мкМ раствор субстрата и к объединенному раствору добавляли LRRK2 в 2x конечной концентрации.
Процедура анализа
В лунки полипропиленового планшета с объемом лунок 50 мкл, предназначенные для холостых проб, добавляли вручную буфер/субстрат из расчета 5 мкл/лунка. Для инициирования киназной реакции ("PLK SAR 23 АТР") использовали Biomek FX. В соответствующие лунки добавляли следующее:
2 мкл соединения + 23 мкл АТФ;
соединение/АТФ из расчета 5 мкл/лунка в анализируемый планшет;
киназу/субстрат из расчета 5 мкл/лунка в анализируемый планшет;
Планшет инкубировали в течение 2 часов в темноте. Для остановки киназной реакции ("PLK Stop") использовали Biomek FX и в анализируемый планшет добавляли стоп-раствор из расчета 10 мкл/лунка. Результаты прочитывали на LabChip 3000.
Протокол для LabChip 3000
Работу на LabChip 3000 проводили, используя программу "LRRK2 IC50" со следующими рабочими настройками:
Пример 53. Мышиная модель болезни Паркинсона
Болезнь Паркинсона можно воспроизвести у мышей и у приматов путем введения 1-метил-4-фенилтетрагидропиридина (МРТР), селективного нигростриального дофаминергического нейротоксина, который вызывает потерю маркера нервных окончаний - дофамина (DA) в стриатуме. Оценку соединений по изобретению на предмет эффективности в лечении болезни Паркинсона можно провести с использованием МРТР-индуцированной нейродегенерации, в целом следуя протоколу, описанному в Saporito et al., J. Pharmacology (1999) Vol. 288, pp. 421-427.
Кратко, МРТР растворяют в PBS (забуференный фосфатом физиологический раствор) в концентрациях 2-4 мг/мл и мышам (самцам С57 весом 20-25 г) делают подкожную инъекцию в дозе 20-40 мг/кг. Соединения по изобретению солюбилизируют, используя гидроксистеарат полиэтиленгликоля, и растворяют в PBS. Мышам вводят подкожной инъекцией раствор соединения в дозе 10 мл/кг за 4-6 ч до введения МРТР и затем один раз в сутки в течение 7 суток. В день последней инъекции мышей умерщвляют и средний мозг блокируют и далее фиксируют в параформальдегиде. Полосатые тела отсекают, взвешивают и хранят при -70°C.
Собранные таким образом полосатые тела оценивают на предмет содержания дофамина и его метаболитов дигидроксифенилуксусной кислоты и гомованилиновой кислоты посредством HPLC с использованием электрохимических методов детекции, как описано в Sonsalla et al., J. Pharmacol. Exp. Ther. (1987) Vol. 242, pp. 850-857. Оценку полосатых тел также можно осуществить, используя анализ тирозингидроксилазы из Okunu et al., Anal. Biochem. (1987) Vol. 129, pp. 405-411 путем измерения выделения 14CO2, ассоциированного с тирозингидроксилаза-опосредуемым превращением меченного тирозина в L-допу. Кроме того, оценку полосатых тел можно осуществить с использованием анализа моноаминоксидазы-В, который описан в White et al., Life Sci. (1984), Vol. 35, pp. 827-833, и путем мониторинга захвата дофамина, как описано в Saporito et al.(1992) Vol. 260, pp. 1400-1409.
Несмотря на то, что настоящее изобретение описано со ссылкой на конкретные его воплощения, специалистам в данной области техники следует понимать, что могут быть внесены различные изменения и могут быть сделаны замены на эквиваленты без отклонения от истинной сущности и объема изобретения. Помимо этого могут быть сделаны многочисленные модификации с целью адаптации конкретной ситуации, вещества, композиции объекта (изобретения), способа, стадии или стадий способа к объективной сущности и действительному объему настоящего изобретения. Подразумевается, что все модификации включены в объем формулы изобретения, прилагаемой к заявке.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРАЗОЛАМИНОПИРИМИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ОБОГАЩЕННОЙ ЛЕЙЦИНОВЫМИ ПОВТОРАМИ КИНАЗЫ 2 (LRRK2) ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ БОЛЕЗНИ ПАРКИНСОНА | 2013 |
|
RU2637948C2 |
| ПРОИЗВОДНЫЕ 2-(ФЕНИЛ ИЛИ ПИРИД-3-ИЛ)АМИНОПИРИМИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ БОГАТОЙ ЛЕЙЦИНОМ ПОВТОРНОЙ КИНАЗЫ 2 (LRRK2) ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2012 |
|
RU2647849C2 |
| ГЕТЕРОЦИКЛИЛЬНЫЕ ПИРИМИДИНОВЫЕ АНАЛОГИ В КАЧЕСТВЕ ИНГИБИТОРОВ Tук2 | 2013 |
|
RU2641895C2 |
| ФТОР-18 И УГЛЕРОД-11 МЕЧЕНЫЕ РАДИОЛИГАНДЫ ДЛЯ ТОМОГРАФИИ С ПОЗИТРОННОЙ ЭМИССИЕЙ (РЕТ), ВИЗУАЛИЗИРУЮЩЕЙ LRRK2 | 2012 |
|
RU2650641C2 |
| БИ-АРИЛ-МЕТА-ПИРИМИДИНОВЫЕ ИНГИБИТОРЫ КИНАЗ | 2006 |
|
RU2589878C2 |
| БИ-АРИЛ-МЕТА-ПИРИМИДИНОВЫЕ ИНГИБИТОРЫ КИНАЗ | 2006 |
|
RU2597364C2 |
| ПРОИЗВОДНЫЕ АМИНОПИРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ БОГАТОЙ ЛЕЙЦИНОМ ПОВТОРНОЙ КИНАЗЫ 2 (LRRK2) | 2012 |
|
RU2634716C2 |
| ИНГИБИТОРНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2673079C2 |
| Замещенные N2-(4-амино-2-метоксифенил)-N4-[2-(диметилфосфорил)-фенил]-5-хлор-пиримидин-2,4-диамины в качестве модуляторов ALK и EGFR, предназначенные для лечения рака | 2015 |
|
RU2607371C1 |
| ИНГИБИТОР EGFR И ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2015 |
|
RU2702631C2 |
Изобретение относится к производным пиразоламинопиримидина, перечисленным в пункте 1 формулы изобретения, которые представляют собой модуляторы обогащенной лейциновыми повторами киназы 2 (LRRK2), фармацевтической композиции их содержащей, применению этих соединений для лечения заболеваний, ассоциированных с рецептором LRRK2, таких как болезнь Паркинсона, и к способу лечения болезни Паркинсона. 4 н. и 2 з.п. ф-лы, 4 табл., 52 пр.
1. Соединение, выбранное из:
N2-(1',5-диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)-пиримидин-2,4-диамина;
N2-(1',3-диметил-1'Н-1,4'-бипиразол-4-ил)-N4-метил-5-(трифторметил)-пиримидин-2,4-диамина;
4-(циклопропиламино)-2-((5-метил-1-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-4-ил)амино)пиримидин-5-карбонитрила;
4-(циклопропиламино)-2-((3-метил-1-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-4-ил)амино)пиримидин-5-карбонитрила;
2-((1-(1-цианопропил)-5-метил-1Н-пиразол-4-ил)амино)-4-(циклопропиламино)пиримидин-5-карбонитрила;
N2-(1-(1-фтор-2-метилпропан-2-ил)-3-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
2-((5-хлор-1-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-4-ил)амино)-4-(этиламино)пиримидин-5-карбонитрила;
5-бром-N2-(1,5-диметил-1Н-пиразол-4-ил)-N4-метилпиримидин-2,4-диамина;
2-метил-2-(3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)пропан-1-ола;
1-((5-хлор-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)метил)циклопропанола;
N2-(3-хлор-1-(2-(4-этил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(1-этил-1Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(3-метилоксетан-3-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-(2-(1,4-диметил-1Н-имидазол-2-ил)пропан-2-ил)-3-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(2-(5-метилоксазол-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(3-метилоксетан-3-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(1-((2-метоксиэтил)сульфонил)-3-метил-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-((2-метоксиэтил)сульфонил)-3-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-((2-метоксиэтил)сульфонил)-5-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(5-хлор-1-(2-(4-метил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(5-метил-1-(2-(1-метил-1Н-пиразол-3-ил)пропил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(2-(пиримидин-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(5-метил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(2-(5-метил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(1-(2-(5-этил-1,3,4-оксадиазол-2-ил)пропан-2-ил)-3-метил-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(1-(2-(1-изопропил-1Н-1,2,4-триазол-3-ил)пропан-2-ил)-3-метил-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(4-метил-4Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(3-хлор-1-(2-(1-метил-1Н-1,2,4-триазол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-N4-этил-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(5-метил-1-(2-(1-метил-1Н-пиразол-3-ил)этил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(2-(1-метил-1Н-пиразол-3-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-этил-N2-(3-метил-1-(2-(1-метил-1Н-пиразол-5-ил)пропан-2-ил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N4-метил-N2-(3-метил-1-(2-(1-метил-1Н-пиразол-3-ил)этил)-1Н-пиразол-4-ил)-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-(3-фтортетрагидро-2Н-пиран-4-ил)-3-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-(3-фтортетрагидро-2Н-пиран-4-ил)-5-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
N2-(1-((3R)-3-фтортетрагидро-2Н-пиран-4-ил)-5-метил-1Н-пиразол-4-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина;
3-метил-3-(3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)бутаннитрила;
2-((3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)метил)бутаннитрила;
2-(5-((4-(этиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1-метил-1Н-пиразол-3-ил)-2-метилпропаннитрила;
2-метил-2-(1-метил-5-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-3-ил)пропаннитрила;
2-((1-(2-цианопропан-2-ил)-3-метил-1Н-пиразол-4-ил)амино)-4-(циклопропиламино)пиримидин-5-карбонитрила;
2-((1-(2-цианопропан-2-ил)-3-метил-1Н-пиразол-4-ил)амино)-4-(этиламино)пиримидин-5-карбонитрила;
2-метил-2-(3-метил-4-((4-(метиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1Н-пиразол-1-ил)бутаннитрила и
5-((4-(этиламино)-5-(трифторметил)пиримидин-2-ил)амино)-1-метил-1Н-пиразол-3-карбонитрила,
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция, ингибирующая активность обогащенной лейциновыми повторами киназы 2 (LRRK2), содержащая:
(a) фармацевтически приемлемый носитель; и
(b) соединение или его фармацевтически приемлемую соль по п. 1.
3. Способ лечения болезни Паркинсона, включающий введение субъекту, нуждающемуся в этом, эффективного количества соединения или его фармацевтически приемлемой соли по п. 1.
4. Соединение или его фармацевтически приемлемая соль по п. 1 для применения в качестве терапевтически активного вещества для ингибирования активности LRRK2.
5. Соединение или его фармацевтически приемлемая соль по п. 1 для применения в качестве терапевтически активного вещества для терапевтического и/или профилактического лечения болезни Паркинсона.
6. Применение соединения или его фармацевтически приемлемой соли по п. 1 в терапевтическом и/или профилактическом лечении болезни Паркинсона.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2340611C2 |
Авторы
Даты
2017-12-08—Публикация
2013-04-30—Подача