Предлагаемое изобретение относится к области клинической медицины, более конкретно к работам по определению паразитологических агентов в клиническом материале - кале, в смывах объектов окружающей среды, в почве адаптированным методом иммуномагнитной сепарации с последующим иммунофлюоресцентным мечением с разработанной пробоподготовкой биологического материала к проведению исследований.
Современный этап развития паразитологических лабораторных исследований позволяет проводить комплексную оценку паразитарной системы с использованием микроскопических, иммунных, иммунохимических и высокотехнологических методов анализа, в т.ч. метода полимеразной цепной реакции и применение комплекса автоматизированной микроскопии. В последние годы методика паразитологических анализов подверглась радикальной модернизации, позволившей создать современный уровень условий труда врача, точности и производительности. Однако при аналитической обработке показателей паразитарной заболеваемости населения независимые эксперты применяют термины «истинной» и «регистрируемой» распространенности паразитозов, подчеркивая невысокую эффективность диагностической работы учреждений здравоохранения и несоответствующие расчетам статистические показатели загрязнения окружающей среды паразитарными патогенами. До настоящего времени в паразитологических лабораториях при определении качества воды на наличие ооцист криптоспоридий и цист лямблий применяются архаичные классические методы, обладающие очень низкой чувствительностью.
Известен способ по исследованию воды на наличие цист лямбли и ооцист криптоспоридий методом иммуномагнитного разделения и мечения флюоресцирующими антителами, включающий отбор проб, проведение исследований и оценку результатов. (Методические указания МУК 4.2.2314-08, МУК 4.2.2959-11).Указанный способ достаточно длительный по времени и трудоемкий и для его реализации необходимо дорогостоящее оборудование и реактивы, ограничен объектом исследования - вода.
Достигаемым при использовании предлагаемого изобретения техническим результатом является повышение эффективности комплексного определения яиц гельминтов, цист патогенных кишечных простейших, в том числе ооцист криптоспоридий в одной постановке методом иммуномагнитной сепарации с последующим иммунофлюоресцентным мечением в биологическом материале кале, в смывах объектов окружающей среды, в почве и сокращении временных затрат на исследование одной пробы исследуемого материала до 15 минут.
Технический результат достигается тем, что в способе определения в одной постановке цист лямблий и ооцист криптоспоридий в биологическом материале - кале, в смывах объектов окружающей среды, в почве, включающем отбор проб, проведение исследований и оценку результатов, при проведении исследований при связывании и промывке цист лямблий и ооцист криптоспоридий переносят ресуспензированный исследуемый осадок в магнитную пробирку и производят оценку микроскопированием с применением насадки «Опти-Люм» на микроскоп, результат учитывают исходя из того, что цисты лямблий представляют собой сверкающие и флюоресцирующие яблочно-зеленым светом объекты, от округлых до овальных от 8 до 14 мкм в длину на 7-10 мкм в ширину, с ярко подсвеченными краями, ооцисты криптоспоридий представляют собой сверкающие и флюоресцирующие яблочно-зеленым светом объекты, от овальных до сферических от 3 до 5 мкм в диаметре, с ярко подсвеченными краями.
Предлагаемый способ реализуется следующим образом.
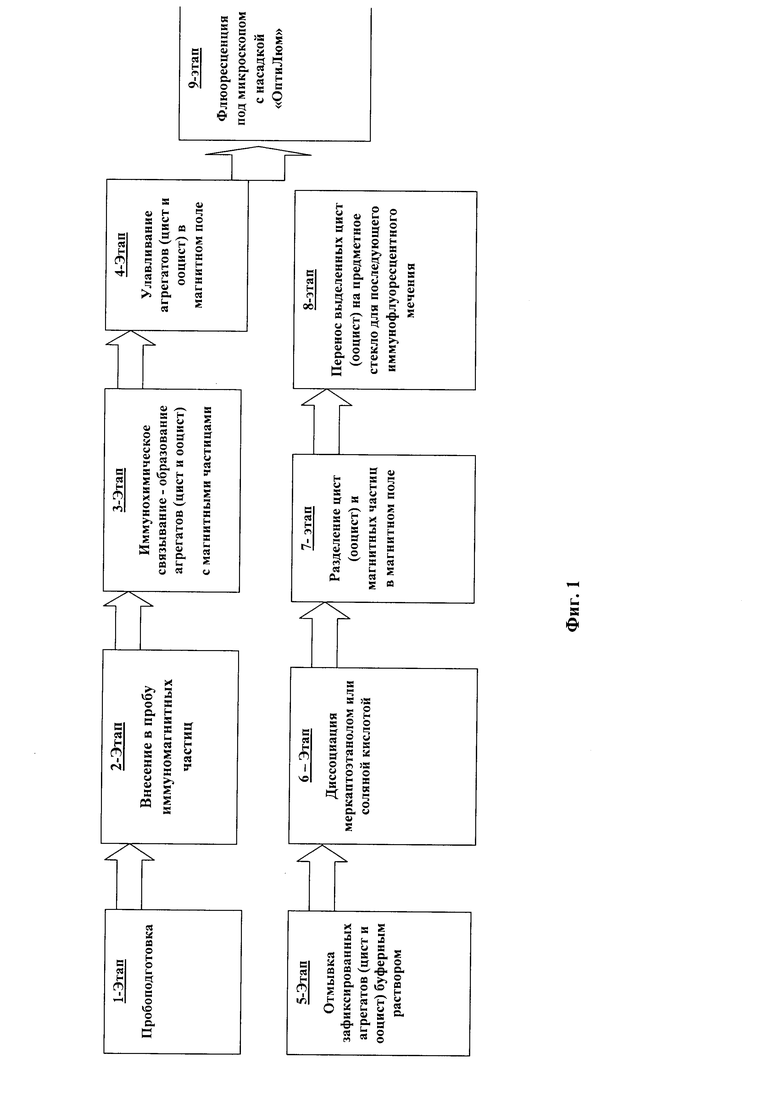
Процедура связывания и промывки цист лямблий и ооцист криптоспоридий заключается в следующем: вносят 5 мл буфера из диагностического набора в магнитную пробирку с плоской боковой поверхностью для иммуномагнитной сепарации, закрывают пробирку крышкой и вращают пробирку, смачивая буфером ее внутренние стенки; в нее вносят диагностический осадок. Весь объем иммуномагнитной суспензии Cryptosporidium Beads и Giardia Beads диагностического набора перемешивают на вортексе в течение 10-15 с, отбирают микродозатором из каждого флакона по 100 мкл (0,1 мл) суспензии и переносят ее в ИМС-пробирку, в которой уже находится порция с диагностическим осадком. Закрывают крышку, закрепляют магнитную пробирку в штативе лабораторного ротатора и перемешивают в течение одного часа при скорости 15-25 об/мин маятникообразными движениями (не переворачивая пробирку!). Затем магнитную пробирку извлекают из ротатора и помещают в магнитный штатив MagnetOn 4Т™; при этом плоская сторона пробирки должна быть обращена к магниту штатива; в течение 2 мин, не переворачивая пробирку, наклоняют пробирку вместе с магнитным штативом по направлению от дна к крышке пробирки и наоборот. По мере движения на плоской стороне магнитной пробирки будет образовываться осадок (налет). Не вынимая ИМС-пробирку из магнитного штатива, открывают крышку и осторожно сливают надосадочную жидкость из пробирки. В магнитную пробирку добавляют 1 мл моющего буфера IT-Wash Buffer (WB), снимают пробирку из штатива, взбалтывают ее для полного смыва осадка с плоской стороны пробирки. С помощью магнитной ручки SepPen собирают магнитную суспензию. Из магнитную пробирки удаляют магнитную ручку SepPen.
В микроцентрифужную пробирку типа Epindorf (объемом на 1,5-2 мл) помещают 1 мл моющего буфера WB и в нее вносят ранее собранную суспензию. Во вторую магнитную пробирку добавляют 1 мл буфера WB, закрывают крышку и промывают буфером внутренние стенки пробирки и крышки, магнитную пробирку помещают в магнитный штатив Magnet Оn4Т™; наклоняя вправо-влево в течение 30-60 с, промывают внутреннюю поверхность пробирки и собирают остатки магнитной суспензии. Не вынимая магнитную пробирку из магнитного штатива, сливают моющий буфер WB из пробирки и добавляют в пробирку новую порцию моющего буфера WB объемом 1 мл. Крышку закрывают и повторяют процедуру промывки. Далее магнитную пробирку снимают со штатива и взбалтыванием смывают суспензию с плоской стороны пробирки. С помощью магнитной ручки SepPen образовавшуюся суспензию переносят в микроцентрифужную пробирку, в которую предварительно внесли моющий буфер WB и первую порцию обработанного диагностического осадка, устанавливают ее в магнитный штатив и в течение 1 мин вместе со штативом наклоняют вправо-влево, оставляют на 15 с в вертикальном положении. Не вынимая микроцентрифужную пробирку из магнитного штатива, сливают моющий буфер WB из пробирки, добавляют в пробирку 1 мл новой порции моющего буфера WB.
Процедура диссоциации заключается в следующем: не вынимая микроцентрифужную пробирку из магнитного штатива, открывают крышку и сливают моющий буфер из пробирки, добавляют в пробирку 100 мкл рабочего раствора 2-меркаптоэтанола, суспензию перемешивают на вортексе в течение 30 с и помещают в термостат или водяную баню при 50°C на 5 мин, затем повторно суспензию в микроцентрифужной пробирке перемешивают на вортексе в течение 30 с и устанавливают в магнитный штатив. Не вынимая пробирку из магнитного штатива, отбирают супернатант и переносят его на слайд SuperStick™ для последующего иммунофлюоресцентного мечения. Во второе окно слайда S100-2 вносят каплю положительного контроля - G. lamblia, С. parvum.
Детекцию (идентификация) ооцист криптоспоридий и цист лямблий методом иммунофлюоресцентного мечения проводят в несколько этапов. Подготовка к мечению. По одной капле (около 45 мкл) рабочего раствора иммунореагента AquaGlo™ G/C* вносят в каждую лунку слайда с подсушенной пробой и контролем. Слайды помещают в ячейку влажности в темноте и инкубируют не менее 30 мин при 37°C или не менее 40 мин при комнатной температуре. В каждую лунку наносят по одной капле фосфатного буфера (PBS) или солевого раствора и выдерживают не менее 2 мин. Каждый слайд наклоняют на чистую фильтровальную бумагу и осторожно аспирируют излишек жидкости.
Процедура мечения заключается в следующем: по одной капле контрастирующего красителя вносят в каждую лунку и выдерживают 1 мин при комнатной температуре, далее в нее добавляют по одной капле разведенного с дистиллированной водой (в соотношении 1:19) фосфатного буфера (PBS) или солевого моющего буфера 20XWash Buffer и выдерживают 1 мин при комнатной температуре. Излишек жидкости из нижней части лунок слайдов аспирируют с помощью фильтровальной бумаги или пастеровской пипетки. Слайды раскладывают на наклонном штативе и подсушивают при комнатной температуре. Затем в лунки вносят по 1 капле монтирующей среды No-Fade™, покрывают покровным стеклом, края заклеивают канадским бальзамом или бесцветным лаком.
Препараты микроскопируют под масляной иммерсией на люминесцентном микроскопе или с применением насадки «Опти-Люм», преобразующей световой микроскоп в люминесцентный. Исследуют препараты при х200. Перед началом микроскопии диагностических препаратов предварительно просматривают препараты положительного контроля из диагностического набора с подсчитанными цистами лямблий и ооцистами криптоспоридий.
Результат учитывают исходя из того, что цисты лямблий - сверкающие и флюоресцирующие яблочно-зеленым светом объекты, от округлых до овальных (8-14 мкм в длину на 7-10 мкм в ширину), с ярко подсвеченными краями; ооцисты криптоспоридий - сверкающие и флюоресцирующие яблочно-зеленым светом объекты, от овальных до сферических (от 3 до 5 мкм в диаметре), с ярко подсвеченными краями.
Предлагаемый способ поясняется примерами.
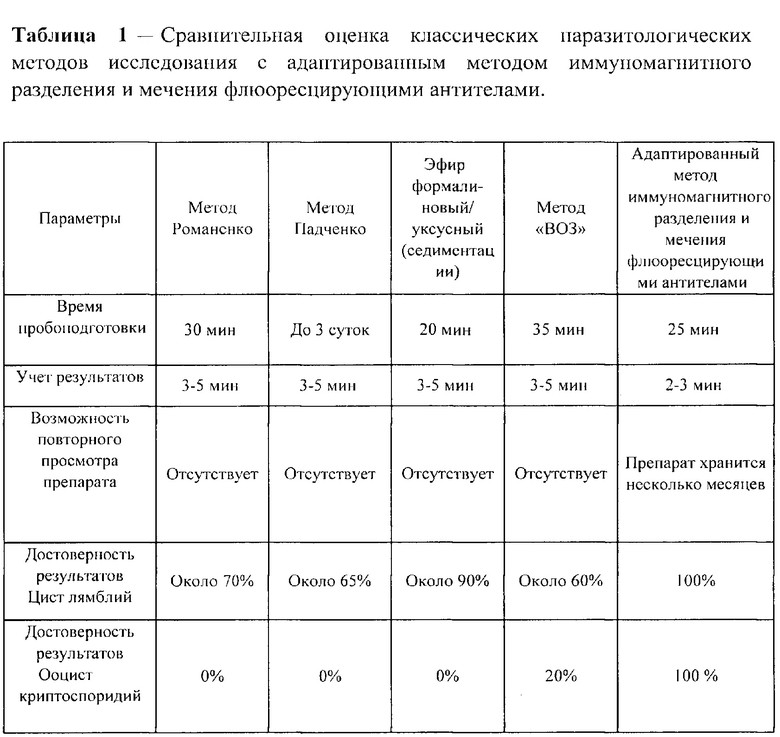
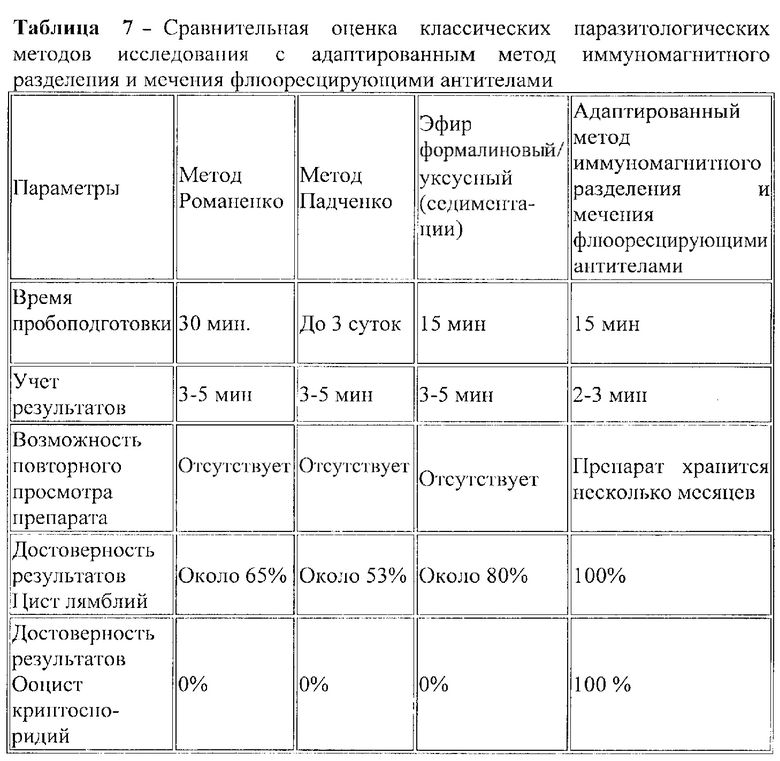
Пример 1. Выявление ряда преимуществ адаптированного метода иммуномагнитного разделения и мечения флюоресцирующими антителами при сравнительной оценке классических методов выявления паразитологических возбудителей из различных объектов окружающей среды и клиническом материале (Таблица 1).
Адаптированный метод иммуномагнитного разделения и мечения флюоресцирующими антителами занимает 25 мин для пробоподготовки, кроме эфирформалинового, позволяет быстро учесть результат, препараты хранятся несколько месяцев, ооцисты криптоспоридий определяются только методом ИМС, кроме дополнительного метода окрашивания по Циль-Нильсону при исследовании клинического материала - кал, 100% достоверность результата по выявлению цист лямблий и ооцист криптоспоридий (Таблица 1).
На Фиг. 1. Схематично изображены этапы адаптированного метода иммуномагнитного разделения и мечения флюоресцирующими антителами.
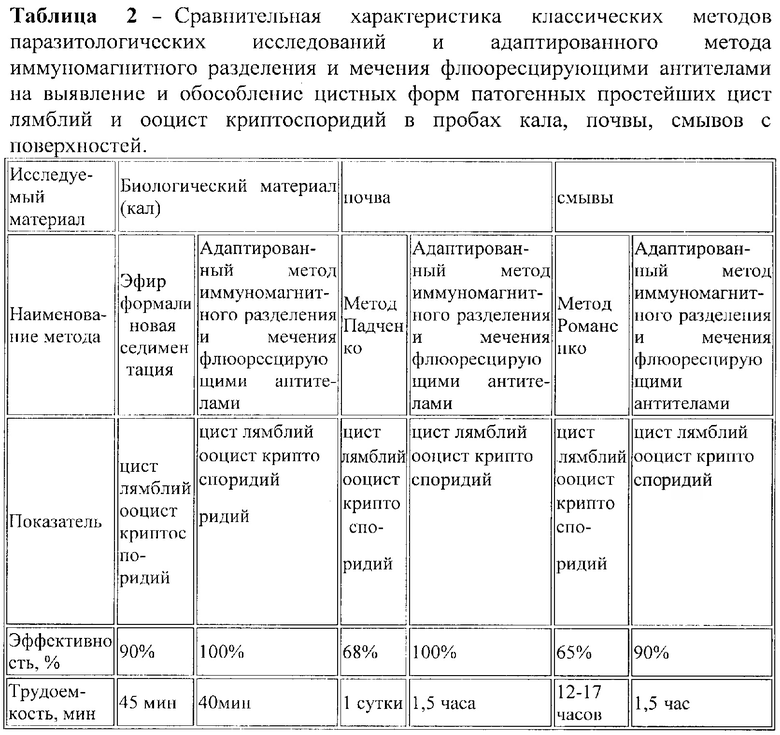
Пример 2. Проведена экспериментальная серия исследований по определению чувствительности адаптированного метода иммуномагнитного разделения и мечения флюоресцирующими антителами по всем видам образцов. В результате установлено, что чувствительность адаптированного метода иммуномагнитного разделения и мечения флюоресцирующими антителами при исследованиях проб объектов окружающей среды без потери исследуемого материала на этапе пробоподготовки (кал, смывы с поверхностей) составляет до 100%. Чувствительность адаптированного метода иммуномагнитного разделения и мечения флюоресцирующими антителами при исследованиях проб с частичной потерей исследуемого материала на этапе пробоподготовки (почва) составляет до 85-90% (Таблица 2).
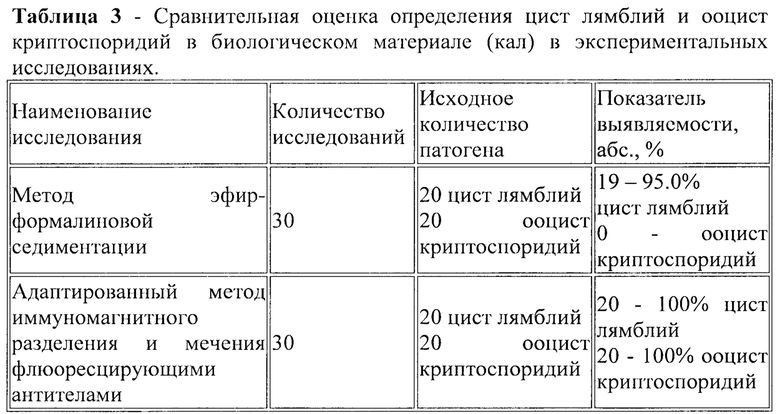
Пример 3. При исследовании 650 проб натурного материала 2 методами установлена 100% эффективность адаптированного метода иммуномагнитного разделения и мечения флюоресцирующими антителами при определении цист лямблий и ооцист криптоспоридий. Для определения специфичности адаптированного метода иммуномагнитного разделения и мечения флюоресцирующими антителами использовали экспериментальные модели с искусственным заражением натурного материала. Эффективность адаптированного метода иммуномагнитного разделения и мечения флюоресцирующими антителами в экспериментальной серии исследований проб кала составила 100% цист лямблий, 100% ооцист криптоспоридий при показателях исследований экспериментальных проб кала методом эфирформалинового осаждения соответственно 95.0% цист лямблий, 0 - ооцист криптоспоридий, не обнаружены (Таблица 3).
Пример 4. При исследовании 900 проб натурного материала 2 методами, осадка и надосадочной жидкости, установлена 90.0% выявляемость определения цист лямблий и 70.0% ооцист криптоспоридий адаптированным методом иммуномагнитного разделения и мечения флюоресцирующими антителами, объясняющейся частичной потерей паразитарных патогенов при проведении пробоподготовки.
Выявляемость определения составляет около 30,0% цист лямблий и 0% ооцист криптоспоридий методом Падченко. При эффективности определения паразитарных патогенов в почве адаптированным методом иммуномагнитного разделения и мечения флюоресцирующими антителами определяется 90% цист лямблий и 100% ооцист криптоспоридий. Для определения специфичности адаптированного метода иммуномагнитного разделения и мечения флюоресцирующими антителами использовали экспериментальные модели с искусственным заражением натурного материала. Эффективность адаптированного метода иммуномагнитного разделения и мечения флюоресцирующими антителами в экспериментальной серии исследований составила 100.0% цист лямблий, 100.0% ооцист криптоспоридий, в отличии от метода Падченко, эффективность которого составила 55.0% для цист лямблий, 0% - для ооцист криптоспоридий (Таблица 4).

Пример 5. При исследовании 900 проб натурного материала осадка и надосадочной жидкости 2 методами установлена 90.0% выявляемость определения цист лямблий и 70.0% ооцист криптоспоридий адаптированным методом иммуномагнитного разделения и мечения флюоресцирующими антителами, объясняющейся частичной потерей паразитарных патогенов при проведении пробоподготовки.
Методом Падченко определяется около 30,0% цист лямблий и 0% - ооцист криптоспоридий. Процент эффективности определения паразитарных патогенов в почве методом ИМС составляет 90% цист лямблий и 100% ооцист криптоспоридий.
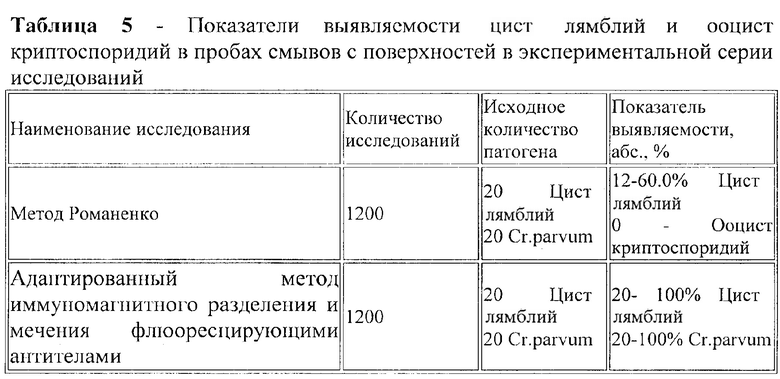
Для определения специфичности адаптированного метода иммуномагнитного разделения и мечения флюоресцирующими антителами использовали натурные исследования 20 проб смывов с поверхностей объектов окружающей среды (пробы отбирались в плавательных детских и взрослых бассейнах, объекты - полы, стены, ручки дверей) и экспериментальные модели с искусственным заражением проб смывов. По результатам исследований смывов с поверхностей адаптированным методом иммуномагнитного разделения и мечения флюоресцирующими антителами обнаружено 5 цист лямблий и 3 ооцисты криптоспоридий, а методом Романенко цисты лямблий и ооцисты криптоспоридий не обнаружены. Пробы смывов с поверхностей бассейнов искусственно заражали по 20 ед. цист лямблий и 20 ед. ооцист криптоспоридий. Эффективность определения цист лямблий и ооцист криптоспоридий в экспериментальной серии исследований адаптированным методом иммуномагнитного разделения и мечения флюоресцирующими антителами составила 100.0%, в отличие от метода Романенко, эффективность которого составила 55.0% цист лямблий и 0% ооцист криптоспоридий (Таблица 5).
Пример 6. Исследование 500 проб натурного материала с плодовоовощной продукции (свекла, морковь, картофель, клубника) осуществлялось 3 методами: надосадочную жидкость исследовали методом Романенко и адаптированным методом иммуномагнитного разделения и мечения флюоресцирующими антителами, почвенный осадок исследовали методом последовательной фильтрации через аналитические трековые мембраны фильтрации и адаптированный метод иммуномагнитного разделения и мечения флюоресцирующими антителами. В надосадочной жидкости установлена 100% эффективность определения цист лямблий и ооцист криптоспоридий адаптированным методом иммуномагнитного разделения и мечения флюоресцирующими антителами. Процент выявляемости паразитарных патогенов при исследовании почвенного осадка классическим методом фильтрации составляет 25.0% для цист лямблий и 0 - ооцист криптоспоридий, а адаптированным методом иммуномагнитного разделения и мечения флюоресцирующими антителами 90.0% для цист лямблий и 85.0% для ооцист криптоспоридий (Таблица 6).

Пример 7. Сравнительная оценка классических методов выявления паразитологических патогенов из различных объектов окружающей среды и в клиническом материале в сравнении с адаптированным методом иммуномагнитного разделения и мечения флюоресцирующими антителами и выявление ряда преимуществ предлагаемого метода: занимает 25 мин для пробоподготовки; позволяет быстро учесть результат; препараты хранятся несколько месяцев; ооцисты криптоспоридий определяются только адаптированным методом иммуномагнитного разделения и мечения флюоресцирующими антителами, кроме дополнительного метода окрашивания по Циль-Нильсону при исследовании клинического материала (кал); 100% достоверность результата по выявлению цист лямблий и ооцист криптоспоридий (Таблица 7).
Таким образом, высокая чувствительность, специфичность и целевая направленность способа определения цист лямблий и ооцист криптоспоридий в клиническом материале - кале, в смывах с объектов окружающей среды и в почве адаптированным методом иммуномагнитной сепарации с последующим иммунофлюоресцентным мечением позволяет определять малые дозы паразитарных патогенов в окружающей среде, что имеет особенно важное значение при санитарно-эпидемиологической и экологической оценке рисков на территориях с нехарактерной для данной местности и/или на удаленной от источника циркуляции возбудителей. Указанные характеристики нового метода, возможность его применения для комплексной оценки паразитологической ситуации, позволят обеспечить достоверность исследований, их информативность и оперативность в принятии управленческих решений и способствовать повышению эффективности государственного мониторинга в области охраны здоровья и окружающей среды.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ пробоподготовки биологического материала кала для определения цист лямблий и ооцист криптоспоридий | 2016 |
|
RU2638811C1 |
| Способ пробоподготовки образцов почвы для определения цист лямблий и ооцист криптоспоридий | 2016 |
|
RU2640927C1 |
| Способ определения жизнеспособности цист лямблий в биологическом материале при низких температурах | 2019 |
|
RU2725951C1 |
| СПОСОБ ОБНАРУЖЕНИЯ ПАРАЗИТАРНЫХ ЗАГРЯЗНЕНИЙ | 2008 |
|
RU2371203C1 |
| Средство дезинвазии против паразитических простейших молодняка крупного рогатого скота | 2023 |
|
RU2802317C1 |
| Способ дезинвазии сточных вод и их осадков при помощи ультразвука | 2019 |
|
RU2715168C1 |
| Средство для дезинвазии объектов внешней среды | 2020 |
|
RU2727519C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПАРАЗИТАРНЫХ ВОЗБУДИТЕЛЕЙ КИШЕЧНЫХ ЗАБОЛЕВАНИЙ В ВОДЕ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1996 |
|
RU2109815C1 |
| Средство для дезинвазии объектов внешней среды | 2020 |
|
RU2748168C1 |
| Набор для комплексной диагностики эндопаразитов животных методом копроскопии | 2016 |
|
RU2683324C2 |
Изобретение относится к медицине и ветеринарии и представляет собой способ определения в одной постановке цист лямблий и ооцист криптоспоридий в биологическом материале - кале, в смывах объектов окружающей среды и в почве, заключающийся в подготовке пробы, внесении в пробу иммуномагнитных частиц, иммунохимическом связывании, в результате чего образуются агрегаты цист и ооцист с магнитными частицами, улавливании агрегатов цист и ооцист в магнитном поле, отмывке зафиксированных агрегатов цист и ооцист буферным раствором, диссоциации меркаптоэтанолом или соляной кислотой, разделении цист, ооцист и магнитных частиц в магнитном поле, переносе выделенных цист и ооцист на предметное стекло для последующего иммунофлуоресцентного мечения и последующей оценки микроскопированием с применением насадки «Опти-Люм» на микроскоп, где результат учитывают исходя из того, что цисты лямблий представляют собой сверкающие и флюоресцирующие яблочно-зеленым светом объекты, от округлых до овальных от 8 до 14 мкм в длину на 7-10 мкм в ширину, с ярко подсвеченными краями, ооцисты же криптоспоридий представляют собой сверкающие и флюоресцирующие яблочно-зеленым светом объекты, от овальных до сферических от 3 до 5 мкм в диаметре, с ярко подсвеченными краями. Изобретение обеспечивает повышение эффективности определения в одной постановке цист лямблий и ооцист криптоспоридий в биологическом материале - кале, в смывах с овощей и объектов окружающей среды, в почве и сокращение временных затрат на исследование одной пробы исследуемого материала адаптированным до 15 минут. 7 пр., 7 табл., 1 ил.
Способ определения в одной постановке цист лямблий и ооцист криптоспоридий в биологическом материале - кале, в смывах объектов окружающей среды и в почве, заключающийся в подготовке пробы, внесении в пробу иммуномагнитных частиц, иммунохимическом связывании, в результате чего образуются агрегаты цист и ооцист с магнитными частицами, улавливании агрегатов цист и ооцист в магнитном поле, отмывке зафиксированных агрегатов цист и ооцист буферным раствором, диссоциации меркаптоэтанолом или соляной кислотой, разделении цист, ооцист и магнитных частиц в магнитном поле, переносе выделенных цист и ооцист на предметное стекло для последующего иммунофлюоресцентного мечения и последующей оценки микроскопированием с применением насадки «Опти-Люм» на микроскоп, где результат учитывают исходя из того, что цисты лямблий представляют собой сверкающие и флюоресцирующие яблочно-зеленым светом объекты, от округлых до овальных от 8 до 14 мкм в длину на 7-10 мкм в ширину, с ярко подсвеченными краями, ооцисты же криптоспоридий представляют собой сверкающие и флюоресцирующие яблочно-зеленым светом объекты, от овальных до сферических от 3 до 5 мкм в диаметре, с ярко подсвеченными краями.
| С.Н | |||
| Власова и др | |||
| Приспособление для зажимания набранных строк | 1929 |
|
SU15553A1 |
| Ж.М | |||
| Ардавова и др | |||
| "Санитарно-паразитологическое состояние объектов инфраструктуры населенных пунктов Кабардино-Балкарской республики", Российский паразитологический журнал, 2010, N2, стр.16-20 | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| В.А | |||
| Громова, Ю.В | |||
| Захарова "Руководство для самостоятельной работы студентов по санитарной микробиологии воды, почвы, лечебно-профилактических организаций", Кемерово - 2010, найдено в Интернет на сайте:http://www.kemsma.ru/do/microbiology/posobie_sanitarnaya_microbiologia.pdf. | |||
Авторы
Даты
2017-12-15—Публикация
2016-12-13—Подача