Изобретение относится к области медицины, а именно к пульмонологии и аллергологии, предназначено для прогнозирования дыхательной недостаточности у больных бронхиальной астмой (БА).
БА - хроническое аллергическое воспалительное заболевание дыхательных путей. В развитии аллергической реакции участвует множество компонентов, одним из которых может являться полиморфизм генов, продукты которых задействованы в патогенезе развития атопии. Молекулярно-генетические маркеры могут помочь в дифференциальной диагностике аллергических заболеваний, предсказании развития осложнений этого заболевания.
Течение бронхиальной астмы может осложняться различными патологическими состояниями. Одним из видов осложнений бронхиальной астмы является дыхательная недостаточность, которая развивается вследствие бронхиальной обструкции, нарушения вентиляционно-перфузионных соотношений и истощения дыхательной мускулатуры. Степень тяжести дыхательной недостаточности зависит от особенностей течения патологического процесса. Недавние исследования показывают различия в генах, вовлеченных в начало развития астмы и в генах, вовлеченных в развитие осложнений заболевания [Dijk FN, de Jongste JC, Postma DS, Koppelman GH. Genetics of onset of asthma. Curr Opin Allergy Clin Immunol. 2013. 13(2): 193-202; Talukdar D, Chaudhry N, Sharma R et al. Recent Advances in Asthma Genetics and Antiasthma Therapy. Current Respiratory Medicine Reviews. 2013. 9(4): 261-267]. Поэтому необходимо изучение генетических особенностей различных осложнений БА.
Увеличение доли лиц с осложнениями БА, высокая распространенность и неуклонный рост заболеваемости БА во всем мире свидетельствуют об актуальности изучения сложных механизмов развития этого заболевания с целью разработки эффективных методов прогнозирования с учетом индивидуальных особенностей каждого больного.
Актуальность прогноза осложнения БА связана с необходимостью своевременного назначения адекватной терапии. При тяжелом осложнении БА требуется более интенсивная терапия. Оценка осложнений затруднительна на раннем его этапе, когда должна определяться тактика ведения больного.
К медиаторам, продуцируемым эпителием дыхательных путей, относится тимусный стромальный лимфопоэтин (TSLP). TSLP - это интерлейкин-7 - подобный цитокин, который стимулирует дендритные и тучные клетки для активации Т-хелперов 2 типа. Его экспрессия наблюдается в эпителиальных клетках легких, кожи и кишечника. Ряд исследований показал, что ген TSLP связан с патогенезом астмы [Hunninghake G.М., Soto-Quiros М.Е., Avila L. et al. TSLP polymorphisms are associated with asthma in a sex-specific fashion. Allergy. 2010, 65(12), pp. 1566-1575; Ying S., O’Connor В., Ratoff J. et al. Expression and cellular provenance of thymic stromal lymphopoietin and chemokines in patients with severe asthma and chronic obstructive pulmonary disease. J. Immunol. 2008, 181(4), pp. 2790-2798]. Роль гена TSLP в развитии осложнений БА требует уточнения.
Известен способ прогнозирования дыхательной недостаточности у больных хроническими бронхолегочными заболеваниями с использованием системы интегральных клинических факторов [В.А. Игнатьев. Принципы системного подхода при изучении формирования и эволюции дыхательной и сердечной недостаточности у больных хроническими бронхолегочными заболеваниями // Гериатрические аспекты клинической пульмонологииʺ. Л., 1990. - С. 103-107]. Способ заключается в том, что вычисляют сумму в условных единицах предикторных клинических факторов прогрессирования дыхательной недостаточности, сравнивают ее с условной шкалой и по результатам сравнения определяют прогноз. К недостаткам известного способа следует отнести то, что он основан на анализе только прогностических клинических факторов и их качественных характеристик и не учитывает индивидуальные генетические особенности больного, определяющие генетическую предрасположенность к развитию осложнения заболевания.
Известен способ прогноза тяжести обострения атонической бронхиальной астмы [патент RU 2190217, 2000 г.], где в начале обострения заболевания в лимфоцитах больных определяют показатели активности ферментов глицерол-3-фосфатдегидрогеназы и НАД-зависимой малатдегидрогеназы и при показателях ниже 0,297 мкЕ/10000 клеток для ГЗФДГ и 0,638 мкЕ/10000 клеток для НАДМДГ прогнозируют тяжелую степень обострения заболевания. Авторы патента исследовали биохимические показатели, имеющие значение в прогнозировании обострения и ремиссии БА, не касаясь оценки дыхательной недостаточности.
Известен способ прогнозирования посленаркозной дыхательной недостаточности у хирургических больных, заключающийся в том, что на предоперационном осмотре по клинико-неврологическим симптомам выделяют больных с шейным остеохондрозом и дополнительно назначают рентгенологическое исследование шейного отдела позвоночника для определения группы риска с возможными циркуляторными расстройствами в расстройствами в вертебробазилярном бассейне и последующим развитием посленаркозной дыхательной недостаточности; проводят лечебно-профилактические мероприятия, включающие дополнительную медикаментозную предоперационную подготовку препаратами, улучшающими мозговой кровоток и ограничение подвижности головы при проведении интубации трахеи во время анестезии [патент RU 2187806, 2000 г.]. Данный способ разработан для прогноза посленаркозной дыхательной недостаточности у хирургических больных и не предназначен для прогноза дыхательной недостаточности у больных бронхиальной астмой.
Прототипом настоящего изобретения является метод, описанный Moffatt MF и др. [Moffatt MF, Gut IG, Demenais F et al. A large-scale, consortium-based genomewide association study of asthma. N Engl J Med. 2010; 363: 1211-1221], включающий генотипирование методом ПЦР полиморфного локуса rs1837253 гена TSLP. На основании полученных данных авторы сделали предположение о возможной связи полиморфного локуса rs1837253 гена TSLP с тяжелой формой БА. Данный метод разработан для прогноза тяжести течения БА, однако отдельно не рассматривает прогноз дыхательной недостаточности у больных БА.
Задачей изобретения стала разработка способа прогнозирования риска развития дыхательной недостаточности у больных БА.
Технический результат при использовании изобретения - получение критериев прогноза развития дыхательной недостаточности у больных БА.
Указанный технический результат достигается тем, что в способе прогнозирования дыхательной недостаточности у больных бронхиальной астмой, включающем выделение ДНК из лимфоцитов периферической венозной крови, генотипирование методом ПЦР полиморфного локуса rs1837253 гена тимусного стромального лимфопоэтина (TSLP), согласно изобретению при выявлении генотипа СС прогнозируют высокий риск развития дыхательной недостаточности у больных БА.
Предлагаемый способ осуществляется следующим образом.
ДНК выделяют из лимфоцитов периферической крови. В качестве консерванта используют раствор следующего состава: 0.48% лимонной кислоты, 1.32% цитрата натрия, 1.47% глюкозы. При заборе крови к 1 мл консерванта добавляют 4 мл крови и хорошо перемешивают.
Для получения ДНК необходимой степени чистоты и достаточного молекулярного веса используется метод выделения ДНК из крови фенольно-хлороформной экстракцией, описанный Мэтью [Mathew С.С. The isolation of high molecular weight eucariotic DNA // Methods in Molecular Biology. / Ed. Walker J.M., N.Y., L.: Human Press.; -1984.- V. 2. - P. 31-34].
1. Кровь в пробирке с консервантом тщательно перемешивается и переливается в центрифужный стакан на 100 мл, туда же добавляли 50 мл охлажденного лизирующего буфера, содержащего 320 мМ сахарозы, 1% раствор тритона Х-100, 5 мМ MgCl2, 10 мМ трисHCl (рН 7,6).
2. Смесь центрифугируется 20 мин при 4000 об/мин.
3. Надосадочную жидкость сливают, к получившемуся осадку приливают 8 мл 25 мМ ЭДТА, рН 8.0, суспендируют.
4. К суспензии добавляют 0,8 мл 10% SDS и протеиназу К (концентрация - 10 мг/мл). Смесь для лизиса оставляют на ночь в термостате при температуре 38°С.
Экстракцию ДНК осуществляют в следующем порядке.
1. Для депротеинизации к лизату добавляют 0,5 мл 5М перхлората натрия и 8 мл фенола, насыщенного 1М трисHCl до рН 7.8.
2. Смесь центрифугируют при 3000 об/мин в течение 10 мин.
3. Отбирают водную фазу, содержащую ДНК, РНК и неденатурированные белки.
4. Отобранную фазу обрабатывают смесью фенол-хлороформа (1:1), а затем - хлороформом.
5. Препараты осаждают двумя объемами 96% этанола.
6. Образовавшийся осадок ДНК растворяют в 1,5 мл деионизированной Н2O; раствор хранят при -20°С.
Анализ полиморфизма проводился методом полимеразной цепной реакции с детекцией накопления аллелей в реальном времени. Для проведения ПЦР использовались аликвоты исследуемых образцов ДНК. Амплификация проводилась с использованием прибора Rotor-GeneQ производства компании Quiagen. Условия амплификации были подобраны опытным путем. Температура отжига праймера рассчитывалась по формуле:

где А, Т, G и С - количество адениновых, тимидиновых, гуаниновых и цитозиновых остатков в последовательности праймера соответственно. Необходимое количество праймера рассчитывалось по формуле:
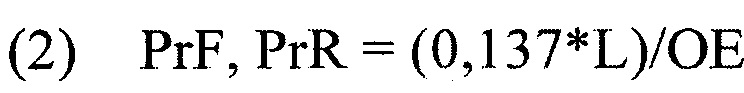
где ОЕ - количество оптических единиц праймера, L - длина праймера (п.о.).
Для генотипирования rs1837253 гена TSLP использовались праймеры: TSLP - F (5’-GCAAGAAATCTATTCАССТАС-3’) и TSLP - R (5’-ACACTCCAGATGAGAAATAA-3’). Для детекции накопления аллелей в реальном времени были использованы следующие олигонуклеотидные пробы, меченные флуорофором и гасителем: TSLP - G (R6G - ATTTGCTTCATAGTTTAGACACGTTGT- BHQ-1), TSLP - А (Су5.5 - ATTTGCTTCATAGTTTAGACACATTGT- BHQ-3). Режим амплификации следующий: денатурация (95°С, 7 мин); денатурация (95°С, 15 сек), отжиг (60°С, 20 сек) и элонгация (72°С, 15 сек).
Подбор праймеров и проб и подбор оптимальных условий проведения полимеразной цепной реакции осуществлялся с использованием программного обеспечения Primer-BLAST (http://www.ncbi.nlm.nih.gov/tools/primer_blast).
Интерпретацию результатов полимеразной цепной реакции в реальном времени проводили с помощью программных средств используемого реал-тайм амплификатора в автоматическом режиме.
При попарном сравнении частот аллелей и генотипов в группах больных использовали критерий χ2(р) для таблиц сопряженности 2×2. Для выявления факторов повышенного риска развития тяжелого течения БА, проводили оценку показателя соотношения шансов (OR - odds ratio), а также границ его 95% доверительного интервала (СI 95%). Степень ассоциаций оценивается в значениях показателя соотношения шансов по формуле:
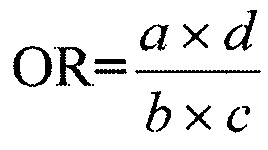
где а и b - число лиц с наличием и отсутствием маркера среди больных; c и d - число лиц с наличием и отсутствием маркера среди здоровых.
При OR=l нет ассоциации, OR>l рассматривается как положительная ассоциация с аллелем или генотипом («фактор повышенного риска») и OR<1 - как отрицательная ассоциация («фактор устойчивости»).
Группу исследования составили 144 больных БА с дыхательной недостаточностью в возрасте от 18 до 50 лет. Пациенты наблюдались в иммунно-аллергологическом отделении клиники ФБУН «Уфимский НИИ медицины труда и экологии человека». В выборке пациентов было 81 мужчин и 63 женщины (М:Ж=1,3:1). Контрольная группа сформирована из 548 неродственных индивидов, не имеющих признаков профессиональных аллергических заболеваний на момент сбора материала, жителей Республики Башкортостан, подобранных по этнической принадлежности и половому составу.
При сравнении выборки больных БА и группы контроля выявлены достоверные различия по частотам генотипов полиморфного локуса rs1837253 гена TSLP (таблица).
В группе больных БА с дыхательной недостаточностью достоверно чаще встречался генотип СС по сравнению с контрольной группой (65,28% и 53,83% соответственно, χ2=5,61; р=0,018). Рассчитанный коэффициент отношения шансов показал, что вероятность развития дыхательной недостаточности у больных БА повышается приблизительно в 2 раза (OR=1,61, CI: 1,10-2,36) при носительстве генотипа СС. Таким образом, наличие в генотипе варианта СС полиморфного локуса rs1837253 гена TSLP является маркером для прогнозирования дыхательной недостаточности у больных БА.
Предлагаемый способ иллюстрируется следующими клиническими примерами.
Пример 1.
Больная В., 1977 г.р. Клинический диагноз: Бронхиальная астма, средней степени тяжести, стадия ремиссии. При молекулярно-генетическом тестировании у больной было взято 4 мл венозной крови, из которой выделена ДНК методом фенольно-хлороформной экстракции. Исследование полиморфного локуса rs1837253 гена TSLP проводилось с помощью ПЦР в реальном времени. На основании генотипирования полиморфного локуса rs1837253 гена TSLP и выявления у больной В. генотипа СС дан прогноз о повышенном риске дыхательной недостаточности, что было подтверждено последующим клиническим наблюдением в течение года. У пациентки отмечено выраженное усиление клинических проявлений болезни, диагностирована дыхательная недостаточность.
Пример 2.
Больной М., 1980 г.р., Клинический диагноз: Бронхиальная астма, средней степени тяжести, стадия ремиссии. На основании исследования по предлагаемой методике у больного М. выявлен генотип ТТ, свидетельствующий о низком риске дыхательной недостаточности. При последующем клиническом наблюдении в течение года признаков дыхательной недостаточности не выявлено.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ТЯЖЁЛОЙ БРОНХИАЛЬНОЙ АСТМЫ | 2023 |
|
RU2803263C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ БРОНХИАЛЬНОЙ АСТМЫ | 2012 |
|
RU2510508C1 |
| Способ прогнозирования риска неконтролируемого течения бронхиальной астмы у детей с ожирением | 2022 |
|
RU2805825C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ БРОНХИАЛЬНОЙ АСТМЫ | 2006 |
|
RU2324937C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИНДИВИДУАЛЬНОГО РИСКА РАЗВИТИЯ БРОНХИАЛЬНОЙ АСТМЫ В РЕГИОНАХ С ВЫСОКОЙ И НИЗКОЙ РАСПРОСТРАНЕННОСТЬЮ ГЕЛЬМИНТНЫХ ИНФЕКЦИЙ | 2012 |
|
RU2503959C1 |
| Способ прогнозирования риска клинически значимого снижения контроля бронхиальной астмы в сезон с высокой влажностью воздуха | 2022 |
|
RU2796882C1 |
| Способ прогнозирования риска развития гипертонической болезни на основании молекулярно-генетических данных | 2018 |
|
RU2679401C1 |
| Способ прогнозирования риска развития хронической истинной экземы на основе молекулярно-генетических данных | 2021 |
|
RU2757936C1 |
| Способ прогнозирования риска клинически значимого снижения контроля бронхиальной астмы в сезон с низкой температурой воздуха | 2022 |
|
RU2796885C1 |
| Способ прогнозирования повышенного риска развития хронической истинной экземы у мужчин с использованием данных о полиморфизме гена филаггрина | 2021 |
|
RU2750963C1 |
Изобретение относится к области медицины, в частности к пульмонологии и аллергологии, и предназначено для прогнозирования дыхательной недостаточности у больных бронхиальной астмой. Проводят генотипирование полиморфного локуса rs1837253 гена TSLP методом ПЦР. При выявлении генотипа СС прогнозируют риск развития дыхательной недостаточности у больных бронхиальной астмой. Изобретение обеспечивает получение критериев прогноза развития дыхательной недостаточности у больных бронхиальной астмой. 1 табл., 2 пр.
Способ прогнозирования дыхательной недостаточности у больных бронхиальной астмой, включающий выделение ДНК из лимфоцитов периферической венозной крови, генотипирование методом ПЦР полиморфного локуса rs1837253 гена тимусного стромального лимфопоэтина (TSLP), отличающийся тем, что при выявлении генотипа СС прогнозируют риск развития дыхательной недостаточности у больных бронхиальной астмой.
| СПОСОБ ОЦЕНКИ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ МИКРОСОСУДИСТОГО ЭНДОТЕЛИЯ У БОЛЬНЫХ БРОНХИАЛЬНОЙ АСТМОЙ | 2010 |
|
RU2436091C1 |
| MOFFATT M.F | |||
| et al | |||
| A large-scale, consortium-based genomewide association study of asthma | |||
| N Engl J Med | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| KUROSAWA M | |||
| et al | |||
| Single Nucleotide Polymorphisms in Thymic Stromal Lymphopoietin Gene are not Associated with Aspirin-Exacerbated Respiratory Disease Susceptibility - A Pilot Study in a Japanese Population | |||
| J Allergy Ther | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Выпрямитель с холодным катодом и сеткой | 1937 |
|
SU54940A1 |
Авторы
Даты
2017-12-19—Публикация
2017-03-01—Подача