Изобретение относится к области медицинских исследований и служит для визуализации мишеней, находящихся в глубине организма, в его органах, тканях и клетках. Способ направлен на визуализацию мишеней, маркированных с помощью аффинных меток на основе полупроводниковых нанокристаллов, флуоресцирующих в инфракрасной области спектра и обеспечивает высокую чувствительность и контрастность изображения. Способ может использоваться для визуализации биологических объектов, таких как ДНК, белки, компоненты клеточного метаболизма, онкологические маркеры и клетки, для целей диагностики или изучения изменений в органах и тканях, а также для мониторинга распределения лекарств и биологически активных компонент в исследуемом организме.
Известен способ визуализации аналитов внутри биологических образцов с помощью зондов, содержащих частицы, флуоресцирующие в инфракрасной области спектра, и функциональные группы, способные связываться с мишенями [1]. Применяемые частицы возбуждаются и флуоресцируют в инфракрасной области спектра. Благодаря высокой проникающей способности инфракрасного излучения в биологические объекты применение инфракрасных флуоресцентных частиц позволяет снизить люминесценцию, поглощение и рассеивание света окружающими биологическими молекулами. Иммобилизованные на поверхности частиц узнающие молекулы могут представлять собой лиганды, рецепторы, антитела, белки, нуклеиновые кислоты и полисахариды, которые обеспечивают специфическое маркирование определенных мишеней в тканях организма, микроорганизма или клетках. Флуоресцентные частицы состоят из оксида редкоземельного металла и содержат неодим, иттербий, а также могут содержать иттрий, лютеций и лантан. Недостатком данного способа является отсутствие механизма увеличения контрастности и чувствительности детекции и визуализации аналитов.
Способ, включающий введение инфракрасных флуоресцентных меток на основе наночастиц, их возбуждение и детектирование флуоресцентного сигнала, описанный в патенте [2], был выбран в качестве прототипа. Флуоресцентные наночастицы получены легированием керамических наночастиц с редкоземельными элементами, такими как уран, титан, хром, никель, молибден и другими. Связывание флуоресцентных меток с исследуемыми мишенями обеспечивается иммобилизованными на их поверхности узнающими молекулами, способными связываться с ДНК, белками, клетками и другими компонентами тканей животных. Возбуждение инфракрасных флуоресцентных меток происходит при длине волны от 780 до 1700 нм, а флуоресцентный сигнал детектируется в диапазоне длин волн от 1000 до 1700 нм. Таким образом, способ направлен на детекцию и визуализацию специфических маркеров внутри организма человека и млекопитающих для целей диагностики заболеваний и изучения их патогенеза. Применение инфракрасных меток позволяет проводить визуализацию исследуемых мишеней в глубине тканей и органов, благодаря тому, что инфракрасное излучение существенно меньше поглощается и вызывает меньшую фоновую флуоресценцию биологических объектов по сравнению с излучением видимого диапазона. К недостаткам описанного способа стоит отнести отсутствие процедур, направленных на повышение контрастности и чувствительности визуализации мишеней.
Техническим результатом предлагаемого изобретения является способ биологической визуализации анализируемых мишеней внутри исследуемого биологического образца или живого организма, позволяющий улучшить контрастность получаемого изображения, а также увеличить чувствительность детекции и визуализации мишеней, маркированных флуоресцентными зондами.
Технический результат достигается тем, что в известном способе биологической визуализации, включающем мечение анализируемых клеточных компонент, клеток, тканей или органов флуоресцентными зондами, состоящими из биологических распознающих молекул и флуоресцентных красителей, излучающих в инфракрасной области оптического спектра, возбуждение флуоресценции красителей с помощью инфракрасного излучения, и последующую регистрацию флуоресценции красителей, в качестве флуоресцентных красителей применяют полупроводниковые нанокристаллы, флуоресцирующие в инфракрасном диапазоне спектра, при этом регистрацию флуоресцентного сигнала от полупроводниковых нанокристаллов проводят через 5-50 наносекунд после возбуждения их флуоресцентного сигнала.
Особенностью полупроводниковых нанокристаллов, в том числе флуоресцирующих в инфракрасной области спектра, является большое время сохранения флуоресценции после возбуждения, так называемое время жизни флуоресценции (ВЖФ). Так, для полупроводниковых нанокристаллов (ППНК) среднее ВЖФ составляет порядка 30 наносекунд, а в отдельных случаях оно может достигать и сотен наносекунд, в то время как для эндогенных органических соединений ВЖФ редко превышает нескольких наносекунд [3]. Экспериментально было установлено, что осуществление регистрации флуоресцентного сигнала через 5 нс после проведения возбуждения позволяет повысить контрастность получаемого изображения и повысить чувствительность детекции, благодаря значительному снижению фоновой флуоресценции окружающих органических соединений, при сохранении интенсивности флуоресценции ППНК. Больший перерыв, между моментом возбуждения и регистрации флуоресценции, позволяет с высокой чувствительностью детектировать малые количества анализируемых клеточных компонент, меченных ППНК, т.к. за это время флуоресценция окружающих органических соединений уменьшается в несколько десятков раз, а флуоресценция ППНК всего в 2-3 раза. Также экспериментально было установлено, что перерыв более 50 нс, между моментом возбуждения и регистрации флуоресценции, приводит к уменьшению контрастности и чувствительности за счет постепенного угасания флуоресценции ППНК.
Существует частный случай, когда в качестве полупроводниковых нанокристаллов, флуоресцирующих в инфракрасном диапазоне оптического спектра, используют нанокристаллы состава PbS/CdS/ZnS, CuInS2/ZnS, Ag2S, флуоресцирующие в инфракрасной области оптического спектра.
Возможны частные случаи, когда в качестве биологических распознающих молекул применены:
- нативные белки;
- модифицированные белки;
- поликлональные антитела;
- моноклональные антитела;
- однодоменные антитела;
- высокоаффинные биологические компоненты;
- стрептавидин;
- биотин;
- пептиды;
- нуклеиновые кислоты.
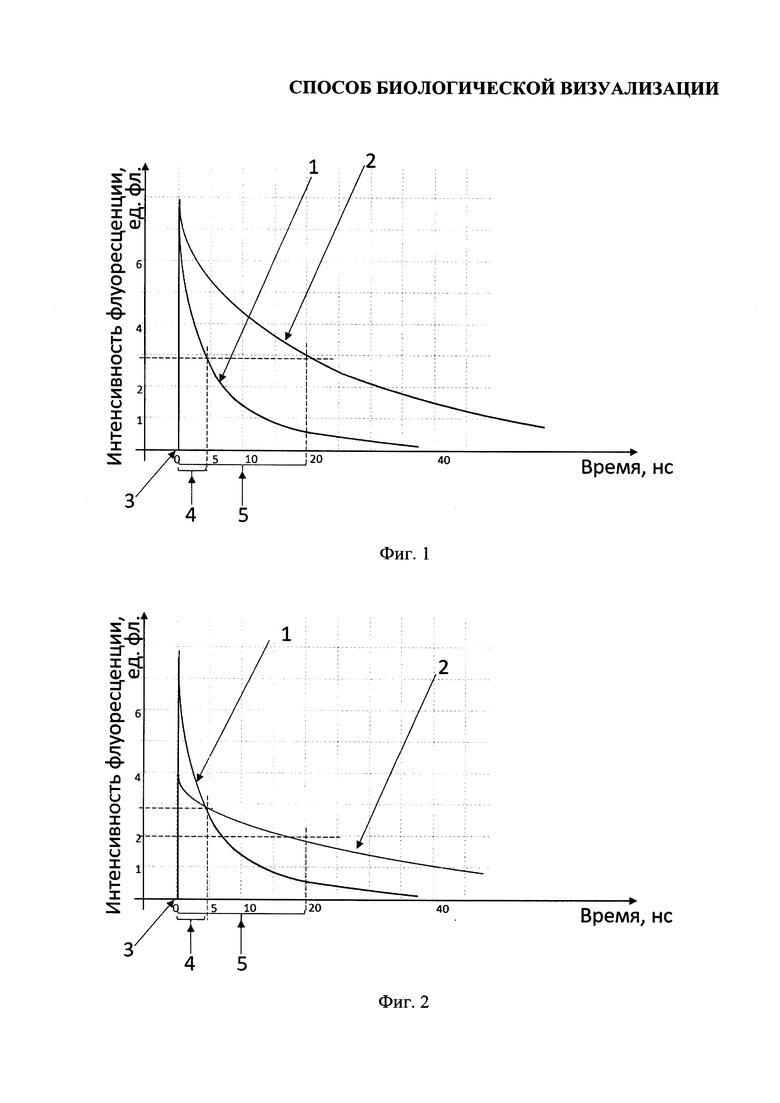
Пример конкретной реализации способа поясняется на примере визуализации раковых клеток, экспрессирующих онкомаркер рака поджелудочной железы СА 19-9. Для этого суспензию флуоресцентных зондов, состоящих из антител, связывающих участок белка СА 19-9 и полупроводниковых нанокристаллов состава CuInS2/ZnS (ВЖФ 20 нс), вводят внутривенно лабораторному животному. Через 1 час (конкретное время зависит от размеров и активности лабораторного животного) флуоресцентные зонды с током крови попадают в поджелудочную железу и связываются с белком СА 19-9, локализованным в раковых клетках. Затем проводят облучение места локализации раковых клеток инфракрасным излучением в течение 2 нс для возбуждения флуоресценции ППНК, после чего проводят регистрацию флуоресцентного сигнала. Технический результат предлагаемого способа, наглядно поясняется графиком зависимости интенсивности флуоресценции от времени, представленным на фиг. 1. Показана зависимость интенсивности флуоресценции биологических молекул (средний максимум ВЖФ 4,7 нс) - 1 и полупроводникового нанокристалла состава CuInS2/ZnS (ВЖФ 20 нс) - 2. Также цифрами на фиг. 1 обозначены: момент времени возбуждения флуоресцентного сигнала, принятый за начало отсчета времени - 3; среднее время жизни флуоресценции для биологических молекул - 4; среднее время жизни флуоресценции для полупроводникового нанокристалла - 5. Из графика видно, что при снятии флуоресцентного сигнала через 3 нс после возбуждения флуоресценции отношение интенсивности флуоресцентного сигнала от полупроводниковых нанокристаллов к интенсивности флуоресцентного сигнала от биологических молекул равно приблизительно 3:2, в то время как при снятии флуоресцентного сигнала через 15 нс это соотношение увеличивается до 4:1. Из этого примера видно, что смещение времени снятия флуоресцентного сигнала в более позднее время после возбуждения флуоресценции позволяет увеличить контрастность изображения более чем в 2,5 раза.
Пример повышения чувствительности иллюстрируется графиком, представленным на фиг. 2. Так, если количество детектируемого аналита мало и уровень начального флуоресцентного сигнала от связанного с ним флуоресцентного зонда ниже уровня флуоресценции от окружающих биологических молекул, то при детекции флуоресцентного сигнала через 3 нс детектировать целевой сигнал невозможно. В то время как при детекции через 30 нс, когда интенсивность флуоресценции биологических молекул сильно снижается, детектируется флуоресцентный сигнал от полупроводниковых нанокристаллов, которыми помечен детектируемый аналит.
Таким образом, предложенный способ биологической визуализации клеток и клеточных компонент, меченных флуоресцентными зондами, позволяет в несколько раз улучшить контрастность изображений получаемых при визуализации мишеней, локализованных в глубине органов и тканей организма. Это также приводит к увеличению чувствительности и позволяет определять меньшие количества детектируемых аналитов, что особенно важно для ранней диагностики заболеваний и обнаружения изменений в органах и тканях. Кроме того, подобная система может применяться для визуализации областей опухолевого роста при проведении или планировании медицинских операций.
Источники информации
1. Masakazu Mitsunaga et al. Functional infrared flourescent particle. Патент США US 20080265208 A1.
2. Tamotsu Zako et al. Bioimaging method using near-infrared (nir) fluorescent material. Патент США US 20110237942 A1.
3. Berezin M. and Achilefu S. Fluorescence Lifetime Measurements and Biological Imaging. Chemical reviews // 2010 //110(5) 2641-2684.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ НАПРАВЛЕННОГО РАЗРУШЕНИЯ РАКОВЫХ КЛЕТОК | 2016 |
|
RU2638446C1 |
| НОСИТЕЛЬ ДЛЯ ДИАГНОСТИКИ, НАПРАВЛЕННОЙ ДОСТАВКИ И КОНТРОЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2018 |
|
RU2693485C1 |
| Комплекс для детекции и направленного разрушения клеток | 2019 |
|
RU2743993C1 |
| НАБОР ДЛЯ ПРОВЕДЕНИЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2019 |
|
RU2740552C1 |
| ФЛУОРЕСЦЕНТНЫЙ ГИДРОГЕЛЬ ДЛЯ ДЕТЕКЦИИ БИОЛОГИЧЕСКИХ МОЛЕКУЛ | 2023 |
|
RU2814452C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНАЛИТИЧЕСКОЙ ТЕСТ-СИСТЕМЫ НА ОСНОВЕ СУСПЕНЗИОННЫХ МИКРОЧИПОВ ДЛЯ ДЕТЕКЦИИ МАРКЕРОВ ЗАБОЛЕВАНИЙ | 2016 |
|
RU2638787C1 |
| СПОСОБ СОЗДАНИЯ НАБОРОВ МИКРОСФЕР, ОПТИЧЕСКИ КОДИРОВАННЫХ ФЛУОРЕСЦЕНТНЫМИ НАНОКРИСТАЛЛАМИ И НЕСУЩИХ НА СВОЕЙ ПОВЕРХНОСТИ РАСПОЗНАЮЩИЕ БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ | 2015 |
|
RU2624853C2 |
| Набор для дифференциальной диагностики заболеваний | 2018 |
|
RU2701742C1 |
| Люминесцентный сенсор для мультиплексного (спектрально-временного) детектирования аналитов в водных средах и способ его получения | 2020 |
|
RU2769756C1 |
| СПОСОБ ДЕТЕКЦИИ АЛЛЕРГЕН-СПЕЦИФИЧЕСКИХ АНТИТЕЛ С ПОМОЩЬЮ ТВЕРДОТЕЛЬНЫХ МИКРОЧИПОВ АЛЛЕРГЕНОВ | 2024 |
|
RU2839485C1 |
Изобретение относится к медицине и может быть использовано для визуализации биологических объектов. Для этого осуществляют мечение анализируемых клеточных компонент, клеток, тканей или органов флуоресцентными зондами. Зонды состоят из биологических распознающих молекул и флуоресцентных красителей, излучающих в инфракрасной области оптического спектра. После чего возбуждают флуоресценцию красителей с помощью инфракрасного излучения и регистрируют их флуоресценцию. В качестве флуоресцентных красителей применяют полупроводниковые нанокристаллы (PbS/CdS/ZnS, CuInS2/ZnS, Ag2S), флуоресцирующие в инфракрасном диапазоне спектра. При этом регистрацию флуоресцентного сигнала от полупроводниковых нанокристаллов проводят через 5-50 наносекунд после возбуждения их флуоресцентного сигнала. Изобретение позволяет визуализировать мишени внутри исследуемого биологического образца или живого организма за счет повышения контрастности получаемого изображения и повышения чувствительности детекции мишеней, маркированных флуоресцентными зондами. 11 з.п. ф-лы, 2 ил.
1. Способ биологической визуализации, включающий мечение анализируемых клеточных компонент, клеток, тканей или органов флуоресцентными зондами, состоящими из биологических распознающих молекул и флуоресцентных красителей, излучающих в инфракрасной области оптического спектра, возбуждение флуоресценции красителей с помощью инфракрасного излучения и последующую регистрацию флуоресценции красителей, отличающийся тем, что в качестве флуоресцентных красителей применяют полупроводниковые нанокристаллы, флуоресцирующие в инфракрасном диапазоне спектра, при этом регистрацию флуоресцентного сигнала от полупроводниковых нанокристаллов проводят через 5-50 наносекунд после возбуждения их флуоресцентного сигнала.
2. Способ по п. 1, отличающийся тем, что в качестве полупроводниковых нанокристаллов, флуоресцирующих в инфракрасном диапазоне оптического спектра, используют нанокристаллы состава PbS/CdS/ZnS, CuInS2/ZnS, Ag2S, флуоресцирующие в инфракрасной области оптического спектра.
3. Способ по п. 1, отличающийся тем, что в качестве биологических распознающих молекул используют нативные белки.
4. Способ по п. 1, отличающийся тем, что в качестве биологических распознающих молекул используют модифицированные белки.
5. Способ по п. 1, отличающийся тем, что в качестве биологических распознающих молекул используют поликлональные антитела.
6. Способ по п. 1, отличающийся тем, что в качестве биологических распознающих молекул используют моноклональные антитела.
7. Способ по п. 1, отличающийся тем, что в качестве биологических распознающих молекул используют однодоменные антитела.
8. Способ по п. 1, отличающийся тем, что в качестве биологических распознающих молекул используют высокоаффинные биологические компоненты.
9. Способ по п. 1, отличающийся тем, что в качестве биологических распознающих молекул используют стрептавидин.
10. Способ по п. 1, отличающийся тем, что в качестве биологических распознающих молекул используют биотин.
11. Способ по п. 1, отличающийся тем, что в качестве биологических распознающих молекул используют пептиды.
12. Способ по п. 1, отличающийся тем, что в качестве биологических распознающих молекул используют нуклеиновые кислоты.
| ОЛЕЙНИКОВ В.А | |||
| и др | |||
| Флуоресцентные полупроводниковые нанокристаллы в биологии и медицине, Российские нанотехнологии, 2007, т.2, N 1-2, с.160-173 | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| DAHAN M | |||
| et al | |||
| Time-gated biological imaging by use of colloidal quantum dots, Optics letters, 2001, June 1,vol | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| US 20110237942 A1, 29.09.2011 | |||
| СПОСОБЫ И ПРИБОРЫ ДЛЯ ОБНАРУЖЕНИЯ И ИДЕНТИФИКАЦИИ ЗАКОДИРОВАННЫХ ГРАНУЛ И БИОЛОГИЧЕСКИХ МОЛЕКУЛ | 2007 |
|
RU2487169C2 |
Авторы
Даты
2017-12-19—Публикация
2016-12-14—Подача