Предшествующий уровень техники
Частота встречаемости повреждений периферических нервов различной этиологии составляет 3-10% [1-3]. Актуальность разработки новых методов лечения обусловлена продолжительностью восстановительного периода (год и более), значительным снижением качества жизни пациентов трудоспособного возраста и высокой частотой инвалидизации. Травма периферического нерва является частой причиной потери профессии. Выбор способа восстановления целостности периферического нерва обусловлен рядом особенностей повреждения в каждом конкретном случае: механизм травмы, время, прошедшее от момента получения травмы до выполнения хирургического пособия, протяженность дефекта периферического нерва и т.д. Одним из видов реконструктивного лечения является сшивание культей пересеченного нерва за счет создания анастомоза конец-в-конец. Однако часто травма периферического нерва сопровождается образованием дефекта различной протяженности, вследствие чего такой подход невозможен. В этой ситуации "золотым стандартом" восстановления целостности нерва является использование аутонервной вставки для устранения протяженного дефекта. В качестве аутовставки может быть использован функционально менее значимый нерв. В качестве альтернативы могут быть использованы различные кондуиты, которые представляют собой тубулированные структуры, предназначение которых заключается в устранении протяженного дефекта тканей и создании благоприятных условий для регенерации периферического нерва.
Степень восстановления функции иннервируемой конечности после хирургического восстановления целостности периферического нерва зависит от множества факторов: время, прошедшее с момента травмы до операции, протяженность дефекта, расстояние от места травмы периферического нерва до иннервируемой области и т.д. Однако несмотря на развитие техники восстановления целостности нерва, даже при самых благоприятных условиях, как правило, происходит лишь частичное восстановление функции иннервируемой конечности. Это побуждает к поиску новых методов лечения, которые позволили бы улучшить результаты стандартного реконструктивного лечения и качество жизни пациентов в целом.
Одним из таких направлений является применение факторов роста с целью индукции регенерации периферического нерва. Данная концепция появилась в результате накопления данных о значимой роли факторов роста в естественном процессе регенерации периферических нервов [4].
Одним из наиболее хорошо изученных факторов роста, влияющих на восстановление периферических нервов, является сосудистый эндотелиальный фактор роста (VEGF). VEGF является одним из основных регуляторов ангиогенеза и васкулогенеза. VEGF - это димерный 34-42 кДа дисульфид-связанный гликопротеин.VEGF-A является специфичным митогеном для эндотелиальных клеток (ЭК).VEGF индуцирует пролиферацию ЭК, их активацию, дифференцировку и формирование ими капиллярных трубочек, ремоделирующихся в дальнейшем в зрелые сосуды. Он также является мощным фактором повышения выживаемости ЭК, так как индуцирует экспрессию антиапоптозных белков. Делеции генов, кодирующих VEGF, приводят к серьезным дефектам и неправильному развитию сердечно-сосудистой системы, что несовместимо с жизнью.
Ген VEGF человека расположен в хромосомном локусе 6р21.3. Кодирующая область охватывает около 14 т.п.н. VEGF существует в нескольких изоформах: VEGF121, VEGF 145, VEGF 148, VEGF 165, VEGF 183, VEGF 189, VEGF206, образуемых в результате альтернативного сплайсингам РНК, которая состоит из 8-ми экзонов. Каждой изоформе VEGF соответствует определенная внеклеточная локализация, основанная на их биохимических различиях в способности связывать гепарин- и гепаран-сульфат. Так, все транскрипты гена VEGF-А у человека содержат экзоны 1-5 и 8, различия же обусловлены альтернативным сплайсингом экзонов 6 и 7.
Долгое время после открытия VEGF фактор рассматривался лишь как индуктор ангиогенеза и потенциальный терапевтический агент для лечения различных заболеваний, сопровождающихся ишемией тканей. Однако с течением времени были получены данные о его нейропротективных свойствах в отношении как нейронов периферической нервной системы, так и центральной [5, 6]. VEGF индуцирует пролиферацию шванновских клеток, астроцитов, микроглии, нейронов коры головного мозга [7-10]. На модели травмы с пересечением седалищного нерва у крысы было показано значительное увеличение экспрессии VEGF и Fit-1 (рецептор VEGF II типа) в спинном мозге на уровне поясничного отдела позвоночника в ответ на повреждение [11]. Таким образом, появились предпосылки для применения данного фактора роста в качестве дополнительного терапевтического компонента реконструктивного лечения повреждений периферических нервов. Применение VEGF в составе матригеля, заполняющего кондуит, индуцирует спрутинг аксонов, что проявляется увеличением количества аксонов в кондуите на единицу площади поперечного среза [12]. Использование гранул полимолочной кислоты с VEGF в графте, выполненном из аутовены, на модели травмы с протяженным дефектом малоберцового и большеберцового нервов, достоверно улучшает функциональный индекс нервов и увеличение количества миелиновых волокон в графте [13]. VEGF в эксперименте индуцирует деление и миграцию шванновских клеток в графте в дистальном направлении, что коррелирует с увеличением количества капилляров и миелиновых волокон [14]. Введение VEGF в комбинации с BDNF в кавернозные тела, на модели травмы кавернозного нерва крысы, приводило к восстановлению утраченной иннервации и эректильной функции [15].
Однако, как известно, применение факторов роста с терапевтической целью имеет ряд ограничений. При их введении в область повреждения они подвергаются быстрому разрушению, ввиду чего нет возможности поддержания постоянной концентрации для достижения желаемого терапевтического эффекта [16]. В связи с этим вырос интерес к применению генной терапии. По механизму трансфера гена, кодирующего терапевтический агент, можно выделить два основных направления - использование вирусных векторов и невирусных. Однако использование вирусных векторов в клинике, несмотря на высокую трансфекционную активность, ограничено ввиду опасности развития инсерционного мутагенеза, воспалительного ответа и токсичности. Более безопасным методом осуществления генного трансфера является применение плазмидной ДНК. На модели реконструкции кожно-мышечного нерва путем создания анастомоза конец-в-конец и конец-в-бок интраоперационное введение плазмиды, содержащей последовательность гена VEGF, в дистальную культю, приводило к достоверному увеличению количества миелиновых волокон на единицу площади поперечного среза участка дистальнее места анастомоза, что коррелировало со значительным увеличением концентрации VEGF в шванновских клетках [17]. Геннотерапевтическая конструкция может также вводиться параневрально. На модели травмы седалищного нерва plVEGF вводилась внутримышечно и использовалась в комбинации с пленками гиалуроновой кислоты, которыми покрывался анастомоз с целью уменьшения выраженности рубцового процесса. Внутримышечное введение препарата сопровождалось достоверным увеличением амплитуды мышечного ответа и увеличения количества миелиновых волокон дистальнее анастомоза относительно использования их по отдельности [18]. В исследовании Wang F. et all был показан дозозависимый эффект plVEGF при введении геннотерапевтической конструкции интраневрально после сшивания культей седалищного нерва конец-в-конец. При применении большей дозировки был получен наиболее выраженный прирост нейрофизиологических показателей, меньшее снижение индекса массы икроножной мышцы [19]. Таким образом, данные экспериментальных исследований, свидетельствующие о возможности применения генных конструкций с целью улучшения регенерации периферических нервов, явились предпосылкой для проведения исследования в клинике с целью оценки возможности применения данного подхода для лечения повреждений периферических нервов у человека.
Перечень иллюстраций:
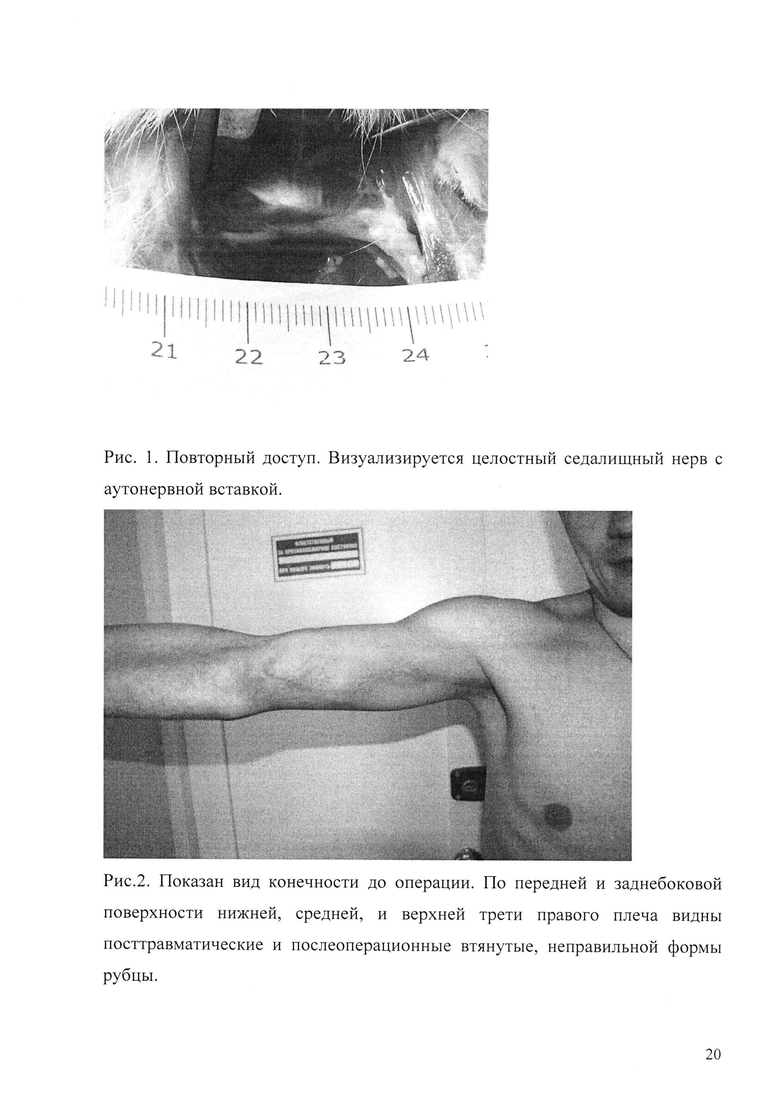
Рис. 1. Повторный доступ. Визуализируется целостный седалищный нерв с аутонервной вставкой.
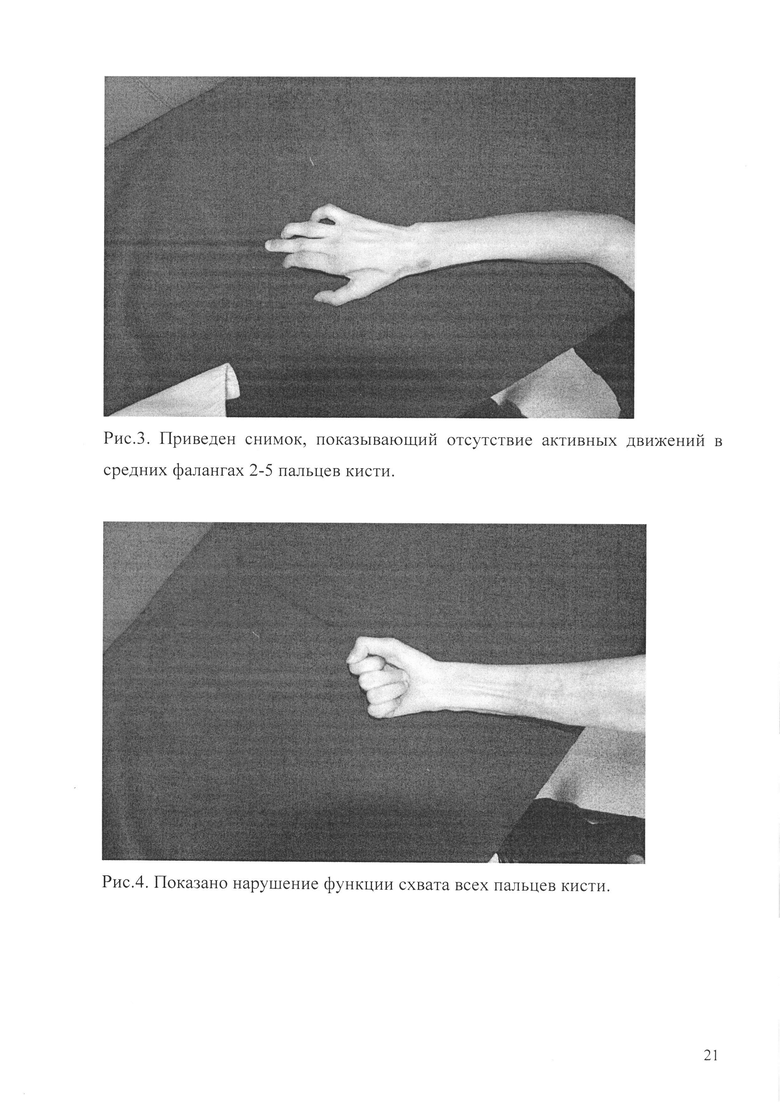
Рис. 2. Показан вид конечности до операции. По передней и заднебоковой поверхности нижней, средней и верхней трети правого плеча видны посттравматические и послеоперационные втянутые, неправильной формы рубцы.
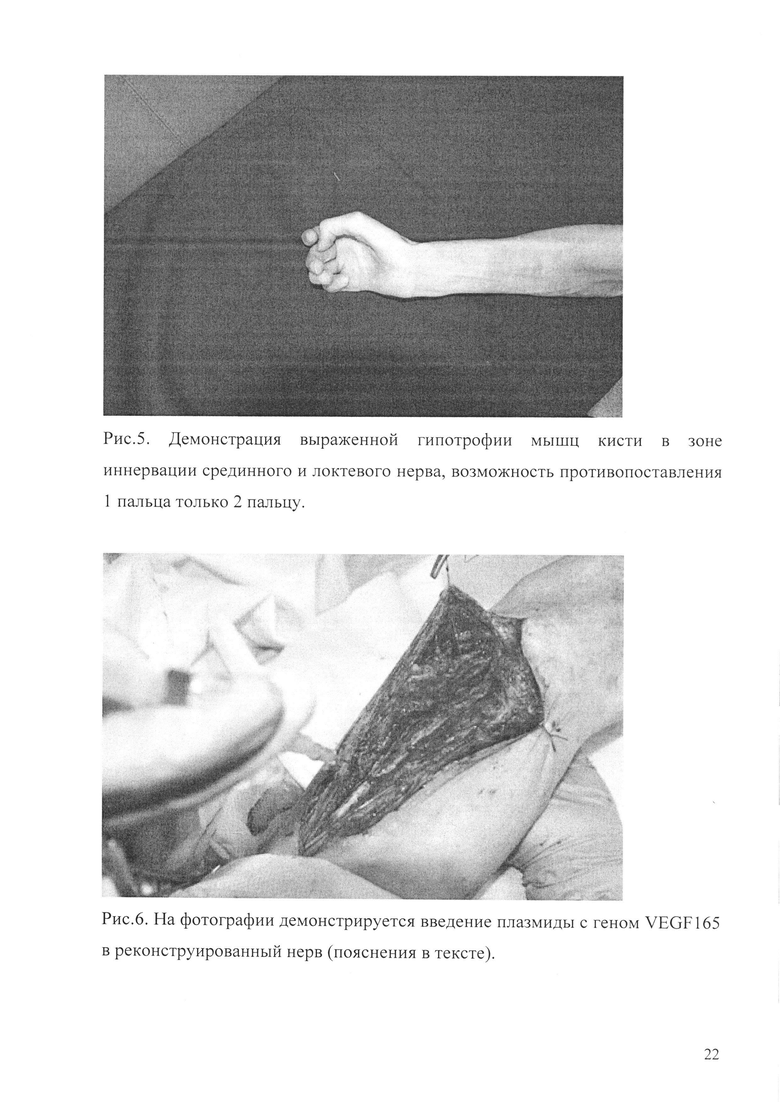
Рис. 3. Приведен снимок, показывающий отсутствие активных движений в средних фалангах 2-5 пальцев кисти.
Рис. 4. Показано нарушение функции схвата всех пальцев кисти.
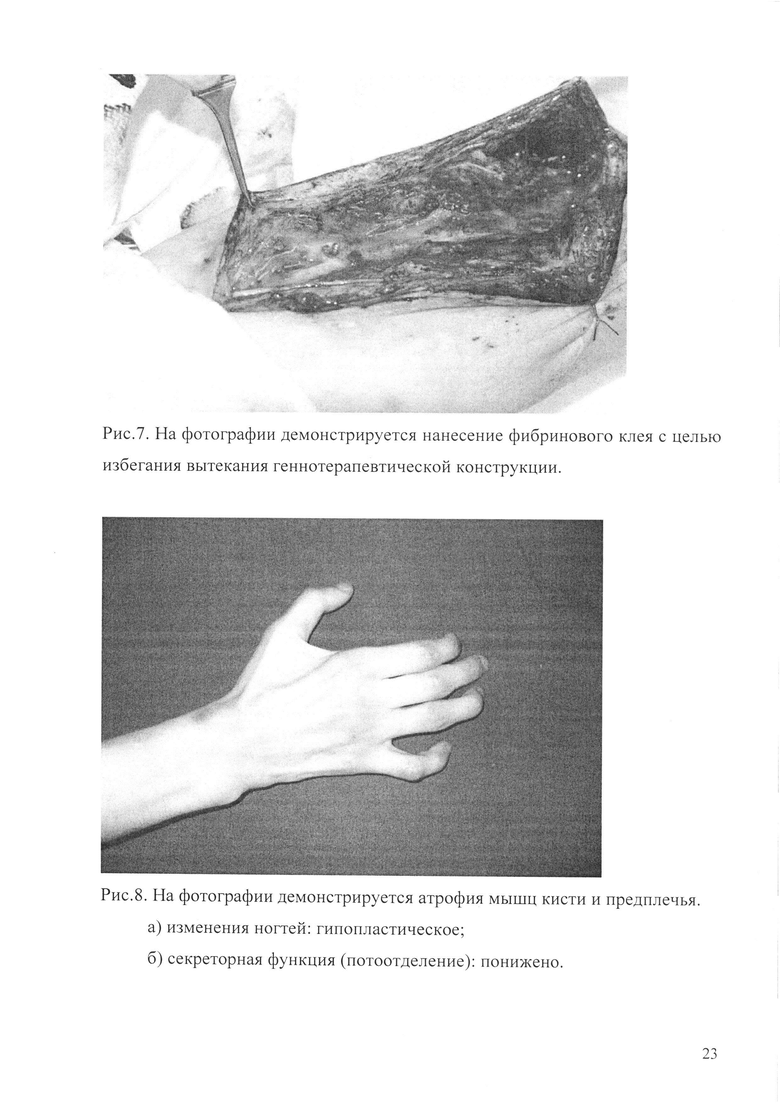
Рис. 5. Демонстрация выраженной гипотрофии мышц кисти в зоне иннервации срединного и локтевого нерва, возможность противопоставления 1 пальца только 2 пальцу.
Рис. 6. На фотографии демонстрируется введение рекомбинантной плазмиды pCMV-VEGF165 в реконструированный нерв (пояснения в тексте).
Рис. 7. На фотографии демонстрируется нанесение фибринового клея с целью избегания вытекания рекомбинантной плазмиды.
Рис. 8. На фотографии демонстрируется атрофия мышц кисти и предплечья:а) изменения ногтей: гипопластическое;
б) секреторная функция (потоотделение): понижено.
Рис. 9. Захват крючок (ручка сумки).
Рис. 10. Захват в кулак.
Рис. 11. Кончиковый захват (I-III палец).
Рис. 12. Кончиковый захват (I-III палец).
Рис.13. Кончиковый захват (I-IV палец).
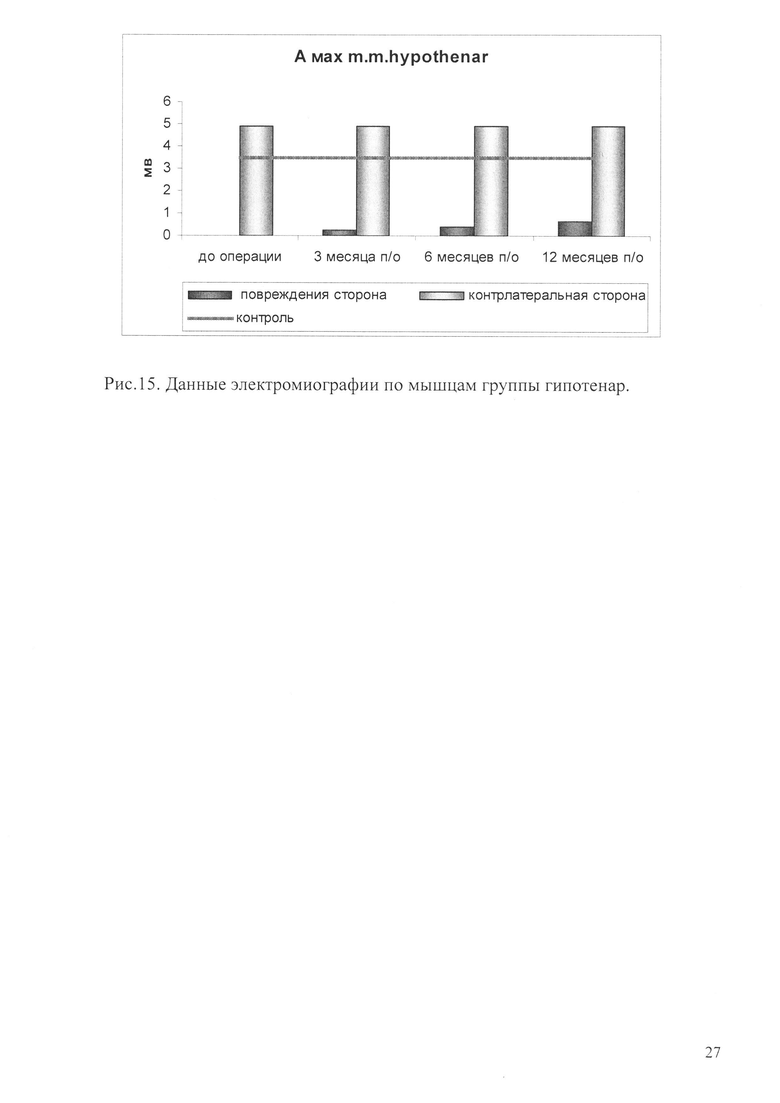
Рис. 14. Приведена диаграмма, отражающая данные электромиографии по мышцам группы тенар.
Рис. 15. Данные электромиографии по мышцам группы гипотенар.
Подробное описание настоящего изобретения
Изобретение относится к медицине, преимущественная область его применения - нейрохирургия и травматология, лечение травм периферических нервов.
Задачей разработки технического решения являлось создание эффективного способа лечения пациентов с повреждениями периферических нервов. Для решения поставленной задачи нами были разработаны различные геннотерапевтические конструкции, различающиеся между собой по количеству кодируемых трансгенов, по самим трансгенам, а также нуклеотидным последовательностям одних и тех же трансгенов.
После этого нами был проведен ряд экспериментальных исследований на животных с моделью травмы периферического нерва с применением различных геннотерапевтических конструкций. Геннотерапевтические конструкции вводились интраневрально непосредственно после восстановления целостности периферического нерва. Результаты оценивались спустя 60 суток после проведения оперативного вмешательства и введения препарата (Рис. 1).
Из всех плазмидных ДНК, используемых нами, наилучшие результаты показала плазмида pCMV-VEGF сплайсинг-вариант 165 (Seq#1), содержащая оптимизированную последовательность со следующими изменениями: делеция «с» в положении 1079, делеция «т» в положении 1111, замена «а» на «с» в положении 1144, делеция «а» в положении 1148, делеция «с» в положении 1155, делеция «а» в положении 1173, делеция «с» в положении 1185, замена «g» на «с» в положении 1536. Это выражалось в достоверном восстановлении показателей амплитуды моторного ответа икроножной мышцы, увеличении количества аксонов в участке седалищного нерва дистальнее места анастомоза относительно животных группы контроля.
Основываясь на доклинических данных об эффективности применения генотерапевтической конструкции pCMV-VEGF сплайсинг-вариант 165 (Seq#1), с целью улучшения регенерации периферического нерва нами был инициировано клиническое исследование, результаты которого представлены ниже.
Пациент Б., 1985 г. р., поступил в травмцентр РКБ МЗ РТ 04.04.11 г. с диагнозом: последствия повреждения срединного и локтевого нерва в средней трети правого плеча (Рис. 2).
Из анамнеза: в 2009 году пациент порезал стеклом плечо на уровне средней трети, при этом были повреждены срединный и локтевой нервы. Незамедлительно был выполнен прямой шов срединного и локтевого нервов, однако в ближайший послеоперационный период как двигательная, так и чувствительная функции полностью отсутствовали. Курс реабилитационной терапии видимых результатов не дал. Далее, спустя 7 месяцев, в 2010 году, в связи с отсутствием положительной динамики восстановления двигательной и чувствительной функций был выполнен невролиз срединного и локтевого нервов. Наблюдение в послеоперационном периоде показало слабую динамику регенерации, а именно полное отсутствие чувствительности, однако, наблюдалось появление двигательной функции, которая характеризовалась незначительным сгибанием пальцев и кисти, в связи с чем было решено выполнить оперативное лечение.
До операции, 21.04.2011 г., пациенту было проведено обследование, со следующими результатами:
Трофические нарушения:
а) состояние кожных покровов: окраска обычная, температура пальцев снижена, повышенная зябкость;
б) атрофия мышц кисти и предплечья по сравнению со здоровой рукой: выраженная степень - больше 2 см (рис. 2-3);
в) изменение ногтей: гипопластическое;
г) секреторная функция (потоотделение): понижено.
Исследование чувствительности у пациента в автономной зоне иннервации нерва:

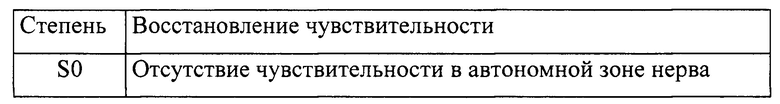
Исследование двигательной функции:

Виды захватов кисти: все виды захватов кисти отсутствуют (рис. 3-4).
Диагноз: повреждение срединного и локтевого нервов в средней трети плеча 2-летней давности. Состояние после шва и невролиза срединного и локтевого нервов (рис. 5).
26.04.11. произведена операция: невролиз срединного и локтевого нервов с интраневральным введением pCMV-VEGF сплайсинг-вариант 165 (Seq#1).
Ход операции: под проводниковой анестезией, после трехкратной обработки операционного поля произведен дугообразный разрез по внутренней поверхности правого плеча. С техническими трудностями выделены срединный и локтевой нервы. Найдены линии швов. Признаков невромы не обнаружено, однако нервы вовлечены в рубцовый процесс и спаяны с окружающей тканью. Инсулиновой иглой произведено интраневральное введение pCMV-VEGF сплайсинг-вариант 165 (Seq#1) по 250 микрограмм в каждый нерв в физиологическом растворе, объемом 2,5 мл. Инъекция осуществлена в зону швов, а также проксимально и дистально на протяжении 10 см. (рис. 6). После чего на выделенные нервы нанесен двухкомпонентный фибриновый клей «Тиссукол» объемом 2 мл (Рис. 7). Гемостаз. Ушивание раны. Установлены резиновые выпускники. Асептическая повязка. Наложена гипсовая лонгета.
Через месяц после операции пациенту проведено повторное обследование.
Данные объективного исследования 25.05.2011 г.:
Трофические нарушения:
а) состояние кожных покровов: окраска обычная;
б) атрофия мышц кисти и предплечья по сравнению со здоровой рукой в см - выраженная степень - больше 2 см (рис. 8);
в) изменения ногтей: гипопластическое;
г) секреторная функция (потоотделение): понижено.
Исследование чувствительности пациента в автономной зоне иннервации нерва:

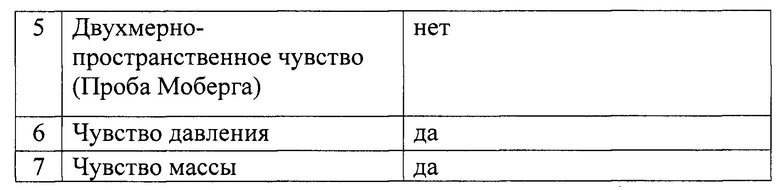

Исследование двигательной функции:

Виды захватов кисти: все виды захватов кисти отсутствуют.
Через 6 месяцев после операции пациенту проведено очередное обследование.
Данные объективного исследования 15.11.2012 г.:
Трофические нарушения:
а) состояние кожных покровов: окраска обычная;
б) атрофия мышц кисти и предплечья по сравнению со здоровой рукой в см - средней степени 1-2 см выраженная степень - больше 2 см;
в) изменения ногтей: соответствует норме;
г) секреторная функция (потоотделение): нормальное.
Исследование чувствительности пациента в автономной зоне иннервации нерва:

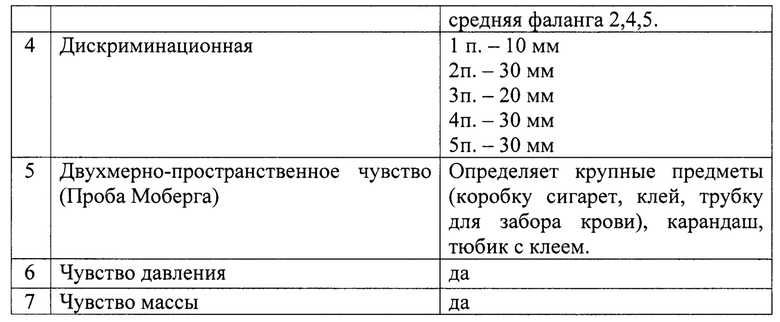

Исследование двигательной функции:

Виды захватов кисти:
1) цилиндрический захват - да
2) сферический захват - да
3) захват крючок (ручка сумки) - да
4) захват в кулак - да
5) кончиковый захват
а) терминальная опозиция - да,
б) (субтерминальная опозиция - нет)
6) боковой захват
а) ключевой захват - нет,
б) (ножничный захват - «сигарета») - нет.
Через 1 год после операции пациенту проведено очередное обследование.
Данные объективного исследования 20.04.2012 г.:
Трофические нарушения:
а) состояние кожных покровов: окраска обычная;
б) атрофия мышц кисти и предплечья по сравнению со здоровой рукой, в см - средняя степень 1-2 см;
в) изменения ногтей: Соответствует норме;
г) секреторная функция: Соответствует норме.
Исследование чувствительности пациента в автономной зоне иннервации нерва:

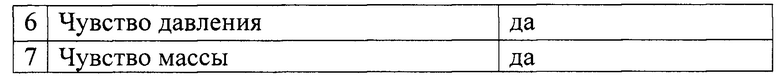

Исследование двигательной функции

Виды захватов кисти:
1) цилиндрический захват - да
2) сферический захват - да
3) захват крючок - да (рис. 9)
4) захват в кулак - да (рис. 10)
5) кончиковый захват (рис. 11-13):
а) терминальная опозиция - да,
б) субтерминальная опозиция - да
6) боковой захват
а) ключевой захват - да,
б) ножничный захват - да.
Таким образом, результаты клинического исследования свидетельствуют о том, что функция конечности значимо улучшилась спустя год после проведения процедуры интраневрального введения геннотерапевтической конструкции. Улучшение функционального состояния конечности выражалось в снижении выраженности трофических нарушений, появлении всех видов чувствительности в зоне иннервации срединного и локтевого нервов, а также достоверное улучшение двигательной функции. По представленным результатам электромиографии амплитуда мышечного ответа группы мышц тенара в течение 1 года возросла с 0 мв до 5 мв и практически достигла показателя на контрлатеральной конечности (рис. 14-15).
Эффективность применения pCMV-VEGF сплайсинг-вариант 165 (Seq#1) обусловлена рядом причин. Во-первых, сама структура плазмидной конструкции позволяет добиться достаточной экспрессии для получения терапевтического эффекта, который обуславливается синтезом необходимого количества фактора роста. Во-вторых, эффективность плазмидной конструкции обусловлена использованием именно гена изоформы VEGF165. Эта изоформа является физиологически самой часто встречающейся и биологически наиболее активной и преобладает в большинстве тканей. Таким образом, мы предполагаем, что достигнутый клинический эффект при применении pCMV-VEGF сплайсинг-вариант 165 (Seq#1) был достигнут благодаря комбинации этих причин.
К сожалению, на данном этапе мы не можем достоверно определить механизм индукции регенерации периферического нерва посредствам вышеописанной геннотерапевтической конструкции, для этого нам необходимо проведение дальнейших исследований. Однако эффективность применения ее с целью улучшения результатов оперативного лечения травм периферических нервов была выявлена и продемонстрирована в условиях эксперимента и клинического наблюдения.
Литература:
1. Hudso, A.R. Timing of peripheral nerve repair: important local and neuropathological factors / A.R. Hudson // Clinical Neurosurgery. - 1977. - Vol.24. - C. 391-405.
2. Deitch, E.A. Experience with 112 shotgun wounds of the extremities/ E.A. Deitch, W.R. Grimes // J Trauma. - 1984. - Vol.24. - P. 600-603.
3. Analysis of upper and lower extremity peripheral nerve injuries in a population of patients with multiple injuries / C.A. Munro // J Trauma. - 1998. - Vol.45. - P. 116-122.
4. Terenghi, G. Peripheral nerve regeneration and neurotrophic factors / G. Terenghi // J Anat. - 1999. - Vol.194. - P.
5. Vascular endothelial growthfactor has neurotrophic activity and stimulates axonal outgrowth, enhancing cell survival and Schwann cell proliferation in the peripheral nervous system / M. Sondell, M. Kanje, G. Lundborg // J Neurosci. - 1999. -Vol.19, №14 - P. 5731-40.
6. VEGF-A165b is an endogenous neuroprotective splice isoform of vascular endothelial growth factor A in vivo and in vitro / N. Beazley-Long [et al.] // J Pathol. - 2013. - Vol. 183, №3 - P. 918-29.
7. Sondell, M. Vascular endothelial growth factor stimulates Schwann cell invasion and neovascularisation of acelular nerve grafts / M. Sondell, G. Lundborg, M.Kanje // Brain Res. - 1999. - Vol. 846 - P. 219-228.
8. Vascular, glial and neuronal effects of vascular endothelial growth factor in mesencephalic explants cultures / W.F. Silverman [et al.] // Neuroscience. - 1999. - Vol. 90 - P. 1529-1541.
9. Forstreuter, F. Vascular endothelial growth factor induces chemotaxis and proliferation of microglial cells / F. Forstreuter, R. Lucius, R. Mentlein // J Neuroimmunol. - 2002. - Vol. 132 - P. 93-98.
10. Zhu, Y. Vascular endothelial growth factor promotes proliferation of cortical neuron precursors by regulating E2F expression / Y. Zhu [et al.] // J FASEB. - 2003. Vol. 17 - P. 186-193.
11. Induction of VEGF and its Flt-1 receptor after sciatic nerve crush injury / R.R. Islamov [et al.]//Neuroreport. - 2004. Vol. 15, №13 - P. 2117 - 21.
12. Effects of vascular endothelial growth factor on nerve regeneration in acellular nerve grafts / J.M. Rovak [et al.] // J Reconstr Microsurg. - 2004. Vol.20, №1 - P. 53-58.
13. Vascular endothelial growth factor-loaded poly (lactic-co-glycolic acid) microspheres-induced lateral axonal sprouting into the vein graft bridging two healthy nerves: nerve graft pre fabrication using controlled release system / H. Karagoz [et al.] // J Microsurgery. - 2012. Vol.32, №8 - P. 635 - 41.
14.Sondell, M. Vascular endothelial growth factor stimulates Schwann cell invasion and neovascularization of acellular nerve grafts // M. Sondell, G. Lundborg, M. Kanje // Brain Res. - 1999. Vol.846, №2 - P. 219-28.
15.The effect of vascular endothelial growth factor and brain-derived neurotrophic factor on cavernosal nerve regeneration in a nerve-crush rat model / P.S. Hsieh [et al.] // BJU Int. - 2003. Vol.92, №4 - P. 470-5.
16.Sciatic nerve grafting and inoculation of FGF-2 promotes improvement of motor behavior and fiber regrowth in rats with spinal cord transaction / F.P. Guzen, [et al.] // Restorative Neurology and Neuroscience. - 2012. Vol.30 - P. 265-275.
17. Enhancement of musculocutaneous nerve reinnervation after vascular endothelial growthfactor (VEGF) gene therapy / P. Haninec [et al] // BMC Neuroscience. - 2012. Vol. 13, №57 - P.
18. Effect of VEGF gene therapy and hyaluronic acid film sheath on peripheral nerve regeneration / F. Zor [et al.] // - 2014. Vol. 34, №3 - P. 209-16.
19.Favorable effect of local VEGF gene injection on axonal regeneration in the rat sciatic nerve / C. Fu [et al.] // J Huazhong University Scince Technology. - 2007. Vol.2 - P. 186-9.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОДОН-ОПТИМИЗИРОВАННАЯ РЕКОМБИНАНТНАЯ ПЛАЗМИДА, СПОСОБ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ ПЕРИФЕРИЧЕСКОГО НЕРВА, СПОСОБ ЛЕЧЕНИЯ ПОВРЕЖДЕННОГО НЕРВА ЧЕЛОВЕКА | 2014 |
|
RU2558294C1 |
| ГЕННОТЕРАПЕВТИЧЕСКИЙ СПОСОБ ЛЕЧЕНИЯ СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ | 2015 |
|
RU2599507C1 |
| Средство для сдерживания гибели нейронов при ишемическом инсульте головного мозга и способ клеточно-опосредованной генной терапии ишемического инсульта головного мозга средством сдерживания гибели нейронов при ишемическом инсульте головного мозга | 2017 |
|
RU2676701C1 |
| СПОСОБ ЗАМЕЩЕНИЯ ДЕФЕКТА ПЕРИФЕРИЧЕСКОГО НЕРВА | 2012 |
|
RU2499565C1 |
| Оптимизированная нуклеотидная последовательность и фармацевтическая композиция на ее основе с пролонгированной экспрессией трансгена vegf | 2015 |
|
RU2612497C2 |
| Способ прогнозирования интраоперационных геморрагических осложнений при тяжелой форме диабетической ретинопатии | 2016 |
|
RU2626681C1 |
| Способ прогнозирования угрозы прерывания беременности во втором триместре в виде угрожающего позднего выкидыша и угрожающих преждевременных родов у женщин с беременностью, наступившей в результате ЭКО | 2022 |
|
RU2784346C1 |
| СПОСОБ ВАСКУЛЯРИЗИРОВАННОЙ АУТОНЕРВНОЙ ПЛАСТИКИ ПЛЕЧЕВОГО СПЛЕТЕНИЯ | 1997 |
|
RU2157109C2 |
| ТВЕРДОФАЗНЫЙ ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ (ELISA) ДЛЯ ФАКТОРА РОСТА ЭНДОТЕЛИЯ СОСУДОВ (VEGF) | 2007 |
|
RU2517301C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ИННЕРВАЦИИ РАЗГИБАТЕЛЬНОЙ МУСКУЛАТУРЫ ПРЕДПЛЕЧЬЯ ПРИ ТРАВМАХ ЛУЧЕВОГО НЕРВА | 2020 |
|
RU2726590C1 |



Изобретение относится к области регенеративной медицины и генной терапии и может быть использовано для стимуляции регенерации нервов за счет применения генннотерапевтической конструкции pCMV-VEGF сплайсинг-вариант 165 SEQ ID №1. Введение геннотерапевтической конструкции может осуществляться как непосредственно в поврежденный нерв, так и в параневральные ткани в интраоперационном периоде. Изобретение значительно улучшает результаты реконструктивного лечения повреждений периферических нервов. 15 ил., 1 пр.
1. Способ индукции регенерации периферического нерва путем введения интраневрально плазмиды pCMV-VEGF сплайсинг-вариант 165 SEQ ID №1.
2. Способ по п. 1, отличающийся тем, что после введения pCMV-VEGF сплайсинг-вариант 165 SEQ ID №1 на поверхность ткани наносится медицинский клей с целью герметизации мест инъекций.
| Накипеуловитель | 1928 |
|
SU12038A1 |
| RU 2014137219 А, 10.04.2016 | |||
| WO 2003024478 A1, 27.03.2003 | |||
| ВИБРООПОРА КОЧЕТОВЫХ | 2005 |
|
RU2295070C1 |
| КОДОН-ОПТИМИЗИРОВАННАЯ РЕКОМБИНАНТНАЯ ПЛАЗМИДА, СПОСОБ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ ПЕРИФЕРИЧЕСКОГО НЕРВА, СПОСОБ ЛЕЧЕНИЯ ПОВРЕЖДЕННОГО НЕРВА ЧЕЛОВЕКА | 2014 |
|
RU2558294C1 |
Авторы
Даты
2017-12-20—Публикация
2016-11-14—Подача