РОДСТВЕННАЯ ЗАЯВКА
По настоящей заявке испрашивается приоритет и преимущество Предварительной Заявки США №60/828203, поданной 4 октября 2006 г., описание которой включено в настоящее описание полностью.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к иммуноанализам для детекции определенных популяций VEGF, которые могут применяться в качестве диагностических и прогностических способов для пациентов с раковыми, сердечно-сосудистыми или другими патологиями.
УРОВЕНЬ ТЕХНИКИ
К настоящему моменту четко установлено, что ангиогенез вовлечен в патогенез разнообразных нарушений. Эти нарушения включают солидные опухоли, интраокулярные неоваскулярные синдромы, такие как пролиферативные ретинопатии или возрастная дегенерация желтого пятна (AMD), ревматоидный артрит и псориаз (Folkman et al. J. Biol. Chem. 267:10931-10934 (1992); Klagsbrun et al. Annu. Rev. Physiol. 53:217-239 (1991); и Garner A, Vascular diseases. In: Pathobiology of ocular disease. A dynamic approach. Garner A, Klintworth GK, Eds. 2nd Edition (Marcel Dekker, NY, 1994), pp. 1625-1710). В случае солидных опухолей неоваскуляризация предоставляет возможность опухолевым клеткам приобретать преимущество роста и пролиферативную автономию в сравнении с нормальными клетками. Соответственно наблюдалась корреляция между плотностью микрососудов в опухолевых участках и выживаемостью пациентов, страдающих раком груди, а также имеющими некоторые другие виды опухолей (Weidner et al. N Engl J Med 324: 1-6 (1991); Horak et al. Lancet 340: 1120-1124 (1992); и Macchiarini et al. Lancet 340: 145-146 (1992)).
Поиск положительных регуляторов ангиогенеза привел к получению множества кандидатов, включая, например, aFGF, bFGF, TGF-α, TGF-β, HGF, TNF-α, ангиогенин, IL-8, и т.д. (Folkman et al., выше, и Klagsbrun et al., выше). Некоторые отрицательные регуляторы, идентифицированные к настоящему времени, включают тромбоспондин (Good et al. Proc. Natl. Acad. Sci. USA. 87: 6624-6628 (1990)), N-концевой фрагмент пролактина с молекулярной массой 16 килодальтон (Clapp et al. Endocrinology, 133: 1292-1299 (1993)), ангиостатин (O'Reilly et al. Cell 79: 315-328 (1994)), и эндостатин (O'Reilly et al. Cell 88: 277-285 (1996)).
С помощью работы, проделанной в течение последних нескольких лет, установили ключевую роль фактора роста эндотелия сосудов (VEGF) в регуляции нормального и аномального ангиогенеза (Ferrara et al. Endocr. Rev. 18: 4-25 (1997)). Открытие того, что потеря даже одного аллеля VEGF приводит в результате к летальным случаям для эмбрионов, указывает на незаменимую роль, которую играет этот фактор в развитии и дифференцировке сосудистой системы (Ferrara et al., выше).
Кроме того, было показано, что VEGF является ключевым медиатором неоваскуляризации, ассоциированной с опухолями и интраокулярными нарушениями (Ferrara et al., выше). мРНК VEGF сверхэкспрессируется большинством исследованных опухолей человека (Berkman et al. J Clin Invest 91: 153-159 (1993); Brown et al. Human Pathol. 26: 86-91 (1995); Brown et al. Cancer Res. 53: 4727-4735 (1993); Mattern et al. Brit. J. Cancer. 73: 931-934 (1996); и Dvorak et al. Am J. Pathol. 146: 1029-1039 (1995)). Также концентрация VEGF в глазной жидкости в значительной степени коррелирует с наличием активной пролиферации кровеносных сосудов у пациентов с диабетической и другими связанными с ишемией ретинопатиями (Aiello et al. N. Engl. J. Med. 331: 1480-1487 (1994)). Кроме того, исследования продемонстрировали локализацию VEGF в хороидальных неоваскулярных мембранах у пациентов, страдающих острой дегенерацией желтого пятна (AMD) (Lopez et al. Invest. Ophtalmo. Vis. Sci. 37: 855-868 (1996)).
VEGF продуцируется в тканях, и ему нет необходимости попадать в кровоток для проявления его биологического эффекта, но он скорее действует локально в качестве паракринного регулятора. В недавнем исследовании, описанном в публикации Yang et al. J. Pharm. Exp. Ther. 284: 103 (1998), было обнаружено, что выведение rhVEGF165 из кровотока происходит очень быстро, что позволяет предположить, что присутствие эндогенного VEGF в кровотоке, наиболее вероятно, является результатом непрерывного синтеза VEGF. Кроме того, в некоторых исследованиях были сделаны попытки соотнесения уровней циркулирующего VEGF с тяжестью опухоли, и предлагалось использовать уровни VEGF в качестве потенциального прогностического маркера (Ferrari and Scagliotti Eur. J. Cancer 32A: 2368 (1996); Gasparini et al. J. Natl. Cancer Inst. 89: 139 (1997); Kohn Cancer 80: 2219 (1997); Baccala et al. Urology 51: 327 (1998); Fujisaki et al. Am. J. Gastroenterol. 93: 249 (1998)). Очевидно, что способность точного измерения VEGF является важной для понимания его потенциальной роли(ей) во множестве биологических процессов, таких как поддержание проходимости сосудов, менструальный цикл, ишемия, диабет, рак, интраокулярные нарушения и т.д.
В публикациях концентрации эндогенного VEGF широко варьировались у здоровых и больных пациентов, находясь в интервале от недетектируемого до высокого уровня. Способность к измерению уровня эндогенного VEGF зависит от доступности чувствительных и специфичных анализов. Были опубликованы варианты твердофазных иммуноферментных анализов (ELISA) для VEGF на основе колориметрического, хемилюминесцентного и флуоресцентного методов. Houck et al., выше, (1992); Yeo et al. Clin. Chem. 38: 71 (1992); Kondo et al. Biochim. Biophys. Acta 1221: 211 (1994); Baker et al. Obstet. Gynecol. 86: 815 (1995); Hanatani et al. Biosci. Biotechnol. Biochem. 59: 1958 (1995); Leith and Michelson Cell Prolif. 28:415 (1995); Shifren et al. J. Clin. Endocrinol. Metab. 81: 3112 (1996); Takano et al. Cancer Res. 56: 2185 (1996); Toi et al. Cancer 77: 1101 (1996); Brekken et al. Cancer Res. 58: 1952 (1998); Obermair et al. Br. J. Cancer 77: 1870-1874 (1998); Webb et al. Clin. Sci. 94: 395-404 (1998).
Например, в публикации Houck et al., выше (1992) описан колориметрический метод ELISA, который, очевидно, имеет чувствительность порядка нг/мл, которая не является достаточно чувствительной для детекции эндогенных уровней VEGF. В публикации Yeo et al., выше (1992) описан двухсайтный иммунофлуоресцентный анализ с разрешением по времени, однако, в нормальной сыворотке VEGF не детектировался (Yeo et al. Cancer Res. 53: 2912(1993)). В публикации Baker et al., выше (1995), описано, что с использованием модифицированной версии этого иммунофлуоресцентного анализа наблюдали детектируемые уровни VEGF в плазме беременных женщин, с наблюдением более высоких уровней у женщин с преэклампсией. Подобные данные для беременных женщин были описаны в публикации Anthony et al. Ann. Clin. Biochem. 34: 276 (1997) с использованием радиоиммуноанализа. Hanatani et al., выше (1995) разработали хемилюминесцентный метод ELISA, способный измерять уровень циркулирующего VEGF, и в публикации было описано, что уровень VEGF в сыворотке 30 здоровых индивидуумов (мужчин и женщин) составляет от 8-36 пг/мл. В публикации Brekken et al выше (1998) описаны анализы ELISA с использованием антител, предпочтительно связывающихся или с отдельным VEGF, или с комплексом VEGF:F1k-1.
Набор ELISA для детекции VEGF является коммерчески доступным от фирмы R&D Systems (Minneapolis, MN). Набор R&D VEGF ELISA также использовался в сэндвич-анализах, где моноклональное антитело используется для захвата мишени в виде VEGF-антигена, и поликлональное антитело используется для детекции VEGF. Webb et al. выше (1998). См. также, например, Obermair et al. выше (1998).
Keyt et al. J. Biol. Chem. 271: 7788-7795 (1996); Keyt et al. J. Biol. Chem. 271: 5638 (1996); и Shifren et al., выше (1996) также разработали колориметрический метод ELISA на основе сдвоенной пары моноклональных антител. Хотя этот метод ELISA был способен к детекции повышенного уровня VEGF у пациентов со злокачественной опухолью, ему не хватает чувствительности, необходимой для измерения эндогенных уровней VEGF у здоровых индивидуумов. Rodriguez et al. J. Immunol. Methods 219:45 (1998) описали двухсайтный флуоресцентный метод VEGF-ELISA, который дает чувствительность, составляющую 10 пг/мл VEGF в исходной плазме или сыворотке. Однако этот флуоресцентный анализ детектирует полностью интактные образцы 165/165 и 165/110 VEGF (Было описано, что VEGF 165/165 может быть протеолитически расщеплен на три другие формы: гетеродимер 165/110, гомодимер 110/110 и С-концевой фрагмент из 55 аминокислот (Keyt et al. J. Biol. Chem. 271: 7788-7795 (1996); Keck et al. Arch. Biochem. Biophys. 344: 103-113 (1997))).
Таким образом, существует необходимость в разработке диагностического и прогностического анализа, который бы детектировал более высокие измеряемые уровни VEGF в биологическом образце экспериментальной модели животного или у пациента, чем существующие в настоящее время методы ELISA, и/или мог бы измерять различные изоформы VEGF.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Способы ELISA антитело-сэндвич-типа для VEGF в качестве антигена были разработаны для детекции форм VEGF в биологических образцах. Способ VEGF-ELISA, предлагаемый настоящим изобретением, способен к детекции изоформ VEGF и фрагментов VEGF с размером более чем 110 аминокислот ("VEGF110+"). Также предлагаются наборы.
Например, способы детекции селективных форм фактора роста эндотелия сосудов (VEGF) с размером более чем 110 аминокислот (VEGF110+) в биологическом образце включает стадии: (a) контактирования и инкубации биологического образца с реагентом захвата, иммобилизованным на твердой подложке, где реагент захвата представляет собой антитело, которое распознает тот же эпитоп, что и антитело 5C3 против VEGF человека, причем указанное моноклональное антитело специфично связывается с остатками, в количестве более чем 110, из VEGF человека; (b) отделение биологического образца от иммобилизованных реагентов захвата; (c) контактирование иммобилизованного молекулярного комплекса реагента захвата-мишени с детектируемым антителом, которое связывается с доменами VEGF, ответственными за связывание с рецептором KDR и/или FLT1; и (d) измерение уровня VEGF110+, связанного с реагентами захвата, с использованием средств детекции для детектируемого антитела. В определенных воплощениях детектируемое антитело связывается с эпитопом в VEGF 1-110. В определенных воплощениях сравнительный анализ ELISA может быть осуществлен для детекции различных типов VEGF. В определенных воплощениях биологический образец (например, образцы опухоли или лизаты опухоли, плазма, сыворотка или моча и т.д.) отбирают у человека.
В одном воплощении реагент захвата представляет собой моноклональное антитело 5C3. В одном воплощении иммобилизованный реагент захвата наносят в качестве покрытия на микротитрационный планшет. В определенных воплощениях детектируемое антитело представляет собой моноклональное антитело. В одном воплощении детектируемое антитело представляет собой мышиное моноклональное антитело. В одном воплощении иммобилизованное моноклональное антитело представляет собой антитело MAb 5C3, и детектируемое антитело представляет собой антитело MAb A4.6.1. В определенных воплощениях детектируемое антитело является непосредственно детектируемым. В одном воплощении детектируемое антитело амплифицируется с помощью колориметрического реагента. В одном воплощении детектируемое антитело биотинилируется и средством детекции является авидин или стрептавидин-пероксидаза и 3,3',5,5'-тетраметилбензидин.
В определенных воплощениях изобретения человек является пациентом с сосудистым, диабетическим или раковым заболеванием, и стадия измерения (d) дополнительно включает сравнение со стандартной кривой для определения уровня VEGF в сравнении с уровнем у здорового индивидуума.
Также предлагаются наборы. Например, набор для иммуноанализа для детекции форм фактора роста эндотелия сосудов (VEGF), содержащих более чем 110 аминокислот (VEGF110+), в биологическом образце включает: (a) антитело против VEGF человека, в качестве реагента захвата, где моноклональное антитело специфично связывается с остатками, в количестве более чем 110, из VEGF человека; и (b) детектируемое антитело, в качестве реагента детекции, которое связывается с доменами VEGF, ответственными за связывание с рецептором, KDR и/или FLT1. В определенных воплощениях детектируемое антитело связывается с эпитопом в VEGF 1-110. В определенных воплощениях набор дополнительно включает твердую подложку для реагентов захвата. Например, реагенты захвата могут быть иммобилизованы на твердой подложке (например, микротитрационном планшете). В определенных воплощениях набор дополнительно включает средство детекции (например, колориметрическое средство, флуоресцентное средство и т.д.) для детектируемых антител. В определенных воплощениях набор дополнительно включает очищенный VEGF в качестве стандарта антигена. В определенных воплощениях изобретения дополнительный анализ VEGF-ELISA или более может предлагаться для сравнительных исследований, полученных с помощью VEGF110+-ELISA. В одном воплощении набор включает реагент захвата в виде моноклонального антитела, которое представляет собой мышиное моноклональное антитело MAb 5C3, и детектируемое антитело, которое представляет собой антитело MAb A4.6.1.
Еще в одном воплощении в изобретении предлагается антитело 5C3 против VEGF (получаемое из гибридомы, депонированной в ATCC под номером PTA-7737 или продуцируемое указанной гибридомой). В изобретении также предлагается антитело, которое не связывается с VEGF 1-110, и связывается с тем же эпитопом VEGF110+, что и моноклональное антитело, продуцируемое гибридомной клеточной линией PTA-7737. В определенных воплощениях антитело по изобретению конъюгировано с детектируемой меткой. В одном воплощении предлагается гибридома 5C3.1.1, депонированная в ATCC под номером PTA-7737.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Панели A, B и C иллюстрируют детекцию молекул рекомбинантного VEGF 165, VEGF 121 (1) (укороченный, с вероятным отсутствием приблизительно 9 аминокислот на С-конце, согласно производителю R&D systems), VEGF 121 (2) (от Pepro Tech), VEGF 110 (N-концевой фрагмент, полученный расщеплением плазмином VEGF) и VEGF8-109 (синтетический VEGF с аминокислотами 8-109 VEGF 165) с помощью различных анализов VEGF-ELISA. (A). ELISA A с использованием 3.5F8 для нанесения покрытия и биотинилированного A4.6.1 для детекции. (B). ELISA B с использованием A4.6.1 для нанесения покрытия и биотинилированного 2E3 для детекции. (C). ELISA C с использованием 5C3 для нанесения покрытия и биотинилированного A4.6.1 для детекции.
Фиг. 2 иллюстрирует белковый блоттинг VEGF, продуцированного клетками A673, с использованием в качестве зондов 3.5F8 (слева) или A4.6.1 (справа). Образцы представляют собой VEGF, очищенный из кондиционированной среды клеток A673 с использованием A4.6.1-аффинной колонки (дорожка 1), и рекомбинантные VEGF-белки: VEGF165, VEGF121 (с вероятным отсутствием приблизительно 9 аминокислот на С-конце, согласно производителю R&D systems), и VEGF8-109, продуцируемого с помощью E.coli (дорожки 2, 3 и 4, соответственно).
Фиг. 3 иллюстрирует диаграмму VEGF165, VEGF121 и VEGF110 (N-концевой фрагмент, полученный расщеплением плазмином VEGF), показывающую предполагаемые сайты связывания антител, использованных в трех анализах VEGF-ELISA.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Перед подробным описанием настоящего изобретения следует понимать, что настоящее изобретение не ограничивается конкретными композициями или биологическими системами, которые, без сомнения, могут варьироваться. Также следует понимать, что здесь используется терминология только в целях описания конкретных воплощений, и подразумевается, что она не является ограничением. При использовании в этом описании и приложенной формуле изобретения формы единственного числа включают обозначения множественного числа, если по содержанию ясно не указано иначе. Таким образом, например, обозначение "молекула" необязательно включает комбинацию двух или более молекул и так далее.
При использовании здесь термин "VEGF" обозначает фактор роста эндотелия сосудов из 165 аминокислот и родственные факторы роста эндотелия сосудов из 121, 145, 189 и 206 аминокислот, как описано в публикациях Leung et al. Science 246: 1306 (1989), Houck et al. Mol. Endocrin. 5: 1806 (1991), и Neufeld et al., выше, вместе с природными аллельными и процессированными формами этих факторов роста. См. также, например, Фиг. 1 A и B из Патента США № 6057428. Активный фрагмент VEGF может высвобождаться из ECM-связанного VEGF с помощью расщепления плазмином, с получением первых 110 аминокислот (см., например, Keyt BA, et al.: The carboxyl-terminal domain (111-165) of vascular endothelial growth factor is critical for its mitogenic potency. J Biol Chem. 271: 7788-7795 (1996)). При использовании в настоящем описании термин "VEGF110+" обозначает фрагменты VEGF, которые содержат более чем 110 аминокислот (от N-конца), но не включают первые 110 аминокислот или меньшие фрагменты (например, VEGF8-109).
Термин "детекция" используется в широком смысле, включая оба измерения молекулы-мишени - качественное и количественное. В одном аспекте описанный здесь способ детекции используется для идентификации всего лишь присутствия VEGF110+ или VEGF в биологическом образце. В другом аспекте способ используется для тестирования, присутствует ли VEGF110+ или VEGF в образце на детектируемом уровне. Еще в одном аспекте способ может использоваться для количественной оценки количества VEGF110+ или VEGF в образце, и, кроме того, для сравнения уровней VEGF110+ или VEGF из различных образцов.
Термин "биологический образец" обозначает образец из организма, полученный от любого животного, но, предпочтительно, от млекопитающего, более предпочтительно, от человека. В определенных воплощениях такой биологический образец получают от пациента с сосудистым, диабетическим или раковым заболеванием. Такие образцы включают биологические жидкости, такие как сыворотка, плазма, жидкость стекловидного тела, лимфатическая жидкость, синовиальная жидкость, фолликулярная жидкость, семенная жидкость, амниотическая жидкость, молоко, цельная кровь, моча, спинномозговая жидкость, слюна, мокрота, слезная жидкость, жидкость при потоотделении, слизь, опухолевые лизаты и среда тканевых клеточных культур, а также тканевые экстракты, такие как гомогенизированная ткань, опухолевая ткань и клеточные экстракты. В определенных воплощениях образец представляет собой образец из организма, полученный от любого животного, в одном воплощении - от млекопитающего, еще в одном воплощении - от человека. В одном воплощении такой биологический образец получают от клинических пациентов.
Термин "детектируемое антитело" обозначает антитело, которое может быть детектировано либо непосредственно с помощью метки, амплифицированной с помощью средств детекции, или косвенно - с помощью, например, другого меченого антитела. Для прямого мечения антитело обычно конъюгируется с компонентом, который детектируется с помощью некоторых средств. В одном воплощении детектируемое антитело представляет собой биотинилированное антитело.
Термин "средство детекции" обозначает компонент или метод, используемый для детекции присутствия детектируемого антитела в настоящем анализе ELISA, и включает агенты детекции, которые амплифицируют иммобилизованную метку, такую как метка, захваченная на титрационном микропланшете. В одном воплощении средство детекции представляет собой агент колориметрической детекции, такой как авидин или стрептавидин-HRP.
Термин "реагент захвата" обозначает реагент, способный к связыванию и захвату молекулы-мишени в образце, так чтобы при подходящих условиях комплекс в виде реагента захвата и молекулы-мишени мог отделяться от остальной части образца. Обычно реагент захвата является иммобилизованным или может быть иммобилизован. В иммуноанализе сэндвич-типа реагент захвата предпочтительно представляет собой антитело или смесь различных антител против антигена-мишени.
Термин "антитело" используется в настоящем описании в широком смысле и конкретно охватывает интактные моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела), образованные, по меньшей мере, из двух интактных антител, и фрагменты антител, при условии, что они проявляют желаемую биологическую активность.
Термин "фрагменты антител" включает часть интактного антитела, предпочтительно, включающую его антиген-связывающий или вариабельный участок. Примеры фрагментов антитела включают фрагменты Fab, Fab', F(ab')2, и Fv; димерные антитела; линейные антитела; одноцепочечные молекулы антител; и мультиспецифичные антитела, образованные из фрагментов антител.
В целях настоящего изобретения "интактное антитело" представляет собой антитело, включающее вариабельные домены тяжелой и легкой цепей, а также участок Fc.
"Нативные антитела" обычно представляют собой гетеротетрамерные гликопротеины с молекулярной массой, составляющей примерно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь соединена с тяжелой цепью с помощью одной ковалентной дисульфидной связи, в то время как количество дисульфидных связей варьируется среди тяжелых цепей иммуноглобулинов различных изотипов. Каждая тяжелая и легкая цепь также содержит дисульфидные мостики внутри цепи, расположенные через определенные интервалы. Каждая тяжелая цепь содержит на одном конце вариабельный домен (VH), следующий за рядом константных доменов. Каждая легкая цепь содержит на одном конце вариабельный домен (VL) и константный домен - на ее другом конце; константный домен легкой цепи располагается по одной линии с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи располагается по одной линии с вариабельным доменом тяжелой цепи. Предполагается, что конкретные аминокислотные остатки образуют границу раздела между вариабельными доменами легкой цепи и тяжелой цепи.
При использовании здесь, термин "моноклональное антитело" обозначает антитело, полученное из популяции, по существу, гомогенных антител, т.е. индивидуальные антитела, включенные в популяцию, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифичными, будучи направленными против одного антигенного сайта. Кроме того, в противоположность препаратам обычных (поликлональных) антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты антигена. В дополнение к их специфичности, преимущество моноклональных антител заключается в том, что они синтезируются с помощью гибридомных культур, не содержащих других иммуноглобулинов. Обозначение "моноклональное" указывает на характер антитела, которое получено из по существу гомогенной популяции антител, и это обозначение не следует понимать, как необходимость получения антитела любым конкретным методом. Например, моноклональные антитела, используемые согласно настоящему изобретению, могут быть получены с помощью гибридомного метода, впервые описанного в публикации Kohler et al., Nature, 256: 495 (1975), или могут быть получены с помощью методов рекомбинантной ДНК (см., например, Патент США № 4816567). "Моноклональные антитела" также могут быть выделены из фаговых библиотек антител с использованием методов, описанных, например, в публикациях Clackson et al. Nature 352: 624-628 (1991) и Marks et al., J. Mol. Biol. 222: 581-597 (1991).
В настоящем описании моноклональные антитела конкретно включают "химерные" антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной с соответствующими последовательностями в антителах, выделенных из конкретных видов или принадлежащих конкретному классу или подклассу антител, в то время как оставшаяся часть цепи(ей) является идентичной или гомологичной с соответствующими последовательностями в антителах, выделенных из других видов или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют желаемую биологическую активность (Патент США № 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA. 81: 6851-6855 (1984)). Здесь, химерные антитела, представляющие интерес, включают "приматизированные" антитела, включающие антиген-связывающие последовательности вариабельного домена, выделенные из примата, отличного от человека (например, из обезьяны старого света, такой как бабуин, макака-резус или макака-крабоед), и включающие последовательности константного участка человека (Патент США № 5693780).
"Гуманизированные" формы не человеческих (например, мышиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность, выделенную из не человеческого иммуноглобулина. По большей части гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельного участка реципиента заменены на остатки из гипервариабельного участка вида, отличного от человека (донорное антитело), такого как мышь, крыса, кролик или примат, отличный от человека, причем эти антитела обладают желаемой специфичностью, аффинностью и способностью. В некоторых случаях, остатки каркасного участка (FR) иммуноглобулина человека заменяют на соответствующие не человеческие остатки. Кроме того, гуманизированные антитела могут включать остатки, которые не обнаружены в реципиентном антителе или в донорном антителе. Эти модификации производят дополнительно для улучшения функций антитела. Как правило, гуманизированное антитело включает, по существу, все из, по меньшей мере, одного, и обычно, из двух вариабельных доменов, в которых все или, по существу, все из гипервариабельных петель соответствуют таким последовательностям из не человеческого иммуноглобулина, и все или, по существу, все из участков FR представляют собой такие последовательности из иммуноглобулина человека. Гуманизированное антитело также необязательно включает, по меньшей мере, часть константного участка иммуноглобулина (Fc), обычно иммуноглобулина человека. Для дополнительных подробностей, см. публикации Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol., 2: 593-596 (1992). В одном воплощении предлагается гуманизированное антитело 5C3, и применяются предлагаемые здесь способы.
Термин "вариабельный" обозначает тот факт, что определенные части вариабельных доменов существенно отличаются по последовательностям среди антител и используются для связывания и специфичности каждого конкретного антитела для его конкретного антигена. Однако вариабельность представлена неравномерно на протяжении последовательности вариабельных доменов антител. Она концентрируется в трех сегментах, называемых гипервариабельными участками в обоих вариабельных доменах - легкой цепи и тяжелой цепи. Наиболее высококонсервативные части вариабельных доменов называются каркасными участками (FR). Вариабельные домены нативных, тяжелой и легкой, цепей, каждый, включают по четыре участка FR, преимущественно принимающих конфигурацию β-листа, связанных с помощью трех гипервариабельных участков, которые образуют петли, связывающие и, в некоторых случаях, образующие часть структуры β-листа. Гипервариабельные участки в каждой цепи поддерживаются вместе в непосредственной близости с помощью FR, и вместе с гипервариабельными участками из другой цепи, что способствует образованию антиген-связывающего сайта антител (см. публикацию Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Константные домены не вовлечены непосредственно в связывание антитела с антигеном, но проявляют разнообразные эффекторные функции, такие как участие антитела в антитело-зависимой клеточной цитотоксичности (ADCC).
С помощью расщепления папаином антител получают два идентичных антиген-связывающих фрагмента, называемых фрагментами "Fab", каждый из которых содержит один антиген-связывающий сайт, и остаточный фрагмент "Fc", название которого отражает его способность легко кристаллизоваться. С помощью обработки пепсином получают фрагмент F(ab')2, который содержит два антиген-связывающих сайта, и все еще остается способным к перекрестному связыванию антигена.
"Fv" представляет собой фрагмент антитела, который содержит полный антиген-распознающий и антиген-связывающий сайт. Этот участок состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, которые находятся в плотной нековалентной ассоциации. Фрагмент находится в такой конфигурации, что три гипервариабельных участка каждого вариабельного домена взаимодействуют для определения антиген-связывающего сайта на поверхности димера VH-VL. Вместе шесть гипервариабельных участков придают антителу антиген-связывающую специфичность. Однако даже один вариабельный домен (или половина фрагмента Fv, включающая только три гипервариабельных участка, специфичных к антигену) обладает способностью связывать антиген, хотя с меньшей аффинностью, чем цельный сайт связывания.
Фрагмент Fab также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab вставкой нескольких остатков в карбокси-конец домена CH1 тяжелой цепи, включающих один или боле цистеинов из шарнирного участка антитела. Fab'-SH в настоящем описании представляет собой обозначение для Fab', в котором остаток(ки) цистеина в константных доменах несут, по меньшей мере, одну свободную тиольную группу. Фрагменты F(ab')2 антитела исходно были получены в виде пар фрагментов Fab', которые содержали между собой цистеины шарнирного участка. Также известны другие химические конденсации фрагментов антитела.
"Легкие цепи" антител (иммуноглобулинов) из любого вида позвоночных могут быть отнесены к одному из двух совершенно различных типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей, антитела могут быть отнесены к различным классам. Существует пять главных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из этих классов могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам антител, называются α, δ, ε, γ и μ, соответственно. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
Фрагменты антитела "одноцепочечный Fv" или "scFv" включают домены VH и VL антитела, где эти домены присутствуют в одной полипептидной цепи. Предпочтительно, полипептид Fv дополнительно включает полипептидный линкер между доменами VH и VL, который предоставляет возможность scFv образовывать желаемую структуру для связывания антигена. В качестве обзора на тему scFv, см. публикацию Pluckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
При использовании здесь, термин "гипервариабельный участок" обозначает аминокислотные остатки антитела, которые ответственны за связывание антигена. Гипервариабельный участок включает аминокислотные остатки из "участка, определяющего комплементарность" или "CDR" (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)), и/или такие остатки из "гипервариабельной петли" (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). Остатки "каркаса" или "FR" представляют собой такие остатки вариабельного домена, которые отличны от остатков гипервариабельного участка, как здесь определено.
"Млекопитающее" для целей лечения обозначает любое животное, классифицированное как млекопитающее, включая людей, домашних и сельскохозяйственных животных, и животных зоопарка, спортивных животных, или домашних животных, таких как собаки, лошади, кошки, овцы, свиньи, коровы и т.д. Предпочтительным млекопитающим является человек.
Термины "рак", "раковый" и "злокачественный" обозначают или описывают физиологическое заболевание у млекопитающих, которое обычно характеризуется неконтролируемым клеточным ростом. Примеры рака включают, но не ограничены ими, карциному, включающую аденокарциному, лимфому, бластому, меланому, саркому и лейкемию. Более конкретные примеры таких раковых заболеваний включают плоскоклеточный рак, рак легкого (включающий мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого), рак брюшины, печеночно-клеточный рак, гастральный или желудочный рак (включая желудочно-кишечный рак), желудочно-кишечный стромальный рак, панкреатический рак, глиобластому, рак шейки матки, рак яичников, рак печени (например, печеночную карциному и гепатому), рак мочевого пузыря, гепатому, рак груди, рак прямой кишки, колоректальный рак, ректальный рак, эндометриальную или утробную карциному, карциному слюнной железы, рак почки или почечный рак, рак печени, рак простаты, рак вульвы, рак щитовидной железы, базально-клеточную карциному, рак яичка, рак пищевода, печеночную карциному, саркому мягкой ткани, саркому Капоши, карциноидную карциному, мезотелиому, множественную миелому, и различные типы рака головы и шеи, а также B-клеточную лимфому (включая низкодифференцированную/фолликулярную неходжкинскую лимфому (НХЛ); НХЛ малых лимфоцитов (SL); среднедифференцированную/фолликулярную НХЛ; среднедифференцированную дифузную НХЛ; высокодифференцированную иммунобластную НХЛ; высокодифференцированную лимфообластную НХЛ; высокодифференцированную мелкоклеточную лимфому НХЛ с нерасщепленным ядром; массивное поражение НХЛ; лимфому клеток мантийной ткани; СПИД-ассоциированную лимфому; и Макроглобулинемию Вальденстрема); лимфому Ходжкина, хроническую лимфоцитарную лейкемию (CLL), острую лимфобластную лейкемию (ALL), лейкемию волосковых клеток; хроническую миелобластную лейкемию, и пост-трансплантационное лимфопролиферативное нарушение (PTLD), а также аномальную сосудистую пролиферацию, ассоциированную с факоматозом, отек (такой как отек, ассоциированный с опухолями головного мозга), и синдром Мейгса.
Выражения "сосудистый" и "сердечно-сосудистый" используются взаимозаменяемо и описывают пациентов с признаками, которые стимулируют ангиогенез и/или кардиоваскуляризацию, и с признаками, которые ингибируют ангиогенез и/или кардиоваскуляризацию. Такие нарушения включают, например, артериальное заболевание, такое как атеросклероз, гипертензия, воспалительный васкулит, болезнь Рейно и феномен Рейно, аневризмы и артериальный рестеноз; венозные и лимфатические нарушения, такие как тромбофлебит, лимфангиит и лимфедема; и другие сосудистые нарушения, такие как периферическое сосудистое заболевание, AMD, рак, такой как опухоли сосудов, например, гемангиома (капиллярная и полостная), гломусные опухоли, телеангиэктазия, бациллярный ангиоматоз, гемангиоэндотелиома, ангиосаркома, гемангиопериктома, саркома Капоши, лимфангиома и лимфангиосаркома, опухолевый ангиогенез, травма, такая как раны, ожоги и другие тканевые повреждения, фиксация имплантанта, рубец, ишемическое реперфузионное повреждение, ревматоидный артрит, цереброваскулярное заболевание, почечные заболевания, такие как острая почечная недостаточность, и остеопороз. Эти нарушения также включают стенокардию, инфаркты миокарда, такие как острые инфаркты миокарда, сердечная гипертрофия и сердечную недостаточность, такую как застойная сердечная недостаточность (CHF).
Термин "диабет" обозначает прогрессирующее заболевание углеводного метаболизма, включающего неадекватное продуцирование или утилизацию инсулина, и характеризуется гипергликемией и глюкозурией. Этот термин включает все формы диабета, такие как диабет I типа и II типа, и инсулиноустойчивый диабет, такой как синдром Менденхолла (Mendenhall), синдром Вернера, лепречаунизм, липоатрофический диабет и другие липоатрофии.
Термин "аффинно-очищенный" обозначает очистку вещества с помощью его элюирования сквозь колонку для аффинной хроматографии.
ELISA
Фактор роста эндотелия сосудов (VEGF) представляет собой гомодимерный гликопротеин и представляет собой ключевой ангиогенный фактор образования кровеносных сосудов во время развития и при патологическом ангиогенезе, ассоциированном с опухолями. Экспрессия VEGF усиливается в ответ на гипоксию, и потенциально в ответ на другие факторы, такие как факторы роста, гормоны и онкогены (см., например, публикацию Ferrara N: Vascular endothelial growth factor: Basic science and clinical progress. Endocrine Reviews 25: 581-611 (2004)). Ген VEGF человека содержит восемь экзонов, разделенных интронами. Альтернативный сплайсинг РНК приводит в результате к получению, по меньшей мере, четырех основных изоформ, содержащих в мономере 121, 165, 189 и 206 аминокислот (см., например, публикации Houck KA, et al.: The vascular endothelial growth factor family: identification of a fourth molecular species and characterization of alternative splicing of RNA. Mol Endocrinol 5: 1806-1814 (1991); и Tischer E, et al.: The human gene for vascular endothelial growth factor. Multiple protein forms are encoded through alternative exon splicing. J Biol Chem 266: 11947-11954 (1991)). Также были описаны менее представленные изоформы, включающие изоформы, содержащие в мономере 145 аминокислот (см., например, публикацию Poltorak Z., et al.: VEGF145, a secreted vascular endothelial growth factor isoform that binds to extracellular matrix. J Biol Chem 272: 7151-7158 (1997)) и 183 аминокислоты (см., например, публикацию Jingjing L, et al.: Human Muller cells express VEGF 183, a novel spliced variant of vascular endothelial growth factor. Invest Ophthalmol Vis Sci 40: 752-759 (1999)). Все изоформы VEGF связываются с двумя рецепторными тирозинкиназами, VEGFR-1 (см., например, публикацию De Vries C, et al.: The fms-like tyrosine kinase, a receptor for vascular endothelial growth factor. Science 255:989-991 (1992)) и VEGFR-2 (см., например, публикацию Terman BI, et al.: Identification of a new endothelial cell growth factor receptor tyrosine kinase. Oncogene 6: 1677-1683 (1991)). VEGF165 также взаимодействует с нейропилином (см., например, публикацию Soker S. et al.: Neuropilin-1 is expressed by endothelial and tumor cells as an isoform-specific receptor for vascular endothelial growth factor. Cell 92: 735-745 (1998)). VEGF189 и VEGF206 связываются с гепарином с высокой степенью аффинности, и являются наиболее связанными во внеклеточном матриксе (ECM). VEGF165 связывается с гепарином со средней степенью аффинности, и является частично связанным с клеточной поверхностью и ECM. VEGF121 не связывается с гепарином и легко растворим. Было обнаружено, что VEGF121 и VEGF165 являются наиболее доминантными вариантами, экспрессирующимися в образцах и клеточных линиях рака груди и рака яичников, полученными с помощью анализа обратной транскрипции-ПЦР, в то время как экспрессия VEGF206 не детектировалась. Было обнаружено, что экспрессия VEGF183 и VEG189 не детектировалась или находилась на низком уровне в клеточных линиях, и детектировалась в некоторых из образцов опухолей (см., например, публикацию Stimpfl M, et al.: Vascular Endothelial growth factor splice variants and their prognostic value in breast and ovarian cancer. Clinical Cancer Research 8: 2253-2259 (2002)).
Активный фрагмент VEGF может высвобождаться из ECM-связанной формы VEGF с помощью расщепления плазмином с получением первых 110 аминокислот (см., например, публикацию Keyt BA, et al., The carboxyl-terminal domain (111-165) of vascular endothelial growth factor is critical for its mitogenic potency. J Biol Chem. 271: 7788-7795 (1996)). Это может являться механизмом для локальной регуляции биодоступности VEGF во время физиологических и патологических процессов ангиогенеза. См., например, публикации Houck KA, et al. Dual regulation of vascular endothelial growth factor bioavailability by genetic and proteolytic mechanisms. J Biol Chem 1992; 267:26031-26037 (1992); Keyt BA, et al. The carboxy-terminal domain (111-165) of vascular endothelial growth factor is critical for its mitogenic potency. J Biol Chem. 271:7788-7795 (1996); и Roth D, et al. Plasmin modulates vascular endothelial growth factor-A-mediated angiogenesis during wound repair. Am Pathology 168: 670-684. (10-12) (2006). Однако концентрации VEGF110 в биологических образцах не были описаны. Активные фрагменты VEGF также могут высвобождаться из ECM-связанной формы VEGF с помощью расщепления матриксной металлопротеиназой (MMP). Это утверждение поддерживается открытием деградированных фрагментов VEGF, содержащих аминокислоты дополнительно к 1-110, присутствующих в асцитах у пациентов с раком яичников. Оба белка - плазмин и MMP3 - были детектированы в асцитах. См., например, публикацию Lee S, Shahla MJ, et al. Processing of VEGF-A by matrix metalloproteinases regulates bioavailability and vascular patterning in tumors. J Cell Biology 169:681-691 (2005).
Твердофазные иммуноферментные анализы (ELISA) для различных антигенов включают анализы на основе колориметрии, хемилюминесценции и флуоресценции. ELISA успешно применялись при определении низких количеств лекарственных средств и других антигенных компонентов в образцах плазмы и мочи, не включая стадии экстракции и будучи простыми в применении. Анализ, описанный здесь, представляет собой анализ ELISA, который применяет антитела в качестве реагентов захвата и детектируемые антитела для VEGF и VEGF110+. В определенных воплощениях анализ ELISA проводится на клеточной основе. На первой стадии анализа биологический образец, потенциально содержащий VEGF или VEGF110+, контактировал и инкубировался с антителами захвата (или с нанесенными в виде покрытия антителами) так, чтобы антитела захвата захватывали или связывались с VEGF или VEGF110+ так, чтобы они детектировались на стадии детекции. Стадия детекции включает использование детектируемого антитела, которое при контакте с любым из связанных VEGF или VEGF110+, связывается с белком, представляющим интерес, если он присутствует, и используется средство детекции для детекции метки на антителе, и, следовательно, детекции присутствия или количества присутствующего VEGF или VEGF110+. Этот анализ ELISA можно сравнить с анализом ELISA, который распознает суммарный VEGF (например, Патент США № 6855508; публикации, описанные здесь, и публикации, известные из уровня техники) или изоформы VEGF для определения присутствующего типа VEGF.
Например, в определенных воплощениях в анализе применяются следующие стадии.
Первая стадия
На первой стадии настоящего анализа биологический образец контактирует или инкубируется с иммобилизованным (или нанесенным в виде покрытия) реагентом захвата, который представляет собой моноклональное антитело против VEGF. Это антитело может быть выделено из любого вида, но предпочтительно, моноклональное антитело является мышиным или крысиным моноклональным антителом, более предпочтительно, мышиным и наиболее предпочтительно, моноклональное антитело является антителом MAb 5C3, выделенным из гибридомы, идентифицированной в настоящем изобретении. Следовательно, в конкретном предпочтительном воплощении иммобилизованное моноклональное антитело представляет собой мышиное моноклональное антитело, наиболее предпочтительно, антитело MAb 5C3. Иммобилизация выполняется подходящим образом или путем перевода реагента захвата в нерастворимую форму перед процедурой анализа, или с помощью адсорбции на водонерастворимый матрикс или поверхность (Патент США № 3720760), или не ковалентно или с помощью ковалентной конденсации (например, с использованием поперечных сшивок глутаральдегида или карбодиимида, вместе или в отсутствии, перед активацией подложки с помощью, например, азотной кислоты и восстанавливающего агента, как описано в Патенте США № 3645852 или в публикации Rotmans et al. J. Immunol. Methods 57:87-98 (1983)), или после процедуры анализа, например, с помощью иммунопреципитации.
Твердая фаза, используемая для иммобилизации, может представлять собой любую инертную подложку или носитель, который, по существу, является нерастворимым в воде и применяется в иммунометрических анализах, включая подложки, например, в форме поверхностей, частиц, пористых матриксов и т.д. Примеры обычно используемых подложек включают небольшие пластины, Сефадекс, поливинилхлорид, пластиковые гранулы и планшеты для анализа или пробирки для теста, произведенные из полиэтилена, полипропилена, полистирола и им подобные, включая 96-луночные микротитрационные планшеты, а также зернистные материалы, такие как фильтровальная бумага, агароза, сшитый декстран и другие полисахариды. Альтернативно, для иммобилизации реагента захвата подходящим образом применяются реакционно-способные не растворимые в воде матриксы, такие как углеводы, активированные цианоген-бромидом, и реакционно-способные субстраты, описанные в Патенте США № 3969287; 3691016; 4195128; 4247642; 4229537 и 4330440. В одном воплощении иммобилизованный реагент захвата наносится в качестве покрытия на микротитрационный планшет, и особенно предпочтительной используемой твердой фазой является многолуночный микротитрационный планшет, который может использоваться для анализа нескольких образцов одновременно, например, 96-луночный ELISA-планшет для микроанализа, такой как предоставляемый фирмой Nune Maxisorb или Immulon. В определенных воплощениях планшет представляет собой 96-луночный ELISA-планшет от MICROTESTTM или MAXISORPTM, такой как предоставляемый фирмой NUNC MAXISORBTM или IMMULONTM.
На твердую фазу в качестве покрытия наносится реагент захвата, как определено выше, который может быть связан с помощью нековалентного или ковалентного взаимодействия, или с помощью физической связи, как описано в литературе. Методы присоединения включают методы, описанные в Патенте США № 4376110 и в ссылках, цитированных здесь. Если присоединение ковалентное, планшет или другая твердая фаза инкубируется со сшивающим агентом, вместе с реагентом захвата при условиях, хорошо известных из уровня техники, например, таких как в течение 1 часа при комнатной температуре.
Образующие перекрестные сшивки агенты, обычно используемые для присоединения реагента захвата к субстрату твердой фазы, включают, например, 1,1-бис(диазоацетил)-2-фенилэтан, глутаральдегид, N-гидроксисукцинимидные сложные эфиры, например эфиры с 4-азидосалициловой кислотой, гомобифункциональные сложные имидоэфиры, включающие дисукцинимидилэфиры, такие как 3,3'-дитио-бис-(сукцинимидилпропионат), и бифункциональные малеимиды, такие как бис-N-малеимидо-1,8-октан. С помощью модифицированных агентов, таких как метил-3-[(п-азидофенил)дитио]пропиоимидат, получают фотоактивируемые промежуточные соединения, способные к образованию перекрестных сшивок в присутствии света.
Если применяются 96-луночные планшеты, то на них обычно в качестве покрытия наносится реагент захвата (обычно разведенный в буфере, таком как 0,05 M карбонат натрия, путем инкубации в течение, по меньшей мере, 10 часов, более предпочтительно, в течение ночи при температурах, которые находятся в примерном интервале 4-20ºС, или в примерном интервале 4-8°C, и при значениях pH, которые находятся в примерном интервале 8-12, или в примерном интервале pH 9-10, или примерно pH 9,6). Если целесообразно провести нанесение покрытия в короткое время, то нанесение покрытия на 96-луночные планшеты может быть проведено специалистом, например, в течение двух часов при комнатной температуре. Планшеты могут быть уложены, и на них может быть проведено нанесение покрытия задолго до самого анализа, и затем может быть проведен анализ одновременно на нескольких образцах вручную, полуавтоматическим или автоматическим способом, таким как с использованием робототехники.
Планшеты с нанесенным покрытием затем обычно обрабатывают с помощью блокирующего агента, который неспецифично связывается и заполняет сайты связывания для предотвращения нежелательного связывания свободного лиганда с избытком сайтов на лунках планшета. Примеры подходящих блокирующих агентов для этих целей включают, например, желатин, бычий сывороточный альбумин, яичный альбумин, казеин и нежирное молоко. Блокирующая обработка обычно проводится в условиях температур окружающей среды в течение примерно 1-4 часов, предпочтительно, примерно 1-3 часов, или в течение ночи при 0-4°C.
После нанесения покрытия и блокирования, стандарт VEGF (очищенный VEGF) или биологический образец, который необходимо подвергнуть анализу, подходящим образом разводят, добавляют к иммобилизованной фазе. Предпочтительная степень разведения по объему составляет примерно 1-15%, предпочтительно примерно 10%. Буферы для разведения, которые могут использоваться для этой цели, включают (a) PBS, содержащий 0,5% BSA, 0,05% детергент TWEEN 20TM (P20), 0,05% антибиотик PROCLINTM 300, 5 мМ EDTA, 0,25% поверхностно-активное вещество Chaps, 0,2% бета-гамма глобулин, и 0,35M NaCl, pH 7,4; (b) PBS, содержащий 0,5% бычьего сывороточного альбумина, 0,05% полисорбат 20, 5 мМ EDTA, 0,25% CHAPS, 0,2% бычьи γ-глобулины, и 0,35 M NaCl; pH 7,4 (c) PBS, содержащий 0,5% BSA, 0,05% полисорбат 20 (P20), и 0,05% PROCLINTM 300, pH 7; (d) PBS, содержащий 0,5% BSA, 0,05% P20, 0,05% PROCLINTM 300, 5 мМ EDTA, и 0,35 M NaCl, pH 6,35; (e) PBS, содержащий 0,5% BSA, 0,05% P20, 0,05% PROCLINTM 300, 5 мМ EDTA, 0,2% бета-гамма глобулин, и 0,35 M NaCl, pH 7,4; и (f) PBS, содержащий 0,5% BSA, 0,05% P20, 0,05% PROCLINTM 300, 5 мМ EDTA, 0,25% Chaps, и 0,35 M NaCl, pH 7,4. PROCLINTM 300 действует в качестве консерванта, и TWEEN 20TM действует в качестве детергента для исключения неспецифичного связывания.
В то время как концентрация реагентов захвата, как правило, определяется согласно интервалу представляющих интерес концентраций VEGF, принимая во внимание любое необходимое разведение биологического образца, конечная концентрация реагента захвата обычно определяется эмпирически для получения максимальной чувствительности анализа в интервале представляющих интерес концентраций.
Условия инкубации образца и иммобилизованного реагента захвата выбирают для получения максимальной чувствительности анализа и минимальной диссоциации. Предпочтительно, инкубацию выполняют при достаточно постоянных температурах, которые находятся в интервале примерно от 0°С до примерно 40°С, предпочтительно, примерно от 20 до 25°C. Время инкубации зависит, главным образом, от температуры, которое, как правило, не превышает более чем примерно 10 часов во избежание нечувствительного анализа. Предпочтительно, время инкубации составляет примерно от 0,5 до 3 часов, и, более предпочтительно, 1,5-3 часа при комнатной температуре для получения максимального связывания свободного VEGF110+ или VEGF с реагентами захвата. Продолжительность инкубации может быть большей, если добавляется протеазный ингибитор для предотвращения протеазной деградации VEGF в биологической жидкости.
На этой стадии pH инкубационной смеси, как правило, находится в примерном интервале 4-9,5, предпочтительно, в примерном интервале 6-9, более предпочтительно, в примерном интервале 7-8, и наиболее предпочтительно, pH разбавителя для анализа (ELISA) составляет 7,4. pH инкубационного буфера выбирают для поддержания существенного уровня специфичного связывания реагента захвата с захваченными VEGF110+ или VEGF. Могут применяться разнообразные буферы для достижения и поддержания во время этой стадии желаемых значений pH, включающие борат, фосфат, карбонат, Tris-HCl или Tris-фосфат, ацетат, барбитал и им подобные. Конкретный применяемый буфер не является критическим по изобретению, но в индивидуальных анализах один буфер может быть предпочтительнее другого.
Вторая стадия
На второй стадии представленного здесь способа анализа, которая является необязательной, биологический образец отделяют (предпочтительно, с помощью промывания) от иммобилизованного реагента захвата для удаления незахваченных молекул. Раствор, используемый для промывания, как правило, представляет собой буфер ("промывающий буфер"), имеющий pH со значением, определенным с использованием анализов и буферов, описанных выше для стадии инкубации, с предпочтительным значением pH в примерном интервале 6-9. Промывание может проводиться три или более раз. Температура промывания, как правило, находится в интервале от низких температур до средних температур с постоянной температурой, поддерживаемой во время проведения анализа, которая обычно находится в примерном интервале 0-40°C, более предпочтительно, в примерном интервале 4-30°C. Например, промывающий буфер может быть перед промыванием помещен в емкость на лед при 4°C, и для этой стадии может применяться устройство для промывания планшетов. Сшивающий агент или другой подходящий агент также может добавляться на этой стадии, чтобы дать возможность в данный момент связанному VEGF110+ или VEGF ковалентно присоединиться к реагенту захвата, если существует любое сомнение в том, что захваченный VEGF110+ или VEGF может в некоторой степени диссоциировать в последующих стадиях.
Третья стадия
На следующей стадии иммобилизованный реагент захвата контактирует с детектируемыми антителами, предпочтительно, при температуре, которая находится в примерном интервале 20-40°C, более предпочтительно, в примерном интервале 20-25°C, с точным значением температуры и времени для контактирования, причем эти два параметра зависят, главным образом, от применяемых средств детекции. Например, когда используется в качестве средства детекции стрептавидин-пероксидаза и 3,3',5,5'-тетраметилбензидин, например, в одном воплощении контактирование проводится (например, примерно 1 час или более) для амплификации сигнала до максимума. Предпочтительно, молярный избыток антитела по отношению к максимальной ожидаемой концентрации свободного VEGF110+ или VEGF (как описано выше) добавляют в планшет после его промывания. Это антитело прямо или косвенно детектируется. Наряду с тем, что детектируемое антитело может представлять собой поликлональное или моноклональное антитело, например, в определенных воплощениях оно представляет собой моноклональное антитело, в одном воплощении - мышиное, и в одном воплощении - антитело MAb A4.6.1. Также детектируемое антитело может быть прямо детектируемым и, в одном воплощении содержит колориметрическую метку, и, в другом воплощении содержит флуоресцентную метку. Более предпочтительно, детектируемое антитело является биотинилированным, и средство детекции представляет собой авидин или стрептавидин-пероксидазу и 3,3',5,5'-тетраметилбензидин. Считывание средства детекции может быть флуоресцентным или колориметрическим. Аффинность антитела должна быть достаточно высокой, чтобы могли детектироваться малые количества свободного VEGF110+ или VEGF, но не настолько высокой, чтобы VEGF110+ или VEGF отрывались от реагентов захвата.
Четвертая стадия
На последней стадии способа анализа уровень свободного VEGF, который в данный момент связан с реагентом захвата, измеряется с использованием средства детекции для детектируемого антитела. Если биологический образец получен от пациента с сосудистым, диабетическим или раковым заболеванием, то стадия измерения, предпочтительно, включает сравнение реакции, которая происходит в результате трех вышеописанных стадий, со стандартной кривой для определения уровня VEGF110+ или VEGF по сравнению с их уровнем у здоровых индивидуумов, или, предпочтительно, включает сравнение реакции, которая происходит в результате трех вышеописанных стадий, с результатами другого анализа VEGF-ELISA, распознающего различные изоформы VEGF или суммарный VEGF, для определения уровня типов VEGF, когда сравниваются результаты ELISA, и, необязательно, по сравнению с уровнем у здоровых индивидуумов.
Продуцирование антитела
Поликлональные антитела к VEGF, как правило, получают от животных с помощью многократных подкожных (sc) или внутрибрюшинных (ip) инъекций VEGF и адъюванта. Может быть удобным конъюгировать VEGF или фрагмент, содержащий аминокислотную последовательность-мишень, с белком, который является иммуногенным в видах, которые необходимо иммунизировать, например, гемоцианин лимфы улитки, сывороточный альбумин, бычий тироглобулин или соевый ингибитор трипсина, с использованием бифункционального или модифицирующего агента, например, малеимидобензоилсульфосукцинимидного эфира (конъюгированного посредством цистеиновых остатков), N-гидроксисукцинимида (конъюгированного посредством лизиновых остатков), глутаральдегида, янтарного ангидрида, SOCl2, или R1N=C=NR, где R и R1 представляют собой различные алкильные группы.
Антитела, используемые для нанесения покрытия или в качестве детектируемых антител, могут быть получены из любого подходящего источника в виде позвоночного, такого как мышь, примат, зайцеобразное, коза, кролик, крыса, курица, бык, овца, лошадь, собака, животное семейства кошачьих или свинья. Могут применяться химерные или гуманизированные антитела, как описано, например, в Патенте США № 4816567; Morrison et al. Proc. Natl. Acad. Sci. USA 81:6851 (1984); Neuberger et al. Nature 312: 604 (1984); Takeda et al. Nature 314:452 (1985); и WO 98/45331 от 15 октября 1998 г., а также в дополнительных ссылках, представленных выше.
Животные могут быть иммунизированы против иммуногенных конъюгатов или производных путем объединения 1 мг или 1 мкг конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда, и путем инъекции раствора внутрикожно во множество точек. Через один месяц животных стимулировали с помощью введения 1/5 - 1/10 от исходного количества конъюгата в неполном адъюванте Фрейнда с помощью подкожной инъекции во множество точек. Через 7-14 дней у животных отбирали кровь, и анализировали сыворотку на титр антител к VEGF. Животных стимулировали до тех пор, пока значение титра не стабилизировалось. Предпочтительно, животное стимулировали с помощью конъюгата VEGF, но конъюгированного с другим белком и/или посредством другого сшивающего агента. Конъюгаты также могут быть получены в культуре рекомбинантных клеток в виде слитых белков. Также агенты агрегации, такие как квасцы, используются для усиления иммунного ответа. Методы получения поликлональных антител описаны в многочисленных учебниках по иммунологии, таких как Davis et al. Microbiology, 3rd Edition, (Harper & Row, New York, New York, 1980).
Моноклональные антитела получают путем извлечения клеток селезенки из иммунизированных животных и иммортализации клеток подходящим образом, например, с помощью слияния с миеломными клетками или с помощью трансформации вирусом Эпштейна-Барра,и скрининга клонов, экспрессирующих желаемое антитело. См., например, публикацию Kohler and Milstein Eur. J. Immunol. 6:511 (1976). Альтернативно, моноклональные антитела или антигенсвязывающий участок моноклонального антитела, такой как фрагменты Fab или (Fab)2, могут быть получены с помощью рекомбинантных методов.
Примеры подходящих антител включают антитела, которые уже применяются в известных анализах RIA для белков, о которых идет речь, например, антитела против VEGF, как описано в ссылках, приведенных здесь во введении.
В определенных воплощениях применяется антитело 5C3 против VEGF, которое получают или которое продуцируется с помощью гибридомы, депонированной в ATCC под номером PTA-7737, необязательно с другим антителом A4.6.1 против VEGF. В изобретении также предлагается антитело, которое не связывается с VEGF 1-110 и связывается с тем же эпитопом VEGF110+, что и моноклональное антитело, продуцируемое гибридомной клеточной линией PTA-7737. Предлагается гибридома 5C3.1.1, депонированная в ATCC под депозитным номером PTA-7737.
Детекция
Антитело, добавляемое к иммобилизованным реагентам захвата, является непосредственно меченым или детектируется косвенно путем добавления, после отмывки от избытка первого антитела, молярного избытка второго меченого антитела, направленного против IgG вида животного, к которому относилось первое антитело. В последнем косвенном анализе меченая антисыворотка против первого антитела добавляется к образцу так, чтобы получить меченое антитело in situ.
Используемая метка для первого или второго антитела представляет собой любую детектируемую функциональную группу, которая не препятствует связыванию свободного VEGF110+ или VEGF с антителом. Примеры подходящих меток представляют собой многочисленные метки, известные по использованию в иммуноанализе, включающие компоненты, которые могут детектироваться прямо, такие как флуорохромные, хемилюминисцентные и радиоактивные метки, а также компоненты, такие как ферменты, которые для детекции должны вступать в реакцию или модифицироваться. Примеры таких меток включают радиоизотопы 32P, 14C, 125I, 3H, и 131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например люцифераза светляка и бактериальная люцифераза (Патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидаза хрена (HRP), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, сахаридооксидазы, например, глюкозооксидаза, галактозооксидаза и глюкозо-6-фосфат дегидрогеназа, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, конденсированные с фермента, который применяет пероксид водорода для окисления предшественника красителя, такого как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, биотин/стрептавидин, биотин/стрептавидин-β-галактозидаза с MUG, спин-метки, бактериофаговые метки, стабильные свободные радикалы и им подобные. Как указано выше, флуоресцентная детекция представляет собой только один пример.
Для ковалентного связывания этих меток с белками или полипептидами доступны подходящие методы. Например, для мечения антител с вышеописанными флуоресцентными, хемилюминесцентными и ферментными метками могут использоваться связывающие агенты, такие как диальдегиды, карбодиимиды, дималеимиды, бис-имидаты, бис-диазотированный бензидин и им подобные. См., например, публикации Патентов США № 3940475 (флуоресценция) и 3645090 (ферменты); Hunter et al. Nature 144: 945 (1962); David et al. Biochemistry 13: 1014-1021 (1974); Pain et al. J. Immunol. Methods 40: 219-230 (1981); и Nygren J. Histochem. and Cytochem. 30: 407-412 (1982). В определенных воплощениях метки, используемые здесь, представляют собой флуоресцентные метки для увеличения амплификации и чувствительности до 8 пг/мл, более предпочтительно, представляют собой биотин вместе с стрептавидин-β-галактозидазой и MUG для амплификации сигнала. В определенных воплощениях используется колориметрическая метка, например в случае, где детектируемое антитело является биотинилированным, и средство детекции представляет собой авидин или стрептавидин-пероксидазу и 3,3',5,5'-тетраметилбензидин.
Для специалиста в области методов иммуноанализа конъюгирование такой метки, включающей ферменты, с антителом представляет собой стандартно проводимую процедуру. См., например, публикацию O 'Sullivan et al. "Methods for the Preparation of Enzyme-antibody Conjugates for Use in Enzyme Immunoassay", Methods in Enzymology, ed. J.J. Langone and H. Van Vunakis, Vol. 73 (Academic Press, New York, New York, 1981), pp. 147-166.
После добавления последнего меченого антитела количество связанного антитела определяется с помощью удаления избытка несвязанного меченого антитела посредством промывания и затем измерения количества присоединенной метки с использованием метода детекции, подходящего для метки, и корреляции измеренного количества с количеством свободной формы VEGF110+ или VEGF в биологическом образце. Например, в случае ферментов, проявленное и измеренное количество окрашивания представляет собой прямое измерение количества присутствующей формы VEGF110+ или VEGF. Конкретно, если меткой является HRP, окрашивание детектируется с использованием субстрата 3,3',5,5'-тетраметилбензидина с поглощением при 450 нм.
В одном примере, после отмывки от иммобилизованной фазы ферментативно-меченого второго антитела, направленного против первого немеченого антитела, окрашивание или хемилюминесценцию проявляли и измеряли с помощью инкубации иммобилизованного реагента захвата с субстратом фермента. Затем количество свободной формы VEGF110+ или VEGF в виде концентрации рассчитывали с помощью сравнения с окрашиванием или хемилюминесценцией, полученными при параллельном проведении анализа с использованием стандартной формы VEGF.
Наборы
Для удобства способ анализа по настоящему изобретению может предлагаться в форме набора. Такой набор представляет собой упакованную комбинацию, включающую основные элементы:
(a) реагент захвата, состоящий из моноклонального антитела против молекулы VEGF человека, где моноклональное антитело распознает VEGF110+;
(b) реагенты детекции, состоящие из детектируемых (меченых или немеченых) антител, которые связываются с доменами VEGF, ответственными за связывание с рецептором KDR и/или FLT1. Эти основные элементы определяются здесь далее. В определенном воплощении реагенты детекции включают детектируемое антитело(а), которое связывается с эпитопом VEGF1-110.
Предпочтительно, набор дополнительно включает твердую подложку для реагентов захвата, которая может предлагаться в виде отдельного элемента, или на которой уже иммобилизованы реагенты захвата. Следовательно, антитела захвата в наборе могут быть иммобилизованы на твердой подложке, или они могут быть иммобилизованы на такой подложке, которая включена в набор или предлагается отдельно от набора.
Предпочтительно, реагенты захвата нанесены в виде покрытия на микротитрационный планшет. Реагент детекции может представлять собой меченые антитела, детектируемые прямо, или немеченые антитела, которые детектируются с помощью меченых антител, направленных против немеченых антител с происхождением из другого вида. В случае, где метка представляет собой фермент, набор обычно включает субстраты и кофакторы, требуемые для фермента, и в случае, где метка представляет собой флуорофор, набор обычно включает предшественник красителя, с помощью которого получают детектируемый хромофор. В случае, где реагент детекции является немеченым, набор может дополнительно включать средство детекции для детектируемых антител, такое как меченые антитела, направленные против немеченых антител, предпочтительно, в формате флуоресцентной детекции. В случае, где метка представляет собой фермент, набор обычно включает субстраты и кофакторы, требуемые для фермента, в случае, где метка представляет собой флуорофор, набор обычно включает предшественник красителя, с помощью которого получают детектируемый хромофор и, в случае, где метка представляет собой биотин, набор обычно включает авидин, такой как авидин, стрептавидин или стрептавидин, конъюгированный с HRP, или β-галактозидазу с MUG.
В одном конкретном воплощении реагент захвата представляет собой моноклональное антитело, предпочтительно антитело грызуна, более предпочтительно мышиное или крысиное, еще более предпочтительно мышиное, и наиболее предпочтительно антитело MAb 5C3. Также в конкретных воплощениях детектируемое антитело представляет собой биотинилированное моноклональное антитело, которое является антителом грызуна, более предпочтительно мышиным или крысиным, еще более предпочтительно мышиным, и наиболее предпочтительно, антителом MAb A4.6.1. В определенных воплощениях реагент захвата в наборе является иммобилизованным.
В определенных воплощениях набор может содержать реагенты для множественного анализа ELISA для сравнительных исследований, как описано здесь, для детекции разнообразных форм VEGF и VEGF110+.
Набор также обычно содержит инструкции по проведению анализа и/или VEGF в качестве стандарта антигена (например, очищенная форма VEGF, предпочтительно рекомбинантно полученный VEGF и VEGF110), а также другие добавки, такие как стабилизаторы, буферы для промывания и инкубации и им подобные.
Примеры стандартов для VEGF представляют собой рекомбинантные VEGF человека, полученные в клетках млекопитающих, стандарты доступны от фирмы Genentech, Inc., South San Francisco, California, и от тех компаний и с помощью таких способов, которые здесь описаны.
Компоненты набора предлагаются в определенных соотношениях, с относительными количествами разнообразных реагентов, которые подходящим образом варьируются с получением в растворе концентраций реагентов, которые, по существу, увеличивают до максимума чувствительность анализа. Конкретно, реагенты могут предлагаться в виде сухих порошков, обычно лиофилизованных, включая вспомогательные вещества, с помощью которых при растворении получают раствор реагентов, имеющий подходящую концентрацию для объединения с тестируемым образцом.
Депонирование материалов
Следующие материалы депонированы в Американской Коллекции Типовых Клеточных Культур, 10801 University Boulevard, Manassas, VA. 20110-2209, USA (ATCC): 5C3.1.1 депонировали в ATCC под порядковым номером PTA-7737 от 19.07.2006.
Депонирование проводили на основании положений Будапештского Соглашения по Международному Признанию Депонирования Микроорганизмов для Целей Патентной Процедуры и Правил в соответствии с этим (Будапештским Соглашением). Это гарантирует поддержание жизнеспособной культуры клеток на депозите в течение 30 лет от даты депозита. Депозиты являются доступными с помощью ATCC на основании определений Будапештского Соглашения, и подлежат соглашению между Genentech, Inc. и ATCC, которые гарантируют постоянную и непрерывную доступность потомства культуры для научного сообщества при опубликовании относящегося к делу патента США или при выкладке для научного сообщества любого патента США или иностранного патента, какой бы из них не оказался первым, и гарантирует доступность потомства культуры специалистам, определенным с помощью комиссара по патентам и торговым маркам США с правами на потомство культуры согласно 35 USC § 122 и в соответствии с правилами Комиссии (включающими 37 CFR § 1.14 со специальной ссылкой на 886 OG 638).
Правопреемник настоящей заявки согласен с тем, что если культура материалов на депозите погибнет или будет потеряна или разрушится при культивировании при подходящих условиях, то при уведомлении материалы будут немедленно заменены на другие такие же. Доступность депонированных материалов не следует понимать, как лицензию на практическое применение изобретения в нарушение прав, предоставленных органом власти любого правительства в соответствии с его патентными законами.
Считается, что описания достаточно, чтобы дать возможность специалисту в данной области практического применения изобретения. Изобретение не ограничивается рамками депонированной конструкции, так как депонированное воплощение изобретения предназначено исключительно для иллюстрации определенных аспектов изобретения, и любые функционально эквивалентные конструкции находятся в рамках изобретения. Депонирование настоящего материала не допускает признания того, что письменное описание является недостаточным для того, чтобы дать возможность практического применения любого аспекта изобретения, включая даже более из него, а также это не следует понимать, как ограничение рамок формулы изобретения определенными иллюстрациями, которыми она представлена. Действительно, разнообразные модификации в дополнение к тем, что показаны и описаны здесь, будут очевидны специалистам в данной области из предшествующего описания, и будут попадать в рамки приложенной формулы изобретения.
Понятно, что примеры и воплощения, описанные здесь, представлены только с целью иллюстрации, и что, в этом свете, специалистами в данной области будут рассматриваться разнообразные модификации или изменения, и примеры и воплощения, описанные здесь, включены в сущность и область действия настоящей заявки и в рамки приложенной формулы изобретения. Все публикации, патенты и патентные заявки, цитированные здесь, фактически полностью введены сюда с помощью ссылки.
ПРИМЕРЫ
Пример 1:
Известно, что фактор роста эндотелия сосудов (VEGF), который экспрессируется в виде различных изоформ благодаря альтернативному РНК-сплайсингу, играет ключевую роль в ангиогенезе опухоли. Нами измерялись концентрации VEGF165 и суммарного VEGF и оценивалось относительное количество VEGF110, который является активным фрагментом, получаемым расщеплением плазмином VEGF. ELISA A (VEGF165-206 ELISA) детектирует VEGF165 и более длинные изоформы, но не детектирует VEGF121. ELISA B (VEGF110-206 ELISA) детектирует VEGF165 и изоформы VEGF121 и VEGF110. ELISA C (VEGF121-206 ELISA) детектирует VEGF165 и более длинные изоформы, VEGF121 и фрагменты VEGF с молекулярной массой более чем у VEGF110, но не VEGF110 (обозначенные здесь, как "VEGF110+").
Материалы и методы
Реагенты и клетки: Рекомбинантные VEGF165 (Genentech), VEGF121 (PeproTech, Rocky Hill, New Jersey), VEGF8-109 (состоящий из аминокислот 8-109 из VEGF165) и укороченный VEGF121 (R&D Systems, Minneapolis, MN) продуцировали в E. coli. Укороченный VEGF121 содержит интактный N-конец, определенный с помощью масс-спектрометрии, но имеет массу 26 кДа, в соответствии с усечением приблизительно девяти аминокислот от карбокси-конца согласно описанию производителя. Он мигрирует между VEGF110 и VEGF121 при анализе с помощью SDS-PAGE при восстанавливающих условиях. VEGF110 получали с помощью расщепления плазмином VEGF165 (Keyt BA, et al.: The carboxyl-terminal domain (111-165) of vascular endothelial growth factor is critical for its mitogenic potency. J Biol Chem. 271: 7788-7795 (1996)). Молекулярная масса, измеренная с помощью масс-спектрометрии, составила 25390, согласуясь с теоретической массой, составляющей 25389. Концентрацию определяли с использованием метода бицинхориновой кислоты (Pierce, Rockford, IL). Молекулярные массы, использованные для расчета концентраций VEGF8-109, VEGF121 и VEGF165, составили 23,8, 28,9 и 38,2 кДа, соответственно. Моноклональные антитела против VEGF, A4.6.1, 3.5F8, 2E3 и 5C3 получали путем иммунизации мышей с помощью VEGF165, продуцированным в клетках CHO (Kim KJ, et al.: The vascular endothelial growth factor proteins: Identification of biologically relevant regions by neutralizing monoclonal antibodies. Growth Factors 7: 53-64 (1992)). Клеточные линии клеток груди SK-BR-3, BT-474, T-47D и MCF-7, а также клеточные линии яичника ES-2, OVCAR-3 и SK-OV-3 (Американская Коллекция Типовых Клеточных Культур, Rockville, MD) растили в среде RPMI, в присутствии 2 мМ L-глутамина и 10% FBS (за исключением 20% для клеток OVCAR-3) в увлажняемом инкубаторе в присутствии 5% CO2 при 37°C.
Очистка VEGF в кондиционированной среде клеток A673: клетки A673 (Американская Коллекция Типовых Клеточных Культур) растили в среде 50:50 F12/DMEM, в присутствии 2 мМ L-глутамина и 5% FBS до 60% конфлюентности, и затем в среде, свободной от сыворотки, (Genentech) до полной конфлюентности. VEGF очищали от супернатантов с использованием A4.6.1-Сефорозной колонки, которую получали из Сефарозы, активированной с помощью CNBr (Amersham Biosciences, Piscataway, NJ). Элюат колонки и контроли рекомбинантных VEGF (0,2 мкг на дорожку) прогоняли на гелях с содержанием 18% Tris-Глицина (Invitrogen, Carlsbad, CA) при восстанавливающих условиях, и переносили на нитроцеллюлозный блот. Блот блокировали с помощью раствора 0,5M Tris-HCl, pH 7,5, 1,5M NaCl, 50 мМ EDTA, 0,5% Тритон100, содержащего 3% бычий сывороточный альбумин, и гибридизовали с 200 нг/мл 3.5F8 или A4.6.1 с последующей гибридизацией с 2 нг/мл козьего антитела к мышиному Fc-HRP (Jackson ImmunoResearch). Сигналы проявляли с использованием SuperSignal West Dura (Pierce) и фиксировали на рентгеновской пленке.
VEGF-ELISA для измерения концентраций VEGF
ELISA A (VEGF165-206 ELISA). Если не указано по-другому, то для измерения VEGF в образцах использовали флуоресцентный анализ ELISA A. Во флуоресцентном анализе ELISA A антитело 3.5F8 использовали для нанесения покрытия, и биотинилированное антитело A4.6.1 использовали после стрептавидин-β-галактозидазы для детекции и использовали 4-метилумбеллиферил-β-D-галактозид в качестве субстрата (Rodriguez CR, et al.: A sensitive fluorometric enzyme-linked immunosorbent assay that measures vascular endothelial growth factor 165 in human plasma. J Immunol Methods 219: 45-55 (1998)). Стандарты VEGF165 представляли собой концентрации 1-128 пг/мл, или 0,026-3,35 пМ. В колориметрическом анализе ELISA A антитело 3.5F8 использовали для нанесения покрытия, и биотинилированное антитело A4.6.1 использовали для детекции, согласно протоколу, используемому для анализа ELISA C, описанному ниже. Стандарты VEGF165 представляли собой концентрации 1,6-200 пг/мл.
ELISA B (VEGF110-206 ELISA) (анализ, ранее известный как VEGF121-206 ELISA, Konecny GE, et al.: Association between HER-2/neu and Vascular Endothelial Growth Factor Expression Predicts Clinical Outcome in Primary Breast Cancer Patients. Clinical Cancer Research, 10: 1706-1716 (2004)): на 96-микролуночные планшеты MaxiSorp наносили покрытие с помощью 0,5 мкг/мл антитела A4.6.1 в 50 мМ карбонатном буфере, pH 9,6 в объеме 100 мкл/на лунку при 4°C в течение ночи. Планшеты промывали после этой стадии и между последующими стадиями инкубации при комнатной температуре с помощью буфера PBS, pH 7,4, содержащего 0,05% полисорбат 20. Планшеты блокировали с помощью 0,5% бычьего сывороточного альбумина, 10 миллионных долей ProclinTM300 (Supelco, Bellefonte, PA) в PBS (150 мкл/на лунку) в течение 1 ч. Стандарты VEGF (1,56-200 пг/мл VEGF165 или 0,0409-5,24 пМ VEGF в двукратном последовательном разведении) и последовательно разведенные образцы (с минимальным разведением 1:10) в двукратном или трехкратном последовательном разведении в буфере PBS, pH 7,4, содержащем 0,5% бычий сывороточный альбумин, 0,05% полисорбат 20, 5 мМ EDTA, 0,25% CHAPS, 0,2% бычьи γ-глобулины (Sigma, St. Louis, MO) и 0,35 M NaCl (буфер для образца) добавляли в планшеты (100 мкл/на лунку) и инкубировали в течение 2 ч. Связанный VEGF детектировали с помощью инкубации биотинилированного антитела 2E3 (или другого антитела, которое связывается с доменом VEGF, ответственным за связывание с рецептором) на планшетах в течение 1 ч с последующей инкубацией со стрептавидином-HRP (Amersham, Copenhagen, Denmark) в течение 30 мин, с биотинил-тирамидом (ELAST ELISA amplification System, Perkin Elmer Life Sciences Inc., MA) в течение 15 мин, и со стрептавидином-HRP в течение 30 мин. Добавляли субстрат TMB (3,3',5,5'-тетраметилбензидин) (Kirkegaard & Perry Laboratories) и останавливали реакцию путем добавления 1 M фосфорной кислоты. Поглощение считывали при 450 нм на стекерном считывающем устройстве Titertek (ICN, Costa Mesa, CA). Титрационные кривые подбирали с использованием программы подбора кривой регрессии с использованием четырех параметров (KaleidaGraph, Synergy software, Reading, PA). Измерительные точки, которые попали в интервал стандартной кривой, использовали для расчета предполагаемых концентраций VEGF в образцах. Получение 1,56-200 пг/мл VEGF165 в 10% EDTA-плазме человека (Golden West Biologicals Inc., Temecula, CA) составило 92-120% после вычитания предполагаемой концентрации эндогенного VEGF, составляющей 2,1 пг/мл в 10% плазме, используемой для этого исследования.
ELISA C (VEGF121-206 ELISA): на микролуночные планшеты наносили покрытие с помощью 1 мкг/мл антитела 5C3 против VEGF и проводили блокирование, как описано выше. Стандарты VEGF (4-512 пг/мл VEGF165 или 0,105-13,4 пМ VEGF в 2-кратном последовательном разведении) и последовательно разведенные образцы в буфере для разведения образцов добавляли в планшеты. Планшеты инкубировали в течение 2 ч. Связанный VEGF детектировали путем добавления биотинилированного антитела A4.6.1 с последующим добавлением стрептавидина-HRP и TMB в качестве субстрата. Данные с планшетов считывали и анализировали, как описано выше. Получение 4-512 пг/мл VEGF165 в 10% плазме составило 77-101% после вычитания 1,6 пг/мл предполагаемой концентрации эндогенного VEGF в 10% плазме, используемой для этого исследования.
Результаты и обсуждение
VEGF-ELISA: В ранее описанном анализе ELISA A использовали антитело 3.5F8 для нанесения покрытия и биотинилированное антитело A4.6.1 для детекции (Rodriguez CR, et al.: A sensitive fluorometric enzyme-linked immunosorbent assay that measures vascular endothelial growth factor 165 in human plasma. J Immunol Methods 219: 45-55, 1998). Этот анализ детектирует VEGF165 (VEGF165), но не VEGF121(1) (VEGF121(1)), который получен от R&D systems, и в нем отсутствуют приблизительно 9 аминокислот с карбокси-конца, и VEGF121(2) (VEGF121(2)), который получен от PeproTech (Фиг. 1A). Антитело 3.5F8 связывается с VEGF165, но не связывается с VEGF121 по данным, полученным с помощью BIAcore. Антитело A4.6.1 связывается с доменом, ответственным за связывание с рецептором (Kim KJ, et al.: The vascular endothelial growth factor proteins: Identification of biologically relevant regions by neutralizing monoclonal antibodies. Growth Factors 7: 53-64, 1992), который присутствует во всех изоформах и в VEGF110. Антитело 3.5F8, вероятно, связывается с соседними аминокислотами 116 и 118, которых нет в VEGF121. Антитело 5C3, вероятно, связывается с соседними аминокислотами 111 и 113, которых нет в VEGF110 (Фиг. 3). Анализ ELISA, вероятно, может детектировать изоформы VEGF, которые содержат последовательности VEGF165, включающие VEGF183, VEGF189 и VEGF206 (см., например, публикацию Stimpfl M, et al.: Vascular Endothelial growth factor splice variants and their prognostic value in breast and ovarian cancer. Clinical Cancer Research 8: 2253-2259, 2002). ELISA B (анализ, ранее известный как VEGF121-206 ELISA, Konecny GE, et al., Association between HER-2/neu and Vascular Endothelial Growth Factor Expression Predicts Clinical Outcome in Primary Breast Cancer Patients. Clinical Cancer Research, 10: 1706-1716, 2004) использует антитело A4.6.1 для нанесения покрытия и биотинилированное антитело 2E3 для детекции. Антитела A4.6.1 и 2E3 связываются с доменом, ответственным за связывание с рецептором, который присутствует во всех трех молекулах. См., например, публикации Kim KJ, et al. The vascular endothelial growth factor proteins: Identification of biologically relevant regions by neutralizing monoclonal antibodies. Growth Factors 7: 53-64 (1992); и, Muller YA, et al. Vascular endothelial growth factor: Crystal structure and functional mapping of the kinase domain receptor binding site. Proc Natl Acad Sci USA 94: 7192-7197 (1997). Также могут использоваться другие антитела, которые связываются с этими участками. Этот анализ ELISA детектирует VEGF165, VEGF121, укороченный VEGF121 (с отсутствием приблизительно 9 аминокислот от карбокси-конца), и с тем же успехом VEGF110 и VEGF8-109 (Фиг. 1B). Этот анализ ELISA может детектировать суммарный VEGF, включая фрагменты более чем VEGF110, полученные с помощью гидролиза матриксной металлопротеиназой. Анализ ELISA C, описанный здесь, в котором используется антитело 5C3 для нанесения покрытия и биотинилированное антитело A4.6.1 для детекции, детектирует VEGF165, VEGF121, и с тем же успехом усеченный VEGF121, но не детектирует VEGF110 или VEGF8-109 (Фиг. 1, C). Антитело 5C3 связывается с VEGF121, но не связывается с VEGF8-109 по данным, полученным с помощью BIAcore. Этот анализ ELISA может детектировать все молекулы VEGF, детектируемые с помощью VEGF110-206, за исключением VEGF110 и более коротких фрагментов.
Чувствительности анализов ELISA A, ELISA B и ELISA C составили 10, 16 и 40 пг/мл VEGF165 (или 0,26, 0,41 и 1,05 пМ для различных изоформ и фрагментов VEGF) для VEGF в образце с использованием минимального разведения, составляющего 1:10, соответственно. Анализы ELISA B и ELISA C являются воспроизводимыми (Таблицы 1 и 2). Анализы ELISA B и ELISA C специфичны для VEGF (VEGF-A). VEGF-B, VEGF-C и VEGF-D при концентрациях до 50 нг/мл давали только фоновые сигналы. Инсулиноподобный фактор роста 1, гормон роста, рекомбинантный фактор роста нервов, фактор некроза опухоли (Genentech), фактор роста тромбоцитов AB, плацентарный фактор роста, трансформирующий фактор роста β1 (R&D Systems) (до 200 нг/мл) давали только фоновые сигналы. Гепарин (Leo Laboratories, Bucks, UK and Dublin, Ireland) (до 100 Ед/мл) не оказывал значительного влияния на анализ.
ELISA B (VEGF110-206 ELISA): Стандартный интервал составил 1,56-200 пг/мл VEGF165 (0,0409-5,24 пМ VEGF) в буфере. Соотношение OD 1,56 пг/мл стандарта относительно пустого контроля составило 1,37±0,11. CV представляет собой коэффициент вариаций.
пг/мл
%CV
%CV
ELISA C (VEGF121-206 ELISA). Стандартный интервал составил 4-512 пг/мл VEGF165 (0,105-13,4 пМ VEGF). Соотношение OD 4 пг/мл стандарта относительно пустого контроля составило 2,72±0,37. CV представляет собой коэффициент вариаций.
пг/мл
%CV
%CV
VEGF в кондиционированной среде клеточных линий: Кондиционированную среду из шести стабильных клонов CHO, трансфицированных с помощью кДНК VEGF165 (Meng et al., 2000), измеряли с помощью трех анализов ELISA, в которых использовался негликозилированный VEGF, продуцируемый в E. coli в качестве стандарта. Гликозилированный рекомбинантный VEGF165 в кондиционированной среде из шести стабильных клонов давал похожие концентрации в трех анализах ELISA. Концентрации, измеренные с помощью ELISA B, составили 28, 63, 64, 43, 3,8 и 3,2 нМ, соответственно. Соотношения концентраций VEGF, измеренных с помощью ELISA A и ELISA C, по сравнению с концентрациями, измеренными с помощью ELISA B, составили 0,90±0,08 и 1,08±0,10, соответственно. Таким образом, три анализа ELISA, с тем же успехом количественно оценивали гликозилированный VEGF, и существовал небольшой протеолиз VEGF165 при условиях культивирования.
Концентрации VEGF в кондиционированной среде клеток A673, измеренные с помощью ELISA A, ELISA B и ELISA C, составили 0,15, 0,29 и 0,24 нМ VEGF, соответственно. Концентрация, измеренная с помощью ELISA A, оказалась ниже, что указывает на присутствие VEGF121. Когда VEGF очищали из кондиционированной среды с использованием A4.6.1-аффинной колонки и анализировали с помощью белкового блотинга, то с помощью антитела 3.5F8 детектировали две полоски, соответствующие, вероятно, гликозилированной и не гликозилированной форме VEGF165. Более низкая полоска обладала такой же мобильностью, что и очищенный VEGF165, продуцируемый в E. coli (Фиг. 2, слева). Обработка с помощью N-гликаназы превращала более высокую полоску в более низкую. С помощью антитела A4.6.1 детектировали две дополнительные полоски с более низкой молекулярной массой, вероятно, соответствующие гликозилированной (частично перекрывающейся с предполагаемой полоской не гликозилированной формы VEGF165) и не гликозилированной форме VEGF121 (Фиг. 2, справа). Более низкая полоска обладала такой же мобильностью, что и очищенный VEGF121, продуцируемый в E. coli, и обработка с помощью N-гликаназы превращала более высокую полоску в более низкую.
Концентрации VEGF в кондиционированных средах из клеточных линий клеток груди SK-BR-3, BT-474, T-47D и MCF-7, измеренные с помощью ELISA B, составили 3,6, 16, 13 и 13 пМ, соответственно. Соотношение концентраций VEGF, измеренных с помощью ELISA A, и концентраций, измеренных с помощью ELISA B, составило 0,49, 0,42, 0,43 и 0,38 (или 49%, 42%, 43% или 38%), соответственно, что согласуется с процентом экспрессии VEGF165 в этих соответствующих клеточных линиях, составляющим 43, 35, 40 и 41% (Stimpfl M, et al.: Vascular Endothelial growth factor splice variants and their prognostic value in breast and ovarian cancer. Clinical Cancer Research 8: 2253-2259, 2002). Соотношения концентраций VEGF, измеренных с помощью ELISA C, к концентрациям, измеренным с помощью ELISA B, составили 1,1-1,2 для этих клеточных линий, что указывает на небольшое присутствие VEGF110. Концентрации VEGF в кондиционированных средах из клеточных линий яичников ES-2, OVCAR-3 и SK-OV-3, измеренные с помощью ELISA B, составили 32, 11 и 20 пМ, соответственно. Соотношения концентраций VEGF, измеренных с помощью ELISA A, и концентраций, измеренных с помощью ELISA B, составили 0,24, 0,20 и 0,32 (или 24%, 20% и 32%), соответственно, по сравнению с процентом экспрессии VEGF165 в этих соответствующих клеточных линиях, составляющим 38, 42 и 24% (Stimpfl et al., выше). Соотношения концентраций VEGF, измеренных с помощью ELISA C, к концентрациям, измеренным с помощью ELISA B, составили 0,64-0,79 для этих клеточных линий, что указывает на возможное присутствие VEGF110 (или более коротких фрагментов).
| название | год | авторы | номер документа |
|---|---|---|---|
| НАНОАНТИТЕЛО V9, СВЯЗЫВАЮЩЕЕ VEGF, И СПОСОБ ЕГО ПОЛУЧЕНИЯ, КОДИРУЮЩАЯ V9 НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ И СОДЕРЖАЩИЙ ЕЕ ВЕКТОР, СПОСОБ ИНГИБИРОВАНИЯ ПРОЛИФЕРАЦИИ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК | 2008 |
|
RU2395521C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКОВЫХ ВЕЩЕСТВ | 2000 |
|
RU2250264C2 |
| СПОСОБ ДИАГНОСТИКИ ОСЛОЖНЕНИЙ ПРИ ПРОЛИФЕРАТИВНОЙ ДИАБЕТИЧЕСКОЙ РЕТИНОПАТИИ У ПАЦИЕНТОВ С НЕПРОЗРАЧНЫМИ ОПТИЧЕСКИМИ СРЕДАМИ ГЛАЗА | 2009 |
|
RU2407428C1 |
| БИОМАРКЕРЫ В ПЛАЗМЕ КРОВИ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ КОМБИНИРОВАННЫХ ТЕРАПИЙ С ИСПОЛЬЗОВАНИЕМ БЕВАЦИЗУМАБА ПРИ ЛЕЧЕНИИ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2011 |
|
RU2582964C2 |
| Способ индукции регенерации периферического нерва | 2016 |
|
RU2639175C1 |
| СПОСОБ ДЕТЕКЦИИ ПАРТНЕРА ПО СВЯЗЫВАНИЮ МУЛЬТИСПЕЦИФИЧЕСКОГО СВЯЗЫВАЮЩЕГО АГЕНТА | 2013 |
|
RU2620563C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2016 |
|
RU2648152C2 |
| СПЕЦИФИЧЕСКОЕ АНТИТЕЛО К S100A4 ИЛИ ЕГО ФРАГМЕНТ (ВАРИАНТЫ), СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ СОДЕРЖАЩАЯ, ГИБРИДОМНАЯ КЛЕТОЧНАЯ ЛИНИЯ (ВАРИАНТЫ), КОНЪЮГАТ, КОМПОЗИЦИЯ, СПОСОБ ПРЕДУПРЕЖДЕНИЯ И/ИЛИ ЛЕЧЕНИЯ РАКА, МЕТАСТАЗИРОВАНИЯ, АНГИОГЕНЕЗА И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ, СПОСОБ И НАБОР ДЛЯ ДИАГНОСТИКИ РАКА ИЛИ ЗАБОЛЕВАНИЯ, АССОЦИИРОВАННОГО С ВОСПАЛЕНИЕМ, (ВАРИАНТЫ), СПОСОБ ДЕТЕКЦИИ S100A4, СПОСОБ СОЗДАНИЯ ИНДИВИДУАЛЬНОЙ ТЕРАПИИ | 2011 |
|
RU2615684C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2009 |
|
RU2531523C9 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СВОБОДНОГО СВЯЗЫВАЮЩЕГО ПАРТНЕРА МУЛЬТИСПЕЦИФИЧНОГО СВЯЗУЮЩЕГО | 2012 |
|
RU2633488C2 |
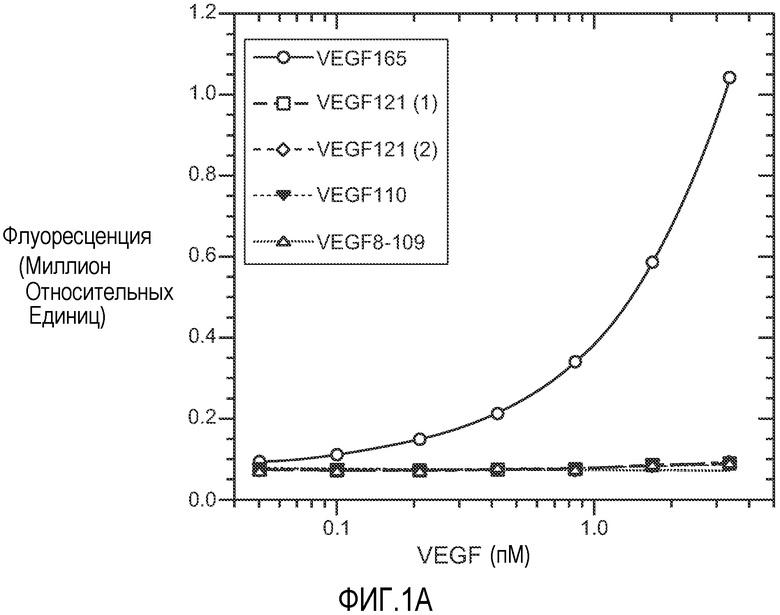
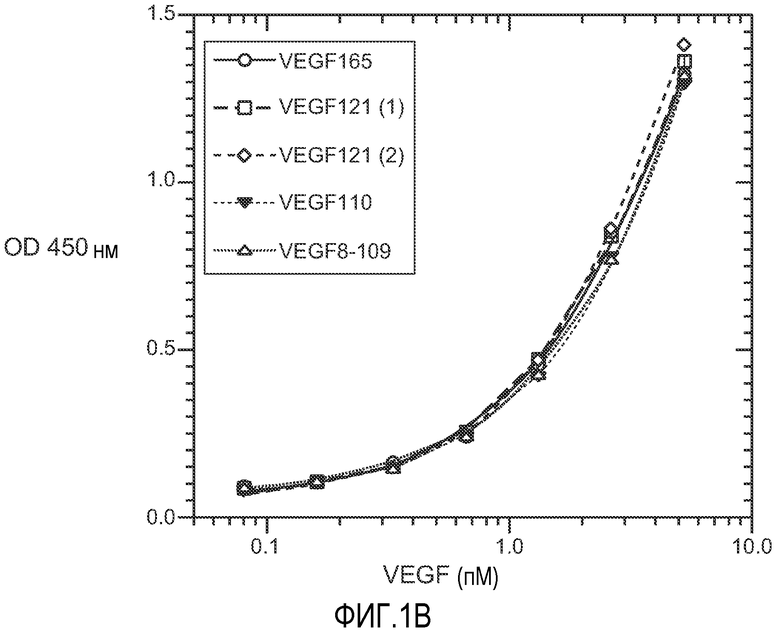
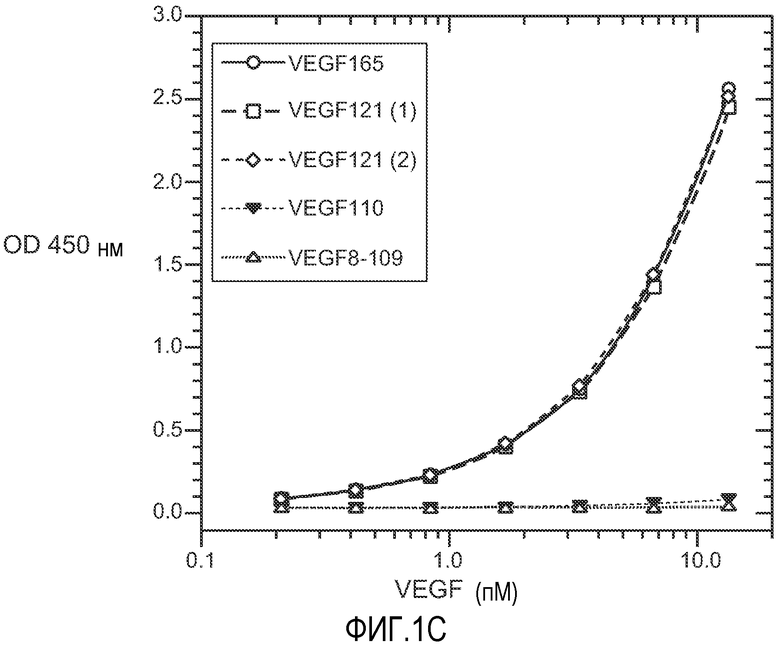
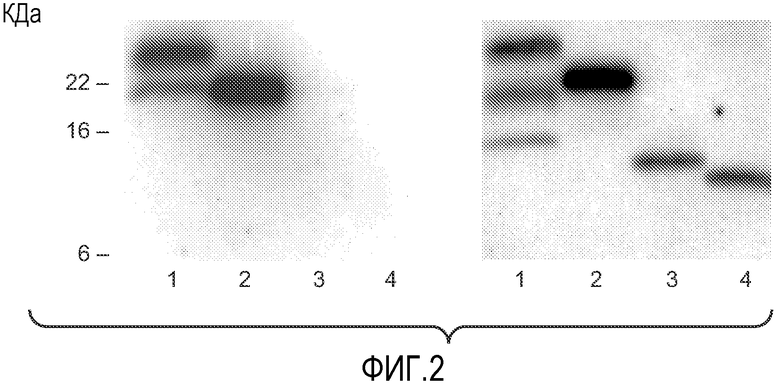
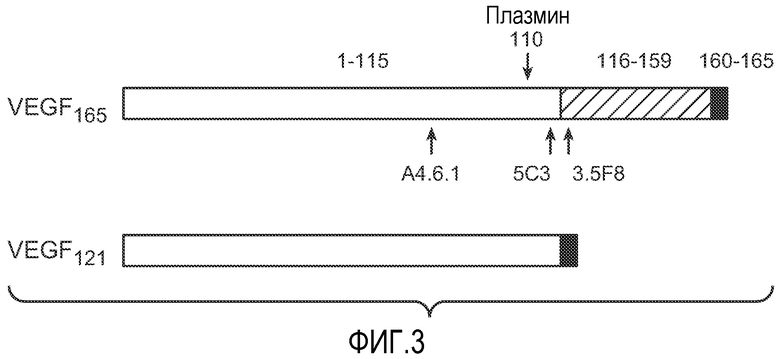
Изобретение относится к области иммунологии, а именно к иммуноферментному анализу, конкретнее к способу детекции форм фактора роста эндотелия сосудов (VEGF) c размером более чем 110 аминокислот в биологическом образце. Способ включает следующие стадии: контактирования и инкубации биологического образца с реагентом захвата, иммобилизованным на твердой подложке, где реагент захвата содержит моноклональное антитело, которое распознает и специфично связывается с остатками, в количестве более чем 110, из VEGF человека; отделение биологического образца от иммобилизованных реагентов захвата; контактирование иммобилизованного молекулярного комплекса реагента захвата-мишени с детектируемым антителом, которое связывается с доменами VEGF, ответственными за связывание с рецептором KDR и/или FLT1, или которое связывается с эпитопом в VEGF1-110; измерение уровня VEGF110+, связанного с реагентами захвата, с использованием средства детекции для детектируемого антитела. Набор реагентов иммуноанализа для детекции форм VEGF110+ в биологическом образце. Антитело 5С3, получаемое из гибридомы 5С3.1.1 с депозитарным номером PTA-7737, при этом указанное антитело 5С3 связывает формы VEGF110+, включая VEGF121+. Гибридома 5С3.1.1, депонированная в АТСС с депозитным номером PTA-7737, для получения моноклонального антитела 5С3. Использование заявленного изобретения позволяет повысить точность детектирования изоформ VEGF, которые не должны включать изоформу VEGF110 и при этом должны обязательно включать изоформу VEGF121. 4 н. и 21 з.п. ф-лы, 3 ил., 2 табл., 1 пр.
1. Способ детекции форм с размером более чем 110 аминокислот (VEGF110+) фактора роста эндотелия сосудов (VEGF) в биологическом образце, где формы включают VEGF121, включающий стадии:
(a) контактирования и инкубации биологического образца с реагентом захвата, иммобилизованным на твердой подложке, где реагент захвата содержит моноклональное антитело, которое распознает и специфично связывается с остатками, в количестве более чем 110, из VEGF человека;
(b) отделение биологического образца от иммобилизованных реагентов захвата;
(c) контактирование иммобилизованного молекулярного комплекса реагента захвата-мишени с детектируемым антителом, которое связывается с доменами VEGF, ответственными за связывание с рецептором KDR и/или FLT1, или которое связывается с эпитопом в VEGF1-110; и
(d) измерение уровня VEGF110+, связанного с реагентами захвата, с использованием средства детекции для детектируемого антитела.
2. Способ по п.1, где биологический образец отобран у человека.
3. Способ по п.2, где человек представляет собой пациента с сосудистым, диабетическим или раковым заболеванием, и стадия измерения (d) дополнительно включает сравнение со стандартной кривой для определения уровня VEGF в сравнении с уровнем у здорового индивидуума.
4. Способ по п.1, где биологический образец представляет собой опухолевые лизаты, плазму, сыворотку или мочу.
5. Способ по п.1, где реагент захвата распознает тот же эпитоп, что и антитело 5С3, и предпочтительно представляет собой моноклональное антитело 5С3.
6. Способ по п.1, где иммобилизованные реагенты захвата наносят в качестве покрытия на микротитрационный планшет.
7. Способ по п.1, где детектируемое антитело является непосредственно детектируемым.
8. Способ по п.7, где детектируемое антитело амплифицируется с помощью люминесцентного реагента.
9. Способ по п.8, где детектируемое антитело является биотинилированным, и средство детекции представляет собой авидин или стрептавидин-пероксидазу и 3,3',5,5'-тетраметилбензидин.
10. Способ по п.1, где детектируемое антитело представляет собой моноклональное антитело.
11. Способ по п.10, где детектируемое антитело представляет собой мышиное моноклональное антитело.
12. Способ по п.11, где иммобилизованное моноклональное антитело представляет собой антитело MAb 5C3, и детектируемое антитело представляет собой антитело MAb A4.6.1.
13. Способ по п.1, где указанный способ дополнительно селективно детектирует форму VEGF165.
14. Набор реагентов иммуноанализа для детекции форм VEGF110+ в биологическом образце, где формы включают VEGF121, включающий:
(а) моноклональное антитело против VEGF человека, в качестве реагента захвата, где моноклональное антитело специфично связывается с остатками, в количестве более чем 110, из VEGF человека; и
(b) детектируемое антитело, в качестве реагента детекции, которое связывается с доменами VEGF, ответственными за связывание с рецептором KDR и/или FLT1, или которое связывается с эпитопом в VEGF1-110.
15. Набор по п.14, дополнительно включающий твердую подложку для реагентов захвата.
16. Набор по п.15, где реагенты захвата иммобилизованы на твердой подложке.
17. Набор по п.16, где реагенты захвата наносят в качестве покрытия на микротитрационный планшет.
18. Набор по п.17, дополнительно включающий средства детекции для детектируемых антител.
19. Набор по п.18, где средство детекции является колориметрическим.
20. Набор по п.14, дополнительно включающий очищенный VEGF в качестве стандарта антигена.
21. Набор по п.14, где реагент захвата в виде антитела представляет собой мышиное моноклональное антитело MAb 5C3, и детектируемое антитело представляет собой антитело MAb A4.6.1.
22. Набор реагентов иммуноанализа по п.14, где указанный набор реагентов иммуноанализа дополнительно селективно детектирует форму VEGF165.
23. Антитело 5C3, получаемое из гибридомы 5C3.1.1 с депозитным номером РТА-7737 (или продуцируемое указанной гибридомой), при этом указанное антитело 5C3 связывает формы VEGF110+, включая VEGF121.
24. Антитело по п.23, конъюгированное с детектируемой меткой.
25. Гибридома 5С3.1.1, депонированная в АТСС с депозитным номером РТА-7737, для получения моноклонального антитела 5С3.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| СПОСОБ ИММУНОФЕРМЕНТНОГО АНАЛИЗА ДЛЯ ОПРЕДЕЛЕНИЯ ФАКТОРА ВИЛЛЕБРАНДА, МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К ФАКТОРУ ВИЛЛЕБРАНДА (ВАРИАНТЫ) И ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS. MUSCULUS L. - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ФАКТОРУ ВИЛЛЕБРАНДА (ВАРИАНТЫ) | 2004 |
|
RU2271010C2 |
| RODRIGUEZ C.R | |||
| Устройство для отыскания металлических предметов | 1920 |
|
SU165A1 |
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| Прибор для записи звуковых волн | 1920 |
|
SU219A1 |
| US 6020473 A (KEYT BRUCE A), 01.02.2000. | |||
Авторы
Даты
2014-05-27—Публикация
2007-10-03—Подача