Область техники
Изобретение относится к биотехнологии, генной инженерии и охране окружающей среды (конкретно – к биосенсорным технологиям) и представляет собой генное слияние промоторного участка clc-оперона Rhodococcus opacus с беспромоторной частью репортерного гена красного флуоресцентного белка rfp, введенное в полилинкерный участок плазмиды pGEM-T под T7-промотор. Трансформация содержащей слияние плазмиды в штамм E.coli BL21 DE3 обеспечивает получение рекомбинантного микроорганизма, который может быть использован для оценки концентрации в среде хлорированных катехолов и их аналогов и ионов меди 2+.
Уровень техники
Биосенсоры представляют собой аналитический инструмент, в котором в качестве чувствительного элемента используются биологические объекты. Последние нередко представлены живыми бактериальными клетками, продуцирующими в ответ на определенное воздействие внешней среды легко детектируемый сигнал. Измерение уровня сигнала и математическая обработка полученных данных позволяют обнаружить это конкретное воздействие среды и оценить его интенсивность (van der Meer, Belkin, 2010).
Наиболее часто такой подход используется для определения присутствия в природных средах различных химических загрязнителей, в том числе сложных органических соединений, традиционными способами определения которых служат жидкостная или газовая хроматография, атомно-адсорбционная спектрофотометрия и другие методы, требующие дорогостоящего и маломобильного оборудования (Лурье, 2001; Tecon, van der Meer, 2008). Селективное определение конкретной группы веществ с использованием биосенсоров при этом обычно достигается за счет конструирования и введения в бактериальную клетку рекомбинантной молекулы ДНК, в которой промотор гена, специфически реагирующего на определенные химические соединения, сшивается с геном-репортером, дающим люминесцентный или флуоресцентный сигнал (Daunert et al., 2000). К настоящему времени разработано уже довольно много биосенсоров для селективного определения различных соединений, в том числе реагирующих на нафталин (Werlen, Jaspers, van der Meer, 2004), фенантрен (Tecon, Wells, van der Meer, 2006), тяжелые металлы (Tauriainen et al., 1999; Патент US №8697388, 15.04.2014), соединения мышьяка (Патент EP №1367134, 12.03.2003), аналоги толуола (Патент US №6329160, 12.11.2001) и др.
Значительная часть этих разработок основана именно на использовании генных слияний, введенных в состав рекомбинантной ДНК.
Наиболее близким по технической сущности к предлагаемому решению, взятым за прототип, является «Рекомбинантная плазмидная ДНК pYfi-qfp, содержащая ген, кодирующий химерный флюоресцентный белок GFPaav..» (Патент РФ №2384620, МПК С12 N 15/70, опубл.20.03.10), в котором предлагается использовать трансляционное слияние промотора гена raiA (yfiA) E.coli с геном зеленого флуоресцентного белка gfp для детекции широкого спектра токсических агентов. Особенностью изобретения-прототипа является способность реагировать на различные химические соединения. Это дает возможность оценить комплексное воздействие среды на бактериальную клетку, однако не позволяет четко установить ни природу действующего фактора, ни его интенсивность, что является принципиальным условием создания биосенсоров.
Предлагаемое решение устраняет этот недостаток, так как создано на основе промотора оперона, селективно реагирующего на хлоркатехолы и их аналоги. Помимо этого, заявляемое изобретение отличается от сходных технических решений бифункциональностью.
Раскрытие изобретения
Задачей, которую призвано решить изобретение, является создание рекомбинантной генетической конструкции для детекции в природных средах хлорированных катехолов и их аналогов и катионов тяжелых металлов.
Сформулированная задача решается путем создания слияния промоторной области clc-оперона Rh. opacus с беспромоторным геном rfp и введения полученной гибридной молекулы под T7lac-промотор.
Cогласно изобретению, рекомбинантная плазмидная ДНК pClcRFP, кодирующая продукцию флуоресцентного белка RFP, для определения биодоступных хлорированных катехолов, их аналогов и тяжелых металлов, имеет размер 5523 п.о., и состоит из следующих элементов:
- содержит промоторный участок clc-оперона (421 п.о.), полноразмерный ген clcR (912 п.о.) и часть кодирующей последовательности гена clcA (252 п.о.),
- содержит ген красного флуоресцентного белка rfp, слитый в рамке считывания с частью кодирующей последовательности гена clcA, что приводит к образованию трансляционного генного слияния.
Являясь производной вектора pGEM-T, плазмида также несет
- ген β-лактамазы (bla), обеспечивающий устойчивость к ампициллину,
- сайт инициации репликации oriE,
- промотор и сайт начала транскрипции, узнаваемый РНК-полимеразой фага Т7.
Предлагаемое изобретение, в отличие от аналогов, является бифункциональным. За счет наличия в рекомбинантной плазмиде перед трансляционным clcA::rfp слиянием двух промоторов (промотора clc-оперона и Т7lac-промотора) оно может быть использовано, с одной стороны, для определения в природных средах хлорированных катехолов и их аналогов, что подтверждает новизну предлагаемого решения, поскольку биосенсоры на эту группу токсичных соединений на основе генов грамположительных высокоактивных деструкторов хлорфенолов, слитых с геном флуоресцентного белка, ранее не создавались и, с другой стороны, ионов тяжелых металлов (в частности, меди 2+).
Созданная конструкция совпадает с прототипом по признаку использования генных слияний в качестве основы биосенсоров для определения загрязнений окружающей среды и по признаку применения флуоресцентных белков как репортерных компонентов генных слияний. Однако она отличается использованием промоторной области clc-оперона высокоактивного деструктора хлорфенолов Rhodococcus opacus 1CP, специфически реагирующего на хлорированные катехолы и их аналоги, и введением генного слияния под T7lac-промотор, что дает возможность использовать созданную конструкцию для детекции ионов тяжелых металлов. В первом случае наличие определяемого компонента осуществляется по возрастанию уровня флуоресценции за счет активации синтеза гибридного белка ClcA-RFP. Во втором – по падению флуоресценции за счет нарушения пространственной структуры предсинтезированного ClcA-RFP. Описываемая бифункциональность предлагаемой конструкции достигается за счет использования штаммов E.coli, способных экспрессировать РНК-полимеразу фага T7 (например, штамма BL21 DE3), необходимую для работы T7lac-промотора.
Изобретение иллюстрируется нижеприведенными примерами, схемой и графиками, где:
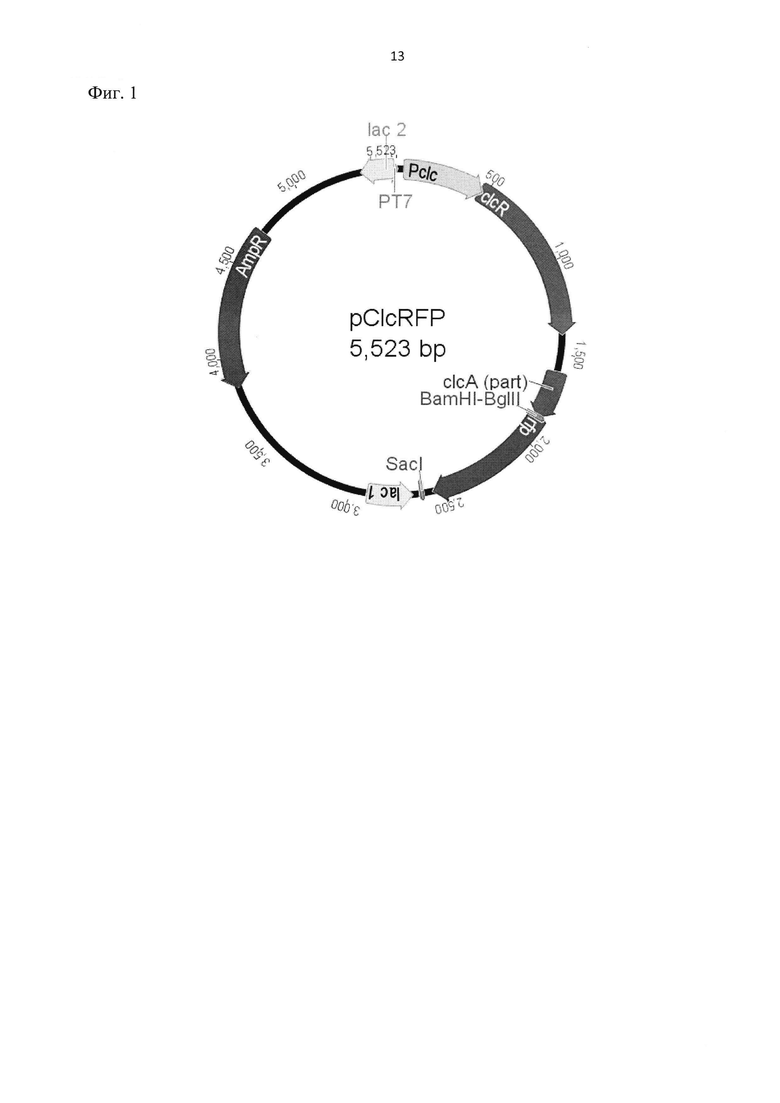
Фиг.1. Схема плазмиды pClcRFP, несущей clcA::rfp-слияние. Pclc – промоторный участок clc-оперона; clcR – первый ген clc-оперона, clcR; clcA (part) – часть гена clcA, образующая трансляционное (без сдвига и прерывания рамки считывания) слияние с rfp; rfp – ген красного флуоресцентного белка; SacI – сайт узнавания для эндонуклеазы SacI, по которому происходила вставка rfp в плазмиду; BamHI-BglII – гибридный сайт, получившийся после соединения молекул ДНК с липкими концами, образованными при гидролизе эндонуклеазами BamHI и BglII; PT7 – T7lac-промотор; AmpR – ген устойчивости к ампициллину, bla.
Фиг.2. Нуклеотидная последовательность плазмиды pClcRFP, несущей clcA::rfp-слияние.
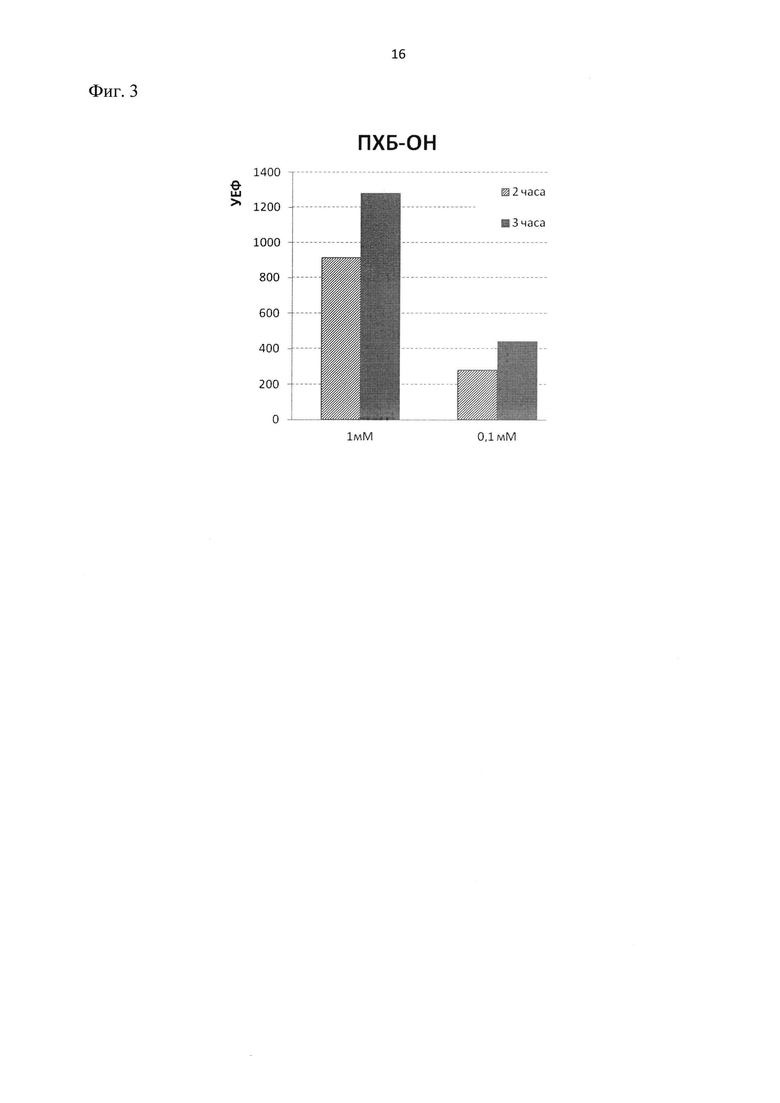
Фиг.3. Влияние смеси гидроксилированных производных полихлорированных бифенилов (ПХБ-ОН) на флуоресценцию гибридного белка ClcA-RFP в клетках E.coli BL21 DE3.
Измерения проведены через 2 и 3 часа после внесения индуктора. Отображен уровень флуоресценции гибридного белка ClcA-RFP в клетках, подвергнутых действию ПХБ-ОН (в концентрациях 1 мМ и 0,1 мМ), за вычетом фонового уровня флуоресценции (клетки находились в тех же условиях, но без индуктора). УЕФ – условные единицы флуоресценции.
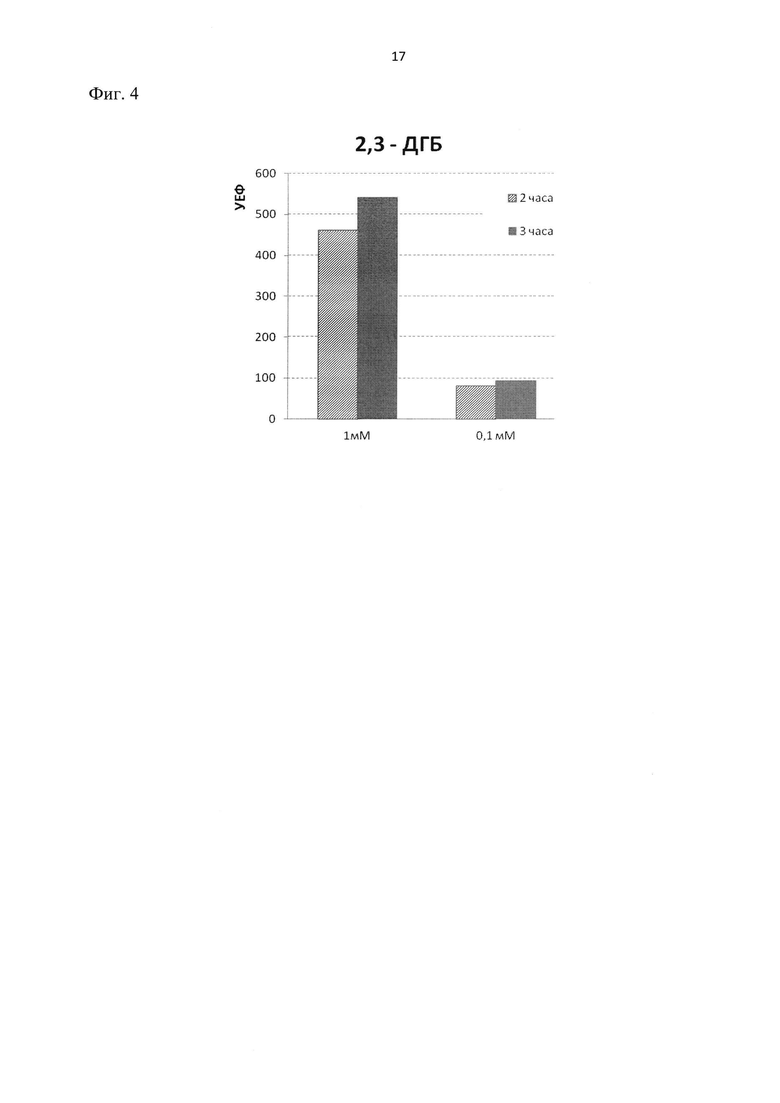
Фиг.4. Влияние 2,3-дигидроксибифенила (2,3-ДГБ) на флуоресценцию гибридного белка ClcA-RFP в клетках E.coli BL21 DE3. Измерения проведены через 2 и 3 часа после внесения индуктора. Отображен уровень флуоресценции гибридного белка ClcA-RFP в клетках, подвергнутых действию 2,3-ДГБ (в концентрациях 1 мМ и 0,1 мМ), за вычетом фонового уровня флуоресценции (клетки находились в тех же условиях, но без индуктора). УЕФ – условные единицы флуоресценции.
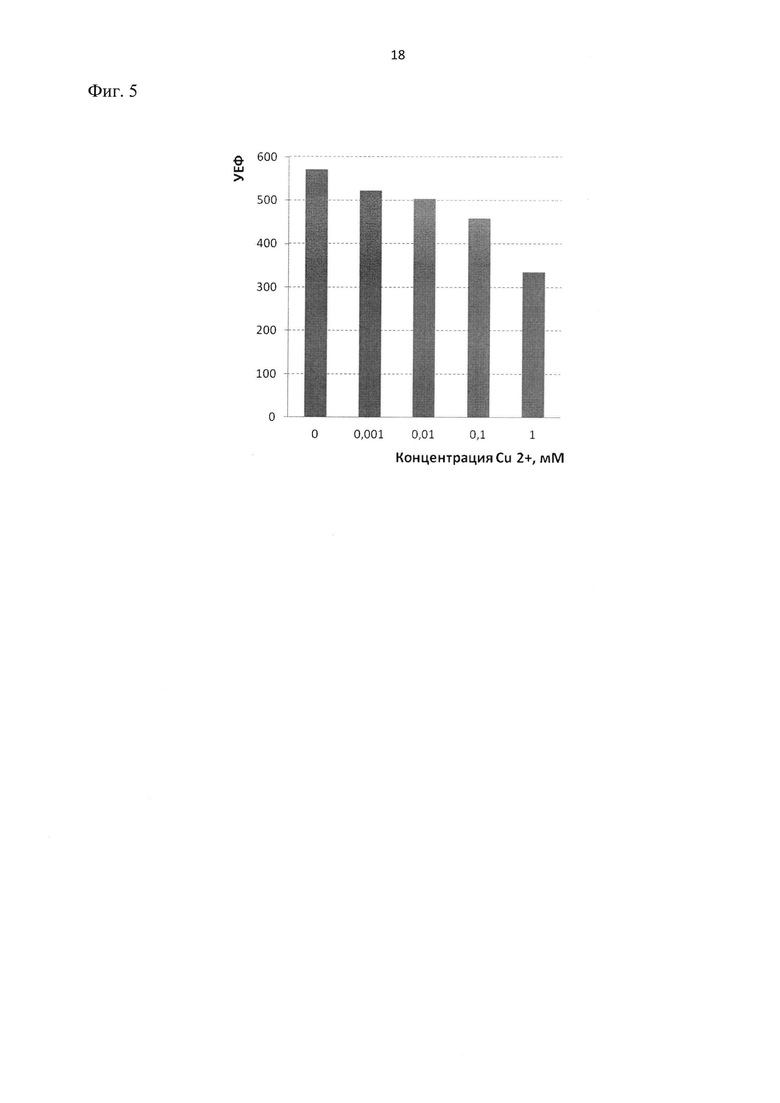
Фиг.5. Влияние катионов меди 2+ на флуоресценцию гибридного белка ClcA-RFP в клетках E.coli BL21 DE3. Измерения проведены через 10 минут после внесения раствора CuSO4. Отображен уровень флуоресценции гибридного белка ClcA-RFP (преиндуцированного добавкой ИПТГ) в клетках, подвергнутых действию CuSO4. УЕФ – условные единицы флуоресценции.
Осуществление изобретения
Пример 1. Конструирование рекомбинантной плазмидной ДНК pClcRFP, кодирующей продукцию флуоресцентного белка RFP, для определения биодоступных хлорированных катехолов, их аналогов и тяжелых металлов.
Осуществление изобретения до состояния, в котором его функциональность может быть проверена, заключается в создании слияния промоторной области clc-оперона Rh. opacus с геном красного флуоресцентного белка rfp, клонировании полученной конструкции в плазмиду pGEM-T под T7-промотор и введении полученного вектора в клетки E.coli, способные экспрессировать РНК-полимеразу фага Т7 (штамм BL21 DE3).
На основе известной нуклеотидной последовательности clc-оперона штамма Rhodococcus opacus 1CP (Eulberg et al., 1998; Moiseeva et al., 2002) были подобраны праймеры для клонирования его промоторного участка: clcRA F 5’- TAGTTGGGGCGGCGTGTTTCCTTC-3’ и clcRA R 5’- CCGGTCAGatctGGGGCACCTTCTTTGA-3’(подчеркнута последовательность, узнаваемая рестрикционной эндонуклеазой BglII). Места отжига праймеров на хромосоме Rh. opacus выбрали таким образом, чтобы итоговая генетическая конструкция включала участок хромосомы перед геном clcR (содержащий промотор и сайт начала транскрипции, 421 п.о.), сам ген clcR (912 п.о.), межгенное пространство clcR-clcA (не содержащее терминаторов, 222 п.о.) и часть кодирующей последовательности гена clcA (252 п.о.). Такой подход оказался необходим ввиду наличия между генами clcR и clcA последовательности, способной формировать на мРНК шпилечную структуру, которая потенциально может препятствовать эффективной экспрессии слияния. Помимо этого, кодируемый геном clcR белок является регуляторным и, очевидно, должен принимать участие в изменении транскрипции clc-оперона в ответ на индуктор. Следовательно, необходимо присутствие этого белка в бактериальной клетке в функциональном состоянии, что и определяет необходимость включения его гена в состав слияния в полноразмерном варианте. Амплифицированный участок clc-оперона далее заклонировали в плазмиду pGEM-T (Promega).
Аналогичным образом по матрице плазмиды pLenti6MV5-RFP с использованием праймеров RFBamH 5’-GCGgATcCTGCAGATATGGCCTCCT-3’ и RFSacI 5’-CCGAGctcAGGGTTAGGGATAGG-3’ (последовательности узнавания рестрикционных эндонуклеаз BamHI и SacI подчеркнуты) был амплифицирован ген красного флуоресцентного белка rfp (длина ПЦР-продукта – 764 п.о.).
После гидролиза ПЦР-продукта RFP эндонуклеазами BamHI и SacI и плазмиды pGEM-T со вставкой промоторной области clc-оперона эндонуклеазами BglII и SacI содержащие липкие концы молекулы были объединены в реакции лигирования, что привело к созданию целевой плазмиды pClcRFP, несущей трансляционное clcA::rfp-слияние и полноразмерную рамку считывания гена clcR. Использование для рестрикции pGEM-T со вставкой промоторной области clc-оперона эндонуклеазы BglII обусловлено наличием в клонируемой последовательности clc-оперона сайта узнавания BamHI. Это приводит в невозможности использования рестриктазы BamHI и необходимости поиска фермента, узнающего другую нуклеотидную последовательность, но дающего такие же липкие концы. Этим требованиям отвечает эндонуклеаза BglII.
По итогам создания плазмиды pClcRFP была составлена ее схема (фиг.1) и подготовлена нуклеотидная последовательность (фиг.2), адекватность которой проверили секвенированием.
Полученная рекомбинантная плазмида характеризуется следующими признаками:
- имеет размер 5523 п.о.,
- содержит промоторный участок clc-оперона (421 п.о.), полноразмерный ген clcR (912 п.о.) и часть кодирующей последовательности гена clcA (252 п.о.),
- содержит ген красного флуоресцентного белка rfp, слитый в рамке считывания с частью кодирующей последовательности гена clcA, что приводит к образованию трансляционного генного слияния.
Помимо этого, плазмида, являясь производной вектора pGEM-T (Promega), несет
- ген β-лактамазы (bla), обеспечивающий устойчивость к ампициллину,
- сайт инициации репликации oriE,
- промотор и сайт начала транскрипции, узнаваемый РНК-полимеразой фага Т7.
Пример 2. Использование предлагаемой конструкции для детекции хлоркатехолов, их аналогов и ионов тяжелых металлов (в частности, Cu2+) в природных средах.
Эффективная работа созданной рекомбинантной плазмиды pClcRFP возможна только в штаммах E.coli, способных к синтезу РНК-полимеразы фага Т7. Одним из таких штаммов является BL21 DE3 (Stratagen, генотип - E.coli B F– dcm ompT hsdS (rB– mB–) gal λ(DE3). Он был использован для получения тестовой бактериальной культуры. Для этого клетки E.coli, содержащие плазмиду pClcRFP, культивировали на среде LB в присутствии 100 мкг/мл ампициллина в течение 18 часов при 37°С с аэрацией на термошейкере 210 об/мин. Из выросшей стационарной культуры выделяли плазмидную ДНК с использованием Wizard Plus SV MiniPreps DNA Purification System (Promega) в соответствии с рекомендациями производителя. Наработанную плазмиду трансформировали в электрокомпетентные клетки E.coli BL21 DE3 по стандартной методике (Sambrook, Russell, 2006).
Для тестирования эффективности работы рекомбинантной плазмидной ДНК pClcRFP в качестве основы биосенсора полученную культуру клеток E.coli BL21 DE3 pClcRFP выращивали на среде LB в присутствии 100 мкг/мл ампициллина в течение 18 часов при 37°С с аэрацией (100 об/мин). Рост культуры оценивали на спектрофотометре UV-Visible BioSpec-mini (Shimadzu), определяя оптическую плотность при длине волны 600 нм в кюветах с длиной оптического пути 1,0 см. Оптическая плотность культуры составляла 1,5 о.е. (около 4×109 клеток бактерий на 1 мл среды). Затем клетки осаждали центрифугированием и дважды отмывали физиологическим раствором. Полученный в итоге клеточный осадок ресуспендировали в физиологическом растворе до плотности 1 о.е. Доведенную таким образом клеточную суспензию вносили в лунки иммунологического планшета и подвергали воздействию хлорированных катехолов и их аналогов или ионов меди 2+. Интенсивность флуоресценции (длина волны облучения – 585 нм, длина волны излучения – 615 нм) оценивали при 25°С в сравнении с аналогичными клетками без добавления «индуктора» (для хлорорганических соединений) либо в сравнении с начальным ее уровнем (для тяжелых металлов). Для детекции использовали гибридный многофункциональный ридер Synergy H1 (BioTek). Существенным отличием подготовки бактериальных клеток для детекции ионов меди было внесение в культуру при плотности 0,3 о.е. неметаболизируемого аналога лактозы ИПТГ (до конечной концентрации 0,3 мМ), необходимого для наработки гибридного ClcA-RFP-белка с T7lac-промотора.
По итогам проведенного тестирования созданной генетической конструкции получены следующие результаты.
1. Флуоресценция гибридного белка ClcA-RFP в клетках E.coli BL21 DE3 pClcRFP, подвергнутых действию смеси гидроксилированных производных полихлорированных бифенилов (ПХБ-ОН), возрастает в концентрационно-зависимом варианте (фиг.3). Очевидно, такое увеличение флуоресценции обусловлено повышением внутриклеточной концентрации ClcA-RFP за счет активации clc-промотора, поскольку ПХБ-ОН являются аналогами хлоркатехолов. Это свидетельствует о работоспособности созданной конструкции и ее применимости для детекции хлоркатехолов и их аналогов в природных средах.
2. Концентрационно-зависимое возрастание флуоресценции гибридного белка ClcA-RFP в клетках E.coli BL21 DE3 pClcRFP наблюдается (фиг.4) и при внесении в среду 2,3-дигидроксибифенила (2,3-ДГБ). Это соединение также является аналогом хлоркатехолов и одновременно выступает в качестве промежуточного продукта пути деградации бифенила. Полученные данные подтверждают эффективность работы clc-промотора в составе рекомбинантной плазмиды pClcRFP и возможность ее использования для детекции хлоркатехолов, интермедиатов разложения бифенила и, возможно, хлорированных бифенилов.
3. При внесении в среду CuSO4 наблюдается (фиг.5) концентрационно-зависимое падение флуоресценции предсинтесированного гибридного белка ClcA-RFP. Поскольку токсическое действие ионов меди обусловлено, прежде всего, образованием связи с SH группами аминокислотных остатков белков (Лужников, Костомарова. 1989, Maksymiec, 1997), это, по-видимому, связано с изменением его конформации, сопровождающейся потерей функциональности. Полученный результат подтверждает возможность использования созданной генетической конструкции для произвольно индуцируемого синтеза гибридного белка ClcA-RFP с последующим его применением для детекции ионов тяжелых металлов (в частности, Cu2+, в природных средах).
Таким образом, нами впервые создана генетическая конструкция, состоящая из промоторной области clc-оперона высокоактивного грамположительного деструктора хлорфенолов Rhodococcus opacus 1CP, слитой с беспромоторным геном красного флуоресцентного белка rfp. Гибридная молекула ДНК введена в состав плазмиды pGEM-T под T7lac-промотор, и итоговый вектор трансформирован в штамм E.coli BL21 DE3. Полученные рекомбинантные клетки E.coli демонстрируют концентрационно-зависимое увеличение флуоресценции в результате активации clc-промотора и последующего синтеза гибридного белка ClcA-RFP в ответ на действие хлорированных катехолов и их аналогов (таких как гидроксилированные производные полихлорированных бифенилов и 2,3-дигидроксибифенил). Это свойство дает возможность использовать их (или другие бактериальные клетки, несущие описанное clcA::rfp-слияние) для детекции названных соединений в природных и искусственных средах. В то же время, произвольная ИПТГ-зависимая активация T7lac-промотора, приводящая к синтезу гибридного белка ClcA-RFP, позволяет заранее накопить этот белок в клетках и затем применить его для определения наличия в среде тяжелых металлов (ионов меди 2+). Созданная рекомбинантная ДНК отличается принципиальной новизной в связи с (а) использованием clc-оперона грамположительного деструктора хлорфенолов Rh. opacus 1CP, (б) соединением промоторной области clc-оперона с геном rfp, (в) введением полученного генного слияния под T7lac-промотор и подходит для использования в качестве основы бифункционального биосенсора.
Заявка на изобретение является результатом работ, выполненных по проекту в рамках реализации ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014 - 2020 годы (соглашение №14.574.21.0028 от 17.06.2014, уникальный идентификатор RFMEFI57414X0028).
Литература
1. Daunert S., Barrett G., Feliciano J.S., Shetty R.S., Shrestha S., Smith-Spencer W. Genetically engineered whole-cell sensing systems: coupling biological recognition with reporter genes // Chem. Rev. 2000. V. 7. P. 2705-2738.
2. Tauriainen S, Virta M, Chang W, Karp M. Measurement of firefly luciferase reporter gene activity from cells and lysates using Escherichia coli arsenite and mercury sensors // Anal. Biochem. 1999. V. 272. N. 2. P. 191-198.
3. Tecon R., Wells M., van der Meer J.R. A new green fluorescent protein-based bacterial biosensor for analysing phenanthrene fluxes // Environ. Microbiol. 2006. V. 8. N. 4. P. 697-708.
4. Tecon R., van der Meer J.R. Biosensors for measuring availability of environmental pollutants // Sensors. 2008. V. 8. N. 7. P. 4062-4080.
5. van der Meer J.R., Belkin S. Where microbiology meets microengineering: design and applications of reporter bacteria // Nature Review Microbiol. 2010. V.8. P. 511-522.
6. Werlen C., Jaspers M.C.M., van der Meer J.R. Measurement of biologically available naphthalene in gas and aqueous phases by use of a Pseudomonas putida biosensor // Appl. Environ. Microbiol. 2004. V. 70. N 1. P. 43-51.
7. Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. М.: Химия, 1984. 448 с.
8. Патент EP №1367134, 12.03.2003.
9. Патент US №8697388, 15.04.2014.
10. Патент РФ №2384620, 17.03.2008 - прототип.
11. Moiseeva O.V., Solyanikova I.P., Kaschabek S.R., Gröning J., Thiel M., Golovleva L.A., Schlömann M. A new modified ortho cleavage pathway of 3-chlorocatechol degradation by Rhodococcus opacus 1CP: genetic and biochemical evidence // J. Bacteriol. 2002. V. 184. N. 19. P. 5282-5292.
12. Eulberg D., Kourbatova E.M., Golovleva L.A., Schlömann M. Evolutionary relationship between chlorocatechol catabolic enzymes from Rhodococcus opacus 1CP and their counterparts in proteobacteria: sequence divergence and functional convergence // J. Bacteriol. 1998. V. 180. N. 5. P. 1082-94.
13. Sambrook J., Russell D.W. & Sambrook J. The Condensed Protocols from Molecular Cloning: A Laboratory Manual. 2006. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY.
14. Лужников Е.А., Костомарова Л.Г. Острые отравления. М.: Медицина, 1989. 419 с.
15. Maksymiec W. Effect of copper on cellular processes in higher plants // Photosynthetica. 1997. V. 34. P. 132-342.


Изобретение относится к области биохимии, генной инженерии и биотехнологии, в частности к рекомбинантной плазмидной ДНК pClcRFP. Указанная плазмида pClcRFP кодирует продукцию гибридного флуоресцентного белка RFP для определения биодоступных хлорированных катехолов, их аналогов и тяжелых металлов. Нуклеотидная последовательность плазмиды pClcRFP представлена на Фиг. 2. Указанная плазмида является производной вектора pGEM-T, под Т7-промотор которого введены промоторный участок clc-оперона (421 п.о.), полноразмерный ген clcR (912 п.о.), межгенное пространство clcR-clcA (222 п.о.), начальная часть кодирующей последовательности clcA (252 п.о.) и ген красного флуоресцентного белка rfp. Настоящий ген rfp объединен в рамке считывания с указанной частью кодирующей последовательности гена clcA. Настоящее изобретение позволяет детектировать биодоступные хлорированные катехолы, их аналоги и тяжелые металлы в природных средах. 5 ил., 2 пр.
Рекомбинантная плазмидная ДНК pClcRFP, кодирующая продукцию гибридного флуоресцентного белка RFP для определения биодоступных хлорированных катехолов, их аналогов и тяжелых металлов, имеющая размер 5523 п.о. и последовательность, представленную на Фиг. 2, являющаяся производной вектора pGEM-T, под Т7-промотор которого введены промоторный участок clc-оперона (421 п.о.), полноразмерный ген clcR (912 п.о.), межгенное пространство clcR-clcA (222 п.о.), начальная часть кодирующей последовательности clcA (252 п.о.) и ген красного флуоресцентного белка rfp, объединенный в рамке считывания с указанной частью кодирующей последовательности гена clcA, также содержащая ген β-лактамазы (bla), обеспечивающий устойчивость к ампициллину, сайт инициации репликации oriE, промотор и сайт начала транскрипции, узнаваемые РНК-полимеразой фага Т7.
| GUAN X ET AL, Chlorocatechol detection based on a clc operon/reporter gene system, ANALYTICAL CHEMISTRY, 2000 | |||
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pYfi-gfp, КОДИРУЮЩАЯ ПРОДУКЦИЮ ФЛЮОРЕСЦЕНТНОГО БЕЛКА GFPaav И ШТАММ БАКТЕРИЙ Escherichia coli JM109-pYfi, ПРОДУЦИРУЮЩИЙ ФЛЮОРЕСЦЕНТНЫЙ БЕЛОК GFPaav В ПРИСУТСТВИИ ТОКСИЧЕСКИХ АГЕНТОВ | 2008 |
|
RU2384620C2 |
| GAILLARD M ET AL, The clc element of Pseudomonas sp | |||
| Насос | 1917 |
|
SU13A1 |
Авторы
Даты
2017-12-20—Публикация
2015-12-10—Подача