Ссылка на родственную заявку
Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США №61/833,189, которая была подана 10 июня 2013 г. и которая включена в данную заявку полностью посредством отсылки.
Область техники
Предусмотрен способ регулирования проводимости во время ферментации сингаза и поддержания величины STY равной примерно 10 г этанола/(л⋅день) или более. Более конкретно, способы регулирования проводимости включают уравновешивание средней проводимости, удельного поглощения углерода или плотности клеток.
Уровень техники
Анаэробные микроорганизмы могут продуцировать этанол из CO при ферментации газообразных субстратов. В процессе ферментации с использованием микроорганизмов рода Clostridium образуется этанол и другие полезные продукты. Например, в патенте США №5,173,429 описан штамм Clostridium ljungdahlii АТСС No. 49587, анаэробного ацетогенного микроорганизма, который продуцирует этанол и ацетат из синтетического газа. В патенте США №5,807,722 описаны способ и устройство для конверсии газообразных отходов в органические кислоты и спирты с применением штамма Clostridium ljungdahlii АТСС No. 55380. В патенте США №6,136,577 описаны способ и устройство для конверсии газообразных отходов в этанол с применением штамма Clostridium ljungdahlii АТСС No. 55988 и 55989.
Ацетогенные бактерии требуют постоянной подачи питательных веществ для сохранения постоянной продуктивности и образования этанола. Более высокая производительность может требовать применения более концентрированных сред для обеспечения эффективных количеств питательных веществ. Применение более концентрированных сред приводит к образованию ферментационного бульона с более высокой ионной силой. Более высокая ионная сила оказывает вредное воздействие на активность культур.
Сущность изобретения
Настоящее изобретение предусматривает способы, которые являются эффективными для регулирования проводимости среды в процессе ферментации CO-содержащего газообразного субстрата при обеспечении величины STY равной примерно 10 г этанола/(л⋅день) или более. Этот способ включает уравновешивание проводимости среды, удельного поглощения углерода или величины плотности клеток.
Способ ферментации CO-содержащего газообразного субстрата включает введение CO-содержащего газообразного субстрата в среду для ферментации. Согласно одному из аспектов настоящего изобретения этот способ включает поддержание проводимости до получения величины удельного поглощения углерода (SCU в ммол/мин/грамм сухих клеток) согласно формуле, где SCU = SCUmax - F*проводимость, при этом SCUmax=0-3 и F=0-1. Ферментационная среда имеет проводимость, составляющую примерно 30 мС/см или менее, и способ эффективно способствует поддержанию STY равной примерно 10 этанола/(л⋅день) или более.
Способ ферментации CO-содержащего газообразного субстрата включает введение CO-содержащего газообразного субстрата в среду для ферментации и ферментацию сингаза. Этот способ включает также поддержание отношения проводимости (у) к удельной скорости подачи газа (х) согласно формуле, где у = -6.0327х + 12.901, до достижения целевой плотности клеток, при этом x равен от примерно 0.2 до примерно 0.7 ммол/мин/грамм клеток. Согласно другому аспекту данный способ включает поддержание плотности клеток выше заданной (целевой) величины плотности клеток и поддержание величины проводимости около 30 мС/см или менее. Настоящий способ эффективно поддерживает величину STY, составляющую примерно 10 г этанола/(л⋅день) или более.
Способ ферментации CO-содержащего газообразного субстрата включает введение CO-содержащего газообразного субстрата в реакционный сосуд, который содержит среду для ферментации, и ферментацию CO-содержащего газообразного субстрата Согласие одному из аспектов данного способа по меньшей мере один или более хлорид-ионов в ферментационной среде замещены ионом, выбранным из группы, состоящей из ионов гидроксида, ацетата, карбоната, бикарбоната и их смесей, в количестве, эффективном для обеспечения величины проводимости равной примерно 30 мС/см или менее. Настоящий способ эффективно поддерживает величину STY, составляющую примерно 10 г этанола/(л⋅день) или более.
Краткое описание фигур
Указанные выше и другие аспекты, признаки и преимущества некоторых форм осуществления настоящего способа будут более очевидными после ознакомлениями со следующими Фигурами.
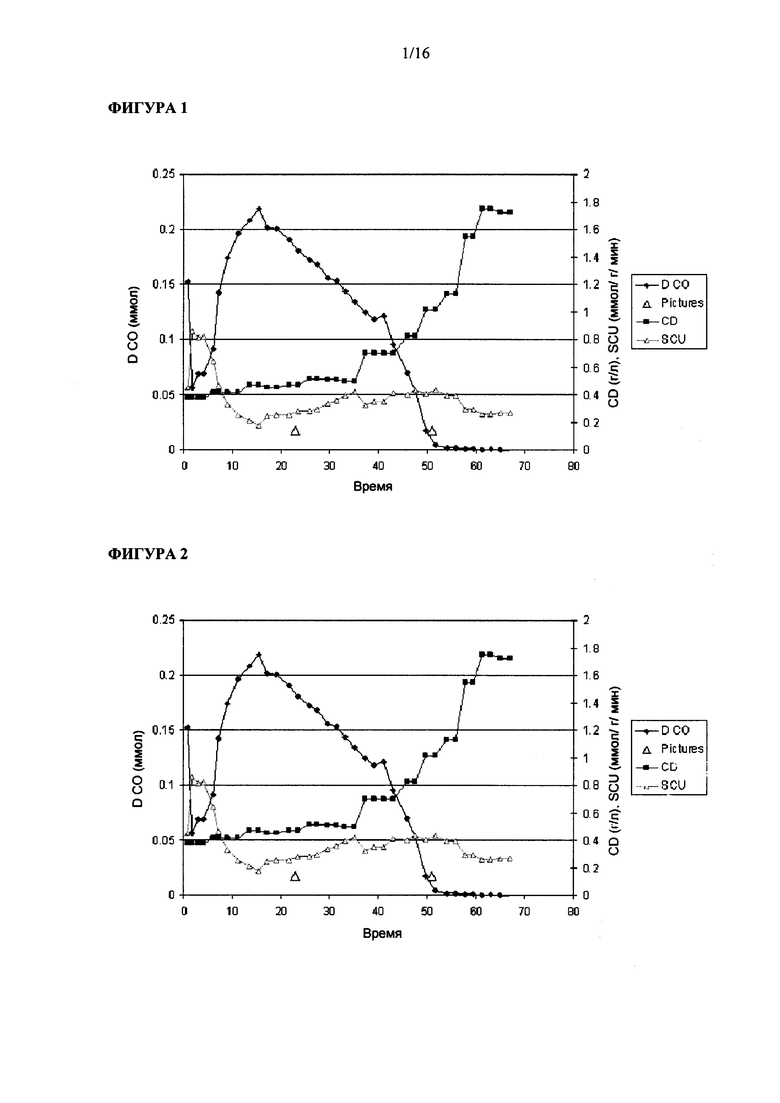
Фигура 1 иллюстрирует рост штамма Clostridium ljungdahlii на среде для роста 1х и при величине скорости подачи сингаза, равной 25 мл/мин.
Фигура 2 иллюстрирует рост штамма Clostridium ljungdahlii на среде для роста 1х и при величине скорости подачи сингаза, равной 35 мл/мин.
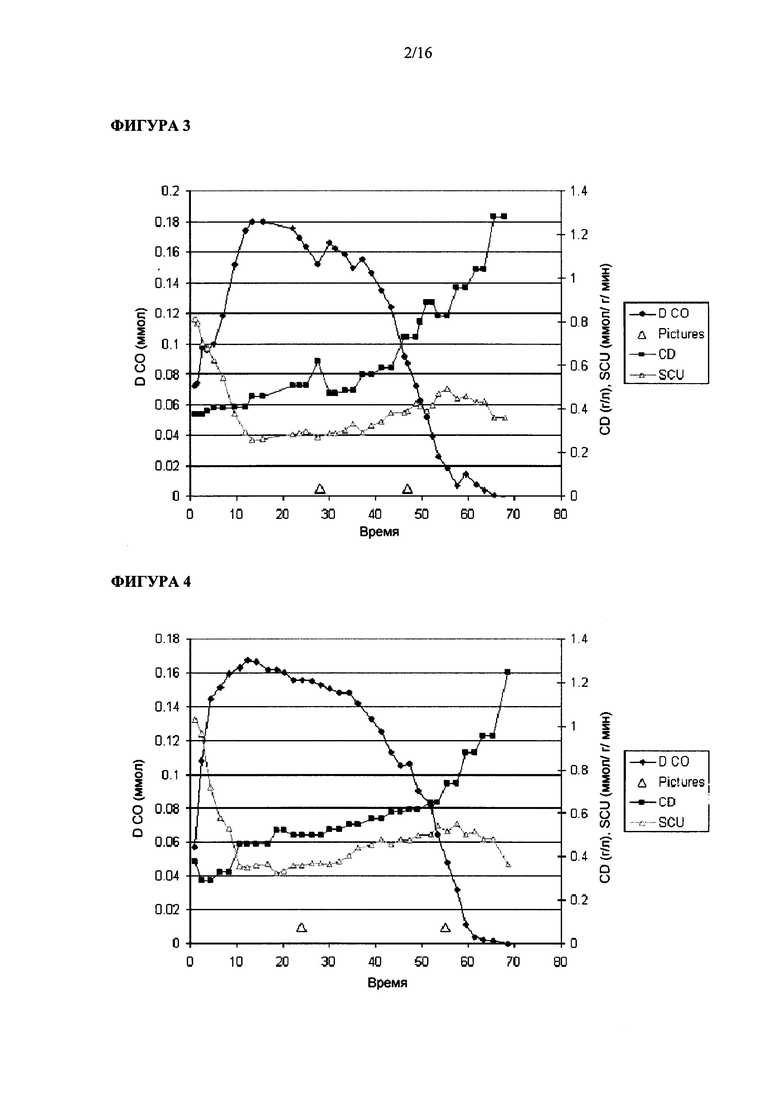
Фигура 3 иллюстрирует рост штамма Clostridium ljungdahlii на среде для роста 1х и при величине скорости подачи сингаза, равной 40 мл/мин.
Фигура 4 иллюстрирует рост штамма Clostridium ljungdahlii на среде для роста 1х и при величине скорости подачи сингаза, равной 45 мл/мин.
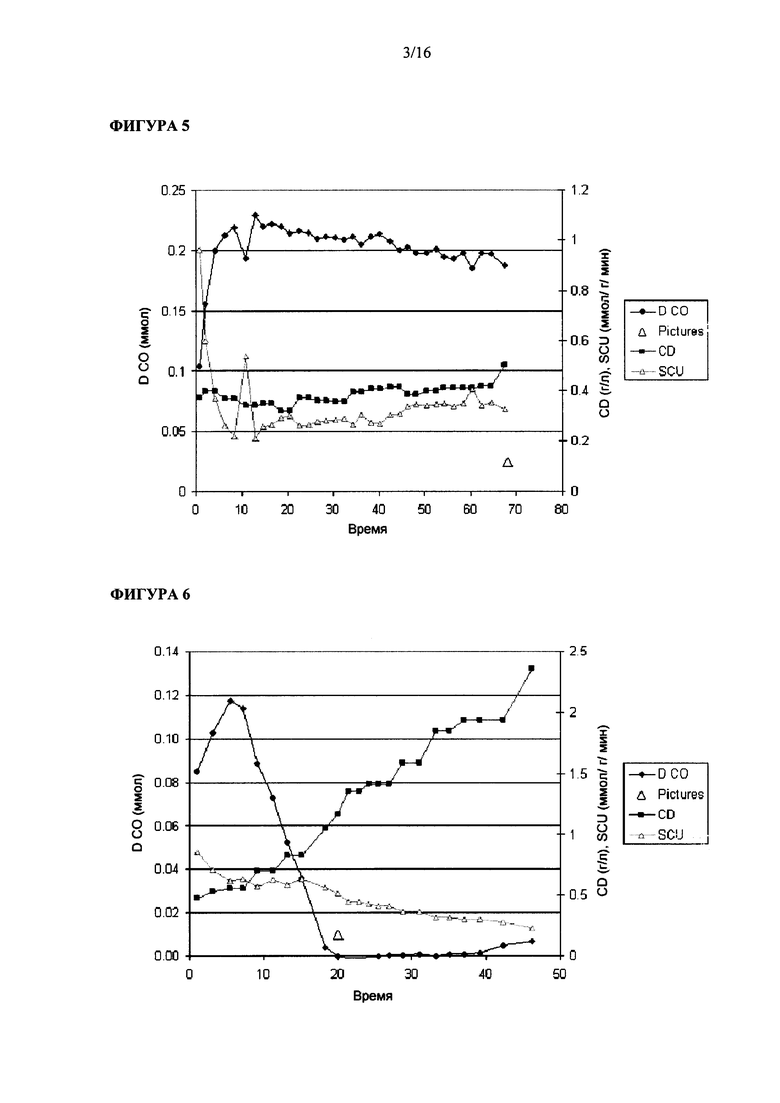
Фигура 5 иллюстрирует рост штамма Clostridium ljungdahlii на среде для роста 1x и при величине скорости подачи сингаза, равной 50 мл/мин.
Фигура 6 иллюстрирует рост штамма Clostridium ljungdahlii на среде для роста 1х и при величине скорости подачи сингаза, равной 50 мл/мин, с большим количеством первичного посевного материала (инокулюма).
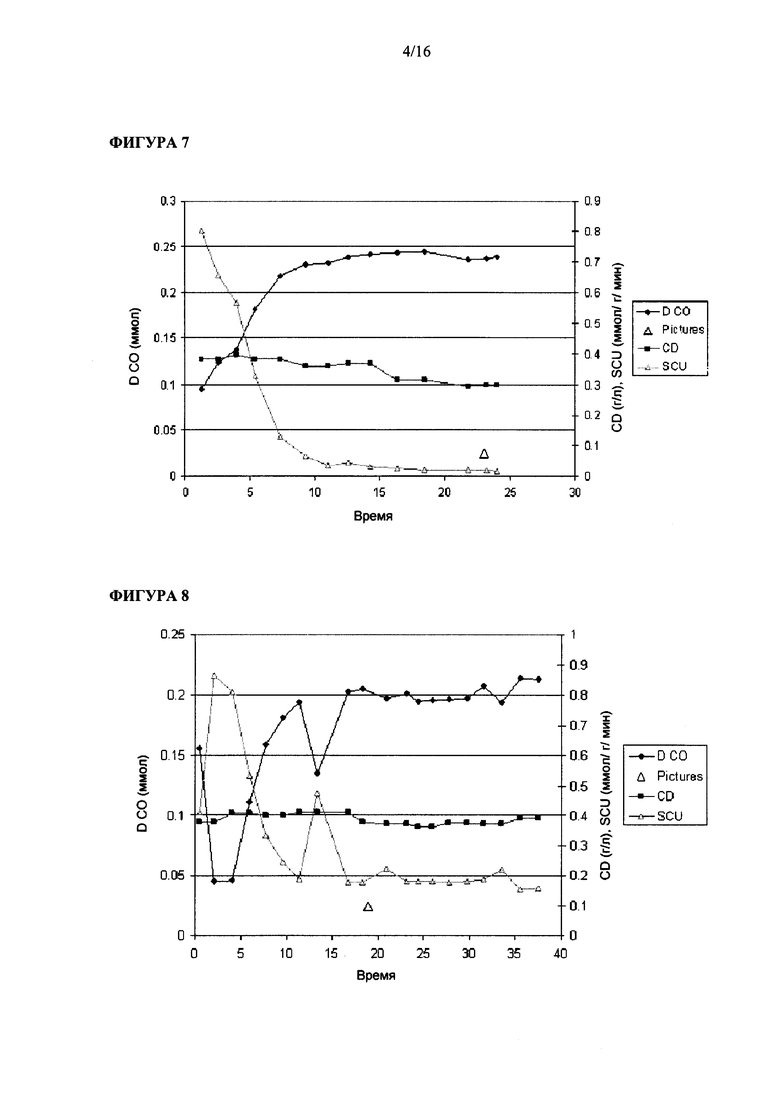
Фигура 7 иллюстрирует рост штамма Clostridium ljungdahlii на среде для роста 1.5х и при величине скорости подачи сингаза, равной 45 мл/мин, с большим количеством первичного посевного материала.
Фигура 8 иллюстрирует рост штамма Clostridium ljungdahlii на среде для роста 1.5х и при величине скорости подачи сингаза, равной 35 мл/мин, с большим количеством первичного посевного материала.
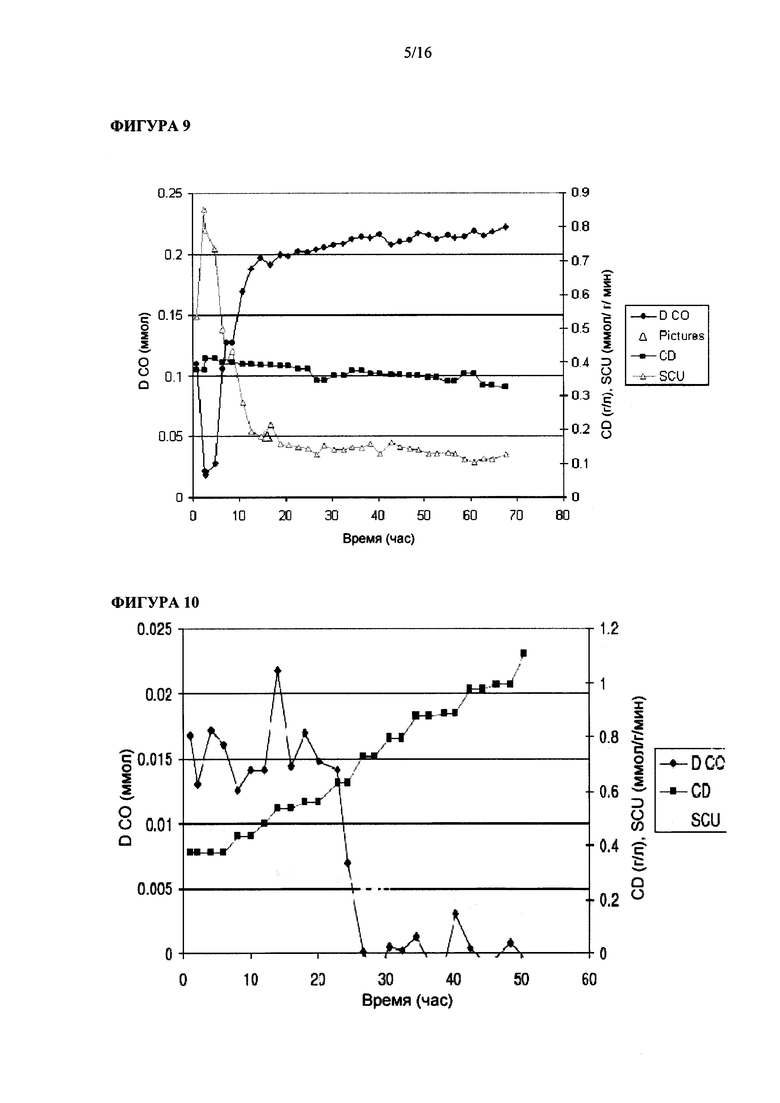
Фигура 9 иллюстрирует рост штамма Clostridium ljungdahlii на среде для роста 1.5х и при величине скорости подачи сингаза, равной 30 мл/мин, с большим количеством первичного посевного материала.
Фигура 10 иллюстрирует рост штамма Clostridium ljungdahlii на среде для роста 1.5х и при величине скорости подачи сингаза, равной 20 мл/мин, с большим количеством первичного посевного материала.
На Фигуре 11 показана величина удельного поглощения углерода Clostridium ljungdahlii, растущей в среде, содержащей хлорид аммония.
На Фигуре 12 показана величина удельной производительности по этанолу Clostridium ljungdahlii, растущей в среде, содержащей хлорид аммония.
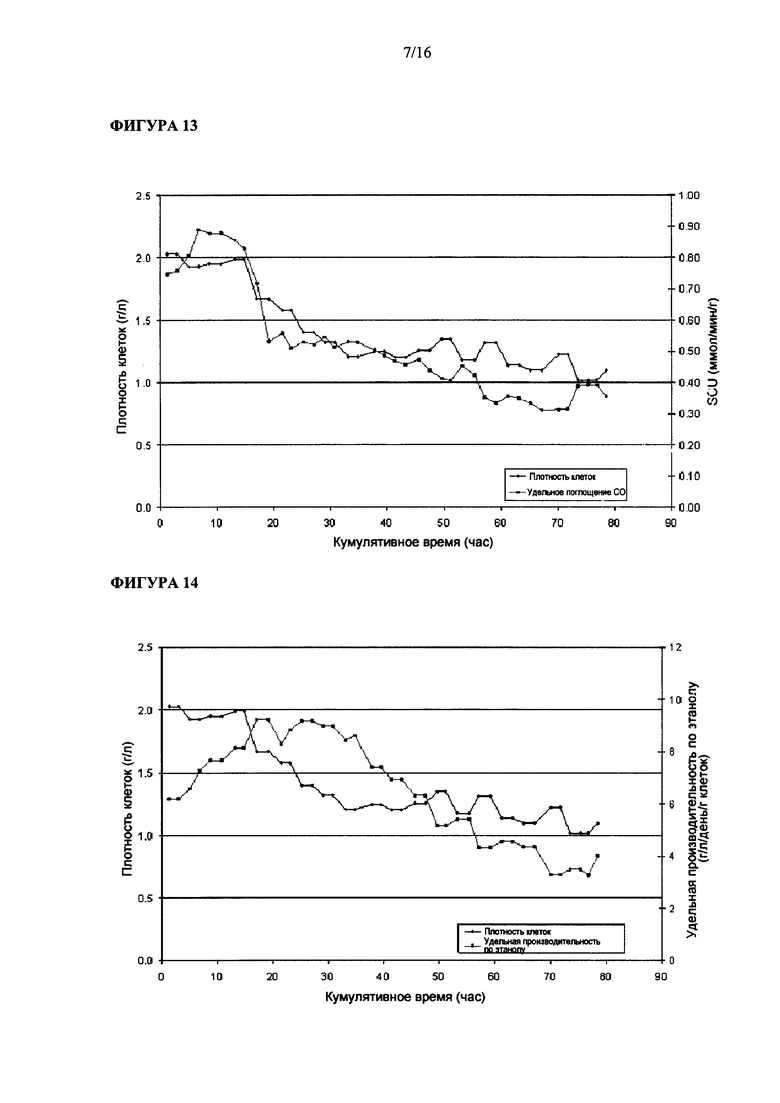
На Фигуре 13 показана величина удельного поглощения углерода Clostridium ljungdahlii, растущей в среде, содержащей L-лизин.
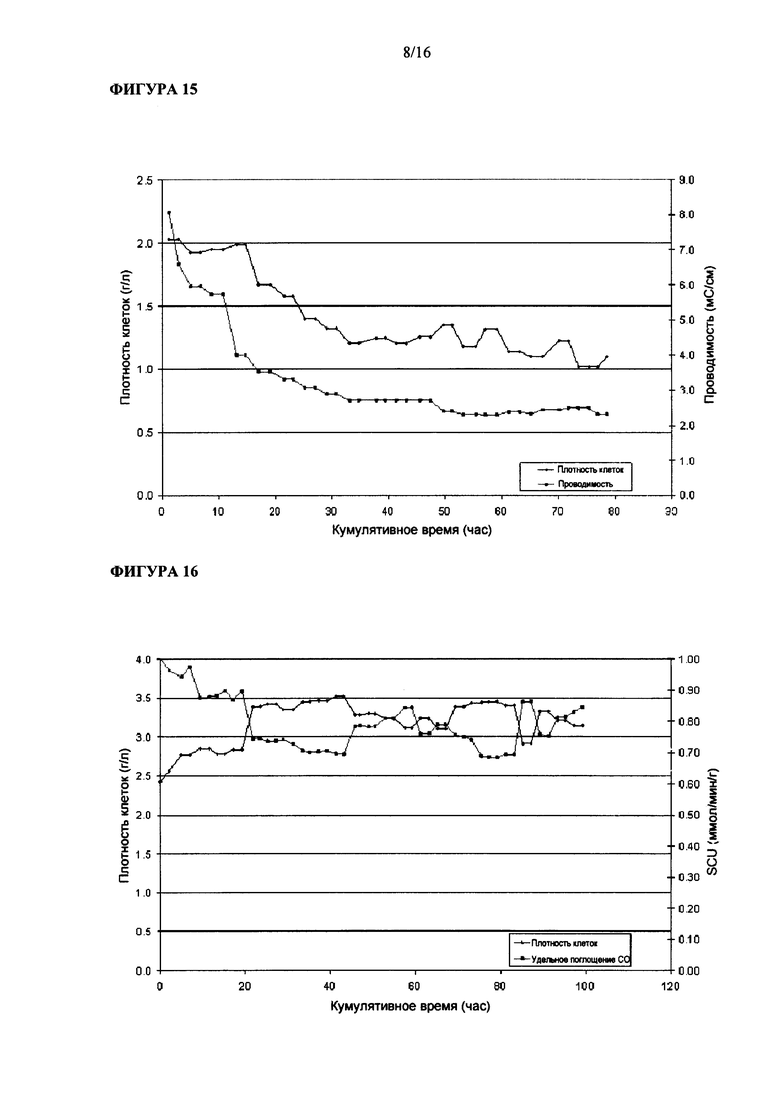
На Фигуре 14 показана величина удельной производительности по этанолу Clostridium ljungdahlii, растущей в среде, содержащей L-лизин.
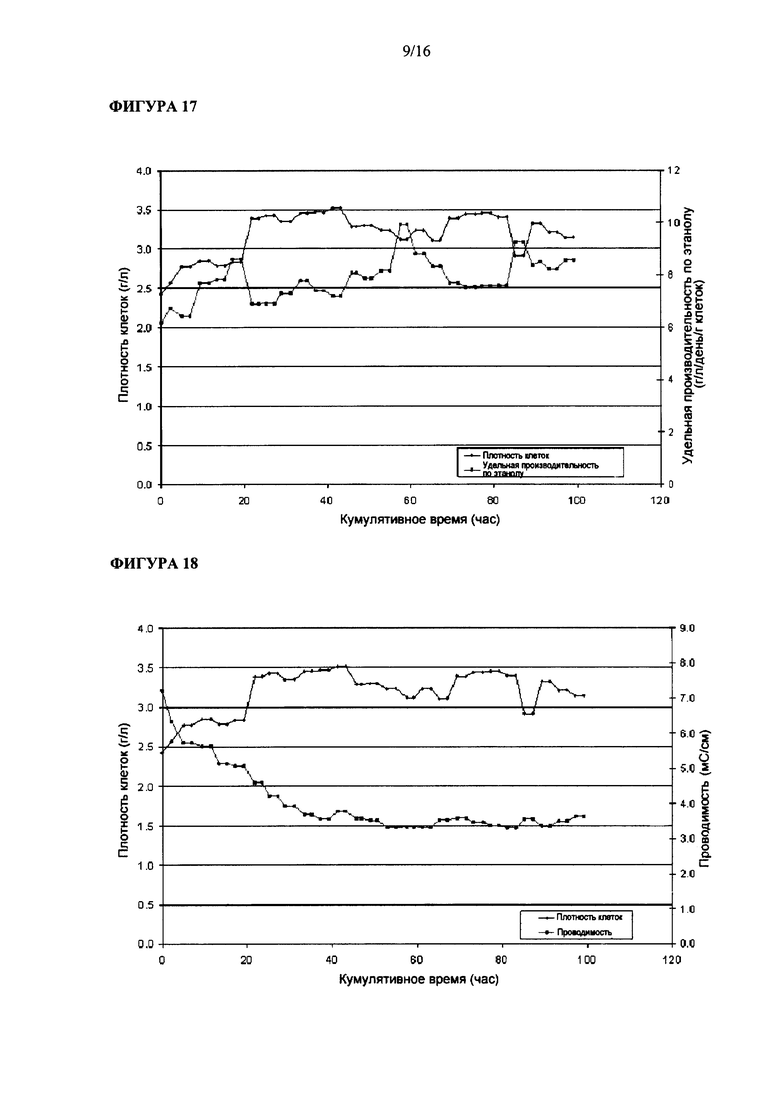
На Фигуре 15 показана величина проводимости Clostridium ljungdahlii, растущей в среде, содержащей L-лизин.
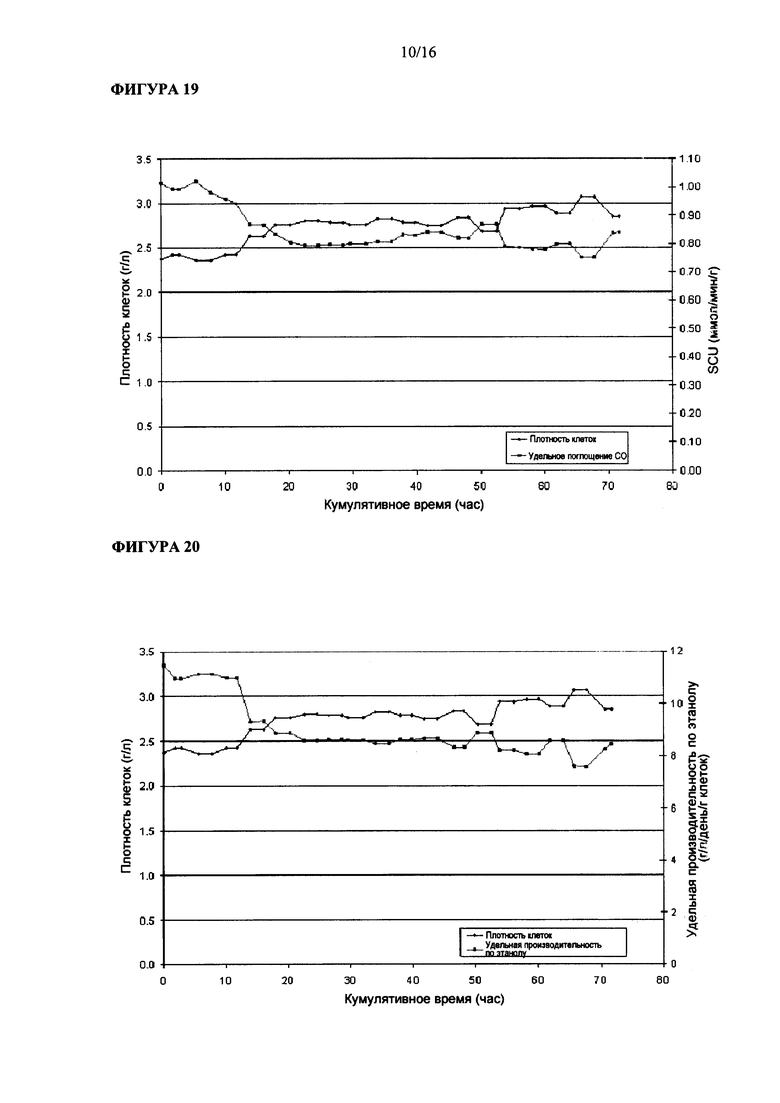
На Фигуре 16 показана величина удельного поглощения углерода Clostridium ljungdahlii, растущей в среде, содержащей ацетат аммония.
На Фигуре 17 показана величина удельной производительности по этанолу Clostridium ljungdahlii, растущей в среде, содержащей ацетат аммония.
На Фигуре 18 показана величина проводимости Clostridium ljungdahlii, растущей в среде, содержащей ацетат аммония.
На Фигуре 19 показана величина удельного поглощения углерода Clostridium ljungdahlii, растущей в среде, содержащей карбонат аммония.
На Фигуре 20 показана величина удельной производительности по этанолу Clostridium ljungdahlii, растущей в среде, содержащей карбонат аммония.
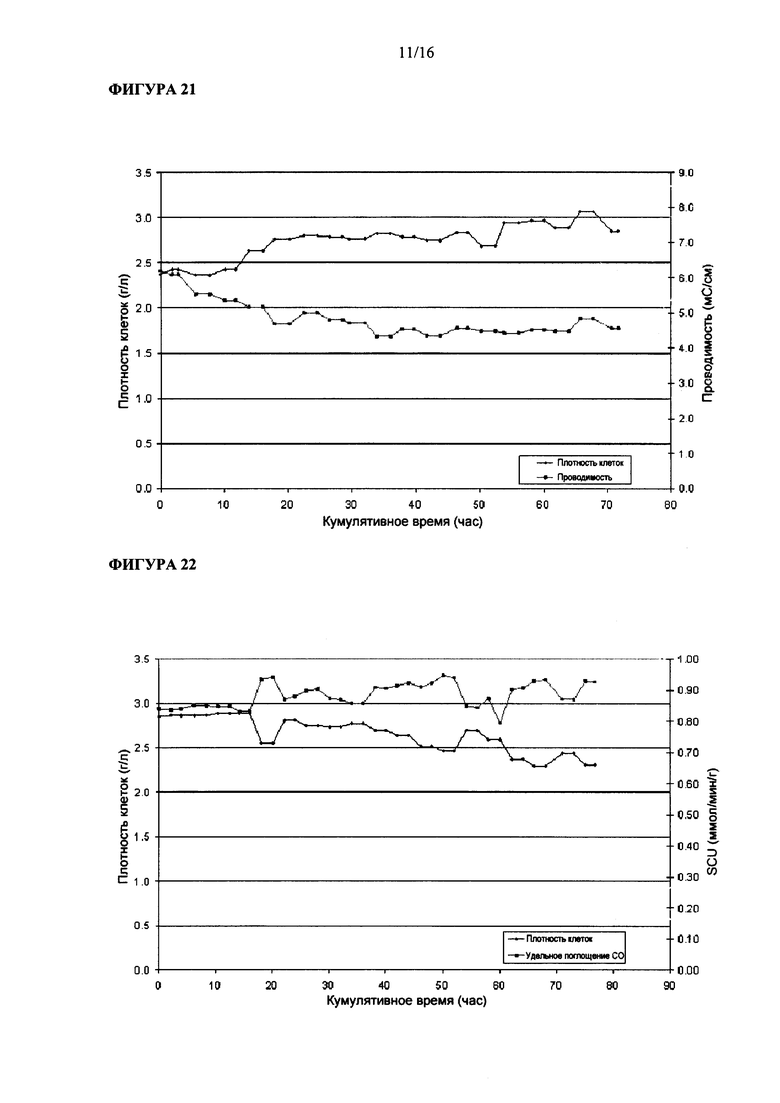
На Фигуре 21 показана величина проводимости Clostridium ljungdahlii, растущей в среде, содержащей карбонат аммония.
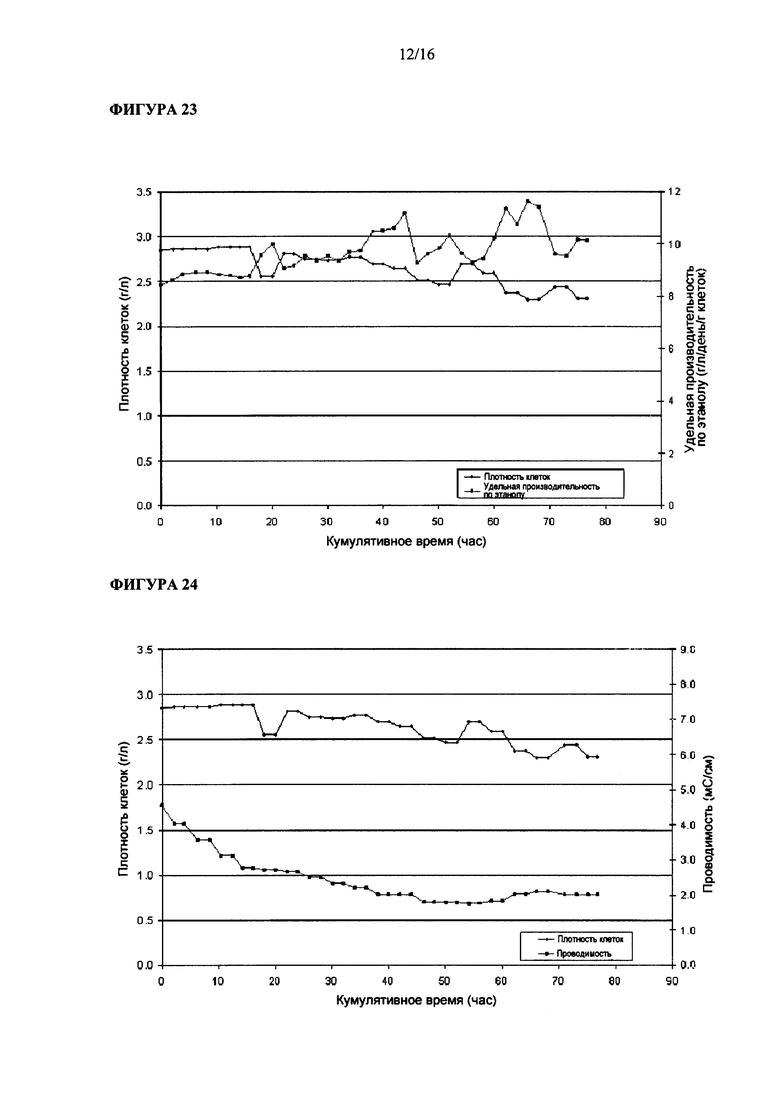
На Фигуре 22 показана величина удельного поглощения углерода Clostridium ljungdahlii, растущей в среде, содержащей карбонат аммония в качестве основы.
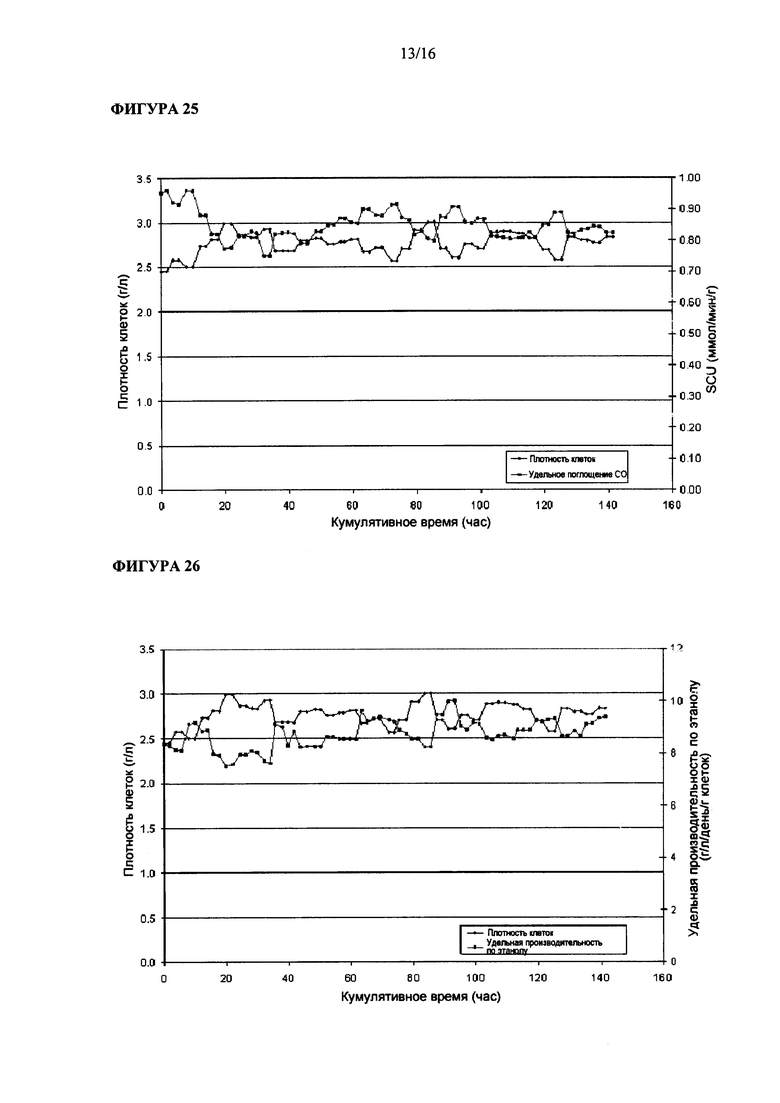
На Фигуре 23 показана величина удельной производительности по этанолу Clostridium ljungdahlii, растущей в среде, содержащей карбонат аммония в качестве основы.
На Фигуре 24 показана величина проводимости Clostridium ljungdahlii, растущей в среде, содержащей карбонат аммония в качестве основы.
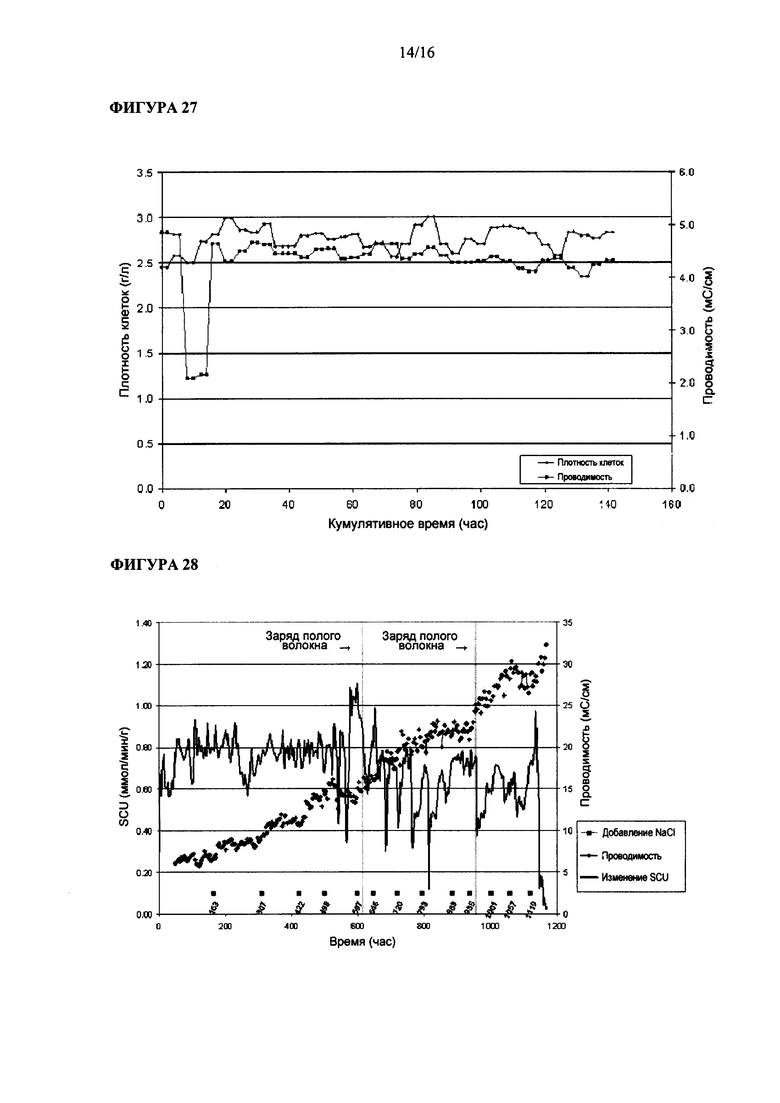
Удельное поглощение Clostridium ljungdahlii, растущей в среде, содержащей бикарбонат аммония, показано на Фигуре 25.
Удельная производительность по этанолу Clostridium ljungdahlii, растущей в среде, содержащей бикарбонат аммония, показана на Фигуре 26.
Проводимость Clostridium ljungdahli, растущей в среде, содержащей бикарбонат аммония, показана на Фигуре 27.
Фигура 28 иллюстрирует влияние ступенчатого увеличения проводимости среды на активность Clostridium ljungdahlii.
Фигура 29 иллюстрирует влияние ступенчатого увеличения проводимости среды на активность Clostridium ljungdahlii.
На Фигуре 30 показано взаимоотношение между удельной скоростью подачи CO и проводимостью в процессе ферментации Clostridium ljungdahlii.
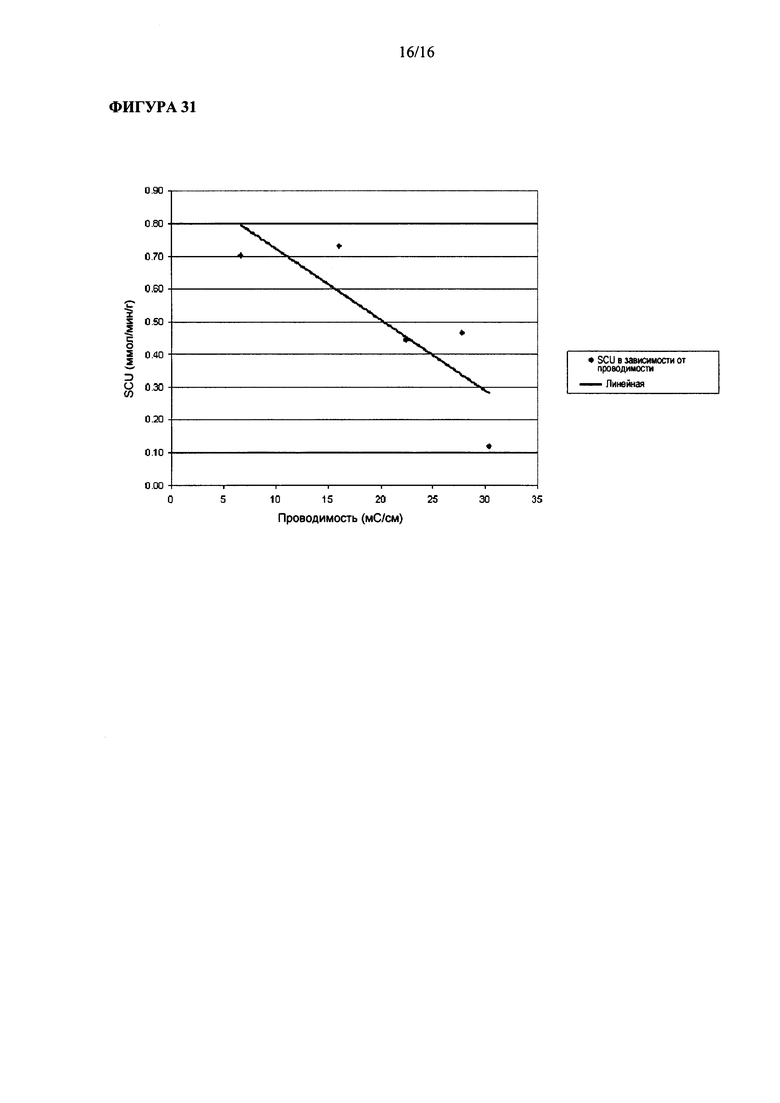
На Фигуре 31 показано взаимоотношение между величиной удельного поглощения углерода и проводимостью в процессе ферментации Clostridium ljungdahlii.
Соответствующие условные обозначения показывают соответствующие компоненты на всех Фигурах. Специалисту в данной области очевидно, что элементы на Фигурах показаны для простоты и ясности и необязательно показаны в масштабе. Например, размеры некоторых элементов на Фигурах могут быть увеличены относительно других элементов для лучшего понимания различных аспектов данного способа и устройства. Следует также отметить, что общеизвестные хорошо известные элементы, которые полезны или необходимы в промышленном осуществлении, часто не показаны для того, чтобы избежать получения перегруженного изображения различных аспектов изобретения.
Подробное описание изобретения
Следующее ниже описание не следует рассматривать как ограничивающее, оно приведено просто в целях описания общих принципов примерных вариантов. Объем настоящего изобретения определяется приведенной формулой изобретения.
Процессы ферментации сингаза, проводимые в биореакторах со средой и ацетогенными бактериями, как описано в данной заявке, являются эффективными для обеспечения конверсии CO в сингазе в спирты и другие продукты. Регулирование проводимости, проводимости (повтор) и плотности клеток позволяют обеспечить высокую производительность. Согласно одному аспекту производительность по спирту может быть выражена как STY (выход продукта за один проход, выраженный в г этанола/(л⋅день). Согласно этому аспекту данный способ эффективен для достижения величины STY (выхода продукта за один проход) равной по меньшей мере примерно 10 г этанола/(л⋅день). Возможные величины STY включают от примерно 10 г этанола/(л⋅день) до примерно 200 г этанола/(л⋅день), согласно другому аспекту эти величины могут быть равны от примерно 10 г этанола/(л⋅день) до примерно 160 г этанола/(л⋅день), согласно другому аспекту эти величины могут быть равны от примерно 10 г этанола/(л⋅день) до примерно 120 г этанола/(л⋅день), согласно другому аспекту эти величины могут быть равны от примерно 10 г этанола/(л⋅день) до примерно 80 г этанола/(л⋅день), согласно другому аспекту эти величины могут быть равны от примерно 10 г этанола/(л⋅день) до примерно 160 г этанола/(л⋅день), согласно другому аспекту эти величины могут быть равны от примерно 20 г этанола/(л⋅день) до примерно 100 г этанола/(л⋅день), согласно другому аспекту эти величины могут быть равны от примерно 10 г этанола/(л⋅день) до примерно 160 г этанола/(л⋅день), согласно другому аспекту эти величины могут быть равны от примерно 40 г этанола/(л⋅день) до примерно 140 г этанола/(л⋅день), и согласно другому аспекту эти величины могут быть равны от примерно 40 г этанола/(л⋅день) до примерно 100 г этанола/(л⋅день).
Определения
Если не указано иное, в данном описании настоящего изобретения использованы следующие термины, которые могут включать или единственное, или множественное число.
Термин "примерно", модифицирующий любое количество, относится к вариации этого количества, которая встречается в реальных условиях, например, в лаборатории, на пилотной установке или в промышленности. Например, количество ингредиента или мера, применяемые в смеси, или количество, модифицированное термином "примерно", включает вариацию и степень тщательности, обычно применяемые при измерении в экспериментальных условиях на производственной установке или в лаборатории. Например, количество компонента продукта, модифицированное термином "примерно", включает вариацию между партиями во многих экспериментах на производственной установке или в лаборатории и вариацию, присущую аналитическому методу. Будучи модифицированными или не модифицированными термином "примерно", эти количества включают эквиваленты этих количеств. Любое количество, указанное в данной заявке и модифицированное термином "примерно", может применяться в данном изобретении как количество, не модифицированное термином "примерно".
Термины "проводимость" и "средняя проводимость" относятся к способности проводить электричество. Вода проводит электричество потому, что она содержит растворенные твердые вещества, которые несут электрические заряды. Например, хлорид, нитрат и сульфат несут отрицательные заряды, в то время как натрий, магний и кальций несут положительные заряды. Эти растворенные твердые вещества влияют на способность воды проводить электричество. Проводимость измеряется методом зонда, который создает напряжение между двумя электродами. Падение напряжения используется для измерения сопротивления воды, которое затем превращается в проводимость. Величина средней проводимости может быть измерена известными методами. Некоторые примеры измерения средней проводимости содержатся в ASTM D1125, "Standard Test Methods for Electrical Conductivity and Resistivity of Water", и в "Standard Methods for the Examination of Water and Wastewater", 1999, American Public Health Association, American Water Works Association, Water Environment Federation, оба этих документа включены в данную заявку посредством отсылки.
Термин "сингаз" или "синтезгаз" означает синтетический газ, этим термином обозначают газовую смесь, которая содержит различные количества монооксида углерода и водорода. Примеры способов его получения включают паровой риформинг природного газа или углеводородов с получением водорода, газификацию угля в некоторых видах установок для газификации с использованием отходов. Указанное название происходит от его использования в качестве промежуточного продукта при получении синтетического природного газа (SNG) и при получении аммиака или метанола. Сингаз является горючим и часто используется как источник топлива или как промежуточный продукт при получении других химических веществ.
Термины "ферментация", "процесс ферментации" или "реакция ферментации" и т.п. охватывают как фазу роста, так и фазу биосинтеза продукта. Согласно одному из аспектов термин "ферментация" относится к конверсии CO в спирт.
Термин "плотность клеток" означает массу клеток микроорганизмов на единицу объема ферментационного бульона, например, в граммах/литр. В соответствии с этим аспектом данный способ и используемые среды позволяют получить величину плотности клеток, составляющую по меньшей мере примерно 1.0 г/л.
Термин "рецикл клеток" относится к выделению микробных клеток из ферментационного бульона и возврат всех или части этих выделенных микробных клеток назад в ферментер. Обычно для проведения выделения клеток используется фильтрационное устройство.
Термины " ферментер", "реакционный сосуд" или "биореактор" включают устройство для ферментации, состоящее из одного или более сосудов и/или башен или разводки трубопроводов, которое включает проточный реактор с мешалкой (CSTR), реактор с иммобилизованными клетками (ICR), реактор с орошаемым слоем (TBR), реактор с биопленочным подвижным слоем (MBBR), барботирующий ферментер, газлифтный ферментер, мембранный реактор, такой как половолоконный мембранный биореактор (HFMBR), статический смеситель или другой сосуд или другое устройство, подходящее для контактирования газа с жидкостью.
CO-содержащий субстрат
CO-содержащий субстрат может включать любой газ, который содержит CO. Согласно этому аспекту CO-содержащий газ может включать сингаз, промышленные газы и их смеси.
Сингаз может быть получен из любого известного источника. Согласно одному из аспектов сингаз может быть получен путем газификации углеродсодержащих материалов. Газификация включает частичное сжигание биомассы при ограниченной подаче кислорода. Получаемый газ в основном включает CO и H2. Согласно этому аспекту сингаз содержит по меньшей мере примерно 10 мол. % CO, согласно одному из аспектов по меньшей мере примерно 20 мол. % CO, согласно одному из аспектов по меньшей мере от примерно 10 до примерно 100 мол. % CO, согласно другому аспекту от примерно 20 до примерно 100 мол. % CO, согласно другому аспекту от примерно 30 до примерно 90 мол. % CO, согласно другому аспекту от примерно 40 до примерно 80 мол. % CO, и согласно другому аспекту от примерно 50 до примерно 70 мол. % CO. Некоторые примеры подходящих способов газификации и аппаратура описаны в заявках США на патент №№61/516,667, 61/516,704 и 61/516,646, все из которых были поданы 6 апреля 2011 г., и в заявках США на патент №№13/427,144, 13/427,193 и 13/427,247, все из которых были поданы 22 марта 2012 г., все эти заявки включены в данную заявку посредством отсылки.
Согласно другому аспекту этот способ применяется для получения спирта из газообразных субстратов, таких как промышленные дымовые газы с высоким объемным содержанием CO. Согласно некоторым аспектам газ, который включает CO, получают из отходов, содержащих углерод, например, из промышленных отработанных газов или при газификации других отходов. Как таковые, эти способы являются эффективными процессами для поглощения углерода, который иначе будет выбрасываться в окружающую среду. Примеры промышленных дымовых газов включают газы, полученные в процессе получения продуктов, содержащих закись железа, получения продуктов, содержащих цветные металлы, в процессе очистки нефти, в процессе газификации угля, газификации биомассы, в процессе получения электрической энергии, в процессе получения углеродной сажи, получения аммиака, получения метанола и получения кокса.
В зависимости от состава CO-содержащего субстрата CO-содержащий субстрат может подаваться непосредственно на стадию ферментации или может быть затем модифицирован для достижения соответствующего мольного отношения Н2 к CO. Согласно одному из аспектов CO-содержащий субстрат, подаваемый в ферментер, характеризуется мольным отношением Н2 к CO, составляющим примерно 0.2 или более, согласно другому аспекту примерно 0.25 или более, и согласно еще одному аспекту примерно 0.5 или более. Согласно другому аспекту CO-содержащий субстрат, подаваемый в ферментер, может включать примерно 40 мол. % или более CO плюс H2 и примерно 30 мол. % или менее CO, согласно еще одному аспекту примерно 50 мол. % или более CO плюс Н2 и примерно 35 мол. % или менее CO, и согласно еще одному аспекту примерно 80 мол. % или более CO плюс H2 и примерно 20 мол. % или менее CO.
Согласно одному из аспектов CO-содержащий субстрат в основном включает CO и Н2. Согласно этому аспекту CO-содержащий субстрат будет содержать по меньшей мере примерно 10 мол. % CO, согласно одному из аспектов по меньшей мере примерно 20 мол. % CO, согласно одному из аспектов от примерно 10 до примерно 100 мол. % CO, согласно другому аспекту от примерно 20 до примерно 100 мол. % CO, согласно другому аспекту от примерно 30 до примерно 90 мол. % CO, согласно другому аспекту от примерно 40 до примерно 80 мол. % CO, и согласно другому аспекту от примерно 50 до примерно 70 мол. % CO. CO-содержащий субстрат будет иметь мольное отношение CO/CO2, разное по меньшей мере примерно 0.75, согласно другому аспекту равное по меньшей мере примерно 1.0, и согласно еще одному аспекту равное по меньшей мере примерно 1.5.
Согласно одному из аспектов газоотделитель имеет такую конфигурацию, чтобы практически выделять по меньшей мере одну часть газового потока, при этом эта часть включает один или более компонентов. Например, газоотделитель может выделять CO2 из газового потока, содержащего следующие компоненты: CO, CO2, Н2, при этом CO2 может подаваться в устройство для удаления CO2 и остальная часть газового потока (содержащая CO и Н2) может вводиться в биореактор. Может быть использован любой газоотделитель, который известен из уровня техники. Согласно этому аспекту сингаз, подаваемый в ферментер, будет содержать примерно 10 мол. % или менее CO2, согласно другому аспекту примерно 1 мол. % или менее CO2, и согласно еще одному аспекту примерно 0.1 мол. % или менее CO2.
Потоки некоторых газов могут включать высокую концентрацию CO и низкую концентрацию Н2. Согласно одному из аспектов может быть желательно оптимизировать состав потока субстрата для того, чтобы достичь высокой эффективности при получении спирта и/или полного поглощения углерода. Например, концентрация Н2 в потоке субстрата может быть увеличена перед подачей потока в биореактор.
В соответствии с некоторыми аспектами настоящего изобретения потоки из двух или более источников могут быть соединены и/или смешаны для получения желательного и/или оптимизированного потока субстрата. Например, поток, содержащий высокую концентрацию CO, такой как выходящий из конвертера сталелитейного завода газ, может быть соединен с потоком, содержащим высокую концентрацию Н2, таким как газ, выходящий из коксовой печи сталелитейного завода.
В зависимости от состава газообразного CO-содержащего субстрата может быть также желательно обрабатывать его для удаления любых нежелательных примесей, таких как частицы пыли, перед введением субстрата на стадию ферментации. Например, газообразный субстрат может быть отфильтрован или промыт в скруббере с использованием известных методов.
Конструкция и работа биореактора
Описание конструкции ферментеров можно найти в заявках США на патент №№13/471,827 и 13/471,858, которые обе поданы 15 мая 2012 г., и в заявке США на патент №13/473,167, поданной 16 мая 2012 г., все из которых включены в данную заявку посредством отсылки.
В соответствии с одним из аспектов процесс ферментации начинается путем добавления среды в реакционный сосуд. Некоторые примеры составов среды описаны в заявках США на патент №№61/650,098 и 61/650,093, поданных 22 мая 2012 г., и в патенте США №7,285,402, поданном 23 июля 2001 г., все эти документы включены в данную заявку посредством отсылки. Такая среда может быть стерилизована для удаления нежелательных микроорганизмов, и реактор затем инокулируют нужными микроорганизмами. Стерилизация среды требуется не всегда.
Согласно одному из аспектов используемые микроорганизмы включают ацетогенные бактерии. Примеры подходящих ацетогенных бактерий включают бактерии рода Clostridium, такие как штаммы Clostridium ljungdahlii, включая штаммы, описанные в WO 2000/68407, ЕР 117309, патентах США №№. 5,173,429, 5,593,886 и 6,368,819, WO 1998/00558 и WO 2002/08438, штаммы Clostridium autoethanogenum (DSM 10061 и DSM 19630 DSMZ, Germany), в том числе, описанные в WO 2007/117157 и WO 2009/151342, и Clostridium ragsdalei (P11, АТСС ВАА-622) и Alkalibaculum bacchi (СР11, АТСС ВАА-1772), включая штаммы, описанные, соответственно, в патенте США №7,704,723 и в публикации "Biofuels and Bioproducts from Biomass-Generated Synthesis Gas", Hasan Atiyeh, представленной в Oklahoma EPSCoR Annual State Conference, 29 апреля 2010 г., и штамм Clostridium carboxidivorans (АТСС PTA-7827), описанный в заявке США на патент №2007/0276447. Другие подходящие микроорганизмы включают микроорганизмы рода Moorella, в том числе Moorella sp. HUC22-1, и рода Carboxydothermus. Каждая из указанных публикаций включена в данную заявку посредством отсылки. Могут быть использованы смешанные культуры двух или более микроорганизмов.
Некоторые примеры подходящих бактерий включают Acetogenium kivui, Acetoanaerobium noterae, Acetobacterium woodii, Alkalibaculum bacchi CP11 (АТСС BAA-1772), Blautia producta, Butyribacterium methylotrophicum, Caldanaerobacter subterraneous, Caldanaerobacter subterraneous pacificus, Carboxydothermus hydrogenoformans, Clostridium aceticum, Clostridium acetobutylicum, Clostridium acetobutylicum P262 (DSM 19630 of DSMZ Germany), Clostridium autoethanogenum (DSM 19630 of DSMZ Germany), Clostridium autoethanogenum (DSM 10061 of DSMZ Germany), Clostridium autoethanogenum (DSM 23693 of DSMZ Germany), Clostridium autoethanogenum (DSM 24138 of DSMZ Germany), Clostridium carboxidivorans P7 (ATCC PTA-7827), Clostridium coskatii (АТСС РТА-10522), Clostridium drakei, Clostridium ljungdahlii ΡETC (ATCC 49587), Clostridium ljungdahlii ERI2 (ATCC 55380), Clostridium ljungdahlii C-01 (ATCC 55988), Clostridium ljungdahlii O-52 (ATCC 55889), Clostridium magnum, Clostridium pasteurianum (DSM 525 of DSMZ Germany), Clostridium ragsdali P11 (ATCC BAA-622), Clostridium scatologenes, Clostridium thermoaceticum, Clostridium ultunense, Desulfotomaculum kuznetsovii, Eubacterium limosum, Geobacter sulfurreducens, Methanosarcina acetivorans, Methanosarcina barkeri, Morrella thermoacetica, Morrella thermoautotrophica, Oxobacter pfennigii, Peptostreptococcus productus, Ruminococcus productus, Thermoanaerobacter kivui, и их смеси.
Желательно проводить ферментацию в подходящих условиях для осуществления нужного процесса ферментации (например, превращения CO в этанол). Следует принимать во внимание условия реакции, включая давление, температуру, скорость потока газа, скорость потока жидкости, величину рН среды, окислительно-восстановительный потенциал среды, скорость перемешивания (если используется проточный реактор с мешалкой), степень инокуляции, максимальную концентрацию газообразного субстрата, для того, чтобы обеспечить неограничивающее количество CO в жидкой фазе и максимальную концентрацию продукта при предотвращения ингибирования образования продукта.
Способы согласно настоящему изобретению могут быть использованы для поддержания жизнеспособности микробной культуры, при этом микробная культура ограничена по содержанию CO, с тем чтобы скорость передачи CO в раствор была меньше, чем скорость поглощения культурой. Такие ситуации могут возникнуть, когда субстрат, содержащий CO, подается в микробную культуру не непрерывно; скорость массопередачи является низкой; или в потоке субстрата содержится недостаточное количество CO для поддержания жизнеспособности культуры при оптимальной температуре. Согласно таким вариантам в микробной культуре будет быстро исчерпываться CO, растворенный в жидкой питательной среде, и будет ограниченное количество субстрата, так как дальнейшее количество субстрата не может подаваться достаточно быстро.
Начало работы (запуск): После инокуляции начальная скорость подачи газа устанавливается такой, чтобы обеспечить эффективную подачу исходной популяции микроорганизмов. Выходящий газ анализируется для определения содержимого этого выходящего газа. Результаты анализа газа используются для регулирования скорости подачи газа. Согласно этому аспекту данный способ может обеспечить рассчитанное отношение концентрации CO к исходной плотности клеток, составляющее от примерно 0.5 до примерно 0.9, согласно другому аспекту от примерно 0.6 до примерно 0.8, согласно еще одному аспекту от примерно 0.5 до примерно 0.7, и согласно еще одному аспекту от примерно 0.5 до примерно 0.6.
Согласно другому аспекту процесс ферментации включает подачу сингаза в ферментационную среду в количестве, достаточном для обеспечения исходной рассчитанной концентрации CO в ферментационной среде равное от примерно 0.15 мМ до примерно 0.70 мМ, согласно другому аспекту от примерно 0.15 мМ до примерно 0.50 мМ, согласно другому аспекту от примерно 0.15 мМ до примерно 0.35 мМ, согласно другому аспекту от примерно 0.20 мМ до примерно 0.30 мМ, и согласно еще одному аспекту от примерно 0.23 мМ до примерно 0.27 мМ. Этот процесс может обеспечить увеличение плотности клеток по сравнению с исходной плотностью клеток.
Согласно одному из аспектов процесс ферментации CO-содержащего газообразного субстрата включает подачу CO-содержащего газообразного субстрата в ферментационную среду и поддержание проводимости для обеспечения удельного поглощения углерода (SCU в ммол/мин/грамм сухих клеток) согласно формуле SCU = SCUmax - F*проводимость, при этом SCUmax = от 0 до 3 и коэффициент F = от 0 до 1. Фигура 31 графически иллюстрирует это уравнение. Согласно этому аспекту ферментационная среда характеризуется проводимостью равной примерно 30 мС/см или менее и согласно другим аспектам может характеризоваться проводимостью, описанной в данной заявке. Согласно другому аспекту коэффициент F (который характеризует наклон линии) может быть равным от 0 до 1, согласно еще одному аспекту от 0.05 до 1, согласно еще одному аспекту от 0.1 до 1, согласно еще одному аспекту от 0.2 до 1, согласно еще одному аспекту от 0.3 до 1, согласно еще одному аспекту от 0.4 до 1 и согласно еще одному аспекту от 0.5 до 1.
Согласно одному из аспектов данный способ включает регулирование проводимости (у) в зависимости от удельной скорости подачи газа (х) согласно формуле у = -10.109х + 14.2 до достижения заданной плотности клеток. Фигура 30 графически иллюстрирует это уравнение. Согласно этому аспекту ферментационная среда имеет проводимость, составляющую примерно 30 мС/см или менее и в соответствии с другими аспектами может иметь проводимость, указанную в данной заявке. Согласно этому аспекту x равен от примерно 0.2 до примерно 0.7 ммол/мин/грамм клеток. Согласно другому аспекту x равен от примерно 0.3 до примерно 0.6 ммол/мин/грамм клеток и согласно еще одному аспекту x равен от примерно 0.4 до примерно 0.5 ммол/мин/грамм клеток.
Согласно другому аспекту данный способ позволяет обеспечить заданную плотность клеток, составляющую от примерно 3 до примерно 30 г/л, согласно другому аспекту от примерно 4 до примерно 25 г/л, согласно другому аспекту от примерно 5 до примерно 25 г/л, согласно другому аспекту от примерно 7 до примерно 25 г/л, согласно другому аспекту от примерно 10 до примерно 25 г/л, согласно другому аспекту от примерно 12 до примерно 20 г/л, и согласно еще одному аспекту от примерно 15 до примерно 20 г/л.
После запуска: После достижения желательных показателей жидкая фаза и клеточный материал выгружаются из реактора и дополняются средой. Настоящий способ позволяет увеличить плотность клеток до примерно 2.0 г/л или более, согласно другому аспекту от примерно 2 до примерно 30 г/л, согласно другому аспекту от примерно 2 до примерно 25 г/л, согласно другому аспекту от примерно 2 до примерно 20 г/л, согласно другому аспекту от примерно 2 до примерно 10 г/л, согласно другому аспекту от примерно 2 до примерно 8 г/л, согласно другому аспекту от примерно 3 до примерно 30 г/л, согласно другому аспекту от примерно 3 до примерно 20 г/л, согласно другому аспекту от примерно 3 до примерно 6 г/л, и согласно еще одному аспекту от примерно 4 до примерно 5 г/л.
После достижения целевой плотности клеток способ по изобретению позволяет поддерживать плотность клеток. Плотность клеток можно поддерживать при помощи рецикла клеток. Способ по изобретению может использовать рецикл клеток для повышения или снижения концентрации клеток внутри реактора. Согласно этому аспекту жидкость, выходящая из реактора, направляется в отделитель клеток, где эти клетки и фильтрат разделяются. Клетки могут быть возвращены в реактор. Плотность клеток можно регулировать с помощью фильтра для рецикла. Некоторые примеры биореакторов и использования рециклов клеток описаны в заявках США на патент №№61/571.654 и 61/571,565, поданных 30 июня 2011 г., в заявке США на патент №61/573,845, поданной 13 сентября 2011 г., в заявках США на патент №№13/471,827 и 13/471,858, поданных 15 мая 2012 г. и в заявке США на патент №13/473,167, поданной 16 мая 2012 г., все из которых включены в данную заявку посредством отсылки.
Согласно одному аспекту способ по изобретению эффективно обеспечивает поддержание степени конверсии Н2 равной примерно 25% или более. Согласно другому аспекту способ по изобретению эффективно обеспечивает поддержание степени конверсии Н2 равной от примерно 25% до примерно 95%, согласно еще одному аспекту от примерно 30% до примерно 90%, согласно еще одному аспекту от примерно 35% до примерно 85%, согласно еще одному аспекту от примерно 40% до примерно 80%, согласно еще одному аспекту от примерно 40% до примерно 70%, согласно еще одному аспекту от примерно 40% до примерно 60%, и согласно еще одному аспекту от примерно 40% до примерно 50%.
Согласно одному аспекту способ по изобретению эффективно обеспечивает поддержание степени поглощения CO в пределах от примерно 0.001 до примерно 10 ммол/мин/грамм сухих клеток. Согласно другому аспекту способ по изобретению эффективно обеспечивает поддержание степени поглощения CO в пределах от примерно 0.001 до примерно 5 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 0.001 до примерно 4 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 0.001 до примерно 3 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 0.001 до примерно 2 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 0.001 до примерно 1 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 0.05 до примерно 9 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 0.05 до примерно 5 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 0.05 до примерно 4 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 0.05 до примерно 3 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 0.05 до примерно 2 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 0.05 до примерно 1 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 1 до примерно 8 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 1 до примерно 5 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 1 до примерно 4 ммол/мин/грамм сухих клеток, согласно другому аспекту от примерно 1 до примерно 3 ммол/мин/грамм сухих клеток и согласно еще одному аспекту от примерно 1 до примерно 2 ммол/мин/грамм сухих клеток.
Согласно одному аспекту способ по изобретению эффективно обеспечивает поддержание степени поглощения CO от примерно 5 до примерно 99%. Согласно другому аспекту степень конверсии CO равна от примерно 10 до примерно 90%, согласно другому аспекту от примерно 20 до примерно 80%, согласно другому аспекту от примерно 30 до примерно 70%, согласно другому аспекту от примерно 40 до примерно 60%, согласно другому аспекту от примерно 50 до примерно 95%, согласно другому аспекту от примерно 60 до примерно 95%, согласно другому аспекту от примерно 70 до примерно 95% и согласно другому аспекту от примерно 80 до примерно 95%.
Регулирование проводимости среды
Использование сред с более низкой проводимостью и/или регулирование проводимости среды путем разбавления эффективны для регулирования проводимости среды. Согласно одному из аспектов способ по изобретению позволяет обеспечить среднюю величину проводимости, составляющую примерно 30 мС/см или менее, согласно другому аспекту равную 25 мС/см или менее, согласно другому аспекту равную 20 мС/см или менее, согласно другому аспекту равную 16 мС/см или менее, согласно другому аспекту равную 12 мС/см или менее, согласно другому аспекту равную 8 мС/см или менее, согласно другому аспекту равную 6.5 мС/см или менее, согласно другому аспекту равную 6.0 мС/см или менее, согласно другому аспекту равную 5.5 мС/см или менее, согласно другому аспекту равную 5.0 мС/см или менее, согласно другому аспекту равную 4.7 мС/см или менее, согласно другому аспекту равную 4.5 мС/см или менее, согласно другому аспекту равную от примерно 4.0 мС/см до примерно 6.5 мС/см, согласно другому аспекту равную от примерно 5.0 мС/см до примерно 6.0 мС/см, и согласно еще одному аспекту от примерно 4.0 мС/см до примерно 5.0 мС/см.
В соответствии с одним аспектом процесс ферментации начинается с добавления подходящей среды в реакционный сосуд. Жидкость, которая содержится в реакционном сосуде, может включать любой тип подходящей питательной среды или ферментационной среды. Питательная среда включает витамины и минералы, являющиеся эффективными для осуществления роста используемых микроорганизмов. Анаэробные среды, пригодные для ферментации этанола с использованием CO в качестве источника углерода, хорошо известны. Один пример подходящей ферментационной среды описан в патенте США №7,285,402, который включен в данную заявку посредством отсылки. Другие примеры подходящих сред описаны в заявках США на патент №№61/650,098 и 61/650,093, которые обе поданы 22 мая 2012 г., и которые обе включены в данную заявку посредством отсылки. Согласно одному из аспектов используемая среда включает менее примерно 0.01 г/л экстракта дрожжей и менее примерно 0.01 г/л углеводов.
Замещение хлорид-иона: Согласно одному из аспектов способ по изобретению использует среды, имеющие средние величины проводимости менее 30 мс/см, за счет замещения хлорид-ионов в среде ионами не хлоридов. Более конкретно, хлорид аммония может быть заменен источником азота, выбранным из группы, состоящей из гидроксида аммония, ацетата аммония, карбоната аммония, бикарбоната аммония и их смесей.
В соответствии с одним аспектом среда включает по меньшей мере один или более источников азота, по меньшей мере один или более источников фосфора и по меньшей мере один или более источников калия. Такая среда может включать любой один из трех указанных источников, любую их комбинацию и согласно основному аспекту изобретения может включать все три эти источника. Источник фосфора может включать источник фосфора, выбранный из группы, состоящей из фосфорной кислоты, фосфата аммония, фосфата калия и их смесей. Источник калия может включать соединение, выбранное из группы, состоящей из хлорида калия, фосфата калия, нитрата калия, сульфата калия и их смесей.
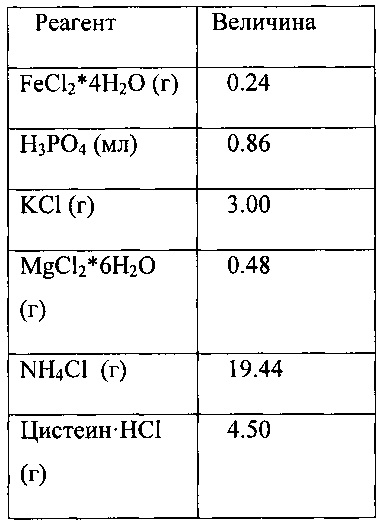
В соответствии с одним аспектом такая среда включает один или более элементов из железа, вольфрама, никеля, кобальта, магния, серы, и тиамин. Эта среда может включать любой из этих компонентов, любую их комбинацию и согласно основному аспекту данного изобретения может включать все три этих компонента. Железо может быть выбрано из источника железа, выбранного из группы, состоящей из хлорида железа, сульфата железа и их смесей. Вольфрам может быть выбран из источника, выбранного из группы, состоящей из вольфрамата натрия, вольфрамата кальция, вольфрамата калия и их смесей. Источник никеля может быть выбран из группы, состоящей из хлорида никеля, сульфата никеля, нитрата никеля и их смесей. Источник кобальта может быть выбран из группы, состоящей из хлорида кобальта, фторида кобальта, бромида кобальта, йодида кобальта и их смесей. Источник магния может быть выбран из группы, состоящей из хлорида магния, сульфата магния, фосфата магния и их смесей. Источник серы может включать цистеин, сульфид натрия и их смеси.
Используются следующие концентрации различных компонентов:
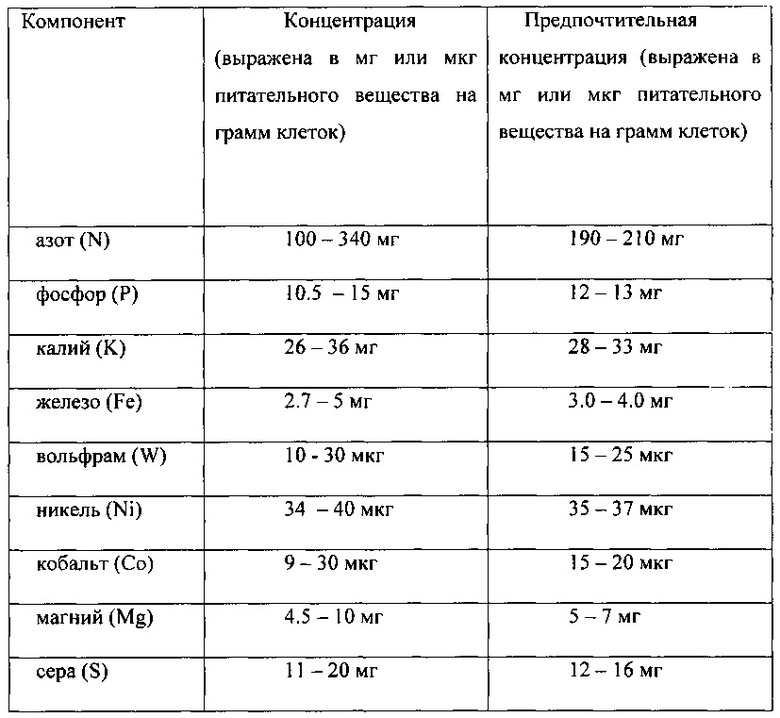

В ходе процесса ферментации поддерживается величина рН, равная от примерно 4.2 до примерно 4.8. Среда включает менее примерно 0.01 г/л экстракта дрожжей и менее примерно 0.01 г/л углеводов.
Согласно другому аспекту проводимость среды регулируется путем разбавления среды. Согласно этому аспекту, как только проводимость ферментационной среды достигает величины, равной примерно 30 мс/см, при ферментации добавляются вода или среда с низкой проводимостью в количестве, эффективном для снижения проводимости среды.
ПРИМЕРЫ
Пример 1: Влияние величины проводимости на рост
Clostridium ljungdahlii выращивали в биореакторе (New Brunswick BioFlo I или IIc). Были проведены следующие операции:
Проводимость культуры регулировали путем изменения силы среды для роста, например, концентрация всех компонентов, за исключением витаминов, в среде была увеличена в 1.5 раза для повышения проводимости культуры от примерно 7 мС до примерно 9.5 мС.
Все эксперименты начинали при начальной плотности клеток равной 0.38 (+/-0.02) или 0.48 г/л.
Начальная скорость подачи газа в каждом эксперименте была неизменной в течение всего опыта. Параметры работы реактора, когда величины конверсии CO достигли плато (постоянного значения) после удачного запуска процесса, использовали для определения КLa для релевантных условий.
Состав сингаза: 30% CO, 15% Н2, 10% CO2 и 45% N2.
Опыт #1 в биореакторе: в этом эксперименте применяли питательную среду (среду для роста) 1х и скорость подачи сингаза, равную 25 мл/мин. Как показано на Фигуре 1, после начального лаг-периода, составлявшего примерно 20 ч, бактерии начали размножаться при времени удвоения около 20 ч. В бульоне в реакторе максимальное содержание растворенного CO составляло примерно 0.22 ммол. (D CO: концентрация растворенного CO в бульоне в реакторе, CD: плотность клеток, SCU: удельное поглощение CO.)
Опыт #2 в биореакторе: в этом эксперименте применяли питательную среду (среду для роста) 1х и скорость подачи сингаза, равную 25 мл/мин. Как показано на Фигуре 2, после начального лаг-периода, составлявшего примерно 36 ч, бактерии начали размножаться при времени удвоения около 20 ч. В бульоне в реакторе максимальное содержание растворенного CO составляло примерно 0.22 ммол.
Опыт #3 в биореакторе: в этом эксперименте применяли питательную среду (среду для роста) 1х и скорость подачи сингаза, равную 40 мл/мин. Как показано на Фигуре 4, после начального лаг-периода, составлявшего примерно 45 ч, бактерии начали размножаться при времени удвоения около 20 ч. В бульоне в реакторе максимальное содержание растворенного CO составляло примерно 0.22 ммол.
Опыт #4 в биореакторе: в этом эксперименте применяли питательную среду (среду для роста) 1х и скорость подачи сингаза, равную 45 мл/мин. Как показано на Фигуре 4, после начального лаг-периода, составлявшего примерно 50 ч, бактерии начали размножаться при времени удвоения около 20 ч. В бульоне в реакторе максимальное содержание растворенного CO составляло примерно 0.17 ммол.
Опыт #5 в биореакторе: в этом эксперименте применяли питательную среду (среду для роста) 1х и скорость подачи сингаза, равную 50 мл/мин. Как показано на Фигуре 5, лаг-период продолжался даже через 70 ч после инокуляции. В бульоне в реакторе максимальное содержание растворенного CO составляло примерно 0.23 ммол.
Опыт #6 в биореакторе: в этом эксперименте применяли питательную среду (среду для роста) 1х и скорость подачи сингаза, равную 50 мл/мин. Этот эксперимент начата с инокулюмом с плотностью 4.8 г/л бактерий. Как показано на Фигуре 6, после начального лаг-периода, составлявшего примерно 10 ч, бактерии начали размножаться при времени удвоения около 20 ч. В бульоне в реакторе максимальное содержание растворенного CO составляло примерно 0.12 ммол.
Опыт #7 в биореакторе: в этом эксперименте применяли питательную среду (среду для роста) 1.5х и скорость подачи сингаза, равную 45 мл/мин. Этот эксперимент начали г: инокулюмом 3.8 г/л бактерий. Как показано на Фигуре 7, с течением времени плотность бактериальных клеток уменьшалась. В бульоне в реакторе максимальное содержание растворенного CO составляло примерно 0.25 ммол.
Опыт #8 в биореакторе: в этом эксперименте применяли питательную среду (среду для роста) 1.5х и скорость подачи сингаза, равную 35 мл/мин. Этот эксперимент начали с инокулюмом с плотностью 3.8 г/л бактерий. Как показано на Фигуре 8, с течением времени плотность бактериальных клеток уменьшалась. В бульоне в реакторе максимальное содержание растворенного CO составляло примерно 0.22 ммол.
Опыт #9 в биореакторе: в этом эксперименте применяли питательную среду (среду для роста) 1.5х и скорость подачи сингаза, равную 30 мл/мин. Этот эксперимент начали с инокулюмом с плотностью 3.8 г/л бактерий. Как показано на Фигуре 9, с течением времени плотность бактериальных клеток уменьшалась. В бульоне в реакторе максимальное содержание растворенного CO составляло примерно 0.22 ммол.
Опыт #10 в биореакторе: в этом эксперименте применяли питательную среду (среду для роста) 1.5х и скорость подачи сингаза, равную 20 мл/мин. Этот эксперимент начали с инокулюмом с плотностью 3.8 г/л бактерий. Как показано на Фигуре 10, с течением времени плотность бактериальных клеток уменьшалась и достигала времени удвоения равного примерно 20 ч. В бульоне в реакторе максимальное содержание растворенного CO составляло примерно 0.22 ммол.
Пример 2: Рост бактерий на альтернативных источниках азота
Clostridium ljungdahlii С-01 выращивали в биореакторе (BioFlo/CelliGen 115) в присутствии следующей среды.

В каждом эксперименте из состава среды исключали NH4Cl и заменяли его мольными эквивалентами одного из азотсодержащих соединений, указанных ниже.

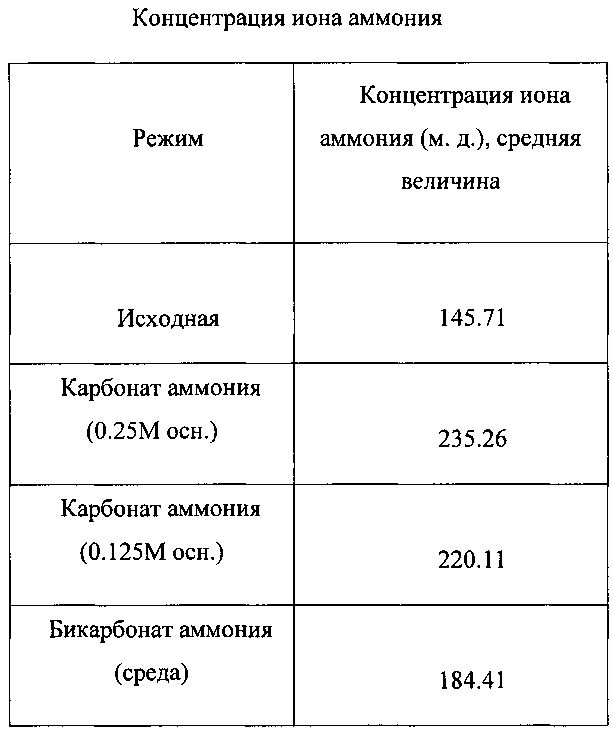
Устанавливали величину рН этих сред, равную ~4.0-4.4. Карбонат аммония также был испытан с концентрациями 0.25М (24.02 г/л) и 0.125М (12.01 г/л) как заменитель 7.7% NaHCO3.
Величины удельного поглощения углерода Clostridium ljungdahlii, растущих в среде, содержащей хлорид аммония, показаны на Фигуре 11.
Производительность Clostridium ljungdahlii по этанолу в среде, содержащей хлорид аммония, показана на Фигуре 12.
Величины удельного поглощения углерода Clostridium ljungdahlii, растущих в среде, содержащей L-лизин, показаны на Фигуре 13.
Производительность Clostridium ljungdahlii по этанолу в среде, содержащей L-лизин, показана на Фигуре 14.
Проводимость Clostridium ljungdahlii, растущих в среде, содержащей L-лизин, показана на Фигуре 15.
Величины удельного поглощения углерода Clostridium ljungdahlii, растущих в среде, содержащей ацетат аммония, показаны на Фигуре 16.
Производительность Clostridium ljungdahlii по этанолу в среде, содержащей ацетат аммония, показана на Фигуре 17.
Проводимость Clostridium ljungdahlii, растущих в среде, содержащей ацетат аммония, показана на Фигуре 18.
Удельное поглощение углерода Clostridium ljungdahlii, растущих в среде, содержащей карбонат аммония, показано на Фигуре 19.
Производительность Clostridium ljungdahlii по этанолу в среде, содержащей карбонат аммония, показана на Фигуре 20.
Проводимость Clostridium ljungdahlii, растущих в среде, содержащей карбонат аммония, показана на Фигуре 21.
Удельное поглощение углерода Clostridium ljungdahlii, растущих в среде, содержащей карбонат аммония в качестве основы, показано на Фигуре 22.
Удельная производительность Clostridium ljungdahlii по этанолу в среде, содержащей карбонат аммония в качестве основы, показана на Фигуре 23.
Проводимость Clostridium ljungdahlii, растущих в среде, содержащей карбонат аммония в качестве основы, показана на Фигуре 24.
Удельное поглощение углерода Clostridium ljungdahlii, растущих в среде, содержащей бикарбонат аммония показано на Фигуре 25.
Удельная производительность Clostridium ljungdahlii по этанолу в среде, содержащей бикарбонат аммония показана на Фигуре 26.
Проводимость Clostridium ljungdahlii, растущих в среде, содержащей бикарбонат аммония, показана на Фигуре 27.
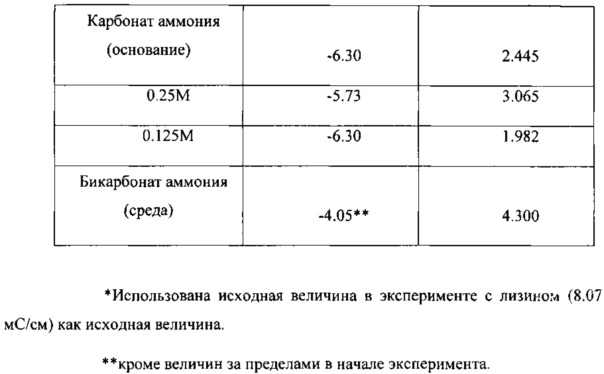
В следующих Таблицах приведены результаты экспериментов.

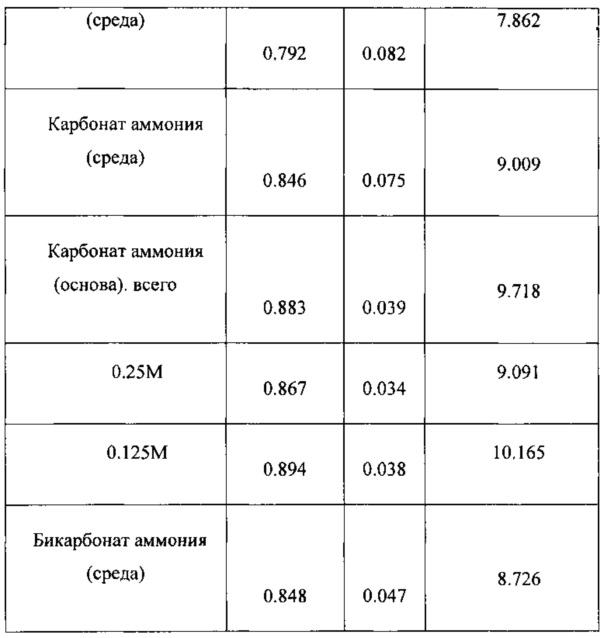
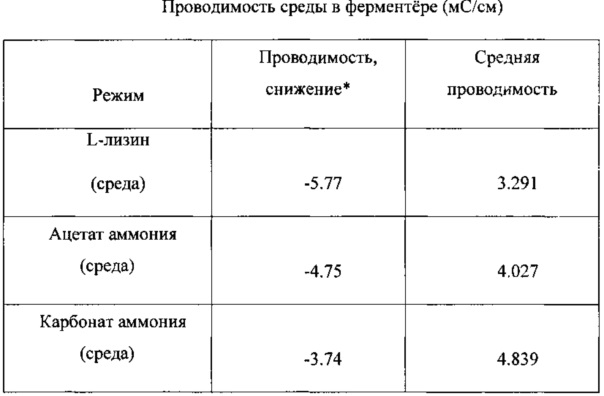
Результаты показывают, что азотсодержащие соединения, особенно те, которые содержат ионы аммония, могут быть использованы в качестве заменителей хлорида аммония. L-лизин, использованный в среде, оказался неудачным в качестве источника азота для достижения высокой производительности. Применение лизина привело вначале к выигрышам как в удельном поглощении углерода (SCU), так и в удельной производительности по этанолу (SEP), но в конечном счете привело к снижению этих обоих параметров. Исходная величина SCU снизилась на 58%, в то время как исходная величина SEP уменьшилась на 47%. Средняя величина SCU снизилась значительно, на 26%. Средняя величина SEP увеличилась на 12, но это увеличение не было статистически значимым из-за очень большого стандартного отклонения. Плотность клеток в течение эксперимента снизилась от 2.03 г/л до 1.02 г/л. Исходная величина проводимости снизилась на 71%, от 8.07 мс/см до 2.30 мс/см, а средняя ее величина во время эксперимента составила 3.291 мс/см. Большую часть времени в этом эксперименте проводимость была меньше 3.0 мс/см.
Использование ацетата аммония в качестве источника азота в составе среды привело к небольшому увеличению средней величины SCU, только на 11%, что не является статистически значимым. Однако исходная величина SCU снижалась от начала эксперимента к его концу (от 0.943 до 0.830), то есть на 12%. Наблюдалось значительное увеличение на 37% средней величины SEP по сравнению с исходным средним значением. Исходная величина SEP во время эксперимента увеличивалась от 6.43 до 8.57, то есть увеличение составило 25%. Во время этого эксперимента проводимость уменьшалась на 58%, до 3.32 мС/см (в качестве базисного значения проводимости в среде РР-А1 использовали начальное значение из опыта с лизином, средняя величина этого параметра составила 4.027 мС/см). Во время большей части эксперимента величина проводимости была меньше 4.0.
Когда в среде в качестве источника азота использовали карбонат аммония, наблюдалось значительное увеличение как величины SCU, так и величины SEP. Величина SCU увеличилась на 19% и величина SEP увеличилась на 57%. Исходные величины SCU и SEP во время эксперимента снизились на 15% и 23%, соответственно. Проводимость во время этого эксперимента снизились на 46%, до 4.33 мС/см, средняя ее величина составила 4.839 мС/см.
Карбонат аммония также использовали в качестве источника азота при исключении этого соединения из состава среды и вместо этого применяли его в качестве основы раствора. Этот способ введения карбоната аммония привел к значительному повышению SCU (19%) и SEP (41%) по сравнению с исходными значениями. При этом применяли две разных концентрации карбоната аммония, 0.25 M и 0.125 М, полученные результаты слегка отличались друг от друга. Каждая величина концентрации приводила к значительному повышению SCU и SEP по сравнению с исходными значениями в реакторе. Каждая величина исходной концентрации слегка отличалась от другой, но стандартные отклонения от этих величин перекрывали друг друга. Проводимость в двух растворах основы снижалась на 71% (0.25 М) и на 78% (0.125 М), пониженные значения были равны 2.34 мС/см и 1.77 мС/см. Средние величины составляли 3.065 мС/см и 1982 мС/см, соответственно. Концентрацию иона аммония в реакторе измеряли непосредственно перед введением и во время наличия карбоната аммония в качестве основы. Результаты этих измерений показали, что в реактор во время этого эксперимента вводили избыток ионов аммония (50-62%).
Бикарбонат аммония также испытывали в качестве добавки к среде. Экспериментальные данные показали, что происходило значительное повышение величин SCU и SEP. По сравнению с исходным уровнем средняя величина SCU увеличилась на 19%, и средняя величина SEP увеличилась на 53%. Проводимость во время этого, эксперимента снизилась на 50%, до 4.02 мс/см, средняя ее величина составляла 4.3 мс/см. Во время этой фазы эксперимента также осуществляли мониторинг концентрации иона аммония. Полученные величины показали, что этот ион был в реакторе в избытке, составляющем 26%.
Пример 3: Влияние постепенного увеличения осмолярности на активность культуры
Clostridium ljungdahlii С-01 выращивали в биореакторе (BioFlo/CelliGen 115) в следующей среде. Средняя скорость потока среды на грамм клеток составляла 1 мл/г/мин.

В течение этого эксперимента, длившегося 21 день, проводимость бульона культуры увеличивали при помощи NaCl. Каждое добавление NaCl с данными интервалами привело к результатам, показанным на Фигуре 28.
Величины концентрации NaCl после каждого добавления.
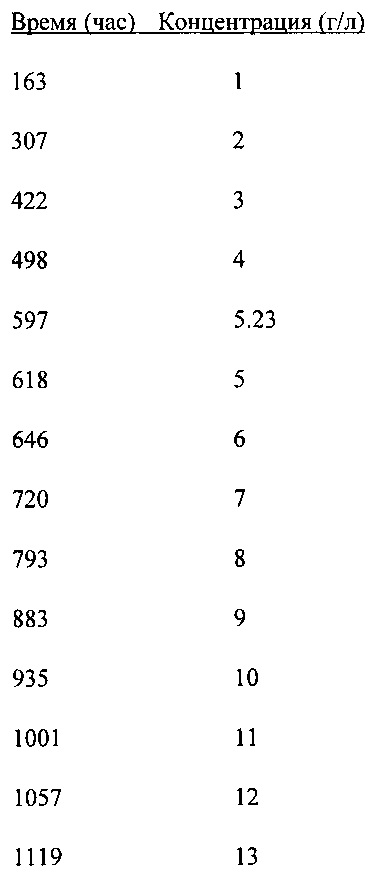
Проводимость культуры увеличивалась с каждым добавлением NaCl. Удельное поглощение углерода, которое является индикатором активности культуры, измеряли в течение этого эксперимента. На Фигуре 28 показано, что с каждым добавлением NaCl величина SCU снижалась в течение некоторого периода времени, но восстанавливалась после короткого периода адаптации.
На Фигуре 28 видны три области, представляющие интерес; 0-500 час (1), 500-1100 час (2) и 1100-1200 час. В области 1, где величина проводимости была меньше 15 мС/см, наблюдается меньшее влияние добавления на величину SCU: происходило небольшое снижение SCU с последующим восстановлением этой величины. В области 2, где величина проводимости была выше 15 мС/см, наблюдается большее влияние добавления на величину SCU: видны большие колебания SCU. В этой области добавление NaCl вызывало большое снижение SCU с последующими большими колебаниями. В последней области, где проводимость увеличилась до примерно 30 мС/см или выше, культура теряла свою активность больше.
Пример 4: Влияние быстрого повышения осмолярности на активность культуры
Clostridium ljungdahlii С-01 выращивали в биореакторе (BioFlo/CelliGen 115) в той же самой среде, которая описана в Примере 3. Средняя скорость потока среды на грамм клеток составляла 1.1 мл/г/мин.
В течение этого эксперимента, длившегося 10 дней, концентрация NaCl в бульоне культуры возрастала вдвое так быстро, как в Примере 3, по следующей схеме.
Величины концентрации NaCl после каждого добавления.

На Фигуре 29 показаны величины SCU культуры при различных проводимостях. Как в Примере 3, культура теряла свою активность в момент достижения проводимости. Составляющей примерно 30 мС/см.
Пример 5: Влияние скорости подачи CO на проводимость
Clostridium ljungdahlii C-01 выращивали в биореакторе (BioFlo/CelliGen 115) в той же самой среде, которая описана в Примере 3. Проводимость культуры регулировали путем изменения силы среды для роста, например, концентрация всех компонентов, за исключением витаминов, в среде для роста повышалась в 1.5 и 2 раза для увеличения проводимости культуры от ~ 7 мС до ~9.5 мС и ~12 мС, соответственно.
Эксперименты начинали при начальной плотности клеток равной 0.38 (+/-0.02) или 0.785 г/л. Сингаз содержал 30% CO, 15% Н2, 10% CO2 и 45% N2. Осуществляли несколько запусков при каждой заданной величине проводимости для определения соответствующей (которая может быть практически использована) удельной скорости подачи газа. В этих экспериментах скорость подачи газа определяли для данной проводимости культуры. Как показано на Фигуре 30, соответствующая/рабочая скорость подачи CO зависит от проводимости культуры:
у = -6.0327х + 12.901
Удельная скорость подачи CO = количество CO в молях на грамм клеток
Соответствующая/рабочая скорость подачи CO = скорость подачи CO, при которой С-01 может удвоиться в течение 40 ч.
Хотя настоящее изобретение было описано на примере конкретных вариантов, примеров и их применения, многочисленные модификации и вариации могут быть осуществлены специалистами в данной области в рамках объема данного изобретения, определяемого формулой изобретения, приведенной ниже.


Группа изобретений относится к области биохимии. Предложен способ ферментации CO-содержащего газообразного субстрата (варианты). Способ включает подачу CO-содержащего газообразного субстрата в ферментационную среду с ацетогенными бактериями и ферментацию субстрата. Причём в одном варианте способа для регулирования проводимости ферментационной среды поддерживают отношение величины проводимости среды к величине удельного поглощения углерода согласно формуле SCU=SCUmax-F*проводимость, где SCUmax равно не более 3 и F равно от 0 до 1. Во втором варианте поддерживают отношение проводимости среды (y) к удельной скорости подачи газа (x) согласно формуле y=-6.0327x+12.901 до достижения заданной плотности клеток, где x равен от 0.2 до 0.7 ммол/мин/грамм клеток, поддерживают величину плотности клеток и проводимости среды. В третьем варианте в ферментационной среде замещают хлорид-ионы ионом, выбранным состоящей из гидроксида, ацетата, карбоната, бикарбоната и их смесей группы, в количестве, эффективном для достижения величины проводимости ферментационной среды, составляющей 30 мС/см или менее. Изобретения обеспечивают увеличение выхода этанола. 3 н. и 10 з.п. ф-лы., 31 ил., 3 табл.., 5 пр.
1. Способ ферментации CO-содержащего газообразного субстрата, включающий:
подачу CO-содержащего газообразного субстрата в ферментационную среду, включающую одну или более ацетогенных бактерий;
регулирование проводимости ферментационной среды путем изменения ее ионной силы таким образом, что отношение величины проводимости ферментационной среды к величине удельного поглощения углерода (SCU в ммол/мин/грамм сухих клеток) поддерживают согласно формуле SCU=SCUmax-F*проводимость, где SCUmax равен не более 3 и F равен от 0 до 1.
2. Способ по п. 1, в котором ферментационная среда характеризуется величиной проводимости, равной 30 мС/см или менее.
3. Способ по п. 1, в котором F равен от 0.05 до 1.0.
4. Способ ферментации по п. 1, в котором СО-содержащий газообразный субстрат включает CO/CO2 в соотношении 0.75 или более.
5. Способ ферментации по п. 1, в котором ацетогенные бактерии выбраны из группы, состоящей из Acetogenium kivui, Acetoanaerobium noterae, Acetobacterium woodii, Alkalibaculum bacchi СР11 (ATCC BAA-1772), Blautia producta, Butyribacterium methylotrophicum, Caldanaerobacter subterraneous, Caldanaerobacter subterraneous pacificus, Carboxydothermus hydrogenoformans, Clostridium aceticum, Clostridium acetobutylicum, Clostridium acetobutylicum P262 (DSM 19630 of DSMZ Germany), Clostridium autoethanogenum (DSM 19630 of DSMZ Germany), Clostridium autoethanogenum (DSM 10061 of DSMZ Germany), Clostridium autoethanogenum (DSM 23693 of DSMZ Germany), Clostridium autoethanogenum (DSM 24138 of DSMZ Germany), Clostridium carboxidivorans P7 (ATCC PTA-7827), Clostridium coskatii (ATCC РТА-10522), Clostridium drakei, Clostridium ljungdahlii PETC (ATCC 49587), Clostridium ljungdahlii ERI2 (ATCC 55380), Clostridium ljungdahlii C-01 (ATCC 55988), Clostridium ljungdahlii O-52 (ATCC 55889), Clostridium magnum, Clostridium pasteurianum (DSM 525 of DSMZ Germany), Clostridium ragsdali P11 (ATCC BAA-622), Clostridium scatologenes, Clostridium thermoaceticum, Clostridium ultunense, Desulfotomaculum kuznetsovii, Eubacterium limosum, Geobacter sulfurreducens, Methanosarcina acetivorans, Methanosarcina barkeri, Morrella thermoacetica, Morrella thermoautotrophica, Oxobacter pfennigii, Peptostreptococcus productus, Ruminococcus productus, Thermoanaerobacter kivui и их смесей.
6. Способ ферментации по п. 1, в котором ферментационная среда включает источник азота, выбранный из группы, состоящей из гидроксида аммония, ацетата аммония, карбоната аммония, бикарбоната аммония и их смесей.
7. Способ ферментации CO-содержащего газообразного субстрата, включающий:
подачу CO-содержащего газообразного субстрата в ферментационную среду, включающую одну или более ацетогенных бактерий;
ферментацию CO-содержащего газообразного субстрата;
регулирование проводимости ферментационной среды путем изменения ее ионной силы таким образом, что отношение проводимости ферментационной среды (y) к удельной скорости подачи газа (x) поддерживают согласно формуле y=-6.0327x+12.901 до достижения заданной плотности клеток, где x равен от 0.2 до 0.7 ммол/мин/грамм клеток; и
поддерживают величину плотности клеток, превышающую заданную величину плотности клеток, и поддерживают величину проводимости ферментационной среды, составляющую 30 мС/см или менее, при этом заданная плотность клеток составляет от 3 до 30 г/л.
8. Способ ферментации по п. 7, в котором СО-содержащий газообразный субстрат включает СО/СО2 в соотношении 0.75 или более.
9. Способ ферментации по п. 7, в котором ацетогенные бактерии выбраны из группы, состоящей из Acetogenium kivui, Acetoanaerobium noterae, Acetobacterium woodii, Alkalibaculum bacchi CP11 (ATCC BAA-1772), Blautia producta, Butyribacterium methylotrophicum, Caldanaerobacter subterraneous, Caldanaerobacter subterraneous pacificus, Carboxydothermus hydrogenoformans, Clostridium aceticum, Clostridium acetobutylicum, Clostridium acetobutylicum P262 (DSM 19630 of DSMZ Germany), Clostridium autoethanogenum (DSM 19630 of DSMZ Germany), Clostridium autoethanogenum (DSM 10061 of DSMZ Germany), Clostridium autoethanogenum (DSM 23693 of DSMZ Germany), Clostridium autoethanogenum (DSM 24138 of DSMZ Germany), Clostridium carboxidivorans P7 (ATCC PTA-7827), Clostridium coskatii (ATCC РТА-10522), Clostridium drakei, Clostridium ljungdahlii PETC (ATCC 49587), Clostridium ljungdahlii ERI2 (ATCC 55380), Clostridium ljungdahlii C-01 (ATCC 55988), Clostridium ljungdahlii O-52 (ATCC 55889), Clostridium magnum, Clostridium pasteurianum (DSM 525 of DSMZ Germany), Clostridium ragsdali P11 (ATCC BAA-622), Clostridium scatologenes, Clostridium thermoaceticum, Clostridium ultunense, Desulfotomaculum kuznetsovii, Eubacterium limosum, Geobacter sulfurreducens, Methanosarcina acetivorans, Methanosarcina barkeri, Morrella thermoacetica, Morrella thermoautotrophica, Oxobacter pfennigii, Peptostreptococcus productus, Ruminococcus productus, Thermoanaerobacter kivui и их смесей.
10. Способ ферментации CO-содержащего газообразного субстрата, включающий:
введение CO-содержащего газообразного субстрата в реакционный сосуд, который содержит ферментационную среду, включающую одну или более ацетогенных бактерий, и ферментацию CO-содержащего газообразного субстрата;
где по меньшей мере один или более хлорид-ионов в ферментационной среде замещены ионом, выбранным из группы, состоящей из гидроксида, ацетата, карбоната, бикарбоната и их смесей, в количестве, которое является эффективным для достижения величины проводимости ферментационной среды, составляющей 30 мС/см или менее.
11. Способ ферментации по п. 10, в котором ферментационная среда включает источник азота, выбранный из группы, состоящей из гидроксида аммония, ацетата аммония, карбоната аммония, бикарбоната аммония и их смесей.
12. Способ ферментации по п. 10, в котором СО-содержащий газообразный субстрат включает СО/СО2 в соотношении 0.75 или более.
13. Способ ферментации по п. 10, в котором ацетогенные бактерии выбраны из группы, состоящей из Acetogenium kivui, Acetoanaerobium noterae, Acetobacterium woodii, Alkalibaculum bacchi CP11 (ATCC BAA-1772), Blautia producta, Butyribacterium methylotrophicum, Caldanaerobacter subterraneous, Caldanaerobacter subterraneous pacificus, Carboxydothermus hydrogenoformans, Clostridium aceticum, Clostridium acetobutylicum, Clostridium acetobutylicum P262 (DSM 19630 of DSMZ Germany), Clostridium autoethanogenum (DSM 19630 of DSMZ Germany), Clostridium autoethanogenum (DSM 10061 of DSMZ Germany), Clostridium autoethanogenum (DSM 23693 of DSMZ Germany), Clostridium autoethanogenum (DSM 24138 of DSMZ Germany), Clostridium carboxidivorans P7 (ATCC PTA-7827), Clostridium coskatii (ATCC PTA-10522), Clostridium drakei, Clostridium ljungdahlii PETC (ATCC 49587), Clostridium ljungdahlii ERI2 (ATCC 55380), Clostridium ljungdahlii C-01 (ATCC 55988), Clostridium ljungdahlii O-52 (ATCC 55889), Clostridium magnum, Clostridium pasteurianum (DSM 525 of DSMZ Germany), Clostridium ragsdali P11 (ATCC BAA-622), Clostridium scatologenes, Clostridium thermoaceticum, Clostridium ultunense, Desulfotomaculum kuznetsovii, Eubacterium limosum, Geobacter sulfurreducens, Methanosarcina acetivorans, Methanosarcina barkeri, Morrella thermoacetica, Morrella thermoautotrophica, Oxobacter pfennigii, Peptostreptococcus productus, Ruminococcus productus, Thermoanaerobacter kivui и их смесей.
| WO 2012074543 A1, 07.06.2012 | |||
| WO 2012074545 A1, 07.06.2012 | |||
| WO 200208438 A2, 31.01.2002 | |||
| COTTER J.L., CHINN M.S | |||
| and et al., Influence of process psrsmeters on growth of Clostridium ljungdahlii and Clostridium autoethanogenum on synthesis gas // Enzyme and Microbial Technology, 44, 2009, стр.281-288 | |||
| US 20100227377 A1, 09.09.2010 | |||
| СПОСОБ ПРЕОБРАЗОВАНИЯ ГАЗООБРАЗНОГО УГЛЕВОДОРОДНОГО СЫРЬЯ В ЖИДКОЕ ТОПЛИВО | 2009 |
|
RU2418070C2 |
Авторы
Даты
2017-12-21—Публикация
2014-06-05—Подача