Изобретение относится к молекулярной генетике, а именно к способам определения полиморфизма генов, а именно гена структурного поддержания хромосом 2 (SMC2), ассоциированного с гаплотипом фертильности голштинского скота НН3, и может быть использовано в селекции крупного рогатого скота.
Наблюдаемый в культурных породах крупного рогатого скота поступательный рост гомозиготности (так, например, средний коэффициент инбридинга у голштинского скота США вырос с 0,4% в 1970 г. до 5,8% в 2012 г. [Trend in Inbreeding Coefficients of Cows for Holstein or Red & White (Calculated August 2015) [Электронный ресурс] // US Department of Agriculture-Animal Improvement Laboratories (USDA-AIPL) URL: https://www.cdcb.us/eval/summary/inbrd.cfm? (дата обращения 30.09.2015)] обусловливает возрастающее негативное влияние на воспроизводительные способности коров так называемых LoF-мутаций (loss-of-function - потеря функций). Исследования на человеке показали, что геном обычного человека несет более 100 LoF-мутаций [MacArthur D.G. et al. A systematic survey of loss-of-function variants in human protein-coding genes // Science. 2012. Is. 335. Pp. 823-828], которые в гомозиготном состоянии могут быть летальными, приводя к эмбриональной гибели. У крупного рогатого скота LoF мутации, обусловливающие наследственные аномалии и вызывающие эмбриональную смертность, проявляются практически во всех молочных породах скота, при этом регулярно регистрируются случаи появления новых дефектов. Так, в голштинской породе идентифицированы LoF мутации, вызывающие такие наследственные заболевания, как дефицит уридинмонофосфатсинтазы, DUMPS, дефицит лейкоцитарной адгезии, BLAD, комплексный порок позвоночника, CVM, брахиспинальный синдром, BY [Зиновьева Н.А. и др. Моногенные наследственные дефекты и их роль в воспроизводстве // Животноводство России. 2015. №6. С. 30-31]. Экономический вес таких дефектов обусловлен, прежде всего, их влиянием на фертильность коров, чем собственно на гибель теленка.
Развитие полногеномных методов анализа способствовало выявлению ряда новых гаплотипов, ассоциированных со снижением воспроизводительной способности коров, получивших название гаплотипов фертильности (НН - голштинские гаплотипы). В настоящее время в голштинской породе выявлено по крайней мере 5 таких гаплотипов (НН1-НН5) [VanRaden P.M. Harmful recessive effects on fertility detected by absence of homozygous haplotypes // J. Dairy Sci. 2011. Is. 94. Pp. 6153-6161; Fritz S. Detection of Haplotypes Associated with Prenatal Death in Dairy Cattle and Identification of Deleterious Mutations in GART, SHBG and SLC37A2 // PLoS ONE. 2013. Vol. 8. Is. 6: e65550; Cooper T.A. Genomic evaluation of Ayrshire dairy cattle and new haplotypes affecting fertility and stillbirth in Holstein, Brown Swiss and Ayrshire breeds // Amer. Dairy Sci. Assoc.-Amer. Soc. Anim. Sci. joint annual meeting, Indianapolis, IN, July 9, 2013. Poster Т206]. Один из них (НН3) ассоциирован с эмбриональной смертностью телят-носителей до 60-го дня стельности. Анализ результатов осеменений коров, отцы которых являются скрытыми носителями НН3, с быками - скрытыми носителями аналогичного гаплотипа, проведенный в североамериканской и французской популяциях голштинов, показал снижение степени стельности, соответственно, на 3,2 и 5,4-5,5% [VanRaden P.M. Harmful recessive effects on fertility detected by absence of homozygous haplotypes // J. Dairy Sci. 2011. Is. 94. Pp. 6153-6161; Fritz S. Detection of Haplotypes Associated with Prenatal Death in Dairy Cattle and Identification of Deleterious Mutations in GART, SHBG and SLC37A2 // PLoS ONE. 2013. Vol. 8. Is. 6: e65550].
Гаплотип НН3 локализован на ВТА8 в области 90-95Mb (сборка генома UMD 3.0) [VanRaden P.M. et al. Harmful recessive effects on fertility detected by absence of homozygous haplotypes // J. Dairy Sci. 2011. Is. 94. Pp. 6153-6161]. В последующем его локализация была уточнена в области 94.0-96 Mb (UMD 3.0) [Fritz S. Detection of Haplotypes Associated with Prenatal Death in Dairy Cattle and Identification of Deleterious Mutations in GART, SHBG and SLC37A2 // PLoS ONE. 2013. Vol. 8. Is. 6: e65550] и установлена ассоциация с мутацией в гене структурного поддержания хромосом 2 (SMC2) [Sahana G. Novel harmful recessive haplotypes identified for fertility traits in Nordic Holstein cattle // PLoS One. 2013. Vol. 8: е82909]. Хайес (Hayes) с соавторами [Hayes В. et al. The 1000 Bull Genomes project - toward genomic selection from whole genome sequence data in dairy and beef cattle // Proc. Plant Anim. Genome XXI Conf., 12-16 January, 2013, San Diego, USA. Poster W150] впервые сообщили, a МакКлур (McClure) с соавторами [McClure M.C. et al. Bovine exome sequence analysis and targeted SNP genotyping of recessive fertility defects BH1, HH2 and HH3 reveal causative mutation inSMC2 for HH3 // PLoS ONE. 2014. Vol. 9: e92769] подтвердили и валидировали мутацию, служащую причиной НН3, как несинонимичную замену Т→С в позиции 95410507 в экзоне 24 гена SMC2 (UMD 3.1). Данный полиморфизм служит причиной аминокислотной замены Phe→Ser в позиции 1135, локализованной внутри домена НТФазы кодируемого белка. Животные, несущие генотип ТТ, являются не носителями НН3, генотип ТС - скрытыми носителями, генотип СС - носителями (плоды погибают до 60-го дня стельности). Детвюлер (Daetwyler) с соавторами [Daetwyler H.D. et al. Whole-genome sequencing of 234 bulls facilitates mapping of monogenic and complex traits in cattle // Nature Genet. 2014. Vol. 46. Pp. 858-865] выполнили секвенирование по Сангеру десяти известных скрытых носителей мутации и подтвердили ожидаемый полиморфизм.
Частота встречаемости скрытых носителей НН3 среди быков-производителей составляет 3,0-4,7% в США, 5,0% - во Франции [Fitz S. et al. Detection of Haplotypes Associated with Prenatal Death in Dairy Cattle and Identification of Deleterious Mutations in GART, SHBG and SLC37A2 // PLoS ONE. 2013. Vol. 8. Is. 6: e65550; McClure M.C. et al. Bovine exome sequence analysis and targeted SNP genotyping of recessive fertility defects BH1, HH2 and HH3 reveal causative mutation inSMC2 for HH3 // PLoS ONE. 2014. Vol. 9: e92769; Daetwyler H.D. et al. Whole-genome sequencing of 234 bulls facilitates mapping of monogenic and complex traits in cattle // Nature Genet. 2014. Vol. 46. Pp. 858-865]. Проведенный анализ родословных быков-производителей (n=560) племенных предприятий в России показал, что у тридцати быков-производителей в поколениях F1-F2 предков встречаются носители мутантного аллеля SMC2. Их частота в различных племпредприятиях варьирует от 2,7 до 8,4% и в среднем составляет 5,4%. Скрытые носители принадлежат двум широко распространенным генеалогическим линиям - Рефлекшн Соверинга и Уэс Идеала.
Анализ научно-технической, патентной и иной информации показал, что единственным применяемым сегодня способом диагностики полиморфизма в SMC2, ассоциированного с НН3, используемым в качестве аналога, является использование кастомных (смоделированных пользователем) биочипов, используемых для полногеномного сканирования SNP. Однако проведение ДНК-диагностики данным способом требует наличия дорогостоящего оборудования и, кроме того, сопряжено с высокой стоимостью биочипов. Если для проведения комплексной ДНК-диагностики (геномная оценка + исследование на наличие нескольких генетических аномалий) такой способ является экономически оправданным, то для массового скрининга популяций необходима разработка простого, относительно дешевого способа, не требующего использования дорогостоящего оборудования.
В качестве прототипа заявленного способа, наиболее близким по технической сущности и достигаемому результату, можно считать секвенирование фрагмента гена SMC2, в результате которого была выявлена мутация, ассоциированная с гаплотипом фертильности НН3 [McClure D. et al. Bovine exome sequence analysis and targeted SNP genotyping of recessive fertility defects BH1, HH2 and HH3 reveal causative mutation in SMC2 for HH3 // PLoS ONE. 2014. Vol. 9: e92769].
Основной недостаток прототипа заключается в необходимости использования дорогостоящего оборудования и высокой стоимости исследований.
При создании настоящего изобретения задача состояла в разработке способа обнаружения аллеля С гена SMC2, ассоциированного с гаплотипом фертильности НН3, с целью идентификации скрытых носителей НН3 и разработки программ их использования в селекции без снижения репродуктивных способностей коров.
Задача изобретения - создание простого, не требующего использования дорогостоящего оборудования способа идентификации полиморфизма в гене SMC2, ассоциированного с гаплотипом фертильности НН3, для использования в селекции крупного рогатого скота.
Технический результат изобретения достигается тем, что предложен способ диагностики полиморфизма SMC2, ассоциированного с гаплотипом фертильности НН3, для использования в селекции крупного рогатого скота, включающий однопробирочный метод аллелеспецифической полимеразной цепной реакции (STAS PCR) [Zinovieva N.A. et al. Single tube allele specific (STAS) PCR for direct determination of the mutation in the porcine ryanodine receptor gene associated with malignant hyperthermia // Animal Biotechnology. 1996. Vol. 7. Is. 2. Pp. 173-177], позволяющий проводить идентификацию результатов с помощью метода электрофореза в агарозном геле без использования дорогостоящего оборудования, что обеспечит относительно невысокую стоимость разрабатываемого способа.
Принцип действия разрабатываемого способа основан на использовании двух «внутренних» аллелеспецифических праймеров, ориентированных в противоположных направлениях, последний нуклеотид которых на 3'-конце приходится на исследуемую нуклеотидную замену. К каждому из аллелеспецифических праймеров подбираются по одному «наружному» праймеру, таким образом, чтобы длины амлифицированных фрагментов, соответствующих разным аллелям, различались. При этом мутантному аллелю С, ассоциированному с НН3, соответствует фрагмент меньшей длины, в то время как нормальному (не мутантному аллелю) - фрагмент большей длины, что позволяет дифференцировать мутантные и немутантные аллели гена SMC2 методом электрофореза в агарозном геле.
Способ отличается тем, что с применением нескольких технически простых и не требующих дорогостоящих реактивов, оборудования, затрат сил и времени методов, возможно выявление мутантного аллеля С гена SMC2, что позволит применить данный метод в селекции животных.
Сущность изобретения - определение полиморфизма гена SMC2, ассоциированного с гаплотипом фертильности НН3 крупного рогатого скота, методом STAS PCR.
Разрабатываемый способ базируется на определении нуклеотидной трансверсии Т→С в позиции 95410507 в экзоне 24 гена SMC2 (UMD 3.1). С этой целью выбран участок гена SMC2 крупного рогатого скота с диагностируемой мутацией.
Для создания серии референтных образцов с известными генотипами по SMC2 (n=60) были использованы образцы ткани (ушной выщип, n=30) и спермы (n=30) коров и быков голштинской и голштинизированной черно-пестрой породы. ДНК выделяли методом экстракции перхлоратом [Зиновьева Н.А. и др. Введение в молекулярную генную диагностику сельскохозяйственных животных // Дубровицы: ВИЖ, 2002, 112 с.], с использованием магнитных частиц (ООО «Изоген», Россия) и колонок Nexttec (Nexttec Biotechnologie GmbH, Германия) в соответствии с рекомендациями производителей. Каждым из вышеназванных методов выделяли ДНК из 10 образцов ткани и 10 образцов спермы. Создание серии референтных генотипов проводили посредством прямого определения последовательности в области мутации методом пиросеквенирования. С этой целью проводили амплификацию фрагмента длиной 199 п.о. с использованием праймеров SMC2_1Pyro и SMC2_2Pyro_Bio (меченые биотином) с последующим отжигом зонда SMC2_Zond и пиросеквенированием. Для него использовали базовую последовательность GTT/CGACACA, где Т/С - мутируемый нуклеотид, G - контрольные нуклеотиды.
Краткое описание чертежей
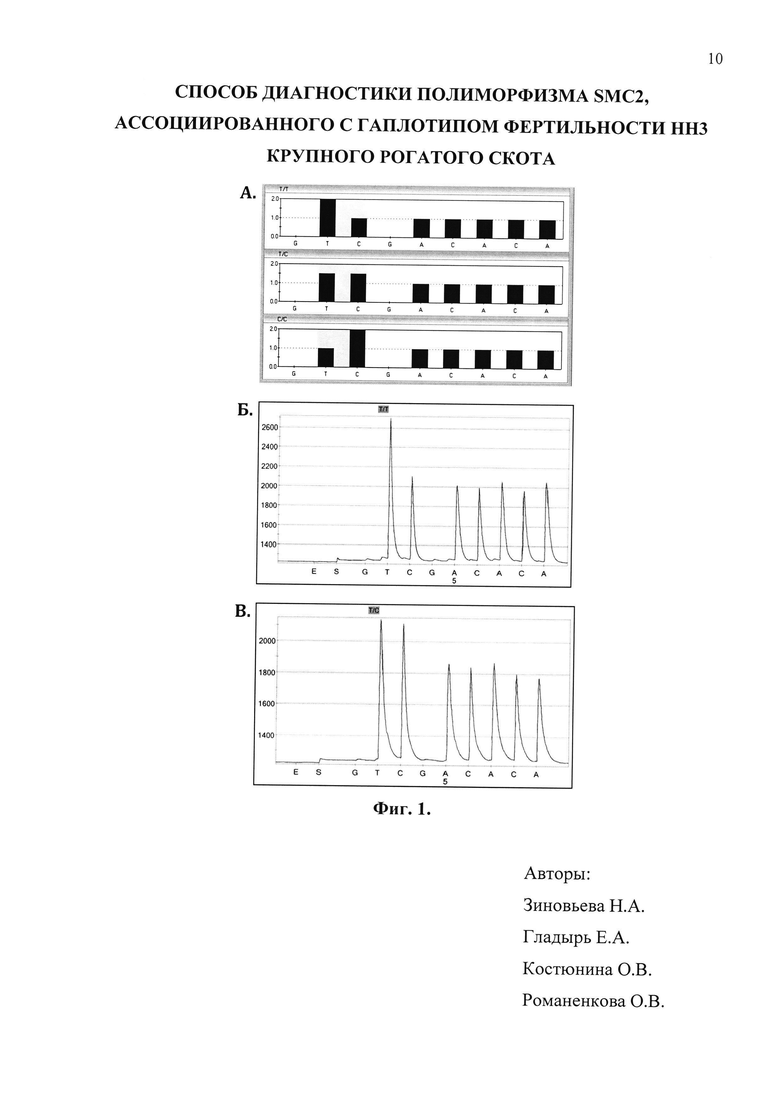
Фиг. 1 - теоретическая модель тест-системы определения гаплотипа НН3 на основе метода пиросеквенирования (А) и результаты генотипирования референтных образцов (Б и В).
Фиг. 2 - теоретическая модель тест-системы определения гаплотипа НН3 на основе STAS PCR (А) и результаты генотипирования референтных образцов (Б).
На фиг. 1А представлены теоретически смоделированные гистограммы возможных генотипов НН3, где на верхнем рисунке гистограмма соответствует генотипу ТТ, на среднем - ТС и на нижнем - СС. На фиг. 1Б представлена результирующая пикограмма последовательности гена SMC2 в области исследуемой мутации соответствующая генотипу ТТ, на фиг. 1B - результирующая пикограмма последовательности SMC2 в области исследуемой мутации соответствующая генотипу ТС.
В результате проведенного генотипирования была создана серия референтных образцов (n=60), в том числе 5 образцов с генотипом ТС (скрытый носитель НН3) и 55 образцов с генотипом ТТ (неноситель).
Определение полиморфизма SMC2 предложенным способом выполняли следующим образом.
1. Исходя из локализации мутации были подобраны два «внутренних» аллелеспецифических праймера, ориентированные в противоположных направлениях, последний нуклеотид которых на 3'-конце приходится на исследуемую нуклеотидную замену, при этом прямой праймер SMC1FR является аллелеспецифическим для аллеля Т, в то время как обратный праймер SMC2CR является аллелеспецифическим для аллеля С:
SMC1FR-5'-TTGGTTCTTACCTGAGAATGTGCGA-3'
SMC2CR-5'-TGGACATATGCTACGTACTCACTC-3'.
2. Исходя из последовательности гена каждому из аллелеспецифических праймеров были подобраны по одному «наружному» праймеру (SMC1 и SMC2), таким образом, что длины амлифицированных фрагментов, соответствующих разным аллелям, различались, при этом мутантному аллелю С соответствует фрагмент длиной 112 п.о., ограниченный праймерами SMC2CR и SMC2, в то время как нормальному аллелю Т соответствует фрагмент длиной 155 п.о., ограниченный праймерами SMClFR и SMCl:
SMC1-5'-TTAGTGGCTCTGTCATTAATCCTG-3'
SMC2-5'-ATACTGACCATTACTAAAGAATAG-3'
Продукт амплификации праймеров SMC1 и SMC2 является общим для обоих аллелей и имеет длину 219 п.о. Место исследуемой мутации помечено звездочкой. Фиг. 2А иллюстрирует описанный выше вариант настоящего изобретения.
3. Выполняли 35 циклов ПЦР в 15 мкл реакционной смеси следующего состава: 1×ПЦР буфер (16.6 мМ (NH4)2SO4, 67.7 мМ Трис-HCl, рН=8.8, 0.1% (v/v) Tween 20, 1.5 мМ MgCl2), 0,2 мМ дНТФ, 10 пмол каждого из праймеров, 1,5 мМ MgCl2, 1 Ед Taq-полимеразы и 1 мкл ДНК при следующем температурно-временном режиме: начальная денатурация при 95°С - 7 мин, 35 циклов последовательно - 94°С - 0,5 мин, 62°С - 0,5 мин, 72°С - 0,5 мин, заключительная элонгация при 72°С - 7 мин.
4. Определение аллелей Т и С гена SMC2 осуществляли методом гель-электрофореза, нанося по 5 мкл амплификата в 2% агарозный гель, электрофоретически разделяли в 1× ТАЕ буфере 20 мин при 100 В и детектировали под ультрафиолетовым светом (УФ), при этом генотипу ТТ (не носителю НН3) соответствуют два фрагмента длиной 219 и 155 п.о., генотипу СТ (скрытому носителю НН3) - три фрагмента длиной 219, 155 и 112 п.о. и генотипу СС (летальный, может быть выявлен только среди плодов на ранних этапах стельности) - два фрагмента длиной 219 и 112 п.о. (Фиг. 2Б). Длины фрагментов сравнивали в сопоставлении с М - маркером длины 100 п.о. (500×2), Биосан, Россия.
5. Результативность разработанной тест-системы оценивали посредством сравнения результатов генотипирования референтных образцов.
Пример. Контрольное использование предложенного способа определения полиморфизма SMC2 было апробировано на выборке племенного поголовья голштинского и голштинизированного черно-пестрого, в том числе 632 быках-производителях и 363 коровах. Исследование выявило наличие 49 животных с генотипом СТ (скрытые носители НН3), в том числе 35 коров и 14 быков, что соответствует частотам встречаемости соответственно 9,9 и 2,2%. Таким образом, разработанный способ может быть использован для выявления животных, являющихся скрытыми носителями мутации С в гене SMC2, ассоциированной с гаплотипом фертильности НН3.
Предложенный способ применим в генетике сельскохозяйственных животных для выявления полиморфизма в гене SMC2 крупного рогатого скота, ассоциированного с гаплотипом фертильности НН3, с целью последующего использования полученных результатов в разведении и селекции крупного рогатого скота.

Изобретение относится к области биохимии. Описан способ диагностики полиморфизма SMC2, ассоциированного с гаплотипом фертильности НН3 крупного рогатого скота. Способ включает однопробирочную аллелеспецифическую амплификацию (STAS PCR) фрагментов гена SMC2, и отличается тем, что продукты амплификации аллелей Т и С в позиции 95410507 (сборка генома UMD 3.1) в экзоне 24 гена структурного поддержания хромосом SMC2 различаются по длине; идентификация генотипов животных осуществляется по результатам электрофореза продуктов STAS PCR в агарозном геле. Изобретение расширяет арсенал средств, позволяющих диагностировать полиморфизм SMC2. 2 ил, 1 пр.
Способ диагностики полиморфизма SMC2, ассоциированного с гаплотипом фертильности НН3 крупного рогатого скота, включающий однопробирочную аллелеспецифическую амплификацию (STAS PCR) фрагментов гена SMC2, отличающийся тем, что продукты амплификации аллелей Т и С в позиции 95410507 (сборка генома UMD 3.1) в экзоне 24 гена структурного поддержания хромосом SMC2 различаются по длине, а идентификация генотипов животных осуществляется по результатам электрофореза продуктов STAS PCR в агарозном геле.
| Matthew C | |||
| McClure et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Daetwyler,H.D | |||
| et al | |||
| Крутильный аппарат | 1922 |
|
SU234A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Радиатор | 1925 |
|
SU858A1 |
| Современные проблемы биохимии | |||
| Методы исследований под редакцией профессора А.А | |||
| Чиркина, Минск, "Вышэйшая школа", 2013, стр | |||
| Способ приготовления хлебного вина | 1925 |
|
SU424A1 |
Авторы
Даты
2017-12-21—Публикация
2015-11-20—Подача