ПРИОРИТЕТ
Данной заявкой заявлен приоритет даты подачи Предварительной Патентной Заявки Соединенных Штатов № 61/428592 от 30 декабря 2010 г., «Молекулы Нуклеиновых Кислот, Которые Придают Устойчивость к Насекомым-Вредителям Отряда Жесткокрылых».
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в основном относится к генетическому контролю за повреждением растений, вызванным насекомыми-вредителями отряда жесткокрылых. В конкретных воплощениях настоящее изобретение относится к идентификации кодирующих и некодирующих последовательностей-мишеней, и к применению технологий рекомбинантных ДНК для посттранскрипционной супрессии и ингибирования экспрессии кодирующих и некодирующих последовательностей-мишеней в клетках насекомых-вредителей отряда жесткокрылых с получением защитного эффекта.
УРОВЕНЬ ТЕХНИКИ
Западный кукурузный жук (WCR), Diabrotica virgifera virgifera LeConte, представляет собой наиболее опустошительный вид кукурузных жуков в Северной Америке, и это особенно касается областей выращивания кукурузы Среднего Запада Соединенных Штатов. Северный кукурузный жук (NCR), Diabrotica barberi Smith and Lawrence, является близкородственным видом, который обитает на большей части той же области распространения, что и WCR. Существует несколько других родственных подвидов Diabrotica, которые являются существенно-значимыми насекомыми-вредителями в Северной Америке: мексиканский кукурузный жук (MCR), D. virgifera zeae Krysan and Smith; южный кукурузный жук (SCR), D. undecimpunctata howardi Barber; D. balteata LeConte; D. undecimpunctata tenella; и D. u. undecimpunctata Mannerheim. По оценкам Департамента Сельского Хозяйства Соединенных Штатов в настоящее время кукурузные жуки каждый год вызывают потери годового дохода 1 биллион долларов, включая $800 миллионов от потери урожая и $200 миллионов затрат на обработку.
Оба WCR и NCR летом находятся в почве в виде яиц. Насекомые остаются на стадии яиц на протяжении зимы. Яйца имеют продолговатую форму, белые и длиной менее чем 0,004 дюйма (0,010 см). Личинки выводятся в конце мая или в начале июня с точным временем выведения яиц, которое варьируется от года к году из-за температурных различий и в зависимости от местоположения. Только что выведенные личинки представляют собой белых червяков длиной менее чем 0,125 дюйма (0,3175 см). После выведения личинка начинает питаться на кукурузных корнях. Кукурузные жуки проходят через три личиночные стадии. После питания в течение нескольких недель личинка линяет до стадии куколки. Они окукливаются в почве, и затем они выходят из почвы в виде зрелых личинок в июле и в августе. Зрелые личинки достигают длины около 0,25 дюйма (0,635 см).
Личинки кукурузного жука завершают развитие на кукурузе и на некоторых других видах трав. Личинки, которые выводятся на желтом лисохвосте, появляются позже и в зрелом состоянии имеют меньший размер головной капсулы, чем у личинок, которые выводятся на кукурузе. Ellsbury et al. (2005) Environ. Entomol. 34:627-34. Зрелые WCR питаются кукурузными рыльцами, пыльцой и зернами на открытых початках кукурузы. Если зрелые WCR появляются перед тем как появятся репродуктивные ткани кукурузы, они могут питаться тканями листьев, замедляя таким образом рост растения и периодически убивая растение-хозяин. Однако зрелые особи быстро переключаются на предпочтительные пыльцу и кукурузные рыльца, когда они становятся доступными. Зрелые NCR также питаются репродуктивными тканями кукурузного растения, но в отличие от других редко питаются листьями кукурузы.
Большинство повреждений кукурузы личинками вызвано их питанием. Только что вылупившиеся личинки сначала питаются тонким кукурузным корневым волоском и проникают в корневые кончики. По мере увеличения роста личинок они питаются и проникают в первичный корень. Когда кукурузных жуков в избытке, то личиночное питание часто приводит к подрезанию корней по всей длине до основания стебля кукурузы. Серьезные корневые повреждения мешают способности корня транспортировать воду и питательные вещества в растение, снижается рост растения, и это приводит к снижению производства зерна, и часто таким образом значительно снижается общий урожай. Серьезные корневые повреждения также часто приводят к полеганию кукурузных растений, что затрудняет сбор урожая и дополнительно его снижает. Кроме того, питание зрелых особей на репродуктивных тканях кукурузы может привести к подрезанию рылец на верхушке початка кукурузы. Если это достаточно серьезное «срезание рыльца» происходит в процессе сброса пыльцы, то опыление может быть нарушено.
Могут осуществляться попытки контроля за кукурузным жуком с помощью ротации культур, химических инсектицидов, биопестицидов (например, спорообразующей грамположительной бактерии, Bacillus thuringiensis) или с помощью их комбинации. Ротация культур страдает значительным недостатком нежелательных ограничений размещения при использовании сельскохозяйственной земли. Кроме того, откладка яиц некоторых видов кукурузных жуков может осуществляться на соевых полях, ослабляя таким образом эффективность ротации культур, которую практикуют для кукурузы и сои.
Химические инсектициды представляют собой наиболее надежную стратегию достижения контроля за кукурузным жуком. Применение химических инсектицидов, тем не менее, представляет собой несовершенную стратегию контроля за кукурузным жуком; около $1 биллиона может быть потеряно в Соединенных Штатах каждый год из-за кукурузного жука, когда затраты на химические инсектициды добавляются к затратам от заражения кукурузным жуком, которые могут иметь место несмотря на использование инсектицидов. Высокая популяция личинок, сильные дожди и не соответствующее применение инсектицида(ов), все вместе может привести к неадекватному контролю за кукурузным жуком. Кроме того, в результате продолжительного применения инсектицидов могут быть выработаны штаммы жуков, устойчивых к инсектицидам, а также существенно повышается влияние экологического фактора благодаря токсичности многих из них по отношению к видам, которые не являются их мишенями.
РНК-интерференция (РНКи) это процесс применения эндогенных клеточных путей, посредством которых молекула интерферирующей РНК (иРНК) (например, молекула дцРНК), которая специфична для всей последовательности или для любой части адекватного размера последовательности гена-мишени, приводит к деградации мРНК, кодируемой им. В последние годы РНКи использовалась для осуществления "нокдауна" гена в ряде видов и в экспериментальных системах, например в C. elegans, в растениях, в эмбрионах насекомых и в клетках тканевых культур. См., например, Fire et al. (1998) Nature 391:806-11; Martinez et al. (2002) Cell 110:563-74; McManus and Sharp (2002) Nature Rev. Genetics 3:737-47.
РНКи осуществляет деградацию мРНК посредством эндогенного пути, включающего белковый комплекс DICER. DICER расщепляет длинные молекулы дцРНК до коротких фрагментов размером приблизительно 20 нуклеотидов, называемых короткие интерферирующие РНК (киРНК). киРНК разворачивается в две одноцепочечные РНК: сопровождающая цепь и направляющая цепь. Сопровождающая цепь деградирует, и управляющая цепь инкорпорируется в РНК-индуцированный комплекс сайленсинга (RISC). Молекулы микроингибирующей рибонуклеиновой кислоты (миРНК) могут быть аналогично инкорпорированы в RISC. Посттранскрипционный сайленсинг генов происходит, когда направляющая цепь специфично связывается с комплементарной последовательностью молекулы мРНК и индуцирует расщепление с помощью Argonaute, каталитического компонента комплекса RISC. Известно, что этот процесс системно распространен в организме несмотря на изначально ограниченные концентрации киРНК и/или миРНК в некоторых эукариотах, таких как растения, нематоды и некоторые насекомые.
Только транскрипты, комплементарные киРНК и/или миРНК, расщепляются и деградируют, и, таким образом, нокдаун экспрессии мРНК является специфичным к последовательности. В растениях существует несколько функциональных групп генов DICER. РНКи-эффект сайленсинга гена сохраняется в течение дней и в экспериментальных условиях может приводить к снижению количества транскрипта-мишени на 90% или более с последующим снижением уровня соответствующего белка.
Патент США 7612194 и патентные публикации США №№ US 2007/0050860, US 2010/0192265 и US 2011/0154545 раскрывают библиотеку из 9112 экспрессирующихся маркерных последовательностей (EST), выделенных из куколок D. v. virgifera LeConte. В патенте США 7612194 и в патентной публикации США № US 2007/0050860 предполагается, что с промотором функционально связана молекула нуклеиновой кислоты, которая комплементарна одной из нескольких конкретных неполных последовательностей H+-ATPазы (V-ATPаза) D. v. virgifera вакуолярного типа, раскрытых в этих документах, для экспрессии антисмысловой РНК в растительных клетках. Патентная публикация США US 2010/0192265 рассматривает функциональное связывание промотора с молекулой нуклеиновой кислоты, которая комплементарна конкретной неполной последовательности гена D. v. virgifera неизвестной и нераскрытой функции (установлено, что неполная последовательность на 58% идентична продукту гена C56C10.3 в C. elegans) для экспрессии антисмысловой РНК в растительных клетках. Патентная публикация США № US 2011/0154545 рассматривает функциональное связывание промотора с молекулой нуклеиновой кислоты, которая комплементарна двум конкретным неполным последовательностям генов бета-субъединицы коатомера D. v. virgifera, для экспрессии антисмысловой РНК в растительных клетках. Кроме того, патент США 7943819 раскрывает библиотеку из 906 экспрессирующихся маркерных последовательностей (EST), выделенных из личинок, куколок и рассеченных маленьких насекомых D. v. virgifera LeConte, и рассматривает функциональное связывание промотора с молекулой нуклеиновой кислоты, которая комплементарна конкретной неполной последовательности гена белка 4b заряженного мультивезикулярного тела D. v. virgifera, для экспрессии двухцепочечной РНК в растительных клетках.
Никаких других предположений для РНК-интерференции не предлагается в патентах США 7612194 и патентных публикациях США №№ US 2007/0050860, US 2010/0192265 и US 2011/0154545 по поводу применения любой конкретной последовательности из более чем девяти тысяч последовательностей, перечисленных там, за исключением нескольких конкретных неполных последовательностей V-ATPазы и конкретных неполных последовательностей генов неизвестной функции. Кроме того, ни в патенте США 7612194 и ни патентных публикациях США №№ US 2007/0050860 и US 2010/0192265, и US 2011/0154545 не предлагается никакого руководства по поводу того, какие другие из предложенных более девяти тысяч последовательностей будут летальны или применимы другим способом к видам кукурузных жуков при использовании этих последовательностей в виде дцРНК и киРНК. В патенте США 7943819 нет никаких предложений по поводу применения какой-либо конкретной последовательности из более чем девятисот последовательностей, перечисленных там, для РНК-интерференции, за исключением конкретной неполной последовательности гена белка 4b заряженного мультивезикулярного тела. Кроме того, в патенте США 7943819 не предлагается никакого руководства по поводу того, какие другие из предложенных более девятисот последовательностей будут летальны или применимы другим способом при их использовании в виде дцРНК и киРНК по отношению к видам кукурузных жуков.
Подавляющее большинство последовательностей, комплементарных ДНК кукурузного жука (такой как упомянутые выше), не летальны для видов кукурузных жуков при использовании в виде дцРНК и киРНК. Например, Baum et al. (2007) описывают эффекты ингибирования нескольких генов-мишеней WCR с помощью РНКи. Эти авторы сообщили, что 8 из 26 генов-мишеней, которые они протестировали, были не способны обеспечить экспериментально значимую смертность насекомых-вредителей отряда жесткокрылых при очень высокой концентрации иРНК (например, дцРНК) более чем 520 нг/см2.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данном документе раскрыты молекулы нуклеиновой кислоты (например, гены-мишени, ДНК, дцРНК, киРНК, миРНК и шпРНК) и способы их применения для контроля за насекомыми-вредителями отряда жесткокрылых, включающими, например, D. v. virgifera LeConte (западный кукурузный жук, «WCR»); D. barberi Smith and Lawrence (северный кукурузный жук, «NCR»); D. u. howardi Barber (южный кукурузный жук, «SCR»); D. v. zeae Krysan and Smith (мексиканский кукурузный жук, «MCR»); D. balteata LeConte; D. u. Tenella, и D. u. undecimpunctata Mannerheim. В конкретных примерах раскрыты иллюстративные молекулы нуклеиновых кислот, которые могут быть гомологичны, по меньшей мере, части одной или нескольких нативных последовательностей нуклеиновых кислот генома насекомого-вредителя отряда жесткокрылых.
В этих и других примерах нативная последовательность нуклеиновой кислоты может быть геном-мишенью, продукт которой может быть, например и без ограничения: вовлечен в метаболический процесс; в репродуктивный процесс; или вовлечен в процесс развития личинки. В некоторых примерах посттрансляционное ингибирование экспрессии гена-мишени с помощью молекулы нуклеиновой кислоты, включающей последовательность, ей гомологичную, может быть летальным для насекомых-вредителей отряда жесткокрылых или может приводить к снижению их роста и/или репродукции. В конкретных примерах, по меньшей мере, один ген, выбранный из списка, состоящего из D_vir_c47185_Caf1180; D_vir_c1229_VatpaseC; D_vir_c1319_vatpaseH и Contig_01_Rho1_1-191_CDC42, может быть выбран в качестве гена-мишени для посттрансляционного сайленсинга. В конкретных примерах ген-мишень, применяемый для посттрансляционного ингибирования, является новым геном, обозначенным в данном документе как D_vir_c47185_Caf1180. Таким образом, в данном документе раскрыты выделенные молекулы нуклеиновых кислот, включающие последовательность D_vir_c47185_Caf1180 (SEQ ID NO:1), комплементарную ей последовательность и фрагменты каждой из них.
Также раскрыты молекулы нуклеиновых кислот, включающие нуклеотидную последовательность, которая кодирует полипептид, который, по меньшей мере, на 85% идентичен аминокислотной последовательности продукта гена-мишени (например, продукта гена, выбранного из группы, состоящей из D_vir_c47185_Caf1180; D_vir_c1229_VatpaseC; D_vir_c1319_VatpaseH и Contig_01_Rho1_1-191_CDC42). В конкретных примерах молекула нуклеиновой кислоты включает нуклеотидную последовательность, кодирующую полипептид, который, по меньшей мере, на 85% идентичен аминокислотной последовательности продукта гена D_vir_c47185_Caf1180. Кроме того, раскрыты молекулы нуклеиновых кислот, включающие нуклеотидную последовательность, которая обратно комплементарна нуклеотидной последовательности, кодирующую полипептид, по меньшей мере, на 85% идентичный аминокислотной последовательности в продукте гена-мишени.
Также раскрыты кДНК-последовательности, которые могут использоваться для получения молекул иРНК (например, дцРНК, киРНК, миРНК и шпРНК), которые комплементарны всей последовательности или части гена-мишени насекомого-вредителя отряда жесткокрылых, например: D_vir_c47185_Caf1180; D_vir_c1229_VatpaseC; D_vir_c1319_VatpaseH и/или Contig_01_Rho1_1-191_CDC42. В конкретных воплощениях могут быть получены дцРНК, киРНК, миРНК и/или шпРНК in vitro или in vivo с помощью генетически модифицированного организма, такого как растение или бактерия. В конкретных примерах раскрыты кДНК-молекулы, которые могут использоваться для получения молекул иРНК, которые комплементарны всей последовательности или части гена D_vir_c47185_Caf1180.
Кроме того, раскрыты средства ингибирования экспрессии существенного гена в геноме насекомого-вредителя отряда жесткокрылых, а также средства предоставления растению устойчивости к насекомому-вредителю отряда жесткокрылых. Средства ингибирования экспрессии существенного гена в геноме насекомого-вредителя отряда жесткокрылых представляют собой одноцепочечную или двухцепочечную молекулу РНК, состоящую из любой из SEQ ID NO:7, 8, 10, 11, 49, 50, 86, 87, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 127, 128, 129, 130, 131 или из комплементарных им последовательностей. Средства предоставления растению устойчивости к насекомому-вредителю отряда жесткокрылых представляют собой ДНК-молекулу, включающую последовательность нуклеиновой кислоты, кодирующую средства ингибирования экспрессии существенного гена в геноме насекомого-вредителя отряда жесткокрылых, функционально связанного с промотором, где ДНК-молекула способна интегрироваться в геном растения кукурузы.
Раскрыты способы контроля за популяцией насекомого-вредителя отряда жесткокрылых, включающие предоставление насекомому-вредителю отряда жесткокрылых молекулы иРНК (например, дцРНК. киРНК, миРНК и шпРНК), которая функционирует при поглощении насекомым-вредителем отряда жесткокрылых с ингибированием биологической функции в насекомом-вредителе отряда жесткокрылых, где молекула иРНК включает всю последовательность или часть нуклеотидной последовательности, выбранной из группы, состоящей из: SEQ ID NO:1; последовательности, комплементарной SEQ ID NO:1; SEQ ID NO:2; последовательности, комплементарной SEQ ID NO:2; SEQ ID NO:3; последовательности, комплементарной SEQ ID NO:3; SEQ ID NO:4; последовательности, комплементарной SEQ ID NO:4; нативной кодирующей последовательности организма Diabrotica (например, WCR), включающей всю последовательность или часть любой из SEQ ID NO:1-4; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, включающей всю последовательность или часть любой из SEQ ID NO:1-4; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей всю последовательность или часть любой из SEQ ID NO:1-4; и последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей всю последовательность или часть любой из SEQ ID NO:1-4.
В конкретных примерах раскрыты способы контроля за популяцией насекомого-вредителя отряда жесткокрылых, включающие предоставление насекомому-вредителю отряда жесткокрылых молекулы иРНК (например, дцРНК, киРНК, миРНК и шпРНК), которая функционирует при поглощении насекомым-вредителем отряда жесткокрылых с ингибированием биологической функции в насекомом-вредителе отряда жесткокрылых, где молекула иРНК включает нуклеотидную последовательность, выбранную из группы, состоящей из: всей последовательности или части SEQ ID NO:1; последовательности, комплементарной всей последовательности или части SEQ ID NO:1; SEQ ID NO:2; последовательности, комплементарной SEQ ID NO:2; SEQ ID NO:3; последовательности, комплементарной SEQ ID NO:3; SEQ ID NO:4; последовательности, комплементарной SEQ ID NO:4; всей последовательности или части нативной кодирующей последовательности организма Diabrotica (например, WCR), включающей SEQ ID NO:1; всей последовательности или части последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, включающей SEQ ID NO:1; всей последовательности или части нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1; и всей последовательности или части последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1.
Также в данном документе раскрыты способы, где дцРНК, киРНК, миРНК и/или шпРНК могут предоставляться насекомому-вредителю отряда жесткокрылых в анализе на основе питания или в генетически модифицированных растительных клетках, экспрессирующих дцРНК, киРНК, миРНК и/или шпРНК. В этих и в следующих примерах дцРНК, киРНК, миРНК и/или шпРНК могут поглощаться личинкой насекомого-вредителя отряда жесткокрылых. Поглощение дцРНК, киРНК, миРНК и/или шпРНК по изобретению может затем привести к РНКи в личинках, которая в свою очередь может привести к сайленсингу гена, существенного для жизнеспособности насекомого-вредителя отряда жесткокрылых, и к смертности личинок. Таким образом, раскрыты способы, где насекомому-вредителю отряда жесткокрылых предоставляются молекулы нуклеиновой кислоты, включающие иллюстративные последовательности нуклеиновых кислот, применяемые для контроля за насекомыми-вредителями отряда жесткокрылых. В конкретных примерах насекомое-вредитель отряда жесткокрылых, контролируемое с помощью применения молекул нуклеиновых кислот по изобретению, может представлять собой WCR или NCR.
Все вышеописанное и другие признаки изобретения станут более очевидными на основе следующего подробного описания некоторых воплощений, которое начинается со ссылок на сопровождающие их чертежи.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ. 1 включает описание стратегии, используемой для получения специфических матриц для получения дцРНК.
ФИГ. 2 включает схему изменчивости ингибирования роста насекомых-вредителей отряда жесткокрылых, обработанных с использованием иллюстративных молекул нуклеиновых кислот.
ФИГ. 3 включает схему изменчивости смертности насекомых-вредителей отряда жесткокрылых, обработанных с использованием иллюстративных молекул нуклеиновых кислот.
ФИГ. 4 включает дополнительную схему изменчивости ингибирования роста насекомых-вредителей отряда жесткокрылых, обработанных с использованием иллюстративных молекул нуклеиновых кислот.
ФИГ. 5 включает динамическое изображение некоторых нуклеотидных последовательностей, которые могут присутствовать в определенных молекулах нуклеиновых кислот по изобретению. Там, где указано «(последовательность)», то это обозначает участок изображенной нуклеотидной последовательности, имеющей любую длину и конкретную последовательность, например и без ограничения непрерывный сегмент одной из SEQ ID NO:1-4. Участки изображенных нуклеотидных последовательностей, отмеченные курсивом, являются необязательными.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Последовательности нуклеиновых кислот, перечисленные в прилагающемся списке последовательностей, представлены с использованием стандартных буквенных сокращений для нуклеотидных оснований, определенных в 37 C.F.R. § 1.822. Представлена только одна цепь каждой последовательности нуклеиновой кислоты, но понятно, что комплементарная и обратная комплементарная цепь также включены путем ссылки на представленную цепь. В прилагаемом списке последовательностей:
SEQ ID NO:1 представляет собой иллюстративную кДНК-последовательность Diabrotica, обозначенную в некоторых местах как D_vir_c47185_Caf1180 или Caf1-180.
SEQ ID NO:2 представляет собой иллюстративную кДНК-последовательность Diabrotica, обозначенную в некоторых местах как D_vir_c1229_VatpaseC или VatpaseC.
SEQ ID NO:3 представляет собой иллюстративную кДНК-последовательность Diabrotica, обозначенную в некоторых местах как D_vir_c1319_VatpaseH или VatpaseH.
SEQ ID NO:4 представляет собой иллюстративную кДНК-последовательность Diabrotica, обозначенную в некоторых местах как Contig_01_Rho1_1-191_CDC42 или Rho1.
SEQ ID NO:5-8 представляют собой иллюстративные, расположенные непоследовательно фрагменты кДНК субъединицы С вакуолярной ATPазы Diabrotica.
SEQ ID NO:9-11 представляют собой иллюстративные, расположенные непоследовательно фрагменты кДНК субъединицы H вакуолярной ATPазы Diabrotica.
SEQ ID NO:12 представляет собой промоторную последовательность фага T7.
SEQ ID NO:13-38 представляют собой праймеры, используемые для амплификации областей кодирующих участков иллюстративных генов-мишеней с помощью ПЦР.
SEQ ID NO:39-48 представляют собой праймеры, используемые для амплификации участков генов Caf1-180 и VatpaseC для синтеза шпилечной РНК.
SEQ ID NO:49 представляет собой последовательность ДНК, образующую шпилечную РНК Caf1-180, содержащую интрон ST-LS1 (SEQ ID NO:136) для экспрессирующего вектора версии 1, который содержит консенсусную последовательность кукурузы.
SEQ ID NO:50 представляет собой последовательность ДНК, образующую шпилечную РНК VatpaseC, содержащую интрон ST-LS1 (SEQ ID NO:136) для вектора, экспрессирующего шпРНК, версии 1, который содержит консенсусную последовательность кукурузы.
SEQ ID NO:51 представляет собой последовательность ДНК участка 1 аннексина.
SEQ ID NO:52 представляет собой последовательность ДНК участка 2 аннексина.
SEQ ID NO:53 представляет собой последовательность ДНК участка 1 бета-спектрина 2.
SEQ ID NO:54 представляет собой последовательность ДНК участка 2 бета-спектрина 2.
SEQ ID NO:55 представляет собой последовательность ДНК участка 1 mtRP-L4.
SEQ ID NO:56 представляет собой последовательность ДНК участка 2 mtRP-L4.
SEQ ID NO:57 представляет собой последовательность ДНК, кодирующей YFP.
SEQ ID NO:58-85 представляют собой праймеры, используемые для амплификации участков генов аннексина, бета-спектрина 2, mtRP-L4, и YFP, для синтеза дцРНК.
SEQ ID NO:86 представляет собой иллюстративный амплифицированный 260 п.о.-фрагмент кДНК D_vir_c47185_Caf1-180, который использовали в качестве матрицы для синтеза молекулы дцРНК.
SEQ ID NO:87-90 представляют собой иллюстративные, расположенные непоследовательно фрагменты кДНК Rho1 Diabrotica.
SEQ ID NO:91 представляет собой иллюстративную последовательность ДНК, образующую шпилечную РНК Caf1-180, содержащую интрон ST-LS1 (SEQ ID NO:136), включающую необязательный сайт клонирования, фланкирующий интрон, для экспрессирующего вектора версии 1, который содержит консенсусную последовательность кукурузы.
SEQ ID NO:92 представляет собой иллюстративную последовательность ДНК, образующую шпилечную РНК Caf1-180, содержащую интрон ST-LS1 (SEQ ID NO:136) для экспрессирующего вектора версии 2, который не содержит консенсусную последовательность кукурузы.
SEQ ID NO:93 представляет собой иллюстративную последовательность ДНК, образующую шпилечную РНК VatpaseC, содержащую интрон ST-LS1 (SEQ ID NO:136), включающую необязательный сайт клонирования, фланкирующий интрон, для вектора, экспрессирующего шпРНК, версии 1, который содержит консенсусную последовательность кукурузы.
SEQ ID NO:94 представляет собой иллюстративную последовательность ДНК, образующую шпилечную РНК VatpaseC, содержащую интрон ST-LS1 (SEQ ID NO:136) для вектора, экспрессирующего шпРНК, версии 2, который не содержит консенсусную последовательность кукурузы.
SEQ ID NO:95 представляет собой иллюстративный сегмент смысловой цепи ДНК Caf1-180, содержащей интрон ST-LS1 (SEQ ID NO:136), для экспрессирующего вектора версии 3.
SEQ ID NO:96 представляет собой иллюстративный сегмент антисмысловой цепи ДНК Caf1-180 для экспрессирующего вектора версии 3.
SEQ ID NO:97 представляет собой иллюстративную последовательность ДНК, образующую шпилечную РНК Caf1-180, содержащую интрон ST-LS1 (SEQ ID NO:136), для экспрессирующего вектора версии 3.
SEQ ID NO:98 представляет собой иллюстративный сегмент смысловой цепи ДНК VatpaseC, содержащей интрон ST-LS1 (SEQ ID NO:136), для экспрессирующего вектора версии 3.
SEQ ID NO:99 представляет собой иллюстративный сегмент антисмысловой цепи ДНК VatpaseC для экспрессирующего вектора версии 3.
SEQ ID NO:100 представляет собой иллюстративную последовательность ДНК, образующую шпилечную РНК VatpaseC, содержащую интрон ST-LS1 (SEQ ID NO:136), для экспрессирующего вектора версии 3.
SEQ ID NO:101 представляет собой иллюстративный сегмент смысловой цепи ДНК VatpaseC, содержащей интрон ST-LS1 (SEQ ID NO:136), для экспрессирующего вектора версии 4.
SEQ ID NO:102 представляет собой иллюстративный сегмент антисмысловой цепи ДНК VatpaseC для экспрессирующего вектора версии 4.
SEQ ID NO:103 представляет собой иллюстративную последовательность ДНК, образующую шпилечную РНК VatpaseC, содержащую интрон ST-LS1 (SEQ ID NO:136), для экспрессирующего вектора версии 4.
SEQ ID NO:104 представляет собой иллюстративный сегмент смысловой цепи ДНК VatpaseH, содержащей интрон ST-LS1 (SEQ ID NO:136), для экспрессирующего вектора версии 1.
SEQ ID NO:105 представляет собой иллюстративный сегмент антисмысловой цепи ДНК VatpaseH для экспрессирующего вектора версии 1.
SEQ ID NO:106 представляет собой иллюстративную последовательность ДНК, образующую шпилечную РНК VatpaseH, содержащую интрон ST-LS1 (SEQ ID NO:136), для экспрессирующего вектора версии 1.
SEQ ID NO:107 представляет собой иллюстративный сегмент смысловой цепи ДНК Rho1, содержащей интрон ST-LS1 (SEQ ID NO:136), для экспрессирующего вектора версии 1.
SEQ ID NO:108 представляет собой иллюстративный сегмент антисмысловой цепи ДНК Rho1 для экспрессирующего вектора версии 1.
SEQ ID NO:109 представляет собой иллюстративную последовательность ДНК, образующую шпилечную РНК Rho1, содержащую интрон ST-LS1 (SEQ ID NO:136), для экспрессирующего вектора версии 1.
SEQ ID NO:110 представляет собой иллюстративный сегмент ДНК Caf-180, используемый для обеспечения матрицы для синтеза дцРНК в биоанализе диетического питания.
SEQ ID NO:111 представляет собой иллюстративный сегмент ДНК участка 1 VatpaseC, используемый для обеспечения матрицы для синтеза дцРНК в биоанализе диетического питания.
SEQ ID NO:112 представляет собой иллюстративный сегмент ДНК участка 1 (короткий) VatpaseC, используемый для матрицы для синтеза дцРНК в биоанализе диетического питания.
SEQ ID NO:113 представляет собой иллюстративный сегмент ДНК участка 2 VatpaseC, используемый для обеспечения матрицы для синтеза дцРНК в биоанализе диетического питания.
SEQ ID NO:114 представляет собой иллюстративный сегмент ДНК участка 1 VatpaseH, используемый для обеспечения матрицы для синтеза дцРНК в биоанализе диетического питания.
SEQ ID NO:115 представляет собой иллюстративный сегмент ДНК участка 2 VatpaseH, используемый для обеспечения матрицы для синтеза дцРНК в биоанализе диетического питания.
SEQ ID NO:116 представляет собой иллюстративный сегмент ДНК Rho1, используемый для обеспечения матрицы для синтеза дцРНК в биоанализе диетического питания.
SEQ ID NO:117 представляет собой иллюстративную смысловую цепь РНК VatpaseC («VatpaseC5’-15»), используемую в качестве дцРНК в биоанализе диетического питания.
SEQ ID NO:118 представляет собой дополнительную иллюстративную смысловую цепь РНК VatpaseC («VatpaseC5’-25»), используемую в качестве дцРНК в биоанализе диетического питания.
SEQ ID NO:119 представляет собой дополнительную иллюстративную смысловую цепь РНК VatpaseC («VatpaseC3’-15»), используемую в качестве дцРНК в биоанализе диетического питания.
SEQ ID NO:120 представляет собой дополнительную иллюстративную смысловую цепь РНК VatpaseC («VatpaseC3’-25»), используемую в качестве дцРНК в биоанализе диетического питания.
SEQ ID NO:121-126 представляют собой праймеры, используемые для амплификации областей гена VatpaseC Diabrotica в качестве матриц для синтеза дцРНК.
SEQ ID NO:127 представляет собой иллюстративную смысловую цепь VatpaseC («VatpaseC5’-50»), используемую в качестве матрицы для дцРНК в биоанализе диетического питания.
SEQ ID NO:128 представляет собой иллюстративную смысловую цепь VatpaseC («VatpaseC5’-100»), используемую в качестве матрицы для дцРНК в биоанализе диетического питания.
SEQ ID NO:129 представляет собой иллюстративную смысловую цепь VatpaseC («VatpaseC-174»), используемую в качестве матрицы для дцРНК в биоанализе диетического питания.
SEQ ID NO:130 представляет собой иллюстративную смысловую цепь VatpaseC («VatpaseC3’-50»), используемую в качестве матрицы для дцРНК в биоанализе диетического питания.
SEQ ID NO:131 представляет собой иллюстративную смысловую цепь VatpaseC («VatpaseC3’-100»), используемую в качестве дцРНК в биоанализе диетического питания.
SEQ ID NO:132-135 представляют собой праймеры, используемые для молекулярных анализов трансгенной кукурузы.
SEQ ID NO:136 представляет собой интрон ST-LS1, который может использоваться в некоторых воплощениях для образования шпилечной РНК.
SEQ ID NO:137-138 представляют собой иллюстративные, расположенные непоследовательно фрагменты кДНК Rho1 Diabrotica.
ПОДРОБНОЕ ОПИСАНИЕ
I. Обзор некоторых воплощений
В данном документе раскрыты способы и композиции для генетического контроля за заражением насекомым-вредителем отряда жесткокрылых. Также предлагаются способы идентификации одного или нескольких генов, существенных для жизненного цикла насекомого-вредителя отряда жесткокрылых, для применения в качестве гена-мишени для РНК-опосредованного контроля за популяцией насекомых-вредителей отряда жесткокрылых. ДНК-плазмидные векторы, кодирующие молекулы дцРНК, могут быть сконструированы для подавления одного или нескольких генов-мишеней, существенных для роста, выживания, развития и/или репродукции. В некоторых воплощениях предлагаются способы посттранскрипционной репрессии экспрессии или ингибирования гена-мишени посредством молекул нуклеиновых кислот, которые комплементарны кодирующей или некодирующей последовательности гена-мишени насекомого-вредителя отряда жесткокрылых. В этих и других воплощениях насекомое-вредитель отряда жесткокрылых может поглощать одну или несколько молекул дцРНК, киРНК, миРНК и/или шпРНК, транскрибированных со всей последовательности или с части молекулы нуклеиновой кислоты, которая комплементарна кодирующей или некодирующей последовательности гена-мишени, обеспечивая, таким образом, растению защитный эффект.
Таким образом, некоторые воплощения включают специфичное к последовательности ингибирование экспрессии продукта гена-мишени, используя дцРНК, киРНК, миРНК и/или шпРНК, которые комплементарны кодирующим и/или некодирующим последовательностям генов-мишеней, для достижения, по меньшей мере, частичного контроля за насекомым-вредителем отряда жесткокрылых. Раскрыт набор выделенных и очищенных молекул нуклеиновых кислот, включающих нуклеотидную последовательность, например, представленную в одной из SEQ ID NO:1-4, а также их фрагменты. В некоторых воплощениях стабилизированная молекула дцРНК может экспрессироваться с последовательностей, их фрагментов или с гена, включающего одну из этих последовательностей, для посттранскрипционного сайленсинга или ингибирования гена-мишени. В некоторых воплощениях выделенные и очищенные молекулы нуклеиновых кислот включают всю последовательность или часть SEQ ID NO:1.
Некоторые воплощения включают в себя рекомбинантную клетку-хозяина (например, растительную клетку), содержащую в своем геноме, по меньшей мере, одну рекомбинантную последовательность ДНК, кодирующую, по меньшей мере, одну молекулу(ы) иРНК (например, дцРНК). В конкретных воплощениях молекула(ы) дцРНК может экспрессироваться при поглощении насекомым-вредителем отряда жесткокрылых с получением эффекта посттранскрипционного сайленсинга или ингибирования экспрессии гена-мишени у насекомого-вредителя отряда жесткокрылых. Рекомбинантная последовательность ДНК может включать, например, любую из SEQ ID NO:1-4, фрагменты любой из SEQ ID NO:1-4 или неполную последовательность гена, включающую одну из SEQ ID NO:1-4, или комплементарные им последовательности.
Конкретные воплощения включают рекомбинантную клетку-хозяина, содержащую в своем геноме рекомбинантную последовательность ДНК, кодирующую, по меньшей мере, одну молекулу(ы) иРНК (например, дцРНК), включающую всю последовательность или часть SEQ ID NO:1. При поглощении насекомым-вредителем отряда жесткокрылых молекулы(а) иРНК могут выключать или ингибировать экспрессию гена-мишени, включающего SEQ ID NO:1, у насекомого-вредителя отряда жесткокрылых, что таким образом приводит к прекращению роста, развития, репродукции и/или питания насекомого-вредителя отряда жесткокрылых.
В некоторых воплощениях рекомбинантная клетка-хозяин, содержащая в своем геноме, по меньшей мере, одну рекомбинантную последовательность ДНК, кодирующую, по меньшей мере, одну молекулу дцРНК, может представлять собой трансформированную растительную клетку. Некоторые воплощения включают в себя трансгенные растения, включающие такую трансформированную растительную клетку. Дополнительно к таким трансгенным растениям предлагается потомство растений любого поколения трансгенного растения, трансгенные семена и продукты трансгенного растения, каждый из которых включает рекомбинантную последовательность(и) ДНК. В конкретных воплощениях молекула дцРНК по изобретению может экспрессироваться в трансгенной растительной клетке. Таким образом, в этих и в других воплощениях молекула дцРНК по изобретению может быть выделена из трансгенной растительной клетки. В конкретных воплощениях трансгенное растение представляет собой растение, выбранное из группы, включающей кукурузу (Zea mays), сою (Glycine max) и растения семейства Poaceae.
Некоторые воплощения включают в себя способ модулирования экспрессии гена-мишени в клетке насекомого-вредителя отряда жесткокрылых. В этих и в других воплощениях может предлагаться молекула нуклеиновой кислоты, где молекула нуклеиновой кислоты включает нуклеотидную последовательность, кодирующую молекулу дцРНК. В конкретных воплощениях нуклеотидная последовательность, кодирующая молекулу дцРНК, может быть функционально связана с промотором, а также может быть функционально связана с последовательностью терминации транскрипции. В конкретных воплощениях способ модулирования экспрессии гена-мишени в клетке насекомого-вредителя отряда жесткокрылых может включать: (a) трансформирование растительной клетки вектором, включающим нуклеотидную последовательность, кодирующую молекулу дцРНК; (b) культивирование трансформированной растительной клетки при условиях, достаточных для возможности развития культуры растительных клеток, включающей множество трансформированных растительных клеток; (c) селекцию трансформированной растительной клетки, которая содержит в своем геноме интегрированный вектор; и (d) определение, что селектированная трансформированная растительная клетка включает молекулу дцРНК, кодируемую нуклеотидной последовательностью вектора. Растение может быть регенерировано из растительной клетки, которая содержит вектор, интегрированный в ее геном, и включает молекулу дцРНК, кодируемую нуклеотидной последовательностью вектора.
Таким образом, также раскрыто трансгенное растение, включающее вектор, содержащий нуклеотидную последовательность, кодирующую молекулу дцРНК, интегрированную в его геном, где трансгенное растение включает молекулу дцРНК, кодируемую нуклеотидной последовательностью вектора. В конкретных воплощениях экспрессии молекулы дцРНК в растении достаточно для модулирования экспрессии гена-мишени в клетке насекомого-вредителя отряда жесткокрылых, которое контактирует с трансформированным растением или с растительной клеткой, с частью растения (например, с корнем) или с растительной клеткой. Трансгенные растения, раскрытые в данном документе, могут проявлять устойчивость и/или повышенную переносимость заражения насекомыми-вредителями отряда жесткокрылых. Конкретные трансгенные растения могут проявлять устойчивость и/или повышенную переносимость по отношению к одному или нескольким насекомым-вредителям отряда жесткокрылых, выбранных из группы, состоящей из WCR; NCR; SCR; MCR; D. balteata LeConte; D. u. Tenella, и D. u. undecimpunctata Mannerheim.
Также в данном документе раскрыты способы доставки контролируемых агентов, таких как молекула иРНК, насекомому-вредителю отряда жесткокрылых. Такие контролируемые агенты могут вызывать прямо или косвенно ухудшение способности насекомого-вредителя отряда жесткокрылых питаться, расти или иным способом вызывать разрушение по отношению к хозяину. В некоторых воплощениях предлагается способ, включающий доставку стабилизированной молекулы дцРНК насекомому-вредителю отряда жесткокрылых для подавления, по меньшей мере, одного гена-мишени насекомого-вредителя отряда жесткокрылых, уменьшая или исключая, таким образом, разрушение растения насекомым-вредителем отряда жесткокрылых. В некоторых воплощениях способ ингибирования экспрессии гена-мишени насекомого-вредителя отряда жесткокрылых может привести к прекращению роста, развития, репродукции и/или питания у насекомого-вредителя отряда жесткокрылых. В некоторых воплощениях способ может фактически приводить к гибели насекомого-вредителя отряда жесткокрылых.
В некоторых воплощениях предлагаются композиции (например, местная композиция), которые включают молекулу иРНК (например, дцРНК) по изобретению для применения в растениях, животных и/или в среде, окружающей растение или животное, для достижения исключения или уменьшения заражения насекомым-вредителем отряда жесткокрылых. В конкретных воплощениях композиция может представлять собой пищевую композицию или источник питания для насекомого-вредителя отряда жесткокрылых. Некоторые воплощения включают создание пищевой композиции или источника питания, доступного насекомому-вредителю отряда жесткокрылых. Поглощение композиции, включающей молекулы иРНК, может приводить к поглощению молекул одной или несколькими клетками насекомого-вредителя отряда жесткокрылых, что может в свою очередь приводить к ингибированию экспрессии, по меньшей мере, одного гена-мишени в клетке(ах) насекомого-вредителя отряда жесткокрылых. Поглощение или разрушение растения или растительной клетки насекомым-вредителем отряда жесткокрылых может быть ограничено или исключено внутри или на любой ткани хозяина, где присутствует насекомое-вредитель отряда жесткокрылых, путем предоставления одной или нескольких композиций, включающих молекулу иРНК по изобретению, в хозяине насекомого-вредителя отряда жесткокрылых.
Композиции и способы, раскрытые в данном документе, могут использоваться вместе в комбинации с другими способами и композициями для контроля за разрушениями, причиняемыми насекомыми-вредителями отряда жесткокрылых. Например, в способе могут использоваться молекулы иРНК, описанные в данном документе, для защиты растений от насекомых-вредителей отряда жесткокрылых, включая дополнительное применение одного или нескольких химических агентов, эффективных против насекомого-вредителя отряда жесткокрылых, биопестицидов, эффективных против насекомого-вредителя отряда жесткокрылых, чередование культур или рекомбинантные генетические методы, которые проявляют свойства, отличные от свойств РНКи-опосредованных методов и композиций РНКи по изобретению (например, рекомбинантное продуцирование в растениях белков, которые вредны для насекомого-вредителя отряда жесткокрылых (например, Bt-токсинов)).
II. Сокращения
III. Термины
В описании и в таблицах, которые следуют далее, использован ряд терминов. Для обеспечения ясного и последовательного понимания описания и формулы изобретения, включая рамки, данные такими терминам, представлены следующие определения.
Насекомое-вредитель отряда жесткокрылых: При использовании в данном документе термин «насекомое-вредитель отряда жесткокрылых» относится к насекомым рода Diabrotica, которые питаются на кукурузе и других истинных травах. В конкретных примерах насекомое-вредитель отряда жесткокрылых выбрано из группы, включающей D. v. virgifera LeConte (WCR); D. barberi Smith and Lawrence (NCR); D. u. howardi (SCR); D. v. zeae (MCR); D. balteata LeConte; D. u. Tenella, и D. u. undecimpunctata Mannerheim.
Контакт (с организмом): При использовании в данном документе термин «контакт с» или «поглощение» организмом (например, насекомым-вредителем отряда жесткокрылых), в отношении молекулы нуклеиновой кислоты, включает интернализацию молекулы нуклеиновой кислоты в организм, например и без ограничения: поглощение молекулы организмом (например, при питании); контакт организма с композицией, включающей молекулу нуклеиновой кислоты; и пропитывание организмов с помощью раствора молекулы нуклеиновой кислоты.
Контиг: При использовании в данном документе термин «контиг» относится к последовательности ДНК, которая реконструирована из ряда перекрывающихся сегментов ДНК, выделенных из одного генетического источника.
Кукурузное растение: При использовании в данном документе термин «кукурузное растение» относится к растению вида Zea mays (кукуруза).
Экспрессия: При использовании в данном документе «экспрессия» кодирующей последовательности (например, гена или трансгена) относится к процессу, с помощью которого кодируемая информация транскрипционной единицы нуклеиновой кислоты (включающей, например, геномную ДНК или кДНК) конвертируется в функциональную, не функциональную или в структурную часть клетки, часто включающую синтез белка. На экспрессию гена могут оказывать влияние внешние сигналы; например, экспонирование клетки, ткани или организма с агентом, который увеличивает или уменьшает экспрессию гена. Экспрессия гена также может регулироваться на любом уровне цепочки ДНК-РНК-белок. Регуляция экспрессии гена происходит, например, посредством контролей, воздействующих на транскрипцию, трансляцию, РНК-транспорт и процессинг, деградацию промежуточных молекул, таких как мРНК, или посредством активации, инактивации, компартментализации или деградации специфических белковых молекул после того, как они были синтезированы, или путем комбинации перечисленного. Экспрессия гена может быть измерена на уровне РНК или на уровне белка с помощью любого метода, известного в данной области, включающего в частности Нозерн-блот, РВ-ПЦР ((RT-PCR) ПЦР в реальном времени), Вестерн-блот или анализы активности белка in vitro, in situ или in vivo.
Генетический материал: При использовании в данном документе термин «генетический материал» включает все гены и молекулы нуклеиновой кислоты, такие как ДНК и РНК.
Ингибирование: При использовании в данном документе термин «ингибирование», при использовании для описания эффекта, оказываемого на кодирующую последовательность (например, ген), относится к измеряемому уменьшению клеточного уровня мРНК, транскрибируемой с кодирующей последовательности, и/или пептидного, полипептидного или белкового продукта кодирующей последовательности. В некоторых примерах экспрессия кодирующей последовательности может ингибироваться так, что экспрессия практически исключается. «Специфичное ингибирование» относится к ингибированию кодирующей последовательности-мишени без последующего воздействия на экспрессию других кодирующих последовательностей (например, генов) в клетке, где происходит специфичное ингибирование.
Выделенный: «Выделенный» биологический компонент (такой как нуклеиновая кислота или белок) по существу отделен от, получен независимо от или очищен от других биологических компонентов в клетке организма, в которой компонент существует в естественном виде, т.е. от других хромосомных или внехромосомных ДНК и РНК и белков. Молекулы нуклеиновых кислот и белки, которые «выделены», включают молекулы нуклеиновых кислот и белки, очищенные стандартными методами очистки. Термин также охватывает нуклеиновые кислоты и белки, полученные с помощью рекомбинантной экспрессии в клетке-хозяине, а также химически синтезированные молекулы нуклеиновых кислот, белки и пептиды.
Молекула нуклеиновой кислоты: При использовании в данном документе термин «молекула нуклеиновой кислоты» может означать полимерную форму нуклеотидов, которая может включать как смысловую, так и антисмысловую цепи РНК, кДНК, геномной ДНК и их синтетические формы, и смешанные полимеры. Нуклеотид может обозначать рибонуклеотид, дезоксирибонуклеотид или модифицированную форму любого типа нуклеотида. При использовании в данном документе термин «молекула нуклеиновой кислоты» является синонимом «нуклеиновой кислоты» и «полинуклеотида». Молекула нуклеиновой кислоты, как правило, составляет по длине, по меньшей мере, 10 оснований до тех пор, пока не определено иначе. Нуклеотидная последовательность молекулы нуклеиновой кислоты читается согласно правилу в направлении от 5’ к 3’ концу молекулы. «Комплементарная последовательность» нуклеотидной последовательности относится к последовательности от 5’ к 3’ нуклеотидных оснований, которые образуют пары оснований с нуклеотидными основаниями нуклеотидной последовательности (т.е. A-T/U и G-C). «Обратная комплементарная последовательность» последовательность нуклеиновой кислоты относится к последовательности от 3’ к 5’ нуклеотидных оснований, которые образуют пары оснований с нуклеотидными основаниями нуклеотидной последовательности.
«Молекулы нуклеиновых кислот» включают одноцепочечные и двухцепочечные формы ДНК; одноцепочечные формы РНК; и двухцепочечные формы РНК (дцРНК). Термин «нуклеотидная последовательность» или «последовательность нуклеиновой кислоты» относится к обеим, смысловой и антисмысловой, цепям нуклеиновой кислоты, представленным как в виде индивидуальных одиночных цепей, так и в виде дуплекса. Термин «рибонуклеиновая кислота» (РНК) включает в себя иРНК (ингибирующая РНК), дцРНК (двухцепочечная РНК), киРНК (короткая интерферирующая РНК), мРНК (матричная РНК), миРНК (микроРНК), шпРНК (шпилечная РНК), тРНК (транспортная РНК), либо заряженная, либо незаряженная с использованием соответствующей ацилированной аминокислоты, и кРНК (комплементарная РНК). Термин «дезоксирибонуклеиновая кислота» (ДНК) включает кДНК, геномную ДНК и гибриды ДНК-РНК. Термины «сегмент нуклеиновой кислоты» и «сегмент нуклеотидной последовательности» или более обобщенно «сегмент» будут понятны специалистам в данной области как функциональные термины, которые включают геномные последовательности, последовательности рибосомной РНК, последовательности транспортной РНК, последовательности матричной РНК, последовательности оперонов и более короткие сконструированные нуклеотидные последовательности, которые кодируют или могут быть адаптированы для кодирования пептидов, полипептидов или белков.
Олигонуклеотид: Олигонуклеотид представляет собой короткий полимер нуклеиновой кислоты. Олигонуклеотиды могут быть образованы путем расщепления более длинных сегментов нуклеиновых кислот или путем полимеризации индивидуальных нуклеотидных предшественников. Автоматические синтезаторы дают возможность синтеза олигонуклеотидов размером до нескольких сотен пар оснований. Так как олигонуклеотиды могут связываться с комплементарной нуклеотидной последовательностью, то они могут использоваться в качестве зондов для детектирования ДНК или РНК. Олигонуклеотиды, состоящие из ДНК (олигодезоксирибонуклеотиды), могут использоваться в ПЦР, методе для амплификации последовательностей ДНК и РНК (обратно транскрибированных в кДНК). В ПЦР олигонуклеотид, как правило, обозначается как «праймер», который дает возможность ДНК-полимеразе удлинять олигонуклеотид и реплицировать комплементарную цепь.
Молекула нуклеиновой кислоты может включать каждый или оба типа нуклеотидов, природные и модифицированные, связанные вместе природными и/или синтетическими нуклеотидными связями. Молекулы нуклеиновой кислоты могут быть модифицированы химически или биохимически или могут содержать синтетические или модифицированные нуклеотидные основания, которые известны специалистам в данной области. Такие модификации включают, например, метки, метилирование, замену одного или нескольких природных нуклеотидов на аналог, межнуклеотидные модификации (например, незаряженные связи: например, метилфосфонатные, фосфотриэфирные, фосфорамидатные, карбаматные и т.д.; заряженные связи: например, фосфоротиоатные, фосфородитиоатные и т.д.; присоединенные компоненты: например, пептиды; интеркаляторы: например, акридин, псорален и т.д.; хелаторы, алкилаторы и модифицированные связи: например, альфа-аномерные нуклеиновые кислоты и т.д.). Термин «молекула нуклеиновой кислоты» также включает любую топологическую конформацию, включающую одноцепочечную, двухцепочечную, частично двойную, тройную, в виде шпильки, циклическую и блокированную конформации.
При использовании в данном документе по отношению к ДНК термин «кодирующая последовательность», «структурная нуклеотидная последовательность» или «структурная молекула нуклеиновой кислоты» относится к нуклеотидной последовательности, которая, в конечном счете, транслируется в полипептид посредством транскрипции и мРНК при помещении под контроль соответствующих регуляторных последовательностей. По отношению к РНК, термин «кодирующая последовательность» относится к нуклеотидной последовательности, которая транслируется в пептид, полипептид или в белок. Границы кодирующей последовательности определяются старт-кодоном трансляции на 5’-конце и стоп-кодоном на 3’-конце. Кодирующие последовательности включают, в частности: геномную ДНК; кДНК; EST; и рекомбинантные нуклеотидные последовательности.
Геном: При использовании в данном документе термин «геном» относится к хромосомной ДНК, обнаруженной внутри ядра клетки, а также относится к ДНК органелл, обнаруженной внутри субклеточных компонентов клетки. В некоторых воплощениях изобретения молекула ДНК может быть введена в растительную клетку, так что молекула ДНК интегрируется в геном растительной клетки. В этих и в других воплощениях молекула ДНК может быть либо интегрирована в ядерную ДНК растительной клетки, либо интегрирована в ДНК хлоропластов или митохондрий растительной клетки. Термин «геном» при применении к бактериям относится как к хромосомной ДНК, так и к плазмидам внутри бактериальной клетки. В некоторых воплощениях изобретения молекула ДНК может быть введена в бактерию, так что молекула ДНК интегрируется в геном бактерии. В этих и в других воплощениях молекула ДНК может быть как хромосомно-интегрированной, так и локализованной в стабильной плазмиде.
Идентичность последовательности: Термин «идентичность последовательности» или «идентичность» при использовании в данном документе в контексте двух последовательностей нуклеиновых кислот или двух полипептидных последовательностей относится к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании на предмет максимального соответствия в рамках определенного окна сравнения.
При использовании в данном документе «процент идентичности последовательностей» может относиться к величине, определенной путем сравнения двух оптимально выравненных последовательностей (например, последовательностей нуклеиновой кислоты) в окне сравнения, где часть последовательности в окне сравнения может включать вставки или делеции (т.е. разрывы) по сравнению с эталонной последовательностью (которая не включает вставки или делеции) для оптимального выравнивания двух последовательностей. Процент рассчитывается путем определением количества положений, в которых идентичные нуклеотидные или аминокислотные остатки встречаются в обеих последовательностях с получением количества совпадающих положений, путем деления количества совпадающих положений на общее количество положений в окне сравнения; и путем умножения результата на 100 с получением процента идентичности последовательностей. Говорят, что последовательность, которая идентична в каждом положении по сравнению с эталонной последовательностью, идентична на 100% с эталонной последовательностью и наоборот.
Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Различные программы и алгоритмы выравнивания описаны, например, в Smith and Waterman (1981) Adv. Appl. Math. 2:482; Needleman and Wunsch (1970) J. Mol. Biol. 48:443; Pearson and Lipman (1988) Proc. Natl. Acad. Sci. U.S.A. 85:2444; Higgins and Sharp (1988) Gene 73:237-44; Higgins and Sharp (1989) CABIOS 5:151-3; Corpet et al. (1988) Nucleic Acids Res. 16:10881-90; Huang et al. (1992) Comp. Appl. Biosci. 8:155-65; Pearson et al. (1994) Methods Mol. Biol. 24:307-31; Tatiana et al. (1999) FEMS Microbiol. Lett. 174:247-50. Подробное рассмотрение методов выравнивания последовательностей и расчета гомологии можно найти, например, в Altschul et al. (1990) J. Mol. Biol. 215:403-10.
Национальный Центр Биотехнологической Информации (NCBI) Средства Поиска Основного Локального Выравнивания (BLAST™; Altschul et al. (1990)) доступен из нескольких источников, включающих Национальный Центр Биотехнологической Информации (Бифезда, Мэриленд), и в сети интернет для применения по отношению к нескольким программам анализа последовательности. Описание того, как определить идентичность последовательности с использованием этой программы, доступно из интернета в разделе «помощь» программы BLAST™. Для сравнения последовательностей нуклеиновых кислот может применяться функция «Blast 2 sequences» программы BLAST™ (Blastn) с использованием по умолчанию установок параметров матрицы BLOSUM62. Последовательности нуклеиновых кислот с еще большей гомологией с эталонными последовательностями будут демонстрировать повышение процента идентичности при оценке с помощью этого метода.
Специфично гибридизующиеся/Специфично комплементарные: При использовании в данном документе термины «специфично гибридизующиеся» и «специфично комплементарные» представляют собой термины, которые указывают на достаточную степень комплементарности, так что происходит стабильное и специфичное связывание между молекулой нуклеиновой кислоты и молекулой нуклеиновой кислоты-мишени. Гибридизация между двумя молекулами нуклеиновых кислот включает в себя образование антипараллельного выравнивания между последовательностями нуклеиновых кислот двух молекул нуклеиновых кислот. Две молекулы затем способны образовывать водородные связи с соответствующими основаниями на противоположной цепи с образованием дуплексной молекулы, если она достаточно стабильна, то ее детектируют с использованием методов, хорошо известных в данной области. Для специфичной гибридизации молекула нуклеиновой кислоты необязательно должна быть на 100% комплементарна ее последовательности-мишени. Однако количество комплементарности последовательности, которое должно иметь место, для того чтобы гибридизация была специфичной, представляет собой функцию используемых условий гибридизации.
Условия гибридизации, приводящие к конкретной степени жесткости, будут варьироваться в зависимости от характера выбранного способа гибридизации и от состава и длины гибридизующихся молекул нуклеиновых кислот. Как правило, температура гибридизации и ионная сила (особенно концентрация Na+ и/или Mg++) гибридизационного буфера будут определять жесткость гибридизации, хотя количество промывок и состав промывочного буфера также влияют на жесткость. Расчеты, касающиеся условий гибридизации, требуемых для достижения конкретной степени жесткости, известны специалистам в данной области и обсуждаются, например, в Sambrook et al. (ed.) Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, chapters 9 and 11; and Hames and Higgins (eds.) Nucleic Acid Hybridization, IRL Press, Oxford, 1985. Дополнительные подробные инструкции и руководство по поводу гибридизации нуклеиновых кислот можно найти, например, в Tijssen, “Overview of principles of hybridization and the strategy of nucleic acid probe assays,” in Laboratory Techniques in Biochemistry and Molecular Biology- Hybridization with Nucleic Acid Probes, Part I, Chapter 2, Elsevier, NY, 1993; и Ausubel et al., Eds., Current Protocols in Molecular Biology, Chapter 2, Greene Publishing and Wiley-Interscience, NY, 1995.
При использовании в данном документе термин «жесткие условия» охватывает условия, при которых гибридизация будет происходить, если имеет место менее чем 20% несовпадений между гибридизующейся молекулой и гомологичной последовательностью внутри молекулы нуклеиновой кислоты-мишени. «Жесткие условия» включают дополнительный конкретный уровень жесткости. Таким образом, при использовании в данном документе, условия «умеренной жесткости» - это те, при которых молекулы, имеющие более чем 20% несовпадений последовательности, не будут гибридизоваться; условия «высокой жесткости» - это те, при которых последовательности, имеющие более чем 10% несовпадений, не будут гибридизоваться; и условия «очень высокой жесткости» - это те, при которых последовательности, имеющие более чем 5% несовпадений, не будут гибридизоваться.
Далее представлены характерные частные условия гибридизации.
Условие высокой жесткости (детектирует последовательности, которые имеют, по меньшей мере, 90% идентичности последовательности): Гибридизация в буфере 5x SSC при 65°C в течение 16 часов; промывка дважды в буфере 2x SSC при комнатной температуре в течение 15 минут каждый раз; и промывка дважды в буфере 0,5x SSC при 65°C в течение 20 минут каждый раз.
Условие умеренной жесткости (детектирует последовательности, которые имеют, по меньшей мере, 80% идентичности последовательности): Гибридизация в буфере 5-6х SSC при 65-70°C в течение 16-20 часов; промывка дважды в буфере 2x SSC при комнатной температуре в течение 5-20 минут каждый раз; и промывка дважды в буфере 1x SSC при 55-70°C в течение 30 минут каждый раз.
Нежесткие контрольные условия (будут гибридизоваться последовательности, которые имеют, по меньшей мере, 50% идентичности последовательности): Гибридизация в буфере 6х SSC при комнатной температуре в течение 16-20 часов; промывка, по меньшей мере, дважды в буфере 2x-3х SSC при температуре до 55°C в течение 20-30 минут каждый раз.
При использовании в данном документе термин «по существу гомологичная» или «существенная гомология» по отношению к непрерывной последовательности нуклеиновой кислоты относится к непрерывным нуклеотидным последовательностям, которые гибридизуются с эталонной последовательностью нуклеиновой кислоты в жестких условиях. Например, последовательности нуклеиновых кислот, которые по существу гомологичны эталонной последовательности нуклеиновой кислоты любой из SEQ ID NO:1-4, это те последовательности нуклеиновых кислот, которые гибридизуются при жестких условиях (например, при условиях умеренной жесткости, представленных выше) с эталонной последовательностью нуклеиновой кислоты любой из SEQ ID NO:1-4. По существу гомологичные последовательности могут иметь, по меньшей мере, 80% идентичности последовательности. Например, по существу гомологичные последовательности могут иметь примерно от 80% до 100% идентичности последовательности, как, например, примерно 81%; примерно 82%; примерно 83%; примерно 84%; примерно 85%; примерно 86%; примерно 87%; примерно 88%; примерно 89%; примерно 90%; примерно 91%; примерно 92%; примерно 93%; примерно 94% примерно 95%; примерно 96%; примерно 97%; примерно 98%; примерно 98,5%; примерно 99%; примерно 99,5% и примерно 100%. Свойство существенной гомологии тесно связано со специфичной гибридизацией. Например, молекула нуклеиновой кислоты специфично гибридизуется, когда имеется достаточная степень комплементарности, чтобы избежать неспецифичного связывания нуклеиновой кислоты с последовательностями, которые не являются мишенями, при условиях, где целевым является специфичное связывание, например, при жестких условиях гибридизации.
При использовании в данном документе термин «ортолог» относится к генам в двух или нескольких видах, которые развились от общей нуклеотидной последовательности-предшественника и которые могут сохранять одну и ту же функцию в двух или в нескольких видах.
При использовании в данном документе говорят, что две молекулы последовательностей нуклеиновых кислот демонстрируют «полную комплементарность», когда каждый нуклеотид последовательности, читаемой в направлении от 5’ до 3’, комплементарен каждому нуклеотиду другой последовательности, читаемой в направлении от 3’ к 5’. Нуклеотидная последовательность, которая комплементарна эталонной нуклеотидной последовательности, будет представлять последовательность, идентичную обратной комплементарной последовательности эталонной нуклеотидной последовательности. Эти термины и описания хорошо известны в данной области и очевидны специалистам в данной области.
Функционально связанный: Первая нуклеотидная последовательность функционально связана со второй последовательностью нуклеиновой кислоты, когда первая последовательность нуклеиновой кислоты находится в функциональной связи со второй последовательностью нуклеиновой кислоты. При рекомбинантном получении функционально связанные последовательности нуклеиновых кислот, как правило, являются сопряженными, а также в случаях, где необходимо соединять два участка, кодирующие белок, в одной рамке считывания (например, в полицистронной ORF). Однако для того чтобы быть функционально связанными, нуклеиновые кислоты необязательно должны быть сопряженными.
Термин «функционально связанная», используемый в отношении регуляторной последовательности и кодирующей последовательности, означает, что регуляторная последовательность влияет на экспрессию связанной с ней кодирующей последовательности. «Регуляторные последовательности» или «контрольные элементы» относятся к нуклеотидным последовательностям, которые влияют на время и уровень/количество транскрипции, РНК-процессинг или стабильность или на трансляцию ассоциированной с ними кодирующей последовательности. Регуляторные последовательности могут включать промоторы; лидерные последовательности трансляции; интроны; энхансеры; структуры стебель-петля; последовательности связывания репрессора; последовательности терминации; последовательности распознавания полиаденилирования; и т.д. Конкретные регуляторные последовательности могут быть локализованы в 5’-области и/или в 3’-области по отношению к кодирующей последовательности, функционально с ней связанной. Кроме того, конкретные регуляторные последовательности, функционально связанные с кодирующей последовательностью, могут быть локализованы на ассоциированной комплементарной цепи двухцепочечной молекулы нуклеиновой кислоты.
Промотор: При использовании в данном документе термин «промотор» обозначает участок ДНК, который может располагаться выше старта транскрипции и который может быть вовлечен в распознавание и связывание РНК-полимеразы и других белков для инициации транскрипции. Промотор может быть функционально связан с кодирующей последовательностью для ее экспрессии в клетке, или промотор может быть функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть функционально связана с кодирующей последовательностью для ее экспрессии в клетке. «Растительный промотор» может быть промотором, способным инициировать транскрипцию в растительных клетках. Примеры промоторов под контролем развития включают промоторы, которые предпочтительно инициируют транскрипцию в определенных тканях, таких как листья, корни, семена, волокна, сосуды ксилемы, трахеиды или склеренхима. Такие промоторы относятся к «тканепредпочтительным». Промоторы, которые инициируют транскрипцию только в определенных тканях, относятся к «тканеспецифичным». Промотор, «специфичный для клеточного типа», прежде всего управляет экспрессией в определенных типах клеток в одном или в нескольких органах, например в клетках сосудов в корнях или листьях. «Индуцируемый» промотор может быть промотором, который может быть обусловлен окружающей средой. Примеры условий окружающей среды, которые могут инициировать транскрипцию с помощью индуцируемых промоторов, включают анаэробные условия и наличие света. Тканеспецифичные, тканепредпочтительные, специфичные для клеточного типа и индуцируемые промоторы составляют класс «неконститутивных» промоторов. «Конститутивный» промотор является промотором, который может быть активен в большинстве условий, обусловленных окружающей средой, или в большинстве типов клеток или тканей
Любой индуцируемый промотор может использоваться в некоторых воплощениях по изобретению. См. Ward et al. (1993) Plant Mol. Biol. 22:361-366. С использованием индуцируемого промотора степень транскрипции увеличивается в ответ на индуцирующий агент. Иллюстративные индуцируемые промоторы включают, в частности: промоторы из системы ACEI, которые отвечают на медь; In2-ген из кукурузы, который отвечает на бензолсульфонамидные антидоты гербицидов; Tet-репрессор из Tn10; и индуцируемый промотор из гена стероидного гормона, транскрипционная активность которого может индуцироваться с помощью глюкокортикостероидного гормона (Schena et al. (1991) Proc. Natl. Acad. Sci. USA 88:0421).
Иллюстративные конститутивные промоторы включают в частности: промоторы из растительных вирусов, такие как 35S-промотор из вируса мозаики цветной капусты (CaMV); промоторы из рисовых генов актина; убиквитиновые промоторы; pEMU; MAS; кукурузный промотор гистона H3; и ALS-промотор, XbaI/NcoI-фрагмент в 5’-области структурного гена ALS3 Brassica napus (или нуклеотидная последовательность, гомологичная указанному XbaI/NcoI-фрагменту) (международная публикация PCT № WO 96/30530).
Кроме того, любой тканеспецифичный или тканепредпочтительный промотор может применяться в некоторых воплощениях по изобретению. Растения, трансформированные молекулой нуклеиновой кислоты, включающей кодирующую последовательность, функционально связанную с тканеспецифичным промотором, могут продуцировать продукт кодирующей последовательности исключительно или предпочтительно в специфических тканях. Иллюстративные тканеспецифичные или тканепредпочтительные промоторы включают, в частности: промотор, специфичный для корня, такой как из гена фазеолина; промотор, специфичный для листьев и свето-индуцируемый промотор, такой как из гена cab или rubisco; промотор, специфичный для пыльника, такой как из гена LAT52; промотор, специфичный для пыльцы, такой как из гена Zm13; и промотор, предпочтительный для микроспоры, такой как из гена apg.
Трансформация: При использовании в данном документе термин «трансформация» или «трансдукция» относится к переносу одной или нескольких молекул нуклеиновой кислоты в клетку. Клетка «трансформируется» с помощью молекулы нуклеиновой кислоты, трансдуцированной в клетку, когда молекула нуклеиновой кислоты начинает стабильно реплицироваться клеткой, или путем инкорпорации молекулы нуклеиновой кислоты в клеточный геном, или с помощью эписомной репликации. При использовании в данном документе термин «трансформация» охватывает все методы, с помощью которых молекула нуклеиновой кислоты может быть введена в клетку. Примеры включают, в частности: трансфекцию вирусными векторами; трансформацию плазмидными векторами; электропорацию (Fromm et al. (1986) Nature 319:791-3), липофекцию (Feigner et al. (1987) Proc. Natl. Acad. Sci. USA 84:7413-7), микроинъекцию (Mueller et al. (1978) Cell 15:579-85); Agrobacterium-опосредованный перенос (Fraley et al. (1983) Proc. Natl. Acad. Sci. USA 80:4803-7), прямое поглощение ДНК; и бомбардировку микрочастицами (Klein et al. (1987) Nature 327:70).
Трансген: Экзогенная последовательность нуклеиновой кислоты. В некоторых примерах трансгеном может быть последовательность, которая кодирует одну или обе цепи молекулы дцРНК, которая включает нуклеотидную последовательность, комплементарную молекуле нуклеиновой кислоты, имеющейся у насекомого-вредителя отряда жесткокрылых. Еще в одном воплощении трансген может представлять собой антисмысловую последовательность нуклеиновой кислоты, где экспрессия антисмысловой последовательности нуклеиновой кислоты ингибирует экспрессию последовательности нуклеиновой кислоты-мишени. Еще в одном воплощении трансген может представлять собой последовательность гена (например, гена устойчивости к гербициду), кодирующего промышленно или фармацевтически используемое соединение, или гена, кодирующего целевое сельскохозяйственное свойство. В этих и других примерах трансген может содержать регуляторные последовательности, функционально связанные с кодирующей последовательностью трансгена (например, промотор).
Вектор: Молекула нуклеиновой кислоты, вводимая в клетку, например, с получением трансформированной клетки. Вектор может включать последовательности нуклеиновой кислоты, которые дают ему возможность репликации в клетке-хозяине, такие как последовательность начала репликации. Примеры векторов включают в частности: плазмиду, космиду, бактериофаг или вирус, которые переносят экзогенную ДНК в клетку. Вектор также может включать один или несколько генов, антисмысловых последовательностей и/или генов маркеров селекции и других генетических элементов, известных в данной области. Вектор может трансдуцировать, трансформировать или инфицировать клетку, вызывая таким образом экспрессию в клетке молекул нуклеиновой кислоты и/или белков, кодируемых вектором. Вектор необязательно включает материалы для помощи в достижении входа молекулы нуклеиновой кислоты в клетку (например, липосомы, белковую оболочку и т.д.).
Выход: Стабильный выход примерно 100% или выше относительно выхода контрольных сортов, растущих в одинаковых местах в одно и то же время при одинаковых условиях. В конкретных воплощениях «повышенный выход» или «повышение выхода» означает, что культурный сорт растения имеет стабильный выход 105%-115% или выше относительно выхода контрольных сортов, растущих в тех же местах, содержащих значительную плотность насекомого-вредителя отряда жесткокрылых, которое наносит вред культуре, растущей в то же время и при тех же условиях.
При использовании в данном документе, до тех пор, пока не определено или не подразумевается иначе, артикли «a», «an» и «the» означают «по меньшей мере, один».
Если не определено иначе, то все технические и научные термины, использованные здесь, имеют тот же смысл, который вкладывается в них обычным специалистом в области, к которой принадлежит данное изобретение. Определения общих терминов в молекулярной биологии может быть обнаружено, например, в Lewin B., Genes V, Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); и Meyers R.A. (ed.), Molecular Biology and Biotechnology: A Comprehensive Desk Reference, VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8). Все проценты являются массовыми, и все пропорции смесей растворителей являются объемными, если не указано иначе. Все температуры представлены в градусах по Цельсию.
IV. Молекулы нуклеиновых кислот, включающие последовательности насекомого-вредителя отряда жесткокрылых
A. Краткое описание.
В данном документе описаны молекулы нуклеиновых кислот, применяемые для контроля за насекомыми-вредителями отряда жесткокрылых. Описанные молекулы нуклеиновых кислот включают последовательности-мишени (например, нативные гены и некодирующие последовательности), дцРНК, киРНК, шпРНК и миРНК. Например, в некоторых воплощениях описаны молекулы дцРНК, киРНК, миРНК и/или шпРНК, которые могут быть специфичны или комплементарны всей последовательности или части одной или нескольким нативным последовательностям нуклеиновых кислот насекомого-вредителя отряда жесткокрылых. В этих и других воплощениях нативная последовательность(и) нуклеиновой кислоты может быть геном(ами)-мишенью, продукт которой может быть, например и без ограничения: вовлечен в метаболический процесс; в репродуктивный процесс; или вовлечен в процесс развития личинки. Молекулы нуклеиновых кислот, описанные в данном документе, при введении в клетку, включающую, по меньшей мере, одну нативную последовательность нуклеиновой кислоты, которой молекулы нуклеиновых кислот специфично комплементарны, могут инициировать РНКи в клетке и могут заметно уменьшать или исключать экспрессию нативных последовательностей нуклеиновых кислот. В некоторых примерах уменьшение или исключение экспрессии гена-мишени с помощью молекулы нуклеиновой кислоты, включающей последовательность, специфично ей комплементарную, может быть летальным для насекомых-вредителей отряда жесткокрылых или может приводить к снижению их роста и/или репродукции.
В некоторых воплощениях может быть выбран, по меньшей мере, один ген-мишень насекомого-вредителя отряда жесткокрылых, где ген-мишень включает нуклеотидную последовательность, выбранную из группы, состоящей из D_vir_c47185_Caf1180 (SEQ ID NO:1); D_vir_c1229_VatpaseC (SEQ ID NO:2); D_vir_c1319_VatpaseH (SEQ ID NO:3), и Contig_01_Rho1_1-191_CDC42 (SEQ ID NO:4). В конкретных примерах выбирают ген-мишень насекомого-вредителя отряда жесткокрылых, где ген-мишень включает новую нуклеотидную последовательность SEQ ID NO:1.
В некоторых воплощениях ген-мишень может представлять собой молекулу нуклеиновой кислоты, включающей нуклеотидную последовательность, которая кодирует полипептид, включающий непрерывную аминокислотную последовательность, которая, по меньшей мере, на 85% идентична (например, примерно 90%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99%, примерно 100% или на 100% идентична) аминокислотной последовательности белкового продукта одного из генов D_vir_c47185_Caf1180 (SEQ ID NO:1); D_vir_c1229_VatpaseC (SEQ ID NO:2); D_vir_c1319_vatpaseH (SEQ ID NO:3); и Contig_01_Rho1_1-191_CDC42 (SEQ ID NO:4). Ген-мишень может представлять собой любую последовательность нуклеиновой кислоты насекомого-вредителя отряда жесткокрылых, посттранскрипционное ингибирование которой обладает пагубным эффектом по отношению к насекомому-вредителю отряда жесткокрылых или обеспечивает защитный эффект для растения против насекомого-вредителя отряда жесткокрылых. В конкретных примерах ген-мишень представляет собой молекулу нуклеиновой кислоты, включающую нуклеотидную последовательность, которая кодирует полипептид, включающий непрерывную аминокислотную последовательность, которая идентична, по меньшей мере, на 85%, примерно на 90%, примерно на 95%, примерно на 96%, примерно на 97%, примерно на 98%, примерно на 99%, примерно на 100% или идентична на 100% аминокислотной последовательности белкового продукта новой нуклеотидной последовательности SEQ ID NO:1.
Согласно изобретению предлагаются нуклеотидные последовательности, экспрессия которых приводит к получению молекулы РНК, включающей нуклеотидную последовательность, которая специфично комплементарна всей последовательности или части нативной молекулы РНК, которая кодируется кодирующей последовательностью насекомого-вредителя отряда жесткокрылых. В некоторых воплощениях после поглощения насекомым-вредителем отряда жесткокрылых экспрессированной молекулы РНК может быть получена отрицательная регуляция кодирующей последовательности в клетках насекомого-вредителя отряда жесткокрылых. В конкретных воплощениях отрицательная регуляция кодирующей последовательности в клетках насекомого-вредителя отряда жесткокрылых может привести к пагубному влиянию на рост, жизнеспособность, пролиферацию и/или репродукцию насекомого-вредителя отряда жесткокрылых.
В некоторых воплощениях последовательности-мишени включают транскрибируемые некодирующие последовательности РНК, такие как 5’UTR; 3’UTR; сплайсированные лидерные последовательности; интронные последовательности; «аутронные» последовательности (например, 5’UTR РНК, впоследствии модифицированная в процессе транс-сплайсинга); «донатронные» последовательности (например, некодирующие РНК, требующиеся для обеспечения донорных последовательностей для процесса транс-сплайсинга); и другие некодирующие транскрибируемые РНК генов-мишеней насекомого-вредителя отряда жесткокрылых. Такие последовательности могут быть получены как из моноцистронных генов, так и из полицистронных генов.
Таким образом, в данном документе применительно к некоторым воплощениям описаны молекулы иРНК (например, дцРНК, киРНК, миРНК и шпРНК), которые включают, по меньшей мере, одну нуклеотидную последовательность, которая специфично комплементарна всей последовательности или части последовательности-мишени насекомого-вредителя отряда жесткокрылых. В некоторых воплощениях молекула иРНК может включать нуклеотидную последовательность(и), которая комплементарна всей последовательности или части последовательностей-мишеней; например 2, 3, 4, 5, 6, 7, 8, 9, 10 или более последовательностям-мишеням. В конкретных воплощениях могут быть получены молекулы иРНК in vitro или in vivo с помощью генетически модифицированного организма, такого как растение или бактерия. Также раскрыты кДНК-последовательности, которые могут использоваться для получения молекул дцРНК, киРНК, миРНК и/или шпРНК, которые специфично комплементарны всей последовательности или части последовательности-мишени насекомого-вредителя отряда жесткокрылых. Кроме того, описаны рекомбинантные ДНК-конструкции для применения в целях достижения стабильной трансформации конкретных мишеней хозяина. Трансформированные мишени хозяина могут экспрессировать на эффективном уровне молекулы дцРНК, киРНК, миРНК и/или шпРНК из рекомбинантных ДНК-конструкций. Таким образом, также описан вектор для трансформации растения, включающий, по меньшей мере, одну нуклеотидную последовательность, функционально связанную с гетерологичным промотором, функциональным в растительной клетке, где экспрессия нуклеотидной последовательности(ей) приводит к получению молекулы РНК, включающей нуклеотидную последовательность, которая специфично комплементарна всей последовательности или части последовательности-мишени насекомого-вредителя отряда жесткокрылых.
В некоторых воплощениях молекулы нуклеиновых кислот, применяемые для контроля за насекомыми-вредителями отряда жесткокрылых, могут включать: всю последовательность или часть нативной последовательности нуклеиновой кислоты, выделенной из Diabrotica, D_vir_c47185_Caf1180 (SEQ ID NO:1); нуклеотидные последовательности, которые при экспрессии приводят к получению молекулы РНК, включающей нуклеотидную последовательность, которая специфично комплементарна всей последовательности или части нативной молекулы РНК, которая кодируется D_vir_c47185_Caf1180 (SEQ ID NO:1); молекулы иРНК (например, дцРНК, киРНК, миРНК и шпРНК), которые включают, по меньшей мере, одну нуклеотидную последовательность, которая специфично комплементарна всей последовательности или части D_vir_c47185_Caf1180 (SEQ ID NO:1); последовательности кДНК, которые могут использоваться для получения молекул дцРНК, молекул киРНК, молекул миРНК и/или молекул шпРНК, которые специфично комплементарны всей последовательности или части D_vir_c47185_Caf1180 (SEQ ID NO:1); и рекомбинантные ДНК-конструкции для применения в достижении стабильной трансформации конкретных мишеней хозяина, где трансформированная мишень хозяина включает одну или несколько вышеописанных молекул нуклеиновых кислот.
В этих и в других воплощениях дополнительные молекулы нуклеиновых кислот, применяемые для контроля за насекомым-вредителем отряда жесткокрылых, могут включать: D_vir_c1229_VatpaseC (субъединица C вакуолярной ATPазы) (SEQ ID NO:2); D_vir_c1319_VatpaseH (субъединица H вакуолярной ATPазы) (SEQ ID NO:3); и Contig_01_Rho1_1-191_CDC42 (Rho1, небольшой GTP-связывающий белок) (SEQ ID NO:4); нуклеотидные последовательности, которые при экспрессии приводят к получению молекулы РНК, включающей нуклеотидную последовательность, которая специфично комплементарна молекуле нативной РНК, которая кодируется D_vir_c1229_VatpaseC (SEQ ID NO:2); D_vir_c1319_VatpaseH (SEQ ID NO:3); или Contig_01_Rho1_1-191_CDC42 (SEQ ID NO:4); молекулы иРНК (например, дцРНК, киРНК, миРНК и шпРНК), которые включают, по меньшей мере, одну нуклеотидную последовательность, которая специфично комплементарна D_vir_c1229_VatpaseC (SEQ ID NO:2); D_vir_c1319_VatpaseH (SEQ ID NO:3); или Contig_01_Rho1_1-191_CDC42 (SEQ ID NO:4); последовательности кДНК, которые могут использоваться для получения молекул дцРНК, молекул киРНК, молекул миРНК и/или молекул шпРНК, которые специфично комплементарны D_vir_c1229_VatpaseC (SEQ ID NO:2); D_vir_c1319_VatpaseH (SEQ ID NO:3); или Contig_01_Rho1_1-191_CDC42 (SEQ ID NO:4); и рекомбинантные ДНК-конструкции для применения в целях достижения трансформации конкретных мишеней хозяина, где трансформированная мишень хозяина включает одну или несколько вышеописанных молекул нуклеиновых кислот.
B. Молекулы нуклеиновых кислот
В настоящем изобретении среди прочего предлагаются молекулы иРНК (например, дцРНК, киРНК, миРНК и шпРНК), которые ингибируют экспрессию гена-мишени в клетке, ткани или в органе насекомого-вредителя отряда жесткокрылых; а также молекулы ДНК, способные экспрессироваться в виде молекулы иРНК в клетке или в микроорганизме с ингибированием экспрессии гена-мишени в клетке, ткани или в органе насекомого-вредителя отряда жесткокрылых.
В некоторых воплощениях изобретения предлагается выделенная молекула нуклеиновой кислоты, включающая, по меньшей мере, одну (например, одну, две, три или более) нуклеотидную последовательность(и), выбранную из группы, состоящей из: SEQ ID NO:1; последовательности, комплементарной SEQ ID NO:1; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов SEQ ID NO:1; последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов SEQ ID NO:1; нативной кодирующей последовательности организма Diabrotica (например, WCR), включающей SEQ ID NO:1; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, включающей SEQ ID NO:1; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1; последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, включающей SEQ ID NO:1; последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, включающей SEQ ID NO:1; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1; и последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1. В конкретных воплощениях контакт с насекомым-вредителем отряда жесткокрылых или поглощение насекомым-вредителем отряда жесткокрылых выделенной последовательности нуклеиновой кислоты ингибирует рост, развитие, репродукцию и/или питание насекомого-вредителя отряда жесткокрылых.
В некоторых воплощениях выделенная молекула нуклеиновой кислоты по изобретению может дополнительно включать, по меньшей мере, одну (например, одну, две, три или более) нуклеотидную последовательность(и), выбранную из группы, состоящей из: SEQ ID NO:2; последовательности, комплементарной SEQ ID NO:2; SEQ ID NO:3; последовательности, комплементарной SEQ ID NO:3; SEQ ID NO:4; последовательности, комплементарной SEQ ID NO:4; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов любой из SEQ ID NO:2-4; последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов любой из SEQ ID NO:2-4; нативной кодирующей последовательности организма Diabrotica, включающей любую из SEQ ID NO:2-4; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, включающей любую из SEQ ID NO:2-4; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей любую из SEQ ID NO:2-4; последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей любую из SEQ ID NO:2-4; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, включающей любую из SEQ ID NO:2-4; последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, включающей любую из SEQ ID NO:2-4; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей любую из SEQ ID NO:2-4; и последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей любую из SEQ ID NO:2-4. В конкретных воплощениях контакт с насекомым-вредителем отряда жесткокрылых или поглощение насекомым-вредителем отряда жесткокрылых выделенной последовательности нуклеиновой кислоты ингибирует рост, развитие, репродукцию и/или питание насекомого-вредителя отряда жесткокрылых.
В некоторых воплощениях молекула нуклеиновой кислоты по изобретению может включать, по меньшей мере, одну (например, одну, две, три или более) последовательность(и) ДНК, способную экспрессироваться в виде молекулы иРНК в клетке или в микроорганизме с ингибированием экспрессии гена-мишени в клетке, ткани или в органе насекомого-вредителя отряда жесткокрылых. Такие последовательности ДНК могут быть функционально связаны с промоторной последовательностью, которая функционирует в клетке, содержащей молекулу ДНК, для инициации или усиления транскрипции кодируемой молекулы дцРНК. В одном воплощении, по меньшей мере, одна (например, одна, две, три или более) последовательность(ей) ДНК может быть выделена из SEQ ID NO:1. Производные SEQ ID NO:1 включают фрагменты SEQ ID NO:1. В некоторых воплощениях фрагмент SEQ ID NO:1 может включать, например, по меньшей мере, примерно 19 последовательно расположенных нуклеотидов SEQ ID NO:1, или комплементарную им последовательность. Таким образом, фрагмент SEQ ID NO:1 может включать, например, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 последовательно расположенных нуклеотидов SEQ ID NO:1, или комплементарную им последовательность. В этих и в других воплощениях фрагмент SEQ ID NO:1 может включать, например, более чем примерно 19 последовательно расположенных нуклеотидов SEQ ID NO:1, или комплементарную им последовательность. Таким образом, фрагмент SEQ ID NO:1 может включать, например, 19, 20, 21, примерно 25 (например, 22, 23, 24, 25, 26, 27, 28 и 29), примерно 30, примерно 40 (например, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 и 45), примерно 50, примерно 60, примерно 70, примерно 80, примерно 90, примерно 100, примерно 110, примерно 120, примерно 130, примерно 140, примерно 150, примерно 160, примерно 170, примерно 180, примерно 190, примерно 200 или более последовательно расположенных нуклеотидов SEQ ID NO:1, или комплементарную им последовательность.
В конкретных воплощениях, по меньшей мере, одна последовательность(и) ДНК, способная экспрессироваться в виде молекулы иРНК в клетке или в микроорганизме с ингибированием экспрессии гена-мишени в клетке, ткани или в органе насекомого-вредителя отряда жесткокрылых, может дополнительно включать последовательность(и) ДНК, которая выделена из нуклеотидной последовательности, выбранной из группы, включающей SEQ ID NO:2-4. Производные нуклеотидной последовательности, выбранной из группы, включающей SEQ ID NO:2-4, включают фрагменты одной или нескольких SEQ ID NO:2-4. В некоторых воплощениях фрагмент одной или нескольких SEQ ID NO:2-4 может включать, например, по меньшей мере, примерно 19 последовательно расположенных нуклеотидов любой из SEQ ID NO:2-4, или комплементарную им последовательность. Таким образом, фрагмент одной или нескольких SEQ ID NO:2-4 может включать, например, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 последовательно расположенных нуклеотидов любой из SEQ ID NO:2-4, или комплементарную им последовательность. В этих и в других воплощениях фрагмент одной или нескольких из SEQ ID NO:2-4 может включать, например, более чем примерно 19 последовательно расположенных нуклеотидов любой из SEQ ID NO:2-4, или комплементарную им последовательность. Таким образом, фрагмент одной или нескольких из SEQ ID NO:2-4 может включать, например, 19, 20, 21, примерно 25 (например, 22, 23, 24, 25, 26, 27, 28 и 29), примерно 30, примерно 40 (например, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 и 45), примерно 50, примерно 60, примерно 70, примерно 80, примерно 90, примерно 100, примерно 110, примерно 120, примерно 130, примерно 140, примерно 150, примерно 160, примерно 170, примерно 180, примерно 190, примерно 200 или более последовательно расположенных нуклеотидов одной или нескольких из SEQ ID NO:2-4, или комплементарную им последовательность.
Некоторые воплощения включают введение частично или полностью стабилизированных молекул дцРНК насекомому-вредителю отряда жесткокрылых для ингибирования экспрессии гена-мишени в клетке, ткани или в органе насекомого-вредителя отряда жесткокрылых. При экспрессии в виде молекулы иРНК (например, дцРНК, киРНК, миРНК и шпРНК) и будучи поглощенными насекомым-вредителем отряда жесткокрылых последовательности нуклеиновых кислот, включающие один или несколько фрагментов любой из SEQ ID NO:1-4, могут вызывать одно или несколько из следующего: гибель, ингибирование роста, изменение в соотношении полов, уменьшение размера выводка, прекращение заражения и/или прекращение поедания растения насекомым-вредителем отряда жесткокрылых. Например, в некоторых воплощениях предлагается молекула дцРНК, включающая нуклеотидную последовательность, включающую от примерно 19 до примерно 300 нуклеотидов, которая по существу гомологична последовательности гена-мишени насекомого-вредителя отряда жесткокрылых и включает один или несколько фрагментов SEQ ID NO:1. Специфические примеры молекул дцРНК, включающих, по меньшей мере, одну нуклеотидную последовательность, которая по существу гомологична SEQ ID NO:1, могут составлять по длине без ограничения, по меньшей мере, 19 нуклеотидов, 20, 21, примерно 25 (например, 22, 23, 24, 25, 26, 27, 28 и 29), примерно 30, примерно 40 (например, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 и 45), примерно 50, примерно 60, примерно 70, примерно 80, примерно 90, примерно 100, примерно 110, примерно 120, примерно 130, примерно 140, примерно 150, примерно 160, примерно 170, примерно 180, примерно 190, примерно 200 или более нуклеотидов. Такие молекулы дцРНК могут дополнительно включать один или несколько фрагментов SEQ ID NO:2-4. Экспрессия такой молекулы дцРНК может приводить, например, к смертности среди насекомых-вредителей отряда жесткокрылых, которые поглотили молекулу дцРНК.
В некоторых воплощениях молекулы дцРНК, предлагаемые по изобретению, включают нуклеотидные последовательности, комплементарные гену-мишени, включающему SEQ ID NO:1, и/или нуклеотидные последовательности, комплементарные фрагменту SEQ ID NO:1, причем ингибирование этого гена-мишени насекомого-вредителя отряда жесткокрылых приводит к уменьшению уровня или к удалению белкового или нуклеотидного агента, который является существенным для роста, развития или другой биологической функции насекомого-вредителя отряда жесткокрылых. Выбранная нуклеотидная последовательность может демонстрировать от примерно 80% до примерно 100% идентичности последовательности с SEQ ID NO:1, с непрерывным фрагментом нуклеотидной последовательности, представленной в SEQ ID NO:1, или с комплементарной последовательностью, любой из вышеописанных. Например, выбранная нуклеотидная последовательность может демонстрировать примерно 81%; примерно 82%; примерно 83%; примерно 84%; примерно 85%; примерно 86%; примерно 87%; примерно 88%; примерно 89%; примерно 90%; примерно 91%; примерно 92%; примерно 93%; примерно 94% примерно 95%; примерно 96%; примерно 97%; примерно 98%; примерно 98,5%; примерно 99%; примерно 99,5% или примерно 100% идентичности последовательности с SEQ ID NO:1, с непрерывным фрагментом нуклеотидной последовательности, представленной в SEQ ID NO:1, или с комплементарной последовательностью, любой из вышеописанных. В конкретных воплощениях молекулы дцРНК, предлагаемые по изобретению, могут дополнительно включать одну или несколько нуклеотидных последовательностей, комплементарных гену-мишени, включающему SEQ ID NO:2-4, причем ингибирование этого гена-мишени насекомого-вредителя отряда жесткокрылых приводит к уменьшению уровня или к удалению белкового или нуклеотидного агента, который является существенным для роста, развития или другой биологической функции насекомого-вредителя отряда жесткокрылых.
В некоторых воплощениях молекула ДНК, способная экспрессироваться в виде молекулы иРНК в клетке или микроорганизме с ингибированием экспрессии гена-мишени, может включать единственную нуклеотидную последовательность, которая специфично комплементарна всей последовательности или части нативной последовательности нуклеиновой кислоты, имеющейся в одном или нескольких видах насекомого-вредителя отряда жесткокрылых, или молекула ДНК может быть сконструирована в виде гибрида из множества специфично комплементарных последовательностей.
В некоторых воплощениях молекула нуклеиновой кислоты может включать первую и вторую нуклеотидные последовательности, разделенные с помощью «спейсерной последовательности». Спейсерная последовательность может представлять собой участок, включающий любую последовательность нуклеотидов, которая облегчает образование вторичной структуры между первой и второй нуклеотидными последовательностями там, где это целесообразно. В одном воплощении спейсерная последовательность является частью смысловой или антисмысловой кодирующей последовательности мРНК. Спейсерная последовательность может альтернативно включать любую комбинацию нуклеотидов или их гомологов, которые способны ковалентно связываться с молекулой нуклеиновой кислоты.
Например, в некоторых воплощениях молекула ДНК может включать нуклеотидную последовательность, кодирующую одну или несколько различных молекул РНК, где каждая из различных молекул РНК включает первую нуклеотидную последовательность и вторую нуклеотидную последовательность, где первая и вторая нуклеотидные последовательности комплементарны друг другу. Первая и вторая нуклеотидные последовательности могут быть связаны внутри молекулы РНК спейсерной последовательностью. Спейсерная последовательность может составлять часть первой нуклеотидной последовательности или второй нуклеотидной последовательности. Экспрессия молекулы РНК, включающей первую и вторую нуклеотидные последовательности, может приводить к образованию молекулы дцРНК по настоящему изобретению с помощью специфичной гибридизации первой и второй нуклеотидной последовательности. Первая нуклеотидная последовательность или вторая нуклеотидная последовательность может быть по существу идентична нативной последовательности нуклеиновой кислоты насекомого-вредителя отряда жесткокрылых (например, гену-мишени или транскрибируемой некодирующей последовательности), ее производному или ее комплементарной последовательности.
Молекулы дцРНК включают двойные цепи полимерных рибонуклеотидных последовательностей и могут включать модификации любого из компонентов фосфатно-сахарного остова или нуклеозидов. В структуре РНК могут быть сделаны модификации для возможности специфичного ингибирования. В одном воплощении молекулы дцРНК могут быть модифицированы посредством повсеместно распространенных ферментативных процессов, так что могут быть образованы молекулы киРНК. В ферментативном процессе может применяться фермент РНКаза III, такой как DICER в эукариотах, либо in vitro, либо in vivo. См. Elbashir et al. (2001) Nature 411:494-8; и Hamilton and Baulcombe (1999) Science 286(5441):950-2. DICER или ферменты, функционально эквивалентные РНКазе III, расщепляют более крупные цепи дцРНК и/или молекулы шпРНК до более коротких олигонуклеотидов (например, киРНК), длина каждого из которых составляет примерно 19-25 нуклеотидов. Молекулы киРНК, продуцированные этими ферментами, содержат 2-3 выступающих нуклеотида с 3’-стороны, и 5’-фосфат и 3’-гидрокси концы. Молекулы киРНК, полученные с помощью фермента РНКаза III, раскручены и разделены в клетке на одноцепочечные РНК. Молекулы киРНК затем специфично гибридизуются с последовательностями РНК, транскрибированными из гена-мишени, и обе молекулы РНК затем деградируют с помощью собственного клеточного РНК-деградирующего механизма. Данный процесс может приводить к эффективной деградации или к удалению последовательности РНК, кодируемой геном-мишенью в организме-мишени. Результатом является посттранскрипционный сайленсинг гена-мишени. В некоторых воплощениях молекулы киРНК, полученные с помощью эндогенных ферментов РНКаза III из гетерологичных молекул нуклеиновых кислот, могут эффективно опосредовать отрицательную регуляцию генов-мишеней насекомого-вредителя отряда жесткокрылых.
В некоторых воплощениях молекула нуклеиновой кислоты по изобретению может включать, по меньшей мере, одну искусственную нуклеотидную последовательность, которая может транскрибироваться в одноцепочечную молекулу РНК, способную к образованию молекулы дцРНК in vivo посредством межмолекулярной гибридизации. Такие последовательности дцРНК, как правило, способны к самосборке и могут обеспечиваться в источнике питания насекомого-вредителя отряда жесткокрылых для достижения посттранскрипционного ингибирования гена-мишени. В этих и в других воплощениях молекула нуклеиновой кислоты по изобретению может включать две различные искусственные нуклеотидные последовательности, каждая из которых специфично комплементарна различным генам-мишеням насекомого-вредителя отряда жесткокрылых. Когда такая молекула нуклеиновой кислоты предлагается в виде молекулы дцРНК насекомому-вредителю отряда жесткокрылых, то молекула дцРНК ингибирует экспрессию, по меньшей мере, двух различных генов-мишеней насекомого-вредителя отряда жесткокрылых.
C. Получение молекул нуклеиновых кислот
Множество нативных последовательностей насекомых-вредителей отряда жесткокрылых может использоваться для дизайна молекул нуклеиновых кислот по изобретению, таких как молекулы иРНК и молекулы ДНК, кодирующие иРНК. Однако селекция нативных последовательностей не является прямым процессом. Только небольшое количество нативных последовательностей насекомого-вредителя отряда жесткокрылых будет представлять собой эффективные мишени. Например, невозможно предсказать с определенностью, сможет ли конкретная нативная последовательность подвергаться эффективной отрицательной регуляции с помощью молекул нуклеиновых кислот по изобретению, или будет ли отрицательная регуляция конкретной нативной последовательности иметь пагубный эффект по отношению к росту, жизнеспособности, пролиферации и/или репродукции насекомого-вредителя отряда жесткокрылых. Огромное большинство нативных последовательностей насекомого-вредителя отряда жесткокрылых, таких как EST, выделенные из них (например, перечисленные в патенте США 7612194 и патенте США 7943819), не имеют пагубного эффекта по отношению к росту, жизнеспособности, пролиферации и/или репродукции насекомого-вредителя отряда жесткокрылых, такого как WCR или NCR. Нельзя предсказать, какая из нативных последовательностей, которая может иметь пагубный эффект по отношению к насекомому-вредителю отряда жесткокрылых, может использоваться в рекомбинантных методах для экспрессии молекул нуклеиновых кислот, комплементарных таким нативным последовательностям, в растении-хозяине, и для обеспечения пагубного эффекта по отношению к насекомому-вредителю отряда жесткокрылых при его питании, не причиняя при этом вреда растению-хозяину.
В некоторых воплощениях молекулы нуклеиновых кислот по изобретению (например, молекулы дцРНК, предоставленные в растении-хозяине насекомого-вредителя отряда жесткокрылых) селектируют на последовательности кДНК-мишени, кодирующие белки, существенные для выживаемости насекомого-вредителя отряда жесткокрылых, такие как аминокислотные последовательности, вовлеченные в метаболические и катаболические биохимические пути, клеточное деление, репродукцию, энергетический метаболизм, пищеварение, паразитирование и тому подобное. Описанное в данном документе поглощение композиций организмом-мишенью, содержащих одну или несколько дцРНК, по меньшей мере, один сегмент которой специфично комплементарен, по меньшей мере, по существу идентичному сегменту РНК, полученному в клетках патогена-мишени, может приводить к гибели или к другому ингибированию мишени. Нуклеотидная последовательность, или ДНК, или РНК, выделенная из насекомого-вредителя отряда жесткокрылых, может использоваться для конструкции растительных клеток, устойчивых к заражению насекомыми-вредителями отряда жесткокрылых. Растение-хозяин насекомого-вредителя отряда жесткокрылых (например, Z. mays или G. max), например, может быть трансформировано так, чтобы оно содержало одну или несколько нуклеотидных последовательностей, выделенных из насекомого-вредителя отряда жесткокрылых, как представлено в данном документе. Нуклеотидная последовательность, трансформированная в хозяина, может кодировать одну или несколько РНК, которые преобразуются в последовательность дцРНК в клетках или в биологических жидкостях внутри трансформированного хозяина, с получением таким образом дцРНК, доступных, если/когда у насекомого-вредителя отряда жесткокрылых образуется пищевая связь с трансгенным хозяином. Это может привести к подавлению экспрессии одного или нескольких генов в клетках насекомого-вредителя отряда жесткокрылых и, в конечном счете, к его гибели или к ингибированию его роста или развития.
Таким образом, в некоторых воплощениях мишенью является ген, который существенно вовлечен в рост, развитие и в репродукцию насекомого-вредителя отряда жесткокрылых. Другие гены-мишени для применения в настоящем изобретении могу включать, например, те гены, которые играют важную роль в жизнеспособности, двигательных функциях, миграции, в росте, развитии, заражающей способности, создании мест питания и в репродукции насекомого-вредителя отряда жесткокрылых. Таким образом, геном-мишенью может быть ген домашнего хозяйства или транскрипционный фактор. Кроме того, нативная последовательность насекомого-вредителя отряда жесткокрылых для применения в настоящем изобретении также может быть выделена из гомолога (например, ортолога), растительного, вирусного, бактериального гена или из гена насекомых, функция которого известна специалистам в данной области и нуклеотидная последовательность которого специфично гибридизуется с геном-мишенью в геноме насекомого-вредителя отряда жесткокрылых, которое является мишенью. Методы идентификации гомолога гена с известной нуклеотидной последовательностью с помощью гибридизации хорошо известны специалистам в данной области.
В некоторых воплощениях в изобретении предлагаются способы получения молекулы нуклеиновой кислоты, включающей нуклеотидную последовательность для продуцирования молекулы иРНК (например, дцРНК, киРНК, миРНК и шпРНК). Одно такое воплощение включает: (a) анализ одного или нескольких генов-мишеней на предмет их экспрессии, функции и фенотипа при дцРНК-опосредованном подавлении гена насекомого-вредителя отряда жесткокрылых; (b) гибридизацию кДНК- или гДНК-библиотеки с зондом, включающим всю последовательность или часть нуклеотидной последовательности или ее гомолога из насекомого-вредителя отряда жесткокрылых, которое является мишенью и которое демонстрирует измененный (например, уменьшенный рост) фенотип роста или развития при применении анализа дцРНК-опосредованного подавления; (c) идентификацию клона ДНК, который специфично гибридизуется с зондом; (d) выделение клона ДНК, идентифицированного в стадии (b); (e) секвенирование кДНК- или гДНК-фрагмента, который включает клон, выделенный в стадии (d), где секвенированная молекула нуклеиновой кислоты транскрибирует всю или существенную часть последовательности РНК или ее гомолога; и (f) химический синтез всей последовательности или существенной части последовательности гена или киРНК, или миРНК, или шпРНК, или мРНК, или дцРНК.
В следующих воплощениях способ получения фрагмента нуклеиновой кислоты, включающей нуклеотидную последовательность для продуцирования существенной части молекулы иРНК (например, дцРНК, киРНК, миРНК и шпРНК), включает: (a) синтез первого и второго олигонуклеотидных праймеров, специфично комплементарных участку нативной нуклеотидной последовательности насекомого-вредителя отряда жесткокрылых, которое является мишенью; и (b) амплификацию кДНК- или гДНК-вставки, присутствующей в клонирующем векторе с использованием первого и второго праймеров стадии (a), где амплифицированная молекула нуклеиновой кислоты транскрибирует существенную часть молекулы киРНК, или миРНК, или шпРНК, или мРНК, или дцРНК.
Нуклеиновые кислоты по изобретению могут быть выделены, амплифицированы или получены с помощью ряда способов. Например, молекула иРНК (например, дцРНК, киРНК, миРНК и шпРНК) может быть получена с помощью ПЦР-амплификации последовательности нуклеиновой кислоты-мишени или ее части (например, гена-мишени или транскрибируемой некодирующей последовательности-мишени), выделенной из гДНК- или кДНК-библиотеки. ДНК или РНК может быть экстрагирована из организма-мишени, и из нее могут быть получены библиотеки нуклеиновых кислот с использованием методов, известных специалистам в данной области. гДНК- или кДНК-библиотеки, полученные из организма-мишени, могут использоваться для ПЦР-амплификации и секвенирования генов-мишеней. Подтвержденный ПЦР-продукт может использоваться в качестве матрицы для in vitro транскрипции с получением смысловой или антисмысловой РНК с минимальными промоторами. Альтернативно, молекулы нуклеиновых кислот могут быть синтезированы с помощью любого из ряда методов (см., например, Ozaki et al. (1992) Nucleic Acids Research, 20: 5205-5214; и Agrawal et al. (1990) Nucleic Acids Research, 18: 5419-5423), включающих использование автоматического ДНК-синтезатора (например, P.E. Biosystems, Inc. (Foster City, Calif.) модель 392 или 394 ДНК/РНК-синтезатор), с использованием стандартных химических реакций, таких как химия фосфорамидитов. См., например, Beaucage et al. (1992) Tetrahedron, 48:2223-2311; патенты США 4980460, 4725677, 4415732, 4458066 и 4973679. Также могут применяться альтернативные химические реакции, приводящие к получению искусственных групп остова, таких как фосфоротиоат, фосфорамидат и тому подобные.
Молекула РНК, дцРНК, киРНК, миРНК или шпРНК по настоящему изобретению может быть получена химически или ферментативно специалистом в данной области посредством ручных или автоматических реакций, или in vivo в клетке, включающей молекулу нуклеиновой кислоты, включающую последовательность, кодирующую молекулу РНК, дцРНК, киРНК, миРНК или шпРНК. РНК также может быть получена с помощью частичного или общего органического синтеза, любой модифицированный рибонуклеотид может быть введен с помощью in vitro ферментативного или органического синтеза. Молекула РНК может быть синтезирована с помощью клеточной РНК-полимеразы или РНК-полимеразы бактериофага (например, T3 РНК-полимеразы, T7 РНК-полимеразы и SP6 РНК-полимеразы). В данной области известны экспрессирующие конструкции, применяемые для клонирования и экспрессии нуклеотидных последовательностей. См., например, международную PCT публикацию № WO 97/32016; и патенты США 5593874, 5698425, 5712135, 5789214 и 5804693. Молекулы РНК, которые синтезируются химически или с помощью in vitro ферментативного синтеза, могут быть очищены перед введением в клетку. Например, молекулы РНК могут быть очищены из смеси путем экстракции с использованием растворителя или смолы, осаждения, электрофореза, хроматографии или их комбинации. Альтернативно, молекулы РНК, которые синтезируются химически или с помощью in vitro ферментативного синтеза, могут использоваться без очистки или с минимальной очисткой, например, чтобы избежать потерь, связанных с процессированием образца. Молекулы РНК могут быть высушены для хранения или растворены в водном растворе. Раствор может содержать буферы или соли для стимулирования отжига и/или стабилизации двойных цепей молекулы дцРНК.
В воплощениях молекула дцРНК может образовываться с помощью одной самокомплементарной цепи РНК или из двух комплементарных цепей РНК. Молекулы дцРНК могут быть синтезированы или in vivo, или in vitro. Эндогенная РНК-полимераза клетки может опосредовать транскрипцию одной или двух цепей РНК in vivo, или может использоваться клонированная РНК-полимераза для опосредования транскрипции in vivo или in vitro. Посттранскрипционное ингибирование гена-мишени насекомого-вредителя отряда жесткокрылых может направленно воздействовать через хозяина с помощью специфичной транскрипции в органе, ткани или в типе клеток хозяина (например, путем применения тканеспецифичного промотора); с помощью стимулирования условий окружающей среды в хозяине (например, путем применения индуцируемого промотора, который отвечает за заражение, стресс, температуру, и/или с помощью химических индукторов); и/или путем созданной транскрипции на определенной стадии развития или определенного возраста хозяина (например, путем применения промотора, специфичного для определенной стадии развития). Цепи РНК, которые образуют молекулу дцРНК, транскрибированную либо in vitro, либо in vivo, могут быть или полиаденилированными или не полиаденилированными, и могут быть способны или не способны транслироваться в полипептид с помощью клеточного аппарата трансляции.
D. Рекомбинантные векторы и трансформация клетки-хозяина
В некоторых воплощениях изобретения для введения в клетку (например, в бактериальную клетку, дрожжевую клетку или в растительную клетку) также предлагается молекула ДНК, которая включает нуклеотидную последовательность, при экспрессии которой до РНК и при поглощении насекомым-вредителем отряда жесткокрылых достигают подавления гена-мишени в клетке, ткани или в органе насекомого вредителя отряда жесткокрылых. Таким образом, в некоторых воплощениях предлагается рекомбинантная молекула нуклеиновой кислоты, включающая последовательность нуклеиновой кислоты, способную экспрессироваться в виде молекулы иРНК (например, дцРНК, киРНК, миРНК и шпРНК) в растительной клетке с ингибированием экспрессии гена-мишени насекомого-вредителя отряда жесткокрылых. С целью инициирования или повышения экспрессии такие молекулы нуклеиновых кислот могут включать одну или несколько регуляторных последовательностей, которые могут быть функционально связаны с последовательностью нуклеиновой кислоты, способной экспрессироватья в виде иРНК. Методы экспрессии в растениях молекулы, подавляющей ген, известны и могут использоваться для экспрессии нуклеотидной последовательности по настоящему изобретению. См., например, международную PCT публикацию № WO06073727 и патентную публикацию США № 2006/0200878 Al).
В конкретных воплощениях молекула рекомбинантной ДНК по изобретению может включать последовательность нуклеиновой кислоты, кодирующей молекулу дцРНК. Такие молекулы рекомбинантной ДНК могут кодировать молекулы дцРНК, способные ингибировать экспрессию эндогенного гена-мишени(ей) насекомого-вредителя отряда жесткокрылых при поглощении. Во многих воплощениях транскрибированная молекула дцРНК может предлагаться в стабилизированной форме, например в виде шпильки и структуры стебель и петля.
В этих и в других воплощениях изобретения одна цепь молекулы дцРНК может быть образована путем транскрипции из нуклеотидной последовательности, которая по существу гомологична нуклеотидной последовательности, выбранной из группы, состоящей из: SEQ ID NO:1; последовательности, комплементарной SEQ ID NO:1; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов SEQ ID NO:1; последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов SEQ ID NO:1; нативной кодирующей последовательности организма Diabrotica (например, WCR), включающей SEQ ID NO:1; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, включающей SEQ ID NO:1; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1; последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica (например, WCR), включающей SEQ ID NO:1; последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, включающей SEQ ID NO:1; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1; и последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1.
Одна цепь молекулы дцРНК также может быть образована путем транскрипции из нуклеотидной последовательности, которая по существу гомологична нуклеотидной последовательности, выбранной из группы, состоящей из: SEQ ID NO:2; последовательности, комплементарной SEQ ID NO:2; SEQ ID NO:3; последовательности, комплементарной SEQ ID NO:3; SEQ ID NO:4; последовательности, комплементарной SEQ ID NO:4; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов любой из SEQ ID NO:2-4; последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов любой из SEQ ID NO:2-4; нативной кодирующей последовательности организма Diabrotica (например, WCR), включающей любую из SEQ ID NO:2-4; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica (например, WCR), включающей любую из SEQ ID NO:2-4; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей любую из SEQ ID NO:2-4; последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей любую из SEQ ID NO:2-4; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica (например, WCR), включающей любую из SEQ ID NO:2-4; последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, включающей любую из SEQ ID NO:2-4; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей любую из SEQ ID NO:2-4; и последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей любую из SEQ ID NO:2-4.
В конкретных воплощениях молекула рекомбинантной ДНК, кодирующей молекулу дцРНК, может включать, по меньшей мере, две нуклеотидные последовательности с таким расположением кодирующей последовательности, что одна нуклеотидная последовательность находится в смысловой ориентации, а другая нуклеотидная последовательность в антисмысловой ориентации по отношению к, по меньшей мере, одному промотору, где смысловая нуклеотидная последовательность и антисмысловая нуклеотидная последовательность связаны или соединены посредством спейсерной последовательности от примерно пяти (~5) до примерно тысячи (~1000) нуклеотидов. Спейсерная последовательность может образовывать петлю между смысловой и антисмысловой последовательностями. Смысловая нуклеотидная последовательность или антисмысловая нуклеотидная последовательность может быть по существу гомологична нуклеотидной последовательности гена-мишени (например, гена, включающего одну из SEQ ID NO:1-4) или его фрагменту. Однако в некоторых воплощениях молекула рекомбинантной ДНК может кодировать молекулу дцРНК без спейсерной последовательности. В воплощениях смысловая кодирующая последовательность и антисмысловая кодирующая последовательность могут отличаться по длине.
Последовательности, идентифицированные как имеющие пагубный эффект по отношению к насекомому-вредителю отряда жесткокрылых или защитный эффект для растения по отношению к насекомым-вредителям отряда жесткокрылых, могут быть легко инкорпорированы в экспрессирующиеся молекулы дцРНК посредством создания соответствующих экспрессирующих кассет в молекуле рекомбинантной нуклеиновой кислоты по изобретению. Например, такие последовательности могут экспрессироваться в виде шпильки со структурой стебля и петли путем использования первого сегмента, соответствующего последовательности гена-мишени (например, SEQ ID NO:1 и ее фрагменты); соединения этой последовательности со вторым сегментом в виде спейсерного участка, который не является гомологичным или комплементарным первому сегменту; и соединения этого и третьего сегмента, где, по меньшей мере, часть третьего сегмента по существу комплементарна первому сегменту. Такие конструкции образуют структуру стебля и петли путем гибридизации первого сегмента с третьим сегментом, где структура петли образуется с включением второго сегмента. См., например, патентные публикации США №№ US 2002/0048814 и US 2003/0018993; и международные PCT публикации №№ WO94/01550 и WO98/05770. Молекула дцРНК может быть получена, например, в форме двухцепочечной структуры, такой как структура стебель-петля (например, шпилька), посредством чего повышается продуцирование киРНК с направленным воздействием на нативную последовательность насекомого-вредителя отряда жесткокрылых путем коэкспрессии фрагмента гена-мишени, например, на дополнительной кассете, способной экспрессироваться в растениях, что приводит к повышенному продуцированию киРНК или уменьшает метилирование для предотвращения транскрипционного генного сайленсинга шпилечного промотора дцРНК.
Воплощения изобретения включают продуцирование молекулы рекомбинантной нуклеиновой кислоты по настоящему изобретению в растении (т.е. трансформацию) для достижения ингибирующего уровня экспрессии одной или нескольких молекул иРНК по отношению к насекомому-вредителю отряда жесткокрылых. Молекула рекомбинантной ДНК может, например, быть вектором, таким как линейная или замкнутая циклическая плазмида. Векторная система может быть одиночным вектором, или плазмидой, или двумя или несколькими векторами или плазмидами, которые вместе содержат общую ДНК, вводимую в геном хозяина. Кроме того, вектор может быть экспрессирующим вектором. Последовательности нуклеиновых кислот по изобретению, например, могут быть подходящим образом вставлены в вектор под контролем подходящего промотора, который функционирует в одном или в нескольких хозяевах для управления экспрессией соединенной с ним кодирующей последовательности или другой последовательности ДНК. Множество векторов доступны для данной цели, и выбор соответствующего вектора будет зависеть главным образом от размера нуклеиновой кислоты, вставленной в вектор, и от конкретной клетки-хозяина, трансформируемой вектором. Каждый вектор содержит компоненты в зависимости от его функции (например, амплификация ДНК или экспрессия ДНК) и конкретной клетки-хозяина, с которой он совместим.
Для передачи трансгенному растению устойчивости к насекомому-вредителю отряда жесткокрылых рекомбинантная ДНК может, например, транскрибироваться в виде молекулы иРНК (например, молекула РНК, которая образует молекулу дцРНК) в тканях или жидкостях рекомбинантного растения. Молекула иРНК может включать нуклеотидную последовательность, которая по существу гомологична и специфично гибридизуется с соответствующей транскрибирующейся нуклеотидной последовательностью насекомого-вредителя отряда жесткокрылых, которое может питаться на видах растений-хозяев. Насекомое-вредитель отряда жесткокрылых может контактировать с молекулой иРНК, которая транскрибируется в клетках трансгенного растения-хозяина, например, при поглощении клеток или жидкостей трансгенного растения-хозяина, которое включает молекулу иРНК. Таким образом, экспрессия гена-мишени подавляется с помощью молекулы иРНК в насекомом-вредителе отряда жесткокрылых, которое заражает трансгенное растение-хозяин. В некоторых воплощениях подавление экспрессии гена-мишени насекомого-вредителя отряда жесткокрылых, которое является мишенью, может привести к тому, что растение будет устойчивым к насекомому-вредителю.
Для возможной доставки молекул иРНК насекомому-вредителю отряда жесткокрылых, которое находится в пищевой связи с растительной клеткой, которая трансформирована рекомбинантной молекулой нуклеиновой кислоты по изобретению, требуется экспрессия (т.е. транскрипция) молекул иРНК в растительных клетках. Таким образом, молекула рекомбинантной нуклеиновой кислоты может включать нуклеотидную последовательность по изобретению, функционально связанную с одной или несколькими регуляторными последовательностями, такими как последовательность гетерологичного промотора, который функционирует в клетке-хозяине, такой как бактериальная клетка, где молекула нуклеиновой кислоты будет амплифицироваться, или растительная клетка, где молекула нуклеиновой кислоты будет экспрессироваться.
Промоторы, подходящие для использования в молекулах нуклеиновых кислот по изобретению, включают индуцируемые промоторы, вирусные, синтетические или конститутивные, каждый из которых хорошо известен в данной области. Частные примеры, описывающие такие промоторы, включают патенты США №№ 6437217 (кукурузный промотор RS81); 5641876 (рисовый актиновый промотор); 6426446 (кукурузный промотор RS324); 6429362 (кукурузный промотор PR-1); 6232526 (кукурузный промотор A3); 6177611 (конститутивные кукурузные промоторы); 5322938, 5352605, 5359142 и 5530196 (промотор 35S); 6433252 (кукурузный промотор L3 олеозина); 6429357 (рисовый промотор актина 2 и рисовый интрон актина 2); 6294714 (свето-индуцируемые промоторы); 6140078 (промоторы, индуцируемые солью); 6252138 (промоторы, индуцируемые патогенами); 6175060 (промоторы, индуцируемые дефицитом фосфора); 6388170 (двунаправленные промоторы); 6635806 (промотор гамма-коиксина); и патентную заявку США № 09/757089 (кукурузный промотор альдолазы хлоропластов). Дополнительные промоторы включают промотор нопалин-синтазы (NOS) (Ebert et al. (1987) Proc. Natl. Acad. Sci. USA 84(16):5745-9) и промотор октопин-синтазы (OCS) (каждый из которых несет опухолеиндуцирующая плазмида Agrobacterium tumefaciens); колимовирусные промоторы, такие как промотор 19S вируса мозаики цветной капусты (CaMV) (Lawton et al. (1987) Plant Mol. Biol. 9:315-24); промотор 35S CaMV (Odell et al. (1985) Nature 313:810-2; промотор 35S вируса мозаики норичника (Walker et al. (1987) Proc. Natl. Acad. Sci. USA 84(19):6624-8); промотор синтазы сахарозы (Yang and Russell (1990) Proc. Natl. Acad. Sci. USA 87:4144-8); комплексный промотор гена R (Chandler et al. (1989) Plant Cell 1:1175-83); промотор гена, кодирующего белок, связывающий хлорофилл a/b; CaMV35S (патенты США №№ 5322938, 5352605, 5359142 и 5530196); FMV35S (патенты США №№ 6051753 и 5378619); PC1SV-промотор (патент США № 5850019); SCP1-промотор (патент США № 6677503); и промоторы AGRtu.nos (регистрационный номер GenBank № V00087; Depicker et al. (1982) J. Mol. Appl. Genet. 1:561-73; Bevan et al. (1983) Nature 304:184-7).
В конкретных воплощениях молекулы нуклеиновой кислоты по изобретению включают тканеспецифичный промотор, такой как промотор, специфичный для корня. Промоторы, специфичные для корня, управляют экспрессией функционально связанных последовательностей исключительно или предпочтительно в тканях корня. Примеры промоторов, специфичных для корня, известны в данной области. См., например, патенты США 5110732; 5459252 и 5837848; и Opperman et al. (1994) Science 263:221-3; и Huston et al. (1992) Plant Mol. Biol. 20:207-18. В некоторых воплощениях нуклеотидная последовательность или фрагмент для контроля за насекомым-вредителем отряда жесткокрылых по изобретению могут быть клонированы в трансгенную растительную клетку между двумя специфичными для корня промоторами, которые функционально связаны, и могут там экспрессироваться с получением в трансгенной растительной клетке молекул РНК, которые могут затем образовывать молекулы дцРНК, как описано выше. Молекулы иРНК, экспрессированные в растительных тканях, могут поглощаться насекомым-вредителем отряда жесткокрылых так, что достигается подавление экспрессии гена.
Дополнительные регуляторные последовательности, которые необязательно могут быть функционально связанными с интересующей молекулой нуклеиновой кислоты, включают 5’-UTR, локализованные между промоторной последовательностью и кодирующей последовательностью, которая функционирует в качестве лидерной последовательности трансляции. Лидерная последовательность трансляции присутствует в полностью процессированной мРНК и может влиять на процессинг первичного транскрипта и/или на стабильность РНК. Примеры лидерных последовательностей трансляции включают лидеры белков теплового шока кукурузы и петуньи (патент США № 5362865), лидеры белков оболочки вирусов растений, лидеры растительного белка rubisco и другие. См., например, Turner and Foster (1995) Molecular Biotech. 3(3):225-36. Частные примеры 5’-UTR включают GmHsp (патент США № 5659122); PhDnaK (патент США № 5362865); AtAnt1; TEV (Carrington and Freed (1990) J. Virol. 64:1590-7); и AGRtunos (регистрационный номер GenBank № V00087; и Bevan et al. (1983) Nature 304:184-7).
Дополнительные регуляторные последовательности, которые необязательно могут быть функционально связаны с интересующей молекулой нуклеиновой кислоты, также включают 3’-нетранслируемые последовательности, 3’-участки терминации транскрипции или участки полиаденилирования. Они представляют собой генетические элементы, локализованные в 3’-области по отношению к нуклеотидной последовательности, и включают полинуклеотиды, которые обеспечивают сигнал полиаденилирования и/или другие регуляторные сигналы, способные влиять на транскрипцию или процессинг мРНК. Сигнал полиаденилирования функционирует в растениях, чтобы вызывать вставку полиаденилатных нуклеотидов к 3’-концу предшественника мРНК. Последовательность полиаденилирования может быть выделена из множества растительных генов или из генов T-ДНК. Частный пример 3’-участка терминации транскрипции представляет собой 3’-участок нопалин-синтазы (nos 3’; Fraley et al. (1983) Proc. Natl. Acad. Sci. USA 80:4803-7). Пример применения различных нетранслируемых 3’-участков предлагается в Ingelbrecht et al., (1989) Plant Cell 1:671-80. Неограничивающие примеры сигналов полиаденилирования включают сигналы из гена bcS2 Pisum sativum (Ps.RbcS2-E9; Coruzzi et al. (1984) EMBO J. 3:1671-9) и AGRtu.nos (регистрационный номер GenBank № E01312).
Некоторые воплощения могут включать вектор трансформации растений, который включает выделенную и очищенную молекулу ДНК, включающую, по меньшей мере, одну из вышеописанных регуляторных последовательностей, функционально связанных с одной или несколькими нуклеотидными последовательностями по настоящему изобретению. При экспрессии одна или несколько нуклеотидных последовательностей приводит к получению одной или нескольких молекул РНК, включающих нуклеотидную последовательность, которая специфично комплементарна всей последовательности или части нативной молекулы РНК насекомого-вредителя отряда жесткокрылых. Таким образом, нуклеотидные последовательности могут включать сегмент, кодирующий всю последовательность или часть рибонуклеотидной последовательности, присутствующей внутри РНК-транскрипта насекомого-вредителя отряда жесткокрылых, которое является мишенью, и может включать инвертированные повторы всей последовательности или части транскрипта насекомого-вредителя отряда жесткокрылых, которое является мишенью. Вектор для трансформации растений может содержать последовательности, специфично комплементарные более чем одной последовательности-мишени, позволяя таким образом продуцирование более чем одной дцРНК для ингибирования экспрессии двух или более генов в клетках одной или более популяций или видов насекомого-вредителя отряда жесткокрылых, которое является мишенью. Сегменты нуклеотидной последовательности, специфично комплементарные нуклеотидной последовательности, присутствующей в различных генах, могут быть объединены в одной композитной молекуле нуклеиновой кислоты для экспрессии в трансгенном растении. Такие сегменты могут быть непрерывными или разделенными спейсерной последовательностью.
В некоторых воплощениях плазмида по настоящему изобретению, уже содержащая, по меньшей мере, одну нуклеотидную последовательность(и) по изобретению, может быть модифицирована путем последовательной вставки дополнительной нуклеотидной последовательности(ей) в одну и ту же плазмиду, где дополнительная нуклеотидная последовательность(и) функционально связана с теми же регуляторными элементами, что и исходная, по меньшей мере, одна нуклеотидная последовательность(и). В некоторых воплощениях молекула нуклеиновой кислоты может быть сконструирована для ингибирования множества генов-мишеней. В некоторых воплощениях множество ингибируемых генов может быть получено из того же вида насекомого-вредителя отряда жесткокрылых, что может повысить эффективность молекулы нуклеиновой кислоты. В других воплощениях гены могут быть выделены из различных насекомых-вредителей отряда жесткокрылых, что может расширить спектр насекомых-вредителей отряда жесткокрылых, против которых эффективен агент(ы). Когда множество генов является мишенью для подавления или мишенью для комбинации экспрессии и подавления, то может быть сконструирован полицистронный элемент ДНК.
Рекомбинантная молекула нуклеиновой кислоты или вектор по настоящему изобретению может включать маркер селекции, который придает селектируемый фенотип трансформированной клетке, такой как растительная клетка. Маркер селекции может использоваться для селекции растительных клеток, которые включают рекомбинантные молекулы нуклеиновой кислоты по изобретению. Маркер может кодировать ген устойчивости к биоциду, ген устойчивости к антибиотику (например, в канамицину, Генетицину (G418), блеомицину, гигромицину и т.д.) или ген устойчивости к гербициду (например, глифосат и т.д.). Примеры маркеров селекции включают в частности: ген neo, который кодирует устойчивость к канамицину и может селектироваться при использовании канамицина, G418 и т.д.; ген bar, который кодирует устойчивость к биалафосу; мутантный ген EPSP-синтазы, который кодирует устойчивость к глифосату; ген нитрилазы, который придает устойчивость к бромксинилу; мутантный ген ацетолактат-синтазы (ALS), который придает устойчивость к имидазолинону или к сульфонилмочевине; и ген DHFR устойчивости к метотрексату. Доступно множество маркеров селекции, которые придают устойчивость к ампициллину, хлорамфениколу, гентамицину. гигромицину, канамицину, линкомицину, метотрексату, фосфинотрицину, пуромицину, спектиномицину, рифампицину, стрептомицину и к тетрациклину и тому подобное. Примеры таких маркеров селекции проиллюстрированы, например, в патентах США №№ 5550318; 5633435; 5780708 и 6118047.
Рекомбинантная молекула нуклеиновой кислоты или вектор по настоящему изобретению также может включать маркер скрининга. Маркеры скрининга могут использоваться для отслеживания экспрессии. Иллюстративные маркеры скрининга включают ген β-глюкуронидазы или uidA (GUS), который кодирует фермент, для которого известно множество хромогенных субстратов (Jefferson et al. (1987) Plant Mol. Biol. Rep. 5:387-405); и ген R-локуса, который кодирует продукт, который регулирует продуцирование антоцианиновых пигментов (красный цвет) в растительных тканях (Dellaporta et al. (1988) “Molecular cloning of the maize R-nj allele by transposon tagging with Ac.” In 18th Stadler Genetics Symposium, P. Gustafson and R. Appels, eds. (New York: Plenum), pp. 263-82); ген β-лактамазы (Sutcliffe et al. (1978) Proc. Natl. Acad. Sci. USA 75:3737-41); ген, который кодирует фермент, для которого известны различные хромогенные субстраты (например, PADAC, хромогенный цефалоспорин); ген люциферазы (Ow et al. (1986) Science 234:856-9); ген xylE, который кодирует катехин-диоксигеназу, которая может конвертировать хромогенные катехины (Zukowski et al. (1983) Gene 46(2-3):247-55); ген амилазы (Ikatu et al. (1990) Bio/Technol. 8:241-2); ген тирозиназы, который кодирует фермент, способный к окислению тирозина до DOPA и допахинона, который в свою очередь конденсирует меланин (Katz et al. (1983) J. Gen. Microbiol. 129:2703-14); и ген α-галактозидазы.
В некоторых воплощениях рекомбинантные молекулы нуклеиновых кислот, как описано выше, могут использоваться в способах для создания трансгенных растений и экспрессии гетерологичных нуклеиновых кислот в растениях с получением трансгенных растений, которые проявляют пониженную чувствительность к насекомым-вредителям отряда жесткокрылых. Векторы для трансформации растений могут быть получены, например, путем вставки молекул нуклеиновых кислот, кодирующих молекулы иРНК, в векторы для трансформации растений и путем введения их в растения.
Подходящие методы для трансформации клеток-хозяев включают любой метод, с помощью которого ДНК может вводиться в клетку, такой как трансформация протопластов (см., например, патент США 5508184), путем поглощения ДНК, опосредованного высушиванием/ингибированием (см., например, Potrykus et al. (1985) Mol. Gen. Genet. 199:183-8), с помощью электропорации (см., например, патент США 5384253), с помощью интенсивного вращения вместе с нитевидными кристаллами карбида кремния (см., например, патенты США 5302523 и 5464765), с помощью трансформации, опосредованной Agrobacterium (см., например, патенты США 5563055; 5591616; 5693512; 5824877; 5981840 и 6384301), и с помощью ускорения частиц, покрытых ДНК (см., например, патенты США №№ 5015580; 5550318; 5538880; 6160208; 6399861; и 6403865), и т.д. Методы, которые особенно применимы для трансформации кукурузы, описаны, например, в патентах США №№ 7060876 и 5591616; и в международной публикации PCT WO 95/06722. С использованием методов из заявок, таких как вышеперечисленные, фактически могут быть стабильно трансформированы клетки любого вида. В некоторых воплощениях трансформирующая ДНК интегрирована в геном клетки-хозяина. В случае многоклеточных организмов трансгенные клетки могут быть регенерированы в трансгенном организме. Любой из этих методов может использоваться для получения трансгенного растения, например, включающего одну или несколько последовательностей нуклеиновых кислот, кодирующих одну или несколько молекул иРНК, в геноме трансгенного растения.
Наиболее широко применяемый метод для введения экспрессирующего вектора в растения основан на природной системе трансформации Agrobacterium, A. tumefaciens и A. rhizogenes, которые являются патогенными для растений почвенными бактериями, которые генетически трансформируют растительные клетки. Плазмиды Ti и Ri A. tumefaciens и A. rhizogenes соответственно несут гены, ответственные за генетическую трансформацию растения. Ti (опухолеиндуцирующие)-плазмиды содержат большой сегмент, известный как T-ДНК, который переносят в трансформированные растения. Другой сегмент Ti-плазмиды, участок vir, отвечает за перенос T-ДНК. Участок T-ДНК ограничивается концевыми повторами. В модифицированных бинарных векторах опухолеиндуцирующие гены были делетированы, и функции участка vir применяются для переноса чужеродной ДНК, ограниченной пограничными последовательностями T-ДНК. T-участок также может содержать маркер селекции для эффективного восстановления трансгенных растений и клеток, а также сайт множественного клонирования для вставки последовательностей для переноса, таких как нуклеиновая кислота, кодирующая дцРНК.
Таким образом, в некоторых воплощениях вектор для трансформации растений получен из Ti-плазмиды A. tumefaciens (см., например, патенты США №№ 4536475, 4693977, 4886937 и 5501967; и европейский патент EP 0122791) или Ri-плазмиды A. rhizogenes. Дополнительные векторы для трансформации растений включают, например и без ограничения, те, что описаны в Herrera-Estrella et al. (1983) Nature 303:209-13; Bevan et al. (1983) Nature 304:184-7; Klee et al. (1985) Bio/Technol. 3:637-42; и в Европейском Патенте EP 0120516, и те, что выделены из любых вышеперечисленных. Другие бактерии, такие как Sinorhizobium, Rhizobium и Mesorhizobium, которые в естественной среде взаимодействуют с растениями, могут быть модифицированы для опосредования переноса генов в ряд различный растений. Эти ассоциированные с растением симбиотические бактерии могут быть сделаны компетентными для переноса генов путем поглощения обоих, нейтрализованной Ti-плазмиды и подходящего бинарного вектора.
После предоставления экзогенной ДНК реципиентным клеткам, трансформированные клетки, как правило, идентифицируют для дальнейшего культивирования и регенерации растений. С целью улучшения способности идентификации трансформированных клеток, может быть целесообразно применение гена маркера селекции или скрининга, как представлено ранее, вместе с трансформирующим вектором, используемым для генерации трансформанта. В случае где используется маркер селекции, трансформированные клетки идентифицируют внутри популяции потенциально трансформированных клеток путем экспонирования клеток с селективным агентом или агентами. В случае где используется маркер скрининга, клетки могут быть скринированы на характерное свойство целевого маркерного гена.
Клетки, которые выживают при экспонировании с селективным агентом, или клетки, которые оценили, как положительные в скрининговом анализе, могут культивироваться в среде, которая поддерживает регенерацию растений. В некоторых воплощениях любая подходящая среда для культивирования растительных тканей (например, среда MS и N6) может быть модифицирована путем включения дополнительных веществ, таких как регуляторы роста. Ткань может поддерживаться на основной среде, содержащей регуляторы роста, до тех пор пока не будет доступно достаточно ткани для того, чтобы начать усилия по регенерации растений, или путем повторения раундов ручной селекции до тех пор, пока морфология ткани не будет подходить для регенерации (например, по меньшей мере, 2 недели), затем осуществляют перенос в среду, приводящую к образованию побегов. Культуры переносят периодически до тех пор, пока не появится достаточная формация побегов. После образования побегов их переносят в среду, способствующую образованию корней. После образования достаточного количества корней растения могут переносить в почву для дальнейшего роста и вызревания.
Для подтверждения присутствия интересующей молекулы нуклеиновой кислоты (например, последовательности ДНК, кодирующей одну или несколько молекул иРНК, которые ингибируют экспрессию гена-мишени насекомого-вредителя отряда жесткокрылых) в регенерирующихся растениях может осуществляться множество анализов. Такие анализы включают, например: молекулярно-биологические анализы, такие как Саузерн- и Нозерн-блотинг, ПЦР и секвенирование нуклеиновых кислот; биохимические анализы, такие как детектирование присутствия белкового продукта, например, с помощью иммунологических средств (ИФА и/или Вестерн-блоты) или с помощью ферментативной функции; анализы частей растений, такие как анализы листьев или корней; и анализ фенотипа цельного регенерированного растения.
События интеграции могут быть проанализированы, например, с помощью ПЦР-амплификации с использованием, например, олигонуклеотидных праймеров, специфичных для интересующей молекулы нуклеиновой кислоты. Понятно, что ПЦР-генотипирование включает, в частности, амплификацию с помощью полимеразной цепной реакции (ПЦР) геномной ДНК, полученной из выделенной каллусной ткани растения-хозяина, который, вероятно, содержит интересующую молекулу нуклеиновой кислоты, интегрированную в геном, с последующим стандартным анализом клонирования и секвенирования продуктов ПЦР-амплификации. Методы ПЦР-генотипирования хорошо описаны (например, Rios, G. et al. (2002) Plant J. 32:243-53) и могут применяться для геномной ДНК, выделенной из любого вида растений (например, Z. mays или G. max) или из типа тканей, включающих клеточную культуру.
Трансгенное растение, полученное с использованием методов Agrobacterium-зависимой трансформации, как правило, содержит единственную последовательность рекомбинантной ДНК, вставленную в одну хромосому. Единственная последовательность рекомбинантной ДНК относится к «трансгенному событию» или к «интеграционному событию». Такие трансгенные растения являются гемизиготными для вставленной экзогенной последовательности. В некоторых воплощениях трансгенное растение, гомозиготное по отношению к трансгену, может быть получено с помощью полового скрещивания (самоопыления) независимого сегрегата трансгенного растения, которое содержит единственную экзогенную последовательность гена, с самим собой, например растения F0, с получением семян Fl. Одна четверть полученных семян Fl будет гомозиготной по отношению к трансгену. Прорастание семян Fl приведет к получению растений, которые могут быть протестированы на гетерозиготность, как правило, с использованием SNP-анализа или анализа термической амплификации, который позволяет различить гетерозиготы и гомозиготы (т.е. анализ зиготности).
В конкретных воплощениях, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более различных молекул иРНК получают в растительной клетке, которые обладают эффектом ингибирования насекомого-вредителя отряда жесткокрылых. Молекулы иРНК (например, молекулы дцРНК) могут экспрессироваться из множества последовательностей нуклеиновых кислот, введенных в процессе различных трансформационных событий, или из единственной последовательности нуклеиновой кислоты, введенной в процессе единственного трансформационного события. В некоторых воплощениях множество молекул иРНК экспрессируется под контролем единственного промотора. В других воплощениях множество молекул иРНК экспрессируется под контролем множества промоторов. Могут экспрессироваться одиночные молекулы иРНК, которые включают множество последовательностей нуклеиновых кислот, каждая из которых гомологична различным локусам внутри одного или нескольких насекомых-вредителей отряда жесткокрылых (например, локусы, определенные с помощью SEQ ID NO:1 и с помощью одной или нескольких из SEQ ID NO:2-4), как в различных популяциях одного вида насекомого-вредителя отряда жесткокрылых, так и в различных видах насекомых-вредителей отряда жесткокрылых.
Дополнительно к прямой трансформации растения с помощью рекомбинантной молекулы нуклеиновой кислоты, трансгенные растения могут быть получены с помощью скрещивания первого растения, содержащего, по меньшей мере, одно трансгенное событие, со вторым растением, лишенным такого события. Например, рекомбинантная молекула нуклеиновой кислоты, включающая нуклеотидную последовательность, которая кодирует молекулу иРНК, может быть введена в первую линию растения, которая поддается трансформации, с получением трансгенного растения, которое может быть скрещено со второй линией растения для интрогрессии нуклеотидной последовательности, которая кодирует молекулу иРНК, в геном второй линии растений.
Некоторые воплощения изобретения также включают товары, содержащие одну или несколько последовательностей по настоящему изобретению, которые получают из рекомбинантного растения или семян, содержащих одну или несколько нуклеотидных последовательностей по настоящему изобретению. Подразумевается, что продукт, содержащий одну или несколько последовательностей по настоящему изобретению, включает без ограничения муку, масла, перемолотые или цельные зерна или семена растения или любой пищевой продукт, включающий любую муку, масло или перемолотое или цельное зерно рекомбинантного растения или семена, содержащие одну или несколько последовательностей по настоящему изобретению. Детектирование одной или нескольких последовательностей по настоящему изобретению в одном или в нескольких товарах или в товарных изделиях, рассмотренных в данном документе, представляет собой очевидный факт, что товар или товарное изделие состоит из трансгенного растения, сконструированного для экспрессии одной или нескольких нуклеотидных последовательностей по настоящему изобретению, в целях контроля за болезнями растений с использованием дцРНК-опосредованных методов подавления генов.
В некоторых аспектах включены семена и товары, полученные с помощью трансгенных растений, выделенных из трансформированных растительных клеток, где семена или товары включают детектируемое количество последовательности нуклеиновой кислоты по изобретению. В некоторых воплощениях такие товары могут быть произведены, например, путем получения трансгенных растений и путем приготовления из них пищи или корма. Товары, включающие одну или несколько последовательностей нуклеиновых кислот по изобретению включают, например, и без ограничения: муку, масло, перемолотое или цельное зерно или семена растения и любой пищевой продукт, включающий любую муку, масло, или перемолотое, или цельное зерно рекомбинантного растения или семена, включающие одну или несколько последовательностей нуклеиновых кислот по изобретению. Детектирование одной или нескольких последовательностей по изобретению в одном или в нескольких товарах или в товарных изделиях представляет собой очевидный факт, что товар или товарное изделие состоит из трансгенного растения, сконструированного для экспрессии одной или нескольких молекул иРНК по изобретению, в целях контроля за насекомыми-вредителями отряда жесткокрылых.
В некоторых воплощениях трансгенное растение иии семена, включающие молекулу нуклеиновой кислоты по изобретению, также могут включать, по меньшей мере, одно другое трансгенное событие в его геноме, включающее без ограничения: трансгенное событие, из которого транскрибируется молекула иРНК с направленным воздействием на локус насекомого-вредителя отряда жесткокрылых, отличный от локусов, определенных в SEQ ID NO:1-4; трансгенное событие, из которого транскрибируется молекула иРНК с направленным воздействием на ген в организме, отличном от насекомого-вредителя отряда жесткокрылых (например, паразитирующая на растениях нематода); ген, кодирующий инсектицидный белок (например, инсектицидный белок Bacillus thuringiensis); ген переносимости гербицида (например, ген, обеспечивающий переносимость глифосата); и ген, способствующий целевому фенотипу в трансгенном растении, такому как повышенная урожайность, измененный метаболизм жирных кислот или восстановление цитоплазматической мужской стерильности. В конкретных воплощениях последовательности, кодирующие молекулы иРНК по изобретению, могут быть объединены в растении с признаками для контроля за болезнями и с другими признаками для контроля за насекомыми с получением целевых признаков для повышенного контроля за болезнями и повреждением растений насекомыми. Объединение признаков контроля за насекомыми, в которых применяются различные способы действия, может обеспечивать получение защищенных трансгенных растений с повышенной устойчивостью по сравнению с растениями, несущими, например, единственный признак контроля, благодаря меньшей вероятности того, что будет развиваться устойчивость к признаку(ам) в полевых условиях.
V. Подавление гена-мишени насекомого-вредителя отряда жесткокрылых
A. Краткое описание.
В некоторых воплощениях изобретения, по меньшей мере, одна молекула нуклеиновой кислоты, применяемая для контроля за насекомыми-вредителями отряда жесткокрылых, может предоставляться насекомому-вредителю отряда жесткокрылых, где молекула нуклеиновой кислоты приводит к РНКи-опосредованному генному сайленсингу в насекомом-вредителе отряда жесткокрылых. В конкретных воплощениях молекула иРНК (например, дцРНК, киРНК, миРНК и шпРНК) может быть предоставлена насекомому-вредителю отряда жесткокрылых. В некоторых воплощениях молекула нуклеиновой кислоты, применяемая для контроля за насекомыми-вредителями отряда жесткокрылых, может быть предоставлена насекомому-вредителю отряда жесткокрылых путем контакта молекулы нуклеиновой кислоты с насекомым-вредителем отряда жесткокрылых. В этих и в других воплощениях молекула нуклеиновой кислоты, применяемая для контроля за насекомым-вредителем отряда жесткокрылых, может предоставляться в виде кормового субстрата насекомого-вредителя отряда жесткокрылых, например в виде пищевой композиции. В этих и в других воплощениях молекула нуклеиновой кислоты, применяемая для контроля за насекомым-вредителем отряда жесткокрылых, может предоставляться посредством поглощения растительного материала, включающего молекулу нуклеиновой кислоты, который поглощается насекомым-вредителем отряда жесткокрылых. В некоторых воплощениях молекула нуклеиновой кислоты присутствует в растительном материале посредством экспрессии рекомбинантной последовательности нуклеиновой кислоты, введенной в растительный материал, например, с помощью трансформации растительной клетки вектором, включающим рекомбинантную последовательность нуклеиновой кислоты, и регенерации растительного материала или цельного растения из трансформированной растительной клетки.
B. РНКи-опосредованное подавление гена-мишени
В воплощениях в изобретении предлагаются молекулы иРНК (например, дцРНК, киРНК, миРНК и шпРНК), которые могут быть сконструированы для направленного воздействия на существенные нативные нуклеотидные последовательности (например, существенные гены) в геноме и/или в кДНК-библиотеке насекомого-вредителя отряда жесткокрылых (например, WCR или NCR), например, путем конструирования молекулы иРНК, которая включает, по меньшей мере, одну цепь, включающую нуклеотидную последовательность, которая специфично комплементарна последовательности-мишени. Последовательность молекулы иРНК, сконструированная таким образом, может быть идентична последовательности-мишени или может включать несовпадения, которые не предотвращают специфичной гибридизации между молекулой иРНК и ее последовательностью-мишенью.
Молекула иРНК по изобретению может использоваться в методах для подавления гена насекомого-вредителя отряда жесткокрылых, с уменьшением уровня повреждений или случаев повреждений, вызванных насекомым-вредителем на растении (например, защищенное трансформированное растение, включающее молекулу иРНК). При использовании в данном документе термин «подавление гена» относится к любому из хорошо известных методов уменьшения уровня белка, полученного в результате транскрипции гена до мРНК и последующей трансляции мРНК, включая уменьшение экспрессии белка из гена, или уменьшения уровня кодирующей последовательности, включая посттранскрипционное ингибирование экспрессии и транскрипционное подавление. Посттранскрипционное ингибирование опосредовано специфичной гомологией между всей последовательностью или частью мРНК, транскрибированной из гена или кодирующей последовательности, которая является мишенью для подавления, и соответствующей молекулой иРНК, используемой для подавления. А также посттранскрипционное ингибирование относится к существенному и измеряемому уменьшению количества мРНК, доступной в клетке для связывания рибосомами.
В воплощениях, где молекула иРНК представляет собой молекулу дцРНК, молекула дцРНК может расщепляться ферментом DICER до коротких молекул киРНК (длиной приблизительно 20 нуклеотидов). Двухцепочечная молекула киРНК, генерированная с помощью активности DICER на молекуле дцРНК, может быть разделена на две одноцепочечные киРНК; «сопровождающая цепь» и «направляющая цепь». Сопровождающая цепь может деградировать, и направляющая цепь может быть инкорпорирована в RISC. Посттранскрипционное ингибирование осуществляется с помощью специфичной гибридизации направляющей цепи с использованием специфично комплементарной последовательности молекулы мРНК и последующего расщепления ферментом Argonaute (каталитический компонент комплекса RISC).
В воплощениях изобретения может использоваться любая форма молекулы иРНК. Специалистам в данной области понятно, что молекулы дцРНК, как правило, более стабильны во время стадии предоставления молекулы иРНК клетке, чем одноцепочечные молекулы РНК, и также, как правило, более стабильны в клетке. Таким образом, в то время как молекулы киРНК и миРНК могут быть, например, равно эффективны в некоторых воплощениях, молекула дцРНК может быть выбрана благодаря ее стабильности.
В конкретных воплощениях предлагается молекула нуклеиновой кислоты, которая включает нуклеотидную последовательность, которая может экспрессироваться in vitro с получением молекулы иРНК, которая по существу гомологична молекуле нуклеиновой кислоты, кодируемой нуклеотидной последовательностью в геноме насекомого-вредителя отряда жесткокрылых. В некоторых воплощениях in vitro транскрибированная молекула иРНК может представлять собой стабилизированную молекулу дцРНК, которая включает структуру стебель-петля. После того как насекомое-вредитель отряда жесткокрылых контактирует in vitro с транскрибированной молекулой иРНК, у насекомого-вредителя отряда жесткокрылых может происходить посттранскрипционное ингибирование гена-мишени (например, существенного гена).
В некоторых воплощениях изобретения экспрессия молекулы нуклеиновой кислоты, включающей, по меньшей мере, 19 последовательно расположенных нуклеотидов нуклеотидной последовательности, используется в способе посттранскрипционного ингибирования гена-мишени насекомого-вредителя отряда жесткокрылых, где нуклеотидная последовательность выбрана из группы, состоящей из: SEQ ID NO:1; последовательности, комплементарной SEQ ID NO:1; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов SEQ ID NO:1; последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов SEQ ID NO:1; нативной кодирующей последовательности организма Diabrotica (например, WCR), включающей SEQ ID NO:1; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, включающей SEQ ID NO:1; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1; последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica (например, WCR), включающей SEQ ID NO:1; последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, включающей SEQ ID NO:1; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1; и последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей SEQ ID NO:1. В некоторых воплощениях может использоваться экспрессия молекулы нуклеиновой кислоты, которая, по меньшей мере, на 80% идентична любой вышеописанной последовательности (например, на 80%, примерно на 81%, примерно на 82%, примерно на 83%, примерно на 84%, примерно на 85%, примерно на 86%, примерно на 87%, примерно на 88%, примерно на 89%, примерно на 90%, примерно на 91%, примерно на 92%, примерно на 93%, примерно на 94%, примерно на 95%, примерно на 96%, примерно на 97%, примерно на 98%, примерно на 99%, примерно на 100% и 100%). В этих и в других воплощениях может экспрессироваться молекула нуклеиновой кислоты, которая специфично гибридизуется с молекулой РНК, присутствующей, по меньшей мере, в одной клетке насекомого-вредителя отряда жесткокрылых.
В этих и других воплощениях в способе для посттранскрипционного ингибирования гена-мишени у насекомого-вредителя отряда жесткокрылых может использоваться экспрессия, по меньшей мере, одной дополнительной молекулы нуклеиновой кислоты, включающей, по меньшей мере, 19 последовательно расположенных нуклеотидов нуклеотидной последовательности, где нуклеотидная последовательность выбрана из группы, состоящей из: SEQ ID NO:2; последовательности, комплементарной SEQ ID NO:2; SEQ ID NO:3; последовательности, комплементарной SEQ ID NO:3; SEQ ID NO:4; последовательности, комплементарной SEQ ID NO:4; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов любой из SEQ ID NO:2-4; последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов любой из SEQ ID NO:2-4; нативной кодирующей последовательности организма Diabrotica (например, WCR), включающей любую из SEQ ID NO:2-4; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica (например, WCR) включающей любую из SEQ ID NO:2-4; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей любую из SEQ ID NO:2-4; последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей любую из SEQ ID NO:2-4; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica (например, WCR), включающей любую из SEQ ID NO:2-4; последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, включающей любую из SEQ ID NO:2-4; фрагмента из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей любую из SEQ ID NO:2-4; и последовательности, комплементарной фрагменту из, по меньшей мере, 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, включающей любую из SEQ ID NO:2-4. В некоторых воплощениях может использоваться экспрессия молекулы нуклеиновой кислоты, которая, по меньшей мере, на 80% идентична любой вышеописанной последовательности (например, 80%, примерно на 81%, примерно на 82%, примерно на 83%, примерно на 84%, примерно на 85%, примерно на 86%, примерно на 87%, примерно на 88%, примерно на 89%, примерно на 90%, примерно на 91%, примерно на 92%, примерно на 93%, примерно на 94%, примерно на 95%, примерно на 96%, примерно на 97%, примерно на 98%, примерно на 99%, примерно на 100% и 100%). В этих и в других воплощениях может экспрессироваться молекула нуклеиновой кислоты, которая специфично гибридизуется с молекулой РНК, присутствующей, по меньшей мере, в одной клетке насекомого-вредителя отряда жесткокрылых.
Важным свойством некоторых воплощений изобретения является то, что система посттранскрипционного ингибирования РНКи способна выдерживать вариации последовательности среди генов-мишеней, которые могут ожидаться благодаря генетическим мутациям, полиморфизму линий или эволюционной дивергенции. Вводимая молекула нуклеиновой кислоты необязательно должна быть абсолютно гомологична либо первичному продукту транскрипции, либо полностью процессированной мРНК гена-мишени при условии, что вводимая молекула нуклеиновой кислоты специфично гибридизуется или с первичным продуктом транскрипции, или с полностью процессированной мРНК гена-мишени. Кроме того, вводимая молекула нуклеиновой кислоты необязательно может быть полноразмерной относительно первичного продукта транскрипции или полностью процессированной мРНК гена-мишени.
Ингибирование гена-мишени с использованием технологии иРНК по настоящему изобретению происходит специфично последовательности; т.е. нуклеотидные последовательности, по существу гомологичные молекуле(ам) иРНК, являются мишенями для генетического ингибирования. В некоторых воплощениях для ингибирования может использоваться молекула РНК, включающая нуклеотидную последовательность, идентичную участку гена-мишени. В этих и в других воплощениях может использоваться молекула РНК, включающая нуклеотидную последовательность, содержащую одну или несколько вставок, делеций и/или точечных мутаций относительно гена-мишени. В конкретных воплощениях молекула иРНК и участок гена-мишени могут быть идентичны по последовательности, например, по меньшей мере, примерно на 80%, по меньшей мере, примерно на 81%, по меньшей мере, примерно на 82%, по меньшей мере, примерно на 83%, по меньшей мере, примерно на 84%, по меньшей мере, примерно на 85%, по меньшей мере, примерно на 86%, по меньшей мере, примерно на 87%, по меньшей мере, примерно на 88%, по меньшей мере, примерно на 89%, по меньшей мере, примерно на 90%, по меньшей мере, примерно на 91%, по меньшей мере, примерно на 92%, по меньшей мере, примерно на 93%, по меньшей мере, примерно на 94%, по меньшей мере, примерно на 95%, по меньшей мере, примерно на 96%, по меньшей мере, примерно на 97%, по меньшей мере, примерно на 98%, по меньшей мере, примерно на 99%, по меньшей мере, примерно на 100% и на 100%. Альтернативно, дуплексный участок молекулы дцРНК может специфично гибридизоваться с участком транскрипта гена-мишени. В специфично гибридизующихся молекулах менее чем полноразмерная последовательность, проявляющая гомологию, восполняет более длинную, менее гомологичную последовательность. Длина нуклеотидной последовательности дуплексного участка молекулы дцРНК, который идентичен участку транскрипта гена-мишени, может составлять, по меньшей мере, примерно 25, 50, 100, 200, 300, 400, 500 или, по меньшей мере, примерно 1000 оснований. В некоторых воплощениях может использоваться последовательность, составляющая более чем 20-100 нуклеотидов. В конкретных воплощениях может использоваться последовательность, составляющая более чем 200-300 нуклеотидов. В конкретных воплощениях может использоваться последовательность, составляющая более чем 500-1000 нуклеотидов в зависимости от размера гена-мишени
В некоторых воплощениях экспрессия гена-мишени в насекомом-вредителе отряда жесткокрылых может ингибироваться, по меньшей мере, на 10%; по меньшей мере, на 33%; по меньшей мере, на 50%; или, по меньшей мере, на 80% в клетке насекомого-вредителя отряда жесткокрылых, так что имеет место значительное ингибирование. Значительное ингибирование относится к ингибированию более порогового значения, и которое приводит к получению детектируемого фенотипа (например, прекращение роста, прекращение питания, прекращение развития и гибель насекомого и т.д.), или к получению детектируемого уменьшения РНК и/или продукта гена, соответствующего ингибируемому гену-мишени. Хотя в некоторых воплощениях изобретения ингибирование происходит по существу во всех клетках насекомого-вредителя отряда жесткокрылых, в других воплощениях ингибирование происходит только в подгруппе клеток, экспрессирующих ген-мишень.
В некоторых воплощениях подавление транскрипции опосредовано присутствием в клетке молекулы дцРНК, проявляющей существенную идентичность последовательности с ДНК-последовательностью промотора или с ее комплементарной последовательностью для осуществления того, что относится к «промоторному транс-подавлению». Подавление гена может быть эффективным против генов-мишеней насекомого-вредителя отряда жесткокрылых, которые могут поглощать или контактировать с молекулами дцРНК, например путем поглощения или контакта с растительным материалом, содержащим молекулы дцРНК. Молекулы дцРНК для применения в промоторном транс-подавлении могут быть специфически сконструированы для ингибирования или подавления одной или нескольких гомологичных или комплементарных последовательностей в клетках насекомого-вредителя отряда жесткокрылых. Посттранскрипционное подавление гена с помощью антисмысловой или смысловой РНК для регуляции генной экспрессии в растительных клетках раскрыто в патентах США 5107065, 5759829, 5283184 и 5231020.
C. Экспрессия молекул иРНК, предоставляемых насекомому-вредителю отряда жесткокрылых
Экспрессия молекул иРНК для РНКи-опосредованного ингибирования в насекомом-вредителе отряда жесткокрылых может проводиться в любом из множества форматов in vitro или in vivo. Затем молекулы иРНК могут предоставляться насекомому-вредителю отряда жесткокрылых, например путем контакта молекул иРНК с насекомым-вредителем или путем поглощения или интернализации другим способом молекул иРНК насекомым-вредителем. Некоторые воплощения изобретения включают трансформированные растения-хозяева насекомых-вредителей отряда жесткокрылых, трансформированные растительные клетки и потомство трансформированных растений. Трансформированные растительные клетки могут быть сконструированы для экспрессии одной или нескольких молекул иРНК, например, под контролем гетерологичного промотора, с получением эффекта защиты от насекомых-вредителей отряда жесткокрылых. Таким образом, когда трансгенное растение или растительная клетка потребляется в процессе питания насекомым-вредителем отряда жесткокрылых, то насекомое-вредитель может поглощать молекулы иРНК, экспрессированные в трансгенных растениях или клетках. Нуклеотидные последовательности по настоящему изобретению также могут вводиться в широкий спектр прокариотических и эукариотических микроорганизмов-хозяев для продуцирования молекул иРНК. Термин «микроорганизм» включает прокариотические и эукариотические виды, такие как бактерии и грибы.
Модулирование генной экспрессии может включать частичное или полное подавление такой экспрессии. В другом воплощении способ подавления генной экспрессии насекомого-вредителя отряда жесткокрылых включает обеспечение в тканях хозяина насекомого-вредителя генно-подавляющего количества, по меньшей мере, одной молекулы дцРНК, транскрибированной с нуклеотидной последовательности, как описано выше, по меньшей мере, один сегмент которой комплементарен последовательности мРНК в клетках насекомого-вредителя отряда жесткокрылых. Молекула дцРНК, включающая ее модифицированные формы, такие как киРНК, миРНК и шпРНК, поглощенная патогенным микроорганизмом согласно изобретению, может быть идентична молекуле РНК, транскрибированной с молекулы нуклеиновой кислоты, включающей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-4, по меньшей мере, примерно на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или примерно на 100%. Таким образом, предлагаются выделенные и по существу очищенные молекулы нуклеиновых кислот, включающие, без ограничения ими, искусственные нуклеотидные последовательности и рекомбинантные конструкции ДНК для транскрипции молекул дцРНК по настоящему изобретению, которые при введении подавляют или ингибируют экспрессию кодирующей последовательности-мишени насекомого-вредителя отряда жесткокрылых.
В конкретных воплощениях предлагается система доставки молекул иРНК для посттранскрипционного ингибирования одного или нескольких генов-мишеней насекомого-вредителя отряда жесткокрылых, паразитирующего на растении, для контроля за популяцией насекомого-вредителя отряда жесткокрылых, паразитирующего на растении. В некоторых воплощениях система доставки включает поглощение трансгенной растительной клетки-хозяина или содержимого клетки-хозяина, включающей молекулы РНК, транскрибированные в клетке-хозяине. В этих и в других воплощениях создают трансгенную растительную клетку или трансгенное растение, которое содержит рекомбинантную ДНК-конструкцию, транскрибирующую стабилизированную молекулу дцРНК по изобретению. Трансгенные растительные клетки и трансгенные растения, включающие последовательности нуклеиновых кислот, кодирующие конкретную молекулу иРНК, могут быть получены путем применения технологий рекомбинантной ДНК (основные из которых хорошо известны в данной области) для конструирования вектора трансформации растений, включающего нуклеотидную последовательность, кодирующую молекулу иРНК по изобретению (например, стабилизированную молекулу дцРНК); для трансформации растительной клетки или растения; и для генерирования трансгенной растительной клетки или трансгенного растения, которое содержит транскрибируемую молекулу иРНК.
Для придания трансгенному растению устойчивости к насекомому-вредителю отряда жесткокрылых рекомбинантная молекула ДНК может, например, транскрибироваться с получением молекулы иРНК, такой как молекула дцРНК, молекула киРНК, молекула миРНК или молекулы шпРНК. В некоторых воплощениях молекула РНК, транскрибированная с рекомбинантной молекулы ДНК, может образовывать молекулу дцРНК в тканях или жидкостях рекомбинантного растения. Такая молекула дцРНК может частично состоять из нуклеотидной последовательности, которая идентична соответствующей нуклеотидной последовательности, транскрибированной с последовательности ДНК насекомого-вредителя отряда жесткокрылых того типа, который может паразитировать на растении-хозяине. Экспрессия гена-мишени в насекомом-вредителе отряда жесткокрылых подавляется с помощью молекулы дцРНК, и подавление экспрессии гена-мишени насекомого-вредителя отряда жесткокрылых приводит к устойчивости растения к насекомому-вредителю отряда жесткокрылых. Было показано, что модулирующие эффекты молекул дцРНК применимы к множеству генов, экспрессирующихся у насекомых-вредителей, например к эндогенным генам, ответственным за клеточный метаболизм или клеточную трансформацию, включающим гены домашнего хозяйства; транскрипционные факторы; гены, ассоциированные с линькой; и другие гены, которые кодируют полипетиды, вовлеченные в клеточный метаболизм или нормальный рост и развитие.
Для транскрипции с трансгена in vivo или экспрессирующей конструкции в некоторых воплощениях может использоваться регуляторный участок (например, промотор, энхансер, сайленсер и сигнал полиаденилирования) для транскрипции цепи РНК (или цепей). Таким образом, в некоторых воплощениях, представленных выше, нуклеотидная последовательность для применения в получении молекул иРНК может быть функционально связана с одной или несколькими промоторными последовательностями, функциональными в растительной клетке-хозяине. Промотор может быть эндогенным промотором, обычно присутствующим в геноме-хозяине. Нуклеотидная последовательность по настоящему изобретению под контролем функционально связанной промоторной последовательности может быть дополнительно фланкирована дополнительными последовательностями, которые преимущественно влияют на ее транскрипцию и/или на стабильность полученного в результате транскрипта. Такие последовательности могут быть локализованы в 5’-области по отношению к функционально связанному промотору, в 3’-области по отношению к 3’-концу экспрессирующей конструкции и могут находиться как в 5’-области по отношению к промотору, так и в 3’-области по отношению к экспрессирующей конструкции.
В некоторых воплощениях предлагаются способы уменьшения повреждений растения-хозяина (например, кукурузы), вызванных насекомым-вредителем отряда жесткокрылых, которое питается на растении, где способ включает предоставление в растении-хозяине трансформированной растительной клетки, экспрессирующей, по меньшей мере, одну молекулу нуклеиновой кислоты по изобретению, где молекула(ы) нуклеиновой кислоты функционирует при поглощении насекомым-вредителем отряда жесткокрылых с ингибированием экспрессии последовательности-мишени насекомого-вредителя отряда жесткокрылых, которое приводит к смертности, уменьшенному росту и/или к уменьшенной репродукции насекомого-вредителя отряда жесткокрылых, с уменьшением таким образом повреждений растения-хозяина, вызванных насекомым-вредителем отряда жесткокрылых. В некоторых воплощениях молекула(ы) нуклеиновой кислоты включает молекулы дцРНК. В этих и в других воплощениях молекула(ы) нуклеиновой кислоты включает молекулы дцРНК, каждая из которых включает более чем одну нуклеотидную последовательность, которая специфично гибридизуется с молекулой нуклеиновой кислоты, экспрессирующейся в клетке насекомого-вредителя отряда жесткокрылых. В некоторых воплощениях молекула(ы) нуклеиновой кислоты состоит из одной нуклеотидной последовательности, которая специфично гибридизуется с молекулой нуклеиновой кислоты в клетке насекомого-вредителя отряда жесткокрылых.
В некоторых воплощениях предлагается способ повышения урожайности кукурузной культуры, где способ включает введение в кукурузу, по меньшей мере, одной молекулы нуклеиновой кислоты по изобретению; культивирование кукурузы, чтобы позволить экспрессию молекулы иРНК, включающей последовательность нуклеиновой кислоты, где экспрессия молекулы иРНК, включающей последовательность нуклеиновой кислоты, ингибирует повреждения, вызванные насекомым-вредителем отряда жесткокрылых, и/или его рост, таким образом уменьшая или исключая потери урожая, вызванные заражением насекомым-вредителем отряда жесткокрылых. В некоторых воплощениях молекула иРНК представляет собой молекулу дцРНК. В этих и в других воплощениях молекула(ы) нуклеиновой кислоты включает молекулы дцРНК, каждая из которых включает более чем одну нуклеотидную последовательность, которая специфично гибридизуется с молекулой нуклеиновой кислоты, экспрессирующейся в клетке насекомого-вредителя отряда жесткокрылых. В некоторых воплощениях молекула(ы) нуклеиновой кислоты состоит из одной нуклеотидной последовательности, которая специфично гибридизуется с молекулой нуклеиновой кислоты в клетке насекомого-вредителя отряда жесткокрылых.
В некоторых воплощениях предлагается способ модулирования экспрессии гена-мишени насекомого-вредителя отряда жесткокрылых, причем способ включает: трансформацию растительной клетки вектором, включающим последовательность нуклеиновой кислоты, кодирующую, по меньшей мере, одну молекулу нуклеиновой кислоты по изобретению, где нуклеотидная последовательность функционально связана с промотором и с последовательностью терминации транскрипции; культивирование растительной клетки при условиях, достаточных для возможности развития культуры растительных клеток, включающей множество трансформированных растительных клеток; селекцию трансформированных растительных клеток, которые содержат интегрированную молекулу нуклеиновой кислоты в своем геноме; скрининг трансформированных растительных клеток на предмет экспрессии молекулы иРНК, кодируемой интегрированной молекулой нуклеиновой кислоты; селекцию трансгенной растительной клетки, которая экспрессирует молекулу иРНК; и поглощение селектированной трансгенной растительной клетки насекомым-вредителем отряда жесткокрылых при его питании. Растения также могут регенерироваться из трансформированных растительных клеток, которые экспрессируют молекулу иРНК, кодируемую интегрированной молекулой нуклеиновой кислоты. В некоторых воплощениях молекула иРНК представляет собой молекулу дцРНК. В этих и в других воплощениях молекула(ы) нуклеиновой кислоты включает молекулы дцРНК, каждая из которых включает более чем одну нуклеотидную последовательность, которая специфично гибридизуется с молекулой нуклеиновой кислоты, экспрессирующейся в клетке насекомого-вредителя отряда жесткокрылых. В некоторых воплощениях молекула(ы) нуклеиновой кислоты состоит из одной нуклеотидной последовательности, которая специфично гибридизуется с молекулой нуклеиновой кислоты в клетке насекомого-вредителя отряда жесткокрылых.
Молекулы иРНК по изобретению могут быть инкорпорированы внутри или на семенах растения (например, кукурузы), либо в виде продукта экспрессии рекомбинантного гена, инкорпорированного в геном растительных клеток, либо будучи инкорпорированными в оболочку или в семена при обработке, которую применяют к семенам перед посадкой. Предполагается, что растительная клетка, включающая рекомбинантный ген, является трансгенным событием. Также включены системы доставки молекул иРНК насекомым-вредителям отряда жесткокрылых. Например, молекулы иРНК по изобретению могут непосредственно вводиться в клетки насекомого-вредителя отряда жесткокрылых. Способы введения могут включать непосредственное смешивание иРНК с растительной тканью из хозяина насекомого-вредителя отряда жесткокрылых, а также применение композиций, включающих молекулы иРНК по изобретению, к тканям растения-хозяина. Например, молекулы иРНК могут быть распылены над поверхностью растения. Альтернативно, молекула иРНК может экспрессироваться микроорганизмом, и микроорганизм может применяться на поверхности растения или вводиться в корень или стебель с помощью физических способов, таких как инъекция. Как обсуждалось выше, трансгенное растение также может быть генетически сконструировано для экспрессии, по меньшей мере, одной молекулы иРНК в количестве, достаточном для того, чтобы убить насекомое-вредитель отряда жесткокрылых, которое, как известно, заражает растение. Молекулы иРНК, полученные методом химического или ферментативного синтеза, также могут быть включены в состав согласно общей сельскохозяйственной практике и могут использоваться как продукты, наносимые распылением, для контроля за болезнями растений. Составы могут включать подходящие стикеры и смачиватели для эффективного лиственного покрытия, а также защитные средства для защиты молекул иРНК (например, молекул дцРНК) от повреждений, наносимых УФ. Такие добавки широко используются в биоинсектицидной промышленности и хорошо известны специалистам в данной области. Такие применения могут быть объединены с другими инсектицидными применениями, наносимыми распылением (на основе биологического или другого действия) для повышения защиты растения от насекомых-вредителей отряда жесткокрылых.
Все ссылки, включающие публикации, патенты и патентные заявки, цитированные в данном документе, включены сюда посредством ссылки в такой степени, чтобы они не противоречили подробному описанию данной заявки, а также включены в такой же степени, как если бы каждая ссылка была указана индивидуально и определенно для включения с помощью ссылки и представлена в данном документе в полном объеме. Ссылки, обсуждаемые в данном документе, представлены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в данном документе не должно быть истолковано как признание того, что изобретение не имеет право датировать более ранним числом такие раскрытия посредством предшествующего изобретения.
Следующие примеры представлены для иллюстрации некоторых конкретных признаков и/или аспектов. Эти примеры не должны рассматриваться как ограничение данного документа в отношении конкретных описанных признаков или аспектов.
ПРИМЕРЫ
Пример 1: Материалы и методы
Приготовление образцов и биоанализы.
Ряд молекул дцРНК (включающих Cafl-180; участок 1 субъединицы С вакуолярной ATPазы (v-ATPаза); участок 2 субъединицы С v-ATPазы; участок 1 субъединицы Н v-ATPазы; участок 2 субъединицы Н v-ATPазы; и Rho1) синтезировали и очищали с использованием набора реагентов MEGAscript®RNAi (AMBION, Foster City, CA). Очищенные молекулы дцРНК готовили в TE-буфере, и все биоанализы содержали контрольную обработку, состоящую из этого буфера, который служил в качестве контроля уровня фона для смертности и ингибирования роста WCR. Концентрации молекул дцРНК в буфере для биоанализов измеряли с использованием спектрофотометра NanoDrop™ 8000 (Thermo Scientific, Wilmington, DE).
Образцы тестировали на предмет активности насекомых в биоанализах, проводимых с только что вылупившимися личинками насекомых на искусственном питании для насекомых. Яйца WCR получали из Crop Characteristics, Inc. (Farmington, MN).
Биоанализы проводили в 128-луночных пластиковых планшетах, сконструированных для биоанализов с насекомыми (C-D International, Pitman, NJ). Каждая лунка содержала приблизительно 1 мл питания, созданного для роста насекомых отряда жесткокрылых. 60-мкл аликвоту белкового образца доставляли с помощью пипетки на 1,5 см2 поверхности питания каждой лунки (40 мкл/см2). Концентрации образцов дцРНК рассчитывали как количество дцРНК на квадратный сантиметр (нг/см2) площади поверхности в лунке. Обработанные планшеты держали под вытяжкой до тех пор, пока жидкость на поверхности питания не испарится или не абсорбируется в питании.
В течение нескольких часов вылупления индивидуальные личинки выкалывали с помощью увлажненной щетки из верблюжьего волоса и помещали на обработанное питание (одна или две личинки на лунку). Зараженные лунки 128-луночных пластиковых планшетов затем запаивали с помощью адгезионных листов прозрачной пластмассы и вентилировали, чтобы была возможность газообмена. Биоаналитические планшеты держали в контролируемых условиях окружающей среды (28°C, ~40% относительной влажности, 16:8 [день:ночь]) в течение 9 дней, после чего записывали суммарное количество насекомых, экспонированных с каждым образцом, количество умерших насекомых и массу выживших насекомых. Процент смертности, среднюю живую массу и ингибирование роста рассчитывали для каждой обработки. Замедление роста определяли как уменьшение средней живой массы. Ингибирование роста (GI) рассчитывали следующим образом:
GI=[1-(TWIT/TNIT)/(TWIBC/TNIBC)],
где TWIT это суммарная масса живых насекомых в обработке;
TNIT - суммарное количество насекомых в обработке;
TWIBC - суммарная масса живых насекомых в фоновом контроле (буферный контроль); и
TNIBC - суммарное количество насекомых в фоновом контроле (буферный контроль).
Определили, что GI50 представляет собой концентрацию образца в питании, при которой значение GI составляет 50%. LC50 (50% летальная концентрация) записывают как концентрацию образца в питании, при которой погибает 50% тестируемых насекомых. Статистический анализ проводили с использованием пакета программ JMP™ (SAS, Cary, NC).
Дублированные биоанализы продемонстрировали, что поглощение образцов приводит к удивительной и неожиданной смертности и ингибированию роста личинки кукурузного жука.
Пример 2: Идентификация кандидатных генов-мишеней
Личинки WCR первой личиночной стадии селектировали для транскриптомного анализа, так как контроль на этой стадии роста с помощью трансгенной технологии устойчивости к насекомым является предпочтительным.
Суммарную РНК выделяли примерно из 0,9 г цельной личинки WCR первой личиночной стадии (Diabrotica virgifera virgifera LeConte; 4-5 дней после вылупления, поддерживали при 16°C) и очищали с использованием метода на основе обработки фенол/TRI-реагент®(Molecular Research Center, Cincinnati, OH; Кат. № TR 118):
Личинки гомогенизировали при комнатной температуре в 15мл-гомогенизаторе с использованием 10 мл TRI-реагента® до тех пор, пока не будет получена гомогенная суспензия. Через 5 мин инкубации при комнатной температуре гомогенат переносили в 1,5-мл центрифужные пробирки (1 мл на пробирку), добавляли 200 мкл хлороформа и смесь встряхивали в течение 15 секунд. После того как экстракционной смеси дали возможность осесть при комнатной температуре в течение 10 мин, фазы разделяли с помощью центрифугирования при 12000×g при 4°C. Верхнюю фазу (включающую примерно 0,6 мл) тщательно переносили в другую стерильную 1,5-мл пробирку и добавляли равный объем (0,6 мл) изопропанола при комнатной температуре. После инкубации при комнатной температуре в течение 5-10 мин смесь центрифугировали 8 мин при 12000×g (4°C или 25°C).
Надосадочную жидкость тщательно удаляли и выбрасывали и осадок РНК промывали дважды путем встряхивания в присутствии 75%-этанола, с восстановлением с помощью центрифугирования в течение 5 мин при 7500×g (4°C или 25°C) после каждой промывки. Этанол тщательно удаляли, осадку давали высохнуть на воздухе в течение 3-5 мин и затем растворяли в стерильной воде, свободной от нуклеазной активности. Концентрацию РНК определяли путем измерения поглощения (A) при 260 нм и 280 нм. Типичная экстракция из примерно 0,9 г личинок давала около 1 мг суммарной РНК с соотношением A260/A280 1,9. Экстрагированную таким образом РНК хранили при -80°C до следующего применения.
Качество РНК определяли путем прогона аликвоты на 1%-агарозном геле. Раствор агарозного геля готовили с использованием автоклавированного буфера 10 X TAE (Tris-ацетат EDTA, 1 X концентрация составляет 0,04M Tris-ацетат, 1 мМ EDTA (натриевая соль этилендиаминтетрауксусной кислоты, pH 8), растворенного в DEPC, в воде, обработанной диэтилпирокарбонатом, в автоклавированной емкости. 1 X TAE использовали в качестве рабочего буфера. Перед использованием электрофорезную емкость и хорошо формирующую гребенку промывали с помощью RNAseAway™ (Invitrogen Inc., Carlsbad, CA). Два мкл образца РНК смешивали с 8 мкл буфера TE (10 мМ Tris HCl pH 7; 1 мМ EDTA) и 10 мкл буфера для образца РНК (Novagen® Каталожный № 70606; EMD4 Bioscience, Gibbstown, NJ). Образец нагревали при 70°C в течение 3 мин, охлаждали до комнатной температуры и добавляли в лунку по 5 мкл (содержащие 1 мкг-2 мкг РНК). Коммерчески доступные маркеры молекулярной массы РНК одновременно добавляли в отдельную лунку для сравнения молекулярного размера. Гель прогоняли при 60 Вт в течение 2 ч.
Нормализованную кДНК-библиотеку готовили из суммарной личиночной РНК с помощью коммерческой службы провайдера (Eurofins MWG Operon, Huntsville, AL), с использованием случайной затравки.
Нормализованную личиночную кДНК-библиотеку секвенировали в масштабе 1/2 планшета с помощью последовательных химических реакций GS FLX 454 Titanium™ на Eurofins MWG Operon, что приводит к получению более 600000 прочитанных фрагментов со средним размером прочитанного фрагмента 348 п.о. 350000 прочитанных фрагментов собирали в более 50000 контигов. Оба типа прочитанных фрагментов, как несобранные прочитанные фрагменты, так и контиги, конвертировали в базу данных BLASTable с использованием общедоступной программы FORMATDB (доступной от Национального Центра Биотехнологической Информации (NCBI)).
Кандидатные гены для направленного воздействия РНКи выбирали с использованием информации, касающейся летальных эффектов РНКи конкретных генов для других насекомых, таких как Drosophila и Tribolium. Предположили, что эти гены являются существенными для выживания и роста насекомых-вредителей отряда жесткокрылых. Селектированные гомологичные гены-мишени идентифицировали в базе данных транскриптомных последовательностей, как описано ниже. Полноразмерные или частичные последовательности генов-мишеней амплифицировали с помощью ПЦР для приготовления матриц для получения двухцепочечной РНК (дцРНК).
Поиски по базе TBLASTN с использованием последовательностей, кодирующих кандидатный белок, прогоняли по базе данных BLASTable, содержащей разбросанные секвенированные фрагменты из генома Diabrotica или собранные контиги. Достоверные совпадения с последовательностью Diabrotica (определяемые как лучше чем e-20 для гомологий контигов и лучше чем e-10 для гомологий разбросанных отсеквенированных последовательностей) подтверждали с использованием BLASTX против нерезервированной базы данных NCBI. Результаты данного поиска по базе данных BLASTX подтвердили, что гомологичные последовательности кандидатных генов Diabrotica, идентифицированные в поиске по базе данных TBLASTN, действительно включают гены Diabrotica, или представляли собой наилучшие совпадения, доступные в последовательностях Diabrotica, с последовательностью кандидатного гена из организма, отличного от Diabrotica. В большинстве случаев кандидатные гены Tribolium, которые были аннотированы как кодирующие белок, давали однозначную гомологию последовательности с последовательностью или с последовательностями в транскриптоме Diabrotica. В нескольких случаях было очевидно, что некоторые из контигов или разбросанных отсеквенированных последовательностей Diabrotica, селектированных с помощью гомологии с кандидатным геном из организма, отличного от Diabrotica, перекрывались, и что сборка контигов была не способна объединить эти перекрывания. В этих случаях использовали Sequencher™ v4.9 (Gene Codes Corporation, Ann Arbor, MI) для сборки последовательностей в более длинные контиги.
Множество кандидатных генов-мишеней было идентифицировано как гены, которые могут приводить к гибели насекомых-вредителей отряда жесткокрылых или к ингибированию их роста, развития или репродукции у WCR, включая SEQ ID NO:1-4. Полноразмерные или частичные клоны последовательностей гомологов кандидатных генов Diabrotica использовали для генерирования ПЦР-ампликонов для синтеза дцРНК.
SEQ ID NO:1 соответствует D_vir_c47185, которая является гомологом Caf1-180 и в данном документе обозначается как Caf1-180. Было показано, что Caf1-180 Drosophila функционирует в процессе доставки гистонов на вновь синтезированную ДНК. Было показано, что мутации с потерей функции в Caf1-180 Drosophila вызывают арест роста и развития личинки, а также гибель личинки (Klapholz et al. (2009) Chromosoma 118(2):235-48; Tyler et al. (2001) Mol. Cell Biol. 21(19):6574-84; Song et al. (2007) Dev. Biol. 311(1):213-22).
SEQ ID NO:2 соответствует D_vir_c1229, которая является гомологом субъединицы С вакуолярной ATPазы и в данном документе обозначается как VatpaseC. SEQ ID NO:5-8 представляют собой неперекрывающиеся фрагменты последовательности VatpaseC.
SEQ ID NO:3 соответствует D_vir_c1319, которая является гомологом субъединицы Н вакуолярной ATPазы и в данном документе обозначается как VatpaseH. SEQ ID NO:9-11 представляют собой не перекрывающиеся фрагменты последовательности VatpaseH.
Вакуолярная ATPаза Drosophila представляет собой переносчик протонов, состоящий из множества субъединиц, вовлеченный в сигнальные пути Notch (Vaccari et al. (2010) Development 137(11):1825-32). Было показано, что мутации с потерей функции субъединиц вакуолярной ATPазы Drosophila являются рецессивно летальными (Allan et al. (2005) Physiol. Genomics 22(2):128-38; и Davies et al. (1996) J. Biol. Chem. 271(48):30677-84). VATPaseC (Vha44) и VATPaseH (VhaSFD) представляют собой две субъединицы вакуолярной ATPазы Drosophila.
SEQ ID NO:4 представляет собой Contig_01_Rho1_1-191_CDC42, обозначенный в данном документе как Rho1. Rho1 Drosophila функционирует в регуляции сборки актиновых филаментов, и мутации с потерей функций в Rho1 Drosophila имеют значительное влияние на передвижение клеточных компонентов, ремоделирование синапса, развитие личинки и реакцию на стресс (Fox et al. (2005) Development 132(21):4819-31; Kadandale et al. (2010) Proc. Natl. Acad. Sci. U.S.A. 107(23):10502-7; Rosales-Nieves et al. (2006) Nat. Cell Biol. 8(4):367-76; Magie and Parkhurst (2005) Dev. Biol. 278(1):144-54; и Xu et al. (2008) Dev. Biol. 321(1):88-100).
Пример 3: Амплификация генов-мишеней
Праймеры конструировали для амплификации фрагментов кодирующих участков каждого из генов-мишеней с помощью ПЦР. См. Таблицу 1. Там, где это необходимо, последовательность промотора фага T7 (TTAATACGACTCACTATAGGGAGA (SEQ ID NO:12)) включали на 5’-конец амплифицированной смысловой или антисмысловой цепи. См. Таблицу 1. Геномную ДНК экстрагировали из WCR и ПЦР-праймеры использовали для амплификации всей последовательности или части нативной последовательности гена-мишени из геномной ДНК посредством ПЦР-реакции.
Последовательности и пары ПЦР-праймеров, используемые для получения дцРНК
Праймера
T7
Пример 4: РНКи-конструкции
Приготовление матрицы с помощью ПЦР и синтез дцРНК.
Стратегия, используемая для обеспечения специфических матриц для in vitro получения дцРНК, представлена на ФИГ. 1. Матрицы ДНК, предназначенные для использования в синтезе дцРНК, получали с помощью ПЦР с использованием пар праймеров, представленных в Таблице 1 и (в качестве ПЦР-матрицы) первую цепь кДНК получали из суммарной РНК, выделенной из личинок WCR первой личиночной стадии. Для каждого выбранного участка гена-мишени осуществляли две отдельные ПЦР-амплификации. Первая ПЦР-амплификация вводила последовательность промотора T7 на 5’-конце амплифицированных смысловых цепей. Вторая реакция включала последовательность промотора T7 на 5’-концах антисмысловых цепей. Два амплифицированных с помощью ПЦР фрагмента для каждого участка генов-мишеней затем смешивали в приблизительно равных количествах и смесь использовали в качестве матрицы транскрипции для получения дцРНК. ФИГ. 1. Двухцепочечную РНК синтезировали и очищали с использованием набора реагентов для РНКи Ambion® MEGAscript®, следуя инструкциям производителя (Foster City, CA). Последовательности матриц дцРНК, амплифицированных с конкретными праймерами, представляют собой: SEQ ID NO:86 (Caf1-180); SEQ ID NO:7 и 8 (VatpaseC); SEQ ID NO:10 и 11 (VatpaseH); и SEQ ID NO:87 (Rho1). Концентрации дцРНК измеряли с использованием спектрофотометра NanoDrop™ 8000 (Thermo Scientific, Wilmington, DE).
Конструирование векторов для трансформации растений - Метод 1
Использовали стандартные по множеству сайтов «Standard Multi-site Gateway®» (Invitrogen) методы клонирования для конструирования векторов, экспрессирующих шпилечную РНК (шпРНК), для трансформации кукурузных клеток, опосредованной WHISKERS™. Отдельные входящие векторы конструировали для двух маркерных генов, применяемых для скрининга/селекции кукурузных клеток после трансформации; желтого флуоресцентного белка (YFP, Shagin et al. (2004) Mol. Biol. Evol. 21(5):841-50) и гена устойчивости к гербициду (фосфинотрицин ацетилтрансфераза (PAT), Wehrmann et al. (1996) Nat. Biotechnol. 14(10):1274-8). Экспрессию каждого из них контролировали с помощью копии промотора рисового актина1 (OsAct1, патент США 5641876). Фрагмент, включающий 3’-нетранслируемый участок из кукурузного гена пероксидазы 5 (ZmPer5 3’ UTR v2, патент США 6699984), использовали для терминации транскрипции генов.
Третий тип входящего вектора (entry vector), созданный для получения шпРНК, также конструировали с применением фрагментов гена Caf1-180 или гена VatpaseC. Участки гена-мишени для Caf1-180 и VatpaseC амплифицировали для синтеза шпильки с использованием праймеров, представленных в Таблице 2. Внутримолекулярное образование шпильки с помощью первичных транскриптов РНК облегчалось расположением (внутри одной транскрипционной единицы) двух копий фрагмента гена-мишени в противоположном направлении друг к другу, причем два фрагмента были разделены с помощью интронной последовательности ST-LS1 (Vancanneyt et al. (1990) Mol. Gen. Genet. 220(2):245-50). Получение первичного транскрипта мРНК управлялось копией промотора кукурузного убиквитина 1 (патент США 5510474). Таким образом, первичный транскрипт мРНК содержит последовательности фрагментов двух генов в виде больших инвертированных повторов друг друга, разделенных интронной последовательностью. Фрагмент, включающий 3’-нетранслируемый участок из кукурузного гена липазы (ZmLip 3’ UTR, патент США 7179902), использовали для терминации транскрипции генов.
Последовательности и пары праймеров, используемые для приготовления шпилечных конструкций для трансформации кукурузы
NO: 39
NO: 40
NO: 41
NO: 42
NO: 43
NO: 44
NO: 45
NO: 46
NO: 47
NO: 48
SEQ ID NO:49 представляет последовательность Caf1-180, образующую шпильку, и SEQ ID NO:50 представляет последовательность VatpaseC, образующую шпильку.
Две версии входящих векторов, экспрессирующих шпРНК, конструировали для каждого из Caf1-180 и VatpaseC. В первой версии входящих векторов кукурузная консенсусная смысловая последовательность старта трансляции присутствовала в 5’-нетранслируемой лидерной последовательности мРНК, прилегающей к 5’-концу последовательности фрагмента первого гена-мишени, который присутствовал в «прямой» ориентации (которая является смысловой относительно промотора). Кукурузная консенсусная последовательность старта трансляции была опущена во второй версии.
Осуществляли стандартную реакцию рекомбинации GATEWAY® с 3 входящими векторами и вектором доставки (destination vector) (pDAB104124) с использованием LR CLONASE II PLUS™ из Invitrogen. В завершенном векторе, экспрессирующем шпРНК, кассета шпРНК фланкировалась экспрессирующими кассетами генов YFP и PAT.
Очистку фрагментов для WHISKERS™-опосредованной трансформации осуществляли в препаративном масштабе с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) после того, как ДНК экспрессирующего вектора YFP/hpRNA/PAT гидролизовали или с помощью Bcl I (для Caf1-180-конструкций) или Bbs I вместе с Afe I (для VatpaseC-конструкций) для удаления бактериального гена устойчивости к спектиномицину, присутствующему в остове вектора.
Конструирование векторов для трансформации растений - Метод 2
WHISKERS™ Вектор доставки: Стандартную методику клонирования через один сайт GATEWAY® (INVITROGEN) использовали для конструирования векторов, экспрессирующих шпилечную РНК (шпРНК), для опосредованной WHISKERS™ трансформации кукурузных клеток. Два маркерных гена включали в вектор доставки (с названием pDAB108916) и применяли для скрининга и селекции кукурузных клеток после трансформации. Ген желтого флуоресцентного белка (YFP, Shagin et al. (2004) Mol. Biol. Evol. 21(5):841-50) использовали для визуального скрининга и ген устойчивости к гербициду (фосфинотрицин ацетилтрансфераза (PAT), Wehrmann et al. (1996) Nat. Biotechnol. 14(10):1274-8) использовали для селекции трансформантов. Экспрессию каждого из двух маркерных генов контролировали с помощью отдельных копий промотора бациллярного баднавируса сахарного тростника (SCBV) (патент США 6489462), включающего химерную 5’UTR-последовательность из участка 5’UTR гена оболочки вируса стрика кукурузы (GENBANK регистрационный номер X01633) и интрон 1 из кукурузного гена алкогольдегидрогеназы 1 (регистрационный номер GENBANK X04049). Фрагмент, включающий 3’-UTR из кукурузного гена липазы (ZmLip 3’ UTR, Патент США 7179902), и фрагмент, включающий 3’UTR из картофеля (Solanum tuberosum) StPinII 3’UTR (An et al. (1989) Plant Cell. 1:115-122), использовали для терминации транскрипции генов YFP и PAT соответственно.
Первый входящий вектор, созданный для получения шпРНК, конструировали с применением ДНК-фрагментов, несущих смысловую цепь Caf1-180 v3 (+ST-LS1 интрон) (SEQ ID NO:95), и фрагментов, несущих антисмысловую цепь Caf1-180 v3 (SEQ ID NO:96). Эти фрагменты синтезировали отдельно с помощью коммерческой фирмы (DNA2.0; Menlo Park, CA). Синтетические фрагменты объединяли в соответствующей ориентации с помощью стандартных методов клонирования с образованием конструкции, образующей шпильку SEQ ID NO:97, и конструкцию клонировали между промотором и 3’UTR-последовательностью во входящем векторе. Получение первичного транскрипта мРНК управлялось копией промотора кукурузного убиквитина 1 (патент США 5510474), в то время как последовательность, включающая 3’-нетранслируемый участок из кукурузного гена пероксидазы 5 (ZmPer5 3’ UTR v2, патент США 6699984), использовали для терминации транскрипции фрагмента гена-мишени. Внутримолекулярное образование шпильки с помощью первичных транскриптов РНК облегчалось расположением (внутри одной транскрипционной единицы) двух копий фрагмента гена-мишени в противоположном направлении друг к другу, причем два фрагмента были разделены с помощью интронной последовательности ST-LS1 (Vancanneyt et al.(1990) Mol. Gen. Genet. 220(2):245-50). Таким образом, первичный транскрипт мРНК содержит последовательности фрагментов двух генов в виде больших инвертированных повторов друг друга, разделенных интронной последовательностью.
Осуществляли стандартную реакцию рекомбинации GATEWAY® с использованием сконструированного входящего вектора, содержащего шпильку Caf-180 v3, и вектора доставки pDAB108916 с использованием LR CLONASE II PLUS™ из INVITROGEN. В завершенном векторе (pDAB109830), экспрессирующем шпРНК Caf-180 v3, YFP-экспрессирующая кассета фланкировалась экспрессирующими кассетами шпРНК и гена PAT.
Аналогично, использовали стандартные методы клонирования Gateway® по одному сайту (Invitrogen) для конструирования векторов, экспрессирующих другую шпилечную РНК (шпРНК), для опосредованной WHISKERS™ трансформации кукурузных клеток. Дополнительные векторы включали шпРНК-конструкции для VatpaseC v3, VatpaseC v4, VatpaseH v1 и Rho1 v1.
Второй входящий вектор, созданный для получения шпРНК, конструировали с применением синтетических фрагментов, включающих смысловую последовательность VatpaseC v3 (+ST-LS1 интрон) (SEQ ID NO:98) и антисмысловую последовательность VatpaseC v3 (SEQ ID NO:99), соединенные в соответствующей ориентации (SEQ ID NO:100) с помощью стандартных методов клонирования. Входящий вектор VaptaseC v3 использовали для клонирования GATEWAY® с использованием вектора доставки (pDAB108916) для конструирования вектора pDAB109828, экспрессирующего шпРНК VatpaseC v3.
Третий входящий вектор, созданный для получения шпРНК, конструировали с применением синтетических фрагментов, включающих смысловую последовательность VatpaseC v4 (+ST-LS1 интрон) (SEQ ID NO:101) и антисмысловую последовательность VatpaseC v4 (SEQ ID NO:102), соединенные в соответствующей ориентации (SEQ ID NO:103) с помощью стандартных методов клонирования. Входящий вектор VaptaseC v4 использовали для клонирования GATEWAY® с использованием вектора доставки (pDAB108916) для конструирования вектора pDAB109828, экспрессирующего шпРНК VatpaseC v4.
Четвертый входящий вектор, созданный для получения шпРНК, конструировали с применением синтетических фрагментов, включающих смысловую последовательность VatpaseH v1 (+ST-LS1 интрон) (SEQ ID NO:104) и антисмысловую последовательность VatpaseH v1 (SEQ ID NO:105), соединенные в соответствующей ориентации (SEQ ID NO:106) с помощью стандартных методов клонирования. Входящий вектор VaptaseH v1 использовали для клонирования GATEWAY® с использованием вектора доставки (pDAB108916) для конструирования вектора pDAB109828, экспрессирующего шпРНК VatpaseH v1.
Пятый входящий вектор, созданный для получения шпРНК, конструировали с применением синтетических фрагментов, включающих смысловую последовательность Rho1 v1 (+ST-LS1 интрон) (SEQ ID NO:107) и антисмысловую последовательность Rho1 v1 (SEQ ID NO:108), соединенные в соответствующей ориентации (SEQ ID NO:109) с помощью стандартных методов клонирования. Входящий вектор Rho1 v1 использовали для клонирования GATEWAY® с использованием целевого вектора (pDAB108916) для конструирования вектора pDAB109828, экспрессирующего Rho1 v1 шпРНК.
WHISKERS™-опосредованную трансформацию осуществляли с использованием очищенной циклической плазмидной ДНК. Пример 9.
Agrobacterium вектор доставки: Использовали стандартные методы клонирования Gateway® (INVITROGEN) для конструирования векторов, экспрессирующих шпилечную РНК (шпРНК), для опосредованной Agrobacterium трансформации кукурузных зародышей. Входящие векторы, приготовленные выше, для получения шпРНК для Caf-180 v3, VatpaseC v3, VatpaseH v1 и Rho1 v1, использовали для клонирования GATEWAY® с использованием вектора доставки (pDAB108915), сконструированного в виде бинарного вектора Agrobacterium для трансформации растений. Между левой и правой границами последовательностей повторов T-ДНК включен маркер селекции/ген устойчивости к гербициду, включающий кодирующую последовательность белка AAD1 (патент США 7838733) под транскрипционным контролем промотора SCBV, как описано выше. Терминацию транскрипции и полиаденилирование мРНК aad1 определяли с помощью 3’UTR кукурузной липазы, по существу раскрытой в виде оснований 921-1277 с регистрационным номером GENBANK™ № gb|L35913.1|MZELIPASE и в патенте США 7179902. Полученные в результате бинарные векторы, экспрессирующие шпРНК, получили названия pDAB109817 (для Caf-180 v3), pDAB109815 (для VatpaseC v3), pDAB109816 (для VatpaseH v1) и pDAB109821 (для Rho1 v1).
Для трансформации кукурузы бинарные векторы, экспрессирующие шпРНК, вводили в нейтрализованный штамм Agrobacterium tumefaciens DAt13192, как описано в международной заявке PCT № PCT/US11/046028 от 29 июля 2011 г.
Пример 5: Скрининг кандидатных генов-мишеней
Синтетические дцРНК, созданные для ингибирования некоторых, но не всех последовательностей генов-мишеней, идентифицированных в Примере 2, вызывали гибель и ингибирование роста при введении жукам WCR в анализах на основе питания. Наблюдали, что Cafl-180, VatpaseC, VatpaseH и Rho1 проявляли повышенную эффективность в данном анализе по сравнению с другими скринированными дцРНК.
Дублированные биоанализы продемонстрировали, что поглощение конструкций, транскрибированных в дцРНК Cafl-180 (SEQ ID NO:110); дцРНК участка 1 VatpaseC (SEQ ID NO:111); дцРНК короткого участка 1 VatpaseC (SEQ ID NO:112); дцРНК участка 2 VatpaseC (SEQ ID NO:113); дцРНК участка 1 VatpaseH (SEQ ID NO:114); дцРНК участка 2 VatpaseH (SEQ ID NO:115) и дцРНК Rho1 (SEQ ID NO:116), приводило к удивительно устойчивой гибели и к ингибированию роста личинок западного кукурузного жука. Таблицы 3 и 4 демонстрируют результаты биоанализов на основе питания личинок WCR после 9-дневного экспонирования вместе с этими дцРНК. ФИГ. 2-4 демонстрируют схему изменчивости для гибели и ингибирования роста насекомых-вредителей отряда жесткокрылых, обработанных с помощью иллюстративных молекул нуклеиновых +кислот.
Результаты биоанализа на основе питания для западного кукурузного жука (через 9 дней питания)
Интервал
Интервал
Интервал
Интервал
участок 1
участок 1 короткий
Участок 2
Участок 1
Участок 2
**НО=не определено.
Результаты биоанализа на основе питания для западного кукурузного жука (через 9 дней питания)
(нг/см2)
смертности
Ранее предполагалось, что некоторые гены Diabrotica spp. могут использоваться для РНКи-опосредованного контроля за насекомыми. См. патентную публикацию США № 2007/0124836, которая раскрывает 906 последовательностей, и патент США 7614924, который раскрывает 9112 последовательностей. Однако было определено, что множество генов, предположительно применимых для РНКи-опосредованного контроля за насекомыми, не эффективны в контроле Diabrotica. Было также определено, что каждый из Cafl-180, VatpaseC, VatpaseH и Rho1 обеспечивает удивительный и неожиданный превосходный контроль Diabrotica, по сравнению с другими генами, предположительно применимыми для РНКи-опосредованного контроля за насекомыми.
Каждый из аннексина, бета-спектрина 2 и mtRP-L4 рассматривался в патенте США 7614924 как эффективный в РНКи-опосредованном контроле за насекомыми. SEQ ID NO:51 представляет собой последовательность ДНК участка 1 аннексина, и SEQ ID NO:52 представляет собой последовательность ДНК участка 2 аннексина. SEQ ID NO:53 представляет собой последовательность ДНК участка 1 бета-спектрина 2, и SEQ ID NO:54 представляет собой последовательность ДНК участка 2 бета-спектрина 2. SEQ ID NO:55 представляет собой последовательность ДНК участка 1 mtRP-L4, и SEQ ID NO:56 представляет собой последовательность ДНК участка 2 mtRP-L4. Последовательность YFP (SEQ ID NO:57) также использовали для получения дцРНК в качестве отрицательного контроля.
Каждую из этих последовательностей использовали для получения дцРНК с помощью методов Примера 4 и каждую дцРНК тестировали с помощью тех же методов биоанализа на основе питания, описанного выше. Таблица 5 перечисляет последовательности праймеров, используемых для получения молекул дцРНК аннексина, бета-спектрина 2 и mtRP-L4. Таблица 6 представляет результаты биоанализов на основе питания личинок WCR после 9-дневного экспонирования вместе с этими молекулами дцРНК. Дублированные биоанализы демонстрировали, что поглощение этих дцРНК не приводит к гибели и ингибированию роста личинки кукурузного жука, что наблюдалось с контрольными образцами буфера TE, YFP или воды.
Последовательности пар праймеров для амплификации участков генов аннексина, бета-спектрина 2, mtRP-L4 и YFP для синтеза дцРНК
Результаты биоанализа на основе питания западного кукурузного жука с использованием дцРНК (через 9 дней питания)
смертности
участок 1
участок 2
Пример 6: Эффект длины последовательности, оказываемый на эффективность дцРНК VatpaseC
дцРНК субъединицы С вакуолярной ATPазы (VatpaseC) с размером в интервале от 349 до 500 п.о. были активны в анализах на основе питания против личинок западного кукурузного жука. Таблица 3. Для определения зависимости эффективности молекул дцРНК от длины длину дцРНК VatpaseC варьировали и тестировали. Последовательности выбирали для того, чтобы представлять 5’-концевые 15-, 25-, 50- и 100-оснований, и 3’-концевые 100-, 50-, 25- и 15-оснований сегмента из 174 пар оснований последовательности, кодирующей VatpaseC (SEQ ID NO:2).
Фрагменты дцРНК, представляющие 15-п.о. и 25-п.о. 5’- и 3’- последовательности VatpaseC, синтезировали с помощью коммерческой фирмы (INTEGRATED DNA TECHNOLOGIES; Coralville, IA). Таблица 7. 50-п.о. и 100-п.о. 5’- и 3’-фрагменты дцРНК и полноразмерный 174-п.о. фрагмент дцРНК генерировали из ПЦР-амплифицированных ДНК-матриц с использованием T7 РНК-полимеразы, следуя инструкциям набора реагентов MEGAscript™ RNAi (AMBION®, Foster City, CA), с использованием праймеров, перечисленных в Таблице 8. Комбинации праймеров, используемых для амплификации ДНК-матриц различной длины, перечислены в Таблице 9.
Синтетические РНК, созданные, чтобы служить в качестве 15-п.о. и 25-п.о. (с тупыми концами) дцРНК VatpaseC
ПЦР-праймеры использовали для генерирования ДНК-матриц VatpaseC различной длины, включающих последовательность промотора T7 (подчеркнута) для синтеза дцРНК
NO: 121
NO: 122
NO:123
NO:124
NO:125
NO:126
Комбинации праймеров, используемые в ПЦР для генерирования ДНК-матриц VatpaseC для синтеза дцРНК различной длины
длина (п.о.)*
длина (п.о.)**
точка для
удлинения
& VatpaseC-R50T7
& VatpaseC-R100T7
& VatpaseC-RT7
VatpaseC-RT7
VatpaseC-RT7
** GGGAGA из последовательности промотора T7 добавляли к 5’-концу обеих цепей дцРНК в процессе транскрипции, приводя к вставке в транскрипт 12 п.о.
Каждую из дцРНК VatpaseC (т.е. VatpaseC 5’-15, VatpaseC 5’-25, VatpaseC 5’-50, VatpaseC 5’-100, VatpaseC 3’-15, VatpaseC 3’-25, VatpaseC 3’-50, VatpaseC 3’-100 и VatpaseC-174) тестировали при одной дозе (1000 нг/см2) на активность (летальность) с использованием анализов на основе питания для личинок западного кукурузного жука. Как представлено в Таблице 10, активности этих образцов дцРНК (по измерениям процента смертности личинок на 9 день питания) различаются. Питание образцами 15-п.о. и 25-п.о. дцРНК VatpaseC (как 5’-, так и 3’-) не индуцировало значительной смертности личинок, этот результат был аналогичен негативному контролю с использованием дцРНК YFP. Однако использование как 5’-, так и 3’- VaptaseC дцРНК размером 100 п.о., так и 5’- и 3’- VaptaseC дцРНК размером 174 п.о. аналогично приводило к неожиданной высокой смертности личинок. Два образца 50-п.о. дцРНК демонстрировали различные результаты в анализах на основе питания; образец дцРНК VatpaseC5’-50 не приводил к значительной смертности личинок, но демонстрировал значительное замедление роста, тогда как образец дцРНК VaptaseC3’-50 вызывал почти 60%-ую смертность, причем этот уровень был настолько высоким, как и значение, полученное для образцов дцРНК 100-п.о. и 174-п.о. Таблица 10.
Кроме того, активности дцРНК VatpaseC определяли при шести тестируемых дозах (1, 3,9, 62,5, 250 и 1000 нг/см2) с получением относительных значений LC50 и GI50. Таблица 11. Значение LC50, полученное с использованием образца VatpaseC 3’-100, составило 3,01 нг/см2, которое оказалось самым низким из наблюдаемых значений (т.е. наибольшая эффективность). Особенно важно значение LC50, которое составило 9,81 нг/см2, полученное с использованием образца VatpaseC-174. Конструкция, созданная для получения шпильки VatpaseC v4 в кукурузных растениях, продемонстрировала активность при тестировании с помощью растений, выращенных в теплице. Пример 10; Таблица 18. Тот фрагмент последовательности VaptaseC v4 (166 п.о.) почти идентичен последовательности VatpaseC-174, описанной в данном документе; последовательность VatpaseC-174, описанная в данном документе, лишена только 8 п.о. (ATGACTGA) на 5’-конце 166п.о.-фрагмента последовательности VaptaseC v4.
Результаты биоанализов на основе питания с дцРНК для личинок западного кукурузного жука (через 9 дней питания) с применением дцРНК VatpaseC различной длины при 1000 нг/см2
** Средние значения % GI, за которыми следует та же буква(ы), не отличаются значительно друг от друга при уровне P=0,05 (при расчете с помощью ANOVA/Tukey сравнения средних значений). Массу личинок отрицательного контроля в виде личинок, которые питались YFP дцРНК, использовали в качестве основы для расчета GI.
Значения LC50 и GI50 для дцРНК VatpaseC различной длины при 1, 3,9, 62,5, 250 и 1000 нг/см2 для личинок западного кукурузного жука (через 9 дней питания)
Пример 7: Эффекты вариации последовательности, оказываемые на эффективность дцРНК VatpaseC
Молекулы дцРНК, которые неточно комплементарны последовательности-мишени (например, имеющие только 95% идентичности с мРНК-мишенью), эффективны для контроля насекомых-вредителей отряда жесткокрылых. Некомплементарные основания вводили в смысловую цепь или в антисмысловую цепь дцРНК VatpaseC с получением несовпадений между смысловой и антисмысловой цепями дцРНК (и затем с получением несовпадений между дцРНК и ее in vivo-мишенью в виде мРНК). Эффекты, оказываемые на инсектицидную активность неточно спаренных дцРНК против личинок кукурузного жука, измеряли в биоанализах на основе питания.
Только одна из двух ДНК-цепей, кодирующих дцРНК VatpaseC, мутировала сразу, и в каждый сайт мутации искусственно вводили один некомплементарный нуклеотид. Сайты мутации произвольно располагались с интервалом в 20 нуклеотидов по всей длине мутированной цепи ДНК, кодирующей дцРНК VatpaseC. Идентичность нуклеотида, выбранного для замены нативного, получали из проксимальных нуклеотидов с каждой стороны от сайта мутации, который не делал комплементарным нуклеотид на не мутированной цепи, противоположной сайту мутации. В случае когда три или более нуклеотидов были одинаковыми в данном расположении, то для замены нативного выбирали ближайший отличный нуклеотид.
Две неточно комплементарные, по существу гомологичные дцРНК VatpaseC (v4) (т.е. v4.1 и v4.2) создавали, генерировали и тестировали на предмет инсектицидной активности. Обе дцРНК включали 166 п.о. последовательности VatpaseC v4 плюс шесть нуклеотидов (GGGAGA) на 5’-конце каждой цепи РНК, которые являются предметом транскрипции промотора T7. Таким образом, общая длина каждой дцРНК составила 178 п.о.
VatpaseC v4.1, по существу гомологичную дцРНК, создавали и генерировали с некомплементарными основаниями, введенными в антисмысловую цепь. Получения этой дцРНК достигали с помощью следующих стадий: (1) последовательность антисмысловой цепи создавали так, чтобы она содержала мутацию, вводимую на каждые 20 нуклеотидов; (2) ДНК-фрагменты, включающие мутированную последовательность антисмысловой цепи ДНК или нативную последовательность смысловой цепи ДНК (т.е. без мутаций), химически синтезировали (IDT); (3) ДНК-олигонуклеотиды, включающие мутированную антисмысловую цепь, и олигонуклеотиды, включающие смысловую цепь, отжигали с образованием двухцепочечных молекул; (3) ПЦР-амплификацию с применением праймеров, включающих 5’-концевые последовательности промотора T7, использовали для включения последовательности промотора T7 в 5’-концы обеих цепей, обеспечивая таким образом достаточную матрицу для синтеза дцРНК; и (4) синтез дцРНК осуществляли с использованием T7 РНК-полимеразы и набора реагентов AMBION® MEGAscript™ для РНКи согласно инструкциям производителя.
VatpaseC v4.2, по существу гомологичную дцРНК, содержащую мутации через интервалы в 20 оснований в последовательности смысловой цепи (но имеющая нативную последовательность антисмысловой цепи), получали с помощью соответствующих модификаций вышеописанных методов. Кроме того, дцРНК VatpaseC v4, включающую нативную последовательность (т.е. имеющую полностью комплементарные смысловую и антисмысловую цепи), конструировали и использовали в качестве контроля эффективности по сравнению с по существу гомологичными дцРНК VatpaseC v4.1 и v4.2 в анализах на основе питания против личинок западного кукурузного жука (осуществляли с использованием ранее описанных методов).
Семь доз этих дцРНК (0,2, 1,0, 3,9, 15,6, 62,5, 250 и 1000 нг/см2) тестировали в биоанализах на основе питания для личинок западного кукурузного жука первой возрастной стадии личинок с получением значений LC50 и GI50. Анализы независимо проводили два раза, и каждый эксперимент имел две реплики.
LC50, рассчитанная для по существу гомологичной дцРНК VatpaseC v4.1 (несовпадающая антисмысловая цепь), составила 780,9 нг/см2, что в 7,9 раз выше, чем LC50, полученная для нативной (т.е. не мутированной) дцРНК VatpaseC v4. Таблица 12. Этот результат указывает, что даже если 178 оснований антисмысловой цепи дцРНК VatpaseC v4.1 содержат 8 мутированных оснований, все равно существует достаточная гомология с цепью мРНК-мишени насекомого-вредителя отряда жесткокрылых для индуцирования у него летального эффекта после поглощения дцРНК. Значение LC50, рассчитанное для по существу гомологичной дцРНК VatpaseC v4.2 (смысловая не совпадающая цепь), составило 868,6 нг/см2, что похоже на значение, полученное для VatpaseC v4.1, и составляет в 8,8 раз выше, чем полученное в этих анализах для дцРНК VatpaseC v4. Эти результаты демонстрируют, что по существу гомологичная дцРНК, включающая несовпадения в смысловой цепи дцРНК, сохраняет достаточную гомологию с цепью мРНК мишени насекомого-вредителя отряда жесткокрылых для индуцирования у него летального эффекта после поглощения дцРНК. Далее было обнаружено, что в данных анализах на основе специального питания дцРНК VatpaseC v4.1 и v4.2 имели значения GI50, которые выше, чем значения, рассчитанные для нативной (т.е. не мутированной) дцРНК VatpaseC v4. Таблица 12. Таким образом, очевидно, что дцРНК VatpaseC v4.1 и 4.2 способны индуцировать как повышенное ингибирование роста, так и повышенную смертность насекомых-вредителей отряда жесткокрылых при их поглощении насекомыми.
Инсектицидная активность по существу гомологичных дцРНК VatpaseC (v4.1 и v4.2) и дцРНК нативной VatpaseC v4 против личинок западного кукурузного жука
(нг/см2)
(нг/см2)
Пример 8: Agrobacterium-опосредованное получение трансгенных кукурузных тканей, включающих инсектицидные шпилечные дцРНК
Стерилизация початков и выделение зародышей: Незрелые кукурузные зародыши получали из растений Zea mays инбредной линии B104, выращенных в теплице и самоопыляемых или родственно опыляемых с получением початков. Початки собирали приблизительно через 9-12 дней после опыления. По экспериментальным данным початки были поверхностно стерилизованы путем погружения в 20%-ый раствор гипохлорита натрия (6,15%), и встряхивали в течение 20-30 мин, после чего следовали три промывки в стерильной воде. После стерилизации незрелые зиготные зародыши (1,5-2,4 мм) асептически вырезали из каждого початка и случайным образом распределяли в микроцентрифужные пробирки, содержащие жидкую инокулирующую среду (2,2 г/л MS солей (Frame et al., 2011, выше); 1X ISU Модифицированные MS Витамины (Frame et al. (2011) “Genetic Transformation Using Maize Immature Zygotic Embryos,” IN Plant Embryo Culture Methods and Protocols: Methods in Molecular Biology. T. A. Thorpe and E. C. Yeung, (Eds.), SPRINGER SCIENCE AND BUSINESS MEDIA, LLC., pp 327-341); 68,4 г/л сахарозы; 36 г/л глюкозы; 115 мг/л L-пролина; 100 мг/л мио-инозита, и 200 мкМ ацетосирингона (приготовленный в DMSO); при pH 5,4). Для данного набора экспериментов зародыши из собранных початков использовали для каждой трансформации.
Инициирование культуры Agrobacterium: Глицериновые исходные растворы штамма Agrobacterium DAt13192, содержащего бинарные трансформирующие векторы, описанные выше в Примере 4, высевали штрихом на чашки с минимальной средой AB (Watson et al. (1975) J. Bacteriol. 123:255-64), содержащие соответствующие антибиотики, растили при 20°C в течение 3-4 дней. Одиночную колонию выкалывали из каждой чашки, высевали штрихом на чашки со средой YEP (10 г/л дрожжевого экстракта, 10 г/л пептона и 5 г/л NaCl), содержащей соответствующие антибиотики, и инкубировали при 20°C в течение 1-2 дней.
Культура Agrobacterium и ко-культивирование. Колонии Agrobacterium отбирали с чашки YEP, суспендировали в 10 мл Инокулирующей Среды в 50-мл одноразовой пробирке, и клеточную плотность доводили до OD550 (оптическая плотность, измеряемая при 550 нм) 0,2-0,4 с использованием спектрофотометра. Культуры Agrobacterium инкубировали на ротационном шейкере при 125 об/мин (комнатная температура), пока не происходило вскрытие зародышей. Незрелые зиготные зародыши (ранее выделенные из стерилизованных кукурузных зерен и помещенные в 1 мл Инокулирующей Среды) промывали один раз в Инокулирующей Среде. 2 мл суспензии Agrobacterium добавляли в каждую пробирку с зародышами, и пробирки помещали на платформу шейкера примерно на 10-15 минут. Зародыши переносили на Среду ко-культивирования (4,33 г/л MS соли; 1X ISU Модифицированные MS Витамины; 30 г/л сахарозы; 700 мг/л L-пролина; 3,3 мг/л Дикамба (3,6-дихлор-o-анисовая кислота или 3,6-дихлор-2-метоксибензойная кислота) в KOH; 100 мг/л мио-инозита; 100 мг/л Казеинового Ферментативного Гидролизата; 15 мг/л AgNO3; 100 мкМ ацетосирингона в DMSO; и 3 г/л GELZAN™ (SIGMA-ALDRICH®); при pH 5,8), ориентированную на повернутый скутеллум, и инкубировали при 25°C, при условиях 24-часового дня с интенсивностью света 50 μEm-2сек-1 в течение 3 дней.
Селекция Каллуса и Регенерация Предполагаемых Событий: После периода ко-культивирования зародыши переносили в Среду состояния покоя (4,33 г/л MS солей; 1X ISU модифицированные MS витаммины; 30 г/л сахарозы; 700 мг/л L-пролина; 3,3 мг/л Дикамба в KOH; 100 мг/л мио-инозита; 100 мг/л казеинового ферментативного гидролизата; 15 мг/л AgNO3; 0,5 г/л MES (2-(N-морфолино)этансульфоновой кислоты моногидрат; PHYTOTECHNOLOGIES LABORATORIES®, Lenexa, KS); 250 мг/л Карбенициллин; и 2,3 г/л GELZAN™; при pH 5,8) и инкубировали при условиях 24-часового дня с интенсивностью света 50 μEm-2сек-1 при 25°C в течение 3 дней.
Зародыши переносили на Селекционную Среду 1 (которая состоит из Среды состояния покоя (выше) с добавлением 100 нМ кислоты Р-Галоксифоп (R-Haloxyfop) (0,0362 мг/л)) и инкубировали в темноте или при условиях 24-часового света с интенсивностью света 50 μEm-2сек-1 в течение 7-14 дней при 28°C. Пролиферирующие эмбриогенные каллусы переносили на Селекционную Среду 2 (которая состоит из Среды состояния покоя (выше) с добавлением 500 нМ кислоты Р-Галоксифоп (0,1810 мг/л)) и инкубировали при условиях 24-часового света с интенсивностью света 50 μEm-2сек-1 в течение 14-21 дней при 28°C. Данная стадия селекции давала возможность трансгенному каллусу дополнительно пролиферировать и дифференцироваться.
Пролиферирующие эмбриогенные каллусы переносили на Среду Пре-Регенерации (4,33 г/л MS солей; 1X ISU Модифицированные MS Витамины; 45 г/л сахарозы; 350 мг/л L-пролина; 100 мг/л мио-инозита; 50 мг/л Казеинового Ферментативного Гидролизата; 1 мг/л AgNO3; 0,25 г/л MES; 0,5 мг/л нафталинуксусной кислоты в NaOH; 2,5 мг/л абсцизиновой кислоты в этаноле; 1 мг/л 6-бензиламинопурина; 250 мг/л Карбенициллина; 2,5 г/л GELZAN™; и 500 нМ кислоты Р-Галоксифоп; при pH 5,8) и культивировали при условиях 24-часового света с интенсивностью света 50 μEm-2сек-1 в течение 7 дней при 28°C.
Эмбриогенные каллусы, содержащие почки типа побегов, переносили на Среду Регенерации I (4,33 г/л MS соли; 1X ISU Модифицированные MS Витамины; 60 г/л сахарозы; 100 мг/л мио-инозита; 125 мг/л Карбенициллина; 3 г/л GELZAN™; и 500 нМ кислоты Р-Галоксифоп; при pH 5,8) и культивировали при условиях 24-часового света с интенсивностью света 50 μEm-2сек-1 в течение 7 дней.
Небольшие побеги с первичными корнями переносили на среду Побеги/Корни (4,33 г/л MS соли; 1X ISU модифицированные MS витамины; 30 г/л сахарозы; 100 мг/л мио-инозита; 3,5 г/л GELZAN™; при pH 5,8) в PHYTATRAYS™ (PHYTOTECHNOLOGIES LABORATORIES®) и инкубировали при условиях 16:8 час день:ночь с интенсивностью света от 140 до 190 μEm-2сек-1 в течение 7 дней при 27°C. Предполагаемые трансгенные ростки анализировали на предмет количества трансгенных копий и переносили в почву.
Получение семян: Растения пересаживали на гидропонную среду для роста METRO-MIX™ 360 (SUN GRO HORTICULTURE; Bellevue, WA) и закаливали в теплице. Затем растения пересаживали на почвенную смесь SUNSHINE CUSTOM BLEND™ 160 и растили до цветения в теплице. Проводили контролируемое опыление для получения семян.
Биоанализы западного кукурузного жука на растениях, выращенных в теплице, проводили с помощью метода, описанного в Примере 12. Растения с корнями категории 0,75 или лучше сразу пересаживали в горшки на 5-галлонов (18,92-литра) для получения семян. Саженцы обрабатывали инсектицидами для предотвращения дальнейшего повреждения личинкой и высвобождения насекомого в теплице. Растения B104 скрещивали с нетрансгенными растениями B104 (донор пыльцы) для получения семян. Семена, полученные этими растениями, сохраняли для оценки T1 и для последующих генераций растений.
Штамм Agrobacterium DAt13192, включающий экспрессирующуюся в растениях конструкцию, кодирующую шпилечную дцРНК Caf1-180 v3 (Пример 4; конструкция в плазмиде pDAB109817), использовали для получения B104-трансгенных кукурузных растений. Биоанализы западного кукурузного жука на этих трансгенных растениях, выращенных в теплице, проводили с помощью метода, описанного в Примере 12. Растения, трансформированные похожей плазмидой (pDAB101556), которая содержит ген для продуцирования YFP, но не содержит ген для продуцирования дцРНК, использовали в качестве отрицательных контролей. Результаты этих биоанализов представлены в Таблице 13.
Результаты биоанализов с использованием западного кукурузного жука и B104 трансгенных кукурузных событий, экспрессирующих шпилечную дцРНК Caf1-180 v3
тестированных растений
Растений
с корневой оценкой
≤0,5 (%)*
Растений
с корневой оценкой ≤0,75 (%)
Штамм Agrobacterium DAt13192, включающий экспрессирующуюся в растениях конструкцию, кодирующую шпилечную дцРНК VatpaseC v3 (Пример 4; конструкция в плазмиде pDAB109815), использовали для получения B104-трансгенных кукурузных растений. Биоанализы западного кукурузного жука на этих трансгенных растениях, выращенных в теплице, проводили с помощью методов, описанных в Примере 12. Растения, трансформированные похожей плазмидой (pDAB101556), которая содержит ген для продуцирования YFP, но не содержит ген для продуцирования дцРНК, использовали в качестве отрицательных контролей. Результаты этих биоанализов представлены в Таблице 14.
Результаты биоанализов с использованием западного кукурузного жука и B104-трансгенных кукурузных событий, экспрессирующих шпилечную дцРНК VatpaseC v3
тестированных растений
Растений
с корневой оценкой
≤0,5 (%)*
Растений
с корневой оценкой
≤0,75 (%)
Штамм Agrobacterium DAt13192, включающий экспрессирующуюся в растениях конструкцию, кодирующую шпилечную дцРНК VatpaseH v1 (Пример 4; конструкция в плазмиде pDAB109816), использовали для получения B104-трансгенных кукурузных растений. Биоанализы западного кукурузного жука на этих трансгенных растениях, выращенных в теплице, проводили с помощью методов, описанных в Примере 12. Растения, трансформированные похожей плазмидой (pDAB101556), которая содержит ген для продуцирования YFP, но не содержит ген для продуцирования дцРНК, использовали в качестве отрицательных контролей. Результаты этих биоанализов представлены в Таблице 15.
Результаты биоанализов с использованием западного кукурузного жука и B104-трансгенных кукурузных событий, экспрессирующих шпилечную дцРНК VatpaseH v1
тестированных растений
Растений
с корневой оценкой
≤0,5 (%)*
Растений
с корневой оценкой
≤0,75 (%)
Пример 9: Опосредованное нитевидными кристаллами (WHISKERS) продуцирование трансгенных кукурузных тканей, включающих инсектицидные шпилечные дцРНК Caf1-180 v3
Получали растения, которые продуцируют одну или несколько инсектицидных молекул дцРНК (например, по меньшей мере, одну молекулу дцРНК, включающую молекулу дцРНК с направленным воздействием на ген, включающий одну из SEQ ID NO:1-4), посредством экспрессии химерного гена, стабильно интегрированного в растительный геном. ДНК-молекулы для трансформации растений готовили, как описано в Примере 4, и доставляли в кукурузные клетки в суспензионных клеточных культурах Hi-II посредством WHISKERS-опосредованной трансформации (по существу, как описано в патентах США 5302523 и 5464765; патентной публикации США № 2008/0182332; и Petolino and Arnold (2009) M. Paul Scott (ed.) Methods in Molecular Biology: Transgenic Maize, Vol. 526, Humana Press, NY, pp. 59-67).
Трансформация растительных клеток и селекция: Все процедуры для WHISKERS-опосредованной трансформации осуществляли с использованием стандартных асептических методов и, как правило, согласно методам, описанным в Petolino and Arnold (2009), выше. Zea mays HiII эмбриогенные клеточные суспензии (Armstrong et al. (1991) Maize Genet. Coop. Newslett. 65:92-3) пассировали путем переноса 30 мл осажденных суспензионных клеток вместе с 70 мл кондиционированной среды (т.е. среды, в которой клетки растут), в 200 мл свежей среды H9CP (4,33 г/л MS основных солей (PHYTOTECHNOLOGIES LABORATORIES, Кат # M524); 30 г/л сахарозы; 100 мг/л мио-инозита; 200 мг/л казеинового ферментативного гидролизата; 2 мг/л 2,4-дихлорфеноксиуксусной кислоты; 2 мг/л нафталинуксусной кислоты; 691 мг/л L-пролина; 2 мг/л глицина; 0,5 мг/л тиамина HCl; 0,5 мг/л пиридоксина HCl; 0,05 мг/л никотиновой кислоты; при pH 6), содержащей 5% кокосовое молоко (SIGMA ALDRICH, St. Louis, MO; Каталожный № C5915) в 175-мл одноразовой пробирке с коническим дном NALGENE™ (THERMO FISHER SCIENTIFIC; Каталожный № 3145-0175). Разведенные клетки затем инкубировали в стерильном одноразовом культуральном флаконе на 1 л в темноте при 28°C на гироротационном шейкере с радиусом качения один дюйм (2,54 см) при 120 об/мин, и клетки пассировали каждые 3,5 дня, как описано выше.
Через день после пересева и за 18-24 ч перед процедурой трансфекции добавляли 50 мл среды H9CP, содержащей 30 мл осажденных клеток, к 150 мл свежей среды GN6 (3,99 г/л Chu N6 основных солей с витаминами (PHYTOTECHNOLOGIES LABORATORIES, Кат. # C167); 30 г/л сахарозы; 100 мг/л мио-инозита; 2 мг/л 2,4-дихлорфеноксиуксусной кислоты; при pH 6) в стерильном флаконе на 1 л, и культуру инкубировали на гироротационном шейкере, как описано выше.
После 18-24 часовой инкубации в среде GN6 всю клеточную суспензию переносили в стерильную одноразовую центрифужную пробирку на 175 мл с коническим дном, и клеткам давали осесть в течение 1-3 мин с получением клеточного объема примерно 40 мл. Использованную среду тщательно удаляли, а оставшуюся жидкость удаляли с помощью пипетки с получением влажной клеточной массы. Клетки центрифугировали примерно в 180 мл высоко осмотической среды (GN6-SM; среда GN6 с добавлением 45 г/л сорбита и 45 г/л маннита) в центрифужной пробирке, и культуру помещали на настольный «рокер-шейкер» при комнатной температуре (23-25°C) в течение примерно 30 минут, но не более чем 45 минут. Через 30 минут осмотической обработки клеткам давали возможность осесть в центрифужной пробирке в течение 3-5 минут. Затем жидкость тщательно удаляли осторожно вниз к 50-мл отметке центрифужной пробирки посредством пипетки так, чтобы не разрушить клеток.
Для доставки плазмидной ДНК к суспензионной культуре клеток кукурузы 5 мл 5% масс./масс. суспензии BIOGRADE™ SC-9 нитевидных кристаллов карбида кремния (ADVANCED COMPOSITE MATERIALS, Greer, SC; партия 981011-101) готовили путем добавления соответствующего количества среды GN6-SM к стерилизованным (автоклавированным) сухим нитям. Соответствующее количество ДНК pDAB109830 (Пример 4) добавляли в центрифужную пробирку (как правило, 80 мкг/50 мл суспензии 40 мл клеток), крышку крепко закрывали и пробирку аккуратно переворачивали, чтобы перемешать содержимое. Центрифужную пробирку прочно закрепляли в коммерческом смесителе для краски (RED DEVIL™ Модель 5400; Minneapolis, MN), модифицированном так, чтобы прочно удерживать пробирку, и встряхивали в течение 10-20 секунд. После разведения для уменьшения осмоляльности среды с помощью добавления примерно 150 мл свежей среды (GN6-SM:GN6; 2:1 об/об) до конечного объема примерно 200 мл, клетки инкубировали на настольном «рокер-шейкере» при комнатной температуре в течение примерно 1 час.
Трансфицированные клетки затем с осторожностью переносили с помощью пипетки в аликвотах примерно 8,3 мл на стерильную фильтровальную бумагу 70 мм WHATMAN™ #4 (THERMO FISHER SCIENTIFIC), так чтобы не разрушить клеток на фильтровальной бумаге. Фильтры помещали на агар GN6 в пластиковых чашках 100×20 мм и затем инкубировали в пластиковых боксах в темноте при 28°C в течение 7 дней.
Через одну неделю после трансформации фильтровальную бумагу, удерживающую клетки, переносили на свежие чашки с твердым агаром GN6-1H (среда GN6 с добавлением 2,5 г/л GELZAN™), содержащим 1 мг/л БИАЛАФОСА в чашках 100×20 мм, и инкубировали в темноте при 28°C. БИАЛАФОС представлен в виде HERBIACE® (20% а.и.) (MEIJI SEIKA KAISHA LTD.; Tokyo, JP).
Через одну неделю клетки заключали в агар путем соскабливания содержимого с каждой фильтровальной бумаги в 50-мл стерильную одноразовую центрифужную пробирку, содержащую 15 мл мягкой агарозной среды GN6 (среда GN6 с добавлением 7 г/л SEAPLAQUE™ Agarose; LONZA, Rockland, ME) при 37°C-40°C, интенсивно встряхивали закрытые пробирки, и затем наливали содержимое пробирки с равной плотностью на четыре пластиковые чашки 100×25 мм, содержащие твердый агар GN61H. Каждую чашку встряхивали, чтобы покрыть поверхность ровным слоем клеточной суспензии, и после затвердевания чашки инкубировали при 28°C в темноте.
Через 6-10 недель инкубации достаточно выросшие появившиеся колонии переносили на свежие чашки, содержащие агар GN61H. Этим кандидатным трансформированным колониям давали расти в течение 2-4 недель на селективной среде для создания стабильных событий, имеющих массу примерно 50-200 мг ткани, которые затем подвергали молекулярному анализу.
Образцы 0,1 мл упакованных каллусных клеток из кандидатных событий отбирали и помещали в 1,2 мл COSTAR™ полипропиленовых кластерных пробирок (CORNING, INC.; Corning NY) и замораживали при -80°C.
Молекулярные анализы: Каллусные клетки анализировали на предмет относительной экспрессии полноразмерного транскрипта с помощью количественной ПЦР в режиме реального времени Per 5 3’UTR, и количество копий оценивали путем сравнения с внутренним геном кукурузы (TIP41-подобный белок). РНК выделяли с использованием набора реагентов RNeasy™ 96 (QIAGEN, Valencia, CA). После первой промывки (RW1) колонки обрабатывали с помощью QIAGEN ДНКазой, свободной от РНКазы в буфере «RDD» (согласно предлагаемому в наборе реагентов дополнительному протоколу). Первую цепь кДНК получали с использованием НАБОРА РЕАГЕНТОВ ДЛЯ СИНТЕЗА кДНК HIGH CAPACITY (INVITROGEN) в реакционном объеме 10 мкл, содержащем 5 мкл денатурированной РНК, по существу согласно протоколу, рекомендованному производителем. Протокол немного модифицировали с включением добавления 10 мкл 100 мкМ T20VN олигонуклеотида (IDT) в 1-мл пробирку исходной смеси случайных праймеров с целью получения рабочей исходной смеси из объединенных случайных праймеров и олиго-dT.
После синтеза кДНК образцы разводили 1:3 в воде, свободной от нуклеаз, и хранили при -20°C до следующего применения. ПЦР в реальном времени осуществляли на LIGHTCYCLER™ 480 (ROCHE DIAGNOSTICS, Indianapolis, IN) в 10 мкл реакционного объема. Все анализы включали отрицательные контроли без матрицы (только смесь). Для стандартных кривых пустой раствор (вода в исходной лунке) также включали в исходную чашку для контроля перекрестной контаминации образца. Реакции проводили с использованием универсального зонда ROCHE UNIVERSAL PROBE™ в концентрации 0,5 мкМ и праймерами для мишени и эталонных генов в концентрации 10 мкМ. Последовательности праймеров представлены в Таблице 16. Условия ПЦР-реакций были следующими: (1) направленная активация при 95°C в течение 10 мин; (2) 43 цикла (денатурация при 95°C в течение 10 сек и протяжка при 60°C); (3) получение продукта при 72°C в течение 1 сек; и (4) охлаждение при 40°C в течение 10 сек.
Последовательности праймеров, используемые для молекулярного анализа трансгенной кукурузы
Анализ данных: Данные анализировали с использованием пакета программ LIGHTCYCLER™ v1.5 с помощью относительной количественной оценки с использованием максимального алгоритма второй производной для расчета значений Cq согласно инструкциям поставщика. Для анализа экспрессии значения экспрессии рассчитывали с использованием метода ΔCt (т.е. 2-(Cq TARGET - Cq REF)), который основан на сравнении различий значений Cq между двумя мишенями, причем основное значение 2 выбрано с предположением, что для оптимизированных реакций ПЦР продукт удваивается на каждом цикле.
Регенерация трансгенного растения: Некоторые стабильно трансформированные события регенерировали в растения для биоанализов с насекомыми in-planta.
После процесса селекции каллусные культуры переносили в среду пре-регенерации 28 (4,33 г/л MS основной среды с витаминами; 30 г/л сахарозы; 5 мг/л 6-бензиламинопурина; 25 мкг/л 2,4-дихлорфеноксиуксусной кислоты; 2,5 г/л GELZAN™; и 1 мг/л БИАЛАФОСА). Перенесенные каллусные культуры инкубировали в течение 7 дней при 28°C при условиях белого флуоресцентного света (приблизительно 50 μEm-2с-1).
Для регенерации культуры переносили в среду регенерации 36 (4,33 г/л MS основной среды с витаминами; 30 г/л сахарозы; 2,5 г/л GELZAN™; и 1 мг/л БИАЛАФОСА), и росткам давали возможность генерироваться и расти при 28°C при условиях белого флуоресцентного света в течение до 3 недель. Когда ростки достигали стадии стабильного роста, их вырезали с помощью пинцета и скальпеля, переносили в аналитические пробирки 20×100 мм, содержащие агар, и помещали на свет в течение 2 дней.
Трансгенным растениям присваивали уникальные идентификаторы и переносили в камеру с контролируемыми условиями (~28°C дневной температуры; 24°C ночной температуры; с соотношением светового фотопериода 16:8). Трансгенные растения пересаживали из пробирок в 3,5-дюймовые (8,89 см) горшки и возвращали в камеру с контролируемыми условиями на 1-2 недели, чтобы помочь растениям акклиматизироваться. Затем трансгенные растения переносили в теплицу и пересаживали из маленьких горшков в ROOTRAINERS™ (типа TINUS™ 350-4; SPENCER-LEMAIRE INDUSTRIES; Acheson, Alberta, Canada), по одному растению на событие на ROOTRAINER™, для проведения биоанализов на основе питания. Приблизительно через четыре дня после пересадки в ROOTTRAINERS™ растения T0 были готовы к биоанализу на основе питания насекомых. Биоанализы на основе питания насекомых проводили с помощью способов, описанных в Примере 12.
Присутствие и экспрессия трансгена, продуцирующего шпилечную дцРНК, приводит к уменьшению подрезания корней жуками WCR, что можно было видеть в тех растениях, которые демонстрировали высокий уровень экспрессии транскрипта дцРНК (по измерениям с помощью относительной ПЦР-оценки Per5 3’UTR). В Таблице 17 представлены результаты биоанализов с западным кукурузным жуком на тех событиях, которые содержат шпильку РНКи, включающую SEQ ID NO:97, и которые имеют относительный уровень экспрессии в 16 раз выше, чем уровень внутреннего эталонного гена TIP41-подобного белка. Результаты выявляют удивительный результат, что 36% трансгенных растений, содержащих трансгенную РНКи, демонстрировали уменьшение повреждений от жука WCR по сравнению с только 3% нетрансгенных контрольных тестированных растений. Хотя биологический ответ варьировался внутри трансгенных кукурузных растений T0, трансгенные растения демонстрировали заметное уменьшение подрезания корней жуком WCR по сравнению с нетрансгенными контрольными растениями.
Результаты биоанализов с использованием западного кукурузного жука и Hi-II трансгенных кукурузных событий, экспрессирующих шпилечную дцРНК Caf1-180
корневой оценкой ≤0,75
на событие
корневой оценкой ≤0,75
Пример 10: WHISKERS-опосредованное продуцирование трансгенных кукурузных тканей, включающих инсектицидные шпилечные дцРНК VatpaseC v3 и VatpaseC v4
Методы трансформации, описанные в Примере 9, также использовали для получения HiII кукурузных трансгенных растений, экспрессирующих шпилечную дцРНК VatpaseC v3 или шпилечную дцРНК VatpaseC v4, с помощью трансформации плазмидами pDAB109828 и pDAB109838 (Пример 4). Молекулярный скрининг осуществляли согласно методам скрининга, описанным в Примере 9, и биоанализы с западным кукурузным жуком осуществляли согласно биоаналитическим методам, описанным в Примере 12.
Присутствие и экспрессия трансгена, продуцирующего шпилечную дцРНК, приводит к уменьшению подрезания корней жуками WCR, что можно было видеть в тех растениях, которые демонстрировали высокий уровень экспрессии транскрипта дцРНК (по измерениям с помощью относительной ПЦР-оценки Per5 3’UTR). В Таблице 18 представлены результаты биоанализов с западным кукурузным жуком на тех событиях, которые содержат шпильку РНКи, включающую SEQ ID NO:100 (VatpaseC v3) или SEQ ID NO:103 (VatpaseC v4), и которые имеют относительный уровень экспрессии в 20 раз выше, чем уровень внутреннего эталонного гена TIP41-подобного белка. Результаты выявляют удивительный результат, что 43% трансгенных растений, содержащих трансгенную РНКи, демонстрировали уменьшение повреждений от жука WCR по сравнению с 0% нетрансгенных контрольных тестированных растений. Хотя биологический ответ варьировался внутри трансгенных кукурузных растений T0, только трансгенные растения демонстрировали заметное уменьшение подрезания корней жуком WCR.
Результаты биоанализов с западным кукурузным жуком и Hi-II трансгенными кукурузными событиями, экспрессирующими шпилечную дцРНК VatpaseC v3 или v4.
корневой оценкой ≤0,5
растений
на событие
с корневой
оценкой ≤0,5
Пример 11: WHISKERS-опосредованное продуцирование трансгенных кукурузных тканей, включающих инсектицидные шпилечные дцРНК VatpaseH v1
Методы трансформации, описанные в Примере 9, использовали для получения HiII кукурузных трансгенных растений, экспрессирующих шпилечную дцРНК VatpaseC Н1, путем трансформации плазмидой pDAB109829 (Пример 4). Молекулярный скрининг осуществляли согласно методам скрининга, описанным в Примере 9, и биоанализы с западным кукурузным жуком осуществляли согласно биоаналитическим методам, описанным в Примере 12.
Присутствие и экспрессия трансгена, продуцирующего шпилечную дцРНК, приводит к уменьшению подрезания корней жуками WCR, что можно было видеть в тех растениях, которые демонстрировали высокий уровень экспрессии транскрипта дцРНК (по измерениям с помощью относительной ПЦР-оценки Per5 3’UTR). В Таблице 19 представлены результаты биоанализов с западным кукурузным жуком на тех событиях, которые содержат шпильку РНКи, включающую SEQ ID NO:106, и которые имеют относительный уровень экспрессии в 18 раз выше, чем уровень внутреннего эталонного гена TIP41-подобного белка. Результаты выявляют удивительный результат, что 60% трансгенных растений, содержащих трансгенную РНКи, демонстрировали уменьшение повреждений от жука WCR по сравнению с 0% нетрансгенных контрольных тестированных растений. Хотя биологический ответ варьировался внутри трансгенных кукурузных растений T0, только трансгенные растения демонстрировали заметное уменьшение подрезания корней жуком WCR.
Результаты биоанализов с западным кукурузным жуком и Hi-II трансгенным кукурузным событием, экспрессирующим шпилечную дцРНК VatpaseH
корневой оценкой ≤0,5
на событие
корневой оценкой ≤0,5
растения
Пример 12: Биоанализ с насекомыми и трансгенной кукурузой
Яйца западного кукурузного жука (WCR, Diabrotica virgifera virgifera LeConte) получали в почве из Crop Characteristics (Farmington, MN). Яйца инкубировали при 28°C в течение 10-11 дней. Яйца промывали от почвы, помещали в 0,15%-раствор агара и концентрацию доводили до приблизительно 75-100 яиц на аликвоты по 0,25 мл. Место для выведения готовили в чашке Петри с использованием аликвоты суспензии яиц для отслеживания степени выведения.
Почву вокруг кукурузных растений заражали с использованием 150-200 яиц WCR. Насекомым давали питаться в течение 2 недель, после чего давали каждому растению «Оценку Корня». Для оценки применяли Шкалу Узел-Повреждение. Oleson et al. (2005) J. Econ. Entomol. 98(1):1-8.
Растения с оценкой корня 0,75 или лучше немедленно пересаживали в горшки на 5 галлонов (18,92 литра) для получения семян. Саженцы обрабатывали инсектицидами для предотвращения дальнейшего повреждения личинкой и высвобождения насекомого в теплице. HiII растения скрещивали с инбредной линией кукурузы 5XH751 (донор пыльцы) для получения семян. Семена, полученные этими растениями, сохраняли для оценки в момент T1 и последующих генераций растений.
Пример 13: Трансгенные Zea mays, включающие последовательности насекомых-вредителей отряда жесткокрылых
10-20 трансгенных растений T0 Zea mays генерировали, как описано в Примерах 8 и 9. Следующие 10-20 независимых линий T1 Zea mays, экспрессирующих шпилечную дцРНК для РНКи-конструкции, представленной в SEQ ID NO:1-4, получали для заражения кукурузным жуком. Это подтверждали с помощью РВ-ПЦР. Суммарную РНК из селектированных независимых линий T1 необязательно использовали для РВ-ПЦР с праймерами, созданными для связывания в pdk-интрон шпилечной кассеты РНКи-конструкций. Кроме того, специфичные праймеры для каждого гена-мишени в РНКи-конструкции необязательно использовали для амплификации и подтверждения получения пред-процессированной мРНК, требуемой для получения киРНК in planta. Амплификация целевых фрагментов каждого гена-мишени подтверждала экспрессию шпилечной РНК в каждом трансгенном Zea mays. Процессинг шпильки дцРНК генов-мишеней в киРНК затем необязательно подтверждали в независимых трансгенных линиях с использованием гибридизаций с РНК-блотами.
Фенотипическое сравнение трансгенных РНКи-линий Zea mays и растений дикого типа.
Гены-мишени насекомого-вредителя отряда жесткокрылых или последовательности, выбранные для создания шпилечных дцРНК, не имеют гомологии ни с какими известными генами или последовательностями растений. Следовательно, не ожидается, что получение или активация (системной) РНКи с помощью конструкций, направленно воздействующих на эти гены или последовательности, будет обладать каким-либо неблагоприятным эффектом в отношении трансгенных растений. Однако развитие и морфологические характеристики трансгенных линий сравнивают с растениями дикого типа, а также с теми из трансгенных линий, которые трансформированы пустым вектором без шпильки. Сравниваются корни, побеги, листва и характеристики репродукции. Не наблюдается никаких различий в длине корня и в параметрах роста трансгенных растений и растений дикого типа. Характеристики побегов растений, такие как высота, количество листьев и размеры, время цветения, размер и появление цветка, аналогичны. В основном, нет никаких наблюдаемых морфологических различий между трансгенными линиями и теми растениями, которые не экспрессируют молекулы иРНК, при культивировании in vitro и в почве в парнике.
Пример 14: Трансгенные Zea mays, включающие последовательность насекомого-вредителя отряда жесткокрылых и дополнительные РНКи-Конструкции
Трансгенное растение Zea mays, включающее в своем геноме гетерологичную кодирующую последовательность, которая транскрибируется в молекулу иРНК, которая направленно воздействует на организм, отличный от насекомого-вредителя отряда жесткокрылых, трансформируют посредством Agrobacterium- или WHISKERS™-опосредованной трансформации с получением одной или нескольких инсектицидных молекул дцРНК (например, по меньшей мере, одной молекулы дцРНК, включающей молекулу дцРНК, направленно воздействующую на ген, включающий одну из SEQ ID NO:1-4). Препараты молекул ДНК для трансформации растений, приготовленные, по существу, как описано в Примере 4, доставляют в кукурузную суспензионную клеточную культуру Hi-II, полученную из трансгенного растения Zea mays, включающего в своем геноме гетерологичную кодирующую последовательность, которая транскрибируется в молекулу иРНК, которая направленно воздействует на организм, отличный от насекомого-вредителя отряда жесткокрылых.
Пример 15: Трансгенные растения, устойчивые к насекомым-вредителям отряда жесткокрылых
Доставка в растение дцРНК, киРНК или миРНК, соответствующих генам-мишеням, и последующее поглощение насекомыми-вредителями отряда жесткокрылых при поедании растения приводит в результате к отрицательной регуляции генов-мишеней посредством РНК-опосредованного сайленсинга генов. Когда функция гена-мишени является важной, то происходит воздействие на рост, развитие и репродукцию насекомого-вредителя отряда жесткокрылых, и в случае, по меньшей мере, одного из WCR, NCR, SCR, MCR, D. balteata LeConte, D. u. tenella и D. u. undecimpunctata Mannerheim это приводит к нарушению успешного паразитирования, питания, развития и/или репродукции или приводит к смерти насекомого-вредителя отряда жесткокрылых на одной или более стадиях развития. Выбор генов-мишеней и успешное применение РНКи затем используется для контроля за насекомыми-вредителями отряда жесткокрылых. Пять-десять реплик 10-20 независимых T1 Z. mays трансгенных линий для каждой РНКи-конструкции переносятся с помощью личинки, повреждающей корни зерновой культуры. Перенос дублируется для каждого вида кукурузного жука. T1 семена РНКи-линий прорастают, и устойчивые растения переносят на среду, модифицированную Knop, через 10-15 дней после проращивания. Контрольные семена Z. mays дикого типа проращивали в то же время и использовали для инфекции кукурузным жуком.
На контролях присутствовало значительно больше (>50%) выживших кукурузных жуков, чем на трансгенных линиях Z. mays, несущих одну или более РНКи-конструкций. Копийность иРНК измеряли в кукурузных жуках, питающихся на корнях растений дикого типа и трансгенных растений, с использованием количественного анализа РВ-ПЦР в реальном времени. Значительно большее количество молекул иРНК было обнаружено в линиях Z. mays, несущих одну или более РНКи-конструкций, по сравнению с контрольными растениями. Эти результаты указывают, что трансгенные линии процессируют киРНК, соответствующие генам-мишеням, и что эти киРНК доступны для поглощения при питании кукурузных жуков. Более важно, эти результаты указывают, что РНКи-опосредованное ингибирование генов-мишеней воздействует на рост, развитие и жизнеспособность мишеней в виде кукурузных жуков. Кроме того, молекулы РНКи, содержащие не совпадающие последовательности, которые имеют более чем 80% идентичности последовательности с генами-мишенями, воздействуют на кукурузных жуков так же, как и последовательности дикого типа. Спаривание несовпадающей последовательности с нативными последовательностями с образованием шпильки дцРНК в одной РНКи-конструкции доставляет процессированные в растении киРНК, способные воздействовать на рост, развитие и жизнеспособность поедающих растение насекомых-вредителей отряда жесткокрылых.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ГЕНЕТИЧЕСКОГО КОНТРОЛЯ ПОРАЖЕНИЯ РАСТЕНИЙ НАСЕКОМЫМИ И ПРИМЕНЯЕМЫЕ ДЛЯ ЭТОГО КОМПОЗИЦИИ | 2006 |
|
RU2478710C2 |
| МОЛЕКУЛЫ НУКЛЕИНОВОЙ КИСЛОТЫ, КОТОРЫЕ ВОЗДЕЙСТВУЮТ НА СУБЪЕДИНИЦУ С ВАКУОЛЯРНОЙ АТФАЗЫ И ПРИДАЮТ УСТОЙЧИВОСТЬ К ЖЕСТКОКРЫЛЫМ НАСЕКОМЫМ-ВРЕДИТЕЛЯМ | 2011 |
|
RU2644669C2 |
| КОНТРОЛЬ ЖЕСТКОКРЫЛЫХ ВРЕДИТЕЛЕЙ С ПРИМЕНЕНИЕМ МОЛЕКУЛ РНК | 2017 |
|
RU2801251C2 |
| НОВЫЕ БЕЛКИ, ПРОЯВЛЯЮЩИЕ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ ПО ОТНОШЕНИЮ К НАСЕКОМЫМ | 2016 |
|
RU2765310C2 |
| ИНСЕКТИЦИДНЫЕ БЕЛКИ | 2017 |
|
RU2765722C2 |
| ОБЪЕКТ КУКУРУЗЫ MON 87411 | 2013 |
|
RU2648155C2 |
| ПОЛИНУКЛЕОТИД И СПОСОБ ДЛЯ ОСУЩЕСТВЛЕНИЯ КОНТРОЛЯ НАД ПОРАЖЕНИЕМ НАСЕКОМЫМИ | 2019 |
|
RU2775943C1 |
| ПОЛИНУКЛЕОТИД И СПОСОБ БОРЬБЫ С НАШЕСТВИЕМ НАСЕКОМЫХ | 2019 |
|
RU2781829C2 |
| ПОЛИНУКЛЕОТИД И СПОСОБ, ИСПОЛЬЗУЕМЫЙ ДЛЯ ОСУЩЕСТВЛЕНИЯ КОНТРОЛЯ НАД НАШЕСТВИЕМ НАСЕКОМЫХ | 2019 |
|
RU2775717C1 |
| ТРАНСГЕННЫЙ ОБЪЕКТ КУКУРУЗЫ MON95275 И СПОСОБЫ ЕГО ОБНАРУЖЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2836053C1 |








































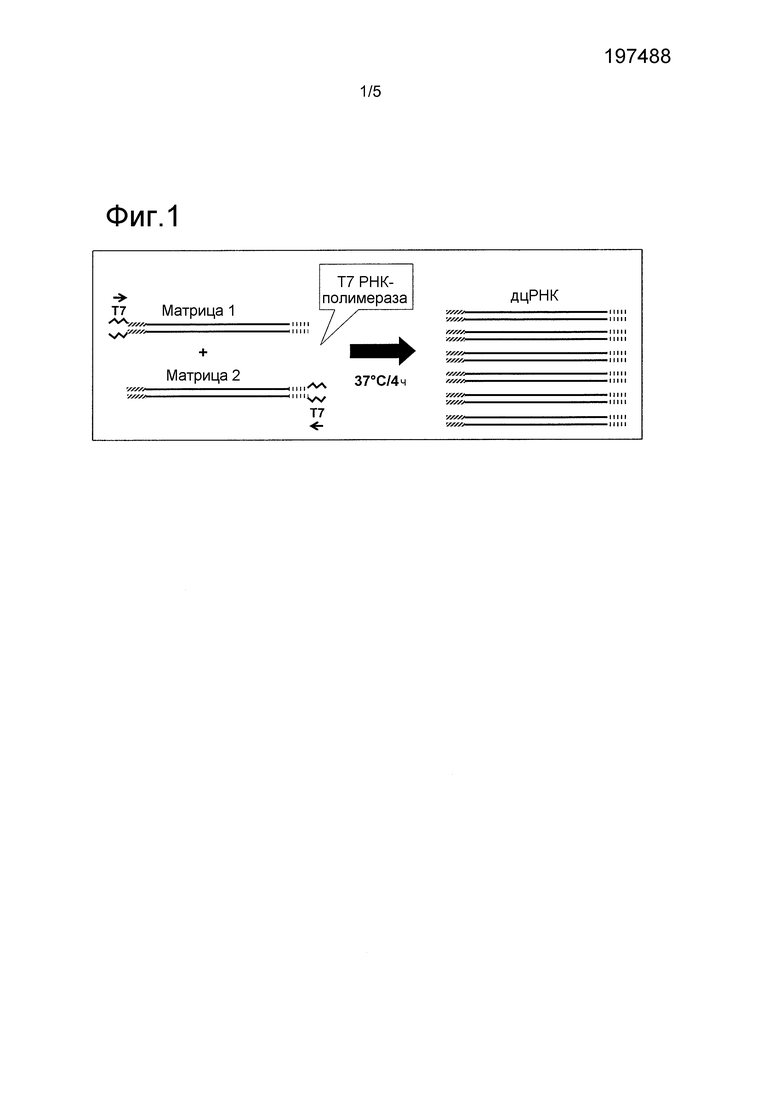

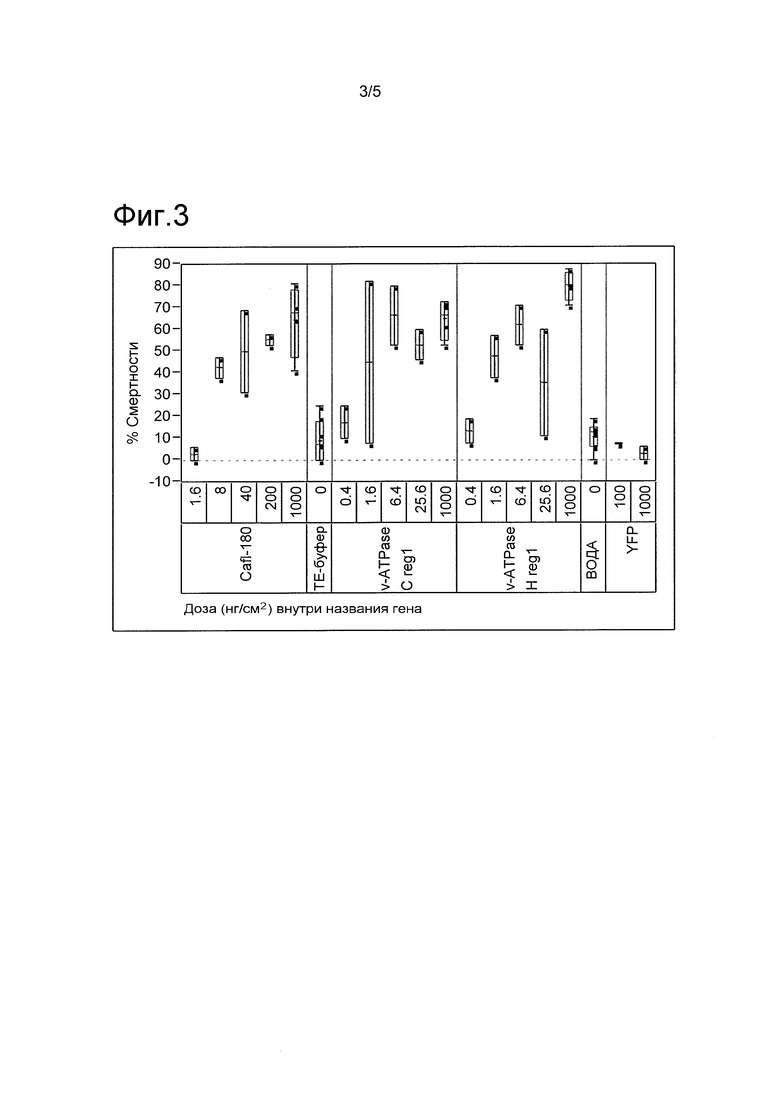
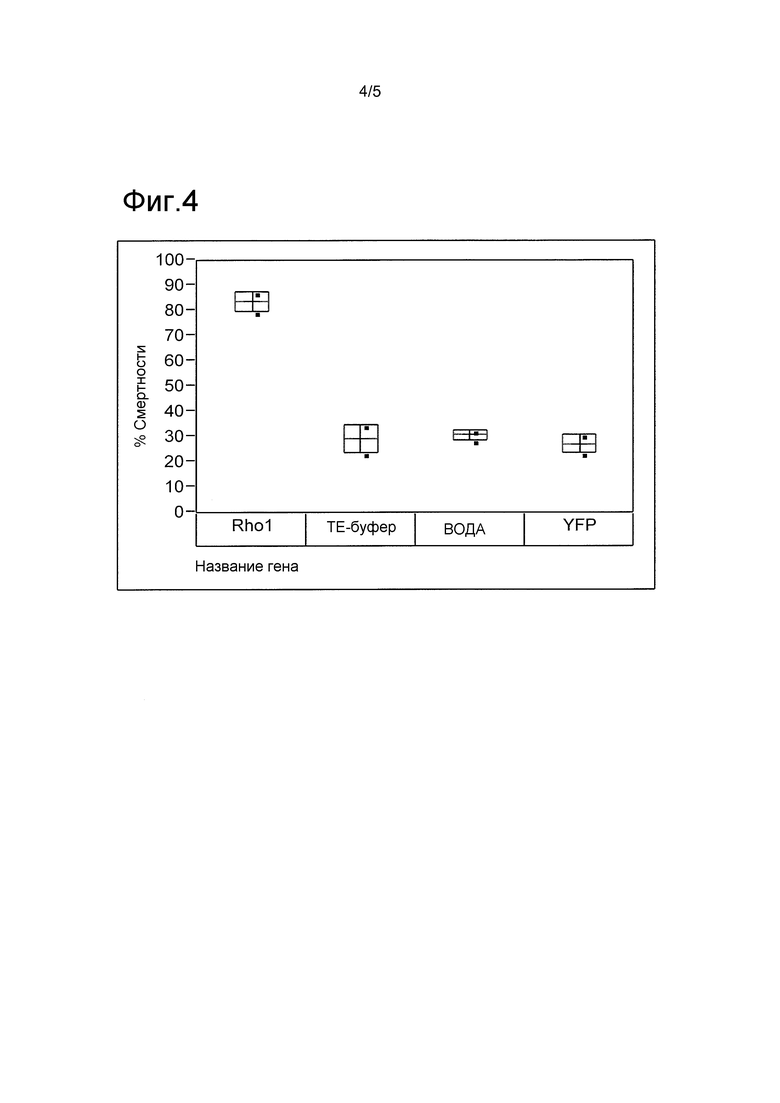

Изобретение относится к области биохимии, в частности к выделенному полинуклеотиду для борьбы с западным кукурузным жуком (WCR), вектору, клетке, растению, семени растения, его содержащим, а также к способу снижения популяции насекомого-вредителя WCR с его использованием. Также раскрыты молекула дцРНК для борьбы с WCR, а также способ уменьшения популяции насекомого-вредителя WCR с ее использованием. Изобретение также относится к способу повышения выхода урожая кукурузы, зараженного WCR, способу получения трансгенной растительной клетки и растения, устойчивого к WCR, с использованием вышеуказанного полинуклеотида. Изобретение позволяет эффективно бороться с западным кукурузным жуком. 11 н. и 14 з.п. ф-лы, 5 ил., 19 табл., 15 пр.
1. Выделенный полинуклеотид для борьбы с западным кукурузным жуком (WCR), где указанный полинуклеотид характеризуется нуклеотидной последовательностью, выбранной из группы, состоящей из: SEQ ID NO: 49, SEQ ID NO: 86, SEQ ID NO: 91, SEQ ID NO: 92, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97 и SEQ ID NO: 110.
2. Полинуклеотид по п. 1, где длина полинуклеотида составляет, по меньшей мере, примерно 100 нуклеотидов.
3. Полинуклеотид по п. 2, где длина полинуклеотида составляет примерно 100 нуклеотидов.
4. Экспрессионный вектор, включающий полинуклеотид по п. 1, где указанный полинуклеотид функционально связан с промотором, функциональным в растительной клетке.
5. Молекула двухцепочечной рибонуклеиновой кислоты (дцРНК) для борьбы с WCR, где указанная дцРНК включает первую, вторую и третью нуклеотидные последовательности, где первая нуклеотидная последовательность кодируется нуклеотидной последовательностью по п. 1, где третья нуклеотидная последовательность связана с первой нуклеотидной последовательностью с помощью второй нуклеотидной последовательности и где третья нуклеотидная последовательность по существу обратно комплементарна первой нуклеотидной последовательности, так что первая и третья нуклеотидные последовательности гибридизуются при транскрипции в рибонуклеиновую кислоту с образованием молекулы дцРНК.
6. Молекула дцРНК по п. 5, где приведение молекулы дцРНК в контакт с насекомым-вредителем WCR ингибирует экспрессию эндогенного гена.
7. Молекула дцРНК по п. 6, где вторая нуклеотидная последовательность включает SEQ ID NO: 136.
8. Клетка, которая экспрессирует молекулу рибонуклеиновой кислоты для борьбы с WCR, где указанная клетка включает полинуклеотид по п. 1.
9. Клетка по п. 8, где клетка представляет собой прокариотическую клетку.
10. Клетка по п. 8, где клетка представляет собой эукариотическую клетку.
11. Клетка по п. 10, где клетка представляет собой растительную клетку.
12. Растение, которое экспрессирует молекулу рибонуклеиновой кислоты для борьбы с WCR, где указанное растение включает полинуклеотид по п. 1.
13. Семя растения по п. 12, где семя экспрессирует молекулу рибонуклеиновой кислоты для борьбы с WCR, где семя включает полинуклеотид по п. 1.
14. Растение по п. 12, где полинуклеотид экспрессируется в растении в виде РНК и где указанная молекула РНК ингибирует экспрессию эндогенного гена насекомого-вредителя WCR, специфично комплементарного указанной нуклеотидной последовательности, когда указанное насекомое-вредитель WCR поглощает часть растения.
15. Клетка по п. 11, где клетка представляет собой клетку Zea mays.
16. Растение по п. 12, где растение представляет собой Zea mays.
17. Растение по п. 14, где указанная молекула РНК представляет собой молекулу дцРНК.
18. Способ уменьшения популяции насекомого-вредителя WCR, включающий приведение указанных насекомых-вредителей WCR популяции в контакт с молекулой дцРНК по п. 5, которая функционирует при контакте с насекомым-вредителем WCR.
19. Способ снижения популяции насекомого-вредителя WCR, причем способ включает:
приведение насекомых-вредителей WCR популяции в контакт с трансгенным растением-хозяином WCR, состоящим по существу из растительных клеток, включающих полинуклеотид по п. 1, так что указанные насекомые-вредители WCR питаются на указанном трансгенном растении-хозяине, где указанный полинуклеотид экспрессируется с получением молекулы РНК, которая функционирует при контакте с указанными насекомыми-вредителями WCR, что приводит к пониженному росту указанных насекомых-вредителей отряда жесткокрылых или популяции насекомых-вредителей отряда жесткокрылых по сравнению с ростом на растении-хозяине того же вида, лишенном указанной трансгенной растительной клетки.
20. Способ по п. 19, где указанная молекула РНК представляет собой молекулу дцРНК.
21. Способ понижения заражения растения насекомыми-вредителями WCR, включающий предоставление полинуклеотида по п. 1 в питании указанного насекомого-вредителя популяции.
22. Способ по п. 21, где указанное питание включает трансгенную растительную клетку, которая экспрессирует молекулу РНК с полинуклеотида по п. 1.
23. Способ повышения выхода урожая кукурузы, зараженного WCR, причем способ включает:
введение полинуклеотида по п. 1 в кукурузу с получением трансгенной кукурузы; и
культивирование растения кукурузы, включающего полинуклеотид по п. 1, дающее возможность экспрессии указанной нуклеотидной последовательности с получением молекулы рибонуклеиновой кислоты, которая подавляет по меньшей мере первый ген-мишень в насекомом-вредителе WCR, которое осуществило контакт с частью растения кукурузы; где экспрессия указанной нуклеотидной последовательности уничтожает насекомого-вредителя WCR, ингибирует рост, репродукцию и/или питание у WCR и тем самым снижает потерю урожая, связанную с заражением насекомым-вредителем WCR.
24. Способ получения трансгенной растительной клетки, устойчивой к WCR, включающий:
трансформацию растительной клетки экспрессионным вектором по п. 4;
культивирование трансформированной растительной клетки при условиях, достаточных для обеспечения возможности развития растительной клеточной культуры, включающей множество трансгенных растительных клеток;
селекцию трансгенных растительных клеток, которые интегрировали указанную нуклеотидную последовательность в свои геномы;
скрининг трансгенных растительных клеток на предмет экспрессии молекулы РНК, кодируемой указанной нуклеотидной последовательностью; и
селекцию трансгенной растительной клетки, которая экспрессирует указанную РНК.
25. Способ получения трансгенного растения, устойчивого к насекомому-вредителю WCR, причем способ включает:
регенерацию трансгенного растения из трансгенной растительной клетки по п. 8, где экспрессии молекулы РНК, кодируемой указанной нуклеотидной последовательностью, достаточно для борьбы с WCR, который контактирует с указанным трансформированным растением.
| WO 2005110068 A2, 24.11.2005 | |||
| BAUM J.A | |||
| et al | |||
| Control of coleopteran insect pests through RNA interference, Nature Biotechnology, 2007, Vol | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| ИНСЕКТИЦИДНЫЕ БЕЛКИ, ВЫДЕЛЕННЫЕ ИЗ ВИДОВ БАКТЕРИЙ Bacillus, И ИХ ПРИМЕНЕНИЕ | 2004 |
|
RU2382822C2 |
Авторы
Даты
2017-12-21—Публикация
2011-12-30—Подача