Область техники
Настоящее изобретение относится к области защиты растений, особенно, защиты сельскохозяйственных культур. В частности, настоящее изобретение относится к полинуклеотиду и способу борьбы с нашествием насекомых, и, особенно, к способу борьбы с нашествием Monolepta hieroglyphica (Motschulsky) за счет уменьшения или прекращения экспрессии целевой последовательности в Monolepta hieroglyphica с использованием технологии РНКи.
Уровень техники
Сельскохозяйственные культуры, как правило, являются мишенью для насекомых. За последние несколько десятилетий были достигнуты некоторые существенные успехи в разработке более эффективных способов и композиций против нападения насекомых на сельскохозяйственные культуры. Например, для борьбы с вредными насекомыми применяют химические инсектициды, микробные инсектициды и способы генетической инженерии.
Химические инсектициды являются относительно эффективным средством борьбы с нашествием вредных насекомых. Однако использование химических пестицидов также имеет много недостатков. Прежде всего, химические инсектициды неселективны. Люди намереваются использовать химические инсектициды для борьбы с насекомыми, которые вредны для многих сельскохозяйственных культур и других растений. Однако из-за отсутствия селективности химические инсектициды также вредны для нецелевых организмов, таких как дождевые черви. Кроме того, после периода применения химических пестицидов они, как правило, делают поля бесплодными. Химические пестициды постоянно существуют в окружающей среде и, как правило, медленно метаболизируются. Этот медленный метаболизм вызывает накопление остатков химических пестицидов в сельскохозяйственных культурах и окружающей среде, так что они могут накапливаться в пищевой цепи, особенно в пищевой цепи высших хищников. Накопление этих химических пестицидов может вызывать заболевания у более совершенных видов, такие как злокачественные опухоли у человека. Monolepta hieroglyphica переживает зиму в виде яйца в почве, и личинки также живут в почве после вылупления в июне следующего года. Однако из-за широкомасштабной популяризации в последние годы возвращения соломы на поле, сложность использования химических пестицидов для борьбы с Monolepta hieroglyphica увеличивается с каждым годом. Тем более, что с конца июля до начала августа взрослая особь Monolepta hieroglyphica выкапывается из земли и в это время вырастает кукуруза, и применять химические пестициды для борьбы с вредителями становится еще сложнее.
Микробные инсектициды, особенно инсектициды, полученные из штаммов Bacillus thuringiensis (Bt) в качестве заменителей химических инсектицидов, играют важную роль в сельскохозяйственном производстве и проявляют определенную инсектицидную активность против насекомых, таких как Lepidoptera, Diptera и Coleoptera. Однако микробные инсектициды предъявляют относительно высокие требования к среде применения. Если среда не подходит для роста этих микроорганизмов, требуется повторное применение в производстве, а в некоторых случаях даже повторное нанесение не может достичь цели борьбы с вредителями, что значительно увеличивает производственные затраты.
Один или несколько генов, кодирующих инсектицидный белок Bt, переносят в растения посредством генетической инженерии, и можно получать некоторые трансгенные растения с повышенной устойчивостью к вредителям. Например, растения кукурузы и хлопка, которые были генетически сконструированы для производства токсинов Cry, широко используются в сельскохозяйственном производстве в США и предоставляют фермерам альтернативу традиционным методам борьбы с вредителями. Однако разработанные в настоящее время генетически модифицированные сельскохозяйственные культуры, содержащие токсин Cry, можно использовать только для борьбы с относительно узким кругом жесткокрылых вредителей, таких как кукурузный корневой жук и колорадский жук. Для одного из основных вредителей кукурузы, Monolepta hieroglyphica, нет сообщений о применении токсина Cry для профилактики и лечения.
Ввиду ограничений вышеупомянутых способов существует острая необходимость в способе борьбы с атаками насекомых или способе искоренения атак насекомых в процессе производства сельскохозяйственных культур, особенно борьбы с нашествием Monolepta hieroglyphica, способе, который является экологически чистым (т.е. селективным, экологически чистым и биоразлагаемым) и может часто использоваться в системе управления устойчивостью к вредителям.
РНК-интерференцию или РНКи можно использовать для подавления экспрессии гена в клетке или целом организме на основании его последовательности. Нацеленного вмешательства в экспрессию гена-мишени можно достичь путем специфического отбора мишени и эффективного подавления мРНК. Хотя использование технологии РНКи для борьбы с вредителями известно в данной области, ввиду большого разнообразия насекомых эта технология не только оказывает очень разное воздействие на разных насекомых, но также ключевым фактором для использования этой технологии в качестве меры по борьбе с вредителями является выбор наиболее подходящих генов-мишеней, то есть тех генов, потеря функции которых приводит к серьезному разрушению основных биологических процессов и/или гибели организмов. Таким образом, в настоящем изобретении используется негативная регуляция конкретных генов-мишеней у вредителей как средство борьбы с нашествием насекомых, особенно, с целью борьбы с нашествием насекомых у растенияй.
Сущность
Задачей настоящего изобретения является создание полинуклеотида и способа борьбы с вторжением насекомого, то есть использование технологии РНКи для подавления экспрессии гена-мишени: ослабление способности насекомых выживать, расти, размножаться, колонизироваться в определенной окружающей среде и/или вторгаться в хозяина, и, таким образом, борьба с нашествием насекомых и вызываемыми ими повреждениями.
Для решения вышеуказанной задачи настоящее изобретение относится к изолированному полинуклеотиду, где полинуклеотид выбран из:
(а) полинуклеотидной последовательности, показанной в SEQ ID NO: 1; или
(b) полинуклеотидной последовательности, по меньшей мере, из 15 последовательных нуклеотидов из SEQ ID NO: 1, где, когда жесткокрылое насекомое-вредитель поглощает двухцепочечную РНК, содержащую, по меньшей мере, одну цепь, комплементарную полинуклеотидной последовательности, рост жесткокрылых насекомых-вредителей ингибируется; или
(c) полинуклеотидной последовательности, по меньшей мере, из 17 последовательных нуклеотидов из SEQ ID NO: 1, где, когда жесткокрылое насекомое-вредитель поглощает двухцепочечную РНК, содержащую, по меньшей мере, одну цепь, комплементарную полинуклеотидной последовательности, рост жесткокрылых насекомых-вредителей ингибируется; или
(d) полинуклеотидной последовательности, по меньшей мере, из 19 последовательных нуклеотидов из SEQ ID NO: 1, где, когда жесткокрылое насекомое-вредитель поглощает двухцепочечную РНК, содержащую, по меньшей мере, одну цепь, комплементарную полинуклеотидной последовательности, рост жесткокрылых насекомых-вредителей ингибируется; или
(e) полинуклеотидной последовательности, по меньшей мере, из 21 последовательного нуклеотида из SEQ ID NO: 1, где, когда жесткокрылое насекомое-вредитель поглощает двухцепочечную РНК, содержащую, по меньшей мере, одну цепь, комплементарную полинуклеотидной последовательности, рост жесткокрылых насекомых-вредителей ингибируется; или
(f) любой из полинуклеотидных последовательностей, показанных в SEQ ID NO: от 3 до 20; или
(g) полинуклеотидной последовательности, которая гибридизуется с полинуклеотидной последовательностью или комплементарна полинуклеотидной последовательности, как определено в любом из пунктов от (а) до (f), при жестких условиях.
Дополнительно, полинуклеотид также включает последовательность, комплементарную полинуклеотидной последовательности.
Дополнительно, полинуклеотид также содержит спейсерную последовательность.
Предпочтительно, спейсерная последовательность представляет собой SEQ ID NO: 23.
В вариантах осуществления, основанных на вышеуказанных технических решениях, жесткокрылым насекомым-вредителем является Monolepta hieroglyphica.
Для достижения вышеупомянутой задачи настоящее изобретение также относится к экспрессионной кассете, содержащей полинуклеотидную последовательность под контролем функционально связанной регуляторной последовательности.
Для достижения вышеупомянутой задачи настоящее изобретение также относится к рекомбинантному вектору, содержащему полинуклеотидную последовательность или экспрессионную кассету.
Для достижения вышеупомянутой задачи настоящее изобретение также относится к использованию полинуклеотида для вмешательства в экспрессию целевой последовательности жесткокрылых насекомых-вредителей или для ингибирования роста жесткокрылых насекомых-вредителей.
Для достижения вышеупомянутой задачи настоящее изобретение также относится к интерферирующей рибонуклеиновой кислоте, которая после того, как интерферирующая рибонуклеиновая кислота попадает в организм жесткокрылого насекомого-вредителя, подавляет экспрессию, по меньшей мере, одного гена-мишени у жесткокрылого насекомого-вредителя, где интерферирующая рибонуклеиновая кислота содержит, по меньшей мере, один элемент сайленсинга, где элемент сайленсинга представляет собой двухцепочечную область РНК, содержащую соединенные комплементарные цепи, где одна цепь содержит нуклеотидную последовательность или состоит из нуклеотидной последовательности, которая, по меньшей мере, частично комплементарна целевой последовательности в гене-мишени, и ген-мишень содержит полинуклеотидную последовательность.
Дополнительно, элемент сайленсинга содержит нуклеотидную последовательность или состоит из нуклеотидной последовательности, по меньшей мере, из 15 последовательных нуклеотидов, которая, по меньшей мере, частично комплементарны целевому фрагменту в целевой последовательности.
Дополнительно, элемент сайленсинга содержит нуклеотидную последовательность или состоит из нуклеотидной последовательности, по меньшей мере, из 17 последовательных нуклеотидов, которая, по меньшей мере, частично комплементарны целевому фрагменту в целевой последовательности.
Дополнительно, элемент сайленсинга содержит нуклеотидную последовательность или состоит из нуклеотидной последовательности, по меньшей мере, из 19 последовательных нуклеотидов, которая, по меньшей мере, частично комплементарны целевому фрагменту в целевой последовательности.
Дополнительно, элемент сайленсинга содержит нуклеотидную последовательность или состоит из нуклеотидной последовательности, по меньшей мере, из 21 последовательного нуклеотида, которая, по меньшей мере, частично комплементарна целевому фрагменту в целевой последовательности.
Альтернативно, интерферирующая рибонуклеиновая кислота содержит, по меньшей мере, два элемента сайленсинга, и каждый из элементов сайленсинга содержит нуклеотидную последовательность или состоит из нуклеотидной последовательности, которая, по меньшей мере, частично комплементарна целевой последовательности в гене-мишени.
Дополнительно, каждый из элементов сайленсинга содержит или включает разные нуклеотидные последовательности, комплементарные другой целевой последовательности.
Дополнительно, другая целевая последовательность происходит исключительно из гена-мишени или происходит из дополнительного гена-мишени, отличного от гена-мишени.
Дополнительный ген-мишень, отличный от гена-мишени, получен от того же жесткокрылого насекомого-вредителя или от другого жесткокрылого насекомого-вредителя.
Предпочтительно, жесткокрылое насекомое-вредитель представляет собой Monolepta hieroglyphica.
В вариантах осуществления, основанных на вышеуказанных технических решениях, интерферирующая рибонуклеиновая кислота дополнительно содержит спейсерную последовательность.
В частности, спейсерная последовательность представляет собой SEQ ID NO: 23.
Для достижения вышеупомянутой задачи настоящее изобретение также относится к композиции для борьбы с нашествием жесткокрылых насекомых-вредителей, содержащей, по меньшей мере, одну из интерферирующих рибонуклеиновых кислот и, по меньшей мере, один подходящий носитель, эксципиент или разбавитель.
Дополнительно композиция содержит клетку-хозяина, которая экспрессирует или способна экспрессировать интерферирующую рибонуклеиновую кислоту. В частности, клетка-хозяин представляет собой бактериальную клетку.
Кроме того, композиция представляет собой твердое вещество, жидкость или гель. В частности, композиция представляет собой инсектицидный спрей.
Необязательно, композиция содержит по меньшей мере один инсектицид, в котором инсектицид представляет собой химический инсектицид, специфический белок клубней картофеля, инсектицидный белок Bacillus thuringiensis, инсектицидный белок Xenorhabdus ehlersii, инсектицидный белок Photorhabdus luminescens, инсектицидный белок Bacillus laterosporus или инсектицидный белок Bacillus sphaericus.
Для решения вышеупомянутой задачи настоящее изобретение также относится к применению композиции для борьбы с нашествием жесткокрылых насекомых-вредителей для профилактики нашествия и/или борьбы с нашествием жесткокрылых насекомых-вредителей.
Предпочтительно, жесткокрылое насекомое-вредитель представляет собой Monolepta hieroglyphica.
Для достижения вышеупомянутой задачи настоящее изобретение также относится к способу борьбы с нашествием жесткокрылых насекомых-вредителей, включающему контактирование жесткокрылых насекомых-вредителей с эффективным количеством, по меньшей мере, одной из последовательностей интерферирующей рибонуклеиновой кислоты.
Для достижения вышеупомянутой задачи настоящее изобретение также относится к способу повышения устойчивости растений к жесткокрылому насекомому-вредителю, включающему введение в растение полинуклеотида или экспрессионной кассеты, или рекомбинантного вектора или конструкции, содержащей интерферирующую рибонуклеиновую кислоту.
Для достижения вышеупомянутой задачи настоящее изобретение также относится к способу получения растения для борьбы с жесткокрылым насекомым-вредителем, включающему введение в растение полинуклеотида или экспрессионной кассеты, или рекомбинантного вектора или конструкции, содержащей интерферирующую рибонуклеиновую кислоту.
Для достижения вышеупомянутой задачи настоящее изобретение также относится к способу защиты растения от повреждения, вызываемого жесткокрылым насекомым-вредителем, включающим введение в растение полинуклеотида или экспрессионной кассеты, или рекомбинантного вектора или конструкции, содержащей интерферирующую рибонуклеиновую кислоту, где растение после введения подавляет рост жесткокрылых насекомых-вредителей после того, как его поедают жесткокрылые насекомые-вредители.
В вариантах осуществления, основанных на вышеуказанных технических решениях, растение представляет собой сою, пшеницу, ячмень, кукурузу, табак, рис, рапс, хлопок или подсолнечник.
Настоящее изобретение включает способ регулирования или ингибирования экспрессии одного или нескольких генов-мишеней у жесткокрылого насекомого-вредителя, способ, включающий введение части или целой стабилизированной двухцепочечной РНК (дцРНК) или ее модифицированной формы (например, последовательности малой интерферирующей РНК) в клетку или внеклеточную среду беспозвоночного вредного насекомого. В организме насекомого дцРНК или миРНК проникает в клетки, подавляя экспрессию, по меньшей мере, одного или нескольких генов-мишеней, и это ингибирование снижает способность насекомого выживать, расти, воспроизводиться и вторгаться в хозяина.
Подробное описание
Далее в настоящем документе будут подробно описаны различные аспекты настоящего изобретения.
Monolepta hieroglyphica и повреждение сельскохозяйственных культур
Monolepta hieroglyphica (Motschulsky) по настоящему изобретению представляет собой голометаболическое насекомое из отрядов Galeruca, Chrysomelidae, Coleoptera. Его яйцо, личинки и куколки живут в почве, а взрослое насекомое вылетает из почвы после вылупления. Это однолетнее насекомое зимует в виде диапаузных яиц. Диапаузные яйца начинают вылупляться в мае каждого года, а личинки можно наблюдать в полевой почве с мая до начала июля; куколки можно увидеть в поле с конца июня до середины июля; взрослые особи появляются время от времени и летают на кукурузные, соевые и другие поля, чтобы нанести ущерб; пиковый период вылупления происходит с конца июля до начала августа; приблизительно через 15 суток после вылупления, может начаться отложение яиц, и период размножения длится приблизительно 1 месяц.
Личинки Monolepta hieroglyphica, в основном, питаются корнями сельскохозяйственных культур в полевых условиях, и повреждение личинками не отражается на надземных частях; ежегодно в середине июля взрослые особи повреждают листья кукурузы и сои; большое количество взрослых особей в основном повреждает волокна кукурузы с конца июля до начала августа, в результате чего кукурузные волокна откусываются, что серьезно влияет на опыление и колосья остаются заостренными и веретеновидными, что приводит к сокращению производства кукурузы; затем Monolepta hieroglyphica перемещается на соевые поля, чтобы питаться листьями сои, или перемещается на окружающие овощные поля, чтобы нанести вред овощам. С 2009 по 2016 год в Китае площадь кукурузы, пораженной Monolepta hieroglyphica, увеличилась с 16 миллионов му до почти 40 миллионов му, а площадь распространения увеличилась вдвое. Зона поражения также распространилась с северо-запада и других мест на основные районы производства кукурузы, такие как северо-восток и север Китая.
В то же время, постоянное совершенствование мер по возврату соломы, постоянное обогащение полевого гумуса и увеличение поверхностного покрова почвы затрудняют внесение пестицидов в почву, и профилактика, и борьба с личинками Monolepta hieroglyphica становятся более серьезными и трудными. Иными словами, естественная защита, обеспечиваемая личинкам Monolepta hieroglyphica возвращаемой соломой, может значительно увеличить коэффициент выживаемости личинок Monolepta hieroglyphica, тем самым вызывая увеличение плотности популяции Monolepta hieroglyphica. Взрослые особи Monolepta hieroglyphica представляют собой хорошо летающих и прыгучих насекомых, и начинают повреждать кукурузу после вылупления с середины до конца июля, когда кукуруза вступает в период опушения. В это время кукуруза становится выше, сложность применения пестицидов возрастает, и легко спровоцировать трагедию, что пестициды случайно повредят опрыскивателям. В то же время их неселективное инсектицидное действие может вызывать повреждение сельскохозяйственных культур и нецелевых органических веществ. Кроме того, химические пестициды могут иметь кумулятивное воздействие на организм человека и становиться мутагенами или канцерогенами. Таким образом, необходимо иметь точный, экологически чистый и простой в использовании способ, позволяющий фермерам бороться с ущербом, наносимым Monolepta hieroglyphica. За счет генетической модификации сельскохозяйственная культура оказывает определенное воздействие против насекомых в течение всего периода роста и обеспечивает защиту всего растения и всего периода роста.
Исходя из вышеупомянутых проблем, одним из лучших решений является применение способа генетически модифицированных РНКи, способных контролировать Monolepta hieroglyphica и обеспечивать профилактику и борьбу в течение полного периода роста и всего растения кукурузы, сои и других сельскохозяйственных культур.
РНКи и полинуклеотидная последовательность
Настоящее изобретение в основном относится к технологии РНКи. В настоящем изобретении «РНК-интерференция (РНКи)» относится к тому, что некоторые РНК могут эффективно и специфично блокировать экспрессию конкретных генов in vivo, способствовать деградации мРНК и побуждать клетки проявлять фенотип делеции конкретного гена. Ее еще называют вмешательством РНК или интерференцией. РНК-интерференция представляет собой высокоспецифичный механизм подавления генов на уровне мРНК.
В настоящем изобретении, РНК-интерференцию или РНКи применяют для снижения экспрессии гена. РНКи представляет собой способ регуляции генов на основе последовательности, как правило, опосредованный двухцепочечной молекулой РНК (такой как миРНК). миРНК содержит смысловую цепь РНК, которая спаривается за счет комплементарного спаривания оснований с антисмысловой цепью РНК. Смысловая или «направляющая цепь» молекулы миРНК включает нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности, расположенной в транскрипте РНК гена-мишени. Таким образом, смысловая цепь миРНК может быть спарена с транскриптом РНК посредством спаривания оснований типа Уотсона-Крика и нацелена на РНК, чтобы разрушить в клетке комплекс, называемый РНКи-индуцированный комплекс сайленсинга или RISC.
Настоящее изобретение относится к изолированному и очищенному полинуклеотиду, последовательность которого показана в SEQ ID NO: 1. Настоящее изобретение также относится к любой РНК, включая дцРНК, экспрессируемой из полинуклеотида. Настоящее изобретение относится к стабилизированной двухцепочечной молекуле РНК для ингибирования экспрессии целевой последовательности жесткокрылых вредителей. При экспрессии в виде дцРНК и предоставлении вредителю, фрагмент можно определить как фрагмент, который заставляет вредителя погибать, препятствует питанию, блокирует или останавливает.Фрагмент может, например, содержать по меньшей мере, приблизительно 19, 21, 23, 25, 40, 60, 80, 100, 125 или более последовательных нуклеотидов, или приблизительно от 19 до приблизительно 100 или более нуклеотидов из SEQ ID NO: 1 или ее комплементарной последовательности, такой как SEQ ID NO: с 3 до 20. Особенно подходящей является последовательность дцРНК, содержащая приблизительно от 19 до 300 нуклеотидов, гомологичных целевой последовательности вредителя.
Стабилизированная двухцепочечная РНК содержит, по меньшей мере, две кодирующих последовательности, которые расположены в смысловом и антисмысловом направлениях относительно, по меньшей мере, одного промотора, где нуклеотидные последовательности, содержащие смысловую цепь и антисмысловую цепь, связаны через спейсерную последовательность, по меньшей мере, длиной приблизительно от 5 до 1000 нуклеотидов, где смысловая цепь и антисмысловая цепь могут иметь разную длину, и где, по меньшей мере, одна из двух кодирующих последовательностей имеет идентичность последовательности, по меньшей мере, 80%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или 100% с нуклеотидной последовательностью, показанной в SEQ ID NO: 1.
Термин «борьба с насекомыми» или «борьба с вредителями» или «борьба с насекомыми-вредителями» в настоящем изобретении относится к любому эффекту, который может ограничить ущерб, причиняемый насекомым, и действовать на насекомое, включая в качестве неограничивающих примеров уничтожение насекомых, замедление развития насекомого, изменение размножения или роста насекомого таким образом, что насекомое наносит меньший ущерб растению, уменьшение количества потомства, производимого насекомым, производство меньшего количества нормальных насекомых, создание насекомого, более уязвимого для хищника, или предотвращение того, чтобы насекомое поедало растение.
«Ген-мишень», описанный в настоящем изобретении, представляет собой любую последовательность, которая предназначена для подавления у насекомых. Нашествие насекомых контролируется подавлением генов-мишеней, таким как разрушение важного биологического процесса у насекомых. Таким образом, предпочтительный ген-мишень в качестве неограничивающих примеров включает ген, который играет ключевую роль в регулировании кормления, выживания, роста, развития, размножения, нашествия и заражения. Когда экспрессия генов-мишеней подавляется или ингибируется, по меньшей мере, 30% насекомых погибают; или, по меньшей мере, у 30% насекомых предотвращен/задерживается/затруднен/отстает/блокируется рост, или, по меньшей мере, у 30% насекомых не происходит размножения, или, по меньшей мере, у 30% насекомых предотвращается переход через жизненный цикл; или снижен ущерб, причиненный насекомыми, и/или способность насекомых заражать или вторгаться в окружающую среду, на поверхности и/или растения или сельскохозяйственную культуру; или, по меньшей мере, 30% насекомых перестают поедать свои естественные пищевые ресурсы (такие как растения и растительные продукты). Эти гены-мишени можно экспрессировать во всех или в части клеток насекомых. Кроме того, эти гены-мишени можно экспрессировать только на определенной стадии жизненного цикла насекомых, такой как стадия взрослого или личиночная стадия, или стадия яйца.
В настоящем изобретении термин «вредитель» относится, предпочтительно, к насекомому, которое вызывает нашествие/нападение на растения/заражение растений, и принадлежит к Coleoptera, предпочтительно, Monolepta hieroglyphica. Термины «заражение», «нападение» и/или «нашествие» в настоящем изобретении в основном используются взаимозаменяемо.
В настоящем изобретении "нуклеиновая кислота" относится к одно- или двухцепочечному полимеру из оснований дезоксирибонуклеиновой кислоты или рибонуклеиновой кислоты, которые читаются от 5'к 3'-концу. Необязательно, «нуклеиновая кислота» может также содержать неприродные или измененные основания, которые могут правильно считываться полимеразой без снижения экспрессии полипептида, кодируемого нуклеиновой кислотой. «Нуклеотидная последовательность» относится к смысловым и антисмысловым цепям нуклеиновой кислоты, которые существуют в виде отдельных однонитевых цепей или существуют в виде дуплекса. «Рибонуклеиновая кислота» (РНК) включает РНКи (РНК-интерференция), дцРНК (двухцепочечную РНК), миРНК (малую интерферирующую РНК), мРНК (матричную РНК), мкРНК (микроРНК), тРНК (транспортную РНК, которая несет или не несет соответствующую ацилированную аминокислоту), гибридную кДНК, геномную ДНК и ДНК-РНК. «Фрагмент нуклеиновой кислоты», «фрагмент последовательности нуклеиновой кислоты» или более часто «фрагмент» будет пониматься специалистами в данной области как содержащий геномную последовательность, последовательность рибосомной РНК, последовательность транспортной РНК, последовательность матричной РНК, последовательность оперона и малую инженерно модифицированную нуклеотидную последовательность, где последовательность экспрессирует белок, полипептид или пептид или может быть модифицирована для экспрессии белка, полипептида или пептида.
«Интерферирующая рибонуклеиновая кислота» по настоящему изобретению включает любой тип молекулы РНК, который может подавлять или «выключать» экспрессию гена-мишени, включая в качестве неограничивающих примеров смысловую РНК, антисмысловую РНК, миРНК, мкРНК, дцРНК, шпилечную РНК и т.д. Способы определения функциональных интерферирующих молекул РНК описаны и хорошо известны в данной области.
Интерферирующая рибонуклеиновая кислота по настоящему изобретению может специфически подавлять экспрессию гена-мишени путем связывания с целевой последовательностью в гене-мишени. Связывание происходит из-за спаривания оснований между интерферирующей РНК и комплементарной областью целевой последовательности.
Кроме того, настоящее изобретение относится к молекулам нуклеиновой кислоты или ее фрагментам, которые гибридизуются (особенно специфически гибридизуются) с полинуклеотидом по настоящему изобретению в «жестких условиях». Как известно специалистам в данной области, молекулы нуклеиновой кислоты или ее фрагменты могут специфически гибридизоваться с другими молекулами нуклеиновой кислоты в определенных условиях. В настоящем изобретении, если две молекулы нуклеиновой кислоты могут образовывать антипараллельную структуру двухцепочечной нуклеиновой кислоты, это указывает, что две молекулы нуклеиновой кислоты могут специфически гибридизоваться друг с другом. Если две молекулы нуклеиновой кислоты демонстрируют полную комплементарность, это указывает, что одна из молекул нуклеиновой кислоты является «комплементарной» другой молекуле нуклеиновой кислоты. В настоящем изобретении, когда каждый нуклеотид одной молекулы нуклеиновой кислоты комплементарен соответствующему нуклеотиду другой молекулы нуклеиновой кислоты, это указывает на то, что две молекулы нуклеиновой кислоты демонстрируют «полную комплементарность». Если две молекулы нуклеиновой кислоты могут гибридизироваться друг с другом с достаточной стабильностью, так что они могут отжигаться и связываться друг с другом, по меньшей мере, при общепринятых условиях с «низкой жесткостью», это указывает, что две молекулы нуклеиновой кислоты являются «минимально комплементарными». Точно так же, если две молекулы нуклеиновой кислоты могут гибридизоваться друг с другом с достаточной стабильностью, так что они могут отжигаться и связываться друг с другом при общепринятых условиях с «высокой жесткостью», это указывает, что две молекулы нуклеиновой кислоты имеют «комплементарность». Отклонение от полной комплементарности допустимо, при условии, что отклонение не полностью препятствует двум молекулам формировать двухцепочечную структуру. Для того чтобы молекула нуклеиновой кислоты действовала в качестве праймера или зонда, необходимо только убедиться, что она имеет достаточную комплементарность по последовательности, так что стабильная двухцепочечная структура может быть сформирована с используемым конкретным растворителем и солью. В настоящем изобретении по существу гомологичной последовательностью является молекула нуклеиновой кислоты, которая может специфически гибридизоваться с комплементарной цепью другой подходящей молекулы нуклеиновой кислоты в очень жестких условиях. Подходящие жесткие условия, способствующие гибридизации ДНК включают, например, обработку 6,0× хлоридом натрия/цитратом натрия (SSC) при приблизительно 45°C, промывание 2,0×SSC при 50°C, и эти условия хорошо известны специалистам в данной области. Например, концентрацию соли на этапе промывания можно выбирать приблизительно от 2,0× SSC, 50°C в условиях низкой жесткости до приблизительно 0,2× SSC, 50°C в условиях высокой жесткости. Кроме того, температурные условия на этапе промывания могут быть индуцированы от комнатной температуры приблизительно от 22°C в условиях низкой жесткости до приблизительно 65°C в очень жестких условиях. Температурные условия и концентрации соли могут изменяться или одна из них может оставаться неизменной, а другая переменная меняется. Предпочтительно, жесткие условия по настоящему изобретению могут заключаться в том, что специфическую гибридизацию с полинуклеотидом по настоящему изобретению проводят при 6× SSC, 0,5% растворе SDS при 65°C, а промывание проводят один раз с использованием каждого из 2× SSC, 0,1% SDS и 1× SSC и 0,1% SDS.
Термин «элемент сайленсинга» относится к части или области интерферирующей рибонуклеиновой кислоты, которая содержит нуклеотидные последовательности или состоит из нуклеотидных последовательностей, комплементарных или, по меньшей мере, частично комплементарных целевой последовательности в гене-мишени, и эта часть или область действует как активная часть интерферирующей рибонуклеиновой кислота, чтобы направлять негативную регуляцию экспрессии гена-мишени. Элемент сайленсинга включает интерферирующую рибонуклеиновую кислоту, которая содержит или состоит из 15 последовательных нуклеотидов, предпочтительно, по меньшей мере, 18 или 19 последовательных нуклеотидов, более предпочтительно, по меньшей мере, из 21 последовательного нуклеотида, даже более предпочтительно, по меньшей мере, из 22, 23, 24 или 25 последовательных нуклеотидов, которые комплементарны целевой последовательности в гене-мишени. В случае предпочтительной интерферирующей рибонуклеиновой кислоты по настоящему изобретению, элемент сайленсинга может представлять собой двухцепочечную область, содержащую спаренную комплементарную цепь, где, по меньшей мере, одна цепь содержит интерферирующую рибонуклеиновую кислоту, которая содержит или включает нуклеотидные последовательности, комплементарные или, по меньшей мере, частично комплементарные целевой последовательности в гене-мишени. Двухцепочечная область имеет длину, по меньшей мере, приблизительно от 15 до приблизительно 25 пар оснований, или длину приблизительно от 25 до приблизительно 100 пар оснований, или даже длину 3000 пар оснований.
В настоящем изобретении «экспрессия гена-мишени» относится к транскрипции и накоплению транскрипта РНК, кодируемого геном-мишенью, и/или трансляции мРНК в белок.
Термин «негативная регуляция» относится к любому из известных в данной области способов для интерферирующей рибонуклеиновой кислоты для снижения уровня транскрипта первичной РНК, мРНК или белка, продуцируемого геном-мишенью. Негативная регуляция относится к ситуации, когда уровень РНК или белка, производимого геном, снижается, по меньшей мере, на 10%, предпочтительно, по меньшей мере, на 33%, более предпочтительно, по меньшей мере, на 50%, даже более предпочтительно, по меньшей мере, на 80%. В частности, негативная регуляция относится к ситуации, при которой уровень РНК или белка, продуцируемого геном в клетках насекомых, снижается, по меньшей мере, на 80%, предпочтительно, по меньшей мере, на 90%, более предпочтительно, по меньшей мере, на 95% и наиболее предпочтительно, по меньшей мере, по меньшей мере, на 99%, по сравнению с насекомыми с общепринятыми способами борьбы (например, насекомыми, которые не подвергались воздействию интерферирующей рибонуклеиновой кислоты или подвергались воздействию контрольной интерферирующей рибонуклеиновой кислоты). Способы определения снижения уровня РНК или белка хорошо известны в данной области и включают гибридизацию раствора РНК, нозерн-гибридизацию, обратную транскрипцию (например, количественный анализ при помощи ОТ-ПЦР), анализ с помощью микропанели, связывание антител и твердофазный иммуноферментный анализ (ELISA), и Вестерн-блоттинг. В то же время негативная регуляция может также относиться к тому, что уровень РНК или белка снижается настолько, что вызывает детектируемое изменение фенотипа насекомых, такое как гибель клеток, задержку роста и т.д., по сравнению с насекомыми с общепринятыми способами борьбы. Таким образом, общепринятые способы в данной области можно использовать для измерения негативной регуляции посредством фенотипического анализа насекомых.
В настоящем изобретении «ингибирование экспрессии гена-мишени» относится к снижению или отсутствию (ниже детектируемого порога) уровня белкового продукта и/или мРНК гена-мишени. Специфичность относится к способности ингибировать ген-мишень, не затрагивая другие гены в клетке, и не оказывая никакого воздействия на какой-либо ген в клетке, которая производит молекулы дцРНК.
В настоящем изобретении «смысловая» РНК относится к транскрипту РНК соответствующей последовательности или фрагменту, который существует в форме мРНК и который может быть переведен в белок с помощью растительной клетки. В настоящем изобретении «антисмысловая» РНК относится к РНК, которая комплементарна всей или части мРНК, в норме производимой в растении. Комплементарность антисмысловой РНК может быть направлена на любую часть транскрипта конкретного гена, т.е. 5'-некодирующую последовательность, 3'-некодирующую последовательность, интрон или кодирующую последовательность. В настоящем изобретении «транскрипт РНК» относится к к продукту транскрипции последовательности ДНК, последовательно катализируемой РНК-полимеразой. Когда транскрипт РНК является полностью комплементарной копией последовательности ДНК, он называется первичным транскриптом, или он может быть РНК, полученной путем посттранскрипционнной обработки первичного транскрипта, и, таким образом, называется зрелой РНК.
В настоящем изобретении молекулы дцРНК могут служить предшественниками активных молекул миРНК, и эти молекулы миРНК направляют транскрипты РНК в комплексы RISC для последующей деградации. Молекула дцРНК, присутствующая в организме или окружающей его среде, может быть поглощена организмом и обработана ферментом, называемым DICER, для получения молекулы миРНК. Альтернативно, молекулу дцРНК можно получать in vivo, то есть она транскрибируется из одного или нескольких полинуклеотидов, кодирующих дцРНК, которые существуют в клетке (например, бактериальной клетке или растительной клетке), и после поглощения более длинного предшественника дцРНК он обрабатывается DICER в клетке-хозяине или предпочтительно в клетке насекомого. дцРНК может быть образована из двух отдельных (смысловой и антисмысловой) цепей РНК, которые спариваются посредством комплементарного спаривания оснований. Альтернативно, дцРНК может быть одной цепью, которая может складываться сама по себе, образуя шпилечную РНК или структуру петли стебля. В случае одной цепи РНК, двухцепочечная область или «стебель» образована двумя областями или сегментами РНК, и эти области или сегменты по сути последовательности с инвертированным повтором друг друга и имеют достаточную комплементарность, чтобы позволить образование двухцепочечной области. В этой «стеблевой области» молекулы может быть один или несколько функциональных двухцепочечных элементов сайленсинга. Область инвертированных повторов, как правило, отделена областью или сегментом, называемым «петлевой» областью в РНК. Эта область может содержать любую нуклеотидную последовательность, которая придает достаточную гибкость, чтобы позволить самоспаривание между фланкирующими комплементарными областями РНК. В основном, область петли по сути одноцепочечная и действует как спейсер между последовательностями с инвертированными повторами.
Интерферирующая рибонуклеиновая кислота по настоящему изобретению содержит, по меньшей мере, одну двухцепочечную область, которая, как правило, является элементом сайленсинга интерферирующей рибонуклеиновой кислоты. Он включает смысловую цепь РНК, спаренную путем комплементарного спаривания оснований с антисмысловой цепью РНК, где смысловая цепь молекулы дцРНК включает нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности, расположенной в транскрипте РНК гена-мишени. Элемент сайленсинга или, по меньшей мере, одна его цепь (когда элемент сайленсинга является двухцепочечным) может быть полностью или частично комплементарна целевой последовательности гена-мишени. «Полностью комплементарный» означает, что все основания нуклеотидной последовательности элемента сайленсинга комплементарны или «совпадают» с основаниями целевой последовательности. Термин «по меньшей мере, частично комплементарный» означает, что совпадают менее 100% оснований элемента сайленсинга и оснований целевой последовательности. Специалисты в данной области поймут, что для того, чтобы опосредовать негативную регуляцию экспрессии гена-мишени, элементу сайленсинга необходимо только, по меньшей мере, частично быть комплементарным целевой последовательности. Известно в данной области, что последовательность РНК со вставкой, делецией и несоответствием по отношению к гену-мишени все еще может быть эффективной в отношении РНКи. Предпочтительно, элемент сайленсинга и целевая последовательность гена-мишени имеют идентичность последовательности, по меньшей мере, 80% или 85%, предпочтительно, идентичность последовательности, по меньшей мере, 90% или 95%, или более предпочтительно, идентичность последовательности, по меньшей мере, 97% или 98%, и даже более предпочтительно, идентичность последовательности, по меньшей мере, 99%. Альтернативно, элемент сайленсинга может содержать 1, 2 или 3 несовпадения по всей длине из 24 частично комплементарных нуклеотидов по сравнению с целевой последовательностью. Специалистам в данной области хорошо известно, что степень комплементарности между элементом сайленсинга и целевой последовательностью варьируется в зависимости от вида насекомых, у которых должна контролироваться экспрессия генов-мишеней, подлежащих подавлению.
Целевую последовательность в настоящем изобретении можно выбирать из любой подходящей области или нуклеотидной последовательности гена-мишени или его транскрипта РНК. Например, целевая последовательность может быть расположена внутри 5'UTR или 3'UTR гена-мишени или транскрипта РНК, или в области экзона или интрона гена.
Интерферирующая рибонуклеиновая кислота по настоящему изобретению может содержать один или несколько элементов сайленсинга, где каждый элемент сайленсинга содержит нуклеотидную последовательность или состоит из нуклеотидной последовательности, которая, по меньшей мере, частично комплементарна целевой последовательности в гене-мишени, и действует, чтобы подавлять экспрессию гена-мишени после поглощения насекомыми. Термин «множество» означает, по меньшей мере, два, по меньшей мере, три, по меньшей мере, четыре и т.д., и до, по меньшей мере, 10, 15, 20 или, по меньшей мере, 30. Интерферирующая рибонуклеиновая кислота содержит множество копий одного элемента сайленсинга, то есть повторение элемента сайленсинга, который связывается с конкретной целевой последовательностью в конкретном гене-мишени. Элемент сайленсинга в интерферирующей рибонуклеиновой кислоте также может содержать различные нуклеотидные последовательности или состоять из различных нуклеотидных последовательностей, комплементарных другим целевой последовательностям. Должно быть ясно, что комбинация множества копий одного и того же элемента сайленсинга в сочетании с элементами сайленсинга, которые связываются с разными целевыми последовательностями, также входит в объем настоящего изобретения.
Для того чтобы добиться негативной регуляции определенного гена-мишени у жесткокрылого насекомого в настоящем изобретении, можно получать различные целевые последовательности из одного гена-мишени у одного насекомого. В этом случае элемент сайленсинга в интерферирующей рибонуклеиновой кислоте можно комбинировать в исходном порядке, в котором целевая последовательность существует в гене-мишени, или по сравнению с порядком целевой последовательности в гене-мишени элемент сайленсинга может быть дезорганизован в интерферирующей рибонуклеиновой кислоте и комбинирован случайным образом в любом порядке.
Альтернативно, разные целевые последовательности представляют собой один ген-мишень, но происходят от разных видов насекомых.
Альтернативно, разные целевые последовательности могут быть получены из разных генов-мишеней. Если интерферирующая рибонуклеиновая кислота применяется для предотвращения и/или борьбы с вторжением вредителей, предпочтительно, чтобы различные гены-мишени были выбраны из группы генов, которые регулируют основные биологические функции насекомых, и эти биологические функции в качестве неограничивающих примеров включают выживание, рост, развитие, размножение и патогенность. Гены-мишени могут регулировать одни и те же или разные биологические пути или процессы.
В настоящем изобретении разные гены, на которые нацелены разные элементы сайленсинга, происходят от одного и того же насекомого. Этот способ можно использовать для усиления атаки против одного насекомого. В частности, разные гены-мишени могут по-разному экспрессироваться на разных стадиях жизненного цикла насекомых, таких как стадия зрелой взрослой особи, стадия незрелой личинки и стадия яйца. Таким образом, интерферирующая рибонуклеиновая кислота по настоящему изобретению может использоваться для предотвращения и/или борьбы с вторжением насекомых в течение более чем одной стадии жизненного цикла насекомых. Альтернативно, разные гены, на которые нацелены разные элементы сайленсинга, происходят от разных насекомых. Таким образом, интерферирующая рибонуклеиновая кислота по настоящему изобретению также может использоваться для предотвращения и/или борьбы с вторжением более чем одного насекомого одновременно.
Элемент сайленсинга по настоящему изобретению может быть непрерывной областью интерферирующей рибонуклеиновой кислоты или может быть отделен за счет присутствия линкерной последовательности. Линкерная последовательность может содержать короткую случайную нуклеотидную последовательность, которая не комплементарна какой-либо целевой последовательности или гену-мишени. Линкерная последовательность может быть условно саморасщепляющейся последовательностью РНК, в том числе pH-чувствительным линкером или гидрофобно-чувствительным линкером. Линкер может также содержать нуклеотидную последовательность, эквивалентную интронной последовательности. Линкерная последовательность может иметь длину в диапазоне от 1 пары оснований до приблизительно 10000 пар оснований, при условии, что линкер не ухудшает способность интерферирующей рибонуклеиновой кислоты подавлять экспрессию гена.
В дополнение к одному или нескольким элементам сайленсинга и любым линкерным последовательностям, интерферирующая рибонуклеиновая кислота по настоящему изобретению также может содержать, по меньшей мере, одну дополнительную полинуклеотидную последовательность. Дополнительная полинуклеотидная последовательность выбрана из (1) последовательности, способной защищать интерферирующую рибонуклеиновую кислоту от процессинга РНК; (2) последовательности, влияющей на стабильность интерферирующей рибонуклеиновой кислоты; (3) последовательности, позволяющей связывание белка, что способствовует поглощению интерферирующей рибонуклеиновой кислоты клеткой насекомого; (4) последовательности, способной способствовать крупномасштабному производству интерферирующей рибонуклеиновой кислоты; (5) последовательности, которая действует как аптамер, способный связываться с рецептором или молекулой на поверхности клетки насекомого, чтобы способствовать поглощению; или (6) последовательности, способной катализировать процессинг интерферирующей рибонуклеиновой кислоты в клетке насекомого и, тем самым, повышать эффективность интерферирующей рибонуклеиновой кислоты.
Длина интерферирующей рибонуклеиновой кислоты по настоящему изобретению должна быть достаточной для того, чтобы ее могла поглотить клетка насекомого, и чтобы подавить ген-мишень этого насекомого. Верхний предел длины может зависеть от (1) потребности в поглощении интерферирующей рибонуклеиновой кислоты клеткой насекомого и (2) потребности в переработке интерферирующей рибонуклеиновой кислоты в клетке насекомого, чтобы опосредовать выключение генов через путь РНКи; и длина также может быть определена производственными способами и составами для доставки интерферирующей рибонуклеиновой кислоты в клетку. Предпочтительно, длина интерферирующей рибонуклеиновой кислоты по настоящему изобретению может составлять от 19 до 10000 нуклеотидов, предпочтительно от 50 до 5000 нуклеотидов, или от 100 до 2500 нуклеотидов, и более предпочтительно от 80 до 2000 нуклеотидов.
Интерферирующая рибонуклеиновая кислота по настоящему изобретению может содержать основания ДНК, неприродные основания или неприродные связи остова или модификации сахарид-фосфатных остовов, например, для повышения стабильности во время хранения или повышения устойчивости к деградации нуклеазами. Кроме того, интерферирующая рибонуклеиновая кислота может быть получена специалистом в данной области химическим или ферментативным способом посредством ручной или автоматической реакции. Альтернативно, интерферирующая рибонуклеиновая кислота может быть транскрибирована из кодирующего ее полинуклеотида. Таким образом настоящее изобретение относится к любому из изолированных полинуклеотидов, кодирующих интерферирующую рибонуклеиновую кислоту.
Полинуклеотид по настоящему изобретению может быть вставлен в конструкцию ДНК или вектор, известный в данной области, с помощью общепринятых способов молекулярного клонирования. Конструкция ДНК может быть рекомбинантным ДНК-вектором, таким как бактериальный, вирусный или дрожжевой вектор. Конструкция ДНК является экспрессирующей конструкцией, и полинуклеотид функционально связан, по меньшей мере, с одной регуляторной последовательностью, способной управлять экспрессией полинуклеотидной последовательности. «Регуляторная последовательность» относится к любой нуклеотидной последовательности, способной влиять на экспрессию функционально связанного полинуклеотида, и включает в качестве неограничивающих примеров промоторы, энхансеры и другие природные или синтетические элементы активации транскрипции. Регуляторная последовательность может располагаться на 5'- или 3'-конце полинуклеотидной последовательности. «Функционально связанный» относится к тому, что регуляторная последовательность и полинуклеотидная последовательность функционально связаны между собой, и такая связь позволяет регуляторной последовательности управлять экспрессией полинуклеотида. Функционально связанные элементы могут непрерывно следовать друг за другом или быть разделенными.
Регуляторная последовательность в настоящем изобретении может быть промотором. Предпочтительно, промотор представляет собой промотор, который можно экспрессировать в растении, и «промотор, который можно экспрессировать в растении» относится к промотору, который обеспечивает экспрессию связанного с ним полинуклеотида в растительной клетке. Промотор, который можно экспрессировать в растении, может быть конститутивным промотором. Примеры промоторов, которые непосредственно конститутивно экспрессируются в растениях в качестве неограничивающих примеров включают промотор 35S, полученный из вируса мозаики цветной капусты, промотор кукурузы ubi, промотор гена GOS2 риса и т.п.Альтернативно, промотор, который можно экспрессировать в растении, может быть тканеспецифическим промотором, таким как промотор карбоксилазы PEP, то есть такой промотор направляет экспрессию кодирующей последовательности в некоторых тканях растения, таких как зеленые ткани на уровне, более высоком, чем в других тканях растения (что можно определить по общепринятому тесту РНК). Альтернативно, промотором, который можно экспрессировать в растении, может быть промотор, индуцируемый повреждением. Повреждение-индуцибельный промотор или промотор, который управляет индуцируемым раной профилем экспрессии, относится к тому, что, когда растение подвергается механическим ранениям или ранам от грызущих насекомых, экспрессия полинуклеотида под регуляцией промотора значительно выше, чем в нормальных условиях роста. Примеры индуцируемых повреждением промоторов в качестве неограничивающих примеров включают промоторы генов ингибиторов протеазы картофеля и помидора (pin I и pin II) и гена ингибитора протеазы кукурузы (MPI).
Альтернативно, одна или несколько последовательностей терминации транскрипции могут быть включены в экспрессирующую конструкцию по настоящему изобретению. Термин «последовательность терминации транскрипции» включает в себя контрольную последовательность в конце блока транскрипции, которая передает сигналы терминации транскрипции, процессинга 3'-конца и полиаденилирования первичного транскрипта. Дополнительные регуляторные элементы в качестве неограничивающих примеров включают энхансеры транскрипции или трансляции, которые могут быть включены в экспрессирующую конструкцию, например, промотор с двойным энхансером CaMV35S.
Способ получения любой интерферирующей рибонуклеиновой кислоты в настоящем изобретении включает следующие этапы: (1) контактирование полинуклеотида, кодирующего интерферирующую рибонуклеиновую кислоту, или конструкции ДНК, содержащей полинуклеотид, с бесклеточным компонентом; (2) введение полинуклеотида, кодирующего интерферирующую рибонуклеиновую кислоту или конструкцию ДНК, содержащую полинуклеотид (например, путем трансформации, трансфекции или инъекции), в клетку.
В настоящем изобретении клетка-хозяин, содержащая любую интерферирующую рибонуклеиновую кислоту по настоящему изобретению, любой полинуклеотид по настоящему изобретению, или конструкцию ДНК, содержащую полинуклеотид, может быть прокариотической клеткой, включая в качестве неограничивающих примеров грамположительные и грамотрицательные бактериальные клетки; или эукариотической клеткой, включая в качестве неограничивающих примеров дрожжевые клетки или растительные клетки. Предпочтительно, клетка-хозяин представляет собой бактериальную клетку или растительную клетку. Полинуклеотид или конструкция ДНК по настоящему изобретению может существовать или поддерживаться как внехромосомный элемент в клетке-хозяине или может быть стабильно включена в геном клетки-хозяина.
В настоящем изобретении, когда интерферирующая рибонуклеиновая кислота экспрессируется в клетке-хозяине и/или применяется для профилактики заражения и/или борьбы с заражением насекомыми организма-хозяина, предпочтительно, чтобы интерферирующая рибонуклеиновая кислота не проявляла значительного «нецелевого» эффекта, то есть интерферирующая рибонуклеиновая кислота не влияет на экспрессию нецелевых генов в организме хозяина. Предпочтительно, чтобы выключенный ген не проявлял значительной комплементарности с нуклеотидной последовательностью, отличной от установленной целевой последовательности гена-мишени. Элемент сайленсинга демонстрирует идентичность последовательности, менее чем 30%, более предпочтительно, менее 20%, более предпочтительно, менее 5% и даже более предпочтительно, менее 5% по отношению к любому гену клетки-хозяина или организма-хозяина. Если доступны данные о геномной последовательности организма-хозяина, то можно использовать стандартные инструменты биоинформатики для перекрестной проверки согласованности с элементом сайленсинга. В области с 17 последовательными нуклеотидами, более предпочтительно в области с 18 или 19 последовательными нуклеотидами, и наиболее предпочтительно в области с 19 или 20 или 21 последовательными нуклеотидами, не существует идентичности последовательности между элементом сайленсинга и геном из клетки-хозяина или организма-хозяина.
Нуклеотидная последовательность по настоящему изобретению может включать инвертированные повторы, разделенные «спейсерной последовательностью». Спейсерная последовательность может представлять собой область, включающую любые из следующих нуклеотидных последовательностей, и, если необходимо, нуклеотидные последовательности могут способствовать образованию вторичной структуры между каждым повтором. Спейсерная последовательность является частью смысловой или антисмысловой кодирующей последовательности, используемой для мРНК. Альтернативно, спейсерная последовательность может включать любую комбинацию нуклеотидов или их гомологов, которые могут быть ковалентно связаны с молекулой нуклеиновой кислоты. Спейсерная последовательность может включать нуклеотидную последовательность, по меньшей мере, от 10 до 100 нуклеотидов в длину, или, по меньшей мере, примерно от 100 до 200 нуклеотидов в длину, по меньшей мере, приблизительно от 200 до 400 нуклеотидов в длину, или, по меньшей мере, приблизительно от 200 до 400 нуклеотидов в длину, или приблизительно от 400 до 500 нуклеотидов в длину.
В настоящем изобретении, когда интерферирующая рибонуклеиновая кислота «вводится» в растение, это означает, что это может происходить посредством прямой трансформации, такой как опосредованная Agrobacterium трансформация, бомбардировка частиц, электропорация и т.д.; или введение можно проводить путем скрещивания растения, имеющего гетерологичную нуклеотидную последовательность, с другим растением, так что потомство имеет нуклеотидную последовательность, включенную в их геном. Такие способы селекции хорошо известны специалистам в данной области.
Растения
Растения, описанные в настоящем изобретении в качестве неограничивающих примеров, включают сою, пшеницу, ячмень, кукурузу, табак, рис, рапс, хлопок или подсолнечник. В конкретном варианте осуществления растение представляет собой кукурузу. В другом конкретном варианте осуществления растение представляет собой сою.
Растения, описанные в настоящем изобретении, могут содержать любой репродуктивный материал или материал для размножения растения, а также могут включать растительные клетки, протопласты растений, растительные тканевые культуры, каллус растений и растительные клетки, которые являются интактными в растении или части растения. «Часть растения» включает зародыши, пыльцу, семяпочки, семена, листья, цветы, ветви, плоды, косточки, колосья, початки, кожуру, стебли, корни, кончики корней и т.п. В конкретном варианте осуществления «часть растения» представляет собой лист, более конкретно, пластинку листа.
Композиции
В настоящем изобретении композиция для предотвращения заражения и/или для борьбы с заражением насекомыми содержит, по меньшей мере, одну интерферирующую рибонуклеиновую кислоту и необязательно, по меньшей мере, один подходящий носитель, эксципиент или разбавитель, где интерферирующая рибонуклеиновая кислота подавляет экспрессию генов-мишеней у насекомого после ее проглатывания насекомым. Интерферирующая рибонуклеиновая кислота содержит или включает, по меньшей мере, один элемент сайленсинга, а элемент сайленсинга представляет собой двухцепочечную область РНК, содержащую спаренные комплементарные цепи, где одна цепь (смысловая цепь) содержит нуклеотидную последовательность, которая, по меньшей мере, частично комплементарна целевой последовательности в гене-мишени. Ген-мишень в качестве неограничивающих примеров включает ген, регулирующий выживание, рост, развитие, размножение и патогенность насекомых. Необязательно, композиция содержит, по меньшей мере, одну клетку-хозяина, клетку-хозяина, содержащую, по меньшей мере, одну интерферирующую рибонуклеиновую кислоту или конструкцию ДНК, кодирующую интерферирующую рибонуклеиновую кислоту, и необязательно, по меньшей мере, один подходящий носитель, эксципиент или разбавитель, где после того как клетка-хозяин поглощена насекомым, интерферирующая рибонуклеиновая кислота подавляет экспрессию гена-мишени у насекомого.
Композиция по настоящему изобретению может быть в любой физической форме, подходящей для введения насекомому. Например, композиция может быть в твердой форме (порошок, осадок или приманка), жидкой форме (в том числе в виде инсектицидного спрея) или форме геля. Композиция может быть краской, пастой или порошком, которые могут быть нанесены на субстрат для защиты субстрата от заражения насекомыми. Композицию можно использовать для защиты любого субстрата или материала, чувствительного к атакам насекомых или повреждению, причиненному насекомыми.
Природа эксципиента и физическая форма композиции могут варьироваться в зависимости от природы подлежащего обработке субстрата. Например, композиция может представлять собой жидкость, которой покрывают материал или субстрат или которую распыляют на материал или субстрат, подлежащий обработке, или напечатывают на материале или субстрате, подлежащем обработке; или может быть покрытием или порошком, который наносится на обрабатываемый материал или субстрат.
В настоящем изобретении композиция может быть в виде приманки. Приманка применяется для привлечения насекомого для контакта с композицией. После того, как насекомое контактирует с ней, композиция затем интернализуется насекомым посредством, например, проглатывания, и опосредует РНКи, тем самым убивая насекомое. Приманка может включать пищу, такую как пища на основе белка, такую как рыба. Борную кислоту также можно использовать в качестве приманки. Приманка может зависеть от вида-мишени. Также можно использовать аттрактант, например, аттрактант может быть феромоном, таким как мужской или женский феромон. Аттрактантные функции привлекают насекомое к контакту с композицией, и могут быть нацелены на конкретное насекомое или могут привлекать весь спектр насекомых, увеличивая шанс этих привлекаемых насекомых контактировать с композицией по настоящему изобретению, тем самым убивая большое количество насекомых. Приманка может быть любой подходящей формы, такой как твердое вещество, паста, осадок или порошок.
Насекомые также могут принести наживку в сообщество насекомых. Затем приманка может служить источником пищи для других членов сообщества, тем самым обеспечивая эффективный контроль над большим количеством насекомых и, возможно, над всем сообществом насекомых. Приманка также может быть предусмотрена в подходящем «корпусе» или «ловушке».
Кроме того, композиция при контакте с насекомым может оставаться на эпидермисе насекомого. При очистке, независимо от того, очищает ли себя одно насекомое или очищают насекомые друг друга, эти композиции могут быть проглочены и, таким образом, опосредуют свое действие на насекомых. Это требует от композиции, чтобы она была достаточно стабильной, чтобы даже после воздействия внешних условий окружающей среды в течение периода времени (например, нескольких суток) интерферирующая рибонуклеиновая кислота оставалась интактной и могла опосредовать РНКи.
В настоящем изобретении композиция может быть представлена в виде спрея. Таким образом, люди-пользователи могут напрямую опрыскивать насекомых композицией. Затем композиция интернализуется насекомым, где она может опосредовать РНК-интерференцию, чтобы бороться с насекомым. Спрей представляет собой преимущественно спрей под давлением/распылительный спрей или спрей с помпой. Эти частицы могут быть подходящего размера, чтобы они прилипали к насекомому, например, прикреплялись к экзоскелету и могли оттуда впитываться.
Носитель композиции по настоящему изобретению представляет собой порошок или гранулу, заряженную статическим электричеством, которое прилипает к насекомому. Необязательно, носитель композиции может содержать магнитные частицы, которые прикрепляются к эпидермису насекомых. Необязательно, носитель композиции содержит металлические частицы, и эти частицы изначально не намагничиваются, но способны становиться магнитно поляризованными при воздействии электрического поля, создаваемого телом насекомого. Предпочтительно, композиция включена в носитель, и носитель увеличивает попадание интерферирующей РНК в организм насекомого. Этот носитель может быть носителем на основе липидов, предпочтительно включающим одно или несколько из следующего: эмульсии «масло-в-воде», мицеллы, холестерин, липополиамины и липосомы. Другие агенты, способствующие проглатыванию конструкции по настоящему изобретению, хорошо известны специалистам в данной области, и включают поликатионы, декстран и катионные липиды, такие как CS096, CS102 и т.п. Необязательно, носитель композиции представляет собой коагулянт нуклеиновых кислот; предпочтительные коагулянты нуклеиновых кислот включают спермидин или протамина сульфат или их производные.
В случае, когда композиция по настоящему изобретению подходит для профилактики заражения и/или для борьбы с заражением растения насекомыми, композиция может включать подходящий сельскохозяйственный носитель. Этим носителем может быть любой материал, который может переносить обрабатываемое растение, этот материал не причиняет чрезмерного вреда окружающей среде или другим существующим в ней организмам, и он позволяет интерферирующей рибонуклеиновой кислоте оставаться эффективной против насекомых. В частности, композицию по настоящему изобретению можно формулировать для доставки к растениям в соответствии с общепринятой практикой, применяемой в индустрии биопестицидов. Композиция может содержать дополнительный компонент, способный выполнять другие функции, включая в качестве неограничивающих примеров (1), усиление или способствование поглощению интерферирующей рибонуклеиновой кислоты клеткой насекомого, и (2) стабилизацию активного компонента композиции. Такой дополнительный компонент, содержащийся в композиции, содержащей интерферирующую рибонуклеиновую кислоту, может быть дрожжевой тРНК или дрожжевой тотальной РНК.
Композицию можно формулировать для прямого применения или составлять в виде концентрированной формы первичной композиции, которую следует разбавить перед использованием. Альтернативно, композиция может быть представлена в виде набора; набора, содержащего интерферирующую рибонуклеиновую кислоту в контейнере или клетку-хозяина, содержащую/экспрессирующую интерферирующую рибонуклеиновую кислоту, и подходящий разбавитель или носитель для РНК или клетки-хозяина в отдельном контейнере. В заявке по настоящему изобретению композицию можно применять для растения или любой части растения на любой стадии развития растения, например, композицию применяют для надземной части растения во время выращивания растения в поле; и композицию наносят на семена растений во время хранения или после посадки в почву. В целом, важно получить хороший контроль над насекомыми на ранних стадиях роста растений, так как это период, когда насекомые могут наиболее серьезно повредить растения.
В настоящем изобретении композицию можно применять к окружающей среде насекомого различными способами, включая в качестве неограничивающих примеров распыление, опрыскивание, опыление, разбрасывание, поливание, покрытие семян, обработку семян, внесение в почву и внесение в воду для орошения. При обработке растения, восприимчивого к заражению насекомыми, композиция может быть доставлена на растение или часть растения до появления насекомых (в целях профилактики) или после того, как начинают появляться признаки заражения насекомыми (в целях борьбы).
Композицию по настоящему изобретению можно формулировать так, чтобы она содержала, по меньшей мере, одно дополнительное активное средство. Таким образом композиция может быть представлена в виде «набора из нескольких частей», набора, включающего несколько композиций, содержащих интерферирующую рибонуклеиновую кислоту в контейнере и один или несколько подходящих активных ингредиентов, таких как химические или биологические пестициды в отдельном контейнере. Альтернативно, композиция может быть представлена в виде смеси, которая является стабильной, и может использоваться в комбинации друг с другом.
Подходящие активные ингредиенты, которые могут действовать на интерферирующую рибонуклеиновую кислоту по настоящему изобретению дополняющим образом, в качестве неограничивающих примеров включают следующие: хлорпирифос, аллетрин, ресметрин, тетрабромэтил, диметанол-циклопропанкарбоновая кислота (в основном, содержится в жидкой композиции); а также гидраметилнон, авермектин, хлорпирифос, сульфурамид, гидропрен, фипронил (рецептор ГАМК), изопропилфенилметил карбамат, индоксакарб, новифлумурон (ингибитор синтеза хитина), имипротрин, абамектин (хлоридный канал с глутаминатными воротами), имидилаклоприд (ацетилхолиновый рецептор) (в основном содержится в композиции приманки). Предпочтительно, в отношении здоровья и окружающей среды известным активным ингредиентом является инсектицид, такой как гидраметилнон и абамектин.
Композицию по настоящему изобретению можно сформулировать так, чтобы она содержала по меньшей мере один дополнительный агрономический агент, такой как гербицид или дополнительный инсектицид. "Дополнительный инсектицид" или "второй инсектицид" относится к инсектициду, отличному от первого или от исходной интерферирующей молекулы РНК из композиции. Необязательно, композиция по настоящему изобретению может быть доставлена в комбинации, по меньшей мере, с одним дополнительным агрономическим агентом (например, гербицидом или вторым инсектицидом). Композиция может быть представлена в комбинации с гербицидом, гербицидом, выбранным из любого гербицида, известного в данной области, такого как глифосат, 2,4-D, имидазолинон, сульфонилкарбамид и бромоксинил. Композиция также может быть представлена в виде комбинации, по меньшей мере, с одним дополнительным инсектицидом, и дополнительный инсектицид, можно выбирать из любого инсектицида, известного в данной области, и/или может содержать интерферирующую рибонуклеиновую кислоту, и интерферирующая рибонуклеиновая кислота действует, подавляя экспрессию гена-мишени у насекомого после того, как насекомое проглотило ее. Вредителем-мишенью является насекомое, и интерферирующая рибонуклеиновая кислота представляет собой любую кислоту, выбранную из интерферирующих рибонуклеиновых кислот по настоящему изобретению. Дополнительный инсектицид включает интерферирующую рибонуклеиновую кислоту, которая подавляет экспрессию известного гена у любого вредителя-мишени. Исходная интерферирующая рибонуклеиновая кислота и второй или дополнительный инсектицид композиции могут быть нацелены на одних и тех же или разных насекомых. Например, исходная интерферирующая рибонуклеиновая кислота и второй инсектицид могут быть нацелены на различных насекомых или могут быть нацелены на насекомых разных семейств или классов, таких как грибы или нематоды, или насекомые. Специалисты в данной области должны знать, как тестировать синергическое действие интерферирующей рибонуклеиновой кислоты в комбинации с другими агрономическими реагентами. Предпочтительно, композиция содержит первую интерферирующую рибонуклеиновую кислоту и один или несколько дополнительных инсектицидов, каждый из которых токсичен для одного и того же насекомого, где один или несколько дополнительных инсектицидов выбраны из специфического белка клубней картофеля, инсектицидного белка Bacillus thuringiensis, инсектицидного белка Xenorhabdus ehlersii, инсектицидного белка Photorhabdus luminescens, инсектицидного белка Bacillus laterosporus, инсектицидного белка Bacillus sphaericus и лигнина. Различные компоненты могут быть доставлены одновременно или последовательно в область или организм, подлежащий лечению.
Способ профилактики вторжения насекомых и/или борьбы с вторжением насекомых
Способ профилактики вторжения насекомых и/или борьбы с вторжением насекомых по настоящему изобретению включает контактирование насекомого с эффективным количеством, по меньшей мере, одной интерферирующей рибонуклеиновой кислоты, где интерферирующая рибонуклеиновая кислота подавляет экспрессию жизненного важного гена-мишени насекомого после того, как поглощается насекомым. Жизненно важным геном-мишенью может быть любой ген насекомого, участвующий в регуляции важного биологического процесса, необходимого насекомому для инициирования или поддержания заражения, включая в качестве неограничивающих примеров выживание, рост, развитие, воспроизводство и патогенность.
Способ по настоящему изобретению для профилактики вторжения насекомых и/или борьбы с вторжением насекомых на полях сельскохозяйственных культур включает экспрессию эффективного количества интерферирующей рибонуклеиновой кислоты в растении. В случае, когда количество применяется для борьбы с вторжением насекомых, термин "эффективное" относится к количеству или содержанию интерферирующей рибонуклеиновой кислоты, необходимому для оказания фенотипического эффекта на насекомое, с тем чтобы уменьшить количество насекомых, поражающих организмы-хозяева и/или уменьшить ущерб, нанесенный насекомым. Фенотипическим эффектом может быть смерть насекомого, и применение интерферирующей РНК приводит к смерти насекомого, по меньшей мере, в 20%, 30%, 40%, предпочтительно, по меньшей мере, в 50%, 60%, 70%, более предпочтительно, по меньшей мере, в 80% или 90% случаев по сравнению с контрольным насекомым. Фенотипические эффекты могут также в качестве неограничивающих примеров включать препятствование росту насекомых, прекращение кормления и снижение яйценоскости. Таким образом, по сравнению с контрольным насекомым, общее количество насекомых, атакующих организм-хозяин, может быть уменьшено, по меньшей мере, на 20%, 30%, 40%, предпочтительно, по меньшей мере, на 50%, 60%, 70%, более предпочтительно, по меньшей мере, на 80% или 90%. Необязательно, ущерб, наносимый насекомым, можно уменьшить, по меньшей мере, на 20%, 30%, 40%, предпочтительно, по меньшей мере, на 50%, 60%, 70%, более предпочтительно, по меньшей мере, на 80% или 90% по сравнению с контрольным насекомым. Таким образом, настоящее изобретение можно использовать для достижения контроля над насекомыми, по меньшей мере, на 20%, 30%, 40%, предпочтительно, по меньшей мере, на 50%, 60%, 70%, и более предпочтительно, по меньшей мере, на 80% или 90%.
Способ и композицию по настоящему изобретению можно использовать для ограничения или устранения вторжения жесткокрылых вредителей, в частности Monolepta hieroglyphica, в окружающей среде или на поверхности, где существует любой вредитель-хозяин, симбионт-вредитель или вредитель, путем предоставления одной или нескольких композиций, содержащих молекулы дцРНК по настоящему изобретению, в корме для вредителей. Этот способ особенно полезен для предотвращения нападения насекомых на растения, а вредители определяются как имеющие пищеварительную систему с pH приблизительно от 4,5 до приблизительно 9,5, приблизительно от 5 до приблизительно 9, приблизительно от 6 до приблизительно 7, и приблизительно pH 7,0.
Преимущества по настоящему изобретению
Настоящее изобретение относится к полинуклеотиду и способу борьбы с нашествием насекомых, который имеет, по меньшей мере, следующие преимущества:
1. Настоящее изобретение относится впервые ко множеству целевых последовательностей гена-мишени c35112 для борьбы с жесткокрылыми насекомыми-вредителями, Monolepta hieroglyphica, и подтверждает, что ингибитор нуклеиновой кислоты, полученный на основе этих целевых последовательностей, может быть непосредственно использован для контроля вторжения жесткокрылого насекомого-вредителя.
2. Высокая специфичность к виду. Целевая последовательность по настоящему изобретению для борьбы с жесткокрылыми насекомыми-вредителями Monolepta hieroglyphica очень специфично действует на Monolepta hieroglyphica и виды, которые тесно связаны с ней и имеют совпадающие последовательности.
3. Отсутствует резистентность. Настоящее изобретение не зависит от комбинации конкретных дцРНК и рецепторного белка у насекомого и может эффективно избежать риска, такого как выработка у насекомого устойчивости к белку токсина Bt.
4. Технология РНКи, используемая в настоящем изобретении, имеет высокую эффективность и специфичность, а полученная дцРНК может быть непосредственно применена в полевых условиях для борьбы с нашествием жесткокрылых насекомых-вредителей, что удобно, дешево и имеет хорошую экологическую совместимость.
Технические решения по настоящему изобретению будут дополнительно описаны в деталях ниже с помощью прилагаемых чертежей и примеров.
Краткое описание чертежей
На фигуре 1 представлена электрофореграмма уровня экспрессии гена-мишени c35112 из полинуклеотида и способа для борьбы с нашествием насекомых по настоящему изобретению;
На фигуре 2 представлена схема рекомбинантного экспрессионного вектора DBNR35112C1, применяемого в полинуклеотиде и способе для борьбы с нашествием насекомых по настоящему изобретению.
Примеры
Следующие конкретные примеры дополнительно иллюстрируют техническое решение полинуклеотида и способа по настоящему изобретению для борьбы с нашествием насекомых.
Пример 1: Определение целевой последовательности Monolepta hieroglyphica
1. Выделение тотальной РНК Monolepta hieroglyphica.
В качестве материала использовали червей личинок первого возраста Monolepta hieroglyphica, РНК экстрагировали при помощи общепринятого способа с тризолом, очищали общепринятым способом, и обрабатывали ферментом для ДНК для получения образца тотальной РНК с концентрацией ≥300нг/мкл, общим количеством ≥6 мкг и OD 260/280 1,8-2,2.
2. Выделение мРНК и синтез кДНК.
Магнитные шарики с олиго-dT применяли для выделения мРНК с полиA из образца тотальной РНК, подготовленного выше, а затем синтезировали первую цепь кДНК при помощи случайного гексамера и набора с обратной транскриптазой Invitrogen's Superscript II.
3. Скрининг генов-мишеней
Один образец гена-мишени c35112 Monolepta hieroglyphica был выделен при скрининге при анализе библиотеки личинок из генов с умеренным уровнем экспрессии и, возможно, участвующих в важных метаболических путях, его полноразмерная нуклеотидная последовательность была показана в SEQ ID NO: 1, и его аминокислотная последовательность была показана в SEQ ID NO: 2.
4. Выбор целевой последовательности в гене-мишени
Восемнадцать целевых последовательностей с разными позициями ORF и/или разными длинами выбирали из гена-мишени c35112, как показано в таблице 1.
Таблица 1. Информация о последовательностях восемнадцати целевых последовательностей
Пример 2: Получение дцРНК
Ссылаясь на инструкции набора MEGAscript RNAi компании ThermoFisher, синтезировали дцРНК из указанных выше 18 целевых последовательностей, которые представляют собой r1-дцРНК в r18-дцРНК; размеры продуктов были определены путем агарозного электрофореза с массовой концентрацией 1%, а концентрацию указанных выше r1-дцРНК до r18-дцРНКли определяли с помощью NanoDrop 2000 (Thermo Scientific), соответственно.
Пример 3: Определение контроля над Monolepta hieroglyphica путем кормления дцРНК.
Выделенные и очищенные дцРНК от r1-дцРНК до r18-дцРНК смешивали раздельно и равномерно добавляли в корм в соотношении 50 мкг/г корма и 5 мкг/г корма (для формулы корма, см.: Development of an artificial diet for the western corn rootworm, Entomologia Experimentalis et Applicata 105:1-11, 2002), и таким образом получали корма от c35112-r1-50 до c35112-r18-50 и корма от c35112-r1-5 до c35112-r18-5 соответственно, где в корма контрольной группы СК добавляли нерелевантную дцРНК (SEQ ID NO: 29), а другие условия были точно такими же. Только что вылупившихся личинок Monolepta hieroglyphica кормили приготовленным кормом, при этом 30 только что вылупившихся личинок с временем инкубации не более 24 часов помещали в каждую чашку, где корма, смешанные с дцРНК, меняли каждые два дня и кормили до тех пор, пока не наступали сутки 12. Смертность насекомых подсчитывали каждые два дня от начала кормления. С начала кормления уровни экспрессии генов-мишеней измеряли на Сутки 0, 4, 8 и 10 определенным способом следующим образом:
Этап 301: червей, которым скармливали корма c35112-r1-50 - c35112-r18-50 и корма c35112-r1-5 - c35112-r18-5, собирали на Сутки 0, 4, 8 и 10 соответственно, и криоконсервировали в жидком азоте;
Этап 302: тотальную РНК вышеуказанных червей экстрагировали с использованием способа с тризолом;
Этап 303: Проводили обратную транскрипцию тотальной РНК вышеуказанных червей с использованием TransGen Biotech ER301-01 для получения кДНК;
Этап 304: Убиквитин-C применяли в качестве внутреннего референсного гена для проведения ПЦР-амплификации, и после амплификации 10 мкл амплифицированного продукта подвергали агарозному электрофорезу в геле с массовой концентрацией 1%.
Каждую обработку в вышеупомянутом эксперименте повторяли 5 раз, и статистические результаты были показаны на фигуре 1 и в Таблице 2. В таблице 2, «-50» в номере материала означает, что 50 мкг соответствующей дцРНК содержится в одном грамме корма, т.е. указанное выше «50 мкг/г корма»; «-5» означает, что 5 мкг соответствующей дцРНК содержится в одном грамме корма, т.е. указанное выше «5 мкг/г корма». Например, «r1-дцРНК-50» означает, что 50 мкг r1-дцРНК содержалось в одном грамме корма. «DAI» относится к количеству суток после кормления.
Результаты измерения экспрессия гена-мишени на фигуре 1 показывают, что дцРНК целевых последовательностей r3 и r4 (50 мкг/г питания) оказывала значительное ингибирующее действие на экспрессию гена-мишени c35112 у Monolepta hieroglyphica, экспрессия гена-мишени c35112 была значительно подавлена на сутки 4 кормления, и экспрессия c35112 почти не определялась на сутки 10.
Результаты кормления дцРНК в таблице 2 показывают, что дцРНК целевых последовательностей r1-r18 гена-мишени c35112 оказывает очевидное летальное воздействие на Monolepta hieroglyphica, и в большинстве повторов на двенадцатые сутки кормления почти не было выживших личинок.
Таблица 2: Результаты коэффициента выживаемости Monolepta hieroglyphica в тесте кормления дцРНК
Пример 4: Неожиданные технические эффекты интерференции экспрессии одного и того же гена у разных насекомых.
Белок частицы распознавания сигнала 54кДа принадлежит к одной из пептидных цепей в комплексе частиц распознавания сигнала. Его основная функция заключается в том, что когда секретируемый в данный момент белок выходит из рибосомы, белок частицы распознавания сигнала 54кДа быстро связывается с сигнальной последовательностью ранее секретированного белка и переносит его на мембранный белок, связанный с цепью транслокации. Соответствующая литература показала, что вмешательство в экспрессию гена, кодирующего белок частицы распознавания сигнала 54кДа, может иметь летальные эффекты для ряда жесткокрылых насекомых; например, как сообщает Julia Ulrich et al. (2015), когда ген, кодирующий белок у Tribolium castaneum, подвергался РНК-интерференции путем инъекции (инъекция последовательности, код iB_00404), было выявлено, что почти все Tribolium castaneum погибли в течение 4 суток после инъекции. Дополнительно, как сообщает Avet-Rochex et al. (2010), когда ген, кодирующий белок у Drosophila, подвергался РНК-интерференции путем инъекции (Таблица 1), результаты показали, что почти все Drosophila погибли после инъекции.
На основании вышеуказанных выше сообщений в литературе и высокой последовательности гомологии, провели скрининг гена, кодирующего белок у Monolepta hieroglyphica, и выбирали последовательность M1, показанную в SEQ ID NO: 30, в соответствующем положении согласно последовательности, введенной в Tribolium castaneum и Drosophila. Также была выбрана последовательность M2, показанная в SEQ ID NO: 31, в несоответствующем положении. Использовали способ кормления дцРНК (соотношение корма 50 мкг/г) в примере 3 по настоящему изобретению для определения способности контроля Monolepta hieroglyphica. Как показано в таблице 3, экспериментальные результаты показали, что ни последовательность M1 в соответствующем положении, ни последовательность M2 в несоответствующем положении не оказали очевидного летального эффекта на Monolepta hieroglyphica, который был в основном таким же, как и в контроле. Аналогичные экспериментальные результаты подтверждены в WO 2018/026770, в котором после получения группы транскрипции, применяли для проверки РНКи летальных генов нематод и дрозофил, то есть, согласно известным летальным генам у нематод и дрозофил, соответствующий ген у корневых червей кукурузы подвергался РНКи, и в принципе не наблюдали очевидного летального эффекта. По сути, технические эффекты интерференции экспрессии одного и того же гена у разных насекомых непредсказуемы, и не обязательно связаны с техническими эффектами известной интерференции и гомологии последовательностей.
Таблица 3: Результаты уровня летальности в тесте кормления дцРНК у Monolepta hieroglyphica
Пример 5: Конструирование растительного экспрессионного вектора
Синтезировали две экспрессионные кассеты в соответствии с последовательностью p35S-RX-tNos-p35S-Hpt-tNos (X был 1-18), и лигировали с растительным экспрессионным вектором с использованием EcoRV и BamHI, и полученные векторы были названы DBNR35112CX (X был 1-18), где схематическая диаграмма вектора DBNR35112C1 показана на фигуре 2 (Kan: ген канамицина; RB: правая граница; pr35S: промотор вируса мозаики цветной капусты 35S (SEQ ID NO: 21); R1 (SEQ ID NO: 22): обратная комлементарная последовательность нуклеотидной последовательности r1 (r1 - целевая последовательность 1 гена-мишени c35112, SEQ ID NO: 3)+спейсерная последовательность (SEQ ID NO: 23)+нуклеотидная последовательность r1; tNos: терминатор гена нопалинсинтазы (SEQ ID NO: 24); Hpt: ген гигромицин фосфотрансферазы (SEQ ID NO: 25); LB: левая граница).
Рекомбинантным экспрессионным вектором DBNR35112C1 были трансформированы компетентные клетки E.coli T1 с помощью способа теплового шока, при котором условия теплового шока были: 50 мкл компетентных клеток E.coli T1, 10 мкл ДНК-плазмиды (рекомбинантный экспрессионный вектор DBNR35112C1), водяная баня 42°C на 30 секунд; встряхивание культуры при 37°C в течение 1 часа (встряхивание на шейкере при 100 об./мин.); затем культивировали при 37°C в течение 12 часов на твердой чашке LB, содержащей 50 мг/л канамицина (триптон 10 г/л, экстракт дрожжей 5 г/л, NaCl 10 г/л, агар 15 г/л, pH доведен до 7,5 с помощью NaOH). Белые колонии отбирали и культивировали в течение ночи при 37°C в жидкой среде LB (триптон 10 г/л, дрожжевой экстракт 5 г/л, NaCl 10 г/л, Канамицин 50 мг/л, pH доведен до 7,5 с помощью NaOH). Плазмиды экстрагировали щелочным способом: бактериальный раствор центрифугировали при 12000 об./мин. в течение 1 минуты, супернатант удаляли, и осажденные бактериальные клетки суспендировали с помощью 100 мкл предварительно охлажденного льдом Раствора I (25 мМ трис-HCl, 10 мМ ЭДТА (этилендиаминтетрауксусная кислота), 50 мМ глюкоза, pH 8,0); Добавляли 200 мкл свежеприготовленного Раствора II (0,2M NaOH, 1% SDS (додецилсульфат натрия)), пробирку переворачивали 4 раза для перемешивания и помещали на лед в течение 3-5 минут; добавляли 150 мкл охлажденного на льду Раствора III (3M ацетат калия, 5M уксусная кислота), тщательно перемешивали и помещали на лед на 5-10 минут; после центрифугировали в течение 5 минут при температуре 4°C и скорости вращения 12000 об./мин. К супернатанту добавляли, равномерно перемешивая, 2 объема абсолютного этанола и выдерживали при комнатной температуре в течение 5 минут; центрифугировали в течение 5 минут при температуре 4°C и скорости вращения 12000 об./мин., супернатант удаляли, осадок отмывали этанолом с 70% содержанием (об./об.) и сушили на воздухе. Добавляли 30 мкл TE (10 мМ Трис-HCl, 1 мМ ЭДТА, pH 8,0), содержащего РНКазу (20 мкг/мл), для растворения осадка; расщепление РНК проводили на водяной бане при 37°C в течение 30 минут; хранили для дальнейшего использования при -20°C. Выделенные плазмиды были секвенированы и идентифицированы при помощи ПЦР, и результаты показали, что рекомбинантный экспрессионный вектор DBNR35112C1 сконструирован верно.
Рекомбинантные экспрессионный векторы DBNR35112C2 в DBNR35112C18 конструировали в соответствии с вышеуказанным способом, и их векторные структуры были: Kan: ген канамицина; RB: правая граница; pr35S: промотор вируса мозаики цветной капусты 35S (SEQ ID NO: 21); RX: нуклеотидная последовательность rX (rX представляла собой целевую последовательность X гена-мишени c35112, X составлял от 2 до 18)+спейсерная последовательность (SEQ ID NO: 23)+последовательность, обратно комплементарная нуклеотидной последовательности rX; tNos: терминатор гена нопалинсинтазы (SEQ ID NO: 24); Hpt: ген гигромицин фосфотрансферазы (SEQ ID NO: 25); LB: левая граница. Рекомбинантными экспрессионными векторами DBNR35112C2 в DBNR35112C18 трансформировали компетентные клетки E.coli T1 с помощью способа теплового шока, плазмиды экстрагировали щелочным способом.
Пример 6: Трансформация Agrobacterium рекомбинантным экспрессионным вектором
Agrobacterium LBA4404 (Invitrgen, Чикаго, США, каталожный номер: 18313-015) были трансформированы правильно сконструированными рекомбинантными экспрессионными векторами от DBNR35112C1 до DBNR35112C18 с помощью способа с жидким азотом, в котором условиями трансформации были: 100 мкл ДНК Agrobacterium LBA4404, 3 мкл ДНК плазмиды (рекомбинантный экспрессионный вектор); помещали в жидкий азот в течение 10 минут, затем на теплую водяную баню при 37°C в течение 10 минут; трансформированные Agrobacterium LBA4404 инокулировали в тестовую пробирку с LB при температуре 28°C и скорости вращения 200 об./мин. в течение 2 часов, затем наносили на чашку с LB, содержащую 50 мкг/л рифампицина и 100 мкг/л канамицина, выращивали до получения положительного моноклона, моноклональную культуру отбирали и выделяли ее плазмиду, рекомбинантные экспрессионные векторы от DBNR35112C1 до DBNR35112C18 подвергали ферментному расщеплению с использованием ферментов рестрикции EcoRV и BamHI для проведения подтверждения расщепления ферментами, и результаты показали, что рекомбинантные экспрессионные векторы DBNR35112C1-DBNR35112C18 были полностью правильными.
Пример 7: Получение трансгенных растений кукурузы
Согласно общепринятому способу заражения Agrobacterium, незрелые зародыши выращиваемой в асептических условиях кукурузы сорта Z31 (Z31) совместно культивировали с трансформированными Agrobacterium, описанными в примере 6, для переноса Т-ДНК (включающей нуклеотидную последовательность RX, последовательность промотора вируса мозаики цветной капусты 35S, ген Hpt и последовательность терминатора Nos) из рекомбинантных экспрессионных векторов от DBNR35112C1 до DBNR35112C18, сконструированных в примере 5, в геном кукурузы, тем самым получая растения кукурузы с перенесенной нуклеотидной последовательностью RX (X был 1-18); одновременно в качестве контроля использовали растения кукурузы дикого типа.
Что касается трансформации кукурузы, опосредованной Agrobacterium, в кратком изложении, незрелые зародыши выделяли из кукурузы и незрелые зародыши контактировали с суспензией Agrobacterium, где Agrobacterium были способны доставлять нуклеотидную последовательность RX, по меньшей мере, к одной из клеток незрелого зародыша (этап 1: этап заражения). На этом этапе незрелые зародыши были предпочтительно погружены в суспензию Agrobacterium (OD 660=от 0,4 до 0,6, инфекционная среда (MS соль 4,3 г/л, MS витамин, казеин 300 мг/л, сахароза 68,5 г/л, глюкоза 36 г/л, ацетосирингон (AS) 40 мг/л, 2,4-дихлорфеноксиуксусная кислота (2,4-D) 1 мг/, pH 5,3)) для начала инокуляции. Незрелые зародыши совместно культивировали с Agrobacterium в течение периода времени (3 суток) (этап 2: этап совместного культивирования). Предпочтительно, незрелые зародыши помещали в твердую среду (MS соль 4,3 г/л, MS витамины, казеин 300 мг/л, сахароза 20 г/л, глюкоза 10 г/л, ацетосирингон (AS) 100 мг/л, 2,4-дихлорфеноксиуксусная кислота (2,4-Д) 1 мг/л, агар 8 г/л, pH 5,8) после этапа заражения. После этого этапа совместного культивирования может быть необязательный этап «восстановления». На этапе «восстановления» среда восстановления (MS соль 4,3 г/л, MS витамины, казеин 300 мг/л, сахароза 30 г/л, 2,4-дихлорфеноксиуксусная кислота (2,4-D) 1 мг/л, растительный гель 3 г/л, pH 5,8) содержала, по меньшей мере, один антибиотик (цефалоспорин), который, как известно, подавляет рост Agrobacterium, без добавления селективного агента для трансформанта растений (стадия 3: стадия восстановления). Предпочтительно, незрелые зародыши культивировали на твердой среде, содержащей антибиотик, но без селективного агента для уничтожения Agrobacterium и обеспечивали период восстановления для инфицированных клеток. Затем инокулированные незрелые зародыши культивировали на среде, содержащей селективный агент (гигромицин) и выбирали растущий трансформированный каллус (этап 4: этап селекции). Предпочтительно, незрелые зародыши культивировали на твердой среде (MS соль 4,3 г/л, MS витамины, казеин 300 мг/л, сахароза 30 г/л, гигромицин 50 мг/л, 2,4-дихлорфеноксиуксусная кислота (2,4-D) 1 мг/л, растительный гель 3 г/л, pH 5,8), содержащей селективный агент, что приводит к селективному росту трансформированных клеток. Затем каллус регенерировали в растение (этап 5: этап регенерации). Предпочтительно, каллус, выращенный на среде, содержащей селективный агент, культивировали на твердых средах (среда для дифференцировки MS и среда для укоренения MS) для регенерации растения.
Отобранные устойчивые каллусы переносили в среду для дифференцировки MS (MS соль 4,3 г/л, MS витамины, казеин 300 мг/л, сахароза 30 г/л, 6-бензиламинопурин 2 мг/л, гигромицин 50 мг/л, растительный гель 3 г/л, pH 5,8) и культивировали при 25°C для дифференцировки. Дифференцированные сеянцы переносили на среду для укоренения MS (MS соль 2,15 г/л, MS витамины, казеин 300 мг/л, сахароза 30 г/л, индол-3-уксусная кислота 1 мг/л, растительный гель 3 г/л, pH 5,8), культивировали при 25°C до высоты примерно 10 см, затем перемещали в теплицу и культивировали до плодоношения. В теплице продолжали выращивание при 28°C в течение 16 часов, а затем при 20°C в течение 8 часов в сутки.
Пример 8: Получение трансгенных растений сои
Согласно общепринятому способу заражения Agrobacterium, ткань семядольного узла ткани стерильно культивируемого сорта сои Zhonghuang 13 совместно культивировали с трансформированными Agrobacterium, описанными в примере 6, для переноса Т-ДНК (включающей нуклеотидную последовательность RX, последовательность промотора вируса мозаики цветной капусты 35S, ген Hpt и последовательность терминатора Nos) из рекомбинантных экспрессионных векторов от DBNR35112C1 до DBNR35112C18 в геном сои, тем самым получая растения сои с перенесенной нуклеотидной последовательностью RX (X составляет 1-18); и одновременно в качестве контроля использовали растения сои дикого типа.
Для трансформации сои, опосредованной Agrobacterium, в кратком изложении, зрелые семена сои проращивали в среде для проращивания сои (B5 соль 3,1 г/л, витамин B5, сахароза 20 г/л, агар 8 г/л, pH 5,6), Семена высевали на среду для проращивания и культивировали в следующих условиях: температура 25±1°С; фотопериод (свет/темнота) составил 16/8 часов. После 4-6 суток прорастания выбирали асептические всходы сои с увеличенными семядольными узлами ярко-зеленого цвета, срезали гипокотили на 3-4 мм ниже семядольных узлов, срезали семядоли продольно, затем удаляли верхушечные почки, боковые почки и корни семян. Снова использовали скальпель для ранения семядольного узла, и раненая ткань семядольного узла контактировала с суспензией Agrobacterium, где Agrobacterium могли передавать нуклеотидную последовательность RX в поврежденную ткань семядольного узла (Этап 1: этап заражения). На этом этапе ткань семядольного узла предпочтительно погружали в суспензию Agrobacterium (OD 660=от 0,5 до 0,8, инфекционная среда (MS соль 2,15 г/л, витамин B5, сахароза 20 г/л, глюкоза 10 г/л, ацетилсирингон (AS) 40 мг/л, 2-морфолинэтансульфоновая кислота (MES) г/л, зеатин (ZT) 2 мг/л, pH5,3) для начала инокуляции. Ткань семядольного узла и Agrobacterium совместно культивировали в течение определенного периода (3 суток) (Этап 2: Этап совместного культивирования). Предпочтительно, после этапа заражения ткань узла семядоли помещали в твердую среду (MS соль 4,3 г/л, витамин B5, сахароза 20 г/л, глюкоза 10 г/л, 2-морфолинэтансульфоновая кислота (MES) 4 г/л, зеатин 2 мг/л, агар 8 г/л, pH 5,6). После этой стадии совместного культивирования может быть необязательный этап «восстановления». На этапе «восстановления», восстановительная среда (B5 соль 3,1 г/л, витамины B5, 2-морфолинэтансульфоновая кислота (MES) 1 г/л, сахароза 30 г/л, зеатин (ZT) 2 мг/л, агар 8 г/л, цефалоспорин 150 мг/л, глутаминовая кислота 100 мг/л, аспарагиновая кислота 100 мг/л, pH 5,6) содержала, по меньшей мере, один антибиотик (цефалоспорин), который, как известно, ингибирует рост Agrobacterium, и не содержала селективный агент для трансформанта растений (стадия 3: стадия восстановления). Предпочтительно, регенерированную тканевую массу узла семядолей культивировали на твердой среде с антибиотиком, но без селективного агента, для уничтожения Agrobacterium и обеспечения периода восстановления инфицированных клеток. Затем регенерированную тканевую массу узла семядолей культивировали на среде, содержащей селективный агент (гигромицин), и выбирали растущий трансформированный каллус (этап 4: этап отбора). Предпочтительно, регенерированную тканевую массу узла семядолей культивировали на твердой среде для скрининга с селективным агентом (B5 соль 3,1 г/л, витамин B5, 2-морфолинэтансульфоновая кислота (MES) 1 г/л, сахароза 30 г/л, 6-бензиламинопурин (6-БАП) 1 мг/л, агар 8 г/л, цефалоспорин 150 мг/л, глутаминовая кислота 100 мг/л, аспарагиновая кислота 100 мг/л, гигромицин 50 мг/л, pH 5,6), что приводило к селективному росту трансформированной клетки. Затем трансформированная клетка была преобразована в растение (этап 5: этап регенерации); предпочтительно регенерированную тканевую массу семядольного узла, выращенную на среде, содержащей селективный агент, культивировали на твердых средах (среда для дифференцировки B5 и среда для укоренения B5) для регенерации растения.
Отобранную устойчивую тканевую массу переносили на среду для дифференцировки В5 (B5 соль 3,1 г/л, витамины B5, 2-морфолинэтансульфоновая кислота (MES) 1 г/л, сахароза 30 г/л, зеатин (ZT) 1 мг/л, агар 8 г/л, цефалоспорин 150 мг/л, глутаминовая кислота 50 мг/л, аспарагиновая кислота 50 мг/л, гиббереллин 1 мг/л, ауксин 1 мг/л, гигромицин 50 мг/л, pH 5,6) и культивировали при 25°C для дифференцировки. Дифференцированные сеянцы переносили на среду для укоренения B5 (B5 соль 3,1 г/л, витамины B5, 2-морфолинэтансульфоновая кислота (MES) 1 г/л, сахароза 30 г/л, агар 8 г/л, цефалоспорин 150 мг/л, индол-3-масляная кислота (IBA) 1 мг/л), культивировали в среде для укоренения при 25°C до высоты примерно 10 см, переносили в теплицу и культивировали до плодоношения. В теплице выращивание проводили при 26°C в течение 16 часов, а затем при 20°C в течение 8 часов в сутки.
Пример 9: Подтверждение трансгенных растений кукурузы и сои посредством TaqMan
Приблизительно 100 мг листьев растений кукурузы с перенесенными нуклеотидными последовательностями RX (X составляло 1-18) брали раздельно в качестве образцов, и выделяли их геномную ДНК при помощи набора DNeasy Plant Maxi от Qiagen, соответственно, и количество копий нуклеотидных последовательностей RX определяли путем определения количества копий гена Hpt с помощью способа количественной ПЦР с флуоресцентным зондом Taqman. При этом растения кукурузы дикого типа использовали в качестве контроля и проводили детекцию и анализ в соответствии с вышеуказанными способами. Эксперимент повторяли 3 раза и брали среднее значение. Конкретный способ определения количества копий гена Hpt был следующим:
Этап 901: 100 мг каждого листа растения кукурузы с перенесенной нуклеотидной последовательностью RX и дикого типа брали раздельно и измельчали до гомогената с жидким азотом в ступке, соответственно, и для каждого образца брали 3 повтора;
Этап 902: выделяли геномную ДНК вышеуказанного образца с использованием мини-набора DNeasy Plant от Qiagen, согласно руководству к продукту для конкретного способа;
Этап 903: Использовали NanoDrop 2000 (Thermo Scientific) для измерения концентрации геномной ДНК вышеуказанного образца;
Этап 904: концентрация геномной ДНК вышеуказанного образца была скорректирована до одинакового значения концентрации, и диапазон значений составлял от 80 до 100 нг/мкл;
Этап 905: Способ количественной ПЦР с флуоресцентным зондом Taqman применяли для определения количества копий образца, идентифицированный образец с известным количеством копий использовали в качестве стандартного продукта, и образец кукурузы дикого типа использовали в качестве контроля, для каждого образца было взято 3 повтора, и брали среднее значение.
Последовательности праймеров и зондов для флуоресцентной количественной ПЦР:
следующие праймеры и зонды использовали для детекции нуклеотидной последовательности Hpt:
Праймер 1: cagggtgtcacgttgcaaga как показано в SEQ ID NO: 26 в списке последовательностей;
Праймер 2: ccgctcgtctggctaagatc как показано в SEQ ID NO: 27 в списке последовательностей;
Зонд 1: tgcctgaaaccgaactgcccgctg как показано в SEQ ID NO: 28 в списке последовательностей;
Система для реакции ПЦР:
JumpStart™ Taq ReadyMix™ (Sigma) - 10 мкл
50× смесь праймер/зонд - 1 мкл
Геномная ДНК - 3 мкл
Вода (ddH2O) - 6 мкл
50× смесь праймер/зонд содержала 45 мкл каждого праймера в концентрации 1 мМ, 50 мкл зонда в концентрации 100 мкМ, и 860 мкл буфера TE 1×, ее хранили в центрифужной пробирке при 4°C.
Условия реакции ПЦР:
Данные анализировали с использованием программного обеспечения SDS2.3 (Applied Biosystems).
Путем анализа экспериментальных результатов количества копий гена Hpt было подтверждено, что нуклеотидные последовательности RX были интегрированы в хромосому тестируемых растений кукурузы, соответственно, и однокопийные трансгенные растения кукурузы были получены из растений кукурузы с перенесенными нуклеотидными последовательностями RX (X составляло 1-18).
В соответствии с вышеописанным способом использования TaqMan для проверки трансгенных растений кукурузы, были детектированы и проанализированы трансгенные растения сои. Путем анализа экспериментальных результатов по количеству копий гена Hpt было подтверждено, что нуклеотидные последовательности RX были интегрированы в хромосому тестируемых растений сои, а однокопийные трансгенные растения сои были получены из растений сои с перенесенными нуклеотидными последовательностями RX (X составляло 1-18).
Пример 10: Идентификация инсектицидного действия трансгенной кукурузы на Monolepta hieroglyphica.
Растения кукурузы, трансформированные с помощью нуклеотидных последовательностей RX (X составлял 1-18), тестировали на устойчивость к насекомым на Monolepta hieroglyphica.
Этап 1001: Выбирали 10 растений каждого из однокопийных трансформантов кукурузы от DBNR35112C1 до DBNR35112C18 (RX-M), идентифицированных как положительные с помощью taqman, и 3 растения из трансформантов кукурузы (NGM1), идентифицированных как отрицательные с помощью taqman, соответственно; кукурузу дикого типа использовали одновременно в качестве контроля (СК1); и высаживали их в теплицу до стадии трилистника;
Этап 1002: брали материалы, описанные в этапе 1001, с каждого саженца был взят третий нежный лист, разрезан на 1×2 см, чтобы удалить листовую пластинку главной жилки, и листовую пластинку выкладывали в чашке Петри, покрытой влажной фильтровальной бумагой;
Этап 1003: 10 недавно вылупившихся личинок Monolepta hieroglyphica с временем инкубации не более чем 24 часа помещали в каждую чашку Петри, и закрывали крышку чашки Петри, чашку Петри помещали в бокс для биопроб с увлажняющей марлей на дне, и бокс для биопроб помещали в камеру для биоанализа с температурой 24±2°C, с режимом день/ночь 24/0, и влажностью 70-80% (т.е. «биоанализ»);
Этап 1004: учитывая, что недавно вылупившиеся личинки Monolepta hieroglyphica были слабыми и склонными к механическим повреждениям, чашку Петри поддерживали как можно более неподвижной в течение суток инокуляции и первые сутки после инокуляции;
Этап 1005: с суток 2 инокуляции подсчитывали количество выживших Monolepta hieroglyphica снаружи чашки Петри каждые сутки до конца суток 16; выживших в чашке Петри Monolepta hieroglyphica переносили в чашку Петри со свежими листьями каждые 2 суток, и результаты экспериментов показаны в таблице 4.
Таблица 4. Экспериментальные результаты кормления Monolepta hieroglyphica листьями трансформантов кукурузы
Результаты экспериментов в таблице 4 показали, что растения кукурузы, трансформированные с помощью нуклеотидных последовательностей RX (X было от 1 до 18), имели хорошее ингибирующее действие на Monolepta hieroglyphica, и коэффициент выживаемости Monolepta hieroglyphica на Сутки 16 (коэффициент выживаемости=количество выживших насекомых/количество испытанных насекомых) составил примерно 30%.
Пример 11: Определение инсектицидных эффектов трансгенной сои на Monolepta hieroglyphica.
Растения сои, трансформированные с помощью нуклеотидных последовательностей RX (X составлял 1-18), тестировали на устойчивость к насекомым на Monolepta hieroglyphica.
Этап 1101: Выбирали 10 растений каждого из однокопийных трансформантов сои от DBNR35112C1 до DBNR35112C18 (RX-S), идентифицированных как положительные с помощью taqman, и 3 растения из трансформантов сои (NGM2), идентифицированных как отрицательные с помощью taqman, соответственно; сою дикого типа использовали одновременно в качестве контроля (СК2); и высаживали их в теплицу до выращивания трех настоящих листов;
Этап 1102: брали материалы, описанные в этапе 1101, от каждого проростка был взят кусок настоящего листа размером примерно 2×2 см и выкладывали в чашке Петри, покрытой влажной фильтровальной бумагой;
Этап 1103: 15 недавно вылупившихся личинок Monolepta hieroglyphica с временем инкубации не более, чем 24 часа помещали в каждую чашку, и закрывали крышку чашки Петри, чашку Петри помещали в бокс для биопроб с увлажняющей марлей на дне, и бокс для биопроб помещали в камеру для биоанализа с температурой 24±2°C, с режимом день/ночь 24/0, и влажностью 70-80%;
Этап 1104: учитывая, что недавно вылупившиеся личинки Monolepta hieroglyphica были слабыми и склонными к механическим повреждениям, чашку Петри поддерживали как можно более неподвижной в течение суток инокуляции и первые сутки после инокуляции;
Этап 1105: с суток 2 инокуляции подсчитывали количество выживших Monolepta hieroglyphica снаружи чашки Петри каждые сутки до конца суток 16; выживших в чашке Петри Monolepta hieroglyphica переносили в чашку Петри со свежими листьями каждые 2 суток, и результаты экспериментов показаны в таблице 5.
Таблица 5. Экспериментальные результаты кормления Monolepta hieroglyphica листьями трансформантов сои
каждые два дня после биоанализа
Результаты экспериментов в таблице 5 показали, что растения сои, трансформированные с помощью нуклеотидных последовательностей RX (X было от 1 до 18), имели хорошее ингибирующее действие на Monolepta hieroglyphica, и коэффициент выживаемости Monolepta hieroglyphica на Сутки 16 (коэффициент выживаемости=количество выживших насекомых/количество тестируемых насекомых) составил не более 35%.
Пример 12: Композиция
Формула приемлемого носителя для пестицида с дцРНК (система 1 л): 50 мМ NaHPO4 (pH7,0), 10 мМ β-меркаптоэтанол, 10 мМ ЭДТА, 0,1% (массовая доля) натрий цэтил сульфонат, 0,1% (массовая доля) простой эфир полиэтиленгликоль октилфенила, с добавлением H2O до 1 л.
Вышеупомянутая формула была формулой буфера, и требовалось только напрямую добавить любую очищенную дцРНК в буфер, при условии, что конечная концентрация удовлетворяет требованиям, таким как 50 мг/л. Его также можно было бы подготовить в виде концентрированного состава по мере необходимости.
Таким образом, настоящее изобретение относится впервые к гену-мишени c35112 и его целевой последовательности для борьбы с жесткокрылыми насекомыми-вредителями Monolepta hieroglyphica, и трансгенным растениям (кукуруза и соя), полученным по технологии РНКи; в трансгенные растения вводят с последовательность дцРНК, образованную целевой последовательностью, и они могут контролировать вторжение Monolepta hieroglyphica, они эффективны и специфичны и могут избегать риска, такого как то, что Monolepta hieroglyphica генерирует устойчивость к белкам токсина Bt. При этом они обладают хорошей экологичностью, удобством и низкой стоимостью.
Наконец, следует отметить, что приведенные выше примеры используются только для иллюстрации технических решений по настоящему изобретению, а не для их ограничения. Хотя настоящее изобретение было описано в деталях со ссылкой на предпочтительные примеры, специалисты в данной области должны понимать, что технические решения по настоящему изобретению могут быть подвергнуты модификации или эквивалентным заменам без отступления от сущности и объема технических решений по настоящему изобретению.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110>BEIJING DABEINONG BIOTECHNOLOGY CO., LTD.
<120>Полинуклеотид и способ борьбы с вторжением насекомых
<130>IEC190006PCT
<150>CN 201810550207.4
<151>2018-05-31
<160>31
<170>SIPOSequenceListing 1.0
<210>1
<211>2994
<212>ДНК
<213>Monolepta hieroglyphica
<400>1
caagagccac gtataaaaca aggttacaga ttttggacaa ctcaaaaaat agtgatgtgt 60
ttataattcg tgtcatttca agaagattaa acaaaaattg ctggataata acccttaaaa 120
atgccacttc gattagatat aaagagaagg ctaacagccc gttcagaccg ggttaaatgc 180
gtggatcttc atccgacaga accctggatg ttatgttctc tgtacagtgg aaatataaat 240
gtctggaata ctgaaaatca acaactggtt aaaacttttg aagtatgtga catacctgtt 300
agagctgcaa agtttgtacc tagaaagaac tggattgtca gtggttcaga tgatatgcag 360
ataagagttt ttaactacaa tacactagac agggtacact ctttcgaagc ccattcagat 420
tatgtgaggt ctattgtggt acatccaaca caaccatata ttttaacaag tagtgatgat 480
atgcttatca aactgtggaa ctgggaaaag gcatgggctt gtcagcaagt gtttgaagga 540
catactcatt atattatgca aattgcaata aatcccaaag acaacaatac atttgccagt 600
gcatctctag atagaacatt aaaagtgtgg cagctaggtg catcaacagc taacttcact 660
cttgaagggc atgagaaagg tgtcaattgt gtagactact accacggagg tgataaaccc 720
tatataatat caggagccga tgataggttg gtcaaaatct gggattacca aaataaaaca 780
tgtgttcaaa ccttagaagg acatggtcaa aatgttactg ctgtcttttt ccatccagaa 840
cttccagttg ctcttacggg aagtgaagat ggtacagtga gaatatggca tgcaaatacc 900
catcgactgg aaagtacctt aaattatgga tttgaaaggg tttggaccat ttgttgctta 960
aaaggaagta ataatgtggc attgggttat gacgagggta gtattcttgt taaagttggt 1020
agagaagaac cagctgttag tatggatgcc agtggtggta aaattatttg ggctaggcac 1080
tcagaactcc aacaagccaa tcttaaggca ttgcctgaag gtgctgaaat aaaagatgga 1140
gaacgacttc cagtatctgt aaaggatatg ggtgcctgtg aaatctatcc tcaaaccatt 1200
caacacaatc ccaatggtcg ttttgtagtt gtgtgtggag atggtgaata tataatttac 1260
actgccatgg ccttacgtaa caaagcattt ggaagtgcac aagaattcgt ttgggcccaa 1320
gattctagtg aatatgctat tagagaatca ggatctacta taaggatatt taaaaatttc 1380
aaagaaaaga aaaatttcaa gtctgatttt ggagctgaag gtatatatgg gggttacctt 1440
ttgggagtca aatctgtttc tgggttaact ttctatgatt gggatacact tgatttggtt 1500
agaaggattg agatacaacc aaaagctgtc tattggtcag atagtggaaa gttggtatgt 1560
ttggccaccg aagatagtta ttttatttta tcatatgatg ctgatgaagt gcaaaaagct 1620
aaagataata atcaagttgc tgacgatggt gtggaatctg cattcaacct tttaggagaa 1680
atcaacgaat ctgttagaac aggcctatgg gtaggtgatt gtttcatcta cacaaatgct 1740
gtgaatcgta tcaattactt tgtaggaggt gaactagtaa ctatcgcaca cttggatcgt 1800
ccattgtacg tcttgggtta tgtgcccaaa gacgatcgtt tgtatctagt agataaagag 1860
ttacgagttg tcagctacca attgcttctt tcagtactcg aatatcagac agctgttatg 1920
aggagggact tcccaacagc agatagagta ctaccgtcta tacctaaaga gcacagaaca 1980
agggtagcac atttcttaga aaagcaaggt tttaaacaac aagctttagc tgtaagttcc 2040
gatcccgaac atagattcga actcgctgtg gcattagaag acctgaatac agctaaaatt 2100
ctagcacaag aggctaacaa tccacaaaag tggagccaat tagctgatct agctgctggc 2160
acaaataatg tagaactagc aaaagaatgc atgcagaaag cccaagattt tggtggatta 2220
ttacttctag ccactagttc gggagatgaa tcattagtcc gtacattagg tgaaacaaca 2280
caagctgagg gcaaacataa tttagccttc ctttctcatt tcttggtagg agatttagac 2340
aagtgtctag atattttagt aagtacagga aggttgccag aagctgcgtt tttcgccaga 2400
tcttatcttc ccgataaaat ttctgaagtt gtagaattgt ggaggacaca attatcaact 2460
ataaatcaaa aagccggaca aagtttagcc gatcctaaaa attatgaaaa tctatttccc 2520
ggtcttcaac aagcattgtc ggcacagaaa tttttggaac agaacaaaca gttgccacct 2580
gcatttatgg ctccttctat tgttcccaac caagatagaa atgttatagc cgaagcggag 2640
gcacagttaa agaatagtgg aacttcatca aatttgttca gtgccccacc ttcagcagaa 2700
acttctagga atgttataga atcagtacca caaaataagc cctcagaaga tttatcaaac 2760
agggtgttat tagatcaaga tgatgatgat gacatagact tggatttgga tggcgtcaat 2820
attgacgata acatcgatac aactgatatc aacttggatg atgatttgct gagtgattaa 2880
aaataacttt ttttactatt ttagtattaa tctgtatatt attcattcct aatttttaag 2940
aaaataaatt atgtaagata atgttttatt aactaaaata tggtaattca aaac 2994
<210>2
<211>919
<212>Белок
<213>Monolepta hieroglyphica
<400>2
Met Pro Leu Arg Leu Asp Ile Lys Arg Arg Leu Thr Ala Arg Ser Asp
1 5 10 15
Arg Val Lys Cys Val Asp Leu His Pro Thr Glu Pro Trp Met Leu Cys
20 25 30
Ser Leu Tyr Ser Gly Asn Ile Asn Val Trp Asn Thr Glu Asn Gln Gln
35 40 45
Leu Val Lys Thr Phe Glu Val Cys Asp Ile Pro Val Arg Ala Ala Lys
50 55 60
Phe Val Pro Arg Lys Asn Trp Ile Val Ser Gly Ser Asp Asp Met Gln
65 70 75 80
Ile Arg Val Phe Asn Tyr Asn Thr Leu Asp Arg Val His Ser Phe Glu
85 90 95
Ala His Ser Asp Tyr Val Arg Ser Ile Val Val His Pro Thr Gln Pro
100 105 110
Tyr Ile Leu Thr Ser Ser Asp Asp Met Leu Ile Lys Leu Trp Asn Trp
115 120 125
Glu Lys Ala Trp Ala Cys Gln Gln Val Phe Glu Gly His Thr His Tyr
130 135 140
Ile Met Gln Ile Ala Ile Asn Pro Lys Asp Asn Asn Thr Phe Ala Ser
145 150 155 160
Ala Ser Leu Asp Arg Thr Leu Lys Val Trp Gln Leu Gly Ala Ser Thr
165 170 175
Ala Asn Phe Thr Leu Glu Gly His Glu Lys Gly Val Asn Cys Val Asp
180 185 190
Tyr Tyr His Gly Gly Asp Lys Pro Tyr Ile Ile Ser Gly Ala Asp Asp
195 200 205
Arg Leu Val Lys Ile Trp Asp Tyr Gln Asn Lys Thr Cys Val Gln Thr
210 215 220
Leu Glu Gly His Gly Gln Asn Val Thr Ala Val Phe Phe His Pro Glu
225 230 235 240
Leu Pro Val Ala Leu Thr Gly Ser Glu Asp Gly Thr Val Arg Ile Trp
245 250 255
His Ala Asn Thr His Arg Leu Glu Ser Thr Leu Asn Tyr Gly Phe Glu
260 265 270
Arg Val Trp Thr Ile Cys Cys Leu Lys Gly Ser Asn Asn Val Ala Leu
275 280 285
Gly Tyr Asp Glu Gly Ser Ile Leu Val Lys Val Gly Arg Glu Glu Pro
290 295 300
Ala Val Ser Met Asp Ala Ser Gly Gly Lys Ile Ile Trp Ala Arg His
305 310 315 320
Ser Glu Leu Gln Gln Ala Asn Leu Lys Ala Leu Pro Glu Gly Ala Glu
325 330 335
Ile Lys Asp Gly Glu Arg Leu Pro Val Ser Val Lys Asp Met Gly Ala
340 345 350
Cys Glu Ile Tyr Pro Gln Thr Ile Gln His Asn Pro Asn Gly Arg Phe
355 360 365
Val Val Val Cys Gly Asp Gly Glu Tyr Ile Ile Tyr Thr Ala Met Ala
370 375 380
Leu Arg Asn Lys Ala Phe Gly Ser Ala Gln Glu Phe Val Trp Ala Gln
385 390 395 400
Asp Ser Ser Glu Tyr Ala Ile Arg Glu Ser Gly Ser Thr Ile Arg Ile
405 410 415
Phe Lys Asn Phe Lys Glu Lys Lys Asn Phe Lys Ser Asp Phe Gly Ala
420 425 430
Glu Gly Ile Tyr Gly Gly Tyr Leu Leu Gly Val Lys Ser Val Ser Gly
435 440 445
Leu Thr Phe Tyr Asp Trp Asp Thr Leu Asp Leu Val Arg Arg Ile Glu
450 455 460
Ile Gln Pro Lys Ala Val Tyr Trp Ser Asp Ser Gly Lys Leu Val Cys
465 470 475 480
Leu Ala Thr Glu Asp Ser Tyr Phe Ile Leu Ser Tyr Asp Ala Asp Glu
485 490 495
Val Gln Lys Ala Lys Asp Asn Asn Gln Val Ala Asp Asp Gly Val Glu
500 505 510
Ser Ala Phe Asn Leu Leu Gly Glu Ile Asn Glu Ser Val Arg Thr Gly
515 520 525
Leu Trp Val Gly Asp Cys Phe Ile Tyr Thr Asn Ala Val Asn Arg Ile
530 535 540
Asn Tyr Phe Val Gly Gly Glu Leu Val Thr Ile Ala His Leu Asp Arg
545 550 555 560
Pro Leu Tyr Val Leu Gly Tyr Val Pro Lys Asp Asp Arg Leu Tyr Leu
565 570 575
Val Asp Lys Glu Leu Arg Val Val Ser Tyr Gln Leu Leu Leu Ser Val
580 585 590
Leu Glu Tyr Gln Thr Ala Val Met Arg Arg Asp Phe Pro Thr Ala Asp
595 600 605
Arg Val Leu Pro Ser Ile Pro Lys Glu His Arg Thr Arg Val Ala His
610 615 620
Phe Leu Glu Lys Gln Gly Phe Lys Gln Gln Ala Leu Ala Val Ser Ser
625 630 635 640
Asp Pro Glu His Arg Phe Glu Leu Ala Val Ala Leu Glu Asp Leu Asn
645 650 655
Thr Ala Lys Ile Leu Ala Gln Glu Ala Asn Asn Pro Gln Lys Trp Ser
660 665 670
Gln Leu Ala Asp Leu Ala Ala Gly Thr Asn Asn Val Glu Leu Ala Lys
675 680 685
Glu Cys Met Gln Lys Ala Gln Asp Phe Gly Gly Leu Leu Leu Leu Ala
690 695 700
Thr Ser Ser Gly Asp Glu Ser Leu Val Arg Thr Leu Gly Glu Thr Thr
705 710 715 720
Gln Ala Glu Gly Lys His Asn Leu Ala Phe Leu Ser His Phe Leu Val
725 730 735
Gly Asp Leu Asp Lys Cys Leu Asp Ile Leu Val Ser Thr Gly Arg Leu
740 745 750
Pro Glu Ala Ala Phe Phe Ala Arg Ser Tyr Leu Pro Asp Lys Ile Ser
755 760 765
Glu Val Val Glu Leu Trp Arg Thr Gln Leu Ser Thr Ile Asn Gln Lys
770 775 780
Ala Gly Gln Ser Leu Ala Asp Pro Lys Asn Tyr Glu Asn Leu Phe Pro
785 790 795 800
Gly Leu Gln Gln Ala Leu Ser Ala Gln Lys Phe Leu Glu Gln Asn Lys
805 810 815
Gln Leu Pro Pro Ala Phe Met Ala Pro Ser Ile Val Pro Asn Gln Asp
820 825 830
Arg Asn Val Ile Ala Glu Ala Glu Ala Gln Leu Lys Asn Ser Gly Thr
835 840 845
Ser Ser Asn Leu Phe Ser Ala Pro Pro Ser Ala Glu Thr Ser Arg Asn
850 855 860
Val Ile Glu Ser Val Pro Gln Asn Lys Pro Ser Glu Asp Leu Ser Asn
865 870 875 880
Arg Val Leu Leu Asp Gln Asp Asp Asp Asp Asp Ile Asp Leu Asp Leu
885 890 895
Asp Gly Val Asn Ile Asp Asp Asn Ile Asp Thr Thr Asp Ile Asn Leu
900 905 910
Asp Asp Asp Leu Leu Ser Asp
915
<210>3
<211>361
<212>ДНК
<213>Monolepta hieroglyphica
<400>3
aggtgtcaat tgtgtagact actaccacgg aggtgataaa ccctatataa tatcaggagc 60
cgatgatagg ttggtcaaaa tctgggatta ccaaaataaa acatgtgttc aaaccttaga 120
aggacatggt caaaatgtta ctgctgtctt tttccatcca gaacttccag ttgctcttac 180
gggaagtgaa gatggtacag tgagaatatg gcatgcaaat acccatcgac tggaaagtac 240
cttaaattat ggatttgaaa gggtttggac catttgttgc ttaaaaggaa gtaataatgt 300
ggcattgggt tatgacgagg gtagtattct tgttaaagtt ggtagagaag aaccagctgt 360
t 361
<210>4
<211>423
<212>ДНК
<213>Monolepta hieroglyphica
<400>4
gaaaatcaac aactggttaa aacttttgaa gtatgtgaca tacctgttag agctgcaaag 60
tttgtaccta gaaagaactg gattgtcagt ggttcagatg atatgcagat aagagttttt 120
aactacaata cactagacag ggtacactct ttcgaagccc attcagatta tgtgaggtct 180
attgtggtac atccaacaca accatatatt ttaacaagta gtgatgatat gcttatcaaa 240
ctgtggaact gggaaaaggc atgggcttgt cagcaagtgt ttgaaggaca tactcattat 300
attatgcaaa ttgcaataaa tcccaaagac aacaatacat ttgccagtgc atctctagat 360
agaacattaa aagtgtggca gctaggtgca tcaacagcta acttcactct tgaagggcat 420
gag 423
<210>5
<211>571
<212>ДНК
<213>Monolepta hieroglyphica
<400>5
gtctgatttt ggagctgaag gtatatatgg gggttacctt ttgggagtca aatctgtttc 60
tgggttaact ttctatgatt gggatacact tgatttggtt agaaggattg agatacaacc 120
aaaagctgtc tattggtcag atagtggaaa gttggtatgt ttggccaccg aagatagtta 180
ttttatttta tcatatgatg ctgatgaagt gcaaaaagct aaagataata atcaagttgc 240
tgacgatggt gtggaatctg cattcaacct tttaggagaa atcaacgaat ctgttagaac 300
aggcctatgg gtaggtgatt gtttcatcta cacaaatgct gtgaatcgta tcaattactt 360
tgtaggaggt gaactagtaa ctatcgcaca cttggatcgt ccattgtacg tcttgggtta 420
tgtgcccaaa gacgatcgtt tgtatctagt agataaagag ttacgagttg tcagctacca 480
attgcttctt tcagtactcg aatatcagac agctgttatg aggagggact tcccaacagc 540
agatagagta ctaccgtcta tacctaaaga g 571
<210>6
<211>780
<212>ДНК
<213>Monolepta hieroglyphica
<400>6
gcacatttct tagaaaagca aggttttaaa caacaagctt tagctgtaag ttccgatccc 60
gaacatagat tcgaactcgc tgtggcatta gaagacctga atacagctaa aattctagca 120
caagaggcta acaatccaca aaagtggagc caattagctg atctagctgc tggcacaaat 180
aatgtagaac tagcaaaaga atgcatgcag aaagcccaag attttggtgg attattactt 240
ctagccacta gttcgggaga tgaatcatta gtccgtacat taggtgaaac aacacaagct 300
gagggcaaac ataatttagc cttcctttct catttcttgg taggagattt agacaagtgt 360
ctagatattt tagtaagtac aggaaggttg ccagaagctg cgtttttcgc cagatcttat 420
cttcccgata aaatttctga agttgtagaa ttgtggagga cacaattatc aactataaat 480
caaaaagccg gacaaagttt agccgatcct aaaaattatg aaaatctatt tcccggtctt 540
caacaagcat tgtcggcaca gaaatttttg gaacagaaca aacagttgcc acctgcattt 600
atggctcctt ctattgttcc caaccaagat agaaatgtta tagccgaagc ggaggcacag 660
ttaaagaata gtggaacttc atcaaatttg ttcagtgccc caccttcagc agaaacttct 720
aggaatgtta tagaatcagt accacaaaat aagccctcag aagatttatc aaacagggtg 780
<210>7
<211>174
<212>ДНК
<213>Monolepta hieroglyphica
<400>7
atgccacttc gattagatat aaagagaagg ctaacagccc gttcagaccg ggttaaatgc 60
gtggatcttc atccgacaga accctggatg ttatgttctc tgtacagtgg aaatataaat 120
gtctggaata ctgaaaatca acaactggtt aaaacttttg aagtatgtga cata 174
<210>8
<211>697
<212>ДНК
<213>Monolepta hieroglyphica
<400>8
tgtacctaga aagaactgga ttgtcagtgg ttcagatgat atgcagataa gagtttttaa 60
ctacaataca ctagacaggg tacactcttt cgaagcccat tcagattatg tgaggtctat 120
tgtggtacat ccaacacaac catatatttt aacaagtagt gatgatatgc ttatcaaact 180
gtggaactgg gaaaaggcat gggcttgtca gcaagtgttt gaaggacata ctcattatat 240
tatgcaaatt gcaataaatc ccaaagacaa caatacattt gccagtgcat ctctagatag 300
aacattaaaa gtgtggcagc taggtgcatc aacagctaac ttcactcttg aagggcatga 360
gaaaggtgtc aattgtgtag actactacca cggaggtgat aaaccctata taatatcagg 420
agccgatgat aggttggtca aaatctggga ttaccaaaat aaaacatgtg ttcaaacctt 480
agaaggacat ggtcaaaatg ttactgctgt ctttttccat ccagaacttc cagttgctct 540
tacgggaagt gaagatggta cagtgagaat atggcatgca aatacccatc gactggaaag 600
taccttaaat tatggatttg aaagggtttg gaccatttgt tgcttaaaag gaagtaataa 660
tgtggcattg ggttatgacg agggtagtat tcttgtt 697
<210>9
<211>342
<212>ДНК
<213>Monolepta hieroglyphica
<400>9
ctgttagtat ggatgccagt ggtggtaaaa ttatttgggc taggcactca gaactccaac 60
aagccaatct taaggcattg cctgaaggtg ctgaaataaa agatggagaa cgacttccag 120
tatctgtaaa ggatatgggt gcctgtgaaa tctatcctca aaccattcaa cacaatccca 180
atggtcgttt tgtagttgtg tgtggagatg gtgaatatat aatttacact gccatggcct 240
tacgtaacaa agcatttgga agtgcacaag aattcgtttg ggcccaagat tctagtgaat 300
atgctattag agaatcagga tctactataa ggatatttaa aa 342
<210>10
<211>139
<212>ДНК
<213>Monolepta hieroglyphica
<400>10
aagtctgatt ttggagctga aggtatatat gggggttacc ttttgggagt caaatctgtt 60
tctgggttaa ctttctatga ttgggataca cttgatttgg ttagaaggat tgagatacaa 120
ccaaaagctg tctattggt 139
<210>11
<211>821
<212>ДНК
<213>Monolepta hieroglyphica
<400>11
catatgatgc tgatgaagtg caaaaagcta aagataataa tcaagttgct gacgatggtg 60
tggaatctgc attcaacctt ttaggagaaa tcaacgaatc tgttagaaca ggcctatggg 120
taggtgattg tttcatctac acaaatgctg tgaatcgtat caattacttt gtaggaggtg 180
aactagtaac tatcgcacac ttggatcgtc cattgtacgt cttgggttat gtgcccaaag 240
acgatcgttt gtatctagta gataaagagt tacgagttgt cagctaccaa ttgcttcttt 300
cagtactcga atatcagaca gctgttatga ggagggactt cccaacagca gatagagtac 360
taccgtctat acctaaagag cacagaacaa gggtagcaca tttcttagaa aagcaaggtt 420
ttaaacaaca agctttagct gtaagttccg atcccgaaca tagattcgaa ctcgctgtgg 480
cattagaaga cctgaataca gctaaaattc tagcacaaga ggctaacaat ccacaaaagt 540
ggagccaatt agctgatcta gctgctggca caaataatgt agaactagca aaagaatgca 600
tgcagaaagc ccaagatttt ggtggattat tacttctagc cactagttcg ggagatgaat 660
cattagtccg tacattaggt gaaacaacac aagctgaggg caaacataat ttagccttcc 720
tttctcattt cttggtagga gatttagaca agtgtctaga tattttagta agtacaggaa 780
ggttgccaga agctgcgttt ttcgccagat cttatcttcc c 821
<210>12
<211>316
<212>ДНК
<213>Monolepta hieroglyphica
<400>12
gaattgtgga ggacacaatt atcaactata aatcaaaaag ccggacaaag tttagccgat 60
cctaaaaatt atgaaaatct atttcccggt cttcaacaag cattgtcggc acagaaattt 120
ttggaacaga acaaacagtt gccacctgca tttatggctc cttctattgt tcccaaccaa 180
gatagaaatg ttatagccga agcggaggca cagttaaaga atagtggaac ttcatcaaat 240
ttgttcagtg ccccaccttc agcagaaact tctaggaatg ttatagaatc agtaccacaa 300
aataagccct cagaag 316
<210>13
<211>174
<212>ДНК
<213>Monolepta hieroglyphica
<400>13
atgccacttc gattagatat aaagagaagg ctaacagccc gttcagaccg ggttaaatgc 60
gtggatcttc atccgacaga accctggatg ttatgttctc tgtacagtgg aaatataaat 120
gtctggaata ctgaaaatca acaactggtt aaaacttttg aagtatgtga cata 174
<210>14
<211>361
<212>ДНК
<213>Monolepta hieroglyphica
<400>14
tgtacctaga aagaactgga ttgtcagtgg ttcagatgat atgcagataa gagtttttaa 60
ctacaataca ctagacaggg tacactcttt cgaagcccat tcagattatg tgaggtctat 120
tgtggtacat ccaacacaac catatatttt aacaagtagt gatgatatgc ttatcaaact 180
gtggaactgg gaaaaggcat gggcttgtca gcaagtgttt gaaggacata ctcattatat 240
tatgcaaatt gcaataaatc ccaaagacaa caatacattt gccagtgcat ctctagatag 300
aacattaaaa gtgtggcagc taggtgcatc aacagctaac ttcactcttg aagggcatga 360
g 361
<210>15
<211>334
<212>ДНК
<213>Monolepta hieroglyphica
<400>15
aggtgtcaat tgtgtagact actaccacgg aggtgataaa ccctatataa tatcaggagc 60
cgatgatagg ttggtcaaaa tctgggatta ccaaaataaa acatgtgttc aaaccttaga 120
aggacatggt caaaatgtta ctgctgtctt tttccatcca gaacttccag ttgctcttac 180
gggaagtgaa gatggtacag tgagaatatg gcatgcaaat acccatcgac tggaaagtac 240
cttaaattat ggatttgaaa gggtttggac catttgttgc ttaaaaggaa gtaataatgt 300
ggcattgggt tatgacgagg gtagtattct tgtt 334
<210>16
<211>342
<212>ДНК
<213>Monolepta hieroglyphica
<400>16
ctgttagtat ggatgccagt ggtggtaaaa ttatttgggc taggcactca gaactccaac 60
aagccaatct taaggcattg cctgaaggtg ctgaaataaa agatggagaa cgacttccag 120
tatctgtaaa ggatatgggt gcctgtgaaa tctatcctca aaccattcaa cacaatccca 180
atggtcgttt tgtagttgtg tgtggagatg gtgaatatat aatttacact gccatggcct 240
tacgtaacaa agcatttgga agtgcacaag aattcgtttg ggcccaagat tctagtgaat 300
atgctattag agaatcagga tctactataa ggatatttaa aa 342
<210>17
<211>139
<212>ДНК
<213>Monolepta hieroglyphica
<400>17
aagtctgatt ttggagctga aggtatatat gggggttacc ttttgggagt caaatctgtt 60
tctgggttaa ctttctatga ttgggataca cttgatttgg ttagaaggat tgagatacaa 120
ccaaaagctg tctattggt 139
<210>18
<211>380
<212>ДНК
<213>Monolepta hieroglyphica
<400>18
catatgatgc tgatgaagtg caaaaagcta aagataataa tcaagttgct gacgatggtg 60
tggaatctgc attcaacctt ttaggagaaa tcaacgaatc tgttagaaca ggcctatggg 120
taggtgattg tttcatctac acaaatgctg tgaatcgtat caattacttt gtaggaggtg 180
aactagtaac tatcgcacac ttggatcgtc cattgtacgt cttgggttat gtgcccaaag 240
acgatcgttt gtatctagta gataaagagt tacgagttgt cagctaccaa ttgcttcttt 300
cagtactcga atatcagaca gctgttatga ggagggactt cccaacagca gatagagtac 360
taccgtctat acctaaagag 380
<210>19
<211>426
<212>ДНК
<213>Monolepta hieroglyphica
<400>19
gcacatttct tagaaaagca aggttttaaa caacaagctt tagctgtaag ttccgatccc 60
gaacatagat tcgaactcgc tgtggcatta gaagacctga atacagctaa aattctagca 120
caagaggcta acaatccaca aaagtggagc caattagctg atctagctgc tggcacaaat 180
aatgtagaac tagcaaaaga atgcatgcag aaagcccaag attttggtgg attattactt 240
ctagccacta gttcgggaga tgaatcatta gtccgtacat taggtgaaac aacacaagct 300
gagggcaaac ataatttagc cttcctttct catttcttgg taggagattt agacaagtgt 360
ctagatattt tagtaagtac aggaaggttg ccagaagctg cgtttttcgc cagatcttat 420
cttccc 426
<210>20
<211>316
<212>ДНК
<213>Monolepta hieroglyphica
<400>20
gaattgtgga ggacacaatt atcaactata aatcaaaaag ccggacaaag tttagccgat 60
cctaaaaatt atgaaaatct atttcccggt cttcaacaag cattgtcggc acagaaattt 120
ttggaacaga acaaacagtt gccacctgca tttatggctc cttctattgt tcccaaccaa 180
gatagaaatg ttatagccga agcggaggca cagttaaaga atagtggaac ttcatcaaat 240
ttgttcagtg ccccaccttc agcagaaact tctaggaatg ttatagaatc agtaccacaa 300
aataagccct cagaag 316
<210>21
<211>328
<212>ДНК
<213>Cauliflower mosaic virus
<400>21
ccattgccca gctatctgtc actttattgt gaagatagtg gaaaaggaag gtggctccta 60
caaatgccat cattgcgata aaggaaaggc catcgttgaa gatgcctctg ccgacagtgg 120
tcccaaagat ggacccccac ccacgaggag catcgtggaa aaagaagacg ttccaaccac 180
gtcttcaaag caagtggatt gatgtgatat ctccactgac gtaagggatg acgcacaatc 240
ccactatcct tcgcaagacc cttcctctat ataaggaagt tcatttcatt tggagaggac 300
acgctgacaa gctgactcta gcagatct 328
<210>22
<211>872
<212>ДНК
<213>Искусственная последовательность - нуклеотидная последовательность-R1
<400>22
aggtgtcaat tgtgtagact actaccacgg aggtgataaa ccctatataa tatcaggagc 60
cgatgatagg ttggtcaaaa tctgggatta ccaaaataaa acatgtgttc aaaccttaga 120
aggacatggt caaaatgtta ctgctgtctt tttccatcca gaacttccag ttgctcttac 180
gggaagtgaa gatggtacag tgagaatatg gcatgcaaat acccatcgac tggaaagtac 240
cttaaattat ggatttgaaa gggtttggac catttgttgc ttaaaaggaa gtaataatgt 300
ggcattgggt tatgacgagg gtagtattct tgttaaagtt ggtagagaag aaccagctgt 360
taagtactgc gatcgcgtta acgctttatc acgatacctt ctaccacata tcactaacaa 420
catcaacact catcactctc gacgacatcc actcgatcac tactctcaca cgaccgatta 480
actcctcatc cacgcggccg cctgcaggag caacagctgg ttcttctcta ccaactttaa 540
caagaatact accctcgtca taacccaatg ccacattatt acttcctttt aagcaacaaa 600
tggtccaaac cctttcaaat ccataattta aggtactttc cagtcgatgg gtatttgcat 660
gccatattct cactgtacca tcttcacttc ccgtaagagc aactggaagt tctggatgga 720
aaaagacagc agtaacattt tgaccatgtc cttctaaggt ttgaacacat gttttatttt 780
ggtaatccca gattttgacc aacctatcat cggctcctga tattatatag ggtttatcac 840
ctccgtggta gtagtctaca caattgacac ct 872
<210>23
<211>150
<212>ДНК
<213>Искусственная последовательность - последовательность спейсера
<400>23
aagtactgcg atcgcgttaa cgctttatca cgataccttc taccacatat cactaacaac 60
atcaacactc atcactctcg acgacatcca ctcgatcact actctcacac gaccgattaa 120
ctcctcatcc acgcggccgc ctgcaggagc 150
<210>24
<211>253
<212>ДНК
<213>Agrobacterium tumefaciens
<400>24
gatcgttcaa acatttggca ataaagtttc ttaagattga atcctgttgc cggtcttgcg 60
atgattatca tataatttct gttgaattac gttaagcatg taataattaa catgtaatgc 120
atgacgttat ttatgagatg ggtttttatg attagagtcc cgcaattata catttaatac 180
gcgatagaaa acaaaatata gcgcgcaaac taggataaat tatcgcgcgc ggtgtcatct 240
atgttactag atc 253
<210>25
<211>1026
<212>ДНК
<213>Salmonella enterica
<400>25
atgaaaaagc ctgaactcac cgcgacgtct gtcgagaagt ttctgatcga aaagttcgac 60
agcgtctccg acctgatgca gctctcggag ggcgaagaat ctcgtgcttt cagcttcgat 120
gtaggagggc gtggatatgt cctgcgggta aatagctgcg ccgatggttt ctacaaagat 180
cgttatgttt atcggcactt tgcatcggcc gcgctcccga ttccggaagt gcttgacatt 240
ggggaattca gcgagagcct gacctattgc atctcccgcc gtgcacaggg tgtcacgttg 300
caagacctgc ctgaaaccga actgcccgct gttctgcagc cggtcgcgga ggccatggat 360
gcgatcgctg cggccgatct tagccagacg agcgggttcg gcccattcgg accgcaagga 420
atcggtcaat acactacatg gcgtgatttc atatgcgcga ttgctgatcc ccatgtgtat 480
cactggcaaa ctgtgatgga cgacaccgtc agtgcgtccg tcgcgcaggc tctcgatgag 540
ctgatgcttt gggccgagga ctgccccgaa gtccggcacc tcgtgcacgc ggatttcggc 600
tccaacaatg tcctgacgga caatggccgc ataacagcgg tcattgactg gagcgaggcg 660
atgttcgggg attcccaata cgaggtcgcc aacatcttct tctggaggcc gtggttggct 720
tgtatggagc agcagacgcg ctacttcgag cggaggcatc cggagcttgc aggatcgccg 780
cggctccggg cgtatatgct ccgcattggt cttgaccaac tctatcagag cttggttgac 840
ggcaatttcg atgatgcagc ttgggcgcag ggtcgatgcg acgcaatcgt ccgatccgga 900
gccgggactg tcgggcgtac acaaatcgcc cgcagaagcg cggccgtctg gaccgatggc 960
tgtgtagaag tactcgccga tagtggaaac cgacgcccca gcactcgtcc gagggcaaag 1020
gaatag 1026
<210>26
<211>20
<212>ДНК
<213>Искусственная последовательность - Праймер 1
<400>26
cagggtgtca cgttgcaaga 20
<210>27
<211>20
<212>ДНК
<213>Искусственная последовательность - Праймер 2
<400>27
ccgctcgtct ggctaagatc 20
<210>28
<211>24
<212>ДНК
<213>Искусственная последовательность - Зонд 1
<400>28
tgcctgaaac cgaactgccc gctg 24
<210>29
<211>334
<212>ДНК
<213>Искусственная последовательность - несоответствующая dsRNA
<400>29
ggaaatcgcc actgctaaga aaaatggaca gaaaaataag agagcggcac ttcaagcact 60
caagcggaag aagcggtatg agaaacagtt gcagcagatt gatggaacat tatcaactat 120
tgaaatgcag agagaagctt tagagggtgc caacactaat acagctgttc tcacaacaat 180
gaaagatgct gcggacgccc tcaaagctgc tcacaaacac atggatgtcg atcaagttca 240
tgatatgatg gatgacattg ccgaacagca agatgtagct agagaaattt ctgatgccat 300
atccaaccca gttgcatttg gtcatgatat tgat 334
<210>30
<211>541
<212>ДНК
<213>Monolepta hieroglyphica
<400>30
atttgttgat actagtggta gacataaaca agaagaatca ctatttgaag aaatgttggc 60
agtttctaat gctgtgagac cagataatat tattttcgtt atggatgcaa ctattggtca 120
agcttgtgag tctcaggcta aagctttcaa agaaaaggta gatgtaggct ctgtaattat 180
aacaaaatta gatggacatg caaaaggagg tggtgcactc agtgctgtgg cagccactaa 240
cagtcctatt atattcattg gtacaggaga acatatagat gacttagaac cttttaaaac 300
aaaacctttc attagtaaat tattaggaat gggtgatata gaaggtttaa ttgataaagt 360
aaacgaatta aagttagagg ataatgaaga attgttagaa aaaattaaac atgggcaatt 420
cacactcaga gacatgtatg aacagttcca aaatattatg aaaatgggac ctttctcaca 480
aataatggga atgatccctg gatttagcca agatttcatg tcaaaaggaa gtgaacaaga 540
a 541
<210>31
<211>394
<212>ДНК
<213>Monolepta hieroglyphica
<400>31
aataatggac agtatgaatg attatgaatt agataaccga gatggtgcaa aattatttac 60
aaagcaaaat ggtagagtta ttagagttgc acaagggtct ggtgttacag aaagagaagt 120
aaaagatttg atcacgcaat acacgaagtt tgccgccgta gtaaagaaaa tgggcggcat 180
aaagggtctt tttaaaggcg gcgatatggc taaaaatgtc aatcacaacc aaatggccaa 240
acttaatcaa caaatggcca agatgatgga tcctcgagtg cttcagcaaa tgggcggcat 300
ggctggatta cagaacatga tgagacagct acaagcgggc gcggcaggag gcttgggagg 360
tttgggtaac cttatgggtg gttttggagg gaaa 394
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИНУКЛЕОТИД И СПОСОБ, ИСПОЛЬЗУЕМЫЙ ДЛЯ ОСУЩЕСТВЛЕНИЯ КОНТРОЛЯ НАД НАШЕСТВИЕМ НАСЕКОМЫХ | 2019 |
|
RU2775717C1 |
| ПОЛИНУКЛЕОТИД И СПОСОБ ДЛЯ ОСУЩЕСТВЛЕНИЯ КОНТРОЛЯ НАД ПОРАЖЕНИЕМ НАСЕКОМЫМИ | 2019 |
|
RU2775943C1 |
| ПОДАВЛЕНИЕ ЭКСПРЕССИИ ГЕНОВ У НАСЕКОМЫХ-ВРЕДИТЕЛЕЙ | 2018 |
|
RU2725953C2 |
| КОНТРОЛЬ ЖЕСТКОКРЫЛЫХ ВРЕДИТЕЛЕЙ С ПРИМЕНЕНИЕМ МОЛЕКУЛ РНК | 2017 |
|
RU2783144C2 |
| ИНСЕКТИЦИДНЫЕ БЕЛКИ | 2017 |
|
RU2765722C2 |
| ИНСЕКТИЦИДНЫЕ БЕЛКИ | 2017 |
|
RU2765304C2 |
| ИНСЕКТИЦИДНЫЕ БЕЛКИ | 2019 |
|
RU2810220C2 |
| СКОНСТРУИРОВАННЫЕ ПЕСТИЦИДНЫЕ БЕЛКИ И СПОСОБЫ КОНТРОЛЯ ВРЕДИТЕЛЕЙ РАСТЕНИЙ | 2017 |
|
RU2817591C2 |
| СКОНСТРУИРОВАННЫЕ ПЕСТИЦИДНЫЕ БЕЛКИ И СПОСОБЫ КОНТРОЛЯ ВРЕДИТЕЛЕЙ РАСТЕНИЙ | 2017 |
|
RU2816526C2 |
| НОВЫЕ БЕЛКИ, ИМЕЮЩИЕ ИНГИБИРУЮЩЕЕ ДЕЙСТВИЕ В ОТНОШЕНИИ НАСЕКОМЫХ | 2017 |
|
RU2781075C2 |
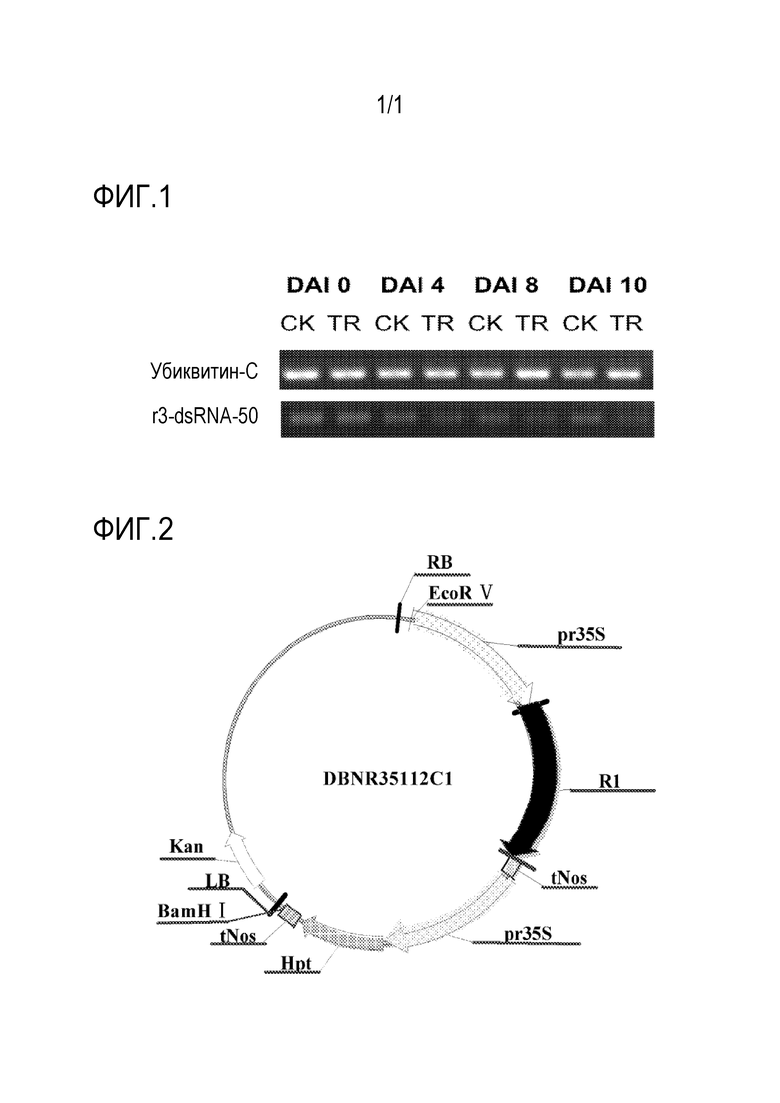
Изобретение относится к области биохимии, в частности к изолированному полинуклеотиду для борьбы с нашествием жесткокрылых насекомых-вредителей. Также раскрыты экспрессионная кассета, рекомбинантный экспрессионный вектор, композиция, содержащие указанный полинуклеотид. Раскрыты применение указанного полинуклеотида, способ для борьбы с нашествием жесткокрылых насекомых-вредителей и способ повышения устойчивости растения к Monolepta hieroglyphica с помощью указанного полинуклеотида, способ получения устойчивого к Monolepta hieroglyphica растения с помощью указанного полинуклеотида. Изобретение позволяет эффективно бороться с нашествием жесткокрылых насекомых-вредителей. 10 н. и 18 з.п. ф-лы, 1 ил., 5 табл., 12 пр.
1. Изолированный полинуклеотид для борьбы с нашествием жесткокрылых насекомых-вредителей, где полинуклеотид содержит полинуклеотидную последовательность, выбранную из:
(а) полинуклеотидной последовательности, показанной в SEQ ID NO: 1; или
(b) полинуклеотидной последовательности по меньшей мере из 139 последовательных нуклеотидов из SEQ ID NO: 1; или
(c) любой из полинуклеотидных последовательностей, показанных в SEQ ID NO: от 3 до 20; или
(d) полинуклеотидной последовательности, которая гибридизуется с полинуклеотидной последовательностью, определенной в любом из пунктов от (а) до (c), при жестких условиях;
где, когда жесткокрылое насекомое-вредитель поглощает двухцепочечную РНК, содержащую по меньшей мере одну цепь, комплементарную полинуклеотидной последовательности, рост жесткокрылого насекомого-вредителя ингибируется.
2. Изолированный полинуклеотид по п. 1, отличающийся тем, что жесткокрылое насекомое-вредитель представляет собой Monolepta hieroglyphica.
3. Изолированный полинуклеотид по п. 1 или 2, где полинуклеотид дополнительно содержит последовательность, комплементарную полинуклеотидной последовательности, определенной в любом из пунктов от (а) до (c) по п. 1.
4. Изолированный полинуклеотид по любому из пп. 1-3, где полинуклеотид дополнительно содержит спейсерную последовательность.
5. Изолированный полинуклеотид по п. 4, где спейсерная последовательность представляет собой SEQ ID NO: 23.
6. Экспрессионная кассета, содержащая изолированный полинуклеотид по любому из пп. 1-5.
7. Рекомбинантный экспрессионный вектор, содержащий изолированный полинуклеотид по любому из пп. 1-5.
8. Применение изолированного полинуклеотида по любому из пп. 1-5 для негативной регуляции экспрессии целевой последовательности жесткокрылого насекомого-вредителя или ингибирования роста жесткокрылого насекомого-вредителя, где жесткокрылое насекомое-вредитель представляет собой Monolepta hieroglyphica.
9. Рибонуклеиновая кислота, характеризующаяся тем, что рибонуклеиновая кислота подавляет экспрессию по меньшей мере одного гена-мишени у насекомого-вредителя Monolepta hieroglyphica после того, как она поглощается насекомым-вредителем, где рибонуклеиновая кислота содержит по меньшей мере один элемент сайленсинга, где элемент сайленсинга представляет собой двухцепочечную область РНК, содержащую соединенные комплементарные цепи, где одна цепь из области двухцепочечной РНК содержит нуклеотидную последовательность или состоит из нуклеотидной последовательности, которая комплементарна целевой последовательности в гене-мишени, и ген-мишень представляет собой полинуклеотидную последовательность, показанной в SEQ ID NO: 1, где целевая последовательность выбрана из:
(a) полинуклеотидной последовательности по меньшей мере из 139 последовательных нуклеотидов из SEQ ID NO: 1; и
(b) любой из полинуклеотидных последовательностей, показанных в SEQ ID NO: от 3 до 20.
10. Рибонуклеиновая кислота по п. 9, где рибонуклеиновая кислота содержит по меньшей мере два элемента сайленсинга, и каждый из элементов сайленсинга содержит нуклеотидную последовательность или состоит из нуклеотидной последовательности, которая комплементарна целевой последовательности в гене-мишени.
11. Рибонуклеиновая кислота по п. 10, где каждый из элементов сайленсинга содержит отличающуюся нуклеотидную последовательность или состоит из отличающейся нуклеотидной последовательности, которая комплементарна другой целевой последовательности в гене-мишени.
12. Рибонуклеиновая кислота по п. 11, где другая целевая последовательность происходит исключительно из гена-мишени или происходит из дополнительного гена-мишени, отличного от гена-мишени.
13. Рибонуклеиновая кислота по п. 12, где дополнительный ген-мишень, отличающийся от гена-мишени, получен от того же жесткокрылого насекомого-вредителя или от другого жесткокрылого насекомого-вредителя.
14. Рибонуклеиновая кислота по п. 13, где жесткокрылое насекомое-вредитель представляет собой Monolepta hieroglyphica.
15. Рибонуклеиновая кислота по любому из пп. 9-14, где рибонуклеиновая кислота дополнительно содержит спейсерную последовательность.
16. Рибонуклеиновая кислота по п. 15, где спейсерная последовательность представляет собой SEQ ID NO: 23.
17. Композиция для борьбы с нашествием жесткокрылых насекомых-вредителей, содержащая по меньшей мере одну из рибонуклеиновых кислот по любому из пп. 9-16 или клетку-хозяина, которая экспрессирует рибонуклеиновую кислоту по любому из пп. 9-16, и по меньшей мере один подходящий носитель, эксципиент или разбавитель.
18. Композиция по п. 17, где клетка-хозяин представляет собой бактериальную клетку.
19. Композиция по п. 17 или 18, где жесткокрылое насекомое-вредитель представляет собой Monolepta hieroglyphica.
20. Композиция для борьбы с нашествием жесткокрылых насекомых-вредителей по любому из пп. 17-19, где композиция представляет собой твердое вещество, жидкость или гель.
21. Композиция по п. 20, где композиция представляет собой инсектицидный спрей.
22. Композиция для борьбы с нашествием жесткокрылых насекомых-вредителей по любому из пп. 17-21, где композиция дополнительно содержит по меньшей мере один инсектицид, и инсектицид представляет собой химический инсектицид, специфический белок клубней картофеля, инсектицидный белок Bacillus thuringiensis, инсектицидный белок Xenorhabdus ehlersii, инсектицидный белок Photorhabdus luminescens, инсектицидный белок Bacillus laterosporus или инсектицидный белок Bacillus sphaericus.
23. Применение композиции для борьбы с нашествием жесткокрылых насекомых-вредителей по любому из пп. 17-22 для профилактики нашествия или борьбы с нашествием жесткокрылых насекомых-вредителей.
24. Применение по п. 23, где жесткокрылое насекомое-вредитель представляет собой Monolepta hieroglyphica.
25. Способ для борьбы с нашествием жесткокрылых насекомых-вредителей, включающий контактирование жесткокрылого насекомого-вредителя с эффективным количеством по меньшей мере одной из интерферирующих рибонуклеиновых кислот по любому из пп. 9-16.
26. Способ повышения устойчивости растения к Monolepta hieroglyphica и защиты растения от повреждения, вызываемого Monolepta hieroglyphica, включающий введение в растение полинуклеотида по любому из пп. 1-5, или экспрессионной кассеты по п. 6, или рекомбинантного вектора по п. 7, или конструкции, содержащей рибонуклеиновую кислоту по любому из пп. 9-16.
27. Способ получения устойчивого к Monolepta hieroglyphica растения, включающий введение в растение полинуклеотида по любому из пп. 1-5, или экспрессионной кассеты по п. 6, или рекомбинантного вектора по п. 7, или конструкции, содержащей рибонуклеиновую кислоту по любому из пп. 9-16.
28. Способ по любому из пп. 25-27, где растение представляет собой сою, пшеницу, ячмень, кукурузу, табак, рис, рапс, хлопок или подсолнечник.
| МОЛЕКУЛЫ НУКЛЕИНОВЫХ КИСЛОТ, КОТОРЫЕ ПРИДАЮТ УСТОЙЧИВОСТЬ К НАСЕКОМЫМ-ВРЕДИТЕЛЯМ ОТРЯДА ЖЕСТКОКРЫЛЫХ | 2011 |
|
RU2639549C2 |
| WO 2011075584 A1, 23.06.2011 | |||
| US 0009371538 B2, 21.06.2016. | |||
Авторы
Даты
2022-10-18—Публикация
2019-05-07—Подача