КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение в общем случае является направленным на стимуляцию иммунного ответа M1-типа (M1 поляризация макрофагов) путем введения соединения, модулирующего активацию макрофагов, которая также называется поляризацией макрофагов. Изобретение является направленным на применение антитела, способного связываться с CSF-1R, путем модулирования активации/поляризации макрофагов. Изобретение также является направленным на способы для оценки зависимой от дозы эффективности антитела, способного связываться с CSF-1R, у пациента путем оценки in vivo или in vitro поляризации макрофагов. Изобретение также дополнительно является направленным на сопутствующий периоду после лечения анализ для оценки эффекта антитела, способного связываться с CSF-1R, у субъекта, которого подвергают лечению.
Во время воспаления циркулирующие моноциты привлекаются в сайты воспаления, где они приобретают тип макрофагов, который предписывается присутствием специфических цитокинов и факторов роста. Зрелые макрофаги подразделяются на две популяции, M1-поляризованные или "классически активированные" и M2-поляризованные или "альтернативно активированные". Макрофаги представляют собой важные инфильтрирующие опухоль клетки, а также играют ключевую роль в росте опухоли и метастазах. В большинстве солидных опухолей наличие макрофагов является предпочтительным для роста опухоли и метастазов. Последние исследования свидетельствуют о том, что ассоциированные с опухолью макрофаги (TAMs) демонстрируют M2 фенотип. Эти ассоциированные с опухолью макрофаги (ТАМ) вырабатывают интерлейкин IL-10 и трансформирующий фактор роста (TGF) β для супрессии общих противоопухолевых иммунных ответов. Кроме того, ТАМ способствуют опухолевому нео-ангиогенезу путем секреции проангиогенных факторов и устанавливают инвазивную микросреду для того, чтобы способствовать опухолевым метастазам и диссеминации. По этим причинам селективное истощение M2 ТАМ стало считаться новым подходом к противораковой терапии (Sica и др., 2006, European Journal of Cancer, 42, 717-727).
Макрофаги участвуют в иммунных ответах на опухоли поляризованным образом. M1 дифференциация запускается с помощью GM-CSF и дополнительно стимулируется с помощью интеферона-γ (IFN-γ), бактериального липополисахарида (LPS), или фактора некроза опухоли α (TNFα), а также опосредуется несколькими путями сигнальной трансдукции, которые вовлекают переносчик сигнала и активатор транскрипции (STAT), ядерный фактор энхансера каппа легкой цепи активированных В клеток (NFĸB) и активированные митогеном протеинкиназы (MAPK). Эти события способствуют продукции агентов, таких, как виды реактивного кислорода и оксид азота (NO), а также стимулируют последующие иммунные ответы путем усиления способности презентации антигена индукции Th1 иммунитета с помощью продукции цитокинов, таких, как IL12. В противовес этому, активация M2 макрофагов используется для описания макрофагов, активированных с помощью путей, которые отличаются от M1 активации, включая IL4/IL13-стимулированные макрофаги, индуцированные IL10 макрофаги, а также запускаемые иммунным комплексом макрофаги. Среди множества молекулярных отличий между M1 и M2 видами активации соотношение продукции IL12 и IL10 является критическим для различения M1 и M2 макрофагов. Примечательным является то, что ТАМ имеют множество свойств M2 макрофагов.
ТАМ демонстрируют M2 профиль, который характеризуется не только IL-12низкийIL-10высокий фенотипом, но также опосредованной FcR способностью к фаголизису, ассоциированной с регуляторными функциями (Schmieder и др. 2012, Semin Cancer Biol., 22, 289-297). Фагоцитарный рецептор гемоглобина (CD163), который экспрессируется ТАМ, был идентифицирован в качестве маркера M2-поляризованных макрофагов (Ambarus и др. 2012, 375, 196-206). ТАМ могут представлять наиболее многочисленную популяцию иммуносупрессивных клеток в опухолевой микросреде, пополненной CSF-1 и CCL-2 (MCP-1) (Sica и др. 2006, Eur J Cancer., 42, 717-727).
Подобно этому, альтернативно активированные M2 макрофаги были втянуты в некоторые патологии, наиболее известные из которых представляют собой аллергию и астму (Duffield, 2003, Clin. Sci. 104, 27; Gordon, 2003, Nat. Rev. Immunol., 3, 23; Dagupta и Keegan, J. Innate Immun., 2012, 4, 478).
Изобретателями было показано, что некоторые моноклональные антитела являются способными переключать M2 макрофаги на M1 макрофаги (то есть, индуцировать дифференциацию M1 макрофагов в большей мере, чем M2 макрофагов). Они показали, что указанные моноклональные антитела являются способными к понижающей регуляции поверхностных FcγRI (CD64) и FcγRIII (CD16), понижающей регуляции MCP-1 (хемотаксический белок макрофагов 1, который также называется CCL-2), продукции IL-6, MMP9 и/или IL-10, и к стимуляции продукции IL-12, IL-1, TNF-α. Они также показали, что указанные моноклональные антитела ингибируют дифференциацию макрофагов CD163+ M2-типа из человеческих моноцитов и повышают соотношение M1/M2 макрофагов.
Раскрытие изобретения
Изобретение в широком смысле является направленным на способы иммуномодуляции путем модулирования активации макрофагов.
Как используется в данной заявке, термин "какой-либо" используется в смысле того, что он означает "по крайней мере, один", "по крайней мере, первый", "один или более" или "множество" упомянутых соединений или этапов, если контекст ясно не указывает на иное. Например, термин "какая-либо клетка" предусматривает множество клеток, включая их смеси.
Термин "и/или" при использовании в данной заявке предусматривает значение "и", "или" и "все или какая-либо другая комбинация элементов, связанных с указанным термином".
Термин "около" или "приблизительно", как используется в данной заявке, означает в пределах 20%, предпочтительно в пределах 10% и более предпочтительно в пределах 5% от заданного значения или интервала. Термин "приблизительно x" дополнительно включает значение х.
Как используется в данной заявке, термины "включающий" и "включает" являются предназначенными для того, чтобы обозначать, что наборы частей, продуктов, композиций и способов включают упомянутые соединения или этапы, но не исключают других. Например, "композиция, включающая x и y" охватывает любую композицию, которая содержит x и y, несмотря на то что другие соединения могут присутствовать в такой композиции. Кроме того, "способ, который включает этап x", охватывает любой способ, в котором осуществляется x, будь то случай, когда x представляет собой единственный этап в способе или тогда, когда он представляет собой только один из этапов, невзирая на то, сколько других этапов может быть, и невзирая на то, насколько простым или сложным является x по сравнению с ними.
"Существенно состоящий из" тогда, когда используется для определения продуктов, композиций и способов, будет означать исключение других соединений или этапов любой существенной значимости. Таким образом, композиция, существенно состоящая из указанного соединения, не будет исключать микропримеси и фармацевтические приемлемые носители. "Состоящий из" будет означать исключение более, чем микропримесей других соединений или этапов.
В соответствии с первым воплощением настоящее изобретение относится к способу иммуномодуляции путем модулирования активации M2 макрофагов у пациента, страдающего от состояний, ассоциированных с нежелательной поляризацией M2 макрофагов, где указанный способ включает этап введения указанному пациенту эффективного количества антитела, способного связываться с CSF-1R. В частности, изобретение является направленным на такой способ иммуномодуляции, в котором указанный пациент также страдает от состояний, ассоциированных с активностью CSF-1R.
В соответствии с одним специальным воплощением настоящее изобретение относится к применению антитела, способного связываться с человеческим CSF-1R, с помощью модулирования поляризации M2 макрофагов, в частности, у пациента, страдающего от состояний, ассоциированных с нежелательной поляризацией M2 макрофагов. В соответствии с одним специальным воплощением указанный пациент также страдает от состояний, ассоциированных с активностью CSF-1R.
Настоящая заявка относится к "модулированию поляризации/активации макрофагов". Этот термин означает то, что модуляторные антитела в соответствии с изобретением вызывают уменьшение пула активации M2 макрофагов и/или увеличение пула M1 макрофагов, предпочтительно уменьшение пула активации M2 макрофагов и увеличение пула M1 макрофагов. Таким образом, соотношение M1/M2 повышается. Это может быть показано, как раскрывается в данной заявке, с помощью изменений в уровнях факторов, которые являются ассоциированными с M1 и M2 макрофагами. Примеры таких факторов представляют собой мембранные маркеры, такие, как CD64 или CD163, цитокины, такие, как IL6, IL10 или IL12, интерфероны, MCP-1, ММР9, и т.д. Такая "модуляция активации макрофагов" у пациентов может подвергаться оценке, например, путем измерения соотношения IL12/IL10, уровня MCP-1 или IL-6, или соотношения CD163-/CD163+ макрофагов после введения пациенту антитела, способного связываться с CSF-1R, в соответствии с изобретением.
В соответствии с другим воплощением настоящее изобретение относится к способу для увеличения пула M1 макрофагов у пациента, страдающего от состояний, ассоциированных с нежелательной M2 поляризацией, где указанный способ включает этап введения указанному пациенту эффективного количества антитела, способного связываться с CSF-1R. Изобретение, в частности, является направленным на такой способ иммуномодуляции, где указанный пациент также страдает от состояний, ассоциированных с активностью CSF-1R.
В соответствии с особым воплощением указанный способ для увеличения пула M1 макрофагов у пациента, страдающего от состояний, ассоциированных с нежелательной M2 поляризацией, дополнительно уменьшает пул M2 макрофагов.
"Пациент" означает позвоночное животное, такое, как млекопитающее, в частности, человек. Млекопитающие включают, но не ограничены людьми, собаками, котами, лошадьми, коровами и свиньями. В соответствии с настоящим изобретением "пациент" страдает от состояний, ассоциированных с нежелательной M2 активацией, и в соответствии с частным воплощением также страдает от состояний, ассоциированных с активностью CSF-1R.
Изобретение также, в частности, является направленным на один способ для снижения проопухолевых функций макрофагов (то есть, онкогенности) и/или повышения макрофагальной активности опухолевой супрессии у пациента, в частности, у пациента, страдающего от состояний, ассоциированных с нежелательной M2 поляризацией и/или от состояний, ассоциированных с активностью CSF-1R, где указанный способ включает этап введения указанному пациенту эффективного количества антитела, способного связываться с CSF-1R.
В соответствии со специальным воплощением способ в соответствии с изобретением репрессирует, по крайней мере, одну проопухолевую макрофагальную функцию, выбранную из группы, которая состоит из опухолевой инвазии, метастазов, пролиферации опухолевых клеток, опухолевого роста, выживания опухоли, нео-ангиогенеза, супрессии врожденного и приобретенного иммунитета и ремоделирования внеклеточного матрикса.
Таким образом, в соответствии с изобретением "модулирование активации/поляризации макрофагов" может также означать то, что модуляторные антитела в соответствии с изобретением снижают, по крайней мере, одну из проопухолевых функций макрофагов (то есть, онкогенность), выбранную из группы, которая состоит из опухолевой инвазии, метастазов, пролиферации опухолевых клеток, опухолевого роста, выживания опухоли, нео-ангиогенеза, супрессии приобретенного или врожденного иммунитета и ремоделирования внеклеточного матрикса.
В соответствии со специальным воплощением способ в соответствии с изобретением ингибирует продукцию MCP-1, MMP-9 и IL-6 макрофагами, в частности макрофагами человека.
В соответствии со специальным воплощением способ в соответствии с изобретением вызывает подавление в отношении экспрессии поверхностных sFcγRI (CD64) и FcγRIII (CD16) на макрофагах, в частности, человеческих макрофагах.
В соответствии со специальным воплощением способ в соответствии с изобретением способствует продукции IL-12 (в частности, P70 формы IL-12) макрофагами, особенно человеческими макрофагами, и/или выявляет понижающую регуляцию соотношений IL-12/IL-10.
В соответствии со специальным воплощением способ в соответствии с изобретением модулирует состояние активации макрофагов с помощью секретированных факторов.
В соответствии со специальным воплощением способ в соответствии с изобретением снижает, по крайней мере, один из следующих показателей:
- привлечение ТАМ к опухоли;
- по крайней мере, одну из проопухолевых функций макрофагов;
- опухолевый ангиогенез;
- опухолевую инвазию и метастазы;
- опухолевый рост;
- пролиферацию опухолевых клеток
у пациентов, в частности, у пациентов, страдающих от состояний, ассоциированных с нежелательной поляризацией M2 макрофагов. В соответствии со специальным воплощением указанный пациент также страдает от состояний, ассоциированных с активностью CSF-1R.
Изобретение также относится к способам для направления макрофагов в сторону M1-типа (M1 поляризация макрофагов) иммунного ответа и/или в сторону от M2-типа (M2 поляризация макрофагов) иммунного ответа у пациентов, в частности у пациентов, страдающих от состояний, ассоциированных с нежелательной M2 поляризацией макрофагов, или у пациентов, страдающих от состояний, ассоциированных с активностью CSF-1R, где указанный способ включает этап введения указанному пациенту эффективного количества антитела, способного связываться с CSF-1R.
Изобретение также дополнительно относится к способам для направления макрофагов к Th1 иммунному ответу или в сторону от Th2 иммунного ответа у пациентов, в частности у пациентов, страдающих от состояний, ассоциированных с нежелательной M2 поляризацией макрофагов, или у пациентов, страдающих от состояний, ассоциированных с активностью CSF-1R, где указанный способ включает этап введения указанному пациенту эффективного количества антитела, способного связываться с CSF-1R.
Изобретение также является направленным на применение антитела, способного связываться с CSF-1R, путем модулирования поляризации макрофагов. Изобретение также является направленным на применение антитела, способного связываться с CSF-1R, для направления макрофагов к M1-типу (M1 поляризация макрофаг) иммунного ответа. Изобретение также является направленным на применение антитела, способного связываться с CSF-1R, для индукции макрофагов с целью стимуляции ммунного ответа Th1-типа. Изобретение также является направленным на применение композиций, таких, как фармацевтические композиции, которые включают антитело, способное связываться с CSF-1R, с целью модулирования активации макрофагов, для направления макрофагов к M1-типу (M1 поляризация макрофагов) иммунного ответа и/или индукции макрофагов с целью стимуляции иммунного ответа Th1-типа.
Как используется в данной заявке, термин "способный связываться с" относится к реакции связывания, которая является определяющей для присутствия целевого белка в гетерогенной популяции белков и других биологических препаратов. Таким образом, при указанных условиях анализа антитело в соответствии с изобретением предпочтительно связывается, по крайней мере, с частью CSF-1R и предпочтительно не связывается в существенном количестве с другими соединениями, присутствующими в исследуемом образце. Специфическое связывание антитела в соответствии с изобретением и CSF-1R мишени означает, что связывающая аффинность составляет, по крайней мере, 103 М-1, и предпочтительно 105 М-1, 106 М-1, 107 М-1, 108 М-1, 109 М-1 или 1010 М-1.
Как используется в данной заявке, термин "CSF-1R" относится к рецептору CSF1 человека.
Как используется в данной заявке, термин "антитело" или "Ab" используется в самом широком смысле. Таким образом, "антитело" или "Ab" может быть существующим в природе или полученным человеком, таким, как моноклональные антитела (mAbs), которые получают с помощью традиционной гибридомной технологии, рекомбинантной методики, и/или оно может представлять собой их функциональные фрагменты. Антитела в соответствии с настоящим изобретением предпочтительно представляют собой моноклональные антитела (mAb).
Как используется в данной заявке, термин "вариабельный участок" относится к вариабельному участку или домену легкой цепи (VL) или тяжелой цепи (VH), который содержит детерминанты для специфичности узнавания связывания. Вариабельные домены являются вовлеченными в узнавание антигена и образуют сайт связывания антигена. Вариабельный участок как тяжелой, так и легкой цепи, подразделяется на сегменты, включающие четыре каркасных субучастка (FR1, FR2, FR3 и FR4), которые прерываются тремя участками гипервариабельных последовательностей, или участками, определяющими комплементарность (CDR's), как определяется в базе данных Кабат, при этом CDR1 размещается между FR1 и FR2, CDR2 располагается между FR2 и FR3, a CDR3 между FR3 и FR4. Без указания конкретных субучастков таких, как FR1, FR2, FR3 или FR4, каркасный участок, как было предложено другими, представляет собой объединенные FR в пределах вариабельного участка единичной цепи существующего в природе иммуноглобулина. Как используется в данной заявке, FR представляет один из четырех субучастков, a FR представляют два или более из четырех субучастков, которые составляют каркасный участок. Каркасный участок антитела представляет собой объединенные каркасные участки, входящие в состав легкой и тяжелой цепей, и служит для определения местоположения и ориентации CDR. CDR, в первую очередь являются ответственными за формирование сайта связывания антитела, который обеспечивает специфичность и аффинность связывания по отношению к эпитопу антигена. В пределах вариабельных участков H или L цепей, которые обеспечивают участки связывания антигена, существуют меньшие последовательности, получившие название "гипервариабельные" по причине их крайней вариабельности между антителами с различной специфичностью. Такие гипервариабельные участки также называются "участками, определяющими комплементарность" или "CDR" участками. Эти CDR участки отвечают за основную специфичность антитела для определенной структуры антигенной детерминанты. Каждая из вариабельных тяжелых и легких цепей имеет 3 CDR участка, каждый из которых не является связанным с другими (называются L1, L2, L3, H1, H2, H3) для соответствующих легких (L) и тяжелых (H) цепей.
"Совместное введение" означает введение в сочетание друг с другом, вместе, координировано, включая одновременное или последовательное введение двух или более агентов.
"Эффективное количество" в общем случае означает количество, которое обеспечивает желаемый местный или системный эффект, например, эффективное для ослабления нежелательных эффектов воспаления, включая модуляцию активации макрофагов, и т.п. Например, эффективное количество представляет собой количество, достаточное для достижения лечебного или желательного клинического результата. Эффективные количества могут обеспечиваться все и сразу в виде одного введения или в виде частей, которые обеспечивают эффективное количество в случае нескольких введений. Точное определение того, что будет считаться эффективным количеством, может основываться на факторах, индивидуальных по отношению к каждому субъекту, включая его вес, возраст, повреждение и/или заболевание, или травму, которые подвергаются лечению, и промежуток времени, прошедший с тех пор, как возникло повреждение или началось заболевание. Специалист в данной области техники будет в состоянии определить эффективное количество для данного субъекта на основе этих соображений, что является обычным в данной области техники. Как используется в данной заявке, "эффективная доза" означает то же самое, что и "эффективное количество".
В соответствии с другим воплощением настоящее изобретение относится к применению антитела, способного связываться с человеческим CSF-1R для снижения, по крайней мере, одной из проопухолевых функций макрофагов, выбранной из группы, которая состоит из опухолевой инвазии, метастазов, опухолевого роста, выживания опухоли, нео-ангиогенеза, супрессии врожденного или приобретенного иммунитета и ремоделирования матрикса (то есть, онкогенности), и/или повышения активности опухолевой супрессии макрофагов у пациентов, в частности, у пациента, страдающего от состояний, ассоциированных с нежелательной M2 активацией, и в соответствии с частным воплощением также страдающего от состояний, ассоциированных с активностью CSF-1R.
В соответствии с другим воплощением настоящее изобретение относится к применению антитела, способного связываться с человеческим CSF-1R, для ингибирования продукции MCP-1, MMP-9 и IL-6 макрофагами, в частности человеческими макрофагами.
В соответствии с другим воплощением настоящее изобретение относится к применению антитела, способного связываться с человеческим CSF-1R для подавления экспрессии поверхностных FcγRI (CD64) и/или FcγRIII (CD16) на макрофагах, в частности, человеческих макрофагах.
В соответствии с другим воплощением настоящее изобретение относится к применению антитела, способного связываться с человеческим CSF-1R, для стимуляции продукции IL-12 (в частности, формы P70IL-12) макрофагами, в частности, человеческими макрофагами/или повышающей регуляции соотношения IL-12/IL-10.
В соответствии с другим воплощением настоящее изобретение относится к применению антитела, способного связываться с человеческим CSF-1R, путем модулирования состояния активации макрофагов с помощью секретируемых факторов.
В соответствии с другим воплощением настоящее изобретение относится к применению антитела, способного связываться с человеческим CSF-1R, для снижения привлечения ТАМ и/или опухолевого ангиогенеза у пациентов, в частности, у пациента, страдающего от состояний, ассоциированных с нежелательной M2 поляризацией макрофагов, и в соответствии с особым воплощением изобретения также страдающего от состояний, ассоциированных с активностью CSF-1R.
Изобретение также, в частности, является направленным на применение антитела, способного связываться с человеческим CSF-1R, для снижения привлечения ТАМ и/или опухолевой инвазии метастазов у пациентов, в частности у пациента, страдающего от состояний, ассоциированных с нежелательной M2 поляризацией макрофагов, и в соответствии с особым воплощением изобретения также страдающего от состояний, ассоциированных с активностью CSF-1R.
Изобретение также специфически является направленным на применение антитела, способного связываться с человеческим CSF-1R, для снижения привлечения ТАМ и/или опухолевого роста у пациентов, в частности, у пациента, страдающего от состояний, ассоциированных с нежелательной M2 поляризацией макрофагов, и в соответствии с особым воплощением изобретения также страдающего от состояний, ассоциированных с активностью CSF-1R.
В соответствии с другим воплощением настоящее изобретение относится к применению антитела, способного связываться с человеческим CSF-1R, для ориентации макрофагов в направлении иммунного ответа M1-типа (M1 поляризация макрофагов) и/или в направлении от иммунного ответа M2-типа (M2 поляризация макрофагов) у пациентов, в частности, у пациента, страдающего от состояний, ассоциированных с нежелательной M2 поляризацией макрофагов, и в соответствии с особым воплощением также страдающего от состояний, ассоциированных с активностью CSF-1R.
В соответствии с другим воплощением настоящее изобретение относится к применению антитела, способного связываться с человеческим CSF-1R для ориентации макрофагов в направлении Th1 иммунного ответа и/или в направлении от Th2 иммунного ответа у пациентов, в частности, у пациента, страдающего от состояний, ассоциированных с нежелательной M2 поляризацией макрофагов, и в соответствии с особым воплощение также страдающего от состояний, ассоциированных с активностью CSF-1R.
В соответствии с предпочтительными воплощениями указанное антитело, способное связываться с человеческим CSF-1R, представляет собой антитело, которое связывается, по крайней мере, с одним эпитопом, расположенным между положениями аминокислот от 20 до 41 последовательности SEQ ID NO: 23 (то есть, N-терминальная часть человеческого домена D1). В предпочтительном воплощении антитело в соответствии с изобретением связывается с одним эпитопом, расположенным между положениями аминокислот от 20 до 39 последовательности SEQ ID NO: 23 (то есть, N-терминальная часть человеческого домена D1), с аминокислотами Asn72, Ser94-Ala95-Ala96, Lys102, Asp131-Pro132-Val133 и Trp159 последовательности SEQ ID NO: 23.
В другом воплощении антитело в соответствии с изобретением связывается с одним эпитопом, расположенным между положениями аминокислот от 20 до 41 SEQ ID NO: 23 (то есть, N-терминальная часть человеческого домена D1) и не сявзывается с любым другим эпитопом, расположенным между положениями аминокислот от 42 до 90, и/или между положениями аминокислот от 91 до 104, и/или между положениями аминокислот от 105 до 199, и/или между положениями аминокислот от 200 до 298 SEQ ID NO: 23. В соответствии с предпочтительным воплощением антитело настоящего изобретения является способным узнавать минимальный эпитоп, расположенный между положениями аминокислот от 20 до 41 SEQ ID NO: 23 (то есть, N-терминальная часть человеческого домена D1), предпочтительно с эпитопом между положениями аминокислот от 20 до 39 SEQ ID NO: 23.
В предпочтительном воплощении указанное антитело, способное связываться с человеческим CSF-1R, представляет собой антитело, которое не конкурирует с IL-34 лигандом за связывание с рецептором CSF-1R. Термин "не конкурирует с IL-34 лигандом", как используется в данной заявке, относится к отсутствию ингибирования связывания IL34 лиганда с его рецептором CSF-1R.
В предпочтительном воплощении указанное антитело, способное связываться с человеческим CSF-1R, представляет собой антитело, которое частично конкурирует с CSF-1 лигандом за связывание с CSF-1R рецептором. Термин "частично конкурирует с CSF-1 лигандом", как используется в данной заявке, относится к ингибированию связывания CSF-1 лиганда с его рецептором CSF-1R, которое составляет менее, чем 100%, предпочтительно менее чем 50%, и даже более предпочтительно менее чем 20%, и преимущественно менее чем 10%. Этот частичный ингибитор только снижает, но не полностью исключает, связывание лиганда. Такое ингибирование называется частичным ингибированием. В предпочтительном воплощении указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое является способным частично предотвращать связывание CSF1 с его рецептором CSF-1R, и не является способным к полному ингибированию указанного связывания. В частности, антитела в соответствии с изобретением являются способными снижать связывание CSF-1 с CSF-1R приблизительно на 5-10%.
В соответствии с одним воплощением указанное антитело, способное связываться с человеческим CSF-1R, представляет собой антитело, которое включает:
(i) по крайней мере, один CDR, где указанный CDR включает, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 45 и заканчивая в положении 54 SEQ ID NO: 1, последовательности, начиная от положения 66 и заканчивая в положении 87 SEQ ID NO: 1, или последовательности, начиная от положения 117 и заканчивая в положении 126 SEQ ID NO: 1;
или,
(ii) по крайней мере, один CDR, где указанный CDR включает, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 44 и заканчивая в положении 56 SEQ ID NO: 2, последовательности, начиная от положения 66 и заканчивая в положении 76 SEQ ID NO: 2 или последовательности, начиная от положения 109 и заканчивая в положении 117 SEQ ID NO: 2.
В соответствии с предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает следующие CDR, включающие, по крайней мере, пять смежных аминокислот:
- последовательности, начиная от положения 45 и заканчивая в положении 54 SEQ ID NO: 1,
- последовательности, начиная от положения 66 и заканчивая в положении 87 о SEQ ID NO: 1,
- последовательности, начиная от положения 117 и заканчивая в положении 126 SEQ ID NO: 1,
- последовательности, начиная от положения 44 и заканчивая в положении 56 SEQ ID NO: 2,
- последовательности, начиная от положения 66 и заканчивая в положении 76 SEQ ID NO: 2
- или последовательности, начиная от положения 109 и заканчивая в положении 117 SEQ ID NO: 2.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, и включает, по крайней мере, один CDR, каждый из которых является выбранным, независимо друг от друга, из группы CDR, как представлено в:
- последовательности, начиная от положения 45 и заканчивая в положении 54 SEQ ID NO: 1,
- последовательности, начиная от положения 66 и заканчивая в положении 87 SEQ ID NO: 1,
- последовательности, начиная от положения 117 и заканчивая в положении 126 о SEQ ID NO: 1,
- последовательности, начиная от положения 44 и заканчивая в положении 56 SEQ ID NO: 2,
- последовательности, начиная от положения 66 и заканчивая в положении 76 SEQ ID NO: 2 и
- последовательности, начиная от положения 109 и заканчивая в положении 117 SEQ ID NO: 2.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает CDR, как представлено в:
- последовательности, начиная от положения 45 и заканчивая в положении 54 SEQ ID NO: 1,
- последовательности, начиная от положения 66 и заканчивая в положении 87 SEQ ID NO: 1,
- последовательности, начиная от положения 117 и заканчивая в положении 126 SEQ ID NO: 1,
- последовательности, начиная от положения 44 и заканчивая в положении 56 SEQ ID NO: 2,
- последовательности, начиная от положения 66 и заканчивая в положении 76 SEQ ID NO: 2 и
- последовательности, начиная от положения 109 и заканчивая в положении 117 SEQ ID NO: 2.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает, по крайней мере, один CDR, который включает аминокислотную последовательность, как представлено в одной из последовательностей SEQ ID NO: 5, 6, 7, 8, 9 или 10.
В соответствии с предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает CDR, включающий аминокислотную последовательность, как представлено в последовательностях SEQ ID NO: 5, 6, 7, 8, 9 или 10.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1, и включает (i) по крайней мере, один CDR, который включает аминокислотную последовательность, как представлено в одной из последовательностей SEQ ID NO: 11, 12 или 13; или (ii) по крайней мере, один CDR, который включает аминокислотную последовательность, как представлено в одной из последовательностей SEQ ID NO: 14, 15 или 16.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает CDR, включающий аминокислотную последовательность, как представлено в последовательностях SEQ ID NO: 11, 12, 13, 14, 15 или 16.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает (i) по крайней мере, один CDR, который включает аминокислотную последовательность, как представлено в одной из последовательностей SEQ ID NO: 17, 18 или 19; или (ii) по крайней мере, один CDR, который включает аминокислотную последовательность, как представлено в одной из последовательностей SEQ ID NO: 20, 21 или 22.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает, по крайней мере, один CDR, который включает аминокислотную последовательность, как представлено в одной из последовательностей SEQ ID NO: 17, 18, 19, 20, 21 или 22.
В соответствии с одним предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает CDR, включающий аминокислотную последовательность, как представлено в последовательностях SEQ ID NO: 17, 18, 19, 20, 21 или 22.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает вариабельный участок, где указанный вариабельный участок включает три CDR, как представлено в SEQ ID NO: 5, 6 и 7.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает вариабельный участок, где указанный вариабельный участок включает три CDR, как представлено в SEQ ID NO: 8, 9 и 10.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает вариабельный участок, где указанный вариабельный участок включает три CDR, как представлено в SEQ ID NO: 11, 12 и 13.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает вариабельный участок, где указанный вариабельный участок включает три CDR, как представлено в SEQ ID NO: 14, 15 и 16.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает вариабельный участок, где указанный вариабельный участок включает три CDR, как представлено в SEQ ID NO: 17, 18 и 19.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает вариабельный участок, где указанный вариабельный участок включает три CDR, как представлено в SEQ ID NO: 20, 21 и 22.
В соответствии с один предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает вариабельный участок, где вариабельный участок включает аминокислотную последовательность, как представлено в SEQ ID NO: 3.
В более предпочтительном воплощении указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает вариабельный участок, где вариабельный участок является таким, как представлено в SEQ ID NO: 3.
В другом предпочтительном воплощении указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, где вариабельный участок включает аминокислотную последовательность, как представлено в SEQ ID NO: 4.
В другом более предпочтительном воплощении указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает вариабельный участок, где вариабельный участок является таким, как представлено в SEQ ID NO: 4.
В соответствии с предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает:
- вариабельный участок, включающий три CDR, как представлено в SEQ ID NO: 5, 6 и 7, и
- вариабельный участок, включающий три CDR, как представлено в SEQ ID NO: 8, 9 и 10.
В соответствии с предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает:
- вариабельный участок, включающий три CDR, как представлено в SEQ ID NO: 11, 12 и 13, и
- вариабельный участок, включающий три CDR, как представлено в SEQ ID NO: 14, 15 и 16.
В соответствии с предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает:
- вариабельный участок, включающий три CDR, как представлено в SEQ ID NO: 17, 18 и 19, и
- вариабельный участок, включающий три CDR, как представлено в SEQ ID NO: 20, 21 и 22.
В соответствии с предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает:
- вариабельный участок, как представлено в SEQ ID NO: 3 и
- вариабельный участок, как представлено в SEQ ID NO: 4.
В соответствии с предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает:
(i) вариабельный участок тяжелой цепи, включающий:
- CDR, как представлено в последовательности, начиная от положения 45 и заканчивая в положении 54 SEQ ID NO: 1,
- CDR, как представлено в последовательности, начиная от положения 66 и заканчивая в положении 87 SEQ ID NO: 1 и
- CDR, как представлено в последовательности, начиная от положения 117 и заканчивая в положении 126 SEQ ID NO: 1;
и
(ii) вариабельный участок легкой цепи, включающий:
- CDR, как представлено в последовательности, начиная от положения 44 и заканчивая в положении 56 SEQ ID NO: 2,
- CDR, как представлено в последовательности, начиная от положения 66 и заканчивая в положении 76 SEQ ID NO: 2 и
- CDR, как представлено в последовательности, начиная от положения 109 и заканчивая в положении 117 SEQ ID NO: 2.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает (i) вариабельный участок тяжелой цепи, включающий три CDR, как представлено в SEQ ID NO: 5, 6 и 7, и (ii) вариабельный участок легкой цепи, включающий три CDR, как представлено в SEQ ID NO: 8, 9 и 10.
В соответствии с другим воплощением антитело в соответствии с изобретением специфически связывается с CSF-1R и включает (i) вариабельный участок тяжелой цепи, включающий три CDR, как представлено в SEQ ID NO: 11, 12 и 13, и (ii) вариабельный участок легкой цепи, включающий три CDR, как представлено в SEQ ID NO: 14, 15 и 16.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает (i) вариабельный участок тяжелой цепи, включающий три CDR, как представлено в SEQ ID NO: 17, 18 и 19, и (ii) вариабельный участок легкой цепи, включающий три CDR, как представлено в SEQ ID NO: 20, 21 и 22.
В соответствии с предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R и включает (i) вариабельный участок тяжелой цепи, как представлено в SEQ ID NO: 3, и (ii) вариабельный участок легкой цепи, как представлено в SEQ ID NO: 4.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, при этом оно включает:
(a) первый вариабельный участок, который определяется следующей формулой:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где:
FR1, FR2, FR3 и FR4 каждый представляет собой каркасный участок;
CDR1, CDR2 и CDR3 каждый представляет собой участок, определяющий комплементарность;
где:
CDR1 имеет, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 45 и заканчивая в положении 54 SEQ ID NO: 1;
CDR2 имеет, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 66 и заканчивая в положении 87 SEQ ID NO: 1; и
CDR3 имеет, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 117 и заканчивая в положении 126 SEQ ID NO: 1;
и
(b) второй вариабельный участок, который определяется следующей формулой:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где:
FR1, FR2, FR3 и FR4 каждый представляет собой каркасный участок;
CDR1, CDR2 и CDR3 каждый представляет собой участок, определяющий комплементарность;
где:
CDR1 имеет, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 44 и заканчивая в положении 56 SEQ ID NO: 2;
CDR2 имеет, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 66 и заканчивая в положении 76 SEQ ID NO: 2; и
CDR3 имеет, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 109 и заканчивая в положении 117 SEQ ID NO: 2.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, которое включает:
(a) первый вариабельный участок, который определяется следующей формулой:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где:
FR1, FR2, FR3 и FR4 каждый представляет собой каркасный участок;
CDR1, CDR2 и CDR3 каждый представляет собой участок, определяющий комплементарность;
где:
CDR1 имеет аминокислотную последовательность, выбранную из группы, которая состоит из: SEQ ID NO: 5, 11 и 17;
CDR2 имеет аминокислотную последовательность, выбранную из группы, которая состоит из: SEQ ID NO: 6, 12 и 18; и
CDR3 имеет аминокислотную последовательность, выбранную из группы, которая состоит из: SEQ ID NO: 7, 13 и 19;
и
(b) второй вариабельный участок, который определяется следующей формулой:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где:
FR1, FR2, FR3 и FR4 каждый представляет собой каркасный участок;
CDR1, CDR2 и CDR3 каждый представляет собой участок, определяющий комплементарность;
где:
CDR1 имеет аминокислотную последовательность, выбранную из группы, которая состоит из: SEQ ID NO: 8, 14 и 20;
CDR2 имеет аминокислотную последовательность, выбранную из группы, которая состоит из: SEQ ID NO: 9, 15 и 21; и
CDR3 имеет аминокислотную последовательность, выбранную из группы, которая состоит из: SEQ ID NO: 10, 16 и 22.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, включающее любой один из следующих (i), (ii) или (iii):
(i)
(a) первый вариабельный участок, который определяется следующей формулой:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где:
FR1, FR2, FR3 и FR4 каждый представляет собой каркасный участок;
CDR1, CDR2 и CDR3 каждый представляет собой участок, определяющий комплементарность;
где:
CDR1 является таким, как представлено в SEQ ID NO: 5;
CDR2 является таким, как представлено в SEQ ID NO: 6; и
CDR3 является таким, как представлено в SEQ ID NO: 7; и
(b) второй вариабельный участок, который определяется следующей формулой:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где:
FR1, FR2, FR3 и FR4 каждый представляет собой каркасный участок;
CDR1, CDR2 и CDR3 каждый представляет собой участок, определяющий комплементарность;
где:
CDR1 является таким, как представлено в SEQ ID NO: 8;
CDR2 является таким, как представлено в SEQ ID NO: 9; и
CDR3 является таким, как представлено в SEQ ID NO: 10; или
(ii) (a) первый вариабельный участок, который определяется следующей формулой:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где:
FR1, FR2, FR3 и FR4 каждый представляет собой каркасный участок;
CDR1, CDR2 и CDR3 каждый представляет собой участок, определяющий комплементарность;
где:
CDR1 является таким, как представлено в SEQ ID NO: 11;
CDR2 является таким, как представлено в SEQ ID NO: 12; и
CDR3 является таким, как представлено в SEQ ID NO: 13; и
(b) второй вариабельный участок, который определяется следующей формулой:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где:
FR1, FR2, FR3 и FR4 каждый представляет собой каркасный участок;
CDR1, CDR2 и CDR3 каждый представляет собой участок, определяющий комплементарность;
где:
CDR1 является таким, как представлено в SEQ ID NO: 14;
CDR2 является таким, как представлено в SEQ ID NO: 15; и
CDR3 является таким, как представлено в SEQ ID NO: 16; или
(iii) (a) первый вариабельный участок, который определяется следующей формулой:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где:
FR1, FR2, FR3 и FR4 каждый представляет собой каркасный участок;
CDR1, CDR2 и CDR3 каждый представляет собой участок, определяющий комплементарность;
где:
CDR1 является таким, как представлено в SEQ ID NO: 17;
CDR2 является таким, как представлено в SEQ ID NO: 18; и
CDR3 является таким, как представлено в SEQ ID NO: 19;
и
(b) второй вариабельный участок, который определяется следующей формулой:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где:
FR1, FR2, FR3 и FR4 каждый представляет собой каркасный участок;
CDR1, CDR2 и CDR3 каждый представляет собой участок, определяющий комплементарность;
где:
CDR1 является таким, как представлено в SEQ ID NO: 20;
CDR2 является таким, как представлено в SEQ ID NO: 21; и
CDR3 является таким, как представлено в SEQ ID NO: 22.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, включающее:
- первый вариабельный участок, включающий аминокислотную последовательность SEQ ID NO: 3; и
- второй вариабельный участок, включающий аминокислотную последовательность SEQ ID NO: 4.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, включающее:
- первый вариабельный участок, включающий аминокислотную последовательность SEQ ID NO: 1; и
- второй вариабельный участок, включающий аминокислотную последовательность SEQ ID NO: 2.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, включающее:
- тяжелую цепь, выбранную из группы, которая состоит из SEQ ID NO: 24 и SEQ ID NO: 25, и
- легкую цепь, выбранную из группы, которая состоит из SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28.
В соответствии с другим воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, включающее:
- первый вариабельный участок, выбранный из группы, которая состоит из SEQ ID NO: 29 и SEQ ID NO: 30; и
- второй вариабельный участок, выбранный из группы, которая состоит из SEQ ID NO: 31, SEQ ID NO: 32 и SEQ ID NO: 33.
В соответствии с одним предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, включающее (a) тяжелую цепь, которая состоит из SEQ ID NO: 24, и (b) тяжелую цепь, которая состоит из SEQ ID NO: 26.
В соответствии с другим предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, включающее (a) тяжелую цепь, которая состоит из SEQ ID NO: 25, и (b) легкую цепь, которая состоит из SEQ ID NO: 27.
В соответствии с одним предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, включающее (a) тяжелую цепь, которая состоит из SEQ ID NO: 24, и (b) легкую цепь, которая состоит из SEQ ID NO: 28. Пример указанного моноклонального антитела представляет собой моноклональное антитело H27K15.
В соответствии с одним предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, включающее (a) первый вариабельный участок, который состоит из SEQ ID NO: 29, и (b) второй вариабельный участок, который состоит из SEQ ID NO: 31.
В соответствии с другим предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, включающее (a) первый вариабельный участок, который состоит из SEQ ID NO: 30, и (b) второй вариабельный участок, который состоит из SEQ ID NO: 32.
В соответствии с одним предпочтительным воплощением указанное антитело, способное связываться с CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, включающее (a) первый вариабельный участок, который состоит из SEQ ID NO: 29, и (b) второй вариабельный участок, который состоит из SEQ ID NO: 33. Пример указанного моноклонального антитела представляет собой моноклональное антитело H27K15.
Антитело, в частности человеческое антитело в соответствии с изобретением, может представлять собой такое различных изотипов, таких, как IgG, IgA, IgM или IgE. В предпочтительном воплощении антитело, в частности человеческое антитело в соответствии с изобретением, представляет собой IgG.
Антитело в соответствии с изобретением может быть гликозилированным или негликозилированным.
Как используется в данной заявке, термин "гликозилирование" относится к присутствию единиц углевода, которые являются ковалентно присоединенными к антителу.
Способы в соответствии с изобретением являются полезными в лечении состояний, ассоциированных с нежелательной M2 активацией, а также ассоциированных с CSF-1R. Способы в соответствии с изобретением являются полезными в лечении заболевания, вовлекающего воспаление, а также ассоциированных с CSF-1R.
"Пациенты, страдающие от состояний, ассоциированных с нежелательный M2 поляризацией макрофагов" в соответствии с изобретением означают рак, в частности, метастатический рак, прогрессирующие фиброзные заболевания, такие как, например, идиопатический легочный фиброз (IPF), фиброз печени или системный склероз (Wynn и Barron, 2010, Semin. Liver Dis., 30, 245), аллергия и астма, атеросклероз и болезнь Альцгеймера.
В соответствии с другим воплощением настоящее изобретение относится к способам для ориентации макрофагов в направлении иммунного ответа M1-типа (M1 поляризация макрофагов) и в направлении от иммунного ответа M2-типа (M2 поляризация макрофагов) у пациентов, страдающих от рака.
В соответствии с другим воплощением настоящее изобретение относится к способам для ориентации макрофагов в направлении иммунного ответа Ml-типа (M1 поляризация макрофагов) и в направлении от иммунного ответа M2-типа (M2 поляризация макрофагов) у пациентов, страдающих от прогрессирующих фиброзных заболеваний.
В соответствии с другим воплощением настоящее изобретение относится к способам для ориентации макрофагов в направлении иммунного ответа M1-типа (M1 поляризация макрофагов) и в направлении от иммунного ответа M2-типа (M2 поляризация макрофагов) у пациентов, страдающих от аллергии.
В соответствии с другим воплощением настоящее изобретение к способам для ориентации макрофагов в направлении иммунного ответа M1-типа (M1 поляризация макрофагов) и в направлении от иммунного ответа M2-типа (M2 поляризация макрофагов) у пациентов, страдающих от астмы.
Как используется в данной заявке, термин "рак" относится к, но не ограничен таковыми видами рака, как аденокарцинома, ацинозноклеточная аденокарцинома, карциномы коры надпочечников, альвеолярноклеточная карцинома, анапластическая карцинома, базалоидная карцинома, базальноклеточная карцинома, бронхиолярная карцинома, бронхогенная карцинома, интернефроидная опухоль почки, эмбриональная карцинома, анометроидная карцинома, фиброламолярная карцинома печеночных клеток, фолликулярные карциномы, гигантоклеточные карциномы, гепатоклеточная карцинома, интраэпидермальная карцинома, интраэпителиальная карцинома, лептоманигиальная карцинома, медуллярная карцинома, меланокарцинома, менигулярная карцинома, мезометонефрическая карцинома, овсяноклеточная карцинома, чешуйчатоклеточная карцинома, карцинома потовой железы, переходноклеточная карцинома, тубулярная карцинома, амелобластосаркома, ацервулома, ботриоидная саркома, саркома эндометриальной стромы, диффузная эндотелиома костей Юинга, веретеноклеточная саркома, гигантоклеточная саркома, гранулоцитарная саркома, иммунобластная саркома, юкстакордиальная остеобластическая саркома, саркома Капоши, лейкоцитарная саркома (лейкемия), лимфатическая саркома (лимфосаркома), медуллярная саркома, миелоидная саркома (гранулоцитарная саркома), остеогенная саркома, паростальная саркома, ретикулярноклеточная саркома (гистиоцитарная лимфома), круглоклеточная саркома, веретеноклеточная саркома, синовиальная саркома, телеангиэктатическая аудиогенная саркома, лимфома Беркитта, NPDL, NML, NH и диффузные саркомы. В соответствии с предпочтительным воплощением способ в соответствии с изобретением является направленным на лечение метастатического рака, где метастатический рак представляет собой такой молочной железы, легких, почек, множественную миелому, рак щитовидной железы, предстательной железы, аденокарциному, злокачественные преобразования клеток крови, включая лейкемию и лимфому; рак головы и шеи; желудочно-кишечные виды рака, включая рак пищевода, рак желудка, рак толстой кишки, рак кишечника, колоректальный рак, рак прямой кишки, рак поджелудочной железы, рак печени, рак желчного протока или желчного пузыря; злокачественные перерождения женского полового тракта, включая карциному яичника, различные виды рака эндометрия матки, вагинальный рак и рак шейки матки; рак мочевого пузыря; рак мозга, включая нейробластому; саркому, остеосаркому; и рак кожи, включая злокачественную меланому или рак чешуйчатых клеток.
Настоящее изобретение также относится к способу для совершенствования лечения ракового пациента, который подвергается химиотерапевтическому лечению с помощью противоракового терапевтического агента, который включает совместное лечение указанного пациента наряду со способом, как раскрывается выше.
Настоящее изобретение также относится к способу для совершенствования лечения ракового пациента, который подвергается иммунотерапевтическому лечению с помощью противораковой терапевтической вакцины, который включает совместное лечение указанного пациента наряду со способом, как раскрывается выше. В соответствии с предпочтительным воплощением указанная противораковая терапевтическая вакцина представляет собой терапевтическую вакцину на основе вируса. Более предпочтительно указанная терапевтическая вакцина на основе вируса представляет собой терапевтическую вакцину на основе MVA (модифицированная вакцина Анкара). Даже более предпочтительно, когда указанная терапевтическая вакцина на основе MVA содержит и экспрессирует E6 и E7 онкобелки человеческого папиллома вируса 16 (HPV16) и человеческий интерлейкин-2 (например, TG4001 продукт), или экспрессирует Muc1 антиген и человеческий интерлейкин-2 (например, TG4010 продукт).
Изобретение также включает анализы для мониторинга после лечения assays, после введения пациенту антитела, способного связываться с CSF-1R, для оценки эффективности указанного лечения и/или для оценки клинического результата указанного лечения.
Анализы для мониторинга включают, но без ограничения таковыми, анализы на факторы крови, которые экспрессируются и/или секретируются активированными макрофагами M1- или M2-поляризовэнными макрофагами.
Факторы, которые экспрессируются в макрофагах, находящихся в состоянии M2-типа активации, включают, но без ограничения таковыми, IL-10, IL-6 и MCP-1. Факторы, которые экспрессируются в макрофагах, находящихся в состоянии M1-типа активации, могут также подвергаться анализу, например путем измерения уровней IL-12, в частности, уровней формы P70 IL-12. Направление макрофагов в сторону иммунного ответа M1-типа (направленная M1 поляризация макрофагов) и в сторону от M2-типа (направленная M2 поляризация макрофаго) у пациентов может подвергаться оценке путем измерения соотношения IL12/IL10 после введения пациенту антитела, способного связываться с CSF-1R в соответствии с изобретением.
Эти анализы могут осуществляться при использования образца сыворотки, крови, ткани пациента и т.п.
Изобретение также включает анализы мониторинга после лечения, после введения пациенту антитела, способного связываться с CSF-1R, для мониторинга активации макрофагов и установления и/или поддержания надлежащего режима дозирования.
В этом случае является возможным получить уровни базовой линии путем оценки присутствия макрофагов M1 и/или M2 в тканях, либо непосредственно, либо при использовании факторов, которые экспрессируются и/или секретируются активированными макрофагами, и потом, после введения антитела, способного связываться с CSF-1R, в процессе лечения, осуществляют мониторинг один или более раз на присутствие M1 против M2 макрофагов в тканях (опухолевые или нормальные ткани). Потом можно определять оптимизированную дозу для лечения, которая будет приводить к сдвигу от ответа макрофагов M2-типа к таковому макрофагов M1-типа.
Изобретение обеспечивает материалы и способы для оценки эффективности лечения, которое вовлекает введение антитела, способного связываться с CSF-1R, пациенту при использовании биологических маркеров (биомаркеров), которые были определены как существенно надежная характеристика, которая коррелирует с желаемым иммунным ответом. Биомаркеры являются присутствующими в биологических образцах, полученных от пациента. Способность предсказывать клинический выход лечения после его начала будет позволять лечащим врачам и пациентам идентифицировать неэффективную терапию, принимать обоснованные решения в отношении курса лечения, включая вопрос о том, запрещать или позволять осуществлять применение альтернативной терапии.
Изобретение обеспечивает ex-vivo способ для оценки эффективности лечения, который вовлекает применение антитела, способного связываться с CSF-1R, пациенту.
В соответствии с изобретением термин "оценка" будет пониматься как "мониторинг, модификация или коррекция" лечения, которое вовлекает введение антитела, способного связываться с CSF-1R, пациенту.
В некоторых аспектах способ включает оценку эффективности антитела, способного связываться с CSF-1R, основываясь на уровнях интеферона γ у пациента после иммунотерапевтического лечения.
Анализы для мониторинга включают, но без ограничения таковыми, анализы на факторы крови, которые экспрессируются и/или секретируются активированными макрофагами M1 и/или M2 типа.
Факторы, которые экспрессируются в макрофагах состояния активации M2-типа, включают, но без ограничения таковыми IL-6, MMP9 и MCP-1. Факторы, которые экспрессируются в макрофагах состояния активации M2-типа, могут также подвергаться оценке, например, путем измерения уровней IL-12, в частности, уровней P70 формы IL-12 или соотношений IL-12/IL-10.
В некоторых аспектах способ включает измерение уровней интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1 у пациента после введения пациенту антитела, способного связываться с CSF-1R; и оценку эффективности лечения на основе уровней интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1.
В некоторых аспектах способ включает измерение уровней интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1 у пациента, по крайней мере, один раз через несколько недель после введения пациенту антитела, способного связываться с CSF-1R; и оценку эффективности иммунотерапевтического лечения на основе уровней интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1.
В некоторых аспектах способ может дополнительно включать измерение уровней интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1 у пациента перед введением антитела, способного связываться с CSF-1R. В соответствии с предпочтительным воплощением значения уровней интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1 у пациента, измеряемые перед указанным введением антитела, способного связываться с CSF-1R, представляют собой "пороговые значения" в соответствии с настоящим изобретением.
Время между введением антитела, способного связываться с CSF-1R, и измерениями интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1 может составлять от 1 дня до приблизительно 48 недель или более (например, от приблизительно 1 дня до приблизительно 1 недели, от приблизительно 1 недели до приблизительно 2 недель, от приблизительно 2 недель до приблизительно 4 недель, от приблизительно 4 недель до приблизительно 8 недель, от приблизительно 8 недель до приблизительно 12 недель, от приблизительно 12 недель до приблизительно 16 недель, от приблизительно 16 недель до приблизительно 24 недель, от приблизительно 24 недель до приблизительно 48 недель, или более). В предпочтительном воплощении в соответствии с изобретением временной интервал составляет приблизительно 5 недель. Подобно этому, могут осуществляться дополнительные измерения (то есть, третье, четвертое, пятое и т.д. измерения) с подобными временными интервалами после второго измерения.
В близких аспектах способ включает определение уровней интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1 у пациента после введения пациенту антитела, способного связываться с CSF-1R; сравнение указанных уровней с пороговым значением; и оценку эффективности иммунотерапевтического лечения на основе уровней интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1 по сравнению с "пороговым значением".
В соответствии со специальным воплощением изобретение относится к способу для оценки эффективности лечения, который вовлекает введение антитела, способного связываться с CSF-1R, пациенту, который включает:
(i) введение одной или более доз указанного антитела, способного связываться с CSF-1R, указанному субъекту;
(ii) измерение уровня интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1 в организме указанного субъекта, по крайней мере, после одного указанного введения.
В соответствии с альтернативным воплощением в соответствии с изобретением способ по изобретению дополнительно включает начальный этап, который состоит из измерения уровней интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1 в организме пациента перед введением антитела, способного связываться с CSF-1R.
В соответствии с настоящим изобретением уровни интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1 измеряются в биологическом образце, полученном от пациента. Биологические образцы включают, но без ограничения таковыми, кровь, сыворотку, ткань и другие жидкие образцы биологического происхождения, образцы твердых тканей, такие как образцы биопсии. В предпочтительном воплощении биологический образец представляет собой кровь, плазму или сыворотку крови, в случае которых получение образцов от пациента является относительно простой и неинвазивной процедурой. Способы получения крови или сыворотки являются хорошо известными в области техники и не являются частью изобретения.
В дополнение, являются известными многочисленные способы для определения и количественной оценки полипептидов, включая актуальные биомаркеры. Такие способы включают, но без ограничения таковыми, способы на основе антитела, в частности, способы на основе моноклонального антитела. Частные способы определения и количественной оценки биомаркеров не являются важными для изобретения. Например, материалы и способы в соответствии с настоящим изобретением могут использоваться с методикой Luminex (Luminex Corporation, Austin, Тех.) или твердофазными иммуноферментными анализами (ELISA, многочисленные наборы ELISA являются коммерчески доступными, например, от CliniScience, Diaclone, Biosource).
В соответствии с одним воплощением в соответствии с изобретением уровни интерлейкина-6, интерлейкина-12, MMP9 и/или MCP-1 определяются при использовании антител.
В соответствии с одним специфическим воплощением в соответствии с изобретением указанное(ые) антитело(антитела) является(являются) специфическим(и) для интерлейкина-6, интерлейкина-12, MMP9 или MCP-1.
В соответствии с одним специфическим воплощением в соответствии с изобретением указанные антитела являются моноклональными антителами.
В соответствии с одним специфическим воплощением в соответствии с изобретением указанные антитела являются меченными, например, с помощью флуоресценции, радиоактивной метки, фермента, биотина или любого другого из способов, предназначенных для обеспечения клеток, меченных с помощью указанных антител, которые способны к определению. Эти методики широко используются и являются известными в области техники.
Иммунотерапевтическое лечение в соответствии с изобретением будет рассматриваться в качестве эффективного, если уровни интерлейкина-6, MMP9 и/или MCP-1, измеряемые у пациента после введения антитела, способного связываться с CSF-1R, являются ниже уровней интерлейкина-6 и/или MCP-1, соответственно, которые измеряются у пациента перед указанным введением (то есть, порогового значения).
Альтернативно, иммунотерапевтическое лечение в соответствии с изобретением будет рассматриваться как эффективное, когда уровни интерлейкина-12, измеренные у пациента после введения антитела, способного связываться с CSF-1R, являются выше уровней интерлейкина-12, измеренных у пациента перед указанным введением (то есть, порогового значения).
Изобретение также включает анализы мониторинга после лечения, после введения пациенту антитела, способного связываться с CSF-1R, для мониторинга активации макрофагов и установления и/или поддержания надлежащего режима дозирования.
В этом случае является возможным получить уровни базовой линии путем оценки присутствия макрофагов M1 и/или M2 в системе циркуляции, либо непосредственно, либо при использовании факторов, которые экспрессируются и/или секретируются активированными макрофагами, и потом, после введения антитела, способного связываться с CSF-1R, в процессе лечения, осуществляют мониторинг один или более раз на присутствие M1 против M2 макрофагов в системе циркуляции.
Потом можно определять оптимизированную дозу для лечения, которая будет приводить к сдвигу от ответа макрофагов M2-типа к таковому макрофагов M1-типа.
Способы в соответствии с изобретением являются полезными в лечении заболевания, вовлекающего воспаление, и ассоциированного с CSF-1R.
Описание фигур
Фигура 1: H27K15 не является цитотоксическим для дифференциации макрофагов, в то время как другие анти-CD115 mAbs индуцируют значительную смерть клеток.
Клетки подсчитывали после культивирования в течение 6 дней культуры моноцитов с GM-CSF и CSF-1, в присутствии или при отсутствии анти-CD115 mAbs или F(ab')2 или с GW2580. Контроли включали культуры, обработанные с помощью ритуксимаба или F(ab')2 ритуксимаба, или без какого-либо добавленного соединения. Являются представленными средние значения количества клеток в 5 полях микроскопа ± стандартное отклонение, полученные в каждой культуре.
Фигура 2: Ингибирование экспрессии CD64 (FcγRI) в человеческих макрофагах, дифференцированных в присутствии моноклонального антитела H27K15
Макрофаги, полученные после культивирования в течение 6 дней культуры моноцитов от 3 различных доноров крови с GM-CSF и CSF-1, подвергали анализу с помощью IC/FC для поверхностной экспрессии CD64. Верхние панели: CD64 окрашивание в культурах от донора 1, обработка при использовании моноклонального антитела H27K15 (слева, жирная линия) или при использовании GW2580 (справа, жирная линия), или их соответствующие негативные контроли ритуксимаба (слева, тонкая линия) или при отсутствии обработки (справа, тонкая линия). Нижняя панель: средние значения интенсивностей флуоресценции в культурах макрофагов, обработанных с помощью исследуемых соединений при концентрации 10, 1 или 0,1 мкг/мл*, сравнивали с такими для соответствующих негативных контролей: H27K15 против ритуксимаба, F(ab')2, имеющий происхождение от Н27К15, против F(ab')2, имеющего происхождение от ритуксимаба, mAbs 2-4А5 или 9-4D2 против крысиного IgG1, GW2580 против варианта при отсутствии лечения. Процент снижения экспрессии CD64 подсчитывали как: 100 - [100 × средняя интенсивность флуоресценции с исследуемым соединением / средняя интенсивность флуоресценции с контролем]. Являются представленными средние значения снижения экспрессии CD64 от трех доноров крови в процентном выражении. *за исключением F(ab')2, которые использовали при эквимолярных концентрациях: 6,6; 0,6; и 0,06 мкг/мл.
Фигура 3: индукция CD86bright SSClow популяции макрофагов с помощью H27K15
Верхние панели: точечные диаграммы, демонстрирующие CD86 окрашивание (ось X) и боковое светорассеяние (SSC, ось Y) макрофагов от трех доноров крови, дифференцированных в течение 6 дней в присутствии H27K15 (слева), или негативный контроль ритуксимаб (справа). Шлюз устанавливали на клеточную популяцию CD86bright SSClow, индуцированную с помощью H27K15. Нижняя панель: процент CD86bright SSClow клеток при использовании исследуемых соединений при концентрации 10, 1 или 0,1 мкг/мл* сравнивали с таковым в соответствующих негативных контролях: H27K15 против ритуксимаба, F(ab')2, который имеет происхождение от H27K15 против F(ab')2, который имеет происхождение от ритуксимаба, GW2580 против такового без обработки. Проценты повышения клеточной популяции CD86bright SSClow подсчитывали как: 100 × процент CD86bright SSClow клеток при использовании исследуемого соединения / процент CD86bright SSClow клеток в контроле. Являются представленными средние значения процентов повышения в отношении клеточной популяции CD86bright SSClow от трех доноров крови. *за исключением для F(ab')2: 6,6; 0,6; и 0,06 мкг/мл.
Фигура 4: H27K15 индуцирует секрецию IL-12p70 и повышает соотношения IL-12/IL-10 макрофагов.
IL-12p70 и IL-10 подвергали титрованию в культуре супернатантов, полученной из шестидневных макрофагов, дифференцированных в присутствии mAb H27K15 (1 мкг/мл), GW2580 (1 мкМ), или их соответствующего негативного контроля ритуксимаба или при отсутствии обработки. Левая панель: уровни IL-12p70 и IL-10 (пг/мл) в культурах макрофагов, полученных от трех доноров крови. Справа: соотношения IL-12p70 (пг/мл)/IL-10 (пг/мл) подсчитывали для каждого донора и каждого из условий культуры. В образцах, где IL-12p70 не определялся (был ниже границы определения, которая составляет 11 пг/мл), его уровень произвольным образом устанавливали на уровне 1 пг/мл для подсчета соотношений IL-12p70/IL-10.
Фигура 5: H27K15 ингибирует секрецию MCP-1/CCL2 и IL-6 макрофагами.
MCP-1 и IL-6 подвергали титрованию в супернатантах культуры, полученных из шестидневных макрофагов, дифференцированных в присутствии mAb H27K15 (1 мкг/мл), GW2580 (1 мкМ) при использовании их соответствующих негативных контролей ритуксимаба или при отсутствии обработки. Проценты снижения продукции MCP-1 (верхняя панель) или IL-6 (нижняя панель) подсчитывали для трех доноров крови как: 100 - [100 × концентрация цитокина при использовании исследуемого соединения (пг/мл) / концентрация цитокина при использовании контроля (пг/мл)].
Фигура 6. Моноциты, изолированные от трех различных доноров крови, дифференцировали в присутствии GM-CSF и CSF-1, при наличии или при отсутствии mAb H27K15, ритуксимаба или GW2580. MAb H27K15 или ритуксимаб (0,1, 1 или 10 мкг/мл) или эквимолярные концентрации F(ab)'2, полученные из обоих mAbs, прибавляли к культурам. MMP-9 титровали с помощью ELISA (R&D Systems) в шестидневных супернатантах культуры.
Фигура 7. Клетки, полученные из шестидневной культуры, выращенной с GM-CSF и CSF-1, собирали и инкубировали в течение 20 минут при 4°C при использовании PBS, содержащей Fc фрагменты человеческого IgG для насыщения Fc рецепторов. Конъюгированные с флуорохромом mAbs (анти-CD14-PerCP-Cy5.5, анти-CD163-PE, анти-CD206-АРС, анти-CD1a-FITC, BD Biosciences) потом инкубировали с каждым из образцов в течение 20 минут при 4°C. FCM анализ проводили при использовании FACS LSR-II (BD biosciences) с применением программного обеспечения DIVA. Являются представленными данные, полученные от трех различных доноров крови.
Фигура 8. Моноциты от двух различных доноров крови культивировали с GM-CSF и CSF-1 в присутствии или при отсутствии анти-CD115 mAb H27K5 или контрольного IgG1 ритуксимаба при концентрации 1 мкг/мл. Соотношения между макрофагами M1- (CD14+CD163-) и M2- (CD14+CD163+) типа среди популяции макрофагов определяли через 6 дней после клеточной дифференциации.
Примеры
Следующие коммерческие моноклональные антитела использовали в исследовании: анти-человеческое CD115 mAb 2-4А5-4 (крысиный IgG1.K, Santa Cruz), 9-4D2 (крысиный IgG1, Biolegend) и изотипический контроль - крысиный IgG1 (R&D Systems). mAb 1.2 SM представляет собой анти-CD115 mAb последовательности 1.2 SM, опубликованной в патентной заявке WO 2009/026303. Ритуксимаб получали от Roche. F(ab')2 получали от Transgene путем переваривания с помощью пепсина моноклонального антитела, после чего проводили очистку с помощью гель-фильтрации.
Анализ дифференциации человеческих макрофагов: пропись Лейкотромбоцитарный слой обеспечивался Французским банком крови (EFS, Strasbourg). Мононуклеарные клетки периферической крови (PBMC) получали путем центрифугирования на градиенте фикола. Моноциты очищали с помощью иммуномагнитной сортировки клеток при использовании шариков, покрытых CD14-антителом (Miltenyii). Обогащенные суспензии имели степень чистоты более 95%. Моноциты дифференцировали в течение 6 дней в планшетах на 96 ячеек (3×105 клеток/ячейка) в среде RPMI-Glutamax™, обогащенной 10% инактивированной прогреванием фетальной телячьей сыворотки и 1% триантибиотической смеси (пенициллин, стрептомицин, неомицин). Прибавляли GM-CSF (10 нг/мл) к среде клеточной культуры от дня 0 до дня 3. H27K15, другие антитела или внутренний контроль GW2580 (LC Labs) прибавляли в день 0. В день 3 после изоляции моноциты промывали с помощью PBS и также культивировали в среде с добавлением CSF-1 (10 нг/мл) и GM-CSF (2 нг/мл), в присутствии или при отсутствии антител или GW2580. На 6 день супернатанты собирали и хранили при -20°C. Клетки отделяли от пластика и пулы в трехкратной повторности подвергали анализу IC/FC (иммуноцитохимия/проточная цитометрия) для определения размеров клеток и экспрессии FcγR и CD86. Цитокины и хемокины количественно оценивали в культуре супернатантов с помощью мультиплексного метода (Bioplex, Bio-Rad) или ELISA.
Для IC/FC анализа культур макрофагов пулы в трехкратной повторности центрифугировали в течение 10 минут при 1500 об/мин и инкубировали в течение 20 минут при 4°C с применением фосфатно-солевого буфера, содержащего 10% человеческой AB сыворотки для насыщения Fc рецепторов. Конъюгированные с флуорохромом mAbs анти-CD64-APC и анти-CD86-AI700, анти-CD64, -CD86, -CD163 и/или -CD14 (BD Biosciences) потом инкубировали с каждым из образцов в течение 20 минут при 4°C. Клетки промывали с помощью PBS (5 мин, 2000 об/мин, 4°C) и фиксировали Cell-Fix (BD Biosciences, France). Анализ на основе проточной цитометрии осуществляли при использовании FACS LSR-II (BD biosciences) с программным обеспечением DIVA для выделения и Flow Jo программного обеспечения для анализа.
Результаты
Анти-CD115 mAb H27K15 не является цитотоксическим для макрофагов, но подвергает поляризации их дифференциацию по направлению к M1 типу.
Для изучения, может ли mAb H27K15 влиять на дифференциацию макрофагов, очищенные CD14+ моноциты культивировали в течение 7 дней в присутствии GM-CSF и CSF-1, известных для индукции, соответственно, макрофагов M1- и M2-типа (Akagawa K.S., 2002; Verreck F.A. и др., 2004). Три различные дозы mab H27K15 или изотипического контроля ритуксимаба (0,1; 1 или 10 мкг/мл) прибавляли к культуральной среде в начале культивирования и повторно через 3 дня. F(ab')2, полученные из H27K15 или из ритуксимаба, подвергали анализу параллельно при эквивалентных молярных концентрациях. F(ab')2, полученный из mAb 1.2 SM (WO 2009/026303), подвергали анализу по сравнению с F(ab')2, полученным из H27K15 или ритуксимаба. Известное блокирующее моноклональное антитело к человеческим CD115, 2-4A5, или неблокирующее mAb 9-4D2 (Sherr C.J. и др., 1989) анализировали и сравнивали с изотипическим контролем крысиного IgG1. В качестве другого контроля небольшую молекулу ингибитора CD115 тирозинкиназы GW2580 прибавляли к некоторым культурам при концентрации 1 мкМ, концентрации, которая ранее была продемонстрирована для ингибирования зависимой от CSF-1 пролиферации человеческих моноцитов и дифференциации мышиных макрофагов in vitro (Conway J.G. и др., 2005; Paniagua R.T. и др., 2010).
Микроскопическое исследование шестидневных культур не продемонстрировало очевидных отличий между ячейками, обработанными с помощью H27K15, ритуксимаба, mAb 9-4D2, IgG1, H27K15 F(ab')2 или F(ab')2 ритуксимаба, по сравнению с необработанными клетками, независимо от донора крови. Для ячеек, обработанных с помощью mAb SM1.2 F(ab')2, наблюдали полную цитотоксичность для всех доноров и трех оцениваемых доз (0,066, 0,66 и 6,6 мкг/мл). Для ячеек, обработанных с помощью mAb 2-4A5, наблюдали полную цитотоксичность для всех доноров при использовании двух самых высоких оцениваемых доз (1 и 10 мкг/мл). Для самой низкой дозы (0,1 мкг/мл) цитотоксичность была только частичной. В общем случае, эти результаты не выявили какой-либо токсичности какого-либо антитела за исключением mAb SM1.2 F(ab')2 и mAb 2-4A5. Для клеток с контрольным GW2580 при концентрации 1 мкМ, в зависимости от поля микроскопа относительную цитотоксичность визуализировали в виде дебриса, а меньшую плотность клеток наблюдали у всех доноров крови. Жизнеспособность клеток анализировали на 6 день путем подсчета 5 полей микроскопа в каждой ячейке планшета (одно в центре ячейки и четыре поля в промежутке между центром и боковой частью ячейки). На основе указанных выше наблюдений осуществляли также подсчет для ячеек, обработанных с помощью соединений, которые демонстрируют частичную или полную цитотоксичность (mAb SM1.2 F(ab')2, mAb 2-4A5 и GW2580). Фигура 1 показывает средние значения 5 полей, подсчитанные для индивидуальной ячейки ± стандартное отклонение. Некоторые антитела демонстрируют частичную или полную цитотоксичность. Таким образом, F(ab')2, который имеет происхождение от mAb SM1.2, индуцировал значительную смерть клеток при всех концентрациях, a mAb 2-4А5 также значительно снижало количество макрофагов по сравнению с их соответствующими контролями. В присутствии GW2580 приблизительно 70% количества макрофагов сохранялось в день 6 по сравнению с необработанными культурами.
Шестидневные культуры подвергали анализу с помощью IC/FC на поверхностную экспрессию активирующего FcγR CD64 (FcγRI) и активацию маркера CD86. Как показано на Фигуре 2, поверхностная экспрессия CD64 была значительно снижена при обработке с помощью H27K15 или с помощью GW2580. H27K15 почти полностью ингибировало экспрессию CD64 при всех исследуемых дозах. Крысиное анти-человеческое CD115 mAb 2-4A5 также снижало поверхностную экспрессию CD64, но зависимым от дозы образом. Неблокирующее CD115 mAb 9-4D2 не модифицировало уровень экспрессии CD64. Интересно отметить, что F(ab')2, который имеет происхождение от H27K15, также оказывал понижающую регуляцию на экспрессию CD64, но менее эффективно, чем полное mAb и только тогда, когда испытывали концентрации 1 или 10 мкг/мл, что дает возможность предположить, что эффект H27K15 был частично зависимым от Fc.
При анализе экспрессии маркера активация/ко-стимуляторной молекулы CD86 в шестидневных макрофагах мы обнаружили, что субпопуляция клеток, которая характеризуется CD86bright SSClow фенотипом, возникала в культурах, обработанных либо с помощью mAb H27K15, либо с помощью GW2580 (Фигура 3). Индукцию этой популяции клеток округлой формы, экспрессирующих высокие уровни CD86, не наблюдали при использовании F(ab')2, имеющих происхождение от H27K15, что дает возможность предположить роль Fc участка для H27K15 в этом процессе. Установка дискриминационного окна для этой популяции продемонстрировало, что CD86bright SSClow клетки в основном представляли собой от CD64low до CD64-негативных (данные не представлены).
IL-12p70 и IL-10 титровали в супернатантах шестидневной культуры. Исследованные макрофаги от трех доноров не продуцировали какого-либо способного к определению IL-12p70 после культивирования с человеческим IgG1 ритуксимабом или при отсутствии реагента. Культура в присутствии mAb H27K15 индуцировала секрецию IL-12p70 макрофагами у 2 из трех доноров крови. В противовес этому, IL-12p70 не определялся после обработки с помощью GW2580 (Фигура 4). IL-10, который продуцируется макрофагами в стадии покоя, полученный от всех доноров, подвергался повышающей регуляции с помощью H27K15 в макрофагах от донора 1, но не у донора 2, и очень слабо повышался у донора 3. Как результат этого, соотношения IL-12p70/IL-10 повышалось у трех исследуемых доноров крови (Фигура 4, правая панель). Малая молекула GW2580 также повышала соотношения IL-12p70/IL-10, но в основном благодаря ингибированию продукции IL-10.
Эти результаты показывают, что нацеливание CD115 с помощью mAb H27K15 на дифференцирующие макрофаги не только значительно подавляет экспрессию CD64/FcγRI, но также индуцирует популяцию SSClow клеток, экспрессирующих высокие уровни CD86 маркера активации. Кроме того, H27K15 может индуцировать продукцию IL-12p70 и оказывать стимулирующее воздействие на соотношения IL-12p70/IL-10 у всех доноров, что является показательным для поляризации макрофагов в направлении M1-типа.
Примечательным является то, что продукция хемокина MCP-1/CCL2 была обнаружена как такая, которая почти полностью супрессируется тогда, когда макрофаги были дифференцированы в присутствии mAb H27K15 или GW2580 {Фигура 5, верхняя панель). Ингибирование секреции MCP-1 с помощью H27K15 было эффективным у трех исследованных доноров и колебалось в интервале от 74% до 99%. Малая молекула GW2580 была так же эффективна, как и H27K15, для супрессии продукции MCP-1. Уровни IL-6 в супернатантах культуре шестидневных макрофагов также снижались при использовании либо H27K15, либо GW2580 у всех доноров (Фигура 5, нижняя панель). Ингибирование продукции IL-6 было не таким сильным при использовании H27K15 (от 27% до 70%), чем при использовании GW2580 (от 75 до 96%). Опосредованное H27K15 ингибирование продукции MCP-1 и IL-6 макрофагами (Roca H. и др., 2009), двух растворимых факторов, которые являются вовлеченными в M2 поляризацию макрофагов, представляет собой другую часть подтверждения, которое свидетельствует о том, что анти-CD115 mAb реполяризирует макрофаги в направлении M1. Анти-CD115 mAb H27K15 ингибирует продукцию MMP-9 моноцитами, культивируемыми с GM-CSF и CSF-1
Ассоциированные с опухолью макрофаги являются известными как такие, которые продуцируют MMP-9 (матриксная металлопротеиназа 9), которая стимулирует как метастатические опухолевые клетки путем разрушения внеклеточного матрикса, так неоангиогенез путем индукции высвобождения VEGF в микросреду опухоли. MMP-9, который продуцируется макрофагами, представляет собой основной регулятор ангиогенного переключения в опухолях.
CD14+ моноциты от 3 различных доноров оставляли для дифференциации в присутствии как GM-CSF, так и CSF-1, которые являются известными как такие, которые индуцируют дифференциацию макрофагов в направлении, соответственно M1- и M2-типов. MAb H27K15 или ритуксимаб (используется в качестве негативного контроля) прибавляли к культурам при концентрации 0,1, 1 или 10 мкг/мл. Эквимолярные концентрации F(ab)'2, который имеет происхождение от обоих моноклональных антител, подвергали анализу параллельно. Ингибитор тирозинкиназы GW2580, который ранее был продемонстрирован как такой, который ингибирует зависимую от CSF-1 пролиферацию человеческих моноцитов и дифференциация мышиных макрофагов in vitro, подвергали исследованию в том же анализе. Через 6 дней культивирования концентрации MMP-9 измеряли в супернатантах с помощью ELISA (Фигура 6). У 2 из трех подвергнутых исследованию доноров существовало зависимое от дозы снижение продукции MMP-9 тогда, когда культуры обрабатывали с помощью mAb Н27К15 или с помощью GW2580. При использовании F(ab)'2, который имеет происхождение от Н27К15, существовал ингибиторный эффект у тех же 2 доноров. Таким образом, mAb H27K15 является способным к снижению секреции MMP-9 путем дифференциации M2 макрофагов.
Эти наблюдения культур макрофагов дают возможность предположить, что H27K15, который вводится раковым пациентам, может снижать концентрацию MMP-9 в опухолевой микросреде. MAb H27K15 ингибирует дифференциацию CD163-позитивных макрофагов M2-типа.
Сквэнджер-рецептор гемоглобина(CD163) был идентифицирован в качестве маркера M2-поляризованных макрофагов, которые экспрессируются ТАМ, в частности, при раке молочной железы. Поверхностную экспрессию CD163 подвергали анализу с помощью проточной цитометрии в шестидневных макрофагах, которые имеют происхождение от человеческих моноцитов, которые культивировали с GM-CSF и CSF-1. Фигура 7 показывает процентное содержание CD163-позитивных клеток в дифференцированных культурах. Культуры с mAb H27K15 ингибировали дифференциацию популяции CD163+ макрофагов у всех подвергнутых исследованию 3 доноров. В присутствии 1 мкг/мл H27K15 процентное содержание CD163-позитивных клеток снижалось в 2,5-4 раз по сравнению с контрольными культурами, обработанными ритуксимабом. GW2580 оказывал такой же эффект только у двух из трех доноров. F(ab)'2, который имеет происхождение от H27K15, оказывал слабый эффект или не выявлял влияния на экспрессию CD163, что свидетельствует о том, что Fc участок анти-CD115 mAb был вовлечен в этот способ действия. Как было продемонстрировано этими изменениями в экспрессии поверхностного CD163 и в соответствии с предыдущими результатами, нацеливание CD115 с помощью mAb H27K15 ингибирует дифференциацию макрофагов M2-типа.
MAb H27K15 сдвигает дифференциацию моноцитов от M2 к M1 макрофагам.
Соотношения между M1 и M2 макрофагами подвергали анализу в клетках, которые имеют происхождение от моноцитов, которые культивировали с GM-CSF и CSF-1, при наличии или при отсутствии mAb H27K15 или ритуксимаба. После 6 дней культивирования клеток, полученных от 2 различных доноров крови, M1 (CD14+CD163-) против M2 (CD14+CD163+) макрофаги количественно определяли с помощью проточной цитометрии. Фигура 8 показывает соотношения M1/M2 макрофагов, подсчитанные в CD14+ популяции макрофагов для каждого из условий культуры. MAb H27K15 при концентрации 1 мкг/мл повышал соотношения M1/M2 у макрофагов, полученных от двух доноров, которых подвергали исследованию, по сравнению с контрольным IgG1 ритуксимабом при той же концентрации или по сравнению с необработанными культурами.
Источники информации
Akagawa K.S. "Functional heterogeneity of colony-stimulating factor-induced human monocyte-derived macrophages." International journal of hematology. (2002) 76 (1): 27-34.
Conway J.G., McDonald B., Parham J., Keith B., Rusnak D.W., Shaw E., Jansen M., Lin P., Payne A., Crosby R.M., Johnson J.H., Frick L., Lin M.H., Depee S., Tadepalli S., Votta B., James I., Fuller K., Chambers T.J., Kull F.C., Chamberlain S.D. and Hutchins J.T. "Ингибирование colony-stimulating-factor-1 signaling in vivo with the orally bioavailable cFMS kinase inhibitor GW2580." Proceedings of the National Academy of Sciences of the United States of America. (2005) 102 (44): 16078-16083.
Paniagua R.T., Chang A., Mariano M.M., Stein E.A., Wang Q., Lindstrom T.M., Sharpe O., Roscow C, Ho P.P., Lee D.M. and Robinson W.H. "c-Fms-mediated differentiation and priming of monocyte lineage cells play a central role in autoimmune arthritis." Arthritis research & therapy. (2010) 12 (1): R32.
Roca H., Varsos Z.S., Sud S., Craig M.J., Ying C. and Pienta K.J. "CCL2 and interleukin-6 promote survival of human CD11b+ peripheral blood mononuclear cells and induce M2-type macrophage polarization." The Journal of biological chemistry. (2009) 284 (49): 34342-34354.
Sherr C.J., Ashmun R.A., Downing J.R., Ohtsuka M., Quan S.G., Golde D.W. and Roussel M.F. "Ингибирование colony-stimulating factor-1 activity by monoclonal antibodies to the human CSF-1 receptor." Blood. (1989) 73 (7): 1786-1793.
Verreck F.A., de Boer T., Langenberg D.M., Hoeve M.A., Kramer M., Vaisberg E., Kastelein R., Kolk A., de Waal-Malefyt R. and Ottenhoff T.H. "Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria." Proceedings of the National Academy of Sciences of the United States of America. (2004) 101 (13): 4560-4565.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ПРОТИВ КСФ-1R | 2012 |
|
RU2621859C2 |
| АНТИТЕЛО ПРОТИВ CSF-1R | 2009 |
|
RU2547586C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2821703C2 |
| АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО CSF-1R И ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2658603C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ ПРЕИМУЩЕСТВЕННО С ВНЕКЛЕТОЧНЫМ ДОМЕНОМ 4 ЧЕЛОВЕЧЕСКОГО CSF-1R, И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2565541C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К ОНКОСТАТИНУ М И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2600444C2 |
| АНТИТЕЛА ПРОТИВ VSIG4 ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2776638C1 |
| АНТИТЕЛА ПРОТИВ CSF-1R ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2617971C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, КОТОРОЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЕТСЯ С CSF-1R | 2020 |
|
RU2751249C1 |
| АНТИТЕЛА ПРОТИВ CSF-1R ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2617966C2 |

























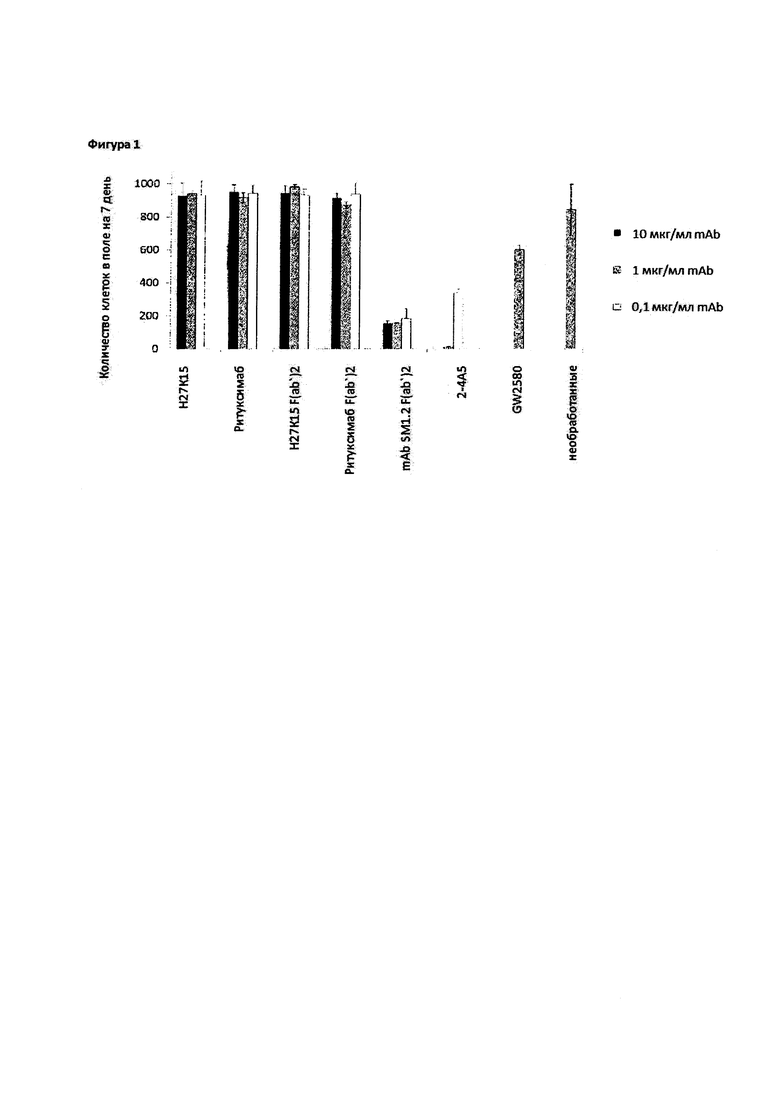
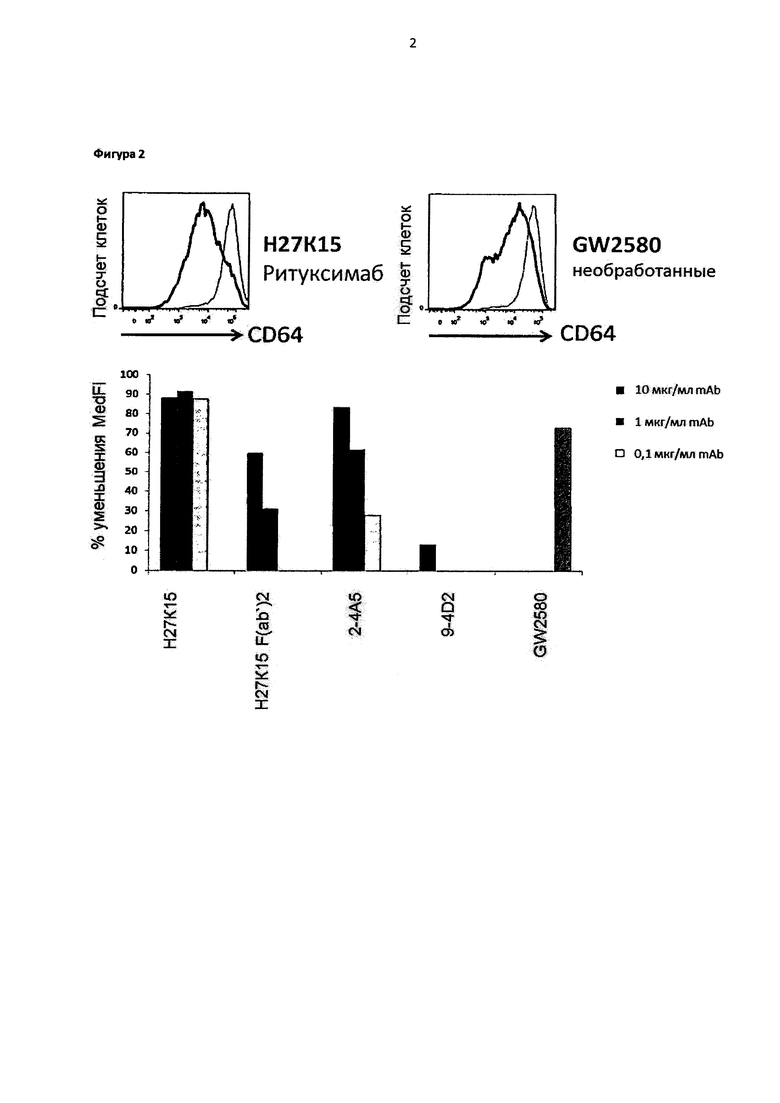
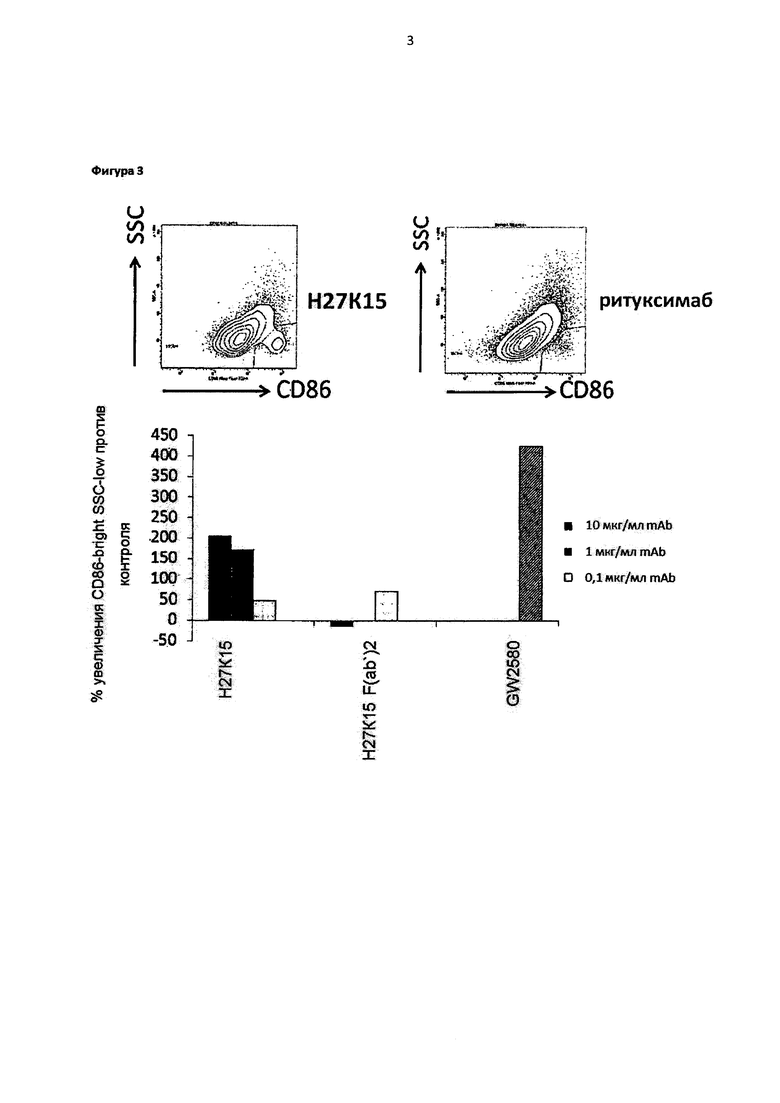
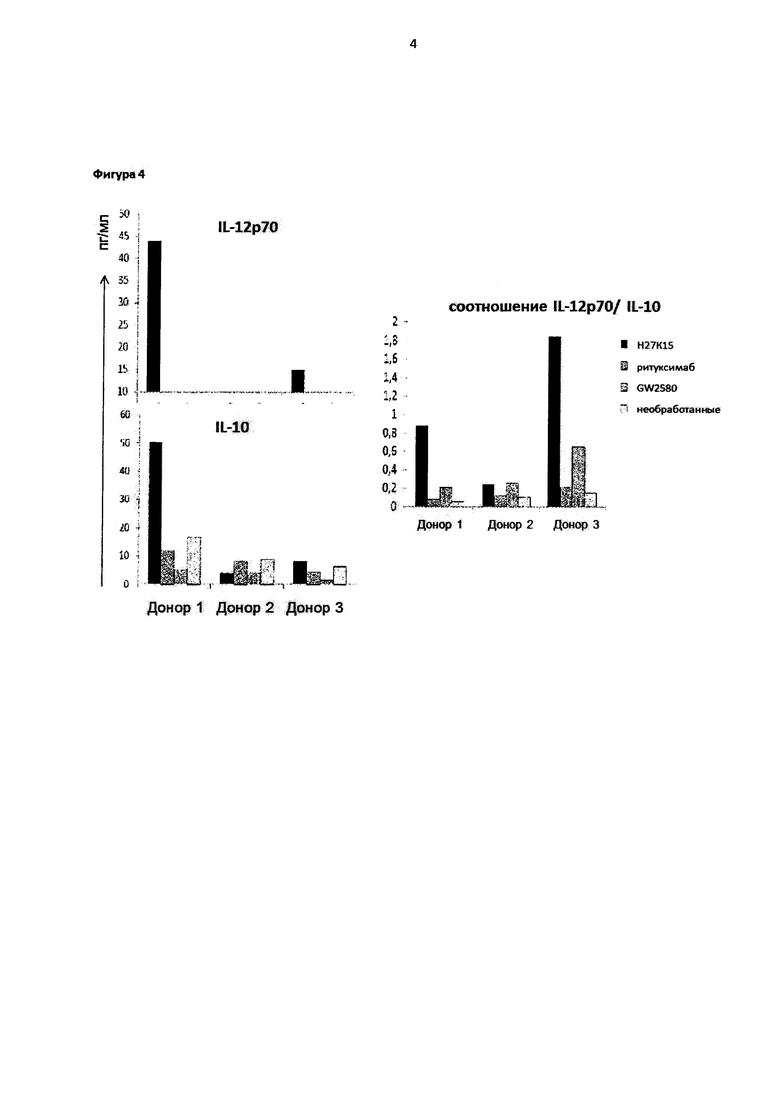
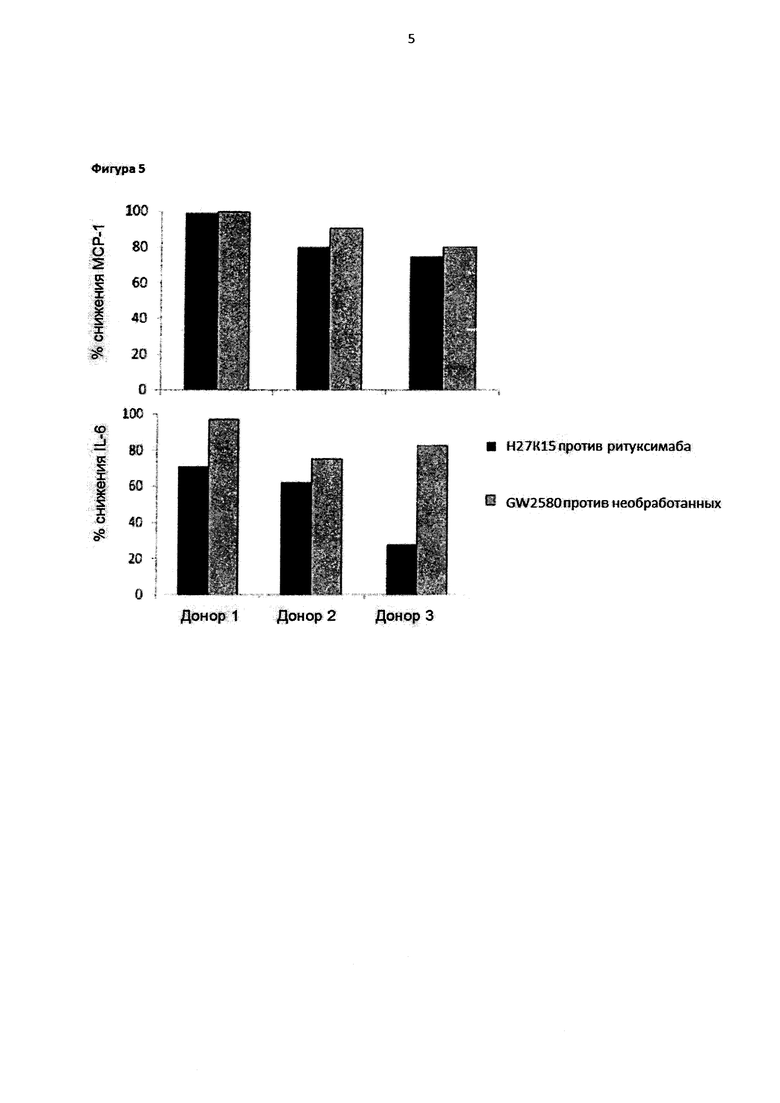
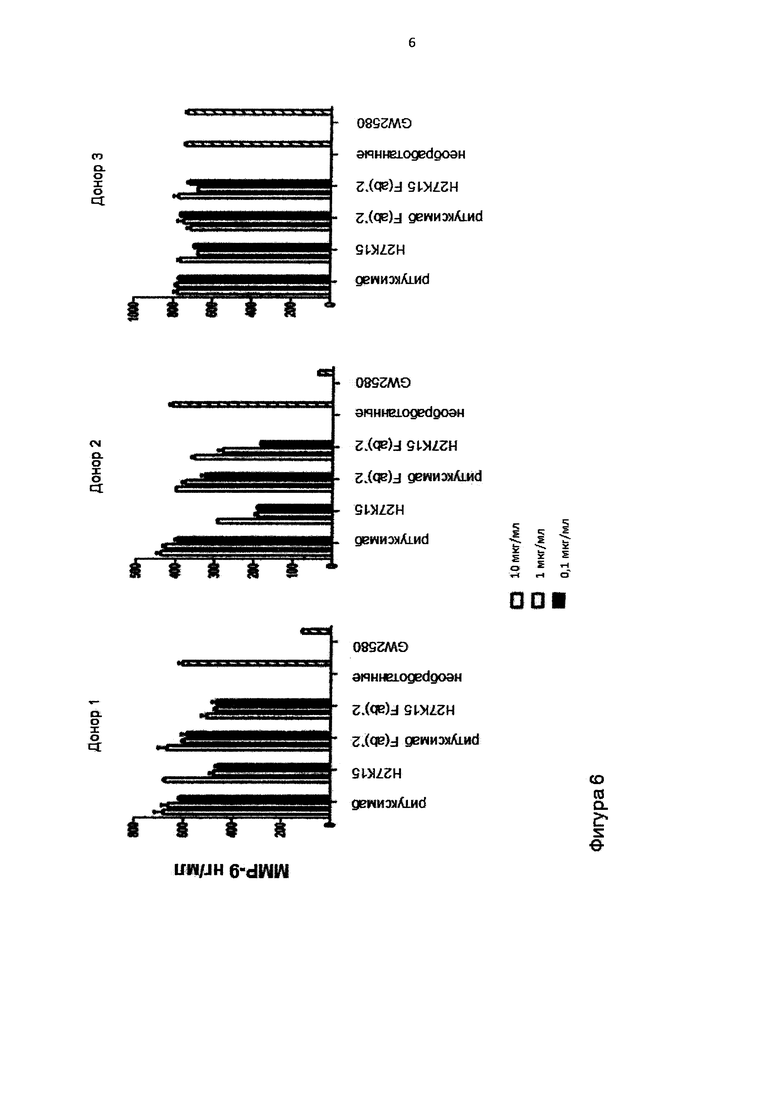

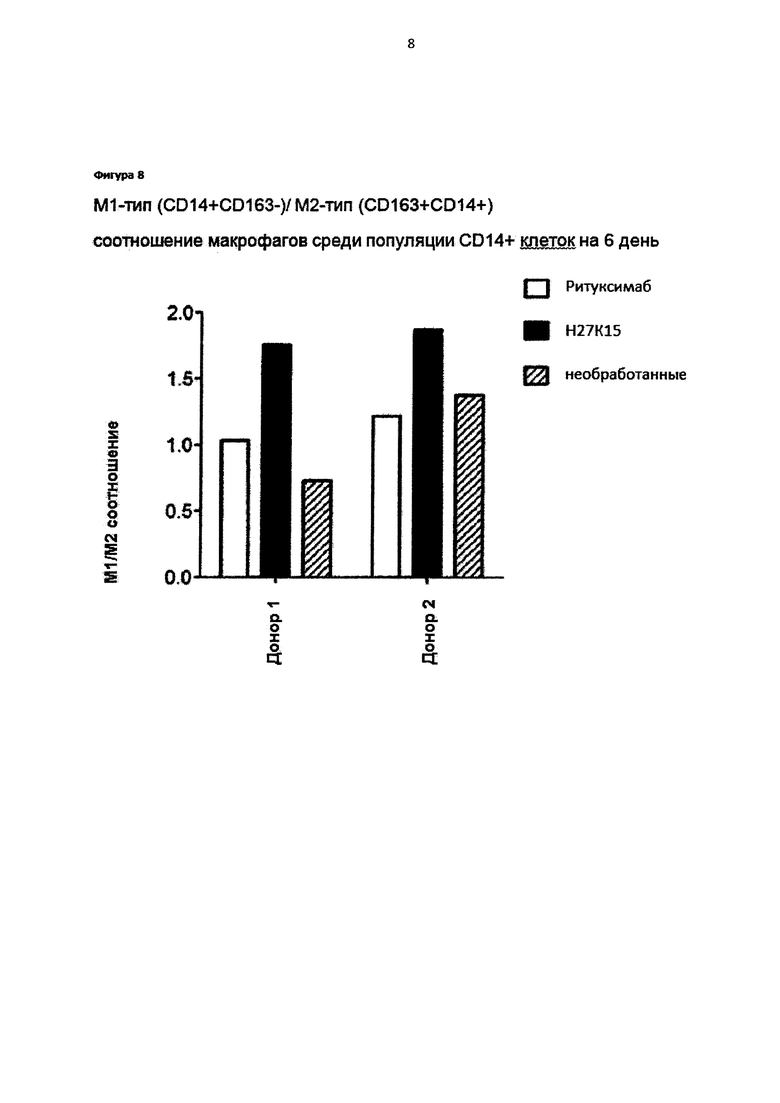
Изобретение касается способа увеличения пула М1 макрофагов у пациента, страдающего от состояний, ассоциированных с нежелательной М2 активацией. Представленный способ включает этап введения указанному пациенту эффективного количества антитела, способного связываться с CSF-1R, где указанное антитело представляет собой антитело, которое связывается по крайней мере с одним эпитопом, расположенным между положениям аминокислот от 20 до 39 ID NO: 23. Изобретение может быть использовано при стимуляции иммунного ответа М1-типа (М1 поляризация макрофагов). 10 з.п. ф-лы, 8 ил.
1. Способ увеличения пула M1 макрофагов у пациента, страдающего от состояний, ассоциированных с нежелательной М2 активацией, где указанный способ включает этап введения указанному пациенту эффективного количества антитела, способного связываться с CSF-1R, где указанное антитело представляет собой антитело, которое связывается, по крайней мере, с одним эпитопом, расположенным между положениями аминокислот от 20 до 39 SEQ ID NO: 23, до аминокислот Asn72, Ser94-Ala95-Ala96, Lys102, Asp131-Pro132-Val133 и Trp159 SEQ ID NO: 23, и указанное антитело представляет собой антитело, которое частично конкурирует с CSF-1 лигандом за связывание с рецептором CSF-1R.
2. Способ по п. 1, где пациент также страдает от состояний, ассоциированных с активностью CSF-1R.
3. Способ по п. 1 или 2, где указанный способ уменьшает пул М2 макрофагов.
4. Способ по п. 1 или 2, где указанный способ ингибирует продукцию МСР-1, IL10 и IL-6 макрофагами.
5. Способ по п. 1 или 2, где указанный способ подавляет экспрессию поверхностных FcγRI(CD64) и FcγRIII (CD16) на макрофагах.
6. Способ по п. 1 или 2, где указанный способ способствует продукции IL-12 макрофагами.
7. Способ по п. 1 или 2, где указанный способ снижает, по крайней мере, одну из следующих функций:
(i) привлечение ТАМ в опухоль;
(ii) по крайней мере, одну из проопухолевых функций макрофагов;
(iii) опухолевый ангиогенез;
(iv) опухолевую инвазию метастазов;
(v) опухолевый рост;
(vi) пролиферацию опухолевых клеток.
8. Способ по п. 1 или 2, где указанные состояния, ассоциированные с нежелательной М2 активацией, являются выбранными из группы, которая состоит из рака, астмы, аллергии и прогрессирующего фиброзного заболевания.
9. Способ по п. 1 или 2, где указанное антитело, способное связываться с человеческим CSF-1R, представляет собой антитело, которое не конкурирует с IL-34 лигандом за связывание с рецептором CSF-1R.
10. Способ по п. 1 или 2, где указанное антитело, способное связываться с человеческим CSF-1R, представляет собой антитело, которое специфически связывается с человеческим CSF-1R, включающее:
(а) первый вариабельный участок, который определяется следующей формулой:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где:
FR1, FR2, FR3 и FR4 каждый представляет собой каркасный участок;
CDR1, CDR2 и CDR3 каждый представляет собой участок, определяющий комплементарность;
где:
CDR1 имеет, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 45 и заканчивая положением 54 SEQ ID NO: 1;
CDR2 имеет, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 66 и заканчивая положением 87 SEQ ID NO: 1; и
CDR3 имеет, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 117 и заканчивая положением 126 SEQ ID NO: 1;
и
(b) второй вариабельный участок, который определяется следующей формулой:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где:
FR1, FR2, FR3 и FR4 каждый представляет собой каркасный участок;
CDR1, CDR2 и CDR3 каждый представляет собой участок, определяющий комплементарность;
где:
CDR1 имеет, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 44 и заканчивая положением 56 SEQ ID NO: 2;
CDR2 имеет, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 66 и заканчивая положением 76 SEQ ID NO: 2; и
CDR3 имеет, по крайней мере, пять смежных аминокислот последовательности, начиная от положения 109 и заканчивая положением 117 SEQ ID NO: 2.
11. Способ по п. 1 или 2, где указанное антитело, способное связываться с CSF-1R, включает (а) тяжелую цепь, которая состоит из SEQ ID NO: 24, и (b) легкую цепь, которая состоит из SEQ ID NO: 28.
| US 2011178278 A1, 21.07.2011 | |||
| LIN E.Y | |||
| et al, Colony-Stimulating Factor 1 Promotes Progression of Mammary Tumors to Malignancy, J Exp Med | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| SIKA A | |||
| et al., Tumour-associated macrophages are a distinct M2 polarised population promoting tumour progression: Potential targets of anti-cancer therapy, Eur J Cancer | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| МОНАСТЫРСКАЯ Е.А | |||
| и др., М1 и М2 фенотипы активированных макрофагов и их роль в иммунном ответе и патологии, Патогенез 2008, т.6, No.4, pp.31- 39. | |||
Авторы
Даты
2017-12-21—Публикация
2012-10-19—Подача