Область техники, к которой относится изобретение
Данное изобретение относится к активирующим антителам к BTN2A1, которые связываются с BTN2A1, вызывают в популяции макрофагов сдвиг в сторону противоопухолевого фенотипа М1 и непосредственно активируют NK-клетки, а также цитотоксичность, направленную против раковых клеток. Альтернативно, указанные антитела способны активировать Vγ9/Vδ2-T-клетки, или же они обладают всеми указанными видами активности. Такие антитела особенно полезны для лечения рака.
Уровень техники
Существуют различные фенотипы макрофагов, начиная с активируемых классическим путем клеток с фенотипом M1 и заканчивая клетками с фенотипом М2, активируемыми иначе. Макрофаги М1 быстро дифференцируются из моноцитов после миграции последних в результате активации агентами бактериального происхождения, например, липополисахаридами (LPS), а также сигнальными агентами, образующимися в связи с инфекцией, например, гамма-интерфероном (IFNγ). Макрофаги М1 обладают высокой провоспалительной, фагоцитирующей и бактерицидной способностью. Они выделяют важные провоспалительные цитокины, например, альфа-фактор некроза опухолей (TNFα) и интерлейкины 1, 6 и 12 (IL-1, IL-6, IL-12), а также реакционноспособные формы кислорода (ROS). В противоположность указанному, макрофаги М2 появляются позже в процессе заживления, когда уже образуется грануляционная ткань; они противодействуют воспалительной реакции, тем самым способствуя началу заживления. Эти противовоспалительные клетки мобилизуют фибробласты и активируют их дифференцировку с образованием миофибробластов, которые выделяют проангиогенные факторы для рекрутинга эндотелиальных клеток-предшественников и образования новых сосудов; этот процесс опосредуется секрецией ключевых противовоспалительных цитокинов IL-4, IL-10 и IL-13, при этом также сокращается образование ROS, оксида азота (NO) и TNFα.
Микроокружение опухоли (TME) существенно влияет на дифференцировку макрофагов, сдвигая ее в сторону фенотипа M2, особенно в случае раковых опухолей, которые вновь образуются после противоракового лечения. Этот сдвиг не только способствует ангиогенезу, но и подавляет иммунную защиту в микроокружении опухоли. Так, давно известно, что в случае большинства солидных раковых опухолей возрастающая инфильтрация макрофагами, ассоциированными с опухолью (TAMs), связана с плохим прогнозом состояния больного, что говорит о потенциальном значении этих клеток как диагностических и прогностических маркеров при раке.
По этим соображениям в качестве перспективной стратегии лечения рака было предложено «перепрограммировать» и избирательно уничтожать макрофаги М2 (Zhu Y et al. Cancer Res 2014).
Кроме того, клетки врожденной иммунной системы, а именно естественные киллеры, или NK-клетки, выполняют ключевые функции в механизмах иммунологического надзора, касающихся рака. NK-клетки способны ликвидировать различные аномальные или испытавшие стресс клетки без предварительной сенсибилизации, причем они уничтожают предпочтительно клетки типа стволовых или злокачественные стволовые клетки. Образовав конъюгат с клеткой-мишенью, NK-клетка выделяет уже имеющиеся в ней цитолитические гранулы, содержащие перфорин, и гранзимы, которые вызывают лизис клетки-мишени.
Был проведен ряд исследований, базирующихся на изложенном выше, в которых с успехом осуществлялся адоптивный перенос N-клеток для воздействия на различные опухоли, в частности при злокачественных поражениях кровеносной системы. Однако при раковых заболеваниях действуют различные механизмы, задерживающие, искажающие или даже останавливающие противоопухолевые иммунологические реакции, из-за чего организм не может контролировать опухолевый рост. Противоопухолевое действие NK-клеток также встречает многочисленные ограничения. В частности, основным препятствием для эффективного действия NK-клеток, особенно NK-клеток, перенесенных в организм при адоптивной терапии рака, остается микроокружением опухоли. Например, клетки иммунной системы, инфильтрирующие опухоль, в том числе дендритные клетки (DCs), макрофаги с супрессорной или толерогенной активностью и регуляторные Т-клетки (Treg-клетки), а также фибробласты, ассоциированные с опухолью, которые внедрены в межклеточный матрикс, могут мешать активации NK-клеток, выделяя иммуносупрессивные цитокины или влияя на экспрессию рецепторных белков. Например, в микроокружении опухоли основным цитокином, подавляющим NK-клетки, является трансформирующий фактор роста бета (TGF-β), секретируемый, в основном, макрофагами с фенотипом М2, который ограничивает количество NK-клеток и препятствует противодействию метастазированию опухоли.
С терапевтической точки зрения было бы исключительно ценно располагать средством стимуляции противоопухолевой активности обоими путями: i) подавляя иммуносупрессивный эффект микроокружения опухоли и ii) напрямую инициируя активацию NK-клеток и -опосредованную ими цитотоксичность.
Бутирофилины - это семейство трансмембранных белков, включающее собственно бутирофилины (BTN), подобные им белки (BTNL), а также белки, участвующие в селекции и поддержании интраэпителиальных Т-клеток (SKINT) (Arnett H.A., Viney J.L., Nat. Rev. Immunol., 2014). У этих белков внеклеточная часть содержит домены, подобные вариабельной и константной областям иммуноглобулинов (домены IgV-L и IgC-L), которые гомологичны соответствующим доменам костимулирующих белков/белковых комплексов типа B7 (Arnett H.A., Viney J.L., 2014); таким образом бутирофилины считаются членами обширного суперсемейства B7 или Ig.
Семейство генов, кодирующих бутирофилины (BTN), у человека включает 13 генов, образующих 8 отдельных групп (Abeler-Dorner et al. Trends Immunol., 2012; Afrache et al. Immunogenetics, 2012). У человека семь генов BTN составляют кластер в той области 6-й хромосомы, где кодируются белки класса I главного комплекса гистосовместимости (MHC I); эти гены подразделяют на три подсемейства, представляющих собой филогенетически связанные группы: BTN1, BTN2 и BTN3. В подсемейство BTN1 входит только один прототипный ген BTN1A1, представленный одной копией, а в подсемействах BTN2 и BTN3 имеется по три гена в каждом - BTN2A1, BTN2A2 и BTN2A3 (последний - псевдоген), BTN3A1, BTN3A2 и BTN3A3 соответственно. Для генов семейства BTN описаны несколько генных полиморфизмов, ассоциированных с различными заболеваниями, включая гипертензию, хроническую почечную недостаточность, миозит с тельцами включения, диабет I и II типа, а также инфекцию вирусом гепатита С (HCV) (Chen et al. Int. J. Clin. Exp. Pathol, 2015; Horibe et al. Am. J. Hypertens., 2011 & 2014; Milman et al. Clin. Respir. 2011; Murakata et al. Biomed.Rep, 2014; Oguri et al. J. Med. Genet., 2013; Pacheco et al. Orphanet J. Rare Dis., 2016). Для BTNL2, BTN2A1, BTN3A2 и BTN3A3 описаны однонуклеотидные полиморфные варианты, а также известна вредоносная вариация числа копий генов BTNL3 и BTNL8 (Aigner et al. BMC Genet., 2013).
Первый из идентифицированных бутирофилинов - BTN1A1 - необходим для образования, секреции и стабилизации жировых капель молока (Ogg et al. Proc. Natl.Acad. Sci., 2004). Предполагается, что гены белков B7 и MHC классов I и II происходят от общего предкового гена и кодируют белки, участвующие в сходных функциях, как, например, активация Т-клеток (Rhodes et al. Genomics, 2001; Harly C et al. Blood 2012). Изоформы белков BTN2A1 и BTN2A2 имеют внеклеточный домен IgV и IgC. трансмембранный домен и специфический внутриклеточный домен B30.2, сходный с BTN3A1 и BTN3A3, но не с BTN3A2. У мышей ген, кодирующий белок BTN2A2, представлен одной копией и ортологичен человеческому гену BTN2A2. С помощью рекомбинантного человеческого белка BTN2A1-Fc было установлено, что определенная гликоформа BTN2A1 связывается с лектином DC-SIGN, присутствующим на поверхности дендритных клеток (DCs). Связывание BTN2A1 с DC-SIGN зависит от профиля гликозилирования, а именно от высокого содержания маннозы в белке при его экспрессии в опухолевых клетках (Malcherek et al. J. Immunol., 2007).
Все больше данных позволяет полагать, что бутирофилины играют различные роли в иммунной системе. Секвенирование РНК из 53 образцов человеческих тканей в рамках проекта по созданию ресурса данных о тканеспецифичной экспрессии генов и эпигеномике (Genotype-Tissue Expression Project; GTEx Consortium, 2013) показало, что транскрипт BTN2A1 имеется во всех нормальных тканях. Сравнение этих данных и информации из базы данных The Cancer Genome Atlas (TCGA) с использованием интерактивной платформы по анализу профилей генной экспрессии (Gene Expression Profiling Interactive Analysis; Tang, Z. et al. Nucleic Acids Res., 2017) свидетельствует об изменениях экспрессии BTN2A1, определяемой по наличию транскрипта, при ряде раковых заболеваний, включая плоскоклеточную карциному шейки матки, эндоцервикальную аденокарциному, мелкоклеточную карциному легкого, карциному яичника, рак поджелудочной железы и карциному эндометрия.
Ранее сообщалось об антителах, распознающих обе изоформы BTN2A (WO2019057933), однако эти антитела подавляли образование IFN-γ и/или TNF-α активированными Vγ9/Vδ2-Т-клетками, и/или цитолитическую функцию активированных Vγ9/Vδ2-T-клеток, и/или пролиферацию активированных Vγ9/Vδ2-T-клеток.
Vγ9/Vδ2-T-клетки являются важными эффекторными элементами иммунной защиты. Они впрямую осуществляют лизис зараженных патогенными агентами или аномальных клеток. Кроме того, Vγ9/Vδ2-T-клетки регулируют иммунный ответ, индуцируя созревание дендритных клеток, а также переключение изотипов и образование иммуноглобулинов. Эта важная часть иммунной системы строго регулируется рецепторными белками клеточной поверхности, хемокинами и цитокинами. Vγ9/Vδ2-T-клетки активируются непептидными фосфорилированными метаболитами пути биосинтеза изопреноидов, называемыми фосфоантигенами (PAg).
Разработка антител, нацеленных на BTN2A1, и активирование клеток иммунной системы, преимущественнго, более одного клеточного компартмента, например, макрофагов, NK-клеток и/или γδT-клеток, в частности Vγ9/Vδ2-T-клеток, может обеспечить существенный вклад в лечение раковых и инфекционных заболеваний.
Раскрытие изобретения
Согласно настоящему изобретению впервые предлагаются антитела, связывающиеся с белком BTN2A (главным образом - с изоформой BTN2A1, например, с человеческим полипептидом BTN2A1), которые обладают по меньшей мере одним из следующих свойств:
i. подавляют дифференцировку моноцитов в макрофаги с фенотипом М2;
ii. вызывают реверсию фенотипа M2 в сторону фенотипа M1 с противоопухолевой активностью;
iii. напрямую запускают активацию NK-клеток;
iv. усиливают цитотоксичность, опосредованную NK-клетками.
В частности, антитело по данному изобретению обладает по меньшей мере одним из свойств i) и ii) и по меньшей мере одним из свойств iii) и iv), говоря более конкретно - антитело по данному изобретению обладает свойствами i) - iv).
Такие антитела в соответствии с изобретением способны
- благоприятно влиять на противоопухолевые свойства микроокружения опухоли, вызывая изменение фенотипа макрофагов и их функциональной активности в сторону провоспалительного фенотипа М1, что приводит к выделению провоспалительных цитокинов, и/или
- напрямую запускать активацию NK-клеток и тем самым усиливать их цитотолитическую активность.
Следовательно, такие антитела в соответствии с настоящим изобретением представляют собой мощный инструмент, который можно использовать в различных подходах при лечении рака.
В определенных воплощениях настоящего изобретения предлагаемые антитела против BTN2A конкурируют за связывание с BTN2A с любым из следующих агентов:
- с референсным мышиным антителом mAb 101G5, включающим (i) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 19, и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 20, или
- с референсным мышиным антителом mAb 107G3, включающим (i) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 1, и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 2.
В некоторых воплощениях настоящего изобретения предлагаемые антитела против BTN2A связываются с эпитопом, содержащим аминокислотные остатки, расположенные:
- в положениях 65, 68, 69, 72, 78; 84, 85, 95, 97, 100 последовательности SEQ ID NO 17 или
- в положениях 212, 213, 218, 220, 224, 229 последовательности SEQ ID NO 17.
В определенных воплощениях настоящего изобретения предлагаемые антитела против BTN2A содержат:
- участок CDR1 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:3; участок CDR2 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:4; участок CDR3 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:5; участок CDR1 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:6; участок CDR2 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:7; и участок CDR3 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:8; или
- участок CDR1 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:21; участок CDR2 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:22; участок CDR3 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:23; участок CDR1 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:24; участок CDR2 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:25; и участок CDR3 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:26.
В определенных воплощениях настоящего изобретения предлагаемые антитела против BTN2A содержат:
- вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO:1, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO:2, или
- вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO:20.
В определенном воплощении настоящего изобретения предлагаемые антитела также обладают по меньшей мере одним из следующих свойств:
- активируют секрецию цитолитических агентов Vγ9Vδ2-T-клетками;
- активируют цитолитическую функцию Vγ9Vδ2-T-клетками; и/или
- активируют пролиферацию Vγ9Vδ2-T-клеток.
В особенности, антитела к BTN2A по такому воплощению настоящего изобретения могут конкурировать за связывание с BTN2A, как правило, с референсным мышиным антителом mAb 107G3, включающим (i) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:1, и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:2.
Более конкретно, такие антитела к BTN2A могут содержать:
- участок CDR1 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:3; участок CDR2 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:4; участок CDR3 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:5; участок CDR1 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:6; участок CDR2 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:7; и участок CDR3 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:8; или
- вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO:1, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO:2.
В некоторых воплощениях настоящего изобретения предлагаемые антитела обладают специфичностью к BTN2A1.
В определенных воплощениях настоящего изобретения предлагаемые антитела против BTN2A являются человеческими, химерными или гуманизированными.
В объем настоящего изобретения входят также молекулы нуклеиновых кислот (полинуклеотиды), кодирующие тяжелую и/или легкую цепь антител против BTN2A, описанных выше.
Настоящее изобретение также касается клеток-хозяев, содержащих такие полинуклеотиды, в частности для применения при получении какого-либо из антител к BTN2А, описанных выше.
Другой аспект настоящего изобретения относится к описанным выше антителам против BTN2A для терапевтического применения, в частности при лечении рака и инфекционных заболеваний.
Как правило, раковые заболевания, раскрытые в настоящем описании, включают злокачественные поражения кровеносной системы и солидные раковые опухоли, в том числе карциномы шейки матки, например, плоскоклеточную карциному и эндоцервикальную аденокарциному, карциному яичника; раковые заболевания кожи, в том числе плоскоклеточную карциному и меланому; раковые поражения легких, в том числе мелкоклеточную карциному легкого; рак предстательной железы, рак толстой кишки, рак поджелудочной железы, карциномы эндометрия, более конкретно - плоскоклеточную карциному и эндоцервикальную карциному, плоскоклеточную карциному, карциному яичника, мелкоклеточную карциному легкого, рак предстательной железы, рак толстой кишки, рак поджелудочной железы и карциномы эндометрия.
Настоящее изобретение также относится к фармацевтической композиции, содержащей антитела против BTN2A, описанные выше, и по меньшей мере фармацевтически приемлемый носитель.
В настоящем изобретении также предлагается способ активации иммунного ответа у субъекта, включающий введение ему эффективного количества антител к BTN2А, описанных в настоящей заявке.
Осуществление изобретения
Определения
В настоящем описании обозначение “BTN2”, соответствуя общепринятому в данной области значению, относится к человеческим полипептидам BTN2, включая BTN2A1, имеющий аминокислотную последовательность SEQ ID NO:17, или BTN2A2, имеющий аминокислотную последовательность SEQ ID NO:18.
SEQ ID NO:17 - аминокислотная последовательность предшественника изоформы 1 белка BTN2A (Homo sapiens):
MESAAALHFSRPASLLLLLLSLCALVSAQFIVVGPTDPILATVGENTTLRCHLSPEKNAEDMEVRWFRSQFSPAVFVYKGGRERTEEQMEEYRGRTTFVSKDISRGSVALVIHNITAQENGTYRCYFQEGRSYDEAILHLVVAGLGSKPLISMRGHEDGGIRLECISRGWYPKPLTVWRDPYGGVAPALKEVSMPDADGLFMVTTAVIIRDKSVRНМ SCSINNTLLGQKKESVIFIPESFMPSVSPCAVALPIIVVILMIPIAVCIYWINKLQKEKKILSGEKEFERETREIALKELEKERVQKEEELQVKEKLQEELRWRRTFLHAVDVVLDPDTAHPDLFLSEDRRSVRRCPFRHLGESVPDNPERFDSQPCVLGRESFASGKHYWEVEVENVIEWTVGVCRDSVERKGEVLLIPQNGFWTLEMHKGQYRAVSSPDRILPLKESLCRVGVFLDYEAGDVSFYНМRDRSHIYTCPRSAFSVPVRPFFRLGCEDSPIFICPALTGANGVTVPEEGLTLHRVGTHQSL
SEQ ID NO:18 - аминокислотная последовательность предшественника изоформы 2 белка BTN2A (Homo sapiens):
MEPAAALHFSLPASLLLLLLLLLLSLCALVSAQFTVVGPANPILAMVGENTTLRCHLSPEKNAEDMEVRWFRSQFSPAVFVYKGGRERTEEQMEEYRGRITFVSKDINRGSVALVIHNVTAQENGIYRCYFQEGRSYDEAILRLVVAGLGSKPLIEIKAQEDGSIWLECISGGWYPEPLTVWRDPYGEVVPALKEVSIADADGLFMVTTAVIIRDKYVRNVSCSVNNTLLGQEKETVIFIPESFMPSASPWMVALAVILTASPWMVSMTVILAVFIIFMAVSICCIKKLQREKKILSGEKKVEQEEKEIAQQLQEELRWRRTFLHAADVVLDPDTAHPELFLSEDRRSVRRGPYRQRVPDNPERFDSQPCVLGWESFASGKHYWEVEVENVMVWTVGVCRHSVERKGEVLLIPQNGFWTLEMFGNQYRALSSPERILPLKESLCRVGVFLDYEAGDVSFYНМ RDRSHIYTCPRSAFTVPVRPFFRLGSDDSPIFICPALTGASGVMVPEEGLKLHRVGTHQSL
В настоящем описании термины «антитело» или «иммуноглобулин» означают одно и то же и употребляются как равноценные.
В настоящем описании термин «антитело» относится к молекулам иммуноглобулинов и их иммунологически активным частям, то есть к молекулам, содержащим участок связывания антигена, который связывается с антигеном иммуноспецифично. В этом смысле термин «антитело» охватывает не только цельные антительные молекулы, но также антительные фрагменты и варианты (включая производные) антител и антительных фрагментов.
В настоящем описании термин «антитело» также включает биспецифичные или мультиспецифичные молекулы. Молекула антитела может быть химически изменена (дериватизирована) или присоединена к другой функциональной молекуле, например, к другому белку или к пептиду (например, к другому антителу или лиганду какого-либо рецептора), так что образуется биспецифичная молекула, связывающаяся по меньшей мере с двумя разными участками связывания или молекулами-мишенями. Молекула антитела может быть дериватизована или соединена с более чем одной функциональной молекулой, так что образуется мультиспецифичная молекула, связывающаяся более чем с двумя различными участками связывания и/или молекулами-мишенями; в настоящем описании такие мультиспецифичные молекулы тоже включаются в термин «биспецифичные молекулы». Для получения биспецифичной молекулы антитело по настоящему изобретению функционально соединяют (например, создают химическую связь, генетическими методами получают слитый белок, образуют нековалентно связанный комплекс или как-то иначе) с одной или более другими связывающими молекулами, например, с другим антителом, антительным фрагментом, пептидом или миметиком, в результате чего получается биспецифичная молекула. Кроме того, в случае воплощения данного изобретения, в котором биспецифичная молекула является мультиспецифичной, эта молекула также включает третий участок специфичного связывания помимо участков специфичного связывания эпитопов первой и второй мишеней. В одном из воплощений данного изобретения раскрытые в настоящем описании биспецифичные молекулы содержат в качестве участка специфичного связывания по меньшей мере одно антитело или антительный фрагмент, включая, например, фрагменты Fab, Fab', F(ab')2, Fv, унитела или одноцепочечный Fv (scFv). Антитело по данному изобретению может также представлять собой димер легкой или тяжелой цепи, или же какой-либо минимальный фрагмент, например, Fv или одноцепочечную конструкцию, как описано в патенте США № 4 946 778 (Ladner et al).
В биспецифичных молекулах, описанных в настоящей заявке, могут также использоваться другие антитела: мышиные, химерные и гуманизированные моноклональные (mAb).
Биспецифичные молекулы по настоящему изобретению получают, тем или иным путем соединяя участки специфичного связывания методами, известными в данной области техники. Например, участки соединяют один за другим. Если участками специфичного связывания являются белки или пептиды, осуществляют ковалентное соединение с помощью разнообразных связывающих агентов или поперечных сшивок. Примеры сшивающих агентов включают протеин А, карбодиимид, N-сукцинимидил-S-ацетилтиоацетат (SATA), 5,5'-дитиобис(2-нитробензойную кислоту) (DTNB), o-фенилендималеимид (oPDM), N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) и сульфосукцинимидный эфир 4-(N-малеимидометил)циклогексановой кислоты (sulfo-SMCC) (Karpovsky et al., 1984; Liu et al., 1985). В числе других методов - способы, описанные в работах Brennan et al., 1985; Glennie et al., 1987; Paulus, 1985. Иной подход заключается в том, что обе нуклеотидные последовательности, кодирующие два разных участка специфичного связывания, встраивают в один вектор, вводят в клетки-хозяева, так что они экспрессируются совместно и объединяются. Этот подход особенно ценен, когда биспецифичная молекула является слитым белком «mAb x mAb, mAb x Fab, Fab x F(ab')2» или «лиганд x Fab». Биспецифичная молекула по настоящему изобретению может быть одноцепочечным полипептидом, содержащим одну цепь антитела и связывающий участок; или же одноцепочечная биспецифичная молекула содержит два связывающих участка. В связывании биспецифичной молекулы с ее мишенями, к которым она специфична, можно удостовериться, например, путем твердофазного иммуноферментного анализа (ELISA), радиоиммунологического анализа (REA), проточной цитометрии методом сортировки клеток с активированной флуоресценцией (FACS), биологического анализа (например, по подавлению клеточного роста или по апоптозу) или вестерн-блоттинга. Все эти аналитические методы, как правило, выявляют присутствие искомых комплексов белок-антитело с помощью специфичных к искомому комплексу реагентов, меченных тем или иным образом (например, меченых антител).
Молекулы природных антител состоят из двух легких и двух тяжелых цепей, попарно соединенных дисульфидными связями. У человека известны два типа легкой цепи - лямбда (λ) и каппа (κ) и пять основных типов тяжелой цепи (изотипов) - IgM, IgD, IgG, IgA, IgE - определяющих функциональную активность антитела. В каждой цепи аминокислотная последовательность образует несколько доменов. В легкой цепи два домена - вариабельный (VL) и константный (CL). В тяжелой цепи четыре домена - вариабельный (VH) и три константных (CH1, CH2 и CH3, которые вместе обозначаются CH). Вариабельные области легких и тяжелых цепей определяют специфичность антитела, то есть его способность распознавать определенный антиген и связываться с ним. Константные области легких и тяжелых цепей тоже выполняют важные биологические функции, обеспечивая, например, ассоциацию цепей в молекулу антитела, секрецию антител из клетки, способность проникать через плаценту, связывание комплемента и связывание с рецепторами Fc (FcR).
Фрагмент Fv антитела - это часть фрагмента Fab иммуноглобулиновой молекулы со стороны N-концов полипептидных цепей; Fv состоит из вариабельных областей одной легкой и одной тяжелой цепей. Специфичность антитела создается структурной комплементарностью между связывающим участком антитела и антигенной детерминантой. Антиген-связывающие участки молекулы антитела образованы, в основном, аминокислотными остатками, входящими в состав участков, определяющих комплементарность, называемых также гипервариабельными (обозначаются CDRs). Иногда аминокислотные остатки из негипервариабельных или каркасных участков (обозначаются FR) могут принимать участие в образовании антиген-связывающего участка и влиять на общую доменную структуру и тем самым на связывающий участок. Аминокислотные последовательности участков CDRs вместе определяют сродство связывания с антигеном (аффинность) и специфичность области Fv природного иммуноглобулина. В каждой цепи молекулы антитела - как в легких, так и в тяжелых - имеются по три участка CDR, обозначаемых в легких цепях L-CDR1, L-CDR2, L-CDR3 и в тяжелых - H-CDR1, H-CDR2, H-CDR3. Таким образом, антиген-связывающий участок антитела, как правило, включает шесть участков CDRs - по три от каждой вариабельной области легкой и тяжелой цепей. Аминокислотные последовательности каркасных участков располагаются между участками CDRs. Соответственно, вариабельные области легкой и тяжелой цепей, как правило, содержат по четыре каркасных участка и по три гипервариабельных: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4.
В нумерации аминокислотных остатков в вариабельных доменах иммуноглобулинов принято следовать системе, предложенной Кэботом (Kabat et al.., 1987, Sequences of Proteins of Immunological Interest, US Department of Health and Human Services, NIH, USA (далее этот источник приводится кратко: Kabat et al.). В настоящем описании используется эта система нумерации. Номер аминокислотного остатка по системе Кэбота не всегда совпадает с его положением в линейной аминокислотной последовательности, представленной в настоящем описании под обозначением SEQ ID NO. В реальной линейной аминокислотной последовательности может быть меньше или больше аминокислотных остатков, чем в строгой нумерации по Кэботу, соответственно, компонент базовой структуры вариабельного домена - каркасный участок или гипервариабельный участок - может быть укороченным или удлиненным за счет вставки. Корректную нумерацию по Кэботу для данного антитела устанавливают путем выравнивания аминокислотных последовательностей по гомологии со «стандартной» последовательностью, пронумерованной по Кэботу. Участки CDRs вариабельного домена тяжелой цепи занимают положения аминокислотных остатков 31-35 (H-CDR1), 50-65 (H-CDR2) и 95-102 (H-CDR3) при нумерации по Кэботу. В легкой цепи участки CDR занимают положения аминокислотных остатков 24-34 (L-CDR1), 50-56 (L-CDR2) и 89-97 (L-CDR3) при нумерации по Кэботу.
В определенных воплощениях данного изобретения предлагаемое антитело является антительным фрагментом, говоря конкретнее - любым белком, включающим антиген-связывающий домен антитела, описанного в настоящей заявке. Антительные фрагменты включают, не ограничиваясь перечисленным здесь, Fv, Fab, F(ab')2, Fab', dsFv, scFv, sc(Fv)2 и димер scFv (диатело).
Термин «изолированное антитело» в настоящем документе относится к препарату данного антитела, в основном не содержащему антител с другой антигенной специфичностью (например, изолированное антитело, которое специфично связывается с BTN2A1, в основном не содержит антител, специфично связывающихся с антигенами, отличными от BTN2A). Изолированное антитело, специфично связывающееся с BTN2, может, однако, проявлять перекрестную реактивность к другим антигенам, например, к белкам, родственным BTN2, но другого видового происхождения Также изолированное антитело в основном не содержит другого клеточного материала и/или других химических веществ.
Термин «аффинность антитела» относится к степени сродства (силе взаимодействия при связывании) антиген-связывающего участка (паратопа) данного антитела к антигенной детерминанте (эпитопу) антигена, например BTN2A1 в настоящем описании. Аффинность оценивается по значению константы диссоциации комплекса антиген-антитело (Kd).
Термин «константа равновесия диссоциации» (обозначается KD) в настоящем описании относится к константе равновесия, измеряемой отношением koff/kon (где koff - константа скорости диссоциации комплекса антиген-антитело, kon - константа скорости его образования) и выражаемой в единицах молярной концентрации (M).
Величина KD отражает концентрацию антитела (количество антитела, требующееся в конкретном опыте); чем она меньше, т.е. чем меньше концентрация антитела, тем выше аффинность антитела. Значения KD для антител определяют стандартными методами, известными в данной области техники. Предпочтительные методы для определения KD моноклональных антител можно найти в работах Harlow, et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1988); Coligan et al., eds., Current Protocols in Immunology, Greene Publishing Assoc. and Wiley Interscience, N.Y., 1992, 1993; Muller, Meth Enzymol 1983, содержание которых включается в настоящий документ в качестве ссылки. KD антител определяют методом поверхностного плазмонного резонанса или с помощью биосенсорной системы, например Biacore® (подробно об определении аффинности см. также в работе Rich R.L., Day Y.S., Morton T.A., Myszka D.G. High-resolution and high-throughput protocols for measuring drug/human serum albumin interactions using BIACORE®. Anal Biochem. 2001) или системы Octet®, основанной на технологии интерферометрии слоя биомолекул (BLI). Метод BLI сводится к анализу интерференционных паттернов белого света, отраженного от двух поверхностей - слоя с иммобилизованными белками на поверхности биосенсора и внутреннего контрольного слоя. Связывание между лигандом, иммобилизованным на поверхности биосенсора, и аналитом в растворе приводит к изменению оптической толщины слоя молекул на поверхности биосенсора и, соответственно, к сдвигу паттерна интерференции. Сдвиг длины волны (δλ в нанометрах) пропорционален изменению оптической толщины слоя молекул на поверхности биосенсора; измеряется δλ за некоторый промежуток времени, и строится график зависимости его значений от времени, что дает кривую ассоциации/диссоциации. Эти изменения, обусловленные взаимодействием лиганда с аналитом, регистрируются в режиме реального времени, что позволяет отслеживать специфичность связывания, скорость ассоциации/диссоциации и концентрацию аналита (см. Abdiche et al. 200, а также раздел “Результаты»). Измерения для определения аффиности проводятся обычно при температуре 25°C.
Термин «константа ассоциации», обозначаемая kassoc, или ka, или kon, в настоящем описании относится к скорости ассоциации (образования комплекса) при взаимодействии конкретного антитела с конкретным антигеном, а термин «константа диссоциации», обозначаемая kdis, или kd, или koff, в настоящем описании относится к скорости диссоциации (распада комплекса) при взаимодействии конкретного антитела с конкретным антигеном.
Термин «моноклональное антитело» или «композиция моноклонального антитела» в настоящем описании относится к препарату антител одного молекулярного состава. Композиция моноклонального антитела характеризуется одной специфичностью и одной аффинностью связывания с определенным эпитопом.
Термин «специфичность» в настоящем описании относится к способности антитела выявляемым образом связываться с эпитопом, имеющимся в молекуле антигена, например, в изоформах белка BTN2A (включая BTN2A1 и BTN2A2) по данному изобретению. Как правило, в настоящем описании этот термин относится к антителу или белку, связывающемуся с человеческим BTN2A, а именно с BTN2A1, причем это связывание характеризуется KD, составляющей 10 нм или меньше, 5 нM, 1 нм или меньше, 100 пM или меньше, или 10 пМ или меньше. Как правило, этв величина составляет от 10-3 пМ до 10 нМ, а именно от 0,1 пМ до 10 нМ, а именно от 0,1 пМ до 5 нМ или от 1 пМ до 10 нМ, а именно от 1 пМ до 5 нМ или от 10 пМ до 5 нМ. Как правило, антитело по данному изобретению специфично к BTN2A1 или как к BTN2A1, так и к BTN2A2, и характеризуется KD, указанной выше. В некоторых воплощениях данного изобретения специфичность определяют путем экспрессии BTN2A1 в культивируемых клетках (например, в клетках лини b HEK-293T) и путем окрашивания трансфицированных клеток в присутствии возрастающих концентраций (например, от 5 нг/мл до 75 мкг/мл) очищенных моноклональных антител к BTN2A, как описано в настоящей заявке, с отрицательным контролем, например, изотипическим контролем. Применяя нелинейный регрессионный анализ к полученным данным по средней интенсивности флуоресценции, определяют EC50 - концентрацию указанного моноклонального антитела, при которой интенсивность флуоресценции составляет 50% от максимального значения. Как правило, антитело, специфичное к BTN2A1, согласно настоящему изобретению, связывается с этим белком с величиной EC50 менее 50 мкг/мл, а именно менее 40 мкг/мл (см. раздел «Примеры»), а именно от 0,1 мкг/мл до 50 мкг/мл или от 0,5 мкг/мл до 20 мкг/мл.
Выражения «антитело, распознающее антиген» и «антитело, специфичное к антигену» в настоящем описании используются взаимозаменяемо с формулировкой «антитело, которое специфично связывается с антигеном».
Термин «избирательное связывание» обычно означает, что данное антитело более прочно связывается с мишенью, к которой специфично, например, с эпитопом, по сравнению с другими мишенями. Антитело связывается с первой мишенью более прочно, чем со второй, если его аффинность к первой мишени выше, чем ко второй. Как правило, антитело связывается с первой мишенью более прочно, чем со второй, если при его связывании с первой мишенью константа равновесия диссоциации (KD) или EC50, о которых говорилось выше, меньше, чем KD или EC50 при связывании со второй мишенью. Наиболее предпочтительно, чтобы данный агент вообще не связывался со второй мишенью в сколько-нибудь существенной степени. В некоторых воплощениях данного изобретения предлагаемые антитела избирательно связываются с BTN2A, прежде всего с BTN2A1. Избирательность связывания также можно выразить через аффинность: например, соотношение аффинностей к антигену, к которому данное антитело специфично, и к молекулярным агентам, к которым оно специфичностью не обладает (например, антитело специфично к полипептиду BTN2A, а именно к BTN2A1, а молекулярным агентом, к которому оно не специфично, является изоформа BTN3), составляет около 10:1, около 20:1, около 50:1, около 100:1, 10 000:1 или больше.
Избирательность антител в указанном выше смысле можно проверить путем анализа перекрестной реактивности антитела по отношению к близкородственным белкам (например, изоформам белка BTN3) по сравнению с “истинной” белковой мишенью антитела (например, изоформам BTN2A). Если при детекции реактивности данного антитела с его «истинной» мишенью наблюдается значительный сигнал, а с другими белками при такой же концентрации антитела и за такой же промежуток времени - нет, то это антитело считается избирательным (см. результаты, описанные в разделе «Примеры» при обсуждении фиг. 3). Антитело считается проявляющим перекрестную реактивность с данным антигеном, если их связывание характеризуется KD = 10 нM или меньше, 1 нM или меньше или 100 пM или меньше. Антитело считается не проявляющим перекрестную реактивность с данным антигеном, если их связывание характеризуется KD = 100 нM или больше, 1 мкM или больше или 10 мкM или больше. В некоторых воплощениях данного изобретения связывание антител с антигеном, к которому они не обладают перекрестной реактивностью, не выявляется стандартными аналитическими методами, применимыми к данным белкам (см. табл. 3 или фиг. 3A).
В определенных воплощениях данного изобретения раскрытые здесь антитела к BTN2A1 проявляют перекрестную реактивность с белком яванского макака, ортологичным белку BTN2A1 [cynoBTN2A1; регистрационный номер NCBI ref XP_015304392.1], имеющему аминокислотную последовательность SEQ ID NО: 35, приведенную ниже:
MQRQFSKASRPCLPWVLMEPAAALHFSLPASLILLLLLLRLCALVSAQFTVVGPTDPILAMVGENTTLRCHLSPEKNAEDMEVRWFRSQFSPAVFVYKGGRERTEEQMEEYRGRTTFVSKDISRGSVALIIHNVTAQENGTYRCYFQEGRSYDEAILHLMVAGLGSKPLVEMRGHEDGGIRLECISRGWYPKPLTVWRDPYGRVVPALKEVFPPDTDGLFMVTTAVIIRDKSMRНМSCSISDTLLGQKKESVIFIPESFMPSVSPCVVALPIIVVFLMIIIAVCIYWINRLQKETKILSGEKESERKTREIAVKELKKERVQKEKELQVKEQLQEELRWRRTVLHAVDVVLDPDTAHPDLLLSEDRRSVRRCPLGHLGESVPDNPERFNSEPCVLGRESFASGKHYWEVEVENVIEWTVGVCRDSVERKEEVLLRPRNGFWTLEMCKGQYRALSSPKRILPLKESLCRVGVFLDYEAGDVSFYНМRDRSHIYTCPRLAFSVPVRPFFRIGSDDSPIFICPALTGASGITVPEEGLILHRVGTNQSLMPVGTRCYGHGMRPTGFIRMREERGIHRTTREEREPDMQNFDLGAHWSNNLPSARSREFLNSDLVPDHSLESPVTPGLANKTGEPQAEVTCLCFSLPSSELRAFPSTATNHNHKATALGSDLHIEVKGYEDGGIHLECRSTGWYPQPQIQWSNTKGQHIPAVKAPVVADGVGLYAVAASVIMRGSSGEGVSCIIRNSLLGLEKTASISITDPFFRNAQPWIAALAGTLPISLLLLAGASYFLWRQQKEKIALSRETEREREMKEMGYAATKQEISLRGGEKSLAYHGTHISYLAAPERWEMAVFPNSGLPRCLLTLILLQLPKLDSAPFDVIGPPEPILAVVGEDAELPCRLSPNASAEHLELRWFRKKVSPAVLVHRDGREQEAEQMPEYRGRATLVQDGIAEGRVALRIRGVRVSDDGEYTCFFREDGSYEEALVHLKVAALGSDPHISMQVQENGEIWLECTSVGWYPEPQVQWRTSKGEKFPSTSESRNPDEEGLFTVAASVIIRDTSVKNVSCYIQNLLLGQEKEVEIFIPG.
В некоторых из воплощений настоящего изобретения связывание антитела, раскрытого в описании, с эктодоменом cynoBTN2A1, характеризуется EC50, сравнимой (+/- 10 %) с EC50, полученной для человеческого белка (huBTN2A1).
Термин «идентичность» относится к сходству двух аминокислотных последовательностей полипептидов или нуклеотидных последовательностей молекул нуклеиновых кислот. Если в данном положении в обеих сравниваемых последовательностях располагаются одинаковые мономеры (аминокислотные остатки или нуклеотиды, соответственно), то сравниваемые молекулы в данном положении идентичны. Степень идентичности (в процентах) двух последовательностей - это количество положений, в которых в этих последовательностях совпадают мономеры, деленное на общее число положений в последовательности и умноженное на 100. Как правило, при сравнении двух последовательностей делается их выравнивание, чтобы выявить максимальное сходство. Степень идентичности рассчитывается путем выравнивания с помощью специальных компьютерных программ, например, PileUp (Genetics Computer Group, Program Manual for the GCG Package, версия 7, Мадисон, шт. Висконсин, США) и алгоритмов сравнения последовательностей, например, BLAST, FASTA или CLUSTALW.
Функциональные варианты референсных молекул (например, моноклонального антитела 107G3 mAb) по данному изобретению обладают функциональными свойствами, в основном такими же, как функциональные свойства референсных молекул, или превосходящими их. Выражение «в основном такие же» в настоящем описании подразумевает, что у указанного варианта имеется функциональная способность референсной молекулы, составляющая по меньшей мере около 50%, 60%, 70%, 80%, 90%, 95% или 100% данной способности референсной молекулы.
В одном из своих аспектов данное изобретение относится к антителу, специфичному к белку BTN2A1, как описано выше. Как правило, связывание такого антитела с человеческим BTN2A1 характеризуется KD, составляющей 10 нМ или меньше, как указано выше.
В некоторых воплощениях данного изобретения предлагаемые антитела не обладают перекрестной реактивностью с изоформами BTN3.
Антитело, специфичное к BTN2A, а именно к BTN2A1, по данному изобретению, как правило, отличается тем, что обладает по меньшей мере одним из следующих свойств:
i. подавляет дифференцировку моноцитов в макрофаги с фенотипом М2;
ii. вызывает реверсию фенотипа макрофагов М2 в сторону противоопухолевого фенотипа М1;
iii. напрямую запускает активацию NK-клеток;
iv. усиливает цитотоксичность, опосредованную NK-клетками.
Антитело по данному изобретению предпочтительно обладает по меньшей мере одним из свойств i и ii и по меньшей мере одним из свойств iii и iv, наиболее предпочтительно оно обладает свойствами i - iv.
Антитела к BTN2A, обладающие предпочтительными качествами, указанными выше, можно выявить среди антител к BTN2A, применяя аналитические методы, например, описанные в разделе «Примеры». Эти методы и их практическое применение кратко описаны ниже.
Для определения формирования фенотипов М1 и М2 получают макрофаги М2 общепринятым в данной области техники образом, а именно проводят дифференцировку в присутствии антител к BTN2A, конкретнее - к BTN2A1, описанным выше, или в условиях отрицательного контроля, например, в присутствии изотипического контроля. Для контроля подавления дифференцировки моноцитов в макрофаги М2 к моноцитам в процессе индуцированной колониестимулирующим фактором макрофагов (M-CSF) указанной дифференцировки добавляют корлониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF) и IFN-γ. В противоположность указанному, макрофаги М1, сформировавшиеся в присутствии GM-CSF, обычно могут служить фенотипическим контролем. После дифференцировки анализируют полученную популяцию макрофагов для выявления экспрессии маркеров на плазматической мембране, связанных с фенотипами М1 и М2, методом проточной цитометрии.
Маркеры фенотипа M1, которые могут быть без затруднений детектированы в соответствии с настоящим изобретением, включают, без ограничения перечисленным здесь, PDL1, CD86, CD40, CD80 и/или SOCS3. Обычно определяют PDL1 и/или CD86. Маркеры фенотипа М2, детектируемые согласно настоящему изобретению, включают, без ограничения перечисленным здесь, CD14, CD163, CD206 и CD20. Обычно определяют CD14 и/или CD163.
Как правило антитела к BTN2A по данному изобретению вызывают подавление дифференцировки макрофагов по фенотипу М2, когда:
- наблюдается значительное возрастание уровня по меньшей мере одного маркера фенотипа М1, когда макрофаги М2 формируются в присутствии антител к BTN2A по настоящему изобретению, по сравнению с изотипическим контролем; и/или
- наблюдается значительное снижение уровня по меньшей мере одного маркера фенотипа М2, когда макрофаги М2 формируются в присутствии антител к BTN2A по настоящему изобретению, по сравнению с отрицательным контролем, например с изотипическим контролем
Также в супернатанте культуры клеток можно установить профиль секреции цитокинов (включая, в особенности, противовоспалительный цитокин IL-10, связанный с М2, и провоспалительный цитокин TNFα, связанный с М1), который является определяющим функциональным показателем для разделения макрофагов по фенотипам М1 и М2; цитокины выявляют при помощи готовых имеющихся в продаже наборов (например, для ELISA). Другие цитокины, которые также нетрудно выявлять для определения фенотипов М1 и М2 макрофагов, включают IL-1, IL-6, IL-12 и IL-23, связанные с фенотипом М1, и TGFβ, и IL-10, связанные с фенотипом M2.
Таким образом, в некоторых воплощениях данного изобретения можно считать дифференцировку моноцитов в макрофаги с фенотипом М2 результатом действия антител к BTN2A по данному изобретению, когда:
- наблюдается значительное сокращение секреции по меньшей мере одного цитокина, связанного с фенотипом М2, когда макрофаги М2 культивируют в присутствии антител к BTN2A по данному изобретению, по сравнению с отрицательным контролем, например, с изотипическим контролем; и/или.
- наблюдается значительное возрастание секреции по меньшей мере одного цитокина, связанного с фенотипом М1, когда макрофаги М2 культивируют в присутствии антител к BTN2A по данному изобретению, по сравнению с отрицательным контролем, например, с изотипическим контролем.
Как правило, антитела к BTN2A по данному изобретению подавляют дифференцировку моноцитов в макрофаги с фентипом М2 зависимым от дозы образом, о чем судят по ослаблению экспрессии маркеров, связанных с фенотипом М2 (например, CD14 и/или CD163) и/или по сокращению секреции цитокинов, связанных с фенотипом М2 (например, IL-10). Для таких антител можно определить концентрацию полумаксимального подавления (IC50) секреции указанного по меньшей мере одного цитокина, связанного с фенотипом макрофагов М2, или экспрессии указанного по меньшей мере одного маркера, связанного с фенотипом макрофагов М2, по кривой доза-ответ, как описано в разделе «Примеры». В некоторых конкретных воплощениях данного изобретения предлагаемые антитела к BTN2A характеризуются:
- IC50 для экспрессии маркера, связанного с фенотипом макрофагов М2 (как правило, CD14 и/или CD163), составляющей от 0,05 мкг/мл, конкретнее от 0,1 мкг/мл до 100 мкг/мл, конкретнее до 50 мкг/мл; и/или
- IC50 для секреции цитокина, связанного с фенотипом М2 (как правило, IL-10) составляющей от 0,01 мкг/мл, конкретнее от 0,05 мкг/мл до 100 мкг/мл, конкретнее до 50 мкг/мл, наиболее конкретно до 20 мкг/мл.
Кроме того, или в качестве альтернативы антитела к BTN2A по данному изобретению зависимым от дозы образом сдвигают дифференцировку моноцитов в сторону формирования макрофагов с фенотипом М1, а не стимулируют преобладание фенотипа М2; это определяли по усилению экспрессии маркеров, связанных с фенотипом М1 (например, CD86 и/или PDL1) и/или ослаблению секреции цитокинов, связанных с фенотипом М2 (например, IL-10). Полумаксимальная эффективная концентрация (EC50) таких антител в отношении секреции указанных по меньшей мере одного цитокина, связанных с фенотипом М1 или экспрессии указанных по меньшей мере одного маркера, связанных с фенотипом М1, определяют по кривой доза-ответ, как описано в разделе «Примеры». В некоторых определенных воплощениях данного изобретения антитела к BTN2A проявляют следующие свойства:
- EC50 для экспрессии маркеров, связанных с фенотипом М1 (например, CD86 и/или PDL1), составляет от 0,01 мкг/мл, конкретно от 0,1 мкг/мл до 100 мкг/мл, конкретно до 50 мкг/мл, наиболее предпочтительно от 1 до 50 мкг/мл; и/или
- EC50 для секреции цитокинов, связанных с фенотипом М1 (например, TNFα), составляет от 0,01 мкг/мл, конкретно от 0,05 мкг/мл до 100 мкг/мл, конкретно до 50 мкг/мл, наиболее предпочтительно от 1 до 10 мкг/мл.
Для анализа реверсии фенотипа M2 макрофаги с фенотипом М2, которые обычно дифференцируются из моноцитов в присутствии M-CSF, культивируют с липополисахаридом (LPS) или без него в присутствии антител к BTN2A (наиболее предпочтительно к BTN2A1, как говорилось выше) или с отрицательным контролем, например, с изотипическим контролем. В культуру макрофагов М2 добавляют колониестимулирующий фактор гранулоцитов-макрофагов (GM-CSF) и IFNγ в качестве положительного контроля реверсии фенотипа М2. Макрофаги M1, образовавшиеся в присутствии GM-CSF, можно, как правило, использовать в качестве фенотипического контроля. После реверсии фенотипа те макрофаги, которые обнаружили такую реверсию без использования LPS, анализируют методом проточной цитометрии для определения экспрессии маркеров, связанных с фенотипами М1 и М2, как говорилось выше. Количественное определение секреции цитокинов проводят так же, как описано выше.
Как правило, реверсия фенотипа макрофагов М2 в М1 вызывается антителами к BTN2A по данному изобретению, когда:
- при культивировании макрофагов М2 в присутствии указанных антител к BTN2A наблюдается значительное увеличение уровня маркеров, связанных с фенотипом М1, по сравнению с изотипическими контролем; и/или
- при культивировании макрофагов М2 в присутствии указанных антител к BTN2A наблюдается значительное уменьшение уровня маркеров, связанных с фенотипом М2, по сравнению с отрицательным контролем, например, с изотипическим контролем.
Для определения активации NK-клеток эти клетки (как правило, взятые у здоровых доноров) культивируют с антителами к-BTN2A, как описано в настоящей заявке, или с антителами изотипического контроля в качестве отрицательного контроля, добавляя или не добавляя IL-2 и/или IL-15. Спустя по меньшей мере 48 часов культивирования, конкретно - по меньшей мере через 4 суток - устанавливают внеклеточный фенотип NK-клеток по маркерам их активации, например, CD69 и/или CD25. Как правило, считается, что активация NK-клеток вызвана антителами к BTN2A по данному изобретению, когда в присутствии указанных антител к BTN2A (с дальнейшей активацией с помощью IL-2 и/или IL-15 либо без нее) наблюдается значительное увеличение уровня маркеров активации NK-клеток, например, CD69 и/или CD25, по сравнению с отрицательным контролем, например, изотипическим контролем. Приведенные в настоящем описании результаты ясно демонстрируют, что антитела по данному изобретению инициируют прямую активацию NK-клеток.
Также определяют усиление цитотоксичности с участием NK-клеток по дегрануляции NK-клеток in vitro. Этот метод функционального анализа предполагает совместное культивирование описанных выше NK-клеток (ранее активированных антителами к BTN2A либо обработанных отрицательным контролем, как описано выше) с клетками раковой линии, например лейкозными (миелогенного лейкоза) или карциномными (например, карциномы толстой кишки, или легкого, или молочной железы, или аденокациномы) в присутствии либо в отсутствие IL-2 и/или IL-15. Дегрануляцию NK-клеток, как правило, определяют путем проточной цитометрии как относительное количество (в процентах) NK-клеток, имеющих CD107 (в присутствии либо в отсутствие IL-2 и/или IL-15).
Как правило, цитотоксичность с участием NK-клеток считается вызванной антителами к BTN2A, когда дегрануляция NK-клеток [например, относительное количество (в процентах) NK-клеток, имеющих CD107] значительно увеличивается после активации NK-клеток указанными антителами к-BTN2A по сравнению с отрицательным контролем, например изотипическим контролем. Также обычно антитела к BTN2A по данному изобретению вызывают дегрануляцию N-клеток зависимым от дозы образом (конкретно - против раковых клеток различных линий, как описано выше). Полуэффективную концентрацию (EC50) таких антител для дегрануляции NK-клеток определяют по кривой доза-ответ, как подробно описано в разделе «Примеры».
В описанных выше методах функционального анализа в качестве положительного контроля можно использовать референсные антитела 101G5 и/или 107G3.
В некоторых воплощениях данного изобретения антитела к BTN2A, описанные в настоящей заявке, подавляют дифференцировку моноцитов в макрофаги с фенотипом М2, вызывают реверсию фенотипа макрофагов М2 в противоопухолевой фенотип М1, напрямую инициируют активацию NK-клеток и/или усиливают цитотоксичность с участием NK-клеток до уровня, в основном равного таковому референсных антител mAb 101G5 или mAb 107G3 или превышающую ее, как подробно описано ниже. Формулировка «подавляют дифференцировку моноцитов в макрофаги с фенотипом М2, вызывают реверсию фенотипа макрофагов М2 в противоопухолевый фенотип М1, напрямую инициируют активацию NK-клеток и/или усиливают цитотоксичность с участием NK-клеток до уровня, в основном равного таковому референсного антитела или превышающего ее», в настоящем описаии означает, что при тестировании данного антитела к BTN2A1 наблюдается изменение данной функциональной активности менее чем на 20%, конкретно - менее чем на 15%, менее чем на 10% и как правило менее чем на 5% по сравнению с любым из референсных антитела mAb 107G3 или 101G5.
В объем данного изобретения входят также антитела, которые
1) специфичны к BTN2A, особенно к BTN2A1, как описано выше; в частности, антитела, обладающие по меньшей мере одним из следующих признаков:
- связываются с человеческим BTN2A1, как правило, экспрессирущимся в клетках линии, например HEK293T, трансфицированных плазмидой, кодирующей человеческий BTN2A1, как описано в разделе «Примеры»; более конкретно, это связывание характеризуется EC50 менее 50 мкг/мл, предпочтительнее 40 мкг/мл; или связывание указанных антител с BTN2A1 характеризуется KD = 10 нм или меньше и/или отношение его аффинности к таковой неспецифического связывания составляет около 10:1, около 20:1, около 50:1, около 100:1, 10 000:1 или больше;
- не проявляют перекрестную реактивность с BTN3;
и
2) дополнительно или в качестве альтернативы проявляют одно или более из следующих функциональных свойств:
- активируют образование цитолитических агентов (а именно, IFN-γ) Vγ9Vδ2-T-клетками; и/или
- активируют цитолитическую функцию Vγ9Vδ2-T-клеток; и/или
- активируют пролиферацию Vγ9Vδ2-T-клеток.
Замечено, что пролиферация, цитолитическая функция и образование цитолитических агентов (а именно, IFN-γ) Vγ9/Vδ2-T-клетками осуществляются активированными Vγ9/Vδ2-T-клетками, которые, как правило, активируются антителами, описанными в настоящей заявке.
Антитела к BTN2A1 по данному изобретению, обладающие такими ценными свойствами, можно выявить среди антител к BTN2A1 применяя методы клеточного анализа, описанные в разделе «Примеры», в частности метод ELISA с использованием определения секреции IFN-γ Vγ9/Vδ2-T-клетками и /или определение дегрануляции с использованием CD107 в раковых клетках различных линий, например, Daudi, Jurkat, L-IPC или MDA-MB-134.
Цитолитическими агентами по данному изобретению, как правило, являются цитокины IFNγ или TNFα.
В настоящем описании формулировка «активация образования цитолитических агентов» (как правило, IFNγ и/или TNFα) означает, что при сравнении образования по меньшей мере IFNγ или TNFα активированными Vγ9/Vδ2-T-клетками и контрольными активированными Vγ9/Vδ2-T-клетками (с IgG1 или культуральной средой от гибридом в качестве контроля) наблюдается значительное увеличение этого показателя, причем указанные Vγ9/Vδ2-Т-клетки активируются совместным культивированием с клетками-мишенями (клетками линий Daudi, Jurkat, L-IPC или MDA-MB-134) или же фосфоантигенами (pAg). Как правило, активация образования IFNγ или TNFα активированными Vγ9/Vδ2-T-клетками можно количественно определить методами клеточного анализа по внутриклеточному мечению антителами к IFNγ или к TNFα, которое определяют методом проточной цитометрии, или по иммуноферментному связыванию (ELISA) при различных концентрациях IFNγ или TNF, выделяемых Vγ9/Vδ2-T-клетками в их культуральную среду. Такие исследования более подробно описаны ниже в разделе “Примеры» (глава «Материала и методы»).
В настоящем описании формулировка «активация цитолитической функции активированных Vγ9/Vδ2-T-клеток” означает, что при сравнении цитолитической функции активированных человеческих Vγ9/Vδ2-T-клеток и контрольных активированных человеческих Vγ9/Vδ2-Tклеток (с IgG1 или культуральной средой от гибридом в качестве контроля) у первых эта функция значительно сильнее, причем указанные человеческие Vγ9/Vδ2-Т-клетки активируются совместным культивированием с клетками-мишенями (клетками линий Daudi, Jurkat, L-IPC или MDA-MB-134) или же фосфоантигенами (pAg). Как правило, активация цитолитической функции активированных Vγ9/Vδ2-T-клеток определяют по данным об активации индукции дегрануляции Vγ9/Vδ2-T-клеток клетками стандартных линий; при этом в качестве маркеров дегрануляции для выявления дегранулированных Vγ9/Vδ2-T-клеток используются вместе CD107a и CD107b. В качестве положительного контроля при определении активации. Vγ9/Vδ2-T-клеток используется, как правило, обработка Vγ9/Vδ2-T-клеток форбол-12-миристат-13-ацетатом (PMA) с иономицином. Такое исследование более подробно описано ниже в разделе “Примеры».
В настоящем описании формулировка «активация пролиферации активированных Vγ9/Vδ2-T-клеток” означает, что при сравнении пролиферации активированных Vγ9/Vδ2-T-клеток и контрольных Vγ9/Vδ2-T-клеток, активированных IgG1, у первых наблюдается значительно большая пролиферация, причем указанные Vγ9/Vδ2-Т-клетки активируются совместным культивированием с клетками-мишенями (клетками линий Daudi, Jurkat, L-IPC или MDA-MB-134) или же фосфоантигенами (pAg). Как правило, пролиферацию активированных Vγ9/Vδ2-T-клеток определяют, оценивая функциональное состояние клеток с использованием карбоксифлуоресцеинсукцинимидилового эфира (CFSE) или красителя Cell Trace Violet и путем проточной цитометрии очищенных Vγ9/Vδ2-T-клеток из периферической крови, или отслеживают пролиферацию популяции Vγ9/Vδ2-T-клеток среди одноядерных клеток периферической крови при наличии стимулирующего агента и без него.
В некоторых воплощениях данного изобретения антитела к BTN2A1 активируют цитолитическую функцию активированных Vγ9/Vδ2-T-клеток до уровня, в основном равного таковому референсных антител mAb 107G3 или превышающих его, как описано выше. Формулировка «активация цитолитической функции активированных Vγ9/Vδ2-T-клеток до уровня, в основном равного таковому референсных антител или превышающих его» в настоящем описании означает, что при тестировании антител к BTN2A1 в сравнении с референсными антителами mAb 107G3 разница составляет менее 15%, конкретно - менее 10% и, как правило, менее 5% от цитолитической функции активированных Vγ9/Vδ2-T-клеток.
В некоторых воплощениях данного изобретения антитела к BTN2A1 активируют образование цитолитических агентов (то есть по меньшей мере IFNγ или TNFα) активированными Vγ9/Vδ2-T-клетками до уровня, в основном, равного таковому референсных антител mAb 107G3 или превышающих его, как описано выше. Формулировка «активация образования по меньшей мере IFNγ или TNFα активированными Vγ9/Vδ2-T-клетками до уровня, в основном равного таковому референсных антител или превышающих его», в настоящем описании означает, что при тестировании антител к BTN2A1 в сравнении с референсными антителами mAb 107G3 разница составляет менее 15%, конкретно - менее 10% и, как правило, менее 5% от образования цитолитических агентов активированными Vγ9/Vδ2-T-клетками.
Референсные антитела mAbs 101G5, 107G3 и их варианты
Антитела, описанные в настоящей заявке, включают референсные моноклональные антитела mAb 101G5, молекулы которых содержат соответствующие вариабельные области тяжелой (VH) и легкой (VL) цепей, представленные SEQ ID NO:19 и SEQ ID NO: 20, соответственно, и mAb 107G3, молекулы которых содержат соответствующие VH и VL, представленные SEQ ID NO:1 и SEQ ID NO: 2, соответственно.
Другие антитела, описанные в настоящей заявке, включают последовательности, по меньшей мере на 90%, а именно на 95, 96, 97, 98, 99 или 100% идентичные областям VH and VL, представленным SEQ ID NO:1 и 2 или SEQ ID 19 и 20, соответственно.
В определенных воплощениях данного изобретения антитела к BTN2A, описанные в настоящей заявке, являются, как правило, гуманизированными антителами к BTN2A1, и содержат в вариабельной области тяжелой цепи гипервариабельные участки (CDRs): CDR1, включающий последовательность SEQ ID NO:3, CDR2, включающий последовательность SEQ ID NO:4 и CDR3, включающий последовательность SEQ ID NO:5; в вариабельной области легкой цепи: CDR1 включающий последовательность SEQ ID NO:6, CDR2 включающий последовательность SEQ ID NO:7 и CDR3 включающий последовательность SEQ ID NO:8. В конкретных воплощениях антител, описанных в настоящей заявке, эти шесть участков CDRs на 100% идентичны шести участкам CDRs референсного антитела mAb 107G3, представленным последовательностями SEQ ID NO:3-8.
В других конкретных воплощениях данного изобретения антитела к BTN2A1, описанные в настоящей заявке, являются, как правило, гуманизированными антителами к BTN2A1, и содержат в вариабельной области тяжелой цепи участок CDR1, включающий последовательность SEQ ID NO:21, CDR2, включающий последовательность SEQ ID NO:22 и CDR3, включающий последовательность SEQ ID NO:23; в вариабельной области легкой цепи: CDR1 включающий последовательность SEQ ID NO:24, CDR2 включающий последовательность SEQ ID NO:25 и CDR3 включающий последовательность SEQ ID NO:26.
В конкретных воплощениях антител, описанных в настоящей заявке, эти шесть участков CDRs на 100% идентичны шести участкам CDRs референсного антитела mAb 101G5, представленным последовательностями SEQ ID NO:21-26. Другие антитела, описанные в настоящей заявке, включают белки, содержащие участки CDRs, аминокислотные последовательности которых являются результатом мутации - делеции, вставки или замены аминокислотного остатка, - однако по меньшей мере на 60, 70, 80, 90, 95, 96, 97, 98, 99 или 100% идентичны участкам CDR референсного антитела mAb 101G5. Как правило, в антителах по данному изобретению могут быть изменены (в результате делеции, вставки или замены) 1, 2, 3 или 4 аминокислотных остатка в одном или более участках CDRs, по сравнению с аминокислотными последовательностями соответственных участков CDRs в референсном антителе mAb 107G3, представленных SEQ ID NO:21-26.
В других конкретных воплощениях антител, описанных в настоящей заявке, эти шесть участков CDRs на 100% идентичны шести участкам CDRs референсного антитела mAb 107G3, представленным последовательностями SEQ ID NO:3-8. Другие антитела, описанные в настоящей заявке, включают белки, содержащие участки CDRs, аминокислотные последовательности которых являются результатом мутации - делеции, вставки или замены аминокислотного остатка, - однако по меньшей мере на 60, 70, 80, 90, 95, 96, 97, 98, 99 или 100% идентичны участкам CDRs референсного антитела mAb 107G3. Как правило, в антителах по данному изобретению могут быть изменены (в результате делеции, вставки или замены) 1, 2, 3 или 4 аминокислотных остатка в одном или более участках CDRs, по сравнению с аминокислотными последовательностями соответственных участков CDRs в референсном антителе mAb 107G3, представленных SEQ ID NO:3-8.
В некоторых воплощениях данного изобретения предлагаемые антитела являются мутантными вариантами mAb 101G5 или mAb 107G3, в которых шесть участков CDRs на 100% идентичны соответствующим шести участкам CDRs референсных антител mAb 101G5 или 107G3, причем указанные мутантные антитела-варианты включают мутантные аминокислотные последовательности, являющиеся результатом делеции, вставки или замены не более чем 1, 2, 3, 4 или 5 аминокислотных остатков в каркасных участках FR1, FR2, FR3 и FR4 по сравнению с соответственными участками в соответствующем референсном антителе.
Функциональные варианты антител
Как свидетельствуют экспериментальные данные, приведенные в разделе «Примеры», референсное антитело mAb 107G3 связывается с человеческим BTN2A1, взаимодействуя с аминокислотными остатками, находящимися в положениях 65, 68, 69, 72, 78; 84, 85, 95, 97, 100 аминокислотной последовательности BTN2A1. Таким образом, в объем данного изобретения входят моноклональные антитела, которые связываются с конформационным эпитопом, содержащим аминокислотные остатки, находящиеся в положениях с 60-го по 100-е последовательности SEQ ID NО:17, наиболее предпочтительно - с конформационным эпитопом, содержащим аминокислотные остатки, находящиеся в положениях 65, 68, 69, 72, 78; 84, 85, 95, 97, 100 последовательности SEQ ID NО:17, и которые обладают одним или более из описанных выше функциональных свойств референсного антитела mAb 107G3.
Как также свидетельствуют экспериментальные данные. приведенные в разделе «Примеры», референсное антитело mAb 101G5 связывается с BTN2A1, взаимодействуя с аминокислотными остатками, находящимися в положениях 212, 213, 218, 220, 224, 229 аминокислотной последовательности BTN2A1. Таким образом, в объем данного изобретения входят моноклональные антитела, которые связываются с конформационным эпитопом, содержащим аминокислотные остатки, находящиеся в положениях с 210-го по 230-е последовательности SEQ ID NО:17, наиболее предпочтительно - с конформационным эпитопом, содержащим аминокислотные остатки, находящиеся в положениях 212, 213, 218, 220, 224, 229 последовательности SEQ ID NО:17, и которые обладают одним или более из описанных выше функциональных свойств референсного антитела mAb 101G5.
В других воплощениях данного изобретения в функциональных вариантах антител, описанных в настоящей заявке, имеются полноразмерные аминокислотные последовательности тяжелой и легкой цепей, или вариабельных областей тяжелой и легкой цепей, или шести участков CDRs, гомологичные или, более предпочтительно, идентичные соответствующим аминокислотным последовательностям любого из референсных моноклональных антител 101G5 или 107G3, описанных выше, и такие функциональные варианты антител сохраняют желаемые функциональные свойства указанного референсного антитела.
Функциональные варианты референсного антитела mAb 101G5 или mAb 107G3, говоря конкретно - функциональные варианты VL, VH или CDRs, по данному изобретению обеспечивают антителам, описанным в настоящей заявке, по меньшей мере существенную долю (по меньшей мере около 50%, 60%, 70%, 80%, 90%, 95% или 100%) аффинности (как правило, определяемой как KD, измеренная методом поверхностного плазмонного резонанса (SPR) или с помощью системы Octet® методом интероферометрии в слое биологических молекул, что обычно осуществляется при температуре 25°C) и/или избирательности связывания исходного антитела (например, mAb 101G5 или 107G3), и в некоторых случаях такие моноклональные антитела по данному изобретению оказываются обладающими большей аффинностью, избирательностью и/или специфичностью, чем исходное антитело (например, mAb 101G5 или 107G3).
Желаемые функциональные свойства референсного антитела mAb 101G5, или 107G3, или варианта указанного референсного антитела, описанного в настоящей заявке, выбирают из группы, состоящей из следующих свойств:
i. специфичноcть к BTN2A1, в частности к человеческому BTN2A1, экспрессирующемуся в клетках линии, например HEK-293T BTN2 KO, трансфицированных плазмидой, кодирующей BTN2A1, как описано в разделе «Примеры», характеризуется предпочтительно EC50 менее 50 мкг/мл, более предпочтительно менее 40 мкг/мл или KD, измеренной методом SPR при температуре, как правило, 25°C, или методом проточной флуорометрии на микросферах (платформа Luminex), как описано в разделе «Примеры», или с помощью системы Octet® (Abdiche et al. 2008), равной 10 нм или меньше, а также отношением аффиностей при связывании с BTN2A1 в сравнении с неспецифическим связыванием около 10:1, около 20:1, около 50:1, около 100:1, 10 000:1 или больше и/или
ii. подавление дифференцировки моноцитов в макрофаги с фенотипом М2, обычно определяемое так, как описано в разделе «Примеры», и/или
iii. индукция реверсии фенотипа макрофагов М2 в сторону противоопухолевого фенотипа М1, обычно определяемая так, как описано в разделе «Примеры», и/или
iv. непосредственный запуск активации NK-клеток, обычно определяемый так, как описано в разделе «Примеры», и/или
v. усиление цитотоксичности с участием NK -клеток, обычно определяемое так, как описано в разделе «Примеры».
В некоторых более конкретных воплощениях данного изобретения желаемые функциональные свойства референсного антитела mAb 107G3 или варианта указанного референсного антитела, описанного в настоящей заявке, выбирают также из группы, состоящей из следующих свойств:
vi. активация образования цитолитических агентов (например, IFNγ или TNFα) Vγ9/Vδ2-T-лимфоцитами, обычно определяемая так, как описано в разделе «Примеры», и/или,
vii. активация цитолитической функции Vγ9/Vδ2-T-клеток, обычно определяемая так, как описано в разделе «Примеры», и/или,
viii. активация пролиферации Vγ9/Vδ2-T-клеток, обычно определяемая так, как описано в разделе «Примеры».
Как правило, функциональные свойства согласно указанным выше пунктам (ii) - (v) функционального варианта mAb 101G5 или 107G3, в основном, такие же, как соответствующие свойства данного референсного антитела - mAb 101G5 или 107G, либо превосходят их. Выражение «в основном такие же» в настоящей заявке подразумевает, что функциональный вариант обладает тем или иным свойством, по меньшей мере, на около 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100% от соответствующего функционального свойства референсного антитела mAb 107G3.
Как правило, функциональные свойства по указанным выше пунктам (vi) - (viii) функционального варианта референсного антитела mAb 107G3, в основном, такие же, как соответствующие свойства референсного антитела - mAb 107G3, или превосходят их. Выражение «в основном такие же» в настоящей заявке подразумевает, что функциональный вариант обладает тем или иным свойством, по меньшей мере, на около 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100% от соответствующего функционального свойства референсного антитела mAb 107G3.
Например, данное изобретение относится к функциональным вариантам референсного антитела mAb 101G5, содержащим аминокислотные последовательности вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL), в которых последовательности шести участков CDRs, а именно HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, по меньшей мере на 60, 70, 90, 95 или 100% идентичны соответствующим участкам CDRs референсного антитела mAb 101G5, представленным SEQ ID NO:21-26, причем указанный функциональный вариант специфично связывается с BTN2A и обладает по меньшей мере одним из функциональных свойств i) - iv):
i. подавляет дифференцировку моноцитов в макрофаги с фенотипом М2;
ii. вызывает реверсию фенотипа макрофагов M2 в сторону противоопухолевого фенотипа M1;
iii. напрямую запускает активацию NK-клеток;
iv. усиливает цитотоксичность с участием NK-клеток.
Предпочтительно такое антитело обладает, по меньшей мере, одним из свойств i) и ii) и, по меньшей мере, одним из свойств iii) и iv), наиболее предпочтительно, оно обладает свойствами i)-iv).
Данное изобретение также относится к функциональным вариантам референсного антитела mAb 107G3, содержащим аминокислотные последовательности вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL), в которых последовательности шести участков CDRs, а именно HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3, по меньшей мере на 60, 70, 90, 95 или 100% идентичны соответствующим участкам CDRs референсного антитела mAb 107G3, представленным SEQ ID NO:3-8, причем указанный функциональный вариант специфично связывается с BTN2A1 и обладает по меньшей мере одним из следующих функциональных свойств:
i. подавляет дифференцировку моноцитов в макрофаги с фенотипом М2;
ii. вызывает реверсию фенотипа макрофагов M2 в сторону противоопухолевого фенотипа M1;
iii. напрямую запускает активацию NK-клеток;
iv. усиливает цитотоксичность с участием NK-клеток
v. активирует образование IFNγ или TNFα Vγ9Vδ2-T-клетками;
vi. активирует цитолитическую функцию Vγ9Vδ2-T-клетками; и/или
v. активирует пролиферацию Vγ9Vδ2-T-клеток.
Предпочтительно указанный функциональный вариант обладает, по меньшей мере, одной из функциональных активностей i) - iv) (предпочтительно, по меньшей мере, активностями i и/или ii, и iii и/или iv) и, по меньшей мере, одной из функциональных активностей v) - vii).
Данное изобретение также относится к функциональным вариантам референсного антитела mAb 101G5, содержащим аминокислотные последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи, которые, по меньшей мере, на 80%, 90% или по меньшей мере на 95, 96%, 97%, 98%, 99% или 100% идентичны соответствующим вариабельным областям легкой и тяжелой цепей указанного референсного антитела mAb 101G5, представленным SEQ ID NO:19 и 20 соответственно, причем указанный функциональный вариант специфично связывается с BTN2 и обладает по меньшей мере одним из следующих функциональных свойств:
i. подавляет дифференцировку моноцитов в макрофаги с фенотипом М2;
ii. вызывает реверсию фенотипа макрофагов M2 в сторону противоопухолевого фенотипа M1;
iii. напрямую запускает активацию NK-клеток;
iv. усиливает цитотоксичность с учасьтием NK-клеток
Предпочтительно такое антитело обладает, по меньшей мере, одним из свойств i) и ii) и, по меньшей мере, одним из свойств iii) и iv), наиболее предпочтительно оно обладает свойствами i)-iv).
Данное изобретение также относится к функциональным вариантам референсного антитела mAb 107G3, содержащим аминокислотные последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи, которые, по меньшей мере, на 80%, 90% или про меньшей мере на 95, 96%, 97%, 98%, 99% или 100% идентичны соответствующим вариабельным областям легкой и тяжелой цепей указанного референсного антитела mAb 107G3, представленным SEQ ID NO:1 и 2 соответственно, причем указанный функциональный вариант специфично связывается с BTN2А и обладает по меньшей мере одним из следующих функциональных свойств:
i. подавляет дифференцировку моноцитов в макрофаги с фенотипом М2;
ii. вызывает реверсию фенотипа макрофагов M2 в сторону противоопухолевого фенотипа M1;
iii. напрямую запускает активацию NK-клеток;
iv. усиливает цитотоксичность с участием NK-клеток
v. активирует образование цитолитических агентов (IFNγ или TNFα) Vγ9Vδ2-T-клетками;
vi. активирует цитолитическую функцию Vγ9Vδ2-T-клеток; и/или
vii. активирует пролиферацию Vγ9Vδ2-T-клеток.
В некоторых воплощениях данного изобретения указанные функциональные варианты антител проявляют по меньшей мере одну из функциональных активностей i) - iv) (главным образом, по меньшей мере, активности i и/или ii, и iii и/или iv) и, по меньшей мере, одну из функциональных активностей v) - vii).
В некоторых воплощениях данного изобретения указанные функциональные варианты антител проявляют, по меньшей мере, одну из функциональных активностей i - iv или одну или более функциональных активностей v - vii.
Как правило, функциональные свойства по указанным выше пунктам (i) - (iv) функционального варианта mAb 101G5 или 107G3, в основном, такие же, как соответствующие функциональные свойства соответствующего референсного антитела mAb 101G5 или 107G3, либо превосходят их. Выражение «в основном, такие же» в настоящей заявке подразумевает, что функциональный вариант обладает данным свойством по меньшей мере на около 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100% от соответствующего функционального свойства референсного антитела mAb 107G3.
В различных воплощениях данного изобретения предлагаемое антитело может проявлять одно или более желаемых функциональных свойств, обсуждавшихся выше.
Антитело по данному изобретению может быть, например, человеческим, гуманизированным или химерным. Как правило, антитело или белок по данному изобретению является гуманизированным антителом, более предпочтительно гуманизированным «молчащим» антителом.
В настоящем описании термин «молчащее антитело» относится к антителам, проявляющим низкую или нулевую антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC), которую определяют соответствующим методом in vitro по лизису клеток-мишеней.
В одном из воплощений данного изобретения понятие «низкая или нулевая активность ADCC” означает, что данное молчащее антитело проявляет активность ADCC, составляющую менее 50%; например, менее 10%, от активности АDCC, наблюдаемой у соответствующего антитела дикого типа (не молчащего), например у человеческого IgG1 дикого типа. Как правило, при определении активности ADCC in vitro ADCC у молчащего антитела в сравнении с контрольным Fab-фрагментом иммуноглобулина указанная активность не выявляется.
«Молчащая» эффекторная функция достигается за счет мутирования Fc-области антитела; это описано в данной области техники в работах Strohl 2009 (LALA & N297A); Baudino 2008, D265A (Baudino et al., J.Immunol. 2008, Strohl, CO Biotechnology 20 2009). Например, молчащие антитела изотипа IgG1 несут мутации, снижающие активность ADCC, в положениях 234, 235 и/или 331 аминокислотной последовательности Fc-области Fc IgG1 (нумерация аминокислотных остатков по системе EU). Другое молчащее антитело изотипа IgG1 содержит мутацию N297A, которая влияет на гликозилирование молекулы антитела.
Аминокислотные последовательности участков CDRs в вариантах антитела могут отличаться от таковых исходного антитела в результате замен, по большей части консервативных, аминокислотных остатков; таких замен может быть, по меньшей мере, 10, например по меньшей мере 9, 8, 7, 6, 5, 4, 3, 2 или 1. В контексте данного изобретения консервативными заменами считаются такие замены, когда вместо исходного встает другой аминокислотный остаток из той же группы аминокислот, подразделяемых по специфике боковых цепей, а именно:
Алифатические - I, L, V, M
Ароматические - F, H, W, Y
Гидрофобные - A, C, F, G, H, I, L, M, R, T, V, W, Y
Отрицательно заряженные - D, E
Полярные - C, D, E, H, K, N, Q, R, S, T
Положительно заряженные - H, K, R
Небольшие - A, C, D, G, N, P, S, T, V
Очень небольшие - A, G, S
Обеспечивающие поворот полипептидной цепи - A, C, D, E, G, H, K, N, Q, R, S, P, T
«Гибкие» - Q, T, K, S, G, P, D, E, R
Более консервативными являются замены в следующих подгруппах: валин/лейцин/изолейцин, фенилаланин/тирозин, лизин/аргинин, аланин/валин, аспарагин/глутамин. Консервативность в смысле свойств гидрофобности/гидрофильности и по массе/размерам также в основном соблюдается в участках CDRs вариантов антител в сравнении с любым из моноклональных антител 1-6. В данной области техники широко известна важность индекса гидрофобности белковой молекулы для ее взаимодействий с другими молекулами и биологической функции. Считается, что относительный гидропатический характер аминокислот влияет на вторичную структуру белковой молекулы, которая, в свою очередь, определяет ее взаимодействия с другими молекулами, например, ферментами, субстратами, рецепторами, ДНК, антителами, антигенами и прочими. Каждой аминокислоте приписывается так называемый индекс гидрофобности (гидропатичности), исходя из ее гидрофобности/гидрофильности и электрического заряда, а именно: изолейцин (+4.5); валин (+4.2); лейцин (+3.8); фенилаланин (+2.8); цистеин/цистин (+2.5); метионин (+1.9); аланин( +1.8); глицин (-0.4); треонин (-0.7); серин (-0.8); триптофан (-0.9); тирозин (-1.3); пролин (-1.6); гистидин (-3.2); глутаминовая кислота (-3.5); глутамин (-3.5); аспарагиновая кислота (-3.5); аспарагин (-3.5); лизин (-3.9); аргинин (-4.5). Также или дополнительно, постоянство сходcтва аминокислотных остатков определяют по численному значению сходства в компьютерных программах группы BLAST (например, в BLAST 2.2.8, доступный в Национальном центре биотехнологической информации США, с использованием стандартных параметров BLOSUM62: открытие пропуска = l l, продление пропуска = l). Подходящие для использования согласно данному изобретению варианты антител, как правило, по меньшей мере, на около 80% идентичны исходной последовательности. В соответствии с изобретением понятие «первая аминокислотная последовательность, по меньшей мере, на 70% идентична второй аминокислотной последовательности» означает, что первая последовательность идентична второй на 70; 71; 72; 73; 74; 75; 76; 77; 78; 79; 80; 81; 82; 83; 84; 85; 86; 87; 88; 89; 90; 91; 92; 93; 94; 95; 96; 97; 98; 99 или 100%. Понятие «первая аминокислотная последовательность, по меньшей мере, на 50% идентична второй аминокислотной последовательности» означает, что первая последовательность идентична второй на 50; 51; 52; 53; 54; 55; 56; 57; 58; 59; 60; 61; 62; 63; 64; 65; 66; 67; 68; 69; 70; 71; 72; 73; 74; 75; 76; 77; 78; 79; 80; 81; 82; 83; 84; 85; 86; 87; 88; 89; 90; 91; 92; 93; 94; 95; 96; 97; 98; 99 или 100%.
В некоторых воплощениях данного изобретения предлагаемые антитела являются химерными, как правило химерными мышино-человеческими. Термин «химерное антитело» относится к моноклональным антителам, молекула которых содержит домены VH и VL антитела нечеловеческого происхождения, а домены CH и CL - из человеческого антитела. Источником нечеловеческого антитела может служить любое животное, например, мышь, крыса, хомяк, кролик или другое. В частности, указанное мышино-человеческое химерное антитело содержит домены VH и VL любого из референсных антител mAb 101G5 или mAb 107G3.
В некоторых воплощениях данного изобретения предлагаемые антитела являются гуманизированными. В определенных воплощениях данного изобретения предлагаемое антитело является гуманизированным, содержащим шесть участков CDRs любого из референсных антител mAb 101G5 или mAb 107G3. В настоящем описании термин «гуманизированное антитело» относится к антителам, в молекуле которых каркасные участки (FR) модифицированы таким образом, что содержат аминокислотные последовательности из донорного иммуноглобулина иного видового происхождения (например, человеческого) по сравнению с исходным иммуноглобулином (например, мышиные CDRs).
В некоторых воплощениях данного изобретения предлагаемое антитело выбирают из группы, состоящей из антительных фрагментов Fab, F(ab')2, Fab' и scFv. В настоящем описании обозначение “Fab” подразумевает антительный фрагмент с молекулярной массой около 50 000, способный связывать антиген; Fab содержит примерно половину N-концевой части тяжелой цепи и всю легкую цепь, соединенные дисульфидной связью - такой фрагмент получается в результате обработки иммуноглобулина протеолитическим ферментом папаином. Обозначение “F(ab')2” относится к антительному фрагменту с молекулярной массой около 100 000, способному связывать антиген и содержащему кроме тех частей молекулы имимуноглобулина, которые имеются в Fab, еще шарнирный участок - такой фрагмент получается при расщеплении молекулы иммуноглобулина другой протеазой, пепсином. Обозначение “Fab'” относится к антительному фрагменту с молекулярной массой 50,000, способному связывать антиген и получающемуся в результате расщепления дисульфидной связи в шарнирном участке фрагмента F(ab')2. Обозначение «scFv» относится к одноцепочечному полипептиду, представляющему собой ковалентно соединенный гетеродимер VH:VL, который образуется в результате экспрессии слитого гена, включающего нуклеотидные последовательности, кодирующие VH, VL и пептидный линкер. Человеческий фрагмент scFv по данному изобретению включает участки CDR, сохраняющие исходную конформацию, что достигается, как правило, методами рекомбинантной ДНК.
Функциональные варианты антител с мутантными аминокислотными последовательностями получают путем мутагенеза (например, сайт-направленного или с помощью полимеразной цепной реакции) кодирующих полинуклеотидов с последующей проверкой сохранения нужной функции (например, тех функций, которые обсуждались выше) у мутантных антител функциональными аналитическими методами, описанными в настоящей заявке.
Антитела, перекрестно конкурирующие
с референсными антителами mAb101G5 или mAb107G3
Дополнительные антитела, обладающие свойствами, близкими к предпочтительным свойствам референсного антитела mAb 101G5 или mAb 107G3, описанными в настоящей заявке, идентифицируют по их способности перекрестно конкурировать (то есть статистически значимым образом конкурентно ингибировать связывание с данным антигеном) с указанным референсным антителом mAb 107G3 за связывание с BTN2A1, которое выявляют стандартными аналитическими методами.
Сначала у проверяемых антител определяют аффинность при связывании с BTN2A1, например, используя библиотеку рекомбинантных человеческих антител и применяя метод фагового дисплея или путем иммунизации трансгенных мышей, у которых экспрессируются антитела с человеческой вариабельной областью, антигенами BTN2A1, как описано в разделе «Примеры» (см. «Материалы и методы»).
В другом воплощении данного изобретения предлагаются антитела, которые связываются с тем же эпитопом, что и, по меньшей мере, референсное антитело mAb 107G3 или mAb 101G5. Как свидетельствуют результаты, представленные в разделе «Примеры», референсные антитела mAb 101G5 и mAb 107G3 связываются не с одним и тем же эпитопом BTN2A1.
Способность тестируемого антитела перекрестно конкурировать с антителами по данному изобретению к человеческому BTN2A1, то есть ингибировать их связывание с этим белком, демонстрирует, что тестируемое антитело конкурирует с антителами по данному изобретению за связывание с человеческим BTN2A1; согласно предположению, не имеющему ограничительного характера, такое антитело может связываться с тем же или сходным (например, структурно близким или пространственно разнесенным) эпитопом человеческого BTN2A1, что и антитела, по отношению к которым наблюдается конкуренция.
Для скрининга антител к BTN2A1 по их способности перекрестно конкурировать с референсным антителом mAb 107G3 и/или для скрининга антител к BTN2A1 по их способности связываться с тем же эпитопом, что и указанное референсное антитело, используют, например, следующий тест. Клетки BTN2KO, трансфицированные геном человеческого BTN2A1 (как правило, клетки HEK293T, как описано в разделе “Примеры»), обрабатывают референсным антителом mAb 107G3 в насыщающей концентрации (например, 10 мкг/мл). Различные дозы тестируемых mAbs к BTN2A1 затем исследуют для определения конкурирующего потенциала mAbs по отношению к референсному антителу mAb 107G3. Те моноклональные антитела, которые конкурируют с референсным антителом, не будут распознавать BTN2A1 в присутствии этого референсного антитела. Полученные данные выражают как среднюю интенсивность флуоресценции. Альтернативно, конкуренцию определяют путем эпитоп-специфичной сортировки с помощью биосенсорной системы, как описано в разделе «Примеры». Как правило, для эпитоп-специфичной сортировки антител рекомбинантный человеческий BTN2A1 иммобилизуют на биосенсоре и наносят референсное антитело, а затем конкурирующее с ним.
Далее у отобранных антител тестируют предпочтительные свойства референсного антитела mAb 101G5 или mAb 107G3, в частности, как описано ранее.
В одном из воплощений данного изобретения предлагается изолированное антитело, конкурирующее с референсным антителом mAb 101G5 или mAb 107G3 за связывание с BTN2A1, причем указанное антитело
i. обладает специфичностью к BTN2A1, в частности связывается с человеческим BTN2A1, экспрессирующимся в клетках, например, линии HEK-293T BTN2 KO, трансфицированных полинуклеотидами, кодирующими человеческий BTN2A1, как описано в разделе «Примеры»; говоря конкретнее, это связывание характеризуется EC50 менее 50 мкг/мл, более конкретно - менее 40 мкг/мл или KD, измеренной методом поверхностного плазмонного резонанса (SPR) или методом проточной флуорометрии на микросферах (платформа Luminex), как описано в разделе «Примеры», или с помощью системы Octet® (Abdiche et al. 2008), равной 10 нм или меньше, а также отношением аффиности при связывании BTN2A1 в сравнении с неспецифическим связыванием около 10:1, около 20:1, около 50:1, около 100:1, 10 000:1 или более (подробнее см. также выше) и/или
ii. подавляет дифференцировку моноцитов в макрофаги с фенотипом М2;
iii. вызывает реверсию фенотипа макрофагов M2 в сторону противоопухолевого фенотипа M1;
iv. напрямую запускает активацию NK-клеток;
v. усиливает цитотоксичность с участием NK-клеток.
Или же дополнительно указанное антитело:
vi. активирует образование цитолитических агентов (IFNγ или TNFα) Vγ9Vδ2-T- клетками, определяемое, как правило, так, как иллюстрируется в разделе «Примеры»; и/или
vii. активирует цитолитическую функцию Vγ9Vδ2-T-клеток, определяемую, как правило, так, как иллюстрируется в разделе «Примеры»; и/или
vii. активирует пролиферацию Vγ9Vδ2-T-клеток, определяемую, как правило, так, как иллюстрируется в разделе «Примеры».
В таких воплощениях данного изобретения указанные антитела предпочтительно не обладают перекрестной реактивностью с BTN3.
Как правило, у антитела, конкурирующего с референсным антителом mAb 101G5 или 107G3 за связывание с BTN2A1, функциональные свойства по приведенным выше пунктам (iii) - (v) в основном такие же, как соответствующие функциональные свойства референсного антитела mAb 101G5 или 107G3, или превосходят их. Выражение «в основном, такие же» в настоящей заявке подразумевает, что функциональный вариант обладает тем или иным свойством по меньшей мере на около 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100% от соответствующего функционального свойства референсного антитела mAb 101G5 или 107G3.
Как правило, у антитела по данному изобретению, конкурирующего с референсным антителом mAb 101G5 или 107G3 за связывание с BTN2A1, сохраняется, по меньшей мере, значительная часть (по меньшей мере 50%, 60%, 70%, 80%, 90%, 95% или 100%) аффинности и/или избирательности по сравнению с референсным антителом (например, mAb 107G3), а в некоторых случаях оно обладает большей аффинностью, избирательностью и/или специфичностью, чем референсное антитело (например, mAb 107G3).
В некоторых воплощениях данного изобретения перекрестно блокирующие антитела или антитела, конкурирующие с референсным антителом mAb 101G5 или 107G3 за связывание с BTN2A1, являются химерными, гуманизированными или человеческими рекомбинантными антителами.
Получение трансфектом, продуцирующих моноклональные антитела
Антитела по данному изобретению можно получать любым методом, известным в данной области техники, например, не ограничиваясь перечисленным здесь, любым химическим, биологическим, генетическим или ферментативным методом, применяя какой-то один из них или их сочетание. Как правило, специалист в данной области техники, зная аминокислотную последовательность нужного полипептида, вполне может получить указанные антитела стандартными методами получения полипептидов. Например, их можно синтезировать хорошо известными методами твердофазного синтеза, обычно используя для этого имеющееся в продаже оборудование для пептидного синтеза (например, продукцию компании Applied Biosystems, Фостер-Сити, шт. Калифорния, США) и следуя инструкциям производителя. Или же антитела по данному изобретению получают методами рекомбинантных ДНК, хорошо известными в данной области техники. Например, антитела получают как продукты экспрессии, встроив нуклеотидные последовательности, кодирующие данное антитело, в экспрессионный вектор и введя такой вектор в подходящий эукариотический или прокариотический организм-хозяин, в котором будут экспрессироваться нужные антитела, после чего их выделяют известными методами.
Соответственно, следующий объект настоящего изобретения - нуклеиновая кислота (полинуклеотид), кодирующая антитело, описанное в настоящей заявке. В частности, такая нуклеиновая кислота по данному изобретению кодирует тяжелую и легкую цепи антитела, согласно изобретению. Говоря конкретнее, такая нуклеиновая кислота содержит нуклеотидные последовательности, кодирующие VH или VL, которые, по меньшей мере, на 70%, 80%, 90%, 95% или 100% идентичны соответственным нуклеотидным последовательностям, кодирующим вариабельную область тяжелой (VH) или легкой (VL) цепи референсного антитела mAb 107G3.
Как правило, указанные полинуклеотиды являются молекулами ДНК или РНК, которые можно включить в состав любого пригодного вектора, например, плазмиды, космиды, эписомы, искусственной хромосомы, фагового или вирусного вектора. В настоящем описании термины «вектор», “вектор клонирования» и «экспрессионный вектор» означают носитель, в составе которого нуклеотидные последовательности ДНК или РНК (например, чужеродный ген) вводят в организм-хозяин, который вектором трансформируется, тем самым обеспечивается экспрессия (например, транскрипция и трансляция) введенной нуклеотидной последовательности. Таким образом, следующий объект данного изобретения относится к вектору, содержащему полинуклеотид, описанный в настоящей заявке. Такие векторы могут содержать регуляторные элементы, например, промоторы, энхансеры, терминаторы транскрипции и др., для инициации и регуляции экспрессии указанного антитела после введения вектора в организм-хозяин. Примеры промоторов и энхансеров, которые используются в экспрессионных векторах для животных клеток, включают промотор ранних генов и энхансер обезьяньего вируса SV40, служащие промотором длинные концевые повторы (LTR) и энхансер вируса лейкоза мышей Молони, промотор и энхансер гена иммуноглобулиновой тяжелой цепи и др. Для животных клеток можно использовать любой экспрессионный вектор, коль скоро в него можно встроить ген, кодирующий константную область человеческого антитела, и этот ген будет экспрессироватьсяю. Примеры векторов, подходящих для использования согласно данному изобретению, включают pAGE107, pAGE103, pHSG274, pKCR, pSG1βd2-4 и др. Другие примеры плазмид включают реплицирующиеся плазмиды, содержащие сайт начала репликации, или интегративные плазмиды - такие, как, например, pUC, pcDNA, pBR и др. Другие примеры вирусных векторов включают аденовирусные, ретровирусные, герпесвирусные векторы и векторы на основе аденоассоциированного вируса (AAV). Такие рекомбинантные векторы получают известными в данной области техники методами, например, путем трансфекции упаковывающих клеток или путем временной трансфекции плазмидами-помощниками или вирусами. Типичные примеры клеток, упаковывающих вирионы, включают клетки PA317, PsiCRIP, GPenv+, 293 и др. Подробные протоколы для получения таких дефектных по репликации рекомбинантных вирусов можно найти, например, в заявках WO 95/14785, WO 96/22378 и WO 94/19478, а также в патентах США №№ 5 882 877; 6 013 516; 4 861 719 и 5 278 056.
Следующий объект данного изобретения относится к клеткам-хозяевам, трансфицированным, инфицированным или трансформированным полинуклеотидом и/или вектором, как описано выше. В настоящем описании термин «трансформация» означает введение в организм/клетку-хозяин чужеродного (то есть происходящего не из данного организма или не из данных клеток) гена, последовательности ДНК или РНК, в результате чего в клетке/организме-хозяине экспрессируются введенный ген или нуклеотидная последовательность и образуется нужное вещество, как правило, белок или фермент, кодируемые введенным геном или нуклеотидной последовательностью. Клетка/организм-хозяин, получившие введенный ген или нуклеотидную последовательность и производящие кодируемый ими пролукт, называются трансформированными.
Полинуклеотиды, описанные в настоящей заявке, можно использовать для получения антител по данному изобретению в подходящей для этой цели экспрессионной системе. Термин «экспрессионная система» в настоящей заявке означает клетку-хозяин и совместимый с ней вектор в подходящих условиях, например, в условиях, обеспчивающих экспрессию белка, кодируемого чужеродной ДНК, которую ввели в клетку в составе вектора. Широко используемые экспрессионные системы включают служащие хозяевами клетки Escherichia coli, и плазмидные векторы, клетки насекомых и бакуловирусные векторы, клетки млекопитающих и подходящие для них векторы. Другие примеры клеток-хозяев включают, не ограничиваясь перечисленным здесь, прокариотические клетки (например, бактерий) и эукариотические клетки (например, дрожжей, млекопитающих, насекомых, растений и др.). Конкретные примеры клеток-хозяев включают E.coli, Kluyveromyces или Saccharomyces, клетки млекопитающих линий HEK-293, Vero, CHO, 3T3, COS и др.), а также первичные или установившиеся культуры клеток млекопитающих (например, полученные из лимфобластов, фибробластов, эмбриональных клеток, эпителиальных клеток, нервных клеток, адипоцитов и др.). Примеры клеток-хозяев также включают мышиные клетки SP2/0-Ag14 cell (ATCC CRL1581), P3X63-Ag8.653 (ATCC CRL1580), клетки CHO с дефектным геном дигидрофолатредуктазы (далее в настоящем описании этот ген обозначается DHFR) (Urlaub G. et al; 1980), крысиные клетки YB2/3HL.P2.G11.16Ag.20 (ATCC CRL1662; далее в настоящем описании эти клетки обозначаются YB2/0) и др.
Данное изобретение также относится к способу получения рекомбинантных клеток-хозяев, в которых экспрессируются антитела, описанные в настоящей заявке, причем указанный способ включает следующие этапы: (i) введение in vitro или ex vivo рекомбинантного полинуклеотида или вектора, описанных выше, в компетентные клетки-хозяева; (ii) культивирование in vitro или ex vivo полученных рекомбинантных клеток-хозяев и (iii) при необходимости отбор клеток, в которых экспрессируется указанное антитело и/или которые секретируют его. Такие рекомбинантные клетки-хозяева используют для получения антител по данному изобретению.
Антитела по данному изобретению должным образом выделяют из культуральной среды обычными методами очистки иммуноглобулинов, например, путем хроматографии на колонках с протеин А-сефарозой или гидроксиапатитом, путем гель-электрофореза, диализа или аффинной хроматографии.
В некоторых воплощениях данного изобретения человеческие химерные антитела получают следующим образом: получают нуклеотидные последовательности, кодирующие домены VL и VH, как описано ранее; конструируют вектор для экспрессии человеческих химерных анител путем встраивания этих последовательностей в экспрессионный вектор для животных клеток, содержащих гены, кодирующими области CH и CL человеческого антитела, и экспрессируют кодирующие последовательности путем введения вектора в клетки животных. Доменом СН человеческого химерного антитела может служить любая область молекулы человеческого иммуноглобулина, причем наиболее подходящими являются IgG любого подкласса, а именно IgG1, IgG2, IgG3 и IgG4. Также доменом CL человеческого химерного антитела может служить любая область молекулы человеческого иммуноглобулина; например можно использовать полипепетиды классов κ и λ. Получение химерных антител включает обычно применяемые методы рекомбинантных ДНК и приемы трансфекции, хорошо известные в данной области техники (см. Morrison S. L.. et al. (1984) и патенты США №№ 5 202 238 и 5 204 244).
Гуманизированные антитела по данному изобретению получают следующим образом: получают нуклеотидные последовательности, кодирующие участки CDRs, как описано ранее; конструируют вектор для экспрессии гуманизированных антител путем встраивания этих последовательностей в экспрессионный вектор, содержащий гены, кодирующие (i) константную область тяжелой цепи и каркасные участки вариабельной области тяжелой цепи, идентичные таковым человеческого антитела, и (ii) константную область легкой цепи и каркасные участки вариабельной области легкой цепи, идентичные таковым человеческого антитела, и экспрессируют указанные гены путем введения экспрессионного вектора в клетки подходящей клеточной линии. Экспрессионным вектором для гуманизированного антитела может служить такой вектор, в котором ген, кодирующий тяжелую цепь антитела, и ген, кодирующий легкую цепь антитела, входят в состав разных векторных частиц, или такой вектор, в котором содержатся оба этих гена (тандемный). Из соображений простоты конструирования и легкости введения экспрессионного вектора в клетки-хозяева, а также должного соотношения между уровнями экспрессии H- и L-цепей в клетке, для гуманизированного антитела предпочтителен экспрессионный вектор тандемного типа. Примеры тандемных экспрессионных векторов для гуманизированного антитела включают pKANTEX93 (WO 97/10354), pEE18 и т.п.
Методы гуманизации антител, базирующиеся на технологии рекомбинантных ДНК и трансфекции, хорошо известны в данной области техники (см., например, Riechmann L. et al. 1988; Neuberger M. S., et al. 1985). Антитела гуманизируют различными способами, известными в данной области техники, например, делается «прививка» участков CDRs (ЕР 239 400; заявка WO91/09967; патенты США №№. 5 225 539; 5 530 101 и 5 585 089), маскировка или модификация поверхностных аминокислотных остатков вариабельной области (ЕР 592 106 и 519 596; Padlan E. A. (1991); Studnicka G. M. et al. (1994); Roguska M. A. et al. (1994)), и комбинирование вариабельных доменов легкой и тяжелой цепей (патент США №.5 565 332). Общая стратегия применения технологии рекомбинантных ДНК для получения таких антител также известна (см. заявку на Европейский патент № 125 023 и заявку WO 96/02576).
Фрагмент Fab по данному изобретению получают путем обработки антитела, специфично взаимодействующего с AMH, протеолитическим ферментом папаином. Также Fab можно получить, если встроить ДНК, кодирующую Fab данного антитела, в вектор для прокариотической или эукариотической экспрессионной системы и ввести его, соответственно, в прокариотический или эукариотический организм, в котором будет экспрессироваться Fab.
Фрагмент F(ab')2 по данному изобретению получают путем обработки антитела, специфично взаимодействующего с AMH, протеолитическим ферментом пепсином. Также F(ab')2 можно получить путем соединения фрагментов Fab', описанных ниже, тиоэфирной или дисульфидной связью.
Фрагмент Fab' по данному изобретению получают путем обработки F(ab')2, специфично связывающего AMН, восстанавливающим агентом дитиотреитолом. Также Fab' можно получить, если встроить ДНК, кодирующую Fab` данного антитела, в экспрессионный вектор для прокариот или эукариот и ввести его в подходящий - прокариотический или эукариотический - организм, в котором Fab` будет экспрессироваться.
Для получения фрагмента scFv по данному изобретению получают комплементарную ДНК (кДНК), кодирующую домены VH и VL, как описано выше; конструируют ДНК, кодирующую scFv; встраивают эту ДНК в экспрессионный вектор для прокариот или эукариот и вводят его в подходящий - прокариотический или эукариотический - организм, в котором будет экспрессироваться scFv.
Для получения гуманизированного фрагмента scFv применяют хорошо известный метод «прививки» участков, определяющих комплементарность (CDRs): из донорного фрагмента scFv берут участки CDRs и объединяют их с каркасными участками scFv известной пространственной структуры (см., например, заявки W098/45322; WO 87/02671; патенты США №№5 859 205; 5 585 089; 4 816 567; ЕР № 0173494).
Сконструированные антитела по данному изобретению также включают такие антитела, в которых внесены изменения в аминокислотные остатки каркасных участков вариабельной области тяжелой и/или легкой цепей, например, с целью улучшения свойств антител. Как правило, такие изменения в каркасных участках делаются для того, чтобы снизить иммуногенность антитела. Например, один из подходов здесь состоит в «обратной» мутации одного или более аминокислотных остатков каркасных участков, в результате чего они становятся такими, как в соответствующей последовательности зародышевой линии. Говоря конкретнее, антитело, претерпевшее соматическую мутацию, может содержать в каркасных участках аминокислотные остатки, отличные от соответственных аминокислотных остатков в последовательности зародышевой линии, из которой происходит данное антитело. Такие аминокислотные остатки можно идентифицировать, сравнивая аминокислотные последовательности каркасных участков данного антитела и соответствующих последовательностей зародышевой линии, из которой происходит данное антитело. Для того, чтобы вернуть последовательности каркасных участков к исходной структуре последовательности зародышевой линии, произошедшую соматическую мутацию надо «обратить», вернув в данное положение тот аминокислотный остаток, который был в нем в последовательности зародышевой линии, что достигается путем, например, сайт-направленного мутагенеза или с помощью полимеразной цепной реакции. Такие «обратно мутантные» антитела тоже входят в объем данного изобретения. Другая модификация каркасных участков включает мутирование одного или более аминокислотных остатков в этих участках или даже в одном или более участках CDRs с целью ликвидации Т-клеточных эпитопов, тем самым снижая потенциальную иммуногенность антитела. Этот подход, называемый деиммунизацией, подробно описан в опубликованной заявке на патент США № 20030153043 (Carr et al.).
Конструирование фрагмента Fc
Антитела, описанные в настоящей заявке, отличаются одним или более функциональных или структурных свойств в обсуждавшихся выше аспектах или сочетанием выбранных функциональных и структурных свойств.
Антитела, описанные в настоящей заявке, могут быть любого изотипа. Выбор изотипа, как правило, определяется тем, какие эффекторные функции антитела требуются, например, «выключение» активности ADCC. Изотипы бывают, например, следующие: IgGl, IgG2, IgG3 и IgG4. Константная область легкой цепи может быть любая - κ или λ. Если нужно, класс антитела может быть изменен известными методами. Как правило, методы изменения (переключения) класса антитела применяют для смены подкласса в классе IgG, например, IgG2 вместо IgG1. Таким образом, эффекторные функции антител по данному изобретению можно изменять, переключая изотип, и получая, например, антитела IgGl, IgG2, IgG3, IgG4, IgD, IgA, IgE, или IgM для различных терапевтических целей. В некоторых воплощениях данного изобретения предлагаемое антитело является полноразмерным. В некоторых воплощениях данного изобретения предлагаемое полноразмерное антитело относится к подклассу IgG1. В некоторых воплощениях данного изобретения предлагаемое полноразмерное антитело относится к подклассу IgG4. В некоторых воплощениях данного изобретения антитело IgG4, специфичное к BTN2A, является стабилизированным антителом IgG4. Примеры стабилизированных антител IgG4, подходящих для использования согласно данному изобретению, - это антитела, в которых остаток аргинина в положении 409 [нумерация аминокислотных остатков указана в системе нумерации EU, согласованной с системой Кэбота (Kabat E.A. et al. 1991)] аминокислотной последовательности константной области тяжелой цепи человеческого IgG4 заменен на остаток лизина, треонина, метионина или лейцина, как правило - лизина (описано в заявке WO2006033386) и/или в которых шарнирный участок содержит последовательность Cys-Pro-Pro-Cys. Другие пригодные стабилизированные антитела IgG4 описаны в заявке WO2008145142.
В некоторых воплощениях данного изобретения предлагаемые антитела не содержат Fc-области, необходимой для антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC). Термин «домен Fc», «Fc-участок» и «Fc-область» относятся к С-концевому фрагменту тяжелой цепи антитела, например с 230-го по 450-е положение аминокислотной последовательности человеческой тяжелой цепи типа γ или соответствующей последовательности в тяжелых цепях других типов (например, α, δ, ε и μ в случае человеческих антител), или их природного аллотипа. Если не указано иное, в настоящем описании используется общепринятая нумерация аминокислотных последовательностей иммуноглобулинов по Кэботу (см. Kabat et al. Sequences of Protein of Immunological Interest, 5-е издание, Служба здравоохранения США, Национальный институт здоровья, Бетезда, шт. Мэриленд, США, 1991). В некоторых воплощениях данного изобретения предлагаемые антитела не содержат домен Fc, способный значительно связываться с полипептидом FcgRIIIA (CD16). В некоторых воплощениях данного изобретения в предлагаемых антителах домен Fc неполный (например, отсутствует домен CH2 и/или CH3) или они содержат домен Fc изотипа IgG2 или IgG4. В некоторых воплощениях данного изобретения предлагаемые антитела содержат Fab, Fab', Fab'-SH, F(ab')2, Fv, диатело, одноцепочечный антительный фрагмент или представляют собой указанные структуры, или содержат мультиспецифичное антитело, включающее множество различных антительных структур, или представляют собой такое мультиспецифичное антитело. В некоторых воплощениях данного изобретения предлагаемое антитело не соединено с токсичным агентом. В некоторых воплощениях данного изобретения один или несколько аминокислотных остатков заменены на другие аминокислотные остатки, в результате чего у антитела нарушено связывание с белком C2q и/или ослаблена или отсутствует комплемент-зависимая цитотоксичность (CDC). Этот подход подробно описан в патенте США № 6 194 551.
Другая модификация антител, раскрытая в настоящей заявке, - присоединение молекул полиэтиленгликоля (ПЭГилирование). Это делается, например, для того, чтобы продлить биологическое время полужизни антитела (например, в сыворотке крови). Для присоединения полиэтиленгликоля к антителу или антительному фрагменту проводится реакция с реакционноспособным эфиром или альдегидным производным полиэтиленгликоля в условиях, в которых одна или более полиэтиленгликольных групп присоединяются к молекуле антитела или к антительному фрагменту. Присоединение полиэтиленгликоля может осуществляться путем реакции ацилирования или алкилирования с реакционноспособными молекулами ПЭГ (или аналогичного реакционноспособного водорастворимого полимера). В настоящем описании термин «полиэтиленгликоль» включает любые формы ПЭГ, которые использовались для дериватизации других белков, например моно(CI-CIO)алкокси- или арилоксиполиэтиленгликоль или полиэтиленгликоль-малеимид. В некоторых воплощениях данного изобретения антитело, к которому присоединяют ПЭГ, не гликозилированное. Методы присоединения полиэтиленгликоля к белкам хорошо известны в данной области техники и применимы к антителам по данному изобретению. См., например, ЕР №. 0154 316 (Nishimura et al.) и 0 401 384 (Ishikawa et al.).
Другая модификация антител, рассматриваемая в настоящей заявке, - конъюгаты или слитые белки, включающие, по меньшей мере, антиген-связывающий участок антитела по данному изобретению и сывороточный белок, например человеческий сывороточный альбумин или его фрагмент, благодаря которойувеличивается время полужизни всей молекулы.
В некоторых воплощениях данного изобретения предлагаются также мультиспецифичные антитела. Примеры форматов мультиспецифичных антител по данному изобретению включают, не ограничиваясь перечисленным здесь, (i) гетероконъюгат из двух антител, поперечно сшитых химически, одно из которых специфично к BTN2А, а другое специфично к другому антигену; (ii) одно антитело, содержащее два различных антиген-связывающих участков; (iii) одноцепочечное антитело, содержащее два различных антиген-связывающих участка, например два фрагмента scFv, соединенных друг за другом дополнительным пептидным линкером; (iv) антитела с двойными вариабельными доменами (DVD-Ig), в которых каждая легкая цепь и каждая тяжелая цепь содержит по два вариабельных домена, соединенных друг за другом коротким пептидным линкером (Wu et al., Generation and Characterization of a Dual Variable Domain Immunoglobulin (DVD-Ig™) Molecule, In : Antibody Engineering, Springer Berlin Heidelberg 2010); (v) химически соединенный биспецифичный фрагмент (Fab')2; (vi) тандемное димерное антитело (TandAb) - два слитых одноцепочечных диатела, вместе образующих тетравалентное биспецифичное антитело, в каждом из которых содержится по два участка связывания для каждого из.антигенов-мишеней; (vii) флекситело - комбинацию фрагментов scFv с диателом, образующую мультивалентную молекулу; (viii) так называемую молекулу «док и лок», основанную на домене димеризации и докинга протеинкиназы A, которая в случае применения по отношению к Fabs, приводит к образованию биспецифичного трехвалентного связывающего белка, состоящего из двух идентичных фрагментов Fab, связанных с другим фрагментом Fab; (5) так называемую скорпионовую молекул, содержащую, например, два scFv, слитых с обоими концами человеческого Fab; (x) диатело - нековалентный димер scFv. Другой пример формата биспецифичного антитела - молекулы, подобные IgG, с комплементарными доменами CH3, что способствует образованию гетеродимеров. Такие антитела получают известными методами, например, используя технологии Triomab/Quadroma (Trion Pharma/Fresenius Biotech), Knob-into-Hole (Genentech), CrossMAb (Roche) и стратегию электростатического управления (Amgen), LUZ-Y (Genentech), метод замены цепей Strand Exchange Engineered Domain body (SEEDbody)(EMD Serono), Biclonic (Merus) и DuoBody (Geнм ab A/S). В некоторых воплощениях данного изобретения биспецифичные антитела получают путем контролируемого обмена Fab-плечами, обычно по технологии DuoBody. Методы получения биспецифичных антител in vitro посредством контролируемого обмена Fab-плечами описаны в заявках WO 2008119353 и WO 2011131746 (обе - Genmab A/S). В одном типичном методе, описанном в заявке WO 2008119353, биспецифичное антитело образуется при обмене "Fab-плечами" или "половинками молекул" (обменивается тяжелая цепь и соединенная с ней легкая цепь) между двумя моноспецифичными антителами, которые оба содержат IgG4-подобные участки CH3, при инкубации в восстанавливающих условиях. Получаемый продукт представляет собой биспецифичное антитело, содержащее два Fab-плеча, которые могут иметь различные аминокислотные последовательности. Согласно другому типичному методу, описанному в заявке WO 2011131746, биспецифичные антитела по данному изобретению получают способом, включающим следующие этапы, причем, по меньшей мере, одно из первого и второго антител является антителом по данному изобретению: a) получение первого антитела, содержащего область Fc иммуноглобулина, причем эта область Fc содержит первый участок CH3; b) получение второго антитела, содержащего область Fc иммуноглобулина, причем эта область Fc содержит второй участок CH3; при этом аминокислотные последовательности первого и второго участков CH3 различны и таковы, что гетеродимерное взаимодействие между указанными первым и вторым участками CH3 сильнее, чем каждое из гомодимерных взаимодействий между первыми и вторыми участками CH3; c) инкубация указанных первого и второго антитела вместе в восстанавливающих условиях; и d) получение биспецифичного антитела, при этом первое антитело является антителом по данному изобретению, а второе антитело обладает другой специфичностью связывания, либо наоборот. Восстанавливающие условия создают, например, добавлением восстанавливающего реагента, например, выбираемого из 2-меркаптоэтиламина, дитиотреитола и трис-(2-карбоксиэтил)фосфина. Стадия d) может дополнительно включать возврат к не восстанавливающим или менее восстанавливающим условиям, например, путем удаления восстанавливающего реагента, например, обессоливанием. Как правило, аминокислотные последовательности первого и второго участков CH3 различны и в них имеется лишь несколько относительно консервативных, асимметричных мутаций, так что гетеродимерное взаимодействие между первым и вторым участками CH3 сильнее, чем каждое из гомодимерных взаимодействий между первыми и вторыми участками CH3. Более подробно об этих взаимодействиях и о том, как они могут осуществляться, раскрыто в заявке WO 2011131746, содержание которой полностью включено в настоящее описание в качестве ссылки. Далее приведены типичные воплощения сочетаний таких асимметричных мутаций, причем, если необходимо, то одна или обе области Fc относятся к изотипу IgG1.
Таким образом данное изобретение обеспечивает биспецифичные или мультиспецифичные антитела (белки), содержащие антитело к BTN2А, описанное в настоящей заявке. Соответственно, в объем данного изобретения входят биспецифичные антитела, содержащие, по меньшей мере, один первый участок специфичного связывания с BTN2A, например, один антиген-связывающий участок антитела, описанного в настоящей заявке, и второй участок специфичного связывания со вторым эпитопом мишени. Например, биспецифичное антитело по данному изобретению может включать один антиген-связывающий участок, содержащий, по меньшей мере:
- участок CDR1 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:3, участок CDR2 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:4, участок CDR3 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:5, участок CDR1 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:6, участок CDR2 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:7 и участок CDR3 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:8, или
- участок CDR1 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:21, участок CDR2 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:22, участок CDR3 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:23, участок CDR1 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:24, участок CDR2 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:25 и участок CDR3 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:26.
В одном из воплощений данного изобретения предлагаемый биспецифичный белок содержит второй участок специфичного связывания с BTN3. Говоря конкретнее, этот биспецифичный белок включает также антиген-связывающий участок активирующих антител к BTN3A, которые специфично связываются с BTN3A и активируют цитолитическую функцию Vγ9/Vδ2-Т-лимфоцитов.
Кроме того, в воплощении данного изобретения, в котором биспецифичный белок является мультиспециифчным, он также включает третий участок специфичного связывания помимо тех, которые связываются с первым и вторым эпитопами мишени.
В одном из воплощений данного изобретения биспецифичные белки, описанные в настоящей заявке, в качестве участка специфичного связывания содержат, по меньшей мере, одно антитело или антительный фрагмент, включая, например, Fab, Fab', F(ab')2, Fv, унитело и одноцепочечный Fv. Это, по меньшей мере, одно антитело может быть представлено димером легкой или тяжелой цепи, или каким-либо минимальным фрагментом, например, Fv или одноцепочечным конструктом, как описано в патенте США №. 4 946 778 (Ladner et al.).
К другим антителам, которые можно использовать в биспецифичных белках, описанных в настоящей заявке, относятся мышиные, химерные и гуманизированные моноклональные антитела.
Фармацевтические композиции
В другом аспекте данного изобретения предлагается композиция, например, фармацевтическая композиция, содержащая, по меньшей мере, одно антитело, описанное в настоящей заявке, объединенное с фармацевтически приемлемым носителем. Такие композиции могут включать одно антитело или комбинацию антител (например, двух или более различных антител), описанных выше. Фармацевтические композиции, раскрытые в настоящей заявке, также можно вводить индивиду в рамках комбинированной терапии, то есть в сочетании с другими лечебными агентами.
Например, антитело по данному изобретению, как правило, комбинируют, по меньшей мере, с одним противовирусным, или противовоспалительным агентом, или с другим антипролиферативным агентом. Примеры терапевтических агентов, которые можно использовать в комбинированной терапии, описаны подробно ниже в разделе о применении антител по данному изобретению.
В настоящем описании термин «фармацевтически приемлемый носитель» включает любые и все физиологически совместимые растворители, дисперсионные среды, покрывающие агенты, антибактериальные и противогрибковые агенты, агенты, обеспечивающие нужное осмотическое давление, агенты, замедляющие всасывание в организме, и другие агенты. Носитель по данному изобретению должен быть пригоден для внутривенного, внутримышечного, подкожного, парентерального, интраспинального или интраэпидермального введения (например, путем инъекции или инфузии). В одном из воплощений данного изобретения носитель пригоден для подкожного введения.
В зависимости от пути введения в организм, активное вещество, то есть антитело по данному изобретению, может быть покрыто материалом, защищающим его от действия кислот и других естественных факторов, способных его инактивировать. Лекарственная форма фармацевтической композиции по данному изобретению, путь ее введения в организм, дозировка и схема введения зависят, разумеется, от специфики состояния, подлежащего лечению, степени тяжести заболевания, возраста, массы тела и пола больного и от других факторов.
Фармацевтические композиции по данному изобретению имеют состав, пригодный для нужного пути введения в организм - местного, перорального, парентерального, интраназального, внутривенного, внутримышечного, подкожного или внутриглазничного и др.
Применения и способы по данному изобретению
Антитела по данному изобретению можно использовать в лечебных целях и для диагностики in vitro и in vivo. Например, эти белки можно вводить в клеточные культуры, например, in vitro, ex vivo или in vivo, или субъекту, например in vivo, для лечения, предотвращения или диагностирования различных расстройств.
Антитела по данному изобретению являются антителами к BTN2A1, способными подавлять дифференцировку моноцитов в макрофаги с проопухолевым фенотипом М2, секрецию цитокинов и/или ингибиторные свойства Т-клеток.
Альтернативно или предпочтительно - в дополнение к сказанному - антитела по данному изобретение непосредственно связываются с BTN2A (главным образом, с BTN2A1) на плазматической мембране NК-клеток и запускают их активацию и цитотоксичность, направленную против раковых клеток.
В некоторых воплощениях данного изобретения предлагаемые антитела также активируют пролиферацию и цитолитическую функцию Vγ9/Vδ-Т-клеток и образование ими цитокинов.
Таким образом, антитела по данному изобретению можно использовать для того, чтобы справиться с механизмами иммуносупрессии, наблюдающимися при раковых заболеваниях и хронических инфекциях
В некоторых воплощениях данного изобретения предлагаемые антитела можно использовать для снижения иммуносупрессивного действия опухолевого окружения.
Антитела к-BTN2A, описанные в настоящей заявке, также способны усиливать цитотоксическое действие NK-клеток и/или Th1-лимфоцитов, воздействуя как на опухолевое микроокружение (способствуя дифференцировке моноцитов в макрофаги с фенотипом М1 и подавляя дифференцировку по фенотипу М2), так и непосредственно на NK-клетки.
В некоторых воплощенияхК данного изобретения предлагаемые антитела (например, антитело 107G3 и его варианты, описанные в настоящейз аявке) также активируют пролиферацию и цитолитическую функцию Vγ9/Vδ-Т-клеток и образование ими цитокинов. Такие антитела могут действовать одновременно в трех компартментах иммунной защиты: на NK-клетки, на макрофаги и на γδ-T-клетки, тем самым представляя собой мощный инструмент для лечения рака, а именно солидных опухолей.
В доклинических исследованиях было убедительно показано, что NК-клетки способны ликвидировать лейкозные клетки миелоидного ряда. Однако, например, при хроническом миелоидном лейкозе по мере прогрессирования заболевания количество NК-клеток становится меньше, они хуже отвечают на стимуляцию и проявляют пониженную цитолитическую активность. При остром миелоидном лейкозе более высокая цитолитическая активность NK-клеток как при диагностировании, так и при ремиссии служит признаком лучшего результата лечения в долгосрочной перспективе (Carlsten M, Järås M. Natural Killer Cells in Myeloid Malignancies: Immune Surveillance, NK Cell Dysfunction, and Pharmacological Opportunities to Bolster the Endogenous NK Cells. Front Immunol. 2019). Исходя из этого в некоторых воплощениях данного изобретения антитела, проявляющие способность запускать NK-клетки, можно использовать в комбинации с методами лечения, затрагивающими NK-клетки, например, с адоптивной клеточной терапией, включающей перенос больному NK-клеток для восстановления их функций, и/или запуска, или усиления их цитотоксичности. В частности, антитела по данному изобретению можно использовать при лечении солидных опухолей, которые обычно устойчивы к киллерному действию NK-клеток. В настоящем описании термины «рак/раковое заболевание», «гиперпролиферация/гиперпролиферативный», и «неоплазия/неопластический» относятся к клеткам, обладающим способностью к автономному размножению, то есть к аномальному состоянию, отличающемуся быстрой пролиферацией (размножением и распространением) клеток. Гиперпролиферативное и неопластическое заболевание/состояние можно отнести к патологическому, то есть характеризующемуся или являющемуся болезненным состоянием, а можно отнести к не патологическому, то есть отклоняющемуся от нормального, но не ассоциированного с болезненным состоянием. Указанные термины включают все типы злокачественного роста или онкогенных процессов, образования метастазов или злокачественно трансформированных клеток, тканей или органов, безотносительно к гистопатологическому типу или стадии инвазивности.
Термины «рак» или «новообразование» включают злокачественные новообразования/опухоли различных систем органов, например поражения легких, молочных желез, щитовидной железы, лимфоидных органов, желудочно-кишечного тракта и мочеполовых путей, а также аденокарциномы, которые включают такие злокачественные новообразования, как большинство раковых опухолей толстой кишки, плоскоклеточную карциному легкого, кожи или влагалища, почечноклеточную карциному, рак предстательной железы и/или опухоли яичек, немелкоклеточную карциному легкого, мелкоклеточную карциному легкого, карциному эндометрия, карциному яичника, эндоцервикальную аденокарциному, рак поджелудочной железы, рак тонкого кишечника, рак пищевода, а в более широком смысле любое раковое заболевание, которое можно лечить, применяя к больным указанными раковыми заболеваниями стимуляцию in vivo активации и/или пролиферации γδ-T-клеток.
Примеры раковых заболеваний включают, не ограничиваясь перечисленным здесь, злокачественные гематологические новообразования, например В-клеточные лимфоидные новообразования, Т-клеточные лимфоидные новообразования, неходжкинскую лимфому (NHL), В-клеточную неходжкинскую лимфому (B-NHL), Т-клеточную неходжкинскую лимфому (T-NHL), хронический лимфоцитарный лейкоз (CLL), мелкоклеточную лимфоцитарную лимфому (SLL), лимфому из клеток мантийной зоны (MCL), NK-клеточные лимфоидные новообразования и новообразования из клеток миелоидного ряда, в том числе острый миелоидный лейкоз.
Примеры раковых заболеваний, не затрагивающих кровеносную систему, включают, не ограничиваясь перечисленным здесь, рак толстой кишки, рак молочной железы, рак легкого, рак яичника, рак головного мозга, рак предстательной железы, рак головы и шеи, рак поджелудочной железы, рак мочевого пузыря, колоректальный рак, злокачественные опухоли из клеток костной ткани, рак шейки матки, рак печени, рак ротовой полости, рак пищевода, рак щитовидной железы, рак почки, рак желудка, рак яичка и рак кожи.
Примеры хронических инфекций включают, не ограничиваясь перечисленным здесь, вирусные, бактериальные и грибковые инфекции и паразитарные инвазии, например, хронический гепатит, инфекционные заболевания легких, инфекции нижних дыхательных путей, бронхит, грипп, пневмонию и инфекции, передающиеся половым путем.
Соответственно, данное изобретение относится к способу лечения одного или более расстройств, указанных выше, у нуждающегося в этом субъекта, включающему введение ему терапевтически эффективного количества антител к BTN2A, описанных в настоящей заявке.
Антитела для описанных выше применений вводят сами по себе, как отдельный активный ингредиент, или в сочетании с вспомогательными ингредиентами или с другими лечебными средствами, например, цитокинами, противовирусными, противовоспалительными или цитотоксическим, антипролиферативными, химиотерапевтическими или противоопухолевыми агентами, средствами для клеточной терапии (например, композициями γδ-T-клеток или с N-клеток), например для лечения или предотвращения заболеваний, указанных выше.
Например, антитела для указанных выше применений можно использовать в комбинации с клеточной терапией, в частности с использованием γδ-T-клеток, NK-клеток, или с химиотерапией, антинеопластическими или иммунотерапевтическими агентами.
В настоящем описании термин «клеточная терапия» относится к терапевтическому подходу, включающему введение нуждающемуся в этом субъекту in vivo, по меньшей мере, терапевтически эффективного количества клеточной композиции. Вводимые клетки могут быть аллогенными либо аутологичными для пациента. Термин «γδ-T-клеточная терапия» относится к такой клеточной терапии, при которой композиция клеток включает в качестве активного начала γδ-T-клетки, в частности Vγ9/Vδ2-Т-клетки (например, адоптивный перенос γδ-T-клеток или γδ-T-клеток, в которых экспрессируется химерный рецептор антигена). Термин «NK-клеточная терапия» относится к такой клеточной терапии, при которой композиция клеток включает в качестве активного компонента NK-клетки, например, адоптивный перенос NK-клеток или NK-клеток, в которых экспрессируется химерный рецептор антигена (CAR-NKs).
Термин «средство для клеточной терапии» относится к композиции клеток, которую вводят указанному больному в терапевтических целях. Указанное средство для клеточной терапии включает терапевтически эффективную дозу клеток и, при необходимости, дополнительные эксципиенты, вспомогательные вещества или иные фармацевтически приемлемые носители.
Подходящие антинеопластические агенты включают, не ограничиваясь перечисленным здесь, алкилирующие агенты (например, циклофосфамид, мехлорэтамин, хлорамбуцил, мелфалан, нитрозомочевину, темозоломид), антрациклины (например, даунорубицин, доксорубицин, эпирубицин, идарубицин, митоксантрон, валрубицин), таксаны (например, пацитаксел, доцетаксел), эпотилоны, ингибиторы топоизомеразы II (например, этопозид, тенипозид или тафлупозид) аналоги и предшественники аналогов нуклеотидов (например, азацитидин, азатиоприн, капецитабин, цитарабин, фторурацил, гемцитабин, гидроксимочевину, меркаптопурин, метотрекесат или тиогуанин), пептидные антибиотики (например, карбоплатин, цисплатин и оксалиплатин), ретиноиды (например, третиноин, алитретиноин, бексаротен), алкалоиды барвинка и их производные (например, винбластин, винкристин, виндезин, винорелбин), средства прицельной терапии, например ингибиторы киназ (например, ибрутиниб, иделализиб, эрлотиниб, гефитиниб, иматиниб, вемурафениб, висмодегиб), ингибиторы протеасом (например, бортезомиб, карфилзомиб), ингибиторы гистондезацетилазы (например, вориностат или ромидепсин).
Примеры иммунотерапевтических агентов включают, не ограничиваясь перечисленным здесь, фосфоантигены (например, золедроновую кислоту или другие бисфосфонаты), антитела к белку запрограммированной клеточной смерти (PD-1), антитела к лиганду этого белка (PD-L1), антитела к белку CTLA-4 и цитокины [например, интерлейкин-2 (IL-2) (Choudhry H/ et al. 2018, Biomed. Res. Int.), интерлейкин-15 (IL-15) (Patidar M. et al. Cytokine Growth Factor Rev. 2016), интерлейкин-21 (IL-21) (Caccamo N. et al. PLoS One. 2012) или интерлейкин-33 (IL-33) (Duault C. et al. J. Immunol. 2016)], или их производные или рекомбинантные формы, или любые цитокины, способные вызывать активность лимфоцитов (например, пролиферацию, или образование цитокинов, или метаболические изменения). Термин «производное» употребляется применительно к любой модификации цитокина, например, присоединению полиэтиленгликоля (PEG), мутациям, например делециям, заменам или вставкам аминокислотных остатков, или ассоциации с потенцирующими агентами [например, комплексы IL15/IL15Ra, слитые с Fc IgG1, где в IL-15 имеется дополнительная мутация (asn72asp), что еще увеличивает биологическую активность, так что этот комплекс становится суперагонистом IL-2 и IL-15Rβγ (Rhode P.R. et al, Cancer Immunol. Res. 2016) (Barroso-Sousa R. et al, Curr. Oncol. Rep. 2018)].
Термин «IL-2» имеет общепринятое значение и в настоящем описании относится к человеческому интерлейкину-2. В основном IL-2 регулирует активность лимфоцитов, связываясь со своим рецептором на их поверхности.
Термин «IL-15» имеет общепринятое значение и в настоящем описании относится к человеческому интерлейкину-15. Подобно IL-2, IL-15 подает сигнал лимфоцитам, связываясь с комплексом, состоящим из β-цепи рецептора IL-2/IL-15 (CD122) и общей γ-цепи (γ-C, CD132). IL-15 регулирует активацию и пролиферацию Т-клеток и NK-клеток.
Термин «IL-21» имеет общепринятое значение и в настоящем описании относится к человеческому интерлейкин-21. С IL-21 связывают плейотропные свойства, в том числе, но не только, усиление цитотоксичности NK-клеток и (CD8+) T-клеток, влияние на дифференцировку плазматических клеток и подавление Treg-клеток.
Термин «IL-33» имеет общепринятое значение и в настоящем описании относится к человеческому интерлейкину-33. Считается, что IL-33 служит эндогенным тревожным сигналом (алармином), который выделяется при стрессе или повреждении в ткани; он относится к семейству интерлейкина-1 и связывается с рецептором ST2. Известно, что IL-33 эффективно стимулирует TH1-иммунные клетки, NK-клетки, инвариантные лимфоциты, несущие как маркеры NK-клеток, так и Т-клеточные дифференцировочные антигены (iNKT-клетки), и (CD8)T-клетки.
Обозначение «PD-1» имеет общепринятое значение и в настоящем описании относится к рецепторному белку 1 запрограммированной клеточной смерти. Также оно относится к трансмембранному белку типа I семейства сигнальных рецепторных белков CD28-B7, которое включает костимулирующий корецептор CD28, антиген-4 цитотоксических Т-лимфоцитов (CTLA-4), индуцибельный костимулирующий белок (ICOS), и ингибирующий рецепторный белок, называемый В/Т-лимфоцитарным аттенюатором (BTLA) (Greenwald RJ et al., 2005, Riley JL et al. 2005).
Термины «антитело к PD-1» или «антитело к PD-L1» имеют общепринятое значение и относятся к антителам, обладающим сродством связывания с PD-1 или его лигандом PD-L1, соответственно, и являющимися антагонистами PD-1, то есть ингибирующими каскад передачи сигнала с участием PD-1 и ингибирующими связывание PD-1 с его лигандами PD-L1 и PD-L2. Такие антитела к PD-1 или к PD-L1, предпочтительно, инактивируют PD-1, проявляя при этом большую аффинность и силу взаимодействия, чем при взаимодействии с другими подтипами и изоформами представителей семейства сигнальных рецепторных белков CD28-B7 (CD28; CTLA-4; ICOS; BTLA). Аналитические методы для определения антагонизма в отношении PD-1 хорошо известны специалистам в данной области техники; они описаны, например, в работах Greenwald et al., 2005; Riley et al., 2005.
Примеры таких антител к PD1 включают, не ограничиваясь перечисленным здесь, ниволумаб, пембролизумаб, авелумаб, дуравлумаб, цемиплимаб или атезолизумаб.
В соответствии со сказанным выше в еще одном аспекте данного изобретения предлагается:
описанный выше способ, включающий совместное введение, например, одновременное или последовательное, терапевтически эффективного количества антитела к BTN2A1 по данному изобретению и, по меньшей мере, еще одного другого лекарственного средства, причем указанное другое лекарственное средство является противовирусным или противовоспалительным агентом, или иммунотерапевтическим агентом, или цитокином, или средством для клеточной терапии (например, γδ-T-клетками), например, как указано выше.
В одном из воплощений данного изобретения предлагаемые антитела используют для выявления уровня растворимого BTN2A1 или количества клеток, в которых экспрессируется BTN2A1. Это достигается, например, путем контактирования образца (например, образца in vitro) и контрольного образца с антителами к BTN2A1 в условиях, обеспечивающих образование комплекса такого антитела с BTN2A1 (в форме, экспонированной на клеточной поверхности, или в растворимой форме, например, в образце крови). Любые комплексы, образованные указанным антителом и BTN2A1, выявляются и далее проводится сравнение образца с контролем. Например, применительно к композициям по данному изобретению можно использовать такие стандартные, хорошо известные в данной области техники методы, как ELISA и проточная цитометрия.
В одном из аспектов данного изобретения также предлагаются способы для выявления присутствия BTN2A1 (например, антигена человеческого BTN2A1) в образце или количественного определения BTN2A1, включающие контактирование образца и контрольного образца с антителом или белком по данному изобретению, или с их антиген-связывающим участком, которые специфично связываются с BTN2A1, в условиях, обеспечивающих образование комплекса антитела или его части с BTN2A1. Затем образование комплекса выявляют и по разнице между данными, полученными для образца и для контроля, судят о присутствии BTN2A1 в образце.
В объем данного изобретения входят также наборы, состоящие из композиций (например, гуманизированных антител, конъюгированных антител и мультиспецифичных белков) по данному изобретению и инструкций по их использованию. Набор по данному изобретению может также содержать, по меньшей мере, один дополнительный реагент, или одно или более дополнительных антител, или один или более дополнительных белков. Обычно набор включает этикетку с указанием предполагаемого использования содержимого набора. Термин «этикетка» включает прилагающуюся к набору информацию на бумажном или ином носителе; этикетка может быть на упаковке или внутри нее, или как-то иначе сопровождать набор. Набор по данному изобретению может также содержать средства для определения того, относится ли данный пациент к группе, в которой достигается терапевтический эффект от лечения антителами к BTN2A1, как описано выше.
Другой терапевтический подход базируется на использовании гуманизированных антител, описанных в настоящей заявке, в качестве агентов, избирательно активирующих NK-клетки, выделенные из образца, взятого у человека.
Таким образом, данное изобретение относится к способу лечения нуждающегося в этом субъекта, включающему:
(a) выделение клеток крови, включающих NK-клетки, например, мононуклеаров периферической крови (PBMC), из образца крови субъекта;
(b) размножение NK-клеток in vitro в присутствии антител к BTN2A1, как описано в настоящей заявке, и при необходимости других клеток - опухолевых или вспомогательных;
(c) сбор размноженных NK-клеток;
(d) при необходимости, приготовление препарата размноженных NK-клеток и введение терапевтически эффективного количества указанных NK-клеток субъекту.
Данное изобретение также относится к применению гуманизированных антител, описанных в настоящей заявке, в качестве агентов, избирательно активирующих химерные рецепторы антигенов (CAR) NК-клеток. Белки CAR NK-клеток и их использование в адоптивной NK-клеточной иммунотерапии рака описаны, например, в работе Rezvani, K. et al. “Adoptive cell therapy using engineered natural killer cells” (Bone Marrow Transplant 2019).
Данное изобретение также относится к антителам к BTN2A1, раскрытым в настощей заявке, для применения in vivo в качестве потенцирующих агентов при NK-клеточной терапии у нуждающегося в этом субъекта, как правило больного раком.
В настоящем описании термин «NK-клеточная терапия” относится к лечению, включающему введение нуждающемуся в этом субъекту, по меньшей мере, эффективного количества NK-клеток. Вводимые N-клетки могут быть аллогенными либо аутологичными для данного субъекта. В конкретных воплощениях данного изобретения NK-клетки для такого лечения генетически модифицированы путем делеции или нокаута, либо вставки или кнокинга определенных генов. В конкретных воплощениях данного изобретения указанные NK-клетки включают NK-клетки, в которых экспрессируется химерный рецептор антигена. Эти NK-клетки затем размножают и/или очищают ex vivo. Альтернативно, эти NK-клетки включают в состав клеточной композиции, содержащей и другие клетки крови и, например, другие клетки иммунной системы. Ссылки на работы, в которых рассматривается γδ-T-клеточная терапия, можно найти в работе Rezvani, K. Bone Marrow Transplant 2019.
Данное изобретение также относится к способу лечения больных раком, например, страдающих злокачественными заболеваниями кровеносной системы, в частности лейкозами, например острым миелоидным лейкозом, и имеющих опухолевые клетки, например злокачественные клетки крови, причем указанный способ включает:
(i) введение указанному субъекту эффективного количества антител к BTN2A1, описанных в настоящей заявке, и
(ii) введение указанному субъекту эффективного количества NK-клеточной композиции;
при этом указанное эффективное количество антител к BTN2A1 может способствовать противоопухолевому цитолизу, опосредованному указанной NK-клеточной композицией, направленному против указанных опухолевых клеток. Данное изобретение также относится к способу лечения нуждающегося в этом субъекта, причем указанный способ включает совместное (одновременное или последовательное) введение NK-клеток, например, NK-клеток, несущих CAR, и гуманизированных антител, описанных в настоящей заявке.
В альтернативных или дополнительных воплощениях данного изобретения терапевтический подход также основывается на применении гуманизированных антител, описанных в настоящей заявке, в качестве агентов, избирательно вызывающих экспансию и/или активацию Vγ9/Vδ2-T-клеток, выделенных из образца, взятого у человека.
Данное изобретение также относится к способу лечения нуждающегося в этом субъекта, включающему:
(a) выделение клеток крови, включающих Vγ9/Vδ2-T-клетки, например, выделение PBMC из образца крови субъекта;
(b) размножение in vitro Vγ9/Vδ2-T-клеток в присутствии антител к BTN2A1, описанных в настоящей заявке, и при необходимости других клеток - опухолевых или вспомогательных;
(c) сбор выращенных Vγ9/Vδ2-T-клеток,
(d) при необходимости, приготовление препарата размноженных Vγ9/Vδ2-T-клеток и введение субъекту терапевтически эффективного количества указанных Vγ9/Vδ2-T-клеток.
Данное изобретение также относится к применению гуманизированных антител, раскрытых в настоящем описании, в качестве агентов, избирательно вызывающих экспансию Vγ9/Vδ2-T-лимфоцитов, несущих химерный антигенный рецептор (CAR). (CAR)γδ-T-клетки и их использование в адоптивной Т-клеточной иммунотерапии рака описаны, например, в работе Mirzaei et al, Cancer Lett. 2016.
Антитела по данному изобретению также можно использовать для получения искусственного Т-клеточного рецептора [известного также под названием химерного Т-клеточного рецептора, или химерного антигенного рецептора (CAR). Например, вариабельные области антитела могут быть использованы для создания Fab или scFv, которые могут быть присоединены посредством спейсера к трансмембранному домену и сигнальному эндодомену Т-клеточного рецептора (TCR), и далее экспонированы на поверхности Т-клеток. Такие CAR используют в терапии с адоптивным переносом иммунокомпетентных клеток, например, для лечения пролиферативных расстройств.
Данное изобретение также относится к антителам к BTN2A1 для применения in vivo в качестве потенцирующих агентов при γδ-T--клеточной терапии у нуждающегося в этом субъекта, как правило, больного раком.
В настоящем описании термин «γδ-T-клеточная терапия” относится к лечению, включающему введение нуждающемуся в этом субъекту, по меньшей мере, эффективного количества γδ-T-клеток. Вводимые γδ-клетки могут быть аллогенными либо аутологичными для данного субъекта. В конкретных воплощениях данного изобретения γδ-T-клетки для такого лечения генетически модифицированы путем делеции или нокаутирования либо вставки или кнокинга определенных генов. В конкретных воплощениях данного изобретения указанные γδ-T-клетки включают γδ-T-клнтки, в которых экспрессируется химерный антигенный рецептор. Эти γδ-T-клетки затем могут быть размножены и/или очищены ex vivo. Альтернативно, эти γδ-T-клетки могут быть включены в состав клеточной композиции, содержащей и другие клетки крови и, например, другие клетки иммунной системы. Ссылки на работы, в которых рассматривается γδ-T-клеточная терапия, можно найти в работах Pauza C. D. et al, Front. Immunol. 2018; J. Saudemont A. et al, Frontiers Immunol. 2018.
Если не ограничиваться конкретной теорией, то предполагаемый механизм действия антител к BTN2A1 по данному изобретению состоит в том, что их связывание с BTN2A1, экспонированным на поверхности опухолевой клетки, инициирует конформационное изменение, подающее сигнал контррецептору на Vγ9Vδ2-T-клетках.
Данное изобретение также относится к способу лечения больного раком, например, злокачественным заболеванием кровеносной системы, в частности лейкозом, например острым миелоидным лейкозом, у которого имеются опухолевые клетки, например злокачественные клетки крови, причем указанный способ включает:
(i) введение указанному субъекту эффективного количества антител к BTN2A1, раскрытых в настоящей заявке, и
(ii) введение указанному субъекту эффективного количества γδ-T-клеточной композиции;
при этом указанное эффективное количество антител к BTN2A1 способствует противоопухолевому цитолизу, опосредованному указанной γδ-T-клеточной композицией, направленному против указанных опухолевых клеток. Данное изобретение также относится к способу лечения нуждающегося в этом субъекта, причем указанный способ включает совместное (одновременное или последовательное) введение Т-клеток, несущих CAR, например, (CAR)γδ-T-клеток, и гуманизированных антител, описанных в настоящей заявке.
Далее данное изобретение иллюстрируется фигурами и примерами. Однако эти примеры и фигуры не следует считать каким-либо образом ограничивающими объем изобретения.
Подписи к фигурам
Фигура 1. Идентификация mAb 107G3 к BTN2A1 mAb. A. Последовательность действий при скрининге моноклональных антител к BTN2A1 от иммунизации мышей до секвенирования белков. B. Столбиковая диаграмма показывает количество клонов с указанными внизу интервалами значений аффинности (KD) по данным, полученным методом проточной флуорометрии на микросферах (платформа Luminex), в ходе первичного отбора. C. Линейная диаграмма с накоплением показывает количество клонов, классифицированных как нейтральные (серый цвет), антагонисты (белый) или агонисты (черный) по их способности влиять на образование IFN-γ Vγ9/Vδ2-T-клетками в ходе первичного (1-й цикл) и вторичного (2-й цикл) скрининга.
Фигура 2. Антитело mAb 107G3 к BTN2A1 усиливает цитолитическую функцию Vγ9/Vδ2-T-клеток. Vγ9/Vδ2-T-клетки из PBMCs от трех здоровых доноров размножали (см. раздел «Материалы и методы») и совместно культивировали при температуре 37°C с клетками-мишенями в соотношении эффектор:мишень (E:T) = 1:1 в присутствии антител к CD107a/b и ингибитора транспорта белков в аппарате Гольджи, в присутствии или в отсутствие указанных антител. Через 4 часа клетки собирали, фиксировали и анализировали путем проточной цитометрии. На фиг. A приведены данные с различными клетками мишенями указанных линий, включая Daudi (лимфома Беркитта), Jurkat (острый Т-клеточный лейкоз), L-IPC (аденокарцинома поджелудочной железы) и MDA-MB-134 (карцинома молочной железы), в присутствии или в отсутствие супернатанта, содержащего mAb 107G3 к BTN2A1, или контрольной гибридомной культуральной среды. Столбиковая диаграмма показывает относительное количество (в процентах) клеток CD107+, соответствующее дегрануляции Vγ9/Vδ2-T-клеток. На фиг. B приведены данные для клеток Daudi в качестве клеток-мишеней в присутствии указанных концентраций очищенного mAb 107G3 к BTN2A1 или соответствующего мышиного IgG1в качестве изотипического контроля. График - это кривая доза-ответ, по которой рассчитывают EC50.
Фигура 3. Антитело mAb 107G3 к BTN2A1 распознает BTN2A1, но не BTN3. Клетки HEK-293T BTN2 KO временно трансфицировали плазмидой, кодирующей слитый белок BTN2A1-CFP. A. На гистограммах видно перекрывание указанных клеток и трансфицированных клеток, окрашенных благодаря связыванию с очищенным mAb 107G3 к BTN2A1 (вверху, черная линия), mAb 103.2 к BTN3 (внизу, черная линия), или контрольных mIgG1 или IgG2a (прерывистые линии). Для трансфицированных клеток окрашивание показано после установки дискриминационного окна клеток CFP+. B. График - кривая доза-ответ для связывания очищенных mAb 107G3 к BTN2A1 на клетках HEK-293T BTN2 KO, трансфицированных плазмидой, кодирующей BTN2A1-CFP. Окрашивание анализировали после установки дискриминационного окна клеток CFP+.
Фигура 4. Экспрессия BTN2A в NK-клетках и моноцитах и влияние референсных моноклональных антител 101G5 и 107G3 к BTN2A на дифференцировку моноцитов в макрофаги с фенотипом М2. (A) Гистограммы представляют экспрессию BTN2A1 и BTN2A2 (белый цвет) по сравнению с изотипическим контролем (серый цвет) на NK-клетках и моноцитах из не стимулированных PBMCs от здоровых доноров по данным проточной цитометрии. (B) Двумерные диаграммы CD14/CD163, полученные методом проточной цитометрии через 5 суток дифференцировки in vitro для макрофагов M1/M2 или макрофагов, индуцированных антителами 101G5 и 107G3 в присутствии M-CSF.
Фигура 5: Референсные моноклональные антитела 101G5 и 107G3 к BTN2A подавляют дифференцировку в макрофаги М2 дозозависимым образом. Макрофаги M1; M2; M2, дифференцированные под действием GM-CSF и IFNγ, и макрофаги, индуцированные M-CSF в присутствии различных концентраций антитела 101G5 или 107G3 (или их изотипического контроля), приобретали фенотип в течение 5 суток и на протяжении еще 2 суток их стимулировали либо не стимулировали LPS. Путем проточной цитометрии анализировали экспрессию CD14 (A), CD163 (B), PDL1 (C) and CD86 (D) в не стимулированных (A-C) или в стимулированных LPS клетках (D). Результаты представлены как средняя интенсивность флуоресценции (MFI), из значений которой вычли значения для изотипического контроля. В супернатанте от макрофагов, стимулированных. LPS, методом ELISA определяли количество IL-10 (E) и TNFα (F). Результаты выражены в пг/мл.
Фигура 6: Референсные моноклональные антитела 101G5 и 107G3 к BTN2A подавляют дифференцировку моноцитов в макрофаги M2+IL-4. Получали макрофаги M1; M2; M2+IL4; M2, дифференцированые под действием GM-CSF и IFNγ; и макрофаги, индуцированные M-CSF+IL-4 и антителом 101G5 или 107G3 mAbs (или их изотипическим контролем) в концентрации 10 мкг/мл, в течение 5 суток и на протяжении еще 2 суток их стимулировали либо не стимулировали LPS. Путем проточной цитометрии анализировали экспрессию CD14 (A), CD163 (B), PDL1 (C), DC-SIGN (D) и CD86 (E) на не стимулированных клетках (A-D) и на клетках, стимулированных LPS (E). Результаты представлены как средняя интенсивность флуоресценции (MFI), из значений которой вычли значения для изотипического контроля. В супернатанте от макрофагов, стимулированных LPS, методом ELISA определяли количество IL-10 (E) и TNFα (F). Результаты выражены в пг/мл.
Фигура 7: Референсные моноклональные антитела 101G5 и 107G3 к BTN2A подавляют дифференцировку моноцитов в макрофаги М2, индуцированную раковыми клетками. Получали макрофаги M1; M2; М2, индуцированные средой, кондиционированной клетками линии PANC-1; M2, дифференцированные под действием GM-CSF и IFNγ; и макрофаги, индуцированные средой, кондиционированной клетками линии PANC-1, и антителом 101G5 или 107G3 (или их изотипическим контролем) в концентрации 10 мкг/мл, в течение 5 суток и на протяжении еще 2 суток их стимулировали либо не стимулировали LPS. Путем проточной цитометрии анализировали экспрессию CD14 (A), CD163 (B) на не стимулированных клетках. Результаты представлены как средняя интенсивность флуоресценции (MFI), из значений которой вычли значения для изотипического контроля. В супернатанте от макрофагов, стимулированных LPS, методом ELISA определяли количество IL-10 (С) и TNFα (D). Результаты выражены в пг/мл.
Фигура 8: Референсные моноклональные антитела 101G5 и 107G3 к BTN2A изменяют фенотип макрофагов M2 в сторону провоспалительного фенотипа М1 и секреции цитокинов.
Получали макрофаги M1, M2 из моноцитов в течение 5 суток. По истечении этого срока к макрофагам М2 добавляли антитело 101G5 или 107G3 (или изотипический контроль) в концентрации 10 мкг/мл или IFNγ и оставляли на 2 суток, после чего на протяжении еще 2 суток стимулировали либо не стимулировали LPS. Путем проточной цитометрии анализировали экспрессию CD14 (A), CD163 (B), PDL1 (C) и CD86 (D) на не стимулированных клетках (A-C) или на клетках, стимулированных LPS (D). Результаты представлены как средняя интенсивность флуоресценции (MFI), из значений которой вычли значения для изотипического контроля. В супернатанте от макрофагов, стимулированных LPS, методом ELISA определяли количество IL-10 (E) и TNFα (F). Результаты выражены в пг/мл.
Фигура 9. Референсные моноклональные антитела 101G5 и 107G3 к BTN2A отменяют опосредованное макрофагами М2 подавление пролиферации Т-клеток и секрецию IFNγ. Дифференцированные макрофаги M1, M2 или макрофаги, индуцированные в присутствии антител 101G5 и 107G3 (или их изотипического контроля) в течение 5 суток совместно культивировали с аллогенными (CD3+)T-клетками, меченными CTV, которые были актвированы антителами OKT3. После совместного культивироавния клетки в течение 5 часов стимулировали PMA/иономицином и ингибитором транспорта белков GolgiStop; после этого путем проточной цитометрии определяли количество (CD3+)T-клеток (A и B), образование IFNγ внутри клеток (C-F) и пролиферацию (CellTrace Violet, клетки CTVdim) (G-J). Пролиферацию определяли по разбавлению красителя CTV (сигнал CTV в День 0 принимали за фон). Результаты представлены как абсолютное количество (CD3+)T-клеток (B, E, F, I и J) , используя для калибровки частицы CountBright absolute counting beads, или как относительное количество (в процентах) (CD3+)T-клеток (C, D, G и H).
Фигура 10. Влияние референсных моноклональных антител 101G5 и 107G3 к BTN2A на активацию и цитотоксичность очищенных NK-клеток. (А-B) Очищенные NK-клетки культивировали с референсными моноклональными антителами 101G5 и 107G3 к BTN2A (или с изотипическим контролем) в течение 5 суток при стимуляции IL-2 или IL-2/IL-15. Активацию NK-клеток определяли по экспрессии CD69 (A) и CD25 (B), выражаемой как средняя интенсивность флуоресценции (MFI) в не стимулированных и стимулированных IL-2/IL-15 NК-клетках в присутствии указанных антител или изотипического контроля. (C-D) Очищенные NK-клетки преинкубировали в течение ночи с референсными моноклональными антителами 101G5 и 107G3 к BTN2A (или с изотипическим контролем) при стимуляции IL-2/IL-15 или без нее, а затем совместно культивировали с человеческими опухолевыми клетками в течение 4 часов Путем проточной цитометрии определяли дегрануляцию NK-клеток c опухолевыми клетками каждой линии в присутствии указанных антител или изотипического контроля; мерой дегрануляции служило относительное количество (в процентах) клеток с CD107αβ среди не стимулированных (C) и стимулированных IL-2/IL-15 NK-клеток (D). (E) Дегрануляция NK-клеток с клетками A549 в случае, когда референсные антитела 101G5 и 107G3 к BTN2A (или изотипический контроль) преинкубировали с NK-клетками или клетками-мишенями до 4-часового совместно культивирования, по сравнению с тем, когда указанные антитела добавляли в совместную культуру без преинкубации.
Фигура 11. Референсные моноклональные антитела 101G5 и 107G3 к BTN2A усиливают дегрануляцию NK-клеток и гибель аденокарциномных клеток. (A) Очищенные NK-клетки преинкубировали с референсными моноклональными антителами 101G5 и 107G3 к BTN2A (или с изотипическим контролем) при стимуляции IL-2/IL-15 либо без нее, после чего совместно культивировали с клетками DU-145 в течение 4 часов. Путем проточной цитометрии определяли дегрануляцию NK-клеток как относительное количество (в процентах) клеток CD107αβ+. Для указанных антител рассчитывали EC50 усиления дегрануляции NK-клеток, используя 4-параметрическую логистическую кривую в программе Prism. (B) Очищенные NK-клетки преинкубировали в течение ночи с референсными моноклональными антителами 101G5 и 107G3 к BTN2A (или с изотипическим контролем, или при стимуляции IL-2/IL-15), а затем совместно культивировали в течение 4 часов с клетками HL-60 и A549. Гибель раковых клеток, опосредованную NK-клетками, определяли по относительному количеству клеток с каспазой 3/7 в присутствии указанных антител или изотипического контроля.
Фигура 12. Эпитоп-специфичная сортировка референсных моноклональных антител 101G5 и 107G3 к BTN2A. Эксперименты по эпитоп-специфичной сортировке проводили с помощью системы Octet Red96, основанной на интероферометрии в слое биологических молекул (BLI). Антитела 107G3 и 101G5 проверяли, изменяя порядок их следования в опыте с белком rhBTN2A1-His. A. Антитело 107G3 выступает как насыщающее, антитело 101G5 - как конкурирующее; B: Антитело 101G5 является насыщающим, антитело 107G3 - конкурирующим; C: Результаты измерений в условных единицах связывания и само-блокирующиеся пары антител.
Фигура 13. Пептиды, образующиеся при расщеплении BTN2A1 трипсином, химотрипсином, эндопептидазой ASP-N, эдастазой и термолизином. Идентифицированные пептиды покрываются 96,37 % аминокислотной последовательности BTN2A1.
Фигура 14. Взаимодействие референсных моноклональных антител 101G5 и 107G3 с человеческим BTN2A. 1. A. 107G3/BTN2A1. B. 101G5/BTN2A1.
Фигура 15. Взаимодействие BTN2A1/107G3. Структура BTN2A,1 согласно банку данных PDB (идентификатор 4F9P); эпитопы выделены серым цветом. Аминокислотные остатки, изображенные голубым цветом, занимают положения 65-78 (RWFRSQFSPAVFVY) и 84-100 (RTEEQMEEYRGRTTFVS) аминокислотной последовательности BTN2A1. A, B, C, D, E: ленточное/поверхностное представление молекулы - вид спереди (A), вид сзади (B), вид сбоку 1 (C), вид сбоку 2 (D), вид сверху (E). F, G, H, I, J: ленточное представление - вид спереди (F); вид сзади (G), вид сбоку 1 (H), вид сбоку 2 (I), вид сверху (J).
Фигура 16. Взаимодействие BTN2A1/101G5. Структура BTN2A1, согласно банку данных PDB (идентификатор 4F9P); эпитопы выделены серым цветом. Аминокислотные остатки, изображенные голубым цветом, занимают положения 212-229 (KSVRНМ SCSINNTLLGQK) аминокислотной последовательности BTN2A1. A, B, C, D, E: ленточное/поверхностное представление молекулы - вид спереди (A), вид сзади (B), вид сбоку 1 (C), вид сбоку 2 (D), вид сверху (E)F, G, H, I, J: ленточное представление - вид спереди (F); вид сзади (G), вид сбоку 1 (H), вид сбоку 2 (I), вид сверху (J).
Фигура 17. Определение перекрестной реактивности референсных моноклональных антител 101G5 и 107G3 к BTN2A1 по отношению к ортологичному белку яванского макака. Методом ELISA определяли связывание антител 107G3 и 101G5 с рекомбинантным человеческим слитым белком BTN2A1-Fc или с рекомбинантным слитым белком яванского макака BTN2A1-Fc, которыми покрывали планшет для ELISA. Графики - кривые доза-ответ, по которым рассчитывают EC50, применяя нелинейный регрессионный анализ и используя переменный угловой коэффициент.
ПРИМЕРЫ
Материалы и методы
Культуры клеток, отбор моноцитов и NK-клеток
Мононуклеары периферической крови (PBMC) выделяли путем центрифугирования в градиенте плотности (Eurobio) из полученной с помощью этилен-диамин-тетрауксусной кислоты (EDTA) лейкоцитарной пленки крови от здоровых доноров, предоставленной местным банком крови [Etablissement Français du Sang (EFS), Марсель, Франция]. Свежие PBMC культивировали при температуре 37°C в атмосфере, содержащей 5% CO2 в среде RPMI-1640 [разработанной в Институте им. Розуэлла Парка (Roswell Park Memorial Institute, Буффало, шт. Нью-Йорк, США) и произведенной компанией Lonza), содержащей 10% сыворотки плода коровы (FBS) и 1% пенициллина/стрептомицина (P/S).
NK-клетки получали из свежих PBMC путем отрицательной селекции с помощью набора EasySepTM Human NK Cell Enrichment Kit (StemCell Technologies), следуя инструкциям производителя. Человеческие (CD14+)-моноциты отбирали путем магнитной сепарации с помощью набора CD14+ Microbead kit (Miltenyi), следуя инструкциям производителя. Моноциты культивировали при плотности клеток 106/мл в среде RPMI, содержащей 1% L-глутамина, 100 Ед/мл пенициллина/стрептомицина, 1 мМ пирувата натрия, 10 мM [4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты (HEPES)], 0,1 мM заменимых аминокислот, 10% FBS (все указанные здесь реактивы производства Thermofisher), в течение 5 суток при температуре 37°C. Клетки аденокарциномы поджелудочной железы (линия PANC-1) культивировали в среде RPMI, содержащей 10% FBS до состояния монослоя 90%. После этого культуральную среду отбрасывали, клетки промывали два раза солевым раствором, забуференным фосфатом (PBS х1). Затем клетки PANC-1 культивировали в среде RPMI, содержащей 5% FBS, еще 24 часа (по 30 мл в колбах объемом 175 cм2, чтобы получить концентрированный супернатант). Собирали среду, в которой культивировали клетки PANC-1, пропускали через фильтр с диаметром пор 0,2 мкм) и выдерживали при температуре -20°C вплоть до использования. Другие человеческие клетки и соответствующие культуральные среды указаны в таблице 1 ниже.
клеток
почка
Glutamax
1мM NaPyr
Glutamax
231
Glutamax
12K
аденокарцинома
Glutamax
карцинома
Glutamax
1мM NaPyr
Таблица 1
NaPyr - пируват натрия
NA - не применимо
Человеческие клетки следующих линий были получены из Американской коллекции типовых культур (АТСС): Daudi (лимфома Беркитта), Jurkat (острый Т-клеточный лейкоз), MDA-MB-134 (протоковая карцинома молочной железы) and HEK-293T (эмбриональная почка). Человеческие клетки аденокарциномы поджелудочной железы [линия L-IPC (PDAC087T)] любезно предоставлены Dr/ Juan IOVANNA. Клетки Daudi и Jurkat, а также PBMC культивировали в среде RPMI 1640, содержащей 10% FCS, 1% пирувата натрия, 1% L-глутамина (все указанные здесь реактивы производства Life Technologies). Клетки HEK-293T BTN2 KO получали путем инактивации генов всех изоформ BTN2 по технологии редактирования генома CRISPR-Cas9 (данные не приводятся). Клетки MDA-MB-134, L-IPC, HEK-293 и HEK-293T BTN2 KO культивировали в среде DMEM (Life Technologies), содержащей 10% FCS. Гибридомы культивировали в смеси (1:1) среды DMEM и среды F12 Хэма (ThermoFisher Scientific), содержащей 4% заменителя сыворотки пода коровы FetalClone I (Hyclone), липидный концентрат Chemically Defined Lipid Concentrate (1:250), 1% глутамина, 1% пирувата натрия и 100 мкг/мл комплексного антибактериального препарата PenStrep (все указанные здесь реактивы производства ThermoFisher Scientific). Для сбора супернатанта гибридомы культивировали в течение 4-5 суток без Fetalclone.
Для определения специфичности моноклональных антител к BTN2A1 клетки HEK-293T BTN2 KO независимо трансфицировали плазмидами pcDNA3-Zeo-BTN2A1-CFP, кодирующими белки BTN2A1 и BTN2A2, слитые с синим флуоресцентным белком (CFP) с тегом Nter, используя липофектамин 3000 (Thermofisher Scientific) согласно инструкциям производителя.
Идентификация референсного моноклонального антитела 107G3
к BTN2A1
Для получения мышиных антител против человеческого BTN2А1 48 мышей с шестью различными комбинациями MHC иммунизировали рекомбинантным человеческим слитым белком BTN2A1-Fc. Через 21 сутки у животных брали кровь и определяли в сыворотке крови титр поликлональных антител, специфичных к BTN2A1, методом проточной флуорометрии на микросферах (платформа Luminex). Особей с наибольшими значениями титра антител, специфичных к BTN2A1, умерщвляли. Выделяли селезеночные В-лимфоциты путем положительной селекции и получали гибридомы, проводя индуцируемое полиэтиленгликолем слияние выделенных клеток с миеломными клетками.
Гибридомы клонировали методом предельных разведений, проводили два цикла скрининга супернатантов культур гибридом на специфичность к мишени и способность вызывать дегрануляцию Vγ9Vδ2-T-лимфоцитов (фиг. 1c и 2); в результате идентифицировали референсное антитело mAb 107G3. Определяли аминокислотные последовательности вариабельных областей легкой и тяжелой цепей этих субклонов (см. Табл. 10).
Размножение Vγ9Vδ2-T-клеток
Получали установленную культуру эффекторных Vγ9/Vδ2-T-клеток, выращивая PBMC от здоровых доноров в присутствии золедроновой кислоты (Sigma, 1 мкM) и рекомбинантного человеческого интерлейкина-2 (rhIL-2; Proleukin, 200 МЕ/мл); культивирование начинали в День 0. Начиная с Дня 5 через день добавляли свежий rhIL-2; плотность клеток поддерживали на уровне 1,15 x 106/мл на протяжении 15 суток. В последний день этого периода определяли чистоту Vγ9/Vδ2-T-клеток путем проточной цитометрии. Для функционального анализа брали только культуры чистотой больше 80%. Очищенные Vγ9/Vδ2-T-клетки хранили замороженными до использования.
Анализ с использованием платформы Luminex
На магнитные микросферы с COOH-группами (Biorad) присоединяли белок rhBTN2A1 (R&D) согласно инструкциям производителя; полученные микросферы выдерживали в буферном растворе для хранения (Biorad) при температуре -20°C вплоть до использования. Для титрования мышиных сывороток крови готовили их серийные 4-кратные разведения в буферном растворе для анализа Luminex (Nanotools), начиная с разведения 1:50; 100 мкл суспензии микросфер смешивали с 100 мкл разведения сыворотки и инкубировали в течение 1 часа при комнатной температуре, после чего микросферы промывали три раза буферным раствором для промывания, инкубировали с биотинилированными козьими антителами против мышиного IgG-Fc в буферном растворе для анализа Luminex и трижды промывали этим же буферным раствором. Наконец, микросферы инкубировали в течение 1 часа с комплексом стрептавидин-фикоэритрин (PE) в концентрации 1 мкг/мл в буферном растворе для анализа Luminex. затем промывали три раза в буферном ридерном растворе Luminex (Nanotools). Микросферы ресуспендировали в буферном ридерном растворе Luminex и проводили измерения на мультиплексном проточном анализаторе Luminex 100/200 System. Для идентификации супернатант вносили в лунки 96-луночного планшета по 30 мкл и прибавляли по 90 мкл буферного раствора для анализа Luminex. Затем смешивали 100 мкл суспензии микросфер с 100 мкл разведения супернатанта и инкубировали в течение 16 часов при комнатной температуре, после чего действовали по описанному выше протоколу. Для идентификации нужных антител выбирали те, которые обладали наибольшей аффинностью при связывании с мишенью и наименьшей аффинностью при контактировании с контрольным белком (Rank-Fc). Для расчета аффинности и Kd гибридомные супернатанты серийно разводили 1:4 в буферном растворе для анализа Luminex, начиная с 40 000 пM, и проводили анализ, как описано выше. Средней точке кривой связывания соответствует Kd.
Проточная цитометрия
Клетки PBMC, очищенные Vγ9Vδ2-T-клетки или клеточные линии инкубировали с определенными моноклональными антителами, после чего проводили анализ на проточном цитофлуориметре BD LSRFortessa (BD Biosciences), CytoFlex LX или CytoFlex S (Beckman Coulter), используя программу FlowJo 10.5.3 software (FlowJo). Для дегрануляции Vγ9Vδ2-T-клеток брали следующие антитела: к CD107a-FITC (BD Biosciences), к CD107b-FITC (BD Biosciences), к CD3-PeVio700 (Miltenyi), к PanTγδ-PE (Miltenyi), LIVE/DEAD Near IR (Thermofisher). При всех вариантах иммунного окрашивания использовали очищенные моноклональные антитела в концентрации 10 мкг/мл в присутствии блокирующего реагента FcR Block (Miltenyi), козьих антител к мышиному IgG, конъюгированные с фикоэритрином, 1:100 (Jackson Immunoresearch) и антитела LIVE/DEAD Near IR (Thermofisher). Мышиные антитела к человеческому CD277 (обозначаемые также BTN3A; клон 103.2 изотипа IgG2a) были описаны ранее (WO2012/080351). Для определения специфичности антител к BTN2A1 через 24 часа после трансфекции собирали клетки HEK-293T BTN2 KO (5x104/образец) и обрабатывали описанными выше моноклональными антителами 107G3 к BTN2A1 в указанных концентрациях (от 5 нг/мл до 75 мкг/мл). Для изотипического контроля использовали мышиные антитела IgG1 (Miltenyi).
Функциональный анализ Vγ9/Vδ2-T-клеток
Очищенные Vγ9/Vδ2-T-клетки из крови здоровых доноров культивировали в течение ночи с rhIL-2 (200 МЕ/мл). Затем их совместно культивировали при температуре 37° C с указанными клеточными линиями-мишенями [в соотношении эффектор:мишень (E:T) = 1:1] в присутствии или в отсутствие следующих моноклональных антител (50 мкл супернатанта от гибридом или 10 мкг/мл очищенных моноклональных антител, как указано): к BTN2A1, mIgG1 (изотипический контроль) или культуральная среда от гибридом. В качестве положительного контроля активации Vγ9/Vδ2-T-клеток использовали форбол-12-миристат-13-ацетат (PMA, 20 нг/мл) с иономицином (1 мкг/мл). При первом цикле скрининга гибридомные супернатанты собирали через 4 часа и определяли содержание IFNγ, служившее показателем активации Vγ9/Vδ2-T-клеток с помощью набора Human IFNγ ELISA (BD Biosciences). При втором цикле анализа для определения дегрануляции Vγ9/Vδ2-T-клеток проводили 4-часовую инкубацию гибридомных супернатантов в присутствии ингибитора транспорта белков GolgiStop (BD Biosciences) и растворимого CD107(a&b), меченного флуоресцеинизотиоцианатом (FITC). Через 4 часа клетки собирали, фиксировали в PBS 2%-ным параформальдегидом и анализировали на проточном цитометре CytoFlex LX (Beckman Coulter), используя программу FlowJo 10.5.3 (FlowJo).
Пролиферация Vγ9/Vδ2-T-клеток
Выделяли Vγ9/Vδ2-T-клетки из PBMC здоровых доноров с помощью набора микросфер к TCRγδ (Miltenyi Biotec). Чистота γδ-T-клеток по данным проточной цитометрии составляла более 80%. γδ-T-клетки метили красителем CellTrace фиолетовый в течение 20 мин при температуре 37°C. Затем меченные клетки в количестве 5x105 культивировали в 96-луночном круглодонном планшете совместно с IL-2 (200 МЕ/мл), в присутствии или в отсутствие белка, продукта гена pAg, и в присутствии или в отсутствие антител 107G3 к BTN2A1 (10 мкг/мл). Через 5 суток культивирования определяли разбавление красителя путем проточной цитометрии на цитометре CytoFlex LX (Beckman Coulter), используя программу FlowJo 10.5.3 (FlowJo).
Статистический анализ
В случае дегрануляции Vγ9/Vδ2-T-клеток результаты выражали как среднее ± стандартная ошибка среднего (SEM). В случае очищенных моноклональных антител к BTN2A1 на клетках HEK-293T BTN2 KO, трансфицированных геном BTN2A1, определяли EC50 по логарифмической кривой доза-ответ, применяя нелинейную регрессию и переменные угловые коэффициенты. Для статистического анализа использовали программу GraphPad Prism 7.04 (GraphPad).
Идентификация референсного антитела mAb 101G5 к BTN2A
Определив аминокислотные последовательности вариабельных областей тяжелой и легкой цепей, авторы получили 23 моноклональных антитела к BTN2A химерного IgG1 формата, с помощью мышиных гибридом, как описано выше. Вкратце, проделывали следующее. Синтезировали in vitro нуклеотидные последовательности, кодирующие VH и VL моноклонального мышиного антитела к BTN2A и амплифицировали их путем полимеразной цепной реакции (PCR), используя ДНК-полимеразу PrimeSTAR Max (Takara). Продукты PCR клонировали в экспрессионных векторах для тяжелой и легкой цепей (MI-mAbs), используя систему In-Fusion (Clontech), и плазмидами трансформировали компетентные клетки Escherichia coli Stellar (Clontech). Проводили секвенирование векторов (MWG Eurofins) для подтверждения того, что получены нужные последовательности для моноклональных антител к BTN2A, прежде чем готовить плазмиды в большом количестве для дальнейшей трансфекции. Векторами, кодирующими нужные тяжелые и легкие цепи для каждого клона антител к BTN2A, проводили транзиторную трансфекцию клеток HEK-293 (2,9x106 клеток/мл) при соотношении H:L=1:1,2 и через 18 часов культуральную среду обновляли. Через 7 суток после трансфекции собирали супернатанты культур для очистки моноклональных антител. Проводили аффинную очистку, используя хроматографическую среду Protein A Sepharose Fast Flow; GE Healthcare), в течение ночи при температуре 44°C. Состав буферного раствора для связывания: 0,5 M глицин, 3M NaCl, pH 8,9. Элюировали буферным раствором 0,1 M цитрат (pH 3). Тотчас после элюции образцы нейтрализовали раствором 1M Tris-HCl, pH 9 (10% объем/объем). Наконец, химерные моноклональные антитела к BTN2A подвергали диализу в PBS (1х) и пропускали через фильтр с порами диаметром 0,22 мкм [Millex GV, гидрофильный PVDF; Millipore]. Определяли концентрацию химерных моноклональных антител к BTN2A с помощью спектрофотометра Nanodrop 2000 (ThermoScientific) с учетом коэффициента экстинкции антител. Чистоту фракции мономеров mAb определяли методом сверхпроизводительной жидкостной эксклюзионной хроматографии (UPLC-SEC), используя систему Acquity UPLC-HClass Bio (Waters) с колонками Acquity UPLC Protein-BEH-200A (1,7 мкм; 4,6x50 мм; Waters). Массу антител определяли с помощью масс-спектрофотометра Xevo G2-S Q-Tof (Waters), используя колонки с обратной фазой (PLRP-S 4000 A, 5 мкм, 50 x,2.1 мм (Agilent technologies). Все образцы анализировали после дегликозилирования пептид-N-гликозидазой F (New England Biolabs) при температуре 37°C. Если обнаруживалось неожиданное значение массы, анализировали первичную аминокислотную последовательность с помощью методов биоинформатики, чтобы выявить возможные места гликозилирования в пределах области Fab. Путем электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) очищенных антител выявляли фрагментацию и/или агрегацию в конечном материале свободных от красителя гелей Mini protean TGX gel 4-15 (Biorad). Определяли также уровень эндотоксина с помощью набора для бактериального эндотоксинового теста с использованием кинетического хромогенного метода Chromogenic LAL Limulus Amebocyte Lysate kinetic assay (Charles River Endosafe) на спектрофотометре ClarioStar (BMG Labtech).
Определение дифференцировки макрофагов по фенотипам М1 и М2 in vitro
Проводили поляризацию макрофагов, то есть их дифференцировку по «полярным» фенотипам M1 или M2, из отсортированных моноцитов из крови здоровых доноров. Чтобы получит макрофаги М1 и М2, отсортированные моноциты культивировали в присутствии GM-CSF или M-CSF (40 нг/мл; Miltenyi) соответственно. Через 5 суток собирали полученные макрофаги для фенотипического анализа либо подвергали их стимуляции липополисахаридом (200 нг/мл) в течение еще 2 суток в культуре. В некоторых экспериментах на 4-й день к макрофагам М2 прибавляли IL-4 (20 нг/мл), что приводило к образованию макрофагов “M2+IL-4”. В некоторых экспериментах макрофаги M2 получали путем культивирования моноцитов в присутствии культуральной среды, кондиционированной раковыми клетками PANC-1 (разбавленной культуральной средой до 30% объем/объем; в день 0 или в день 3) без добавления M-CSF. Полученные макрофаги М2 в настоящем описании обозначены “Tum-ind-M2”. Для проверки моноклональных антител к BTN2A на способность влиять на дифференцировку макрофагов по фенотипу М2 получали макрофаги M2 из моноцитов, как описано выше, в присутствии либо в отсутствие химерных моноклональных антител к BTN2A или в присутствии изотипического контроля (человеческого IgG1; Sigma) в указанных концентрациях. Все антитела во избежание пересыхания выдерживали в PBS 1х в течение ночи при комнатной температуре. В качестве контроля подавления дифференцировки моноцитов по фенотипу М2 к ним в процессе индуцированной M-CSF дифференцировки добавляли GM-CSF (40 нг/мл) и IFNγ (100 нг/мл, BioTechne). Макрофаги М1, полученные в присутствии GM-CSF, использовали как фенотипический контроль. После дифференцировки собирали сформировавшиеся макрофаги и супернатанты их культур и определяли экспрессию маркеров фенотипов М1 и М2 на плазматической мембране клеток методом проточной цитометрии. Кроме того, в культуральных супернатантах определяли содержание цитокинов, используя наборы для определения IL-10 и TNα методом ELISA (ThermoFisher Scientific), следуя инструкциям производителя.
Определение реверсии фенотипа макрофагов M2 in vitro
Макрофаги M2 получали из моноцитов в присутствии M-CSF, как описано выше, без референсных моноклональных антител. Собирали макрофаги М2 и культивировали в течение 2 суток в присутствии и в отсутствие липополисахарида, причем лунки планшета предварительно выдерживали в течение ночи с референсными антителами в концентрации 10 мкг/мл или с моноклональными антителами контрольного изотипа (человеческий IgG1; Sigma). В качестве контроля реверсии фенотипа к культуре макрофагов М2 в течение 2 суток добавляли GM-CSF (40 нг/мл) и IFNγ (100 нг/мл). В качестве фенотипического контроля использовали макрофаги М1, сформировавшиеся в присутствии GM-CSF. После экспериментов по реверсии фенотипа собирали макрофаги, которые инкубировали без добавления липополисахарида, для определения фенотипа путем проточной цитометрии. Супернатанты от культур ревертированных макрофагов, стимулированных липополисахаридом, собирали для определения содержания цитокинов методом ELISA.
Определение обусловленного макрофагами М2 подавления пролиферации
Т-клеток и образования ими IFNγ in vitro
Макрофаги M1 и M2 получали с добавлением референсных антител или соответствующих моноклональных антител для изотипического контроля либо без антител, как описано выше. Из PBMC здоровых доноров отсортировывали (CD3+) T-клетки с помощью набора микросфер CD3+Microbead kit (Miltenyi), согласно инструкциям производителя, и до совместного культивирования хранили в замороженном виде. Активированные (CD3+) T-клетки получали следующим образом. (CD3+) T-клетки окрашивали красителем CellTrace фиолетовый (ThermoFisher Scientific) в концентрации 5 мкМ; затем 105 таких клеток культивировали на 96-луночных плоскодонных планшетах, предварительно покрытых моноклональными антителами к CD3 (клон OKT3, BD biosciences), в среде X-Vivo 10, содержавшей 20 Ед/мл IL-2 (Miltenyi), липополисахарид (200 нг/мл) и микросферы CountBright (в абсолютном количестве 5x103 на лунку; ThermoFisher Scientific). Для совместного культивирования брали 2x104 аллогенных макрофагов M1, M2, или макрофагов, сформировавшихся в присутствии M-CSF и референсных антител или антител контрольного изотипа, добавляли к активированным клеткам CD3+ и культивировали в течение 5 суток, после чего добавляли в кокультуру PMA (20 нг/мл) и иономицин (0,5 мкг/мл) чтобы усилить образование цитокинов, в присутствии ингибитора транспорта белков GolgiStop в течение 5 часов. Затем анализировали фенотип путем проточной цитометрии. В качестве показателя пролиферации (CD3+) T-клеток использовали разбавление красителя CellTrace фиолетового. Данные по фенотипу и по пролиферации выражали как относительнок количество (в процентах) или абсолютное количество клеток в 1 мл (использовали готовую калибровочную суспензию микросфер Аbsolute Сounting Beads).
Действие референсных моноклональных антител к BTN2A1 на NK-клетки
Отсортированные NK-клетки от здоровых доноров метили и затем культивировали при температуре 37°C в атмосфере, содержащей 5% CO2, в среде RPMI, дополненной 10% FBS и 1% пенициллином/стрептомицином, IL-2 (50 МЕ/мл), в присутствии или в отсутствие стимуляции IL-15 (10 нг/мл). В день 0 в эту культуру клеток добавляли референсные моноклональные антитела к BTN2A или изотипический контроль (10 мкг/мл). Через 5 суток внеклеточно фенотипировали NK-клетки по экспрессии маркеров активации. Активацию NK-клеток оценивали по индукции экспрессии CD69 и CD25 [относительное количество (в процентах) и средняя интенсивность флуоресценции (MFI)]. Установка дискриминационного окна при проточной цитометрии NK-клеток показана на фиг.4. Для определения цитотоксичности NK-клеток отсортированные NK-клетки от трех здоровых доноров культивировали при температуре 37°C в атмосфере, содержщей 5% CO2, в среде RPMI, дополненной 10% FBS и 1% пенициллином/стрептомицином, в присутствии или в отсутствие IL-2 (50 МЕ/мл), IL-15 (10 нг/мл). К NК-клеткам, стимулированным IL-2/IL-15 либо не стимулированным добавляли референсные моноклональные антитела к BTN2A или изотипический контроль (10 мкг/мл) и инкубировали в течение ночи. На следующий день NK-клетки совместно культивировали с указанными клетками крови или клетками карциномной линии в соотношении 1:1; в совместную культуру добавляли моноклональные антитела к CD107a и к CD107b, меченные FITC (оба - BD Biosciences) и инкубировали в течение 4 часов. Дегрануляцию NK-клеток определяли путем проточной цитометрии по относительному количеству клеток (в процентах), несущих оба указанных маркера (CD107ab+) в образце не стимулированных NK-клеток и в образце NK-клеток, стимулированных IL-2/IL-15. Для вычисления EC50 усиления дегрануляции NK-клеток моноклональные антитела к BTN2A и изотипический контроль использовали в концентрациях от 0,005 нМ до 300 нМ. При определении гибели раковых клеток с участием NK-клеток очищенные NK-клетки преинкубировали в течение ночи с референсными моноклональными антителами 101G5 and 107G3 или с соответствующим контрольным IgG1 в концентрации 10 мкг/мл при температуре 37°C в атмосфере, содержащей 5% CO2, в среде RPMI, дополненной 10% FBS и 1% пенициллином/стрептомицином, с IL-2 (50 МЕ/мл) и IL-15 (10 нг/мл), что служило положительным контролем. На следующий день NK-клетки совместно культивировали с раковыми клетками указанных линий, меченных красителем CellTrace фиолетовый, в соотношении 1:1 в течение 4 суток. Гибель раковых клеток определяли, как относительное количество (в процентах) этих клеток, несущих каспазу 3/7+, используя флуорогенный субстрат для активированной каспазы-3/7 CellEventTM Caspase-3/7 Green Detection reagent (Thermofisher Scientific).
Проточная цитометрия
Клетки PBMC/NK и моноциты/макрофаги инкубировали в течение 10 мин с человеческим блокатором Fc-рецепторов (Miltenyi) или человеческим IgG1 (Sigma) для насыщения Fc-рецепторов, после чего проводили окрашивание. Использовали следующие меченые моноклональные антитела: CD14-FITC и -APC-Vio770 (Miltenyi), CD163-VioBlue (Miltenyi), DC-SIGN-PE-Vio770 (Miltenyi), CD80-PE (BD Biosciences), PDL1-APC (BD Biosciences), CD3-PE-CF594 (BD Biosciences) и CD3-BV605 (Biolegend), CD56-PE-Vio770 (Miltenyi) и -BV605 (BD Biosciences), CD69-BV421 (BD Biosciences), CD25-APC (BD Biosciences). Клетки инкубировали с этой смесью антител в течение 30 мин при температуре 4°C. Мертвые клетки исключали с помощью красителя Live/Dead Near IR Dye (ThermoFisher Scientific), чтобы задать область живых клеток на гистограмме их распределения. Для внутриклеточного окрашивания IFNγ, внеклеточно окрашенные клетки фиксировали, увеличивали мембранную проницаемость с помощью набора Intracellular Fixation & Permeabilization Buffer Set (eBioscience) и инкубировали с антителами к IFNγ, меченными аллофикоцианином (APC) (BD Biosciences). Данные получали на проточном цитофлуориметре Fortessa (BD Biosciences) и анализировали с помощью программы FlowJo 10. Для фенотипирования по BTN2A1 и BTN2A2 использовали очищенные моноклональные антитела к BTN2A1 (mAb5) и к BTN2A2 (mAb17) в концентрации 10 мкг/мл и выявляли их с помощью меченных фикоэритрином (PE) антител к IgG (H+L) (Jackson Immunoresearch). После отбора единичных клеток NK-клетки были охарактеризованы как клетки CD45+CD14-CD3-CD56+ в пределах области живых клеток на гистограмме. Моноциты выявляли как клетки CD45+CD19-CD3-CD56-CD14+ в пределах области живых клеток после отбора единичных клеток. Данные получали на проточном цитофлуориметре Cytoflex LS (Beckman Coulter), iQue Screener (Intellicyt) или Fortessa (BD Biosciences) и анализировали с помощью программы FlowJo 10. Результаты выражали как среднюю интенсивность флуоресценции (MFI) после вычитания значений, полученных при соответствующем контрольном окрашивании
Определение аффинности к эпитопу BTN2A1 и эпитоп-специфичная сортировка
с помощью системы Octet
Получив референсные химерные IgG1-антитела к BTN2A, авторы определили их аффинность к двум различным изоформам мишени (BTN2A1 и BTN2A2) и изучили конкурентное связывание, чтобы установить, распознают ли эти моноклональные антитела один и тот же эпитоп BTN2A1. Определение аффинности и эпитоп-специфичную сортировку осуществляли с помощью системы Octet Red96 (Fortebio/PALL), основанной на интероферометрии в слое биологических молекул (BLI). Для определения аффинности рекомбинантный человеческий (rh)BTN2A1-Fc (GTP) биотинилировали, используя набор EZ-Link™ NHS-PEG4 Biotinylation Kit, согласно инструкциям производителя; биотинилированный rhBTN2A2-Fc был предоставлен компанией R&D Systems. В случае определения аффинности к BTN2A1 биотинилированный rhBTN2A1-Fc наносили на биосенсор со стрептавидином (SA) (ForteBio), разведенным в готовом буферном растворе Kinetic Buffer 1X (ForteBio), с уровнем наслоения мишени около 1 нм; аналитом служили химерные антитела к BTN2A. В случае определения аффинности к BTN2A2 химерные антитела к BTN2A наносили на сенсоры FAB2G (антитела к человеческому CH1; Fortebio), как описано выше; аналитом служил биотинилированный rhBTN2A2-Fc. В обоих случаях аналиты оставались в растворе, и их рабочая концентрация достигалась разведением готовым буферным раствором Kinetic Buffer 10х (ForteBio). В первом прогоне стандартная рабочая концентрация была 200-3,125 нМ. Если нужен был второй прогон, то рабочую концентрацию доводили до 80-1,25 нМ. Все прогоны (включая наслоение, уравновешивание, ассоциацию/погружение сенсора в аналит) проводили при температуре 30°C и перемешивании со скоростью 1000 об/мин. Для анализа использовали модель Лэнгмюра для связывания 1:1 или 2:1 (для BTN2A1 или BTN2A, соответственно), рассчитанную с помощью программного обеспечения Octet, что обеспечивало лучший расчет соответствий. Для эпитоп-специфичной сортировки BTN2A1 с гистидиновым тэгом (rhBTN2A-His) был получен от компании R&D Systems. Референсные антитела к BTN2A проверяли парами с BTN2A1. Сортировку проводили «друг за другом», то есть rhBTN2A-His иммобилизовали на биосенсоре (anti-Penta-His «HIS1K»; ForteBio/PALL) и контактировали с двумя конкурирующими антителами последовательно. Для кинетического анализа наносили rhBTN2A-His на HIS1K (интенсивность сигнала 1 нм), затем следовал этап ассоциации при концентрации антитела 10 мкг/мл в течение 3 мин, затем этап диссоциации в течение 3 мин. Активность. rhBTN2A1-His подтверждалась результатами кинетического анализа, проведенного в том же формате, что и анализ связывания (BTN2A1 в качестве лиганда, иммобилизованного на сенсоре и антитело в качестве аналита). Все антитела (насыщающее или конкурирующее) брали в концентрации 10 мкг/мл, разведенные готовым буферным раствором Kinetic Buffer 1х. Для кинетического анализа после загрузки rhBTN2A1-His на HIS1K (интенсивность сигнала 1 нм) следовал этап ассоциации в течение 3 мин, затем этап диссоциации в течение 3 мин. Этапы анализа: Базовый уровень > Связывание антигена -> базовый уровень -> Насыщающее антитела -> Базовый уровень -> Конкурирующее антитело -> Регенерация, затем этап «друг за другом». Данные по эпитоп-специфичной сортировке анализировали с помощью программы Octet Data Analysis HT 11, используя группы антител, связывающих различные эпитопы.
Картирование эпитопов, распознаваемых референсными моноклональными антителами 107G3 and 101G5
Взаимодействие между BTN2A1 и референсными моноклональными антителами 107G3 и 101G5 оценивали по разнице данных, полученных методом отпечатков пептидных масс, для BTN2A1 самого по себе и с антителом 107G3 или 101G5. Перед картированием эпитопов проводили анализ белка rhBTN2A1-Fc (GTP Technologies) масс-спектрометрическим методом матрично-активированной лазерной десорбции/ионизации для частиц с большой массой (High-mass MALDI анализ), чтобы проверить целостность и уровень агрегации, используя масс-спектрометр Autoflex II MALDI ToF (Bruker), снабженный модулем CovalX HM4 (CovalX). В результате было подтверждено, что в образце нет нековалентных агрегатов или мультимеров BTN2A1. Для того, чтобы охарактеризовать BTN2A1 и определить его эпитопы, с которыми связываются моноклональные антитела 107G3 и 101G5, образец обрабатывали трипсином, химотрипсином, эндопротеазой Asp-N, эластазой и термолизином и после протеолиза проводили анализ в масc-спектрометрическом комплексе на базе масс-спектрометра типа «ионная ловушка» и нанопоточной высокоэффективной жидкостной хроматографии nLC-LTQ-Orbitrap MS/MS, используя систему nLC Ultimate 3000-RSLC с масс-спектрометром LTQ-Orbitrap (Thermo Scientific). В случаях связывания BTN2A1/107G3 и BTN2A1/101G5 белковые комплексы до полиферментного расщепления инкубировали с дейтерированными поперчено сшивающими агентами. После обогащения поперечно сшитых пептидов образцы анализировали и полученные данные обрабатывали с помощью программ XQuest 2.0 и Stavrox 3. Для получения образцов осуществляли восстановительное алкилирование следующим образом. Смешивали BTN2A1 (4,04 мкM) с дисукцинимидилсубератом ((DSS d0/d12; 2 мг/мл в диметилформамиде (DMF)) и инкубировали 180 мин при комнатной температуре. По окончании инкубации останавливали реакцию, добавляя 1 мкл бикарбоната аммония (конечная концентрация 20 мМ) и инкубировали 1 час при комнатной температуре. Затем раствор высушивали вакуумным концентратором SpeedVac, после чего добавляли водную суспензию 8М мочевины (10 мкл). После перемешивания добавляли 1 мкл дитиотреитола (DTT; 500 мM). Полученную смесь инкубировали 1 час при температуре 37ºC. По окончании инкубации в смесь добавляли 1 мкл йодацетамида (1M) и инкубировали 1 час при комнатной температуре в темноте. Затем добавляли 100 мкл буферного раствора для протеолиза. Буферный раствор для протеолиза трипсином содержал 50 мМ. бикарбоната аммония (Ambic; pH 8,5), 5% ацетонитрила; буферный раствор для протеолиза химотрипсином содержал Tris-HCl 100 мM, CaCl2 10 мM (pH 7,8); буферным раствором для протеолиза эндопротеазой Asp-N служил фосфатный буферный раствор 50 мM (pH 7,8); буферный раствор для протеолиза эластазой содержал Tris-HCl 50 мM (pH 8,0) и буферный раствор для протеолиза термолизином содержал Tris-HCl 50 мM, CaCl2 0,5 мM (pH 9,0). Для триптического гидролиза 100 мкл восстановленного/алкилированного BTN2A1 смешивали с 1 мкл трипсина (Roche Diagnostic) в соотношении 1/100. Эту смесь инкубировали в течение ночи при температуре 37ºC. Для протеолиза химотрипсином 100 мкл восстановленного/алкилированного BTN2A1 смешивали с 0,5 мкл химотрипсина (Roche Diagnostic) в соотношении 1/200. Эту смесь инкубировали в течение ночи при температуре 25ºC. Для протеолиза эндопротеазой Asp-N 100 мкл восстановленного/алкилированного BTN2A1 смешивали с 0,5 мкл эндопротеазы Asp-N (Roche Diagnostic) в соотношении 1/200. Эту смесь инкубировали в течение ночи при температуре 37ºC. Для протеолиза эластазой100 мкл восстановленного/алкилированного BTN2A1 смешивали с 1 мкл эластазы (Roche Diagnostic) в соотношении 1/100. Эту смесь инкубировали в течение ночи при температуре 37ºC. Для протеолиза термолизином 100 мкл восстановленного/алкилированного BTN2A1 смешивали с 2 мкл теромолизина (Roche Diagnostic) в соотношении 1/50. Эту смесь инкубировали в течение ночи при температуре 70ºC. После протеолитической инкубации добавляли муравьиную кислоту до конечной концентрации 1%. По завершении протеолиза 10 мкл полученного раствора пептидов загружали в систему нанопоточной жидкостной хроматографии (Ultimate 3000-RSLC) при следующих параметрах: A: 95/05/0.1 H2O/ACN/HCOOH объем/объем/объем; B: 20/80/0.1 H2O/ACN/HCOOH объем/объем/объем; градиент 5-40 % B за 35 минут; вносимый объем 10 мкл; предварительная колонка - внутренний диаметр (ID) 300 мкм ID, длина 5 мм C18 PepMapTM, скорость потока 20 мкл/мин; колонка внутренний диаметр (ID) - 75-мкм ID, длина 15 см C18 PepMapRSLC, скорость потока 200 нл/мин.
Анализ перекрестной реактивности человеческого BTN2A1
и ортологичного белка яванского макака методом ELISA
Ортологичную аминокислотную последовательность BTN2A1 яванского макака (Macaca fascicularis) (XM_015448906.1) идентифицировали путем поиска с помощью программ BLAST, используя аминокислотную последовательность человеческого BTN2A1; внеклеточный домен белка макака клонировали в векторе pFUSE-hIgG1FC2 (InvivoGen) с сайтами рестрикции EcoRI/EcoRV. Для конструирования рекомбинантного слитого белка яванского макака cynoBTN2A1-Fc полученной плазмидой pFUSE-hIgG1FC2-cynoBTN2A1 трансфицировали клетки Expi293FTM, используя для этого реагент ExpiFectamine™ 293 (ThermoFisher) согласно инструкциям производителя. На 6-е сутки собирали супернатант культуры трансфицированных клеток и очищали указанный белок путем аффинной хроматографии. Очищенный белок cynoBTN2A1-Fc анализировали методами SDS-PAGE и вестерн-блоттинга, чтобы определить молекулярную массу и чистоту. Концентрацию белка cynoBTN2A1-Fc определяли по методу Бредфорда, используя бычий сывороточный альбумин (BSA) в качестве стандарта. Для анализа методом ELISA белком cynoBTN2A1-Fc и рекомбинантным человеческим BTN2A1-Fc (huBTN2A1-Fc, GTP Technologies) покрывали планшеты (5 мкг/мл в PBS х1) в течение ночи при температуре 4°C. Планшеты промывали 3 раза PBS, обрабатывали BSA (2% объем /объем в PBS) в течение 1 часа при комнатной температуре, после чего этот раствор сливали. Готовили 10-кратные серийные разведения референсных моноклональных антитела 101G5 и 107G3 либо контрольного человеческого IgG1 в PBS с 2% BSA начиная с 1мкМ до 1 пМ;. в ячейки вносили по 100 мкл каждого разведения и инкубировали 90 мин с перемешиванием на планшетном шейкере. Каждую лунку промывали 3 раза PBS, затем вносили козьи антитела к мышиному IgG, конъюгированные с пероксидазой хрена (HRP; Jackson ImmunoResearch), разведенные 1:10000 в PBS с 2% BSA и инкубировали в течение 1 часа при комнатной температуре. После инкубации лунки промывали 2 раза PBS и для выявления связывания добавляли 2,2'-азино-бис-(3-этилбензтиозолин-6-сульфонат (1-step ABTS solution; ThermoFisher, после чего определяли поглощение на длине волны 405 нм с помощью спектрометра Spark (Tecan). Со всеми образцами каждый вариант опыта повторяли дважды.
Результаты
Идентификацмя референсного антитела 107G3 к BTN2A1
Референсное антитело 107G3 к BTN2A1 идентифицировали следующим образом. Мышей иммунизировали антигеном BTN2A1-Fc, у животных с наибольшим титром специфичной к BTN2A1 сыворотки брали спленоциты и сливали их с миеломными клетками, чтобы получить гибридомы. Из супернатантов от культур гибридом отбирали те антитела, которые обладали наибольшей аффинностью к BTN2A1, и проводили с ними первый скрининг по их способности влиять на секрецию IFN-γ Vγ9/Vδ2-T-клетками. Отобранные в первом скрининге клоны субклонировали и проверяли их способность вызывать секрецию IFN-γ и дегрануляцию Vγ9/Vδ2-клеток, в особенности дегрануляцию (фиг. 1с и 2); эти данные позволяли идентифицировать референсное моноклональное антитело 107G3. Определяли аминокислотные последовательности областей VH и VL этих субклонов (см. Табл. 10).
Антитело 107G3 к BTN2A1 вызывает дегрануляцию Vγ9Vδ2-T-клеток по отношению к различным раковым клеткам-мишеням
Очищенные Vγ9/Vδ2 T-клетки из PBMC здоровых доноров размножали и совместно культивировали с раковыми клетками различных линий, включая Daudi (лимфома Беркитта), Jurkat (острый Т-клеточный лейкоз), L-IPC (аденокарцинома поджелудочной железы) и MDA-MB-134 (карцинома молочной железы), служившие мишенями, в присутствии или в отсутствие супернатанта от культуры гибридом, содержащего антитела 107G3 к BTN2A1. Как демонстрируют фиг.2 и таблица 2, добавление супернатанта от культуры гибридом, содержащего антитела 107G3 к BTN2A1, приводило к индукции цитолитической функции Vγ9/Vδ2-T-клеток, которую определяли, как относительное количество (в процентах) клеток CD107+ с дегрануляцией в сравнении с культурами одних только клеток-мишеней или совместных культур клеток-мишеней с контрольной культуральной средой для гибридом. Обработка Vγ9/Vδ2-T-лимфоцитов PMA/иономицином приводила к максимальной индукции их цитолитической функции независимо от клеток-мишеней, как и ожидалось.
Относительное количество (в процентах) клеток CD107+, индуцированных гибридомным супернатантом с антителами 107G3 к BTN2A1, составила от 71,1 ± 7,4% в случае клеток Daudi, до 17,1 ± 2,9% в случае клеток MDA-MB-134 по сравнению с 24,9 ± 4,7% и 4,9 ± 0,4% в случае совместных культур этих клеток с контрольной гибридомной культуральной средой, соответственно. Во всех совместных культурах Vγ9/Vδ2-T-лимфоцитов с клетками раковых линий, служивших мишенями в этом эксперименте, антитела 107G3 к BTN2A1 вызывали дегрануляцию Vγ9/Vδ2-T-клеток в 2-8 раз превышавшую таковую в тех же совместных культурах в присутствии контрольной гибридомной культуральной среды.
Очищенные антитела 107G3 к BTN2A1 при индукции дегрануляции характеризовались EC50 =0,77 мкг/мл (95% IC 0,32 - 13,22 мкг/мл), что подтверждается данными об относительном количестве (в процентах) клеток CD107+ в совместной культуре с клетками Daudi в качестве мишени в присутствии возрастающих концентраций (от 0 до 18 мкг/мл) моноклональных антител 107G3 к BTN2A1 (фиг. 2b).
Taблица 2
к BTN2A1
гибридомный супернатант
(95% IC 0,21-0,46) мкг/мл
(95%IC 0,32 - 13,22) мкг/мл
с клетками Daudi
(% клеток CD107+)
с клетками MDA-MB-134
(% клеток CD107+)
с клетками L-IPC
(% клеток CD107+)
с клетками Jurkat
(% клеток CD107+)
Антитело 107G3 к BTN2A1 распознает BTN2A1, но не BTN3
Чтобы установить специфичность mAb 107G3 к BTN2A1 по отношению только к изоформе BTN2A1, клетки HEK-293T BTN2 KO, у которых путем геномного редактирования по технологии CRISPR-Cas9 инактивированы обе изоформы BTN2, транзиторно трансфицировали плазмидой, кодирующей BTN2A1 в составе слитого белка с CFP. Как видно из фиг. 3a, окрашивание на очищенное mAb 107G3 к BTN2A1 выявлялось только в тех клетках HEK-293T BTN2 KO, которые были трансфицированы плазмидой, кодирующей BTN2A1, но не в клетках HEK-293T BTN2 KO самих по себе.
Моноклональное антитело 103.2 к BTN3, распознающее все изоформы BTN3 легко выявляло экспрессию BTN3 в клетках HEK-293T BTN2 KO. Следовательно, антитело 107G3 к BTN2A1 специфично к изоформе BTN2A1 и не обладает перекрестной реактивностью по отношению к BTN3.
Аффинность mAb 107G3 к BTN2A1 in cellulo
Для количественного определения аффинности mAb 107G3 к BTN2A1 по отношению к его мишени клетки HEK-293T BTN2 KO, трансфицированные плазмидой, кодирующей BTN2A1, обрабатывали очищенным mAb 107G3 к BTN2A1 либо контрольным моноклональным антителом IgG1 в возрастающих концентрациях (от 5 нг/мл до 75 мкг/мл) (фиг. 3b). Полученные значения средней интенсивности флуоресценции анализировали методом нелинейной регрессии и установили, что для mAb 107G3 к BTN2A1 EC50 = 0,32 мкг/мл (95% IC 0,21-0,46 мкг/мл).
Получение химерных моноклональных антител к BTN2A, определение аффинности и специфичности к изоформе BTN2A
Были получены 23 моноклональных антитела путем транзиторной экспрессии в клетках HEK-293T; при этом продуцирование антител происходило с разной интенсивностью. У большинства антител к BTN2A уровень экспрессии был высоким (>100 мг/мл, до 430 мг/мл). Одно из антител к BTN2A, а именно mAb3 (см. табл. 3), образовывалось в клетках HEK-293T очень мало - от 6 до 8 мг/мл. Анализ его аминокислотной последовательности показал, что в части Fab в участке CDR1 вариабельной области тяжелой цепи имеется сайт N-гликозилирования. У двух других антител к BTN2A - mAb9 и mAb11 - тоже обнаружился сайт N-гликозилирования в области Fab (у mAb9 - в участке CDR1_VH; у mAb11 - в участке CDR1_VL). Шесть антител к BTN2A обнаруживали низкую чистоту (<95% в мономерах), но лишь у антител mAb1 и mAb3 чистота была <90% (86% и 75% соответственно). После конечного этапа очистки во всех моноклональных антителах к BTN2A было очень низкое содержание эндотоксина (порядка 0,1 EU/мг; EU - эндотоксиновая единица). Только в mAb3 было больше эндотоксина (0,73 EU/мг), чем в полученных препаратах других антител, но все равно в пределах допустимого, т.е, <1EU/мг. Константы, характеризующие аффинность (KD, kon и koff) этих 23 моноклональных химерных антител к BTN2A определяли с изоформами BTN2A1 и BTN2A2 в системе Octet, используя биотинилированные рекомбинантные слитые с Fc растворимые белки. В таблице 4 приведены значения KD для каждого моноклонального антитела к BTN2A mAb. В случае mAb6 и mAb9 рассчитать KD было невозможно из-за отсутствия диссоциации в течение периода измерений (koff <10-7 с-1), что можно объяснить из-за высокой авидности этих антител, замедлявшей диссоциацию комплекса с мишенью. Восемь моноклональных антител к BTN2A связывались только с изоформой BTN2A1 (mAb2, mAb3, mAb4, mAb5, mAb6, mAb8, mAb9 и mAb10), еще восемь моноклональных антител к BTN2A связывались только с изоформой BTN2A2 (mAb16, mAb17, mAb18, mAb19, mAb20, mAb21, mAb22 и mAb23) и семь антител связывались с обеими этими изоформами (mAb1, mAb7, mAb11, mAb12, mAb13, mAb14 и mAb15).
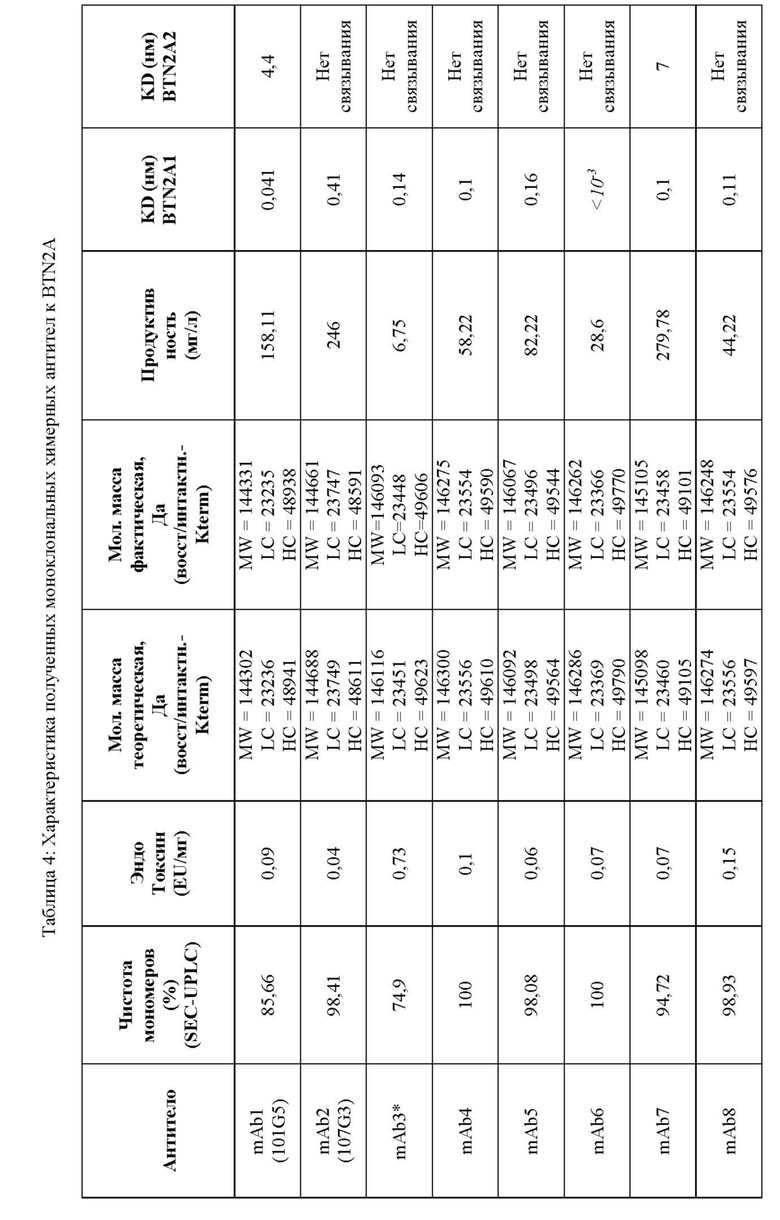
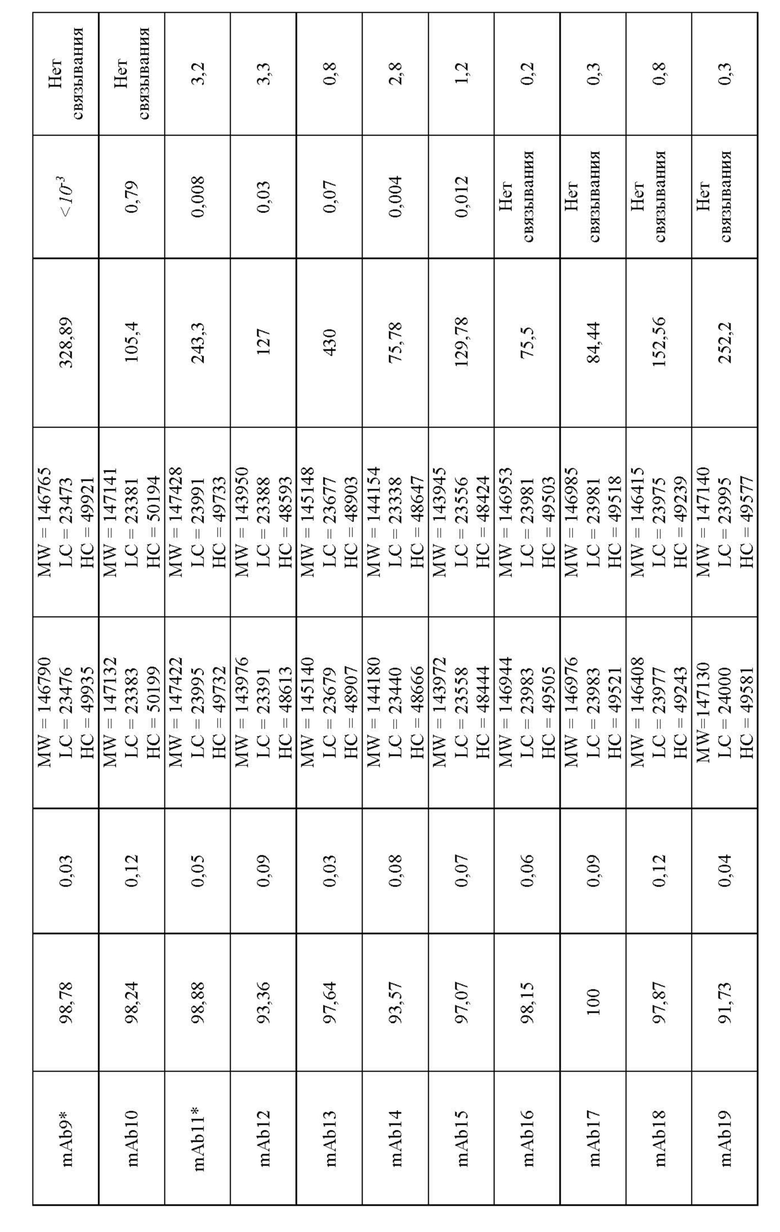
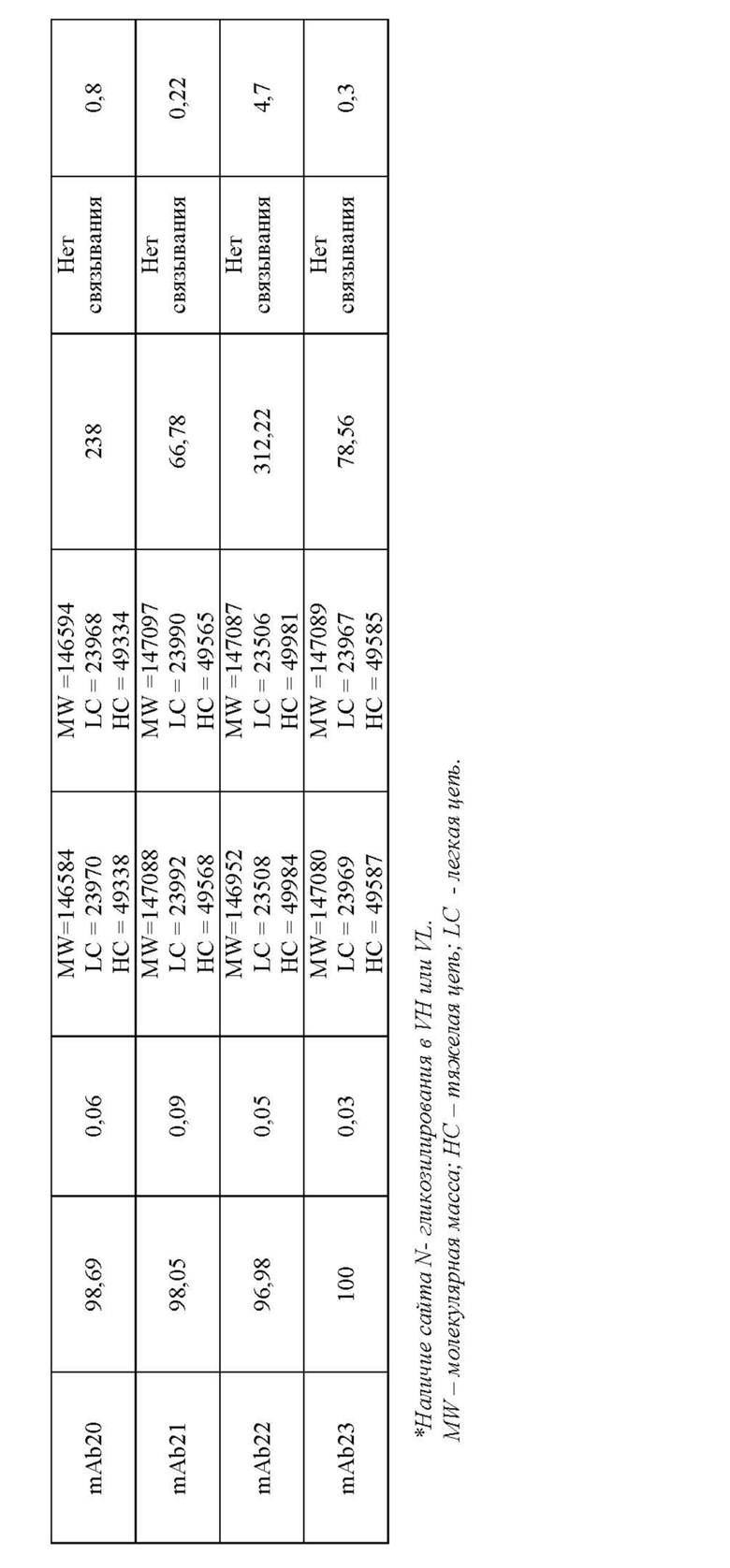
Экспрессия BTN2A1 и BTN2A2 на плазматической мембране моноцитов и NK-клеток
В терапевтических целях авторы попытались установить, могут ли быть мишенью моноклональных антител к BTN2A в периферической крови другие клетки, не Vγ9/Vδ2-T-клетки, а именно моноциты и NK-клетки. Для этого в анализе с помощью системы Оctet авторы использовали антитела mAb5 и mAb17 для связывания только BTN2A1 либо BTN2A2, соответственно, чтобы фенотипировать моноциты и N-клетки из периферической крови. Как показано на фиг. 4, плазматическая мембрана у моноцитов и NK-клеток окрашивалась только в случае mAb5 к BTN2A1, причем у моноцитов окрашивание было интенсивнее. Следовательно, на плазматической мембране моноцитов и NK-клеток выявляется BTN2A1, а не BTN2A2, что дает основания для проведения скрининга моноклональных антител, распознающих BTN2A1, по их способности модулировать функции этих клеток иммунной системы.
Скрининг моноклональных антител к BTN2A по их способности модулировать дифференцировку моноцитов в макрофаги
Моноциты в ответ на сигналы из своего микроокружения дифференцируются в макрофаги с фенотипом М1 либо М2. Макрофаги М1 проявляют провоспалительные и противоопухолевые свойства, тогда как макрофаги M2 обладают противовоспалительными свойствами и ассоциированы с развитием опухолей. При том, что на плазматической мембране моноцитов обнаружена только изоформа BTN2A1, моноклональные антитела к BTN2A, распознающие только BTN2A1 или же обе изоформы - и BTN2A1, и BTN2A2, определяли по их способности мешать дифференцировке моноцитов в макрофаги с фенотипом М2 в присутствии M-CSF in vitro. В качестве контроля расхождения макрофагов по фенотипам М1 и М2 использовали макрофаги M1, полученные в присутствии GM-CSF (CD14+/- CD163-), и макрофаги M2 (CD14+ CD163+), полученные в присутствии M-CSF, и те, и другие без моноклональных антител. Через 5 суток дифференцировки in vitro определяли методом проточной цитометрии экспрессию CD14 и CD163 на плазматическйо мембране макрофагов M1, M2 и макрофагов, стимулированных M-CSF и дифференцировавшихся в присутствии моноклональных антител к BTN2A или контрольного IgG1 (см. табл. 4). Как и ожидалось у клеток с фенотипом M1 был низкий уровень экспрессии CD14, а экспрессия CD163 не выявлялась (см. табл. 5 и фиг.4), тогда как у макрофагов M2 наблюдался высокий уровень экспрессии обоих указанных маркеров. Интересно, что антитела mAb1 к BTN2A, которые далее обозначаются 101G5, вызывали самое значительное снижение уровня экспрессии CD14 CD163 в присутствии M-CSF, сдвигая индуцированную M-CSF дифференцировку макрофагов в сторону фенотипа, подобного M1 (см. табл. 4 и фиг. 4B). Вторым наилучшим ингибитором индуцированной M-CSF дифференцировки макрофагов по фенотипу M2 было антитело mAb2, обозначаемое также 107G3 (см. табл. 4 и фиг 4B). Это противоположно тому фенотипу макрофагов, который генерируется в присутствии M-CSF и контрольного антитела IgG1, и подобен фенотипу необработанных макрофагов М2.
Таблица 4. Влияние моноклональных антител к BTN2A на экспрессию CD14 и CD163 после дифференцировки моноцитов в макрофаги с фнотипом М2
дифференцировку
(101G5)
(107G3)
SEM --- стандартная ошибка среднего, MFI - средняя интенсивность флуоресценции
hIgG1 - человеческий IgG1
Фиг. 5 демонстрирует зависимый от дозы эффект ингибирования проявления фенотипа М2, определяемый по экспрессии CD14 и CD163, референсными моноклональными антителами 101G5 и 107G3 к BTN2A по сравнению с изотипическим контролем (фиг. 5A и 5B), а также усиление экспрессии PDL1 и CD86, характерной для фенотипа M1 (фиг. 5C и 5D). Профиль секреции цитокинов у макрофагов M2 тоже иной, нежели у клеток M1. Поэтому далее определяли методом ELISA секрецию IL-10 (противовоспалительный цитокин, связанный с фенотипом M2) и TNFα (провоспалительный цитокин, связанный с фенотипом M1) после стимуляции липополисахаридом в культуральных супернатантах макрофагов, индуцированных M-CSF, в присутствии и в отсутствие референсных моноклональных антител к BTN2A. Как видно на фиг. 5E и 5F, референсные моноклональные антитела к BTN2A зависимым от дозы образом подавляли секрецию IL-10 и усиливали секрецию TNFα в противоположность изотипическому контролю. Эти наблюдения подтверждают, что антитела 101G5 и 107G3 подавляют индуцированную M-CSF дифференцировку моноцитов в макрофаги с фенотипом M2, сдвигая ее в сторону фенотипа, подобного М1, о чем можно судить по фенотипу и выделению цитокинов. Кроме того, эти эффекты антител 101G5 и 107G3 зависят от дозы. Значения IC50 и EC50 для каждого из этих моноклональных антител приведены в табл. 5. Заметим, что по всем показателям, кроме маркера PDL1, значения IC50 и EC50 для 101G5 меньше, чем для 107G3.
Таблица 5. Значения IC50 и EC50 референсных моноклональных антител к-BTN2A для маркеров фенотипов макрофагов M2 и M1 и для секреции цитокинов
Цитокины
Описаны и другие стимулирующие факторы микроокружения опухоли, которые влияют на формирование макрофагов с фенотипом М2 (Mosser, Edwards, Nat. Rev. Immunol. 2008; Mantovani, Allavena, J. Exp. Med. 2015). Помимо M-CSF, одним из наиболее распространенных стимулирующих агентов, вызывающих формирование макрофагов с фенотипом М2, является IL-4. Авторы определяли влияние антител 101G5 и 107G3 на дифференцировку так называемых проопухолевых макрофагов M2+IL-4, образующихся из моноцитов после стимуляции M-CSF и IL-4. Через 45 суток культивирования в таких условиях антитела 101G5 и 107G3 подавляли экспрессию маркеров, связанных с фенотипом M2+IL-4 (CD14, CD163 и DC-SIGN; см. фиг 6A, 6B и 6D), и секрецию IL-10 (фиг. 6F), в то же время усиливая экспрессию маркеров, связанных с фенотипом M1 (CD86, PDL1), и секрецию TNFα (фиг. 6C, 6E и 6G). Таким образом, в проопухолевом окружении (M-CSF и IL-4), антитела 101G4 и 107G3 подавляют дифференцировку в сторону фенотипа M2+IL-4 и усиливают дифференцировку в сторону провоспалительного фенотипа M1.
Кроме того, воздействие антител 101G5 и 107G3 на индуцированную раковыми клетками дифференцировку моноцитов с образованием макрофагов с фенотипом М2 определяли путем культивирования моноцитов в присутствии супернатанта от культуры клеток линии PANC-1 (аденокарцинома поджелудочной железы). Когда к такой культуре моноцитов добавляли антитела 101G5 или 107G3, дифференцировка моноцитов в сторонцу фенотипа М2 подавлялась, что демонстрировалось снижением уровня экспрессии маркеров, связанных с фенотипом М2 (CD14, CD163) и сокращением секреции IL-10 (фиг. 7A-C) а также усилением экспрессии провоспалительного цитокина TNFα, связанного с фенотипом М1 (фиг. 7D).
Влияние роеференсных антител 101G5 и 107G3 к BTN2A
на «перепрограммирование» макрофагов М2 в сторону фенотипа М1
Определяли возможность моноклональных антител 101G5 и 107G3 ревертировать дифференцированные макрофаги с фенотипом М2 в клетки с фенотипом М1. Для этого макрофаги М2, предварительно дифференцировавшиеся в присутствии M-CSF в течение 5 суток, высевали в лунки планшета, покрытые моноклональными антителами 101G5 и 107G3, и культивировали еще 2 или 4 суток. В качестве положительного контроля реверсии M2->M1 служила обработка макрофагов М2 γ-интерфероном. Как видно на фиг. 8, макрофаги M2, культивировавшиеся с референсными антителами 101G5 и 107G3, приобретали фенотип, подобный фенотипу М1, сходному с тем, который получался при обработке IFN-γ. А именно, обработка макрофагов М2 референсными антителами e 101G5 и 107G3 mAbs приводила к снижению уровня экспрессии CD14 (фиг. 8A) и CD163 (фиг. 8B), но к увеличению. экспрессии CD86 (фиг. 8C). После обработки антителом 101G5 наблюдалось умеренное усиление экспрессии PDL1, после обработки антителом 107G3 усиления экспрессии PDL1 не было совсем (фиг. 8D). Кроме того, обработка макрофагов M2 антителами 101G5 и 107G3 подавляла секрецию IL-10 (фиг. 8E) и усиливала секрецию TNFα (фиг. 8F), что указывало на фенотип М1.
На фиг. 8G-8I представлен зависимый от дозы эффект референсных антител 101G5 и 107G3, состоящий в “перепрограммировании» макрофагов М2 на фенотип М1 в сравнении с изотипическим контролем, а именно: подавление экспрессии CD163 (фиг. 8G), ослабление секреции IL-10 и усиление секреции TNFα (фиг.8H и 8I). В табл. 6 приведены значения IC50 и EC50 каждого из этих антител для маркеров фенотипов M1 и M2; видно, что моноклональное антитело 101G5 к BTN2A обладает наилучшей активностью в смысле «перепрограммирования» макрофагов М2 на фенотип М1.
Таблица 6. Значения IC50 и EC50 референсных моноклональных антител к BTN2A для маркеров превращения макрофагов М2.
nd -не определяется
Референсные моноклональные антитела 101G5 и 107G3 к BTN2A устраняют подавление пролиферации Т-клеток, обусловленное макрофагами М2
Авторы изучили способность референсных антител 101G5 и 107G3 влиять на функции макрофагов с фенотипом M2, а именно на опосредованное макрофагами M2 подавление пролиферации Т-клеток. Для этого аллогенные предварительно активированные (CD3+) Т-клетки совместно культивировали с макрофагами M1, М2 или с M2, полученными в присутствии указанных антител. Как и ожидалось, в совместной культуре с обычными макрофагами М2 наблюдалось уменьшение количества (CD3+) Т-клеток, а также ослабление пролиферации Т-клеток [определяли по разбавлению красителя СellTrace фиолетовый (CTV)] и образования IFNγ по сравнению с совместной культурой, содержащей макрофаги M1 (фиг. 9A, C, G, E и I). Напротив, макрофаги M2, полученные в присутствии антител 101G5 и 107G3 не подавляли пролиферацию Т-клеток, что демонстрируется более высоким относительным количеством (в процентах) и абсолютным количеством (CD3+) Т-клеток по сравнению с совместной культурой, содержащей макрофаги, полученные в присутствии контрольных антител IgG1 (фиг. 9B, 9H и 9J). Кроме того, относительное количество (в процентах) и абсолютное количество Т-клеток, продуцирующих IFN-γ тоже были больше в совместных культурах, содержащих макрофаги, полученных в присутствии антител 101G5 и 107G3, по сравнению с кокультурой, содержащей макрофага, полученные в присутствии контрольных антител IgG1 (фиг. 9D and 9F).
Следовательно, в противоположность макрофагам M2, индуцированным одним только M-CSF, макрофаги, образовавшиеся в присутствии не только M-CSF, но и антител 101G5 или 107G3, не подавляют пролиферацию и хелперную (Th1) функцию (секреция IFN-γ) аллогенных (CD3+) Т-клеток, т.е. действуют подобно макрофагам М1.
Референсные моноклональные антитела 101G5 и 107G3 к BTN2A инициируют активацию и цитотоксичность NK-клеток
Поскольку белок BTN2A1 был обнаружен на плазматической мембране NK-клеток, авторы изучили потенциальную способность антител 101G5 и 107G3 влиять на активацию NK-клеток. Очищенные NK-клетки культивировали в течение 5 суток в присутствии антитела 101G5 или 107G3 и в присутствии либо в отсутствие других активирующих агентов (IL-2 и IL-15 или только IL-2, соответственно.). Как видно на фиг. 10, оба антитела, и 101G5, и 107G3, усиливали экспрессию CD69 на плазматической мембране NK-клеток в условиях эксперимента (фиг. 10A). Кроме того, антитела 101G5 и 107G3 также усиливали экспрессию CD25, индуцированную воздействием IL-2 и IL-15 на NK-клетки (фиг. 10B). Поскольку антитела 101G5 и 107G3 оказались способными активировать очищенные NK, авторы проверили, усиливают ли эти антитела также цитотоксичность NK-клеток. Для этого, определяли дегрануляцию NK-клеток [как относительное количество (в процентах) клеток CD107] с раковыми клетками линий HL-60 (миелогенный лейкоз), HT-29 (карцинома толстой кишки), MDA-MB-231 (аденокрацинома молочной железы) и A549 (аденокарцинома легкого) в присутствии антитела 101G5 или 107G3 и при стимуляции IL-2 и IL-15 либо без нее. Как и ожидалось, в присутствии контрольного антитела IgG1 дегрануляция NK-клеток происходила только с клетками HL-60 (фиг. 10C) и усиливалась при стимуляции IL-2 и IL-15 (фиг. 10D). С клетками солидных опухолей линий HT-29, MDA-MB-231 и A549 умеренная дегрануляция NK-клеток наблюдалась также в случае контрольного IgG1 и IL-2+IL-15. В табл. 7 приведены данные о дегрануляции NK-клеток с раковыми клетками указанных и других (Raji, HCT116, DU-145) линий, использовавшихся в этом эксперименте. Интересно, что референсные моноклональные антитела 101G5 и 107G3 усиливали дегрануляцию NK-клеток с клетками солидных опухолей MDA-MB-231 и A549, и в меньшей степени - с клетками HT-29 без стимуляции IL-2+IL-15. Добавление IL-2 и IL-15 усиливало эффект антител 101G5 и 107G3 в случае клеток линий MDA-MB-231, A549 и DU145 (см. табл. 7). Добавление референсных моноклональных антител 101G5 и 107G3 не приводило к такому усилению в случае раковых клеток кровеносной системы HL-60 и Raji (табл. 7 и фиг. 10C и 10D). Кроме того, референсные моноклональные антитела 101G5 и 107G3 оказались способны инициировать дегрануляцию NK-клеток в случае клеток линии A549, если до совместного культивирования эти антитела преинкубировали с NK-клетками и потом уже не добавляли в совместную культуру (фиг.10E). Из этого следует, что эффект антител 107G3 и 101G5 состоит в непосредственном связывании с NK-клетками, что инициирует их цитотоксичность, направленную против раковых клеток. Также в случае клеток линии DU-145 (аденокарцинома предстательной железы) определяли, зависит ли усиление дегрануляции NK-клеток от дозы антител 107G3 и 101G5 И действительно, антитела 101G5 и 107G3 усиливали дегрануляцию NK-клеток с клетками DU-145 зависимым от дозы образом (EC50(без стимуляции)= 0,14 и 0.54 нм; EC50(IL-2+IL-15)= 0,08 и 0.2 нм для 101G5 и 107G3, соответственно).
Таблица 7. Дегрануляция NK-клеток (относительное количество (в процентах) клеток CD107+) с раковыми клетками различных линий при стимуляции IL-2 и IL-15 и без нее
Наконец, авторы проверили способность антител 101G5 и 107G3 усиливать гибель раковых клеток, опосредованную NK-клетками; для этого определяли относительное количество (в процентах) клеток, содержащих каспазы 3 и 7 после совместного культивирования очищенных NK-клеток с клетками линии HL-60 (миелогенный лейкоз) или с клетками линии A459 (аденокарцинома легкого). Как видно на фиг. 11, антитела 101G5 и 107G3 усиливали опосредованную NK-клетками гибель аденокарциномных клеток A549 (примерно в 2 раза), но не лейкозных клеток HL-60. Эти наблюдения, вместе взятые, свидетельствуют, что антитела 101G5 и 107G3 усиливают цитотоксичность NК-клеток, направленную против, предпочтительно, солидных опухолей.
Референсные моноклональные антитела 101G5 и 107G3 к BTN2A
распознают разные эпитопы BTN2A1
Оба указанных антитела, и 101G5, и 107G3, связываются с BTN2A1 и обладают способностью подавлять приобретение макрофагами фенотипа М2 и усиливать активацию и цитотоксичность NK-клеток. Авторы решили проверить, распознают ли эти два антитела один и тот же эпитоп белка BTN2A1. Была проведена эпитоп-специфичная сортировка антител с помощью системы Оctet: антитела 101G5 и 107G3 конкурировали за связывание с BTN2A1 «друг за другом». Как видно на фиг. 12, антитело 101G5 не блокирует связывание антитела 107G3 с BTN2A1 и наоборот; это свидетельствует о тои, что данные два антитела распознают не один и тот же эпитоп BTN2A1.
Картирование эпитопов, распознаваемых моноклональными антителами 101G5 и 107G3
Чтобы охарактеризовать BTN2A1 для картирования эпитопов, этот белок подвергли протеолизу ферментами трипсином, химотрипсинов, эндопептидазой Asp-N, эластазой и термолизином, после чего проанализировали полученные гидролизаты на установке nLC-LTQ-Orbitrap MS/MS. После триптического гидролиза в аминокислотной последовательности BTN2A1 были идентифицированы 32 пептида, занимавших 79,84% полипептидной цепи BTN2A1; после расщепления химотрипсином идентифицировали 27 пептидов, занимавших 94,76% полипептидной цепи BTN2A1; после расщепления эндопептидазой Asp-N идентифицировали 2 пептида, занимавших 12,5% полипептидной цепи BTN2A1; после расщепления эластазой идентифицировали 33 пептида, занимавших 89,11% полипептидной цепи BTN2A1; после расщепления термолизином идентифицировали 29 пептидов, занимавших 78,23% полипептидной цепи BTN2A1. На основе полученных в этом анализе результатов была составлена «карта» полипептидной цепи BTN2A1 с перекрывающимися участками - пептидами, образующимися в результате расщепления BTN2A1 указанными ферментами (фиг. 13). Объединение всех этих пептидов покрыло 96,37% аминокислотной последовательности BTN2A1. Чтобы с высоким разрешением определить эпитопы в комплексах BTN2A1/107G3 и BTN2A1/101G5, эти комплексы инкубировали с дейтерированными поперечно сшивающими агентами, а затем подвергали расщеплению указанными ферментами. После протеолиза белкового комплекса BTN2A1/107G3 трипсином, химотрипсинов, эндопептидазой Asp-N, эластазой и термолизином анализ на установке nLC-Оrbitrap MS/MS выявил 17 поперечно-сшитых пептидов между антителом BTN2A1 и антителом 107G3.
Таблица 8. Аминокислотные последовательности и положение поперечно сшитых пептидов после полиферментного протеолиза комплекса BTN2A1/107G3
(белок 1 - белок 2)
Таким образом, полученные авторами данные свидетельствуют о том, что во взаимодействии BTN2A1 и антитела 107G3 участвуют аминокислотные остатки BTN2A1, занимающие следующие положения в его полипептидной цепи: 65, 68, 69, 72, 78; 84, 85, 95, 97, 100. Эти результаты иллюстрируются фиг. 14A и 15.
После полиферментного протеолиза комплекса BTN2A1/101G5 анализ на установке nLC-Оrbitrap MS/MS выявил 14 поперечно сшитых пептидов между BTN2A1 и антителом 101G5.
Таблица 9. Аминокислотные последовательности и положение поперечно сшитых пептидов после полиферментного протеолиза комплекса BTN2A1/101G5.
(белок 1 - белок 2)
Белок 1
Белок 2
Таким образом, полученные авторами данные свидетельствуют о том, что во взаимодействии BTN2A1 и антитела 101G5 участвуют аминокислотные остатки BTN2A1, занимающие следующие положения в его полипептидной цепи: 212, 213, 218, 220, 224, 229. Эти результаты иллюстрируются фиг. 14B и 16.
Референсные моноклональные антитела 101G5 and 107G3 к BTN2A проявляют перекрестную реактивность с ортологом BTN2A1 яванского макака
У большинства приматов, помимо человека, имеются ортологи BTN2A1; они есть, например, у яванского макака (Macaca fascicularis). Чтобы определить перекрестную реактивность моноклональных антител 101G5 и 107G3 с ортологичным BTN2A1 белком яванского макака [cynoBTN2A1; регистрационный номер в базе данных Национального центра биотехнологической информации США (NCBI) XM_015448906.1; идентичногсть с человеческим (hu) BTN2A1 93,31%], авторы получили рекомбинантный слитый с Fc белок, содержащий эктодомен белка cynoBTN2A1 (cynoBTN2A1-Fc) и определили связывание референсных моноклональных антител с этим белком методом ELISA. Также был проведен анализ ELISA с рекомбинантным слитым белком huBTN2A1-Fc, чтобы сравнит аффинность референсных антител при связывании с человеческим BTN2A1 и его обезьяньим ортологом. Как видно на фиг. 13, как антитело 101G5, так и 107G3 обладали способностью связываться с эктодоменом cynoBTN2A1, что характеризовалось EC50 = 0,60 и 0.57 нм, соответственно; эти значения сравнимы с EC50 при связывании указанных антител с huBTN2A1 (0,82 и 0,56 нм, соответственно).
Таблица 10. Краткое описание аминокислотных и нуклеотидных последовательностей, нужных для практического осуществления данного изобретения
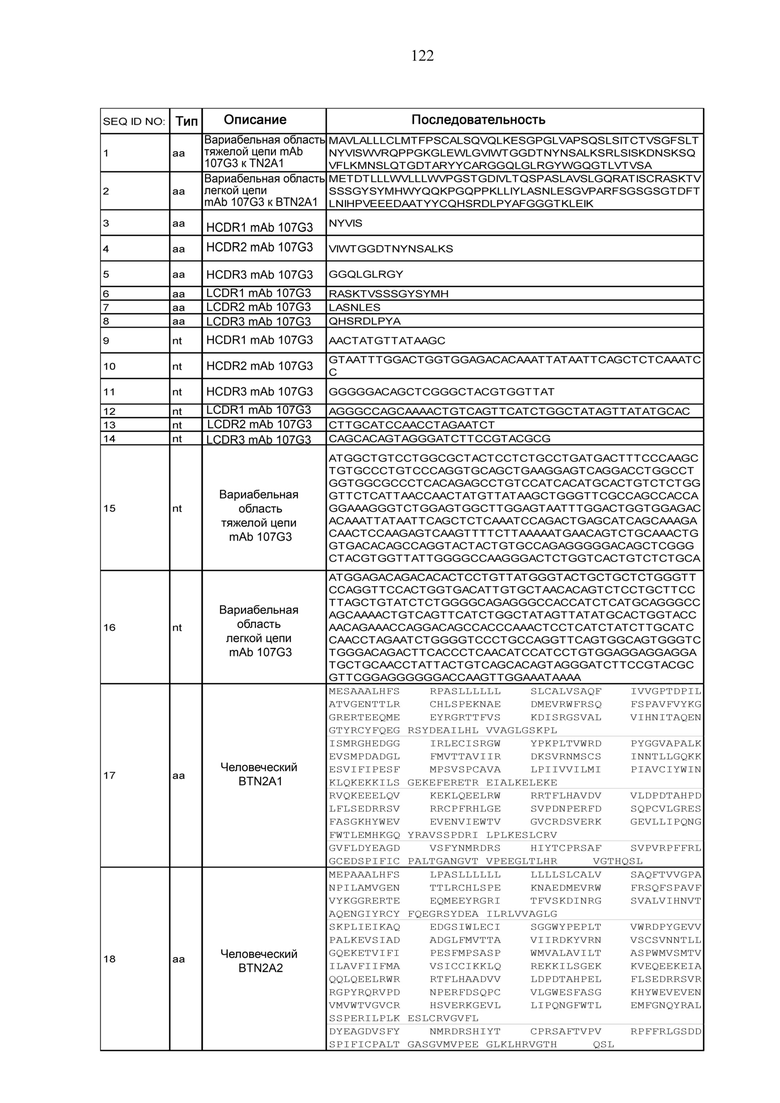

Ссылки
В настоящей заявке процитированы различные документы для описания уровня области техники, к которой относится данное изобретение. Содержание соответствующих работ включено в настоящее описание в качестве ссылки.
--->
Список последовательностей
<110> ИМЧЕК ТЕРАПЬЮТИКС САС
ИНСЕРМ
СНРС
ЮНИВЕРСИТЭ ДЕ Э-МАРСЕЙ
ЭНСТИТЮ ЖАН ПАОЛИ Э ИРЕН КАЛЬМЕТ
<120> ANTIBODIES HAVING SPECIFICITY FOR BTN2 AND USES THEREOF
<130> BCT200062 QT
<150> EP19305345.1
<151> 2019-03-20
<150> EP19219691.3
<151> 2019-12-24
<160> 35
<170> PatentIn version 3.5
<210> 1
<211> 136
<212> PRT
<213> Homo sapiens
<400> 1
Met Ala Val Leu Ala Leu Leu Leu Cys Leu Met Thr Phe Pro Ser Cys
1 5 10 15
Ala Leu Ser Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala
20 25 30
Pro Ser Gln Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu
35 40 45
Thr Asn Tyr Val Ile Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu
50 55 60
Glu Trp Leu Gly Val Ile Trp Thr Gly Gly Asp Thr Asn Tyr Asn Ser
65 70 75 80
Ala Leu Lys Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln
85 90 95
Val Phe Leu Lys Met Asn Ser Leu Gln Thr Gly Asp Thr Ala Arg Tyr
100 105 110
Tyr Cys Ala Arg Gly Gly Gln Leu Gly Leu Arg Gly Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ala
130 135
<210> 2
<211> 131
<212> PRT
<213> Homo sapiens
<400> 2
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala
20 25 30
Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Lys Thr
35 40 45
Val Ser Ser Ser Gly Tyr Ser Tyr Met His Trp Tyr Gln Gln Lys Pro
50 55 60
Gly Gln Pro Pro Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser
65 70 75 80
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
85 90 95
Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys
100 105 110
Gln His Ser Arg Asp Leu Pro Tyr Ala Phe Gly Gly Gly Thr Lys Leu
115 120 125
Glu Ile Lys
130
<210> 3
<211> 5
<212> PRT
<213> Homo sapiens
<400> 3
Asn Tyr Val Ile Ser
1 5
<210> 4
<211> 16
<212> PRT
<213> Homo sapiens
<400> 4
Val Ile Trp Thr Gly Gly Asp Thr Asn Tyr Asn Ser Ala Leu Lys Ser
1 5 10 15
<210> 5
<211> 9
<212> PRT
<213> Homo sapiens
<400> 5
Gly Gly Gln Leu Gly Leu Arg Gly Tyr
1 5
<210> 6
<211> 15
<212> PRT
<213> Homo sapiens
<400> 6
Arg Ala Ser Lys Thr Val Ser Ser Ser Gly Tyr Ser Tyr Met His
1 5 10 15
<210> 7
<211> 7
<212> PRT
<213> Homo sapiens
<400> 7
Leu Ala Ser Asn Leu Glu Ser
1 5
<210> 8
<211> 9
<212> PRT
<213> Homo sapiens
<400> 8
Gln His Ser Arg Asp Leu Pro Tyr Ala
1 5
<210> 9
<211> 15
<212> DNA
<213> Homo sapiens
<400> 9
aactatgtta taagc
15
<210> 10
<211> 48
<212> DNA
<213> Homo sapiens
<400> 10
gtaatttgga ctggtggaga cacaaattat aattcagctc tcaaatcc
48
<210> 11
<211> 27
<212> DNA
<213> Homo sapiens
<400> 11
gggggacagc tcgggctacg tggttat
27
<210> 12
<211> 45
<212> DNA
<213> Homo sapiens
<400> 12
agggccagca aaactgtcag ttcatctggc tatagttata tgcac
45
<210> 13
<211> 21
<212> DNA
<213> Homo sapiens
<400> 13
cttgcatcca acctagaatc t
21
<210> 14
<211> 27
<212> DNA
<213> Homo sapiens
<400> 14
cagcacagta gggatcttcc gtacgcg
27
<210> 15
<211> 408
<212> DNA
<213> Homo sapiens
<400> 15
atggctgtcc tggcgctact cctctgcctg atgactttcc caagctgtgc cctgtcccag
60
gtgcagctga aggagtcagg acctggcctg gtggcgccct cacagagcct gtccatcaca
120
tgcactgtct ctgggttctc attaaccaac tatgttataa gctgggttcg ccagccacca
180
ggaaagggtc tggagtggct tggagtaatt tggactggtg gagacacaaa ttataattca
240
gctctcaaat ccagactgag catcagcaaa gacaactcca agagtcaagt tttcttaaaa
300
atgaacagtc tgcaaactgg tgacacagcc aggtactact gtgccagagg gggacagctc
360
gggctacgtg gttattgggg ccaagggact ctggtcactg tctctgca
408
<210> 16
<211> 393
<212> DNA
<213> Homo sapiens
<400> 16
atggagacag acacactcct gttatgggta ctgctgctct gggttccagg ttccactggt
60
gacattgtgc taacacagtc tcctgcttcc ttagctgtat ctctggggca gagggccacc
120
atctcatgca gggccagcaa aactgtcagt tcatctggct atagttatat gcactggtac
180
caacagaaac caggacagcc acccaaactc ctcatctatc ttgcatccaa cctagaatct
240
ggggtccctg ccaggttcag tggcagtggg tctgggacag acttcaccct caacatccat
300
cctgtggagg aggaggatgc tgcaacctat tactgtcagc acagtaggga tcttccgtac
360
gcgttcggag gggggaccaa gttggaaata aaa
393
<210> 17
<211> 527
<212> PRT
<213> Homo sapiens
<400> 17
Met Glu Ser Ala Ala Ala Leu His Phe Ser Arg Pro Ala Ser Leu Leu
1 5 10 15
Leu Leu Leu Leu Ser Leu Cys Ala Leu Val Ser Ala Gln Phe Ile Val
20 25 30
Val Gly Pro Thr Asp Pro Ile Leu Ala Thr Val Gly Glu Asn Thr Thr
35 40 45
Leu Arg Cys His Leu Ser Pro Glu Lys Asn Ala Glu Asp Met Glu Val
50 55 60
Arg Trp Phe Arg Ser Gln Phe Ser Pro Ala Val Phe Val Tyr Lys Gly
65 70 75 80
Gly Arg Glu Arg Thr Glu Glu Gln Met Glu Glu Tyr Arg Gly Arg Thr
85 90 95
Thr Phe Val Ser Lys Asp Ile Ser Arg Gly Ser Val Ala Leu Val Ile
100 105 110
His Asn Ile Thr Ala Gln Glu Asn Gly Thr Tyr Arg Cys Tyr Phe Gln
115 120 125
Glu Gly Arg Ser Tyr Asp Glu Ala Ile Leu His Leu Val Val Ala Gly
130 135 140
Leu Gly Ser Lys Pro Leu Ile Ser Met Arg Gly His Glu Asp Gly Gly
145 150 155 160
Ile Arg Leu Glu Cys Ile Ser Arg Gly Trp Tyr Pro Lys Pro Leu Thr
165 170 175
Val Trp Arg Asp Pro Tyr Gly Gly Val Ala Pro Ala Leu Lys Glu Val
180 185 190
Ser Met Pro Asp Ala Asp Gly Leu Phe Met Val Thr Thr Ala Val Ile
195 200 205
Ile Arg Asp Lys Ser Val Arg Asn Met Ser Cys Ser Ile Asn Asn Thr
210 215 220
Leu Leu Gly Gln Lys Lys Glu Ser Val Ile Phe Ile Pro Glu Ser Phe
225 230 235 240
Met Pro Ser Val Ser Pro Cys Ala Val Ala Leu Pro Ile Ile Val Val
245 250 255
Ile Leu Met Ile Pro Ile Ala Val Cys Ile Tyr Trp Ile Asn Lys Leu
260 265 270
Gln Lys Glu Lys Lys Ile Leu Ser Gly Glu Lys Glu Phe Glu Arg Glu
275 280 285
Thr Arg Glu Ile Ala Leu Lys Glu Leu Glu Lys Glu Arg Val Gln Lys
290 295 300
Glu Glu Glu Leu Gln Val Lys Glu Lys Leu Gln Glu Glu Leu Arg Trp
305 310 315 320
Arg Arg Thr Phe Leu His Ala Val Asp Val Val Leu Asp Pro Asp Thr
325 330 335
Ala His Pro Asp Leu Phe Leu Ser Glu Asp Arg Arg Ser Val Arg Arg
340 345 350
Cys Pro Phe Arg His Leu Gly Glu Ser Val Pro Asp Asn Pro Glu Arg
355 360 365
Phe Asp Ser Gln Pro Cys Val Leu Gly Arg Glu Ser Phe Ala Ser Gly
370 375 380
Lys His Tyr Trp Glu Val Glu Val Glu Asn Val Ile Glu Trp Thr Val
385 390 395 400
Gly Val Cys Arg Asp Ser Val Glu Arg Lys Gly Glu Val Leu Leu Ile
405 410 415
Pro Gln Asn Gly Phe Trp Thr Leu Glu Met His Lys Gly Gln Tyr Arg
420 425 430
Ala Val Ser Ser Pro Asp Arg Ile Leu Pro Leu Lys Glu Ser Leu Cys
435 440 445
Arg Val Gly Val Phe Leu Asp Tyr Glu Ala Gly Asp Val Ser Phe Tyr
450 455 460
Asn Met Arg Asp Arg Ser His Ile Tyr Thr Cys Pro Arg Ser Ala Phe
465 470 475 480
Ser Val Pro Val Arg Pro Phe Phe Arg Leu Gly Cys Glu Asp Ser Pro
485 490 495
Ile Phe Ile Cys Pro Ala Leu Thr Gly Ala Asn Gly Val Thr Val Pro
500 505 510
Glu Glu Gly Leu Thr Leu His Arg Val Gly Thr His Gln Ser Leu
515 520 525
<210> 18
<211> 523
<212> PRT
<213> Homo sapiens
<400> 18
Met Glu Pro Ala Ala Ala Leu His Phe Ser Leu Pro Ala Ser Leu Leu
1 5 10 15
Leu Leu Leu Leu Leu Leu Leu Leu Ser Leu Cys Ala Leu Val Ser Ala
20 25 30
Gln Phe Thr Val Val Gly Pro Ala Asn Pro Ile Leu Ala Met Val Gly
35 40 45
Glu Asn Thr Thr Leu Arg Cys His Leu Ser Pro Glu Lys Asn Ala Glu
50 55 60
Asp Met Glu Val Arg Trp Phe Arg Ser Gln Phe Ser Pro Ala Val Phe
65 70 75 80
Val Tyr Lys Gly Gly Arg Glu Arg Thr Glu Glu Gln Met Glu Glu Tyr
85 90 95
Arg Gly Arg Ile Thr Phe Val Ser Lys Asp Ile Asn Arg Gly Ser Val
100 105 110
Ala Leu Val Ile His Asn Val Thr Ala Gln Glu Asn Gly Ile Tyr Arg
115 120 125
Cys Tyr Phe Gln Glu Gly Arg Ser Tyr Asp Glu Ala Ile Leu Arg Leu
130 135 140
Val Val Ala Gly Leu Gly Ser Lys Pro Leu Ile Glu Ile Lys Ala Gln
145 150 155 160
Glu Asp Gly Ser Ile Trp Leu Glu Cys Ile Ser Gly Gly Trp Tyr Pro
165 170 175
Glu Pro Leu Thr Val Trp Arg Asp Pro Tyr Gly Glu Val Val Pro Ala
180 185 190
Leu Lys Glu Val Ser Ile Ala Asp Ala Asp Gly Leu Phe Met Val Thr
195 200 205
Thr Ala Val Ile Ile Arg Asp Lys Tyr Val Arg Asn Val Ser Cys Ser
210 215 220
Val Asn Asn Thr Leu Leu Gly Gln Glu Lys Glu Thr Val Ile Phe Ile
225 230 235 240
Pro Glu Ser Phe Met Pro Ser Ala Ser Pro Trp Met Val Ala Leu Ala
245 250 255
Val Ile Leu Thr Ala Ser Pro Trp Met Val Ser Met Thr Val Ile Leu
260 265 270
Ala Val Phe Ile Ile Phe Met Ala Val Ser Ile Cys Cys Ile Lys Lys
275 280 285
Leu Gln Arg Glu Lys Lys Ile Leu Ser Gly Glu Lys Lys Val Glu Gln
290 295 300
Glu Glu Lys Glu Ile Ala Gln Gln Leu Gln Glu Glu Leu Arg Trp Arg
305 310 315 320
Arg Thr Phe Leu His Ala Ala Asp Val Val Leu Asp Pro Asp Thr Ala
325 330 335
His Pro Glu Leu Phe Leu Ser Glu Asp Arg Arg Ser Val Arg Arg Gly
340 345 350
Pro Tyr Arg Gln Arg Val Pro Asp Asn Pro Glu Arg Phe Asp Ser Gln
355 360 365
Pro Cys Val Leu Gly Trp Glu Ser Phe Ala Ser Gly Lys His Tyr Trp
370 375 380
Glu Val Glu Val Glu Asn Val Met Val Trp Thr Val Gly Val Cys Arg
385 390 395 400
His Ser Val Glu Arg Lys Gly Glu Val Leu Leu Ile Pro Gln Asn Gly
405 410 415
Phe Trp Thr Leu Glu Met Phe Gly Asn Gln Tyr Arg Ala Leu Ser Ser
420 425 430
Pro Glu Arg Ile Leu Pro Leu Lys Glu Ser Leu Cys Arg Val Gly Val
435 440 445
Phe Leu Asp Tyr Glu Ala Gly Asp Val Ser Phe Tyr Asn Met Arg Asp
450 455 460
Arg Ser His Ile Tyr Thr Cys Pro Arg Ser Ala Phe Thr Val Pro Val
465 470 475 480
Arg Pro Phe Phe Arg Leu Gly Ser Asp Asp Ser Pro Ile Phe Ile Cys
485 490 495
Pro Ala Leu Thr Gly Ala Ser Gly Val Met Val Pro Glu Glu Gly Leu
500 505 510
Lys Leu His Arg Val Gly Thr His Gln Ser Leu
515 520
<210> 19
<211> 137
<212> PRT
<213> Mus musculus
<400> 19
Met Gly Trp Asn Trp Ile Phe Ile Leu Ile Leu Ser Val Thr Thr Gly
1 5 10 15
Val His Ser Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe
35 40 45
Thr Val Tyr Tyr Met Leu Trp Val Lys Gln Ser Pro Glu Lys Ser Leu
50 55 60
Glu Trp Ile Gly Glu Ile Asn Pro Ser Thr Gly Gly Thr Thr Tyr Asn
65 70 75 80
Gln Lys Phe Lys Ala Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Met Gln Leu Lys Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Gly Pro Ser Phe Tyr Ala Leu Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Ser Val Thr Val Ser Ser
130 135
<210> 20
<211> 130
<212> PRT
<213> Mus musculus
<400> 20
Met Asp Phe Gln Met Gln Ile Ile Ser Leu Leu Leu Ile Ser Val Thr
1 5 10 15
Val Ile Val Ser His Gly Glu Ile Val Leu Thr Gln Ser Pro Thr Thr
20 25 30
Met Ala Ala Ser Pro Gly Glu Lys Ile Thr Ile Thr Cys Ser Ala Thr
35 40 45
Ser Ser Ile Ser Ser Asn Tyr Leu His Trp Tyr Arg His Lys Pro Gly
50 55 60
Phe Ser Pro Lys Leu Leu Ile Tyr Arg Thr Ser Asn Leu Ala Ser Gly
65 70 75 80
Val Pro Gly Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu
85 90 95
Thr Ile Gly Thr Met Glu Ala Glu Asp Val Ala Thr Tyr Tyr Cys Gln
100 105 110
Gln Gly Ser Ser Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu
115 120 125
Ile Lys
130
<210> 21
<211> 5
<212> PRT
<213> Mus musculus
<400> 21
Val Tyr Tyr Met Leu
1 5
<210> 22
<211> 17
<212> PRT
<213> Mus musculus
<400> 22
Glu Ile Asn Pro Ser Thr Gly Gly Thr Thr Tyr Asn Gln Lys Phe Lys
1 5 10 15
Ala
<210> 23
<211> 9
<212> PRT
<213> Mus musculus
<400> 23
Gly Pro Ser Phe Tyr Ala Leu Asp Tyr
1 5
<210> 24
<211> 12
<212> PRT
<213> Mus musculus
<400> 24
Ser Ala Thr Ser Ser Ile Ser Ser Asn Tyr Leu His
1 5 10
<210> 25
<211> 7
<212> PRT
<213> Mus musculus
<400> 25
Arg Thr Ser Asn Leu Ala Ser
1 5
<210> 26
<211> 9
<212> PRT
<213> Mus musculus
<400> 26
Gln Gln Gly Ser Ser Ile Pro Arg Thr
1 5
<210> 27
<211> 15
<212> DNA
<213> Mus musculus
<400> 27
gtctactaca tgctc
15
<210> 28
<211> 51
<212> DNA
<213> Mus musculus
<400> 28
gagattaatc ctagcactgg tggtactacc tacaaccaga agttcaaggc c
51
<210> 29
<211> 27
<212> DNA
<213> Mus musculus
<400> 29
ggcccgagct tttatgctct ggactac
27
<210> 30
<211> 36
<212> DNA
<213> Mus musculus
<400> 30
agtgccacct ctagtataag ttccaattac ttgcat
36
<210> 31
<211> 21
<212> DNA
<213> Mus musculus
<400> 31
aggacatcca atctggcttc t
21
<210> 32
<211> 27
<212> DNA
<213> Mus musculus
<400> 32
cagcagggta gtagtatacc acgcacg
27
<210> 33
<211> 411
<212> DNA
<213> Mus musculus
<400> 33
atgggatgga actggatctt tattttaatc ctgtcagtaa ctacaggtgt ccactctgag
60
gtccagctgc agcagtctgg acctgagctg gtgaagcctg gggcttcagt gaagatatcc
120
tgcaaggctt ctggttactc attcactgtc tactacatgc tctgggtgaa acaaagtcct
180
gaaaagagcc ttgagtggat tggagagatt aatcctagca ctggtggtac tacctacaac
240
cagaagttca aggccaaggc cacattgact gtagacaaat cctccagcac agcctacatg
300
cagctcaaga gcctgacatc tgaggactct gcagtctatt actgtgcaag gggcccgagc
360
ttttatgctc tggactactg gggtcaagga acctcagtca ccgtctcctc a
411
<210> 34
<211> 390
<212> DNA
<213> Mus musculus
<400> 34
atggattttc agatgcagat tatcagcttg ctgctaatca gtgtcacagt catagtgtct
60
catggagaaa ttgtgctcac ccagtctcca accaccatgg ctgcatctcc cggggagaag
120
atcactatca cctgcagtgc cacctctagt ataagttcca attacttgca ttggtatcga
180
cataagccag gattctcccc taaactcttg atttatagga catccaatct ggcttctgga
240
gtcccaggtc gcttcagtgg cagtgggtct gggacctctt actctctcac aattggcacc
300
atggaggctg aagatgttgc cacttactac tgccagcagg gtagtagtat accacgcacg
360
ttcggagggg ggaccaagct ggaaataaaa
390
<210> 35
<211> 1083
<212> PRT
<213> Macaca fascicularis
<400> 35
Met Gln Arg Gln Phe Ser Lys Ala Ser Arg Pro Cys Leu Pro Trp Val
1 5 10 15
Leu Met Glu Pro Ala Ala Ala Leu His Phe Ser Leu Pro Ala Ser Leu
20 25 30
Ile Leu Leu Leu Leu Leu Leu Arg Leu Cys Ala Leu Val Ser Ala Gln
35 40 45
Phe Thr Val Val Gly Pro Thr Asp Pro Ile Leu Ala Met Val Gly Glu
50 55 60
Asn Thr Thr Leu Arg Cys His Leu Ser Pro Glu Lys Asn Ala Glu Asp
65 70 75 80
Met Glu Val Arg Trp Phe Arg Ser Gln Phe Ser Pro Ala Val Phe Val
85 90 95
Tyr Lys Gly Gly Arg Glu Arg Thr Glu Glu Gln Met Glu Glu Tyr Arg
100 105 110
Gly Arg Thr Thr Phe Val Ser Lys Asp Ile Ser Arg Gly Ser Val Ala
115 120 125
Leu Ile Ile His Asn Val Thr Ala Gln Glu Asn Gly Thr Tyr Arg Cys
130 135 140
Tyr Phe Gln Glu Gly Arg Ser Tyr Asp Glu Ala Ile Leu His Leu Met
145 150 155 160
Val Ala Gly Leu Gly Ser Lys Pro Leu Val Glu Met Arg Gly His Glu
165 170 175
Asp Gly Gly Ile Arg Leu Glu Cys Ile Ser Arg Gly Trp Tyr Pro Lys
180 185 190
Pro Leu Thr Val Trp Arg Asp Pro Tyr Gly Arg Val Val Pro Ala Leu
195 200 205
Lys Glu Val Phe Pro Pro Asp Thr Asp Gly Leu Phe Met Val Thr Thr
210 215 220
Ala Val Ile Ile Arg Asp Lys Ser Met Arg Asn Met Ser Cys Ser Ile
225 230 235 240
Ser Asp Thr Leu Leu Gly Gln Lys Lys Glu Ser Val Ile Phe Ile Pro
245 250 255
Glu Ser Phe Met Pro Ser Val Ser Pro Cys Val Val Ala Leu Pro Ile
260 265 270
Ile Val Val Phe Leu Met Ile Ile Ile Ala Val Cys Ile Tyr Trp Ile
275 280 285
Asn Arg Leu Gln Lys Glu Thr Lys Ile Leu Ser Gly Glu Lys Glu Ser
290 295 300
Glu Arg Lys Thr Arg Glu Ile Ala Val Lys Glu Leu Lys Lys Glu Arg
305 310 315 320
Val Gln Lys Glu Lys Glu Leu Gln Val Lys Glu Gln Leu Gln Glu Glu
325 330 335
Leu Arg Trp Arg Arg Thr Val Leu His Ala Val Asp Val Val Leu Asp
340 345 350
Pro Asp Thr Ala His Pro Asp Leu Leu Leu Ser Glu Asp Arg Arg Ser
355 360 365
Val Arg Arg Cys Pro Leu Gly His Leu Gly Glu Ser Val Pro Asp Asn
370 375 380
Pro Glu Arg Phe Asn Ser Glu Pro Cys Val Leu Gly Arg Glu Ser Phe
385 390 395 400
Ala Ser Gly Lys His Tyr Trp Glu Val Glu Val Glu Asn Val Ile Glu
405 410 415
Trp Thr Val Gly Val Cys Arg Asp Ser Val Glu Arg Lys Glu Glu Val
420 425 430
Leu Leu Arg Pro Arg Asn Gly Phe Trp Thr Leu Glu Met Cys Lys Gly
435 440 445
Gln Tyr Arg Ala Leu Ser Ser Pro Lys Arg Ile Leu Pro Leu Lys Glu
450 455 460
Ser Leu Cys Arg Val Gly Val Phe Leu Asp Tyr Glu Ala Gly Asp Val
465 470 475 480
Ser Phe Tyr Asn Met Arg Asp Arg Ser His Ile Tyr Thr Cys Pro Arg
485 490 495
Leu Ala Phe Ser Val Pro Val Arg Pro Phe Phe Arg Ile Gly Ser Asp
500 505 510
Asp Ser Pro Ile Phe Ile Cys Pro Ala Leu Thr Gly Ala Ser Gly Ile
515 520 525
Thr Val Pro Glu Glu Gly Leu Ile Leu His Arg Val Gly Thr Asn Gln
530 535 540
Ser Leu Met Pro Val Gly Thr Arg Cys Tyr Gly His Gly Met Arg Pro
545 550 555 560
Thr Gly Phe Ile Arg Met Arg Glu Glu Arg Gly Ile His Arg Thr Thr
565 570 575
Arg Glu Glu Arg Glu Pro Asp Met Gln Asn Phe Asp Leu Gly Ala His
580 585 590
Trp Ser Asn Asn Leu Pro Ser Ala Arg Ser Arg Glu Phe Leu Asn Ser
595 600 605
Asp Leu Val Pro Asp His Ser Leu Glu Ser Pro Val Thr Pro Gly Leu
610 615 620
Ala Asn Lys Thr Gly Glu Pro Gln Ala Glu Val Thr Cys Leu Cys Phe
625 630 635 640
Ser Leu Pro Ser Ser Glu Leu Arg Ala Phe Pro Ser Thr Ala Thr Asn
645 650 655
His Asn His Lys Ala Thr Ala Leu Gly Ser Asp Leu His Ile Glu Val
660 665 670
Lys Gly Tyr Glu Asp Gly Gly Ile His Leu Glu Cys Arg Ser Thr Gly
675 680 685
Trp Tyr Pro Gln Pro Gln Ile Gln Trp Ser Asn Thr Lys Gly Gln His
690 695 700
Ile Pro Ala Val Lys Ala Pro Val Val Ala Asp Gly Val Gly Leu Tyr
705 710 715 720
Ala Val Ala Ala Ser Val Ile Met Arg Gly Ser Ser Gly Glu Gly Val
725 730 735
Ser Cys Ile Ile Arg Asn Ser Leu Leu Gly Leu Glu Lys Thr Ala Ser
740 745 750
Ile Ser Ile Thr Asp Pro Phe Phe Arg Asn Ala Gln Pro Trp Ile Ala
755 760 765
Ala Leu Ala Gly Thr Leu Pro Ile Ser Leu Leu Leu Leu Ala Gly Ala
770 775 780
Ser Tyr Phe Leu Trp Arg Gln Gln Lys Glu Lys Ile Ala Leu Ser Arg
785 790 795 800
Glu Thr Glu Arg Glu Arg Glu Met Lys Glu Met Gly Tyr Ala Ala Thr
805 810 815
Lys Gln Glu Ile Ser Leu Arg Gly Gly Glu Lys Ser Leu Ala Tyr His
820 825 830
Gly Thr His Ile Ser Tyr Leu Ala Ala Pro Glu Arg Trp Glu Met Ala
835 840 845
Val Phe Pro Asn Ser Gly Leu Pro Arg Cys Leu Leu Thr Leu Ile Leu
850 855 860
Leu Gln Leu Pro Lys Leu Asp Ser Ala Pro Phe Asp Val Ile Gly Pro
865 870 875 880
Pro Glu Pro Ile Leu Ala Val Val Gly Glu Asp Ala Glu Leu Pro Cys
885 890 895
Arg Leu Ser Pro Asn Ala Ser Ala Glu His Leu Glu Leu Arg Trp Phe
900 905 910
Arg Lys Lys Val Ser Pro Ala Val Leu Val His Arg Asp Gly Arg Glu
915 920 925
Gln Glu Ala Glu Gln Met Pro Glu Tyr Arg Gly Arg Ala Thr Leu Val
930 935 940
Gln Asp Gly Ile Ala Glu Gly Arg Val Ala Leu Arg Ile Arg Gly Val
945 950 955 960
Arg Val Ser Asp Asp Gly Glu Tyr Thr Cys Phe Phe Arg Glu Asp Gly
965 970 975
Ser Tyr Glu Glu Ala Leu Val His Leu Lys Val Ala Ala Leu Gly Ser
980 985 990
Asp Pro His Ile Ser Met Gln Val Gln Glu Asn Gly Glu Ile Trp Leu
995 1000 1005
Glu Cys Thr Ser Val Gly Trp Tyr Pro Glu Pro Gln Val Gln Trp
1010 1015 1020
Arg Thr Ser Lys Gly Glu Lys Phe Pro Ser Thr Ser Glu Ser Arg
1025 1030 1035
Asn Pro Asp Glu Glu Gly Leu Phe Thr Val Ala Ala Ser Val Ile
1040 1045 1050
Ile Arg Asp Thr Ser Val Lys Asn Val Ser Cys Tyr Ile Gln Asn
1055 1060 1065
Leu Leu Leu Gly Gln Glu Lys Glu Val Glu Ile Phe Ile Pro Gly
1070 1075 1080
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ BTN3A И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ РАКА ИЛИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2800726C2 |
| ИНГИБИТОР ИММУНОСУПРЕССИИ, СВЯЗАННЫЙ С РАКОМ | 2018 |
|
RU2805232C2 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-15Rα ДОМЕНА SUSHI | 2012 |
|
RU2763298C2 |
| РЕКОМБИНАНТНЫЕ КЛЕТКИ ДРОЖЖЕЙ, ПРОДУЦИРУЮЩИЕ ПОЛИМОЛОЧНУЮ КИСЛОТУ, И ИХ ИСПОЛЬЗОВАНИЯ | 2016 |
|
RU2758138C2 |
| ВАРИАНТЫ КИСЛОЙ АЛЬФА-ГЛЮКОЗИДАЗЫ И ИХ ИСПОЛЬЗОВАНИЕ | 2017 |
|
RU2780410C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ О-АЦЕТИЛИРОВАННОГО ГАНГЛИОЗИДА GD2 ДЛЯ УЛУЧШЕНИЯ ТЕРАПЕВТИЧЕСКОГО ПОТЕНЦИАЛА ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2017 |
|
RU2771173C2 |
| ЛЕЧЕНИЕ АНОМАЛЬНОГО ОТЛОЖЕНИЯ ВИСЦЕРАЛЬНОГО ЖИРА С ИСПОЛЬЗОВАНИЕМ РАСТВОРИМЫХ ПОЛИПЕПТИДОВ РЕЦЕПТОРА ФАКТОРА РОСТА ФИБРОБЛАСТОВ 3 (sFGFR3) | 2018 |
|
RU2794170C2 |
| ПОЛИПЕПТИДЫ, ЯВЛЯЮЩИЕСЯ РАСТВОРИМЫМИ РЕЦЕПТОРАМИ 3 ФАКТОРА РОСТА ФИБРОБЛАСТОВ (SFGFR3), И ПУТИ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2751483C2 |
| Выделенное антитело к CD45RC человека, нуклеиновая кислота, вектор экспрессии, клетка, фармацевтическая композиция, их применение, in vitro способ обнаружения hCD45RC | 2019 |
|
RU2826421C2 |
| АНТИТЕЛА К CD38 И СОСТАВЫ | 2020 |
|
RU2826957C2 |
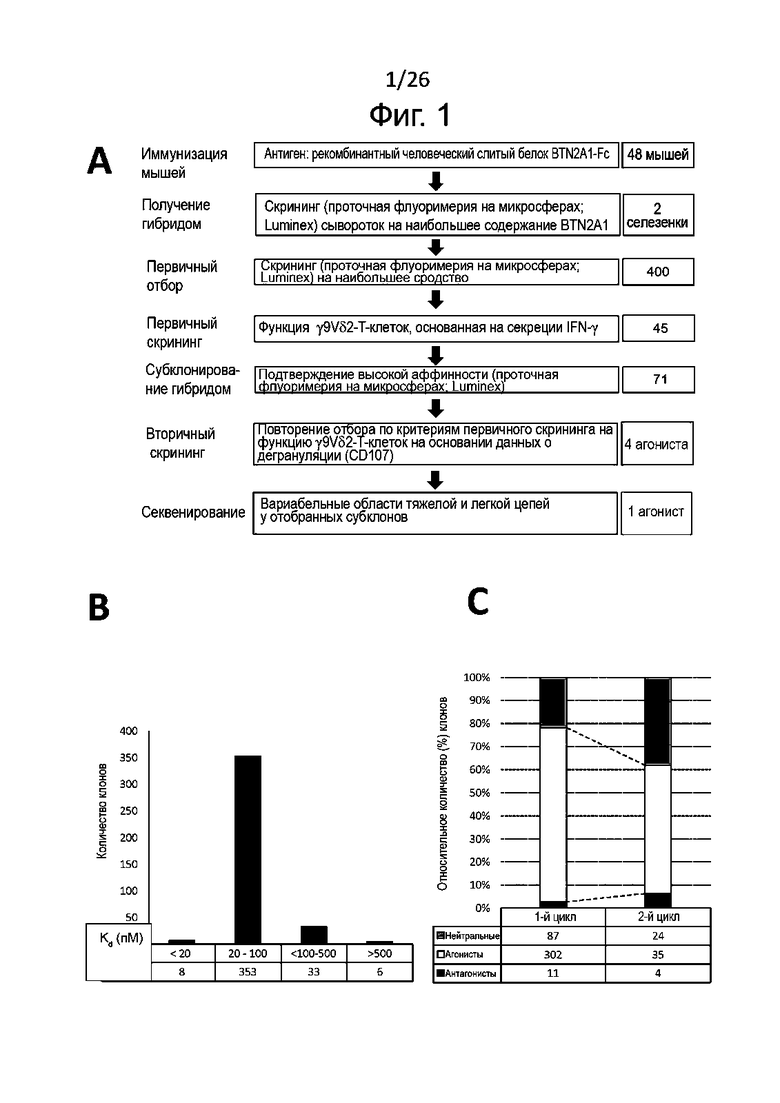
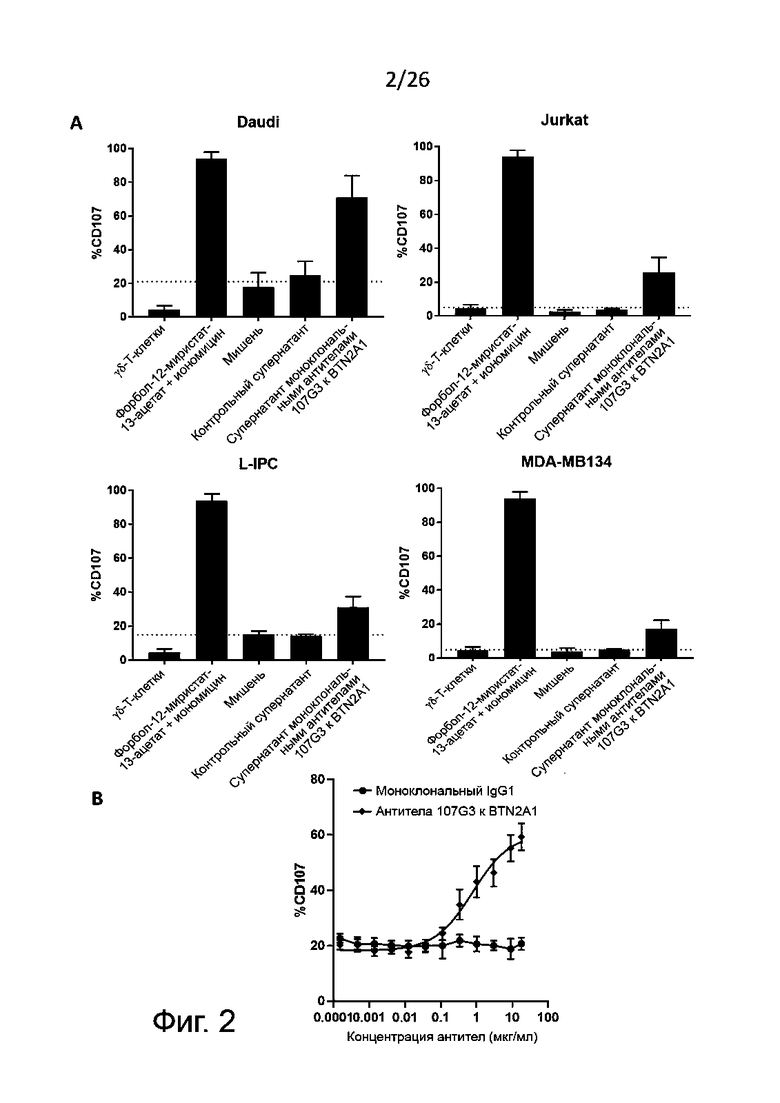
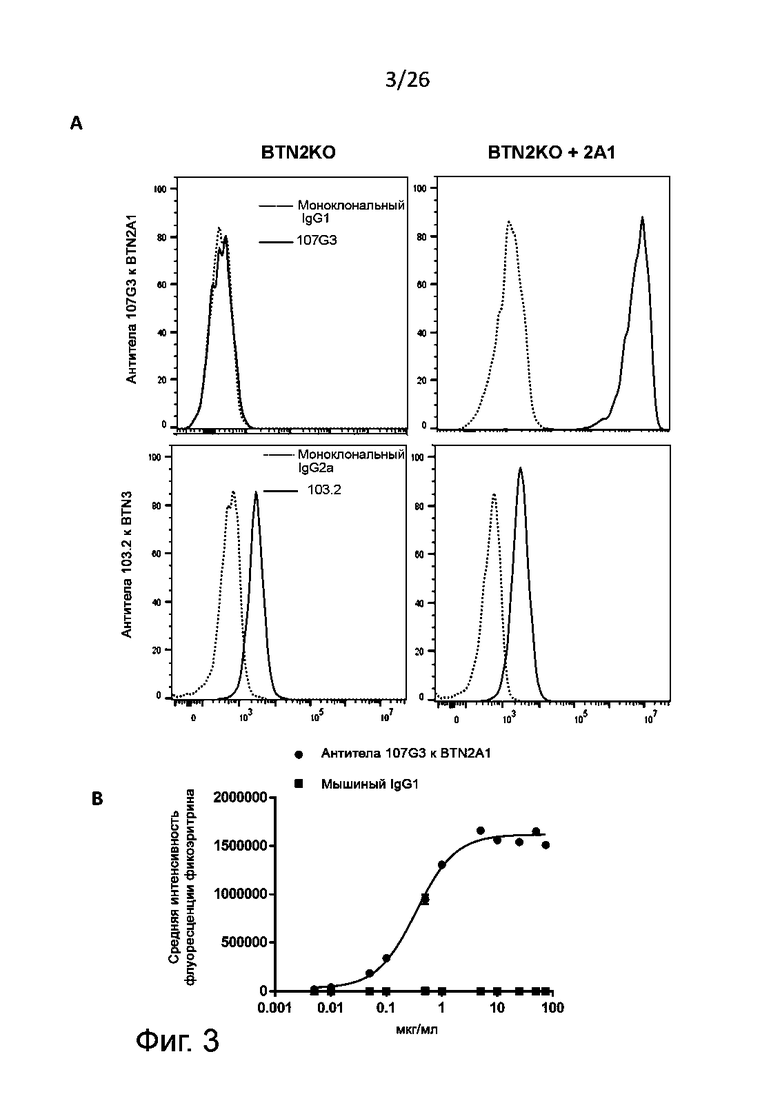
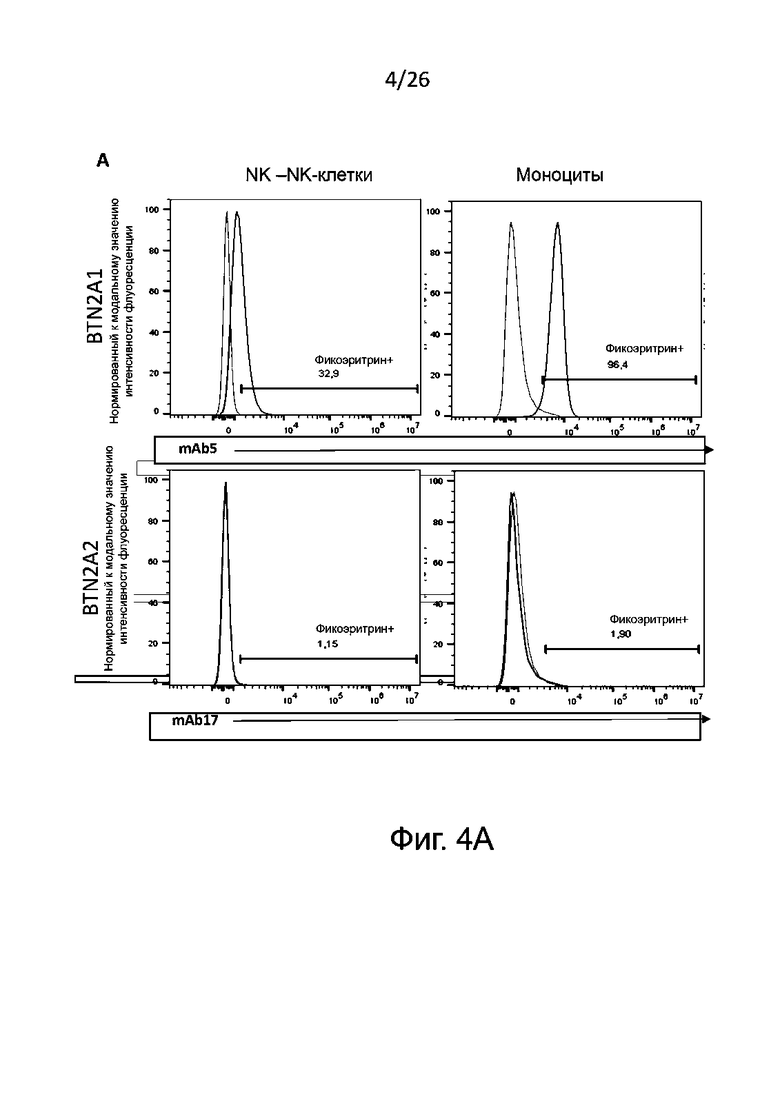
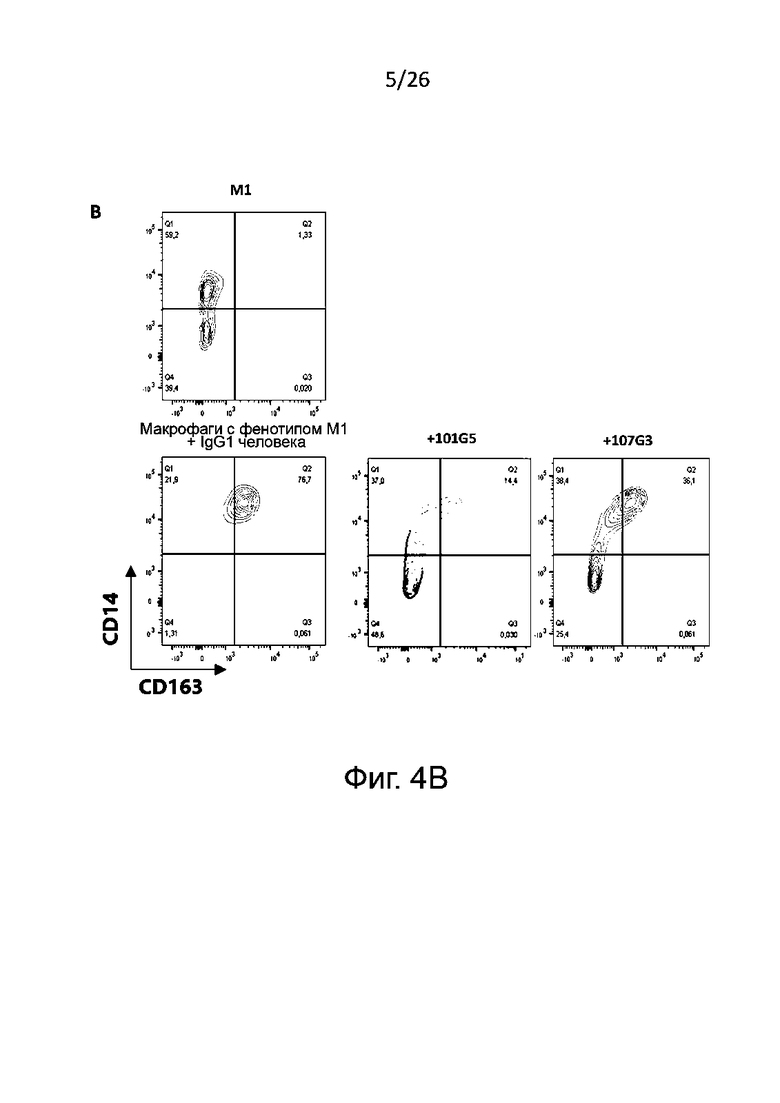
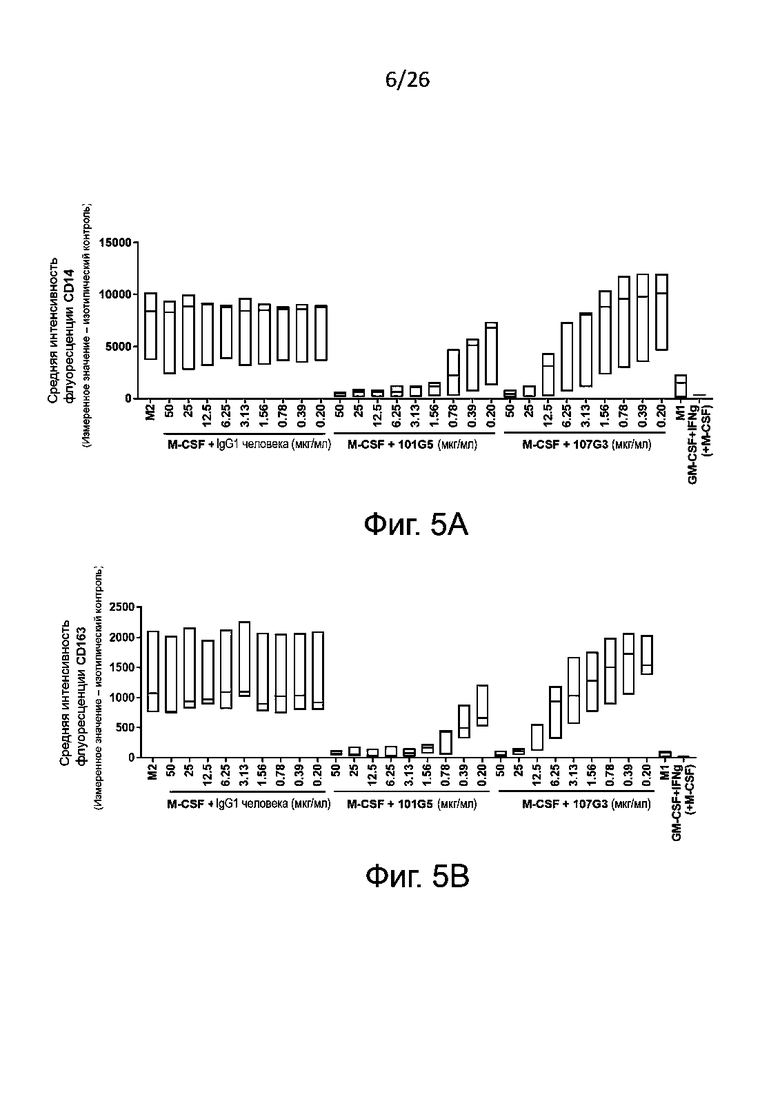
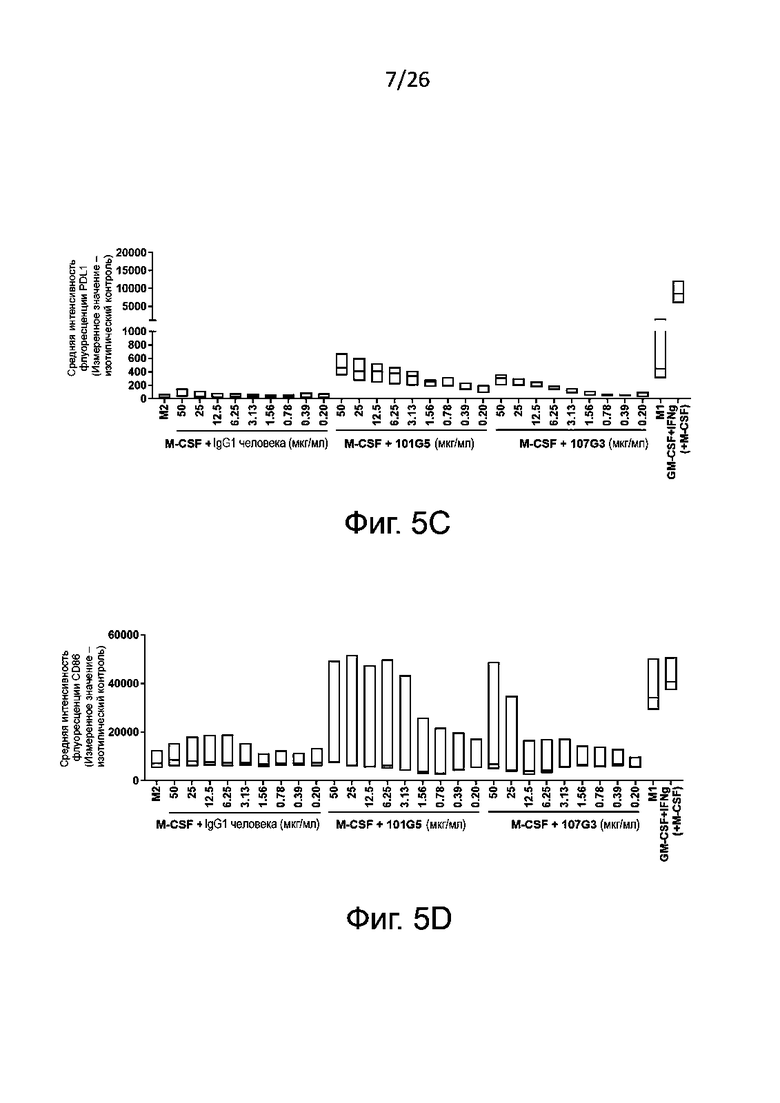
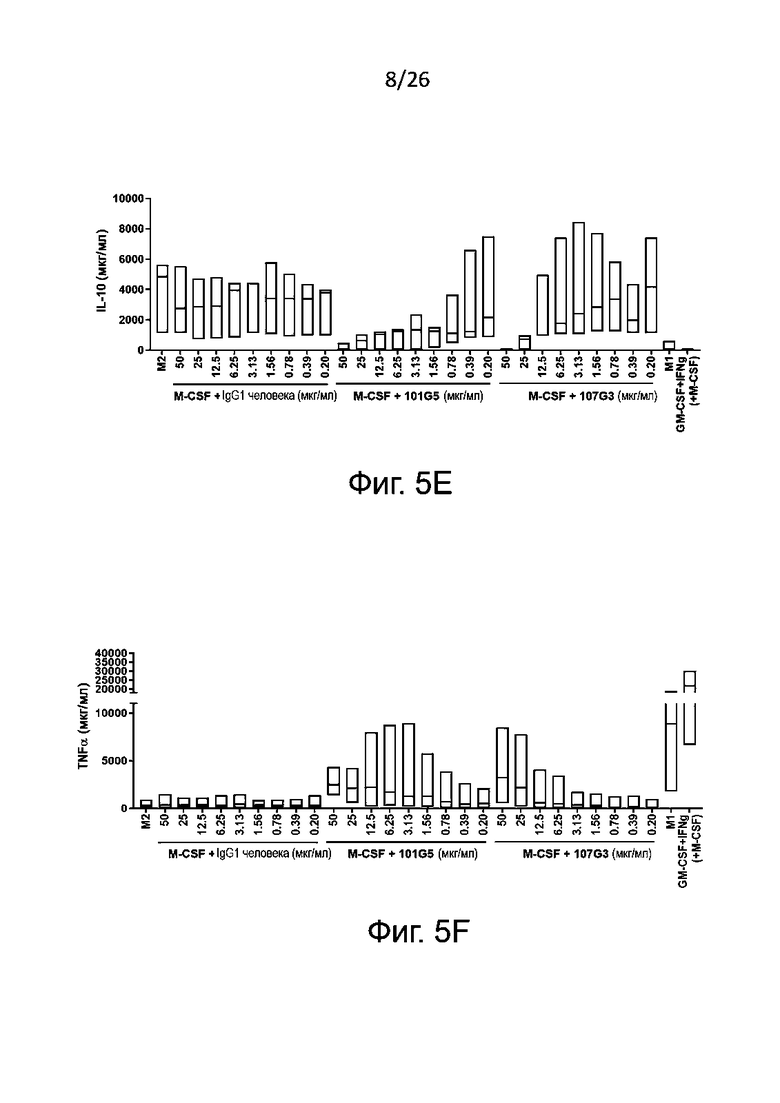
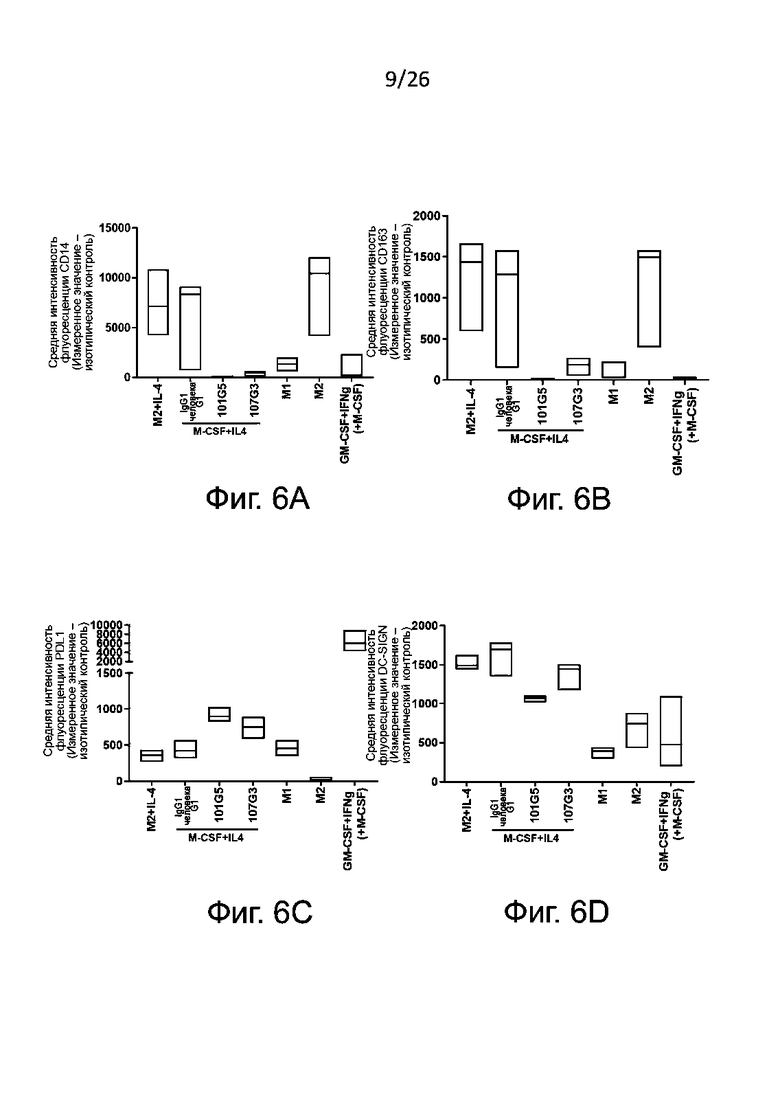
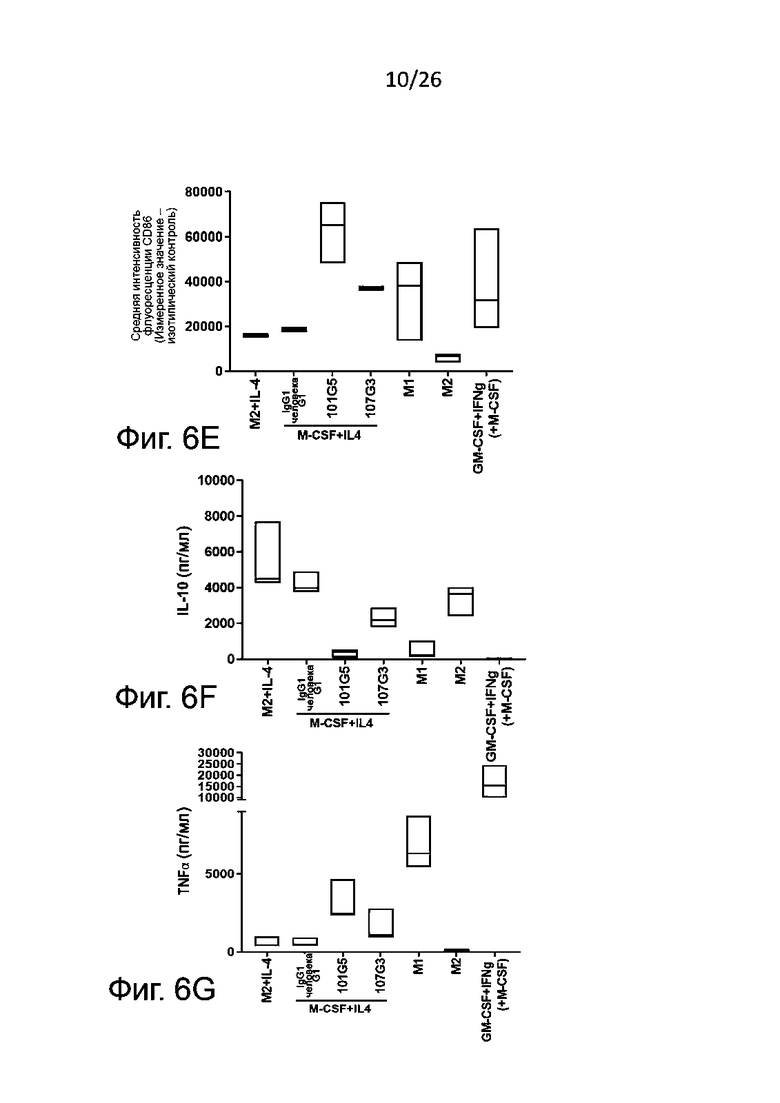
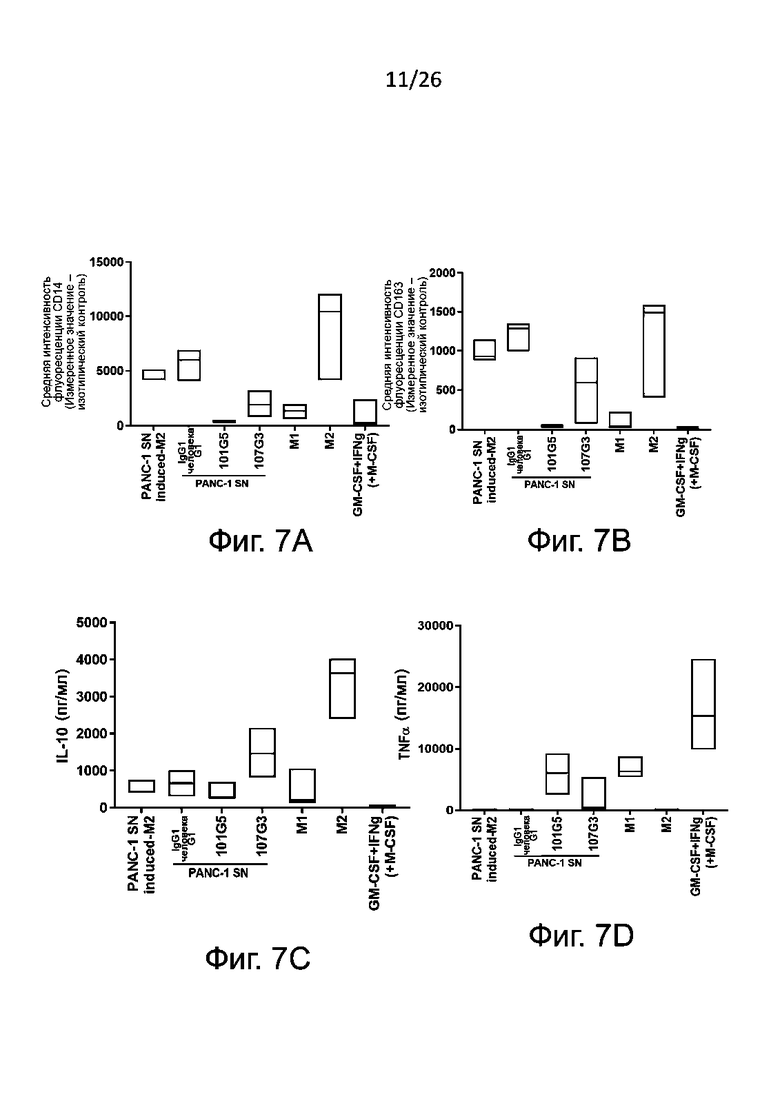
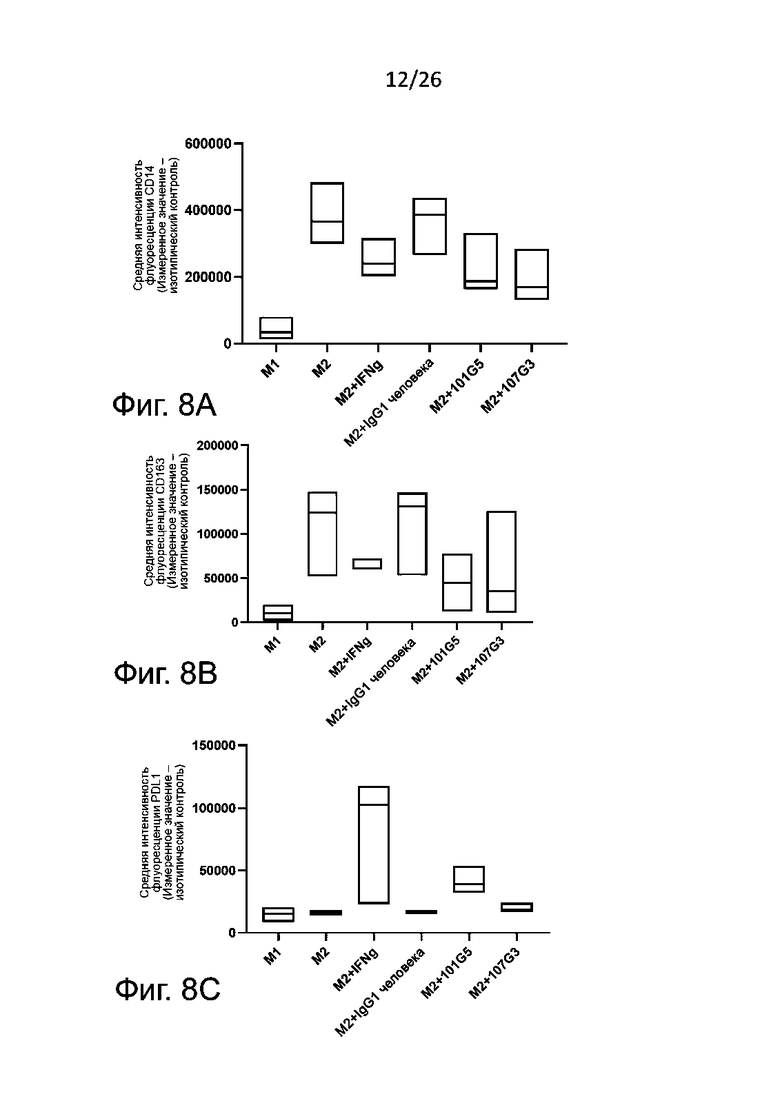
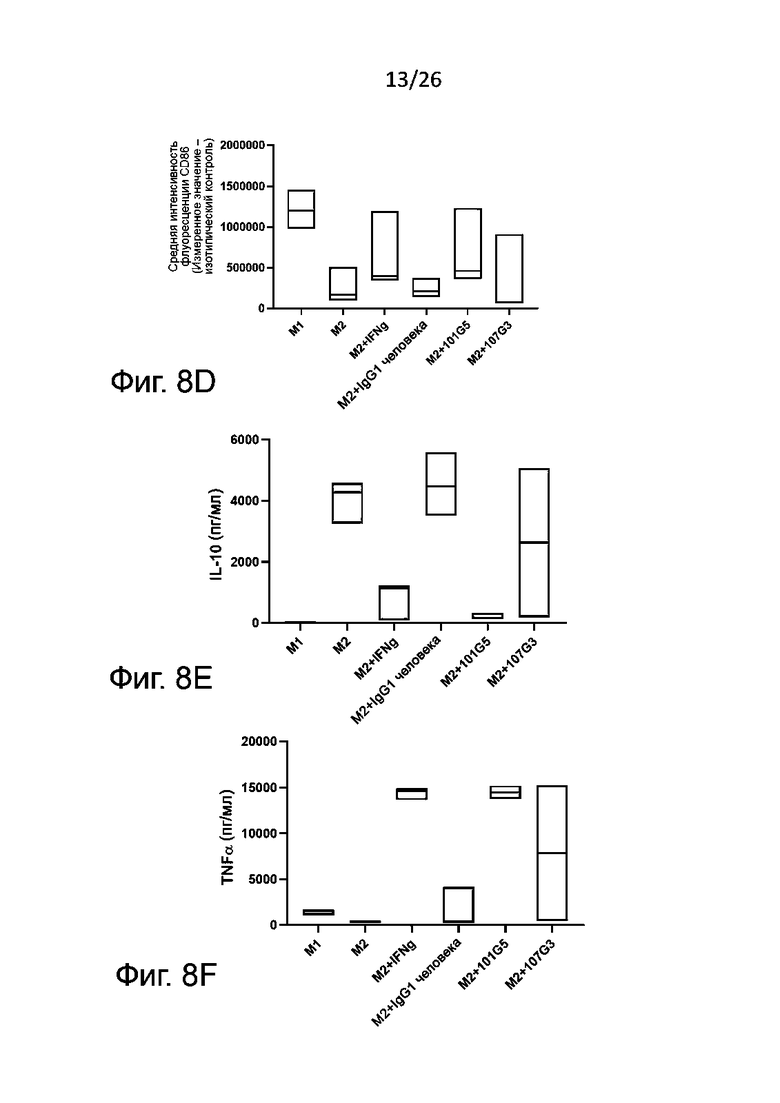
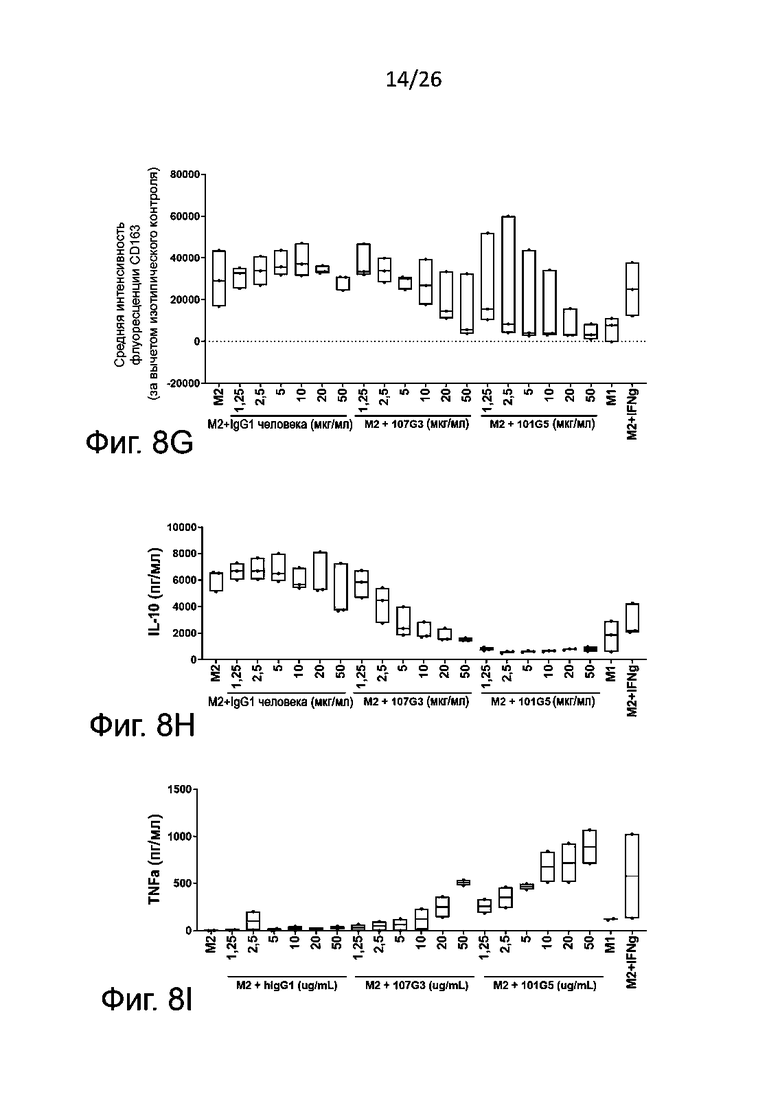
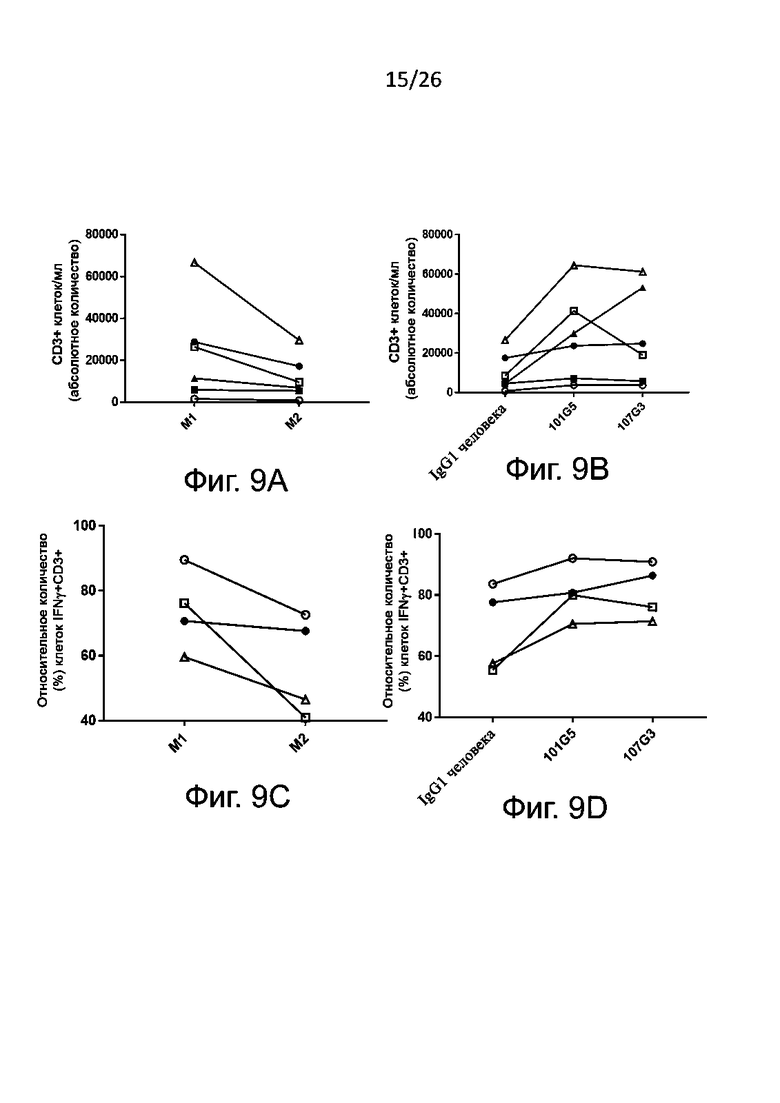
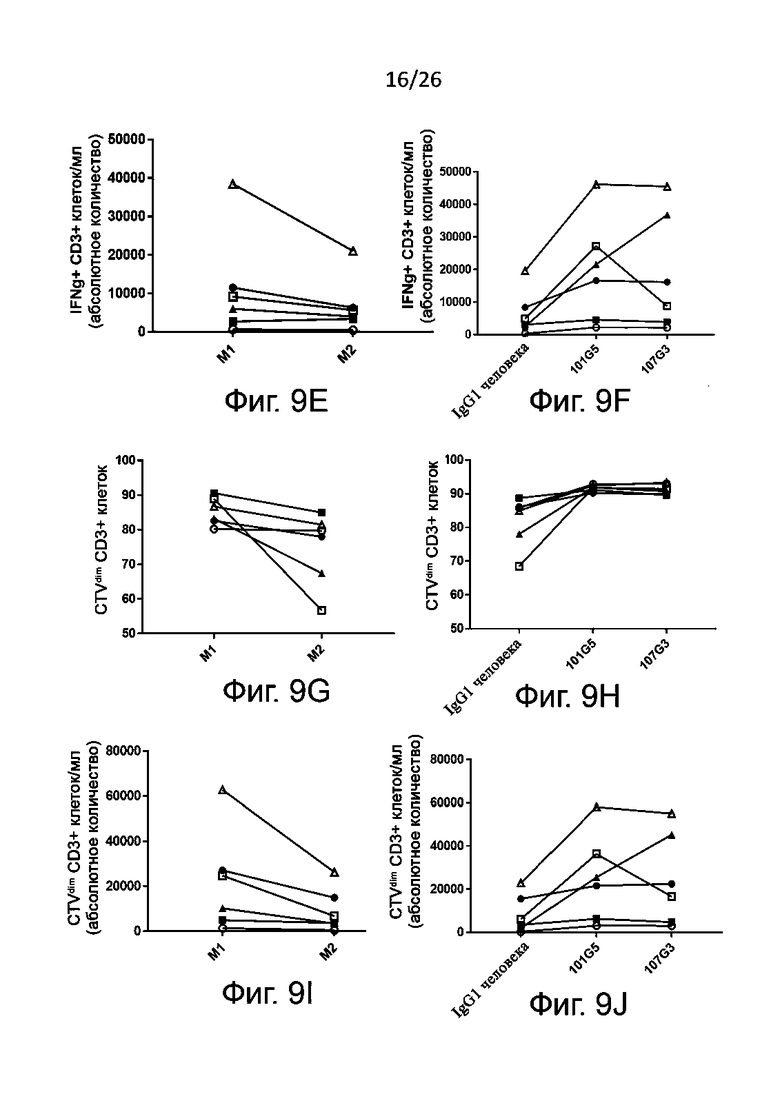
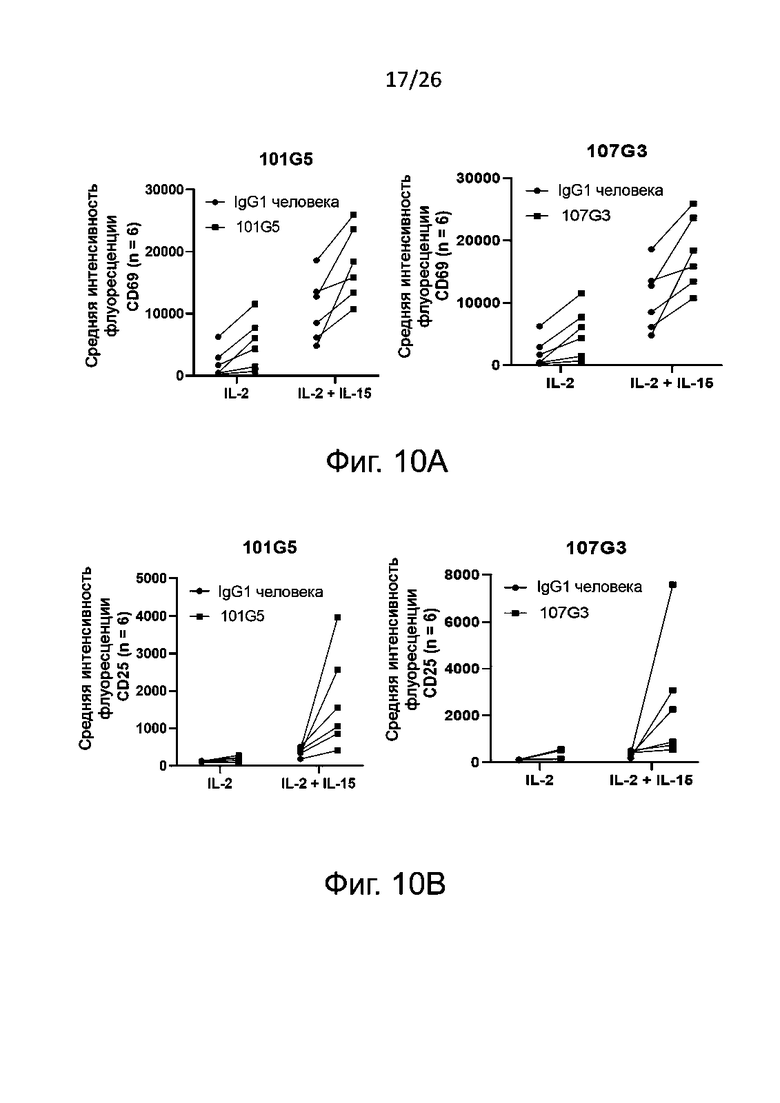
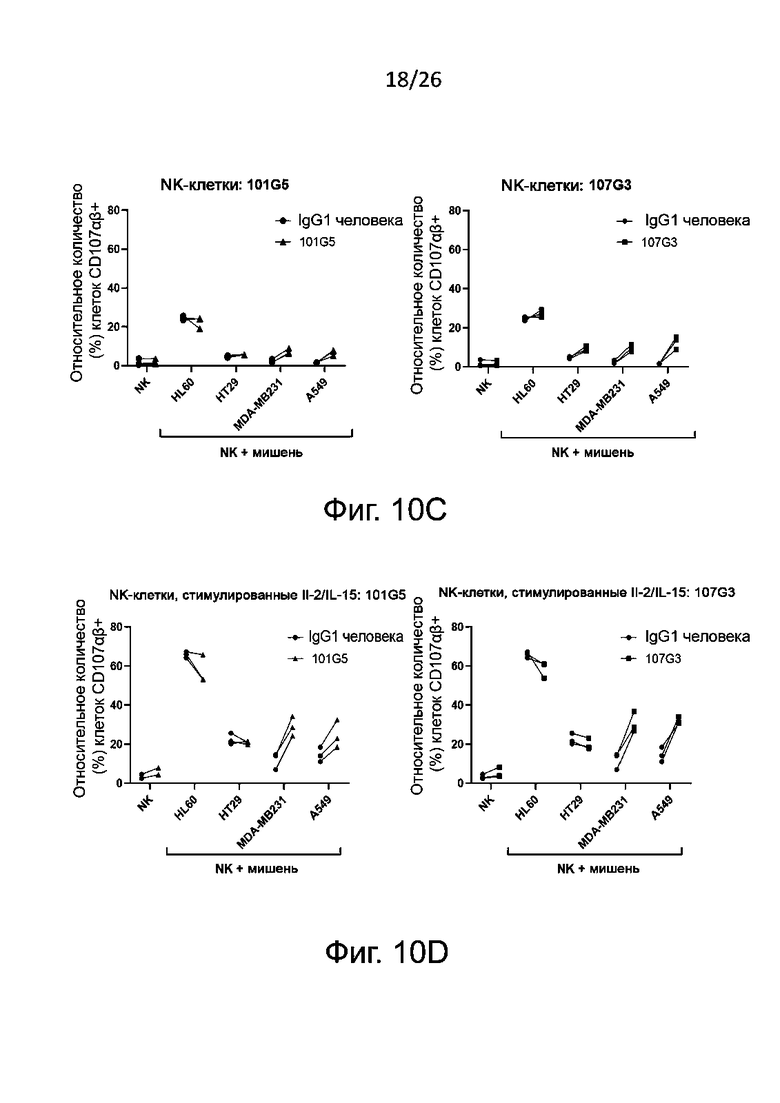
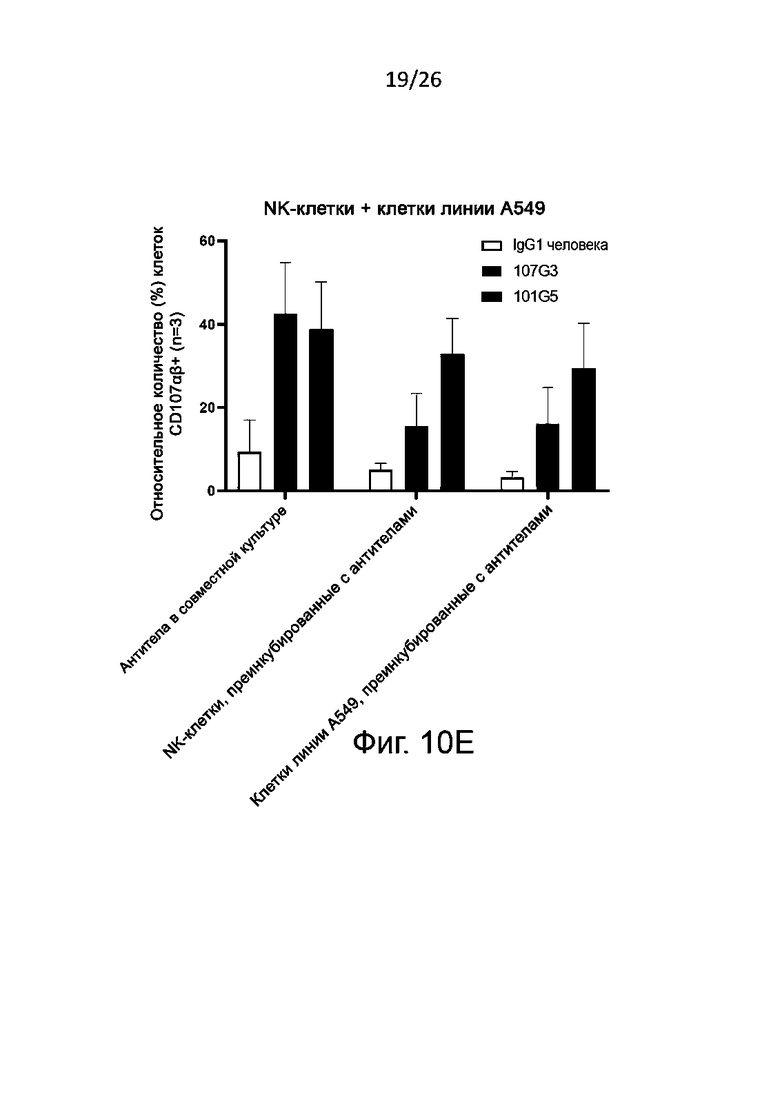
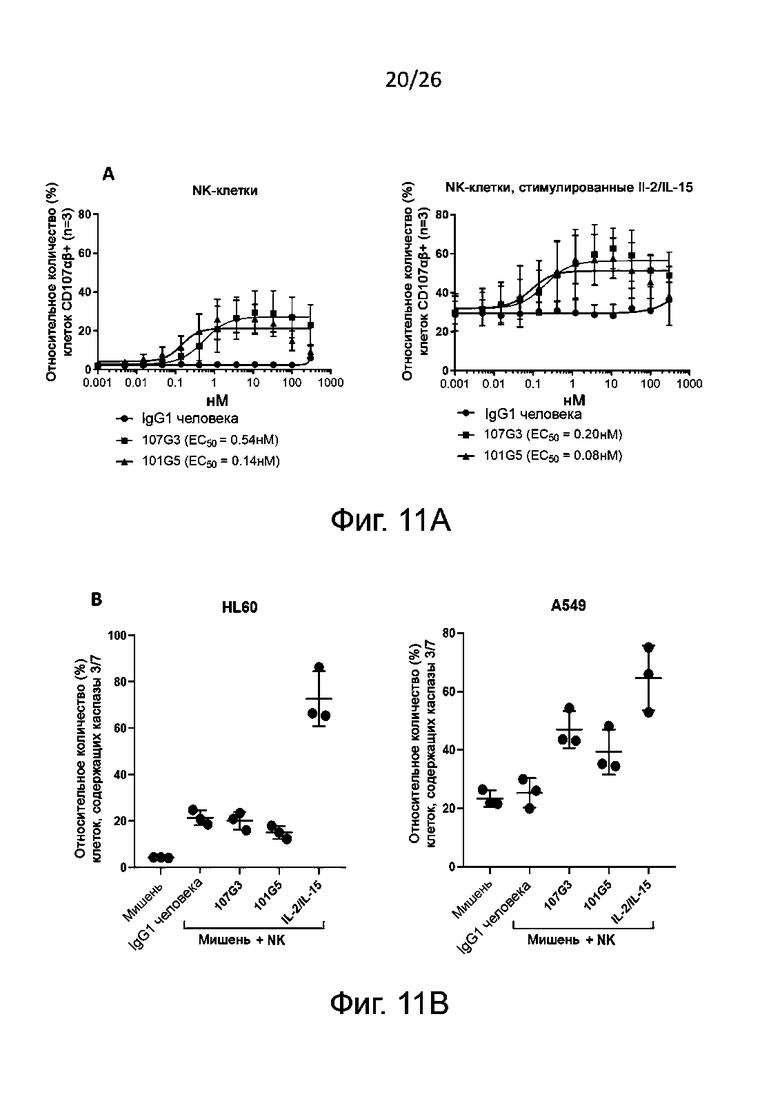
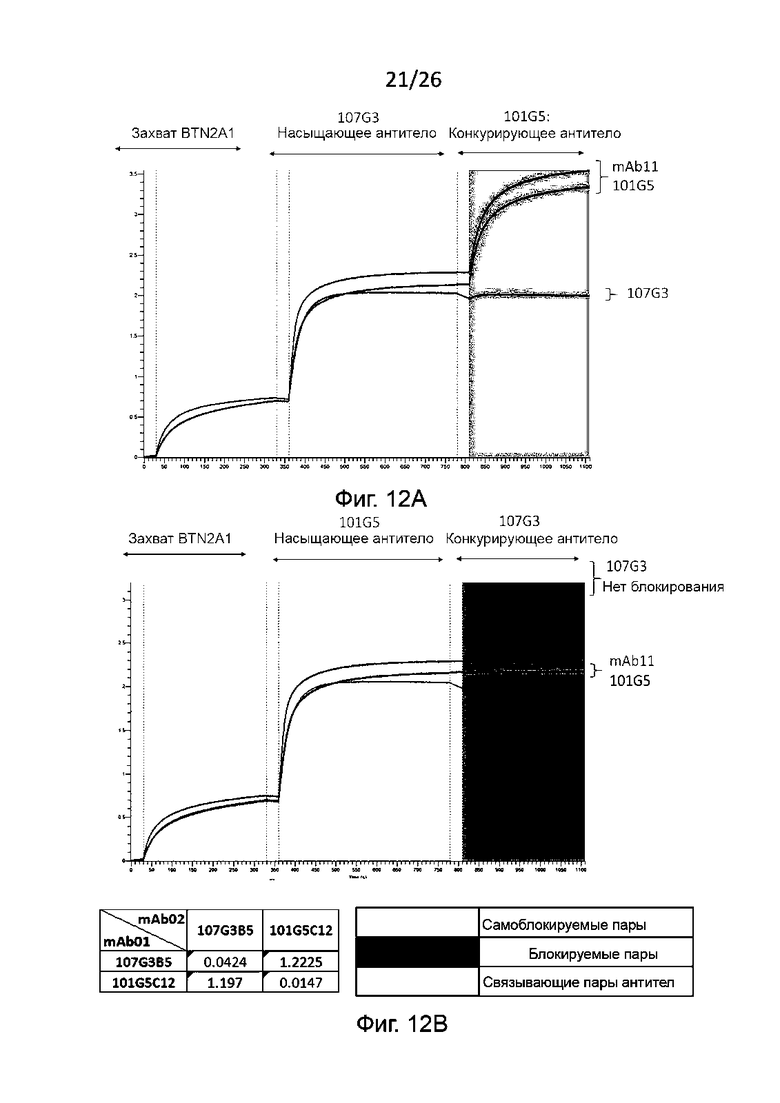

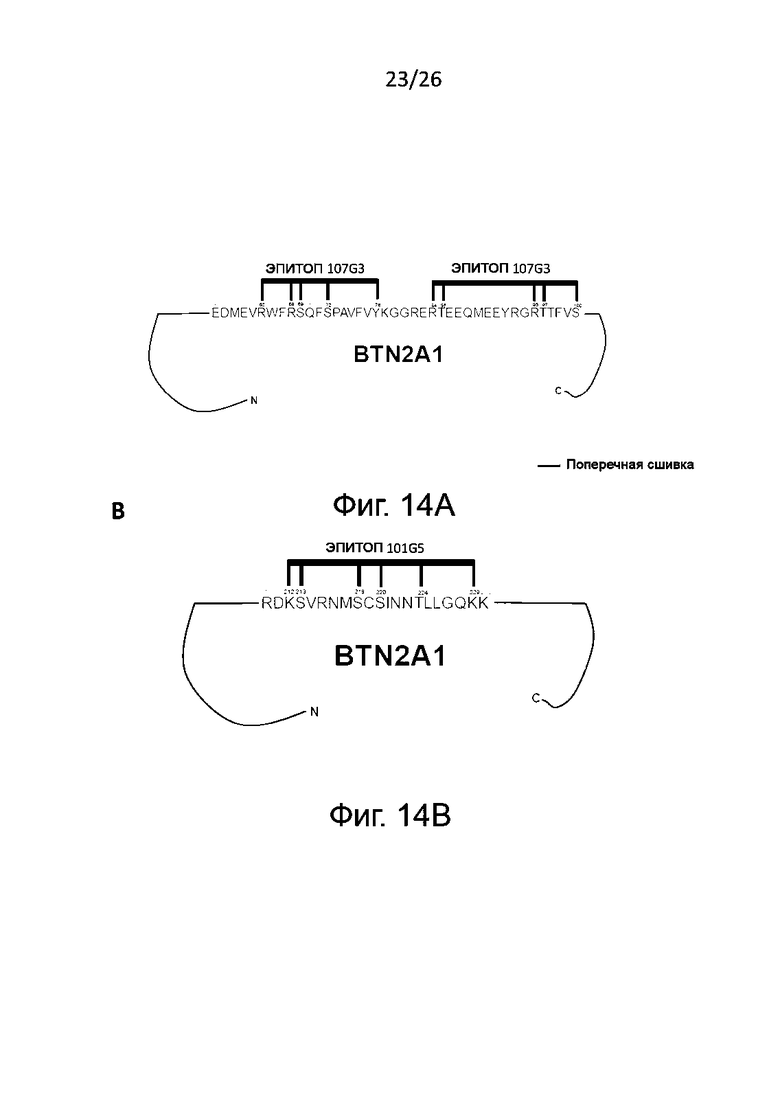

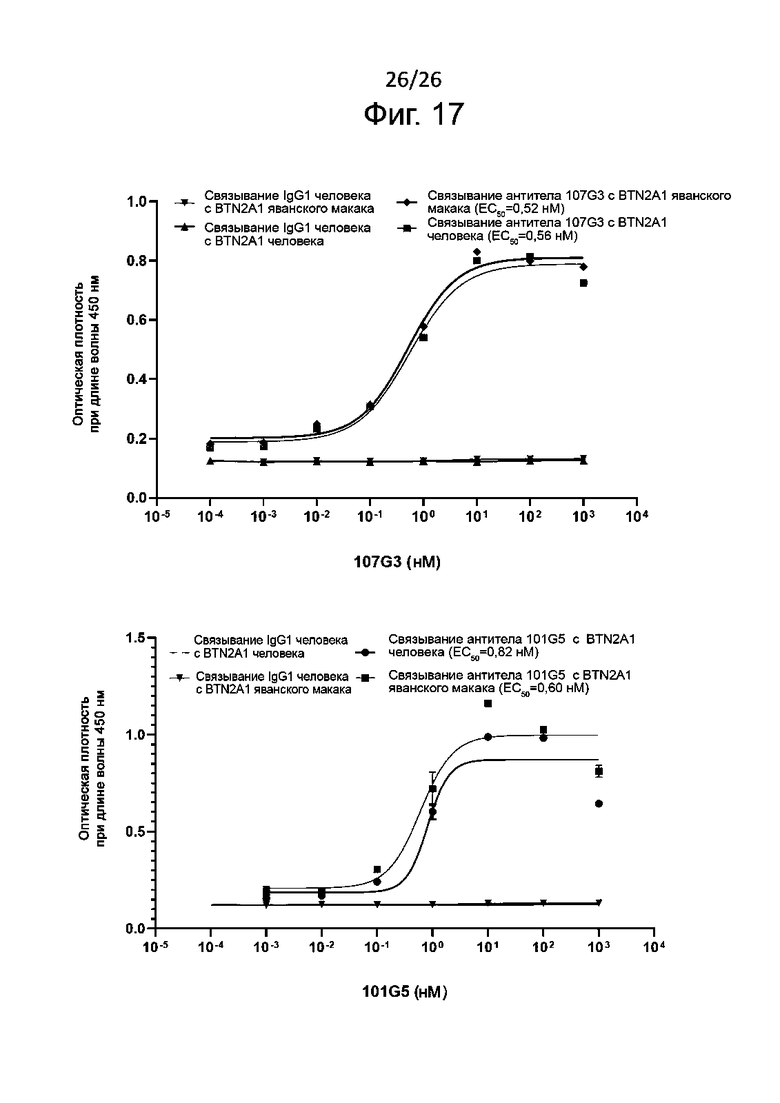
Изобретение относится к области биотехнологии. Предложено антитело, специфичное к BTN2A1. Также предложено применение указанного антитела для усиления опосредованного макрофагами иммунитета у пациента, имеющего рак или инфекционное заболевание. Кроме того, изобретение относится к нуклеиновой кислоте, кодирующей указанное антитело, и клетке-хозяину, содержащей такую нуклеиновую кислоту. Изобретение может найти применение в терапии для лечения рака и инфекционных заболеваний. 5 н. и 16 з.п. ф-лы, 56 ил., 10 табл.
1. Антитело к бутирофилину-2A1 (BTN2A1), характеризующееся тем, что содержит:
участок CDR1 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:3, участок CDR2 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:4, участок CDR3 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:5, участок CDR1 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:6, участок CDR2 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:7 и участок CDR3 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:8, или
участок CDR1 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:21, участок CDR2 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:22, участок CDR3 вариабельной области тяжелой цепи, содержащий последовательность SEQ ID NO:23, участок CDR1 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:24, участок CDR2 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:25, и участок CDR3 вариабельной области легкой цепи, содержащий последовательность SEQ ID NO:26.
2. Антитело по п. 1, которое обладает по меньшей мере одной из следующих функций:
(i) подавляет поляризацию моноцитов в макрофаги М2;
(ii) вызывает реверсию макрофагов М2 в сторону противоопухолевых макрофагов М1;
(iii) напрямую запускает активацию NК-клеток;
(iv) усиливает цитотоксичность, опосредованную NК-клетками.
3. Антитело по п. 1 или 2, которое напрямую запускает активацию NК-клеток и/или усиливает цитотоксичность, опосредованную NК-клетками.
4. Антитело по любому из пп. 1-3, которое конкурирует за связывание с BTN2A1
- с референсным моноклональным антителом, включающим (i) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:1, и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:2, или
- с референсным моноклональным антителом, включающим (i) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:19, и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:20.
5. Антитело по любому из пп. 1-4, которое связывается с эпитопом, содержащим аминокислотные остатки в положениях 65, 68, 69, 72, 78; 84, 85, 95, 97 и 100 последовательности SEQ ID NО:17.
6. Антитело по любому из пп. 1-5, которое связывается с эпитопом, содержащим аминокислотные остатки в положениях 212, 213, 218, 220, 224 и 229 последовательности SEQ ID NО:17.
7. Антитело по любому из пп. 1-6, не проявляющее перекрестной реактивности с изоформами человеческого BTN3 и/или проявляющее перекрестную реактивность с белком яванского макака, который является ортологом BTN2A1.
8. Антитело по любому из предыдущих пунктов, которое содержит:
- вариабельную область тяжелой цепи, содержащую аминокислотную последовательность по меньшей мере на 90% идентичную последовательности SEQ ID NO:1, и вариабельную область легкой цепи, содержащую аминокислотную последовательность по меньшей мере на 90% идентичную последовательности SEQ ID NO:2, или
- вариабельную область тяжелой цепи, содержащую аминокислотную последовательность по меньшей мере на 90% идентичную последовательности SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность по меньшей мере на 90% идентичную последовательности SEQ ID NO:20.
9. Антитело по любому из пп. 1-7, которое дополнительно обладает по меньшей мере одной из следующих функций:
i. активирует секрецию цитолитических агентов Vγ9Vδ2-T-клетками,
ii. активирует цитолитическую функцию Vγ9Vδ2-T-клеток и/или
iii. активирует пролиферацию Vγ9Vδ2-T-клеток.
10. Антитело по п. 9, конкурирующее за связывание с BTN2A1 с референсным моноклональным мышиным антителом, включающим (i) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:1, и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:2.
11. Антитело по любому из пп. 9 или 10, которое включает:
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность по меньшей мере на 90% идентичную последовательности SEQ ID NO:1, и вариабельную область легкой цепи, содержащую аминокислотную последовательность по меньшей мере на 90% идентичную последовательности SEQ ID NO:2.
12. Антитело по любому из пп. 9-11, специфичное к изоформе BTN2A1 человеческого белка.
13. Антитело по любому из предыдущих пунктов, которое является человеческим, химерным или гуманизированным.
14. Молекула нуклеиновой кислоты, кодирующая тяжелую цепь и легкую цепи антитела по любому из пп. 1-13.
15. Клетка-хозяин, содержащая молекулу нуклеиновой кислоты по п. 14, для применения при получении антитела по любому из пп. 1-13.
16. Антитело по любому из пп. 1-13 для применения в терапии.
17. Антитело по любому из пп. 1-13 для применения при лечении рака или инфекционных заболеваний.
18. Фармацевтическая композиция, содержащая антитело по любому из пп. 1-13 и по меньшей мере фармацевтически приемлемый носитель, для применения для усиления опосредованного макрофагами иммунитета у пациента, имеющего рак или инфекционное заболевание.
19. Способ усиления опосредованного макрофагами иммунитета у пациента, имеющего рак или инфекционное заболевание, включающий стадию активации белка BTN2A1, экспрессируемого на плазматической мембране моноцитов и макрофагов.
20. Способ по п. 19, включающий введение пациенту эффективного количества антитела по любому из пп. 1-13.
21. Способ по п. 19 или 20 для лечения рака или инфекционного заболевания.
| WO 2015077844 A1, 04.06.2015 | |||
| WO 2009030884 A2, 12.03.2009 | |||
| SMITH I.A | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| AMMANN J | |||
| U | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2024-06-26—Публикация
2020-03-20—Подача