ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к человеческому антителу, способному нейтрализовать биологическую активность, вызванную онкостатином М, путем связывания с мембранными рецепторами, и способам его использования.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Онкостатин M (ОМ) является мультифункциональным членом семейства цитокинов ИЛ-6 с массой 28 кДа, которые секретируются моноцитами, макрофагами, нейтрофилами и активированными Т-лимфоцитами (Tanaka & Miyajima, Rev Physiol Biochem Pharmacol 149: 39-53, 2003). Протеолитическое расщепление в области карбоксильного конца секретированного ОМ приводит к формированию полностью активной формы ОМ, которая составляет 209 аминокислотных остатков в длину и содержит два N-связанных участка гликозилирования. ОМ относится к семейству цитокинов ИЛ-6, которое включает ИЛ-6, ИЛ-11, фактор, ингибирующий лейкемию (LIF), кардиотрофин-1, цилиарный нейтротрофический фактор (CNTF) и кардиотрофин-подобный цитокин (CLC), которые содержат общую рецепторную субъединицу - белок gp130. У людей ОМ проявляет сигнальную активность посредством рецепторных гетеродимеров, содержащих gp130 и субъединицу LIFRα или gp130 и субъединицу β OSMR. В отличие от других цитокинов семейства ИЛ-6, ОМ непосредственно связывается с gp130 при отсутствии какого-либо дополнительного мембраносвязанного корецептора (Gearing et al., Science 255: 1434-1437, 1992). После того, как ОМ связался с gp130, в образовании высокоафинного сигнального комплекса принимают участие OSMRβ или LIFRα (Mosley et al., J Biol Chem 271: 32635-32643, 1996). Активация другого рецептора приводит к передаче сигнала по пути JAK/STAT (Auguste et al., J Biol Chem 272: 15760-15764, 1997).
ОМ главным образом вырабатывается клетками, вырабатываемыми иммунной системой, и, в связи с широкой распространенностью сигнальных рецепторов, он связан с разнообразными проявлениями биологической активности, включающей регуляцию клеточного роста, развитие нервной системы и регуляцию состава внеклеточного матрикса.
Как следует из названия, онкостатин М связан с процессами онкогенеза. Кроме того, ОМ также принимает участие в ранних стадиях каскадов реакций, происходящих при воспалительных и гипертрофических процессах, приводящих к таким вредоносным состояниям, как легочный фиброз. Таким образом, существует необходимость в получении человеческих антител, специфичных к человеческому ОМ, которые были бы способны к блокированию сигнальных рецепторов (сигнальных рецепторов gp130), и антитела, которые блокируют эти сигналы, могут оказывать используемое в клинике цитотоксическое или иммуномодуляторное действие на клетки, которые экспрессируют gp130.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает ОМ-связывающие моноклональные антитела, способные блокировать активность, связанную с одним или более видом биологической активности, связанной с действием ОМ и ОМ-связывающего рецептора на клетки, ткани или органы в организме пациента. Представлены аминокислотные последовательности примерных ОМ-связывающих моноклональных антител, которые закодированы при помощи нуклеиновых кислот для их экспрессии в клетках организма. Одни или более моноклональные ОМ-антитела настоящего изобретения распознают эпитоп на поверхности ОМ, соединение которого с антителом изобретения предотвращает его взаимодействие с рецепторными компонентами сигнального комплекса gp130 и LIFRα или gp130 и OSMRβ, тем самым предотвращая лигатирование лиганда, вызванное сигнальной и регулирующей последующие звенья сигнальных каскадов биологической активностью.
Одним из аспектов изобретения является выделенное антитело, взаимодействующее с человеческим ОМ-белком и имеющим антиген-связывающую активность моноклонального антитела, содержащего антиген-связывающий домен, содержащий аминокислотные последовательности, которые указаны в SEQ ID NO: 13-18 по отдельности или в определенных положениях FR1-CDR1-FR2-CDR2-FR3, как указано в SEQ ID NO: 1-3, CDR3, как представлено в SEQ ID NO: 27-29 и 47; или антиген-связывающий домен, содержащий аминокислотную последовательность, указанную в SEQ ID NO: 23-26 по отдельности или в определенных положениях, как указано в SEQ ID NO: 5-8 или их варианты, и CDR3, как представлено в SEQ ID NO: 19-22. В конкретном варианте осуществления человеческое ОМ-связывающее антитело содержит вариабельный домен, выбранный из SEQ ID NO: 49-55.
В другом варианте осуществления изобретения связывающие домены моноклонального антитела используются как непроцессированные структуры IgG, имеющие константные домены, полученные из константных доменов человеческого IgG, или их специфические варианты, и используются как терапевтические молекулы в фармацевтических препаратах для предотвращения связывания ОМ с клетками, экспрессирующими рецепторные компоненты для ОМ. В другом варианте осуществления связывающие домены сконфигурированы как фрагменты антитела, которые используются как терапевтические молекулы, способные предотвращать связывание ОМ с клетками, экспрессирующими рецепторные компоненты для ОМ. В одном аспекте изобретения обеспечивается фармацевтически приемлемый состав, система или набор для доставки, а также способ лечения состояний, связанных с онкостатином М, содержащие один или более домен для связывания ОМ настоящего изобретения, которое не ограничивается 13-28, 30-46 и вариантами, которые представлены в SEQ ID NO: 29 и 47 .
КРАТКОЕ ОПИСАНИЕ НЕКОТОРЫХ ВИДОВ НА ФИГУРАХ
Фигура 1 изображает зародышевые последовательности генов, используемые для построения библиотек Fab-фрагментов, обнаруживаемых на белке оболочки pIX, причем каждый из гипервариабельных участков доменов содержит мозаичный FR1-CDR1-FR2-CDR2-FR3 в соответствии с SEQ ID NO: 1-3 (1=IGHV1-69, 2=IGHV3-23 и 3=IGHV5-51), что сопровождается вариабельной длиной, мозаичным участком H-CDR3 и J-участком (FR4, SEQ ID NO: 4); и каждый из низковариабельных участков доменов содержит мозаичный FR1-CDR1-FR2-CDR2-FR3 в соответствии с SEQ ID NO: 5-8 (5=IGKV1-39 (O12), 6=IGKV3-11 (L6), 7 - IGKV3-20 (A27) и 8=IGKV4-1 (B3)), а также CDR3 в соответствии с SEQ ID NO: 9, который сопровождается J-участком (FR4, SEQ ID NO: 10).
Фигура 2A является графиком зависимости дозы от эффекта рекомбинантного онкостатина человека и яванского макака, который был получен из клеточной линии СНО, для подавления пролиферации клеток A375-S2, которое измерялось при помощи включения 5-бромдезоксиуридина и нормализации до контроля только в присутствии несущей среды.
Фигура 2B является графиком, изображающим способность антитела M71, содержащего вариабельные домены L180 (SEQ ID NO: 53) и H17 (SEQ ID NO: 54), для уменьшения супрессии пролиферации ОМ A375-S2, когда ОМ присутствует в концентрации 2 нг/мл.
Фигура 3 является столбчатой диаграммой, изображающей эффект M64, M71, M55 и M69 в концентрации 20 мкг/мл для увеличения поглощения35SO4, которое является мерой увеличения синтеза протеогликанов, который превышает свой нормальный уровень при отсутствии антител и когда антитела неспецифического изотипа использовались в качестве контроля в ко-культивировании человеческих хондроцитов в гранулах альгината и человеческих макрофагах, которые способны секретировать ОМ.
Фигура 4A является графиком зависимости дозы от эффекта человеческого ОМ, стимулирующего pSTAT3 в клетках неходжкинской лимфомы, когда найденная EC50 составляет около 1 нг/мл.
Фигура 4B является графиком, изображающим способность антитела M71 нейтрализовать сигнал pSTAT3 в присутствии 2 нг/мл ОМ.
Фигуры 5A и B являются диаграммами рассеяния, которые изображают количество IP-10 (A) и MCP-1 (B), обнаруживаемого в сыворотке отдельных мышей после введения ОМ при наличии или отсутствии предварительного введения указанных концентраций антитела M71.
Фигуры 6A и B являются графиками, изображающими сывороточные концентрации у яванских макак через некоторое время после внутривенного (A) или подкожного (B) введения 3 мг/кг M71 или Fc-варианта M71.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Все публикации, упоминаемые в данном описании, включая патенты и патентные заявки, но не ограничиваясь ими, включенные путем ссылок, являются частью настоящего документа, как если бы они были изложены непосредственно в настоящем документе.
Сокращения
BSA= Бычий сывороточный альбумин; CDR = Гипервариабельный участок; Cyno = Яванский макак (Macaca fascicularis); ДН= Диабетическая нефропатия; ECD = Внеклеточный домен; FR = Каркасный участок; H = Тяжелая цепь; РА-ИЗЛ= Интерстициальное заболевание легких при ревматоидном артрите; L = Легкая цепь; Ig = Иммуноглобулин; Mab = Моноклональные антитела; ОМ= Онкостатин М; OA = Остеоартрит; PBS = физиологический раствор с фосфатным буфером; РА= Ревматоидный артрит; VL = Вариабельный участок легкой цепи; VH = Вариабельный участок тяжелой цепи,
Определения
Используемый в настоящем документе термин "антитело” включает целые антитела, любые антиген-связывающие фрагменты или одну из их цепей. Таким образом, антитело включает любую белковую или пептидсодержащую молекулу, которая содержит, по меньшей мере, часть молекулы иммуноглобулина, без ограничений включающую в себя, по меньшей мере, один гипервариабельный участок (CDR) тяжелой или легкой цепей или их лиганд-связывающую часть, вариабельный участок тяжелой или легкой цепей, константный участок тяжелой или легкой цепей, каркасный участок (FR) или любую их часть, или, по меньшей мере, одну часть связывающего белка, который может быть включен в антитело настоящего изобретения. Термин «антитело» дополнительно охватывает антитела, их расщепленные фрагменты, специфические части и варианты, включающие миметики антител или содержащие части антител, которые схожи по структуре и/или функции с антителом или его специфическим фрагментом или частью, включая одноцепочечные или однодоменные антитела и их фрагменты. Функциональные фрагменты включают антиген-связывающие фрагменты к предопределенной мишени. Примеры связывающих фрагментов охвачены термином "антиген-связывающая часть" антитела, которая включает (i) Fab-фрагмент, моновалентный фрагмент, содержащий домены VL, VH, CL и CH; (ii) F(ab')2-фрагмент, который является двухвалентным фрагментом, содержащим два Fab-фрагмента, которые связаны дисульфидным мостиком в области шарнира; (iii) Fd-фрагмент, состоящий из доменов VH и CH; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), который состоит из домена VH; и (vi) выделенный гипервариабельный участок (CDR). Более того, хотя два домена VL и VH Fv-фрагмента кодируются разными генами, они могут быть объединены способами рекомбинации при помощи синтетического линкера, который позволяет сделать из них одну белковую цепь, в которой участки VL и VH соединяются для образования моновалентных молекул (известных как одноцепочечные Fv (scFv); см, например, Bird et al. (I 988) Science 242:423-426, and Huston et al. (1988) Proc. Natl. Acad Sci. USA 85:5879-5883). Такие одноцепочечные антитела также охватываются термином "антиген-связывающая часть" антитела. Эти фрагменты антитела получаются при помощи стандартных способов, известных специалистам в данной области техники, и пригодность фрагментов проверяется таким же образом, как и пригодность интактных антител. Напротив, для анализа антиген-связывающей способности могут использоваться библиотеки конструкций scFv, после чего при помощи стандартных способов они могут сплайсироваться с другой ДНК, которая кодирует зародышевые последовательности генов человека. Одним из примеров такой библиотеки является “HuCAL: Комбинаторная библиотека антител человека” (Knappik, A. et al. J Mol Biol (2000) 296(1):57-86).
Термин “CDR” относится к участку, который определяет комплементарность, или гипервариабельному участку аминокислотных остатков антитела, который участвует или отвечает за связывание с антигеном. Гипервариабельные участки, или CDR, антитела человека подтипа IgG содержат аминокислотные остатки из остатков 24-34 (L-CDR1), 50-56 (L-CDR2) и 89-97 (L-CDR3) в легкой цепи вариабельного домена, и 31-35 (H-CDR1), 50-65 (H-CDR2) и 95-102 (H-CDR3) в тяжелой цепи вариабельного домена, как описано у Kabat et al. (1991 Sequences of Proteins of Immunological Interest, пятая редакция Службы общественного здравоохранения, Национальные институты здравоохранения, Бетесда, Мэриленд), и/или эти остатки из гипервариабельной петли (т.е. остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в легкой цепи вариабельного домена и 26-32 (H1), 53-55 (H2) или текущем обозначении H2 по Хотии 52-57, и 96-101 (H3) в тяжелой цепи вариабельного домена, как описано у Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987). Хотия и Леск относят HV с консервативной структурой к «каноническим структурам». Каркасный участок или остатки FR1-4a являются остатками этого вариабельного домена, которые отличаются от гипервариабельных участков, тем самым ограничивая их. Система нумерации по Хотии и Леску учитывает различия в нумерации остатков в петле, указывая протяженность конкретных остатков, обозначенных условными знаками в виде маленьких букв, например, 30a, 30b, 30c и т.д. В последнее время была разработана и широко распространена международная система нумерации - международная информационная система ImMunoGeneTics information system® (IMGT) (LaFranc, et al. 2005. Nucl Acids Res. 33:D593-D597).
Здесь CDR упоминаются как с учетом их аминокислотной последовательности, так и расположения в легкой и тяжелой цепи при помощи последовательной нумерации. Поскольку «расположение» CDR в структуре вариабельного домена иммуноглобулина консервативно у различных видов и присутствует там в виде структур, называемых петлями, использование систем нумерации, которые упорядочивают вариабельные домены в соответствии с особенностями структуры, CDR и остатки каркасного участка быстро определяются. Эта информация используется для замены и трансплантации остатков CDR из иммуноглобулинов одного вида в акцепторный каркасный участок, который обычно находится в человеческом антителе.
Термин «созревание» применяется к направленным изменениям в вариабельном участке антитела с целью изменения свойств полипептида. Как известно в данной области техники и описывается в настоящем документе, большое количество последовательностей, расположенных в V-участке, могут влиять на распознавание антигена. В природе антитела достигают высокой аффинности и специфичности при помощи прогрессивного процесса соматических мутаций. Этот процесс может имитироваться in vitro для обеспечения параллельного отбора и селективной изменчивости, при которых поддерживается целостность последовательности каждой цепи антитела таким образом, что они соответствуют антителам определенных видов, в данном случае - человека, а также усиление аффинности или биофизических параметров, таких как растворимость или стойкость к окислению. Процесс создания направленных изменений, или «созревание», обычно проводится на уровне кодирующей последовательности и обеспечивается посредством создания подбиблиотек для выбора усиленного свойства.
В настоящем документе термин «ОМ» относится к полипептиду онкостатину М или полинуклеотиду, содержащему последовательность, которая кодирует полипептид онкоститин М. Человеческий ОМ является продуктом человеческого гена osm (Ген 5008).
Термин «эпитоп» обозначает область связывания белка, которая способна к специфическому связыванию с антителом. Эпитопы обычно состоят из химически активных групп на поверхности молекул, таких как аминокислоты или боковые цепи сахаров, и обычно имеют специфические трехмерные структурные характеристики, как и определенные характеристики заряда. Конформационные и неконформационные эпитопы различаются тем, что в присутствии денатурирующих растворителей теряется связывание с первыми, но не теряется связывание со вторыми.
В настоящем документе KD обозначает константу диссоциации, более конкретно - KD антитела к предопределенному антигену, и является мерой аффинности антитела к конкретной мишени. Высокоаффинные антитела к предопределенному антигену имеют KD 10-8 M или менее, более предпочтительно - 10-9 M или менее, и наиболее предпочтительно - 10-10 M или менее. Обратной для KD является константа ассоциации KA. Используемые в настоящем документе термины "kdis", "k2" или “kd” предназначены для обозначения скорости диссоциации во время определенного взаимодействия антитела с антигеном. "KD" является отношением скорости диссоциации (k2), также называемой (koff), к скорости ассоциации (k1), или (kon). Таким образом, KD равна k2/k1 или koff/kon, и выражается в виде молярной концентрации (M). Из этого следует, что чем меньше KD, тем сильнее связывание. Таким образом, KD 10-6 M (или 1 мкмоль/л) указывает на слабое связывание в сравнении с 10-9 M (или 1нмоль/л).
Термины «моноклональное антитело» или «композиция моноклональных антител» в данном документе относятся к получению молекул антител с одной молекулярной композицией. Композиция моноклональных антител имеет одинаковую специфичность связывания и аффинность к определенному эпитопу. Этот термин также включает «рекомбинантное антитело» и «рекомбинантное моноклональное антитело» в качестве антител, которые были получены, экспрессированы, созданы или выделены рекомбинантными способами, в которых (a) антитела, выделенные из клеток животных или гибридом, получаются при помощи слияния клеток животных, секретирующих антитела, и сливающихся клеток, (b) антитела, выделенные из клеток организма, трансформируются для экспрессирования антител, образуя, например, трансфектому, (c) антитела, выделенные из комбинаторной библиотеки рекомбинантных антител человека или других видов, и (d) антитела, полученные, экспрессированные, созданные или выделенные другими способами, которые включают сплайсинг последовательностей гена иммуноглобулина с другими последовательностями ДНК. В настоящем документе термин «выделенное антитело» предназначен для обозначения антитела, которое по существу не содержит других антител, которые имеют другую антигенную специфичность. Выделенное антитело, которое специфично связывается с эпитопом, изоформой или вариантом человеческого ОМ, тем не менее, может быть способно к перекрестной реактивности с другими родственными антигенами, например, других видов (например, ОМ гомологичных видов). Кроме того, выделенное антитело может быть практически свободным от постороннего клеточного материала и (или) химических веществ. В одном варианте осуществления комбинация «выделенных» моноклональных антител, имеющих различную специфичность, имеет четко определенный состав.
В настоящем документе словосочетания «специфическое связывание», «иммуноспецифическое связывание» и «связывается иммуноспецифично» относятся к связыванию антитела с предопределенным антигеном. Как правило, связывание антитела характеризуется константой диссоциации (KD) 10-7 M или менее. Связывание с предопределенным антигеном происходит при KD, в два раза меньшей, чем KD связывания с неспецифичным антигеном (например, BSA, казеин, или любой другой полипептид), отличным от предопределенного антигена. Фразы «антитело распознало антиген» и «антитело специфично к антигену» в настоящем документе взаимозаменяемы с термином «антитело, которое специфически связывается с антигеном». В настоящем документе «высокоспецифическое» связывание означает, что относительная KD антитела при связывании с эпитопом, который является его специфической мишенью, по меньшей мере в 10 раз меньше, чем KD при связывании этого антитела с другими лигандами.
В настоящем документе «тип» относится к классу антитела (например, IgA, IgE, IgM или IgG), который кодируется генами константного участка тяжелой цепи. Некоторые классы антител дополнительно охватывают подклассы, или «изотипы», которые также кодируются константными участками тяжелой цепи (например, IgG1, IgG2, IgG3 и IgG4). Антитела могут быть дополнительно соединены с олигосахаридами, связанными с белком при помощи специфических остатков в доменах константного участка, что дополнительно усиливает биологические функции антитела. Например, у человека изотипы антител IgG1, IgG3 и в меньшей степени IgG2 проявляют такие же эффекторные функции, как и мышиные антитела IgG2a.
Под «эффекторными» функциями или «положительным эффектором» подразумевается, что антитело содержит домены, которые отличаются от доменов для специфического связывания антигена и способны взаимодействовать с рецепторами или другими компонентами крови, такими как комплемент, что приводит, например, к рекрутингу макрофагов и событиям, приводящим к разрушению клеток, связанных с антиген-связывающими доменами антитела. Антитела имеют некоторые эффекторные функции, обусловленные связыванием с эффекторными молекулами. Например, связывание C1-компонента комплемента с антителом активирует систему комплемента. Активация комплемента важна для опсонизации и лизиса клеточных патогенов. Активация комплемента стимулирует воспалительный ответ и может также участвовать в аутоиммунной гиперчувствительности. Кроме того, антитела связываются с клетками при помощи Fc-участка, который содержит Fc рецепторный участок на Fc-участке антитела, связывающегося с Fc-рецептором (FcR) на клетке. Существует множество Fc-рецепторов, которые специфичны для различных классов антител, включая IgG (гамма-рецепторы), IgE (эта-рецепторы), IgA (альфа-рецепторы) и IgM (мю-рецепторы). Связывание антитела с Fc-рецепторами на поверхностях клеток запускает множество важных и разнообразных биологических ответов, включающих захват и разрушение покрытых антителами частиц, выведение иммунных комплексов, лизис покрытых антителами клеток-мишеней при помощи клеток-киллеров (называемый опосредованной антителами клеточной цитотоксичностью, или ADCC), высвобождение медиаторов воспаления, плацентарный перенос и контроль за продукцией иммуноглобулинов.
Термин «полипептид» означает молекулу, которая содержит аминокислотные остатки, связанные пептидной связью с образованием полипептида. Небольшие полипептиды, состоящие из менее чем 50 аминокислот, могут быть отнесены к «пептидам». Полипептиды могут быть также названы «белками».
ОБЩЕЕ ОПИСАНИЕ
Настоящее изобретение предусматривает выделенные Mab, способные к связыванию и нейтрализации биологической активности ОМ-белков и продуктов расщепления. В частности, ОМ-связывающие mAb настоящего изобретения способны блокировать связывание ОМ с gp130 или предотвращать рекрутинг LIFRa или OSMRb, вызванный связыванием ОМ с gp130. В ином случае, ОМ-связывающее mAb настоящего изобретения способно блокировать вызванное ОМ сигнальное действие рецептора gp130.
Сообщалось, что фосфорилирование STAT3 приводит к гиперпродукции коллагена фибробластами в различных патологических условиях (Lim et al. Oncogene 23(39): 5416-25, 2006; Huang et al. J Cell Biochem 81(1): 102-13, 2001). Эти свойства показывают возможное терапевтическое значение этих антител при РА, OA и при фиброзах, таких как идиопатический легочный фиброз (ИЛФ) и диабетическая нефропатия (ДН).
Продукт человеческого гена ОМ, ОМ (образец NCBI № NP_065391) является препрополипептидом с длиной 252 аминокислот (SEQ ID NO: 11), имеет сигнальный пептид длиной 25 аминокислот и участок протеолитического расщепления между остатками 234 и 235. Он является секретируемым белком, имеющим пять остатков цистеина, которые образуют две внутренние дисульфидные связи между остатками аминокислот 31-152 и 74-192 (Kallestad JC, et al. J Biol Chem. 1991 May 15; 266 (14):8940-5). Имеются два возможных N-связанных участка гликозилирования у остатков 100 и 217, и при продукции в эукариотических клетках данный белок гликозилируется. Человеческий ОМ содержит свободную сульфгидрильную группу у остатка 105.
Последовательность белка ОМ макак отсутствует в открытом доступе, хотя существует автоматически-вычисленная запись 1867 пар нуклеотидных оснований мРНК (NCBI № XM_001110148), полученная из аннотированной геномной последовательности (NW_001095169). Для получения последовательности ОМ макак РНК была выделена из мононуклеарных клеток периферической крови макак, и затем ген был амплифицирован из кДНК при помощи ПЦР в реальном времени и секвенирован. Предсказанная трансляция клонированной последовательности (SEQ ID NO: 12) была на 99,6% идентичной предсказанной последовательности Macaca mullata (резус), на 92% идентичной последовательности белка ОМ человека, и на 41% идентичной последовательности белка ОМ мыши, как было описано заявителем в одной из заявок, находящихся одновременно на рассмотрении патентного ведомства США (Сер. № 12/648430).
Более того, настоящее изобретение направлено на идентификацию полученных у человека ОМ-связывающих Mab, способных ингибировать последующие звенья сигнальных каскадов биологической активности, приводящей к появлению сигналов при связывании ОМ с gp130, и где Mab обнаруживают способность к;
восстановлению пролиферации клеток в присутствии ОМ, ингибированию вызванной ОМ деградации хондроцитов во внутрисуставном матриксе тканевого эксплантата,
эффективной нейтрализации ОМ-зависимого фосфорилирования STAT3 в фибробластах легких человека и предотвращению ОМ-индуцированного высвобождения цитокинов.
1. Состав антитела настоящего изобретения
ОМ-нейтрализующее антитело настоящего изобретения является антителом, которое подавляет, блокирует или противодействует по меньшей мере одному виду активности ОМ или связыванию ОМ с рецептором in vitro, in situ и/или in vivo, и не способствует, не стимулирует, не индуцирует или не увеличивает активность ОМ или его связывание с лигандом, а также не является антителом, которое при своем связывании имитирует эффекты последующих звеньев сигнальных каскадов, вызванных ОМ-обусловленным лигатированием ОМ-рецепторов, в частности взаимодействие gp130 с ОМ, заключающееся в передаче сигнала в клетке организма. Подходящее ОМ-нейтрализующее антитело, определенная часть или вариант могут также в необязательном порядке влиять, по меньшей мере, на один вид активности или функцию ОМ, которые неограниченно включают; синтез РНК, ДНК или белка; высвобождение белка; активацию, пролиферацию или дифференцировку клетки; секрецию антитела; передачу сигналов рецептором ОМ; расщепление ОМ; связывание ОМ, индукцию, синтез или секрецию ОМ или gp130.
Настоящее изобретение основывается на открытии противочеловеческих моноклональных антител к ОМ, способных подавлять сигнальное действие gp130 после связывания с ОМ или ОМ-индуцированного рекрутинга LIFR. Для связывания ОМ были выбраны связывающие домены антитела в виде Fab-библиотеки, которые отображаются в виде частиц нитевидного фага, связанных с оболочечным белком pIX (см. WO29085462A1 и дальнейшее описание ниже). Для распознавания этих Fab-фрагментов был использован сравнительный анализ при помощи gp130 таким образом, чтобы при их связывании с ОМ происходило предотвращение связывания ОМ с gp130. В ином случае, Fab-фрагменты должны были предотвращать рекрутинг LIFR, вызванный связыванием gp130 с ОМ. Клеточный анализ (A375, клетки меланомы человека) был использован для идентификации некоторых подходящих антител, способных к ингибированию gp130-обусловленной активации pSTAT3 в ОМ-экспрессирующих клетках организма.
ОМ-связывающие антитела, описанные в настоящем документе, распознают, по меньшей мере, две различных области в активной форме человеческого белка ОМ, что указывает на дополнительное открытие множественных участков ОМ, которые подходят для направленного воздействия антител или других соединений со схожими блокирующими функциями. Таким образом, экспрессия и очистка связывающих доменов антител в настоящем документе сводится к аминокислотной последовательности, которая является инструментом, который может обеспечить возможность выбора новых молекул, проявляющих ОМ-нейтрализующую активность.
В одном варианте осуществления противочеловеческое ОМ-антитело содержит связывающий участок, имеющий вариабельный участок легкой цепи (VL) или вариабельный участок тяжелой цепи (VH), который содержит аминокислотную последовательность, показанную в SEQ ID NO: 49-55, и это антитело или его связывающая часть иммуноспецифически связывает ОМ. В другом варианте осуществления настоящего изобретения, который содержит тяжелую цепь, содержащую в свой антиген-связывающей части SEQ ID NO: 54 или 55, антитело связывается с белком ОМ и, помимо этого, имеет специфические функциональные свойства антитела изобретения, такие как:
1. связывание человеческий ОМ с KD менее 100 пмоль/л
2. связывание ОМ макак с KD менее 500 пмоль/л
3. способность восстанавливать пролиферацию клеток A375-S2 в присутствии 2 нг/мл человеческого ОМ на 90% от уровня, который наблюдается при отсутствии ОМ,
4. способность восстанавливать пролиферацию клеток A375-S2 в присутствии 2 нг/мл ОМ макак на 90% от уровня, который наблюдается при отсутствии ОМ,
5. ингибирование ОМ-индуцированной деградации хондроцитов во внутрисуставном матриксе тканевых эксплантатов,
6. эффективная нейтрализация ОМ-зависимого фосфорилирования STAT3 в фибробластах легких нормального человека (NHLF), или
7. блокирование высвобождения цитокинов после системной проверки иммунности к ОМ у мышей.
В другом аспекте настоящего изобретения структурные особенности антител, проявляющих некоторые или все виды вышеперечисленной биологической активности, в частности, Mab, обозначенных как связывающие домены M55 и M71, используются для создания родственных по структуре человеческих анти-ОМ антител, которые сохраняют, по меньшей мере, одно функциональное свойство антител настоящего изобретения, такое как связывание с ОМ. Более конкретно, один или более участок CDR в M55 и M71 (такой как специфические остатки в SEQ ID NO: 1 и 8) может быть рекомбинирован с известными каркасными участками человека и такими CDR, как SEQ ID NO: 13-28, 30-46, для создания дополнительных рекомбинантных генно-инженерных человеческих анти-ОМ антител настоящего изобретения.
В одном варианте осуществления антитела настоящего изобретения имеют последовательности, включающие FR1, 2 и/или 3; IGVH1-69 (SEQ ID NO: 1) или IGVH5-51 (SEQ ID NO: 3), причем один или более остаток CDR выбирается из группы, включающей SEQ ID NO: 13-22, которые находятся в CDR, расположенном в SEQ ID NO: 1 или 3, причем способность антитела к связыванию ОМ сохраняется (например, за счет консервативных замен). Таким образом, в другом варианте осуществления, генно-инженерное антитело может содержать один или более CDR, который, например, может быть на 90%, 95%, 98% или 99,5% идентичным CDR, перечисленным в SEQ ID NO: 13-22, или вариантам L-CDR3, приведенным в SEQ ID NO: 29 или 47.
В дополнение к простому связыванию с ОМ, генно-инженерные антитела, такие как описанные выше антитела, могут быть выбраны с точки зрения сохранения функциональных свойств антител настоящего изобретения, таких как способность подавлять связывание белка ОМ или его продуктов расщепления с GP130-положительными клетками, и это связывание может привести к подавлению пролиферации GP130-положительных клеток in vivo.
Человеческие моноклональные антитела настоящего изобретения могут быть исследованы на связывание с ОМ, например, при помощи стандартного твердофазного иммуноферментного анализа.
2. Синтез ОМ-нейтрализующих антител
ОМ-нейтрализующие антитела, демонстрирующие желаемый спектр биологической активности, примерами чего являются антитела M5, M6, M9, M10, M42, M45, M53, M54, M55, M62, M63, M65, M66, M67, M68, M69, M71 и M83, содержащие последовательности тяжелой цепи и легкой цепи, которые указаны в библиотеке каркасных участков SEQ ID NO: 1, 3, 8, а также имеющие CDR с SEQ ID NO: 13-28, 30-46, могут быть синтезированы различными способами.
В другом варианте осуществления эпитоп, связываемый антителами настоящего изобретения и содержащий всего лишь пять из всех остатков 51-227 с SEQ ID NO: 11, или нуклеиновая кислота, кодирующая данную последовательность, могут использоваться для иммунизации испытуемого для продуцирования антител настоящего изобретения непосредственно в организме с целью лечения, профилактики или облегчения течения заболевания или симптомов заболевания, которые связаны с продукцией ОМ.
В одном варианте осуществления и в качестве примера в настоящем документе человеческое антитело выбирается из библиотеки фагов, где эти фаги содержат гены человеческого иммуноглобулина, и библиотека экспрессирует связывающие домены антитела, например, в виде одноцепочечных антител (scFv), Fab-фрагментов или некоторых других конструкций, содержащих парные и непарные вариабельные участки антител (Vaughan et lo al. Nature Biotechnology 14:309-314 (1996): Sheets et al. PITAS (USA) 95:6157-6162 (1998)); Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al. J. Mol. Biol., 222:581 (1991)). Человеческие моноклональные антитела настоящего изобретения могут также получаться при помощи способов фагового дисплея для скрининга библиотек генов человеческих иммуноглобулинов. В данной области техники признаны данные способы фагового дисплея для изоляции человеческих антител. См., например: Патенты США № 5223409; 5403484; и 5571698 Ладнер и соавт.; Патенты США № 5427908 и 5580717 Довер и соавт.; Патенты США № 5969108 и 6172197 МкКафферти и соавт.; и Патенты США № 5885793; 6521404; 6544731; 6555313; 6582915 и 6593081 Гриффитс и соавт.
Клоны фагов выбираются и идентифицируются при помощи многоэтапной процедуры, которая известна как биопэннинг. Биопэннинг осуществляют посредством инкубирования фага, мишенью которого являются варианты белковых лигандов (библиотеки генов фагового дисплея), удаления несвязанного фага при помощи промывания, и специфического элюирования связанного фага. Элюированный фаг необязательно может амплифицироваться перед прохождениями дополнительных циклов связывания и необязательной амплификации, которые пополняют пул специфических последовательностей в пользу клонов этих фагов, которые несут фрагменты антител, демонстрирующих наилучшее связывание с мишенью. После нескольких циклов характеризуются отдельные клоны фагов, и пептидные последовательности, отображенные при помощи клонов, предопределяются посредством секвенирования соответствующей ДНК вириона фага.
Библиотека Fab-фрагментов фага-pIX
В конкретном варианте осуществления способа фагового дисплея синтетические Fab-библиотеки отображаются на фаговом оболочечном белке pIX, описанном Shi et al. J Mol Biol 397:385-396, 2010; а также в международной заявке WO29085462A1 и патенте США Сер. № 12/546850, что будет подробно рассматриваться далее, и используются для выбора связующего вещества из иммунного репертуара последовательностей человеческого IgG, которые получены из зародышевых генов человека. Библиотеки сконструированы из четырех доменов VL и трех доменов VH, кодирующихся известными зародышевыми последовательностями IGV и IGJ, выбранными на основании частоты, с которой эти последовательности обнаруживаются в человеческих антителах, выделенных из естественных источников. По номенклатуре IMGT VH является IGHV1-69 (SEQ ID NO: 1), IGHV3-23 (SEQ ID NO: 2) или IGHV5-51 (SEQ ID NO: 3). Разнообразие конструкций VH приводит к образованию тяжелых цепей с последовательностью вариабельной длины в участке CDR3, многообразие положений которых ограничивается H-CDR1 и H-CDR2, длина которых остается постоянной. Каркасный участок четыре (H-FR4) остается постоянным у всех представителей библиотеки (SEQ ID NO: 4).
VH169, IGHV1-69*01 Длина=98, CDR1=31-35, CDR2=50-66
QVQLVQSGAE VKKPGSSVKV SCKASGGTFS SYX1ISWVRQA PGQGLEWMGX2 IX3X4X5X6GTANY AQKFQGRVTI TADESTSTAY MELSSLRSED TAVYYCAR (SEQ ID NO: 1)
Причем в 169 библиотеке X1 является A или G, X2 является G или W, X3 может быть I или S,X4 может быть P или A, X5 может быть I или Y, и X6 может быть F или N.
VH323, IGHV3-23*01 Длина=98, CDR1=31-35, CDR2=50-66
EVQLLESGGG LVQPGGSLRL SCAASGFTFS X1YX2MX3WVRQA PGKGLEWVSX4 IX5X6X7GX8STYY ADSVKGRFTI SRDNSKNTLY LQMNSLRAED TAVYYCAK (SEQ ID NO: 2)
Причем в 323 библиотеке X1 может быть S, D, N или T; X2 может быть A, G или W; X3 может быть S или H; X4 может быть V, A, N или G; X5 может быть S, N, K или W; X6 может быть Y, S, G или Q; X7 может быть S или D; и X8 может быть S или G.
VH551, IGHV5-51*03 Длина=98, CDR1=31-35, CDR2=50-66
EVQLVQSGAE VKKPGESLKI SCKGSGYSFT X1YWIX2WVRQM PGKGLEWMGX3 IX4PX5DSX6TRY SPSFQGQVTI SADKSISTAY LQWSSLKASD TAMYYCAR (SEQ ID NO: 3)
Причем в 551 библиотеке X1 может быть S, N или T; X2 может быть S или G; X3 может быть I или R; X4 может быть D или Y; X5 может быть G или S; X6 может быть D или Y.
Участки FR4 или JH, содержащие 11 остатков, WGQGTLVTVSS (SEQ ID NO: 4), были присоединены к вышеупомянутым последовательностям для образования целого вариабельного участка тяжелой цепи.
Положения H-CDR1 и H-CDR2, которые были использованы в качестве мишени для разнообразия, были предопределены 1) разнообразием в зародышевых генах; и 2) частотой, с которой они обнаруживаются с антигеном в комплексах антитело-антиген с известной структурой (Almagro J Mol Recognit.17:132-143, 2004). Разнообразие аминокислот в выбранных положениях предопределяется 1) использованием зародышевой линии; 2) аминокислотами, которые наиболее часто обнаруживаются в реаранжированных V-генах человека; 3) аминокислоты, которые предположительно являются результатами соматических мутаций в одном основании; и 4) биохимическими и биофизическими свойствами аминокислот, которые участвуют в распознавании антигена.
Библиотека включает разнообразие CDR3 в VH (H3), имитирующее иммунный репертуар человеческих антител (Shi et al. 2010 supra) показанным ниже способом (Формула I), где итоговая длина составляет от 7 до 14 остатков. Среди CDR3 из 5000 человеческих вариабельных участков во всех положениях часто используются аминокислоты глицин (G) и аланин (A). Кроме того, аспарагиновая кислота (D) часто используется в положении 95, и тирозин (Y) зачастую закодирован в положениях, предшествующих каноническому участку J-сегмента. Аминокислоты фенилаланин (F), аспарагиновая кислота (D) и тирозин (Y) предопределены в положениях 99-101, и в этих же положениях используются в IgG. Поскольку эти положения часто служат для структурной поддержки H-CDR3 и менее открыты для антигена и/или на поверхности IgG, аминокислоты фенилаланин с лейцином (в соотношении 50/50) фиксируются в положении 99, аспарагиновая кислота - в положении 100, а тирозин - в положении 101. Таким образом, последовательность Формулы I вставлена между SEQ ID NO: 1, 2 или 3 и SEQ ID NO: 4 для образования целого домена VH.
-(D)-(N)n(N+O)m(F)DY- (I)
Где:
(D) = положения, богатые аспарагиновой кислотой (D) и глицином (G).
(N)n = положения, богатые аланином (A) и глицином (G), n =3-7.
(O)m = положения, богатые аланином (A), глицином (G) и Y (тирозином), m= 1-4.
(F) = основное положение фенилаланина (F).
Различные версии библиотек, охватывающих объединения с фиксированными или разнообразными легкими цепями, также были получены из иммунного репертуара человеческой зародышевой линии. В настоящем изобретении четыре библиотеки генов легких цепей VLкаппа (Kawasaki et al. 2001. Eur J Immunol 31: 1017-1028 и Schaeble & Zachau, 1993 Biol Chem Hoppe Seyler 374: 1001-1022) являются A27 (IGKV3-20*01), B3 (IGKV4-1*01), L6 (IGKV3-11*01) и O12 (IGKV1-39*01), где название гена в круглых скобках было предположено при помощи соответствующего гена IMGT. Fab-фрагменты отображены на pIX за счет экспрессии двухцистронного вектора, в котором домен VH-CH1 конденсирован с последовательностью оболочечного белка, и VL-CL каппа или VL-CL лямбда экспрессируются в виде свободного полипептида, который самостоятельно соединяется с VH-CH1. Участки CDR подчеркнуты.
Библиотека вариабельных участков легких цепей основывается на зародышевых генах V каппа (Vk)
012; IGKV1-39*01, IGKV1D-39*01 Длина=88; CDR1=24-34, CDR2=50-56
DIQMTQSPSS LSASVGDRVT ITCRASQSIS X1X2X3NWYQQKP GKAPKLLIYX4 ASSLQSGVPS RFSGSGSGTD FTLTISSLQP EDFATYYC (SEQ ID NO: 5)
L6, IGKV3-11*01 Длина=88, CDR1=24-34, CDR2=50-56
EIVLTQSPAT LSLSPGERAT LSCRASQSV X1X2X3LAWYQQKP GQAPRLLIYX4 ASNRATGIPA RFSGSGSGTD FTLTISSLEP EDFAVYYC (SEQ ID NO: 6)
A27, IGKV3-20*01, Длина=89, CDR1=24-35, CDR2=51-57
EIVLTQSPGT LSLSPGERAT LSCRASQSVX1 X2X3X4LAWYQQK PGQAPRLLIY X5ASSRATGIP DRFSGSGSGT DFTLTISRLE PEDFAVYYC (SEQ ID NO: 7)
B3, DPK24, VKIVKlobeck; IGKV4-1*01 Длина=94, CDR1=24-40, CDR2=56-62
DIVMTQSPDS LAVSLGERAT INCKSSQSVL X1SSNNX2NX3LA WYQQKPGQPP KLLIYX4ASTR ESGVPDRFSG SGSGTDFTLT ISSLQAEDVA VYYC (SEQ ID NO: 8)
Разнообразие определенных положений каждого поддерживающего вариабельного участка суммировано ниже в Таблице 1, где применяется однобуквенный аминокислотный код, который используется и присутствует в качестве альтернативы для определенных положений, которые показаны на Фиг. 1.
(SEQ ID NO: 5)
(SEQ ID NO: 6)
(SEQ ID NO: 7)
(SEQ ID NO: 8)
Домен VL CDR3 во всех библиотеках содержит семь остатков, причем первые два остатка являются глутамином (Gln, Q), и остаток, соответствующий 95 остатку по Кабату, является пролином (Pro, P). В L-CDR3 последовательность соответствует QQX1X2X3X4PX5T (SEQ ID NO:9), причем ее изменчивость приведена ниже в таблице, а положения остатков соответствуют нумерации по Кабату.
Поскольку длина вариабельной последовательности изменяется от гена к гену, разнообразие положений определенного остатка в гипервариабельной петле или CDR может быть описано следующим образом при помощи нумерации остатков, приведенной в Al-Lazikani B, Lesk AM, Chothia C, 1997(Standard conformations for the canonical structures of immunoglobulins. J Mol Biol 273: 927-948). В этой системе изменения длины гипервариабельных петель определяются посредством обозначения субположений a, b, c и т.д. для данного остатка.
Такой сегмент каркасного участка 4 (FR4), как JK4, FGQGTKVEIK (SEQ ID NO: 10) используется для образования целостного человеческого вариабельного участка легкой цепи.
Во время исходных отборов была продемонстрирована аффинность Fab-фрагментов к отдельным белкам-мишеням, которая составила от 0,2 до 20 нМ.
Способы интегрированного процесса созревания для улучшения параметров связывания включают перестановку экзонов VL или VH в целях разнообразия, или, напротив, направленную или ограниченную модификацию домена VL, которая производится при помощи векторов и праймеров, созданных и используемых для библиотек, как описано в указанной публикации и настоящем документе, и комбинации со способами, которые известны специалистам в данной области техники.
Альтернативные источники ОМ-связывающих доменов иимуноглобулинов
ОМ-связывающие антитела, имеющие характеристики человеческих Mab, которые были описаны в настоящем документе, могут быть изготовлены, или связывающие фрагменты, полученные из доменов иммуноглобулинов, могут быть сформированы множеством способов, включающих стандартные способы гибридизации соматических клеток (способ гибридомы) по Kohler и Milstein (1975) Nature 256:495. При получении гибридомы мышь или другое подходящее животное, например, хомячка или макаку, иммунизируют описанным в настоящем документе способом, чтобы выделить лимфоциты, производящие или способные производить антитела, специфически связывающиеся с белками, используемыми для иммунизации. В ином случае лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты могут быть слиты с клетками миеломы при помощи подходящего фактора, вызывающего слияние клеток, такого как полиэтиленгликоль, для образования клеток гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
ОМ-нейтрализующие антитела также необязательно могут быть синтезированы посредством иммунизации трансгенных животных (например, мыши, крысы, хомяка, приматов (за исключением человека) и т.п.), способных к продуцированию иммунологического репертуара человеческих антител, как описывается в настоящем документе и/или известно специалистам в данной области техники. Клетки, продуцирующие человеческие анти-ОМ антитела, могут быть выделены из этих животных и иммунизированы при помощи подходящих способов, таких как способы, описанные в настоящем документе. В другом случае, последовательности, кодирующие антитело, можно клонировать, ввести в подходящий вектор и использовать для трансфекции клетки-хозяина, чтобы экспрессировать и выделить антитела описанными в настоящем документе способами и другими способами, известными специалистам в данной области.
Использование трансгенных мышей, являющихся носителями локуса человеческого иммуноглобулина (Ig) в конфигурации своей зародышевой линии, обеспечивает изоляцию высокоаффинных полностью человеческих моноклональных антител, направленных против различных мишеней, включая собственные антигены человека, к которым нормальная иммунная система человека толерантна (Lonberg, N. et al., Патент США US5569825, Патент США US6300129 и 1994, Nature 368:856-9; Green, L. et al., 1994, Nature Genet. 7:13-21; Green, L. & Jakobovits, 1998, Exp. Med. 188:483-95; Lonberg, N and Huszar, D., 1995, Int. Rev. Immunol. 13:65-93; Kucherlapati, et al. US6713610; Bruggemann, M. et al., 1991, Eur. J. Immunol. 21:1323- 1326; Fishwild, D. et al., 1996, Nat. Biotechnol. 14:845-851; Mendez, M. et al., 1997, Nat. Genet. 15:146-156; Green, L., 1999, J. Immunol. Methods 231:11-23; Yang, X. et al., 1999, Cancer Res. 59:1236-1243; Brüggemann, M. and Taussig, M J., Curr. Opin. Biotechnol. 8:455-458, 1997; Tomizuka et al., международная заявка WO02043478). Эндогенный локус иммуноглобулина у таких мышей можно разрушить или подвергнуть делеции, чтобы таким образом лишить животное способности образовывать антитела, кодируемые эндогенным генами. Кроме того, компании, такие как Abgenix, Inc. (Фримонт, Калифорния) и Medarex (Сан-Хосе, Калифорния), могут привлекаться к получению человеческих антител, направленных против определенного антигена, при помощи описанной выше технологии.
Подготовка полипептидов для использования в качестве лигандов мишени способом пэннинга и иммуногенных антигенов может проводиться при помощи любого подходящего способа, такого как рекомбинантное получение белка. Лиганд мишени или его фрагмент в виде очищенного белка или белковой смеси, включающей целые клетки, клеточные или тканевые экстракты, или, в случае иммунизации, антиген может быть сформирован de novo в теле животного из нуклеиновых кислот, кодирующих упомянутый антиген или его часть.
Как хорошо известно специалистам, выделенные нуклеиновые кислоты, составляющие предмет настоящего изобретения, могут быть получены с использованием (а) рекомбинантных способов, (b) синтетических способов, (c) способов очистки или их сочетаний. ДНК, кодирующая моноклональные антитела, легко выделяется и секвенируется при помощи способов, известных в данной области техники (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи участков человеческого антитела). При создании гибридом такие клетки могут служить источником такой ДНК. В другом случае, когда используется способ дисплея со слиянием кодирующей последовательности и продукта трансляции (например, библиотеки фагового или рибосомального дисплея), селекция связующего звена и нуклеиновой кислоты упрощена. После селекции участки фага, кодирующие антитело, можно выделить и использовать для синтеза целых антител (в том числе человеческих) или любых других требуемых антигенсвязывающих участков, и экспрессировать в любом желаемом хозяине (в том числе в клетках млекопитающих, клетках насекомых, клетках растений, дрожжах и бактериях).
Человеческие антитела
Кроме того, изобретение предусматривает человеческие иммуноглобулины (или антитела), которые связывают человеческий ОМ. Эти антитела также можно охарактеризовать как генно-инженерные или адаптированные антитела. Иммуноглобулины имеют вариабельные участки, которые по существу происходят из человеческих зародышевых иммуноглобулинов, и включают направленную изменчивость в остатках, которые, как известно, участвуют в распознавании антигена, примером чего могут служить CDR по Кабату или гипервариабельные петли с известной структурой. Константные участки, если они имеются, также по существу находятся в человеческом иммуноглобулине. Человеческие антитела имеют KD для ОМ по меньшей мере около 10-6 M (1 микромоль/л), около 10-7 M (100 нмоль/л), 10-9 M (1 нмоль/л) или менее. Для изменения аффинности, которое, например, выражается в улучшении аффинности или уменьшении KD человеческого антитела с ОМ, могут быть введены заместители в любой из остатков CDR или другие остатки.
Источником продукции человеческих антител, которые связываются с ОМ, предпочтительно являются представленные здесь последовательности, которые содержат вариабельные участки, каркасные участки и/или CDR, обозначенные как SEQ ID NO: 13-55, которые идентифицированы как способные к связыванию человеческого ОМ и перекрестному реагированию с ОМ яванского макака за счет иммунного репертуара полученных у человека Fab-фрагментов, введенных в частицы нитевидного фага.
Замещение любого из CDR в любом каркасном участке вариабельного домена человека, скорее всего, приведет к сохранению его правильной ориентации в пространстве, если каркасный участок вариабельного домена человека примет конформацию, которая аналогична или схожа с родительским вариабельным каркасным участком, из которого был получен CDR. Вариабельные каркасные участки тяжелой и легкой цепи могут быть объединены в итоговое Mab, которое может быть получено из одинаковых или различных последовательностей человеческого антитела. Последовательности человеческого антитела могут быть последовательностями естественных человеческих антител, могут получаться из зародышевых последовательностей иммуноглобулинов или могут быть консенсусной последовательностью некоторых человеческих антител и/или зародышевых последовательностей.
Подходящие последовательности человеческих антител идентифицируются при помощи компьютерного сравнения аминокислотных последовательностей вариабельных участков мыши с последовательностями известных человеческих антител. Сравнение проводится отдельно для тяжелых и легких цепей, однако его принцип для них одинаков.
Что касается эмпирического способа, то было обнаружено, что он особенно удобен для создания библиотеки вариантов последовательностей, которые могут быть исследованы для обнаружения желаемой активности и аффинности или специфичности связывания. Одним из форматов создания подобной библиотеки вариантов является вектор для фагового дисплея. В ином случае, варианты могут быть созданы при помощи альтернативных известных способов рандомизирования и мозаицирования последовательности нуклеиновой кислоты, кодирующей целевые остатки в вариабельном домене.
При необходимости дальнейшей замены может использоваться другой способ предопределения, в котором выбор аминокислотных остатков для замещения может осуществляться с помощью компьютерного моделирования. Широко доступно аппаратное и программное обеспечение компьютера для получения трехмерных изображений молекул иммуноглобулина. В целом, молекулярные модели создаются на основе известных структур цепей иммуноглобулина или его доменов. Аминокислотная последовательность моделируемых цепей сравнивается с цепями или доменами известных трехмерных структур для обнаружения их сходства, и цепи и домены, чья последовательность оказалась наиболее схожей, выбираются в качестве начальной точки для конструирования молекулярной модели. Известные исходные структуры модифицируются с учетом различий между аминокислотами в цепях или доменах моделируемого иммуноглобулина и исходной структурой. Затем модифицированные структуры объединяются в смешанный иммуноглобулин. В итоге модель совершенствуют путем минимизации энергии и убеждаются в том, что все атомы находятся на надлежащем расстоянии друг от друга, и что длины связей и углы находятся в химически приемлемых пределах.
В связи с вырожденностью кода каждую аминокислотную последовательность иммуноглобулина может кодировать множество последовательностей нуклеиновых кислот. Желаемые последовательности нуклеиновых кислот могут создаваться de novo при помощи твердофазного синтеза ДНК или ПЦР-мутагенеза полученного ранее варианта желаемого полинуклеотида. Все нуклеиновые кислоты, кодирующие антитела, описанные в данной заявке, специально включены в настоящее изобретение.
Вариабельные сегменты человеческих антител, получаемые в соответствии с настоящим документом, обычно связаны, по меньшей мере, с частью константного участка человеческого иммуноглобулина. В составе антитела будут константные участки и легкой, и тяжелой цепи. Константный участок тяжелой цепи обычно содержит домены CH1, шарнирный, CH2, CH3 и иногда CH4.
Человеческие антитела могут содержать любой тип константных доменов любого класса антител, включая IgM, IgG, IgD, IgA и IgE, и любого подкласса (изотипа), включая IgG1, IgG2, IgG3 и IgG4. Когда желательно, чтобы гуманизированное антитело проявляло цитотоксическую активность, константный домен обычно является константным доменом, который фиксирует комплемент и обычно принадлежит к классу IgG1. Когда такая цитотоксическая активность нежелательна, в качестве константного домена можно использовать IgG2 . Гуманизированное антитело может содержать последовательности из более чем одного класса или изотипа антител.
Нуклеиновые кислоты, кодирующие вариабельные участки легкой и тяжелой цепи гуманизированного антитела, которые необязательно могут быть связаны с константным участком, помещены в экспрессионные векторы. Легкую и тяжелую цепи можно клонировать в одном или в разных векторах экспрессии. Сегменты ДНК, кодирующие цепи иммуноглобулинов, функционально связаны с контрольными последовательностями в экспрессионных векторах, которые обеспечивают экспрессию полипептидов иммуноглобулина. Такими контролирующими последовательностями являются сигнальная последовательность, промотор, энхансер и терминатор транскрипции (см. Queen et al., Proc. Natl. Acad. Sci. USA 86, 10029 (1989); WO 90/07861, Co et al., J. Immunol. 148, 1149 (1992), которые включены во всей полноте в настоящий документ посредством ссылки).
3. Способы применения анти-ОМ антител
Как подробно описывается ниже, настоящее изобретение показывает, что выделенные моноклональные антитела, имеющие вариабельные домены M5, M6, M9, M10, M42, M45, M53, M54, M55, M62, M63, M65, M66, M67, M68, M69, M71 и M83, связываются с перекрывающимися антигенными детерминантами ОМ и проявляют in vitro и/или in vivo активность, связанную с подавлением ОМ. Существенно, что реактивность выбранных MAb включает способность к дозозависимому блокированию взаимодействия ОМ с gp130, уменьшению сигнальной активности ОМ в присутствии gp130, уменьшению стимулируемой ОМ пролиферации клеток A375, предотвращению стимулируемой макрофагами продукции коллагена хондроцитами или уменьшению высвобождения цитокинов под действием ОМ in vivo.
Учитывая свойства моноклональных антител, описанных в настоящем изобретении, антитела или их антиген-связывающие фрагменты пригодны для использования в качестве как лечебных, как и профилактических средств для лечения или профилактики ОМ-ассоциированных состояний у людей и животных.
В целом, применение может включать введение терапевтически или профилактически эффективного количества одних или более моноклональных антител или их антиген-связывающих фрагментов в соответствии с настоящим изобретением, или антител или молекул, которые были выбраны из-за сходного спектра связывающей и биологической активности, восприимчивому субъекту или субъекту, находящемуся в состоянии, в котором ОМ вызывает известные патологические последствия, такие как иммунологические расстройства или рост опухоли и метастазов. Вводить можно любую активную форму антитела, в том числе фрагменты Fab и F(ab')2.
Предпочтительно использовать антитела, совместимые с видом реципиента, чтобы действие MAb не было слишком коротким или не индуцировало у субъекта иммунный ответ на MAb. При приеме MAb могут проявлять некоторые второстепенные функции, такие как связывание с Fc-рецепторами субъекта и активация механизмов опосредованной антителами клеточной цитотоксичности для истощения популяции клеток-мишеней при помощи цитолитических или цитотоксических механизмов, или они могут быть генетически сконструированы с учетом ограничения или исключения этих вторичных эффекторных функций с целью сохранения популяции клеток-мишеней.
Лечение индивидуумов может заключаться во введении терапевтически эффективного количества антител настоящего изобретения. Антитела могут быть в составе набора, описанного ниже. Антитела могут применяться или вводиться в виде смеси, например, в равных количествах, или по отдельности в виде определенной последовательности, или они могут вводиться все сразу. При обеспечении пациента антителами или их фрагментами, способными связывать ОМ, или антителами, способными защищать реципиента от ОМ, дозировка вводимого агента может варьироваться в зависимости от таких факторов, как возраст пациента, вес, рост, пол, общее медицинское состояние, медицинский анамнез и т.д.
При подобном подходе другим терапевтическим применением моноклональных антител настоящего изобретения является активная иммунизация пациента при помощи антиидиотипического антитела, индуцированного против одного из настоящих моноклональных антител. Иммунизация антиидиотипическими антителами, которые имитируют структуру эпитопа, позволяет вызвать ответную реакцию против ОМ (Linthicum, D. S. и Farid, N. R., Anti-idiotypes, Receptors, and Molecular Mimicry (1988), стр. 1-5 и 285-300).
Более того, активную иммунизацию можно индуцировать, включив в состав вакцины один и более антигенных и (или) иммуногенных эпитопов. Вакцинацию в целях профилактики или терапии можно проводить орально или парентерально, в количестве, достаточном для генерации реципиентом защитных антител к этим биологически активным участкам. Хозяина можно активно иммунизировать антигенным/иммуногенным пептидом в чистом виде, фрагментом этого пептида, или модифицированной формой пептида. К N- или С-концу оригинального пептида или его части можно добавить одну и более аминокислот, отсутствующих в оригинальной последовательности белка. Такие дополнительные аминокислоты обычно включают для обеспечения взаимодействия пептида с другим пептидом, с белком-носителем или с подложкой. Аминокислоты, которые могут использоваться в этих целях, включают: тирозин, лизин, глютаминовую кислоту, аспарагиновую кислоту, цистеин и их производные. В альтернативных способах модификации белков могут использоваться, например, NH2-ацетилирование или COOH-концевое аминирование для обеспечения дополнительных средств для объединения или конденсации пептида с другим белком, пептидной молекулой или подложкой.
Антитела, способные защищать от нежелательной биологической активности ОМ, предназначены для их предоставления реципиентам в количествах, достаточных для эффективного подавления, разрешения или смягчения симптомов или патологий, связанных с ОМ. Количество называется достаточным или "терапевтически эффективным количеством" для "эффективного" уменьшения симптомов, если дозировка, пути введения и т.д. агента достаточны для его влияния в виде такого ответа. Реакции в ответ на введение антитела можно измерить, анализируя ткани, органы или клетки субъекта способами визуализации или получая образцы тканей и изучая их ex vivo. Вещество считается физиологически значимым, если его присутствие вызывает поддающиеся обнаружению изменения физиологии реципиента.
Терапевтические применения
ОМ-нейтрализующие антитела настоящего изобретения, антиген-связывающие фрагменты или их специфические варианты могут использоваться для вызова эффектов в клетке, ткани, органе или животном (включая млекопитающих и людей) для диагностики, наблюдения, модулирования, лечения, облегчения или предотвращения заболевания, уменьшения симптомов, состояний, опосредованных, вызванных или модулируемых ОМ или клетками, экспрессирующими ОМ. Таким образом, настоящее изобретение обеспечивает способ модулирования или лечения, по меньшей мере, одного заболевания, связанного с ОМ, клетки, ткани, органа, животного или пациента известными в данной области техники способами или способами, которые описаны в настоящем документе, при помощи, по меньшей мере, одного антитела к ОМ настоящего изобретения.
Известно, что ген ОМ активируется при различных патологических состояниях, которые включают воспаление, и играет различные биологические роли в процессах, включающих формирование кости, деградацию хряща, поглощение холестерина, боль и воспаление. Конкретные показания обсуждаются ниже.
Показания
Авторы настоящего изобретения продемонстрировали, что ОМ обуславливает деструкцию хряща, и было показано, что ОМ вызывает деградацию хондроцитов во внутрисуставном матриксе тканевых эксплантатов. ОМ также способствует высвобождению цитокинов, таких как ФНО-α, которые способны стимулировать выработку коллагена в хряще, как показано T. Cawston et al (1998, Arthritis and Rheumatism, 41(10) 1760-1771), и в настоящее время такое антитело, как, например, связывающие домены M71, способно блокировать систему высвобождения цитокинов. Антитела настоящего изобретения M55, M64, M69 и M71 в системе, в которой проводится ко-культивирование микрофагов и хондроцитов, демонстрируют способность к повышению синтеза протеогликанов, который превышает уровень, наблюдающийся при отсутствии ОМ-специфичного антитела.
Авторы настоящего изобретения далее показали, что введение нейтрализующего анти-ОМ антитела настоящего изобретения может подавлять вызванное ОМ высвобождение таких цитокинов и хемокинов in vivo, как ИЛ-6, IP-10 и KC. IP-10, интерферон-гамма индуцируемый протеин массой 10 кДа, или малый индуцируемый цитокин B10, является белком, который у человека кодируется геном CXCL10 (C-X-C мотив хемокина 10 (CXCL10). CXCL10 был связан с некоторыми биологическими ролями, такими как хемоаттракция моноцитов/макрофагов, T-клеток, НК-клеток и дендритных клеток, и стимуляция адгедии Т-клеток к эндотелию. KC, теперь известный как лиганд 1 (CXCL1) хемокина с мотивом C-X-C, является малым цитокином, принадлежащим к семейству хемокина CXC, который ранее назывался GRO1-онкогеном, GROα, нейтрофил-активирующим протеином 3 (NAP-3) и стимулирующим активатором роста меланомы альфа (MSGA-α). У людей этот белок кодируется геном CXCL1. CXCL1 экспрессируется макрофагами, нейтрофилами и эпителиальными клетками, и он обладает хемоаттрактантной активностью для нейтрофилов.
Поэтому, в соответствии с настоящим изобретением, в данном документе предлагается использование антитела или фрагмента антитела, выбранного из группы M5, M6, M9, M10, M42, M45, M53, M54, M55, M62, M63, M65, M66, M67, M68, M69, M71 и M83, для производства лекарственного препарата для лечения или профилактики заболеваний суставов, связанных с деградацией протеогликанов, таких как остеоартрит, воспалительная артропатия или воспалительные расстройства. Конкретным использованием антагониста ОМ является производство лекарственного препарата, который предотвращает или уменьшает синтез коллагена в хряще. Изобретение далее предполагает способ лечения или профилактики воспалительной артропатии или воспалительного расстройства, заключающийся во введении эффективного количества антител, которые блокируют связывание ОМ с gp130 у пациентов, которые страдают данными расстройствами.
Антитело настоящего изобретения может использоваться при подготовке к лечению воспалительных процессов, при которых ОМ прямо или косвенно, например, посредством высвобождения провоспалительных цитокинов, приводит к патологическим изменениям в тканях или органах, в особенности в коже, легких и суставах. Такие патологии включают остеоартрит, ревматоидный артрит, псориатический артрит, анкилозирующий спондилит, нейропатическую артропатию, реактивный артрит, артропатию при поражении вращателей плеча, острую ревматическую лихорадку, синдром Рейтера, прогрессирующий системный склероз, первичный билиарный цирроз печени, пемфигоид, некротический васкулит, тяжелую псевдопаралитическую миастению, рассеянный склероз, красную волчанку, полимиозит, саркоидоз, гранулематоз, васкулит, пернициозную анемию, воспалительное нарушение ЦНС, заболевания, обусловленные действием комплекса антиген-антитело, аутоиммунную гемолитическую анемию, тиреоидит Хашимото, болезнь Грейвса, болезнь Рейно, гломерулонефрит, дерматомиозит, хронический активный гепатит, целиакию, аутоиммунные осложнения СПИДа, атрофический гастрит, болезнь Аддисона, эндотоксикоз или септический шок (сепсис), или один или более симптом сепсиса и других видов острого или хронического воспаления. Пациенты, которые, в частности, способны извлечь для себя пользу из данного способа лечения, страдают от инфекций, вызванных E. coli, Haemophilus influenza B, Neisseria meningitides, стафилококков или пневмококков. Пациенты с риском сепсиса включают пациентов, страдающих от ожогов, ран, почечной или печеночной недостаточности, травм, ожогов, иммунодефицита (ВИЧ), гемопоэтических неоплазий, множественной миеломы, болезни Кастлемена или миксомы сердца.
Другие состояния, связанные с ОМ и поддающиеся лечению или превентивной терапии антителами настоящего изобретения, включают склерозирующие заболевания, такие как легочный фиброз, диабетическая нефропатия, идиопатический легочный фиброз, системная склеродермия и цирроз. Другим показанием к использованию антител настоящего изобретения является лечение или профилактика ноцицептивной боли, затрагивающей нейроны дорсальных корешковых ганглиев.
Введение и дозирование
Изобретение предусматривает наличие стабильных составов антител, которые нейтрализуют ОМ и предпочтительно являются водными растворами фосфатного буфера или растворами смеси солей, а также консервированными растворами и составами, как и консервированными составами для многоразового использования, которые пригодны для фармацевтического и ветеринарного применения и содержат по меньшей мере одно ОМ-нейтрализующее антитело в фармацевтически приемлемом составе. Допустимые для целей настоящего изобретения несущие среды и их композиция с возможностью введения других белков человека, например, сывороточный альбумин человека, описаны, например, в публикации Remington: The Science and Practice of Pharmacy, 21st Edition, Troy, D.B. ред., Lipincott Williams and Wilkins, Филадельфия, Пенсильвания, 2006, Часть 5, Pharmaceutical Manufacturing на стр. 691-1092, особенно см. стр. 958-989.
Описанное в настоящем документе ОМ-нейтрализующее антитело в стабильном или консервированном составе или растворе может быть введено пациенту в соответствии с настоящим изобретением при помощи множества путей введения, включая внутривенный (в/в.); внутримышечный (в/м); подкожный (п/к); трансдермальный; легочный; чресслизистый; использование состава в имплантате, осмотическом насосе, картридже, микронасосе; или других средствах, которые хорошо известны специалистам в данной области техники.
Например, возможно направленное введение в ту или иную часть тела или полость, такое как внутрисуставное введение, внутрь бронха, внутрибрюшинное, внутрь капсулы, хряща, полости, интрацелиальное, внутрь мозжечка, желудочка мозга, внутрь толстой кишки, шейки, желудка, печени, миокарда, внутрь кости, таза, перикарда, полости живота, плевры, простаты, легких, внутрь прямой кишки, внутрь почки, сетчатки, позвоночника, суставной сумки, грудной клетки, внутрь матки, мочевого пузыря, внутрь поврежденной ткани, вагинально, ректально, за щеку, под язык, интраназально или трансдермально.
В целом, при системном введении антител желательно давать реципиенту дозу антител в диапазоне 1 нг/кг-100 нг/кг, 100 нг/кг-500 нг/кг, 500 нг/кг-1 мкг/кг, 1 мкг/кг-100 мкг/кг, 100 мкг/кг-500 мкг/кг, 500 мкг/кг-1 мг/кг, 1 мг/кг-50 мг/кг, 50 мг/кг-100 мг/кг, 100 мг/кг-500 мг/кг (веса тела реципиента), хотя возможно применение более низких или более высоких доз. Конечно, подходящие дозировки антагониста настоящего изобретения могут варьироваться в зависимости от таких факторов, как заболевание или расстройство, которое подвергается лечению, путь введения, возраст и вес индивидуума, который подвергается лечению, и природа антагониста. Без привязки к какой-либо конкретной дозе считается, что при парентеральном введении дневная дозировка составляет от 0,01 до 20 мг/кг антитела (или другой крупной молекулы) настоящего изобретения (обычно присутствует как часть указанной выше фармацевтической композиции), которое подходит для лечения обычного взрослого человека.
Лечить пациента можно однократной дозой, или - что предпочтительнее - по схеме с многократным введением препарата, при этом первичный курс лечения может состоять из 1-10 доз, и далее - через определенные промежутки времени, так, чтобы иммунный ответ сохранялся или усиливался (например, через 1-4 месяца - вторая серия доз и, при необходимости, еще через несколько месяцев - следующая серия). Примеры допустимых схем лечения включают: (i) 0, 1 месяц и 6 месяцев, (ii) 0, 7 дней и 1 месяц, (iii) 0 и 1 месяц, (iv) 0 и 6 месяцев или другие схемы, достаточные для вызова желаемых ответов, при которых ожидается уменьшение симптомов заболевания или уменьшение тяжести заболевания.
Антитела настоящего изобретения могут использоваться по отдельности или в комбинации с иммуносупрессивными агентами, такими как стероиды (преднизолон и т.д.), циклофосфамид, циклоспорин А или аналоги пуринов (например, метотрексат, 6-меркаптопурин и т.п.), или антителами, такими как антитела к антилимфоцитарному антигену, антитела к антилейкоцитарному антигену, антагонисты ФНО, например, анти-ФНО антитела или ингибиторы ФНО, например, растворимый рецептор ФНО, или такие агенты, как НПВС или другие ингибиторы цитокинов.
Таблица последовательностей
Где X1 является A или G, X2 является G или W, X3 может быть I или S,X4 может быть P или A, X5 может быть I или Y, и X6 может быть F или N.
Где X1 может быть S, D, N или T;
X2 может быть A, G или W; X3 может быть S или H; X4 может быть V, A, N или G; X5 может быть S, N, K или W; X6 может быть Y,
S, G или Q; X7 может быть S или D; и X8 может быть S или G
Где X1 может быть S, N или T;
X2 может быть S или G; X3 может быть I или R; X4 может быть D или Y; X5 может быть G или S; X6 может быть D или Y
Где X1 может быть A, D, N, S или R;
X2 может быть D, G, K, N или S; X3 может быть A, D, F, H, N, S, W, V или Y; X4 может быть A, D, F, G, K, N, T или Y.
Где X1 может быть A, D, N, R или S;
X2 может быть D, K, N или S; X3 может быть A, D, F, H, N, S, W или Y; X4 может быть A, D, K, G, F, T или N.
Где X1 может быть D, N, S, R или T;
X2 может быть N, S или R; X3 может быть A, D, H, N, S или R; X4 может быть E, F, H, K, Q, S или Y; X5 может быть A, D, G или S.
Где X1 может быть A, F, H, S или Y;
X2 может быть E, K, N или T; X3 может быть A, D, F, H, N, S, W или Y; X4 может быть A, D, S, W или Y.
Где X1 может быть A, D, F, H, P, S или Y;
X2 может быть D, E, G, H, I, K, N, R, T или Y; X3 может быть D, G, H, K, N, S, T или R; X4 может быть F, I, L, N, R, W или Y, как определено в Таблице 2.
SGLNIEDLEKLQMARPNILGLRNNIYCMAQLLDNSDTAEPTKAGRGASQP
PTPTPASDAFQRKLEGCRFLHGYHRFMHSVGRVFSKWGESPNRSRRHSPH
QALRKGVRRTRPSRKGKRLMTRGQLPR
ESPGAFPSEETLRGLGRRGFLQTLNATLGRVLHRLADLEQHLPKAQDLER
SGLNIEDLEKLQMARPNVLGLRNNIYCMAQLLDNSDMTEPTKAGRGTPQP
PTPTPTSDVFQRKLEGCSFLRGYHRFMHSVGRVFSKWGESPNRSRRHSPH
QALRKGVRRTRPSRKGNRLMPRGQLPR
Настоящее изобретение далее будет рассмотрено со ссылкой на конкретные, но не лимитирующие примеры.
Пример 1. Реагенты и анализы
Для выбора и характеристики ОМ-связывающих антител были созданы конструкты из ОМ человека и макак, которые позволяют оценить экспрессию в клетке млекопитающего. Человеческий ОМ (NP_065391, кодируемый NM_020530) является предшественником из 252 аминокислот, который процессируется в непроцессированный секретируемый белок из 227 аминокислот (SEQ ID NO: 11), который является пропротеином, который далее процессируется в более активную зрелую форму из аминокислот 1-184. кДНК человеческого ОМ была заказана в OriGene (Кат. № SC121421), и открытая рамка считывания человеческого ОМ из клона OriGene была амплифицирована при помощи ПЦР, сигнальный пептид (мышиный IgG1) был введен отдельно с гекса-гистидиновой меткой для очистки белка, а AviTag (SEQ ID NO: 56) - для направленной обработки белка биотином. Последний реагент был выбран для предотвращения случайного химического биотинилирования остатков лизина, присутствующих в области, в которой ОМ взаимодействует с рецепторами.
ОМ яванских макак был клонирован из РНК мононуклеарных клеток периферической крови макак при помощи первой системы синтеза нитей Superscript III (InVitrogen) для получения кДНК, после чего она была амплифицирована при помощи ПЦР и нетранслируемых областей праймеров, созданных из последовательности человеческого ОМ, как описано в заявке на патент США Сер. № 12/648430. Экспрессированный непроцессированный белок приведен в SEQ ID NO: 12 с расщепленной активной формой, представленной 184 остатками 51-227.
Предшественники зрелые формы ОМ человека и макак были экспрессированы клетками HEK 293 и очищены при помощи стандартных способов. Функциональная активность белков была изучена во время анализов пролиферации клеток A375-S2 и сигнальной активности pSTAT3, причем в качестве контроля использовался полученный из E. coli имеющийся в продаже человеческий ОМ (R&D Systems, Кат. № 295-OM).
Mab
В случае, если использовались контрольные антитела, были использованы человеческие антитела изотипа IgG1, обозначенные как CNTO6234.
Химическое биотинилирование
Рекомбинантный человеческий ОМ был биотинилирован при помощи эфира N-гидроксисукцинимида (набор для биотинилирования EZ-Link Sulfo-NHS-LC-Biotinylation Kit, Pierce, №21435), направленно воздействующего на аминные остатки цитокинов. Реакция присоединения биотина была оптимизирована для эффективного мечения мишеней одним молем биотина на моль антигена. Последнее минимизирует потерю связывающей и функциональной активности, тем самым обеспечивая почти полное мечение совокупности белков. После завершения реакции белок очищается от несвязанного биотинового реагента и оставшихся уходящих групп при помощи центрифужных колонок Zeba Desalt Spin Column, которые включены в набор для биотинилирования EZ-Link Sulfo-NHS-LC-Biotinylation Kit (Pierce). Было восстановлено приблизительно 80% исходного материала. Анализ с 2-п-гидроксифенилазобензойной кислотой (набор Pierce Biotin Quantitation Kit, № 28005) был использован для оценки уровня встраивания биотина, который ориентировочно указывает на один моль биотина на моль человеческого ОМ. Прибор Octet (FortéBIO) был использован для проверки связывания стрептавидина и gp130-Fc (R&D Systems, Кат. № 671-GP) с биотинилированным белком. Измерения при помощи прибора Octet показали, что профиль связывания биотинилированного ОМ с gp130 по существу аналогичен таковому для немеченного исходного материала.
Направленное биотинилирование In Vitro
AviTag из 15 остатков (GLNDIFEAQKIEWHE) (SEQ ID NO: 56) имеет схожую кинетику соединения с биотином с эндогенным BirA и субстратом BCCP (Beckett et. al. 1999, Protein Science). После связывания интересующего нас белка с AviTag, имеющего один акцепторный остаток лизина, он может быть биотинилирован только в одном положении. Рекомбинантный ОМ макак был направленно биотинилирован in vitro при помощи биотин-протеин лигазы и имеющихся в продаже реагентов для определения авидности. Биотинилированный ОМ макак был очищен при помощи моновалентной смолы, аффинной к стрептавидину. Качество полученного белка было оценено при помощи ДСН-ПААГ-электрофореза эксклюзионной ВЭЖХ. Анализ с 2-п-гидроксифенилазобензойной кислотой (набор Pierce Biotin Quantitation Kit, №28005) был использован для оценки уровня встраивания биотина, который ориентировочно указывает на один моль биотина на моль ОМ макак. Прибор Octet (FortéBIO) был использован для проверки связывания стрептавидина и химеры gp130-Fc с биотинилированным белком. Измерения при помощи прибора Octet показали, что профиль связывания биотинилированного ОМ макак с gp130 по существу аналогичен таковому для немеченного исходного материала.
Твердофазные иммуноанализы
Начальный пэннинг фаговых Fab-фрагментов был осуществлен при помощи планшетов для твердофазного ИФА NEUTRAVIDIN™ (Pierce), покрытых 2 мкг/мл биотинилированного ОМ человека или ОМ макак в TBS. После инкубации в течение ночи при 4°C, блокирования и промывания, разведения 1:100 на каждом этапе пэннига были добавлены поликлональные фаговые пулы. Связанные фаги были обнаружены при помощи моноклонального антитела, конъюгированного с пероксидазой хрена и специфичного к pVIII, который является главным оболочечным белком фага M13 (GE Healthcare, Кат. № 27-9421-01), после чего была добавлена хемилюминесцентная подложка из пероксидазы (Roche, Кат. № 11582950001), и фаги были прочитаны при помощи прибора PerkinElmer.
Первичный поиск отдельных клонов был проведен при помощи секретируемого растворимого Fab-His-белка из супернатантов E. coli. Бактериальные супернатанты, содержащие Fab-His-белок, были использованы для связывания в условиях твердофазного ИФА. Планшеты Black MaxiSorp (Nunc, Кат. № 437111) были покрыты 1 мкг/мл овечьих противочеловеческих Fd (CH1) антител (The Binding Site, Кат. № PC075) и инкубированы при 4°C в течение ночи. После блокирования и промывания планшетов было добавлено 50 мкл неразведенного бактериального супернатанта (содержащего Fab-His-белок), после чего было продолжено инкубирование в течение 1 часа при комнатной температуре и аккуратном встряхивании. Планшеты были промыты, после чего к связанным Fab-фрагментам было добавлено 20 нМ биотинилированного ОМ человека или макак. После 1 часа при комнатной температуре был добавлен конъюгат стрептавидин-пероксидазы хрена (Invitrogen, Кат. № 43-4323), после чего было проведено хемилюминесцентное обнаружение описанным выше способом. Было рассчитано, что проверка первичного связывания при помощи твердофазного ИФА с человеческим ОМ в концентрации 20 нМ позволяет обнаружить клоны с аффинностью в наномолярном диапазоне аффинности.
Сортировка эпитопов
Сортировка эпитопов является конкурентным анализом, проводимым для группировки MAb на основании связывающих характеристик при помощи моноклональных конвертированных человеческих IgG1 и имеющихся в продаже антител MAB29, которые известны как блокаторы рекрутинга OSMRβ/LIFRα (R-блокаторы).
В каждую лунку 384-луночного планшета Multi-Array (Meso Scale Discovery (MSD), L25XA-4) было добавлено 2,5 мкг/мл противочеловеческого Fc (Jackson Immuno, 709-005-149) в фосфатно-солевом буфере (PBS) с pH 7,4 (Sigma, P3813). Планшет был инкубирован при 4°C в течение ночи, а затем блокирован 50 мкл блокатора А MSD при комнатной температуре в течение 1 часа. 384-луночный планшет Multi-Array был промыт три раза (PBS pH 7,4, 0,05% полисорбат 20 (Scytek, PBT010)), и в каждую лунку было добавлено 1,0 мкг/мл раствора исследуемых mAb с последующим встряхиванием на 6 уровне встряхивателя титровального планшета при комнатной температуре в течение 1 часа. Как и ранее, планшет был промыт три раза.
Параллельно этому 5 мкг/мл раствор конкурирующих mAb и 1 мкг/мл биотинилированного ОМ (R&D Systems, 295-OM-010/CF) были смешаны на отдельном 96-луночном планшете (COSTAR, 3357) в буфере для анализа MSD (1:3 блокирующего буфера с PBS pH 7,4 и 0,05% полисорбатом 20) и встряхивались на 3 уровне встряхивателя титровального планшета при комнатной температуре в течение 1 часа. Прекомплекс конкурирующего антитела и биотинилированного ОМ был добавлен в каждую лунку 384-луночного планшета Multi-Array и перемешан (на уровне 6 встряхивателя титровального планшета) при комнатной температуре в течение 1 часа. Планшет был промыт три раза, и в каждую лунку был добавлен стрептавидин sulfo TAG (MSD, R32Ad-S) и перемешан (на уровне 6 встряхивателя титровального планшета) при комнатной температуре в течение 30 минут. Планшет был промыт три раза, и в каждую лунку был добавлен буфер T для считывания, разведенный в отношении 1:4 дистиллированной водой (MSD, R92TC-1). Планшет был считан при помощи прибора MSD S6000.
Данные были интерпретированы на основании сигналов, полученных для исследуемых mAb в присутствии биотинилированного ОМ и без какого-либо конкурирующего mAb (максимальный сигнал), вместе с сигналами при самоконкуренции (уменьшение максимального сигнала в 2-4 раза). Конкурирующий анализ эпитопов был завершен, когда значение, полученное в присутствии конкурирующего mAb, было в пределах трех стандартных отклонений от значения, полученного при самоконкурирующем анализе.
Клетки A375
Клетки A375 (ATCC; CRL-1619) являются клетками человеческого эпителия, полученными из злокачественной меланомы. Клетки A375-S2 (ATCC; CRL-1872, сублиния CRL-1619, чувствительная к ИЛ-1) культивируются в готовой питательной среде (DMEM/GlutaMax-I, Gibco) с добавлением 10% фетальной бычьей сыворотки (FBS, Gibco) в колбы с культурой T-175 (Corning; Кат. № 431080), и пассируются, когда в течение каждых трех-четырех дней происходит приблизительно 80% слияние с соотношением субкультур 1:20.
Анализ пролиферации клеток A375-S2 (включение 5-бромдезоксиуридина)
Уменьшение пролиферации клеток A375-S2 под действием ОМ человека или яванских макак было измерено по включению 5-бромдезоксиуридина при помощи хемилюминесцентного твердофазного ИФА. Онкостатин M снижает пролиферацию в линии клеток меланомы человека A375-S2 (Zarling et al. PNAS 83:9739-9743). Эта клеточная линия была использована для оценки активности антител к онкостатину М на всех стадиях обнаружения антител. Клетки A375-S2 были помещены в колбы с культурой ткани T-150 (BD Falcon 35-5001) в DMEM (модифицированную по способу Дульбекко среду Игла, Gibco 11995) +10% FBS (Gibco 16140) +1% Pen-Strep (пенициллин/стрептомицин, Gibco 15140) при 37°C в 95% O2 - 5% CO2, и разводились при пересеве в соотношении 1:10 два раза в неделю.
Для проведения анализа пролиферации клетки были трипсинизированы (0,25%, Gibco 25200) для их удаления из колб T150, а затем помещены на планшеты с плотностью 2000 клеток на лунку во внутренние 48 лунок черных планшетов, обработанных тканевой культурой (BD Falcon 353948), с 200 мкл DMEM/FBS/Pen-Strep. После инкубации в течение ночи при 37°C/95% O2 - 5% CO2 среда была удалена и заменена 180 мкл свежей среды. Был подготовлен отдельный планшет, содержащий все исследуемые растворы с десятикратной конечной концентрацией. Из этого планшета 20 мкл было перенесено в соответствующую лунку с клеточной пластинкой для создания надлежащих условий для эксперимента. Каждые экспериментальные условия проверялись на трех экземплярах. В любом эксперименте, в котором оценивается нейтрализация, в клетки добавляются антитело и онкостатин М, после чего они инкубируются вместе, по меньшей мере, в течение 1 часа. Затем планшеты инкубируются при 37°C/95% O2 - 5% CO2 в течение дополнительных 72 часов. В это время проводится хемилюминесцентный анализ пролиферации клеток способом твердофазного ИФА с 5-бромдезоксиуридином (Roche 11669915001). Реагент для мечения 5-бромдезоксиуридина добавляется в культуру на 4 часа. Затем среда удаляется, и в каждую лунку добавляется 100 мкл фиксирующего раствора. После 30 минут при комнатной температуре раствор удаляется, и в каждую лунку добавляется по 100 мкл раствора анти-5-бромдезоксиуридин-пероксидазы. После 2 часов при комнатной температуре планшет был промыт PBS-полисорбатом, и в каждую лунку было добавлено по 100 мкл Super Signal Pico (Thermo Scientific 37069). Затем люминесценция была считана при помощи прибора Perkin Elmer Victor3.
Исходные эксперименты были проведены для определения дозозависимого ответа на рекомбинантный онкостатин М человека и яванских макак, который был выделен из клеток CHO, полученных внутрилабораторно, при подавлении пролиферации. ОМ был исследован с начальной концентрацией 100 нг/мл с 1-5 разведениями до конечной концентрации 0,0244 нг/мл. Процентное подавление пролиферации было рассчитано в сравнении с клетками, обработанными растворителем. Результаты этого эксперимента показаны на Фигуре 2A. Повышение концентрации онкостатина М человека и макак соответствует уменьшению встраивания 5-бромдезоксиуридина. Антипролиферативная активность онкостатина М человека и яванских макак неотличима друг от друга и основывается на степени антипролиферативной активности и эффекте EC50.
На основании данных экспериментов можно сказать, что концентрация 2 нг/мл онкостатина М была использована для оценки и сравнения антител против онкостатина М, поскольку эта концентрация ингибирует пролиферацию приблизительно на 80%, образуя большое окно, в котором можно определять дозозависимый ответ на антитела. Полный диапазон доз антител был оценен в присутствии 2 нг/мл онкостатина М человека или макак. Кроме того, в эксперимент был включен контроль изотипов при использовании более высоких концентраций антител к онкостатину М. Окно анализа было определено по разнице между необработанными контрольными лунками (с максимальной пролиферацией) и лунками, инкубированными с 2 нг/мл одного онкостатина М (с минимальной пролиферацией), и в этом окне определяется процент нейтрализации при любой концентрации.
Анализ сигнальной активности pSTAT3 при помощи A375-S2 Phospho-STAT3Assay
ОМ ингибирует рост клеток A375-S2 путем связывания с рецептором gp130 на поверхности клеток и индуцирования гетеродимеризации рецептора, что позволяет OSMRβ запустить каскад внутриклеточных сигнальных реакций, которые включают активацию (фосфорилирование) сигнальной молекулы STAT3 (Kortylewski et al., Oncogene 18: 3742-3753, 1999). Нарушение сигнальной активности STAT3 прекращает вызванное ОМ подавление роста клеток A375-S2, тем самым демонстрируя, что активация STAT3 является ключевым шагом в сигнальной активности ОМ (Heinrich et al., Biochem. j. 374: 1-20, 2003). Было показано, что фосфорилирование STAT3 в клетках A375-S2 зависит от концентрации ОМ, и при помощи имеющихся в продаже наборов возможно его измерить в стимулированных клетках. Нейтрализация ОМ-индуцированного фосфорилирования STAT3 в клетках A375-S2 была выбрана в качестве главного анализа при отборе кандидатов для Mab.
Для нейтрализации антител при ОМ-индуцированном фосфорилировании STAT3 клетки A375-S2 были посеяны в 96-луночные планшеты с тканевой культурой (Corning; Кат. № 3596) в количестве 25000 клеток на лунку в 200 мкл готовой питательной среды и инкубированы в течение 24 часов. Клетки были обработаны раствором, содержащим 5 нг/мл человеческого ОМ (рекомбинантного OSMN1-1, полученного из клеток млекопитающих), который был предварительно инкубирован в течение 3 часов при комнатной температуре с серийно разведенными экспериментальными mAb в соотношении 1:5 с начальной концентрацией 10 мкг/мл. Контроли включали необработанные клетки, стимулированные клетки (5 нг/мл только ОМ) и контрольные mAb изотипа hIgG1. Все обработки проводились в трех экземплярах, если не было указано иное.
Анализ содержания pSTAT3 проводился при помощи набора Phospho-STAT3 Whole-Cell Lysate Kit (MSD; Кат. № K150DID-1, Серия № K0010570) в соответствии с протоколом производителя. Вкратце, клетки обрабатывались в лунке объемом 200 мкл в течение 10 минут; растворы для обработки удалялись, и при помощи многоканальной пипетки было добавлено 50 мкл буфера для лизиса клеток MSD. Планшет помещался в орбитальный встряхиватель (при 300 оборотах в минуту) на 5 минут. После этого 30 мкл каждого лизата переносилось на 96-луночный планшет MSD phospho-STAT3. Планшет герметизировали помещали в орбитальный встряхиватель (при 300 оборотах в минуту) на 1 час при комнатной температуре, промывался три раза 150 мкл промывочного буфера MSD, и в каждую лунку добавлялось по 25 мкл конъюгата вторичных детекторных антител (анти-pSTAT3-Ru(bpy)32+), после чего планшет снова герметизировался и инкубировался на орбитальном встряхивателе (при 300 оборотах в минуту) в течение 1 часа при комнатной температуре. Планшет предварительно промывался, и в каждую лунку было добавлено по 150 мкл буфера для считывания MSD (раствора трипропиламина). Планшет был считан при помощи прибора MSD SECTOR Imager 6000.
Полные кривые дозы-ответа EC50 для встроенных зрелых, родственных и контрольных mAb были получены и изображены как нормализованный процент сигнала pSTAT3.
Измерение аффинности при помощи поверхностного плазмонного резонанса (Biacore)
Связывающая способность была измерена при помощи поверхностного плазмонного резонанса (SPR) на оптическом биосенсоре Biacore 3000 (Biacore) с использованием конструктов ОМ человека или макак описанным здесь способом. Поверхность биосенсора была подготовлена путем соединения смеси антител анти-IgG Fc (противомышиных (Jackson, Кат. № 315-005-046) и противочеловеческих (Jackson, Кат. № 109-005-098)) с поверхностью карбоксиметилированного декстрана чипа CM-5 (Biacore, Кат. № BR-1000-14) с использованием инструкций производителя для проведения реакции аминирования. Приблизительно 19000 ЕО (единиц ответа) анти-Ом антител было иммобилизировано на каждой из четырех проточных ячеек. Кинетические эксперименты были проведены при 25ºC в подвижном буфере (DPBS (фосфатно-солевой буфер Дульбекко)+0,005% P20+3 мМ ЭДТА). В подвижном буфере были приготовлены серийные разведения ECD ОМ человека и макак от 100 нМ до 0,412 нМ. Около 200 ЕО mAb было захвачено проточными ячейками 2-4 сенсорного чипа. Проточная ячейка 1 была использована как поверхность сравнения. Захват mAb сопровождался трехминутным введением (фаза ассоциации) антигена со скоростью 50 мкл/мин, после чего в течение 10 минут подавался буфер (фаза диссоциации). Поверхность чипа была регенерирована двумя выбросами в виде 18-секундных введений 100 мМ H3PO4 (Sigma, Кат. № 7961) со скоростью 50 мкл/мин.
Собранные данные были обработаны при помощи программного обеспечения BIAevaluation (Biacore, версия 3.2). Во-первых, проводили двойное эталонное вычитание данных, вычитая графики, полученные при инъекции буфера, из эталонных графиков, полученных при инъекциях анализируемых веществ. Кинетический анализ данных был проведен при помощи описанной общей модели связывания в пропорции 1:1. Результат для каждого mAb регистрировали в формате Ka (скорость ассоциации), Kd (скорость диссоциации) и KD (константа сродства).
Пример 2 Выбор ОМ-связывающих FAB-фрагментов
Библиотеки Fab-pIX de novo были описаны Shi et al. J Mol Biol 397:385-396, 2010; в международной заявке WO09085462A1; патенте США Сер. № 12/546850; и выше в настоящем документе обозначены как 169, 323 и 551, что соответствует использованным человеческим зародышевым каркасным участкам тяжелых цепей: IGHV1-69 (SEQ ID NO: 1), IGHV3-23 (SEQ ID NO: 2) или IGHV5-51(SEQ ID NO: 3) по номенклатуре IMGT. Библиотека каркасных участков трех тяжелых цепей комбинируются с библиотекой каркасных участков VLкаппа четырех легких цепей: A27 (IGKV3-20*01 (SEQ ID NO: 5)), B3 (IGKV4-1*01 (SEQ ID NO: 6)), L6 (IGKV3-11*01(SEQ ID NO: 7)) и O12 (IGKV1-39*01 (SEQ ID NO: 8)). В библиотеках Fab-фрагментов V-участки завершаются добавлением J-участка (FR4), содержащего SEQ ID NO: 4 в тяжелых цепях и SEQ ID NO: 10 в легких цепях. Тяжелая цепь CDR3 имеет вариабельную длину в 7-14 остатков. Примеры целых V-участков из каждой библиотеки показаны на Фиг. 1, и пронумерованные участки CDR показаны в соответствии с нумерацией по Кабату.
Исходный набор анти-ОМ попаданий в фаговом дисплее был идентифицирован при помощи доступного в продаже агликозилированного человеческого ОМ. Библиотеки фаговых дисплеев Fab-pIX были разделены способом пэннинга с использованием захвата биотинилированного человеческого ОМ (R&D Systems, Кат. № 295-OM) на парамагнитных гранулах стрептавидина (SA) (Invitrogen, Кат. № 112.05D) в соответствии с опубликованным протоколом для отбора фагов (Marks and Bradbury, Antibody Engineering, Vol. 248: 161-176, Humana Press, 2004). Вкратце, биотинилированный человеческий ОМ был добавлен к фаговой библиотеке, которая была предварительно абсорбирована на неконъюгированных гранулах, до получения конечной концентрации 100 нМ и инкубирован в течение 1 часа при легком вращении. Блокированные гранулы SA были добавлены и инкубированы в течение 15 минут для захвата биотинилированного ОМ со связанным фагом. Захваченный магнитом комплекс фага/антигена/гранулы был промыт 5 раз 1 мл TBST (буферного раствора Трис и полисорбата 20) и однократно 1 мл TBS. После удаления остатков от промывания TBS был добавлен 1 мл экспоненциально растущих клеток TG1 (Stratagene, Кат. № 200123) и инкубирован при 37°C в течение 30 минут без встряхивания. Инфицированные бактерии были нанесены на планшеты с агаром Луриа-Бертани (1% глюкозы/100 мкг/мл карбенициллина) (Teknova, Кат. № L5804) и инкубированы в течение ночи при 37°C. Бактериальные газоны были соскоблены, после чего в глицерине была приготовлена чистая культура [15% глицерин/ карбенициллин (100 мкг/мл)/2xYT], которая хранилась при -80°C. Для приготовления фагов для второго этапа пэннинга было инокулировано 25 мл 2xYT/карбенициллина (100 мкг/мл) с 25 мкл чистой культуры бактерий в глицерине с последующим выращиванием при 37°C до OD600 около 0,5. Хелперный фаг VCSM13 (Stratagene, Кат. № 200251) был добавлен в культуру с множественным заражением в соотношении около 10:1, и инкубирование проводилось в течение 30 минут при 37°C без встряхивания. Бактерии были отцентрифугированы, и осадок был ресуспендирован в индукционную среду (2xYT/Carb/Kan/изопропилтиогалактозид) и культивирован при 30°C в течение ночи. Фаги были осаждены с 2% полиэтиленгликолем/0,25M NaCl (конечная концентрация) и ресуспендированы в 2 мл PBS. После первого этапа пэннинга фаги хранились при 4°C и использовались для проведения второго этапа пэннинга. Параметры пэннинга: Этап 1, 100 нМ антигена, 1 час инкубирования при комнатной температуре, пятикратное промывание TBST с последующим однократным промыванием TBS; Этап 2, 10 нМ антигена, 1 час инкубирования при комнатной температуре, десятикратное промывание TBST/однократное промывание TBS; и Этап 3, 1 нМ антигена, 16 часов (в течение ночи) инкубирование при 4°C, десятикратное промывание TBST/однократное промывание TBS.
Результаты наблюдались при помощи твердофазного ИФА, где Fab-фрагменты захватывались противочеловеческими антителами Fd (CH1), биотинилированный человеческий ОМ был добавлен в концентрации 20 нМ, и связывание ОМ было обнаружено при помощи конъюгата стрептавидин-пероксидазы хрена.
Как было отображено на Fab-фрагментах, было идентифицировано тридцать (30) уникальных пар тяжелых цепей-легких цепей, и при помощи твердофазного ИФА было показано, что они перекрестно реагируют с ОМ макак. Тяжелые цепи отобразили последовательности из 169 (получена из IGHV1-69) и 551 (получена из IGHV5-51) библиотеки, и они были скомбинированы с вариабельными участками легких цепей, которые отобразили все четыре библиотеки зародышевого происхождения (A27, B3, L6 и O12).
Пример 3 Характеристика ОМ-связывающих MAB
Строение ОМ в виде узла из четырех спиралей характеризуется четырьмя α-спиральными сегментами, обозначенными как A, B, C и D, которые связаны относительно неструктурированными петлями. ОМ взаимодействует с gp130 поверхностью, находящейся на спиралях A и C (участок II), которые предопределены для контакта с аминокислотными остатками Q16, Q20, G120, N123, N124 из SEQ ID NO: 1 (Deller et al. Структура 8(8): 863-874, 2000; Liu et al. Int. J. Mol. Med. 23: 161-172, 2009). Считается, что поверхность, отвечающая за взаимодействие ОМ с OSMRβ и LIFRα (участок III), большей частью определяется остатками, расположенными в спирали D (Deller et al. ibid).
Цель состояла в выборе высокоаффинных связующих веществ для ОМ, которые были бы способны предотвращать вызванную ОМ сигнальную активность gp130 или за счет предотвращения связывания ОМ с gp130 (участок II или B-блокатор), или за счет предотвращения рекрутинга LIFRa или OSMRb, вызванного связыванием ОМ с gp130 (участок III или R-блокатор).
Из 30 изначально отобранных ОМ-связывающих Fab-фрагментов 29 были клонированы в векторы для конверсии в непроцессированные человеческие Mab IgG1. Характеризующие анализы включали (1) конкурентное связывание для идентификации групп эпитопов, или “сортов”, (2) измерение аффинности посредством поверхностного плазмонного резонанса (Biacore), и (3) способность блокировать сигнальную активность pSTAT3. Все отборы и анализы проводились с использованием клеток млекопитающих, вырабатывающих (гликозилированные) белки человека и макак, как описано в Примере 1.
Результаты
Данные измерений аффинности для субпопуляции mAb, выбранных на основании их положения относительно контроля MAB295 (R&D Systems) при анализах связывания pSTAT3 и твердофазном ИФА, показаны в Таблице 3.
Аффинность выбранной субпопуляции анти-ОМ mAb после первого этапа пэннинга
человека
макак
Результаты сортировки показали, что M5, M6 и M9 конкурируют друг с другом, но не с MAB295. M10 может конкурировать с MAB295. В анализе pSTAT3 было показано, что эти четыре mAb могут играть роль функциональных нейтрализаторов сигнальной активности gp130. Таким образом, из этого следует, что M10 является R-блокатором, а M5, M6 и M9 блокируют связывание ОМ с gp130 (B-блокаторы).
Аффинность к мишени с точки зрения терапевтического применения была продиктована необходимостью убедительного конкурирования при взаимодействии ОМ с gp130, измеренная аффинность которого (KD) составляет около 1 нМ. Поэтому желательно, чтобы аффинность к мишени для ОМ составляла 100 пМ или имела меньшую KD.
Обнаружено, что нейтрализующие MAb M5, M6 и M9 являются блокаторами взаимодействия ОМ с gp130, а M10 выл выбран в связи с соответствующим созреванием, в ходе которого образуются производные, которые соответствуют требованиям аффинности 100 пМ для кандидата, который может использоваться в лечебных целях. Дополнительным желательным свойством является связывание mAb с ОМ яванского макака с пятикратной аффинностью в сравнении с ОМ человека (KD 500 пМ или менее).
Было обнаружено, что композиции связывающих доменов этих четырех Mab соответствуют четырем уникальным парам тяжелых и легких цепей, обозначенных, как показано в Таблице 4.
Полные последовательности вариабельных участков содержат зародышевые последовательности, используемые для создания фаговых библиотек, которые были описаны выше, следовательно, фиксированные остатки соответствуют немутированным родительским зародышевым остаткам. Таким образом, каждый V-участок состоит из обозначенных CDR1 и CDR2 в поддерживающем участке, обозначенном как SEQ ID NO: 1-3 или 5-8; с последующим CDR3 (Таблица 3 и 4) для вариабельного участка легкой цепи соответственно (Таблица 5 для LC и Таблица 6 для HC), и с последующим J-участком с SEQ ID NO: 4 для тяжелой цепи и SEQ ID NO: 10 для легкой цепи.
Вариабельный участок HC H2 содержит FR1-CDR1-FR2-CDR2-FR3, полученную из SEQ ID NO: 1, где X1=A, X2=G, X3=I, X4=P, X5=I и X6=F с дополнительной мутацией в H-CDR2. HC из библиотеки 551 (H14, H17 и H135) содержит FR1-CDR1-FR2-CDR2-FR3, полученную из SEQ ID NO: 3, где X1=S, X2=S или G, X3=I, X4=Y, X5=G и X6=Y или D. Каждый из четырех HC содержал уникальную CDR3 (SEQ ID NO: 19-22).
Все вариабельные участки LC выбранных Fab были получены из библиотеки B3 и включают проверенную зародышевую последовательность, обозначенную в базе данных IMGT как IGKV4-1 (B3), которая используется как начальная последовательность для обеспечения разнообразия описанным здесь способом и в соответствии с публикациями. Три из четырех легких цепей имеют различия в CDR1 и содержат идентичный H-CDR2. Консенсусная последовательность для четырех выбранных вариабельных участков легких цепей FR1-CDR1-FR2-CDR2-FR3 была получена из SEQ ID NO: 8, где X1 является Y, S или A; X2 является K, E или N; X3 является Y, W или F; и X4 всегда является W.
Были идентифицированы две уникальные последовательности CDR3. L-CDR3 может быть представлен консенсусной последовательностью (SEQ ID NO: 29), обозначенной формулой Q-Q-(S,Y)-(F,Y)-S-(F,T)-PLT.
Пример 4. Повторный выбор аффинности
Четыре пары V-участков, OSMM5, OSMM6, OSMM9 и OSMM10, описанных в Примере 3, были повторно выбраны для легкой цепи для улучшения аффинности. Для быстрого и эффективного установления аффинности большого количества антител при первичном отборе был использован процесс “внутрилинейного” созревания, описанный Shi et al. в J Mol Biol 397:385-396, 2010, международной заявке WO09085462A1 и заявке на патент США Сер. № 12/546850. Вкратце, участки VH антиген-специфичных клонов, полученных на начальных этапах селекции, были комбинированы с библиотеками соответствующих поддерживающих участков VL, в этом случае B3 основывается на участке V (SEQ ID NO: 8).
Были созданы три новые библиотеки, в одной из которых используется библиотека VL, использующаяся при первичных отборах как источник отдельных VL цепей, и две дополнительные библиотеки, разработанные на основе предыдущих анализов комплексов антиген-антитело известной структуры (Raghuanthan et al., J. Mol. Recognit, 2010). Остатки были выбраны из разнообразия, основанного на остатках, которые наиболее вероятно будут участвовать в связывании белка-мишени, что также называется использованием специфически предопределенных остатков (SDRU). В легких цепях V каппа были предопределены три контактирующих участка, сконцентрированных вокруг гипервариабельных петель, как было установлено Хотией и Леском, которые несколько отличаются в зависимости от того, является ли мишень белком, пептидом или небольшим гаптеном. Таблица 5 показывает библиотеки VL, использованные для установления аффинности, где B3 является той же библиотекой, которая используется во время фазы поиска, библиотека 2, «Сфокусированная на SDRM», основывается на остатках SDRU и фокусируется на их разнообразии, и NNK является разупорядоченной библиотекой. В таблице «X» означает любую аминокислоту с одним стоп-кодоном, созданным из смеси NNK.
Таблица 7 суммирует разнообразие в библиотеках 1, 2 и 3. Во время анализа итоговой библиотеки некоторые аминокислоты были идентифицированы не как части исходной структуры, и поэтому представляются как следствия применения способа синтеза. В библиотеке 2, синтезированной с использованием динуклеотидов, эти аминокислоты были: S (положение 30c), T (положение 30d), EK (положение 30f), IW (положение 32), TV (положение 50), I (положение 92), D (положение 93) и F (положение 96).
Таблица 7
Fab-His-протеин был получен из результатов третьего этапа пэннинга, и твердофазный ИФА моноклональных Fab-His-протеинов используется для идентификации отдельных пиков с большим связывающим сигналом, чем у соответствующего родительского Fab-фрагмента. В этой сортировке при помощи твердофазного ИФА были использованы две концентрации биотинилированного человеческого антигена: 2 нМ и 0,2 нМ. Сигнал при связывании для каждого родительского клона был принят за 100%. Были получены 22 пика от увеличения аффинности M6 и M9, которые показали девятикратное (900%) улучшение связывания при сравнении с родительскими Fab, содержащими исходные V-участки тяжелых и легких цепей. Некоторые из этих новых пар тяжелых и легких цепей были выбраны для дальнейшей оценки.
Аффинности (KD) внутрилинейного зрелого mAb к ОМ человека и яванского макака в сравнении с контрольным антителом MAB295 и родительскими антителами mAb M6 и M9 были суммированы в Таблице 8, и состав CDR этих mAb показан в Таблице 9. В некоторых случаях LCV образовывал пару и с H14, и с H17. Некоторые mAb, которые были признаны возможными кандидатами для использования в терапевтических целях на основании их биофизических свойств и функциональных возможностей, были выделены серым.
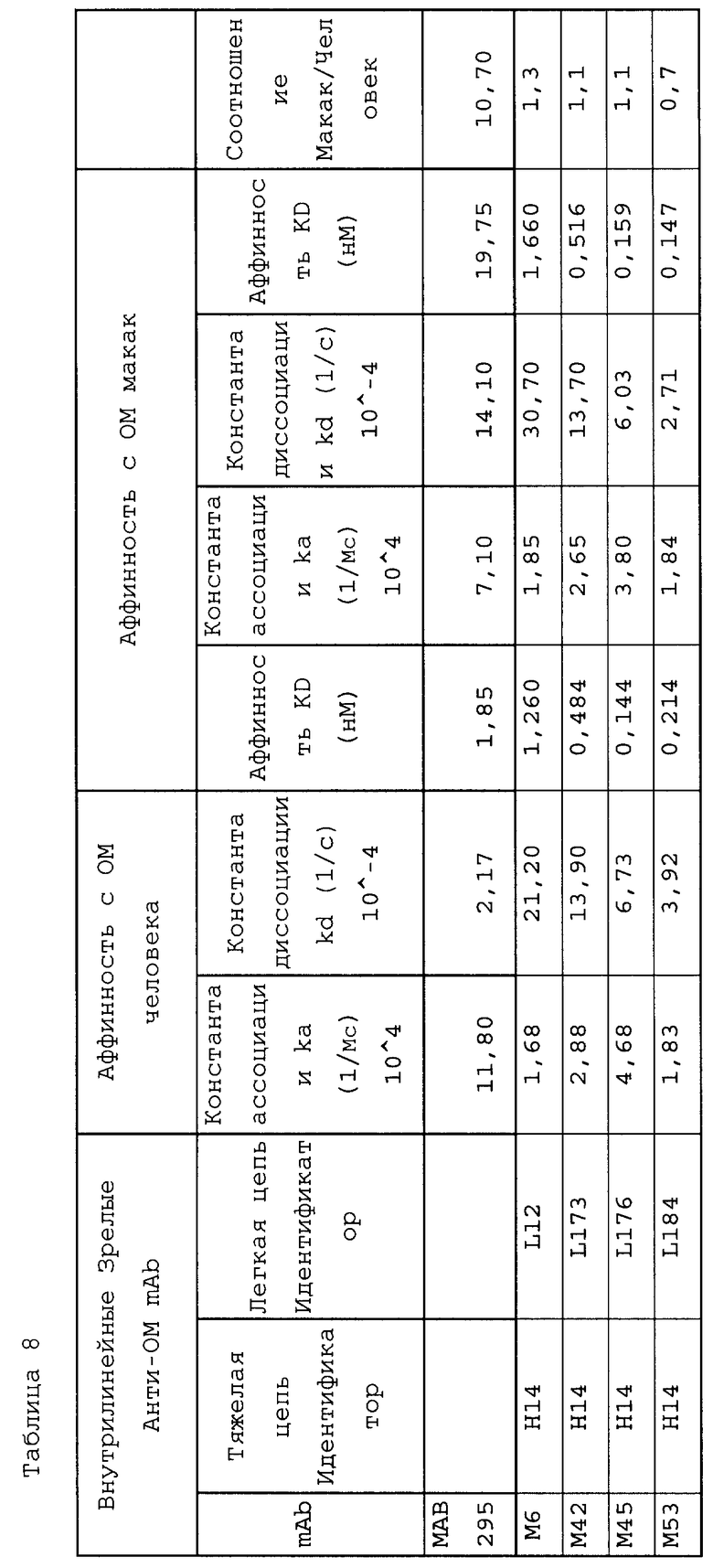
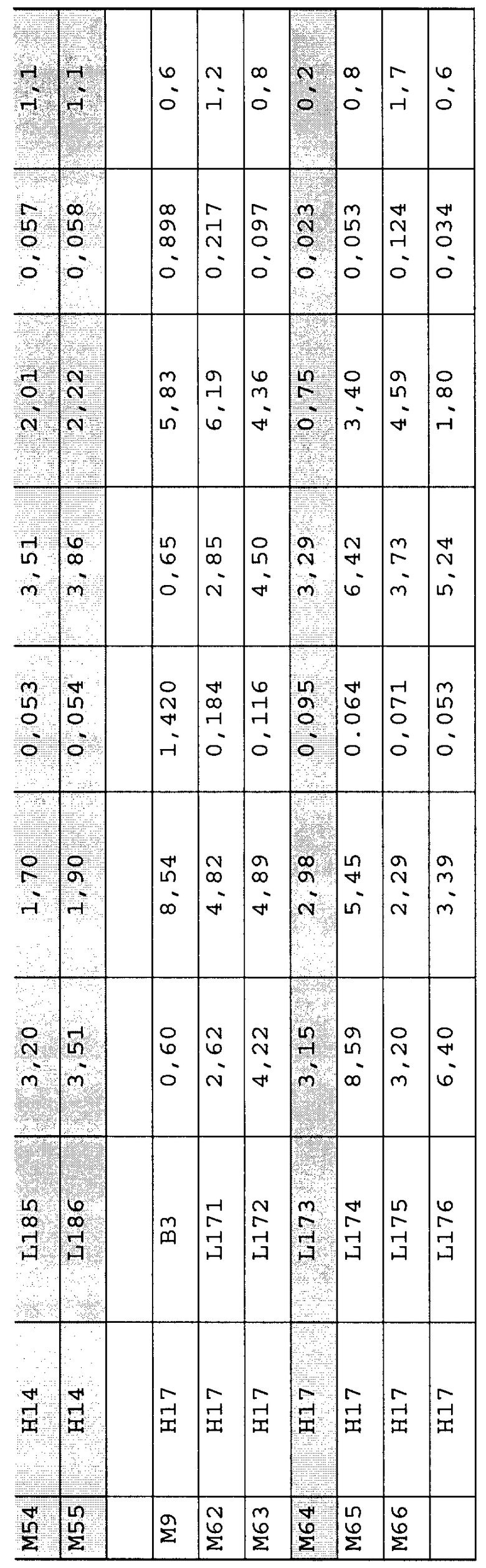

Таблица 9
LC-CDR Таблица высокоаффинных Mab
Разнообразие LC-CDR3 Q-Q-(S,Y)-(F,Y)-S-(F,T)-PLT (SEQ ID NO: 29) в выбранных кандидатах было уменьшено, и консенсусные последовательности повторно выбранных высокоаффинных LC-CDR3 представлены как QQY-(F,Y)-STP-(L,I)-T (SEQ ID NO: 47).
В повторно выбранных mAb VH из H14 и H17 содержат общий участок FR1-CDR1-FR2-CDR2-FR3, который представлен в SEQ ID NO: и содержит SEQ ID NO: 14 (CDR1) и SEQ ID NO: 17 (CDR2).
Способность уменьшать пролиферацию клеток A375-S2 у человека и макак
Оценка зависимости ответа от дозы внутрилинейных зрелых антител проводилась, начиная от дозы 5 мкг/мл или 1 мкг/мл с 1-5 разведениями до 0,0016 или 0,00032 мкг/мл соответственно. Нейтрализация M71 показана на Фигуре 2B. При повышении концентрации антител антипролиферативный эффект Онкостатина М человека и макак будет нейтрализован. Кривые зависимости ответа от дозы были рассчитаны с использованием данных из трех отдельных экспериментов с Онкостатином М человека (незакрашенные обозначения) и яванских макак (закрашенные обозначения). В Таблице 10 суммированы IC50 (с 95% доверительными интервалами) M55, M64, M69 и M71 против Онкостатина М человека и яванских макак.
Таблица 10
Конкуренция с gp130 человека
Конкурентные эксперименты были проведены между анти-ОМ mAb, выбранными для внутрилинейного созревания, и новыми связывающими веществами из приведенной выше таблицы и gp130 человека при помощи поверхностного плазмонного резонанса (SPR) на оптическом биосенсоре Biacore 3000 (Biacore), как описывалось в Примере 1.
Поверхность биосенсора была подготовлена посредством соединения каждого исследуемого mAb с поверхностью карбоксиметилированного декстрана чипа CM-5 (Biacore, Кат. № BR-1000-14) в соответствии с инструкциями производителя. Приблизительно 4000-15000 ЕО (единиц ответа) каждого исследуемого mAb было иммобилизировано в четырех проточных ячейках прибора. Конкурентные эксперименты проводились при 25ºC в подвижном буфере (DPBS+0,005% P20 + 3 мМ ЭДТА). ОМ человека (внутрилабораторный OSMN1-1) был разведен до 30 нМ в подвижном буфере и введен со скоростью 3 мкл/мин в течение 3 минут в каждую проточную ячейку с иммобилизированными mAb. Последующий захват ОМ человека происходил во время трехминутного введения (фаза ассоциации) каждого конкурентного mAb или gp130-Fc человека в концентрации 300 нМ с последующим промыванием буфером (фаза диссоциации) в течение 3 минут. Поверхность чипа была регенерирована двумя 12-секундными выбросами 100 мМ H3PO4 (Sigma, Ка. № 7961) со скоростью 50 мкл/мин. Полученные данные были обработаны при помощи программного обеспечения BIAevaluation версии 3.2 (Biacore). Во-первых, сенсорограммы были нацелены на введение ОМ человека. Затем были записаны уровни связывания (ЕО) для ОМ человека, конкурирующего mAb или gp130-Fc. Увеличение связывания (ЕО) при введении конкурентного mAb или gp130-Fc на поверхность ОМ указывает на то, что они не конкурируют с иммобилизированными исследуемыми mAb и наоборот. Проточная ячейка (Fc1 и т.д.) с иммобилизированными mAb находится вдоль горизонтальных рядов образцов из Таблицы 10.
Ранее было показано, что M2 конкурирует с имеющимся в продаже антителом MAB295, которое, как известно, не конкурирует с gp130 при связывании с ОМ. Результаты анализов конкурентного связывания показывают, что M54, M55, M64, M69 и M71 конкурируют с gp130-Fc человека при связывании с антигеном ОМ (Таблица 11).
Таблица 11
Конкурентное исследование зрелых антител к gp130, являющихся кандидатами для создания лекарственных mAb
Способность блокировать pSTAT3 в клетках A375
Рассчитанные значения EC50 для ингибирования pSTAT3, происходящего в клетках A375 в присутствии или отсутствии 5 нг/мл человеческого ОМ для M6, M9 и внутрилинейных зрелых вариантов этих Mab, показаны в Таблице 12.
Таблица 12
Ингибирование pSTAT3
Пример 5. Биологическая активность
Анализ ко-культуры макрофагов и хондроцитов
M71 был исследован в системе ко-культуры макрофагов и хондроцитов. Известно, что дифференцированные макрофаги продуцируют онкостатин M (Hasegawa et al. Rheumatology 38:612-617, 1999). ОМ может снижать синтез высокосульфатированных протеогликановых аггреканов (гликозоаминогликанов), которые образуют значительную часть матрикса хряща.
Противочеловеческие антитела к онкостатину M были обнаружены при помощи рекомбинантного меченного His-Avi-белком онкостатина М человека и яванских макак из клеток HEK, и активность этих антител была оценена при помощи этих молекул и полученного из бактерий рекомбинантного человеческого онкостатина M компании R&D Systems (295-OM). Ни один из них не является идентичным к естественному эндогенному онкостатину М человека либо из-за мечения his-avi-белком (ОМ из клеток HEK), либо из-за отсутствия гликозилирования (бактериальный рекомбинантный ОМ). Известно, что макрофаги секретируют онкостатин M (Grove et al., J Lipid Res 32:1889-97, 1991), и онкостатин M снижает синтез протеогликанов в хондроцитах человека (Sanchez et al. OA and Cart. 12: 810-10, 2004). Таким образом, ко-культуральная система используется для определения способности противочеловеческих антител к онкостатину M нейтрализовывать эндогенный, или естественный, человеческий онкостатин M. Вкратце, одиночные альгинатные гранулы, содержащие 40000 нормальных человеческих суставных хондроцитов, были культивированы в течение 72 часов в присутствии дифференцированных макрофагов человека. Эти эксперименты проводились в присутствии диапазона доз антител к онкостатину М. В конце эксперимента синтез протеогликанов измерялся по включению радиоактивного 35SO4.
CD14+ моноциты периферической крови были получены из компании AllCells. Моноциты культивировались на 48-луночных планшетах с 2,5×105 клетками в лунке в 0,5 мл макрофагальной среды (RPMI + глутамин с 10% термоинактивированной FBS, 1% NEAA (заменимые аминокислоты) и 1% Pen-Strep). Клетки обрабатывались 100 нг/мл макрофагального колониестимулирующего фактора (M-CSF). Через 48 часов среда была заменена для удаления неприкрепившихся клеток. На 6 день макрофагальная среда, содержащая M-CSF, была заменена макрофагальной средой без M-CSF. На 8 день макрофагальная среда была заменена хондроцитарной средой (50% F-12 Хэма/50% DMEM с 10% фетальной телячьей сыворотки), и в каждую лунку были добавлены отдельные альгинатные гранулы с культурой хондроцитов (Articular Engineering №CDD-H-2200). Аликвоты кондиционированной макрофагальной среды были дублированы и сохранены при -80o C для анализов уровней онкостатина М при помощи набора R&D Systems Human Oncostatin M DuoSet (DY295).
Ко-культуры макрофагов с альгинатными гранулами содержались в присутствии или 20 мкг/мл противочеловеческих антител против онкостатина M (M64, M71, M55, M69), или в присутствии диапазона доз (от 5 мкг/мл до 0,00076 мкг/мл; 1-3 разведения) антитела (M71 и M55). Кроме того, контроль в виде человеческого изотипа IgG1 (CNTO6234) внесен на планшет к наибольшей концентрации исследуемого антитела против онкостатина M. Другие контроли включали только хондроциты (в ко-культуре) и хондроциты в присутствии 2 нг/мл человеческого онкостатина M. Кроме того, лунки, содержащие только макрофаги, содержались для измерения продукции онкостатина М. После 72 часов ко-культивирования в каждую лунку было добавлено 10 мкКи/мл радиоактивного 35SO4 (Perkin-Elmer NEX041H002MC) на дополнительные 20 часов.
Включение 35SO4 было измерено при помощи способа преципитации CPC (MP BIomedicals (№ 190177). Через 20 часов инкубирования с 35SO4 меченная среда была удалена, и каждая гранула была дважды промыта DPBS с Ca и Mg. После второго промывания к каждой грануле было добавлено 200 мкл цитратного буфера (150 мМ NaCl, 55 мМ цитрата Na, pH 6,8). Планшеты инкубировались в течение от 10 до 15 мин при 37°C до тех пор, пока гранулы не растворились. 100 мкл аликвоты из каждой лунки было перенесено на 96-луночный фильтровальный планшет Millipore Multiscreen, предварительно смоченный 1% CPC, после чего в каждую лунку было добавлено по 10 мкл 10% CPC на 5 минут. Затем планшет был помещен в вакуум до тех пор, пока фильтры не стали сухими. Затем каждая лунка была промыта 2 раза 200 мкл 1% CPC, после чего лунки были помещены в вакуум до тех пор, пока фильтры не стали сухими. Затем из планшета было удалено пластиковое дно, и оно было заменено на приспособление для заклеивания планшетов (Perkin Elmer №6005185). В каждую лунку была добавлена сцинтилляционная жидкость (50 мкл, Perkin Elmer №6013621), и приспособление для заклеивания планшетов было помещено на верхнюю часть планшета. Затем планшет был считан при помощи считывателя Top Count.
В концентрации 20 мкг/мл M64, M71, M55 и M69 повышают синтез протеогликанов выше уровня, наблюдаемого при отсутствии антител, когда контрольный изотип неэффективен (Фиг. 3). В отдельном эксперименте M71 дозозависимо повышает синтез протеогликанов до уровня, наблюдаемого у одних хондроцитов (определен как 100% нейтрализация), причем EC50 составила 30 нг/мл, и контрольный изотип был неэффективен. Эти данные показывают, что полученный из макрофагов ОМ снижает синтез протеогликанов в ко-культивированных хондроцитах, и что противочеловеческие антитела к онкостатину M нейтрализуют естественный онкостатин M.
Анализ фосфорилирования STAT3 в фибробластах человеческого легкого
ОМ индуцирует пролиферацию и продукцию коллагена в нормальных фибробластах человеческого легкого (Scaffidi et al., Br. J. Pharmacol 136: 793-801, 2002). Чрезмерная продукция коллагена фибробластами является ключевой особенностью многих патологических состояний (Lim et al. Oncogene 23(39): 5416-25, 2006; Huang et al. J Cell Biochem 81(1): 102-13, 2001). Сигнальная активность рецептора онкостатина M запускает каскад реакций JAK-STAT, и фосфорилирование STAT3 является начальным этапом этого сигнального пути (Auguste et al. (1997) Signaling of Type II Oncostatin M Receptor. J Biol Chem 272:15760-15764). Способность онкостатина M к образованию фосфорилированного STAT3 была определена в нормальных фибробластах человеческого легкого (NHLF) при помощи набора R&D Systems human/mouse pSTAT3 Duoset (DYC4607-5). Этот анализ затем был использован для определения способности M55 и M71 к нейтрализации сигнальной активности онкостатина M.
Эти эксперименты были проведены при помощи NHLF из Lonza (CC-2512), которые культивировались на соответствующей среде Lonza FGM-2 (CC-3132). Вкратце, клетки были помещены на планшет в количестве 25000 клеток на лунку в FGM-2 и культивировались в течение 24 часов. Затем клетки были обработаны онкостатином M или антителами и онкостатином M в течение 10 минут. Для предотвращения влияния температуры во время 10-минутной инкубации все растворы, используемые для подготовки к обработке, были предварительно нагреты и содержались при 37°C. После 10-минутной обработки среда была аспирирована и заменена полным лизирующим буфером. Лизирующий буфер (pH=7,2), содержащий 1% NP-40, 1% дезоксихолата натрия, 0,1% SDS, 0,15M NaCl и 0,01M фосфат натрия, хранился при 4oC. Во время использования полный лизирующий буфер был приготовлен посредством добавления 1 таблетки смеси ингибиторов протеаз (Roche, 11836153001) и 110 мкл ингибитора фосфатазы HALT (Thermo Scientific 78420) в 11 мл лизирующего буфера. Через 10 минут лизиса полученный лизат был готов для определения фосфорилированного STAT3.
Для определения дозозависимого ответа на онкостатин M клетки NHLF были обработаны диапазоном доз ОМ (от 100 нг/мл до 0,024 нг/мл с 1-4 разведениями для трех лунок). Планшет для разведения был подготовлен при помощи предварительно нагретого PBS + 1% BSA, в каждой лунке которого концентрация ОМ была в 10 раз выше, чем конечная концентрация, которая необходима для обработки, а лунки, содержащие только среду, были включены в качестве необработанных контролей. Среда была полностью удалена из культурального планшета и заменена 180 мкл предварительно подогретой среды FGM-2. Таймер был включен на 10 минут, и затем из каждой лунки планшета для разведения 20 мкл были перенесены в соответствующую лунку культурального планшета. Через 10 минут растворы для обработки были полностью удалены из клеточной пластинки путем аспирации и замещены 100 мкл полного лизирующего буфера. Для минимизации различий во времени инкубирования лизирующий буфер был добавлен в лунки в том же порядке, что и растворы для обработки. Затем анализируемый планшет был помещен во встряхиватель на 10 минут. После встряхивания лизаты были или заморожены при -80°C для дальнейшего анализа, или напрямую нанесены на планшеты для твердофазного ИФА, которые были покрыты антителами к фосфорилированному STAT3. Твердофазный ИФА (набор R&D Systems human/mouse pSTAT3 Duoset) был проведен в соответствии с инструкциями производителя за исключением того, что 1) в каждую лунку было добавлено только 90 мкл лизата или стандарта, и 2) в качестве подложки для SuperSignal Pico (ThermoScientific 37069) была использована пероксидаза хрена. Люминесценция планшета для твердофазного ИФА была считана при помощи спектрофотометра для прочтения планшетов Victor3.
Для оценки способности M55 и M71 к нейтрализации сигнальной активности ОМ в клетках NHLF эти клетки были обработаны диапазоном доз антител к ОМ (по три лунки для каждого опыта, от 500 нг/мл до 0,005 нг/мл с 1-10 разведениями или от 50 нг/мл до 1,563 нг/мл с 1-2 разведениями) в присутствии 2 нг/мл человеческого ОМ. Планшет для разведения был подготовлен при помощи PBS для дозозависимой обработки антителами в концентрации, которая в 20 раз превышает конечную, причем планшет содержал лунки для контроля изотипов (с большей концентрацией антител к ОМ) и лунки без антител для необратонанных контролей и клеток, обработанных только ОМ. Человеческий онкостатин М был приготовлен отдельно в концентрации 40 нг/мл (двадцатикратная конечная концентрация) в среде FGM-2. Антитела в двадцатикратной концентрации с растворами ОМ были перемешаны в равных объемах на планшете для разведения для получения растворов для обработки с десятикратной концентрацией, и планшет был инкубирован в течение 1 часа при 37°C для обеспечения связывания ОМ с антителами. Через 1 час среда была удалена из культурального планшета и замещена 180 мкл предварительно нагретого FGM-2. Таймер был включен на 10 минут, и затем из каждой лунки планшета для разведения 20 мкл были перенесены в соответствующую лунку культурального планшета. Через 10 минут растворы были полностью удалены из клеточной пластинки путем аспирации и замещены 100 мкл полного лизирующего буфера. Для минимизации различий во времени инкубирования лизирующий буфер был добавлен в лунки в том же порядке, что и растворы для обработки. Затем анализируемый планшет был помещен во встряхиватель на 10 минут. После встряхивания лизаты были или заморожены при -80°C для дальнейшего анализа, или напрямую нанесены на планшеты для твердофазного ИФА, которые были покрыты антителами к фосфорилированному STAT3. Твердофазный ИФА (набор R&D Systems human/mouse pSTAT3 Duoset) был проведен в соответствии с инструкциями производителя за исключением того, что 1) в каждую лунку было добавлено только 90 мкл лизата или стандарта, и 2) в качестве подложки для SuperSignal Pico (ThermoScientific 37069) была использована пероксидаза хрена. Люминесценция планшета для твердофазного ИФА была считана при помощи спектрофотометра для прочтения планшетов Victor3.
Человеческий онкостатин M повышает фосфорилирование STAT3 в клетках NHLF с EC50 около 1 нг/мл. Примеры ответов на введение доз онкостатина М приведены на Фигуре 4A. В этом примере EC50 составила 0,90 нг/мл с 95% доверительным интервалом от 0,70 до 1,17 нг/мл. Нейтрализующая способность антилел к онкостатину M была определена в присутствии 2 нг/мл онкостатина M, и все данные были нормализованы в соответствии с люминесценцией в присутствии 2 нг/мл ОМ в отсутствие антител. Фигура 4B изображает дозозависимую нейтрализацию ОМ-индуцированного фосфорилирования STAT3 антителами M71. При повышении концентрации M71 степень фосфорилирования STAT3 снижаетсяКривая зависимости ответа от дозы была рассчитана на основании данных шести отдельных экспериментов, и рассчитанная IC50 для M71 составила 8,9 нг/мл с 95% доверительным интервалом от 6,9 до 11,6 нг/мл.
Пример 6 Активность IN VIVO
Способность M71 к блокированию продукции цитокинов in vivo была оценена после системного введения человеческого онкостатина M. Внутрибрюшинное введение человеческого онкостатина M повысило уровень некоторых сывороточных цитокинов, вероятно, за счет взаимодействия с рецептором мышиного фактора ингибирования лейкемии.
Системное (и/п) введение человеческого онкостатина M мышам было разработано в качестве модели оценки нейтрализующей способности моноклональных антител к онкостатину M в условиях in vivo. Мышам и/п вводилось по 10 мкг человеческого онкостатина M в 200 мкл контрольной несущей среды PBS или PBS. Через 1 час мыши были наркотизированы CO2, и кровь была забрана при помощи терминальной пункции сердца. Отдельным образцам крови дали свернуться на льду в течение 20 мин, а затем они были центрифугированы на 3500 оборотах в минуту в течение 10-15 минут. В соответствии с инструкциями производителя образцы сыворотки оставались замороженными до проведения анализа при помощи панели Milliplex Murine MAP Cytokine/Chemokine Multiplex (32). Анализы образцов показали, что в сравнении с контрольной несущей средой человеческий онкостатин М существенно повысил уровень мышиных KC, IP-10, MCP-1, ИЛ-6 и эотаксина и не повлиял на другие цитокины данной панели. Эти данные показали, что введение человеческого онкостатина M индуцирует высвобождение цитокинов, предположительно, за счет взаимодействия с рецептором мышиного фактора ингибирования лейкемии (Richards et al. J Immunol. 159:2431-37, 1997; Lindberg et al., Mol Cell Biol 18:3357-3367, 1988), который может использоваться для исследования нейтрализующей способности антител к онкостатину M in vivo.
M71 и M55 были оценены в мышиной модели системного введения онкостатина М. Вкратце, мышам подкожно были введены дозы M71 или M55 (человеческих IgG1 к ОМ в дозе 20, 2,0 или 0,2 мг/кг), CNTO6234 (контрольного изотипа huIgG1, 20 мг/кг) или PBS в объеме 10 мкл/г. Через 24 часа каждой мыши подкожно было введено или по 10 мкг внутрилабораторного рекомбинантного онкостатина М, полученного из клеток CHO, в PBS (Sigma D8357) с 0,1% мышиным сывороточным альбумином (Sigma A3559), или только контрольной несущей среды PBS-MSA (общим объемом 200 мкл). Через 1 час мыши были наркотизированы CO2, и кровь была забрана при помощи терминальной пункции сердца. Отдельным образцам крови дали свернуться на льду в течение 20 мин, а затем они были центрифугированы на 3500 оборотах в минуту в течение 10-15 минут. Образцы сыворотки оставались замороженными до проведения анализа при помощи панели Milliplex Murine MAP Cytokine/Chemokine Multiplex (32). Образцы сыворотки были проанализированы в соответствии с инструкциями производителя.
Человеческий онкостатин M достоверно (в соответствии с критерием Стьюдента для одной выборки) индуцирует повышение уровней пяти цитокинов в сыворотке крови, что было определено при помощи набора: эотаксина, ИЛ-6, IP-10, KC и MCP-1. Предварительное введение дозировки контрольного изотипа CNTO6234 в дозе 20 мг/кг не повлияло на вызванное онкостатином M высвобождение цитокинов. Тем не менее, предварительное введение дозировки M71 достоверно снизило уровни IP-10, MCP-1, ИЛ-6 и эотаксина в сыворотке при 2,0 и 20 мг/кг и KC при 20 мг/кг. Введение 0,2 мг/кг M71 не оказало эффекта на цитокины. Эффект M71 и контрольного изотипа на IP-10 и MCP-1 показан на Фигурах 5A и B соответственно. Менее сильная нейтрализация наблюдалась при введении M55 в дозе 20 и 2,0 мг/кг наблюдалась только с IP-10. Сывороточные уровни ИЛ-6, эотаксина и MCP-1 были снижены при введении 20 мг/кг M55, но снижение уровня KC было отмечено только при введении любой дозы M55. Эти данные демонстрируют способность антител к онкостатину M к нейтрализации биологических эффектов экзогенного человеческого онкостатина M в мышиной модели его системного введения.
IP-10, интерферон-гамма индуцируемый протеин массой 10 кДа, или малый индуцируемый цитокин B10, является белком, который у человека кодируется геном CXCL10 (C-X-C мотив хемокина 10 (CXCL10). CXCL10 был связан с некоторыми биологическими ролями, такими как хемоаттракция моноцитов/макрофагов, T-клеток, НК-клеток и дендритных клеток, и стимуляция адгедии Т-клеток к эндотелию. KC, теперь известный как лиганд 1 (CXCL1) хемокина с мотивом C-X-C, является малым цитокином, принадлежащим к семейству хемокина CXC, который ранее назывался GRO1-онкогеном, GROα, нейтрофил-активирующим протеином 3 (NAP-3) и стимулирующим активатором роста меланомы альфа (MSGA-α). У людей этот белок кодируется геном CXCL1. CXCL1 экспрессируется макрофагами, нейтрофилами и эпителиальными клетками, и он обладает хемоаттрактантной активностью для нейтрофилов.
Пример 7. Ко-кристаллография
Fab-фрагмент, содержащий V-участки H17 (SEQ ID NO: 51) и L180 (SEQ ID NO: 55) был кристаллизован с остатками человеческого ОМ (SEQ ID NO: 10) 26-212.
ОМ имеет общую трехмерную структуру в виде узла из четырех спиралей с другими членами семейства цитокинов gp130. Строение в виде узла из четырех спиралей характеризуется четырьмя α-спиральными сегментами, обозначенными как A (основания 10-37), B (основания 67-90), C (основания 105-131) и D (основания 159-185) и связанными относительно неструктурированными петлями. ОМ взаимодействует с gp130 посредством конечного участка эпитопа II, который включает аминокислотные остатки (Q16, Q20, G120, N123, N124), расположенные в спиралях A и C (Deller et al. Структура 8(8): 863-874, 2000; Liu et al. Int. J. Mol. Med. 23: 161-172, 2009). Участок III, эпитоп, ответственный за взаимодействие ОМ с OSMRβ и LIFRα, вероятно, большей частью определяется остатками, расположенными в спирали D (Deller et al. Структура 8(8): 863-874, 2000).
Кристаллизация
Кристаллизация комплекса проведена при помощи способа диффузии паров в сидячей капле при 20°C с использованием робота для кристаллизации протеина Oryx4 (Douglas Instruments), распределяющего равные объемы 0,2 л белкового комплекса (10,95 мг/мл) и 0,2 л резервуарного раствора. Было проведено несколько попыток кристаллизации. Множество капель, которые остались прозрачными, отражают высокую растворимость комплекса. Кристаллы были получены из 0,1 M MES pH 6,5, 2,4 M сульфата аммония и 0,1 M Трис pH 8,5, 3,5 M формиата натрия.
Полученная кристаллическая структура раствора
Остатки ОМ в сочетании с H14/L180 Fab-фрагментами образуют связываемый эпитоп. Остатки антитела в сочетании с ОМ образуют связываемый паратоп. Все шесть CDR двух вариабельных доменов участвуют в связывании ОМ. Контактирующие остатки приведены в Таблице 13 и показаны на Фигуре 5. Длинный CDR-L1, вместе с CDR из вариабельного участка H1 тяжелой цепи образуют участок связывания антигена в виде впадины с небольшим ребром снизу (Фигура 4C, левая панель). После связывания две стороны впадины охватывают узел из четырех спиралей ОМ вдоль спиралей A и C, причем нижнее ребро связывается между двумя спиралями (Фигура 4C, правая панель). Поверхность для связывания антитела и антигена закрывает 2,514 Å2 поверхности, доступной для воздействия растворителя (1225 Å2 для антитела и 1298 Å2 для антигена). Хотя на поверхности присутствует множество заряженных остатков, там отсутствуют ионные связи, тем самым подтверждая, что вандервальсовы и водородные связи играют наиболее важные роли во взаимодействиях антитела и антигена.
Таблица 13
* Длина составляет 3,3 Å для водородных связей (выделены жирным) и 3,9 Å для вандервальсовых сил.
Поэтому H17/L180 Fab контактирует с ОМ остатками, которые, как было показано ранее, взаимодействуют с gp130; Q20 и G120, и вдоль спиралей A и C.
Пример 8 Фармакокинетика
ОМ является растворимой мишенью, связанной с воспалительными процессами, в отличие от клеточной поверхности, презентирующей мишень на клетке. Целый IgG содержит связывающие участки, которые были описаны в настоящем документе, и дополнительно имеет Fc домен, который, с учетом цели и терапевтических характеристик, относящихся к применению использованных способов генной инженерии Fc с мутациями, обеспечивает изменения в связывании FcR.
В настоящем составе длительная активность и персистенция в крови является положительной характеристикой для терапевтического моноклонального IgG. Поэтому Fc-домен имеет сильную аффинность к неонатальному рецептору (FcRn).
Использование описанных ранее мутаций M428L (MedImmune патент США № 7670600) в сочетании с N434S (Заявка на патент США 7371826, международная заявка WO2006/053301) позволяет использовать стандартные способы рекомбинации для создания мутантных антител и антител дикого типа. Два Mab, M71 и M71 L/S, были сравнены в анализах стандартной активности и с точки зрения персистенции в крови приматов (кроме человека).
Анализы
M71 и M71 L/S были сравнены друг с другом в анализе пролиферации A375-S2. Зависимость ответов от дозы была оценена с начальной концентрации 1 мкг/мл и 1-5 разведениями до 0,00032 мкг/мл. При концентрации 1 мкг/мл контрольный изотип этих антител, CNTO3930 и CNTO8852 соответственно, не влияет на способность 2 нг/мл человеческого онкостатина M ингибировать пролиферацию. M71 и M71 L/S полностью нейтрализовали влияние онкостатина M в концентрации 1 мкг/мл с измеренной разницей в IC50.
M71 и M71 L/S были сравнены в мышиной модели системного введения ОМ. Вкратце, мышам подкожно вводили дозы M71 и M71 L/S (20, 10 или 5,0 мг/кг), CNTO3930 (контрольный изотип huIgG1, 20 мг/кг), CNTO8852 (контрольный изотип для мутантной версии Fc, 20 мг/кг) или PBS в объеме 10 мкл/г. Через 24 каждой мыши было введено и/п 10 мкг или лабораторного рекомбинантного человеческого онкостатина М, полученного из клеток CHO, в PBS (Sigma D8357) с 0,1% мышиного альбумина сыворотки (Sigma A3559), или одной контрольной несущей среды PBS-MSA (общий объем 200 мкл). Через 1 час мыши были наркотизированы CO2, и кровь была забрана при помощи терминальной пункции сердца. Отдельным образцам крови дали свернуться на льду в течение 20 мин, а затем они были центрифугированы на 3500 оборотах в минуту в течение 10-15 минут. Образцы сыворотки оставались замороженными до проведения анализа при помощи изготовленного на заказ мышиного мультикомплекса Millipore, содержащего гранулы, специфичные к ИЛ-6, MCP-1, эотаксину, KC и IP-10. Контрольный изотип не оказал какого-либо воздействия на высвобождение цитокинов, вызванное человеческим онкостатином М. Тем не менее, M71 и M71 L/S нейтрализуют вызванное онкостатином М высвобождение цитокинов без очевидных различий в силе и эффективности.
Фармакокинетический анализ
Периоды полужизни M71 и M71 L/S в сыворотке были сравнены в неконечном исследовании фармакокинетики на яванских макаках. Исследование включало всего 12 яванских макак, у которых оценивалось подкожное (п/к, n=3) и внутривенное (в/в, n=3) введение каждого антитела. Антитела вводились в дозе 3 мг/кг, и исследование продолжалось в течение 60 дней. Образцы крови были взяты через 1 (только IV группы) и 6 часов и на 1, 2, 4, 6, 8, 12, 16, 30, 37, 45 и 60 дни. Сыворотка образцов была заморожена при -80o C до начала исследования. Уровни антител в сыворотке были определены при помощи твердофазного ИФА, оптимизированного для сыворотки яванских макак на платформе MesoScale Discovery. Биотинилированные захваченные антитела были антиидиотипическими антителами против M71 (мышиные анти-M71). Детекторное антитело было мечено рутением противочеловеческим IgG, и считывающее устройство было представлено хемилюминесцентным прибором MesoScale Discovery.
Результаты исследования показаны на Фигурах 6A и B. Фиг. 6A изображает графики при в/в введении, при котором период полужизни в сыворотке M71 составляет 15,21+/-3,0 дня, и период полужизни M71 L/S составляет 29,4+/-2,3 дня. Схожие результаты были получены при подкожном введении (Фиг. 6B) с периодом полужизни в сыворотке 15,4+/-4 дня для M71 и 32,0+/-5,9 дня для M71 L/S.
Результаты показали, что M71 L/S t ½ повысилась в два раза в сравнении с M71.
| название | год | авторы | номер документа |
|---|---|---|---|
| Молекулы, связывающиеся с 4-1ВВ | 2011 |
|
RU2710717C2 |
| АНТИ-GM-CSF АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2447085C2 |
| БЛОКИРУЮЩИЕ АНТИТЕЛА ПРОТИВ Dkk-1 И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2548817C2 |
| АНТИТЕЛА ПРОТИВ MST1R И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2534890C2 |
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |
| ВЫДЕЛЕННОЕ АНТИТЕЛО ПРОТИВ IP-10, ИММУНОКОНЪЮГАТ И БИСПЕЦИФИЧЕСКАЯ МОЛЕКУЛА НА ЕГО ОСНОВЕ, ИХ КОМПОЗИЦИИ, СПОСОБ ЛЕЧЕНИЯ (ВАРИАНТЫ), КОДИРУЮЩАЯ МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ, СООТВЕТСТВУЮЩИЙ ЭКСПРЕССИОННЫЙ ВЕКТОР, КЛЕТКА-ХОЗЯИН И ГИБРИДОМА | 2004 |
|
RU2486199C2 |
| АНТИТЕЛО ПРОТИВ NR10 И ЕГО ПРИМЕНЕНИЕ | 2008 |
|
RU2531521C2 |
| МОЛЕКУЛЫ АНТИТЕЛ С УЛУЧШЕННЫМИ СВОЙСТВАМИ | 2009 |
|
RU2430111C1 |
| АНТИТЕЛА К ИНТЕРЛЕЙКИНУ 6 И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2656162C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ IL-10 ДЛЯ ЛЕЧЕНИЯ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ (SLE) | 2010 |
|
RU2587622C2 |























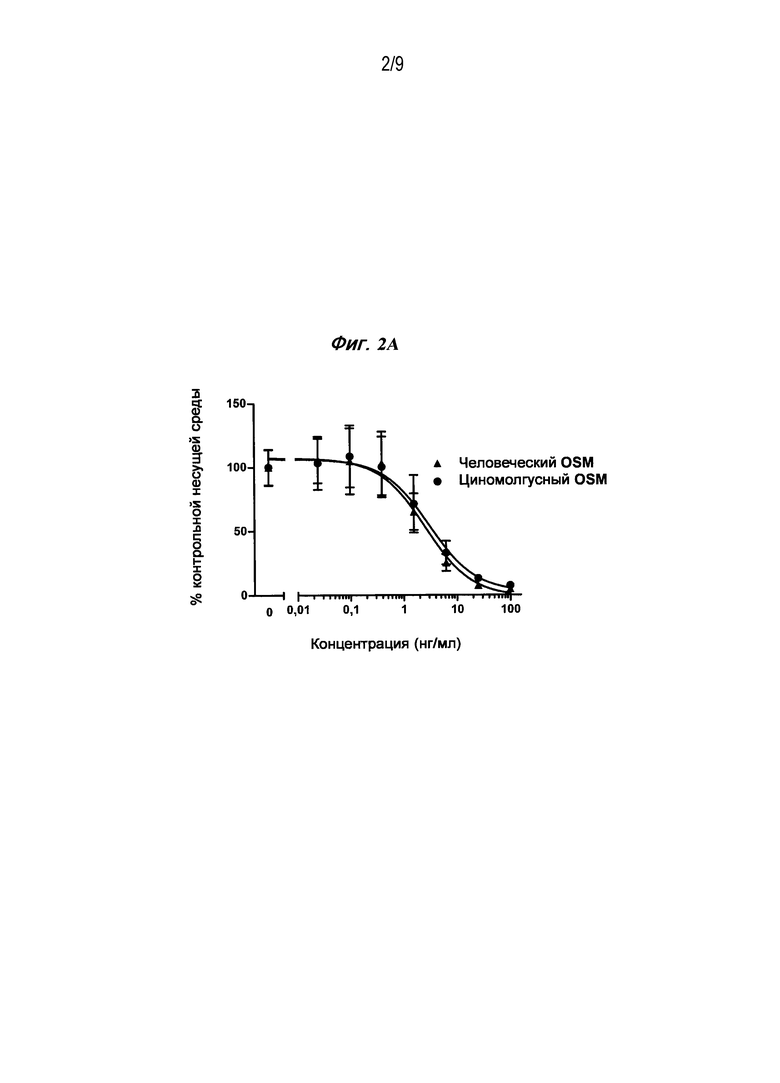
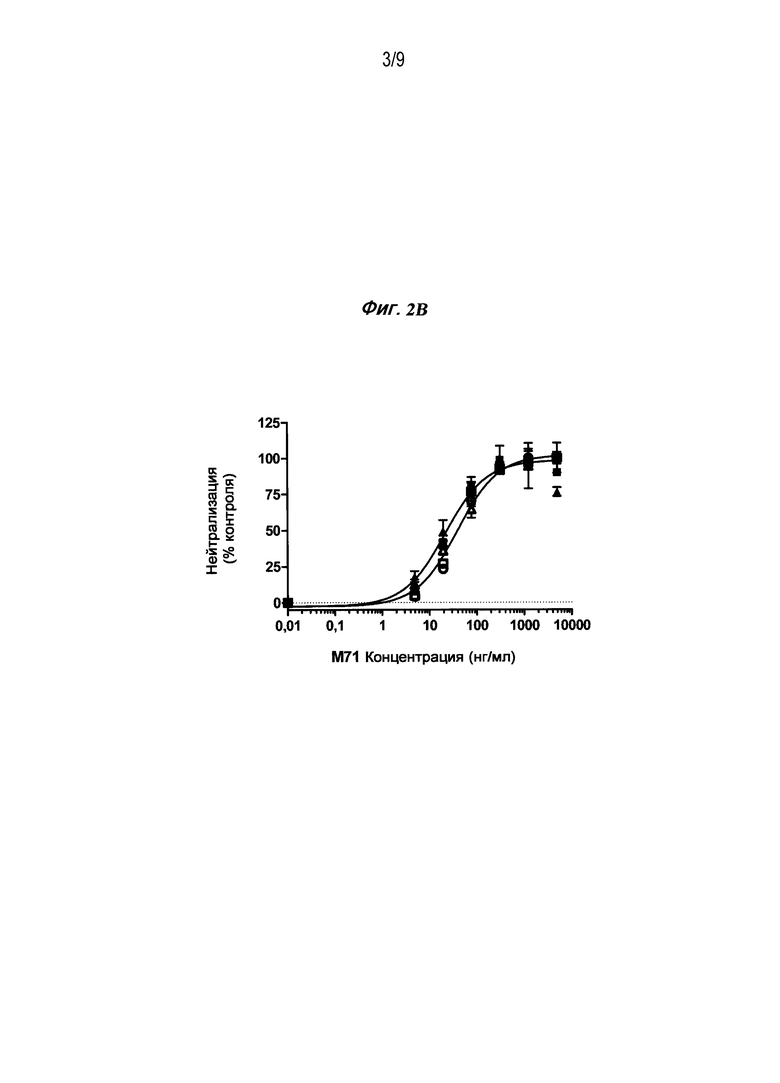
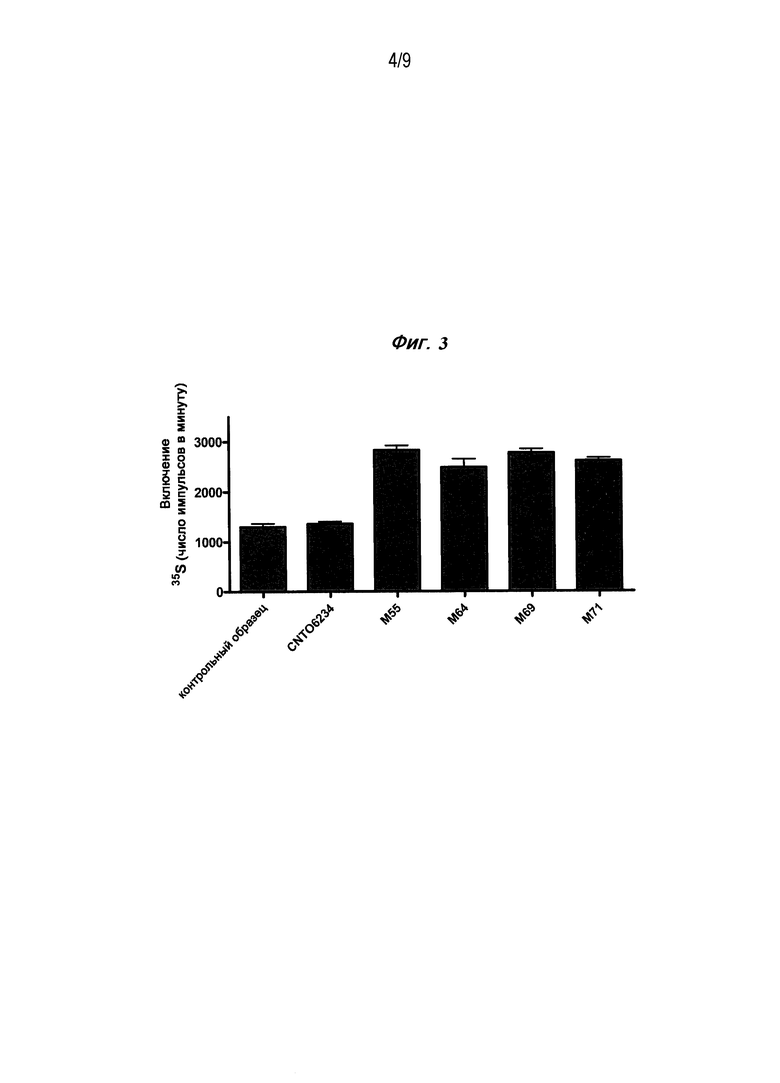
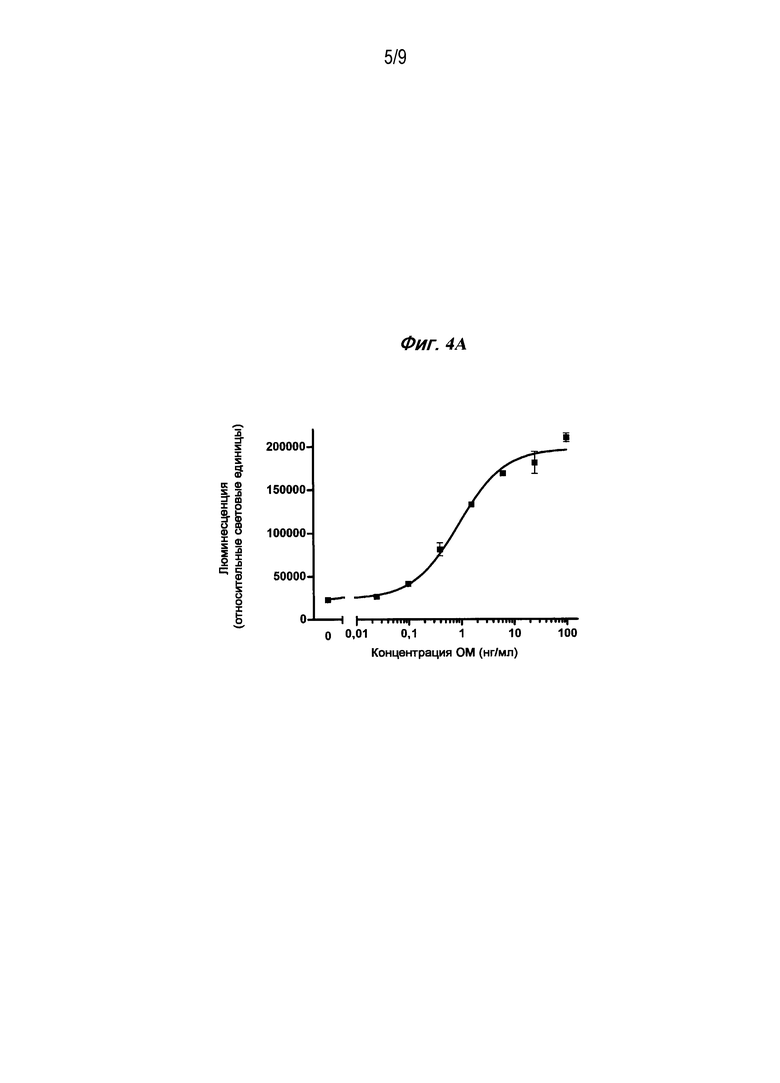
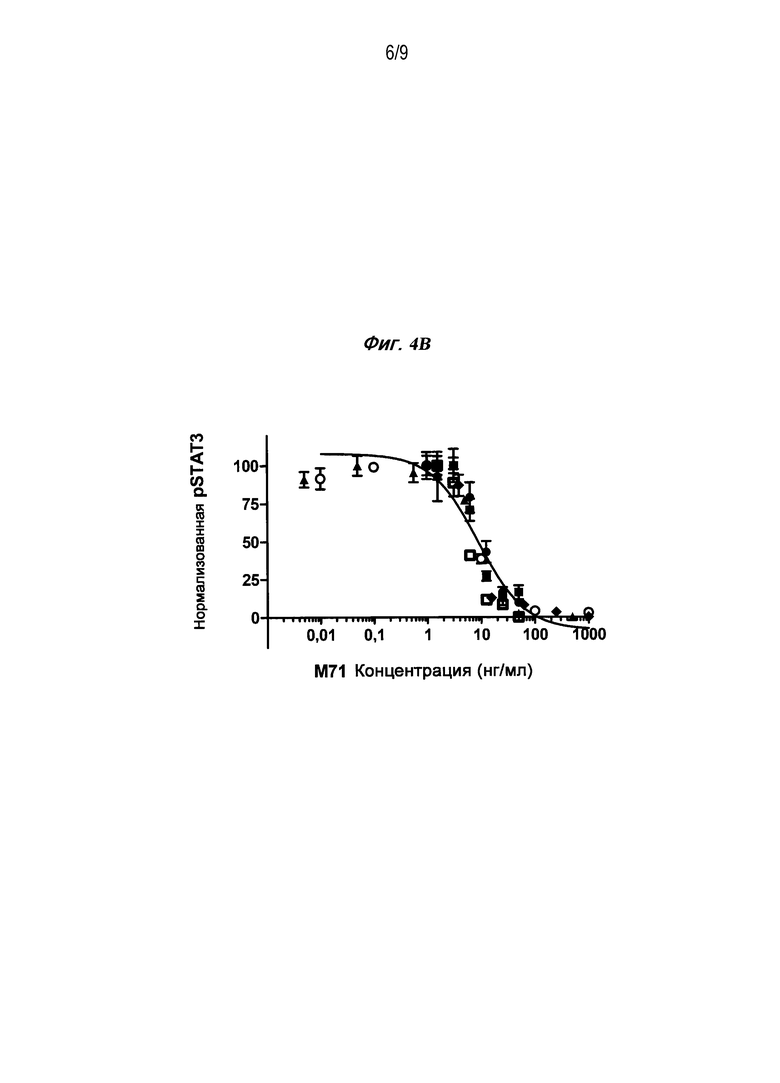
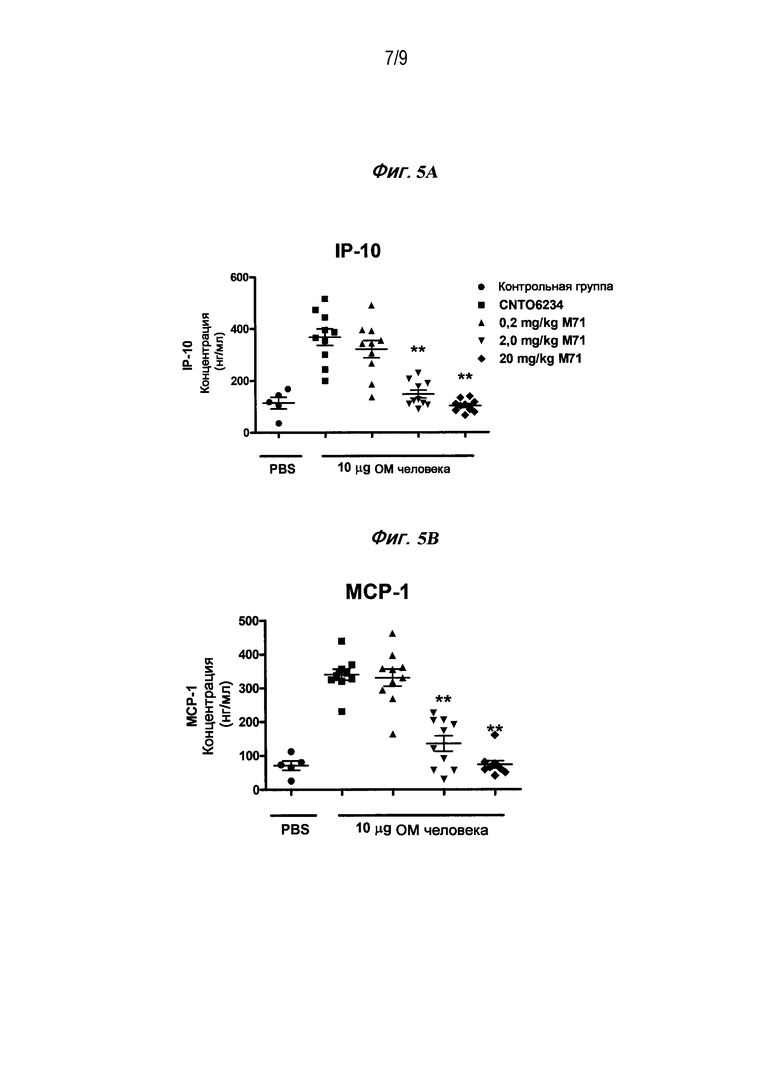
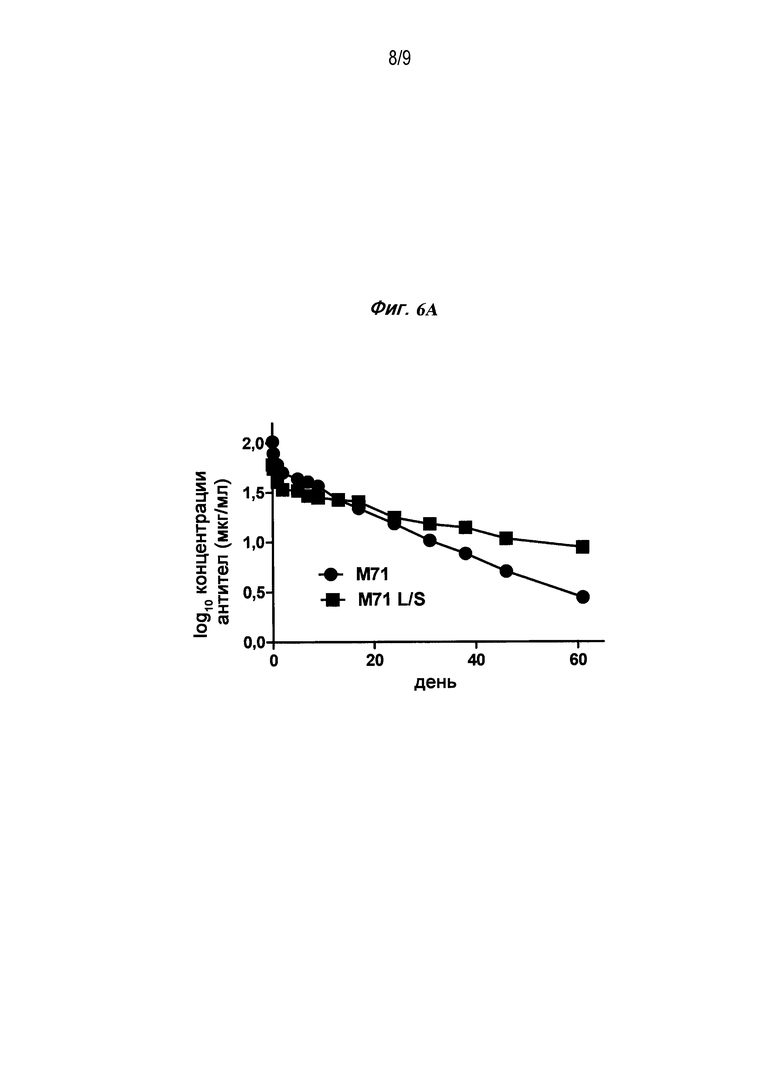
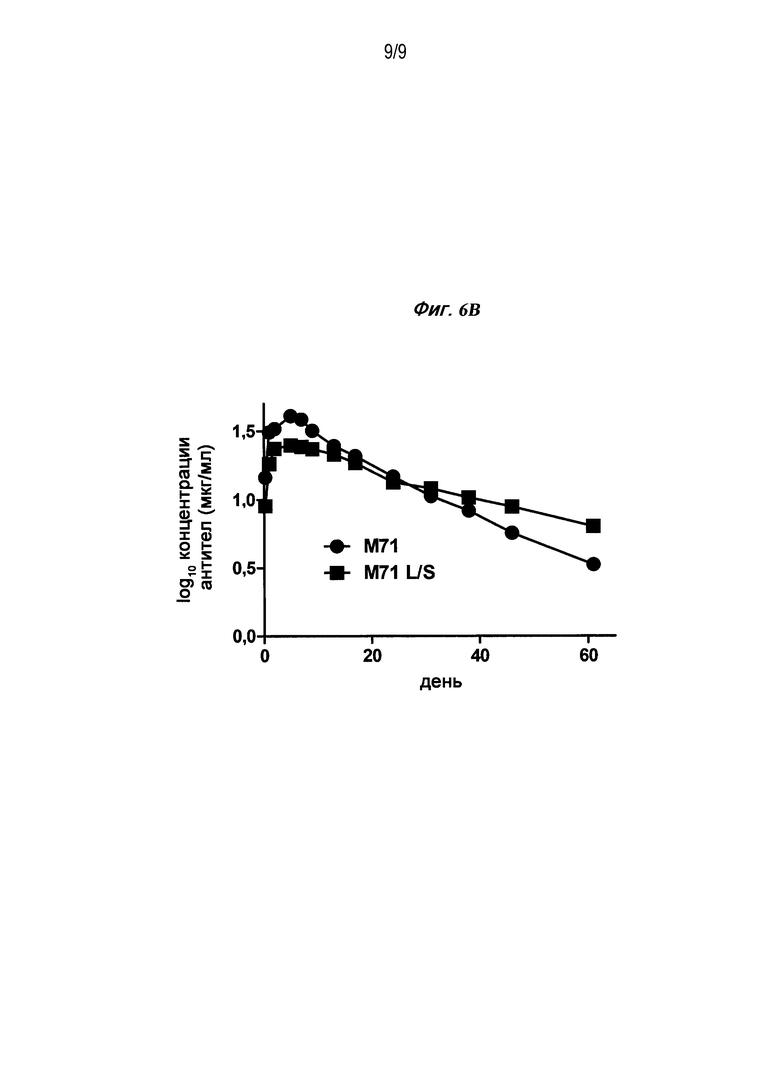
Группа изобретений раскрывает группу антител и их антигенсвязывающих фрагментов, специфично связывающихся с человеческим онкостатином М (ОМ), а также фармацевтические композиции, содержащие указанные антитела и антигенсвязывающие фрагменты, предназначенные для лечения или профилактики ОМ-ассоциированных состояний, таких как остеоартрит и идиопатический легочный фиброз. Антитела и антигенсвязывающие фрагменты согласно группе изобретений блокируют сигнальные рецепторы gp130 и, соответственно, оказывают используемое в клинике цитотоксическое или иммуномодуляторное действие на клетки, которые экспрессируют gp130. 8 н. и 14 з.п. ф-лы, 10 ил., 13 табл., 13 пр.
1. Выделенное антитело, которое специфично связывается с человеческим онкостатином М (ОМ), содержащее вариабельный участок легкой цепи с аминокислотной последовательностью SEQ ID NO: 51 и вариабельный участок тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 55.
2. Выделенное антитело по п. 1, дополнительно содержащее константный участок тяжелой цепи человека, выбранный из группы, состоящей из IgA1, IgA2, IgD, IgE, IgGl, IgG2, IgG3, IgG4 и IgM.
3. Выделенное антитело по п. 2, в котором константный участок содержит изотип IgG человека.
4. Выделенное антитело по п. 3, в котором изотипом является IgGl.
5. Выделенное антитело по п. 4, в котором константный участок модифицирован, чтобы обеспечить нелизируемость антитела.
6. Выделенное антитело по п. 3, в котором константный участок модифицирован для усиления аффинности антитела к неонатальному рецептору (FcRn) в сравнении с антителом с последовательностью константного домена IgGl дикого типа.
7. Выделенное антитело по п. 6, в котором константный участок модифицирован в положениях 428 и 434, причем нумерация соответствует европейской нумерации по Кабату.
8. Выделенное антитело по п. 7, в котором модификациями являются M428L и N434S, причем нумерация соответствует европейской нумерации по Кабату.
9. Антигенсвязывающий фрагмент антитела по п. 1, отличающийся тем, что упомянутый фрагмент выбран из группы, состоящей из Fab, Fab′, Fd, F(ab)2 и ScFv.
10. Фармацевтическая композиция для лечения или профилактики ОМ-ассоциированных состояний, содержащая эффективное количество выделенного антитела по п. 1, и фармацевтически приемлемое вспомогательное вещество или носитель.
11. Набор для лечения или профилактики ОМ-ассоциированных состояний, содержащий стерильный препарат выделенного антитела по п. 1, и инструкции по введению антитела нуждающемуся в нем субъекту.
12. Выделенное антитело, которое специфично связывается с человеческим онкостатином М (ОМ),
содержащее:
H-CDR1, с аминокислотной последовательностью SEQ ID NO: 14;
H-CDR2, с аминокислотной последовательностью SEQ ID NO: 17;
H-CDR3, с аминокислотной последовательностью SEQ ID NO: 21;
L-CDR1, с аминокислотной последовательностью SEQ ID NO: 38;
L-CDR2, с аминокислотной последовательностью SEQ ID NO: 43;
и
L-CDR3, с аминокислотной последовательностью SEQ ID NO: 46.
13. Выделенное антитело по п. 12, дополнительно содержащее константный участок тяжелой цепи человека, выбранный из группы, состоящей из IgA1, IgA2, IgD, IgE, IgGl, IgG2, IgG3, IgG4 и IgM.
14. Выделенное антитело по п. 13, в котором константный участок содержит изотип IgG человека.
15. Выделенное антитело по п. 14, в котором изотипом является IgG1.
16. Выделенное антитело по п. 15, в котором константный участок модифицирован, чтобы обеспечить нелизируемость антитела.
17. Выделенное антитело по п. 14, в котором константный участок модифицирован для усиления аффинности антитела к неонатальному рецептору (FcRn) по сравнению с антителом с последовательностью константного домена IgGl дикого типа.
18. Выделенное антитело по п. 17, в котором константный участок модифицирован в положениях 428 и 434, причем нумерация соответствует европейской нумерации по Кабату.
19. Выделенное антитело по п. 18, в котором модификациями являются M428L и N434S, причем нумерация соответствует европейской нумерации по Кабату.
20. Антигенсвязывающий фрагмент антитела по п. 12, отличающийся тем, что упомянутый фрагмент выбран из группы, состоящей из Fab, Fab′, Fd, F(ab)2 и ScFv.
21. Фармацевтическая композиция для лечения или профилактики ОМ-ассоциированных состояний, содержащая эффективное количество выделенного антитела по п. 12 и фармацевтически приемлемое вспомогательное вещество или носитель.
22. Выделенное антитело, которое специфично связывается с человеческим онкостатином М (ОМ), содержащее:
H-CDR1, с аминокислотной последовательностью SEQ ID NO: 14;
H-CDR2, с аминокислотной последовательностью SEQ ID NO: 17;
H-CDR3, с аминокислотной последовательностью SEQ ID NO: 21;
L-CDR1, с аминокислотной последовательностью SEQ ID NO: 38;
L-CDR2, с аминокислотной последовательностью SEQ ID NO: 43;
и
L-CDR3, с аминокислотной последовательностью SEQ ID NO: 46,
причем антитело содержит константный участок IgGl модифицированный для повышения аффинности антитела к неонатальному рецептору (FcRn), по сравнению с
последовательностью константной области антитела человеческого IgG1 дикого типа, и модификациями являются M428L и N434S, причем нумерация соответствует европейской нумерации по Кабату.
| US2007286861 A1, 13.12.2007 | |||
| WO9948523 A2, 30.09.1999 | |||
| WO2006084092 A2, 10.08.2006 | |||
| HEINRICH PETER C | |||
| et al | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Устройство для телефонирования по проводам токами высокой частоты | 1921 |
|
SU374A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2016-10-20—Публикация
2011-10-10—Подача